 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

//
俗话说“病从口入”,我们的健康状况很大一部分取决于饮食。而食物基本上是由各种营养素构成的。
宏量营养素是人体大量需要的必需营养成分。宏量营养素指的是“三大”营养素:蛋白质、脂肪和碳水化合物,它们是我们饮食中的关键。
虽然术语“宏量营养素”已经存在了一段时间,但直到近几年才引起广泛关注。因为越来越多的人开始计算他们的“宏”而不是卡路里,无论是为了减肥还是想潜在的改善健康亦或健康管理(目前很多的名人,明星都加入了这一趋势)。
计算宏也是某些流行饮食计划的一个要素,例如生酮饮食,参与者计算脂肪、蛋白质和碳水化合物,希望获得更健康的饮食。
在本篇文章,我们带您一起了解有关宏量营养素和以及如何在饮食中计算它们的含量,人们是否应该开始关注和重视它们,从而获得更健康的身体。//
营养素是维持机体繁殖、生长发育和生存等一切生命活动和过程,需要从外界环境中摄取的物质。
来自食物的营养素种类繁多,根据其化学性质和生理作用可将营养素分为七大类,即蛋白质、脂类、碳水化合物、矿物质、膳食纤维、维生素和水。
根据人体对各种营养素的需要量或体内含量多少,又可将营养素分为宏量营养素(也称常量营养素)和微量营养素。
问
宏量营养素和微量营养素有什么区别?
三种主要的宏量营养素是脂肪、蛋白质和碳水化合物,需要大量它们才能为提供能量并在身体中发挥其重要作用。
微量营养素,如维生素和矿物质,对健康也是必不可少的,但需要的量较少。
答
如果按重要性对营养素进行排序,宏量营养素将位居榜首。
我们身体需要的三种宏量营养素是碳水化合物、蛋白质和脂肪,每一种都在身体中发挥着不同的、重要的作用——它们一起工作,保障我们身体的各种功能,如生长、繁殖、消化和运动,协调运转。
✦宏量营养素进行能量供应
能量供应是宏量营养素的关键作用。脂肪、蛋白质和碳水化合物等宏量营养素为我们的细胞提供能量,而微量营养素维生素和矿物质则不能。
宏量营养素通常以克为单位测量,有些人会记录一天中他们所消耗的每种宏量营养素的克数来获取更健康的身体。
宏量营养素对机体非常重要
宏量营养素除了提供能量外,每种必需的宏量营养素在体内都有重要的功能,例如参与构成和修复我们的身体组织;调节机体各种正常的生命活动。
注:含有宏量营养素的食物一般同时可以提供维生素和矿物质等微量营养素。
三种宏量营养素——蛋白质、碳水化合物和脂肪——都被认为是必需营养素(维生素、矿物质等微量元素也是必需营养素)。这些营养素被认为是“必需的”,因为身体需要它们才能正常运作。
注:这些营养元素均无法由身体自己创造,需要依赖从食物中摄入。
“术语‘宏观’意味着大而‘微观’意味着微小——我们需要大量的碳水化合物、脂肪、蛋白质宏量营养素,同时也需要微量的维生素、矿物质等微量营养素。
宏量营养素就像主角,微量营养素是饮食中的配角,每个角色对身体的健康表现都很重要。
▸矿物质
矿物质又称无机盐,是人体内无机物的总称。是构成人体组织和维持正常生理功能必需的各种元素,是七大营养素之一。
人们对一部分矿物质也比较熟悉,例如体内最丰富的矿物质包括钙、钠、钾和镁,通常毫克为单位。
★ 矿物质的作用
虽然矿物质在人体内的总量不及体重的5%,也不能提供能量,但是它们在人体组织的生理作用中发挥重要的功能。
•构成机体组织的重要成份:钙、磷、镁——骨骼、牙齿。
•多种酶的活化剂、辅助因子或组成成份:钙——凝血酶的活化剂、锌——多种酶的组成成份。
•某些具有特殊生理功能物质的组成部分:碘——甲状腺素、铁——血红蛋白。
•维持机体的酸碱平衡及组织细胞渗透压:酸性(氯、硫、磷)和碱性(钾、钠、镁)无机盐适当配合,加上重碳酸盐和蛋白质的缓冲作用,维持着机体的酸碱平衡;无机盐与蛋白质一起维持组织细胞的渗透压。
•维持神经肌肉兴奋性和细胞膜的通透性:钾、钠、钙、镁是维持神经肌肉兴奋性和细胞膜通透性的必要条件。
✦矿物质的摄入要在一个适量范围
在人体的新陈代谢过程中,每天都有一定数量的矿物质通过粪便、尿液、汗液、头发等途径排出体外,人体内矿物质不足可能出现许多症状。因此必须通过饮食予以补充。
注:根据无机盐在食物中的分布以及吸收情况,在我国人群中比较容易缺乏的矿物质有钙、铁、锌。如果在特殊的地理环境和特殊生理条件下,也存在碘、氟、砸、铬等缺乏的可能。
但是,由于某些微量元素在体内的生理作用剂量与中毒剂量非常接近,因此过量摄入不但无益反而有害。矿物质如果摄取过多,容易引起过剩症及中毒。所以一定要注意矿物质的适量摄取。
▸ 维生素
维生素是人和动物为维持正常的生理功能而必须从食物中获得的一类微量有机物质,在人体生长、代谢、发育过程中发挥着重要的作用。
维生素,一般以微克进行测量。
✦缺乏维生素影响免疫与代谢
维生素虽然不能为人体提供能量,但是参与人体的生化反应,调节人体的代谢功能,如果维生素摄入不足,会导致人体新陈代谢失去平衡,会导致免疫力下降并可能导致营养不良,易患各种疾病。
✦维生素摄入过量胃肠道紊乱、脏器负担加大
维生素也不可以补用过量的,如果维生素补用过量会造成消化系统功能紊乱,维生素都属于酸性物质,如果补多了会造成胃肠道的吸收功能失调,从而会引起胃肠道的反酸、烧心、恶心、呕吐等,严重者还会明显的出现大便不成形或者黏液脓血便、稀便等。
另外维生素补多了还会造成肝脏、肾脏的负担加大,因为维生素主要是肝脏进行分解消化,肾脏进行排泄,长期维生素摄入过多会造成慢性的肝脏和肾脏的功能减退。
注意
根据疾病控制和预防中心指出,所有微量营养素对身体都至关重要,有助于预防疾病和改善健康。
无论是微量营养素还是宏量营养素,获取它们的最佳方法是食用各种健康、新鲜的天然食物。接下来将为您具体讲解宏量营养素的摄入。
宏量营养素的摄入相对更直观便于控制
/
/
宏量营养素指的是碳水化合物、脂类、蛋白质,这三种营养素在膳食中所占的比重大、称之为宏量营养素。
三种营养素有相同之处,同时又有自己独特的作用,无法彼此替代,下面由谷禾讲述一下这三种宏量营养素。
很多人一听到脂肪就“谈脂色变”,过多的脂肪确实会造成我们肥胖及行动不便,而且过高的血脂,很可能是诱发高血压和心脏病的主要因素。导致很多人觉得应该摄入越少越好,但脂肪不应该是人们回避的营养素。
✦脂肪对于人体是不可缺少的
作为三大主要营养素之一,脂肪也是不可缺少的。
必需脂肪酸非常重要,如亚油酸和亚麻酸、DHA和ARA。
无论是橄榄油还是野生鲑鱼,我们可能听过医生或营养师对它们脂肪的推荐或赞美。确实,我们的身体需要这些食物中脂肪和油的必需脂肪酸。
脂肪除了具有提供能量,保护内脏器官,维持体温,也是构成人体细胞很重要的组成成分,有维持细胞的功能的作用;同时参与调节内分泌激素的作用;还可促进脂溶性维生素的吸收;增加食物的美味和增加饱腹感的作用。
✦尽量选择不饱和脂肪
但是注意,在饮食中选择的脂肪类型很重要。根据研究文献和饮食白皮书,理想情况下建议降低或限制饱和脂肪和反式脂肪等“坏脂肪” ,因为这会增加你体内的低密度脂蛋白或“坏”胆固醇。
注:饱和脂肪存在于培根和香肠,而反式脂肪有时存在于加工食品中。
相反,选择单不饱和脂肪和多不饱和脂肪可以改善胆固醇,并可能降低患心脏病和中风的几率。橄榄油、牛油果和许多坚果中含有单不饱和脂肪,而鱼和亚麻籽含有多不饱和脂肪。
当然,最健康的来源是植物。植物性脂肪和油类通常来自谷物、蔬菜、坚果和豆类。
需要多少的脂肪?
从饮食中摄取足够的脂肪大部分人很容易做到。“绝大多数食物至少含有一点点脂肪,但是脂肪摄入不足与过量都不健康,如何确定自己需要多少脂肪呢?
如果有人通过计算克数(g)来计算他们的宏量,一般普通成年人每天需要40到70克脂肪,每克脂肪含有的热量大概是9大卡。
注:如果需要摄入大量健康脂肪,那么就需要适当增加摄入量。
地中海饮食降低了炎症和疾病风险
地中海饮食中烹饪时用植物油(含不饱和脂肪酸)代替动物油(含饱和脂肪酸)以及各种人造黄油,尤其提倡用橄榄油;脂肪占膳食总能量的最多35%,饱和脂肪酸只占不到7%~8%。
针对使用地中海饮食模式减少心脏病的研究表明,与常规饮食模式相比,地中海饮食中的脂肪主要来自单不饱和脂肪,有助于减少炎症和疾病风险。
地中海饮食改善了研究参与者的整体健康状况,并降低了死亡率。因为除了在烹饪中大量使用橄榄油外,可能还定期食用鱼类。为了获得omega-3脂肪对健康的益处,谷禾建议每周食用富含不饱和脂肪的鱼类2到3次。
一些优质的脂肪来源

根据哈佛大学公共卫生学院和谷禾的相关资料整理,以下是一些优质脂肪的一些来源:
单不饱和脂肪:橄榄油、花生油、菜籽油、杏仁、胡桃、榛子、南瓜籽和南瓜籽油、芝麻和芝麻油、鳄梨和鳄梨油
多不饱和脂肪:核桃、三文鱼、金枪鱼、鲱鱼、沙丁鱼、鳀鱼、鲭鱼、银鳕鱼、亚麻籽和亚麻籽油、菜籽油(同时含有单不饱和脂肪和多不饱和脂肪)
现在许多人采用富含蛋白质的饮食是有原因的。因为蛋白质在体内起着许多重要作用——它被认为是生命的基石,它参与一切生命的形成。生命的产生、存在、消亡都与蛋白质有关,没有蛋白质就没有生命。
✦身体的所有活动都离不开蛋白质
构建、修复身体
蛋白质几乎无处不在——在我们的骨骼、肌肉、头发、皮肤中等等。蛋白质由不同类型的氨基酸组成,可以构建、修复和维护我们身体。
调节生理功能
蛋白质的主要功能为调节生理功能,细胞功能、食物消化吸收、免疫调节、肌肉收缩、运送营养素、维持渗透压、体液、激素平衡等。
需要多少蛋白质?
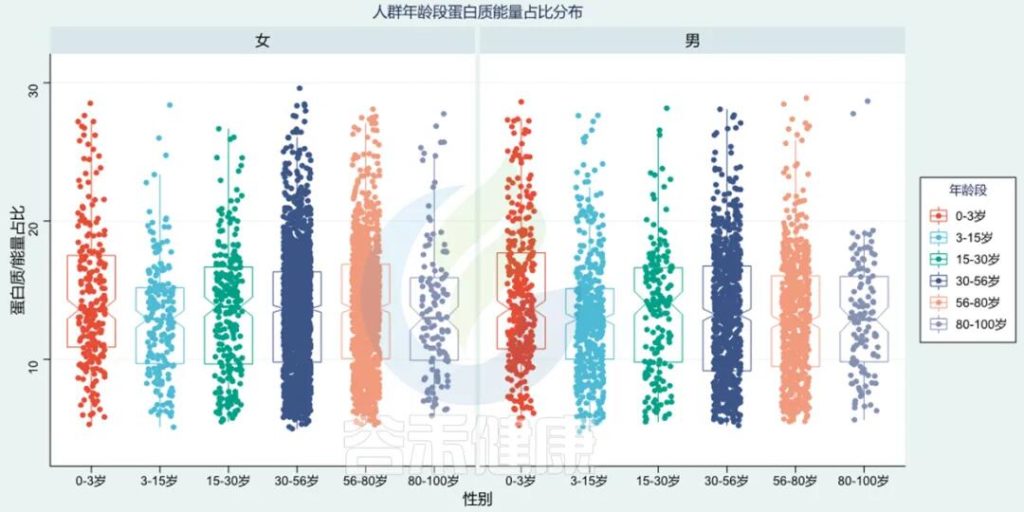
谷禾统计研究发现,不同年龄段的人群蛋白质能量占比有所差异。每个人目标蛋白质会根据个人需求做调整,例如是否怀孕亦或是参与专业的体育运动。
一般建议每日卡路里的10%到35%来自蛋白质。哈佛大学公共卫生学院建议每9公斤体重摄入7克蛋白质。
例如一个人的体重为90公斤,那么每天的目标就是摄取70克蛋白质。
✦高蛋白饮食可能有助于减肥
有些人可能为了减肥而采用高蛋白饮食。2020年9月发表在《J Obes Metab Syndr》上分析研究得出6-12个月临床试验证明,高蛋白饮食(HPD)具有减肥效果,并且可以防止减肥后体重反弹。
高蛋白饮食下的肠道激素
在肠道衍生的激素中,胰高血糖素样肽1、胆囊收缩素和肽酪氨酸-酪氨酸会降低食欲,而生长素释放肽会增强食欲。
高蛋白饮食会增加这些降食欲激素水平,同时降低促食欲激素水平,导致饱腹感信号增加,并最终减少食物摄入量。
此外,饮食诱导的产热增加、血液氨基酸浓度增加、肝脏糖异生增加以及由较高的膳食蛋白质引起的生酮增加都有助于增加饱腹感。
✦热量限制期间摄入更多蛋白质防止肌肉流失
另一项于2022年5月发表在《Obesity》杂志上的研究发现在热量限制期间增加蛋白质摄入量可改善饮食质量并减少瘦体重的损失,摄入更多的蛋白质防止肌肉流失。
蛋白质杠杆假说 (PLH)
有一种宏量营养素调节模式被称为“蛋白质优先化”,即蛋白质杠杆假说 (PLH)。根据PLH,即特定营养素的食欲相互作用,将膳食摄入引导至特定的膳食宏量营养素平衡,并且在宏量营养不平衡的饮食中,蛋白质调节主导脂肪和碳水化合物。
在随机控制条件下证明,研究发现,试验期间体重的变化与蛋白质对能量摄入的贡献百分比呈负相关。
一个重要的优先事项是确定蛋白质杠杆是否在推动自由生活的人类的能量过度消耗和肥胖方面发挥作用,如果是这样,膳食蛋白质稀释的生态原因是什么。
研究表明,美国饮食中蛋白质的能量百分比随着肥胖的增加而下降,国家健康和营养检查调查 (NHANES) 和粮食及农业组织食物平衡表的数据都证明了这一点 。
一项针对一组青年人的回顾性研究同样发现,膳食蛋白质百分比与能量消耗之间存在预期的负相关关系。NHANES数据的一项分析强调了一类高度加工食品、超加工食品可能是美国饮食中蛋白质的稀释剂 。这与一项实验性研究一致,该研究发现,在为期14天的试验中,接受超加工饮食的住院患者摄入的碳水化合物、脂肪和总能量多于未加工饮食的患者,并且体重增加,而蛋白质摄入量在不同饮食中没有差异。然而,还没有针对大量营养素平衡、蛋白质利用不平衡蛋白质稀释饮食或膳食蛋白质稀释的生态原因对相同人口数据进行综合研究测试。
✦蛋白质摄入过量会增加心脏和肾脏负担
目前市场上有很多的蛋白粉和高蛋白产品,很多人也会选择通过蛋白粉这类产品增加蛋白质摄入。但是注意,过量的蛋白质会增加我们的卡路里摄入量,因为它不会简单地从体内排出。
如果你摄入的蛋白质多于需要,可能会导致体重增加。此外过多的蛋白质也会增加患心脏病以及肾病等的风险,尤其是当蛋白质来源含有大量饱和脂肪时。
一些优质的蛋白质来源

•动物蛋白,比如鸡肉、鱼肉、虾肉、猪肉、牛肉,这些动物的肉类当中都含有优质的蛋白质。
•植物蛋白,比如黄豆、黑豆,这些豆类中也含有许多蛋白质。
•蛋类,比如鸡蛋、鸭蛋、鹌鹑蛋,动物的蛋类也是优质蛋白质的重要来源。
•乳类,比如牛奶、羊奶也含有丰富的优质蛋白质。
✦碳水化合物是最主要的供能营养素
碳水化合物是占比最大,是重要的营养素,机体50%以上的能量由食物中的碳水化合物提供。一般组织消耗的能量均来自碳水化合物在有氧条件下氧化。
食物中的碳水化合物经过消化产生的糖,一部分以肝糖原的形式储存在肝脏,一部分以肌糖原的形式储备在骨骼肌中。肝糖原维持血糖平衡,肌糖原满足骨骼肌的需要。
一般将碳水化合物分为3个主要类型:
糖,这是一种简单的碳水化合物(例如甜点和苏打水中的糖)
淀粉,这是一种复杂的碳水化合物(比如意大利面和土豆红薯等蔬菜中)
纤维,也是一种复杂的碳水化合物(存在于许多植物性食物中,如蔬菜、水果、坚果和豆类)
当然,碳水化合物也存在于高度加工食品。通常情况下,加工程度较低的食物,例如全谷物,可以提供更多的纤维和营养,过度加工的食品对健康不利。
简单碳水化合物和复杂碳水化合物有什么区别?
当讨论碳水化合物时,日常生活中经常用“简单”和“复杂”这两个词来区分它们,但这是什么意思呢?
这里有一个简单的比喻方法来区别:
简单的碳水化合物就像一个短串珠的手镯,而复杂的碳水化合物就像一个长串珠的项链。一个是短链,另一个是长链。
长链碳水需要更长的时间来消化,并且进入血液的速度也更慢。另一方面,一条简单的或短则会迅速分解并进入血液。
✦复杂碳水相对更健康
简单碳水化合物是指糖,如果糖、蔗糖和乳糖。
复杂碳水化合物包括淀粉(蔬菜、豆类、谷物)和纤维。复杂碳水化合物对胰腺的压力较小,并能在较长时间内提供饱腹感。
有些食物由两者组成——比如水果既含有果糖又含有纤维。减缓消化的是水果中的纤维,这意味着水果在体内不等同于糖果。
✦碳水摄入过低可能导致日常所需能量不足
如果按照某些饮食(如食肉动物饮食,本质上是全肉饮食)的指示,从饮食中清除所有碳水化合物,可能会感觉不太好。因为碳水化合物为身体的所有细胞提供精神和身体任务和活动所需的能量。它们提供了身体所需能量的一大半。
减少或排除它们,你可能会感到疲倦和头昏眼花。也就是说,许多低碳水化合物饮食的成功案例并不适合所有人和长期遵循,因为饮食中应该含有一些碳水化合物。
需要多少碳水化合物?
一般建议每天45%到65%的卡路里来自碳水化合物。这意味着对于一个摄入1800卡路里热量的人来说,每天从碳水化合物中摄取810到1170卡路里热量。
如果以克为单位计算碳水化合物,则相当于每天约203g至293克碳水化合物。
碳水化合物每克约含有4卡路里,仅供参考
注意:如果要确保身体的碳水化合物来自对健康有益的来源,并且同时满足获得了充足的纤维。大多数人会忽略摄入足够的不溶性和可溶性纤维来源所带来的许多好处,关注我们文章的还可以了解膳食纤维对于维持身体健康和肠道健康的益处。
一些优质的碳水来源

绿叶蔬菜、地瓜、西兰花、菜花、豆子、鹰嘴豆、扁豆、坚果、原味、低脂或脱脂酸奶、燕麦片、藜麦、全麦面包、大麦、苹果、梨、浆果、香蕉
不太健康的碳水化合物
各种糖果、高糖分饮料,精制、加工和低纤维碳水化合物,如白面包、白米、烘焙蛋糕和饼干、披萨。
/
/
宏量营养素之间需要保持平衡,并且由于宏量营养素提供能量,因此摄入过多的任何一种营养素可能会提供比身体每天消耗的的卡路里。
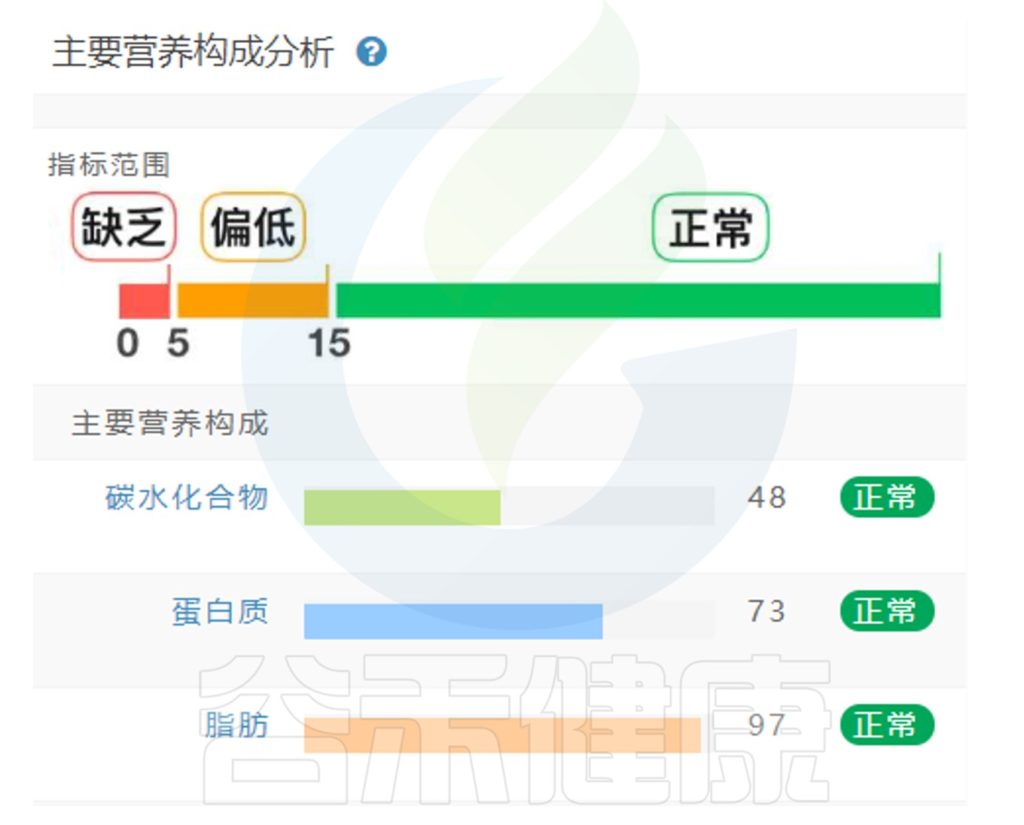
谷禾的健康检测报告评估的3大宏量营养元素:蛋白质,脂肪,碳水化合物是一个百分比的结构,其中一个营养元素太高,其它就会低。
这意味着,如果你摄入高水平的蛋白质,那么其它两项常量营养素就会相对低,而且同时也会不经意地摄入比您需要的更多的卡路里。
那么我们应该如何做到均衡的饮食呢?
宏的计算公式
通过计算宏量营养素(简称宏)的相对含量,我们可以相对地做到饮食均衡。
宏的计数公式是什么?
首先,计算出你一天要摄入多少卡路里,然后估计出你的宏观目标。如果想采用生酮饮食且每天摄入2,000卡路里热量,那么你可能希望大约70%的卡路里来自脂肪。因此,将2,000乘以0.70得到1,400卡路里,那是你的脂肪宏观目标。
计算宏时,卡路里重要吗?
关注宏量营养素需要付出努力,并且不同的人可能会有不同的宏量营养素目标。但大部分国家的膳食指南建议31至50岁女性的宏量百分比如下:
45%到65%的卡路里来自碳水化合物
20%到35%的卡路里来自脂肪
10%到35%的卡路里来自蛋白质
因此,假如一个人的目标是每天摄入1800卡路里的热量,他们可能需要810卡路里来自碳水化合物 (45%),630卡路里来自脂肪 (35%),360卡路里来自碳水化合物每天摄入蛋白质 (20%)。
通常,碳水化合物每克含有4卡路里热量,脂肪每克含有9卡路里热量,而蛋白质每克含有4卡路里热量。
因此,如果同一个人在1800卡路里的饮食中关注克数,他们每天需要大约203克碳水化合物、70克脂肪和90克蛋白质。
尽量计算宏量比计算卡路里更好吗?
计数宏确实比计算卡路里有一些好处。计算卡路里并不能说明您所吃食物的质量,与之不同,计算宏量可以带来更健康、更均衡的饮食选择。
例如,当你计算卡路里时,可能会从碳水化合物中获取大部分卡路里,而可能会错过宝贵的健康脂肪和蛋白质。
✦精确饮食有助于身材管理
此外,如果想更具体地定制饮食计划,公式会变得更加复杂。例如,在计算每天要摄入的卡路里目标数量时,还要考虑身高、体重、年龄和性别。
那么,为什么有这么多人致力于精确营养计算或计算宏呢?目前大多数计算宏的人这样做是为了减肥或优化运动或锻炼中的身体表现。未来不排除更多的人为了健康目标而加入这个“事业”。▼
计算宏在人群之中逐渐流行。那么宏观计数有哪些潜在的好处呢?
•它可以帮助您开始更健康、更均衡的饮食
如果你不知道自己一天吃什么或者只关注卡路里,那么了解什么是宏以及正在食用哪些宏营养元素可能有助于你养成更健康的饮食习惯。
一袋薯片所含的卡路里与一片全麦面包和半个鳄梨所含的热量相似,但其中一种能为你提供饱腹感及营养,对身体有益,而另一种则不能。
例如,半个鳄梨含有超过10克对身体有益的脂肪、约 6 克碳水化合物(以及近 5 克有益纤维)和近 2 克蛋白质。
计算宏量可以让饮食更健康、均衡,但如果它导致强迫性测量并干扰正常的日常生活,比如与朋友外出就餐,就不建议长期坚持下去。对许多人来说,有条不紊地追踪常量营养素会变得乏味。
目前有多检测可以评估膳食宏量营养元素的摄入,比如通过菌群检测,营养素分析等。
•它可以帮助你减肥(但这是有争议的)
关于计算宏量是否有助于减肥尚无定论,任何宏量摄入过多都会导致体重增加。但根据2017年8月糖尿病研究杂志发表的一项研究,经常追踪饮食的人长期减肥成功的几率更高。
一些人认为高蛋白饮食有助于人们减肥,但是美国梅奥诊所指出坚持高蛋白饮食长期以来,它与健康问题有关,例如增加患心脏病的风险。
出于同样的原因,计算碳水化合物并增加脂肪,同时将蛋白质限制在适量(生酮的标志性特征),以实现快速减肥而著称。
事实上,健康专家对这种饮食方式仍存在分歧。并非所有研究都表明它具有优势。例如, 加拿大家庭医生对2018年12月发表的13项随机对照试验的评论的作者发现,与低脂饮食相比,生酮饮食与一年后体重减轻约4.5磅(约20.4公斤)有关。但其他研究发现两个计划产生了相似的结果。更重要的是,酮的减肥效果很难保持。▼
计算宏需要时间,很多人太忙而没有时间保持这个习惯。在日常生活里,发现这种营养方法的其他困难之处。
•计算宏可能忽略了卡路里总量
许多专注于计算宏量营养素的人都在尝试获取更多的一种特定营养素并减少其他营养素,例如少吃脂肪或多吃蛋白质。不过,有些专家并不认为以这种方式进食会带来积极的结果。研究最终表明,来自任何常量营养素来源的过量卡路里都会导致体重和脂肪增加,即使是蛋白质也是如此,尽管高蛋白饮食通常与体重减轻有关。
相比之下,卡路里限制,无论宏量营养素阈值如何,都会导致体重减轻。
例如,一项评论得出的结论是,在减肥方面,低脂饮食并不比高脂饮食更成功。为了减少了脂肪,但没有改善饮食质量,更多人变得越来越胖,越来越病。
•经常计算宏可能导致强迫症或饮食失调
记录消耗的宏量营养素可能会带来不良后果。与任何饮食一样,计算宏量,就像计算卡路里一样,会变成对你吃什么和吃多少的不健康的痴迷,这会导致饮食失调和其他健康问题。
•准确计数可能较困难
计数宏的另一个缺点是它很难做到精准。许多食物含有大量营养素的组合,除非你是一位知道你所吃的每一种食物的分解的食品科学家,否则很难确切地知道自己在吃什么。
包装食品可能会在包装盒上清楚地标明每份宏量的数量,但大多数健康的天然食品(您想要放在盘子里的那些)如水果和蔬菜都没有营养标签,因此可能需要处理处理转换数据才能得到。
/
/
随着越来越多的人们开始关注饮食健康,膳食中的三大宏量营养素应该占一个合适比例。
《中国营养学会》建议碳水化合物占总能量的55%-65%、脂肪占20%-25%,蛋白质占10%-15%,这个比例可以根据具体情况上下幅度内进行调整。
谷禾的健康报告中也含有营养元素的构成分析,可以借此来及时判断自我的健康状况。
虽然宏量营养素是我们饮食中不可或缺的一部分,但是日常生活中不必时刻计算他们,只需要保持饮食多样化,多考虑食物种类。通过一些食物的多样化可以满足我们的日常营养需求,帮助提升健康水平。
综上所述,掌握膳食中三大宏量营养素的摄入,对于保持良好的饮食健康是十分重要。主要参考文献:
Freire R. Scientific evidence of diets for weight loss: Ogilvie AR, Schlussel Y, Sukumar D, Meng L, Shapses SA. Higher protein intake during caloric restriction improves diet quality and attenuates loss of lean body mass. Obesity (Silver Spring). 2022 Jul;30(7):1411-1419.
Freire R. Scientific evidence of diets for weight loss: Different macronutrient composition, intermittent fasting, and popular diets. Nutrition. 2020 Jan;69:110549.
Moon J, Koh G. Clinical Evidence and Mechanisms of High-Protein Diet-Induced Weight Loss. J Obes Metab Syndr. 2020 Sep 30;29(3):166-173.
Leslie BarrieMedically, Kayli Anderson, RDN.2023.What Are Macronutrients? A Complete Scientific Guide. Everydayhealth.diet-nutrition
Sebastián Domingo JJ, Sánchez Sánchez C. From the intestinal flora to the microbiome. Rev Esp Enferm Dig. 2018 Jan;110(1):51-56.
Mousa A, Naqash A, Lim S. Macronutrient and Micronutrient Intake during Pregnancy: An Overview of Recent Evidence. Nutrients. 2019 Feb 20;11(2):443.

谷禾健康

益生菌可以产生有益的维生素、消化酶、必需氨基酸、免疫调节和抗菌代谢产物,从而促进人体健康,预防肠道炎症性疾病、自身免疫性疾病和胃肠道感染。其宝贵特性已得到健康行业、医疗专业人士和公众的认可。
比起单菌株益生菌,多菌株益生菌在改善肠道微生物群稳定性和宿主健康更具优势。然而,总的来说,尚不清楚不同菌株会在多大程度上合作或竞争资源,以及共同生物膜微环境的建立如何影响它们的相互作用。需要新的方法来设计合成益生菌联合体,以克服单一菌株配方的局限性。
罗伊氏乳杆菌Lactobacillus reuteri 和 布拉酵母菌Saccharomyces boulardii是两种重要的益生菌。
罗伊氏乳杆菌L. reuteri是一种革兰氏阳性杆菌,可以抑制病原微生物的定植并改善宿主共生微生物群组成的平衡,减少促炎细胞因子的产生,可以加强肠道屏障功能。关于罗伊氏乳杆菌详见:认识罗伊氏乳杆菌(Lactobacillus reuteri)
布拉酵母菌S. boulardii是一种对胃环境有抵抗力并在低 pH 条件下具有良好生存能力的酵母。它带来肠道屏障功能的改善、病原体竞争排斥、抗菌肽的产生、免疫调节和营养效应。
本文介绍和验证了一个系统的方法来描述微生物在多种生长条件下的相互作用,该方法将共培养分析与代谢的基因组规模建模和多变量数据分析相结合,并将其应用于L. reuteri 和 S. boulardii这两种益生菌之间的相互作用,表征它们产生有益于人类健康的化合物的潜力。
结果表明,这些菌株可以建立一种混合的合作-拮抗相互作用,最好的解释是争夺共享资源,个体交换增加,但氨基酸和短链脂肪酸的净产量通常减少。
整个试验方法主要分为三个部分:
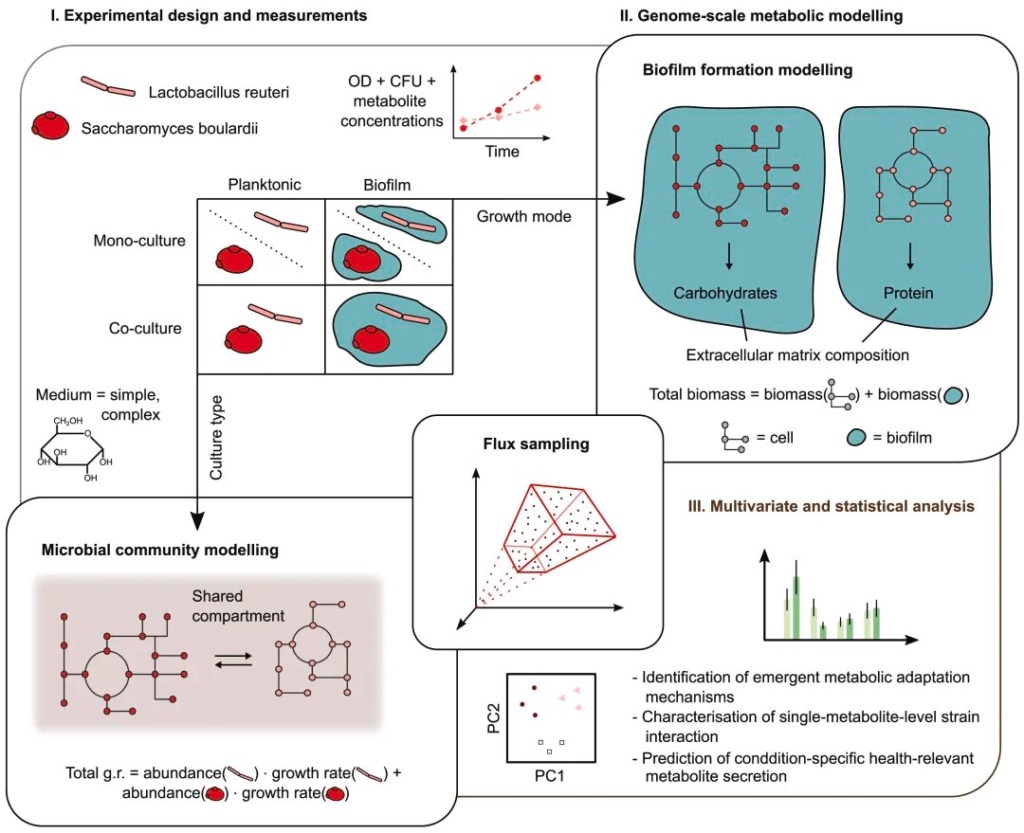
使用的菌株分别是
同时准备两种不同的培养基用于微生物培养,分别为tryptone soya broth(TSB)培养基和含0.4%葡萄糖的M9最小培养基。
为了测试菌株在不同生长条件下对生态相互作用(单一培养或混合培养)的影响,同时制作了含有10ml(浮游培养物)或2ml(生物膜培养物)的培养液。
根据光密度、CFU数量和一组相关代谢物的浓度,对每个培养物进行长期监测。
生化测定使用生化检测试剂盒分别测定培养基中的代谢物,葡萄糖、甘油、琥珀酸盐、乙酸盐、乙醇、短链脂肪酸、L-氨基酸和氨水平。
将观察到的代谢活动扩展到基因组规模,对两例菌株及微生物群和生物膜发展采用了专用的建模策略。
代表混合培养的微生物群落基因组尺度代谢模型(简称,GSMM模型)是通过 COBRA 工具箱中的 createMultipleSpeciesModel 函数创建的。
结果是创建了一个共同的细胞外隔间,其中单个GSMMs被封装,并与环境共享边界代谢物交换,有效的模拟了交叉喂养和营养竞争。而为了模拟再现实验观察到的菌株在不同生长模式下的代谢活动,引入了群落生物量伪反应,定义如下:
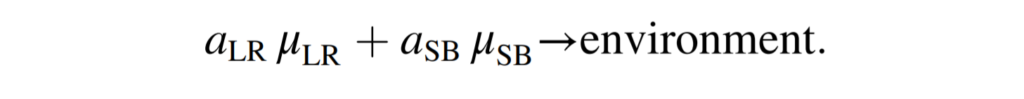
μ LR和μ SB表示通过L. reuteri和S. boulardii的单个生物质假反应的通量。
文章中为L. reuteri菌株自动化构建了一个新GSMM模型。新生成的模型包含了精选模型中54%的反应和69%的代谢物,几乎将反应数量增加了一倍,引入的43%的代谢物只有2.4%的通量不一致反应。
对于S. boulardii菌株,使用的是现有的iMM904模型,这是一个经过验证的酿酒酵母GSMM模型。
为了全面了解每种条件下的代谢潜能,使用通量采样充分探索可实现的代谢状态。
使用Matlab R2017b和R3.5软件对数据进行了统计分析,主要有PCA、PLSCA和聚类分析。
►⋙
观察在单一培养和混合培养下分别以浮游模式和生物膜模式生长时的干重动态,如下图:
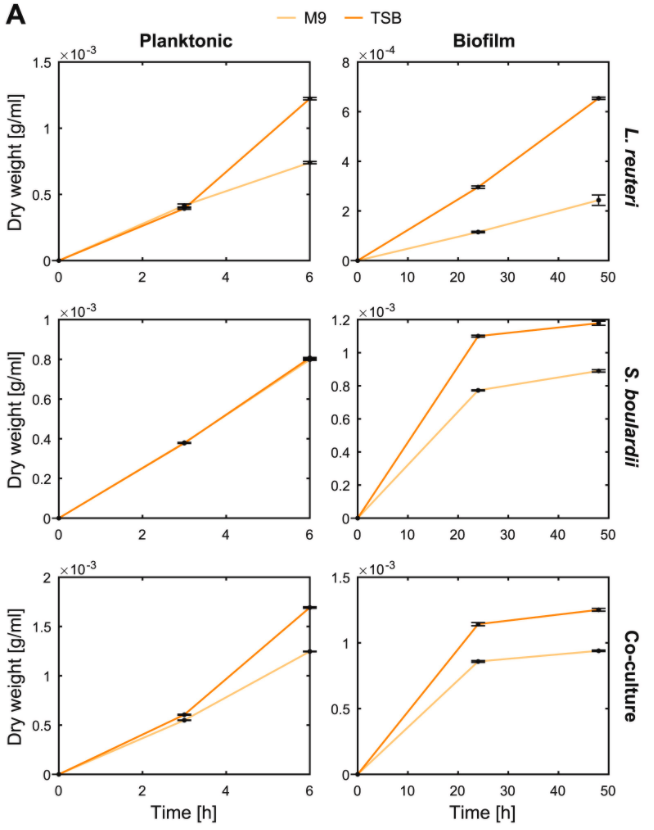
结果表示:
◆ S. boulardi菌株在6h时浮游模式生长得更快更好
◆ L. reuteri菌株在48h时形成了更好的生物膜
►⋙
当菌种一起生长时,两个菌株最终时间点的CFU浓度发生了显著变化,如下图:
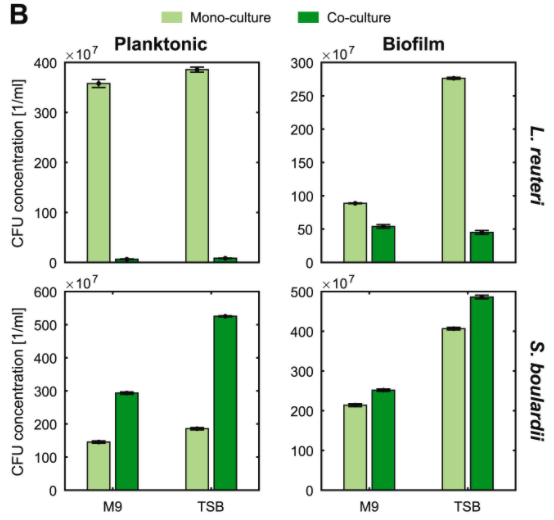
结果表示:
◆ L. reuteri 的浮游生长模式在混合培养中急剧下降
◆ S. boulardi 的浮游生长则受到了积极的影响
►⋙
分析两种菌株生长模式的潜在机制
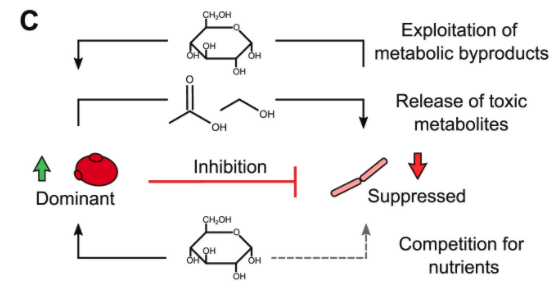
结果表示:
◆ S. boulardi 是共生长的受益者
◆ L. reuteri 受到抑制
例如:S. boulardi 可能受益于L. reuteri 菌株产生的糖,同时 L. reuteri 可能会受到 S. boulardi菌株生长代谢的伤害。
例如:S. boulardi 生长耦合离子交换或有机酸的产生可能引发环境pH值降低,这可能在多个功能水平上影响 L. reuteri 的代谢。
►⋙
在代谢水平上也观察到单一培养和混合培养之间存在的一些差异,如下图:
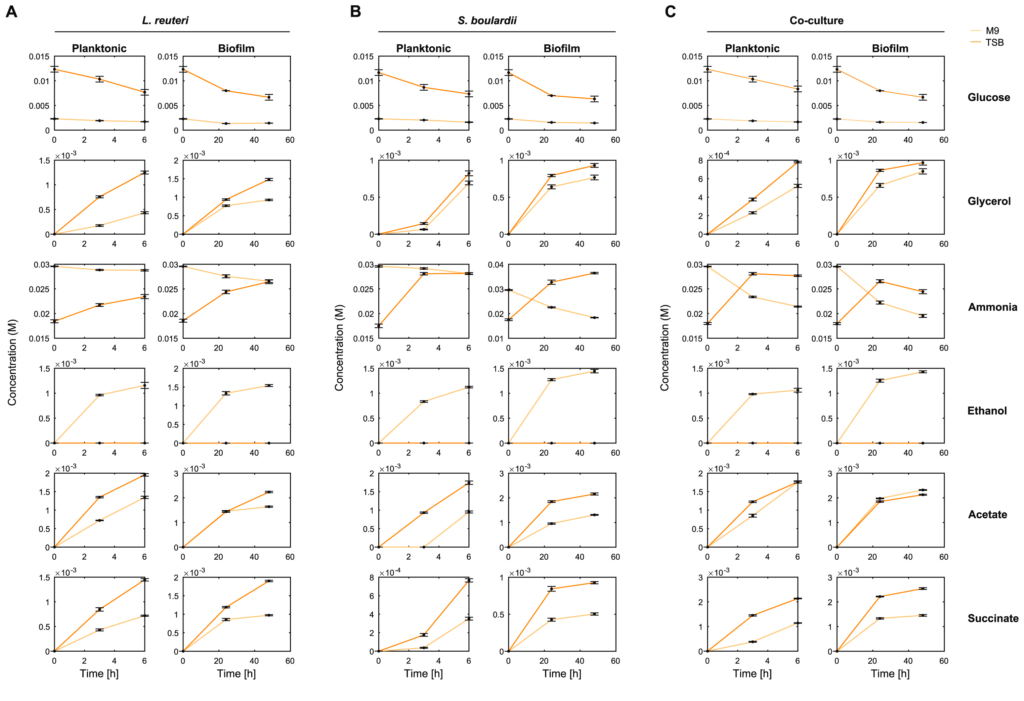
例如,M9混合培养6h的氨消耗量是相应的单一培养的近7倍。
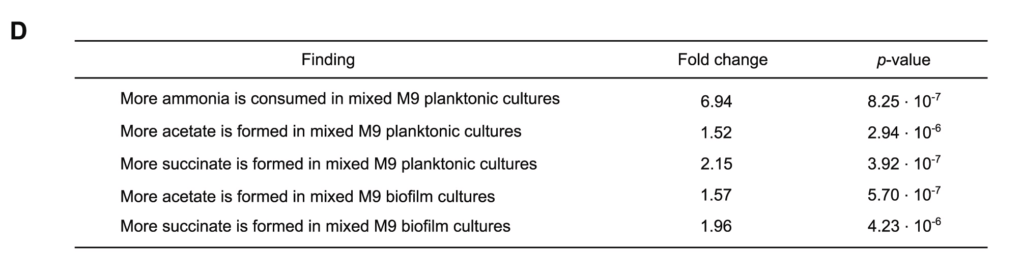
还有,在浮游和生物膜混合培养中,乙酸和琥珀酸的形成大约多两倍。统计值如图D所示。
上述生化数据表明,在乳酸菌-酵母组合中,乙酸盐和琥珀酸盐的产量增加,但试剂盒所能测的代谢物毕竟有限。
►⋙
为了全面估计未直接测量的代谢潜能,采用了如方法所述的基因组建模。
图A 分别为使用实验测量数据和基于计算机建模预测生成的数据的PCA分析结果, 与实验测量结果表现一致,只是在建模产生的数据中更加放大了复杂培养基中的共培养物与各自的单一培养物之间的鸿沟。研究人员因此有理由假设,在广泛的水平上,这种模式也发生在体外。
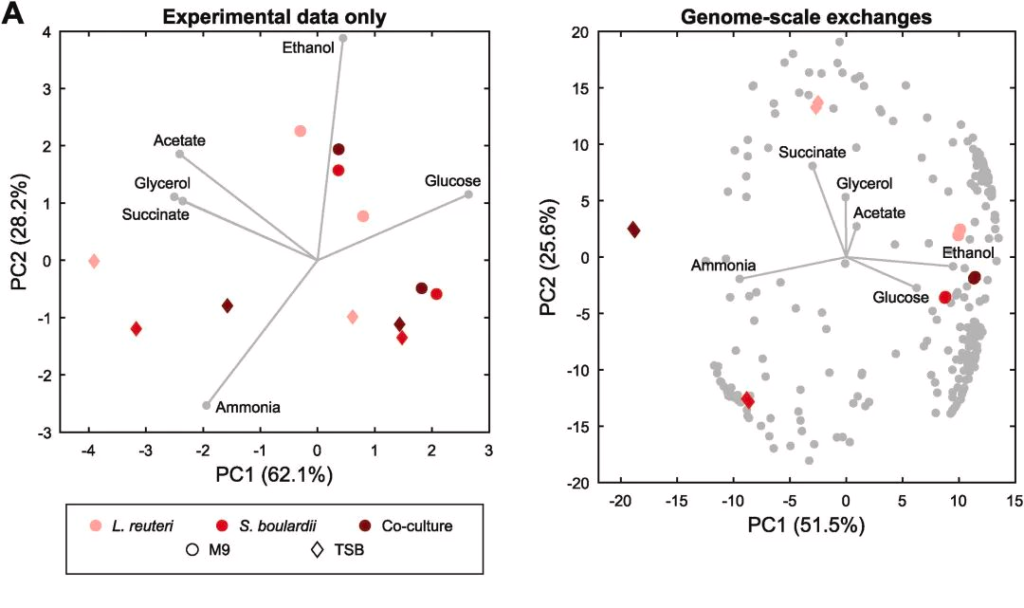
图B 观察到不同条件导致的各代谢物的产出和消耗变化,如模型预测了S. boulardi的生物素分泌,当使用最小培养基时,生物素分泌在生物膜模式下减少,而在复杂培养基中增加。类似地,多菌株环境与最小培养基中生物素产量的减少有关,而在复杂培养基中观察到相反的趋势。
►⋙
为了评估模型预测的可信度,同时再现上述结果,研究人员测量了不同条件下的总氨基酸分泌率,如下图显示:
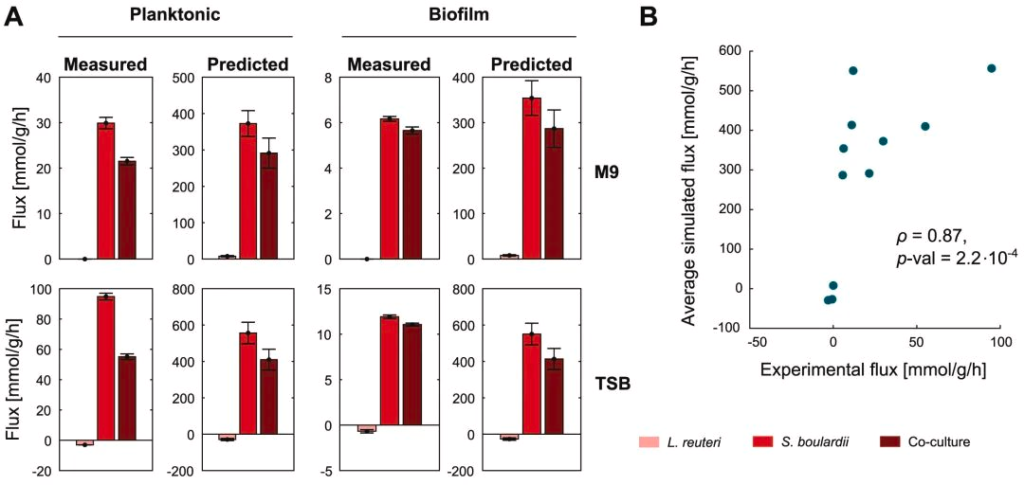
尽管模型通量相对于实验值些许膨胀,但趋势是一致的,特别是与 S. boulardi 菌株相比,混合培养中总氨基酸产量的下降。因此,在所有条件下,S. boulardi 产生氨基酸的速率最高,但生物膜也与这种速率的大幅降低有关。
图A应用PLSCA分析,重点研究了菌株水平的代谢交换率与包括菌株、培养基、培养类型和生长方式在内的因素集之间的关系。
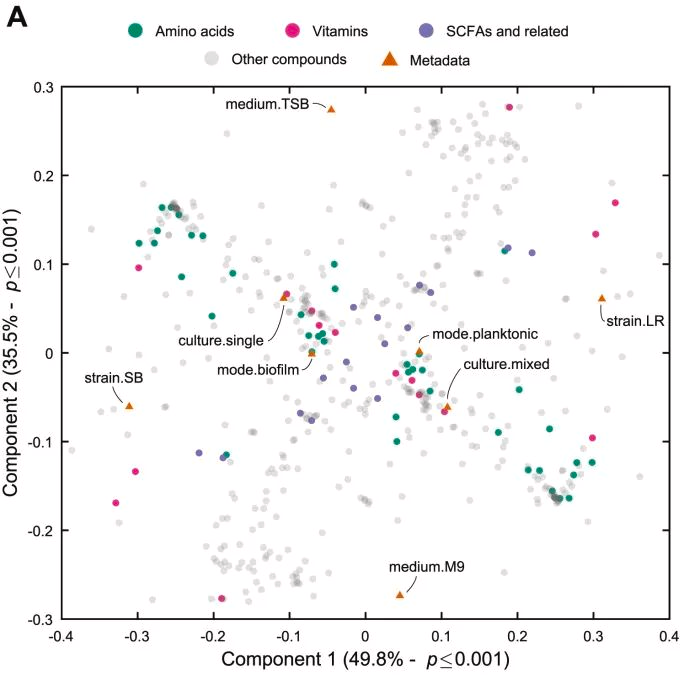
可以观察到菌株和培养基类型是对生长归一化代谢物交换影响最大的参数,因为它们位于距离原点最远的地方。
随着作用强度的降低,培养类型(单一培养或共培养)和生长方式(生物膜、浮游)也随之改变。其中,培养类型的影响比生长模式更强,这突出表明两个物种之间的生态相互作用对它们的代谢物产生有显著影响。
图B展示了与实验因素相关的交换机制,以及与之高度相关的代谢物。
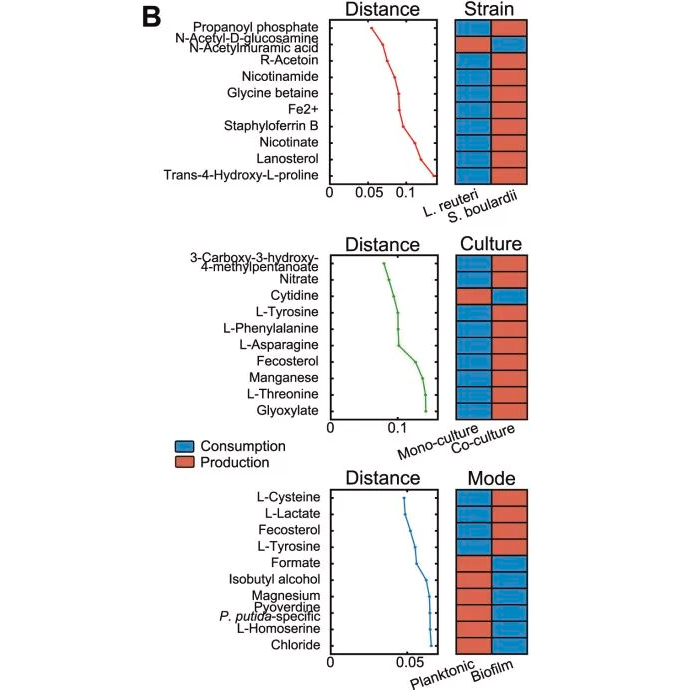
►⋙
下图展示了在单一培养和共培养下,各代谢物归一化后的增长率差异,以更好地评估群落建立的影响,并做出更详细的互动机制假设。
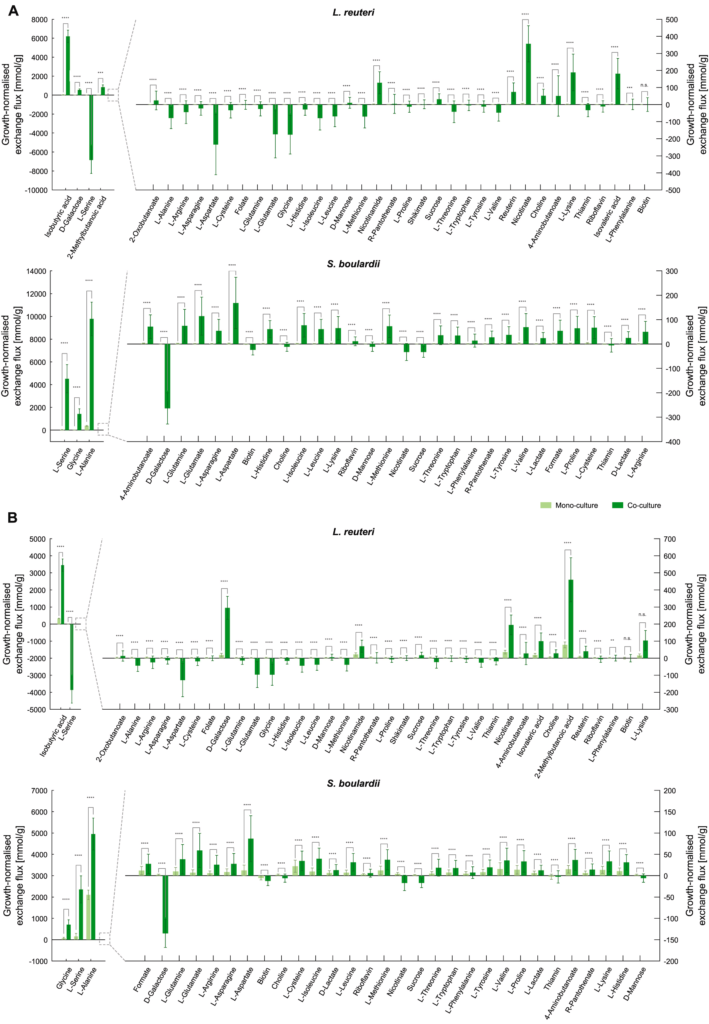
可以看到,当在增长率归一化时,许多健康相关化合物与单一培养相比,在共培养中产生得更多。尽管总氨基酸产量下降,但当微生物在一起生长时,这些氨基酸实际上可能会进行大量的交换。
这是一个综合实验和计算机建模方法来探究生长方式(生物膜vs浮游生长)对生态相互作用(单一培养vs混合培养)的影响的研究。
研究发现,特定微生物代谢物的产生会受到生长模式、生长培养基的组成、微生物种类及其在共培养中的相互作用的显著影响。
研究人员表示通过文中提出的计算方法,可以设计新的益生菌产品,并为代谢工程方法的应用提供科学见解,以优化所需有益代谢物的生产。
这可以提高某些益生菌产品的生物学和商业价值,直接造福于益生菌行业,临床上也有可能为与肠道菌群相关的疾病制定更好的治疗方案,如炎症性肠病、肥胖、2型糖尿病、心血管疾病、自身免疫和神经系统疾病。
参考文献:
Zampieri G, Efthimiou G, Angione C. Multi-dimensional experimental and computational exploration of metabolism pinpoints complex probiotic interactions. Metab Eng. 2023 Jan 28;76:120-132. doi: 10.1016/j.ymben.2023.01.008. Epub ahead of print. PMID: 36720400.
谷禾健康
锌与肠道微生物
锌(Zn)是人体必需的微量元素,是人体中第二丰富的矿物质。锌在细胞和器官功能中起着关键的催化、调节和结构作用。
★ 膳食锌缺乏或过量均不健康
锌缺乏与发育不良、免疫功能低下、味觉丧失、不良妊娠结局、脱发、皮肤损伤和神经行为异常有关。
世界卫生组织估计,全球三分之一的人口面临锌缺乏症的风险,他们的饮食锌摄入量不足或食物中锌的生物利用度低。
不过需要注意不可在没有医嘱下擅自过量补充,导致锌的摄入量超过既定的营养需求。锌摄入过量也不利于健康,容易导致氧化应激增加、长期记忆受损、肠道吸收和分泌能力改变以及内脏脂肪增加。
近年来的几项体内研究表明,膳食锌摄入缺乏或过量会影响肠道菌群的组成和功能,进而对人体健康产生一定的影响。
本文主要讲述锌缺乏或锌超载情况下细菌类群的一些改变,短链脂肪酸生成变化,细菌金属抗性和抗生素抗性基因增加,以及锌相关转运蛋白的变化。
有助于进一步了解膳食锌对人体肠道微生物组的影响,并阐明利用肠道微生物组作为潜在锌状态生物标志物的适用性。帮助人们更好地控制锌的摄入量来塑造自身健康。
锌(Zinc)是一种化学元素,也是第四”常见”的金属。在现代工业中,锌是电池制造上不可替代、相当重要的金属。
锌还是人体必需的微量元素之一,起着极其重要的作用。
•维持正常食欲,利于生长发育
缺锌会导致味觉下降,锌会影响舌黏膜的正常功能,缺锌时味觉敏感度会比较差,可能还会因此而产生食欲不振或厌食等。长时间厌食会影响营养物质吸收,产生营养不良。
锌有助于生长发育、智力发育,缺乏锌会对我们的身体,特别是生长发育造成严重影响。所以,补充足够的锌是必须的。
•增强人体免疫力
锌是免疫器官胸腺发育的营养素,只有锌充足才能有效保证胸腺发育,正常分化T淋巴细胞,促进细胞免疫功能。失调的锌稳态会损害整体免疫功能,从而增加对感染的易感性。
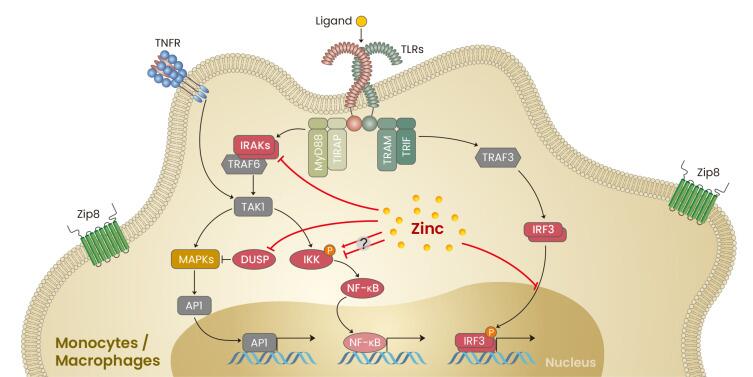
锌还以类似于钙的方式作为免疫反应的离子调节剂,通过作为细胞内信使参与信号通路。
锌在单核/巨噬细胞信号传导中的作用

Kim B,et al.Mol Cells.2021
•影响伤口恢复
锌作为许多转录因子和酶系统的辅助因子,包括锌依赖性基质金属蛋白酶,可在伤口修复过程中增强自体清创和角质形成细胞迁移。
缺锌易导致皮肤疾患,患口腔溃疡,受损伤口不易愈合,青春期痤疮等。
★ 锌对肠道微生物有重要影响
肠道微生物在宿主营养状况中发挥着重要作用,在免疫、与宿主细胞相互作用、代谢不可消化的营养素和合成必需维生素等方面发挥着关键作用。
锌结合蛋白占细菌蛋白质组的5%,突出了细菌定植胃肠道的主要锌。锌是一种重要的营养物质和抗菌剂,近年来的研究发现,膳食中锌含量的不同导致肠道微生物的组成和功能产生改变,进而对人体健康产生一系列影响。
膳食锌(锌缺乏或锌过量)对肠道菌群的影响
向上滑动阅览



Cheng J,et al.Crit Rev Food Sci Nutr.2023
接下来跟随谷禾了解一下膳食锌缺乏和过量情况下肠道微生物的具体改变
1. 在缺锌条件下,发现能够有效竞争锌的细菌(即肠杆菌科和瘤胃球菌科以及肠球菌属和脱硫弧菌属)增殖。
2. 与碳水化合物和糖代谢相关的微生物代谢途径的表达改变已被发现与锌缺乏相关,其中细菌可以将碳水化合物和糖代谢为短链脂肪酸。
3. 粘蛋白相关细菌丰度的改变(即粘嗜阿克曼氏菌和异源杆菌)也与锌缺乏有关。肠道粘蛋白由粘多糖和糖蛋白组成,细菌可以以这种粘蛋白为食并产生短链脂肪酸。
与锌缺乏相关的潜在结果包括细菌的定植和生长,这些细菌可以有效地竞争锌。
4. 此外,锌缺乏可能导致产生短链脂肪酸的细菌(即Blautia和Ruminococcus)的丰度降低。短链脂肪酸浓度与肠道pH值相关,由于短链脂肪酸含量降低导致的pH值升高会降低锌的溶解度,从而降低锌的生物利用度和吸收。
与锌缺乏相关的潜在宿主和肠道菌群
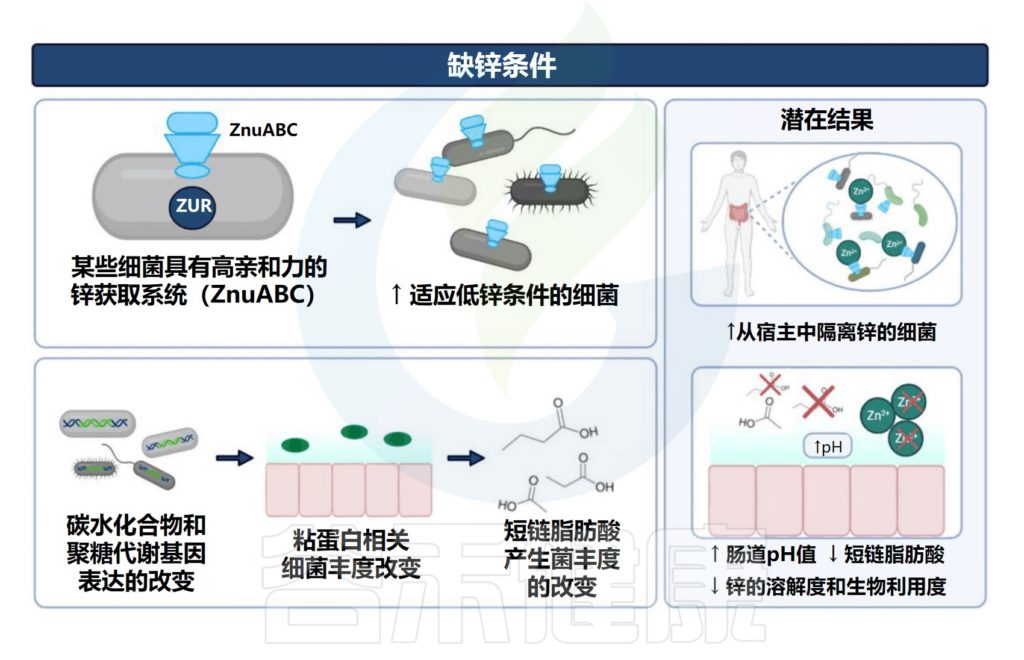
Cheng J,et al.Crit Rev Food Sci Nutr.2023
六项研究比较了锌缺乏相对于锌充足对肠道菌群的影响,其中五项研究通过膳食锌控制诱导锌缺乏。
与锌充足对照组相比,锌缺乏组血浆/血清、指甲、羽毛、肝脏、睾丸和粪便锌含量降低。
锌缺乏组的实验对象大部分生物多样性下降,尤其是粘蛋白相关细菌丰度降低,短链脂肪酸的产量也减少,微生物相关代谢也在一定程度上减弱。
以上实验研究主要是基于小鼠,大鼠,鸡和猪等动物实验,关于人类的临床实验还较少,但是动物的实验也可以为人类提供一定的参考价值。
锌缺乏影响微生物多样性
关于与锌缺乏相关的肠道菌群调节,所有六项研究都评估了α-多样性和β-多样性。
✦α多样性
关于缺锌对肠道菌群α-多样性的影响,六项研究尚无共识。总的来说,三项研究发现α-多样性的改变与缺锌相关,三项研究没有发现变化,其中大多数研究采用了不同的α-多样性测量方法。
缺锌对α多样性的影响具有差异
在锌缺乏的情况下,一项研究发现α-多样性以性别依赖的方式增加或减少(雄性小鼠增加,雌性小鼠减少)。
同样,在人类研究中,缺锌对α-多样性的影响也存在差异。在学龄儿童中,锌缺乏导致α-多样性增加,而在锌缺乏的母乳和配方奶喂养的婴儿中,α-多样性降低。
虽然每项研究中生物多样性变化的差异可能与不同的研究对象有关,但还需要在人类和动物模型中进一步研究锌缺乏对肠道微生物群改变的影响。
✦β多样性变化暂不明确
进行的六项研究中有五项发现了与锌缺乏相关的β多样性变化。
然而,在第六项研究中没有发现β-多样性的变化,该研究使用了θYC距离测量。β多样性的变化并不一定表明细菌类群的有益或消极变化。
●门水平
在门水平上,锌缺乏与变形菌门(Proteobacteria)和黑色素杆菌(Melainabacteria)的增加以及厚壁菌门(Firmicutes)的减少有关。
注:其中变形菌丰度的增加被认为是生态失调和疾病风险的潜在诊断标准,因为在健康的人类肠道中发现了低变形菌丰度。而厚壁菌门的许多成员都是有益菌
这或许可以从一部分角度解释锌缺乏对健康的不利影响
短期缺锌与长期缺锌菌群改变不同
短期缺锌会降低疣微菌门(Verrucomicrobia)的丰度(主要是Akkermansia muciniphila属),而长期缺锌则与疣微菌门丰度的增加有关。
菌群改变出现性别差异
发现与锌充足的野生型小鼠相比,通过ZnT7敲除诱导的锌缺乏导致了敲除(ZnT7-/-)和异质(ZnT7+/-)小鼠的红蝽菌科(Coriobacteriaceae)丰度和Allobaculum属丰度的增加,这种变化仅在雌性小鼠中发现。这表明锌的调节功能可能因性别而异。
注:因此锌对不同性别的人群影响可能不同
●属水平
在属水平上,研究发现双歧杆菌(Bifidobacterium)、希瓦式菌属(Shewanella)、Rheinheimera的减少与血浆锌水平相关。
除此之外还发现粪杆菌属(Faecalibaculum)增加,经黏液真杆菌属(Blautia)、乳杆菌(Lactobacillus)、Negativibacillus减少。
慢性缺锌的情况
在慢性锌缺乏的情况下,以下菌群丰度增加:
肠球菌(Enterococcus) ↑↑↑
肠杆菌(Enterobacteriaceae) ↑↑↑
瘤胃球菌科(Ruminococcaceae) ↑↑↑
而下列菌群丰度下降:
Clostridiales ↓↓↓
消化链球菌科(Peptostreptococcaceae) ↓↓↓
●物种水平
在物种水平上,Lachnospiraceae NK4A136和
真杆菌属(Eubacterium coprostanoligene)的丰度随着锌的缺乏而增加,而Ruminococcus gauvreauii的丰度随着锌的缺乏而降低。
此外还发现了一些菌群的增加和下降
增加的菌群:
吲哚梭菌(Clostridium indolis) ↑↑↑
未分类的某种拟杆菌 ↑↑↑,
减少的菌群:
酸奶瘤胃球菌(Ruminococcus lactaris) ↓↓↓
肠球菌(Enterococcus sp.) ↓↓↓
Clostridium lactatifermentans ↓↓↓
Clostridium clostridioformme ↓↓↓
// 注意
锌缺乏可能使得一些对人体有益的细菌丰度下降,而致病菌的丰度上升,从而对健康产生影响
虽然在上述研究中发现了从门到属水平的显著差异,但在一些学者的研究中,微生物群的相对丰度没有显著差异。
锌缺乏对菌群主要代谢产物——短链脂肪酸的影响
研究了锌缺乏与微生物代谢物(短链脂肪酸)生产和功能的变化。
✦锌缺乏影响短链脂肪酸的产量
锌缺乏时间不同对短链脂肪酸的影响不同
一项小鼠研究发现,短链脂肪酸产量在短期锌缺乏时增加,但在长期锌缺乏时减少。鸡的研究发现,相对于锌充足,锌缺乏会降低短链脂肪酸的产量。
具体而言,短期(4周)饮食锌不足会增加盲肠乙酸,并与各组短链脂肪酸产生细菌(Flavonifractor、Alistipes、Odoribacter、Anaerotruncus、 Alloprevotella、Bifidobacterium adolescentis、Paralactobacillus Leisner)呈正相关,表明在锌匮乏的条件下,肠道微生物群可以增加锌的利用率。
另一方面,长期锌不足(8周)与戊酸盐产量下降有关。发现与碳水化合物、氨基酸、萜类/聚酮、核苷酸代谢、聚糖生物合成和代谢以及异种生物降解和代谢相关的微生物代谢途径随着长期锌缺乏而降低。
✦短链脂肪酸浓度影响锌的利用与吸收
短链脂肪酸浓度与肠腔pH值相关,其中,由于短链脂肪酸含量增加而导致的pH值降低可增加锌的溶解度,从而增加锌的生物利用度和吸收。
说明锌与短链脂肪酸存在相互作用的关系
鉴于短链脂肪酸、宿主营养和肠上皮维持之间的联系,其中短链脂肪酸的产生与黏蛋白的产生有关,细菌发酵碳水化合物和抗性淀粉,短链脂肪酸被用作细菌能量来源。
一组研究人员发现锌缺乏导致乙酸盐产量下降,这可能是由于产生短链脂肪酸的细菌属,如梭状芽胞杆菌和瘤胃球菌的减少。
综上所述,锌缺乏情况下肠道菌群组成的改变及其相关代谢途径影响碳水化合物和糖基代谢、肠道黏蛋白降解,从而影响短链脂肪酸的产生。
锌缺乏与代谢通路变化
✦锌缺乏使微生物相关代谢减弱
在微生物代谢途径中,锌缺乏与碳水化合物代谢相关基因的表达降低有关、以及糖聚糖生物合成和代谢、核苷酸代谢、氨基酸代谢、抗生素耐药性、矿物质吸收、脂肪酸代谢、一级/二级胆汁酸合成和异种生物降解都有联系。
此外,发现与锌吸收、脂肪酸代谢和碳水化合物消化和发酵相关的KEGG途径表达减少,其中最后一种途径也可能导致短链脂肪酸产量减少,这与提高锌生物利用度有关,从而使锌缺乏状态持续存在。
注:基于人类疾病KEGG通路,分别在短期和长期锌缺乏症中发现了更多与物质依赖和心血管疾病相关的基因。
锌缺乏对肠道粘蛋白及相关菌的影响
额外的微生物类群改变与锌缺乏和肠粘蛋白丰富有关。由杯状细胞产生的黏液层由粘多糖和糖蛋白组成,并容纳有助于消化矿物质的肠道微生物群。
粘蛋白——黏蛋白关键特征是其形成凝胶的能力; 因此它们是大多数凝胶状分泌物的关键组成部分,提供润滑,细胞信号通路及化学屏障的功能。
✦锌缺乏影响粘蛋白相关细菌丰度
锌缺乏会影响与粘蛋白相关细菌丰度,例如嗜黏蛋白阿克曼菌的减少不利于肠道屏障的完整性,并在一定程度上影响乙酸和丙酸等短链脂肪酸的产生,从而对健康产生危害。下面是一些具体实验证据:
锌缺乏影响嗜黏蛋白阿克曼菌丰度
共生细菌以黏液蛋白为食并粘附在黏液蛋白上,与宿主相互作用并调节黏液蛋白基因的表达和分泌,与上皮细胞相互作用以维持黏液和上皮内稳态。
在短期锌缺乏的情况下,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在统计学上显著下降,这与之前的研究一致,这些研究表明嗜黏蛋白阿克曼菌相对丰度较低与锌缺乏相关。
嗜黏蛋白阿克曼菌(A.muciniphila)存在于大肠黏液层,调节肠道屏障的完整性,其丰度与代谢性疾病和炎症性肠病发病率呈负相关。此外,嗜黏蛋白阿克曼菌是一种粘蛋白降解物,可将粘蛋白转化为乙酸和丙酸以供能量使用。
锌缺乏与其他影响粘蛋白丰度的菌群相关
同样,在缺乏锌的情况下,发现经黏液真杆菌属(Blautia)和乳酸杆菌属,以及粪杆菌(Faecalibaculum)属的增加,这些都是可能影响粘蛋白丰度的类群。
乳酸菌的减少可能会减少肠道黏蛋白,因为某些乳酸菌会刺激黏液蛋白2 (MUC2)的产生,黏液蛋白2是杯状细胞表达的主要肠道黏蛋白。
经黏液真杆菌属(Blautia)含量降低,经黏液真杆菌属含有粘蛋白降解基因是一种短链脂肪酸(丁酸和乙酸)生产者,其丰度可能预测锌状态的差异。
异杆菌属丰度增加有利于结肠上皮健康
研究发现,与锌充足野生型(ZnT7+/+)相比,通过敲除ZnT7诱导的锌缺乏导致敲除(ZnT7-/-)小鼠和异质性(ZnT7+/-)小鼠的异杆菌属(Allobaculum)丰度在雌性小鼠中均有所增加。黏蛋白密度(酸性和中性黏蛋白减少,杯状细胞数量减少)与异杆菌属(Allobaculum)相对丰度呈负相关。
异杆菌属(Allobaculum)与发酵碳水化合物(即粘蛋白)有关,以产生短链脂肪酸(乳酸和丁酸),供异源菌群作为碳源利用,这表明异杆菌属(Allobaculum)丰度的增加可能与有利于结肠上皮健康的潜力有关。
小结
总的来说,锌缺乏通常会导致细菌生物多样性、从门到种水平的细菌丰度的降低、短链脂肪酸的产生减少以及与碳水化合物和糖基代谢相关的细菌代谢途径的减弱,锌相关蛋白基因表达也可能在一定程度上减弱。
注:这些变化影响了人体原本正常的代谢,可能导致一些疾病的产生。
注意
所有六项关于锌缺乏和肠道菌群改变影响的研究都使用了膳食锌作为锌源。对于α-多样性和短链脂肪酸产生的变化还缺乏共识,一个可能的解释可能是所使用的动物模型以及模型的生命阶段和性别的差异。
注:只有一项研究使用了大鼠模型,而所有其他研究都使用了小鼠模型。与其他研究相比,所使用的小鼠年龄最大,小鼠肠道菌群随着年龄的增长逐渐稳定。
三项研究仅使用男性受试者,一项研究仅使用女性受试者,两项研究同时使用女性和男性受试者,其中考虑到人类性别之间免疫功能的差异以及锌、免疫功能和肠道微生物组之间的联系,在设计阐明锌缺乏症对肠道微生物组组成和功能的影响的未来研究时,应考虑受试者的性别。
1.与高锌或锌过载相关的潜在结果包括具有高锌条件机制的细菌定殖和生长。
某些细菌具有通过有效的重金属排出系统来抵消高锌浓度的机制。在高锌条件下,发现了对增加金属锌暴露有进化适应的细菌(即梭状芽孢杆菌科、肠杆菌科和大肠杆菌)。
2.增加的细菌进化适应增加的金属暴露(金属抗性),已发现与抗生素耐药性相关的微生物基因表达增加有关。
此外,高锌条件可能会潜在地增加耐药肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐药现象。
与高锌或锌过载相关的潜在宿主和肠道菌
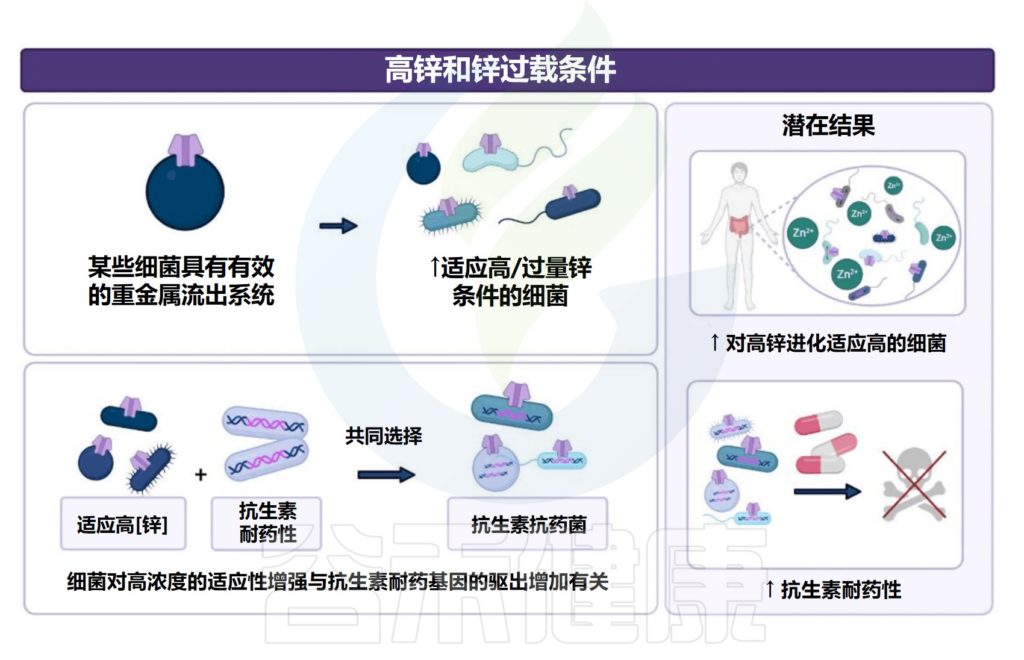
Cheng J,et al.Crit Rev Food Sci Nutr.2023
★锌过量的危害
1.一般情况下,补锌过量可能会导致机体出现锌中毒,大部分人群可能会出现胃肠道症状,如恶心、呕吐等。
2.抵抗力下降:过高的血锌会抑制白细胞的吞噬作用和杀菌作用,使人体的抵抗力下降,容易遭受致病菌侵袭。
3.记忆力下降:对于不缺锌的人,额外补充有可能造成体内锌过量,从而引发代谢紊乱,甚至会对大脑造成损害,可能损伤大脑神经元,导致记忆力下降。
4.贫血:有些家长误把锌制品当作营养品,给婴儿长期大量服用,殊不知补锌过量同样会带来危害,会使体内的维生素C和铁的含量减少,抑制铁的吸收、利用,容易引起、加重缺铁性贫血。
下面具体讲述一下锌过量状态下肠道微生物具体发生的变化
五项研究比较了高膳食锌或锌过载相对于锌充足对肠道菌群的影响。
锌过量与相关代谢基因
与锌充足对照相比,高锌或锌过载导致锌相关蛋白基因表达有所改变。
✦高锌摄入降低锌转运蛋白ZIP4基因表达
ZIP4是锌从肠腔进入肠上皮细胞的主要导入物,由饮食中的锌调节,随着锌摄入的增加,ZIP4的表达下调。
两项研究发现,高锌摄入量会降低ZIP4基因的表达。还发现,高锌摄入的小鼠ZnT2表达增加(仅回肠),MT1和MT2表达增加(回肠和结肠),而其他测试的ZnT(4-7,9)和ZIP(1,3,5-11,13,14)蛋白的基因表达没有变化。
✦脂质代谢基因表达降低
与短链脂肪酸产量降低一致,与脂质代谢相关的微生物基因表达也在高锌和过量锌饲粮中被发现降低。
✦抗性基因表达增强
在微生物代谢途径中,高锌和过量膳食锌与抗生素耐药性相关基因的表达增加有关、传染病和金属离子结合,以及与脂代谢、异种生物降解和酶活性(果胶酯酶、α-葡糖醛酸酶、α-l-阿拉伯糠醛苷酶)相关的基因表达降低。
抗生素耐药性增强
将抗生素抗性基因丰度的增加与肠杆菌的增加联系起来,其中高氧化锌饲粮已普遍用于猪,并导致促进抗生素耐药性。
具体而言,在猪肠道中发现耐多药大肠杆菌的患病率增加,这归因于高氧化锌饮食。
研究发现,饮食中锌过量会增加肠球菌,其中肠球菌具有质粒编码的耐药基因,本质上对许多常见抗菌剂不那么敏感。
尽管没有研究微生物代谢基因,但考虑到细菌类群对锌增加的适应性增加,考虑到金属耐药基因和抗生素耐药基因的共同共存,有可能存在抗生素耐药细菌基因的增加。
总的来说,高锌或锌过载似乎潜在地增加了耐抗生素的肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐抗生素现象,从而导致人体的抗生素和金属耐药性增强。
锌过量影响微生物多样性
评估了与高锌或锌过载相关的肠道菌群调节的多样性测量;4项研究评估了α-多样性,5项研究评估了β-多样性。
✦高锌下α多样性降低
利用Pielou的均匀度α-多样性测量发现,α-多样性随着高锌而降低。通过1/Simpson多样性测量也发现,α-多样性随着Zn过载而降低。
此外,短期(4周)高饲粮锌或锌过载被发现不会显著影响α-多样性,长期高锌被发现不会改变(观察物种)或降低α-多样性,长期(8周)锌过载也不会改变α-多样性。
注:这可能取决于所使用的评估方法
α多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌等增多,进而影响人体的的健康。
✦β多样性的变化未达成共识
关于高锌或锌过载对微生物组β-多样性的影响,在五项选定的研究中也没有共识,其中三项研究发现了与高锌或锌过量相关的β-多样性变化,并在其他两项研究中保持不变,尽管不同的研究使用了不同的距离测量。
疣微菌门的丰度与锌过载暴露时间有关
在小鼠中,高饲粮锌和锌过载在短期内增加了疣微菌门(Verrucomicrobia)丰度,但在长期暴露后会降低疣菌菌丰度,此前在仔猪中也有这种情况,其中长期高饲粮锌或锌过载会通过细菌金属间竞争、金属蛋白错金属、或与金属毒性和细菌金属稳态改变相关的氧化还原活性。
高锌显著增加了梭状芽孢杆菌科(Clostridiaceae)的丰度,其中梭状芽孢杆菌科被发现具有通过有效的重金属外排系统来抵消高锌浓度的机制,该系统可能是从携带重金属抗性基因的质粒转移而来的。
梭菌科更适应高锌的浓度
鉴于这些更强的抗锌机制,梭菌科可以适应高锌浓度,因此相对于其他细菌有更多的定殖。最后,在高膳食锌摄入量下,与金属离子结合和金属离子转运相关的微生物基因表达增加,支持了对高膳食锌环境具有特定进化适应的正向选择细菌类群的假设。
注:在所选研究中,在不同的分类水平上研究了肠道微生物群的组成和功能的变化。在这五项研究中都发现了细菌类群的显著变化,这些变化可以归因于微生物群对有效锌浓度增加的适应。
✦门水平
对于细菌类群的变化,在门水平上,两项研究发现高锌没有显著改变细菌丰度。
虽然在两项利用猪模型的研究中拟杆菌门(Bacteroidetes)丰度有所增加,但在门水平上的其他变化没有达成共识。
时间不同菌群丰度变化不同
研究发现短期(4周)高锌和锌过载会增加疣微菌门(Verrucomicrobia)的丰度,而长期暴露(8周)会降低疣微菌门(Verrucomicrobia)的丰度。
另一项研究发现,短期锌过载导致变形菌门丰度增加,长期锌过载导致放线菌门丰度增加。
✦科、属、种水平变化较小
与膳食锌含量过高或过量相关的科、属或种水平变化之间不明显。
在短期(4周)和长期(8周)暴露中,黑色素杆菌(Melainabacteria)与血清锌水平呈负相关,而Desulfovibrio sp. ABHU2SB与血清锌水平呈正相关。
✦锌过载时肠道菌群的具体变化
罗伊氏乳杆菌(L. reuteri)与短期锌过载呈负相关;然而,随着长期锌过载,该属与血清锌无显著相关性。
高锌显著增加了梭菌科(Clostridiaceae)丰度,降低了乳杆菌科(Lactobacillaceae)和肠杆菌科(Enterobacteraceae)丰度。
在利用猪模型的研究中发现, 普雷沃氏菌(Prevotella)和乳酸菌属增加,琥珀酸弧菌属(Succinivibrio) 减少。
另一组研究人员发现锌过载下列菌株丰度增加:
拟杆菌属(Bacteroides) ↑↑↑
副杆菌属(Parabacteroides) ↑↑↑
柯林斯菌属(Collinsella) ↑↑↑
醋弧菌属 (Acetivibrio) ↑↑↑
经黏液真杆菌属(Blautia) ↑↑↑
粪球菌属(Coprococcus) ↑↑↑
普拉梭菌(Faecalibacterium) ↑↑↑
霍尔德曼氏菌(Holdemania) ↑↑↑
Subdoligranulum ↑↑↑
Nestiinimonas ↑↑↑
Lachnoclostridium ↑↑↑
Pseudoflavonifractor ↑↑↑
而以下菌群减少:
巨型球菌属(Megasphaera) ↓↓↓
戴阿利斯特杆菌属 (Dialister) ↓↓↓
氨基酸球菌属(Acidaminococcus) ↓↓↓
瘤胃球菌(Ruminococcus) ↓↓↓
Treponema ↓↓↓
虽然生物多样性变化的差异可能与每项研究中不同的研究对象和不同的研究时间有关,但高膳食锌或锌过量对人类肠道微生物群的影响仍不确定,这突显了进一步研究的必要性。
锌过量对细菌主要代谢产物——短链脂肪酸的影响
✦高锌降低短链脂肪酸含量
长期(8周)高锌与对照组相比,短链脂肪酸总产量更低。具体而言,与锌充足相比,长期高饲粮锌导致盲肠戊酸、丁酸、乙酸、异戊酸、异丁酸和丙酸降低。
短链脂肪酸在管理炎症和促进肠上皮完整性方面发挥着重要作用,高锌除了抑制短链脂肪酸生成外,还发现导致结肠炎症增加。
锌过量与炎症及免疫
虽然锌通常被认为是安全的,因为它不具有氧化还原活性,但大量或过量的锌暴露与肠道功能的改变、免疫功能的改变和炎症有关,因此强调需要确定高剂量和锌过载剂量对肠道微生物组组成和功能的影响。
✦锌过量影响炎症疾病发病率
乳酸菌科的细菌与短链脂肪酸的产生有关,将碳水化合物发酵成乳酸。此外,乳酸菌,产生各种各样的胞外多糖,作为阳离子金属离子(如Zn2+)的结合位点,可以保护这些微生物免受金属毒性。
根据种类的不同,乳酸菌可以是促炎的,也可以是抗炎的。在一项研究中,来自乳酸菌科的细菌丰度增加(Lactobacillus spp.),但在两项研究中(罗伊氏乳杆菌)丰度下降,高膳食锌摄入量。人类罗伊氏乳杆菌丰度的降低与炎症疾病发病率的增加相关。
✦高浓度锌具有抗菌作用
此外,膳食中高浓度的锌在防御致病性大肠杆菌、单核细胞增生李斯特菌和链球菌方面发挥抗菌作用。
小结
总的来说,在大多数选定的研究中,高饲粮锌和锌过载状态与α-多样性降低或不变、短链脂肪酸产量降低以及金属和抗生素抗性基因增加有关。
这些因素都在一定程度上影响人体的健康,对其产生不利的影响。
不足之处
在每一项研究中,并没有量化短链脂肪酸和微生物代谢基因,这本可以更好地了解过量锌摄入相关的微生物群组成和功能。
饮食中高锌或锌过载对人类肠道菌群的影响研究较少。鉴于抗生素耐药性的潜在灾难性影响,未来的研究应了解微生物分类和多样性的变化,以及微生物代谢物产生的变化和驻留菌群的宏基因组潜力。
锌的每日推荐食用量
中国营养学会规定,婴幼儿(0-1岁)5毫克/天,儿童(1-10岁)10毫克/天。青春期男性15毫克/天,女性12毫克/天。
孕妇和哺乳期产妇因为母乳喂养,乳汁中的锌流失比较多,所以锌的摄入量也应多一点,每天20-25毫克。一般锌的摄入量不超过25毫克。
★ 含有锌的食物
海鲜类:如牡蛎、鱼、扇贝、虾仁等,不仅含有较多的锌元素,且含有较多的不饱和脂肪酸,有助于减少动脉硬化的发生风险,从而预防心血管疾病的发生,其中牡蛎的含锌量比较高;
肉禽类:如猪肝、瘦牛肉、猪肉、鸡肉等,通常会含有较多的蛋白质以及微量元素,如锌、铁、磷等,有助于补充锌元素以及预防缺铁性贫血的发生;
蛋类:如鸡蛋、鸭蛋中也含有一定的锌元素,还富含脂溶性维生素、磷脂等,有助于减少口唇干裂、皮炎等疾病的发生;
干果类:如花生、核桃、芝麻、蚕豆、黄豆、绿豆、板栗等,含有钙、锌等多种微量元素,以及胡萝卜素、核黄素等多种维生素和脂肪、碳水化合物,在补充锌元素的同时有助于能量的补充。
膳食锌缺乏与摄入过量都会影响肠道微生物组的组成和功能,进而影响人体正常代谢与健康。
缺锌时,肠道微生物组的改变包括α-多样性的改变、粘蛋白降解细菌丰度的下降、短链脂肪酸产生的减少以及影响碳水化合物和糖基代谢的代谢途径表达减弱。
过量摄入膳食锌的情况下,肠道微生物组变化包括α-多样性没有变化或减少,短链脂肪酸产量减少,细菌金属抗性和抗生素抗性基因的潜在增加。
未来期待更多关于锌等微量营养元素和肠道菌群互作以及影响机理的的人类试验,虽然人类膳食营养的研究中单一变量不太好控制,但是基于大人群的营养调查以及其他协变量控制情况下,去调查这些关键营养素与肠道菌群的扰动可以帮助进一步明确阐明营养在人体健康和疾病扮演的角色和作用机理,对于后续基于菌群或营养素的预防干预治疗有重要的指导价值。
主要参考文献:
Cheng J, Kolba N, Tako E. The effect of dietary zinc and zinc physiological status on the composition of the gut microbiome in vivo. Crit Rev Food Sci Nutr. 2023 Jan 23:1-20. doi: 10.1080/10408398.2023.2169857. Epub ahead of print. PMID: 36688291.
Kim B, Lee WW. Regulatory Role of Zinc in Immune Cell Signaling. Mol Cells. 2021 May 31;44(5):335-341. doi: 10.14348/molcells.2021.0061. PMID: 33986184; PMCID: PMC8175146.
Baholet D, Skalickova S, Batik A, Malyugina S, Skladanka J, Horky P. Importance of Zinc Nanoparticles for the Intestinal Microbiome of Weaned Piglets. Front Vet Sci. 2022 Jun 2;9:852085. doi: 10.3389/fvets.2022.852085. PMID: 35720843; PMCID: PMC9201420.
Chen, X., Y. Jiang, Z. Wang, Y. Chen, S. Tang, S. Wang, L. Su, X. Huang, D. Long, L. Wang, et al. 2022. Alteration in gut microbiotaassociated with zinc deffciency in school-age children. Nutrients 14 (14):2895.
Cheng, J., H. Bar, and E. Tako. 2021. Zinc status index (ZSI) for quantiffcation of zinc physiological status. Nutrients 13 (10):3399.
Chen, L., Z. Wang, P. Wang, X. Yu, H. Ding, Z. Wang, and J. Feng. 2021. Effect of long-term and short-term imbalanced Zn manipulation on gut microbiota and screening for microbial markers sensitive to zinc status. Microbiology spectrum 9 (3):e0048321.
Bombaywala, S., H. J. Purohit, and N. A. Dafale. 2021. Mobility of antibiotic resistance and its co-occurrence with metal resistance in pathogens under oxidative stress. Journal of Environmental Management 297:113315.
谷禾健康

抑郁症和抑郁情绪是不一样的,如果说抑郁情绪是一阵悲伤或沮丧,那么抑郁症可以具有巨大的深度和持久力。抑郁症不只是沮丧发作,也不是性格弱点,无法以“快刀斩乱麻”的方式轻松摆脱。
世界卫生组织统计,全球约10亿人正在遭受精神障碍困扰,新冠疫情后,全球精神障碍疾病负担更加沉重,抑郁症患者激增 5300万,增幅高达 27.6%。受抑郁症影响的女性多于男性。
抑郁症患者通常会出现持续的压抑,兴趣减退,动力不足;除了在情绪上的悲观冷漠之外,很多抑郁症患者还常伴有食欲不振、便秘等胃肠道症状。

抑郁症是一种多因素,多重机制参与的复杂的疾病,病情绵长。它与神经递质表达异常、炎性因子分泌、神经细胞通路改变、下丘脑-垂体-肾上腺(HPA)轴持续紊乱、肠道菌群改变及线粒体结构异常等诸多因素有关。
抑郁症在中医中属于“郁证”的范畴,几千年前的书籍中就已有所记载。《黄帝内经》中所述 “心主血脉、心主神志” , 这里“神志之心”与现代医学脑的生理功能基本对应,中医学“心与小肠相表里”理论与现代医学提出的“脑-肠轴”理论相通,其部分内涵可以理解为中枢神经系统与肠道菌群的密切关系。
近年来,越来越多的中药、中药复方被证实可以发挥抗抑郁作用,人们开始认识到中医药通过调节肠道菌群而影响抑郁症发生发展,这为抑郁症的治疗提供新思路。
本文主要介绍肠道菌群和抑郁症之间的关联,窥探中医与肠道菌群之间的微妙关联,以及基于肠道菌群来探讨中医药改善抑郁症的相关机制。
本文主要内容如下:

抑郁症是一种常见的医学疾病,会对感受、思维方式和行为方式产生负面影响。它是一种复杂的疾病,有多种成因,包括各种生活方式、饮食、环境和遗传因素。
▼ 常见的抑郁症症状有哪些?
抑郁的人通常会出现以下几种症状:

▼ 抑郁症有哪些类型?
不同类型抑郁症的例子包括:
双相情感障碍、重度抑郁症(临床抑郁症)、持续性抑郁症和季节性情感障碍。
双相情感障碍的人会经历抑郁和躁狂(情绪异常升高)或轻躁狂(明显但不一定异常的情绪升高)交替状态。
重度抑郁症的特征是严重的症状会扰乱个人的日常生活,通常会影响食欲、睡眠、工作或享受生活的能力。
持续性抑郁症涉及持续两年或更长时间的症状,有时以严重抑郁症发作为特征。
其他类型的抑郁症包括产后抑郁症、精神病性抑郁症和季节性情感障碍,每一种都在特定情况下发生。
产后抑郁症发生在女性分娩后的时期。症状包括焦虑、对照顾婴儿缺乏兴趣,以及悲伤、绝望或无能为力的感觉。
精神病性抑郁症是在精神病的背景下出现的,精神病可能涉及妄想、幻觉或偏执的症状。
季节性情感障碍的特点是抑郁症状在秋季和冬季发作,随着春季和夏季暴露于自然光的增加而缓解。
▼ 哪些人群患抑郁症的风险相对较高?
▼ 有什么方法可以治抑郁症?
目前用的较多的是药物和心理疗法。
目前常用的药物包括:
抗抑郁药可能会在使用的第一周或两周内产生一些改善,但可能需要两到三个月才能看到效果。
心理疗法帮助一个人识别扭曲/消极的想法,以更积极的方式应对生活中的挑战。
例如与他人建立积极的互动关系,识别消极的信念和行为并改善,学习设定切实可行的人生目标等。
心理疗法或“谈话疗法”有时单独用于治疗轻度抑郁症;对于中度至重度抑郁症,心理治疗通常与抗抑郁药物一起使用。
其他疗法包括:
电惊厥疗法、经颅磁刺激、按摩疗法、音乐或艺术疗法、瑜珈(或太极或冥想)、时间疗法、针灸疗法、写作疗法、光疗、有氧运动、基于肠道菌群调节的补充剂非药物疗法(包括益生菌、益生元等)等。
▼ 什么原因可能导致抑郁症?
与抑郁症发生相关的因素可能有很多:
自尊心低、容易被压力压垮,对自己和世界产生消极想法,这样的人群似乎更容易患抑郁症。
持续暴露于暴力、忽视、虐待或贫困等不良环境,或不利的生活事件,会增加一个人患抑郁症的可能性或引发抑郁发作。
抑郁症可以在家族中遗传。例如,如果同卵双胞胎中的一个患有抑郁症,则另一个有 70% 的机会在一生中的某个时候患上抑郁症。
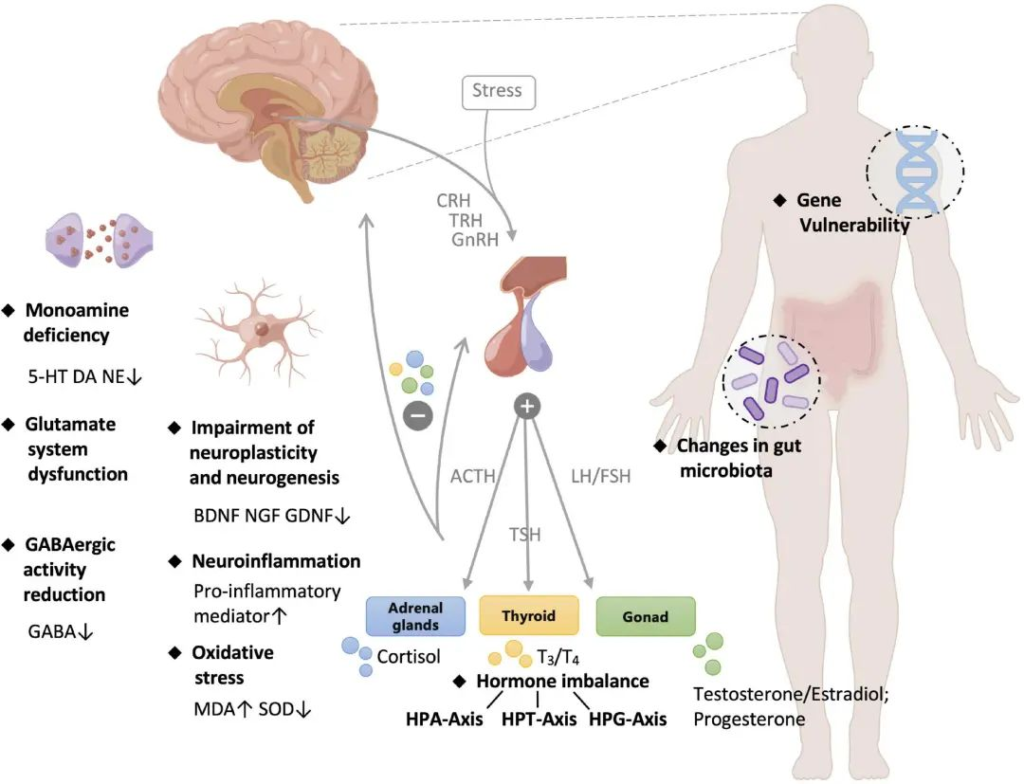
抑郁症的发病机制复杂且仍然难以摸透,目前已经提出了几种假说/理论来从不同的角度解释临床表现。
抑郁症的病理学
doi.org/10.3389/fpsyt.2022.1054726
单胺假说:
谷氨酸能假说和 GABA 能缺陷假说:
激素失调:
神经发生和神经可塑性假说:
肠道菌群理论:
关于肠道菌群如何通过微生物群-肠-脑轴影响抑郁症,我们在下一章节详细阐述。
肠道菌群与人体是共生互利密不可分的统一体, 又被称为人的 “ 第二大脑 ” ,它的作用不仅局限于胃肠道,还可以通过 “脑-肠轴” , 参与调控脑发育、应激反应、焦虑抑郁、认知功能等中枢神经系统的活动,从而对脑的功能和行为产生重大影响。肠道菌群、肠道、脑三者间密切的信息交流,共同影响人的喜怒哀乐。
抑郁患者常伴有胃肠功能障碍, 表现在食欲不振、代谢紊乱、胃肠功能紊乱及肠道菌群异常等方面的问题。即便不是抑郁症患者,我们回想一下,有时候对某些事件感到压抑,恐惧等情绪,或者一些状况感到焦虑的时候:是不是也会经历某种肠道不适,比如恶心、反胃、腹泻等。
胃肠道和大脑之间似乎有着某种联系,如果说大脑可以影响肠道,那么反过来肠道是不是也能影响大脑?这种联系究竟是怎么发生的?
本章节我们详细了解其中的故事。

近期发表在《自然通讯》杂志上的两项研究发现,肠道中的几种细菌与抑郁症状之间存在联系。
一 “抑郁症状的肠道微生物组关联研究” :

该研究调查了来自鹿特丹研究队列的 1,054 名参与者的粪便微生物组多样性和组成与抑郁症状的关系,并在 1,539 名受试者的阿姆斯特丹 HELIUS 队列中验证了这些发现。
研究人员确定了 13 个与抑郁相关菌群,包括:
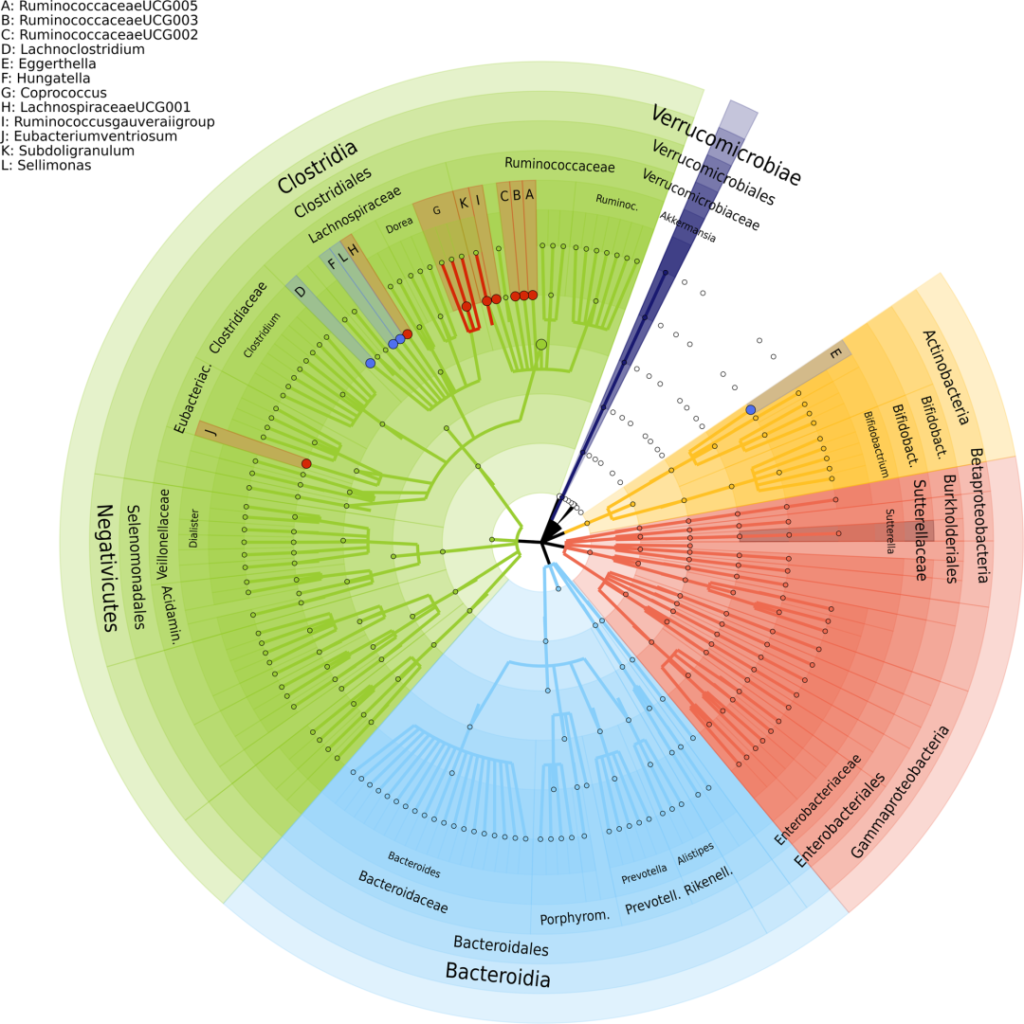
红点表示与抑郁症状负相关的属,蓝色点表示与抑郁症状正相关的属。最外层描述了门级,然后是纲、目、科和属级。
已知这些细菌参与谷氨酸、丁酸、血清素和γ-氨基丁酸 (GABA) 的合成,这些是抑郁症的关键神经递质。该研究表明,肠道微生物组成可能在抑郁症中发挥关键作用。
二 “跨种族的肠道菌群和抑郁症状”的研究:
不同种族群体的微生物组和抑郁症状水平差异很大。因此,任何针对微生物组的抑郁症干预都需要了解不同种族的微生物组抑郁症相关性。

通过分析HELIUS队列的数据,研究人员描述了生活在同一城市地区的6个种族群体(荷兰、南亚苏里南、非洲苏里南、加纳、土耳其、摩洛哥;N=3211)的肠道微生物群及其与抑郁症状的关联。
考虑到人口统计学、行为学和医学差异,肠道菌群在个体内部(α多样性)和个体之间(β多样性)可预测抑郁症状水平。
β多样性解释了29%-18%的抑郁症状的种族差异。与抑郁症状相关的细菌属属于多个科,主要包括:
该研究结果表明,肠道微生物群与抑郁症状水平相关,这种关联在不同种族群体中普遍存在。肠道微生物群的种族差异可能部分解释了抑郁症的平行差异。
以上我们了解到肠道菌群和抑郁症之间的关联。那么肠道菌群是如何影响抑郁症的?这就涉及到一个概念:
“ 微生物群-肠-脑轴 ”
1980 年,由于对神经元和脑细胞中胃肠内分泌系统的激素信号传导的研究发现,肠-脑轴的概念意外诞生。在接下来的几十年里,这一概念得到进一步加强和扩展,包括微生物群对肠-脑轴的贡献。
目前,微生物群-肠-脑轴更像一个复杂的循环而不是单向关系,它代表了宿主体内中枢神经系统、内分泌化学信号系统、免疫调节、微生物群和代谢效应,以及大脑和肠道的屏障功能之间的相互作用。
以上这些因素的协调对维持个体的健康状态起着重要作用。如果微生物群-肠-脑轴失衡,则会引起包括抑郁症等精神障碍。
我们前面的文章已经讨论过,肠道菌群可以通过许多潜在途径影响抑郁症,从大脑神经元到肠道小分子。
这里我们结合最新研究再了解一下,通常肠道菌群可以通过以下三种主要途径参与抑郁症,包括:
肠道微生物群和大脑之间的沟通途径
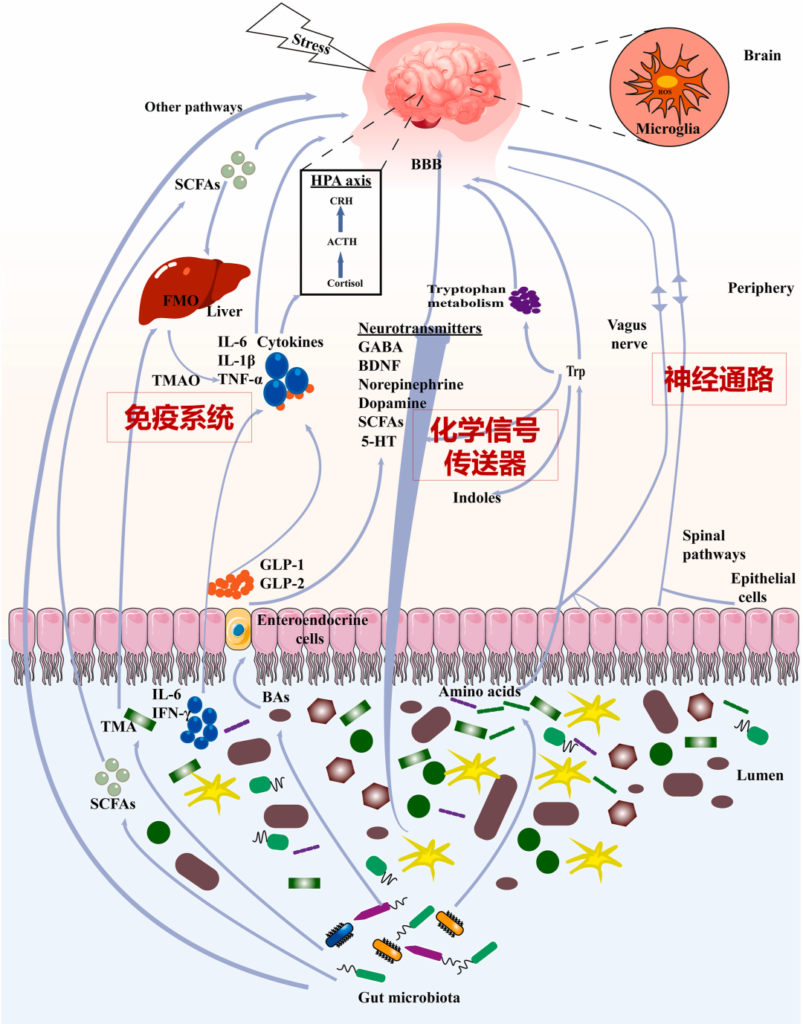
编辑
Li B, et al., J Ethnopharmacol. 2023
肠道菌群和大脑的沟通方式包括:
迷走神经、脊髓通路、短链脂肪酸(SCFA)、吲哚、色氨酸(Trp)、γ-氨基丁酸(GABA)、脑源性神经营养因子(BDNF)、去甲肾上腺素、多巴胺、5-羟色胺(5-HT)、细胞因子等。
接下来,我们就以上这些,逐一了解每个途径具体的运作方式。
Part 1 化学信号
▼
神 经 递 质 ——“信号兵”
神经递质是指脑内的化学物质,它们可以在神经元间的信息传递中起着重要作用,也就是充当“信号兵”的作用。根据其化学成分,神经递质分为:
神经递质——单胺
抑郁症的发病与单胺系统密切相关,多巴胺能、去甲肾上腺素能和血清素能神经元参与学习、记忆、行为、情绪和认知。
肠道微生物群影响单胺,包括多巴胺、去甲肾上腺素。例如,蜡样芽孢杆菌(Bacillus cereus)和蕈状芽孢杆(Bacillus mycoides)可以产生多巴胺。
神经递质——胆碱
胆碱是肠道、皮肤、神经系统和细胞中的必需营养素。胆碱水平会影响肠道菌群。如:胆碱缺乏可导致革兰氏阴性菌增加,并增强抑郁症患者的抑郁样行为。
肠道微生物群可以影响胆碱的生物利用度(如大肠杆菌可以抑制人体吸收胆碱的能力),从而导致胆碱缺乏和神经系统疾病的发生。
抑郁症患者的胆碱水平显著高于健康人。同时,抑郁症患者表现出肠道微生物群失衡。这表明影响胆碱代谢的肠道菌群可能参与中枢神经系统调节。
神经递质——谷氨酸
谷氨酸是大脑中的一种兴奋性神经递质,记忆、学习、行为、认知和发育与谷氨酸神经递质有关。突触传递通过谷氨酸受体实现,谷氨酸受体与神经递质释放和突触可塑性发育密切相关。
抑郁症患者的内侧前额叶皮质中谷氨酸水平降低。肠道细菌可影响谷氨酸代谢,如:
• 空肠弯曲杆菌 (Campylobacter jejuni)
• 谷氨酸棒状杆菌 (Corynebacterium glutamate)
• 乳酸发酵短杆菌 (Brevibacterium lactofermentum)
肠道微生物群将蛋白质分解为氨基酸,其中大部分被肠内肠细胞顶膜上的转运蛋白(如兴奋性氨基酸C1)吸收。因此,谷氨酸被肠道吸收并进入血液。谷氨酸转化为γ-氨基丁酸(GABA)。
部分肠道微生物群可以直接产生GABA。例如,双歧杆菌可以分泌大量GABA。
注:GABA作为大脑中的神经递质,促进神经系统的稳定。这些神经递质由肠道产生,通过肠脑轴进入中枢神经系统,发挥各种功能。
▼
胆 汁 酸
胆汁酸是胆汁的重要组成部分,在脂肪代谢中起着重要作用。胆汁酸在肝脏中产生,由肠道菌群产生的酶代谢,促进脂质的消化和吸收。
肠道微生物群介导的胆汁酸通过酶水解转化为次级胆汁酸,这会影响肠肝循环并导致中枢炎症。因此,胆汁酸代谢亢进与抑郁症的发展相关。
例如,Turicibacter 的相对丰度与抑郁症患者血液中的几种胆汁酸呈正相关,表明Turicibacter可能参与肠内胆汁酸的合成。
胆汁酸受体可以影响葡萄糖代谢,从而导致抑郁症的发生。肠道微生物群通过调节胆汁酸的变化,影响BA-TGR5-GLP-1途径,进而导致抑郁症的发作。
▼
短 链 脂 肪 酸
短链脂肪酸主要由乙酸、丙酸、丁酸和戊酸组成。可以通过肠道吸收并穿过血脑屏障,影响大脑功能。
短链脂肪酸可以改变血脑屏障的通透性,肠道菌群如如长双歧杆菌和短双歧杆菌产生的短链脂肪酸促进5-HT的合成和循环,从而实现抗抑郁作用。临床上没有针对短链脂肪酸的药物。外源性短链脂肪酸的补充还可能加重疾病。通过肠道微生物群调节短链脂肪酸可以改善抑郁症。
▼
三 甲 胺
三甲胺(TMA)是胃肠道化学递质的主要调节因子之一。肠道微生物群代谢肉类、高脂肪乳制品和其他食品中富含的胆碱和TMA。肠道微生物群产生的TMA由肝脏中的黄素单加氧酶3催化,生成三甲胺N-氧化物(TMAO),这会导致衰老、认知障碍、社会行为改变和脑部疾病。
TMA的产生可以通过调节肠道微生物群来抑制。
血清TMAO水平与心血管疾病和抑郁样行为相关。3,3-二甲基-1-丁醇(DMB)是人体中的一种重要神经递质,被证实可抑制肠道微生物群产生TMA,并降低高胆碱小鼠的TMAO水平。研究发现,DMB可以增加肠道中AKK菌的丰度。
TMA被肠道吸收,并穿过血脑屏障进入大脑,导致神经元兴奋性毒性、氧化应激和炎症。
TMA的结构与谷氨酸类似,谷氨酸是一种兴奋性神经递质。抑郁症患者表现出明显低于健康人的谷氨酸水平,TMA激活受体,导致分子损伤和氧化应激。因此,TMA影响抑郁症的发病机制。
通过抑制与TMA和TMAO相关的肠道微生物群,可以实现抗抑郁效果,并且可以减少药物直接作用引起的副作用。
▼
脑源性神经营养因子(BDNF)
BDNF是神经营养因子家族的一员,对海马和额叶皮层神经元的生长和存活至关重要。BDNF广泛分布于大脑中,与学习、记忆和神经发生密切相关。
BDNF——大脑和肠道细菌之间的重要纽带
肠道微生物群影响BDNF。例如,一些益生菌增加了血清BDNF水平,而补充真杆菌和梭状芽孢杆菌可降低BDNF的水平。肠道微生物群与BDNF密切相关,从而影响大脑功能。
肠道微生物群可以通过BDNF/TrkB信号通路实现双向肠道脑调节,这表明抑郁症的发病机制也与BDNF有关。
BDNF与抑郁症的发生和发展密切相关
肠道菌群失衡导致小鼠BDNF表达减少,导致认知功能和焦虑发生变化。同时,抑郁症患者大脑中BDNF和成熟BDNF的表达水平均降低。BDNF mRNA在海马和杏仁核(与抑郁症相关的区域)的表达显著降低。
在抑郁症模型中,发现将BDNF注射到中脑和海马的齿状回区域会产生类似抗抑郁的效果,通过注射TRK抑制剂可以逆转这种效果。
▼
色 氨 酸 代 谢
色氨酸是一种必需的氨基酸,可以影响人类的生长和健康。肠道微生物的变化可以通过调节色氨酸代谢来引起,而色氨酸代谢产物,如血清素、犬尿氨酸和吲哚,可以影响肠道微生物群和抑郁症之间的关系。
注:5-HT,5-羟色胺,又名血清素。
通过调节血清素的产生影响抑郁症
中枢神经系统中,色氨酸在酶的催化下生成血清素。血清素是参与控制睡眠、疼痛和情绪的关键神经递质。
肠道微生物群,例如乳球菌、乳杆菌、链球菌、大肠杆菌、克雷伯氏菌,通过表达色氨酸合酶来调节 5-HT 的产生, 脑肠轴进一步影响大脑中色氨酸的代谢。
通过肠道菌群代谢产物犬尿氨酸影响抑郁症
犬尿氨酸是色氨酸的代谢产物。犬尿氨酸具有抗氧化功能,可防止大脑皮层中的脂质氧化。肠道微生物群通过犬尿氨酸途径影响犬尿氨酸代谢。
抑郁症患者的血清 犬尿氨酸/喹啉酸 比率显着降低。犬尿氨酸和喹啉酸代谢之间的平衡与大脑结构和功能有关,尤其是在海马体中。
通过肠道菌群代谢产物吲哚影响抑郁症
吲哚是肠道菌群代谢的重要组成部分,与色氨酸代谢密切相关。
Part 2 神 经 通 路
▼
迷 走 神 经
迷走神经:脑-肠之间的一条高速公路,可以双向传递信息。
迷走神经是连接胃肠道和神经系统的最长神经之一,在肠道和大脑之间的主要沟通途径中起着重要作用。
一方面,肠道微生物群通过激活迷走神经来改变下游神经活动,如BDNF、GABA和催产素信号。肠道包含肠感觉上皮细胞,这些细胞与迷走神经神经元形成回路,使大脑能够直接感知肠道的变化。
另一方面,迷走神经可以通过刺激传出神经释放乙酰胆碱,从而影响巨噬细胞和α-7烟碱胆碱能神经受体,同时抑制炎症因子以实现抗抑郁作用。
补充乳酸杆菌JB-1菌株降低了前额叶皮层GABAα2受体的mRNA表达,从而降低了应激诱导的皮质酮水平和减轻抑郁。
▼
脊 髓
脊髓是自主神经系统的重要组成部分。脊髓连接大脑和肠道,肠道是中枢神经系统最重要的部分。脊髓损伤导致肠交感神经和自主神经张力失衡,导致胃肠道疾病。
肠道微生物群会影响脊髓
脊髓损伤会损害肠道神经系统,导致肠道运输功能障碍。脊髓损伤后的并发症,包括肠道功能障碍、焦虑和抑郁,可能是由于微生物群-肠-脑轴相互作用所致。
脊髓影响抑郁症的发病机制
脊髓中抑制性神经元的功能障碍导致脊髓层面传入感觉信息的放大,这是抑郁症患者疼痛的原因之一。疼痛和抑郁是密切相关的。事实上,前额叶和杏仁核与抑郁症密切相关。
Part 3 免 疫 系 统
免疫系统是肠脑轴的一部分,是从微生物到大脑的重要信号级联。肠道细菌失调导致肠道和血液之间的屏障变得可渗透,从而让“坏”细菌进入血液,可能引起炎症。
炎症可能是一个重要的免疫节点
免疫炎症反应机制:胃肠道系统是最大的免疫器官,抑郁症中存在一种慢性、低水平的炎症状态,肠道菌群可作用于免疫系统,降低外周血中促炎因子IL-1、IL-6、IL-8、IL-10、TNF-α、TGF-3等释放,并升高抗炎急性期蛋白、趋化因子、黏附分子、前列腺素等的表达,从而影响中枢神经系统,最终导致脑功能的改变。
临床上,抑郁症患者表现出细胞因子水平升高、神经发生减少和氧化应激水平升高。肠道菌群对免疫系统的调节是影响抑郁症的重要因素之一。
以上化学信号、神经通路、免疫系统三大途径,详细描述了微生物群-肠-脑轴之间的关联,以及肠道菌群是如何通过该轴影响抑郁症的发生发展。显而易见,肠道菌群其中扮演重要角色。
目前关于抑郁症的治疗,药物治疗是常见手段之一,化学合成药物因其疗效快、剂量低等优点被广泛使用,但容易引起耐药性,抑制质子泵,可能危害肠道健康。
药物对肠道菌群和肠道屏障的影响是药物安全性和有效性的重要评价指标。近年来,随着大众对肠道健康的日益重视,肠道已成为中药领域的研究热点。中药具有抗菌活性温和、修复作用以及人类不易对其产生耐药性等优点。
那么中药与肠道菌群有什么关联,与肠道菌群的相互作用及其肠道屏障的修复机制如何?下一章节我们来详细了解一下。
强调“整体性”
中医认为人与自然、社会环境具有整体性。自然界孕育人类的繁衍,人类活动顺应四时变化方能“精神乃治”,两者交互协作、对立统一,即通过“天人相应”实现“天人合一”。
作为人体内的微生态,肠道菌群与机体各项结构机能与内在环境共生共存,互根互用,构成一个有机整体。
“多因素”相关
中医提出体质是人体形态结构、功能活动的个体特征,与生命过程、遗传、后天环境等因素有关。
肠道菌群也受到饮食、生活方式、药物、社会环境、遗传、地理位置等多因素影响。
“个体化”防治
辨证论治作为中医基本原则之一,其核心目的是通过因人因时因地制宜辨证来更好地阐述个体疾病的易患因素和疾病发展的倾向性。
虽然人体肠道肠道菌群的核心菌群相似,但在不同宿主个体间,不同菌群的相对丰度和菌种存在很大差异。肠道菌群是健康的动态组成部分。个体化治疗计划的制定和实施与肠道菌群检测分析密切相关。
《黄帝内经》云:“胃足阳明之脉……是动则病洒洒振寒……心欲动,独闭户塞牖而处。甚则欲上高而歌,弃衣而走,贲响腹胀,是为骭厥。”
提示古人认为精神状态异常不仅与心失神明相关,亦与阳明胃病变关系密切。
中医学提出人体由“形”和“神” 构成,“形为神之宅”“神乃形之主”,即心理特征影响人的生理机能和形态结构,又同时受到机体生理病理情况反馈的影响。
现代医学提出心理压力或其他抑郁因素引起的饮食偏好、应激激素调节、炎症反应及自主神经反应可重塑肠道菌群,肠道菌群的代谢产物、毒素、神经激素等又能反过来调节宿主的饮食偏好或心情。
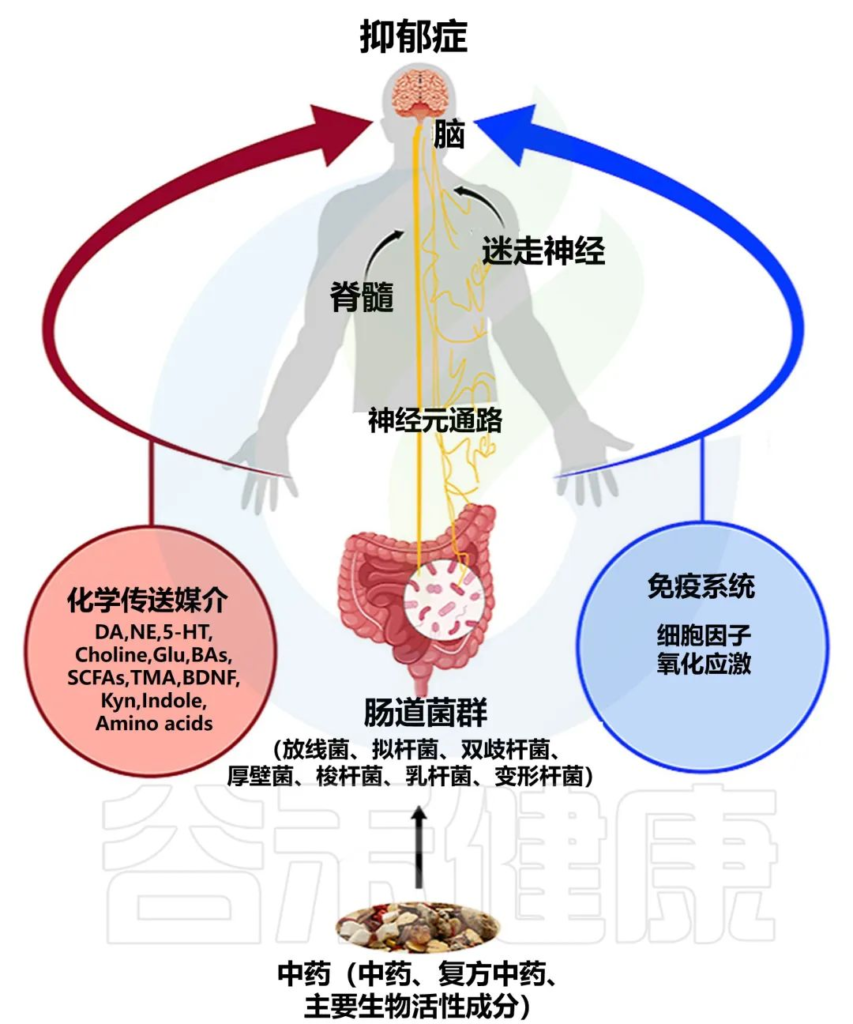
Li B, et al., J Ethnopharmacol. 2023
抑郁症可由“气”(生命能量)、血液循环障碍、“热”(炎症)、湿气和痰引起。
解气是抑郁症的常见治疗方法,从而促进血液循环、减少炎症和缓解疼痛。传统上,一些中药配方被用于治疗抑郁症,如逍遥散和小柴胡、甘麦大枣(GMDZD)和半夏厚朴汤。一些治疗胃肠道疾病的中药也具有抗抑郁类型的作用。
下面列一些常见的治疗抑郁症的复方中药配方:
逍遥散、解郁丸、四逆散、薯蓣散、小柴胡汤、柴胡温胆汤、柴胡桂枝汤
甘麦大枣汤、开心散、柴胡加龙骨牡蛎汤、酸枣仁汤
柴胡疏肝方、半夏厚朴汤、
补阳还五汤、血府逐瘀汤
百合地黄汤、小补心汤、归脾汤、桃红四物汤
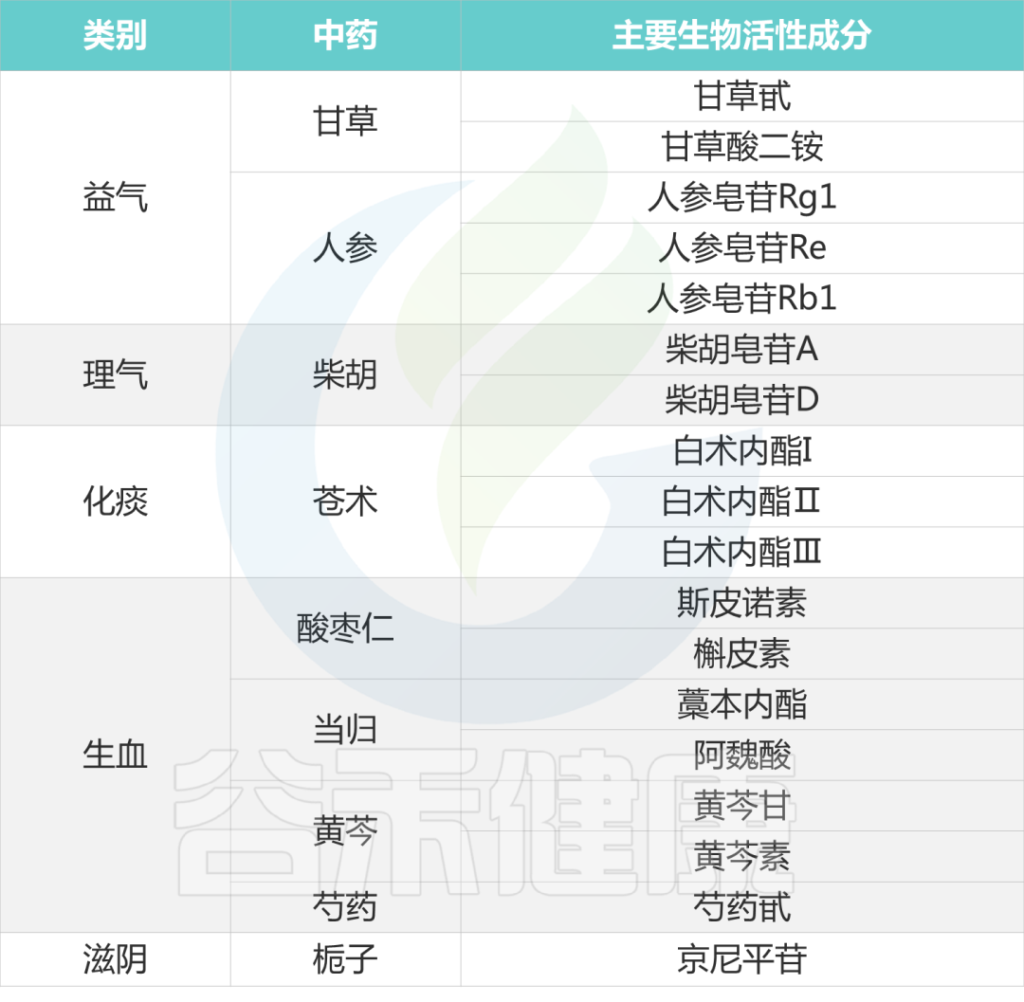
栀子豉汤、栀子厚朴汤
大多数治疗抑郁症的中药都具有疏肝、益气、养血、活血、化痰的作用。
下表列出各种中药的主要生物活性成分:
Li B, et al., J Ethnopharmacol. 2023
以上是中药与肠道菌群的整体关联,以及常见的一些具有抗抑郁作用的中药及其生物活性成分,这些中药是如何通过调节肠道菌群,从而达到抗抑郁的效果?下一章节我们继续。
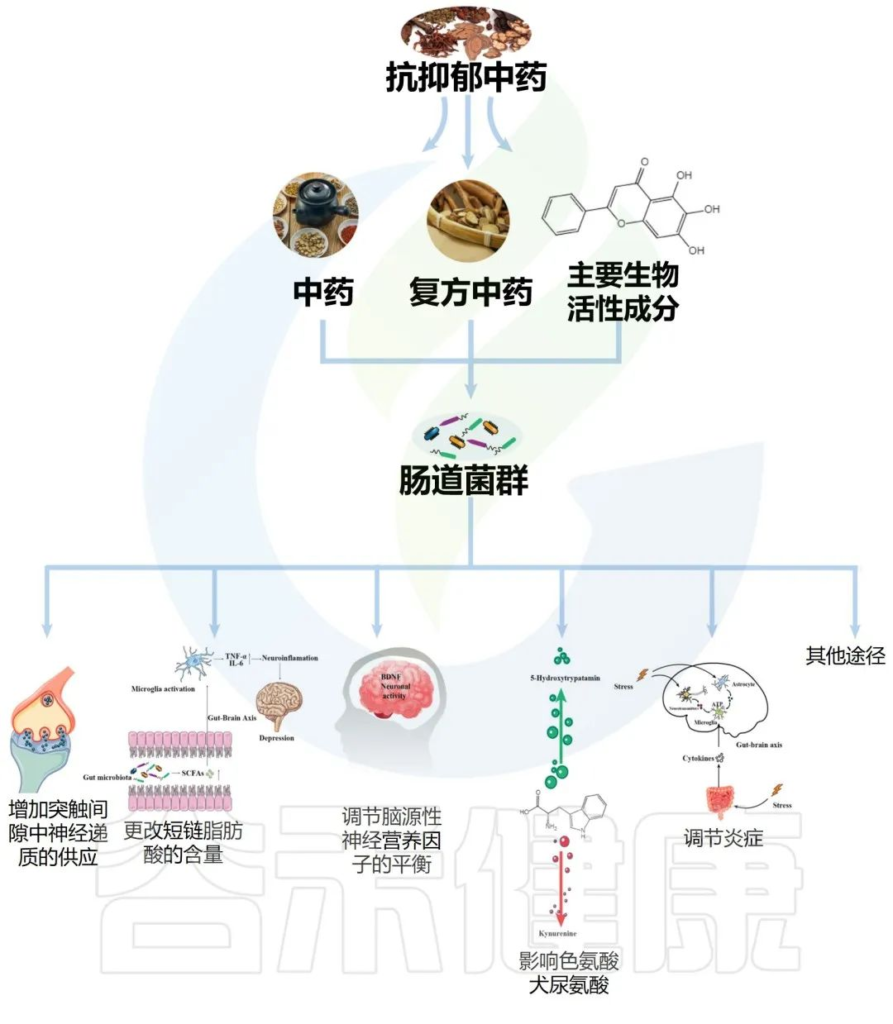
虽然目前对于中医药抗抑郁作用的潜在机制相对模糊,但可能涉及多种机制,其中之一可能包括肠道微生物群的调节。本章节讨论了由调节肠道微生物群的化学递质和细胞介质诱导的中药抗抑郁作用。
传统中药配方,包括复方中药、中药和主要生物活性成分,它们影响肠道菌群改善抑郁症如下:
Li B, et al., J Ethnopharmacol. 2023
迄今为止,大多数抗抑郁药物都是神经递质再摄取抑制剂,通过抑制神经递质的再摄取和增加突触间隙的神经递质供应来改善神经传递。
中医药在中枢神经系统疾病的治疗方面有着丰富的历史。
开心散
开心散(KXS)、栀子豉汤(ZZCD)和甘麦大枣汤是用于治疗抑郁症的不同类型的中药。研究发现,这些物质参与调节肠道微生物群,最终缓解抑郁症状。
注:栀子豉汤(ZZCD)首载于《伤寒论》,在中国被广泛用于治疗抑郁症、发热性疾病和失眠症已有1000多年的历史。
开心散调节肠道和大脑功能的重要组成部分。开心散治疗改变了CUMS诱导抑郁症小鼠肠道微生物群的相对丰度,并通过增加Allobaculum、Turicibacter、双歧杆菌,改善了抑郁症症状。
栀子厚朴汤
相关的中药处方,如栀子厚朴汤,逆转了CUMS诱导抑郁症小鼠肠道神经递质(如5-HT、多巴胺和色氨酸)的抑制。
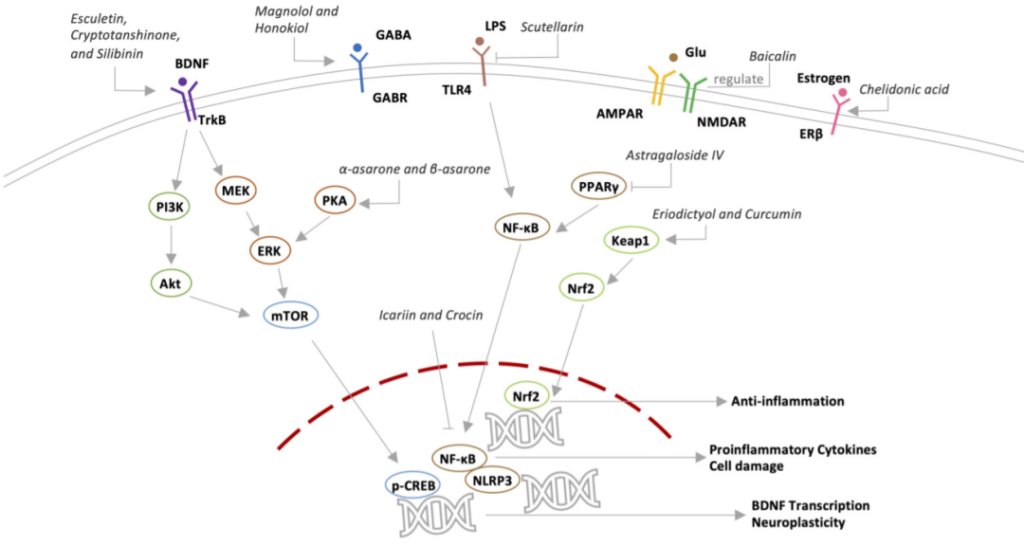
研究报告,栀子厚朴汤的抗抑郁类型效应由肠道微生物群介导,肠道微生物群影响神经递质的代谢。与未治疗组相比,栀子厚朴汤治疗组显著增加了Barnesiella和Lachnospiraceae的成分,但降低了链球菌。
总之,这些结果表明,栀子厚朴汤通过肠脑轴调节肠道微生物群以改善抑郁症,这影响了大脑中的相关神经递质。此外,在用栀子厚朴汤治疗后,CUMS诱导的齿状回中未成熟和新生神经元的丰度降低显著改善,抑郁样行为得到缓解。
潜在抗抑郁机制
doi.org/10.3389/fpsyt.2022.1054726
甘麦大枣
甘麦大枣增加了大鼠肠道中的神经递质水平,缓解了抑郁症,这可能是由于活性成分甘草酸苷的作用。
其他
一些草药以 5-HT 受体为主要抗抑郁机制。
如来自葛根的葛根素不仅作为 5-HT2C 和 5-HT2A 受体的拮抗剂,而且作为 5-HT1A 受体的激动剂。
大量中药配方以及主要生物活性成分通过调节肠道微生物群中的神经递质发挥抗抑郁作用。如下表所示:
表 中药对抑郁症患者化学神经递质的影响
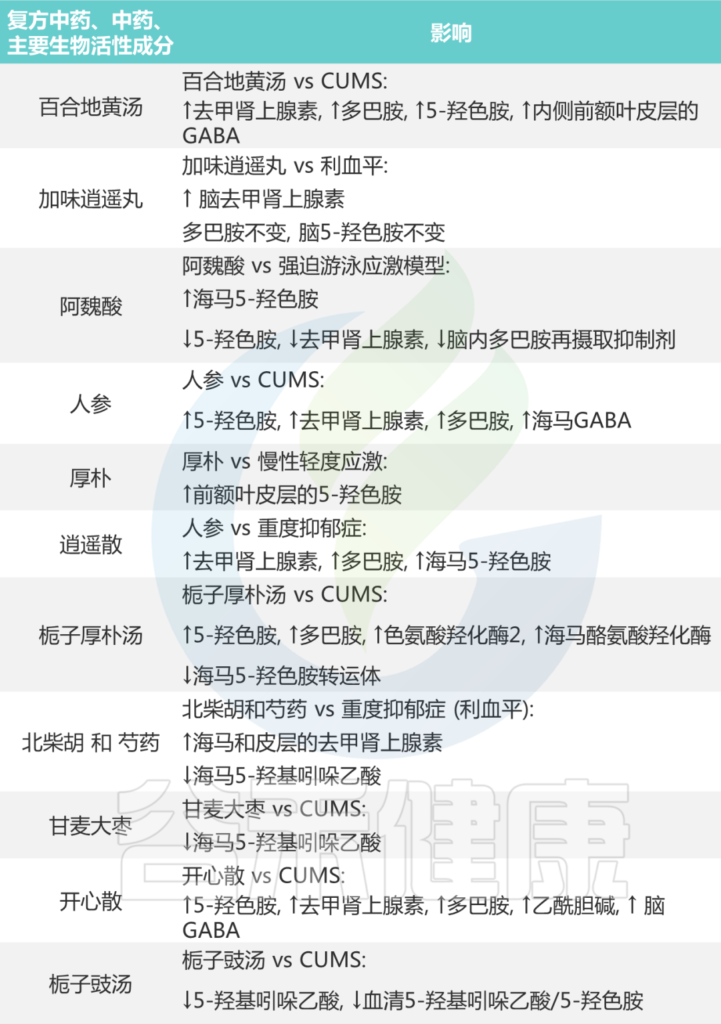
Li B, et al., J Ethnopharmacol. 2023
►⋙
总之,中药含有多种活性成分,这些成分旨在整合和调节人体内的多个环节、水平和靶点,通过调节肠道菌群和神经递质来实现抗抑郁效果。在临床实践中,除了用作抗抑郁药的补充外,它还为与神经递质紊乱相关的其他疾病提供治疗。
研究发现,短链脂肪酸作为肠脑轴的递质,会影响抑郁症。例如,患者体内可产生短链脂肪酸的Alloprevotella的相对丰度增加。一些中药配方及其活性成分可以通过改变肠道中的短链脂肪酸含量来诱导抑郁症样症状。
DOI: 10.16438/j.0513-4870.2022-0844
五味子素可以缓解抑郁小鼠肠道微生物群失衡,这与粪便短链脂肪酸水平的变化有关。
黄芩苷(BAI)是甘草的一种生物活性成分,通过促进肠道中产短链脂肪酸的细菌,影响抑郁症的发展。
栀子厚朴汤的抗抑郁类型效应通过调节肠道微生物群来促进丁酸分泌而发生。
用肉苁蓉(CTE)治疗CUMS模型大鼠显示,肠道微生物群的破坏与短链脂肪酸的产生之间存在强烈的相关性。
杏仁可以增加肠道微生物群的含量,如瘤胃球菌和真细菌。人参及其提取物通过改变肠道微生物群的代谢产物,从而影响血清短链脂肪酸水平和大脑中的神经递质,从而达到抗抑郁作用。
黄连素和淡豆豉通过调节短链脂肪酸达到抗抑郁作用。
总之,如下表所示,研究结果支持各种中药制剂可以通过介导肠道微生物群的短链脂肪酸来治疗抑郁症。
中药对抑郁症患者短链脂肪酸的影响
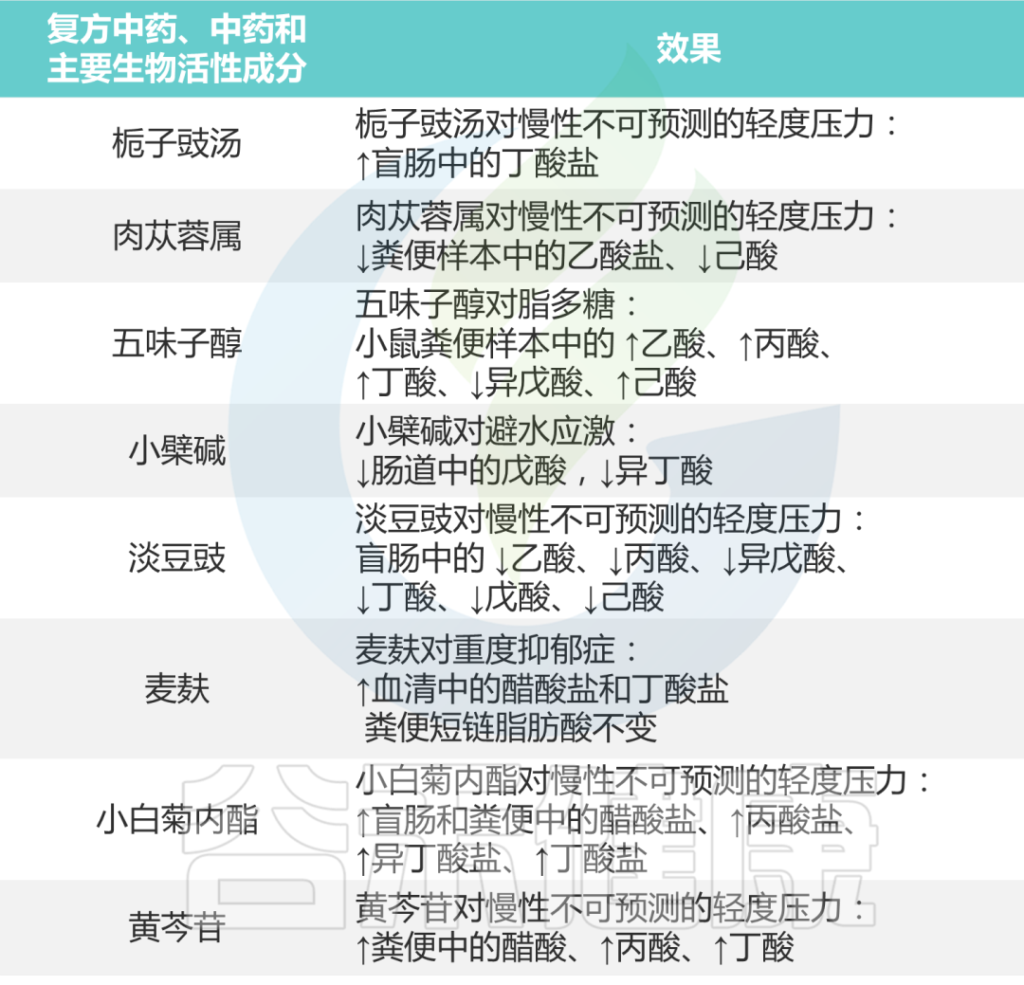
Li B, et al., J Ethnopharmacol. 2023
►⋙
目前,中医对短链脂肪酸的调节更广泛地用于治疗代谢性疾病,如肥胖症、糖尿病和高血脂,但通过中医调节肠道微生物组治疗抑郁症的研究相对较少。因此,将中医药作为深入研究抑郁症的切入点将有助于开发新药。
BDNF与抑郁症密切相关,是许多抑郁症中医治疗的目标,包括槲皮素、肉苁蓉、人参和柴胡。
槲皮素
槲皮素来源于多种植物多酚,据报道可以预防焦虑,缓解抑郁,提高记忆力。
值得注意的是,槲皮素已被证明可以改变肠道微生物群。例如,槲皮素处理增加了肠道微生物多样性以及下列菌群的相对丰度:
槲皮素的抗抑郁作用是通过调节BDNF相关蛋白CPNE6和TREM1之间的平衡实现的。
在一项研究中,槲皮素能够改善大鼠的抑郁样行为,同时降低肠道微生物群的含量,如Verrucomichobiae和脱硫弧菌。
此外,槲皮素改善了受损的结肠组织,增强了海马中BDNF的表达。
肉苁蓉
肉苁蓉可以改善抑郁大鼠肠道微生物群的含量,如拟杆菌的增加和瘤胃球菌的减少。此外,肉苁蓉增加了抑郁症患者的BDNF水平。这些发现支持BDNF可能影响抑郁症的治疗。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分也通过调节BDNF实现抗抑郁作用,如下表所示:
表 中药对抑郁症患者BDNF的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,没有药物直接调节大脑中的BDNF,大脑中每天的BDNF含量只能通过添加一些蔬菜来维持。如果中医能调节肠道微生物群中的BDNF,它不仅能改善抑郁症,还能治疗BDNF相关疾病。
一些中药配方通过影响色氨酸-犬尿氨酸代谢平衡来改善抑郁症样症状。
人参皂苷
人参和相关的中药配方富含人参皂苷,已表明人参皂苷可改善大肠杆菌K1诱导的小鼠抑郁和肠道失调。此外,据报道,人参皂苷改善了肠色氨酸-犬尿氨酸代谢紊乱和血清犬尿氨酸水平,导致海马犬尿氨酸含量显著变化。
此外,人参皂苷治疗抑制小胶质细胞过度激活,以改善抑郁样行为。
天丝饮
天丝饮是一种中药,可以提高肠道微生物群(乳杆菌和毛螺菌科)的含量,然后调节色氨酸-犬尿氨酸途径的代谢产物,以改善抑郁症状。因此,色氨酸-犬尿氨酸代谢可能影响肠道微生物群。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节犬尿氨酸水平实现抗抑郁作用,如下表所示。
中药治疗抑郁症对犬尿氨酸的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,已发现氯胺酮和右旋西帕明等抗抑郁药与犬尿氨酸密切相关,但尚未应用直接作用于犬尿氨酸的药物。因此,发现新的抗抑郁药或辅助药物作用于犬尿氨酸已成为一个悬而未决的问题。
中医药可以通过肠道微生物组调节犬尿氨酸来改善抑郁症状,具有安全性高、稳定性好的潜在优势。
与色氨酸-犬尿氨酸代谢相关的酶的调节,如QPRT(喹啉磷酸核糖转移酶)和IDO(吲哚胺2,3-二加氧酶),也是抑郁症治疗的理想靶点。因此,中药肠道微生物群对犬尿氨酸的调节将成为抗抑郁药物的新靶点。
越来越多的研究表明,改变肠道微生物群可以通过细胞因子调节影响抑郁症。
一些中药制剂通过影响血液和肠道中的细胞因子水平(如细胞因子IL-6和IL-1β)发挥抗抑郁作用,从而通过血脑屏障改变中枢神经系统的细胞因子,并影响脑小胶质细胞。作为中枢神经系统中最重要的免疫细胞之一,小胶质细胞与一系列神经退行性疾病有关,并与神经炎症密切相关。
秋葵
秋葵处理增加了Barnesiella、拟杆菌和乳杆菌的相对丰度。此外,秋葵抑制toll样受体4的表达、NF-κB的核易位、高水平的促炎细胞因子和增强的丝裂原活化蛋白激酶信号传导。最终,秋葵达到了抗抑郁类型的效果。
柴胡疏肝散
柴胡疏肝散的主要成分皂苷A和D,在CUMS模型大鼠中发挥抗抑郁作用,恢复HPA轴的平衡,并通过提高肠道和海马促炎因子(如IL-1β、IL-6和TNF-α)的水平,减少神经炎症。
这些研究进一步证明,肠道微生物群可以通过调节细胞因子来影响大脑的神经系统。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节细胞因子发挥抗抑郁作用,如下表所示。
中药对抑郁症患者细胞因子的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
在临床实践中,抑郁症患者菌群的相对丰度与免疫力密切相关,这表明特定菌株有可能影响免疫力。因此,在未来,中医不仅可以治疗抑郁症,还可以通过肠道微生物群调节免疫系统,这可能对其他神经疾病具有良好的治疗效果。
临床上,有几种方法可以通过刺激神经通路来治疗抑郁症,如脑深部刺激(DBS)和迷走神经刺激(VNS)。然而,这些技术存在一些并发症,例如需要手术和术后恢复。
肠道微生物群通过迷走神经调节脑-肠轴信号。例如,长双歧杆菌NC3001通过迷走神经缓解焦虑样行为。柠檬酸杆菌(Citrobacter)通过调节迷走神经的活动产生焦虑-抑郁样行为。
▸中药通过调节迷走神经缓解抑郁症
因此,影响肠道的某些类型的中药,如四逆散(SNS)、柴胡温胆汤、柴胡桂枝方和桂皮方,通过调节迷走神经来影响抑郁样行为。
柴胡温胆汤通过调节迷走神经的活动来影响乙酰胆碱含量的变化,从而缓解抑郁症。
看起来,就缓解抑郁症而言,在调节迷走神经活动方面,使用中医药调理肠道微生物群,比直接使用药物更有效;这是一个值得进一步研究的研究方向。
▸中药通过调节脊髓损伤缓解抑郁症
抑郁症常伴有慢性疼痛,疼痛信号主要存在于脊髓通路;因此,脊髓在与抑郁症相关的神经通路中起着重要作用。研究发现,脊髓损伤可导致肠道生态紊乱;肠道菌群的重塑可能会恢复肠道功能。
在脊髓损伤中,益生菌复苏可以改善脊髓损伤。用抗生素治疗的小鼠表现出更严重的脊髓损伤。因此,中医可以通过调节脊髓通道的活动来调节肠道微生物群以缓解抑郁症。
中医作用于多种神经通路,并在多个层面治疗抑郁症。它们不仅在抑郁症的快速治疗中发挥作用,还可以缓解与抑郁症相关的并发症。因此,中医显示出巨大的潜力。然而,中医治疗的手段五花八门,以上主要是服用各种药剂,其他还有包括食疗、针灸、太极、按摩等。
● 针灸影响肠道菌群
研究表明,针灸可以通过对胃肠动力、分泌和免疫的调节影响肠道菌群。
研究人员通过针刺应激性胃溃疡模型大鼠的百会、中脘、足三里穴位,结果表明,针刺能够有效改善应激性胃溃疡引发的胃黏膜损伤,可能与增加的菌群多样性,促使紊乱的肠道菌群水平回调有关。
研究人员对实验组溃疡性结肠炎的患者应用益阳愈溃汤结合针刺治疗,对照组仅给予益阳愈溃汤,治疗后实验组双歧杆菌、乳酸杆菌等优势菌种均高于对照组。
另外有研究人员认为早期针刺对中风患者的干预不仅可以促进神经功能的恢复,并可以有效降低中风后抑郁症的发病率,说明中医针灸治疗与肠道菌群也有某种联系,更有利于对肠道菌群的研究,从而拓宽抑郁症治疗的新方法和思路。
很少有研究报道了中药制剂在抑郁症临床治疗中的毒性。
柴胡皂苷D是柴胡中的主要生物活性成分,具有抗抑郁、肝毒性、神经毒性、溶血性和心脏毒性作用。因此,应注意中药配方中柴胡的用量。
黄芩苷在肠道中作为黄芩素代谢。黄芩苷在HepG2细胞中显示出比黄芩素更高的毒性,但肠道微生物群产生的黄芩苷代谢产物的毒性低于黄芩苷本身。因此,黄芩苷生产工艺应进一步优化,以治疗抑郁症。
开心散导致白细胞和淋巴细胞以及血糖水平升高,尽管所有患者在治疗30天后均表现出正常水平。因此,口服开心散被认为是相对安全的。
甘麦大枣汤与治疗抑郁症的不良反应有关,如口干、便秘、失眠和易怒。
补骨脂及其主要生物活性成分具有抗抑郁作用,但临床前安全性研究揭示了未知化合物和机制对肝脏和生殖系统的毒性作用。
►⋙
一般来说,中药配方不会刺激肝脏或肾脏,也不会损害胃肠道。与西医使用的抗抑郁药物相比,中医药治疗抑郁症的副作用一般较少,不会产生依赖或成瘾,疗效稳定,从而防止治愈后复发。
人体大多数疾病都与肠道有关,肠道菌群调节越来越被认为是疾病的立足点和突破口。
从中医的角度来看,人的各个器官并不是独立存在的,而是相互联系的,共同影响着全身的生理机能。中医擅长于动态和整体上把握疾病的发生发展,这与肠道菌群反映人体健康动态的理念不谋而合。
通过监控肠道菌群的动态预测易感疾病,并运用其与人体自身的共生关系和个体化的生物学特征,使中医在疾病诊治中突出整体观和辨证论治的优势。
抑郁症的发病机制尚不确定,单胺、神经营养因子、神经递质和肠道菌群被认为参与了抑郁症的发展。抑郁症研究的重点已经从大脑转移到其他系统,微生物群-肠-脑轴可通过形成复杂的内分泌、神经、免疫炎症的生物学免疫机制,在影响抑郁症的发生发展中发挥重要作用。
中药通过非常复杂的机制调节肠道功能。虽然中药调节肠道菌群的机制没有完全摸透,但其显著疗效已经受到越来越多的关注。中医身心一体观的临床实践经验在防治抑郁症方面具有潜在优势。
中药与肠道菌群之间抗抑郁的关系不仅仅有中药对于肠道菌群的影响, 还有肠道菌群对中药成分代谢和促进吸收的作用等值得探索。
目前仍需进行大量的研究以探寻中药与肠道菌群之间的相互作用,这对于研究抑郁症的发病机制和抗抑郁新药研发有深远意义。结合中医药理论,以肠道菌群为靶点,开发中药新药研究,将为中医药防治抑郁症提供新的思路和治疗方案。
主要参考文献:
Radjabzadeh, D., Bosch, J.A., Uitterlinden, A.G. et al. Gut microbiome-wide association study of depressive symptoms. Nat Commun 13, 7128 (2022). https://doi.org/10.1038/s41467-022-34502-3
Sun Y, Zhao J, Rong J. Dissecting the molecular mechanisms underlying the antidepressant activities of herbal medicines through the comprehensive review of the recent literatures. Front Psychiatry. 2022 Dec 22;13:1054726. doi: 10.3389/fpsyt.2022.1054726. PMID: 36620687; PMCID: PMC9813794.
Li B, Xu M, Wang Y, Feng L, Xing H, Zhang K. Gut microbiota: A new target for traditional Chinese medicine in the treatment of depression. J Ethnopharmacol. 2023 Mar 1;303:116038. doi: 10.1016/j.jep.2022.116038. Epub 2022 Dec 15. PMID: 36529248.
Asim M, Wang H, Waris A. Altered neurotransmission in stress-induced depressive disorders: The underlying role of the amygdala in depression. Neuropeptides. 2023 Jan 20;98:102322. doi: 10.1016/j.npep.2023.102322. Epub ahead of print. PMID: 36702033.
Wilkowska A, Szałach ŁP, Cubała WJ. Gut Microbiota in Depression: A Focus on Ketamine. Front Behav Neurosci. 2021 Jun 23;15:693362. doi: 10.3389/fnbeh.2021.693362. PMID: 34248517; PMCID: PMC8261217.
Park LT, Zarate CA Jr. Depression in the Primary Care Setting. N Engl J Med. 2019 Feb 7;380(6):559-568. doi: 10.1056/NEJMcp1712493. PMID: 30726688; PMCID: PMC6727965.
王凯新, 董晓梦, 苏毅鹏,等. 肠道菌群与抑郁症关系的研究进展[J]. 吉林大学学报:医学版, 2022(004):048.
Xu J, Chen HB, Li SL. Understanding the Molecular Mechanisms of the Interplay Between Herbal Medicines and Gut Microbiota. Med Res Rev. 2017 Sep;37(5):1140-1185. doi: 10.1002/med.21431. Epub 2017 Jan 4. PMID: 28052344.
Bosch, J.A., Nieuwdorp, M., Zwinderman, A.H. et al. The gut microbiota and depressive symptoms across ethnic groups. Nat Commun 13, 7129 (2022). https://doi.org/10.1038/s41467-022-34504-1
Ashraf H, Salehi A, Sousani M, Sharifi MH. Use of Complementary Alternative Medicine and the Associated Factors among Patients with Depression. Evid Based Complement Alternat Med. 2021 Mar 26;2021:6626394. doi: 10.1155/2021/6626394. PMID: 33854557; PMCID: PMC8019377.
鲍婷婷, 杨凯麟, 龙治勇,等. 基于”心与小肠相表里”探讨肠道菌群与抑郁症[J]. 中国中西医结合杂志, 2021.
Barandouzi ZA, Starkweather AR, Henderson WA, Gyamfi A, Cong XS. Altered Composition of Gut Microbiota in Depression: A Systematic Review. Front Psychiatry. 2020 Jun 10;11:541. doi: 10.3389/fpsyt.2020.00541. PMID: 32587537; PMCID: PMC7299157.
Zhao Y, Luan H, Gao H, Wu X, Zhang Y, Li R. Gegen Qinlian decoction maintains colonic mucosal homeostasis in acute/chronic ulcerative colitis via bidirectionally modulating dysregulated Notch signaling. Phytomedicine. 2020 Mar;68:153182. doi: 10.1016/j.phymed.2020.153182. Epub 2020 Feb 7. PMID: 32065953.
袁霞红, 刘林. 肠道菌群调节抑郁症机制及中医药防治研究进展[J]. 中华中医药学刊, 2022, 40(9):4.
Aktar R, Parkar N, Stentz R, Baumard L, Parker A, Goldson A, Brion A, Carding S, Blackshaw A, Peiris M. Human resident gut microbe Bacteroides thetaiotaomicron regulates colonic neuronal innervation and neurogenic function. Gut Microbes. 2020 Nov 1;11(6):1745-1757. doi: 10.1080/19490976.2020.1766936. Epub 2020 Jun 9. PMID: 32515657; PMCID: PMC7524364.
Dinan TG, Cryan JF. Gut microbes and depression: Still waiting for Godot. Brain Behav Immun. 2019 Jul;79:1-2. doi: 10.1016/j.bbi.2019.02.007. Epub 2019 Feb 13. PMID: 30771453.
丁书凝, 贾心如, 阮善明,等. 中医思辨体系中肠道菌群的共性分析和诊疗应用[J]. 时珍国医国药, 2022(007):033.

谷禾健康

传染病,肠道微生物,营养
传染病和感染目前是许多地区尤其是低收入国家主要死亡原因,也是婴儿和老年人等弱势群体的主要风险。免疫系统在这些感染的易感性、持续性和清除中起着至关重要的作用。由于 70-80% 的免疫细胞存在于肠道中,肠道微生物群、肠上皮层和局部黏膜免疫系统之间存在着错综复杂的相互作用。除了肠道中的局部黏膜免疫反应外,目前越来越多的证据证实:肠道微生物组也会影响全身免疫。
临床医生未来可能会更多地利用关于免疫系统、肠道微生物组和人类病原体之间复杂相互作用的更多知识。现在公认的营养对肠道微生物群组成和免疫系统的影响阐明了营养在改善健康方面可以发挥的作用。
本文将综合介绍维持微生物群、肠道健康、局部免疫反应和全身免疫之间复杂平衡的机制,并将其与一生中的传染病联系起来,并讨论营养在传染病预防和治疗中的影响。

由于卫生条件的改善、疫苗接种和抗生素的使用,传染病的发病率在过去几十年中显着降低。然而,仍有近三分之一的死亡仍与传染病有关,尤其像新冠病毒这样的传播。
此外,感染仍然对婴儿和老年人等弱势群体构成重大风险。上呼吸道感染是医疗保健中的最常见疾病,在老年人中,流感和肺炎仍然是常见的死亡原因 。
世界卫生组织指出,传染性肠道疾病是导致死亡的主要原因之一,根据 2015 年全球疾病负担、伤害和风险因素研究,感染性腹泻是全球主要的死亡原因,尤其是5岁以下儿童。
病原体需要克服三个主要障碍,才能在胃肠道中引起感染:
本小节主要介绍前两个:肠道微生物群和肠上皮层。
肠道微生物群由多物种微生物群组成,由细菌、真菌和病毒组成,它们生活在与宿主协同作用的特定生态位中。肠道微生物和哺乳动物共同进化,因此在微生物获得栖息地繁衍的同时,微生物调节宿主的各种生理功能,包括调节对病原体的保护性免疫。
肠道微生物群的组成受许多因素影响,例如遗传、性别、年龄、社会经济因素、营养、压力、疾病和环境因素(污染物、抗生素等)。
扰乱微生物群落结构和功能的因素,如抗生素的使用,为机会性病原体提供了定殖、生长和持续存在的空间。有几种机制可以确保微生物群防止定植、过度生长、病原体引起的损害以及随后的宿主感染。
定 殖 抗 性
一种机制被称为定殖抗性,其中共生微生物群和入侵微生物在营养或功能空间方面竞争资源可用性或生态位机会。
群 体 感 应
为了允许这种竞争,细菌细胞使用细菌复制过程中积累的信号分子不断地感知环境,从而监测种群密度并相应地调整它们的基因表达,这种机制称为群体感应。
化学信号导致细菌的表型变化,这些变化与粘附、运动和肠道密度或保护性化合物的排泄有关。
群体感应机制被共生体用来确保肠道内稳态,但也被病原体用来最小化宿主免疫反应并增加致病性。可能由饮食、压力、抗生素和药物治疗引起的微生物群落结构或非有益微生物群组成的改变会改变微生物群与宿主之间的整体动态,从而导致低度炎症、降低定植抗性和改变感染易感性。
肠道菌群会影响各种炎症和传染病
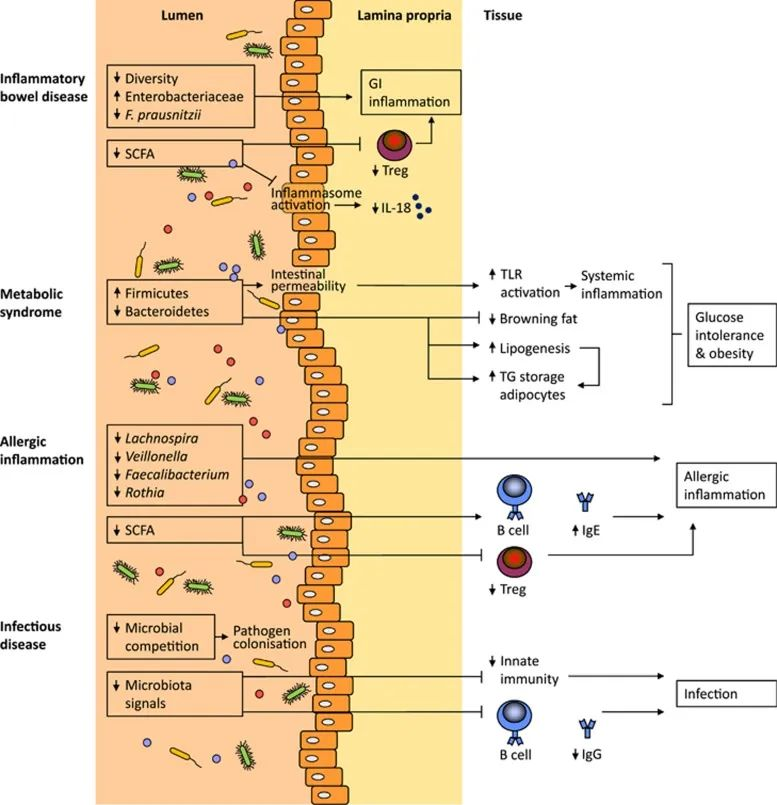
van den Elsen LW et al., Clin Transl Immunology. 2017
除了肠道微生物群,肠道上皮屏障在保护宿主免受病原体感染方面起着至关重要的作用 。
这种将肠道中的共生细菌与下层组织分开的物理屏障是通过紧密连接的蛋白质复合物连接的单层细胞。紧密连接复合物的组装是一个动态过程,某些细菌会通过释放毒素来破坏该过程。
此外,上皮细胞层由一层粘液加强。这种上皮屏障的粘液“衬里”是肠道上皮细胞抵抗细菌入侵的首要防御机制之一,通过防止管腔和粘膜微生物直接与上皮细胞相互作用。
微生物群和抵御感染威胁的肠道屏障
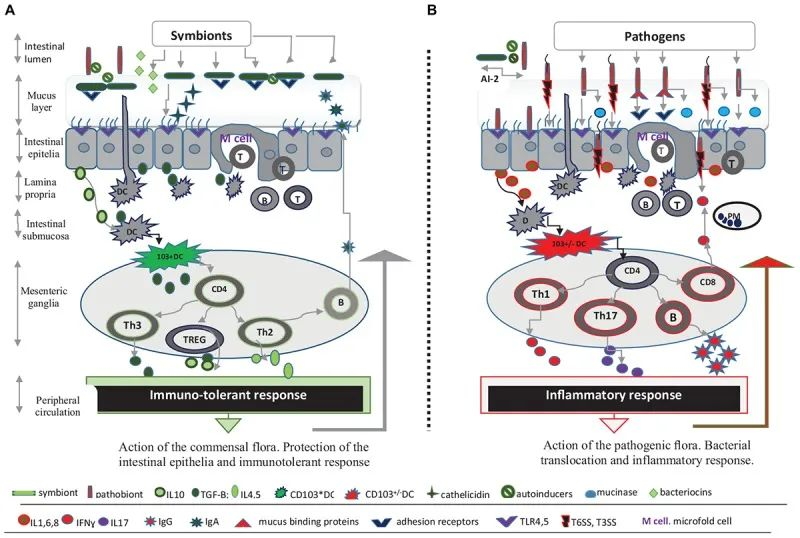
Iacob S, et al., 2019, Front Microbiol.
除了作为生物物理屏障的功能外,粘液还充当宿主产生的抗菌分子(如分泌型 IgA 和防御素)的储存库 。粘液的产生和降解是通过宿主和微生物之间复杂的相互作用来控制的,这种相互作用通过宿主对微生物相关分子模式 (MAMP) 和细菌代谢物的识别来调节,因此容易受到原生微生物群组成变化的影响 。
粘液和微生物之间存在相互关系,宿主炎症状态的变化和微生物群组成的变化都可能导致粘液产生和组成的改变,从而导致感染易感性增加。
短链脂肪酸在抗感染防御中的作用
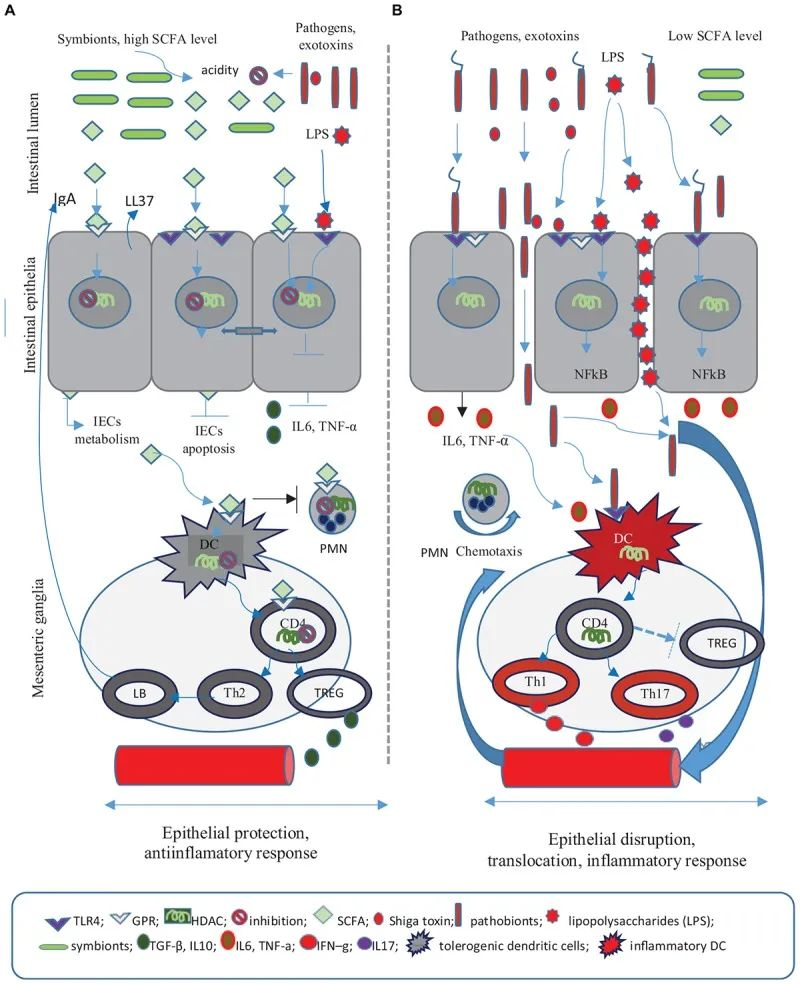
Iacob S, et al., 2019, Front Microbiol.
肠道微生物组成的炎症相关改变导致上皮屏障破坏,使细菌脂多糖能够全身循环。这些代谢变化会导致葡萄糖不耐受和肥胖。
过敏性炎症与特定细菌属的丰度较低有关。耗尽肠道微生物群已被证明会增加 IgE 的产生,这与 Treg 反应减少一起会导致过敏性炎症。
耗尽肠道微生物群会导致肠腔内缺乏微生物竞争已被证明会增加 IgE 的产生,这与 Treg 反应减少一起会导致过敏性炎症。
肠腔内缺乏微生物竞争会导致艰难梭菌定植。
最后,缺乏微生物信号也会降低对微生物的先天免疫和适应性免疫反应,使宿主更容易受到感染。
肠道微生物群和肠道上皮细胞之间的持续相互作用导致持续的免疫信号传导。在共生细菌和入侵病原体存在的情况下,这种免疫反应的调节以及上皮屏障的完整性和通透性对于维持肠道稳态至关重要。如果这个过程受损,可能会导致炎症和感染。
免疫反应在感染的易感性、持续性和清除率中起着至关重要的作用。
免疫系统由两部分组成:
先天免疫系统 通过多种防御机制提供非特异性保护,包括:
适应性免疫系统的细胞,T 和 B 淋巴细胞,识别并响应特定的外来抗原。T 细胞识别已进入宿主细胞的感染因子。这种类型的适应性免疫依赖于细胞的直接参与,因此被称为细胞免疫。
此外,T 细胞在调节 B 细胞功能方面发挥重要作用,B 细胞分泌识别特定抗原的抗体和蛋白质。因为抗体通过体液(即体液)循环,所以由 B 细胞诱导的保护称为体液免疫。
免疫系统的发育和免疫反应的功效与肠道微生物群的发育和组成密切相关
这方面的证据来自比较年龄和性别匹配的没有肠道微生物群的无菌饲养小鼠、相同品系的常规饲养动物和具有特定微生物群的无菌小鼠,即所谓的无菌小鼠。特别是,使用无菌小鼠提高了我们对单一细菌菌株、菌株联合体、特定微生物表达基因和微生物产生的代谢物对肠道稳态以及局部和全身免疫的影响的理解。
这些研究的见解强调,先天免疫在首次识别和响应微生物衍生产物中起着关键作用。
肠道中的先天免疫始于直接暴露于肠腔内容物和微生物产物的单层肠上皮细胞 (IEC)。宿主和微生物之间的关键平衡通过模式识别受体 (PRR) 识别微生物得到安全保护。
PRRs 构成了一个大家族的细胞外和细胞内受体,可识别特定的微生物相关分子模式 (MAMP)。PRR 包括 TLR、C 型凝集素受体 (CLR)、核苷酸结合寡聚结构域 (NOD) 样受体 (NLR) 以及 DNA 和 RNA 的胞质传感器。
MyD88 是 PRR 信号传导下游的重要衔接分子,将 PRR 激活与转录因子 NF-ĸB 的激活联系起来,后者是炎症的主要调节因子。因此,MyD88 的缺乏会导致免疫反应受损和对感染的易感性增加。
然而,PRRs的不当激活可能导致过度的免疫反应,甚至导致炎症性疾病和自身免疫;因此,PRR 反应通过正负反馈回路和交叉调节受到严格调节。
此外,IEC 分泌抗菌肽 (AMP),这是一种具有杀菌、抗炎和抗内毒素特性的先天免疫效应分子。
AMP是先天免疫防御的重要组成部分,可限制病原体与上皮的相互作用。它们的表达可以被某些病原体下调,并因特定微生物的存在而增强,因此,微生物群的组成是形成先天免疫反应的关键。
免疫系统的发育和免疫反应的功效与肠道微生物群代谢产物密切相关
微生物群控制免疫反应的另一种机制是通过肠道微生物群从饮食成分、宿主产物或其他微生物代谢物产生的代谢物的形成。
种类繁多的微生物代谢产物介导了共生细菌的许多保护功能。
具有免疫保护能力的代谢产物包括:
短链脂肪酸、色氨酸代谢物、胆汁酸衍生物等。
➭ 短链脂肪酸
短链脂肪酸通过特殊的肠上皮细胞增强抗菌肽和粘液的产生,并刺激结肠调节性 T 细胞的成熟和扩增,从而抑制对微生物群的局部炎症反应。
短链脂肪酸通过调节上皮屏障来支持结肠内的肠道稳态,并通过诱导这些细胞的增殖和分化来支持肠道细胞的修复 。
短链脂肪酸在先天淋巴细胞 (ILC3) 的增殖中很重要,ILC3 会释放 IL22,这对上皮细胞诱导抗菌分子很重要。
➭ 色氨酸代谢物
色氨酸代谢物,尤其是吲哚类来源于膳食色氨酸的共生发酵,并作为芳烃受体 (AhR) 的配体发挥作用,这是一种对维持肠道稳态很重要的受体,这些代谢物的丢失与炎症性肠病的发生有关疾病。
➭ 胆汁酸衍生物
胆汁酸衍生物通过激活法尼醇 X 受体 (FXR) 和 G 蛋白偶联胆汁酸受体 (TGR5) 来支持肠道稳态并影响大量宿主功能。胆汁酸衍生物是通过特定细菌门表达的细菌胆汁盐水解酶 (BSH) 的作用从胆汁酸代谢而来的,而 BSH 基因丰度的丧失与炎症性肠病的发生有关。
以上表明肠道中的粘膜稳态是肠道微生物群、微生物代谢物和宿主因素之间的微妙平衡。这种持续的相互作用导致严格调节的生理低度炎症状态,维持最佳的宿主防御,从而影响对感染的易感性。
人们越来越认识到,肠道微生物群除了调节局部粘膜免疫系统外,还通过多种机制影响先天性和适应性细胞介导的全身免疫反应。
▸肠道菌群释放微生物可溶性产物,影响外周免疫细胞的激活
一种机制涉及释放微生物可溶性产物,这些产物转移到循环中并影响外周免疫细胞的激活。事实上,肠道远端器官中的常驻免疫细胞可以直接感知循环微生物衍生因子,而微生物群衍生信号分子的缺失会导致免疫功能发生改变,从而导致对全身感染的易感性。
▸肠道菌群对适应性免疫系统(T细胞)的影响
目前,肠道微生物组影响全身免疫反应的最佳表征机制可能是其对适应性免疫系统的 T 细胞室的影响。已经表明,胃肠道微生物群可以影响 T 细胞群分化为 Th1、Th2 和 Th17 细胞或具有调节表型的 T 细胞。
具体而言,丁酸盐作为一种短链脂肪酸可促进外周部位诱导的调节性 T 细胞的这种分化,并且以这种方式能够抑制全身炎症的发展。短链脂肪酸还能够重新编程细胞的代谢活动,从而诱导调节性 B 细胞,并通过戊酸抑制 Th17 细胞的产生,这可能与炎症性肠病和自身免疫性疾病有关。
此外,微生物群来源的 ATP 可以诱导 Th17 细胞的扩增,色氨酸分解产物可以导致上皮内 CD4 + CD8αα + T 细胞的增加,而细菌来源的多糖可以引发调节性 T 细胞。通过其诱导调节群体的能力,微生物组可以支持抑制炎症反应。
▸宿主-病原体相互作用的研究:
结果表明,记忆 T 细胞的共生激活及其向发炎部位的运输,对于防止细菌病原体感染是必要的。
此外,通过共生菌主动控制 IL10 介导的抗炎反应对于防止感染性损伤很重要。这种效应可以使用特定的 toll 样受体 (TLR) 激动剂来重现,这会减少 IL10 的产生,通过增加细菌清除率使小鼠对感染具有更强的抵抗力,并使适当的炎症反应成为可能 。
▸细菌在造血过程中影响调节免疫系统
微生物群释放的信号分子进入循环的能力,也使肠道中的常驻细菌在造血过程中影响免疫细胞发育,调节免疫系统,从而影响对感染的反应。
事实上,短链脂肪酸丁酸盐被证明可以促进骨髓单核细胞从炎症表型分化为更具耐受性的表型。
骨髓细胞也表达多种 PRR(受体),并且对循环中的 MAMP 敏感,其影响由 PRR 表达和 MAMP 可用性决定。例如,在造血干细胞和祖细胞 (HSPCs) 上激活 CLR dectin-1 会导致诱导已经对单核细胞和巨噬细胞进行过训练的免疫。相反,在 HSPCs 上激活 TLR2 会产生具有高抗原呈递共刺激能力的耐受巨噬细胞 。已显示通过 AhR 配体激活 HSPC 可导致产生能够免疫抑制的髓源性抑制细胞。
▸肠道微生物群衍生的信号调节先天免疫防御
除了影响 T 细胞发育和功能外,肠道微生物群衍生的信号被证明还可以通过脾脏中的淋巴刺激、中性粒细胞迁移和功能的调节、巨噬细胞的诱导和活化以及调节自然杀伤 (NK) 细胞的功能来调节先天免疫防御。
▸特定菌群降低皮质酮水平,从而调节炎症反应
最近,研究表明,特定的细菌种类还通过降低血浆皮质酮(肾上腺分泌的皮质醇激素控制炎症“关闭”过程。皮质醇也是身体的减压激素,这个我们下次单独讲)水平来调节炎症反应,这是一种抗炎类固醇,在控制对粘膜损伤的炎症反应中很重要。
综上所述,很明显,肠道微生物群的失调会导致诱导适当的局部和全身免疫反应的能力降低,从而导致局部炎症性疾病,但也会导致远端疾病。
一个远端部位是气道,这两个部位之间的这种特定的直接关系被称为:肠-肺轴。
▸肠道菌群影响肺部:哮喘、过敏性气道疾病、呼吸道感染等,益生菌可改善
事实上,在动物和人类研究中,已经表明抗生素引起的肠道微生物群改变可能与特应性表现、过敏性气道疾病和患哮喘的风险增加有关。
除了影响过敏性气道疾病的发展,已经表明肠道微生物群在防止细菌和病毒呼吸道感染方面发挥着至关重要的作用,因为肠道微生物群直接控制先天性和适应性免疫反应。
事实上,多项人体临床试验表明,使用益生菌可降低呼吸道感染的发生率并改善其健康结果。
▸肠道菌群影响肺部:通过粘膜免疫系统
肠道事件影响肺部疾病的另一种机制是通过常见的粘膜免疫系统,其中在肠道中引发的抗原特异性 B 细胞可以通过胸导管迁移到远端有效部位。
在肠-肺微生物群研究中,确定肠道微生物群变化是疾病的原因还是结果是具有挑战性的。此外,还需要进行纵向研究,以更好地了解肠道微生物群对已确诊肺部疾病的严重程度和病程的影响。
在人群中可以看到,年幼的婴儿和老年人特别容易受到感染。这两个人群的共同点是,在这两个人群中,免疫系统都没有发挥最佳功能。接下来的两个章节,主要介绍婴儿和老年人的免疫系统与肠道菌群的关联。
▸婴儿的免疫系统在出生时受到了极大的抑制,母体抗体提供保护
婴儿的免疫系统在出生时并没有完全发挥作用,这意味着他们的先天和适应性免疫反应都受到了极大的抑制。子宫内环境要求胎儿的免疫系统主动下调并耐受来自母亲的抗原,以避免可能导致终止妊娠的免疫反应。
然而,出生后,暴露于环境抗原,其中许多来自肠道微生物群,需要快速改变免疫反应,以保护婴儿免受病原体入侵。
在生命的最初几个月,母体 IgG 抗体提供了对许多感染的保护,该抗体从母亲转移到婴儿身上;然而,当这些抗体水平下降时,婴儿变得更容易受到感染。
幸运的是,先天免疫细胞提供了抵御入侵病原体的早期第一道防线,在胎儿期就已经发育成熟。但是,这种情况发生在不同的时期,与生命后期相比,新生儿先天免疫所有成分的功能仍然较弱。在抗原暴露的驱动下,适应性免疫系统也在生命的最初几个月迅速发展,从而导致免疫记忆的发展。
▸微生物群和免疫系统密切相关,婴儿的感染率增加也可能与微生物组的变化有关
婴儿最初可能会在子宫内接触细菌,出生后会迅速出现肠道定植。定植模式受以下因素的影响:
有人提出,生命的前 24 个月是建立微生物组的关键发育窗口,甚至可能决定整个生命过程中肠道微生物群的组。由于部分免疫系统发育或成熟需要某些细菌,这两个过程密不可分。
实际上,需要共生微生物来训练免疫系统以区分成为耐受抗原的共生细菌和致病细菌。有缺陷的免疫耐受会加剧自身免疫和炎症性疾病,例如过敏。研究表明,特应性儿童和健康儿童的肠道微生物群组成不同,细菌多样性降低和生态失调与特应性疾病的发展有关。
在年龄范围的另一端,免疫系统也处于次优状态。这种以先天免疫和适应性免疫逐渐下降为特征的免疫系统生物老化是不可逆转的,被称为“免疫衰老”。
▸与年龄相关的免疫系统变化
树突状细胞 (DC) 信号通路中与年龄相关的变化已被证明会影响其功能,从而导致响应病原体的细胞因子分泌模式发生改变。
此外,这些变化会导致吞噬作用降低和呈递抗原的能力受损,并对树突状细胞的迁移能力产生负面影响。同样,研究表明,来自老年人的循环单核细胞、巨噬细胞和迁移性中性粒细胞显示出吞噬功能受损。
在单核细胞、树突状细胞和中性粒细胞中,TLR的表达和功能随着年龄的增长而下降。此外,TLR 的定位受损可诱导细胞因子产生的变化。一个例外是老年人单核细胞上的 TLR5 表达,与年轻人单核细胞中的 TLR5 表达水平相比,它实际上有所增加,并导致老年人中细胞因子的产生增加。
此外,随着年龄的增长,T 细胞会发生复杂的变化,包括表观遗传和代谢变化,这些变化会影响初始 T 细胞、记忆 T 细胞和效应 T 细胞。
此外,T 细胞受体 (TCR) 库减少,功能不活跃的衰老或衰竭 T 细胞的频率增加。与年龄相关的 T 细胞改变的起源可能在于细胞因子产生的调整,因为细胞因子在介导 T 细胞反应中至关重要。确实已经表明,来自老年人的 T 细胞主要表现出 Th2 样表型。
Th17 与调节性 T 细胞的比例似乎也有所增加,这被认为与老年人对感染的反应降低有关。除了 T 细胞区室的变化之外,老年人的 B 细胞库多样性较少,这可能导致老年人更容易受到感染。
▸免疫系统伴随炎症,共同导致慢病
免疫衰老伴随着一种慢性、无菌、低度炎症。有几种先天免疫系统的激活剂会导致炎症。此类刺激包括持续的病毒和细菌感染、细胞分解产物和错误折叠的蛋白质。免疫衰老和炎症共同导致感染、癌症、自身免疫和慢性疾病的患病率增加,以及老年人对疫苗接种的反应不佳。»»»
▸衰老影响肠道菌群稳态
与婴儿肠道微生物群研究以及微生物群对免疫系统的影响相比,较少数量的研究关注衰老过程中肠道微生物群发生的系统发育和功能变化。
尽管老年人的肠道微生物群存在很大差异,但健康的成人肠道微生物群被认为是相当稳定的,直到衰老过程开始影响微生物群的稳态。由此导致的生物多样性减少,尤其是产生抗炎短链脂肪酸的细菌减少,以及肠道微生物群的稳定性受损,通常与感染易感性增加有关。
此外,与肠道菌群变化和免疫衰老相关的慢性低度炎症有利于病菌的生长,病菌是健康肠道菌群的一小部分,在发炎的环境中,可以超过共生菌的生长并导致感染。
▸设计饮食干预实验时,应考虑免疫状态
最近的证据表明,衰老从根本上改变了营养对免疫功能的影响。因此,对调查饮食对免疫功能影响的研究数据的解释在很大程度上取决于受试者的年龄。
在调查膳食成分的功效时,研究设计至关重要,大多数涉及老年人的研究都包括基于病史、实验室测试的严格纳入/排除标准,一般健康状况,通常还有营养状况。
然而,免疫状态很少被考虑在内,但即使在健康的老年人中也可能存在显着差异。有几个明显的例子表明免疫细胞组成、表型和/或功能与年龄相关的变化可以直接改变干预的结果。
随着全球人口迅速老龄化,老年人的健康将越来越受到关注。由于免疫功能下降,与年轻人相比,老年人被认为发生感染的风险增加,严重程度和死亡率增加。尤其是在老年护理机构中,感染容易在居民中传播,预防感染至关重要。
传统上,传染病专家的重点是识别和治疗个体病原体。最有效的治疗策略之一是使用抗生素。然而,抗生素耐药病原体的增加,突出了对替代策略的需求。
▸抗生素破坏肠道菌群结构和功能,给病原体生长的空间
除了刺激耐抗生素病原体的生长外,抗生素还会破坏微生物群的结构和功能,从而使潜在的病原体能够定殖、生长和持续存在。由于对免疫系统、肠道微生物群和病原体之间的复杂平衡和相互作用的认识不断增加,传染病和临床微生物学领域目前正在发生范式转变,临床医生现在开始关注和拓展诊疗和用药信息,这是一个好消息。
▸肠道菌群与传染病之间关系最突出的例子是:抗生素使用后的艰难梭菌感染
在抗生素治疗期间,抗生素敏感细菌被杀死,导致微生物群的信号减少和对艰难梭菌的免疫反应减弱。
此外,由于没有其他细菌,艰难梭菌使用了更多的可用营养物质,这导致在一系列抗生素清除细菌的部位的定植率增加。抗生素的使用与艰难梭菌之间的密切关系使这种感染成为基于微生物组治疗的热门目标。
▸肠道菌群影响病毒感染
同样,多种肠道病毒,包括轮状病毒、诺如病毒(在我们的临床菌群检测报告中也会判别这两种病毒)和脊髓灰质炎病毒,已被证明利用细菌微生物组进行免疫逃避,支持进入肠道并在肠道中复制,从而增加感染率。
使用上述全身免疫机制,肠道微生物组已被证明具有影响全身病毒感染的潜力。例如,微生物群衍生的短链脂肪酸已被描述为通过改变 T 细胞的反应而对流感感染具有保护作用。此外,已证明 HIV 患者肠道内乳酸杆菌目的丰度较高与病毒载量呈负相关,这表明微生物群可以直接或间接地调节 HIV 感染的病理学。
▸ 肠道菌群也可能影响疫苗反应和药物代谢
这是目前有一个非常有意义的领域;然而,这可能也是药物或疫苗特异性的。
在 2017 年一项调查益生元和益生菌对疫苗免疫原性和有效性影响的随机对照试验 (RCT) 的系统评价和荟萃分析中,比较了 13 项使用益生菌的试验和 6 项使用益生元的试验。
然而,应该谨慎解释这项荟萃分析的总体结果,因为它结合了使用不同益生元和益生菌菌株后疫苗反应的数据。查看个别研究中的效果,有时显示没有效果,有时显示干预的积极效果,强调结果高度依赖于干预。
众所周知,营养对肠道微生物群的组成和免疫系统有很大影响,因此可以在健康和疾病的发展中发挥重要作用。
例如,西方饮食通过诱导骨髓祖细胞的表观遗传和转录重编程与炎症反应增强有关,从而直接影响几种非传染性疾病的发展。
增加对肠道微生物群、宿主反应和其他微生物之间关系的理解甚至进一步提供了调节这个三元组的机会。
例如通过营养来帮助维持肠道稳态和抗感染性。应该考虑到不同的膳食成分,如矿物质、碳水化合物、维生素、脂质和蛋白质,都具有特定的特性,它们以不同的方式直接或间接地通过微生物组影响宿主与病原体之间的相互作用。在这些营养素之间建立机制联系,为影响健康提供了多种机会。
饮食干预——
“操纵宿主-微生物轴的宝贵工具”,以帮助维持肠道稳态和感染抵抗力
碳水化合物、脂质、蛋白质、植物化学物质、矿物质和维生素等膳食成分都具有独特的结构和化学(物理化学)特性,可通过微生物组直接或间接影响宿主病原体抵抗力。弥合饮食、宿主和微生物组之间的差距,因为它们与免疫和抗病性有关,是一个多方面的领域,需要了解它们对肠道稳态的综合影响。
饮食促成了微生物群、宿主和病原体之间相互交织的机制的黑匣子
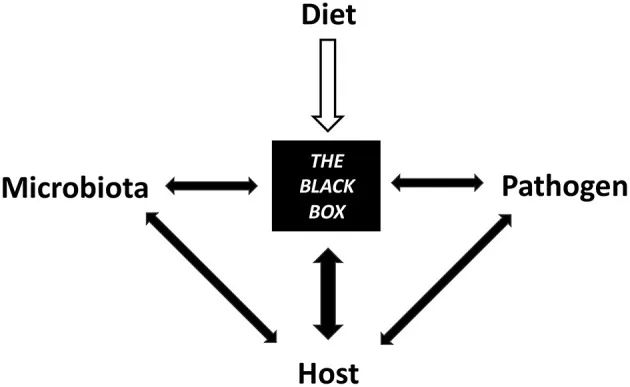
因此,饮食干预应被视为调节传染病风险、防止病原微生物入侵、减轻感染严重程度和支持传染病治疗的宝贵工具;然而,需要在这个迅速兴起的领域进行进一步的研究。
已知有多种营养化合物会对宿主微生物组和免疫系统产生影响,但膳食纤维、益生元和益生菌受到了很多关注。
★ 益生元
益生元是一种不易消化的食物成分,通过选择性地刺激结肠中一种或有限数量的细菌的生长和/或活性来对宿主产生有益的影响。这意味着并非所有的膳食纤维都是益生元,除非有证据表明该纤维被宿主有机体选择性地利用,从而对健康有益。
典型的益生元是人乳低聚糖 (HMO)、菊粉和低聚果糖,以及低聚半乳糖。
★ 膳食纤维
膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖 (AX)、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物来促进肠道中有益细菌的生长,同时通过排除生态位来抑制病原体的生长。
主要的发酵产物是短链脂肪酸,它们对免疫系统有重大影响,如上所述,因此可以抑制传染病的发展。除了短链脂肪酸,正如 Asadpoor 等人最近审查的那样,益生元和膳食纤维还可以通过排除和抗菌活性直接预防胃肠道感染。
★ 益生元和膳食纤维
益生元和膳食纤维与上皮细胞和免疫细胞的直接相互作用也有助于预防感染。已证明 DFs,如 β-葡聚糖和 AX 可激活 CLR dectin-1,这是一种参与训练免疫诱导的重要受体,可增加对继发感染的免疫反应。
HMO、AX 和果胶还与 TLR 相互作用,从而提高 DC (树突细胞)的功效,通过肠上皮细胞诱导产生耐受性树突系报告,并保护胃肠道免受过度的 TLR 信号传导,但也支持在胃肠道感染后消退炎症。
★ 益生菌
益生菌是活细菌,当以足够的量给药时,可为宿主提供健康益处。使用益生菌的基本原理主要是基于它们改变肠道微生物群的能力,支持共生细菌的生长超过病原菌的生长。
▸ 益生菌通过与病原体竞争营养和功能资源以及产生抗菌物质来塑造微生物群
许多研究调查了益生菌在预防和治疗传染病中的潜在作用;然而,并非所有数据都一致。
✔ 积极作用
在一项关于益生菌在急性腹泻中的疗效的 Cochrane 系统评价中,作者得出结论,益生菌通过缩短急性感染性腹泻的持续时间和减少平均排便频率具有明显的积极作用。
关于呼吸道感染,研究表明,使用益生菌的儿童在出生后第一年的呼吸道感染复发率较低,肺炎和严重急性下呼吸道感染的发生率也有所降低。
○ 单种益生菌未发现积极作用,联合治疗产生效果
一些研究并未发现对下呼吸道感染发病率的影响。例如,一项研究发现接受鼠李糖乳杆菌GG (LGG) 组和对照组之间的中耳炎 (OM) 发生率没有差异。
然而,另一项针对72名婴儿的试验表明,与对照组相比,接受LGG和乳酸双歧杆菌联合治疗的儿童发生OM的几率显著降低。
▸为什么会出现不同的结果?
数据的异质性,主要是由于菌株、剂量、研究环境和测量结果的变化,限制了广泛使用益生菌预防感染的循证建议。
对营养成分(例如益生菌)的影响产生矛盾结果的原因之一,可能是调查营养影响的临床研究通常与调查药物化合物影响的研究类似。这种类似药物的方法可能不适合识别个体对饮食治疗的反应,与药物化合物的靶向作用相比,这可能是多因素的。
如果不报告个体对营养干预的反应,可能会错过对于更好地了解营养、微生物组和宿主之间的相互作用至关重要的信息,而这些信息对于设计个性化的营养方法是必需的。
▸ 有没有什么方法可以深入了解特定营养素对个体特定健康结果的影响?
网络分析、系统生物学和基于机器的学习技术可以整合基于预先存在的大型队列数据集的多个特征(通过多年的积累和持续迭代,谷禾健康已经构建了超过60万例肠道样本数据),可以深入了解特定营养素对个体特定健康结果的影响。
例如,提出了一种机器学习算法来预测对现实生活中膳食摄入反应。然而,由于个人的整体健康结果取决于许多过程和反应,未来还需要调查血液、血糖反应以获得个人健康状况的更多整体情况。
▸ 为什么不同人对营养化合物的反应不同?
个体对营养化合物的反应受个体遗传特征的影响。例如,炎症基因(如 IL1B、IL6 和 TNFA)中的单核苷酸多态性 (SNP) 会导致不同的炎症反应,这可以解释观察到的对营养化合物的反应性差异的部分原因。
还有越来越多的证据表明,个体的遗传特征对于使肠道内的有益细菌定植至关重要,这会影响免疫系统、宿主的整体健康和传染病。
★ 合生元
除了分别使用益生元和益生菌外,还有一些营养概念将益生元和益生菌组合成混合物:合生元。考虑到上述临床研究的局限性,合生元已显示出部分临床上的成功,未来可能有望成为治疗选择之一。
这一点在最近在印度农村进行的一项随机、双盲、安慰剂对照试验中得到印证,该试验显示,在接受为期 7 天的合生元概念干预的新生儿中,败血症和随后的死亡显着减少。
注:败血症是发展中国家新生儿发病率和死亡率的主要原因,这一概念对促进全球儿童健康很有希望。
随着我们更多地了解肠道微生物群影响局部、先天和全身免疫的复杂机制,以及科学家,企业和临床医生开始利用这些信息来开发针对这些过程的方法,以支持改进预防和治疗策略为最终目标的传染性疾病。
目前对抗这些传染原的策略包括疫苗、小分子药物、提高卫生标准和针对特定疾病的干预措施的组合。虽然这些方法有助于大幅降低与感染相关的死亡发生率和人数,但仍需要继续投资于当前战略并开发新的治疗方法,以应对这些全球健康威胁。
这种干预策略应考虑到个体之间微生物组和免疫反应的显着差异,因此需要个性化的方法。饮食干预能够引起微生物组功能和下游免疫反应的快速变化,这一事实可用于开发量身定制的营养概念,从而影响传染病的发展和治疗成功。主要参考文献:
Wiertsema SP, van Bergenhenegouwen J, Garssen J, Knippels LMJ. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients. 2021 Mar 9;13(3):886.
van den Elsen LW, Poyntz HC, Weyrich LS, Young W, Forbes-Blom EE. Embracing the gut microbiota: the new frontier for inflammatory and infectious diseases. Clin Transl Immunology. 2017 Jan 20;6(1):e125.
Van den Elsen L.W., Poyntz H.C., Weyrich L.S., Young W., Forbes-Blom E.E. Embracing the gut microbiota: The new frontier for inflammatory and infectious diseases. Clin. Transl. Immunol. 2017;6:e125.
Iacob S, Iacob DG, Luminos LM. Intestinal Microbiota as a Host Defense Mechanism to Infectious Threats. Front Microbiol. 2019 Jan 23;9:3328. doi: 10.3389/fmicb.2018.03328. PMID: 30761120; PMCID: PMC6362409.
Kirk M.D., Pires S.M., Black R.E., Caipo M., Crump J.A., Devleesschauwer B., Döpfer D., Fazil A., Fischer-Walker C.L., Hald T., et al. World Health Organization Estimates of the Global and Regional Disease Burden of 22 Foodborne Bacterial, Protozoal, and Viral Diseases, 2010: A Data Synthesis. PLoS Med. 2015;12:e1001921.
Troeger C., Forouzanfar M., Rao P.C., Khalil I., Brown A., Reiner R.C., Jr., Fullman N., Thompson R.L., Abajobir A., Ahmed M., et al. Estimates of global, regional, and national morbidity, mortality, and aetiologies of diarrhoeal diseases: A systematic analysis for the Global Burden of Disease Study 2015. Lancet Infect. Dis. 2017;17:909–948.
Iacob S., Iacob D.G., Luminos L.M. Intestinal Microbiota as a Host Defense Mechanism to Infectious Threats. Front. Microbiol. 2018;9:3328. doi: 10.3389/fmicb.2018.03328.
Lazar V., Ditu L.-M., Pircalabioru G.G., Gheorghe I., Curutiu C., Holban A.M., Picu A., Petcu L., Chifiriuc M.C. Aspects of Gut Microbiota and Immune System Interactions in Infectious Diseases, Immunopathology, and Cancer. Front. Immunol. 2018;9:1830.
Slack E., Hapfelmeier S., Stecher B., Velykoredko Y., Stoel M., Lawson M.A.E., Geuking M.B., Beutler B., Tedder T.F., Hardt W.-D., et al. Innate and adaptive immunity cooperate flexibly to maintain host-microbiota mutualism. Science. 2009;325:617–620
谷禾健康
✦ ✦ ✦
炎症:就是平时人们所说的“发炎”,是机体对于刺激的一种防御反应。炎症,可以是感染引起的感染性炎症,也可以不是由于感染引起的非感染性炎症。
炎症在在各种症状中起重要作用,如脑雾、焦虑和抑郁、腹胀、各种身体疼痛和低血糖水平。为了更好地理解这是如何工作的,需要了解身体的炎症回路。

谷禾在本文中介绍了炎症的一些症状与原因,炎症回路如何影响人体的健康,并有研究发现肠道微生物在炎症回路中起重要作用,这有助于人们更好地认识炎症以及在炎症时做出正确的应对。
✦ ✦ ✦
从本质上讲,炎症是身体对任何类型的压力做出反应的结果。这意味着这可能是由于身体或心理性质的压力。
举例来说,身体压力的一个例子可能是你跌倒摔断了腿,或者你患上了流感。另一方面,心理压力是你情绪的结果,如你在上班路上与路人发生激烈的争吵。
★ 炎症的症状
炎症是身体一系列变化的结果。这些是在分子和细胞水平上产生的信号,可以改变你的正常生理反应。炎症一般有四个症状:
Dolor – pain (疼痛、悲伤)
引起炎症局部疼痛的因素与多种因素有关。局部炎症病灶内钾离子、氢离子的积聚,尤其是炎症介质诸如前列腺素、5-羟色胺、缓激肽等的刺激是引起疼痛的主要原因。
炎症病灶内渗出物造成组织肿胀,张力增高,压迫神经末梢可引起疼痛,故疏松组织发炎时疼痛相对较轻,而牙髓和骨膜的炎症往往引起剧痛;此外,发炎的器官肿大,使富含感觉神经末梢的被膜张力增加,神经末梢受牵拉而引起疼痛。
Rubor – redness (发红)
由于炎症病灶内充血所致,炎症初期由于动脉性充血,局部氧合血红蛋白增多,故呈鲜红色。随着炎症的发展,血流缓慢、淤血和停滞,局部组织含还原血红蛋白增多,故呈暗红色。
Calor – heat (灼热、发热)
热是由于动脉性充血及代谢增强所致,白细胞产生的白细胞介素Ⅰ(IL-1)、肿瘤坏死因子(TNF)及前列腺素E(PGE)等均可引起发热。
Tumor (肿胀、肿瘤)
主要是由于渗出物,特别是炎性水肿所致。慢性炎症时,组织和细胞的增生也可引起局部肿胀。
•身体对抗病原体产生炎症
当涉及到身体自我修复时,炎症是极其重要的,因为炎症过程允许身体对抗和摆脱任何造成伤害的东西。我们感觉到的症状——发红、肿胀、疼痛和发热——是这个过程的副作用。
当我们的身体开始保护自己免受侵入我们身体的毒素和病原体或身体开始愈合时,炎症就开始了。
•炎症影响内分泌
在这个过程中,毛细血管扩张,而血管壁变得更加多孔。这允许白细胞穿过血管壁,从而到达因感染而造成损害的区域。
这些区域的肿胀和相关疼痛是由于液体积聚,进而对这些区域的神经施加压力,从而导致我们感到疼痛和不适。
分子介质(即抗炎分子)也会引发疼痛,增加您的不适感。在炎症过程中感受到的热量是由于流向身体特定区域的血流量增加所致。
// 小结
一般来说,炎症回路会对您体内的任何情况做出反应,以保持自身健康并以最佳状态工作。这是一种自然的生物反应。然而,当炎症不受控制时,就会出现问题。如果您身体的自然炎症反应没有得到抑制和控制,可能是慢性炎症。
•炎症具有防御作用
在炎症过程中,以血管系统为中心的一系列局部反应限制并消除损伤因子,同时也促进受损组织的愈合。液体的渗出可稀释毒素,吞噬搬运坏死组织以利于再生和修复,使致病因子局限在炎症部位而不蔓延全身。
因此,炎症是以防御为主的天然的局部反应,一般而论,是对机体有利的。可以设想,如果没有炎症反应,细菌感染就无法控制,损伤永远也不能愈合,对机体可以造成严重的危害。
•一些情况下炎症是有害的
但是在有些情况下,炎症又是潜在有害的。炎症反应是一些疾病的发病基础,如严重的超敏反应炎症过于剧烈时可以威胁病人的生命。
此外,特殊部位或器官所发生的炎症可造成严重后果,如脑或脑的炎症可压迫生命中枢,声带炎症阻塞喉部导致窒息,严重的心肌炎可以影响心脏功能,此时,应使用抗炎症药物抑制炎症反应。
如上所述,炎症是身体或心理压力的结果。然而,由心理压力引起的炎症通常比由身体(生理)压力引发的炎症影响要小。炎症是对身体所经历的任何威胁的自动反应。
炎症通常可依病程经过分为两大类:急性炎症和慢性炎症。急性炎症起病急骤,持续时间短,仅几天到一个月,以渗出病变为其特征,炎症细胞浸润以粒细胞为主。
慢性炎症持续时间较长,常数月到数年,常以增生病变为主,其炎症细胞浸润则以巨噬细胞和淋巴细胞为主。
✦急性炎症较容易控制
健康人的急性炎症很容易控制。健康身体在感知到威胁时被激活,然后它与感染作斗争并开始修复任何损坏。然而,一旦威胁过去,身体也会恢复正常,让身体再次正常运作。肾上腺分泌的皮质醇激素控制炎症“关闭”过程。
注:皮质醇也是身体的减压激素。
✦慢性炎症易反复发作,治疗较困难
虽然炎症的典型迹象很容易识别(发热、发红、疼痛和肿胀),但慢性炎症的迹象并不那么容易看到。其中包括:腹胀、食物敏感、焦虑、抑郁、肠漏(肠易激)、头晕等等。
多数可以由急性炎症治疗不及时、不彻底,或治疗效果不佳,造成疾病逐渐发展导致,一般持续时间比较长,多数在6周以上,甚至长达数月或数年。并且慢性炎症的治疗比较困难,而且容易反复发作。
✦持续炎症具有负面影响
通常身体对急性炎症的反应相关的短期疼痛是具有长期益处的。然而,当涉及到低度、持续的炎症时,情况并非如此,这种炎症通常是对心理压力和慢性感染的反应,就像莱姆病或EB病毒一样。
这种情况,身体会经历持续的压力状态,导致炎症回路超时工作,结果是一种不平衡的状态,使你的身体更容易感染不同的疾病,并对与衰老过程相关的影响产生负面影响。
莱姆病是一种以蜱为媒介的螺旋体感染性疾病,是由伯氏疏螺旋体所致的自然疫源性疾病。
EB病毒(Epstein-Barr virus,EBV)是疱疹病毒科嗜淋巴细胞病毒属的成员,基因组为DNA。EB病毒具有在体内外专一性地感染人类及某些灵长类B细胞的生物学特性。人是EB病毒感染的宿主,主要通过唾液传播。无症状感染多发生在幼儿,3~5岁幼儿90%以上曾感染EB病毒,90%以上的成人都有病毒抗体。
这种炎症虽然不明显,但在实际表现出来之前已经存在多年。这种炎症状态存在的时间长度不仅直接影响诊断疾病的严重程度,还直接影响预后。在许多情况下,你身体的炎症回路对某些疾病的反应是某些慢性疾病的原因。
注意
尽管炎症不舒服,但也是必要的,身体的设计方式既可以让我们既可以忍受它又可以控制它。研究表明,即使没有身体迹象,慢性低水平压力也会在体内停留一段时间,并对生理和心理健康产生负面影响。
✦许多疾病都伴有炎症
与特定慢性病相关的炎症是局部的。例如:心脏病患者的动脉有局部炎症,糖尿病患者的胰腺有炎症,阿尔茨海默氏症患者的大脑有炎症。
炎症也可能是环境或我们吃的食物中存在或身体代谢出来某些毒素的结果。在这种情况下,这些毒素会影响身体的不同部位,包括局部和全身。
★ 与炎症相关的疾病
有许多疾病和健康问题都包括炎症的一个方面。其中包括:纤维肌痛、狼疮、哮喘、中风、乳糜泻、自闭症、酸回流、对某些感染(病毒、细菌、真菌)的易感性、癌症、关节炎、皮肤问题,以及糖尿病、慢性疼痛、支气管炎、骨质疏松症等
任何能够引起组织损伤的因素都可成为炎症的原因,即致炎因子。可归纳为以下几类:
生物性因子
细菌、病毒、立克次体、支原体、真菌、螺旋体和寄生虫等为炎症最常见的原因。由生物病原体引起的炎症又称感染。
物理性因子
高温、低温、放射性物质及紫外线等和机械损伤。
化学性因子
外源性化学物质如强酸、强碱及松节油、芥子气等。内源性毒性物质如坏死组织的分解产物及在某些病理条件下堆积于体内的代谢产物如尿素等。
坏死组织
缺血缺氧等原因引起的组织坏死是潜在的致炎因子。
免疫反应
免疫反应所造成的组织损伤最常见于各种类型的超敏反应:I型变态反应如过敏性鼻炎、荨麻疹,II型变态反应如抗基底膜性肾小球肾炎,III型变态反应如免疫复合物沉着所致的肾小球肾炎,IV型变态反应如结核、伤寒等;另外,还有许多自身免疫性疾病如淋巴细胞性甲状腺炎、溃疡性结肠炎等。
✦慢性炎症的原因
慢性炎症的原因相较于急性炎症有所不同,主要是炎症回路变得不平衡。其中包括:
•肠道菌群失调
•环境毒素
•生活方式和饮食不健康
•某些药物,例如导致肠道菌群失调的抗生素
✦慢性压力对炎症有重要影响
慢性压力,无论是心理上的还是生理上的,都会导致肾上腺皮质醇的过量产生,从而导致炎症
注:肾上腺疲劳通常被忽视为炎症回路不平衡的原因。
✦炎症回路会及时对压力做出反应
当身体受到任何类型的“压力”时,炎症回路是关键的反应器之一。当对压力做出反应时,炎症反应与其他身体系统和器官协同工作。最直接影响炎症回路的身体系统包括:免疫系统、肠道(胃肠道)以及微生物组。
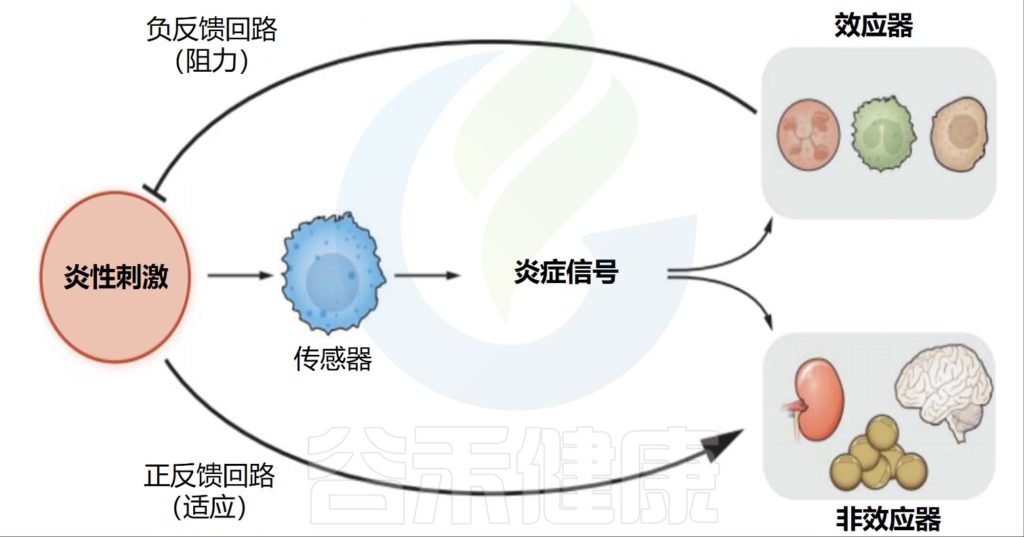
Medzhitov R.Science.2021
所有炎症反应都包括四个部分。这些信号包括触发反应的炎性刺激、检测它们的传感器、传感器产生的炎症信号以及炎症信号的各种目标。
•负反馈回路直接消除病原体
炎症信号有两种类型的靶点:第一种是效应靶点,它们直接参与了炎症病原体的消除。炎症信号诱导效应细胞的激活、招募和分化。炎症回路的这一部分以负反馈的方式运作。
•正反馈回路调节信号
第二种靶点是不直接参与病原体消除的组织和器官。根据问题是什么(调节、功能或结构的缺失),炎症信号会以与稳态信号相同的“方向”改变这些功能,或者对抗稳态信号。
✦面对病原体激活炎性小体
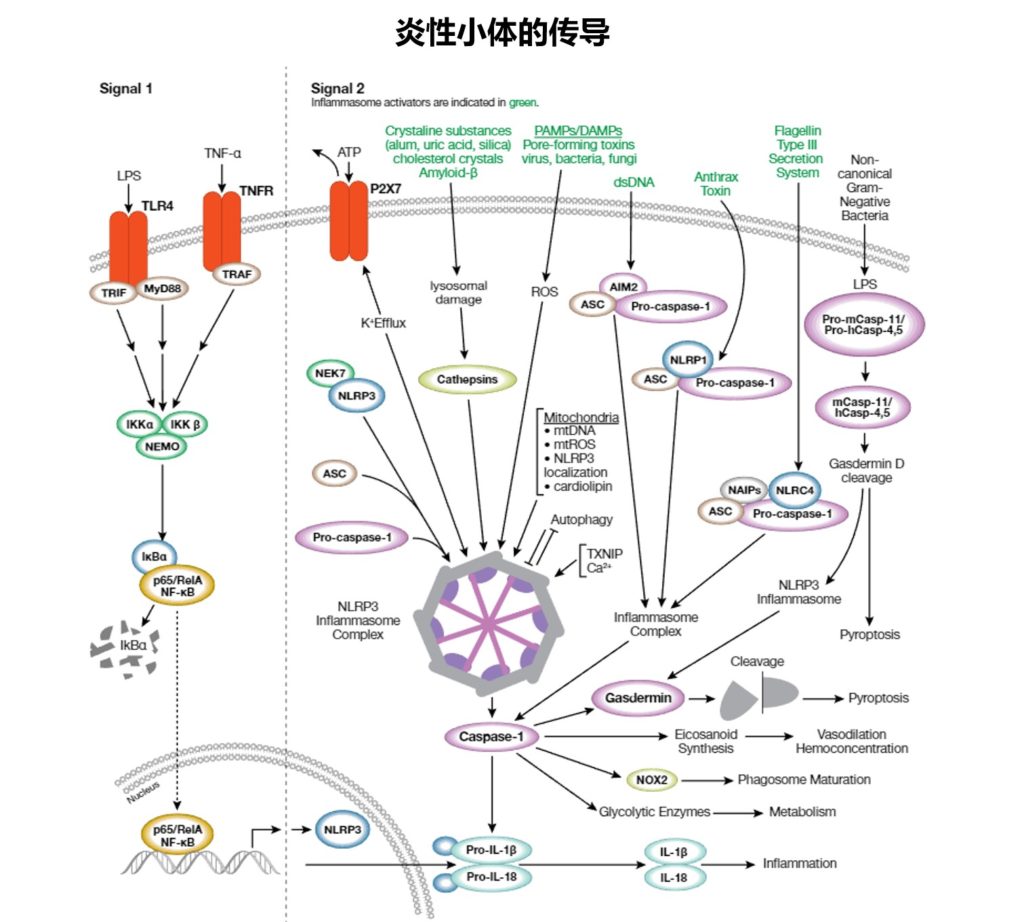
2023 © Cell Signaling Technology
先天性免疫系统是防止病原微生物和宿主源性细胞窘迫信号的第一道防线。这些“危险”信号诱发炎症的一种方式是通过激活炎性体,炎性体是在暴露在病原体相关分子模式 (PAMP) 或危险相关分子模式 (DAMP) 下之后在胞质中组装的多蛋白复合体,并且会激活caspase-1以及后续裂解活化促炎性细胞因子白细胞介素1β和白细胞介素18。
炎性复合体
炎性复合体通常含有胞质模式识别受体(PRR;一种核苷酸结合结构域和亮氨酸富集重复序列 [NLR] 或 AIM2 样受体 [ALR] 家族成员)、接头蛋白 (ASC) 和 pro-caspase-1。
现已检测到许多不同的炎性体复合体,每个复合体有独特的PRR和激活触发物。特征最明显的是NLRP3复合体,它含有 NLRP3、ASC、pro-caspase-1和丝氨酸-苏氨酸激酶NEK7。NLRP3炎性体在2个步骤的过程中被激活。
首先,PAMP或DAMP介导的TLR4或TNFR 激活会诱导 NF-kB 信号转导,导致NLRP3、pro-IL-1β和pro-IL-18表达升高(引导步骤,信号1)。
接下来,大量信号(全病原体、PAMP/DAMP、钾外流、溶酶体损坏的环境因子 [尿酸、硅和明矾]、内源性因子 [淀粉样蛋白 β、胆固醇结晶] 和线粒体损害)会间接激活NLRP3,导致复合体组装和 caspase-1激活(信号2)。
蛋白组分之间的结构域相互作用会形成复合体炎性体结构。其他炎性体通过更直接的方式被激活:双链DNA激活AIM2复合体,炭疽霉素激活NLRP1,细菌flagelllin激活NLRC4。激活的caspase-1会诱导促炎性细胞因子IL-1β和-18的分泌,而且调控代谢酶表达、吞噬体成熟、血管舒张和细胞焦亡(一种炎性程序性细胞死亡)。
炎性体信号转导会导致许多疾病的发作,包括动脉粥样硬化、II型糖尿病、阿尔茨海默病和自身免疫性疾病。
✦抗炎信号调节炎症器官
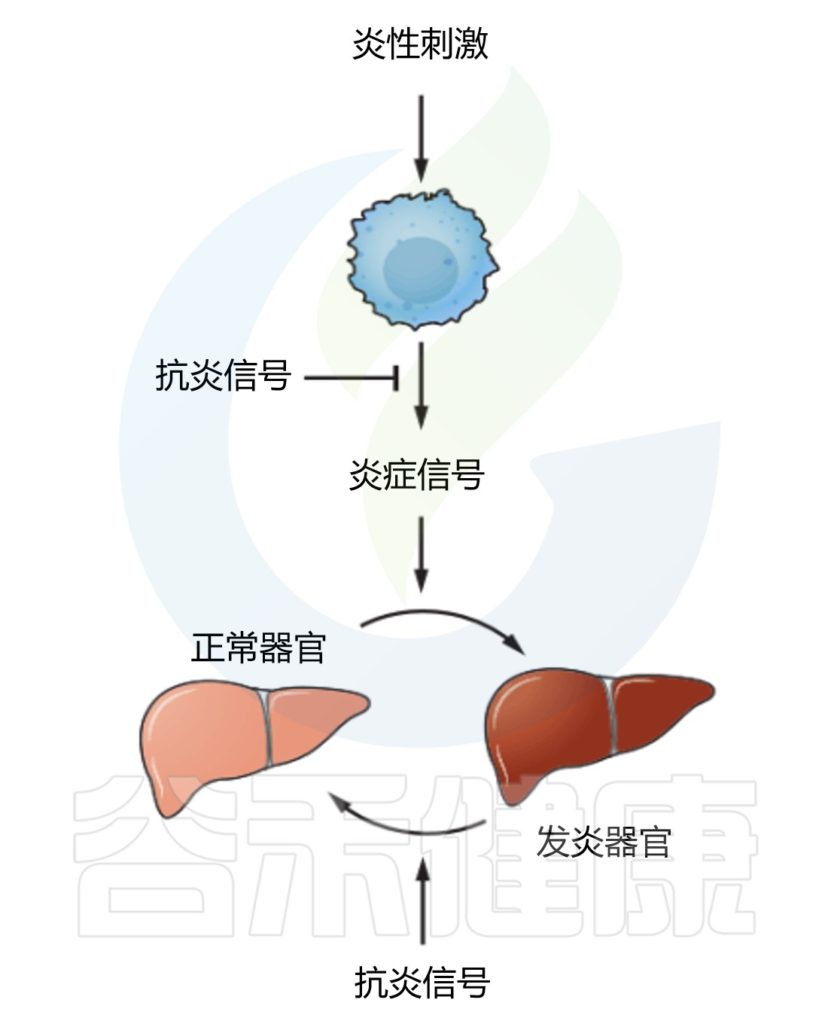
Medzhitov R.Science.2021
消除病原体本身并不足以控制炎症,在没有负调节因子的情况下,炎症反应总是极端过渡到病理状态。
控制炎症程度的抗炎信号(Anti-inflammatory signals)包括IL-10、TGF-β和糖皮质激素等。如何抑制由炎症反应引起的附带损伤也很重要,一种机制有可能是通过靶组织对炎症信号的反应性不同,使最容易受到炎症损伤的重要组织和器官对炎症信号的反应性较低。
另一种可能机制是通过“反炎信号(counter-inflammatory signals)”将组织的炎症状态恢复到原来的“稳态”状态。控制靶组织的反应程度,将炎症反应成本降到最低。
这些稳态信号很可能纠正机体偏离正常时的炎症状态,例如肾上腺素对支气管平滑肌的影响:组胺和白三烯在炎症反应中诱导支气管收缩,而肾上腺素通过诱导支气管松弛恢复到稳态来抵消这种作用。
目前发现的“反炎信号”(counter-inflammatory signals)有调节性T细胞(Tregs,不仅控制炎症的大小,而且还控制组织稳态)和参与分解的信号分子(脂质素和分解素)。
需要注意的是,抗炎和反炎作用可能由相同的信号来实现。例如,腺苷和TGF-β可能同时具有抗炎(即作用于传感器细胞和效应细胞)和反炎(即作用于所有其他靶组织)来调节炎症的模式。
不足之处
虽然现有的抗炎药物提供了一定的治疗效果,但它们增加了对感染的易感性。激活抗炎途径应该在不损害防御功能的同时,有助于恢复组织和器官的稳态。
抗炎途径的研究未来将是新型治疗方法开发的重要方向,更多抗炎信号的研究可能有助产生炎症领域的有效新药。
✦大部分炎症性疾病始于胃肠道
大多数不同的炎症性疾病始于身体的肠道(或胃肠道)。从那里扩散到身体的不同部位。肠道内壁是可渗透的,这意味着它允许某些物质通过并进入血液。
•炎性物质可能会扩散到其他器官
然而,当这种渗透性增加时,不需要的物质也会通过,从而触发身体的免疫系统来对抗它。这可能不仅会导致炎症,还会导致过敏和疾病。在某些情况下,这些毒素会进入您的大脑,不仅会导致抑郁症,还会导致某些神经系统问题。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
✦炎症小体与肠道稳态相关
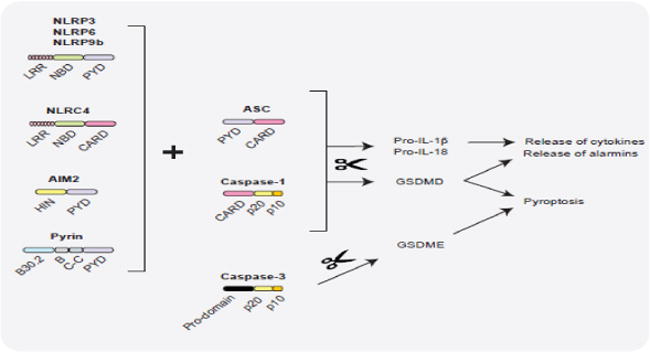
Rathinam VAK,et al.Trends Mol Med.2018
宿主和微生物来源的各种信号被不同的炎性体受体感知,导致ASC-CASPASE-1复合物的组装和 CASPASE-1的成熟。在酶促作用下,活性 CASPASE-1通过蛋白水解加工激活pro-IL-1β、pro-IL-18和gasdermin D (GSDMD)。GSDMD通过质膜穿孔执行裂解性细胞死亡,还促进IL-1β、IL-18和警报素释放。
•炎性体影响肠道上皮细胞
炎性体激活的所有这些结果都会在不同程度上影响肠上皮细胞和固有层免疫细胞的功能,从而以依赖于环境的方式协调肠道稳态。
此外,细胞凋亡半胱天冬酶CASPASE-3可以裂解GSDME以响应化疗,从而引发癌细胞焦亡。然而,尚不清楚GSDME诱导的细胞焦亡是否参与肠道稳态。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
下面让我们来看看可能由发炎的胃肠系统引起的一些症状。
食物敏感性和炎症回路
目前面临比较突出的问题越来越多的人正在增加对某些食物的敏感性,尤其是麸质。食物敏感性经常长时间未被诊断的原因是因为这些症状与其他肠道疾病和病症的症状非常相似。他们通常被误认为是另一种疾病。
为什么对麸质敏感的人数增加了这么多?
小麦经过各种加工使其变得更易溶于水,以便与其他成分混合。这意味着我们实际上消耗的小麦数量比我们的祖先曾经做过的要多得多。
食用后,由于酶的作用,麸质会分解成麦醇溶蛋白和麦谷蛋白。一旦它们到达您的肠道相关淋巴组织 (GALT),系统就会对其进行评估,以确定它们是否对您的身体有害。
•酶的攻击使肠道受损
如果您碰巧对麸质敏感,GALT会通过抗体攻击蛋白质。在患有乳糜泻的人中,分解麸质的蛋白质和酶都会受到GALT产生的抗体的攻击。
这种酶的另一个功能是帮助吸收营养。这是通过将肠道的微绒毛保持在一起来实现的。微绒毛是在肠壁中发现的毛发状结构。对这种酶的任何攻击都会导致微绒毛受损——进而对肠壁产生负面影响,使其更容易被毒素渗透,并导致称为漏肠的状况。抗体还可能攻击你自身的器官和组织,例如皮肤和大脑,结果就是发生自身免疫性疾病。
然而,引起炎症的不仅仅是麸质。其他来源是乳制品、含有亚油酸的油,例如花生油、向日葵油、红花油和玉米油,以及海鲜和特定调味品。
可以通过识别和消除敏感的食物来治愈肠道并平息您的炎症回路。慢性炎症与肾上腺疲劳综合征 (AFS) 和神经内代谢 (NEM) 应激反应密切相关。通过调整饮食,您可以帮助自己从肾上腺疲劳中恢复过来,同时降低患胃肠道疾病的风险。
便秘与炎症回路
什么是便秘?
便秘是一种排便不规律的情况,导致排便困难,过程伴随痛苦的。偶尔便秘被认为是正常的,经常便秘可能会导致肠道疾病,从而影响炎症回路。
你可能会问“正常到什么程度才正常?” 它因人而异,但在大多数情况下,每天排便一次或两次在被认为是正常的范围内。超过三天没有排便会导致便秘,因为随着时间的推移大便会变干,使排便变得更加困难和痛苦。
✦便秘会引起其他问题
便秘时上厕所不仅不舒服,而且用力也会引起一系列问题,例如痔疮或憩室病。
✦便秘的原因
便秘的原因有很多。其中包括:纤维含量低的饮食、喝水过少、乳制品含量高的饮食、结肠癌、肠易激综合征、长时间不活动、结肠肌肉或神经问题引起的问题、压力、某些类型的药物、甲状腺功能减退和怀孕。
便秘通常是肾上腺疲劳后期出现的并发症,因为您的身体能量水平降低,难以排便以保存能量。你的消化速度减慢,导致废物留在结肠中。这会增加毒性并导致炎症。
✦便秘的危害
如果不理会,随着肾上腺疲劳的加剧,随着时间的推移,情况可能会变得更糟。体内积聚的毒素压倒了炎症回路,可能导致炎症,进而导致肌肉骨骼系统的崩溃。这还包括内部器官的胶原蛋白结构。随着时间的推移,胃肠道会受到损害,从而导致便秘和消化问题恶化的循环效应。
•便秘容易加重一系列疾病
由于胃不能产生足够的酸来分解食物以吸收营养,这会耗尽细胞,结果是一个循环导致整个系统减速以节省能量。然而,它可能导致以体重大幅减轻为特征的分解代谢状态。
在大多数情况下,甲状腺也会受到损害,会减慢速度以降低新陈代谢率以节省能量。这进一步加剧了疲劳并增加了便秘问题。由于废物堆积,毒素开始影响肝脏和肾脏功能。
•改善肠道菌群有助于调节便秘
如果便秘严重或持续存在,则可能需要干预。这其中包括改善肠道菌群组成,帮助调节肠道运动,有助于改善便秘及相关症状。
腹泻和炎症回路
腹泻会导致脱水并失去电解质。如果持续存在,可能表明存在更严重的问题。
注:如果发现大便中有血或粘液,并且发烧、疼痛或体重减轻,您可能需要尽快咨询医生或就医,因为这些是潜在的、更深层次的问题的迹象。
✦腹泻的病因
腹泻有多种常见原因。这些包括细菌,吃你过敏或敏感的食物,或病毒。其他原因可能包括克罗恩氏病、肠易激综合征 (IBS)、糖尿病、某些癌症、甲状腺机能亢进和吸收不良等。
然而,在大多数情况下,腹泻与这些疾病中的任何一种都无关,而且问题通常可以通过药店买治疗腹泻的药就可以缓解。在大多数情况下,清淡的食物、充足的休息和保持水分会很有帮助。
注意
患有肾上腺疲劳综合症 (AFS) 的人通常更容易患便秘而不是腹泻。另一方面,肾上腺衰竭晚期的人往往会出现非常严重的腹泻。
肠易激综合征和炎症回路
肠道最重要的目的之一是防止毒素、微生物、未消化的食物和外来物质进入血液。健康时,肠道黏膜细胞的连接很紧密,只允许身体所需的营养物质通过。当你的肠道渗漏时,这些连接处就不那么紧密了,毒素和其他颗粒会被允许通过。这些被免疫系统视为外来入侵者。然后你的炎症回路会攻击它们,导致炎症。
✦症状
肠易激综合征 (IBS) 的症状包括:恶心、背疼、尿频、焦虑、疲劳、腹胀、肚子痛、便秘/腹泻、口臭、关节痛、头痛。
当实验室测试排除具有类似症状的其他情况时,通常通过排除过程来诊断肠易激综合征。它本质上是对胃肠道的刺激。
✦病因
许多因素会导致肠易激综合征,例如使用某些药物,抗生素,焦虑,抑郁,荷尔蒙失衡和各种其他因素。压力起着重要作用。
患有肠易激综合征的后期阶段新陈代谢减慢以节省能量。在这个过程中,肠道运动也会减慢。因此,食物以慢得多的速度穿过身体。结果通常是便秘,尽管有时也会出现腹泻。当然,这会增加肠道刺激并恶化与肠易激综合征相关的症状。
建议
某些补充剂,如omega-3脂肪酸、谷氨酰胺、植物甾醇、槲皮素和益生菌益生元,改善饮食等都可能有助于预防肠易激综合征的发生。某些类型的纤维甚至有助于帮助微生物组和加强炎症回路。
微生物组(microbiome )可以描述为体内特定环境中所有不同微生物的所有遗传物质。这是炎症回路的第二部分。
注:不应将术语微生物群与仅指特定环境中的微生物(microbiota),即仅指胃肠道中的微生物这一术语混淆。
据估计,人体中大约90%的细胞都不是人类的。在大多数情况下,它们本质上是原核生物。原核生物是单细胞的,没有线粒体,细胞核没有膜。这些原核细胞是来自1,800多个不同属的 4 万多种不同菌株的结果。而肠道中拥有最丰富的微生物群。
当我们年轻的时候,肠道的微生物组在我们免疫系统的形成中起着极其重要的作用。在免疫系统仍在发育的儿童早期尤其如此。
✦免疫系统影响炎症的产生
小时候,我们的身体免疫系统接触并习惯于抗原,并对它们产生耐受性。一旦达到稳态(平衡)状态,外来微生物和抗原将无法在体内引起炎症反应。
只有当我们的免疫系统较弱或发育不全时,接触外来过敏原才会触发炎症回路中的反应,导致自身免疫性疾病、过敏以及对化学品和某些食物的敏感性问题。
一个很好的例子是老鼠一生都被关在无菌环境中。虽然他们很健康,但他们的免疫系统还没有完全发育。一旦接触到外来微生物,它们往往会发展为自身免疫性疾病和其他健康问题。
✦微生物群对健康有重要影响
研究表明,婴儿的第一个肠道微生物组对他们的健康有着深远的影响。
身体某些部位的不同微生物具有相同的功能。一个例子是,两个人的舌头上有不同的微生物,但在分解糖分时,他们的工作完全相同。就我们所吃的食物而言,微生物需要一个稳定的栖息地。反过来,当它们分解某些被肠道消化的成分时,我们会从释放的热能中受益。
这意味着我们的身体和我们的微生物宿主之间存在明确的、有益的相互作用,并且身体中的某些功能依赖于这些微生物才能保持健康。当由于某种原因,我们的微生物群落失衡时,我们就处于生态失调状态。
•肠道菌群影响炎症回路
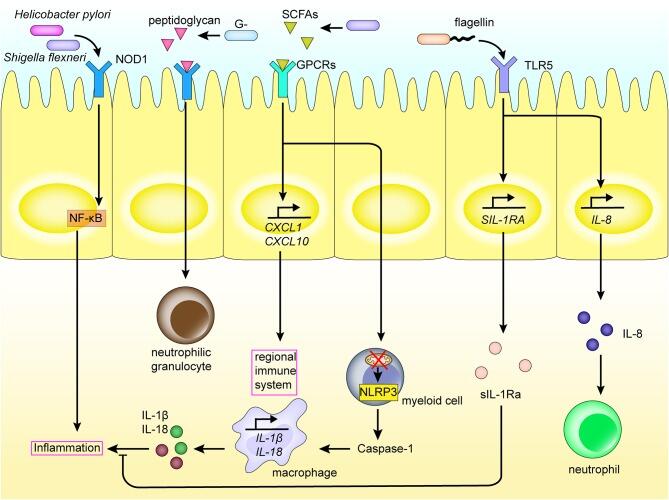
Zhou B,et al.Front Immunol.2020
肠道菌群和代谢物与肠道中的区域免疫系统相互作用。PRRs如NOD1、表达于肠粘膜上皮细胞的Toll样受体,识别肠道菌群的PAMPs和短链脂肪酸,从而激活炎症通路和炎症细胞因子的产生。
这会诱导骨髓细胞的分化、巨噬细胞和中性粒细胞的募集等,引发炎症反应,并激活局部免疫系统。这种相互作用还促进炎症因子的表达。
炎症通常是生态失调的结果。它在许多健康问题中发挥作用,包括糖尿病、肥胖症、哮喘、自闭症和心脏问题等。它还与某些与肠道有关的问题有关,例如克罗恩病。它也可能在大脑中发挥作用,被认为是肠易激综合征 (IBS) 的触发因素之一。这些情况都与肠道生态失调有关。
生态失调的一个常见原因是抗生素。它们会破坏保持系统平衡所需的“好”细菌。当“好”微生物组受到负面影响时,免疫系统也会受到负面影响。
✦肠道菌群失调引起炎症
肠道菌群失调可能引起炎症,进而导致粘膜损伤。当不同黏膜细胞之间的连接受损时,免疫系统会做出相应的反应。
蛋白质、细菌和毒素很容易通过受损的肠壁进入血液,导致所谓的肠漏。与这种情况相关的症状包括:脑雾、抑郁、失眠和疲劳,以及许多其他症状。
健康的肠道细菌与多样化的微生物组相结合,可以形成健康的肠道来支持炎症回路。肠道健康的人通常更健康,感染或复发性疾病的可能性更低,因为他们的身体防御系统更强。
微生物组和神经系统疾病
肠道菌群失调与许多神经系统疾病有关。其中包括自闭症谱系、多发性硬化症 (MS) 和帕金森氏症。帕金森病患者的最初症状通常是便秘,随后是嗅觉和味觉丧失。其他症状,如震颤和摇晃,仅在胃肠道紊乱出现后很久才会出现。
有许多环境因素会影响神经系统状况和炎症回路。其中之一是大脑中没有正确使用蛋白质,导致许多神经退行性疾病。这可能是肠道炎症触发大脑中某些炎症反应的结果,导致蛋白质使用不足和大脑神经细胞退化。
炎症和肠道失衡也可能与某些自身免疫性疾病有关。西方国家的人群有相似的饮食和相应的更高的多发性硬化症发病率。随后的饮食可能会导致炎症,从而破坏肠道中存在的微生物的正常功能。
•压力与饮食通过肠道进而影响炎症回路
帕金森氏症和多发性硬化症患者的肠壁通透性增加,导致针对多种抗原的抗体增加。有证据表明,持续的压力以及其他各种原因是炎症回路失调的原因。
阿尔茨海默氏症和认知功能下降的特点是氧化应激、免疫问题和大脑本身的变化。实验表明,这些都是由于饮食及其对肠道生物群落的影响。神经营养因子是一种保护和促进健康神经元的蛋白质,它依赖于健康的肠道生物群落。阿尔茨海默病患者在这方面表现出明显下降。
微生物组对精神疾病的影响
有证据表明肠道和大脑健康之间存在很强的相关性。这意味着某些心理问题,例如抑郁症,可能是炎症的结果,肠道是最初的煽动者。对动物的研究表明,当某些微生物从抑郁的小鼠身上移植时,健康小鼠的心理会显著下降。
•肠道微生物有助于神经与身体恢复
与肾上腺疲劳综合症相关的两个最常见的症状是焦虑和抑郁。因此,有证据表明,有问题的人必须确保健康的肠道微生物组。它不仅有助于恢复他们的神经处理,还有助于身体恢复。
▸ 小肠细菌过度生长造成危害
当小肠中细菌的生长超出健康限度时,这种情况被称为小肠细菌过度生长 (SIBO)。这些细菌通常存在于结肠中。患有小肠细菌过度生长的人与患有肠易激综合征的人有非常相似的症状,许多人同时患有这两种情况。与该病症相关的症状包括腹痛、便秘、腹胀、胀气和腹泻。
•原因
这种情况发展的原因有很多。最常见的原因包括:
•高糖饮食、富含精制碳水化合物的饮食、酒精过多;
•克罗恩病导致的疤痕会聚集细菌;
•憩室病,其中小肠壁形成袋并收集细菌;
•某些药物,例如对肠道菌群具有破坏性影响的抗生素;
•由于念珠菌、莱姆病和人类疱疹病毒等感染导致炎症回路减弱
•危害
如果小肠细菌过度生长未经治疗,它会对健康产生不利影响,导致慢性腹泻,导致身体所需营养物质吸收不足,最终导致营养不良。
•抵抗外界病原体会触发炎症
炎症是免疫系统的重要组成部分。慢性炎症通常是感染、对自身身体物质的自身免疫反应或来自环境的抗原等的结果。
在慢性炎症的情况下,介质是单核细胞和巨噬细胞,它们是免疫系统的组成部分。也称为白细胞,白细胞在遇到问题时会释放化学试剂,靶向导致炎症回路反应的化学试剂。
•修复自身组织也会触发炎症
然而,问题是这些细胞不仅针对入侵者,还针对您自己的组织,从而造成损害。这些受损组织需要不断修复。慢性感染也是导致您的身体不断发展新血管的原因。
完成的修复工作通常会引起刺激,从而导致炎症过程被重新触发。如果由于某种原因,这变成了一个循环,你的身体就会一直处于炎症状态,从长远来看,它会产生衰弱的影响。
注:现代医学并没有为问题提供长期的解决方案。有时,会开具某些抑制免疫力的类固醇。然而,这些药物通常只能提供短期的症状缓解,并不能解决问题的根本原因。
当处于压力之下时,免疫系统会发现并保护我们免受病原体的侵害,从而引发炎症反应来解决问题。免疫系统因此攻击并清除任何潜在的危险病原体。一个按预期发挥作用的免疫系统可以迅速摆脱某些慢性病原体和感染带来的危险。
✦免疫系统过强和减弱都会导致疾病
尽管免疫系统减弱通常是导致反复感染,甚至是那些难以摆脱的感染的原因,但这不一定是疾病的原因——免疫系统过度活跃也可能是原因。
在“正常”条件下,免疫系统会识别并瞄准敌人的病原体,而将那些被认为是有益的病原体留在一边。然而,有时情况并非如此,炎症回路变得过激,甚至对正常细胞和条件产生免疫反应。
由于强大的免疫系统,炎症回路不一定能正常工作,免疫系统会在过度活跃时导致自身免疫问题。
当这种情况发生时,某些抗体会混淆它们所看到的正常细胞和被认为是病原体的细胞。然后它不分青红皂白地攻击。结果,当这种情况发生时,炎症回路随后会出现与某些自身免疫状况一致的突然发作。
✦导致免疫过度的原因
考虑以下情况,身体可能会将自己的细胞识别为外来细胞并产生自身免疫类型的反应:
•食物敏感性
吃我们敏感的食物会引起炎症,并导致我们的免疫细胞将我们的组织视为异物。免疫反应被激活以摆脱这些不受欢迎的客人。
•微生物组失衡
我们的肠道本身就是一个完整的生态系统。当这个系统失去平衡时,如患有小肠细菌过度生长、胃反流、幽门螺杆菌、肠易激、炎症性肠病、分解代谢状态或肾上腺疲劳晚期胃部减慢的人,可能意味着好的有益细菌被外来的非有益细菌所取代。
外来机会性细菌和隐形病毒从休眠状态转变为活跃状态。这会导致免疫系统超速运转,从而导致慢性炎症。
在这个过程中,免疫系统,特别是在过度活跃的状态下,很容易混淆谁是真正的敌人。外来机会性细菌及其自身同时受到攻击,导致各种自身免疫性疾病。
•HPA轴不平衡
HPA轴又叫下丘脑-垂体-肾上腺轴,是身体的主要压力调节激素轴。皮质醇是主要的抗应激激素。在肾上腺疲劳的晚期阶段,产生的皮质醇不足会导致猖獗的全身炎症,进而导致或引发自身免疫症状。
•肠漏或肠道通透性增加
当食物颗粒穿过胃肠黏膜时,就会引发炎症。未消化的食物应该在胃肠道内。当它进入肝循环和身体其他部位时,免疫系统将其识别为异物,并尽一切努力尝试攻击和中和这些异物。
免疫系统的持续激活会导致免疫细胞与正常细胞发生交叉反应,从而引发自身免疫性疾病
•重金属毒性和化学敏感性
环境毒素无处不在。如果一个人生活在城市世界中,就不可能逃脱。我们体内积累的过多毒素会触发我们的免疫系统在过度活跃的状态下工作,以清除我们身体中这些不需要的物质。那些不能自然而适当地发挥这种功能的人可能会出现自身免疫性疾病的症状。
•慢性和隐形感染
生活中,让我们接触到不断涌现的病毒、真菌、细菌和原生动物等。一些病原体往往会长期伴随我们,处于休眠状态。当我们的免疫系统较弱时,它们会被激活并爆发。这些生物包括伯氏疏螺旋体、小巴贝虫、白色念珠菌、孢疹病毒等。这些病原体引起的疾病会导致免疫系统过度活跃。
与体内正常组织的交叉反应并不少见。这些传染病中的许多都具有自身免疫性疾病的症状,例如肿胀、关节痛、牛皮癣、疲劳和食物过敏。自身免疫实验室标志物可能在血液测试中会升高。
•身体或情绪压力过大
情绪压力持续可能会降低病原体入侵的障碍,触发我们的免疫系统进入超速状态。换句话说,压力会使任何先前存在的临床或亚临床自身免疫性疾病恶化。
注意
由于现有的微生物群失衡、胃肠道刺激或反应性代谢物超负荷而导致身体发炎,很难完全确定是否存在真正的自身免疫性疾病(如原发性桥本氏甲状腺炎或狼疮),或者只是出现类似于自身免疫性疾病的症状。
抗体等测试也可能会混淆。但是注意在这些情况下,它们可能是正常的或临界高,而不是像真正的原发性自身免疫状态那样高。
不幸的是,目前临床医生较少对这种依赖于详细病史进行正确评估的区分保持警惕。当正常或临界高实验室检查伴有疲劳、关节痛、牛皮癣、胃部不适、体重增加、血管炎和肌肉酸痛时,医生的下意识反应是跳到自身免疫性疾病的临床诊断。没有对身体进行全面的整体观察,很难对过度活跃的免疫状态找寻到其根本原因。
因为临床表现相似,所以很少努力将症状追溯到根本原因——无论是主要由病原体驱动、过度活跃的免疫状态驱动,还是两者兼而有之。患者经常服用类固醇和自身免疫药物。短期益处很常见,因为过度活跃的免疫状态会因皮质类固醇的抗炎特性而平静下来。
然而长期服用类固醇可能是有问题的,因为它会降低我们的整体免疫反应,并掩盖在过度活跃的免疫状态是真正原因的情况下代谢产物过多的潜在问题。随着时间的推移,炎症回路会随着时间的推移而缓慢但逐渐恶化,因为它变得功能失调。一个典型的例子是桥本甲状腺炎。
自身免疫性甲状腺炎
✦炎症回路过度运转导致甲状腺出现问题
当身体的炎症回路超速运转时,甲状腺系统通常是最容易因过度活跃的免疫状态而导致功能障碍的器官之一。
甲状腺控制着整体的新陈代谢率,并负责我们的体温调节。甲状腺功能的轻微变化会导致疲劳、体重增加和甲状腺功能减退侧感觉寒冷以及焦虑和心悸。
在过度活跃的免疫状态下,靶向一种或多种甲状腺成分的抗甲状腺自身抗体(也称为抗甲状腺抗体)可能会被激活。最重要的一种是抗TPO抗体。它存在于大约90%的桥本甲状腺炎、10%至20%的结节性甲状腺肿或甲状腺癌以及75%的格雷夫斯病中。
注:TPO抗体是人体针对甲状腺的自身抗体,如果甲状腺相关抗体增高,容易导致甲状腺素分泌增高,引起甲亢或甲状腺炎等疾病。tpo抗体全称是甲状腺过氧化物酶抗体,它是甲状腺自身免疫抗体之一,正常人一般为阴性,如果该抗体升高一般提示可能存在桥本氏甲状腺炎。
甲状腺炎的诊断
临床医生通常根据在疲劳和低能量的临床环境中显示抗TPO抗体的实验室测试来诊断桥本氏甲状腺炎。
此外,应该注意的是,10%到15%的正常个体可以具有更高水平的抗TPO抗体滴度。他们没有像上面提到的那些原发性自身免疫性疾病。当我们的炎症回路处于超速状态时,高滴度可能继发于过度活跃的免疫系统。这些患者可能被错误地诊断为患有临床或亚临床原发性桥本甲状腺炎。通常开始甲状腺替代治疗。很少考虑其他原因,例如炎症回路过载。
根据实验室测试和症状,甲状腺减慢症状被视为自身免疫问题,而实际上,有些时候它代表了处于炎症回路问题的身体。在这种情况下,甲状腺替代疗法只是掩盖了症状。应采用整体方法,以充分理解根本原因并影响全面的长期恢复计划。
炎症回路是人体为克服压力而部署的神经内代谢应激反应的一部分。过度和失调的炎症反应会破坏人类的身体,导致一系列疾病和不良症状。
传统医学解决这个问题的方法是抑制症状。随着时间的推移,这可能会使情况恶化。自身免疫性疾病和过度活跃的免疫状态是常见的后果。由于当身体过度发炎时系统范围内的统一,因此需要从整体的角度了解身体以更好控制炎症。肠道菌群在其中扮演着重要作用,有更多值得被研究和发现的价值。
主要参考资料:
Michael Lam, MPH; Justin Lam, Carrie Lam,
Inflammation Circuit Dysfunction.Drlamcoaching.
Zhou B, Yuan Y, Zhang S, Guo C, Li X, Li G, Xiong W, Zeng Z. Intestinal Flora and Disease Mutually Shape the Regional Immune System in the Intestinal Tract. Front Immunol. 2020 Apr 3;11:575. doi: 10.3389/fimmu.2020.00575. PMID: 32318067; PMCID: PMC7147503.
Ruiz F, Vigne S, Pot C. Resolution of inflammation during multiple sclerosis. Semin Immunopathol. 2019 Nov;41(6):711-726. doi: 10.1007/s00281-019-00765-0. Epub 2019 Nov 15. PMID: 31732775; PMCID: PMC6881249.
Rathinam VAK, Chan FK. Inflammasome, Inflammation, and Tissue Homeostasis. Trends Mol Med. 2018 Mar;24(3):304-318. doi: 10.1016/j.molmed.2018.01.004. Epub 2018 Feb 9. PMID: 29433944; PMCID: PMC6456255.
Amoroso C, Perillo F, Strati F, Fantini MC, Caprioli F, Facciotti F. The Role of Gut Microbiota Biomodulators on Mucosal Immunity and Intestinal Inflammation. Cells. 2020 May 16;9(5):1234. doi: 10.3390/cells9051234. PMID: 32429359; PMCID: PMC7291275.
Hess JM, Stephensen CB, Kratz M, Bolling BW. Exploring the Links between Diet and Inflammation: Dairy Foods as Case Studies. Adv Nutr. 2021 Oct 11;12(Suppl 1):1S-13S. doi: 10.1093/advances/nmab108. PMID: 34632478; PMCID: PMC8502778.
Brennan CA, Garrett WS. Gut Microbiota, Inflammation, and Colorectal Cancer. Annu Rev Microbiol. 2016 Sep 8;70:395-411. doi: 10.1146/annurev-micro-102215-095513. PMID: 27607555; PMCID: PMC5541233.

谷禾健康

随着大家陆续“阳康”,大家逐渐恢复以往的生活,城市的烟火气回来了。
然而阳康后真的万事大吉了吗?
还是有很多朋友处于这样的状态:感觉恢复了,又好像没有完全恢复,身体多少有点不适,开始关心:
这种新冠肺炎后遗症,也就是临床上常说的“长新冠”,已经成为部分人不得不面临的事实。
“长新冠”是一种多系统疾病,据估计,全球至少有 6500 万人患有长新冠,病例每天都在增加。由于许多未记录在案,这个数字实际可能要高得多。
“长新冠”与所有年龄段和急性期疾病严重程度相关,许多患者在多个器官系统中经历了数十种疾病,包括心血管、血栓、脑血管疾病、2型糖尿病、自主神经功能障碍等。基于对其超过 2 年的研究,如果不采取行动任其发展,很大一部分患有长新冠的人可能会有严重后果。
新出现的临床前和临床研究表明,肠道微生物群可能有助于理解 COVID-19 的发病机制和疾病结果;SARS-CoV-2 感染与肠道微生物群的改变有关,并与炎症和免疫反应相关。
本文基于多篇文献报道,主要介绍关于“二次感染”以及“长新冠”问题的最新研究进展,同时也着重介绍了多种与新冠恢复期调理相关的干预措施。
本文由于篇幅较长,主要分为上、中、下三大篇章,主要包括以下内容:
上篇: 关于“二次感染”
中篇: 关于“长新冠”
下篇: 关于“干预措施”
上 篇
关于 “二次感染”
已经阳康的朋友,可能关心会不会马上又来一波,出现“二次感染”?
我们先了解一下,二次感染指的是什么?
“二次感染” 也叫“再感染”或者“重复感染”,是指一个人感染了新冠之后,经过足够的时间,然后再次感染。一般而言,如果一个人在第一次阳性检测后 90 天或更长时间再次检测呈阳性,则被视为二次感染。
注:也有部分研究定义间隔>30天。
再感染后可能出现临床症状,患者因核酸载量高而具有传染性。
与没感染过的人群相比,已经感染过的人群再感染风险低87%
先看一组数据:
➪
一项Meta分析综合了先前感染SARS-CoV-2人群再感染风险的全球证据:先前感染SARS-CoV-2的人可能会再次感染,他们的感染风险比之前没有感染的人低。
SARS-CoV-2再感染发病率为:
0.7 / 10,000人日(标准差0.33).
以前感染过的人比从未感染过的人再次感染的可能性低87%(HR = 0.12)。

注:该研究荟萃分析和系统审查分别包括11项研究和11份病例报告(样本量都不小于100)。
看到这里是不是觉得可以放心了,再次感染的概率很低?
并不一定。需要注意的是,该研究虽在近期发表,但研究的数据是基于出现在2021年4月及之前的毒株,当时奥密克戎变种尚未出现。
研究表明,奥密克戎变异株的免疫逃逸,导致比其他变异株具有更高的传播。那么,有没有关于奥密克戎毒株的数据?
有。
与感染过德尔塔毒株的人群相比,在奥密克戎阶段,再感染风险显著高于德尔塔时期
➪
一项回顾性观察性研究,分析来自意大利北部利古里亚地区的感染者,在研究期间(2021年9月至2022年5月),利古里亚记录了335117例SARS-CoV-2感染病例,其中15715例再次感染。在奥密克戎阶段(从2022年1月3日开始占主导地位),再感染的风险是德尔塔阶段的4.89倍(p<0.001)。
其他也有来自意大利的研究(2021年8月至2022年3月)认为,奥密克戎时期的再感染风险比德尔塔时期高18倍。
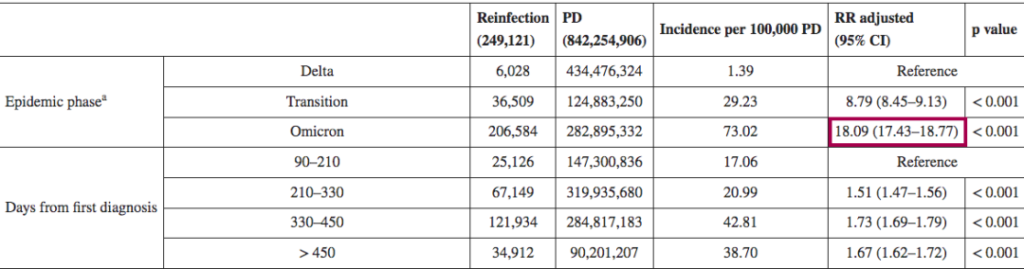
DOI: 10.2807/1560-7917.ES.2022.27.20.2200372
➪
英国爱丁堡大学的研究人员发现,奥密克戎变异株的可能再感染率约为德尔塔变异株的10倍。
➪
来自圣保罗大学医院281名医护人员的再感染率(2020年3月10日至2022年3月10日):
奥密克戎时期再感染率显著增加(0.8%到4.3%;相对风险5.45 [95%IC 3.80–7.81];p < 0.001)
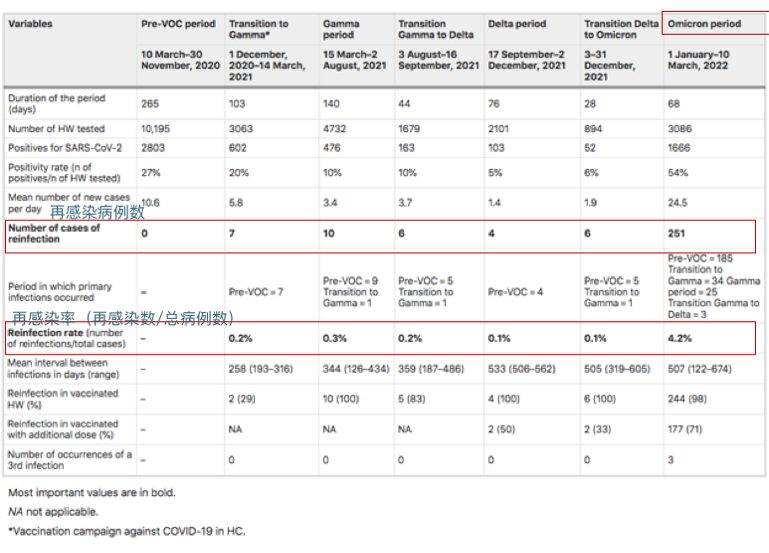
Guedes AR, et al., Sci Rep. 2023
关于奥密克戎再感染率上升的证据相当多,此处就不一一列举了。既往感染虽然可以在一定程度上防止新冠的再次感染,但对于奥密克戎来说,之前的抗体保护作用较弱,并且在一定期限后迅速减弱,接下来我们来看一下,既往感染的保护期限大概能维持多久。
队列研究证实,既往感染对奥密克戎变异株(BA.1、BA.2、BA.4 和 BA.5)再感染的保护作用低于对德尔塔和较旧变异株再感染的保护作用。
➪
50项研究共纳入118名再感染患者,从首次感染到再感染的最短时间为19日,最长为293日。
● 针对奥密克戎BA.1和BA.2毒株:
先前感染德尔塔变异株可将症状性感染的风险降低50%至67%.
➪
在丹麦的一项队列研究中,如果先前感染发生在3至6个月前,则对奥密克戎BA.1或BA.2的保护率为43.1%,如果先前感染至少发生在6个月前,则为22.2%.
● 针对奥密克戎BA.4和BA.5毒株:
BA.4 和 BA.5 这两个变体与 BA.2 的相似性高于 BA.1 菌株,携带着它们自己独特的突变,包括病毒刺突蛋白中 L452R 和 F486V 的变化,这些变化可能会调整其锁定宿主细胞并避开某些免疫反应的能力。
对卡塔尔人群的分析提供了关于奥密克戎BA.4和BA.5防护的详细信息:
在未接种疫苗的人群中,既往感染奥密克戎BA.1或BA.2可使任何感染奥密克戎BA.4或BA.5的风险降低至少68.7%(CI,64.0%至72.9%),而如果先前感染发生在奥密克戎变异株出现之前,则仅为27.7%(CI,19.3%至35.2%).
针对BA.4或BA.5免受BA.1或BA.2感染的保护作用在4个月内是强大的,但这种保护可能会迅速减弱。
关于再感染的风险和保护期限的研究
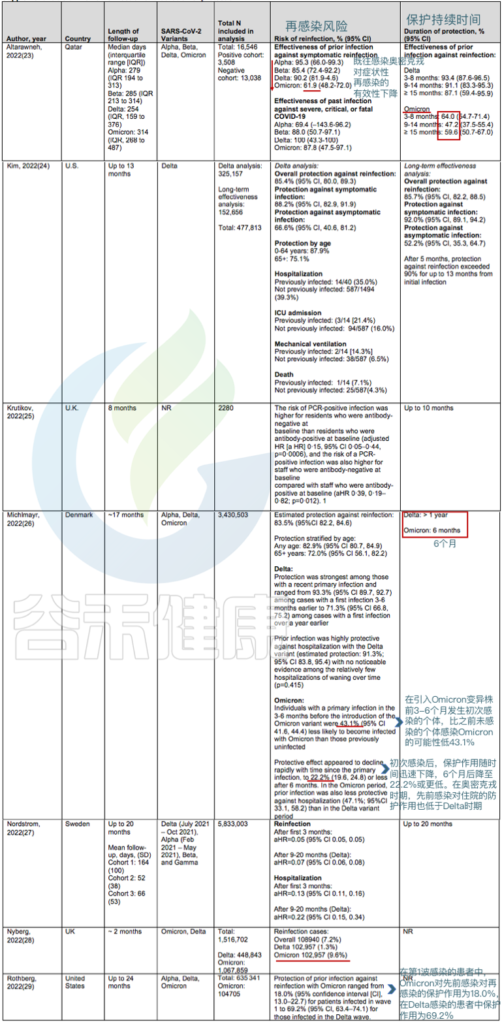
doi:10.7326/M22-1745
高龄和抑郁状态是奥密克戎再感染的危险因素
一项前瞻性队列研究,纳入了 933 名被诊断为 Omicron BA.2.2 感染且治疗后检测呈阴性的成年患者。
最终,683例符合标准,进行研究分析。
注:数据来源以及筛选标准:
患者来自四川省临水县,数据由四川省疾病预防控制中心提供。如果患者符合以下任何标准,则被排除在外:
感染前诊断为精神疾病,伴随需要住院治疗的严重疾病,以及交流障碍或拒绝参与。
在683名奥密克戎感染患者中,出院后30天内有116例再阳性,总体再阳性率为16.4%.
预测再阳性风险变量的单变量逻辑回归
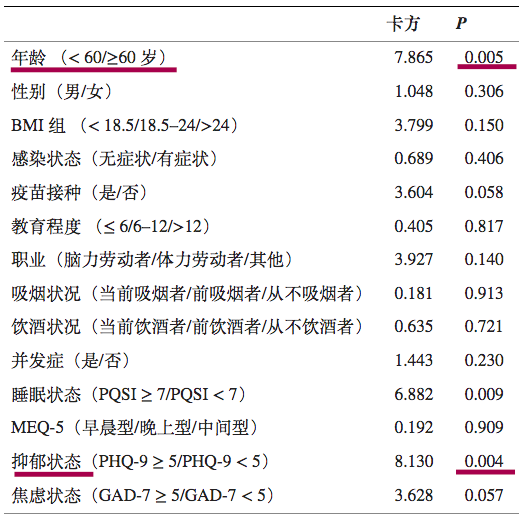
DOI:10.3389/fpubh.2022.1014470
注:PHQ-9,患者健康问卷九。PHQ-9量表的总分范围为0至27分,其中0至5分表示没有抑郁,得分>5表示抑郁状态;评分越高,抑郁症状越严重。
比较分析显示:
慢性肾功能衰竭、心血管疾病、支气管肺病、神经病变和自身免疫性等疾病患者再感染的风险相对增加
来自意大利北部地区的数据显示:
女性个体的再感染风险比男性高17%(OR为1.17,95%CI为1.13-1.21,p <0.0001)
在再感染者中,60岁及以上患至少一种潜在慢性病人群的风险比其他年龄组高7倍。
在慢性心血管疾病中,心力衰竭和脑血管病变与再感染风险的相关性最高,风险为1.24(95%CI为1.04-1.47,p = 0.0184)和1.49(95%CI为1.29-1.71,p <0.0001)是 未再感染个体的1.24倍(95%CI为1.29-1.71,p 0.0001).
在慢性肾衰竭患者中,接受透析的患者再感染风险几乎高出 3 倍(OR 为 2.77,95% CI 为 1.76–4.38,p < 0.0001).
与未再感染者相比,哮喘和呼吸衰竭/氧疗患者的再感染风险分别增加 1.17 倍(95% CI 为 1.05 –1.33,p = 0.0070)和 1.67 倍(95% CI 为 1.23–2.25,p = 0.0009).
在神经病变患者中,癫痫患者、帕金森病和阿尔茨海默病的再感染风险几乎是未再感染个体的两倍。
痴呆患者的风险大约高出四倍(OR为3.71,95%CI为3.04-4.52,p <0.0001).
在患有自身免疫性疾病的个体中,桥本甲状腺炎是再感染个体中最相关的疾病(OR为1.19,95%CI为1.00-1.44,p = 0.0479)
2021年9月至2022年5月期间与SARS-CoV-2再次感染患者有关的主要合并症的详细信息:
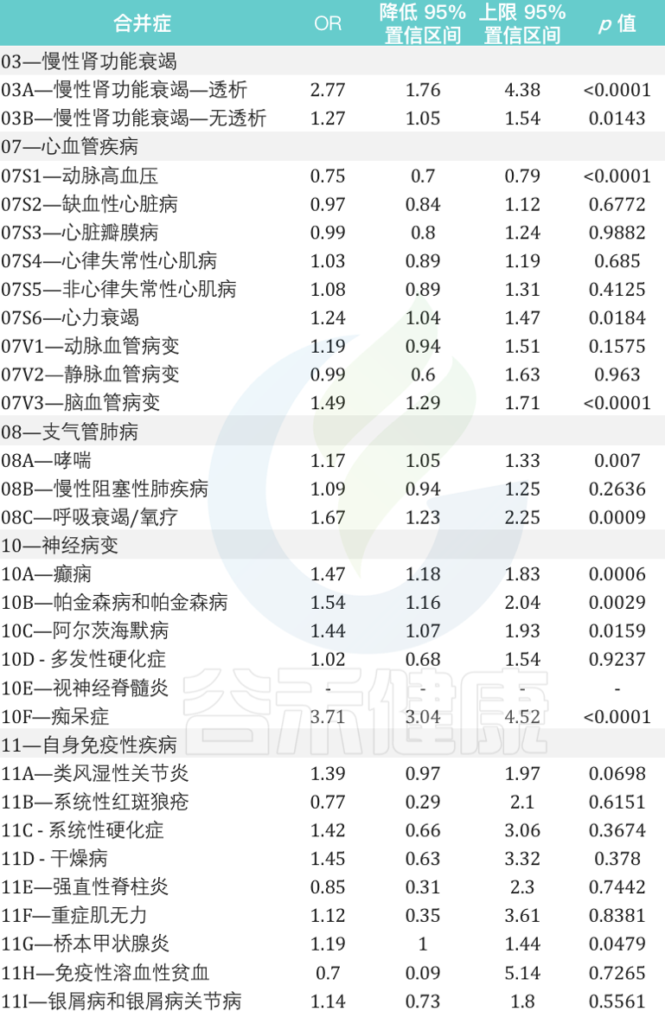
doi: 10.3390/vaccines10111885
此外,2022年发表的一篇系统评价报告了2019年12月1日至2021年9月1日的数据,发现高血压和肥胖是再感染患者中最常见的,其次是终末期肾衰竭、哮喘、慢性阻塞性肺病、痴呆、血脂异常和2型糖尿病。
其他研究也报道,终末期肾衰竭、高血压、糖尿病、慢性呼吸系统疾病、肝病和心血管疾病病史患者的再感染风险更高。
二次感染依然有症状
大多数再感染患者表现出临床症状,只有少数研究报告患者在第一次和继发感染时均无症状。
其他包括50项研究的数据显示再感染患者特征:


注:以上数据是2019年12月1日至2021年9月1日期间的研究
➪
二次感染相对首次感染严重程度有所减轻
韩国疾病控制和预防局于2020年1月20日至2022年5月7日在流行病学调查中通过综合系统报告的新冠肺炎病例数据库与健康保险审查和评估服务系统合并。使用具有二项分布的广义线性模型估计二次感染发作时与一次感染时的严重性比值比(SOR)。
结果发现,在所有患者中,再次感染的SOR为0.89(95%置信区间[CI]:0.82–0.95),与首次感染发作相比,严重程度有所减轻。
➪
一项研究显示,截至 2022 年 11 月 9 日,估计 94%(95% CrI,79%-99%)的美国人口至少感染过一次 SARS-CoV-2。
2022年11月针对SARS-CoV-2感染和重症的有效保护大大高于2021年12月
结果发现,2022年11月9日,在美国,对奥密克戎变异株SARS-CoV-2感染的保护估计为63%(51%-75%),对重症的保护率为89%(83%-92%).
11 月的人口免疫力高于最初奥密克戎激增后立即出现的情况。
对二次感染后的重症情况,不同研究结果不一致。
➪
发表在《Nature Medicine》的一项研究建立了一个包括5819264人的队列,其中SARS-CoV-2感染者(n = 443588)、再感染(两次或多次感染,n = 40947)和非感染对照(n = 5334729). 使用逆概率加权生存模型来估计死亡、住院和事件后遗症的风险和6个月的负担。
结果发现,与无再感染相比,再感染增加了死亡风险(危险比(HR) = 2.17,95%置信区间(CI)1.93–2.45),住院风险(HR = 3.32,95%可信区间3.13-3.51)和后遗症风险,包括肺部、心血管、血液学、糖尿病、胃肠道、肾脏、精神健康、肌肉骨骼和神经系统疾病。无论疫苗接种状况如何,风险都很明显。
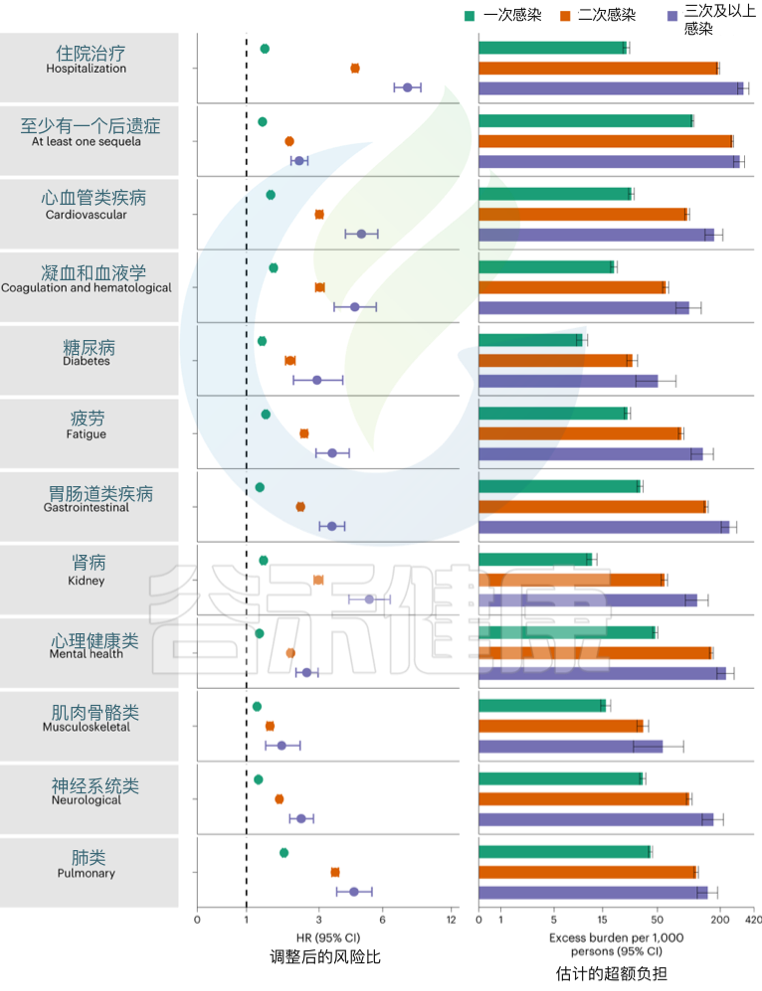
Bowe B, et al., Nat Med. 2022
风险在急性期最为明显,但在6个月后持续存在。与未感染的对照组相比,反复感染的累积风险和负担随着感染次数的增加而增加。
注:该研究数据主要来自美国退伍军人事务部国家医疗保健数据库,选取时间在2020年3月1日至2022年4月6日期间。退伍军人事务部的人口大多由老年人和男性组成,该队列也包括 10.3% 的女性,12% 在 38.8 岁以下(2021 年美国人口的中位年龄)。
关于未来:
英国牛津大学研究病毒进化的科学家认为,奥密克戎及其分支继续占据主导地位的时间越长,慢性感染产生全新变种的可能性就越小。
流行病学研究表明,连续的 COVID-19 浪潮正在变得温和。但这种趋势不应该被视为理所当然。
随着全球对反复接种疫苗和感染后免疫力的增强,研究人员预计 SARS-CoV-2 浪潮的频率将会放缓。
也有研究人员认为,SARS-CoV-2 的一个可能未来是,随季节起伏,通常在冬季达到顶峰,通常每三年左右重新感染一次。
关于其带来的症状是否会越来越轻等问题,研究人员还将持续关注。
总的来说,COVID-19疫情是一个高度动态的全球事件,各种流行病学驱动因素随着时间的推移而变化(包括新变异株的出现、疫苗吸收的增加和免疫力的减弱等各种因素),再感染的流行病学及其健康后果也可能随着时间的推移而改变。
对于已经感染过一次的人来说,继续保持警惕,降低再感染的风险,对于整体健康来说可能很重要。
以上是针对阳康后担心自己是否会二次感染的朋友的问题,然而也有一些朋友到现在,仍然觉得身体没有完全恢复,那就要考虑新冠可能带来的后遗症,也就是临床上说的“长新冠”,接下来章节,我们来了解一下关于“长新冠”及其持续时间,什么人群容易发生,会影响哪些器官功能,具体形成机制,与肠道菌群的关联等。
中 篇
关于“长新冠”
▾◆▽◆▽◆▾
►
“长新冠”是如何定义的?
2021年10月,世界卫生组织将其定义为:
有疑似或确诊新冠感染史,通常发生于起病三个月后,症状通常至少持续两个月,且不能被其他诊断所解释的症状。
►
“长新冠”会有哪些表现?
常见症状包括:
也包括其他一些症状,通常或多或少会影响日常生活。
症状可能是:
从新冠急性发作初步恢复后新出现的症状;
也可能从最初的疾病中持续存在;
也可能随着时间的推移而波动或复发。
►
“长新冠”什么时候发生发展?持续多长时间?
症状的发作和时间过程因个体和症状类型而异。
神经系统症状通常延迟发作数周至数月:在有认知症状的参与者中,43%的人报告在COVID-19至少1个月后才出现认知症状,延迟发作与年龄较轻有关。一些神经认知症状会随着时间的推移而恶化,并且往往会持续更长时间。而胃肠道和呼吸道症状更容易解决。
关节、骨骼、耳朵、脖子和背部的疼痛在1年时比2个月时更常见,感觉异常、脱发、视力模糊以及腿、手和脚肿胀也是如此。
麻痹症在初次感染后平均3个月发病;与其他神经认知症状不同,它通常会随着时间的推移而减少。
很少有长新冠患者能够完全康复,一项研究发现,在最初感染2个月后出现症状的患者中,85%在症状出现1年后出现症状。尽管ME/CFS和自主神经障碍的诊断通常是终身的,但未来的预后仍不确定。
►
有多少人会患“长新冠”?
据保守估计,全世界至少有 6500万 人患有长新冠,病例每天都在增加。
注:有许多未登记病例,这个数字实际上可能要高的多。
据估计,非住院病例的发病率为10-30%,住院病例为50-70%,接种疫苗病例为10-12%。
长冠肺炎与所有年龄段和急性期疾病严重程度相关,36岁至50岁之间的确诊率最高,大多数长冠肺炎病例发生在患有轻度急性疾病的非住院患者中,因为该人群占新冠肺炎总病例的大多数。
►
哪些人群更有可能患“长新冠”?
风险因素可能包括:
注:三分之一的长期 COVID 患者没有确定的原有疾病。
COVID-19 可能对任何患者产生长期影响,包括无症状或轻症患者。相比儿童和青少年,“长新冠”看起来在成人中更为常见。
►
“长新冠”的发病机制?
简单来说,潜在机制包括:
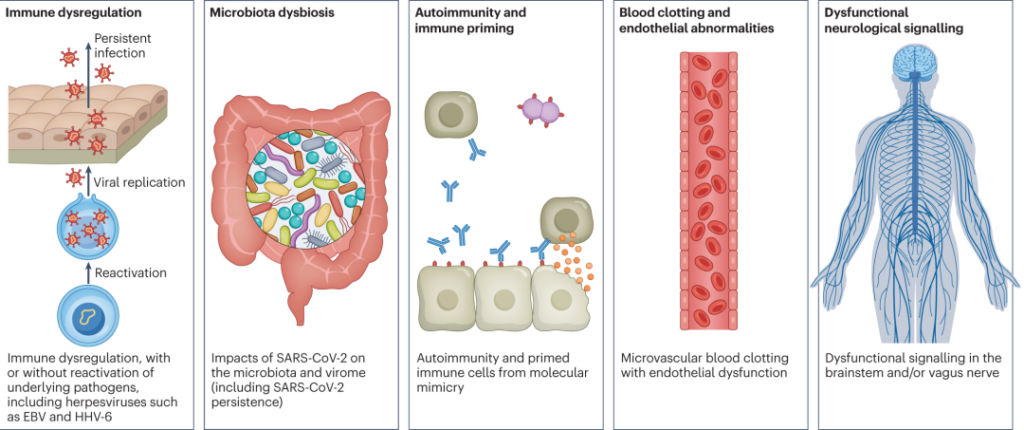
DOI: 10.1038/s41579-022-00846-2
以上是关于“长新冠”的一些基本科普,具体关于“长新冠”带来的多种不良后果,需要关注的疾病,形成机制,与菌群的关联等,我们将在接下来的小节详细介绍。
▾◆▽◆▽◆▾
长新冠包括多种不良后果,常见的新发疾病包括:心血管、血栓和脑血管疾病, 2型糖尿病、肌痛性脑脊髓炎/慢性疲劳综合征(ME/CFS)和自主神经功能障碍,体位性心动过速综合征 (POTS).
长新冠症状及其对多种不同病理器官的影响
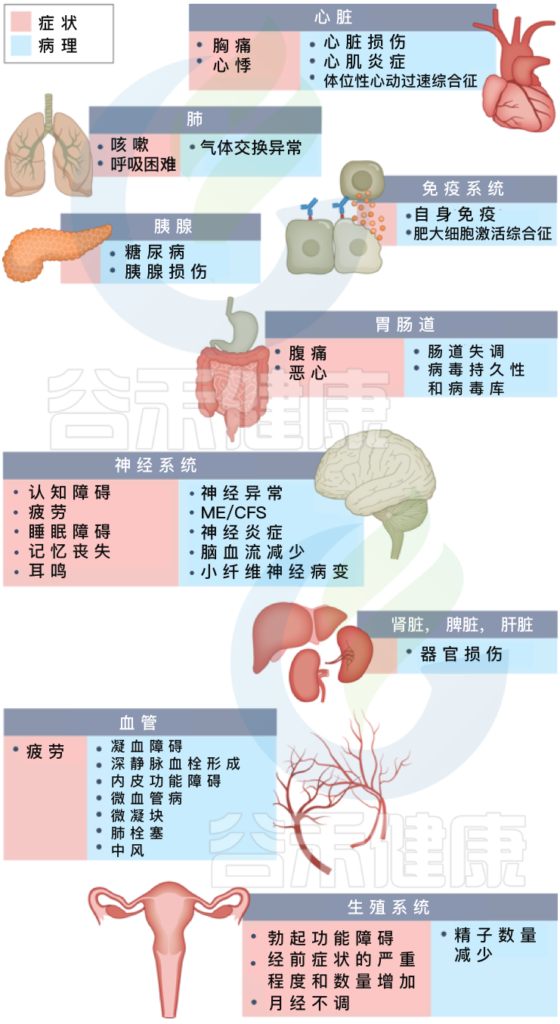
Davis HE, et al., Nat Rev Microbiol. 2023
★
血管问题和器官损伤
SARS-CoV-2会损害许多器官系统。在不同组织中已经证明的损伤主要归因于免疫介导的反应和炎症,而不是病毒对细胞的直接感染。
循环系统破坏包括内皮功能障碍和随后的下游影响,以及深静脉血栓形成、肺栓塞和出血事件的风险增加。
微凝块-> 促进血栓形成
在急性新冠肺炎和长冠肺炎中检测到的微凝块有助于血栓形成,在长新冠中也发现了血细胞大小和硬度的长期变化,有可能影响氧气输送。感染18个月后,长新冠患者的血管密度长期降低,特别影响小毛细血管。
心血管疾病风险增加
对美国退伍军人事务部数据库的分析显示,SARS-CoV-2感染1年后超过150000人患多种心血管疾病的风险显著增加,包括心力衰竭、心律失常和中风,与最初出现新冠肺炎的严重程度无关。
持久的心脏异常
心脏MRI研究显示,在100名既往有新冠肺炎发作史的患者中,78%的患者(感染后平均71天进行调查)和58%的长期冠状病毒感染者(感染后12个月进行研究)存在心脏损害,这增强了心脏异常的持久性。
新冠与多器官损害有关
除了心脏之外,新冠还与其他多种器官受损相关。
一项针对低风险个体的前瞻性研究,观察了心脏、肺、肝脏、肾脏、胰腺和脾脏,发现201名患者中70%至少有一个器官受损,29%有多个器官受损。
在同一研究小组对536名参与者进行的一项为期一年的随访研究中,研究作者发现,59%的人有单器官损伤,27%的人有多器官损伤。
一项针对VA数据的专门肾脏研究,包括89000多名患有新冠肺炎的患者,发现许多肾脏不良结果的风险增加。
另一项VA数据分析,包括181000多名患有新冠肺炎的患者,发现感染也会增加2型糖尿病的风险。
长新冠患者的心血管疾病风险增加,此外,器官损伤似乎是持久的,长期影响仍然未知。
★
神经和认知系统
神经和认知系统的症状是长新冠的主要特征,包括感觉运动症状,记忆丧失、认知障碍、感觉异常、头晕和平衡问题、对光和噪音的敏感性、嗅觉或味觉丧失(或幻觉)以及自主神经功能障碍,影响日常生活。长新冠的前庭听觉表现包括耳鸣、听力损失和眩晕。
认知障碍程度,类似酒驾上限
一项荟萃分析中,在感染后12周,32%的新冠肺炎患者出现疲劳,22%的患者出现认知障碍。长新冠患者的认知障碍会使人衰弱,与英国酒后驾驶限制的醉酒程度或认知衰老10年的程度相同,并且可能会随着时间的推移而增加。
犬尿氨酸途径的激活可能与认知障碍相关
一项研究发现,16%的患者在感染后2个月出现,26%的患者在感染后12个月出现。犬尿氨酸途径的激活,特别是代谢产物喹啉酸、3-羟基邻氨基苯甲酸和犬尿氨素的存在,已在长新冠中确认,并与认知障碍相关。
部分患者可能没有意识到认知障碍
在新冠康复的个体中也发现了认知障碍,当使用客观与主观测量时,认知障碍的比率更高,这表明有一部分认知障碍患者可能没有意识到和/或报告他们的障碍。
认知障碍是一种独立于焦虑和抑郁等心理健康状况的特征
认知障碍在住院和非住院患者中发生率相似。一份有130多万新冠肺炎患者参与的报告显示,随着时间的推移,焦虑和抑郁等心理健康状况恢复正常,但认知障碍(脑雾)、癫痫、痴呆、精神病和其他神经认知疾病的风险增加至少持续了2年。
神经病理学的可能机制包括:神经炎症、凝血病和内皮功能障碍对血管的损伤以及神经损伤
长新冠患者脑脊液异常,年龄较小可能延迟发作
研究发现,患有长新冠的患者存在阿尔茨海默病样信号,脑和脑干代谢低下与特异性症状和长新冠患者中的异常脑脊液发现相关,且年龄较小与神经症状延迟发作相关。
长新冠患者——“化疗脑”
在最近的一份预印本中,轻度感染的长新冠患者的多线细胞失调和髓磷脂丢失,其小胶质细胞反应性类似于化疗,即“化疗脑”。
即使非住院患者,认知能力也可能下降
英国生物银行(UK Biobank)的一项研究,包括新冠流行前后相同患者以及对照组的大脑成像,显示眶额皮层和海马旁回(初级嗅觉皮层相关区域的组织损伤标志物)的灰质厚度减少,与对照组相比,即使是非住院患者,新冠后患者的大脑整体缩小,认知能力下降更大。
尽管该研究将新冠感染者与对照组进行了比较,但并不是特别长的新冠患者,这可能对长新冠的认知成分有影响。在中枢神经系统中发现了线粒体蛋白以及SARS-CoV-2刺突蛋白和核衣壳蛋白的异常水平。在长新冠中也发现了四氢生物蝶呤缺乏症和氧化应激。
眼睛不适?可能与病毒在视网膜感染和复制有关
在眼睛中,在长新冠患者中发现角膜小神经纤维丢失和树突细胞密度增加,瞳孔光反应显著改变,视网膜微循环受损。SARS-CoV-2可以在视网膜和大脑类器官中感染和复制。长新冠的其他表现包括视网膜出血、棉絮斑和视网膜静脉闭塞。
焦虑和抑郁人群比例上升
在爱尔兰,研究报告了20-28%的普通人群出现焦虑和抑郁症状,多达4%的人有自残或自杀的想法。而在2018年爱尔兰健康调查(一项全国性的代表性调查),结果显示,在新冠大流行之前,自我报告的抑郁和焦虑发生率为6%.
仓鼠模型:持续炎症与焦虑和抑郁行为相关
轻度感染的小鼠模型显示小胶质细胞反应性和CCL11水平升高,这与认知功能障碍和受损神经发生有关。
仓鼠模型表现出持续的炎症状态,包括T细胞和髓细胞活化、产生促炎细胞因子和干扰素反应,与仓鼠的焦虑和抑郁行为相关,在新冠肺炎患者的组织中发现了类似的转录特征。轻度疾病感染的非人灵长类动物表现出神经炎症、神经元损伤和凋亡、脑微出血、慢性低氧血症和脑缺氧。
血液皮质醇水平较低,持续症状超过1年
最近的报告表明,与对照组相比,长新冠患者的血液皮质醇水平较低,持续症状超过1年。肾上腺产生的低皮质醇应通过垂体产生的促肾上腺皮质激素(ACTH)来补偿,但事实并非如此,这支持下丘脑-垂体-肾上腺轴功能失调。这也可能反映了潜在的神经炎症过程。此前,ME/CFS患者的皮质醇水平较低。
注:ME/CFS——肌痛性脑脊髓炎/慢性疲劳综合征,是一种多系统神经免疫性疾病。将在下一小节详细阐述。
★
ME/CFS、自主神经功能障碍和相关疾病
ME/CFS通常在病毒或细菌感染后发病。标准包括至少6个月的“疾病前从事职业、教育、社会或个人活动的能力大幅降低或受损”,伴随着无法通过休息缓解的严重疲劳,以及运动后不适、睡眠不足和认知障碍或直立不耐受(或两者兼有)。
高达75%的ME/CFS患者不能全职工作,25%的人患有重度ME/CFS,这通常意味着他们卧床,对感官输入极度敏感,并依赖他人照顾。
大约一半的长新冠患者符合ME/CFS标准
许多研究人员评论了ME/CFS与长新冠之间的相似性;据估计,大约一半的长新冠患者符合ME/CFS标准,在测量运动后不适的主要ME/CFS症状的研究中,大多数长新冠患者报告经历了运动后不舒服。
一项对长新冠患者和ME/CFS患者的直立压力的研究发现,与健康个体相比,两组患者的血流动力学、症状和认知异常相似。
• ME/CFS中一致的异常发现
包括自然杀伤细胞功能减弱、T细胞衰竭和其他T细胞异常、线粒体功能障碍以及血管和内皮异常,包括红细胞变形和血容量减少。
其他异常包括运动不耐受、耗氧量受损和无氧阈值降低,以及代谢异常,包括脂肪酸和氨基酸的使用改变。还观察到神经功能改变,包括神经炎症、脑血流减少、脑干异常和心室乳酸水平升高,以及眼睛和视力异常。反应性疱疹病毒(包括EBV、HHV-6、HHV-7和人巨细胞病毒)也与ME/CFS相关。
• 长新冠患者中观察到上述这些发现
长新冠研究发现,线粒体功能障碍包括线粒体膜电位丧失和可能的线粒体代谢失调、脂肪酸代谢改变和线粒体依赖性脂质分解代谢失调,与运动不耐受、氧化还原失衡、运动不耐受和氧提取受损的线粒体功能障碍一致。
研究还发现了内皮功能障碍、脑血流异常和代谢变化(即使是POTS症状减轻的长新冠患者)、广泛的神经炎症、疱疹病毒重新激活、红细胞变形以及其他地方讨论的许多发现。不仅在长新冠患者中,而且在ME/CFS患者中也发现了微裂纹和过度活化的血小板。
自主神经障碍,特别是POTS,通常与ME/CFS共病,也常伴有病毒性发作
POTS与G蛋白偶联的肾上腺素能受体和毒蕈碱乙酰胆碱受体自身抗体、血小板储存库缺陷、小纤维神经病变和其他神经病变有关。POTS和小纤维神经病变通常在长新冠中发现,一项研究发现67%的长新冠队列中存在POTS。
注:POTS——体位性心动过速综合征,一种随着姿势的改变而心率增加的情况,例如躺着坐起来或站着。这会导致头晕或昏厥。
肥大细胞激活综合征也通常与ME/CFS共病
与新冠前患者和对照组相比,长新冠患者肥大细胞激活综合征症状的数量和严重程度显著增加,组胺受体拮抗剂可改善大多数患者的症状。
注:肥大细胞活化综合征(MCAS)是一种由肥大细胞异常活化导致的慢性多系统性疾病.肥大细胞广泛分布于胃肠道,因此MCAS易累及胃肠道并出现相应症状。
其他可能共病的疾病
其他通常与ME/CFS共病的疾病包括结缔组织疾病,包括Ehlers–Danlos综合征和高移动性、神经矫形脊柱和颅骨疾病以及子宫内膜异位症。
长新冠中观察到与ME/CFS,自主神经障碍,肥大细胞激活综合征等疾病类似的发现,其他疾病也可能与长新冠合并。应进一步探讨病毒后条件与这些条件的重叠。
★
生 殖 系 统
长新冠中经常报告对生殖系统的影响。与无冠状病毒病史的女性以及患有新冠肺炎但不长时间冠状病毒的女性患者相比↓↓↓
患长新冠的女性更有可能发生月经改变
月经和月经前一周已被患者确定为长新冠症状复发的诱因。
在新冠肺炎患者中观察到卵巢储备下降和生殖内分泌紊乱,初步理论表明SARS-CoV-2感染会影响卵巢激素的产生和/或子宫内膜反应,因为卵巢和子宫内膜组织中ACE2受体丰富。
与那些没有月经变化的人相比,同时患有新冠和月经改变的人更容易出现疲劳、头痛、身体疼痛和气短,最常见的月经变化是月经不规律、经前症状增加和月经不频繁。
ME/CFS与多种妇科疾病存在关联
对ME/CFS的研究表明,ME/CFS与经前焦虑障碍、多囊卵巢综合征、月经周期异常、卵巢囊肿、绝经早期和子宫内膜异位症之间存在关联。妊娠、产后变化、围绝经期和月经周期波动会影响ME/CFS,并影响代谢和免疫系统变化。长新冠的研究应该关注这些关系,以更好地理解病理生理学。
病毒在阴茎组织中的持续存在,勃起功能障碍的风险也增加
这可能是由内皮功能障碍引起的。在一项研究中,与对照组相比,长新冠患者的精子计数、精液体积、活力、精子形态和精子浓度受损,并与细胞因子水平升高以及精液中胱天蛋白酶8、胱天蛋白酶9和胱天蛋白酶3的存在相关。
长新冠患者女性月经变化(月经不规律等),更容易出现疲劳,头痛等症状,男性精子质量变化,长期影响仍需进一步研究。
★
呼吸系统
呼吸系统疾病是长新冠的常见表现型,在一项研究中,新冠肺炎幸存者的发病率是普通人群的两倍。
呼吸短促和咳嗽是最常见的呼吸道症状,分别在40%和20%的长新冠患者中持续至少7个月。
几项包括长新冠患者的非住院患者的影像学研究显示了肺部异常,包括空气潴留和肺部灌注。
对感染后3-6个月的患者进行的免疫学和蛋白质组学研究表明,气道中的细胞凋亡和上皮损伤,但血液样本中没有。
进一步的免疫学特征比较了长新冠肺炎患者和新冠肺康复者,发现肺功能下降、全身炎症和SARS-CoV-2特异性T细胞之间存在相关性。



doi: 10.3389/fimmu.2021.686029
★
胃肠道系统
长新冠的胃肠道症状包括恶心、腹痛、食欲不振、胃灼热、便秘等。
持续的呼吸道和神经系统症状都与特定的肠道病原体有关。
SARS-CoV-2 RNA存在于新冠肺炎患者的粪便样本中,一项研究表明,12.7%的参与者在新冠肺炎确诊4个月后粪便中持续存在,3.8%的参与者在确诊7个月后持续存在。大多数感染7个月后出现长新冠症状和炎症性肠病的患者在肠粘膜中存在抗原持久性。
与没有长新冠或SARS-CoV-2阴性对照的患者相比,长新冠肺炎患者的血浆中发现了来自肠道和/或肺上皮的较高水平的真菌易位,可能会诱导细胞因子的产生。
长新冠患者的胃肠道症状可能与肠道菌群变化相关
与非新型冠状病毒肺炎对照组(疫情爆发前)相比,长新冠感染者中发现了较高水平的Ruminococcus gnavus和普通拟杆菌(Bacteroides vulgatus)和较低水平的普氏粪杆菌(Faecalibacterium prausnitzii),肠道失调持续至少14个月;低水平的产丁酸盐细菌与6个月时的长新冠密切相关。
将长新冠患者的肠道细菌转移到健康小鼠体内,导致小鼠认知功能丧失,肺部防御受损。
为什么长新冠患者的肠道菌群会发生变化?
胃肠道和呼吸道症状怎样将微生物群与SARS-CoV-2感染联系起来?
病毒是如何感染肠道的?
感染后的肠道菌群及宿主免疫会受到什么样的影响?
……
我们将在下一小节详细介绍。
▾◆▽◆▽◆▾
要了解病毒是如何感染,为什么会与肠道菌群相关联,我们来先从病毒的结构说起:
SARS-CoV-2是新冠肺炎的病原体。它是一种正向单链RNA病毒。它编码膜蛋白(M蛋白)、核衣壳蛋白(N蛋白)、刺突蛋白(S蛋白)和包膜结构蛋白(E蛋白)和多种非结构蛋白。
呼吸道胃肠道是人类微生物群的主要栖息地,也是SARS-CoV-2感染的目标
⇓⇓⇓
SARS-CoV-2病毒如何实现感染?
病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染。
在病毒体上,刺突蛋白(S蛋白)是包含S1和S2亚基的同源三聚体:
病毒劫持宿主细胞表面蛋白酶,如跨膜丝氨酸蛋白酶2(TMPRSS2),TMPRSS2反过来激活病毒S蛋白,切割ACE2受体,并促进病毒与宿主细胞膜的结合。
除了ACE2和TMPRSS2介导的进入外,SARS-Cov-2还可以利用宿主细胞的吞噬作用或内吞作用侵入某些免疫细胞类型,如巨噬细胞。
为什么SARS-CoV-2可感染肠道?
ACE2和TMPRSS2在呼吸道和胃肠道中强烈表达。由于后者与外部环境沟通,它们是SARS-CoV-2入侵的主要目标。
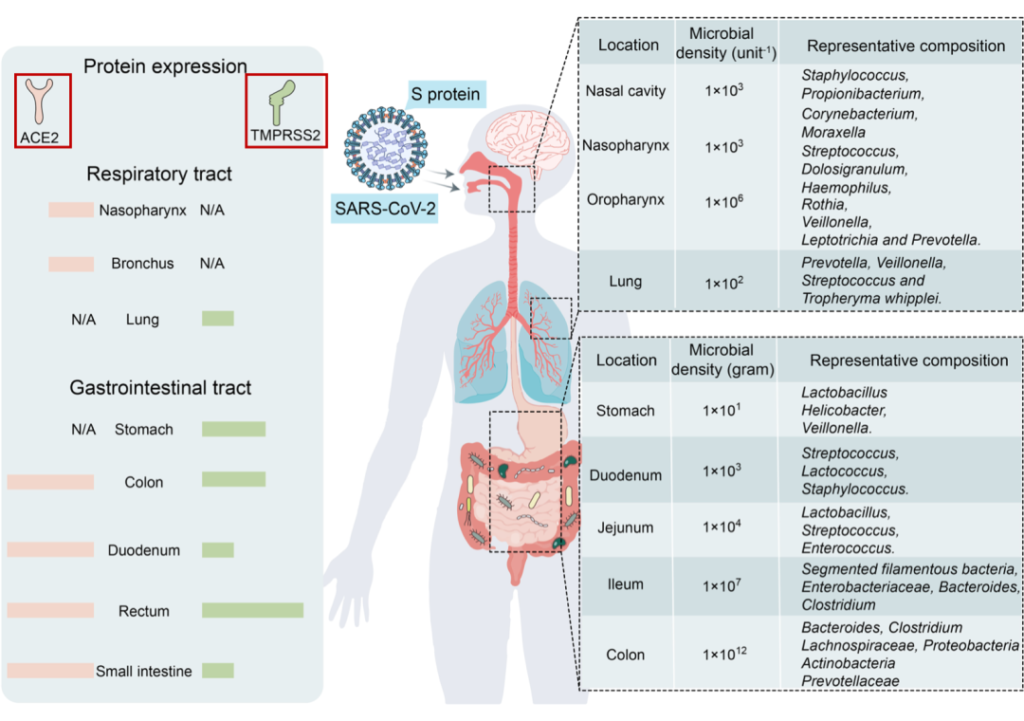
Wang B, et al., Signal Transduct Target Ther. 2022
SARS-CoV-2受体ACE2和TMPRSS2主要在呼吸道和胃肠道中表达,为微生物提供了许多合适的栖息地。
由于ACE2和TMPRSS2在胃肠道中高度表达,SARS-CoV-2也以肠道为靶点。一些研究报告称,新冠肺炎患者粪便样本中SARS-CoV-2病毒RNA呈阳性。
对一名新冠肺炎患者进行的活组织检查显示,SARS-CoV-2蛋白涂层存在于胃、十二指肠和直肠中。因此,SARS-CoV-2可感染肠道。
COVID-19的胃肠道和呼吸道症状将微生物群与SARS-CoV-2感染联系起来
⇓⇓⇓
几项临床研究报告,11-39% 的 COVID-19 患者有胃肠道症状,包括恶心、呕吐、腹泻和腹痛。
智利进行的一项研究报告称,在 7016 名 COVID-19 患者中,有 11% 表现出胃肠道症状。
在浙江的651例COVID-19患者中,8.6%表现出腹泻,4.15%表现出恶心或呕吐。
胃肠道症状与相对较高的住院风险和/或更高的疾病严重程度相关。在重症和/或危重患者中,疾病进展并引起并发症,例如急性呼吸窘迫综合征(ARDS),败血症,继发性病原体肺炎和终末期器官衰竭。
由于微生物群维持呼吸道和胃肠道稳态和健康,上述COVID-19相关症状可能将微生物群与SARS-CoV-2感染联系起来。
一些研究证实,肠道菌群有助于调节肠道免疫稳态和病原体感染。因此,肠道细菌可能对SARS-CoV-2感染的宿主免疫反应至关重要。
一些研究小组报告称,与新冠完全康复的患者相比,长新冠患者的肠道微生物群存在差异。在诊断时检测到微生物差异,但在6个月后被夸大。特别是,长新冠患者出院后,微生物群的丰富度没有恢复到正常状态。
持续的症状可能与免疫隔离组织中存在少量残余病毒有关,特别是身体中不受抗体直接保护的区域,如肠道。
一个重要的观察结果显示,病毒清除后,肠道失调持续了数月。与作为对照的健康个体相比,从新冠肺炎中恢复的患者在3个月时细菌多样性和丰富度降低,同时有益共生菌丰富度较低,机会性病原体丰富度较高。在随访6个月时,与对照组相比,COVID-19患者中双歧杆菌和瘤胃球菌的相对丰度显著降低(P < 0.001).
一项前瞻性研究追踪了香港106名新冠肺炎住院患者肠道微生物群的纵向动态,大约四分之三的患者在感染后6个月出现”长新冠”症状(通常是疲劳、记忆力差和焦虑)。
粪便样本的Shotgun宏基因组分析显示,与没有长新冠的个体和作为对照的健康个体相比,长新冠患者微生物多样性显著降低,细菌类型减少。
长新冠患者的Bacteroides vulgatus和Ruminococcus gnavus 的丰度增加,而P.prausnitzii的丰度减少。
有趣的是,与健康个体(n = 11)相比,PI-IBS患者(n = 11)的粪便样本中Bacteroides vulgatus也显示出6倍的升高;这一发现表明,Bacteroides vulgatus可能与长新冠和PI-IBS的发病机制有关。
注:因感染而导致的IBS被称为感染后肠易激综合征(PI-IBS)
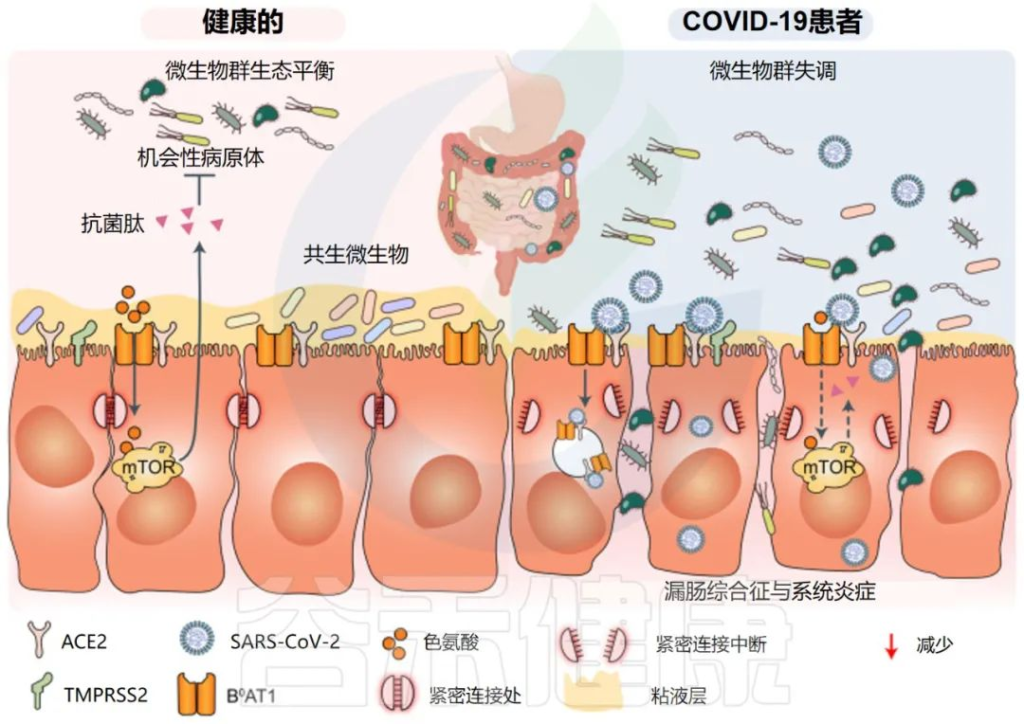
doi: 10.1038/s41392-022-00986-0
此外,SARS-CoV-2感染后6个月出现呼吸道症状与Streptococcus vestibularis和Streptococcus anginosus等机会性致病物种的水平升高有关。
而疲劳和神经精神症状与医院内病原体有关,如:Clostridium innocuum 和 Actinomyces naeslundii。
在脱发患者中,产丁酸盐细菌显著减少,某些细菌,如Bifidobacterium pseudocatenulatum和F. prausnitzii,与长新冠的发展具有最大的负相关。入院时的细菌种类,包括长双歧杆菌(B.longum)和Blautia wexlerae,与6个月时长新冠的发展呈负相关,这意味着这些细菌在恢复期具有潜在的保护作用。
相比之下,在长新冠患者中富集的菌有:
Atopobium parvulum
Actinoomyces johnsonii
Actinomyces sp. S6 Spd3
这些发现表明,一个人在感染时的肠道微生物组组成能会影响其对新冠长期并发症的敏感性。尽管如此,这些变化可能代表长新冠的反应性变化,未来的研究需要包括从感染到症状发展的非住院患者的前瞻性纵向研究,以描述肠道菌群失调对长新冠症状的确切影响。
持久战——免疫细胞数量变化
针对患有轻度急性新冠肺炎的长冠肺炎患者的免疫失调进行的研究发现,T细胞改变,包括耗尽的T细胞、CD4+和CD8+效应记忆细胞数量减少以及中央记忆细胞PD1表达升高,持续至少13个月。
研究还报道了高度活化的先天免疫细胞,缺乏初始T细胞和B细胞,I型和III型干扰素(IFN-β和IFN-λ1)的表达升高,持续至少8个月。
一项综合研究将长新冠患者与未感染者和无长新冠的感染者进行了比较发现,在感染后中位数14个月,长新冠患者的非经典单核细胞、活化B细胞、双阴性B细胞以及分泌IL-4和IL -6的CD4+ T细胞数量增加,常规树突状细胞和T细胞数量减少,皮质醇水平降低。
疲劳和神经认知功能障碍可能与细胞因子变化和EBV再激活相关
细胞毒性T细胞的扩增已被发现与长冠的胃肠道表现有关。更多的研究发现细胞因子水平升高,特别是IL-1β、IL-6、TNF和IP10,最近的预印本报道了CCL11水平的持续升高,这与认知功能障碍有关。
在长新冠患者中发现了包括EBV和HHV-6在内的反应性病毒(已在ME/CFS45中发现),并导致线粒体断裂,严重影响能量代谢。最近的一份预印本报告,在长新冠患者中,EBV再激活与疲劳和神经认知功能障碍相关。
抗体生成量低,可预测长新冠
几项研究表明,在新冠肺炎急性期,无论是住院患者还是非住院患者,SARS-CoV-2抗体生成量低或无,以及其他免疫反应不足,都可以预测6至7个月后长新冠。
这些不足的免疫反应包括IgG的低基线水平、受体结合域和刺突特异性记忆B细胞的低水平、核衣壳IgG的低水平和刺突特异性IgG的低峰值。
在最近的一份预印本中,发现严重长新冠患者的CD4+T细胞和CD8+T细胞应答较低或缺失,另一项研究发现,与无长新冠的感染对照组相比,长新冠患者的CD8+T淋巴细胞表达CD107a的水平较低,核衣壳特异性干扰素-γ-产生的CD8+T细胞下降。
二次感染可能与抗体水平低相关
长新冠患者体内高水平的自身抗体与保护性新冠肺炎抗体呈负相关,这表明高水平自身抗体的患者更有可能发生突破性感染。
SARS-CoV-2病毒在肠道内反弹,可能是由于病毒持续存在,也与受体结合域IgA和IgG抗体的水平较低和产生较慢有关。
长新冠驱动因素:病毒持续存在
一些报告指出,病毒持续存在可能是长新冠的驱动因素;在生殖系统、心血管系统、大脑、肌肉、眼睛、淋巴结、阑尾、乳腺组织、肝组织、肺组织、血浆、粪便和尿液中发现了病毒蛋白和/或RNA。胃肠道活检后的多份报告表明存在病毒,提示某些患者体内存在持久性病毒库。
ACE2——病毒感染人体细胞的“钥匙”
前面我们已经知道,病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染,可见,ACE2作为病毒进入的一个入口点,扮演者重要的角色。
ACE2能做什么?
ACE2在肾素-血管紧张素系统(RAS)中起主要作用,除此之外,其活性在肺部也有作用,因为它通过抑制des-Arg9-缓激肽调节缓激肽1受体信号传导,从而减少血管舒张和血管通透性。
ACE也在肠道肠细胞中表达,它可以调节微生物生态、先天免疫和饮食氨基酸稳态。
ACE2亦敌亦友
ACE2在肺部的保护作用可能是COVID-19中的一把双刃剑:
ACE2在肾素-血管紧张素系统(RAS)中的作用以及严重急性呼吸综合征SARS-CoV-2诱导的细胞表面ACE2表达下调的机制如下:
doi: 10.1161/CIRCULATIONAHA.120.047049
ACE2平衡肾素-血管紧张素系统的2个轴:
➭ 增加的ACE2促进保护性ACE2/Ang 1-7/MASR
➭ ACE2的丢失导致向以ACE/血管紧张素II(Ang II)/AngII受体1型(AT1)受体轴(AT1R)过度活性为特征的疾病状态转变。
doi: 10.1161/CIRCULATIONAHA.120.047049
SARS-CoV-2的病毒刺突糖蛋白与细胞表面ACE2相互作用,并通过内吞作用一起内化,导致表面ACE2表达降低。ACE2的丢失导致Ang II的积累,Ang II通过AT1受体也上调ADAM17,导致细胞表面ACE2的进一步裂解。
肠道微生物群对肠道ACE2表达的影响?
动物研究中,无菌小鼠的肠道和肺部ACE2表达水平明显高于常规小鼠。以不同微生物群定殖的促性腺激素小鼠显示出肠道ACE2表达的可变性,这可能部分归因于微生物组编码的蛋白酶和肽酶类型的差异。
2021发表的一项研究确定了调节肠道ACE2表达的转录因子,包括已知受肠道微生物群调节的GATA4。这些数据表明,肠道微生物群可能在调节ACE2表达中发挥作用。
特定肠道菌群抑制ACE2表达
在小鼠模型中,特定的细菌种类,如多氏拟杆菌(Bacteroides dorei)和长双歧杆菌,可以抑制结肠ACE2的表达。
与小鼠结肠ACE2表达下调相关的四种拟杆菌显示出显著性差异(P < 0.05),与粪便SARS-CoV-2载量呈负相关。
“阳”之前肠道菌群已经异常,促进易感性
死于新冠肺炎的高危人群通常是那些患有糖尿病、心血管疾病和肥胖症等共病的人群,这些疾病也与微生物异常有关,其特征是细菌多样性减少。
这一发现表明,感染前的肠道微生物群可能促进宿主对SARS-CoV-2和ACE表达的易感性。
拟议的感染前、中、后肠道菌群变化模型及新冠措施如何影响人一生中的菌群多样性
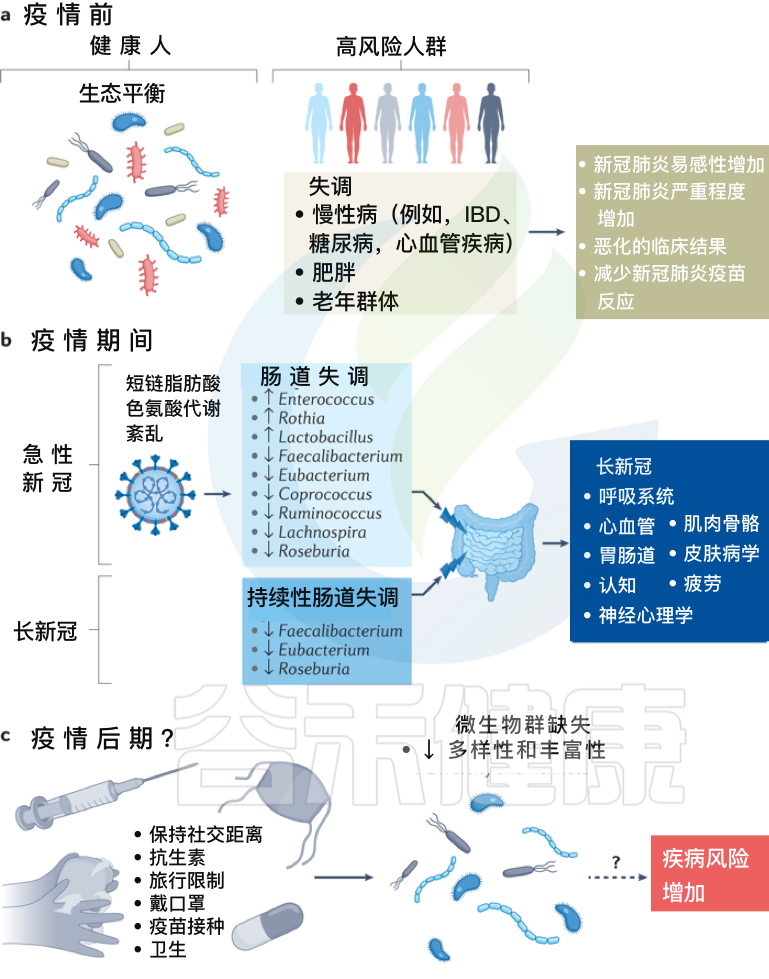
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
a、在新冠疫情之前,健康个体的肠道微生物群以“生态平衡”为特征,这是一个具有丰富微生物多样性的平衡肠道生态系统。
而某些个体,包括老年群体和患有炎症性肠病、糖尿病、心血管疾病和肥胖等慢性病的个体,肠道生态系统发生了变化,微生物多样性降低,肠道微生物组成失调可能导致严重急性呼吸综合征SARS-CoV-2感染的易感性增加,新冠肺炎严重程度增加,临床结局恶化和/或新冠肺炎疫苗反应降低。
b、在疫情期间,急性新冠感染与持续的肠道微生物群组成变化、短链脂肪酸生物合成受损和色氨酸代谢紊乱有关。
最初感染中出现的功能障碍也与急性后新冠肺炎综合征有关,包括慢性呼吸道症状(例如咳嗽或气短)、心血管症状(例如胸痛或心悸)、胃肠道症状(例如食欲不振或腹泻)、神经精神症状(例如焦虑或失眠)、肌肉骨骼症状(例如关节疼痛或肌肉无力)和皮肤病症状(例如皮疹或脱发)。
在急性新冠肺炎疫情后阶段,肠道微生物群持续受到破坏,其特征是产短链脂肪酸的细菌粪杆菌、真杆菌和Roseburia持续耗竭。急性期肠道菌群组成的改变也与多器官急性后新冠肺炎综合征有关。
c、除了大流行之外,现有的疫情控制做法,包括严格执行社交距离、广泛的卫生消毒措施、定期接种疫苗和限制旅行,可能会对婴儿的微生物组多样性产生负面影响,并对肠道中的早期细菌定植产生重大影响,对疾病风险产生未知后果。
需要做更多的工作来调查和确认新冠、微生物群丧失和未来疾病风险之间的潜在联系。未来导致微生物损失的感染控制措施需要与促进微生物多样性的战略相平衡,以确保子孙后代的健康益处。
迄今为止,大多数临床研究表明 SARS-CoV-2 感染与肠道菌群改变之间存在关联,但尚不清楚肠道菌群改变是感染的原因还是影响。
为此研究人员提出了两种假设,并推断了相应的机制。
SARS-CoV-2感染 ▬► 肠道菌群失调
那么研究人员假设了 SARS-CoV-2 可导致肠道菌群失调,推断了几种可能的机制:
1) SARS-CoV-2侵入肺部可导致组织损伤,可以激活以NF-κB和TNF途径上调为特征的强促炎途径,激活模式识别受体(TLR、RLR、NLR),这些受体被先天免疫细胞识别,导致各种促炎细胞因子的释放。
或者肠道感染可导致肠道结构的直接损伤和肠上皮屏障的破坏,可能损害肠道通透性,并促进肠道炎症。
激活的全身炎症和肠道炎症可能导致破坏肠道微生物群平衡,导致:
• 机会病原体(例如肠杆菌科和肠球菌)的丰度增加
• 共生菌(例如Faecaliberium、Eubacterium和Roseburia)的丰度降低
关于Faecaliberium详见:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
关于Eubacterium 详见:
肠道核心菌属——优/真杆菌属(Eubacterium),你为什么要关心它?
关于Roseburia 详见:
2) SARS-CoV-2感染可下调肠上皮细胞管腔表面ACE2和B0AT1(分子ACE2伴侣)的表达,这可能促进病原菌的生长。
3) 一项体外研究发现SARS-CoV-2可能直接感染细菌。揭示了SARS-CoV 2 影响肠道微生物群的另一种可能机制。
肠道菌群特征 ▬► 严重程度和免疫反应
动物研究提供了证据,SARS-CoV-2感染可能在驱动肠道微生物群生态变化中发挥作用。
➪
当用SARS-CoV-2攻击恒河猴和食蟹猴的非人灵长类动物模型时:
➪
仓鼠模型能够重现人类严重新冠的一些特征:
研究人员提出SARS-CoV-2感染点的特定内在“微生物组特征”,可以通过几种假设机制影响感染的严重程度和宿主免疫反应:
i) 增加的机会性病原体可能会被先天性淋巴细胞进一步识别,并强化肠道促炎反应。
ii)机会性病原体和毒素可能转移到循环系统中,导致菌血症,加剧系统炎症和疾病严重程度。
iii)有益菌逐渐减少耗尽,可能会对免疫细胞的募集产生负面影响,如激活的粘膜相关不变性T细胞(MAIT),从而影响呼吸道感染的易感性和严重性。
肠道菌群可能导致免疫反应功能失调和 COVID-19严重程度的潜在机制
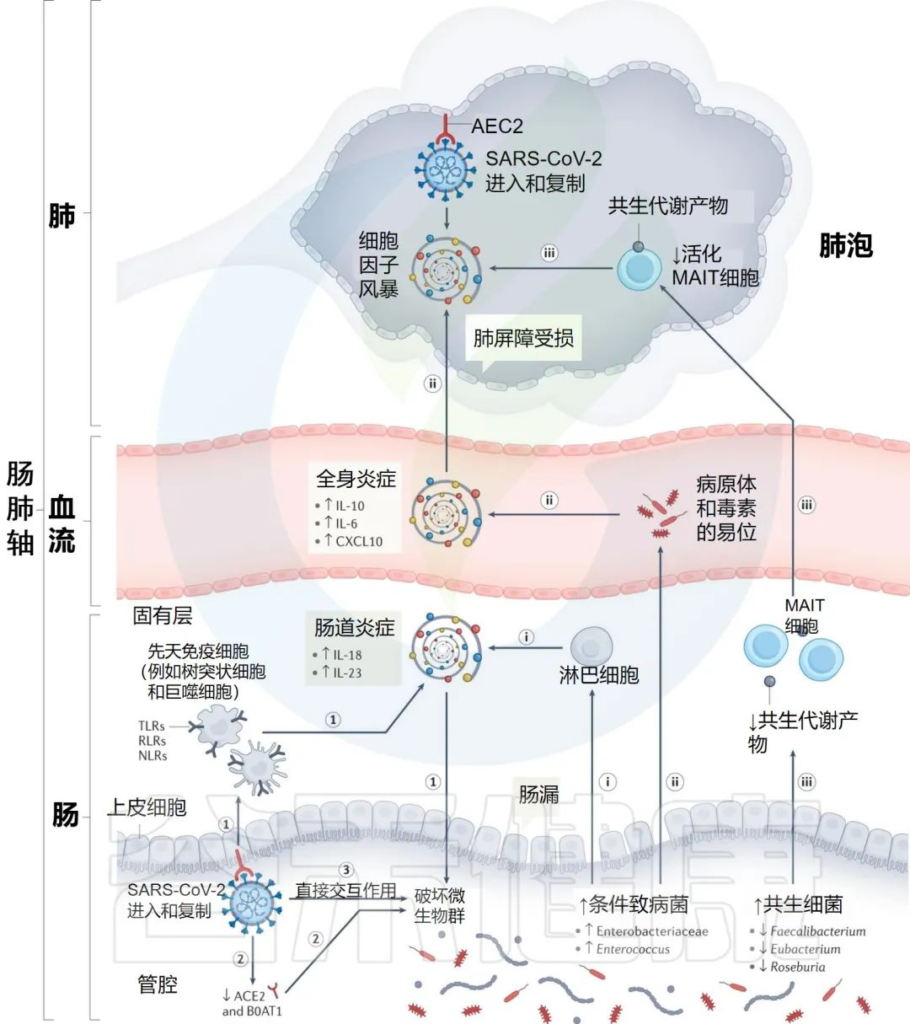
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
肠道菌群代谢产物
SARS-CoV-2感染与肠道微生物群的碳水化合物、脂质和氨基酸代谢改变有关。
——短链脂肪酸:合成受损
多项研究表明,COVID-19 患者的粪便样本中的短链脂肪酸生物合成受损。
在对66名新冠肺炎抗生素无效患者和70名未感染新冠的患者进行的宏基因组分析中,SARS-CoV-2感染患者的肠道微生物群合成短链脂肪酸的能力降低,这与疾病严重程度和血浆中促炎细胞因子IL-10和趋化因子CXCL10浓度升高呈负相关。
通过粪便代谢物的测量,19名与新冠相关的严重和/或危重疾病患者的粪便中短链脂肪酸(包括乙酸、丙酸、丁酸、戊酸和己酸)浓度持续下降。
短链脂肪酸可以激活免疫细胞的抗炎反应,抑制炎症信号通路,并保持肠道屏障的完整性,以防止肠道内毒素和细菌进入循环,从而减轻局部和全身炎症反应。
鉴于短链脂肪酸在调节宿主免疫反应中的重要性,新冠肺炎中短链脂肪酸生物合成不足可能与疾病发病机制和严重程度有关。然而,短链脂肪酸缺失是否是新冠感染的原因或后果尚待阐明。
——色氨酸代谢:受到干扰
一些测量新冠患者血浆代谢物的研究表明,与健康人作为对照组相比,色氨酸代谢受到干扰,与色氨酸新陈代谢有关的犬尿氨酸途径的激活增强。
色氨酸代谢通过调节调节性T细胞与TH17细胞的比率和B细胞活性与自身免疫、病毒感染和肠道健康相关。
在人类和动物研究中,犬尿氨酸途径代谢产物进入大脑的增加可能会引发疲劳、记忆力差和抑郁等症状,这是“长新冠”的常见症状。重要的是,色氨酸代谢产物是宿主-微生物群界面的关键介质。
根据人类和动物研究的证据,肠道微生物群可以直接使用色氨酸作为底物,并影响宿主色氨酸的吸收和代谢,以调节宿主的生理和免疫反应。内源性宿主色氨酸代谢产物可以深刻影响肠道微生物群的组成和功能,如阿克曼氏菌和乳杆菌。
综上所述,这些数据表明色氨酸代谢是肠道微生物群参与新冠肺炎的一种可能机制。
——胆汁酸代谢:菌群失调影响胆汁酸代谢,胆汁酸浓度升高破坏肠道屏障,引起炎症
初级胆汁酸由胆固醇、胆酸和鹅去氧胆酸通过与甘氨酸或牛磺酸结合在肝脏中合成。然后,它们被分泌到小肠,在那里它们被肠道菌群转化为次级胆汁酸,主要是脱氧胆酸(DCA)和石胆酸(LCA)。
次级胆汁酸在上皮细胞和内皮细胞以及肝细胞中充当核受体FXR、VDR和PXR的配体。它们还与TGR5相互作用。
注:TGR5是一种在肠、胰腺、淋巴组织和大脑中表达的膜结合受体。DCA和LCA都能够通过上述受体调节免疫系统。
研究人员根据疾病严重程度将新冠肺炎患者从无症状患者到处于关键阶段的患者进行分组。随着疾病严重程度的增加,来自患者的肠道菌群中厚壁菌/拟杆菌的比例逐渐受到更大的影响。
来自无症状患者的肠道菌群保留了有益菌种类,这些细菌与新冠肺炎的不良后果呈负相关:
此外,与危重症患者的微生物群不同,他们的微生物群的特征在于参与次级胆汁酸生物合成代谢途径的基因的高表达。
Harry Sokol等人观察了SARS-CoV-2感染对灵长类微生物群的影响,并发现总胆汁酸的数量随疾病严重程度而增加。值得注意的是,初级/次级胆汁酸的比率也明显较高。
这些数据表明,SARS-CoV-2感染对肠道菌群的破坏随着疾病的严重程度而加剧。随着菌群失调程度的增加,回肠的内在功能进一步改变,导致肠内转运增加,从而阻止胆汁酸的完全重吸收,从而增加其在结肠中的浓度。此外,重症新冠肺炎患者的肠道菌群功能有限,因此胆汁酸集中在这些患者的粪便中。
血清胆汁酸谱显示,急性呼吸窘迫综合征(ARDS)患者符合这些观察结果,因此可以推断,在严重的新冠肺炎中,胆汁酸浓度升高可能会破坏肠道屏障,并通过血流到达包括肺、心脏、肾和内皮在内的外周组织。它们的细胞毒性活性可能会损伤外周组织的细胞膜,导致局部和全身炎症反应,并在临床上表现出来。
——鞘脂:肠道微生物鞘脂代谢改变
据报道,新冠肺炎患者血清和粪便中鞘脂浓度降低,肠道微生物鞘脂代谢改变。鞘磷脂是生物膜的组成部分,介导信号转导和免疫激活。
拟杆菌产生的鞘脂可以增加外源鞘脂,从而增强体外或体内研究中观察到的调节性T细胞的分化,这可能抑制冠状病毒的复制。
这一观察支持肠道微生物群衍生的鞘脂可能调节宿主对SARS-CoV-2感染的防御的假设。
——蔗糖、葡萄糖:异常
与47名健康人作为对照组相比,56名新冠肺炎患者的粪便蔗糖水平升高,粪便葡萄糖水平降低。蔗糖和葡萄糖的异常水平可能与蔗糖酶-异麦芽糖酶活性受损有关。
这种变化可能与新冠肺炎常见的肠道症状有关,如腹泻、呕吐、肠胃气胀和腹痛。胀气通常是由细菌在肠道中发酵未吸收的碳水化合物引起的。
蔗糖水平的增加与放线菌和Streptococcus parasanguinis水平的增加有关,这意味着COVID-19 中的生态失调,可能会破坏肠道发酵并导致胃肠道症状。
▾◆▽◆▽◆▾
累积的证据表明,肠道菌群失调与 COVID-19 感染的严重程度和疾病恢复后的长期多系统并发症有关。
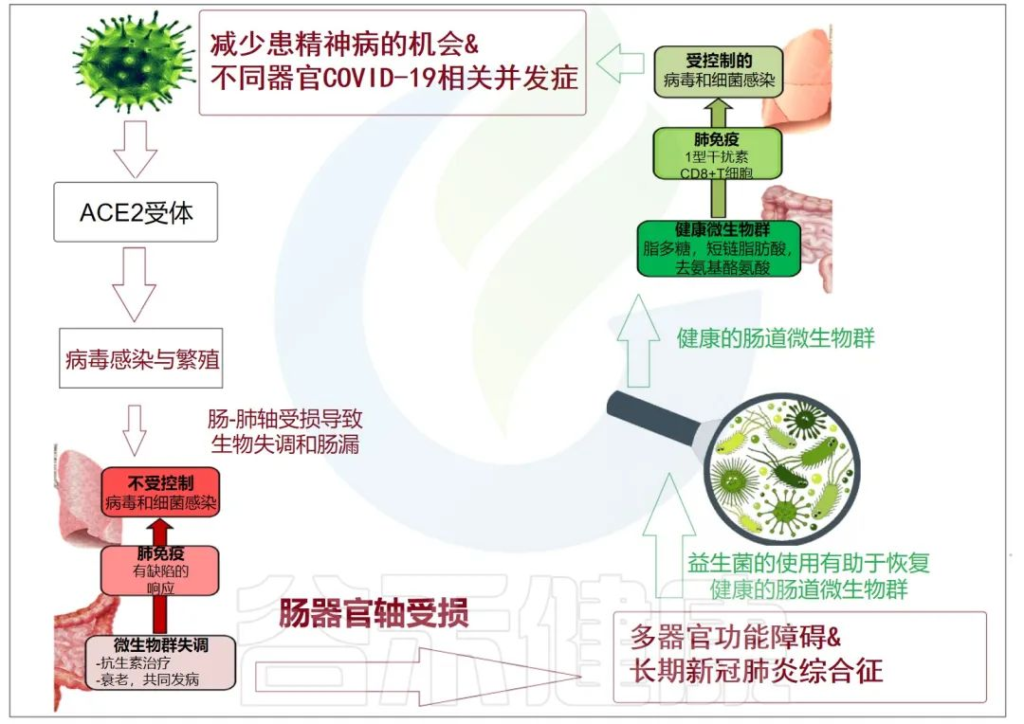
doi: 10.3390/metabo12100912
肠-肝轴是指肠道及其微生物群和肝脏之间的双向通路。这种相互作用是由门静脉建立的,通过门静脉,肠道菌群产物直接运输到肝脏,肝脏将胆汁和抗体反馈到肠道。
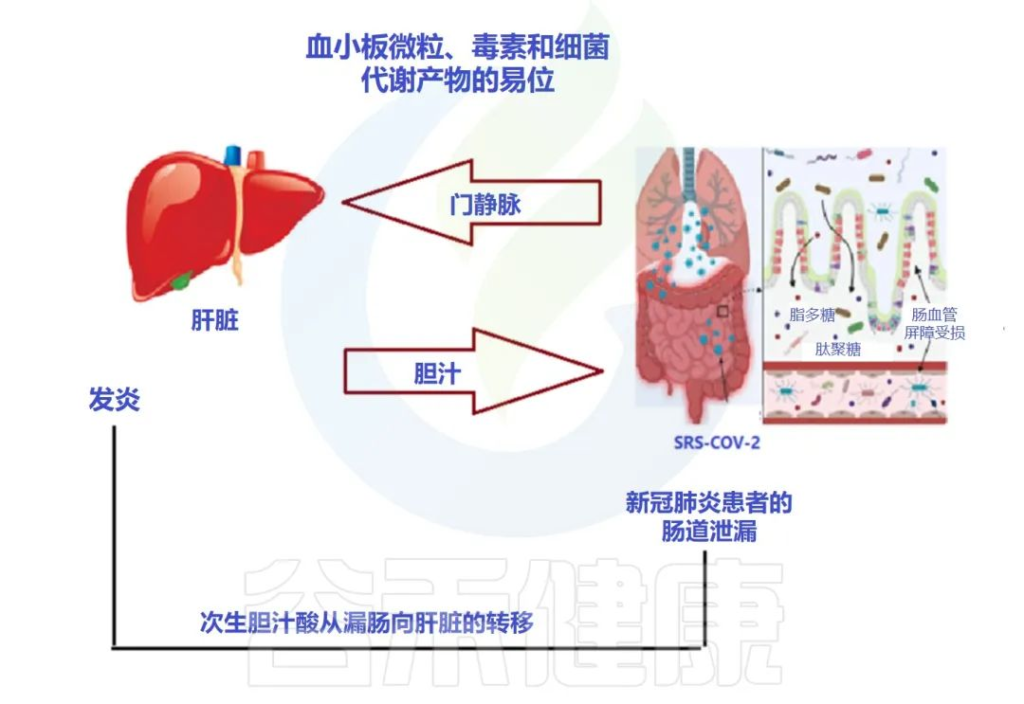
doi: 10.3390/metabo12100912
最近的两项研究表明:
代谢功能障碍相关性脂肪肝(MAFLD)是进展为严重和长期COVID-19的主要危险因素。
MAFLD征象的患者风险高
两项研究均证明,有MAFLD征象的患者发生呼吸系统疾病进展的风险高于无MAFLD的患者,年轻COVID-19患者的风险远高于老年COVID-19患者。
风险增加与病毒影响肠道通透性有关
研究人员认为,在MAFLD患者中观察到的风险增加可能与SARS CoV-2感染对肠道的影响有关,SARS CoV-2感染使肠道通透性和粘膜炎症恶化,从而加剧全身免疫功能障碍,这是严重COVID-19的特征。
当然,这个过程也可以阐明肥胖、2型糖尿病甚至炎症性肠病中 COVID-19 进展的较高风险,这与肠道微生物群改变、粘膜炎症和肠道通透性增加有关。
大量研究表明,腹泻、呕吐和腹痛等胃肠道症状在COVID-19患者中很常见,胃肠道症状的严重程度与呼吸系统疾病和肝功能障碍同时增加。
胃肠道中病毒进入受体表达的增加
已发现ACE-2 SARS CoV-2受体在肠细胞细胞上表达,因为粪便中高水平的SARS CoV-2病毒表明肠道是病毒感染和炎症的合理部位。
用于SARS-CoV-2进入的跨膜丝氨酸蛋白酶2在肠道细胞中也广泛表达。基于此,胃肠道中病毒进入受体表达的增加以及胃肠道症状的早期发作,意味着胃肠道异常可能是由病毒的直接恶化肠漏引起的,而不是对上呼吸道感染的继发性免疫致病反应的结果。
胃肠道症状的临床表现与肝功能不全的生物标志物呈正相关,支持了PAMPs向肝脏传播增加的观点。
SARS-CoV-2 感染会破坏肠道屏障,导致全身细菌脂多糖和肽聚糖升高,并有助于增强全身炎症。因此,肠漏和肠道菌群失调可能导致COVID-19重症患者发生细胞因子风暴。
基于此,已经开发的用于治疗肠漏的治疗方法,例如用于肠道粘膜保护/再生的益生菌和益生元,可以最大限度地减少进展为严重和长新冠的 MAFLD/肥胖/T2D 患者的数量。此外,在SARS CoV-2病毒感染期间,应避免使用干扰肠道微生物群的药物,例如抗生素。
充分证据表明,肠道微生物群改变和肠道细菌多样性减少,在心力衰竭合并冠状动脉疾病患者中很常见。
肠漏导致炎症,和心血管疾病相关
功能失调的肠道屏障会延缓菌群产物的被动泄漏,其中包括促炎脂多糖(LPS)进入血液,这可以通过炎症小体激活导致全身炎症。LPS结合蛋白(LBP)作为老年男性心血管风险高预测生物标志物的血浆水平显著升高,证明了这一点。
有趣的是已经发现,肠漏和炎症小体激活,与肌钙蛋白作为心肌损伤的标志物呈正相关。
肠道菌群-心轴在长新冠综合征中的作用
相当大比例的COVID-19住院患者有心脏问题。早期心血管疾病和心血管疾病危险因素(如肥胖)似乎是发生严重且长新冠并发症的关键危险因素。然而,高比例的COVID-19患者既往无心血管疾病的心脏受累。
在COVID-19患者中,心脏问题也被视为一个危及生命的实质性问题,从MI和心肌炎到伴有心脏应激的肺动脉高压。这种心脏受累的机制尚不清楚。
心肌感染可能与ACE2受体相关
ACE2在多个器官中表达,除肺、心脏和肾脏组织外,ACE2也在肠道中表达,肠细胞中的ACE2表达区可作为SARS-CoV-2进入和提示肠道感染的位点。继发于下调ACE2(SARSCoV-2受体)的抗炎和心脏保护性血管紧张素(AT)-1-7通路下调,通过表达ACE2的心脏细胞引导心肌感染,导致心脏炎症。
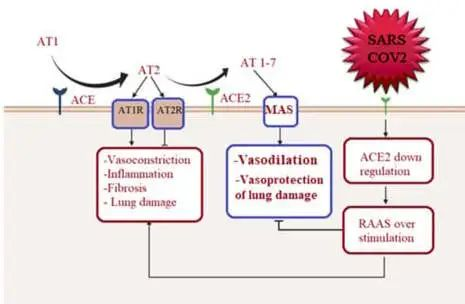
doi: 10.3390/metabo12100912
心脏成像的长期随访,结合肠道菌群分析,是进一步测试长冠状病毒肺炎患者肠道-心脏轴潜在影响的必要后续步骤。
肠道微生物群与肾脏疾病之间的致病性相互关联
肠道菌群参与广泛的临床表现,如慢性肾脏病(CKD),急性肾损伤(AKI)和高血压。
在肠漏的情况下,活细菌经常从肠道转移到其他肠外位置,例如肾脏。这种细菌易位可能伴有菌群失调、病原菌过度生长和宿主免疫系统低下。
在慢性肾病的情况下,肠道微生物群会产生许多毒素和尿毒症溶质,例如对甲酚硫酸盐 (PCS)、硫酸吲哚酯和三甲胺 (TMA) N-氧化物。另一方面,尿素水平升高可能导致肠道微生物群的改变(图3)。
尿毒症毒素可能导致慢性肾病患者出现疲乏、矿物质骨疾病、神经系统疾病和心血管损害。
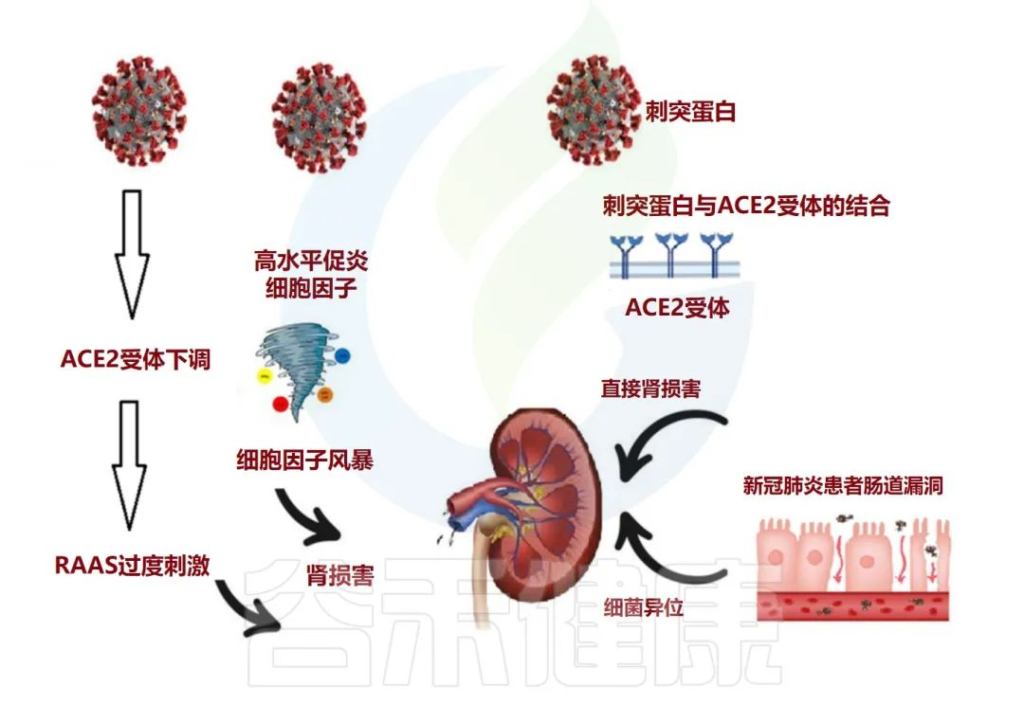
doi: 10.3390/metabo12100912
肠道生态失调在与 COVID-19 相关的长期肾脏问题中的作用
急性肾损伤 (AKI) 通常被视为 COVID-19 患者的并发症。除了先前存在的慢性肾病与COVID-19中的重症或死亡有关外,值得注意的是,解决SARS CoV-2通过AEC2受体进入肾脏,并诱导临床表现的不同途径。
人们普遍认为,该病毒可直接进入肾脏并复制,导致功能障碍,并且通过肾素-血管紧张素-醛固酮系统(RAAS)稳态的局部紊乱影响肾脏。
研究显示,既存慢性肾病患病率较高的群体可能更容易发生急性肾损伤。新出现的证据还表明,COVID-19的肾脏表现与长期严重COVID-19相关肾脏并发症的风险增加有关。
在菌群失调型COVID-19患者中,有益菌(主要是双歧杆菌和乳酸杆菌)逐渐消失,并且由于微生物群改变和病原体优势,观察到短链脂肪酸和胆汁酸水平下降。
短链脂肪酸,特别是丁酸盐是结肠细胞的重要能量来源,在上皮完整性中也起着重要作用。此外,短链脂肪酸受体GPR109A的激活与几种促炎介质的抑制有关。这可能解释了在 COVID-19 患者中出现的显著长期并发症。
作者报告说,慢性肾病患者的厌氧菌群减少,而有氧菌群增加,以肠杆菌科为主。所有这些机制都可以解释一些COVID-19患者的长期肾脏并发症。
在COVID-19住院期间监测肾功能,有助于识别后果更严重风险的患者,有助于早期和更有效的干预。
尽管 COVID-19 的主要临床表现与呼吸系统有关,但也会带来脑相关的问题,引发急性脑血管问题和颅内感染。
约35%的患者和高达85%的重症患者报告神经系统症状,包括头痛、头晕、肌痛或味觉和嗅觉丧失。
COVID-19感染可能导致神经系统疾病以及大脑结构和功能改变的机制有很多。
部分感染后的患者存在一致的记忆缺陷模式
认知问题是最常报告的症状之一,影响10%-25%的COVID-19患者,表现为SARS-CoV感染后的慢性疾病。作者发现,经历过COVID-19感染的人存在一致的记忆缺陷模式,随着自我报告的持续症状的严重程度,记忆缺陷也在增加。
此外,他们报告说,最初疾病期间的疲劳/混合症状和持续的神经系统症状可以预测认知能力。
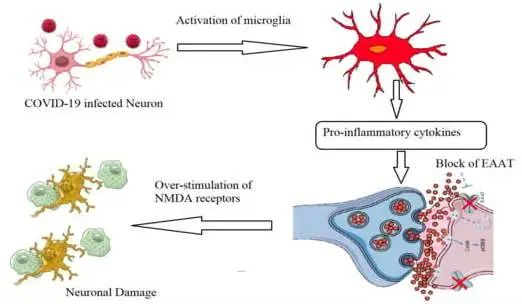
doi: 10.3390/metabo12100912
COVID-19与神经损伤有关,主要见于神经系统症状
对COVID-19死亡患者的尸检显示,有缺血性损伤的指征和神经炎症的证据是病因机制。许多研究记录了不同脑区的功能和结构畸形,如出血性损伤和癫痫样放电。
谷氨酸兴奋性毒性的作用:诱导促炎细胞因子产生
关于神经炎症,谷氨酸兴奋性毒性的作用应考虑为导致长新冠相关神经系统症状的原因。Ahmed等人(2020)报道,由于谷氨酸兴奋性毒性,SARS-CoV感染可诱导促炎细胞因子的产生和神经元变性显著增加。
简单地说,谷氨酸作为神经系统中的主要兴奋性神经递质,主要由神经元产生并在突触间隙中排出,之后它与配体依赖性AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)结合。这有助于钠离子的进入和神经冲动通过突触后神经元,导致N-甲基-D-天冬氨酸受体(NMDA)的激活,从而诱导钙离子进入。
新冠引起的神经元感染,扰乱谷氨酸稳态的控制
在新冠病毒引起的神经元感染过程中,小胶质细胞产生促炎细胞因子(TNF-α、IL-1β和IL-6),下调星形胶质细胞和突触前神经元上的谷氨酸转运蛋白1(GLT-1)。这将降低谷氨酸有效再摄取的速率,并导致谷氨酸 / GABA神经递质的不平衡和NMDA受体的过度刺激。这些事件扰乱了谷氨酸稳态的控制,突触间隙中谷氨酸的过量产生诱导神经元兴奋性毒性,钙显著进入,最终导致神经细胞变性和损失。
关于谷氨酸与大脑健康以及肠道菌群之间的关联,我们在之前的文章也有写过,详见:
新冠引起的肠道菌群失衡➔影响肠道屏障和血脑屏障通透性 ➔ 菌群代谢产物进入大脑➔脑功能障碍
肠道菌群维持肠上皮屏障、免疫稳态和防止病原体入侵。此外,肠道菌群可以通过增加紧密连接蛋白的表达来影响血脑屏障 (BBB) 的完整性和通透性。ACE2与肠道微生物稳态密切相关。
SARS-CoV-2 感染引起的肠道感染和 ACE2 表达下调可导致肠道菌群组成异常,包括乳酸杆菌和双歧杆菌等菌群水平降低。微生物失衡和肠道炎症势必会影响肠道屏障功能和血脑屏障的完整性和通透性,从而导致肠道细菌、毒素等肠道微生物代谢产物易位,通过血液循环进入大脑,最终导致脑功能障碍。
SARS-CoV-2侵入肠神经系统,出现异常,通过迷走神经影响大脑
迷走神经与肠神经系统中的神经元形成突触连接,并将肠道信息传输到NTS,在那里信息被整合并传递到大脑。
肠神经系统的异常不仅会导致胃肠功能障碍,还会通过肠-脑轴影响大脑功能。先前的研究表明,嗜神经病毒持续感染肠神经系统,并导致肠功能障碍。
SARS-CoV-2进入肠道后,通过与ACE2结合侵入肠神经系统,然后通过迷走神经进入大脑,影响中枢神经系统功能。
更重要的是,肠神经系统损伤导致肠道运动障碍、肠道血流异常和上皮屏障功能障碍,从而进一步促进肠道微生物和细菌代谢产物的毒素进入血液,加重大脑损伤。
越来越多的证据表明,肠道菌群失调也被发现是增加骨质流失的关键因素,而骨质流失又反过来促进了几种骨相关疾病的发展,例如类风湿性关节炎和骨质疏松症。
一系列报告显示,肠道菌群通过改变骨组织的质量来影响骨强度。肠道菌群调节骨骼健康的机制是通过促进调节代谢产物的生成,如吲哚衍生物、三甲基胺N-氧化物(TMAO:氧化胺)、短链脂肪酸和气体递质,如硫化氢(H2S)。
在卵巢切除术(ovx)诱导的绝经后骨质疏松小鼠模型中,H2S供体化合物GYY4137通过激活Wnt10b生成,从而增加骨形成,减少小梁骨损失,从而增强骨健康。
短链脂肪酸如乙酸、丙酸和丁酸诱导骨吸收细胞的代谢重编程,导致糖酵解增强,从而降低破骨细胞的特异性基因,如NFATc1和TRAF6,这是骨骼稳态的有效调节因子。
肠道菌群失调会加剧COVID-19疾病的严重程度和骨质流失
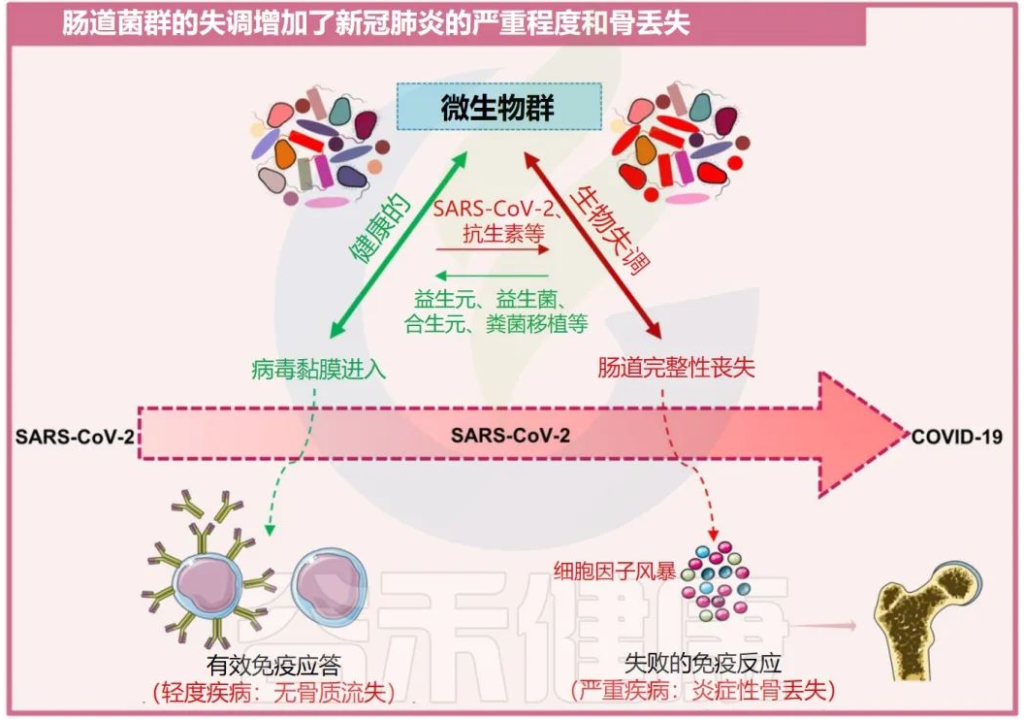
Sapra L, et al., Inflamm Res. 2022
还需要在该领域进行更多研究,并对康复的 COVID-19 感染患者进行长期随访,以确定 COVID-19 引起的骨病变的机制。
★ 肠-脾轴
SARS-CoV-2 被证明可能通过 ACE-2 受体诱导脾脏的特定嗜性。人们认为脾功能障碍与其他机制一起导致B细胞和T细胞淋巴细胞减少,这是感染后COVID-19的典型特征。
与健康对照组相比,脾切除术或脾功能障碍患者的革兰氏阴性菌产物LPSs丰度较高,因此肠道微生物群组成改变是血浆LPS升高的主要原因,可能与长期COVID-19并发症有关。
下 篇
干 预 措 施
饮 食 模 式
坚持高质量的饮食模式与较低的COVID-19感染和住院风险相关
一项Meta分析纳入5项研究,包括4023663名受试者(3149784名高质量饮食者和873881名对照组)。
高质量饮食模式对SARS-CoV-2感染和住院的有效性分别为28%(95% CI 19% ~ 36%)和62% (95% CI 25% ~ 80%)。
基于不同类型的高质量饮食和COVID-19感染风险的亚组分析显示:
一项病例对照研究调查了来自六个国家(法国、德国、意大利、西班牙、英国、美国)的2884名一线医护人员的饮食模式与新冠肺炎之间的关系。
注:这些医护人员是根据与新冠肺炎患者的大量接触情况进行筛选的。这项研究依赖于主要由男性医生组成的自我报告人群,不包括受最严重COVID-19病例影响的个体。
报告食用植物性饮食或鱼素饮食(包括益生元食品在内的)的人,中度至重度 COVID-19 的几率分别降低了 73% 和 59%。
地中海饮食特征:
地中海饮食的依从性高,COVID-19严重程度和症状的可能性降低
一项横断面研究中,对 250 名年龄在 18 至 65 岁之间的 COVID-19 患者进行了检查。结果发现,对地中海饮食的依从性越高,COVID-19严重程度和症状的可能性降低,住院和康复时间缩短,炎症生物标志物也越短。
地中海饮食和COVID-19风险及相关死亡呈负相关
一项仅针对欧洲国家的生态学研究表明,地中海饮食与COVID-19相关死亡之间存在显着的负相关(r2= 0.771, p = 0.030).
一项观察性病例对照研究探讨了不同饮食模式与 COVID-19 事件和结局之间的可能关联。结果显示,病例的地中海饮食评分平均值(p=0.009)低于对照组,表明地中海饮食与COVID-19风险呈负相关。
地中海饮食有益地调节肠道微生物群和免疫系统
地中海饮食富含益生元物质,如半乳聚糖、果聚糖、纤维和菊粉。大量报道表明,这些化合物被宿主微生物使用,支持有利细菌的生长并促进有益代谢物的产生。
膳食纤维是影响复合碳水化合物对炎症影响的重要因素。研究表明,纤维消耗量的增加(约30g/d)与hs-CRP浓度的显着降低有关。膳食纤维摄入的另一个优点是对肠道微生物组组成更有利,可降低肠道和全身炎症。
多酚是地中海饮食中最丰富的次生植物化合物或植物化学物质之一,可能通过抑制NF-κB和AP-1以及激活Nrf2发挥许多抗氧化和抗炎作用。对肠道微生物群具有益生元作用。
地中海饮食:对抗冠状病毒感染的潜在策略
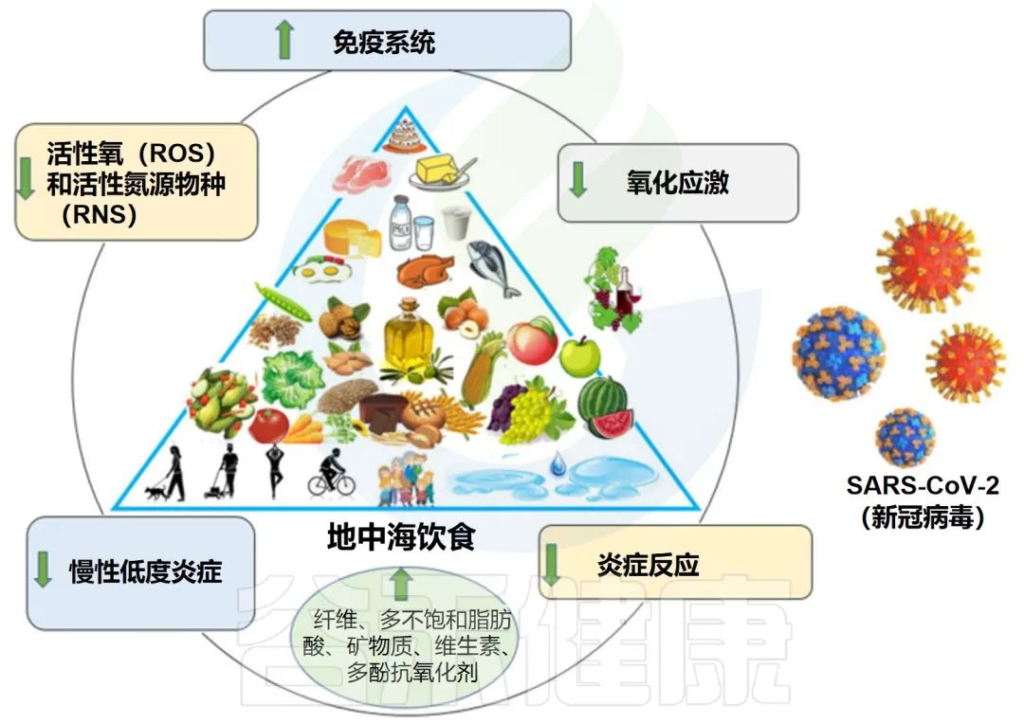
DOI:10.3390/medicina57121389
植物性饮食并不完全等于素食。在少量摄入动物源性食物的基础上,健康植物性饮食更倾向于新鲜蔬菜、坚果等健康的植物源性食物;而不健康的植物性饮食则更倾向于腌制蔬菜、糖等不健康的植物源性食物。
研究报告了植物性饮食是营养丰富的,包括高浓度的多酚,类胡萝卜素,纤维,维生素A,C和E,叶酸,铁,钾和镁。植物性饮食在预防高血压和心血管等疾病方面有益处。素食植物性饮食还可以增强免疫系统,减少炎症和氧化应激,并可能有助于预防慢性肾脏疾病和保持肾功能。
一项流行病学前瞻性队列研究表明,植物性食物与较低的COVID-19严重程度有关。
对来自美国和英国的五十多万参与者进行了一项研究,其中记录了 31815 例 COVID-19 病例。那些食用健康植物性饮食的人患 COVID-19 的风险降低了 10%,COVID-19 的严重程度降低了 40%.
对于年龄较大的COVID-19患者,研究人员发现,非素食饮食与COVID-19严重程度的风险较高有关。
对 2021 年 5 月至 2021 年 8 月期间在一家医疗中心被诊断为 COVID-19 的 509 名患者进行了回顾性评估。患者根据疾病严重程度分为三组。对于 ≥65 岁的患者,COVID-19 症状严重程度与坚持素食有统计学意义且呈负相关(p = 0.013).
水果、蔬菜摄入的重要性
一项针对COVID-19住院患者的横断面研究表明,水果、蔬菜和纤维的摄入量增加与 COVID-19 的严重程度、临床症状、住院和康复持续时间以及炎症标志物的浓度呈负相关。
水果和蔬菜富含纤维,是抗炎和增强免疫力的维生素,矿物质和抗氧化剂的良好来源。
为了确定饮食习惯对全球大流行期间COVID-19风险和严重程度的影响,需要进行进一步的研究。
间歇性禁食是一种潜在的补充疗法,不仅影响慢性病风险,而且有充分证据表明对传染病有影响。
SARS-CoV-2可能诱发肠道微生物群失调,导致致病菌的增殖增强,并导致有害的继发性病原体从肠道进入血流。
没有研究直接评估禁食对SARS-CoV-2感染者微生物组的影响,但由于其他观察结果,禁食塑造微生物组以支持与最佳代谢健康和低肥胖风险相关的物种,因此可以预期在预防不良变化方面产生影响。禁食期间,肠道微生物生长及其副产物(例如三甲胺N-氧化物)的产生受到抑制。
间接性禁食改变了微生物群丰度
间歇性禁食改变了各种微生物的丰度,例如脱硫弧菌科、Hydrogenoanaerobacterium、阿克曼氏菌、瘤胃球菌科等。
一项针对两种间歇性禁食(即限时进食和隔日禁食)的系统评价报道,禁食对微生物组有明显影响,例如改变厚壁菌/拟杆菌的比例,两种方案均增加了代谢保护微生物(如乳杆菌属和 Akkermansia municiphila)的丰度。
周期性禁食患者的死亡、住院和新诊断心力衰竭的风险也较低。特别是,禁食会在禁食期间急剧大幅降低葡萄糖水平,并在长期内降低基础葡萄糖水平,这在两种情况下都会使葡萄糖在感染期间减少使用,因此应该抵消SARS-CoV-2对糖酵解的刺激。
注意:禁食的安全问题包括轻微的潜在副作用,如饥饿、疲劳、头晕、便秘、头痛等,对健康的人是安全的。禁食会降低血糖,并可能导致低血糖。也可能导致脱水。2型糖尿病患者应谨慎禁食。其他安全问题可能包括身体过度紧张和营养缺乏等。
然而不可忽视的是间歇性禁食的一系列机制,使受损的人体免疫系统自我修复。在感染之前开始间歇性禁食方案可能对预防 COVID-19 等疾病的严重后果最有利。
总的来说,整体健康的饮食可能在预防SARS-CoV-2感染和降低感染严重程度方面发挥作用。需要更多的研究来证实这些发现,未来的研究应确定饮食质量与COVID-19感染风险之间关系的生物学机制。
生 活 方 式
注意,这里的运动并不是剧烈运动,特别是爬山、徒步等运动量大的活动更要注意量力而行。仍要加强健康监测。
刚阳康后需要进行一个休息阶段,尤其是老年“阳康”者,建议可循序渐进,先进行低等强度的温和运动,如适当散步、拉伸等。可以配合一些温和的养生方法,例如广播操,太极拳,八段锦等。
⇘⇘
太极拳作为中国传统运动之一,其特点是动作连贯、柔和,既能增强体质,调和身心,又能改善肺功能,避免运动时的呼吸短促。太极拳作为一种慢性病辅助治疗方法,已被临床证实能改善和缓解慢性阻塞性肺病。慢性阻塞性肺病,是一种常见的导致呼吸困难的慢性肺部疾病,被认为是COVID-19患者病情恶化的一个风险因素。
一项Meta分析共纳入11项随机对照实验,共纳入708名慢性阻塞性肺疾病患者。中期(3-6个月)或长期(12个月)太极拳运动对改善肺通气功能有效,且对改善慢性阻塞性肺疾病患者肺通气功能效果而言,干预时间在12个月以上的太极拳运动相较于中期运动更明显。
太极拳的简单易操作更容易让疫情期间老年人群体做出选择,同时也因为负荷量小更能够保证老年人的锻炼需求,从而达到免疫力提升的效果。
⇘⇘
八段锦具有运动强度小、动作幅度舒缓等特征,符合新冠肺炎患者年龄偏大、身体乏力、行动不便的需求,对于预防期新冠肺炎的发生以及预后呼吸功能的回复具有很好的预防和恢复作用。
90名亚健康状态学生为研究对象,随机分为对照组、散步组、八段锦组,30例/组。结果:八段锦组亚健康恢复率为50.00%(15/30),高于对照组的13.33%(4/30)和散步组的30.00%(9/30),差异有统计学意义(P<0.01). 八段锦练习能够显著改善亚健康状态,提高亚健康恢复率,且效果优于日常散步活动。
吸烟被认为与不良疾病预后有关,因为大量证据强调了吸烟对肺部健康的负面影响。吸烟会增加肺部感染的风险和严重程度,因为它会损害上呼吸道并降低肺部免疫功能。
吸烟已被证实是 COVID-19 负面进展的一个危险因素,尤其是在疾病严重程度和死亡方面。
Meta分析纳入 40 项研究,目前吸烟和以前吸烟都会显著增加疾病严重程度的风险(分别为:OR=1.58;95%CI:1.16–2.15,p=0.004;OR=2.48;95%CI:1.64–3.77,p<0.001),表现出中度异质性。
前吸烟者患疾病严重程度的几率是从不吸烟者的 1.58 倍。前吸烟者患疾病严重程度的几率是从不吸烟者的 2.48 倍。
同样,目前吸烟和以前吸烟也会显著增加死亡风险(分别为OR=1.35;95%CI:1.12–1.62,p=0.002;OR=2.58;95%CI:2.15–3.09,p<0.001;),并出现中度异质性。
对于死亡结果,当前和以前吸烟也分别使死亡风险显著增加 1.35 倍和 2.58 倍。
冥想练习调节注意力和情绪,向外关注特定的身体和感官刺激,向内转向精神体验和身体体验的躯体感觉。
由于冥想对包括抑郁症、焦虑症、慢性疼痛和药物滥用在内的精神病理学的特定领域产生积极影响,以及它与注意力障碍、创伤性压力、饮食失调和严重精神疾病的关联,冥想越来越多地被纳入心理健康干预措施。
与当地招募的对照组相比,长期冥想的佛教僧侣的肠道微生物群组成发生了显著变化。在属水平上,普氏菌属和拟杆菌属在冥想组中显着丰富。根据 LEfSe 分析,两个有益细菌属(巨型单胞菌属和粪杆菌属)在冥想组中显着增加。功能预测分析进一步表明,包括聚糖生物合成、新陈代谢和脂多糖生物合成在内的几种途径在冥想组中显着丰富。
这种改变的肠道微生物群组成可以降低焦虑和抑郁的风险,并改善身体的免疫功能。生化标志物概况表明冥想可以降低心身医学中心血管疾病的风险。这些结果表明,长期深度冥想可能对肠道微生物群产生有益影响,使身体保持最佳健康状态。
来自麻省理工学院、加州大学圣地亚哥分校、乔普拉综合研究图书馆和哈佛大学的研究人员探索后认为,某些冥想、瑜伽体式(姿势)和调息(呼吸)练习可能是治疗和/或预防SARS-CoV-2感染的有效辅助手段。
来自 13 个国家的 44 项研究,共 4023 人,时间范围从 20 到 4800 分钟不等。主要研究结果表明,瑜伽、冥想和调息,无论是单独使用还是组合使用,都可以通过调节抗炎和促炎生物标志物来有效提高健康和临床人群的免疫力,可能有效降低 IL-6、皮质醇和 TNF-α 患者的水平。
⇘⇘
晒太阳
时间可以选择在11点-15点,晒5-30分钟,尽量不隔着玻璃,夏季应注意避开紫外线最强的时候。
2022 年 1 月发表在《韩国家庭医学杂志》上的一项研究着眼于气候如何影响 COVID-19。研究人员发现,当涉及较高的湿度、气温和暴露在阳光下时,COVID-19 病例较少。
⇘⇘
卫生措施
阳康后依然有必要进行日常的防护措施,包括出门戴口罩,回家后勤洗手。
衣服上的病毒会传染吗?
2020 年 11 月发表的一项研究发现,虽然活病毒在皮肤上存在长达四天,但在衣服上,病毒存活不到八小时。
美国疾病控制与预防中心指出,COVID-19 主要通过三种方式传播:
受污染的衣服(或其他材料)不被视为主要传播方式。
马里兰州约翰霍普金斯健康安全中心资深学者、传染病专家认为,病毒的生长和存活在很大程度上取决于环境条件——温度和湿度。总的来说,衣服不是 SARS-CoV-2 的“主要传播媒介”。
衣服上的病毒可以被洗掉吗?
莱斯特德蒙福特大学的研究表明,使用洗涤剂在洗衣机中用热水洗衣服可以完全消除病毒。
⇘⇘
保暖
此外,天气寒冷时去户外应注意防寒保暖,天气寒冷时可适当减少外出。
以上是针对饮食、生活方式的调整,是所有调理方式的基石。当然可能还有许多没有列举出来的其他健康的生活方式,可以慢慢探索,找到一种适合自己的健康的生活方式,“病毒”就难以伤害你。
肠道菌群对免疫调节至关重要。针对肠道菌群的干预措施可能对COVID-19患者产生全身性有益作用。
益生菌和益生元是我们饮食中会影响微生物组的两个组成部分。营养状况和饮食在COVID-19中起着至关重要的作用,主要是由于肺和肠道微生物群之间的双向相互作用。
下图描述了人体肠道和肺部之间的相互作用以及益生菌和益生元引发的潜在阳性免疫反应。
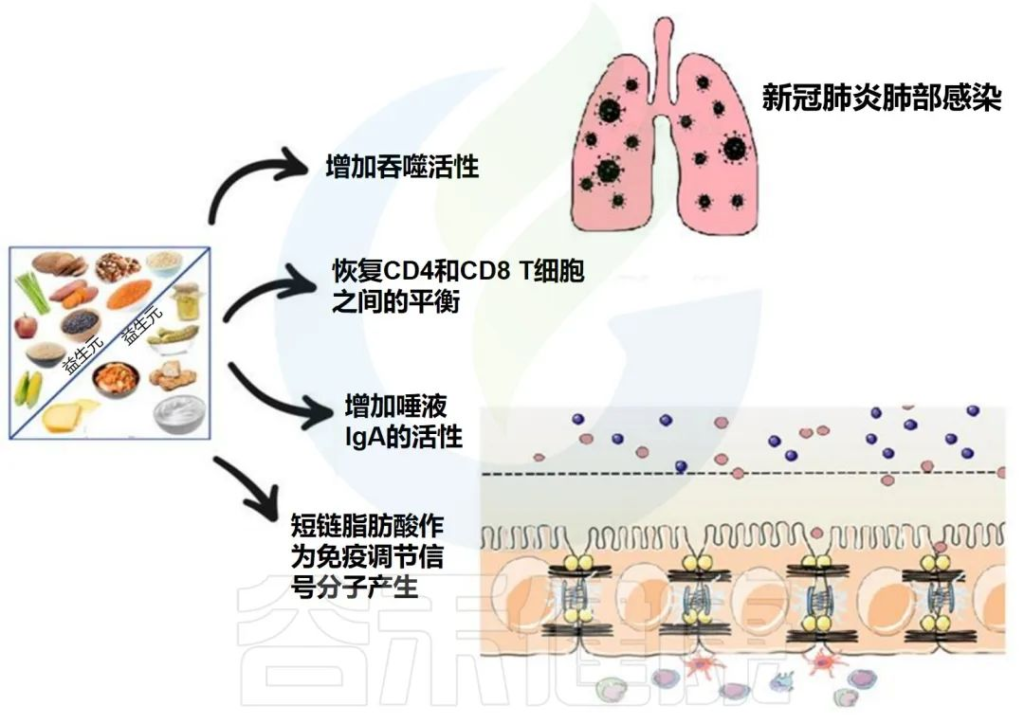
doi.org/10.3390/metabo12100912
益生菌和益生元都可以增强巨噬细胞的吞噬活性,平衡T细胞免疫以有利于更多的调节状态,增加唾液IgA的活性,并通过产生短链脂肪酸作为重要的信号分子,来发挥免疫调节细胞外和细胞内功能。
在临床研究中,使用益生元和益生菌操纵肠道微生物群是治疗肺部疾病的一种有前途的方法。
国家卫生健康委员会和国家中医药管理局指南建议重症COVID-19感染患者在常规治疗的同时食用益生菌,以改善肠道菌群平衡并预防继发细菌感染。
益生菌可能会改变肠道微生物群的组成,并在维持肠道微生物群的生态系统中发挥至关重要的作用。
益生菌通过调节肠道菌群有助于COVID-19治疗
益生菌有利于增强上皮屏障功能和改善肠道微生物多样性。此外,益生菌可对抗和阻断肠道中的有害细菌菌株或增强有益的信号通路。
尽管细菌引起的免疫反应与病毒引起的免疫反应相对不同,但许多临床研究得出结论,益生菌有助于治疗COVID-19。
注:已有超过 25 项注册临床试验旨在调查益生菌给药对 COVID-19 管理的生物学和治疗作用。
在迄今为止发表的有限试验中,关于益生菌给药的主要发现是:症状的更快改善,疲劳减少,并可能解决胃肠道问题。
已发表的研究:服用益生菌对COVID-19及其相关后遗症的影响

编辑
doi: 10.1016/j.clnesp.2022.08.023
益生菌通过调节宿主免疫系统带来益处
除了改善肠道微生物平衡外,最近的证据表明,益生菌还可以通过调节宿主免疫功能对宿主产生有益作用。一些研究报告了益生菌与ACE2相互作用的潜力,ACE2是SARS-COV2 进入宿主的受体。
例如,据报道,几种益生菌(主要是益生菌乳酸菌)在牛奶发酵过程中释放出对ACE2具有高亲和力的肽。同样,益生菌也可能通过ACE2途径改善呼吸道感染。
益生菌还可以提高肺免疫系统中自然杀伤细胞(NK细胞)、I.型干扰素、T和B淋巴细胞以及APC的水平。
注:NK细胞在针对病毒感染的早期免疫反应中起重要作用,主要是通过清除病毒感染。
先前的一项研究表明,益生菌会改变IL-10的表达并降低炎性细胞因子的表达。
益生菌还抑制其他促炎细胞因子,如TNF-a、CRP、IL-1b、IL2、IL-6、IL7、MCP1和LDH等。
益生菌通过细菌素抑制病毒与其受体的结合
除了抗炎作用、免疫调节和调节微生物组的机制外,益生菌还可以通过细菌素抑制 SARS-CoV-2 与其受体的结合。
益生菌植物乳杆菌(LPG)的独特菌株可以通过增强干扰素信号传导和抑制凋亡和炎症途径,在有效阶段和记忆阶段促进SARS-CoV-2特异性免疫反应。
由植物乳杆菌等益生菌分泌的植物素等细菌素参与抑制SARS-CoV-2的进入和复制
doi: 10.1016/j.clnesp.2022.08.023
分子对接研究预测,植物素结构可能通过靶向S蛋白或结合RNA依赖RNA聚合酶(RdRP)来阻碍病毒的进入,从而阻碍基因组的转录。
植物乳杆菌的PlnE和PlnF可以通过在解旋酶的ssRNA或ATP结合位点结合来抑制SARS CoV-2复制。
益生菌并不是治疗COVID-19的灵丹妙药,益生菌的功效和安全性在文献中存在争议,例如在接受Bacillus clausii 治疗的免疫功能低下患者中出现了菌血症等现象。因此,对一个病人有益的配方可能对另一个病人有害。还需要进行更多的研究。
此外,在推断临床试验结果时,重要的是要意识到混淆因素,如不同年龄组,不同免疫系统状态,不同季节,益生菌的成分,剂量,营养状况,正在服用的其他补充剂等。因此,也可能需要根据症状进行调整。
更有针对性的方法,包括肠道菌群检测等措施,以充分了解微生物群的作用及其在饮食和外部应激源之间的相互作用,以对抗SARS-CoV-2感染,可能会带来个性化治疗,以便益生菌能给每个需要的人带来真正益处。
益生元包括多不饱和脂肪酸、抗性淀粉、阿拉伯寡糖、低聚糖、果聚糖、低聚糖、半乳甘露聚糖、车前子、蔗糖乳糖、乳糖酸、多酚等。
大多数益生元是从植物多糖中合成或分离的,是低聚糖,例如:
含有益生元的食物,如纤维、低聚糖和多酚,可以改善细菌的生长。例如,富含菊粉的饮食刺激双歧杆菌和拟杆菌的生长;全麦谷物可以改变细菌谱,增加双歧杆菌和乳酸杆菌的相对数量。
益生元以与益生菌类似的方式调节肠道微生物群,从而抑制病原体并刺激免疫系统。同样,益生元通过直接和间接机制,对免疫系统和宿主的健康产生有益的改变。
益生元为益生菌的生长提供能量
此外,益生元选择性地刺激益生菌的有利生长并增强益生菌的活性。益生元通过增强益生菌的生长和生存能力,对 COVID-19 感染具有潜在作用。益生元也可能通过阻断ACE2对COVID-19引起的胃肠道症状产生潜在影响。
益生元明显降低了促炎IL-6的水平,这似乎是迄今为止描述的COVID-19严重预后的主要原因,并改善了抗炎IL-10的水平。
母乳低聚糖:在COVID-19中的潜在应用
母乳低聚糖在母乳中固体成分的比例排名第三。母乳低聚糖可以发挥多种功能,即抗感染(针对细菌和病毒),信号传导,抗炎/免疫调节和益生元作用。
母乳低聚糖对抗SARS-CoV-2的潜在作用模式
doi: 10.3390/biomedicines10020346
a) 母乳低聚糖分子结构类似于HBGA,并充当受体诱饵以阻止病毒进入。
b) 母乳低聚糖诱导局部防御和免疫调节。
c) 母乳低聚糖减弱TLR4介导的信号通路以维持粘膜稳态。
d) 母乳低聚糖在长新冠中缓解肠道菌群失调并恢复健康的肠道微生物群。
地中海饮食多酚:对 COVID-19 引起的炎症的潜在用途
研究人员发现,地中海饮食中存在的主要酚类化合物作为COVID-19预防/治疗剂的潜在用途,基于其抗氧化和抗炎作用。
目前的证据支持羟基酪醇、白藜芦醇、黄酮醇(如槲皮素)、黄烷醇(如儿茶素)和黄烷酮可能对 COVID-19 产生的潜在益处。
茶多酚:具有抗病毒固体和抗氧化特性,可能有助于降低出现严重COVID-19症状的风险
肠肺轴在SARS-CoV-2感染中起着重要作用,因此靶向肠肺轴治疗COVI-19尤为重要。茶多酚被认为是多功能生物活性分子,除了抗菌和调节肠道菌群以增强免疫功能外,还具有抗病毒作用。因此,茶多酚对COVID-19具有潜在的预防和治疗作用。
茶多酚降低 COVID-19 合并症风险

DOI:10.3389/fnut.2022.899842
茶多酚可以促进肠道中有益细菌的生长,并抑制肠道中病原微生物的生长,从而调节肠道菌群的组成。
研究人员研究了茶多酚对回肠损伤和肠道菌群紊乱的治疗和预防作用。结果表明,茶多酚可以减少炎症和氧化应激标志物,提高抗氧化酶和紧密连接蛋白的水平,有效改善肠道菌群失衡,减少对肠粘膜的损害,增强机体免疫力。
使用茶多酚预防和治疗COVID-19并发症
DOI:10.3389/fnut.2022.899842
在一项针对200名医护人员的随机双盲试验中,每天六粒胶囊(包括378毫克儿茶素和270毫克EGCG)持续5个月,在预防流感病毒方面优于安慰剂。
注意:在确定使用茶多酚治疗COVID-19之前,仍然需要大量实验来确认具体的药物给药(绿茶饮料、粉状绿茶提取物、儿茶素混合物、单独儿茶素)、剂量方案(不同剂量、不同治疗持续时间)和给药途径管理(饮食口服、饮料口服)。
针对COVID-19住院患者研究中,接受合生元患者临床症状缓解的比例更高
在一项针对55名COVID-19住院患者的开放标签研究中,与标准治疗组相比,接受双歧杆菌菌株和益生元的合生元配方(SIM01)4周的患者的临床症状得到缓解的比例更高(88%对63.3%),抗SARS-CoV-2的IgG抗体增加,IL-6、CCL2、M-CSF、TNF和IL-1RA等血液促炎标志物减少。
在接受SIM01的个体肠道菌群中,共生菌(如双歧杆菌、真杆菌和粪杆菌)的丰度也有所增加,而机会致病菌(如大肠杆菌和拟杆菌)的丰度则有所下降。
合生元配方 SIM01 可加速针对 SARS-CoV-2 的抗体形成,降低鼻咽病毒载量,减少促炎免疫标志物,并恢复住院 COVID-19 患者的肠道生态失调。
合生元辅助治疗两周可以有效调节针对COVID-19感染的炎症反应
一项随机安慰剂对照试验招募了 78 名确诊 COVID-19 感染的住院患者。干预组和对照组分别每天两次接受合生元或安慰剂胶囊,持续两周。
注:合生元胶囊含有多种菌株益生菌,如鼠李糖乳杆菌 、瑞士乳杆菌、干酪乳杆菌、乳双歧杆菌、嗜酸乳杆菌、短双歧杆菌、保加利亚乳杆菌、长双歧杆菌、植物乳杆菌、双歧双歧杆菌、格氏乳杆菌和嗜热链球菌,以及低聚果糖益生元剂。
结果发现:
后生元:在宿主中具有生物活性的微生物的非活细菌产物或代谢产物。也有研究人员称之为“幽灵益生菌”、“灭活益生菌”、“非活性益生菌”等。
短链脂肪酸、微生物细胞组分、功能蛋白、细胞外多糖(EPS)、细胞裂解物、替胆酸、肽聚糖衍生的多肽和毛状结构等多种代谢产物都算后生元。
后生元对抗 COVID-19 的抗病毒机制可以与以下作用相关联:
(a) 抗病毒抑制代谢物的产生
(b) 改善肠上皮衬里屏障功能
(c) 调节先天性和适应性免疫系统
(d) 对肠脑轴的影响
(e) 缓解继发性真菌感染
各种后生元对肠道屏障完整性的调节
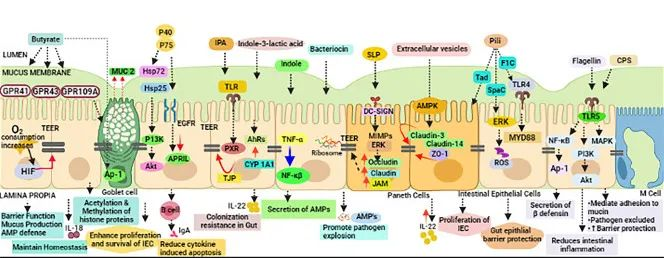
doi: 10.1007/s12602-021-09875-4
人们越来越热衷于利用益生菌,尽管由于宿主微生物组和侵入性病毒之间的固有复杂性和串扰,其详细的作用机制仍在研究中。后生元在降低致命的SARS-CoV-2感染严重程度方面可能比益生菌具有显着优势。
然而从治疗和调节的角度来看,还有一些关键问题需要回答,例如:最适合提取它们的方法,它们在宿主内的有效传递方法,它们的稳定性和保质期,后生元商业化的生物处理策略等。
未来,根据病原体变异的流行情况,将后生元用作个性化疗法或许是一种可行的选择。基于后生元在增强或调节个体免疫力方面的作用,也可以探索降低对其他病毒感染的易感性或严重程度。
在粪菌移植中,来自健康供体的体外培养或粪便物质纯化的粪便或复杂微生物群落被接种到患者的肠道中。粪菌移植已证明对结肠炎、糖尿病和复发性艰难梭菌感染有效。
11名COVID-19患者中有5名报告胃肠道症状有所改善,血液免疫标志物和肠道微生物群组成有良好的改善,双歧杆菌和粪杆菌的丰度增加。
在两名合并复发性艰难梭菌感染的 COVID-19 患者中,FMT 治疗似乎是安全的,并且 COVID-19 相关呼吸道症状在 FMT 后 1 个月内迅速消退。
一项注册临床试验(ClinicalTrials.gov 标识符号 NCT04824222),试图验证粪菌移植作为免疫调节风险降低剂,在与细胞因子风暴和炎症升级相关的COVID-19疾病进展中的功效。
对照组接受标准的药物治疗,而实验组也接受口服FMT,剂量为30–50,双层,耐胃酸,肠溶性冷冻60-g胶囊。
➳ 主要的结果指标是:
给药后第30天安全试验组的不良事件发生率。
➳ 另一个结果指标是:
研究组和对照组中需要升级无创氧疗方式的患者百分比
如增加FiO2、给予高流量鼻插管氧治疗(HFNOT)、持续气道正压(CPAP)或有创通气、呼吸机和/或ICU住院治疗,对应于新冠肺炎表现状态量表中5-7级疾病恶化。
这个试验仍在进行中。然而,考虑到肠道微生物群在免疫调节中的重要作用,研究人员认为FMT是抑制新冠肺炎诱导的细胞因子风暴和炎症的一种可能的治疗选择。
益生菌、益生元和FMT旨在增加有益细菌的丰度,而抗生素则用于抑制有害微生物群的丰度。世卫组织建议,患有可能患有严重急性呼吸道感染(SARI)和败血症的COVID-19患者可能需要广谱抗生素,这可以覆盖尽可能多的致病菌。
密歇根州38家医院新冠肺炎患者的随机数据显示,至少50%的患者接受了早期经验性抗生素治疗。抗生素在危重症患者中的应用也占很大比例,并在抑制患者继发感染方面发挥关键作用。
然而,抗生素治疗可以不加区别地消除正常的共生微生物群,同时消除病原体,导致肠道菌群失调。
与健康对照组相比,新冠肺炎患者的抗生素治疗对肠道微生物群有显著影响,有益于宿主免疫的共生菌较少,包括粪杆菌、粪球菌和直肠真杆菌,而铜绿假单胞菌和分枝杆菌,这已被证实与新冠肺炎的严重程度增加呈正相关。
特别是在疫情期间,抗生素的使用面临巨大挑战。
在早期大流行中,抗生素被普遍使用。一项荟萃分析估计,全球四分之三的新冠肺炎患者曾服用过抗生素,这一比例明显高于新冠肺炎中细菌合并感染的估计发生率,后者仅为8.6%。
45名中度新冠肺炎患者的临床结果显示,服用和未服用抗生素的患者之间没有差异,这表明抗生素对改善新冠肺炎的临床结局并无益处。
据报道,在住院期间接受抗生素治疗的新冠肺炎患者出现明显的肠道失调,抗生素诱导的肠道失调损害了人类对季节性流感疫苗的免疫反应。
一项对200名新冠肺炎患者的纵向研究表明,新冠肺炎爆发前一年抗生素摄入量的减少与疾病严重程度的减轻和SARS-CoV-2的快速清除有关。
因此,抗菌药物管理对于预防抗生素诱导的失调、严重的新冠肺炎和新冠肺炎患者的抗菌药物耐药性风险至关重要。抗菌治疗必须有明确严格的适应症,应谨慎选择病原学检测后敏感的抗生素,并根据患者的具体情况适当调整用药时间。
➤ 多 酚
多酚是源自植物的酚类化合物,富含抗氧化和抗炎特性。膳食多酚大致分为四类,包括酚酸、木脂素、二苯乙烯和类黄酮。
有大量证据强调了多酚对肠道的益生元作用。这可能有助于纠正据报道由SARS-CoV-2感染引发的肠道微生物群的生态失调。
——槲皮素
槲皮素被认为有助于预防严重的COVID-19症状,因为它具有已知的抗炎、抗氧化和免疫调节特性。分子对接和体外研究通过多种机制揭示了强大的抗病毒潜力,包括阻止与ACE2受体的附着和阻断病毒复制。
槲皮素的临床试验结果很有希望。在一项随机、开放标签试验中,研究人员测试了用向日葵磷脂配制的槲皮素提高吸收的有效性。
与标准护理相比,槲皮素组的住院风险降低了68.2%,住院时间缩短了76.8%,对氧气治疗的需求减少了93.3%。此外,槲皮素组没有患者入住ICU或死亡,对照组分别有10.5%和3.9%的患者入住ICU或死亡。同一组的进一步随访研究证实,槲皮素显著改善了病毒清除率,缩短了症状时间,改善了炎症标志物,与对照组的19%相比,槲皮素组的57%在7天后完全康复。
最近的一项小型研究证实了这些结果。槲皮素组的炎症标志物和住院时间显著减少。此外,槲皮素组入住ICU的患者数量减少,ICU天数减少,无死亡,而对照组有3例死亡。在所有情况下,这些结果都接近显著性,但很可能由于样本量小而没有统计学意义。
虽然缺乏大型临床试验,存在局限性,上述研究仍显示了症状减轻、进展至严重疾病和死亡率方面的益处。鉴于槲皮素在短期服用时具有良好的安全性,以及其广泛的可用性和众多其他健康益处,可以与患者讨论使用。
槲皮素可以从几种水果和蔬菜中获得,如浆果、芦笋,红叶生菜、洋葱、苹果、莳萝、萝卜、刺山柑、香菜、银杏叶、葡萄、葱、西红柿、西兰花、青椒、豌豆等。也可以从含有槲皮素或其一些合成衍生物的补充片剂中补充。
——姜黄素
姜黄素是姜黄中存在的生物活性化合物,具有多机制作用模式。
它可以抑制病毒进入细胞,包裹病毒和病毒蛋白酶。它调节各种信号通路。
姜黄素可能在治疗 COVID-19 感染中发挥有益作用,因为它能够调节负责 SARS-CoV-2 在许多器官(如肾脏、肝脏和心血管系统)中的附着和内化的各种靶点。它还可以抑制COVID-19感染时触发的纤维化相关通路和肺水肿。
研究表明,口服姜黄素可降低死亡率、恢复时间、对氧气的需求、机械通气、住院时间以及存在几种炎症标志物。
在三项安慰剂对照试验中,每天服用160 mg纳米姜黄素或1050 mg姜黄素和胡椒碱的患者的死亡率分别降低了80%、50%和82%。最近的一项荟萃分析表明,姜黄素治疗患者的死亡率总体降低了77%.
六项临床试验中,有五项也发现轻度、中度和重度新冠肺炎患者的症状持续时间显著缩短。
虽然还需要进行更大规模的试验,但现有数据表明姜黄素对降低新冠肺炎的严重程度非常有效。
鉴于几乎所有先前的临床试验都表明姜黄素补充剂是安全且耐受性良好的,即使剂量高达8000 mg/d,建议在症状出现时或首次阳性试验时每天服用1000 mg 较为合适。
虽然补充剂是达到试验中同等剂量的最佳方法,但用于烹饪的姜黄粉含有约3%的姜黄素。因此,一茶匙(5克)的姜黄粉含有大约150毫克。虽然姜黄素的低生物利用度一直存在问题,但胡椒碱(一种存在于黑胡椒中的化合物)已被证明可将生物利用度提高20倍,因此想要提高饮食中姜黄素摄入量的做法,可以在加姜黄粉的同时加入黑胡椒。
——白藜芦醇
白藜芦醇是一种多酚,白藜芦醇可能与SARS-CoV-2相互作用,至少部分是通过触发Nrf2,而Nrf2作为宿主防御机制对某些呼吸道病毒疾病(如呼吸道合胞病毒病)具有重要的调节作用。
白藜芦醇可以降低氧化应激,通过谷胱甘肽过氧化物酶的调节。这增强了谷胱甘肽的产生,并抵消了氧化应激介导的组织损伤。
白藜芦醇通过抗氧化和抗炎机制对SARS-CoV-2诱导的损害的主要潜在保护作用
doi: 10.1007/s13105-022-00926-0.
白藜芦醇通过eIF2α和NADPH氧化酶途径降低氧化应激水平。
高血压和动脉粥样硬化是新冠病毒感染的两个危险因素。在这方面,白藜芦醇调节SIRT1和Nrf2通路的能力,以及ROS的产生,导致更大的一氧化氮(NO)生物利用度。因此,白藜芦醇介导的NO增加很可能是多酚的血管扩张剂和抗血小板作用的基础,这反过来又可以减轻许多患者的COVID-19严重程度。
白藜芦醇在内皮细胞中积累,由于其潜在的抗血栓作用,能够保护内皮屏障。
由于其抗氧化活性,白藜芦醇可以减轻与ROS介导的氧化应激相关的炎症反应。较低的ROS水平导致NF-κB和细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)的抑制。
对随机临床试验的各种荟萃分析强调了白藜芦醇的抗炎作用,这可能有助于缓解新冠肺炎特有的所谓“炎症形式”。
项研究利用网络药理学方法和生物信息学基因分析探讨了白藜芦醇对新冠肺炎患者作用的潜在机制。该研究表明,白藜芦醇可以通过抑制IL-17、TNF和NF-κB信号通路来减轻SARS-CoV-2产生的过度炎症。
白藜芦醇,自然存在于不同的食物来源中,浓度较低,典型的地中海饮食,包括葡萄、红酒、浆果和坚果。
关于白藜芦醇与肠道菌群的关联详见:
——羟基酪醇
羟基酪醇,存在于橄榄中,在橄榄成熟过程中由于橄榄苦苷水解而增加。它是从橄榄叶和果实中提取出来的,在特级初榨橄榄油中含量尤其丰富。
注:橄榄油是地中海饮食中最具特色的食物之一。
羟基酪醇的抗病毒能力是众所周知的,部分原因是其抗炎作用。不同的研究表明,这种酚类化合物抑制MMP-9和COX-2酶的活性。
MMP-9循环水平升高被认为是COVID-19患者呼吸衰竭的早期指标。在急性肺损伤(例如COVID-19中发生的肺损伤)中,MMP-9从中性粒细胞中释放出来,从而产生炎症和肺泡毛细血管屏障的退化,进而促进炎症细胞的迁移,导致肺组织的进一步破坏。
羟基酪醇诱导的MMP-9抑制可以通过该途径减轻和/或部分预防COVID-19产生的肺损伤。
羟基酪醇通过抗炎机制对 SARS-CoV-2 诱导的肺泡组织损伤的潜在保护作用
doi: 10.1007/s13105-022-00926-0.
➤ 类胡萝卜素
类胡萝卜素是四萜类。它们包括由植物、藻类和细菌产生的橙色、红色和黄色有机色素。一些常见的类胡萝卜素是α-和β-胡萝卜素、叶黄素、玉米黄质和番茄红素。类胡萝卜素以其抗氧化特性和抑制ROS而闻名。
因此,低水平的类胡萝卜素与氧化应激有关。叶黄素、胡萝卜素和玉米黄质的抗病毒作用已被报道。
一些类胡萝卜素可作为维生素A的前体,与免疫调节功能直接相关。据报道,类胡萝卜素可缓解COVID-19感染期间导致肺损伤的炎症反应。
当通过饮食提供必要的微量营养素(如维生素 A、B 和 D)以及硒、锌和铜等必要质量和数量时,可以达到最佳健康状况。
随着新冠的持续,很明显,最容易感染的人是那些失去生理营养状况和免疫系统平衡的人。这种不平衡使SARS-CoV-2病毒得以发展并导致疾病的不同临床形式(无症状,轻度,中度和重度)。
SARS-CoV-2感染中个体反应的微量营养素调节
DOI:10.1007/s12011-022-03290-8
维生素A缺乏导致第一道防御屏障缺乏先天免疫的重要成分,从而增强了病毒的反应。
维生素B和硒在感染期间抵抗氧化应激的免疫和抗氧化反应中发挥作用。维生素B、D、硒、锌和铜以非常重要的方式参与,促进抑制促炎细胞因子的合成,促炎细胞素引发细胞因子风暴,从而通过抑制Th1反应和促进Th2细胞产生细胞因子来调节适应性免疫应答。
锌本身参与细胞信号转导,因此参与细胞和病毒基因表达模式,从而避免病毒突变。
➤ 维 生 素 A
维生素A,一种脂溶性维生素。是身体许多部位正常生长和功能所必需的,包括眼睛、皮肤和免疫系统。
维生素A或视黄酸在全身水平上作为一种激素,并通过核视黄酸受体(RAR和RXR)信号调节免疫系统中的I型干扰素(IFN)合成。此外,它还通过维甲酸诱导基因I(RIG-I)信号通路负责对病毒感染的永久性免疫系统反应。另外调节NF-kB的活化。
德国进行的一项多中心、观察性、横断面、前瞻性分析调查中,研究人员发现维生素A缺乏与ARDS的发展和死亡率之间存在很强的关联(OR 5.21 [1.06–25.5],p = 0.042)。
注:ARDS,呼吸窘迫综合征
该研究纳入了40名SARS-CoV-2感染住院患者,并被诊断为中度、重度和危重度ARDS。对照组由47例症状较轻且不需要住院治疗的康复患者组成,结果显示,随着ARDS严重程度的增加,维生素A缺乏症更高,康复组的维生素A缺乏症明显降低(p <0.01至p <0.001)。
最近一项针对155名老年患者(18-95岁)的研究显示,36.5%的患者缺乏维生素A (< 0.343 mg/L); 作者认为,COVID-19疾病患者耗尽了血清维生素A储存。
免疫反应机制从先天转变为适应性,阻止了维甲酸的使用,这表明炎症平衡了COVID-19严重程度和维生素A水平之间的关系。
维生素A缺乏会降低影响上皮机械屏障功能的先天免疫应答,并增强呼吸道和肠道感染。这些上皮中的粘蛋白产生受视黄酸调节;因此,中等剂量维生素A补充剂通过调节上皮生长因子和相关细胞因子的基因表达来改善屏障完整性。
食物来源:肝脏,鱼类,鸡蛋,乳制品等,还包括橙黄色蔬菜、绿叶蔬菜、西红柿、水果等。
注意:维生素 A 补充剂可能与某些类型的避孕、抗癌药物、痤疮治疗和血液稀释剂相互作用,服用任何这些类型药物的人在服用维生素A补充剂之前应咨询医生。
➤ B 族 维 生 素
B族维生素是多种细胞反应的辅助因子,介导氨基酸的合成。包括维生素 B1、B2、B3、B5、B6、B7、B9、B12等,对免疫系统对抗感染反应至关重要。
B族维生素在激活先天性和适应性免疫应答中起关键作用,下调促炎细胞因子和炎症的产生,并显著改善呼吸功能。B族维生素还可以减少胃肠道问题,预防高凝状态,并缩短COVID-19患者的住院时间。
一项研究的311名法国受试者中,与7455名健康受试者相比,SARS-CoV-2阳性患者的维生素B9摄入量较低(OR = 0.84 (0.72,0.98),p = 0.02)。
在以色列,162例诊断为重症COVID-19的患者叶酸水平低于中轻度病例(分别为9.6ng/mL vs 12.9ng/mL vs 18.2ng/mL,p=0.005),其中12%为免疫抑制,9%需要无创氧合,15%为插管。
一组来自新加坡的患者纳入了43例50岁以上的COVID-19患者,发现联合补充维生素B12、维生素D和镁入院后与疾病严重程度的降低有关。在补充的患者中,与未接受这些微量营养素补充剂的患者相比,对氧疗的需求减少(17.6 vs 61.5%,p = 0.006)和重症监护需求减少有关。
——维生素B12
维生素B12对DNA合成和调节至关重要。转钴胺素发挥其抗氧化机制,促进还原性谷胱甘肽在细胞质中的生物利用度,从而促进氧化性谷胱甘肽的合成。钴胺素由肠道微生物群产生,有助于调节肠-脑轴,防止肠道生态失调,并有利于产生适当比例的微生物代谢物。这些过程对DNA合成、细胞稳态、造血和免疫至关重要。
在生理条件下,VB12调节抗炎细胞因子和生长因子的表达,减轻全身炎症。此外,通过促进NK细胞和CD8 + T细胞的增加,提高免疫反应,调节抗病毒反应。
当维生素B12缺乏时,感染的风险更大,严重程度也会增加。
一些因素如年龄和某些药物的使用与维生素B12缺乏的风险较高有关。在老年人中,内因子(intrinsic factor)的产生减少导致B12吸收不良、营养不良或尿和肠损失增加。
二甲双胍作为2型糖尿病的治疗也与VB12吸收不良引发的缺乏有关。因此,这可能会使这些患者更容易受到感染。
➤ 维 生 素 C
维生素C在免疫功能和伤口愈合中很重要,并具有抗氧化,抗病毒和抗炎的特性。维生素C已被证明可以增加中性粒细胞向感染部位的迁移,引发活性氧(ROS)和吞噬作用的产生。
据报道,饮食中的抗坏血酸可以降低c反应蛋白的浓度。维生素C被认为通过增加干扰素蛋白的产生而表现出抗病毒活性。
维生素C被认为是严重疾病的潜在治疗方法,也是降低感染风险的预防措施,因为它能够调节免疫细胞活性并减少炎症。
小规模研究显示,在对ICU入院后24小时内循环维生素C水平的分析中发现,高达82%的COVID-19患者缺乏维生素C,许多患者的维生素C水平仅为0.1mg/dL(正常值为0.4-2mg/dL),18%的维生素C水平检测不到(低于0.1mg/dL)。
在 50 例 COVID 病例中进行了一项临床试验,其中给予了高剂量维生素C 静脉干预,结果显示 COVID 患者的氧合指数发生了积极变化。
有研究表明,高剂量(8000mg/d)口服维生素补充剂可使COVID-19恢复率提高70%.
仍需要进一步的临床试验来充分描述维生素 C 对 COVID-19 感染的影响。
维生素 C 静脉注射被 FDA 归类为药物,只有口服剂量才能被评估并用作膳食补充剂,儿童(取决于年龄)每天 400 至 1800 毫克,成人每天 2000 毫克被认为是安全的。
富含维生素C的食物包括:猕猴桃,橙子,辣椒,草莓,樱桃,苹果,西兰花,菠菜,青椒,甜菜,花椰菜等。
➤ 维 生 素 D
除了对钙的吸收和骨骼强度的强大影响外,维生素D对于维持免疫力至关重要。它还减慢病毒复制,降低炎症活动,并增加体内 T 调节细胞的数量。
维生素 D 还可以缓解传染病、感染性休克和 ARDS 疾病(由于维生素 D 水平低)等并发症,这可能有助于预防新型冠状病毒作为辅助补充剂。
维生素D通过中性粒细胞和巨噬细胞合成组织蛋白酶和防御素来提高先天免疫力。这些作用控制病毒复制,并下调肿瘤坏死因子TNFα和IFN-γ的表达。
维生素D在增强免疫力中的作用
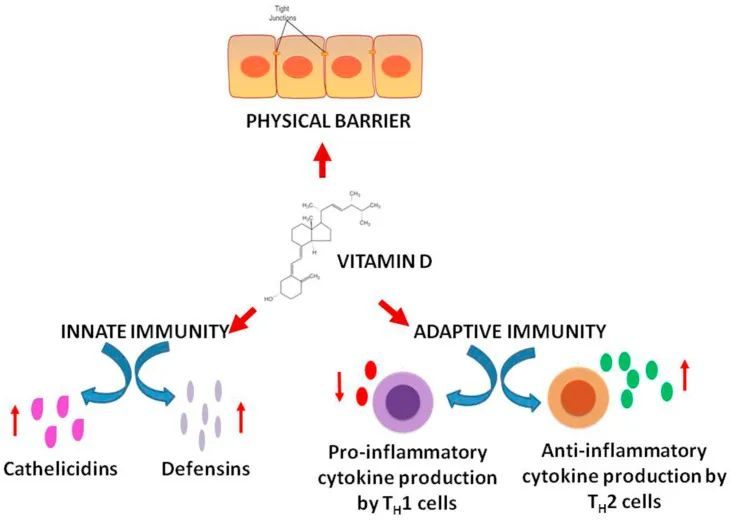
DOI:10.1016/j.clnesp.2022.04.007
低水平的维生素D(<20 ng/mL)与慢性疾病的发展和进展有关,如心血管疾病、2型糖尿病、癌症和抑郁症,也与骨骼健康不良有关。一些研究认为,维生素 D 水平低的人更容易患上 COVID-19 并患有更严重的疾病。维生素 D 缺乏会导致宿主体内的 SARS-CoV-2 病毒存活和复制。
与维生素D充足(感染率8.1%)或最高(感染率5.9%)的患者相比,缺乏维生素D的患者更有可能感染COVID-19(感染率12.5%)。
一项研究比较了中国335名COVID-19患者和560名健康志愿者的血液25(OH)D水平,发现COVID-19患者的25(OH)D浓度(中位数为26.5 nmol·L−1 [10.6 ng·mL−1])明显低于健康志愿者(中位数为32.5 nmol·L−1 [13 ng·mL−1])。
维生素D不足[具体定义为血清25(OH) D低于30 nmol·L−1 (12 ng·mL−1)]在COVID-19患者中比健康志愿者更常见。
与轻度COVID-19相比,重度COVID-19症状与最显著的维生素D缺乏相关。
土耳其的95名住院COVID-19患者,向他们补充了25-羟基维生素D,显示纤维蛋白原浓度降低,补充维生素D减少了住院时间,即使存在合并症。
在对13项研究的荟萃分析中,Pal等人计算出补充维生素D的人患严重疾病的风险降低了73%。在COVID-19发病后进行补充的研究中,风险降低最为显著(降低88%,OR 0.12)。
对SARS-CoV-2感染确诊病例的回顾性分析表明,维生素D水平低与较高的死亡风险显着相关,特别是在既往患病的老年人和男性个体中。
补充维生素D可以帮助25(OH) D水平低于25 nmol·L−1 (10 ng·mL−1) 的患者避免呼吸道感染。
补充维生素D,可以通过多晒太阳;饮食补充富含脂肪的鱼类如鲑鱼,鳟鱼,鲫鱼,金枪鱼,鳗鱼等,其他包括蘑菇,肝脏,蛋黄,新鲜水果蔬菜等。
注:冬季日照不够的情况可以通过维生素D补充剂,推荐最低剂量是每日400IU.
➤ 维 生 素 E
维生素E是一种脂溶性维生素,包括生育酚和生育三烯酚。是一种有效的抗氧化剂。可以影响免疫系统细胞,因为它具有抗氧化活性、蛋白激酶C(PKC)抑制和通过酶调节的信号转导。
在巨噬细胞中,维生素E修饰环氧化酶活性,从而控制过氧亚硝酸盐的合成。这导致前列腺素E2的产生降低,T细胞介导的T淋巴细胞反应上调。此外,它通过一氧化氮调节提高自然杀伤(NK)细胞活性。
与健康对照组相比,COVID-19患者的维生素E水平较低。
补充维生素E既往已被证明可增加免疫活性,特别是T细胞增殖,改善老年患者对疫苗接种的反应,并将老年肺炎患者的再住院风险降低63%.
维生素E来源:如小麦胚芽、葵花籽、杏仁、榛子、松子、鳄梨和甜红辣椒等。
扩展阅读:
➤ 铁
先天免疫反应精心控制铁代谢。铁稳态的破坏与感染,癌症,心血管疾病,肾脏疾病和血液疾病密切相关。
铁在病毒感染中也起着重要作用。在病毒复制过程中,需要ATP,而ATP合成需要铁。此外,铁调节素铁调素的表达增加几种细胞因子(例如,IL-6、IL-1),已知铁调素水平升高与血浆铁水平低有关(一种基于铁剥夺入侵病原体的非特异性宿主防御机制)。
注:铁调素通过结合和介导铁转运蛋白的降解来发挥其作用,铁转运蛋白是唯一已知的细胞铁输出剂,存在于肠细胞和巨噬细胞的细胞膜中,从而防止铁从这些细胞外排到血浆中。
铁缺乏在预测从轻度到重度疾病的转变方面很有价值,低血清铁水平是COVID-19患者死亡的独立危险因素。
汇总研究结果显示,COVID-19患者、严重程度状态和非幸存者的铁水平分别明显低于对照组、非严重程度状态和幸存者。
最近的研究中,与对照组(1.87±0.66mg/L)相比,COVID-19患者的血清铁(重症患者为1.33±0.7mg/L)显著降低。
此外,铁稳态的紊乱可在疾病发作后持续数月,并与肺部病变未消退和体能受损密切相关。
细胞内铁水平的升高和降低都是危险信号,分别通过NF-κB和HIF-1激活炎症和抗菌途径。
与中度病例相比,重症病例的血红蛋白、红细胞计数较低,铁蛋白水平较高,而非幸存者的铁蛋白水平高于幸存者。
铁过量也被认为是COVID-19发病机制的一个因素,因为它在活性氧的产生中发挥了作用,但更重要的可能是由于诱导非凋亡细胞死亡的铁死亡。
富含铁的食物包括:肝脏、动物血、红肉、扇贝、干、木耳、紫菜、菠菜、海带、黑芝麻、李子、桃、杏、苹果等。
扩展阅读
➤ 锌
锌是最普遍和最重要的微量元素,它参与细胞代谢的许多方面和近 100 种酶的催化活性。
它刺激适应性和固有免疫力,以及有助于维持呼吸上皮等组织屏障的抗病毒和抗炎特性。初步证据表明,ACE-2表达受Sirtuin 1(SIRT1)调节。由于锌能够下调SIRT1活性,这可能导致ACE-2表达降低,并减少SARS-CoV 2 进入细胞。
锌缺乏会阻碍淋巴细胞的产生、刺激和成熟,导致免疫功能下降。它还影响免疫介质,抑制 T 细胞、白细胞介素-2 合成以及抑制自然杀伤和细胞毒性 T 细胞活性。此外,它的缺失与更多的促炎介质有关,这可能会增加对疾病和炎症性疾病的易感性,尤其是那些影响肺部的疾病和炎症性疾病。
补充锌可能减轻COVID-19症状,因为这种金属抑制细胞内SARS-CoV 2复制的pH依赖性步骤,增加细胞内小泡的pH.
COVID-19典型的细胞因子过度产生(即“细胞因子风暴”),能够影响多个器官,似乎与短暂缺锌显著相关。
在2020年报告的一项研究显示,COVID-19患者的高剂量锌盐(每天<200毫克)改善了治疗后24小时的氧合并减少了发烧。尽管评估的病例数量很少,但这项工作确定了锌在SARS-CoV-2病毒控制和COVID-19并发症中可能产生的有益作用。
一项横断面对照研究报道,血清锌水平相对于疾病严重程度下降(中位数56.61μg/dL,n=200),重度COVID-19患者的降幅最大。
锌的典型每日剂量为15-30毫克锭剂,直接保护上呼吸道。补锌前检测确定锌水平至关重要。
➤ 硒
硒(Se)具有广泛的作用,如抗氧化和抗炎。硒在病毒感染中的氧化还原信号传导、氧化还原稳态和抗氧化防御中具有重要作用。
硒在保护呼吸系统,特别是抵御病毒感染方面发挥着重要作用。大量证据表明,硒缺乏与RNA病毒感染的易感性和不良结局有关。
硒与辅酶Q10联合使用可降低非特异性炎症反应和心血管疾病的死亡率。当与乙酰半胱氨酸一起服用时,硒有助于实现细胞内GSH(还原型谷胱甘肽)的正常水平,这是GPX(谷胱甘肽过氧化物酶是最强的抗氧化硒酶之一)的最佳水平的原因。GPX模拟依布硒(ebselen,一种合成硒化合物)是主要SARS-CoV-2蛋白酶的强抑制剂。
硒在正常免疫系统功能中的作用与其抗氧化特性和增加白细胞介素IL-2产生的能力有关,白细胞介介素IL-2具有免疫调节特性;例如,它根据当前需求刺激或抑制免疫反应。
适当剂量的硒对SARS-Cov-2感染患者的免疫系统的有益作用很重要,因为它调节IL-6的分泌,IL-6在疾病的病理生理学中起关键作用。硒的剂量建议为每天100至200µg。
➤ 铜
铜(Cu)是一种必需的微量元素,具有两种主要的生物学功能,第一种是酶的结构/催化辅因子,第二种是关键转录因子的辅激活因子。
铜转运基因参与巨噬细胞介导的宿主防御,其缺乏会降低IL-2和T细胞的增殖,并降低循环中性粒细胞的数量及其产生超氧阴离子的能力。在病毒感染和ROS启动氧化反应时,铜下调NF-κB表达,导致炎症细胞因子、趋化因子和粘附分子受到抑制。
一项对铜消费的荟萃分析显示,中国儿童反复呼吸道感染的发生与免疫功能、遗传因素和营养状况有关。在这项研究的结果中,锌和铜缺乏可能是儿童易患呼吸道感染的因素。

编辑
DOI:10.1007/s12011-022-03290-8
微量元素锌和铜之间存在拮抗作用和竞争吸收关系。当锌摄入量长期超标时,会导致铜缺乏,反之亦然。
自行服用锌补充剂的COVID-19患者,极有可能缺铜。作为一种必需的微量元素,铜是维持生物机制和细胞稳态所必需的;因此,有必要注意保持平衡。
关于微量元素的补充,应考虑锌与其他微量金属和维生素的相互作用。锌、铜、铁的吸收和生物利用度取决于元素之间的竞争,当以等比例给予时,铁和铜的吸收约减少40%。因此,过量补充锌可能导致铜或铁不足。
从目前的角度来看,除临床试验外,COVID-19中的维生素和微量元素补充剂不应超过一般人群和年龄组的推荐剂量。
药用植物,作为抗病毒、抗感染、抗炎、抗氧化、退热和肺肠道免疫增强剂,已被用于治疗与新冠肺炎相关的症状。
药用植物,在免疫刺激和维持平衡肠道微生物组中具有支持作用,可能是管理COVID-19的有效策略。
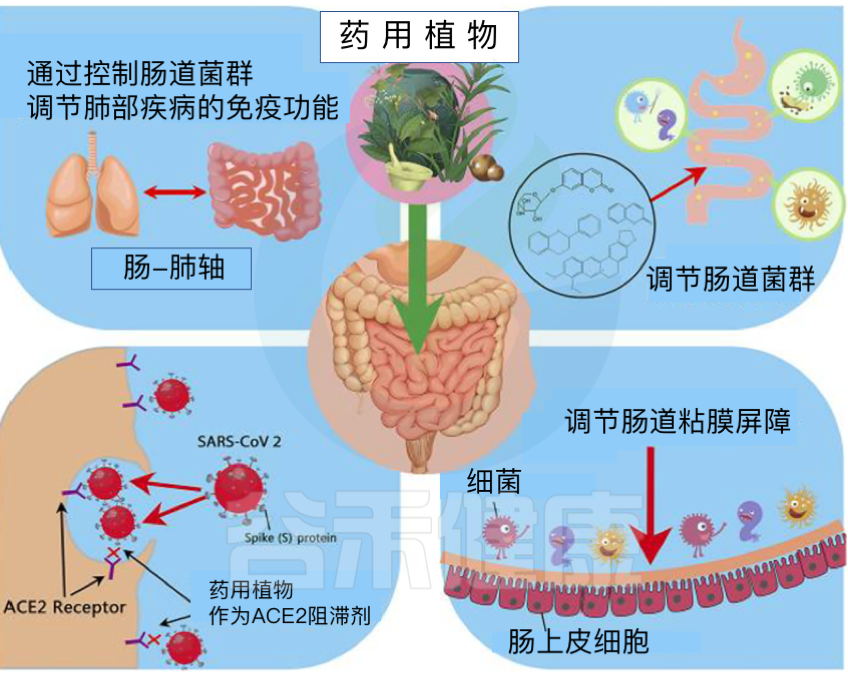
doi: 10.1186/s43088-022-00277-1.
➦ 吉 洛 伊 (Giloy,Guduchi)
由于其免疫调节特性,粉末状吉洛伊植物在前病毒期和后病毒期被彻底使用。此外,吉洛伊植物也可用作抗氧化剂,因此可以降低体内的整体氧化应激。这进一步防止了体内重要生物分子的氧化分解。
在慢性新冠肺炎感染期间,吉洛伊表现出抗炎作用,这在冠状病毒诱导的肺炎和肺部炎症中有很大的作用。血液中的氧饱和度低于正常范围,导致缺氧、疲劳,甚至死亡。
临床试验评估其对新冠肺炎确诊的无症状至轻度症状患者的疗效。91名年龄在18岁至75岁之间的患者,其中11.7%的对照组在平均1.8天后出现轻微症状,试验组没有任何其他症状。研究人员从研究中建议,Guduchi Ghan Vati可以作为无症状新冠肺炎患者的预防和治疗药物(NCT04480398)。
➦ 甘 草 (Mulethi)
由豆科甘草的根和细根组成,其活性化学成分是甘草酸。甘草是一种阿育吠陀药,以其外围和中枢作用的抗咳特性而闻名。
研究表明,甘草酸苷具有止咳作用,可以抑制咳嗽和相关的呼吸短促;也就是新冠肺炎感染的主要症状。它已被证明可以阻止被SARS感染的细胞释放HMGB1核蛋白(高运动性基盒蛋白1)。这使巨噬细胞失效,巨噬细胞在激活免疫中发挥积极作用,并负责产生促炎细胞因子。因此,避免了“细胞因子风暴”的开始及其对健康的不利影响。
在伊朗进行了一项单中心、开放标签、随机、平行组临床试验,以评估甘草对60名年龄≥18岁(体重≥35 kg)的新冠肺炎患者的抗炎作用(IRCT20200506047323N2)。
➦ 茯 苓 (Poria cocos)
其活性成分为茯苓酸。蛋白酶负责生物在宿主细胞中的复制。在冠状病毒中发现的一种蛋白酶是Mpro酶。Mpro是SARS-CoV-2的关键酶,参与介导病毒复制和转录。茯苓的主要活性成分茯苓酸与Mpro酶结合并抑制,从而阻止生物体在宿主细胞中的进一步复制和生长。
在COVID-19重症病例中,很少患者可能出现肺炎并发症,65岁或以上人群的并发症甚至更高。在这种情况下,茯苓酸的抗炎特性可以被解释为提供缓解。在一项研究中,用茯苓酸治疗肺炎大鼠肺部,结果显示通过NF-κB通路抑制炎症因子的表达。
➦ 蒙古紫云英(Mongolian milkvetch)
它由豆科黄芪的根、茎和叶组成。活性植物化学物质为黄芪甲苷、熊竹素和毛蕊异黄酮。黄芪甲苷是黄芪根、茎和叶中发现的多糖,可调节促炎因子如细胞因子、TNFα、IL-1β和NFATc4的表达,从而发挥免疫调节作用。它已被发现有助于避免细胞因子风暴的状况。
熊竹素在一定程度上也能成功抑制Mpro酶。作为一种免疫调节剂,在COVID-19的情况下,作为一种预防措施,可以使用蒙古紫云英来增强免疫力。
研究人员对小鼠血浆进行了代谢组学研究。结果表明,蒙古紫云英与人参同时食用可提高大鼠的脾、胸腺指数、脾淋巴细胞增殖和NK细胞毒活性。
➦ 其 他
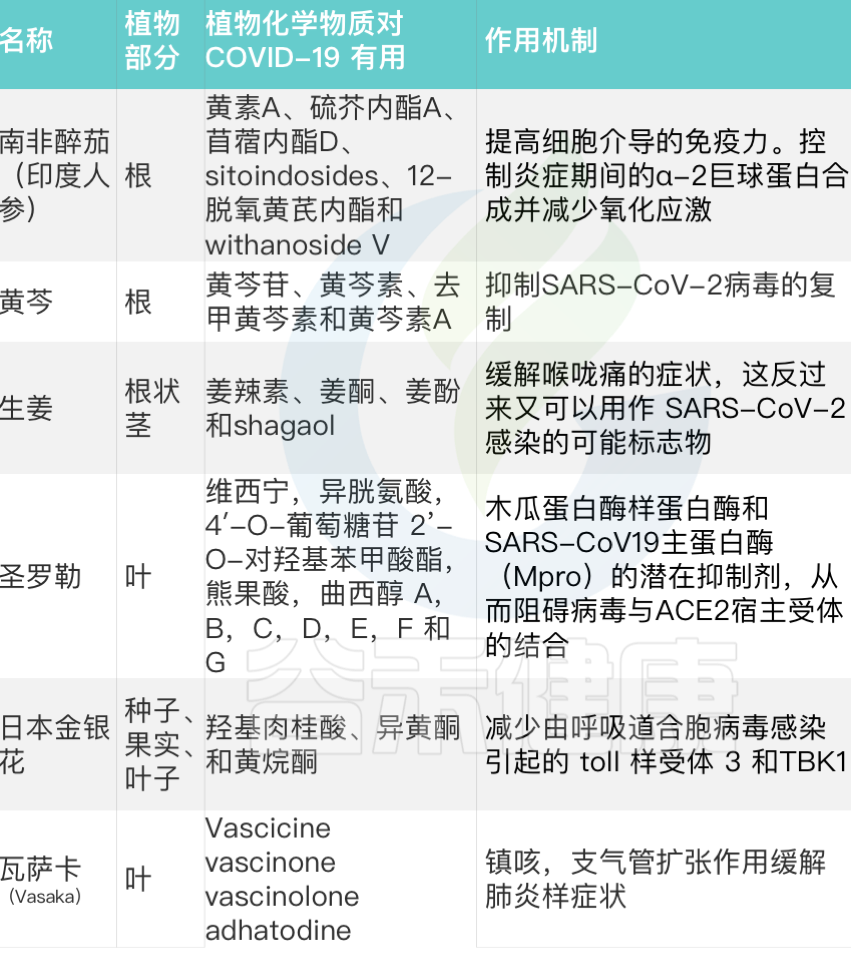
doi: 10.1016/j.ccmp.2022.100021.
改变的肠道微生物群或菌群失调可以作为全身炎症活动的调节剂,并可以通过多个肠道器官轴影响不同的器官。肠道通透性增加或者说肠漏,使细菌代谢物和毒素进入循环系统,并进一步恶化全身炎症反应,导致不同的新冠肺炎并发症。
肠道微生物群不仅显着影响COVID-19的发展和疾病的严重程度,而且还反映了COVID-19患者对长期并发症的易感性。
初步临床研究揭示了益生菌对 SARS-CoV-2 感染及恢复期的潜在调节作用。鉴于针对COVID-19的特定药物仍然是个谜,疫苗是有效的预防和控制策略;然而,病毒的持续突变加剧了这一难题。因此,通过益生菌、益生元、膳食补充剂、药用植物、FMT等多种方式,进行肠道菌群干预,是未来治疗COVID-19的有前途的补充策略。
尽管大规模临床试验有限,但相信这个领域正在发展,并蕴藏着巨大的机遇,一个个新诞生的研究可以在疫情的不同浪潮中推动微生物群的发现走向临床应用。
在此,也向一直奋斗在前线的医务工作者、在该领域辛勤耕耘的科研人员、其他相关工作者致敬。
对于个人而言,通过多种方式增强体质提高自身免疫力,是抵抗病毒侵袭的最好选择。
在新开启的2023里,希望大家都能找到属于自己的健康生活。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li M, Peng H, Duan G, Wang J, Yu Z, Zhang Z, Wu L, Du M, Zhou S. Older age and depressive state are risk factors for re-positivity with SARS-CoV-2 Omicron variant. Front Public Health. 2022 Oct 4;10:1014470. doi: 10.3389/fpubh.2022.1014470. PMID: 36268004; PMCID: PMC9576942.
Sacco C, Petrone D, Del Manso M, Mateo-Urdiales A, Fabiani M, Bressi M, Bella A, Pezzotti P, Rota MC, Riccardo F; Italian Integrated Surveillance of COVID-19 study group. Risk and protective factors for SARS-CoV-2 reinfections, surveillance data, Italy, August 2021 to March 2022. Euro Surveill. 2022 May;27(20):2200372. doi: 10.2807/1560-7917.ES.2022.27.20.2200372. PMID: 35593164; PMCID: PMC9121659.
Deng L, Li P, Zhang X, Jiang Q, Turner D, Zhou C, Gao Y, Qian F, Zhang C, Lu H, Zou H, Vermund SH, Qian HZ. Risk of SARS-CoV-2 reinfection: a systematic review and meta-analysis. Sci Rep. 2022 Dec 1;12(1):20763. doi: 10.1038/s41598-022-24220-7. PMID: 36456577; PMCID: PMC9714387.
Hansen CH, Friis NU, Bager P, Stegger M, Fonager J, Fomsgaard A, Gram MA, Christiansen LE, Ethelberg S, Legarth R, Krause TG, Ullum H, Valentiner-Branth P. Risk of reinfection, vaccine protection, and severity of infection with the BA.5 omicron subvariant: a nation-wide population-based study in Denmark. Lancet Infect Dis. 2022 Oct 18:S1473-3099(22)00595-3. doi: 10.1016/S1473-3099(22)00595-3. Epub ahead of print. PMID: 36270311; PMCID: PMC9578720.
Guedes AR, Oliveira MS, Tavares BM, Luna-Muschi A, Lazari CDS, Montal AC, de Faria E, Maia FL, Barboza ADS, Leme MD, Tomazini FM, Costa SF, Levin AS. Reinfection rate in a cohort of healthcare workers over 2 years of the COVID-19 pandemic. Sci Rep. 2023 Jan 13;13(1):712. doi: 10.1038/s41598-022-25908-6. PMID: 36639411; PMCID: PMC9837751.
Holmer HK, Mackey K, Fiordalisi CV, Helfand M. Major Update 2: Antibody Response and Risk for Reinfection After SARS-CoV-2 Infection-Final Update of a Living, Rapid Review. Ann Intern Med. 2023 Jan;176(1):85-91. doi: 10.7326/M22-1745. Epub 2022 Nov 29. PMID: 36442059; PMCID: PMC9707440.
Bowe B, Xie Y, Al-Aly Z. Acute and postacute sequelae associated with SARS-CoV-2 reinfection. Nat Med. 2022 Nov;28(11):2398-2405. doi: 10.1038/s41591-022-02051-3. Epub 2022 Nov 10. PMID: 36357676; PMCID: PMC9671810.
Davis HE, McCorkell L, Vogel JM, Topol EJ. Long COVID: major findings, mechanisms and recommendations. Nat Rev Microbiol. 2023 Jan 13:1–14. doi: 10.1038/s41579-022-00846-2. Epub ahead of print. PMID: 36639608; PMCID: PMC9839201.
O’ Mahony L, Buwalda T, Blair M, Forde B, Lunjani N, Ambikan A, Neogi U, Barrett P, Geary E, O’Connor N, Dineen J, Clarke G, Kelleher E, Horgan M, Jackson A, Sadlier C. Impact of Long COVID on health and quality of life. HRB Open Res. 2022 Apr 22;5:31. doi: 10.12688/hrbopenres.13516.1. PMID: 36101871; PMCID: PMC9440374.
Zhang F, Lau RI, Liu Q, Su Q, Chan FKL, Ng SC. Gut microbiota in COVID-19: key microbial changes, potential mechanisms and clinical applications. Nat Rev Gastroenterol Hepatol. 2022 Oct 21:1–15. doi: 10.1038/s41575-022-00698-4. Epub ahead of print. Erratum in: Nat Rev Gastroenterol Hepatol. 2023 Jan 12;: PMID: 36271144; PMCID: PMC9589856.
Sun K, Tempia S, Kleynhans J, von Gottberg A, McMorrow ML, Wolter N, Bhiman JN, Moyes J, Carrim M, Martinson NA, Kahn K, Lebina L, du Toit JD, Mkhencele T, Viboud C, Cohen C; PHIRST-C group. Rapidly shifting immunologic landscape and severity of SARS-CoV-2 in the Omicron era in South Africa. Nat Commun. 2023 Jan 16;14(1):246. doi: 10.1038/s41467-022-35652-0. PMID: 36646700; PMCID: PMC9842214.
Wang B, Zhang L, Wang Y, Dai T, Qin Z, Zhou F, Zhang L. Alterations in microbiota of patients with COVID-19: potential mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2022 Apr 29;7(1):143. doi: 10.1038/s41392-022-00986-0. PMID: 35487886; PMCID: PMC9052735.
Vaezi M, Ravanshad S, Rad MA, Zarrinfar H, Kabiri M. The effect of synbiotic adjunct therapy on clinical and paraclinical outcomes in hospitalized COVID-19 patients: A randomized placebo-controlled trial. J Med Virol. 2023 Jan 5. doi: 10.1002/jmv.28463. Epub ahead of print. PMID: 36602047.
Chutipongtanate S, Morrow AL, Newburg DS. Human Milk Oligosaccharides: Potential Applications in COVID-19. Biomedicines. 2022 Feb 1;10(2):346. doi: 10.3390/biomedicines10020346. PMID: 35203555; PMCID: PMC8961778.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Gang J, Wang H, Xue X, Zhang S. Microbiota and COVID-19: Long-term and complex influencing factors. Front Microbiol. 2022 Aug 12;13:963488. doi: 10.3389/fmicb.2022.963488. PMID: 36033885; PMCID: PMC9417543.
Xu L, Ho CT, Liu Y, Wu Z, Zhang X. Potential Application of Tea Polyphenols to the Prevention of COVID-19 Infection: Based on the Gut-Lung Axis. Front Nutr. 2022 Apr 14;9:899842. doi: 10.3389/fnut.2022.899842. PMID: 35495940; PMCID: PMC9046984.
Xu L, Yang CS, Liu Y, Zhang X. Effective Regulation of Gut Microbiota With Probiotics and Prebiotics May Prevent or Alleviate COVID-19 Through the Gut-Lung Axis. Front Pharmacol. 2022 Apr 25;13:895193. doi: 10.3389/fphar.2022.895193. PMID: 35548347; PMCID: PMC9081431.
Rahmati M, Fatemi R, Yon DK, Lee SW, Koyanagi A, Il Shin J, Smith L. The effect of adherence to high-quality dietary pattern on COVID-19 outcomes: A systematic review and meta-analysis. J Med Virol. 2023 Jan;95(1):e28298. doi: 10.1002/jmv.28298. Epub 2022 Nov 18. PMID: 36367218.
Pandey M, Bhati A, Priya K, Sharma KK, Singhal B. Precision Postbiotics and Mental Health: the Management of Post-COVID-19 Complications. Probiotics Antimicrob Proteins. 2022 Jun;14(3):426-448. doi: 10.1007/s12602-021-09875-4. Epub 2021 Nov 22. PMID: 34806151; PMCID: PMC8606251.
Horne BD, Bunker T. Pathogenic Mechanisms of the Severe Acute Respiratory Syndrome Coronavirus 2 and Potential Direct and Indirect Counteractions by Intermittent Fasting. Nutrients. 2022 Dec 21;15(1):20. doi: 10.3390/nu15010020. PMID: 36615679; PMCID: PMC9823718.
Hou YC, Su WL, Chao YC. COVID-19 Illness Severity in the Elderly in Relation to Vegetarian and Non-vegetarian Diets: A Single-Center Experience. Front Nutr. 2022 Apr 29;9:837458. doi: 10.3389/fnut.2022.837458. PMID: 35571931; PMCID: PMC9101048.
Karupaiah T, Lu KC. Editorial: Nutraceuticals for the recovery of COVID-19 patients. Front Nutr. 2022 Nov 14;9:1054632. doi: 10.3389/fnut.2022.1054632. PMID: 36451742; PMCID: PMC9703639.
Itsiopoulos C, Mayr HL, Thomas CJ. The anti-inflammatory effects of a Mediterranean diet: a review. Curr Opin Clin Nutr Metab Care. 2022 Nov 1;25(6):415-422. doi: 10.1097/MCO.0000000000000872. Epub 2022 Aug 30. PMID: 36039924.
Yue Y, Ma W, Accorsi EK, Ding M, Hu F, Willett WC, Chan AT, Sun Q, Rich-Edwards J, Smith-Warner SA, Bhupathiraju SN. Long-term diet and risk of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) infection and Coronavirus Disease 2019 (COVID-19) severity. Am J Clin Nutr. 2022 Dec 19;116(6):1672-1681. doi: 10.1093/ajcn/nqac219. PMID: 35945354; PMCID: PMC9384672.
Zargarzadeh N, Tadbir Vajargah K, Ebrahimzadeh A, Mousavi SM, Khodaveisi H, Akhgarjand C, Toyos FMP, Cerqueira HS, Santos HO, Taghizadeh M, Milajerdi A. Higher Adherence to the Mediterranean Dietary Pattern Is Inversely Associated With Severity of COVID-19 and Related Symptoms: A Cross-Sectional Study. Front Med (Lausanne). 2022 Jul 19;9:911273. doi: 10.3389/fmed.2022.911273. PMID: 35928288; PMCID: PMC9343686.
Xu J, Ren Z, Cao K, Li X, Yang J, Luo X, Zhu L, Wang X, Ding L, Liang J, Jin D, Yuan T, Li L, Xu J. Boosting Vaccine-Elicited Respiratory Mucosal and Systemic COVID-19 Immunity in Mice With the Oral Lactobacillus plantarum. Front Nutr. 2021 Dec 22;8:789242. doi: 10.3389/fnut.2021.789242. PMID: 35004816; PMCID: PMC8733898.
Gualtieri P, Marchetti M, Frank G, Cianci R, Bigioni G, Colica C, Soldati L, Moia A, De Lorenzo A, Di Renzo L. Exploring the Sustainable Benefits of Adherence to the Mediterranean Diet during the COVID-19 Pandemic in Italy. Nutrients. 2022 Dec 26;15(1):110. doi: 10.3390/nu15010110. PMID: 36615768; PMCID: PMC9824251.
Ferro Y, Pujia R, Maurotti S, Boragina G, Mirarchi A, Gnagnarella P, Mazza E. Mediterranean Diet a Potential Strategy against SARS-CoV-2 Infection: A Narrative Review. Medicina (Kaunas). 2021 Dec 20;57(12):1389. doi: 10.3390/medicina57121389. PMID: 34946334; PMCID: PMC8704657.
Chavda VP, Patel AB, Vihol D, Vaghasiya DD, Ahmed KMSB, Trivedi KU, Dave DJ. Herbal Remedies, Nutraceuticals, and Dietary Supplements for COVID-19 Management: An Update. Clin Complement Med Pharmacol. 2022 Mar;2(1):100021. doi: 10.1016/j.ccmp.2022.100021. Epub 2022 Feb 5. PMID: 36620357; PMCID: PMC8816850.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Renata RN, Arely GA, Gabriela LA, Esther MM. Immunomodulatory Role of Microelements in COVID-19 Outcome: a Relationship with Nutritional Status. Biol Trace Elem Res. 2022 Jun 6:1–19. doi: 10.1007/s12011-022-03290-8. Epub ahead of print. PMID: 35668151; PMCID: PMC9170122.
Li Y, Luo W, Liang B. Circulating trace elements status in COVID-19 disease: A meta-analysis. Front Nutr. 2022 Aug 12;9:982032. doi: 10.3389/fnut.2022.982032. PMID: 36034929; PMCID: PMC9411985.
Bego T, Meseldžić N, Prnjavorac B, Prnjavorac L, Marjanović D, Azevedo R, Pinto E, Duro M, Couto C, Almeida A. Association of trace element status in COVID-19 patients with disease severity. J Trace Elem Med Biol. 2022 Dec;74:127055. doi: 10.1016/j.jtemb.2022.127055. Epub 2022 Aug 4. PMID: 35985069; PMCID: PMC9349050.
Milton-Laskibar I, Trepiana J, Macarulla MT, Gómez-Zorita S, Arellano-García L, Fernández-Quintela A, Portillo MP. Potential usefulness of Mediterranean diet polyphenols against COVID-19-induced inflammation: a review of the current knowledge. J Physiol Biochem. 2022 Nov 8:1–12. doi: 10.1007/s13105-022-00926-0. Epub ahead of print. PMID: 36346507; PMCID: PMC9641689.
Sun Y, Ju P, Xue T, et al., Alteration of faecal microbiota balance related to long-term deep meditation. General Psychiatry 2023;36:e100893. doi: 10.1136/gpsych-2022-100893
Callaway E. What Omicron’s BA.4 and BA.5 variants mean for the pandemic. Nature. 2022 Jun;606(7916):848-849. doi: 10.1038/d41586-022-01730-y. PMID: 35750920.
Wang K, Gheblawi M, Oudit GY. Angiotensin Converting Enzyme 2: A Double-Edged Sword. Circulation. 2020 Aug 4;142(5):426-428. doi: 10.1161/CIRCULATIONAHA.120.047049. Epub 2020 Mar 26. PMID: 32213097.
Sapra L, Saini C, Garg B, Gupta R, Verma B, Mishra PK, Srivastava RK. Long-term implications of COVID-19 on bone health: pathophysiology and therapeutics. Inflamm Res. 2022 Sep;71(9):1025-1040. doi: 10.1007/s00011-022-01616-9. Epub 2022 Jul 28. PMID: 35900380; PMCID: PMC9330992.
Alenazy MF, Aljohar HI, Alruwaili AR, Daghestani MH, Alonazi MA, Labban RS, El-Ansary AK, Balto HA. Gut Microbiota Dynamics in Relation to Long-COVID-19 Syndrome: Role of Probiotics to Combat Psychiatric Complications. Metabolites. 2022 Sep 27;12(10):912. doi: 10.3390/metabo12100912. PMID: 36295814; PMCID: PMC9611210.
Shi Y, Li Z, Yang C, Liu C. The role of gut-brain axis in SARA-CoV-2 neuroinvasion: Culprit or innocent bystander? Brain Behav Immun. 2021 May;94:476-477. doi: 10.1016/j.bbi.2021.01.024. Epub 2021 Feb 15. PMID: 33600935; PMCID: PMC7883713.
De R, Dutta S. Role of the Microbiome in the Pathogenesis of COVID-19. Front Cell Infect Microbiol. 2022 Mar 31;12:736397. doi: 10.3389/fcimb.2022.736397. PMID: 35433495; PMCID: PMC9009446.
谷禾健康
迄今为止最全面的全球抗菌素耐药性 (AMR) 研究发现,由耐药菌引起的感染是所有年龄段人群死亡的主要原因之一。
22年发表在《柳叶刀》杂志上的分析估计,2019 年有 495 万人死于细菌性 AMR 发挥作用的疾病。其中,127 万人死亡是 AMR 的直接结果——这意味着耐药性感染导致的死亡人数超过了艾滋病毒/艾滋病(864,000 人死亡)或疟疾(643,000 人死亡)。
细菌性 AMR 感染最常见的三个部位是胸部、血液和腹部——身体这些部位的感染占直接归因于 AMR 死亡的 78.8%。六种最致命的细菌病原体导致了将近四分之三的所有因耐药性导致的死亡。2019 年,仅耐抗生素大肠杆菌就导致约 20 万人死亡。
“AMR 确实是一个全球性问题,需要决策者和全球卫生界采取紧急行动,以避免可预防的死亡,”
对抗生素有耐药性的细菌比例正在上升。在一个抗生素使用变得如此普遍的世界里,耐药细菌比那些被药物杀死的细菌更胜一筹。
伤口敷料的微观纤维上的金黄色葡萄球菌
图片来源: Science Photo Library
预计到 2050 年,每年可能有多达 1000 万人死于抗菌素耐药性。如果任其发展,以前可以用几天抗生素治愈的感染可能变得无法治愈。
如果细菌感染无法控制会导致严重的健康问题,比如梅毒会引起失明和神经损伤。女性感染衣原体会导致不孕。梅毒可以传染给未出生的孩子,导致出生时患有这种疾病的婴儿流产、死产或大脑和器官受损。
淋病细菌(如图)对某些抗生素产生了耐药性
图片来源: SPL
数据显示,低收入国家的 AMR 相关死亡率最高。在 21 个 GBD 地理区域中,西撒哈拉以南非洲直接归因于 AMR 的死亡率最高,每 10 万人中有 27.3 人死亡。大洋洲最低,每 10 万人中有 6.5 人死亡。
低收入地区的耐药率和耐药菌感染数量均高于富裕国家。造成这种情况的原因包括环境卫生和卫生条件差、用于治疗的检测设施不足以及无法获得最新的抗生素和疫苗。
但是注意,许多低收入和中等收入国家的抗微生物药物耐药性数据很少,这表示实际的AMR比调查的数据更严重,这凸显了在这些地区大幅扩大实验室能力的必要性。
抗生素药物旨在消灭细菌,但它们不一定会杀死所有的细菌,它们只是将细菌减少到安全水平。但是不幸的是,这个过程选择留下了最强壮的细菌个体,然后可以通过基因传递产生耐药性。几十年后,就会有这么多种细菌进化出对一系列抗生素的抗性。
对抗生素产生耐药性的致病细菌的出现,往往归因于人类和牲畜过度和不合理使用抗生素。虽然这是问题背后的主要机制,但这不是唯一的因素。昆士兰大学的研究人员希望测试其他药物,即使是那些没有抗生素特性的药物,是否可以在超级细菌的出现中发挥作用。
最近昆士兰大学的研究人员已经将注意力集中在另一个潜在的抵抗力驱动因素上:抗抑郁药。通过研究在实验室中生长的细菌,已追踪到抗抑郁药如何引发耐药性。
“即使接触几天后,细菌也会产生耐药性,不仅针对一种抗生素,还针对多种抗生素”,布里斯班昆士兰大学澳大利亚水与环境生物技术中心的资深作者郭建华(英译)说。
早期线索
2014 年,郭开始对非抗生素药物对抗生素耐药性的可能贡献产生兴趣,因为他的实验室发现生活废水样本中循环的抗生素耐药基因比抗生素使用率更高的医院废水样本中循环的抗生素耐药基因更多。
郭的团队和其他团队还观察到,抗抑郁药——世界上使用最广泛的药物之一——可以杀死或阻碍某些细菌的生长。郭解释说,它们会引发“SOS 反应”,从而触发细胞防御机制,使细菌能够更好地在随后的抗生素治疗中存活下来。
在 2018 年的一篇论文中,该小组报告说,大肠杆菌在接触氟西汀后就对多种抗生素产生了耐药性,氟西汀通常以百忧解的形式出售。最新研究检查了6种此类药物中的5种其他抗抑郁药和13种抗生素,并调查了大肠杆菌的耐药性是如何产生的。
备注:百优解(盐酸氟西汀胶囊)是一种选择性血清素(5-羟色胺,5-HT)再吸收抑制剂(SSRI)型的抗忧郁药,其药物形态为盐酸氟西汀(Fluoxetinehydrochloride),商品名为“百优解”或“百忧解”(Prozac)。在临床上用于成人忧郁症、强迫症等。
在氧气充足的实验室条件下生长的细菌中,抗抑郁药会导致细胞产生活性氧:一种激活微生物防御机制的有毒分子。最重要的是,这激活了细菌的外排泵系统,这是许多细菌用来消除各种分子(包括抗生素)的通用排出系统。这可能解释了细菌如何在没有特定抗性基因的情况下抵抗抗生素。
在抗抑郁药存在的情况下,革兰氏阴性细菌大肠杆菌可以抵御抗生素
图片来源:Steve Gschmeissner/Science Photo Library
但是大肠杆菌暴露于抗抑郁药也导致微生物突变率增加,以及随后选择各种抗性基因。然而,在厌氧条件下生长的细菌中,活性氧水平要低得多,抗生素耐药性的发展要慢得多。
此外,至少一种抗抑郁药舍曲林(舍曲林是5-羟色氨再摄取抑制剂,是一种新型的抗抑郁剂,具有较强抗抑郁,抗焦虑作用,既可用于抑郁症,焦虑症、双相障碍的抑郁相,强迫障碍的治疗)促进了细菌细胞之间的基因转移,这一过程可以加速耐药性在人群中的传播。这种转移可以发生在不同类型的细菌之间,从而使耐药性在物种之间转移——包括从无害细菌到致病细菌。
越来越多的认可
英国剑桥大学研究微生物组-化学相互作用的 Kiran Patil 说,在过去五年中,人们越来越认识到许多针对人体细胞的非抗生素药物也会影响细菌并导致抗生素耐药性。
德国图宾根大学的 Lisa Maier 指出,研究药物与微生物组之间的相互作用,要了解抗抑郁药如何驱动抗生素耐药性,研究人员需要确定药物针对细菌中的哪些分子并评估药物对更广泛的临床相关细菌种类的影响。
2018 年,Maier 和她的同事调查了 835 种不针对微生物的药物,发现 24% 的药物抑制了至少一种人类肠道细菌菌株的生长。
Patil 和 Maier 表示,重要的是要收集证据来评估抗抑郁药在现实世界中对耐药性的影响,例如抗抑郁药是否正在推动抗生素耐药细菌的积累,尤其是致病细菌在人、动物或环境中的积累。
尽管在废水中发现了大量的抗抑郁药,但报告的水平往往低于郭的小组在大肠杆菌中看到显着效果的浓度。不过,预计在服用这些药物的人的大肠中会达到在这项研究中具有强烈作用的一些抗抑郁药的浓度。
后续研究
Maier 说,现在有几项研究将抗抑郁药和其他非抗生素药物与细菌的变化联系起来,并且初步研究已经给出了关于这些药物如何影响服用它们的人的微生物组的“初步提示”。
但在健康人类中,大肠杆菌主要存在于大肠中,那里的条件是厌氧的,这意味着论文中描述的过程可能不会以相同的速度发生在人身上,Maier 说,未来的研究应该使用细菌生长条件来模拟抗抑郁药可能起作用的部位。
郭说他的实验室现在正在研究给予抗抑郁药的小鼠的微生物组。早期未发表的数据表明,这些药物可以改变动物的肠道微生物群并促进基因转移。
但是郭和相关研究人员告诫人们不要根据这项研究停止服用抗抑郁药。“如果您患有抑郁症,则需要以最好的方式进行治疗,其次是关注肠道细菌”。
但是研究人员和制药公司需要量化非抗生素药物对抗生素耐药性的贡献。非抗生素药物是我们不应忽视的一个大问题。
寻找新抗生素的需求迫在眉睫,但许多科学家和政策制定者正在从其他角度解决抗菌素耐药性问题。《Nature》期刊详细地介绍了三种方法。
➤ 等离子清洗
富含化学不稳定形式的氧和氮(也称为自由基和活性物质)的等离子活化水被认为是潜在的新型消毒剂。“如果细菌被自由基淹没,它们最终就会死亡,” 澳大利亚阿德莱德大学的生物医学研究员 Katharina Richter 说。
Richter 和她的同事正在研究与未经治疗的伤口相比,血浆活化水清除感染耐甲氧西林金黄色葡萄球菌(MRSA) 的伤口的速度有多快。他们还将这项技术与通过静脉滴注施用抗生素进行比较。
她说,尚未公布的初步结果还不错。“治疗改善了伤口并比没有治疗更快地清除了感染,” 她说,“它不如抗生素治疗有效,但 Richter 说实验设计可能是罪魁祸首。将其与局部给予的抗生素进行比较会更公平。我们的下一项研究将有更好的控制。”
➤ 金属奇迹
细菌虽然在自然界中是单细胞,但确实聚集在一起并互相帮助以逃避药物和防腐剂。他们这样做的一种方法是形成生物膜——生活在它们自己制造的粘液环境中的细菌群。
生物膜保护居住在其中的单个细胞;据认为,大约 80% 的慢性人类感染是由生物膜引起的。金属元素镓会干扰细菌对铁的吸收,最终导致微生物缺乏营养。
正因为如此,含镓药物是一种正在探索的破坏生物膜的途径。英国曼彻斯特大学的科学家发现,镓化合物可以减少多达 87% 的细菌生长(JM Baker et al. Life Sci . 305 , 120794; 2022)。
这项工作建立在中国上海交通大学研究人员的研究结果之上,该研究表明镓可以有效溶解 MRSA 生物膜的结构,使细菌可以用常用抗生素剂量的十分之一杀死(W. Xia et al., ACS Infect. 2021, 2565–2582)。现在的研究重点是如何最好地输送镓以及输送多少剂量。
➤ 分子签证
抗生素应具有三个关键特性:溶解性,易于与细菌结合的能力,以及穿透细胞膜的能力。这使得设计一种新的抗生素成为一项艰巨的任务。
因此,一些研究人员并没有创造全新的抗生素,而是通过“大型数字图书馆”进行筛选,以预测哪些现有化合物可能已经具备所需的条件。
新加坡生物技术初创公司 BIOptimize 的计算化学家 Javad Deylami 说:“已经有既定的方法可以在几分钟内评估前两个特性,但渗透是这个难题中缺失的一块。”
Deylami 说,这意味着科学家们经常评估理论上可以很好地杀死细菌的化合物,但在进入细菌内部的第一个障碍上却达不到要求。“这就像他们到达边境但没有签证可以通过。”
Deylami 构建了一个细菌外细胞膜的计算机化版本,在上面进行模拟,测试分子穿透细胞膜的能力。他的模型确定了影响潜在药物通过或失败的力,从而使 Deylami 能够计算化合物的渗透性。
通过该程序运行已知的分子结构,Deylami 的团队能够在人工智能的帮助下了解化合物需要哪些“品质”来提高其渗透性。这些知识应该可以帮助他们在“庞大的图书馆”中寻找具有这些特性的现有药物。
主要参考文献
Wang, Y. et al. Proc. Natl Acad. Sci. USA 120, e2208344120 (2023).
Drew L. How antidepressants help bacteria resist antibiotics. Nature. 2023 Jan 24. doi: 10.1038/d41586-023-00186-y. Epub ahead of print. PMID: 36693968.
Antimicrobial Resistance Collaborators Lancet 399, 629–655 (2022).
Jin, M. et al. Environ. Int. 120, 421–430 (2018).
Maier, L. et al. Nature 555, 623–628 (2018).

谷禾健康

与人类密切相关的微生物
我们的世界大到浩瀚宇宙,小到微观下的生物分子。我们总说漫天繁星,其实身边微生物数量可能更多。动物、植物、真菌、细菌、病毒等,共同构成了丰富多彩的生命世界。
细菌、真菌、病毒是其中的三个大类,虽然它们都体型微小,但是相互之间可以说是天差地别。并且它们与我们的生活以及健康息息相关,有对人体有益的益生菌,也有对人体危害极大的病毒。

谷禾在本文中介绍了细菌、真菌、病毒的一些特征,它们的分类及繁殖方式,以及有致病性的微生物和感染后的一些症状与免疫过程。
在最后,针对一些病原体的感染。我们提出了一些预防的方法,以及目前技术条件下的治疗手段。微生物检测技术能够帮助人们更好地了解就在我们体内或身边的微生物,有助于塑造更健康的身体及生活。
本文主要从以下几个方面讲述
●什么是细菌、真菌、病毒?
●细菌、真菌、病毒的分类与繁殖方式
●细菌、真菌、病毒的致病性与感染症状
●细菌、真菌、病毒在体内的免疫反应
●病原体感染的预防及治疗方法
细菌
细菌(Bacteria)是生物的主要类群之一,属于细菌域。广义的细菌即为原核生物, 是指一大类细胞核无核膜包裹,只存在拟核区(或拟核)的裸露DNA的原始单细胞生物,包括真细菌(eubacteria)和古细菌(archaea)两大类群。
注:其中除少数属古细菌外,多数的原核生物都是真细菌。
✦结构简单、个体小
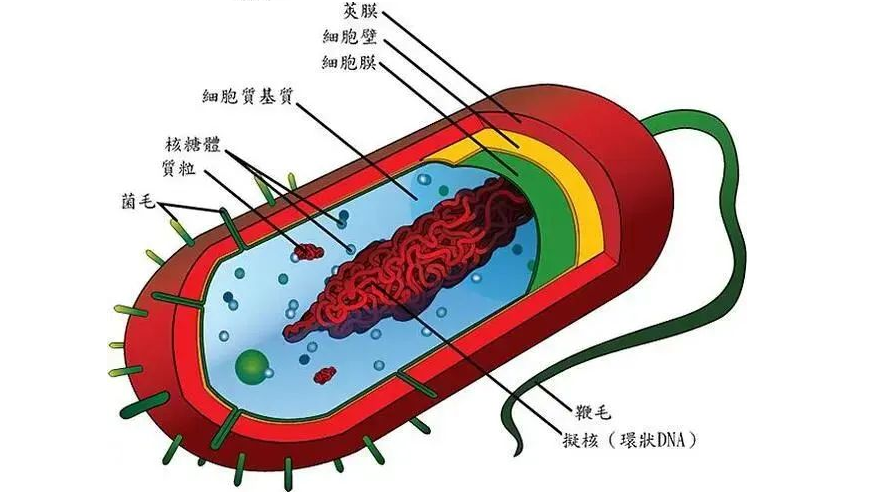
图片来源:百度
细菌为原核微生物的一类,是一类形状细短,结构简单,多以二分裂方式进行繁殖的原核生物。细菌一般是单细胞,主要由细胞壁、细胞膜、细胞质、核质体等部分构成,有的细菌还有荚膜、鞭毛、菌毛等特殊结构, 缺乏细胞核、细胞骨架以及膜状胞器,例如粒线体和叶绿体。
细菌的个体非常小,绝大多数细菌的直径大小在0.5~5μm之间。目前已知最小的细菌只有0.2微米长,因此大多情况只能在显微镜下看到它们。但处于有利环境中时,细菌可以形成肉眼可见的集合体,例如菌簇。
✦数量众多、分布广泛
细菌是所有生物中数量最多的一类,据估计,其总数约有5×10的三十次方个。
细菌广泛分布于土壤和水中,或者与其他生物共生。人体是大量细菌的栖息地;可以在皮肤表面、肠道、口腔、鼻子和其他身体部位找到。据估计,人体内及表皮上的细菌细胞总数约是人体细胞总数的十倍。
此外,也有部分种类分布在极端的环境中,例如温泉,甚至是放射性废弃物中,它们被归类为嗜极生物,其中最著名的种类之一是海栖热袍菌(Thermotoga maritima),科学家是在意大利的一座海底火山中发现这种细菌的。
★ 常见的细菌
大肠埃希氏菌(Escherichia coli)
大肠杆菌是短杆菌,两端呈钝圆形,属革兰氏阴性菌,于1885年首次被发现。
图片来源:百度百科
大肠杆菌是条件致病菌,在一定条件下可以引起多种疾病,如腹泻,肠炎,尿路感染,呼吸道感染、菌血症和其他临床感染(如新生儿脑膜炎)。
金黄色葡萄球菌(Staphylococcus aureus)
金黄色葡萄球菌也称“金葡菌”,隶属于葡萄球菌属,是革兰氏阳性菌代表,为一种常见的食源性致病微生物。
图片来源:百度
该菌最适宜生长温度为37℃,pH为7.4,耐高盐,可在盐浓度接近10%的环境中生长。金黄色葡萄球菌常寄生于人和动物的皮肤、鼻腔、咽喉、肠胃、痈、化脓疮口中,空气、污水等环境中也无处不在。
金黄色葡萄球菌是最臭名昭著、分布最广的细菌病原体之一。这种病原体可引起多种疾病,从中度严重的皮肤感染到致命的肺炎和败血症。
每年在全球范围内造成难以估计数量的无并发症皮肤感染,并可能导致数十万至数百万更严重的侵入性感染。
双歧杆菌属(Bifidobacterium)
双歧杆菌是一种革兰氏阳性、不运动、细胞呈杆状、一端有时呈分叉状、严格厌氧的细菌属,广泛存在于人和动物的消化道、阴道和口腔等生境中。双歧杆菌属的细菌是人和动物肠道菌群的重要组成成员之一。
双歧杆菌是一种重要的肠道有益微生物。双歧杆菌作为一种生理性有益菌,对人体健康具有生物屏障、营养作用、抗肿瘤作用、免疫增强作用、改善胃肠道功能、抗衰老等多种重要的生理功能。
★ 细菌对人类有利有弊
细菌也对人类活动有很大的影响。一方面,细菌是许多疾病的病原体,可以通过各种方式,如接触、消化道、呼吸道、昆虫叮咬等在正常人体间传播疾病,具有较强的传染性,对社会危害极大。
另一方面,人类也时常利用细菌,例如乳酪及酸奶和酒酿的制作、部分抗生素的制造、废水的处理等,都与细菌有关。在生物科技领域中,细菌也有着广泛的运用。
真菌
真菌(Fungus)是一种真核生物。在生物学分类上属于藻菌植物中真菌超纲。微生物中只有真菌具有真正的细胞核和完整的细胞器,故又称真核细胞型微生物。
最常见的真菌是各类蕈类,另外真菌也包括霉菌和酵母。现在已经发现了七万多种真菌,估计只是所有存在的一小半。大多真菌原先被分入动物或植物,现在成为自己的界,分为四门。
✦结构
菌体由菌丝组成,无根、茎、叶的分化,无叶绿素,不能自己制造养料,以寄生或腐生方式生活的低等生物。
真菌菌丝呈管状,多数菌丝有隔膜,此类菌丝为多细胞,隔膜中央有小孔,使细胞质、细胞核得以通过。有些真菌的菌丝无隔膜,为多核细胞。
✦分布
真菌广泛分布于全球各带的土壤、水体、动植物及其残骸和空气中,营腐生、寄生和共生生活。
★ 常见的真菌
蘑菇(Agaricus campestris)

图片来源:百度
蘑菇属于腐生真菌中的一种,其体内并没有叶绿素的存在,因此不能直接在光照下进行光合作用。蘑菇生长过程中,主要是将培养料中的各类营养物质作为营养来源,从而实现生长发育。
酵母(Saccharomyces)
图片来源:百度
酵母菌是单细胞微生物。它属于高等微生物的真菌类。有细胞核、细胞膜、细胞壁、线粒体、相同的酶和代谢途径。酵母无害,容易生长,空气中、土壤中、水中、动物体内都存在酵母。有氧气或者无氧气都能生存。
酵母菌的作用
1、在面包、蛋糕、饼干和烤饼等这种一般的粮食制品掺入酵母菌可以提高食品的营养价值,酵母菌还在婴儿食品以及健康食品中作为食品营养的强化剂。
2、利用酵母菌可以将糖类发酵成酒精,在白酒、啤酒、果酒、黄酒等的酿造过程中都会加入酵母菌。
3、此外,大量的酵母菌还能令酒免受外界杂菌的侵害,在酵母菌发酵完成之后有澄清酒体的作用。
4、酵母菌还有入药价值,入药后的酵母菌不仅在治疗克山病和大骨节病起到辅助作用,还可以具有一定的防衰老作用。
酵母菌的危害
1、个别的酵母菌会危害生物或家庭用具,例如红酵母菌会生长在浴帘或者一些潮湿的家具上,会慢慢地腐蚀这些家具。
2、酵母菌种类中的白色假丝酵母菌,也就是俗称的白色念珠菌,主要出现在口腔、肠道、尿道和阴道等部位的粘膜上,会引起鹅口疮或尿道炎等感染疾病。
病毒
病毒(virus)是一种可以利用宿主细胞系统进行复制的微小, 无完整细胞结构的亚显微粒子。病毒不具细胞结构,无法独立生长和复制, 但病毒可以感染所有的具有细胞的生命体, 具有遗传、复制等生命特征。
✦无细胞结构
病毒主要由核酸和蛋白质外壳组成。有些病毒有囊膜和刺突,如流感病毒。病毒基因同其他生物的基因一样,也可以发生突变和重组,因此也是可以演化的。
对于病毒到底是一种生命形式,还是仅仅是一种能够与生物体作用的有机结构,人们的观点各不相同。
病毒有高度的寄生性,完全依赖宿主细胞的能量和代谢系统,获取生命活动所需的物质和能量,离开宿主细胞,它只是一个大化学分子,停止活动,可制成蛋白质结晶,为一个非生命体,遇到宿主细胞它会通过吸附,进入、复制、装配、释放子代病毒而显示典型的生命体特征,所以病毒是介于生物与非生物之间的, 一种处于“生命边缘的生物体”。
★ 常见的病毒
狂犬病毒(Rabies virus)
图片来源:百度
狂犬病病毒为弹状病毒,其头部为半球形,末端常为平端,形态呈典型的子弹状,长约130-240nm,直径65~80nm,内含有单链RNA。
狂犬病病毒是引起狂犬病的病原体。狂犬病毒具有两种主要抗原:一种是病毒外膜上的糖蛋白抗原,能与乙酰胆碱受体结合使病毒具有神经毒性,并使体内产生中和抗体及血凝抑制抗体,中和抗体具有保护作用;另一种为内层的核蛋白抗原,可使体内产生补体结合抗体和沉淀素,无保护作用。
冠状病毒
图片来源:百度
冠状病毒属的病毒是具囊膜、基因组为线性单股正链的RNA病毒,是自然界广泛存在的一大类病毒。
冠状病毒直径约80~120nm,基因组全长约27-32kb,是已知RNA病毒中基因组最大的病毒。
冠状病毒是成人普通感冒的主要病原之一,在儿童可以引起上呼吸道感染,一般很少波及下呼吸道。
冠状病毒还可以引起婴儿、新生儿急性肠胃炎,主要症状是水样大便、发热、呕吐,每天10余次,严重者可以出现血水样便。
2019新型冠状病毒(2019-nCoV ,引发新型冠状病毒肺炎COVID-19)是已知的第7种可以感染人的冠状病毒。
注:第一个已知的病毒是烟草花叶病毒,由马丁乌斯·贝杰林克于1899年发现并命名,如今已有超过5000种类型的病毒得到鉴定。研究病毒的科学被称为病毒学,是微生物学的一个分支。
细菌和真菌的名称中均有一个“菌”字,同属微生物,但两者在生物类型、结构、大小、增殖方式上却有着诸多不同。比较如下:
✦生物类型不同
一是就有无成形的细胞核来看:细菌没有核膜包围形成的细胞核,属于原核生物;真菌有核膜包围形成的细胞核,属于真核生物。
二是就组成生物的细胞数目来看:细菌全部是由单个细胞构成,为单细胞型生物;真菌既有由单个细胞构成的单细胞型生物(如酵母菌),也有由多个细胞构成的多细胞型生物(如食用菌、霉菌等)。
✦细胞结构不同
细菌和真菌都具有细胞结构,属于细胞型生物,在它们的细胞结构中都具有细胞壁、细胞膜、细胞质,但却存在诸多不同,具体表现在:一是细胞壁的成分不同:细菌细胞壁的主要成分是肽聚糖,而真菌细胞壁的主要成分是几丁质。
二是细胞质中的细胞器组成不同:细菌只有核糖体一种细胞器;而真菌除具有核糖体外,还有内质网、高尔基体、线粒体、中心体等多种细胞器。
三是细菌没有成形的细胞核,只有拟核;真菌具有。细菌没有染色体,其DNA分子单独存在;真菌细胞核中的DNA与蛋白质结合在一起形成染色体。
✦细胞大小差异
细胞大小:原核细胞一般较小,直径一般为1μm-10μm;真核细胞较大,直径一般为10μm-100μm。
✦增殖方式不同
细菌是原核生物,为单细胞型生物,通过细胞分裂而增殖,具有原核生物增殖的特有方式(二分裂);真菌为真核生物,细胞的增殖主要通过有丝分裂进行,因真菌种类的不同其个体增殖方式主要有出芽生殖(如酵母菌)和孢子生殖(食用菌)等方式。
注:尽管在细菌和真菌的名称中都有一个菌字,但细菌的名称中一般含有:球、杆、弧、螺旋等描述细菌形态的字眼,只有乳酸菌例外(实为乳酸杆菌);而真菌名称中则不含有。
✦体积差异大
细菌和病毒同属于微生物,只有在显微镜下才能看到。但两者是截然不同的东西。
细菌和病毒均属于微生物。在一定的环境条件下,细菌和病毒都可以在人体中增殖,并可能导致疾病发生。细菌较大,用普通光学显微镜就可看到,它们的生长条件也不高。病毒则较小,一般要用放大倍数超过万倍的电子显微镜才能看到。
注意:有一点值得指出的是,在人们身体的许多部位都有细菌的增殖。医学上称之为正常菌群,它们与我们和平相处,互惠互利。而在任何情况下从机体中发现病毒都非正常状况。因为只有侵入我们的活组织细胞中这些病毒才能存活。
✦结构不同
细菌是和植物一样,有细胞壁,而人的细胞是没有细胞壁的,这就是很多抗生素杀菌的原理。比如破坏它的细胞壁或者阻止合成细胞壁,细菌就死掉了,而人没有这个结构,所以对人无影响。
病毒与细菌不同之处是,病毒没有细胞结构,可以说是最低等的生物,但是它的能耐可不小,人类的疾病从小的感冒到大的癌症都和它有关系。
病毒构造很简单,外面是一层蛋白质,称为病毒外壳。蛋白质外壳内部包裹着病毒的遗传物质,可以是DNA,也可以是RNA。病毒自己不能完成新陈代谢,也不能完成繁殖,需要寄生在其它细胞内完成。
病毒没有自己的生长代谢系统,它的生存靠寄生在宿主(如人)和细胞中依赖他人的代谢系统。也是因为如此,目前抗病毒的特殊药物不多。
✦按形状分类
细菌具有不同的形状,并可根据形状分为三类,即:球菌、杆菌和螺旋菌(包括弧菌、螺菌、螺杆菌)。
✦不同生存条件
按细菌的生活方式来分类,分为两大类:自养菌和异养菌,其中异养菌包括腐生菌和寄生菌。
按细菌对氧气的需求来分类,可分为需氧(完全需氧和微需氧)和厌氧(不完全厌氧、有氧耐受和完全厌氧)细菌。
按细菌生存温度分类,可分为喜冷、常温和喜高温三类。
✦按细胞壁组成分类
细菌的结构十分简单,原核生物,没有成形的细胞核,没有膜结构的细胞器例如线粒体和叶绿体,但是有细胞壁,有的细菌还有鞭毛和荚膜,根据细胞壁的组成成分,细菌分为革兰氏阳性菌和革兰氏阴性菌。
“革兰氏”来源于丹麦细菌学家革兰,他发明了革兰氏染色。
革兰氏阳性菌具有较厚的肽聚糖细胞壁结构,在革兰氏染色试验中呈紫色/蓝色;
革兰氏阴性菌的细胞壁较薄,在革兰氏染色试验中呈红色至粉红色。
革兰氏阳性菌特征
革兰氏阳性细菌的主要特征是它们的结构。一般有以下特点:
●没有外膜。革兰氏阳性细菌没有外膜,但革兰氏阴性细菌有。
●复杂的细胞壁。包围细胞质膜的细胞壁由肽聚糖、多糖、磷壁和蛋白质组成。它很容易吸收外来物质。
●厚的肽聚糖层。在革兰氏阳性细菌中,肽聚糖有40到80层厚。
●某些表面附属物。革兰氏阳性细菌可能有鞭毛,可以帮助它们移动。它们很少有被称为菌毛的毛发状结构。
革兰氏阴性菌特征
革兰氏阳性菌和革兰氏阴性菌具有不同的结构。通常,革兰氏阴性菌具有以下特征:
●外脂质膜
●肽聚糖薄层(2-3纳米)
●通常不含磷壁酸
●可以有鞭毛或毛
小结
主要的区别是外脂膜。它很难渗透,这给了革兰氏阴性细菌额外的保护。革兰氏阳性细菌没有这种特征。
由于这种差异,革兰氏阴性细菌更难杀死。这意味着革兰氏阳性菌和革兰氏阴性菌需要不同的处理方法。
真菌较高层级的分类系统仍有很大争议,新理论不断被提出,各个分类阶层的名称均常有变动。且同一种真菌还可能在生活史的不同阶段,例如无性与有性世代拥有数种不同的学名,使真菌分类更加复杂。目前将真菌界分为4门和1类。
✦壶菌门
壶菌门(Chytridiomycota)壶菌门是游动细胞具有“9+2”结构的鞭毛,并能在水中游动的一类真菌,游动孢子具有一根后生尾鞭式鞭毛。
壶菌多水生,大多腐生在动植物残体上或寄生于水生植物、藻类、小动物和其他真菌上,少数寄生于高等种子植物上。大多数种类能分解纤维素和几丁质。
✦接合菌门
接合菌门(Zygomycota)是由低等的水生真菌发展到陆生种类,由游动的带鞭毛的孢囊孢子发展为不游动的孢囊孢子——静孢子或单孢孢子囊的分生孢子。
接合菌门菌物共同特征是有性生殖产生接合孢子。接合菌营养体为单倍体,大多是很发达的无隔菌丝体,少数菌丝体不发达,较高等的种类菌丝体有隔膜。有的种类菌丝体可以分化形成假根和匍匐丝。细胞壁的主要成分为几丁质。
✦子囊菌门
子囊菌门(Ascomycota)是真菌中最大的类群,与担子菌被称为高等真菌,生殖菌丝细胞出现较短双核阶段,其区别于其他真菌的一个特征是产生子囊。
子囊菌大都陆生,营养方式有腐生、寄生和共生。腐生的子囊菌可以引起木材、食品、布匹和皮革的霉烂以及动植物残体的分解。
✦担子菌门
担子菌门(Basidiomycota)是一类高等真菌,构成双核亚界,包含2万多种,包括蘑菇、木耳等主要食用菌。
担子菌门包括以下组:蘑菇,马勃,鬼笔科,和人体致病酵母隐球菌属等等。
担子菌门的真菌基本全为陆生品种,主要特征是由多细胞,有横隔膜的菌丝体组成,菌丝分为两种,初生菌丝体的细胞只有一个细胞核,次生菌丝体的细胞有两个核,两个核的次生菌丝体可以形成一种子实体,称为担子果,经过有性繁殖过程,在担子上生成担孢子;也可以经过无性繁殖过程生成无性孢子或出芽繁殖。
✦半知菌类
半知菌类(Deuteromycota)是一种已废止的生物分类,指在子囊菌、担子菌的同伴之中,还未发现有性繁殖阶段而在分类学上位置不明的一种临时分类。
只进行无性繁殖的菌类被称作不完全型,这一阶段被称为无性阶段。进行有性繁殖的被称为完全型,该阶段被称作有性阶段,通常有性阶段的菌类也是同时进行无性生殖的。
从遗传物质分类:DNA病毒、RNA病毒、蛋白质病毒(如:朊病毒)
RNA病毒和DNA病毒在结构、成分、复制能力和致病力等方面都不同。RNA病毒就是遗传物质是RNA的一种病毒。DNA病毒也称为脱氧核苷酸病毒,是一种生物病毒,属于原发病毒。
✦DNA病毒和RNA病毒的区别
1、结构:RNA病毒是单链病毒,比较容易发生变异。DNA病毒是双链结构的病毒,不容易发生变异,更稳定。
2、组成成分:RNA病毒是由核糖和磷酸组成,一般只有数百个或者数千个核苷酸。DNA病毒是由去氧核糖和磷酸组成,通常有上百万个核苷酸单位。
3、复制能力:RNA病毒感染人体后,在人体细胞中复制非常活跃,而复制过程中发生变异后也不修复,而是继续复制下去。这样就使RNA病毒变异非常快,不容易被攻破。比如甲型流感H1N1病毒和SARS病毒以及新冠病毒等,都是RNA病毒。
4、致病力:DNA病毒相对不容易变异,致病比较单一。由于RNA病毒相对比较容易变异,因此较容易致病。
从病毒结构分类:真病毒(Euvirus,简称病毒)和亚病毒(Subvirus,包括类病毒、拟病毒、朊病毒)
从寄主类型分类:噬菌体(细菌病毒)、植物病毒(如烟草花叶病毒)、动物病毒(如禽流感病毒、天花病毒、HIV等)
从性质来分:温和病毒(例如HIV)、烈性病毒(例如狂犬病毒)。
✦无性二分裂方式
细菌主要以无性二分裂方式繁殖,即细菌生长到一定时期,在细胞中间逐渐形成横隔,由一个母细胞分裂为两个大小相等的子细胞。
细胞分裂是连续的过程,分裂中的两个子细胞形成的同时,在子细胞的中间又形成横隔,开始细菌的第二次分裂。有些细菌分裂后的子细胞分开,形成单个的菌体,有的则不分开,形成一定的排列方式,如链球菌、链杆菌等。
分裂过程
采用电子显微镜研究细菌的分裂过程表明:细菌细胞分裂大致可经过核物质与细胞质分裂、横隔壁形成和子细胞分离等过程。
细菌细胞分裂时,核质DNA与中介体或细胞膜相连,首先DNA复制并向细胞两端移动,与此同时,细菌细胞膜向内凹陷并形成一垂直于细胞长轴的细胞质隔膜,使细胞质和核质均匀分配到两个子细胞中。
其次细胞形成横隔壁,在细胞膜不断内陷,形成子细胞各自的细胞质膜同时,母细胞的细胞壁也从四周向中心逐渐延伸。最后,逐渐形成子细胞各自完整的细胞壁。接着,子细胞分裂,形成两个大小基本相等的子细胞。
✦繁殖速度快
细菌繁殖速度快,一般细菌约20-30min便分裂一次,即为一代。接种子肉汤培养中的细菌在适宜的温度下迅速生长繁殖,肉汤很快即可变浑浊,表明有细菌的大量生长。不过也有些细菌,如结核分枝杆菌(M.tuberculosis)的繁殖速度较慢,需要15-18小时才能繁殖一代。
真菌的繁殖方式分为无性繁殖和有性繁殖两种。
✦无性繁殖
无性繁殖是指营养体不经过核配和减数分裂产生后代个体的繁殖。它的基本特征是营养繁殖通常直接由菌丝分化产生无性孢子。
常见的无性孢子有三种类型:
(1)游动孢子:形成于游动孢子囊内。游动孢子囊由菌丝或孢囊梗顶端膨大而成。游动孢子无细胞壁,具1-2根鞭毛,释放后能在水中游动。
(2)孢囊孢子:形成于孢囊孢子囊内。孢子囊由孢囊梗的顶端膨大而成。孢囊孢子有细胞壁,水生型有鞭毛,释放后可随风飞散。
(3)分生孢子(conidium)产生于由菌丝分化而形成的分生孢子梗(conidiophore)上,顶生、侧生或串生,形状、大小多种多样,单胞或多胞,无色或有色,成熟后从孢子梗上脱落。有些真菌的分生孢子和分生孢子梗还着生在分生孢子果内。孢子果主要有两种类型,即近球形的具孔口的分生孢子器(pycnidium)和杯状或盘状的分生孢子盘(acervulus)。
✦有性繁殖
真菌生长发育到一定时期(一般到后期)就进行有性生殖。有性生殖是经过两个性细胞结合后细胞核产生减数分裂产生孢子的繁殖方式。
多数真菌由菌丝分化产生性器官即配子囊,通过雌、雄配子囊结合形成有性孢子。其整个过程可分为质配、核配和减数分裂三个阶段。
第一阶段:质配阶段
即经过两个性细胞的融合,两者的细胞质和细胞核(N)合并在同一细胞中,形成双核期(N+N)。
第二阶段:核配阶段
核配阶段,就是在融合的细胞内两个单倍体的细胞核结合成一个双倍体的核(2N)。
第三阶段:减数分裂阶段
双倍体细胞核经过两次连续的分裂,形成四个单倍体的核(N),从而回到原来的单倍体阶段。
经过有性生殖,真菌可产生四种类型的有性孢子。
(1)卵孢子(oospore):卵菌的有性孢子。是由两个异型配子囊——雄器和藏卵器接触后,雄器的细胞质和细胞核经授精管进入藏卵器,与卵球核配,最后受精的卵球发育成厚壁的、双倍体的卵孢子。
(2)接合孢子(zygospore):接合菌的有性孢子。是由两个配子囊以配子囊结合的方式融合成1个细胞,并在这个细胞中进行质配和核配后形成的厚壁孢子。
(3)子囊孢子(ascospore):子囊菌的有性孢子。通常是由两个异型配子囊——雄器和产囊体相结合,经质配、核配和减数分裂而形成的单倍体孢子。子囊孢子着生在无色透明、棒状或卵圆形的囊状结构即子囊内。
每个子囊中一般形成8个子囊孢子。子囊通常产生在具包被的子囊果内。子囊果一般有四种类型,即球状而无孔口的闭囊壳,瓶状或球状且有真正壳壁和固定孔口的子囊壳,由于座溶解而成的、无真正壳壁和固定孔口的子囊腔,以及盘状或杯状的子囊盘。
(4)担孢子(basidiospore):担子菌的有性孢子。通常是直接由“+”、“-”菌丝结合形成双核菌丝,以后双核菌丝的顶端细胞膨大成棒状的担子。在担子内的双核经过核配和减数分裂,最后在担子上产生4个外生的单倍体的担孢子。
此外,有些低等真菌如根肿菌和壶菌产生的有性孢子是一种由游动配子结合成合子,再由合子发育而成的厚壁的休眠孢子(restingspore)。
✦自我复制
病毒繁殖借助宿主细胞为其提供的原料、能量和酶等必要条件,以自我复制的方式进行增殖,利用宿主细胞的核苷酸和氨基酸来自主地合成自身的一些组件,装配下一代个体。
流感病毒自我复制过程
1.病毒体附着到宿主细胞表面并通过胞吞进入细胞;2.衣壳分解后,病毒核糖核蛋白转运入核;3a.病毒基因组转录;3b.病毒基因组复制;4.新合成的病毒mRNA出核并完成翻译;5a.合成的核蛋白入核与新复制的核酸结合;5b.合成的病毒表面蛋白进入高尔基体完成翻译后修饰并转运上膜;6.新形成的核衣壳进入细胞质并与插有病毒表面蛋白的细胞膜结合;7.新生成的病毒体通过出泡方式离开宿主细胞。
✦细菌因素
主要与病原菌的毒力和数量有关。毒力强或数量多的致病菌进入机体,引起败血症的可能性较大。
注:败血症是指各种致病菌侵入血液循环,并在血中生长繁殖,产生毒素而发生的急性全身性感染。
✦人体因素
细菌侵入人体后是否引起感染,与人的防御、免疫功能有关。
•皮肤和黏膜是抵御细菌的有效武器
完整的皮肤和粘膜是防止细菌侵入人体的天然屏障,破损后细菌易于从此处侵入体内,挤压皮肤炎症部位或脓肿时细菌侵入的可能性更大。
严重烧伤时,创面为细菌敞开门户,皮肤坏死、血浆渗出又为细菌繁殖提供了良好环境,故极易发生感染。尿路、胆道、胃肠道、呼吸道粘膜受破坏后,若同时有内容物积滞、压力增高,细菌更易进入血中。保留导尿管、静脉等血管内留置导管、人工辅助呼吸时插管等,也使细菌易于侵入。
•免疫细胞能清除细菌
人体免疫功能正常时,进入血中的细菌迅速被血中免疫细胞如单核细胞、嗜中性粒细胞等所清除,而患肝硬变、糖尿病、血液病、结缔组织病等慢性病者,可因代谢紊乱、体液免疫及细胞免疫功能减低,易导致细菌感染发生;各种免疫抑制药物的使用、放射治疗亦是导致细菌感染发病率高的原因。
注:广谱抗菌药物使用后,对药物敏感的细菌虽被抑制或杀灭,而一些耐药菌乘机繁殖,亦可酿成细菌感染。
★细菌病
由细菌引起的疾病有许多,如:伤寒和副伤寒、细菌性食物中毒、 细菌感染性腹泻、霍乱、弯曲菌感染(弯曲菌肠炎、幽门螺杆菌感染) 细菌性痢疾、鼠疫、炭疽、白喉、百日咳、猩红热、流行性脑脊髓膜炎、结核病、人感染猪链球菌病、破伤风、败血症等。
✦症状
原发炎症:各种病原菌所引起的原发炎症与其在人体的分布部位有关。原发炎症的特点是局部的红、肿、热、痛和功能障碍。
皮疹:见于部分患者,以瘀点最为多见,多分布于躯干、四肢、眼结膜、口腔粘膜等处,为数不多。
关节症状:可出现大关节红、肿、热、痛和活动受限,甚至并发关节腔积液、积脓,多见于革兰阳性球菌、脑膜炎球菌、产碱杆菌等败血症的病程中。
感染性休克:约见于1/5~1/3败血症患者,表现为烦燥不安,脉搏细速,四肢厥冷,皮肤花斑,尿量减少及血压下降等,是严重败血症所致。
除外伤性、手术后、挤压疮疖后发生的败血症有较明显的潜伏期外,大多发病急骤。
注意
由于新生儿及老年患者具有不同的生理特点,其败血症亦各有特征。
•新生儿免疫力弱,发病率高
新生儿的皮肤粘膜屏障功能、淋巴及单核吞噬细胞系统功能尚不健全,补体尚缺乏,体液免疫水平低,细胞免疫也未完善;脐带残端为细菌入侵创造了有利条件,孕母泌尿生殖道感染或全身感染等均可使新生儿败血症发病率高、表现复杂、并发症多。
•老年人发病往往比较严重
老年人败血症的发病率有增高的趋势,由于机体反应性差,早期临床表现较隐蔽,热型往往不规则;又因免疫功能低下,病情常较严重,进展迅速且不易控制;老年人脏器功能多有减退或原有慢性病,败血症极易诱发脏器功能衰竭。
故新生儿及老年败血症预后差、死亡率亦高。及时发现新生儿和老年败血症,主要依据年龄特点和提高警惕。
真菌感染性疾病根据真菌侵犯人体的部位分为4类:浅表真菌病、皮肤真菌病、皮下组织真菌病和系统性真菌病;前二者合称为浅部真菌病,后二者又称为深部真菌病。
真菌感染多为继发性感染,由机会致病性真菌引起,特别是深部真菌感染多是由于各种诱因使机体免疫功能显著下降所致。
某些真菌如白假丝酵母菌、烟曲霉中可产生高分子强毒素或低分子毒素,这些毒素也会在治病中起到一定作用。另外,真菌的黏附能力,对免疫系统功能的抑制及胞壁中的酶类也与致病性有关。
诱发因素:发烧、创伤、肿瘤、严重其他微生物感染等。
✦浅部真菌感染
主要是由于人体接触所致,如皮肤廯菌、角层癣菌等皮肤感染真菌,多具有嗜角质性,可分解细胞的角蛋白和脂质,还可通过机械刺激和代谢产物作用,引起局部病变。
✦深部真菌感染
多发生于人体抵抗力下降或菌群失调时,为继发性感染,常见菌属有白色念珠菌、新生隐球菌、肺孢子菌、曲霉及毛菌等,因患者抵抗力较差,治疗效果往往不佳。
✦系统性真菌感染
在机体抵抗力低下时致病,如患有白血病、淋巴瘤、糖尿病等疾病或有长期大量广谱抗生素、激素使用史时,许多条件致病菌、如念珠菌、曲霉、毛霉等感染后在体内发展繁殖,从而引起系统性真菌感染。
✦症状
•浅表真菌病
感染仅仅局限于皮肤角质层的最外层,极少甚至完全没有组织反应,感染毛发时也只累及毛发表面,很少损伤毛发。
主要包括:花斑癣、掌黑癣和毛结节菌病。
•皮肤真菌病
感染累及皮肤角质层和皮肤附属器,如毛发、甲板等,能广泛破坏这些组织的结构并伴有不同程度的宿主免疫反应;这类真菌感染中最常见的是皮肤癣菌病,其他真菌引起的感染还包括皮肤念珠菌病等。
皮肤癣菌病根据不同的发病部位可以分为足癣(俗称”脚气”)、手癣、体癣、股癣、甲癣以及头癣等各类癣病;在世界范围内广泛发生,是最常见的真菌性疾病,发病率高。
•皮下真菌病
感染皮肤、皮下组织,包括肌肉和结缔组织,一般不会经血液流向重要脏器播散;但有些感染可以由病灶向周围组织缓慢扩散蔓延,如足菌肿等;也有些则沿淋巴管扩散,如孢子丝菌病、着色芽生菌病。免疫受损患者的皮下真菌具有潜在的播散全身的危险。
•系统性真菌病
除侵犯皮肤和皮下组织外,还累及组织和器官,甚至引起播散性感染,又称为侵袭性真菌感染。
近年来,随着高效广谱抗生素、免疫抑制剂、抗恶性肿瘤药物的广泛应用,器官移植、导管技术以及外科其他介入性治疗的深入开展,条件致病性真菌引起的系统性真菌病日益增多,新的致病菌不断出现,病情也日趋严重。
主要包括念珠菌病、曲霉病、隐球菌病、接合菌病和马内菲青霉病等。
病毒通过多种途径侵入机体,并在易感的宿主细胞中增殖。
✦水平传播
水平传播是指病毒在人群中不同个体之间的传播,包括病毒从动物到人的传播。常见的水平传播方式有以下几种。
(1)经呼吸道传播:病毒经空气、飞沫等吸入感染,如流感病毒、风疹病毒等。
(2)经消化道传播:病毒污染了食物和水源,经口食入而感染。如甲型肝炎病毒、脊髓灰质炎病毒等。
(3)经泌尿生殖道传播:由直接性接触而感染,如人类免疫缺陷病毒、单纯疱疹病毒等。
(4)经皮肤伤口传播:经昆虫媒介的叮咬、动物咬伤或皮肤伤口直接接触病毒而感染。如流行性乙型脑炎病毒、狂犬病病毒等。
(5)经血液传播:经输血或血液制品,包括经注射、器官移植等途径引起的感染,如乙型肝炎病毒、人类免疫缺陷病毒等。
✦垂直传播
病毒经胎盘、产道、哺乳由母亲传给胎儿或新生儿的方式,称为垂直传播。可经垂直传播的病毒有风疹病毒、人类免疫缺陷病毒、乙型肝炎病毒等。
✦症状
机体感染病毒后,可表现出不同的临床类型。依据有无症状,可分为显性感染和隐性感染;依据病毒滞留时间及症状持续时间长短,又可分为急性感染和持续性感染。
•隐性感染
由于侵入机体的病毒数量较少、毒力较弱或机体的抵抗力较强,病毒在宿主细胞内增殖,但机体不出现明显的临床症状,称为隐性感染。
隐性感染可使机体获得对该病毒的特异性免疫,保护机体免受该病毒的再次感染。隐性感染虽不出现临床症状,但病毒仍在体内增殖并向外界传播病毒,成为重要的传染源。
•显性感染
由于侵入机体的病毒数量较多、毒力较强或是机体的抵抗力较弱,病毒在宿主细胞内大量增殖,出现明显的临床症状,称为显性感染。显性感染根据感染持续时间长短。分为急性感染和持续性感染。
急性感染:病毒侵入机体后,其潜伏期短、发病急、病程数日至数周,病后常可获得特异性免疫力,机体可通过自身的免疫机制把病毒完全清除出体外,如甲型肝炎病毒。
持续性感染:病毒侵入机体后,在体内持续存在数月、数年,甚至数十年,机体可出现临床症状,也可不出现临床症状而长期带有病毒,成为重要的传染源。持续感染按病程、致病机制的不同,可分为三种。
①慢性感染:病毒侵入机体后,长期存在于血液或组织中,机体可出现症状,也可不出现症状。在整个病程病毒均可被查出,如乙型肝炎病毒引起的慢性肝炎。
②潜伏感染:原发感染后,病毒基因潜伏在机体一定的组织或细胞中,但不复制增殖出具有感染性的病毒,此时机体既没有临床症状,也不会向体外排出病毒。在某些条件下病毒可被激活而急性发作,并可检测出病毒,如单纯疱疹病毒。
③慢发病毒感染:经显性或隐性感染后,病毒长时间潜伏在机体内,潜伏期可长达数月至数年,此时机体一般无症状,一般也检测不出病毒。一旦发病,则呈亚急性进行性加重直至死亡,如人类免疫缺陷病毒的感染。
抗细菌感染的免疫是指机体抵御细菌感染的能力,是由机体的非特异性免疫和特异性免疫共同协调来完成的。
先天具有的非特异性免疫包括机体的屏障结构,吞噬细胞的吞噬功能和正常组织及体液中的抗菌物质;后天获得的特异性免疫包括以抗体作用为中心的体液免疫和致敏淋巴细胞及其产生的淋巴因子为中心的细胞免疫。
病原菌侵入机体后,由于其生物学特性的不同,致病物质的不同。机体对它们的免疫反应也各有差别。
✦宿主体表的防御功能
(一)机械的阻挡和排除作用
健康和完整的皮肤与粘膜能有效地阻挡细菌的侵入。
呼吸道粘膜上皮细胞的纤毛向上颤动,可将细菌咳出或咽下;随粪便每日约排菌1012个;小便可清除尿道上皮的细菌。
(二)分泌液中化学物质的局部抗菌作用
汗腺分泌的乳酸,皮脂腺分泌的脂肪酸均有一定的抗菌作用。
胃酸能杀死寒杆菌、痢疾杆菌和霍乱弧菌。阴道分泌物中的酸类亦有抗菌作用。前列腺分泌的精素是正常精液中存在的对革兰氏阳性细菌有效的抑制物。泪液、唾液、乳汗和呼吸道分泌物中广泛分布的溶菌酶能溶解革兰氏阳性细菌。
(三)正常菌群的拮抗作用
人体表以及与外界相通腔道中的正常菌群,可以通过它们的代谢产物对抗病原菌入侵。
例如皮肤上的痤疮丙酸菌(Propionibacterium acnes)能产生抗菌性脂类、抑制金黄色葡萄球菌和化脓性链球菌在皮肤上生长;肠道中的某些厌氧菌能产生脂肪酸阻止沙门氏菌在局部生存;肠道中大肠杆菌产生的大肠菌毒和酸性产物能抑制痢疾杆菌、金黄色葡萄球菌;咽部的草绿色链球菌(Viridans Streptococci)似能阻止肺炎球菌在局部生长;鼻腔的表皮葡萄球菌和类白喉杆菌能妨碍金黄色葡萄球菌定居等。当这种拮抗作用受影响时,则可发生菌群失调症。
✦机体抗毒性免疫
抗毒性免疫是一种以体液抗体为主的免疫应答。许多以外毒素致病的病原菌造成的感染,如白喉、破伤风、气性坏疽及内毒中毒等,机体的免疫应答,主要表现为抗毒素(lgG)中和毒素的作用。
由抗毒素与外毒素特异结合形成的复合物,可被吞噬细胞吞噬,并将其降解消除。抗毒素与毒素结合,可以通过空间阻碍使毒素不能吸附到敏感的宿主细胞(受体)上,或者使毒素生物学活性部位(酶)被封闭,从而使毒素不能发生毒性作用。
注意:抗毒素不能对已与组织结合的毒素起中和作用。
// 建议
根据外毒素的免疫特点,可应用类毒素进行预防接种,应用抗毒素血清进行早期治疗与紧急预防,使用时要保证“早期足量”。
✦机体的抗菌性免疫
病原侵入机体后,由于其生物学特征的不同,可分为胞外菌感染和胞内菌感染两类,机体对这两类感染的免疫反应是有差别的。
(一)胞外寄生菌的抗感染免疫
1.抗体对细菌繁殖的抑制作用:抗体与细菌结合,可以出现凝集和鞭毛制动现象,但一般而言,对细菌的活力只有微弱的影响,甚至没有影响。如果抗体的结合能抑制细菌的重要酶系统或代谢途径,则可能抑制细菌的生长。
例如,某些细菌(例如败血巴氏杆菌)从血清转铁蛋白摄取铁的能力可被特异性抗体封闭,从而导致细菌生长受抑制。
2.抗体对细菌吸附作用的抑制:病原菌吸附到粘膜上皮细胞是造成感染的先决条件。粘膜表面的抗体,在防止病原菌对粘膜的侵犯中具有更重要的作用。
在粘膜表面起这种作用的抗体主要是SlgA它是局部免疫的主要因素。SlgA抗细菌感染可有以下几种方式:在补体和溶菌酶的参与下溶解某些细菌;在肠道局部增强吞噬作用;防止细菌对粘膜上皮细胞的吸附。
例如SlgA能阻止链球菌、致病性大肠杆菌、霍乱弧菌、淋球菌、百日咳杆菌等对粘膜表面的吸附。
3.抗体和补体对细菌的溶解作用:在许多感染中,机体能产生相应抗体(lgG、lgM、lgA),当细菌表面抗原和lgG、lgM结合的免疫复合物一旦通过经典途径使补体活化或由分泌型 lgA或聚合的血清lgA通过替代途径活化补体,即可引起细胞膜的损伤,最终发生溶菌。
实验证明补体的溶菌作用仅对革兰氏阴性菌,其中包括霍乱弧菌、大肠杆菌、痢疾杆菌、伤寒杆菌等发挥作用。但这种作用往往并不彻底,仅使杆菌菌体膨大或变为球形,不引起溶解。但若于试验中系统中加入适量的溶菌酶,则可出现溶菌现象。
4.抗体和补体对吞噬作用的调理:抗体和补体单独能适当的靶细胞起调理吞噬作用,若两者联合作用效应更加强大。中性粒细胞和单核吞噬细胞表面具有lgG的Fc受体。当lgG通过其特异性抗原结合部位(Fab)与细菌表面相应抗原结合后,其Fc段可与吞噬细胞表面相应Fc受体结合,即可在细菌与吞噬细胞间形成抗体“桥梁”,这不仅能促进吞噬细胞对细菌的吞噬,而且有助于强化细胞内的杀菌作用。
注:中性粒细胞和单核细胞表面还有C3b 受体。因此,细菌与所有能结合补体的抗体(lgg 、lgM )形成的复合物,均可激活补体形成活化产物C3B,从而发挥调理吞噬作用。尤以lgM 的作用更强,此作用在感染的早期特别重要,因为此时lgM抗体占优势。
(二)胞内寄生菌的细胞免疫
凡侵入人体后大部分时间停留在宿主细胞内并繁殖的病原菌称胞内寄生菌。例如结核杆菌、麻风杆菌、布氏杆菌等均属此类。
由于抗体不能进入细胞内,所以体液免疫对这类细菌感染的作用受到限制,对胞内感染的防御功能主要靠细胞免疫。例如机体初次感染结核杆菌,由于细胞免疫尚未建立,吞噬细胞虽可将它们吞噬,但不能有效地消化杀灭,因此病原菌容易随吞噬细胞在体内扩散,蔓延,而造成全身感染。
但在传染过程中,机体在病原菌的刺激下逐渐形成细胞免疫,通过致敏淋巴细胞释放的各种淋巴因子,激活吞噬细胞,可增强其吞噬消化能力,抑制病原菌在吞噬细胞内生存,从而获得防御同种病种原菌再感染的免疫力。
✦非特异性免疫
人类对真菌感染有天然免疫力。包括皮肤分泌短链脂肪酸和乳酸的抗真菌作用,血液中转铁蛋白扩散至皮肤角质层的抑真菌作用;中性粒细胞和单核巨噬细胞的吞噬作用,以及正常菌群的拮抗作用。
注意:许多真菌病受生理状态影响,如婴儿对念珠菌病易感,学龄前儿童易患头癣。
✦特异性免疫
•细胞免疫排菌杀菌
真菌感染中细胞免疫是机体排菌杀菌及复原的关键,T细胞分泌的淋巴因子对加速表皮角化和皮屑形成,随皮屑脱落,将真菌排除;以T细胞为主导的迟发型变态反应引起免疫病理损伤能局限和消灭真菌,以终止感染。
一般反应强度与体内菌量呈反比,如阴性则菌量增加,病情严重,而经治疗又转阳性,说明治疗见效,预后良好。
•体液免疫具有保护作用
体液免疫对部分真菌感染有一定保护作用,如特异性抗体可阻止真菌转为菌丝相以提高吞噬细胞的吞噬率;抗白色念珠菌抗体与菌表面甘露醇蛋白质复合物结合,阻止本菌粘附宿主细胞;全身性白色念珠菌感染,尽管其迟发型变态反应阳性,或通过被动转移致敏淋巴细胞,还必须同时输入特异抗体才起保护作用。
注意:而DTH反应阴性者即使有抗体,不能引起保护作用,表明抗体须在具有良好的细胞免疫基础的机体内才发生保护作用。
DTH指的是迟发型超敏反应,主要是T细胞与相应抗原作用后,引起单个核细胞浸润以及组织细胞损伤为主的炎症反应。
✦先天性免疫
人体抵御病毒的第一道防线是先天性免疫系统。这一免疫系统由能够抵御非特异性病毒感染的细胞和其他机制组成,即以一种通用方式来对入侵的病原体做出识别和反应,但不同于获得性免疫系统,这一免疫系统并不产生持久的或保护性的免疫。
RNA干扰是对抗病毒的一种重要的先天性防御机制。
✦体液免疫
当人体的获得性免疫系统探测到病毒时,会产生特异性的抗体来与病毒结合并使其失去感染性,这种作用被称为体液免疫。
其中,有两类抗体非常重要。第一类被称为IgM(免疫球蛋白M),它能高效地使病毒去活,但免疫系统的细胞产生IgM的时间只有几个星期。第二类被称为IgG(免疫球蛋白G),它能够被免疫系统不停地制造出来。
IgM存在于宿主的血液中是用于急性感染的情况,而IgG的存在则表明过去曾经受到某种感染(用于防御以后的同类感染)。进行免疫性测试时,通常是对体内的IgG型抗体进行测量。
✦细胞免疫
人体对抗病毒的另一道防线是细胞免疫,包括了被称为T细胞的免疫细胞。人体中的细胞不断地将其内部蛋白质的片断展示在细胞表面(抗原呈递)供T细胞来进行检查,一旦T细胞识别出可能的病毒片断,那么对应的细胞就会被病毒特异性T细胞扩增所消灭。
诸如巨噬细胞在内的一些细胞专门负责抗原呈递。制造干扰素是一种重要的宿主防御机制。干扰素是病毒感染之后由机体所产生的一种激素,它在免疫中的作用较为复杂,可以确定的是它能够通过杀死受感染细胞及其邻近细胞来逐步阻止病毒的复制。
注:并非所有的病毒感染都会引起保护性免疫反应。例如,艾滋病毒可以通过不断地变换其病毒体表面蛋白的氨基酸序列来逃避免疫系统的打击。这些顽固的病毒采用多种方式来逃脱免疫系统的控制,如隔离、阻断抗原呈递、产生细胞因子抗性、逃避自然杀伤细胞的作用、逃脱细胞凋亡以及抗原转移。其他一些病毒,如向神经病毒,可以通过神经来传播,而在神经系统中免疫系统可能无法接触到它们。
✦预防
细菌感染的预防需要重点关注防止感染,对于具有传播性质的疾病,应从传染源、传播途径和易感人群三个基本环节中进行防控。
1、注意卫生:日常生活中注意饮食卫生,家庭居所最好日常进行消毒、灭菌,防止带入外界环境的致病菌。
2、接种疫苗:接种疫苗后可使机体产生免疫应答,产生特异性抗体,使机体获得针对病原疫苗的免疫力,应及时接种相关疫苗提高自身抗细菌感染能力。
3、体育锻炼:适当从事体育锻炼可以提高免疫力,可根据自身情况选择打太极拳、健身、跑步、郊游等,劳逸结合。
4、远离传染源:有传染性疾病的人群应做好隔离措施,其他人群也应做好防护措施,避免与其接触,避免到细菌感染流行病区。
小结
经常保持皮肤和粘膜的清洁和完整,避免创伤,控制慢性病,合理使用免疫抑制剂和抗生素类药物,烧伤病房应严格消毒等措施,均可预防细菌感染。
一切明显的或隐匿的化脓性病灶如能及早予以清除,感染的发生就可以减少。小儿时常见的传染病如麻疹、流行性感冒、百日咳等每易继发较重的呼吸道细菌感染,从而发生细菌感染。对这类病儿,必须加强保护。对不论多么细小的皮肤创伤必须予以重视,早作适当处理。
✦治疗
一般治疗:卧床休息,加强营养,补充适量维生素。维持水、电解质及酸碱平衡。必要时给予输血、血浆、白蛋白和丙种球蛋白。高热时可给予物理降温,烦躁者给予镇静剂等。
病原治疗:及时选用适当的抗菌药物是治疗的关键。应注意早期、足量并以杀菌剂为主;一般两种抗菌药物联合应用,多自静脉给药;首次剂量宜偏大,注意药物的半衰期,分次给药;疗程不宜过短,一般三周以上,或热退后7~10天方可酌情停药。
局部病灶的处理:化脓性病灶不论原发性或迁徙性,均应在使用适当、足量抗生素的基础上及时行穿刺或切开引流。化脓性胸膜炎、关节脓肿等可在穿刺引流后局部注入抗菌药物。胆道及泌尿道感染有梗阻时应考虑手术治疗。
建议
关键在于及时选用适当的抗菌药物,并予以休息及适量的营养。诊断基本肯定后应尽早治疗,在培养未获阳性结果前可根据细菌入侵途径及临床表现推测致病菌的种类给药,若获阳性培养而治疗效果欠佳时,则可按药物敏感试验选用适宜抗菌药物。
革兰氏阳性球菌感染者可选用青霉素、红霉素、头孢菌素等;革兰氏阴性杆菌感染则选用庆大霉素、丁胺卡那霉素、头孢菌素及半合成广谱青霉素;厌氧菌感染则首选甲硝唑,也可选用青霉素、氯霉素、氯洁霉素等;败血症确为真菌所致则应选用二性霉素。
此外,正确处理局部病灶及各阶段的突出矛盾(如感染性休克、弥漫性血管内凝血、心肾功能不全)亦很重要。
✦预防
1.保持皮肤干燥和清洁。
2.穿着宽松的衣服。
3.避免共用发刷,梳子和毛巾,因为它们可能含有与皮肤真菌菌落片段。
4.为避免脚气,应该使用备用鞋,每2、3天换洗。
5.尽量选择天然纤维制品的衣服,如棉花、蚕丝,使皮肤呼吸。
6.糖尿病患者应控制血糖水平。疾病有可能会导致免疫功能低下,增加了真菌感染的概率。
✦治疗
•大多真菌感染症状较轻微
除头癣和甲癣外,大多数真菌感染症状都较轻微,常用抗真菌霜剂治疗。一般不用抗真菌粉剂。抗真菌药物的活性成分有咪康唑、克霉唑、益康唑和酮康唑等。
一般霜剂每天涂敷两次,治疗持续到皮损消退后7~10天。如果霜剂停用太快,感染并未消除,皮疹又会复发。
抗真菌霜剂要在使用几天后才显效,其间可用皮质类固醇霜剂缓解瘙痒和疼痛。严重的或顽固性感染,可用灰黄霉素治疗几个月,有时同时用抗真菌霜剂。
•部分口服药物会引起副作用
口服灰黄霉素很有效,但可引起副作用,如头痛、胃肠道功能紊乱、光敏、水肿和白细胞减少等。停用灰黄霉素后,感染可能复发。皮肤真菌感染也可用酮康唑治疗。与灰黄霉素一样,口服酮康唑也有严重的副作用,包括肝脏损害。
保持感染部位清洁、干燥有助于抑制真菌繁殖,促进皮肤愈合。感染处应经常用肥皂和水清洗,擦干后扑撒滑石粉。避免使用含玉米粉的粉剂,因为它容易促进真菌生长。
注意
如果真菌感染有渗液,可能并发了细菌感染。需要用抗生素治疗。涂敷抗生素霜剂或口服抗生素。稀释醋酸铝溶液或怀特菲尔德软膏也可用来使渗液的皮肤干燥。
由于病毒使用了宿主细胞来进行复制并且寄居其内,因此很难用不破坏细胞的方法来杀灭病毒。现在最积极的对付病毒疾病的方法是疫苗接种来预防病毒感染或者使用抗病毒药物来降低病毒的活性以达到治疗的目的。
部分病毒感染以对症支持治疗为主,如普通感冒,甲型肝炎、病毒性胃肠炎等,可通过补液维持体内水分、电解质和酸碱平衡。
✦疫苗接种预防感染
疫苗接种是一种廉价而又有效的防止病毒感染的方法。早在病毒被发现之前,疫苗就已经为人们用于预防病毒感染。随着疫苗接种的普及,病毒感染相关的一些疾病(如小儿麻痹、痳疹、腮腺炎和风疹)的发病率和死亡率都大幅度下降,而曾经是致命疾病的天花已经绝迹。
目前各类疫苗可以预防超过30种对人体的病毒感染,而有更多的疫苗被用于防止动物受到的病毒感染。
疫苗的成分可以是活性降低或死亡的病毒,也可以是病毒蛋白质(抗原)。活疫苗包含了活性减弱的可致病的病毒,这样的病毒被称为“减毒”病毒。
注意
虽然活性减弱,但活疫苗对于那些免疫力较弱或免疫缺陷的人可能是危险的,对他们注射活疫苗可能反而会导致疾病。
生物技术和基因工程被用于改造病毒疫苗,改造后的疫苗(即亚单位疫苗)只含有病毒的衣壳蛋白,如乙肝疫苗。由于不含有病毒核酸,因此亚单位疫苗对于免疫缺陷的病人是安全的。
对于活疫苗的安全性也有一些例外,如黄热病毒疫苗,虽然是一种减毒病毒株(被称为17D),却可能是目前所有疫苗中最安全和最有效的。
✦治疗
•抗病毒药物
在过去的二十年间,抗病毒药物的发展非常迅速。艾滋病的不断蔓延推动了对抗病毒药物的需求。抗病毒药物常是核苷类似物,当病毒复制时如果将这些类似物当作核苷用于合成其基因组就会产生没有活性的病毒基因组(因为这些类似物缺少与磷相连能够相互连接形成DNA“骨架”的羟基,会造成DNA的链终止),从而抑制病毒的增殖。
核苷类似物作为抗病毒药物的例子包括阿昔洛韦,可用于抑制单纯疱疹病毒感染,和拉米夫定,可用于治疗艾滋病和乙型肝炎。阿昔洛韦是最早出现也是最经常被指定使用的抗病毒药物。其他使用中的抗病毒药物是针对病毒生活周期的不同阶段。艾滋病毒需要依赖一种被称为HIV-1蛋白酶的作用来获得完整的感染能力;而通过使用大量的蛋白酶抑制剂类的药物可以使这种酶失活。
•“吃病毒”生物
近日,美国的研究人员称,他所在的研究团队于近日首次发现了有生物会把“病毒”作为“食物”。他们研究后发现,两种浮游生物——“Halteria”和“Paramecium”可以主动食用病毒并茁壮成长。
研究发现,“Halteria”在两天内就有明显成长的迹象,纤毛的种群在两天内增长了约15倍,而氯病毒含量则下降了100倍以上。而在没有氯病毒的对照样本中,“Halteria”与初始状态相差无几。“Paramecium”也有类似表现,同样把氯病毒作为营养来源。并且,标记在氯病毒DNA的荧光绿移动痕迹证实病毒被“吃掉”了。
从科学上讲,这是人类第一次改变看待病毒的方式:病毒不仅是导致机体发生病变的“病原体”,还可以是自然界食物链中的一环。这可能对未来治疗病毒相关疾病具有重要作用。
细菌、真菌、病毒等生物共同构成了我们生活的世界。它们基本上无处不在,也时刻影响着我们的生命活动。而人体内的肠道菌群是其中数量最庞大的一类,其对人们的影响巨大。
微生物检测技术可以较为清晰地发现生活中的一些细菌和其他微生物,有助于我们判断健康状况,并根据此来做出一些调整。
随着测序技术和其他体外诊断技术的快速发展,新标志物的发现等新技术的发展将能更快更精准的区分和诊断感染病原,甚至大大提高用药的针对性和减少无效用药和耐药性,将有利于人类和微生物更好的共存。
主要参考文献:
Kwiecinski JM, Horswill AR. Staphylococcus aureus bloodstream infections: pathogenesis and regulatory mechanisms. Curr Opin Microbiol. 2020 Feb;53:51-60. doi: 10.1016/j.mib.2020.02.005. Epub 2020 Mar 12. PMID: 32172183; PMCID: PMC7244392.
Fisher CR, Streicker DG, Schnell MJ. The spread and evolution of rabies virus: conquering new frontiers. Nat Rev Microbiol. 2018 Apr;16(4):241-255. doi: 10.1038/nrmicro.2018.11. Epub 2018 Feb 26. PMID: 29479072; PMCID: PMC6899062.
Riley LW. Distinguishing Pathovars from Nonpathovars: Escherichia coli. Microbiol Spectr. 2020 Dec;8(4). doi: 10.1128/microbiolspec.AME-0014-2020. PMID: 33385193.
Cheung GYC, Bae JS, Otto M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 2021 Dec;12(1):547-569. doi:
10.1080/21505594.2021.1878688. PMID: 33522395; PMCID: PMC7872022.
Liu N, Pang X, Zhang H, Ji P. The cGAS-STING Pathway in Bacterial Infection and Bacterial Immunity. Front Immunol. 2022 Jan 13;12:814709. doi: 10.3389/fimmu.2021.814709. PMID: 35095914; PMCID: PMC8793285.
Klein EY, Monteforte B, Gupta A, Jiang W, May L, Hsieh YH, Dugas A. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses. 2016 Sep;10(5):394-403. doi: 10.1111/irv.12398. Epub 2016 Jun 24. PMID: 27232677; PMCID: PMC4947938.
Piepenbring M, Maciá-Vicente JG, Codjia JEI, Glatthorn C, Kirk P, Meswaet Y, Minter D, Olou BA, Reschke K, Schmidt M, Yorou NS. Mapping mycological ignorance – checklists and diversity patterns of fungi known for West Africa. IMA Fungus. 2020 Jul 7;11:13. doi: 10.1186/s43008-020-00034-y. PMID: 32699745; PMCID: PMC7341642.
Wu HY, Chang PH, Huang YS, Tsai CS, Chen KY, Lin IF, Hsih WH, Tsai WL, Chen JA, Yang TL, Lee CY, Ho TS, Wang HW, Huang SF, Wu AY, Chen HJ, Chen YC, Chen WC, Tseng CH, Lin PC, Yang CH, Hong PL, Lee SS, Chen YS, Liu YC, Wang FD; Infectious Disease Society of Taiwan; Medical Foundation in Memory of Dr. Deh-Lin Cheng; Foundation of Professor Wei-Chuan Hsieh for Infectious Diseases Research and Education; CY Lee’s Research Foundation for Pediatric Infectious Diseases and Vaccines,; 7th Guidelines Recommendations for Evidence-based Antimicrobial agents use in Taiwan (GREAT) working group; Members of the expert panel and board members of the IDST are listed in alphabetical order. Recommendations and guidelines for the diagnosis and management of Coronavirus Disease-19 (COVID-19) associated bacterial and fungal infections in Taiwan. J Microbiol Immunol Infect. 2022 Dec 21:S1684-1182(22)00284-5. doi: 10.1016/j.jmii.2022.12.003. Epub ahead of print. PMID: 36586743; PMCID: PMC9767873.
Dickson RP, Singer BH, Newstead MW, Falkowski NR, Erb-Downward JR, Standiford TJ, Huffnagle GB. Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol. 2016 Jul 18;1(10):16113. doi: 10.1038/nmicrobiol.2016.113. PMID: 27670109; PMCID: PMC5076472.
de Wilde AH, Snijder EJ, Kikkert M, van Hemert MJ. Host Factors in Coronavirus Replication. Curr Top Microbiol Immunol. 2018;419:1-42. doi: 10.1007/82_2017_25. PMID: 28643204; PMCID: PMC7119980.
谷禾健康
癌症是一种复杂的疾病,归因于多因素变化,导致治疗策略困难。
90%的癌症患者死于复发或转移。癌症转移是恶性肿瘤进展的关键步骤,由癌细胞内在特性和外在环境因素决定。
一些微生物组通过诱导癌性上皮细胞和慢性炎症促进癌发生、癌症进展和调节癌症治疗。
关于微生物群在肿瘤发生和临床效率中的作用的大部分认知都与肠道微生物群有关。
然而,研究也证实了肿瘤内微生物群在癌症中的作用。近年来,肿瘤内微生物群已被确定为肿瘤的一个组成部分,并可能在功能上调节转移的各个方面。
肿瘤内微生物群与区分正常组织与癌组织、药物反应者与无反应者癌症、良好与不良预后、转移性与非转移性癌症有关。
肿瘤内微生物群的调节可以减少癌症转移,阻止癌症进展,并重新编程免疫反应。
本文主要集中于肿瘤内微生物群的发现和表征及其在肿瘤转移过程中的独特功能,并讨论了癌症治疗的挑战和意义。
癌症转移通常被定义为:
肿瘤从原始肿瘤部位转移到远端器官的多步骤过程。
这一过程涉及几个步骤,包括入侵、传播、血管内、外渗、定植。
转移的一个关键特征是其极低效率,这是由于癌细胞在成功到达并定居目的地之前,需要应对许多物理、化学和生物挑战。
转移级联期间的应激源包括:
• 细胞外基质(ECM)僵硬
注:肿瘤细胞外基质的硬度约为周围正常组织的1.5倍
• 失巢凋亡
注:失巢凋亡是由于细胞与细胞外基质和其他细胞失去接触而诱导的一种特殊的程序化细胞死亡形式,在机体发育、组织自身平衡、疾病发生和肿瘤转移等方面起重要作用。
• 流体剪切应力
注:压缩、拉伸、剪切力导致的组织变形导致组织液在细胞周围运动。
• 化疗
注:使用化学治疗药物杀灭癌细胞达到治疗目的。
• 免疫监视
注:免疫系统具有识别、杀伤并及时清除体内突变细胞,防止肿瘤发生的功能,称为免疫监视。
确定转移效率的关键是:
了解早期转移细胞如何能够抵抗这些挑战并增强其对不同环境的适应性,以及每种类型的压力对最终转移效率的影响程度。
转移是一个低效的多步骤易位过程
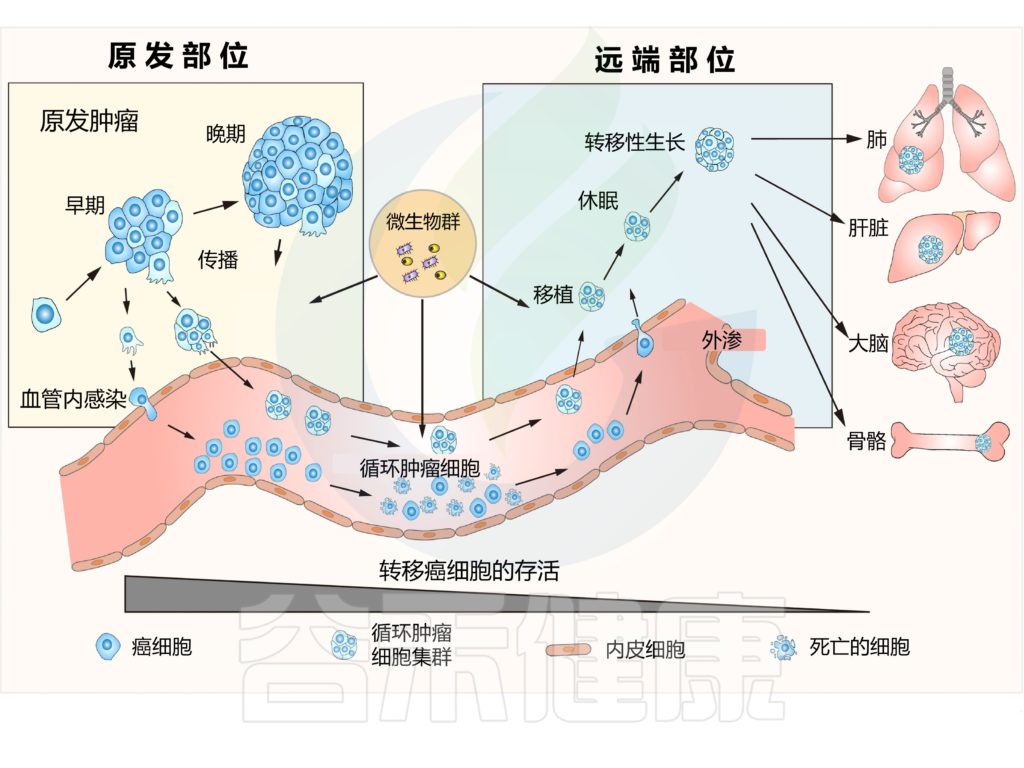
doi.org/10.1016/j.tcb.2022.11.007
新的研究扩大了我们对转移的认知。例如,研究表明转移开始发生在肿瘤进展的非常早期。
集体侵入相邻组织
在这些转移细胞到达远端器官之前,癌细胞甚至可以通过分泌成分远程准备转移前生态位(PMN)。当转移细胞开始迁移时,它们通常会集体侵入相邻组织,并作为寡克隆细胞簇在血流中传播,以增强其定植新生态位的能力。
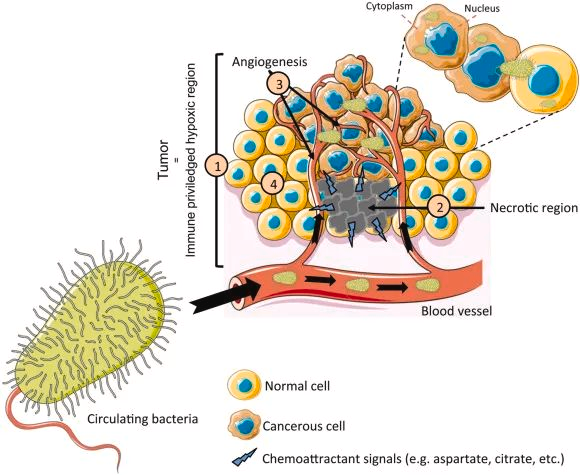
doi.org/10.1016/j.canlet.2021.09.009
改变代谢程序,逃避免疫监视
这些先驱转移起始细胞改变它们的代谢程序以增强它们的转移潜能,并且可以逃避免疫监视并长时间保持休眠状态,直到开始分裂。
转移能力高度依赖于癌细胞内部细胞特性
这些研究使我们对转移细胞生存策略的理解更进一步,并证实了癌细胞转移能力高度依赖于癌细胞内部细胞特性的观点,例如 EMT 状态、干细胞可塑性、遗传学、表观遗传学、染色体不稳定性和代谢适应,以及环境因素,如机械压力、免疫反应、ECM、PMN 和肠道微生物组。
那么,癌细胞获得这些转移性状的驱动力是什么?

在实验上,肿瘤内微生物群已被确定为组织的一个组成部分。这些肿瘤内细菌是癌症进展不同阶段的新参与者,可以从外部相互作用和细胞内部影响癌细胞。
下面一个章节,我们来看肿瘤内微生物群是什么,有什么作用?
我们知道,已经有越来越多的文章阐述肠道微生物组在癌症进展中的作用,这方面我们的理解在迅速增长,然而我们对肿瘤内微生物群的理解仍处于初级阶段。
近期与转移相关的肿瘤内微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
人类组织,包括癌组织,通常被认为是无菌的,除了结肠、皮肤和口腔。
▸ 肿瘤内微生物群
癌症生物学的最新概念进展是,鉴定出癌症组织中存在微生物群。这些肿瘤组织驻留细菌被归类为“肿瘤内微生物群”。
我们知道,肠道微生物群可以通过代谢产物或通过与免疫细胞的相互作用,远距离影响肿瘤组织。
而肿瘤内微生物群与癌细胞密切接触,因此可能与肠道微生物群有不同的功能模式。
我们其他文章有对肠道微生物组在癌症诊断、预后和治疗反应中的作用进行详细介绍:
肠道微生物群与五种癌症的相互作用:致癌 -> 治疗 -> 预后
因此,本文主要集中于肿瘤内微生物群的发现和表征及其在肿瘤转移过程中的独特功能。
▸ 肿瘤内微生物群发现的证据:
-早前提出假设
一百多年前,威廉·科利发明了科利毒素(化脓性链球菌和粘质沙雷菌的混合物)来治疗一位癌症患者,并观察到肿瘤消退。
他假设“每一种恶性肿瘤都可能有外源性或微生物来源”。然而,在这个假设之后的几十年里,没有直接证据表明肿瘤内细菌的存在。
瘤内微生物群研究的重大突破包括发现、机制等成果
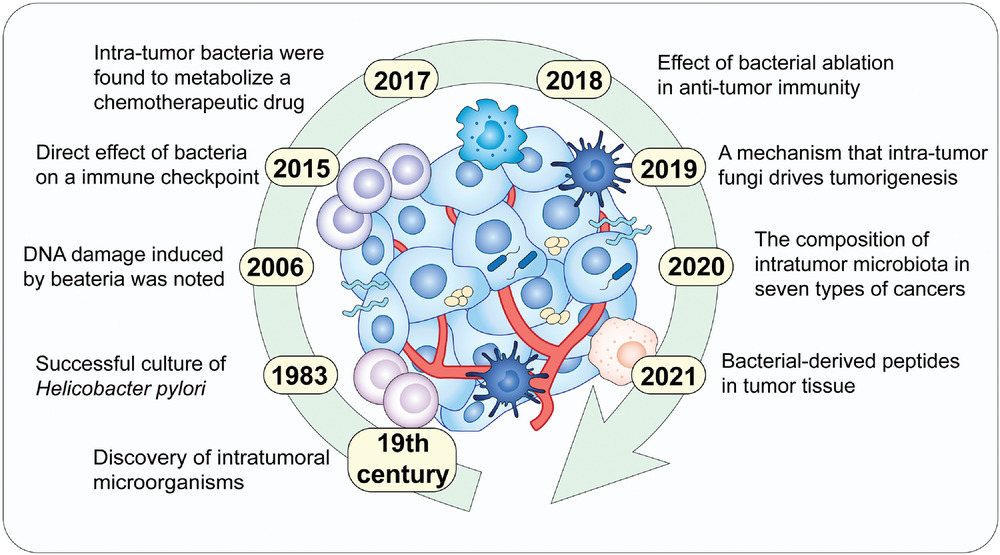
doi.org/10.1002/advs.202200470
-攻克瘤内微生物的检测技术挑战
到现在,下一代测序技术 (NGS) 能够使用 16S rDNA 测序将细菌 DNA 与肿瘤组织区分开来,然而,由于瘤内细菌丰度低和宿主基因组污染严重,从组织处理或试剂中引入的环境噪声信号使数据收集变得复杂,因为它们会掩盖组织的真实微生物概况并削弱结论的稳健性。
这些技术挑战在过去几年已被攻克,多个研究小组报告了大量数据,进一步支持瘤内微生物群的存在。此外,生物信息学微生物特征能够区分健康个体和癌症患者。
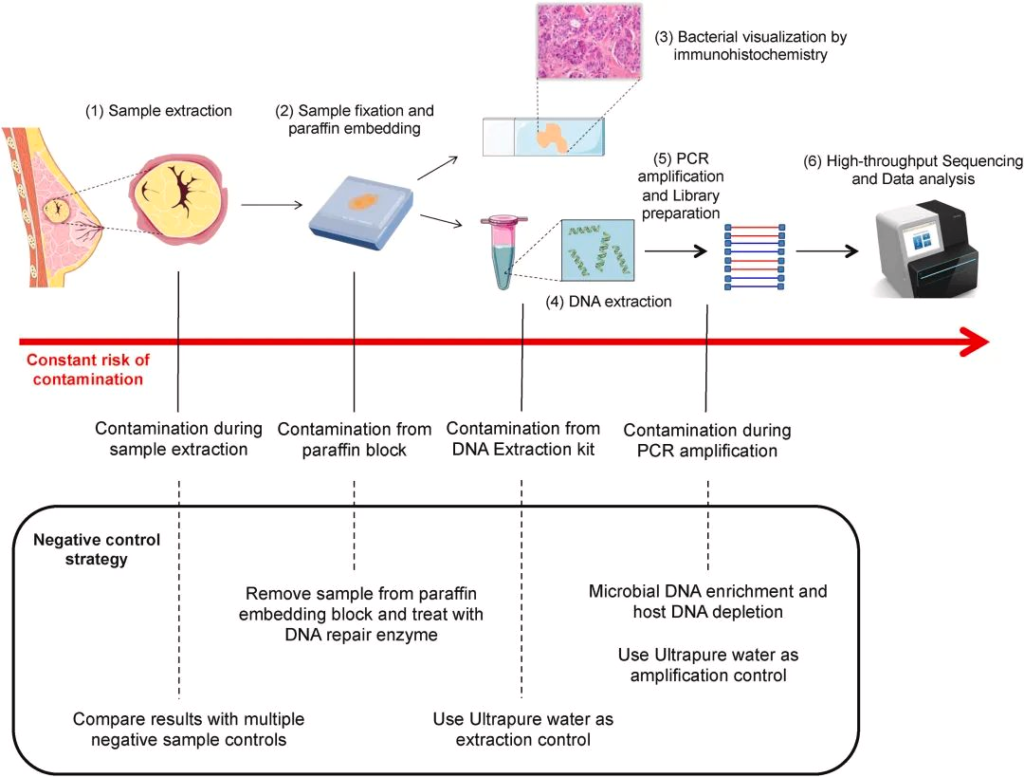
doi.org/10.1016/j.canlet.2021.09.009
识别肿瘤微生物组为癌症研究领域开辟了新的机遇。更好地表征肿瘤内微生物组可能会导致开发新的治疗方法,从而克服传统的癌症治疗方法。下一代测序方法,包括 16S 扩增子测序,可以在组织提取和石蜡固定后,将肿瘤内细菌精确地聚集在确定的细菌亚群中。
此外,宏基因组学对于肿瘤内微生物的鉴定也很重要。
宏基因组
宏基因组是一种针对样本中所有 DNA 的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。
此外,宏基因组学可以与转录组分析结合使用,以消除死亡微生物和细胞外DNA造成的干扰。
最近的研究表明,最新的宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
在瘤内微生物研究中,宿主DNA和环境微生物DNA的污染是最大的障碍。因此,需要开发从 TCGA 中丢弃不可信数据的方法。
在一项分析多种癌症的研究中,研究人员删除了总序列数据的 92.3%,以确保分析中数据的可靠性。2021 年,Dohlman 等人开发了一种去污染算法,可以去除 TCGA 数据中的污染。
随着这些方法的发展,宏基因组学可以为肿瘤内微生物群的研究提供更有力的支持。
▸ 细菌是各种癌症类型中肿瘤组织不可或缺的组成部分和活的居民
各种癌症类型有不同的微生物群。
肿瘤内微生物群的组成与许多类型的癌症有关。器官和组织包括食道、肺、乳腺、前列腺、膀胱、胃、肾、肝、胰腺等,以前被认为是无菌的。下一代测序显示这些器官含有低生物量微生物群。瘤内微生物组是肿瘤微环境的主要组成部分,影响肿瘤发生、疾病进展、耐药性和预后。
不同癌症类型的肿瘤内微生物群生态位
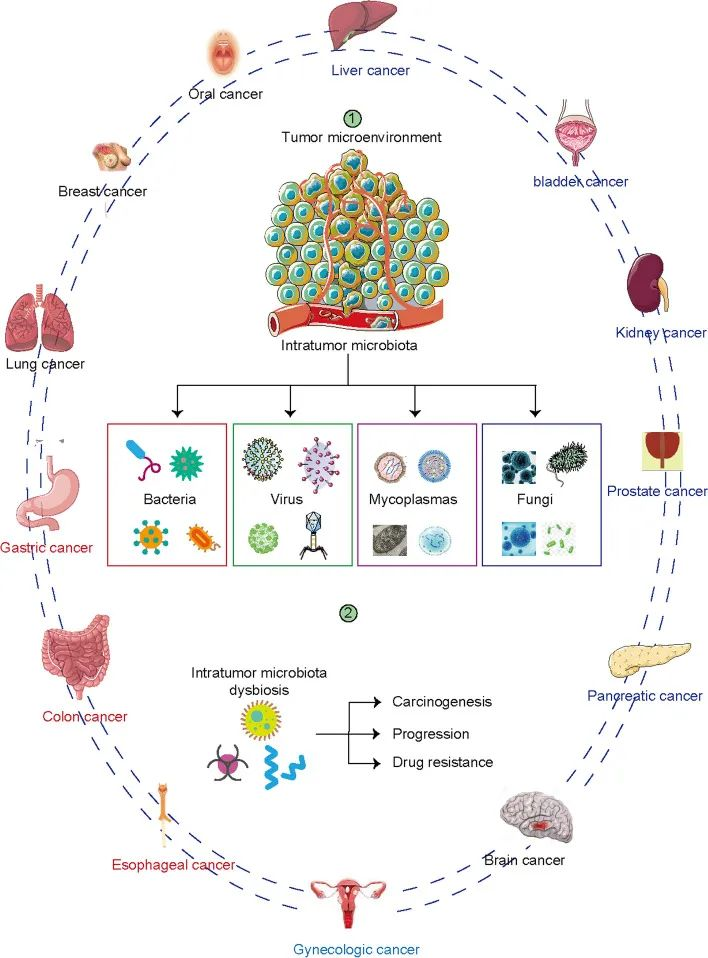
Liu J, et al., Biomark Res. 2022
在暴露于环境的组织(如肺癌和黑色素瘤)中并未发现微生物群丰度最高,而是在乳腺癌,骨癌,胰腺癌中。这表明肿瘤内微生物群的丰度是肿瘤特异性的。
作为癌症生态系统不可或缺的组成部分的肿瘤内微生物群
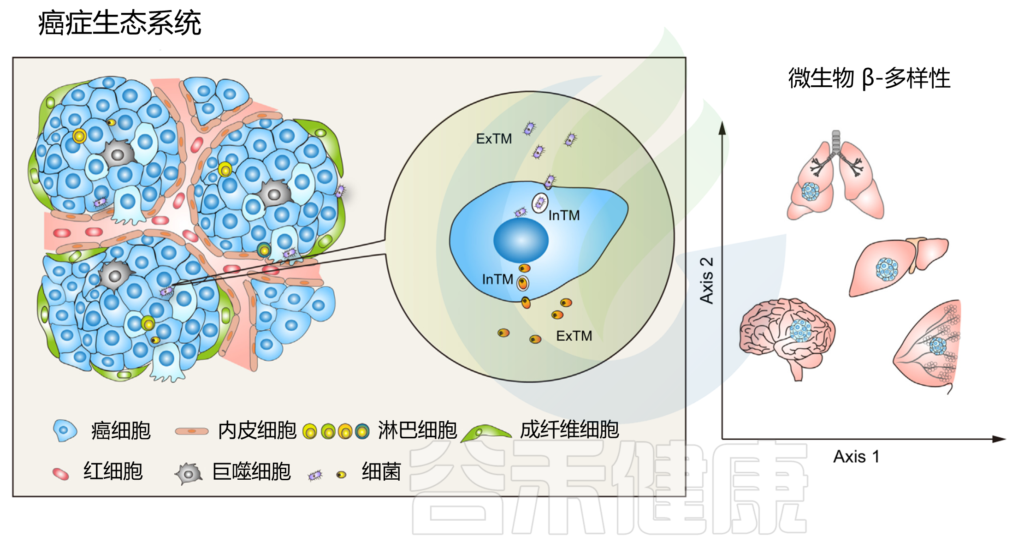
doi.org/10.1016/j.tcb.2022.11.007
如果肿瘤内微生物群存在于广泛的癌症类型中,那么它们来自哪里?
很少有研究专门去调查其原始来源。然而,对来自肿瘤组织的分离细菌菌株的分析提供了一些见解。
在小鼠乳腺肿瘤中,在正常组织对应物中检测到肿瘤内细菌菌株,这表明肿瘤组织从周围组织获得某些细菌。这些细菌菌株在体内的主要栖息地是多种多样的,有皮肤上的葡萄球菌、口腔中的链球菌和肠道中的肠球菌。
鉴于细菌具有在组织之间传播的能力,肿瘤内微生物群可能有多个起源。对鼻咽癌的分析表明,瘤内细菌主要来自鼻咽部,一小部分来自口腔和肠道。
* 也需要通过宏基因组比较和基因追踪分析来进一步加强。
肿瘤内微生物群的来源
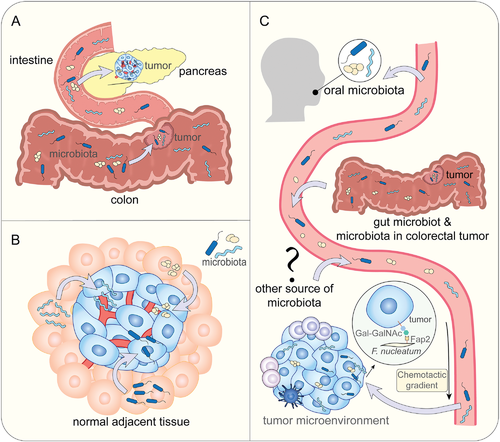
doi.org/10.1002/advs.202200470
A) 通过粘膜屏障从粘膜部位产生的肿瘤内微生物
B) 从正常邻近组织产生的肿瘤内微生物
C) 肿瘤内微生物是血行传播的结果
瘤内细菌的共同特征
1- 丰度低
它们在癌组织中的丰度远低于肠道中的丰度,根据 qPCR 定量和成像定量,0.1-10% 的癌细胞携带细菌,不同的量化方法和/或细菌 DNA 的提取效率引入了差异。
2- 多样性低
癌组织中微生物群落的多样性通常低于正常组织,这表明肿瘤可能形成一个独特的环境,选择性地扩展某些细菌种类。
3- 活的
这些细菌是活的。主要是主要存在于细胞内空间的共生生物。癌组织中不同的细菌栖息地可能与其在与癌细胞相互作用时的多效性作用模式有关。
细胞内外微生物群功能不一
鉴于细胞内和细胞外空间之间存在巨大的分子、生物化学和生物物理学差异,在肿瘤起始、肿瘤进展过程中,与细胞外肿瘤驻留微生物群 (ExTM) 相比,细胞内肿瘤驻留微生物群 (InTM) 可能具有完全不同的功能和免疫相互作用。
长期以来,细胞内细菌一直被研究为参与病原体-宿主相互作用的致病菌菌株。致病菌通过“触发”或“拉链”模式侵入宿主细胞,并能够迅速破开核内体膜进入细胞质。
肿瘤内共生细菌是遵循相同的原则还是使用不同的机制来侵入癌细胞?这方面仍知之甚少。在特定的癌症类型中,如乳腺癌,肿瘤内微生物群落主要以革兰氏阳性和兼性厌氧细菌为主,这表明肿瘤微环境具有选择效应。
不同的肿瘤类型具有不同的血管生成和氧水平、内吞作用和微胞作用以及周围组织中的微生物来源。这些因素共同决定肿瘤内微生物群的组成,并形成肿瘤类型特异性特征。
肠道菌群刺激特定代谢物的产生,调节免疫系统,并重建远端器官的微环境。相比之下,专门研究肿瘤内微生物群在癌症转移中的作用的研究有限。
这个领域的研究还比较浅,缺乏合适的实验工具来准确和特异性地调节肿瘤内的微生物群,同时又不扰乱身体其他部位的共生细菌。这个问题可以通过使用各种抗生素给药方案、使用无菌小鼠和原位细菌再给药来部分解决。
越来越多的证据证实,瘤内细菌可以调节癌细胞的内在特性及其外部环境,从而增强癌细胞的能力并为癌症转移铺平道路。
为了克服转移过程中的物理、化学和生物学挑战,癌细胞通常会改变其内在程序以应对不利的环境。这些包括干细胞程序/可塑性(用于新位点的肿瘤起始)、EMT 程序(用于癌症侵袭和传播)、粘附程序(防止失巢凋亡诱导的细胞死亡)和机械应激反应程序(抵抗机械力诱导的损伤) 。
研究表明,这些程序也可以通过肿瘤内微生物群进行调节。
肿瘤内微生物群改变癌细胞的内在特性并重塑转移中的肿瘤微环境
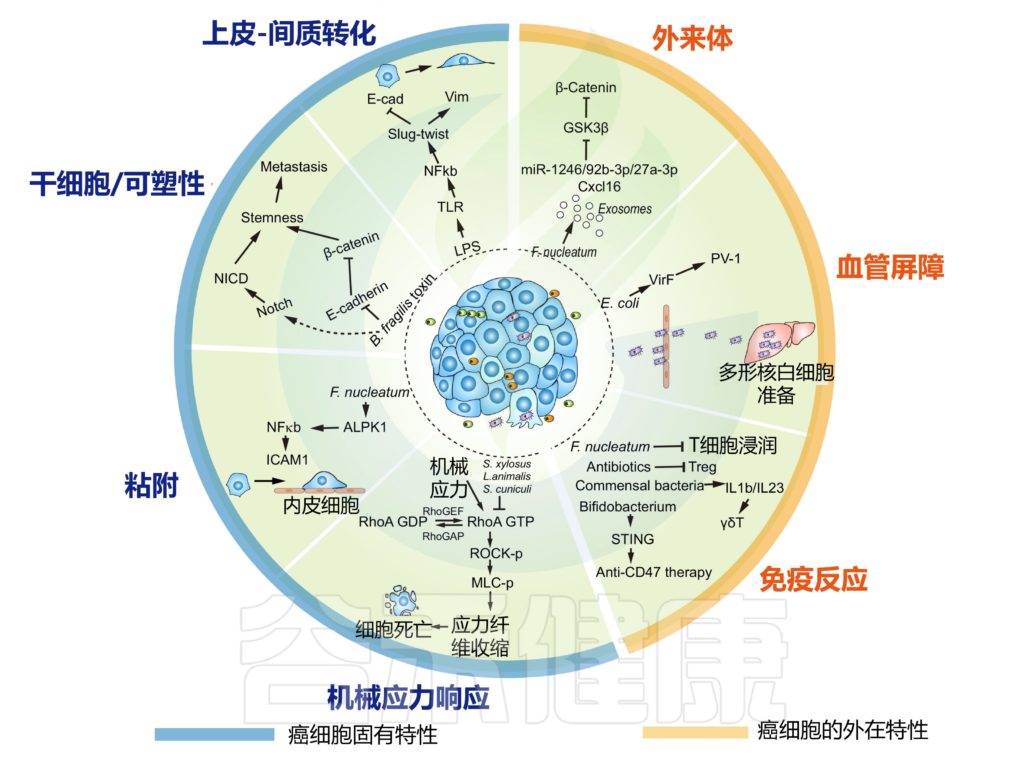
doi.org/10.1016/j.tcb.2022.11.007
我们先来看看,EMT程序是什么?
EMT程序赋予癌细胞迁移性间充质特征,具有松散的细胞间粘附特性,可动员癌细胞进行侵袭和扩散。这是由 TGFβ 信号通路的激活和与 Zeb、Twist 和 Snail 相关的协调转录程序驱动的。
微生物群和EMT程序之间有关联吗?
答案是肯定的。多项研究表明微生物群与 EMT 之间存在相关性。
在人类乳腺癌细胞系中,肿瘤驻留脆弱拟杆菌分泌的毒素诱导迁移和侵袭表型,EMT 相关的 Slug 和 Twist 的表达升高。在位于乳腺导管的肿瘤细胞中,脆弱拟杆菌的定植刺激了远端器官转移的增强。
这种功能调节是否仅限于细胞外肿瘤驻留微生物群,还是也适用于细胞内肿瘤驻留微生物群,以及不同的肿瘤驻留细菌对 EMT 的影响有多普遍,仍然是一个悬而未决的问题。
然而,有证据表明,脂多糖能够在依赖于 TLR-NFκB 通路的正常人肝内胆管上皮细胞中诱导 EMT.
在 EMT 驱动的小鼠结肠癌模型中,微生物群的存在对于肿瘤的发展至关重要。
这些研究支持组织驻留微生物群与 EMT 计划之间存在联系。
癌细胞的可塑性和干性是转移启动的另一个重要因素。
研究发现,脆弱拟杆菌毒素可以裂解 E-cadherin,触发下游 β-catenin 核定位,伴随 Notch 效应子 NICD 在乳腺癌中的核聚集。
在小鼠移植肿瘤模型中,Wnt 和 Notch 信号通路的后续激活,导致干性和肿瘤生长以及转移进展。
在自发性 MMTV-PyMT 乳腺肿瘤模型 [具有多瘤病毒中间 T 抗原 (PyMT) 的小鼠乳腺肿瘤模型在小鼠乳腺肿瘤病毒 (MMTV) 长末端重复序列下表达],各种肿瘤驻留细菌物种侵入 PyMT 癌症细胞触发了乳腺干细胞程序的富集。 由于与细菌侵入的癌细胞的体内分离相关的挑战,尚不清楚干细胞程序是否可以在生理细胞环境中被肿瘤内细菌激活。
癌细胞渗入血流引发细胞死亡程序
癌细胞渗入血流伴随着粘附丧失,这通常引发失巢凋亡,或其他形式的细胞凋亡的细胞死亡程序。癌细胞表面粘附分子的表达增强了它们的存活,并防止了转移失败。
在人类结直肠癌细胞系中,结直肠癌中常见的具核梭杆菌通过上调粘附分子 ICAM1 显着增强癌细胞对内皮细胞的粘附。这种增强的粘附力使癌细胞能够在尾静脉注射测定中外渗并引发新的转移灶。ICAM1 的上调部分是通过细菌依赖性激活 Alpk1-NFκB 通路实现的。
循环癌细胞受机械应力的影响导致细胞损伤
除了失巢凋亡依赖性细胞死亡外,循环癌细胞还会受到血液中各种机械应力的影响,从而导致细胞损伤,例如流体剪切应力,并在远端器官中,导致结构限制。
这些应激源部分被粘附分子(如整合素)感知,由 RhoGTPase 信号级联传递,并由 Yap/Taz 转录因子协调。
小鼠肿瘤模型的新发现表明,InTM 在侵入宿主癌细胞时会触发流体剪切应力反应,并且这种反应与细菌物种促进转移的能力相关。
被细菌侵入的癌细胞可以携带细菌,游走至远端器官,促进癌细胞的存活。这种表型是 InTM 特有的,因为通过调节 RhoAGTPase-Rock-actin 细胞骨架重组途径,癌细胞变得更能抵抗机械应力。引发这种反应的细菌机制仍不清楚。
然而,从肉毒梭状芽胞杆菌中分离出来并被多种细菌共享的 ADP-核糖基转移酶 C3 胞外酶是一个潜在的候选者,因为 C3 对细胞是不可渗透的,并且与膜穿透肽融合的 C3 经常被细胞生物学家用来解离肌动蛋白应力纤维并增强细胞扩散。
除了直接调节癌细胞外,瘤内细菌是重要的炎症介质,可以在癌细胞周围形成特定的微环境,从而间接促进癌症转移。
调节 PMN 的关键因素之一是细菌本身
结直肠癌研究表明,肿瘤驻留细菌能够通过毒力因子 VirF 调节肠道血管屏障。PV-1 表达升高的血管屏障受损,促进了细菌从原发性结直肠肿瘤传播到肝脏,并在癌细胞到达之前建立了 PMN.
注:PMN-迁移前生态位
患者体内较高的 PV-1 水平与较高的细菌负荷和较远的转移有关。这种依赖于细菌的 PMN 远程控制是一个新概念,可能对癌症以外的疾病有影响。
肿瘤外泌体可以调节 PMN 并决定转移器官的趋向性
肿瘤外泌体含有多种功能性脂类、蛋白质、RNA和DNA,释放到细胞外环境中调节靶细胞,重塑微环境。
源自具核梭杆菌侵入的人结直肠癌细胞,分离出含有 miR-1246/92b-3p/27a-3p 和 Cxcl16 的外泌体。这些外泌体在调节结直肠癌细胞迁移方面发挥作用,并通过靶向 GSK3β 激活 Wnt-β-catenin 信号通路显著增加肺转移。
这意味着邻近的癌细胞不一定需要被细菌侵入才能转移;相反,它们也可以通过旁分泌外泌体信号来动员以启动转移。
瘤内细菌最显着的特征之一是它们可以被免疫系统识别,从而触发特定的免疫反应
有许多关于肠道菌群失调与异常免疫反应之间关联的报道,但肿瘤内微生物群在调节免疫系统中的作用仍不清楚。
一方面,抗生素治疗和细菌再给药试验显示肿瘤内细菌抑制免疫反应的证据
在乳腺癌中,瘤内具核梭菌以免疫介导的方式加速肿瘤进展和肺转移,瘤内给药具核梭菌减少浸润的 CD4+ 和 CD8+ T 细胞。
在小鼠黑色素瘤癌症模型中,肺组织的抗生素治疗降低了细菌负荷,显示出调节性 T 细胞减少,T 细胞和自然杀伤 (NK) 细胞活化增强,同时肺转移显着减少。
在转基因小鼠肺癌模型中,肺部共生细菌激活了 γδT 细胞,这是一种 T 细胞亚群,通过刺激骨髓来源的 IL1β 和 IL23 并引发肿瘤炎症来促进淋巴和骨髓谱系的炎症反应。
另一方面,肿瘤内细菌可以触发抗肿瘤免疫。
例如,益生菌(鼠李糖乳杆菌)的施用强烈促进了针对小鼠黑色素瘤肺转移的肿瘤免疫。
此外,瘤内注射双歧杆菌可刺激 STING 通路,增加树突状细胞数量,并促进基于抗 Cd47 的免疫治疗。
因此,肿瘤内细菌的免疫调节作用是复杂的,并且依赖于环境,并且可能是细菌物种特异性的和/或受其细胞内/细胞外居住状态的高度影响。
传统癌症疗法的限制
迄今为止,主要的癌症疗法基于手术、放疗和化疗。尽管对大多数确定的肿瘤有效,但它们都有缺点,依赖于冗长、乏味的程序,非特异性地对抗肿瘤,通常无法区分恶性组织和健康组织。
由于缺乏对肿瘤样区域的特异性,某些癌细胞得以存活并定植在附近的组织中,从而导致潜在的癌症复发。靶向健康组织可能会产生意想不到的副作用,从而导致严重的致癌 DNA 损伤。
所有这些缺点,加上对治疗产生耐药性的持续风险,与癌症死亡率和发病率的增加有关。
90%的癌症患者死于复发或转移。
肿瘤内微生物群的作用可以通过具有肿瘤内微生物群信息的癌症患者的生存数据来评估。
在胰腺癌患者中,与短期幸存者相比,长期幸存者往往具有更高的微生物群落多样性。
此外,肿瘤内微生物群特征(假黄单胞菌Pseudoxanthomonas–链霉菌Streptomyces–糖多孢菌Saccharopolyspora –克劳氏芽孢杆菌Bacillus clausii)被确定与生存相关。
在其他癌症类型中,尽管样本量有限,但据报道特定的肿瘤内微生物组特征也与转移有关。
在对 800 多个患者样本进行分析的鼻咽癌临床研究中,肿瘤内细菌载量被确定为一种强有力的预后工具,可以区分恶性进展的风险。这些研究证实了肿瘤内微生物群的预后价值,并支持其在临床肿瘤进展中的作用。
然而,在临床上特异性调节肿瘤内微生物群具有挑战性。
有几项关于抗生素治疗和癌症风险、癌症反应和生存的回顾性研究,但它们很少专门设计用于剖析肿瘤内微生物群的消除和患者预后。
这些广泛的抗生素治疗数据分析报告了癌症发病率的增加和对免疫疗法的一般反应受损。鉴于已经确定肠道微生物组与免疫检查点抑制剂治疗密切相关,目前尚不清楚肠道肿瘤微生物组在调节癌症进展方面是否具有相似或不同的作用。
相比之下,一项胰腺腺瘤研究表明,抗生素治疗与晚期转移性胰腺导管腺癌的更好预后相关。
鉴于抗生素在效力、吸收效率、细胞渗透性以及给药途径和时间窗的可变性方面存在巨大差异,所有这些变量都可能导致肠道微生物组和细胞内/细胞外肿瘤微生物组概况的根本差异。因此,迫切需要精心定义的肿瘤内微生物群调节临床研究集。
肿瘤内微生物群数据在癌症筛查和治疗中的应用
Liu J, et al., Biomark Res. 2022
A) 来自临床样本的数据可能有助于开发新的癌症筛查和预后,包括来自肿瘤部位和易于获取的样本的微生物群模式。
B) 肿瘤内微生物群可用于癌症治疗,包括工程菌、饮食调节、粪便微生物组移植、抗生素和肿瘤内微生物组注射等。
新兴研究揭示了肿瘤内微生物群在癌症转移的各个步骤中的生物学功能。这些肿瘤内微生物群不仅是肿瘤环境的传感器、肿瘤病理类型、药物反应和预后的指标,而且在功能上也参与肿瘤进展。
肠道细菌的宿主内进化会导致共生菌株变成致病。因此,需要进一步的研究来测试肿瘤内细菌促进癌症转移的能力是否源于细菌进化。这或许可以解释不同的细菌种群及其在正常组织和癌组织中的各种功能,以及为什么某些肿瘤类型比其他肿瘤发展得更快。
未来,肿瘤内微生物领域将受到更多关注,该领域有四个方面可能成为未来研究的重点:
肿瘤内微生物群可以作为癌症筛查的生物标志物。
包括肿瘤内微生物组衍生的个性化数据,这些数据可以将食管癌、胰腺癌、肺癌和口腔癌患者与健康人区分开来。分析肿瘤内微生物群特征,可能为患者的预后提供潜在的生物标志物。
此外,肿瘤内微生物群为癌症治疗带来新的机遇。
考虑到肿瘤内微生物群的异质性,个性化治疗策略因其高效和靶向作用而具有吸引力。
肿瘤内细菌的细胞外和细胞内定位使它们成为药物载体的完美候选者,可以在肿瘤细胞内外递送,以倒带细胞间和细胞内信号网络。
与其他抗肿瘤疗法一样,细菌疗法和抗生素也可以与其他疗法结合使用,例如免疫疗法和化学疗法。
使肿瘤内微生物群正常化和移植某些微生物也是提高抗肿瘤治疗效率的潜在策略。
癌症疗法正面临着巨大的转变:传统疗法正逐渐被更精确和复杂的疗法所取代。了解肿瘤内微生物群对癌症发生和发展的不同贡献,将有助于制定癌症预防和治疗策略。
主要参考文献:
Fu A, Yao B, Dong T, Cai S. Emerging roles of intratumor microbiota in cancer metastasis. Trends Cell Biol. 2022 Dec 13:S0962-8924(22)00258-6. doi: 10.1016/j.tcb.2022.11.007. Epub ahead of print. PMID: 36522234.
Liu J, Zhang Y. Intratumor microbiome in cancer progression: current developments, challenges and future trends. Biomark Res. 2022 May 31;10(1):37. doi: 10.1186/s40364-022-00381-5. PMID: 35642013; PMCID: PMC9153132.
An Y, Zhang W, Liu T, Wang B, Cao H. The intratumoural microbiota in cancer: new insights from inside. Biochim Biophys Acta Rev Cancer. 2021 Dec;1876(2):188626. doi: 10.1016/j.bbcan.2021.188626. Epub 2021 Sep 11. PMID: 34520804.
Heymann CJF, Bard JM, Heymann MF, Heymann D, Bobin-Dubigeon C. The intratumoral microbiome: Characterization methods and functional impact. Cancer Lett. 2021 Dec 1;522:63-79. doi: 10.1016/j.canlet.2021.09.009. Epub 2021 Sep 10. PMID: 34517085.
Wang Y, Guo H, Gao X, Wang J. The Intratumor Microbiota Signatures Associate With Subtype, Tumor Stage, and Survival Status of Esophageal Carcinoma. Front Oncol. 2021 Oct 27;11:754788. doi: 10.3389/fonc.2021.754788. PMID: 34778069; PMCID: PMC8578860.
Xie Y, Xie F, Zhou X, Zhang L, Yang B, Huang J, Wang F, Yan H, Zeng L, Zhang L, Zhou F. Microbiota in Tumors: From Understanding to Application. Adv Sci (Weinh). 2022 Jul;9(21):e2200470. doi: 10.1002/advs.202200470. Epub 2022 May 23. PMID: 35603968; PMCID: PMC9313476.
Huang Y, Zhu N, Zheng X, Liu Y, Lu H, Yin X, Hao H, Tan Y, Wang D, Hu H, Liang Y, Li X, Hu Z, Yin Y. Intratumor Microbiome Analysis Identifies Positive Association Between Megasphaera and Survival of Chinese Patients With Pancreatic Ductal Adenocarcinomas. Front Immunol. 2022 Jan 25;13:785422. doi: 10.3389/fimmu.2022.785422. PMID: 35145519; PMCID: PMC8821101.