 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
人的身体拥有数千种细菌,这些细菌在维持健康方面发挥着重要作用。当这些细菌失控繁殖并侵入身体的其他部位或将有害细菌引入身体的系统时,可能会发生细菌感染。
细菌感染的严重程度取决于所涉及的细菌类型和所感染的部位等。细菌最常感染肠道、皮肤和呼吸系统,包括肺、泌尿道和阴道。
目前应对细菌感染的主要治疗方法还是使用抗生素,但是抗生素管理,或改进抗生素的处方和使用方式,对于优化感染患者的治疗、保护患者免受伤害和对抗抗生素耐药性至关重要。
今天我们重点了解下什么是细菌感染,感染的症状、原因和类型,包括诊断测试和治疗方案,抗生素什么时候使用,什么时候不用,抗生素的耐药性如何产生以及使用抗生素的注意事项等。
了解什么是细菌感染以及如何治疗细菌感染,我们应该先了解细菌的概念。
来源:MedicineNet
地球上所有的生物都是由两种基本类型的细胞中的一种组成:
真核细胞,其遗传物质被包裹在核膜内;
原核细胞,其遗传物质与细胞的其他部分不分离。
传统上,所有的原核细胞都被称为细菌,被归为原核生物界。
1970年代后期,美国微生物学家卡尔·沃斯(Carl Woese)率先在分类上进行了重大变革,将所有生物分为真核生物、细菌(原名真细菌)和古细菌(原名古细菌)三个领域,以反映三条古老的进化路线。原核生物以前被称为细菌,然后被分为两个领域,细菌和古细菌。
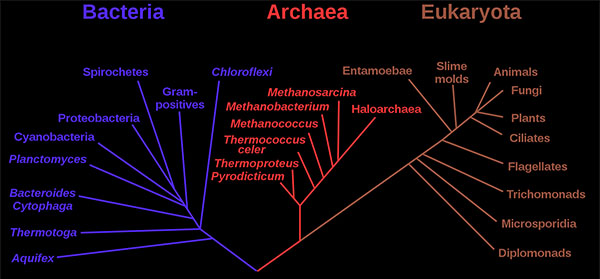

published by Woese et al.
细菌和古细菌在表面上是相似的,例如,它们没有细胞内的细胞器,它们有环状DNA。但是,它们在本质上是截然不同的,它们的分离是基于其古老而又独立的进化谱系的遗传证据,以及其化学和生理学的根本差异。这两个原核域的成员彼此之间的区别与它们和真核细胞中的区别一样。
细菌细胞在几个方面不同于动物细胞和植物细胞。一个根本的区别是细菌细胞缺乏动物细胞和植物细胞中都存在的细胞内细胞器,例如线粒体,叶绿体和细胞核。细菌体积小,设计简单,代谢能力强,使它们能够迅速生长和分裂,并在几乎任何环境中生存和繁衍。
细菌,动物和植物细胞的比较

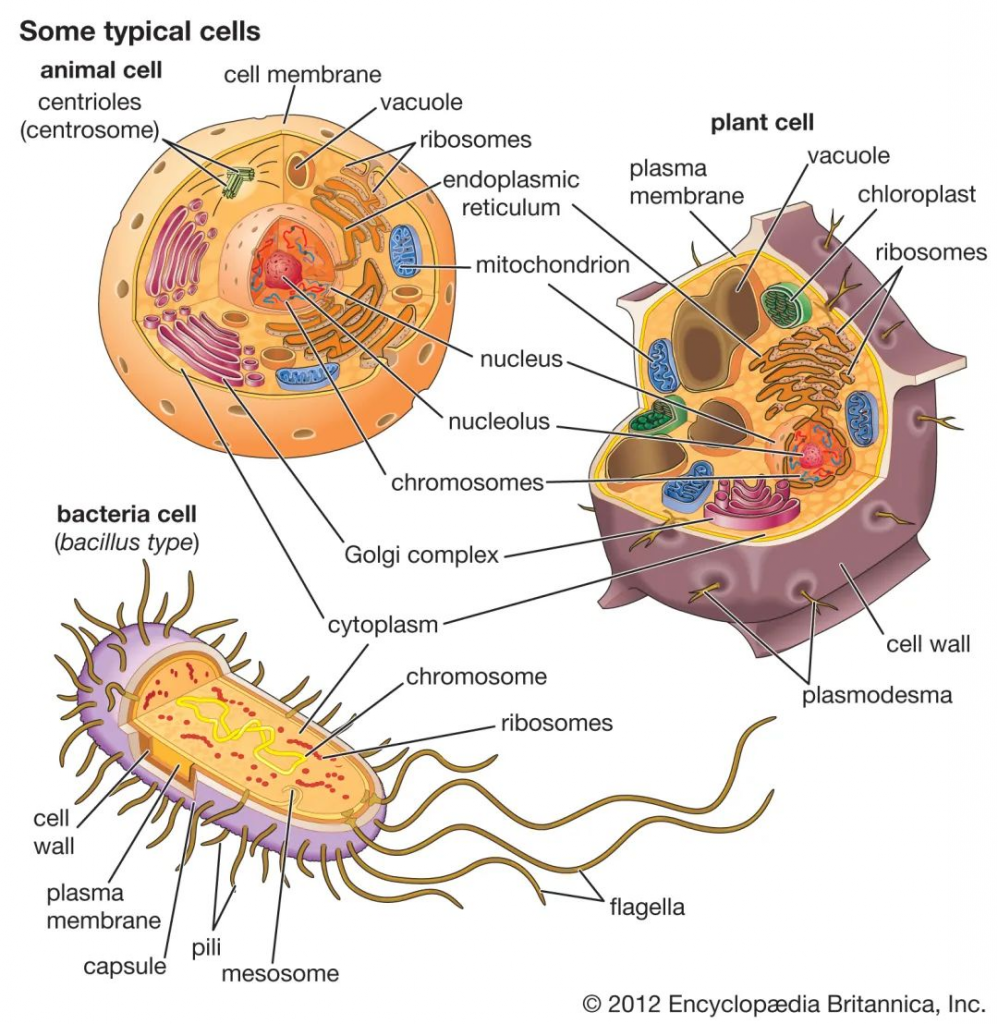
除此之外,原核和真核细胞在许多其他方面有所不同,包括脂质组成,关键代谢酶的结构,对抗生素和毒素的反应以及遗传信息的表达机制。
真核生物包含多个线性染色体,这些染色体的基因比编码蛋白质合成所需的基因大得多。遗传信息的核糖核酸(RNA)副本(脱氧核糖核酸或DNA)的大部分被丢弃,剩余的信使RNA(mRNA)在被翻译成蛋白质之前已被充分修饰。相反,细菌具有一个包含所有遗传信息的环形染色体,它们的mRNA是其基因的精确副本,不会被修饰。
细菌细胞在结构上比真核细胞小得多,也简单得多,但细菌是一个在大小、形状、生境和代谢上都有差异的极其多样化的有机体群体。
许多关于细菌的知识来自对致病细菌的研究,这些细菌比许多自由生活的细菌更容易在纯培养中分离出来,也更容易被研究。必须注意的是,许多自由生活的细菌与适应作为动物寄生虫或共生体生活的细菌有很大的不同。因此,关于细菌的组成或结构没有绝对的规则,任何说法都会有许多例外。
大多数细菌对地球上的生命都是有益的,甚至是生命所必需的,但少数细菌却对人类有害。目前,没有一种古细菌被认为是病原体,但是包括人类在内的动物不断遭到大量细菌的“轰击和居住”。
口腔,肠道和皮肤被大量特定类型的细菌定殖,这些细菌适应这些栖息地的生活。这些微生物在正常情况下是无害的,并且仅在它们以某种方式穿过身体的屏障并引起感染时才变得危险。
一些细菌擅长入侵宿主,被称为病原体或疾病产生者。一些病原体作用于人体的特定部位,例如:
在食物中传播的许多致病菌的毒素在摄入时会引起食物中毒。
由金黄色葡萄球菌(Staphylococcus aureus)产生的毒素,能引起迅速、严重但有限的胃肠道不适。
肉毒梭菌(Clostridium botulinum)的毒素,通常是致命的。在密封前未完全煮熟的罐装非酸性食品中可能产生肉毒杆菌毒素。肉毒梭菌形成耐热孢子,可以发芽为营养细菌细胞,在厌氧环境中茁壮成长,这有利于产生其极强的毒素。
其他食源性感染实际上是由受感染的食物处理者传播的,包括伤寒、沙门氏菌病(沙门氏菌属)和志贺氏菌病(痢疾志贺氏菌属)。
关于食物中毒相关细菌详见:正值夏季,警惕食源性疾病,常见的食物中毒的病原菌介绍
细菌感染是指病原菌侵入宿主组织。当有害细菌进入人体或伤口并繁殖,导致疾病、器官损伤、组织损伤或疾病时,就会发生细菌感染。细菌可以感染身体的任何部位。
细菌感染很常见,但它们并不完全相同。细菌有很多种,每种对身体都有不同的影响。广义上来讲,细菌感染也可以是由任何细菌引起的任何内部或外部疾病的广义术语。
细菌存在于与人体的各种关系中。它们在体表内定殖并提供益处,正常情况下细菌可以与人类身体共存不会产生有害的影响(在共生关系中)。但是有时候,通常无害地存在于我们体内或皮肤上,而不会造成任何异常问题的细菌会失控并导致感染。这种情况通常发生在我们的免疫系统不够强大,无法保持它们的平衡,或者我们的微生物区系的组成发生了一些变化,对某些细菌生存繁殖更有利。
细菌感染是由体内的坏细菌引起的。一些细菌感染可能危及生命。标准的医学治疗通常涉及一剂抗生素。细菌感染很容易与病毒感染混淆。但是他们并不一样,后面我们会单独解释。
当皮肤粘膜有破损或发生化脓性炎症时,细菌则容易侵入体内。
人体的免疫反应可分为非特异性免疫反应及特异性免疫反应两种,后者又可分为细胞免疫与体液免疫两方面。当机体免疫功能下降时,不能充分发挥其吞噬杀灭细菌的作用时,即使入侵的细菌量较少,致病力不强也能引起感染;条件致病菌所引起的医源性感染也逐渐增多。
人体免疫功能正常时,进入血中的细菌迅速被血中防御细胞如单核细胞、嗜中性粒细胞等所清除,而患肝硬变、糖尿病、血液病、结缔组织病等慢性病者,可因代谢紊乱、体液免疫及细胞免疫功能减低,易招致败血症发生;各种免疫抑制药物的使用、放射治疗亦是导致败血症发病率高的原因。广谱抗菌药物使用后,对药物敏感的细菌虽被抑制或杀灭,而一些耐药菌乘机繁殖,亦可酿成败血症。
细菌侵入人体后是否引起感染,除了与人的防御、免疫功能,还与细菌的毒力及数量有关。毒力强或数量多的致病菌进入机体,引起感染的可能性较大。
严重烧伤时,创面为细菌敞开门户,皮肤坏死、血浆渗出又为细菌繁殖提供了良好环境,故极易发生感染。
尿路、胆道、胃肠道、呼吸道粘膜受破坏后,若同时有内容物积滞、压力增高,细菌更易进入血中,保留导尿管、静脉等血管内留置导管、人工辅助呼吸时插管等,也使细菌易于侵入。
细菌是微观的,通常是单细胞生物,到处都可以找到(例如,在我们体内、皮肤上、空气中、水里、土壤中或我们吃的食物里)。细菌具有传染性,因此,它可以通过与患者的密切接触在人与人之间传播。接触受污染的表面、食物、水以及打喷嚏和咳嗽就是例子。
发生感染的几个条件:
此外,细菌还可以导致急性感染(快递治疗)和慢性感染(持续很长时间甚至终生),以及潜伏感染(最初可能没有任何明显迹象或症状但可以过段时间自然发展)。症状可以从轻度、中度到重度不等。在严重的情况下,导致数百万人死亡;例如,许多人死于黑死病或鼠疫。
细菌感染的常见特征:
常见的各部位细菌感染的症状

细菌性感冒
细菌性感冒(Bacterial cold)是指继发细菌感染引起的感冒。感冒在习惯上分为病毒性感冒和细菌性感冒。
病毒性感冒有:普通感冒、流行性感冒和病毒性咽炎等。其主要不同是致病因素不同,病毒性感冒是由于病毒所致,而细菌性感冒是由于细菌所致。
注:流行性感冒(流感通过病毒传播,不是细菌性感冒,注意区分),是由流感病毒引起的急性呼吸道传染病。
细菌的感染还取决于受感染细菌的类型,常见的细菌感染例如:
细菌感染具有高度传染性,因此需要特别注意避免通过洗手、打喷嚏和咳嗽时遮盖以及不共用杯子和饮料瓶来传播感染。
细菌有多种传播方式,包括:

当你忍不住咳嗽或打喷嚏时,用纸巾捂住口鼻或用手肘内侧。
在下述情况下需要洗手,至少洗20秒:
如果没有肥皂和水,可以使用酒精含量至少为 60% 的酒精类洗手液。
除此之外,其他需要注意的:
接种疫苗。如轮状病毒是一种导致婴儿和幼儿严重肠胃炎的病毒。所有婴儿都应在 6 周和 4 个月大时接种轮状病毒疫苗。
流感疫苗。当患上流感时,免疫系统会被削弱。这使细菌有机会侵入肺部并引起感染。每年注射一次流感疫苗可以防止感染肺部细菌。
肺炎球菌多糖疫苗。美国疾病控制与预防中心 (CDC) 推荐 65 岁及以上的人接种肺炎球菌多糖疫苗 (PPSV)。它也适用于免疫系统较弱或患肺炎风险较高的成年人。
治疗取决于感染的严重程度、患者的年龄、免疫系统有多强、是否存在任何并存症状以及现有的医疗条件。
治疗可能包括:
扩展阅读:
细菌素——对抗感染、保存食品、重塑肠道菌群
还在滥用抗生素?15种天然抗生素助你调节肠道菌群
这里我们主要来了解一下,用于细菌感染的药物——抗生素。
目前抗生素是对抗细菌感染的常用药物。它们通过破坏细菌细胞生长和增殖所需的过程来发挥作用。
抗生素根据抗菌谱可以分为:
广谱抗生素,中谱抗生素和窄谱抗生素。
✓ 广谱抗生素
广谱抗生素可对抗多种细菌。广谱抗生素可治疗革兰氏阳性菌和阴性菌,因此如果医生不确定有哪些细菌,他或她可能会开出其中一种抗生素。
阿莫西林、奥格门汀、头孢菌素(第 4 代和第 5 代)、四环素氨基糖苷类和氟喹诺酮类(环丙沙星)是广谱抗生素的例子。
✓ 中谱抗生素
中谱抗生素针对一组细菌。青霉素和杆菌肽是流行的中谱抗生素。
✓ 窄谱抗生素
窄谱抗生素用于治疗一种特定的细菌。多粘菌素属于这一小类抗生素。当确定患有哪种细菌感染时,治疗会更容易和更有效。
抗菌活性通常分为五种机制:
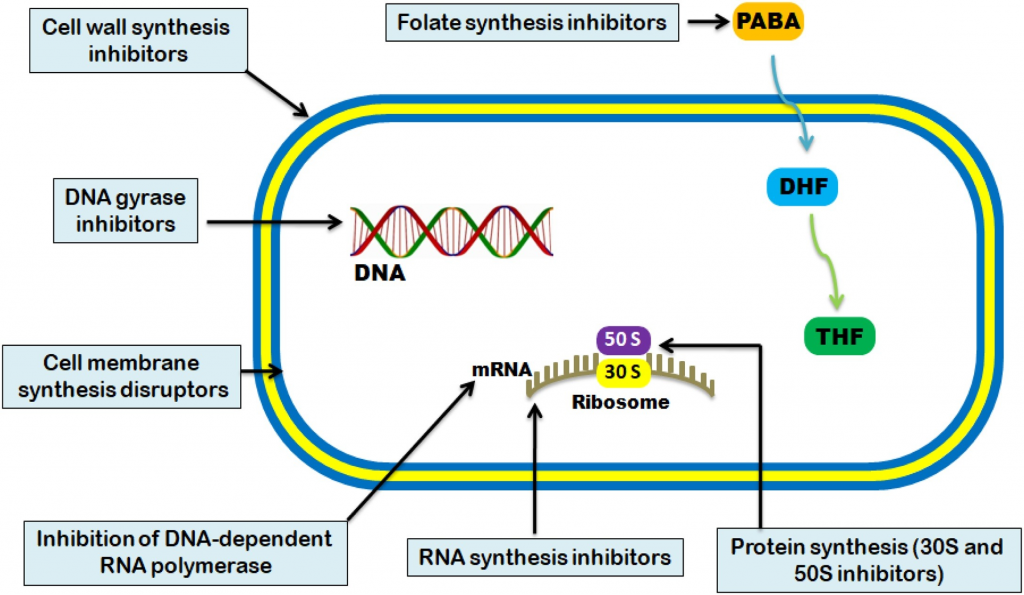

Uddin TM, et al., J Infect Public Health. 2021
不同种类抗生素作用的方式


Uddin TM, et al., J Infect Public Health. 2021
青霉素
最初的青霉素仅用于革兰阳性菌感染的治疗,由于金黄色葡萄球菌很快产生一种青霉素酶对青霉素产生了耐药,人们研制出了以甲氧西林、苯唑西林为代表的耐酶青霉素,用于产青霉素酶的葡萄球菌( 甲氧西林耐药者除外) 感染。
之后,以氨苄西林、阿莫西林为代表的广谱青霉素由仅对革兰阳性(G+) 菌有效扩展到对革兰阴性(G-) 菌( 主要为肠杆菌科细菌) 也具有抗菌活性。在广谱青霉素的基础上又发展为对铜绿假单胞菌等非发酵菌也具抗菌活性者,当前应用主要为脲基类青霉素,包括: 哌拉西林、阿洛西林、美洛西林。
代表药物: 阿莫西林(amoxicillin)
阿莫西林是一种抗细菌的青霉素抗生素。
阿莫西林用于治疗由细菌引起的多种不同类型的感染,例如扁桃体炎、支气管炎、肺炎以及耳、鼻、喉、皮肤或泌尿道感染。
阿莫西林有时还与另一种称为克拉霉素( Biaxin ) 的抗生素一起用于治疗由幽门螺杆菌感染引起的胃溃疡。这种组合有时与一种称为兰索拉唑(Prevacid)的胃酸减少剂一起使用。
四环素
四环素是一类抗生素,可用于治疗由易感微生物引起的感染,例如革兰氏阳性菌和革兰氏阴性菌、衣原体、支原体、原生动物或立克次体。
它们是在 1940 年代发现的,第一个四环素是从链霉菌中获得或衍生的。
四环素抑制微生物 RNA 中的蛋白质合成(一种重要的分子,作为 DNA 的信使)。它们主要是抑菌剂,这意味着它们可以防止细菌繁殖,但不一定会杀死它们。
四环素类药物现今应用的品种除四环素外,更常用有多西环素( 强力霉素) 和米诺环素( 二甲胺四环素) 。由于常见病原菌对本类药物耐药性普遍升高及其不良反应多见,当前本类药物临床应用已受到很大限制。
代表药物:强力霉素(doxycycline)
强力霉素是一种四环素抗生素,可以对抗体内的细菌。
强力霉素用于治疗许多不同的细菌感染,例如痤疮、尿路感染、肠道感染、呼吸道感染、眼部感染、淋病、衣原体、梅毒、牙周炎(牙龈疾病)等。
强力霉素也用于治疗由红斑痤疮引起的瑕疵、肿块和痤疮样病变。
某些形式的强力霉素用于预防疟疾、治疗炭疽或治疗由螨虫、蜱虫或虱子引起的感染。
什么是林可霉素衍生物?
林可霉素衍生物是一小类抗生素,可抑制细菌蛋白质的合成,而细菌蛋白质对细菌的生存至关重要。林可霉素衍生物保留用于治疗由肺炎球菌、葡萄球菌和链球菌的敏感菌株引起的感染。一种衍生物也可用于治疗恶性疟原虫(疟疾)。
林可霉素类包括林可霉素及克林霉素。克林霉素的体外抗菌活性优于林可霉素,主要可应用于敏感肺炎链球菌、其他链球菌属( 肠球菌属除外) 及甲氧西林敏感金葡菌所致的各种感染。该类药物对厌氧菌有良好的抗菌活性常与其他抗菌药物联合用于腹腔感染及盆腔感染,也由于其骨组织浓度较高适用于骨和关节的G + 菌感染。使用本类药物时,应注意假膜性肠炎的发生,如有可疑应及时停药。本类药物有神经肌肉阻滞作用,应避免与其他神经肌肉阻滞剂合用,应注意静脉滴注速度宜缓慢滴注,不可静脉推注。
代表药物:克林霉素(Clindamycin)
克林霉素是一种抗生素,可以对抗体内的细菌。
克林霉素用于治疗由细菌引起的严重感染。
服用此药前 如果对克林霉素或林可霉素过敏,则不应使用该药。
为确保克林霉素的安全,请告诉医生是否曾经有过:结肠炎、克罗恩病或其他肠道疾病; 湿疹或皮肤过敏反应; 肝病; 哮喘或对阿司匹林的严重过敏反应; 对黄色食用色素过敏。
什么是喹诺酮类药物?
喹诺酮类是一种抗生素。抗生素杀死或抑制细菌的生长。
有五种不同的喹诺酮类。此外,另一类抗生素,称为氟喹诺酮类,是从喹诺酮类通过氟修饰其结构衍生而来的。氟喹诺酮类抗生素可导致严重或致残的副作用,这些副作用可能不可逆。
喹诺酮类药物和氟喹诺酮类药物有许多共同点,但也有一些区别,例如它们对哪些生物有效。有些人互换使用喹诺酮和氟喹诺酮这两个词。
喹诺酮类和氟喹诺酮类对细菌产生的两种酶(拓扑异构酶 IV 和 DNA 促旋酶)的功能产生不利影响,因此它们不能再修复 DNA 或帮助其制造。
现今临床主要应用为氟喹诺酮类,常用有诺氟沙星、环丙沙星等主要用于单纯性下尿路感染或肠道感染。但应注意,现今国内尿路感染的主要病原菌大肠埃希菌中,耐药株已达半数以上。环丙沙星尚与β-内酰胺类抗生素联合用于治疗中、重度革兰阴性杆菌感染包括铜绿假单胞菌的感染。
近年来研制的新品种左氧氟沙星、莫西沙星等对肺炎链球菌、化脓性链球菌等G + 球菌的抗菌作用增强,对衣原体属、支原体属、军团菌等细胞内病原或厌氧菌的作用亦有增强,但对G-菌活性增强不明显,对铜绿假单胞菌的抗菌活性仍以环丙沙星为最强。左氧氟沙星、莫西沙星除可用于尿路感染或肠道感染外也可用于呼吸道感染,特别适合于肺炎链球菌( 包括耐青霉素肺炎链球菌) 、支原体、衣原体、军团菌等所致社区获得性肺炎的治疗,此外亦可用于皮肤软组织感染。
在治疗腹腔、胆道感染及盆腔感染时除莫西沙星外需与甲硝唑等抗厌氧菌药物合用。部分品种可与其他药物联合应用作为治疗耐药结核分枝杆菌和其他分枝杆菌感染的二线用药。
代表药物:环丙沙星(Ciprofloxacin)和左氧氟沙星(Levofloxacin)
环丙沙星和左氧氟沙星是一种氟喹诺酮抗生素,用于治疗不同类型的细菌感染。也用于治疗接触过炭疽或某些类型鼠疫的人。环丙沙星和左氧氟沙星应仅用于无法用更安全的抗生素治疗的感染。
左氧氟沙星、莫西沙星:对肺炎链球菌、A 组溶血性链球菌等革兰阳性球菌、衣原体属、支原体属、军团菌等细胞内病原或厌氧菌的作用强。
环丙沙星、左氧氟沙星:主要适用于肺炎克雷伯菌、肠杆菌属、假单胞菌属等革兰阴性杆菌所致的下呼吸道感染。
头孢霉素
头孢菌素是一大类从霉菌顶孢菌(以前称为头孢菌素)中提取的抗生素。头孢菌素具有杀菌作用(杀死细菌),其作用方式与青霉素相似。它们结合并阻断负责制造肽聚糖的酶的活性,肽聚糖是细菌细胞壁的重要组成部分。它们被称为广谱抗生素,因为它们对多种细菌有效。
自 1945 年发现第一个头孢菌素以来,科学家们一直在改进头孢菌素的结构,以使其对更广泛的细菌更有效。每次结构发生变化,都会产生新的“一代”头孢菌素。迄今为止,头孢菌素已有五代。所有头孢菌素均以 cef、ceph 或 kef 开头。请注意,该分类系统在不同国家/地区的使用并不一致。
第一代头孢菌素是指发现的第一组头孢菌素。它们的最佳活性是对抗革兰氏阳性细菌,如葡萄球菌和链球菌。它们对革兰氏阴性菌几乎没有活性。
第二代头孢菌素尚可应用于由流感嗜血杆菌、大肠埃希菌、奇异变形杆菌等中的敏感株所致的尿路感染、皮肤软组织感染、败血症、骨及关节感染和腹腔、盆腔等感染。但如用于腹腔感染和盆腔感染时需与抗厌氧菌药合用。头孢呋辛尚可用于脑膜炎球菌、流感嗜血杆菌所致脑膜炎的治疗,也可作为围术期预防用药。
第三代头孢菌素:对肠杆菌科细菌等革兰阴性杆菌具有强大抗菌作用,头孢他啶和头孢哌酮对铜绿假单胞菌亦具较强抗菌活性;注射品种有头孢噻肟、头孢曲松、头孢他啶、头孢哌酮等,口服品种有头孢克肟和头孢泊肟酯等,口服品种对铜绿假单胞菌均无作用。应注意的是,不是所有的三代头孢菌素都可用于非发酵菌( 如铜绿假单胞菌、不动杆菌等) 感染的治疗,除了头孢哌酮和头孢他啶;外,如头孢曲松和头孢噻肟不可以用于非发酵菌感染的治疗。
第四代头孢菌素:常用者为头孢吡肟,对肠杆菌科细菌作用与第三代头孢菌素大致相仿,对铜绿假单胞菌的作用与头孢他啶相仿,对革兰阳性球菌的作用较第三代头孢菌素略强。其不同于三代头孢菌素之处为对产头孢菌素酶( AmpC) 的肠杆菌属有效,其次是增强了对作用靶位细菌青霉素结合蛋白( PBP) 的亲和力以及其抗革兰阳性菌的抗菌活性亦较三代头孢菌素增强。
第五代(或下一代)头孢菌素头孢洛林( Teflaro ) 对耐甲氧西林金黄色葡萄球菌(MRSA)具有活性。Avycaz 含有β-内酰胺酶抑制剂avibactam。
代表药物:头孢氨苄(Cephalexin)
头孢氨苄是一种头孢菌素(SEF 一种低孢子)抗生素。它通过对抗体内的细菌起作用。
头孢氨苄用于治疗由细菌引起的感染,包括上呼吸道感染、耳部感染、皮肤感染、尿路感染和骨骼感染。
头孢氨苄用于治疗成人和至少 1 岁儿童的感染。
注意事项:
如果对头孢氨苄或类似抗生素(如Ceftin、Cefzil、Omnicef等)过敏,则不应使用该药。如果对任何药物(尤其是青霉素或其他抗生素)过敏,请告诉医生。
对任何药物(尤其是青霉素)过敏;
肝脏或肾脏疾病;要么肠道问题,例如结肠炎,请告诉医生。
头孢氨苄可以进入母乳。如果正在哺乳婴儿,请咨询医生。
β-内酰胺酶抑制剂
β-内酰胺酶抑制剂是一类阻断 β-内酰胺酶(也称为 β-内酰胺酶)活性,防止 β-内酰胺类抗生素降解的药物。本类药物适用于因产β-内酰胺酶的细菌感染,其抗菌谱主要依据原有抗生素的活性而酶抑制剂仅有对抗细菌产酶的作用,一般不增加抗菌活性。
β-内酰胺酶由以下细菌的某些菌株产生:拟杆菌属、肠球菌属、流感嗜血杆菌、卡他莫拉菌、淋病奈瑟菌和葡萄球菌属,无论是组成型还是暴露于抗微生物剂。
β-内酰胺酶裂解易感青霉素和头孢菌素的 β-内酰胺环,使抗生素失活。一些抗微生物药物(如头孢唑啉和氯唑西林)对某些 β-内酰胺酶具有天然耐药性。β-内酰胺类:阿莫西林、氨苄青霉素、哌拉西林和替卡西林,可以通过与β-内酰胺酶抑制剂组合来恢复和扩大其活性。
克拉维酸、舒巴坦和他唑巴坦都是β-内酰胺酶抑制剂。
大环内酯类
大环内酯类药物主要作为青霉素过敏患者的替代药物,用于治疗β-溶血性链球菌、肺炎链球菌中的敏感菌株所致的上、下呼吸道感染、敏感β-溶血性链球菌引起的猩红热及蜂窝织炎等感染。
大环内酯类是从红糖多孢菌(原名红链霉菌)中提取的一类抗生素,一种土壤传播的细菌。
红霉素是第一个发现的大环内酯类;其他大环内酯类包括阿奇霉素、克拉霉素和罗红霉素。
它们的作用主要是抑菌,但在高浓度时可能具有杀菌作用,或取决于微生物的类型。
代表药物:红霉素
红霉素为大环内酯类原型代表药物,由于其胃肠道反应大、口服吸收差使其疗效受到影响。当下在临床应用的主要为大环内酯类新品种罗红霉素、阿奇霉素和克拉霉素等,其他大环内酯类疗效多不如该三种药物。
罗红霉素主要是改善了其药代动力学,口服生物利用度明显提高、给药剂量减小、不良反应明显减少,但其抗菌谱没有明显的改善,是红霉素的替代药物。
氨基糖苷类
临床常用的氨基糖苷类药物主要有: 链霉素、卡那霉素、丁胺卡那霉素、庆大霉素、妥布霉素、奈替米星、依替米星。
其中链霉素当前主要用抗结核治疗,其次可用于治疗鼠疫及布鲁菌病; 庆大霉素、妥布霉素、奈替米星、依替米星肠杆菌科细菌和铜绿假单胞菌等G - 杆菌具强大抗菌活性,对葡萄球菌属亦有良好作用者。所有氨基糖苷类药物对肺炎链球菌、溶血性链球菌的抗菌作用均差。
链霉素、卡那霉素:对肠杆菌科和葡萄球菌属细菌有良好抗菌作用,但对铜绿假单胞菌无作用者。
庆大霉素、妥布霉素、奈替米星、阿米卡星、异帕米星、小诺米星、依替米星:对肠杆菌科细菌和铜绿假单胞菌等革兰阴性杆菌具强大抗菌活性,对葡萄球菌属亦有良好作用。
碳青霉烯类
碳青霉烯类药物是当下抗菌药物中抗菌谱最广的药物,对各种革兰氏阳性球菌、革兰氏阴性杆菌( 包括铜绿假单胞菌的非发酵菌) 和多数厌氧菌具强大抗菌活性,对大多数β-内酰胺酶高度稳定,但对甲氧西林耐药葡萄球菌和嗜麦芽窄食单胞菌等抗菌作用差。
当下在国内应用的碳青霉烯类抗生素有亚胺培南-西司他丁、美罗培南、帕尼培南-倍他米隆、比阿培南。厄他培南与上述品种不同对非发酵菌缺乏抗菌活性,而其他抗菌作用与上述药品基本相同,适合于治疗社区与医院早期特别是G-杆菌感染的重症患者。
碳青霉烯类对各种革兰阳性球菌、革兰阴性杆菌(包括铜绿假单胞菌、不动杆菌属)和多数厌氧菌具强大抗菌活性,对多数β-内酰胺酶高度稳定,但对甲氧西林耐药葡萄球菌和嗜麦芽窄食单胞菌等抗菌作用差。
现用于细菌感染的抗生素被认为是医学史上最重要的突破之一。不幸的是,细菌的适应性很强,抗生素的过度使用让许多人对抗生素产生了耐药性,造成了严重的问题,尤其是在医院的环境里。
抗生素耐药性是细菌抵抗抗生素杀伤力的能力。换句话说,以前治疗感染的抗生素没有效果了,或者说根本无法杀死细菌。
由于过度使用抗生素,抗生素耐药率持续上升,新的抗菌药物开发缓慢。感染耐药细菌可能导致住院时间更长、费用更高,并增加死于感染的风险。
抗生素耐药性是对全球健康的紧迫威胁,包括后来逐渐出现危险耐药细菌——“超级细菌”。
疾病控制和预防中心 (CDC)发布了对美国的前 18 种耐药性威胁的清单,至少包括:
注:以上这些并未全面列出所有耐药菌。抗生素耐药性模式不断演变,细菌可能并不总是对每位患者的选择抗生素表现出耐药性。在正常情况下,抗生素的选择应基于感染部位和由医疗保健专业人员评估的临床表现、培养/敏感性和其他所需的实验室结果、局部耐药性/敏感性模式以及患者的特定特征。
细菌通过以某种方式调整其结构或功能作为防御机制,从而对抗生素产生抗药性。
当细菌以某种方式发生变化时,细菌会抵抗药物。这种变化可以保护细菌免受药物的影响或限制药物接触细菌。或者这种变化可能导致细菌改变药物或破坏药物。
细菌可以用以下方式与抗生素抗争:
如果说以上列举的是抗生素产生耐药性的内因,那么除细菌本身外的因素也会导致抗生素耐药性的出现。
早前,医生有时会依赖不可靠或不准确的知识,开具抗生素“以防万一”,或在特定窄谱抗生素可能更合适时却开出广谱抗生素。这些情况加剧了选择压力并加速了抗菌素耐药性。
当医生不清楚是细菌或病毒加剧了感染时,他们可能会开抗生素。抗生素对病毒感染不起作用,可能会产生耐药性。
抗生素自我治疗(SMA)与药物使用不当的可能性有关,这会使患者面临药物不良反应的风险,掩盖潜在疾病的迹象,并在微生物中产生耐药性。
过度使用抗生素,尤其是在不正确治疗的情况下服用抗生素,会促进抗生素耐药性。根据疾病控制和预防中心的数据,人类使用大约三分之一的抗生素既不需要也不合适。
抗生素可以治疗由细菌引起的感染,但不能治疗由病毒引起的感染(病毒感染)。例如,抗生素是可以治疗由细菌引起的链球菌性咽喉炎。但对于大多数由病毒引起的喉咙痛,并不是正确的治疗方法。
每天都有成千上万的患者、工作人员和访客到达医院,每个人的衣服上和身体上/体内都有自己的一套微生物组。如果医院没有适当的程序和规程来帮助保持空间清洁,细菌就会传播。
抗生素被用作动物的生长补充剂和生长促进剂。在家畜中发现的耐抗生素细菌可能对人类致病,很容易通过食物链传播给人类,并通过动物粪便在生态系统中广泛传播。在人类中,这可能会导致复杂的、无法治疗的和长期的感染。
由于技术挑战、缺乏知识、对抗细菌生理学的重大困难,制药业对新抗生素的发明在很大程度上放缓了,当新抗生素普及时,耐药性的发展(在相对较短的时间内)几乎是不可避免的。
世界范围内抗生素的过度使用和滥用正在导致抗生素耐药性的全球医疗问题。可能会发生抗生素耐药性感染,在最坏的情况下,可能会没有有效的抗生素。这种情况在严重感染时可能会危及生命。
大多数病毒性疾病不需要特殊药物并且是“自限性”的,也就是说患者自身的免疫系统可以抵抗疾病。病毒性疾病的患者可以休息、多喝水并使用对症治疗。
由病毒引起的疾病包括:
有时,在复杂或长期的病毒感染中,细菌也可能侵入,并导致所谓的“继发感染”。在这些情况下,如果需要,可以使用抗生素。
在感染由病毒引起的疾病中,例如咳嗽、感冒或流感,患者不应要求医生开抗生素。抗生素不能治愈病毒感染,患者可能会因不必要的药物而产生副作用。医生可以用其他方法来帮助患有病毒性疾病的患者进行治疗。
如果感染没有得到正确治疗,抗生素耐药细菌也可能传播给其他人。
——有以下几个原因:
它可能不是治疗感染的正确抗生素
它可能已过时且无效
整个疗程可能没有足够的药物
如果新疾病是病毒感染,则不需要抗生素
一些疫苗可以预防细菌性疾病。抗病毒疫苗,例如流感疫苗或COVID-19 疫苗,可以帮助预防可能与继发性细菌感染(如严重的肺部肺炎)相关的原发性疾病。
在治疗的最初几天感觉好些了的时候,仍应完成整个抗生素疗程。
抗生素使用注意事项
✓ 按照指示使用抗生素
按照医生的指示治疗感染。医生会选择最能对抗导致感染的特定细菌的抗生素类型。目前市面上有许多不同种类的抗生素,大部分需要医生开出的非处方抗生素。
✓ 了解抗生素
有的抗生素需要进行皮试,比如青霉素,以防过敏,不同的抗生素杀菌的作用原理不尽相同,比如青霉素是通过能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用的一类窄普抗生素,杀菌作用强,可用于敏感菌所致的严重感染,由于该类药物作用的靶位为细菌细胞壁,而人体的细胞没有细胞壁,因此毒性低,用于老年人,新生儿和孕妇时安全性相对较高。
✓ 确保清楚抗生素的使用方式
确保明确知道应该服用多少抗生素,以及何时服用。有些抗生素需要与食物一起服用,有些需要在晚上服用等。特别注意要用完整的病征疗程抗生素,有些人担心抗生素对身体有副作用,病情稍微好转就会停止服用或注射抗生素,但是这可能导致体内的致病细菌未完全清楚,再次发生感染,或引起形成抗生素抗药性,使得以后的感染治疗变得困难。
✓ 清洁伤口以防止细菌感染
通过立即正确清洁和包扎伤口来预防皮肤感染。适当的急救治疗对于帮助预防细菌感染至关重要,但不应尝试自己治疗严重的皮肉伤口。如果伤口很深、很宽或出血很多,应该立即寻求医疗帮助。
治疗伤口前先洗手。如果你用脏手治疗伤口,会增加细菌感染的机会。用温水和抗菌肥皂洗手 20 秒,然后擦干。如果有条件可以戴上手套。
细菌感染性疾病起病急、进展快,重症疑难患者病原细菌复杂,诊断及治疗困难,可危及生命。早期、准确地明确病原微生物对感染判定至关重要,有助于改善预后。
准确诊断细菌感染对于避免不必要的抗生素使用和集中适当的治疗至关重要。
细菌感染是细菌的存在与炎症或全身功能障碍的结合;因此,通常需要不止一种诊断方式进行确认,确定患者是否符合临床病例定义的病史和检查。
不同的病原微生物检测技术对感染的判定价值不同,临床上也会根据患者的病情,可能感染的部位,可供采集的标本等选择适宜的检测技术。


当前,病原微生物检测技术层出不穷,能识别的微生物种类越来越多,但如何正确利用和分析微生物检测结果仍是临床关注的难题。值得注意的是,感染首先是个临床诊断,所有的判定必须基于临床。
定植容易对感染判定产生混淆。正常生理状态下人体口腔、胃肠道、呼吸道及体表等部位均有细菌、真菌存在,患者无感染症状时称为定植菌。当定植菌的致病力改变或机体防御能力下降时,可大量繁殖或被带入机体深部引起感染成为致病菌。
临床医生应如何判断所获取的病原体为定植还是感染,是长久以来的难题,且未形成成熟统一的解决方案。
呼吸道定植菌的综合分析:
就呼吸道定植菌而言,既往认为可根据菌落数量或菌种拷贝数来判定定植与感染,但结果存在偏差。越来越多的学者认为,临床上判定是定植还是感染,需结合患者症状、体征及其他检查结果综合分析。
若患者存在与检测阳性结果相匹配的临床症状和体征,如发热、咳嗽、咳痰等,感染指标升高,肺部出现新发病灶,应考虑感染并给予相应的抗感染治疗。如仅培养阳性,患者无任何感染相关临床表现,则倾向于定植菌。
念珠菌定植的综合分析:
念珠菌可广泛定植于呼吸道、胃肠道及泌尿生殖道,正常屏障破坏、免疫功能受损或局部菌群失调时,定植的念珠菌可生长繁殖引起感染。痰和尿标本中分离出的念珠菌亦应根据临床症状和体征鉴别是定植还是感染,念珠菌血培养阳性时要高度警惕念珠菌血症。
此外,病原微生物检测结果阳性,并不意味着患者一定存在感染或感染一定由检出的病原体所致,需结合标本质量、采集部位、病史及其他检测结果综合分析。
不同部位标本检测出同一种病原体,其代表的临床意义可能并不相同。
以肺炎克雷伯氏菌为例,从肠道粪便样本中检出肺炎克雷伯氏菌,其中丰度占比超过1%的人群有3765例,占比28.2%【谷禾健康数据库】。但是当肺炎克雷伯菌进入血液并感染时,通常会发生细菌血症。症状可能包括发冷,发烧,发抖,肌肉酸痛,疲劳和嗜睡。当肺炎克雷伯菌感染肝脏时,会引起脓性病变,也被称为化脓性肝脓肿。这种类型的感染更常见于患有糖尿病一段时间或已经服用抗生素多年的人。
因病原微生物种类不同,微生物检测方法的选择也不相同;即便检测同一种微生物,因采集部位不同所选择的检测方法也有所差别。
如大肠埃希菌,血培养阳性时需考虑血流感染,怀疑致病性大肠埃希菌感染肠道时需特殊培养或者血清学、PCR,16s测序检测等。因普通大肠埃希菌可寄居在肠道中,粪便普通培养有大肠埃希菌生长并不能直接考虑大肠埃希菌肠道感染。
病原微生物检测技术快速发展,能识别的微生物种类越来越多,但感染首先是个临床诊断,所有的判定必须基于临床。随着检测技术革新带来的是临床辅助手段的进步和多样化,更快、更准确地判定感染一直都是病原学检测的挑战,不同方法各有优劣。当前,并没有一项技术可通过从标本中识别微生物来直接判定机体是否感染该病原体,甚至依靠检测的阴性结果来排除感染都很难实现。
在面对细菌感染诊疗过程中始终需要思考3个问题:患者是否存在感染?如果有感染,致病病原体是什么?如何治疗干预?
充分利用现有的病原微生物检测方法和其他实验室检查手段,综合判定,给出合适的抗菌治疗或其他综合治疗方法,是科学可持续的手段。
主要参考文献:
Uddin TM, Chakraborty AJ, Khusro A, Zidan BRM, Mitra S, Emran TB, Dhama K, Ripon MKH, Gajdács M, Sahibzada MUK, Hossain MJ, Koirala N. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766. doi: 10.1016/j.jiph.2021.10.020. Epub 2021 Oct 23. PMID: 34756812.
Cheung GYC, Bae JS, Otto M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 2021 Dec;12(1):547-569. doi: 10.1080/21505594.2021.1878688. PMID: 33522395; PMCID: PMC7872022.
Tshibangu-Kabamba E, Yamaoka Y. Helicobacter pylori infection and antibiotic resistance – from biology to clinical implications. Nat Rev Gastroenterol Hepatol. 2021 Sep;18(9):613-629. doi: 10.1038/s41575-021-00449-x. Epub 2021 May 17. PMID: 34002081.
BRM, Mitra S, Emran TB, Dhama K, Ripon MKH, Gajdács M, Sahibzada MUK, Hossain MJ, Koirala N. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766. doi: 10.1016/j.jiph.2021.10.020. Epub 2021 Oct 23. PMID: 34756812.
Carmen Fookes, BPharm, Bacterial Infection. January 13, 2020 Medicine
Spagnolo F, Trujillo M, Dennehy JJ. Why Do Antibiotics Exist? mBio. 2021 Dec 21;12(6):e0196621. doi: 10.1128/mBio.01966-21. Epub 2021 Dec 7. PMID: 34872345; PMCID: PMC8649755
Baquero F, Coque TM, Cantón R. Counteracting antibiotic resistance: breaking barriers among antibacterial strategies. Expert Opin Ther Targets. 2014 Aug;18(8):851-61. doi: 10.1517/14728222.2014.925881. Epub 2014 May 31. PMID: 24881465.
武洁, 王荃. 病原微生物检测在感染判定的意义[J]. 中国小儿急救医学, 2020, 27(3):6.
李丹鹤, 荣爱国, 马瑞芝,等. 病原微生物检验在抗感染经验治疗中的临床意义[J]. 医学理论与实践, 2019, 32(09):127-129.

谷禾健康
说起抗生素,可能会觉得有些抽象,那如果说阿莫西林、头孢、红霉素、阿奇霉素等等这些日常生活经常使用的药物,会不会有一些熟悉的感觉。当我们发现身体有一些小炎症(如头痛发热、喉咙痒疼、咳嗽)的时候,首先会想到要使用这类药物(抗生素) 进行消炎。
在现实生活中,抗生素被许多人当作是包治百病的妙药,一遇到头痛发热或喉痒咳嗽,首先想到的就是使用抗生素,而对滥用抗生素产生耐药性的危害却知之甚少。
世界卫生组织在1996年时就向全世界发出了警告,因为人们对抗生素的滥用,产生了一些严重的后果。其中之一就是导致了细菌的耐药性增强,其结果直接提高了人类对感染类疾病的治疗的难度,增加治疗所需的成本,甚至患病人群的死亡率剧增。
在人类和其他哺乳动物中,所有暴露于环境的表面都是无数古细菌、细菌、病毒和真核微生物的家园,这些定殖微生物被称为微生物群。
微生物群的定植为我们抵御病原微生物感染提供了最有效的屏障之一。微生物群通过启动免疫防御、通过代谢将病原体排除在其首选的生态位中以及通过直接的抗微生物拮抗作用来防止感染。微生物群的破坏,尤其是抗生素的破坏,是细菌病原体定植的主要风险因素。
研究表明,常见的革兰氏阴性菌感染包括由克雷伯氏菌、铜绿假单胞菌和大肠杆菌以及革兰阳性菌感染如艰难梭菌感染,最初的定植与治疗复发均与抗生素的使用和被破坏的肠道菌群有关。
例如,肺炎克雷伯菌是属于肠杆菌科的革兰氏阴性变形菌。它是包括人类在内的几种哺乳动物的胃肠道和上呼吸道共生的,估计人类携带率约为 3-8%。在住院患者中,胃肠道定植的发生率可能会显着升高(高达 38%)。在一部分宿主中,肺炎克雷伯菌会引起呼吸道、泌尿道、伤口和血流感染 。
胃肠道定植是肺炎克雷伯菌的关键步骤发病机制。住院时间和抗生素的使用会增加肺炎克雷伯菌的定植率。住院时间可能会增加患者通过医护人员和污染物接触细菌的可能性。抗生素的使用导致微生物群失调,为肺炎克雷伯菌提供了有利条件。抗生素耐药性的发展也放大了肺炎克雷伯菌的感染几率。
此外,革兰氏阳性菌感染中艰难梭菌感染可能是最广为人知且临床上最常见的感染。艰难梭菌感染的主要危险因素之一是之前的抗生素治疗 。感染的初始治疗通常依赖抗生素甲硝唑和万古霉素;然而,高达 35% 的患者会出现感染复发,并且与免疫抑制和进一步的抗生素治疗有关 。 此外,临床研究认为氟喹诺酮类、克林霉素和头孢菌素也是使患者对艰难梭菌易感的主要抗生素。
本文主要探讨抗生素究竟对人体肠道菌群有哪些影响,以及对人体健康的主要影响。
抗生素
抗生素是指由微生物(包括细菌、真菌、放线菌属) 或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质。简单来说就是在非常低浓度下对所有的生命物质有抑制和杀灭作用的药物。临床常用的抗生素有微生物培养液中的提取物以及用化学方法合成或半合成的化合物。
自人们发现抗生素的使用大大的降低了传染病导致的死亡率后,抗生素就开始被广泛的应用于疾病的治疗中,并在全球范围内彻底改变了传染病的治疗方法。在20世纪更是一度被称为 “预期寿命延长” 的一大促成因素。
抗生素的本质作用其实就是把感染我们的微生物消灭,清除掉病原体,控制住疾病的发展,最终得以将病症治疗康复。但因为人类、兽医学以及畜牧业中过度使用、误用等情况的发生,导致了当前出现了抗生素耐药性的危机。
抗生素的种类很多,目前国内在医学和兽医日常应用的抗生素不少于几十种。不同的抗生素对病菌的作用原理不尽相同:
1. 有的抗生素是干扰细菌的细胞壁的合成,使细菌因缺乏完整的细胞壁,抵挡不了水份的侵入,发生膨胀、破裂而死亡。
2. 有的抗生素是使细菌的细胞膜发生损伤,细菌因内部物质流失而死亡。
3. 有的抗生素能阻碍细菌的蛋白质合成,使细菌的繁殖终止。
4. 有的抗生素是通过改变细菌内部的代谢,影响它的脱氧核糖核酸的合成,使细菌(还有肿瘤细胞)不能重新复制新的细胞物质而死亡。
在日常生活以及医疗当中所指的抗生素主要是针对细菌、病毒微生物的药物,种类是相当多的,大概可以分成十余种大类。在临床上常见的更是有百余种之多。
在此简单的对其抗菌谱、化学结构、用途等方面进行分类。
◾ 按抗菌的范围(抗菌谱),分为:
◆ 广谱抗生素
指的是抗菌谱比较宽的药物,简单说就是能够抵抗大部分细菌的药物;
如. 氯霉素、金霉素、土霉素、四环素、甲砜霉素等
◆ 窄谱抗生素
是专门杀灭某一种或一类细菌的药物。
如. 青霉素G
◾ 按照化学结构,分为:
◆ 喹诺酮类抗生素
◆ β-内酰胺类抗生素
◆ 大环内酯类抗生素
◆ 氨基糖苷类抗生素
……
◾ 按照用途,分为:
◆ 抗细菌抗生素
◆ 抗真菌抗生素
◆ 抗肿瘤抗生素
◆ 抗病毒抗生素
◆ 畜用抗生素
◆ 农用抗生素
◆ 其他微生物药物(如麦角菌产生的具有药理活性的麦角碱类,有收缩子宫的作用) 等。
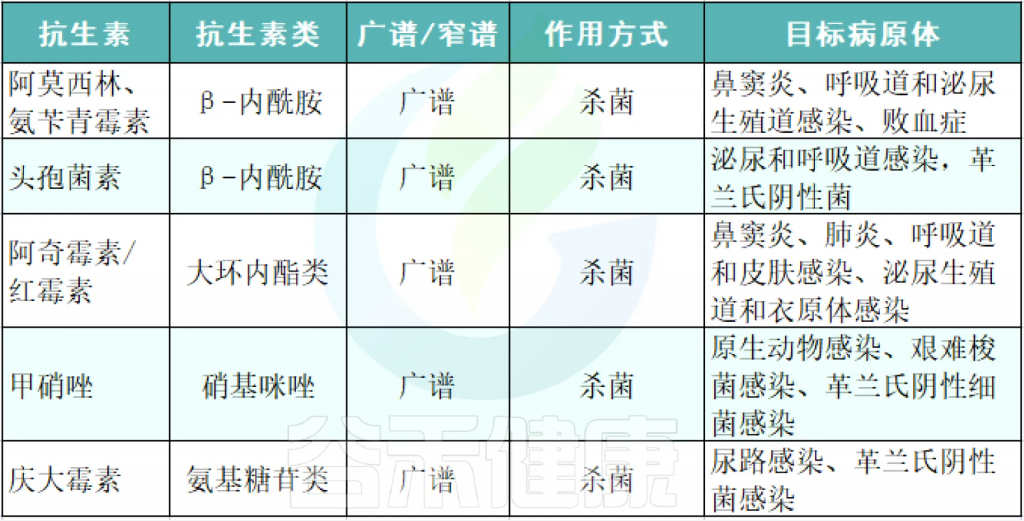
列举常用的各类抗生素及其作用、对应的病症等:

Patangia DV, et al., Microbiologyopen. 2022
肠道微生物群的组成
肠道微生物群对于宿主的健康起着重要的作用 —— 可以防止病原体的定植,调节肠道免疫,提供必需的营养物质、生物活性代谢物、参与能量稳态等。
肠道微生物群是由细菌、古细菌、微真核生物和病毒组成,且根据迄今为止的多项研究可以得出,平衡且稳定的微生物群组成和丰富的菌群多样性对于机体功能等至关重要。健康成人的肠道微生物群主要由厚壁菌门和拟杆菌门组成,其次是放线菌门、变形菌门和疣微菌门。人们普遍认为,肠道微生物群是在婴儿出生时就获得的,其母体是婴儿肠道微生物群最重要的来源,此后在肠道免疫力的发展中发挥着重要作用。婴儿肠道中菌群的多样性减少、微生物群组出现不平衡与肠道疾病和晚年易患的某些疾病有关。而健康婴儿肠道微生物群的建立以及其后续的持续发展是一个长久的过程,并受诸多因素的影响发生变化。
微生物群的变化随多种因素的影响而改变。其中对于婴儿来说,大部分的肠道菌群受其母体的影响最为严重,主要是与分娩方式、胎龄以及产后喂养习惯等方面有关;对于抗生素的使用同样是影响肠道菌群的一大常见因素。
◾ 分娩方式是影响婴儿肠道菌群的首要因素之一。通过对比发现,阴道分娩婴儿的微生物群明显更加的多样化,与其母亲的阴道微生物群相似度更高;而剖宫产出生的婴儿则因为被缺乏了部分相应的生产过程以及母体的接触,因此具有肠道微生物群仅与其母亲的皮肤和医院环境所类似。其中,
在剖宫产出生的婴儿中 ——
丰度增加的包含:
丙酸杆菌(Propionibacterium)
棒状杆菌(Corynebacterium)
葡萄球菌(Staphylococcus)
艰难梭菌(C.difficile)
链球菌(Streptococcus)
丰度降低的包含:
双歧杆菌(Bifidobacteria)
拟杆菌(Bacteroides)
在阴道分娩的婴儿中发现了 ——
乳酸杆菌(Lactobacillus)
普雷沃氏菌(Prevotella)
斯奈斯菌属(Sneathia spp.)
◾ 胎龄也是改变肠道菌群的因素。早产儿明显比足月新生儿的肠道菌群多样低,其中 ——
变形菌(Proteobacteria)的丰度较高;
专性厌氧菌(如. 双歧杆Bifidobacterium)、拟杆菌(Bacteroides)、Atopobium的水平较低。
◾ 喂养习惯是影响婴儿肠道菌群的另一个关键因素。由于母乳中存在大量的低聚糖(母乳低聚糖) 用来产生双歧杆菌(Bifidobacteria)。与配方奶喂养的婴儿相比:
母乳喂养的婴儿 ——
双歧杆菌的水平更高,且在断奶后的比例仍然很高;
检测出的菌群包含:
拟杆菌(Bacteroides)
链球菌(Streptococcus)
乳酸杆菌(Lactobacillus)
……
配方奶喂养的婴儿 ——
丰度较高的菌包含:
大肠杆菌(Escherichia coli)
艰难梭菌(C. difficile)
脆弱拟杆菌群(Bacteroides fragilis group)
乳酸杆菌(Lactobacilli)
以下,为各种抗生素对人体肠道微生物群影响:

Patangia DV, et al., Microbiologyopen. 2022
怀孕期间的阴道微生物群发生了特定的变化。有研究报道,与未怀孕女性的阴道微生物群相比,怀孕期间的阴道微生物群的变化重点表现在高细菌负荷、高乳酸菌丰度、低丰富度和菌群多样性的降低等。在整个怀孕期,表示机体健康的特有特征包括了细菌的负荷增加以及肠道微生物群组成发生的明显变化。在妊娠的前三个月至妊娠晚期,随着生理的变化,会出现诸如变形菌和放线菌总含量的明显增加以及其丰富度下降的现象。
抗生素所引起微生物组成的变化会对宿主的健康产生直接或间接的负面影响。
其中包括 ——
微生物多样性下降
微生物群功能属性发生变化
抗生素抗性菌株的形成和选择
这些变化会使宿主更容易感染艰难梭菌等病原体。
以下,是过度使用和滥用抗生素可能对宿主健康产生负面影响:
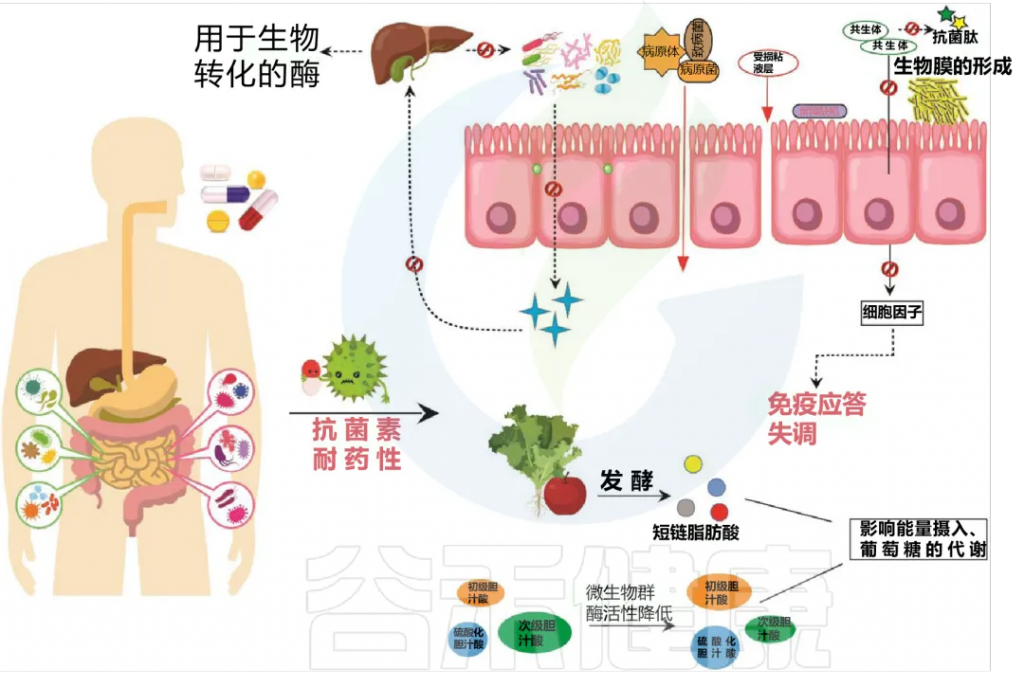

Patangia DV, et al., Microbiologyopen. 2022
◾ 母体&婴儿常使用的抗生素及原因 ——
◆ 怀孕期间 最常用的一些抗生素包含:
β-内酰胺类抗生素
磺胺类
甲氧苄啶
大环内酯类
林可酰胺
链霉素
其他规定的抗生素类
◆ 分娩期间 经常给母体服用抗生素,目的:
防止 B 群链球菌的传播
减少并预防子宫内膜感染的风险
以及预防伤口感染的产生
◆ 婴儿 最常用的抗生素包括:
阿莫西林
苄青霉素
头孢菌素
庆大霉素
万古霉素
克林霉素
阿奇霉素
……
这些抗生素适用于呼吸道和耳部的感染、支气管炎、咽炎和高温。
对于孕妇和幼儿来说要尤其注意,上肠道微生物群可能会因受到短期或低剂量抗生素的干扰,而对健康造成了长期深远的严重影响。希望人们可以警戒,不过度滥用抗生素。
◾ 广谱抗生素对肠道微生物群有害影响 ——
广谱抗生素会降低肠道微生物群的多样性,以杀死相关病原体,并根除有益微生物,其结果对宿主是有害的。
在西方国家,高达 35% 的女性在怀孕和分娩期间都会接触抗生素,并经常使用预防性抗生素来预防和治疗感染。女性在怀孕期间抗生素的使用就占了接触药物总量的 80%左右。
◾免疫性疾病
接触过产时抗生素预防(IAP) 的婴儿肠道菌群的多样性会发生改变。如果在儿童早期或发育阶段所接触到的微生物群种类较少或不足,则可能导致免疫相关疾病的产生。为此,世界卫生组织曾提出建议表示尽量不要在分娩后预防性的使用抗生素。
◆ 对于新生儿尤其是早产儿来说
由于其健康状况以及感染的高度敏感性和免疫力较低,导致经常性的要接受抗生素的相关治疗。
经常接触抗生素,会导致 ——
微生物群发生改变
增加患感染性疾病的可能性
常见如. 哮喘和过敏性致敏、NEC 和侵袭性真菌感染。
若延长使用抗生素进行治疗,则可能会 ——
增加发生迟发性败血症(主要由 B 组链球菌引起)
坏死性小肠结肠炎(NEC)
机体性死亡率增加的风险
◆ 在婴儿期使用抗生素,也会产生类似的影响。在哺乳期间,母体所使用抗生素会影响乳汁微生物群的变化,这又将会影响到婴儿肠道菌群的组成。抗生素等一些外在因素会对母体微生物群的多样性进行改变,从而直接或间接地影响到婴儿肠道微生物群的多样性、免疫力的增减以及疾病的发生。过早期的使用抗生素增加了儿童期患哮喘过敏、特应性皮炎和 IBD 等疾病的风险。
◆ 围产期(怀孕28 周到产后一周) 和围产期抗生素的使用会影响肠道菌群的定植以及婴儿的耐药性。
为了了解妊娠期间抗生素给药对后代的潜在影响,科学家们在白细胞介素 10(IL-10) 缺乏的结肠炎小鼠模型 (Miyoshi) 中研究了,在围产期给药头孢哌酮对母体及其后代微生物群随着给药时间的改变所带来的影响。暴露于头孢哌酮的后代在成年后显现出发生改变的肠道微生物群落,并且对自发性和化学性诱发的结肠炎的易感性增加。且用抗生素改变的微生物群落接种无菌怀孕小鼠后,观察到,改变的微生物群落被传播给缺乏 IL-10 的后代,此变化会导致结肠炎的显着增加。另一项研究表明,怀孕期间服用抗生素会导致出生前阴道微生物的组成发生变化;这可能会影响婴儿出生时所会接触的微生物组成。据报道,孕期母体抗生素摄入与微生物组成的改变有关,具体的改变趋势取决于抗生素类型。
对于抗生素会增加婴儿患哮喘和过敏的风险度、免疫学的改变和后代糖尿病的发生几率以及发育和认知功能的障碍等的相应结论,现阶段还存在争议和不确定性。
◾ 免疫发育
婴儿期,免疫系统就进行了对抗病原体的练习,而此时正是微生物定植的重要时期。这种共同生长发育的过程体系导致了对微生物定植的任何干扰都会影响免疫系统的成熟稳定。
通过对无菌小鼠的研究证实,如果肠道中没有微生物群则会影响肠道环境的生理结构和免疫特性,这些变化主要包括了粘液厚度和成分的改变、胃动力的降低、肠细胞和免疫细胞的非正常发育和功能缺失以及免疫系统发育不当。实验显示,抗生素治疗会减少结肠粘液层的厚度,从而增加小鼠(8-10 周龄) 病原体入侵和肠道炎症的风险。
另一项针对小鼠的研究报告称,抗生素诱导的微生物群改变将 TH1/TH2 平衡转变为 TH2 的主导免疫——伴随着淋巴细胞数量的减少,将导致特应性的发生。
在新生大鼠的相关治疗中观察到,微生物组成和基因成熟谱的改变,例如编码MHC 1b类和II类蛋白质和潘氏细胞产物(如防御素) 的基因下调,这可能会影响粘膜屏障的发育。一项研究表明,肠道菌群产生的某些分子与免疫系统的成熟发育有关。相关研究还发现了,用产生细菌多糖的脆弱拟杆菌来定殖无菌小鼠,可以纠正其T细胞的缺陷、改善 T(H)1/T(H)2 失衡同时促进淋巴器官的发育;然而在不产生多糖的突变体脆弱拟杆菌中并没有观察到该现象。
肠上皮细胞分泌抗菌肽受微环境中微生物群的调节。用常规或人类微生物群或特定益生菌物种或 LPS 定植的无菌小鼠表现出增加的抗微生物肽(如 REGIII-γ) 的产生,增强了先天免疫反应。一项针对小鼠的研究表明,产前抗生素不仅改变了新生小鼠的微生物群定植模式,而且还对影响其免疫反应的病毒感染的 CD8+ T 淋巴细胞的活性产生了负面影响。此外,还观察到,在更加严格的卫生环境下的新生小鼠更容易受到感染。另一种细菌多样性低的小鼠模型在抗生素治疗后有类似的结果产生,同时发现了 CD4+ T 淋巴细胞产生的细胞因子减少以及干扰素-γ 的产生减少。在一项涉及流感患者的研究中发现,感染滴度低并接受抗生素治疗的受试者的免疫反应较低,并会伴有微生物群的丢失以及免疫球蛋白(Ig) G1、IgA 和抗感染的次级胆汁酸水平的降低。这些研究证明了微生物群与宿主免疫反应之间的复杂关系,以及抗生素对其相互作用的影响,部分影响需要进一步相关研究证明。可能还会影响到使用抗生素疫苗治疗的有效性。
◾ 先天性异常
妊娠期间抗生素使用与新生儿和先天性异常之间存在关联。研究报告称,在怀孕期间接受大环内酯类药物治疗的母亲所生的婴儿患脑性麻痹、癫痫、心脏和生殖器畸形的风险增加,在孕早期服用这些药物的有害影响更大。
在少数病例中发现,在孕早期使用阿莫西林与婴儿的唇裂和腭裂的形成有关联,其有利证实了怀孕期间使用抗生素的不利影响。
妊娠前三个月使用磺胺类药物和呋喃妥因与小眼症、左心发育不全综合征、房间隔缺损和唇裂伴腭裂等出生缺陷也有关连;孕期使用甲氧苄啶-磺胺类药物与心血管畸形的高风险相关;可能是由于在子宫内器官发生和早期发育阶段对新生儿产生了影响。
虽然相关的病例还不能总结出确切的关系,但是对于妊娠期间抗生素的使用应该重新进行评估。
◾ 肥 胖
由于肠道微生物群在饮食代谢中的作用,肥胖与早期菌群的定植有着广泛的关联。早期使用抗生素对体重指数的增加、超重以及引起中心性肥胖症有潜在的关联。对此现象在男性中的影响大于女性,所以此类影响可能是具有性别特异性的。
在一项针对 96 人的研究中(其中抗生素组和对照组各 48 人),研究人员发现使用万古霉素和庆大霉素治疗的患者在感染性心内膜炎发作后的体重显着且持续增加。
在对动物的进一步研究后得出,如果早期使用低剂量或亚治疗浓度的抗生素会扰乱微生物组成,影响参与免疫和碳水化合物代谢基因的表达,并可能会破坏代谢的稳态,使宿主在后期更容易出现肥胖的症状。
婴儿期以及儿童期使用抗生素可能会与微生物组成以及代谢功能的改变、晚年的肥胖有关。
在功能水平上,无论是静态的还是灭活的抗生素,不同的类型都会对肠道微生物群产生不同的影响。抗生素可以影响原微生物群并导致耐药菌株的生长,这些菌株在使用治疗后可以持续保留数年。
◾对个体微生物影响
◆ 某种抑菌药物导致了革兰氏阴性菌增多,其影响了 ——
脂多糖(LPS)合成的基因数量的增加
杀菌药物与革兰氏阳性菌的增加有关
其现象还伴有内生孢子形成的基因过度表达
◆ 母体使用了产时抗生素是会影响到婴儿口腔微生物群,其中母体使用了抗生素治疗的婴儿中 —— 放线菌门、拟杆菌门、变形杆菌门更为丰富。氨苄青霉素在母体用于产时预防性药物对抗 B 组链球菌,其结果同样降低了婴儿双歧杆菌的水平含量。
◆ 产前暴露于抗生素的婴儿中拟杆菌和双歧杆菌有所降低,并且发现改变的微生物群类似于同期新生儿重症监护室中的耐药菌。许多相关的影响与产后服用抗生素观察到的结果相似。
◆ 接触 IAP 的婴儿特别是新生儿出生后的最初几周内 ——
放线菌、拟杆菌的比例较低
口腔变形杆菌属水平较高
双歧杆菌的水平较低
◆ 出生后3个月,使用抗生素的婴儿 ——
含量较低的菌属包含:
拟杆菌属
副杆菌属
高等肠球菌属
梭菌属
丰度较高的菌属包含:
而肠杆菌科
◆ 在早产儿中观察到——
双歧杆菌丰度下降
拟杆菌丰度下降
肠球菌丰度增加
早产儿短期和长期接触抗生素都会对其肠道菌群有所改变,包括细菌种群的多样性减少、肠道中物种丰富度降低、抗生素抗性基因增多等方面。
◾相关疾病的微生物
由于微生物群在宿主代谢和生理学中所起到的作用,大量研究提出了“缺失的微生物”(即.假设微生物失衡) 可能会与肥胖、糖尿病和哮喘等疾病具有一定的关联性。
通过微生物群的组成和饮食习惯等可控因素来控制来调控多因素条件,从而尽可能的防止疾病发生。
◆ 研究抗生素使用与肥胖之间的关联发现——
厚壁菌门与拟杆菌门的比例增加(不确定性)
短链脂肪酸(SCFA) 含量更高
◆ 重复性的使用广谱抗生素与糖尿病之间存在着联系。在易患糖尿病的动物中,部分原因是特异性抗原负荷的降低或耐受性 APC 的生长。微生物组成的变化与Ⅱ型糖尿病之间的关联更为明显,Ⅱ型糖尿病患者中产生丁酸盐的细菌水平有所下降。在研究了 121 名糖耐量正常、糖尿病前期以及新诊断为糖尿病的受试者得出,在糖尿病前期阶段肠道微生物组成受到调节,这可以作为糖尿病的一个状态发展标志。
抗生素所引起的微生物的定植变化与Ⅰ型糖尿病之间同样存在着关联性。对自身免疫性Ⅰ型糖尿病的新生非肥胖糖尿病小鼠,给予单独的广谱抗生素或与万古霉素的组合使用会发现——
大肠杆菌的种类增加
乳酸杆菌的种类增加
梭菌目减少
其微生物群发生了显着的变化
回肠和结肠固有层中IL-17 细胞产生大量减少
这会影响到宿主的防御机制。此外,葡萄糖稳态和胰岛素抵抗相关的代谢变化,也与糖尿病的患病有关。
◆ 抗生素导致抗生素相关性腹泻(AAD) ,克林霉素可导致微生物群发生改变,从而促进艰难梭菌等潜在病原体的定植,进而导致腹泻和结肠炎的发生。抗生素治疗导致 ——
α和β多样性下降
导致水平下降的包含:
血清素
色氨酸水解酶
次级胆汁酸
进一步影响肠道的蠕动和代谢问题。NEC 和 AAD 还与生命早期延长或预防性抗生素摄取有关。
◆ 许多抗生素通常用于牙科手术。这些抗生素可以增加口服耐药菌株的数量,还可以增加最低抑菌浓度,以及消除非致病菌株——这些菌株会导致全身感染和炎症。
Patangia DV, et al., Microbiologyopen. 2022
◾代谢物
通过影响微生物群落的组成,抗生素还会改变微生物群的功能,从而改变产生的代谢物。
◆ 肠道微生物群负责产生许多必需代谢物,包括 SCFA 和氨基酸,所产生的丁酸盐和丙酸盐具有抗炎作用,促进调节性 T 细胞的产生和分化,在能量代谢中发挥作用。抗生素的摄取会导致微生物群中的蛋白质表达、能量代谢发生变化。
抗生素治疗后,分析代谢的变化——
氨基酸代谢相关代谢产物浓度较高;
氨基酸浓度降低;
丁酸盐和丙酸盐水平降低;
SCFA产量下降;
脂肪酸氧化分解代谢;
氨基酸生物合成发生下降;
影响激素的合成途径(各类细胞因子的基因表达上调);
在微生物群的恢复中,抗生素治疗改变了细菌代谢产物,其中包括——
SCFAs、氨基酸水平的降低;
以及胆汁酸和寡糖等前体增加;
提高胰岛素敏感性;
改变了全身葡萄糖代谢;
肝脏和回肠中参与葡萄糖和胆汁酸代谢的基因表达;
可能会导致屏障功能受损,其作为溃疡性结肠炎和沙门氏菌感染的致病因素。
◆ 抗生素对宿主代谢具有性别依赖性,已研究发现万古霉素和环丙沙星-甲硝唑治疗仅导致雌性小鼠厚壁菌门和 SCFAs 显着减少;两种抗生素暴露都显着降低了雌性小鼠结肠内容物中丙氨酸、支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)和芳香族氨基酸的水平,但雄性小鼠中没有发现。
◾异生素的积累
肠道微生物群可以影响宿主的异生物质半衰期、到达靶受体的程度,以及宿主代谢异生物质的能力。
◆ 异生素(包括抗生素、重金属和环境化学品) 对肠道微生物组成的影响是周期性的,因微生物群是外源生物转化所必需的,所以异生素在到达其靶器官部位之前的代谢很大程度上取决于微生物群。
◆ 通过体内和体外研究都表明了,肠道微生物群参与了异生物质的生物转化,其中缺乏肠道微生物群会影响许多肝酶基因的表达。缺乏代谢特定化合物所必需的微生物会导致其在宿主中的累积,从而导致产生毒性。
对 SPF 和无菌小鼠使用环丙沙星后,显示 —— 肝脏 Cyp3a11 表达降低,这与肠道微生物群的改变有关。由于抗生素给药后产生 LCA 的细菌减少从而导致较的低石胆酸 (LCA) 水平,这可能是Cyp3a11 表达减少的原因。对人类的类似影响可导致多种 CYP3A4(Cyp3a11 的人体类似物) 依赖性药物的清除及减少。
◆ 使用抗生素对肠道微生物组成的改变,会产生的影响 ——
肝脏脂质积累水平增加
甘油三酯(TG) 水平升高
唾液酸和琥珀酸盐的水平增加
对沙门氏菌和艰难梭菌的易感性增加
导致某些仅由细菌产生的代谢物或维生素缺乏
导致铜 (Cu) 代谢发生变化
由于铜在一些功能中所发挥的作用,这可能会对免疫和肠道屏障产生影响。
◾细菌的相关影响
抗生素可以改变几个主要功能基因的转录,其中主要包括 —— 编码转运蛋白的基因;参与碳水化合物代谢的基因和蛋白质合成。
◆ 交叉喂养是肠道微生物群的一个重要特征,常见如 利用低聚果糖和淀粉产生乳酸和乙酸;而产生丁酸盐的厌氧菌不能利用低聚果糖和淀粉,而是依赖乳酸和乙酸作为生长底物。在许多细菌群中,通过交叉喂养间接促进了产丁酸盐物种的增殖和扩张。对此进行的相关研究发现万古霉素是一种革兰氏阳性靶向抗生素,可减少肠道中革兰氏阴性细菌的丰度,这可能是由于其细菌中的相互依赖性所导致的。相互依赖可能会因使用抗生素而受到干扰,从而导致某些代谢物/化合物的积累增加或缺乏。
◆ 细菌使用模式识别受体 (PRR) 通过产生胆汁酸、SCFA、脂肪酸、氨基酸、LPS、脂磷壁酸、鞭毛蛋白、CpG DNA 和肽聚糖的信号与其宿主相互作用,这些信号分子既可以作为其他细胞的能量来源,也可以通过 G 蛋白偶联受体和核受体家族、游离脂肪酸受体调节或调节免疫细胞(如单核细胞、巨噬细胞、T 细胞)的功能。
抗生素的使用导致这些细菌的减少,从而减少了 PRR,产生如 TLR 信号传导和先天防御的下游调节。对其研究发现,抗生素介导的丁酸盐产生细菌减少会导致通过细胞内的丁酸盐传感器的过氧化物酶体增殖物其激活受体 γ 的上皮信号传导减少。
同样,由于产生 IL-22 的淋巴样细胞的迁移中断,共生微生物群的抗生素破坏,增加了其肺炎的易感性;这种效应可以通过在出生时将共生微生物群转移给小鼠来逆转。共生菌还在防止结肠损伤和维持肠道稳态方面具有重要作用,共生体通过 TLR 诱导保护因子的释放,然而这些因子在缺乏共生细菌的抗生素治疗的小鼠中没有得到释放;因此,由于微生物群落组成的变化,抗生素可以影响复杂的宿主-微生物相互作用。
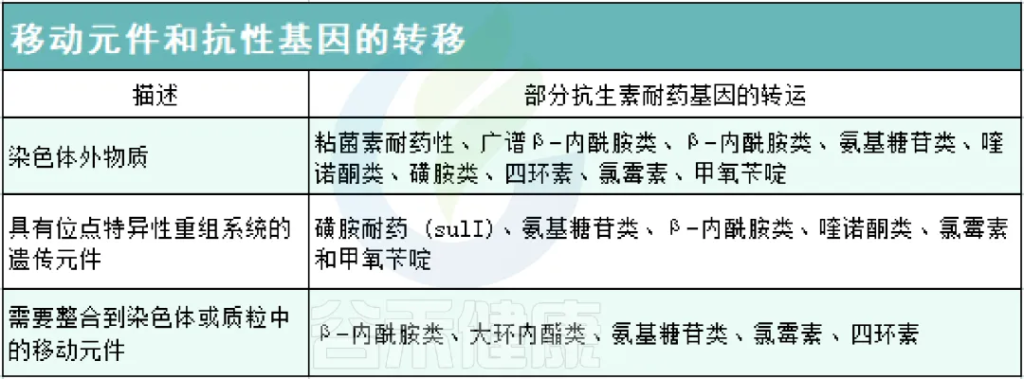
◾ 抗生素抗性基因
肠道已被确定为抗生素耐药性的中心,人体也是抗生素抗性基因(antibiotic resistance genes; ARGs)的储存库。在肠道中,细菌可以通过移动遗传元件将基因水平垂直传递给其他相关或不相关的细菌。
◆ 抗生素抗性基因存在于环境中,包括海洋和淡水体、土壤、冰川、食物链以及内部人类;除细菌外,病毒也是抗生素抗性基因的携带者。有些ARG的传播是历史遗留性的,例如在一些未受污染/未受污染的环境中;但其中大部分是因为人类广泛使用抗生素所传播的,除了用于治疗人类感染外,抗生素还被广泛用作动物体重增加的生长促进剂以及治疗和控制感染的使用,甚至应用于水产养殖。
其中一些抗生素与治疗人类感染的抗生素相同或结构相似,例如红霉素、庆大霉素、恩诺沙星、新霉素、链霉素。农业和水产养殖中抗生素抗性细菌的发展是一个严重的问题,因为这些细菌可以通过食物链进入人体,促进交叉耐药性,并降低传染性细菌对抗生素治疗的敏感性。
◆ 有研究发现来自偏远地区的人类中存在抗生素抗性基因,然而这些人对抗生素的接触使用非常有限;其中 —— 四环素、氨苄青霉素、甲氧苄啶/磺胺甲恶唑、链霉素和氯霉素等抗生素的高水平获得性耐药。
进而研究发现,尽管没有使用过抗生素,但健康的人体内也有抗生素抗性基因——对从未接触过抗生素的健康婴儿和儿童进行的研究表明,存在对 β-内酰胺类、氟喹诺酮类、四环素类、大环内酯类、磺胺类药物或多种药物产生耐药性的基因。
该研究发现其肠球菌属、葡萄球菌属、克雷伯氏菌属、链球菌属和大肠杆菌/志贺氏菌属是 ARGs 的主要携带者。
以下,列举出可用于 ARGs 转移的各种可移动遗传元件:
Patangia DV, et al., Microbiologyopen. 2022
抗生素可对宿主组织产生直接毒性作用,如 ——
线粒体损伤
抑制核糖体基因表达
哺乳动物细胞中的氧化组织损伤
该结论现今依旧存在一些争议。抗生素有时会使原本要治疗的病情变得恶化。许多 β-内酰胺类抗生素的杀菌作用会增加毒素的产生,例如 —— 从肠出血性大肠杆菌中释放的志贺毒素,使宿主更容易患溶血性尿毒症综合征。
抗生素还有可能直接影响宿主的代谢,无需微生物作为介质,同时会使目标病原体对抗生素的敏感性降低;宿主代谢物的这些变化大多发生在感染部位,其中包括高水平的 AMP,这会降低抗生素的功效并增加吞噬的活性。由于抗生素对免疫细胞呼吸活动的抑制作用,这可能会导致免疫功能的损伤。
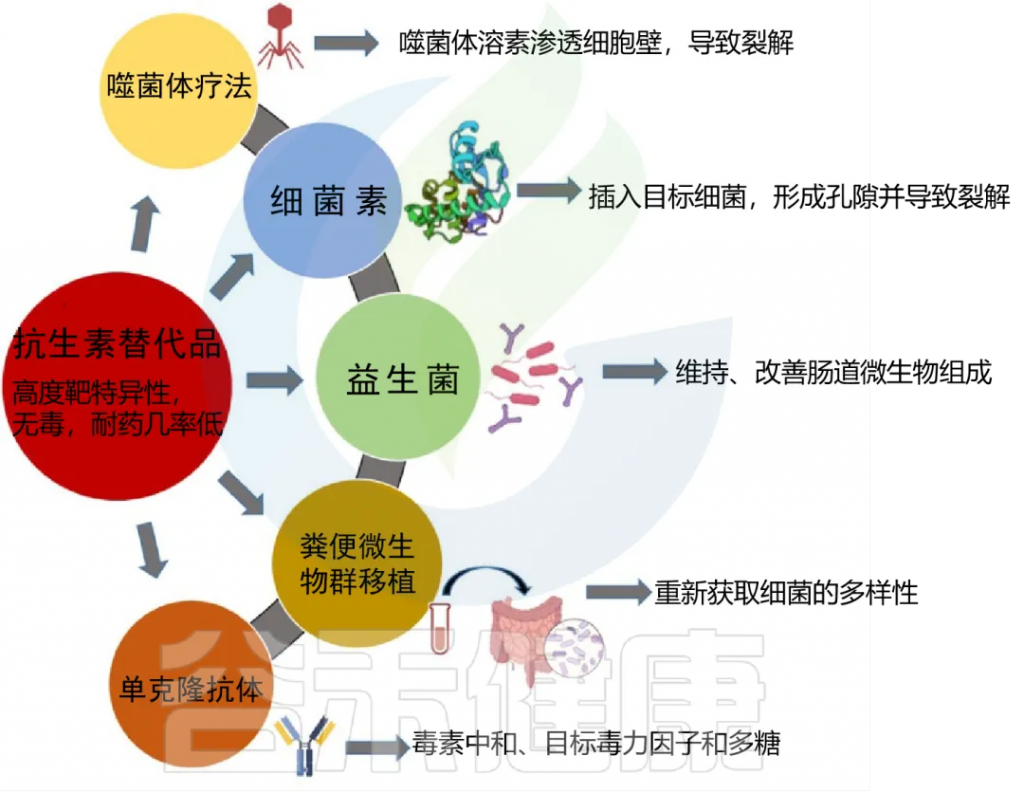
以下,列举出可单独使用或在某些情况下与抗生素治疗联合使用的各种抗生素替代品:

Patangia DV, et al., Microbiologyopen. 2022
因为抗生素的使用会导致微生物组成发生变化,很可能会对宿主产生有害的影响。为减少其影响,使用一些方法在使用抗生素后或与抗生素一起进行调节使用,得以更快地恢复其微生物群。
抗生素的使用其主要问题之一就是对于细菌耐药性的产生。目前正在研究诸如噬菌体(噬菌体) 疗法和细菌素等替代物作为抗生素的替代品或抗生素的补充疗法,以克服耐药性问题。
◆ 噬菌体疗法在1900年代初首次被提出和使用,但由于抗生素的引入,噬菌体疗法在西方医学中逐渐被摒弃,但在国外有部分国家仍旧使用着。随着抗生素耐药性危机的日益严重,需要对噬菌体疗法进行重新审视。
如今已经证明噬菌体疗法可以成功地治疗呼吸道铜绿假单胞菌的感染。随着使用特异性噬菌体疗法,逐步实现了对多重耐药鲍曼不动杆菌患者的感染进行了清除和成功治疗;以及对细菌性前列腺炎、败血症和急性肾损伤患者的病原体实现了临床症状的减轻以及根除。
对96名患者的伤口和溃疡的实验中有 67 名在噬菌体治疗后愈合,其愈合与病原体的减少有关;还在使用工程化噬菌体治疗耐药性脓肿分枝杆菌中显示了囊性纤维化患者的临床改善。对其进行深入研究后,发现使用噬菌体溶解蛋白作为抗菌化合物的方法,可以使噬菌体成为抗生素的强大抗菌竞争者。
◆ 细菌素 —— 另一类潜在的抗生素替代品,是由细菌产生的核糖体产生的抗菌肽,由于特定的免疫机制,细菌本身对杀伤肽免疫。迄今为止,细菌素在食品工业中主要用作食品安全剂和防腐剂;在动物研究中,细菌素作为抗菌剂已逐渐展示出期望的结果。
在小鼠模型的研究中,成功使用绿脓杆菌治疗铜绿假单胞菌肺部感染,其疗效并高无任何副作用;在给予产乳链菌肽和片球菌素的乳酸乳球菌和乳酸乳酸菌菌株有助于减少肠道内耐万古霉素的肠球菌定植。
细菌素已成功应用于治疗和预防牛乳腺炎,且其疗效与抗生素相当。此外,对由葡萄球菌引起乳腺炎的8名哺乳期女性的研究中,已经证明了乳酸链球菌肽可有效的对其进行治疗。
◆ 单克隆抗体作为替代品或与抗生素结合使用,也可以解决抗生素耐药性的问题。单克隆抗体绕过了毒性、耐药性发展和免疫系统早期清除的并发症,这在抗生素的情况下是可见的。使用单克隆抗体治疗细菌感染是近几年兴起的,在此之前,单克隆抗体主要用于治疗癌症、自身免疫性疾病或病毒感染。
在兔子身上进行实验研究表明,使用单克隆抗体bezlotoxumab对抗炭疽保护性抗原是成功的。奥比妥昔单抗的使用提高了接受致死剂量的炭疽芽孢杆菌孢子兔子的存活率;在一项 2655 名参与者的临床试验中,使用bezlotoxumab(抗艰难梭菌毒素的单克隆抗体) 治疗艰难梭菌感染可降低感染的复发率。进一步研究发现,从患者的 B 细胞中产生了一种单克隆抗体,用于对抗小鼠结核分枝杆菌的感染。
单克隆抗体比生产抗生素虽然成本更高,但有很许多好处 —— 相比较细菌素、噬菌体及其内溶素、单克隆抗体的主要优点之一是可以具有高度的靶标特异性,因此对微生物群的附带损害最小。对于这方面的研究,更多的是将用于改变医学上的使用。
◆ 益生菌被广泛的应用于此方面,如今已被证明其可以增加有益微生物的丰度,稳定微生物群落,从而减轻抗生素的影响。
益生菌是通过促进抗菌肽的产生、从而产生细菌素,通过争夺肠道黏膜上的营养物质和受体来抑制非共生菌的生长、增强肠道屏障功能和调节免疫力来发挥作用的,但使用益生菌可能不能够让肠道微生物群完全恢复如初。
◆ FMT更有利于恢复肠道中的微生物平衡。FMT已被广泛用于医疗性的重平衡艰难梭菌感染患者的微生物群,恢复其微生物群和代谢活性。
FMT还可以在抗生素治疗前利用患者自身的供体粪便,称为自体FMT。由于如疗效、成本和适用性等多种因素,使选择FMT成为了一个极具发展性的选择,但具体的使用还需要详细的研究来进行优化,并对其进一步进行肠道疾病以外的其他应用可能性的研发。
人体还可以通过合理的饮食调节和健康的作息安排来控制自身的微生物群,从长远来看,自身的调控会保持机体持续的健康,且对预防炎症疾病起到很好的作用。
以上对于肠道菌群在宿主代谢和免疫功能(如免疫发育、定植抗性、细胞信号传导) 中的重要性;抗生素在单个细菌细胞水平上的影响,其使用和滥用会导致耐药性的发生以及抗生素治疗的替代方法进行了说明。
在先进的组学技术的帮助下,宿主和微生物群之间复杂的相互作用现在变得清晰起来。抗生素会破坏微生物平衡,从而破坏细菌群落内相互关系,以及影响其与宿主之间的关联,并因此产生的耐药菌使临床治疗变得困难。
由于宿主和微生物群之间的这种复杂联系,目前对抗生素需要遵循严谨的使用规范,而;另一方面,对抗生素替代品的研究以及应用是重点,要同时满足限制替代品所附带的损害。研究出可以维持和改善宿主健康并在使用时尽量减少抗生素影响的治疗方法。
主要参考文献:
Abrams, G. D., & Bishop, J. E. (1967). Effect of the normal microbial flora on gastrointestinal motility. Proceedings of the Society for Experimental Biology and Medicine, 126(1), 301– 304.
Adedeji, W. A. (2016). The treasure called antibiotics. Annals of Ibadan Postgraduate Medicine, 14(2), 56– 57.
Adriaenssens, N., Coenen, S., Versporten, A., Muller, A., Minalu, G., Faes, C., Vankerckhoven, V., Aerts, M., Hens, N., Molenberghs, G., & Goossens, H., ESAC Project Group. (2011). European surveillance of antimicrobial consumption (ESAC): Outpatient antibiotic use in Europe (1997-2009). Journal of Antimicrobial Chemotherapy, 66(Suppl. 6), 3– 12.
Akhavan, B. J., Khanna, N. R., & Vijhani, P. (2020). Amoxicillin, StatPearls [Internet]. StatPearls Publishing.
Allegretti, J. R., Mullish, B. H., Kelly, C., & Fischer, M. (2019). The evolution of the use of faecal microbiota transplantation and emerging therapeutic indications. The Lancet, 394(10196), 420– 431.
Aagaard, K., Ma, J., Antony, K. M., Ganu, R., Petrosino, J., & Versalovic, J. (2014). The placenta harbors a unique microbiome. Science Translational Medicine, 6(237), 237ra65.
Blaser, M. (2011). Stop the killing of beneficial bacteria. Nature, 476(7361), 393– 394.
Brestoff, J., & Artis, D. (2013). Population genetic tools to dissect innate immunity in humans. Nature Immunology, 14(7), 676– 684.
Brugman, S., Klatter, F. A., Visser, J. T., Wildeboer-Veloo, A. C., Harmsen, H. J., Rozing, J., & Bos, N. A. (2006). Antibiotic treatment partially protects against type 1 diabetes in the bio-breeding diabetes-prone rat. Is the gut flora involved in the development of type 1 diabetes? Diabetologia, 49(9), 2105– 2108.
Bui, T., & Preuss, C. V. (2021). Cephalosporins, StatPearls [Internet]. StatPearls Publishing.
Cahenzli, J., Köller, Y., Wyss, M., Geuking, M. B., & McCoy, K. D. (2013). Intestinal microbial diversity during early-life colonization shapes long-term IgE levels. Cell Host and Microbe, 14(5), 559– 570.
Cao, F., Wang, X., Wang, L., Li, Z., Che, J., Wang, L., Li, X., Cao, Z., Zhang, J., Jin, L., & Xu, Y. (2015). Evaluation of the efficacy of a bacteriophage in the treatment of pneumonia induced by multidrug resistance Klebsiella pneumoniae in mice. BioMed Research International, 2015, 2015– 2019.
Cao, L. T., Wu, J. Q., Xie, F., Hu, S. H., & Mo, Y. (2007). Efficacy of nisin in treatment of clinical mastitis in lactating dairy cows. Journal of Dairy Science, 90(8), 3980– 3985.
Cash, H. L., Whitham, C. V., Behrendt, C. L., & Hooper, L. V. (2006). ‘Symbiotic bacteria direct expression of an intestinal bactericidal lectin’. Science, 313(5790), 1126– 1130.
Chaves, B. J., & Tadi, P. (2021). Gentamicin, StatPearls [Internet]. StatPearls Publishing.
Centre for Disease Control (CDC). (2017). Pediatric treatment recommendations.
Aloisio, I., Quagliariello, A., De Fanti, S., Luiselli, D., De Filippo, C., Albanese, D., Corvaglia, L. T., Faldella, G., & Di Gioia, D. (2016). Evaluation of the effects of intrapartum antibiotic prophylaxis on newborn intestinal microbiota using a sequencing approach targeted to multi hypervariable 16S rDNA regions. Applied Microbiology and Biotechnology, 100(12), 5537– 5546.
Arboleya, S., Binetti, A., Salazar, N., Fernández, N., Solís, G., Hernández-Barranco, A., Margolles, A., los Reyes-Gavilán, C. G., & Gueimonde, M. (2012). Establishment and development of intestinal microbiota in preterm neonates. FEMS Microbiology Ecology, 79(3), 763– 772.

谷禾健康
在谷禾肠道菌群检测报告中,有时候会看到这样的检测结果,沙眼衣原体超出正常范围。

这个沙眼衣原体到底是什么?
粪便中检出衣原体代表什么?
感染衣原体会带来什么问题?
在什么情况下会感染呢?
感染了该怎么解决?
需要注意什么呢?
……
本文将为大家详细介绍——衣原体。
衣原体是一组极小的,专性细胞内生长,有独特生命周期的微生物,革兰氏阴性。它比细菌小,比病毒大,是近似细菌与病毒的一种微生物。依赖于宿主细胞,以三磷酸腺苷 (ATP) 和烟酰胺腺嘌呤二核苷酸 (NAD+) 形式提供能量。
衣原体以两个阶段存在:
(1)感染性粒子称为原生小体(elementary bodies)
(2)胞质内生殖形式称为网状体( reticulate bodies)
除眼部和呼吸道感染外,它们主要通过性传播感染。使用抗生素可以治愈感染。
Laboratory of Dr. Lance Liotta
分类
界:细菌界
门:衣原体门
纲:衣原体纲
目:衣原体目
科:衣原体科
属:衣原体属
衣原体以下几种类别:
其中较为常见的是前三种,后面章节会详细介绍这三大类衣原体。
形态和基因组
生理代谢
衣原体需要活细胞才能生长。它们无法合成自己的ATP或氧化再生 NAD+.
有了外来供给的高能分子,衣原体从葡萄糖、丙酮酸和谷氨酸等化合物中产生二氧化碳,并进行通常的细菌代谢活动。
沙眼衣原体的生长依赖色氨酸。然而,沙眼衣原体不能合成色氨酸并利用环境进行色氨酸代谢。如果沙眼衣原体生活在缺乏色氨酸的环境中,它将分化成一种不具传染性的持续异常形式。
有人认为衣原体是一种“无声”感染。大多数感染者没有任何症状。
大约 70-95% 的女性和 50% 的男性衣原体感染后根本没有观察到衣原体症状。症状也可能很轻微,几乎不明显。
调查显示,很多衣原体感染发生在25岁以下的青年人,全球范围内衣原体感染病例正在不断增加。
衣原体在感染男性和女性后会出现不同的症状。
不同性别感染后的症状
女性:
男性:
不同部位感染后的症状
无保护的性行为也可能导致身体其他部位感染,如肛门、喉咙、眼睛等。
传播途径
是否有可能从马桶座上感染衣原体?
沙眼衣原体是导致衣原体感染的细菌,不能在人体外生存。因此,不会从马桶座上感染衣原体。衣原体也不会通过其他非正式接触传播,如拥抱、亲吻,或共用毛巾、床单、游泳池或餐具等。
那么有人担心,如果接触到毛巾、床单或马桶座圈上残留的含有衣原体感染者的新鲜体液,会不会感染?
如果仅仅因为碰到皮肤或臀部而接触到,是不足以让你感染的。它需要接触合适的身体组织,如宫颈、尿道或眼角膜才能存活。
易感人群
以上人群更应该注意。
传播特点
我们可以看到,衣原体有个潜伏期,也就是一开始感染的时候人体可能感知不到,然而在细胞内可能一刻不停地在发生变化,那么在这个阶段,究竟发生了什么?
这要从衣原体附着在另一个人的细胞上开始说起。
衣原体的生长发育有两个阶段,这两个阶段是两种不同的形态:
一类是小而致密的原生小体(Elementarybody,EB),
另一类是大而疏松的网状体(Reticulatebody,RB),
如果说原生小体承担着感染的任务,那么网状体更多的是承担繁殖任务。原生小体通常存在于受感染男性的精液和受感染女性的阴道分泌物中。
再来看它的整个生命周期。
生命周期
阶段1 ——原生小体
首先,沙眼衣原体以一种原生小体的小孢子状形式附着在新的宿主细胞上。原生小体通过其表面上的粘附素与几种宿主受体蛋白和硫酸乙酰肝素蛋白聚糖之间的相互作用与细胞结合。
原生小体进入宿主细胞,被包涵体的宿主液泡包围。
在包涵体中,衣原体转变为一种更大、代谢更活跃的形式,称为网状体。
阶段2 ——网状体
网状体显著改变了内含物,使其成为细菌快速复制的更宜居环境,这将在接下来的 30 – 72 小时内发生。
大量细胞内细菌随后转变回具有抗药性的原生小体,然后导致细胞破裂并被释放到环境中。
然后这些新的原生小体在精液中脱落或从女性生殖道的上皮细胞中释放出来,并附着在新的宿主细胞上。
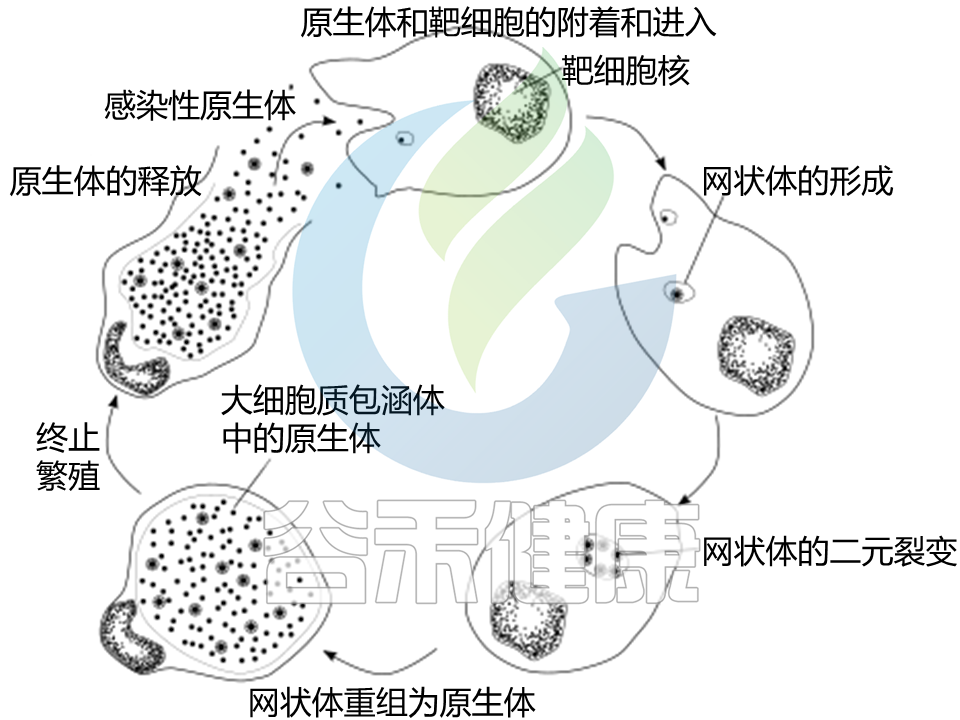
而这个时候,原生小体正在继续感染临近细胞开始新一轮的发育周期
…
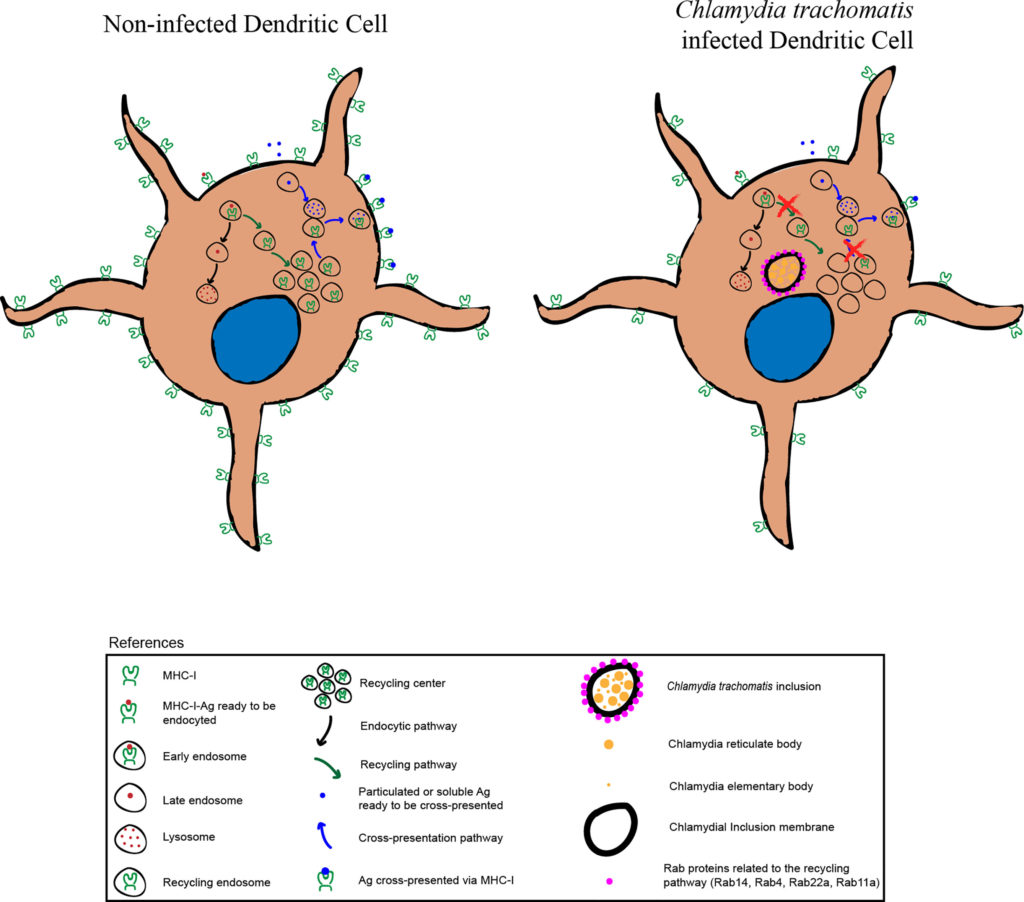
毒力因素
Del Balzo D, et al.,Front Immunol. 2021
目前已知可以引起人类疾病的衣原体共有三种:鹦鹉热衣原体、沙眼衣原体、肺炎衣原体。
下面详细介绍一下这三类衣原体。
细胞内革兰氏阴性。鹦鹉热衣原体具有主要的外膜蛋白(MOMP),其功能与孔蛋白的生化特性相似。这些通道可渗透ATP,并且可能是细菌利用三磷酸核苷的途径。可以从宿主细胞中获得ATP和必需氨基酸。
鹦鹉热,也称为鸟类病,是指一种人畜共患病(如鹦鹉、孔雀、鸡、鸭、鸽等)。
★ 传播途径
通过吸入被感染鸟类的呼吸道分泌物或粪便污染的灰尘而传播给人类。其他接触方式包括嘴对嘴接触和处理受感染鸟类的羽毛和组织。
禽类养殖场、宰杀车间、羽绒加工厂、农贸市场或家禽鸟类集散点、信鸽调教基地等均可能成为传染场所。
患病或流产过的牛羊猪、带菌或发病的鸟类、家禽、野生水鸟、外观健康但排菌的鹦鹉、金丝雀、鸽子等观赏鸟类也是重要的传染源。
此外,带有鹦鹉热衣原体细菌的患者的咳痰也具有传染性。
人类疾病通常针对下呼吸道。
★ 潜伏期
被感染后5–14天
★ 治疗
抗生素
★ 预防
Chlamydia trachomatis
革兰氏阴性,一种专性的细胞内需氧,呈球状或棒状,缺乏肽聚糖细胞壁,需要生长的细胞才能保持活力,因为它无法合成自己的ATP.
有糖酵解途径和相关的三羧酸循环。糖原的合成和葡萄糖衍生物的使用在代谢中起辅助作用。代谢前体和产物,如丙酮酸、琥珀酸、甘油-3-磷酸和NADH脱氢酶、NADH泛素氧化还原酶和细胞色素氧化酶的存在表明,沙眼衣原体利用电子传递的形式来产生能量。它有多种策略逃避免疫系统。
沙眼衣原体,不止会引起沙眼。实际上,目前已发现沙眼衣原体有15个血清型,能引起不同的疾病,除沙眼外,还有可能引起生殖道感染,甚至造成不孕不育。
★ 症状以及传播途径
主要感染粘膜,例如子宫颈,直肠,尿道,喉咙和结膜。大多数人没有任何症状。
女性盆腔炎(PID),输卵管阻塞,不孕不育, 异位妊娠。
附睾炎, 前列腺炎,尿道炎。
沙眼可通过直接或间接接触传播。
衣原体 NGU 在症状上与淋球菌引起的感染相似。无论是否有局部症状,感染都可能上升到上生殖道,波及男性的附睾和女性的输卵管及邻近组织(盆腔炎)。
沙眼衣原体血清型 L1、L2 和 L3 会导致性病性淋巴肉芽肿 (LGV),这是一种更具侵袭性的性传播疾病。
LGV 的特征是外生殖器上出现短暂的丘疹,随后在 1 至 2 个月内出现腹股沟和直肠周围淋巴结的疼痛肿胀。
在分娩过程中从阴道传播到孩子身上,导致肺炎或严重的眼部感染。
50%以上的婴儿是由感染了沙眼衣原体(血清型D-K)的女性所生。最常见的表现是新生儿包涵体结膜炎。如果不治疗,感染会导致角膜或结膜永久性疤痕。
患有沙眼衣原体的人患反应性关节炎风险更高
感染的分泌物从生殖器到手部,最终到眼睛会导致沙眼。
沙眼衣原体、血清型 A、B、Ba 和 C 会导致慢性角膜结膜炎,通常会导致失明。
沙眼是通过个人接触传播的,例如,通过飞沫从眼睛到眼睛,通过手接触并传播到眼睛的受污染表面,或通过苍蝇。
由于持续或反复感染数年,炎症反应和伴随的疤痕导致角膜永久性混浊和眼睑变形。
任何年龄的个体都可能发生由沙眼血清型 D-K 引起的暂时性化脓性结膜炎。这些人也可能感染了生殖器。
★ 治疗
抗生素治疗。在大多数情况下,感染会在一到两周内消退,期间不要进行性行为。伴侣也需要检查。
★ 预防
沙眼衣原体与菌群的相互作用
在沙眼衣原体感染的情况下,阴道和肛门环境都会出现一定程度的生态失调。
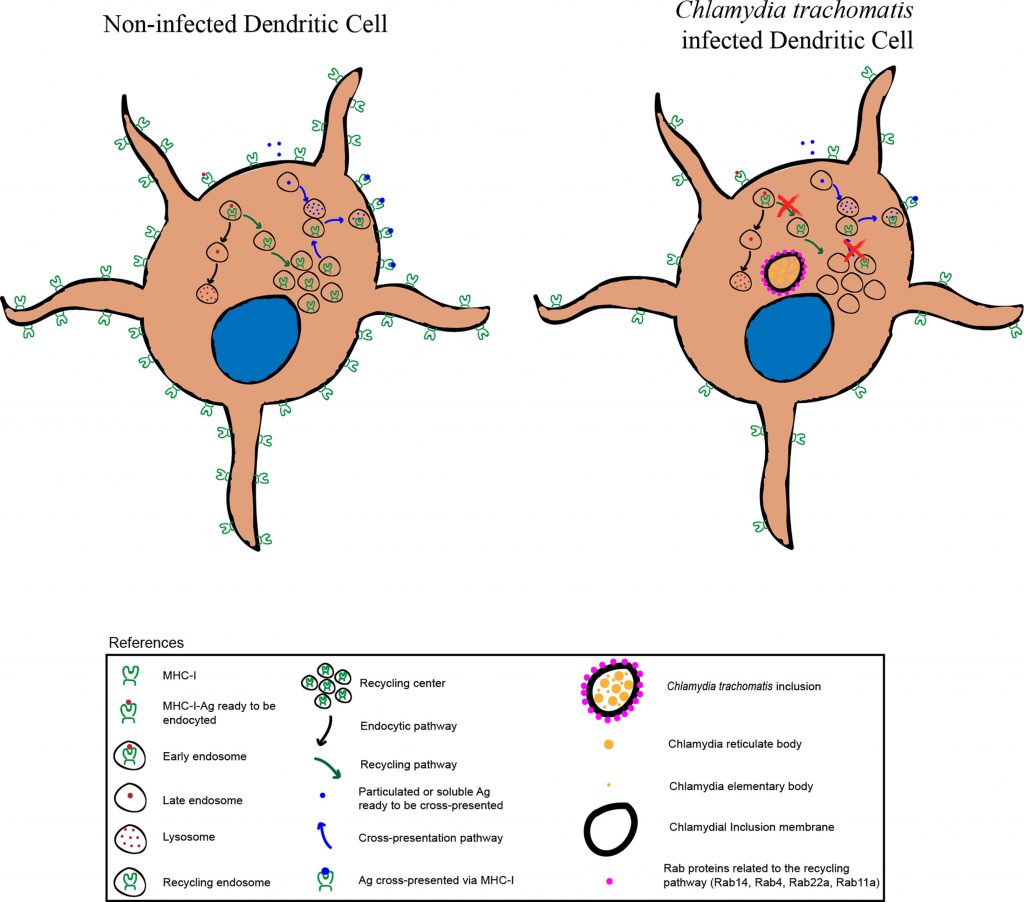
沙眼衣原体,因其导致女性不孕的能力而臭名昭著。虽然沙眼衣原体感染的部分发病机制尚不清楚,但潜在因素与微生物群有关。
沙眼衣原体感染的阴道微生物群可能失调:

乳酸在抗衣原体方面发挥重要作用
健康的阴道微生物群以乳酸杆菌属为主,这些细菌通过产生抗菌化合物和提供机械屏障来保护宿主免受沙眼衣原体等细菌的入侵。乳酸可以通过调节宿主上皮功能,在阴道微生物群的抗衣原体特性中发挥重要作用。
乳酸有两个变构提体或异构体:L型和D型。D-乳酸对阴道具有保护作用。
不是所有乳酸杆菌主导的阴道菌群都健康
其中,惰性乳酸杆菌L. iners几乎不产生D-乳酸,以L. iners为主的阴道微生物群与沙眼衣原体感染的易感性增加有关。
沙眼衣原体趁阴道菌群紊乱入侵
微生物组与宿主有密切的相互作用。不仅是宿主免疫系统对于抵御外部威胁至关重要,微生物组的屏障功能也至关重要。病原体感染的一个重要风险因素是阴道微生物组的屏障功能减弱,比如菌群失调时出现细菌性阴道病。
在细菌性阴道病患者的菌群中,微生物群多样性增加,且pH 值的升高导致更中性的 pH 环境。患有细菌性阴道病的女性更容易感染沙眼衣原体。沙眼衣原体可能会利用失效的防御系统入侵。

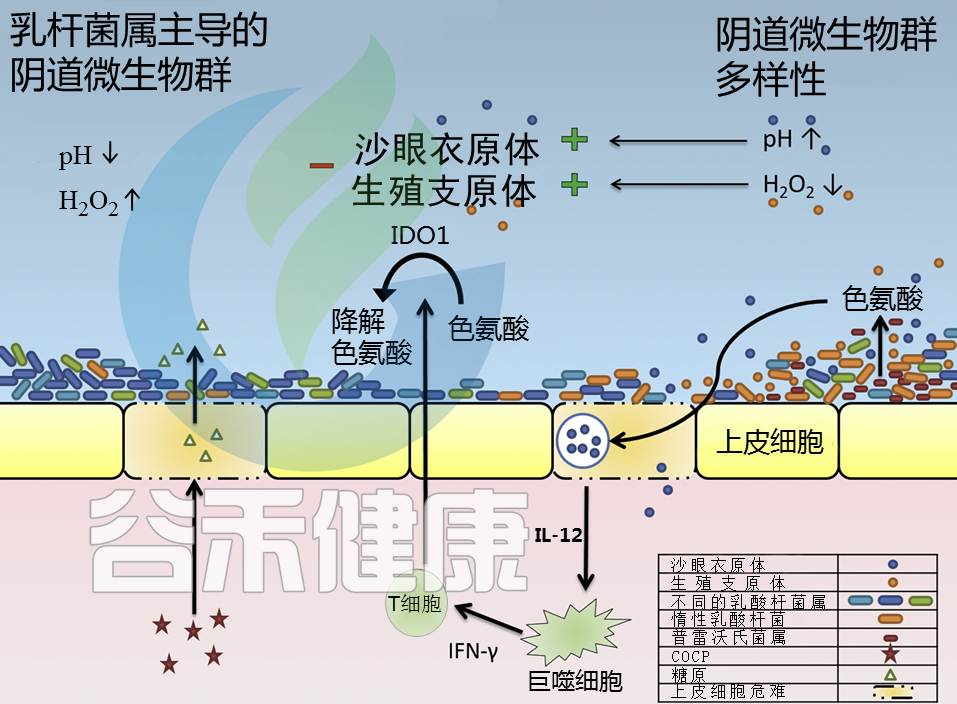
Molenaar MC,et al.,J Reprod Immunol. 2018
沙眼衣原体绕过屏障,感染人类细胞,免疫系统产生IL-12来应付
沙眼衣原体很狡猾,通过绕过如乳酸杆菌所建立的屏障,可以感染人类细胞。在识别出沙眼衣原体感染后,免疫系统会产生更多的IL-12,以及其他炎症细胞因子。这个IL-12能派上什么用处呢?
IL-12诱导IDO1的产生
IL-12是一种炎症细胞因子,可刺激γ干扰素(IFN-γ)的产生。这是由巨噬细胞产生的,刺激炎症,并诱导吲哚胺-2,3-双加氧酶1(IDO1)。
IDO1通过“断粮”抑制沙眼衣原体
前面我们知道,沙眼衣原体的生长需要依赖色氨酸,而这个IDO1呢,就是通过限制色氨酸,来抑制沙眼衣原体的生长。
如果沙眼衣原体就这么被免疫系统干掉了,那么事情就简单了,然而实际上,普雷沃氏菌属也会产生色氨酸。
沙眼衣原体的另一个“救兵”——普雷沃氏菌属
然而,色氨酸还有另一个来源,普雷沃氏菌属Prevotella. 关于普雷沃氏菌属在我们之前的文章中有详细介绍过:肠道重要基石菌属——普雷沃氏菌属 Prevotella
普雷沃氏菌属如果在阴道菌群中占了主导,那么往往与细菌性阴道病有关。
已有研究表明,当色氨酸的其他来源较低或耗尽时,普雷沃氏菌属产生的色氨酸可被衣原体用于生存。
总体而言,阴道菌群的构成在沙眼衣原体的感染过程中起着重要作用。此外,沙眼衣原体感染的免疫反应也与阴道菌群紊乱有关。
TNF-α在沙眼衣原体感染的先天免疫反应中发挥作用
在宿主和微生物之间的相互作用中考虑的一个重要因素是免疫基因的多态性,因为这些可能影响免疫应答。
例如,TNF-α基因(TNFA-208G > A)的多态性可以影响表达量,从而影响宿主的炎症反应。这主要发生在菌群紊乱的情况下,Nugent评分>7(Nugent是检查阴道微生态的一项指标),可能导致早产。这与沙眼衣原体感染有关,因为TNF-α在沙眼衣原体感染的先天免疫反应中发挥作用。
阴道微生物群是女性生殖道的第一道防线。沙眼衣原体可以在乳酸菌较少的微生物群中茁壮成长。因此,调节阴道菌群平衡是预防沙眼衣原体的有效途径。
影响阴道菌群的因素
促使阴道菌群发生变化的原因有很多,可能与自身免疫力下降、经期不洁、频繁性交、反复阴道灌洗等因素有关。
★ 卫生习惯:过度清洁可能出现细菌性阴道病
大量清洗和冲洗阴道对微生物群有很大影响,并可能导致菌群已经改变的女性出现细菌性阴道病。
★ 激素变化:有益菌减少
在月经、怀孕或哺乳期间,雌激素水平下降或其他激素失衡会减少阴道内的有益细菌,使人容易受到感染。
★ 口服避孕药:影响微生物组和炎性细胞因子
性激素雌激素和阴道微生物群之间的关系有利于糖原的产生,从而有利于乳酸杆菌。由于这些激素会影响乳酸杆菌,所以它也会影响其他细菌。
在沙眼衣原体感染期间使用COCP(复方口服避孕药)时,炎性细胞因子显著增加。显然,COCP中的激素会影响微生物组和炎性细胞因子。研究人员认为,这可能是由于不同激素组合对炎症的不同调节。另一种解释可能是,用于激素避孕的激素是合成的,而不是自然产生的激素,因此可能引发反应。
★ 抗生素:菌群失调
抗生素可能抑制乳酸杆菌的生长,在这个过程中,其他致病菌可能逐渐成为优势菌,阴道菌群逐渐失调。
★ 老年人:雌激素减少,菌群可能失调
卵巢功能低下、老年人等雌激素水平的下降,阴道内乳酸杆菌数量减少,可能导致阴道菌群的改变。
★ 饮食不当:避免高糖、高油食物
长期的高糖、高油、低膳食纤维等食物摄入,尤其是爱吃甜食的女性朋友,可能改变阴道内正常的环境,从而引起菌群失调。

关于沙眼衣原体感染女性阴道微生物群的研究越来越多,但关于肠道微生物群组成的信息仍然较少,沙眼衣原体感染后的肠道菌群变化如下:

虽然这些菌群变化背后的原因尚不清楚,推测可能与以下原因有关:
(i)衣原体可引起炎症反应(即通过产生细胞因子和金属蛋白酶招募自然杀伤细胞和中性粒细胞),随着某些物种的减少或增加,打破肠道微生物群原有的平衡;
(ii)沙眼衣原体感染细胞或招募的白细胞的耗氧量有利于严格厌氧菌的增殖;
(iii)衣原体可以根据其营养需求修改特定的代谢途径,导致肠道微生物群中特定菌群的优先增殖。
有趣的是,肠道和阴道的微生物群有许多共同的细菌类群,反映了这两个部位之间的微生物“共享”。
这种情况有利有弊:
革兰氏阴性,专性的细胞内细菌。是一种引起咽炎的呼吸道病原体,其最初的定植部位是口腔和鼻粘膜。一旦它定居在肺部,它就由单核细胞通过血液循环分布到身体的其他部位。
★ 症状
肺炎衣原体感染是一种轻度疾病,最常引起上呼吸道感染。常见症状包括:
★ 传播途径
肺炎衣原体主要以呼吸道飞沫、母婴传播和性接触等方式传播。
★ 治疗
大多数人无需药物即可自行康复。也可以用抗生素来治疗。
★ 易感人群
所有年龄段的人都可能感染,其中免疫较弱的人群更易感染。8岁以上的儿童及青年也是极易被感染人群。此外,集体生活的人群易爆发,例如:学校、宿舍、军营、疗养院、医院、监狱等。
★ 预防
对于衣原体感染眼部、尿道、阴道宫颈标本最好刮取黏膜。
此外,根据感染部位,可采集血液、呼吸道分泌物、痰液、肺等组织。
在 LGV(性病性淋巴肉芽肿)的情况下,应收集淋巴结中的脓液。
关于衣原体的检测方法有如下类别。在谷禾肠道菌群检测报告中的检测方法是16S rRNA 扩增子测序。
——光学显微镜(特异性和敏感性较低):
结膜、尿道、宫颈沙眼衣原体感染的诊断,可通过Giemsa染色、Macchiavello染色、Castaneda染色等方法,在细胞核周围显示典型的肾样包涵体。
由于包涵体具有糖原基质,因此,它们也可以用碘溶液染色。
该方法特异性和敏感性较低。
——免疫荧光(快速):
物种或属特异性抗原用荧光标记抗体(通常是单克隆抗体)进行染色。
该方法的敏感性为90%,特异性为95%。
方法快速。在一个小时内就可以得到结果。
——ELISA法检测衣原体抗原:
可检测由附着在塑料体或微量滴定孔等固体表面的抗体捕获的可溶性属特异性抗原。
该检测是基于酶标记检测系统和显色底物。
ELISA方法的敏感性和特异性与免疫荧光法相似。
——DNA探针:
DNA杂交可用于直接检测结膜和宫颈涂片中的沙眼衣原体。
——化学发光测定:
使用吖啶酯标记的链状DNA探针, 根据需要与沙眼衣原体RNA或其他RNA特异性互补。
DNA-RNA 杂交体在光度计中检测,该光度计测量吖啶酯标记发出的光。
敏感性和特异性为 95%。
——聚合酶链反应(PCR):
omp1基因和16s rRNA基因可以通过PCR进行扩增和检测。
检测这些 DNA 的特异性高达 95%,可用于鉴定物种水平和菌株。
——体液细菌培养:
该方法比检测细菌DNA或表面抗原的测试需要更长时间。
感染衣原体后,一般以抗生素治疗为主。
★ 肠道菌群检测出来有衣原体超标,需要治疗吗?
首先看下自身有没有出现相关症状,如果完全无症状不必太担心,可过段时间再次检测;若几次检测都超标则需重视;若已经出现相关症状,例如女性出现阴道分泌物异常,小便烧灼感等,则需去医院就诊。
★ 衣原体可以自愈吗?
衣原体不太可能自行消失。虽然症状可能会暂时缓解,但如果不进行治疗,感染可能会在体内持续存在(亚临床感染)。
因此,如果诊断出来衣原体感染,及时治疗很重要。
★ 如果不治疗,会发生什么?
衣原体最初感染时常常被忽视。后面可能会导致严重的健康问题,如不孕不育等。
女性朋友注意了,衣原体可能会感染到子宫和输卵管,可能导致盆腔炎。
盆腔炎通常没有症状,部分女性可能有腹痛和骨盆疼痛。即使它最初不会引起症状,盆腔炎也会对生殖系统造成永久性损害。盆腔炎可导致长期盆腔疼痛、无法怀孕,以及可能致命的异位妊娠(也就是宫外孕)。
相对来说,男性的问题少一点。衣原体感染有时会扩散到从睾丸携带精子的输精管,引起疼痛和发烧。衣原体阻止男性生育的概率不大。
衣原体感染后,可能会出现的其他问题,例如:菲茨-休-柯蒂斯综合征(肝脏及周围组织的组织炎症),反应性关节炎(关节炎症)等疾病。
此外,未经治疗的衣原体感染也会增加一个人感染HIV的风险。
不过好消息是,衣原体可以通过正确的治疗治愈。治疗服用药物需遵医嘱,按时服用。如果服用得当,会阻止感染,并可能减少以后出现并发症的概率。
★ 如果已经感染过衣原体,是不是不会再感染了?
不是。重复感染衣原体很常见。应在最初感染后约3个月进行重新检测。如果是你的性伴侣感染了,那么ta即便已经接受了治疗,你也应该在大约三个月后再次接受检测(尤其是女性)。
★ 如果怀孕了,衣原体感染是否影响宝宝?
如果确定怀孕并患有衣原体感染,有可能会在分娩期间将感染传染给宝宝。这样就可能会导致早产(妊娠37周前分娩),新生儿眼部感染(新生儿结膜炎,红眼等),新生儿肺炎等情况。
应该在第一次产前检查时接受衣原体检查,如果有衣原体感染则进行相关治疗。
总体而言,有许多因素在阴道微生物组、肠道微生物组、宿主免疫系统和衣原体之间的相互作用中发挥作用。这是一个复杂的关系,许多方面仍有待发现。破译宿主-微生物群相互作用在细胞和分子水平上的复杂性,将有助于更好地理解微生物群调节衣原体感染风险的机制。
主要参考文献:
Molenaar MC, Singer M, Ouburg S. The two-sided role of the vaginal microbiome in Chlamydia trachomatis and Mycoplasma genitalium pathogenesis. J Reprod Immunol. 2018 Nov;130:11-17. doi: 10.1016/j.jri.2018.08.006. Epub 2018 Aug 22. PMID: 30149363.
Mott PD, Taylor CM, Lillis RA, et al. Differences in the Genital Microbiota in Women Who Naturally Clear Chlamydia trachomatis Infection Compared to Women Who Do Not Clear; A Pilot Study. Front Cell Infect Microbiol. 2021;11:615770. Published 2021 Apr 12. doi:10.3389/fcimb.2021.615770
Ziklo N, Huston WM, Hocking JS, Timms P. Chlamydia trachomatis Genital Tract Infections: When Host Immune Response and the Microbiome Collide. Trends Microbiol. 2016 Sep;24(9):750-765. doi: 10.1016/j.tim.2016.05.007. Epub 2016 Jun 16. PMID: 27320172.
Ceccarani C, Marangoni A, Severgnini M, et al. Rectal Microbiota Associated With Chlamydia trachomatis and Neisseria gonorrhoeae Infections in Men Having Sex With Other Men. Front Cell Infect Microbiol. 2019;9:358. Published 2019 Oct 18. doi:10.3389/fcimb.2019.00358
Tamarelle J, Thiébaut ACM, de Barbeyrac B, Bébéar C, Ravel J, Delarocque-Astagneau E. The vaginal microbiota and its association with human papillomavirus, Chlamydia trachomatis, Neisseria gonorrhoeae and Mycoplasma genitalium infections: a systematic review and meta-analysis. Clin Microbiol Infect. 2019;25(1):35-47. doi:10.1016/j.cmi.2018.04.019
Edwards VL, Smith SB, McComb EJ, et al. The Cervicovaginal Microbiota-Host Interaction Modulates Chlamydia trachomatis Infection. mBio. 2019;10(4):e01548-19. Published 2019 Aug 13. doi:10.1128/mBio.01548-19
Raimondi S, Candeliere F, Amaretti A, et al. Vaginal and Anal Microbiome during Chlamydia trachomatis Infections. Pathogens. 2021;10(10):1347. Published 2021 Oct 19. doi:10.3390/pathogens10101347
Del Balzo D, Capmany A, Cebrian I, Damiani MT. Chlamydia trachomatis Infection Impairs MHC-I Intracellular Trafficking and Antigen Cross-Presentation by Dendritic Cells. Front Immunol. 2021 Apr 15;12:662096. doi: 10.3389/fimmu.2021.662096. PMID: 33936099; PMCID: PMC8082151.

谷禾健康

最近的Nature 和 Nature Medicine 连发表了好几篇关于肠道菌群的文章,包括肠道菌群与神经互作,和基于这个原理的针对自闭症的临床治疗方案。心血管疾病的微生物组和代谢特征等。
今天我们主要介绍心血管疾病中冠状动脉疾病的相关重要研究发现和意义。
复杂的疾病,如冠状动脉疾病(CAD),往往是多因素的,由多种潜在的病理机制引起。尽管冠状动脉疾病在预防、诊断和治疗方面取得了巨大进展,但仍然是世界范围内发病率和死亡率的主要原因。目前对冠状动脉疾病的治疗基于传统的和可控制的冠状动脉疾病风险因素,只能取得部分成功。
冠状动脉疾病的发展包括血管壁上动脉粥样硬化斑块的逐渐生长,这通常与代谢状态受损有关。人体接触环境分子的主要部位是胃肠道,其中膳食成分被微生物群转化,利用产生代谢物传播到全身器官。
血液充当体内分子的液体输送器, 特别是数以千计的循环代谢小分子,它们可以帮助我们了解体内生物过程状况,并且是研究冠状动脉疾病多因素性质疾病的宝贵来源。肠道微生物组积极参与血液代谢物的代谢。
几种肠道微生物群衍生的循环代谢物与心血管疾病相关:
三甲胺 N-氧化物
三甲胺 N-氧化物被确定为人类心血管疾病的标志物,进一步的证据表明在小鼠模型中具有促动脉粥样硬化性和促血栓形成。
硫酸吲哚酚
硫酸吲哚酚在细菌色氨酸酶降解色氨酸后在肝脏中产生,并被证明与动脉僵硬和外周血管疾病有关。
对甲酚
对甲酚是苯丙氨酸和酪氨酸的结肠细菌发酵产物,显示与心血管事件增加相关。
近期,以色列科学家招募了下列人群,采集其粪便和血清样本进行了全面的多组学分析,同时调查详细的医疗、生活方式和营养问卷等。
通过对粪便样本宏基因组测序(每个样本1000万 reads,约3G/样本)和对血清样本的进行非靶向质谱LC-MS测量了 961 种代谢物的水平,包括脂质、氨基酸、异生物质、碳水化合物、肽、核苷酸和大约 30% 的未命名化合物。
通过 Nightingale Health 的质子核磁共振 ( 1 H-NMR) 平台测量了另外 228 种血浆代谢物和比率,并使用了一个独立宏基因组数据集MetaCardis进行验证(该数据集样本来自于北欧血统队列,在地里区域上与该研究样本来源不同,这样可以分析遗传,饮食差异变量)。
MetaCardis数据集主要由四个主要群体组成:缺血性心脏病、健康对照组、代谢匹配的对照组和未经治疗的代谢受损对照组(详细数据集描述可以参看原文)
一、ACS的肠道微生物组特征
1. ACS 患者的变形杆菌丰度更高
这与之前的大多数研究结果一致,变形菌增多会导致处于炎症状态,是生态失调的标志。
20个在 ACS 或对照个体中显着富集的细菌,包括产丁酸盐的细菌如:梭菌属(Clostridium)、Anaerostipes hadrus嗜热链球菌(Streptococcus thermophilus)和Blautia菌属,以及Odoribacter splanchnicus 和大肠杆菌。
2. ACS患者队列中一种梭菌科的细菌物种 SGB 4712缺乏
在20 个显着富集的基因组中,鉴定到了一种以前未知的梭菌科细菌物种,索引为 SGB 4712。为了进一步验证该结果稳定和实用性,使用另外一个来自北欧血统地理上分布不同的队列,MetaCardis宏基因组数据集进行验证,与该研究结果一致,该物种的相对丰度随着具有 CAD 传统风险因素的种群逐渐减少。
3. SGB 4712关联15种显著差异的代谢物,其中包括降低心血管疾病风险的独立标志物——麦角硫因(ergothioneine,天然氨基酸)
对照组相比, 鉴定到SGB 4712 菌种与15 种循环代谢物的水平显着相关,在 MetaCardis 研究中,所有 15 种代谢物与 SGB 4712 的相关系数均可以重复,其中 10 种相关性仍然显著。
值得注意的是,SGB 4712与麦角硫因呈正相关,麦角硫因是一种天然存在的氨基酸,在体外显示对细胞应激源具有抗氧化和细胞保护能力,最近被证明是降低心血管疾病和人类死亡率风险的独立标志物。
此外,SGB 4712 与七种化学结构未知的化合物有关。其中包括 X-11315 和 X-24473,预测它们来自饮食,并与 SGB 4712 呈正相关。
图一 ACS 的微生物组和血清代谢组学特征
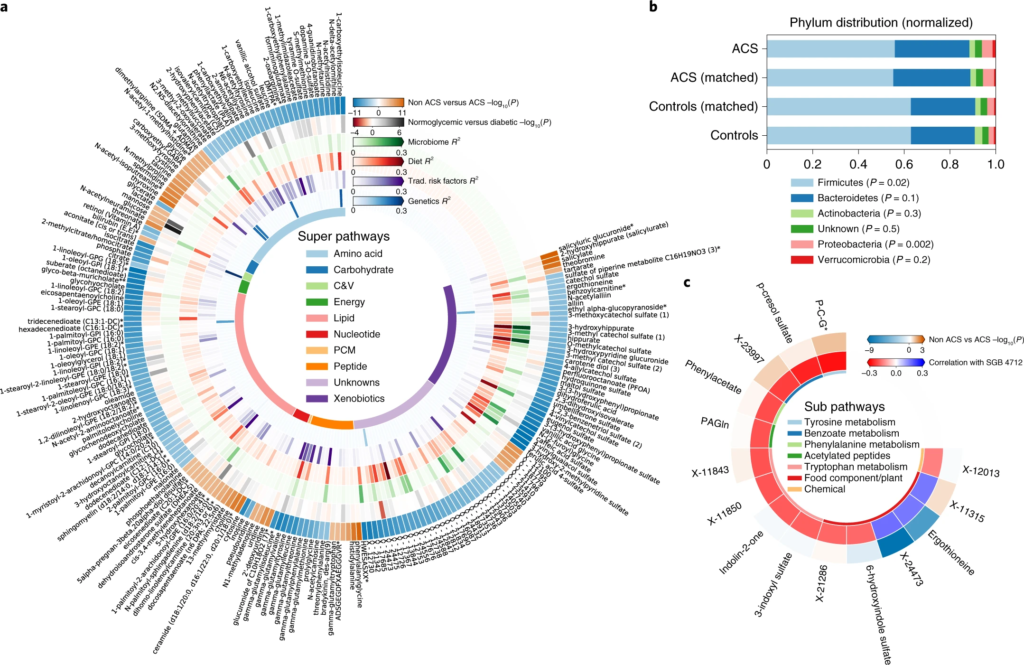
圆形热图显示 ACS 和非 ACS 对照组之间显着差异的前 200 种代谢物,与年龄、性别、BMI、吸烟状况和 DM 相匹配(方法)。每个切片代表一个代谢物,其名称显示在图表的外层周围。
这些结果突出了SGB 4712菌种在 CAD 发展中具有潜在的保护作用,由一系列循环血液代谢物介导,其中一些以前被证明在元生物途径中发挥核心作用,而另一些则未知。
因此,在实验研究中进一步验证后,这些代谢物可能会形成降低 CAD 风险的新目标。
二、ACS 的代谢特征因人而异
1. ACS 患者的血清代谢物水平个体化差异较大
虽然 CAD 患者具有共同的内表型,但他们通常表现出生物学上不同的疾病特征。为了更好地了解 ACS 的个体水平变异性,作者试图检查与非 ACS 对照的代谢偏差,并询问它们是否是个体特异性的。
计算了他们的个体偏差,并根据之前根据饮食、微生物组、传统风险因素和遗传学估计的 EV 对每个个体的前 100 个偏差代谢物进行加权。最后发现ACS 患者与其匹配对照的代谢偏差是因人而异的。
急性冠脉综合征患者的血清谱在血清代谢物水平上表现出广泛的扰动,包括533种显著改变的代谢物。
ACS的血清代谢组遵循一种主要的消耗模式,因为在对照组参与者中,358种代谢物(67%)的平均测量值较高。然而,这一趋势在主要的生物途径中并不一致。但是,与富含 ACS 的代谢物相比,饮食和微生物组在与 ACS 耗尽代谢物的偏差相关联方面更为显着(双尾 Mann–Whitney U-检验,P-value小于10 -20),这表明微生物组对 CAD 起保护作用。
值得注意的是,超过 90% 的显着扰动的代谢物无法用血糖状态来解释,这表明这种变化背后还有其他机制。所以进一步分析了其他系列综合因素(包括宿主遗传学、微生物组和饮食),得到一个重要发现就是:饮食和微生物组可以更好地解释 ACS 缺乏或含量低的代谢物,而传统的风险因素可以更好地解释 ACS 富集的代谢物。
图2 代谢偏差由潜在决定因素解释,并与临床参数相关
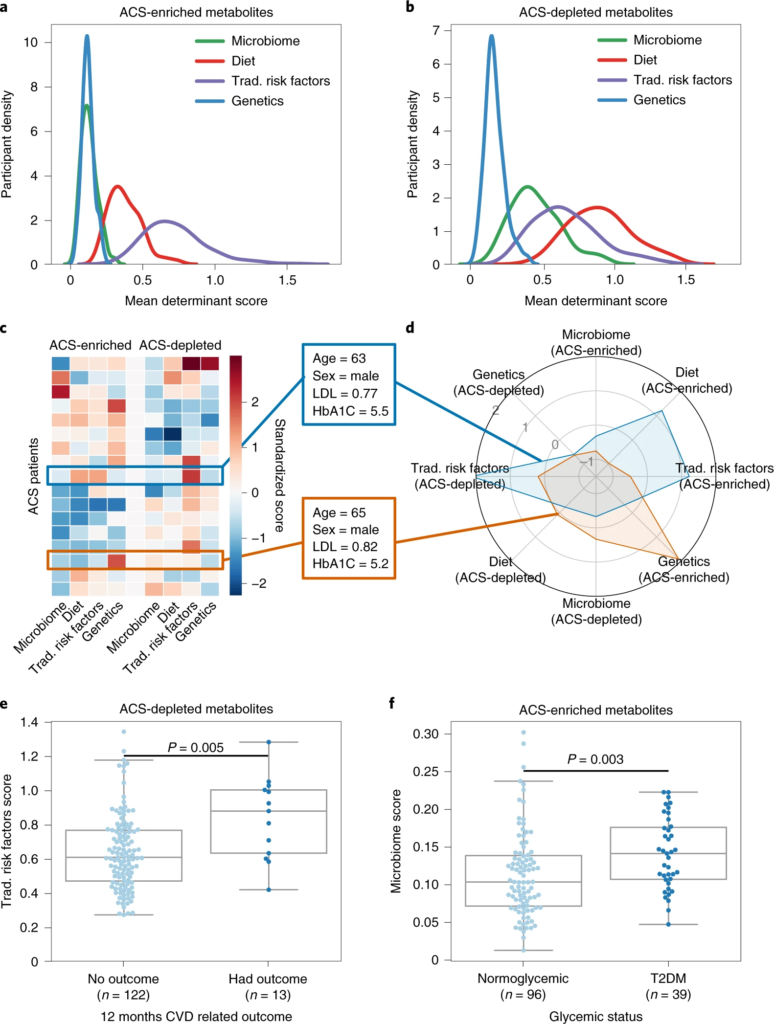
a、b、密度图显示 ACS 参与者的分布(y轴)与代谢物的潜在决定因素(微生物组、饮食、传统风险因素或遗传学)的平均加权R 2 ( x轴);富含 ACS 的代谢物。
2. 相似的临床特征,但其动脉粥样硬化负担的代谢机制却不同
虽然一些患者可能具有相似的临床特征,但他们的潜在生理状态和疾病轨迹可能不同。为了强调这种 CAD 患者的变异性,作者选择了 ACS 患者的常规危险因素的同质亚组。其中包括 17 名 60 至 70 岁的男性患者,低密度脂蛋白 (LDL) 在 0.70–1.30 mg ml -1范围内,糖化血红蛋白 (HbA1C) 低于 6%。尽管具有相似的临床特征,但该 ACS 患者亚组在代谢偏差方面表现出异质性。
三、微生物组在CAD早期阶段发挥作用
动脉粥样硬化是一种经过多年发展的进行性疾病,其中动脉粥样硬化斑块形成的每个阶段的特点是不同的病理过程。在早期阶段,血管壁上的动脉粥样硬化斑块的生长通常与代谢状态的损害有关。
为了解释每个代谢成分在 CAD 发展的时间轴上的参与,作者将个体代谢偏差的分析应用于代谢受损的对照(定义为 T2DM、高血压或血脂异常的诊断,或 BMI > 35),以及到非 ACS 个体的随机子集。
在比较这三组的分数时,我们发现分数分布存在一致的差异。与微生物组和饮食相关的代谢异常呈现出渐进的趋势,与对照组的随机子集相比,代谢受损的对照参与者的代谢物存在显着偏差。
这表明,微生物组和饮食对ACS的贡献可能是通过受损的代谢状态介导的,而不是代谢受损个体中尚未表现出的与传统风险因素和遗传学相关的代谢物异常。
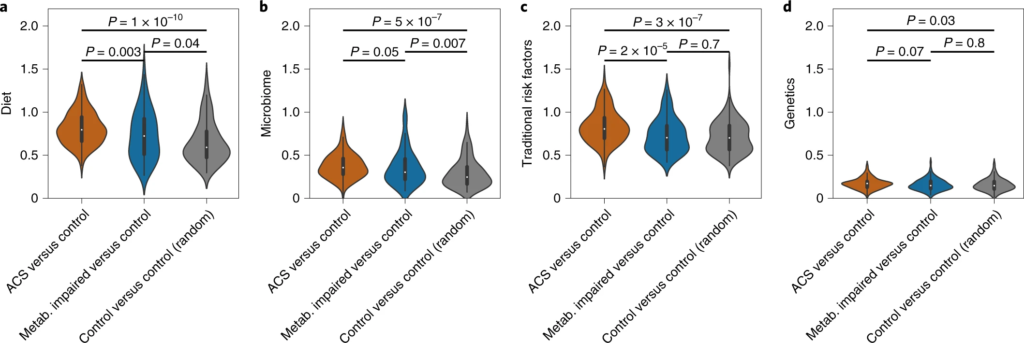
a – d,归因于饮食 ( a )、微生物组 ( b )、传统风险因素 ( c ) 和遗传学 ( d ) 的代谢偏差分数计算三个亚组:(1) ACS 个体 ( n = 135) 与非 ACS 对照与年龄、性别和 BMI 相匹配(橙色);(2) 患有代谢障碍的非 ACS 对照(定义为:诊断为 T2DM、高血压或血脂异常,或 BMI > 35;n = 102)与其他年龄、性别和 BMI 匹配的非 ACS 对照(蓝色);(3) 一组随机的非 ACS 个体 ( n = 132) 与其他匹配年龄、性别和 BMI(灰色)的非 ACS 对照。
四、血清代谢组学预测ACS患者 BMI 更高
肥胖是 CAD 的主要独立危险因素,影响已知的危险因素,如血脂异常、高血压、葡萄糖耐受不良和炎症状态,以及可能尚未认识到的机制。BMI 测量被用作肥胖的标志和代谢健康的指标。
为了研究肥胖作为 CAD 的独立危险因素,该研究设计并彻底验证了基于血清代谢组学的 BMI 模型,并表明较高的预测 ΔBMI 对应于更广泛的动脉粥样硬化疾病。
作者分析了CAD 患者的 BMI-代谢组平衡是否以及如何被破坏。使用了梯度提升决策树 (GBDT) 算法预测 BMI,结果表明在非ACS受试者中发现的代谢组-BMI模式在ACS患者中受到干扰。
为了研究这些扰动,作者测试了对照组和 ACS 测试集中预测和测量 BMI 之间的差异,这里称为 ΔBMI。结果发现,与非 ACS 受试者相比,该研究的模型预测 ACS 的 ΔBMI 更高。
为了验证这些结果的稳健性,作者试图根据其他类型的代谢组学数据和独立队列来复制这些发现。将相同的预测程序应用于基于 NMR 的代谢组学数据,并观察到ACS 和对照之间 ΔBMI 的更大差异,应用于为发表的MetaCardis 队列数据中得出在所有 BMI 范围内,与血糖正常的缺血性心脏病患者相比,患有糖尿病的缺血性心脏病患者的 ΔBMI 显着更高。
进一步分析推断哪些特定代谢物是 ACS 患者高 ΔBMI 的主要驱动因素,发现两种脂质在对照组中与 BMI 呈负相关,后者在患有更广泛疾病的患者中也显着减少,这两种脂质分别是:
1-(1-enyl-palmitoyl)-2-oleoyl-GPC (P-16:0/18:1)
1-(1-enyl-palmitoyl)-2-linoleoyl-GPC (P-16:0/18:2)
最近的研究表明,脂质1-linoleoyl-GPC (18:2) 与肥胖和 T2DM呈负相关,并且脂质水平的增加显着降低了T2DM的风险。该研究发现 1-linoleoyl-GPC (18:2) 和 1-(1-enyl-palmitoyl)-2-linoleoyl-GPC (P-16:0/18:2) 在对照组中与 BMI 呈负相关,并且在患有更广泛 CAD 的患者中显着耗尽,这表明这些代谢物可能作为降低 CAD 风险的潜在靶点。
此外,两种代谢物都含有一条亚油酸链,一种必需脂肪酸,与 T2DM 风险呈负相关。然而,这些假设应在干预性研究中进一步检验。
迄今为止,大多数研究都集中在寻找在 CAD 患者中增加的新代谢物,而该研究对 199 名 ACS 患者进行了全面的多组学分析结果强调, ACS 的代谢组学特征是缺乏多种血清代谢物,其中许多与饮食和微生物组有关。
其中一个重要的发现是以前未知的细菌物种 SGB 4712,它在 ACS 患者和独立验证队列中都显着缺乏或偏低。通过进一步将这种细菌与心脏毒性和心脏保护代谢物的水平联系起来,证明了特定细菌基因组的缺失可能与 CAD 风险增加相对应,并提出在后续干预研究中评估的具体目标。总体而言,这些发现因此为 CAD 患者的预测甚至治疗提供了一种新方法。
迄今为止,大多数研究都对 CAD 患者进行了批量分析,寻找人群水平的风险因素,而不是关注个体水平的生物变异性。在这项研究中,作者使用全面的代谢组学和微生物组分析,呈现了 CAD 内部变异性的深度映射。总之,结果揭示了新的范式和治疗方向。
参考文献:Talmor-Barkan Y, Bar N, Shaul AA, Shahaf N, Godneva A, Bussi Y, Lotan-Pompan M, Weinberger A, Shechter A, Chezar-Azerrad C, Arow Z, Hammer Y, Chechi K, Forslund SK, Fromentin S, Dumas ME, Ehrlich SD, Pedersen O, Kornowski R, Segal E. Metabolomic and microbiome profiling reveals personalized risk factors for coronary artery disease. Nat Med. 2022 Feb;28(2):295-302. doi: 10.1038/s41591-022-01686-6. Epub 2022 Feb 17. PMID: 35177859.
谷禾健康
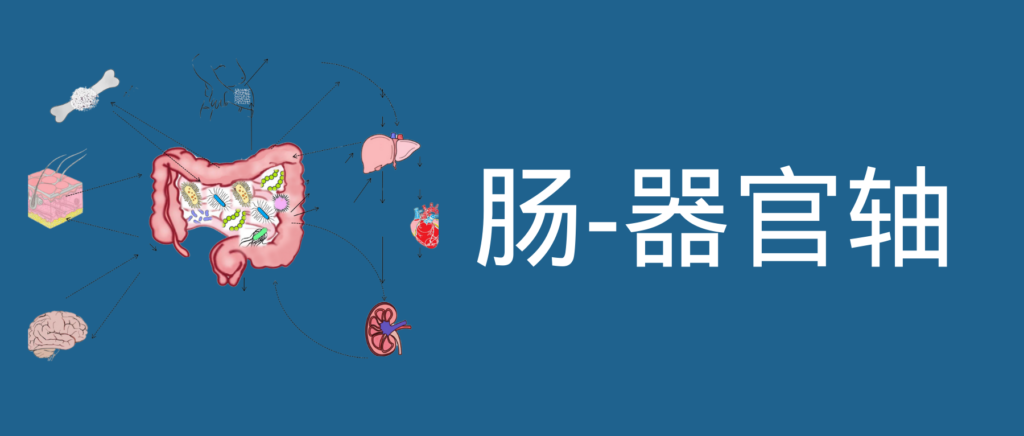
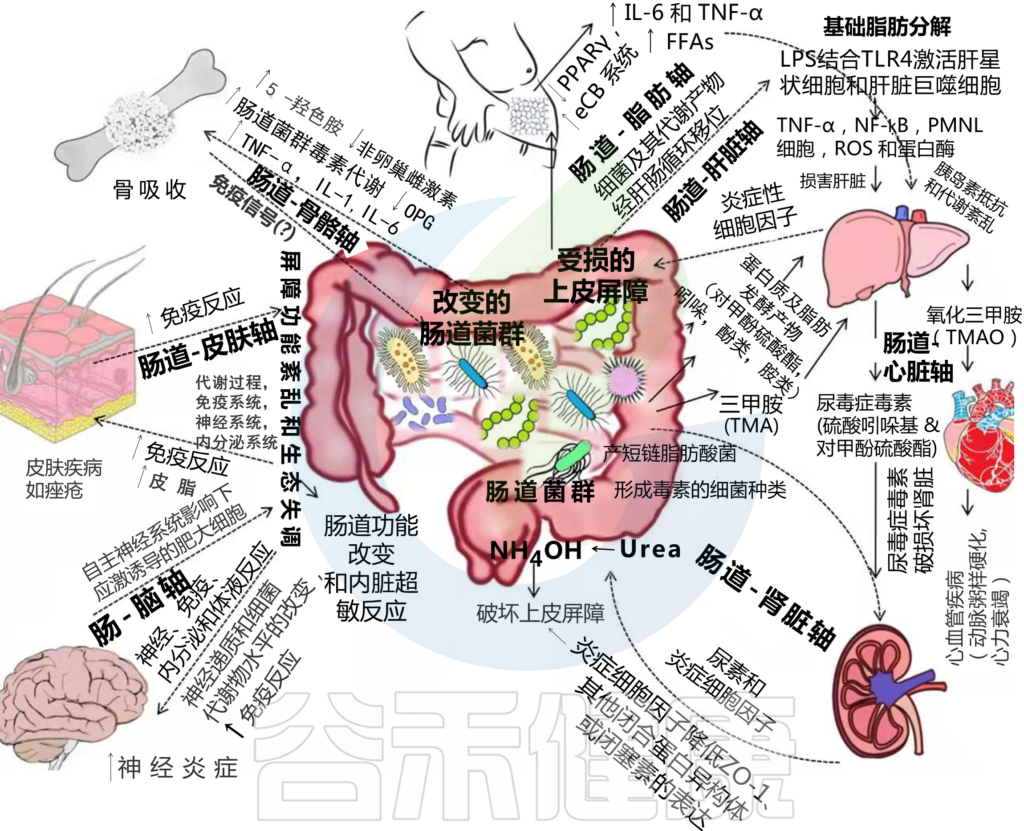
肠道菌群和宿主免疫代谢系统之间的复杂相互作用会影响与其他器官相关的身体功能,它们之间形成“轴”。
这种串扰通过宿主和微生物及其代谢物之间的直接或间接相互作用发生。宿主-微生物免疫代谢轴是宿主细胞途径和各种微生物群之间的多向通信系统。在这个轴内,不同的微生物通过产生胆汁酸、胆碱、短链脂肪酸、神经递质、小分子、有毒物,炎症因子等来调节生理代谢过程,从而对健康和疾病发生产生重要的影响。
图1 在肠道、相关微生物群和各种器官之间的双向或多向通信连接(轴)
Ahlawat S,et al.,Lett Appl Microbiol. 2021
肠道菌群在个体之间或在同一个人的一生中是不同的,并且受到各种因素的影响,包括饮食、年龄、生活方式、药物、疾病状态等。受这些因素影响的动态的肠道菌群成分可能会通过改变多样性或组成来影响健康或疾病风险。
因此,胃肠道和相关微生物群的一个复杂综合的对话机制在越来越多的研究中被证实,肠道以及肠道菌群与各个器官的对话交流机制,即“肠道-器官轴”,在维持各个器官的健康方面变得越来越重要。
本文主要讨论了肠道和人体重要器官之间的双向关系,以及在各类疾病中肠道菌群发挥的作用。
本文主要介绍的各类肠轴如下:
01 肠-大脑轴
02 肠-肾脏轴
03 肠-肝脏轴
04 肠-骨骼轴
05 肠-皮肤轴
06 肠-脂肪轴
07 肠-心脏轴
“肠道作为“第二大脑”影响情绪和行为
大脑和肠道的双向沟通,构成了“肠-脑轴”的基础。肠-脑轴相互作用的证据来自各种研究,涉及无菌动物模型、抗生素、益生菌、中枢神经系统疾病和功能性胃肠道疾病的生态失调。
通过建立肠-脑轴,肠道菌群可以影响大脑,如行为、食欲调节、肠道糖异生和5-羟色胺代谢。
肠道菌群的改变与焦虑、多发性硬化、自闭症谱系障碍、帕金森病等多种神经系统疾病有关。
在了解肠道菌群是如何影响肠脑轴之前,我们先了解一下肠-脑轴是怎么回事。
肠道-大脑轴将大脑的认知和情感中心与外周肠道功能(即免疫激活、肠道反射、肠道通透性和肠道内分泌信号)联系起来。
肠-脑轴涉及:
中枢神经系统(CNS),包括大脑和脊髓;
自主神经系统(ANS)及其交感和副交感肢体;
肠神经系统(ENS);
下丘脑-垂体-肾上腺轴(HPA)
自主神经系统驱动从管腔到中枢神经系统的传入信号,通过脊髓、肠道和迷走神经通路传输,以及从中枢神经系统到肠壁的传出信号。
HPA轴涉及记忆和情绪反应,协调生物体对压力源的适应性反应。促炎细胞因子增加的环境应激通过下丘脑分泌促肾上腺皮质激素释放因子(CRF)触发该系统。CRF刺激垂体分泌促肾上腺皮质激素(ACTH),进而导致肾上腺分泌皮质醇,影响包括大脑在内的各种器官(下图)。
图2 “肠-脑轴”(GBA)结构示意图
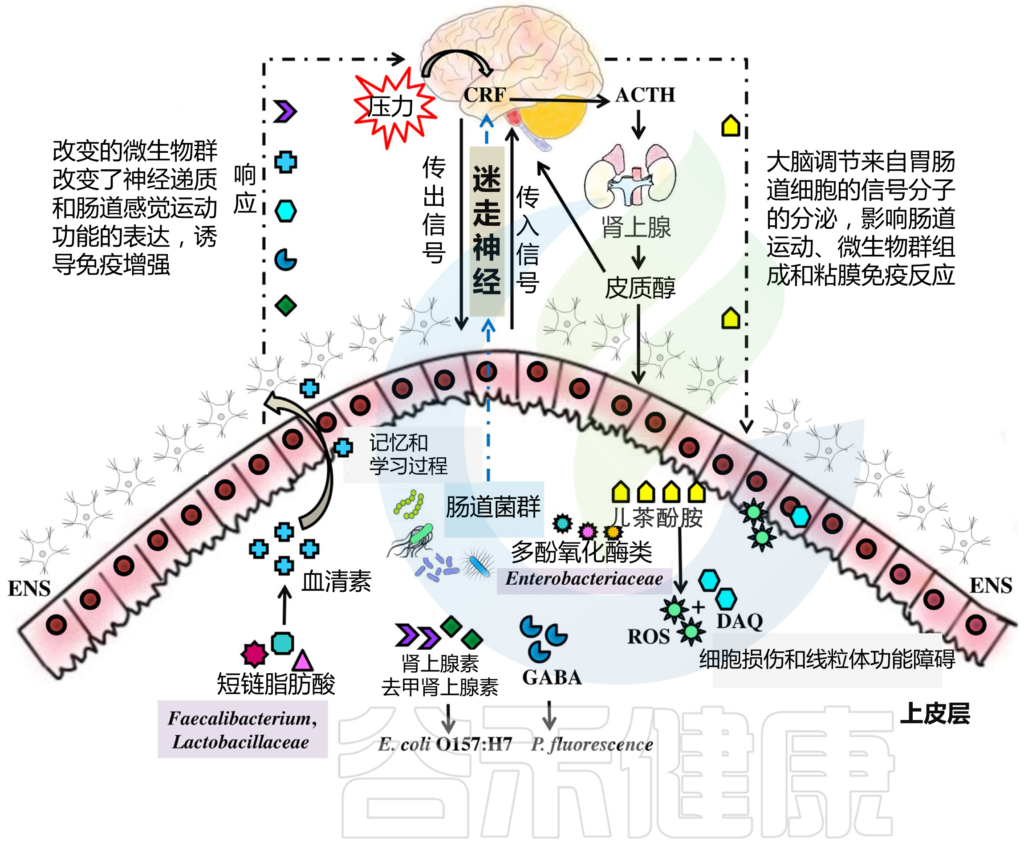
Ahlawat S,et al.,Lett Appl Microbiol. 2021
因此,不同的通讯线路一起允许大脑控制肠道效应细胞的活动,这些细胞也受肠道菌群的影响。
关于肠脑轴,在我们之前的文章中也有详细介绍:深度解读 | 肠道菌群和中枢神经系统的关系
肠道菌群通过代谢和神经内分泌途径与肠道细胞和肠神经系统以及中枢神经系统进行沟通。
肠-脑轴的破坏控制着肠道功能的变化,如分泌和运动,导致内脏过敏,从而导致肠内分泌和免疫系统的细胞变化。
如果没有微生物定植会发生什么?
改变神经递质的表达(包括5-羟色胺、褪黑素、乙酰胆碱、GABA和组胺)和肠道感觉运动功能,如减少肠道运输、迁移性运动复合体循环复发、远端繁殖、延迟胃排空、扩大盲肠大小…
可能还有各种想象不到的后果,总之,肠道菌群在调节肠道和大脑功能方面起着至关重要的作用。
以细菌物种特异性的方式对动物进行定植可以恢复所有这些异常。
微生物群通过在肠腔中产生局部神经递质和儿茶酚胺的生物活性形式来影响肠神经系统活性。短链脂肪酸等细菌代谢物通过刺激交感神经系统、粘膜5-羟色胺释放、记忆和学习过程影响肠神经系统。
肠神经系统是什么?
肠神经系统主要由肠胶质细胞(EGCs)组成,类似于中枢神经系统中的星形胶质细胞。肠上皮细胞分布于肠壁,包括粘膜固有层。
肠神经系统有什么功能?
——肠神经系统自主调节胃肠道的生理和功能
肠神经系统可以自主调节胃肠道的生理和功能,并通过迷走神经通路与中枢神经系统进行双向沟通,从而形成“肠-脑轴”。
随着肠神经胶质网络的发展,肠道菌群在肠神经系统的调节中起着关键作用。肠神经胶质网络通过钙依赖性信号传导在调节胃肠功能方面发挥作用(如血流、肠道运动、免疫炎症反应和外分泌/内分泌)。
所以说,如果肠神经胶质细胞出了问题,就会导致胃肠道疾病,如炎症性肠病、运动障碍、PD等神经退行性疾病和感染引起的肠道炎症。
通过Toll样受体(TLR)发出的LPS信号在肠道菌群和肠神经系统发育之间起着中介作用。
——肠神经系统是肠内神经肽合成的关键来源
通过信号传递到远端器官,如大脑,产生肠外作用,而远端器官有迷走神经上的神经肽受体。
这些神经肽可以通过影响肠道菌群成分来调节肠道内稳态。它们水平的改变导致各种肠道失调和肠道炎症相关的神经精神障碍。例如,自闭症和重度抑郁症分别与降钙素基因相关肽(CGRP)、神经肽Y(NPY)和P物质(SP)(即神经传递介质)的循环水平改变有关。
微生物群调节血清素能系统,因为在无菌动物的边缘系统中发现血清素和相关代谢物水平的改变。
此外,肠道菌群具有多种氧化还原酶,可以调节神经递质的水平。例如,漆酶(一种多铜氧化酶或MCO)调节肠道中合成的血清素的数量,参与其代谢,在肠-脑轴中起重要作用。漆酶可将儿茶酚胺氧化为活性氧(ROS)和多巴胺奎宁(DAQ)。
研究发现,发现生成的 ROS 受损细胞和 DAQ, 与 帕金森患者的线粒体功能障碍和痴呆有关。微生物群通过迷走神经与大脑沟通,迷走神经将信息从管腔传输到中枢神经系统(图2)。
肠道细菌具有神经递质的表面受体,使肠道和中枢神经系统之间的联系更加有效。
例如,Pseudomonas fluorescence 具有GABA受体,而肾上腺素和去甲肾上腺素受体存在于大肠杆菌O157:H7上(图2)
肠道菌群调节肠道屏障和传入感觉神经,增强其兴奋性,从而调节肠道运动和疼痛感知。
肠道菌群通过激素调节饱腹感
肠道菌群也可能通过从肠内分泌细胞释放各种生物活性肽与肠-脑轴相互作用。例如,甘丙肽触发HPA轴的活动;因此,释放CRF和ACTH可增强肾上腺皮质的糖皮质激素释放,或直接刺激肾上腺髓质的去甲肾上腺素和肾上腺皮质细胞的皮质醇分泌。
几种外围使食欲减退的激素,如肽YY(PYY)、胰高血糖素样肽-1(GLP-1)、胰岛素、瘦素和阿片黑皮素原,以及含有可卡因和安非他明调节转录物的神经元,可诱导饱足感。然而,含有NPY和刺鼠相关肽(AGRP)的神经元的ghrelin(胃饥饿素)会增加饥饿感。
肠道菌群影响粘膜免疫激活
这可能部分由蛋白酶介导。蛋白酶是粘膜和肠神经损伤的终末期效应物,在几种肠道免疫介导的疾病中上调。
大脑调节来自免疫细胞、神经元和胃肠道嗜铬细胞的信号分子的分泌,这可能会影响微生物群的组成。
肠-脑轴的任何失调都会通过扰乱正常粘膜栖息地,影响肠道菌群。胃肠道转运的变化对营养物质输送到肠道微生物群有着深远的影响。
由于自主神经系统影响下应激诱导的肥大细胞导致肠道通透性增强,因此微生物群组成有所不同。这导致类胰蛋白酶和组胺失衡。微生物群的改变也是由于胃肠道Paneth细胞释放抗微生物肽,如α-防御素。
总之,肠道菌群对中枢神经系统的发育和功能有重大影响。同样,中枢神经系统调节胃肠道的生理,最终调节肠道环境。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
许多神经系统疾病包括多发性硬化、帕金森病、阿尔茨海默病、癫痫症、中风与脑损伤等在这两篇文章中有详细介绍:
肠道微生物组在人类神经系统疾病中的作用
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
“调节体内废物的水平
肠道和肾脏也具有双向协同关系。
在一个方向上,尿毒症毒素如三甲胺-N-氧化物(TMAO)、对甲酚硫酸盐和吲哚硫酸盐从微生物代谢中产生;
而在另一个方向上,尿毒症会破坏肠道菌群组成和代谢。
这种双向交流之间的任何干扰都会导致各种严重并发症,如慢性肾病(CKD)、终末期肾病(ESRD)和脓毒性急性肾损伤(AKI)。
膳食纤维:通过菌群发酵成短链脂肪酸,修复肾上皮细胞
膳食纤维是菌群的碳水化合物来源。结肠微生物群的组成受到饮食及其在小肠中的同化作用的显著影响。膳食纤维逃避小肠的消化过程,成为结肠菌群碳水化合物的主要来源。
膳食纤维被结肠微生物群发酵成短链脂肪酸。短链脂肪酸在保持肠道上皮完整性和能量稳态方面发挥着重要作用。它们通过改善线粒体生物发生来修复肾上皮细胞的缺氧损伤。
膳食蛋白质:通过菌群发酵,形成尿毒症毒素,加剧肾病
抵抗上消化道消化的膳食蛋白质是结肠微生物群的氮源。这些蛋白质在结肠中的命运主要取决于结肠菌群生长和发育所需能量的可用性,而结肠菌群主要来自碳水化合物发酵。
如果碳水化合物的利用率较高,蛋白质及其中间产物要么被同化为细菌生物量,要么在碳水化合物缺乏的情况下被梭菌和拟杆菌发酵为对甲酚、吲哚、酚和胺。
蛋白质发酵产物经过进一步加工,形成尿毒症毒素,如对甲酚硫酸盐和硫酸吲哚酚。
——尿毒症毒素如何导致肾病发展?
这些毒素由于与白蛋白有较高的亲和力(非共价相互作用)而在血液中循环,并由肾小管分泌物释放出来。如果尿毒症滞留溶质在体内积聚,则会增加肾小球硬化的发生率和肾脏疾病的进展。因此,它们在血液中的浓度可以用来衡量肾脏的功能效率。
硫酸吲哚酚和对甲酚硫酸盐的其他毒性作用包括炎症反应增加、内皮功能障碍、血管钙化、氧化应激增强、红细胞生成减少、细胞衰老增加、血栓形成、动脉粥样硬化形成,左心室肥厚、胰岛素抵抗、肾小管-间质纤维化和肾素-血管紧张素-醛固酮系统激活。
膳食脂肪:高脂饮食导致TMAO升高,与慢性肾病进展直接相关
胆碱、肉碱和卵磷脂是膳食脂肪的主要成分。哺乳动物缺乏打破这些脂肪成分的氰化物键所需的酶。
然而,结肠微生物群有TMA裂解酶,可以破坏氰化物键。胆汁中的TMA裂解酶和肝酶(即含黄素的单加氧酶)的联合作用导致肉碱和胆碱形成TMAO。
2021年发表在Science期刊上的一篇文章指出,高脂饮食会损害结肠上皮细胞线粒体的功能,使肠道氧气和硝酸盐的浓度增加,促进大肠杆菌的生长以及对胆碱的分解,导致TMA水平增加,最终导致循环中有害代谢物TMAO水平的升高。
——TMAO的升高会发生什么?
TMAO与其他尿毒症毒素一样,进入身体循环,并由肾脏释放。TMAO增加与慢性肾病进展直接相关。与健康对照组相比,终末期肾病患者体内的TMAO浓度可高出20倍。
TMAO高导致有害后果,如血小板活性增加、血栓形成潜能、肾小管间质纤维化和动脉粥样硬化的发展。
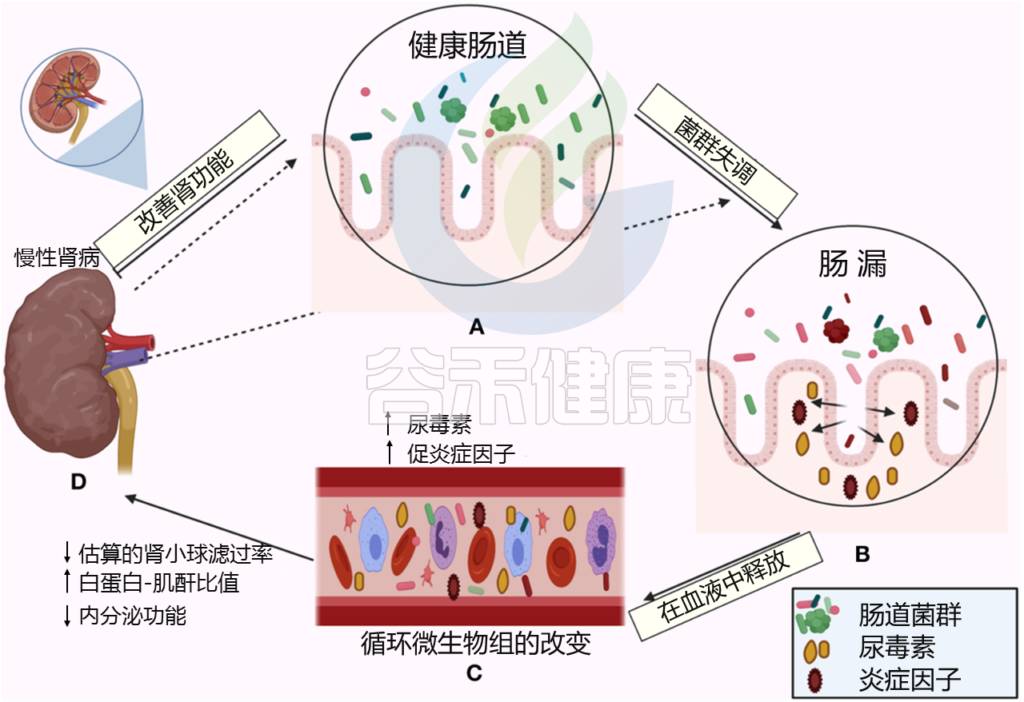
Al Khodor D, et al., Frontiers in Medicine,2022
← 在一个方向上,肠道菌群影响肾脏:
(A)健康的肠道
(B)肠道微生物失调和破坏粘膜层
(C)释放血液中炎性因子和炎症级联的开始,尿毒症毒素积累
(D)估计的肾小球滤过率下降(eGFR),白蛋白肌酐比值(ACR)升高,肾脏内分泌功能丧失
→ 在另一个方向,慢性肾病驱动肠道内的生态失调(虚线箭头所示),并引发炎症级联
尿毒症患者的微生物群组成与健康人不同。据观察,在接受血液透析的尿毒症患者中,需氧菌如肠杆菌和肠球菌增加很多倍,而厌氧菌如双歧杆菌则减少。
5期慢性肾病患者体内含有短链脂肪酸形成酶的细菌较少;然而,其中含有更多的脲酶、尿酸酶、吲哚和对甲酚产生菌。
另一项研究发现,在区分慢性肾病患者和健康对照组方面表现最好的两种菌:
Lachnospira 和 Ruminocococus gnavus
慢性肾病进展和血液透析和Holdemanella、巨单胞菌、普雷沃氏菌属Prevotella和Scardovia有关。
关于慢性肾病的进一步报告表明,慢性肾病是一种蛋白质发酵增加的状态,与肾功能恶化有关。发现这些细菌蛋白发酵产生的代谢物(对甲酚硫酸盐、吲哚硫酸盐和苯乙酰谷氨酰胺)与肾功能呈负相关。
结肠微生物群通过其代谢产生尿毒症毒素,其失衡可能导致上皮屏障损伤。尿毒症毒素的增加会降低紧密连接蛋白的表达,如紧密连接蛋白(ZO-1)、闭合蛋白、claudin-1。
急性肾损伤也有各种原因引起的,有感染性的,败血症性的,脓毒性的等。
感染性急性肾损伤:
肾功能受损->肠道通透性增高->全身炎症->肾功能进一步损伤
患者的炎性细胞因子增加,肾功能受损,导致肠道损伤。细胞因子水平的增强作用于胃肠道壁的连接复合体;因此,通过改变紧密连接蛋白的表达,导致其通透性增高。此外,增加的肠道通透性会以正反馈方式放大全身炎症反应。增强的全身炎症进一步促进肾功能障碍。
败血症性急性肾损伤:
水分潴留->肠壁水肿->尿素代谢->破坏屏障->细菌移位->炎症->衰竭
该类患者中,钠、尿素、尿毒症溶质和水的潴留是由于其肾功能障碍引起的。过多的水分滞留导致肠壁水肿显著增加。来自体循环的尿素扩散到胃肠道腔,肠道细菌脲酶在那里代谢尿素。
尿素转化为氨[CO(NH2)2+H2O→ CO2+2NH3]
进一步代谢为氢氧化铵(NH3+H2O→ NH4OH)
此后,肠道菌群产生的氢氧化铵(NH4OH)作用于连接蛋白,破坏上皮屏障(图1)。
受损的上皮屏障导致肠腔毒素流入,同时细菌从肠腔转移到肠系膜淋巴系统和体循环。这会促进局部和全身炎症,从而导致多器官衰竭和死亡。
脓毒性急性肾损伤:
外部+内部因素->菌群变化
患者的微生物组成发生改变,这可能是由于炎性细胞因子或上皮屏障受损。肠道菌群及其代谢产物能够改变胃肠道细菌细胞受体的表达,从而改变微生物组成。
肠道微生物组成也受到脓毒症患者肠道生理学各种变化的影响,这些变化可能是由于肠外营养和抗生素等外部因素,也可能是肠道渗漏和全身炎症等内部因素。
当使用微生物源性短链脂肪酸治疗时,败血症性AKI患者的肾功能得到改善。这种改善与低水平的细胞浸润/激活、炎症、氧化性细胞应激和凋亡有关。
一项确定蛋白质发酵代谢物对肠道微生物特征的作用的研究显示,梭菌有56个成员,在早期肾脏疾病中,以Christensenellae、Ruminococaceae和Lachnospiraceae为代表。
对终末期肾病患者的类似研究表明,从普雷沃氏菌向拟杆菌转变,产丁酸菌包括 Roseburia、粪球菌、梭菌、粪杆菌、普雷沃氏菌减少。
此外,他们还增加了来自下列菌的OTU:Brachybacterium, Catenibacterium,
Enterobacteriaceae, Moraxellaceae,
Nesterenkonia, Halomonadaceae,
Pseudomonadaceae, Polyangiaceae, Thiothrix
据报道,钙肾结石患者粪便微生物多样性降低,粪便杆菌、大肠杆菌和肠杆菌的代表性显著降低。
此外,在泌尿系结石病中,抗生素引起的泌尿道微生物群的长期变化从乳杆菌(健康保护)转变为肠杆菌科(促结石)。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:慢性肾脏病中的人类微生物组:一把双刃剑
“酒精不一定是导致肝脏退化的罪魁祸首
肠道和肝脏之间的双向通讯网络涉及这些器官之间的相互关系,肝脏在这些器官中产生有益物质并被肠道吸收。
肠道菌群变化使肠道通透性增加,内毒素移位,肝毒素进入肝脏。
“肠道-肝脏轴”对于理解各种肝脏疾病的病理生理学至关重要。
肠道菌群如何与肝脏产生联系?
肝脏通过门静脉从肠道的静脉流出接收近70%的血液供应,因此,它持续暴露在肠道菌群及其代谢产物。
在健康个体中,进入肝脏的微生物代谢产物,如氨、乙醛和乙醇,由肝脏巨噬细胞(库普弗细胞)代谢。因此,肠道菌群对肝脏生理有很大影响。
肠道菌群变化如何导致肝脏受损?
炎症和门脉高压或肠道微生物组成变化导致的肠道上皮改变增加了肠道通透性。肠道通透性增加导致内毒素移位,导致肝脏中各种促炎基因和细胞因子的转录激活。由于肠道屏障受损,大量细菌及其代谢物如脂多糖(LPS)通过肝肠循环进入肝脏。
在激活LPS时,发生了一系列级联事件,通过NF-kβ介导的机制产生促炎症细胞因子,如TNF-α,这些细胞因子与肝损伤有关(图1)。
LPS是一种肝毒素;因此,暴露于肝脏会导致形态和功能改变。诱导的变化导致急性炎症反应和多形核细胞的积聚,通过从颗粒中释放蛋白酶、活性氧代谢物和其他酶,进一步加剧肝脏损伤。
肝硬化合并门脉高压导致肠道运动受损,促炎细胞因子释放增加,上皮通透性增加,从而影响肝脏。
对于理解各种肝脏疾病的病理生理学至关重要,如非酒精性脂肪肝(NAFLD)、脂肪性肝炎(NASH)、酒精性肝病(ALD)、肝癌发生和肝性脑病(HE)、急性或慢性肝衰竭、肝硬化的进展和并发症。
非酒精性脂肪肝是代谢综合征的一种肝脏表现,其原因是肥胖的普遍存在。
原发性脂肪性肝炎与肥胖、高脂血症和2型糖尿病(T2D)等代谢表现相关。而继发性脂肪性肝炎则是由于空肠回肠旁路手术、全肠外营养、快速减肥、脂肪营养不良或威尔逊氏病以及药物摄入所致。
肠道菌群在能量摄取中的作用
有趣的是,瘦肉型和肥胖型个体的肠道菌群成分不同,肥胖型个体具有的厚壁菌、普雷沃菌、卟啉单胞菌和更少的拟杆菌,这表明肠道菌群在肠道内容物的能量摄取中的作用。
此外,肠道菌群对能量收集和脂肪储存途径有影响,表明它们在胰岛素抵抗和相关代谢疾病的发展中起直接作用。在肥胖个体中,双歧杆菌与血清丙氨酸转氨酶水平呈负相关,丙氨酸转氨酶可作为非酒精性脂肪肝的标志物。
肠道通透性增加、小肠细菌过度生长
肠细胞释放乳糜微粒是脂肪代谢(代谢性内毒素血症)的结果,支持含LPS细菌的生长和移位。它会导致肠道失调和促炎细胞因子的释放(即由于LPS、乙醇和内毒素等细菌产物与TLR之间的相互作用),以应对肥胖。因此,非酒精性脂肪肝的发展主要取决于TLR-4或TLR-9和TNF-α受体的流行。
然而,非酒精性脂肪肝导致脂肪性肝炎的发生过程尚不清楚,但研究表明,产乙醇的肠道菌群的改变导致脂肪性肝炎的发生。肥胖患者的肠道菌群改变可诱导瘦素产生,通过STAT3信号上调CD14。这会导致对低剂量LPS的更高反应性,导致脂肪性肝炎中的肝脏炎症和纤维化。
非酒精性脂肪肝中的肠道菌群变化
在一项对86名经活检证实的非酒精性脂肪肝患者(72名患者患有轻度/中度非酒精性脂肪肝,14名患者患有晚期纤维化)的研究中,在轻度/中度非酒精性脂肪肝患者中,厚壁菌、Eubacterium rectale、普通拟杆菌Bacteroides vulgatus 数量丰富,而变形菌门,晚期(3-4期)纤维化患者中大肠杆菌和普通拟杆菌的比例过高。与轻度/中度非酒精性脂肪肝相比,晚期纤维化患者下列菌群显著减少:
Eu. rectale, Ruminococcus obeum , R. obeum
另一项针对非酒精性脂肪肝患者的研究显示,Alistipes和Prevotella的丰度较低。厌氧菌属、大肠杆菌属、链球菌属和乳酸杆菌属在这些患者中更为丰富。
紧密连接变宽,微绒毛排列异常,T淋巴细胞减少,TNF-α、IFN-γ和IL-6升高,揭示了肠道菌群介导的炎症在非酒精性脂肪肝发病机制中的重要性。
其他各类非酒精性脂肪肝中肠道菌群变化
一项针对100名患有2型糖尿病的非酒精性脂肪肝患者的研究中,50名糖代谢正常的非酒精性脂肪肝患者和60名对照组报告,患有2型糖尿病的非酒精性脂肪肝患者的双歧杆菌显著减少。然而,这两组患者的多形拟杆菌丰度均较低,而Eu. rectale ,Lactobacillus 较高。
在一项研究中,使用定量实时PCR进行肠道菌群肠道菌群结构分析,涉及11名单纯性脂肪变性(SS)患者、22名非酒精性脂肪性肝炎(NASH)患者和17名健康对照者(HC)。与单纯性脂肪变性患者和HC患者相比,脂肪性肝炎患者中的拟杆菌显著减少,而与SS患者相比,脂肪性肝炎患者中的Clostridium coccoides 更丰富。
另一项针对22名脂肪性肝炎患者、25名肥胖者和16名对照者的研究显示,肥胖和脂肪性肝炎患者的拟杆菌数量增加,厚壁菌数量减少。与对照组相比,脂肪性肝炎患者的放线菌丰度较低;然而,肥胖组和脂肪性肝炎组之间的变形菌存在显著差异(表1)。
肠道通透性增加、内毒素进入肝脏、促炎
酒精性肝病(ALD)是一系列肝脏疾病,包括脂肪肝、脂肪变性、急性酒精性脂肪性肝炎,酒精性肝纤维化和肝硬化是由成瘾性饮酒引起的,酒精及其代谢物(如乙醛)通过产生ROS导致肝损伤。
它们能够破坏上皮细胞紧密连接,从而导致肠道通透性增加。这会导致细菌易位,增加内毒素、LPS、细菌DNA和其他代谢物通过门静脉进入肝脏。库普弗细胞激活在ALD的发病机制中起着核心作用,LPS通过TLR-4或TLR-9激活库普弗细胞,导致促炎细胞因子的释放。
LPS、TLR-4和炎症细胞因子通过生长因子-β信号激活星状细胞,导致纤维化,这是一个的渐进过程。
酗酒者:
人类酗酒者的肠道菌群与健康对照组不同,前者的拟杆菌科减少,而后者的拟杆菌科增加。
酒精依赖综合征和酒精性肝硬化:
一项关于酒精依赖综合征(ADS)和酒精性肝硬化(ALC)的研究报告,肠杆菌科、拟杆菌、普氏杆菌、粪杆菌、克雷伯菌、乳球菌增加。然而,通过对肠道群落结构的比较,可以确定这两个群体之间差异丰富的分类群。尤其是,ADS患者的阿克曼病、粪球菌、未分类梭状芽胞杆菌显著减少。然而,ALC表现为拟杆菌、Blautia、双歧杆菌、链球菌、乳酸杆菌增加,普雷沃氏菌属、Paraprevotella、Alistipes 减少(表1)。
肝硬化:
肝硬化患者低水平的胆汁酸分泌和门脉高压会影响肠道菌群的组成和生长。肝硬化患者肠道内的病原体(链球菌科和肠杆菌科)增加,有益细菌(双歧杆菌和乳酸菌科)减少,从而导致生态失调。进一步的报道表明,拟杆菌门、变形菌门和毛螺菌科的比例降低;然而,肝硬化患者中梭杆菌类、肠杆菌科、韦荣球菌科和链球菌科的比例增加。
在另一项研究中,在肝硬化患者中观察到厚壁菌门比例降低,链球菌和韦荣球菌数量增加。在这些患者中,生物失调导致其他严重并发症,如菌血症、HE伴SIBO和肠道通透性增加。他极大地影响着生活质量;由于器官损伤和微生物产生的有毒物质(主要是氨,其他还有酚类、硫醇、苯二氮卓、短链和中链脂肪酸等)的综合作用,以认知功能受损为特征。
TH17与肠道菌群相互作用
肠道菌群在肝癌发生中的作用也很明显,研究表明,肠道菌群可以减少无菌小鼠的肝癌发生,丙酸盐可以抑制肝癌细胞的增殖。产生肿瘤内IL-17的T辅助细胞(Th17)通过与肠道菌群相互作用在肠道中生成。发现它们与肝细胞癌患者的不良预后相关,可能是由于血管生成和肠道菌群肿瘤生长的进展。
因此,从上述讨论中可以看出,不是单个微生物而是微生物失调会导致几种肝脏相关疾病。因此,可以得出结论,肠道菌群在通过“肠道-肝脏轴”维持个体健康方面起着关键作用。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
“微生物代谢产物和骨骼健康
肠道菌群及其衍生分子对骨骼健康有影响。
肠道菌群对骨密度、骨强度、养分吸收产生影响。
饮食影响肠道菌群,从而影响骨骼健康。
骨骼:身体的支撑框架,细胞因子的仓库
人体骨骼对身体的整体功能起着至关重要的作用。除了作为身体的特殊支撑框架,骨骼还保护重要器官,充当钙稳态的矿物质储库,为骨髓(脂肪储存和血液形成)提供环境,并且是细胞因子和生长因子的仓库。
有趣的是,肠道菌群及其衍生分子对骨骼健康有影响。
最近的报告揭示了肠道和骨骼健康之间通过“肠道-骨骼轴”的复杂关联。在宫内和产后早期,暴露或限制环境因素可调节生长迟缓、骨矿化以及身体和肠道微生物组成。
肠道菌群对骨密度和骨强度的影响
各种临床前试验显示,乳酸杆菌是主要影响因素。骨丢失和肠道细菌过度生长验证了肠道、其微生物群和骨骼健康之间的沟通。肠道菌群通过各种潜在机制调节骨骼生长,如营养吸收、免疫系统成熟、释放各种代谢产物、改变胃肠道通透性、肠源性血清素和LPS诱导的全身炎症。
肠道菌群对养分吸收有重大影响
例如,胃肠道中长双歧杆菌和罗伊氏乳杆菌水平的增加通过钙、磷和镁等矿物质吸收水平的提高导致骨密度增加。肠道菌群在维生素B和K的合成中起着重要作用,维生素B和K对骨骼健康调节和胆汁酸代谢至关重要。
胆汁酸调节钙的吸收过程,就像脱氧胆酸抑制钙的吸收一样;然而,熊去氧胆酸会提高钙吸收过程。
饮食->肠道菌群->营养吸收->进一步影响骨骼
饮食对肠道菌群(碳水化合物作为主要能源)的组成有很大影响;因此,对营养吸收过程的影响进一步影响骨骼健康。有效的蛋白质含量对骨骼生长至关重要,而高蛋白饮食会导致胃肠道中甲烷和硫化氢等毒素的产生增加。
因此,饮食中适当的碳水化合物与蛋白质比例至关重要,任何偏差都会导致肠道菌群成分的破坏,从而可能导致骨代谢过程的故障。骨干细胞分化依赖于细胞因子等全身因素;此外,微生物群组成破坏导致的免疫改变会影响骨骼。
多种免疫因子参与骨代谢的调节
核因子-κB受体激活剂(RANK)、RANK配体(RANKL)和骨保护素(OPG)等多种免疫因子参与骨代谢的调节。
有两种类型的细胞,间充质干细胞来源的成骨细胞和单核细胞系来源的破骨细胞。单核细胞系细胞通过RANKL途径分化为巨噬细胞/树突状细胞或破骨细胞,具体取决于细胞周围的微环境。巨噬细胞集落刺激因子(M-CSF)的存在导致RANK表达增加,导致RANKL信号的刺激,最终通过形成破骨细胞导致骨吸收。
TNF-α、IL-6和IL-1等细胞因子也通过RANKL途径直接或间接放大骨吸收,因为细胞因子增加髓系细胞上RANK受体的表达。然而,OPG(RANKL的天然受体)阻止它与RANK结合,从而减少破骨细胞的生成过程。OPG的主要来源是B细胞,炎症状态下B细胞的失调导致B细胞RANKL表达升高,OPG表达降低,从而导致更高水平的骨吸收和破骨细胞过度生成。
血清素水平的增加与骨量的减少有关
据报道,肠道菌群通过维持代谢激素5-羟色胺或5-羟色胺(5-HT)的水平来影响骨代谢,5-羟色胺是由肠道嗜铬细胞在色氨酸羟化酶-1(Tph1)酶的帮助下合成的。由于这两种细胞类型,即骨细胞和成骨细胞都有5-HT受体,它通过5-HT信号转导途径在骨发育和维持的调节中起主要作用。
短链脂肪酸等微生物产物在骨密度调节中发挥作用
短链脂肪酸通过OPG和Runx信号通路参与骨矿化和骨形成;然而,丁酸通过抑制RANKL信号通路减少破骨细胞的生成过程。研究表明,短链脂肪酸通过潜在影响宿主内分泌因子(如胰高血糖素样肽1(GLP-1)和肽YY(PYY))的功能,在维持骨密度方面发挥间接作用,这些内分泌因子与骨代谢有关。
PYY和GLP-1均由胃肠道内分泌L细胞分泌,其中GLP-1通过破坏成骨细胞和脂肪细胞之间的平衡,从骨髓间充质干细胞分化为骨代谢调节器。然而,在绝经前妇女中,PYY与全身和髋部骨密度之间存在矛盾的联系。
肠道菌群改变激素水平影响骨骼健康
肠道菌群还通过改变肠道来源的非卵巢雌激素(如己烯雌酚和类黄酮)水平影响骨骼健康。雌激素水平低是绝经后骨质疏松风险的主要因素。
其他疾病中,肠道菌群和骨骼健康的联系
克罗恩病(CD)和肥胖会增加骨折风险,因此,将骨密度和肠道菌群联系起来。
早些时候,一项用于测定类风湿性关节炎(一种关节慢性炎症性疾病)中肠道菌群改变的研究显示乳酸杆菌显著增加。
另一份报告显示拟杆菌、普雷沃菌,Porphyromonas的数量较低。然而,最近的一项研究表明,以下菌群比例过高:Porphyromonadaceae, Carnobacterium, Parabacteroides, Phascolarctobacterium, Bacteroides, Paraprevotella. 此外,据报道,产生丁酸盐的粪杆菌、Roseburia、Subdoligranulum、瘤胃球菌、Pseudobutyrivibrio 数量减少。
类似地,强直性脊柱炎(关节炎的一种形式)患者在回肠末端有离散的微生物特征,属于毛螺菌科、卟啉单胞菌科、瘤胃球菌科、拟杆菌科、Rikenellaceae的细菌数量增加。Prevotellaceae和Veillonellaceae科细菌的丰度降低(表1)。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:肠道微生物组:肌肉骨骼研究的新领域
“肠道健康对容光焕发的皮肤的重要性
皮肤内稳态和外稳态与胃肠道有关,皮肤和肠道之间存在双向沟通。
胃肠道疾病和饮食都会影响皮肤的病理生理学。
肠道菌群通过产生短链脂肪酸、免疫系统修饰等影响皮肤健康。
各类皮肤病中肠道菌群的作用。
皮肤和肠道对维持生理内环境平衡至关重要。它们具有多种共同特征,如大量微生物群的定植、高度神经支配、大量血管化,并提供与外部环境的接口。皮肤再生过程对于维持其内环境稳定状态非常重要,这是通过持续更新和有效的表皮更新来实现的。
处于稳态的皮肤可以执行各种基本功能,如温度调节、保护和保水。皮肤内稳态和外稳态与胃肠道有关;因此,考虑到皮肤和肠道之间的双向沟通。尽管肠道和皮肤关系的完整机制尚不清楚;然而,研究表明,它涉及代谢系统、免疫系统、神经系统和内分泌系统之间的复杂通信网络。
胃肠道疾病和饮食都会影响皮肤的病理生理学,皮肤表现与某些胃肠道疾病有关。
皮肤通常由四个细菌门控制,包括拟杆菌门、变形菌门、放线菌门和厚壁菌门。
肠道菌群通过产生短链脂肪酸影响皮肤微生物群
短链脂肪酸在决定皮肤微生物群物种的流行程度方面具有重要作用,从而影响皮肤免疫反应机制。通过抑制炎症细胞的粘附、迁移、增殖和细胞因子的产生,短链脂肪酸(尤其是丁酸)减缓了免疫反应。短链脂肪酸还通过组蛋白去乙酰化酶(HDAC)抑制和NF-kB信号通路失活在调节免疫细胞凋亡和激活中发挥作用。
许多皮肤生理功能,如伤口愈合和毛囊干细胞分化的调节,都受皮肤调节细胞的控制,其增殖受到HDAC抑制的刺激。
重要的皮肤菌——表皮葡萄球菌和痤疮丙酸杆菌
有趣的是,据报道,两种最显著的皮肤共生菌,即表皮葡萄球菌和痤疮丙酸杆菌能够耐受短链脂肪酸的显著变化。丙酸杆菌本身产生类似丙酸和乙酸盐的短链脂肪酸。丙酸对条件致病菌耐甲氧西林金黄色葡萄球菌具有抗菌作用。
补充副干酪乳杆菌NCC2461降低皮肤敏感性
在皮肤的功能中,屏障功能可以防止病原体入侵以及皮肤水分、电解质和蛋白质的流失。经表皮失水(TEWL)是一种测量稳态水蒸气穿过皮肤进入环境的通量,已被用作皮肤屏障功能的标志。人类临床研究表明,服用短乳杆菌SBC8803口服补充剂12周后,角膜水合作用显著增加,TEWL降低。同样,补充副干酪乳杆菌NCC2461 2个月的个体TEWL和皮肤敏感性降低。
肠道微生物组主要通过免疫系统修饰影响皮肤健康
它通过影响T细胞对各种免疫刺激的反应,从而增强皮肤的异质性。Th-17细胞数量异常或更高,以及促炎细胞因子与白塞病(BD)等多种炎症表现有关。这验证了肠道菌群在通过免疫系统修饰维持皮肤健康方面的关键作用。
免疫改变、皮肤屏障功能障碍
特应性皮炎(AD)是一种皮肤炎症性疾病,其发病机制主要由免疫反应改变和皮肤屏障功能障碍控制。由于Th1/Th2比率中断,以细胞因子产生增加(IL-4、IL-5和IL-13)为标志的免疫改变导致IgE水平升高,并增加金黄色葡萄球菌与特应性皮炎患者皮肤的结合。这种免疫失衡是由于存在特定类型的微生物群时,炎症微环境导致肠道菌群及其代谢物发生改变的结果。
特应性皮炎患者肠道菌群增加了金黄色葡萄球菌、大肠杆菌、艰难梭菌的数量,其中拟杆菌和双歧杆菌减少。
另一项针对特应性皮炎患者的研究显示,Faecalibacterium prausnitzii在亚种水平上存在失调,丙酸盐和丁酸盐的产生量较低,包括与菌株A2-165相关的产生量。它导致皮肤对过敏原产生异常的Th2型免疫反应(表1)。此外,还发现大肠杆菌和梭菌通过嗜酸性炎症与特应性皮炎相关。
然而,屏障功能障碍的主要遗传原因是丝聚蛋白(filaggrin)基因突变导致的功能丧失,这对维持表皮内环境稳定至关重要,因为丝聚蛋白基因有助于屏障功能和保水。因此,对环境抗原的易感性增加和TEWL增加可能是该特定基因突变的结果。
逐渐地,已确定的肠道菌群失调以及免疫系统失衡持续到成年,从而导致疾病的自然病程。肠道菌群破坏降低了其调节宿主免疫系统的能力。这会导致局部和系统性炎症,如牛皮癣(银屑病)。
扩展阅读:微生物群对三大过敏性疾病发展的影响
生命早期微生物接触和过敏风险:如何预防
菌群变化、肠道炎症
据报道,牛皮癣患者的肠道菌群多样性较低,粪球菌数量减少。
此外,一项针对15名银屑病患者、16名银屑病关节炎(PsA)患者和17名对照受试者的研究显示,银屑病和PsA患者中的粪球菌数量均减少。同时,PsA患者的Akkermansia、瘤胃球菌和假丁酸菌数量减少(表1)。
银屑病可导致身体其他器官发炎。据报道,7–11%的炎症性肠病患者患有银屑病,银屑病进一步将皮肤与胃肠道连接起来。
发现银屑病患者的血浆中含有肠道细菌的DNA。其他皮肤表现如酒渣鼻与幽门螺杆菌感染有关。这些患者的SIBO发病率更高,通过产生有毒代谢物导致肠道通透性、肠细胞损伤和全身炎症。
扩展阅读:牛皮癣看似皮肤病,实则关系到肠道
阻塞、炎症、痤疮杆菌介导、mTOR途径
痤疮,一种较常见的皮肤异常,是由于皮脂分泌过多、导管阻塞和炎症引起的,由痤疮杆菌介导。对寻常痤疮患者粪便的高通量测序显示,变形菌数量增加,放线菌、双歧杆菌、丁酸杆菌、共细菌、乳酸杆菌和异杆菌的数量减少(表1)。
据报道,痤疮的病理生理学受到mTOR途径和肠道菌群之间双向通讯的影响。
在一个方向上,肠道代谢物对mTOR途径介导的代谢过程具有调节作用,如脂质代谢和细胞增殖。或者,mTOR途径通过调节肠道屏障的完整性来影响肠道菌群成分。
扩展阅读:痘痘?粉刺?皮肤问题很可能是肠道问题
这7种类型的食物可能引起 “痘痘”
菌群变化
湿疹的标志是双歧杆菌、巨球菌、嗜血杆菌、脆弱拟杆菌和唾液链球菌的丰度降低。此外,这些患者以下菌群数量增加:
Escherichia/Shigella, Veillonella, Clostridium XlVa,
Lachnospiraceae incertae sedis, F. prausnitzii,
Ruminococcus gnavus, A. muciniphila
免疫功能障碍、菌群变化
研究表明,肠道菌群的改变与白塞病患者的免疫功能障碍有关。这些患者双歧杆菌和埃格特菌的数量增加,而巨单胞菌和普氏杆菌的数量减少(表1)。
总之,这些发现为皮肤和肠道之间的功能互动机制提供了强有力的支持性证据。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
“肠道菌群和能量平衡
脂肪介导的小肠效应可能有助于理解脂肪介导的代谢紊乱的病因。
肠道脂肪吸收可以根据饮食中的脂肪含量进行调整。
肠道菌群通过与脂肪组织的通讯轴影响代谢
膳食脂肪的消化吸收过程
在我们的饮食中,甘油三酯(TAG)几乎占膳食脂质的95%。在吸收之前,它在胃中被酸性稳定的胃脂肪酶部分水解成二酰甘油(DAG)和游离脂肪酸(FFA)。
它在小肠中继续消化,在小肠中,依赖于脂肪酶的胰脂肪酶释放2-单酰甘油(MAG)和长链脂肪酸(LCFA)。长链脂肪酸具有可能对细胞完整性有害的清洁剂特性。因此,它们分散在肠腔中的胶束中,与肠吸收细胞中的脂质结合蛋白结合,并作为富含甘油三酯的脂蛋白(乳糜微粒)分泌到淋巴中,这些脂蛋白被内皮脂蛋白脂肪酶进一步水解,为外周组织提供长链脂肪酸。
小脂蛋白中剩余的甘油三酯和残余物被肝脏脂肪酶进一步水解,并被肝脏从血液中清除。因此,膳食脂肪的高效消化和吸收确保了长链脂肪酸正确供应到发挥各种基本细胞功能的身体。
脂肪吸收可以根据饮食中的脂肪含量进行调整
小肠是一种选择性屏障,可有效吸收膳食脂肪并负责其处置。新出现的数据表明,肠道的甘油三酯的高生物利用度是后天获得的特性。
这表明肠道脂肪吸收可以根据饮食中的脂肪含量进行调整。有趣的是,这些脂质介导的肠道适应防止了高脂肪饮食期间粪便中脂质的过度清除。
因此,在食物匮乏的环境中提供生存优势。相反,在食物充足的时期,它们会增加肥胖和相关疾病的患病率。
总之,这些数据强调,脂肪对小肠的影响可能是促成脂肪介导的代谢紊乱的病因。
过度摄入脂肪的肥胖,引起系列代谢紊乱
过度摄入脂肪会增加肥胖的风险,肥胖涉及一系列代谢改变,如葡萄糖稳态紊乱(胰岛素抵抗和2型糖尿病或T2D)、心血管疾病(CVD)或风险因素(如高血压)和非酒精性脂肪肝。它涉及器官间(肠-脂肪组织和肠-大脑)通讯网络的严重紊乱,这有助于能量消耗、脂肪组织发育和胰岛素抵抗的改变。然而,并非所有肥胖者都有胰岛素抵抗和糖尿病。
它与两个主要细菌分类的相对丰度的改变有关,即拟杆菌减少,厚壁菌增加。因此,微生物组从饮食中提取能量的能力更高。
肠道菌群不仅是代谢紊乱的结果,也可能是原因
有几项研究将肠道双歧杆菌数量的减少与肥胖和/或糖尿病的发病联系起来。然而,现有证据表明,肠道菌群成分的改变不仅仅是结果,还可能导致肥胖。
高脂饮食改变菌群引发炎症反应,导致代谢综合征
高脂饮食也与肠内拟杆菌相对丰度降低、含LPS细菌丰度增加以及血浆LPS水平升高(称为代谢性内毒素血症)有关,通过增加LPS-TLR4结合增强局部炎症反应。
其次是脂肪/肠系膜脂肪组织积聚和胰岛素抵抗。胰岛素敏感性受绕过LPS诱导的CD95介导的髓样细胞炎症的影响。然而,在生理学上,局部肠道炎症是一种调节肠道屏障功能和促进乳糜微粒转运的适应,以在脂质摄入增加的情况下存活。但长期高脂肪摄入和肠道菌群改变会在肠道引发持续/慢性低度局部炎症反应,进而导致代谢综合征(图1)。
代谢异常也受脂肪分布的影响。中枢性肥胖的个体,脂肪主要集中在上胸廓和腹腔内沉积,更容易发生这种异常。
肠道菌群通过与脂肪组织的通讯轴影响代谢
由生物活性脂质组成的内源性大麻素(eCB)系统可以调节肠道和脂肪组织之间的联系。它通过与大麻素受体结合而引发细胞信号。此外,它的严格调控依赖于特定酶的合成和降解之间的平衡。它在控制能量平衡的组织中表达,因此,其失调会导致各种代谢状况,包括肥胖和2型糖尿病。
免疫反应诱导胰岛素抵抗,维持平衡,但长时间会引起代谢异常
免疫细胞尤其是巨噬细胞(具有LPS受体)对代谢内毒素血症的反应,增加白色脂肪组织浸润,产生炎症免疫反应,增强IL-6和TNF-α,从而诱导胰岛素抵抗,以维持饥饿和感染条件下的体内平衡。
然而,在肥胖患者中观察到的,如果它持续很长时间,就会产生有害影响,并导致代谢异常。
类似地,肠屏障功能受损和肠系膜脂肪大量积聚的克罗恩病患者中,细菌向肠系膜脂肪的移位增加。
脂肪细胞肥大->游离脂肪酸升高->代谢紊乱
LPS可以降低前脂肪细胞中过氧化物酶体增殖物激活受体γ(PPARγ)的表达,即脂肪生成(脂肪细胞分化和脂肪生成)的关键调节因子,并激活eCB的产生。这会对前脂肪细胞分化产生不利影响,并导致脂肪细胞肥大。
肥大脂肪细胞沉积游离脂肪酸的能力受损,从而导致循环游离脂肪酸水平升高,从而导致基础脂肪分解(图1)。
相反,它们会释放更多的游离脂肪酸和炎性细胞因子,包括脂肪因子,也就是不好的代谢特征。
总之,肝脏代谢受内脏脂肪和肠道分泌特征的影响。在肥胖个体中,内脏脂肪沉积物中的FFA和促炎细胞因子以及肠道进入门静脉循环的内毒素(LPS)的释放增加对肝脏胰岛素敏感性产生负面影响,这可能导致代谢综合征的发生。这证实了“肠道脂肪组织”和肝脏之间存在一个网络。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
“双向通信网络
大多数心血管疾病风险因素,都会导致与肠道炎症和肠道屏障完整性降低相关的生态失调。
肠道和心脏之间双向沟通,“肠道-心脏轴”
肠道菌群参与各类心血管疾病的进展。
心血管疾病由多种风险因素引起,分为可改变的(饮食和生活方式)和不可改变的(年龄和遗传学)。
几项研究表明,肠道菌群与宿主生理过程保持着复杂的关系,因此表明它是心血管疾病风险的基因外因素。
大多数心血管疾病风险因素都会导致与肠道炎症和肠道屏障完整性降低相关的生态失调,提高肠道细菌结构成分和循环中微生物代谢产物的水平,从而加快了心血管疾病的发展。
一些影响心脏的疾病,如代谢综合征或肥胖症,与出生后微生物组的获取受到干扰或不足有关,或与儿童时期肠道微生物组中存在特定细菌或细菌家族的环境微生物的早期接触有关。
此外,患有肠易激综合征等肠道疾病的患者患冠心病的风险增加。这表明肠道和心脏之间存在额外的连接。
以上证据共同表明,肠道和心脏之间存在双向通信网络,即“肠道-心脏轴”。
越来越多的数据表明,肠道在心力衰竭(HF)的病理生理学中起着至关重要的作用。
心力衰竭患者损害肠道,导致疾病发展
心力衰竭患者会出现外周血管收缩、心输出量减少和组织充血等障碍,这些障碍会在结构和功能上损害肠道,导致肠道血流量减少、肠壁增厚(结肠和回肠末端),增加(小肠中)胶原蛋白的积累和血流动力学改变。由于缺氧诱导的肠缺血,这些微循环障碍在功能上损害了肠上皮细胞,从而损害营养吸收,导致疾病发展和营养不良。
肠道细菌及其产物转移到循环中,诱发炎症反应
屏障功能障碍导致肠道细菌及其产物转移到循环中。当进入循环系统时,肠道细菌源性内毒素(如LPS)结合其受体,即心肌细胞上的Toll样受体4(TLR-4)。这种结合与循环细胞因子(TNF-α)增加、结构组织损伤、收缩力下降和心功能受损等炎症反应的诱导有关。LPS还会触发吞噬细胞和粒细胞释放儿茶酚胺,从而对肠道灌注产生额外的不利影响。
心力衰竭与菌群失调有关
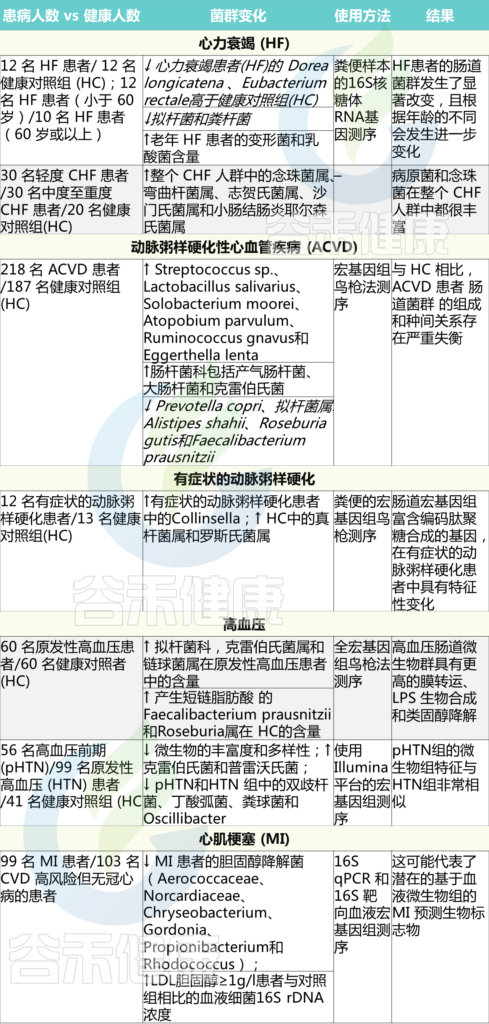
最近,心衰患者的肠道菌群分析表明,肠道菌群发生了显著改变, 以下菌群较少:
Dorea longicatena 、 Eu. rectale
菌群随着年龄的不同而进一步变化,因此老年心力衰竭患者(60岁或以上)的拟杆菌和粪杆菌数量较少,变形菌和乳酸杆菌比例较大。
另一项针对慢性心力衰竭(CHF)患者的研究显示,患者的肠壁厚度增加,三氯蔗糖和乳果糖/甘露醇的通透性增加,D-木糖吸收减少,同时乙状结肠粘膜生物膜中的粘附细菌水平升高。这些变化共同导致肠道缺血、慢性炎症和营养不良。
此外,与健康对照组相比,CHF患者肠道内念珠菌和沙门氏菌、弯曲菌、志贺氏菌和小肠结肠炎耶尔森氏菌等病原菌过度生长(表1)。
心力衰竭和代谢产物的异常产生有关
肠道菌群衍生的代谢物也会促进疾病进程。尿毒症毒素,如TMAO、对甲酚硫酸盐和吲哚氧基硫酸盐,是从饮食摄入的微生物发酵中产生的。硫酸吲哚氧基对心脏有促肥大和促纤维化作用,而TMAO是预测心血管疾病风险的一个有前途的生物标志物。
一项大型队列研究表明,在接受选择性冠状动脉造影的患者中,血浆TMAO水平升高与心肌梗死、中风和死亡风险增加有关。此外,心力衰竭患者的TMAO血浆水平也明显高于健康对照组。
动脉粥样硬化涉及代谢和炎症成分,受肠道菌群变化的影响
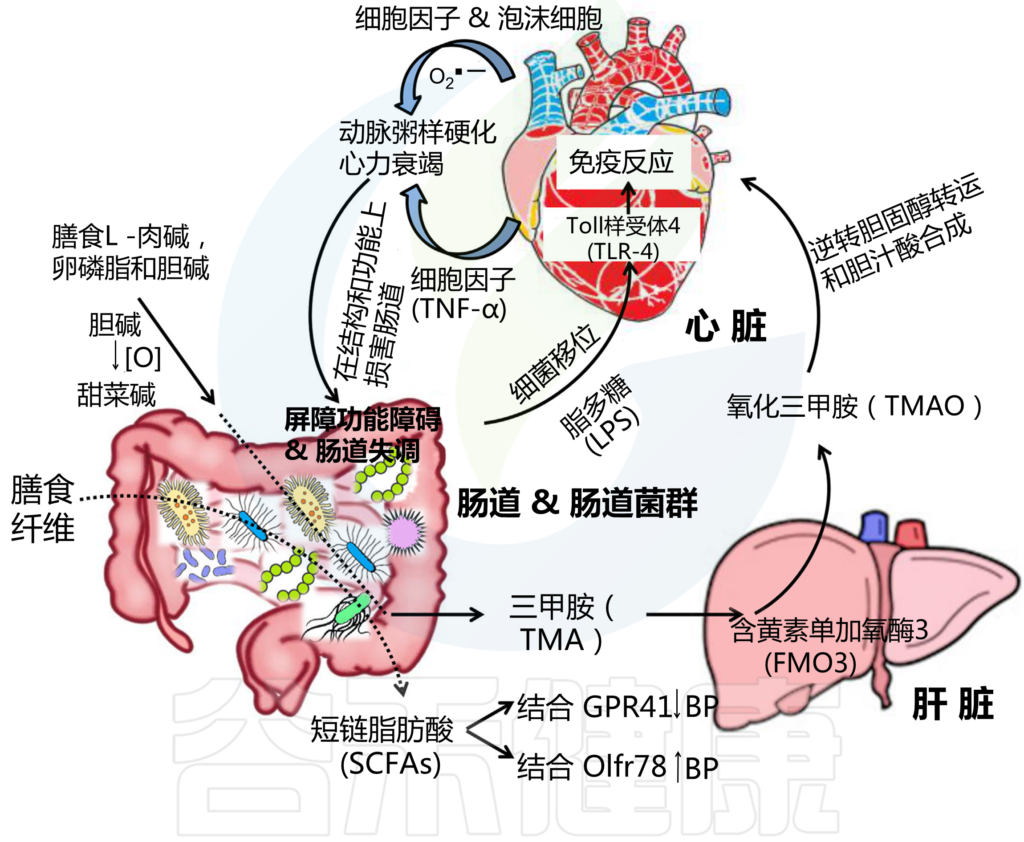
新出现的报告提出了一种新的途径,将膳食脂质摄入、肠道菌群和动脉粥样硬化联系起来。从膳食磷脂酰胆碱(卵磷脂)中产生甜菜碱、胆碱和TMAO代谢物取决于肠道菌群的代谢,TMAO与心血管疾病风险呈最强正相关。
根据一项研究,TMAO可减少胆汁酸的合成,并抑制胆固醇的逆向转运,而胆固醇的逆向转运与动脉粥样硬化的增加有关。然而,确切的机制仍然难以捉摸。
此外,人们认为慢性肺炎衣原体和幽门螺杆菌感染以及随后的免疫反应对动脉粥样硬化的发展至关重要。
LPS升高与动脉粥样硬化有什么样的关联?
各种研究支持血清LPS(内毒素)水平升高与动脉粥样硬化之间的关联。IBD或肝硬化患者的肠道屏障功能受损,导致血清LPS水平升高,动脉粥样硬化发生率增加。
LPS通过与低密度脂蛋白(LDL)相互作用影响脂蛋白代谢,诱导内皮细胞损伤,刺激超氧阴离子释放和低密度脂蛋白氧化。氧化低密度脂蛋白有利于巨噬细胞释放细胞因子(IL-1和TNF-α),刺激巨噬细胞转化为泡沫细胞。这些特征共同促进动脉粥样硬化的发展和进展。
肠道菌群参与动脉粥样硬化性心血管疾病的发展
动脉粥样硬化斑块和同一个体的肠道中存在不同种类的细菌DNA,表明肠道菌群是动脉粥样硬化细菌的潜在来源。因此,肠道菌群可能参与冠心病的发病和进展。
在早期的研究中,动脉粥样硬化性心血管疾病患者中链球菌属和肠杆菌科的比例高于健康对照组。另一项针对症状性动脉粥样硬化患者的研究显示,与健康对照组相比,症状性动脉粥样硬化组的Collinsella数量增加,Eubacterium ,Roseburia比例降低(表1)。
此外,肠道菌群是多种疾病的风险因素,如代谢综合征、肥胖、糖尿病和动脉粥样硬化,这些疾病与高血压有关。
高血压的发病机制是复杂的、多因素的。由细菌诱导的膳食纤维厌氧发酵在肠道产生的短链脂肪酸在调节血压(BP)方面具有生理功能。短链脂肪酸的高血压和降压作用分别通过与受体Olfr78和GPR41结合来介导(图3)。
图3 “肠道-心脏”轴
Ahlawat S,et al.,Lett Appl Microbiol. 2021
最近一项针对56名高血压前期(pHTN)、99名原发性高血压(HTN)患者和41名健康对照(HC)的研究表明,在pHTN和HTN两组中,产生短链脂肪酸的F. prausnitzii 和 Roseburia 均减少。
另一份报告提出了条件致病菌(Parabacteroides merdae, Klebsiella, Streptococcus)在高血压发病机制中的作用(表1)。
扩展阅读:认识肠道微生物及其与高血压的关系
总之,血压与肠道菌群的多样性、丰富度和均匀度密切相关,并受厚壁菌/拟杆菌比率的影响。
Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:与心血管疾病相关的肠道菌群代谢产物或毒素
最新 | 肠道微生物群与心血管疾病:机遇与挑战
微生物群与宿主之间的相互作用对维持内稳态很重要,但这种相互作用一旦受到干扰,就会成为许多慢性疾病的核心驱动因素。
目前随着对肠道菌群的了解逐步深入,我们开始了解它们的信号以及与人类健康和相关疾病的相关性。当然还有更多需要探索的问题,肠道菌群的改变是导致疾病的原因还是仅仅反映疾病状态,应该如何针对菌群作出精准干预等。
当我们真正开始理解微生物彼此之间的关系,及其与宿主之间复杂多变的进化和生态关系时,对疾病的机制理解就会越来越清晰,从而在菌群的基础上进行有效的干预措施。
主要参考文献:
Ahlawat S, Asha, Sharma KK. Gut-organ axis: a microbial outreach and networking. Lett Appl Microbiol. 2021 Jun;72(6):636-668. doi: 10.1111/lam.13333. Epub 2020 Jul 16. PMID: 32472555.
Yoo W, Zieba JK, Foegeding NJ, Torres TP, Shelton CD, Shealy NG, Byndloss AJ, Cevallos SA, Gertz E, Tiffany CR, Thomas JD, Litvak Y, Nguyen H, Olsan EE, Bennett BJ, Rathmell JC, Major AS, Bäumler AJ, Byndloss MX. High-fat diet-induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide. Science. 2021 Aug 13;373(6556):813-818. doi: 10.1126/science.aba3683. PMID: 34385401; PMCID: PMC8506909.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14. doi: 10.3390/microorganisms7010014. PMID: 30634578; PMCID: PMC6351938.
Parikh K, Antanaviciute A, Fawkner-Corbett D, Jagielowicz M, Aulicino A, Lagerholm C, Davis S, Kinchen J, Chen HH, Alham NK, Ashley N, Johnson E, Hublitz P, Bao L, Lukomska J, Andev RS, Björklund E, Kessler BM, Fischer R, Goldin R, Koohy H, Simmons A. Colonic epithelial cell diversity in health and inflammatory bowel disease. Nature. 2019 Mar;567(7746):49-55. doi: 10.1038/s41586-019-0992-y. Epub 2019 Feb 27. PMID: 30814735.
Lun H, Yang W, Zhao S, Jiang M, Xu M, Liu F, Wang Y. Altered gut microbiota and microbial biomarkers associated with chronic kidney disease. Microbiologyopen. 2019 Apr;8(4):e00678. doi: 10.1002/mbo3.678. Epub 2018 Aug 7. PMID: 30088332; PMCID: PMC6460263.
谷禾健康
现状
全球肥胖患病率的上升是一个主要的社会经济负担,肥胖与许多疾病的风险增加有关,包括糖尿病、心血管疾病和癌症。
尽管人们努力改善生活方式选择,提高对潜在病因的认识,但在预防和治疗肥胖方面的长期成功似乎有限,因为饮食诱导的体重减轻在5年随访后仅维持约25%。
近年来,在了解肠道微生物群作为宿主能量和底物代谢调节器参与肥胖和相关心脏代谢并发症方面取得了进展。因此,通过肠道微生物群靶向宿主代谢可能是饮食干预减轻体重的一项重要策略。
过去十年中,关于肠道微生物组对宿主代谢影响的研究数量呈指数增长,研究的数量和质量都在迅速发展,这些研究表明,基线微生物组成可以预测包括肥胖在内的代谢综合征。然而,研究同时表明微生物群组成的调节不可能会在所有条件下对人体代谢产生重要积极的影响,而这种影响取决于个体的特征,例如年龄、习惯性饮食、代谢表型和基线肠道微生物谱。
肠道微生物群的组成由可遗传、人口统计和环境因素决定,包括出生时的分娩方式、年龄、性别、胃肠道转运时间和药物使用。但是诸多因素中,饮食已成为塑造和定义肠道微生物组的关键因素。
饮食尤其是膳食纤维等引起的肠道微生物群组成和功能变化与肥胖和相关疾病的发展有关。这些研究结果发现肠道微生物群的个体间差异可以作为对抗肥胖代谢疾病的更精确饮食方法的基础。
本文将介绍有关饮食成分、肠道微生物组和宿主代谢之间相互作用的知识和研究成果,以及如何整合这些知识来制定基于精确的营养策略,以改善人类的体重控制和代谢健康。
厚壁菌/拟杆菌门
肠道微生物群影响免疫功能和上皮完整性、能量和底物代谢以及葡萄糖稳态。初步研究表明,与瘦个体相比,肥胖的人类和啮齿动物的厚壁菌门与拟杆菌门的比例增加,但也有个别研究未能观察到这种差异,甚至报告了比例下降。
多样性和微生物基因丰富度
在代谢健康与不健康个体的比较中,代谢不健康组的α多样性较低。而且重度肥胖症患者的低微生物基因丰富度比例高达75%,而瘦或超重/中度肥胖症患者的低微生物基因丰富度比例为23%-40%。
(小编推测可能是由于中重度肥胖人群其饮食比较丰富且量大,微生物不需要太多多余的基因就可以代谢获得生存繁殖的食物,而较瘦的个体食物不太丰富,那么菌需要更多的基因才获取生存的食物和繁殖生存)
具体菌属
具体而言,颤螺菌属(Oscillospira)和 红蝽菌科(Coriobacteriaceae)的细菌与良好的代谢健康相关。 在一项包含正常体重和超重/肥胖人群的研究人群中,特定菌属的丰度与代谢特征相关。 例如,产气柯林氏菌、Dorea formicigenans 和 Dorea longicatena 在超重/肥胖人群中的丰度更高。
Akkermansia属的细菌是最有说服力的证据,它与患肥胖症和代谢综合征的风险呈负相关。在超重/肥胖患者中,为期 3 个月的 Akkermansia muciniphila 补充剂可改善胰岛素敏感性并降低肝功能障碍和炎症的血液标志物。
基线菌属
另一项研究表明,在瘦肉型个体中,嗜粘菌A.muciniphila和Alistipes obesi显著富集,而在肥胖型个体中,Ruminococcus gnavus显著富集。该研究还确定,当在基线检查时高丰度存在的菌,如Blautia wexlerae 和 Bacteroides dorei 减肥前以高丰度存在时将有助于减肥。此外,基线普雷沃菌属 (Prevotella)普氏菌丰度可以预测肥胖人群在膳食纤维干预减肥中是否可以成功。
此外,与健康个体相比,II型糖尿病患者和代谢受损个体表现出微生物功能改变和发酵能力降低,尤其是产丁酸盐细菌丰度较低的个体。此外,胰岛素抵抗个体的肠道微生物组可能具有增加的生物合成潜力,并减少了支链氨基酸(BCAA,主要由Prevotella copri,B. vulgatus驱动)的吸收和分解代谢,这与有害代谢效果有关。
总之,代谢受损个体的微生物基因丰富度和多样性降低。肠道微生物群组成和功能的个体差异与饮食干预的反应变化有关。
在当前的西方世界,习惯性饮食结构已转向高能量密集型食物,包括相对较高的饱和脂肪和简单碳水化合物含量,以及较低的膳食纤维含量。尤其是膳食纤维的消耗,以及大量营养素的质量和消耗量都会强烈影响肠道微生物群的组成和功能。基于人群的宏基因组分析揭示了微生物组成和多样性与60多种饮食因素的习惯饮食之间的关联。这些因素包括能量和大量营养素的摄入,以及面包和软饮料等特定食品的消耗。这些数据证实了饮食对塑造肠道微生物群的重要性。
饮食塑造肠型
在一项纵向单卵双生子研究中,粪便微生物群分析表明,能量的习惯性摄入、不饱和脂肪酸(FA)的类型和可溶性纤维会影响微生物群的组成,尤其是拟杆菌属和双歧杆菌的丰度。微生物肠道类型与长期习惯性饮食密切相关,尤其是蛋白质和动物脂肪(拟杆菌属)与碳水化合物摄入(普雷沃氏菌属)相比。
与此一致,长期坚持地中海饮食与特定分类群以及肠道微生物谱的功能有关。肠道微生物组的组成是地中海饮食与心脏代谢疾病风险之间保护性关联的调节因素。当比较习惯性高脂肪饮食和高碳水化合物饮食时,高脂肪饮食的微生物多样性似乎较低。此外,与高(饱和)脂肪饮食和高碳水化合物/纤维饮食相比,微生物多样性似乎更低。这种饮食诱导的失调被认为是肥胖症代谢障碍的诱因。
饮食干预菌群变化较快,但是整齐菌群结构稳定
虽然主要在动物模型中得到证实,但数量有限的人体研究表明,饮食干预引起的微生物组成和功能改变可能已经在饮食摄入改变后的几周甚至几天内发生。在人类中,在严格转向完全以植物或动物为基础的饮食后,发现了适度的微生物变化。这些相当极端的饮食干预形式提供了对饮食-肠道微生物组相互作用的潜在机制的见解,并表明饮食干预引起的微生物变化可能会非常迅速地发生。
与此一致,一项小型控制喂养研究显示,在开始高脂肪/低纤维或低脂肪/高纤维饮食后 24 小时内微生物组组成发生了变化,尽管在整个为期 10 天的研究中肠型特征保持稳定。这些研究结果表明,成年人存在微生物复原力的趋势,这可能与长期习惯性饮食摄入有关。然而,由于缺乏对肠型动力学和复原力的理解,细菌肠型的概念受到了其他几项研究的质疑。
一项为期 1 年的干预研究比较了限制能量的地中海饮食和增加体力活动与等热量地中海饮食对超重/肥胖成年人的影响,结果显示两组之间肠道菌群组成的变化存在显著差异。尽管如此,两种饮食的微生物转移趋势是相同的。这表明饮食模式对于肠道微生物的整齐迁移起关键作用。
饮食与肠道和宿主代谢中的糖酵解和蛋白水解发酵之间的相互作用
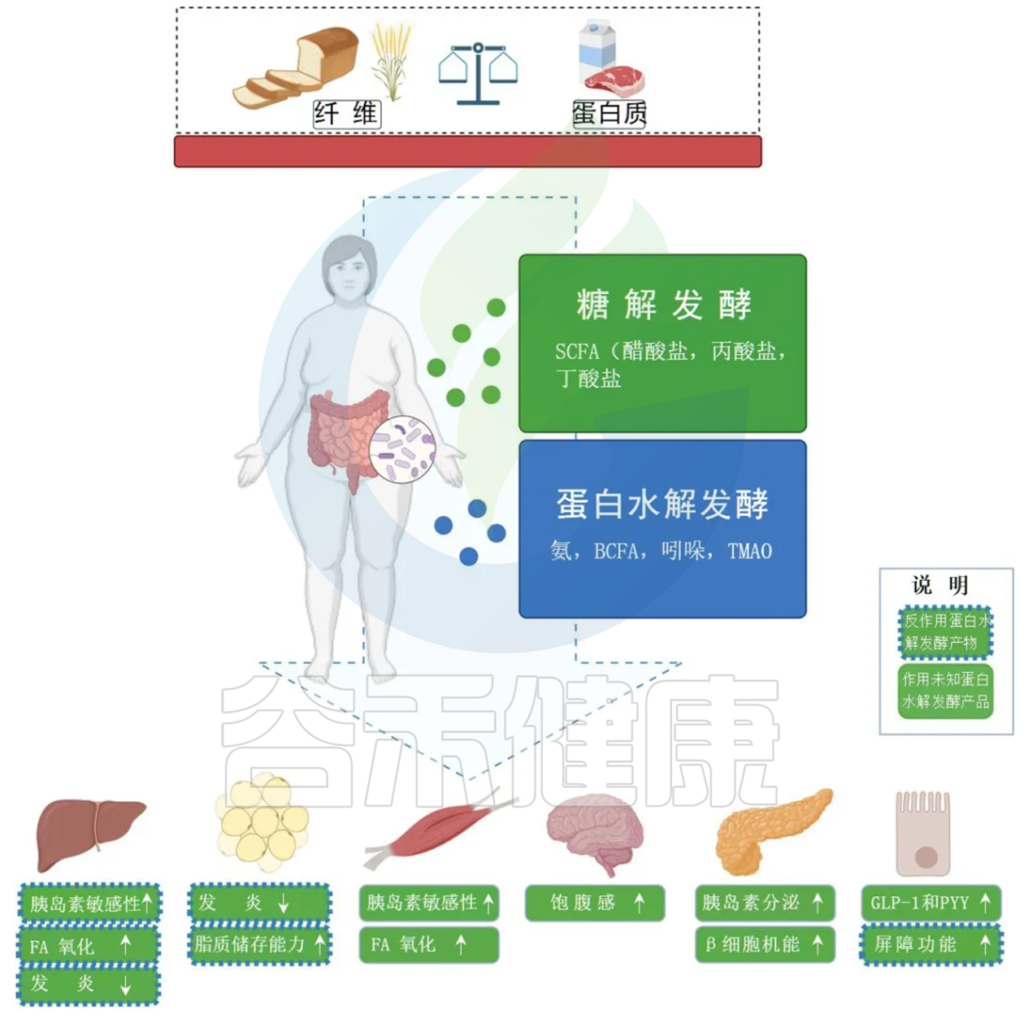
Jardon KM et al., Gut. 2022
膳食纤维的发酵主要发生在近端结肠并产生 SCFA,既可以用作肠细胞的燃料,也可以充当外周信号分子。SCFA 通过影响 GLP-1 和 PYY 的分泌,参与集中调节食物摄入和能量消耗。
蛋白质发酵主要发生在远端结肠并产生更多样化的代谢物,包括与肠道和代谢健康有害影响的 BCFA。
绿框表示 SCFAs 对周围器官代谢过程的影响。
蓝色边框表示蛋白水解发酵产物的相反方向位点方向(虚线)或未知方向(无线)的影响。
BCFA,支链脂肪酸;FA,脂肪酸;GLP-1,胰高血糖素样肽 1;PYY,肽YY;SCFA,短链脂肪酸;TMAO,三甲胺 N-氧化物。
成人肠道微生物组的塑造在生命早期就已经开始,这取决于诸如暴露于母体微生物组、分娩方式和早期暴露于膳食成分等因素。在所有生命阶段影响肠道微生物群组成和功能的众多因素中,饮食是调节特定细菌种类及其功能的丰度的关键。反之亦然,个人对某种饮食或饮食成分的反应可能在很大程度上受肠道微生物群特征的影响。
肠道微生物群能够发酵宿主无法获得的食物成分。小肠中不能被酶分解的膳食纤维和其他复杂碳水化合物可以(部分)被大肠中的细菌发酵,这一般是细菌作为首选能源,发酵后产生微生物产品,如短链脂肪酸(主要是乙酸盐、丙酸盐和丁酸盐)。
主要的产丁酸菌属于厚壁菌门,尤其是:
Faecalibacterium prausnitzii、Clostridium leptum、Eubacterium rectale 、Roseburia.
其他短链脂肪酸的产生由双歧杆菌等细菌介导,双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸。此外,A. muciniphila 物种同时产生丙酸盐和乙酸盐。
稳定同位素技术与13 C标记的短链脂肪酸可根据呼吸、尿液和血液分析对体内结肠产生的短链脂肪酸进行量化。短链脂肪酸主要在结肠中形成,其中约95%随后被吸收。
短链脂肪酸的作用
丁酸盐主要用作结肠细胞的主要能量来源,而丙酸盐和乙酸盐则通过门静脉进入肝脏。特别是,乙酸盐在进入体循环后也能到达外周组织,引起多种代谢和饱腹感相关效应。
短链脂肪酸可与G蛋白偶联受体(GPRs)结合。研究最好的受体包括GPR41、GPR43、GPR109a和GPR164,它们在大量细胞中表达,包括结肠上皮、胰腺β细胞、免疫细胞和周围组织,如脂肪组织。
短链脂肪酸对外周组织的影响包括脂肪生成、抑制脂肪组织脂肪分解(尤其是通过乙酸盐)和减轻脂肪细胞炎症、骨骼肌脂质氧化能力增加、胰腺胰岛素分泌和β细胞功能增加,肝脏的胰岛素敏感性和脂质氧化增加并改变肠-脑相互作用。但是注意这些数据主要来自体外和啮齿动物研究。
短链脂肪酸减脂(人类研究)
在人类研究中发现,长期结肠丙酸盐输送可防止体重增加,减少腹部肥胖和肝细胞内脂质含量,并防止超重成年人胰岛素敏感性的恶化。与这些发现一致,人体内数据表明,在超重或肥胖的成年人中,饮食诱导微生物短链脂肪酸产生变化或直接结肠短链脂肪酸输注后,空腹脂质氧化和静息能量消耗增加。
碳水化合物的消化是一个复杂的过程,涉及摄入的碳水化合物类型的特定酶。大多数可消化的膳食碳水化合物在小肠中被消化和吸收,而某些不可消化的碳水化合物,包括抗性淀粉和膳食纤维,很容易被结肠中含量最高的肠道微生物发酵。
膳食纤维对肠道菌群的有益影响
膳食纤维已被证明对与健康益处相关的肠道微生物群的组成和功能具有显著影响。这些因膳食纤维的结构、物理和化学特性可能会有所不同,例如水溶性、粘度、粘合和膨胀能力以及发酵性。高度可发酵的纤维,如 β-葡聚糖、菊粉和低聚半乳糖,在对微生物群组成和肠道代谢物产生的影响方面得到了很好的定义,而不溶性纤维虽然部分发酵,但大多数人都知道它们对粪便的有益作用一致性和结肠传输时间。

摄入高纤维饮食有益地影响宿主的健康,其中包括影响葡萄糖和脂质代谢。重要的机制包括调节营养吸收或产生短链脂肪酸,但有关膳食纤维对健康影响的数据存在争议。
对于膳食纤维研究中不一致发现的解释:
首先,在大多数人体研究中,只补充了一种特定的可发酵纤维,因此只刺激了一种或几种个体(潜在有益的)细菌属。后者的后果可能是其他必需细菌或核心菌属的丰度减少,这可能导致微生物生态系统的不平衡。因此,结合刺激多种不同细菌属的不同纤维可能对维持微生物丰富度以及对免疫状态和代谢健康产生更显著的(相加或协同)影响很重要,所以多样化膳食纤维和饮食摄入对于健康益处的微生物调节更有用。
有趣的是,一项研究表明,结肠中产生短链脂肪酸的部位可能是代谢健康的决定因素。急性远端结肠乙酸盐给药增加了超重男性的循环乙酸盐浓度,增加了脂肪氧化和刺激饱腹感激素 PYY,并降低了血浆肿瘤坏死因子-α。与远端输注相比,近端结肠中的乙酸盐给药不影响代谢特征。因此,通过结合不同的膳食纤维和/或更复杂的膳食纤维,针对远端结肠中微生物物种的膳食纤维可用性和短链脂肪酸形成,可能是改善免疫和代谢健康的有前景的策略。
TIPs
短链脂肪酸在一定范围内是越高越好,但是超过一定范围,也会产生害处。例如,高纤维饮食增加丁酸盐,诱导Stx受体球形三酰神经酰胺表达从而促进致病大肠杆菌定植。
此外,有益的短链脂肪酸一般需要通过结肠部位的菌群发酵产生,如果外源性的补充摄入,例如,丙酸盐有助于防止食物上霉菌,被广泛使用于烘焙食物、动物饲料和人造调味品中。如果长期摄入过量含有丙酸盐的食物,可能会增加人类患糖尿病和肥胖症的风险。
其次,到目前为止,大多数膳食纤维干预研究都没有考虑基线微生物组或代谢表型。基线肠道微生物组的特征可能与饮食干预结果密切相关。例如,已经表明肠道微生物群对膳食纤维(抗性淀粉与非淀粉多糖)的反应可以根据肥胖男性的基线微生物多样性来预测。高微生物多样性与微生物群的较低膳食反应性相关,这可能支持肠道微生物的更高多样性与微生物生态系统的稳定性有关的假设。
与此一致,与基因计数低的个体相比,基线时的高微生物基因计数与对减肥饮食的不太明显的反应有关。在低基因计数组中,基因丰富度和临床参数有所改善,尽管在基因丰富度低的个体中炎症标志物的变化不太明显。
一项针对肥胖个体的研究表明,不是基线微生物多样性而是厚壁菌门的基线丰度预测了个体微生物群的饮食反应。总之,这些发现表明微生物多样性并不总是饮食反应性的预测指标,这意味着需要进一步研究以更好地了解复杂的饮食-微生物组-宿主代谢相互作用。
作为对菊粉型果聚糖益生元的反应,具有高习惯性膳食纤维摄入量的健康个体的肠道菌群组成发生了更大的变化,而习惯性纤维摄入量低的人肠道菌群似乎更能适应变化。在II型糖尿病患者中进行的一项研究表明,膳食纤维促进了一组精选的产生短链脂肪酸的菌株,而许多其他微生物,包括蛋白水解发酵中的微生物,要么减少要么不变,表明微生物基因丰富度总体下降。粪便短链脂肪酸增加,尤其是丁酸盐,伴随着葡萄糖稳态的改善。因此,如几项人类纤维膳食干预研究所示,更高的微生物基因丰富度本身可能无益,但生理结果可能更依赖于微生物网络的功能。
在一项调查 6 周全麦饮食对体重变化影响的研究中,普雷沃氏菌属的高基线丰度与超重、健康成年人的体重减轻程度较高相关。这些发现表明,作为对特定饮食干预的反应,肠道微生物群的影响调节剂具有预测能力。
此外,发现超重、前驱糖尿病个体与瘦个体相比,对短期施用长链菊粉和抗性淀粉的微生物多样性和餐后胰岛素敏感性的变化的反应降低。与此一致,最近的研究表明,基线肠道微生物特征可以预测补充 3 个月长链菊粉后 BMI 的变化,这种效应在不同个体的粪便微生物群定植的小鼠中得到了复制。
有趣的是,可溶性菊粉纤维已被证明可以降低空腹血糖受损人群的胰岛素抵抗,但不能降低葡萄糖耐量受损的人群。鉴于空腹血糖受损与肝脏胰岛素抗性密切相关的发现,后一发现可能表明纤维 – 肠道微生物群 – 宿主代谢串扰中的组织特异性。
总体而言,益生元膳食纤维对代谢健康结果的有效性可能取决于几个参数,包括基线微生物组成以及微生物发酵的部位。
在低膳食纤维的西方饮食人群中,结肠远端的微生物群更擅长于利用剩余肽和蛋白质的发酵,因为首选的燃料,可发酵碳水化合物,已经在近端结肠中被人体大量使用。这种蛋白水解发酵过程的产物包括气体产物,如氢、甲烷、二氧化碳和硫化氢;BCFAs异丁酸酯、2-甲基丁酸酯和异戊酸酯(源自BCAAs发酵)、酚类和吲哚类化合物(源自芳香族氨基酸微生物发酵)以及较小的、未知的短链脂肪酸。
与糖解发酵产物相比,大多数蛋白水解发酵产物被认为对宿主肠道和代谢健康有害,尽管一些动物数据表明吲哚和硫化氢对肠道和外周组织功能有益。
例如,一些只能由肠道细菌(吲哚)或哺乳动物宿主(酪胺、色胺和短链脂肪酸)产生的氨基酸衍生化合物通过影响GLP-1和肠内分泌细胞血清素的分泌,直接影响哺乳动物的饱腹感和肠道运动。
然而,大多数这些化合物对宿主肠道和周围组织的生理作用仍不清楚。许多此类化合物的人类来源和细菌来源之间的区别尚未完全确定,需要进一步的体内研究来验证此类效应。
结肠中糖酵解和蛋白水解发酵之间的平衡,以及对宿主生理的假定有益和有害调节之间的平衡,可能对制定饮食干预策略很有意义。
一些研究表明,增加膳食纤维的摄入量,特别是缓慢发酵纤维的摄入量,会减少肠道微生物群仅产生有害的蛋白水解代谢物,使得整体发酵平衡向更有益的糖酵解发酵转变。
摄入的膳食蛋白质首先在小肠中被胰酶和来自肠细胞的肽酶消化。然后,大量的寡肽和氨基酸通过肠细胞转运蛋白被转运到门静脉血流中,在那里它们被用作蛋白质合成的氨基酸前体或被代谢为燃料或肠粘膜代谢物必需的前体。
由于远端小肠和近端结肠中的大多数细菌优先使用可发酵碳水化合物而不是蛋白质,因此大多数氨基酸作为能量来源的发酵发生在碳水化合物被耗尽的远端结肠。
摄入的蛋白质到达大肠的百分比也可能取决于蛋白质质量,估计约为 10%。由于植物的细胞壁不易消化,源自植物的蛋白质的消化率较低,而源自动物的蛋白质更容易在大肠中消化,这表明功能结果存在潜在差异。
酪蛋白是一种从动物产品中提取的相对缓慢消化的蛋白质,是防止高脂肪/高蛋白饮食小鼠体重增加和脂肪量增加的最有效蛋白质来源。
蛋白水解和糖酵解发酵之间的平衡可能决定对生活方式干预的反应情况,因此应在未来的研究中加以考虑。


流行病学研究还表明,摄入乳制品和素食蛋白质来源与预防肥胖有关,而大量摄入肉类(尤其是红肉)则预示着体重增加会更高。
尽管研究较少,但蛋白质摄入已被证明会影响微生物群的组成和功能。效果取决于蛋白质的氨基酸组成和消化率,而蛋白质的来源和摄入量会影响它们。
蛋白质摄入影响微生物组成
在大鼠研究中,高蛋白饮食与C. coccoides, C. leptum, F. prausnitzii 减少有关,而超重或肥胖雄性中Roseburia, E. rectale, C. aerofaciens, Bacteroides, Oscillibacter 减少。
值得注意的是,以等热量的方式比较高脂肪/高蛋白饮食与中等蛋白质或低蛋白质饮食会导致饮食之间碳水化合物或脂肪含量的差异。因此,对于所有的等热量膳食宏量营养素交换研究,很难确定导致肠道微生物群组成变化的主要膳食因素,这可能归因于一种(宏量)营养素的增加或另一种营养素的减少。
膳食脂肪已被广泛研究与饮食相关的代谢疾病(如肥胖)相关,但其对人类肠道微生物群的影响尚不明确,而且研究通常会得出相反的结果。
不同类型的脂肪酸(饱和、单不饱和、多不饱和脂肪酸)、碳链长度和饱和度可能对肠道微生物群组成有明显影响。
横断面研究表明,食用富含动物蛋白和脂肪的饮食与拟杆菌属肠型有关,而高纤维、水果和蔬菜的摄入与健康成年人的普氏菌肠型有关。

此外,主要饱和脂肪酸(SFA)的高摄入量与成人和婴儿肠道微生物丰富度和多样性的降低有关。在超重和肥胖人群中, 主要饱和脂肪酸与肠单胞菌属呈负相关,而主要饱和脂肪酸与Roseburia呈正相关,后者在体重正常的个体中也非常丰富。在这项研究中,根据 BMI,习惯性 主要饱和脂肪酸摄入量与产丁酸菌表现出相反的关联特征。
总体而言,应该注意的是,与膳食纤维相比,膳食脂肪-微生物组-宿主生理学相互作用的研究较少,而且其机理知识主要基于动物研究。根据人类生理学比较难解释这些发现,应进一步研究。
多酚主要作为酚类化合物存在于水果和蔬菜中,以其作为抗氧化、抗炎、心脏保护、癌症预防和神经保护剂的有益作用而闻名。
补充天然存在于茶中的表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate) 2个月,对肥胖小鼠胆汁酸代谢和疣微菌科Verrucomicrobiaceae丰度均有影响,促进了A. muciniphila丰度的增加。在其他研究中,后者与有益的代谢作用有关。
此外,虽然也在动物模型中,但 8 周的多酚补充剂可防止饮食引起的肥胖和肠道炎症,这与Akkermansia的丰度增加有关。在健康、超重或肥胖的个体中,12 周的白藜芦醇和表没食子儿茶素-3-没食子酸酯联合补充剂改善了男性的代谢参数并减少了拟杆菌门,但女性没有。
以上两项研究都表明存在性别特异性微生物反应,在评估干预反应时应考虑这一点。

总体而言,在饮食中添加膳食多酚似乎可以促进肠道和代谢健康,尽管仍然需要对人体研究的机制见解。
基于微生物组的精准营养预测代谢健康参数,如血糖反应和变异性,或用于抵消代谢紊乱,目前已受到很大关注。
该领域的一项具有里程碑意义的研究表明,尽管餐后血糖反应的人际差异很大,但在机器学习算法的帮助下创建的个性化饮食(基于习惯性饮食、身体活动和肠道微生物群)可能会成功降低血糖反应和不良代谢健康,还有助于减肥。
研究测试在对不同类型面包的血糖反应中发现了显著的人际差异,并且这种血糖反应可以通过基线微生物组特征来预测。值得注意的是,这些研究主要基于他们对急性膳食挑战和短期干预的反应,而不是长期干预反应。
肠道微生物组的预测能力正变得越来越明显,特别是在检查纤维和粪便微生物群移植效果的研究中。在长期的肠道菌群检测经验实践中也证实,基线微生物特征是对饮食干预(例如,膳食纤维或复合蛋白质)的反应性的有趣生物标志物,也是个性化健康管理的应该纳入的指标基础。
微生物组-宿主代谢轴可能对胰岛素抵抗患者的饮食干预存在抗性,这表明干预可能需要更长的时间,或者需要摄入的功能性膳食成分(如膳食纤维)来诱导有益的效果。特定功能微生物群的特点是对膳食成分的不同消化能力,导致微生物代谢物(如 短链脂肪酸)的不同产生,随后影响宿主代谢的调节。
总的来说,在评估饮食模式和常量营养素组成不同的饮食时,重要的是要同时考虑饮食成分的数量和质量,由于与宿主的微生物和代谢表型的不同相互作用,在整体饮食方法中要考虑到微量营养素和生物活性成分,如多酚。
对饮食干预的反应不仅取决于肠道微生物群的特征,还取决于饮食、生活方式和环境因素以及代谢表型等临床特征之间复杂的多因素相互作用。
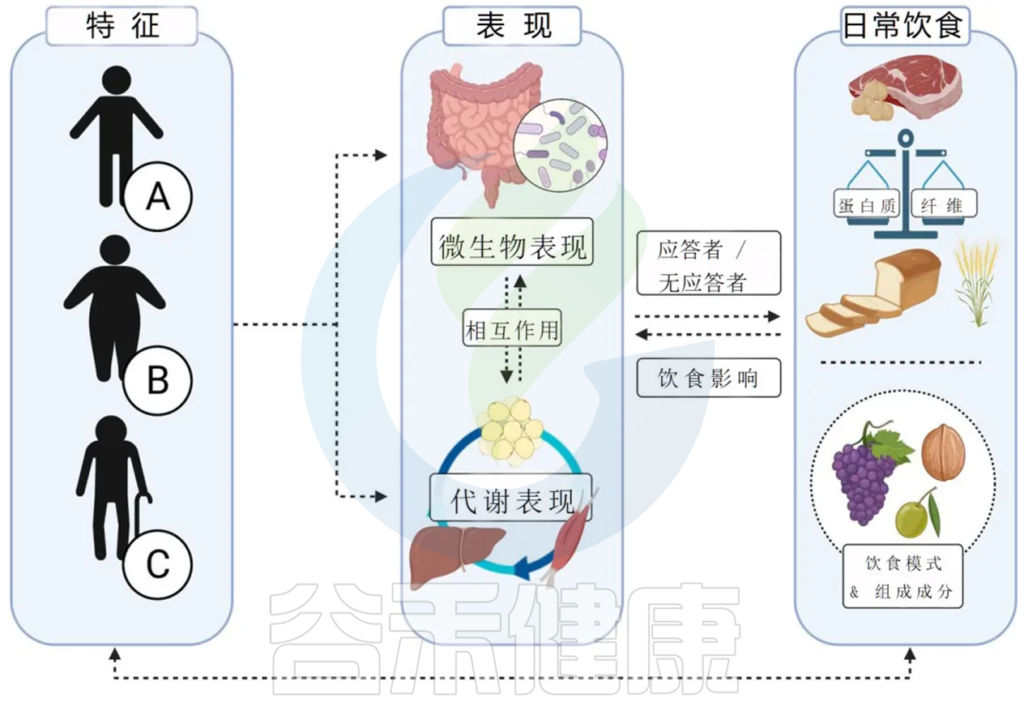
Jardon KM, et al., Gut. 2022
为了将基于精确的策略转化为医疗保健实践或指南,我们需要彻底了解为什么人们对饮食的反应不同,差异反应和相关表型是否长期保持,以及开发的算法在多大程度上是可重复的。
在饮食干预研究中通过最先进的方法进行详细的微生物和代谢表型分析至关重要。显然,鉴于复杂性,除了生活方式和环境因素的详细信息外,还需要详细的信息,包括出生方式、病史、药物使用情况(尤其是抗生素)、身体活动、心理压力和睡眠质量等。这也意味着需要先进的统计和建模方法来梳理不同因素的重要性。

主要参考文献:
Jardon KM, Canfora EE, Goossens GH, Blaak EE. Dietary macronutrients and the gut microbiome: a precision nutrition approach to improve cardiometabolic health. Gut. 2022 Feb 8:gutjnl-2020-323715. doi: 10.1136/gutjnl-2020-323715. Epub ahead of print. PMID: 35135841.
Agus A, Clément K, Sokol H. Gut microbiota-derived metabolites as central regulators in metabolic disorders. Gut. 2021 Jun;70(6):1174-1182. doi: 10.1136/gutjnl-2020-323071. Epub 2020 Dec 3. PMID: 33272977; PMCID: PMC8108286.
Jie Zhuye,Yu Xinlei,Liu Yinghua et al. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories.[J] .Gastroenterology, 2021
Jie Z, Yu X, Liu Y, Sun L, Chen P, Ding Q, Gao Y, Zhang X, Yu M, Liu Y, Zhang Y, Kristiansen K, Jia H, Brix S, Cai K. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories. Gastroenterology. 2021 May;160(6):2029-2042.e16. doi: 10.1053/j.gastro.2021.01.029. Epub 2021 Jan 20. PMID: 33482223.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康

有没有觉得无论你一天刷了多少次牙,仍然需要吃几颗口香糖?
或者外出与人交谈时对自己的呼吸感到不自在?
……
你不是一个人。
事实上,现代人们饮食不规律,加上高油高脂高盐以及辛辣等饮食习惯,存在口臭问题的人群越来越多,口臭是目前消化科门诊较为常见的主诉之一。口臭给人们自身健康和心理问题都会带来很大困扰和担忧。

口臭与多方面因素有关,大多数口臭可能是由各种口腔问题引起的,但同时,口臭也可能是其他健康问题的征兆。例如消化系统的失调可能是重要原因。消化系统不仅包括口腔,还包括食道、胃、小肠和大肠等,因此这些地方出现问题都可能导致口臭。这其中,被扰乱的微生物群平衡是造成口臭的不可忽视的因素之一。
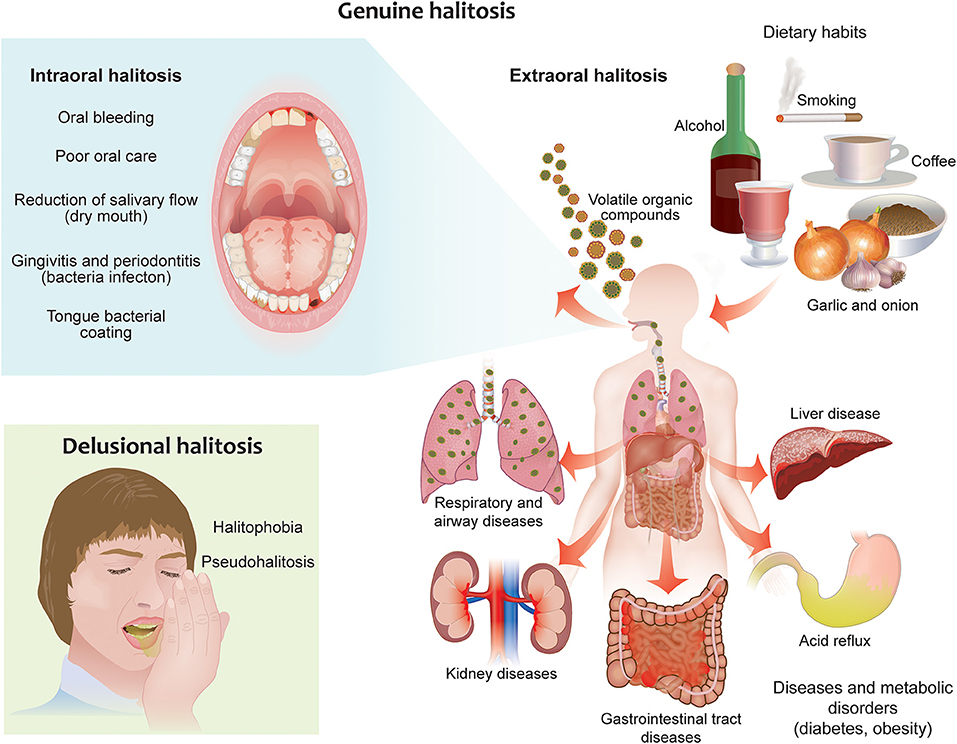
Zanetti F, et al., Front Oral Health. 2021
本文结合对口臭研究的最新进展,从更广泛的角度来了解与口臭相关的原因,包括口腔病理因素、口腔菌群的作用、细菌代谢途径、消化道疾病,肠道菌群失调等,同时也包括一些口臭相关干预措施。
口臭分为几种:真口臭、假口臭、口臭恐惧症。
这其中真正的口臭又分为生理性和病理性两种。
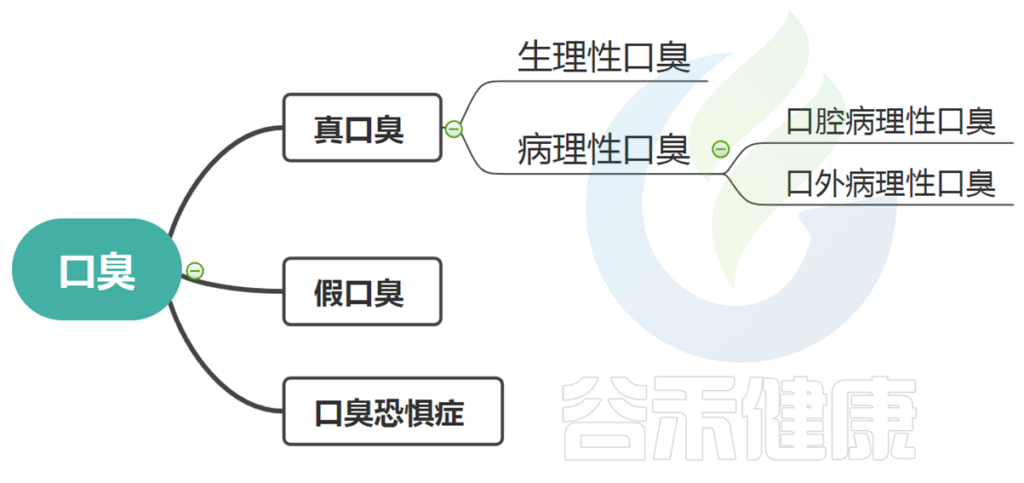
什么叫真口臭和假口臭?口臭恐惧症又是什么?
我们一条条来看。
——“ 没有口臭觉得有口臭 ”
这种分类是指患者没有实际的呼吸气味问题(嗅觉或科学测试无法检测到),但他们仍然确定自己有口臭。
假性口臭约占15%。
——“ 总觉得口臭被别人嫌弃,尴尬,不敢正常交流 ”
此类别是指尽管患者的真正口臭状况得到成功治疗,或者在接受咨询后假性口臭的情况下,患者仍然对呼吸问题有感知,其他人的行为(例如,打开窗户、嗅嗅、摸鼻子等)被误解为口臭的证据。并且在许多情况下,朋友和家人无法说服ta。其症状包括害怕呼气、抑郁和社会孤立,甚至会产生离职、离婚或自杀念头。
直接原因在于心理问题:
在许多情况下,患者受到有关口臭的评论或戏弄,存在心理创伤。这通常发生在童年时期,伴随着被拒绝或嘲笑的感觉一直到成年。其他也可能包括疑病症或强迫症等疾病。
后果可能加剧心理问题:
这种情况可能导致妄想的心理疾病,例如精神分裂症或双相情感障碍,也可能导致口臭恐惧症的发展。
此时,需要将患者病情的治疗转到心理医生处。
这一类别指的是口腔腐败(有机物的腐烂)导致的臭味,通常出现在舌头后部(最后端)的白色涂层内。
这是最常见的口臭形式,涉及约90%的真口臭病例。
不过这种口臭一般被认为是短暂的,因为它时有时无,由口腔中的临时局部条件决定。
患者通常可以通过改善口腔护理来解决生理性口臭,尤其是舌头清洁。
病理性口臭又分为口腔病理性口臭和口外病理性口臭。
口腔病理性口臭:
这一类别包括由口腔内组织相关疾病或其他病理条件引起或加重个人气味问题的情况。
举个例子,一个人口臭可能是由于牙龈疾病的存在,或因其加重。此外,相关因素(如口干和吸烟)也可能在病理性口臭中起作用。
口外病理性口臭:
在这些情况下,口臭源于涉及口腔以外的身体组织的疾病或病理状况。气味可能来自:
• 鼻、鼻旁或喉区域(上呼吸道)
可能的相关病症:鼻后滴漏、慢性鼻窦炎、急性病毒或细菌感染、扁桃体炎、扁桃体结石、深扁桃体隐窝。
• 下呼吸道(肺)或上消化道
可能的相关病症:慢性支气管炎、支气管扩张、裂孔疝、幽门螺杆菌感染、吸收不良病症。
• 身体其他部位的疾病。在这些情况下,疾病过程产生的化合物是血液传播的,当它们从肺部呼出时,会产生一种呼吸恶臭的状态。
可能的相关疾病:糖尿病、肝硬化、尿毒症、肾功能不全、月经周期、内出血。
由此可见,口臭的原因包括口腔和消化道等其他因素,下面我们主要从口腔和消化道两方面对口臭的形成进行深入了解。
前面我们了解到,在这几种口臭类型中,口源性口臭占比较大。其病因有龋齿、牙周病、口腔感染、种植体周围炎、冠周炎、黏膜溃疡、潴留的食物或残渣、舌苔等。
虽然牙周健康的人也可能出现口臭,但牙周炎是口臭的原因之一。如果不及时清洁,口腔中残留的食物颗粒会腐烂并产生异味。牙齿护理不到位可能会导致口腔中的菌斑积聚,从而产生气味。牙菌斑积聚在牙齿上也会导致牙周病。当斑块变硬时,变成牙垢。牙垢中的细菌会刺激牙龈,导致牙龈疾病。轻微的牙龈疾病称为牙龈炎;如果不治疗牙龈炎,可能会发展为牙周炎。
这些患者的口臭主要是由口腔环境中基质腐败引起的,这其中微生物扮演了重要角色。研究发现,口腔内的多种细菌与口臭的产生紧密相关。
目前认为,口源性口臭源于口腔微生态的平衡被打破,口腔内菌群失调造成产臭厌氧菌比例的增加,致臭菌含硫蛋白代谢产物释放增多,从而引起口臭。
硫氨基酸降解的一般模式和口臭的机制
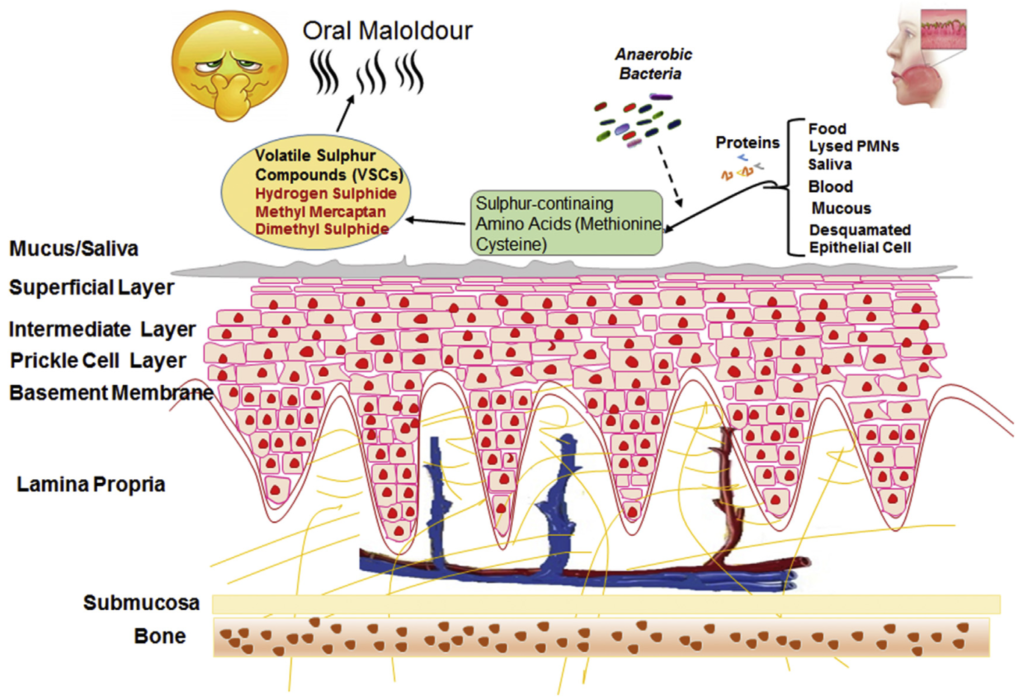
Karbalaei M, et al., New Microbes New Infect. 2021
接下来,我们将从与口臭有关的化合物、菌群、发酵底物、代谢途径、环境这些个方面来阐述它们是如何导致口臭的发生。
与口臭有关的化合物
口腔中基质腐烂会产生各种代谢物,包括挥发性硫化合物 (VSC) 和其他有机化合物,这些代谢物挥发气味就出现了口臭。
口臭主要归因于挥发性硫化合物 (VSC)。在患有口内口臭和牙周炎的受试者中,还报告了挥发性芳香族化合物水平升高,例如吲哚、多胺、粪臭素、吡啶和甲基吡啶,而这些在健康受试者中没有检测到。
呼吸气体中腐败化合物列表
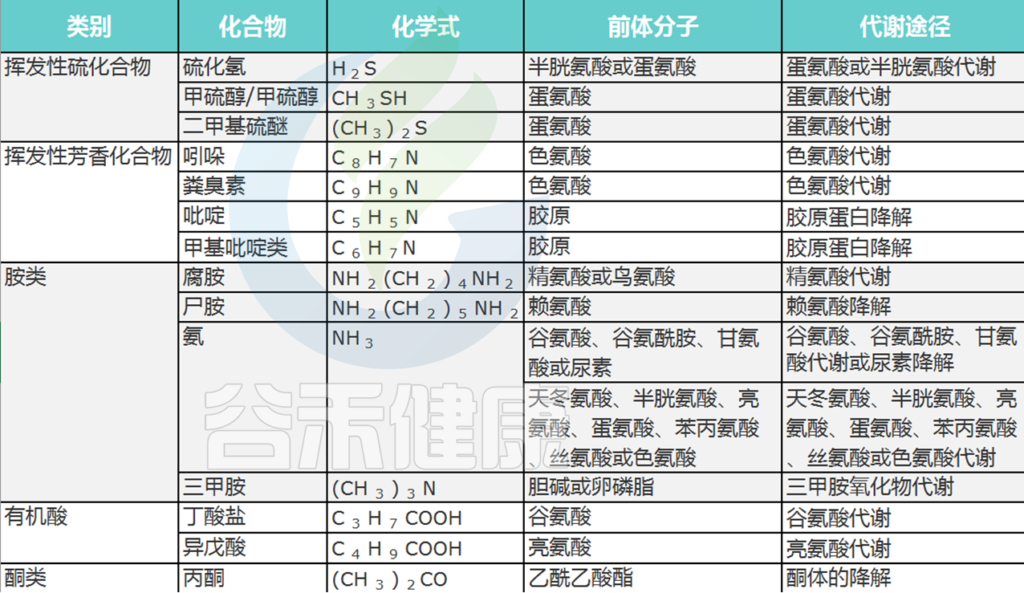
Foo LH,et al., Crit Rev Microbiol. 2021
在VSC中,与口臭有关的最重要的化合物是:
硫化氢 (H2S)
甲硫醇 (CH3SH)
二甲硫醚 [(CH3)2S]
其中,硫化氢和甲硫醇占口腔内VSC的90%.
口臭患者的口腔空气中可能含有H2S和CH3SH或两者。这两者浓度在口内口臭中可能会有所不同。这是因为高H2S和高CH3SH患者的菌群结构在系统发育上是不同的。
接下来我们来看看具体哪些菌与口臭相关。
与口臭有关的口腔菌群
研究表明,产VSC的细菌很多,如Solobacterium moorei,牙龈卟啉单胞菌,密螺旋体Treponema denticola,中间普雷沃氏菌Prevotella intermedia,口腔链球菌Streptococcus oralis,Tannerella forsythia 等。
挥发性硫化合物(VSCs)与口腔细菌的相关性
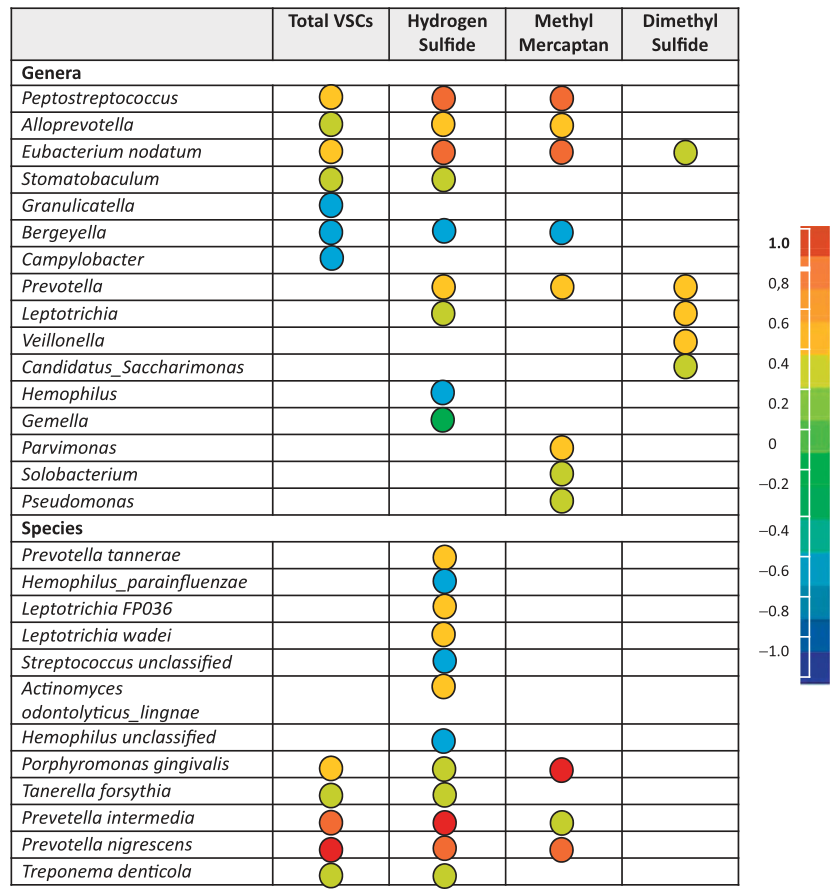
Foo LH,et al., Crit Rev Microbiol. 2021
前面我们知道,在口腔空气中H2S和CH3SH含量高与口臭相关。
在H2S较高的患者中,奈瑟菌属、梭杆菌属、卟啉单胞菌属和SR1属的比例更高。
相比之下,高CH3SH患者的普雷沃菌属、韦荣球菌属、阿托波姆属Atopobium、巨球菌属Megasphaera、硒单胞菌属Selenomonas的比例较高。
在体内研究发现,嗜血杆菌Hemophilus和孪生球菌属Gemella与口内口臭呈负相关。
那么这也说明了,气味化合物的产生是一个非常复杂的现象,任何单一细菌物种的存在都不能解释口臭的原因。不同菌群之间会产生相互作用,口臭可能是许多不同细菌的活动共同导致的。
这些细菌为生存形成了代谢网络。
不同口腔生态位中口臭和健康的微生物群结构
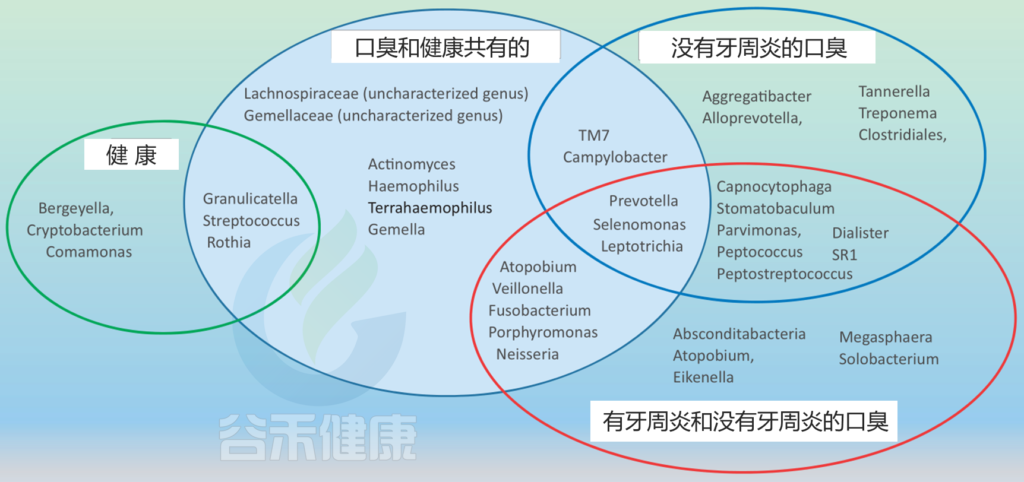
Foo LH,et al., Crit Rev Microbiol. 2021
健康组包括在没有口臭的受试者中存在的属;非牙周炎组的口臭包括牙周健康者伴有口臭的属;口臭和健康共有组包括健康和口臭的属,不考虑牙周炎;有牙周炎和没有牙周炎的口臭组包括存在于口臭的属,这些属的研究没有明确排除或提到牙周炎的影响。
与无口臭者相比,牙周健康者的微生物群中下列菌较多:
普雷沃菌属Prevotella、Alloprevotella、
Aggregatibacter、Campylobacter、
嗜二氧化碳噬细胞菌Capnocytophaga、
梭菌目Clostridiales、 小类杆菌属Dialister、
Parvimonas、消化球菌属Peptococcus、
Selenomonas、SR1 genera、
坦纳菌属Tannerella、TM7、Treponema、
纤毛菌属Leptotrichia、 Stomatobaculum、
消化链球菌属Peptostreptococcus 等。
有趣的是,在物种水平上,牙周炎相关的物种在牙周健康受试者舌背的微生物谱中均未检测到,如:
牙龈卟啉单胞菌P. gingivalis、Treponema denticola、T. forsythia、Capnocytophaga.
在一项基于PCR的研究中,81.1%的口臭患者样本中未检出牙龈卟啉单胞菌,86.5%的样本中未检出F. nucleatum和48.6%的样本中未检出P. intermedia。
由此可以推断,健康相关性口臭的口腔微生物群与牙周炎引起的口臭不同。
细菌发酵底物
吃东西的过程中,有些食物可能会卡在牙齿里,成为细菌的发酵底物,促进细菌和牙菌斑的生长,从而导致口臭。
口腔细菌的主要营养素来自唾液、龈沟液和脱落的上皮,含有糖蛋白、蛋白质、肽和氨基酸。
蛋白水解细菌可以通过细胞膜结合或细胞外分泌的蛋白酶将这些化合物降解为小肽和氨基酸,以便随后用作代谢底物。
那么具体哪些细菌,如何将这些底物发酵,从而导致口臭?
接下来的小节,我们来详细看看它们的代谢途径。
口臭相关细菌的代谢途径
牙龈卟啉单胞菌有牙龈蛋白酶(类胰蛋白酶半胱氨酸蛋白酶)和二肽基肽酶,而中间普氏菌有几种降解白蛋白和免疫球蛋白的蛋白酶。
革兰氏阳性菌,如唾液链球菌S.salivarius和 S. moorei,可以通过使唾液糖蛋白去糖基化,使蛋白核心可供革兰氏阴性菌进一步降解,从而间接促进口内口臭。
革兰氏阳性菌产生的酶和蛋白水解细菌的协同作用可以促进VSC的产生。虽然关于口腔中氨基酸降解的信息不多,但最常见的口臭代谢途径如下:
蛋氨酸和半胱氨酸代谢
蛋氨酸和半胱氨酸是主要的含硫氨基酸,属于正常发育所需的必需氨基酸。蛋氨酸-半胱氨酸代谢的第一步涉及天冬氨酸末端羧基的两次连续减少,以形成高丝氨酸(下图)。
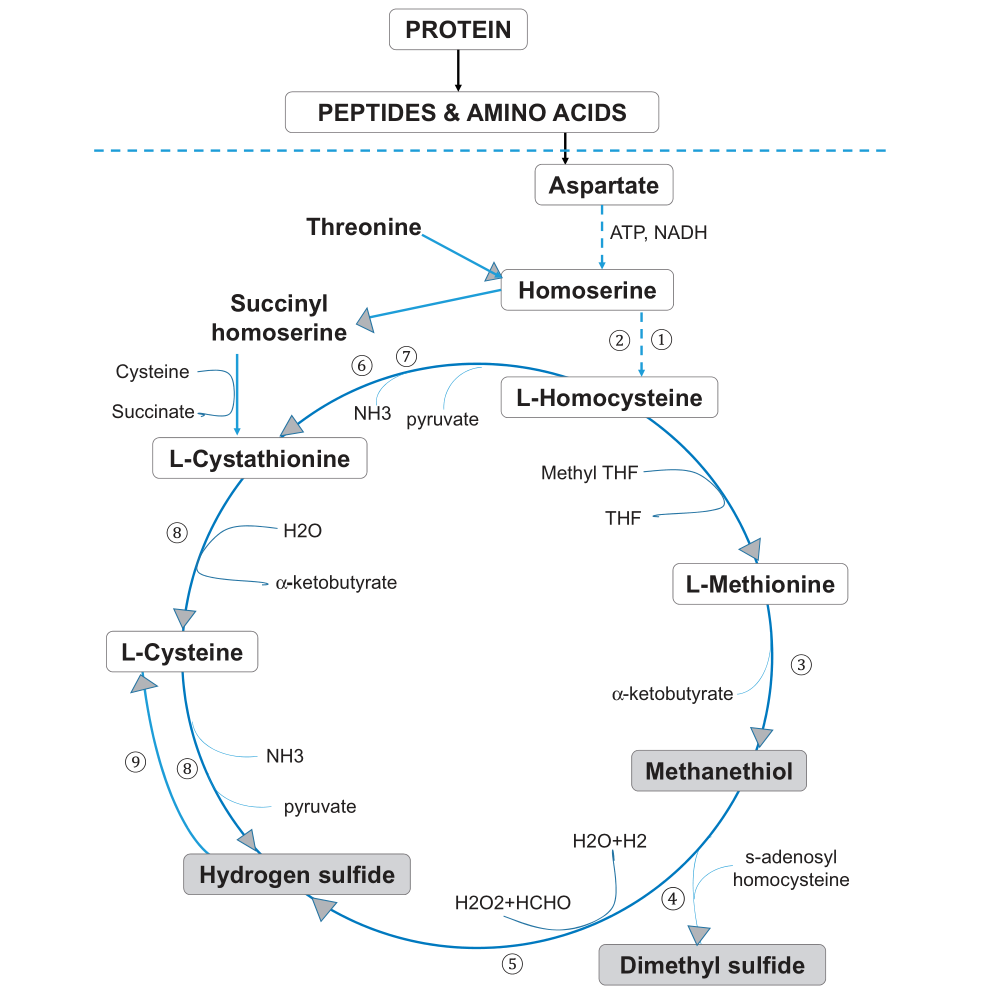
Foo LH,et al., Crit Rev Microbiol. 2021
口腔厌氧菌利用谷氨酸和/或天冬氨酸或其肽作为能量底物。
例如,牙龈卟啉单胞菌P. gingivalis、 中间普氏菌P. intermedia、P. nigrescens可以使用aspartyl aspartate,而牙龈卟啉单胞菌、具核梭杆菌F. nucleatum也可以使用谷氨酰谷氨酸glutamylglutamate作为能源。
高丝氨酸的激活允许发生反式磺酰化,形成同型半胱氨酸。同型半胱氨酸可以重新甲基化形成蛋氨酸,也可以通过反式硫化途径转化为半胱氨酸。通过METase酶促作用,同型半胱氨酸再甲基化为蛋氨酸导致VSC、甲硫醇或CH3SH的形成。
牙龈卟啉单胞菌、具核梭杆菌、齿垢密螺旋体T. denticola是通过转化酶活性产生甲硫醇的关键口腔微生物群。METase存在于细菌的细胞内和真菌的细胞外,但在哺乳动物中不存在。因此,抑制这种酶对人类的影响应该很小,使其成为治疗口腔异味的潜在药物靶点。
在蛋氨酸代谢的后续步骤中,甲硫醇通过酶、硫醇S-甲基转移酶和CH3SH氧化酶进一步甲基化,生成其他VSC,如(CH3)2S和H2S.
色氨酸代谢
经典的牙周病原体牙龈卟啉单胞菌、中间普氏菌和核梭杆菌是通过色氨酸代谢途径产生吲哚和粪臭素的主要细菌。
色氨酸也是一种必需氨基酸,由膳食蛋白质提供。它被色氨酸酶降解,色氨酸酶在氧化和脱氨基后产生中间产物吲哚-3-丙酮酸和吲哚-3-乙酸,最终形成粪臭素(下图)。
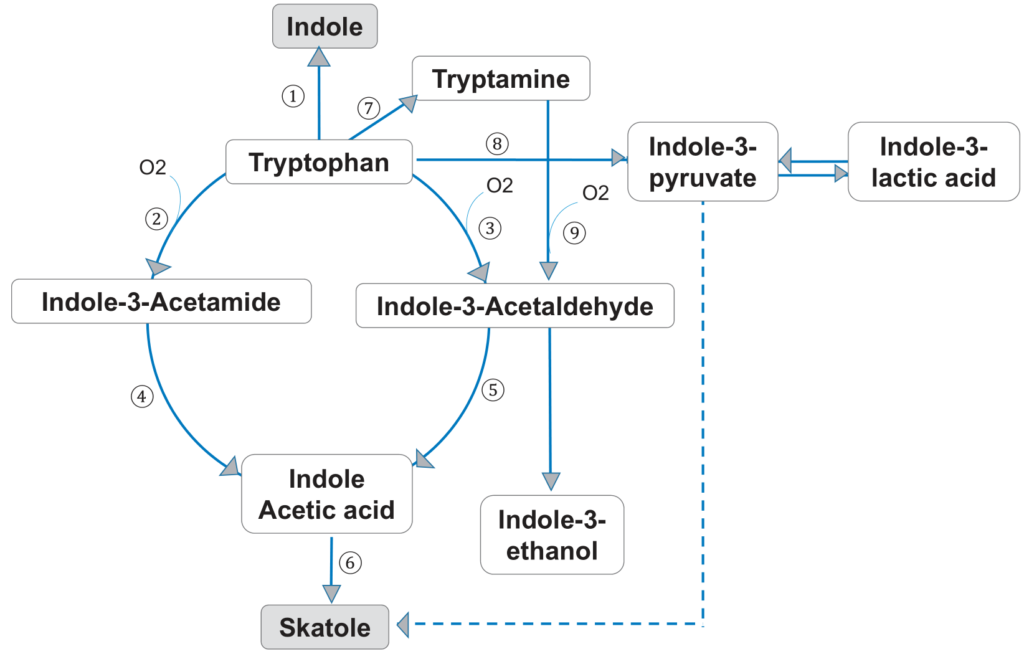
Foo LH,et al., Crit Rev Microbiol. 2021
另一方面,吲哚可以通过色氨酸酶的一步催化作用产生。吲哚和粪臭素是色氨酸的两种主要代谢物,与口内口臭有关。据报道,中间普氏菌、牙龈卟啉单胞菌、具核梭杆菌等革兰氏阴性蛋白水解细菌在口腔内产生大部分吲哚和粪臭素。
然而,纯革兰氏阳性细菌培养物,如S. salivarius, S. mutans, A. naeslundii, L. acidophilus,并不产生这些代谢物。
相比之下,最近在肠道微生物组学方面的研究表明,色氨酸的降解可能不仅限于蛋白水解细菌,革兰氏阳性乳酸杆菌也表现出分解色氨酸的能力。
影响口臭的环境因素
舌苔
舌苔的形成是与口腔卫生不良、牙周组织发炎、戴假牙、吸烟和饮食摄入等因素有关。舌背不规则且深度裂开,难以进入该区域进行清洁,这会促进脱皮的上皮细胞和食物残渣保留在舌背表面。这种位置为微生物在舌头上粘附和增殖创造了理想的环境,并能很好地防止唾液的冲洗作用。
在戒除舌头卫生的情况下,平均细菌总数往往会显著增加,而在清洁舌头后,VSC减少75%。
舌头生态位中的低氧水平会使微生物群向厌氧菌群倾斜。
在一项实验研究中,当受试者停止舌头清洁七天时,牙龈卟啉单胞菌P. gingivalis、齿垢密螺旋体T.denticola、T. forsythensis、中间普氏菌P. intermedia、P. nigrescens的数量显著增加。虽然口臭的强度与不同的细菌定植模式显著相关,但这些关联与舌苔评分无关。
其他研究也报告了患有和不患有口臭的牙周健康受试者在可观察到的舌苔和厚度得分方面没有显著差异。
因此,可以推断,VSC和口内口臭的原因不是舌苔厚度,而是高细菌密度。
唾液流
平均未受刺激的唾液流速范围为0.3至0.4 毫升/分钟,进餐时可以增加到4-5.0 毫升/分钟。但在唾液流量减少的受试者中,静息唾液流量降至0.1毫升/分钟以下,并被指定为唾液分泌不足。
药物治疗(如抗抑郁药、抗利尿药和抗高血压药)、唾液腺疾病(如Sjögren综合症)、不受控制的糖尿病、病毒感染和其他医疗(如化疗和放射疗法)都可能导致唾液分泌减少。唾液流量减少使口腔的正常清洁机制效率低下,增加了细菌腐败的基质。
此外,唾液本身具有抗菌活性。晨间口臭是一种非病理性口臭,由夜间唾液分泌减少引起,具有短暂特征。
需要注意的是,口呼吸还可以促进硬腭、舌背和口腔粘膜周围的干燥,间接促进VSC的产生。
在当前的SARS-CoV-2大流行中,长时间使用口罩,以及戴口罩时的口腔呼吸习惯,往往会让人们更加注意自己的口气(“口罩口臭”)。
牙周袋
在牙周炎患者中,VSC水平和CH3CH/H2S比率与出血指数和探测深度成比例增加。这主要是由于牙周袋深处的氧气压力较低,使其成为能够产生VSC的厌氧细菌的理想环境。在可培养的口腔细菌中,与牙周炎相关的厌氧革兰氏阴性菌(P. gingivalis, T. denticola, T. forsythia)是体外H2S最活跃的产生菌。
由于牙齿和舌头周围的清洁不足,牙周炎患者的口腔卫生状况通常较差。此外,它们的唾液中含有脱落的上皮细胞和白细胞,这些细胞可能沉积在舌头表面,并间接为VSC的形成提供二硫化物和硫醇基团。这解释了牙周炎患者产生的舌苔是非牙周炎患者的四倍。
然而,它并不一定代表牙周炎是口内口臭的原因,因为舌苔的厚度不一定等同于微生物量。事实上,如前所述,已知与VSC产生有关的是舌苔中的微生物密度,而不是舌苔溃疡。因此,可观察到的舌苔数量与舌苔上的微生物数量关系不大。
同样,也可以说,像脱落的上皮细胞一样,来自牙周袋深处的牙周病原体也可能会移位,并在舌头表面定居,在那里它们可以生长和繁殖。因此,牙周微生物群可能会影响舌头微生物群的定植,并加剧VSC的生成。
牙列(包括牙齿修复中的问题)
口腔内任何部位的细菌积聚、食物嵌塞和随后的腐败都可能有利于口内口臭。因此,口内口臭最常见的牙齿来源包括深龋病变、牙间食物嵌塞和牙齿拥挤。
固定正畸支架和悬垂修复体也可能是食物滞留和腐败的潜在场所。悬垂修复可以改变微环境,有利于增加间接导致口内口臭的厌氧细菌(V.alcolescens、V.parvula和产黑色素拟杆菌)。
丙烯酸假牙,尤其是在夜间存放在口腔中或不定期清洁时,也会产生典型的口腔气味。面向牙龈的义齿表面是多孔的,对细菌、酵母、碎屑和所有导致腐败的因素都有保持力。
暴露在外的牙髓营养丰富,是细菌和口内口臭的另一种合适基质。已从坏死牙髓中分离出混合厌氧菌(普雷沃氏菌、Furobacterium、梭菌、消化链球菌Peptostreptococcus、链球菌、乳酸杆菌)和常见的牙周病原体(牙龈卟啉单胞菌、齿垢密螺旋体),表明它们在口内口臭中的作用。
牙齿修复可以改善口腔微生物生态,这取决于所用修复材料的性质。例如,修复过程中金属或氟离子的泄漏可能会干扰细菌粘附并防止其积聚。另一方面,当修复材料深入牙龈时,可能会导致出血,并增加拟杆菌和螺旋体等厌氧菌的比例。
物理化学条件
除了存在细菌和基质外,物理化学条件对于产生有气味的挥发物至关重要。口腔卫生不良会导致菌斑厚度增加,以及菌斑外层细菌对氧气的利用率增加。这导致大面积的厌氧和低氧化还原条件,促进口内口臭的形成。
此外,在口腔中,温度在34-37℃之间变化,经口呼气时湿度在91%-96%之间变化。这些条件也可能为口内口臭相关细菌的生长提供合适的环境。
一般来说,温度会影响分子本身的挥发性,气体在较低温度下的挥发性较小。要使化合物有气味,它必须是挥发性的。口内口臭的强度与吲哚或粪便的浓度之间缺乏相关性,这可能是因为吲哚在室温和37℃下的挥发性较低 。
pH值也是产生口臭的关键因素之一。上述pH值对于口腔异味的形成至关重要,而酸性pH值可以起到抑制作用。由于口腔粘膜表面的pH值主要由粘附细菌的发酵和腐败活动决定,因此了解pH值是有必要的。
以上是与口臭有关的口腔原因,当然口臭的原因不仅限于此。
消化系统疾病导致许多口臭。这类口臭主要是由气味挥发物从肠胃通过食道泄漏到口鼻。然而,由肠道引起的口臭通常是消化系统总体失衡的标志。
消化道疾病
胃食管反流病,胃酸/胃灼热/胃痛的情况都可能导致气味。
腹胀、胀气和打嗝
任何让你打嗝的消化系统疾病都可能导致口臭。这些包括消化系统的不平衡,如肠易激综合征、食物不耐受或高糖摄入。
肠梗阻或便秘
当你的身体不能正常消化食物时,一个不幸的副作用可能是,出现类似粪便的口臭。
肠道屏障薄弱
当肠道屏障被削弱时,它会被损坏,也就是出现“肠漏”,不能再作为屏障发挥最佳作用,于是一下麸质、有害细菌、未消化的食物颗粒、化合物和毒素等有害物质都开始“泄漏”出来。这些物质会进入身体系统,可能出现发炎,对健康造成损害,也包括出现口臭问题。
导致肠漏的因素有很多,例如药物的使用,过多摄入糖分,食物过敏刺激肠壁,缺乏维生素 A 和 D 等营养素,过量饮酒,慢性压力,自身免疫性疾病等。
菌群失调
除了这些明显的疾病或症状之外,有些容易被忽略的问题也可能导致口臭,比如肠道菌群失衡。
前面我们知道,挥发性亚硫酸盐化合物是罪魁祸首——硫化氢、甲硫醇、二甲硫醚。
这些也会由结肠细菌通过食物发酵产生的。
这些气体可能会从结肠中被重新吸收,然后出现在呼吸中。
结合谷禾肠道菌群数据库,我们整理了与口臭相关的常见肠道菌属如下:
口臭相关肠道菌属

幽门螺杆菌:
幽门螺杆菌感染造成口臭存在争议。幽门螺杆菌具有菌株依赖的能力,可以在体外从结合的半胱氨酸-蛋氨酸底物中合成硫化氢和甲硫醇。
与健康对照组相比,感染幽门螺旋杆菌的患者呼吸中氰化氢和硝酸氢水平都有所升高;然而,这是否代表这类型的口臭尚不清楚。也可能是由于幽门螺杆菌在口腔的定植引起口内口臭。
一些研究报告了幽门螺旋杆菌和口臭之间的正相关关系,然而,其中一些研究可能因为基于自我报告的口臭标准,而不是呼吸分析。其他的报告没有统计上显著的相关性。
饮食
食物是口腔异味的主要来源。有些食物,如大蒜、洋葱、辛辣食物、一些奶酪、鱼、酸性饮料,如咖啡,可能会留下挥之不去的气味。大多数时候,这种气味是短暂的。
然而,饮食与肠道菌群密切相关,糖的摄入过多,蛋白质摄入缺乏等都会导致肠道菌群紊乱,对人体有害菌群大量生长,有益菌生存空间不足,身体受到损害,当然也包括可能出现的口臭。
低碳水化合物饮食也可能导致“酮呼吸”。这些饮食使身体燃烧脂肪作为能量来源。产生这种能量的最终产物是酮,当呼出时会在呼吸中产生口臭,类似丙酮的果味。
吸烟和咀嚼烟草会在口腔中留下化学物质。吸烟还可能导致口臭,如牙龈疾病或口腔癌。
口臭的相关因素有很多,除了上述常见的原因之外,一些身体疾病也会出现口臭症状,例如:
鼻窦感染、肺炎、喉咙痛(咽炎)和其他喉咙感染、普通感冒、流感、扁桃体结石、鹅口疮、支气管炎、鼻后滴漏、糖尿病、胃酸反流、乳糖不耐症、其他肠胃或消化等问题,一些肝脏疾病或肾脏疾病可能与口臭有关。
物体卡在鼻子里(通常是儿童)、酗酒和大剂量维生素补充剂也可能引起口臭。
扁桃体炎
与扁桃体炎有关的口臭可发生在急性、慢性和复发性扁桃体炎中。
扁桃体是位于喉部两侧的两小块腺体组织。它们构成你免疫系统的一部分,制造抗体和白细胞来攻击口腔内的细菌。它们是抵御食物或空气中细菌的第一道防线的一部分。
扁桃体像蜂窝一样,在它的表面和里面有一些孔隙,这些孔隙被称为隐窝。在这些隐窝里,藏有一些灰色或者灰白色的、质地比较硬的块状物质。这些块状物质就是扁桃体结石。
扁桃体结石最常见的症状是咽痛和口臭。如果结石比较小可能感受不到明显的症状,但是多数情况下会有明显的口臭。
鼻窦炎
鼻窦炎可能是一种长期的慢性疾病,伴有过敏和/或鼻子结构问题。长期鼻窦炎会严重影响生活质量。
鼻窦位于脸颊内、鼻子周围和后面。它们的作用是加热、湿润和过滤进入鼻腔的空气。它们还帮助发声。
鼻窦炎的症状因严重程度和涉及的鼻窦而异。它们可能伴随着口臭。鼻窦炎患者窦腔内的分泌物不能排出来。伴有细菌感染的话就会发生脓性分泌物,久而久之就可能发生腐败,通过鼻咽部流向口内,就会造成口臭。
其他呼吸系统疾病
如支气管扩张、肺脓肿或坏死性肺肿瘤都会产生难闻的气味。
过敏
许多用于治疗过敏的药物都会导致口干,这是导致口臭的另一个原因。此外,鼻后滴漏是一种常见的过敏症状,可导致口臭。过敏引起的鼻窦充血也会导致人们用口呼吸,导致口干,从而引起口臭。
药物
许多药物,包括治疗过敏的抗组胺药和利尿剂,可能会导致口干(如前所述),从而导致口臭。其他可能导致口臭的药物可能包括氨苯蝶啶(Dyrenium)和多醛。
糖尿病
糖尿病患者的胰岛素产量不足,导致他们燃烧脂肪并产生酮。这意味着他们容易出现酮呼吸。糖尿病患者的另一个口臭原因可能是慢性肾功能衰竭。
慢性肾功能衰竭
这可能会导致闻起来有鱼腥味或像氨水的气味,唾液中的大量尿素及其分解为氨会导致口臭。
怀孕
怀孕本身不会引起口臭,但怀孕期间常见的恶心和晨吐可能会引起口臭。此外,激素变化、脱水以及因渴望而吃不同的食物也可能导致怀孕期间的口臭。
首先,要排除是否是一些特殊疾病引起的口臭,例如糖尿病、肝功能衰竭等,如果是这类原因,则需要进行相应的疾病治疗。
其次,需要检查是否存在其他不太严重的疾病,如口腔疾病、鼻窦炎、胃食管反流、肠道菌群失调等问题。
如果存在较为明显的疾病症状,例如牙周炎,则配合口腔科医生进行相应治疗;如果症状不是特别明显,则可进行口腔菌群或者肠道菌群检测,看看是否由于菌群失调引起的口臭。
益生菌
研究表明,益生菌可以解决部分口腔问题,包括口臭。
唾液链球菌是一种非致病性的口腔优势菌,是最重要的共生益生菌之一,最常从无口臭的人群中分离出来。唾液链球菌K12可产生两种抗生素——唾液霉素A2 (SalA2)和唾液霉素B (SboB)。临床试验表明,含唾液链球菌K12的抗菌漱口水显著降低了VSC产生菌的水平。唾液链球菌K12作为一种益生菌,最初来源于口腔共生菌,在口臭的治疗中可以发挥关键作用。
益生菌预防龋齿
研究表明,食用含有鼠李糖乳杆菌GG (LGG) 和罗伊氏乳杆菌的牛奶可显着减少变形链球菌和远缘链球菌的数量,这是龋齿的两种主要致病菌。链球菌属发酵饮食中的碳水化合物。牙菌斑的 pH 值降低(从 7.0 到 4.0)会导致牙釉质脱矿。因此,益生菌可用作乳制品中的预防性细菌。
最近,基于体外和体内实验证明,魏斯氏菌Weissella cibaria(原属乳酸杆菌属)作为一种新型益生菌菌株可以预防龋齿,并显着抑制变形链球菌形成生物膜。这种细菌会产生大量的过氧化氢,并且可以与具核梭菌聚集并抑制这些病原体在口腔中产生VSCs(下图)。
益生菌预防口臭的可能机制
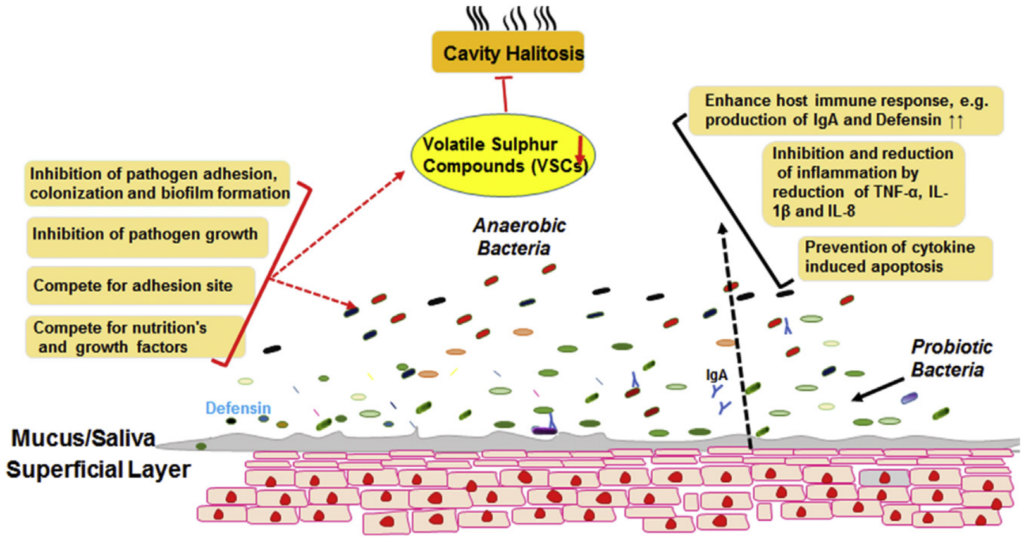
Karbalaei M, et al., New Microbes New Infect. 2021
应用于食品和健康领域的常用益生菌

*a 安全微生物的合格推定
Bustamante M, et al., Probiotics Antimicrob Proteins. 2020
另外需要注意的是,口臭并没有想象中的可怕。排除各类疾病的可能性,其余口臭原因都是生理性的,也就是短暂的,可能是吃了味道比较大的食物造成的,那么这类人群只要注意饮食和养成良好的口腔卫生习惯,问题不大。
注意饮食
吃的东西会影响呼吸的味道。需要注意的一些食物和饮料包括:
咖啡。除了喝完后留在嘴里的刺鼻气味外,咖啡中的咖啡因也会导致口干。
糖。高糖和精制碳水化合物(即白面包)的饮食与口臭有关。含糖食物会导致酸产生,不仅会增加蛀牙的风险,还会促进念珠菌的过度生长。
大蒜、洋葱和辛辣食物等味道浓郁的食物会在口腔中留下难闻的气味。虽然大蒜通常属于健康的食物,但不可否认,这些食物会导致暂时的口臭。
避免发炎的食物
炎症性食物会增加体内炎症,往往会加剧疾病症状,并可能导致口腔健康恶化。这些食物包括加工肉类、苏打水和含糖饮料、咸味零食、包装糖果和精制碳水化合物。特别是盐分过多会加剧口干并导致口臭。
抗炎饮食
另一方面,抗炎食物有助于减少体内炎症,并可能减轻症状,包括减少口臭。有许多抗炎食物,包括姜黄、生姜、绿叶蔬菜、浆果、亚麻和奇异籽、核桃、杏仁、橄榄油和鲑鱼等。
试试这些健康的饮食秘诀,包括吃新鲜蔬菜和尽量减少零食。还有一些更具体的食物已被经验证明可以改善口臭:
肉桂是一种抗病原菌的抗菌剂。为了缓解口臭,咀嚼肉桂棒、喝肉桂香料茶、咀嚼含有肉桂油的口香糖或用肉桂味漱口水漱口。
绿茶具有抗菌特性,可以减少异味。这是因为它含有抗氧化剂和多酚。

研究表明,绿茶可以减少与S. moorei 相关的口臭,并且它可能会降低龋齿和牙周病的发病率/严重程度。喝绿茶以促进整体口腔健康和治疗口臭。也可以制作冰绿茶,只需将绿茶叶放入罐中,加水并冷藏即可。
多喝水,少喝咖啡因和酒精
多喝水,但是避免苏打水、含糖饮料和酒精是个好办法。
如果患有口干症,那么饮用的饮料就显得尤为重要。全天饮水,以保持口腔中的液体持续流动。但是,避免气泡水,它会使口干变得更糟糕。含咖啡因的饮料和酒精都会使口腔干燥。尝试改用不含咖啡因的咖啡或茶来增加能量。
虽然有些食物可能会导致口臭,但还有其他食物实际上可以帮助改善口臭。某些食物可以通过它们的酶作用、食物中抗氧化剂的活性和/或食物的 pH 值来除臭。
例如,菠菜,生苹果,香菜,薄荷,绿茶等。
此外,发酵、富含益生菌的食物,如酸奶、泡菜、康普茶、开菲尔、酸菜等,可以帮助促进口腔中“好”细菌的平衡,并阻止念珠菌的生长。
多喝水不仅几乎可以立即冲走细菌,还有助于防止口干。目标是每天 6-8 杯。
椰子油
椰子油具有天然的抗炎和抗菌特性,每天用椰子油漱口或在嘴边刷几分钟,可以预防蛀牙和牙龈炎。
柠檬
由于其抗菌和抗氧化作用,柠檬可以帮助控制口臭。在吃过大量洋葱或大蒜后,用柠檬水漱口可能特别有用。此外,在舌尖滴一滴柠檬有助于刺激唾液分泌,从而缓解口干。
补充剂
锌
体内有 300 多种不同的细胞功能使用锌,包括与肠道菌群、口腔和微生物组有关的细胞功能。研究表明,锌可有效减少导致口臭的含硫化合物的积累。可以使用含锌漱口水来控制口臭。
维生素D
获得足够的维生素 D很重要,原因有很多,包括口腔健康。维生素 D 的缺乏会导致灼口综合征,它会使口腔中出现金属味或苦味,同时还会导致口臭。
良好的口腔卫生习惯
每天刷牙(和舌头)两次,每天使用牙线,每六个月去看一次牙医,但口腔健康不仅仅是最基本的要求。以下是维持长期口腔健康的 3 个不太明显的技巧。
正确的刷牙
刷牙有助于清除口腔中的菌斑和细菌,防止蛀牙、蛀牙甚至牙周病。虽然刷牙是我们每天都会做的事,但刷牙也是个技术活,刷得不到位可能会出现口腔问题。
这里再次强调一下正确的刷牙方式。
首先,刷牙齿的外表面。轻轻地刷你牙齿的上下部分,可以帮助你减缓这个过程,防止你遗漏任何斑点。
然后,倾斜你的刷子45度来清洁牙龈线。它可以帮助清除牙龈上滞留的菌斑和食物残渣。
牙齿的内表面是不可见的。因此,以45度的角度前后刷牙对清洁牙齿内部至关重要。
此外,来回刷你的后牙顶部。很多食物残渣都会在那个地方积聚。
最后,刷一下舌头,也就是下面提到的使用刮舌器,去除异味,呼吸清新。
使用刮舌器
口臭可能是由残留在舌头上的病原菌堆积引起的。使用刮舌器,或者牙刷背面刮舌。小心不要对舌头施加太大压力,因为重度刮擦会割伤组织。
治疗口干
口臭的另一个常见罪魁祸首是口干。如果觉得自己的口气需要清新,请记得多喝水有助于清除细菌并保持口腔湿润。为了长期增加唾液量,也可尝试使用益生菌等产品。
尝试盐水冲洗
将盐倒入温水中搅拌至溶解,然后在嘴巴和喉咙周围漱口。盐水的温和酸度会阻止有害微生物的生长。
每天使用漱口水
我们的嘴里含有平衡的好细菌和坏细菌。使用漱口水也是一种良好的习惯,不过尽量避免使用含酒精的漱口水,也可以试试专为口干设计的非酒精漱口水。
适度运动
新的研究表明,适度运动有益于口腔健康。锻炼时,可随身携带一瓶水(可能含有镁或钾)以保持水分。

主要参考文献:
Foo LH, Balan P, Pang LM, Laine ML, Seneviratne CJ. Role of the oral microbiome, metabolic pathways, and novel diagnostic tools in intra-oral halitosis: a comprehensive update. Crit Rev Microbiol. 2021 May;47(3):359-375. doi: 10.1080/1040841X.2021.1888867. Epub 2021 Mar 3. PMID: 33653206.
Mogilnicka I, Bogucki P, Ufnal M. Microbiota and Malodor-Etiology and Management. Int J Mol Sci. 2020;21(8):2886. Published 2020 Apr 20. doi:10.3390/ijms21082886
Bustamante M, Oomah BD, Mosi-Roa Y, Rubilar M, Burgos-Díaz C. Probiotics as an Adjunct Therapy for the Treatment of Halitosis, Dental Caries and Periodontitis. Probiotics Antimicrob Proteins. 2020 Jun;12(2):325-334. doi: 10.1007/s12602-019-9521-4. PMID: 30729452.
Zanetti F, Zivkovic Semren T, Battey JND, Guy PA, Ivanov NV, van der Plas A, Hoeng J. A Literature Review and Framework Proposal for Halitosis Assessment in Cigarette Smokers and Alternative Nicotine-Delivery Products Users. Front Oral Health. 2021 Dec 10;2:777442. doi: 10.3389/froh.2021.777442. PMID: 35048075; PMCID: PMC8757736.
Karbalaei M, Keikha M, Kobyliak NM, Khatib Zadeh Z, Yousefi B, Eslami M. Alleviation of halitosis by use of probiotics and their protective mechanisms in the oral cavity. New Microbes New Infect. 2021 Apr 23;42:100887. doi: 10.1016/j.nmni.2021.100887. PMID: 34123388; PMCID: PMC8173312.
Jo JK, Seo SH, Park SE, et al. Identification of Salivary Microorganisms and Metabolites Associated with Halitosis. Metabolites. 2021;11(6):362. Published 2021 Jun 7. doi:10.3390/metabo11060362

谷禾健康

口服酶可以对肠道微生物群的组成产生深远的影响,并且可以作为一种有吸引力的替代调节剂。
本文总结了酶影响肠道微生物群的三种方式,并讨论了选择合适的酶来调节肠道微生物群的挑战。
酶:一种被忽视的调节肠道微生物群的因子
人类肠道容纳多达100万亿微生物,包括细菌、古细菌、真菌等。
最近的一项研究发现,有178种肠道微生物可产生400多种高度丰富的代谢物,其中许多可通过肠道屏障迁移,进入血液循环,并对宿主进行免疫、代谢和神经元调节。
目前用于调节肠道微生物群的大多数策略都集中在化学品和整个微生物细胞上。而酶,作为具有催化功能的特殊蛋白质,却没有被广泛考虑。
几乎在所有生化反应中都需要酶。在畜牧业中,各种酶被广泛添加到饲料中,以促进动物的生长。它们的有益作用与肠道菌群的变化有关,并可能部分归因于肠道菌群的变化,这强烈表明可以有意选择酶来调节肠道菌群。
事实上,在小鼠和其他实验动物中,酶无疑已被证明对肠道微生物群有潜在影响。
酶可以通过三种方式影响肠道微生物群。
1
// 一些酶可以杀死肠道微生物
溶菌酶、类溶菌酶糖苷水解酶和细菌噬菌体溶菌酶直接降解细菌细胞壁的主要成分肽聚糖。

Su X, Yao B. Trends Microbiol. 2022
在小鼠中,口服赖氨酸-防御素嵌合蛋白可显著减少粪便艰难梭菌孢子,从而降低死亡率。酶可以产生对肠道微生物有害的反应产物。
在肠道中,管腔葡萄糖(浓度为几十毫摩尔)、L-氨基酸(回肠中的几毫摩尔),甚至细菌衍生的游离D-氨基酸(盲肠内容物中的约200-500 nmol/g)都可以被酶氧化,释放过氧化氢杀菌。在小鼠体内,D-氨基酸氧化酶导致霍乱弧菌(Vibrio cholera)在小肠中的定植显著减少。
2
// 酶可以刺激肠道微生物生长
在人类中,食物中约一半的木聚糖被肠道微生物木聚糖酶降解为低聚木糖,低聚木糖支持某些肠道微生物(如拟杆菌、双歧杆菌和乳酸杆菌属)的生长。

Su X, Yao B. Trends Microbiol. 2022
木聚糖酶的刺激谱可以通过肠道微生物的生态网络进一步扩展。
酶还可以通过催化去除有害化学物质来刺激肠道微生物生长。
肠道碱性磷酸酶(IAP)是一种由肠上皮细胞分泌的内源性酶,通过降低抑制细菌的管腔核苷酸三磷酸的浓度来促进特定肠道微生物的生长。这与减轻肠道屏障损伤和减轻酒精诱导的肝脂肪变性等疾病密切相关。
3
// 酶能通过干扰微生物网络影响肠道菌群
群体感应(QS)是微生物群形成网络的一种方式。通过感应信号分子,微生物同步生成生物膜并排出有毒分子。

Su X, Yao B. Trends Microbiol. 2022
通过N-酰基高丝氨酸乳糖等酶去除QS分子(群体猝灭)可以调节金鱼的肠道微生物群,这可以通过增加变形菌的丰度和减少肠道中致病性嗜水气单胞菌(Aeromonas hydrophila)来证明。
分散素B也证明了微生物网络的干扰,它水解生物膜稳定剂1,6-N-乙酰-D-葡萄糖胺,从而显著减少铜绿假单胞菌(Pseudomonas aeruginosa)在肠道中的定植。
研究表明,有充分的机会利用酶来调节肠道微生物群,进而促进宿主的健康。
这其中最大的挑战可能是该使用什么酶。
以治疗慢性疾病为例。由于整合多组学分析的能力不断发展,慢性病中的致病菌群正逐渐被识别出来。
因此,酶可以作为有选择地富集或减少有害致病微生物的宝贵工具。
因为酶能够通过将致病微生物与微生物结合模块(如抗体)连接起来,从而瞄准致病微生物。
为了制造这种具有精确调节功能的酶,可以从拟杆菌的“自私”策略中获取经验。这种细菌编码细胞表面附着的甘露聚糖酶,以帮助它在竞争激烈的肠道生态位中靠甘露聚糖繁衍生息。
此外,成功地将赖氨酸与细菌素融合,使酶能够杀死革兰氏阴性细菌,可以减少不必要的致病菌。
酶可以作为已知化学物质或微生物的增强剂,影响致病微生物。
例如,2型糖尿病患者(50%)对两种精心设计的高纤维饮食没有积极的反应。在那些从饮食中受益的人中,利用低聚糖的细菌,如双歧杆菌属,属于少数“公会”致病微生物。在这些饮食中添加纤维特异性酶可以释放更多低聚糖,从而改善细菌的生长,从而有助于缓解更多患者的疾病。
然而,许多其他疾病与肠道微生物群变化之间的机制联系目前仅限于关联而非因果关系。因为肠道中几乎所有的成分都是酶的潜在底物,除了上述几种酶之外,还有大量其他候选酶。
从理论上讲,直接受酶影响的肠道微生物可以从酶的作用模式中推断出来,根据已知的机械关联,可以使用该模式选择酶作为进一步测试的候选酶。
酶可以用来帮助释放真正的效应剂
这在使用化学药品和微生物来调节肠道微生物群的组成时是不容易做到的。例如,溶菌酶通过杀死乳酸乳球菌(Lactococcus lactis)和释放细胞内超氧化物歧化酶来缓解结肠炎。
总的来说,这些结果表明,通过询问与上述三种酶以及其他类似的候选酶,并对其进行系统地测试,可以发现在有效调节肠道微生物群方面的隐藏酶。或者,将有关酶、饮食和宿主基因型的累积信息集成到现有数据库中,如Amadis (http://gift2disease.net/GIFTED/)将肠道微生物群与疾病联系起来,可能会有更合理的选择,并减少需要筛选的酶的数量。
尽管生产、储存和口服都很容易,但在选择合适的酶时仍有重要的考虑因素。
1、考虑酶的耐受条件,相应增加剂量
口服给药时,酶必须能够耐受肠道内的恶劣条件,包括酸性pH值和蛋白酶消化,这表明应选择候选酶来满足抵抗力,最初计算的剂量应在实验验证的基础上相应增加,以补偿储存和使用过程中任何可能的活性损失。
2、考虑酶的多效作用甚至危害影响
虽然酶不具有水平基因转移和引入多药耐药生物体甚至与基因工程益生菌和粪便微生物群移植相关的病原体的安全风险,但酶可以发挥不必要的多效作用,甚至产生有害影响。例如,磷脂酶将磷脂酰胆碱水解为胆碱,可被肠道细菌进一步转化为代谢产物三甲胺,三甲胺与不良疾病相关。
3、同一家族中不能调节菌群的酶需要排除
同一家族中的一些酶略有不同。那些不能调节目标微生物的也应该被排除在外。例如,木聚糖酶释放大量不同的低聚木糖,肠道细菌如Roseburia intestinalis和Bacteroides ovatus对具有不同糖链长度的低聚木糖的反应非常不同。
酶影响肠道微生物群,进而影响宿主健康,再加上大量候选者的可用性和可感知的优势,使其成为调节肠道微生物群的一种不错的方式。了解酶的功能和催化机制可以更好地调节肠道菌群,指导药物使用,治疗人类疾病。
然而,由于酶与其底物、肠道微生物群和宿主之间的复杂相互作用,开发酶等新试剂并非易事。需要针对不同情况选择合适的酶。此外,酶并非排他性的,它们可以与化学物质和微生物合作,改变肠道微生物群的组成,进一步促进宿主的健康。
主要参考文献:
Su X, Yao B. Exploiting enzymes as a powerful tool to modulate the gut microbiota. Trends Microbiol. 2022 Feb 1:S0966-842X(22)00003-8. doi: 10.1016/j.tim.2022.01.003. Epub ahead of print. PMID: 35120774.
Jia B, Han X, Kim KH, Jeon CO. Discovery and mining of enzymes from the human gut microbiome. Trends Biotechnol. 2022 Feb;40(2):240-254. doi: 10.1016/j.tibtech.2021.06.008. Epub 2021 Jul 22. PMID: 34304905.
Neves ALA, Yu J, Suzuki Y, Baez-Magana M, Arutyunova E, O’Hara E, McAllister T, Ominski KH, Lemieux MJ, Guan LL. Accelerated discovery of novel glycoside hydrolases using targeted functional profiling and selective pressure on the rumen microbiome. Microbiome. 2021 Nov 23;9(1):229. doi: 10.1186/s40168-021-01147-1. PMID: 34814938; PMCID: PMC8609826.

谷禾健康

维生素对人体健康至关重要;它们是无数酶的辅助因子,包括促进脂肪和碳水化合物代谢的酶,并具有直接和间接的抗氧化特性。
由于人类自身无法产生足够量的维生素(维生素 D 除外),因此要从食物中获取维生素。然而,许多维生素对温度敏感,在食品加工和储存过程中容易降解。因此,维生素缺乏症在某些人群(例如,素食主义者或老年人)中很常见。
例如口角炎,脚气病,腿部容易抽筋,皮肤容易红肿,容易烦躁和疲倦等,都有可能与缺乏B族维生素有关。
B族维生素从哪里来?
曾经有人认为B族维生素只从饮食中获得;然而并非如此,肠道微生物群也是维生素的重要来源。
B 族维生素包括哪些?
常见的有维生素 B1 (硫胺素)、B2(核黄素)、B3(烟酸/烟酰胺)、B5(泛酸)、B6(吡哆醇)、B7(生物素)、B9(叶酸)和B12 (钴胺素)等。

B族维生素的吸收情况
B族维生素主要通过结肠产生和吸收,大多数B族维生素的吸收情况类似:在低浓度时,主动运输系统促进吸收,而在较高浓度时,被动扩散主要发生在小肠。过量摄入B族维生素会使B族维生素到达大肠。

B族维生素是多种代谢途径中普遍必需的辅助因子的生物合成前体,对宿主和肠道微生物群都是不可或缺的,它们在维持免疫稳态中也发挥着重要作用。
本文来详细了解一下B族维生素(8类)和肠道微生物群之间有什么联系,它们在免疫代谢中有哪些作用,缺乏会导致什么症状,如何补充B族维生素。
维生素B1是维持神经、心脏及消化系统正常机能的重要生物活性物质。
维生素B1参与肠道粘膜免疫系统的免疫防御,调节免疫细胞在肠道内发挥作用。维生素B1对巨噬细胞有调控作用,能够介导巨噬细胞的生长及其细胞因子的分泌,间接促进免疫细胞的增殖和分化。
维生素 B1(硫胺素)是几种酶的辅助因子,包括丙酮酸脱氢酶和 α-酮戊二酸脱氢酶,它们都参与三羧酸 (TCA) 循环,从而为人体提供能量。
维生素B1在体内是如何参与代谢的?
前面我们已经知道,维生素B的两种来源:
摄入食物和细菌代谢生成。
膳食和细菌维生素B1在宿主中有不同的作用。因此我们从这两个方面分别了解其吸收转化过程。
膳食维生素B1
维生素 B1 在肉类(尤其是猪肉和鸡肉)、鸡蛋、谷芽、米糠、豆类中以高浓度的焦磷酸硫胺素 (TPP) 形式存在。
膳食TPP被碱性磷酸酶水解,并在小肠内转化为游离硫胺素。游离硫胺素通过硫胺素转运体(例如,THTR-1、THTR-2)被肠上皮吸收,并被输送到血液中以分布在全身。游离硫胺被转化回TPP,用于TCA循环中的能量代谢。
细菌维生素B1
结肠中各种类型的肠道细菌也会产生维生素B1作为游离硫胺素和TPP。在结肠中,游离细菌硫胺素主要被硫胺素转运体吸收,运输到血液中,并分布在全身;这一机制与小肠吸收游离膳食硫胺素的方式相似。
然而,肠道细菌产生的TPP不会转化为游离硫胺素,因为结肠中不会分泌碱性磷酸酶。相反,TPP通过在结肠顶膜上高度表达的TPP转运体(如TPPT-1)直接被结肠吸收。被吸收的TPP通过MTPP-1进入线粒体,MTPP-1是一种TPP转运体,在线粒体内膜中表达,用作ATP生成的辅助因子。这表明细菌TPP对结肠中的能量生成很重要。
这两者之间的区别在于:肠道细菌产生TPP这条途径,并不是通过游离硫氨酸,而是直接被结肠吸收。
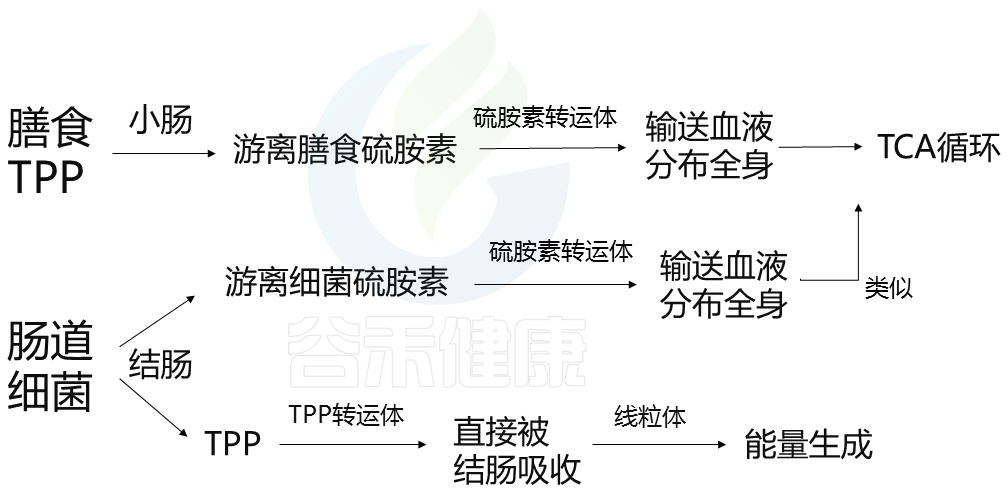
哪些菌会产生维生素B1呢?
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃氏菌、艰难梭菌(Clostridium difficile)、一些乳杆菌属、Ruminococcus lactaris、双歧杆菌属、可变梭杆菌(Fusobacterium varium)是维生素B1的产生菌。

此外,比如干酪乳杆菌(Lactobacillus casei)在发酵乳饮料的生产过程中产生硫胺素,婴儿双歧杆菌和双歧双歧杆菌在培养上清液中产生硫胺素。
许多肠道细菌拥有完整的维生素B1合成途径,包括噻唑和嘧啶的合成途径。
维生素B1的结构由嘧啶环和噻唑环通过亚结合而成。
细菌从甘氨酸或酪氨酸和1-deoxy-d-xylulose-5-phosphate中获得噻唑部分;
嘧啶部分来自5-氨基咪唑核糖核苷酸,这是嘌呤途径的中间产物。
宿主和某些菌存在VB1竞争
在肠道微生物群中,并非所有细菌都产生 B 族维生素,一些细菌利用膳食 B 族维生素或其他肠道细菌产生的 B 族维生素来满足自己的需要;因此,宿主和肠道微生物群之间可能存在对 B 族维生素的竞争。
比如,粪杆菌属(Faecalibacterium)的生长虽然需要维生素B1,但它却缺乏维生素B1合成途径。因此,必须通过硫胺素转运体从其他细菌或宿主饮食中获得维生素B1,这表明宿主和某些肠道细菌之间存在维生素B1竞争。
建议摄入量
世界卫生组织 (WHO)/粮食及农业组织 (FAO) 建议成人每日维生素 B1 摄入量为 1.1-1.2 毫克。
缺乏导致
维生素 B1 缺乏会导致嗜睡,如果不及时治疗,可能会发展成脚气病,这是一种影响周围神经系统和心血管系统的疾病。
含量较高的食物
维生素B1 存在于全麦谷物、酵母、豆类、坚果和肉类(尤其是猪肉和鸡肉)等食物中。

维生素 B2(核黄素)及其活性形式(黄素腺嘌呤二核苷酸 [FAD] 和黄素单核苷酸 [FMN])是 TCA 循环和脂肪酸氧化(也称为 β-氧化)中酶促反应的辅助因子。
维生素B2通过调节脂肪酸氧化来控制免疫细胞的分化和功能。
除了产生能量外,维生素B2通过启动NADPH氧化酶2与免疫细胞中活性氧(ROS)的产生有关,ROS是炎症和免疫过程中重要的效应分子和信号分子。
维生素B1和B2介导肠道B细胞分化的免疫代谢
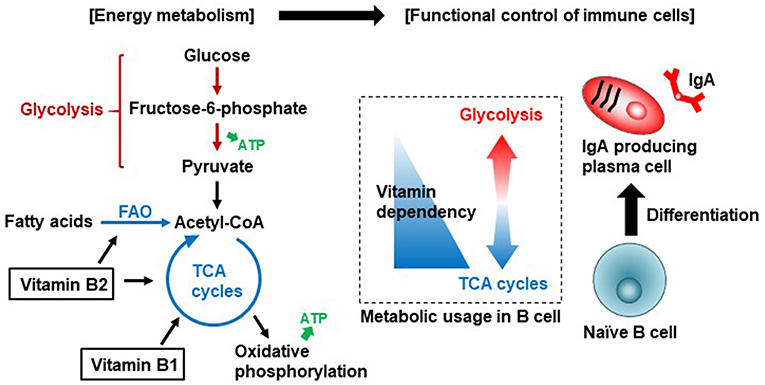
Yoshii K, et al., Front Nutr. 2019
维生素B1是参与TCA循环的丙酮酸脱氢酶和α-酮戊二酸脱氢酶等酶的辅助因子。维生素B2是TCA循环中琥珀酸脱氢酶和脂肪酸氧化(FAO,也称为β-氧化)中酰基辅酶a脱氢酶等酶的辅助因子。初始B细胞优先使用TCA循环有效产生能量。一旦B细胞被激活,分化为产生IgA的浆细胞,它们就会利用糖酵解产生IgA抗体。
膳食维生素B2
膳食维生素 B2 以 FAD 或 FMN 形式存在,并在小肠中通过 FAD 焦磷酸酶和 FMN 磷酸酶转化为游离核黄素。游离核黄素通过小肠上皮上表达的核黄素转运蛋白被吸收,然后释放到血液中。在血液中,游离核黄素转化回 FAD 或 FMN 并分布在全身。
细菌维生素B2
细菌维生素B2是由三磷酸鸟苷(GTP)和5-磷酸核酮糖合成的。细菌维生素B2以游离核黄素的形式存在,可直接在大肠中吸收,转化为FAD或FMN,并如上所述分布在全身。
哪些菌会产生维生素B2呢?
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃特菌属;艰难梭菌(Clostridium difficile)、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(L. fermentum)、Ruminococcus lacttaris表达合成维生素B2所必需的因子,表明这些细菌是大肠中维生素B2的重要来源。
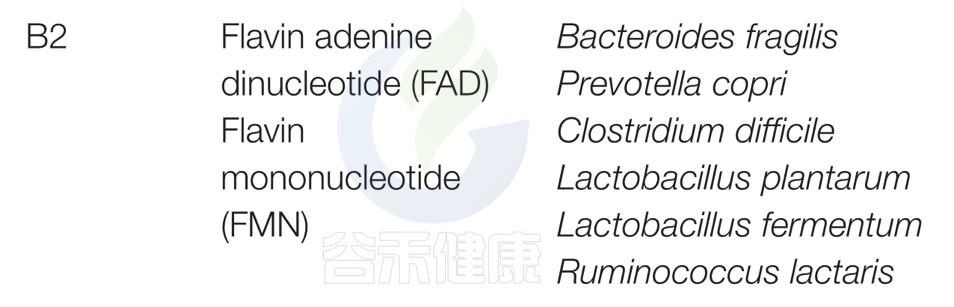
从酸面团中分离出的发酵乳杆菌可以在体外合成维生素B2。
双歧杆菌和Collinsella缺乏维生素B2途径。
在缺乏维生素B2的小鼠中,添加含有植物乳杆菌的发酵豆浆可以促进维生素B2的产生,防止维生素B2缺乏。
宿主和共生细菌之间对VB2的竞争
拟杆菌门中的某些物种比放线菌门和厚壁菌门产生更多的VB2。然而,放线菌和厚壁菌门仍然表达核黄素转运蛋白以及从游离核黄素生成 FAD 和 FMN 所必需的酶(即 FAD 合酶和黄素激酶),这表明所有细菌,包括那些不能合成维生素的细菌B2 本身需要 FAD 和 FMN 才能生长和生存。因此,与维生素 B1 一样,宿主和共生细菌之间可能存在对维生素 B2的竞争。
某些菌产生维生素B2中间体,有助于防御病原体
除了能够产生维生素 B2 之外,一些细菌(例如嗜酸乳杆菌等共生菌,结核分枝杆菌和鼠伤寒沙门氏菌等病原体)还产生维生素 B2 中间体(6-hydroxymethyl-8-d-ribityllumazine ),该中间体与抗原呈递细胞上的主要组织相容性复合物I类相关基因蛋白(MR1)结合;这会导致粘膜相关不变T细胞(MAIT)产生细胞因子,如干扰素γ和IL-17,这有助于宿主防御病原体(下图)。
来自维生素B2和B9的微生物代谢产物对MAIT细胞的调节
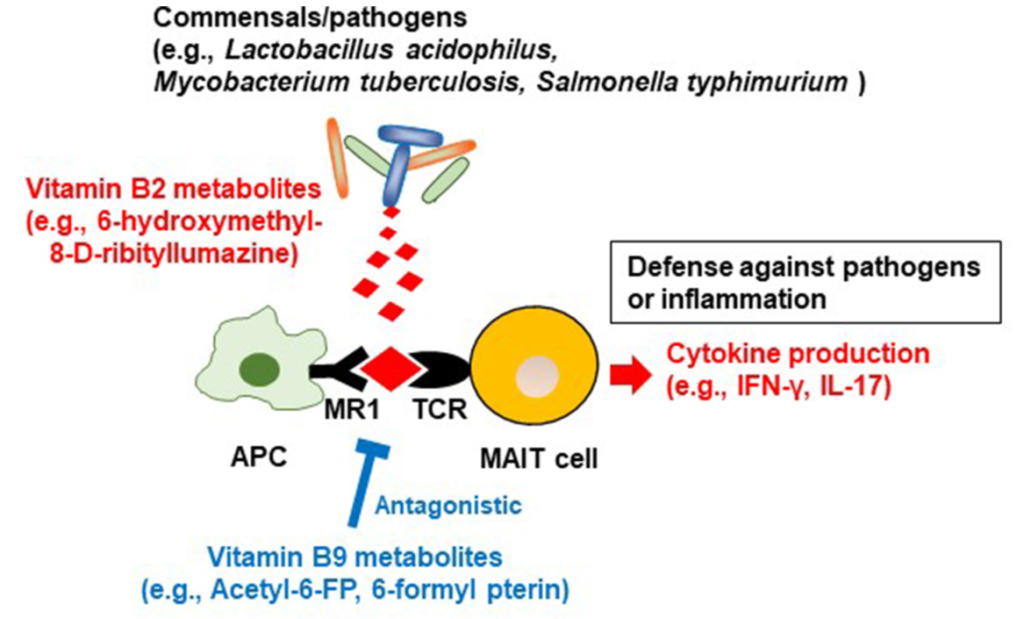
Yoshii K, et al., Front Nutr. 2019
有人认为,共生细菌的刺激有助于MAIT细胞的发育和激活,以便对病原体进行免疫监测。MAIT细胞还产生炎性细胞因子并具有组织归巢特性,表明这些细胞也参与自身免疫和炎症疾病的发展。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B2 摄入量为 1.0–1.3 毫克。
缺乏会导致
维生素 B2 缺乏会抑制参与脂肪酸氧化生成乙酰辅酶 A 的酰基辅酶 A 脱氢酶的活性,而乙酰辅酶 A 被线粒体用来通过 TCA 循环产生 ATP。
含量较高的食物
绿叶蔬菜、肝脏和鸡蛋中的维生素 B2 含量很高。

维生素 B3(烟酸)通常被称为烟酸和烟酰胺。这些化合物是烟酰胺腺嘌呤二核苷酸 (NAD) 的前体,NAD 是细胞氧化还原反应中的一种辅酶,在有氧呼吸中起核心作用。
免疫功能:抗炎,抑制结肠炎
维生素 B3 也是 GPR109a 的配体,GPR109a 是一种 G 蛋白偶联受体,在包括免疫细胞在内的多种细胞上表达。维生素 B3-GPR109a 信号传导诱导调节性 T 细胞分化并以 GPR109a 依赖性方式抑制结肠炎。维生素 B3 还抑制巨噬细胞和单核细胞产生促炎细胞因子 IL-1、IL-6 和肿瘤坏死因子 α (TNF-α)。
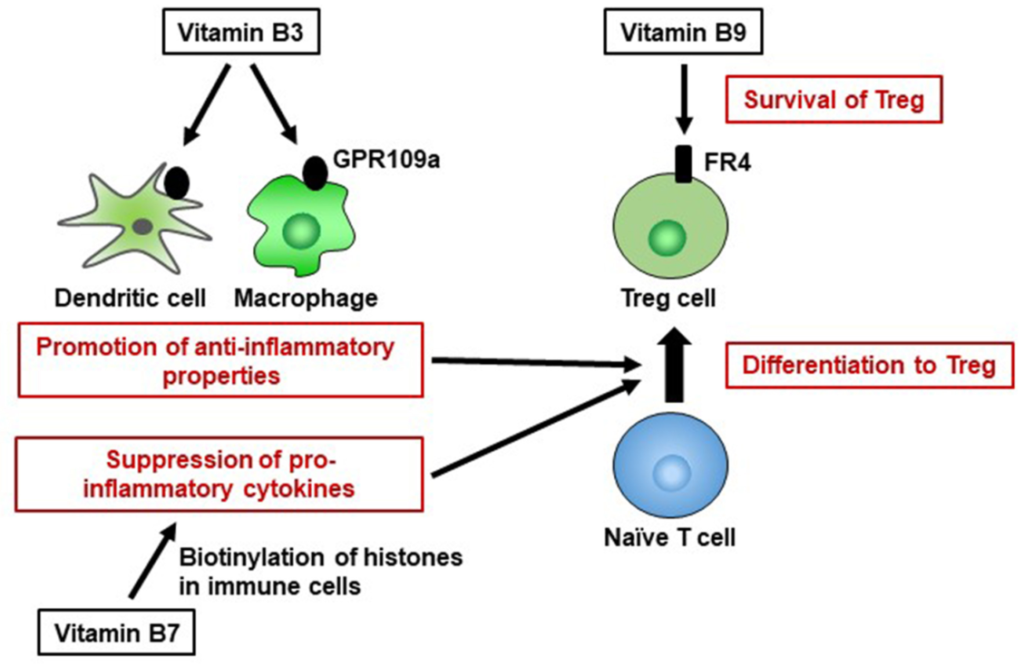
Yoshii K, et al., Front Nutr. 2019
因此,维生素B3通过调节宿主免疫细胞而具有抗炎特性,并在维持免疫稳态中发挥重要作用。
与其他B族维生素不同,维生素B3可由哺乳动物通过色氨酸的内源性酶途径生成,并储存在肝脏中,也可从饮食中获得。
膳食维生素B3
动物性食品如鱼和肉含有维生素B3作为烟酰胺,而植物性食品如豆类含有维生素B3作为烟酸。烟酰胺和烟酸都通过小肠直接吸收,烟酸在小肠转化为烟酰胺。
哪些菌会产生维生素B3呢?

维生素B3也是由肠道细菌从色氨酸合成的。可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、乳瘤胃球菌、艰难梭菌、婴儿双歧杆菌、幽门螺杆菌、可变梭杆菌。
因此,来自不同属的许多肠道细菌可以产生维生素B3,这表明饮食和共生细菌来源的维生素B3对宿主免疫都很重要。
缺乏会导致
在人类中,维生素B3缺乏会导致糙皮病,这是一种以肠道炎症、腹泻、皮炎和痴呆为特征的疾病。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B3 摄入量为 11-12 毫克。
含量较高的食物
全麦制品、糙米、绿豆、芝麻、花生、香菇、紫菜、无花果、乳制品、蛋、鸡肉、肝、瘦肉、鱼等。

维生素B5(泛酸)是辅酶a(CoA)的前体,辅酶a是TCA循环和脂肪酸氧化的必要辅助因子。
与维生素B1和B2一样,维生素B5通过免疫细胞的能量生成参与宿主免疫的控制。
缺乏导致
维生素B5缺乏会导致皮炎等免疫疾病,以及疲劳和失眠等非免疫相关疾病。
维生素B5缺乏如何引起炎症?
在一项针对成年人的随机、双盲、安慰剂对照研究中,膳食中补充维生素B5可改善面部痤疮,表明上皮屏障功能通过促进角质形成细胞增殖和分化为成纤维细胞而改善。
为了在缺乏维生素B5的时候保持维生素B5水平,辅酶A通过泛碱转化回维生素B5或半胱胺。然而,半胱胺抑制过氧化物酶体增殖物激活受体γ(PPARγ)信号,导致炎症。在泛碱产生酶基因敲除小鼠中,结肠炎已得到改善。因此,维生素B5缺乏通过上皮屏障功能障碍和促炎分子的产生引起炎症。
维生素B5通过激活免疫反应来促进宿主防御
在免疫反应方面,维生素B5通过促进先天免疫和适应性免疫,增强抗结核分枝杆菌感染的保护活性。在小鼠中,补充维生素B5可激活巨噬细胞的吞噬作用和细胞因子(包括IL-6和TNF-α)的产生,并随后促进Th1和Th17反应,以清除肺结核分枝杆菌。因此,维生素B5通过激活免疫反应来促进宿主防御,表明这种维生素作为一种天然佐剂具有重要作用。
膳食维生素B5
维生素B5在肝脏、鸡蛋、鸡肉和发酵大豆中以辅酶A或磷酸泛酰巯基乙胺pantetheinase的形式存在,浓度很高。辅酶A和磷酸泛乙烯通过小肠内的内源性酶(如磷酸酶和泛乙烯酶)转化为游离泛酸。游离泛酸通过小肠上皮上表达的钠依赖性复合维生素转运体(SMVT)被吸收,然后释放到血液中。最后,游离泛酸被转化回辅酶A并分布在全身,尤其是肝脏和肾脏。
细菌维生素B5
细菌维生素B5由2-二氢泛酸盐和β-丙氨酸通过从头合成途径合成。细菌维生素B5以游离泛酸的形式存在,其在大肠中直接吸收,转化为辅酶A,并以与膳食维生素B5相同的方式分布。
哪些菌会产生维生素B5呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、一些瘤胃球菌属(乳链球菌和扭链球菌)、肠道沙门氏菌、幽门螺杆菌具有维生素B5生物合成途径,表明肠道共生菌可以产生维生素B5。
细菌与宿主竞争维生素B5
相比之下,大多数梭杆菌和双歧杆菌属、艰难梭菌、粪杆菌属和乳酸杆菌属(厚壁菌属)的一些菌株缺乏这种途径,尽管其中一些菌株确实表达泛酸转运体以利用维生素B5产生能量,表明这些细菌与宿主竞争维生素B5。
摄入量
世卫组织/粮农组织建议成年人每天摄入5.0毫克维生素B5。
含量较高的食物
蔬菜中的卷心菜类,例如西兰花羽衣甘蓝,以及鳄梨、全麦谷物、土豆、乳制品、内脏等食物。

维生素B6以多种形式存在,包括吡哆醇、吡哆醛和吡哆胺。这些形式的维生素B6是辅酶磷酸吡哆醛(PLP)和磷酸吡哆胺(PMP)的前体,参与多种细胞代谢过程,包括氨基酸、脂质和碳水化合物代谢。
维生素B6在肠道免疫监测中起着重要作用
维生素B6调节炎症的机制目前尚不清楚。维生素B6通过脂质介质1-磷酸鞘氨醇(S1P)的代谢促进肠道免疫调节。
S1P调节淋巴细胞进入肠道,尤其是大肠。淋巴细胞转运依赖于S1P的产生及其降解产生的S1P梯度。S1P降解由S1P裂解酶介导,该裂解酶需要维生素B6作为辅助因子。服用维生素B6拮抗剂会损害S1P裂解酶活性,并产生不适当的S1P梯度,导致淋巴细胞从淋巴组织迁移受损,并减少肠道中淋巴细胞的数量。位于肠道上皮细胞之间的淋巴细胞被称为上皮内细胞(IEL),参与抵抗病原体的保护。
膳食维生素B6
膳食维生素B6以PLP或PMP的形式存在;它通过内源性酶(如吡哆醛磷酸酶)转化为游离维生素B6,然后被小肠吸收。虽然已经证明维生素B6通过酸性pH依赖和载体介导的转运被吸收,但尚未在任何哺乳动物物种中鉴定出肠吡哆醇转运体。在吸收游离维生素B6后,它进入血液,并转化回PLP或PMP。
细菌维生素B6
细菌维生素B6是由脱氧基果糖5-磷酸和4-磷酸羟基-L-苏氨酸或甘油醛-3-磷酸和d-核酮糖5-磷酸合成的PLP。在大肠中,细菌衍生的PLP转化为游离维生素B6,通过被动运输被吸收,运输到血液中,并分布在全身。
哪些菌会产生维生素B6呢?

可能参与B6合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属、长双歧杆菌、产气柯林斯菌、幽门螺杆菌。
拟杆菌和变形杆菌可能从5-磷酸脱氧纤维素和4-磷酸羟基-l-苏氨酸开始产生维生素B6,而放线菌可能从甘油醛-3-磷酸和d-核酮糖5-磷酸开始产生。
相比之下,大多数厚壁菌属(韦荣球菌、瘤胃球菌、粪杆菌和乳杆菌属)都缺乏维生素B6生物合成途径,除了一些梭菌(C. bartlettii、C. leptum、C.methylpentosum和C. sporogenes)和乳杆菌(短乳杆菌和瘤胃乳酸杆菌)外。
摄入量
世卫组织/粮农组织建议成年人每天摄入1.3-1.7毫克维生素B6。青少年和怀孕或哺乳的女性每天需要更多的维生素 B6,大约 2 毫克。
缺乏导致
维生素B6缺乏与过敏和类风湿性关节炎等炎症性疾病的发展以及神经元功能障碍有关。维生素B6缺乏会破坏Th1-Th2平衡,导致过度的Th2反应,导致过敏。此外,在类风湿性关节炎患者中观察到血浆维生素B6水平较低,以及促炎细胞因子(如TNF-α和IL-6)水平升高。
其他还包括导致肌肉无力、抑郁、易怒、短期记忆丧失、紧张和注意力不集中等问题。
含量高的食物
鱼类、鸡肉、豆腐、红薯、鳄梨、扁豆、牛奶、三文鱼、虾、菠菜、葵花籽、金枪鱼、糙米等。

维生素B7(生物素)是葡萄糖、氨基酸和脂肪酸代谢所必需的几种羧化酶的辅助因子。例如,维生素B7是参与脂肪酸生物合成的乙酰辅酶A羧化酶和脂肪酸合成酶的必要辅助因子。因此,维生素B7可能会影响免疫代谢。
维生素B7的抗炎作用
维生素B7通过结合(生物素化)组蛋白抑制基因表达;这些基因包括编码NF-κB的基因,NF-κB是产生几种促炎细胞因子(例如,肿瘤坏死因子α、IL-1、IL-6、IL-8)的主要信号分子。NF-κB的核转录在维生素B7缺乏时被激活,表明组蛋白的生物素化抑制NF-κB信号中编码促炎细胞因子的基因的表达。
因此,维生素B7通过抑制NF-κB活化而具有抗炎作用,膳食维生素B7缺乏通过促进促炎细胞因子的分泌而引起炎症反应。
膳食维生素B7
膳食生物素以游离蛋白质结合形式或生物素形式存在。在小肠中,生物素酶从结合蛋白中释放游离生物素,游离生物素通过生物素转运体SMVT被吸收。
细菌维生素B7
维生素B7也是由肠道细菌产生的游离生物素,由丙二酰辅酶A或吡美乐酸通过吡美乐酰辅酶A合成。细菌游离生物素被结肠中表达的SMVT吸收。
哪些菌会产生维生素B7呢?

可能参与B7合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属可变梭杆菌、大肠弯曲杆菌(campylobacteric coli)。
维生素B7的产生似乎在不同的肠道细菌之间以合作的方式进行;肠道中的长双歧杆菌产生吡美拉酸,它是维生素B7的前体,可增强其他肠道细菌产生维生素B7。
细菌与宿主竞争维生素B7
相比之下,普雷沃氏菌属、双歧杆菌属、梭菌属、瘤胃球菌属、粪杆菌属和乳酸杆菌属缺乏这种途径;然而,它们确实表达游离生物素转运体,这表明这些细菌也利用饮食和细菌维生素B7,因此可能与宿主竞争。
因此,游离生物素可能会影响肠道微生物群的组成,因为生物素是微生物群生长和存活所必需的。
缺乏导致
生物素缺乏会导致肠道失调和鼠乳杆菌过度生长,从而导致脱发。
什么情况会缺乏?
生蛋清中含有大量的抗生物素,它与维生素B7紧密结合,阻止维生素B7在肠道中被吸收。因此,维生素B7缺乏症不仅可能由维生素B7摄入不足引起,还可能由过量摄入生蛋清引起。
摄入量
世卫组织/粮农组织建议成年人每天摄入30微克。
含量较高的食物
维生素B7在坚果、豆类和油籽等食物中含量丰富。

维生素B9(叶酸)以四氢叶酸的形式存在,是包括DNA和氨基酸合成在内的多种代谢反应的辅助因子。
缺乏导致
由于红细胞对维生素B9的高需求,维生素B9缺乏会导致巨幼细胞性贫血。维生素B9缺乏症还通过将细胞周期阻滞在S期并增加DNA损伤的频率,在体外抑制人类CD8+T细胞的增殖。
维生素B9有助于维持免疫稳态
调节性T细胞(Treg)表达高水平的维生素B9受体(叶酸受体4[FR4])。服用抗FR4抗体会导致Treg细胞群的特异性减少,这表明维持Treg细胞需要维生素B9–FR4轴。
在维生素B9减少的条件下体外培养Treg细胞会导致细胞存活受损,抗凋亡Bcl2分子的表达减少,尽管幼稚T细胞仍保留分化为Treg细胞的能力;这表明维生素B9是Treg细胞的生存因子。
与这些发现一致,膳食维生素B9缺乏导致小肠中Treg细胞数量减少。由于Treg细胞在预防过度免疫反应中起着重要作用,喂食缺乏维生素B9饮食的小鼠对肠道炎症的易感性增加。
膳食维生素B9
维生素B9以单谷氨酸和多谷氨酸叶酸的形式存在于饮食中。叶酸-聚谷氨酸酯与谷氨酸单酯脱结合,然后通过叶酸转运体(如质子耦合叶酸转运体(PCFT))在小肠吸收。在肠上皮中,叶酸单谷氨酸盐在被输送到血液之前转化为四氢叶酸(THF),四氢叶酸是一种活性形式和辅助因子。
细菌维生素B9
肠道细菌从GTP、4-磷酸红糖和磷酸烯醇式丙酮酸合成维生素B9作为THF。细菌性THF通过PCFT在结肠中直接吸收,并通过血液分布到全身。
哪些菌会产生维生素B9呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、艰难梭菌、植物乳杆菌、罗氏乳杆菌、德氏乳杆菌、保加利亚和嗜热链球菌、双歧杆菌属中的一些物种、可变梭杆菌、肠道沙门氏菌具有维生素B9生物合成途径。这表明几乎所有门中的所有物种都会产生叶酸。
膳食中添加双歧杆菌益生菌菌株(青春期双歧杆菌和假链双歧杆菌)可提高叶酸缺乏大鼠和无叶酸培养基大肠中叶酸的生成。此外,植物乳杆菌、德氏乳杆菌、保加利亚乳杆菌和罗氏乳杆菌可提高缺乏叶酸合成所需成分的细菌培养上清液中叶酸的生成。
维生素B9代谢物防止过敏和炎症
在共生细菌中,维生素B9代谢产物6-甲酰蝶呤(6-FP)是通过光降解产生的。与维生素B2代谢物6-羟甲基-8-d-三嗪一样,6-FP与MR1结合,但与B2代谢物不同,它不能激活MAIT细胞。6-FP的类似物乙酰-6-FP是MR1的拮抗剂,可抑制MAIT细胞活化。
如关于维生素B2的章节所述,6-羟甲基-8-d-三硝基脲嗪可激活MAIT细胞,从而抵御病原体,因此维生素B9代谢物可抑制过度的MAIT细胞反应,并防止过度过敏和炎症反应。
膳食维生素B2和B9与微生物群的组成及其代谢这些维生素的能力之间的定量平衡,可能是理解肠内MAIT细胞介导的稳态的关键。
摄入量
世卫组织/粮农组织建议成年人每天摄入400微克维生素B9。美国国立卫生研究院建议母乳喂养的母亲每天需要 500 微克,青少年和怀孕女性每天应该摄入 600 微克。
较高含量的食物
牛肉肝、深绿叶蔬菜、芦笋、抱子甘蓝、橙子、坚果、豆类等食物含有高水平的维生素B9。

维生素B12(钴胺素)是一种含钴的维生素,以甲钴胺素和腺苷钴胺素的活性形式催化甲硫氨酸的合成。
维生素B12促进免疫反应
在宿主免疫方面,膳食维生素B12缺乏会减少小鼠体内CD8+T细胞的数量,并抑制自然杀伤T细胞的活性;补充甲钴胺可以改善这些状况,这表明维生素B12通过CD8+T细胞和自然杀伤T细胞促进免疫反应。
膳食维生素B12
膳食维生素B12与膳食蛋白质复合存在,胃蛋白酶将其分解为游离维生素B12。游离维生素B12通过胃糖蛋白内源性因子(IF)被小肠上皮细胞吸收。在上皮细胞内,如果维生素B12复合物被溶酶体分解为游离维生素B12,然后释放到血液中,在血液中转化为活性形式并分布在全身。
细菌维生素B12
细菌维生素B12由前甲胎蛋白-2合成,产生腺苷钴胺素,直接被大肠吸收并分布在全身;这种吸收的机制目前尚不清楚。
哪些菌会产生维生素B12呢?

可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、艰难梭菌、粪杆菌和乳瘤胃球菌、动物双歧杆菌、婴儿双歧杆菌和长双歧杆菌、可变梭杆菌。
从发酵食品中分离出的植物乳杆菌和棒状乳杆菌产生维生素B12,而动物双歧杆菌在牛奶发酵过程中合成维生素B12。
摄入量
世卫组织/粮农组织建议成年人每天摄入2.4μg维生素B12。青少年和怀孕或哺乳的女性需要更多:每天 2.6 至 2.8 μg。
缺乏导致
与维生素B6和B9一起,维生素B12在红细胞形成和核酸合成中起着重要作用,尤其是在神经元中。因此,维生素B12缺乏会导致巨幼细胞性贫血和神经系统症状,如手脚麻木,刺痛。
其他还会导致包括贫血、失智、沮丧、难以保持平衡、疲劳、虚弱、体重减轻、肠道问题、肌肉无力、口腔或舌头酸痛等症状,缺乏也会损害神经系统,并可能导致记忆力差、情绪障碍、抑郁、精神错乱和痴呆。
什么情况会缺乏?
除了饮食摄入量不足的原因之外,维生素 B-12 缺乏还可能是由于恶性贫血(一种影响壁细胞和内因子释放的自身免疫性疾病,维生素 B-12 吸收所必需的)导致的生物利用度低或吸收受损;随着年龄的增长,药物(例如质子泵抑制剂)的使用,胃肠道疾病(例如炎症性肠病)或胃肠道感染(例如幽门螺杆菌、肠道蠕虫)的发生,萎缩性胃炎、吸收不良和恶性贫血的风险增加。
含量较高的食物
牛肝、双壳类、鱼类、鸡肉和鸡蛋含有高水平的维生素B12。

微生物群失调和维生素缺乏是相互关联的,这种关系可能直接影响宿主健康。
对哺乳期女性进行的一项关联研究发现,增加维生素 B2、B5、B6 和 B12 的摄入量与120个粪便样本中普氏菌的相对丰度增加和拟杆菌的相对丰度降低有关。
炎症性肠病(IBD)患者会出现血浆维生素B2浓度较低。肠道慢性炎症包括促炎细胞因子浓度升高,已被证明会导致上皮吸收功能的改变。肠上皮细胞暴露于促炎细胞因子肿瘤坏死因子-α中会显著抑制维生素B2的摄取,这可能解释了IBD患者中维生素B2浓度显著较低的原因。
维生素B2和B3浓度可能是疾病状态的标志物。
克罗恩病恶化与参与抗炎的维生素B2、B1、B9生物合成相关的微生物基因减少有关。
此外,患有 2 型糖尿病的受试者在与微生物介导的维生素代谢相关的基因丰度方面表现出显着变化。
营养不良儿童的微生物组显示参与B 族维生素代谢的多种途径显着减少,包括烟酸/NADP 生物合成。
所有这些观察结果表明,微量营养素的缺乏会改变肠道微生物群。
因此,在某些条件下,针对肠道微生物群的维生素补充剂(直接和间接)可能对健康有益。
越来越多的证据表明,当大量服用以逃避完全吸收或以结肠靶向递送系统 (CTDS) 的形式服用时,维生素可以直接调节肠道微生物组。此外,维生素似乎通过体循环的间接机制影响肠道微生物群,与人类健康直接相关。
结肠靶向维生素补充剂可能通过三种相互关联的途径影响宿主健康
1) 对肠道免疫系统的直接影响(上左图)
2) 对肠道上皮屏障的直接影响(上右图)
3) 通过微生物代谢产物对肠道微生物群以及随后对肠道免疫和上皮屏障的影响(中)
在一个小型成人志愿者组中进行了一项试点研究,该组补充了过量的维生素B2(100 毫克),为期 14 天。他们发现,在补充过程中,每克粪便中的Faecalibacterium prausnitziip数量增加。作者还注意到厌氧罗氏菌属的增加和大肠杆菌减少。
关于维生素的结肠靶向性,最近的一项研究表明,通过缓释微囊结肠靶向补充烟碱酸有益于影响微生物组成和胰岛素敏感性。有趣的是,作者还观察到肥胖受试者群体中α多样性和拟杆菌丰度降低,并指出这种变化与膳食烟酸摄入量降低有关。
针对克罗恩病的研究发现发现,补充维生素 B2 可减少全身氧化应激、一些抗炎作用,降低 C 反应蛋白、红细胞沉降率、血小板和 IL-2,并减轻临床症状。粪便微生物群的荧光原位杂交分析显示 克罗恩病患者中粪便肠杆菌科细菌减少、粪便钙卫蛋白水平降低。
维生素可以调节微生物组、改变氧化还原电位,并且就维生素 B3而言,对全身胰岛素敏感性和代谢性炎症的生物标志物产生积极影响。虽然需要进行额外的临床研究以充分了解结肠靶向递送维生素的优势和潜在副作用,但在菌群失调的情况下,这种方法可能成为预防和治疗微生物组相关疾病的新的菌群调节途径。
该领域的研究很复杂,因为不仅肠道菌群的组成因人而异,饮食也会改变肠道菌群的组成和功能,维生素介导的免疫维持也因人而异。
补充结肠靶向维生素可能与基于个人健康状况和微生物组组成的个性化营养建议相关。
目前,对肠道微生物群的研究及其与多种 B族维生素的相互作用机制的理解正逐步深入,精准健康和营养新时代正在开启。
主要参考文献
Beane, K.E., Redding, M.C., Wang, X. et al. Effects of dietary fibers, micronutrients, and phytonutrients on gut microbiome: a review. Appl Biol Chem 64, 36 (2021). doi.org/10.1186/s13765-021-00605-6
Uebanso T, Shimohata T, Mawatari K, Takahashi A. Functional Roles of B-Vitamins in the Gut and Gut Microbiome. Mol Nutr Food Res. 2020 Sep;64(18):e2000426. doi: 10.1002/mnfr.202000426. Epub 2020 Aug 19. PMID: 32761878.
Yoshii K, Hosomi K, Sawane K, Kunisawa J. Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity. Front Nutr. 2019 Apr 17;6:48. doi: 10.3389/fnut.2019.00048. PMID: 31058161; PMCID: PMC6478888.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Heather M Guetterman, Samantha L Huey, Rob Knight, Allison M Fox, Saurabh Mehta, Julia L Finkelstein, Vitamin B-12 and the Gastrointestinal Microbiome: A Systematic Review, Advances in Nutrition, 2021;nmab123, doi.org/10.1093/advances/nmab123
Putnam EE, Goodman AL. B vitamin acquisition by gut commensal bacteria. PLoS Pathog. 2020 Jan 23;16(1):e1008208. doi: 10.1371/journal.ppat.1008208. PMID: 31971969; PMCID: PMC6977713.