 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

粪球菌属(Coprococcus)
是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,菌种大部分从粪便中分离出来,积极发酵碳水化合物,是和Faecalibacterium prausnitzii 一样,丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。此外,该菌还与抑郁症,幼儿语言发育、便秘、睡眠以及慢性疲劳等相关。
细胞球状,直径0.8~1.5μm,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度37℃,多数物种分离于人的肠道和粪便,很少从人类临床标本中分离出来表明该菌主要定植于健康人的肠道。
需要注意的是,该菌需要与非常耐药且容易引起感染的肠球菌属(Enterococcus )区分开来,他们翻译的中文名虽然只差一个字,但是肠球菌能引发感染,以耐药性出名。
而粪球菌(Coprococcus)是厌氧球菌属,虽然它们都是人类粪便菌群的一部分。但是粪球菌积极发酵碳水化合物,产生丁酸和乙酸以及甲酸或丙酸和/或乳酸等。
在人类粪便中发现的最多产丁酸盐的细菌是属于梭菌簇 IV 和 XIVa 的对氧高度敏感的厌氧菌。其中包括许多以前未描述的与真杆菌属、罗斯氏菌属、普拉梭菌以及本文的粪球菌属。
该菌属主要至少包括以下物种:
Coprococcus catus (species)
Coprococcus comes (species)
Coprococcus eutactus (species)
Coprococcus sp. DJF_CR49 (species)
Coprococcus sp. L2-50
此属的模式种为(Coprococcus eutactus)
不同碳水化合物上的 Coprococcus 物种的生长不太一样,其中:
Coprococcus eutactus的丰度与肠道中更大的细菌基因丰富度有关,β-葡聚糖是与Coprococcus eutactus相关的人类肠道细菌的主要生长底物,其代谢产生丁酸盐和甲酸盐或乳酸。
此外,这两种菌可以利用广泛的碳水化合物底物:
Coprococcus. eutactus
Coprococcus sp. L2-50
但是,Coprococcus comes仅在葡萄糖上表现出良好的生长,而Coprococcus catus 仅在葡萄糖上表现出非常有限的生长,Coprococcus catus代谢产生丁酸盐和丙酸盐。
细菌互相作用或共同在一个生态位生存对整个菌群结构和宿主健康有很重要的影响,例如共现关系(例如,赋予抗生素耐药性)、共生关系(例如,交叉喂养其他成员产生的化合物)和协同作用。
研究报告Coprococcus和Roseburia之间的共现关系的支持,两者都属于Lachnospiraceae家族,表明系统发育密切相关的属也可能具有共现关系,而不是由于它们相似的栖息地偏好而总是相互竞争。然而,由于对人类肠道微生物群落的机理了解不足,因此应谨慎解释肠道细菌之间的生态联系。
此外还发现该菌属在生物化学上与瘤胃球菌密切相关。
值得注意的是,一项来自广东肠道微生物组计划的大规模队列数据,分析得出脱硫弧菌(DSV) 经常在人体肠道中发现,DSV的相对丰度与包括Oscillospira Coprococcus , Ruminococcus , Akkermansia,Roseburia , Faecalibacterium 和 Bacteroides呈正比。
人类肠道微生物群的物种组成对于弯曲杆菌感染的定植抗性很重要。相比于感染弯曲杆菌的人群,健康人群中Coprococcus丰度更好,表明高水平的Coprococcus有利于抵抗弯曲杆菌。
2019年比利时通过一项1070抑郁症病人的验证集小组发现,即使在控制了抗抑郁药的作用后,抑郁症患者的粪球菌属(Coprococcus)和小杆菌属(Dialister)细菌都已耗尽。
还发现Coprococcus具有与多巴胺相关的生物途径,多巴胺是一种会影响心理健康的神经递质。该研究的粪便宏基因组的肠脑模块分析确定,多巴胺代谢物 3,4-二羟基苯乙酸的微生物合成潜力与心理生活质量呈正相关,并表明微生物产生的γ-氨基丁酸在抑郁症中的潜在作用。
研究将重度抑郁症 (MDD) 患者的粪便微生物群移植 (FMT) 移植到大鼠体内,发现:相比较与移植健康粪便的大鼠, FMT-MDD大鼠瘤胃球菌科和毛螺菌属升高,而粪球菌属则被耗尽,从机理上表明粪球菌的缺乏会与抑郁症的关系。
另外一项对82 名抑郁的人随机分配接受多菌株益生菌加生物素治疗或生物素加安慰剂治疗 28 天。发现28天后,与接受安慰剂治疗的个体相比,精神症状的改善明显更高;同时粪便16s测试表明相比于安慰剂组,益生菌组的多样性高,Coprococcus 显著增加。
该研究的益生菌干预组为:包括九种菌株,双歧杆菌W23、乳酸双歧杆菌W51、乳酸双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24 和乳酸乳球菌W19。此外,益生菌产品中还添加了 125 毫克 D-生物素(维生素 B7)、30 毫克马尾草、30 毫克鱼胶原蛋白和 30 毫克角蛋白加基质。
帕金森病是一种神经退行性疾病,其特征是错误折叠的 α-突触核蛋白的细胞内聚集体沿脑轴聚集。一些研究报告了肠道菌群失调与帕金森病之间的关联,尽管因果关系仍有待确定。帕金森病组中最显著的变化突出了细菌类群的减少,特别是在毛螺菌科家庭和关键成员,例如丁酸弧菌属、粪球菌属(Coprococcus)和Blautia。
另外的研究发现帕金森病患者的结肠中有 α-突触核蛋白 (α-Syn) 聚集,并有结肠炎症的证据。PD患者的黏膜和粪便微生物群与对照组相比有显著差异,粪便样本比乙状结肠黏膜有更显著的差异。在属的分类水平上,来自 Blautia、Coprococcus和 Roseburia 属在对照组的粪便中明显多于 PD 患者。
此外,还有研究指出其他神经退行性疾病 (NDs)包括阿尔茨海默病 (AD)、多系统萎缩 (MSA)、多发性硬化症 (MS)、视神经脊髓炎(NMO) 和肌萎缩侧索硬化症 (ALS)中Faecalibacterium 、Coprococcus、Blautia 、 Prevotella减少。
一项针对136名3岁乌干达儿童粪便样本研究表明,产丁酸盐的肠道细菌Coprococcus eutactus可以作为乌干达农村三岁儿童语言发展的预测因子。
该研究模型指出3岁时语言发展高于平均水平的儿童,在其2岁时粪便中有相对较高水平的Coprococcus eutactus,语言发育低的儿童中Coprococcus 属平均丰度低,而且该研究表明早期获得产丁酸盐Coprococcus eutactus对语言发展的重要性,而在在语言发育受损的儿童中,耐氧物种的优势增加。
湿疹的严重程度一般与微生物群多样性和产生丁酸盐的细菌的丰度呈负相关,尤其产生丁酸盐的Coprococcus eutactus相关细菌的降低。我们数据库数据和案例也显示过敏和哮喘的儿童Coprococcus丰度很低或显著低于健康儿童。
自闭症谱系障碍 (ASD) 是世界范围内普遍存在的神经生物学疾病,原因复杂。多项研究表明自闭症儿童Coprococcus、Prevotella、Blautia 、Lachnospiraceae和Ruminococcaceae属的丰度较低。
睡眠在儿童的身心发展中发挥着重要作用。一项针对学龄前儿童(4.37 ±0.48 岁,n=143)的睡眠与肠道微生物群之间的关系研究表明拟杆菌中双歧杆菌的相对丰度较高,在睡眠效率较高和入睡后醒来时间较低(LDA 评分 >2)的儿童中较高。相比之下,包括 Blautia 和 Coprococcus 在内的一些毛螺菌科成员分别与较短的夜间睡眠时间和较低的效率相关。
慢性便秘是全球最常见的胃肠道疾病之一。然而,其发病机制在很大程度上仍不清楚。在便秘患者的肠道微生物组中,产生丁酸盐的 Roseburia、Coprococcus和 Faecalibacterium 属的丰度很低。不存在便秘状态的特定微生物生物标志物,整个肠道微生物群在都可能发挥作用。
此外,功能性便秘(FC)个体的肠道微生物群被证明缺乏属于拟杆菌属、罗斯氏菌属和 Coprococcus 的成员。与对照相比,FC 相对应的微生物组显示出高丰度的参与制氢、产甲烷和甘油降解的基因。
新出现的证据表明,肠道菌群失调与慢性肾脏病 (CKD) 的发病机制有关,其潜在机制涉及粘膜和/或系统免疫或代谢紊乱。
一项纳入1436 名慢性肾病的meta分析显示终末期肾病 (ESRD)患者中普氏菌属、粪球菌属、巨单胞菌属和粪杆菌属的丰度较低。
虚弱是一种常见的老年综合征,与不良健康后果的风险相关。从 176 名韩国老年人的粪便样本中获得的 16S rRNA 基因测序数据研究了虚弱测量与肠道微生物组的关联。发现在较虚弱的个体中,普氏菌和 Coprococcus eutactus的丰度减少。
先兆子痫是一种以高血压和多个器官功能障碍为特征的妊娠特异性疾病,与母体和胎儿并发症有关。
对 213 名孕妇的粪便样本进行 16S rRNA 基因扩增子测序,调查了妊娠 28 周时发生迟发性(>34 孕周)先兆子痫 (DPE) 的女性的肠道微生物群组成发现产丁酸的丰富粪球菌属在 DPE 中显著减少。产生丁酸盐的细菌特别是Coprococcus spp. 丰度的减少可能会增加孕妇患先兆子痫的风险。
此外,研究发现喹那普利在降低肠道菌群负荷较低的高血压大鼠的血压方面更有效。当他们分析肠道微生物群的组成时,Coprococcus 属成为一个重要的参与者。
早期乳腺癌 (BC) 患者和健康对照者的粪便微生物群分析对比表明早期 BC 的患者中微生物多样性的减少、Odoribacter、Butyricimonas和Coprococcus 的相对丰度降低的趋势。
慢性广泛性肌肉骨骼疼痛 (CWP) 是纤维肌痛的特征性症状,已被证明与肠道微生物组的改变有关。在 CWP 病例中,Coprococcus的物种显著减少 。
维生素 D 会增加瘤胃球菌科、阿克曼氏菌、粪杆菌和粪球菌的增加。
在整个人群中,Coprococcus 的变化与体重、总胆固醇和甘油三酯的变化呈正相关,与 HDL 胆固醇呈负相关。
银屑病是一种常见的慢性复发性皮炎。瘤胃球菌科、 Coprococcus_1属和Blautia属的丰度随着银屑病的改善而降低( p< 0.05),这已被证明在银屑病中显著增加。
但是也有研究指出观察到 Coprococcus属减少。这些研究队列都只有几十例,需要更大队列验证。
小檗碱和二甲双胍都是源自草药的成熟药剂,对包括糖尿病在内的多种疾病具有偶然的有益作用。使用二甲双胍或小檗碱干预 db/db 小鼠的肠道微生物群,增加产短链脂肪酸的细菌(例如,丁酸单胞菌属、粪球菌属、瘤胃球菌属)的数量。
补充维生素 D 对 26 种维生素 D 缺乏(25-羟基维生素 D (25(OH)D) ≤50 nmol/L)、超重或肥胖(BMI ≥25 kg/m 2) 其他健康的成年人。
一项研究是 2014 年至 2016 年间进行的基于社区的双盲随机临床试验的辅助研究。参与者在基线和 100,000 国际单位 (IU) 负荷剂量的胆钙化醇之后提供粪便样本,然后每天 4000 IU 或匹配安慰剂 16周。与25(OH)D <50 nmol/L的个体相比,25(OH)D >75 nmol/L 的个体的粪球菌属丰度增高。
关节和肠道炎症之间的密切关系早已为人所知。20 名受肠病性关节炎影响的患者,他们从未接受过生物药物治疗,在基线时和治疗 6 个月后接受了 TNFi 治疗。所有患者都遵循地中海饮食。治疗后6个月毛螺菌科和粪球菌属显著增加。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
紫薯中提取的抗性淀粉 (RS) 有利于增加Coprococcus的丰度。
胞外多糖 (EPS) 是合成并存在于双歧杆菌表面的碳水化合物聚合物。由于其在食品、生物技术、化妆品和医药等多个领域的潜在应用,双歧杆菌 EPS 促进了 Coprococcus 属的生长。与淀粉组相比,EPS 还增加了丙酸的产生。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
主要参考文献:
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S, Raes J. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol. 2019 Apr;4(4):623-632. doi: 10.1038/s41564-018-0337-x. Epub 2019 Feb 4. PMID: 30718848.
Vascellari S, Palmas V, Melis M, Pisanu S, Cusano R, Uva P, Perra D, Madau V, Sarchioto M, Oppo V, Simola N, Morelli M, Santoru ML, Atzori L, Melis M, Cossu G, Manzin A. Gut Microbiota and Metabolome Alterations Associated with Parkinson’s Disease. mSystems. 2020 Sep 15;5(5):e00561-20. doi: 10.1128/mSystems.00561-20. PMID: 32934117; PMCID: PMC7498685.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson’s disease. Mov Disord. 2015 Sep;30(10):1351-60. doi: 10.1002/mds.26307. Epub 2015 Jul 16. PMID: 26179554.
Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, Marmon S, Neimann A, Brusca S, Patel T, Manasson J, Pamer EG, Littman DR, Abramson SB. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015 Jan;67(1):128-39. doi: 10.1002/art.38892. PMID: 25319745; PMCID: PMC4280348.
Sun C, Chen L, Yang H, Sun H, Xie Z, Zhao B, Jiang X, Qin B, Shen Z. Involvement of Gut Microbiota in the Development of Psoriasis Vulgaris. Front Nutr. 2021 Nov 22;8:761978. doi: 10.3389/fnut.2021.761978. PMID: 34881280; PMCID: PMC8646027.
Andreo-Martínez P, García-Martínez N, Sánchez-Samper EP, Martínez-González AE. An approach to gut microbiota profile in children with autism spectrum disorder. Environ Microbiol Rep. 2020 Apr;12(2):115-135. doi: 10.1111/1758-2229.12810. Epub 2019 Nov 27. PMID: 31713352.
Mancabelli L, Milani C, Lugli GA, Turroni F, Mangifesta M, Viappiani A, Ticinesi A, Nouvenne A, Meschi T, van Sinderen D, Ventura M. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses. Sci Rep. 2017 Aug 29;7(1):9879. doi: 10.1038/s41598-017-10663-w. PMID: 28852182; PMCID: PMC5575163.
Yarullina DR, Shafigullin MU, Sakulin KA, Arzamastseva AA, Shaidullov IF, Markelova MI, Grigoryeva TV, Karpukhin OY, Sitdikova GF. Characterization of gut contractility and microbiota in patients with severe chronic constipation. PLoS One. 2020 Jul 17;15(7):e0235985. doi: 10.1371/journal.pone.0235985. PMID: 32678865; PMCID: PMC7367488.
Lim MY, Hong S, Kim JH, Nam YD. Association Between Gut Microbiome and Frailty in the Older Adult Population in Korea. J Gerontol A Biol Sci Med Sci. 2021 Jul 13;76(8):1362-1368. doi: 10.1093/gerona/glaa319. PMID: 33437992.

谷禾健康


最近关于“益生菌”的风很大,我们越来越容易从各种渠道听到关于补充益生菌的科普,但依然一知半解。
我们每个人都需要补充益生菌吗?
不同益生菌有什么不同,如何选择?
为什么有的人补充有效,有的人无效?
益生菌真的能定植吗?与什么因素有关?
…..

本文我们来逐一解答这些问题。
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。补充益生菌是改善菌群的一种方式。
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
目前已有研究的,与菌群相关的疾病包括:
消化系统(腹泻、腹胀、便秘等);
神经系统(自闭症、精神障碍等);
免疫系统(哮喘等);
代谢系统(肥胖、糖尿病等);
心血管疾病(高血压、中风等);
癌症(胰腺癌、结肠癌等);
…
本号里有各类与菌群相关疾病的研究进展。
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。
假如在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
如果症状与菌群有关,或者正经历慢性压力、营养不良、药物、环境变动、衰老、疾病、旅行、肠道菌群紊乱等情况,可以通过补充益生菌的方式来改善菌群从而缓解症状。
然而,不同益生菌有不同的功效,并不是可以随意补充,究竟该如何选择?
下一章节我们来详细了解。
目前市面上的益生菌种类五花八门,要从这么多益生菌中选择适合自己的能发挥作用的,并不是一件容易的事儿,我们可以尝试从以下几个方面来了解益生菌。
最可靠的益生菌是那些经过双盲测试的益生菌。如果不进行双盲试验,益生菌测试可能会有偏差这些信息应该清楚地印在包装上。要检查包装确认益生菌厂家是否告知检测结果。
使用标准化流程的可追溯性确保了消费者安全和产品注册,尽可能选择严格规范的公司生产的益生菌。
对于无活菌标识、无菌株号、无任何文献数据支持的类型,则需谨慎。
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:
嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


-357x1024.png)
-1024x426.png)
-1024x615.png)
<来源:谷禾健康数据库>
研究表明最好空腹服用,通常是在早上。服用益生菌的是为了让它到达大肠,因为这是菌群存活率最高的地方。当有食物时,胃酸分泌较多,益生菌可能会被胃酸杀死,因此最好空腹服用。
一天中,最佳时间是早上空腹时,其余的话饭前或睡前也可以,饭后服用效果较差。
绝大多数人开始服用益生菌是安全的。在开始服用前几天,可能会出现胃部不适、胀气、腹泻或腹胀等症状。这些症状通常会在身体习惯后消失。
服用益生菌可能出现的副作用


如果是小肠细菌过度生长等疾病患者,则需要注意,可能会出现腹胀、便秘等消化疾病问题。
此外,它也可能会跟某些药物相互作用,如果长期服用药物,或有严重感染和近期做过手术的人群,使用益生菌前请遵医嘱。
如有牛奶过敏或乳糖不耐症、怀孕或哺乳等情况,请咨询医生是否适合服用。
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。微胶囊化可以提高其在不利环境条件下的存活率,确保一定数量的益生菌进入人体并且在肠道中释放,提高益生菌的使用价值。
益生菌的种类不同,存储方式可能也有所不一,
益生菌产品的储藏方式一般可以分为常温,冷藏和冷冻三种,市场上的很多益生菌产品都需要冷藏。请检查包装去了解如何储存。对于干性益生菌补充剂,一般来说需要在干燥、黑暗的地方存储(潮湿条件会导致代谢发酵或降解)。
关于这部分详见《益生菌的靶向递送:研究和商业化前景》
跟其他食品一样,益生菌也要看生产日期或到期日期。随着时间的推移,CFU 的数量可能会下降。因此最好检查包装上的日期。
如果已经使用某种益生菌补充剂几周甚至几个月了,但没有发现消化系统健康状况有所改善,那么是时候尝试换一种新的益生菌了。
与药物不同,更换益生菌补充剂不会产生重大副作用。
此外,可以利用好肠道菌群检测这个工具。可以从两个方面入手:
益生菌抑制其他菌群生长
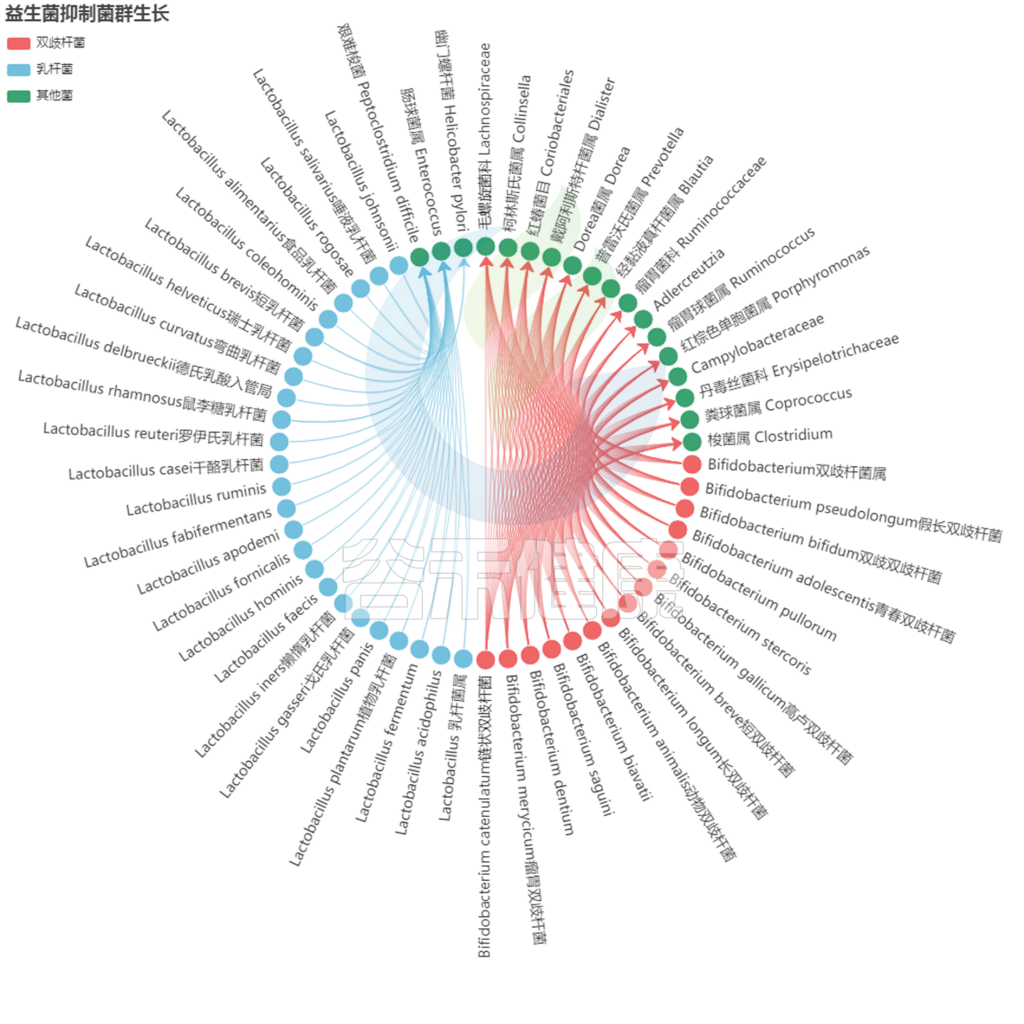

<来源:谷禾健康数据库>
注:以上红色代表双歧杆菌,蓝色代表乳杆菌,绿色则为其他菌群,箭头指向代表抑制的菌群。
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。那能不能在抗生素使用的时候,补充一些益生菌使其恢复平衡?
目前针对益生菌和抗生素同时服用的研究,支持和不支持的都有。
√ 支持益生菌和抗生素同时服用的研究:效果显著
对给予益生菌的23项研究(3938名参与者)进行调查,22个试验报告了抗生素相关腹泻的发生率,结果显示,与活性、安慰剂或无治疗对照组相比,益生菌组显著受益(益生菌组8%,对照组19%)。
研究副作用的16项试验(n = 2455)中,没有一项记录了可归因于益生菌的任何严重副反应。作者认为益生菌对预防抗生素相关性腹泻具有保护作用。相对危险度为0.46 (95% CI为0.35 ~ 0.61),NNT为10。
作者认为鼠李糖乳杆菌或布氏酵母菌Saccharomyces boulardii 形成单位为每天50 – 400亿个是最合适的选择。
建议在进行进一步研究之前,应避免在有不良事件风险的儿童人群中使用益生菌。
× 反对益生菌和抗生素同时服用的研究:菌群恢复难
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。这是在益生菌有效地在肠道定植的情况下。问题是新的细菌和酵母菌株的存在使肠道微生物群在整个6个月的研究期间无法恢复正常。
而那些没有服用益生菌的人的肠道菌群在停用抗生素三周后恢复正常。作者得出的结论是,这项研究只是检测了一种益生菌,不同的益生菌可能对服用不同抗生素的患者有帮助。不过他们也认为,在服用抗生素之后再服用益生菌可能是没有益处的。
还需要更多的研究来确定是否有其他方法来探索益生菌和抗生素的共存关系,如益生菌封装技术增强效果、自体粪菌移植等各种方式。
研究发现,封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素;胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。这可能为益生菌和抗生素共同使用带来利好。
研究表明,自体粪便移植(在使用抗生素之前收集粪便样本并冷冻,在抗生素治疗后移植),8天内肠道菌群就恢复正常。未进行粪便移植的那一组的肠道菌群花了21天时间才恢复。
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
还有其他方式也可以获取益生菌或者协助益生菌生长。
补充益生元,协助有益菌生长
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达大肠和结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
菊粉型果聚糖和阿拉伯木聚糖低聚糖等益生元表现出双歧化和产丁酸作用。产丁酸菌正需要这些益生元,例如直肠真杆菌、普拉氏粪杆菌和罗氏菌属。
有机酸的产生还可以形成对病原体的防御并增加矿物质的吸收。通过益生元和有益菌繁殖结合将导致较低的管腔 pH 值,阻止病原体在肠粘膜中的粘附和生长,并增加盲肠和结肠对矿物质,特别是钙和镁的吸收。
★ 哪些食物中含有益生元?
蒲公英嫩叶
蒲公英绿叶植物是菊粉和其他纤维的重要来源,每100克含有4克纤维。
蒲公英绿色植物也因其抗炎、抗氧化、降低胆固醇的功效而闻名,同时也有助于减轻便秘。
菊芋
每 100 克菊芋含有约 2 克膳食纤维,其中 3/4 由菊粉组成。它们还富含硫胺素和钾,可支持神经系统并促进适当的肌肉功能
青香蕉或青香蕉粉
未成熟的(绿色)香蕉富含抗性淀粉,绕过小肠的消化(可消化的淀粉转化为葡萄糖)并携带到结肠,被有益细菌发酵成代谢物。
香蕉中的纤维已被证明可以增加健康的肠道细菌并减少腹胀。
大麦和燕麦
大麦和燕麦由 3-8% 的 β-葡聚糖组成,这是一种益生元纤维,可促进肠道中有益细菌的生长。
还发现大麦和燕麦中的 β-葡聚糖可以降低 LDL 胆固醇(坏胆固醇)和血糖水平
大麦富含硒 – 支持甲状腺功能,抗氧化益处与预防多种癌症有关。
由于其酚酸含量,燕麦还提供抗氧化和抗炎保护。
魔芋根
魔芋根,也称为葡甘露聚糖,原产于亚洲部分地区,用于中药以及烹饪中作为增稠剂。它因其减肥益处和帮助降低低密度脂蛋白胆固醇而得到普遍认可。
除魔芋外,一项研究发现有助于减少粉刺并改善患者的整体皮肤健康。它还被发现有助于减少过敏。
菊苣根
菊苣根与蒲公英来自同一个家族,新鲜菊苣根由高达 70% 的菊粉组成,研究发现它有助于改善血糖控制,尤其是对糖尿病患者而言,并且还被发现有助于减轻体重。
菊苣根可以整个煮熟后与食物一起食用,也可以作为热饮冲泡,或者作为补充剂。
牛蒡根
通常作为茶饮用,具有广泛的益处,包括治疗癌症、糖尿病和炎症。其他好处包括帮助降低血糖水平和治疗糖尿病治疗和预防感染。
牛蒡可以作为茶服用,也可以作为补充剂的粉末服用。
亚麻籽
亚麻籽具有多种相关的健康益处。除了高纤维含量外,亚麻籽还富含蛋白质、omega-3 脂肪酸,以及一些维生素和矿物质的丰富来源。
一汤匙亚麻籽含有 3 克纤维,占每日推荐摄入量的 10%。亚麻籽有助于促进肠道中有益细菌菌株的生长,有助于降低血糖水平和治疗糖尿病、治疗和预防感染。
雪莲果根
雪莲果根的外观与甘薯相似,富含果糖(FOS),使其具有甜味。
豆薯根
豆薯根是一种可食用的根茎类蔬菜,原产于墨西哥,通常被称为墨西哥萝卜,由大约 5% 的膳食纤维组成。
海藻
海藻含有大量的生物活性化合物,如多糖和酚类物质,长期以来因其对健康的益处以及作为益生元的价值而得到认可。
海藻中发现的许多化合物对小肠的消化有抵抗力,但会刺激有益肠道细菌的生长及其发酵成短链脂肪酸。
土豆
土豆(以及土豆泥、薯条和炸薯条等土豆产品),一听就觉得是容易长胖的食物。确实,煮沸或油炸时,很容易在小肠中消化成葡萄糖。
然而,当土豆煮熟然后完全冷却至室温时,或者更好的是放在冰箱里,就会形成抗性淀粉。抗性淀粉属于膳食纤维的一种,抗性淀粉不被消化,进入结肠,作为菌群的营养源,菌群通过发酵,将碳水化合物代谢后生成丁酸等短链脂肪酸,促进肠道健康。
苹果
苹果含有丰富的纤维、维生素C、抗氧化剂和钾,具有显着的健康益处。它含有果胶,一种可溶性纤维,具有益生元作用并促进健康的肠道菌群。果胶会增加丁酸盐(短链脂肪酸),可以滋养有益的肠道细菌并减少有害细菌的数量。
其他协助益生菌的方式
▸ 适当锻炼
干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。
关于运动锻炼对菌群的影响,详见:运动如何影响肠道微生物群,如何正确运动
▸ 足够睡眠
某些菌群会在睡觉时会大量繁殖,这些菌群在白天不会很好地繁殖。
如果你缩短睡眠时间,这些菌群可能会受到影响,没有机会增殖,从而影响肠道菌群的整体平衡。保持足够的睡眠对于健康的身体、肠道极为重要。
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
关于睡眠与肠道菌群详见:
肠道菌群与睡眠:双向调节
深度解析|睡眠健康与肠道健康之间的双向联系
有人说,益生菌在体内不能定植,很快就会被排出体外了…… 益生菌究竟能不能定植?


可以定植,但不容易。
首先,我们来看口服的益生菌在体内经历了什么?
▸口腔——唾液对益生菌的影响微乎其微
益生菌首先会接触到口腔中的唾液。唾液是一种透明且微酸性的黏液性外分泌物,由保护牙齿和黏膜表面的免疫和非免疫成分组成。
对多种乳酸杆菌、小球菌和双歧杆菌菌株进行的体外研究表明,与对照组相比,接触唾液时细胞计数没有显著损失。
▸胃——胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,转运需要5分钟到2小时,长时间暴露在酸性胃液中,对益生菌来说是一个巨大的挑战。
尤其是对不耐酸的细菌,会导致细菌细胞质pH降低。
氢离子(H+)的涌入导致糖酵解酶活性下降,进而影响F1F0 – ATP酶质子泵。低pH条件下F1F0 – ATP酶质子泵活性的降低,因此益生菌存活难。
胃中存在的其他不利条件:
包括离子强度、酶活性(胃蛋白酶)和机械搅拌对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在模拟胃液中1小时内消失。


▸小肠——胆汁酸和消化酶影响益生菌生存
益生菌通过幽门到达小肠,那里有大量胰液和胆汁。在肠液的中和作用下,小肠内的pH约为6.0-7.0,比胃液温和得多。
然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以影响益生菌的生存能力,通过细胞膜破坏和DNA损伤等方式。
体外研究表明,在模拟肠液中唾液乳杆菌Lactobacillus salivarius Li01、Pediococcus pentosaceus Li05 的生存能力降低。
为了增强益生菌对胃液和胆汁的耐受性,可以将益生菌包裹在一层保护性外壳上,也就是前面说的微胶囊。近年来,微囊化技术在提高存活率和保证足够数量的活菌到达结肠方面取得了很大进展。
经历以上重重考验,益生菌的定植之路看起来并不容易。

而以上这些只是其中一部分原因。
等益生菌到了结肠之后,有更多的考验等着它。
共生菌的定植抗性,给益生菌的定植带来不利影响
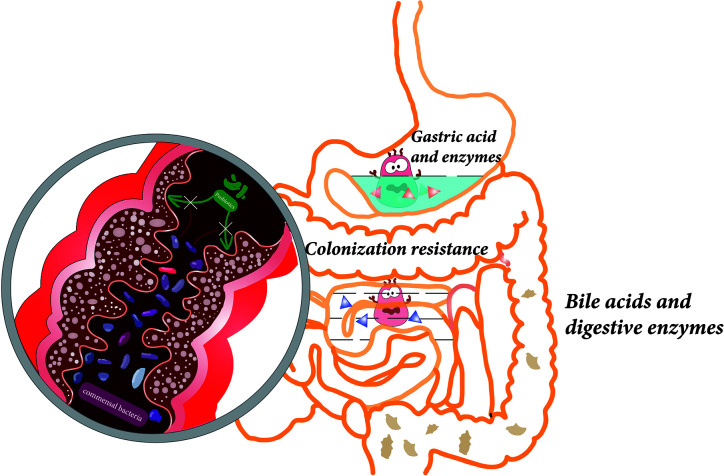
doi.org/10.3389/fcimb.2021.609722
由于定植抗性,大多数益生菌在口服后和消耗停止后不久随粪便排出结肠。
那么,什么是定植抗性?
通俗地说,在人类的菌群中,一个新的物种想要入侵并定居下来,也就是定植。但是本身存在的菌群会用各种方式,拒绝新的物种一起生活,就是所谓的“定植抗性”。
对于病原体而言,常驻微生物群的这种定植抗性,可以使其更难生长和繁殖,从而预防疾病的发生。
举个例子:
鼻腔微生物群的存在,可以保护人体免受呼吸道金黄色葡萄球菌感染,金黄色葡萄球菌想要入侵得过鼻腔微生物群这一关…
换句话说,益生菌如果想要定植,必须与宿主菌群竞争养分和粘附部位,争到了资源,活下来,才能繁衍后代。
具体的争抢资源的方式是什么?
包括以下各种方式:改变资源可用性、占领生态位、捕食、竞争等。
我们大致分成两种机制:直接和间接。
指严格通过与肠道菌群相关的因素,来限制外源微生物定植,独立于与宿主的任何相互作用。
这就涉及到菌群之间的相互作用。
一般这样的相互作用分为两种情况:
互利共生和竞争关系。
以拟杆菌为例。
▸ 互利共生(定植成功):
不同的拟杆菌种之间存在广泛的互利共生作用,也就说,拟杆菌群在肠道中团结友爱,稳定存在。
比如说,一些拟杆菌能够分解某种多糖,并释放出小分子物质,从而促进不能利用该多糖的拟杆菌生长。更有甚者,这种交互共生关系有时是以过量消耗某一种拟杆菌能量的前提下实现的。
延伸到其他菌群,可能会出现的情况:
里应外合:
准备入侵的菌与本地菌群偶然相互作用,促进定植;
抱团取暖:
两个非本地菌群之间的良好相互作用,可以使定植更加成功。
▸ 竞争关系(一争高下):
非病原菌与细菌竞争肠道上皮细胞刷状缘的结合位点,阻止病原菌的黏附、侵袭;
细菌竞争性利用营养素,消耗掉维持各自种群的生长原料。
有些菌群不直接和新来的菌群产生竞争,而是可以通过改变环境(改变pH值,胆汁酸浓度等)或释放抑制因子(如,代谢产物、细菌素等),从而决定另一个物种是否能成功定植。
结合肽聚糖抑制其他菌生长:
例如,拟杆菌的结构分子及代谢产物,能通过激活一系列的免疫细胞而参与宿主肠道免疫。
拟杆菌还能够更大量地刺激肠上皮细胞分泌RegIIIγ,它能够强力结合大部分革兰氏阳性菌表面的肽聚糖,抑制脂磷壁酸的合成从而抑制细菌的生长。
环境的改变如何影响其他菌群?
更高的营养浓度会导致微生物之间更多的负面相互作用
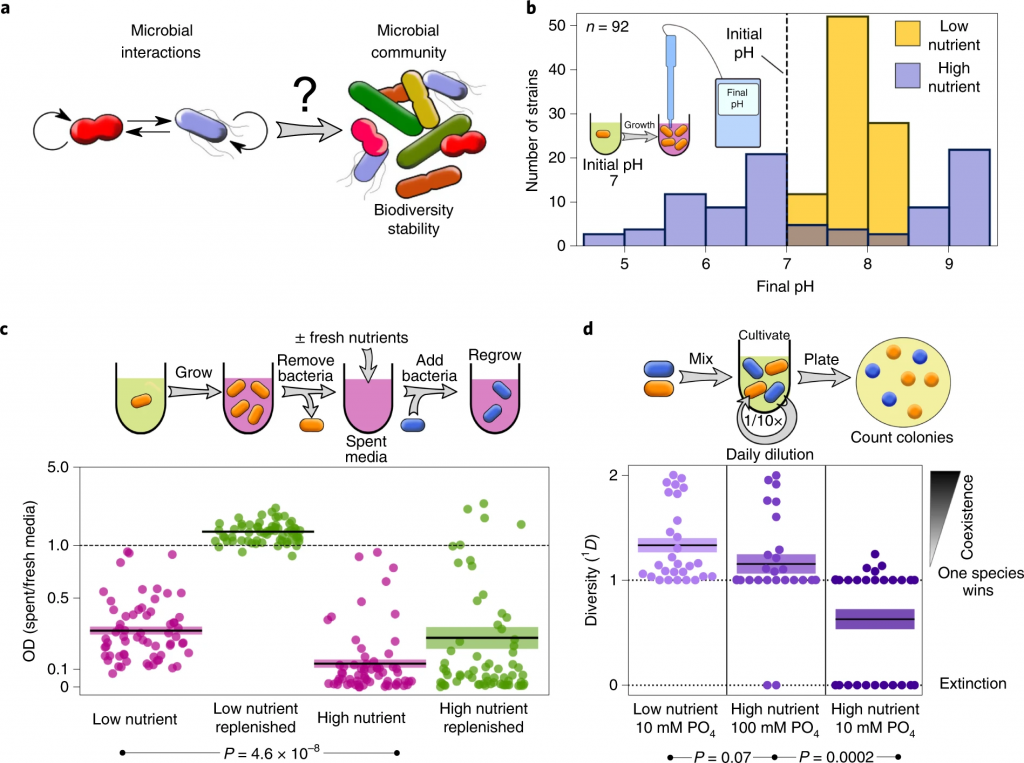

Ratzke C, et al., Nat Ecol Evol. 2020
在较高的营养浓度下,细菌会更强烈地改变环境pH值。
在较高的营养浓度下,细菌会产生更具生长抑制性的环境。
参考上图c,直接(紫色)或补充资源(绿色)后使用不同细菌的废培养基重新培养细菌。每个相互作用对的相对增长显示为散点图。
高营养浓度会减少相互作用对之间的共存。
低营养成分包括0.1%酵母抽提物和0.1%大豆酮。高营养的培养基与添加1%葡萄糖和0.8%尿素的培养基相同。所有28种共培养结果均显示为一个群体图。
微生物获得的营养浓度越高,它们生长的越多,它们代谢的底物就越多,因此它们可以改变环境的能力越强。
再看常见的益生菌,例如,乳酸杆菌和双歧杆菌:
乳酸杆菌和双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸,有机酸可以通过交叉喂养相互作用被其他细菌转化为丁酸盐。这些产生的有机酸降低了腔内的 pH 值,抑制了病原体的生长并增加了矿物质的吸收。
注:丁酸盐和其他短链脂肪酸对肠道健康至关重要,但也可能进入体循环并直接影响新陈代谢或外周组织的功能。短链脂肪酸在脂肪组织、骨骼肌中发挥重要作用和肝脏底物代谢和功能,有助于改善葡萄糖稳态和胰岛素敏感性。
以上,我们了解菌群之间相互作用机制。
可见菌群的定植并不容易,它们要面临的,可能是同伴的帮助,也可能是其他菌群的竞争或杀戮,又或者是受到环境的考验。
在经历此番折腾后,益生菌如果能顺利定植,它会在哪里,如何定植?
胃肠道的成功定植,是益生菌能够发挥足够的作用,是赋予健康益处的关键。粘膜粘附是益生菌定植的重要步骤。
在本小节中,我们将讨论肠道粘液层的组成和与益生菌粘附相关的特定蛋白质。
什么是肠粘膜和粘液层?
肠粘膜由上皮层、固有层和肌层组成。小肠绒毛由上皮细胞和伸入肠腔的固有层组成,覆盖在黏膜表面,负责肠内营养物质的吸收。
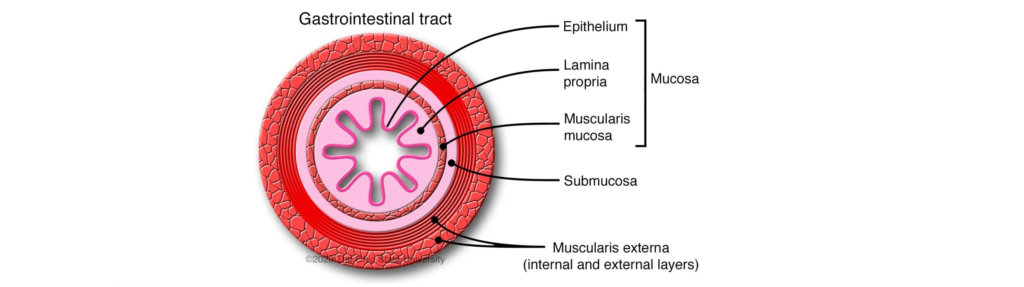
上皮细胞由吸收细胞、杯状细胞和内分泌细胞组成。杯状细胞分散在吸收细胞之间,分泌覆盖整个小肠腔的粘液,由碳水化合物、脂类、盐、蛋白质、细菌和细胞碎片组成。
粘液厚度约为 30 ~ 300 μm;从肠道到直肠的厚度都在增加。主要的蛋白质是粘蛋白,它聚合形成一个连续的凝胶基质,为粘膜层提供结构基础,保护肠道免受病原体、酶、毒素、脱水和磨损。
同时,肠道粘液中含有维生素、矿物质等外源性营养物质,为定植于肠道粘液中的细菌提供了巨大的生态生长优势。可以说,粘液是益生菌和病原体的绝佳生态位。
细菌粘附粘膜的过程包括可逆阶段和稳定阶段。
可逆阶段(初相识)
最初,益生菌通过非特异性的物理接触(包括空间和疏水识别)与粘膜结合,建立可逆的、弱的物理结合。
稳定阶段(如胶似漆)
随后,随着粘附素(通常是固定在细胞表面的蛋白)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IECs)建立了稳定的结合,从而成功定植胃肠道。
益生菌可以编码大量的细胞表面因子,这些因子参与粘液蛋白或上皮细胞的粘附。
除蛋白质外,益生菌中还存在非蛋白分子,如磷壁酸和胞外多糖,它们可以与宿主细胞相互作用,影响粘附。
从目前的研究可以推断,没有固定的分子可以适用于所有菌株的益生菌。
许多粘附素似乎是种或株依赖性的。这些与粘附相关的益生菌表面分子和粘附相关的机制将在下面详细讨论(下表)。
表 益生菌中的粘附相关分子
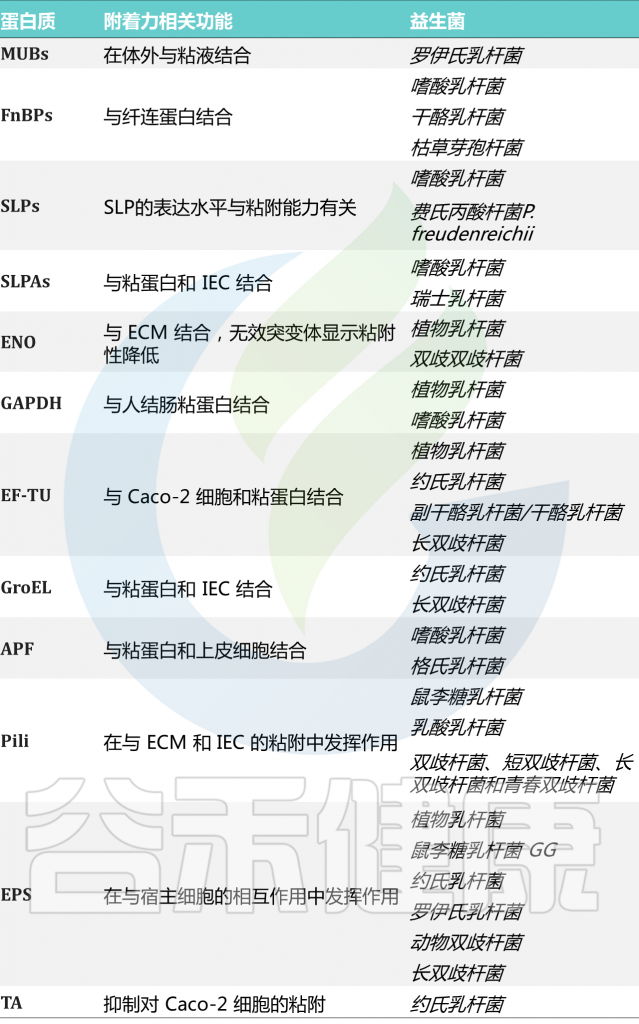

doi.org/10.3389/fcimb.2021.609722
粘液层的组成和与益生菌表面蛋白的结合
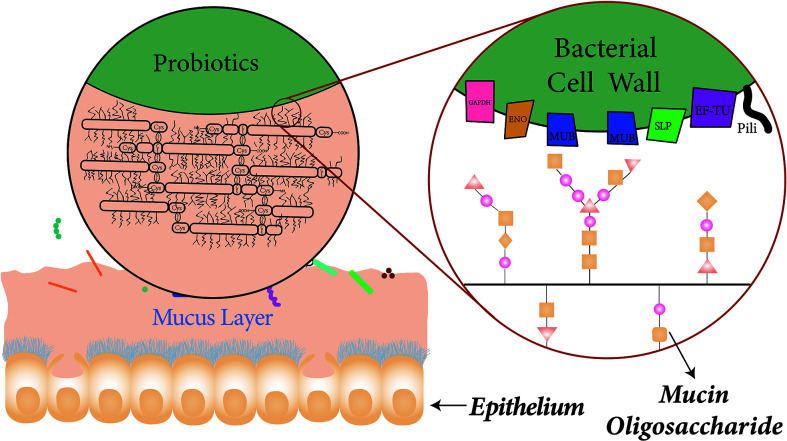
doi.org/10.3389/fcimb.2021.609722
杯状细胞分散在吸收细胞之间,吸收细胞可以分泌覆盖整个小肠的粘液。粘液主要由富含半胱氨酸的粘蛋白组成。粘液蛋白之间广泛的二硫键形成黏液特有的粘弹性。
益生菌表面的特异蛋白在益生菌粘附粘液中起着重要作用。例如,粘液结合蛋白可以通过与粘液蛋白的糖基修饰相互作用而与粘液层结合。
一旦粘附在肠道,益生菌通过将碳水化合物、蛋白质和其他次要化合物转化为能杀死病原菌的重要物质,如有机酸、酶、过氧化氢、细菌素和低分子量肽,可以产生细胞外抗菌成分。
以上是益生菌的定植给人体带来益处,当然这也不一定会发生在每个人身上。
益生菌定植的效果因人而异。
看一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
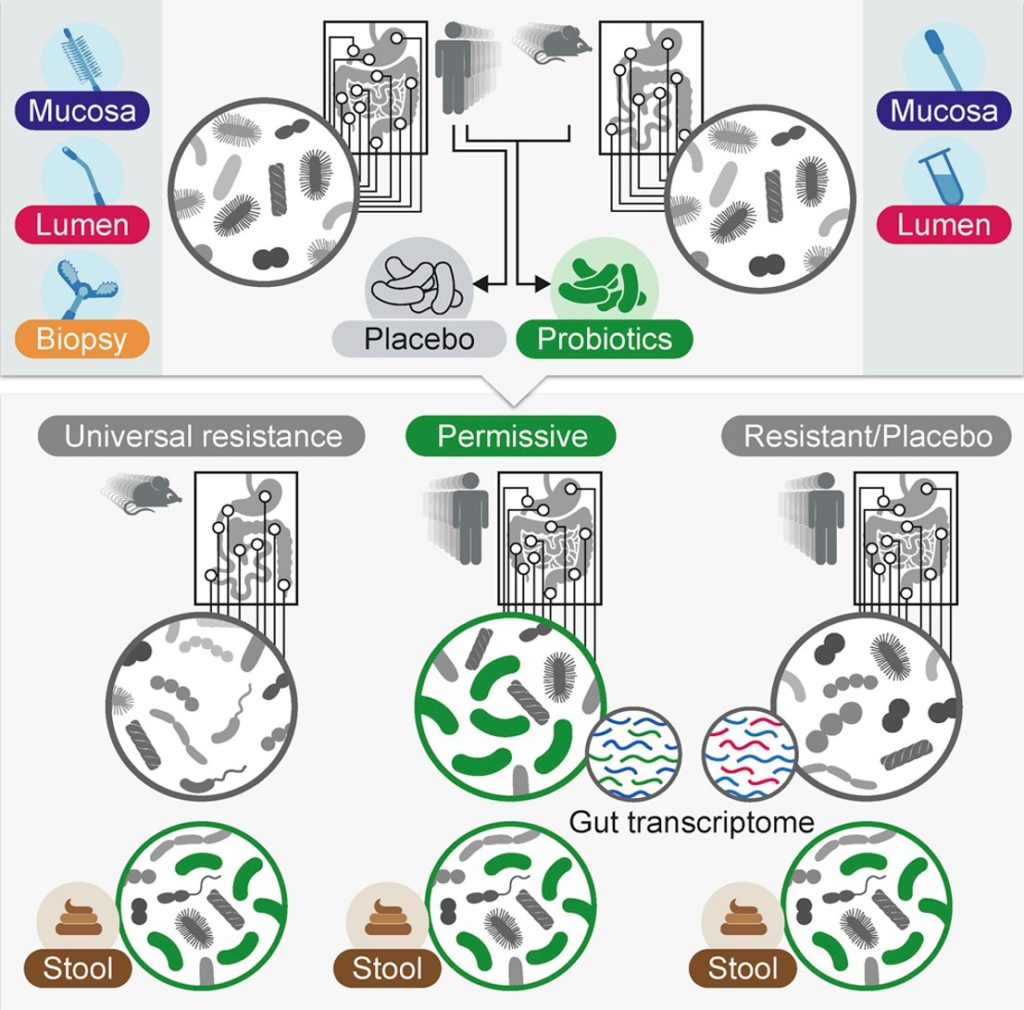
doi.org/10.1016/j.cell.2018.08.041
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。
常驻微生物群对人类健康很重要,因为它们占据了可能被病原微生物占据的生态位。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前面的文章《菌群多样性是如何形成的,与健康的关系,如何改善?》已经详细阐述。
这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
那么,益生菌在什么样的菌群中更容易定植?
再来看一项研究,为了评估定植抗性,该研究建立了一种电子入侵分析方法,在该方法中,稳定的菌群受到不同种群规模的入侵者的挑战。
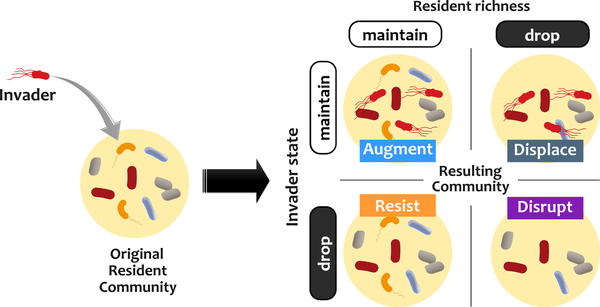
doi.org/10.1371/journal.pcbi.1008643(下同)
根据入侵者和常驻菌群的命运对结果进行分类。
有四种可能的结果:
增加入侵者的数量不会增加入侵者定植的概率。
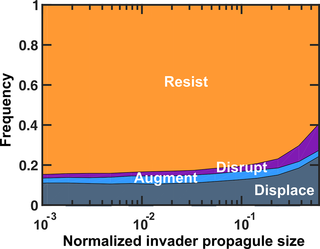
类比到益生菌,高剂量的益生菌可能并不会因此带来明显的定植效果。
基础增长率较高的入侵者更有可能取代常驻菌群,这可能是竞争潜力的主要指标。

如果常驻菌群创造的化学环境有利于入侵者,入侵者会更成功。
这就说明,常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
研究人员在宏基因组和宏转录组学研究中表明,在 12 名健康老年人中食用鼠李糖乳杆菌GG益生菌菌株改变了常驻菌群的活性,而不会影响肠道微生物群组成本身。
益生菌虽然没有在菌群构成上带来改变,但是菌群的表达特征发生较大变化。尤其是益生菌服用后会大大促进双歧杆菌和主要丁酸产生菌:Roseburia和Eubacterium的鞭毛、运动,趋化性和粘附相关基因的表达。表明其能促进这些关键菌主动渗透进入肠粘膜的能力,提高宿主对于丁酸盐的利用度。
那么对于部分人群,益生菌不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。
益生菌:有助于维持宿主体内的动态平衡和防治疾病
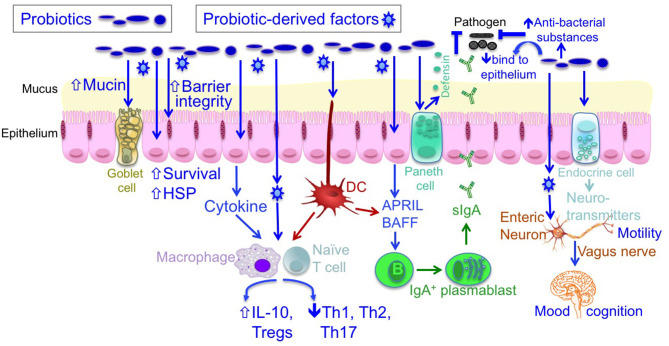
Yan F, Polk DB. Front Immunol. 2020
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡
(4)通过产生神经递质和迷走神经调节肠脑轴
益生菌衍生因子:有助于增强肠道屏障功能和刺激抗炎免疫反应
益生菌源因子对宿主反应的调控。一些益生菌衍生因子,包括产物和代谢物,对宿主发挥促进健康的作用。
益生菌的这些功能因子有助于增强肠道屏障功能,刺激抗炎免疫反应,从而改善肠道炎症紊乱。

Yan F, Polk DB. Front Immunol. 2020
益生菌混合物:减少成人肠道致病性或耐药性肠杆菌定植
益生菌补充剂可以减少肠道中潜在的耐药性或致病性肠杆菌,但有时候不能完全根除。
“如果益生菌单打独斗的力量不够,是不是可以寻求其他外援?”
比如多联益生菌,或者益生菌-益生元联合使用等方式。
多联益生菌减少肠杆菌:
为了根除潜在的肠杆菌,益生菌混合物(Bactiol duo ®:S. boulardii、L. acidophilus NCFM、L. paracasei Lpc-37、B. lactis Bl-04、B. lactis Bi-07 )的临床试验表明 ,在阿莫西林-克拉维酸治疗后,产 AmpC肠杆菌的定植会暂时增加,而在益生菌干预后会下降。
嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R 和鼠李糖乳杆菌CLR2 (Bio-K+ ® )的混合物在预防成人抗生素相关性腹泻和初级预防艰难梭菌感染方面也表现出显着效果。
益生菌-益生元联合使用减少肠杆菌:
60名健康绝经前日本女性连续摄入发酵豆奶(含异黄酮)和干酪乳杆菌Shirota,能够降低肠道杆菌的粪便水平,并提高异黄酮的生物利用度。
当然以上只是小规模研究,还需进一步研究。
在人类中,一些临床干预可能会促进肠杆菌的肠道携带。益生菌可能有助于根除肠道携带的致病性或耐药性肠杆菌。
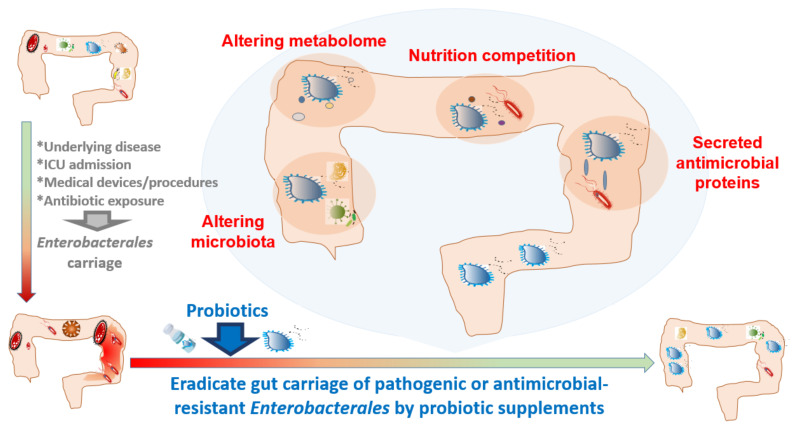
doi:10.3390/antibiotics10091086
综上,益生菌不能定植并不能说就是无效的,它有各种方式来影响人体健康。
“
广谱益生菌无论是否定植,在一定程度上都可以为我们的健康带来益处。当然每个人的菌群特征各不相同,结合肠道菌群检测结果,根据自身菌群特征,选择适合自己的益生菌,可以更加快速有效地帮助建立或恢复健康的菌群。
在服用益生菌的同时,如果能注意上述合理的饮食、健康的生活方式等,相当于开启了外挂,对于快速恢复菌群具有重要意义。主要参考文献:
Yan F, Polk DB. Probiotics and Probiotic-Derived Functional Factors-Mechanistic Insights Into Applications for Intestinal Homeostasis. Front Immunol. 2020;11:1428. Published 2020 Jul 3. doi:10.3389/fimmu.2020.01428
Hung, Yuan-Pin et al. “The Potential of Probiotics to Eradicate Gut Carriage of Pathogenic or Antimicrobial-Resistant Enterobacterales.” Antibiotics (Basel, Switzerland) vol. 10,9 1086. 8 Sep. 2021, doi:10.3390/antibiotics10091086
Wieërs G, Belkhir L, Enaud R, et al. How Probiotics Affect the Microbiota. Front Cell Infect Microbiol. 2020;9:454. Published 2020 Jan 15. doi:10.3389/fcimb.2019.00454
Pickard, Joseph M et al. “Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease.” Immunological reviews vol. 279,1 (2017): 70-89. doi:10.1111/imr.12567
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21. doi: 10.1016/j.cell.2018.08.041. PMID: 30193112.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722. doi: 10.3389/fcimb.2021.609722. PMID: 33791234; PMCID: PMC8006270.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076. doi: 10.1016/j.biotechadv.2018.09.003. Epub 2018 Sep 26. PMID: 30266342.
Eloe-Fadrosh, Emiley A et al. “Functional dynamics of the gut microbiome in elderly people during probiotic consumption.” mBio vol. 6,2 e00231-15. 14 Apr. 2015, doi:10.1128/mBio.00231-15

谷禾健康

毛螺菌属(Lachnospira),属于厚壁菌门,毛螺菌科(Lachnospiraceae),该菌属存在于大多数健康人的肠道里,可能是一种潜在的有益菌,参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强,发酵导致乙酸和丁酸的产生为宿主提供能量的主要来源。
图片来源:microbiomology
毛螺菌科(Lachnospiraceae)目前在NCBI中被描述为包括 58 个属和几个未分类的菌。毛螺菌属(Lachnospira)是毛螺菌科的一个重要组成成员。
认识毛螺菌属之间先了解下毛螺菌科。
人类结肠微生物群可以处理多种底物,包括蛋白质、寡肽、膳食多糖、内源性粘蛋白和逃避宿主消化的糖蛋白 。肠道菌群对碳水化合物的代谢是向宿主提供营养和能量的关键过程。
在厚壁菌门中,毛螺菌科、乳杆菌科和瘤胃球菌科水解淀粉和其他糖以产生丁酸盐和其他短链脂肪酸。
毛螺菌科(Lachnospiraceae)的基因组分析揭示了其组内成员利用饮食衍生的多糖(包括淀粉、菊粉和阿拉伯木聚糖)的相当大的能力,但是在菌种和菌株之间存在很大差异。
毛螺菌科是一个系统发育和形态异质的分类群,属于厚壁菌门的梭菌簇 XIVa,毛螺菌科的所有成员都是厌氧的、发酵的和化学有机营养的,并且一些表现出强水解活性,例如通过果胶甲酯酶、果胶酸裂合酶、木聚糖酶、α-L-阿拉伯呋喃糖苷酶、β-木糖苷酶α-和β-半乳糖苷酶的活性、α-和β-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶或α-淀粉酶。
毛螺菌科存在于早期婴儿中,甚至在胎粪中也有发现。然而,毛螺菌科丰度的增加与衰老有关。毛螺菌科的丰度在患有不同疾病的受试者的肠腔中也增加了,尽管该科的分类群一再显示出它们为宿主产生有益代谢物的能力。
★ 形态和代谢
Lachnospira细胞形态呈直的或略微弯曲的棒状细胞,有的可能呈螺旋状。单细胞尺寸为 0.35–0.6×2.0–4.0 µm,DNA G + C 含量( mol %):38–45。细胞成对出现,有时呈长链状。细胞具有革兰氏阳性超微结构,严格厌氧。
在 30–45 °C 下生长,在含有瘤胃液或酵母提取物、无机盐、果胶或聚半乳糖醛酸的厌氧培养基中生长。
化能有机营养,发酵代谢;发酵果胶、聚半乳糖醛酸、果糖和纤维二糖等。乙酸盐、甲酸盐、乙醇和 CO2是聚半乳糖醛酸和果胶发酵的主要最终产物。也可能产生少量的H2 。果胶发酵时也会产生甲醇,不产生琥珀酸盐、丁酸盐和丙酸盐。
不产生吲哚、过氧化氢酶或 H2S,不还原硝酸盐。不水解明胶或淀粉。主要存在于哺乳动物肠道,从牛瘤胃内容物和猪粪便和盲肠内容物中分离。
在肠道中,抗性淀粉和低聚半乳糖可以通过结合胆盐直接降低胆汁酸的浓度。Lachnospira等产生丁酸盐细菌的增加都间接导致胆汁盐浓度降低。
★ 分类和物种
Lachnospira(毛螺菌属)主要有以下结果物种:
Lachnospira rogosae
Lachnospira eligens
Lachnospira multipara
Lachnospira multiparis
Lachnospira pectinoschiza
模式种是多对毛螺菌(Lachnospira multiparus)。
以前的16S 的测试,可能会错误地将Lachnospira rogosae识别为乳酸杆菌。后来纠正这一错误并更新了数据库,重新正确重命名为Lachnospira rogosae。
Lachnospira pectinoschiza 是从猪的结肠内容物中分离的能分解果胶的菌。但是该菌物种无法从羊的瘤胃内容物中分离出来,即使这些动物被喂食高果胶饮食。实验中果胶、聚半乳糖醛酸和葡萄糖酸盐是支持该菌快速生长的唯一底物。
不同的是,Lachnospira multiparus 是瘤胃内主要的果胶分解菌。它的碳水化合物代谢在实验室发酵罐的生长实验中进行的研究。
★ 哪些因素影响毛螺菌属
增加
食用富含纤维的植物性饮食与Roseburia、Lachnospira和Prevotella属的丰度增加以及短链脂肪酸产量增加相关。
用全谷物代替六周的饮食习惯精制谷物增加了 Lachnospira和Roseburia,减少了肠杆菌科的成员,总体上产生了更有利的微生物景观。
全谷物:是指完整、碾碎、破碎或压片的谷物,其基本组成包括淀粉质胚乳、胚芽与皮层,各组成部分的相对比例与完整颖果一样。
全谷物不仅含有丰富的B族维生素、镁、铁和膳食纤维,还含有多酚、维生素E、单宁、类胡萝卜素、植酸、木质素和木脂素等常见抗氧化成分,而且还含有一些果蔬食品中少见但具有很高营养价值的抗氧化成分,如γ-谷维素、烷基间苯二酚、燕麦蒽酰胺等。比如:全燕麦,荞麦,黑米,小米,全麦等。
果胶是一种水果蔬菜中发现的复杂的膳食纤维和益生元。研究表明水果中纤维的消耗与健康成人肠道中大量的果胶分解细菌属Lachnospira 密切相关。果胶摄入增加梭菌属簇 XIV(Lachnospira、Dorea和Clostridium),其中Lachnospira的增幅最大。
最近的一项研究发现Lachnospira与 β-胡萝卜素、维生素 E 和植物脂肪的摄入量呈正相关,而与肉类、总蛋白和胆固醇的摄入量呈负相关 。
洋车前子是一种广泛用于治疗便秘的药物。它将水分困在肠道中,增加粪便中的水分,缓解排便并改变结肠环境。研究显示洋车前子处理可以增加Lachnospira,Roseburia 和 Faecalibacterium.
茶多糖维持了肠道微生物群的多样性,恢复了一些因糖尿病而减少的细菌属(毛螺菌属、罗斯氏菌和Fluviicola)的相对丰度。
茶多糖主要由葡萄糖、阿拉伯糖、木糖、岩藻糖、核糖、半乳糖等组成。
葡萄不仅含有各种植物化学物质,如儿茶素,原花青素,花青素,亮氨酸花青素,槲皮素,山奈酚,二苯乙烯,鞣花酸和羟基肉桂酸酯,而且也是膳食纤维的良好来源。与基线相比,4周的葡萄粉摄入量显着增加三个属Akkermansia,Flavonifractor和毛螺菌属的相对丰度。
减少
将117名超重成年人随机均分为食用4次/周炸肉组和不食用炸肉组,干预4周,发现食用炸肉组的菌群多样性降低,Lachnospira和Flavonifractor丰度降低,Dialister、Dorea、韦荣球菌属丰度增加。
越来越多的证据表明,众所周知的致癌驱动因素吸烟会影响肠道微生物组。一项研究针对 803 名成年人子集的吸烟和肠道微生物组使用16s测序进行了分析。
发现以前和现在吸烟者的粪便微生物组的整体组成与从不吸烟者有显着差异。相对于从不吸烟者而言, Lachnospira 和Tenericutes菌则被耗尽。这些变化在种族和族裔亚群中是一致的,表明吸烟会导致Lachnospira消失或减少。
★ 与其他菌的相互作用(仅供参考)


睡眠(夜猫子)
海法大学和以色列理工学院的合作研究项目发现,“早起的人”和“夜猫子”的肠道微生物组(寄居在消化道的细菌群)彼此不同。该研究将人们分为三种不同的‘时型’:
“云雀”——早起的晨型人,在早晨活力最好;
“猫头鹰”——晚睡的夜猫子,在早晨运作困难;
“中间群体”——大部分人属于这种。
研究结果指出了“云雀”和“猫头鹰”的微生物组之间的差异;在“云雀”中,细菌属Alistipes 的百分比更高,而在“猫头鹰”中,属于Lachnospira属的细菌更高,该细菌为产生丁酸盐的细菌,是一种短链脂肪酸,是睡眠和觉醒相关信号的来源。
其他研究也陆续发现包括毛螺菌属Lachnospira、棒状杆菌属Corynebacterium 和 布劳特氏菌属Blautia 在内的几种微生物与睡眠质量呈负相关。
调节肠道菌群是改善睡眠的可行路径之一,好好睡觉也可以帮助我们维护肠道微生态健康,好眠养好菌,好菌助好眠。
肝病
非酒精性肝脂肪变性疾病中毛螺菌属的丰度相对对照较高,同样在非酒精性脂肪肝中也发现毛螺菌属的富集。
哮喘
哮喘是一种气道慢性疾病,尤其对于儿童。生命早期的特定细菌属与 1 岁儿童的特应性和喘息有关。越来越多的证据表明,其中一个原因可能是儿童在生命早期获得的健康微生物受到破坏。
加拿大健康婴儿纵向发育 (CHILD) 研究中发现,在生命的前 3 个月内,毛螺菌相对丰度的的下降与学龄前哮喘有关,并且 Lachnospira/Clostridium 比率可作为预测哮喘发展的潜在生命早期生物标志物。
《Science Translational Medicine》上刊登了加拿大温哥华的不列颠哥伦比亚大学(UBC)Brett Finlay 等科学家的文章,他们采集了300多个婴儿在3个月和1岁时的便便和尿液样本,结果显示,粪便样品中缺乏四种细菌(Lachnospira,Veillonella,Faecalibacterium,Rothia)的3个月的婴儿,后来在1岁时都显示出了早期哮喘的症状(喘息和皮肤过敏)。
而那些在1岁时没有这些症状的孩子,无一例外在其3个月的粪便样本中含有大量的这四种微生物。检测这些肠道微生物即可预测这些孩子日后患哮喘的风险,通过控制这些肠道细菌的组成还有可能找到预防儿童哮喘的方法。
抑郁症
研究发现,Lachnospira、Roseburia和Faecalibacterium与抑郁症状的严重程度呈负相关。
自闭症
南医大刘星吟团队揭示在属水平上,Lachnospira 和Megamonas 在对照组内的2-3岁和7-11岁亚组中丰度较高,而自闭症组不存在此趋势。
阿尔兹海默症
与健康对照组相比,阿尔茨海默病 (AD) 患者的肠道微生物组发生了改变。然而,以前的研究经常评估一直在服用药物或其他疾病干预措施的 AD 患者。此外,在一项研究中同时测定轻度认知障碍 (MCI) 或 AD 患者的肠道微生物组是罕见的。
与健康对照组相比,阿尔茨海默病患者的拟杆菌属、毛螺菌属和瘤胃梭菌减少,普氏菌属水平增加。而轻度认知障碍患者中这些属的变化方向与AD患者相同。然而,Lachnospira是唯一一个在轻度认知障碍患者中的丰度在统计学上显着低于健康对照组的属,表明该菌属的关键作用。
慢性肾病
研究表明,与健康人群相比,慢性肾脏病人群的肠道菌群组成不同,Lachnospira 和Ruminocococus gnavus 是很好的微生物标志物。
食管鳞状细胞癌
口腔健康以及口腔微生物不佳与食管鳞状细胞癌(ESCC)的发生有很大的关系。中国淮安市第一人民医院的 23 名食管癌患者身上采集的粪便样本中含有丰富的厚壁菌门和放线菌门。根据这项研究, Lachnospira可用作食管鳞状细胞癌潜在的生物标志物。
系统性红斑狼疮
肠道微生物组与系统性红斑狼疮 (SLE) 之间相关性被越来越多的研究关注。研究表明Lachnospira与SLE风险呈负相关。
慢性自发性荨麻疹
慢性自发性荨麻疹(CSU)是一种肥大细胞驱动的疾病,在过去几年中其病因和发病机制取得了许多进展。CSU的主要治疗方法是口服第二代抗组胺药。
然而,只有平均 50% 的 CSU 患者对常规或四倍剂量的非镇静抗组胺药有充分反应。同时,肠道菌群会影响药物的疗效。研究发现毛螺菌科及其下属分类群被发现是响应者和非响应者之间肠道微生物群的主要差异。而且Lachnospira是预测抗组胺药对 CSU 患者疗效的标志物。
格雷夫斯病(GD)
格雷夫斯病(GD)是一种以甲状腺功能亢进为特征的全身性自身免疫性疾病。有证据表明,肠道菌群的改变可能与自身免疫性疾病的发展有关。研究发现GD患者中Lachnospira 相较于对照减少。
肠癌
根据已有报道发现,两个丁酸盐生产者Lachnospira multipara和Eubacterium eligens在结直肠癌中含量降低,生成硫化物的细菌Desulfovibrio vietnamensis、D.longreachensis和Bilophila wadsworthia 增加。
大肠癌是由大肠息肉(腺瘤)和粘膜内癌一步步演变而来的(多阶段癌变)。研究表明,双歧杆菌属(Bifidobacterium)的细菌群会在粘膜内癌阶段减少。另外,作为丁酸产生菌的多毛毛螺菌(Lachnospira multipara)和挑剔真杆菌(Eubacterium eligens)从粘膜内癌阶段到晚期大肠癌阶段一直持续减少。
胃癌
胃癌患者肠道菌群的特点是物种丰富度增加,丁酸产生菌减少,以及其他共生细菌的富集,尤其是乳酸杆菌、埃希氏菌和克雷伯氏菌。据报道乳杆菌属和毛螺菌属是胃癌相关细菌属网络中的关键物种。毛螺菌属、乳杆菌属、链球菌属、韦荣氏菌属的组合在区分胃癌患者和健康对照方面表现出良好的表现。
2 型糖尿病 (T2D)
肠道微生物组可能在与 2 型糖尿病 (T2D) 发展相关的炎症中发挥作用。横断面研究发现 2 型糖尿病患者中毛螺菌属和消化链球菌科较少。
与对照大鼠相比,糖尿病大鼠肠道菌群中厚壁菌属的比例增加而拟杆菌属的丰度降低,菊粉治疗可使糖尿病大鼠的肠道菌群组成恢复正常。
与未治疗的糖尿病大鼠相比,接受菊粉治疗的糖尿病大鼠的益生菌乳杆菌及可产生短链脂肪酸的细菌(如毛螺菌属、考拉杆菌属及拟杆菌属)丰度会明显增加,可产生脂多糖的脱硫弧菌属丰度会降低。进一步分析发现,毛螺菌属的丰度与葡萄糖负荷后的血糖反应呈负相关。
白塞病
在白塞病 (BD) 中,一种自身炎症性血管炎,不平衡的肠道微生物群可导致促炎反应。与对照相比,Barnesiellaceae和Lachnospira属的显着减少与 BD 患者有关。

尽管毛螺菌属是一个重要的肠道菌属,但是目前关于该菌的研究和证据还不是很多,还仅限于关联性研究,在机制方面研究较少,以上文中主要的健康相关性证据支持还不充足,需要更大队列来探讨。
总的来说,该菌是一个对健康有益的菌,更深入地了解其与宿主相互作用的机制将有利于我们干预肠道菌群,最终目标是将其用于预防和治疗肠内外疾病。
主要参考文献:
Carasso S, Fishman B, Lask LS, Shochat T, Geva-Zatorsky N, Tauber E. Metagenomic analysis reveals the signature of gut microbiota associated with human chronotypes. FASEB J. 2021 Nov;35(11):e22011. doi: 10.1096/fj.202100857RR. PMID: 34695305.
Liu R, Peng C, Jing D, Xiao Y, Zhu W, Zhao S, Zhang J, Chen X, Li J. Lachnospira is a signature of antihistamine efficacy in chronic spontaneous urticaria. Exp Dermatol. 2022 Feb;31(2):242-247. doi: 10.1111/exd.14460. Epub 2021 Sep 30. PMID: 34558729.
Xiang K, Wang P, Xu Z, Hu YQ, He YS, Chen Y, Feng YT, Yin KJ, Huang JX, Wang J, Wu ZD, Yang XK, Wang DG, Ye DQ, Pan HF. Causal Effects of Gut Microbiome on Systemic Lupus Erythematosus: A Two-Sample Mendelian Randomization Study. Front Immunol. 2021 Sep 7;12:667097. doi: 10.3389/fimmu.2021.667097. PMID: 34557183; PMCID: PMC8453215.
Saladrigas-García M, D’Angelo M, Ko HL, Nolis P, Ramayo-Caldas Y, Folch JM, Llonch P, Solà-Oriol D, Pérez JF, Martín-Orúe SM. Understanding host-microbiota interactions in the commercial piglet around weaning. Sci Rep. 2021 Dec 6;11(1):23488. doi: 10.1038/s41598-021-02754-6. PMID: 34873196; PMCID: PMC8648723.
Maskarinec G, Raquinio P, Kristal BS, Setiawan VW, Wilkens LR, Franke AA, Lim U, Le Marchand L, Randolph TW, Lampe JW, Hullar MAJ. The gut microbiome and type 2 diabetes status in the Multiethnic Cohort. PLoS One. 2021 Jun 23;16(6):e0250855. doi: 10.1371/journal.pone.0250855. PMID: 34161346; PMCID: PMC8221508.
Prakash A, Peters BA, Cobbs E, Beggs D, Choi H, Li H, Hayes RB, Ahn J. Tobacco Smoking and the Fecal Microbiome in a Large, Multi-ethnic Cohort. Cancer Epidemiol Biomarkers Prev. 2021 Jul;30(7):1328-1335. doi: 10.1158/1055-9965.EPI-20-1417. Epub 2021 May 21. PMID: 34020999; PMCID: PMC8254769.
Ye X, Wang D, Zhu H, Wang D, Li J, Tang Y, Wu J. Gut Microbiota Changes in Patients With Major Depressive Disorder Treated With Vortioxetine. Front Psychiatry. 2021 May 7;12:641491. doi: 10.3389/fpsyt.2021.641491. PMID: 34025474; PMCID: PMC8138160.
Chen W, Bi Z, Zhu Q, Gao H, Fan Y, Zhang C, Liu X, Ye M. An analysis of the characteristics of the intestinal flora in patients with Parkinson’s disease complicated with constipation. Am J Transl Res. 2021 Dec 15;13(12):13710-13722. PMID: 35035709; PMCID: PMC8748098.

谷禾健康
菌群多样性
✦
关于菌群多样性,小伙伴们常会问到:
菌群多样性是如何形成的?
菌群多样性越高越好吗?
它与健康的关系如何?
该怎么去改善呢?
……
✦
✦
本期推文就为大家统一解答这类问题。
本文要点
在了解前面问题之前。我们首先要明确,菌群多样性是什么?
首先,我们知道肠道微生物群代表了一个不断变化的生态系统。
为了便于理解,我们可以把肠道菌群比作一块草地,健康的肠道菌群包含多种菌群,它们之间相对平衡,就好比一块生长完好的草地,生长各种类型的草,整体和谐 ↓↓

一旦遇到疾病,药物等干扰之后,一些菌群被杀死,也就是说少了很多种类型的草,这块“草地”会逐渐变秃,甚至部分沦为荒漠 ↓↓


之后如果不加任何看管,没有很好得到恢复的话,部分菌群可能会野蛮生长,破坏了原有的平衡 ↓↓


以上,我们可以看到关于多样性的几个特点。
一个是种类:
成年人群中肠道菌群的种类参考范围在100~2000种,种类数量越多多样性越高。类比图1那样。
一个是均匀性:
即各个菌种的含量丰度较为均一,如果出现单一菌种占据绝大部分的情况,类比以上图3,那么多样性也不理想。
多样性的评估一般通过一个叫做香农-维纳多样性指数的指标来进行评估,计算公式为:
H=-∑(Pi)(log2Pi)
其中Pi为每个菌的占比例,值越大代表物种种类越多,均匀性也更好相应的多样性也越高。正常人群中香浓指数在2~9之间,一般大于3以上表明具有一定多样性。
肠道菌群多样性表现在:
微生态系统的稳定性,以及面对外界致病菌等入侵的抵御能力。
这要追溯到生命早期。
在胎儿发育和婴儿期,菌群多样性通常很低。
由于在生命的早期阶段,肠道含有氧气,此时肠道内的微生物大多是耐氧的。
随着不断发育,这些菌群开始逐渐被厌氧菌取代。肠道菌群的这种进化是迅速的。
研究表明,婴儿在出生后第一周,肠道内发现的病毒序列有56%,在第二周后就不存在了。
这种多样性在生命的前3个月继续迅速扩大,其中约95%的微生物随着时间的推移而保存下来。
婴儿的微生物群组成具有特征丰富的Akkermansia muciniphila、拟杆菌属、韦荣氏菌属、球状梭菌属和肉毒梭菌属等。肠道微生物多样性延迟与过敏、哮喘和营养不良有关。
肠道菌群变得稳定,微生物群落多样性随着年龄的增长而增加,直到它成为一个稳定的成年微生物群,主要由三个细菌门组成:
厚壁菌门
(Lachnospiraceae和ruminococaceae)
拟杆菌门
(拟杆菌科、Prevotellaceae和Rikenellaceae)
放线菌门
(双歧杆菌科和Coriobacteriaceae)
从出生到2.5岁的微生物群发育期可能非常关键,婴儿早期肠道微生物群的破坏可能会严重影响人类健康。
大约三岁时,儿童肠道微生物群的组成和多样性与成人最为相似。
在个体的整个生命过程中,它继续以更稳定、更慢的速度进化。

研究还发现,青春期之前儿童,肠道微生物群富含可能参与持续发育功能的菌群,如叶酸和维生素B12的合成方面也很丰富。
青少年微生物群,梭状芽胞杆菌属、双歧杆菌属的丰度显著高于成人。
健康成人肠道菌群以厚壁菌门和拟杆菌门为主,也包括较小比例的Verrucomicrobia、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)。
一般来说,老年微生物群的特点是微生物多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌门、梭状芽胞杆菌和真细菌Eubacteria增加,产生短链脂肪酸菌群减少。衰老显著影响老年人微生物群的组成和功能。
是不是所有老人的肠道菌群多样性都会降低?
不是,长寿老人的肠道菌群多样性水平高。
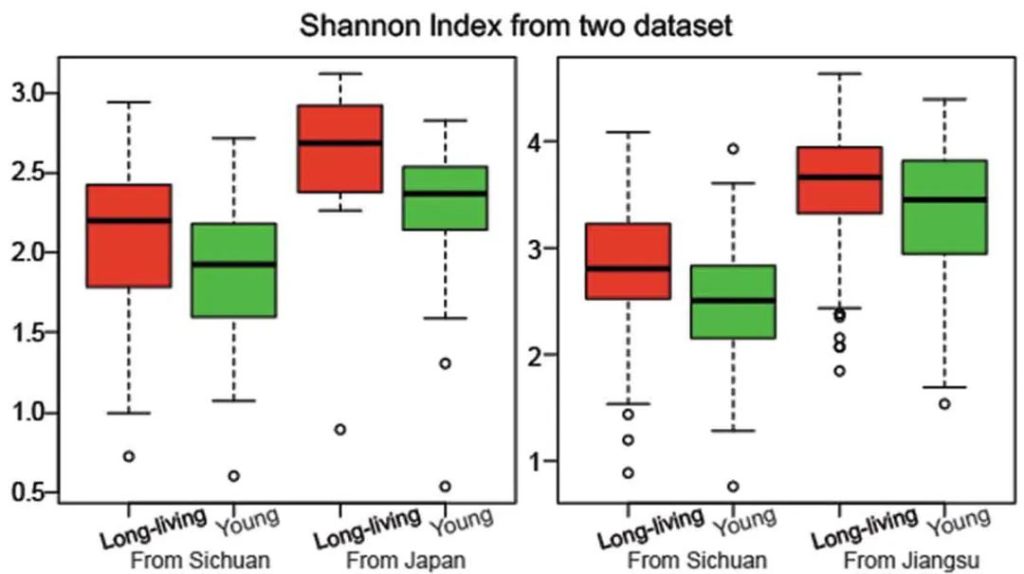
研究人员检测了一群健康的长寿老人的肠道微生物组,来自中国四川都江堰市的长寿老人,包括“90-99岁”和“≥100岁”两个年龄段。
他们发现长寿人群的肠道菌群比年轻成年人的肠道菌群更多样化,这与传统观点相矛盾。
Kong F, et al., Gut Microbes, 2018
他们还发现了产短链脂肪酸菌在长寿老人中开始增加,例如梭状芽胞杆菌XIVa。
国内外研究结果一致
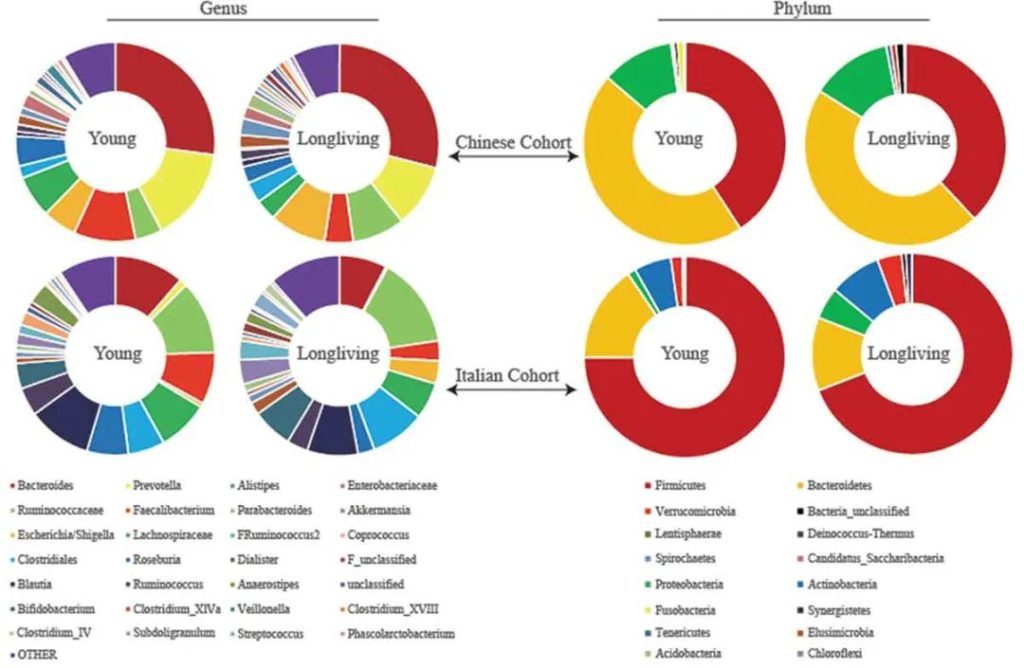
为了验证他们的发现,他们分析了来自一个意大利小组的独立数据集。
Kong F, et al., Gut Microbes, 2018
出现一致的结果:长寿的意大利人也比年轻的人群的肠道菌群多样化水平更高 。
庆幸的是,谷禾肠道菌群数据库中也有比较长寿的老人肠道菌群数据。
我们抽取其中一例相对较为健康的长寿老人的数据:
编号:083*****97 ,98岁(谷禾肠道菌群数据库)
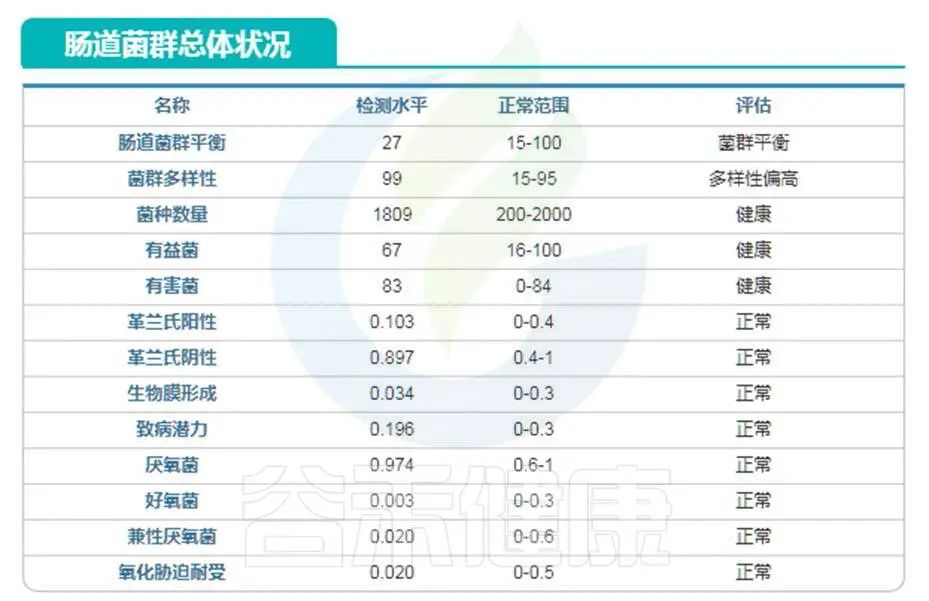
可以看到肠道菌群多样性水平也是明显增高,与文献报道相符。大部分指标都处于正常水平。
那么,菌群多样性是不是仅随年龄的变化而变化呢?
不是的,我们会发现同一年龄层人群的多样性还是有差别的。也就是说除了年龄这个因素之外,肠道菌群变化与某些其他因素也存在关联。
下一章节我们逐一展开了解一下其他相关因素。
前一章节,我们发现年龄会影响菌群多样性变化,其他也可能是由遗传、饮食习惯、生活方式、生理变化、地理位置、药物等因素共同决定的。
▼ 遗传(双胞胎菌群特征相似)
研究发现,分开生活多年的同卵双胞胎在微生物特征上表现出高度的相似性,而生活在相同环境和饮食习惯相似的配偶则没有。


厚壁菌门、放线菌门、Tenericutes、Euryarchaeota的遗传性更强,而拟杆菌门的遗传性很低。
以上这些发现有力地证明,遗传因素在塑造肠道微生物群方面提供了强大的力量。
其他也有研究证实了猪、人和小鼠之间的遗传分类群和候选基因的功能类别的高度相似性,这表明宿主基因对哺乳动物肠道微生物群的影响机制相似。
▼ 地理位置(一方水土养一方人)
肠道菌群中每一个门的比例随着地理位置的变化而变化。这些可能是受到各种不同生活方式有关的大气、基因、饮食或其他因素影响。
在非洲农村布吉纳法索村的儿童(高纤维饮食,脂肪和动物蛋白含量低),马拉维和委内瑞拉的儿童和成人中富含普雷沃特菌,他们吃的主要是玉米、木薯和其他植物源性多糖。


研究表明,普氏杆菌与碳水化合物和单糖有关(在农业社会普遍存在)。
在西方国家,拟杆菌门与厚壁菌门的比例更高。
拟杆菌与长期饮食中,富含动物蛋白、几种氨基酸和饱和脂肪有关(在美国和欧洲普遍存在);


西方国家,肠道菌群多样性的普遍减少,引发了人们的思考,更广泛人群中重要共生菌该如何维持?全球饮食趋势是否会导致有益菌群永久消失?

在发展中国家保持个体菌群(特别是在农业文化中),可能有助于保存人类微生物群中潜在的重要组成部分。
此外,特殊环境,如医院的ICU病房、更衣室等消毒严格的地方,也可能导致环境菌群多样性下降。
▼ 饮食 (调节菌群怎么离得开吃?)
都知道饮食对肠道微生物群的调节起着至关重要的作用,这其中可能起到有益的作用,也可能是有害的。
为什么要把婴儿单独拎出来讲呢?因为对他们来说,人生重要事儿就是吃吃睡睡,那么吃就占了很重要的一块。饮食可以说是塑造肠道菌群的关键驱动力。
婴儿早期,肠道微生物群富含与母乳中低聚糖消化有关的基因,后来,随着其他辅食的引入,富含与多糖和维生素代谢相关的基因。
母乳喂养的婴儿表现出放线菌的过度生长以及厚壁菌和变形菌的抑制。母乳中含有可被这些细菌有效代谢的低聚糖,导致短链脂肪酸增加,从而使免疫系统增加免疫球蛋白G的表达。
配方奶粉喂养的婴儿表现出梭菌、链球菌、拟杆菌和肠杆菌的增加。婴儿期后,肠道微生物群继续发展,饮食成为组织肠道微生物群结构、形状和多样性的主要关键。
日常强调的水果和蔬菜,在决定α多样性方面发挥了最重要的作用。研究发现α多样性或微生物丰富度与长期水果和蔬菜摄入呈正相关(p<0.05)。

膳食纤维的摄入对于保持肠道粘膜屏障功能的完整性至关重要。高纤维饮食可以改善2型糖尿病患者的血糖控制和促进更健康的代谢状况。
素食与健康、肠道菌群多样性的变化以及厚壁菌和拟杆菌的优势有关。
高蛋白质和高脂肪的饮食与大量耐胆汁的菌群有关,如拟杆菌、嗜胆汁菌和厚壁菌,以及对厚壁菌的抑制。不过需要注意的是,这种饮食习惯,可能会导致免疫力降低、感染易感性增加和代谢性疾病的发展。因此,减肥人士也需谨慎。
具体如何选择可见后面章节。
▼ 季节 (果蔬也有属于它们的生长季节)
食物供应的季节性变化的影响菌群多样性。
首先,初步研究将坦桑尼亚的哈扎狩猎采集人与城市化人进行了比较,结果与意大利城市居民相比,哈扎人的饮食富含复杂的多糖,并表现出更高水平的微生物多样性,表现为拟杆菌的比例较高。
后续宏基因组分析显示碳水化合物活性酶的富集,这与觅食、富含多糖的饮食一致。肠道微生物组保留的代谢复杂碳水化合物和蛋白质的功能潜力,可能是由于食物供应的季节性变化。
哈扎人肠道菌群在组成上,经历了与湿季和旱季同时发生的季节性循环,其中 Prevotellaceae 、 Spirochaetaceae 是 2 个最具季节性变化的菌群。Prevotellaceae 的比例在雨季下降,这与宏基因组中存在的碳水化合物活性酶显着减少有关,特别是植物碳水化合物。
另一项研究针对北达科他州的社区哈特派人群,他们的夏季饮食富含高纤维的新鲜水果和蔬菜。与冬季相比,北达科他州的夏季肠道微生物群与拟杆菌门的丰度显着增加相关,而放线菌和厚壁菌门的丰度相应减少。
当然,在城市化人群中并没有这种现象。
总的来说,研究城市化程度、地理位置和特定食物供应的全球饮食模式,有助于在宏观层面上形成全球肠道微生物群的巨大异质性。
▼ 生活方式 (除了吃还有什么能改变菌群?动!)
——运动锻炼
在人类研究中,运动增加了肠道菌群的多样性,与蛋白质摄入量和肌酸激酶水平呈正相关。
与非运动员相比,运动员的拟杆菌水平较低,厚壁菌数量较多。
对运动产生反应的细菌种类包括乳酸杆菌、双歧杆菌和阿克曼菌,而其他种类则有所减少,如变形杆菌、Turicibacter、Rikenellaceae.
此外,在运动的反应中,产短链脂肪酸菌(尤其产丁酸菌),如梭菌Clostridiales、罗斯氏菌Roseburia、毛螺菌科Lachnospiraceae、Erysipelotrichaceae增加,并在调节运动对宿主肠道菌群的影响中发挥重要作用。

运动增强丰富菌群的机制是什么?
涉及内部和外部因素。
【内】对耐力训练的内在适应,如血流量减少、组织缺氧和转运增加,会导致胃肠道的变化。
【外】运动型个体暴露于他们的环境生物圈中,遵循整体健康的生活方式,促进更丰富的微生物群。
与对照组相比,运动员表现出较低的炎症和改善的代谢标志物,并且运动与较低的慢性炎症导致的发病率降低有关。
有研究人员提出,运动可以作为一种治疗支持,可用于治疗与失调相关的疾病,如肥胖和其他一些胃肠道疾病。
关于运动详见:《运动如何影响肠道微生物群,如何正确运动》
《肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?》
——吸烟
在戒烟的健康个体的粪便微生物群中也观察到显著的变化,包括厚壁菌门和放线菌门相对丰度的增加,拟杆菌门和变形菌门的减少。
研究证实,吸烟者和非吸烟者的口腔菌群存在显著差异。特别是在吸烟者的口腔中,卟啉单胞菌和奈瑟菌的繁殖增加,Gemella减少。


▼ 药物
抗生素的使用是一把双刃剑:它摧毁致病菌的同时,可能也伤害了有益菌,导致肠道微生物群失调,多样性大幅下降,并且需要一段时间才能恢复。
广谱抗生素导致厚壁菌门和拟杆菌门之间的不平衡。在治疗过程中,菌群整体多样性降低,这些细菌的丰度也降低。
微生物组组成的改变取决于抗生素类别、剂量、暴露时间、药理作用和目标细菌等。例如,连续两年服用克林霉素会导致肠道微生物群发生变化,而拟杆菌种类不会恢复。
在幽门螺杆菌治疗中使用克拉霉素会导致放线菌数量减少,而环丙沙星会导致治疗半年后仍未恢复的瘤胃球菌数量减少。
研究表明,氨苄青霉素、万古霉素、甲硝唑和新霉素具有长期的负面影响,可引起肠道菌群多样性的不可逆变化,从而增加宿主疾病的风险。
关于抗生素对菌群的影响详见:
《抗生素对微生物组及对人体健康的影响》
《细菌感染和抗生素使用》
《细菌的天敌抗生素,如何用好这把救命的双刃剑?》
其他药物也会降低菌群多样性,如治疗胃溃疡和反酸的质子泵类药物也会导致菌群多样性降低。
以上是常见的菌群多样性的决定因素,那么菌群多样性是如何对身体产生影响的?下一章节我们探讨这部分内容。
微生物组的多样性和平衡在人类健康中发挥着重要作用。
▼ 消化系统疾病
以IBD为例。
在 IBD 患者中,肠道菌群的多样性减少,这主要是由于厚壁菌门的多样性减少。在厚壁菌中,梭菌减少,尤其是普拉梭菌,普拉梭菌是产丁酸盐的菌群之一。这些菌群少了,产出来的丁酸盐就少,丁酸有什么用呢?
它能对肠道防御机制具有多阶段调节作用,包括通过促进肠上皮中的紧密连接蛋白保护肠粘膜屏障,支持先天性和适应性免疫反应,刺激成熟的结肠细胞,抑制未分化的恶性细胞和干细胞,通过降低环氧合酶-2(COX-2)水平抑制氧化应激,并通过诱导过氧化氢酶,改善过氧化氢(H2O2)的解毒作用。
丁酸也能刺激芳香烃受体(AhR)、GPR41和GPR109A受体,并抑制不同细胞类型的HDAC,从而稳定肠道屏障功能并减少炎症过程。
丁酸少了,肠道屏障可能受损,炎症反应增加,就会出现IBD等肠道疾病。
在克罗恩病(CD)、肠易激综合征(IBS)等消化系统疾病中,无论是否伴有腹泻和结直肠癌,都会持续观察到多样性降低。
乳糜泻患者的十二指肠相关微生物群多样性也不太理想。
艰难梭菌结肠炎复发的危险因素之一就是多样性降低。
扩展阅读:
《深度解析 | 炎症,肠道菌群以及抗炎饮食》
《炎症性肠病中宿主与微生物群的相互作用》
▼ 神经系统疾病
目前越来越多的研究表明,在抑郁症、帕金森病 、阿尔茨海默病等神经系统疾病中,肠道菌群多样性减少。
抑郁症、帕金森病和AD患者肠道菌群的变化
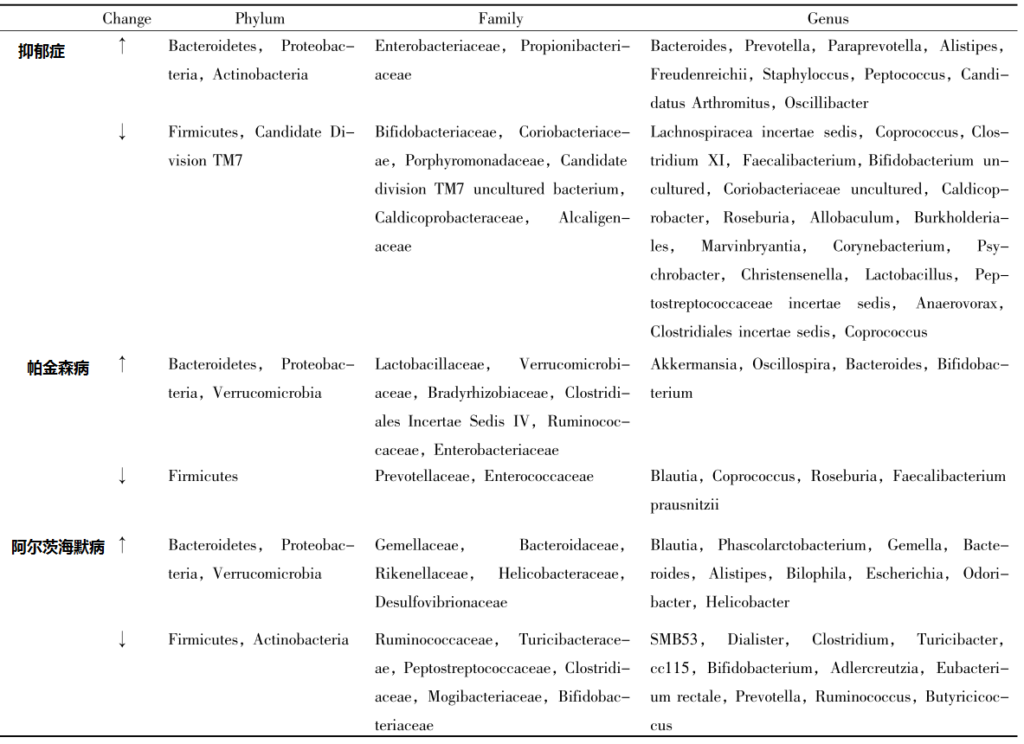
MU Xin et al., Chinese Pharmacological Bulletin 2019
扩展阅读:《肠道微生物组在人类神经系统疾病中的作用》
《最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用》
《深度解读 | 肠道菌群和中枢神经系统的关系》
▼ 癌症
以乳腺癌为例。
乳腺癌患者多样性减少。一项基于人群的病例对照试验研究中,调查了绝经后妇女的粪便微生物群与乳腺癌之间的关系。发现与对照组患者相比,病例患者的微生物群组成显着改变(β-多样性,P = 0.006)和较低的α-多样性(P = 0.004)。
肠道菌群失调可诱发慢性炎症,因此有可能影响乳腺癌的发展。
扩展阅读:《肠道微生物群与五种癌症的相互作用:致癌 -> 治疗 -> 预后》
《结直肠癌防治新策略——微生物群》
《“隐藏高手” 胰腺癌的新出路——微生物》
《肺癌最新研究进展,与肠肺微生物息息相关》
《深度解析 | 肠道菌群与慢性肝病,肝癌》
▼ 代谢类疾病
肥胖
一般来说,肥胖个体的微生物多样性低于瘦的个体。饮食干预可以改善微生物的丰富度和相关的临床表型,例如改善代谢和炎症状态。
扩展阅读:《体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)》
糖尿病
1 型糖尿病患者的肠道微生物群,高水平的拟杆菌,大量产生乳酸和丁酸的细菌以及细菌功能多样性降低。
2型糖尿病前期,菌群多样性就已经存在下降趋势。
扩展阅读:《2型糖尿病如何做到可防可控?肠道菌群发挥重要作用》
▼ 儿童发育
对来自孟加拉国的营养不良儿童和营养良好的健康儿童的肠道微生物群进行了横向比较研究,结果发现,营养不良儿童微生物群的多样性显著降低。
扩展阅读:《生命早期营养不良和微生物群影响大脑发育和行为》
《真实案例 | 儿童发育迟缓肠道菌群检测的应用》
《发育迟缓/营养不良不容忽视,问题很有可能在肠道》
▼ 心脑血管疾病
高血压个体的肠道微生物多样性减少,厚壁菌门/拟杆菌门比率增加。
扩展阅读:《认识肠道微生物及其与高血压的关系》
《饮食-肠道微生物群对心血管疾病的相互作用》
▼ 免疫系统疾病
以过敏为例。
在出生第一年甚至更早的时候,饮食多样性可能对预防过敏产生积极影响。早期接触多种食物抗原可能会促进免疫耐受的发展。
扩展阅读:《婴幼儿过敏有望改善,与肠道菌群密切相关》
《生命早期微生物接触和过敏风险:如何预防》
《微生物群对三大过敏性疾病发展的影响》
▼ 睡眠
人类肠道微生物群可以通过脑-肠道微生物群轴影响健康。
一项研究使用活动描记术量化睡眠测量,并结合肠道菌群采样,以确定肠道菌群与各种睡眠生理测量之间的相关性。测量了免疫系统生物标记物,并进行了神经行为评估,因为这些变量可能会改变睡眠和肠道菌群组成之间的关系。
总微生物组多样性与睡眠效率、总睡眠时间的增加呈正相关,睡眠越好,肠道菌群多样性越丰富,与睡眠开始后的觉醒呈负相关。
总微生物组多样性与IL-6之间存在正相关。微生物组分分析显示,拟杆菌和厚壁菌门内的丰富性与睡眠效率、IL-6浓度和抽象思维呈正相关。研究人员也发现了几个分类群(Lachnospiraceae, Corynebacterium, Blautia)与睡眠指标呈负相关。
肠道菌群多样性高有助于减轻压力,改善睡眠。
扩展阅读:
《肠道菌群与睡眠:双向调节》
《深度解析|睡眠健康与肠道健康之间的双向联系》
以上是菌群多样性与疾病的关联,了解这些我们可以有针对性地去改善菌群多样性。
我们在实际检测中会发现有这样一种情况:
多样性指标虽然很高,但是整体看起来健康总分并不理想。甚至还有很多慢性疾病风险,这是为什么呢?
这种情况可能是核心菌群丰度不够,核心菌群在代谢、免疫等方面都发挥重要作用,一旦核心菌群丰度下降,则可能造成外源物质侵入。感染、旅行等可能会出现这种情况。
如果发现肠道菌群检测报告中多样性很低,该如何判别具体情况,这要看以下几种情况:
✦
总的来说,在一定范围内,更高的多样性通常代表饮食更加丰富多样,同时也意味着更健康的身体状况。
✦
一个健康、有弹性的肠道微生物群依赖于高丰富性和生物多样性,也就是说,当你的肠道菌群多样性相对较高时,会更强大、更稳定。
就好比你拥有一支队伍,有很多不同类型的、不同专长的人可供你使用时,整体的能力就会很强大。


前面我们已经知道,菌群多样性的各种决定因素,例如,饮食、年龄、遗传、环境等。
多样性低不代表一定有疾病,但是更容易受到饮食,环境或疾病的影响,包括更易发生水土不服或更容易因饮食不洁导致腹泻等。菌群多样性低可能是肠道菌群不健康不稳定的一种表现形式。
当然,也不能过度追求菌群多样性高。
随着对饮食-微生物组-健康轴的理解逐渐加深,最近创造了个词叫“食品药学”,即“食品作为药物”的概念逐渐得到推广,基于个体微生物组特征的“食物疗法”的个性化得到越来越多的关注。
饮食干预引起的改变可能在几周甚至几天就会发生。对调节肠道菌群而言,饮食调节是一个非常重要且纯天然的方式。那到底该吃什么?如何吃?
我们可以从食物种类,饮食结构,饮食质量等多个角度去优化日常饮食,从而调节菌群。
✔ 食物种类:
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
食用膳食纤维时,各种菌群可以利用这些膳食纤维作为基质,扩大其种群,从而增加微生物组的总体多样性。
许多住在结肠和盲肠内的厌氧细菌,依赖于复杂碳水化合物的代谢来产生短链脂肪酸,短链脂肪酸是肠粘膜的重要能量来源,在宿主代谢、免疫功能和细胞增殖中发挥关键作用。
丁酸盐是肠道中一种丰富的短链脂肪酸,在结肠癌中起着复杂的作用,如最近的两项临床前研究所示,丁酸盐似乎是浓度和环境依赖性的。丁酸盐可以抑制肿瘤的发生,因为丁酸盐受体Grp109a缺乏的小鼠增加了炎症刺激或APC突变促进的肿瘤发生,并且通过Grp109a的信号传导抑制了这些刺激诱导的肿瘤发生。
▸ 富含膳食纤维的食物在哪里?
膳食纤维可以在各种水果、蔬菜、坚果、种子、豆类和谷类中找到。

吃洗过的生水果和蔬菜,这些水果和蔬菜含有环境微生物(如果难以消化生蔬菜,可以榨汁),包括益生元,以促进多样化的微生物群,不要只吃某一种蔬菜或水果。
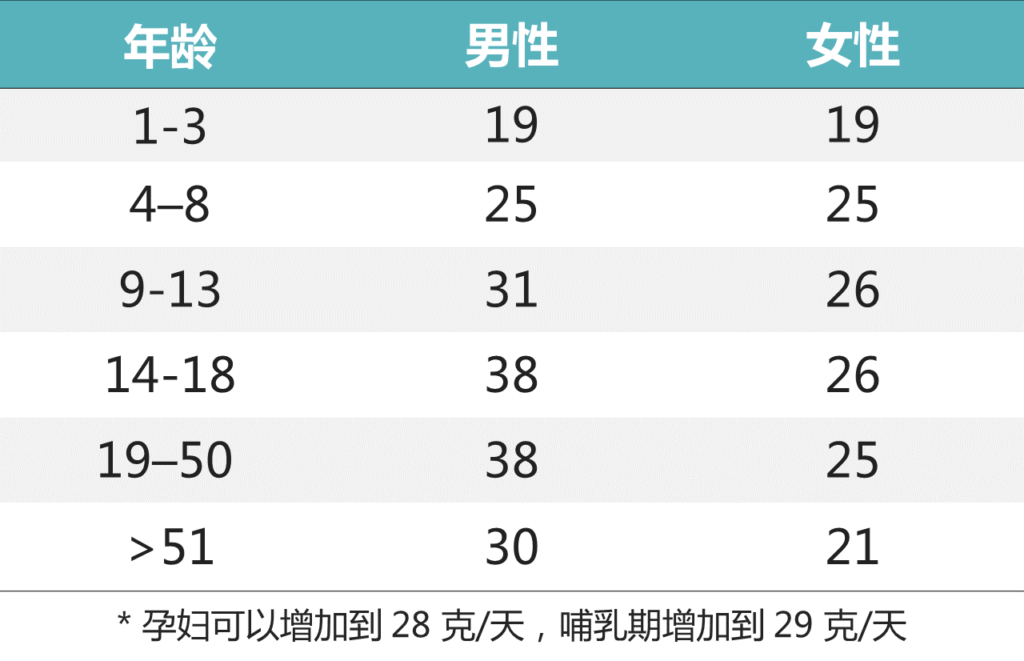
▸ 足量的膳食纤维该吃多少?
推荐的纤维摄入量(充足摄入 克/天)
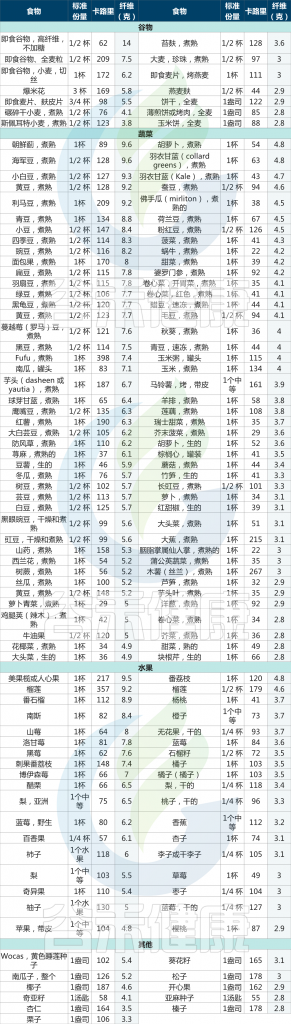
▸ 具体哪些水果蔬菜中的富含膳食纤维?
各类水果蔬菜中每标准份量膳食纤维的含量及热量

数据来源:U.S. Department of Agriculture, Agricultural Research Service. FoodData Central
同时,水果蔬菜里面一般富含多酚,多酚可以塑造肠道细菌的组成。
Vemana Gowd, et al.,Trends in Food Science & Technology, 2019
白藜芦醇
食用白藜芦醇可减轻结肠炎小鼠模型中的炎症状态并恢复微生物群多样性。
新的证据表明,红酒中的白藜芦醇能通过支持短链脂肪酸的产生来预防阿尔茨海默病 (AD),短链脂肪酸会干扰有毒的 β-淀粉样蛋白聚集体形成。在AD背景下,白藜芦醇的消耗与较高比例的有益菌有关,例如 F. prausnitzii、Akkermansia 物种和具有脑抗炎特性的产丁酸盐细菌。
姜黄素
姜黄素能够部分逆转多样性的变化 肠道微生物群,增加 F/B 比并降低 Anaerotruncus 和 Helicobacter 属的丰度。
已证明,姜黄素治疗降低了在癌症患者中发现的与癌症相关的菌群丰度(例如普氏菌属、冠状杆菌属和瘤胃球菌属)。
富含多酚的食物包括:


此外,饮食中添加全麦大麦、糙米或这两种的混合物会增加菌群多样性。
发酵食品是益生菌的另一个重要来源。
2021 年 7 月的《细胞》杂志上,健康成年人被分为两组,21人食用水果、全谷物、豆类、蔬菜、坚果和种子等高纤维食品,18人食用发酵食品。
在试验前的三周、指定饮食后的10周内,以及研究结束后的四周内,当参与者想吃什么就吃什么时,从受试者身上收集粪便样本。还采集了血液样本以测量炎症和免疫功能。
结果发现食用发酵食品的人,除了增加肠道微生物群的多样性外,同时对四种免疫细胞的激活程度较低,包括IL-6在内的几种炎症蛋白水平也降低。
然而,在大多数情况下,发酵食品对我们肠道微生物群的改变是暂时的,因此,持续摄入发酵食品更有利于对于维持高水平的有益菌。
▸ 发酵食物有哪些?
坚果(尤其是核桃)对健康有益,食用坚果可以降低血脂水平。核桃如何改变菌群?
在一项随机对照试验(交叉设计)中,96名健康参与者接受了为期8周的富含核桃的饮食,然后改用无坚果饮食。第二组98名参与者按相反顺序遵循饮食模式,收集粪便样本做16S rRNA测序分析。
在α多样性方面没有发现差异,但在β多样性方面,观察到核桃和对照组的明显聚集,也就是说,他们的菌群发生明显变化。
与对照饮食相比,核桃饮食仅解释了观察到的差异的5%左右。在核桃组,与对照组相比,瘤胃球菌Ruminococcaceae和双歧杆菌的丰度显著增加,同时梭状芽孢杆菌属簇XIVa物种的数量减少。
因此,摄入核桃可能会促进肠道微生物群向潜在的益生菌和产短链脂肪酸菌群的组成转变。核桃含有丰富的多酚和n-3 脂肪酸,这两种脂肪酸都具有益生元特性。
以上是各类食物对菌群多样性的影响。那么这些食物如何搭配在一起可以对菌群产生更好的影响?
这就涉及到日常饮食结构。
以现代地中海饮食金字塔为代表的高品质饮食,包括大量食用水果和蔬菜、豆类、坚果和全麦,适量橄榄油、鱼、家禽和酒,尽可能少吃红肉、糖果和加工肉类等食品。
坚持地中海饮食与降低疾病风险和改变微生物多样性有关。
地中海饮食评分与拟杆菌、普氏杆菌丰度较高呈正相关,与双歧杆菌/大肠杆菌的比例、粪便丙酸盐和丁酸盐浓度较高呈正相关。
地中海饮食中存在的典型食物成分与肠道微生物群中特定菌株的存在相关。
例如,全谷物与双歧杆菌、粪杆菌、 Tenericutes、Dorea的存在有关。橄榄油和红酒的食用量与Faecalibacterium的存在有关,蔬菜的食用量与Rikenellaceae, Dorea, Alistipes Ruminococcus存在有关,豆类与Coprococcus的存在有关。同一作者还观察到饮食中的多酚含量(通常在地中海饮食中较高)与特定梭菌(XIVa)和粪杆菌簇的存在之间存在相关性,这些梭菌簇能够合成丁酸,可能具有抗炎作用(如Akkermansia,也更多地与地中海饮食相关)。

doi: 10.3390/nu13010007
地中海饮食它没有指定份量大小或具体数量。由每个人根据自身情况设定每餐吃多少,大致比例参考以上金字塔。
目前认为的健康的饮食结构越来越偏向于,强调植物性食物和少吃红肉的饮食。
在地中海饮食结构中,我们可以看到,这类饮食结构的特点是:水果、蔬菜、高纤维食物类占比较多。
大多数研究表明,以植物为基础的饮食可以促进微生物的多样性。与杂食动物相比,纯素食者和素食者菌群具有显着更高的 α 多样性,也就是丰富度。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
一些研究表明,高纤维饮食可以降低体重增加的风险。高纤维饮食随后有助于形成高度多样的微生物群。
高纤维饮食的摄入会降低饮食的能量密度,从而导致体内的短链脂肪酸促进体内更高水平的糖异生。这会导致肠促胰岛素的形成,从而使人更快、更长时间地拥有饱腹感。
地中海饮食与肠道菌群生长之间的相关性
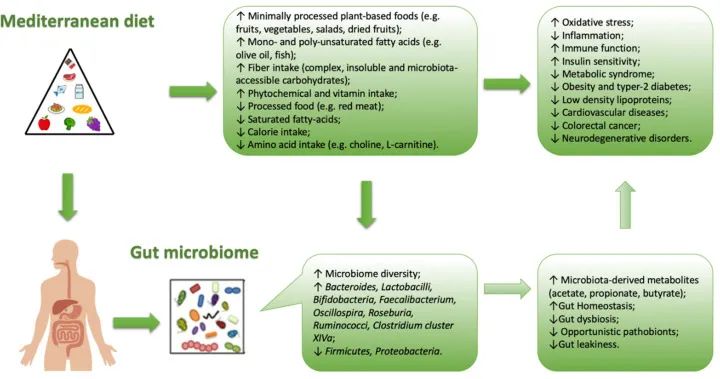
doi: 10.3390/nu13010007
此外,我们看到,地中海饮食结构中红肉类,加工肉类等是需要少吃,那么脂肪是否足够?能不能满足人体需求?
不必担心,地中海饮食中含有大量植物脂肪,这些脂肪来自橄榄油(主要是特级初榨橄榄油)和坚果,它们属于高脂肪能量密集型。
★ 地中海饮食中含有优质脂肪
榛子、 杏仁、夏威夷果、开心果、腰果等,都是单不饱和脂肪酸的重要来源。此外,核桃、碧根果和夏威夷果还富含植物性ω-3脂肪酸。核桃中的ω-3脂肪酸与ω-6脂肪酸的比例极好。
研究表明这些脂肪源与健康代谢状况直接相关,对改善大脑健康、消减炎症、降低各种原因的死亡风险和预防心脏病等有明显的作用,主要归因于它们的特定脂肪成分和生物活性分子含量。
ω-3脂肪酸,在肠道微生物群中的作用,可以调节炎症反应,改善结肠炎时的上皮屏障。
注:炎症反应是几种慢性非传染性退行性疾病的基础,如动脉粥样硬化、癌症、神经退行性疾病、慢性肾功能衰竭、糖尿病、男性肥胖、继发性性腺功能减退等。
地中海饮食中,除了坚果之外,鱼类、海鲜等食物都富含ω-3脂肪酸。显然优质的脂肪更有利于健康。
除了以上脂肪之外,地中海饮食中强调,“鱼和海鲜、鸡蛋、家禽类和高脂奶制品的摄入量每周几次;红肉每月只吃几次”,那么,蛋白质的量是否足够满足人体需求?
我们来看看地中海饮食中,蛋白质对菌群的影响。需要考虑多方面,比如蛋白质的数量、质量、加工方式和来源。
★ 高蛋白饮食可能不利于健康,地中海饮食中蛋白比例更合适
研究表明,与正常蛋白质饮食(20% 蛋白质,56% 碳水化合物)相比,喂给 Wistar 大鼠的高蛋白饮食(45% 蛋白质,30% 碳水化合物)对结肠微生物群有不利影响。
在高蛋白饮食中,链球菌、大肠杆菌/志贺菌和肠球菌分别增加了5.36倍、54.9倍和31.3倍,其丰度与与疾病发病相关的基因和代谢物(包括代谢物尸体)呈正相关,它来源于赖氨酸的脱羧作用,大量使用已被证明会引起氧化应激和DNA损伤。
有益菌在高蛋白饮食中大量减少,包括丁酸生产菌F.prausnitzii(减少3.5倍)、瘤胃球菌(减少8.04倍)和Akkermansia(在高蛋白饮食组中未检测到)。
慢性肾病下,长期低蛋白饮食更有利于改善健康。
研究表明,六个月的低蛋白饮食(0.6 g/kg/天)可以降低非透析慢性肾病患者的血清尿毒症毒素水平,包括对甲酚硫酸盐。低蛋白饮食也与肾功能改善、总胆固醇和低密度脂蛋白胆固醇降低有关。
★ 植物来源的蛋白比动物来源蛋白可能更有利于菌群和健康
在喂食大豆、猪肉、牛肉、鸡肉、鱼类和酪蛋白(后者作为对照)的大鼠中进行了为期14天的喂食试验,结果显示,到第2天,尤其是红肉(猪肉和牛肉)和白肉(鱼和鸡肉)之间的变化。主成分分析显示,在第7天和第14天有不同的微生物群,因此大豆蛋白组与肉类和对照组分开,也就说菌群特征显著变化。
在另一项类似的研究中,与喂食白肉、红肉或酪蛋白的大鼠相比,大豆蛋白与大鼠粪便短链脂肪酸增加有关。大豆组中拟杆菌和普氏杆菌的相对丰度也较高,它们是丙酸盐和其他短链脂肪酸的主要生产者。
另外研究发现,与接受牛奶分离蛋白的仓鼠相比,大豆喂养的仓鼠的血脂显著降低,至少部分原因是大豆蛋白引起的肠道微生物群变化。在高脂饮食制度下,大豆分离蛋白减少了高脂饮食诱导的小鼠体重增加和脂肪组织质量积累,并减轻了肝脏脂肪变性,而乳蛋白没有观察到这种情况。
荞麦蛋白抑制大肠杆菌的生长,促进乳酸杆菌、肠球菌和双歧杆菌的生长,后者与血脂密切相关。荞麦喂养的小鼠粪便中总胆汁酸和短链脂肪酸的排泄量显著增加。
绿豆蛋白在降低高脂饮食诱导的小鼠体重增加方面也优于酪蛋白。绿豆蛋白导致GLP-1分泌增加,盲肠和粪便胆汁酸池增加,次级和初级胆汁酸比率显著升高;在无菌小鼠中被消除的效应。就肠道微生物群而言,食用绿豆作为高脂肪饮食的一部分,导致了瘤胃菌科的扩张,并导致拟杆菌门分类群的增加和厚壁菌门丰度的减少。
乳清蛋白提取物和豌豆蛋白已被证明可以增加多样性、双歧杆菌和乳酸杆菌,其中,乳清蛋白提取物减少拟杆菌和梭菌。
以上这些研究清楚地表明,植物源性蛋白质在促进有益微生物群方面优于动物源性蛋白质,对宿主代谢具有积极影响。
蛋白质的加工(包括热加工)及其对蛋白质功能的影响(包括微生物组的调节)尚不完全清楚,需要进一步研究。
因此,在我们的饮食干预中,不能认为高蛋白饮食一定是健康的,还取决于其来源、加工方式等方面,对待“高蛋白饮食”需谨慎,尤其是在长期或反复饮食实践中。
我们可以看到,地中海饮食结构中,来源于动物蛋白只占金字塔上部(比例较小),无论是对慢病患者或者普通人群,都是一种更为安全、稳妥、健康的选择。
以上是地中海饮食结构对菌群多样性及健康的影响。那么知道吃什么,如何搭配之后,还需要注重什么?
✔ 饮食质量
同样是植物性饮食,有些高温下高油高盐等烹饪方式也会影响其营养。
为了防止破坏大量维生素、矿物质和纤维,加工烹饪的时候应尽量简化。天然食物的本味,对味蕾和身体是一种滋养。
在有条件的情况下,可以尽可能选用本地的、应季的新鲜蔬果作为食材。
高度加工的食物,富含脂肪、精制糖、盐等,与肠道微生物多样性降低有关,对宿主健康产生负面影响。
此外,各类添加剂比如,羧甲基纤维素 (CMC) 和聚山梨醇酯 80 (P80) 这两种乳化剂会降低肠道的微生物多样性并显着改变微生物群组成。
关于食品添加剂对菌群影响详见:《你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化》
服用含有益生元的食物,乳糖不耐症的症状减轻。
低聚半乳糖是益生元,通过刺激肠道中的有益细菌对人体有益。对于乳糖不耐症患者,当低聚半乳糖诱导的微生物群变化增加了双歧杆菌、粪杆菌、乳酸杆菌、Roseburia等乳糖发酵物种的丰度时,它们会起到有益作用。
一项研究观察到,通过向参与者喂食高纯度低聚半乳糖(>95%),乳糖不耐受相关症状得到改善。在有反应的受试者中,观察到微生物组的组成发生了显著变化,但是,双歧杆菌、乳酸杆菌和粪杆菌,所有乳糖发酵菌均出现增加,50%的原本腹痛的受试者报告在使用低聚半乳糖治疗结束时没有腹痛。在将乳制品重新引入饮食后,喂低聚半乳糖的受试者在治疗后,乳糖耐受性的可能性也增加了六倍。
总的来说,以上这些研究强调了饮食对肠道菌群及其对人体的深远影响,具体取决于摄入的食物种类、饮食结构、饮食质量等。除了饮食之外,其他方式也能对菌群产生影响,具体如下:
益生菌
益生菌通过多种机制发挥作用,对肠道菌群的多样性产生积极影响,并改变人体的免疫反应,与改善多种慢性疾病密切相关。
研究发现,益生菌会抑制肠杆菌科(志贺氏菌和埃希氏菌)的生长,同时促进厚壁菌门的大量增殖,尤其是厌氧菌属。益生菌具有帮助从抗生素治疗中恢复个体菌群的显著能力。
益生菌可以直接作用于肠黏膜层和下层上皮,影响肠屏障功能和黏膜免疫;也可以通过调节常驻微生物种群结构或酶活性对宿主产生间接影响。
益生元
益生元本质上是一种肠道菌群的肥料,可以滋养有益菌群。例如,菊粉等益生元支持双歧杆菌的平衡。
益生元通过多种方式与潜在病原体、免疫系统的直接相互作用,调节肠道环境,从而有利于人体健康。
关于益生菌、益生元这部分内容由于在前面的文章中多次提到,此处就不详述了,详见:
《如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍》
《益生菌的靶向递送:研究和商业化前景》
《益生菌的简单入门指南》
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
详见:《维生素D与肠道菌群的互作》
缺铁可能导致微生物群组成的显著重组,微生物多样性降低。
详见:《人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长》
如果从婴儿时期开始,住在农村或者养宠物,可能对儿童菌群多样性的建立比较有益。
另外,多去户外活动,亲近大自然。
一项研究对城市环境生物多样性进行人为干预试验,以检测其对儿童共生菌群和免疫调节的影响。在为期28天的生物多样性干预期间,对标准城市托儿所和自然托儿所的儿童进行对比分析,研究儿童皮肤和肠道微生物群以及血液免疫标记物的变化。
干预使环境和皮肤Gammaproteobacteria群落多样化,这反过来又与血浆TGF-β1水平和调节性T细胞比例的增加有关。
该研究发现,生物多样性干预增强了免疫调节途径,降低城市社会中免疫介导疾病的风险。
这可能为未来的预防方法提供了很大的参考价值。
写在最后
跟任何生态系统一样,我们的肠道菌群处于一种微妙的平衡。在不断变化的环境中,我们永远不知道自己会遇到什么新的威胁。
肠道菌群多样性高,能使整体菌群更有能力去抵抗外界的干扰,例如压力,抗生素药物等。
当然,对于“菌群多样性”这个指标,我们也应该理性看待,多样性出现异常高,如果是各类致病菌大量定植,核心菌群难以生存,那么也不利于健康…
肠道菌群检测报告可以帮助我们从更多角度去看待肠道菌群的整体状况,利用机器学习等最新技术,发现潜在的疾病风险,反映不同营养物质摄入比例,应该多吃什么、尽量少吃什么…
每个人对于要达到健康这个目的,可能有不同的路径,饮食需求不能一概而论,“个性化饮食建议”可以成为我们的健康指向标。我们可以利用好它,结合自身健康状态,有针对性地做出饮食或其他干预措施,从而达到更接近理想的健康状态。
主要参考文献:
Fatima Enam, Thomas J Mansell, Prebiotics: tools to manipulate the gut microbiome and metabolome, Journal of Industrial Microbiology and Biotechnology, Volume 46, Issue 9-10, 1 October 2019, Pages 1445–1459
Rinninella, Emanuele et al. “What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases.” Microorganisms vol. 7,1 14. 10 Jan. 2019, doi:10.3390/microorganisms7010014
Wu Y, Wan J, Choe U, Pham Q, Schoene NW, He Q, Li B, Yu L, Wang TTY. Interactions Between Food and Gut Microbiota: Impact on Human Health. Annu Rev Food Sci Technol. 2019 Mar 25;10:389-408. doi: 10.1146/annurev-food-032818-121303. PMID: 30908952.
Muralidharan J, Galiè S, Hernández-Alonso P, Bulló M, Salas-Salvadó J. Plant-Based Fat, Dietary Patterns Rich in Vegetable Fat and Gut Microbiota Modulation. Front Nutr. 2019;6:157. Published 2019 Oct 11. doi:10.3389/fnut.2019.00157
Fitzgerald E, Lambert K, Stanford J, Neale EP. The effect of nut consumption (tree nuts and peanuts) on the gut microbiota of humans: a systematic review. Br J Nutr. 2021 Mar 14;125(5):508-520. doi: 10.1017/S0007114520002925. Epub 2020 Jul 27. PMID: 32713355.
Azcarate-Peril MA, Ritter AJ, Savaiano D, Monteagudo-Mera A, Anderson C, Magness ST, Klaenhammer TR. Impact of short-chain galactooligosaccharides on the gut microbiome of lactose-intolerant individuals. Proc Natl Acad Sci U S A. 2017 Jan 17;114(3):E367-E375. doi: 10.1073/pnas.1606722113. Epub 2017 Jan 3. PMID: 28049818; PMCID: PMC5255593.
Smith RP, Easson C, Lyle SM, et al. Gut microbiome diversity is associated with sleep physiology in humans. PLoS One. 2019;14(10):e0222394. Published 2019 Oct 7. doi:10.1371/journal.pone.0222394
Spolidoro GCI, Azzolino D, Cesari M, Agostoni C. Diet Diversity Through the Life-Course as an Opportunity Toward Food Allergy Prevention. Front Allergy. 2021;2:711945. Published 2021 Sep 24. doi:10.3389/falgy.2021.711945
Ecklu-Mensah G, Gilbert J, Devkota S. Dietary Selection Pressures and Their Impact on the Gut Microbiome. Cell Mol Gastroenterol Hepatol. 2022;13(1):7-18. doi:10.1016/j.jcmgh.2021.07.009
Merra G, Noce A, Marrone G, et al. Influence of Mediterranean Diet on Human Gut Microbiota. Nutrients. 2020;13(1):7. Published 2020 Dec 22. doi:10.3390/nu13010007
Elena Mengheri, Diet Quality Is Associated with Microbial Diversity and Host Health, The Journal of Nutrition, Volume 149, Issue 9, September 2019, Pages 1489–1490
Wilson, Annette S et al. “Diet and the Human Gut Microbiome: An International Review.” Digestive diseases and sciences vol. 65,3 (2020): 723-740. doi:10.1007/s10620-020-06112-w
Huang C, Feng S, Huo F, Liu H. Effects of Four Antibiotics on the Diversity of the Intestinal Microbiota. Microbiol Spectr. 2022 Mar 21:e0190421. doi: 10.1128/spectrum.01904-21. Epub ahead of print. PMID: 35311555.
Shreiner AB, Kao JY, Young VB. The gut microbiome in health and in disease. Curr Opin Gastroenterol. 2015;31(1):69-75. doi:10.1097/MOG.0000000000000139
Sakkas H, Bozidis P, Touzios C, Kolios D, Athanasiou G, Athanasopoulou E, Gerou I, Gartzonika C. Nutritional Status and the Influence of the Vegan Diet on the Gut Microbiota and Human Health. Medicina (Kaunas). 2020 Feb 22;56(2):88. doi: 10.3390/medicina56020088. PMID: 32098430; PMCID: PMC7073751.

谷禾健康
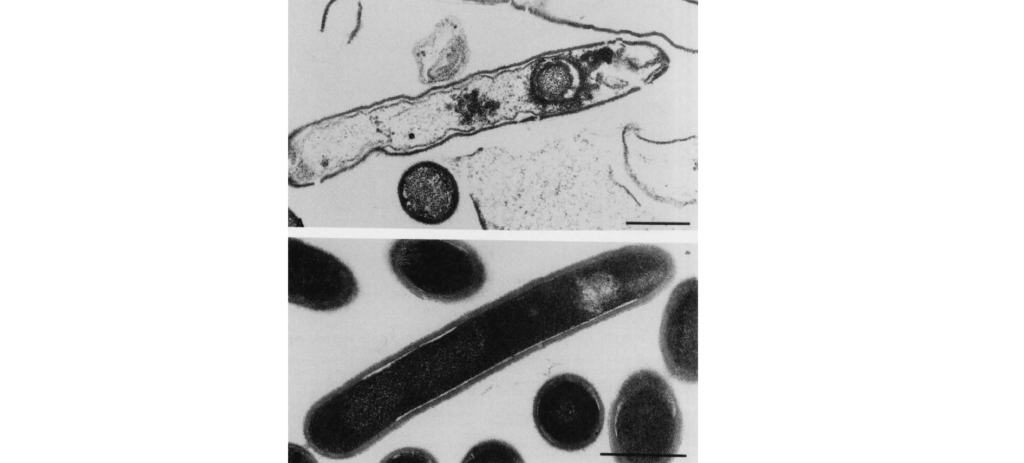
梭杆菌属(Fusobacterium),是梭菌门最主要的菌属,厌氧革兰氏阴性细菌,与拟杆菌属、普氏菌属、卟啉单胞菌属一样都是医学上重要的厌氧革兰氏阴性杆菌。
梭杆菌属是人类和动物的身体共生菌之一,主要定植在人类和动物的粘膜中,两个最主要的聚集地是口腔和结肠,某些类型物种属于机会性病原体,会引起菌血症和各种快速进展的感染。这些微生物比大多数正常的厌氧菌群更具毒性,产生重要的 脂多糖(LPS),内毒素和溶血素等,这可能是毒力的原因。
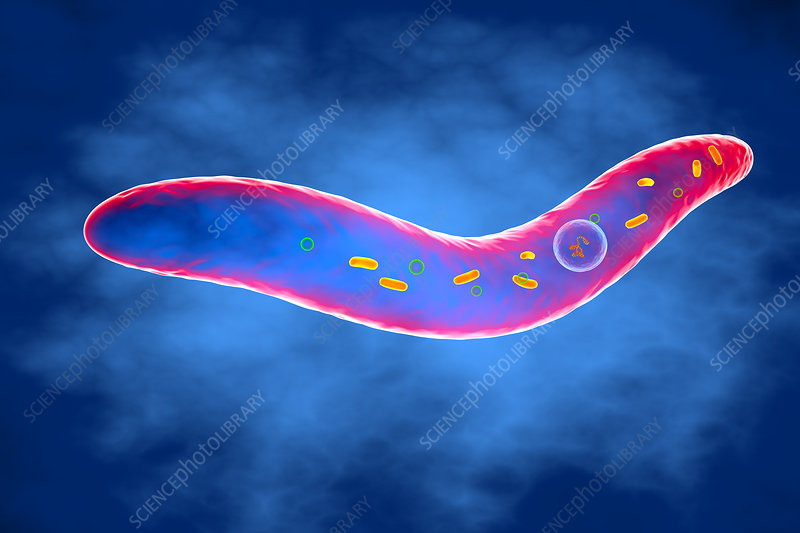
其中具核梭杆菌(Fusobacterium nucleatum, 简F. nucleatum)和坏死梭杆菌(Fusobacterium necrophorum,简F. necrophorum) 是可怕的厌氧病原体之一,最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、口腔癌、溃疡性结肠炎、克罗恩病和结直肠癌有关。
此外,梭杆菌与大约一半的头颈部厌氧菌感染有关,包括牙龈和牙齿感染、慢性扁桃体炎、慢性鼻窦炎、中耳炎、咽旁感染以及口腔感染。它们不仅在这些组织中繁盛,而且很容易扩散,有时会引起肿瘤、息肉、囊肿和其他无害组织块的破坏。即使是局部炎症环境的变化也可能导致无功能组织过度生长,因此也称为“癌杆菌”。
梭杆菌属对粘菌素和卡那霉素敏感,这将它们与拟杆菌属和卟啉单胞菌区分开来。一些菌株产生β-内酰胺酶并对青霉素耐药。
梭杆菌
梭杆菌是一种独特的细菌门,是以前研究不足的分类群中的一个主要例子。该门下研究广泛的主要是梭杆菌属。
梭杆菌属细菌是革兰氏阴性、不形成孢子的厌氧菌,球状、多形性小球(坏死梭杆菌)到杆状的一系列细胞形态。当杆状时,梭杆菌细胞具有平行的壁,具有圆形或锥形末端,可分为运动和不运动。
梭杆菌属DNA(G + C)含量约为26~34mol%,正常存在于人或动物的口腔、消化道和土壤中,已知对人和动物致病的有十几种以上,其中主要代表为具核梭杆菌(F. nucleatum)和坏死梭杆菌(F. necrophorum).
在健康人的粪便中,发现以下数量的梭杆菌:
幼儿: 108-109 CFU/g
成人: 107-1010 CFU/g
老年人:108-109 CFU/g
通常,在成人的口腔中,含有 102 -104 CFU/g 的梭杆菌。
在血琼脂上,梭杆菌会形成圆形或不规则的针状菌落,一些物种,如具核梭杆菌,在孵化 3 至 5 天后会形成伞形“煎蛋”菌落。根据菌株的不同,它们可以是溶血的,并且一些菌株具有血凝作用。
临床感染中最常见的梭杆菌属有:
具核梭杆菌、坏死梭杆菌。
它们几乎存在于儿童的所有类型的感染中,包括菌血症,与耳科疾病相关的脑膜炎 ,内脏破裂后的腹膜炎,以及口腔或肛门口附近的皮下脓肿等。
致病梭杆菌在生物膜(特别是软组织)中粘附革兰氏阴性和革兰氏阳性菌斑微生物的卓越能力使其成为一种高度侵入性的病原体。
最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、溃疡性结肠炎和克罗恩病有关。在免疫缺陷中,可引起继发性坏疽和化脓性坏疽过程。对于扁桃体炎,疱疹性口炎,儿童营养不良,免疫缺陷病,可能会发生梭菌病,扁桃体,口腔粘膜的坏死性炎症过程。
梭杆菌具有独特的代谢能力, 梭杆菌细胞通过发酵碳水化合物和蛋白获得能量。这种发酵产生丁酸盐,在某些情况下产生乙酸作为主要的代谢副产物。这是梭杆菌属物种与其他革兰氏阴性、非孢子杆状细菌的区别。
致病性
在革兰氏阴性厌氧菌中,梭杆菌作为主要病原体侵入人类宿主的能力很强。已经描述了许多毒力决定因素,包括白细胞毒素、蛋白水解酶、脂多糖(LPS)和血凝素的表达。
虽然是人体组织正常菌群的一部分,但梭杆菌可以在手术或意外创伤、水肿、缺氧和/或组织破坏后侵入组织。
★ 坏死梭杆菌 (F. necrophorum)
坏死梭杆菌在其细胞壁中含有特别强大的内毒素脂多糖,并产生一种促进凝块形成的凝固酶。此外,它还产生多种外毒素,包括杀白细胞素、溶血素、脂肪酶和细胞质毒素,所有这些都可能导致其致病。
坏死梭杆菌的粘附素和菌毛在宿主细胞附着中起关键作用。
白细胞毒素是已知的坏死梭菌的毒力因子,可能促进脓肿形成。内毒素和溶血素似乎也是脓肿形成和局部感染组织坏死增加的重要毒力因子。血凝素和尚未确定的导致血小板聚集的因素与Lemierre 综合征中发现的血栓形成后果相关性很大。
★ 具核梭杆菌 (F. nucleatum)
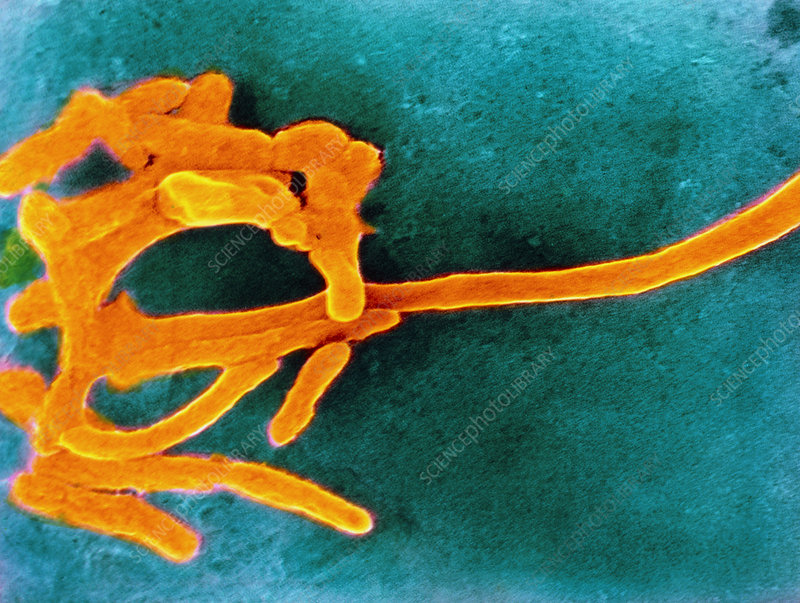
具核梭杆菌是少数利用氨基酸分解代谢来提供能量的非产孢厌氧物种之一,能使用谷氨酸、组氨酸和天冬氨酸。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。
但是,具核梭杆菌不使用葡萄糖作为其主要能源。现有数据表明,葡萄糖用于细胞内分子的生物合成,而不是能量代谢。具核梭杆菌也可以在低至 5 的 pH 值下存活。
——粘附各种细菌和细胞
具核梭杆菌是革兰氏阳性和革兰氏阴性物种之间物理相互作用的中心物种,可能对生物膜的形成很重要。
F. nucleatum具有外膜,于其细胞外表面上有大量蛋白质,可以发现细菌与宿主细胞表面上的各种互补结构具有特定的相互作用。这种粘附是由粘附素介导的。这种依从性对于易感宿主中感染的定植和建立非常重要。
它是附着在牙齿和上皮表面的共生体与真正的病原体。F. nucleatum有两种物质:菌毛和非菌毛粘附素,用于附着在其他细菌和细胞上。这些物质有助于定植以及细菌发病机制和感染。
——梭杆菌粘附 A (FadA)
梭杆菌粘附A (FadA) 是一种菌毛粘附蛋白,最近被证明是细菌附着和侵入牙龈上皮和内皮细胞所必需的。它在栖息于口腔黏膜的梭杆菌属中是保守的,并且对细胞结合很重要。
FadA 是一种含有 129 个氨基酸的蛋白质,具有 18 个氨基酸的信号肽。它具有一种分泌形式,可导致 β-连环蛋白途径和 Wnt 基因表达上调,这两种重要的发育途径在失调时都是致癌的主要原因。
FadA 的晶体结构揭示了一种独特的“亮氨酸链”结构,该结构在发生突变时会破坏宿主细胞的结合。尽管他们没有确定 FadA 的受体结合位点,但他们认为 FadA 作为细丝发挥作用,该区域的治疗靶点可能适用于未来的临床治疗。
梭杆菌多样性和生态位
从 1880 年代和 1890 年代开始,科学家们在各种人畜共患病和人类样本中发现了梭形杆状物,包括健康和患病的口腔。
以前梭杆菌属区分开来的特征主要是代谢与发酵和分泌的有机酸谱、吲哚和硫化氢的产生以及胆汁敏感性有关。尽管这些指标在区分梭杆菌中无法真正有效,从基因组上层面区分和鉴定梭杆菌属是在测序时代,而且还提高了对梭杆菌内部差异的理解。
目前梭杆菌属鉴定的有30 多个物种,包括:
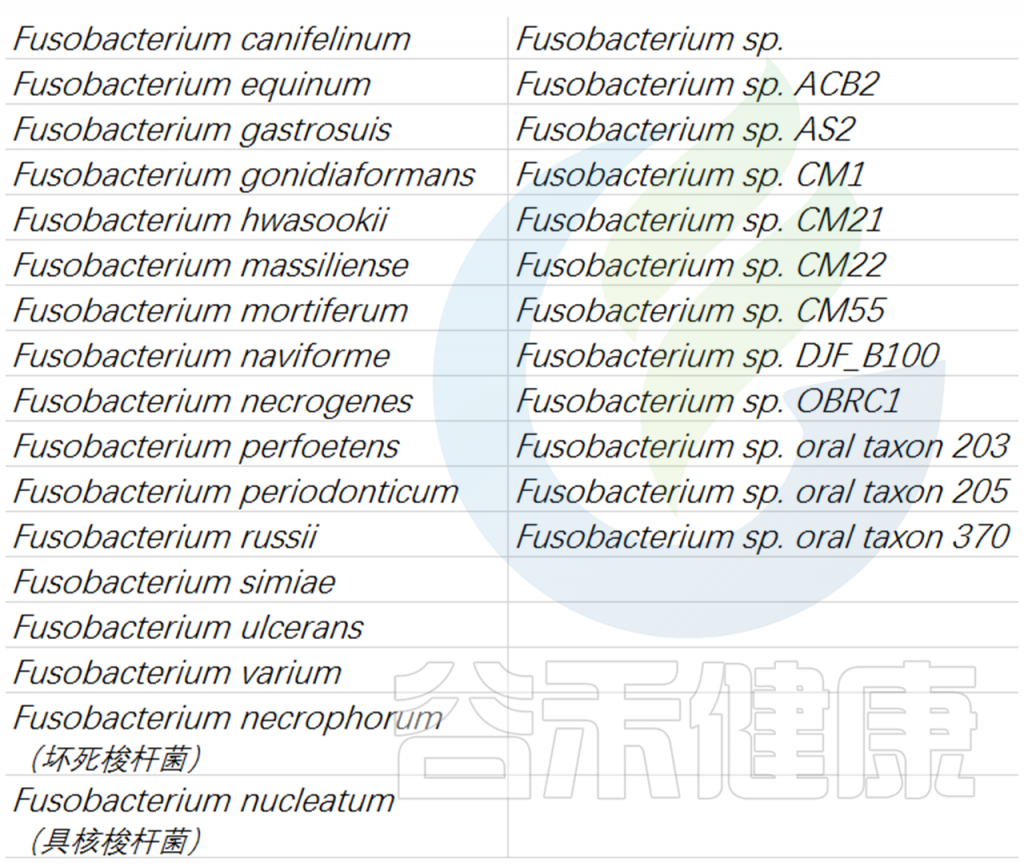
通过对 16s rRNA 序列的系统发育分组分析,发现F. nucleatum与拟杆菌属和黄杆菌属密切相关。
比较基因组学研究表明,梭杆菌物种之间主要可以分为三个谱系。在这个模型中,F. nucleatum 进化为与牙周梭杆菌的谱系,这些物种不仅共享一个生态位,而且还具有与宿主细胞入侵相关的相似功能。
F. nucleatum本身可进一步划分为四个亚种:nucleatum、animalis、vincentii、polymorphum
虽然有人认为这些亚种在 DNA 水平上有足够的差异,可以被认为是独立的物种。
梭杆菌栖息在人类和动物的粘膜中,是两者的病原体。由于其致病性和寄生性,梭杆菌不会直接影响环境,但它可能会通过对受感染宿主动物菌群的影响来改变生态系统。
常见感染
一些梭杆菌菌株会导致多种人类疾病,包括牙周病、Lemierre 综合征和局部感染或溃疡。
较早的研究表明梭杆菌在人类口咽部很常见,但目前的共识是梭杆菌应始终被视为病原体。与拟杆菌属相比,梭杆菌属具有强效的脂多糖。
在与牙周病统计学相关的所有牙周菌群中,具核梭杆菌是在其他身体部位发现的临床感染中最常见的。
“具核梭杆菌心包炎”——一名疑似感染分枝杆菌的 49 岁男子胸部发现具核梭杆菌心包炎。被认为分枝杆菌是原因,因此对他使用了抗结核药物。然而,这是F. nucleatum导致的。这一发现使人们认识到,具核梭杆菌通过口咽入口进入是导致此类疾病的原因。这是较早的发现之一,即具核梭杆菌也可能影响除口腔以外的其他体腔。
一些身体感染包括:皮肤溃疡、扁桃体周围脓肿、脓肌炎和化脓性关节炎、菌血症、肝脓肿、宫内感染、细菌性阴道病、尿路感染、心包炎和心内膜炎、肺和胸膜肺感染。巧合的是,它更常见于儿童体内。
F. necrophorum 在某些类型的感染中可能具有很强的毒性。在心绞痛后脓毒症(Lemierre 综合征)中,感染始于膜感染,如扁桃体炎,然后发展为伴有转移性感染的败血症,包括肺脓肿、脓胸、肝脓肿、骨髓炎和化脓性关节炎。
梭杆菌属以多种方式与其他细菌相互作用。相对于人类口腔和胃肠道中同时存在的微生物,梭杆菌属可以是互惠者、促进者、拮抗者和/或协同者。
梭杆菌代谢的副产物可以促进其他细菌种类的生长。上面提到的梭杆菌粘附素库就允许与许多不同的菌属共聚集,甚至可以促进其他非侵入性细菌物种的入侵。
担当调解者——连接主要定植菌和厌氧菌——有益牙周健康
F. nucleatum在有助于牙周健康和疾病的生物膜中发挥不可或缺的有益作用。在牙菌斑生物膜中,具核梭菌作为桥梁生物在结构上起到支持作用,将主要定植菌(如链球菌属)与主要厌氧的次级定植菌(牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans )连接起来。
许多口腔微生物,包括梭杆菌属是专性厌氧的,并且作为生物膜的一部分存在于口腔的富氧环境中。然而,溶解在唾液中的氧气可能会通过牙龈下生物膜中的通道深入渗透到牙龈下生物膜中。尽管在单一培养中,对氧气极为敏感的口腔菌斑衍生微生物(如牙龈卟啉单胞菌)无法在这种微通气条件下存活,但与更耐氧的具核梭菌共培养可以促进专性厌氧菌的生长,这可能是由于梭杆菌对局部还原条件的贡献。
能在酸性条件存活,增加pH值,促进其他菌生长
除了在低氧水平下生长的能力,F. nucleatum也可以在低至 5 的 pH 值下存活。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。除了促进其他细菌的生长,梭杆菌细胞可以将它们的 “同居者” 固定在适当的位置。
梭杆菌属,特别是具核梭杆菌,已显示与所有测试的口腔细菌属可以发生共聚集。然而,这种聚合并不是无差别的。在每个属中,梭杆菌分离物优先与特定的某些菌株而非其他菌株共聚集。由于这种相互作用,具核梭菌是口腔生物膜发育的重要贡献者,是早期和晚期定植者之间的桥梁。
接下来,我们了解一下,F. nucleatum可能与之共聚的细菌。
与肠源性细菌共聚集——协同作用
梭杆菌细菌素可以通过去除特定的口腔和/或肠道微生物来促进其他微生物的生长,从而促进互惠相互作用的选择性。
通过与具核梭菌的侵入性菌株共聚集,一种具有粘附和侵入哺乳动物细胞能力的梭杆菌分离物——非侵入性细菌“乘客”可以穿梭到哺乳动物细胞中。
例如,具核梭菌的侵入性菌株,促进一些源自口腔的非侵入性细菌能够侵入人类口腔细胞。有趣的是,尽管F. nucleatum原产于人类口腔已证明菌株但是能够与人类胃肠道结直肠区域的原生细菌共聚集。
细菌共聚集可能对人类健康产生的影响
这种共聚集能力可能通过协同相互作用在结直肠癌(CRC)的病因中发挥作用。
尽管大量研究调查了结肠微生物群与结直肠癌进展之间的联系,结直肠癌病例相关的细菌包括F. nucleatum、产肠毒素脆弱拟杆菌(ETBF)、致肠致病大肠杆菌(EPEC)、侵入性大肠杆菌(AIEC)、粪肠球菌、弯曲杆菌属和Leptotrichia spp 等。
已发现具核梭杆菌和以上菌可能协同加速结直肠癌进展和/或转移。
早在 1936 年,科学家就将梭杆菌感染与颈静脉血栓性静脉炎联系起来。
最近,梭杆菌感染的发病率有所增加。虽然这种增加的原因尚不清楚,但抗生素使用减少和检测技术改进有关的理论可能解释了这种变化。
临床医生能够发现梭杆菌属感染的早期迹象至关重要,这种感染会迅速出现一系列并发症,如 Lemierre 综合征(心绞痛后脓毒症)、菌血症、骨髓炎和感染性休克。
儿童发病 ↓↓↓
儿科人群中的梭杆菌感染主要影响头部和颈部区域,因为细菌主要存在于口腔内。急性中耳炎是最常见的感染部位,尤其是在 2 岁及以下的儿童中。
一项研究了 27 名中位年龄为 3.5 岁的儿童的梭杆菌感染的神经系统表现,发现其中 5 人出现意识水平下降,7 人在开始治疗前癫痫发作。
厌氧菌引起的中耳感染不到 1%;但是,如果不及时治疗,可能会出现严重的并发症,例如骨膜下和硬膜外脓肿。
菌血症是一种严重的并发症,常见于高达 77% 的儿童梭杆菌病例,可能是由于颅内窦靠近乳突骨所致。在 40% 的患者中也观察到骨髓炎,并且通常是多灶性的,需要长期静脉内抗生素治疗。
成年发病
在免疫功能正常的患者中,男性和女性的发病率相等。最初的症状包括发烧(38°C ~ 39°C)并伴有急性中耳炎,通常进展为乳突炎。实验室评估显示炎症标志物升高:C 反应蛋白水平、白细胞计数和中性粒细胞绝对计数。
梭杆菌引起的脑膜炎罕见且被描述少于 20 次;然而,人们经常注意到它会导致严重的发病率和死亡率。
Lemierre 综合征
有人提出,Lemierre 或 Lemierre 样综合征的发展通常发生在梭杆菌感染中耳之后。这是由于中耳感染延伸到静脉窦血栓形成。
Lemierre 综合征是梭杆菌感染的严重并发症。
在一项对 12 名感染患者的研究中,58% 的患者发展为 Lemierre 或 Lemierre 样综合征。该综合征以颈内静脉脓毒性血栓性静脉炎或血栓形成为特征,可在肺部或其他无菌部位引起脓毒性栓塞性病变。
坏死梭杆菌(F. necrophorum)是导致 Lemierre 综合征的梭杆菌属物种,是造成 10% 的急性咽喉痛和 21% 的复发性咽喉痛的原因,其余由引起由A 组链球菌或病毒引起。
F. necrophorum的其他并发症包括脑膜炎,并发脑静脉血栓形成, 以及泌尿生殖道和胃肠道感染。
菌血症
具核梭杆菌引起的菌血症不常见,但死亡率高
一些危险因素包括恶性肿瘤、年龄较大、酗酒、免疫抑制和透析;通常是通过医院感染。然而,F. nucleatum菌血症的死亡率可达 10%,并且与基础疾病的严重程度相关。
有一项研究调查了有梭杆菌属感染事件病例。研究期间的菌血症(每年 0.55 例/100,000 人),具核梭杆菌是最常见的物种(61%),其次是坏死梭杆菌(25%)。
许多具核梭杆菌菌血症发生在不同的疾病患者(糖尿病、肠道、肺部、肝脏或妇科疾病),其中口咽部、胃肠道、泌尿生殖道和呼吸道,通常是F. nucleatum定植,可能成为感染源。
在强化化疗后患有恶性肿瘤(白血病和淋巴瘤)的血液病患者中,发生了具核梭杆菌菌血症。在大多数情况下,发生在口腔粘膜炎患者中。值得注意的是,F. nucleatum菌血症的病程似乎比由F. necrophorum等梭杆菌属引起的其他菌血症更有利,后者通常会导致 Lemierre 综合征。
F. nucleatum 感染与新冠感染有关
比利时研究团队报告了2020 年 3 月和 2020 年 4 月,比利时布鲁塞尔的 2 家主要医院观察到 4例 具核梭菌感染病例,均与冠状病毒病(COVID-19)患者的严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)感染有关。
在口腔中,细菌、真菌、病毒和古细菌在不同的栖息地自然定殖,包括牙齿、牙龈沟、舌头、脸颊、软硬腭和扁桃体。口腔微生物群是指这些生物的高度多样化和复杂的生态系统。超过 700 种细菌是口腔特有的,而本土口腔菌群则可以防止外来细菌的定居。
口腔菌群的两面性
口腔中的一些细菌是有害的,会导致严重的疾病,而同时也有许多口腔细菌上对预防疾病是有益的。
现在已经确定,许多慢性炎症状况是由宿主-微生物群相互作用之间的不平衡引起的。口腔共生菌在口腔疾病的发展中起着至关重要的作用,包括牙周病和牙齿脱落,以及维持正常的口腔生理环境。此外,已知口腔共生菌参与了肺炎、心血管疾病、糖尿病、痴呆等系统性疾病的发病和发展。
梭杆菌在口腔疾病中的作用
梭杆菌是口腔中常见的专性厌氧革兰氏阴性菌,可充当牙菌斑中早期和晚期定植细菌之间的桥梁,并在口腔和口腔外感染中发挥作用。
具核梭杆菌是一种常见于人类牙菌斑中的细菌。这种细菌已被证明在牙菌斑形成和牙龈炎等其他疾病中起着核心作用。
这是因为它能够粘附广泛的革兰氏阳性和革兰氏阴性菌斑微生物,例如牙龈卟啉单胞菌。与牙周炎以及头部和颈部、胸部、肺部、肝脏和腹部的侵入性人类感染密切相关。由于其粘附能力,它可以与病毒相关联,病毒粘附在宿主组织细胞上作为入侵并调节宿主的免疫反应。
口腔鳞状细胞癌中的梭杆菌
最近已经表明,在口腔鳞状细胞癌(OSCC)组织中检测到梭杆菌一种口腔共生细菌。OSCC 组织表面生物膜内需氧菌和厌氧菌的比例约为 1:2,而健康对照组为 2:1,表明 OSCC 表面为厌氧菌提供了重要的储存库。梭杆菌在 OSCC 组织中的分布可能与健康口腔粘膜组织中的分布不同。
具核梭杆菌侵入上皮细胞
与P. gingivalis相比,F. nucleatum 显着粘附并侵入人牙龈上皮细胞 (HGEC) 。具核梭菌的自发突变体无法侵入HGEC ,这表明它们的侵入需要细菌成分。
此外,葡萄糖抑制试验表明,凝集素样相互作用参与了具核梭菌与 OSCC 细胞的附着。
具核梭杆菌在上皮细胞促进细胞迁移
具核梭杆菌的感染在人类上皮细胞中促进细胞迁移,可能通过刺激 Etk/BMX、S6 激酶 p70 和 RhoA 激酶,并通过激活丝裂原活化蛋白激酶 p38 增加 MMP-13(胶原酶 3)的产生 。
然而,梭杆菌在 OSCC 细胞中的粘附以及具核梭杆菌介导的OSCC细胞侵袭的详细机制仍不清楚。但是,普遍共识认为在OSCC 患者的口腔中富含具核梭杆菌这一事实似乎在口腔癌的肿瘤发生和/或进展中很重要。
具核梭杆菌通过产生有毒代谢物成为牙周病原体
这些有毒成分具有杀死或阻止附近牙周正常细胞(成纤维细胞)增殖的能力。
F. nucleatum形成的硫化物可能为细菌提供了一种避开宿主免疫系统的方法。丁酸(以组织刺激性丁酸的形式)、丙酸和铵离子,由具核梭菌产生,抑制人牙龈成纤维细胞的增殖。
具核梭杆菌有穿透牙龈上皮的能力
且在与牙周炎相关的斑块中,以高水平存在。
因此,它们可能对产生牙龈炎等口腔疾病具有非常重要的作用。
毒素的作用对细胞来说不是致命的,但成纤维细胞增殖的抑制很严重,因为伤口快速愈合的潜力受到了损害。
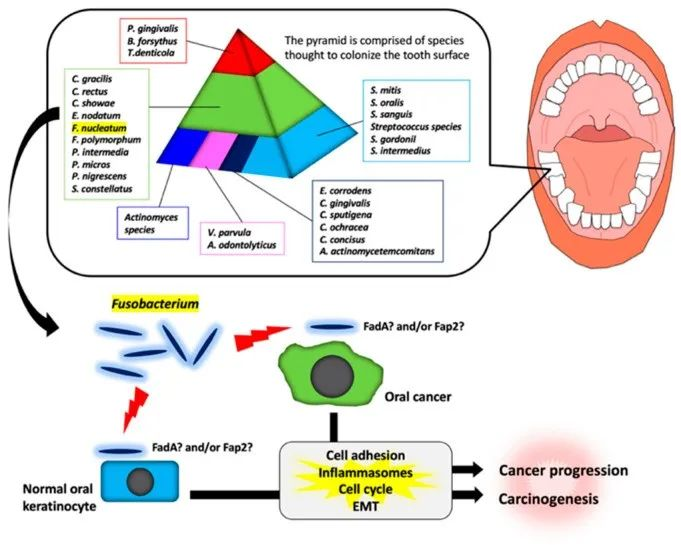
通过对龈下菌斑样本进行聚类分析,发现牙菌斑中的细菌之间存在特定关联。如下图,如金字塔所示,存在各种细菌。具核梭杆菌在金字塔的中间。
梭杆菌属参与口腔癌发生和癌症进展的示意图
编辑
Fujiwara, Natsumi et al, INT J MOL SCI, 2020
在金字塔中部的物种中,具核梭菌在牙菌斑形成后期的牙齿生物膜中占优势。
如上所述,梭杆菌感染通过各种反应影响 OSCC 的肿瘤发生和发展。然而,梭杆菌的靶分子仍然未知。需要进一步的研究来阐明梭杆菌参与 OSCC 肿瘤发生和发展的证据。
梭杆菌属物种可能与炎症性肠病 (IBD) 有关,包括溃疡性结肠炎和克罗恩病。IBD 是一个已知的危险因素,它是结直肠癌的三个最高风险因素之一。
已报道了几种梭杆菌菌株与 IBD 相关。然而,大多数 (69%) 与F. nucleatum相关。
F. nucleatum和其他梭杆菌属物种可以引发宿主促炎反应,并具有促进它们与宿主上皮细胞粘附的毒力特征以及它们侵入上皮细胞的能力细胞。
因此,与正常邻近组织和健康对照中的水平相比,结直肠癌中的具核梭杆菌富集,这些微生物可能导致肿瘤发生的可能性,可能在有限的患者亚群中,最可能是通过炎症介导的机制。
具核梭杆菌在结直肠癌患者中丰度及作用
最近的一项荟萃分析表明,与邻近的健康组织和对照组的健康组织相比,结直肠肿瘤组织中检测到具核梭杆菌DNA 的几率更高。与对照组的健康组织相比,结直肠息肉组织中的具核梭杆菌DNA 也较高。
结直肠癌患者粪便样本中,具核梭杆菌高
研究表明,结直肠癌患者的粪便样本中F. nucleatum 含量丰富。Meta 分析发现,与健康对照组相比,结直肠癌患者粪便样本中具核梭菌阳性的综合几率更高;与结直肠息肉患者相比,结直肠癌患者更高;但与健康对照相比,结肠直肠息肉患者的情况并非如此。
F. nucleatum已从消化道其他部位的癌症中分离出来,即胰腺 、食道和胃。
肿瘤内具核梭杆菌可能起源于口腔
有趣的是,已经表明结直肠癌中的具核梭杆菌菌株与从口腔中分离的该物种的菌株相同,这表明肿瘤内具核梭杆菌可能起源于口腔。如果来自口腔的具核梭菌在口腔外部位的癌症发展中起作用,那么假设这种细菌可能导致口腔本身的致癌作用是合理的。
具核梭菌感染诱导特定的肿瘤分子事件
F. nucleatum曾经被认为是胃肠道中的被动细菌。然而,现在人们认识到,具核梭菌感染可以在结直肠癌中诱导一系列特定的肿瘤分子事件,包括 CpG 岛甲基化表型、微卫星不稳定性以及BRAF和TP53的基因突变。
肿瘤内有具核梭杆菌的存在,与较差生存率相关
此外,许多这些研究已经确定,肿瘤内有具核梭杆菌的存在与较差的生存率有关 。还观察到,具核梭杆菌感染与更差的临床病理学特征相关,例如更大的肿瘤、更差的分化、淋巴结和远处转移、晚期肿瘤分期和更深的肿瘤侵袭。
总之,结直肠癌微生物组的基因组分析揭示了这些癌症中梭杆菌属的显着富集,尤其是与具核梭杆菌、死亡梭菌和坏死梭杆菌具有最大相似性的种系型。这种富集通过肿瘤组织的组织学分析以及结肠肿瘤转移中梭杆菌DNA 的鉴定得到证实。
梭杆菌介导结直肠癌发生,随着肿瘤转移进肝脏
2017年发表在《Science》肠道细菌Fusobacterium介导结肠癌的发生及伴随肿瘤的转移。作者进行以下操作:
结果发现,10个患者里面,只有2个患者的原位病灶和肝转移病灶中Fusobacterium含量不一样,其他8个病人是高度吻合的(Fuso-qPCR)。
由以上结果我们可以得知:Fusobacterium阳性的患者中,原发灶和肝转移灶中的细菌谱是高度相似的。Fusobacterium很有可能能够随着结肠癌一起进入肝脏。
接下来,作者从病人体内分离出Fusobacterium,通过给小鼠口服Fusobacterium,发现可以诱导结肠癌的产生。同时再次分离小鼠结肠癌中的细菌,通过测序发现,小鼠结肠癌中的细菌谱跟之前病人结肠癌中的细菌谱也是高度一致的。
是否可通过抗生素消灭具核梭杆菌及其他细菌,能否抑制结肠癌的生长?
作者先使用了没有Fusobacterium的细胞系HT-29,通过皮下成瘤,发现甲硝唑并不能够抑制肿瘤的生长。然后使用了从结肠癌患者的肿瘤组织中分离出Fusobacterium,诱导产生结肠癌。发现甲硝唑能够显著抑制肿瘤的生长。
具核梭杆菌高与复发相关
此外,上海交通大学仁济医院房静远教授团队在《Cell》上发表了相关论文,发现在肿瘤复发患者中肠菌具核梭杆菌含量明显升高,并明确了该菌诱导癌细胞自噬而导致化疗耐药与肿瘤的术后复发机制,从而引起大肠癌患者五年生存率降低。
另外,2017年发表在《Gastroenterology》上复旦大学肿瘤研究所领衔完成和《Oncotarget》(由西南医科大学领衔完成)杂志上的两篇也从另外的角度阐述了具核梭杆菌促进肿瘤发生发展的分子机制。
总结一下梭杆菌与结肠癌的进展:
1)研究发现Fusobacterium在结肠癌组织中大量富集;
2)研究发现Fusobacterium能够抑制免疫,减少T细胞的在肿瘤组织中的浸润;
3)研究发现Fusobacterium能够促进结肠癌的发生和发展,通过给小鼠口服Fusobacterium可以诱导结肠癌的产生;
4)研究发现Fusobacterium在结肠癌原位和肝转移灶都能检测到,意味着Fusobacterium可能能够跟随肿瘤细胞一起转移到肝;
5)研究发现使用抗生素消灭Fusobacterium后可以抑制结肠癌细胞的生长(这里使用甲硝唑做实验并不代表今后治疗中可以直接使用,毕竟这是个广谱抗生素)。
那这些研究对我们临床有什么启示呢?
近些年来的很多研究都表明,Fusobacterium与结直肠癌的发生有很大的关联性。我们知道肿瘤防治重点在于防而不在于治。关于肿瘤跟细菌的相关研究,大家最熟悉的是幽门螺杆菌和胃癌的研究。
2017年8月《Nature》首度报道了幽门螺杆菌导致胃癌发生的机制。通过对幽门杆菌的清除可以将胃癌的患病风险降低65%,那么通过以后监测Fusobacterium以及清除Fusobacterium可能为以后结肠癌的预后提供新的思路。同时,为什么Fusobacterium能够介导结肠癌的发生也同样值得研究。
越来越多的证据表明,微生物会影响癌症治疗的效果。具核梭杆菌在具有不同微卫星不稳定性 (MSI) 状态的结直肠癌中,诱导不同的免疫反应。
增强PD-L1阻断剂疗效
高F. nucleatum水平与结直肠癌患者对 PD-1 阻断的治疗反应改善相关。此外,F. nucleatum增强了 PD-L1 阻断剂对小鼠结直肠癌的抗肿瘤作用并延长了生存期。结合F. nucleatum补充免疫疗法,挽救了 PD-L1 阻断的治疗效果。
激活信号,诱导 PD-L1 表达
此外,具核梭杆菌通过激活 STING 信号传导诱导 PD-L1 表达,并在 PD-L1 阻断治疗期间增加干扰素-γ (IFN-γ) + CD8 +肿瘤浸润淋巴细胞 (TIL) 的积累,从而增强肿瘤对PD-L1 阻断。
最后,源自患者的类器官模型表明,增加的具核梭菌水平与改善对 PD-L1 阻断的治疗反应相关。这些发现表明,F. nucleatum可能会调节结直肠癌的免疫检查点治疗。
1
与其他微生物共聚集
F. nucleatum是早期和晚期定植者之间的关键“桥梁”生物,其外膜粘附素 Fap2 部分负责促进多物种生物膜的形成 。当口腔生物膜中报告牙龈卟啉单胞菌(P. gingivalis)时,始终存在F. nucleatum,这表明它先于该物种,并且是其殖民化所必需的。
P. gingivalis是一种酸敏感细菌,但F. nucleatum可以通过发酵谷氨酸和天冬氨酸产生氨,从而为P. gingivalis定殖提供更中性的环境。
F. nucleatum和P. gingivalis可能协同工作,通过引发慢性炎症来促进肿瘤变化,刺激了人 OSCC 细胞的体外增殖 。
白色念珠菌是一种机会性致病酵母,常见于胃肠道和口腔。最近的真菌生物组研究表明,OSCC 中包括白色念珠菌在内的几种真菌种类的丰度增加 。众所周知,口腔中的念珠菌属具有乙醇脱氢酶,负责催化酒精产生乙醛,乙醛是一种有效的致癌物质 。已经表明,具核梭菌与念珠菌共聚集,这可以促进定殖。念珠菌口腔白斑的定植与F. nucleatum水平升高有关。F. nucleatum可能通过增加口腔黏膜与念珠菌产生的乙醛的接触而间接增加口腔癌的风险。
2
激活细胞增殖
最简单的癌症是不受控制的细胞生长,而有核梭菌已被证明通过与内皮钙粘蛋白(E-钙粘蛋白)相互作用来影响癌细胞的增殖。梭杆菌 FadA 与在宿主细胞膜表面表达的 E-钙粘蛋白结合。E-cadherin 是一种通过 β-catenin 发挥作用的肿瘤抑制因子。梭杆菌 FadA 与 E-cadherin 的相互作用激活 WNT/β-catenin 信号传导,导致细胞增殖并增加致癌和炎症基因的表达。
类似地,已显示F. nucleatum通过激活 Toll 样受体 4 (TLR4) 向 MYD88 发出信号来增加小鼠异种移植物中的 CRC 增殖,从而导致核因子 NFκB 的激活和 miR21 的表达增加;这种 miRNA 降低了负责控制细胞增殖和分化的 RAS GTPase RASA1 的水平 。
由细胞周期蛋白激活的细胞周期蛋白依赖性激酶促进细胞周期进程。F. nucleatum感染与细胞周期蛋白 D1 的激活有关,这促进了肠道肿瘤的发生 。在 OSCC 中,F. nucleatum和P. gingivalis均被证明能够通过上调 cyclin D1 和 c-Myc显着刺激 OSCC 细胞增殖。
TLR4 的细菌激活导致白细胞介素 6 (IL-6) 的表达增加,白细胞介素 6 (IL-6) 反过来又激活了 STAT3,这是一种负责调节细胞周期蛋白 D1 和 c-Myc 的关键信号分子 。而且,F. nucleatum通过降低 p27(一种细胞周期蛋白依赖性激酶抑制剂)的表达和加速细胞周期来引起 DNA 损伤并促进口腔癌细胞的细胞增殖 。此外,具核梭菌下调 DNA 修复蛋白 Ku70 和 p53,从而削弱细胞修复能力。
最近的一项研究发现,HNSCC 中具核梭菌的富集与宿主基因启动子甲基化有关,包括肿瘤抑制基因LXN和SMARCA2的高甲基化。SMARCA2是一种参与与 DNA 修复和复制相关的 ATP 依赖性染色质重塑的基因。这表明F. nucleatum感染可能通过表观遗传沉默导致细胞增殖。
3
炎症的诱导
F. nucleatum的促炎潜力已得到充分证明,因为它可以促进活性氧 (ROS) 的产生和细胞因子的产生 。慢性炎症在致癌过程中起着关键作用,并且可以解释牙周炎与 OSCC 高风险之间的密切关联。已发现具核梭菌与 CRC 和 OSCC 中的高细胞因子水平相关,从而产生支持肿瘤进展的炎症微环境 。LPS,存在于细胞外膜中F. nucleatum激活 TLR4 介导的 NF-κB 信号通路以产生促炎细胞因子,如 IL-6、IL-8 和肿瘤坏死因子 α 。
4
抗肿瘤免疫反应
F. nucleatum在 ApcMin/+ 小鼠模型中已显示将骨髓来源的抑制细胞募集到肿瘤微环境中。髓源性抑制细胞可抑制 T 细胞增殖并诱导 T 细胞凋亡 。
这与最近发现的F. nucleatum的数量与结肠直肠癌和乳腺癌组织中 CD3 和 CD4 T 细胞的密度之间的负相关的发现一致。
还观察到 OSCC 中具核梭菌负荷与 B 淋巴细胞、CD4 T 辅助淋巴细胞、M2 巨噬细胞和成纤维细胞的标志物之间存在显着负相关。
F. nucleatum抑制蛋白还可以通过将细胞阻滞在细胞周期的 G1 期来抑制人类 T 细胞活化 。梭杆菌 Fap2 粘附素结合并激活具有 Ig 和 ITIM 结构域 (TIGIT) 的 T 细胞免疫受体,TIGIT 是 T 细胞和自然杀伤 (NK) 细胞中的一种免疫调节信号受体。这种 Fap2-TIGIT 相互作用可保护具核梭菌和附近的肿瘤细胞免于被免疫细胞杀死。局部免疫抑制也可能发生,因为有核梭菌的Fap2和 RadD 外膜蛋白会诱导淋巴细胞中的细胞死亡。
F. nucleatum还通过促进有核梭菌相关 CRC中巨噬细胞的 M2 极化发挥免疫抑制作用,可能通过 TLR4/IL-6/p-STAT3/c-MYC 信号通路。
5
细胞迁移和侵袭
基质金属蛋白酶 (MMP) 是一个锌依赖性内肽酶家族,它们共同能够降解细胞外基质 (ECM) 的所有成分。MMP 在 ECM 过度降解的病理状况中发挥作用,包括肿瘤侵袭和转移。P. gingivalis和F. nucleatum都可以通过不同的机制产生 MMP,从而促进癌细胞的侵袭和转移。
在 OSCC 中,已观察到暴露于牙龈卟啉单胞菌和具核梭菌导致 MMP-1 和 MMP-9 的诱导。同样,与F. nucleatum一起孵育的 AT3 小鼠乳腺癌细胞也表现出 MMP-9 的过表达。
上皮-间质转化 (EMT) 定义为上皮细胞采用间充质表型的过程,是在癌症发展和进展中观察到的现象。
一般来说,进入 EMT 的细胞表现出上皮标志物(如 E-钙粘蛋白)的下调和间充质标志物的上调,包括神经钙粘蛋白(N-钙粘蛋白)和波形蛋白 。这种细胞分化行为的转变是由一组转录因子控制的,包括锌指 E-box 结合同源框 1 和 2 蛋白 (ZEB1/2)、SNAIL 和 TWIST。
CRC 中高水平的具核梭杆菌与 E-cadherin 表达呈负相关,但与 N-cadherin 表达呈正相关。同样,OSCC 细胞系暴露于F. nucleatum与 E-cadherin 转录的显着降低以及 N-cadherin、vimentin 和 Snail 的上调有关。
F. nucleatum可以上调ZEB1 在口腔癌细胞中诱导这种间充质状态,一种先前已在H. pylori感染的胃上皮细胞中发现的机制。
痛风
痛风患者中普氏杆菌(Prevotella)、梭杆菌(Fusobacterium)和拟杆菌(Bacteroides)的相对丰度增加,而肠杆菌科(Enterobacteriaceae)和产丁酸盐菌的相对丰度减少。
胃肠道肿瘤
梭杆菌属(Fusobacterium)在胃肠道肿瘤的发生和发展中起重要作用。与正常组织样本,尤其是正常血源性样本相比,原发肿瘤中梭杆菌较多。泛癌分析还显示,在原发肿瘤组织和邻近正常组织样本中,将所有胃肠道癌(n = 8)与非胃肠道癌(n = 24)进行比较时,梭杆菌丰富度都是较高的。
胰腺导管腺癌
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria 较少。
口腔和唾液微生物群组成的改变与PDAC(胰腺癌主要是指胰腺导管腺癌,简称PDAC)的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌、纤毛杆菌、梭杆菌的丰度有显著差异。
PDAC肿瘤内梭杆菌的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
梭杆菌的严重程度和传播范围,决定了所需治疗程度
一般所有梭杆菌感染都必须用抗生素治疗,并且通常对 β-内酰胺类药物敏感,例如青霉素或头孢菌素或其衍生物。
一些梭杆菌菌株被发现含有 β-内酰胺酶,因此建议使用特定的厌氧抗生素,例如甲硝唑或克林霉素。
适当的抗生素治疗与手术清创相结合可预防并发症
抗生素治疗通常通过肠胃外给药 1 至 2 周,然后进行大约 10 天的口服治疗。有些孩子需要切除坏死组织或手术引流。
在一项对 7 名小于 2.2 岁的梭杆菌感染患者的监测研究中,除了乳突切除术外,所有患者都需要一根通气管。
在以色列对 22 名感染梭杆菌的儿童进行的一项为期 14 年的研究中,5 名出现 Lemierre 综合征的患者中有 3 名接受了低分子量肝素治疗以缓解脑窦静脉血栓形成的症状,但是该治疗仍存在争议。
一项 40 年文献回顾确定了, 12 例 2 岁以下儿童的梭杆菌感染病例;所有儿童都出现了乳突炎,并接受了乳突切除术和抗生素治疗,无论严重程度如何,都取得了成功。
早期发现和适当治疗,可以有效阻止和逆转感染的进展
梭杆菌感染在 2 岁及以下的儿童中,临床表现为急性中耳炎,但如果不及时治疗,则会发展为乳突炎和更严重的菌血症、骨髓炎症状,并可能出现 Lemierre 综合征和感染性休克。
使用适当的抗菌检测技术以及适当的成像程序应允许及时使用抗生素和手术参与,以防止感染的进一步传播。
虽然对梭杆菌感染的研究和分析有限,但对感染症状和严重程度的重要认识可以帮助临床医生发现感染的早期发作并将患者引导至适当的专科医生处。
口腔牙周病感染中,高达 90% 的菌群由专性厌氧菌组成,钙化合物已被证明是牙科中有价值的材料。钙与酯的配方在牙齿结构的愈合过程中表现出显着的特性。根据国外“Calcium Therapy Institute”研究所的介绍,他们长达16 年的时间里,发现使用钙化合物来开发治疗牙髓和牙周(牙龈和骨)感染的牙周治疗钙法 (CMPT)具有重要意义。
口腔厌氧菌分散的一个原因是梭杆菌在上颌骨中获得了稳定的立足点,以增殖并将其大量的毒素释放到多孔的上颌骨、上颚和下牙列中。这个过程与人体正常的进食、呼吸、说话和吸吮机制相联系,是梭杆菌对人体细胞异常失衡的完美寄生关系。
北美该研究人员最近报告了的一项突破,发现厌氧细菌被局部刺激或炎症所吸引,会开启“饥饿触发”信号,向侵袭性细菌发出信号,释放一种酶以减少抗生素的影响。
这种自我饥饿细菌的“饥饿信号”会产生一种冬眠状态,或者说是防御状态,直到不再使用抗菌药物。他们进入休眠状态,只是为了在更有利的条件下重新发动进攻。
该研究所实验人员发现舌下颌下腺唾液肽的生物学特性,以及用于根管和牙周治疗的钙材料有助于深入了解答案。
它们是具有解热、抗炎、定时释放特性的非类固醇。几项临床研究表明,长期摄入唾液腺分泌物和对组织有益的钙材料具有积极的全身作用。
——降低有害菌的复制率
在 1980 年代中期,一些的血清研究表明,某些钙质材料不会杀死细菌,而是“降低”它们的复制率,而流行的抗菌剂在几毫秒内杀死一切,包括健康的细胞和细菌。在那项研究中,根据对口腔组织钙治疗的多年临床观察,消除细菌需要十个小时。关键因素是时间。
鉴于饥饿细菌的发现,钙材料会发出警报,但不会造成伤害。
——饿死那些“自我饥饿的细菌”
几十年来,钙疗法已被证明对口腔或皮肤的任何正常健康细胞无害,同时它们还能维持环境“围攻”。不是直接杀死它们,而是逐渐将饥饿细菌饿死。
然后,由于几乎没有复制能力,它们开始消亡,而健康细胞迅速蓬勃发展并主导该领域,尤其是在定时释放钙离子的情况下。
如果厌氧梭杆菌最常存在于口腔、牙菌斑中,并且与牙周病和炎症性牙龈炎有关,那么梭杆菌的下一个最有利的栖息地是结肠,可以刺激溃疡性结肠炎、癌症和克罗恩病。
口腔和结肠这两个区域很容易受到异常水平的梭杆菌的影响,这会长时间造成炎症环境并增强细胞的扩散或分布,甚至会扩散到以厌氧微生物而臭名昭著的身体远处器官。众所周知,生物膜菌落容易引起囊性和脓肿感染。
梭杆菌的管理,中和它们的毒素仍然在控制厌氧微生物环境的范围内。同样,健康的一个主要考虑因素是限制侵入性病原体的局部和全身传播。
从用钙材料管理口腔环境可以明显看出,下颌前切牙上的斑块沉积快速愈合和减少。对口腔黏膜和牙周组织进行长期钙治疗的患者会显著减少牙菌斑和牙石。
考虑到梭杆菌的两个最主要的聚集地,口腔和结肠,那么未来继续研究钙材料应该是价值的。这种病原体比预期的更容易控制,至少在口腔和下消化道的炎症和感染的早期阶段是如此。
声明:关于药物、诊断和治疗方法的部分中提供的信息仅供医疗专业人员交流使用,并非使用说明。
主要参考文献:
Brennan CA, Garrett WS. Fusobacterium nucleatum – symbiont, opportunist and oncobacterium. Nat Rev Microbiol. 2019 Mar;17(3):156-166. doi: 10.1038/s41579-018-0129-6. PMID: 30546113; PMCID: PMC6589823.
Susan Bullman et al. Analysis ofFusobacteriumpersistence and antibiotic response in colorectal cancer, Science (2017). DOI: 10.1126/science.aal5240
Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res. 2012 Feb;22(2):299-306. doi: 10.1101/gr.126516.111. Epub 2011 Oct 18. PMID: 22009989; PMCID: PMC3266037.
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res. 2012 Feb;22(2):292-8. doi: 10.1101/gr.126573.111. Epub 2011 Oct 18. PMID: 22009990; PMCID: PMC3266036.
Vidaurrazaga MM, McKinley GF, Camins BC. Postpartum Fusobacterium gonidiaformans bacteremia. Anaerobe. 2020 Apr;62:102168. doi: 10.1016/j.anaerobe.2020.102168. Epub 2020 Jan 28. PMID: 32045837.
Centor RM, Huddle TS. Should the risk of Fusobacterium necrophorum pharyngotonsillitis influence prescribing empiric antibiotics for sore throats in adolescents and young adults? Anaerobe. 2021 Oct;71:102388. doi: 10.1016/j.anaerobe.2021.102388. Epub 2021 Jun 2. PMID: 34089856.
Duncan SH, Hold GL, Harmsen HJM, Stewart CS, Flint HJ. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. Int J Syst Evol Microbiol. 2002 Nov;52(Pt 6):2141-2146. doi: 10.1099/00207713-52-6-2141. PMID: 12508881.
Arane K, Goldman RD. Fusobacterium infections in children. Can Fam Physician. 2016 Oct;62(10):813-814. PMID: 27737977; PMCID: PMC5063768.
Peluso EA, Scheible M, Ton-That H, Wu C. Genetic Manipulation and Virulence Assessment of Fusobacterium nucleatum. Curr Protoc Microbiol. 2020 Jun;57(1):e104. doi: 10.1002/cpmc.104. PMID: 32539234; PMCID: PMC7398570.
Broadley M, Schweon SJ. Get the facts about Fusobacterium. Nursing. 2017 May;47(5):64-65. doi: 10.1097/01.NURSE.0000515524.23032.d5. PMID: 28445341.
Tadepalli S, Narayanan SK, Stewart GC, Chengappa MM, Nagaraja TG. Fusobacterium necrophorum: a ruminal bacterium that invades liver to cause abscesses in cattle. Anaerobe. 2009 Feb-Apr;15(1-2):36-43. doi: 10.1016/j.anaerobe.2008.05.005. Epub 2008 May 24. PMID: 18595747.
Mark J. Manhart DDS, Thomas B. Steg DDS,2011, Calcium Method of Fusobacteria Management. Alciumtherapy.com

谷禾健康


如果说前一篇文章《微生物组-神经免疫轴:心血管疾病的预防和治疗希望》更多的是借助心血管疾病(CVD),来宏观地阐述肠道-神经免疫-菌群之间的关联,那么这篇文章更多地是具体讨论肠道菌群及其代谢产物参与CVD疾病的发生发展,以及饮食和微生物群的串扰机制,基于上述理论,从更实际具体的角度来了解饮食相关的干预措施及其对健康的影响。
越来越多的研究表明,肠道菌群作为一个不可或缺的“隐形器官”,在人类新陈代谢和包括心血管疾病在内的疾病状态中发挥着至关重要的作用。
在可能影响肠道微生物群的许多内源性和外源性因素中,饮食成为宿主-微生物群关系的重要组成部分,可能与 CVD 易感性有关。
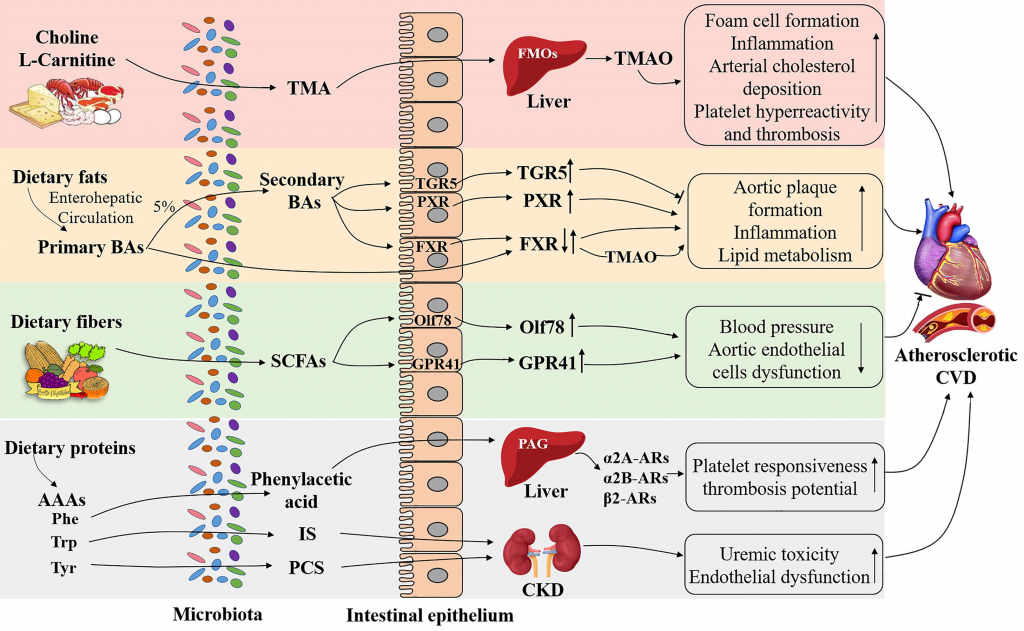
本文主要介绍肠道微生物群饮食调节的主要概念,及其参与心血管疾病发展。还讨论了调节 CVD 进展的饮食-微生物群串扰的机制,包括内毒素血症、炎症、肠道屏障功能障碍和脂质代谢功能障碍。也阐述了关于微生物群产生的代谢物,包括三甲胺-N-氧化物、次级胆汁酸、短链脂肪酸以及芳香族氨基酸衍生的代谢物如何在 CVD 发病机制中发挥作用。最后,列举了与肠道微生物群相互作用的潜在饮食干预措施,作为 CVD 管理的新型预防和治疗策略。
在了解CVD中基于菌群的饮食干预之前,首先我们来了解一下,饮食变化对肠道微生物群可能产生哪些影响?
主要可概括为三个方面:
(1) 快速/短期效应
对在植物性(高纤维)之间切换的人类受试者和以动物为基础的(高脂肪)饮食的研究表明:
所有受试者的微生物群组成在 1-2 天内发生变化,厚壁菌门在植物性饮食中代谢膳食纤维的丰度增加,在动物性饮食中耐胆汁微生物Alistipes和Bilophila增加。然而,即使经过 10 天的干预,短期饮食改变对肠型也没有影响。
(2) 长期影响
尽管微生物群落迅速调节,但长期的饮食干预不仅与成分改变有关,还与生理变化有关。
例如,用高脂肪饮食 (HFD) 喂养大鼠 8 周或 12 周会导致肠杆菌门(变形杆菌门)的丰度增加,这与全身炎症、肠道通透性和肥胖表型的升高相结合。相反,人类队列干预 3 个月的低碳水化合物或低脂肪健康饮食导致 14 或 12 种与体重减轻相关的菌群变化,这表明长期干预是必要的。此外,肠型主要与长期饮食影响而不是短期影响有关。
(3) 特定饮食引起的特定微生物变化
例如,膳食纤维的摄入促进了肠道微生物群的丰度或多样性以及厚壁菌门的增加。抗性淀粉饮食干预下 Ruminococcus bromii 增多。
有趣的是,不仅是微生物组成,还有特定的微生物代谢与特定的饮食和疾病模式相关。例如,富含红肉饮食的受试者血浆中的三甲胺-N-氧化物 (TMAO)(红肉中胆碱的肠道微生物代谢产物)比素食者多。已在人类受试者中发现 TMAO 水平升高,肠型普氏菌比例较高,并且与 CVD 风险增加有关。
人类队列中与心血管疾病相关的肠道微生物群的改变


Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
在健康状态下,适当的肠道屏障提供了抵御病原体的关键第一道防线,它由多种生理成分支持,包括粘液层、由紧密连接蛋白连接的上皮细胞和免疫细胞。
然而,心力衰竭或高血压的 CVD 患者经常观察到肠道屏障功能障碍,伴随全身微生物成分LPS和炎症的增加。
那么CVD过程中,引发肠道渗漏和炎症的风险因素是什么?
其中一个假设是,长期食用西方饮食或 HFD 会导致生态失调并损害肠道屏障,从而增强 LPS 易位和全身炎症,导致心血管疾病风险增加。
有鉴于此,富含饱和脂肪或反式脂肪酸的饮食摄入量较高与 CVD 风险的增加高度相关,而饮食中饱和脂肪的摄入量较低可使 CVD 降低约 30%。
在大型队列研究中,长期(6 个月)食用 HFD 会导致微生物菌群失调,其中革兰氏阴性菌(如Alistipes和Bacteroides)的比例增加,同时参与 LPS生物合成的基因水平更高。同时,已发现膳食脂肪通过激活促炎细胞因子(例如 TNF-α、IFNγ 和 IL-1β)的分泌来损害肠道屏障。促炎细胞因子的上调进一步激活 MLCK(肌球蛋白轻链激酶)信号通路,重组紧密连接蛋白,包括occludin、ZO-1(Zonula occludens-1)并导致肠漏。
当肠道屏障被破坏时,LPS或病原体可能转移到循环中,引起内毒素血症,从而刺激全身性促炎细胞因子的释放。一旦在血流中易位,内毒素可以通过与细胞表面的 TLR-4(Toll 样受体 4)相互作用来触发内皮细胞的损伤,并增强 ROS(活性氧)的产生,从而降低内皮细胞 NO(一氧化氮)的生物利用度导致形成斑块和动脉粥样硬化病变。
这一假设已在动物模型中得到证实,其中 ApoE-/-西方饮食下的小鼠动脉粥样硬化病变加重,变形菌(革兰氏阴性促炎细菌)和全身 LPS 水平显着增加。
此外,西方饮食促进炎症细胞因子(如 TNF-α 和 IL-1β)的上调,增加肠道通透性,同时修饰 ApoE-/- 小鼠中的紧密连接蛋白(如 occludin)。
然而,在人类队列中仍然缺乏数据来解释,由于西方饮食导致的肠道屏障受损和相关的内毒素血症增加在什么情况下会诱发CVD发病机制。
除了饮食-微生物群对炎症和肠道屏障功能的相互作用外,肠道微生物还通过宿主脂质代谢影响 CVD。
越来越多的动物和人类研究表明,肠道微生物群与脂质代谢紊乱有关,如血脂异常或高脂血症,它们是 CVD 发展的主要危险因素。
肠道微生物群将胆固醇转化为粪(甾)醇降低胆固醇
例如,GF 小鼠的胆固醇代谢发生了改变 ,而ApoE -/-小鼠肠道微生物群的消耗导致与传统的 ApoE -/-小鼠相比,血浆胆固醇伴有更大的主动脉病变。
此外,从高血浆胆固醇人类到小鼠的微生物群移植引发了上调循环胆固醇的表型以及肝脏胆固醇合成 的减少。
这可能是由于肠道微生物群将胆固醇转化为粪(甾)醇,这可以促进体内胆固醇的消除和降低胆固醇血症。
胆固醇代谢的数学模型已经证实了这一点,最近发现肠道菌群的胆汁盐代谢和胆固醇向粪(甾)醇的转化都会影响血液中的胆固醇水平。
此外,最近对人类队列进行的一项有趣的研究也证实了这一点,并确定了含有胆固醇代谢酶ismA的Eubacterium coprostanoligenes等粪(甾)醇形成菌的个体,粪便胆固醇水平显著降低,血清总胆固醇显著降低。
然而,在斑块面积较小的无菌 ApoE-/- 小鼠中也发现了有争议的结果,尽管血浆总胆固醇(TC)上调可能是由于缺乏与无菌状态相关的内毒素。
有趣的是,肠道微生物群的缺失似乎减弱了长期膳食脂质消耗的致动脉粥样硬化作用。
具体而言,与传统小鼠相比,HFD 喂养的无菌 Ldlr-/- 小鼠的血栓大小显着减小。尽管无菌和常规 Ldlr-/- 喂食 HFD 小鼠的血浆 TC 水平没有差异,但与喂食的无菌小鼠相比,富含脂质的饮食仍然诱导无菌小鼠的 TC 水平(TC≈1.6 mg/dlx103)约两倍配合食物(TC≈0.8 mg/dlx103)。
相比之下,HFD 诱导常规小鼠血浆 TC 增加约 8 倍(TC ≈1.6 mg/dlx103) 与以食物喂养的小鼠相比 (TC≈0.2 mg/dlx103 )。在这项研究中也发现了 VLDL 的类似发现。富含脂质的饮食还加剧了 Ldlr -/-小鼠的微生物群失调,梭菌科、葡萄球菌科、芽孢杆菌科的丰度增加,乳酸杆菌科的丰度降低。然而,最近的研究表明,在晚期主动脉粥样硬化方面,无菌Ldlr-/-与常规小鼠之间没有发现显着差异。
总之,不同的研究表明肠道微生物群对血脂代谢。这种影响对 CVD 发展是否具有保护作用或加重作用仍不清楚。这种差异可能取决于动物模型、动物年龄、饮食类型、喂养期以及住宿条件。未来的研究可以将这些因素纳入考虑范围,以便进行更好的调查。
TMAO,是一种饮食诱发的心血管疾病风险微生物生物标志物。
★ 饮食-肠道菌群代谢物TMAO(三甲胺-N-氧化物)
这是一种从饮食营养素衍生的肠道微生物共同代谢物,十年前首次被发现并被报道预测CVD的风险。饮食前体磷脂酰胆碱、胆碱和L-肉碱通常存在于奶酪、红肉、海鲜、蛋黄和其他西式营养素中,主要由特定的肠道微生物酶代谢,产生高水平的三甲胺(TMA)。
具体而言,含有功能性微生物CutC/D基因的TMA裂解酶负责胆碱相关TMA转化。TMA进一步被血液吸收,并在肝脏中被黄素单加氧酶(FMO,主要是FMO3)氧化,生成TMO。
在人类肠道中发现了七种不同的表达TMA裂解酶CutC/D的菌株,包括:
此外,TMA可以通过微生物里斯克型左旋肉碱加氧酶CntA/B从左旋肉碱合成。
虽然CntA/B编码基因已在变形杆菌中鉴定,但尚未证明共生肠道微生物群形成依赖于L-肉碱的TMA。然而,最近的一项研究发现,两种细菌菌株Emergencia timonensis和Ihubacter Massilensis的新组合在肉碱转化的TMA积累中具有潜在的重要作用。
有趣的是,最近发现的细菌E.timonensis通过L-肉碱促进TMAO的产生→ γ-BB(γ-丁基甜菜碱,肉碱的前体)→ TMA→ TMAO途径。然而,与肉碱TMA转化途径相关的特定共生微生物群仍需进一步发现。
★ 饮食-微生物群衍生的TMAO在CVD发病机制调节中的作用
最初的研究表明,高胆碱或肉碱饮食饲养的小鼠循环TMAO水平升高,巨噬细胞泡沫细胞形成的增加和主动脉粥样斑块形成的增强(图1)。
相反,在无菌或抗生素治疗的ApoE−/−小鼠中,TMAO产生能力和胆碱或肉碱饮食相关的动脉粥样硬化斑块负荷分别被消除或抑制 (C57BL/6株)。有趣的是,ApoE−/− 研究发现,当从高TMA/TMAO产生的供体C57BL/6小鼠接受盲肠微生物群移植时,小鼠比从低TMA/TMAO产生的供体NZW/LacJ小鼠产生更高的胆碱饮食依赖性主动脉病变聚集。
类似地,在无菌小鼠体内移植产生高TMA的微生物可诱导血小板高反应性,并增强与高血浆TMAO水平相关的血栓形成。
因此,微生物群对于TMAO的产生是必要的,TMAO通过以下几种机制参与动脉粥样硬化的进展:
1)泡沫细胞形成
微生物群衍生的TMAO可以激活应激诱导的热休克蛋白(HSP)HSP70或HSP60的表达,这可能触发巨噬细胞中清道夫受体(例如SR-A1)和CD36的激活,以刺激氧化低密度脂蛋白(ox-LDL)的摄取和泡沫细胞的形成。
2)炎症
TMAO通过激活Ldlr中的丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,诱导促动脉粥样硬化炎症标志物表达,包括IL-6、环氧合酶2(COX-2)和细胞内粘附分子 Ldlr−/− 小鼠吃富含胆碱的食物。
循环TMAO的增加与促炎细胞因子TNF-α和IL-1β的升高以及抗炎细胞因子IL-10的降低有关。
3) 脂质代谢
TMAO可抑制胆固醇逆向转运(RCT),导致动脉胆固醇沉积,加速动脉粥样硬化病变。
4) 血小板高反应性和血栓形成
饮食诱导的高水平微生物TMAO可刺激血小板激活次最大刺激物,包括凝血酶、二磷酸腺苷(ADP)和胶原,并诱导细胞内钙的释放,导致血小板高反应性。
然而,一些研究显示了相反的结果,表明饮食中的TMAO、胆碱或肉碱不会诱发ApoE−/− 的动脉粥样硬化或者Ldlr−/− 小鼠模型。这种差异可能是由于居住条件和小鼠模型造成的,但确切的原因仍有待进一步发现。
最近证明,TMA(而非TMAO)降低了心肌细胞和血管平滑肌细胞的活力。在大鼠体内静脉注射TMA时,平均动脉血压显著升高,表明TMA对CVD有有害影响。
进一步证实TMA在CVD发病机制中的作用并验证相关机制,还需要进行更多的体内和体外研究。
图1 肠道菌群产生的膳食代谢物在心血管疾病发病中的潜在机制

Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★人体循环TMAO在心血管疾病预测和预后中的研究
大量人体研究已经证明肠道微生物衍生的TMAO在预测CVD风险中的作用。
最初的研究调查了1800多名受试者的人类队列,发现血浆TMAO升高与多种CVD亚型的发生有关,包括外周动脉疾病(PAD)、冠状动脉疾病和心肌梗死史。
在临床结果研究中,大量参与者表明,循环TMAO与主要不良心血管事件、事件死亡率和动脉梗死的风险增加呈正相关。在许多研究中,血浆TMAO的临界值超过6μM,以预测全因死亡率的风险,最近对10000多名受试者进行的荟萃分析提出,CVD预后的血浆TMAO临界值为5.1μM。
此外,已发现高水平的TMAO与人类队列中促炎性单核细胞和心血管风险的增加有关。
同样,一项系统回顾和剂量反应荟萃分析招募了13000多名参与者,发现血浆TMAO水平升高与炎症标志物C反应蛋白(CRP)升高之间存在非线性关联。然而,并非所有的人体研究都发现了类似的数据。例如,无症状动脉粥样硬化患者的肠道微生物群和血液TMAO水平没有明显变化。然而,中风和短暂性脑缺血发作患者表现出肠道微生物群的显著失调,但血浆TMAO水平降低。
相比之下,在一组35-55岁的参与者(n=817)中,在10年的随访中,TMAO浓度与动脉粥样硬化进展之间没有显著关系。
有趣的是,最近的一项研究发现,TMA而非TMAO与高血压负荷和CVD风险因素有关,并与早期慢性肾病(CKD)受试者中Akkermansia属、粪杆菌属、Ruminococcus、Subdoligranulum的丰度降低有关。
然而,仍需对人类队列进行进一步研究,以调查TMAO前体TMA是否是早期CVD发病机制调节中被遗忘的毒素或预测因子。
胆汁酸(BAs)是羟基化和饱和类固醇,有助于乳化和肠道吸收膳食脂肪和脂溶性分子。
在人类肝细胞中,初级胆汁酸(胆酸和鹅去氧胆酸)由胆固醇通过催化酶合成,如胆固醇7a羟化酶(CYP7A1)、甾醇27羟化酶(CYP27A1)、氧化甾醇7a羟化酶(CYP7B1),其表达受肠道微生物群的调节。
然后,初级胆汁酸与甘氨酸或牛磺酸结合,95%以上的初级胆汁酸被重新吸收并再循环回肝脏。非再吸收的胆汁酸可通过催化酶胆盐水解酶(BSH)解结合,该酶由几种共生肠道细菌表达,包括革兰氏阳性双歧杆菌、梭菌、肠球菌、乳酸杆菌和革兰氏阴性拟杆菌。
除了去结合,肠道微生物如梭菌和真杆菌也是7-脱氢酶的来源,以生成次级胆汁酸,包括来自CDCA的石胆酸(LCA)和来自CA的脱氧胆酸(DCA)。
此外,胆汁酸的氧化和差向异构化是通过羟类固醇脱氢酶(HSDHs)催化的,这种酶已在各种细菌中发现,包括放线杆菌、变形杆菌、梭菌和其他细菌。
一旦微生物代谢的胆汁酸进入循环血液,胆汁酸受体就可以介导信号通路来调节宿主代谢,有助于CVD的发展。
最重要的胆汁酸受体之一是FXR,它是肝脏初级胆汁酸和肠道次级胆汁酸的主要传感器。FXR在调节脂质和葡萄糖代谢方面已被证实。
有趣的是,在动脉粥样硬化易感小鼠中FXR的激活在动脉粥样硬化病变的形成中显示出保护作用。相应地,ApoE−/−中FXR的缺失导致脂质代谢缺陷的严重程度增加,主动脉斑块形成增强。相比之下,对FXR/ApoE或FXR/Ldlr双缺陷小鼠的其他研究显示主动脉病变和血浆LDL胆固醇降低。有趣的是,FXR还通过调节FMO3活性来调节TMAO途径。
另一个重要的胆汁酸受体是TGR5,通过继发性胆汁酸激活该受体,可通过减少斑块内炎症、斑块巨噬细胞含量和脂质负荷来减轻血管病变的形成。
PXR是另一种与胆汁酸代谢相关的核受体,由次级胆汁酸(如LCA)激活。
与其他受体相比,PXR的激活提高了脂蛋白VLDL、LDL和CD36的表达水平,从而聚集动脉粥样硬化形成中的ApoE−/− 小鼠,而PXR在载脂蛋白E中的抑制作用ApoE−/− 小鼠,通过减少巨噬细胞的脂质摄取和CD36表达减轻了主动脉病变区域。
尽管大多数关于胆汁酸在CVD发病机制中的研究都是在小鼠模型上进行的,但在临床队列中发现胆汁酸的循环水平与CVD表型相关。
例如,研究发现,人类受试者的初级和次级胆汁酸水平降低,慢性心力衰竭患者的总体生存率降低。此外,较低的空腹血浆总胆汁酸与冠状动脉疾病、MI和冠状动脉病变的严重程度显著相关。
总之,肠道微生物群衍生的胆汁酸通过多种类型的胆汁酸受体调节CVD的发展,而血浆胆汁酸可能是CVD发生的另一个重要预测因子,仍需进一步研究。
短链脂肪酸是膳食纤维(主要是多糖)发酵的主要微生物产物,主要由乙酸盐、丁酸盐和丙酸盐组成。肠道微生物群的特定成员参与短链脂肪酸合成的特定发酵途径。
肠道微生物群调节富含纤维的饮食与心血管疾病风险之间的保护性关联。具体而言,许多研究已经阐明了膳食纤维或短链脂肪酸在缓解高血压或其他CVD亚型中的功能作用(图1)。
其中一项研究发现,高纤维饮食和补充乙酸盐都可以降低收缩压和舒张压、心肌纤维化和左心室肥厚,这与改善肠道失调和增加拟杆菌的数量有关。
类似地,丙酸盐治疗可保护小鼠免受高血压心血管损伤,而产丁酸盐的细菌(如Roseburia intestinalis)可减少主动脉粥样硬化病变面积。
研究发现,Olfr78和GPR41参与调节宿主血压和内皮功能。具体而言,丙酸盐通过调节Olfr78和GPR41表达的中断,在野生型小鼠中诱导急性低血压反应。然而,抗生素治疗Olfr78−/− 小鼠(而非野生型小鼠)血压升高,GPR41升高,与野生型小鼠相比,小鼠也有收缩性高血压。
此外,最近的一项研究表明,乙酸盐和丁酸盐通过仅对丁酸盐进行GPR41/43激活,从而提高NO的生物利用度,从而改善大鼠主动脉内皮功能障碍。为了揭示短链脂肪酸在CVD发病机制中的机制作用,还需要进行进一步的研究。
★ 人类研究
在人类中,大多数关于CVD风险的研究都与短链脂肪酸相关的血压调节有关。早期临床干预研究发现,增加膳食纤维摄入量与高血压患者的血压降低有关。
在一项荟萃分析研究中也发现了粘性可溶性纤维对血压的类似保护作用。
相比之下,最近的一项干预研究报告称,高纤维高蛋白饮食可能通过上调循环短链脂肪酸水平增加CVD的风险。具体来说,高蛋白高纤维饮食诱导丙酸水平升高,这与LDL胆固醇和血压的上调有关;较高的丁酸水平与葡萄糖的上调和高密度脂蛋白胆固醇的下调有关。然而,它仍然局限于短链脂肪酸对人类CVD风险或保护作用的直接证明,需要进一步澄清。
芳香族氨基酸(AAA)是含有芳香环的氨基酸,包括苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)。
芳香族氨基酸的主要来源是膳食蛋白质,如牛肉、猪肉、鸡肉或鱼。有趣的是,研究人员发现了肠道微生物群产孢梭菌Clostridium sporogenes产生芳香族氨基酸代谢物的途径。
最近,几项研究发现,苯丙氨酸衍生的微生物代谢物苯乙酰谷氨酰胺(PAG)与主要心脏不良事件(如心肌梗死、急性缺血性中风或冠状动脉疾病)之间存在密切关系。
具体来说,膳食中的苯丙氨酸通过富含porA基因的肠道微生物群转化为苯乙酸,随后在肝脏中转化为PAG。PAG进一步激活G蛋白偶联受体,包括α2A、α2B和β2肾上腺素能受体,以促进动脉损伤动物模型中的血小板反应性和血栓形成潜能。
同样,来自Trp的肠道微生物衍生代谢物吲哚硫酸酯(IS)和来自Tyr的对甲酚硫酸酯(PCS)也被确定为预测CKD患者CVD事件的有价值标记物。
这可能是由于IS和PCS通过诱导尿毒症毒性和内皮功能障碍而产生的有害影响。
然而,一些研究发现IS、PCS或PAG与CVD结果无关。这种差异可能是由于不同研究的阈值效应造成的。这些肠道微生物代谢物在心血管疾病进展中的作用尚需进一步研究。
健康饮食模式已被建议预防 CVD 进展(图 2),包括地中海饮食(Med-diet)、阻止高血压的饮食方法(DASH)和间歇性禁食(IF)等喂养模式。
图2 针对肠道微生物群的饮食干预在预防心血管疾病方面的潜在疗法

Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★ 饮食类型
多项临床试验证实了地中海饮食对主要血管事件、冠状动脉事件、中风和心力衰竭的保护作用。这种效应与微生物群多样性和微生物代谢物短链脂肪酸的增加以及TMAO 和血浆LPS水平的降低有关。
然而直到最近,才发现地中海饮食的长期干预可以通过肠道微生物群调节来预防 CVD。
具体来说,地中海饮食的长期干预可以通过富含膳食纤维代谢物(如Faecalibacterium prausnitzii和Bacteroides cellulosilyticus )显着改变整体肠道微生物组。
特别是,在没有普氏菌的情况下,地中海饮食对 CVD 危险因素(包括脂质代谢、炎症和葡萄糖稳态)显示出强大的保护作用。
尽管多项数据表明 DASH 饮食可以通过降低血压和血脂异常来改善心脏危险因素,仍然缺乏关于 DASH 饮食与 CVD 预防中微生物群改变之间直接联系的数据。
★ 喂养模式
间歇性禁食(IF)是一种重要的饮食喂养模式,是一种周期性能量限制的做法,可以通过改变肠道微生物群来降低CVD风险。
具体而言,自发性高血压卒中易感大鼠在IF干预50天后,肠道微生物群β多样性发生显著变化,这与通过调节胆汁酸代谢降低血压有关。这些发现已通过对GF大鼠的粪便移植得到证实。
此外,在8周内对患有IF的人群进行临床干预,显著改善了血管舒张参数,减轻了氧化应激、与微生物群产生的短链脂肪酸增加相关的炎症,并降低了血浆LPS。有趣的是,短期禁食5天也可以降低血压和体重,调节微生物群,包括脱硫弧菌科、阿克曼菌和瘤胃菌科。
★水果和蔬菜中的多酚
多酚是一大类常见于植物产品中的有机化合物,尤其是水果和蔬菜。超过90%的总多酚在小肠中不可吸收,并被大肠中的肠道微生物群进一步代谢。
越来越多的研究支持膳食多酚对肠道微生物群的修饰和CVD保护的作用。
白藜芦醇(在葡萄、苹果和浆果等水果中发现)已被确定通过下调TMAO水平和上调BAs合成来减轻ApoE-/-小鼠的动脉粥样硬化,而BAs合成与有益菌拟杆菌、乳酸杆菌、双歧杆菌和阿克曼菌的丰度增加有关。
口服槲皮素(在洋葱、西兰花和西红柿等蔬菜中发现)可以抑制体重增加,改善动脉粥样硬化病变的程度,降低胆固醇水平、致动脉粥样硬化溶血磷脂酰胆碱水平,减少革兰氏阴性菌疣状芽胞菌的丰度,同时增加微生物多样性。
在人类受试者中,富含多酚的饮食干预发现,饮食多酚可以显著增加微生物多样性和Ruminococcaceae,这些与心脏代谢危险因素(如血浆甘油三酯和大 VLDL 中的胆固醇)的改善有关 。
总的来说,水果和蔬菜中的多酚可能是心血管疾病的潜在治疗干预措施,它们的部分保护作用可以通过肠道微生物群的修饰来介导。
关于多酚详见这篇文章:肠道微生物群与膳食多酚互作对人体健康的影响
★膳食纤维
膳食纤维是不易消化的碳水化合物,包括水溶性或不溶性形式,通常存在于水果、蔬菜、全谷物、坚果和豆类等中。
膳食纤维不能被小肠吸收,“喂养”健康的肠道微生物群,导致短链脂肪酸的多样性和产量增加。
如前所述,短链脂肪酸激活特异性受体,从而改善高血压和主动脉内皮细胞功能障碍。
最近的一项研究发现鹰嘴豆膳食纤维提高了微生物多样性,增加了拟杆菌和乳酸杆菌的相对丰度,并提高了丙酸水平。鹰嘴豆膳食纤维也可以通过对肠道微生物群进行类似的修饰来改善高血糖症。
全谷物燕麦还能降低血浆胆固醇水平,提高胰岛素敏感性,这与微生物群中有益乳酸杆菌的增加有关。同样,人类食用全谷物产品时,总胆固醇和低密度脂蛋白胆固醇水平较低,双歧杆菌含量较高。
关于膳食纤维详见这篇文章:你吃的膳食纤维对你有帮助吗?
益生元是植物源性或不易消化的食物成分,可刺激胃肠道中“友好”微生物的生长。
大多数益生元是膳食纤维,而不是所有膳食纤维都可以归类为益生元。常见的益生元包括低聚糖和多糖,如菊粉、低聚果糖、β-葡聚糖,它们通常能诱导肠道微生物群的特定修饰。
许多研究通过三个主要方面有趣地研究了益生元对宿主代谢的有益影响,以改善CVD状况(图2):
1)降低血脂
补充益生元纤维(例如菊粉)可以降低血浆胆固醇水平,并减少肝脏中的TAG积累;
2)减少内毒素血症和炎症
益生元低聚果糖可以增加双歧杆菌的数量,与血浆和脂肪组织中的内毒素血症和炎症呈负相关;
3)降低血压
补充富含益生元纤维的饮食可以通过GPR43信号通路降低收缩压和舒张压。
益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。人类饮食中的大量发酵食品,如酸奶、酸菜、开菲尔、泡菜,都含有益生菌菌株。
作为益生元,益生菌菌株也被确定在更多方面防止CVD进展(图2):
1) 改善血管内皮功能
服用植物乳杆菌299v可改善冠心病患者阻力动脉的内皮依赖性血管舒张功能。同样,发酵乳杆菌CECT5716治疗可降低大鼠的血管氧化应激并改善内皮功能。
2) 降低血糖和氧化活性
益生菌酸奶的干预显著降低血糖,提高总抗氧化状态。
3) 降低胆固醇
补充长双歧杆菌BB536对降低总胆固醇、肝脏脂质沉积和脂肪细胞大小有显著效果。
4) 减轻内毒素血症和炎症
通过恢复肠道屏障功能,通过改善系统性内毒素血症诱导的炎症,口服粘液阿克曼菌已被证明可减少动脉粥样硬化病变。此外,补充乳酸杆菌 L.reuteri V3401可降低炎症标志物水平,如TNF-α、IL-6、IL-8,这与降低CVD风险有关。
更多益生菌、益生元等介绍详见这篇文章:
如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
一些来自中药的天然成分也通过调节肠道微生物群被用作潜在的CVD疗法(图2)。
小檗碱(BBR),一种生物活性异喹啉生物碱,广泛存在于各种中草药中并从中提取,已被证明具有许多有益的作用。
最近发现,高剂量的小檗碱不仅通过降低总胆固醇和极低密度脂蛋白胆固醇水平来改善脂质代谢,还下调促炎细胞因子TNF-α、Il-1β、Il-6和上调的抗炎性Il-10水平,这些水平与参与短链脂肪酸产生的Alistipes和Roseburia的丰度增加有关。
Roseburia菌 详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
此外,BBR可以通过重塑肠道微生物群成分来抑制TMAO的产生,从而减轻胆碱诱导的动脉粥样硬化。
红曲米(RYR)可以通过降低总胆固醇和低密度脂蛋白水平来缓解斑块的形成,而总胆固醇和低密度脂蛋白水平与厚壁菌/拟杆菌的比例降低有关,同时也降低了黄曲霉和黄酮类提取物的丰度。
RYR干预还能改善肠道屏障功能,并通过TLR信号通路减轻炎症。
灵芝是一种药用蘑菇,通过降低携带内毒素的变形菌水平和增加有益细菌(包括梭菌和真杆菌),来减少肥胖、内毒素血症、慢性炎症以及恢复肠屏障功能。
肠道微生物群与心血管疾病之间存在着重要而复杂的联系。作为肠道微生物群中重要的调节剂之一,膳食成分可改变与全身内毒素、炎症、肠道屏障功能障碍以及脂质代谢功能障碍相关的微生物成分,从而增加CVD风险。
然而,更多的研究数据表明,肠道微生物群对饮食代谢在调节CVD发病机制中的主要作用包括:
1) 代谢饮食胆碱或L-肉碱以诱导TMAO的释放,促进动脉粥样硬化的进展;
2) 调节胆汁酸代谢,可能通过多种受体途径调节动脉粥样硬化的形成;
3) 产生芳香族氨基酸代谢物PAG、IS、IPA或PCS,加速动脉粥样硬化形成;
4) 发酵膳食纤维以产生短链脂肪酸,这对CVD的进展起到了一些有益的作用。
这些发现为开发CVD的新型潜在预防和治疗方法提供了一些极好的支持,例如可以通过健康饮食和喂养模式、含有健康膳食成分的饮食等干预措施改善菌群,从而预防改善CVD。当然也包括:来自水果和蔬菜的膳食多酚、膳食纤维和益生元、益生菌以及饮食中药等干预措施。主要参考文献:
Xufei Zhang, PhilippeGérard. Diet-gut microbiota interactions on cardiovascular disease. Computational and Structural Biotechnology Journal. 2022,Mar: 1528-1540. doi: org/10.1016/j.csbj.2022.03.028
Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell Mol Life Sci. 2019 Apr;76(8):1541-1558. doi: 10.1007/s00018-019-03011-w. Epub 2019 Jan 25. PMID: 30683985.
Bapteste E, Gérard P, Larose C,et al., The Epistemic Revolution Induced by Microbiome Studies: An Interdisciplinary View. Biology (Basel). 2021 Jul 12;10(7):651. doi: 10.3390/biology10070651. PMID: 34356506; PMCID: PMC8301382.
Tang WHW, Li DY, Hazen SL. Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol. 2019 Mar;16(3):137-154. doi: 10.1038/s41569-018-0108-7. PMID: 30410105; PMCID: PMC6377322.

谷禾健康
神经免疫,菌群,心血管疾病
最新的《中国心血管病健康和疾病报告2019》数据显示,中国居民心血管病现患人数已达3.30亿,拐点尚未到来,且7-17岁儿童青少年高血压患病率呈现上升趋势。
心血管疾病(CVD)仍然是全世界发达国家死亡和残疾的主要原因。此外,广泛存在的心血管危险因素,如代谢综合征、糖尿病、肥胖和性类固醇激素代谢紊乱,有效预防策略已成功减少急性心血管事件和死亡的影响。
大脑和其他器官系统之间的双向通信对于大脑健康和生物体的整体健康至关重要。曾经被认为具有免疫特权的大脑现在被认为是一个高度免疫特化的器官,拥有自己的大脑驻留免疫细胞。这些细胞形成神经元回路和淋巴系统,这些系统调节免疫细胞的复杂流出,以及从脑脊髓空间与循环的其余部分交换的液体。
而共生微生物群是个体间异质性的重要来源,可以通过调节宿主免疫来影响人类健康。人们越来越认识到 CVD 的许多潜在原因,包括免疫和肠道菌群失调可能是 CVD 的致病因素,提出了对新的免疫调节治疗策略的需求。
本文总结了免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展,并探索菌群-神经免疫通讯是否为 CVD 的潜在治疗靶点。
本文缩略词:
CVD: 心血管疾病 (cardiovascular disease )
心血管疾病,又称为循环系统疾病,是一系列涉及循环系统的疾病,循环系统指人体内运送血液的器官和组织,主要包括心脏、血管(动脉、静脉、微血管),可以细分为急性和慢性,一般指心脑血管疾病。
ANS: 自主神经系统 (autonomic nervous system)
自主神经系统是脊椎动物的末梢神经系统,由躯体神经分化、发展,形成机能上独立的神经系统,是外周传出神经系统的一部分,能调节内脏和血管平滑肌、心肌和腺体的活动,又称植物性神经系统、不随意神经系统,故名自主神经系统(参考自:百度百科)。
SFO: 穹窿下器神经元 (Neurons of the subfornical organ )
穹窿下器官,室周器官,位于第三脑室前背侧壁、海马连合腹侧穹窿柱分歧处、适平室间孑L平面。
OVLT: 下丘脑终板血管区(Organum vasculosum laminae terminalis)
终板就是第三脑室前缘的隔膜。下丘脑终板血管区,内生致热原作用于血脑屏障外的脑血管区,即下丘脑终板血管区,该区位于第三脑室壁的视上隐窝处。
PVN: 下丘脑室旁核 (paraventricular nucleus)
下丘脑室旁核 位于第三脑室下丘脑部的上端两侧,呈长楔形轮廓,是下丘脑前区最显著的核团之一,与神经内分泌活动和植物性功能等有关的复合体结构,参与体内电解质与体液平衡,心血管活动调节及其它多项生理功能的调控。
NTS: 孤束核 (nucleus tractus solitarius)
孤束核为延髓内重要内脏感觉性核团,为一般内脏感觉和味觉传导通路上的第一级中继站。随着神经解剖学和神经生理学研究方法的不断发展,人们对孤束核的认识日趋深入,近年来HRP和ARG技术有关孤束核的大量的研究证实了孤束核不但与低级中枢(脊髓、脑干)具有传入、传出神经联系,而且与高位中枢(前脑、小脑)也具有复杂的往返联系。
DMV:迷走神经运动背核 (dorsal nucleus of vagus nerve)
迷走神经背核是2014年经全国科学技术名词审定委员会审定发布的人体解剖学名词。位于延髓室底灰质内,迷走神经三角深面的神经核。属一般内脏运动核,支配颈部、胸部所有内脏器官和腹腔大部分内脏器官的平滑肌、心肌的活动和腺体的分泌。
神经和免疫系统通常通过特定的大脑区域、传入和传出周围神经以及神经激素通路进行交流(下图)。
大脑和周围器官之间的通讯途径
Carnevale D. Nat Rev Cardiol. 2022
大脑通过不同的途径与周围器官和组织相连。特定的大脑区域,统称为脑室周围器官,与周围形成自然的大脑界面,内衬有渗漏的血脑屏障。神经网络从脑室器官延伸到周围神经系统,并建立重要的神经解剖学连接。
穹窿下器官 (SFO) 和终板血管器官 (OVLT) 的神经元密集表达 1 型血管紧张素 II 受体和渗透压感受器,并为下丘脑的室旁核 (PVN) 提供神经支配。反过来,PVN 与延髓腹外侧 (RVLM) 的交感神经元相连,RVLM 具有调节外周交感神经活动的重要功能。
PVN 的其他神经元连接到孤束核 (NTS) 和迷走神经背运动核 (DMV) 的复合体,它们负责通过迷走神经传递的外周胆碱能神经支配。
所有主要的外周器官通常都有交感神经支配(包括心脏、脉管系统、肾脏和颈动脉体)和副交感神经支配(包括心脏、颈动脉体、肝脏、胃和肠)。
交感神经支配是免疫器官(以浅蓝色显示)和内脏组织的神经控制的主要途径。大脑、心血管系统和免疫器官之间的进一步整合轴是由神经内分泌系统通过下丘脑-垂体-肾上腺轴形成的。
循环物质,如细菌源性肽、宿主源性细胞因子和组织代谢物,向特定的大脑区域发出信号,这些区域的特点是存在渗漏的血脑屏障。
脑室周围器官由穹窿下器官(SFO)、终板血管器(OVLT)和末梢区组成,是监测周围组织并在神经免疫过程中发挥关键功能的大脑区域。同时,脑室周围器官在心血管疾病中起着至关重要的作用。
穹窿下器官富含血管紧张素II受体1型,它是肾素-血管紧张素-醛固酮系统的关键介质。
OVLT的神经元同时表达血管紧张素II受体1型和渗透压感受器,它们对感知细胞外钠/盐负荷浓度至关重要。
它们共同传递有关血容量、血压和细胞外液渗透压的外围信息。
有趣的是,从穹窿下器和OVLT投射到下丘脑室旁核(PVN)的神经元也被描述过,脑室旁核也接受后脑的投射,这表明它具有整合功能。虽然它们位于脑室周围器官之外,但孤束核(NTS)和迷走神经背侧运动核(DMV;心血管功能最有效的调节器之一)接收来自末梢区的输入。
大脑通过在脑室旁核和脊髓中间外侧细胞柱之间建立直接投射,或通过延髓头端腹外侧间接连接,来控制周围交感神经反射反应。外周的稳态扰动由延髓头端腹外侧感觉到,并通过蓝斑的去甲肾上腺素能神经元以反射反应传递。
作为补充,神经元表达细胞因子受体,这有助于神经免疫串扰和脑与身体的相互作用。
当细胞因子在各种生理和病理生理环境中的外周组织中分泌时,神经元活动就会改变。虽然神经元细胞因子受体的生理功能仍在研究中,但细胞因子在脑发育、外周组织损伤和动物行为方面的作用已被证明。这些观察表明存在由细胞因子介导的脑-体双向轴。
接下来进一步的讨论这些信号是如何在心血管疾病中启动、传播和转移到大脑的。
投射到中枢神经系统之外的神经被称为外周神经系统,它双向连接大脑和外周器官和组织。
外周神经系统分为两个部分:
躯体神经系统和自主神经系统(ANS)
躯体神经系统与中枢神经系统交换感觉和运动信息,而ANS调节非自愿功能,并在神经免疫和心血管相互作用中起决定作用。
ANS由传入和传出神经元组成,将大脑与周围内脏器官和组织连接起来。历史上,ANS被定义为平行的交感和副交感臂,分别负责所谓的“逃跑或战斗”和“休息和消化”反应。
ANS作为大脑与外周沟通的关键途径的概念不断发展,有证据表明,ANS也发挥了神经免疫调停者的作用。生理和心血管反应的改变都受到ANS的深度影响,ANS的失衡是许多心血管疾病的典型特征。
我们对ANS如何调节心血管功能的理解有了实质性的进步,这得益于实验方法的发展,使直接分析神经系统活动成为可能。
实验性和临床性的显微神经学被用来测量指向心血管系统的节后交感神经传出的电活动。例如,骨骼肌血管的显微神经造影术成为评估人类区域交感神经活动的金标准方法。
应用于动物实验的类似程序有助于确定ANS调节心血管功能的解剖路线和分子机制。在过去5年中,已经制定了直接评估调节免疫系统的ANS臂的实验方案,从而能够定义神经免疫机制如何促进心血管疾病的发病和进展。
神经系统和免疫系统之间的进一步相互作用是通过神经内分泌系统进行的,主要通过下丘脑-垂体-肾上腺轴进行调节。下丘脑-垂体-肾上腺轴通常对心理压力敏感,是免疫反应和心血管功能的有效调节剂。
神经元顺行和逆行追踪技术已被用于通过周围神经系统的传入和传出臂绘制大脑和免疫器官之间的连接(下图)。
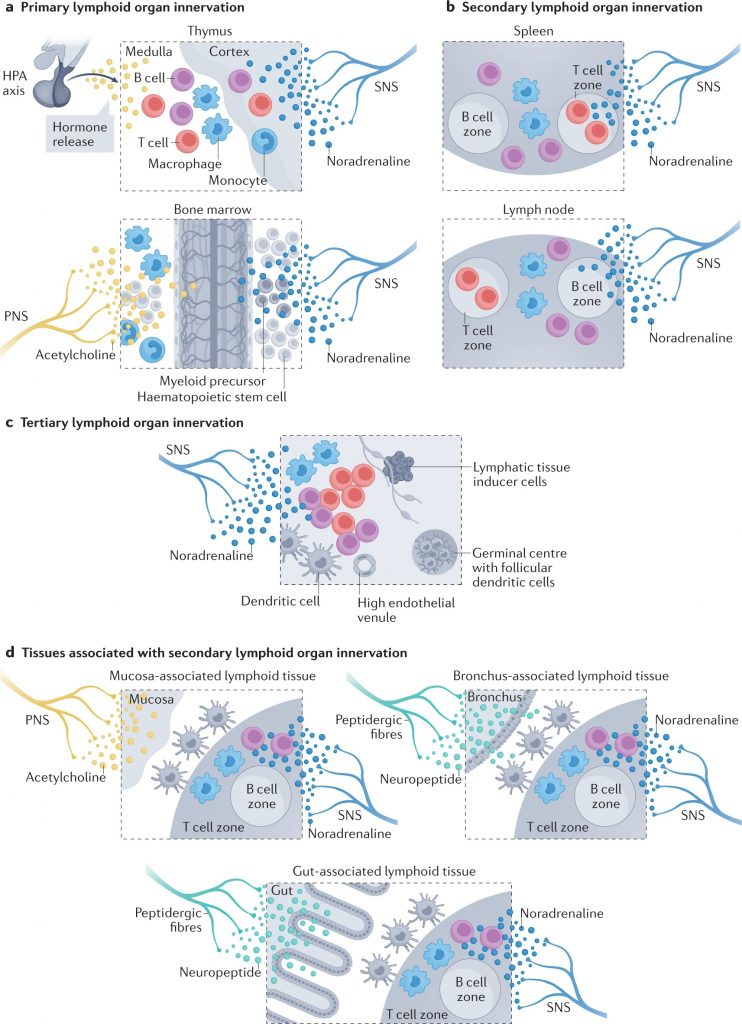

Carnevale D. Nat Rev Cardiol. 2022
a |初级淋巴器官神经支配。胸腺主要由去甲肾上腺素能纤维支配。虽然不存在直接的胆碱能神经支配,但交感神经与下丘脑-垂体-肾上腺(HPA)轴之间的相互作用已被证实。相反,骨髓神经支配更为复杂,包括交感神经系统(SNS)、副交感神经系统(PNS)和与大脑建立双向通讯的感觉纤维。骨髓的造血和免疫功能受到这种神经网络的严格调节。
b |次级淋巴器官包括脾脏和淋巴结,由去甲肾上腺素能纤维密集支配,其起源于大脑,已通过神经调节研究确定。淋巴结也有一个明显的感觉神经网络,可以严密监测外周免疫状态。
c |三级淋巴器官是为了应对非淋巴器官的病理挑战而形成的,具有独特的组织特异性组织。控制第三淋巴器官神经支配的神经纤维仅在少数解剖部位被发现。
d |粘膜相关淋巴组织在粘膜组织(如支气管或肠道)中形成,以响应稳态的扰动,并由神经网络严格控制,包括SNS、PNS和肽能感觉纤维。
神经元追踪确定外周器官神经支配路线
神经元连接性的研究需要对轴突进行双向追踪,包括从神经元细胞体到轴突终末的顺行追踪,以及从终末到胞体的逆行追踪。神经解剖学追踪是一种通过追踪神经元在突触前或突触后水平的连接来识别神经元的常用方法。神经解剖学追踪技术在确定包括免疫器官在内的外周器官的神经支配途径方面变得特别有用。
原始追踪研究的基础是将氟金注射到免疫器官中,使研究人员能够逆行识别节前神经元,或注射生物素化葡聚糖胺以顺行识别神经元连接。几十年来,这些单独使用或联合使用的示踪剂使研究人员能够研究连接大脑和周围器官的神经回路。
随后的技术进步利用伪狂犬病病毒(一种高度传染性的神经营养性α疱疹病毒,Pseudorabies virus,PRV)的能力来定义中枢神经系统中的多突触回路。病毒的逆行扩散只发生在突触相连的神经元链中。在将伪狂犬病病毒注射到感兴趣的器官或组织后,更高阶的神经系统结构在稍后的时间点被标记。通过这种方式,可以定义神经元连接的精确路径,从外周器官开始,追溯到大脑。此外,伪狂犬病病毒在神经元细胞体中复制的过程具有自我放大的能力,这使得在受感染动物的大脑中识别二级、三级甚至四级神经元成为可能。
初级免疫器官包括胸腺和骨髓,它们参与淋巴细胞的产生和初始选择。胸腺在新生儿和青春期前发育阶段活跃,逐渐退化,只有残留的淋巴细胞生成持续到成年期。骨髓包含在骨腔中,从未成熟的造血祖细胞开始产生红细胞和免疫细胞。
胸腺神经支配和神经元调节
不同类型的细胞参与胸腺器官发生,这需要神经嵴细胞的协调相互作用。基于旧追踪技术的初步研究显示,交感神经纤维错综复杂,主要释放去甲肾上腺素,并在胸腺中形成血管周围神经网络。使用经典单突触逆行和顺行示踪剂的类似方法并没有识别胸腺的副交感神经支配。
后续的研究使用伪狂犬病病毒(PRV)的逆行跨神经元多突触追踪,来确定负责交感神经流出到胸腺的中枢神经系统区域。PRV感染的神经元分布在脊髓、延髓、脑桥、下丘脑室旁核、去甲肾上腺素能细胞A5组、延髓头端腹外侧核和中缝尾侧核。
值得注意的是,PRV感染的动物在DMV中没有PRV阳性细胞核,这与之前的观察结果一致,之前的观察排除了支配该区域胸腺的迷走神经纤维的存在。
虽然连接胸腺和大脑的硬连线路径的证明来自动物研究,追踪技术是可行的,但报告显示人类存在类似的胸腺神经支配模式,为这些发现提供了转化相关性。
神经样纤维和垂体激素通过人胸腺的免疫组织进行化学鉴定。胸腺糖皮质激素通过调节儿茶酚胺释放和肾上腺素受体表达,对胸腺细胞的存活和分化以及交感神经系统功能都很重要。相反,接受肾上腺切除术的动物胸腺去甲肾上腺素水平显著降低。
典型的感觉神经肽,如P物质和降钙素基因相关肽(CGRP),已在胸腺中被发现,但没有明确的报告表明,这些神经肽可以为大脑提供感觉通路,这意味着交感神经支配可能是调节胸腺免疫功能的唯一神经通路。
骨髓神经支配和神经元调节
骨髓神经支配沿着主动脉传导,并通过血管丛穿透骨髓。实质以神经纤维树枝状排列为特征,末端靠近造血细胞和淋巴细胞。大多数纤维支配骨髓血管系统,但其他一些神经末梢支配实质性和血窦元素以调节造血和细胞迁移。
酪氨酸羟化酶是去甲肾上腺素合成的限速酶,存在于大动脉周围的所有神经中,并延伸至骨髓实质。除了主要的去甲肾上腺素能神经支配外,还确定了神经肽Y的免疫反应性,从而表明骨髓的去甲肾上腺素能神经支配和肽能神经支配是混合的。
在很久以前发表的研究中也检测到对 P 物质和 CGRP 呈阳性的神经纤维,但感觉神经元的功能直到最近才被发现。CGRP感觉纤维与去甲肾上腺素能神经一起延伸到骨髓,在那里它们与酪氨酸羟化酶神经元合作,控制造血干细胞的动员。这些发现表明大脑通过硬连接的交感神经和感觉连接控制骨髓的免疫和稳态功能。
随后的研究还发现了支配骨骼和骨髓的副交感神经纤维。尽管在造血生态位附近检测到合成乙酰胆碱的胆碱乙酰转移酶的免疫反应性,但仅在骨中发现了明显的功能性副交感神经支配,其中胆碱乙酰转移酶调节骨重塑。
后来的研究表明,骨髓神经支配与昼夜节律密切相关。骨髓中去甲肾上腺素的释放依赖于昼夜振荡,进而调节与控制白细胞和造血干细胞的保留和排出过程相关的基因表达。尽管这种构成过程在生理上是相关的,但神经介导的白细胞和造血干细胞转运的节律过程在疾病背景下可能特别重要。
未来的研究将有必要澄清清晨急性心血管事件的高发病率是否与神经调节白细胞和造血干细胞运输的影响有关。
次级淋巴器官包括淋巴结、脾脏和与粘膜相关的淋巴组织,通常由交感神经和感觉神经支配。
淋巴结神经支配和神经调节
淋巴结的结构包括血管系统和淋巴管,它们穿透髓质实质,在 T 细胞区域中被复杂的去甲肾上腺素能纤维网络缠绕。相比之下,富含B细胞的生发中心缺乏神经支配。
在稳定状态下,去甲肾上腺素的释放依赖于昼夜节律的激活,进而通过β2-肾上腺素受体信号调节淋巴细胞的生理日常再循环。
通过使用各种技术,从整体免疫标记到逆行神经元追踪、单细胞基因组学和光遗传学,研究人员发现了支配淋巴结的独特感觉神经元阵列。将腺相关病毒注射到淋巴结后,四种类型的神经元被追溯到背根神经节。对这些不同的神经元群体进行的单细胞RNA测序确定了肽能伤害感受器的密集表达,形成了与大脑的双向通讯途径,并持续监测周围免疫环境。
脾神经支配和神经调节
脾脏是最大的次级淋巴器官,监测血液传播的物质和抗原。脾脏主要由去甲肾上腺素能脾神经支配,通常通过神经信号调节免疫功能。
脾神经从腹腔神经节分支,从脾门进入脾脏,沿着脾动脉外侧走行。去甲肾上腺素能神经分布穿过边缘区,伸入白髓,在白髓中,T细胞、B细胞和树突状细胞附近可以发现神经末梢。相反,红髓的神经支配似乎稀疏而分散。通过组织学和追踪的方法,在脾脏中没有发现直接的胆碱能神经支配。
白髓,位于脾脏内部,包含着一种特殊的白细胞,这些细胞聚集在血管周围,当血液流过脾脏的时候,白髓中的淋巴细胞辨认并吞噬掉任何侵入的细菌和病毒,以此方式过滤人体血液,防止机体被病菌感染。
红髓,动物体内最大的淋巴器官。位于左上腹胃的背面,胃与膈之间,呈内侧向内凹陷的扁椭圆形或条索状等。
一项使用完整全组织3D成像的研究提供了有关脾脏神经支配的额外信息。实质内交感神经支配的结构被揭示为圆锥状结构,这在其他免疫器官中是不存在的,这表明独特的神经调节功能发生在脾脏中。
在脾脏中发现了具有独特特征的神经胶质细胞,这又增加了复杂性。自主神经支配通常包含非髓鞘神经胶质细胞。虽然神经胶质细胞在由周围神经系统支配的内脏器官中的特定功能尚未得到充分研究,但它们在免疫器官中的存在可能在神经细胞和免疫细胞之间起着中介作用,这需要进一步研究。
使用逆行示踪剂和后来的跨神经元多突触PRV追踪的研究明确证明,脾脏神经支配完全是去甲肾上腺素能的,起源于腹腔神经节。
通过对脾脏注射PRV后较长时间点的分析,确定了脑干、桥脑和下丘脑的运动前脑核团。随后,光遗传学领域出现了一种追踪神经元回路的完全创新工具,它在功能上映射直接投射到腹腔神经节的DMV胆碱能神经元。
当DMV神经元被光激活时,会诱发脾神经放电,从而直接证明腹腔迷走神经和脾神经之间的解剖联系。
粘膜相关淋巴组织神经支配
身体内的粘膜,如呼吸道和胃肠道的粘膜,有分散的粘膜淋巴组织区域,这些区域共同构成了最广泛的淋巴组织,这些区域统称为粘膜相关淋巴组织,保护机体免受各种挑战。
虽然传统的次级淋巴器官是在胚胎发生过程中发育起来的,但淋巴滤泡,如支气管相关淋巴组织或肠道相关淋巴组织,在出生后会因炎症或感染而聚集。尽管如此,这些异位淋巴组织与传统淋巴组织在结构上有许多相似之处。
粘膜相关淋巴组织的一个典型特征是广泛的神经支配。早期研究描述了支气管相关淋巴组织和肠道相关淋巴组织的交感神经和肽能神经支配,这些淋巴组织含有大量神经肽,如P物质、血管活性肠肽和生长抑素。通常情况下,神经纤维沿着小血管排列,然后在与淋巴细胞接触的粘膜组织的实质中分支,在含有T细胞的区域,神经占优势。
随后的研究通过专门检测和解码各种有害外周刺激的伤害感受器,确定了粘膜相关淋巴组织神经支配的感觉通路。
支配肠道相关淋巴组织的伤害感受器感知胃肠道的扰动,并建立具有保护功能的神经反射。虽然肠道相关淋巴组织的感觉神经支配在抵御微生物方面的作用越来越明显,但对心血管疾病中肠道神经系统的影响仍不清楚。
支气管相关淋巴组织的神经支配作用研究较少,但交感神经、胆碱能神经和感觉神经纤维已被确定。
三级淋巴样器官是指在成年期由淋巴样新生在随机、典型的非淋巴样和非粘膜部位形成的淋巴样组织,以应对慢性炎症。这些组织在自身免疫性疾病、微生物感染、慢性同种异体移植排斥反应、癌症甚至动脉粥样硬化中都被观察到。
在几种转基因小鼠模型中诱导第三淋巴器官,可以表征炎症细胞因子和淋巴趋化因子的模式,这些细胞因子和趋化因子是其发育和调节所必需的。
虽然已经描述了三级淋巴器官的形态、细胞和血管成分,与第二淋巴器官(如B细胞和T细胞室的独特组织、含有滤泡树突状细胞的B细胞滤泡和生发中心)有相当大的相似性,他们在疾病进展中的参与是有争议的,并且仍然是研究的主题。
例如,在微生物感染期间,三级淋巴样器官会在局部保留病原体,从而阻碍它们进入生物体的其他部位。相反,自身免疫性疾病的进展可能因同时存在三级淋巴器官而加剧。通过选择性地去神经支配肠道交感神经或胆碱能神经,迷走神经在三级淋巴器官形成中的重要作用已在实验性结肠炎中得到证实。目前还尚不清楚ANS是否有助于其他器官中第三淋巴器官的发育、组织和功能。
神经免疫相互作用是对挑战体内平衡的应激源做出快速反应的基本适应机制。这一概念首次出现时,脾脏神经支配在细菌内毒素血症(对身体最危险的疾病之一)期间被观察到具有保护功能。
去甲肾上腺素能纤维和淋巴细胞之间的直接神经免疫相互作用被描述,同时确定在脾脏中引起去甲肾上腺素能放电的神经回路,该回路在抑制脂多糖诱导的细胞因子负荷和对抗感染性休克方面有效。
神经免疫相互作用已被确定为心血管危险因素和心血管疾病病理生理学的潜在机制。
神经免疫相互作用促进心血管危险因素的发生及进展
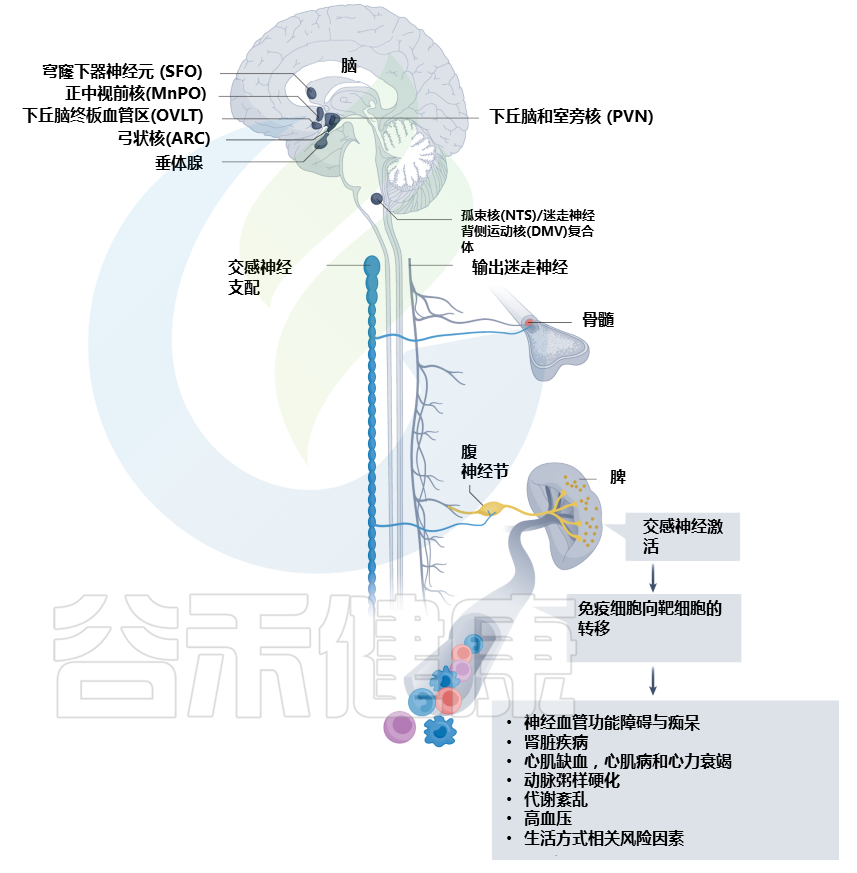
Carnevale D. Nat Rev Cardiol. 2022
大脑中的环室器官被心血管系统的挑战激活。通过一系列中枢和周围神经系统的解剖连接,大脑在免疫器官中建立神经反射来控制和调节免疫功能。心血管危险因素,如高血压、代谢紊乱和动脉粥样硬化,是常见的神经免疫机制改变的基础。心血管疾病,例如心肌缺血、压力过载心肌病、心力衰竭、肾脏疾病和神经血管功能障碍,其特征在于受影响的心血管组织中局部和免疫器官中的神经免疫改变。ARC,弓状核;DMV,迷走神经背运动核;MnPO,正中视前核;NTS,孤束核;OVLT, 终板的血管器官;PVN,下丘脑室旁核;SFO,穹窿下器官。
高血压
与高血压相关的炎症和免疫反应最早出现在20世纪70年代。然而,这些过程大多被认为是高血压导致靶器官损害的结果。
免疫系统在高血压中的机制作用的第一个证据,来自缺乏 T 细胞和 B 细胞且典型的高血压刺激不会增加血压的Rag1 -/-小鼠的研究。通过过继转移重建Rag1 -/-小鼠中的 B 细胞或 T 细胞池,这项研究表明,血管紧张素II或脱氧皮质酮醋酸盐(DOCA)仅在小鼠具有成熟 T 细胞时才会诱发高血压。
随后大量研究调查了特定的T细胞亚群是否对高血压的发展至关重要,发现血管紧张素II给药不会增加Cd8 -/-小鼠的血压,但会增加Cd4 -/-小鼠的血压。免疫系统在血压升高中所起作用的细胞和分子机制仍有待研究。
与血压稳态有关的基本生理变量,如血管张力和肾脏钠排泄,依赖于严格的神经控制。因此,神经调节系统、免疫器官和心血管功能之间建立的关系值得研究。
重要的研究揭示了大脑和免疫系统之间的联系可能对高血压至关重要。首先,在动物模型中,脑室内注射血管紧张素II可通过交感神经系统诱导外周细胞因子的释放。此外,选择性的脑室周围器官损伤阻碍了小鼠对血管紧张素II的典型血压升高反应。
有趣的是,脑室周围器官受损的小鼠无法激发T细胞并促进T细胞在血管系统中的浸润,这表明高血压患者的神经系统和免疫系统之间存在关系。
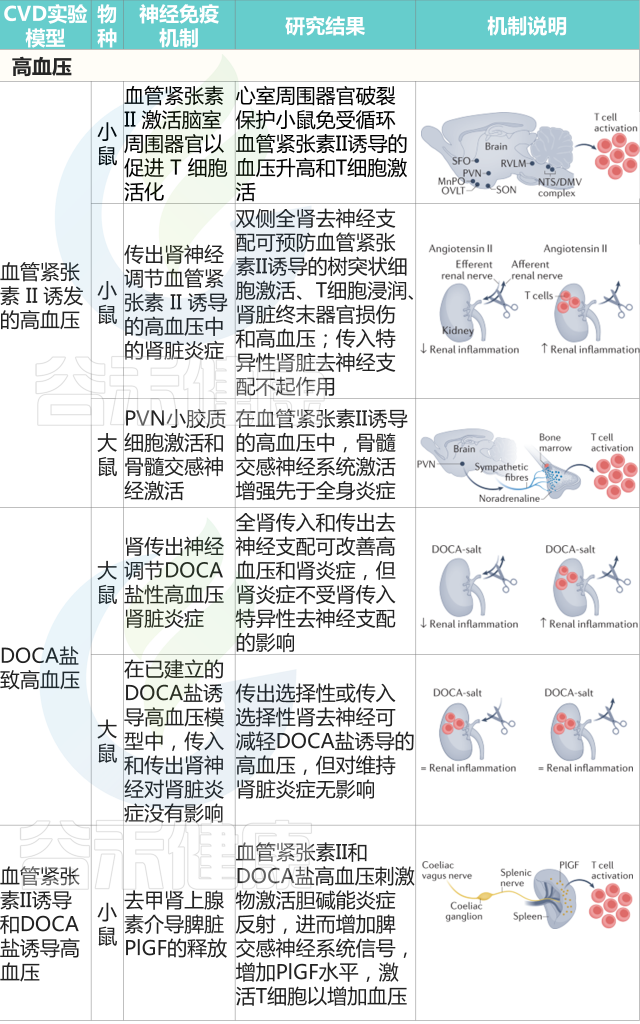

Carnevale D. Nat Rev Cardiol. 2022
高血压患者免疫系统的直接神经控制随后被证实。利用小鼠脾神经的显微神经学检查,血管紧张素II和DOCA盐均能增加神经放电,促进脾脏中去甲肾上腺素的释放。选择性脾脏去神经可防止血压升高以应对任何一种高血压刺激,脾切除术也重现了这一效应。
逆行追踪法,加上在测量脾神经放电时进行的选择性去神经手术,阐明了腹腔迷走神经输出是由高血压刺激激活的节前神经元。
在分子水平上,脾脏中的去甲肾上腺素释放是促进胎盘生长因子激活所必需的,胎盘生长因子是一种血管内皮生长因子家族的血管生成生长因子,也具有对血压升高至关重要的免疫调节功能。
高血压患者的神经免疫另一个相互作用的水平被称为双向脑-骨髓轴,即骨髓中交感神经流出增加先于全身炎症。
有关高血压患者肠道失调的证据正在迅速积累,来自小肠的激活免疫细胞已被证明与血压升高和大脑靶器官损伤有关。目前还不清楚是否存在相反的途径,即神经信号控制与高血压发病和进展相关的肠道和免疫机制。
动脉粥样硬化
脂质在动脉壁的积聚是动脉粥样硬化的一个典型特征,并伴随着免疫细胞的进行性浸润,导致斑块的形成。这一过程以慢性低度炎症为特征,逐渐增加动脉粥样硬化斑块的大小并导致动脉阻塞。
尽管有很多工作研究了导致斑块形成和决定斑块稳定性的机制,但神经免疫通讯的潜在作用才刚刚开始研究。
动脉粥样硬化斑块没有神经支配,但在斑块形成和进展过程中调节免疫反应的神经线索已被确定。Netrin 1首先被确定为指导轴突生长锥的神经信号,在人和小鼠动脉粥样硬化动脉的巨噬细胞中也发现了Netrin 1,它通过趋化因子驱动的迁移过程抑制巨噬细胞的排出。
巨噬细胞中的Ntn1缺失阻碍了小鼠的动脉粥样硬化过程,促进巨噬细胞从斑块中流出。
另一种蛋白质通常存在于神经元中,与胆碱能途径有关,可调节高胆固醇血症Ldlr–/–小鼠的动脉粥样硬化过程。在骨髓来源的细胞中,编码α7烟碱型乙酰胆碱受体(α7-nAChR)的Chrna7被切除会恶化小鼠动脉粥样硬化的进展。值得注意的是,人类动脉粥样硬化病变的特征是存在α7-nAChR+免疫细胞,表明该受体的通用相关性。
对受动脉粥样硬化影响的动脉周围三级淋巴器官的鉴定表明,神经机制可能与这些淋巴聚集相互作用,以控制和/或调节动脉粥样硬化疾病的进展。
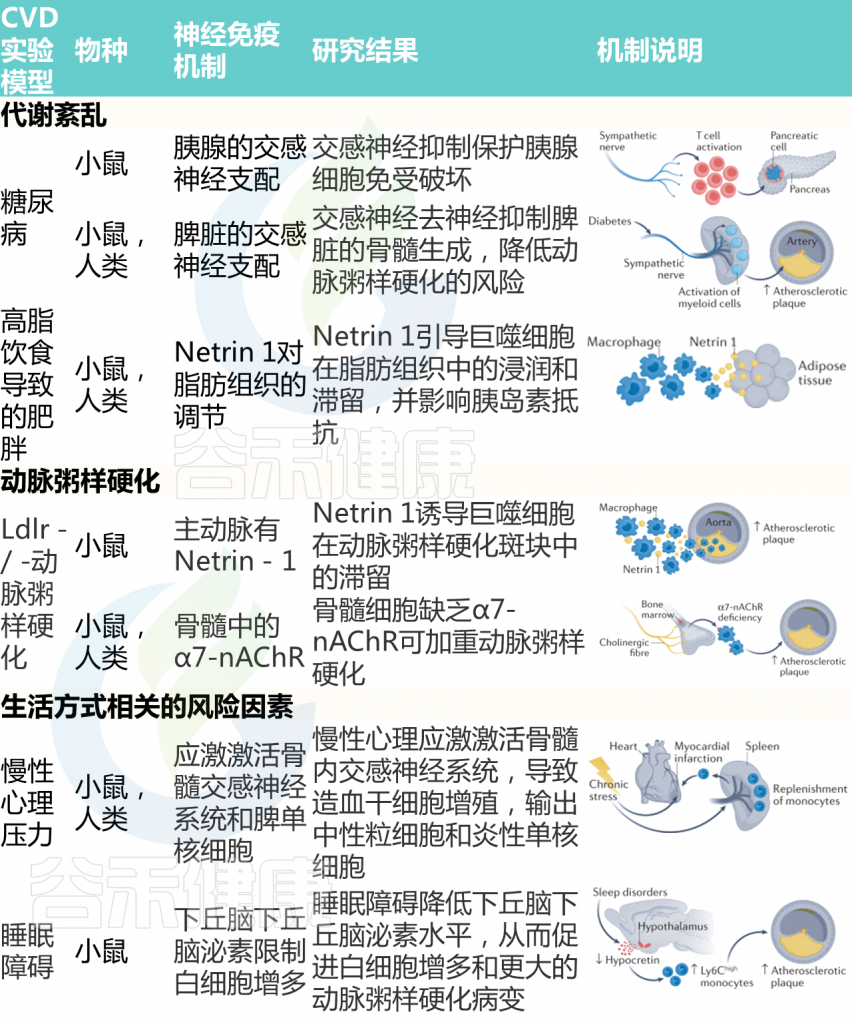

Carnevale D. Nat Rev Cardiol. 2022
代谢紊乱和肥胖
代谢综合征通常指可能单独或合并发生的一系列疾病,总体上增加了CVD的风险。除了血压升高,通常还包括高血糖和肥胖。
已知ANS失衡和免疫系统激活是代谢综合征的特征。在小鼠中发现了自身免疫性糖尿病的神经免疫机制。由CD8+T细胞介导的对胰腺β细胞的攻击诱导,糖尿病的发病取决于完整的胰腺神经支配的存在。
事实上,6-羟基多巴胺的化学消融或去甲肾上腺素能胰腺纤维的手术去神经支配阻碍了这些小鼠糖尿病的发病。在分子水平上,这种效应是由α1-肾上腺素能受体信号诱导的,因为使用哌唑嗪而不是普萘洛尔可以重现胰腺去神经支配的保护作用。
神经信号还可以控制与高脂饮食诱发的肥胖相关的糖尿病。患有肥胖症的小鼠和人类的脂肪组织被免疫细胞密集浸润,这些细胞导致脂肪组织炎症和胰岛素抵抗。
值得注意的是,脂肪组织中存在神经免疫指导线索netrin 1,这表明netrin 1可能调节巨噬细胞向脂肪组织的动员。此外,选择性缺失小鼠造血细胞中的Ntn1可有效促进巨噬细胞从脂肪组织中排出,减少炎症,并改善胰岛素敏感性。
这些发现确定了靶组织中的神经免疫相互作用,但免疫器官的神经控制也参与了疾病相关炎症状态的系统调节。例如,由脾交感神经驱动的神经通路已被确定为糖尿病的关键。通过手术或使用6-羟基多巴胺实现的选择性脾脏去神经支配,阻碍了糖尿病小鼠的过度脾脏骨髓生成。
一种连接大脑和脂肪组织的新型神经免疫途径已经被描述。在小鼠的脂肪间充质细胞附近发现了交感神经,交感神经控制着一个特定免疫细胞亚群的活动:2型固有淋巴细胞。
反过来,2型固有淋巴细胞通过释放神经营养因子来调节脂肪组织的稳态和肥胖。重要的是,通过在小鼠身上使用逆行追踪技术,结合外科手术和化学遗传学操作,定义了一个新的神经回路,通过交感主动脉-肾回路将脂肪组织中的2型固有淋巴细胞连接到高阶脑区,如室旁核。未来的研究应该调查这种新发现的神经免疫回路是否与肥胖和胰岛素抵抗的心血管并发症有关。
生活方式相关的危险因素
众所周知,生活方式相关的风险因素对CVD的发病率有着深远的影响,同时也对免疫系统构成挑战。此外,心理或身体上的应激状态与ANS的紊乱有关。对生活方式相关风险因素对心血管系统有害影响的潜在相关神经免疫相互作用的研究可以揭示创新的治疗机会。
正如在人类身上经常观察到的那样,慢性应激状态会增加小鼠的血压。值得注意的是,Rag1–/–小鼠对应激诱导的高血压具有抵抗力,并能减轻靶器官损伤。
除了血压升高,慢性应激还会增加动脉粥样硬化和心肌梗死的易感性。经过反复和各种应激性挑战的小鼠显示出造血干细胞增殖增加,导致产生高水平的促进疾病的炎性白细胞。这种效应是由骨髓交感神经纤维释放的去甲肾上腺素增加介导的,而去甲肾上腺素又反过来调节造血干细胞增殖、中性粒细胞和炎性单核细胞的排出。
睡眠障碍对心血管健康构成了重大挑战。小鼠正常睡眠节律的改变会增加动脉粥样硬化,与过度造血和促炎性单核细胞积聚有关。
在分子水平上,研究发现,睡眠碎片化可下调小鼠130的下视黄醇水平。下视黄醇是一种下丘脑神经激素,在控制睡眠、觉醒和觉醒方面具有重要功能。鉴于下视黄醇通过减少巨噬细胞集落刺激因子1的产生来限制骨髓生成,睡眠不良引起的下视黄醇水平降低与白细胞增多有关。
流行病学数据显示,健康的生活方式,如定期的体育活动,可以降低患CVD的风险。尽管许多观察分析都支持这种关联,但很少有机制研究调查这种有益关系的根本原因。有趣的是,习惯性自愿性跑步会降低小鼠的造血活动。在动脉粥样硬化小鼠中,运动抑制了慢性白细胞增多,但不影响紧急造血。通过降低脂肪-瘦素水平,这种效应促进造血生态位静止,改善心血管炎症和预后。
心肌缺血、心肌病和心力衰竭
ANS通过控制血管张力和各种心肌细胞特性,如收缩力、传导和频率,调节心脏功能。交感神经流出增加是慢性心力衰竭不良后果的最强预测因子之一。此外,非心肌细胞,尤其是常驻和非常驻免疫细胞,在应对各种挑战的心脏重塑中起着至关重要的作用。神经、免疫和心脏机制之间的相互作用值得研究。
急性缺血性心脏损伤通过增加骨髓中的交感神经信号与脾髓样细胞的生成增加有关。从脾脏部署的一部分单核细胞积聚在缺血心肌中,并参与心脏重塑。心-脾轴也被发现参与慢性心肌缺血的长期免疫反应,这总体上有助于不良的心脏重塑。脾脏的神经控制是否与这些表型有关仍有待阐明。
慢性高血压和肾功能衰竭会对心肌造成压力或容量过载,如果没有得到充分补偿,最终会导致心力衰竭。
在舒张功能不全的小鼠中,由于单核细胞募集和骨髓和脾脏造血增加,心脏巨噬细胞的数量增加。当巨噬细胞进入心肌时,会产生促纤维化细胞因子IL-10,进而促进胶原沉积和心肌僵硬,进一步加重舒张功能损害。
然而,其他巨噬细胞群体可以通过依赖于多器官相互作用的机制,促进慢性压力超负荷的适应性重塑。受到横向主动脉收缩以诱导心脏压力超负荷的小鼠增加了肾交感神经流出,由此去甲肾上腺素刺激粒细胞-巨噬细胞集落刺激因子的分泌,并对心脏巨噬细胞产生旁分泌作用。这项研究表明,心肌对慢性压力超负荷的适应取决于肾脏和心脏的神经和免疫反应之间的整合。
随后的研究阐明,心肌在稳定状态下含有大量不同的免疫细胞,对挑战的反应取决于常驻和招募的免疫细胞群体之间的整合。
鉴于ANS通过从颈上神经节、星状神经节和胸上神经节分支的纤维直接支配心肌,可以想象,参与心脏重塑的免疫反应的神经调节可能发生在心脏局部。
值得注意的是,尽管颈上神经节的去神经支配对心肌缺血引起的急性心脏重构没有影响,但从长远来看,这一过程减少了炎症浸润,减轻了心力衰竭。
肾脏疾病
肾钠处理、肾素分泌和肾血管张力受ANS的严格调节。肾传入和传出神经支配构成了最广为人知和研究最广泛的心血管反射系统之一。此外,炎症和免疫浸润通常伴随肾脏疾病。
急性肾损伤或慢性肾脏疾病均可导致肾功能衰竭,总的来说会增加心血管疾病的风险。促炎症环境和ANS平衡改变是肾病的特征,但神经系统和免疫系统之间的相互作用才刚刚开始澄清。
已经证实神经免疫调节在急性缺血再灌注反应中对肾损伤的重要作用。当用能引起胆碱能炎症反射的胆碱能激动剂进行预处理时,患有双侧肾缺血-再灌注或细菌内毒素血症的啮齿类动物对肾损伤的敏感性较低,这意味着神经反射调节由不同原因引起的肾损伤引起的炎症过程。
鉴于在类似的肾缺血再灌注损伤小鼠模型中,通过超声激活胆碱能炎症反射通过抑制炎症减轻了结构和功能损伤,该发现具有转化相关性。
2021发表的一项研究确定在小鼠急性肾损伤期间连接肾脏、大脑和脾脏的神经通路。通过光遗传学,迷走神经的传出或传入纤维被选择性地刺激,表明两者都对肾脏损伤有保护作用。通过激活传入的顺行感觉纤维,可以描绘出从肾脏追溯到延髓头端腹外侧的神经回路,以补充迷走神经-脾反射。
肾脏也是高血压损害的主要目标,这是心血管疾病不良后果的一个强有力的独立风险因素。浸润肾脏的活化免疫细胞和ANS失衡是高血压性慢性肾病的特征。
在动物模型中,肾脏去神经支配可有效对抗过度的肾交感神经流出和血压升高,并抑制T细胞聚集和由此引起的炎症反应、肾纤维化和蛋白尿。
在分析传入和传出肾神经支配的差异贡献时,在DOCA盐大鼠中,传入特异性肾去神经支配降低动脉血压和交感神经活动的程度与总(传入+传出)肾去神经支配的程度相同,但对血管紧张素II诱导的高血压没有影响。
有趣的是,在随后的一项研究中,同样的研究人员对已建立高血压和肾炎症的DOCA盐大鼠进行了传入特异性或全肾去神经支配。在这些动物中,虽然传入特异性和全肾去神经支配在降低血压方面仍然轻微有效,但两种治疗均未显着改变已确立的肾脏炎症。
总之,这些研究表明,肾神经(传入神经和传出神经)和炎症在高血压和肾脏炎症的发病机制中存在密切联系,但是,在确定高血压后,去肾神经支配不是抑制炎症过程的有效治疗,是通过其他机制维持的。
内脏器官炎症由ANS调节的观察可以追溯到之前研究肾传入和传出神经支配的作用。
一项初步研究表明,肾脏去神经支配可有效预防大鼠实验性肾小球肾炎,从而减少蛋白尿、系膜血管溶解、肾小球胶原沉积和转化生长因子-β的表达。这些数据表明,来自肾脏神经输入的信号分子可能在各种疾病环境下引发肾脏炎症和纤维化,进一步导致终末器官肾损伤。
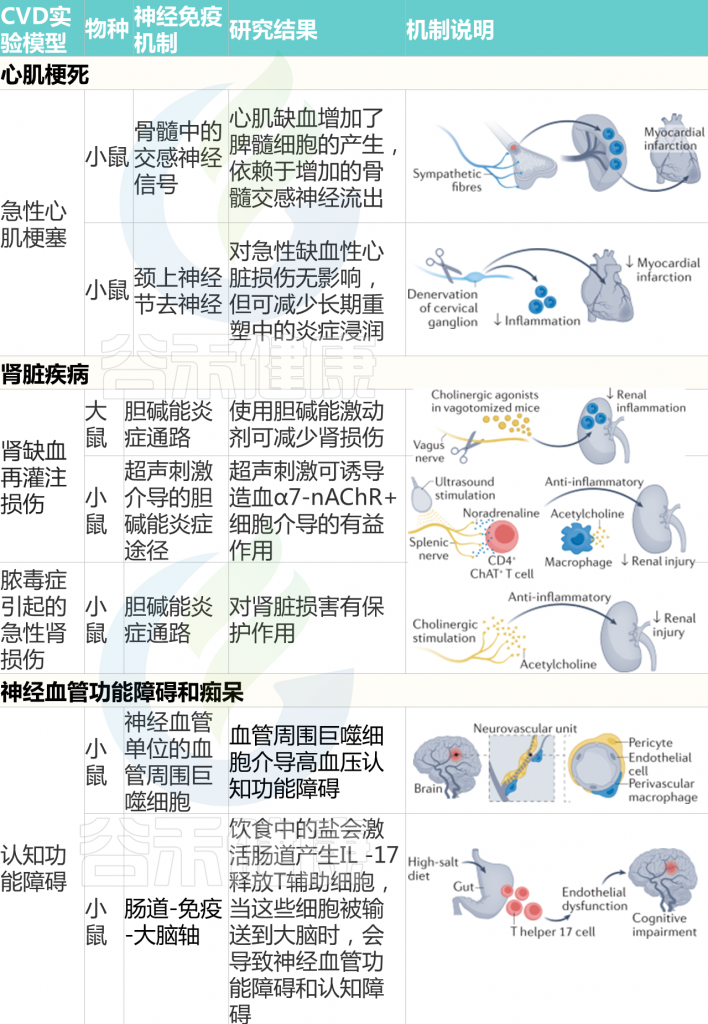

Carnevale D. Nat Rev Cardiol. 2022
神经血管功能障碍和痴呆
大脑由于没有能量储备,一直依赖于通过循环提供的营养,必须根据动态区域激活来适应其需求。因此,大脑对循环系统的改变特别敏感。
多种细胞类型构成脑实质和血管周围组织,包括免疫细胞。正如在其他器官和组织中观察到的那样,大脑中含有常驻免疫细胞(主要是小胶质细胞和血管周围巨噬细胞),当挑战干扰血脑屏障通透性时,这些细胞可以与招募的免疫细胞相互作用。
心血管风险因素会影响血脑屏障的完整性,改变脑血管内稳态,增加患痴呆症的风险。在小鼠和人类中,高血压会导致进行性脑血管损伤,并伴有典型的认知障碍症状。
免疫系统在高血压发病中的作用已得到明确证明,但免疫细胞如何参与高血压诱导的脑损伤才刚刚开始研究。
血管紧张素II诱导的高血压小鼠脑血管周围巨噬细胞的耗竭抵消了血管氧化应激和神经血管损伤,表明免疫的关键作用。
相反,在小鼠中,募集的免疫细胞会导致由血管危险因素(例如过度盐摄入)引起的脑损伤。脑血流、内皮功能和认知能力的损害取决于T淋巴细胞产生的IL-17,而IL-17是通过摄入肠道中的盐激活的。随后的一项研究还阐明了辅助性T淋巴细胞17对大脑有害影响的机制,表明肠道免疫轴对神经的调节非常关键。
外周神经系统的解剖结构和组织结构对轴突亚群的选择性和精确治疗提出了挑战,轴突亚群在特定器官中发挥独特的调节功能。因此,研究人员试图开发出越来越复杂的电极,以刺激更靠近目标组织的较小神经。这种方法有助于获得有关生理学和疾病中免疫神经调节的病理生理学基础的信息。
值得注意的是,靶向脾神经并直接测量其活性的技术的发展,使我们能够确定该免疫器官是神经系统和心血管系统之间串扰的中枢介质。相反,选择性去神经提供了有关该通路在CVD发病和进展中的相关性的机制信息。
研究表明,ANS调节免疫功能的功能障碍是心血管风险和CVD进展的重要组成部分。免疫器官自主神经外流的靶向调节是将这些发现转化为患者治疗的一种可能性。
值得注意的是,神经免疫通讯的机制研究被认为与一系列临床条件有关,如克罗恩病、类风湿性关节炎和原发性干燥综合征,所有这些都涉及免疫和炎症过程的失调。在临床前模型以及随后的炎症和自身免疫性疾病的人类临床试验中进行了探索,以非侵入性方式针对神经免疫机制的可能性也可能成为CVD的一种可能性。
对心血管疾病中调节免疫反应的神经通路的分子和电生理成分的临床前和临床研究为创新疗法提供了理论基础。能够对涉及心血管疾病的神经免疫反射进行精细调节的工具将有助于设计针对组织靶向免疫调节作用的策略,而不会增加感染风险或导致其他不良反应的普遍免疫抑制。根据特定疾病的特定背景和炎症环境,可以通过设计对腹腔迷走神经传出神经的生物电子刺激的选择性模式来微调脾脏的迷走交感神经激活。迄今为止,只有临床前工具已被开发并证明可有效调节免疫细胞从脾脏排出的过程。相反,通过手术切除腹腔神经节或热消融脾动脉周围的交感神经纤维,可以减弱脾交感神经流出的过度激活。
到目前为止,迷走神经刺激的研究主要集中在使用颈部植入装置,这些装置会触发传出和传入神经通路的混合,并产生潜在的不良影响。因此,尽管在自身免疫性疾病的临床试验中取得了有希望的结果,但迷走神经刺激方案具有引起脱靶刺激的局限性。
为了克服这一缺点,已经实施了改进的实验性迷走神经刺激方案,以选择性地刺激腹腔传出迷走神经并诱发脾神经流出。有趣的是,一系列研究提供了交感神经介导的脾神经控制的证据。特别是,通过腹腔神经节与脾神经相连的内脏神经已被证明可调节脾介导的炎症反应。具体作用是整合的还是单独作用的,取决于具体的病理生理学背景。
对腹腔迷走神经刺激后的脾脏免疫细胞的分析显示,特定的生物电子调节模式促进选择性T细胞亚型的排出,这表明可能会发展出靶向免疫调节。
使用活体和离体制剂对小鼠、大鼠、猪和人脾神经进行神经解剖学和功能比较,表明将临床前发现转化为临床相关工具的可行性。然而,尽管这种方法需要在实验模型中进行进一步研究,以揭示CVD中神经免疫通讯的病理生理学基础,但临床应用可能会受到该过程侵入性的限制。
肠道微生物群决定下丘脑-垂体系统的激活水平。特别是,肠道微生物群是心血管疾病发病机制中神经免疫介质的重要来源。
心肌缺血、心肌病和心力衰竭
与 CVD 相关的压力通过激活 ANS 的交感神经分裂来影响整个生物体,包括胃肠道。在 ANS 的影响下,肠道内微生物群的血液供应减少,从而降低了消化腺的活动,胃肠道的肠道蠕动减慢。上述机制决定了由于 CVD 相关应激导致的肠上皮细胞的进一步紊乱。
CVD相关应激期间肠道上皮损伤的机制

Suslov, Andrey V,, et al. J Clin Med. 2021
肠壁由肾上腺素能交感神经纤维支配,在刺激期间增加水和钠的吸收,伴随着肠道通透性的增加。同时,在大肠迷走神经的影响下,肠上皮杯状细胞产生的粘液减少。
值得注意的是,一方面,粘液为肠道上皮细胞提供保护,使其免受共生体及其代谢产物的影响,另一方面,粘液阻止免疫细胞的过早激活。因此,粘液层的减少和肠壁通透性的增加可导致肠道细菌的紊乱和肠上皮细胞的空间分离。
在Wistar大鼠中显示,出生后早期有限的筑巢压力会导致高皮质类固醇激素血症,增加肠道通透性,减少粪便微生物多样性,导致肠道微生物群组成失衡。肠道血供减少不仅是由于ANS交感分裂的影响,也是由于CVD的致病影响。
几项研究表明,肠道供血衰竭伴随着多种类型的CVD:心肌梗死、严重动脉粥样硬化、慢性心力衰竭、糖尿病和肥胖。因此,CVD期间肠道内的血供衰竭是由多种机制同时决定的。
肠血供减少伴有组织缺氧,而肠粘膜对缺氧最为敏感。
肠粘膜是一种支持粘液层以及微生物群与上皮下组织空间分离的解剖结构。在缺氧期间,有氧和无氧分解代谢循环中的葡萄糖转化会在中间阶段损害能量的生物合成。这导致活性氧(ROS)的释放。
由于活化免疫细胞的积累和 ROS 的产生,再灌注会增加缺血性损伤的破坏性影响。活性氧对蛋白质、脂质、碳水化合物和核酸具有高反应性,导致肠上皮完整性受损。至于肠道菌群与缺血性肠道损伤之间的关系,在大鼠模型中显示,肠道缺血-再灌注损伤导致肠道菌群发生显著变化,大肠杆菌和口腔普氏杆菌数量增加,随后在愈合阶段乳酸杆菌数量增加。
同时,在急性心肌梗死大鼠模型中证明,肠道微生物群的改变会导致肠道炎症和细胞凋亡的发展,也就是说,肠道缺血不仅会导致肠道微生物群失衡,反之亦然,肠道微生物群的变化会导致肠道损伤。
除粘液层外,肠上皮层在提供肠屏障功能方面也起着重要作用。肠上皮层由与紧密连接蛋白连接的上皮细胞组成,特别是紧密连接蛋白、封闭蛋白、钙粘蛋白和粘附分子。
紧密连接蛋白作为肠-脑轴结构中肠屏障的重要元素。研究表明,脑肠肽ghrelin可以减轻动物模型脑出血后激活紧密连接蛋白 zonula occludens-1 和 claudin-5 的肠道屏障功能障碍。
一些研究通过改变紧密连接蛋白证明了肠道微生物组变化与肠道屏障损伤的关系。例如,植物乳杆菌增强上皮屏障刺激基因的表达,这些基因参与紧密连接zonula occludens-1、zonula occludens-2 和 occludin 的信号通路。
在小鼠模型的另一项研究中也证明了相同的效果,其中用乳酸杆菌、双歧杆菌和链球菌的混合物治疗增加了紧密连接 zonula occludens-1 和紧密蛋白的表达。紧密连接完整性的改变可导致与代谢宿主状态受损相关的细菌或细菌代谢物的流入增加,表现为心脏代谢疾病。
肠上皮和粘液屏障位于肠道环境、肠道细菌和免疫系统之间。
众所周知,肠上皮层包括不同类型的细胞:
肠细胞
杯状细胞
肠内分泌细胞
潘氏细胞
簇状细胞
M细胞
以及多种专业免疫细胞,如
淋巴细胞
树突状细胞
巨噬细胞
均位于肠粘膜表面附近
上皮内淋巴细胞是第一个对致病因素做出反应的免疫细胞,它侵入上皮并传播树突以检测肠腔抗原。
其他细胞位于有组织的淋巴结构中,如派尔斑和隐斑,或分散在固有层内。
与巨噬细胞和树突状细胞等专业免疫细胞类似,肠上皮细胞表达先天免疫受体,如模式识别受体,包括 Toll 样受体 (TLR) 和核苷酸结合蛋白,含有寡聚化结构域 (NOD)。
潘氏细胞合成抗菌分子受 TLR4/MyD88 和 NOD2 信号传递的调节,这些信号传递受肠道微生物的控制。
TLR 通过激活促炎信号通路以响应微生物抗原,在先天免疫系统中发挥着重要作用。
肠道免疫细胞通过细胞因子或直接的细胞连接支持肠道黏膜的屏障功能。因此,由 Th17 细胞或 3 型先天性淋巴细胞 (ILC3) 产生的 IL-17 和 IL-22 会增加肠上皮细胞分泌的 AMP 和 Reg3 家族蛋白 。
此外,上皮内淋巴细胞产生的 IL-6 可增强肠上皮细胞增殖并促进损伤后黏膜的修复。然而,其他促炎细胞因子,如 TNF-α 和 IFN-γ,通过抑制 β-连环蛋白/T 细胞因子 (TCF) 信号传递来抑制上皮细胞增殖 。
肠上皮细胞还通过分泌细胞因子和趋化因子来调节宿主免疫反应。
在用革兰氏阴性细菌大肠杆菌和变形杆菌的鞭毛蛋白刺激肠内皮期间,TLR5 / MyD88 信号促进 IL-8 的产生,IL-8 将中性粒细胞募集到固有层中。
前面CVD中提到的胆囊收缩素、胰高血糖素样肽 (GLP) 和血清素由肠道内分泌细胞分泌,影响肠道免疫系统的活动。
胆囊收缩素通过 CD4+ 细胞和 B 细胞调节细胞因子的分化和产生。值得注意的是,交感神经系统调节的消化腺活性的降低间接影响免疫细胞的活性。
有趣的是,微生物群对上皮肠屏障的影响不仅取决于免疫成分,还取决于其他影响。特别是,由肠道微生物群合成的短链脂肪酸被用作上皮细胞的能量来源,并间接增强上皮屏障。微生物代谢产物吲哚通过激活孕烷-X 受体具有防御屏障作用,并增加胰高血糖素样肽-1 的分泌。
无法保存肠上皮的复杂解剖和功能特征会降低上皮屏障的抗菌、免疫调节和再生能力。粘膜的破坏导致共生细菌及其代谢物从肠腔转移到上皮下组织,导致促炎细胞因子的分泌。反过来,这会导致器官功能障碍,并伴有肠粘膜炎症。
现在越来越多的证据表明,肠道细菌的代谢物在炎症过程中通过被破坏的肠道屏障进入循环。
微生物组介导疾病的三个因素:
首先,肠道细菌的代谢物是慢性免疫反应的永久激活剂,会在肠道以及整个生物体中引起持续性炎症。
其次,先天免疫系统成熟期肠道微生态失调导致免疫耐受性受损,随后表现为自身免疫和自身炎症性疾病。
第三,微生物组可以影响控制肠道远处组织特异性免疫的免疫因素。
考虑到肠道微生物群在神经免疫网络形成中的作用。脑源性神经营养因子 (BDNF) 是一种应激蛋白,是神经营养因子家族的成员,可增加大脑中神经元对功能障碍的抵抗力,并提供神经系统的可塑性。
BDNF 控制了广泛的过程,包括微生物群-肠-脑轴参与心脏代谢疾病的发病机制。研究表明,BDNF 信号可能介导间歇性禁食对血糖调节和心血管功能的影响 。此外,研究表明,用高剂量益生菌治疗可以调节斑马鱼的行为,导致一些大脑相关基因的表达发生显着变化,例如 BDNF。因此,BDNF 可能代表了微生物-肠-脑轴的分子机制。
神经免疫轴:微生物群-肠-脑-CVD
肠道粘液膜的缺氧损伤、微生物群转移到上皮下组织、肠上皮屏障功能的破坏、肠道细菌代谢产物和炎症细胞因子的合成使肠道成为最大的内毒素源。炎症介质通过全身血液和淋巴循环到达神经系统中心。
血脑屏障
血脑屏障 (BBB) 在妊娠期间形成,充当大脑和血液循环系统之间的选择性过滤器。肠道微生物群和微生物代谢物在血脑屏障形成中的重要性已在不可知菌小鼠身上得到证实。在没有肠道微生物的情况下,与正常动物的血脑屏障相比,小鼠的血脑屏障变得具有渗透性。
研究发现,大脑的淋巴系统流入脑脊液,进入蛛网膜下腔,并进一步进入颈深淋巴结。脂质的溶解度、蛋白质的三级结构、浓度、分子质量和化合物的电荷决定了介质从外周血供应和淋巴系统到大脑的通道。
外周血中的细胞因子主要是亲水性的,可以调节神经系统的免疫功能。研究还表明,静脉注射吲哚(类似于色氨酸的细菌代谢产物)可以克服BBB。
LPS(脂多糖)的神经炎症效应通过外周组织中的TLR激活发挥作用,通过血脑屏障阳性的促炎细胞因子在神经系统中引起继发效应。
血脑屏障和淋巴血管系统被认为是信号进入大脑的入口。例如,循环免疫细胞和炎症介质(包括宿主和细菌的激素和神经递质)以及迷走神经刺激代表了有助于直接或间接微生物信号从肠道传输到大脑的机制 。
炎性细胞因子也是激活中枢神经系统的一个重要因素,作为对各种刺激的反应,包括在肠道病理过程中激活下丘脑-垂体-肾上腺轴的促炎性细胞因子。
肠易激综合征患者的皮质醇和促炎细胞因子白细胞介素IL-6和IL-8显著升高。IL-1α细胞因子在中枢神经系统水平上刺激机体的整个葡萄糖代谢;IL-6、IL-1、TNF-α和IFN细胞因子相互独立地刺激下丘脑-垂体-肾上腺轴(HPA轴)。
除了炎性细胞因子外,炎症期间环氧合酶系统合成的前列腺素也参与HPA轴的激活。多项研究发现炎性细胞因子(TNF-α、IL-1和IL-6)在HPA轴激活中的作用。任何炎性细胞因子的注射都会刺激HPA轴,并导致循环皮质酮水平升高。值得注意的是,在LPS穿透后,任何细胞因子的阻断都不会阻断HPA轴的激活,也就是说,如果肠上皮屏障功能停止,LPS进入血液,那么细胞因子激活HPA轴的复制效应就会实现。那么接下来就是神经免疫性疾病和靶器官损伤了。
因此,所有炎症介质都会促进HPA轴的激活,而阻断任何一种细胞因子都不能减少HPA轴的刺激,因为它们之间存在重复效应。
因此,下丘脑-垂体-肾上腺轴的激活是大脑介导的对疾病的基本反应之一。HPA 轴被认为是神经内分泌系统的基础,它在心理和生理压力(包括感染)的影响下调节机体的稳态,促进对压力的充分反应。
所考虑的机制在慢性应激中非常重要。由于情绪唤醒的阈值不足以在CVD期间形成压力,因此神经系统中形成全值压力反应,随后通过肠内炎症介质持续激活HPA,激活ANS的交感分裂。
值得注意的是,机体的整个复杂病理变化是通过急性应激途径发展起来的,而情绪成分(情绪刺激)与慢性应激阈值相对应或完全缺失。这个问题需要进一步研究。因此,综述的机制对神经系统中心(包括ANS中心)有激活作用,ANS中心反过来又支配内脏器官,包括微生物群居住的肠道。
结合有关肠道微生物群的机制及其与神经系统通过肠-脑轴发育紊乱的关系,可以初步得出结论,在CVD期间,来自肠道的介质通过血流和淋巴进入大脑,并激活下丘脑核团。然后,只要下丘脑是ANS的节段上整体中心,ANS的交感神经分裂就会被激活。
因此,来自肠道的介质到达ANS的节段上中心,并激活交感和副交感分裂的工作,从而关闭肠道微生物群参与CVD发病机制的病理循环。许多发表的研究报告表明,微生物群介导的炎症介质的增加会加重CVD的病程和预后。
研究还发现,恢复CVD患者的肠道菌群可以改善疾病的预后。使用增加阿克曼菌属、双歧杆菌、乳酸杆菌、拟杆菌和普氏杆菌的细菌数量的复合治疗制剂可改善CVD的病程。
众所周知,双歧杆菌和乳酸杆菌属的细菌对肠壁具有局部抗炎作用。肠上皮屏障功能的恢复是因为肠壁炎症的减少,这意味着炎症介质在体循环中的水平降低,因此它们对神经系统的激活作用降低。
尤其是,高血压与肠道微生物群紊乱和肠脑轴失调有关。在高血压大鼠模型中证明,长期开菲尔治疗可降低IL-6和TNF-α蛋白密度,并消除在下丘脑室旁核和延髓头端腹外侧区观察到的小胶质细胞激活,保护心脏调节核免受肠道介导炎症的影响,从而提供开菲尔的降压作用。在小鼠缺血性中风或脑缺血模型中进行的一些研究表明,缺血性中风脑损伤通过增加促炎反应和细胞因子、趋化因子和免疫细胞浸润大脑结构,促进肠道失调的发展,这与不良预后有关。
CVD患者肠道菌群与神经系统的相互作用

Suslov, Andrey V,, et al. J Clin Med. 2021
肠道微生物群参与了 CVD 的发病机制并决定了 HPA 轴的炎症激活。
一些研究调查了微生物组靶向制剂可改善 CVD 病程,减少动脉粥样硬化的进展和主要 CVD 并发症的风险 。
在这里,我们可以假设基于微生物组治疗的有益心脏保护机制是由于其对微生物组-肠道-脑轴的影响。
通过阻断左前冠状动脉诱发心肌梗死的大鼠中显示,与安慰剂组相比,使用基于瑞士乳杆菌和长双歧杆菌组合的益生菌可降低与心肌梗死相关的不同脑区的凋亡倾向。
另一项针对小鼠的研究表明,在实验性中风后,抗生素调节肠道微生物群可降低缺血脑内的LPS水平和神经炎症。一项针对冠心病患者的研究发现,益生菌鼠李糖乳杆菌与益生元菊糖复合物对抑郁、焦虑和炎症生物标志物具有有益作用。
建议所有成年人每周至少进行150-300分钟的中等强度或75-150分钟的高强度有氧运动,或两者的同等组合。当然要视身体状况而定,如果自身基础不太好,在能力和条件允许的情况下尽可能保持一些低强度活动。
减少久坐时间,适当进行轻度体力活动是有益的。
饮食对人类健康的多个方面都有重大影响,不健康的饮食模式(例如高脂肪的西式饮食)与动脉粥样硬化、代谢综合征和肥胖症等一系列慢性疾病的风险增加有关。免疫系统正在成为这种关系的关键中介,通过食物诱导调节与慢性炎症相关的促炎/抗炎因子以及增加/减少各种病理结果的风险。
支持这一观点的大型流行病学研究表明,以高摄入饱和脂肪和低纤维为特征的饮食模式与促炎生物标志物水平升高有关,例如 C 反应蛋白 (CRP) 和白细胞介素 IL- 6。相反,摄入大量水果和蔬菜和/或经常食用鱼类的饮食模式与较高的脂联素血清浓度相关,脂联素具有抗炎特性。
这些观察性研究得到了干预试验的进一步支持,干预试验表明饮食可能会影响血清炎症生物标志物谱。例如,高胆固醇食物的饮食干预增加了对胰岛素敏感的参与者的 CRP 和血清淀粉样蛋白 A 浓度。

Yu E, et al.,J Am Coll Cardiol. 2018
健康的饮食可以降低心血管疾病和其他慢性疾病的风险。从更多荤食(以动物为基础的)饮食模式转变为素食(以植物为基础的)饮食模式,可能会减少心血管疾病。
建议饮食中多吃水果、蔬菜、坚果等;少量食用低脂乳制品和海鲜;而且尽可能少摄入加工肉类、含糖饮料、精制谷物、盐等。
戒烟可迅速降低心血管疾病风险,是预防动脉粥样硬化性心血管疾病最具成本效益的策略。
建议限制饮酒或戒酒,每周最多饮酒100g。
通过改变生活方式来达到和保持健康体重,对这些指标可产生有利影响(如血压、血脂、血糖等),并降低CVD风险。
当饮食和体力活动改变以及其他常规的非侵入性干预措施效果不佳时,应考虑对高危人群行减重手术;也可以考虑使用具有心血管保护作用的抗肥胖药物。
新指南提出心理压力与动脉粥样硬化性心血管疾病风险相关,需要加强对心理障碍患者的关注和支持,对其进行生活方式和药物干预,方式包括呼吸练习、冥想、写日记、适当锻炼、与大自然接触、与他人建立联系等,尽可能改善压力症状和生活质量,可改善心血管疾病。
通过对血压,血糖,血脂等指标的日常监测来了解健康状况,也可以通过肠道菌群健康检测等方式来了解慢病风险,阻断这类慢病的进程,预防控制代谢紊乱,从根本上预防心血管疾病的发生。
本文主要基于研究阐述免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展。
在CVD的初始阶段,肠道微生物群在其发病机制中的作用是次要的,这意味着细菌的定性和定量变化不像在随后的阶段那么重要。
然而,后来,当肠道微生物群决定了下丘脑-垂体-肾上腺轴的炎症激活水平时,肠道微生物群的变化对CVD的发展具有重要意义。
在CVD进展过程中,肠道细菌与肠壁的病理过程密切相关,成为CVD发病机制中的关键因素之一。在这方面,试图确定与CVD进展过程最相关的肠道细菌,可能是开发CVD诊断、预防和治疗新相关方法的重要一步。
此外,注意通过饮食衍生的微生物代谢物、炎症反应转变、校准神经免疫从而影响CVD干预和治疗反应。
·
具体基于肠道菌群的饮食调节,以及CVD 进展中的饮食-微生物群串扰的机制,菌群代谢产物的作用等详见本次推文的第二篇:
《 饮食-肠道微生物群对心血管疾病的相互作用 》主要参考文献:
Carnevale D. Neuroimmune axis of cardiovascular control: mechanisms and therapeutic implications. Nat Rev Cardiol. 2022 Mar 17. doi: 10.1038/s41569-022-00678-w. Epub ahead of print. PMID: 35301456.
Yu E, Malik VS, Hu FB. Cardiovascular Disease Prevention by Diet Modification: JACC Health Promotion Series. J Am Coll Cardiol. 2018;72(8):914-926. doi:10.1016/j.jacc.2018.02.085
Suslov, Andrey V et al. “The Neuroimmune Role of Intestinal Microbiota in the Pathogenesis of Cardiovascular Disease.” Journal of clinical medicine vol. 10,9 1995. 6 May. 2021, doi:10.3390/jcm10091995
Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature. 2016 Jul 7;535(7610):65-74. doi: 10.1038/nature18847. PMID: 27383981.
Huh JR, Veiga-Fernandes H. Neuroimmune circuits in inter-organ communication. Nat Rev Immunol. 2020 Apr;20(4):217-228. doi: 10.1038/s41577-019-0247-z. Epub 2019 Dec 17. PMID: 31848462.
Frank L J Visseren, François Mach, Bryan Williams,et al., ESC Scientific Document Group, 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC), European Heart Journal, Volume 42, Issue 34, 7 September 2021, Pages 3227–3337

谷禾健康
中风是一种常见的脑血管疾病,是一个重大的健康问题,每年影响全球超过 1500 万人。大约 70% 的中风是由脑缺血引起的,称为缺血性中风。它通常是由阻塞大脑血管的血凝块引起的。
缺血性中风一般有以下症状:
中风后,高达 50% 的患者会出现胃肠道并发症,包括便秘、吞咽困难、胃肠道出血和大便失禁等问题,胃肠道并发症会影响患者治疗效果不佳。

多项研究证实,中风患者存在肠道菌群失调。
肠道菌群可以调节疾病和健康之间的平衡,因为它们有可能产生各种代谢物(如,短链脂肪酸、胆汁酸、维生素、氨基酸和氧化三甲胺)。这些代谢物可能参与调节宿主的生理功能。其中氧化三甲胺增强血小板反应性和血栓形成可能性,这可能是缺血性中风的潜在致病因素。
我们之前的文章也有关于这方面的详细介绍:
肠道菌群 —— 中风的关键参与者
然而之前的研究较少说明,短链脂肪酸对缺血性中风有保护作用。短链脂肪酸是肠道微生物发酵膳食纤维的最终产物,它的存在加深了微生物与宿主之间的联系。
根据最近的研究,通过移植富含短链脂肪酸的粪便微生物群,缺血性中风的恢复得到了有效改善。短链脂肪酸可能作为肠道菌群和大脑之间的媒介,参与调节缺血性中风的预后。
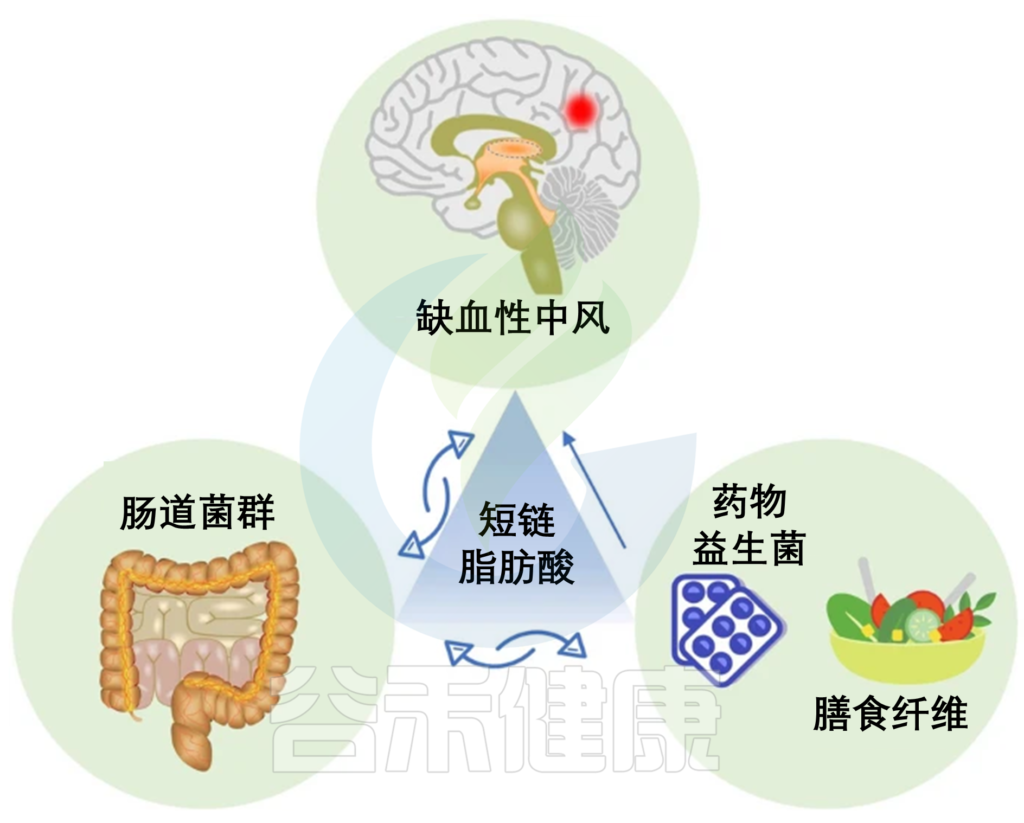
Fang Z, et al., Cell Mol Neurobiol. 2022
本文主要介绍关于缺血性中风和肠道菌群之间关系的研究,概述了短链脂肪酸作为它们之间桥梁的作用及其潜在机制,讨论了短链脂肪酸介导的治疗措施,如饮食、膳食补充剂(益生菌和益生元)、粪菌移植和药物治疗缺血性脑损伤的有益效果。
随着临床证据的不断增加,肠道菌群可能是中风的一个关键易感因素。
↓↓↓ 发现中风与肠道菌群关联的研究:
最早的一项横断面研究报告说,与健康、无症状的对照组相比,中风患者的条件致病菌更多。这种生态失调与中风的严重程度有关。
分析粪便中的有机酸浓度发现,中风患者的乙酸浓度显着降低,而戊酸浓度显着升高。然而,中风患者的总有机酸浓度降低。
这些研究表明:
中风会影响肠道微生物的多样性,并导致微生物代谢物发生相应的变化。
有了这个线索后,研究人员开始进一步探索中风、肠道菌群和短链脂肪酸之间的相关性。
↓↓↓ 进一步研究表明:中风患者的产短链脂肪酸菌及短链脂肪酸水平都较低
在大脑中动脉闭塞期间,小鼠的短链脂肪酸水平较低,尤其是丁酸盐。
研究人员认为,急性缺血性中风患者肠道菌群失调的特征是:产短链脂肪酸菌的低丰度和粪便短链脂肪酸的低水平,尤其是那些中风较严重的患者,短链脂肪酸水平与严重程度之间可能存在负相关,也就说,短链脂肪酸水平越低,中风严重程度越高。
↓↓↓ 然而事情没有这么简单。出现矛盾的是:
一项临床研究发现,在缺血性中风中,随着个体产生短链脂肪酸的增加,肠道菌群的调节异常。但由于没有相应地测量短链脂肪酸水平,因此无法确定这种失调是否会导致粪便短链脂肪酸水平发生实质性变化。
此外,肠杆菌科(条件致病菌)的扩张也是中风患者肠道菌群失调的主要表现之一,但肠杆菌科也能产生乙酸盐。
因此,中风患者短链脂肪酸低,可能不仅仅是由产短链脂肪酸菌的减少引起的,可能部分原因是不同菌群的协同效应。
除了疾病本身的进展,合并其他疾病(例如高血压、糖尿病)、年龄、饮食、吸烟和其他危险因素可能会加剧对缺血性脑损伤的病理生理反应,包括神经炎症。因此,肠道菌群对中风易感性和恢复的贡献是一个不断增长的研究领域。例如,高血压 、糖尿病、肥胖症和动脉粥样硬化,所有已知的中风危险因素都与肠道菌群密切相关。
↓↓ 肠道菌群与中风风险关联的研究:高风险人群条件致病菌多,产丁酸盐菌少
一项横断面研究评估了肠道菌群与中风风险之间的关联,发现中风高风险人群肠道中条件致病菌(例如肠杆菌科和韦荣氏菌科)的比例显着高于低风险人群。此外,产丁酸盐细菌的消耗和粪便丁酸盐水平低是中风风险增加的潜在因素。
▸ 中风后认知障碍:梭杆菌↑ 肠杆菌科↑
中风后认知障碍(PSCI)是中风后遗症之一。已有研究表明,PSCI患者肠道内梭杆菌含量增加,同时粪便中短链脂肪酸缺乏。研究人员进一步构建了基于肠道菌群和短链脂肪酸的PSCI风险预测模型,该模型能够准确预测中风发作3个月或更长时间后的PSCI。
另一项研究发现,与中风后非认知障碍组相比,PSCI组的肠杆菌科细菌增多。这些革兰氏阴性病原体可能会促进神经系统的炎症变化。此外,患有其他中风后共病精神障碍(如抑郁症和情感障碍)的患者的肠道菌群也可能发生相应的变化。
▸ 中风后吞咽困难:管饲易引发胃肠道不良反应
大约65%的中风患者表现出吞咽困难。为了降低中风后吞咽困难导致吸入性肺炎和营养不良的风险,经常使用管饲代替口服食物。
然而,最近的一项研究表明,当吞咽改善,恢复最初的口服摄入量时,中风患者的肠道菌群发生了变化。这可能是因为与肠内营养相比,口服食物的膳食纤维含量更高。
此外,与早期口服食物的患者相比,长期管饲患者接受治疗的时间更长,感染风险更高。长期肠内营养管理可能会产生许多胃肠道不良反应(例如腹泻、便秘、胃食管反流)。
▸ 为什么中风患者表现出对感染的易感性增加(肺炎和尿路感染等)?
——肠道通透性增加、细菌易位
在中风后感染的患者中检测到的大多数微生物是通常存在于肠道中的常见共生细菌,这可能与中风后肠道通透性增加以及共生细菌的易位和传播有关。值得一提的是,肠道菌群组分的改变可能会增加菌血症并改变宿主的免疫反应。
——产丁酸菌减少
此外,在一项前瞻性病例对照研究中,在中风患者住院24小时内,产丁酸的细菌很少,这可能会增加中风后感染的风险。
尽管肠道菌群和短链脂肪酸可能对大多数中风后并发症有显著影响,但迄今为止尚未对其潜在机制和治疗应用进行研究。
▸ 肠道菌群失调具体通过什么与中风产生关联?
随着临床证据的增加,中风引起的肠道菌群失调已逐渐被解开。然而,这种微生物失调可能是由肠道菌群-肠-脑轴中持续积累的“自上而下”信号引起的,而不是突然发作。
中风中的自下而上和自上而下的信号
Battaglini D, et al., Front Neurol. 2020
脑缺血会导致自主神经系统或 HPA 轴的紊乱,增加肠道通透性并改变肠道微环境。例如,条件致病菌积累,内毒素水平增加,产生短链脂肪酸的细菌耗尽,短链脂肪酸水平下降。反过来,这种改变会加剧中风或脑损伤并影响患者预后。

Fang Z, et al., Cell Mol Neurobiol. 2022
一般来说,微生物产生的短链脂肪酸可能与肠道菌群-肠-脑轴一起参与中风的病理生理学,短链脂肪酸影响中风的潜在机制将在后面章节讨论。
在缺血再灌注损伤和永久性缺血的情况下,神经炎症是中风进一步进展的关键因素。
炎症过程始于血管内。当缺氧发生时,活性氧(ROS)产生过多,从而激活补体、血小板和内皮细胞。内皮细胞中的氧化应激(ROS)会降低NO的生物利用度,从而间接影响血小板活性。
在脑缺血期间,未刺激的T细胞可能通过IFN-γ和ROS促进组织损伤。γδT细胞被小胶质细胞和巨噬细胞释放的IL-23激活,产生细胞毒性细胞因子IL-17,参与急性缺血性脑损伤。
然而,小胶质细胞和巨噬细胞也能促进Treg的成熟,分泌抗炎因子IL-10,抑制Th1和Th2反应,介导神经保护作用。
在健康条件下,调节性T细胞(Treg)和效应性T细胞处于动态平衡状态。而在缺血性中风中,这种平衡受到干扰。
中风后诱导的炎症反应可增加血脑屏障的通透性和脑水肿,扩大脑梗死面积,进一步加重缺血性脑损伤。
因此,研究人员继续测试免疫调节策略在中风患者中的治疗潜力。
肠道微生物群可能参与了中风的免疫调节。最近对啮齿类动物的两项研究表明,中风后的微生物群失调会导致效应T细胞(γδT细胞)从肠道迁移到大脑外的脑膜,从而加剧缺血性脑损伤。
中风后恢复健康的微生物成分和应用抗生素诱导微生物失调都可以减轻神经炎症,减少缺血性脑损伤。这一过程与Treg细胞的启动密切相关。
总体而言,肠道菌群可以调节宿主免疫系统,从而改善缺血性脑损伤。
对肠道菌群介导的免疫机制的研究仍处于起步阶段。然而,在这一复杂现象的背后,存在着通过生产短链脂肪酸的可能性。
在了解短链脂肪酸在中风中发挥作用之前,我们先来看下,短链脂肪酸是如何参与宿主免疫系统发挥作用。
短链脂肪酸是一种潜在的免疫调节因子,与各种免疫细胞相互作用,介导全身炎症反应。短链脂肪酸也影响小胶质细胞的结构和功能完整性,并激活与神经炎症相关的小胶质细胞。
丁酸盐:研究最多的是丁酸盐,具有抗炎作用。
丙酸盐:会引起炎症,但丙酸盐的这些数据可能仍有一定争议,组织特异性可能是一种解释。
乙酸盐:可以通过抑制炎症信号通路来减轻炎症反应。
短链脂肪酸在免疫和炎症中的作用
Yao Y, et al., Crit Rev Food Sci Nutr. 2022
在肠道上皮细胞中,短链脂肪酸可通过被动扩散和转运进入肠道组织。转运蛋白包括MCT1、MCT4、SMCT1和SMCT2。此外,短链脂肪酸还能激活肠上皮细胞中的G蛋白偶联受体(GPRs),引起一系列下游反应。短链脂肪酸可以调节许多免疫细胞的活动,参与宿主免疫系统的调节。
短链脂肪酸调节炎症的机制
Yao Y, et al., Crit Rev Food Sci Nutr. 2022
在巨噬细胞、中性粒细胞和树突状细胞中,短链脂肪酸可以通过G蛋白偶联受体激活MAPK通路,抑制β – arrestin2/NF-κ b通路,抑制环腺苷一磷酸(cAMP)的合成,促进钙离子(Ca2+)进入细胞核,从而调节与炎症和免疫相关的基因表达。此外,短链脂肪酸可通过被动扩散进入细胞,抑制线粒体/AMPK/mTOR通路,抑制组蛋白去乙酰化,通过促进MKP表达抑制MAPK通路。
↓↓↓ 粪菌移植研究:是什么改善中风小鼠脑损伤并提高存活率?
一项关于小鼠粪菌移植的研究发现,通过灌胃改变年轻中风小鼠(2-3个月)的微生物群,使其与老年小鼠(18-20个月)的微生物群相似,会增加死亡率和全身炎症反应。
相比之下,用年轻小鼠的肠道菌群对老年小鼠进行定植可以改善脑损伤并提高存活率。
老年小鼠的粪便短链脂肪酸水平和拟杆菌与厚壁菌的比率(B:F)显著低于年轻小鼠。
↓↓↓ 进一步研究:短链脂肪酸对缺血性中风具有保护作用
研究人员将富含短链脂肪酸的粪便微生物群移植到中风小鼠体内,可以减少神经功能缺损,消除脑水肿,减少梗死体积。有趣的是,通过直接灌胃补充丁酸盐也可获得类似的有益效果。因此,短链脂肪酸可能是影响中风恢复的关键代谢物。
↓↓↓ 进一步研究:微生物源性短链脂肪酸影响中风的潜在机制是什么?
Sadler等人提供了第一个证据,他们通过向中风小鼠的饮用水中添加短链脂肪酸来增加其循环短链脂肪酸浓度。
这种方法可以改善运动功能并调节中风后突触可塑性,但不会影响原发性脑梗死体积。
更重要的是,在没有淋巴细胞的情况下,即使补充了短链脂肪酸,小胶质细胞的数量和形态也没有显著改变。这表明淋巴细胞可能介导短链脂肪酸对小胶质细胞的调节作用。
另外的研究人员在中风小鼠中更直接地移植了四种产生短链脂肪酸的细菌和菊糖(一种增加产生短链脂肪酸的益生元)。研究发现,短链脂肪酸可增强肠道完整性,扩张肠道和大脑中的调节细胞(Treg),并减少中风后IL-17+γδT细胞在大脑中的浸润。
尽管小胶质细胞缺乏短链脂肪酸受体,但在小胶质细胞中发现了单羧酸转运蛋白的表达。这可能是一种小胶质细胞调节机制,不涉及短链脂肪酸受体,这需要在未来进一步验证。
★ 短链脂肪酸参与T细胞的极化和迁移
现有证据表明,T细胞可以通过分泌促炎和抗炎细胞因子来调节M1(促炎)和M2(抗炎)小胶质细胞的平衡。
此外,短链脂肪酸还促进了T细胞在生理条件下分化为效应T细胞,主要是通过增加Treg的数量和功能。有趣的是,在无菌小鼠中进行了中风后菌群再定植,这显著地诱导了Th1和Th17的极化。
另一方面,抗生素治疗导致Treg扩增和Th17细胞减少。因此,有理由怀疑短链脂肪酸参与了由肠道菌群失调诱导的T细胞极化过程。
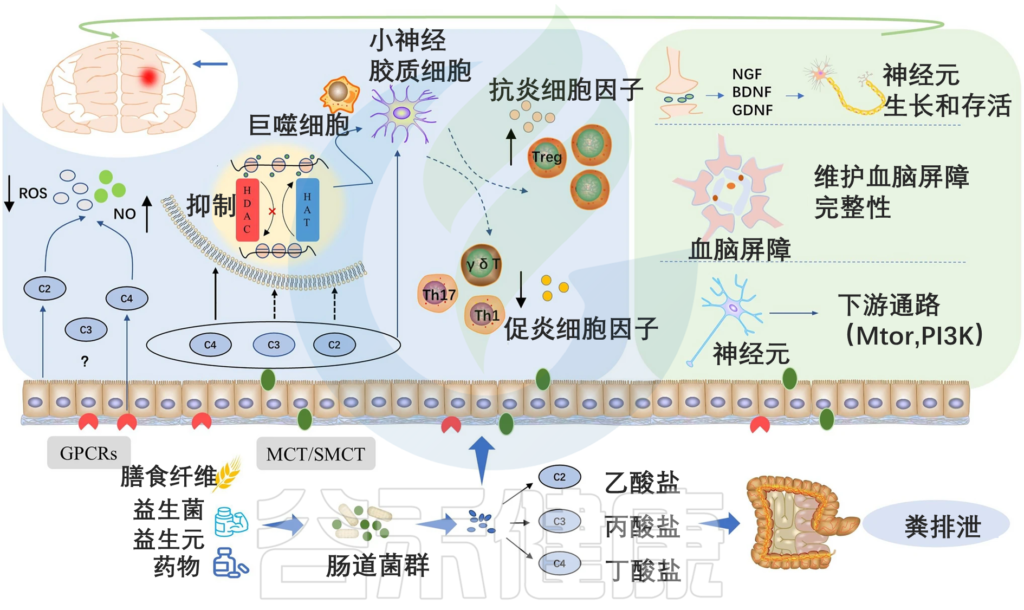
Fang Z, et al., Cell Mol Neurobiol. 2022
总之,短链脂肪酸可以诱导T细胞极化,从而影响免疫系统,从而改善缺血性脑损伤。此外,尽管没有直接证据,但短链脂肪酸可能参与T细胞向大脑的迁移。
★ 短链脂肪酸激活GPCR
GPCR与细胞周围的化学物质结合,包括气体、光敏化合物、激素、趋化因子和神经递质,并激活一系列细胞内信号通路,最终发挥不同的生理作用。
注:G蛋白偶联受体(GPCR)是一类由七个α螺旋组成的膜蛋白受体。
未知配体的两个GPCR(GPR41和GPR43)因与短链脂肪酸结合而改名为游离脂肪酸受体(分别为FFAR3和FFAR2)。
FFAR2更有可能结合较短的脂肪链(如乙酸盐),FFAR3优先结合较长的脂肪链,包括丙酸盐、丁酸盐和戊酸盐。此外,G蛋白偶联受体109A也可被丁酸和β-d-羟基丁酸激活。
短链脂肪酸通过激活肠上皮细胞上的GPR41和GPR43,导致快速丝裂原激活蛋白激酶信号、趋化因子和细胞因子。但到目前为止,只有少数研究探索了短链脂肪酸激活GPCR对中风有益作用的机制。
目前的一项研究表明,与乙酸盐和丙酸盐相比,经鼻给予低剂量丁酸钠(7.5 mg/kg)可显著减少大脑中动脉阻塞后的梗死体积,改善神经功能。
这可能与丁酸钠通过GPR41/Gβγ激活PI3K/Akt并减轻大脑中动脉阻塞后神经细胞死亡的机制密切相关。值得一提的是,丁酸盐和乙酸盐可以通过抑制氧化应激增加NO的生物利用度。有趣的是,丁酸盐的这种保护作用似乎取决于GPR41/43的激活,而乙酸盐的这种作用似乎独立于GPCR。
★ 短链脂肪酸抑制HDAC活性
组蛋白脱乙酰酶(HDAC)是一类修饰和调节染色体结构和基因表达的蛋白酶。在细胞核中,组蛋白乙酰化和组蛋白去乙酰化处于动态平衡,并由组蛋白乙酰转移酶和组蛋白去乙酰化酶共同调节。
研究表明,细胞内短链脂肪酸可以抑制HDAC活性,并且丁酸盐相对于其他短链脂肪酸具有较强的HDAC抑制作用。相比之下,乙酸盐几乎没有抑制作用。
大多数证明短链脂肪酸介导的HDAC抑制对中风影响的证据来自丁酸钠(SB)的动物研究。例如,在永久性缺血的大鼠模型中,皮下注射丁酸钠(300 mg/kg)可减少梗死体积,抑制小胶质细胞激活,并改善大鼠的运动、感觉和反射能力。
此外,研究人员发现SB在体外改变小胶质细胞中组蛋白3-赖氨酸9-乙酰化(H3K9ac,一种由HDAC调节的组蛋白修饰)的基因启动子。已经在小鼠中证实,SB可以通过表观遗传调节减少小胶质细胞介导的神经炎症,H3K9ac水平的上调可能是观察到的效应的一个重要原因。
令人惊讶的是,丁酸钠对脑缺血的改善作用在不同种类的大鼠和不同的给药方式下没有发生质的改变。除了减轻成人中风模型中的脑损伤,SB在新生儿缺氧-缺血中也具有潜在的神经保护作用。
除了小胶质细胞激活的表观遗传调节外,短链脂肪酸还具有与抑制HDAC活性相关的其他神经保护和神经营养作用。
例如,它们通过抑制诱导Treg细胞产生的HDAC,独立于游离脂肪酸受体调节mTOR-S6K通路。短链脂肪酸还上调神经递质和神经营养因子,如神经生长因子(NGF)、胶质细胞源性神经营养因子(GDNF)和脑源性神经营养因子(BDNF)的表达。
总之,短链脂肪酸目前可能通过影响T细胞极化、与FFAR相互作用以及抑制HDAC活性来影响中风预后。
然而,目前还没有研究探索短链脂肪酸在人类中的这些作用机制。在进一步探索短链脂肪酸影响中风的其他机制(免疫途径、内分泌途径和其他体液途径)的同时,研究短链脂肪酸作为调节剂在应用膳食短链脂肪酸补充剂、益生菌/益生元、FMT(恢复肠道微生物组成)的人类中风患者中的有效性和安全性将是未来研究的关键。
不同的饮食习惯可能会对肠道菌群产生不同的影响。例如,长期摄入西方饮食(高脂肪、高糖、低纤维)可能会减少肠道菌群多样性。饮食中富含复合碳水化合物的人的肠道菌群种类增加。生产短链脂肪酸所需的底物(膳食纤维)主要来源于饮食。
现在有大量证据表明,增加膳食纤维摄入可以降低心血管疾病(包括中风)的风险,这种有益的效果可能与循环短链脂肪酸水平的增加有关。
换句话说,增加膳食纤维的摄入可能是预防中风的有效方法之一。适当减少钠摄入量通常会对心血管系统产生有益影响,例如降低血压。此外,循环短链脂肪酸水平的增加可能维持心血管健康。
益生菌和益生元对宿主健康的益处已得到广泛研究和明确界定。益生菌中乳酸杆菌、丁酸梭菌Clostridium butyricum、地衣芽孢杆菌对中风的有益作用已在啮齿动物模型中得到证实。
最近一项针对肥胖女性的研究显示,在摄入益生菌混合物(菊粉和低聚果糖的混合物)长达三个月后,产丁酸菌显著富集。有趣的是,功能型大麦可以增加丁酸产生菌的数量,并增加肠道中的丁酸水平。
乳果糖(由果糖和半乳糖组成)是一种常见的益生元,在结肠中被肠道菌群转化为低分子量有机酸,并通过保持水分软化大便,常用于治疗中风后便秘。尽管乳果糖不是一种典型的益生元,但体外研究发现,它可以剂量依赖性地增加肠道中短链脂肪酸的水平(每天5克乳果糖,持续5天,可以产生完全的益生元效应)。
一项研究发现,乳果糖(20 g/kg)干预6周后,小鼠的肠道和血清短链脂肪酸水平发生改变。有趣的是,最近的一项研究发现,补充乳果糖可改善中风的功能预后,并降低中风后的炎症反应。
为了更好地利用益生菌和益生元之间的协同作用,创建了产品“合生元”,它是活性微生物(益生菌)和基质(益生元)的混合物。
一项实验研究发现菊糖和产短链脂肪酸菌之间有协同作用;与单独使用菊糖或单独使用产短链脂肪酸的菌相比,使用产短链脂肪酸菌和菊糖可改善中风后小鼠的神经功能缺损评分和行为结果。
此外,近年来的证据表明,益生菌对人体的影响不一定与活性微生物直接相关,而是活性微生物的代谢产物或细菌成分(后生物)至关重要-短链脂肪酸,一种被肠道菌群分解的植物多糖产品。
FMT可能是未来改善中风的潜在选择。然而,现有证据仍然很少,通过动物研究观察到的比较结果:移植富含短链脂肪酸的粪便微生物群可以改善中风后的脑损伤。
为了更好地阐明FMT在缺血性中风中的作用,有必要进一步扩大对小鼠FMT的研究,以探索有利于脑损伤恢复的肠道微生物群组成,并评估其安全性。在阐明FMT的潜在益处后,开始将其转化为人体试验。
除了可以影响肠道菌群和短链脂肪酸的抗生素,中风患者常用的药物阿托伐他汀可以逆转微生物组成,增加粪便丁酸水平,并增强中风患者的肠道屏障功能。这表明肠道微生物群和短链脂肪酸可能参与阿托伐他汀的抗炎作用。然而,其他常用于治疗中风的药物(如抗血小板和抗高血压药物)是否也发挥类似作用仍有待研究。
白藜芦醇是一种潜在的HDAC抑制剂,可增加产短链脂肪酸菌的数量。此外,白藜芦醇和丙戊酸钠(一种结构类似于丁酸盐的短链脂肪酸)的联合使用,减轻了缺血性中风的脑损伤。
关于白藜芦醇,详见:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
总的来说,药物会引起肠道菌群的改变。这种改变对中风的发展是有益的还是有害的,对中风的预后是重要的还是无关紧要的,都需要根据药物的类型进行进一步的探索和发现。
本文讨论了有关短链脂肪酸作为肠道菌群和缺血性中风之间桥梁,是如何影响中风的,通过机制的阐明,发现它们可以通过调节饮食、饮食补充、FMT等干预措施,调节缺血性中风的预后。
虽然短链脂肪酸和缺血性中风之间的联系在动物研究中逐渐得到巩固,但人类研究并没有同步进行。需要进一步扩大研究,以探索特定肠道菌群或短链脂肪酸的长期益处,并随后扩大转化为人体试验。
短链脂肪酸作为缺血性中风的潜在调节剂,为缺血性中风的菌群靶向治疗开辟了新的可能性。
主要参考文献:
Fang Z, Chen M, Qian J, Wang C, Zhang J. The Bridge Between Ischemic Stroke and Gut Microbes: Short-Chain Fatty Acids. Cell Mol Neurobiol. 2022 Mar 28. doi: 10.1007/s10571-022-01209-4. Epub ahead of print. PMID: 35347532.
Battaglini D, Pimentel-Coelho PM, Robba C, et al. Gut Microbiota in Acute Ischemic Stroke: From Pathophysiology to Therapeutic Implications. Front Neurol. 2020;11:598. Published 2020 Jun 25. doi:10.3389/fneur.2020.00598
Pluta R, Januszewski S, Czuczwar SJ. The Role of Gut Microbiota in an Ischemic Stroke. Int J Mol Sci. 2021 Jan 18;22(2):915. doi: 10.3390/ijms22020915. PMID: 33477609; PMCID: PMC7831313.
Zeng X, Gao X, Peng Y, et al. Higher Risk of Stroke Is Correlated With Increased Opportunistic Pathogen Load and Reduced Levels of Butyrate-Producing Bacteria in the Gut. Front Cell Infect Microbiol. 2019;9:4. Published 2019 Feb 4. doi:10.3389/fcimb.2019.00004
Roy-O’Reilly M, McCullough LD. Age and Sex Are Critical Factors in Ischemic Stroke Pathology. Endocrinology. 2018;159(8):3120-3131. doi:10.1210/en.2018-00465

谷禾健康
人类肠道菌群复杂多样,在与人类长期的共同进化过程中,具备了调节人体免疫应答、影响疾病发展等作用。这种作用与肠道菌群本身的多样性和关键核心菌种的是否存在等具有紧密联系。
在前面的文章我们已经了解到,肠道菌群失调与很多疾病相关,详见:
肠道菌群失衡的症状、原因和自然改善
造成菌群失调的原因有很多,比如抗生素的使用,膳食营养不均衡,感染,重金属污染,疾病发生以及过渡清洁肠道等。
一般肠道菌群失衡可以通过一些明显的迹象表明肠道菌群失衡,如腹胀气、腹泻、便秘、间歇性或慢性腹泻、肠易激综合征、溃疡性结肠炎和克罗恩病,频繁呼吸道感染、过敏、神经问题、免疫低下或代谢异常等来判别。
说到对改善修复肠道菌群,一般是针对菌群存在异常或者偏离健康状态的特定情况才进行针对性调节,这些调节思路主要包括 “清除”,“补充”,“置换”,“塑造”。常用的手段或措施如,使用抗生素或抗菌剂,益生菌,益生元,膳食纤维,粪菌移植,饮食或天然补充物等。
以上改善措施单一或者组合对改善和调节宿主微生态平衡发挥重要作用。不过个体的菌群构成和状态差异很大,由此带来的干预对不同个体和状态的干预效果同样有很大差异,这也反映在很多菌群干预临床研究上。
所以盲目的补充益生菌,益生元等单纯的从菌量或功效来评价益生菌产品的好坏,都可能不利于有效的改善健康状况和调整微生态平衡。除了对比如益生菌菌株,益生元结构区分等进行更加精细化的功能分析外,还需要结合肠道菌群检测,基于不同肠道菌群特点进行精准化的匹配干预和临床研究。
今天我们主要简单讲下不同的一些益生菌、益生元、天然调节剂等对肠道菌群的调节以及对宿主健康的影响及其差异化。
益生菌的现代定义为“活的微生物,当给予足够的剂量时,会赋予宿主健康”。益生菌主要存在于人体肠道内,通过维持肠道微生物平衡,在宿主体内发挥有益作用。在日常生活中,常见的益生菌,如乳酸杆菌或双歧杆菌,通常作为活性菌制剂食用。
近年来,益生菌的研究取得了重大进展。例如,益生菌益生菌可以改善肠道菌群的组成缓解便秘,IBS,IBD,改善腹泻,修复多种与肠道相关的损伤等,此外,益生菌可以在慢性炎症性疾病的治疗中发挥作用,具有抗癌、抗肥胖和抗糖尿病等作用。
本章节我们列举一些常见的益生菌及其功效。
双歧杆菌
人体内双歧杆菌的数量实际上随着年龄的增长而下降。双歧杆菌在提高整体免疫力、减少和治疗胃肠道感染以及改善腹泻、便秘和湿疹等方面发挥作用。
双歧杆菌中常见的种类有:双歧双歧杆菌、长双歧杆菌、婴儿双歧杆菌、乳酸双歧杆菌、短双歧杆菌等。
双歧双歧杆菌B.bifidum是一种通常用于改善消化问题的益生菌。B.bifidum与健康饮食相结合还可以改善血糖控制、减轻压力并帮助对抗感染,有助于增强免疫系统并减少过敏。
双歧双歧杆菌是在母乳喂养婴儿中发现的第二大菌种。在成年期,双歧杆菌的水平显著下降,但保持相对稳定 (2-14%),在老年时再次开始下降。
对其他肠道菌群的影响
在一项针对 27 名健康志愿者的临床试验中,双歧杆菌的摄入量减少了普氏菌科和普氏菌属,并增加了瘤胃球菌科和Rikenellaceae。
在一项针对 53 名慢性肝病患者的临床试验中,双歧双歧杆菌是成功防止小肠细菌过度生长的益生菌之一。同样,在一项针对 66 名酒精性肝损伤患者的试验中,它与植物乳杆菌(后面会讲到)的组合恢复了肠道菌群。
在对 30 人进行的另一项试验中,双歧双歧杆菌与嗜酸乳杆菌(后面会讲到)结合也在抗生素治疗后恢复了肠道菌群。
健康益处


双歧杆菌除在以上列举的疾病发挥作用之外,还在压力、过敏等方面发挥作用(小规模研究或临床试验单一)。
安全性
B. bifidum一般都是安全的,但应避免在免疫功能低下的个体、器官衰竭和“肠漏”的人群中使用。在这些情况下,益生菌可能会导致感染。在具有自身免疫性甲状腺疾病遗传易感性的人群中,双歧杆菌可能导致其发展和恶化。
短双歧杆菌是一种有益细菌,可以在人类母乳以及婴儿和成人的胃肠道中找到。随着个体年龄的增长,其肠道内的短双歧杆菌减少。
对肠道菌群的影响
在一项对 30 名没有其他畸形、染色体异常或宫内感染的低出生体重婴儿的研究中,早期给予短双歧杆菌促进了双歧杆菌的定植和正常肠道菌群的形成。
B. breve还显著减少了 10 名极低出生体重婴儿的吸入空气量并改善了体重增加。
健康益处


短双歧杆菌除在以上列举的疾病发挥作用之外,还在肥胖、坏死性小肠结肠炎、乳糜泻、感染等疾病中发挥作用(小规模研究或临床试验单一)。
目前已有文献中,部分关于短双歧杆菌菌株的研究:
短双歧杆菌M -16V (B. breveM-16V) 显着抑制 Th2 和 Th17 淋巴细胞亚群。
同时,B. breve M-16V 可能激活 MyD88 表达并促进 Th1 相关细胞因子 IL-12 的产生。此外,B. breve M-16V 可能部分恢复肠道菌群失调。
B. breve CCFM1025 是一种很有前途的候选精神生物菌株,可减轻抑郁症和相关的胃肠道疾病。
B. breve FHNFQ23M3可以缓解腹泻症状。
母乳分离的益生菌菌株B. breve CECT7263 是一种安全有效的婴儿绞痛治疗方法。
B. breve UCC2003 在生命早期驱动肠上皮稳态发育中发挥着核心作用。
安全性
B. breve被证明是适合早产儿常规使用的益生菌。
与使用短双歧杆菌相关的不良事件发生率极低,且严重程度较轻。
长双歧杆菌是一种革兰氏阳性、杆状细菌,天然存在于人体胃肠道中。它可以改善人体免疫反应并帮助预防肠道疾病。早期证据表明,它还可以抑制过敏、降低胆固醇和改善皮肤健康。
我们之前这篇文章有详细介绍,详见:双歧杆菌:长双歧杆菌
乳酸杆菌
鼠李糖乳杆菌是一种革兰氏阳性乳酸菌,是人类正常肠道菌群的一部分。通常都是安全的,并已广泛用于食品和保健品中。
健康益处


鼠李糖乳杆菌除在以上列举的疾病发挥作用之外,还在体重管理、肝功能、牙齿健康、免疫、怀孕与分娩等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
鼠李糖乳杆菌在健康成人中是安全的并且耐受性良好,并且似乎不会对年轻或老年受试者造成不良影响。
但是,免疫功能低下的人不应服用它,因为它可能导致菌血症。在器官衰竭、免疫功能低下状态和肠道屏障功能失调的患者中使用益生菌可能导致感染。
短乳杆菌L. brevis是一种植物来源的乳酸菌,L. brevis可以在酸菜和泡菜等发酵食品中找到。它也是人体肠道微生物群的正常组成部分。
健康益处


短乳杆菌除在以上列举的疾病发挥作用之外,还在睡眠、口腔黏膜炎等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
L. brevis被认为对人类食用是安全的。
L. brevis可以产生生物胺,如酪胺和腐胺。
对于器官衰竭、免疫功能低下和肠道屏障机制功能障碍的患者,应避免使用益生菌,因为可能会导致感染。为避免任何不利影响或意外相互作用,请在服用短乳杆菌之前咨询医生。
干酪乳杆菌是一种革兰氏阳性、非致病性乳酸菌。它存在于发酵乳制品(例如奶酪)、植物材料(例如葡萄酒、泡菜)以及人类和动物的生殖和胃肠道中。
作为一种营养补充剂,干酪乳杆菌已被证明可以改善肠道微生物平衡、关节炎、2 型糖尿病,并具有潜在的抗癌特性。
干酪乳杆菌在动物消化道中的运输过程中增强了免疫系统,可以刺激一氧化氮、细胞因子和前列腺素的产生。
干酪乳杆菌通过激活自然杀伤 (NK) 细胞、细胞毒性 T 细胞和巨噬细胞来促进小鼠化疗药物引起的免疫抑制的恢复。这些都是识别和消除肿瘤细胞和感染细胞的白细胞。
对其他肠道菌群的影响
干酪乳杆菌与普氏菌属、乳酸杆菌属、粪杆菌属、丙酸杆菌属、双歧杆菌属和一些拟杆菌科和毛螺菌属呈正相关,与梭菌属、芽孢杆菌属、沙雷氏菌属、肠球菌属、志贺氏菌属和希瓦氏菌属的存在呈负相关。
在志愿者实验中,L. casei 抑制了潜在有害的假单胞菌和不动杆菌。
含有干酪乳杆菌的发酵乳保留了肠道微生物群多样性,缓解了腹部功能障碍,在学业压力的健康医学生中,它并防止了皮质醇水平升高。
健康益处


干酪乳杆菌除在以上列举的方面发挥作用之外,还在压力、免疫力、呼吸道和胃肠道感染、病毒感染、炎症、关节炎、过敏、牙齿健康、心血管疾病、糖尿病、吸烟的并发症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
干酪乳杆菌通常具有良好的耐受性。应避免在器官衰竭、免疫功能低下和肠道屏障功能障碍的患者中使用益生菌。为避免不良反应,请在开始任何新的益生菌补充剂之前咨询医生。
格氏乳杆菌是一种乳酸菌,具有抗菌活性、产生细菌素以及调节先天和适应性免疫系统。
健康益处


格氏乳杆菌除在以上列举的疾病发挥作用之外,还在胆固醇、免疫力、肠道健康(腹泻、溃疡、幽门螺杆菌)、过敏、疲劳、子宫内膜异位症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
一般认为是安全的。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌。为防止不良副作用,请在开始服用新的益生菌补充剂之前咨询医生。
嗜酸乳杆菌是一种革兰氏阳性乳酸菌,传统上广泛用于乳制品行业,最近还用作益生菌。
嗜酸乳杆菌因其风味和益生菌作用而被添加到商业酸奶和乳制品配方中,并且是最常选择的用于饮食的乳酸菌之一。
对其他肠道菌群的影响
接受嗜酸乳杆菌和纤维二糖的健康志愿者表现出乳酸杆菌、双歧杆菌、柯林氏菌和真杆菌的水平升高,而Dialister降低了。
酸奶中的嗜酸乳杆菌可正向改变肥胖小鼠的肠道微生物群并增加肠道双歧杆菌。
嗜酸乳杆菌增加了大鼠中乳酸杆菌和双歧杆菌的数量,增加了乙酸、丁酸和丙酸的水平,并降低了人体微生物群模拟器中的铵盐。


嗜酸乳杆菌除在以上列举的疾病发挥作用之外,还在改善儿童叶酸和 B12 状态、糖尿病、轻微肝性脑病、老化、疲劳等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
嗜酸乳杆菌通常耐受性良好。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌,因为它可能导致感染。
肠道微生物植物乳杆菌是一种很有前途的,用于治疗腹泻、高胆固醇和特应性皮炎的益生菌。植物乳杆菌是一种广泛分布的乳酸菌。它常见于许多发酵的植物产品中,例如酸菜、泡菜、卤橄榄和韩国泡菜。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂。植物乳杆菌可以减少促炎细胞因子(IL-6、IL-8和MCP-1)的产生,增加抗炎细胞因子 ( IL-10 ) 的产生,降低 ALT 和 AST,减少NF-κB.
营养益处
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素(B2) 和叶酸(B9)。
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50%。
植物乳杆菌可以将女性从燕麦基质中的铁吸收提高 100% 以上。
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取。


植物乳杆菌除在以上列举的疾病发挥作用之外,还在改善肥胖、血糖、伤口愈合、牙齿健康、免疫、过敏、念珠菌病等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
在大鼠中未观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,用于器官衰竭、免疫功能低下状态和功能失调的肠道屏障机制的患者可能会导致感染。为了避免不良事件,请在使用益生菌之前咨询医生。
菊粉(不要与胰岛素混淆,胰岛素是一种控制血糖水平的激素)是一种存在于多种植物中的可溶性纤维。纤维是不被人体肠道消化或吸收的化合物。可溶性纤维吸水并在消化过程中变成凝胶。
来源及用处
菊粉存在于 36,000 种植物中,包括我们日常饮食中食用的植物,如小麦、洋葱、香蕉、大蒜和芦笋。它们也存在于不太常见的食物中,例如菊芋,尤其是菊苣,菊粉是商业提取菊粉的主要来源。
菊粉的其他天然来源有:菊苣根、龙舌兰、雪莲果根、新鲜香草等。不太常见的菊粉来源是蒲公英根、松果菊、牛蒡根等。
含有菊粉的植物用它来储存能量和抵御低温。当暴露于低温时,菊粉起到防冻剂的作用。
菊粉的溶解度使其能够吸收大量水分。当它膨胀时,它会形成一种凝胶,沿途聚集脂肪颗粒并将它们排出体外。
此外,它通过充当有益菌的食物,来增加肠道中有益细菌的数量。
对其他肠道菌群的影响
前面我们知道,双歧杆菌是肠道中的有益菌。菊粉基本上是双歧杆菌的食物并刺激它们的生长和活动。
多项研究表明,菊粉可刺激双歧杆菌的生长。例如:
8 名健康受试者被给予低聚果糖 15 天,并监测他们的粪便。虽然粪便中的细菌总数没有变化,但双歧杆菌成为主要类型。
在另一项研究中,10 名便秘的老年患者服用菊粉 19 天,并监测他们的大便情况。这些患者还表现出双歧杆菌数量增加,同时有害细菌减少。
此外,其他菌群似乎也受到菊粉的影响。
在一项针对 165 人的临床试验中,这种纤维还增加了厌氧菌的丰度(可以通过产生丁酸改善消化,甚至预防结肠癌),并减少嗜胆菌(与大便和便秘有关)。
不一样的研究结果
对实验室培养的细菌进行的一些研究表明,菊粉还会增加沙门氏菌等有害细菌,以及那些不会在正常人中引起疾病但可能导致免疫系统较弱的人感染的细菌,例如克雷伯氏菌和大肠杆菌。然而,其他实验室研究表明,菊粉通过增加双歧杆菌的生长来抑制艰难梭菌等有害细菌的生长。


菊粉除在以上列举的疾病发挥作用之外,还在增加钙和镁的摄取、骨骼健康、炎症性肠病、预防结肠癌的发展等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
菊粉可能对敏感个体产生某些副作用,或者如果使用的剂量太大产生不良反应。这些包括:
肠道不适,包括胀气、腹胀、胃部噪音、嗳气和痉挛、结肠肿胀、腹泻等。
此外可能会发生严重的过敏反应,但很罕见。在一些孤立的案例中,它会导致过敏反应,可能与食物过敏反应有关。
此外,对于在怀孕和哺乳期间补充菊粉的效果知之甚少。因此,孕妇应避免服用菊粉补充剂。
对于肠易激综合征 (IBS) 患者,低剂量可能会调节肠道细菌并减轻症状,但大剂量可能会产生中性甚至负面影响。
果胶是一种复杂的碳水化合物(多糖),存在于植物细胞壁中,有助于维持其结构。它是一种粘性可溶性纤维,具有形成凝胶的能力。果胶由主要在大肠(结肠)中的有益菌群发酵,产生短链脂肪酸。
由于其凝胶状稠度,果胶是一种流行的食品添加剂,作为增稠剂和纤维的重要来源,具有许多潜在的健康益处。研究表明,它可能有助于治疗高胆固醇、反酸、减肥和糖尿病。
果胶含量高的水果和食物
果胶存在于水果、蔬菜、豆类和坚果中。柑橘皮中的果胶含量最高,如橙皮、柠檬皮和葡萄柚皮(30% 至 35%)和苹果果肉(15% 至 20%)。其他主要来源包括木瓜、李子、醋栗、樱桃、杏子、胡萝卜等 。


在食品工业中用作胶凝剂(用于果酱和果冻)或用作稳定剂(用于糖果、果汁和奶饮料)的果胶主要从苹果果肉或柑橘类水果的果皮中提取。


果胶除在以上列举的疾病发挥作用之外,还在改善糖尿病、减肥、辐射损伤、便秘、呕吐、降血压、溃疡性结肠炎、铅毒性等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
对肠道菌群的影响
果胶在结肠中由不同的细菌属发酵,如双歧杆菌、乳酸杆菌、肠球菌、直肠真杆菌、普氏粪杆菌、梭菌、厌氧菌、Roseburia属,以促进其生长。
果胶的降解由不同的细菌衍生酶(如果胶酶、甲基酯酶、乙酰酯酶和裂解酶)促进,产生不同的POS,其取决于微生物群组成和果胶结构。
体外发酵系统报告的果胶效应


Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶通过增加拟杆菌的丰度来改变肠道菌群的组成,并改善酒精诱导的肝损伤(在非酒精性脂肪肝中,拟杆菌的丰度降低)。
膳食纤维果胶可以改变肠道和肺微生物群中厚壁菌门与拟杆菌门的比例,增加粪便和血清中短链脂肪酸的浓度。
通过果胶产生的短链脂肪酸进行免疫调节
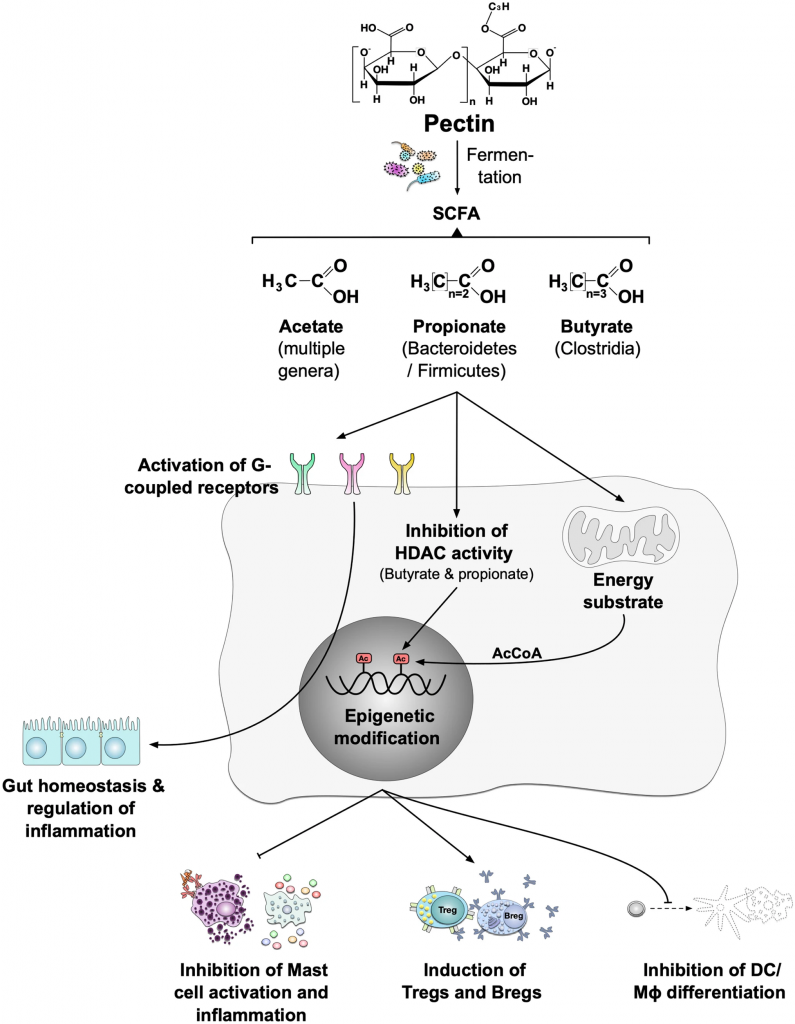

Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶经肠道菌群发酵可产生短链脂肪酸。不同的属可以产生不同的短链脂肪酸。例如,乙酸盐可以由许多不同的属生产;丙酸主要由拟杆菌门和厚壁菌门产生,丁酸主要由梭状芽胞杆菌产生。短链脂肪酸结合“代谢感知”G蛋白偶联受体,如GPR41、GPR43、GPR109A和嗅觉受体(Olfr)-78。这些受体促进肠道内稳态和炎症反应的调节。GPRs及其代谢产物影响Treg活化、上皮完整性、肠道稳态、DC生物学和IgA抗体反应。通过抑制HDAC的表达或功能,短链脂肪酸还影响许多细胞和组织中的基因转录。
过敏:果胶在过敏反应中的作用存在争议
一些临床报告表明,食用果胶后出现过敏反应,这可能归因于果胶和过敏原之间的交叉反应。此外,果胶还被描述为防止胃中过敏原的消化,促进完整的过敏原分子到达肠道并诱发过敏反应。
然而,其他人则认为果胶有直接和间接免疫调节作用。已经提供了一系列广泛的证据,描述了应用果胶诱导有益微生物群的转变和SCFA水平的增加,这两者都与减少体内外的炎症和过敏反应有关。由于不同的果胶增加或减少了与人类健康相关的细菌数量,因此,施用果胶可能会对肠道中的菌群进行特异性调节。
果胶能够通过与TLR2的静电相互作用直接与免疫细胞(如DC和巨噬细胞)相互作用,从而抑制促炎症TLR2-TLR1途径,同时不影响TLR2-TLR6耐受途径。
此外,它能够结合LPS,影响其与TLR4的结合。其他类型的细胞,如T细胞、B细胞和NK细胞也被果胶激活,而腹腔巨噬细胞中的iNOS和COX-2表达则被IKK活性、MAPK磷酸化和NF-κB激活抑制,表明其具有抗炎特性。
炎症性肠病:果胶调节IBD相关菌群
在短链脂肪酸中,丁酸能滋养结肠细胞并抑制结肠肿瘤,因此在大肠中表现出促进局部健康的特性。
产丁酸菌(主要属于厚壁菌门)的流失被认为是IBD期间微生物失调的一个特征。果胶可以促进厚壁菌门中许多丁酸生产者的生长。
果胶物质在调节 IBD 相关肠道微生物群中的综合概况
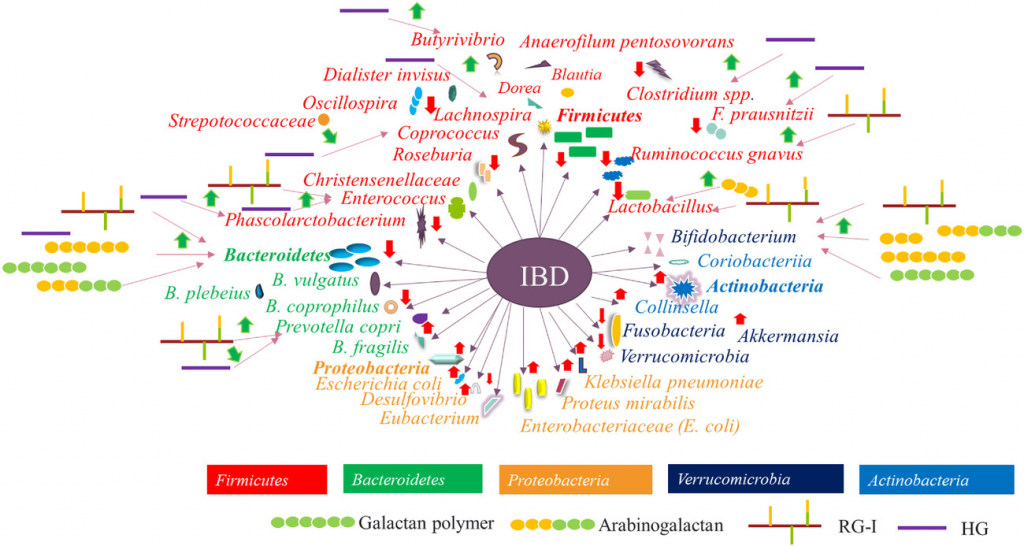

Wu D, et al., Compr Rev Food Sci Food Saf. 2021
注:不同颜色表示不同的细菌门。绿色箭头表示果胶物质对细菌的调节作用,红色箭头表示 IBD 与特定微生物群之间的正相关或负相关。
注意事项
果胶通常对人类食用是安全的。然而,在临床试验中,纤维与果胶的混合物(每天 20 克,持续 15 周)会引起一些与肠道相关的副作用,例如腹泻、肠胃胀气和稀便。
与药物相互作用:
在 3 名高胆固醇患者中,每天服用 15 克果胶和 80 毫克降胆固醇药物(洛伐他汀)会增加 LDL 水平。
建议把果胶和地高辛分开至少 2 小时。
在一项对 7 名健康受试者进行的研究中,他们服用 12 克柑橘果胶和 25 毫克 β-胡萝卜素,果胶将 β-胡萝卜素(维生素 A的前体)血液水平降低了 50% 以上。
姜黄是一种来自植物的香料,通常用于调味或着色咖喱粉、芥末和其他食物。姜黄根也用于制造替代药物。
姜黄已被用于替代医学中,作为降低血液胆固醇、减轻骨关节炎疼痛或缓解慢性肾病引起的瘙痒的一种可能有效的帮助。
姜黄含有几种被称为类姜黄素的主要成分,姜黄素是姜黄中最活跃的植物化学物质。它占类姜黄素的 77%.
姜黄素的健康益处
姜黄素和整个姜黄根茎在治疗慢性疾病如胃肠道、心血管和神经系统疾病、糖尿病和几种癌症方面具有一些有益作用。


姜黄素除在以上列举的疾病发挥作用之外,还在关节痛和关节炎、克罗恩病(肠蠕动、腹泻和胃痛)、狼疮、糖尿病、经前综合症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。

姜黄素目前已被认为可以治疗许多疾病,肠道微生物群在姜黄素生物活性机制中可能产生的作用,是一个有趣且有吸引力的研究领域。下面我们来看它们之间有怎样的互作关系。
姜黄素与肠道菌群的相互作用
★ 姜黄素直接调节肠道菌群
食用姜黄素与梭状芽孢杆菌、拟杆菌属物种的增加以及Blautia、Ruminococcus的减少有关。
研究证实,口服姜黄素能够显著改变肠道微生物群落中有益细菌和有害细菌的比例,有利于有益细菌菌株的生长,如双歧杆菌、乳酸杆菌和产丁酸菌,并减少致病菌的丰度,如普雷沃氏菌科、Coriobacteries、肠杆菌、Rikenellaceae.
姜黄素治疗会物种的微生物丰度,例如发现结直肠癌患者粪便中的普雷沃氏菌多。患有结肠癌的小鼠被喂食不同的颗粒饲料,姜黄素的计算人体等效剂量为8/mg/kg/天-162 mg/kg/天。最高剂量的姜黄素给药可减少或消除结肠肿瘤负担,增加乳酸杆菌,减少Coriobacteries。
还清楚地证明,姜黄素治疗可减少几种瘤胃球菌;这是一个有趣的发现,因为瘤胃球菌种类的增加与大肠癌的发生有关。此外,在使用致突变化合物治疗的小鼠中,膳食姜黄素能够将乳酸杆菌的数量恢复到控制水平,这已被证明具有抗肿瘤功能。
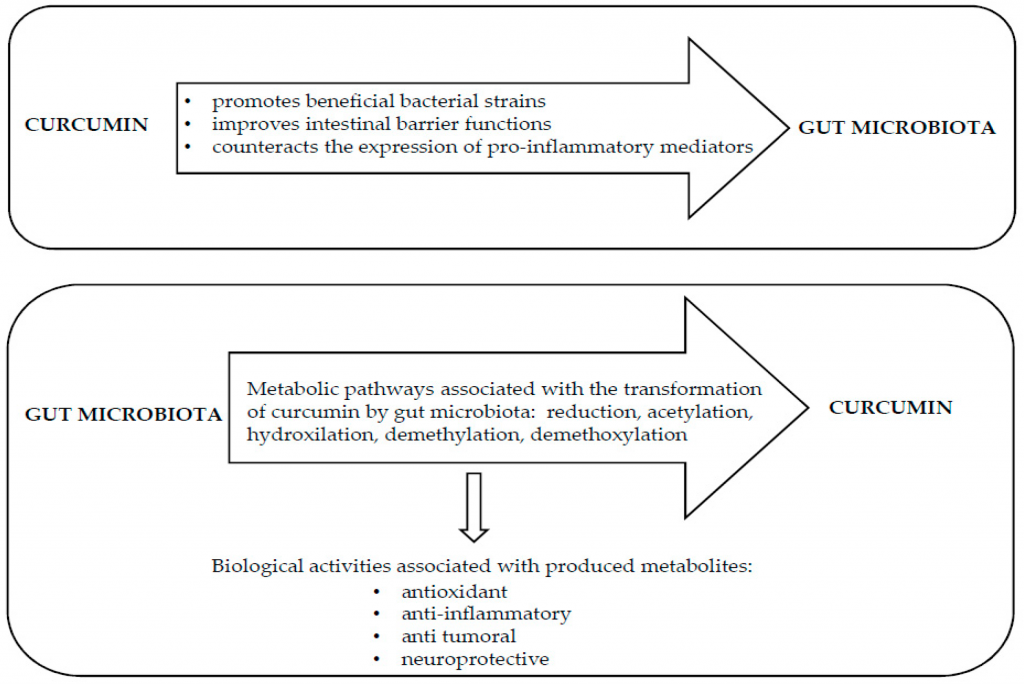

Scazzocchio B, et al., Nutrients. 2020
★ 肠道菌群对姜黄素进行生物转化,产生活性代谢物
姜黄素的代谢转化不仅发生在肠细胞和肝细胞中,还通过肠道微生物群产生的酶进行,这些酶产生许多活性代谢物。姜黄素代谢产物的生物活性可能不同于天然姜黄素,姜黄素的特定生物学特性实际上取决于肠道微生物群消化产生的生物活性代谢产物。
已经鉴定出几种能够修饰姜黄素的肠道细菌:对从人类粪便中分离的微生物的分析表明,大肠杆菌代表了姜黄素代谢活性最高的细菌,通过NADPH依赖的姜黄素/二氢姜黄素还原酶。这种酶能够将姜黄素转化为二氢姜黄素,然后转化为四氢姜黄素。
其他菌群,如长双歧杆菌、假链状双歧杆菌、粪肠球菌、嗜酸乳杆菌和干酪乳杆菌,代表了能够代谢姜黄素的相关菌株,母体化合物的还原率高于50%.
姜黄素代谢物具有与姜黄素相似的特性和效力:四氢姜黄素表现出与母体化合物相同的生理和药理特性,可能是通过β-二酮部分以及酚羟基。此外,四氢姜黄素能够预防氧化应激和神经炎症,还表现出抗癌作用,这可能是由于抑制了显着的细胞因子释放,例如 IL-6 和 TNFα。因此,在对姜黄素的进一步研究中应考虑细菌分解产物,因为它们可能具有有益作用。
对肠道屏障的影响
体外研究表明,姜黄素是一种潜在的化合物,可以恢复被破坏的肠道通透性。在 CaCo2 细胞中,姜黄素能够减轻肠上皮屏障功能的破坏,抵消 LPS 诱导的 IL-1β 分泌并防止紧密连接蛋白破坏。此外,姜黄素还能够减少由 IL-1β 诱导的 p38 MAPK 活化,以及随后紧密连接蛋白磷酸化的升高。
对肠道炎症的影响
代谢组学分析显示姜黄素对氧化应激和炎症的生物标志物具有有益作用,作者认为,姜黄素治疗抵消了非酒精性脂肪肝进展过程中一些细菌菌株的增加。
一项活体动物研究报告,新开发的纳米姜黄素通过抑制促炎介质的表达和诱导Treg扩张(同时伴随粪便丁酸水平的增加)积极改善DSS-结肠炎小鼠的炎症。将姜黄素与正常啮齿类动物饮食的粉末形式(含有0.2%(w/w)纳米姜黄素)混合:该化合物能够抑制NF-κB的激活和治疗小鼠结肠上皮细胞中促炎症介质的表达。
或者,姜黄素可以通过抑制TLR4/MyD88/NF-κB信号通路的激活来减轻LPS诱导的炎症。此外,姜黄素能抑制NF-κB核转位,并减轻其他在癌症中过度激活的促炎症基因的表达。
在喂食添加姜黄素(300 mg/kg姜黄素,与正常饲料混合)28天的断奶仔猪中,Gan等人证明,这种多酚能够通过抑制大肠杆菌增殖来减轻炎症,下调TLR4的表达。
虽然姜黄素迄今为止在体内研究中描述了所有有益的作用,但这些结果必须通过更大的人体临床试验得到一致的支持。
潜在风险和副作用
姜黄素通常耐受性良好。
常见的副作用包括便秘、消化不良(消化不良)、腹泻、腹胀、胃食管反流(胃酸反流)、恶心、呕吐和其他肠道问题。
极少的情况下,姜黄素会引起瘙痒或凹陷性水肿。
姜黄涂在皮肤上可能会引起过敏性接触性皮炎。
在高剂量体外模型中,姜黄素可引起细胞毒性和 DNA 损伤。
协同效应
添加胡椒碱(来自黑胡椒)可能会增加姜黄素在血液中的吸收。研究人员估计它可能会将姜黄素的生物利用度提高多达 2000%.
白藜芦醇是一种多酚,主要存在于葡萄皮和红酒中。
白藜芦醇是一种小多酚,在 1990 年代引起了科学界的关注。这种化合物被戏称为“瓶中的法国悖论”,因为在红酒中发现了白藜芦醇,法国人喜欢在高饱和脂肪饮食的同时食用不太适量的白藜芦醇。然而,法国人的心脏病发病率非常低。
虽然红酒中的白藜芦醇不太可能完全解释这一悖论,但一些科学家表示它可能是一个促成因素。
葡萄皮中的白藜芦醇含量很高,因为葡萄会产生白藜芦醇来防御毒素和寄生虫。它也存在于各种浆果、花生、大豆中。
有限的研究探索了它的抗氧化、抗炎、抗衰老和植物雌激素活性。白藜芦醇确实具有改善慢性疾病的一些潜力。
白藜芦醇有一个主要缺陷:生物利用度差。
白藜芦醇比其他多酚(如槲皮素)更容易从肠道吸收到血液中。但它会很快分解,在血液中留下很少的游离白藜芦醇。
与肠道菌群之间的关系
白藜芦醇和肠道菌群之间的双向相互作用:肠道菌群进行白藜芦醇生物转化,白藜芦醇对肠道菌群进行相互靶向,从而维持肠道稳态。
白藜芦醇的长期摄入改变了DSS诱导小鼠的肠道菌群,厚壁菌门/拟杆菌门的比例显著提高,这反过来又改变了白藜芦醇的代谢。
白藜芦醇补充对肠道生态系统的作用

Wellington VNA, et al., Int J Mol Sci. 2021
白藜芦醇添加增加了产短链脂肪酸菌,同时减少了产生LPS的肠道细菌。
补充白藜芦醇也可以通过增加自噬小体的数量和诱导微管相关蛋白1A/1B-light chain 3和Beclin-1的表达来恢复自噬,这两种蛋白在自噬中都是重要的蛋白。白藜芦醇补充也可能会中断Th1/17和细胞因子依赖的促炎通路,一氧化氮依赖的促氧化通路,并干扰toll样受体(TLR) 4信号转导。
白藜芦醇能减轻LPS对小鼠肠道和肝脏的炎症损伤。白藜芦醇减少了拟杆菌和Alistipes的相对丰度,增加了乳酸杆菌的相对丰度。白藜芦醇治疗降低了肝脏中TNF-α、IL-6、IFN-γ、髓过氧化物酶和丙氨酸转氨酶的水平。
此外,益生菌Ligilactobacillus salivarious Li01促进白藜芦醇大量代谢为二氢藜芦醇、硫酸白藜芦醇和白藜芦醇葡萄糖苷酸。在代谢产物中,二氢藜芦醇水平升高最为显著。
肠道菌群的存在促进了二氢藜芦醇的产生,同时促进了硫酸白藜芦醇和白藜芦醇葡萄糖苷酸的消除。

补充剂量
大多数补充剂含有 50 – 500 毫克白藜芦醇。有些含有更高的剂量,高达 1,200 毫克。
临床数据仍然有限。可用的临床研究使用典型的白藜芦醇剂量:
口服纯白藜芦醇的剂量在 150 – 500 毫克/天之间变化。每天喝 1 – 2 杯葡萄酒(100 – 300 毫升)可降低患心脏病的风险并改善血管健康。不含酒精的葡萄酒可能更有益,尤其是对于已经有患心脏病风险的人。
注意:对于有自身免疫和组胺问题的人来说,葡萄酒可能不合适。某些慢病患者如果不确定每天喝一杯葡萄酒是不是安全,请咨询医生。
在接受高剂量(每天 2.5 克或 5 克)白藜芦醇 29 天的人中观察到频繁的胃肠道不适/腹泻。根据 NOAEL 研究,使用 10 倍的安全系数,对于体重 60 公斤的个体,每日 450 毫克白藜芦醇的剂量被认为是安全的。
补充形式
白藜芦醇有多种形式作为口服补充剂:
大多数研究得出结论,反式白藜芦醇是更活跃的白藜芦醇形式。
增加生物利用度的方法
一些可能增加白藜芦醇生物利用度的方法包括:
协同效应
在研究中探索了以下白藜芦醇协同作用:


与药物相互作用
白藜芦醇可能与肠道或肝脏中的药物相互作用,尤其是那些被相同肝酶 (CYP450) 分解的药物。
白藜芦醇还可以减少血液凝固,增强抗凝血药物(抗凝血剂或抗血小板药物,如阿司匹林、氯吡格雷、达肝素、肝素和华法林)的活性。
一起来看下白藜芦醇可能与之相互作用的药物:
“
他汀类药物(Mevacor)
降低高血压的药物(如硝苯地平)
用于减少心律失常的药物(胺碘酮)
抗真菌剂(Sporanox)
抗组胺药(Allegra)
镇静剂/抗焦虑药(安定等苯二氮卓类药物)
抗抑郁药(Halcion)
抗病毒药物和 HIV 药物(蛋白酶抑制剂)
降低免疫反应的药物(免疫抑制剂)
勃起功能障碍(ED)药物
抗凝血药物
NSAID 止痛药/抗炎药,如双氯芬酸 (Voltaren)、布洛芬 (Advil, Motrin)、萘普生 (Anaprox)
……
来源
你知道葡萄酒中含有多少白藜芦醇吗?
通常,白藜芦醇的总浓度为:
红葡萄酒中 0.2 – 5.8 mg/L(平均约为 2 mg/L)
白葡萄酒中仅约 0.68 mg/L
红葡萄酒的反式白藜芦醇含量是白葡萄酒的六倍;白葡萄酒含有高水平的顺式白藜芦醇。红葡萄酒是在不去除葡萄皮的情况下提取的。
白藜芦醇的其他食物来源包括:
黑巧克力、各种浆果、大豆和生或煮花生。
1 杯煮花生含有 1.28 毫克白藜芦醇,大多数食物中的白藜芦醇含量可能太低,无法指望太多特定的健康益处。
副作用
在对健康人进行的临床研究中,每天服用 500 毫克的白藜芦醇具有良好的耐受性。
给予癌症患者高剂量的高生物利用度白藜芦醇(每天 5 克)不会引起任何严重的副作用,但一些患者会出现恶心和胃部不适。
由于缺乏适当的安全数据,儿童应避免使用白藜芦醇。
有人提出,补充白藜芦醇在怀孕期间有益于平衡新陈代谢和产前健康。不过,没有充分的临床研究调查孕妇中的白藜芦醇。
注意事项
白藜芦醇可减少铁吸收和/或血液水平,这可能会恶化贫血。
白藜芦醇转向代表涉及铁代谢(肝素)的重要蛋白质的基因,这可能降低铁吸收。另一方面,白藜芦醇对铁代谢的影响可能是有益的铁过载。
“
肠道菌群的维护和有益菌等的获得以及核心菌群的定植等,与每个人自身的饮食,遗传,生活环境等息息相关,尽量保持饮食多样化,每天食物应该包括蛋白,肉,全谷物,蔬菜,水果,坚果,鱼油/亚麻籽,发酵和多酚食物,食材选择新鲜,无过渡添加/烹饪同时清洁干净的食物,此外,不滥用抗生素或过渡清洁肠道,合理睡眠,适量运动,保持乐观,将有利于肠道和菌群健康。
主要参考文献:
Kato-Kataoka A, Nishida K, Takada M, et al., Fermented Milk Containing Lactobacillus casei Strain Shirota Preserves the Diversity of the Gut Microbiota and Relieves Abdominal Dysfunction in Healthy Medical Students Exposed to Academic Stress. Appl Environ Microbiol. 2016 May 31;82(12):3649-58. doi: 10.1128/AEM.04134-15. PMID: 27208120; PMCID: PMC4959178.
Segers ME, Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG–host interactions. Microb Cell Fact. 2014;13 Suppl 1(Suppl 1):S7. doi:10.1186/1475-2859-13-S1-S7
Ren JJ, Yu Z, Yang FL, et al. Effects of Bifidobacterium Breve Feeding Strategy and Delivery Modes on Experimental Allergic Rhinitis Mice. PLoS One. 2015;10(10):e0140018. Published 2015 Oct 7. doi:10.1371/journal.pone.0140018
Diaz Ferrer J, Parra V, Bendaño T, Montes P, Solorzano P. Utilidad del suplemento de probioticos (Lactobacillus acidophilus y bulgaricus) en el tratamiento del sindrome de intestino irritable [Probiotic supplement (Lactobacillus acidophilus and bulgaricus) utility in the treatment of irritable bowel syndrome]. Rev Gastroenterol Peru. 2012 Oct-Dec;32(4):387-93. Spanish. PMID: 23307089.
Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30. doi: 10.1016/j.nut.2009.04.011. Epub 2009 Aug 19. PMID: 19695834.
Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016;8(3):173. Published 2016 Mar 18. doi:10.3390/nu8030173
Tursi A, Brandimarte G, Giorgetti GM, Forti G, Modeo ME, Gigliobianco A. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis. Med Sci Monit. 2004 Nov;10(11):PI126-31. Epub 2004 Oct 26. PMID: 15507864.
van Zanten GC, Krych L, Röytiö H, Forssten S, Lahtinen SJ, Abu Al-Soud W, Sørensen S, Svensson B, Jespersen L, Jakobsen M. Synbiotic Lactobacillus acidophilus NCFM and cellobiose does not affect human gut bacterial diversity but increases abundance of lactobacilli, bifidobacteria and branched-chain fatty acids: a randomized, double-blinded cross-over trial. FEMS Microbiol Ecol. 2014 Oct;90(1):225-36. doi: 10.1111/1574-6941.12397. Epub 2014 Sep 5. PMID: 25098489.
Kadooka Y, Sato M, Ogawa A, Miyoshi M, Uenishi H, Ogawa H, Ikuyama K, Kagoshima M, Tsuchida T. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013 Nov 14;110(9):1696-703. doi: 10.1017/S0007114513001037. Epub 2013 Apr 25. PMID: 23614897.
Fujii T, Ohtsuka Y, Lee T, Kudo T, Shoji H, Sato H, Nagata S, Shimizu T, Yamashiro Y. Bifidobacterium breve enhances transforming growth factor beta1 signaling by regulating Smad7 expression in preterm infants. J Pediatr Gastroenterol Nutr. 2006 Jul;43(1):83-8. doi: 10.1097/01.mpg.0000228100.04702.f8. PMID: 16819382.
Kanjan P, Hongpattarakere T. Prebiotic efficacy and mechanism of inulin combined with inulin-degrading Lactobacillus paracasei I321 in competition with Salmonella. Carbohydr Polym. 2017 Aug 1;169:236-244. doi: 10.1016/j.carbpol.2017.03.072. Epub 2017 Apr 1. PMID: 28504142.
Micka A, Siepelmeyer A, Holz A, Theis S, Schön C. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int J Food Sci Nutr. 2017 Feb;68(1):82-89. doi: 10.1080/09637486.2016.1212819. Epub 2016 Aug 5. PMID: 27492975.
Blanco-Pérez F, Steigerwald H, Schülke S, Vieths S, Toda M, Scheurer S. The Dietary Fiber Pectin: Health Benefits and Potential for the Treatment of Allergies by Modulation of Gut Microbiota. Curr Allergy Asthma Rep. 2021 Sep 10;21(10):43. doi: 10.1007/s11882-021-01020-z. PMID: 34505973; PMCID: PMC8433104.
Wu D, Ye X, Linhardt RJ, Liu X, Zhu K, Yu C, Ding T, Liu D, He Q, Chen S. Dietary pectic substances enhance gut health by its polycomponent: A review. Compr Rev Food Sci Food Saf. 2021 Mar;20(2):2015-2039. doi: 10.1111/1541-4337.12723. Epub 2021 Feb 16. PMID: 33594822.
Scazzocchio B, Minghetti L, D’Archivio M. Interaction between Gut Microbiota and Curcumin: A New Key of Understanding for the Health Effects of Curcumin. Nutrients. 2020;12(9):2499. Published 2020 Aug 19. doi:10.3390/nu12092499
Ding S, Jiang H, Fang J, Liu G. Regulatory Effect of Resveratrol on Inflammation Induced by Lipopolysaccharides via Reprograming Intestinal Microbes and Ameliorating Serum Metabolism Profiles. Front Immunol. 2021 Nov 15;12:777159. doi: 10.3389/fimmu.2021.777159. PMID: 34868045; PMCID: PMC8634337.
Wellington VNA, Sundaram VL, Singh S, Sundaram U. Dietary Supplementation with Vitamin D, Fish Oil or Resveratrol Modulates the Gut Microbiome in Inflammatory Bowel Disease. Int J Mol Sci. 2021;23(1):206. Published 2021 Dec 24. doi:10.3390/ijms23010206
Yao M, Fei Y, Zhang S, et al. Gut Microbiota Composition in Relation to the Metabolism of Oral Administrated Resveratrol. Nutrients. 2022;14(5):1013. Published 2022 Feb 28. doi:10.3390/nu14051013
Del Follo-Martinez A, Banerjee N, Li X, Safe S, Mertens-Talcott S. Resveratrol and quercetin in combination have anticancer activity in colon cancer cells and repress oncogenic microRNA-27a. Nutr Cancer. 2013;65(3):494-504. doi: 10.1080/01635581.2012.725194. PMID: 23530649.
Malhotra A, Nair P, Dhawan DK. Curcumin and resveratrol synergistically stimulate p21 and regulate cox-2 by maintaining adequate zinc levels during lung carcinogenesis. Eur J Cancer Prev. 2011 Sep;20(5):411-6. doi: 10.1097/CEJ.0b013e3283481d71. PMID: 21633290.