 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康 原创
由于肠道菌群会影响T细胞和其他免疫细胞亚群的功能,无论是在肠道相关的淋巴样组织(GALT)内还是在肠道菌群之外,微生物群衍生的信号已被证明在多种疾病的调节及其调控中具有广泛的作用。近日,来自《The Journal of Clinical Investigation》一篇研究结果:“Gut microbiota modulate dendritic cell antigen presentation and radiotherapy-induced antitumor immune response”(肠道微生物群调节树突状细胞抗原递呈及放射治疗诱导的抗肿瘤免疫反应)指出肠道微生物群可以被调节用于改善放疗介导的抗肿瘤反应。并提示了一种新的机制,即消除产生短链脂肪酸的细菌有助于提高万古霉素和放疗介导的抗肿瘤疗效,这同时伴随肿瘤微环境的重塑以及肿瘤中抗原提呈和细胞毒性T细胞浸润的增加。
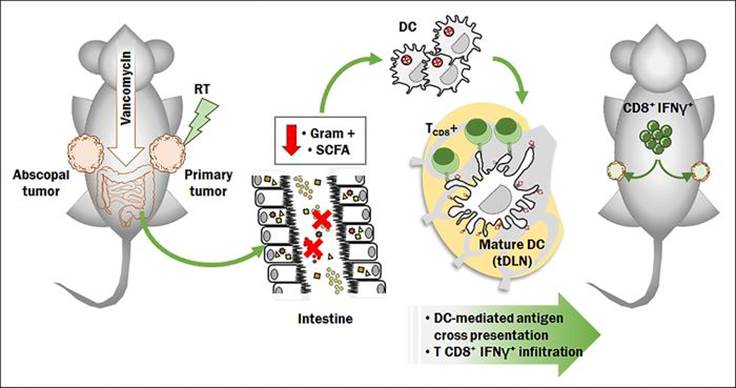

OVA:全称Ovalbumin,是一个蛋白。这个蛋白作为一个免疫学模型蛋白研究的比较清楚。尤其是小鼠的MHC I and II 展示这个蛋白的哪段多肽,都研究清楚了。比如最常用的C57B6小鼠,MHC-I展示OVA-257-264, MHC-II展示OVA-323-339.
OT-1 和OT-2是两种T细胞受体-TCR转基因鼠(都是B6)
肠道微生物群的改变会影响包括癌症在内的几种疾病的病理生理学。放疗(RT)是一种公认的根治性和姑息性癌症治疗方法,具有很强的免疫调节作用,还有诱导肿瘤相关抗原(TAA)与抗肿瘤CD8+T细胞的交叉诱导及抑癌作用。在这篇文章中,研究人员描述了肠道菌群组成对低分割放疗的影响,发现万古霉素治疗对荷瘤小鼠在放疗中引起的抗肿瘤作用有积极影响,并证明改变肠道菌群可以提高放疗效果。值得注意的是,万古霉素被耗尽的肠道细菌产生的代谢物丁酸盐消除了万古霉素的作用。研究结果表明,革兰氏阳性肠道细菌群落的改变可以引起肿瘤微环境重塑,介导引流淋巴结抗原呈递增加,并提高放疗的抗肿瘤作用。由于万古霉素是一种应用广泛且相对安全的临床药物,这些发现提高了利用这种抗生素在增强癌症患者放疗效果的可能性。
低分割、高剂量放疗可产生免疫原性细胞死亡(ICD),并通过肿瘤相关抗原(TAA)交叉激活诱导适应性抗肿瘤免疫。肿瘤细胞屈服于ICD刺激抗原呈递细胞(APCs),如树突状细胞(DCs),有效地吞噬肿瘤抗原,并将它们交叉呈递给CD8+细胞毒性T淋巴细胞。这一过程最终会产生一种特异性免疫反应,能够影响远距离未受辐射的肿瘤,被称为“abscopal effect”。 RT与免疫疗法的结合最近引起了相当大的临床兴趣,因为它有可能将RT从一种用于治疗局部疾病的方式转变为一种用于治疗全身恶性肿瘤的方式。然而免疫疗法与其他方法的结合只对一小部分患者有疗效,这提出了一个问题,即是否还没有发现RT介导的抗肿瘤免疫反应的重要调节因子此外,肠道微生物群衍生的信号已被证明在调节几种疾病及其治疗中具有广泛的作用,包括癌症及其对化疗的反应。研究人员最近证明了肠道微生物群影响过继细胞疗法(ACT)的抗肿瘤效果。在这篇文章中,研究人员选择万古霉素(一种主要作用于革兰氏阳性菌的糖肽类抗生素)作为特异性干扰肠道菌群的药剂,因为口服万古霉素后吸收非常差,不会进入体循环。
1.实验小鼠准备
6~8周龄C57BL/6雌性小鼠、6~8周龄 Ifng-KO雌性小鼠、OT1小鼠。均为购买。为了确保更换笼子时野生型和Ifng-KO小鼠之间的微生物群同质性,将来自所有使用过的笼子的鼠粪混合添加到干净的未使用的笼子中,以使动物的细菌菌群正常化。6~8周龄C57BL/6雌性小鼠在100μL PBS中双腿皮下注射1×105 TC-1或B16-OVA细胞用于建立B16-OVA黑色素瘤模型和TC-1肺癌/宫颈癌模型。未受辐射的肿瘤(abscopal)在原发肿瘤后3天注射。当肿瘤约为50mm (10-11天)时,使用XRAD320iX辐照器对每只小鼠上的一个肿瘤进行21 Gy单次剂量的RT,同时采取预防措施,通过屏蔽非辐射区域来避免辐射到肠道的任何区域。在对肿瘤进行辐射的前一天,小鼠开始接受含有万古霉素0.5g/L的饮用水。在含丁酸盐的实验中,加入丁酸盐5g/L与饮用水中,并与万古霉素联合使用。在体内CD8耗尽实验中,小鼠接受每周一次(共3个剂量)的抗小鼠单克隆CD8阻断抗体或大鼠IgG2b同型对照的腹腔注射治疗。实验中每组使用5-10只小鼠。
2.所需细胞的细胞培养及分离纯化
TC-1细胞在37°C的5%二氧化碳中增殖;B16-OVA细胞在添加了10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM中生长;树突状细胞培养,取小鼠股骨骨髓细胞,接种于6孔板中,与10 ng/mL的粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-4(IL-4)共同孵育7d。肿瘤用600U/mL的IV型胶原酶消化,再重悬于HBSS中。从肿瘤和淋巴结中分离出的树突状细胞用CD11c MicroBead UltraPure磁珠分离。瘤引流淋巴结用胶原酶D消化再重悬于HBSS中。OT1小鼠脾细胞中的T细胞使用Pan T Cell Isolation Kit II试剂盒分离。
3.细胞定量分析及基因表达分析
使用流式细胞仪从分离的纯化CD3+T细胞中进行细胞内染色以检测T细胞极化。并用以下针对小鼠标记的单克隆抗体来对T细胞进行表型:抗CD45、抗CD3、抗CD25、抗CD4、抗CD8。酶联免疫法检测IFN-γ水平。qPCR对所选基因的表达水平进行相对定量。利用光电二极管阵列探测器和自Waters Acquity uPLC System对粪便样本中短链脂肪酸进行了定量。用液相色谱高分辨质谱分析瘤引流淋巴结和肿瘤样品中的短链脂肪酸。酶联免疫斑点实验用于测定分泌特异性抗体或细胞因子的单个细胞对特异性抗原的应答能力,及产生应答的细胞数量。从处理过的小鼠中分离出B16-OVA肿瘤,并将这些细胞与从OVA转基因OT1小鼠中纯化的OT1OVA特异性CD8+T细胞共同孵育,用酶联免疫斑点实验检测产生IFN-γ的细胞。
4. 16S rRNA测序
收集小鼠粪便样本并在-80°C下冷冻,提取DNA,针对16S基因的V4-V6区进行PCR扩增。Roche 454GS FLX仪器测序。使用QIIME管线版本1.8使用默认参数处理DNA序列数据。去除了具有2个以上不明确碱基调用的低质量序列读取或长度小于200bp的序列。使用UCLUST选择可操作的分类单元,并使用QIIME中的默认一致分配方法生成分类分配。代表序列与PyNAST比对,并用于与FastTree构建系统发育树。使用QIIME计算每对样品之间的UniFrac距离。使用非参数统计检验(Mann-Whitney,Kruskal-Wallis)比较类群的相对丰度和组内UniFrac距离。
5.统计
双尾学生t检验用于比较指定的数据集。双因素方差分析比较肿瘤进展。对数转化后的双侧t检验比较细菌分类群的相对丰度。置换多变量方差分析(PERMANOVA)评估组间样本差异性。Kaplan-Meier估计器分析随时间变化的生存率。P值小于0.05被认为是显著的。对错误发现率的校正用于对多次比较进行校正。
1. 口服万古霉素治疗可以增强临床前的黑色素瘤和肺/宫颈肿瘤模型中低分割放疗的抗肿瘤作用。
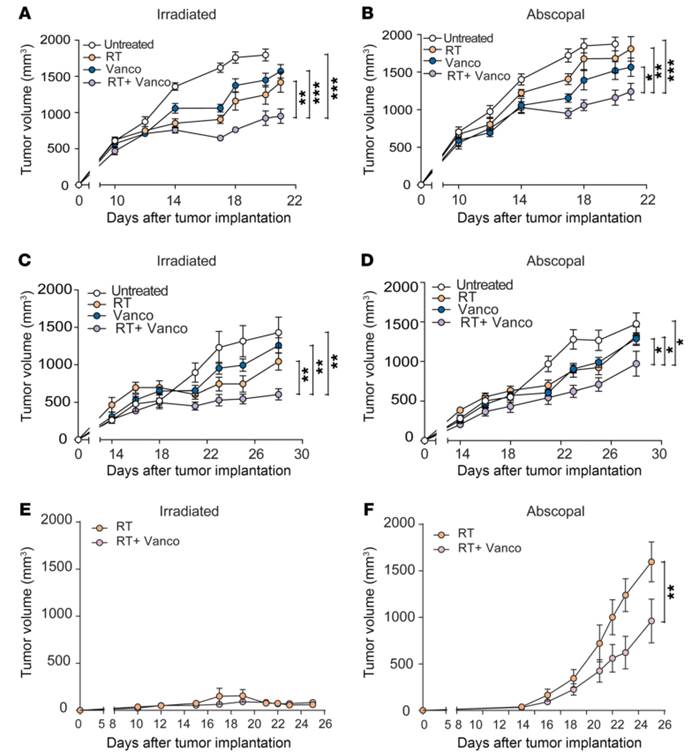

对照(Untreated)、单独万古霉素治疗(Vanco)、单独放疗(RT)、联合治疗(RT+Vanco)
A)和C) 分别来自B16-OVA黑色素瘤模型和TC-1肺癌/宫颈癌模型的受辐射的原发肿瘤(primary tumor)。
B)和D)分别来自TC-1肺癌/宫颈癌模型的未受辐射远端肿瘤(abscopal tumor)
E)和F)分别来自B16-OVA黑色素瘤模型的受辐射原发肿瘤和未受辐射远端肿瘤。发现加入万古霉素和RT作为联合治疗产生的抗肿瘤作用都大于单独使用万古霉素或单独使用RT介导的抗肿瘤作用。对照和单独放疗的队列相比,肿瘤也出现了生长延迟。在图E中无论是否使用万古霉素治疗,RT都控制了原发肿瘤的生长。在图F中,与单独使用放疗相比,在使用万古霉素和RT治疗后远端肿瘤生长显著降低。
2.万古霉素治疗增加了因放疗产生的肿瘤细胞溶解CD8+T细胞的数量。在CD8耗尽的小鼠中,万古霉素的作用被消除。万古霉素通过一种需要细胞溶解CD8+T细胞群的机制来增强放疗介导的全身抗肿瘤效应。
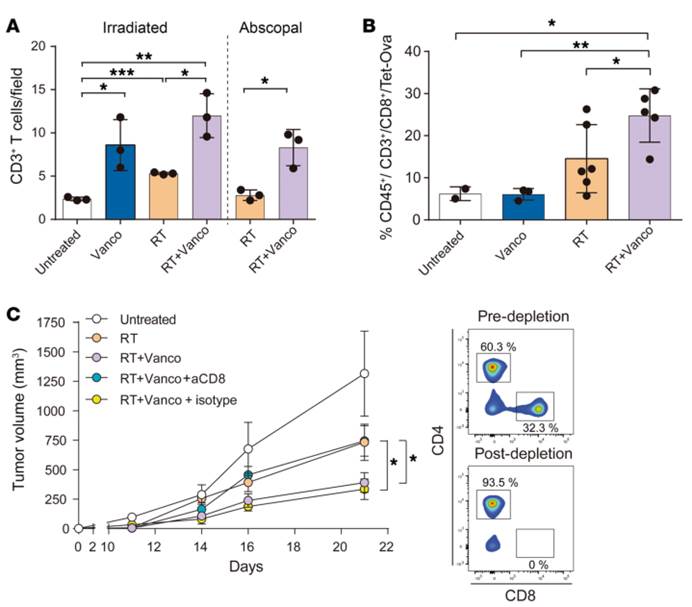

A). 来自B16-OVA黑色素瘤模型的原发肿瘤以及远端肿瘤的各组的CD3+细胞浸润的免疫组织化学定量。在免疫组化分析中发现有可测量的CD3+T细胞浸润,联合治疗后CD3+T细胞浸润明显高于单纯放疗(P<0.05)
B).来自各组原发肿瘤的OVA特异性CD8+T细胞的百分比。联合治疗的小鼠肿瘤中OVA特异性CD8+T细胞(即CD45+/CD3+/CD8+/TETOVA细胞的百分比)明显高于对照组、单独万古霉素治疗组和单纯放疗组的肿瘤(双因素方差分别为P=0.0117,P=0.0028,P=0.0472)
C).CD8耗尽小鼠的肿瘤生长率。在联合治疗前耗尽小鼠内的CD8+细胞影响了联合治疗本该有的抗肿瘤作用,这表示CD8+T细胞群是介导观察到的抗肿瘤作用所必需的细胞(P=0.0120)。
3.联合治疗的抗肿瘤作用是依赖于IFN-γ水平的。万古霉素重塑了肿瘤微环境,增加了肿瘤浸润的OVA特异性CD8+T细胞的功能,而IFN-γ是增强放疗诱导的抗肿瘤免疫效应所必需的组分。
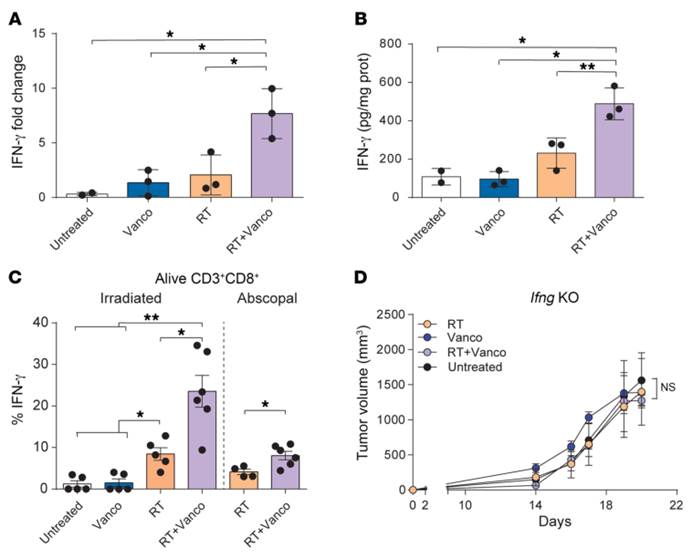
A).放疗后5天B16-OVA黑色素瘤模型中原发肿瘤的Ifng mRNA表达水平。与单独放疗组或单独万古霉素治疗组相比,联合治疗组的Ifng mRNA表达水平显著增加(P=0.0131、 P=0.0293)。
B). 放疗后5天肿瘤裂解物中 IFN-γ 蛋白表达水平的酶联免疫分析。联合治疗组的IFN-γ蛋白表达水平相比其他治疗组显著增加(P=0.0028、P=0.0179)。
C).经过一夜的Kb-OVA肽刺激后,CD8+T细胞内 IFN-γ 的表达。联合治疗小组内的CD8+T细胞的IFN-γ数量明显高于单独治疗的任何一种治疗(两两比较P<0.0 5)。
D).联合治疗对Ifng基因敲除小鼠(Ifng-KO)的抗肿瘤作用消失。(与放疗组和单独万古霉素治疗组相比,分别为P=0.5601、P=0.0911)
4. 万古霉素治疗增加了肿瘤局部TAA(肿瘤相关抗原)交叉呈递,促进了抗原特异性T细胞对肿瘤的识别
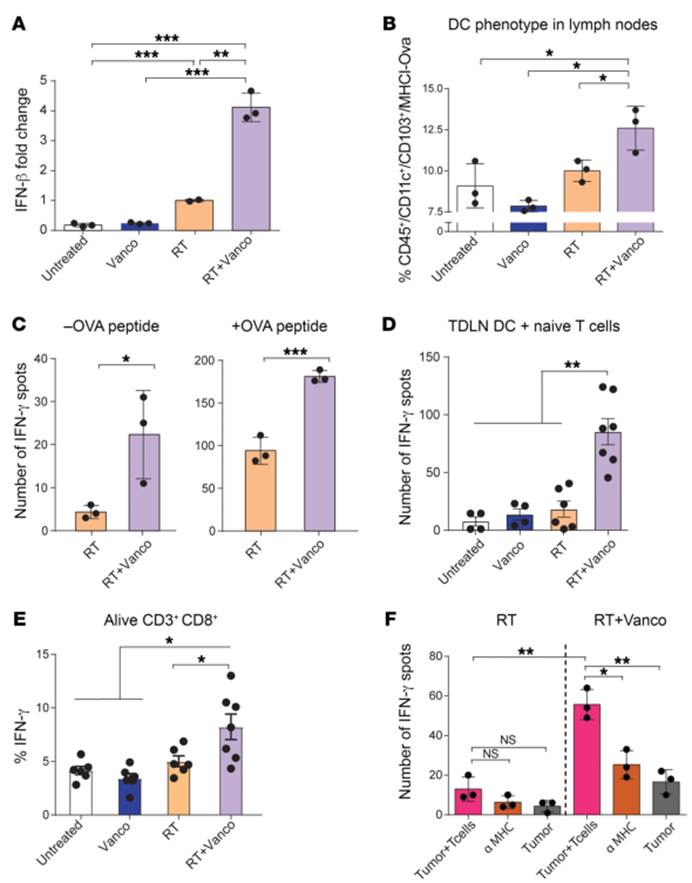

A).辐射后第一天,小鼠TDLNs(瘤引流淋巴结)中Ifnb1 mRNA表达水平。与单独放疗相比,万古霉素治疗在TDLNs中协同增强了Ifnb1基因的表达。(P=0.0032)
B).放疗后第5天,肿瘤浸润细胞CD11c+ CD103+ DCs的抗mhc1 (Kb)-SL8 OVA肽染色。联合治疗组的DCs细胞与单独放疗组相比显著增加(P=0.0396)
C). 用TDLN单细胞悬液和OT1 T细胞(1:5 TDLN细胞/ T细胞)在没有OVA肽(-OVA)或存在OVA肽(+OVA)的情况下进行IFN-γ的酶联免疫斑点试验。放疗处理5天后收集细胞。来自联合治疗的小鼠的TDLNs的IFN-γ产生细胞的数量与只使用放疗的小鼠的TDLNs相比显著增加(分别为P=0.0398和P=0.0010)
D). 将来自各治疗组的TDLN中纯化的CD11c+DCs细胞在IFN-γ 酶联免疫斑点试验(1:10DCs/T细胞)中与幼稚的OT1 T细胞共培养过夜。联合治疗增强了CD11c+DCs细胞的局部抗原提呈功能
E).与每种治疗方法处理的小鼠DCs细胞共培养过夜的OT1细胞表达IFN-γ的百分比。从联合治疗组中分离纯化的CD11c+细胞能特异性的增加未诱导的(Naive)OT1细胞中CD8+T细胞产生IFN-γ的能力。
F). 将单独放疗或联合治疗的B16-OVA模型下的小鼠肿瘤分离并与OT1细胞在IFN-γ酶联免疫斑点试验平板上共培养24小时。与RT组相比,联合治疗可增加IFN-γ的分泌(P=0.0016)。MHC1阻断抗体显著减少了产生IFN-γ的细胞,表明MHC1依赖于CD8+T细胞的激活(P=0.0073)
5. 肠道细菌产生的短链脂肪酸在体外削弱了抗原提呈细胞活性,干扰了交叉启动的活性,在体内消除在放疗中万古霉素增强的抗肿瘤作用。
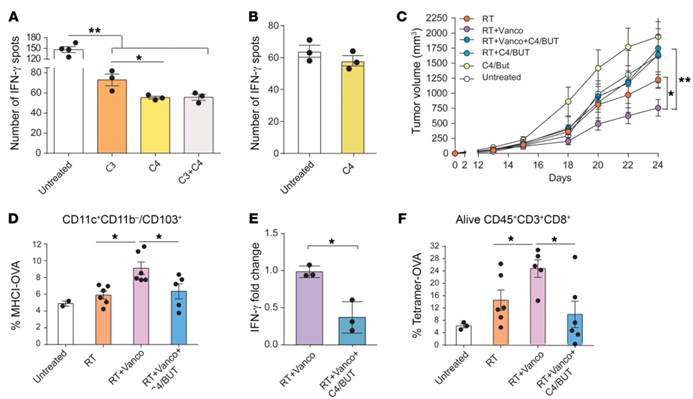

A).骨髓来源的树突状细胞对照(Untreated),用100μM丁酸盐处理(C4),或用100μM丙酸和OVA(100μg/mL)处理24h(C3),然后与OT 1小鼠的T细胞一起接种于酶免疫斑点试验平板上。与对照组相比,经C4或C3处理的骨髓树突状细胞分泌IFN-γ减少,这表明C4有单独抑制树突状细胞的抗原提呈细胞功能,只经C3处理的树突状细胞也表现出对抗原提呈细胞功能的部分抑制,但与C4共同处理时不能增强C4单独诱导的抑制(P=0.0134)
B).纯化的T细胞在IFN-γ酶免疫斑点试验平板中,在有或无100μM 丁酸盐的情况下,用aCD3/aCD28刺激纯化的T细胞。在刺激过程中,C4的存在对T细胞产生IFN-γ没有明显影响。
C)含万古霉素的饮用水中加或不加丁酸盐(C4)对辐射小鼠体内肿瘤生长的影响。万古霉素增强了放疗的抑瘤作用(P=0.0307),但C4的加入消除了这一作用(P=ns)
D) 对小鼠淋巴结中OVA呈递的树突状细胞进行计数,发现用经C4处理的小鼠这一数量显着减少
E)采用qPCR检测辐射小鼠体内 肿瘤中mRNA的Ifng的表达水平。经C4处理的治疗组。万古霉素对Ifng水平的影响降低。
F).肿瘤内抗原特异性T细胞的百分比。经C4处理的联合治疗组降低了肿瘤内抗原特异性T细胞的百分比。
6. 万古霉素处理改变了短链脂肪酸浓度和细菌群落组成。万古霉素治疗优先针对革兰氏阳性细菌群体,包括丁酸盐产生菌,并降低粪便和组织样本中的短链脂肪酸浓度。
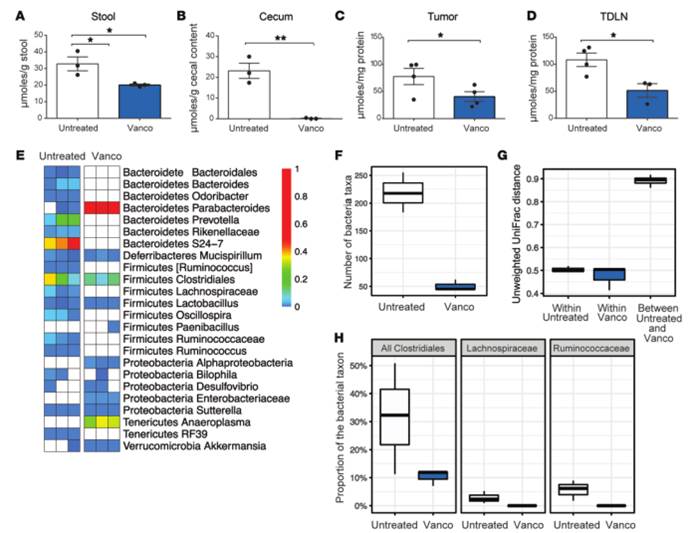

A)B)C)D).粪便、盲肠内容物、肿瘤、瘤引流淋巴结中C4短链脂肪酸浓度。万古霉素显著降低了C4短链脂肪酸浓度。
E).细菌分类群丰度热图。白色方块表示样本中没有观察到的分类群。万古霉素处理引起了细菌群落组成的重大变化,包括大多数革兰氏阳性分类群的消失,并对革兰氏阴性分类群产生了一些影响。
F).细菌群落多样性。万古霉素治疗组中发现的细菌分类群数量比对照组减少了4倍(P=0.01)
G).未加权UniFrac距离的细菌群落差异。万古霉素处理后细菌群落的组成发生了一致的变化,对照组和万古霉素治疗组内样本距离显著低于组间距离(P<0.001)。
H). 已知含有产生丁酸的细菌种类的分类群的相对丰度万古霉素治疗消除了产生短链脂肪酸的梭状芽孢杆菌2个主要科:瘤胃球菌科和毛螺菌科(两个科均P<0.01)
这些数据表明肠道微生物群可以被调节用于改善放疗介导的抗肿瘤反应。并提示了一种新的机制,即消除产生短链脂肪酸的细菌有助于提高万古霉素和放疗介导的抗肿瘤疗效,这同时伴随肿瘤微环境的重塑以及肿瘤中抗原提呈和细胞毒性T细胞浸润的增加。总之,去除对万古霉素敏感的细菌可以增强RT的抗肿瘤活性,这具有重要的临床意义。基于这些发现,研究人员建议以患者特有的方式使用肠道调节,以便将RT的局部抗肿瘤效应转化为可靶向转移性疾病的全身反应。