 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康 原创
转移性肾细胞癌(RCC)长期以来被认为是一种“免疫性恶性肿瘤”,对不同的免疫疗法敏感。免疫检查点阻断疗法(ICB)的发展,使肾细胞癌(RCC)的临床预后发生了革命性的变化。虽然如此,但治疗响应的持续时间以及预测的改善仍旧没有满足医疗需求。虽然人们已经认识到抗生素(ATBs)会降低ICB在各种恶性肿瘤中的临床活性,但对于不同的肠道非致病菌(共生菌)对ICB在肾细胞癌中的疗效的直接影响却知之甚少。
近日,来自法国科学家的一项发表在《Eur Urol (欧洲泌尿学杂志)》期刊的一篇题为“Gut Bacteria Composition Drives Primary Resistance to CancerImmunotherapy in Renal Cell Carcinoma Patients” 研究发现:微生物群的组成受TKI和ATB的影响,并影响免疫治疗的成功, 未来研究人员表示在开始治疗前对粪便的分析可能可以指导临床医生用药,以防止肾细胞癌患者对免疫治疗的原发性耐药。
简称/名词介绍:
ORR:客观缓解率,指肿瘤缩小达到一定量并且保持一定时间的病人的比例,也就是在任何时候完全缓解和/或部分缓解的患者数量。
PFS:无进展生存期,指从随机分组开始到第一次肿瘤进展或死亡时间。
BOR:本文中,研究者评估的从nivolumab开始治疗之日到治疗结束的最佳肿瘤反应(完全缓解、部分缓解、疾病稳定或疾病进展)。
文章中使用RECIST疗效评价标准1.1评估肿瘤反应
完全缓解【complete response,CR】:除结节性疾病外,所有目标病灶完全消失或所有目标结节须缩小至正常大小(短轴<10mm)
部分缓解【partial response,PR】:所有可测量目标病灶的直径总和低于基线≥30%。目标结节总和使用短径,而所有其它目标病灶的总和使用最长直径。
疾病进展【progressive disease,PD】:可测量目标病灶的直径总和增大≥20%超过观察到的最小总和,如治疗期间未观察到总和降低,则定义为超过基线。
疾病稳定【stable disease,SD】:介于PR和PD之间。
摘要
文章的主要目的是评估在晚期肾细胞癌患者中,其肠道菌群组成对ICB疗效的预测价值。研究人员收集了69例晚期肾细胞癌患者的粪便样本和2994例健康志愿者的粪便样本。同时,研究人员还进行了临床前研究,将对ICB具有抗性的肾细胞癌患者粪便微生物移植到荷瘤小鼠上,以此证明了肠道细菌组成与ICB临床结果之间的因果关系。研究人员还评估了在开始nivolumab治疗前使用TKl对微生物群组成的影响。通过WGS-MG测序分析识别其微生物群组成。研究发现,近期抗生素使用可改变肠道菌群组成,并降低患者的客观缓解率,促进了不同优势物种类群的形成,如Clostridium hathewayi菌在肾细胞癌患者的粪便中较为富集。还有一个重要的点,就是在接受nivolumab药物前服用酪氨酸激酶抑制剂(TKI)能够改变肠道菌群的组成。最后,研究人员表示微生物群的组成受TKI和ATB的影响,并影响免疫治疗的成功。未来的研究将有助于提高这些特定细菌的作用,以及它们作为新的生物标志物的潜力。
实验设计

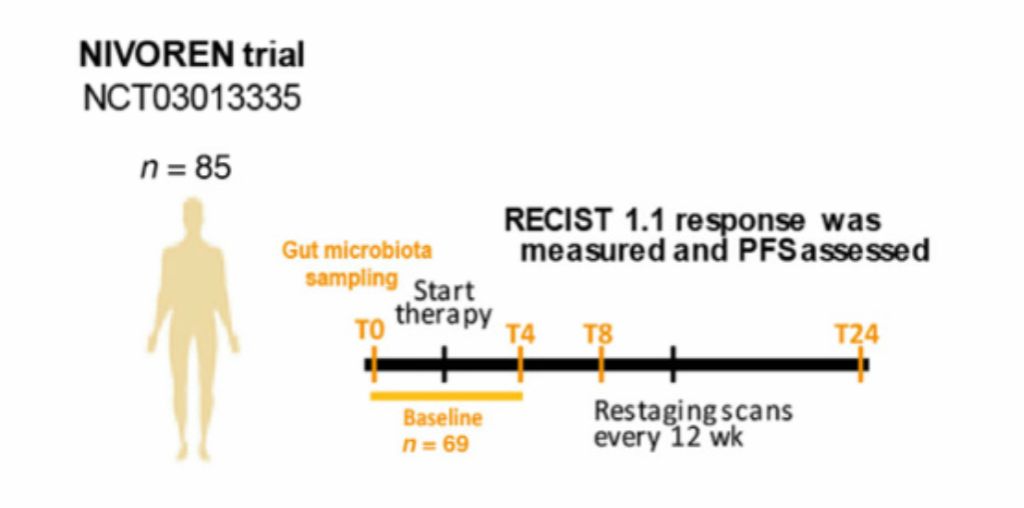
受试者纳入标准:
对IV期肾细胞癌患者和疾病进展的患者每2周注射3mg/kg的nivolumab(纳武单抗),直到疾病进展或在NIVOREN
GETUG-AFU 26第二阶段试验中出现无法忍受的毒性为止。
细节:
第一年在基线和每8-12周进行一次CT扫描,然后每12-15周进行一次CT扫描直到疾病进展。根据国际人体微生物组标准指南(SOP_03_V1) 进行粪便样本收集,在第一次注射nivolumab前(T0,<1mo);第二次(T4,4wk);第四次(T8,8wk);第12次(T24,24wk)
宏基因组学和统计学分析:
从粪便标本中提取总DNA,并按照MetaGene Polis(INRA)工作流程使用IonProton技术进行测序。从丰度矩阵开始,只考虑在所有样本中至少有20%存在的分类群,然后对原始数据进行归一化和标准化。监督偏最小二程判别分析(PLS-DA)和随后的变量对模型的重要性图(VIP)找出与BOR相关的组中的差异物种。双尾Mann-Whitney U和Kruskal-Wallis检验分别评估成对比较和多重比较的意义,p<0.05。计算用于网络相关分析的Pearson矩阵。所有的p值都经过FDR矫正。
主要结果
1. ATBs影响了ICBs对肾细胞癌患者的临床疗效,并改变了肠道菌群的β多样性和组成
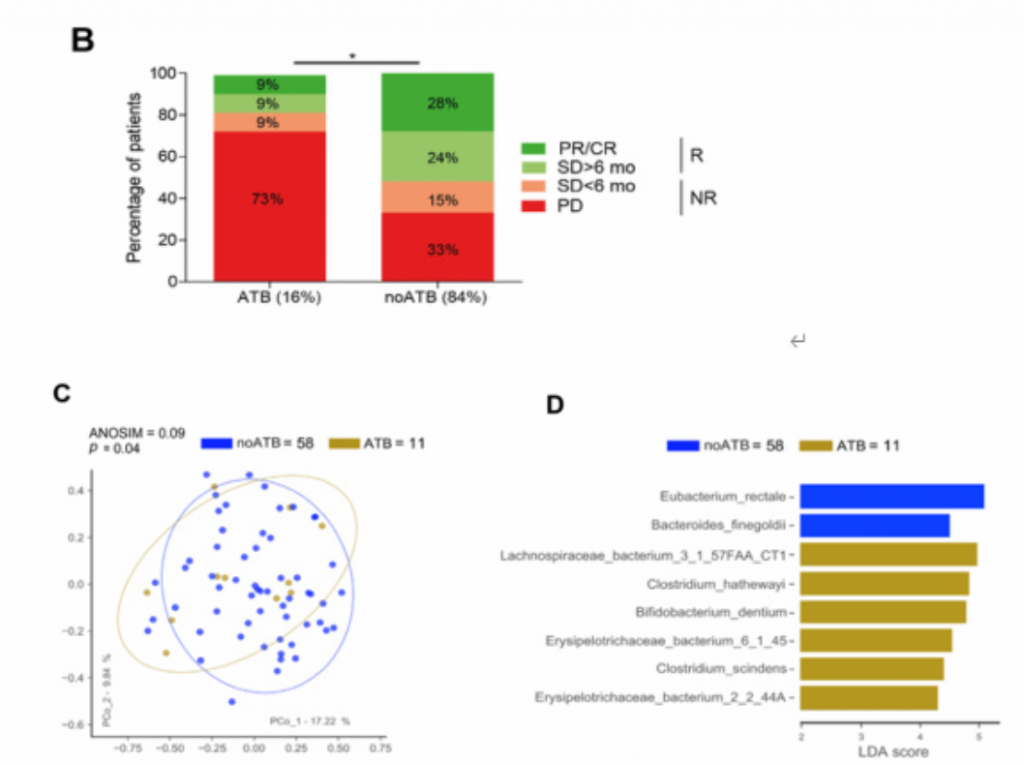


ATB:抗生素;noATB:未使用抗生素;NR:无肿瘤反应;PR:部分缓解;PD:疾病进展;
PFS:无进展生存期;R:有肿瘤反应;SD:疾病稳定;ORR:客观缓解率
(B).使用和不使用抗生素肾细胞癌患者人数占总患者人数的比例以及不同RECIST疗效结果占使用或不使用抗生素肾细胞癌患者人数的比例。ATB组11例,在抗PD-1阻断后2个月内服用抗生素;noATB组58例,未服用抗生素。接受ATBs治疗的患者的ORR低于未接受ATBs治疗的患者(9%
vs 28%, p < 0.03,p值采用双尾卡方检验)
(C). 基于PCoA分析的预处理样品粪便微生物群组成标准化和归一化数据的β多样性排序图。95%置信度。ANOSIM指标通过999次置换来评估ATB组和noATB组之间的差异。ATB个体与noATB个体的从粪便中分离出的细菌种类有显著差异。
(D).
Lefse图,基于LDA得分为每个组识别出差异物种。在这些差异物种中,如Eubacterium rectale菌在noATB粪便中富集,而其他细菌类群,如Erysipelotrichaceae bacterium_2_2_44A和Clostridium hathewayi在ATB粪便中富集。
2. 在noATB队列中,肠道菌群组成可以预测ICBs的临床结果。
利用粪便中的微生物组成的Alpha和Beta多样性结果可以对肾细胞癌患者人群中的R和NR个体进行分层,并可用于预测PFS>
12个月的患者。

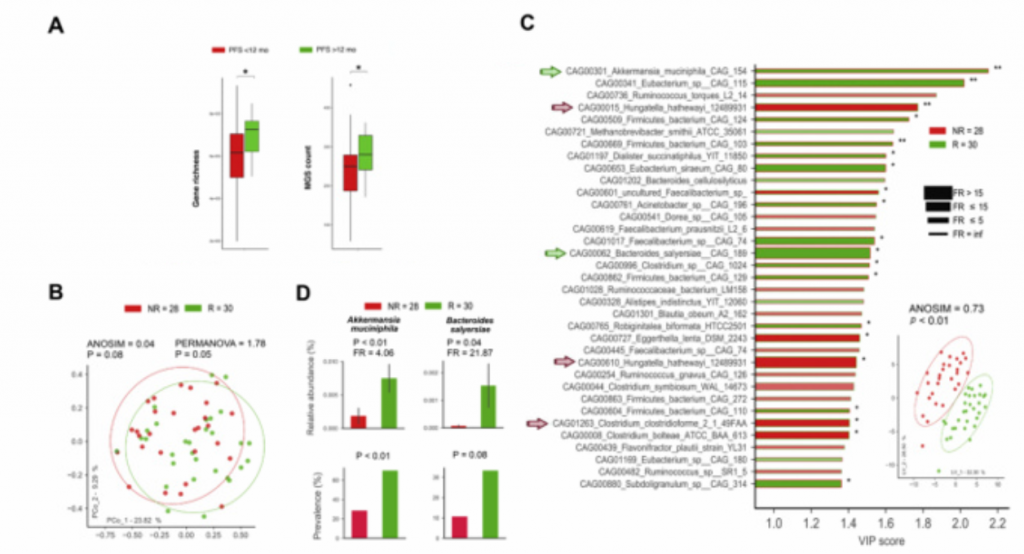
mAb:单克隆抗体;MGS:metagenomic species;SEM:标准误
(A).对noATB基线样本(n=58)中的粪便微生物使用鸟枪法测序,图中展示了PFS<12个月和PFS>12个月的所有癌症患者的基因丰富度和MGS计数。ICBS开始后12个月,丰富度计数(GC)或MGS水平与以无疾病进展为标准的临床反应相关。
(B). noATB预处理样本的PCoA分析(使用细菌流行率>=20%的阈值)的β多样性排序图。95%置信度。ANOSIM和PERMANOVA指标使用999次置换,评估R(完全缓解或部分缓解或病变稳定>6个月)和NR(死亡或疾病进展或病变稳定<6个月)之间的差异。两组间有明显的分离。
(C).使用偏最小判别分析的变量对模型的重要性图,按重要程度由大到小描述了35个组间差异物种。箭头突出重要物种。条形填充颜色表示物种平均相对丰度最高的队列,条形框颜色表示物种平均相对丰度最低的队列。条形的宽度表示FR的高低。*表示Mann-Whitney
U检验的显著性。Akkermansia muciniphila, Bacteroides
salyersiae,和 Eubacterium siraeum菌种比例过高。
(D).被选中的Akkermansiamuciniphila和Bacteroides salyersiae菌种的相对丰度和流行率条形图。在肾细胞癌患者粪便中这两种菌的流行率和相对丰度在R和NR队列中都较高。相对丰度的p值由双尾Mann-Whitney U检验得到,流行率的p值由卡方检验得出。
3.在肾细胞癌患者中,在使用nivolumab前先使用TKI和ATB药物与肠道菌群组成改变密切相关。在69个RCC队列中,R和NR的细菌比较分析,弥补了用NR-FMT在小鼠中观察到的反应性的不足,建立了粪便中有利的细菌组成与临床结果之间的因果关系。

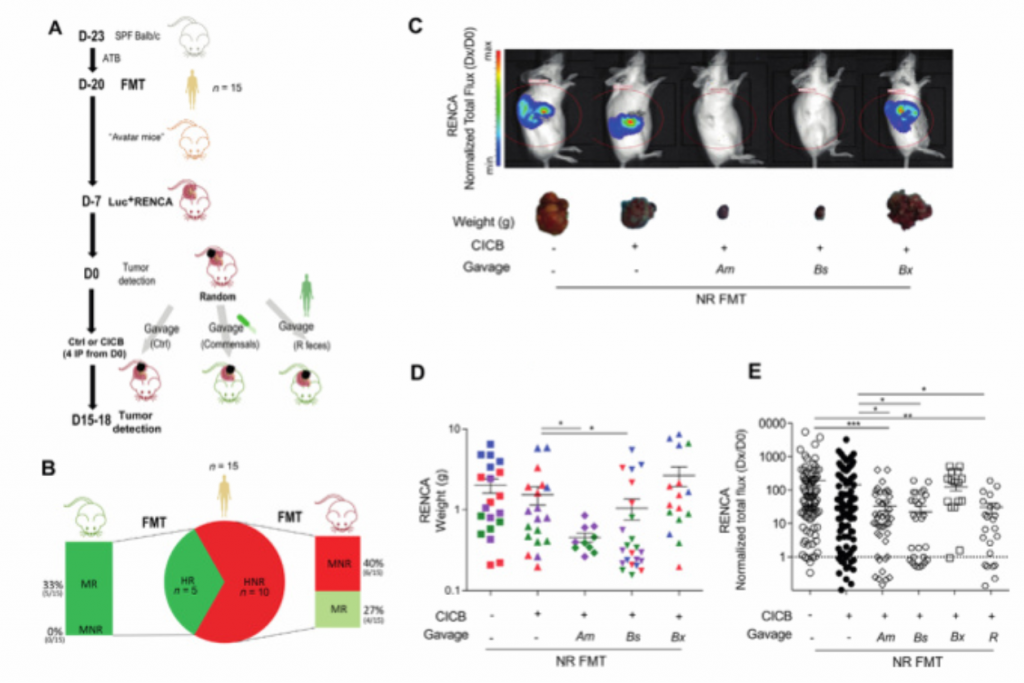
CICB:联合ICB治疗;D0:随机日期;Dx:最后一次IVIS测量;
(A). 在无特定病原体(SPF)的BALB/c小鼠体内注射ATB3天后进行粪便微生物移植(FMT)。2周后,原位接种荧光素酶工程肾癌(Luc+RencA),从第7天开始每4天腹腔接种抗PD-1+抗CTLA-4单抗(CICB)或同型对照单抗(Ctrl)。此外,在第4天,每隔3天给接受CICB的受体小鼠口服Akkermansia muciniphila菌(Am)、Bacteroides salyersiae 菌(Bs)细菌B.xylanosolvens(Bx)或应答者患者(R)的粪便。
(B). 15份FMT供体粪便的比例. (人类有肿瘤反应者[HR]和人类无肿瘤反应者[HNR])在BALB/c小鼠(小鼠有肿瘤反应者[MR]和小鼠无肿瘤反应者[MNR])。观察到患者的反应和小鼠受体对ICBS的反应之间有27%的一致性:只使用了4份高于15FMT的粪便样本。
(C)(E).使用荧光素酶活性的生物发光成像监测ATB治疗小鼠在FMT后的Renca进展。在每个ICB周期前口服具有免疫刺激作用的Am或Bs或R-FMT来补偿NR-FMT(不含Am或Bs菌),恢复了对治疗的敏感度(牺牲时的肾脏重量)且荧光亮度降低。
(C)(D).使用肿瘤重量的生物发光成像监测ATB治疗小鼠在FMT后的Renca进展。在每个ICB周期前口服具有免疫刺激作用的Am或Bs或R-FMT来补偿NR-FMT(不含Am或Bs菌),恢复了对治疗的敏感度(牺牲时的肾脏重量)。
4. TKIs诱导肠道菌群改变。TKIs诱导了显著的和典型的微生物群落改变,包括免疫刺激共生物种,可以利用这些共生物种来提高肾细胞癌患者ICBS的疗效。[if !vml]
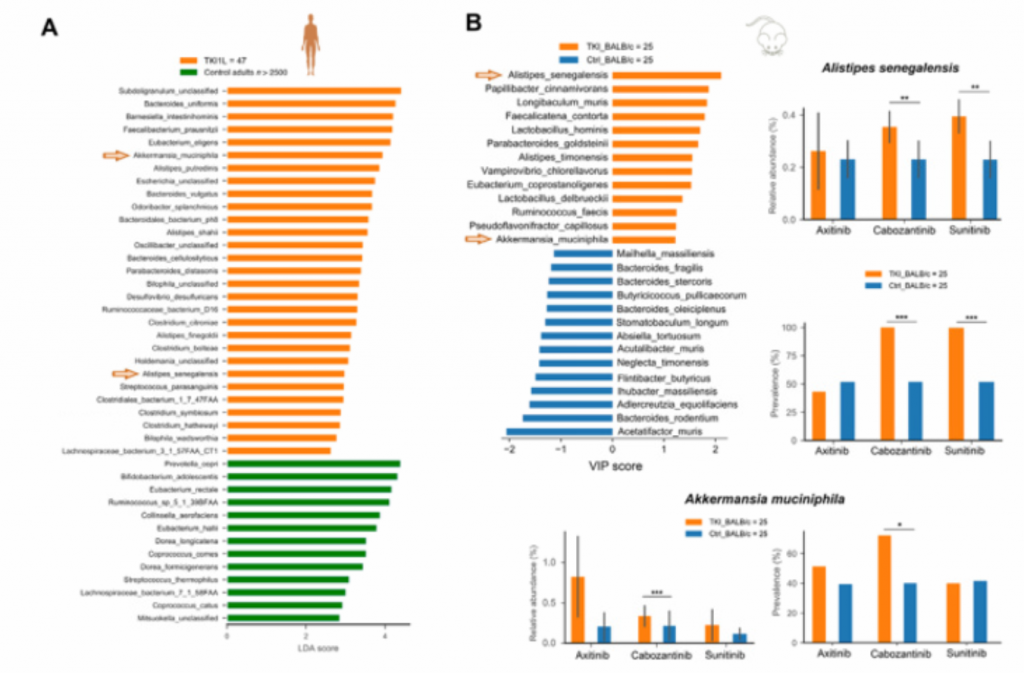

(A).接受TKI一线治疗的患者与对照成人粪便菌群的差异。按LDA分值排序的组间差异物种。观察到在TKI一线治疗组中Akkermansia muciniphila和Alistipes senegalensis富集。
(B).对接受TKI治疗(阿西替尼、舒尼替尼和卡博替尼)的BALB/c小鼠进行分析,利用偏最小二乘判别分析,差异物种按重要性从大到小排序。在BALB/c小鼠中,随着时间的推移,所有三种TKI都显著地诱导了菌群的α和β多样性的变化。
箭头表示相关的细菌种类。
柱状条形图分别描述了TKI治疗组中最具判别意义的两个菌种的相对丰度和流行率,即Akkermansia muciniphila和Alistipes senegalensis. 其中,观察到在人类和小鼠身上,Sunitinib和Cabozantinib有效的刺激了Alistipes senegalensis的丰度增长。对于三种不同的TKI(axitinib(阿西替尼)、sunitinib(舒尼替尼)和Cabozantinib(卡博替尼)),使用Mann-Whitney U检验来评估统计学差异. (*p<0.05,**p<0.01,*p<0.001)
结论
通过应用不同的生物信息学和组间差异分析手段(LEfSe, PLS-DA, VIP, and networks),研究人员确定了一组与原发耐药相关的物种(厚壁菌门,梭菌科,Clostridium clostridioforme种和Clostridium hathewayi种),并且由于使用ATB和癌症转移的状况。这些物种变得丰富。据以往的一些研究报告,Clostridium hathewayi菌种是与结肠癌诊断相关的致病因子的一部分,并且可以减轻小鼠的抗原特异性T细胞反应。
研究人员还发现了一些与预后良好和肠道稳态状态相关的共生物种,它们分别属于优杆菌科(Eubacterium
rectale和Eubacterium siraeum种),毛螺菌科(Dorea longicatena种),Verrucomicrobioaceae科(Akkermansia muciniphila种),而且都属于拟杆菌目。
结果表示微生物群的组成受TKIs和ATBs的影响,并影响免疫治疗的成功。ATB显著影响微生物群的β多样性,导致如前所述的优杆菌科家族成员(如Eubacterium rectale)的优势不突出,而有利于致病菌种(Erysipelotrichaceae bacterium_2_2_44A和Clostridium hathewayi)。这种微生物群的改变与ICB治疗期间ORR的降低有关(ATB组73%的原发耐药,noATB 33%,p<0.03)。在使用nivolumab之前使用TKI也可导致肠道菌群组成的变化,可能抑制ICB的疗效。该研究的局限性在于,比如研究的结论依赖于69名肾细胞癌患者的单一队列,其中只有11名患者服用ATBs和二线治疗,并受到许多混杂因素(既往治疗、发病和其他因素,如血红蛋白)的干扰。
展望
研究人员表示在开始治疗前对粪便的分析可能可以指导临床医生用药,以防止肾细胞癌患者对免疫治疗的原发性耐药。而更好地了解肠道菌群组成与局部、全身和肿瘤免疫系统之间的机制联系,将有助于为肾细胞癌患者的肠道菌群失调设计最佳的补充治疗方案。