 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

近年来,多重耐药病原体数量的增加以及食品安全已成为全球面临的严重问题,寻找或开发新一代抗菌药物或保存剂变得越来越重要。科学家们发现细菌产生的细菌素,能够控制临床相关的敏感菌和耐药菌,纯化的细菌素可以作为天然防腐剂或保存剂添加到食品中。细菌素可以作为抗病原体添加剂添加到动物饲料中,以保护牲畜免受病原体损害。医学上细菌素具有替代抗生素作为抗菌药物的潜力,是一种新型的抗癌药物。
本文将详细介绍细菌素相关的知识,包括:什么是细菌素、分类、生态与进化、抗病原菌以及抗病机制、食品保存和控制食物中毒发展、制药和替代抗生素潜力、益生菌特性、重塑肠道菌群以及影响健康的目标。
细菌素是一种小的、热稳定的、核糖体合成的抗菌肽,由细菌产生,对其他细菌具有活性,并且生产者对其免疫。它们在大小、结构、作用机制、抑制谱、免疫机制和靶细胞受体方面表现出相当大的多样性。
它们表现出针对产生它们的相同细菌菌株或针对密切相关物种的菌株的抗微生物活性。细菌素的合成发生在位于质粒或染色体 DNA 中的基因的控制下,这些基因同时包含生产者对产生的细菌素的抗性的遗传决定因素。
编码活性蛋白质的基因,编码蛋白质抗性的基因,负责细菌素从细胞中输出的基因,偶尔编码参与细菌素翻译后修饰酶的基因同时表达。
细菌素由革兰氏阳性菌(乳酸杆菌、乳球菌、链球菌、肠球菌、明串珠菌、片球菌和丙酸杆菌)和革兰氏阴性菌(大肠杆菌、志贺氏菌、沙雷氏菌、克雷伯菌和假单胞菌)产生。
“细菌素(Bacteriocin)”是指由任何类型的细菌产生的有毒蛋白质或肽,它对相关细菌有活性,但不会伤害生产细胞。这是描述的第一种由大肠杆菌产生的细菌素。在这种情况下,后缀cin被添加到生产物种中,例如pyocins来自Pseudomonas pyocyanea。属名也被用来命名细菌,例如klebicins(来自克雷伯氏菌),lactococcins(来自乳球菌)。尽管细菌素对细菌具有毒性,但不应将其与“毒素”(外毒素)混淆。
肠菌素是第一个被鉴定的细菌素,由发现者André Gratia 于 1925 年命名,当时他注意到一种大肠杆菌菌株产生一种有毒的可扩散物质,可杀死邻近的大肠杆菌。
从那时起,已经描述了成百上千种肽和蛋白质细菌素,它们是由革兰氏阴性和革兰氏阳性细菌制成的各种天然抗菌化合物库的一部分,以抵御竞争对手。为了与细菌素研究的起源保持一致,大肠菌素仍然是研究最多的,特别是在细菌素如何破坏细菌强大的防御机制方面。
大肠杆菌素通过多种机制杀死细胞,这些机制分为两种细胞毒性类别;酶促大肠菌素切割核酸或肽聚糖前体,而成孔大肠菌素使细胞质膜去极化。
在复杂和过度拥挤的环境中,微生物顽强地相互竞争领土和营养,因此形成了过多的防御机制。其中,细菌素被认为是目前分布最广的机制。根据定义,细菌素是原核来源的分泌的、核糖体合成的肽,具有抗菌特性。
从人类健康的角度来看,细菌素代表了一个经过 30 亿年进化磨练的潜在先导化合物库。它们的靶标范围窄、活性高、稳定性惊人且毒性低,使其成为现有小分子抗生素的可行替代品或补充品。它们使用这些强大的武器在微生物战争中茁壮成长。为了完成这个武器库,产生细菌素的菌株被赋予了有效的策略来逃避被自己的毒素杀死。大多数细菌素在皮摩尔或纳摩尔范围内具有活性,并且靶向在系统发育上与生产菌株接近的细菌物种,尽管有些细菌素表现出更广泛的活性谱。
事实上,例如,许多细菌素的活性谱很窄,对与生产者密切相关的菌株表现出抗菌活性,而其他细菌素则表现出对多种不同属的抗菌活性。细菌素生产的调节可能很复杂,在某些情况下会受到环境条件的影响,例如 pH 值、温度和生长培养基等。
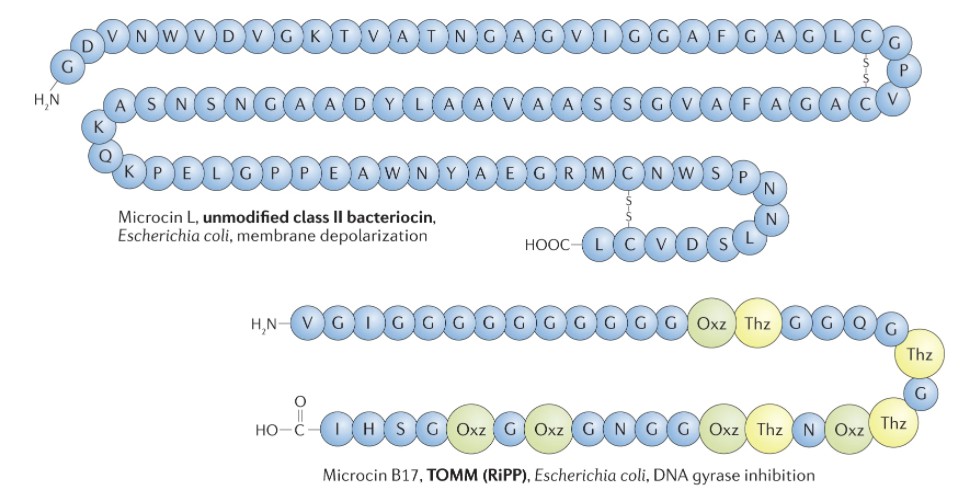
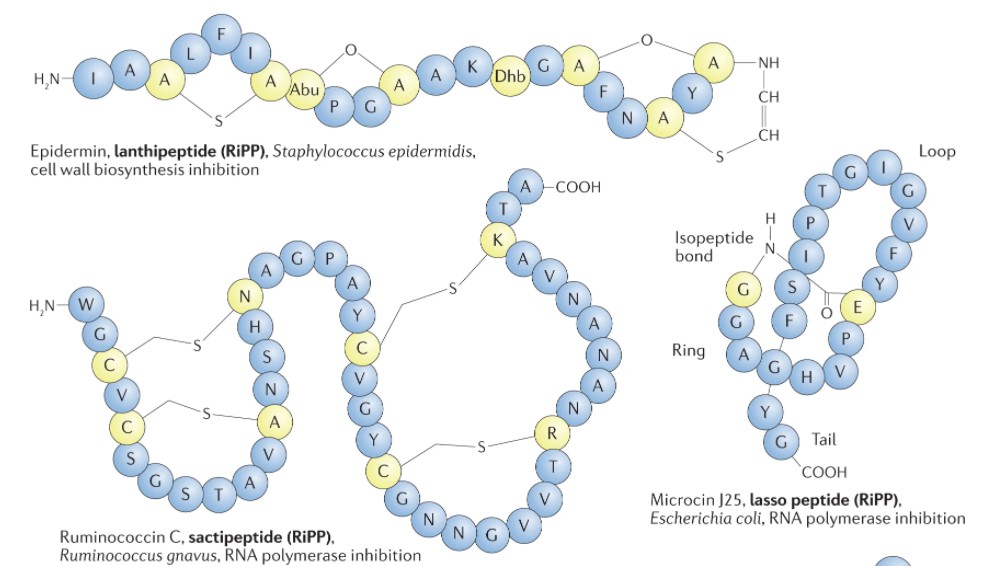
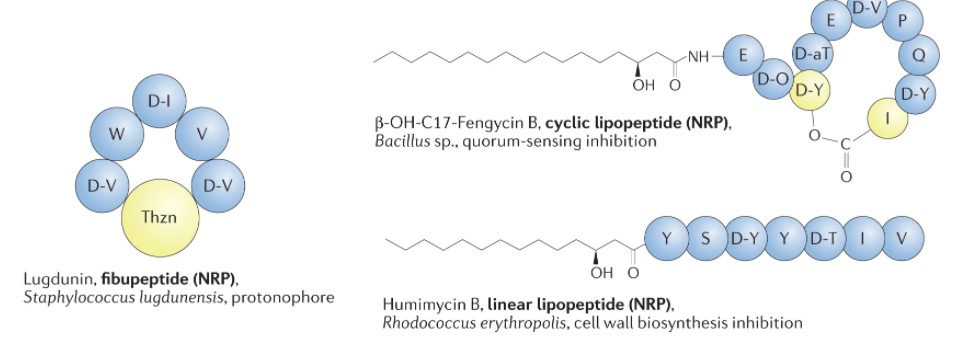
Heilbronner S, et al., Nat Rev Microbiol. 2021
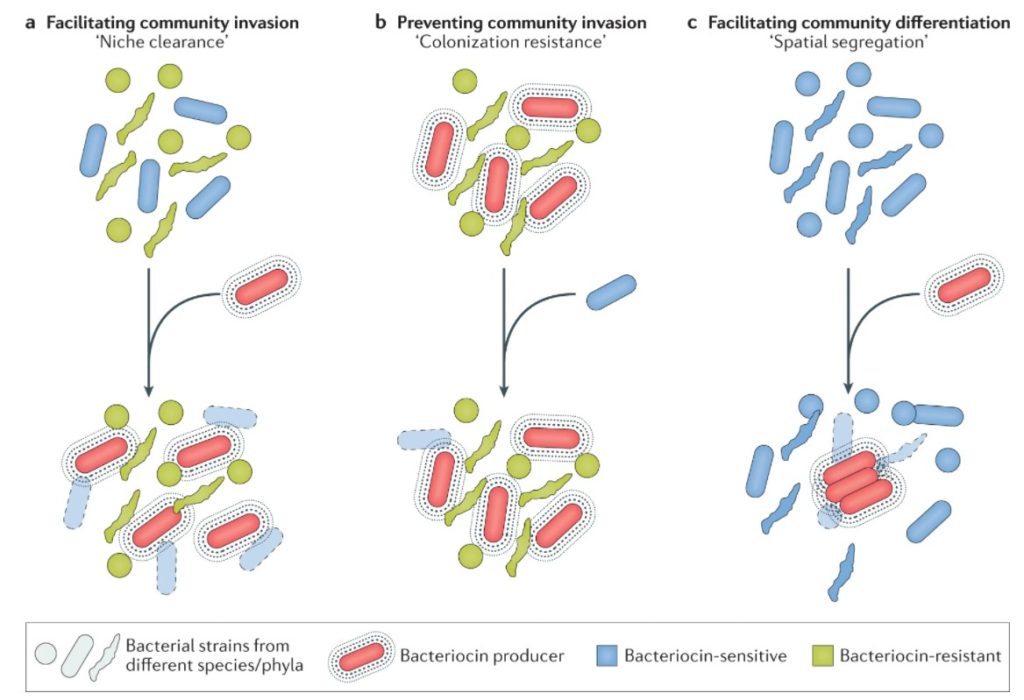
小分子细菌素的例子。
不同类别小分子细菌素代表的结构、生产者和抗菌作用方式。标准氨基酸用单字母代码表示。D-氨基酸用D前缀表示。不寻常的残基包括 2-氨基丁酸 (Abu)、2,3- 脱氢丁氨酸(Dhb)、D- allo 苏氨酸 ( D -aT)、恶唑 (Oxz)、噻唑 (Thz) 和噻唑烷 (Thzn)。NRP,非核糖体肽;RiPP,核糖体合成和翻译后修饰的肽;TOMM,噻唑/恶唑修饰的小菌素。
各种经验和理论研究表明,细菌素在介导细菌之间的种间和种内相互作用中发挥重要作用,因此在塑造细菌群落多样性方面发挥着重要作用。人们也越来越认识到,细菌素可能是传统抗生素的可行替代品,并且可能是用于预防或限制病原体形成的益生菌菌株的关键特征。
细菌素的益处取决于六个方面:谱系、稳定性、生物工程、多样性、生产和安全性。
★ 猎物谱
大多数抗生素固有的广泛宿主范围通常会对整个微生物群(皮肤、消化道、泌尿生殖道和呼吸道)产生剧烈影响,从而导致微生物群的失衡。用一个比喻,化合物就像核弹一样,让“半裸的地面”暴露在传染性细菌的定殖中。相比之下,窄谱抗菌药物类似于外科手术,专门针对来势汹汹的病原菌并限制生态系统稳态的失衡。这种特殊的治疗方法减少了对本土和平细菌的选择压力,最大限度地减少了耐药菌株/克隆的全球富集,从而减少了耐药基因对病原体的传播。
“狙击”细菌素可能被用于个性化和保护性药物/解决方案。未来可以使用这些工具动态访问微生物群组成并跟踪实时谱系再平衡。
★ 稳定
在物理化学水平上,细菌素通常比抗生素更不稳定,并且可以支持高温和极端 pH。在这方面,稳定性与细菌素的不同结构和翻译后修饰(环化、二硫键和非常规氨基酸)的水平直接相关。
另一方面,由于其肽主链,细菌素与化学抗生素相比可以对蛋白酶敏感。因此,它们在自然界和有机环境中的生物半衰期较低。这被认为是抑制耐药性出现的一种手段,因为毒素的低残留和亚致死浓度具有致突变性,有利于初始种群的逐步适应。
★ 分子适应性
合理调整或构思从头化合物以扩大抗菌武器库是一条昂贵且持久的途径,成功的机会不可预测。细菌素的遗传基础可能会减轻低通量化学方法的障碍。通过连续的随机突变筛选,细菌素集可能会在没有任何先入之见的情况下进行优化。因此,可以针对特定医学或生物技术应用的功效、稳定性、细胞毒性或光谱对肽变体进行生物加工。例如,除了稳定性、扩散和溶解度略有不同的天然乳链菌肽变体外,几项研究报告了具有调节作用的乳链菌肽 A 和 Z 的生物工程突变体。 药代动力学特性或避免杀菌抗性。
此类方法将允许探索由于内在(宿主的产生和分泌)或外在(例如外部 pH、温度和蛋白酶环境)限制而在体内反选的一系列肽序列。最后,细菌素的模块化特性用于设计嵌合双歧分子并产生双重细菌杀手。
★ 多样性
到目前为止,医疗和兽医领域可供使用的抗生素分子不到150种。根据收集数据挖掘和实验数据的 BAGEL 数据库,索引细菌素的数量增加了 800 个以上。然而,它没有考虑到单个细菌素的所有天然变异,而新的独立细菌素基因很难检测,特别是如果它们不在编码免疫、转运蛋白或修饰酶的基因附近。例如,细菌素数据库仅确定了五分之一的有效 II 类细菌素。因此,可以合理地预测,这个数字大大低估了真正的细菌素全集。
★ 低细胞毒性
一般抗生素对人类健康有副作用。相反,细菌素被认为具有低或无细胞毒性,这主要是因为受试细菌素来源于乳酸菌,长期以来被用作发酵和乳制品的生物防腐剂,而健康的人类消化道被细菌素的共生菌菌株过度定殖。例如,II 类细菌素、乳酸链球菌肽和其他羊毛肽已被证明对各种真核细胞系是细胞中性的。一些研究报告了溶细胞素等细菌素的细胞毒性作用 、小菌素 E492 或抗菌肽P40。因此,需要对将给药于人体的每种单一细菌素(或组合)的细胞毒性进行个性调查。
然而,从不同的角度来看,细胞毒性细菌素可能被用作抗肿瘤策略,因为它们优先插入癌细胞的带负电荷的细胞膜。此外,考虑到可以对基于肽的抗菌剂进行工程设计以将其细胞毒性降至最低,同时保持其杀菌作用,因此对真核细胞有毒的细菌素值得关注。
★ 生产
细菌素的产生需要维持 BGC 并将其传播给后代,表达生物合成酶,以及代谢物从初级代谢到次级代谢。最后,需要建立生产者自我抗性,这可能需要修改目标细胞机制或代谢途径。组成型细菌素表达的实验实施可以降低生产者的生长速度。
此外,细菌素(如大肠杆菌素)的释放是对一部分生产者种群诱导裂解的反应,导致生产者种群的初始大量减少,需要通过细菌素介导的对剩余生产者种群的生长益处来抵消。为了最大限度地减少这些生理成本,细菌素的生物合成通常以复杂的方式进行调节,并且通常取决于生产者细胞密度和竞争者的存在。在某些情况下,细菌素可以作为“公共产品”,不仅有利于生产者,而且有利于社区中的其他细菌素抗性细菌。因此,阻断细菌素产生同时保持抗性的调节回路或自发突变对于克隆的一部分细胞可能是有利的。只有当这种“欺骗”策略与细菌素的产生保持适当的平衡时,细菌素才能继续产生健康益处。
到目前为止,生产商业细菌素的典型方法是从天然生产菌株中分批发酵。当前化学合成方面的进展,为高水平生产基于细菌素的抗微生物化合物扫清了道路,符合临床安全要求(良好生产规范)。尽管从严格定义的角度来看,它们不能被视为细菌素,因为它们不是由核糖体产生的,但 C 端到 N 端的体外组装能够产生生物活性分子。毫无疑问,主要优势是设计具有侧链修饰(例如,交联剂)或包含外来或 D 型氨基酸的肽模拟物,以优化稳定性和/或蛋白水解不敏感。同样,在这种情况下,小的未修饰细菌素(II 类)特别合适。可以低产率合成几种糖基化或环状(头对尾或二硫键桥接)细菌素。
★ 细菌素分类
细菌素可以根据它们的生化和遗传特征或二硫键或单硫键的存在、分子量、热稳定性、蛋白水解酶稳定性、氨基酸翻译后修饰的存在与否以及抗菌作用进行排序。
▪ I 类细菌素
I 类细菌素是小肽/羊毛硫抗生素(<5 kDa,19-37 个氨基酸),其一级结构中含有不寻常的羊毛硫氨酸和甲基羊毛硫氨酸。已知近 60 种羊毛硫抗生素,其中 30%从乳酸菌中纯化。这些细菌素是翻译后修饰的热稳定肽,通常通过靶向病原体(尤其是革兰氏阳性菌)细胞壁的骨架起作用。
亚类 Ia 细菌素
这些肽是带正电荷的细长细菌素,可通过孔形成杀死细菌。原型抗生素乳酸链球菌肽是该组的成员。
亚类 Ib 细菌素
这些细菌素,包括乳酸菌素 481、溶细胞素和唾液酸素,特征是球状、不灵活、带负电荷或不带净电荷。它们抑制易感细菌生命维持过程所需的各种催化酶。
▪ Ⅱ类细菌素
II 类细菌素是热稳定的、小 (<10 kDa)、非羊毛硫抗生素或未修饰或类似片碱的抗生素,等电点(pI)从 8.3 到 10.0 不等,其特征是存在亲水性 N 末端共有序列 Tyr-Gly-Asn-Gly-Val-Xaa-Cys [YGNGV(X)C(X)4C(X)V(X)4A],由 ATP 结合盒(ABC) 转运系统。
除了氧化环境中的二硫键形成和氨基末端前导肽的裂解外,几种细菌素不进行翻译后修饰。这种具有二硫键的未修饰细菌素包括,例如,肠杆菌小菌素 L、V 和S,产自乳酸片球菌的片菌素 PA-1和产自由拟杆菌属物种产生的拟杆菌素。
IIa 类细菌素
The antilisterial bacteriocins(抗李斯特菌细菌素)归入这一类。本组代表性细菌素有白细胞素A、酸菌素A、肠系膜菌素、片菌素PA-1和sakacin P。
IIb 类细菌素
IIb 类细菌素(双肽细菌素)需要至少两种不同的肽才能发挥活性,因此通常具有协同作用。这些肽在单独测试时几乎没有或没有活性,例如乳球菌素G 和植物素。
IIc 类细菌素
这些是小的、热稳定的肽,由先导肽携带,并进一步分为两类,即硫生物和胱氨酸。巯基生物是含有两个半胱氨酸残基的细菌素,而含有一个半胱氨酸残基的细菌素是半胱氨酸抑制剂。乳球菌素A、发霉素A和酸霉素B是IIc类细菌素。
▪ 第三类细菌素
除III类细菌素含量较大(>30 kDa)肽,例如zoocin A、溶葡萄球菌酶、helveticin J 和helveticin V。这些细菌素分为不耐热溶性细菌素和不耐热非溶性细菌素。裂解细菌素通常是以酶的方式裂解细菌细胞壁的内肽酶肽。
溶性细菌素外,还发现了一些不具有溶性作用模式的不耐热高分子量细菌素,例如,来自瑞士乳杆菌481的helveticin J,来自停乳链球菌亚种(Streptococcus dysgalactiae )的失乳链球菌。
▪ IV类或复合细菌素或环状细菌素
这些含有脂质或碳水化合物部分的复合细菌素对糖酵解或脂解酶敏感,例如植物素 S 和亮白星菌素 S。最近,由乳房链球菌(Streptococcus uberis)分泌的一种新型环状细菌素样物质 uberolysin。
有许多细菌素表现出广谱抗菌活性。与广谱抗生素一样,这是一个有吸引力的特性,因为它允许针对未知病因的感染。然而,广谱抗生素会破坏共生的人类微生物群,因此在特定情况下使用窄谱抗生素的价值受到重视。
艰难梭菌相关性腹泻 (CDAD) 是这种情况的一个特别合适的例子,因为在这种情况下,该疾病通常由可以调节常驻肠道微生物群的抗生素引起并用抗生素治疗。艰难梭菌可以竞争性地受益于抗生素诱导的微生物群破坏,然后可以在这种改变的环境中蓬勃发展。艰难梭菌随后的生长和毒素产生导致 CDAD,这需要进一步的抗生素治疗。这可以解决严重的问题,但也可能导致共生种群的进一步破坏,并且这种疾病经常复发。筛选肠道中靶向艰难梭菌的窄谱细菌素导致发现了由苏云金芽孢杆菌产生的 sactibiotic thuricin CD。在人类远端结肠模型中,发现 Thuricin CD 表现出与抗生素万古霉素和甲硝唑(这两种药物在临床上均用于治疗 CDAD)的活性相当的抗菌活性。然而,重要的是,thuricin CD 并没有显着改变共生微生物群的组成,而万古霉素和甲硝唑都以牺牲其他菌门的生物为代价,如使变形菌门生物的丰度显著增加。
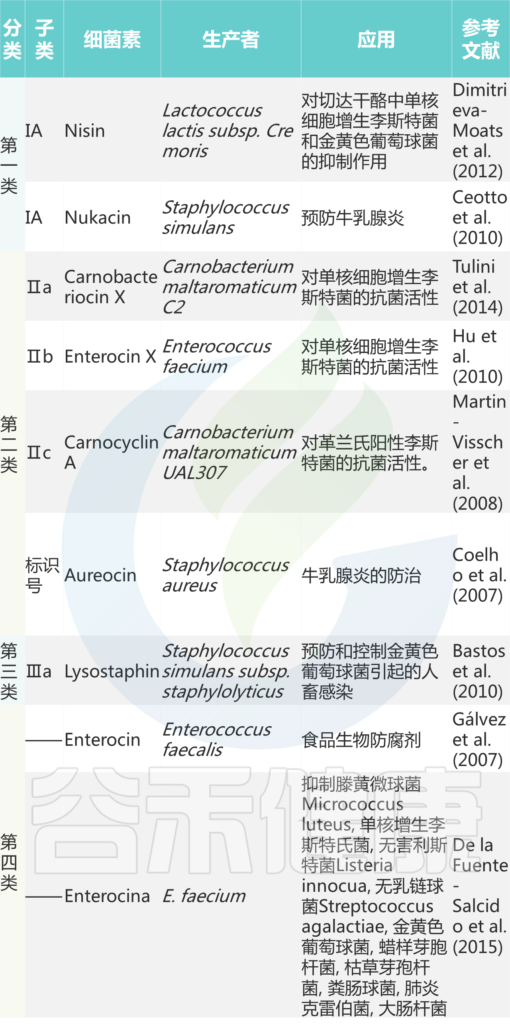
细菌素的产生可以被认为是一种塑造微生物群的适应性特征,它可以促进或阻止新细菌菌株对微生物群落的入侵。一方面,一些产细菌素菌株能够入侵以细菌素敏感菌株为主的生态系统。‘社区居民’生产的细菌素可以防止新的细菌素敏感菌株或物种对生态系统的入侵。这种现象得到越来越多的研究,因为它可以促进对病原体定植的抵抗力。
细菌相互作用的特点不仅是对抗性的,而且是互惠性的,这需要在社区凝聚力和功能方面对这两类特征进行微妙的平衡。缺乏对细菌素如何整合到这种多因素网络中的清晰理解。当前的宏基因组分析策略也不了解群落内菌株的空间分布。特别是在固体表面上,细菌素的产生可以产生菌株的空间分离。此外,细菌素的产生通常可能是一种瞬时性状,可以由细菌菌株通过 BGC 的 HGT 自发获得,并且可以通过生物合成基因的缺失而丧失。
Heilbronner S, et al., Nat Rev Microbiol. 2021
细菌素的产生可以促进或阻止新细菌菌株对细菌群落的入侵,或者可以导致微生物组成员重新分布到亚生境中。a| 细菌素的产生可以允许入侵的细菌菌株清除常驻细菌素敏感社区成员的生态位。b| 居民社区成员产生的细菌素可以防止细菌素易感入侵者(例如耐抗生素的细菌病原体)定植。c| 如果细菌素敏感细菌与细菌素生产者在空间上隔离,则它们不一定从细菌群落中消除。
宏基因组分析提供了广泛的证据,表明细菌素 BGC 在人类相关微生物组中无处不在。许多产生 I 类、II 类或其他类型细菌素的细菌素 BGC 与可移动的遗传元件有关,例如质粒、转座子和整合和接合元件,或 GC 含量与基因组平均值不同的基因组岛。HGT 很容易发生在人类微生物组的物种。事实上,编码羊毛脂肽的接合质粒在定植于人类口腔的唾液链球菌菌株之间转移和硫肽 BGC 最有可能在特定身体部位的微生物组成员之间移动。
此外,噬菌体介导的细菌素编码岛 HGT 已在葡萄球菌物种和霍乱弧菌中得到证实,结构相似的细菌素经常在不同的细菌物种中发现,甚至在系统发育较远的细菌中,都表明细菌素 BGC 经历 HGT。
细菌素 BGC 的 HGT 很可能是一个频繁的过程,对菌株的竞争适应性有重大影响。同时,移动细菌素 BGC 通常仅在给定细菌物种的少数分离株中发现,这意味着细菌素生产不是确保谱系成功的通用手段,而是代表对确定的微生物群落和空间栖息地内的需求的适应。细菌素的获得和合成很可能是喜忧参半,有几个因素会影响细菌素 BGC 受体在给定环境中的成功持久性或丢失。
人们普遍认为,细菌素生产是取代竞争对手的一种手段。在混合的社区,细菌竞争养分的限制,诸如痕量金属和碳,氮,氢,磷和硫源。这种代谢竞争在具有相似代谢需求的微生物之间尤其激烈。此外,微生物竞争空间,并在体表上竞争粘附位点(例如人类基质分子或上皮细胞上的受体)以避免清除。病原体粘附到不同身体部位的上皮表面受体的机制已在研究中描述。然而,尚不清楚非致病性共生体是否使用与病原体相似的粘附机制和相同的配体,这表明空间重叠和相关竞争。此外,α-多样性在不同的身体部位的微生物组的(一个栖息地或区域内平均物种多样性)人类个体之间变化,这表明主要的竞争性状相应地不同,并且需要抗菌化合物的适当的目标谱。
此外,基于细菌素的竞争者杀死导致细胞内容物从目标中释放;例如,细菌表达有利于获取DNA的靶物种转化感受肺炎链球菌和霍乱弧菌。还可以从裂解的靶细胞中获得必需的营养物质;例如,Dolosigranulum pigrum 的丰度显著减少,对多种氨基酸和维生素具有营养缺陷,但编码多种细菌素 BGC,这使得人们很容易推测这些细菌素可以作为一种从共同定殖物种中释放必需营养素的手段。
许多其他小分子细菌素的目标范围更广,针对不同生态位内不同门的竞争者,而不是密切相关的物种。在鼻腔内,葡萄球菌分离株产生针对厚壁菌门以及来自其他门的共生物种的抗菌化合物,例如放线菌和变形菌。在人体皮肤上,硫肽表皮霉素由毛囊内的痤疮丙酸杆菌(放线菌门)产生,并靶向厚壁菌门,同时保留放线菌。在阴道微生物组中,乳酸杆菌属,产生针对不同门的病原体的细菌素。 在人类肠道中,已经描述了几种细菌素的跨门活动,例如由肠球菌、Blautia和乳酸杆菌属产生的。
对细菌素 BGC 的获得如何影响其特定社区内谱系的成功缺乏深入的了解。然而,考虑到上述因素,社区组成和细菌素目标范围必须决定社区内生产者的成功。当生产者依赖共生共生体时,狭窄的目标范围很可能优于广泛的目标范围,而共生体需要免受细菌素的影响,而主要竞争来自代谢相似的物种。相比之下,当竞争源于空间而不是生态位内的代谢重叠时,或者当需要从竞争者中释放必需营养素时,针对不同菌门的活动可能是有利的。
关于可能使宿主易患特定炎症、代谢或恶性疾病或侵入性细菌感染的细菌物种定植抗性的机制才刚刚开始阐明。这种特性对于对抗细菌非常有帮助,这些细菌可以在人类微生物组中的共生体和致病性生活方式之间转换,后者涉及在其他无菌宿主组织中的入侵和繁殖。
当这些兼性病原体对一些最有效的抗生素具有抗性时,它们就代表了一种特殊的威胁。微生物组衍生的耐抗生素细菌病原体包括耐万古霉素粪肠球菌和粪肠球菌(万古霉素耐药)、耐甲氧西林金黄色葡萄球菌、超广谱 β-内酰胺酶和产碳青霉烯酶的变形菌,以及固有的抗生素耐药性艰难梭菌。值得注意的是,这些病原体中的大多数都不是人类微生物组核心分类群的成员。它们的丰度因人而异,并且可能随着时间的推移而变化,这可能是由于共生体的存在或不存在提供抵抗病原体定植的结果,这对感染的风险有重大影响。识别和利用这种有益的共生体及其细菌素可以帮助制定迫切需要的预防策略,以对抗难以治疗的细菌感染。
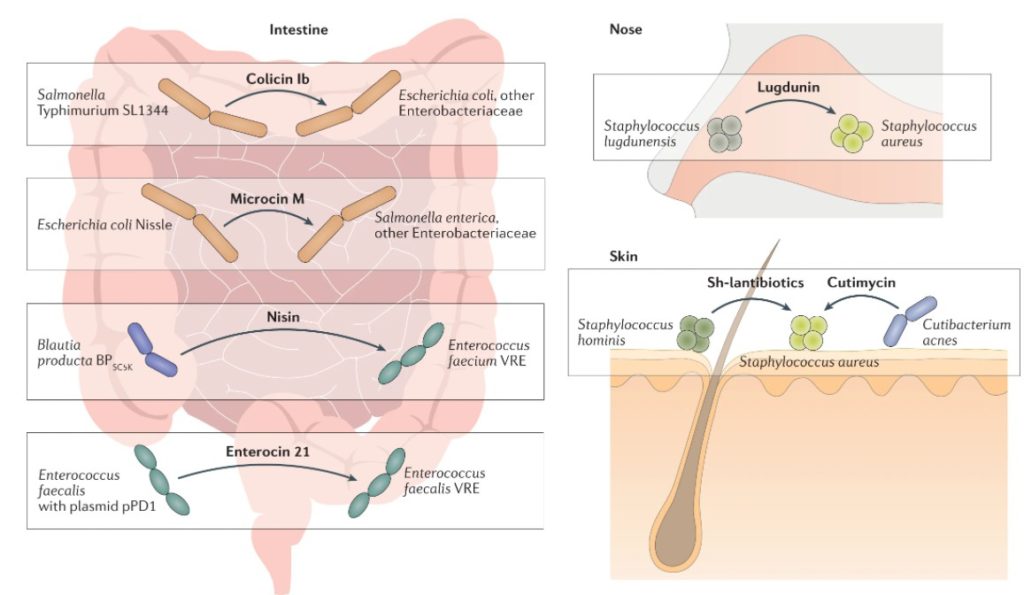
最近的一些例子证明了产生细菌素的共生细菌如何从体内微生物群落中取代病原体。大肠菌素 Ib 和小菌素 M 或 H47 的产生可以分别从肠道微生物组中消除致病性大肠杆菌和鼠伤寒沙门氏菌,而肠菌素和乳酸链球菌素 A 变体可防止肠道中万古霉素耐药菌的扩大。
产生 Lugdunin 的S. lugdunensis在鼻微生物群中胜过金黄色葡萄球菌,并且凝固酶阴性葡萄球菌分泌一组特殊的抗菌肽(Sh- lantibiotics),消除特应性皮炎患者皮肤中的金黄色葡萄球菌。
以nisin A和Sh- lantibiotics为例,将该细菌作为益生菌治疗应用足以有效排除病原体。虽然细菌素生产者通常只在一些人类相关的微生物群中发现,但其中一些似乎足够普遍以限制兼性病原体的携带。乳酸链球菌肽 A、lugdunin 和 Sh-lantibiotics 的生产者对人类微生物群的定殖可能足够频繁,可以部分解释为什么许多人不是或很少是万古霉素耐药菌或金黄色葡萄球菌的携带者。
许多塑造微生物群的细菌素仅影响一小群微生物群,对α-多样性的影响有限,这可能是由于活性谱窄或生产者空间隔离的结果。因此,细菌素生产者根除病原体的风险低于常规广谱抗生素的根除风险,后者对微生物组(包括有益细菌)造成广泛损害,并促进耐抗生素定植病原体的扩张。 有趣的是,一些细菌素的表达受到严格调控,只允许它们在特定条件下产生,从而进一步降低产生抗性的选择压力。例如,铁载体 RiPP microcins M 和 H47 仅在铁可用性差的条件下表达,这发生在肠道炎症期间,并使微生物组成员面临更高的竞争压力。因此,这些小霉素的生产商仅在患有肠道炎症的小鼠中根除肠道病原体。
痤疮丙酸杆菌产生的硫肽表皮霉素减少金黄色葡萄球菌毛囊中的丰度,并且表皮霉素的表达在金黄色葡萄球菌存在下上调,但仅在共生物种纹状体棒状杆菌存在下下调。
从微生物组中排除兼性病原体也可能涉及宿主抗菌因子,这些因子通常是在病原体入侵时释放出来的。这些因素包括,例如,病原体特异性分泌型 IgA 抗体和抗微生物宿主防御肽,例如防御素。有趣的是,一些细菌素结合了抗菌和免疫调节能力,促进了免疫反应的诱导。例如,lugdunin 诱导皮肤细胞中抗菌肽的产生,这些肽与 lugdunin 协同作用以根除金黄色葡萄球菌。
铜绿假单胞菌是一种发生在泌尿道、皮肤、眼睛、耳朵和肺部的革兰氏阴性条件致病菌,与危及生命的医院获得性和社区获得性感染有关。尽管抗生素通常用于对抗铜绿假单胞菌感染,但面对日益增加的假单胞菌抗生素耐药性,它们越来越无效。最近的研究集中在铜绿假单胞菌产生的蛋白质细菌毒素绿脓杆菌作为治疗铜绿假单胞菌的新型抗生素的潜力感染。与细菌素家族的其他成员一样,化脓菌素主要杀死密切相关的物种。
Pyocins 目前分为三大类:S 型蛋白酶敏感性 pyocins,在大小和作用方式上与大肠杆菌的大肠杆菌素相似,以及 R 和 F 型蛋白酶抗性 pyocins,类似于噬菌体尾部。
链球菌属是最多样化的细菌属中的一个,目前包括70个限定物种栖息各种各样生态的栖息地。某些物种用于生产食品,但大多数是人类和其他动物的共生殖民者或病原体。许多是细菌素的生产者,尤其是羊毛硫抗生素类;舌栖性唾液链球菌是产细菌素最多的物种之一。一些唾液链球菌菌株含有特别大 (>100 kb) 的巨质粒。这些特性,连同其极低的致病潜力,有利于唾液链球菌作为口服益生菌的来源,以治疗由其他链球菌引起的人类感染,包括咽炎(化脓性链球菌)和龋齿(变形链球菌)。
★ 细菌素的抗菌机制
Heilbronner S, et al., Nat Rev Microbiol. 2021
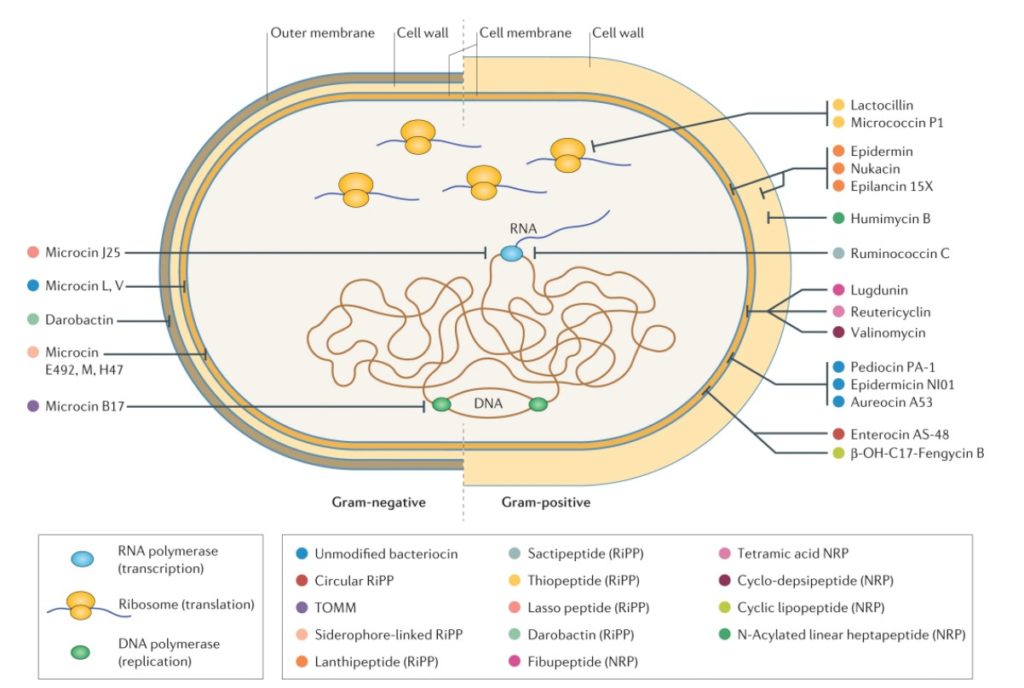
小分子细菌素通过各种机制抑制革兰氏阴性(左)或革兰氏阳性(右)细菌.
例如抑制细胞壁生物合成(例如,羊毛脂肽和腐殖霉素 B)、转录(例如,某些糖肽和套索肽) )、翻译(例如,硫肽)、DNA 复制(例如,噻唑/恶唑修饰的小菌素 (TOMM) 小菌素 B17)和外膜生物发生(例如,darobactin),以及细胞膜的破坏(例如,羊毛脂肽) 、lugdunin 和环状细菌素)。NRP,非核糖体肽;RiPP,核糖体合成和翻译后修饰的肽。
已证明在体内对病原菌定植的抗性包括成孔细菌素大肠菌素 Ib、环状细菌素肠菌素、铁载体模拟细菌素小菌素 M、羊毛脂肽乳酸链球菌素 A、丝氨酸硫辛肽和羊毛硫肽Sh-羊毛硫抗生素α和β。
细菌感染,其中许多始于微生物群落定植病原体,每年在全世界造成数百万人死亡,是导致死亡的主要原因之一。迫切需要新的抗生素,并且由于一些微生物组来源的细菌素与经典抗生素具有相同的特性,因此它们可能适合开发具有相对广泛活性谱的新型抗菌药物。此外,有针对性的去定植或防止病原体定植微生物群对减少需要全身抗生素干预的严重感染的数量很有吸引力。然而,调节和恢复受干扰的微生物群落和排除抗生素耐药定植病原体的能力目前仅限于最严厉的策略,主要依赖于广谱抗生素。
此外,市售的肽抗生素具有相对较广的活性谱,几十年前就选择了这一属性以允许对感染进行经验性治疗。随着快速诊断的进步,我们应该能够在未来更有选择性地进行治疗,而微生物组对整体健康的重要作用需要更精确的干预措施以保持其完整性。各种窄谱细菌素是已知的,可以排除特定病原体并避免共生共生体。
★ 病原体靶向细菌素的作用
Heilbronner S, et al., Nat Rev Microbiol. 2021
细菌素的临床潜力受到三个主要问题的限制:
(i) 相对于常规抗生素而言,它们的杀灭活性范围很窄
(ii) 这些蛋白质不太可能到达大多数细菌感染部位或在其发挥作用的概念
(iii) 蛋白质抗微生物剂的假定抗原性和随后的毒性
对形成通道的细菌素的代表大肠菌素 Ia 的研究表明,这些看似无法克服的障碍实际上不再具有相关性。细菌素对人类或动物组织没有毒性,它们的存在似乎不会诱导免疫反应,并且在体内表现出高在测试的所有动物组织中的活性,包括循环系统。
一些最近发现的,可能是一些众所周知的细菌素有潜力作为治疗和预防细菌感染的新型窄谱抗生素,以应对抗生素耐药性增加和抗生素开发管道枯竭的紧迫威胁。微生物组衍生的细菌素已进化为对体表有效,因此在其自然部位使用它们可能是有利的。
此外,已知细菌素具有免疫刺激活性并与宿主产生的抗微生物分子协同作用。如果某些细菌素仅用于局部干预(包括在肠道和肺中),那么过去使它们对全身治疗应用不那么有吸引力的某些细菌素的局限性(例如较差的药代动力学或全身毒性)是无关紧要的。表面上可以容忍没有单一明确定义的目标的混杂抗菌活性,甚至可能有利于延缓耐药性的发展。应加大努力,利用细菌素在体表自然环境中的潜力,帮助预防感染。
除了纯化细菌素的治疗潜力外,具有排除特定定植病原体能力的共生细菌可以发展成精密益生菌,作为一种强大且可持续的感染预防策略。甚至可以对细菌共生体进行设计,以优化它们在微生物组中的持久性并产生清除病原体的细菌素。
细菌素通过靶向不良成分来调节肠道微生物群而不会对有益菌群产生负面影响的能力是一个吸引人的特点。一项研究对细菌素调节肠球菌之间或肠球菌与肠道微生物群之间的生态位竞争的作用进行了研究。研究表明,含有表达细菌素的接合pPD1质粒的粪肠球菌既取代了本土肠球菌,又超过了缺乏该质粒的粪肠球菌,而将该质粒转移到其他粪肠球菌菌株可提高其在肠道中的存活率。最后,万古霉素耐药肠球菌在随后与含有接合缺陷pPD1突变体的粪肠球菌进行定植后被清除。这些结果确实表明,共生细菌产生细菌素有助于生态位竞争,而消除多重耐药细菌肠道定植的另一种治疗方法可能是由共生细菌提供细菌素。
为了延长保质期,将抗生素或食品防腐剂(例如亚硝酸盐和二氧化硫)加入食品中以延缓微生物生长和可能的腐败。然而,大多数商业防腐剂是通过化学合成开发的,长期食用合成防腐剂可能对人体产生不利影响。此外,在食品中使用抗生素是违法的。由于细菌素对某些蛋白酶的敏感性,无害的细菌素可能被消化,因此,无功能的小肽和氨基酸是在胃肠道中消化的富含细菌素的食物。因此,细菌素被胃肠系统摄入后,被认为是基本安全的食品添加剂,因此许多国家都在尝试使用细菌素来保存食品。
遗憾的是,大部分细菌素活性范围非常有限,单独使用细菌素既不能保护食品,也不能保护消费者。已经研究了几种产细菌培养物和细菌素在各种食品材料中的用途;尽管缺乏普遍接受度,但食品中只允许使用乳酸链球菌肽。乳酸菌 (LAB) 在大多数食品发酵中发挥着重要作用,并且在乳制品、肉类、蔬菜和烘焙产品的制造中经常使用多种菌株作为发酵剂。与原始底物相比,这些微生物最重要的贡献之一是发酵产品的保质期延长。由于营养竞争和发酵剂衍生抑制剂的存在,如乳酸、过氧化氢和细菌素,这些食物中腐败菌和致病菌的生长受到抑制。
在许多细菌素中,乳酸链球菌素是唯一一种在许多国家广泛用作食品防腐剂的纯化细菌素。Nisin 是一种分子量为 3500 Da的多肽,含有稀有氨基酸(羊毛硫氨酸、3-甲基羊毛硫氨酸、脱氢丙氨酸和脱氢丁氨酸)。乳链菌肽作为食品防腐剂具有多项优势,因为它无毒、易于被消化酶降解、耐热且不会产生异味和异味。
在细菌细胞壁的形成过程中,乳链菌肽最初与脂质前体分子形成复合物。然后,乳链菌肽-脂质复合物-II 将自身插入必需细胞成分的细胞质渗出液中,导致细菌被抑制或死亡。革兰氏阴性细菌是乳链菌肽抗性,因为它们的外膜,其使细胞壁比那些革兰氏阳性菌远不易渗透。
LAB 产生的细菌素的主要类别包括:
1. 羊毛硫抗生素
2. 小的热稳定肽
3. 大的热不稳定蛋白质
4. 其活性需要碳水化合物或脂质部分结合的复合蛋白质。
然而,值得注意的是,这些物质的抑制活性仅限于革兰氏阳性菌,这些细菌素对革兰氏阴性菌的抑制作用尚未得到证实,可以通过对革兰氏阳性和革兰氏阴性细菌细胞壁的组成进行详细分析和比较来解释的观察结果。在这两种类型中,形成细胞质和外部环境之间边界的细胞质膜被一层肽聚糖包围,该层在革兰氏阴性菌中比在革兰氏阳性菌中明显薄。革兰氏阴性菌有一个额外的层,即所谓的外膜,由磷脂、蛋白质和脂多糖 (LPS) 组成,该膜对大多数分子是不可渗透的。然而,该层中孔蛋白的存在将允许分子量低于 600 Da 的分子自由扩散。乳酸菌产生的最小细菌素大约为 3000Da,因此太大而无法到达它们的目标细胞质膜。
已观察到许多细菌素在酸性 pH 值、较高温度或较低温度(对冷藏食品很重要)下更稳定和有效。细菌素作为杀菌屏障,有助于降低污染细菌的水平,同时采取生物抑制措施,如气调包装或者减少用水可以阻止剩余菌群的增长。它们也可以与其他抗菌因子结合使用。动物源性蛋白质溶菌酶可溶解许多革兰氏阳性细胞,并用于防止某些奶酪中产生气体。溶菌酶和乳链菌肽可以协同作用灭活单核细胞增生李斯特菌的细胞。螯合剂的作用也可以增强细菌素的活性。植物来源的抗微生物剂,其中一些已经在使用,例如苯甲酸、山梨酸、乙酸和柠檬酸,以及酚类化合物和精油例如大蒜中的那些,可用于食品保鲜,但缺点是食品可能不被认为是“天然”的,或者抑制所需的水平可能会给食品带来太浓的味道。
细菌素可以替代或允许较低水平的此类抑制剂。一些细菌素(例如乳酸菌素 S)的杀灭速度比其他的要慢得多。将速效和缓慢作用的细菌素结合在食物中可能会使其“安全”更长时间。或者,可以将细菌素用作与快速检测方法相结合的补救措施,以去除污染,例如在酿造过程中。细菌素的未来不在于发现或设计完美的细菌素适用于所有应用程序;相反,为特定任务想象特定的细菌素更为实际。由于其相对较大的分子量,细菌素可被认为是有限的大分子抑制剂群体,因此灭活靶细胞所需的相对量可能取决于可能存在的细胞群体。这个和其他已经讨论过的限制细菌素对食物的有效性的因素说明不能单独依赖细菌素来确保特定食物的安全。
抗菌素/细菌素的产生可能通过三种不同的机制促进益生菌功能:
首先,作为定植肽,细菌素有助于肠道环境中生产菌株的存活;
其次,细菌素通过直接抑制病原体的生长发挥作用;最后,细菌素可以作为肠道环境中的信号肽/群体感应分子。
然而,虽然细菌素的产生通常被认为是一种益生菌特性,但可以说,与其他特性相比,它通常被认为是一种理想的特性,而不是关键的益生菌特性。比如,细菌素的产生是双歧杆菌中的一种罕见特征此,因此,这些肽对肠道健康以及其他应用的真正潜力尚未实现。
细菌素,从发现到潜在的益生菌应用。
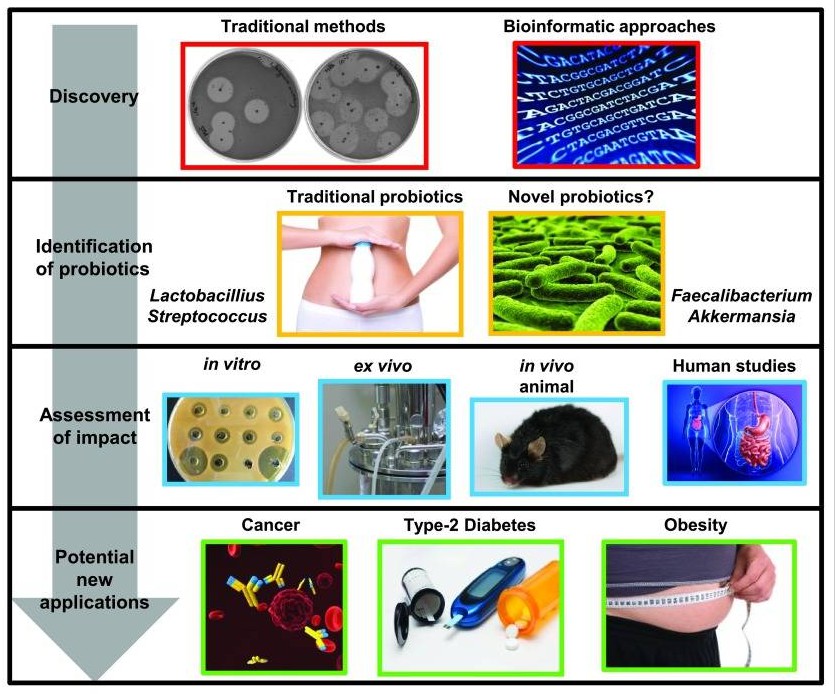
Hegarty JW, et al, F1000Res. 2016
识别新细菌素的策略包括基于培养的方法和更新的基于生物信息学的方法。这些可以导致从传统使用的或新的益生菌物种中鉴定出产细菌素的菌株。可以使用体外、 离体和体内方法评估产细菌素菌株对健康的影响 ,并且 根据结果,有可能用于预防或治疗各种疾病状态。
★ 双歧杆菌
在双歧杆菌的情况下,只有少数菌株已被证明产生细菌素:双歧杆菌NCFB1454 产生双歧杆菌素 B。最近,已经描述了一种双歧杆菌菌株,嗜热双歧杆菌RBL67,它能够产生细菌素样抑制物质或“羊毛硫抗生素” ,再次强调了该属中生产的稀有性。其他益生菌包括链球菌属、 乳球菌属、肠球菌属以及大肠杆菌菌株 Nissle 1917 和酵母菌,例如 布拉氏酵母菌。
★ 乳酸菌
细菌素产生促进乳酸菌属益生菌功能的机制一直是许多研究的焦点。 据报道,植物素生产和运输所需的基因有助于植物乳杆菌 WCFS1 对外周血单核细胞的免疫调节作用。使用相同的植物乳杆菌菌株, 另外一项研究确定调节树突状细胞细胞因子反应的 8 个基因中有 6 个参与细菌素的产生或分泌。
已鉴定出许多具有益生菌特性的唾液乳杆菌菌株,该属还与许多II类(a、b和d)细菌素的产生有关。尽管潜在益生菌菌株产生的细菌素作为靶向临床相关病原体的替代治疗具有重大前景,但它们在胃肠道内恶劣条件下的表达程度尚未得到详细研究。出于同样的原因,尚未制定策略来确保在这种环境中触发细菌素的产生。仅确定由唾液乳杆菌菌株产生的某些细菌素确实可以在肠道中遇到的许多压力条件下产生。唾液链球菌UCC118(NCIMB 40829 LSUCC118)是一种特征非常明确的菌株,已针对潜在的益生菌应用进行了研究,并显著产生II类双肽细菌素Abp118。
Abp118对许多食源性和医学上重要的病原体具有相对广泛的抗菌活性。这种益生菌菌株在一项重要的“概念验证”研究中得到了特别关注,该研究证明细菌素的产生确实是一种益生菌特性,因为它能够保护小鼠免受李斯特菌感染。研究使用该菌株和一种非细菌素产生的等效物来测试它们在饮食诱导肥胖(DIO)小鼠模型中减轻与肥胖相关的代谢异常的相对能力,并调节肠道微生物群作为这些异常的潜在驱动因素。
尽管接受细菌素产生菌株的动物体重增加明显减少,但这些影响是暂时的。值得注意的是,小鼠肠道微生物群的组成因喂养的菌株而异,表明其具有原位功能。由于粘附于肠上皮的能力可以在益生菌功能中发挥作用,因此也对该菌株进行了检测,以评估粘附于肠上皮细胞对基因表达的影响。值得注意的是,细菌素基因表达在粘附到上皮细胞时被诱导,可能是通过一种机制,即在足够高的局部浓度下存在诱导肽触发细菌素的产生。
尽管UCC118可能是产生细菌素的益处最明显的益生菌菌株,但该菌株尚未推向市场。另一种唾液链球菌产生的细菌素一直是研究的重点,它是一种IId类细菌素bactofencin A。这种细菌素是不寻常的,因为它与以前描述的细菌素没有显著的同源性,而是更类似于一组真核抗菌肽。Bactofensin A具有相对广泛的活性,可抑制两种具有临床意义的病原体:金黄色葡萄球菌和单核细胞增生性李斯特菌。在远端结肠的模拟模型中,研究了产bactofencin A菌株对肠道菌群和微生物多样性的影响,发现该菌株改变了许多重要肠道菌属的比例,包括梭杆菌属、类杆菌属和双歧杆菌属,从而产生了一种阳性的,尽管很微妙的,对肠道菌群的影响。
嗜酸乳杆菌益生菌(其中一些用于商业产品)在这方面有点特殊,因为已知两种菌株NCFM和LA-5可产生细菌素-乳酸菌素B。这种细菌素的活性谱较窄,能够抑制其他乳酸杆菌和粪肠球菌。但是,尚未确定乳酸菌素B对益生菌功能的贡献。
★ 唾液链球菌
唾液链球菌(Streptococcus saliarius)是一种具有良好特征的人类口腔共生菌,已被发现在出生后几个小时内就可定植。它也是肠道的常见居民,尤其是胃和空肠。唾液链球菌的一些菌株因其作为安全有效的益生菌的作用而受到关注,并已被用于促进健康的口腔微生物群。
菌株K12是唾液链球菌益生菌模型。最初选择K12是因为它能够抑制致病菌化脓性链球菌,但现在已经注意到其他几种促进健康的作用。这包括抑制B组链球菌(GBS)的能力,包括疑似引起新生儿疾病的分离物和从孕妇阴道道分离的定植分离物。其中一些活性依赖或部分依赖于编码唾液毒素A2和唾液毒素B细菌素的大质粒的存在。
其他唾液链球菌菌株的益生菌应用包括M18,其中包含编码许多细菌素的大质粒。为了评估其益生菌潜力,在一项随机、双盲、安慰剂对照试验中,研究了该菌株对预防或降低龋齿风险和影响牙齿健康的影响。该菌株在唾液中的持久性也进行了调查,并显示出剂量依赖性。这项研究证明了编码细菌素的巨质粒在两株唾液链球菌之间的体外转移。这可能允许通过将大质粒从持续性差但显示出强细菌素产生的菌株转移到持续性差但显示出弱细菌素产生的本地唾液链球菌来增强益生菌菌株。此外,从该物种中鉴定新的细菌素,包括唾液毒素9和最近鉴定的唾液毒素E,继续增强唾液链球菌的益生菌潜力。
细菌素通过靶向不良成分来调节肠道微生物群而不会对有益菌群产生负面影响的能力是一个吸引人的特点。
研究观察到,在对其他鼻腔成员具有高度可变抗菌活性的鼻葡萄球菌菌株中,细菌素的产生频率很高,这表明需要抑制不同的竞争对手。鼻内细菌素的不同活性谱可能有助于细菌物种控制居民群体的能力,这表明益生菌的开发可以促进理想的微生物群组成并消除金黄色葡萄球菌等病原体。
迄今为止,大多数研究都集中在产生细菌素的益生菌上,这些益生菌可以抑制已确定的肠道病原体。新一代测序技术继续提供对肠道微生物群肠道健康中作用的更透彻的了解,因此,新的目标正在出现。通过确定特定分类群的增加是否是此类疾病的原因或结果,使用有针对性的方法有助于为此类研究提供进一步的见解。更具体地说,在假定病原体与疾病之间的联系不明确的情况下,通过基于细菌素的方法有针对性地去除微生物可以确定病因。更重要的是,如果目标微生物被确定为病原体,细菌素也可用于预防/治疗疾病。
★ 代谢健康
肥胖是一种复杂的综合征,对人类健康有许多严重影响,包括心血管疾病、2型糖尿病(T2D)和肌肉骨骼疾病。近年来,肠道微生物群在肥胖和整体代谢健康中的作用受到了广泛关注。
尽管如此,前面提到的唾液乳杆菌UCC118菌株抑制大量厚壁菌的能力是研究其控制饮食诱导肥胖小鼠体重增加能力背后逻辑的一部分。最近的研究特别强调了可能在肥胖或T2D中起作用的人群,可能通过抗菌作用,直接或间接成为改善肠道平衡进而改善胃肠道健康的目标。
还有其他研究更明确地确定了特定物种或菌株在肥胖和T2D中的作用。证明了产生内毒素的阴沟肠杆菌(Enterobacter cloacae)B29在无菌小鼠中诱导肥胖和胰岛素抵抗的作用。研究还表明,分枝梭状芽孢杆菌(Clostridium ramosum,一种先前在T2D患者中表现出富集的物种)在喂食高脂肪饮食的灵长类小鼠模型中促进肥胖。肠道内产生的细菌素对某些生物体具有特异性活性,可有效平衡代谢健康。
★ 癌症
在过去的半个世纪里,癌症已经成为一个严重的问题,威胁着人类的健康。
在癌症治疗中,一些研究表明细菌素显示出对抗肿瘤细胞的活性。考虑到细菌素是在食品中天然和合法添加的,细菌素可能适合作为潜在的抗肿瘤候选药物。
有一些建议认为细菌素可以用作抗癌剂,通过要么是通过对癌细胞的影响,要么是通过抑制与疾病发生相关的细菌。其中一项研究集中于nisin对小鼠口腔癌头颈鳞状细胞癌(HNSCC)细胞凋亡和细胞增殖的影响。结果表明,在三种不同的癌细胞系上,增加nisin浓度的处理诱导了更多的DNA断裂和凋亡。
它们对癌细胞的影响或通过抑制与疾病的发生相关的细菌。其中一项研究侧重于乳酸链球菌肽对小鼠口腔癌体外和体内头颈部鳞状细胞癌 (HNSCC) 细胞凋亡和细胞增殖的影响。结果表明,用增加浓度的乳链菌肽进行处理会导致三种不同癌细胞系的 DNA 断裂和细胞凋亡增加。在口腔癌小鼠模型中,与对照组相比,接受乳酸链球菌肽的组通过激活 CHAC1 表达显示出肿瘤体积减少,而在接种肿瘤细胞之前和三周后用乳酸链球菌肽预处理导致相同的效果。有人提出,在这项研究中,乳链菌肽的选择性作用源于 HNSCC 细胞和原代角质形成细胞之间质膜组成的结构差异。尽管使用的是乳酸链球菌肽而不是产生细菌素的菌株,但如果能够以类似方式使用能够产生乳酸链球菌素或其变体的菌株,估计这样的研究更有意义。
在抑制潜在致癌微生物的背景下,参考了具核梭杆菌(Fusobacterium nucleatum)的例子。虽然最初被认为是口腔的一个组成部分,但有具核梭杆菌也存在于肠道中,并与不同的胃肠道疾病如结直肠癌(CRC)、炎症性肠病和阑尾炎有关。由于梭杆菌属的成员,尤其是具核梭杆菌,在上述许多疾病状态中发挥作用,它们是产生细菌素的益生菌的理想靶点,但这一潜力仍有待利用。
另外,一些细菌素,例如成孔大肠杆菌素 A 和 E1,抑制了一种人类标准成纤维细胞系 MRC5 和 11 种人类肿瘤细胞系的生长。相反,成孔大肠菌素 U 和 RNAase 活性大肠菌素 E3 没有表现出这种生长抑制能力。大肠菌素 D、E2、E3 和成孔大肠菌素 A 可以抑制鼠白血病细胞 P388 的活力,而成孔大肠菌素 E1 和大肠菌素 E3 抑制 v-myb 转化的鸡单核细胞。在160名健康人的粪便中,有102人(63.8%)含有产barteriocins的大肠杆菌,这也说明来自肠道细菌的大肠杆菌素可能是降低人类结直肠癌的因素之一。大肠杆菌素可以作为一种具有中等潜力的抗癌药物。补充产生细菌素的益生菌可能是另一种预防癌症发生的方法。
细菌素是用作未来治疗剂的有力候选者。最近的研究表明细菌素在体外具有抗菌活性楷模。尽管如此,开发新的基于细菌素的治疗剂的下一步涉及使用体内模型。细菌素的抗菌和/或毒性作用已在小鼠模型和最新的替代动物模型中进行了研究,例如果蝇、斑马鱼胚胎、蛔虫、大蜡蛾或盐水虾。这些结果表明,细菌素可以在宿主中发挥多种积极反应,例如免疫原性反应的改变、炎症反应的改变以及与感染相关的生化和组织病理学参数的降低。另一方面,在替代模型中进行的研究中有 20% 评估了抗菌活性,但没有报告毒性。这些数据表明细菌素缺乏毒性和生物安全性研究体内模型,这对于推进临床试验至关重要。
研究新的微生物组衍生细菌素的筛选活动和评估计划不仅应关注病原体抑制,还应关注共生保护,以防止广泛的微生物组损伤并维持对病原体定植的抗性机制。一些细菌素将抗菌作用与其他活性相结合,这也可能直接或间接影响其他微生物组成员和/或宿主。一些细菌素诱导促炎反应或损害宿主细胞(例如,酚溶性调节蛋白),而其他细菌素有助于细菌过渡金属稳态(例如,铁载体细菌素)或允许细菌相互交流(例如,乳链菌肽作为控制自身表达的自诱导剂)。尽管进行了上述研究,商业益生菌乳酸杆菌中的细菌素生产一般未进行详细研究,关于哪些商业益生菌生产细菌素以及哪些细菌素最常生产的信息有限。只有充分了解细菌素的各种功能,我们才能了解它们如何塑造生产者的竞争力,并利用特定的细菌素进行有针对性的微生物组干预。
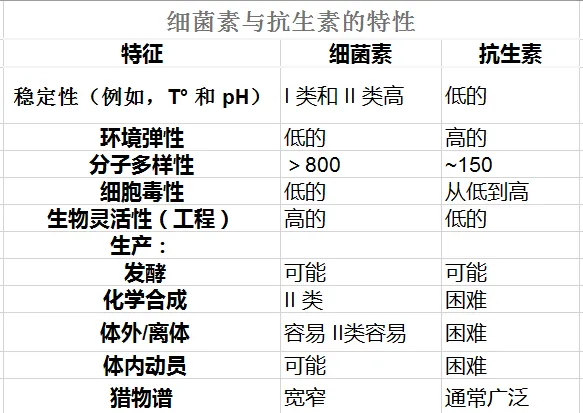
细菌素与抗生素的区别
细菌素是由细菌产生的蛋白质毒素,用于抑制相似或密切相关的细菌菌株的生长,对封闭生物体在局部位置竞争和防止产生的细菌免受外部有害影响几乎没有影响。
抗生素或抗菌剂是一种用于治疗和预防细菌感染的抗菌剂。它们可以杀死或抑制细菌的生长。抗生素是由某些细菌和真菌产生的物质,对其他微生物具有广泛的作用。
具体区别:
1. 细菌素在微生物细胞的核糖体表面产生,而抗生素主要是细胞的次级代谢产物。
2. 与抗生素生产者不同,细菌素生产者对杀菌剂不敏感。
3. 细菌素可以附着在目标细胞壁表面的任何位置,因为目标细胞壁上显然不存在特异性受体。
4. 细菌素作用于靶细胞的机制多种多样,与细胞外膜上的孔形成方法有关。细菌素与敏感微生物的细胞壁结合、动力离子失衡并产生毛孔。无机离子通过产生的孔泄漏靶细胞,从而杀死它们。抗生素可以抑制亚细胞过程的合成(细胞壁合成、细胞内蛋白质产生以及 DNA 和 RNA 复制)。它们的杀菌和抑菌机制多种多样,可能包括孔的形成、细胞 DNA 的降解、通过 16S rRNA 的特异性裂解造成的破坏以及肽聚糖合成的阻断。
主要参考文献:
Hegarty JW, Guinane CM, Ross RP, Hill C, Cotter PD. Bacteriocin production: a relatively unharnessed probiotic trait?. F1000Res. 2016; 5:2587.
Heilbronner S, Krismer B, Brötz-Oesterhelt H, Peschel A. The microbiome-shaping roles of bacteriocins. Nat Rev Microbiol. 2021 Nov;19(11):726-739. doi: 10.1038/s41579-021-00569-w. Epub 2021 Jun 1. PMID: 34075213.
Abee T, Krockel L, Hill C. Bacteriocins: modes of action and potentials in food preservation and control of food poisoning. Int J Food Microbiol. 1995 Dec;28(2):169-85. doi: 10.1016/0168-1605(95)00055-0. PMID: 8750665.
Cotter PD, Ross RP, Hill C. Bacteriocins – a viable alternative to antibiotics? Nat Rev Microbiol. 2013 Feb;11(2):95-105. doi: 10.1038/nrmicro2937. Epub 2012 Dec 24. PMID: 23268227.
Yang SC, Lin CH, Sung CT, Fang JY. Antibacterial activities of bacteriocins: application in foods and pharmaceuticals. Front Microbiol. 2014 May 26;5:241. doi: 10.3389/fmicb.2014.00241. Erratum in: Front Microbiol. 2014;5:683. PMID: 24904554; PMCID: PMC4033612.
Benítez-Chao DF, León-Buitimea A, Lerma-Escalera JA, Morones-Ramírez JR. Bacteriocins: An Overview of Antimicrobial, Toxicity, and Biosafety Assessment by in vivo Models. Front Microbiol. 2021;12:630695.
Kumariya R, Garsa AK, Rajput YS, Sood SK, Akhtar N, Patel S. Bacteriocins: Classification, synthesis, mechanism of action and resistance development in food spoilage causing bacteria. Microb Pathog. 2019 Mar;128:171-177. doi: 10.1016/j.micpath.2019.01.002. Epub 2019 Jan 3. PMID: 30610901.