 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


最近关于“益生菌”的风很大,我们越来越容易从各种渠道听到关于补充益生菌的科普,但依然一知半解。
我们每个人都需要补充益生菌吗?
不同益生菌有什么不同,如何选择?
为什么有的人补充有效,有的人无效?
益生菌真的能定植吗?与什么因素有关?
…..

本文我们来逐一解答这些问题。
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。补充益生菌是改善菌群的一种方式。
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
目前已有研究的,与菌群相关的疾病包括:
消化系统(腹泻、腹胀、便秘等);
神经系统(自闭症、精神障碍等);
免疫系统(哮喘等);
代谢系统(肥胖、糖尿病等);
心血管疾病(高血压、中风等);
癌症(胰腺癌、结肠癌等);
…
本号里有各类与菌群相关疾病的研究进展。
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。
假如在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
如果症状与菌群有关,或者正经历慢性压力、营养不良、药物、环境变动、衰老、疾病、旅行、肠道菌群紊乱等情况,可以通过补充益生菌的方式来改善菌群从而缓解症状。
然而,不同益生菌有不同的功效,并不是可以随意补充,究竟该如何选择?
下一章节我们来详细了解。
目前市面上的益生菌种类五花八门,要从这么多益生菌中选择适合自己的能发挥作用的,并不是一件容易的事儿,我们可以尝试从以下几个方面来了解益生菌。
最可靠的益生菌是那些经过双盲测试的益生菌。如果不进行双盲试验,益生菌测试可能会有偏差这些信息应该清楚地印在包装上。要检查包装确认益生菌厂家是否告知检测结果。
使用标准化流程的可追溯性确保了消费者安全和产品注册,尽可能选择严格规范的公司生产的益生菌。
对于无活菌标识、无菌株号、无任何文献数据支持的类型,则需谨慎。
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:
嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


-357x1024.png)
-1024x426.png)
-1024x615.png)
<来源:谷禾健康数据库>
研究表明最好空腹服用,通常是在早上。服用益生菌的是为了让它到达大肠,因为这是菌群存活率最高的地方。当有食物时,胃酸分泌较多,益生菌可能会被胃酸杀死,因此最好空腹服用。
一天中,最佳时间是早上空腹时,其余的话饭前或睡前也可以,饭后服用效果较差。
绝大多数人开始服用益生菌是安全的。在开始服用前几天,可能会出现胃部不适、胀气、腹泻或腹胀等症状。这些症状通常会在身体习惯后消失。
服用益生菌可能出现的副作用


如果是小肠细菌过度生长等疾病患者,则需要注意,可能会出现腹胀、便秘等消化疾病问题。
此外,它也可能会跟某些药物相互作用,如果长期服用药物,或有严重感染和近期做过手术的人群,使用益生菌前请遵医嘱。
如有牛奶过敏或乳糖不耐症、怀孕或哺乳等情况,请咨询医生是否适合服用。
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。微胶囊化可以提高其在不利环境条件下的存活率,确保一定数量的益生菌进入人体并且在肠道中释放,提高益生菌的使用价值。
益生菌的种类不同,存储方式可能也有所不一,
益生菌产品的储藏方式一般可以分为常温,冷藏和冷冻三种,市场上的很多益生菌产品都需要冷藏。请检查包装去了解如何储存。对于干性益生菌补充剂,一般来说需要在干燥、黑暗的地方存储(潮湿条件会导致代谢发酵或降解)。
关于这部分详见《益生菌的靶向递送:研究和商业化前景》
跟其他食品一样,益生菌也要看生产日期或到期日期。随着时间的推移,CFU 的数量可能会下降。因此最好检查包装上的日期。
如果已经使用某种益生菌补充剂几周甚至几个月了,但没有发现消化系统健康状况有所改善,那么是时候尝试换一种新的益生菌了。
与药物不同,更换益生菌补充剂不会产生重大副作用。
此外,可以利用好肠道菌群检测这个工具。可以从两个方面入手:
益生菌抑制其他菌群生长
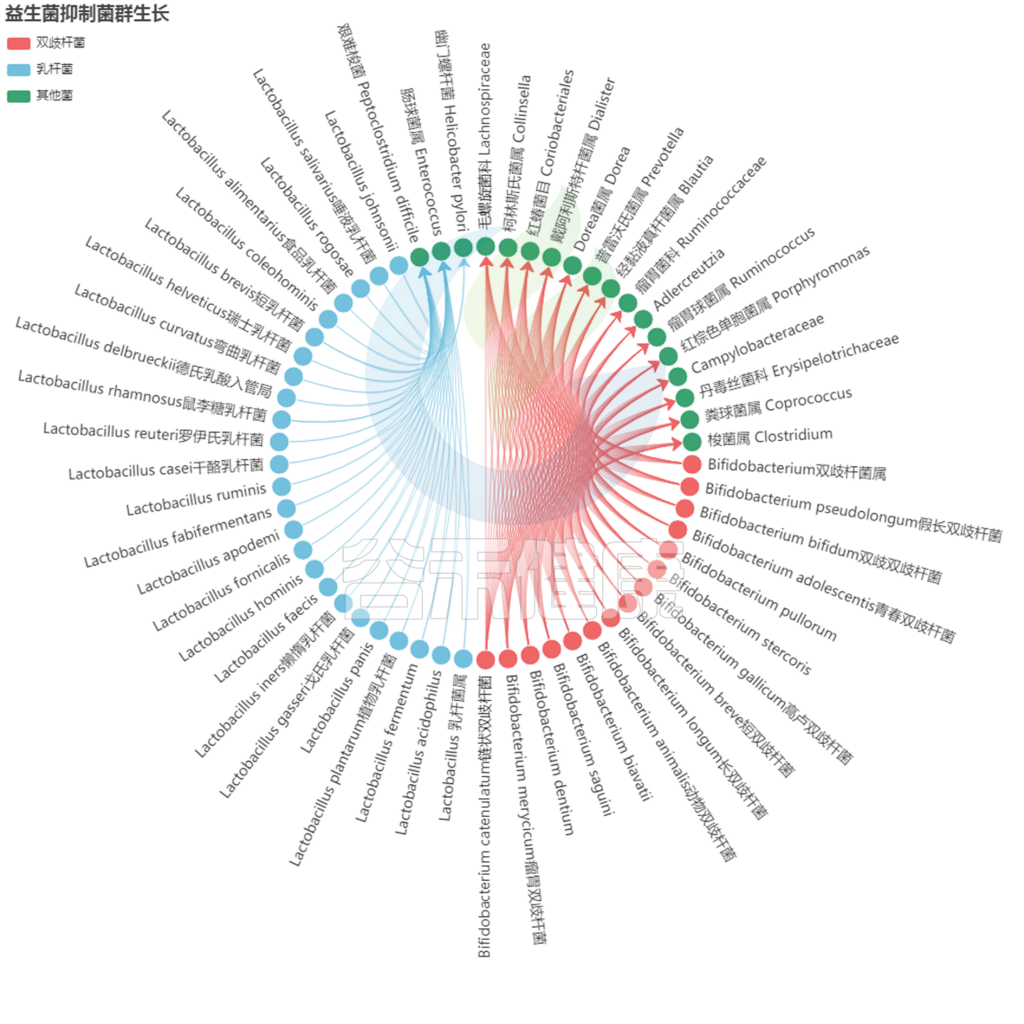

<来源:谷禾健康数据库>
注:以上红色代表双歧杆菌,蓝色代表乳杆菌,绿色则为其他菌群,箭头指向代表抑制的菌群。
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。那能不能在抗生素使用的时候,补充一些益生菌使其恢复平衡?
目前针对益生菌和抗生素同时服用的研究,支持和不支持的都有。
√ 支持益生菌和抗生素同时服用的研究:效果显著
对给予益生菌的23项研究(3938名参与者)进行调查,22个试验报告了抗生素相关腹泻的发生率,结果显示,与活性、安慰剂或无治疗对照组相比,益生菌组显著受益(益生菌组8%,对照组19%)。
研究副作用的16项试验(n = 2455)中,没有一项记录了可归因于益生菌的任何严重副反应。作者认为益生菌对预防抗生素相关性腹泻具有保护作用。相对危险度为0.46 (95% CI为0.35 ~ 0.61),NNT为10。
作者认为鼠李糖乳杆菌或布氏酵母菌Saccharomyces boulardii 形成单位为每天50 – 400亿个是最合适的选择。
建议在进行进一步研究之前,应避免在有不良事件风险的儿童人群中使用益生菌。
× 反对益生菌和抗生素同时服用的研究:菌群恢复难
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。这是在益生菌有效地在肠道定植的情况下。问题是新的细菌和酵母菌株的存在使肠道微生物群在整个6个月的研究期间无法恢复正常。
而那些没有服用益生菌的人的肠道菌群在停用抗生素三周后恢复正常。作者得出的结论是,这项研究只是检测了一种益生菌,不同的益生菌可能对服用不同抗生素的患者有帮助。不过他们也认为,在服用抗生素之后再服用益生菌可能是没有益处的。
还需要更多的研究来确定是否有其他方法来探索益生菌和抗生素的共存关系,如益生菌封装技术增强效果、自体粪菌移植等各种方式。
研究发现,封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素;胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。这可能为益生菌和抗生素共同使用带来利好。
研究表明,自体粪便移植(在使用抗生素之前收集粪便样本并冷冻,在抗生素治疗后移植),8天内肠道菌群就恢复正常。未进行粪便移植的那一组的肠道菌群花了21天时间才恢复。
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
还有其他方式也可以获取益生菌或者协助益生菌生长。
补充益生元,协助有益菌生长
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达大肠和结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
菊粉型果聚糖和阿拉伯木聚糖低聚糖等益生元表现出双歧化和产丁酸作用。产丁酸菌正需要这些益生元,例如直肠真杆菌、普拉氏粪杆菌和罗氏菌属。
有机酸的产生还可以形成对病原体的防御并增加矿物质的吸收。通过益生元和有益菌繁殖结合将导致较低的管腔 pH 值,阻止病原体在肠粘膜中的粘附和生长,并增加盲肠和结肠对矿物质,特别是钙和镁的吸收。
★ 哪些食物中含有益生元?
蒲公英嫩叶
蒲公英绿叶植物是菊粉和其他纤维的重要来源,每100克含有4克纤维。
蒲公英绿色植物也因其抗炎、抗氧化、降低胆固醇的功效而闻名,同时也有助于减轻便秘。
菊芋
每 100 克菊芋含有约 2 克膳食纤维,其中 3/4 由菊粉组成。它们还富含硫胺素和钾,可支持神经系统并促进适当的肌肉功能
青香蕉或青香蕉粉
未成熟的(绿色)香蕉富含抗性淀粉,绕过小肠的消化(可消化的淀粉转化为葡萄糖)并携带到结肠,被有益细菌发酵成代谢物。
香蕉中的纤维已被证明可以增加健康的肠道细菌并减少腹胀。
大麦和燕麦
大麦和燕麦由 3-8% 的 β-葡聚糖组成,这是一种益生元纤维,可促进肠道中有益细菌的生长。
还发现大麦和燕麦中的 β-葡聚糖可以降低 LDL 胆固醇(坏胆固醇)和血糖水平
大麦富含硒 – 支持甲状腺功能,抗氧化益处与预防多种癌症有关。
由于其酚酸含量,燕麦还提供抗氧化和抗炎保护。
魔芋根
魔芋根,也称为葡甘露聚糖,原产于亚洲部分地区,用于中药以及烹饪中作为增稠剂。它因其减肥益处和帮助降低低密度脂蛋白胆固醇而得到普遍认可。
除魔芋外,一项研究发现有助于减少粉刺并改善患者的整体皮肤健康。它还被发现有助于减少过敏。
菊苣根
菊苣根与蒲公英来自同一个家族,新鲜菊苣根由高达 70% 的菊粉组成,研究发现它有助于改善血糖控制,尤其是对糖尿病患者而言,并且还被发现有助于减轻体重。
菊苣根可以整个煮熟后与食物一起食用,也可以作为热饮冲泡,或者作为补充剂。
牛蒡根
通常作为茶饮用,具有广泛的益处,包括治疗癌症、糖尿病和炎症。其他好处包括帮助降低血糖水平和治疗糖尿病治疗和预防感染。
牛蒡可以作为茶服用,也可以作为补充剂的粉末服用。
亚麻籽
亚麻籽具有多种相关的健康益处。除了高纤维含量外,亚麻籽还富含蛋白质、omega-3 脂肪酸,以及一些维生素和矿物质的丰富来源。
一汤匙亚麻籽含有 3 克纤维,占每日推荐摄入量的 10%。亚麻籽有助于促进肠道中有益细菌菌株的生长,有助于降低血糖水平和治疗糖尿病、治疗和预防感染。
雪莲果根
雪莲果根的外观与甘薯相似,富含果糖(FOS),使其具有甜味。
豆薯根
豆薯根是一种可食用的根茎类蔬菜,原产于墨西哥,通常被称为墨西哥萝卜,由大约 5% 的膳食纤维组成。
海藻
海藻含有大量的生物活性化合物,如多糖和酚类物质,长期以来因其对健康的益处以及作为益生元的价值而得到认可。
海藻中发现的许多化合物对小肠的消化有抵抗力,但会刺激有益肠道细菌的生长及其发酵成短链脂肪酸。
土豆
土豆(以及土豆泥、薯条和炸薯条等土豆产品),一听就觉得是容易长胖的食物。确实,煮沸或油炸时,很容易在小肠中消化成葡萄糖。
然而,当土豆煮熟然后完全冷却至室温时,或者更好的是放在冰箱里,就会形成抗性淀粉。抗性淀粉属于膳食纤维的一种,抗性淀粉不被消化,进入结肠,作为菌群的营养源,菌群通过发酵,将碳水化合物代谢后生成丁酸等短链脂肪酸,促进肠道健康。
苹果
苹果含有丰富的纤维、维生素C、抗氧化剂和钾,具有显着的健康益处。它含有果胶,一种可溶性纤维,具有益生元作用并促进健康的肠道菌群。果胶会增加丁酸盐(短链脂肪酸),可以滋养有益的肠道细菌并减少有害细菌的数量。
其他协助益生菌的方式
▸ 适当锻炼
干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。
关于运动锻炼对菌群的影响,详见:运动如何影响肠道微生物群,如何正确运动
▸ 足够睡眠
某些菌群会在睡觉时会大量繁殖,这些菌群在白天不会很好地繁殖。
如果你缩短睡眠时间,这些菌群可能会受到影响,没有机会增殖,从而影响肠道菌群的整体平衡。保持足够的睡眠对于健康的身体、肠道极为重要。
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
关于睡眠与肠道菌群详见:
肠道菌群与睡眠:双向调节
深度解析|睡眠健康与肠道健康之间的双向联系
有人说,益生菌在体内不能定植,很快就会被排出体外了…… 益生菌究竟能不能定植?


可以定植,但不容易。
首先,我们来看口服的益生菌在体内经历了什么?
▸口腔——唾液对益生菌的影响微乎其微
益生菌首先会接触到口腔中的唾液。唾液是一种透明且微酸性的黏液性外分泌物,由保护牙齿和黏膜表面的免疫和非免疫成分组成。
对多种乳酸杆菌、小球菌和双歧杆菌菌株进行的体外研究表明,与对照组相比,接触唾液时细胞计数没有显著损失。
▸胃——胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,转运需要5分钟到2小时,长时间暴露在酸性胃液中,对益生菌来说是一个巨大的挑战。
尤其是对不耐酸的细菌,会导致细菌细胞质pH降低。
氢离子(H+)的涌入导致糖酵解酶活性下降,进而影响F1F0 – ATP酶质子泵。低pH条件下F1F0 – ATP酶质子泵活性的降低,因此益生菌存活难。
胃中存在的其他不利条件:
包括离子强度、酶活性(胃蛋白酶)和机械搅拌对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在模拟胃液中1小时内消失。


▸小肠——胆汁酸和消化酶影响益生菌生存
益生菌通过幽门到达小肠,那里有大量胰液和胆汁。在肠液的中和作用下,小肠内的pH约为6.0-7.0,比胃液温和得多。
然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以影响益生菌的生存能力,通过细胞膜破坏和DNA损伤等方式。
体外研究表明,在模拟肠液中唾液乳杆菌Lactobacillus salivarius Li01、Pediococcus pentosaceus Li05 的生存能力降低。
为了增强益生菌对胃液和胆汁的耐受性,可以将益生菌包裹在一层保护性外壳上,也就是前面说的微胶囊。近年来,微囊化技术在提高存活率和保证足够数量的活菌到达结肠方面取得了很大进展。
经历以上重重考验,益生菌的定植之路看起来并不容易。

而以上这些只是其中一部分原因。
等益生菌到了结肠之后,有更多的考验等着它。
共生菌的定植抗性,给益生菌的定植带来不利影响
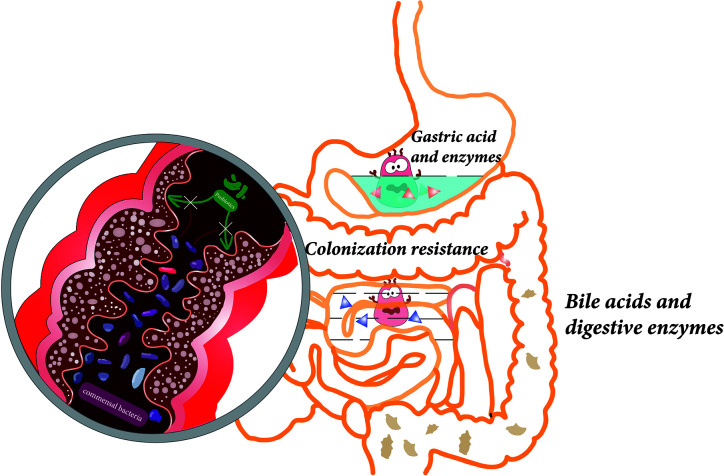
doi.org/10.3389/fcimb.2021.609722
由于定植抗性,大多数益生菌在口服后和消耗停止后不久随粪便排出结肠。
那么,什么是定植抗性?
通俗地说,在人类的菌群中,一个新的物种想要入侵并定居下来,也就是定植。但是本身存在的菌群会用各种方式,拒绝新的物种一起生活,就是所谓的“定植抗性”。
对于病原体而言,常驻微生物群的这种定植抗性,可以使其更难生长和繁殖,从而预防疾病的发生。
举个例子:
鼻腔微生物群的存在,可以保护人体免受呼吸道金黄色葡萄球菌感染,金黄色葡萄球菌想要入侵得过鼻腔微生物群这一关…
换句话说,益生菌如果想要定植,必须与宿主菌群竞争养分和粘附部位,争到了资源,活下来,才能繁衍后代。
具体的争抢资源的方式是什么?
包括以下各种方式:改变资源可用性、占领生态位、捕食、竞争等。
我们大致分成两种机制:直接和间接。
指严格通过与肠道菌群相关的因素,来限制外源微生物定植,独立于与宿主的任何相互作用。
这就涉及到菌群之间的相互作用。
一般这样的相互作用分为两种情况:
互利共生和竞争关系。
以拟杆菌为例。
▸ 互利共生(定植成功):
不同的拟杆菌种之间存在广泛的互利共生作用,也就说,拟杆菌群在肠道中团结友爱,稳定存在。
比如说,一些拟杆菌能够分解某种多糖,并释放出小分子物质,从而促进不能利用该多糖的拟杆菌生长。更有甚者,这种交互共生关系有时是以过量消耗某一种拟杆菌能量的前提下实现的。
延伸到其他菌群,可能会出现的情况:
里应外合:
准备入侵的菌与本地菌群偶然相互作用,促进定植;
抱团取暖:
两个非本地菌群之间的良好相互作用,可以使定植更加成功。
▸ 竞争关系(一争高下):
非病原菌与细菌竞争肠道上皮细胞刷状缘的结合位点,阻止病原菌的黏附、侵袭;
细菌竞争性利用营养素,消耗掉维持各自种群的生长原料。
有些菌群不直接和新来的菌群产生竞争,而是可以通过改变环境(改变pH值,胆汁酸浓度等)或释放抑制因子(如,代谢产物、细菌素等),从而决定另一个物种是否能成功定植。
结合肽聚糖抑制其他菌生长:
例如,拟杆菌的结构分子及代谢产物,能通过激活一系列的免疫细胞而参与宿主肠道免疫。
拟杆菌还能够更大量地刺激肠上皮细胞分泌RegIIIγ,它能够强力结合大部分革兰氏阳性菌表面的肽聚糖,抑制脂磷壁酸的合成从而抑制细菌的生长。
环境的改变如何影响其他菌群?
更高的营养浓度会导致微生物之间更多的负面相互作用
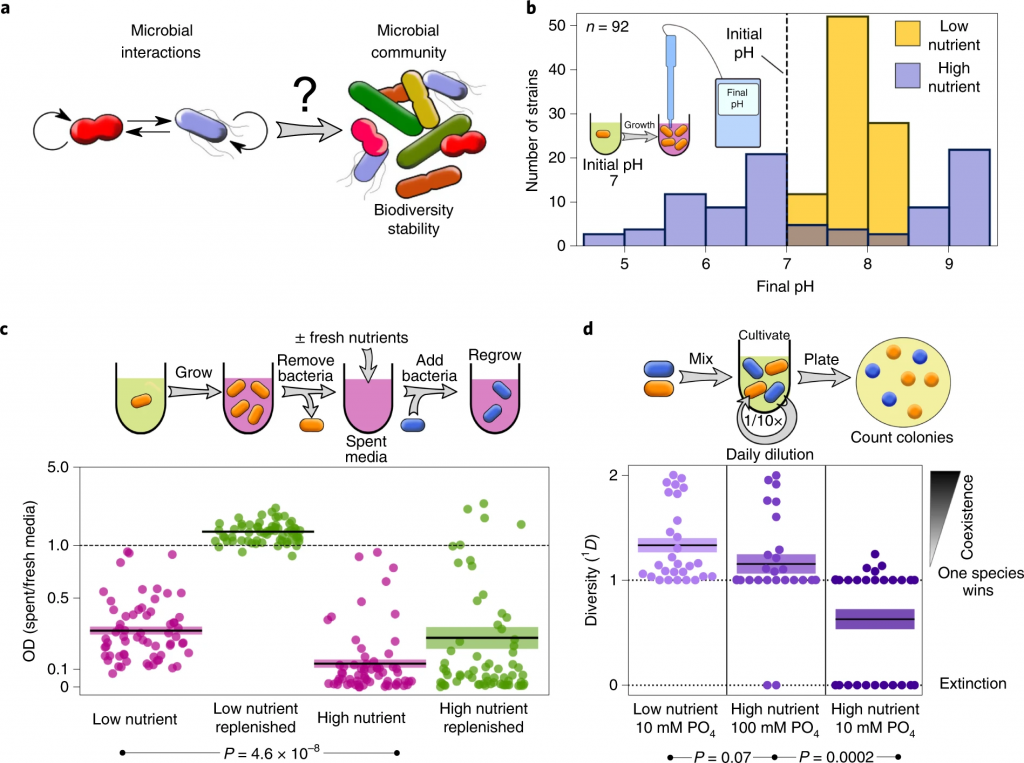

Ratzke C, et al., Nat Ecol Evol. 2020
在较高的营养浓度下,细菌会更强烈地改变环境pH值。
在较高的营养浓度下,细菌会产生更具生长抑制性的环境。
参考上图c,直接(紫色)或补充资源(绿色)后使用不同细菌的废培养基重新培养细菌。每个相互作用对的相对增长显示为散点图。
高营养浓度会减少相互作用对之间的共存。
低营养成分包括0.1%酵母抽提物和0.1%大豆酮。高营养的培养基与添加1%葡萄糖和0.8%尿素的培养基相同。所有28种共培养结果均显示为一个群体图。
微生物获得的营养浓度越高,它们生长的越多,它们代谢的底物就越多,因此它们可以改变环境的能力越强。
再看常见的益生菌,例如,乳酸杆菌和双歧杆菌:
乳酸杆菌和双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸,有机酸可以通过交叉喂养相互作用被其他细菌转化为丁酸盐。这些产生的有机酸降低了腔内的 pH 值,抑制了病原体的生长并增加了矿物质的吸收。
注:丁酸盐和其他短链脂肪酸对肠道健康至关重要,但也可能进入体循环并直接影响新陈代谢或外周组织的功能。短链脂肪酸在脂肪组织、骨骼肌中发挥重要作用和肝脏底物代谢和功能,有助于改善葡萄糖稳态和胰岛素敏感性。
以上,我们了解菌群之间相互作用机制。
可见菌群的定植并不容易,它们要面临的,可能是同伴的帮助,也可能是其他菌群的竞争或杀戮,又或者是受到环境的考验。
在经历此番折腾后,益生菌如果能顺利定植,它会在哪里,如何定植?
胃肠道的成功定植,是益生菌能够发挥足够的作用,是赋予健康益处的关键。粘膜粘附是益生菌定植的重要步骤。
在本小节中,我们将讨论肠道粘液层的组成和与益生菌粘附相关的特定蛋白质。
什么是肠粘膜和粘液层?
肠粘膜由上皮层、固有层和肌层组成。小肠绒毛由上皮细胞和伸入肠腔的固有层组成,覆盖在黏膜表面,负责肠内营养物质的吸收。
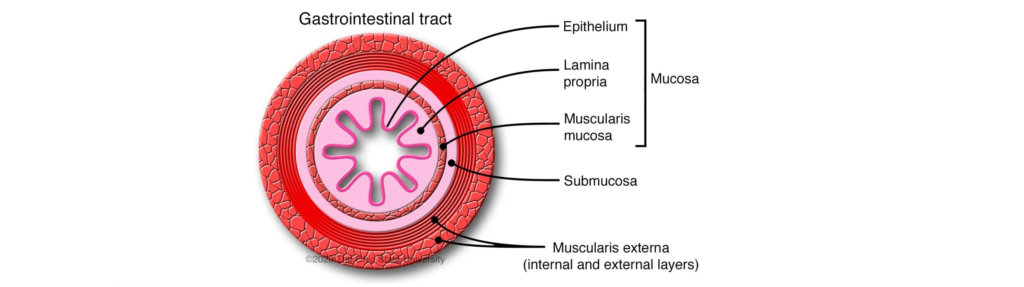
上皮细胞由吸收细胞、杯状细胞和内分泌细胞组成。杯状细胞分散在吸收细胞之间,分泌覆盖整个小肠腔的粘液,由碳水化合物、脂类、盐、蛋白质、细菌和细胞碎片组成。
粘液厚度约为 30 ~ 300 μm;从肠道到直肠的厚度都在增加。主要的蛋白质是粘蛋白,它聚合形成一个连续的凝胶基质,为粘膜层提供结构基础,保护肠道免受病原体、酶、毒素、脱水和磨损。
同时,肠道粘液中含有维生素、矿物质等外源性营养物质,为定植于肠道粘液中的细菌提供了巨大的生态生长优势。可以说,粘液是益生菌和病原体的绝佳生态位。
细菌粘附粘膜的过程包括可逆阶段和稳定阶段。
可逆阶段(初相识)
最初,益生菌通过非特异性的物理接触(包括空间和疏水识别)与粘膜结合,建立可逆的、弱的物理结合。
稳定阶段(如胶似漆)
随后,随着粘附素(通常是固定在细胞表面的蛋白)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IECs)建立了稳定的结合,从而成功定植胃肠道。
益生菌可以编码大量的细胞表面因子,这些因子参与粘液蛋白或上皮细胞的粘附。
除蛋白质外,益生菌中还存在非蛋白分子,如磷壁酸和胞外多糖,它们可以与宿主细胞相互作用,影响粘附。
从目前的研究可以推断,没有固定的分子可以适用于所有菌株的益生菌。
许多粘附素似乎是种或株依赖性的。这些与粘附相关的益生菌表面分子和粘附相关的机制将在下面详细讨论(下表)。
表 益生菌中的粘附相关分子
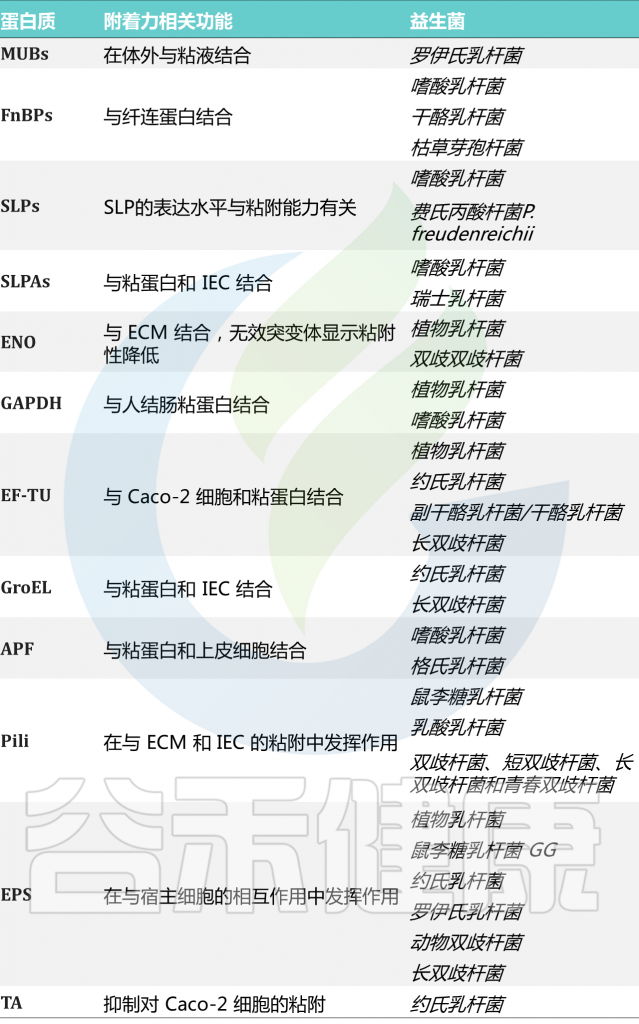

doi.org/10.3389/fcimb.2021.609722
粘液层的组成和与益生菌表面蛋白的结合
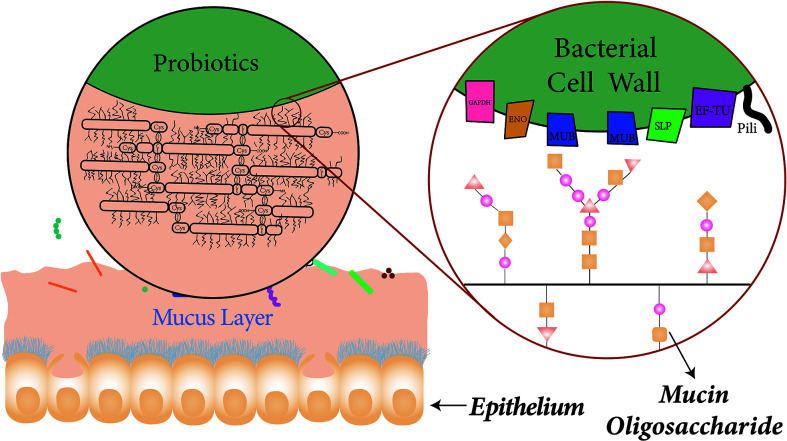
doi.org/10.3389/fcimb.2021.609722
杯状细胞分散在吸收细胞之间,吸收细胞可以分泌覆盖整个小肠的粘液。粘液主要由富含半胱氨酸的粘蛋白组成。粘液蛋白之间广泛的二硫键形成黏液特有的粘弹性。
益生菌表面的特异蛋白在益生菌粘附粘液中起着重要作用。例如,粘液结合蛋白可以通过与粘液蛋白的糖基修饰相互作用而与粘液层结合。
一旦粘附在肠道,益生菌通过将碳水化合物、蛋白质和其他次要化合物转化为能杀死病原菌的重要物质,如有机酸、酶、过氧化氢、细菌素和低分子量肽,可以产生细胞外抗菌成分。
以上是益生菌的定植给人体带来益处,当然这也不一定会发生在每个人身上。
益生菌定植的效果因人而异。
看一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
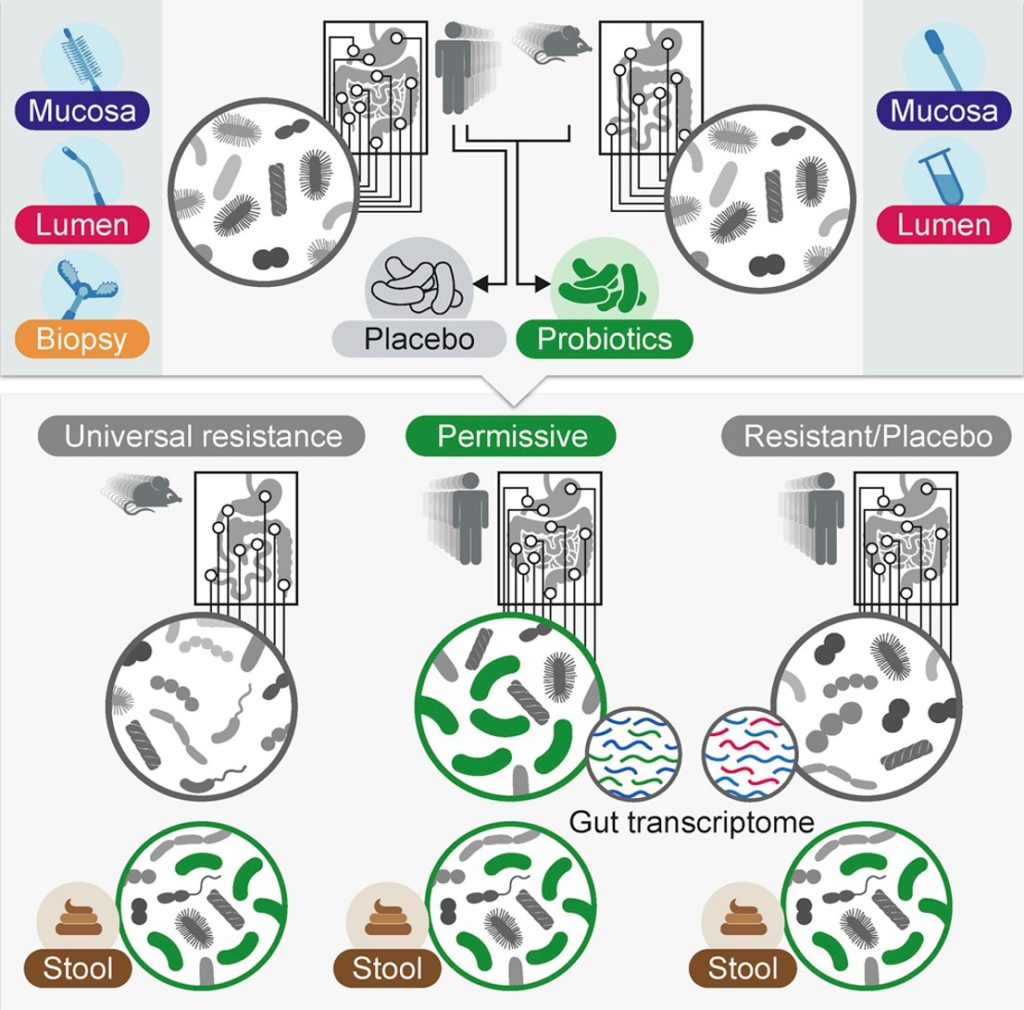
doi.org/10.1016/j.cell.2018.08.041
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。
常驻微生物群对人类健康很重要,因为它们占据了可能被病原微生物占据的生态位。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前面的文章《菌群多样性是如何形成的,与健康的关系,如何改善?》已经详细阐述。
这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
那么,益生菌在什么样的菌群中更容易定植?
再来看一项研究,为了评估定植抗性,该研究建立了一种电子入侵分析方法,在该方法中,稳定的菌群受到不同种群规模的入侵者的挑战。
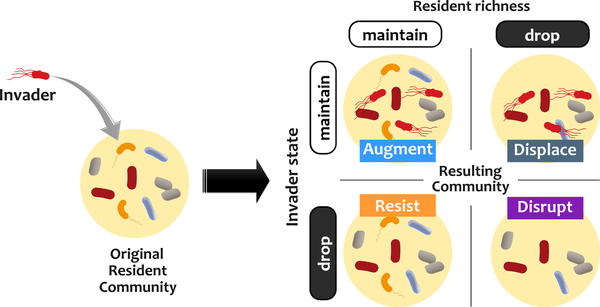
doi.org/10.1371/journal.pcbi.1008643(下同)
根据入侵者和常驻菌群的命运对结果进行分类。
有四种可能的结果:
增加入侵者的数量不会增加入侵者定植的概率。
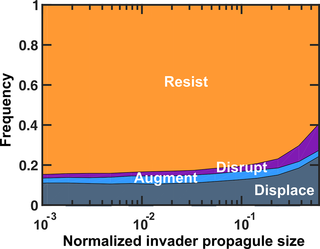
类比到益生菌,高剂量的益生菌可能并不会因此带来明显的定植效果。
基础增长率较高的入侵者更有可能取代常驻菌群,这可能是竞争潜力的主要指标。
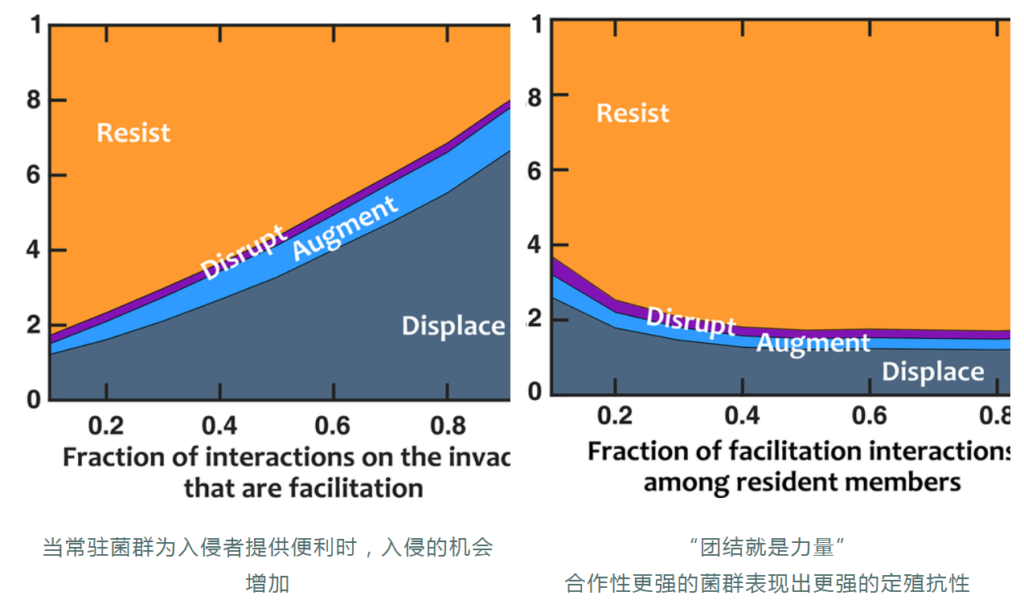

如果常驻菌群创造的化学环境有利于入侵者,入侵者会更成功。
这就说明,常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
研究人员在宏基因组和宏转录组学研究中表明,在 12 名健康老年人中食用鼠李糖乳杆菌GG益生菌菌株改变了常驻菌群的活性,而不会影响肠道微生物群组成本身。
益生菌虽然没有在菌群构成上带来改变,但是菌群的表达特征发生较大变化。尤其是益生菌服用后会大大促进双歧杆菌和主要丁酸产生菌:Roseburia和Eubacterium的鞭毛、运动,趋化性和粘附相关基因的表达。表明其能促进这些关键菌主动渗透进入肠粘膜的能力,提高宿主对于丁酸盐的利用度。
那么对于部分人群,益生菌不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。
益生菌:有助于维持宿主体内的动态平衡和防治疾病
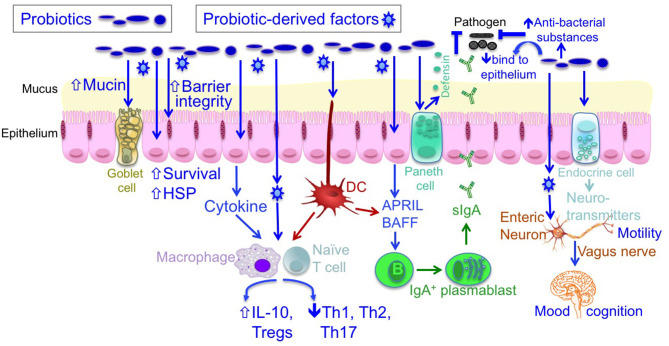
Yan F, Polk DB. Front Immunol. 2020
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡
(4)通过产生神经递质和迷走神经调节肠脑轴
益生菌衍生因子:有助于增强肠道屏障功能和刺激抗炎免疫反应
益生菌源因子对宿主反应的调控。一些益生菌衍生因子,包括产物和代谢物,对宿主发挥促进健康的作用。
益生菌的这些功能因子有助于增强肠道屏障功能,刺激抗炎免疫反应,从而改善肠道炎症紊乱。

Yan F, Polk DB. Front Immunol. 2020
益生菌混合物:减少成人肠道致病性或耐药性肠杆菌定植
益生菌补充剂可以减少肠道中潜在的耐药性或致病性肠杆菌,但有时候不能完全根除。
“如果益生菌单打独斗的力量不够,是不是可以寻求其他外援?”
比如多联益生菌,或者益生菌-益生元联合使用等方式。
多联益生菌减少肠杆菌:
为了根除潜在的肠杆菌,益生菌混合物(Bactiol duo ®:S. boulardii、L. acidophilus NCFM、L. paracasei Lpc-37、B. lactis Bl-04、B. lactis Bi-07 )的临床试验表明 ,在阿莫西林-克拉维酸治疗后,产 AmpC肠杆菌的定植会暂时增加,而在益生菌干预后会下降。
嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R 和鼠李糖乳杆菌CLR2 (Bio-K+ ® )的混合物在预防成人抗生素相关性腹泻和初级预防艰难梭菌感染方面也表现出显着效果。
益生菌-益生元联合使用减少肠杆菌:
60名健康绝经前日本女性连续摄入发酵豆奶(含异黄酮)和干酪乳杆菌Shirota,能够降低肠道杆菌的粪便水平,并提高异黄酮的生物利用度。
当然以上只是小规模研究,还需进一步研究。
在人类中,一些临床干预可能会促进肠杆菌的肠道携带。益生菌可能有助于根除肠道携带的致病性或耐药性肠杆菌。
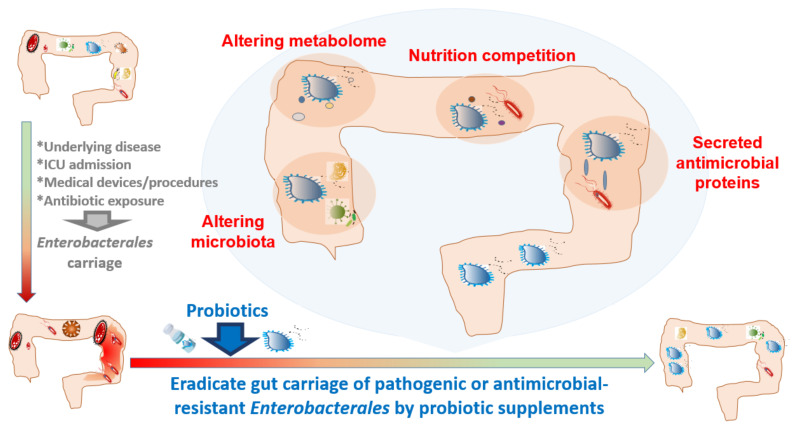
doi:10.3390/antibiotics10091086
综上,益生菌不能定植并不能说就是无效的,它有各种方式来影响人体健康。
“
广谱益生菌无论是否定植,在一定程度上都可以为我们的健康带来益处。当然每个人的菌群特征各不相同,结合肠道菌群检测结果,根据自身菌群特征,选择适合自己的益生菌,可以更加快速有效地帮助建立或恢复健康的菌群。
在服用益生菌的同时,如果能注意上述合理的饮食、健康的生活方式等,相当于开启了外挂,对于快速恢复菌群具有重要意义。主要参考文献:
Yan F, Polk DB. Probiotics and Probiotic-Derived Functional Factors-Mechanistic Insights Into Applications for Intestinal Homeostasis. Front Immunol. 2020;11:1428. Published 2020 Jul 3. doi:10.3389/fimmu.2020.01428
Hung, Yuan-Pin et al. “The Potential of Probiotics to Eradicate Gut Carriage of Pathogenic or Antimicrobial-Resistant Enterobacterales.” Antibiotics (Basel, Switzerland) vol. 10,9 1086. 8 Sep. 2021, doi:10.3390/antibiotics10091086
Wieërs G, Belkhir L, Enaud R, et al. How Probiotics Affect the Microbiota. Front Cell Infect Microbiol. 2020;9:454. Published 2020 Jan 15. doi:10.3389/fcimb.2019.00454
Pickard, Joseph M et al. “Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease.” Immunological reviews vol. 279,1 (2017): 70-89. doi:10.1111/imr.12567
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21. doi: 10.1016/j.cell.2018.08.041. PMID: 30193112.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722. doi: 10.3389/fcimb.2021.609722. PMID: 33791234; PMCID: PMC8006270.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076. doi: 10.1016/j.biotechadv.2018.09.003. Epub 2018 Sep 26. PMID: 30266342.
Eloe-Fadrosh, Emiley A et al. “Functional dynamics of the gut microbiome in elderly people during probiotic consumption.” mBio vol. 6,2 e00231-15. 14 Apr. 2015, doi:10.1128/mBio.00231-15