 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
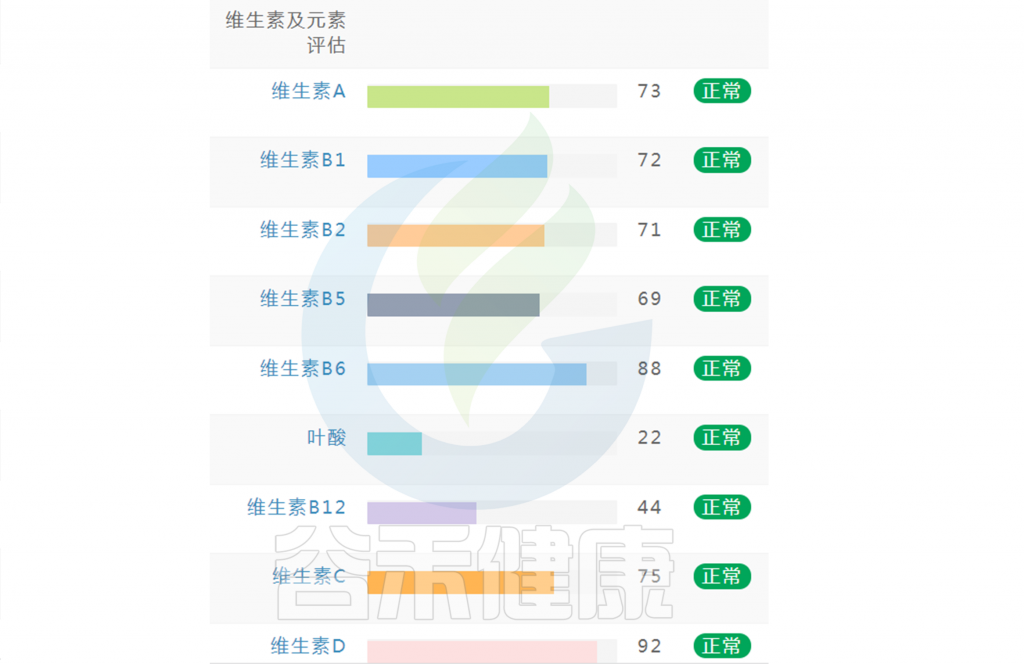
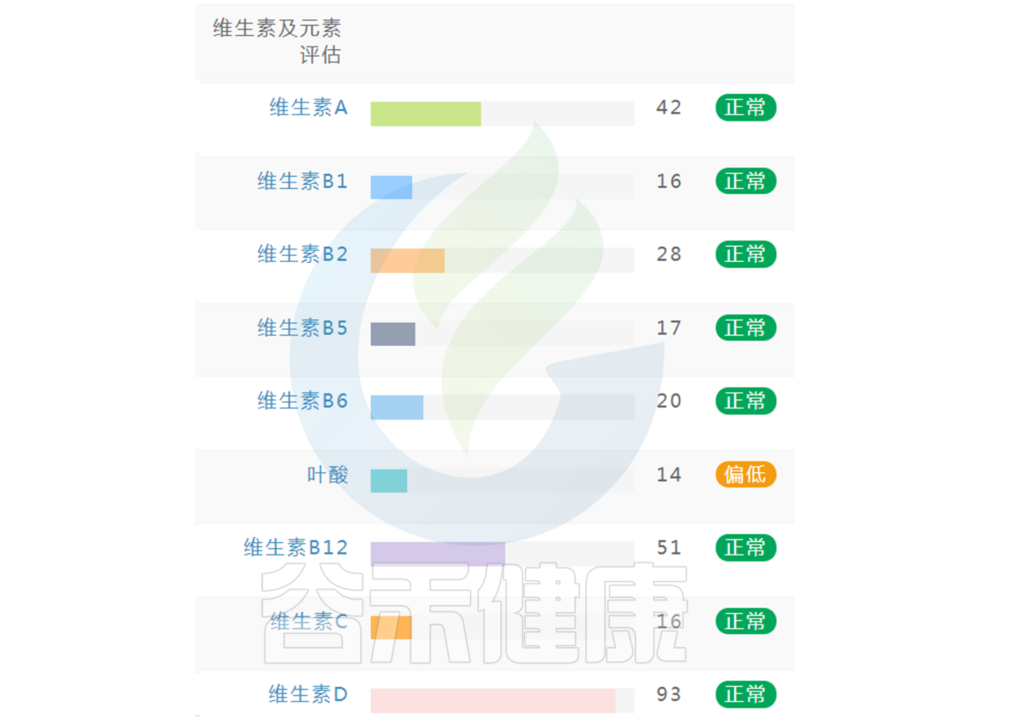
在谷禾肠道菌群健康检测中,我们会看到结果报告中关于维生素的评估如下:

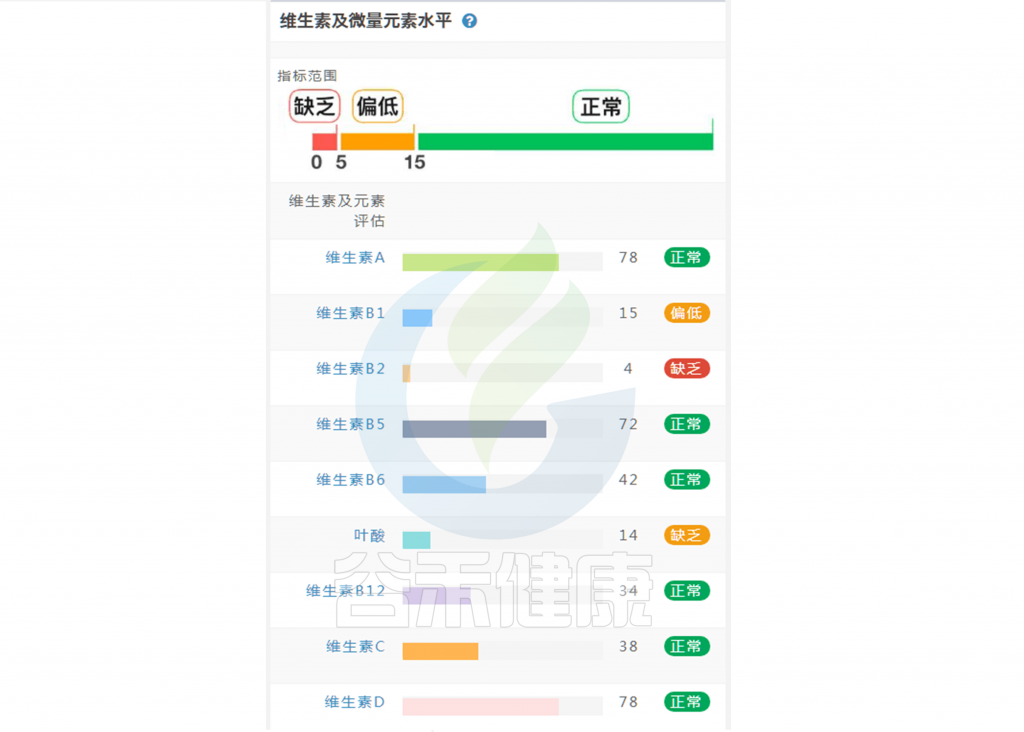
摄入水平建议保持在70-80分之间最佳,如果单项指标低于5表明摄入比例在人群中属于最低的5%,评估为缺乏,如上图中维生素B2;低于15评估为偏低,如上图中叶酸;达到或超过95则表明该项指标可能摄入比例偏高,可适当减少摄入;其余则为正常范围。
上图可以看到,像维生素C这项指标分值在38,虽然正常但相对于最佳来说是偏低的。
一些小伙伴可能会存在这样的疑惑:
为什么肠道菌群检测可以评估维生素?
这些维生素指标的分值代表着什么含义?
肠道菌群和维生素之间有什么样的关联?
它们如何影响人体健康/疾病?
如何判断维生素是否缺乏?
该如何补充?
…
本文就以上问题进行详细解答,同时也包括维生素-微生物群之间的相互作用,维生素维持肠道菌群稳态和减少肠道炎症以预防癌症的机制,产生维生素的益生菌,补充调节维生素的方式包括饮食、益生菌等。
在阅读本文之前,可以先了解一下各类常见的维生素功能,缺乏导致的症状。


每个维生素的详细介绍可以点开以下查看(请在谷禾健康微信公众号找到这篇文章查看)。
维生素B1(硫胺素)
维生素B2(核黄素)
维生素B3(烟酸)
维生素B5(泛酸)
维生素B6(吡哆醇)
维生素B7(生物素)
维生素B9(叶酸)
维生素B12(钴胺素)
以上每个都有关于该维生素的详细介绍,包括:
—正文—
维生素是一种微量营养素,在人体的生长、新陈代谢和发育中起着至关重要的作用。
在谷禾肠道菌群健康检测报告中,维生素分值即代表该维生素的膳食摄入水平和菌群代谢能力(报告中显示的分值是经过一系列计算得到的一个相对值)。
其中B族维生素很多需要通过肠道菌群对初始原料进行代谢之后才会产生,因此肠道菌群相应的基因和代谢途径的丰度水平也会直接反映这些维生素的摄入水平。
我们知道维生素的缺乏可能引起一些不良后果,导致维生素缺乏的原因有很多,摄入不足,吸收不良等都会导致维生素缺乏。
我们日常主要从饮食中获取维生素,肠道是主要吸收部位。例如,维生素 A 主要在近端空肠吸收,维生素 D 在远端空肠吸收最佳,维生素 E 和 K 主要在回肠吸收。因此,肠道功能受损可能会影响维生素的吸收。当然,影响维生素吸收的其他原因还包括年龄,某些疾病,药物等因素。
那么肠道菌群和维生素之间有什么关联?
肠道菌群是人体生理和健康的重要决定因素。肠道菌群帮助吸收营养,并参与维生素代谢。
肠道有益菌:乳酸菌和双歧杆菌,可以重新合成B族和K族维生素,为宿主提供约30%的每日摄入量。与从食物中获得的维生素不同,微生物产生的维生素主要在结肠中吸收。接下来了解一下具体哪些菌群,如何产生维生素。
前一章节我们知道,除了通过饮食提供维生素外,人体肠道中的细菌也可以产生一些维生素,如果吸收得当,可以部分满足人体的需要。
可以把这些细菌微生物想象成小小的维生素工厂。细菌确保为自己和与他们共生的微生物朋友提供维生素,同时也会为人体提供维生素。
合成的B族维生素的菌群较多
研究人员估计了人体肠道细菌可以提供维生素每日参考摄入量的百分比,得出的结论是可以提供:
40-65% 的人体肠道菌群具有合成 B 族维生素的能力。两种最常见的合成维生素是维生素B2和B3,预测分别有 166 和 162 个生产者。
可以合成 B 族维生素的细菌以及B 族维生素缺乏对肠道健康的影响
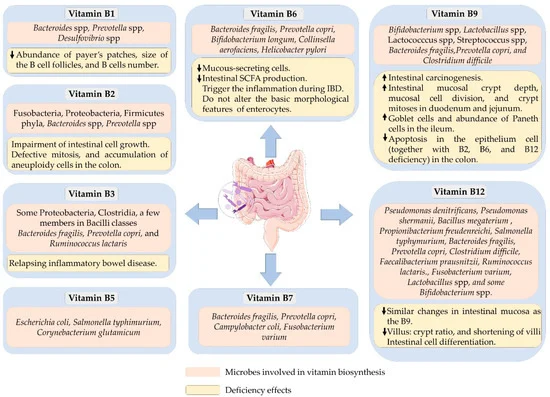
doi.org/10.3390/microorganisms10061168
大部分肠道菌群都参与维生素的合成
随着基因组注释方法的不断完善,研究人员可以预测维生素代谢途径并评估维生素生物合成潜力。通过检索 UniProt 数据库,研究人员发现:
厚壁菌门是维生素的主要代谢相关菌,其次是变形菌门,再然后是拟杆菌和放线菌。这四种菌群是人体肠道菌群的主要组成部分,占总菌群的60%-90%.
下表列出了参与合成B族维生素的肠道菌群,以及相应的代谢机制。


以上是肠道菌群对维生素产生的影响,而维生素和肠道菌群之间的作用是双向的,维生素也会影响肠道菌群,下一章节我们详细了解维生素对肠道菌群的影响。
维生素通过调节免疫力、细菌生长和新陈代谢来改变肠道微生物群的组成。
例如,膳食补充剂中的维生素 B、C、D 和 E 通过有利于双歧杆菌、乳酸杆菌和罗斯氏菌等有益菌属的肠道黏膜扩张和定植,在很大程度上有助于微生物组的组成。
肠道微生物组和宿主之间的微量营养素交换
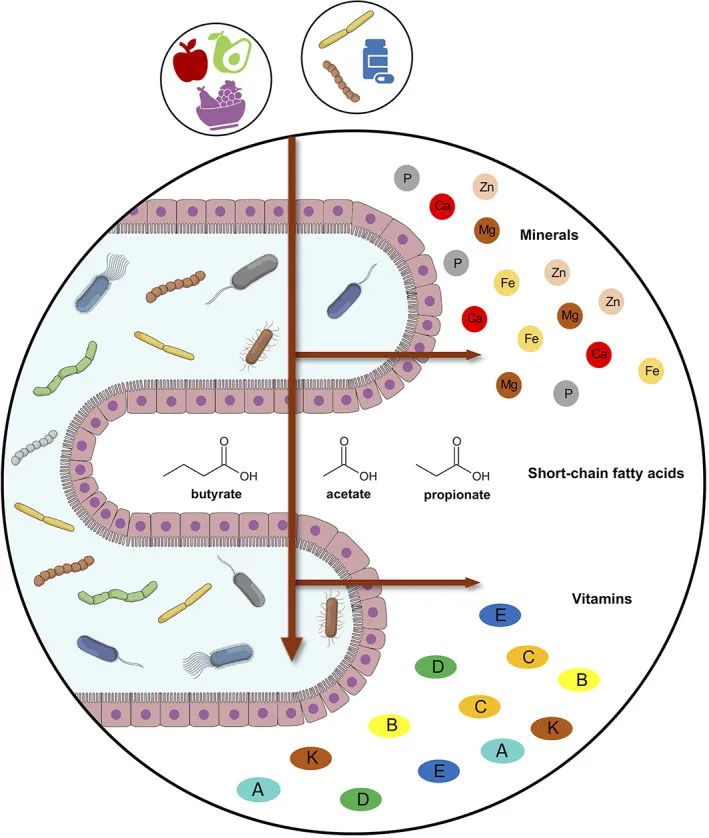
doi: 10.1002/biof.1835
一项研究调查了 96 名健康志愿者,结果表明:
补充维生素 B2 后肠道微生物的种类数量显着增加;联合补充维生素 B2 和 C 导致Sutterella显着减少,但Coprococcus数量增加;
维生素C显着提高肠道微生物的α多样性;
服用维生素D后,促进放线菌的生长和抑制拟杆菌的生长。
补充维生素对人体肠道菌群的影响

doi.org/10.3390/nu14163383
/ 维生素A /
维生素 A 的充足状态可能与微生物多样性增加有关。在小鼠实验中,普通拟杆菌(Bacteroides vulgatus )在维生素 A 缺乏期显着增加。维生素 A 缺乏导致的粘膜反应受损,粘蛋白和防御素 6 表达减少,可能使病原菌更容易穿透肠道屏障。
维生素A缺乏使厚壁菌门中毛螺菌_NK4A136_群、厌氧菌、颤杆菌的数量减少,毛螺菌的含量也降低;然而,Parasutterella呈上升趋势。TLR4 可能参与了维生素 A 调节微生物群的过程。
/ B族维生素 /
研究人员在一个小的成年志愿者群体中进行了一项试点研究,该群体补充了过量核黄素(100mg),持续14天。他们发现,在补充期间,每克粪便中的Faecalibacterium prausnitzii数量增加。作者还注意到厌氧菌Roseburia 增加,大肠杆菌减少。
其他关于B族维生素对肠道菌群的影响详见:
/ 维生素C /
补充维生素 C 可减少肠杆菌科细菌的数量,增加乳酸杆菌的丰度,抑制有害菌的生长,促进有益菌的增加。
也有研究表明,维生素 C 服用4周导致 α 多样性增加,短链脂肪酸浓度增加。

/ 维生素D /
维生素 D 和肠道微生物群的相互作用对免疫稳态至关重要。补充高水平的维生素 D 增加了普氏菌,减少了韦荣氏菌和嗜血杆菌。
婴儿饮食中补充维生素 D 对早期微生物组成的变化有重要影响,而儿童缺乏维生素 D 会导致细菌多样性降低。
最近的一项研究表明,维生素D的活性代谢物1,25-二羟基胆钙化醇,维生素D受体的配体(VDR),影响美国不同地区老年人肠道菌群的α -和β -多样性。
研究人员报告了通过食物频率问卷评估的微量营养素摄入量与孕妇微生物群组成之间的相关性。他们观察到,高脂溶性维生素,特别是维生素D的膳食摄入量与微生物α多样性降低有关(P值<0.001),维生素D和视黄醇与变形菌相对增加有关,变形菌门是一个已知包含多种病原体并具有促炎特性的门。
/ 维生素E /
维生素E对变形菌有抑制作用,而维生素E(和纤维)的摄入量较低与Sutterella水平较高相关,据报道,自闭症和某些胃肠道疾病婴儿的Sutterella水平大量增加。
体外维生素E 可以防止几种人类病原体的生物膜形成,特别是金黄色葡萄球菌和表皮葡萄球菌。
/ 维生素K /
一项动物实验表明,缺乏维生素 K 的小鼠的肠道中,瘤胃球菌、毛螺菌科、Muribaculaceae的含量较多。
关于维生素对人体肠道微生物组直接影响的研究
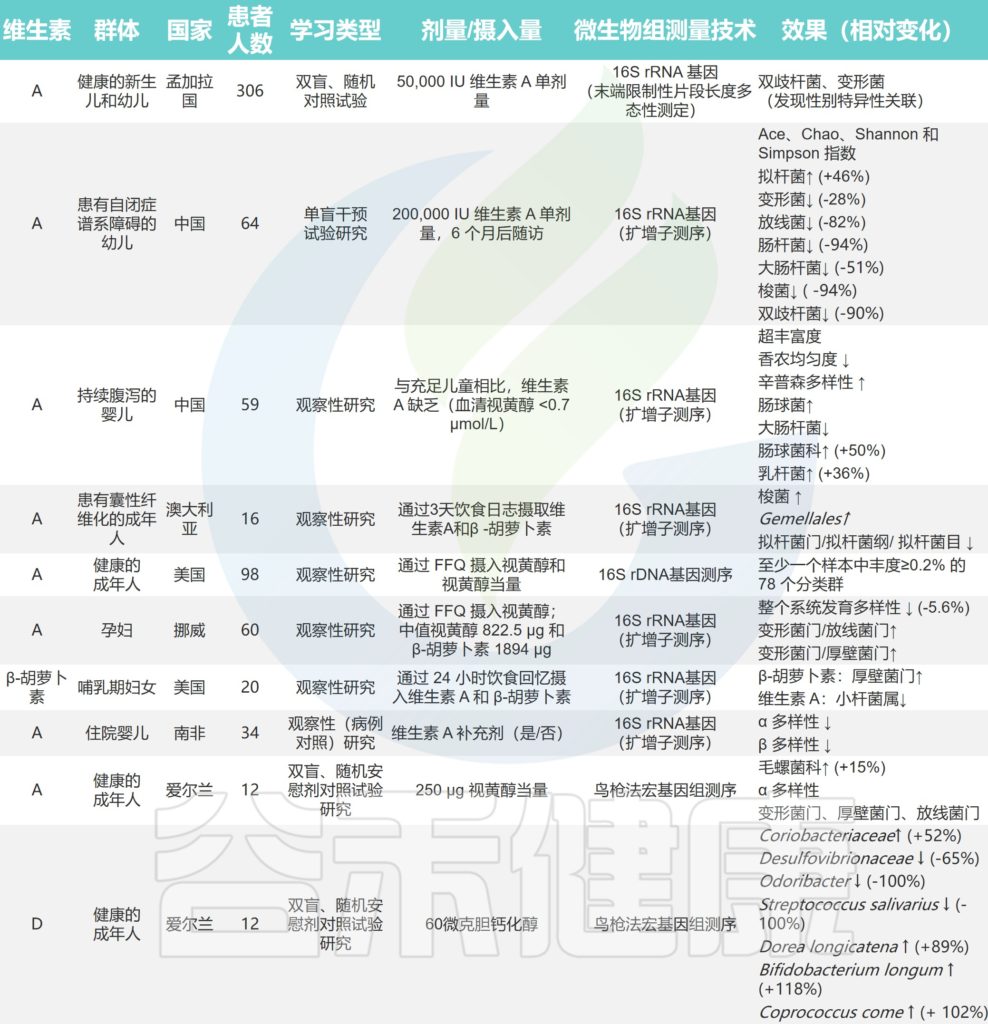
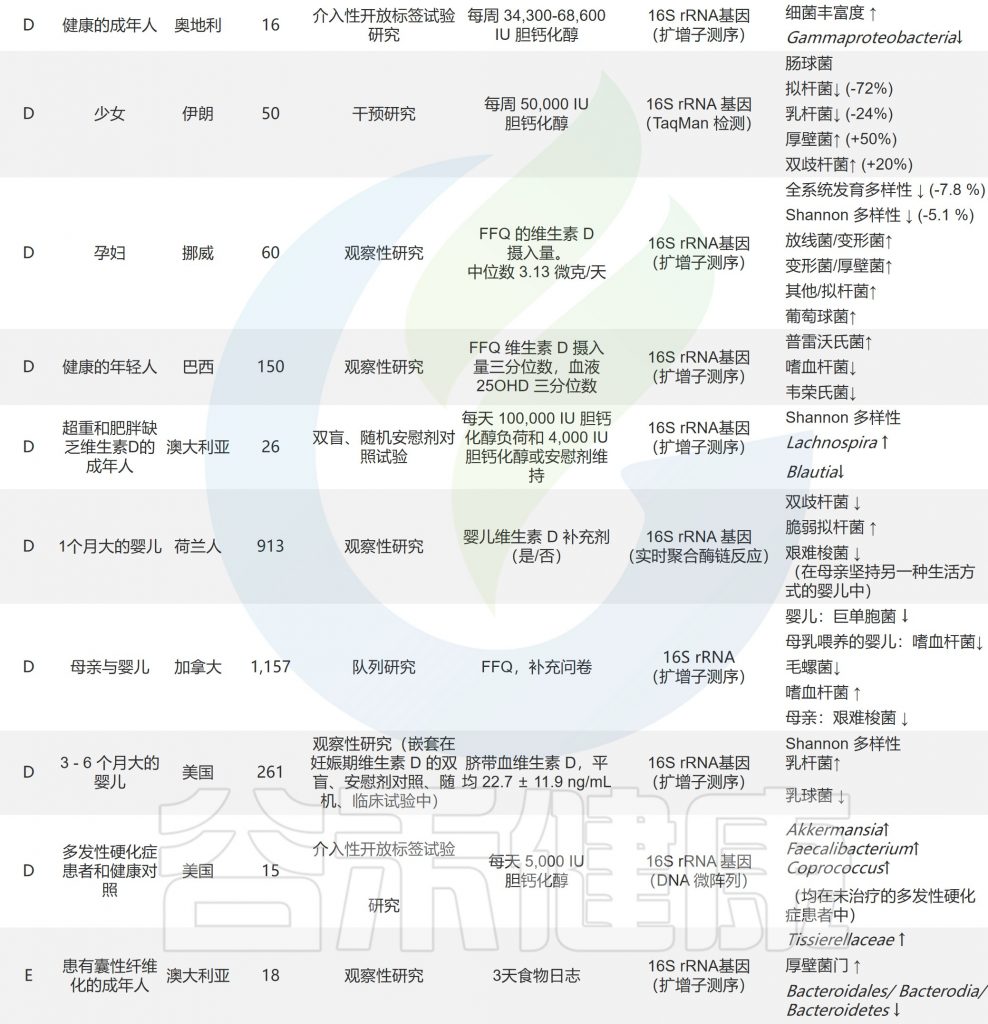
doi.org/10.1016/j.nutres.2021.09.001
饮食是维生素的主要来源,通过饮食补充维生素也会影响菌群。
注:由于测试饮食干预效果所需的随机试验的样本量和持续时间,相关发病率的研究具有挑战性。此外,由于特定的营养素不是孤立地消耗的,而是作为饮食模式的一部分,并且饮食成分之间相互作用,因此饮食带来的实际影响可能只有作为一个整体考虑时才会变得明显。
因此这里我们主要考虑饮食模式,例如地中海饮食等饮食方式。
地中海饮食是营养均衡饮食的典型代表,其特点是大量且频繁地摄入重要的纤维来源(谷物、蔬菜、豆类、水果和坚果)和具有抗氧化特性的化学成分(维生素、类黄酮、植物甾醇、矿物质、萜烯和酚类)。

同时地中海饮食还富含复杂和不溶性纤维含量。我们知道,大量摄入膳食纤维可促进肠道中有益菌群的生长,例如增加拟杆菌、普雷沃氏菌属、罗斯氏菌属、瘤胃球菌属、普拉梭菌等菌属的丰度,从而在肠道中产生高水平的短链脂肪酸,包括丁酸盐。
响应地中海饮食而增殖的细菌可以充当“基石”物种,也就是说它们对于稳定的“肠道生态系统”至关重要。这些变化主要是由于膳食纤维和相关维生素和矿物质的增加,特别是维生素C、B6、B9、铜、钾、铁、锰和镁。
总之,维生素似乎是微生物-宿主间代谢相互作用的重要媒介。
越来越多证据表明,维生素缺乏会导致肠道菌群紊乱,进而引发肠道疾病,甚至促进炎症和肿瘤的发展。下一章节详细讨论,维生素-微生物群相互作用对健康/疾病的影响。
最近的几项观察表明,微生物群失调和维生素缺乏是相互关联的。
维生素对宿主健康的影响

doi.org/10.1016/j.nutres.2021.09.001
这种关系可能直接影响宿主健康:例如,克罗恩病恶化与参与抗炎介质核黄素、硫胺和叶酸生物合成的微生物基因减少有关。
此外,2型糖尿病受试者在与微生物介导的维生素代谢相关的基因丰度谱中显示出显著变化。
营养不良儿童的微生物群显示,参与B族维生素代谢的多种途径(包括烟酸/NADP生物合成)显著减少。
在经历饮食振荡以诱导急性短期维生素A缺乏的灵长类小鼠模型中,Hibberd等人观察到细菌群落结构和宏转录组的调节,其中Bacteroides vulgatus是显著的应答者,在缺乏维生素A的情况下其丰度增加。有趣的是,B.vulgatus是在人类肠道微生物群的灵长类小鼠模型中鉴定的一种生长差异物种。
所有这些观察结果表明,维生素缺乏可能会改变肠道微生物群,从而影响人体健康。
下面我们以肠道疾病和精神类疾病两大类疾病为例,来具体了解维生素-微生物相互作用及其在疾病中的影响。
维生素 A 和 D 分别在近端和远端空肠吸收。维生素E和K主要在回肠吸收;微生物产生的维生素主要在结肠中吸收。维生素缺乏会加重肠道炎症,甚至通过多种机制促进癌症。
肠道菌群->维生素->肠道疾病中的作用
慢性 IBD 发生和发病机制中的关键作用是微生物(尤其是共生菌群)对宿主黏膜免疫功能的影响。同时,肠道微生物群和慢性炎症已被证明与肿瘤发生密切相关。
维生素具有调节肠道菌群和保护肠道的功能。因此,维生素和微生物群的相互作用可能在 IBD 和结直肠癌的治疗中具有巨大的潜力。
维生素A通过促进黏膜愈合、促进产生ASCFA的相关菌增加、降低UC相关菌的水平来达到治疗UC的效果。
费氏丙酸杆菌ET-3 产生维生素 K2 的前体,即 1,4-二羟基-2-萘甲酸 (DHNA),可激活芳烃受体 (AhR) 以改善结肠炎并调节肠道微生物群。
维生素 D 的缺乏会增加拟杆菌门、变形杆菌门和螺杆菌科的丰度,降低厚壁菌门和去铁细菌的丰度门,并且还影响 E-钙粘蛋白表达并减少耐受树突状细胞的数量。
然而,在治疗 IBD 时,维生素 D 与利福昔明的共同给药会影响肠道菌群和利福昔明的疗效。维生素 D 促进A. muciniphila的生长以保护肠粘膜屏障,这些作用对于对抗结直肠癌的发展尤为重要。
研究表明,维生素 E 及其代谢物在调节肠道菌群、减少炎症和抑制癌变方面具有巨大潜力。此外,维生素 Eδ-生育三烯酚 (δTE) 及其代谢物δTE-13′-羧基色原酚 (δTE-13′) 增加了肠道中的乳球菌和拟杆菌,并抑制炎症因子的产生。
维生素->肠道菌群->肠道疾病中的作用
▸维生素在IBD和结直肠癌中的作用不容忽视
大量临床研究表明,缺乏维生素 B 和维生素 D 的人群中结直肠癌的患病率较高。同时,IBD 的长期不愈合使患者面临更高的结直肠癌风险。维生素 D 水平低的 IBD 患者疾病严重程度和预后较差。
▸为什么肠道炎症容易导致癌症高风险?
在炎症背景下,敲除 IKKbetaβ(炎症与癌症之间的联系)可减少由于上皮细胞凋亡增加而导致的癌症发生。在一项关于结肠炎相关癌前癌 (CApC) 的研究中,IL-6 反式信号转导的存在增加了炎症性致癌的风险。如果不及时治疗,由肠道菌群紊乱和维生素缺乏引起的肠道炎症最终可能发展为癌症。
维生素 A 在肠道炎症和癌症中的作用
维生素 A 及其活性代谢物视黄酸 (RA) 在人体免疫系统中发挥着关键作用,并可能对辅助 T 细胞的分化产生影响。
炎症下:视黄酸从保护转变为破坏作用
在非炎症条件下,视黄酸能够抑制 IL-6 受体的表达和 Th1/Th17 的产生。
在炎症条件下,视黄酸从对粘膜的保护作用转变为破坏作用;这反映在活动期 IBD 患者黏膜中视黄酸水平显着升高,伴随着 CD4 和 CD8 分泌的 IL-17 和 IFN-γ 的上调。
维生素A及其代谢物:发挥抗炎作用
维生素 A 及其代谢物通过阻断 Th1 和 Th17 的激活,抑制 IL-17、INF-γ 和 TNF-α 的产生而显示出抗炎作用。同时,它们可以通过与TGF-β协同作用,提高Foxp3的水平,发挥免疫功能,从而促进抗炎因子的发挥。
一项数据显示,低水平的维生素 A 会激活核 NF-kB 并促进胶原蛋白的形成,从而加剧结肠炎的炎症。补充维生素后,肠道炎症明显缓解。
全反式维甲酸 (AtRA) 可降低 UC 和结直肠癌患者结肠黏膜分泌的 TNF-α 和一氧化氮合酶 2 (NOS2) 蛋白的表达。

维生素A保护肠黏膜屏障,其潜在机制是拮抗LPS的肠道破坏作用
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展的影响的检查中,研究人员使用葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎;此外,偶氮甲烷 (AOM) 预注射和 DSS 结肠炎的组合诱导了结直肠癌。缺乏维生素的小鼠肠道炎症水平较高,黏膜愈合较慢,免疫反应增强,更容易发生结直肠癌。
AtRA具有抗癌作用,结直肠癌中AtRA 水平降低
在结直肠癌小鼠模型中,肠道细菌引起的炎症影响 AtRA 代谢;这导致其水平下降。在 UC 及其相关结直肠癌的临床样本中发现 AtRA 代谢酶活性降低和 AtRA 水平降低。同时,AtRA通过激活CD8 + T细胞发挥抗癌作用;这为 CAC 的治疗提供了新的见解。
视黄醇和视黄醇结合蛋白(RBP)的结合激活致癌基因STRA6,促进结直肠癌的发生;Holo-RBP/STRA6 通路可通过促进成纤维细胞的致癌作用进一步发挥致癌作用。
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展影响的动物实验中,当维生素 A 处于低水平时,小鼠体内的维生素 A 脂滴会被降解,免疫反应会增强,结肠炎症会加重,癌变进程将加快。
维生素 B12 和叶酸在肠道炎症和癌症中的作用
IBD 患者缺乏维生素 B12 和叶酸的原因有很多,包括回肠和空肠微生物过度生长、维生素 B12 摄入不足或身体需求增加、维生素肠道破坏增加或吸收能力降低、某些药物(如甲氨蝶呤或柳氮磺胺吡啶)的不良反应、一些病理原因例如蛋白丢失性肠病、肝功能异常、回肠相关病变或手术切除、肠瘘等。
维生素 B12 缺乏不会影响健康的肠道微生物群组成;然而,它会导致实验性结肠炎中肠道菌群失调,并促进条件致病菌的生长。出乎意料的是,维生素 B12 缺乏减少了结肠组织的损伤;这可能与抗炎细胞因子 IL-10 的增加有关。

对甲基缺乏饮食 (MDD) 的潜在作用进行了一项研究,该饮食可降低维生素 B12 和叶酸的血浆浓度,并提高同型半胱氨酸水平,对 DSS 诱导的小鼠结肠炎的影响。喂食 MDD 的 DSS 治疗小鼠比其他治疗组患有更严重的结肠炎。
尽管超氧化物歧化酶和谷胱甘肽过氧化物酶活性保持稳定,但 caspase-3 和 Bax 的水平受到影响。除Bcl-2表达增加外,炎症相关标志物如胞质磷脂酶A2和环氧合酶2的表达也有明显增加趋势;这伴随着金属蛋白酶组织抑制剂(TIMP)3蛋白的表达降低。因此,维生素 B12 缺乏可能会加重实验性 IBD 的炎症程度。
高维生素 B12 水平可通过减少 DNA 甲基化来降低结直肠癌的风险
在结直肠癌患者中,与低血清维生素 B12 组相比,高维生素 B12 组的肿瘤区域和外周血单个核细胞 (PBMC) 中长散布的核元素 1 (LINE1) 甲基化被证明是降低的;肿瘤区域的LINE1甲基化水平也低于周围的非肿瘤区域。
氧化应激是结直肠癌发病机制之一;此外,叶酸和维生素 B12 的水平与体内抗氧化剂谷胱甘肽的水平呈正相关。提高 AOM 诱导的结直肠癌中的叶酸和维生素 B12 水平显示出显着的抗凋亡、抗氧化应激和抗 AOM 细胞毒性。
在对 4517 名 IBD 患者的系统评价和荟萃分析中,补充叶酸被证明可以降低 IBD 患者的结直肠癌风险并防止结直肠癌发展。
有趣的是,有证据表明缺乏甲基供体营养素叶酸、胆碱、蛋氨酸和维生素 B12 会抑制 Apc 突变小鼠的肿瘤发展。总而言之,维生素B12和叶酸在肠道疾病中的作用需要更深入的研究。
维生素 D 在肠道炎症和癌症中的作用
流行病学和动物实验表明,维生素 D 缺乏是 IBD 和 结直肠癌的高危因素。维生素 D 补充剂有助于降低疾病严重程度,可能通过多种机制,包括调节免疫细胞运输和分化,以及抗菌肽合成。
维生素D可以维持肠黏膜屏障的正常功能,提高机体的先天性和适应性免疫
1α,25-二羟基维生素 D3(骨化三醇)是维生素 D 的活性形式,可与 TGF-β 结合,提高 IL-2 水平,调节 T 细胞抑制炎性细胞因子的产生,增强 Foxp3 + Treg 细胞的存活和功能。

维生素D受体(VDR)是维生素D调节免疫和发挥抗炎作用的重要途径
相关资料显示,VDR对肠道有保护作用;它可以通过调节 JAK/STAT 通路来维持肠道稳态并预防癌症。
在 IBD 患者 中,结肠上皮中VDR的含量明显低于正常人。在实验性结肠炎模型中,与缺乏 VDR 的小鼠相比,表达 hVDR 的转基因小鼠的结肠炎症较少。用 hVDR 转基因恢复上皮 VDR 表达可减轻严重结肠炎并降低死亡率。内在机制是 VDR 通过抑制 NF-κB 活化发挥抗凋亡作用,以保护肠道屏障缓解结肠炎。
肠道菌群通过犬尿氨酸通路(合成维生素),在精神健康方面发挥作用
关于肠道细菌在心理健康方面的作用的关键方面,是它们通过犬尿氨酸通路参与调节色氨酸代谢。微生物群能够合成犬尿氨酸途径 (KP) 的酶促辅助因子,如维生素 B2 和 B6。

犬尿氨酸是主要的色氨酸代谢途径,其中 95% 的这种氨基酸被代谢为各种免疫和神经调节犬尿氨酸/色氨酸分解代谢物 (TRYCAT),在大脑中,犬尿氨酸途径主要在神经胶质细胞中分隔。
犬尿氨酸通路在精神、神经退行性和神经系统疾病中的作用是至关重要的,包括重度抑郁症,双相情感障碍,精神分裂症,阿尔茨海默病,亨廷顿病和帕金森病,与 HIV 感染相关的痴呆,手术后认知能力下降,肌萎缩侧索硬化(ALS) 等。
精神病理学和炎症中维生素缺乏与高同型半胱氨酸血症有关
精神病理学和炎症中维生素缺乏的另一个关键机制与高同型半胱氨酸血症(hHcy)有关,这可能是由叶酸、维生素 B6 和 B12 缺乏引起的。
高同型半胱氨酸血症和维生素 B 缺乏在重度抑郁症、精神分裂症、双相情感障碍、自闭症、焦虑症和痴呆症(包括阿尔茨海默病和帕金森病)中起关键作用。
同型半胱氨酸(Hcy)是在蛋白质消化过程中获得的另一种氨基酸蛋氨酸代谢过程中形成的氨基酸和中间体。该反应需要维生素 B12 作为酶促辅因子和叶酸衍生物(5-甲基四氢叶酸)作为甲基供体。
注:Hcy-同型半胱氨酸,是人体内含硫氨基酸的一个重要的代谢中间产物,可能是动脉粥样硬化等心血管疾病发病的一个独立危险因子。
此外,Hcy 可以在需要维生素 B6 作为酶辅因子参与的途径中转化为半胱氨酸。
因此,Hcy 被认为是叶酸和维生素 B12 缺乏的敏感标志物。
高同型半胱氨酸血症导致神经和精神病理学的机制包括:
促进免疫炎症反应、增加肠道和血脑屏障通透性、NMDA受体激动和神经毒性、诱导神经元凋亡、氧化应激、线粒体功能障碍和由于甲基化受损导致的单胺能神经递质合成失调。
目前对体内维生素水平的检测例如:
抽取血液检测其中维生素的含量水平,可以判断是否存在维生素的缺乏情况。
其他,例如通过肠道菌群健康检测,也可以查看近期体内维生素状况。
与通过血液进行维生素检测不同,肠道菌群的评估更加反映一段时间 ( 一般2周左右 ) 的长期状态,如部分B族维生素无法在体内留存,需要每日补充,血液检测波动较大。
注:菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食 ,这样能更好的反映真实的营养饮食状态。
在了解补充维生素的干预措施之前,我们先从肠道菌群的角度,来了解一下影响维生素合成吸收的因素。
人类基因的变异与肠道结构和微生物组组成有关。人类肠道微生物群中存在不同的维生素 B 生物合成途径支持人类遗传变异影响维生素 B 合成的观点。
维生素的合成吸收不仅需要靠饮食补充,还与吸收相关。而维生素的吸收涉及到相关基因,例如:
MTHFR 基因的突变会影响我们产生加工维生素 B9的酶——亚甲基四氢叶酸还原酶。
亚甲基四氢叶酸还原酶是叶酸代谢通路中的一种重要的辅酶,亚甲基四氢叶酸还原酶基因缺陷,容易造成叶酸在体内的代谢障碍,MTHFR基因最主要的两种突变为C677T、A1298C基因多态性。该两种位点同时突变可显著降低MTHFR活性进而降低叶酸水平。
VDR基因(维生素 D 受体):维生素 D(来自阳光、食物或补充剂)经过转化步骤后,活性形式骨化三醇 (1,25(OH)2D3 ) 可以通过VDR在细胞内发挥作用,是打开或关闭基因的转录因子。该基因突变可能导致维生素D缺乏引起的佝偻病。
维生素缺乏是一个严重的问题,尤其是在老年人中。随着年龄的增长,营养需求会随之变化。
由于食物中的维生素B12 需要胃酸及胃蛋白酶的作用才能释放出来被吸收,而老年人胃酸及胃蛋白酶分泌减少,就会影响维生素B12 的吸收。
患有维生素B12缺乏症的老年人可能出现神经精神或代谢缺陷。
一些药物会改变营养物质的吸收或代谢方式。例如,抗惊厥药也会减少叶酸的吸收。
肠道菌群通过各种代谢途径影响维生素的合成,例如拟杆菌属、肠球菌属和双歧杆菌属等人类肠道共生菌可以从头合成维生素 K 和大多数水溶性 B 族维生素,这在前面第二章节的表已经详细阐述。
在 B 族维生素合成中暴露于抗生素的反应因使用的抗生素类型而异。例如,在饮食中添加青霉素和金霉素会增加雄性大鼠的肝脏维生素 B2 浓度,以及 B2 和 B3 在尿液中的排泄。然而,链霉素和放线菌酮的施用降低了肝脏中维生素 B9 和 B12 的浓度。维生素合成对抗生素暴露的混合反应尚不清楚,但它们可能是由肠道微生物群的选择性改变引起的。
自由基是含有不成对电子的化学物质,可以诱导氧化应激。一个这样的例子是一氧化氮,它与金属离子形成复合物,包括钴,维生素 B12 的一种结构成分,因此使其无法用于细菌维生素 B12 的生物合成。此外,维生素生产者(如脆弱拟杆菌)暴露于过氧化氢等自由基会抑制其生长 ,从而降低维生素的生物合成能力。
维生素主要在小肠中吸收,其生物利用度取决于食物成分,相关相互作用等。
饮食和膳食的组成会通过影响肠道转运时间和/或混合胶束的肠道形成来影响某些维生素的吸收。
饮食中足量的水和膳食脂肪对于分别吸收水溶性和脂溶性维生素至关重要。
*水溶性维生素包括:B族维生素,维生素C;
脂溶性维生素包括:维生素 A、D、E 、K.
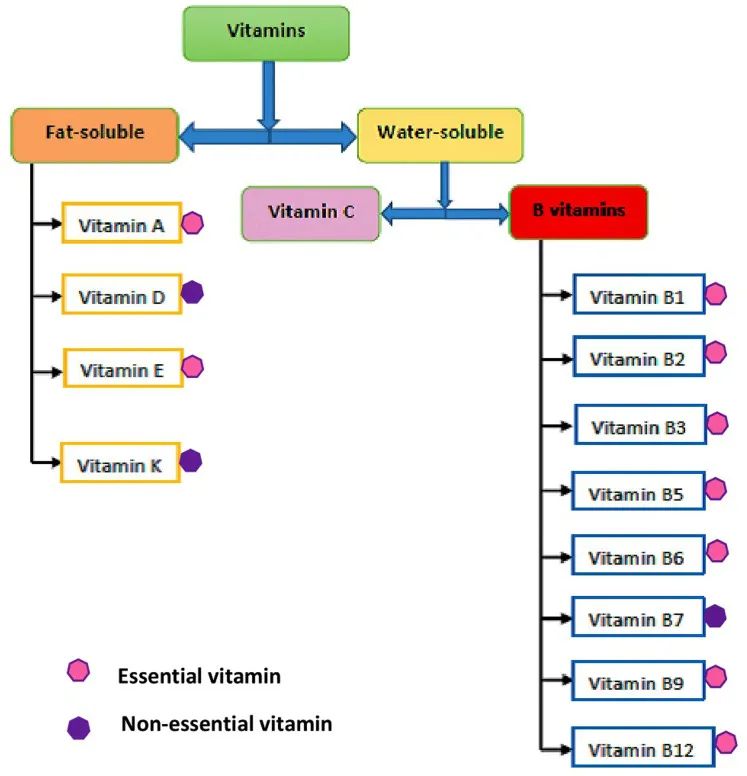
doi: 10.7717/peerj.11940
由于脂溶性维生素可以溶解在脂肪中,因此与膳食脂肪一起食用时最容易被吸收。例如,一种富含维生素 A 的小胡萝卜,如果单独食用,将在食物中获取维生素 A,但如果它是在含有一些膳食脂肪的食物成分中(比如说,橄榄油),将增加体内维生素 A 的吸收。
食物的性质(物理状态)也会影响维生素的吸收效率。例如,存在于可消化性较差的纤维植物材料中的类胡萝卜素已被证明相对于维生素A表现出较低的生物利用度。
当我们看到维生素缺乏的时候,可能希望通过饮食来补充相应缺乏的维生素,下表列出了常见的维生素的食物来源,可供参考。
此外,宿主饮食作为肠道中细菌的底物,其对肠道微生物分布的影响已被广泛研究。含有益生元和其他膳食营养素(如微量营养素和多酚)的饮食可以显着影响有益细菌的生长,包括维生素生产菌。
一些维生素,如核黄素,可作为氧化还原介质并刺激营养缺陷菌(如Faecaibacterium prauznitsii)的生长。
在即将形成共生关系的环境中,限制这些基质会增加微生物和微生物与宿主之间的竞争。
除了通过饮食直接补充之外,我们还可以通过补充益生菌来调节维生素水平,从而改善疾病。
双歧杆菌
在健康成人中补充益生菌菌株青春双歧杆菌DSM 18350、青春双歧杆菌DSM 18352 和假链双歧杆菌DSM 18353,导致粪便中叶酸浓度显着增加。
乳酸菌
乳酸菌通过不同的机制抑制炎症过程,包括调节IBD患者肠道菌群紊乱、保护肠道屏障和黏膜的正常功能、调节人体免疫反应等。乳酸菌通过产生核黄素(维生素 B2)和叶酸发挥抗炎和抗氧化作用。
产维生素的乳酸菌不仅对急性肠炎有抗炎作用,还能有效缓解复发性结肠炎。此外,在与美沙拉秦合用过程中,可有效降低不良反应,提高疗效。
研究人员发现注射产生叶酸的乳酸菌会缓解 5-FU 引起的肠炎小鼠的腹泻,改善结肠组织的结构和功能。这一发现降低了癌症化疗期间发生的肠黏膜炎症的严重程度,并提高了药物有效性;因此,这提高了患者的生活质量。
此外,乳酸菌 和 5-FU 的联合使用可减少 5-FU 引起的血细胞计数减少,并使患者获得完整的治疗周期。
产维生素的益生菌在肠道疾病中的作用

doi.org/10.3390/nu14163383
研究人员从 150 个收集的人类粪便样本中分离出三种产生核黄素和叶酸的益生菌;他们用它们来治疗乙酸引起的大鼠结肠炎。他们发现这些益生菌可以保护结肠黏膜,促进溃疡性病变的愈合;此外,它们具有抗炎和抗氧化应激作用。
一种新分离的具有产生叶酸能力的细菌——清酒乳杆菌LZ217,具有促进丁酸产生和改善肠道菌群组成的作用。
Akkermansia muciniphila 是肠道中的一种常见细菌,可调节 CLT 以保护肠道免受炎症和肿瘤侵袭;它还产生维生素 B12 以缓解 IBD 患者的维生素缺乏症。
研究发现,丙酸杆菌菌株 P. UF1 合成维生素 B12;这对肠道免疫和肠道健康有积极的调节作用。
大肠杆菌通过产生维生素来缓解 IBD. 使用大肠杆菌生产两种产生β-胡萝卜素的菌株来治疗维生素A缺乏症。这些结果显示出巨大的临床潜力。
维生素 A 及其代谢物与短乳杆菌KB290 的组合提高了 CD11c + MP/CD103-DC 比率;因此,这在结肠炎的治疗中起着积极的作用。
此外,肠道中的分段丝状细菌 (SFB) 可以产生 AtRA,以抵消感染对肠道的损害。
益生菌对维生素D及其受体活性有积极作用,如鼠李糖乳杆菌GG(LGG)和植物乳杆菌(LP);同样在沙门氏菌结肠炎模型中,使用 VDR (-/-) 小鼠验证 LGG 对 IBD 的缓解作用是通过 VDR 信号通路。
此外,胆汁盐水解酶 (BSH)活性罗伊氏乳杆菌NCIMB 30,242 可调节血浆中的活性维生素 D 水平。磷虾油 (KO)、益生菌罗伊氏乳杆菌和维生素 D 的混合物显着降低病理评分和炎症因子的释放,促进黏膜愈合并减少机会性感染的发生。
经益生菌 VSL#3 预处理后,VDR 水平显着提高,共同保护肠黏膜,防止损伤;这对预防CRC的发展起到一定的作用。
用从韩国泡菜中分离的乳酸菌条件培养基处理 HCT116 细胞或肠类器官后,其分泌的蛋白质 P40 和 P75 与 VDR 的表达增加有关;它们还增强自噬反应,共同具有抗炎作用。肠道微生物合成的石胆酸 (LCA) 充当连接 VDR 与微生物的桥梁,从而提高维生素 D 水平。
益生菌配方有助于抑郁症患者维生素水平的增加
一项随机对照试验中,重度抑郁症患者接受了多种益生菌配方,其中含有双歧杆菌W23、乳双歧杆菌W51、乳双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24、乳酸乳杆菌W19。
此外,益生菌组和安慰剂组的患者接受了相同剂量的维生素 B7。在两组中,抑郁症的临床参数都有所改善,然而,益生菌干预组与安慰剂组相比,仅在微生物 β 多样性方面存在差异,临床结果指标没有差异。有趣的是,尽管两组都接受了相同剂量的生物素,但接受益生菌的那组维生素 B6 和 B7 的合成上调。
多种益生菌相结合通过增加叶酸和维生素 B12血浆水平,改善精神疾病
八周的个性化饮食与含有多种益生菌的菌株相结合:婴儿双歧杆菌DSM 24737、长双歧杆菌DSM 24736、短双歧杆菌DSM 24732、嗜酸乳杆菌DSM 24735 、德氏乳杆菌、保加利亚乳杆菌DSM 24734、副干酪乳杆菌DSM 24733、植物乳杆菌DSM 24730 、嗜热链球菌DSM 24731 (VSL#3),在健康老年人中增加了叶酸和维生素 B12 血浆水平并降低了 Hcy 血浆水平。
此外,益生菌的添加导致粪便双歧杆菌浓度增加,这种变化与叶酸和维生素 B12 水平呈正相关。
在精神病患者中引入高同型半胱氨酸的评估和治疗可能非常有价值,益生菌可能成为治疗工具之一。
维生素是相互关联的、具有协同作用的微量营养素,当它们处于适当的平衡状态时,它们的全部潜力就会得到充分发挥。
因此,在食用益生菌和发酵食品时,应考虑维生素生产者与代谢者之间复杂的相互作用。
除了以上方式干预菌群之外,也可以通过良好的生活方式调理菌群,从而使维生素达到一个相对健康稳定的水平,减少各类疾病风险。
▸在服用维生素的同时可以服用益生菌吗?
可以。在大多数情况下,服用益生菌不会影响其他补充剂的效果。
一项 2021 年对临床试验的系统评价发现,益生菌可以改善健康人群的微量营养素水平,特别是维生素 B12、叶酸(维生素 B9)、钙、铁和锌。
2017 年的一项非随机临床试验发现,服用益生菌和铁补充剂的参与者比不服用益生菌的铁吸收明显更多。
有研究表明,维生素 D 和益生菌之间存在协同关系。
随机对照试验发现,维生素 D 补充剂与益生菌一起可以改善多囊卵巢综合征患者和同时患有冠心病的糖尿病患者的各种心理健康参数、一般健康状况、代谢和炎症标志物。
2019 年对随机对照试验的系统评价和荟萃分析发现,维生素 D 强化酸奶(富含益生菌嗜酸乳杆菌)有助于改善维生素 D 和胆固醇水平、代谢功能和身体测量值。
然而以上研究都没有单独研究维生素 D 和益生菌的作用,因此尚不清楚结果是否与两者的综合影响有关。
研究人员认为,无论有没有维生素,服用益生菌的时间很重要。作为一般规则,服用益生菌的最佳时间是空腹,大约在进食前 30 分钟。
研究人员担心胃酸的存在会影响益生菌的生存能力。在餐前或餐后几个小时服用时,当胃酸自然降低时,益生菌可以进入肠道,从而提高其生存几率。
何时服用维生素取决于维生素的种类。复合维生素通常最好在早上第一时间服用,非常适合搭配早餐前的益生菌。脂溶性维生素,如 A、D、E 和 K 以及一些矿物质,包括铁和镁,最好与食物一起服用。否则可能会导致胃部不适。
▸应该从食物中补充维生素还是通过维生素补充剂?
2020 年的一篇文献综述发现,与浓缩补充剂相比,许多微量营养素在其全食物形式中的生物利用度更高。因此提倡补充方式以食物为先。
一般认为,对于健康人来说,营养均衡的饮食可以提供身体需要的维生素,不需要额外补充,但对于可能存在免疫功能、肠道健康、吸收不良等问题的人群,可以考虑维生素补充剂进行补充,具体补充剂量请遵医嘱。
下表是维生素易缺乏的高风险人群:

▸可以长期服用维生素补充剂吗?补充过量会带来副作用吗?
一般健康人不需要长期服用维生素补充剂。
对于服用复合维生素片,多余的维生素会被排出体外,因此不用过于担心会带来危害。但是如果长期十倍以上的用量,对身体是有危害的。

doi: 10.7717/peerj.11940
在发现维生素缺乏的症状的时候,我们可能希望通过补充相应的维生素补充剂来改善健康。然而服用任何补充剂之前,我们应该寻找其根本原因而不是直接根据症状盲目补充。
通过肠道菌群健康检测可以了解维生素缺乏状况,且可以根据各类菌群丰度来推断维生素的菌群代谢状况。如果是由于菌群的代谢异常,可能直接补充并没有太大效果,这时候优先调节菌群或许是更好的选择。
如果维生素指标都显示正常没有缺乏(如下图),保持常规饮食不需要刻意补充。还想要更健康,指标更接近70的话,可以在数值略小的指标上,针对性地通过饮食进行补充调理。

如果维生素指标中出现个别指标缺乏或偏低(如下图),可以通过饮食针对性地进行改善调整,如果已经出现对应症状,例如缺乏维生素A,同时出现干眼症或者夜盲症等相应的症状,可以使用相应的维生素补充剂进行干预,或者根据菌群代谢通路判别,通过菌群调理进行相应干预。
如果维生素指标中出现缺乏或偏低的指标较多,则需要选用复合维生素,各类维生素之间可能存在协作关系,同时配合饮食、菌群进行干预。
选择补充剂,应优先考虑生产规范良好的产品,比如说可以查看是否有“OTC”标志。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.
Bellerba F, Muzio V, Gnagnarella P, Facciotti F, Chiocca S, Bossi P, Cortinovis D, Chiaradonna F, Serrano D, Raimondi S, Zerbato B, Palorini R, Canova S, Gaeta A, Gandini S. The Association between Vitamin D and Gut Microbiota: A Systematic Review of Human Studies. Nutrients. 2021 Sep 26;13(10):3378. doi: 10.3390/nu13103378. PMID: 34684379; PMCID: PMC8540279.
Ofoedu CE, Iwouno JO, Ofoedu EO, Ogueke CC, Igwe VS, Agunwah IM, Ofoedum AF, Chacha JS, Muobike OP, Agunbiade AO, Njoku NE, Nwakaudu AA, Odimegwu NE, Ndukauba OE, Ogbonna CU, Naibaho J, Korus M, Okpala COR. Revisiting food-sourced vitamins for consumer diet and health needs: a perspective review, from vitamin classification, metabolic functions, absorption, utilization, to balancing nutritional requirements. PeerJ. 2021 Sep 1;9:e11940. doi: 10.7717/peerj.11940. PMID: 34557342; PMCID: PMC8418216.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Pham VT, Dold S, Rehman A, Bird JK, Steinert RE. Vitamins, the gut microbiome and gastrointestinal health in humans. Nutr Res. 2021 Nov;95:35-53. doi: 10.1016/j.nutres.2021.09.001. Epub 2021 Oct 21. PMID: 34798467.
Hossain KS, Amarasena S, Mayengbam S. B Vitamins and Their Roles in Gut Health. Microorganisms. 2022 Jun 7;10(6):1168. doi: 10.3390/microorganisms10061168. PMID: 35744686; PMCID: PMC9227236.
Rudzki L, Stone TW, Maes M, Misiak B, Samochowiec J, Szulc A. Gut microbiota-derived vitamins – underrated powers of a multipotent ally in psychiatric health and disease. Prog Neuropsychopharmacol Biol Psychiatry. 2021 Apr 20;107:110240. doi: 10.1016/j.pnpbp.2020.110240. Epub 2021 Jan 9. PMID: 33428888.
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314. doi: 10.1002/biof.1835. Epub 2022 Mar 16. PMID: 35294077; PMCID: PMC9311823.

谷禾健康


宫颈癌、卵巢癌和子宫内膜癌是最常见的妇科癌症。根据最新的全球癌症数据,女性宫颈癌的发病率和死亡率分别居第四位和第六位,而卵巢癌的死亡率居第五位,居妇科恶性肿瘤之首。
此外,随着人类生活水平的提高,肥胖、内分泌失调、环境污染也可能增加妇科癌症的发病率和死亡率。
研究表明,妇科恶性肿瘤患者在发病前和治疗期间表现出肠道菌群的变化,表明肠道菌群与妇科恶性肿瘤之间存在相关性。深入研究妇科癌症患者的肠道菌群变化,可用于妇科癌症的筛查,改善妇科癌症的治疗,改善不良预后。
本文从肠道菌群这个角度出发,介绍肠道菌群与绝经后状态以及妇科恶性肿瘤之间的潜在关系,肠道菌群与早期筛查以及治疗方面的关系,此外还描述了益生菌在妇科恶性肿瘤预防、治疗和预后中的作用。
健康稳定的肠道菌群会抑制癌症的发展,而失调的肠道菌群对身体的保护作用有限,可能会促进癌症的发展,也会对癌症免疫、化疗疗效和预后产生不利影响。
绝经后女性的菌群变化
大多数妇科恶性肿瘤好发于绝经后和老年女性;因此,有必要探讨绝经后女性肠道菌群的变化及相关疾病。
绝经后女性缺乏内源性雌激素会引发一系列问题,例如心血管疾病、骨质疏松症、肥胖、糖尿病、乳腺癌和其他妇科癌症的发病率增加。在绝经过渡期间发现肠道通透性增加;此外,肠道通透性增加与炎症发展之间存在关系。
✦绝经前后女性的菌群变化
绝经后女性的粪便样本显示出与内分泌失调和骨质疏松症相关的菌群变化。
下列菌群减少:
下列菌群增加:
用于对抗这些疾病的激素替代疗法可能会增加雌激素相关癌症的发病率,包括乳腺癌和卵巢癌。因此,有必要分析微生物对雌激素水平的影响,创新微生物辅助疗法或减少激素替代疗法的副作用。
先前的研究报道,非卵巢系统性雌激素水平与肠道菌群的丰度和α多样性直接相关,并可能通过肠肝循环影响其水平。
由此引发思考,是否可以通过人为干预绝经期和绝经后女性的肠道微生物,从源头上控制疾病,降低疾病的发病率。
此外,绝经后女性的阴道干燥和组织萎缩显著影响生活质量。阴道环境状况的改变可能使病原菌更容易从阴道侵入,导致阴道生态失调和妇科恶性肿瘤。
✦ 卵巢和肠道微生物存在直接相互作用
在一项实验中,将卵巢完整且多产的雌性小鼠的粪便微生物移植到卵巢切除的阴道萎缩小鼠体内,萎缩症状显著改善。
这表明卵巢和生殖道状态以及肠道微生物之间存在相互作用。此外,通过粪菌移植改善阴道上皮萎缩症状,可能通过改善阴道上皮萎缩相关的保护作用,对预防妇科恶性肿瘤产生影响。
总之,研究绝经后妇女肠道微生物的变化及其在疾病发展和治疗中的作用,将对绝经后妇女的健康和生活质量产生前所未有的影响。
▸ 宫颈癌
宫颈癌是威胁女性生命和健康的最常见的妇科恶性肿瘤之一。目前对肠道菌群与宫颈癌关系的研究主要集中在宫颈癌患者放疗后肠道微生物及相关肠道疾病的变化。
大多数学者对宫颈癌患者的肠道微生物改变持相似观点。然而,肠道生物标志物的研究存在争议,缺乏相关生物学机制的研究。
✦ 宫颈癌患者与健康个体的肠道微生物差异
通过16S rRNA测序比较,学者们注意到宫颈癌患者和健康个体之间肠道微生物的差异。根据最新研究,下列菌群是鉴定宫颈癌的潜在生物标志物:
然而,不久之后的另一项研究显示了不同的结果。研究结果将下列菌群确定为预测早期宫颈癌的生物标志物:
上述研究为未来宫颈癌早期预测和诊断方式的升级提供了未来方向和催化剂。
✦ 短链脂肪酸能抗肿瘤,产短链脂肪酸菌减少
研究人员发现早期宫颈癌患者肠道中产生丁酸盐的细菌Ruminococcus和Clostridium减少了。
微生物代谢产生的丁酸等短链脂肪酸具有良好的抗肿瘤活性,影响各种有益的过程,如癌细胞的免疫和凋亡。
从而提示肠道菌群与癌症发展之间可能通过特定属的存在或缺失以及数量的改变而间接联系。需要更多的实验来验证肠道微生物和宫颈癌发生之间的相互关系及其在筛查和诊断中的作用。
腹部不适是卵巢癌的标志性症状,且治疗期间胃肠道不良反应明显,因此研究肠道微生物与卵巢癌之间的关系具有重要意义。
肠道微生物的失调与卵巢癌的发展密切相关。肠道微生物疾病促进肿瘤生长并导致异种移植小鼠的上皮-间质转化。
✦菌群失调➝肥胖和雌激素失衡➝卵巢癌
肠道微生物的不平衡与肥胖和雌激素水平相关;肥胖和雌激素失衡是卵巢癌发病的危险因素。这表明失调的肠道微生物可能导致肥胖和雌激素失衡触发卵巢癌。
此外,非肥胖者应调节饮食。高油、高脂肪和高盐的饮食也是不可取的。一项对接受高脂肪饮食的动物的研究报告称,这种饮食可能通过破坏炎症因子的水平来促进卵巢癌的发展。因此,不良的饮食习惯和健康习惯是癌症发生的关键危险因素。
✦肠道菌群影响人对铂类药物的敏感性
对卵巢癌治疗的研究表明,肠道微生物会影响人体对铂类药物的敏感性。化疗会对肠道微生物产生不利影响,例如菌群失调,在患有卵巢癌的患者和动物模型中更为普遍。
此外,与铂类敏感患者相比,铂类耐药患者的肠道微生物菌群失调更为明显,健康相关菌群减少,产乳酸菌的比例增加,包括Coriobacteriaceae和双歧杆菌。
✦失调菌群促进肿瘤生长,降低存活率
除了降低对铂的敏感性外,动物研究还表明,肠道微生物的破坏促进卵巢恶性肿瘤的生长并降低小鼠的存活率。同时也表明肠道微生物的完整性和稳定性调节化疗药物的疗效。
胆汁酸等肠道菌群代谢物可以与宿主药物代谢酶相互作用,从而影响药物配置、药代动力学和药效学。
✦肠道菌群及其产物可能有助于治疗卵巢癌
肠道微生物潜在特征的发现可能为未来上皮性卵巢癌的早期检测、治疗甚至预后提供新思路。肠道微生物及其产物也可能有助于治疗卵巢癌。
分离出四株芽孢杆菌从健康人和癌症患者的粪便中观察到细菌产物抑制卵巢癌细胞的增殖,可能是通过引起细胞凋亡,这些细菌产物将来可能被优化为抗癌药物。
✦肠道菌群有利地影响抗癌药物
此外,一项使用小鼠模型的研究发现,抗癌药物对 肠道微生物有一定的作用,导致革兰氏阳性细菌转移到次级淋巴器官并产生免疫反应。这表明肠道微生物群有利地影响抗癌免疫反应的形成和化疗的疗效。
还应注意卵巢癌治疗后肠道微生物的变化。与卵巢癌术前粪便样本不同,术后粪便样本中拟杆菌门和厚壁菌门的丰度显著降低,而变形菌门的丰度显著升高。化疗组也有类似的变化。这意味着卵巢癌的治疗对肠道菌群有显著影响,肠道菌群与卵巢癌患者的临床预后之间可能存在潜在的相关性。
▸ 子宫内膜癌
子宫内膜癌是一组子宫内膜上皮恶性肿瘤,最常见于围绝经期和绝经后妇女。子宫内膜癌的危险因素包括肥胖、糖尿病和高血压。
子宫内膜癌的发病率不仅在绝经前和绝经后妇女之间存在显著差异,而且在不同发展程度的国家之间也存在着差异。欧洲和北美的发病率高于发展中国家。
研究人员推测,子宫内膜癌的发展可能与由于生活质量和人们饮食改善而导致的荷尔蒙异常和超重的不良后果有关。
✦ 影响子宫内膜癌的发病因素
肠道微生物失调引起的消化吸收中断可能导致肥胖,肥胖的发生可能导致高血压、糖尿病和激素紊乱。这表明肠道微生物与子宫内膜癌之间存在关系。
此外,子宫内膜癌的发病与月经、婚育、吸烟、饮酒等因素有关。不同国家的饮食习惯、婚恋政策和风俗习惯,环境污染,甚至种族差异都可能导致不同的子宫内膜癌发病率。
✦ 肠道菌群能调节女性的全身雌激素水平
由雌激素编码的β-葡糖苷酸酶和β-葡糖苷酸,例如双歧杆菌、梭状芽孢杆菌和乳酸杆菌能够在肠道中发挥作用,调节循环雌激素水平,去除通过胆汁排泄的结合雌激素的葡糖苷酸,以获得游离的雌激素分子。
此外,羟基类固醇脱氢酶也广泛存在于人体肠道中,并参与从胆固醇前体合成雌激素的部分还原过程。
尿液和血清雌激素水平与肠道微生物多样性呈正相关。肠道微生物还赋予外来雌激素样化合物生物活性。例如,肠道微生物能够催化大豆苷元以雌马酚或O-去甲基安果胶的形式代谢。木脂素的有益作用还取决于肠道微生物代谢物肠二醇和肠内酯的活性。
因此,除了女性遗传差异和身体条件改变以及环境雌激素暴露的直接影响在激素水平上,由于不良生活方式、饮食和抗生素滥用导致的肠道微生物生态失调也间接影响雌激素水平,进而促进子宫内膜癌的发生。
最近关于肠道菌群、肥胖、绝经状态、雌激素和子宫内膜癌之间潜在关系的综述也表明,更年期和肥胖可以通过引起肠道菌群失衡引起的雌激素变化来调节子宫内膜癌的发展。
✦ 肥胖导致子宫内膜癌的风险增加和预后更差
一项研究发现,肥胖妇女的子宫内膜上皮细胞显示出大量甲基化变化,与I期子宫内膜癌存在54个重叠的差异甲基化区域。
这表明肥胖通过影响DNA甲基化并导致相关代谢途径的失调而促进子宫内膜癌的发生。肥胖对子宫内膜癌的影响引发了人们的猜测,即减肥手术是否可以通过稳定肠道微生物和雌激素水平来帮助改善肥胖,甚至可能在未来促进子宫内膜癌治疗。
一项相关研究报告称,减肥手术会导致肠道微生物发生变化,产生有益的影响,但不会影响激素水平,而且减肥手术与子宫内膜癌发病率之间没有直接关系。然而,深入研究减肥手术在子宫内膜癌中的潜在作用可能会在未来的癌症研究中有前所未有的应用。
影响肠道微生物的因素及其在妇科癌症中的潜在作用机制
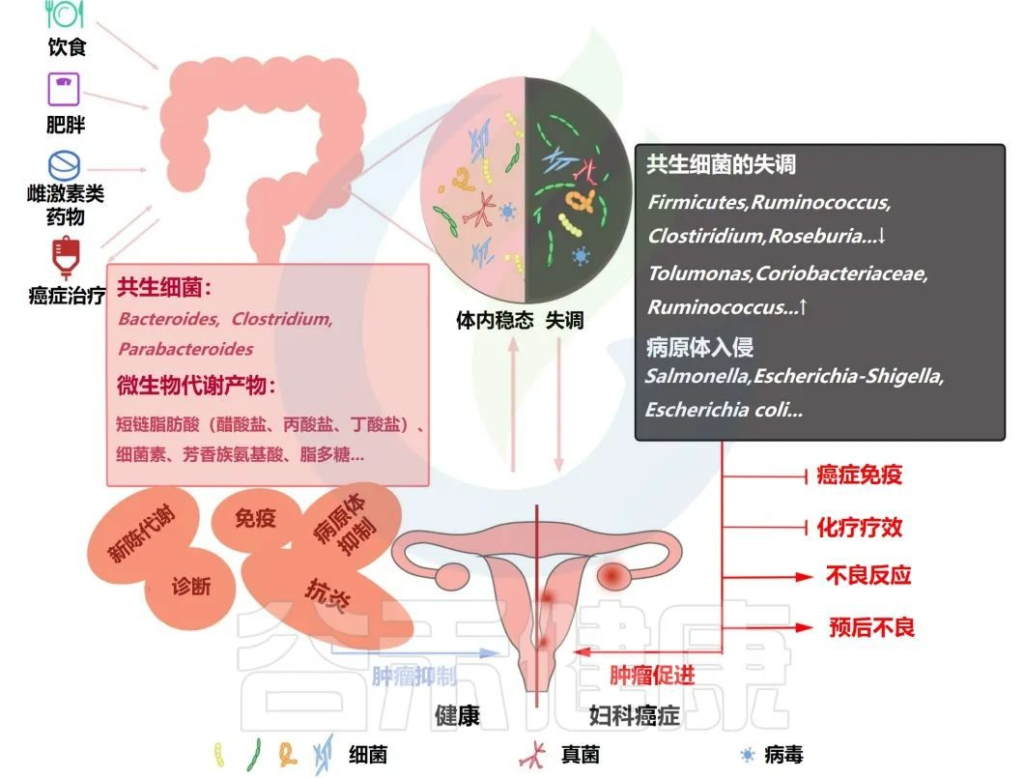
Han M,et al.Front Oncol.2022
不健康的饮食、肥胖、雌激素药物滥用和癌症治疗都会影响肠道微生物的体内平衡,共生菌减少,病原菌增加。
益生菌是在一定剂量范围内对身体有益的微生物。可以在一定程度上改善肠道微生物的生态失调,进而通过影响雌激素水平、癌症免疫、癌细胞增殖和凋亡、耐药性等对妇科癌症产生有益的影响。
益生菌和粪菌移植在妇科癌症中的意义
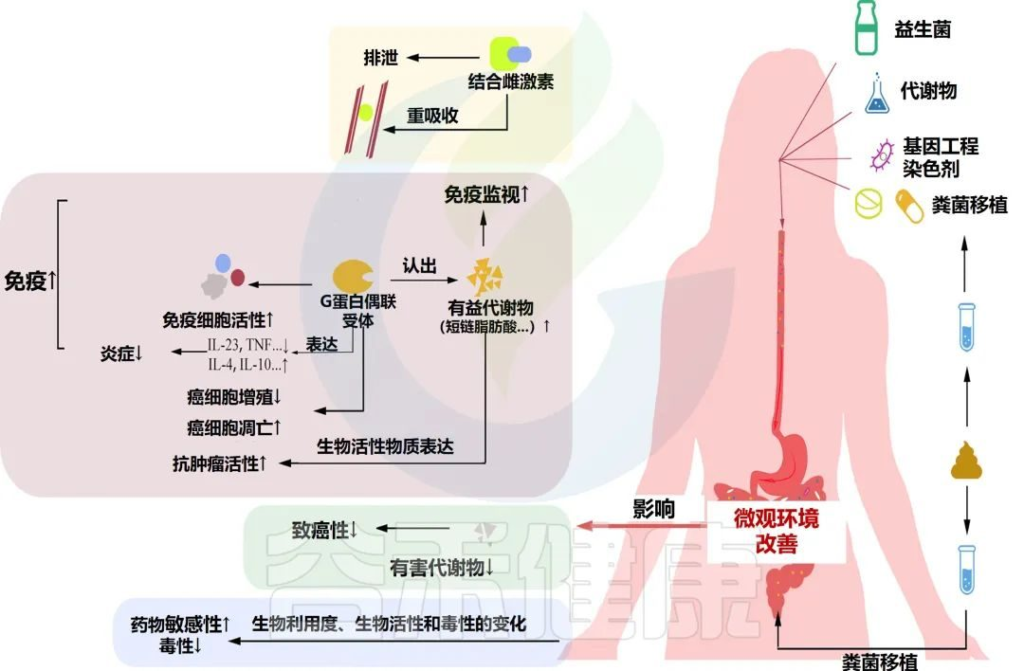
Han M,et al.Front Oncol.2022
益生菌及其代谢物、基因工程菌株和粪菌移植可以改善肠道微生物环境。肠道微生物环境的改善可以影响雌激素水平,提高癌症免疫力和化疗疗效,增加癌细胞的凋亡,减少癌细胞的快速增殖和药物副作用。
鼠李糖乳杆菌(Lactobacillus rhamnosus)是益生菌领域的一个明星属,具有广泛的应用。鼠李糖乳杆菌在癌症中的潜在作用广泛分为以下几部分。
● 鼠李糖乳杆菌帮助恢复肠道屏障功能
首先,鼠李糖乳杆菌通过增强健康肠道通透性相关基因的表达,调节肠道菌群的动态平衡,保护粘膜并恢复肠道屏障功能,上文也已经提到了肠道菌群对妇科恶性肿瘤的稳态作用。
● 鼠李糖乳杆菌调节免疫
其次,关于人的自我保护,鼠李糖乳杆菌潜在地调节免疫,通过激活或抑制细胞因子表达和病原体入侵引起癌细胞凋亡和抗炎作用。
最终,鼠李糖乳杆菌还可以保护身体免受放射疗法和其他治疗方法的毒性和副作用。
从分泌物或排泄物中分离的细菌(益生菌特性)
一些研究记录了从人和动物的分泌物或排泄物中分离出的某些细菌的抗癌活性。
从母乳中分离的三种潜在益生菌菌株:
还有从猪肠道食物中分离的Enterococcus faecalis por1
以上这些菌群具有益生菌特性,并且可以通过靶向癌基因、防止癌细胞生长、诱导凋亡或调节免疫应答能力来抑制癌症的发展。
研究发现,从Bacillus thuringiensis 4R2中分离出来的parasporin-2Aa1被蛋白酶K激活,诱导来自不同组织的各种人类癌细胞的凋亡,包括子宫内膜癌细胞,但它不影响正常细胞。由于其良好的特性,parasporin-2Aa1可在未来与化疗药物联合使用以减少对正常细胞的杀伤。
益生菌混合物和基因工程益生菌通过靶向免疫系统来促进癌症治疗。
研究发现,经鼻内给药的Lactococci 被设计为表达HPV-16 E7抗原,可刺激细胞介导(分泌IL-12和IFN-γ)和体液免疫系统(产生E7抗体),以预防HPV相关宫颈癌。
此外,口服含有特定鼠李糖乳杆菌、嗜酸乳杆菌和乳铁蛋白RCXTM的益生菌混合物可调节阴道和全身的先天性和适应性免疫反应,削弱Gardasella vaginalis诱导的阴道病,并预防由炎症引起的妇科癌症。
● 雌激素过多或过少都可能影响妇科癌症
雌激素缺乏会影响女性的健康,然而,不适当的雌激素补充也可能导致包括乳腺癌和子宫内膜癌在内的疾病。因此,益生菌与激素相关药物联合用药是未来雌激素缺乏研究的热点。
具有选择性雌激素受体亲和力的生物可利用异黄酮在预防和治疗因雌激素缺乏引起的骨质疏松症方面具有潜力,同时最大限度地减少或消除其致癌副作用。
● 益生菌调节癌症治疗副作用的预防和管理
通过放射疗法治疗宫颈癌的一种可能的急性副作用是辐射引起的腹泻。许多实验表明,补充益生菌包括乳酸乳杆菌、动物双歧杆菌和嗜酸乳杆菌可以最大限度地降低宫颈癌患者放射引起的腹泻的发生率和严重程度。
上述研究大多基于现象,需要深入研究来证明结论的准确性。益生菌在妇科肿瘤治疗中的作用机制研究尚缺乏,有待进一步探索。
微生物本身没有好坏之分;它们分为对宿主有益和有害的细菌,导致微生物对宿主产生双重作用。
菌群失调和病原菌入侵促进癌变,不利于妇科恶性肿瘤的后期治疗。然而,维持菌群稳态和益生菌的应用可以抑制癌症。
肠道微生物的有效利用对妇科恶性肿瘤的未来具有重大影响。以上研究促进了妇科恶性肿瘤微生物学方面的进步;但是,还存在样本量小和机制研究不完整等缺点。
更多研究应增加样本量,考虑影响结果的所有相关参数,并侧重于研究机制和临床效果,以便更好地延长妇科恶性肿瘤患者的生存时间,提高生存率和生活质量。
关于妇科癌症预防治疗的建议
▸避免或减少肉类、乳制品和饱和脂肪
总体而言,病例对照研究发现,尤其是与红肉相关的子宫内膜癌风险增加。一项研究队列发现血红素铁(在红肉和白肉中都存在)与肝脏消耗和子宫内膜癌之间存在显着关系。对脂肪摄入和子宫内膜癌的剂量反应分析得出结论,将总脂肪摄入量增加 10% 的卡路里会使患这种癌症的风险增加 5%。
然而,饱和脂肪摄入量增加 10 克/1000 大卡与更大的风险相关(17%)。也就是说饱和脂肪对增加子宫内膜癌风险的影响是其他类型脂肪的三倍以上。
▸避免生的或未煮熟的海鲜
化疗会影响女性的免疫系统和抵抗感染的能力,因此不应食用可能含有细菌的生的或未煮熟的海鲜或肉类,因为受损的免疫系统更难抵抗食源性感染。在手术或化疗期间发生感染可能会导致癌症治疗延误。
▸限制含有丙烯酰胺的食物(油炸食品)
包括国际癌症研究机构在内的多个来源都认为,饮食中的丙烯酰胺是一种“可能的致癌物”。膳食丙烯酰胺是高温烹饪某些淀粉时产生的化学副产物。它存在于深度加工和油炸食品中,例如:薯片、炸薯条、某些加工过的谷类食品和零食等都可能含这种物质。
▸多吃水果、蔬菜
先前的研究表明,蔬菜水果可能与降低风险的程度有关,可达50-60%。在美国癌症协会的癌症预防研究II营养队列(超过41,000名女性)中,蔬菜和水果(分别降低20%和25%的风险)对食用这些食物最多的人的保护作用仅在从未使用激素治疗的女性中确定。例如苹果、西兰花、蓝莓、草莓、辣椒等。
尤其是所有的十字花科蔬菜,如西兰花、芥菜和球芽甘蓝,都有抗癌作用。这些蔬菜中存在的一种叫做萝卜硫素的化学物质会产生一种减少肿瘤生长的酶。
另一种化合物 Indole-3-carbinol 在对抗癌细胞方面也很不错。
β-葡聚糖是一种存在于某些蘑菇中的化合物,在抗癌方面很受欢迎。
在水果中,葡萄具有巨大的健康益处。它们含有抗氧化剂,可以防止自由基破坏身体的健康细胞。葡萄皮含有白藜芦醇,这是另一种具有抗癌特性的化合物。
▸避免糖和高血糖指数碳水化合物
研究发现,饮用含糖饮料多的女性患子宫内膜癌的风险要高出 78%。一项荟萃分析比较了饮食中血糖负荷最高的女性与血糖负荷最低的女性,发现前者的风险高出约20%.
▸尽可能吃完整的、未加工的食物
子宫内膜癌主要与体内高水平的无拮抗雌激素有关。包装食品不仅缺乏营养,还含有人造防腐剂和化学物质,以及包装中的塑料,导致雌激素循环增加。
对于子宫内膜癌患者来说,理想的饮食需要包含大量的天然食品,并且应该不含高度加工的食品。糙米、燕麦片、豆类和麸皮等全谷物提供足够的纤维,有助于定期排除体内的毒素。
许多非有机食品中的杀虫剂会增加体内的雌激素。吃完整的有机食品可能对其预防和管理特别重要。
▸喝咖啡和绿茶
研究发现,喝咖啡量相对较多的女性患子宫内膜癌的风险降低20%,而喝咖啡量高从未接受过HRT治疗的女性,患子宫内膜癌症的风险降低40%。
可能是由于咖啡中的咖啡因和其他甲基黄嘌呤能够增加性激素结合球蛋白(SHBG)并增加胰岛素敏感性。
同样,喝绿茶的人患子宫内膜癌的风险在最高摄入量组低近20%。其作用可能包括促进细胞凋亡、细胞周期阻滞、上调谷胱甘肽- s转移酶,使致癌物失活,以及抗雌激素作用。
▸适度饮酒
酒精摄入与子宫内膜癌风险之间似乎存在J型关系。研究发现,与不喝酒或偶尔喝酒的女性相比,每天喝半杯到一杯的女性风险降低4-7%,而每天喝2.5杯或超过2.5杯的女性风险分别高出14%和25%。
▸补充维生素
据《营养杂志》报道,每天服用 500mg 维生素 C和 400 国际单位的维生素 E 可以将患卵巢癌的风险降低 68% 。斯坦福大学的科学家说,这两种营养素都有助于关闭为异常细胞生长提供燃料的酶。
▸可能预防卵巢癌的食物
密歇根大学的研究人员认为,生姜的活性化合物(姜酚)破坏卵巢癌细胞。
番茄汁的细胞壁在加工过程中被分解,更容易吸收。研究人员报告称,每天只需喝八盎司番茄汁就能将患卵巢癌的风险降低一半。
一项针对人体细胞的妇科肿瘤学研究发现,一种仅存在于鱼类中的 omega-3 脂肪酸 DHA 可抑制卵巢癌的生长。
发表在BMC Cancer上的研究表明,含有矿物质硒的食物可能会降低卵巢癌的风险。它在体内充当抗氧化剂,降低破坏细胞的自由基水平。高蛋白食物中很多富含硒,例如瘦肉、鱼(金枪鱼)、虾、豆类、坚果等。
▸其他营养和生活方式建议
限制高能量密集型食物和高盐(或高钠食物)、定期运动和保持健康体重可能会降低癌症风险。
与其他饮食模式相比,遵循植物性饮食提供更高的饮食质量,有助于实现健康体重。
▸疫苗接种
HPV 疫苗可以帮助预防导致大多数宫颈癌病例的HPV 类型的感染,最好在青少年时期就接种。
▸肠道菌群健康检测
随着深入研究体内微生物群与妇科恶性肿瘤发生发展的关系,利用菌群预测癌症的早期阶段成为可能。
通过及时调整饮食、生活方式、配合益生菌的使用等干预手段,尽可能避免疾病发展。
主要参考文献
Han M, Wang N, Han W, Ban M, Sun T, Xu J. Gut Microbes in Gynecologic Cancers: Causes or Biomarkers and Therapeutic Potential. Front Oncol. 2022 Jul 13;12:902695. doi: 10.3389/fonc.2022.902695. PMID: 35912194; PMCID: PMC9326394.
Avgerinos KI, Spyrou N, Mantzoros CS, Dalamaga M. Obesity and Cancer Risk: Emerging Biological Mechanisms and Perspectives. Metabolism (2019) 92:121–35. doi: 10.1016/j.metabol.2018.11.001.
Tong J, Zhang X, Fan Y, Chen L, Ma X, Yu H, et al. Changes of Intestinal Microbiota in Ovarian Cancer Patients Treated With Surgery and Chemotherapy. Cancer Manag Res (2020) 12:8125–35. doi: 10.2147/CMAR.S265205.
Ding K, Hua F, Ding W. Gut Microbiome and Osteoporosis. Aging Dis (2020) 11(2):438–47. doi: 10.14336/AD.2019.0523.
Garcia-Gutierrez E, Narbad A, Rodriguez JM. Autism Spectrum Disorder Associated With Gut Microbiota at Immune, Metabolomic, and Neuroactive Level. Front Neurosci (2020) 14:578666. doi: 10.3389/fnins.2020.578666.

谷禾健康

帕金森综合征
帕金森病(Parkinson’s disease,PD)是全球增长最快的神经系统疾病之一,原因有很多,包括人口老龄化和环境影响。老年人多见,平均发病年龄为60岁左右,40岁以下起病的青年帕金森病较少见。
我国流行病学调查显示,65岁以上人群帕金森病的患病率大约是1.7%。估计全国每年新发患者数达10万以上,我国现有帕金森病患者人数近300万。大部分帕金森病患者为散发病例,仅有不到10%的患者有家族史。
帕金森病最主要的病理改变是中脑黑质多巴胺(dopamine, DA)能神经元的变性死亡,由此而引起纹状体多巴胺含量显著性减少而致病。
虽然这种神经退行性疾病目前主要由临床运动特征(运动迟缓、僵硬和静止性震颤)来定义,但非运动特征,如自主神经功能障碍、认知行为问题和睡眠障碍,大大增加了总体疾病负担。
200多年前,詹姆斯·帕金森首次正式描述帕金森病时,胃肠功能障碍被认为是帕金森病临床表现的一部分。值得注意的是,他还推测帕金森病可能起源于胃肠系统,并评论道“胃肠紊乱状态可能会导致脊髓的一部分发生病态行为”。
肠道微生物群对神经系统过程(如神经发生、髓鞘形成和小胶质细胞激活)至关重要,能够调节行为和认知,并越来越多地参与调节神经退行性疾病和神经精神疾病的易感性和进展。
帕金森发病过程中肠道和大脑之间的串扰被认为受到肠道微生物失衡(失调)以及由此引起的细菌代谢活性改变的重大影响。
本文概述了帕金森病的肠-脑轴,包括迷走神经、肠神经系统中的α-突触核蛋白、改变的肠道通透性和炎症以及肠道微生物及其代谢活动的潜在作用和相互关系。阐述了肠道相关因素(包括肠道菌群)在帕金森病治疗进展中的作用和作为治疗靶点的作用,并基于研究文献讨论了常见的一些帕金森疗法。
关键词解释
α-突触核蛋白
是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,它与帕金森病的发病机制和相关功能障碍密切相关,是路易小体的主要成分。
路易小体
是以帕金森病为代表的路易体病患者脑内的特征性标志物。显微镜下为圆形粉红色均质状结构。
▸ 震颤
震颤通常始于手或手指,其他包括手臂、腿、下巴或头部都可能出现震颤。可能会来回摩擦拇指和食指,类似弹丸滚动的震颤。手在休息时可能会颤抖。
▸ 肌肉僵硬
肌肉长时间保持收缩。尤其是在疾病的早期阶段,可能被误认为关节炎或骨科问题。
▸ 运动缓慢
随着时间的推移,帕金森病可能会让人减慢运动速度,使简单的任务变得困难且耗时。走路时步数可能会变短,可能拖着脚。可能很难从椅子上站起来。
▸ 平衡和协调受损
可能会变得弯腰,或者可能因帕金森病而出现平衡问题,有时会导致跌倒。
▸ 认知变化
一项研究发现,认知障碍是帕金森病常见且进展迅速的症状。在平均患有帕金森病五年且在研究开始时认知正常的参与者中,约有一半在确诊帕金森病后的六年内(约11年)出现轻度认知障碍。
少数出现轻度认知障碍的患者在五年内发展为痴呆。帕金森痴呆症患者可能有严重的记忆和思维问题,影响日常生活。
▸ 抑郁、焦虑等
可能会经历抑郁症,有时是在非常早期的阶段。
大约 40%-50% 的帕金森患者会出现抑郁症。可能还会经历其他情绪变化,例如恐惧、焦虑或失去动力等。也包括可能出现的精神病,例如幻觉或妄想。
▸ 吞咽、咀嚼和说话困难
由于吞咽缓慢,唾液可能会积聚在口腔中,导致流口水。晚期帕金森病会影响口腔中的肌肉,使咀嚼变得困难。这会导致窒息和营养不良。
▸ 排尿问题或便秘
帕金森病可能会导致膀胱问题,包括无法控制尿液或排尿困难。许多帕金森病患者出现便秘,主要是由于消化道较慢。
▸ 睡眠问题
帕金森病患者经常有睡眠问题,包括整夜频繁醒来、早起或白天想睡觉。
▸ 其他影响
其他还包括嗅觉障碍、疲劳、皮肤问题(黑色素瘤)、性功能障碍、疼痛、头晕目眩、眼睛和视力问题、体重减轻等问题。
帕金森氏症的症状和进展速度因人而异。这种疾病的早期症状很微妙,并且逐渐发生。例如:
有时候朋友或家人可能是第一个注意到早期帕金森氏症患者的变化的人。他们可能发现患者:
当疾病发展到晚期帕金森病时,症状变得更加严重且相当复杂,行动变得局限。其中包括:
从1980年代帕金森病患者肠道神经系统(ENS)中发现α-突触核蛋白沉积开始,进行了尸检研究,提出突触核蛋白病起源于迷走神经背运动核(DMNV)和前嗅核,帕金森病病理学肠-脑传播的“上升解剖学理论”获得了广泛的关注。
根据这一理论,作用于肠道的损伤会触发α-突触核蛋白的错误折叠和聚集,α-突触核蛋白开始于肠上皮细胞,然后通过朊病毒样细胞间转移传播到大脑。
这些结果表明,需要进一步的研究才能得出α-突触核蛋白的肠-脑支持是否是帕金森病的关键致病步骤。
鉴于帕金森病的复杂性和异质性以及肠-脑相互作用的多方面性质,目前的观点是,这种相互作用可能在帕金森病中起作用,但在个别患者中的作用程度不同。
▸▸
在过去十年中,多项临床和临床前研究提供了帕金森病患者肠道通透性改变(“肠道渗漏”)和炎症的证据。
Toll样受体4(TLR4)信号通路可感知受损或坏死组织释放的革兰氏阴性细菌脂多糖和内源性分子,被认为在帕金森病的肠道和脑部炎症中起着至关重要的作用。
虽然研究普遍显示帕金森病患者存在肠道炎症的证据,但这些变化仅在一部分患者中明显,胃肠道通透性研究的结果也具有高度异质性。
肠道相关因素在某些但并非所有患者的神经退行性变中起着重要作用。已知炎症可导致肠屏障功能障碍,在炎症性肠病(IBD)患者中,抗肿瘤坏死因子(anti-TNF)治疗可抑制肠道炎症,使胃肠道通透性恢复正常。
然而,屏障缺陷有时可以作为疾病的早期事件发生,与炎症无关。
一些支持和反对肠道优先参与PD的证据
▸流行病学研究
支持证据:
• 便秘、胃食管反流和胃轻瘫等胃肠道症状可先于帕金森病运动症状几十年。
• 大量研究表明,完全切断迷走神经干与显著降低帕金森病的发病风险相关。
反对证据:
• 胃肠功能障碍等非运动特征可能比运动特征更早出现,因为副交感神经系统(PNS)和肠神经系统(ENS)对神经退行性变的补偿能力不如中枢神经系统(CNS)。
• 一项大型纵向研究发现迷走神经切断术后帕金森病风险没有显著降低。
▸神经病理学研究
支持证据:
• 尸检研究表明,几乎所有帕金森病患者的肠神经系统中都存在突触核细胞病变。
• 在帕金森病诊断前20年,在食道、胃、小肠和结肠的活检中检测到α-突触核蛋白沉积。
反对证据:
• 对老年人的尸检研究发现,在没有脑α-突触核蛋白参与的情况下,没有“仅肠道”路易病理学,尽管不能排除在胃肠道迅速传播或高度局限性病理学的可能性。
• 其他活检研究发现,神经健康个体的胃肠道中存在α-突触核蛋白积聚。
▸动物研究
支持证据:
• 在啮齿动物模型中已经证明,肠-脑α-突触核蛋白传递,伴有黑质多巴胺能神经变性和帕金森病样运动和非运动症状,可能与年龄有关。
• 在鱼藤酮帕金森病小鼠模型中,半迷走神经切断术阻止了α-突触核蛋白在迷走神经背侧运动核(DMNV)中的积聚以及与该方法同侧的黑质多巴胺能细胞死亡。
•暴露于胃肠道中的微生物淀粉样蛋白(CULLI)会增加老年大鼠肠道和大脑中的α-突触核蛋白病理学和炎症,以及转基因α-突触核蛋白过度表达的小鼠,并伴有相应的运动缺陷。
反对证据:
• 涉及将大量α-突触核蛋白注射到胃肠道的动物模型可能无法准确再现人类帕金森病。
• 中枢神经系统紊乱也会改变肠道功能;例如,大鼠的黑质病变导致肠道运动障碍、炎症和微生物组改变。
半透性肠道屏障调节营养吸收,允许免疫感应,同时限制有害物质的运输。
在帕金森病中,“渗漏”的肠道允许微生物和分子(包括细菌和毒素)通过肠道上皮细胞的流量增加。表达脂多糖(LPS)的失调的肠道微生物群可以激活上皮细胞、免疫细胞和肠胶质细胞上表达的Toll样受体,并促进肠道渗漏以及肠道和脑炎症。
正如在患者结肠活检和粪便样本中观察到的那样,肠道炎症部分通过系统机制驱动疾病发病,包括细胞因子产生增加、血脑屏障破坏、炎性细胞迁移到大脑和小胶质细胞激活,最终导致神经功能障碍或丢失。
恶性循环可能发生,生物失调、通透性增高、炎症和α-突触核蛋白聚集相互延续。
这些因素的重要性和时间顺序可能因患者而异,这取决于环境影响(如影响微生物组的饮食)、衰老和宿主遗传学,导致不同的途径更容易出现功能障碍。
α-突触核蛋白参与先天性和适应性免疫
炎症环境增强了α-突触核蛋白的表达、错误折叠和聚集,进而诱导局部促炎免疫反应,从而形成促进α-突触核蛋白扩散的反馈环。
帕金森患者肠道屏障、炎症和α-突触核蛋白聚集
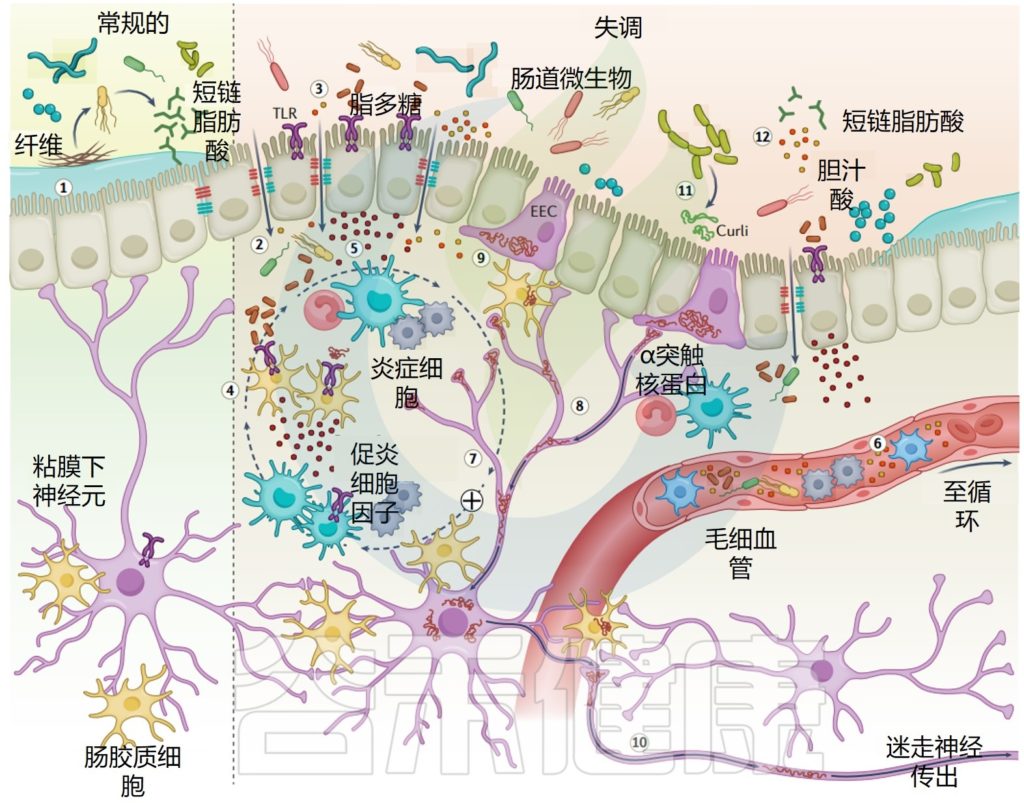
Tan AH, et al.,Nat Rev Neurol. 2022
值得注意的是,轴突终止于肠腔的粘膜下神经元和具有直接管腔和神经连接的肠内分泌细胞可以表达α-突触核蛋白,可能是α-突触核蛋白聚集的来源,并通过迷走神经扩散到大脑。微生物卷曲被建议在肠道中模板α-突触核蛋白聚集。
虽然肠道炎症和α-突触核蛋白表达可能是常见事件,但人们认为只有在存在其他促发因素(如宿主遗传脆弱性或衰老)时,帕金森才会发生。潜在有益的肠道代谢物的改变,如短链脂肪酸也可能在帕金森病发病中发挥作用。
帕金森病中微生物-肠-脑轴的示意图
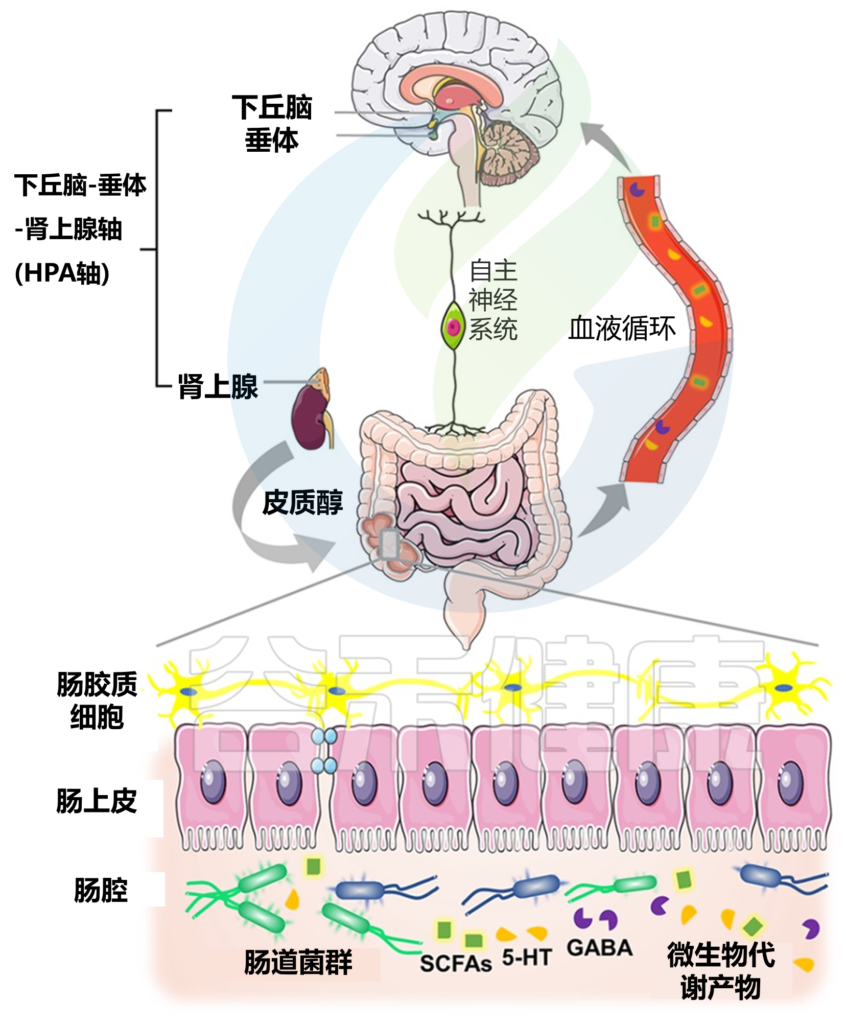
Wang Q, et al., Brain. 2021
在肠神经系统中,肠道菌群通过释放各种信号分子来调节大脑功能,这些信号分子可能进入体循环并到达目标部位。
中枢神经系统通过自主神经系统 (ANS) 下丘脑-垂体-肾上腺 (HPA) 轴在生理上支配胃肠道;反过来,肠道向大脑提供反馈以建立双向交流。
肠道微生物与宿主共同进化,形成复杂的互惠关系:胃肠道为其微生物群落提供滋养环境,而微生物群发挥着广泛的重要功能,影响宿主的生理机能。
在解释与疾病相关的肠道微生物组组成和功能改变时,宿主-微生物组相互作用的多维度和微生物组的个体变异是需要考虑的重要因素。
各种内在和外在因素改变了肠道微生物组,导致微生物组成的显著个体间差异。
影响肠道菌群的因素
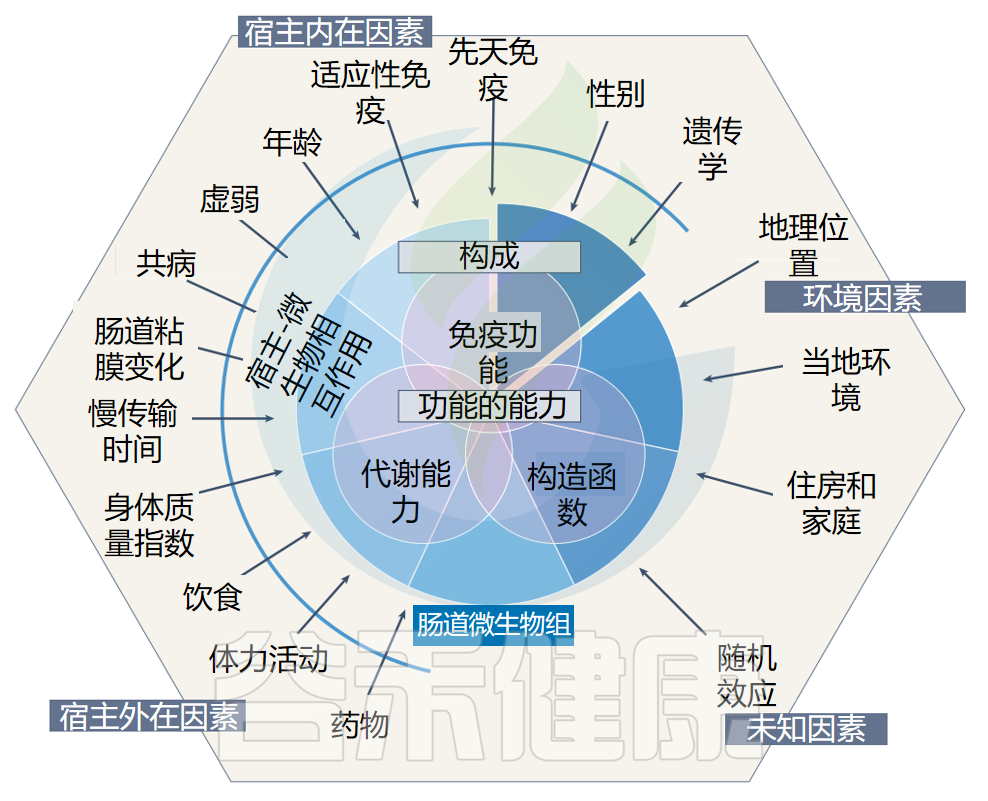
Tan AH, et al.,Nat Rev Neurol. 2022
微生物组适应环境和宿主因素的变化并不总是产生有害后果,宿主-微生物和微生物-微生物相互作用的动力学是整个肠道微生物组成和功能的重要决定因素。
事实上,健康个体之间的微生物组成可能差异很大,但仍保持着非常相似的功能能力,这为肠道健康提供了更好的衡量标准。因此,对肠道失调的研究不仅应关注与疾病相关的微生物组成变化,还应考虑影响疾病病因、发病机制、诊断、预后和治疗的功能变化。
衰老是帕金森病病理生理学的一个重要因素,并对肠道微生物生态系统有重要影响。在讨论PD相关变化之前,我们先概述与年龄相关的肠道微生物组变化。
与年龄相关的肠道菌群变化可归因于肠道生理衰老(例如,黏膜变薄、屏障破坏、肠道运动能力下降和免疫衰老)、生活方式的改变(例如,饮食、生活条件和体育活动)和健康状况(例如,共病、药物和虚弱)。
关于肠道微生物群在衰老过程中发生变化详见我们之前的文章:
肠道微生物群的老化及其对宿主免疫力的影响
健康长寿的步伐永不停歇
值得注意的是,肠道菌群具有调节炎症信号和与其他器官相互作用的能力,越来越多地认为它在“炎症”中发挥着核心作用。
来自ELDERMET联盟的开拓性研究表明,老年人肠道微生物组个体间具有高度的差异性,居住在社区的老年人与居住在长期护理机构的老年人之间存在显著差异,后者的微生物组多样性和时间稳定性较差。
长期护理患者的微生物组变化也与饮食因素、营养状况受损以及炎症和虚弱标志物的增加有关。
▸ 百岁老人的肠道菌群多样性较高,有益菌富集
在寻找健康老龄化和长寿的微生物标志的过程中,对百岁老人和超级百岁老人的研究几乎无一例外地揭示出,与其他老年人和年轻人相比,他们的微生物组多样性水平很高,不同地域不同人群研究表明长寿个体会富集例如瘤胃球菌(Ruminococcaceae)和阿克曼菌(Akkermansia)在内的几个细菌类群,同时,两组shotgun宏基因组的功能分析表明,长寿人群的微生物群具有较高的碳水水化合物和脂类代谢能力,以及外源生物降解能力。
▸ 炎症变化导致菌群变化
随着年龄的增长,可能出现相关炎症,引起肠道生理和营养环境变化,这时候,能够适应炎症的肠道环境的菌群,具有竞争优势,而其他微生物可能在炎症状态下丢失。
整合了来自 11 个国家的 30 项独立病例对照 NGS 研究,几乎所有的研究都发现,帕金森病患者和对照组之间的总体肠道微生物组组成存在显著差异。
重要的是,一些研究发现了可能影响肠道微生物组的潜在混杂因素,包括年龄、饮食因素(可能受到吞咽困难或 PD 嗅觉和味觉改变的影响)、便秘、虚弱和帕金森病药物(COMT 抑制剂和左旋多巴),虽然在控制这些因素后,帕金森病患者和对照组之间的差异仍然很大,不过这些差异的影响大小是在适度范围内的。
事实上,研究方法和地理位置可以解释微生物组组成中比PD状态更大的方差比例(在18-54%之间)。与之前关于微生物多样性减少与不健康衰老之间关系的观点相反,大多数研究发现帕金森病患者与对照组相比要么没有差异,要么总体多样性增加。
帕金森病:AKK菌、双歧杆菌、乳酸杆菌增加
据报道,帕金森病患者与对照个体之间至少有42科、102属和44种细菌存在差异。然而,只有大约四分之一的研究结果在一项或多项研究中得到了重复。
帕金森病最一致的发现是阿克曼菌(Akkermansia)的丰度增加(30项研究中的14项),该属属于疣状菌科(12项研究中也发现帕金森病增加)。
其他组成特征包括双歧杆菌(Bifidobacterium)属和乳酸杆菌(lactobacillus)属的丰度增加,丁酸生产菌(Roseburia)、粪杆菌属和布劳特氏菌(Blautia)的丰度减少。
帕金森病患者在物种或亚种水平上的研究仍然很少,在两项鸟枪式宏基因组研究和一些具有较高测序分辨率的16S rRNA研究中进行了初步探索。
Akk菌增加可能的原因
阿克曼菌(Akkermansia)、双歧杆菌(Bifidobacterium)和乳酸杆菌(lactobacillus) 被广泛视为“有益”细菌,后两个属通常包含在益生菌制剂中。
它们在帕金森病含量增加的原因尚不清楚,但可能与它们在改变的肠道环境中生存的适应性更强有关。值得注意的是,Akkermansia的增多与结肠运输缓慢和体重或脂肪量低有关,这两个特征在帕金森病患者中普遍存在。
其他神经系统疾病中也有Akkermansia丰度增加的报道,包括多系统萎缩(MSA)、进行性核上性麻痹、阿尔茨海默病和多发性硬化症,表明这一特征并非帕金森病特有。
扩展阅读:Nature | AKK菌——下一代有益菌
引人注目的是,对跨越十种疾病的28项病例对照研究进行的荟萃分析发现,与疾病相关的细菌属之间存在明显的重叠,表明某些变化代表了对健康和疾病的共同反应。
菌株特异性
细菌的功能可能具有菌株特异性,同一物种的不同菌株可能产生相反的作用。因此,根据目前在属和种水平上的知识推断细菌在帕金森病中的潜在作用可能信息不足。
此外,人类肠道微生物群中的大多数基因尚不能进行功能分配,其动态转录和翻译活动尚待阐明。
在统一的人类胃肠道基因组目录中,从超过200000个人类微生物基因中鉴定出的物种中,有70%以上仍有待培养或实验鉴定,对这些物种内的菌株和功能变异性的了解仍极为有限。
至关重要的是,单一微生物分类群的作用不能在隔离中看待,但应在社区环境中考虑,考虑到具有类似代谢功能的微生物与具有对抗作用的微生物的净效应,以及微生物-微生物和微生物-宿主相互作用。
因此,使用粪便转录组学、代谢蛋白质组学和代谢组学对代表肠道菌群集体功能输出的活性细菌代谢途径和产物进行直接测量,可能比细菌分类学描述更具相关性,以便更深入地了解肠道菌群在健康和疾病中的作用。
帕金森病患者:短链脂肪酸下降
帕金森病患者粪便短链脂肪酸的水平(乙酸盐,丙酸盐,丁酸盐)一直在下降。短链脂肪酸在微生物群-肠-脑串扰中发挥关键作用,部分通过调节肠道和血-脑屏障的完整性、炎症级联、内分泌信号和神经元存活。
除了作为结肠上皮的主要基质外,实验性帕金森模型中还发现丁酸通过组蛋白脱乙酰酶抑制发挥神经保护作用,包括减轻运动损伤和多巴胺能细胞死亡。
在MSA中也发现粪便短链脂肪酸和胆碱代谢产物水平降低,表明这种情况与帕金森病之间存在共同的微生物反应。
帕金森病患者肠道微生物组和代谢物的临床相关性在后面章节关于帕金森病风险和进展中的肠道相关因素中进行了讨论。
在几种帕金森病啮齿动物模型中已证实肠道微生物群的改变,包括:通过腹腔注射或皮下注射的神经毒素模型等,大多数研究还发现,与野生同窝鼠相比,患病啮齿动物的胃肠道(肠道运动障碍、炎症、屏障破坏和神经功能丧失)或大脑(运动功能障碍、炎症和多巴胺能细胞丧失)发生病理生理学变化。
在其中一些研究中,观察到肠道变化先于帕金森病样运动特征的出现;然而,肠道微生物对观察到的变化的贡献尚不清楚。
与帕金森病相关的菌群改变的因果关系推断
几项使用无菌小鼠(出生和饲养时未接触活微生物)、粪便微生物移植(FMT)或使用广谱抗生素治疗的研究,可以推断出与人类帕金森病相关的微生物组改变的因果关系。
与无菌ASO小鼠相比,含有复杂微生物群的ASO小鼠运动功能和便秘更差,伴有明显的神经炎症反应和脑内α-突触核蛋白沉积。
值得注意的是,帕金森病患者肠道微生物群的移植加剧了无菌ASO小鼠的运动功能障碍。有趣的是,补充短链脂肪酸(SCFA)通常被认为是有益的,与无菌ASO小鼠中的小胶质细胞激活和α-突触核蛋白聚集有关。
然而,无菌小鼠小胶质细胞缺陷的观察结果使这些发现与人类帕金森病的解释复杂化。短链脂肪酸的作用也可能取决于剂量和类型;肠道中不同短链脂肪酸浓度和比率的差异可能导致不同的健康结果。
在另一项研究中,长期口服鱼藤酮会导致常规饲养小鼠的肠道通透性增高和运动功能障碍,但在无菌小鼠中则没有。
在另外两项针对啮齿动物的研究中,抗生素治疗耗尽了肠道微生物负荷和多样性,似乎可以减轻MPTP和六羟基多巴(6-OHDA)诱导的多巴胺能神经毒性。
综上所述,这些实验模型提供了证据,证明肠道微生物的存在、组成和代谢产物在帕金森病样发病机制中具有致病或促进作用。
肠道微生物及其代谢产物的高度个人化和复杂性质使微生物组因果成分的鉴定变得复杂,这些微生物及其代谢产物可能单独发挥作用,或在微生物群中发挥增强或抵消作用。
此外,大多数研究中使用的供体数量较少,无法捕获人类肠道微生物群的广泛个体间差异。至关重要的是,未能解释宿主-微生物相互作用和内环境平衡及其在个人整个生命周期中的演变,以及饮食、生活方式、衰老和其他因素的变化,是这些实验的主要限制。
几项大型流行病学和临床研究将肠道疾病、肠道干预和饮食因素与随后的帕金森病发展和恶化风险联系起来。
便秘是帕金森病的典型前驱症状,20多年前发表了第一项基于社区的长期研究,证明患有这种疾病的个体患帕金森病的风险升高。
帕金森病的便秘是由一系列因素引起的,包括结肠传输缓慢和肛门直肠功能障碍。2021发表的一项研究表明,便秘的不同亚型与帕金森病的不同发病风险相关,慢传输比排便协同障碍的发病风险略高。
便秘也预示着帕金森病的恶化趋势
一项针对465名社区帕金森病患者的研究发现,患者在发病时便秘的存在和严重程度与痴呆更快进展之间存在关系。
这些患者从诊断开始就接受了长达8年的监测。严重便秘患者平均得痴呆症的时间为6.0年,而无便秘的患者则为7.5年。排便协同障碍是便秘患者排便过程中出现的一种反常肛门括约肌收缩障碍。
同样,使用来自帕金森病进展标志物倡议423名新诊断帕金森病患者的数据,这些患者接受了长达5年的监测发现,胃肠道症状的综合得分越高(肠蠕动、大便硬和失禁的频率越低),认知能力越差,轻度认知障碍和痴呆的发生率越高。
在这两项研究中,认知功能与非胃肠道自主症状无关,这表明这种关联是胃肠道系统特有的,而不是自主功能障碍本身。
帕金森病患者便秘的相关因素
在一个单独队列的3年随访研究中,基线便秘严重程度与体脂质量损失独立相关。反过来,帕金森病患者的体重减轻与营养不良、骨折、压疮和死亡的风险增加有关。
2021发表的一项粪便代谢组学研究发现,帕金森病患者的便秘严重程度与丁酸盐(一种潜在有益的SCFA)水平降低相关。
另一项初步研究发现,帕金森病和便秘患者外周血中辅助性T细胞的数量增加。这种具有强大炎症潜能的CD4+T辅助细胞亚群可由特定的肠道细菌诱导,并与帕金森病(以及炎症性肠病)的发病机制有关。
长期以来,人们推测结肠淤滞会导致细菌产物和其他毒素更多地转移到循环中;尽管这一点尚未得到令人信服的证明,但粪便稠度被认为对肠道微生物群组成有重大影响。
如上所述,炎症与帕金森病的发病机制有关,帕金森病患者的一些结肠活检和粪便结果与炎症性肠病患者相似。
迄今为止最大的一项研究调查了美国1.7亿多人的索赔数据,发现炎症性肠病患者的帕金森病发病率增加了28%。
荟萃分析表明,当分别分析克罗恩病患者和溃疡性结肠炎患者时,帕金森病风险的增加仍然显著。研究人员还发现,抗TNF疗法可以显著降低这种风险,这表明炎症性肠病的有效治疗可能会降低帕金森病的发病风险。
一项利用瑞典全国组织病理学数据库进行的研究还发现,显微镜下结肠炎(另一种慢性肠道炎症疾病)与帕金森病之间存在强烈的相关性。
遗传学研究表明,帕金森病和炎症性肠病患者(尤其是克罗恩病)的发生有共同的生物学机制。LRRK2基因中的突变是单基因(常染色体显性)帕金森病最常见的原因之一。
随后的几项研究确定了LRRK2变异体与散发性帕金森病和克罗恩病之间的关联,还报告了帕金森病和炎症性肠病的其他重叠风险位点。这些位点进一步暗示了免疫反应和微生物感应(例如,NOD2基因和HLA位点),以及溶酶体功能障碍,这是两种情况下的常见机制。
约有50个和10个基因分别与单基因炎症性肠病和帕金森病相关,但导致这两种疾病的单基因形式的罕见变异迄今尚未报道。
最后,在2022年发表的一项研究中,与无结肠炎的小鼠相比,患有结肠炎的小鼠的运动功能降低,多巴胺能神经元丢失加重,进一步支持LRRK2、结肠炎和帕金森病之间的联系。
肠易激综合征(IBS)症状,如腹痛和肠道习惯改变,在帕金森病患者中很常见,并与粪便微生物群的变化相关。
在肠易激综合征患者身上观察到的病理生理变化,包括失调、肠道通透性增加和轻度粘膜炎症,可能会使胃肠道更容易受到帕金森病病理的影响。
肠易激综合征与帕金森病之间的关联
在一项来自台湾的全国性注册研究中,涉及约120000人,肠易激综合征与帕金森病风险增加相关。
然而,在芬兰进行的一项类似研究中,在前2年的随访中,风险显著升高,导致作者得出结论,肠易激综合征与帕金森病之间的关联可归因于反向因果关系(即帕金森病的前驱胃肠道症状被误解为肠易激综合征症状);或检测偏差(即,对肠易激综合征症状患者进行更密切的临床监测可提高诊断帕金森病的可能性)。
韩国的一项研究包括约285000名受试者,他们接受了长达11年的监测,发现患有肠易激综合征的老年人(65岁及以上)患帕金森病的风险增加。
迄今为止最大的一项涉及瑞典170万参与者的研究发现,专家诊断肠易激综合征与帕金森病风险增加相关。
然而,在同一研究者进行的补充队列研究中,肠易激综合征的诊断基于自我报告的症状,结果没有统计学意义。因此,这种常见的肠-脑相互作用障碍(影响全球十分之一的人)与帕金森病之间的可能联系仍然没有定论。
迷走神经
迷走神经起源于延髓,在腹腔内为胃、小肠和大肠提供副交感神经支配,直至脾曲。
在两项大型研究中,完全躯干(但非选择性)迷走神经切断术与患帕金森病的风险显著降低相关。
另一项研究分析了相同的丹麦数据库,但包含了较长时间内的大量病例,并使用了不同的编码分类和统计方法,发现躯干或其他类型的迷走神经切断术没有显著降低风险。
相互矛盾的结果可能部分归因于迷走神经切断术的混合效应:虽然这种干预可能限制α-突触核蛋白病理学从肠道向大脑的传播,但由于胆碱能抗炎途径的破坏,它也可能导致免疫稳态向促炎反应的转变。
阑尾切除术
虽然阑尾以前被认为是一个退化器官,但现在人们认识到它富含多种免疫细胞,可以影响胃肠道的炎症和自身免疫,它还充当肠道微生物组的蓄水池和调节器。
研究发现,除了迷走神经背侧运动核的密集神经支配外,阑尾在帕金森病发病机制中的可能作用还表现在该器官中大量聚集的α-突触核蛋白。
在一项研究中,发现年轻人和老年人(从婴儿到84岁)的阑尾中都有大量截短形式的α-突触核蛋白,这些截短形式的α-突触核蛋白是路易小体的主要成分,在实验模型中被证明是α-突触核蛋白聚集的有效种子,包括那些没有神经系统疾病的人,表明阑尾是α-突触核蛋白致病形式的储库。
在2021发表的一项研究中,53%的帕金森病患者和8%的对照组患者的CT扫描显示有慢性阑尾炎的病变。
一小群7名患者接受了阑尾切除术,对切除组织的组织病理学分析显示,阑尾粘膜和粘膜下层存在α-突触核蛋白聚集。
在一些研究中,阑尾切除术与帕金森病风险降低相关,但在大多数研究中,未发现任何影响,甚至风险轻度升高。
有趣的是,一项针对12名帕金森病患者的小型研究采用多组学方法研究了阑尾微生物群,发现了脂质和胆汁酸代谢紊乱的证据,包括阑尾中微生物源性(次生)胆汁酸升高5.6–18.7倍。这些胆汁酸具有毒性作用,并与肠道炎症有关。
与上文所述的对帕金森病下消化道失调的理解的扩展相反,关于帕金森病上消化道失调的研究主要集中在幽门螺杆菌感染和小肠细菌过度生长(SIBO)。
有幽门螺杆菌感染史的人帕金森风险高
幽门螺杆菌感染与帕金森病之间的联系始于20世纪60年代,一项观察性研究显示,患有这种疾病的患者中消化性溃疡的发生率很高,通常在8-10年前出现帕金森症状。
一项来自台湾的研究发现,有感染史的人患帕金森病的风险增加了一倍。
来自丹麦的另一项研究发现,患者根除幽门螺杆菌的治疗史与5年或更长时间后患帕金森病的风险增加45%相关。
帕金森病患者的幽门螺杆菌感染率在不同地理区域的研究中有所不同,从呼吸和粪便抗原检测的25-33%到血清学检测的48-50%不等。这些比率与当地人口的比率相当。
帕金森患者的小肠细菌过度生长患病率范围广
小肠细菌过度生长可作为幽门螺杆菌诱导的胃酸过少的后遗症;其他原因包括使用质子泵抑制剂、小肠运动障碍和免疫反应受损。
研究发现,帕金森病患者的小肠细菌过度生长患病率范围广泛(25–67%),这可能是由于研究参与者的异质性和呼吸测试协议,这些协议提供了小肠细菌过度生长的间接评估,准确性有限。
幽门螺杆菌感染和小肠细菌过度生长均与更严重的运动严重性和更严重的运动反应并发症(延迟和缩短时间)相关。
致病原理
幽门螺杆菌感染和小肠细菌过度生长可能通过降低左旋多巴的生物利用度,或通过诱导慢性外周炎症状态来加剧神经退行性变过程,从而导致帕金森病患者的运动功能障碍。
例如,幽门螺杆菌诱导的细胞毒素可以改变宿主的免疫反应并触发大量促炎物质的释放,这可能导致血脑屏障的破坏、小胶质细胞的激活,最终导致神经元损伤和死亡。
在一项小型研究中,幽门螺杆菌阳性的帕金森病患者被发现对神经功能至关重要的蛋白质的自身抗体水平升高,包括核因子I亚型A、血小板衍生生长因子B和真核翻译起始因子4A3。
另一方面,肠道运动障碍(以及更普遍的自主神经功能障碍)可能是严重帕金森病的表现,并可能导致小肠细菌过度生长,导致观察到这些疾病之间的关联。
几项研究调查了肠道微生态系统与帕金森病风险或前驱症状之间的关系,包括睡眠行为障碍(RBD),它可能在 PD 运动诊断之前 20 年或更长时间。
肠道菌群
对来自德国和日本的队列(包括46名特发性睡眠行为障碍(RBD)患者、223名帕金森病患者和137名对照个体)进行的荟萃分析表明,睡眠行为障碍患者与帕金森病患者具有不同的微生物成分,尽管观察到一些重叠(例如,两种情况下Akkermansia的丰度增加)。
有趣的是,与对照组相比,在一小群睡眠行为障碍患者中,产生短链脂肪酸的细菌数量并没有减少,
作者认为短链脂肪酸可能在孤立性快速眼动睡眠行为障碍向帕金森病的转化中发挥作用。同时,在包括666名个体的大趋势队列研究中,一些帕金森病的风险或前驱标记物与微生物组组成的改变相关,尽管其影响很小。
如上所述,病例对照研究已经确定了帕金森患者中存在大量差异丰富的菌群。然而,在单独的研究中,只有少数与运动特征(MDS-UPDRS评分、运动反应并发症或姿势不稳定和步态困难(PIGD)表型)或非运动特征(认知、抑郁、焦虑或便秘)相关。
在一项研究中,肠杆菌科细菌的丰度与更严重的运动表型相关,这与大肠杆菌通过产生脂多糖和卷曲菌毛在帕金森病发病机制中的可能作用有关。
纵向研究的结果也不一致。在25名新发PD患者的3年随访研究中,更快的PD运动进展(使用Hoehn和Yahr评分量表或UPDRS测量)与较低的基线Roseburia丰度相关;在36名PD189患者的2年随访研究中,使用19种细菌分类群的定量PCR,与双歧杆菌和Atopobium 的基线丰度相关。
短链脂肪酸
帕金森病患者肠道微生物群衍生代谢的临床研究仍然很少。低水平的粪便丁酸盐与较差的认知功能和步态困难评分以及更早出现运动和非运动症状相关,而低水平的粪便乙酸盐与低BMI和排便频率降低相关。
帕金森病患者的血浆乙酸盐和丙酸盐水平高于对照组。一些研究人员推测,由于肠道屏障破坏和结肠上皮细胞对肠道短链脂肪酸的利用或清除减少,肠道短链脂肪酸会泄漏到体循环中。
血浆丙酸水平与运动严重程度呈负相关,这与短链脂肪酸对帕金森病有益的总体临床趋势一致。
氧化三甲胺(TMAO)
另一种对帕金森病越来越感兴趣的肠道代谢物是氧化三甲胺(TMAO),根据实验研究,氧化三甲胺可以通过促进正确的蛋白质折叠和防止病理性不溶性纤维的形成来防止神经变性。
如上所述,一些研究发现帕金森病患者粪便和血浆样本中的氧化三甲胺水平均降低,尽管其他研究发现帕金森病患者的血浆氧化三甲胺水平高于对照组。血浆氧化三甲胺水平与帕金森病进展之间的相关性也得到了相互矛盾的结果。
饮食是决定微生物组成和功能的关键因素。肠道微生物将摄入的营养物质用于基本的生物过程,反过来,它们的代谢产物被认为对人类健康有重要影响。
尽管每种主要的宏量营养素和微量营养素都能改变肠道微生物群,但为大肠微生物提供主要能量来源的不可消化碳水化合物(例如纤维和抗性淀粉)在饮食-微生物群相互作用中发挥着特别突出的作用。
这些聚糖的低消耗与微生物多样性降低、短链脂肪酸产量减少以及肠道微生物对粘液的觅食增加有关,导致肠道屏障完整性中断。
许多研究调查了帕金森病风险与饮食成分(包括大量营养素、微量营养素、特定食物和饮食模式)之间的关系。
饮食与帕金森病风险和进展

Tan AH, et al.,Nat Rev Neurol. 2022
研究结果往往相互矛盾,前瞻性研究和病例对照研究之间存在差异。虽然前瞻性研究比病例对照研究更好地确定饮食和疾病之间的因果关系,但它们不能完全消除反向因果关系,即患者因疾病早期迹象改变饮食习惯。
此外,病例对照研究受到选择和饮食回忆偏差的限制。然而,令人惊讶的是,咖啡因研究的结果具有显著的可重复性,这使得咖啡因成为最能降低帕金森病风险的环境暴露之一。
地中海饮食
近年来,地中海饮食已成为一种潜在的“健康”饮食模式,与降低慢性病(包括帕金森病)的风险相关,以及几项前瞻性研究中的总体死亡率减低。
这种饮食通常包括相对较高的水果、蔬菜、全谷物和不饱和脂肪的摄入量,相对较低的肉类(包括家禽)和乳制品的摄入量,以及适度的酒精摄入。
据推测,地中海饮食的有益健康效应部分是通过保护机体免受氧化应激和炎症的影响,以及通过肠道微生物代谢产物改善宿主代谢的调节来实现的。
与其他慢性病一样,大量研究与缺乏减少帕金森病发展或进展的决定性饮食建议之间仍存在明显差距。对饮食化合物反应的个体间差异,可能源于肠道微生物群和宿主基因组成的差异,进一步使饮食与疾病之间的关联复杂化,基于人群的研究结果可能对个别病例的普遍性有限。帕金森的饮食干预研究仍处于起步阶段,将在后面的治疗策略部分进行讨论。
前面介绍了LRRK2基因、帕金森病和炎症性肠病之间相互关系的概念。LRRK2蛋白在免疫细胞中高度表达,并在接触微生物病原体后上调。
与克罗恩病患者的非炎症结肠组织相比,炎症结肠组织中检测到更高水平的LRRK2,与匹配对照组相比,散发性帕金森病患者的外周免疫(血单个核)细胞中检测到更高水平的LRRK2。
LRRK2过度表达也显示出增加结肠炎的严重程度,因此,LRRK2被认为在一定程度上通过介导肠道中的异常炎症反应参与帕金森病的发病机制。然而,其他作者推测,通过增强肠道细菌清除和减轻肠道炎症,增加LRRK2激酶活性会产生有益的效果。
免疫细胞中高水平的LRRK2是否对帕金森病产生保护作用或有害作用,目前尚不清楚。
就动物模型而言,缺乏PTEN基因诱导的假定激酶1(PINK1)的小鼠的肠道革兰氏阴性细菌感染,该激酶参与线粒体内环境平衡,并由帕金森病的某些单基因形式突变的基因编码,触发外周和大脑中自反应性线粒体特异性细胞毒性CD8+T细胞的产生,导致纹状体多巴胺能丧失和运动障碍。
左旋多巴是帕金森病的主要治疗药物,必须到达原代小肠才能被吸收。
胃轻瘫是一种在没有机械阻塞的情况下胃排空延迟的情况,导致左旋多巴留在胃中并转化为多巴胺,而多巴胺不能穿过血脑屏障进入大脑。
反过来,胃中的多巴胺可能进一步损害胃运动。通过使用无线运动胶囊(“智能药丸”),这是一项相对较新的技术,35%患有各种胃肠道症状的帕金森病患者发现胃排空时间延长,20%有小肠传输延迟,8%有合并传输异常。
胃轻瘫通过降低左旋多巴的生物利用度,导致反应波动,如延迟开启状态,甚至剂量失效。因此,胃轻瘫的治疗,以及“绕过”胃的新疗法,可能会缓解帕金森病的运动波动和症状。
饮食蛋白质限制可以减少摄入的氨基酸和左旋多巴之间的竞争,以实现通过肠道上皮和血脑屏障的可饱和主动运输;然而,由于人们认识到体重减轻、营养不良、肌肉减少和骨质疏松症在帕金森病中已经很常见,并且可能被这种方法放大,因此现在人们往往不鼓励这种做法。
胃肠功能和左旋多巴药代动力学
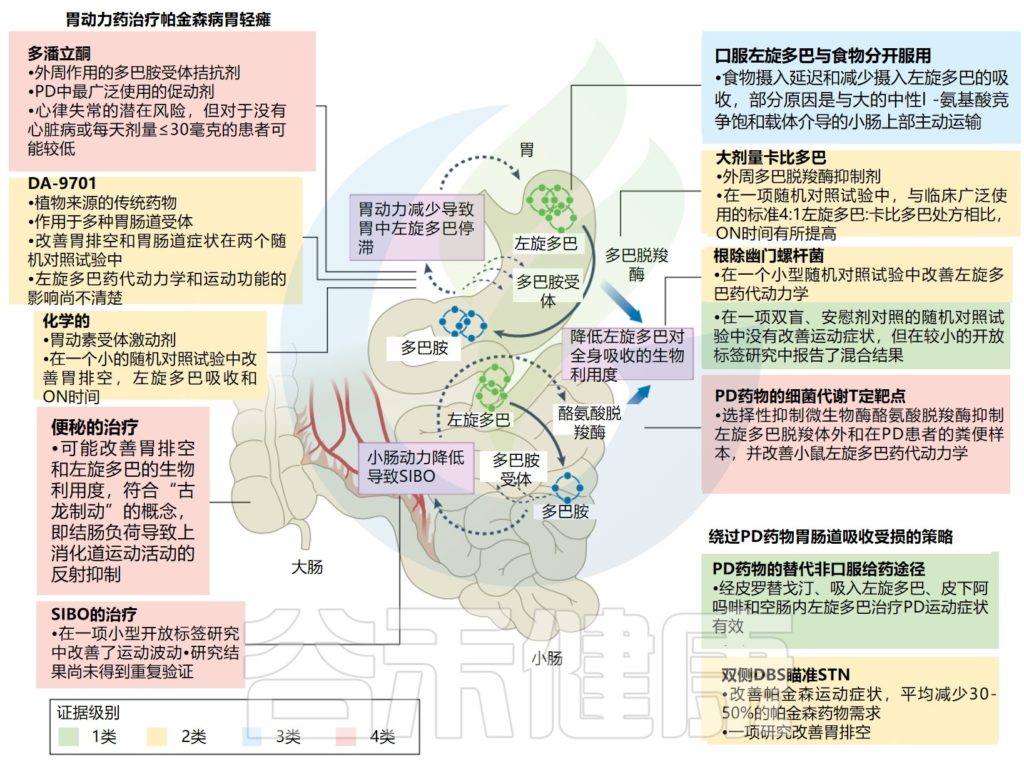
Tan AH, et al.,Nat Rev Neurol. 2022
该图说明了胃轻瘫和小肠微生物活性对帕金森病患者左旋多巴药代动力学的影响,并概述了改善胃肠功能和提高左旋多巴生物利用度的治疗策略。
促动力药物,尤其是多潘立酮,是治疗帕金森病相关胃轻瘫的主要药物,临床试验证明了DA-9701和Camicinal (胃动素受体激动剂)等新型促动力药物的潜在益处,而其他药物,如5-羟色胺5-HT4受体激动剂莫沙必利和普鲁卡因丙利、组胺激动剂尼扎替丁和胃饥饿素(ghrelin)激动剂对帕金森病的益处的证据仍然有限。
从食物中单独口服左旋多巴或与大剂量卡比多联合使用可以帮助提高左旋多巴的生物利用度。一些临床研究探讨了幽门螺杆菌感染、小肠细菌过度生长(SIBO)和便秘治疗对左旋多巴生物利用度和帕金森病运动反应并发症的影响。
肠道微生物在左旋多巴代谢中的作用也得到强调,并可能开辟新的治疗途径来改善帕金森病药物的吸收。绕过胃肠道的策略,包括非口服形式的多巴胺替代品和DBS,是治疗帕金森病运动症状的可能选择。
高度多样化的肠道微生物群及其丰富的酶库可以将许多药物转化为活性更高或活性更低的代谢物,现已被认为是药物药理、疗效和毒性个体间差异的主要因素。
在一项开创性的研究中,在271种不同的口服药物中,三分之二的药物被76种人类肠道细菌分离物中的至少一种显著耗尽,每种菌株代谢11-95种不同的药物。
细菌酪氨酸脱羧酶的发现可以在小肠中将左旋多巴转化为多巴胺,从而限制其生物利用度并可能导致外周多巴胺能不良反应,这为帕金森病患者对左旋多巴观察到的显著个体间反应提供了一种解释。
粪肠球菌(Enterococcus faecalis)是负责左旋多巴脱羧的主要微生物。考虑到小肠细菌过度生长与运动严重程度和波动之间的关联,推测小肠中的细菌过度生长会导致酪氨酸脱羧酶或其他代谢左旋多巴的细菌酶的产生增加。
值得注意的是,左旋多巴肠道细菌代谢产生的多巴胺也会损害肠道运动,可能导致恶性循环,增加小肠细菌过度生长。
然而,目前几乎没有直接证据支持这些观点,部分原因是进入小肠的技术困难。帕金森病的所有研究都使用呼吸试验评估小肠细菌过度生长,如前所述,缺乏标准化。
一项针对18名帕金森病患者的小型研究发现,使用利福昔明进行西博治疗不会影响左旋多巴的药物动力学,但会改善治疗的及时性(但6个月后复发率为43%)。
肠道微生物也可以通过间接机制与左旋多巴相互作用,包括肠道环境的变化(例如,粘膜损伤和炎症),导致细菌降解产物与左旋多巴之间的无效吸收和竞争,以在小肠中进行主动转运。
例如,幽门螺杆菌相关性胃十二指肠炎伴胃低氯酸盐被认为可减少左旋多巴的吸收,左旋多巴在酸性降低的环境中溶解性较低。然而,幽门螺杆菌感染对左旋多巴药代动力学的影响尚不清楚。
一项小型研究(n=34)发现根除幽门螺杆菌后左旋多巴药代动力学得到改善;然而,另一项较大的研究(n=73)没有发现帕金森病幽门螺杆菌阳性和阴性患者之间左旋多巴的药代动力学有任何差异。
此外,尽管几项小型开放标签研究发现根除幽门螺杆菌后运动结果显著改善,但2020年发布的一项双盲、安慰剂对照、随机临床试验(DBPC-RCT)在短(12周)或长(52周)随访后,未发现运动功能或运动波动(使用MDS-UPDRS和可穿戴传感器评估)或生活质量的改善。小肠细菌过度生长状态不影响本研究的结果。
虽然在本研究中根除幽门螺杆菌与任何临床意义的改善无关,但从长远来看或在疾病早期阶段,仍有可能改变根除幽门螺杆菌对帕金森病的影响。
各种微生物导向疗法有望在各种情况下进行症状管理或疾病治疗,但临床试验患者人数相对较少。
最好的证据来自粪菌移植(FMT)对严重梭状芽胞杆菌感染的治疗,证明了约90%的疗效,并为这些方法的临床应用提供了概念证明。
前面我们已经知道,饮食可以通过微生物群-肠-脑轴影响肠道微生物群的组成和中枢神经系统的神经活动。
★ 地中海饮食
前面已经提到,地中海饮食与帕金森的关联。
也有研究表明,坚持地中海饮食与前驱帕金森病的低发病率显着相关。
最近的一项随机临床试验调查了地中海饮食对帕金森病患者认知功能的影响,发现坚持地中海饮食可显着提高执行功能、语言、注意力、记忆力并改善认知功能。因此,地中海饮食可能是减少帕金森病发病和发展的有前景的干预策略。

地中海饮食
地中海饮食是以大量植物性食物为特征的健康饮食模式,如水果、蔬菜、谷类、豆类、坚果等,中低量的乳制品,以橄榄油为主,少量和中等量的鱼和肉,以及少量的红肉,用香料代替盐。
高膳食纤维是地中海饮食的特点之一。膳食纤维结构的细微变化可能强烈影响肠道微生物群的组成和功能。
扩展阅读:你吃的膳食纤维对你有帮助吗?
将富含抗氧化剂的食物(对整体大脑健康很重要)加入饮食中。包括颜色鲜艳的和深色的水果和蔬菜。前瞻性研究发现膳食维生素 E 和胡萝卜素的摄入可以降低患帕金森病的风险。这些抗氧化剂可以中和氧自由基的作用,减少氧化损伤。
橄榄油是地中海饮食的主要脂肪来源,主要含有单不饱和脂肪酸,具有抗氧化活性并抑制α突触核蛋白聚集。橄榄油中的酚类化合物具有抗炎、抗氧化、神经保护和免疫调节活性。
补充水分,每天至少应饮用 8 杯水。
需要限制或避免摄入的:
避免食用含有大量胆固醇或饱和脂肪的食物,少吃肉类(尤其是红肉类)也很重要。
糖、盐、饮料的摄入量也应该严格限制。
尽量限制加工食品的摄入。
★ 禁食疗法
除了我们熟悉的地中海饮食,与预防或治疗帕金森病相关的饮食疗法还包括禁食疗法。
模拟禁食的饮食可以减少 MPTP 诱导的帕金森病小鼠黑质中多巴胺能神经元的损失。
间歇性禁食可以保护疾病动物模型中的神经元,减少多巴胺能神经元的数量并改善帕金森病的运动功能。
关于间歇性禁食详见我们上一篇文章:
间歇性禁食 & 肠道菌群 & 心血管代谢疾病
药物治疗时需要注意避免混合在一起的:
在服用药物治疗帕金森氏症时最好避免饮酒,因为酒精可能会干扰药物治疗。
对于一些帕金森病患者来说,如果服药时间与蛋白质或铁(以铁补充剂的形式)的摄入时间接近,那么服药时间的安排尤其成问题。这些人对药物的吸收很敏感。
总之,饮食可以调节肠道菌群的改变,并通过抗炎、减少氧化应激和神经保护作用对大脑产生影响。饮食介导的治疗可以作为治疗和预防帕金森病的新策略。
益生元主要是不易消化的碳水化合物,短链脂肪酸是由其发酵产生的。益生元是宿主微生物(或施用的益生菌菌株)利用的基质,具有健康益处。
在一项小型开放标签研究(n=19)中,富含不溶性纤维(一种常见益生元食物来源)的饮食改善了便秘、血浆左旋多巴生物利用度和运动功能。
此外,一项有87名参与者参与的开放性研究报告称,在接受益生元干预的帕金森病患者中,使用抗药性进行益生元干预后,非运动症状评分得到改善,粪便丁酸显著增加,粪便钙卫蛋白水平降低。
在仅接受饮食指导的患者中未观察到此类变化,并且两种干预措施均未导致微生物成分或便秘严重程度的显著变化。
帕金森病肠道微生物组的治疗调节
Tan AH, et al.,Nat Rev Neurol. 2022
益生菌是活的微生物,当剂量足够时,可带来健康益处。
两项研究为多系列益生菌的价值提供了I级证据(作为添加益生元纤维的发酵乳服用(n=120)或作为每日一次的胶囊配方(n=72))用于治疗帕金森病便秘,据报道,肠道频率和粪便组成有所改善。
益生菌配方中包括各种乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)和肠球菌(enterococcus)菌株。由于这两项研究的干预持续时间仅为4周,因此需要进一步研究,以检查益生菌治疗帕金森病的长期疗效和安全性。
事实上,大多数益生菌制剂中都含有双歧杆菌和乳酸杆菌,但它们是帕金森病患者中已经普遍升高的两个属。肠球菌有时也包括在益生菌中,但已显示出强大的左旋多巴降解能力,强调在PD患者中使用这些益生菌时需要谨慎。
粪菌移植(FMT)对肠道微生物群的调节作用可能通过免疫、内分泌、代谢和神经通路对神经系统疾病的症状或进展产生影响。
粪菌移植在帕金森病患者便秘治疗中的潜在价值已在6名患者的病例系列和11名患者的开放标签研究中显示。
从供体向患者传播传染病或其他微生物介导的特征是与这种方法相关的潜在风险。
在两项研究中,供体粪便菌群均采用内窥镜管理,无重大不良事件发生。目前正在研究粪菌移植(FMT)对帕金森病运动和非运动症状的影响。
抗菌剂减少了许多肠道微生物的数量,可能无法区分有害微生物和有益微生物。此外,反复治疗(例如,反复出现的小肠细菌过度生长)也有产生抗生素耐药性的风险。
上文讨论了根除幽门螺杆菌或治疗帕金森病SIBO的抗生素。尽管在研究后1年的随访中,根除幽门螺杆菌并没有改善临床特征,但潜在的疾病改善效应仍然存在。
在几项研究中发现的安慰剂干预后小肠细菌过度生长状态的自发变化和治疗后相对较高的复发率突出了与研究和试图根除帕金森病患者小肠细菌过度生长相关的挑战。
后生元是指赋予健康益处的无生命(杀死的)微生物和/或其成分的制剂。作用于肠道相关靶点的小分子、生物制剂或代谢物可能包括抑制肿瘤坏死因子、Toll样受体或富含亮氨酸的重复激酶2信号、短链脂肪酸和肠道屏障恢复治疗,如紧密连接调节剂或粘液稳定剂。
其他有可能使帕金森病患者受益的微生物导向药物,包括小分子药物和生物制剂,尚未在临床环境中进行广泛探索。
给予短链脂肪酸和靶向抑制左旋多巴代谢细菌酶似乎具有特别的前景,但仍需在人类干预研究中进行测试。
免疫调节和肠道屏障恢复方法也值得进一步关注。抗TNF治疗可降低炎症性肠病患者的帕金森病发病率,已证明可使炎症性肠病患者的粪便微生物群组成向健康人的粪便微生物群组成转变,丁酸盐和相关底物的粪便水平与临床缓解有关。
针对肠道神经系统中帕金森病相关分子发病机制(例如,涉及α-突触核蛋白或葡萄糖脑苷酶)的策略可能代表另一个新的前沿;在一项开放性试验中,口服角鲨胺(建议以静电方式取代肠道神经元中的α-突触核蛋白聚集体)是安全的,并能显著改善帕金森病患者的便秘症状。
发表在《神经病学》杂志上的一项研究发现,患有早期帕金森病的人每周两次定期通过散步或园艺等活动进行一到两个小时的适度体育锻炼,他们的平衡、行走能力、力量和耐力可能会有所改善。
五年以上经常锻炼的早期帕金森患者,在认知测试中表现更好,症状进展较慢。
每周至少进行4小时中等强度到剧烈运动(比如走路或跳舞)的人,与没有进行那么多运动的人相比,平衡能力下降的速度要晚5年。
有规律的活动,即使是小量的活动,也会有产生影响。
不同形式的体力活动似乎有不同的效果:
研究表明,89% 的帕金森病患者会出现言语和声音障碍,包括声音轻柔、单调、呼吸沙哑和发音不确定。因此,患有帕金森的人不太能参与正常对话,或者对社交环境没有信心。
言语障碍会逐渐降低帕金森患者的生活质量。一个人越早接受基线言语评估和言语治疗,就越有可能随着疾病的进展保持沟通技巧。沟通是帕金森患者生活质量高、充满信心的关键因素。
音乐疗法作为一种发展相对成熟、安全、方便实施而又成本低廉的非药物干预方法,被广泛应用于帕金森病人的康复中。
★ 措施
根据音乐疗法的性质及其应用方式可将音乐疗法分为 3 种类型:
① 主动音乐疗法:
大多采用治疗师与病人合作的方式,通过让病人唱歌、跳舞等形式调节病人情绪,逐步提高病人适应外界的能力,是国外康复机构主要治疗方法之一。
② 被动音乐疗法:
多注重治疗师的引导作用,常在病人休息时进行,让病人在欣赏和感受音乐的过程中,通过音乐的节奏、音色等因素影响人的神经系统,从而达到治疗的作用。
③ 综合疗法:
综合疗法往往是主动、被动双管齐下,并不限于哪种方法的使用,如在绘画时听音乐以陶冶情绪,或用音乐导引练习气功等。通过综合考虑音乐风格、人格类型、文化背景 、兴趣爱好 、职业等因素开出音乐处方实行辨证施乐。
★ 效果
改善运动障碍,增加运动协调性
对11例男性帕金森病人实施音乐疗法方案,用维也纳测试系统(VTS)测量病人在听音乐前后的身体运动协调性,研究发现实施音乐疗法后病人肢体瞄准和直线追踪方面有显著改善。
从华盛顿大学医学院招募了 23 例帕金森病人进行音乐疗法实验,研究者让病人边走边唱自己熟悉且韵律感强的歌曲,结果发现当病人以与舒适的步态步调相匹配的节奏唱歌时,可以改善步态的协调性和稳定性,同时还增强了病人的语言清晰度和声音强度。
18 例帕金森病人随机分为干预组和对照组,干预组采用音乐疗法,病人根据音乐节拍做一些特定的舞蹈动作或跟着音乐唱歌,对照组则采用传统理疗方式,结果显示干预组病人在身体灵活性、步态等方面较对照组有显著改善,病人的跌倒次数也显著减少。
研究平板训练联合音乐疗法对帕金森病人冻结步态的影响,结果显示平板训练联合音乐干预能够显著缓解帕金森病人冻结步态,减少摔跤次数。
提高认知能力,改善吞咽功能和言语障碍
有研究招募了 25 例帕金森病高龄病人为研究对象,实验组病人接受音乐疗法 24 周,对照组不进行任何干预,结果发现实验组病人认知能力、处理速度、注意力、记忆能力较对照组有明显改善。
美国一项研究对 27 例帕金森病人进行音乐疗法干预后,病人吞咽功能明显改善,同时说话吐字也更加清晰,但在实验干预的过程中使用多个研究人员进行干预和评估,无法保证被测病人的 2 次评估是由相同的研究人员完成,因此不同的评估者的主观因素可能会影响评估结果。
对 4 例帕金森病人进行了为期 1 个月的音乐干预,结果显示音乐疗法提高了帕金森病人的声音强度和语言清晰度。和谐而又有节奏感的音乐能够有效改善帕金森病人的认知能力,同时也有利于病人的言语康复。
改善负面情绪,提高病人生活质量
将80 例帕金森病人随机分为对照组和实验组各 40 例,对照组接受常规治疗,实验组病人在常规治疗的基础上接受音乐干预,通过汉密尔顿抑郁量表评估干预后的效果,结果显示实验组抑郁评分明显下降,并激发了病人积极的情绪状态。
对 32 例帕金森病人进行为期 3 个月的随机对照实验发现,接受音乐干预的帕金森病人调节情绪的能力明显提高,同时病人也对音乐疗法提供的社交和创造性的交流方式表达了欣赏和喜爱,幸福指数也明显增高。
镁
矿物镁的摄入量低会使过量的重金属和毒素在大脑中沉积,从而导致帕金森和阿尔茨海默病。
当有足够的镁存在时,重金属不能在小肠中被吸收。镁在保护神经元免受铝和汞中毒的致命影响方面起着至关重要的作用。
镁也是治疗震颤最重要的自然疗法之一。研究人员发现,每天服用镁补充剂可以缓解手部震颤的症状。
富含镁的食物:
B族维生素
缺乏维生素 B9 和 B12可能导致最初表现为抑郁、焦虑甚至精神病的大脑问题。其他 B 族维生素可用于防止与年龄有关的脑萎缩,并可能防止记忆丧失。
谷胱甘肽
谷胱甘肽是抗氧化剂,能有效中和自由基损伤,并大大减少破坏神经元的氧化应激。
葡萄籽提取物
具有超强抗氧化作用,可减少大脑中的 DNA 碎片。它能够进入大脑,保护脑细胞免受自由基损伤。
帕金森病微生物组研究的当前差距和未来方向
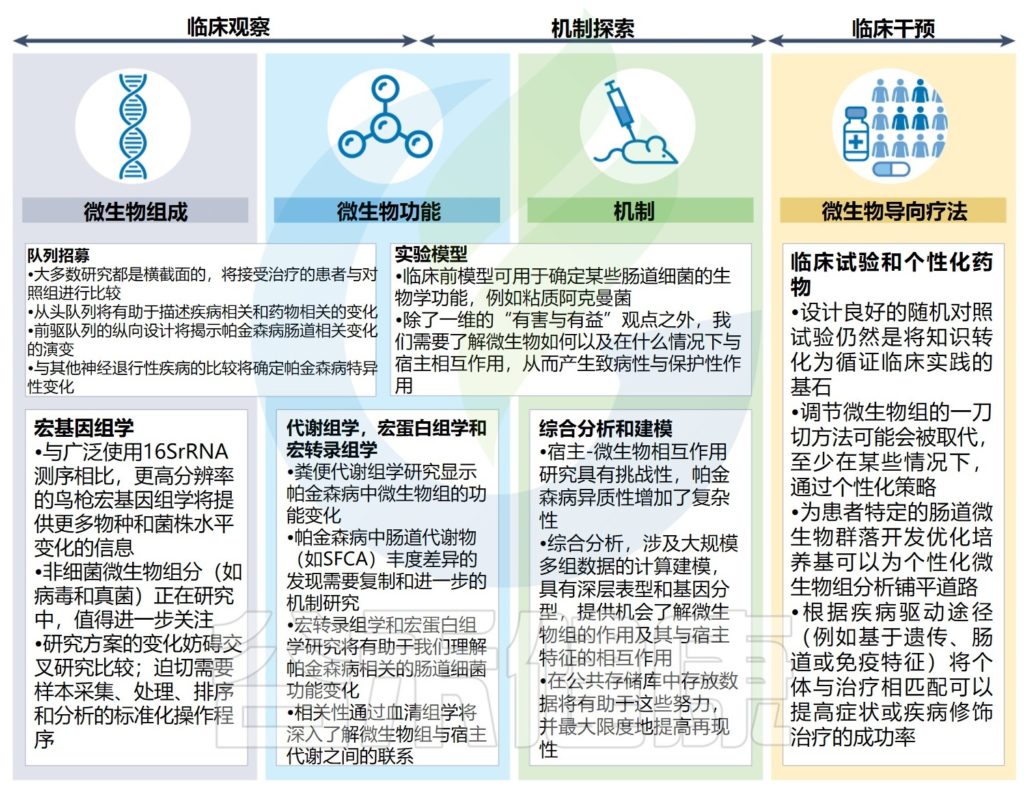
Tan AH, et al.,Nat Rev Neurol. 2022
帕金森病微生物组研究重点正在从研究微生物组结构和潜力(即肠道中存在哪些微生物及其相对丰度和代谢潜力)转向通过使用多组学平台和机理研究来了解微生物功能。
根据观察性研究和基本机制研究的结果,以回答有关肠道微生物和代谢物在帕金森病发病、维持和进展中的作用的基本问题,该领域有望发展到微生物导向疗法的临床试验,从而将微生物组学转化为这种疾病患者的临床现实。
目前,有关肠道相关因素与人类帕金森病之间关系仍然存在很大的相关性,现在需要从观察性研究设计过渡到干预性研究设计。
然而,一些问题仍然存在,确定改变是否是疾病过程的因果关系或促成因素将是至关重要的。例如,与肠道微生物组分的相关性——可能反映了对疾病因素(如转运时间改变或炎症)的次要或共同的非特异性反应。
总之,关于胃肠道参与神经退行性路径,许多疑难杂症仍有待解开。我们希望这一领域的科学进步可以给人们带来新的诊断、预后和治疗方法,最终将改善帕金森病患者及其家人的生活质量。主要参考文献:
Tan AH, Lim SY, Lang AE. The microbiome-gut-brain axis in Parkinson disease – from basic research to the clinic. Nat Rev Neurol. 2022 Jun 24. doi: 10.1038/s41582-022-00681-2. Epub ahead of print. PMID: 35750883.
Wang Q, Luo Y, Ray Chaudhuri K, Reynolds R, Tan EK, Pettersson S. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 2021 Oct 22;144(9):2571-2593. doi: 10.1093/brain/awab156. PMID: 33856024.
Menozzi, E., Macnaughtan, J. & Schapira, A. H. V. LRRK2 parkinsonism: does the response to gut bacteria mitigate the neurological picture? Mov. Disord. 36, 71–75 (2021).
Nishiwaki, H. et al. Short- chain fatty acid- producing gut microbiota is decreased in Parkinson’s disease but not in rapid- eye-movement sleep behavior disorder. mSystems 5, e00797-20 (2020).
Vascellari, S. et al. Clinical phenotypes of Parkinson’s disease associate with distinct gut microbiota and metabolome enterotypes. Biomolecules 11, 144 (2021).
马春潮.帕金森的防治[J].开卷有益-求医问药,2021(09):35.
Koutzoumis,D.N. et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson’s disease. Exp. Neurol. 325, 1 13159 (2020).

谷禾健康
在过去几十年中,人类的饮食行为发生了巨大的变化。传统的早餐-午餐-晚餐模式已被频繁的小吃、夜间大餐和不吃早餐所取代。这种不规律的饮食模式可能对心血管代谢疾病风险产生不利影响,如肥胖、胰岛素抵抗、高血糖症、2型糖尿病等。
间歇性禁食已被越来越多的人认为是一种有前途的治疗心血管代谢疾病(CMD)的方法。一些神经科学家认为,我们的身体已经进化到能够不吃东西几个小时,甚至几天。
进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
间歇性禁食(IF),包括周期性禁食和限时饮食(TRF)等开始越来越流行。

本文讨论肠道微生物组的组成和功能改变,对代谢、高血压、2型糖尿病、肥胖症及其长期微血管和大血管并发症发展的风险之间潜在联系的新证据,同时也包括间歇性禁食的安全性,将间歇性禁食融入日常生活的建议等。
本文关键词

间歇性禁食在进食和禁食之间循环,通常是只能在特定时间进食,比如通过每周12小时至几天的限制进食。它关注的不是吃什么,而是在什么时间段内可以吃。
在食物缺乏的时间内,人体新陈代谢通过产生和利用脂肪酸衍生的酮,以及通过自噬增加细胞水平的营养循环,将脂肪从储存转换到动员。
注:脂肪动员是指储存在脂肪细胞中的脂肪,被脂肪酶逐步水解为游离脂酸(FFA)及甘油并释放入血液,被其他组织氧化利用的过程。
目前已有许多研究表明,间歇性禁食在减轻体重、改善葡萄糖稳态和血脂以及抗炎作用等方面都带来益处。
间歇性禁食包括以下几种常见的方式:
隔日禁食(ADF)
在某一天规律进食和第二天不进食之间进行交替。
周期性禁食(5:2天)
5:2天的进食也称为周期性禁食,其特征是一周两天极度限制或完全禁食,而一周其他五天可以不受限制地进食。
模拟禁食的饮食(FMD)
定期禁食的一种变体,特点是连续几天低热量摄入周期,然后每一到四个月或每隔一周进行一次正常的饮食循环。
限时饮食(TRF)
不那么极端的饮食,将每天的食物摄入量限制在4-12小时内,例如,分别在12:12小时或16:8小时(禁食:进食),包括斋月期间的禁食。
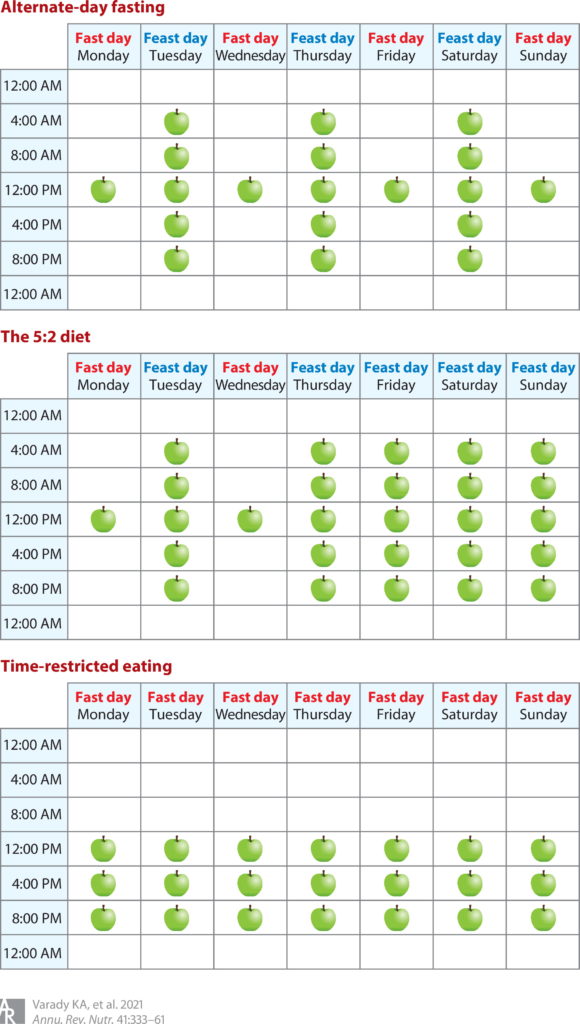
此图概述了一周中每一天的隔日禁食、5:2 饮食和限时进食 (TRE)(此处显示 8 小时 TRE)期间的食物摄入时间。食物摄入时间用苹果图标表示。
临床上对间歇性禁食的研究结果不一致:
几项临床研究表明,间歇性禁食可延长预期寿命并提供广泛的益处,包括减轻肥胖、高血压、2型糖尿病和心血管疾病。
然而,其他研究发现,特定时间的饮食在改善心血管和代谢结果方面并不优于控制能量的饮食。
因此,禁食和进食期间代谢转换的机制值得进一步研究。
最近,间歇性禁食已被证明会影响肠道菌群,几乎涉及宿主生理学的所有方面,这表明间歇性禁食生理影响的全新机制。
人类研究中,关于禁食对肠道菌群的影响

Angoorani P, et al.,Nutr Metab (Lond). 2021
本小节重点介绍一些关于肠道微生物组在间歇性禁食中作用的显著发现,肠道微生物组反过来影响心血管疾病相关的代谢表现,如肥胖、高血糖、高血压等。
我们知道,体重增加是由于过多的能量摄入加上较低的能量消耗,这通常是由体内脂肪的积累造成的。脂肪积累会对心血管系统造成严重的威胁。
关于肥胖与菌群的关系详见我们之前的文章:
体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
对人体随机对照试验的Meta分析表明,每周定期禁食2-3天的间歇性能量限制可改善超重和肥胖使体重减轻,降低体脂。这些改善的重要贡献可归因于肠道微生物群对脂质代谢和能量平衡的影响。
其中一种机制涉及脂肪组织,这是一种对营养刺激敏感并在间歇性禁食期间经历动态重塑的异质器官。
在哺乳动物中发现了两种不同形式的脂肪组织:
▸ 肠道菌群在隔日禁食介导的代谢改善中具有因果作用
喂食高脂肪食物并接受隔日禁食方案的肥胖小鼠在WAT中表现出白色脂肪积累增加,同时伴有体重减轻和肠道微生物组组成改变。
值得注意的是,向接受隔日禁食的肥胖小鼠补充抗生素消除了隔日禁食的有益代谢作用,并且将 隔日禁食小鼠的粪便移植到抗生素治疗的肥胖小鼠的粪便改善了代谢健康,表明肠道微生物组在隔日禁食介导的代谢改善中具有因果作用。
间歇性禁食介导的肠道微生物群调节宿主能量代谢的积极作用
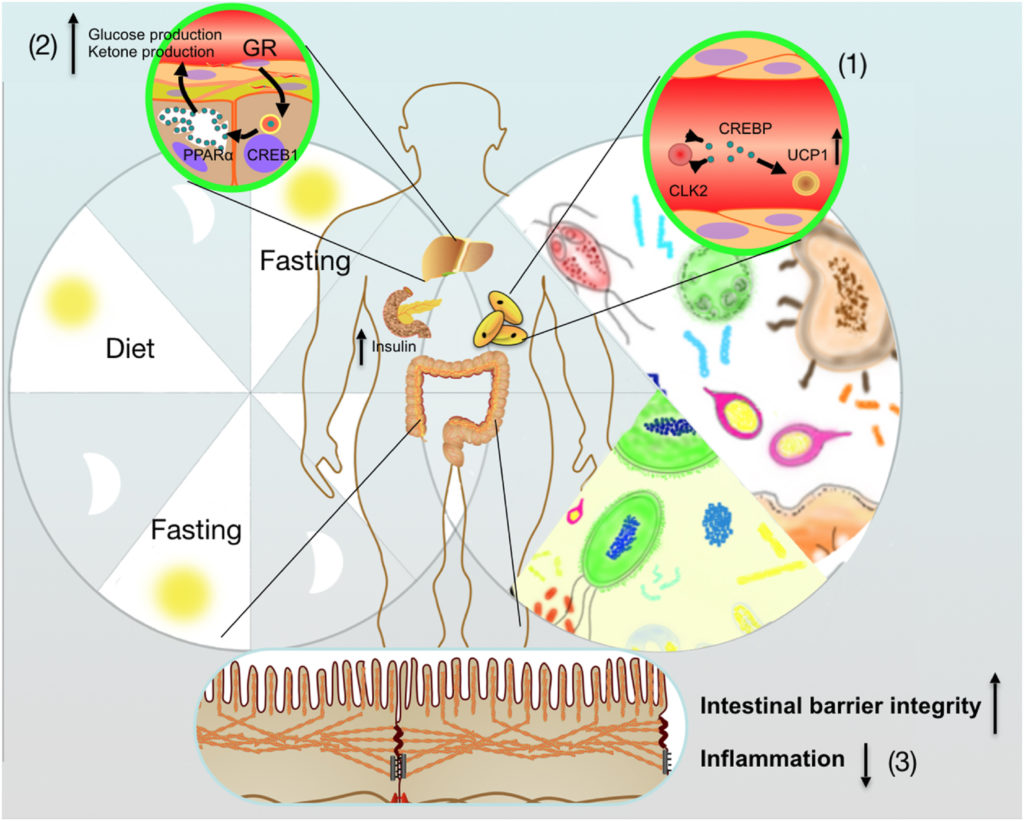
Rong B, et al.,Anim Nutr. 2021
(1) 间歇性禁食通过改善肠道菌群,促进WAT米色脂肪组织
(2) 在不摄入营养期间,肠道微生物群参与增加肝酮的产生
(3) 间歇性禁食优化的微生物群还负责保护宿主肠道屏障
▸ 隔日禁食诱导多种肠道细菌产生乙酸和乳酸
将盲肠代谢组学与Shotgun宏基因组学相结合,发现隔日禁食会导致肠道微生物群的组成发生变化,从而导致产生乳酸和乙酸的细菌(如罗伊氏乳杆菌)发生变化,进而导致血清乳酸和乙酸的积累。
关于罗伊氏乳杆菌详见:认识罗伊氏乳杆菌(Lactobacillus reuteri)
隔日禁食还通过促进米色脂肪生成来增加能量消耗,并改善体重增加和其他代谢紊乱。
在另一项研究中,仅在喂食正常饲料的小鼠中,乳酸杆菌水平在隔日禁食喂养的小鼠身上重复升高,而Allobaculum属则只在隔日禁食和高脂肪饲料的小鼠中富集。Allobaculum属是一种活性的葡萄糖代谢产物,能产生丁酸盐和乳酸盐。
这些结果表明,隔日禁食诱导多种肠道细菌产生乙酸和乳酸。然而,还需要更多的研究来确定乳酸和短链脂肪酸对WAT褐变以及对宿主产热和能量消耗的影响。
肠道微生物群的变化除了影响脂肪细胞产热之外,也可能影响适时进食过程中的脂质摄取。
控制宿主昼夜脂质吸收可能通过以下几种机制发生:
▸核因子白细胞介素-3 (NFIL3)的调节
核因子白细胞介素-3是一种受昼夜节律控制的转录因子,调节参与肠上皮细胞中脂质的摄取、加工和储存的基因的节律性表达。
NFIL3中的节律振荡由肠道微生物组通过激活先天免疫细胞反应驱动。
▸组蛋白脱乙酰酶3(HDAC3)的调节
刺激HDAC3的节律性表达和向染色质招募导致肠上皮组蛋白乙酰化的同步昼夜振荡,这反过来调节营养转运蛋白的基因表达,从而影响营养物质摄取和脂质吸收。
总的来说,肠道微生物群通过调节控制脂质和营养摄入的基因,以及通过产生影响脂肪组织的微生物代谢物来影响能量代谢。
间歇性禁食导致肠道微生物组分和功能的改变,这反过来可能影响心血管代谢健康
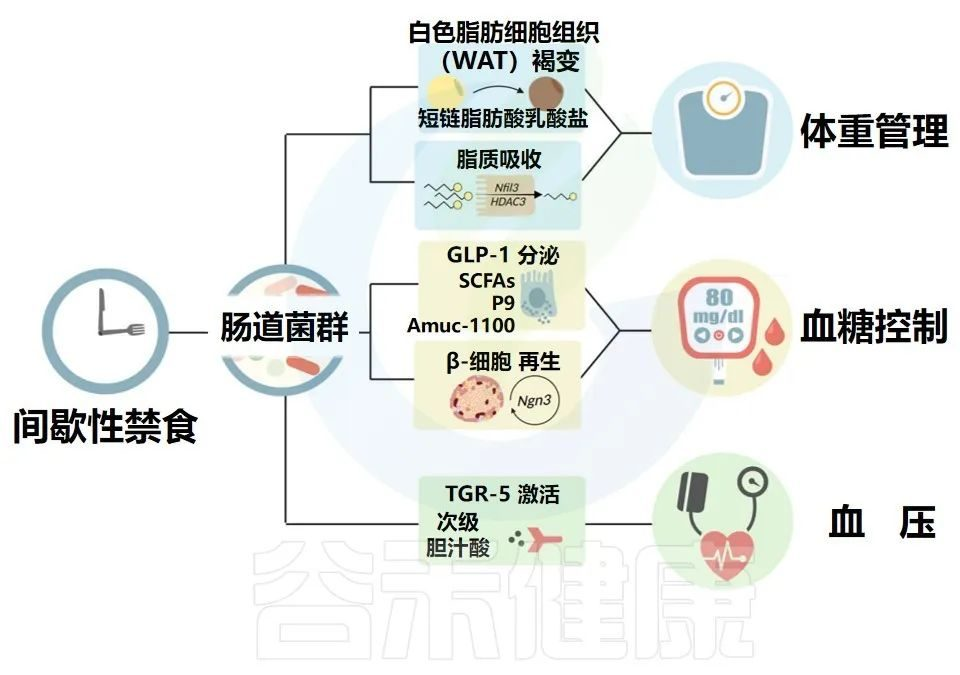
Karina R,et al.Rev Art Jou of Dia.2022
肠道微生物群驱动的WAT褐变和脂质吸收有助于体重管理。微生物通过GLP-1分泌和β细胞再生对血糖控制的影响。
微生物衍生的次级胆汁酸激活TGR-5以控制血压。
对啮齿动物和猴子的研究表明,间歇性禁食对血糖控制具有持续的有益作用。
肠道微生物组分与血糖水平相关,并适应日常生活中的禁食和再喂养期,包括昼夜饮食模式和限时饮食(例如,作为宗教禁食的一部分)。
在小鼠中,乳酸杆菌属在禁食期间高度富集,而Akkermansia muciniphila在喂养期间高度富集。除了昼夜变化外,A. muciniphila在接受限时饮食的人和小鼠体内都显著扩增。
▸A. muciniphila的增加如何在血糖控制中发挥作用?
这些成分的变化很有趣,因为A. muciniphila 与啮齿动物和人类的血糖水平呈负相关。
此外,A. muciniphila的增加与GLP-1的分泌增强有关,GLP-1是一种促胰岛素激素,由肠内分泌L细胞分泌,对膳食作出反应,并在全身血糖控制中发挥关键作用。
▸ 微生物群的昼夜变化 & GLP-1的昼夜分泌
GLP-1的分泌遵循昼夜节律,在活动期葡萄糖负荷后,餐后GLP-1水平较高,而在静息期,GLP-1水平较低,此外还受L细胞时钟机制的调节。
在喂食西方饮食的肥胖小鼠和缺乏微生物组的小鼠中,GLP-1的波动性分泌减弱。这项研究表明,通过将食用正常食物的常规小鼠的粪便微生物群转移到肥胖小鼠中,可以恢复无菌小鼠GLP-1的昼夜节律。
间歇性禁食、肠道微生物群和昼夜节律之间的多向关系
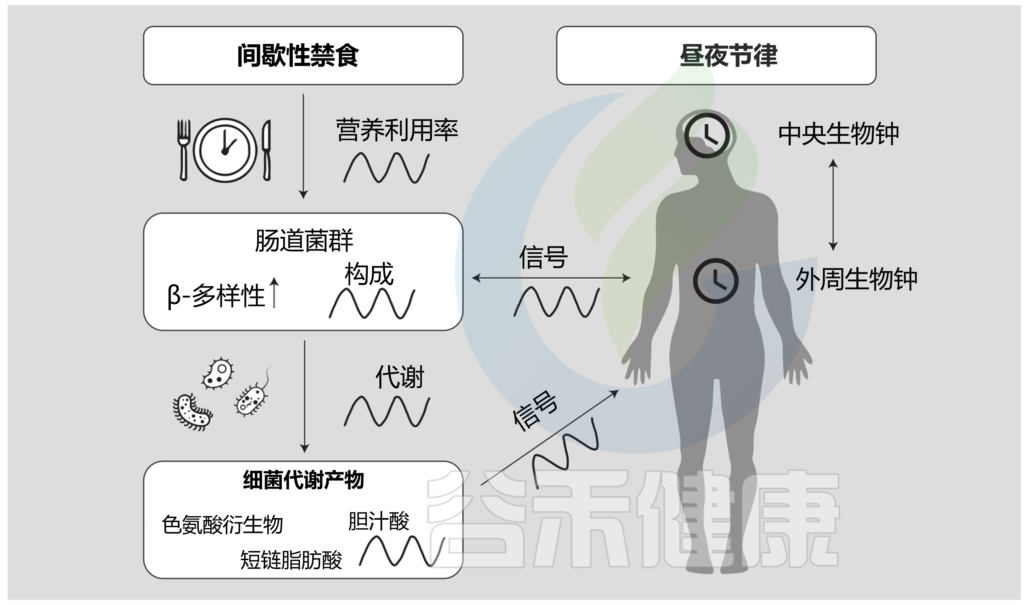
Daas MC, et al.,Benef Microbes. 2021
这些结果表明,微生物群的昼夜变化可能在GLP-1的昼夜分泌及其对葡萄糖稳态的后续影响中起着核心作用。至于机制,最近的研究已经确定了由A. muciniphila产生的几个假定的生物分子,它们可以触发肠L细胞分泌GLP-1。其中,丙酸盐和蛋白P9和Amuc-1100可刺激L细胞分泌GLP-1。
▸ 间歇性禁食改善血糖调节和2型糖尿病
给予肥胖和高血糖小鼠或缺乏瘦素受体的糖尿病db/db小鼠间歇性禁食或模拟禁食的饮食(FMD),可分别改善血糖控制和2型糖尿病。
模拟禁食的饮食有益于葡萄糖稳态的一个主要潜在机制包括神经生长素3(Ngn3)的激活,Ngn3是产生胰岛素的β细胞发育所必需的转录因子。β细胞的再生发生在暴露于间歇性模拟禁食的饮食后,并表明其遵循肠道微生物群的重组,这与db/db小鼠的血糖水平相关。
根据粪便微生物群的16S rRNA测序,
模拟禁食的饮食增加了下列菌的丰度:
模拟禁食的饮食降低了下列菌的丰度:
这与低血糖水平相关。
在此背景下,发现在模拟禁食饮食中具有较高丰度的Blautia,在糖尿病大鼠经2型糖尿病药物治疗后相对增加。
总之,营养时间对肠道微生物群、GLP-1分泌以及β细胞增殖的影响可能有助于改善血糖控制和胰岛素敏感性,从而为基于饮食和微生物群的2型糖尿病治疗潜力提供理论基础。与间歇性禁食对啮齿动物β细胞再生的影响一致,人类随机临床试验表明,与每日热量限制的匹配组相比,定期禁食(5:2饮食)对空腹胰岛素的影响更为显著。
有几个迹象表明,间歇性禁食和进餐时间可能有助于改善小鼠和人类的高血压。
不过间歇性禁食的有效性仍有争议,但DASH饮食(阻止高血压的饮食方法)提供了一种可以降低高血压的低钠饮食。
最近的一项研究表明,在高血压代谢综合征患者中,五天禁食后进行改良DASH饮食可以降低收缩压。
▸ 五天禁食通过改变肠道菌群影响血压
这种禁食还改变了肠道微生物群,包括一些与短链脂肪酸产生相关的菌群和基因。
使用对基线微生物组数据的机器学习分析来预测持续的收缩压反应,确定以下菌群为控制高血压的潜在贡献菌:
在大鼠中,五周的隔日禁食治疗可显著降低易患高血压卒中动物的血压。这种表型变化伴随着微生物组结构的改变,包括下列菌升高:
Shi H, et al.,Circ Res. 2021
▸ 隔日禁食饮食的调节血压机制
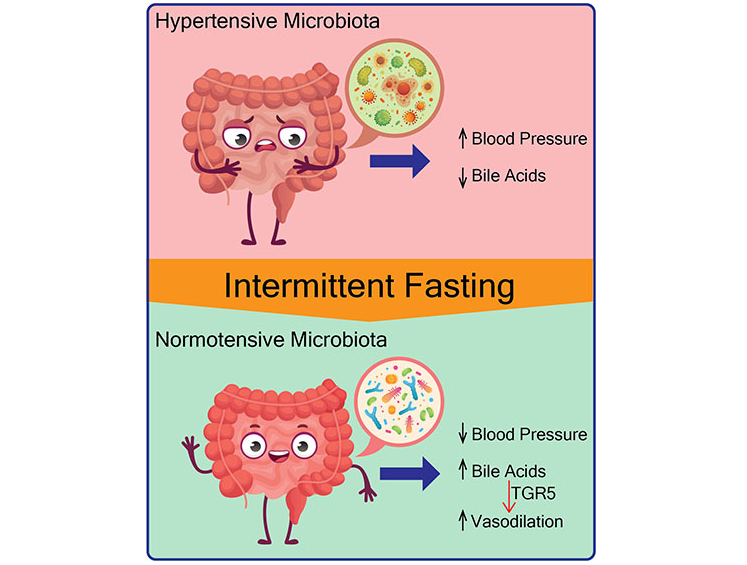
从机理上讲,隔日禁食饮食与微生物向产生次级胆汁酸的细菌转移有关,包括共轭和非共轭的二级胆汁酸(如牛磺胆酸、牛磺脱氧胆酸、牛磺脱氧胆酸[TUDCA]、LCA、甘鹅脱氧胆酸等),以及胆汁酸受体TGR5的激活。
此外,用胆酸或TGR5激动剂治疗这些高血压大鼠可降低血压,从而超过隔日禁食的需要。
从隔日禁食喂养的大鼠到无菌大鼠的粪菌移植可防止收缩压升高,表明肠道微生物群在降低血压方面的因果作用。
进一步的研究需要确定对次级胆汁酸产生反应的靶组织和细胞类型,以及这些胆汁酸诱导的导致血压下降的细胞途径。此外,还需要更多的试验来确定不同的间歇性禁食在降低各种心血管代谢紊乱患者血压方面的疗效和可持续性。
心血管代谢疾病是一种进行性疾病,具有长期和毁灭性的后果。
2型糖尿病患者的常见表现是微血管并发症,包括视网膜病和肾病以及心血管疾病。作为营养疗法的一部分,间歇性禁食已经成为治疗2型糖尿病几种长期并发症的潜在干预措施,包括视网膜病、认知能力下降、心力衰竭和肾病。
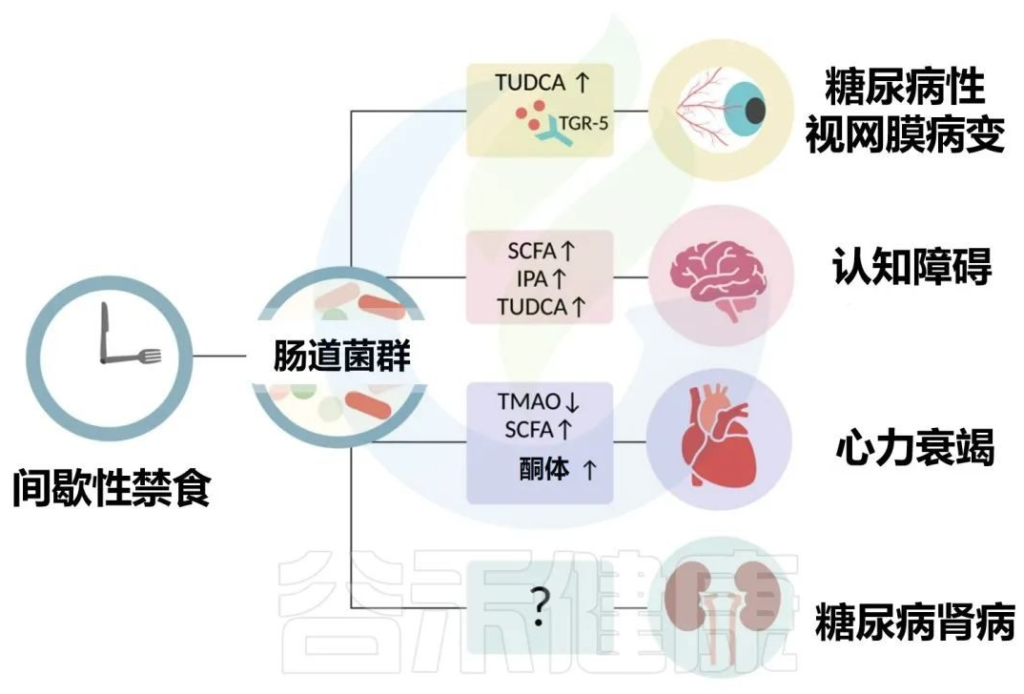
Karina R,et al.Rev Art Jou of Dia.2022
糖尿病性视网膜病变是2型糖尿病的一种并发症,它会影响视网膜的血管,并可能导致未经治疗的个体失明。
幸运的是,通过早期检测和及时治疗可以控制血糖水平和血压,可以降低糖尿病性视网膜病变导致的失明风险。
▸ 糖尿病性视网膜病变的菌群变化
以下三者之间的肠道微生物群存在显著差异:
比如说,研究人员Das等人发现,糖尿病视网膜病变患者中菌群变化:
在这项观察性研究之后,其他研究人员提出了肠道微生物组作为糖尿病视网膜病变鉴别生物标志物的潜在用途,并发现以下细菌是区分2型糖尿病患者和糖尿病视网膜病变患者的主要生物标志物:
这可能有助于视网膜病变的诊断。
其中,巴氏杆菌科在患有视网膜病的2型糖尿病患者中特别减少,这种细菌的减少可以作为该疾病的预测生物标志物。
▸ 隔日禁食干预后,糖尿病小鼠的菌群变化
研究人员使用糖尿病小鼠(db/db)比较了隔日禁食喂养的小鼠与随意喂养的小鼠糖尿病视网膜病变的经典标志物,发现隔日禁食方案阻止了无细胞视网膜毛细血管数量的增加,并减少了炎性细胞对视网膜的浸润。
隔日禁食的糖尿病小鼠具有厚壁菌门显著扩张的特征,更具体地说,在属的水平上,下列菌群丰度增加:
下列菌群减少:
随着肠道微生物组组成的变化, 作者观察到,与非糖尿病小鼠相比,糖尿病小鼠表现出昼夜微生物模式的差异,这种差异也在对隔日禁食的反应中发生了改变。
▸ 隔日禁食引起的代谢变化,有助于改善及诊断视网膜病变
值得注意的是,隔日禁食仅在糖尿病小鼠中增强了初级至次级胆汁酸的代谢,如TUDCA。
TUDCA的受体TGR5在视网膜神经节细胞中表达,这表明TUDCA的微生物生产可能会潜在地影响视网膜。
给糖尿病小鼠补充TGR5的强效激动剂导致糖尿病视网膜病变减少,其特征是视网膜炎症减少和无细胞毛细血管减少。
因此,隔日禁食可能导致次级胆汁酸的肠道细菌生产发生改变,激活视网膜TGR5,防止视网膜变性。
综上所述,这些结果表明,如果隔日禁食等干预措施可能导致肠道微生物群和代谢物的独特改变,这可能有助于视网膜病的诊断,并可能潜在地改善糖尿病视网膜病变。
▸ 2型糖尿病 → 认知障碍
2型糖尿病可引起明显的中枢神经系统并发症,包括结构改变或脑萎缩、脑微血管损伤、神经炎症以及最终导致认知缺陷的脑电生理特性改变。
随着时间的推移,这些认知和大脑结构的改变可能会导致认知能力的加速下降,并增加老年痴呆症等与年龄相关的神经退行性变的风险。
多项因素会导致糖尿病认知障碍,包括大脑胰岛素抵抗和葡萄糖摄取降低以及神经递质代谢紊乱。在动物模型中,各种类型的间歇性禁食有益于大脑健康,延缓神经退行性疾病的发展。
▸ 肠道菌群在调节隔日禁食诱导的认知功能中发挥作用
在隔日禁食治疗糖尿病db/db小鼠期间,肠道微生物组与认知功能之间存在联系。
糖尿病小鼠表现出认知能力下降,但28天的隔日禁食方案改善了焦虑行为、运动活动和突触结构,同时保护了海马中的胰岛素信号和线粒体生物生成。
隔日禁食干预小鼠组脑功能的改善伴随着下列菌群增加:
下列菌群减少:
抗生素治疗后,隔日禁食对糖尿病小鼠认知功能的保护作用被部分消除。学者发现隔日禁食组的初级和次级胆汁酸生物合成途径丰富。
▸ 菌群代谢物在调节隔日禁食诱导的认知功能中发挥作用
此外,db/db隔日禁食小鼠组的粪便和血浆中几种微生物相关代谢物的水平升高,其中包括短链脂肪酸、TUDCA(也可预防视网膜病变的次生胆汁酸)、吲哚-3-丙酸(IPA)和血清素。
补充这些代谢物可改善db/db小鼠的认知功能和胰岛素敏感性。
总的来说,隔日禁食诱导的肠道细菌种类和代谢物可能有助于减轻糖尿病诱导的认知障碍,并表明即使在没有隔日禁食的情况下,细菌代谢物也可能调节大脑功能的特征。
胰岛素抵抗的小鼠模型表明,如TRF和FMD等饮食方式可以改善高血压、血脂异常、高血糖和高胰岛素血症,所有这些都是心血管健康的一般指标。
▸心力衰竭与肠道菌群联系的证据
多项研究表明,心力衰竭患者肠道微生物群的组成发生了改变。对Dahl盐敏感大鼠进行的一项研究表明,补充益生菌植物乳杆菌可降低其对心力衰竭的易感性,并可在心肌梗死后更好地恢复。
已经提出了几种机制来解释肠道微生物组与心力衰竭之间的潜在联系,包括微生物组诱导的炎症调节、肠道通透性以及与细菌过度生长和细菌生物膜形成的关联。
▸肠道菌群影响心血管健康的机制:增加短链脂肪酸产生菌,为心脏提供能量
在几项研究中,在心力衰竭患者中也检测到几种病原菌的扩增。一项研究揭示了间歇性禁食对心脏的益处,提出肠道微生物群可以产生短链脂肪酸,在禁食期间为心脏提供充足的能量。
与常规小鼠相比,无菌小鼠的肝脏酮体生成量减少。根据这项研究,禁食与更高丰度的拟杆菌有关,这些拟杆菌可能负责产生短链脂肪酸,尤其是乙酸盐,可用于肝脏生酮,从而为心脏提供能量来源。
▸肠道菌群影响心血管健康的机制:TMAO降低
一项开创性研究表明,肠道微生物代谢膳食胆碱和左旋肉碱产生TMA,TMA被宿主肝脏转化为 TMAO.
研究发现,TMA-TMAO通路与动脉粥样硬化、血小板过度活跃和血栓形成有关,并用于预测心血管疾病风险的增加。
禁食影响肝脏代谢,与TMAO降低有关。此前有研究表明,维持低水平的TMAO可能对预防2型糖尿病相关的心肌病特别有帮助。
最近,在白天和夜间的db/db小鼠中发现TMAO水平升高,这与各种肠道细菌的昼夜振荡消失有关。作者建议,可以通过限制活跃期的摄食来恢复失去的细菌的昼夜振荡。
根据啮齿类动物的研究结果,间歇性禁食是否能够利用肠道微生物群,调节氧化三甲胺水平,并导致2型糖尿病患者心血管预后的有效改善,仍有待确定。
糖尿病可能导致肾功能障碍或肾病。在糖尿病患者中,血糖控制不良和高血压可导致肾小球滤过、蛋白尿、肾病性蛋白尿,并发展为终末期肾脏疾病。
多项研究表明,糖尿病肾病患者的肠道细菌丰度发生改变,总体上较低的细菌多样性与疾病进展相关。
在啮齿类动物中,糖尿病肾病与菌群及其代谢物(如苯基硫酸盐)的改变有关,并与肾素-血管紧张素系统的激活相关。
已有多项观察性研究测试了斋月禁食对糖尿病肾病严重程度的影响,但没有一项研究显示肾功能有显著变化。这些报告不是随机对照研究,样本量小,并且包含使用不同药物或透析治疗的患者。
目前,间歇性禁食对肾功能和糖尿病肾病的疗效以及肠道菌群在这一过程中的作用尚未阐明。
间歇性禁食除了前面章节提到的,通过脂质代谢来调节能量平衡从而减轻肥胖之外,还可以改善食欲调节,促进减肥。
▸ 三项短期研究评估:间歇性禁食增加饱腹感
在为期8周的ADF试验中,从基线检查到治疗后,主观饥饿感保持不变,饱腹感水平增加。这些饱腹感的增加与肽YY(PYY)的增加平行,肽YY是一种有效的饱腹激素。然而在任何时间点,饱腹感和PYY的变化与体重减轻或静息代谢率无关。
其他研究也有类似的发现。12周ADF后,肥胖受试者的饥饿感未受影响,饱腹感显著增加。饱腹感增加与体重减轻之间没有显著关系。
研究人员比较了ADF和每日卡路里限制对体重减轻后食欲的影响(比基线降低5%)。饥饿感在两组中都有类似的下降,但饱足指数保持不变。
▸ 一项长期研究评估:间歇性禁食对食欲调节没有长期有益影响
Kroeger等人进行的一项为期12个月的试验表明,ADF期间体重下降不理想和饮食依从性差与食欲没有任何有益变化有关。
总之,对ADF的短期研究表明,主观食欲有所改善(最常见的是饱腹感增加),而对ADF的长期研究表明,在食欲调节方面没有长期的益处。这方面还需要更多的研究。
目前似乎还没有任何人体试验检测ADF或5:2饮食对睡眠的影响,但有几项研究测试了限时进食对睡眠的影响。
▸三个限时进食试验:限时进食期间睡眠质量无变化
研究一:经过8周的4小时或6小时限时进食后,睡眠质量没有改变。
研究二:观察到8小时限时进食治疗12周后对睡眠质量没有影响。
研究三:10周10小时限时进食后,睡眠质量没有变化。
虽然这一初步证据表明,限时进食不会影响睡眠质量,但应该注意的是,这些研究的参与者基本上都是良好的睡眠者。因此,通过干预,他们的睡眠质量没有进一步改善,这并不奇怪。
▸限时进食不会影响睡眠时间
限时进食是否会改变睡眠时间也已得到评估。
前面的研究指出,4小时或6小时限时进食的睡眠时间没有变化。同样,8小时和9小时限时进食的睡眠时间保持不变。
然而,大多数参与者的平均睡眠时间为每晚约7小时,这符合国家睡眠基金会规定的最低7小时。这些受试者已经有足够的睡眠时间,这可以解释为什么限时进食不会影响睡眠时间。
▸限时进食可能改善睡眠
研究还评估了限时进食对失眠严重程度的影响。
研究人员推测,睡前禁食2-3小时可能会改善睡眠。更具体地说,睡前不吃脂肪和酸性食物可以减少胃酸反流和夜间胃灼热,这可能有助于降低失眠率。
在6小时限时进食研究中,受试者在基线检查时表现出阈下失眠症,到8周试验结束时,没有出现具有临床意义的失眠症。
相比之下,对于基线检查时无临床意义失眠的受试者,4小时和8小时限时进食对失眠严重程度没有影响。
综上所述,这些发现表明,对于已经显示出健康睡眠习惯的受试者来说,使用限时进食进行轻度减肥不会影响睡眠质量或睡眠时间。相比之下,限时进食可能有助于减轻受这种情况困扰的人的失眠严重程度。需要更多的研究来证实这些初步发现。
间歇性禁食虽然带来以上种种益处,但其安全性一直受到质疑。有些人对胃肠道问题、能量水平紊乱、饮食失调症状和激素紊乱的发生率增加表示担忧。这些饮食是否会对饮食质量产生负面影响也是一个问题。
人体试验的结果表明,禁食通常不会产生任何长期的胃肠道不良反应,例如便秘、腹泻、恶心、口干或口臭。不过早期的 6 小时限时进食导致了一些轻微的呕吐和腹泻病例。
最近的几项试验证明了,间歇性禁食也不会导致易怒、疲劳或头晕的程度增加。因此,迄今为止的研究结果表明,间歇性禁食几乎不会产生胃肠道问题或能量水平紊乱。
禁食因可能增加饮食失调风险而受到质疑。
来自 ADF 和限时进食研究的最新数据表明,这类饮食不会增加抑郁、暴饮暴食、通便行为或对肥胖的恐惧的发生率。
事实上,一项研究表明,ADF 可能对身体形象感知产生很小的有益影响。ADF 的这些发现与每日卡路里限制的发现相当。
在减少能量摄入的长期影响综合评估 (CALERIE) 试验中,将能量限制 25% 不会增加饮食失调症状,也没有其他有害的心理影响。
因此,间歇性禁食,也和卡路里限制一样,不会增加饮食失调症状,并且对身体形象感知具有良性或有益的影响。
然而,应该指出的是,这些研究排除了有饮食失调史的参与者。对于诊断为饮食失调的人来说,间歇性禁食是否安全仍然未知。
▸甲状腺激素
在健康人群和亚临床甲状腺功能减退人群中,研究了禁食期间甲状腺激素水平的变化。
招募年轻男性运动员参加8小时限时进食与阻力训练相结合的试验。8周后,血浆总三碘甲状腺原氨酸(T3)略有下降,但促甲状腺激素(TSH)无明显变化。在这些受试者中未观察到体重变化。游离甲状腺素(fT4)的变化没有报道,因此很难确定限时进食是否破坏这些甲状腺功能正常受试者的T3:fT4比率。
其他研究人员比较了ADF和每日卡路里限制对肥胖和亚临床甲状腺功能减退患者甲状腺水平的影响。24周后,ADF和卡路里限制(8%)同样降低体重,循环fT4、T3和TSH保持不变。这些试点数据表明,在间歇性禁食期间,瘦人的T3水平可能会略有降低,但这些影响不会发生在肥胖和亚临床甲状腺功能减退的人身上。
▸ 生殖激素
在 5:2 禁食 24 周后,绝经前妇女的睾酮、雄烯二酮、脱氢表雄酮硫酸盐、性激素结合球蛋白或催乳素没有变化。
相比之下,在 8 小时限时进食 8 周后,年轻男性的游离和总睾酮浓度降低。合成代谢激素睾酮的减少并没有导致身体成分的任何有害变化或肌肉力量的损害。
由于缺乏这方面的数据,因此很难就禁食对生殖健康的影响得出结论。此外,这些变化如何影响生育能力仍然未知,因为没有研究测试过这些饮食对男性和女性怀孕能力的影响。
据推测,在限时进食期间限制进食时间窗口期会导致高能量食物的消耗增加和补偿性地多喝(即,增加无糖苏打水和咖啡因的摄入)。
研究人员评估了4小时和6小时限时进食期间饮食质量的变化。
▸ 纤维摄入量偏少
8周后,4小时和6小时限时进食组的糖、饱和脂肪、胆固醇和钠摄入量与对照组相比没有显著差异。然而,限时进食受试者纤维摄入量远远低于(∼10-15克/天)在基线检查和治疗后的推荐量[25-38克/天]。ADF和5:2饮食试验中也经常报告纤维摄入不足。
▸ 饮料、酒等摄入量没有变化
至于饮料摄入,8周后,4小时限时进食、6小时限时进食和对照组的饮食苏打水、含咖啡因饮料(即咖啡、茶和能量饮料)和酒精的摄入没有差异。
作为这些发现的补充,一项为期一年的ADF试验报告称,饮料摄入量没有变化。
这些初步发现表明,间歇性禁食不会对饮食质量或饮料摄入产生不利影响。然而,应在间歇禁食期间向受试者提供膳食咨询以增加纤维摄入量,以确保肠道健康。
▸ 间歇性禁食并不代表胡吃海喝
重要的是,个人应注意间歇禁食期间的饮食质量。诚然,这些方案要求个人更多地关注用餐时间,而不是所摄入的营养素类型。虽然如此,临床医生应该向患者明确指出,进食窗口时间并不能让患者完全不考虑健康影响,彻底放纵自己乱吃。
为了使这些方案成为改善健康的可持续解决方案,应鼓励间歇性禁食的人食用水果、蔬菜和全谷物含量高、加工食品含量低的饮食。
本章节总结了一些关于如何开始禁食方案,以及如何将这些方法融入日常生活的实用建议。同时,就哪些人不应该使用间歇性禁食来控制体重提供建议。
对于大多数人来说,大约需要1-2周才能完全适应这种新的饮食模式。
据报道,在初期可能会出现头晕,头痛和便秘,但这些不良反应通常在禁食第二周后消退。
头痛通常是由于水分摄入不足导致脱水,当食物受到限制时可能会发生脱水。增加饮水量(每天增加1.5升)可能有助于个人在禁食期间缓解头痛。
与普遍的看法相反,禁食时锻炼确实是可能的。已经进行了几项将禁食与运动相结合的人体试验。
这些研究中的受试者可以在12-36小时的禁食期内进行中等强度到高强度的耐力或阻力训练。
有趣的是,在研究中,受试者在快节奏的日子里感觉到能量的增强,这对那些希望锻炼的人来说是有利的。
然而ADF期间,建议个人在运动后食用禁食日餐。一些人在运动后会出现能量摄入的代偿性增加。因此,把饭留到运动后吃,可能有助于个人保持在禁食日卡路里目标的范围内。
虽然对于间歇性禁食期间摄入的食物类型没有具体的建议,但始终建议强调多吃水果、蔬菜和全谷类食物。
这些食物可以帮助禁食参与者增加纤维摄入量,从而有助于缓解禁食期间偶尔出现的便秘。
避免超加工食品也很重要。与富含能量相匹配的未加工食品的饮食相比,富含加工食品的饮食会导致自由摄入的能量增加和体重增加。
间歇性禁食期间允许饮酒。然而不建议在ADF和5:2禁食模式中的禁食日饮酒。
禁食日的能量摄入非常有限(∼500千卡),因此建议将这些卡路里花在能提供营养的健康食品上,而不是酒精上,因为酒精会消耗营养。
无论是在禁食期间还是在进食窗口,都允许喝含咖啡因的饮料。越来越多的证据表明,与基线相比,个体在禁食期间的含咖啡因饮料消费模式没有显著改变。
不过,将咖啡因的摄入限制在上午和下午可能是值得的,这样它就不会干扰一个人晚上的入睡能力。
除以上人群之外,一般都可以安全地进行间歇性禁食,这可能是一种生活方式的改变。
如果尝试间歇性禁食后持续发现,异常焦虑、头痛、恶心或其他症状,不要勉强继续,说明暂时还不适合这种方式,可暂停。
间歇性禁食导致肠道菌群结构改变,以及细菌产生特定的代谢物发生变化,如次级胆汁酸和酮体,可能会潜在地影响正常宿主生理,及心血管代谢异常的临床结果。这些发现可以作为治疗干预的潜在基础。
当相同的膳食在不同的时间提供时,餐后对食物的反应因人而异。由于肠道微生物群参与了个人对食物的反应,因此有理由假设个人对间歇性禁食的反应也与肠道微生物群有关。这也是将间歇性禁食方案转化为临床实践的一个挑战。
需要更多控制良好的、前瞻性的、纵向的临床研究,来确定不同饮食带来的微生物变化,以便进一步转化为临床实践。同时包括肠道菌群健康检测在内的对个体肠道微生物组的进一步了解,或将为最终的临床实践带来益处。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Ratiner K, Shapiro H, Goldenberg K, Elinav E. Time-limited diets and the gut microbiota in cardiometabolic disease. J Diabetes. 2022 Jun;14(6):377-393. doi: 10.1111/1753-0407.13288. Epub 2022 Jun 13. PMID: 35698246.
Angoorani P, Ejtahed HS, Hasani-Ranjbar S, Siadat SD, Soroush AR, Larijani B. Gut microbiota modulation as a possible mediating mechanism for fasting-induced alleviation of metabolic complications: a systematic review. Nutr Metab (Lond). 2021 Dec 14;18(1):105. doi: 10.1186/s12986-021-00635-3. PMID: 34906176; PMCID: PMC8670288.
Varady KA, Cienfuegos S, Ezpeleta M, Gabel K. Cardiometabolic Benefits of Intermittent Fasting. Annu Rev Nutr. 2021 Oct 11;41:333-361. doi: 10.1146/annurev-nutr-052020-041327. PMID: 34633860.
Shi H, Zhang B, Abo-Hamzy T, Nelson JW, Ambati CSR, Petrosino JF, Bryan RM Jr, Durgan DJ. Restructuring the Gut Microbiota by Intermittent Fasting Lowers Blood Pressure. Circ Res. 2021 Apr 30;128(9):1240-1254. doi: 10.1161/CIRCRESAHA.120.318155. Epub 2021 Feb 18. Erratum in: Circ Res. 2022 Mar 4;130(5):e18. PMID: 33596669; PMCID: PMC8085162.
Aron-Wisnewsky J,Clément K.The gut microbiome, diet,and links to cardiometabolic and chronic disorders. Nat RevNephrol. 2016;12(3):169-181.
Di Francesco A, Di Germanio C, Bernier M, de Cabo R. A time to fast. Science. 2018;362(6416):770-775.
Daas MC, de Roos NM. Intermittent fasting contributes to aligned circadian rhythms through interactions with the gut microbiome. Benef Microbes. 2021 Apr 12;12(2):147-161. doi: 10.3920/BM2020.0149. Epub 2021 Feb 3. PMID: 33530881.
Rong B, Wu Q, Saeed M, Sun C. Gut microbiota-a positive contributor in the process of intermittent fasting-mediated obesity control. Anim Nutr. 2021 Dec;7(4):1283-1295. doi: 10.1016/j.aninu.2021.09.009. Epub 2021 Oct 9. PMID: 34786501; PMCID: PMC8567329.

谷禾健康
骨骼
骨骼是人体重要的器官,起着支持,运动,代谢,保护和造血等多种功能,与我们的健康和寿命息息相关。
据估计,中国低矮症患病率高达3.77%,90%以上的矮小症患儿都存在自卑、抑郁等不同的心理障碍,因此儿童骨骼的健康生长发育备受家长的关注。
与此同时,随着社会老龄化,骨质疏松症 (OP)、骨关节炎 (OA) 和类风湿性关节炎(RA) 等骨骼疾病是对人类健康的主要威胁之一。这些疾病最给患者带来常见的症状是疼痛、身体机能下降、严重残疾和死亡率增加。
大多数矮小症或骨骼疾病的预防和治疗包括:
治疗方法不断发展,确实缓解了原发性疼痛并改善了骨骼发育,但仍有相当一部分患者获益甚微或没有获益,甚至出现不良反应。
近年来,一些横断面的临床研究以及系统评价和荟萃分析均发现肠道菌群改变与调节骨量、骨力学功能、骨髓生成,骨骼发育、骨代谢、骨质疏松、骨骼炎症、骨折风险以及骨癌的许多因素有关(如肠道代谢物、免疫功能、肠上皮屏障功能、肠-脑-骨骼轴、营养吸收代谢、内分泌以及激素等)。
同时许多研究还表明,针对肠道菌群的干预方式,包括抗生素、益生菌、益生元以及其他的维生素 D、钙、植物雌激素和功能饮食可以改善骨稳态以及代谢问题,在骨骼发育中发挥优化补充作用。这些治疗或干预对于快速生长时期尤为关键,例如青春期,此时骨量获取量很大,以及骨质流失期间,例如老龄。
肠道菌群从出生开始随着年龄发育,成熟,老化而不断变化的,同时还会受到许多因素的影响,比如饮食、抗生素、疾病、感染等,所以要正确的反映肠道菌群和骨骼的健康发育关联或因果关系需要足够大的样本量和纵向数据的积累(这是谷禾一直致力关注和研发的方向之一),从全局开发一个描述能量营养代谢调节、肠道作用及其与人类骨组织关系的模型,可以帮助有效调节骨骼发育和疾病中的骨代谢,同时助力不同人群的骨骼干预和治疗。
骨骼:人或动物体内或体表坚硬组织,具有运动(使身体运动)、保护(保护内部器官)、支持(构成身体骨架)、代谢(内分泌调节,体内激素)、造血(骨髓参与制造红血球和白血球)和贮存(贮存钙和磷等矿物质)功能。
骨是由骨质、骨膜、骨髓构成。
骨质:由骨组织构成,分骨密质和骨松质,骨密质在骨的表面,骨松质在骨的里面。
骨膜:覆盖在骨的表面,主要由纤维结缔组织构成,包括血管、神经、淋巴管对骨有再生和营养作用。
骨髓:在髓腔和骨松质间隙中,分为红骨髓和黄骨髓。黄骨髓没有造血能力,红骨髓有造血能力。
▲ “软硬兼施” ——骨的化学成分(有机质、矿物质)
它们共同构成一个支架,使骨骼能够承受一定程度的机械压力而不容易断裂。
▲ 破骨细胞与成骨细胞在骨骼重塑中发挥重要作用
骨骼是由成骨细胞的非造血细胞形成的,它们来源于骨髓中的基质细胞。成骨细胞产生胶原蛋白,形成钙和磷沉积的支架,从而形成新骨。
另一方面,破骨细胞的骨细胞行使骨吸收的功能,它们来源于骨髓内的造血干细胞。破骨细胞粘附并分泌氢离子到骨骼表面,从而溶解并释放骨骼中的矿物质沉积。
▲ 骨的生长发育代谢——“骨构建”、“骨重建”
骨组织的生长,发育,代谢和衰老表现为骨量的增加或减少,而在组织学上则以骨构建和骨重建两种方式进行,表现为骨组织细胞的分化,增值,凋亡和转型。
骨构建:是指骨表面的组织间隙单方向运动,引起骨几何形态、大小和骨量的改变。骨构建对改变骨的形状及内外直径十分重要。人体骨构建经历胎儿、儿童、少年阶段,直到骨成熟为止,大约18-20岁。
童年和青春期骨微环境中的细胞活动有利于净骨增加,其中骨量的最大增加发生在青春期。儿童时期的骨骼发育问题对成年期的骨量产生不可挽回的影响,导致身材矮小、骨质疏松、骨折和其他老年问题。
骨重建:骨骼成熟后“骨构建”停止,不再参加成年后骨代谢活动,然而成年后,骨在一生中仍在不断进行更新和改造,这就是骨重建。
骨重建是一种循环:已形成的骨被消除,而新形成的骨又在这一部位生成。这种循环始终贯穿在骨骼新陈代谢。
儿童、青少年骨构建和骨重建同时存在;
成人只进行骨重建。
骨构建时,骨形成大于骨吸收,二者非偶联;
骨重建时,骨形成与骨吸收偶联。骨代谢标志物是反映成骨细胞或破骨细胞功能的标志物。
因此,在骨重建过程中,成骨细胞和破骨细胞之间的持续相互作用对维持骨骼稳态至关重要。当骨骼稳态得不到维持时,就会发生骨质减少或骨质疏松等衰弱性骨骼疾病。这主要是由于破骨细胞活性被过度激活或者成骨细胞活性受到抑制,使得骨骼降解比新骨骼形成要多(关于骨质疏松在后面章节也会详细介绍)。
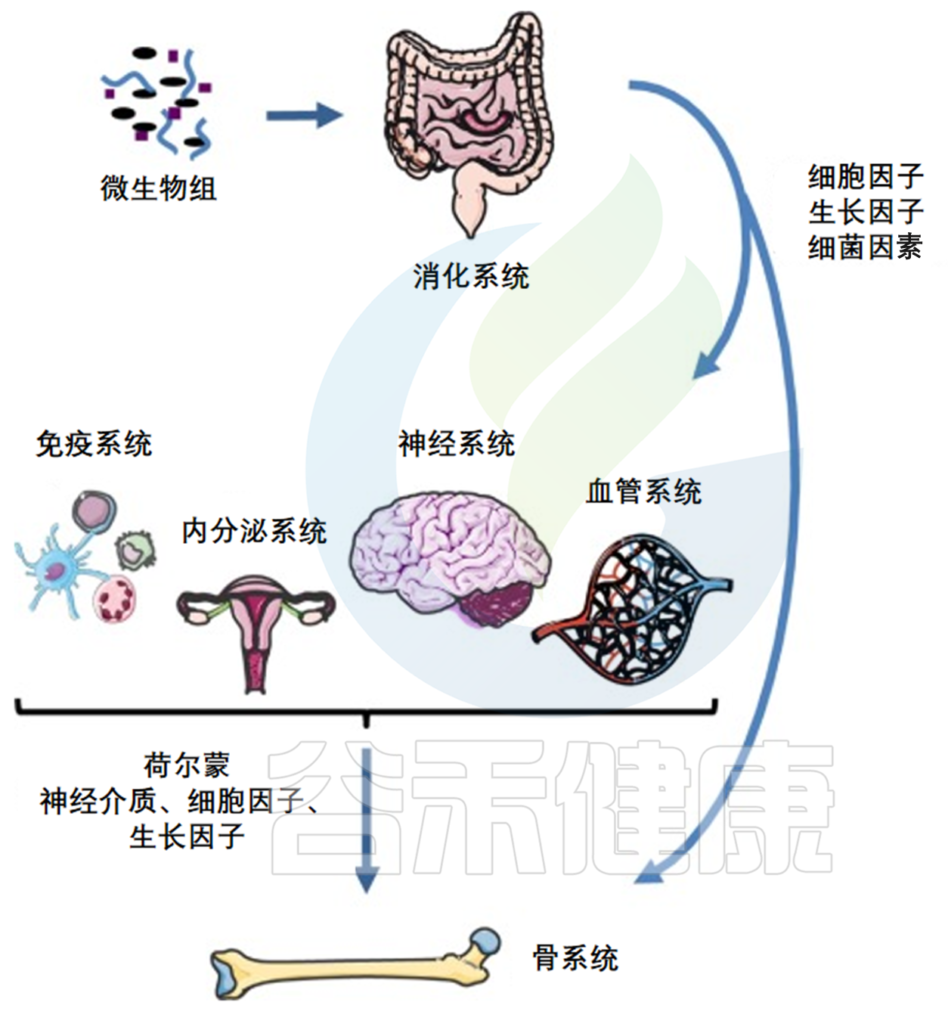
熟悉我们文章的都知道,肠道菌群可以塑造宿主生理过程的许多方面,包括代谢功能、营养吸收、免疫反应和激素分泌等。
肠道细菌产生的分子既有益又有害,会影响肠道内分泌细胞、肠神经系统、肠道通透性和免疫系统。
在稳态时,肠道菌群提供具有上皮和免疫平衡的定植抗性,保护宿主免受细菌、病毒和可能的其他类型病原体的入侵。
一旦这种稳态破坏(可能是由病原体、抗生素治疗和饮食引起的),则可能引起炎症、组织破坏和生态失调,导致疾病发展。
在数百万年的共同进化中,微生物群和宿主免疫系统形成了一种相互依赖的关系,免疫系统的先天性和适应性依赖于微生物伙伴来实现逐步的成熟和稳定,而免疫系统稳定也包括肠道微生物生态系统的稳定。
微生物群组成的变化(通常称为生态失调)与许多疾病状态有关,其中许多是由宿主免疫和炎症反应的改变介导的。骨髓细胞能够感知微生物衍生产物,在宿主防御中发挥重要作用,它们是肿瘤微环境的主要组成部分,因此在宿主/共生体对话中发挥关键作用。
初识:肠道菌群与骨骼健康
由于骨稳态受肠道屏障、代谢途径、钙磷等营养吸收、免疫系统和激素环境的影响,因此,肠道微生物群就可以通过这些途径影响骨代谢平衡。
肠道菌群产生的代谢产物——短链脂肪酸,通过直接抑制骨吸收、刺激钙吸收和免疫调节作用来调节骨稳态。
益生菌作为确保骨骼健康的关键成分之一,正在迅速获得认可。大多数研究表明,使用益生菌(如乳酸杆菌属)调节肠道微生物群,可增加骨量,促进骨形成。
▸ 肠道菌群参与骨骼发育的证据
20年前,几项临床研究指出,肠道中细菌过度增殖与骨矿物质密度(BMD)降低之间存在关联。小肠细菌过度生长综合征患者的 BMD 值低,骨软化,其中一些患者具有高水平的促炎细胞因子TNF-α和IL-1,以及破骨细胞活化增加。
小肠细菌过度生长综合征的另一个特征是由于肠道细菌消耗营养而导致营养缺乏。肠道对钙、磷酸盐和维生素D的吸收不足导致了该综合征的骨骼表现。因此,这些研究不能提供肠道微生物与骨表型之间直接联系的证据。
仅十年后,通过对无菌小鼠的研究,获得了肠道菌群参与骨组织发育的令人信服的证据。
▸ 如果没有肠道菌群会带来什么影响(无菌/SPF小鼠试验)?
基于无菌/SPF小鼠试验,鉴于肠道菌群对新陈代谢的影响,出生时没有肠道菌群会导致许多生理和代谢改变:
肠道微生物组和骨骼之间的联系
doi.org/10.1016/j.jbspin.2018.02.008
骨髓细胞生成受到转录因子和外在信号的严格调节,以确保在稳态期间维持体内平衡,并提供快速的细胞输出以满足病理条件(如感染、炎症和癌症)增加的需求。后者通常被称为“需求适应”或“紧急”造血。
▸ 骨髓生成失调—>炎症
除了细胞因子、趋化因子和骨髓生成生长因子受体外,小鼠和人类造血干细胞及源祖细胞都表达模式识别受体,例如 TLR,并且可以通过病原体相关分子模式(pathogen-associated molecular patterns,简称PAMP) 的结合直接感知病原体。因此,骨髓生成失调可能代表炎症和应激反应的初始步骤,而不是一种代偿机制 。
注:PAMP,是病原微生物表面存在一些人体宿主所没有的,但可为许多相关微生物所共享,结构恒定且进化保守的分子结构。固有免疫识别的PAMP,往往是病原体赖以生存,因而变化较少的主要部分,如病毒的双链RNA和细菌的脂多糖,对此,病原体很难产生突变而逃脱固有免疫的作用。
▸ 微生物调节—> 早期造血发育相关
先前的一项研究表明,在稳态条件下,MyD88(一种通过 TLR 信号识别 PAMP 的关键衔接分子)缺乏也会导致脾脏中的中性粒细胞、单核细胞和巨噬细胞数量减少,以及骨髓中的髓系隔室减少,主要是由于粒细胞减少。
由共生微生物或可能的内源性配体诱导的 MyD88 依赖性 TLR 信号传导,可影响早期造血发育和终末骨髓分化潜能(下图)。
稳态骨髓生成和中性粒细胞稳态的微生物群调节
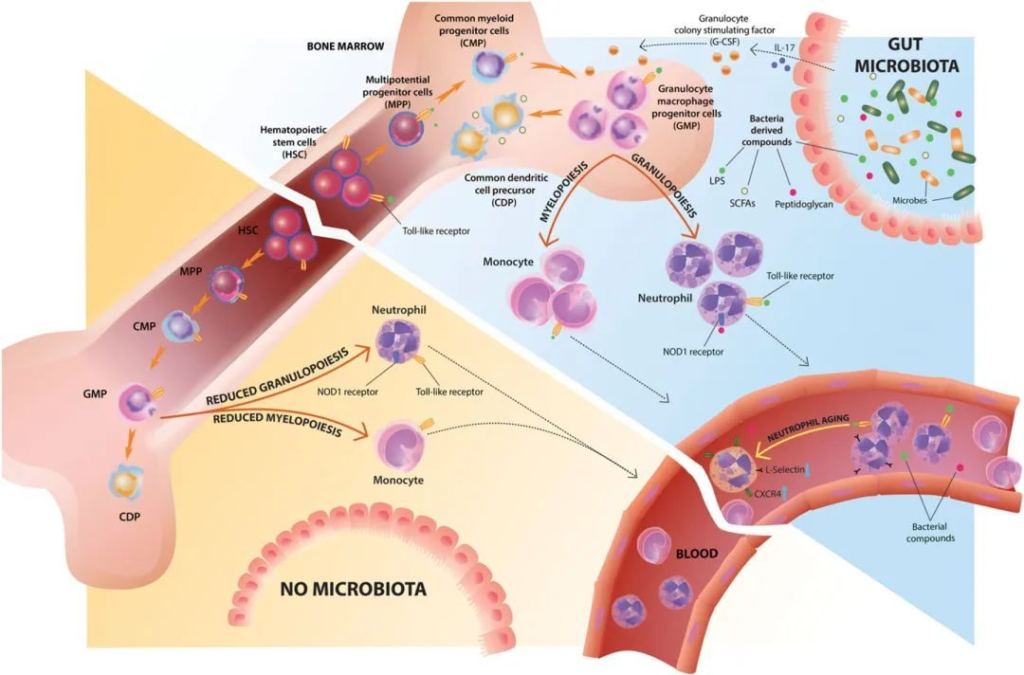
doi.org/10.1189/jlb.3RI0516-222R
造血干细胞及源祖细胞和骨髓祖细胞表达模式识别受体,使它们能够直接感知细菌衍生的产物。共生信号调节骨髓生成,主要是通过影响粒巨噬祖细胞频率和分化潜能。
▸ 肠道微生物群及其代谢物调节骨髓中的中性粒细胞
肠道微生物群至少部分地通过局部诱导 IL-17 产生和增加血浆 G-CSF 水平来促进粒细胞生成。肠道共生微生物群的缺失导致粒巨噬祖细胞的数量和分化潜能减少,从而导致骨髓和外周组织中的中性粒细胞、单核细胞和巨噬细胞数量减少。
细菌代谢物,如短链脂肪酸,通过增加常见树突状细胞前体的数量来调节树突细胞分化。共生微生物还通过 Nod1 受体直接识别微生物衍生的肽聚糖来调节骨髓中的中性粒细胞功能。循环中性粒细胞老化是由微生物群衍生信号通过 TLR/MyD88 信号驱动的,缺乏共生体导致 CXCR4 数量减少hi /L-Selectin循环中的低龄中性粒细胞。
几条证据表明,造血区室直接参与了对感染的反应,并且不同的感染刺激形成了对抗特定病原体所需的适当的骨髓生成反应。因此,相同的细胞可能感知来自远处肠道微生物群的信号是合理的。
LPS(脂多糖)的全身给药可诱导造血干细胞及源祖细胞动员和归巢到脾脏,以及骨髓中造血干细胞的增殖和增强的自我更新能力,这表明共生衍生产物可以到达骨髓和调节骨髓生成。
丰富的肠道微生物群的会导致非炎症条件下骨髓中粒细胞、单核细胞和粒巨噬祖细胞的数量持续增加。然而,在小鼠恢复无菌状态后,这种效应又恢复了,这表明稳态骨髓生成受到当前微生物群暴露水平的动态调节。
在后一项研究中,无菌小鼠与完整菌群或仅与大肠杆菌的关联足以纠正在无菌小鼠中观察到的缺陷,指出革兰氏阴性菌在调节骨髓生成中的作用。
骨髓生成和粒细胞稳态的微生物群依赖性变化会影响宿主对炎症和感染性损伤的反应。
研究发现中性粒细胞和骨髓细胞前体的骨髓池减少,血液中粒细胞的周转减少;然而,他们没有观察到骨髓生成的稳态动力学差异。这意味着微生物群在定植后不久就控制了骨髓细胞池的初始大小。减少的初始骨髓生成池导致可用于抵抗入侵病原体的细胞数量减少,全身给药后细菌清除延迟就证明了这一点。与此一致,组织驻留和 骨髓衍生的吞噬细胞的稳态数量减少使 GF(无菌)和 Abx 处理的小鼠易受急性全身性单核细胞增生李斯特菌(Lysteria monocytogenes)感染,而它们在继发感染后产生适应性免疫的能力不受影响甚至增强,表明早期先天而非适应性反应的缺陷 。
微生物群组成改变对宿主生理的诸多影响之一是增加患过敏性疾病的风险。
最近的两项研究表明,这至少部分是通过稳态造血功能的改变来介导的。使用屋尘螨提取物诱导的过敏性气道炎症模型表明,短链脂肪酸增强了骨髓中的树突细胞前体造血功能并改变了肺树突状细胞功能,使其诱导 Th2 细胞效应功能的能力受损。短链脂肪酸的保护作用是通过结合 GPR41 而不是 GPR43 介导的,其特点是炎症反应的快速消退。
短链脂肪酸也被证明可以调节人类单核细胞衍生的树突状细胞,它们的作用程度因个体短链脂肪酸而异。
在炎症性关节炎和抑制卵清蛋白(OVA)诱导的气道炎症的小鼠模型中,短链脂肪酸也是防止炎症反应加剧和及时解决炎症所必需的。另一项研究表明,微生物群衍生的信号通过限制骨髓中嗜碱性粒细胞前体的增殖来调节嗜碱性粒细胞造血,从而影响 Th2 细胞依赖性过敏性炎症。
由于缺乏共生体而改变的骨髓生成在某些情况下可能是有益的。例如,循环中性粒细胞衰老是由微生物群衍生的信号以细胞内在的、TLR/MyD88 依赖的方式驱动的。在没有共生微生物的情况下,减少循环中过度活化的老化中性粒细胞的数量可改善内毒素驱动的脓毒性休克和镰状细胞病小鼠模型中炎症引起的组织损伤。
也有人提出,从肠道吸收的循环细菌衍生产物量的波动可能影响炎症单核细胞从骨髓的迁移。骨髓间充质干细胞和祖细胞检测到低水平的循环内毒素(即 LPS)导致它们表达 MCP1 并将炎症单核细胞释放到血流中。因此,这提供了另一种机制,通过该机制,共生微生物可以微调系统性先天免疫基调,增强抗菌防御,但并非没有潜在的有害后果,例如恶化非感染性炎症状况。
微生物群似乎对造血产生影响,主要在骨髓中的粒巨噬祖细胞水平和髓外造血部位,影响单核细胞和粒细胞后代,中性粒细胞稳态有明显缺陷。另一方面,淋巴细胞室似乎不受影响。然而宿主-微生物串扰是如何发生的仍不清楚。
大量证据表明,循环微生物群衍生产物或细菌代谢物可能到达骨髓或髓外部位,在那里它们可以被造血干细胞及源祖细胞和的骨髓祖细胞直接感知或者循环的造血干细胞在重新进入骨髓之前可能会在外围遇到细菌或其产物。
除粒细胞生成外,新生儿中性粒细胞稳态还取决于肠道共生体的存在。Abx(抗生素处理或清扫) 处理的小鼠的微生物群减少和改变与循环和骨髓中性粒细胞数量减少以及骨髓中的粒巨噬祖细胞降低有关。
微生物群衍生成分,例如通过 TLR4/MyD88 信号传导的 LPS,主要由肠道中的第 3 组先天淋巴细胞诱导 IL-17 产生,并增加 G-CSF 的血浆水平,导致粒细胞增多。新生儿肠道黏膜定植还增强了 B 细胞辅助中性粒细胞向脾边缘区的募集和重编程,在那里它们引发了针对高度保守的微生物 T 细胞非依赖性抗原的类别转换和抗体产生。
有充分的证据表明,骨量在出生后会增加,并在青春期达到峰值,并且受生活方式因素以及年龄等的影响。
整个生命过程中骨矿物质密度和肠道微生物群多样性的轨迹
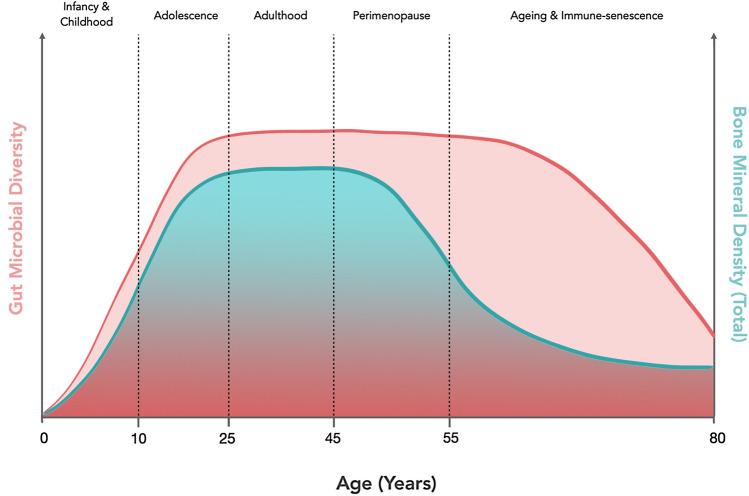
一生中骨量的轨迹在许多方面与一生中肠道菌群多样性的变化相似,其中最大的变化发生在婴儿期和青春期。
骨量是骨折风险随年龄增长而增加的重要决定因素。随着年龄的增长,肠道微生物群表现出增强的多样性和降低的稳定性,但研究结果与微生物群是否促进骨骼生长或吸收存在矛盾。
根据一项针对小鼠的新研究,肠道微生物群的存在会增加胰岛素样生长因子 1 (IGF1) 的循环水平并支持骨骼生长。通过饮食调整的肠道微生物群可调节 IL-1 β(白细胞介素 1β)的产生,并防止易患自身炎症性骨髓炎的 Pstpip2cmo 小鼠自发发展为骨髓炎。
最近的研究表明,与常规饲养小鼠相比,无菌小鼠缺乏肠道菌群会导致骨量增加。结果发现,与常规饲养小鼠相比,无菌小鼠股骨远端的骨小梁体积/组织体积(BV/TV)增加了 39%,海绵状小梁骨和致密皮质骨均受到影响。此外,无菌小鼠的皮质骨面积也增加。
▸这种骨量增加与什么有关?
无菌小鼠的骨和骨髓培养物中 OCL 数量减少,骨髓 CD4 + T 细胞和 OCL 前体细胞 (CD11b + /Gr1 -)。相比之下,无菌小鼠的骨形成率没有显着改变,这表明无菌小鼠的骨量增加主要是由于破骨细胞生成受抑制导致骨吸收减少所致。
由于无菌小鼠骨中溶骨细胞因子 IL-6 和 TNFα 的 mRNA 水平也降低,因此可以表明破骨细胞生成减少是由免疫介导的机制引起的。
重要的是,在无菌环境中出生的小鼠在 3 周龄时在常规环境中饲养的肠道菌群定植导致骨小梁和皮质骨量以及 CD4 + T 细胞和 OCL 前体细胞的频率正常化。
有人提出,无菌小鼠的骨量增加是由于血液和次级淋巴组织中再循环的 CD4 +细胞减少,导致骨髓中 CD4 + T 细胞的频率降低。骨量增加与骨中炎性细胞因子表达减少和破骨细胞生成减少有关。
不能排除其他机制也可能导致无菌小鼠的高骨量表型。然而,骨量增加不太可能是由钙代谢改变引起的,因为无菌小鼠的血清钙和调节钙稳态的激素是正常的。
据报道,肠源性循环血清素抑制骨形成并减少骨量。事实上,无菌小鼠的血清 5-羟色胺水平降低了,然而,无菌小鼠在常规环境中饲养的小鼠的肠道微生物定植,导致骨量正常化,并没有显着影响血清 5-羟色胺水平,表明高骨量在无菌小鼠中可能不是血清血清素水平改变的直接影响。
到目前为止,肠道微生物影响骨量的最可能机制涉及改变全身和骨髓免疫状态,这反过来又调节破骨细胞生成(下图)。
肠道微生物群调节骨量
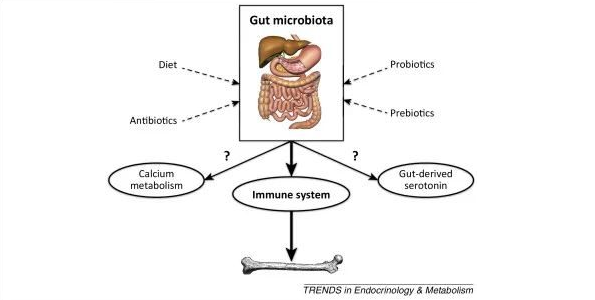
编辑
最近使用无菌小鼠的研究表明肠道微生物是骨量的调节剂,肠道微生物对骨量的抑制作用主要是通过对免疫系统的影响来介导的,而免疫系统反过来又调节破骨细胞生成。然而不能完全排除其他机制,如改变钙代谢和调节肠道衍生的血清素也有作用。饮食是影响肠道菌群成分的环境因素。
骨代谢通过骨形成和骨吸收来平衡。
当骨形成占优势时,以骨形成和合成代谢为特征,反之则以再吸收和分解代谢为特征。
骨矿物质密度 (BMD) 在临床实践中被广泛用作骨质疏松症和骨折风险的间接指标。据了解,宿主代谢途径、免疫系统和激素环境可以影响这种骨代谢平衡,肠道微生物群也可以影响这些途径。
除了生理状况外,炎症性或代谢性骨病,如代谢性骨关节炎、骨质疏松症、自身炎症性骨髓炎,也与肠道微生物改变有关。
小鼠的骨骼生物力学特性受损也是由免疫缺陷或生长过程中长期抗生素干预导致的肠道微生物群改变引起的。
▸ 肠道菌群如何影响骨骼发育/疾病?
与传统饲养的小鼠相比,出生时缺乏肠道微生物的雌性小鼠在小梁骨和皮质骨中的骨矿物质密度值更高。这些高骨矿物质密度值反映了破骨细胞前体和成熟破骨细胞数量的减少,这转化为骨吸收减少,骨骼形成不变。
骨吸收减少的其他因素包括 CD4 + T 细胞频率的降低以及骨髓中 TNF-α 和 IL-6 的表达水平的降低。
来自常规饲养小鼠的肠道菌群定植无菌小鼠可纠正骨矿物质密度和免疫参数值,证实在骨骼生长过程中,肠道菌群控制破骨细胞分化。在参与免疫系统识别细菌的受体中,核苷酸结合寡聚结构域蛋白 NOD1 和 NOD2 结合细菌肽聚糖并激活 NFκB 通路。在NOD1和NOD2敲除小鼠中,肠道微生物的变化对骨矿物质密度或 TNF-α 和RANKL表达没有影响,这表明 NOD1 和 NOD2 在肠道菌群对骨骼的影响中起关键作用。
然而,肠道微生物对骨骼发育的影响比普通人看来要复杂得多。2016 年报道的一项对无菌幼年雄性 Balb/c 小鼠的研究产生了相互矛盾的结果,与常规饲养的对照组相比,大多数主要生长参数延迟,股骨较短。
两项研究结果之间的差异可能归因于小鼠的遗传背景、性别或年龄的差异。
肠道菌群从正常小鼠中定植无菌小鼠后,骨吸收和骨形成均增加。然而,骨吸收增强是短暂的,4 周后消退。因此,肠道菌群对骨组织具有急性分解代谢作用。
从长远来看,骨形成占主导地位,导致骨骼生长和骨量校正增加,这表明肠道菌群对骨组织具有长期的合成代谢作用 。这种合成代谢作用与胰岛素生长因子(IGF)-1的产生增加相吻合。
在无菌小鼠和给予抗生素的小鼠中,血清和骨髓中的 IGF-1 水平较低。它们在肠道重新定殖或摄入后增加富含短链脂肪酸的饮食是肠道细菌分解多糖时产生的。鉴于 IGF-1 在骨骼发育中的主要作用,控制 IGF-1 的产生是可以解释肠道菌群对骨骼生长的影响的机制之一。
▸ 肠道菌群对骨骼形态学特性的影响取决于年龄/营养
来自不同年龄或营养状况的供体的未成熟肠道微生物群定植的无菌小鼠表现出不同的股骨表型。
通过断奶后暴露于低剂量青霉素或通过在怀孕期间将青霉素引入其母亲,肠道微生物群紊乱的成年后代显示出骨矿物质含量和骨矿物质密度改变。
▸ 性别的影响
雄性和雌性 C57Bl/6J 小鼠在出生时就开始使用低剂量青霉素治疗诱导显着的肠道菌群改变,表现出不同的表型。
与未经治疗的动物相比,雌性而非雄性具有更高的成年 BMD 值。此外,长期来看,雄性小鼠肠道再定殖后的 BMD 增加比雌性小鼠更显着。有趣的是,雄性和雌性小鼠在青春期前的肠道菌群相似,但在成年期有所不同,这些差异有助于增加对某些疾病的易感性,例如雌性I 型糖尿病。肠道菌群中的性别相关差异也已在人类中得到报道。因此,肠道菌群和性激素之间的相互作用会影响菌群的组成和宿主组织(包括骨骼)对肠道菌群的反应。
1) 短链脂肪酸 (SCFA)
肠道菌群对膳食纤维或复合碳水化合物的主要发酵产物是短链脂肪酸。短链脂肪酸(乙酸、丙酸和丁酸)肠上皮细胞的主要能量来源,在肠粘膜中具有抗炎作用。短链脂肪酸可以进入血液,参与各种生物合成途径,从而改变破骨细胞和成骨细胞的活性。
▸ 短链脂肪酸维持稳态,增加骨量,刺激骨骼合成代谢,抗炎免疫调节,有助骨营养吸收
研究发现补充短链脂肪酸可以增加肝脏和脂肪胰岛素样生长因子-1 (IGF-1)(一种已知可调节骨骼形成的生长因子),导致血清 IGF-1 水平升高,从而间接调节对骨骼的合成代谢刺激。
短链脂肪酸包括丙酸盐和丁酸盐诱导破骨细胞的代谢重组,并减少破骨细胞基因如 TRAF6 和 NFATc1,从而抑制破骨细胞分化和骨吸收。
短链脂肪酸通过激活 G 蛋白偶联受体 (GPCR) 或通过组蛋白去乙酰化酶 (HDAC) 抑制骨吸收来抑制破骨细胞形成的直接影响,可能会短暂性促进破骨细胞骨吸收。
一项基于三种独立实验方法对去卵巢 (ovx) 雌性小鼠进行测试的研究表明,短链脂肪酸对骨稳态有益,并且可以增加骨量。
此外,短链脂肪酸具有抗炎免疫调节特性,与抑制破骨细胞活性直接相关。用短链脂肪酸(丙酸盐和丁酸盐)治疗小鼠可显着增加骨量并防止绝经后和炎症引起的骨丢失。
与此同时,短链脂肪酸会降低肠腔的 pH 值并改善钙和其他矿物质的吸收,对骨营养吸收有帮助。
肠道菌群衍生的短链脂肪酸对骨稳态的机制显示如下图:
肠道微生物群通过代谢物介导的屏障完整性和免疫系统对骨代谢的影响
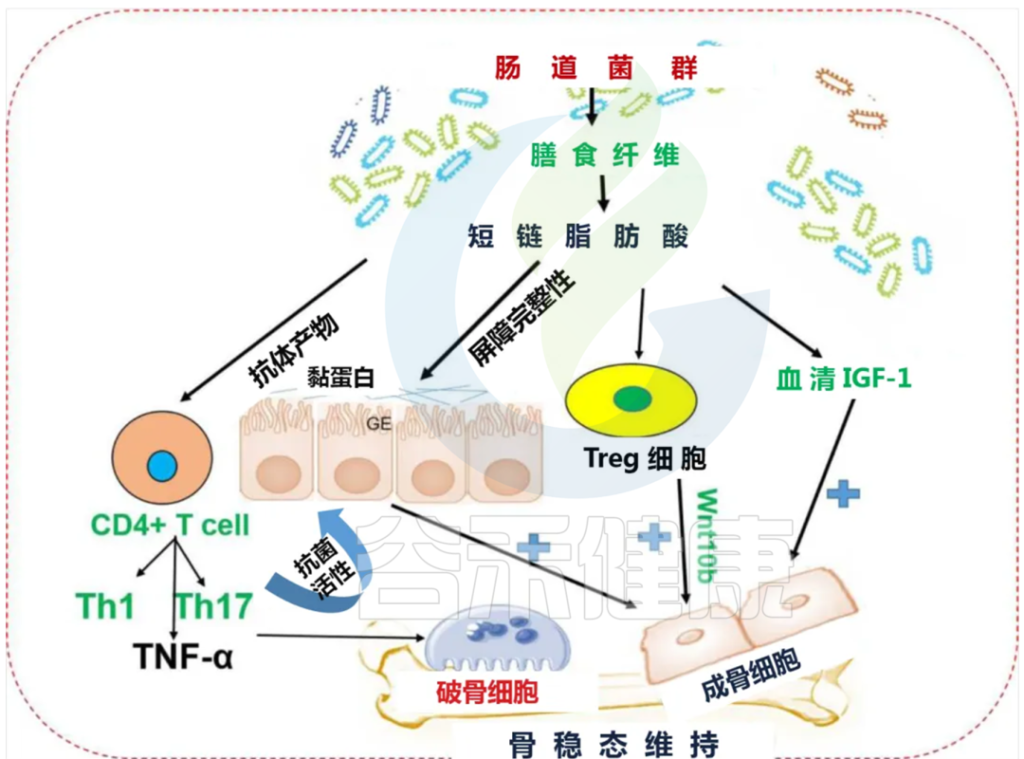
编辑
doi: 10.1016/j.bone.2020.115317
短链脂肪酸具有通过 Wnt10 作用影响 Tregs 发育和促进骨代谢的能力。短链脂肪酸的产生可能是微生物群增加血清IGF – 1水平从而导致骨生长和体内平衡的机制。肠道微生物群诱导肠道屏障完整性的增加。肠道微生物成分的改变导致代谢紊乱。肠黏膜屏障功能障碍可能导致血清脂多糖(LPS)水平升高,进而增加膜通透性,导致代谢性内毒素血症。Th17 细胞对于雌激素缺乏的骨质流失至关重要,它会产生 IL-17 细胞因子。消除IL-17或使用抗IL17 抗体可预防雌激素缺乏导致的骨质流失。
GE:肠道上皮细胞,Treg 细胞:T 调节细胞,Th1:T helper-1,Th17:T helper-17 细胞,IGF-1:胰岛素样生长因子。
2) 胆汁酸
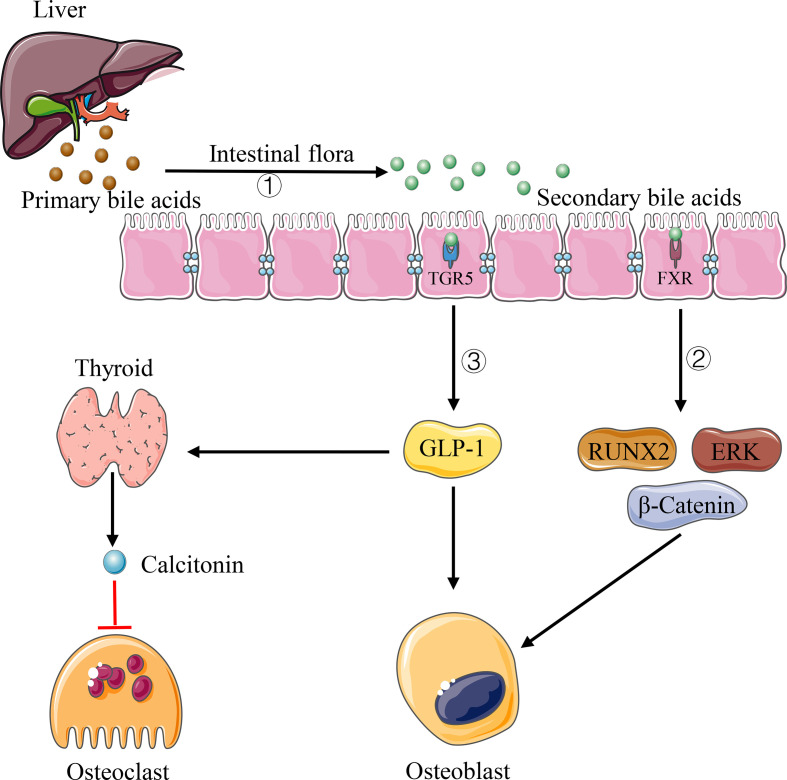
胆汁酸是在肝脏中产生的小的代谢分子。它们被分泌到小肠参与膳食脂质的吸收。新出现的证据表明,肠道微生物组在胆汁酸代谢中起着重要作用。
在肠道中,初级胆汁酸通过厌氧菌生物转化为次级胆汁酸(主要是脱氧胆酸和脱氧胆酸)。在肠肝再循环期间,胆汁酸在全身循环中扩散,并可以到达身体的每个器官,包括骨骼。
越来越多的证据表明,胆汁酸通过成骨细胞和破骨细胞上的各种信号传导调节骨骼稳态。尤其是,在体外,胆汁酸(鹅去氧胆酸)或 FXR 激动剂(Fexaramine)激活 FXR 信号通过上调 Runx2 和增强细胞外信号调节激酶(ERK)和 β-连环蛋白信号显着增强成骨细胞矿化。
注:
在细菌转化次级胆汁酸后,它充当肠细胞膜结合 G 蛋白偶联受体 (TGR5) 的激动剂,并增加胰高血糖素样肽 1 (GLP-1) 的产生,这导致甲状腺细胞通过旁分泌作用分泌降钙素,从而抑制骨吸收。
GLP-1还可以刺激成骨细胞的增殖和分化。单羟基化二级石胆酸 (LCA) 是一种由肠道细菌 7-脱羟基产生的衍生胆汁酸,可作为维生素 D 受体 (VDR) 配体并影响骨代谢。LCA 的过度沉积会损害成骨细胞线粒体活性并降低细胞活力。此外,LCA 降低了成骨细胞中维生素 D 的作用,并与骨钙素和 RANKL 基因表达降低有关。
编辑
doi: 10.3389/fcimb.2021.579323
3) 血清素
血清素是一种微生物代谢物被证明会影响宿主生理。肠道微生物群可以通过影响外周和中枢血清素合成和调节血清素前体色氨酸代谢来影响骨代谢。有证据表明外周血清素对小鼠的骨形成具有抑制作用。但是,中枢血清素促进小鼠的骨形成。
据报道,肠道菌群在神经系统中对合成激素和神经递质如血清素(5-羟色胺,5-HT)具有重要作用。而血清素信号传导在骨发育和生长的调节中很重要。
2010有研究提出循环中产生的血清素对骨代谢有负面作用。相比之下,当它作为一种神经递质从大脑中产生时,它会促进骨骼发育。
最近的研究报告称,肠道微生物群在调节血液中血清素水平方面发挥作用。链球菌、棒状杆菌和大肠杆菌等细菌已被证明在动物培养条件下产生血清素。
此外,在无菌小鼠中观察到血清素水平降低和骨小梁体积/组织体积增加。另一项研究表明,无菌小鼠的 5-HT 水平确实降低了,并且肠道微生物群的移植可以恢复血清和结肠中的血清素水平。
某些产芽孢微生物可以调节肠道血清素,进而通过 Htr1b/PKA/CREB/cyclins 信号传导调节成骨细胞增殖和骨形成。对肠道菌群衍生的血清素对骨代谢的作用的详细了解描述于下图:
肠道微生物群通过血清素的双相作用对骨稳态的影响
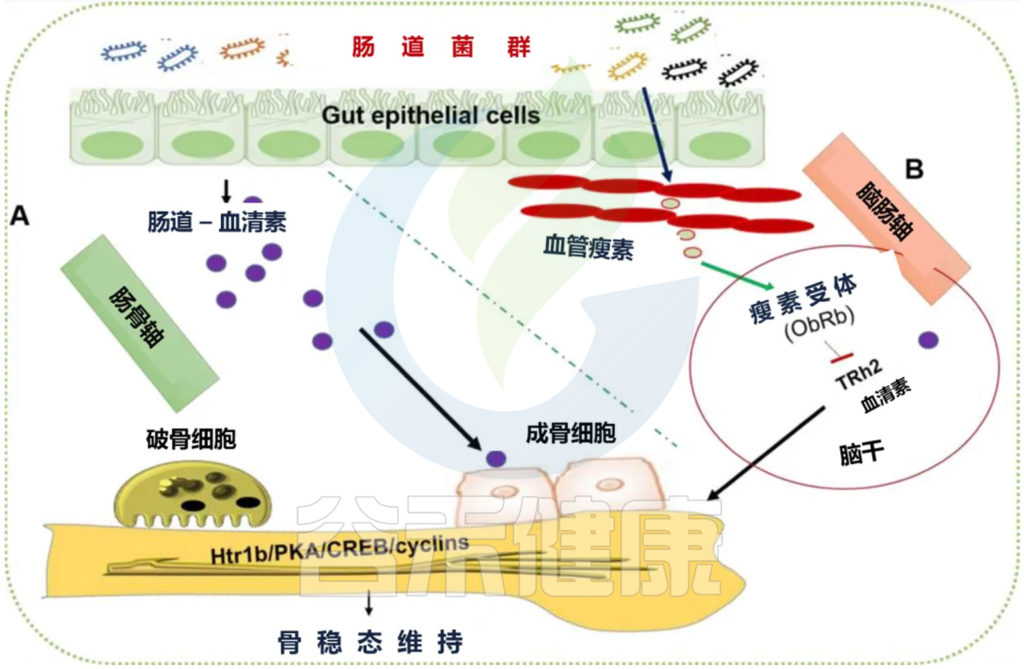
编辑
10.1016/j.bone.2020.115317
(A)某些微生物群,例如产芽孢微生物,可调节肠道、血清和粪便中的血清素水平。这种释放的血清素与成骨细胞膜的 htr1b 受体结合,并通过 Htr1b/PKA/CREB/cyclins 信号传导调节其增殖。
(B)另一组细菌种类(乳球菌、粘螺菌、乳杆菌和双歧杆菌)可以正向调节外周/血管瘦素水平,进而通过脑血清素作用调节骨稳态。htr1b:5-羟色胺受体 1B,PKA:蛋白激酶 A,CREB:cAMP 反应元件结合蛋白。
众所周知,脂肪细胞特异性激素瘦素可调节许多生理过程,包括骨骼发育、能量稳态等。
2013 年的一项研究揭示,乳球菌、粘螺菌、乳杆菌和双歧杆菌等微生物群正向调节全身瘦素水平。这种释放的瘦素产生与在脑干神经元中表达的瘦素受体 (ObRb) 结合,从而导致脑血清素水平的释放减少,并可能影响骨稳态。
4) 叶酸
一项基于绝经后妇女的研究表明,血清叶酸低于健康对照组。绝经后妇女的红细胞叶酸含量与骨矿物质密度和骨密度呈正相关。叶酸可以减少氧化应激,防止DNA损伤和细胞凋亡,从而直接调节骨细胞。
当叶酸摄入量低时,叶酸水平降低也与亚甲基四氢叶酸还原酶 (MTHFR) 基因突变有关,这与同型半胱氨酸代谢改变、低骨矿物质密度和骨折发生率增加有关。最高的叶酸水平与最高的同型半胱氨酸水平有关,据报道,这会干扰新形成的胶原蛋白的交联,从而干扰骨强度和骨矿化。
许多肠道微生物(如嗜热链球菌、双歧杆菌和粪肠球菌)可以合成叶酸或参与叶酸代谢,这也可以解释肠道微生物组在骨骼健康中的作用。
5) 多胺
据报道,ovx(卵巢切除术)大鼠中适量的多胺可以保护胫骨的小梁结构。基于三种独立实验方法(多胺缺乏饮食 (PDD)、PDD 加抗生素、PDD 加多胺补充剂)对雄性大鼠进行的一项研究表明,PDD 导致小肠和结肠粘膜显着发育不全。
多胺被血清素氧化酶如多胺氧化酶和精胺氧化酶代谢以产生包括过氧化氢在内的活性氧(ROS)和包括丙烯醛在内的细胞毒性醛。ROS 和醛类都调节破骨细胞在细胞活力、分化和成熟中的功能。天然多胺(如亚精胺和精胺)可以阻止 RANKL 诱导的破骨细胞分化,这与抑制破骨细胞中核因子-κB(NF-κB)的磷酸化和转录活性有关,而不是影响成骨细胞。
一些特定的共生细菌,如大肠杆菌、假单胞菌、拟杆菌属、梭状芽胞杆菌和厌氧球菌可能通过多胺的合成间接参与骨代谢。
6) 钙吸收
肠道菌群可影响骨骼发育所需的钙和维生素 D 等营养物质的吸收。钙是骨骼健康的主要矿物质,维生素 D 可促进其吸收。
钙通过主动跨细胞途径或被动细胞扩散被肠道细胞吸收,具体取决于细胞中钙的含量,并以钙的形式沉积骨骼和牙齿中的羟基磷灰石 (Ca10[PO4]6[OH]2)。
缺乏钙或维生素 D都会导致严重的骨骼异常。临床研究表明,膳食钙摄入量高(47.4 毫摩尔/天,而推荐的 22.5 毫摩尔/天)表明青春期女孩的骨吸收减少。除了这些发现之外,该研究表明,仅低钙饮食就足以增强大鼠模型中骨小梁形成的骨吸收和受损情况。
据报道,肠道微生物群将膳食益生元发酵为短链脂肪酸会导致更高的钙吸收。对青少年的研究发现,食用不同的益生元饮食,例如低聚半乳糖 (GOS) 和可溶性玉米纤维 (SCF),两者都可以发酵成短链脂肪酸,导致钙吸收增加。这种增加的钙吸收与粪便中测量的副杆菌属、双歧杆菌属、拟杆菌属、酪球菌属、颤杆菌属和Dialister物种的相对丰度有关。
此外,一项临床试验报告称,绝经后妇女摄入短链脂肪酸对骨钙潴留有积极反应,并观察到骨特异性碱性磷酸酶活性显着增加。
在另一项研究中,实验大鼠模型中的低聚半乳糖喂养导致股骨远端和胫骨近端的钙吸收增加和骨小梁体积骨密度 (vBMD) 增加,从而提高了骨强度。与生长中的大鼠模型中的寡糖相比,益生元菊粉还提高了钙吸收以及皮质和松质骨密度。
此外,在 Caco-2 细胞培养模型中,一种特定的益生菌唾液乳杆菌刺激肠细胞吸收钙,益生菌对骨量功能具有有益作用。
7) 肠道屏障
肠上皮屏障是由不同类型的肠道上皮细胞组成。几种紧密连接蛋白封闭细胞旁通路并在上皮细胞中发挥门和栅栏功能。
在这一层之下,存在一层薄薄的结缔组织,称为固有层,它提供了微生物组和免疫系统之间的健康交流。此外,黏膜层是一种化学屏障,在上皮中提供第一层防御,由一层粘液形成,限制微生物组与上皮细胞之间的直接接触。粘液层的缺失导致肠道炎症和各种代谢免疫疾病的发作。
肠道微生物群组成的改变会导致肠道通透性和肠道屏障破坏。肠黏膜屏障功能障碍可能导致血清脂多糖 (LPS) 水平升高,从而导致代谢性内毒素血症。早期研究表明,LPS 可促进体内股骨的骨质流失和体外破骨细胞的存活。LPS 显着降低了小鼠模型中的骨小梁体积、腰椎骨矿物质密度和椎体数量。
特别是,缺乏性类固醇会提高血清内毒素水平并降低紧密连接蛋白(如密合蛋白 和 JAM3)的转录水平,这些蛋白已被证明可调节肠道屏障的完整性。
同时,性类固醇缺乏会增加细菌易位并诱导局部和全身免疫反应,导致破骨细胞因子的产生增加并导致与年龄相关的骨质流失。
此外,肠道上皮细胞表达雌激素受体,雌激素受体信号激活 MAPK 信号通路,从而间接影响骨骼健康。
最近的研究表明,免疫系统和骨代谢之间存在密切的相互作用,这一术语称为“骨免疫学”,它代表了免疫细胞或免疫相关因素在调节骨骼发育中的作用。此外,肠道微生物是免疫系统功能和成熟所必需的,它也影响宿主健康。
2012首次发现了微生物群与骨骼发育之间的关系。该研究还证实,无菌小鼠的免疫状态改变(促炎细胞因子减少、CD4+ T 细胞减少和骨髓中破骨细胞/前体细胞减少)可能是导致骨量形成高于 CONV-R 小鼠的原因。
其他研究表明,肠道分节丝状菌(Segmented filamentousbacteria)能够增加 IFN-γ 和 IL-17 的产生,它们在体内骨形成中起重要作用,并在卵巢切除术 (OVX) 后挽救小鼠的骨质疏松症。这些研究表明,肠道微生物群通过改变宿主免疫状态来调节骨代谢。
T 淋巴细胞可以通过表达促炎和抗炎细胞因子以及 NF-κB 配体 (RANKL) 和骨保护素 (OPG) 的受体激活剂来调节破骨细胞和成骨细胞的平衡。
破骨细胞分化通过促破骨细胞因子调节,包括 RANKL、IFN-γ、TNF-α、IL-6、IL-1 和 IL-17,而成骨细胞分化通过成骨细胞因子调节,包括 IFN-γ、 OPG、IL-10、IL-6 和 IL-4。
Th17 细胞是 CD4+T 细胞的一个子集,可产生对先天免疫很重要的 IL-17 和 IL-22,这些诱导肠上皮细胞产生抗病原体的抗菌肽。
在无菌小鼠中移植分节丝状菌后,Th17 细胞的数量增加并维持上皮细胞的抗菌作用。CD4 + FOXP3 + Treg 细胞与全身免疫相关并且在肠黏膜中稳定。此外,许多研究表明肠道菌群与 Treg 细胞之间存在密切关系。
动物模型中,涉及骨骼健康的肠道微生物介导的免疫机制

编辑
doi.org/10.1016/j.foodres.2021.110331
梭状芽胞杆菌属物种定殖在无菌小鼠中导致结肠 Tregs 的积累增加。此外,CD4+CD25+Foxp3+Treg 细胞能够通过细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA-4) 介导的途径抑制破骨细胞的成熟/分化。
克劳氏芽孢杆菌通过增加 OVX (卵巢摘除)小鼠模型中的 Treg 细胞来促进骨形成。益生菌嗜酸乳杆菌通过调节 Treg-Th17 细胞平衡来抑制 OVX 小鼠的骨质流失。此外,该报告还显示,微生物群确实影响 B 细胞发育,它产生骨保护素(一种破骨细胞抑制剂,用于有效的骨吸收)。
注:Wnt信号通路是一个复杂的蛋白质作用网络,其功能最常见于胚胎发育和癌症,但也参与成年动物的正常生理过程。Wnt信号传导途径是由配体蛋白质Wnt和膜蛋白受体结合激发的一组多下游通道的信号转导途径。
Wnt信号在早期胚胎发育、器官发生和组织形态发生中起重要作用。已知肠道细菌如具核梭杆菌和脆弱拟杆菌可激活 Wnt/β-连环蛋白信号传导。而β-连环蛋白的丢失与骨形成减少有关。鼠李糖乳杆菌 GG (LGG) 治疗通过 Treg 细胞介导的 CD8+T 细胞 Wnt10b 产生调节来调节骨合成代谢。
为了使免疫系统充分发挥作用,人体必须能够区分宿主环境中通常存在的分子和不存在的外来微生物。由于肠道微生物群是从环境中获得的,它们可能会在肠道局部部位或全身全身引发免疫反应。因此,某些物种的存在可能导致许多细胞因子的增加,包括许多与骨代谢相关的细胞因子(如上所述)以及TNF-α。
无菌小鼠的促炎细胞因子 TNF-α 和 IL-6 的表达降低。肿瘤坏死因子-α已知可刺激核因子 κB 配体信号通路的受体激活剂,这可能促进骨丢失,并抑制间充质干细胞分化为成骨细胞,抑制骨形成。
然而,骨质流失与 TNF-α 和 IL-6 水平升高还是降低有关还没有一致的结论,需要更多的人体研究来证实肠道微生物群可以通过各种免疫因子影响骨代谢。
由于影响皮质醇、肠道激素和神经递质的合成,肠道微生物群被认为是一个虚拟的“内分泌器官”,并且对骨骼健康有特定的影响。
宿主激素不仅塑造了宿主微生物组的结构和功能,还可以改变宿主激素(如儿茶酚胺、雌激素、睾酮、甲状腺和生长激素)的产生和调节,改变激素的表达谱。缺乏这些激素会导致骨质流失增加并影响骨骼形成。
一方面,肠道菌群通过皮质醇通路的紊乱影响骨骼,因为皮质醇和外源性糖皮质激素不仅可以减少钙的吸收,还可以促进成骨细胞的凋亡并抑制成骨细胞的增殖。同时,过量的糖皮质激素可以减少成骨细胞和破骨细胞的数量,延长破骨细胞的寿命,促进成骨细胞的凋亡。
另一方面,性激素的变化成为人类骨质流失的重要刺激因素。缺乏性激素会导致肠道微生物群减少,从而增加破骨细胞和成骨细胞的活性并导致净骨质流失。
性激素缺乏以 TNF 和 RANKL 依赖的方式导致肠道通透性和破骨细胞骨吸收。
性类固醇缺乏会提高小鼠模型中的肠道通透性和破骨细胞形成细胞因子 TNF、RANKL 和 IL-17 的水平,同时保护无菌小鼠免于骨质流失。用益生菌LGG补充本地微生物群可防止性类固醇引起的骨质流失。
其他研究表明,当雌激素缺乏或卵巢切除小鼠接受嗜酸乳杆菌治疗时,骨吸收标志物水平降低,骨形成得到改善。
此外,益生菌罗伊氏乳杆菌的施用可防止雌激素缺乏 (OVX) 和 1 型糖尿病小鼠模型的骨质流失。
1) 胃肠激素
它们包含调节食物摄入的激素,例如肽 YY 和生长素释放肽,以及肠促胰岛素胃抑制肽 (GIP) 和胰高血糖素样肽 (GLP) 。
这些肽的作用与营养状况变化过程中涉及的脂肪因子(如瘦素和脂联素)相互作用;胰腺激素(胰岛素、胰淀素和胰高血糖素);以及控制饥饿和饱腹感的复杂脑肽网络,例如神经肽 Y、黑皮质素(proopiomelanocortin,POMC)、黑素细胞刺激素 (αMSH)、刺鼠相关肽、食欲素和神经递质(例如,多巴胺、去甲肾上腺素和血清素) 。
在药理学策略和减肥手术中,胃肠激素已被确定为糖尿病和肥胖症的治疗靶点。
通过直接或间接机制参与骨代谢的肠道肽的相互作用
编辑
Lafage Proust MH. Joint Bone Spine. 2017
浅灰色类型的肽增加食欲,而黑色类型的肽增加饱腹感和/或饥饿感或胃排空缓慢。
2) 生长素释放肽
生长激素释放肽(Ghrelin) 主要由胃底的泌酸细胞产生。它与在胃、心脏、肺、胰腺、肠道、肾脏、性腺、脂肪组织、下丘脑和骨骼中表达的生长激素促分泌素受体 (GHSR) 结合。胃空腹时,Ghrelin 会增加食欲,而且它的血清水平会在饭前达到峰值。当胃填满时,肽YY、胆囊收缩素和胰高血糖素样肽-1(GLP-1)被释放出来,抑制生长素释放肽的分泌。
在早期研究中,外源性生长素释放肽通过影响生长激素 (GH) 释放和激活 GH-IGF-1 轴来增加生长和骨量。培养的成骨细胞表达 GHSR1a 和 ghrelin 的转录本,这两种蛋白质都存在于骨表面。
当以不引起体重增加的剂量给予正常或缺乏生长激素的大鼠外源性生长素释放肽时,骨矿物质密度 (BMD) 会增加。在体外,生长素释放肽抑制破骨细胞生成并增强成骨细胞增殖和分化,这些影响的大小在模型之间有所不同。
这些数据支持生长素释放肽对骨骼的直接影响,与生长素无关。在最近一项针对大鼠的研究中,将生长素释放肽注入脑室通过一种独立于食欲和体重增加的效应来增加骨量。
但是对血清 ghrelin 水平与骨量相关性的流行病学研究得出了不一致的结果。在肥胖儿童和健康对照组的比较中,血清酰基-生长素释放肽与健康对照组的全身骨量呈负相关,而血清去酰基-生长素释放肽与肥胖组的全身骨量呈正相关。
在胃切除术后患者或健康对照者中,4 小时静脉注射生长素释放肽没有引起骨转换标志物的显着变化。相比之下,在 60 至 81 岁的健康成年人中,与安慰剂相比,口服 ghrelin 模拟物治疗 1 年导致 BMD 略有增加。因此,生长素释放肽对骨骼产生复杂的影响,这是由于中枢和外周效应,并且可能取决于性别和营养状况。
3) 肽酪氨酸-酪氨酸(肽YY)
肽 YY (PYY) 的前体由回肠末端、结肠和乙状结肠中的 L 细胞产生。酶二肽酶 4 (DPP4) 的切割释放活性循环形式 PYY3-36。PYY 产量在用餐期间增加。PYY 抑制食欲,从而限制膳食的大小和摄入的卡路里量。
在大脑中,PYY 通过与 Y2 受体结合来抑制神经肽 Y 的作用。厌食症患者的血清 PYY 水平升高。在体外,PYY 激活表达 Y1 受体的成骨细胞中的信号通路。
PYY 缺陷小鼠在 14 周龄前表现出与野生型小鼠相似的体重和生长。在一项研究中,与野生型同窝仔鼠相比,PYY -/-小鼠的全身骨矿物质密度较低,骨小梁量显着减少。然而,据报道,由于成骨细胞刺激作用,PYY 缺乏会增加雄性和雌性小鼠的骨量。PYY 过度表达的女性骨骼更小,骨量更低,骨形成减少,骨吸收增加。
4) 胃泌素抑制肽
胃泌素抑制肽(GIP )由十二指肠和小肠中的 K 细胞响应进食而释放,并刺激胰腺释放胰岛素和胰高血糖素。GIP 受体 (GIPR) 在内分泌胰腺、肠道、大脑、免疫系统、心血管系统、肺、肾脏、甲状腺和脂肪组织中表达。在骨骼中,GIPR 存在于成骨细胞谱系以及破骨细胞中。
在体外,GIP 增强成骨细胞增殖和分化,调节胶原成熟,并抑制破骨细胞活性。
两种可用的 GIPR 敲除小鼠模型具有相反的骨骼和脂肪组织表型。在一个模型中,GIPR -/-与野生型对照相比,小鼠在 1 个月大时骨骼生长和 BMD 发生变化,小梁骨量减少,在 5 个月大时,血清骨钙素水平降低,但似乎可以防止与年龄相关的骨丢失。在另一个模型中,GIPR -/-小鼠体重较轻,骨小梁体积较大,骨形成标志物增加,骨吸收标志物减少。
另一方面,皮质骨的厚度和性能有所下降。与野生型小鼠相比,GIP 过度表达的小鼠骨小梁和血清骨钙素增加,脱氧吡啶啉减少,组织形态学参数没有变化。在大鼠中,外源性 GIP 治疗减少了因卵巢切除术引起的骨质流失。
在人类中,一项针对健康志愿者的研究表明,GIP 输注可降低骨吸收标志物,并且这种作用与血清葡萄糖水平的作用相互作用。
5) 胰高血糖素样肽 (GLP) 1 和 2
肠道中的 L 细胞响应进食迅速产生 GLP-1 和 GLP-2。两种肽都通过胰高血糖素原的切割释放,然后被 DPP4 迅速灭活。
成骨细胞谱系的未成熟细胞是否表达 GLP-1 受体存在争议。GLP-1 对健康小鼠的骨骼没有影响。在患有糖尿病的啮齿动物和老年卵巢切除大鼠中,GLP-1或 GLP-1 受体激动剂 exendin-4 ( 39 个氨基酸组成的多肽) 对骨骼有合成代谢作用。缺乏 GLP-1 受体的小鼠表现出皮质和骨小梁骨质减少,破骨细胞再吸收增加。
相反,在人类中,GLP-1 给药既不影响体外破骨细胞生成,也不影响体内血清 CTX 水平。在小鼠中,口服骨钙素可增加肠道释放 GLP-1。与 GLP-1 和 GLP-2 或 DPP4 抑制剂相比,靶向这些肽的口服抗糖尿病药物是半衰期更长的模拟物。
对使用这些抗糖尿病药物治疗的糖尿病患者进行的一项荟萃分析显示,对骨折没有保护作用。破骨细胞表达 GLP-2 的受体,抑制骨吸收。在患有骨质减少的绝经后妇女中,睡前皮下注射 GLP-2 可降低早晨血清 CTX 水平,4 个月后,股骨颈 BMD 增加 1.1%。
主要胃肠激素的一些生理和骨骼效应

编辑
doi.org/10.1016/j.jbspin.2016.12.015
肠-脑轴是指整合肠道和大脑之间的神经、激素和免疫信号的连接网络。通信系统是双向的。来自大脑的信号通过自主神经系统和下丘脑-垂体-肾上腺轴影响与胃肠道稳态相关的过程,例如蠕动和转运、粘蛋白产生、免疫功能和肠道通透性、肠道微生物丰度和基因表达模式。
相反,肠道微生物群通过数百种代谢物被肠道中的特殊细胞感知,包括肠内分泌细胞 (EEC)、肠嗜铬细胞 (ECC) 以及初级或次级传入神经末梢。这些细胞对细菌代谢物的感知导致向大脑发出神经信号,并与基于肠道的免疫细胞相互作用,导致局部和全身免疫激活,或者循环代谢物通过血脑屏障进入中枢神经系统并直接影响神经活动。
基于作为多向交互通信”高速公路”的肠-脑轴,这些信号过程影响多个器官(肠道和非肠道器官,如肝脏、大脑和骨骼)。
近年来,血清素 [5-羟色胺 (5-HT)] 是一种重要且被广泛研究的神经递质,已被证明可通过肠道微生物群调节骨代谢。5-HT 是骨骼健康的关键调节剂,根据其合成位点有两种类型:脑源性血清素 (BDS) 和肠源性血清素 (GDS)。有趣的是,这两种类型的 5-HT 具有不同的功能。肠源性 5-HT 对骨形成有负面影响,而脑源性 5-HT 则相反。
十二指肠的肠嗜铬细胞负责 GDS 合成,其部分受肠道微生物群的调节。成骨细胞和破骨细胞都合成 5-HT,表达血清素受体,并调节 5-HT 的摄取。
在大鼠中,5-HT 水平升高会导致骨质流失。另一项研究表明,肠道微生物群不仅诱导 T 细胞和细胞因子调节骨代谢,而且通过促进 5-HT 生物合成的限速酶、色氨酸羟化酶-1 的减少和血清素的增加来调节肠源性血清素 的水平转运蛋白。
然而,具有正常肠道微生物群的无菌小鼠(GF小鼠)在骨量正常化后仅引起5-HT水平的微小变化。不可忽视的是,肠道微生物组通过肠-脑轴中的 5-HT 调节骨量。因此,微生物、大脑和骨骼(肠-脑-骨轴)之间已建立的联系支持了一种治疗骨骼疾病的新方法的可行性。
正如我们所讨论的,肠道微生物群对于维持骨量是必不可少的,其变化与骨量和微结构的变化有关。
骨强度定义为骨响应机械需求的能力,最终由骨分布、微结构、成分和数量决定。
骨骼或骨骼在体内的主要功能是抵抗机械力,因此骨骼机械强度的损害受到临床骨病的挑战,也可能导致脆性骨折。
骨矿物质密度 (BMD) 通常可以解释骨强度,也是研究骨和肠道相互作用的首选表型。
2017一项研究表明,肠道菌群的变化不仅会改变骨量,还会损害骨骼的力学性能。
在这项研究中,他们使用两种不同的小鼠模型检查了骨强度,例如 toll 样受体 5 缺陷小鼠 [TLR5KO])和 WT (C57Bl/6) 小鼠,它们接受了选定的抗生素(氨苄青霉素和新霉素)以杀灭微生物群。
有趣的是,数据表明处理的小鼠的股骨弯曲强度低于未处理的 WT 小鼠。然而,在 WT 和 TLR5KO 小鼠之间观察到全骨弯曲强度存在微小差异。在另一项研究中,证明益生菌菌株瑞士乳杆菌给药可改善骨强度。
肠道微生物组可在很大程度上影响营养吸收和热量吸收,从而直接和间接影响骨代谢。发酵成短链脂肪酸的益生元纤维可以降低 pH 环境和矿物质的络合,例如磷酸钙的形成。因此,更多的钙会被吸收以支持骨骼的生长或保留。
慢性营养不良会影响肠道微生物组的结构和多样性,并与青春期骨骼生长受损有关。
据报道,来自健康和营养不良儿童的微生物群被移植到年轻的无菌小鼠中。结果表明,与对照组相比,健康儿童肠道菌群定植的小鼠体重增加。矛盾的是,与来自健康儿童的微生物群定植的小鼠相比,向营养不良供体的微生物群中添加瘤胃球菌和共生梭菌会增加受体小鼠的股骨皮质骨体积和 BMD。
小鼠缺乏营养的饮食会削弱骨骼生长并导致骨骼长度下降。补充乳酸菌可改善小鼠的骨骼生长。
肠道菌群与膳食磷吸收代谢的关系
饮食是调节或支持消化系统和其他器官功能的重要环境因素,同时也在胃肠道中塑造健康的微生物生态系统。
在膳食成分中,磷 (P) 是一种必需营养素,有助于微生物和宿主的新陈代谢,例如骨骼发育、细胞信号传导、能量代谢、膜蛋白合成,还可以提供抵抗肠道病原体的屏障。
新出现的证据表明,磷可以作为多磷酸盐储存在细菌细胞中,并用作能量和代谢过程。磷作为细菌合成纤溶酶的辅酶,这对于肠道中的膳食纤维降解至关重要。
通过饮食供应磷对肠道短链脂肪酸的产生至关重要。此外,他们证明,由于绵羊反刍动物胃肠道中纤维素的发酵减少,磷缺乏会导致短链脂肪酸合成减少。
膳食磷酸钙 (CaPi) 对肠道菌群平衡有积极作用(通过增加回肠和粪便嗜酸乳杆菌的数量),并在大鼠模型中证实可以防止肠炎沙门氏菌感染。
最近的一项调查中,报告称饲喂富含 CaP 的日粮促进了猪胃部细菌生长和乳酸杆菌的增殖。一般来说,乳酸杆菌能产生非常有效的杀菌素和有机酸,它们可以抑制大肠杆菌等潜在病原体的生长。因此,CaP 介导的胃肠道中乳酸杆菌的增加可能对促进肠道微生物的共生和肠道屏障功能至关重要。然而,尚无直接证据表明肠道微生物群与磷代谢在小鼠和人类骨骼发育中的关系。因此,未来的研究有必要研究膳食磷代谢对肠道菌群共生、肠道屏障完整性的作用,以促进骨质疏松症患者更好的骨量形成。
骨骼肌功能由中枢神经功能通过神经肌肉传递调节。它表现出显着的可塑性,可以对运动和营养等多种环境刺激做出反应。
骨骼肌是参与葡萄糖稳态和脂肪酸氧化的重要器官之一。骨骼肌功能障碍与少肌症、肌肉萎缩有关,因此会导致代谢紊乱。
已经确定肠道菌群与糖尿病、癌症、肥胖症和骨质疏松症等几种病理生理状况的发生有关。然而,目前尚不清楚肠道菌群如何影响骨骼肌功能。
2019的一项工作表明,肠道细菌对于宿主的最佳骨骼肌功能是必不可少的。在研究中,他们发现小鼠在施用广谱抗生素后,肌肉耐力受到严重影响。此外,小鼠的肠道菌群耗竭严重影响了葡萄糖代谢。
缺乏肠道菌群的无菌 (GF) 小鼠的骨骼肌与具有菌群支持的无病原体 (PF) 小鼠的骨骼肌进行比较,表明肠道微生物群是骨骼肌质量和功能所必需的。
肠道细菌对于维持骨骼肌质量至关重要。在研究中,他们发现无菌小鼠骨骼肌出现萎缩,IGF-1表达降低,骨骼肌生长和线粒体功能相关基因也出现下降。
与 PF 小鼠相比,无菌小鼠还表现出血清胆碱减少和氨基酸精神改变。将肠道菌群从 PF 小鼠移植到 无菌小鼠中增加了骨骼肌质量并改善了氧化代谢能力。总之,从这些研究中可以推断出的一个含义是,维持健康的肠道微生物群对肌肉的健康很重要。
肠道菌群在骨骼肌质量和功能中的作用:
肠道微生物群影响小鼠的骨骼肌质量和功能
编辑
doi: 10.1016/j.bone.2020.115317
我们已经了解,肠道微生物群可间接影响成骨细胞和破骨细胞,从而影响骨形成和吸收之间的平衡。肠道微生物可以通过改变骨免疫状态或影响生长因子来调节骨代谢,还可以改变皮质醇、血清素和性激素的代谢,从而影响骨量。
与骨病相关的人类肠道微生物群变化

编辑
doi.org/10.1016/j.foodres.2021.110331
骨质疏松症,一种由遗传和环境因素引起的脆弱骨骼疾病。骨质疏松症引起的骨折是一个主要的健康问题,并给医疗保健系统带来巨大的经济负担,并且骨折与老年人的死亡率和发病率显着相关。
▸ 骨质疏松症的特征
是由于骨骼数量和/或质量的减少而导致骨骼脆性增加。骨强度不能在体内直接测量,但骨矿物质密度与骨强度高度相关,临床上常用来预测骨折风险。
▸ 骨质疏松症的风险:遗传因素
骨质疏松症的风险取决于骨骼生长和发育过程中获得的骨量,直到 20-30 岁达到骨量峰值,以及随后的年龄依赖性骨丢失率。双胞胎和家庭研究表明,50% 到 85% 的峰值骨量差异是由基因决定的,并且与年龄相关的骨质流失也有可遗传的成分。
此外,这种疾病可能是多种复杂因素的结果,包括营养、激素、性别、遗传和生活方式。
▸ 骨质疏松症的风险:雌激素减少
最知名的骨代谢调节剂是雌激素、钙、维生素 D、PTH 和炎症因子。尽管有一系列有效的化合物可以降低骨折风险,但高危人群的治疗率仍然很低。
骨质疏松在绝经后妇女中最常见。雌激素水平下降会刺激过度的破骨细胞形成和骨吸收,从而导致快速骨丢失。
▸ 雌激素减少与肠道菌群失调相关
肠道菌群失调,例如肠道菌群多样性降低,可能导致循环雌激素减少,因为肠道菌群通过分泌 β-葡萄糖醛酸酶来调节雌激素,β-葡萄糖醛酸酶是一种将雌激素分解为活性形式的酶。这些结果可以在卵巢切除术 (OVX) 小鼠中得到验证,这是一种绝经后骨质疏松症模型。
▸ 益生菌调节减轻骨质流失
OVX 通过肠道 TNF+ 的微生物依赖性运输诱导骨质流失由于 IL-17a、TNF 和 RANKL 水平升高,T 细胞和 Th17 细胞。然而,基于不同物种(主要包括乳酸杆菌)的益生菌治疗可防止 OVX 引起的骨质流失。
Lactobacillus paracasei和Lactobacillus plantarum通过降低破骨细胞因子(TNF-α 和 IL-1β)的表达和增加 OPG 的表达来增加骨质疏松小鼠的骨体积/组织体积、骨小梁数量、骨小梁厚度和皮质骨丢失。
此外,长双歧杆菌还会增加骨质流失 OVX 大鼠的骨量密度 。
补充罗伊氏乳杆菌可有效治疗因糖皮质激素诱导或抗生素后诱导的肠道微生物失调和屏障功能障碍导致的骨质疏松小鼠小梁骨丢失。
在一项研究表明,在健康的绝经后日本女性中,与安慰剂治疗的对照组相比,益生菌枯草芽孢杆菌C-3102治疗组的总髋骨矿物质密度在 6 个月内有所增加。
关于益生菌的调节机制在本文后面章节还会阐述。
▸ 性类固醇消耗→ 促炎→ 骨质疏松
性类固醇消耗会增加促炎和促破骨细胞因子的产生,从而导致骨质疏松。性类固醇缺乏通过增加肠道通透性、允许细菌易位和增加进入上皮粘膜的细菌抗原数量来增加肠道炎症。
注:性类固醇(Sex steroid,亦称为性甾体)是指一类与脊椎动物雄激素或雌激素受体相互作用的甾体激素。
▸ 肠道菌群参与免疫调节机制,影响骨骼健康
与常规饲养 (CONV-R) 小鼠相比,无菌小鼠受到保护免受骨质疏松和性类固醇剥夺诱导的骨转换增加,因为 TNF、RANKL 和 IL-17 没有增加。同时,每个骨表面的破骨细胞数量减少。骨髓中 CD4 + T 细胞和 CD11b + /Gr1 -破骨细胞前体细胞的频率降低,而骨形成不受影响。与这一发现一致,在性成熟后定植常规微生物群的无菌小鼠在定植后 1 个月具有较低的骨小梁质量和显着较高的骨吸收标志物 CTX-I 。
肠道微生物群依赖性扩增骨髓 Th17 细胞和产生 TNF-α 的 T 细胞,这增加了它们产生促炎和促破骨细胞因子,如 TNF-α、IL-17 和 RANKL,并减少 RANKL 拮抗剂 OPG 的分泌,可能是骨质疏松发展中潜在的免疫调节机制。
RANKL 诱导破骨细胞形成,TNF 增强 RANKL 活性并诱导 Th17 细胞的扩增,IL-17 减少骨形成。
新产生的破骨细胞激活产生 TNF-α 的 CD4 + T 细胞并诱导 Treg 细胞的产生。Th17 细胞是一种 CD4 + T 细胞的破骨细胞群,由它们产生 IL-17 以及分泌 RANKL 和 TNF 的能力定义,而 Treg 细胞(从天然 CD4 + T 细胞通过CD4 +中转录因子基因FOXP3的内在表观遗传上调T 细胞)抑制免疫反应,从而诱导和维持宿主的免疫耐受,并通过各种机制减少慢性炎症,包括产生免疫抑制细胞因子 IL-10 和 TGF-β。
如上所述,Th17细胞和Treg细胞之间的关系是复杂的;它可以抑制或促进骨骼健康。然而,肠道细菌可能会控制这种平衡。
骨质疏松症中肠道微生物群耗竭的证据
几项研究发现,通过抗生素治疗消耗肠道微生物群会影响小鼠生命早期的生长。抗生素通过骨免疫反应诱导青春期后骨骼发育过程中肠道微生物群的消耗,从而改变肠道细菌组成和骨骼形态。此外,肠道微生物群的消耗可导致由主要组织相容性复合物的 II 类抗原的呈递受到抑制而导致的失调介导的高免疫状态。
肠道微生物群是否会导致硬脂酰辅酶去饱和酶小鼠的骨质流失,发现肠道微生物群的消耗显着改善了骨量的减少。这是通过增加成骨细胞和成骨细胞相关基因表达以及炎症导致肠道屏障受损而发生的。
低剂量青霉素诱导青春期前小鼠肠道微生物群的消耗,导致代谢物改变和肠道免疫异常。治疗剂量脉冲抗生素治疗诱导的肠道微生物群耗竭可加速体重和骨骼生长。
通过注射亚治疗抗生素创建了狗的肥胖模型,发现肠道微生物群的消耗可以将碳水化合物代谢转变为短链脂肪酸代谢,为代谢稳态提供证据。肠道微生物群的消耗对女性弯曲强度的影响较小,B 和 T 细胞群也被消耗,这表明免疫细胞群的改变与骨组织材料特性之间存在关联。抗生素对微生物群的影响通常受性别、年龄和抗生素药物剂量的影响 。
无菌 (GF) 动物是研究肠道微生物群耗竭的另一种方法,它们还可用于检查特定微生物对骨质疏松症和骨关节炎的影响。研究无菌小鼠以评估与年龄相关的免疫和炎症系统,发现肠道微生物群的消耗导致无菌小鼠的牙槽骨丢失。
用 SPF 定植无菌小鼠会增加骨形成,从而提供 IGF-1 来模拟骨骼骨的发育。发现炎症反应是由于缺乏调节肠道微生物群的类固醇引起的,导致小梁骨丢失。结果表明,肠道腔内微生物群增加了肠道通透性并触发了炎症通路。
使用 Nod1-/- 或 Nod2-/- 小鼠和无菌小鼠来减少骨量。不同微生物群落对不同小鼠的影响以及无菌小鼠粪便移植的成功率。这一结果表明,骨量、骨参数、破骨细胞前体和 T 细胞群没有显着变化。与常规大鼠相比,无菌小鼠增加了骨量并减少了每块骨表面的破骨细胞数量。这表明破骨细胞介导的骨免疫状态和骨吸收机制发生了变化。此外,肠道微生物群通过转录因子(例如 Gata 结合蛋白 3 增强成骨细胞和破骨细胞的活性来防止过度矿化)。
骨关节炎是最常见的关节炎类型,是一种具有低度炎症的退行性疾病,是全球关节疼痛和残疾的主要原因,尤其是在老年人中。
骨关节炎的病理变化影响所有关节组织,导致软骨和骨骼退化、骨形成异常(骨赘)和滑膜炎症(滑膜炎)。
先前的研究表明,肥胖和代谢综合征是众所周知的骨关节炎危险因素,因为关节负荷过重和低度全身炎症,而肠道微生物群与其发病机制有关。
一般来说,肠道微生物群通过各种机制减轻会增加肥胖,这将对改变骨关节炎的风险产生影响。因此,一些设计巧妙的动物研究表明,长期高脂饮食或高蔗糖饮食的小鼠容易发生肥胖介导的膝关节关节炎。然而,通过干酪乳杆菌或益生元低聚果糖的干预降低了这种风险和症状。
最近的其他研究表明,骨关节炎患者梭杆菌、粪杆菌和瘤胃球菌的丰度发生了变化可能加剧了关节炎的发生。
研究表明,血清和滑液中高水平的脂多糖 (LPS) 与膝关节 OA 严重程度、巨噬细胞相关炎症和 OA 病理恶化有关。
一项针对成人的大规模人群研究证实,链球菌种属的丰富与膝关节局部炎症导致的膝关节疼痛增加有关。值得注意的是,在膝关节炎患者中进行的随机、双盲、安慰剂对照临床试验也表明,益生菌干酪乳杆菌Shirota 和嗜热链球菌(TCI633) 对改善膝关节关节炎有积极作用。
类风湿关节炎是一种由免疫系统介导的全身性慢性炎症性疾病,会导致进行性关节破坏并损害生活质量。
迄今为止,许多研究都集中在类风湿关节炎上以研究微生物群在自身免疫中的作用。在动物和人类研究中,已在类风湿关节炎中观察到“特定”的肠道微生物群结构。在类风湿关节炎病例中,普氏菌和乳杆菌属物种已被证明在物种水平上更为丰富。因此,普氏菌丰度的增加和胃肠道微生物群的不平衡可能是类风湿关节炎 发生或进展的潜在来源。
然而,普氏菌的作用机制诱导的类风湿关节炎仍然未知。含有乳酸杆菌属的益生菌(主要是干酪乳杆菌和嗜酸乳杆菌)被报道可以用作缓解剂或食品补充剂来控制类风湿关节炎和维持整体健康。
骨关节炎中肠道微生物群耗竭的证据
多项研究指出由抗生素治疗的肠道微生物群可以缓解骨关节炎的进展 。肠道微生物群的消耗还可以通过减少炎症状态和降低 Wnt 信号调节蛋白的表达来减缓骨关节炎的结果 。
与肥胖相关的类风湿关节炎也会受到肠道微生物群耗竭的影响。这可能是由较低水平的脂多糖引起的。脂质代谢物在破坏肠道菌群方面也发挥着重要作用。血清和滑液脂肪营养不良也是骨关节炎发展的重要预测因子。
骨关节炎中肠道菌群耗竭的可能机制包括慢性炎症因子、脂质代谢物和先天免疫。由于 LPS 水平升高与肥胖和代谢综合征有关,而肥胖和代谢综合征与骨关节炎的风险密切相关,因此很容易假设至少一种微生物群落与骨关节炎、炎症、低水平和代谢内毒性有关有关的。
巨噬细胞活化和关节损伤。脂多糖 (LPS) 和 LPS 结合蛋白 (LBP) 的增加与膝关节骨赘的严重程度和滑膜中巨噬细胞活化的频率有关。由于肠道菌群和骨关节炎之间存在这一因素,迫切需要开发有效的疾病缓解疗法来缓解症状和减缓骨关节炎的进展。此外,粪便微生物群移植 (FMT) 在类风湿关节炎管理中具有广阔的应用前景。
痛风是一种与晶体相关的关节疾病,是由于单钠尿酸盐 (MSU) 沉积所致。奇怪的是,痛风患者粪便中的肠道菌群与 2 型糖尿病更相似,产生的丁酸盐水平均较低。
具体参见:全面认识痛风:症状、风险因素、发病机理及管理
近几年的科学进步极大地促进了对肠道微生物群与多种癌症类型的发生、进展和预后之间潜在关联的理解。
骨癌,尤其是骨肉瘤,通常发生在儿童和青少年身上。尽管临床治疗(包括手术技术、化学疗法和放射疗法)在过去的几十年中取得了很大的进步,但目前或正在复发的转移性疾病患者的结果仍然很差,导致死亡率很高。因此,骨癌治疗仍然是世界范围内的一项重大挑战。
长期以来,人们就知道慢性炎症与癌症发展有关 。先天免疫细胞能够通过细胞质中的模式识别受体检测组织中的感染或损伤 。当检测到损伤时,先天免疫细胞会进入受损的癌前组织并诱导炎症反应;这导致血管生成、组织重塑以及细胞因子和趋化因子的存在,为肿瘤发生创造了理想的环境。
虽然几乎没有证据支持肠道微生物群影响胃肠道癌症转移的观点,但在调节实体瘤从肠道转移的机制逐渐发现证据。
骨是实体瘤最常见的转移部位之一。
在骨关节炎和骨质疏松症中发现的破骨细胞活性增强可能有助于骨转移,为肿瘤细胞浸润骨微环境创造空间。结果表明,关节炎小鼠的乳腺癌细胞骨转移发生率高于非关节炎小鼠。
此外,虽然骨质疏松症不被认为是骨转移的危险因素,但发现未经治疗的骨质疏松症的乳腺癌患者的骨转移加速。总之,这些发现表明肠道微生物群可能在骨转移的发展和适合骨转移性疾病的环境中发挥关键作用。
破骨细胞生成也可能受到肠道微生物群的影响。如前所述,循环中的 LPS (脂多糖)刺激单核细胞和巨噬细胞的破骨细胞分化,并促进产生的破骨细胞的成熟和存活。高水平的全身循环 LPS 还诱导巨噬细胞释放促炎细胞因子 TNF-α,已知通过与 TNF-α肿瘤坏死因子受体 1 (TNFR-1)结合来控制破骨细胞活性。
除了循环 LPS,肠道微生物群还可以通过胆汁酸代谢调节破骨细胞生成。胆汁酸介导的破骨细胞生成主要由石胆酸(LCA) 促进,这是一种通过鹅去氧胆酸的 7α-脱羟基转化的次级胆汁酸,这一过程受到位于肠道细菌细胞壁上的细菌水解酶的严重影响。一旦转化,LCA 作为维生素 D 受体的配体。传统上,与维生素 D 结合的维生素 D受体以其在钙吸收中的作用而闻名,而高水平的维生素 D 与骨矿物质密度呈正相关。然而,当 LCA 与成骨细胞上的维生素 D 受体结合时,它会抑制骨形成。
破骨细胞生成被证明对于为骨转移性肿瘤细胞的生长创造空间至关重要,但成骨细胞在骨转移性进展中也起着至关重要的作用。位于骨内膜的成骨细胞支持造血干细胞的自我更新、多能性、归巢和迁移。
此外,骨转移性乳腺癌细胞首先通过细胞 – 细胞粘附连接定植成骨细胞生态位。此后,成骨细胞生态位中的这些 DTC 在被重新激活形成完整的骨转移之前可以保持休眠状态数年。这些发现表明,成骨细胞对于癌症定植的早期发生及其在骨内的存活至关重要。
肠道微生物群也可以参与骨转移癌细胞的早期定植,因为它们还通过激活成骨细胞来诱导骨形成。如上所述,肠道微生物群能够分解宿主无法通过厌氧发酵自行消化的营养物质 ,而短链脂肪酸通常是这种生化反应的产物。已知这些肠道微生物群诱导的短链脂肪酸可以上调骨骼形成。
短链脂肪酸通过刺激肠上皮细胞产生胰岛素样生长因子 1 (IGF-1) 来增强骨形成,IGF-1 是一种已知可增强骨骼形成的生长因子,来自肠上皮细胞。
肠道微生物群影响骨形成的另一个机制是通过调节性激素雄激素。众所周知,雄激素可促进正常和癌变前列腺细胞的生长,而雄激素剥夺疗法 (ADT) 通常是前列腺癌的一线治疗方法。
分析评估雄激素剥夺疗法 (ADT) 和/或雄激素受体抑制剂对前列腺癌患者的疗效研究,结果表明非转移性去势抵抗性前列腺癌患者在这些治疗后表现出骨脆性增加和骨矿物质密度降低抗雄激素治疗。
未来的其他实体肿瘤干预和治疗中要考虑肠道菌群的监测,防止对骨骼健康的影响,此外更多的研究值得探索骨肿瘤和肠道微生物群,为骨癌相关疾病提供可行的预防和治疗。
肠道和骨组织通过由肠道微生物群调节的复杂网络相互作用,恢复肠道菌群对治疗骨骼相关疾病具有积极作用。肠道微生物群的调节可以通过饮食、生活方式来实现,也可以通过益生菌、益生元、合生元、抗生素、粪菌移植等各种干预来实现。
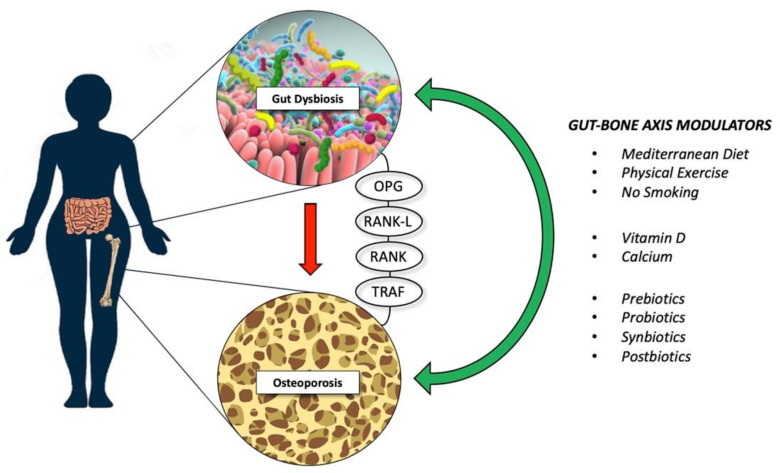
编辑
doi: 10.3390/cells11040743
包括乳酸杆菌(如嗜酸乳杆菌、罗伊氏乳杆菌、干酪乳杆菌、乳杆菌 GG、唾液乳杆菌)、双歧杆菌(长双歧杆菌)和枯草芽孢杆菌等在内的单一益生菌,以及乳酸杆菌的混合物,都可以减少动物模型的肠道和骨骼的炎症,提高肠道通透性,防止骨质流失。
在一项包括 417 名患有急性桡骨远端骨折的老年患者的双盲安慰剂对照临床试验中,干酪乳杆菌Shirota 加速了功能恢复,第 4 个月接受益生菌的患者的治疗结果与第 6 个月接受安慰剂的患者的治疗结果相当,表明益生菌可以加速骨折愈合过程。
多项研究表明,益生菌(即罗伊氏乳杆菌、副干酪乳杆菌和瑞士乳杆菌)可防止卵巢切除术诱导的绝经后小鼠模型中的骨质流失。
五项随机安慰剂对照试验评估了益生菌对健康绝经后妇女骨代谢的影响。不同数量的各种菌株使用 6 或 12 个月。在 3 项试验中观察到骨吸收标志物有所降低,其中 4 项试验对 BMD 有益。
益生菌还被建议作为局部骨质流失(如牙周炎和牙槽侵蚀)的辅助治疗。不同的乳酸菌菌株已被证明可以减少破骨细胞的数量,防止牙槽侵蚀和牙齿移动。
益生菌是维持骨稳态的有效途径;然而,不同物种和不同宿主的肠道菌群组成不同,可能会影响药效。因此,考虑菌株,利用肠道菌群检测,结合宿主的特异性,可以保证益生菌的最佳功效。
益生菌对骨骼影响的研究
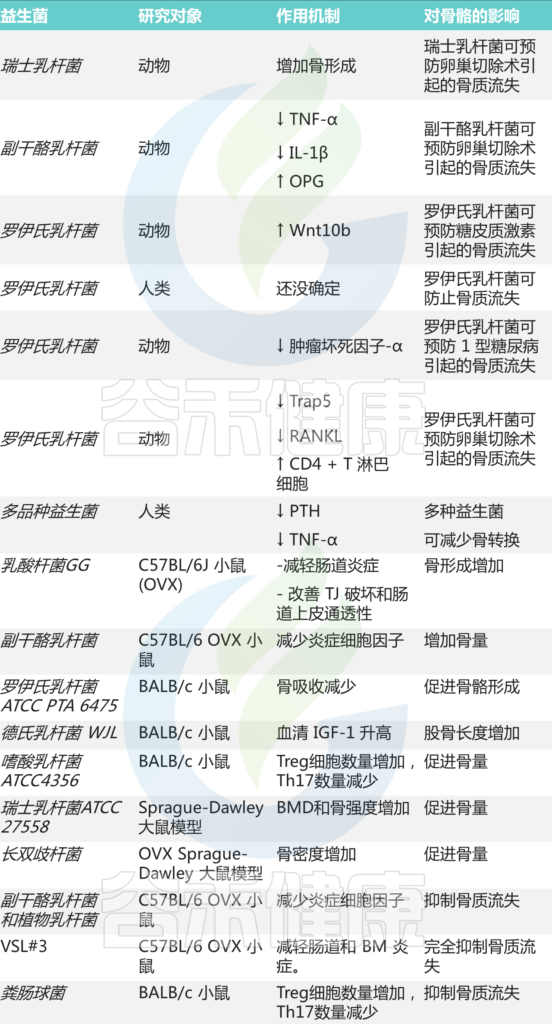
编辑
Behera J, et al., Bone. 2020;& de Sire A, et al., Cells. 2022
益生菌干预的几种机制如下:
1 通过免疫功能调节骨骼健康
益生菌可以通过调节RANKL、CD4T细胞和促炎细胞因子,间接调节破骨细胞的功能和分化,也可以通过Wnt10b、IGF-1和OPG的变化间接调节成骨细胞的功能和分化。
2 通过肠道屏障功能调节骨骼健康
益生菌可以通过增加双歧杆菌和乳酸杆菌等有益细菌,促进肠道菌群趋向健康稳态,防止局部肠道炎症和渗透性,从而有益于骨骼健康。
3 通过代谢产物调节骨骼健康
益生菌可以增加短链脂肪酸等代谢物,这些代谢物可以加强钙的吸收,并在肠道和骨骼中部分发出信号。
益生菌对不同人群的影响
益生元是一种不易消化的食物成分,通过改变肠道微生物群的组成和活性来有益于宿主的健康。
益生元主要包括多种难消化的低聚糖,其中最常见的是低聚半乳糖(GOS)、低聚果糖(FOS)、低聚木糖(XOS)、菊粉和乳果糖。益生元也天然存在于蔬菜、水果和其他高纤维食物中。
低聚半乳糖 (GOS) 对肠道菌群组成和骨量的影响已在生长中的大鼠和人类中进行了评估。在大鼠中,补充 GOS 改变了肠道菌群组成,增加了双歧杆菌的相对比例,并增加了骨量。
低聚果糖FOS 在双歧杆菌的生长刺激方面显示出与GOSs相似的效果,与丁酸盐的结肠浓度增加相关,与丙酸盐一起调节肠道菌群,特别是其对骨代谢的作用。
在动物模型中,FOS摄入与骨强度增加、矿化和骨吸收减少相关。在人类中,补充FOS(3.6克/天,持续12个月)并补充钙可降低绝经后妇女的血清骨转换标记物水平。
在最近的一项研究表明益生元治疗增强了青春期生长过程中的骨矿化。该研究中使用的益生元是短链和长链菊粉型果聚糖的混合物,作为每日食品补充剂给予 1 年,与对照组相比,BMD 增加了 47%。作者提出,这种对 BMD 的影响主要是由于钙吸收的改善。
抗性淀粉属于膳食纤维的一种,未经消化就到达结肠,因为小肠无法改变其组成。这些纤维被结肠中的微生物群用作底物,它们的发酵产生短链脂肪酸;还促进大豆异黄酮的产生,并增加双歧杆菌、乳酸杆菌和拟杆菌的比例。这些淀粉可减少去卵巢小鼠的骨质流失,减轻炎症,并干扰 RANKL/OPG 通路。
低聚木糖XOS是由2-7个木糖分子组成的益生元,在乳酸杆菌上培养双歧杆菌;在小鼠中,它们通过上调十二指肠内TRPV6(瞬时受体电位香草醛受体6)和Na+/Ca2+交换器的表达来增加钙摄取,并增加BMD;它们还能减少高脂饮食胰岛素抵抗小鼠的骨质流失,并减少炎症标志物。
口服补充乳果糖(每6周20克/千克)可抑制破骨细胞的生成,减少骨吸收,防止小鼠卵巢切除引起的骨质流失,同时增加男性和绝经后女性的钙和镁吸收。
可溶性玉米纤维(SCF)粘度低,耐加工和制造技术(如高温和可变pH值),可溶性玉米纤维中存在的α-键在上消化道不可消化,因此允许微生物在下肠道发酵。
研究表明,每天摄入8-21克可溶性玉米纤维会增加粪便中双歧杆菌的比例,并且摄入高达65克/天的可溶性玉米纤维比低剂量的菊糖更能耐受。对动物和人类的研究表明,这种纤维与改善大鼠的钙吸收和骨强度有关,与青少年男孩和女孩的钙吸收有关,与改善绝经后妇女的钙潴留有关。
补充益生元对骨骼的影响和对肠道菌群的调节

编辑
de Sire A, et al.,Cells. 2022
益生元影响骨骼的机制主要体现在两个方面:
维生素D对促进肠道钙磷吸收和骨代谢有巨大影响。
饮食中的维生素 D 必须代谢成活性形式,以调节肠道钙吸收、肾钙重吸收和骨重塑。25-羟基维生素 D3(25(OH)D3 ) 是维生素 D 的主要循环形式,也是维生素 D 状态的重要生物标志物。在低钙负荷条件下,25(OH)D3成为肠道钙吸收的重要决定因素。
肠道微生物组调节维生素D代谢和功能
无菌(GF)小鼠的维生素D代谢有缺陷(1,25 -双羟基维生素D水平低;低钙血症),而带有微生物群的小鼠定植显示,1,25 -双羟基维生素D和钙的水平恢复。
维生素D的作用是通过内分泌和免疫系统发挥的
一项临床试验表明,口服补充罗伊氏乳杆菌NCIMB 30242的益生菌,可提高循环25-羟基维生素D的平均水平。最近发现维生素D受体(VDR)在胃肠道高表达,提示维生素D的作用是通过内分泌和免疫系统发挥作用的。
维生素D激活VDR,并在维持肠上皮屏障功能和肠道微生物群优生方面发挥作用。
VDR基因敲除小鼠与野生型小鼠相比,肠道菌群失调,拟杆菌门和变形菌门的丰度增加,粪便中厚壁菌门和脱铁杆菌门(Deferribacteres)的丰度减少,这种疾病更容易在VDR基因敲除小鼠中诱发结肠炎,而补充维生素D后,炎症得到控制,厚壁菌和脱铁杆菌的比例得到恢复。
维生素D缺乏诱导肠道炎症,增加骨质疏松风险
其他研究表明,维生素D缺乏通过降低上皮表面和免疫细胞的E-cadherin表达,以及在小鼠模型中减少耐受性树突状细胞,从而诱导肠道炎症。这种变化(宿主炎症加剧)可能使病原体在竞争战胜共生细菌,导致免疫反应的上调或下调。
这一发现与人体研究中的观察结果一致,研究表明,肠道微生物群组成和炎症标志物的差异与维生素D摄入量或维生素D水平一致。
此外,多项流行病学研究表明,血清维生素D水平低的人患多种不良健康后果的风险增加,包括骨质疏松、癌症、自身免疫性疾病和心血管疾病。因此,补充维生素D可以恢复更健康的肠道微生物群,减轻炎症,确保日常生活中摄入足够的维生素很重要。
★ 钙
钙是骨骼的主要成分并提供骨骼强度。加膳食钙摄入量可以在短时间内提高骨矿物质密度。钙摄入量是总体骨量的重要预测指标。
膳食钙通过主动和被动运输被小肠吸收。小肠是钙离子被细胞转运到血液中的重要反应部位。
细胞内外钙离子浓度的调节机制
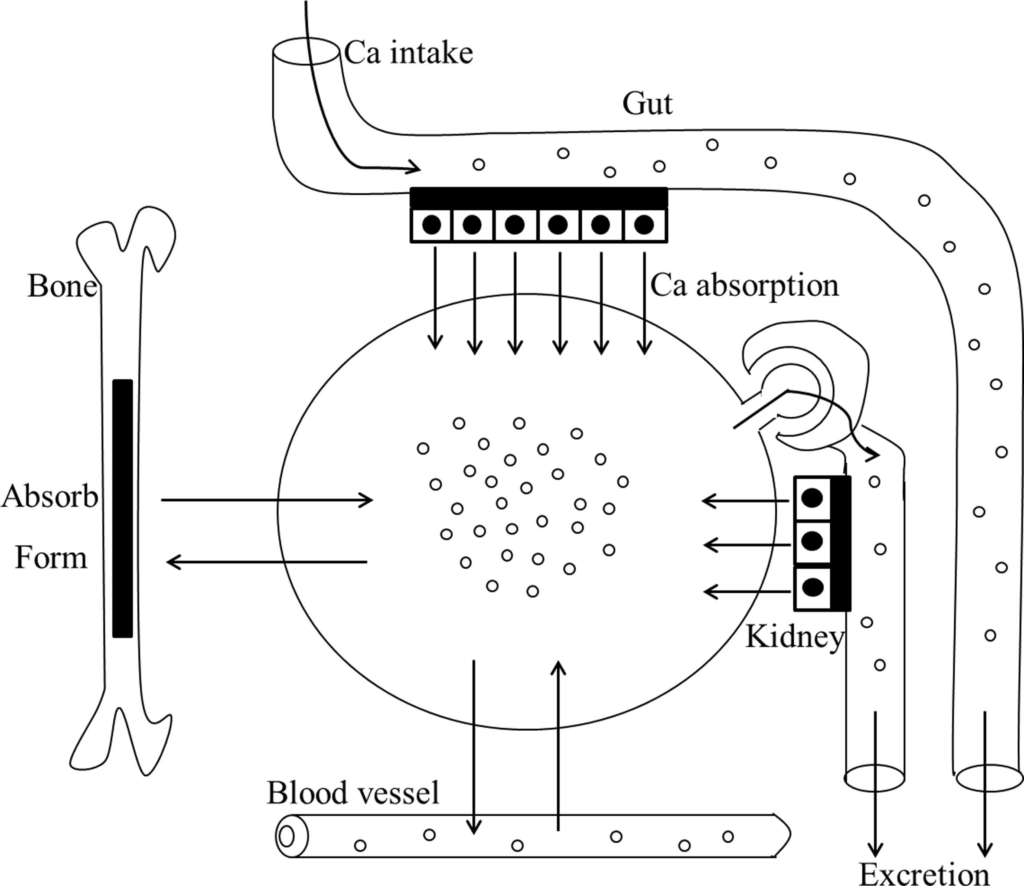
编辑
Xu, Y. J. (2016). Iron Metabolism and Osteoporosis. ISBN:9787567218970
肾脏主要负责钙和磷的代谢,是骨代谢的基础。当血液中的钙离子通过肾脏时,大部分通过肾小管的钙离子被重新吸收回血液中,在那里它们积累形成骨细胞。
摄入钙对骨骼健康的潜在有益影响可能与肠道微生物群和完整性的改变有关
已证明,在动物模型中补充钙或高钙饮食可增加潜在有益细菌的数量(如乳杆菌、瘤胃球菌科和阿克曼菌),增加短链脂肪酸的产生,维持肠道完整性,防止内毒素血症,并调节紧密连接蛋白。
如何通过菌群调节钙水平,从而有益骨骼健康?
——益生菌
益生菌补充剂(乳酸杆菌菌株)有利于小鼠的钙转运和摄取。
绝经后女性,补充瑞士乳杆菌发酵乳增加了血清钙水平,降低了血清甲状旁腺激素 (PTH) 水平。钙和 PTH 的变化表明对骨骼健康有益。
——益生元
在对雄性 Sprague Dawley 大鼠进行的一项实验中,低聚半乳糖 (GOS) 促进钙和镁的吸收,骨密度增加。在生长的 Sprague Dawley 大鼠中,钙和镁的吸收随着 GOS 的补充而以剂量反应的方式增加。这些对矿物质利用的益处与降低盲肠 pH 值、增加盲肠壁和内容物重量以及增加双歧杆菌比例有关。
另一项研究发现,绝经后妇女 20 g GOS 治疗组,钙吸收高于对照组。
益生菌和益生元提高钙的生物利用度
★ 其他微量元素(铁、锌、硒)
补充微量元素对骨骼的影响和对肠道菌群的调节

编辑
de Sire A, et al.,Cells. 2022
植物雌激素是一类来源于植物的生物活性化合物,具有多种雌激素和抗雌激素作用。
植物雌激素(异黄酮和木脂素)主要由小肠吸收和代谢,通常在大豆营养中以糖苷形式摄入。许多植物雌激素具有糖苷键,可被肠道微生物群水解(如乳酸杆菌属和双歧杆菌属)。
同时,植物雌激素可以促进骨保护素/RANKL比率,以及成骨样细胞(MC3T3-E1)的矿化。
据报道,在ovx小鼠模型中施用植物雌激素可抑制破骨细胞,改善BMD、骨钙素和骨桥蛋白水平。此外,喂食植物雌激素染料木素的非肥胖糖尿病小鼠,其肠道微生物β多样性显著不同,这与免疫稳态有关。
★ 抗生素
抗生素被认为是肠道微生物群的深层调节剂,抗生素治疗通过调节肠道菌群,可以影响骨量。
抗生素的作用受性别和年龄的影响
研究人员分析了断奶和出生时给予低剂量青霉素(LDP)的小鼠的肠道微生物组和骨组织形态学。正如所料,与没有LDP的小鼠相比,在出生后的多个时间点,LDP雌性小鼠体内的乳酸杆菌和分段丝状菌(SFB)的水平要低得多。LDP雌性小鼠的骨密度显著增加。有趣的是,雄性小鼠的骨密度变化没有显著差异。
断奶时开始使用低剂量抗生素会导致生命早期的全身生长速度加快
同样,研究人员建立了一个肥胖模型,在该模型中,幼鼠在断奶时服用四种不同配方的低剂量抗生素(青霉素、万古霉素、青霉素加万古霉素和金霉素)。所有低剂量抗生素均在三周内不同程度地增加了骨密度,但七周后骨密度无显著差异。
16S测序结果表明,低剂量抗生素处理后,小鼠的厚壁菌科和Lachnospiraceae的比例显著增加。
通过对肠道、肝脏和脂肪组织的深入研究,可以清楚地看出,抗生素活性主要影响下游肝脏的微生物群,后者通过短链脂肪酸、血脂和胆固醇的代谢影响骨骼发育。
四环素治疗可预防卵巢切除术引起的骨质流失,适度减少骨吸收并显着刺激骨形成。
由于治疗持续时间、性别、遗传菌株、年龄和使用的抗生素的差异,研究之间的直接比较很复杂,需要更多研究。
★ 其他药物
目前可用的骨质疏松症治疗包括抑制破骨细胞活性的抗吸收剂、刺激成骨细胞的成骨化合物和同时抑制骨吸收和增强骨累积的双重作用药物。
在骨内稳态中,Wnt/β-连环蛋白和OPG/RANKL/RANK信号通路分别在骨合成代谢和分解代谢中起着关键作用。抗再吸收治疗包括双膦酸盐和狄诺塞麦,一种抗RANKL抗体。
甲状旁腺素类似物(氨基酸1-34)可刺激骨合成代谢过程。
罗莫单抗是一种抑制硬化蛋白的新型抗体,干扰了硬化蛋白/Wnt信号通路,可能对骨骼具有合成代谢和抑制骨吸收的作用。
在同样的途径中,卷曲相关蛋白(FRPs)被认为是新的治疗靶点,基于miRNA的靶向FRPs的治疗方法正在开发中,以预防和治疗骨质疏松。
针对骨质疏松的干预治疗及建议

编辑
doi: 10.3390/ijms22179452
在骨骼疾病的背景下,年轻至老年大鼠的粪菌移植,通过恢复门和科水平的肠道失调,在骨体积、骨小梁体积分数、骨小梁数量和骨小梁厚度方面改善了老年性骨质疏松症。
肠道菌群是营养物质进入人体的主要生物屏障,其异常扰动会导致骨骼退化。肠道菌群的组成和功能可以通过膳食营养迅速改变;反过来,膳食营养的吸收、利用和代谢也会受到改变的肠道菌群的影响。
有益于骨骼的饮食模式,强调接近地中海饮食模式:
水果、蔬菜、全谷物、鱼和家禽、坚果、豆类和低脂乳制品,但不包括饮料、油炸食品、加工肉类等,已被证明可改善 BMD 并降低骨折风险。
★ 乳制品(发酵乳制品)增骨量,降低骨折风险
膳食蛋白质的摄入,尤其是乳制品中的蛋白质,与骨骼大小、骨量和强度有关。这些产品中包含的一些肽溶解钙并促进其被肠道吸收。
此外,发酵乳制品中富含的芳香氨基酸刺激肝脏IGF-1的生成,这种生长因子调节骨骼生长。
最近的一项研究表明,在一组健康的绝经后妇女中,食用发酵乳制品可能会减缓非负重骨骼部位与年龄相关的皮质骨丢失,这与总能量、钙或蛋白质摄入无关。
此外,摄入发酵乳制品与老年人的骨量增加和骨折风险降低有关,部分原因是乳果糖衍生产品中的乳果糖含量与益生菌一起降低甲状旁腺激素(PTH)的血清水平,促进骨吸收,从而降低骨吸收标记物。
开菲尔
在乳制品中,开菲尔是一种复杂的发酵产品,由包裹在蛋白质和多糖基质中的乳酸菌和酵母菌通过牛奶的共生发酵产生。
在切除卵巢小鼠中补充开菲尔8周,可增加骨密度,增加骨小梁的数量和厚度,增加骨体积,提高力学性能和断裂韧性。
在同一项研究中,还显示了对肠道微生物群的影响,与假手术组相比,Alloprevotella, Anaerostipes, Parasutterella, Romboutsia, Ruminococcus, Streptococcus的粪便丰度更高。
细菌可能会水解肠道中的蛋白质,这一过程可以通过饮食来改变。
研究补充蛋白质、多肽和氨基酸对骨骼的影响和对肠道菌群的调节
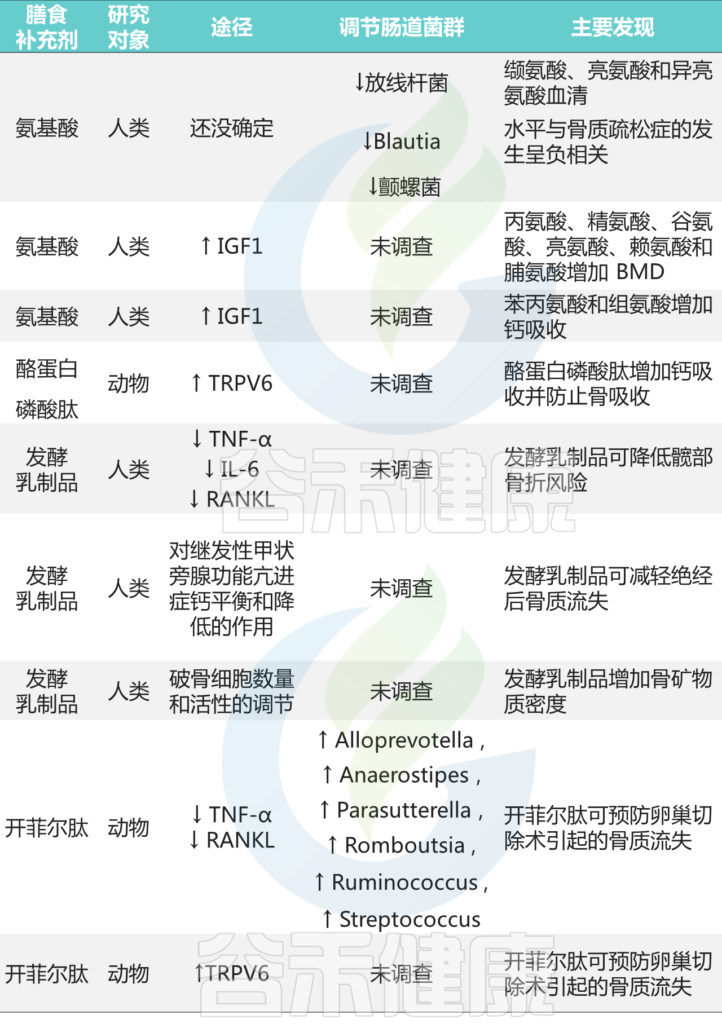
编辑
de Sire A, et al.,Cells. 2022
★ 尽可能避免高脂饮食
高脂饮食(HFD)被定义为含有占总能量摄入量 30% 以上的脂质的饮食。高脂饮食与骨代谢具有复杂的相关性。传统上,高脂饮食被认为是一种骨骼保护剂,因为它会导致体重增加,而高体重是骨骼健康的保护因素。
然而,最近的研究发现,膳食脂肪摄入过多会破坏骨骼重塑,加速骨骼老化,是骨质疏松症独立可控的危险因素。
高脂肪对骨骼结构和骨骼健康有着至关重要的影响,肠道菌群失衡和肠道屏障恶化、炎症、氧化应激、脂肪因子变化和骨髓脂肪组织(BMFT)积聚是潜在的机制。大多数研究表明,高脂饮食会降低骨密度和骨微结构。
高脂饮食对肠道菌群的不利影响是介导骨稳态的关键因素。高脂饮食引起肠道炎症并破坏肠黏膜屏障,随后肠道微生物转移到循环系统并影响骨代谢。
高脂饮食下,肠道微生物群对骨骼的影响
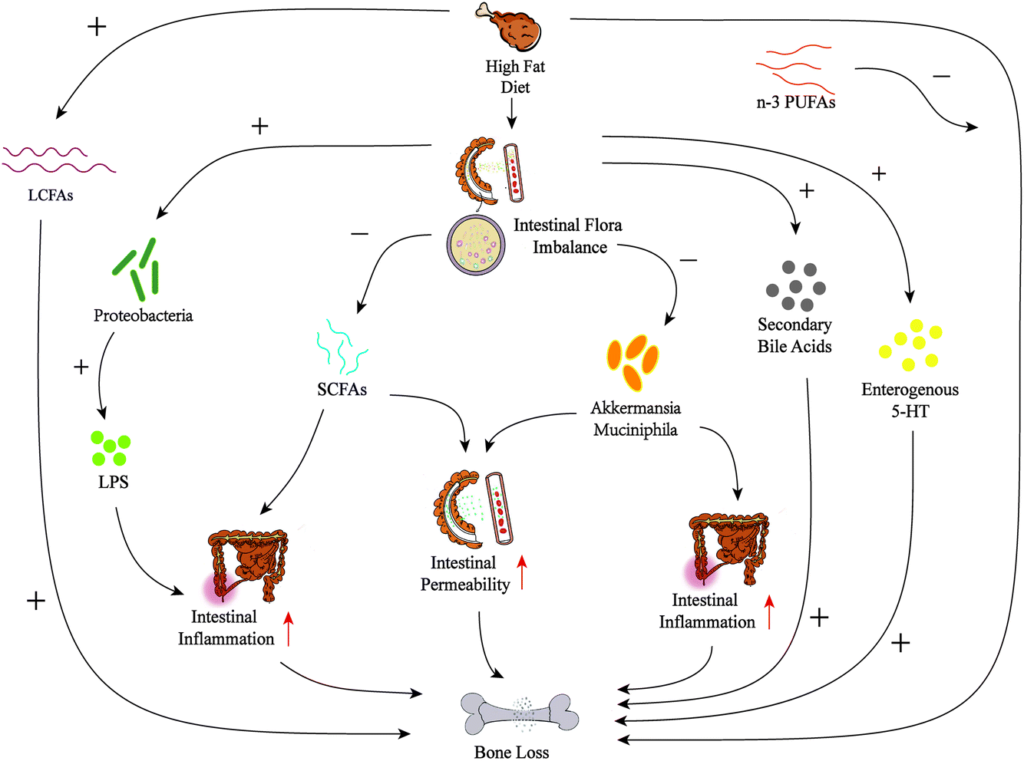
肠道微生物群失衡可减少高脂饮食引起的短链脂肪酸产生和Akkermansia muciniphila的丰度。两者的减少可导致肠道炎症,并增加肠道屏障的通透性。
高脂饮食会产生大量的变形菌;脂多糖在其膜表面可引起肠道炎症。高脂饮食还可以促进长链脂肪酸、次级胆汁酸和肠源性5-HT的产生。所有这些变化最终导致骨质流失。然而,n3多不饱和脂肪酸可以减轻高脂饮食对骨骼的影响。
高脂饮食引起的骨质疏松症是老年人中发现的一种严重疾病,但可以通过预防措施在很大程度上加以控制。传统的有氧运动,如步行、跑步和负重训练,可以逆转过量摄入高脂饮食对小鼠骨骼健康的不利影响。
★ 抗炎饮食
发表在《骨与矿物质研究杂志》上的研究表明,富含抗炎食物的饮食方式的女性比同龄人的骨质流失少。
关于抗炎饮食详见:深度解析 | 炎症,肠道菌群以及抗炎饮食
★ 饮酒习惯
饮酒需要分情况讨论。
对于适度饮酒的人来说,饮酒与较高的 BMD、较低的骨折风险和增加的骨转换标志物有关。
而长期和/或大量饮酒与 BMD 降低和骨折风险增加有关。最近的一项系统评价表明,长期饮酒者(即每天饮酒超过 2 杯)患骨质疏松症的风险是普通饮酒者的 1.63 倍。
酗酒及其对骨骼健康影响的4个主要机制如下:
营养不良是低骨密度的一个不可或缺的风险因素,长期酗酒与营养不良有关。在一项相关的动物研究中,大量饮酒抑制了食物摄入和体重增加。
在酗酒的情况下,许多研究表明酒精对骨细胞有直接影响,也有些研究表明酒精可以影响成骨细胞的活性。
急性饮酒可导致暂时性甲状旁腺功能减退,与暂时性低钙血症、高钙尿和高镁尿有关。它还可以损害生长激素分泌的5-羟色胺能刺激调节和对胰岛素诱导的低血糖的生长激素反应,这在骨骼获得和重塑中起着至关重要的作用。
慢性饮酒可以通过增加成骨细胞中NADPH氧化酶(烟酰胺腺嘌呤二核苷酸磷酸氧化酶氧化酶)的表达来加速活性氧的生成,这与骨吸收有关。
★ 戒烟
吸烟会降低循环雌激素水平,这可以从血液中促卵泡激素和促黄体激素的浓度升高看出。
吸烟还可能增加骨吸收,导致血钙水平升高、血清甲状旁腺激素水平下降以及尿中羟脯氨酸和吡啶啉排泄增加。
吸烟(包括吸电子烟)的化学成分会干扰综合治疗方案中其他治疗措施。电子烟液体可能具有细胞毒性,带来负面影响,当然还需要更多相关研究。
建议所有希望保持骨骼健康的朋友尽可能戒烟。
运动对骨骼和肠道都有好处。体育锻炼对肠道菌群多样性具有积极影响,体育锻炼可以成为儿童和青少年骨形成以及老年人骨代谢的强大刺激因素。
★ 锻炼对不同年龄组带来不同益处
人的骨矿物质密度 (BMD) 在生命的前 30 年逐渐增加,之后开始下降。
▸ 青少年:增加骨量和骨强度
先前对儿童和青少年的研究表明,体育锻炼与更高的 BMD 和更好的骨骼微结构显着相关。进行中度或剧烈的体育活动与骨量的增加更大有关。
负重运动,如体操和足球,与更好的骨骼几何结构相关,而非负重运动,如游泳,则没有这种影响。
一项调查上半身运动(抛球)长期益处的横断面研究表明,在整个生命周期中,骨骼大小的益处占一半,骨骼强度的益处占三分之一。
在其他研究中,九年的日常学校锻炼与更大的肌肉骨骼增益、骨折风险的显著降低以及生命后期更长的体力活动时间有关。
▸成年人
与非活动对照组相比,年龄在35-45岁之间的绝经前女性,进行了为期18个月的高强度运动方案,包括跳跃和跨步训练,股骨颈(承重部位)的BMD逐渐增加。
▸老年人:减轻与年龄相关的骨质流失和骨质疏松
在 50 岁及以上的女性中,用身体活动代替 30 分钟的久坐时间可使 BMD 增加约 3 mg/cm2,并将脊柱骨质疏松症的风险降低约 12%.
★ 如何选择运动?
▸负重有氧训练
负重运动是指骨骼和肌肉对抗重力影响的任何活动。大多数有氧运动都属于这类。这些类型的运动直接作用于腿部、臀部和下脊柱的骨骼,以减缓矿物质流失,同时还提供心血管益处。结合其中一种或几种形式的活动可以帮助支撑骨骼,预防骨骼疾病。
▸ 力量训练
身体有七个主要的肌肉群:腿、臀部、背部、腹部、胸部、肩部和手臂。为了获得最佳效果,应该在每次训练中只锻炼两到三处,中间要有一天的休息。给身体一个治愈和修复的机会,可以防止受伤或紧张,并提高锻炼的效果。
▸ 稳定性和平衡训练
预防跌倒对骨质疏松症患者尤为重要。稳定性和平衡练习可帮助肌肉协同工作,从而更加稳定且不太可能跌倒。单腿站立等简单的运动或太极等,可以提高稳定性和平衡性。
以下第一组中列出的练习是保持骨骼强壮的最佳方法。如果患有骨质疏松症、容易跌倒或身体虚弱,请从第2组或第3组中选择更安全的选项。
编辑Bone Basics-Exercise for Your Bone Health
★ 怎么能确定运动方式是否有益?
✓ 正确的姿势
首先,当你练习走路时,要保持正确的身体姿势。步行是一种好方法,前提拥有强壮的核心(腹部和背部肌肉)。
当然除了步行之外,其他的运动,姿势也需要尽可能标准,才能达到事半功倍的效果。
✓ 多关注自己的身体状态
其次,需要学会倾听你的身体。平时不运动的人,一下子锻炼过多会导致受伤,锻炼计划可能也会因此中断。所以要有对自己身体状况有个较为清晰的认知,增加运动量不要过度是能坚持锻炼和避免受伤的关键。
无论进行哪种锻炼,记得从适合自己的水平开始锻炼,循序渐进。
✓ 适当寻求专业帮助
如果不知道自己走路或运动姿势是否正确,或者知道姿势不正确却不如何调整,也可以寻求专业帮助,相关机构或健身房可能提供更专业的建议。
针对骨质疏松训练:
在开始锻炼计划之前,可以进行骨密度测量、体能评估。
肠道与骨骼的相互作用也越来越受到骨生物学领域的关注,肠道菌群可以通过调节宿主代谢、内分泌、免疫状态以及营养吸收等多个方面在骨骼形成发育和骨代谢中发挥重要的作用。
随着高通量测序技术的不断发展,生物信息工具的不断改进,肠道菌群检测技术在用于评估肠道菌群成分作为低骨量和骨折风险的生物标志物和辅助干预治疗方面,会越来越展示其潜力价值。
结合饮食、生活方式、益生菌、益生元、抗生素等干预手段,改善骨骼健康问题将变得越来越可行,以肠道菌群为靶点可能是骨骼发育的调节剂,也可能成为骨质流失或骨质疏松患者的潜在替代治疗途径。注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
de Sire A, de Sire R, Curci C, Castiglione F, Wahli W. Role of Dietary Supplements and Probiotics in Modulating Microbiota and Bone Health: The Gut-Bone Axis. Cells. 2022;11(4):743. Published 2022 Feb 21. doi:10.3390/cells11040743
Behera J, Ison J, Tyagi SC, Tyagi N. The role of gut microbiota in bone homeostasis. Bone. 2020;135:115317. doi:10.1016/j.bone.2020.115317
Weaver, C. M. (2015). Diet, gut microbiome, and bone health. Current Osteoporosis Reports, 13(2), 125-130. 10.1007/s11914-015-0257-0.
D’Amelio, P., & Sassi, F. (2017). Gut microbiota, immune system, and bone. Calcified Tissue International, 1-11. doi: 10.1007/s00223-017-0331-y.
Li S, Mao Y, Zhou F, Yang H, Shi Q, Meng B. Gut microbiome and osteoporosis: a review. Bone Joint Res. 2020;9(8):524-530. Published 2020 Aug 2. doi:10.1302/2046-3758.98.BJR-2020-0089.R1
Lucas, S., Omata, Y., Hofmann, J., Böttcher, M., Iljazovic, A., & Sarter, K., et al. (2018). Short-chain fatty acids regulate systemic bone mass and protect from pathological bone loss. Nature Communications, 9(1), 55. doi: 10.1038/s41467-017-02490-4.
Saman Khalesi,Correspondence Authors,Saman Khalesi.(2018).A review of probiotic supplementation in healthy adults: helpful or hype,European Journal of Clinical Nutrition,10.1038/s41430-018-0135-9.
Qiao J, Wu Y, Ren Y. The impact of a high fat diet on bones: potential mechanisms. Food Funct. 2021 Feb 15;12(3):963-975. doi: 10.1039/d0fo02664f. PMID: 33443523.
Li C, Pi G, Li F. The Role of Intestinal Flora in the Regulation of Bone Homeostasis. Front Cell Infect Microbiol. 2021;11:579323. Published 2021 Mar 12. doi:10.3389/fcimb.2021.579323
Peng J, Yu XJ, Yu LL, Tian FW, Zhao JX, Zhang H, Chen W, Zhai QX. The influence of gut microbiome on bone health and related dietary strategies against bone dysfunctions. Food Res Int. 2021 Jun;144:110331. doi: 10.1016/j.foodres.2021.110331. Epub 2021 Mar 22. PMID: 34053534.
Sheng B, Li X, Nussler AK, Zhu S. The relationship between healthy lifestyles and bone health: A narrative review. Medicine (Baltimore). 2021;100(8):e24684. doi:10.1097/MD.0000000000024684
Schepper JD, Irwin R, Kang J, et al. Probiotics in Gut-Bone Signaling. Adv Exp Med Biol. 2017;1033:225-247. doi:10.1007/978-3-319-66653-2_11
Collins, Fraser L et al. “The Potential of Probiotics as a Therapy for Osteoporosis.” Microbiology spectrum vol. 5,4 (2017): 10.1128/microbiolspec.BAD-0015-2016. doi:10.1128/microbiolspec.BAD-0015-2016
Malmir H, Ejtahed HS, Soroush AR, et al. Probiotics as a New Regulator for Bone Health: A Systematic Review and Meta-Analysis. Evid Based Complement Alternat Med. 2021;2021:3582989. Published 2021 Aug 2. doi:10.1155/2021/3582989
Li J, Ho WTP, Liu C, et al. The role of gut microbiota in bone homeostasis. Bone Joint Res. 2021;10(1):51-59. doi:10.1302/2046-3758.101.BJR-2020-0273.R1
Billington EO, Mahajan A, Benham JL, Raman M. Effects of probiotics on bone mineral density and bone turnover: A systematic review. Crit Rev Food Sci Nutr. 2021 Nov 8:1-12. doi: 10.1080/10408398.2021.1998760. Epub ahead of print. PMID: 34748440.
Cronin O, Lanham-New SA, Corfe BM, et al. Role of the Microbiome in Regulating Bone Metabolism and Susceptibility to Osteoporosis. Calcif Tissue Int. 2022;110(3):273-284. doi:10.1007/s00223-021-00924-2
Darling AL, Millward DJ, Lanham-New SA. Dietary protein and bone health: towards a synthesised view. Proc Nutr Soc. 2021 May;80(2):165-172. doi: 10.1017/S0029665120007909. Epub 2020 Nov 13. PMID: 33183359.
谷禾健康

痛风(Gout)是最常见的自身炎症性疾病之一,其特征是血清尿酸(SUA)水平升高,从而导致尿酸盐在关节内和关节周围沉积,是最常见的炎症性关节炎之一。
据统计,我国高尿酸血症呈明显上升和年轻化趋势,患者人数已达1.77亿,总体患病率高达11.3%,基于线上用户调研显示,18-35岁的高尿酸血症及痛风患者占比近60%.
——数据来源:2021年《中国高尿酸血症及痛风趋势白皮书》
痛风已经成为我国仅次于糖尿尿病的第二大代谢类疾病。

Dalbeth N, et al., Lancet. 2021
痛风的合并症例如心血管疾病、感染、中风、心律失常和糖尿病缺血性心脏病 、糖尿病,是老年痛风患者住院的主要原因。
尿酸浓度升高的三种主要机制:内源性过度生产、外源性(食物-衍生)摄入和尿酸排泄不足。尿酸的排出主要是肾脏和肠道。痛风的迅猛增长与人们饮食习惯的改变以及环境因素如肠道菌群失衡有关。
痛风病人肠道菌群失衡的主要表现为条件致病菌的增加和促使抗炎症因子产生细菌的减少两个方面。
尿酸合成主要是通过黄嘌呤氧化酶,促使这个酶的活力增加的最大因素就是炎症,当肠道菌群失调有害菌增加,产生的内毒素通过肠道屏障进入血液或肾脏,导致炎性反应不断激活,促进了黄嘌呤氧化酶的活性,结果就是尿酸的过度生产。
此外,肠道中的一些细菌还能够分泌尿酸转运蛋白。例如,乳酸菌属和假单胞菌属的细菌能够合成与尿酸分解代谢有关的一些酶。
肠道菌群是人类进化过程中长期积累下来的特定模式,当过量摄入肉类、海鲜和动物内脏以及酒精导致体内尿酸代谢和积累异常,造成肠道菌群失衡,诱发炎症和免疫反应,引发痛风。与此同时,痛风中尿酸的异常排泄可能会改变肠道微生物组,进而又促进痛风的发展。
在过去的十年中,对于痛风发病机制、风险因素、诊断方法和治疗管理方面的研究取得了重大进展。本文将基于最新研究进展综合讨论痛风的现状,发病率,风险因素,发病机理,与肠道菌群的关联,如何诊断,治疗管理及预防措施。
痛风是一种炎症性,疼痛形式的全身性关节炎。痛风是由单钠尿酸盐晶体在关节和非关节结构中沉积引起的常见病症。
痛风患者可不仅是老年人,任何人都可能患痛风。
滑液偏振光显微镜显示负双折射尿酸单钠晶体
Dalbeth N, et al., Lancet. 2021
当患有痛风时,尿酸盐晶体会在的关节中积聚多年,而大多数人却不知道它们的存在。《白皮书》数据显示,近70%的线上患者是通过身体出现不适后去医院就诊,27%是通过体检的方式确诊为高尿酸血症或痛风。
当关节中有大量晶体时,其中一些会从软骨溢出到关节中两块骨头之间的空间中。 微小、坚硬、锋利的晶体可以摩擦关节的柔软内层,称为滑膜,引起大量疼痛肿胀和炎症。当这种情况发生时,就是我们常听到的痛风发作。
如果痛风不治疗,发作会越来越频繁,并可能扩散到新的关节。攻击通常会影响大脚趾底部的关节,并且通常在凌晨开始。
有尿酸盐晶体的关节横截面
痛风表现为严重疼痛的关节炎(痛风发作)的间歇性发作,这是由对沉积的尿酸单钠晶体的先天免疫反应引起的。
▸特点:疼痛,肿胀,灼烧,跳动等
一个或多个关节突然剧烈疼痛、肿胀、发红和压痛,可发生在关节或关节周围组织(例如,滑囊、肌腱和肌腱)。疼痛包括刺痛、啃咬、灼烧或跳动。受影响的一个或多个关节变得肿胀、触痛、温暖和发红。随着时间的推移,可能导致骨骼和软组织损伤以及关节畸形。
痛风最常见的是影响大脚趾,但其他关节也可能受到影响,包括:
脚上的其他关节、脚踝、膝盖、肘部、手腕 、手指、肾脏。
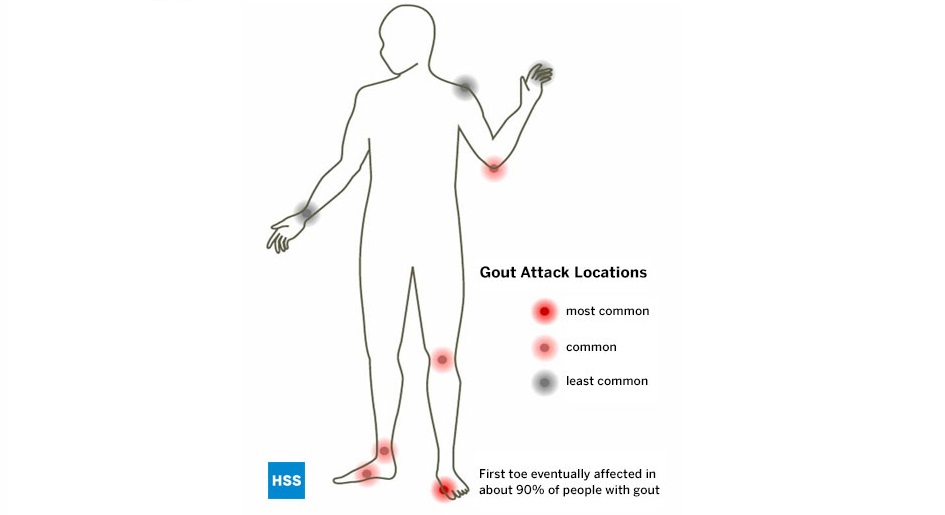
痛风发作通常是单关节的,多关节发作相对比较严重,通常发生在疾病控制不佳的患者或住院期间。多关节发作可伴有明显的全身症状,包括发热、寒战,甚至谵妄。
▸痛风发作一般持续多久?
疼痛可能在开始后的前 4 -12 小时内最为严重。在最剧烈的疼痛消退后,一些关节不适可能会持续几天到几周。后面的攻击可能会持续更长时间,并影响更多的关节。
▸疼痛发作突如其来
痛风的体征和症状几乎总是突然发生,首次发作通常发生在夜间。
特定事件也可能导致痛风发作,比如:饮食过量、饮酒、创伤、某些药物或手术。可持续数天或数周,随后的发作很常见,通常在 1 年内。
随着痛风的进展,关节可能无法正常活动。
▸如果不治疗会怎么样?
在没有治疗的情况下,痛风发作通常会在 7-14 天内自限性。消退后,有一段无痛无症状期(临界痛风),直到再次发作痛风。
有些患者只有一次痛风发作,之后没有任何进一步的症状,甚至未经治疗。然而,不要抱着侥幸心理,大多数患者有反复发作。痛风发作的复发难以预测,但复发发作的可能性与高尿酸血症的严重程度有关。
反复发作的痛风会导致痛风性关节炎,这是一种恶化的关节炎。
随着时间的推移,一些患有持续性高尿酸血症的人还会出现痛风石、慢性痛风性关节炎(由尿酸单钠晶体引起的持续性关节炎症)和结构性关节损伤。
痛风石性痛风和慢性痛风性关节炎通常是长期疾病,血清尿酸盐没有得到控制的表现。
如果痛风没有得到控制,往往会更频繁地发生,长期高尿酸水平和痛风会导致其他健康问题, 出现更严重的情况,例如:
• 肾结石
尿酸盐结晶可能会聚集在痛风患者的尿道中,导致肾结石。药物可以帮助降低肾结石的风险。
• 动脉变窄
这可能导致中风、心脏病发作或其他心脏问题的风险增加。
• 骨关节炎
骨关节炎通常发生在,尿酸盐结晶和硬质痛风石引起关节损伤时。
• 心脑血管疾病
已有证据表明痛风会增加血管疾病的风险。在英国痛风患者在痛风诊断前后的十年中被诊断患有外周血管疾病的风险增加 50% 以上,女性的风险更大。
美国、中国台湾地区和英国的队列研究发现,痛风与发生房颤的风险增加有关,可能是由于高尿酸血症和慢性炎症。在一项分析美国医疗保健索赔数据的研究中,痛风患者和老年组的房颤风险较高。
• 癌症
某些癌症的风险增加,尤其是前列腺癌。
在中国台湾地区和英国进行的基于人群的队列研究表明,痛风与勃起功能障碍的风险增加有关(中国台湾地区为 21%,英国为31%)。
•心理健康问题
痛风患者患抑郁和焦虑的概率明显高于一般人。
一项针对痛风患者心理健康的调查研究表明,在1805名接受治疗的痛风患者中,焦虑和抑郁的患病率分别为10%和12.6%。
• 甲状腺功能低下
一项基于人群的横断面研究,包括115名痛风患者、439名高尿酸血症患者和2254名无痛风和高尿酸血症的个体,结果表明,女性痛风患者甲状腺功能减退的风险显著增加(OR=2.44,95%可信区间1.15-5.17,p=0.02).
• 糖尿病
一项研究跟踪了英国35,000 多名痛风患者,发现与没有痛风的人相比,患有痛风的女性患糖尿病的可能性要高出 71%,对于男性来说,风险增加了 22%。
由于痛风是全球最常见的炎症性关节炎,因此了解痛风患病率的趋势对于充分促进医疗保健资源规划非常重要。
关于痛风患病率和发病率的报告因研究人群和采用的方法而有很大差异,但患病率从 <1% 到 6.8% 不等。
在西方国家,男性发病率为 3-6%,女性为 1-2%。在一些国家,患病率可能增加高达10%。
80 岁以上的男性和女性的患病率分别上升 10% 和 6%。
痛风在男性中比在女性中更普遍,它发生在男性身上比女性多 2-6 倍。10%-20% 的成年人患有高尿酸血症。而且,糟糕的是,目前痛风发病率正在年轻化。
在绝经后时期,女性痛风的患病率趋于上升,但从未达到与男性相同的水平。在男性中,痛风患病率从 35 岁开始上升。
肉类(器官肉)的嘌呤含量很高,酒精会抑制肾脏对尿酸的排泄。
痛风的患病率也取决于种族。据报道,黑人痛风的患病率(5.0%)高于白人(4.0%)。最近在社区动脉粥样硬化风险 (ARIC) 的一项研究中,即使在调整了混杂因素后,黑人患痛风的风险也高出 1.5 倍。
我们国家沿海地区和经济发达的地区痛风患病率更高。
我们知道,高尿酸血症是痛风发生的最重要危险因素,血清尿酸与痛风发病风险之间存在浓度依赖性关系。
如果体内的尿酸水平较高,更有可能患上痛风。与尿酸水平增高相关的因素包括:
我们吃的食物可以在痛风症状的发展中发挥重要作用。在很大程度上归因于食物中的嘌呤,嘌呤被身体分解并转化为废物尿酸。在正常情况下,它会被肾脏从血液中过滤出来,并通过尿液排出体外。
如果尿酸的形成速度超过其从体内排出的速度,它将开始积聚,最终形成导致攻击的晶体。
高嘌呤食物有哪些?
中度嘌呤食物包括:
嘌呤含量相对较高的食物表详见本文末附录。
除上述高嘌呤食物之外,饮用高糖饮料也与痛风相关。
具体的饮食建议可见本文08痛风治疗管理和预防章节。
季节性对痛风发作或加重的影响颇具争议。来自北半球国家的两项研究表明,夏季痛风的发病率最高,然而,来自美国的一项研究显示出不同的结果,急性痛风性关节炎住院人数在秋季达到高峰。
一项使用系统评价和荟萃分析的生态研究得出了不同的结论,即急性痛风性关节炎最常发生在春季,发作频率从 3 月开始增加,并在 7 月达到峰值。
一项基于痛风互联网搜索的研究发现,痛风的季节性变化主要表现为春末/夏初的高峰和秋末/冬初的低谷。
气象因素在痛风加重及发病机制中的作用

Wu ZD, et al. Environ Res. 2022
极端的温度和湿度可能导致肾脏和肠道尿酸的排泄减少,以及皮肤尿酸的生成减少。长期紫外线照射也可能导致皮肤产生尿酸。
气象因素引起的持续高尿酸血症可导致MSU晶体沉积。MSU晶体以两种方式参与痛风的发病机制。
此外,气象因素可加重痛风症状。痛风的常见临床症状是手、脚和膝盖等关节部位的疼痛和肿胀。
为避免极端气候条件,减少不良暴露时间,痛风患者的治疗和预后应处于相对舒适的小气候中。
空气污染物以气体、固体或液体的形式存在,都可以被吸入体内,造成一系列的身体/组织损伤。短期或长期暴露于主要由有害气体、颗粒物(PM) 或重金属组成的空气污染物可能会增加血清尿酸水平,增加痛风的风险,或加重痛风的临床症状。
空气污染和痛风关系的流行病学研究

Wu ZD, et al. Environ Res. 2022
空气污染物引起的持续性高尿酸血症可导致 MSU 结晶沉积。MSU晶体长期存在可形成痛风石,这是痛风的常见临床症状。
痛风的风险随着年龄的增长而增加,因此在老年人群中更为常见。
痛风更常见于男性,女性的尿酸水平相对较低。然而,绝经后女性的尿酸水平接近男性。
男性也更有可能更早地患上痛风,通常在 30-50 岁之间,而女性通常在更年期后出现体征和症状。
如果其他家庭成员(尤其直系亲属)患有痛风,那么更有可能患上这种疾病。即使肾脏完全健康,但有时遗传的基因使肾脏更可能无法正常排出尿酸盐。这是原发性痛风最常见的原因。
肥胖是痛风的重要危险因素,是痛风患病率和发病率上升的主要原因。
在 2018 年的一项荟萃分析中,肥胖(BMI ≥ 30 kg/m 2)与患痛风的风险增加 2 倍以上相关。
在一项随机试验中,较高的 BMI 而不是腰臀比与痛风有因果关系,独立于其他危险因素。
在非随机瑞典肥胖受试者干预研究中,经过长达 26 年的随访,减肥手术后痛风的发病率降低了 40%。
痛风、高尿酸血症和合并症之间的关系很复杂,有些疾病患者患高尿酸血症和/或痛风的风险更高,而另一些疾病则由痛风引起。
最近的研究证实了早期对传统心血管危险因素(如高血压和高脂血症)、心血管疾病和慢性肾病的观察。
一项来自英国临床实践研究数据链 (CPRD) 数据的大型研究,调查了首次诊断痛风前后合并症发生之间的时间关系。这项研究证实了高血压、高脂血症和肾脏疾病是痛风的危险因素,以及公认的痛风与随后的心血管疾病和肾脏疾病的关联。
一项队列研究的荟萃分析证实,高血压和利尿剂治疗易患痛风。
来自英国、美国和加拿大的队列研究也证实了痛风和慢性肾病之间的双向关联,慢性肾病易患痛风,进而增加慢性肾病进展的风险。
在瑞典西部卫生保健区登记处,在首次诊断痛风时出现的大多数合并症在女性中比男性更普遍。
一些用于控制高血压的药物,包括噻嗪类利尿剂、血管紧张素转换酶 (ACE) 抑制剂和 β 受体阻滞剂,也可以增加尿酸水平。
其他可能引发痛风的药物或维生素还包括:
痛风与阻塞性睡眠呼吸暂停 (OSA) 之间的关联也已得到证实。缺氧会增强核苷酸周转,增加代谢为尿酸的嘌呤的产生,从而导致高尿酸血症。
两项使用英国初级保健数据的队列研究发现,阻塞性睡眠呼吸暂停是痛风的独立危险因素。
在对合并症、BMI 和饮酒量进行调整后1 年随访期间,患有阻塞性睡眠呼吸暂停的患者发生痛风的风险比没有阻塞性睡眠呼吸暂停的患者高 50%。阻塞性睡眠呼吸暂停患者诊断后 1-2 年痛风风险最高。
Kelley-Seegmiller 综合征或 Lesch-Nyhan 综合征,这是两种罕见的情况,身体可能缺乏调节尿酸盐水平的酶,或者是磷酸核糖焦磷酸合成酶异常。
近期经历手术或创伤,有时会引发痛风发作。在某些人中,接种疫苗会引发痛风发作。
肠道菌群失调,有害菌繁殖(下面详解)。
肠道菌群通过下列方式影响痛风:
痛风一个多因素代谢疾病,主要是由尿酸异常升高和尿酸单钠 (MSU) 结晶引起的。
痛风是如何与肠道菌群产生关联的?
在健康人中,从体内排出尿酸有两种途径:
肾脏负责排出 70% 的尿酸;
另外30%则由肠道负责排出。
人类不产生尿酸酶(一种负责降解尿酸的酶)。然而,每天产生的三分之一的膳食和内源性尿酸,可以由部分肠道细菌来降解。
在这过程中,由肠道菌群分泌的尿酸转运蛋白将尿酸从血液中运输至肠腔,经乳杆菌属和假单胞菌属等分解或由肠腔直接排出体外。
多项研究结果表明,在痛风患者中可以检测到肠道微生物群失调,尤其是机会病原菌增加。
▸综合许多已有的小规模研究结果
痛风患者的α多样性减少,下列菌群丰度增加:
下列菌群丰度下降:
与拟杆菌肠型相比,普氏菌属肠型的个体血清中的尿酸水平更高。拟杆菌属具有 5-羟基尿酸水解酶 (K07127),一种能够将尿酸转化为尿囊素的酶。
此外,痛风患者的肠道微生物功能,尿酸排泄和嘌呤代谢的代谢物也发生改变。
▸一项大型的宏基因组分析结果
研究人员收集了来自 102 名痛风患者和 86 名健康个体的 307 份粪便样本。作者旨在确定中国痛风患者肠道微生物组的功能特征,及其与尿酸血清水平等临床参数的关系。
结果发现:
在研究中,克雷伯氏菌属与尿酸盐降解基因的相关性最高,作者认为属于肠杆菌科的细菌,如克雷伯氏菌属,可能有助于肠道微生物组中的尿酸分解代谢,它们的丰度降低可能会降低肠道微生物组的功能,因此有助于增加尿酸水平。
痛风相关微生物基因功能与尿酸盐降解有关
Chu Y, et al. NPJ Biofilms Microbiomes. 2021
肠道菌群的失调与尿酸降解失调和全身炎症有关,这可能作为痛风的非侵入性诊断标志物。
以上我们了解到,肠道菌群与尿酸降解过程,维持人体内尿酸的稳定性。
肠道细菌能够使用嘌呤作为碳和氮的来源。嘌呤与尿酸有直接的关系,嘌呤是产生尿酸的主要物质。
肠道微生物群与氨基酸和核苷酸碱基代谢密切相关,因此也与尿酸产生密切相关。核苷酸含有嘌呤或嘧啶碱基(含氮碱基)。
两种类型的碱基都直接或间接地衍生自氨基酸。同样,鸟嘌呤和腺嘌呤嘌呤环可以从甘氨酸、天冬氨酸、谷氨酰胺、CO2和四氢叶酸 (THF) 衍生物从头合成。
肠道细菌进行的嘌呤分解代谢的最终产物是草酸和甘氨酸,通过 (S)-脲基甘氨酸和嘌呤分解代谢的最终产物 (乙醛酸) 之间的转氨作用产生尿酸和甘氨酸。
甘氨酸是谷胱甘肽、血红素、肌酸和核酸生物合成所需的一种不可替代的氨基酸。甘氨酸有助于嘌呤环中 C-4、C-5 和 N-7 原子的形成。
细菌可能利用甘氨酸裂解系统 (GSC) 将甘氨酸分解代谢为氨、CO2和甲基 (-CH2-) 以形成 5,10-亚甲基四氢叶酸。总体而言,GSC,也称为甘氨酸合酶,本质上是可逆的,厌氧菌可以在人体远端肠道提供的厌氧条件下显着触发甘氨酸的合成。
嘌呤环结构及其构象来源
Méndez-Salazar EO, et al, Rheumatol Int. 2022
大量的临床研究表明炎症会改变肠道微生物及其代谢产物,而受影响的肠道以及肠道微生物又会激发免疫响应和代谢活动,从而导致慢性炎症,最终形成慢性疾病,包括痛风。
痛风作为一种早期诱导的免疫应答反应,目前发现 MSU 晶体是诱发以及加重炎症反应发生的重要介质,其能引起白细胞趋化并分泌出大量炎性物质,从而造成痛风急性发作。
在调控机体对 MSU 晶体诱发的炎症反应过程中,肠道菌群结构改变引起乙酸盐、丙酸盐及丁酸盐等短链脂肪酸,脂多糖(LPS)含量变化,因此肠道菌群在这过程中起着重要作用。
痛风性关节炎的发病机制
10.13422/j.cnki.syfjx.20221036
注:图中①部分包含肠道菌群、免疫、细胞凋亡、氧化应激方面在痛风性关节炎中的作用机制;图②部分为痛风与骨代谢之间的相关性
▸肠道菌群失衡->丁酸盐减少->促炎发生
研究发现丁酸盐调控 G 蛋白偶联受体及相关炎症信号通路的表达活性以减少促炎细胞因子的分泌,如果肠道菌群失衡导致丁酸盐减少时将明显促进炎症反应的发生。
▸变形菌影响肠道通透性,促使痛风发作
其他研究人员也在实验中证实了,在变形菌门的作用下,痛风大鼠的肠上皮及肾脏内皮的通透性会明显增加,并出现肠道营养较差的情况,并进一步加剧 LPS 转运至血液循环中,最终促使痛风的急性发作。
综上,在痛风患者中:
痛风是人类最常见的代谢紊乱之一,由对尿酸单钠 (MSU) 晶体沉积的炎症反应引起,该晶体在尿酸盐浓度增加的情况下形成。
痛风的发病机制是尿酸单钠晶体通过激活组织中的巨噬细胞,促进中性粒细胞向组织或器官的聚集,引发强烈的炎症反应。
单钠尿酸盐晶体激活 NOD-、LRR- 、NLRP3 炎性体,并释放 IL-1β,在痛风发作的起始中起主要作用。
高尿酸血症是痛风发展的重要步骤,但高尿酸血症不是痛风发作的唯一危险因素。
导致高尿酸血症的三种主要机制:
高尿酸血症的发病机制
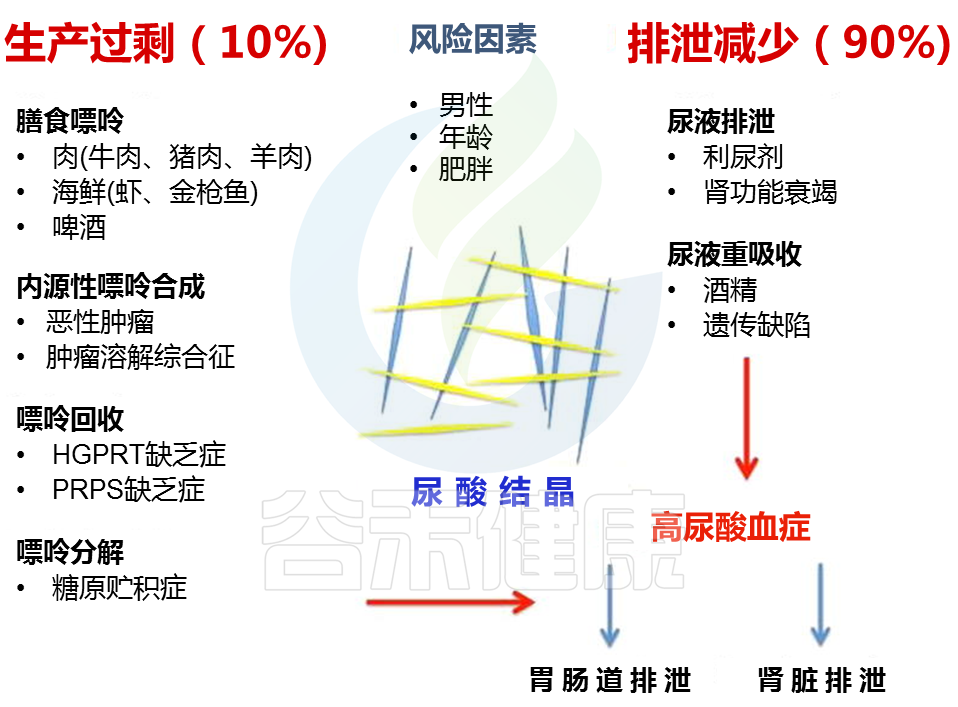
Ragab G, et al.,J Adv Res. 2017
高尿酸血症和痛风的进展可以发生在四个病理生理阶段:
尿酸盐是嘌呤核苷酸降解的最终产物。导致嘌呤核苷酸降解的高嘌呤饮食或其他饮食因素(如酒精和果糖摄入)会增加血清尿酸和痛风发作的风险。
高尿酸血症向痛风的进展
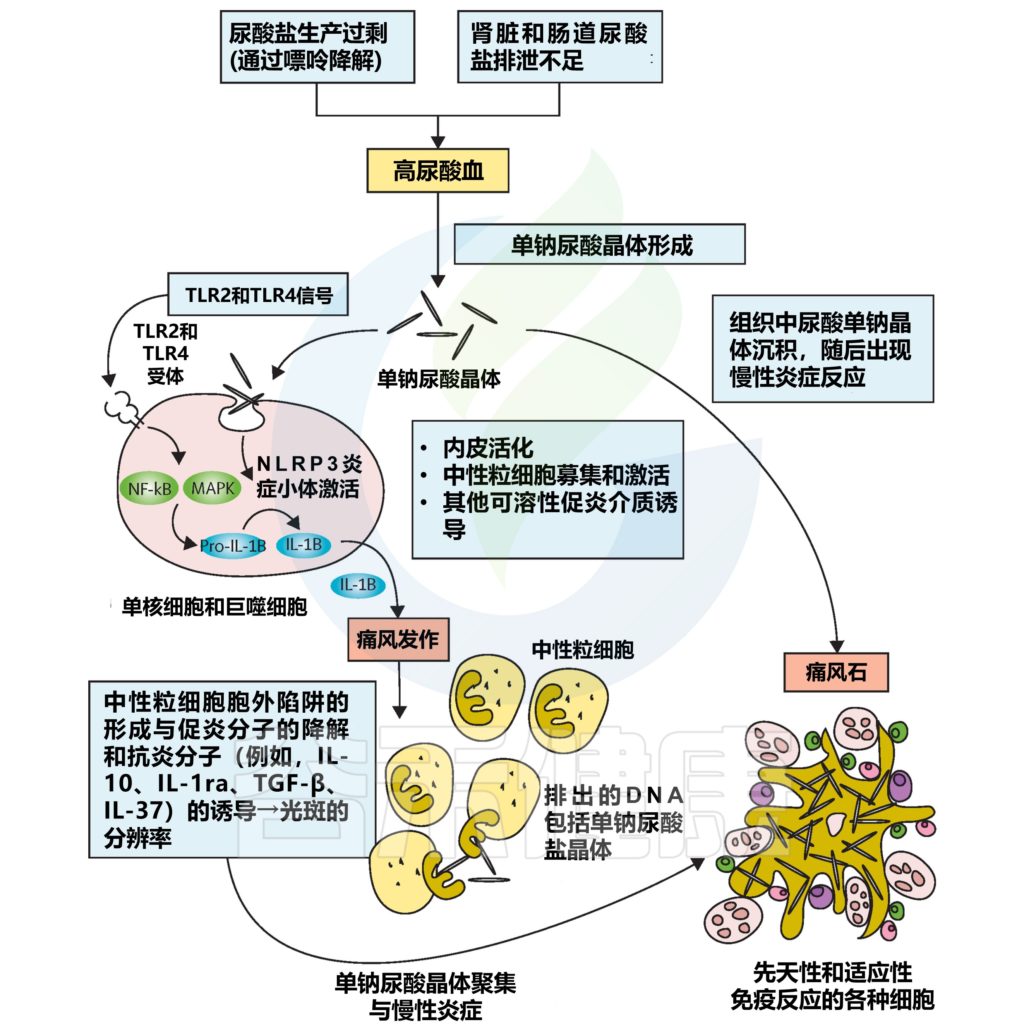
Dalbeth N, et al., Lancet. 2021
导致高细胞更新的疾病,例如银屑病和骨髓增生性疾病,也会由于尿酸盐的过量产生而导致血清尿酸盐浓度增加。
尽管几乎每个痛风患者都存在高尿酸血症,但这不足以发展为临床明显的疾病,因为很多高尿酸血症患者没有症状并且不会发展为痛风。
即使在患有严重高尿酸血症(高于或等于 0·60 mmol/L;10 mg/dL)的人群中,在 15 年内也只有不到一半的人会患上痛风。
高尿酸血症患者尿酸单钠晶体沉积被认为是进展为临床明显痛风的下一个检查点;大约 25% 的高尿酸血症患者有尿酸单钠晶体沉积,可以通过专门的成像方法检测到,特别是在第一跖趾关节。
尿酸盐浓度是形成尿酸单钠晶体的最重要因素,但低温、生理 pH 值在 7-10 之间、钠离子浓度高以及滑膜和软骨成分也会促进尿酸单钠结晶。
从高尿酸血症到痛风临床表现的检查点
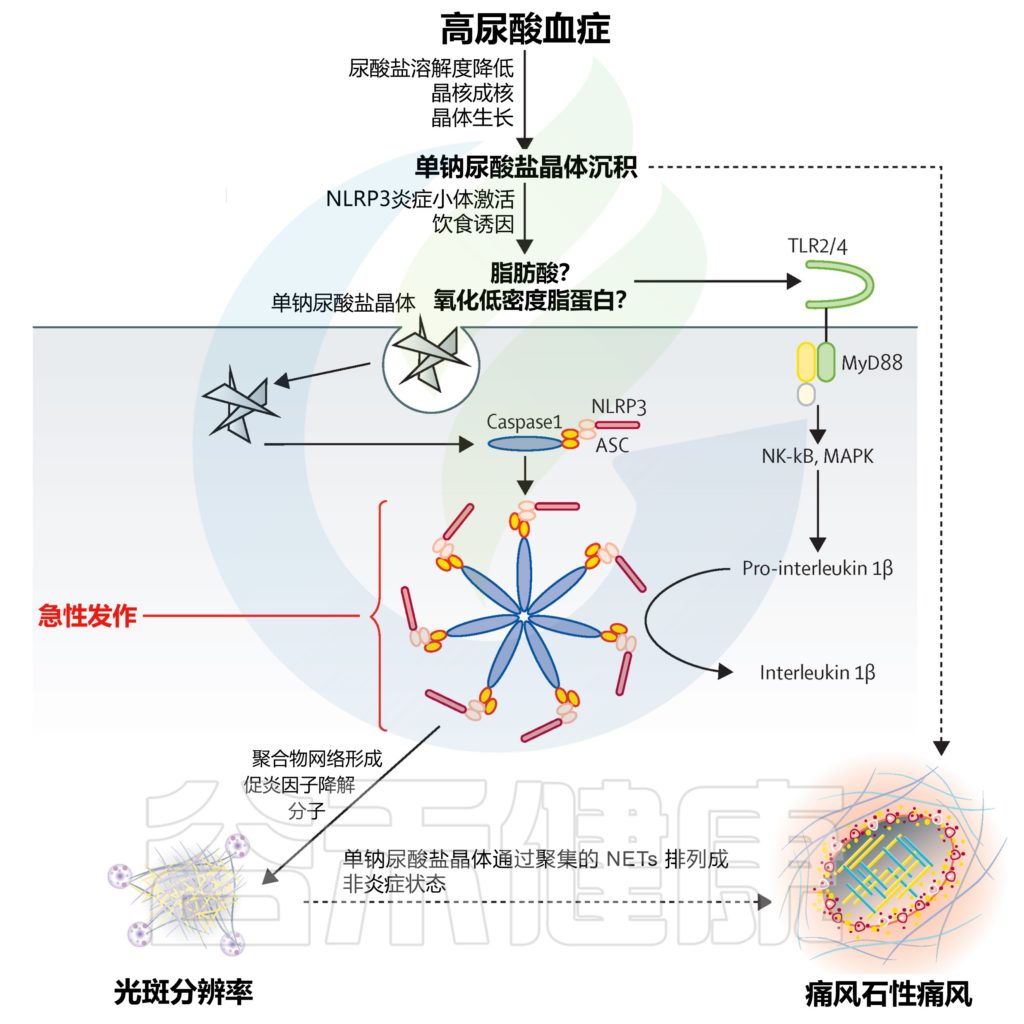
Dalbeth N, et al. Gout. Lancet. 2016
结晶单钠尿酸盐是一种损伤相关分子,可以刺激先天免疫通路。单钠尿酸盐晶体对巨噬细胞和单核细胞中 NLRP3 炎性体的激活与痛风发作的发生特别相关。
NLRP3 炎性体依赖于双信号启动系统
它避免了会损害宿主的不受调节的激活。第一个信号导致通过 TLR4 和 TLR2 刺激 NF-κB,并合成 pro-IL-1β 和炎性体成分。
尿酸单钠晶体作为第二个激活信号,引起炎性体的组装和 caspase-1 的激活,caspase-1 将 pro-IL-1β 蛋白水解成成熟的 IL-1β。
然后,IL-1β 与 IL-1β 受体相互作用,触发涉及促炎细胞因子和趋化因子的下游信号级联,导致中性粒细胞和其他细胞募集到晶体沉积部位。
因为 NLRP3 炎性体的启动需要两步启动过程,单单尿酸盐晶体的沉积并不一定会导致炎症,这解释了尿酸单钠晶体如何存在于关节中而没有临床明显的炎症。
刺激第一个信号的因素,例如游离脂肪酸(由摄入大量膳食或酒精引起)、肠道微生物群和其他微生物成分,可以在尿酸单钠晶体沉积的情况下诱导急性炎症反应。
AMPK (PRKAA2) 是一种具有抗炎活性的代谢生物传感器,可抑制这些激活途径。
中性粒细胞产生一系列不同的促炎物质和机制,使它们能够驱动局部急性免疫反应。然而,它们也可以通过将它们的 DNA 喷射到细胞外基质中来迅速关闭这些炎症过程,这被称为中性粒细胞细胞外陷阱的部署。在高中性粒细胞密度下,聚集的中性粒细胞胞外陷阱捕获并降解促炎介质。
这种反应与其他抗炎因子如 IL-1ra (IL1RN)、IL-10、TGF-β 和 IL-37 一起有助于缓解痛风发作,尽管该部位仍存在单钠晶体的炎症。
晚期痛风的特征是痛风石、慢性痛风性滑膜炎和结构性关节损伤。痛风石代表对尿酸单钠晶体的慢性异物肉芽肿性炎症反应,由三个主要区域组成:
先天性和适应性免疫系统的细胞都存在于痛风石中,包括多核巨细胞。
晚期痛风的一个常见特征是结构性关节损伤,伴有骨侵蚀和局部软骨损伤。痛风石通常存在于痛风的结构损伤部位,在痛风石 – 骨界面处有许多骨吸收破骨细胞。
此外,尿酸单钠晶体直接降低成骨细胞的活力和功能,并间接促进骨细胞功能的转变,有利于骨吸收和炎症。
诊断痛风通常很简单,特别是如果你有典型的痛风症状就比较容易看出,例如,脚趾疼痛。 但有时也难诊断。医生需要了解症状,并且可能需要进行一些检查。
验血
用于测量尿酸水平的血液测试,有助于支持痛风的诊断。
血液测试中的高尿酸盐水平可能表明患有痛风。但这需要与症状一起考虑,可能有高水平的尿酸盐,但没有任何症状。
扫描
超声波和 CT 扫描可以很好地发现关节损伤、关节中的晶体和痛风的早期迹象。
X光一般用于检测因长期痛风而造成的骨关节损伤。
成像
成像技术还可以帮助区分痛风与骨和关节感染:例如,MRI 上存在高度骨水肿高度提示痛风患者的骨髓炎。
滑液测试
这是确认诊断和排除其他原因的好方法。
滑液是在一些关节的囊内制成的。它有助于滋养和润滑关节。通过将针插入一个关节,然后在显微镜下检查液体中的尿酸盐晶体。如果有痛风石,医生可以从其中一个中取样。
炎症
严重痛风发作和感染均可报告发热和白细胞增多。
重要的是,痛风和感染可以共存。
应进行滑液或其他受累组织取样以进行细胞计数和革兰氏阳性菌染色和培养,以完全排除感染。
与其他疾病的区分
此外,注意痛风和银屑病关节炎的临床表现有多种相似之处。银屑病和银屑病关节炎患者代谢综合征和高尿酸血症的患病率很高。
与痛风类似,银屑病关节炎表现为单关节炎或少关节炎。脚趾疼痛不适在银屑病关节炎中很常见,有时很难与痛风区分开来。这两种情况的共存也有据可查。
晚期多关节痛风可以模仿类风湿病的对称性小关节多关节炎。此外,类风湿结节可能与皮下痛风石混淆或难以区分。单钠尿酸盐晶体沉积在受骨关节炎影响的关节中更常见。
治疗痛风有两个主要部分,包括:
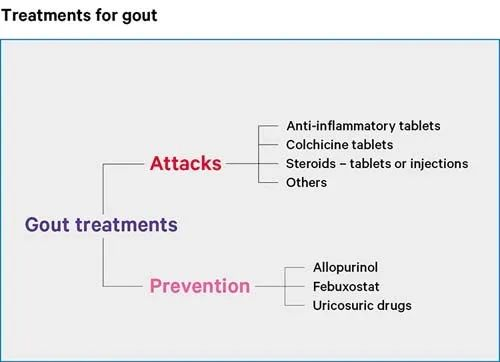
抗炎和降尿酸是痛风治疗的两个主要策略。
抗炎主要用于急性治疗,其目标是直接抑制炎症。基于这种策略的治疗包括使用:
降尿酸的主要方法有 3 种(第二种策略):
痛风发作的管理策略

Dalbeth N, et al., Lancet. 2021
▸ 非甾体抗炎药(NSAIDs)
痛风发作通常用非甾体抗炎药片治疗,它可以帮助缓解疼痛并减轻一些炎症。萘普生、双氯芬酸和依托考昔是可以服用的三种非甾体抗炎药。
如果已开具非甾体抗炎药来治疗,则应在发现有发作迹象后立即开始服用。医生可能会让你常备药,可以在发作的第一时间开始服用。
不过,非甾体抗炎药并不适合所有人,如果有任何其他情况,请先咨询医生。它们还可以与其他药物相互作用,因此请确保在开始使用任何新药物之前先咨询医生。
非甾体抗炎药通常不会长期服用,因为它们会导致消化系统出现问题。为了降低发生这种情况的风险并保护胃,医生可能还会开出质子泵抑制剂。
▸ 秋水仙碱
秋水仙碱不是止痛药,但可以非常有效地减少尿酸盐结晶引起的炎症。
一旦感觉到马上要发作了,应立即服用秋水仙碱片剂,否则可能效果不佳。医生可能会建议在家中常备。
秋水仙碱可以与其他几种药物相互作用,包括用于治疗高胆固醇的他汀类药物。应尽可能遵医嘱。
如果患有慢性肾脏疾病,应该避免服用秋水仙碱。
秋水仙碱片可引起腹泻或胃痛。
▸ 类固醇
类固醇对痛风的急性发作非常有用,通常作为短期片剂服用,持续几天。
但也可以注射到受痛风影响的肌肉或关节中。如果痛风仅影响一个关节,这可能特别有用。
治疗高尿酸血症和痛风发作的常用药物

doi: 10.3390/biom11020280
▸ 益生菌
目前关于这方面的研究仍然有限,益生菌可能对部分人的痛风有一些积极影响,但并不一定对所有人都有效。
——益生菌帮助减轻体内炎症
2016 年,在中国人群中进行了一项病例对照研究,发现益生菌菌株长双歧杆菌的口服给药可以降低实验性痛风小鼠模型中的炎症反应,表明它可以用作痛风患者的辅助治疗。
——益生菌帮助降低痛风发作的严重程度和频率
在一项研究中,与未服用益生菌补充剂的参与者相比,服用益生菌补充剂 8 周的参与者痛风症状明显减轻。
另一项研究发现,服用益生菌补充剂 12 周的参与者患痛风的风险明显低于未服用补充剂的参与者。
还是需要更多的研究来证实这些发现。
▸ 益生元
——菊苣提取物
一种优质的益生元,其能下调高尿酸血症大鼠体内嘌呤代谢酶的活性,并降低小肠浓度型核苷转运体(CNT2)mRNA 的表达水平,发挥抑制肠道嘌呤吸收的作用。
此外研究还发现菊苣提取物能增加高尿酸血症大鼠 FUA 含量,促进肠道尿酸排泄,降低 DAO、D-乳酸、LPS 水平,改善其肠道组织形态的病理改变,降低 DEFB1 异常升高,促进 sIgA 分泌,改善肠道上皮细胞的通透性,从而抑制粪肠球菌等致病菌属的生成,促使双歧杆菌的增多,最终发挥维持肠道屏障功能、调节肠道菌群稳态,以加快体内血尿酸排泄的作用。
——白藜芦醇
白藜芦醇是毛叶藜芦中的一种多酚化合物,可充当植物益生元。白藜芦醇可通过触发 Nrf2/HO-1信号传导通路以提升机体 NQO1、SOD 以及 Nrf2 的表达水平,并抑制 ROS以及 MDA 蛋白的活性,以此发挥调控氧化物质的作用,缓解痛风炎症中的氧化应激反应。
▸ 中药调节
大量中药被证实具有抑制痛风初期炎性发作的功效,其有效避免了炎性因子的过度分泌及炎性细胞聚集,在改善症状及减缓炎症的发展中发挥着重要作用。
中医药对痛风性关节炎的防治机制

10.13422/j.cnki.syfjx.20221036
黄连素是黄连中的异喹啉生物碱,目前发现它可通过抑制 NLRP3/TLRs信号通路以干预痛风小鼠体内 MyD88、TLR7 及 NF-κB p65 等蛋白的表达,并最终达到下调 TNF-α、IL-6 等炎症因子水平的作用,从而缓解关节炎症的进展。
虎杖醇提物 、鼠麴草醇取物、葛根素等均可抑制痛风动物模型体内 NLRP3/ASC/Caspase-1 的表达水平,并减少 NLRP3 的活性以阻断 TNF-α 、 IL-6 等的分泌,改善关节症状。
桑黄乙醇提取物能够显著降低高尿酸血症大鼠体内的血尿酸水平,其作用机制可能与桑黄乙醇提取物通过下调 ADA及 XOD的表达水平及增加肠道 Lactobacillus菌属数量有关。
桑抹茶通过促使拟杆菌、乳杆菌等肠道优势菌群的增生,发挥抑制血清 LPS浓度及 XOD活性的作用以降低高尿酸血症动物模型体内的血尿酸水平。
▸ 非药物措施
保持发作的部位凉爽,用冰袋或用毛巾包裹的一袋冷冻豌豆可以特别有效地减轻一些疼痛和肿胀。
让该部位得到充分休息。
前面主要讲的是通过抗炎(缓解炎症)的方式,对痛风发作进行干预,接下来主要从降尿酸的策略出发,来预防痛风发作。
有一些药物可以降低尿酸盐水平,防止新晶体形成并溶解关节中的晶体。降尿酸疗法通常在痛风发作完全消失后开始。
降尿酸疗法没有单一的固定剂量,不同的人需要不同的剂量才能达到正确的血尿酸水平。
药物可能需要几个月或几年的时间才能完全清除体内的尿酸盐结晶。 降尿酸疗法不会立即阻止痛风的发作。
在开始的前六个月内,有可能会遭受更频繁发作。如果发生这种情况,请不要停止降尿酸疗法,因为这实际上表明药物正在发挥作用。随着药物开始溶解晶体,晶体变小,更有可能进入关节腔,引发攻击。
医生可能会建议在开始降尿酸疗法的前六个月服用低剂量的秋水仙碱或 NSAID,以预防发作。
降尿酸疗法通常是终生治疗,需要每年检查一次,监测尿酸水平。如果症状没有得到控制,需要咨询医生,也可能需要服用更高的剂量。
尽量不要任意服用剂量,尤其是在开始治疗的第一年或第二年。这可能会导致尿酸水平上下波动,从而引发攻击。
别嘌醇是最常用的降尿酸疗法。对于大多数痛风患者来说,这是一种非常有效的治疗方法,它可以减少身体产生的尿酸量。
从低剂量的别嘌醇开始,可以逐渐增加,逐渐增加剂量的好处是温和,它不太可能引发攻击。
别嘌醇会通过肾脏分解并从体内排出,因此对于肾脏有问题的人群,它可能不适合。
非布司他是一种较新的药物,它可以减少体内产生的尿酸盐量,其作用方式与别嘌醇相同。
它的作用方式与别嘌醇相似,但它不会被肾脏分解,而是被肝脏分解。对于前面提到肾脏有问题的人群,或者不能服用足够高剂量的别嘌醇的人群,非布司他很有用。
当第一次开始治疗时,非布司他比别嘌醇更容易引发痛风发作。因此,作为预防措施,可能会建议在服用非布司他的前六个月服用低剂量的非甾体抗炎药或秋水仙碱。
包括磺吡酮、苯溴马隆和丙磺舒,通过肾脏排出比正常更多的尿酸盐起作用。
只有在别嘌醇和非布司他不起作用或不适合的情况下,医生才会开具处方。
如果有肾结石或肾脏有严重问题,不太能服用这些药物。这是因为排尿酸药物会促使肾脏过滤更多的尿酸盐。这样做还会增加患肾结石的风险。
在极少数情况下,如果尝试了几种降尿酸疗法,没有一种有效,则可以将尿酸排泄药与其他降尿酸疗法一起使用,例如别嘌醇或非布司他。
长期痛风管理的原则
(药物因地区而异,视供应情况和批准情况而定)

Dalbeth N, et al., Lancet. 2021
痛风影响日常生活的许多方面,包括工作和休闲活动,痛风的发生和发展一般是饮食、遗传、环境等多种因素共同作用的结果。幸运的是,遗传因素并不是决定因素。
近日,发表在BMC上的一项基于人群的大型纵向研究发现,健康的生活方式(包括不/适度饮酒,不吸烟,定期进行体育锻炼和健康饮食),可能抵消遗传因素对痛风事件的风险影响。该研究强调了保持健康的生活方式对于预防有遗传倾向的人痛风的重要性。
生活方式和遗传易感性共同影响痛风的多重调整风险比 (HRs) 和 95% 置信区间 (CI):Cox 回归模型的结果
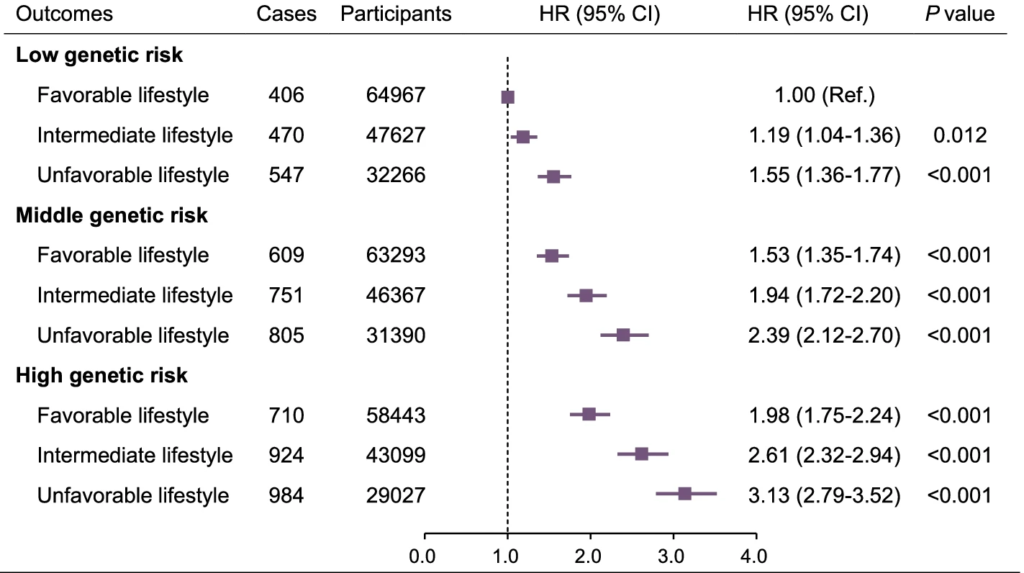
Zhang Y, et al., BMC Med. 2022
★ 健康饮食
避免可能引发痛风发作的食物,包括嘌呤含量高的食物(如富含红肉、内脏和海鲜的饮食),并限制酒精摄入量(尤其是啤酒和烈性酒)。
食物嘌呤含量表详见附录。
痛风饮食的一般原则遵循典型的健康饮食建议:
包括浆果类(蓝莓,草莓等),瓜类(西瓜,蜜瓜等),十字花科类(西蓝花,花菜等),绿叶蔬菜(生菜,羽衣甘蓝等),其他还包括朝鲜蓟,樱桃,扁豆,西芹,甜菜根,南瓜,黄瓜,大蒜,洋葱,葡萄柚,百香果,橙子,彩椒等,需要足够量。
通过饮用水或柠檬水保持充足的水分。
减少红肉(猪肉、牛肉、羊肉等)、多脂家禽和高脂乳制品。避免肉汤类,其他也包括烧菜的油(玉米油,大豆油,芥花油等)也应少放。
避免鱼油、海鲜(如凤尾鱼、贝类、沙丁鱼和金枪鱼),动物内脏等摄入。
酒精和痛风反复发作的风险增加有关,尤其是啤酒,要限制摄入。
★ 锻炼身体
专家建议成年人每周至少进行 150 分钟的适度体育活动。
推荐的适度、低影响的活动包括步行、游泳或骑自行车。定期进行体育锻炼还可以降低患心脏病、中风和糖尿病等其他慢性疾病的风险。
参加有效的体育锻炼计划。对于担心体力活动可能使关节炎恶化或不确定如何安全运动的人来说,参加体力活动计划,适当学习相关知识和课程,可以帮助减轻与关节炎相关的疼痛和残疾,并改善情绪和运动能力。
★ 减肥
减少卡路里的数量和减轻体重,即使没有限制嘌呤的饮食,也会降低尿酸水平并减少痛风发作的次数。
超重会增加患痛风的风险。对于超重或肥胖的人来说,减肥可以减轻关节的压力,尤其是髋关节和膝关节等负重关节。达到或保持健康的体重可以缓解疼痛、改善功能并减缓关节炎的进展。
★ 保护关节
关节损伤会导致或加重关节炎。选择对关节轻松的活动,如步行、骑自行车和游泳。这些低冲击力的活动受伤风险低,不会扭曲或对关节施加太大压力。
总的来说,遵循痛风饮食,定期锻炼,超重人群需适当减肥,同时不要忽略肠道菌群的管理,可以帮助改善痛风及整体健康状况,提高生活质量。
附录:
食物嘌呤含量表
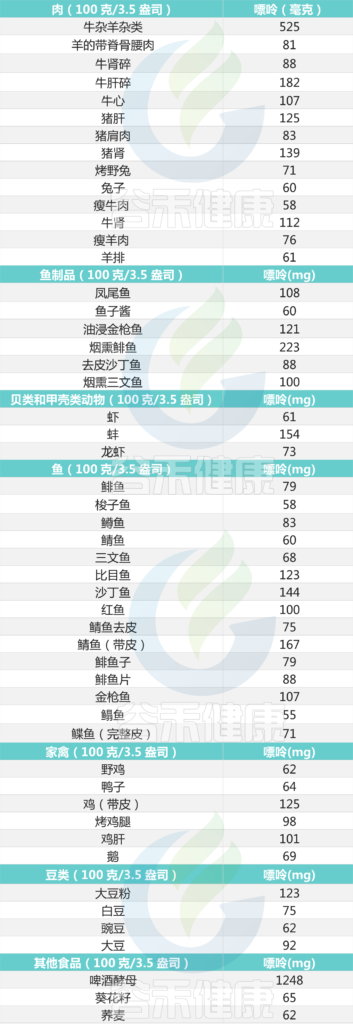
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Guo, Zhuang et al. “Intestinal Microbiota Distinguish Gout Patients from Healthy Humans.” Scientific reports vol. 6 20602. 8 Feb. 2016, doi:10.1038/srep20602
Zhang Y, Yang R, Dove A, Li X, Yang H, Li S, Wang J, Li WD, Zhao H, Xu W, Wang Y. Healthy lifestyle counteracts the risk effect of genetic factors on incident gout: a large population-based longitudinal study. BMC Med. 2022 Apr 29;20(1):138. doi: 10.1186/s12916-022-02341-0. PMID: 35484537; PMCID: PMC9052486.
Chu Y, Sun S, Huang Y, et al. Metagenomic analysis revealed the potential role of gut microbiome in gout. NPJ Biofilms Microbiomes. 2021;7(1):66. Published 2021 Aug 9. doi:10.1038/s41522-021-00235-2
Wu ZD, Yang XK, He YS, Ni J, Wang J, Yin KJ, Huang JX, Chen Y, Feng YT, Wang P, Pan HF. Environmental factors and risk of gout. Environ Res. 2022 Apr 29;212(Pt C):113377. doi: 10.1016/j.envres.2022.113377. Epub ahead of print. PMID: 35500858.
Méndez-Salazar EO, Martínez-Nava GA. Uric acid extrarenal excretion: the gut microbiome as an evident yet understated factor in gout development. Rheumatol Int. 2022 Mar;42(3):403-412. doi: 10.1007/s00296-021-05007-x. Epub 2021 Sep 29. PMID: 34586473.
Ragab G, Elshahaly M, Bardin T. Gout: An old disease in new perspective – A review. J Adv Res. 2017;8(5):495-511. doi:10.1016/j.jare.2017.04.008
Zhang WZ. Why Does Hyperuricemia Not Necessarily Induce Gout?. Biomolecules. 2021;11(2):280. Published 2021 Feb 14. doi:10.3390/biom11020280
Dalbeth N, Gosling AL, Gaffo A, Abhishek A. Gout. Lancet. 2021 May 15;397(10287):1843-1855. doi: 10.1016/S0140-6736(21)00569-9. Epub 2021 Mar 30. Erratum in: Lancet. 2021 May 15;397(10287):1808. PMID: 33798500.
Fenando A, Rednam M, Gujarathi R, Widrich J. Gout. 2022 Mar 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 31536213.
章晓云,曾浩,李华南,李时斌,陈锋,王伟伟.痛风性关节炎的发病机制及中医药治疗研究进展[J/OL].中国实验方剂学杂志:1-12[2022-06-16].DOI:10.13422/j.cnki.syfjx.20221036.
Xu J, Wang B, Li Q, Yao Q, Jia X, Song R, Zhang JA. Risk of Thyroid Disorders in Patients with Gout and Hyperuricemia. Horm Metab Res. 2019 Aug;51(8):522-530. doi: 10.1055/a-0923-9184. Epub 2019 Aug 13. PMID: 31408898.
李雅楠,侯云霞,李鸿斌.肠道菌群与尿酸相关性疾病的研究进展[J].临床荟萃,2021,36(01):80-83.
Lin S, Zhang T, Zhu L, Pang K, Lu S, Liao X, Ying S, Zhu L, Xu X, Wu J, Wang X. Characteristic dysbiosis in gout and the impact of a uric acid-lowering treatment, febuxostat on the gut microbiota. J Genet Genomics. 2021 Sep 20;48(9):781-791. doi: 10.1016/j.jgg.2021.06.009. Epub 2021 Jul 9. PMID: 34509383.
谷禾健康
关于谷氨酸
谷氨酸是一种多功能氨基酸,它处于多种代谢途径的十字路口,不仅参与消化系统和免疫系统,还与大脑健康密切相关。
谷氨酸是大脑中最丰富的游离氨基酸,也是大脑主要的兴奋性神经递质。它可以帮助我们说话、处理信息、思考、运动、学习新事物、存储新知识和集中注意力学习等。
学习和记忆是脑的高级功能,是一个相当复杂的生理过程,其神经生物学基础是突触可塑性。突触的传递是谷氨酸及其受体实现的。
谷氨酸也是γ-氨基丁酸(GABA)的前体,γ-氨基丁酸是脑内普遍存在的抑制性神经递质,这二者之间的平衡对于我们大脑健康非常重要(下次我们专门讲)。
很早以前人们就已经知道,谷氨酸广泛存在于人体各组织和食物以及母乳,这凸显了谷氨酸对人类成长中脑和躯体发育的重要性;但直至20世纪80年代,谷氨酸在中枢神经系统(CNS)和大脑内的作用才得到认识。在过去的30年中,越来越多的研究进展已揭示了谷氨酸及其受体在神经退行性疾病疾病(阿尔茨海默氏症、肌萎缩侧索硬化症、多发性硬化症、癫痫、帕金森等)以及肠道疾病如克罗恩病 (CD) 和溃疡性结肠炎 (UC)的病因中起核心作用。
根据区域的不同,每公斤脑组织含有 5-15 mmol 谷氨酸,比其他任何氨基酸都多。因此,谷氨酸应该在正确的时间、正确的位置以正确的浓度存在。
细胞应该对谷氨酸有正确的敏感性,并且有足够的能量来承受正常的刺激,并且应该以适当的速率从正确的位置去除谷氨酸。谷氨酸过多和谷氨酸过少都是有害的。
海马中靠近血管的突触周围的谷氨酸转运蛋白分布示意图
Zhou Y and Danbolt NC. J Neural Transm. 2014
四个谷氨酸能神经末梢 ( T ) 显示在树突棘 ( S ) 上形成突触。指示星形胶质细胞分支 ( G )。请注意星形胶质细胞的 EAAT2(红点)和 EAAT1(蓝点)的密度非常高。
随着工业水平的发展和人类口味的发展,越来越多的谷氨酸衍生物添加到许多食物中,以赋予“鲜味”味道。鲜味感知分布在人类口腔和胃肠道中的多个受体系统,这些系统激活大脑中涉及不同功能的多个区域,从食物识别到与特定食物相关的情感价值的形成,进而影响食欲和情感等。
加工食品是游离谷氨酸的最大来源。因此目前谷氨酸过量带来的神经毒性不容忽视。一些研究将味精以及谷氨酸衍生添加剂与体重增加、麻木/刺痛、虚弱、高血压、哮喘发作、胃肠道问题、代谢综合征和敏感人群的短期副作用联系起来。
现在强有力的证据表明肠道微生物产生神经活性分子,如神经递质(即去甲肾上腺素、多巴胺、血清素、GABA 和谷氨酸)和代谢物(即,色氨酸代谢物,短链脂肪酸等)维持宿主和细菌之间跨界跨区域交流。谷氨酸代表了在这种跨界交流中活跃的众多神经活性分子之一。
在我们的检测实践中,也发现在精神科病人或存在精神症状的人群中,谷氨酸指标异常。

这些表明谷氨酸以及肠道菌群的异常与大脑健康问题存在关联,它们之间的因果及其发病机制还需更大和更精细的研究和临床探索,但是至少我们可以看到谷氨酸及其与肠道菌群和精神健康方面不可忽视的关联。
本文主要讨论谷氨酸是什么,对人体的健康益处和影响,通过食物或生活方式如何改善谷氨酸缺乏或中毒症,以及共同探讨通过传统药理学方法以及使用产生神经活性分子的益生菌作为治疗神经胃肠道和/ 或精神疾病以及相关的中枢神经系统疾病,如焦虑和抑郁。
谷氨酸(Glutamic acid), 化学构成为2-氨基-5羟基戊酸,作为一种非必需氨基酸,但却是人体最丰富的氨基酸,广泛存在与大脑和肌肉中,是谷氨酰胺,脯氨酸以及精氨酸的前体。
谷氨酸也被定义为功能性氨基酸,意味着其可以调节关键代谢途径以改善动物和人类的健康、生长、发育和繁殖。这个将我们的视野扩展到营养必需或非必需氨基酸的营养范式之外。
在哺乳动物的中枢神经系统中,由于与特定受体的相互作用,谷氨酸充当重要的兴奋性神经递质。此外,谷氨酸还在细胞能量产生和蛋白质合成,免疫功能中发挥重要作用 。
化学信使:谷氨酸将信息从一个神经细胞传递到另一个神经细胞。
脑细胞的能量来源:当细胞的主要能量来源葡萄糖储备低时,可以使用谷氨酸。
学习和记忆的调节:谷氨酸有助于随着时间的推移增强或减弱神经元之间的信号,以塑造学习和记忆。
疼痛传递器:较高水平的谷氨酸与增加的疼痛感有关。
睡眠和清醒介质:大鼠模型研究表明,当我们清醒或快速眼动 (REM) 睡眠期间,谷氨酸水平最高。丘脑是个例外,在非快速眼动睡眠期间谷氨酸水平最高。
谷氨酸是所谓的兴奋性神经递质。它的作用很像兴奋剂,就像咖啡一样。太多会导致问题,但太少也不好。
如果谷氨酸太少,我们无法对进入大脑的刺激做出快速反应,无法很好地记住事物,难以集中注意力,学习会更加困难。
过多的谷氨酸会导致兴奋性毒性,从而破坏神经元。由于谷氨酸是神经元的兴奋剂,过多会导致神经元过度激活并死亡。
如果高水平不受控制,这种神经递质会过度刺激细胞,一直到它们采取剧烈行动自杀以保护周围的细胞。
我们体内的细胞一直在死亡,其中大部分是可以被替换的。然而,谷氨酸导致自杀的神经元,大脑无法制造新的来代替,因此保持它们的健康和安全很重要。
谷氨酸作为兴奋性毒素的作用,与多种神经退行性疾病有关,例如多发性硬化症、 阿尔茨海默病和肌萎缩性侧索硬化症(ALS 或 Lou Gherig 病)。谷氨酸失调也被认为是纤维肌痛和慢性疲劳综合征的原因之一。
两种形式的谷氨酸,结合的和游离的,是显着不同的。
谷氨酸的结合形式存在于完整的蛋白质来源中。结合谷氨酸是天然存在于未加工食品中的氨基酸形式,尤其是蛋白质含量高的食品。它与其他氨基酸结合,当你吃它时,它通常被缓慢消化和吸收,并能够精确调节你摄入的量。这种形式的谷氨酸很少有任何敏感性。因为多余的量可以简单地通过废物排出,以防止毒性。
在蛋白质中,谷氨酸提供负电荷,这可能对稳定蛋白质结构很重要。例如,涉及谷氨酰残基的离子对于稳定转录因子 GCN4 的亮氨酸拉链结构很重要。带电荷的残基,例如谷氨酸,经常出现在球状蛋白质的外表面。表面上极性残基的重要性,很容易通过血红蛋白 (HbS) β 链 6 位上的谷氨酸 → 缬氨酸突变的破坏性影响来证明,从而在具有这种突变的杂合子和镰状细胞中产生镰状细胞性状纯合子个体的疾病。
脱氧血红蛋白在 EF 连接处有一个疏水口袋(phe B85,leu B88)。表面上允许谷氨酸,因为它在能量上不利于它与疏水袋相互作用,因此脱氧 HbA 保持可溶性。然而,在 HbS 中取代它的缬氨酰残基从表面突出并很容易嵌入疏水袋中,导致 HbS 分子粘在一起,导致长而僵硬的纤维扭曲红细胞。
谷氨酸不仅在合成蛋白质时掺入蛋白质中,而且可以在合成后作为翻译后修饰以聚谷氨酰尾的形式添加。例如,微管蛋白的多谷氨酰化被认为会影响其与其他蛋白质的相互作用,例如微管相关蛋白 (MAP) 和分子马达。
在蛋白质中,谷氨酸与阳离子的结合相当弱,但它对钙的亲和力可以通过维生素 K 依赖性 (VKD) 羧化作用大大增加,这种羧化作用在翻译后将 γ-羧化谷氨酰残基 (gla) 引入蛋白质中。
所有 VKD 蛋白都含有一个同源氨基酸序列,该序列将蛋白靶向羧化酶。羧化发生在“gla 结构域”内的多个谷氨酸残基上。VKD 蛋白包括许多参与止血的蛋白:凝血酶原和因子 VII、IX 和 X。其他 VKD 蛋白参与骨形态发生(骨 gla 蛋白和基质 gla 蛋白)。
VKD 羧化酶功能的抑制对于基于香豆素的抗凝治疗至关重要,因为 4-OH 香豆素类似物会抑制维生素 K 环氧化物还原酶 (VKOR),该酶将维生素 K 环氧化物重新转化为还原的维生素 K.
这些研究清楚地说明了谷氨酸残基在蛋白质中所起的关键作用之一,包括它们的翻译后修饰。
另一方面,游离谷氨酸是吸收更快的修饰形式。谷氨酸敏感性在游离形式中更为常见。游离谷氨酸不与其他氨基酸结合,更快地被吸收到您的系统中。这种快速吸收率会导致血液中谷氨酸水平的峰值。
一些天然食物来源含有游离谷氨酸,但最成问题的来源之一是加工和包装食品。谷氨酸钠 (MSG) 形式的谷氨酸在这些产品中用作防腐剂和增味剂。这种形式存在于一些完整/未加工的食品中,但在许多超加工和包装食品中更为常见。
多年来,味精一直被用来给食物调味,尤其是汤、薯条和某些类型的亚洲食物。一些吃很多这些食物的人在进食后会出现症状。
谷氨酸被归类为非必需氨基酸,这意味着它可以在体内以足够的数量合成。事实上,它必须在体内合成。这是对各种动物肠道进行仔细平衡研究的结果,结果表明膳食谷氨酸几乎在肠道内定量代谢,主要是通过肠细胞。
这首先由 Windmueller 和 Spaeth 在1975 -1980年间使用灌注的大鼠肠道以及在大鼠体内进行了展示。随后,对仔猪、早产儿和成年人的研究表明,膳食谷氨酸被肠道广泛代谢。
1993年后,Matthews 和Battezzati 等在人群中做了临床实验,表明大部分的肠内谷氨酸可以通过代谢排出。事实上,膳食谷氨酸是一种重要的代谢燃料,其中大部分被完全氧化为 CO2。对仔猪的详细研究表明,只有小部分的肠内谷氨酸出现在门静脉血中。
在肠内喂养的早产人类婴儿中,大约 74% 的谷氨酸在第一次通过肠道时被去除。肠道谷氨酸代谢的后果之一是血浆谷氨酸水平不受膳食谷氨酸的特别影响。事实上,健康人循环中的谷氨酸盐严格维持在相当低的浓度。
谷氨酸的肠道代谢有一个非常重要的后果:身体的大部分谷氨酸需要内源性合成。谷氨酸可以以两种不同的方式合成。
天然富含谷氨酸的食物通常(但不总是)富含蛋白质,包括:
肉、家禽、奶酪、蛋、蘑菇、酱油、番茄、葡萄、鱼露、西兰花、豌豆、核桃、骨汤…
谷氨酸和谷氨酰胺的区别
谷氨酸很容易与谷氨酰胺混淆,谷氨酰胺是体内富含的另一种重要氨基酸。
两者的化学结构略有不同;谷氨酰胺具有氨 (-NH3) 基团,而不是羟基 (-OH) 基团。
谷氨酰胺
是一种非必需氨基酸(蛋白质的组成部分)。它存在于植物和动物蛋白中。一般在肌肉中大量制造,它是体内最丰富的氨基酸。谷氨酰胺有助于肠道功能、大脑功能、免疫系统、氨基酸产生和压力。
压力和某些药物会消耗它,肌肉萎缩是常见的结果。在身体需要氮的地方(例如,在伤口修复中),其中三分之一来自谷氨酰胺。
谷氨酰胺有助于“治愈”肠道。它可以修复肠壁中受损的细胞,也是肠道内免疫球蛋白产生和免疫系统的重要氨基酸来源。
谷氨酸
谷氨酸也是一种非必需氨基酸。它可以通过多种方式进入人体,例如,以蛋白质或味精、谷氨酸钠的形式。它可以完整或以结合形式提供。
但在体内,它也可以作为多种化合物的分解产物——比如来自谷氨酰胺,也来自叶酸和葡萄糖。谷氨酸广泛存在于肌肉中所有的蛋白质储存中。
谷氨酸对大脑和神经功能也是必不可少的。它是神经中的主要传递器。具有更多谷氨酸受体的人往往具有更高的智商。然而,大脑通过血脑屏障摄取的谷氨酸非常低。绝大多数谷氨酸是谷氨酰胺转化的结果,因为神经元不能从大脑内的葡萄糖中产生谷氨酸。
谷氨酰胺是谷氨酸的来源,它是由谷氨酰胺酶产生的。
谷氨酰胺-谷氨酸循环
星形胶质细胞摄取的谷氨酸可通过三羧酸循环代谢,用于蛋白质合成或转化为谷氨酰胺。谷氨酸向谷氨酰胺的转化由谷氨酰胺合成酶(GLUL) 以 ATP 依赖性方式催化。但是由于谷氨酰胺转运蛋白迄今尚未在脑组织的末端中得到阳性鉴定。因此谷氨酰胺-谷氨酸循环已经研究和争论了很多年,至今没有明确答案。
1) 支持大脑功能
谷氨酸是脑功能正常的重要神经递质
大脑和脊髓(中枢神经系统)中几乎所有的兴奋性神经元都是谷氨酸能神经元。作为主要的兴奋性神经递质,它向大脑和全身发送信号。它有助于认知功能、记忆、学习和其他大脑功能 。
人脑的质子-MRS 研究显示谷氨酸浓度非常高(10-12 mM),但这平均了不同亚细胞区室中非常不同的谷氨酸浓度,从脑脊液中的约 1 μM 到分泌颗粒中 100 mM。
谷氨酸通过两种主要类型的受体在中枢神经系统中发挥作用:
每种受体有许多亚型。对大脑中谷氨酸信号传导的详细说明不在这详细展开,只要了解其在突触可塑性中的作用,这是其在学习和记忆等认知功能中的作用的基础。
有限的研究将大脑谷氨酸水平低与神经和精神疾病联系起来。例如,在一项研究中,精神分裂症成人的谷氨酸水平低于健康成人。
代谢型谷氨酸受体5型(mGluR5)含量低表明癫痫患者大脑发育不良。
在小鼠中,低谷氨酸释放已被用于模拟自闭症谱系障碍。
在大鼠中,亮氨酸会增加谷氨酸进入大脑,这有助于在脑损伤后恢复大脑功能 。
2) 血脑屏障和谷氨酸
血脑屏障位于血液和大脑间质液之间。它是在哺乳动物中受脑细胞影响后由内皮细胞形成的。另一个屏障位于分泌脑脊液 (CSF) 的脉络丛上皮中。
这些屏障很重要,从生理学的角度来看,维持大脑稳态,从药理学的角度来看,可以防止药物进入脑组织。
神经系统通过屏障将自身与血液隔离。谷氨酸是一种非必需氨基酸,不能穿过血脑屏障,必须在脑细胞内局部由谷氨酰胺和其他前体产生 。
然而,如果血脑屏障“渗漏”(由于血脑屏障损伤或功能障碍导致通透性增加),血液中的谷氨酸可能会进入大脑,这会使身体增加炎症。
更高水平的炎症也会导致血脑屏障发生渗漏。这放松了对进入大脑的内容的控制。在这种情况下,反应性代谢物可以进入大脑。
如果你已经对谷氨酸敏感,并且还在吃富含游离谷氨酸的食物,这些情况可能会使症状加重。
3) GABA 的前体(与GABA保持平衡)
身体使用谷氨酸来产生神经递质 GABA(γ-氨基丁酸),这是一种在学习和肌肉收缩中起重要作用的抑制性神经递质。
在大脑中,GABA 作用于下丘脑,帮助调节睡眠、温度、HPA 轴和自主神经系统。下丘脑的主要作用是使身体保持体内平衡,而没有 GABA 则无法做到这一点。
GABA—谷氨酸:
“相互作用,相辅相成,适量才和谐”
正如谷氨酸是一种兴奋性神经递质一样,GABA(γ-氨基丁酸)是一种抑制性神经递质。它的目的是让大脑和神经系统慢下来。这两种神经递质在大脑中平衡工作。
GABA 和谷氨酸之间复杂而相互关联,这有助于保持身体平衡,任何一种过量都会导致严重的疾病状况。GABA 和谷氨酸有助于保持交感神经和副交感神经系统之间的平衡。如果没有这两种神经递质,我们会不断地发现自己受到这些系统中的一个或另一个的刺激。我们要么对外部刺激反应过度,要么反应不足。
“一个太少,另一个就会负重前行”
如果 GABA太少,就会过分强调谷氨酸的作用,从而在肾上腺疲劳、慢性疲劳、惊恐发作和化学敏感性的发展中发挥重要作用。体内的 GABA 过少可能会导致所谓的“超负荷现象”,即由于谷氨酸含量高而对神经元产生过多的刺激。由于过多的刺激,这最终导致神经元死亡。
据报道,代谢型 Glu 和 GABA B受体,以及细菌周质氨基酸结合蛋白,可能是从一个共同祖先进化而来的 。
Mazzoli R and Pessione E. Front Microbiol. 2016
谷氨酸能/GABA能神经网络的表示,包括兴奋性(谷氨酸能)锥体神经元(红色)、抑制性(GABA能)神经元(蓝色)和相关连接。左侧的抑制神经元集成到反馈 (FB) 电路中,而右侧的抑制神经元集成到前馈 (FF) 环路中。针对锥体细胞体细胞或树突的抑制性突触被浅蓝色染色包围,这表明背景 GABA 浓度有助于整体抑制。
4) 在免疫中发挥作用
谷氨酸受体存在于免疫细胞(T 细胞、B 细胞、巨噬细胞和树突状细胞)上,这表明谷氨酸在先天免疫系统和适应性免疫系统中均发挥作用。
谷氨酸还参与肺、肾、肝、心脏、胃、骨骼和免疫系统组织的功能。
科学家们正在研究谷氨酸对调节性 T 细胞(Treg)、B 细胞和炎症性神经退行性疾病的影响。
一项研究得出结论,谷氨酸对正常以及癌症和自身免疫病理性 T 细胞具有有效作用。这意味着它可能能够增强对抗癌症和感染的有益 T 细胞功能 。
根据至少一项针对多发性硬化症小鼠模型的研究,这些受体还具有抑制自身免疫发展和保护中枢神经系统免受炎症影响的潜力。
不过,大多数情况下,科学家发现谷氨酸对免疫系统有益还是有害,都取决于体内的浓度。
谷氨酸诱导的神经元细胞损伤的关键机制之一是小胶质细胞释放谷氨酸。小胶质细胞本质上是大脑和神经系统的常驻免疫细胞。了解神经系统和免疫系统之间的联系至关重要。小胶质细胞释放谷氨酸是一个关键环节。
一旦谷氨酸的游离池增加,谷氨酸受体,如 NMDA 就会被过度刺激。然后,这会导致大量钙离子流入细胞,导致神经元细胞损伤和细胞死亡。
许多因素可以作为小胶质细胞激活的诱导剂。汞毒性已显示可迅速诱导小胶质细胞活化,并且汞毒性已显示可改变小鼠大脑中谷氨酸的转运和摄取。有毒金属镉也显示出强大的诱导小胶质细胞活化的能力。
基本上任何类型的“非自身”分子都能够引发大脑和神经元组织中的小胶质细胞活化。这包括各种病原体和抗原、病毒、疫苗、佐剂以及任何穿过血脑屏障的外源物质。
5)支持肠道
我们从食物中获得的谷氨酸为肠道细胞提供能量,并有助于激活消化系统。
在胃肠道上皮细胞的顶膜中发现了多种介导谷氨酸吸收的转运蛋白,主要存在于小肠中,但也存在于胃中,而氨基酸从管腔到门户的转运很少或没有血液出现在结肠中。它是营养物质吸收和代谢的主要能量来源。
谷氨酸是肠细胞的主要营养素之一。对不同动物模型(包括早产儿和成人)的几项研究一致认为,存在于 GI 腔中的大多数谷氨酸被氧化为 CO2,或者其次被肠粘膜转化为其他氨基酸。
只有一小部分(5% 到 17%,取决于研究)摄入的 谷氨酸被转运到门静脉循环,但这通常不会在很大程度上影响血浆中的谷氨酸浓度。此外,血浆谷氨酸浓度增加(摄入谷氨酸后)并不一定会影响脑组织中的谷氨酸浓度,因为人们普遍认为谷氨酸不能通过血脑屏障。
发现啮齿动物的脑组织需要血浆谷氨酸浓度增加 20 倍(或更多)。膳食摄入(或肠道微生物群的谷氨酸生物合成)后血浆中达到如此高的谷氨酸浓度似乎不太可能。
谷氨酸还可以通过帮助产生抗氧化剂谷胱甘肽来保护肠壁。
一项动物研究发现,补充 L-谷氨酸有助于改善仔猪的肠道完整性,这有利于营养物质的消化和吸收。
谷氨酸还可以预防由于幽门螺杆菌 和长期使用阿司匹林等非甾体抗炎药(非甾体抗炎药)引起的胃肠道损伤。
α-gustducin,一种味觉特异性 G 蛋白,在胃和肠中的作用导致人们认识到味觉细胞存在于肠道中。现在很清楚,胃和小肠中都存在类似味觉的谷氨酸受体和细胞。在胃中发现了离子型和代谢型谷氨酸受体很明显,谷氨酸是唯一能刺激传入胃迷走神经的氨基酸。
谷氨酸的胃内输注刺激特定的前脑区域,包括边缘系统和下丘脑。它还刺激胃收缩活动。谷氨酸与 IMP 一起刺激大鼠十二指肠中的碳酸氢盐分泌,这可能是中和胃蛋白消化过程中产生的胃酸的保护作用。
Cryan, Dinan,2012
肠道中 Luminal Glu/GABA(饮食或肠道微生物群来源)影响神经系统的潜在途径。5-羟色胺,血清素;EC肠嗜铬细胞;EEC,肠内分泌细胞;GI,胃肠道;网;内在初级传入神经元
此外,包括普通拟杆菌和空肠弯曲杆菌在内的肠道微生物群会影响谷氨酸代谢,并减少谷氨酸代谢物 2-酮基谷氨酸。同时,具有谷氨酸消旋酶的肠道细菌,包括谷氨酸棒杆菌Corynebacterium glutamicum、乳发酵短杆菌 Brevibacterium lactofermentum和Brevibacterium avium,可以将 L-谷氨酸转化为 D-谷氨酸。由肠道细菌代谢的 D-谷氨酸可能会影响痴呆患者的谷氨酸 NMDAR 和认知功能。
6) 支持肌肉功能
谷氨酸可能在肌肉功能中发挥重要作用。
在运动过程中,谷氨酸在提供能量和支持谷胱甘肽生产方面起着核心作用。
然而,在动物模型中,谷氨酸可能会延缓缺乏维生素 D 的动物的肌肉萎缩症。进一步的研究应该探索谷氨酸、肌肉功能和肌肉萎缩疾病之间的联系。
7)对骨骼很重要
谷氨酸也适用于骨骼和肌肉,用于神经和非神经信号。神经递质对骨骼的健康很重要,并且可能在多种骨骼疾病的潜在治疗中发挥作用。
8)谷氨酸与味觉
鲜味,特别是谷氨酸,被认为可以调节对富含蛋白质的食物的食欲反应。因此,它们在评估食物的营养价值方面发挥着重要作用。
谷氨酸通过激活鲜味受体发挥关键的信号传导作用。这些味觉受体的激活还需要作为共配体的 5′-核糖核苷酸,例如单磷酸肌苷 (IMP) 或单磷酸鸟苷。
对于完全表达鲜味所需的受体多样性仍然存在一些不确定性。当然,涉及 G 蛋白偶联受体 T1R1 和 T1R3 的异二聚体。此外,最近利用 T1R3 敲除小鼠的研究表明,这些动物继续区分鲜味和其他促味剂,这表明其他受体的作用。特别是,两种代谢型谷氨酸受体 mGluR1 和 mGluR4 可能很重要。
一个促成因素是食用加工食品,由改良的游离形式谷氨酸制成的。例如,谷氨酸用于制造味精(或谷氨酸钠),这是一种合成化学物质,会添加到许多食品中,增加咸味和吸引力。

但要注意的是,有些时候这些高水平可能不是由于饮食中的谷氨酸,而是身体的其他缺陷或功能障碍。
过量水平可能是由压力或对谷氨酸脱羧酶 (GAD) 的自身免疫反应引起的,谷氨酸脱羧酶 (GAD) 旨在将谷氨酸转化为其镇静伴侣 GABA。
谷氨酸是大脑中必不可少的(也是主要的兴奋性)神经递质。然而,谷氨酸在某些情况下会变得有毒——这一过程称为谷氨酸兴奋性毒性 (GE):如果大脑中有过量的谷氨酸或谷氨酸受体被过度刺激。GE在神经退行性变中起关键作用。
兴奋性氨基酸过度激活谷氨酸受体会导致许多负面影响,即细胞钙稳态受损、自由基的产生、线粒体通透性转变的激活和继发性 GE。
GE 还与抑郁症、焦虑症、自闭症、多动症、慢性疼痛、中风和脑肿瘤以及许多其他疾病有关。
过多的谷氨酸可能在多发性硬化症 (MS)、阿尔茨海默病、亨廷顿病、癫痫和 ALS(肌萎缩性侧索硬化症或 Lou Gehrig 病)中起作用。
在亨廷顿舞蹈病中,谷氨酸受体的敏感性是主要特征。已经发现,降低谷氨酸的活性可以产生治疗作用。
ALS 被认为是由谷氨酸诱导的兴奋性毒性引起的,利鲁唑等药物试图控制谷氨酸水平。
涉及谷氨酸的通路功能障碍也可能导致多发性硬化症和阿尔茨海默病的发展。
研究人员正在研究专注于改善谷氨酸途径以治疗退行性脑病的药物和疗法。
谷氨酸过多(或过少)也与抑郁症和精神分裂症等心理健康障碍有关。
大量研究发现,在患有重度抑郁症的人中经常发现高水平的谷氨酸或过度活跃的谷氨酸受体。
还有一个普遍的假设是,过量(或不足)的谷氨酸活性可能导致精神分裂症症状。当然也可能没有那么简单,该领域的相互矛盾的研究表明,症状可能是由神经递质异常(包括谷氨酸)以及可能的基因突变和其他发育问题共同引起的。
谷氨酸在痛觉和传递中也起着举足轻重的作用。
这意味着,可以通过靶向谷氨酸受体和降低谷氨酸的影响来缓解慢性疼痛。
高浓度的谷氨酸盐和偏头痛之间也有密切的联系。一项研究发现,偏头痛患者的血浆谷氨酸水平显着升高。另一项研究得出结论,GABA 能药物(那些改变 GABA 作用的药物)可能有助于治疗偏头痛。
同时,阻断谷氨酸受体的药物也可能有效治疗偏头痛。
有一些证据表明,随着时间的推移,高水平的谷氨酸会导致 1 型和2 型糖尿病的发生。一项研究发现,谷氨酸水平对两种类型的糖尿病中 β 细胞的损失都有直接和间接的影响。
如果对谷氨酸敏感并怀疑自己的谷氨酸含量很高,最实际的方法是消除添加的游离谷氨酸的来源。尤其经过改良以改善口味的加工食品和包装食品,限制味精,酱油等摄入量。选择完整的、未经加工的食物,这是让你的水平恢复到正常、健康范围内的最佳方法。
总体而言,最好限制或避免使用富含谷氨酸的食物包括:酱油、硬奶酪、腌肉、谷物(尤其是含有麸质的)、骨汤,土豆片、快餐、方便面、沙拉酱等
除了监测提供这种氨基酸的食物的摄入量外,增加抗炎食物的摄入量也是有益的,因为这些食物可能在一定程度上有助于抵消过量谷氨酸的影响。
一些抗炎食物有:
关于抗炎饮食可详见之前的这篇文章:
深度解析 | 炎症,肠道菌群以及抗炎饮食
PPAR -γ激活剂可能是对抗 GE(谷氨酸兴奋性毒性)的最佳方法之一。
PPAR(过氧化物酶体增殖物激活受体)是对身体具有深远影响的特定蛋白质。它们属于所谓的核受体超家族(该类的其他成员包括维生素 A 和 D、雌激素甲状腺和糖皮质激素受体)。
许多食物和草药具有降低谷氨酸兴奋性毒性的能力。它们有多种作用机制,起作用的一个关键原因是 PPAR- γ激活剂。对文献的回顾发现,以下许多天然草药具有激活 PPAR 的潜力(括号中的是 PPAR -γ – 活化成分):
注意在多发性硬化或其他自身免疫性疾病的情况下,应谨慎使用或干脆避免使用过度刺激免疫系统的补充剂,如紫锥花、黄芪、人参甚至绿茶。
维生素 B6 有助于减少谷氨酸过量,因为参与将谷氨酸转化为 GABA。维生素 B6 缺乏可能是谷氨酸过量积累并且不能正确转化为 GABA 的一个原因。B6 缺乏症不会单独发生,通常与 B12 和叶酸一起发生。
维生素 B2(核黄素)本身具有神经保护作用,可以通过几种不同的方式抵消谷氨酸过量:
核黄素依赖性酶在吡哆醇活化、色氨酸-犬尿氨酸途径和同型半胱氨酸代谢中具有重要作用。
还发现维生素 B12(甲基钴胺素)对 GE 具有保护作用(可能通过 SAM 介导的甲基化改变膜特性起作用)。
维生素 B9(叶酸)补充剂:仅限低剂量。谷氨酸在结构上与叶酸相似,它可能会竞争神经元上的结合位点并可能导致问题。
维生素 D – 单独使用或与处方药联合使用
辅酶Q10 – 改善谷氨酸兴奋性毒性、线粒体功能和氧化应激
镁是健康神经信号传输所必需的矿物质。分子和动物研究表明,健康的镁水平可以防止神经元过度兴奋引起的细胞死亡。
从理论上讲,意味着增加镁含量可能有助于预防与细胞死亡有关的疾病,包括:
一项针对 60 名患有纤维肌痛的女性的小型研究发现,每天服用 300 毫克柠檬酸镁超过 8 周,可以降低压痛点的数量和报告的疼痛强度水平。然而,还需要进行更大规模的研究。
除了服用镁补充剂外,还可以尝试食用更多富含镁的食物,包括:
谷氨酸是大脑里需求量比较大的一种酸性氨基酸,主要是参与脑内蛋白质或者是脂肪酸等的合成和代谢,过低可能影响人的精神状态,也可能诱发神经衰弱。
谷氨酸在情绪障碍中的作用:
正在研究的一种此类情绪障碍是重度抑郁症(MDD),其症状包括空间记忆受损和快感缺失(无法感受到快乐)。研究人员发现,阻止大鼠吸收谷氨酸会导致类似抑郁的效果,这可能反映了快感缺失。
谷氨酸在慢性疲劳综合征中的作用:
关于谷氨酸失调是否在慢性疲劳综合征中起作用的研究存在分歧,这种情况还涉及感觉超负荷、焦虑和运动/平衡问题。
也有一些证据表明慢性疲劳综合征可能涉及与谷氨酸失调相关的基因。
有谷氨酸补充剂或增加谷氨酸的处方。如果想尝试提高谷氨酸水平,可能需要考虑在饮食或生活方式中加入其前体,前体是身体制造其他物质所需的物质。
提高谷氨酸水平/途径可能是一项非常复杂的任务。促进线粒体健康、减少氧化应激和炎症、平衡谷氨酸与大脑中其他神经递质以及改善糖和脂肪代谢的补充剂、疗法和生活方式的改变都是有益的。
运动
运动实际上可以帮助你的身体产生更多的谷氨酸。研究人员研究了近 40 名健康人类志愿者的谷氨酸和 GABA 水平。他们在三个持续 8 到 20 分钟的剧烈运动之前和之后立即测量了两个不同大脑区域的这些神经递质水平。
锻炼的参与者的谷氨酸或 GABA 水平增加。即使在停止运动后效果仍然存在,这表明谷氨酸水平会随着运动而发生更持久的变化。
在服用任何膳食补充剂之前,请先咨询医生。如果患有其他疾病,包括慢性病或怀孕,这一点尤其重要。
有助于提高谷氨酸水平的补充剂包括:
5-HTP:身体将 5-HTP 转化为血清素,血清素可以增强 GABA 活性,这可能会影响谷氨酸的活性。谷氨酸是 GABA 的前体。
一些前体包括:
GABA:理论上,由于 GABA 镇静和谷氨酸刺激,两者是对应的,一种不平衡会影响另一种。然而,研究尚未证实 GABA 是否可以纠正谷氨酸的失衡。
谷氨酰胺:身体将谷氨酰胺转化为谷氨酸。谷氨酰胺可以作为补充剂使用,也可以在肉类、鱼类、鸡蛋、奶制品、小麦和一些蔬菜中找到。
牛磺酸:对啮齿动物的研究表明,这种氨基酸可以改变谷氨酸的水平。牛磺酸的天然来源是肉类和海鲜。它也可作为补充剂使用,并存在于一些能量饮料中。
茶氨酸:这种谷氨酸前体可以通过阻断受体降低大脑中的谷氨酸活性,同时提高 GABA 水平。天然存在于茶中,也可作为补充剂使用。
不建议大多数人使用谷氨酸补充剂,一般人都可以从饮食中能获得足够的谷氨酸,而且人体会自己制造一些。
如上所述,经过改良以改善口味的加工食品是游离谷氨酸的最大来源。
天然高谷氨酸食物包括:
发酵、陈化、腌制、压力烹制的食品。其中包括:
陈年奶酪、慢煮肉类和家禽、蛋、酱油、大豆蛋白、鱼露,某些蔬菜,如蘑菇、成熟的西红柿、西兰花和豌豆、核桃、大麦麦芽。
多运动,保持足够睡眠。
本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Albarracin SL, Baldeon ME, Sangronis E, Petruschina AC, Reyes FGR. L-glutamate: a key amino acid for senory and metabolic functions. Arch Latinoam Nutr. 2016 Jun;66(2):101-112. PMID: 29737666.
Purves D, Augustine GJ, Fitzpatrick D. Glutamate. Neuroscience 2nd edition.
Huntington’s Outreach Project for Education, Stanford. About glutamate toxicity.
Dana Foundation. Protecting the brain from the glutamate storm.
Sheng P, Zhang Y, Zhang J, Wang H, Ren B. Glutamate receptors and signal transduction in learning and memory. Mol Biol Rep. 2011 Jan;38(1):453-60. doi: 10.1007/s11033-010-0128-9
Watson CJ, Lydic R, Baghdoyan HA. Sleep duration varies as a function of glutamate and GABA in rat pontine reticular formation. J Neurochem. 2011 Aug;118(4):571-580. doi:10.1111/j.1471-4159.2011.07350.x
Bechtholt-Gompf AJ, Walther HV, Adams MA, Carlezon WA Jr, Ongür D, Cohen BM. Blockade of astrocytic glutamate uptake in rats induces signs of anhedonia and impaired spatial memory. Neuropsychopharmacology. 2010;35(10):2049-2059.
Maddock RJ, Casazza GA, Fernandez DH, Maddock MI. Acute Modulation of Cortical Glutamate and GABA Content by Physical Activity. J Neurosci. 2016 Feb 24;36(8):2449-57. doi:10.1523/JNEUROSCI.3455-15.2016
Byun J, Shin YY, Chung S, Shin WC. Safety and efficacy of gamma-aminobutyric acid from fermented rice germ in patients with insomnia symptoms: a randomized, double-blind trial. J Clin Neurol. 2018;14(3):291-. doi:10.3988/jcn.2018.14.3.291
Cruzat V, Macedo Rogero M, Noel Keane K, Curi R, Newsholme P. Glutamine: metabolism and immune function, supplementation and clinical translation. Nutrients. 2018;10(11):1564-. doi:10.3390/nu10111564
Bulley S, Shen W. Reciprocal regulation between taurine and glutamate response via Ca2+- dependent pathways in retinal third-order neurons. J Biomed Sci. 2010;17(Suppl 1):S5-. doi:10.1186/1423-0127-17-S1-S5
White D, de Klerk S, Woods W, Gondalia S, Noonan C, Scholey A. Anti-stress, behavioural and magnetoencephalography effects of an l-theanine-based nutrient drink: a randomised, double-blind, placebo-controlled, crossover. Trial Nutrients. 2016;8(1):53-. doi:10.3390/nu8010053
Holton KF, Taren DL, Thomson CA, Bennett RM, Jones KD. The effect of dietary glutamate on fibromyalgia and irritable bowel symptoms. Clin Exp Rheumatol. 2012 Dec 14;30(6 Suppl 74):10-17. PMID:22766026
Bagis S, Karabiber M, As I, Tamer L, Erdogan C, Atalay A. Is magnesium citrate treatment effective on pain, clinical parameters and functional status in patients with fibromyalgia?. Rheumatol Int. 2013 Jan 22; 33(1):167-72. doi:10.1007/s00296-011-2334-8

谷禾健康

现代化疗,放射疗法在摧毁癌细胞的同时,对健康细胞也造成了伤害,引发相关毒性,反应例如便秘,腹泻,疲劳,恶心,呕吐等。
癌症患者的营养状况可能是癌症治疗相关毒性的核心决定因素,也是癌症症状的指标。
一些临床前研究和初步临床试验表明,饮食干预可能会减轻某些癌症治疗相关的症状和毒性。可能机制包括影响炎症、氧化应激、肌肉质量、心脏健康和调节肠道菌群。
本篇涵盖了三大块内容,包括:
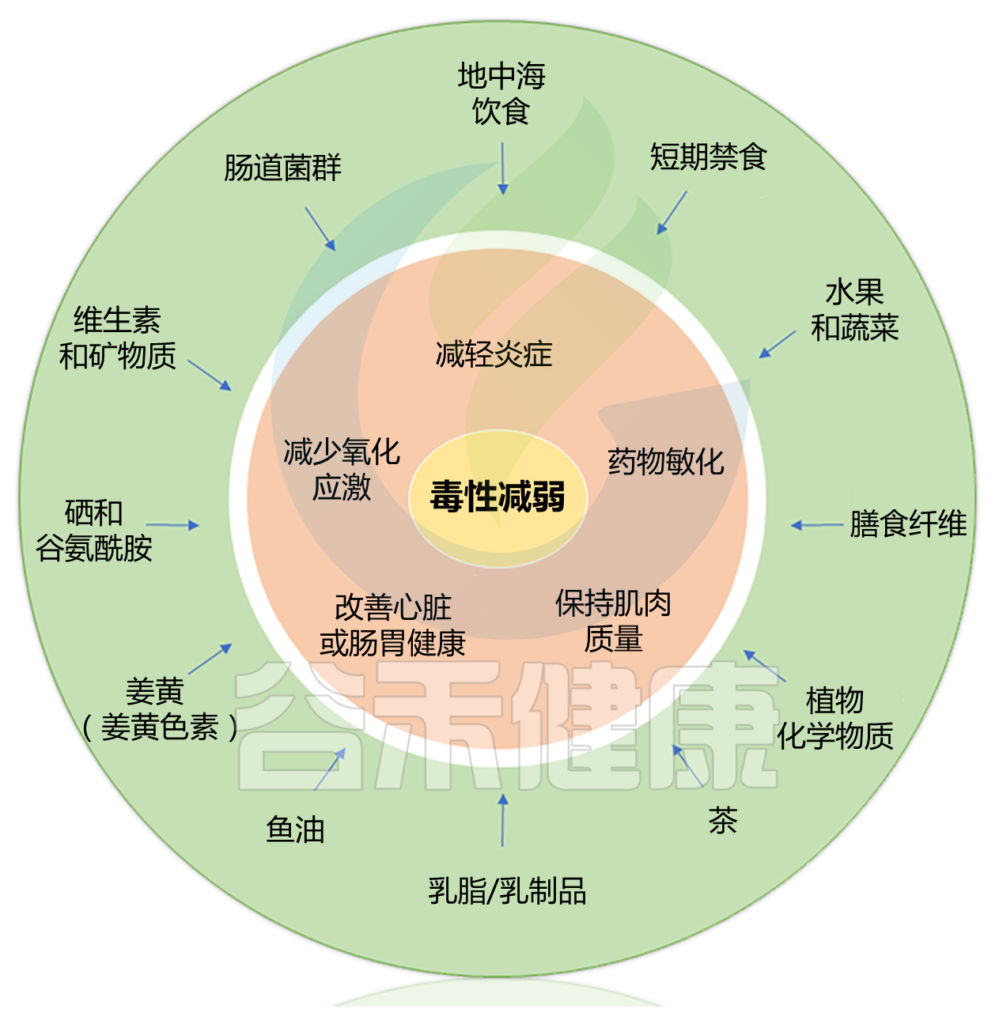
Alan J. Kim et al.,Cancer Treatment Reviews, 2022
地中海饮食模式,其特点是大量摄入水果、蔬菜、豆类、橄榄、全谷物、不饱和脂肪、坚果和鱼类;适度饮酒;减少红肉和加工肉类以及高脂肪乳制品的摄入,对减少炎症,改善心血管健康,抗肥胖,改善血脂以及对肠道菌群和免疫调节有积极作用。
↓↓ 降低心源性猝死
在一项大型前瞻性研究中,调查了激素替代疗法、钙和维生素D或饮食调整对健康绝经后妇女的影响,发现地中海饮食模式与降低心源性猝死的风险有关。
↓↓ 缓解癌症相关的疲劳
一项随机对照试验中,23名前列腺癌男性患者接受了至少3个月的雄激素剥夺治疗,被随机分成两组,一组接受12周常规治疗,另一组接受地中海饮食并同时接受六次个性化营养咨询,与常规治疗相比,坚持地中海饮食与缓解癌症相关的疲劳以及提高总体生活质量有关。
↓↓ 减轻妇科肿瘤患者症状
一项对22名接受铂类化疗的妇科肿瘤患者的观察研究表明,坚持地中海饮食的患者胃肠道毒性较小,恶心、胃痛、腹胀和干扰日常活动的频率和严重程度差异有统计学意义。
周期性禁食即在给定的时间内部分或完全不吃除水以外的食物和饮料。在动物模型和人类患者中,周期性禁食与降低癌症治疗中的毒性密切相关。
↓↓ 延缓肿瘤进展
例如,在一项临床前研究中证明,禁食条件增加了对化疗药物的敏感性,并延缓了肿瘤的进展。还有人发现,在荷尔蒙受体阳性乳腺癌的小鼠模型中,周期性禁食或类似禁食的饮食(FMD)可增强激素治疗的活性(如他莫昔芬和氟维司群),并通过降低循环中胰岛素、瘦素和IGF1的水平以及抑制AKT-mTOR信号传导来促进长期的肿瘤消退。
↓↓ 提升生活质量
在一项针对131名HER2阴性的II/III期乳腺癌患者的II期临床研究证实了4天FMD的潜在益处。在新辅助化疗前3天和新辅助化疗当天,接受了植物性、低氨基酸替代饮食(包括肉汤、汤、液体、维生素片和茶)的患者报告称,与对照组(常规饮食)相比,总体幸福感有所提高,情绪、身体、认知和社会功能都有所改善。
↓↓ 减少化疗相关毒性
在一项对照交叉初步研究中,调查了30名接受化疗的妇科癌症患者,结果表明,短期禁食的改良形式减少了化疗相关的毒性,包括口腔炎、头痛、虚弱和总体毒性。
据报道,FMD是安全可行的,可以减少脂肪量,降低循环中胰岛素生长因子1、胰岛素和瘦素的水平。禁食强烈影响新陈代谢和细胞途径,导致循环中类胰岛素一号生长因子(IGF-1)和葡萄糖水平下降。这些变化反过来影响几个癌基因,包括RAS和AKT信号通路,导致细胞生长和增殖的下调。
禁食和FMD(低卡路里、低蛋白质和低糖的饮食)可能与减少化疗副作用有关,即当营养素缺乏时,正常细胞,而不是肿瘤细胞,可以切换到抑制生长和增殖途径的保护模式,这一过程被称为差异应激抵抗。
↓↓ 增强免疫
此外,禁食和/或FMD已被证明可以增强免疫系统,减少炎症,减缓小鼠的骨密度损失,并减少HER2阴性的II期乳腺癌患者化疗引起的淋巴细胞DNA损伤。
生酮饮食的特点通常是碳水化合物消耗量低,占每日总热量摄入量的5%-10%,但其他产生能量的大量营养素,即脂肪和蛋白质的含量却不同。生酮比用来定义饮食的生酮能力,定义为脂肪克数与碳水化合物和蛋白质克数之和的比值。
在癌症中研究最多的生酮饮食包括经典生酮饮食(CKD),其特征是生酮比为4:1或3:1,每日87%-90%的热量来自脂肪)和中链甘油三酯生酮饮食[MCTKD,其中30%-60%的总热量来自中链脂肪酸,如己酸(C6)、辛酸(C8)、葵酸(C10)和月桂酸(C12)]。
↓↓ 血糖,体重更可控,生活质量高
在接受放化疗和辅助化疗的胶质母细胞瘤患者中,那些生酮饮食患者的血糖水平低于那些标准饮食的患者。有人研究发现,在接受放疗的非转移性乳腺癌患者中,以天然食物为基础的生酮饮食与未指定标准饮食相比,体重和脂肪减少得更多,生活质量水平更高。
↓↓ 降低癌症治疗相关毒性
生酮饮食降低癌症治疗相关毒性的机制可以用瓦氏效应(Warburg effect)来解释,在瓦氏效应中,癌细胞利用糖酵解而不是氧化磷酸化,能预防由活性氧引起的氧化损伤。
生酮饮食(通常是高脂肪低葡萄糖),可以利用这种代谢差异,要么让癌细胞挨饿,要么迫使它们转而利用氧化磷酸化。与正常细胞相比,癌细胞中氧化应激的增加可以使它们对化疗和放射更加敏感,从而减少治疗所需的剂量,降低与治疗相关的毒性。
↓↓ 注意高脂肪生酮饮食的副作用
有限的依据支持在临床实践中使用生酮饮食,而且,根据总含量和相对常量营养素组成,不同类型的生酮饮食可能对治疗相关的毒副作用产生不同的影响。例如,长期食用高脂肪生酮饮食可能会增加心血管或脑血管疾病的风险,特别是与特定的抗癌药物联合使用时。高脂生酮饮食还可能增加严重脂肪性肝炎的风险,促进肝纤维化的进展。此外,研究表明,高脂肪生酮饮食增加了酮体乙酰乙酯的循环水平,并促进了异种移植小鼠中表达BRAF-V600E致癌基因的人类黑色素瘤细胞的肿瘤生长潜力。
因此,根据目前对营养的理解,接受癌症治疗的患者的饮食应该包括所有的常量营养素,以降低营养不良的风险。
膳食纤维与多种肿瘤类型的胃肠道毒性和症状的预防有关。在一项随机对照试验中,在放疗期间服用高剂量膳食纤维(18克/天)的盆腔癌患者报告称辐射引起的胃肠道毒性发生率较低,证明了膳食纤维在预防放射治疗相关毒性方面存在潜在影响。
膳食纤维还可以促进健康的肠道菌群,从而降低毒性并增强治疗效果,例如纤维与促进免疫的普拉梭菌和短链脂肪酸丁酸盐的有关。有人发现在黑色素瘤患者中,膳食纤维会影响肠道菌群,并与免疫检查点阻断反应的增强有关。

Spencer CN, et al.,Science. 2021
tips
对于腹膜癌、肠癌进展或原发性胃肠癌的患者来说,可能需要低膳食纤维饮食,以降低肠梗阻的风险。
增加水果和蔬菜的摄入量与改善胃癌幸存者的身体和认知功能、减少疲劳和食欲不振有关。
水果和蔬菜含有过多的植物化学物质,并且已经检查了几种植物化学物质的影响,并在下表中进行了总结。

Alan J. Kim et al.,Cancer Treatment Reviews, 2022
例如,葡萄产品的抗氧化和抗炎作用归因于它们的植物化学物质,即芪类、花青素和原花青素,包括白藜芦醇。
其他几种水果,包括黑醋栗、李子、石榴和苹果,已经被证明具有抗癌和细胞毒性作用,这归因于植物化学物质,特别是多酚和黄酮类物质的抗氧化和抗炎作用。
tips
对于肠梗阻风险较高的患者,应避免过量摄入水果和蔬菜相关的膳食纤维。
据报道,在70多种植物中发现的一种植物化学物质白藜芦醇可以增加结直肠癌细胞系对化疗药物的敏感性,包括阿霉素、索拉非尼、5-氟尿嘧啶、依托泊苷、丝裂霉素、奥沙利铂和姜黄素。
关于白藜芦醇在该文有详细介绍:
注意:高剂量(每天>2.5克)会引起轻微的毒性(包括腹泻、胃肠道症状和前额头痛),即使在健康的人身上也是如此。
其他多酚也可能具有抗炎和抗氧化作用。
▸槲皮素是浆果中一种常见黄酮醇,它通过作用于炎症介质,包括白细胞介素6、白细胞介素8、干扰素γ、诱导型一氧化氮合酶、环氧合酶2和肿瘤坏死因子α来诱导抗炎作用,并在对促凋亡刺激敏感的癌细胞系中提供促凋亡作用。
▸非瑟素是一种存在于草莓、苹果和柿子中的类黄酮类化合物,在结构上与槲皮素相似,具有类似的抗炎和抗癌活性。
▸番茄红素是番茄和红色水果(包括木瓜和西瓜)中的一种植物化学物质,具有高抗氧化活性,并通过减少氧化应激以及染色体和膜的异常来减轻致癌损害。此外,番茄红素具有神经保护作用,并被认为可以通过减少氧化应激和神经炎症来预防神经毒性。
喝茶,尤其是绿茶,与抗癌作用、减轻药物引起的毒性以及对化疗药物的敏感性有关。
↓↓ 抑制继发性肿瘤
茶中存在的儿茶素在促进健康的作用中起着重要作用。表没食子儿茶素没食子酸酯在体外和体内乳腺癌模型中显示了抗氧化和抗炎活性(尤其是在他莫昔芬诱导的氧化应激情况下),能够抑制头颈部或盆腔癌症患者的放射性皮炎,并抑制继发性肿瘤的继发发展。
↓↓ 防止辐射带来的不良反应
据报道,表没食子儿茶素没食子酸酯还可用于预防暴露于γ辐射或以顺铂为基础的治疗后的唾液腺细胞功能障碍,防止辐射引起的不良血液学变化(如贫血、血小板减少),以及预防博莱霉素引起的肺纤维化。
↓↓ 减少药物引起的毒性
此外,表没食子儿茶素没食子酸酯可减少伊立替康治疗期间的胃肠紊乱、顺铂引起的肾毒性和耳毒性,以及阿霉素和柔红霉素治疗引起的心脏毒性。
在药物致敏方面,绿茶显示了许多与化疗的协同作用,其中一些包括与4-羟基他莫昔芬联合使用可以提高细胞毒性水平,通过降低大B细胞淋巴瘤(Bcl-xL)基因(编码抗凋亡蛋白)的表达使得MCF7细胞对5-氟尿嘧啶增敏,以及4只接种T1的Balb/c小鼠对紫杉醇的敏感性。这种致敏作用通过降低所需化学治疗药物的剂量有效地降低了药物引起的毒性的严重程度。
乳制品/奶制品与癌症治疗之间的关系一直存在争议。尽管据报道在Balb/c小鼠中,乳制品/乳脂可以增强紫杉醇治疗的有效性,并减少与该制剂相关的毒性,例如,器官损伤、腓肠肌丧失、附睾脂肪组织减少、红细胞和白细胞损失以及空肠形态、绒毛长度和肠 γ-谷氨酰转肽酶活性的破坏。
tips
有研究表明,在被诊断患有早期浸润性乳腺癌的女性中,高脂牛奶与乳腺癌、全因和非乳腺癌死亡率的增加有关,以及与绝经前妇女乳腺癌进展的风险增加有关。
鱼油富含omega-3脂肪酸,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),在减少癌症和癌症治疗相关症状和毒性方面的作用已被广泛研究。
↓↓ 减少化疗引起的毒性
一项随机临床试验表明,在宫颈癌患者(n=40)中,补充鱼油可以减少化疗引起的毒性,如厌食、恶心、口干和味觉障碍。一项对88例癌症患者补充精氨酸、谷氨酸和鱼油的研究表明,补充精氨酸、谷氨酸和鱼油可显著减少3-4级血液毒性,并提高两年总生存率。
↓↓ 增强抗肿瘤作用
一些体外和体内研究表明,与单纯化疗相比,化疗期间给予EPA和DHA可以增强抗肿瘤作用,减少化疗对正常组织的毒性,抑制全身炎症,改善癌症患者的营养状况。同样,在紫杉醇和顺铂/卡铂治疗期间,在等卡路里饮食中添加EPA与非小细胞肺癌患者的疲劳减轻、食欲改善和化疗引起的神经病变减少有关。
↓↓ omega-3脂肪酸减少化疗毒性
omega-3脂肪酸还可以减少癌症相关的恶病质,增加免疫调节作用,从而增强结直肠癌和食道癌患者的化疗与放疗,减少食道癌患者化疗引起的毒性(如口腔炎,3/4级腹泻,以及天冬氨酸转氨酶和丙氨酸转氨酶水平的升高)。
已经提出了多种机制来解释omega-3脂肪酸在降低癌症治疗相关毒性方面的作用。其中一种假设是细胞膜的组成,这表明不饱和脂肪酸掺入癌细胞膜中,导致细胞膜组成模式与正常细胞不同。考虑到细胞膜是细胞内信号传导和基因表达调控的中心,癌细胞和正常细胞之间细胞膜上脂肪酸分布的不同可能导致信号通路的不同激活(例如,PKC激活和NF-KB 通路)。
尽管omega-3脂肪酸在临床试验中显示出了益处,但在临床前模型中,omega-3脂肪酸十六碳-4,7,10,13-四烯酸已证明可以抑制铂化合物的肿瘤导向细胞毒性,这可能会对患者造成潜在的伤害。
因此,在建议临床食用鱼油之前,有必要进一步研究普通鱼油成分与纯化的EPA/DHA对特定化疗药物的细胞毒性的影响。
姜黄是一种开花植物,可从中提取姜黄素。它们与预防和治疗化疗和放疗相关的不良事件有关。姜黄/姜黄素对癌症的有益作用归因于它们的抗氧化和抗炎特性,以及它们在抑制细胞增殖和肿瘤干细胞发展方面的作用,以及它们对肠道菌群和免疫系统的积极作用。
↓↓ 姜黄油降低化疗4级毒性发生率
姜黄油具有保肝作用,并缓解刀豆蛋白A诱导的氧化应激和炎症,从而减少人类患者的多种症状和毒性。同样,与其他草本物质:发酵大豆提取物、绿茶提取物、樟芝菌丝体、螺旋藻和葡萄籽提取物相结合,可显著降低接受亚叶酸钙/5-氟尿嘧啶化疗患者的4级毒性发生率。
↓↓ 姜黄/姜黄素减轻粘膜炎严重程度
一项评估的结论是,局部应用姜黄和姜黄素可以控制接受化疗和/或放疗的癌症患者的口腔粘膜炎,而接受姜黄/姜黄素治疗的患者报告称疼痛较轻,红斑强度较低,溃疡区域较少。一项评估32名接受放射治疗的头颈部癌症患者的临床试验也得出结论,口服纳米胶束姜黄素显著减轻了放疗引起的粘膜炎的严重程度。
↓↓ 姜黄/姜黄素有助于控制癌症相关的疼痛
一项针对绝经后乳腺癌患者的多中心临床试验(n=45)显示,联合应用羟基酪醇(一种在橄榄油中发现的具有强大抗氧化作用的酚类植物化学物质)、omega-3脂肪酸和姜黄素可以减轻患者报告的疼痛,并降低炎症生物标志物的水平。
↓↓ 姜黄与常见化疗药物的协同 / 拮抗作用
姜黄素在I期临床试验中协同增强化疗药物FOLFOX(5-氟尿嘧啶、亚叶酸钙、奥沙利铂)和达沙替尼对经FOLFOX处理的HCT116和HT-29细胞有抗增殖作用。
尽管这些结果提示了有希望的进一步研究领域,但对人乳腺癌细胞株(即MCF-7、MDA-MB-231和BT-474)的体外实验表明,姜黄素与以伊立替康或环磷酰胺为基础的化疗之间存在拮抗作用,饮食补充姜黄素可能会抑制基于化疗的肿瘤消退。这些发现表明,需要更多的研究来确定乳腺癌患者是否应该在化疗期间避免补充姜黄素。
谷氨酰胺是巨噬细胞、淋巴细胞和肠细胞的主要燃料来源,具有多种有益作用,包括改善免疫系统、减少炎症和分解应激状态。
↓↓ 化疗配合谷氨酰胺补充,降低血液学毒性发生率
一项针对接受同步放化疗的癌症患者的随机研究表明,除了常规饮食外,还接受精氨酸、谷氨酰胺和鱼油营养补充剂的患者与未接受补充剂的患者相比,发生3级或4级血液学毒性的发生率较低。
↓↓ 补硒改善免疫系统
据报道,补硒在脂质过氧化方面具有抗氧化作用,刺激自然杀伤细胞的细胞毒活性,减少肿瘤内血管生成,并在体外改善免疫系统。硒与重金属的解毒作用有关。这些影响的产生可能是因为硒是硒蛋白和酶的重要组成部分,这些硒蛋白和酶有助于抗氧化防御、减少炎症、甲状腺激素产生、DNA合成。
一项对关于硒和放射治疗的文章进行了评估,得出的结论是,每天服用300-500微克的硒,持续10天到6个月,可以减少放疗的副作用,包括腹泻、唾液腺损伤和辐射伤口,不会产生不良影响。
tips
高剂量的硒(>400微克/天)会产生严重的副作用,像指甲变脆、脱发、胃肠功能障碍、皮疹、神经紊乱等。
维生素补充剂在减少癌症和癌症治疗相关症状和毒性方面的功效研究显示出相互矛盾的结果。
例如,尽管许多研究表明维生素C补充剂具有潜在的抗癌作用和降低毒性作用,但对接受化疗的癌症患者的维生素C进行的系统审查发现,没有明确的证据表明服用维生素C补充剂可以减少毒性或改善治疗的抗癌效果。
同样,尽管维生素D补充剂已被证明可以预防癌症治疗引起的骨质流失,并恢复许多早期乳腺癌患者经历的维生素D不足,但在各种研究中报告的维生素D的抗肿瘤效果仍然很差。
tips
由于维生素补充剂在癌症治疗期间的效果尚不清楚,强烈建议患者遵守饮食建议,通过水果和蔬菜等天然食物摄入维生素,而不是依赖膳食补充剂。
一个健康人体胃肠道中的各种复杂的微生物群已显示出显著的生理益处,如增强肠道功能和消化能力、抵御病原体和调节免疫力。
虽然“健康”肠道菌群的定义并不明确,但数据表明,具有高度功能冗余度的多样化和稳定的微生物群是健康状态的关键标志。
肠道菌群对癌症患者的治疗反应有显著影响。例如,白血病或淋巴瘤患者在造血干细胞移植后具有高水平的粘液真杆菌,其复发或肿瘤进展的可能性较低。
↓↓ 肠道菌群失调影响抗PD-L1治疗效果
人类、动物和体外研究表明,肠道菌群的免疫调节影响靶向免疫治疗的疗效,如细胞毒性T淋巴细胞相关4(CTLA-4)阻断和抗PD-L1治疗。与这些发现一致的是,一部分接受抗PD-L1治疗和广谱抗生素治疗的上皮性肿瘤患者经历了失败治疗,其原因可能是导致了微生物群的失调。
进一步支持这些发现的是,从应答者和无应答者患者向有免疫活性小鼠的粪便转移导致小鼠对抗PD-L1抗体产生了与相应粪便移植供体相同的反应,从而证明了肠道菌群对抗PD-L1治疗的效果。
↓↓ 肠道菌群调节化疗的疗效和毒性
化疗药物环磷酰胺和阿霉素能诱导革兰氏阳性菌(约氏乳杆菌、鼠乳杆菌和海氏肠球菌)转移到小鼠的次级淋巴器官中。一旦转移到淋巴器官,微生物就会刺激17型和1型T辅助细胞反应的积累,从而增强免疫反应。
临床前和临床证据都表明,抗生素会降低化疗的疗效。例如,长期使用抗生素已被证明会降低环磷酰胺治疗荷瘤小鼠P815肥大细胞瘤的疗效,支持了肠道细菌易位的重要性。
一项对C57BL/6(B6)和129SvEv(129)小鼠化疗所致周围神经病变的临床前研究表明,肠道细菌在确定紫杉醇诱导的疼痛敏感性中起主导作用;在对紫杉醇诱导的疼痛敏感和抵抗的小鼠之间,观察到肠道微生物群组成的显著差异。
↓↓ 肠道菌群与胃肠道不良反应的发生率有关
一项对接受放化疗的宫颈癌患者进行的临床研究(n=35)得出结论,肠道微生物多样性与胃肠道毒性的发生率呈负相关。
同样,一项针对儿童急性淋巴细胞性白血病患者(n=51)的临床研究确定,化疗期间肠道微生物群的变化与胃肠道不良反应的发生率有关,如全身炎症和肠道粘膜炎。Toll样受体(TLRs)和肠道微生物之间的免疫调节相互作用可能调节结肠的炎症和愈合,防止甲氨蝶呤化疗的毒性。
↓↓ 肠道菌群从根本上与粘膜炎的发病机制相关
粘膜炎是一种常见的胃肠道毒性,会导致腹泻、疼痛、体重减轻和剂量限制。例如,伊立替康是一种已知会引起严重腹泻的化疗剂。这种毒性的一种机制可能是某些细菌β-葡萄糖醛酸酶的作用,这些酶已被证明通过将伊立替康的活性代谢物SN-38释放到肠腔中来诱导腹泻。
与这一假设一致,通过喹诺酮类抗生素环丙沙星抑制此类酶可抑制伊立替康治疗小鼠的腹泻,从而证明肠道微生物群的调节可以降低伊立替康的毒性。
↓↓ 肠道菌群影响癌症治疗相关的心理神经症状
一项系统评价评估了肠道微生物群与化疗之间关系的研究,得出的结论是,肠道微生物群可能会影响癌症治疗相关的心理神经症状,例如疲劳、焦虑、抑郁和睡眠障碍。
因此,相对健康的肠道微生物群可以改善癌症患者的健康,通过增强治疗效果和减少免疫疗法和化学疗法的副作用以及通过免疫调节等方式。
饮食影响肠道微生物种类的组成和多样性。膳食纤维的高摄入量有利于膳食纤维消化细菌的增加。作用机制是消化膳食纤维的细菌产生丁酸等短链脂肪酸,滋养肠道上皮细胞,从而加强肠道黏膜屏障,增强黏膜和全身免疫。
↓↓ 食品补充剂调节微生物群驱动的化学治疗毒性
由于肠道屏障和微生物群稳态的潜在损害,化疗通常与肠道菌群的改变有关。因此,预防和治疗与化疗相关的肠道菌群改变可能有助于预防与化疗相关的胃肠道毒性。
▸从鱿鱼墨汁中提取的多糖在小鼠给药环磷酰胺后可富集双歧杆菌,并减少拟杆菌,从而改善肠道微生物群功能障碍。
▸人参化合物可以增强化疗药物5-氟尿嘧啶对结直肠癌细胞系的作用,特别是当这些化合物被肠道微生物群菌群代谢时。
▸鞣花酸,一种常见于草莓、葡萄和黑莓等蔬菜和水果中的多酚,被肠道菌群代谢释放尿石素,这对人类结肠癌具有抗增殖作用。
↓↓ 益生元和益生菌在癌症治疗中发挥作用
益生元(促进有益肠道微生物生长的难消化的食物成分,例如香蕉、芦笋和朝鲜蓟)和益生菌(引入体内以发挥有益作用的微生物,例如酸奶、克非尔、酸菜、豆豉,和泡菜)与肠道菌群的组成密切相关,这些物质在癌症治疗过程中的作用很关键。
许多动物和人类研究表明,益生元、益生菌在预防化疗期间的粘膜炎方面具有强大的作用。
对于接受同步放化疗的鼻咽癌患者,益生菌与放射治疗相结合,可以通过改变肠道菌群,显着增强宿主免疫力,缓解放化疗相关的口腔黏膜炎。
VSL #3(包括Streptococcus thermophiles, Bifidobacterium breve, B. longum, B. infantis, Lactobacillus paracasei, L. delbrueckii subsp. bulgaricus, L. acidophilus, L. plantarum),在伊立替康治疗期间,减少大鼠腹泻和体重减轻。
L. casei, L. rhamnosus, B. bifidum 通过抑制肿瘤坏死因子α、白细胞介素-1b和白细胞介素-6 mRNA的表达减少化疗诱导的小鼠腹泻。
鼠李糖乳杆菌GG补充可减少人类大肠癌患者在5-氟尿嘧啶化疗期间的严重腹泻和腹部不适。
在接受化疗的儿童中使用养乐多的短双歧杆菌菌株可预防发烧并减少静脉注射抗生素的频率。
膳食补充益生元低聚果糖和菊粉可放大药物对小鼠的作用(5-氟尿嘧啶、多柔比星、长春新碱、环磷酰胺、甲氨蝶呤、阿糖胞苷),从而证明了益生元与化疗之间的协同作用。
编辑
大量临床前数据以及有限的临床证据表明,饮食因素可能在预防和/或治疗癌症以及癌症治疗相关的症状和毒性方面发挥作用,寻求特定饮食干预措施的数据仍在不断涌现。
人们对肠道菌群的性质和对癌症治疗的影响也越来越感兴趣。期待更大样本量的随机对照试验,进一步研究饮食干预措施。
最好的饮食是患者愿意并且能够坚持的饮食,因此在将这些策略引入临床时可能需要一定程度的个性化。
如果能开发出,通过调节肠道菌群来改善治疗效果的药物,其潜力是巨大的。
主要参考文献
Spencer CN, McQuade JL, Gopalakrishnan V, McCulloch JA, Vetizou M, Cogdill AP, Khan MAW, Zhang X, White MG, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science. 2021 Dec 24;374(6575):1632-1640. doi: 10.1126/science.aaz7015. Epub 2021 Dec 23. PMID: 34941392; PMCID: PMC8970537.
Yu ZK, Xie RL, You R, et al. The role of the bacterial microbiome in the treatment of cancer. BMC Cancer. 2021;21(1):934. Published 2021 Aug 19. doi:10.1186/s12885-021-08664-0
Kim AJ, Hong DS, George GC. Dietary influences on symptomatic and non-symptomatic toxicities during cancer treatment: A narrative review. Cancer Treat Rev. 2022 May 13;108:102408. doi: 10.1016/j.ctrv.2022.102408. Epub ahead of print. PMID: 35623220.
Barrea L, Caprio M, Tuccinardi D, Moriconi E, Di Renzo L, Muscogiuri G, Colao A, Savastano S; Obesity Programs of nutrition, Education, Research and Assessment (OPERA) group. Could ketogenic diet “starve” cancer? Emerging evidence. Crit Rev Food Sci Nutr. 2022;62(7):1800-1821. doi: 10.1080/10408398.2020.1847030. Epub 2020 Dec 4. PMID: 33274644.
Baguley BJ, Skinner TL, Jenkins DG, Wright ORL. Mediterranean-style dietary pattern improves cancer-related fatigue and quality of life in men with prostate cancer treated with androgen deprivation therapy: A pilot randomised control trial. Clin Nutr. 2021 Jan;40(1):245-254. doi: 10.1016/j.clnu.2020.05.016. Epub 2020 May 25. PMID: 32534948.

谷禾健康


如果说前一篇文章《微生物组-神经免疫轴:心血管疾病的预防和治疗希望》更多的是借助心血管疾病(CVD),来宏观地阐述肠道-神经免疫-菌群之间的关联,那么这篇文章更多地是具体讨论肠道菌群及其代谢产物参与CVD疾病的发生发展,以及饮食和微生物群的串扰机制,基于上述理论,从更实际具体的角度来了解饮食相关的干预措施及其对健康的影响。
越来越多的研究表明,肠道菌群作为一个不可或缺的“隐形器官”,在人类新陈代谢和包括心血管疾病在内的疾病状态中发挥着至关重要的作用。
在可能影响肠道微生物群的许多内源性和外源性因素中,饮食成为宿主-微生物群关系的重要组成部分,可能与 CVD 易感性有关。
本文主要介绍肠道微生物群饮食调节的主要概念,及其参与心血管疾病发展。还讨论了调节 CVD 进展的饮食-微生物群串扰的机制,包括内毒素血症、炎症、肠道屏障功能障碍和脂质代谢功能障碍。也阐述了关于微生物群产生的代谢物,包括三甲胺-N-氧化物、次级胆汁酸、短链脂肪酸以及芳香族氨基酸衍生的代谢物如何在 CVD 发病机制中发挥作用。最后,列举了与肠道微生物群相互作用的潜在饮食干预措施,作为 CVD 管理的新型预防和治疗策略。
在了解CVD中基于菌群的饮食干预之前,首先我们来了解一下,饮食变化对肠道微生物群可能产生哪些影响?
主要可概括为三个方面:
(1) 快速/短期效应
对在植物性(高纤维)之间切换的人类受试者和以动物为基础的(高脂肪)饮食的研究表明:
所有受试者的微生物群组成在 1-2 天内发生变化,厚壁菌门在植物性饮食中代谢膳食纤维的丰度增加,在动物性饮食中耐胆汁微生物Alistipes和Bilophila增加。然而,即使经过 10 天的干预,短期饮食改变对肠型也没有影响。
(2) 长期影响
尽管微生物群落迅速调节,但长期的饮食干预不仅与成分改变有关,还与生理变化有关。
例如,用高脂肪饮食 (HFD) 喂养大鼠 8 周或 12 周会导致肠杆菌门(变形杆菌门)的丰度增加,这与全身炎症、肠道通透性和肥胖表型的升高相结合。相反,人类队列干预 3 个月的低碳水化合物或低脂肪健康饮食导致 14 或 12 种与体重减轻相关的菌群变化,这表明长期干预是必要的。此外,肠型主要与长期饮食影响而不是短期影响有关。
(3) 特定饮食引起的特定微生物变化
例如,膳食纤维的摄入促进了肠道微生物群的丰度或多样性以及厚壁菌门的增加。抗性淀粉饮食干预下 Ruminococcus bromii 增多。
有趣的是,不仅是微生物组成,还有特定的微生物代谢与特定的饮食和疾病模式相关。例如,富含红肉饮食的受试者血浆中的三甲胺-N-氧化物 (TMAO)(红肉中胆碱的肠道微生物代谢产物)比素食者多。已在人类受试者中发现 TMAO 水平升高,肠型普氏菌比例较高,并且与 CVD 风险增加有关。
人类队列中与心血管疾病相关的肠道微生物群的改变


Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
在健康状态下,适当的肠道屏障提供了抵御病原体的关键第一道防线,它由多种生理成分支持,包括粘液层、由紧密连接蛋白连接的上皮细胞和免疫细胞。
然而,心力衰竭或高血压的 CVD 患者经常观察到肠道屏障功能障碍,伴随全身微生物成分LPS和炎症的增加。
那么CVD过程中,引发肠道渗漏和炎症的风险因素是什么?
其中一个假设是,长期食用西方饮食或 HFD 会导致生态失调并损害肠道屏障,从而增强 LPS 易位和全身炎症,导致心血管疾病风险增加。
有鉴于此,富含饱和脂肪或反式脂肪酸的饮食摄入量较高与 CVD 风险的增加高度相关,而饮食中饱和脂肪的摄入量较低可使 CVD 降低约 30%。
在大型队列研究中,长期(6 个月)食用 HFD 会导致微生物菌群失调,其中革兰氏阴性菌(如Alistipes和Bacteroides)的比例增加,同时参与 LPS生物合成的基因水平更高。同时,已发现膳食脂肪通过激活促炎细胞因子(例如 TNF-α、IFNγ 和 IL-1β)的分泌来损害肠道屏障。促炎细胞因子的上调进一步激活 MLCK(肌球蛋白轻链激酶)信号通路,重组紧密连接蛋白,包括occludin、ZO-1(Zonula occludens-1)并导致肠漏。
当肠道屏障被破坏时,LPS或病原体可能转移到循环中,引起内毒素血症,从而刺激全身性促炎细胞因子的释放。一旦在血流中易位,内毒素可以通过与细胞表面的 TLR-4(Toll 样受体 4)相互作用来触发内皮细胞的损伤,并增强 ROS(活性氧)的产生,从而降低内皮细胞 NO(一氧化氮)的生物利用度导致形成斑块和动脉粥样硬化病变。
这一假设已在动物模型中得到证实,其中 ApoE-/-西方饮食下的小鼠动脉粥样硬化病变加重,变形菌(革兰氏阴性促炎细菌)和全身 LPS 水平显着增加。
此外,西方饮食促进炎症细胞因子(如 TNF-α 和 IL-1β)的上调,增加肠道通透性,同时修饰 ApoE-/- 小鼠中的紧密连接蛋白(如 occludin)。
然而,在人类队列中仍然缺乏数据来解释,由于西方饮食导致的肠道屏障受损和相关的内毒素血症增加在什么情况下会诱发CVD发病机制。
除了饮食-微生物群对炎症和肠道屏障功能的相互作用外,肠道微生物还通过宿主脂质代谢影响 CVD。
越来越多的动物和人类研究表明,肠道微生物群与脂质代谢紊乱有关,如血脂异常或高脂血症,它们是 CVD 发展的主要危险因素。
肠道微生物群将胆固醇转化为粪(甾)醇降低胆固醇
例如,GF 小鼠的胆固醇代谢发生了改变 ,而ApoE -/-小鼠肠道微生物群的消耗导致与传统的 ApoE -/-小鼠相比,血浆胆固醇伴有更大的主动脉病变。
此外,从高血浆胆固醇人类到小鼠的微生物群移植引发了上调循环胆固醇的表型以及肝脏胆固醇合成 的减少。
这可能是由于肠道微生物群将胆固醇转化为粪(甾)醇,这可以促进体内胆固醇的消除和降低胆固醇血症。
胆固醇代谢的数学模型已经证实了这一点,最近发现肠道菌群的胆汁盐代谢和胆固醇向粪(甾)醇的转化都会影响血液中的胆固醇水平。
此外,最近对人类队列进行的一项有趣的研究也证实了这一点,并确定了含有胆固醇代谢酶ismA的Eubacterium coprostanoligenes等粪(甾)醇形成菌的个体,粪便胆固醇水平显著降低,血清总胆固醇显著降低。
然而,在斑块面积较小的无菌 ApoE-/- 小鼠中也发现了有争议的结果,尽管血浆总胆固醇(TC)上调可能是由于缺乏与无菌状态相关的内毒素。
有趣的是,肠道微生物群的缺失似乎减弱了长期膳食脂质消耗的致动脉粥样硬化作用。
具体而言,与传统小鼠相比,HFD 喂养的无菌 Ldlr-/- 小鼠的血栓大小显着减小。尽管无菌和常规 Ldlr-/- 喂食 HFD 小鼠的血浆 TC 水平没有差异,但与喂食的无菌小鼠相比,富含脂质的饮食仍然诱导无菌小鼠的 TC 水平(TC≈1.6 mg/dlx103)约两倍配合食物(TC≈0.8 mg/dlx103)。
相比之下,HFD 诱导常规小鼠血浆 TC 增加约 8 倍(TC ≈1.6 mg/dlx103) 与以食物喂养的小鼠相比 (TC≈0.2 mg/dlx103 )。在这项研究中也发现了 VLDL 的类似发现。富含脂质的饮食还加剧了 Ldlr -/-小鼠的微生物群失调,梭菌科、葡萄球菌科、芽孢杆菌科的丰度增加,乳酸杆菌科的丰度降低。然而,最近的研究表明,在晚期主动脉粥样硬化方面,无菌Ldlr-/-与常规小鼠之间没有发现显着差异。
总之,不同的研究表明肠道微生物群对血脂代谢。这种影响对 CVD 发展是否具有保护作用或加重作用仍不清楚。这种差异可能取决于动物模型、动物年龄、饮食类型、喂养期以及住宿条件。未来的研究可以将这些因素纳入考虑范围,以便进行更好的调查。
TMAO,是一种饮食诱发的心血管疾病风险微生物生物标志物。
★ 饮食-肠道菌群代谢物TMAO(三甲胺-N-氧化物)
这是一种从饮食营养素衍生的肠道微生物共同代谢物,十年前首次被发现并被报道预测CVD的风险。饮食前体磷脂酰胆碱、胆碱和L-肉碱通常存在于奶酪、红肉、海鲜、蛋黄和其他西式营养素中,主要由特定的肠道微生物酶代谢,产生高水平的三甲胺(TMA)。
具体而言,含有功能性微生物CutC/D基因的TMA裂解酶负责胆碱相关TMA转化。TMA进一步被血液吸收,并在肝脏中被黄素单加氧酶(FMO,主要是FMO3)氧化,生成TMO。
在人类肠道中发现了七种不同的表达TMA裂解酶CutC/D的菌株,包括:
此外,TMA可以通过微生物里斯克型左旋肉碱加氧酶CntA/B从左旋肉碱合成。
虽然CntA/B编码基因已在变形杆菌中鉴定,但尚未证明共生肠道微生物群形成依赖于L-肉碱的TMA。然而,最近的一项研究发现,两种细菌菌株Emergencia timonensis和Ihubacter Massilensis的新组合在肉碱转化的TMA积累中具有潜在的重要作用。
有趣的是,最近发现的细菌E.timonensis通过L-肉碱促进TMAO的产生→ γ-BB(γ-丁基甜菜碱,肉碱的前体)→ TMA→ TMAO途径。然而,与肉碱TMA转化途径相关的特定共生微生物群仍需进一步发现。
★ 饮食-微生物群衍生的TMAO在CVD发病机制调节中的作用
最初的研究表明,高胆碱或肉碱饮食饲养的小鼠循环TMAO水平升高,巨噬细胞泡沫细胞形成的增加和主动脉粥样斑块形成的增强(图1)。
相反,在无菌或抗生素治疗的ApoE−/−小鼠中,TMAO产生能力和胆碱或肉碱饮食相关的动脉粥样硬化斑块负荷分别被消除或抑制 (C57BL/6株)。有趣的是,ApoE−/− 研究发现,当从高TMA/TMAO产生的供体C57BL/6小鼠接受盲肠微生物群移植时,小鼠比从低TMA/TMAO产生的供体NZW/LacJ小鼠产生更高的胆碱饮食依赖性主动脉病变聚集。
类似地,在无菌小鼠体内移植产生高TMA的微生物可诱导血小板高反应性,并增强与高血浆TMAO水平相关的血栓形成。
因此,微生物群对于TMAO的产生是必要的,TMAO通过以下几种机制参与动脉粥样硬化的进展:
1)泡沫细胞形成
微生物群衍生的TMAO可以激活应激诱导的热休克蛋白(HSP)HSP70或HSP60的表达,这可能触发巨噬细胞中清道夫受体(例如SR-A1)和CD36的激活,以刺激氧化低密度脂蛋白(ox-LDL)的摄取和泡沫细胞的形成。
2)炎症
TMAO通过激活Ldlr中的丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,诱导促动脉粥样硬化炎症标志物表达,包括IL-6、环氧合酶2(COX-2)和细胞内粘附分子 Ldlr−/− 小鼠吃富含胆碱的食物。
循环TMAO的增加与促炎细胞因子TNF-α和IL-1β的升高以及抗炎细胞因子IL-10的降低有关。
3) 脂质代谢
TMAO可抑制胆固醇逆向转运(RCT),导致动脉胆固醇沉积,加速动脉粥样硬化病变。
4) 血小板高反应性和血栓形成
饮食诱导的高水平微生物TMAO可刺激血小板激活次最大刺激物,包括凝血酶、二磷酸腺苷(ADP)和胶原,并诱导细胞内钙的释放,导致血小板高反应性。
然而,一些研究显示了相反的结果,表明饮食中的TMAO、胆碱或肉碱不会诱发ApoE−/− 的动脉粥样硬化或者Ldlr−/− 小鼠模型。这种差异可能是由于居住条件和小鼠模型造成的,但确切的原因仍有待进一步发现。
最近证明,TMA(而非TMAO)降低了心肌细胞和血管平滑肌细胞的活力。在大鼠体内静脉注射TMA时,平均动脉血压显著升高,表明TMA对CVD有有害影响。
进一步证实TMA在CVD发病机制中的作用并验证相关机制,还需要进行更多的体内和体外研究。
图1 肠道菌群产生的膳食代谢物在心血管疾病发病中的潜在机制

Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★人体循环TMAO在心血管疾病预测和预后中的研究
大量人体研究已经证明肠道微生物衍生的TMAO在预测CVD风险中的作用。
最初的研究调查了1800多名受试者的人类队列,发现血浆TMAO升高与多种CVD亚型的发生有关,包括外周动脉疾病(PAD)、冠状动脉疾病和心肌梗死史。
在临床结果研究中,大量参与者表明,循环TMAO与主要不良心血管事件、事件死亡率和动脉梗死的风险增加呈正相关。在许多研究中,血浆TMAO的临界值超过6μM,以预测全因死亡率的风险,最近对10000多名受试者进行的荟萃分析提出,CVD预后的血浆TMAO临界值为5.1μM。
此外,已发现高水平的TMAO与人类队列中促炎性单核细胞和心血管风险的增加有关。
同样,一项系统回顾和剂量反应荟萃分析招募了13000多名参与者,发现血浆TMAO水平升高与炎症标志物C反应蛋白(CRP)升高之间存在非线性关联。然而,并非所有的人体研究都发现了类似的数据。例如,无症状动脉粥样硬化患者的肠道微生物群和血液TMAO水平没有明显变化。然而,中风和短暂性脑缺血发作患者表现出肠道微生物群的显著失调,但血浆TMAO水平降低。
相比之下,在一组35-55岁的参与者(n=817)中,在10年的随访中,TMAO浓度与动脉粥样硬化进展之间没有显著关系。
有趣的是,最近的一项研究发现,TMA而非TMAO与高血压负荷和CVD风险因素有关,并与早期慢性肾病(CKD)受试者中Akkermansia属、粪杆菌属、Ruminococcus、Subdoligranulum的丰度降低有关。
然而,仍需对人类队列进行进一步研究,以调查TMAO前体TMA是否是早期CVD发病机制调节中被遗忘的毒素或预测因子。
胆汁酸(BAs)是羟基化和饱和类固醇,有助于乳化和肠道吸收膳食脂肪和脂溶性分子。
在人类肝细胞中,初级胆汁酸(胆酸和鹅去氧胆酸)由胆固醇通过催化酶合成,如胆固醇7a羟化酶(CYP7A1)、甾醇27羟化酶(CYP27A1)、氧化甾醇7a羟化酶(CYP7B1),其表达受肠道微生物群的调节。
然后,初级胆汁酸与甘氨酸或牛磺酸结合,95%以上的初级胆汁酸被重新吸收并再循环回肝脏。非再吸收的胆汁酸可通过催化酶胆盐水解酶(BSH)解结合,该酶由几种共生肠道细菌表达,包括革兰氏阳性双歧杆菌、梭菌、肠球菌、乳酸杆菌和革兰氏阴性拟杆菌。
除了去结合,肠道微生物如梭菌和真杆菌也是7-脱氢酶的来源,以生成次级胆汁酸,包括来自CDCA的石胆酸(LCA)和来自CA的脱氧胆酸(DCA)。
此外,胆汁酸的氧化和差向异构化是通过羟类固醇脱氢酶(HSDHs)催化的,这种酶已在各种细菌中发现,包括放线杆菌、变形杆菌、梭菌和其他细菌。
一旦微生物代谢的胆汁酸进入循环血液,胆汁酸受体就可以介导信号通路来调节宿主代谢,有助于CVD的发展。
最重要的胆汁酸受体之一是FXR,它是肝脏初级胆汁酸和肠道次级胆汁酸的主要传感器。FXR在调节脂质和葡萄糖代谢方面已被证实。
有趣的是,在动脉粥样硬化易感小鼠中FXR的激活在动脉粥样硬化病变的形成中显示出保护作用。相应地,ApoE−/−中FXR的缺失导致脂质代谢缺陷的严重程度增加,主动脉斑块形成增强。相比之下,对FXR/ApoE或FXR/Ldlr双缺陷小鼠的其他研究显示主动脉病变和血浆LDL胆固醇降低。有趣的是,FXR还通过调节FMO3活性来调节TMAO途径。
另一个重要的胆汁酸受体是TGR5,通过继发性胆汁酸激活该受体,可通过减少斑块内炎症、斑块巨噬细胞含量和脂质负荷来减轻血管病变的形成。
PXR是另一种与胆汁酸代谢相关的核受体,由次级胆汁酸(如LCA)激活。
与其他受体相比,PXR的激活提高了脂蛋白VLDL、LDL和CD36的表达水平,从而聚集动脉粥样硬化形成中的ApoE−/− 小鼠,而PXR在载脂蛋白E中的抑制作用ApoE−/− 小鼠,通过减少巨噬细胞的脂质摄取和CD36表达减轻了主动脉病变区域。
尽管大多数关于胆汁酸在CVD发病机制中的研究都是在小鼠模型上进行的,但在临床队列中发现胆汁酸的循环水平与CVD表型相关。
例如,研究发现,人类受试者的初级和次级胆汁酸水平降低,慢性心力衰竭患者的总体生存率降低。此外,较低的空腹血浆总胆汁酸与冠状动脉疾病、MI和冠状动脉病变的严重程度显著相关。
总之,肠道微生物群衍生的胆汁酸通过多种类型的胆汁酸受体调节CVD的发展,而血浆胆汁酸可能是CVD发生的另一个重要预测因子,仍需进一步研究。
短链脂肪酸是膳食纤维(主要是多糖)发酵的主要微生物产物,主要由乙酸盐、丁酸盐和丙酸盐组成。肠道微生物群的特定成员参与短链脂肪酸合成的特定发酵途径。
肠道微生物群调节富含纤维的饮食与心血管疾病风险之间的保护性关联。具体而言,许多研究已经阐明了膳食纤维或短链脂肪酸在缓解高血压或其他CVD亚型中的功能作用(图1)。
其中一项研究发现,高纤维饮食和补充乙酸盐都可以降低收缩压和舒张压、心肌纤维化和左心室肥厚,这与改善肠道失调和增加拟杆菌的数量有关。
类似地,丙酸盐治疗可保护小鼠免受高血压心血管损伤,而产丁酸盐的细菌(如Roseburia intestinalis)可减少主动脉粥样硬化病变面积。
研究发现,Olfr78和GPR41参与调节宿主血压和内皮功能。具体而言,丙酸盐通过调节Olfr78和GPR41表达的中断,在野生型小鼠中诱导急性低血压反应。然而,抗生素治疗Olfr78−/− 小鼠(而非野生型小鼠)血压升高,GPR41升高,与野生型小鼠相比,小鼠也有收缩性高血压。
此外,最近的一项研究表明,乙酸盐和丁酸盐通过仅对丁酸盐进行GPR41/43激活,从而提高NO的生物利用度,从而改善大鼠主动脉内皮功能障碍。为了揭示短链脂肪酸在CVD发病机制中的机制作用,还需要进行进一步的研究。
★ 人类研究
在人类中,大多数关于CVD风险的研究都与短链脂肪酸相关的血压调节有关。早期临床干预研究发现,增加膳食纤维摄入量与高血压患者的血压降低有关。
在一项荟萃分析研究中也发现了粘性可溶性纤维对血压的类似保护作用。
相比之下,最近的一项干预研究报告称,高纤维高蛋白饮食可能通过上调循环短链脂肪酸水平增加CVD的风险。具体来说,高蛋白高纤维饮食诱导丙酸水平升高,这与LDL胆固醇和血压的上调有关;较高的丁酸水平与葡萄糖的上调和高密度脂蛋白胆固醇的下调有关。然而,它仍然局限于短链脂肪酸对人类CVD风险或保护作用的直接证明,需要进一步澄清。
芳香族氨基酸(AAA)是含有芳香环的氨基酸,包括苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)。
芳香族氨基酸的主要来源是膳食蛋白质,如牛肉、猪肉、鸡肉或鱼。有趣的是,研究人员发现了肠道微生物群产孢梭菌Clostridium sporogenes产生芳香族氨基酸代谢物的途径。
最近,几项研究发现,苯丙氨酸衍生的微生物代谢物苯乙酰谷氨酰胺(PAG)与主要心脏不良事件(如心肌梗死、急性缺血性中风或冠状动脉疾病)之间存在密切关系。
具体来说,膳食中的苯丙氨酸通过富含porA基因的肠道微生物群转化为苯乙酸,随后在肝脏中转化为PAG。PAG进一步激活G蛋白偶联受体,包括α2A、α2B和β2肾上腺素能受体,以促进动脉损伤动物模型中的血小板反应性和血栓形成潜能。
同样,来自Trp的肠道微生物衍生代谢物吲哚硫酸酯(IS)和来自Tyr的对甲酚硫酸酯(PCS)也被确定为预测CKD患者CVD事件的有价值标记物。
这可能是由于IS和PCS通过诱导尿毒症毒性和内皮功能障碍而产生的有害影响。
然而,一些研究发现IS、PCS或PAG与CVD结果无关。这种差异可能是由于不同研究的阈值效应造成的。这些肠道微生物代谢物在心血管疾病进展中的作用尚需进一步研究。
健康饮食模式已被建议预防 CVD 进展(图 2),包括地中海饮食(Med-diet)、阻止高血压的饮食方法(DASH)和间歇性禁食(IF)等喂养模式。
图2 针对肠道微生物群的饮食干预在预防心血管疾病方面的潜在疗法

Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★ 饮食类型
多项临床试验证实了地中海饮食对主要血管事件、冠状动脉事件、中风和心力衰竭的保护作用。这种效应与微生物群多样性和微生物代谢物短链脂肪酸的增加以及TMAO 和血浆LPS水平的降低有关。
然而直到最近,才发现地中海饮食的长期干预可以通过肠道微生物群调节来预防 CVD。
具体来说,地中海饮食的长期干预可以通过富含膳食纤维代谢物(如Faecalibacterium prausnitzii和Bacteroides cellulosilyticus )显着改变整体肠道微生物组。
特别是,在没有普氏菌的情况下,地中海饮食对 CVD 危险因素(包括脂质代谢、炎症和葡萄糖稳态)显示出强大的保护作用。
尽管多项数据表明 DASH 饮食可以通过降低血压和血脂异常来改善心脏危险因素,仍然缺乏关于 DASH 饮食与 CVD 预防中微生物群改变之间直接联系的数据。
★ 喂养模式
间歇性禁食(IF)是一种重要的饮食喂养模式,是一种周期性能量限制的做法,可以通过改变肠道微生物群来降低CVD风险。
具体而言,自发性高血压卒中易感大鼠在IF干预50天后,肠道微生物群β多样性发生显著变化,这与通过调节胆汁酸代谢降低血压有关。这些发现已通过对GF大鼠的粪便移植得到证实。
此外,在8周内对患有IF的人群进行临床干预,显著改善了血管舒张参数,减轻了氧化应激、与微生物群产生的短链脂肪酸增加相关的炎症,并降低了血浆LPS。有趣的是,短期禁食5天也可以降低血压和体重,调节微生物群,包括脱硫弧菌科、阿克曼菌和瘤胃菌科。
★水果和蔬菜中的多酚
多酚是一大类常见于植物产品中的有机化合物,尤其是水果和蔬菜。超过90%的总多酚在小肠中不可吸收,并被大肠中的肠道微生物群进一步代谢。
越来越多的研究支持膳食多酚对肠道微生物群的修饰和CVD保护的作用。
白藜芦醇(在葡萄、苹果和浆果等水果中发现)已被确定通过下调TMAO水平和上调BAs合成来减轻ApoE-/-小鼠的动脉粥样硬化,而BAs合成与有益菌拟杆菌、乳酸杆菌、双歧杆菌和阿克曼菌的丰度增加有关。
口服槲皮素(在洋葱、西兰花和西红柿等蔬菜中发现)可以抑制体重增加,改善动脉粥样硬化病变的程度,降低胆固醇水平、致动脉粥样硬化溶血磷脂酰胆碱水平,减少革兰氏阴性菌疣状芽胞菌的丰度,同时增加微生物多样性。
在人类受试者中,富含多酚的饮食干预发现,饮食多酚可以显著增加微生物多样性和Ruminococcaceae,这些与心脏代谢危险因素(如血浆甘油三酯和大 VLDL 中的胆固醇)的改善有关 。
总的来说,水果和蔬菜中的多酚可能是心血管疾病的潜在治疗干预措施,它们的部分保护作用可以通过肠道微生物群的修饰来介导。
关于多酚详见这篇文章:肠道微生物群与膳食多酚互作对人体健康的影响
★膳食纤维
膳食纤维是不易消化的碳水化合物,包括水溶性或不溶性形式,通常存在于水果、蔬菜、全谷物、坚果和豆类等中。
膳食纤维不能被小肠吸收,“喂养”健康的肠道微生物群,导致短链脂肪酸的多样性和产量增加。
如前所述,短链脂肪酸激活特异性受体,从而改善高血压和主动脉内皮细胞功能障碍。
最近的一项研究发现鹰嘴豆膳食纤维提高了微生物多样性,增加了拟杆菌和乳酸杆菌的相对丰度,并提高了丙酸水平。鹰嘴豆膳食纤维也可以通过对肠道微生物群进行类似的修饰来改善高血糖症。
全谷物燕麦还能降低血浆胆固醇水平,提高胰岛素敏感性,这与微生物群中有益乳酸杆菌的增加有关。同样,人类食用全谷物产品时,总胆固醇和低密度脂蛋白胆固醇水平较低,双歧杆菌含量较高。
关于膳食纤维详见这篇文章:你吃的膳食纤维对你有帮助吗?
益生元是植物源性或不易消化的食物成分,可刺激胃肠道中“友好”微生物的生长。
大多数益生元是膳食纤维,而不是所有膳食纤维都可以归类为益生元。常见的益生元包括低聚糖和多糖,如菊粉、低聚果糖、β-葡聚糖,它们通常能诱导肠道微生物群的特定修饰。
许多研究通过三个主要方面有趣地研究了益生元对宿主代谢的有益影响,以改善CVD状况(图2):
1)降低血脂
补充益生元纤维(例如菊粉)可以降低血浆胆固醇水平,并减少肝脏中的TAG积累;
2)减少内毒素血症和炎症
益生元低聚果糖可以增加双歧杆菌的数量,与血浆和脂肪组织中的内毒素血症和炎症呈负相关;
3)降低血压
补充富含益生元纤维的饮食可以通过GPR43信号通路降低收缩压和舒张压。
益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。人类饮食中的大量发酵食品,如酸奶、酸菜、开菲尔、泡菜,都含有益生菌菌株。
作为益生元,益生菌菌株也被确定在更多方面防止CVD进展(图2):
1) 改善血管内皮功能
服用植物乳杆菌299v可改善冠心病患者阻力动脉的内皮依赖性血管舒张功能。同样,发酵乳杆菌CECT5716治疗可降低大鼠的血管氧化应激并改善内皮功能。
2) 降低血糖和氧化活性
益生菌酸奶的干预显著降低血糖,提高总抗氧化状态。
3) 降低胆固醇
补充长双歧杆菌BB536对降低总胆固醇、肝脏脂质沉积和脂肪细胞大小有显著效果。
4) 减轻内毒素血症和炎症
通过恢复肠道屏障功能,通过改善系统性内毒素血症诱导的炎症,口服粘液阿克曼菌已被证明可减少动脉粥样硬化病变。此外,补充乳酸杆菌 L.reuteri V3401可降低炎症标志物水平,如TNF-α、IL-6、IL-8,这与降低CVD风险有关。
更多益生菌、益生元等介绍详见这篇文章:
如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
一些来自中药的天然成分也通过调节肠道微生物群被用作潜在的CVD疗法(图2)。
小檗碱(BBR),一种生物活性异喹啉生物碱,广泛存在于各种中草药中并从中提取,已被证明具有许多有益的作用。
最近发现,高剂量的小檗碱不仅通过降低总胆固醇和极低密度脂蛋白胆固醇水平来改善脂质代谢,还下调促炎细胞因子TNF-α、Il-1β、Il-6和上调的抗炎性Il-10水平,这些水平与参与短链脂肪酸产生的Alistipes和Roseburia的丰度增加有关。
Roseburia菌 详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
此外,BBR可以通过重塑肠道微生物群成分来抑制TMAO的产生,从而减轻胆碱诱导的动脉粥样硬化。
红曲米(RYR)可以通过降低总胆固醇和低密度脂蛋白水平来缓解斑块的形成,而总胆固醇和低密度脂蛋白水平与厚壁菌/拟杆菌的比例降低有关,同时也降低了黄曲霉和黄酮类提取物的丰度。
RYR干预还能改善肠道屏障功能,并通过TLR信号通路减轻炎症。
灵芝是一种药用蘑菇,通过降低携带内毒素的变形菌水平和增加有益细菌(包括梭菌和真杆菌),来减少肥胖、内毒素血症、慢性炎症以及恢复肠屏障功能。
肠道微生物群与心血管疾病之间存在着重要而复杂的联系。作为肠道微生物群中重要的调节剂之一,膳食成分可改变与全身内毒素、炎症、肠道屏障功能障碍以及脂质代谢功能障碍相关的微生物成分,从而增加CVD风险。
然而,更多的研究数据表明,肠道微生物群对饮食代谢在调节CVD发病机制中的主要作用包括:
1) 代谢饮食胆碱或L-肉碱以诱导TMAO的释放,促进动脉粥样硬化的进展;
2) 调节胆汁酸代谢,可能通过多种受体途径调节动脉粥样硬化的形成;
3) 产生芳香族氨基酸代谢物PAG、IS、IPA或PCS,加速动脉粥样硬化形成;
4) 发酵膳食纤维以产生短链脂肪酸,这对CVD的进展起到了一些有益的作用。
这些发现为开发CVD的新型潜在预防和治疗方法提供了一些极好的支持,例如可以通过健康饮食和喂养模式、含有健康膳食成分的饮食等干预措施改善菌群,从而预防改善CVD。当然也包括:来自水果和蔬菜的膳食多酚、膳食纤维和益生元、益生菌以及饮食中药等干预措施。主要参考文献:
Xufei Zhang, PhilippeGérard. Diet-gut microbiota interactions on cardiovascular disease. Computational and Structural Biotechnology Journal. 2022,Mar: 1528-1540. doi: org/10.1016/j.csbj.2022.03.028
Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell Mol Life Sci. 2019 Apr;76(8):1541-1558. doi: 10.1007/s00018-019-03011-w. Epub 2019 Jan 25. PMID: 30683985.
Bapteste E, Gérard P, Larose C,et al., The Epistemic Revolution Induced by Microbiome Studies: An Interdisciplinary View. Biology (Basel). 2021 Jul 12;10(7):651. doi: 10.3390/biology10070651. PMID: 34356506; PMCID: PMC8301382.
Tang WHW, Li DY, Hazen SL. Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol. 2019 Mar;16(3):137-154. doi: 10.1038/s41569-018-0108-7. PMID: 30410105; PMCID: PMC6377322.

谷禾健康
中风是一种常见的脑血管疾病,是一个重大的健康问题,每年影响全球超过 1500 万人。大约 70% 的中风是由脑缺血引起的,称为缺血性中风。它通常是由阻塞大脑血管的血凝块引起的。
缺血性中风一般有以下症状:
中风后,高达 50% 的患者会出现胃肠道并发症,包括便秘、吞咽困难、胃肠道出血和大便失禁等问题,胃肠道并发症会影响患者治疗效果不佳。

多项研究证实,中风患者存在肠道菌群失调。
肠道菌群可以调节疾病和健康之间的平衡,因为它们有可能产生各种代谢物(如,短链脂肪酸、胆汁酸、维生素、氨基酸和氧化三甲胺)。这些代谢物可能参与调节宿主的生理功能。其中氧化三甲胺增强血小板反应性和血栓形成可能性,这可能是缺血性中风的潜在致病因素。
我们之前的文章也有关于这方面的详细介绍:
肠道菌群 —— 中风的关键参与者
然而之前的研究较少说明,短链脂肪酸对缺血性中风有保护作用。短链脂肪酸是肠道微生物发酵膳食纤维的最终产物,它的存在加深了微生物与宿主之间的联系。
根据最近的研究,通过移植富含短链脂肪酸的粪便微生物群,缺血性中风的恢复得到了有效改善。短链脂肪酸可能作为肠道菌群和大脑之间的媒介,参与调节缺血性中风的预后。
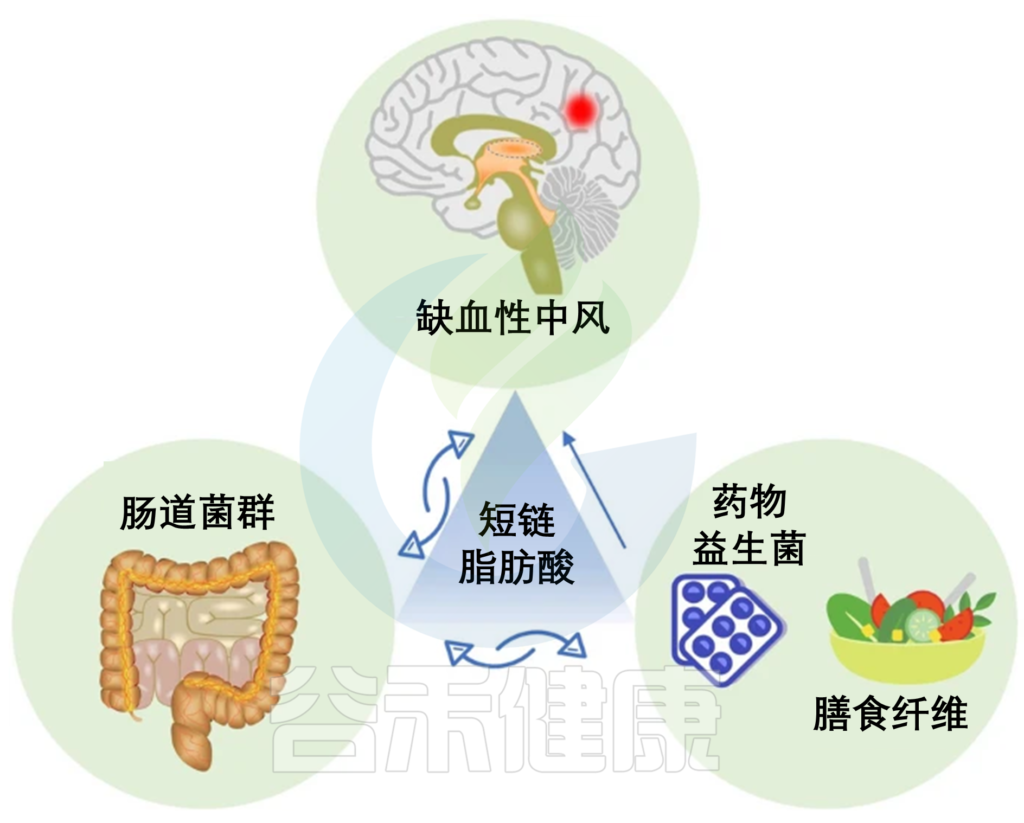
Fang Z, et al., Cell Mol Neurobiol. 2022
本文主要介绍关于缺血性中风和肠道菌群之间关系的研究,概述了短链脂肪酸作为它们之间桥梁的作用及其潜在机制,讨论了短链脂肪酸介导的治疗措施,如饮食、膳食补充剂(益生菌和益生元)、粪菌移植和药物治疗缺血性脑损伤的有益效果。
随着临床证据的不断增加,肠道菌群可能是中风的一个关键易感因素。
↓↓↓ 发现中风与肠道菌群关联的研究:
最早的一项横断面研究报告说,与健康、无症状的对照组相比,中风患者的条件致病菌更多。这种生态失调与中风的严重程度有关。
分析粪便中的有机酸浓度发现,中风患者的乙酸浓度显着降低,而戊酸浓度显着升高。然而,中风患者的总有机酸浓度降低。
这些研究表明:
中风会影响肠道微生物的多样性,并导致微生物代谢物发生相应的变化。
有了这个线索后,研究人员开始进一步探索中风、肠道菌群和短链脂肪酸之间的相关性。
↓↓↓ 进一步研究表明:中风患者的产短链脂肪酸菌及短链脂肪酸水平都较低
在大脑中动脉闭塞期间,小鼠的短链脂肪酸水平较低,尤其是丁酸盐。
研究人员认为,急性缺血性中风患者肠道菌群失调的特征是:产短链脂肪酸菌的低丰度和粪便短链脂肪酸的低水平,尤其是那些中风较严重的患者,短链脂肪酸水平与严重程度之间可能存在负相关,也就说,短链脂肪酸水平越低,中风严重程度越高。
↓↓↓ 然而事情没有这么简单。出现矛盾的是:
一项临床研究发现,在缺血性中风中,随着个体产生短链脂肪酸的增加,肠道菌群的调节异常。但由于没有相应地测量短链脂肪酸水平,因此无法确定这种失调是否会导致粪便短链脂肪酸水平发生实质性变化。
此外,肠杆菌科(条件致病菌)的扩张也是中风患者肠道菌群失调的主要表现之一,但肠杆菌科也能产生乙酸盐。
因此,中风患者短链脂肪酸低,可能不仅仅是由产短链脂肪酸菌的减少引起的,可能部分原因是不同菌群的协同效应。
除了疾病本身的进展,合并其他疾病(例如高血压、糖尿病)、年龄、饮食、吸烟和其他危险因素可能会加剧对缺血性脑损伤的病理生理反应,包括神经炎症。因此,肠道菌群对中风易感性和恢复的贡献是一个不断增长的研究领域。例如,高血压 、糖尿病、肥胖症和动脉粥样硬化,所有已知的中风危险因素都与肠道菌群密切相关。
↓↓ 肠道菌群与中风风险关联的研究:高风险人群条件致病菌多,产丁酸盐菌少
一项横断面研究评估了肠道菌群与中风风险之间的关联,发现中风高风险人群肠道中条件致病菌(例如肠杆菌科和韦荣氏菌科)的比例显着高于低风险人群。此外,产丁酸盐细菌的消耗和粪便丁酸盐水平低是中风风险增加的潜在因素。
▸ 中风后认知障碍:梭杆菌↑ 肠杆菌科↑
中风后认知障碍(PSCI)是中风后遗症之一。已有研究表明,PSCI患者肠道内梭杆菌含量增加,同时粪便中短链脂肪酸缺乏。研究人员进一步构建了基于肠道菌群和短链脂肪酸的PSCI风险预测模型,该模型能够准确预测中风发作3个月或更长时间后的PSCI。
另一项研究发现,与中风后非认知障碍组相比,PSCI组的肠杆菌科细菌增多。这些革兰氏阴性病原体可能会促进神经系统的炎症变化。此外,患有其他中风后共病精神障碍(如抑郁症和情感障碍)的患者的肠道菌群也可能发生相应的变化。
▸ 中风后吞咽困难:管饲易引发胃肠道不良反应
大约65%的中风患者表现出吞咽困难。为了降低中风后吞咽困难导致吸入性肺炎和营养不良的风险,经常使用管饲代替口服食物。
然而,最近的一项研究表明,当吞咽改善,恢复最初的口服摄入量时,中风患者的肠道菌群发生了变化。这可能是因为与肠内营养相比,口服食物的膳食纤维含量更高。
此外,与早期口服食物的患者相比,长期管饲患者接受治疗的时间更长,感染风险更高。长期肠内营养管理可能会产生许多胃肠道不良反应(例如腹泻、便秘、胃食管反流)。
▸ 为什么中风患者表现出对感染的易感性增加(肺炎和尿路感染等)?
——肠道通透性增加、细菌易位
在中风后感染的患者中检测到的大多数微生物是通常存在于肠道中的常见共生细菌,这可能与中风后肠道通透性增加以及共生细菌的易位和传播有关。值得一提的是,肠道菌群组分的改变可能会增加菌血症并改变宿主的免疫反应。
——产丁酸菌减少
此外,在一项前瞻性病例对照研究中,在中风患者住院24小时内,产丁酸的细菌很少,这可能会增加中风后感染的风险。
尽管肠道菌群和短链脂肪酸可能对大多数中风后并发症有显著影响,但迄今为止尚未对其潜在机制和治疗应用进行研究。
▸ 肠道菌群失调具体通过什么与中风产生关联?
随着临床证据的增加,中风引起的肠道菌群失调已逐渐被解开。然而,这种微生物失调可能是由肠道菌群-肠-脑轴中持续积累的“自上而下”信号引起的,而不是突然发作。
中风中的自下而上和自上而下的信号
Battaglini D, et al., Front Neurol. 2020
脑缺血会导致自主神经系统或 HPA 轴的紊乱,增加肠道通透性并改变肠道微环境。例如,条件致病菌积累,内毒素水平增加,产生短链脂肪酸的细菌耗尽,短链脂肪酸水平下降。反过来,这种改变会加剧中风或脑损伤并影响患者预后。

Fang Z, et al., Cell Mol Neurobiol. 2022
一般来说,微生物产生的短链脂肪酸可能与肠道菌群-肠-脑轴一起参与中风的病理生理学,短链脂肪酸影响中风的潜在机制将在后面章节讨论。
在缺血再灌注损伤和永久性缺血的情况下,神经炎症是中风进一步进展的关键因素。
炎症过程始于血管内。当缺氧发生时,活性氧(ROS)产生过多,从而激活补体、血小板和内皮细胞。内皮细胞中的氧化应激(ROS)会降低NO的生物利用度,从而间接影响血小板活性。
在脑缺血期间,未刺激的T细胞可能通过IFN-γ和ROS促进组织损伤。γδT细胞被小胶质细胞和巨噬细胞释放的IL-23激活,产生细胞毒性细胞因子IL-17,参与急性缺血性脑损伤。
然而,小胶质细胞和巨噬细胞也能促进Treg的成熟,分泌抗炎因子IL-10,抑制Th1和Th2反应,介导神经保护作用。
在健康条件下,调节性T细胞(Treg)和效应性T细胞处于动态平衡状态。而在缺血性中风中,这种平衡受到干扰。
中风后诱导的炎症反应可增加血脑屏障的通透性和脑水肿,扩大脑梗死面积,进一步加重缺血性脑损伤。
因此,研究人员继续测试免疫调节策略在中风患者中的治疗潜力。
肠道微生物群可能参与了中风的免疫调节。最近对啮齿类动物的两项研究表明,中风后的微生物群失调会导致效应T细胞(γδT细胞)从肠道迁移到大脑外的脑膜,从而加剧缺血性脑损伤。
中风后恢复健康的微生物成分和应用抗生素诱导微生物失调都可以减轻神经炎症,减少缺血性脑损伤。这一过程与Treg细胞的启动密切相关。
总体而言,肠道菌群可以调节宿主免疫系统,从而改善缺血性脑损伤。
对肠道菌群介导的免疫机制的研究仍处于起步阶段。然而,在这一复杂现象的背后,存在着通过生产短链脂肪酸的可能性。
在了解短链脂肪酸在中风中发挥作用之前,我们先来看下,短链脂肪酸是如何参与宿主免疫系统发挥作用。
短链脂肪酸是一种潜在的免疫调节因子,与各种免疫细胞相互作用,介导全身炎症反应。短链脂肪酸也影响小胶质细胞的结构和功能完整性,并激活与神经炎症相关的小胶质细胞。
丁酸盐:研究最多的是丁酸盐,具有抗炎作用。
丙酸盐:会引起炎症,但丙酸盐的这些数据可能仍有一定争议,组织特异性可能是一种解释。
乙酸盐:可以通过抑制炎症信号通路来减轻炎症反应。
短链脂肪酸在免疫和炎症中的作用
Yao Y, et al., Crit Rev Food Sci Nutr. 2022
在肠道上皮细胞中,短链脂肪酸可通过被动扩散和转运进入肠道组织。转运蛋白包括MCT1、MCT4、SMCT1和SMCT2。此外,短链脂肪酸还能激活肠上皮细胞中的G蛋白偶联受体(GPRs),引起一系列下游反应。短链脂肪酸可以调节许多免疫细胞的活动,参与宿主免疫系统的调节。
短链脂肪酸调节炎症的机制
Yao Y, et al., Crit Rev Food Sci Nutr. 2022
在巨噬细胞、中性粒细胞和树突状细胞中,短链脂肪酸可以通过G蛋白偶联受体激活MAPK通路,抑制β – arrestin2/NF-κ b通路,抑制环腺苷一磷酸(cAMP)的合成,促进钙离子(Ca2+)进入细胞核,从而调节与炎症和免疫相关的基因表达。此外,短链脂肪酸可通过被动扩散进入细胞,抑制线粒体/AMPK/mTOR通路,抑制组蛋白去乙酰化,通过促进MKP表达抑制MAPK通路。
↓↓↓ 粪菌移植研究:是什么改善中风小鼠脑损伤并提高存活率?
一项关于小鼠粪菌移植的研究发现,通过灌胃改变年轻中风小鼠(2-3个月)的微生物群,使其与老年小鼠(18-20个月)的微生物群相似,会增加死亡率和全身炎症反应。
相比之下,用年轻小鼠的肠道菌群对老年小鼠进行定植可以改善脑损伤并提高存活率。
老年小鼠的粪便短链脂肪酸水平和拟杆菌与厚壁菌的比率(B:F)显著低于年轻小鼠。
↓↓↓ 进一步研究:短链脂肪酸对缺血性中风具有保护作用
研究人员将富含短链脂肪酸的粪便微生物群移植到中风小鼠体内,可以减少神经功能缺损,消除脑水肿,减少梗死体积。有趣的是,通过直接灌胃补充丁酸盐也可获得类似的有益效果。因此,短链脂肪酸可能是影响中风恢复的关键代谢物。
↓↓↓ 进一步研究:微生物源性短链脂肪酸影响中风的潜在机制是什么?
Sadler等人提供了第一个证据,他们通过向中风小鼠的饮用水中添加短链脂肪酸来增加其循环短链脂肪酸浓度。
这种方法可以改善运动功能并调节中风后突触可塑性,但不会影响原发性脑梗死体积。
更重要的是,在没有淋巴细胞的情况下,即使补充了短链脂肪酸,小胶质细胞的数量和形态也没有显著改变。这表明淋巴细胞可能介导短链脂肪酸对小胶质细胞的调节作用。
另外的研究人员在中风小鼠中更直接地移植了四种产生短链脂肪酸的细菌和菊糖(一种增加产生短链脂肪酸的益生元)。研究发现,短链脂肪酸可增强肠道完整性,扩张肠道和大脑中的调节细胞(Treg),并减少中风后IL-17+γδT细胞在大脑中的浸润。
尽管小胶质细胞缺乏短链脂肪酸受体,但在小胶质细胞中发现了单羧酸转运蛋白的表达。这可能是一种小胶质细胞调节机制,不涉及短链脂肪酸受体,这需要在未来进一步验证。
★ 短链脂肪酸参与T细胞的极化和迁移
现有证据表明,T细胞可以通过分泌促炎和抗炎细胞因子来调节M1(促炎)和M2(抗炎)小胶质细胞的平衡。
此外,短链脂肪酸还促进了T细胞在生理条件下分化为效应T细胞,主要是通过增加Treg的数量和功能。有趣的是,在无菌小鼠中进行了中风后菌群再定植,这显著地诱导了Th1和Th17的极化。
另一方面,抗生素治疗导致Treg扩增和Th17细胞减少。因此,有理由怀疑短链脂肪酸参与了由肠道菌群失调诱导的T细胞极化过程。
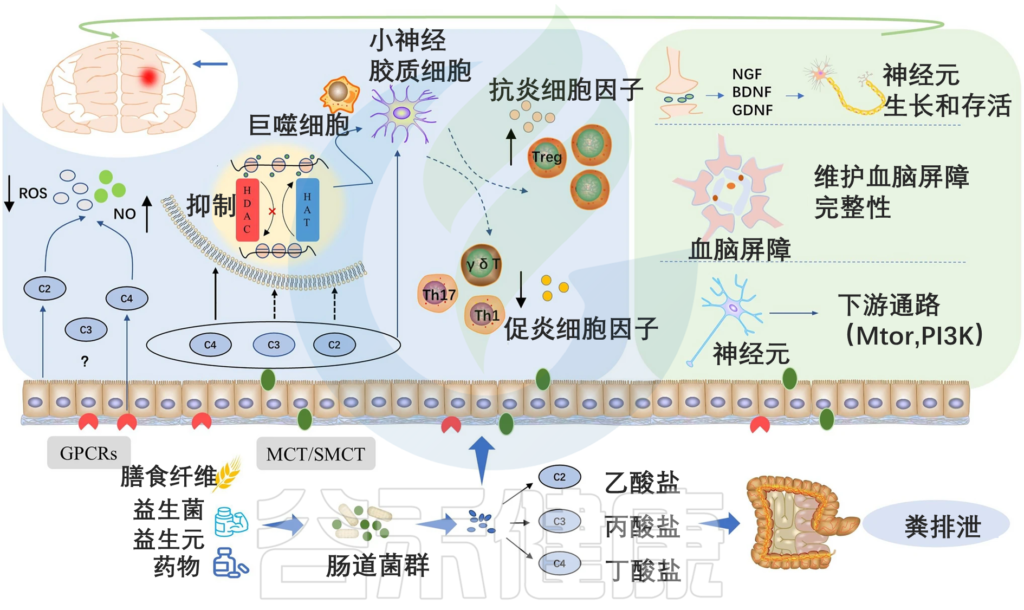
Fang Z, et al., Cell Mol Neurobiol. 2022
总之,短链脂肪酸可以诱导T细胞极化,从而影响免疫系统,从而改善缺血性脑损伤。此外,尽管没有直接证据,但短链脂肪酸可能参与T细胞向大脑的迁移。
★ 短链脂肪酸激活GPCR
GPCR与细胞周围的化学物质结合,包括气体、光敏化合物、激素、趋化因子和神经递质,并激活一系列细胞内信号通路,最终发挥不同的生理作用。
注:G蛋白偶联受体(GPCR)是一类由七个α螺旋组成的膜蛋白受体。
未知配体的两个GPCR(GPR41和GPR43)因与短链脂肪酸结合而改名为游离脂肪酸受体(分别为FFAR3和FFAR2)。
FFAR2更有可能结合较短的脂肪链(如乙酸盐),FFAR3优先结合较长的脂肪链,包括丙酸盐、丁酸盐和戊酸盐。此外,G蛋白偶联受体109A也可被丁酸和β-d-羟基丁酸激活。
短链脂肪酸通过激活肠上皮细胞上的GPR41和GPR43,导致快速丝裂原激活蛋白激酶信号、趋化因子和细胞因子。但到目前为止,只有少数研究探索了短链脂肪酸激活GPCR对中风有益作用的机制。
目前的一项研究表明,与乙酸盐和丙酸盐相比,经鼻给予低剂量丁酸钠(7.5 mg/kg)可显著减少大脑中动脉阻塞后的梗死体积,改善神经功能。
这可能与丁酸钠通过GPR41/Gβγ激活PI3K/Akt并减轻大脑中动脉阻塞后神经细胞死亡的机制密切相关。值得一提的是,丁酸盐和乙酸盐可以通过抑制氧化应激增加NO的生物利用度。有趣的是,丁酸盐的这种保护作用似乎取决于GPR41/43的激活,而乙酸盐的这种作用似乎独立于GPCR。
★ 短链脂肪酸抑制HDAC活性
组蛋白脱乙酰酶(HDAC)是一类修饰和调节染色体结构和基因表达的蛋白酶。在细胞核中,组蛋白乙酰化和组蛋白去乙酰化处于动态平衡,并由组蛋白乙酰转移酶和组蛋白去乙酰化酶共同调节。
研究表明,细胞内短链脂肪酸可以抑制HDAC活性,并且丁酸盐相对于其他短链脂肪酸具有较强的HDAC抑制作用。相比之下,乙酸盐几乎没有抑制作用。
大多数证明短链脂肪酸介导的HDAC抑制对中风影响的证据来自丁酸钠(SB)的动物研究。例如,在永久性缺血的大鼠模型中,皮下注射丁酸钠(300 mg/kg)可减少梗死体积,抑制小胶质细胞激活,并改善大鼠的运动、感觉和反射能力。
此外,研究人员发现SB在体外改变小胶质细胞中组蛋白3-赖氨酸9-乙酰化(H3K9ac,一种由HDAC调节的组蛋白修饰)的基因启动子。已经在小鼠中证实,SB可以通过表观遗传调节减少小胶质细胞介导的神经炎症,H3K9ac水平的上调可能是观察到的效应的一个重要原因。
令人惊讶的是,丁酸钠对脑缺血的改善作用在不同种类的大鼠和不同的给药方式下没有发生质的改变。除了减轻成人中风模型中的脑损伤,SB在新生儿缺氧-缺血中也具有潜在的神经保护作用。
除了小胶质细胞激活的表观遗传调节外,短链脂肪酸还具有与抑制HDAC活性相关的其他神经保护和神经营养作用。
例如,它们通过抑制诱导Treg细胞产生的HDAC,独立于游离脂肪酸受体调节mTOR-S6K通路。短链脂肪酸还上调神经递质和神经营养因子,如神经生长因子(NGF)、胶质细胞源性神经营养因子(GDNF)和脑源性神经营养因子(BDNF)的表达。
总之,短链脂肪酸目前可能通过影响T细胞极化、与FFAR相互作用以及抑制HDAC活性来影响中风预后。
然而,目前还没有研究探索短链脂肪酸在人类中的这些作用机制。在进一步探索短链脂肪酸影响中风的其他机制(免疫途径、内分泌途径和其他体液途径)的同时,研究短链脂肪酸作为调节剂在应用膳食短链脂肪酸补充剂、益生菌/益生元、FMT(恢复肠道微生物组成)的人类中风患者中的有效性和安全性将是未来研究的关键。
不同的饮食习惯可能会对肠道菌群产生不同的影响。例如,长期摄入西方饮食(高脂肪、高糖、低纤维)可能会减少肠道菌群多样性。饮食中富含复合碳水化合物的人的肠道菌群种类增加。生产短链脂肪酸所需的底物(膳食纤维)主要来源于饮食。
现在有大量证据表明,增加膳食纤维摄入可以降低心血管疾病(包括中风)的风险,这种有益的效果可能与循环短链脂肪酸水平的增加有关。
换句话说,增加膳食纤维的摄入可能是预防中风的有效方法之一。适当减少钠摄入量通常会对心血管系统产生有益影响,例如降低血压。此外,循环短链脂肪酸水平的增加可能维持心血管健康。
益生菌和益生元对宿主健康的益处已得到广泛研究和明确界定。益生菌中乳酸杆菌、丁酸梭菌Clostridium butyricum、地衣芽孢杆菌对中风的有益作用已在啮齿动物模型中得到证实。
最近一项针对肥胖女性的研究显示,在摄入益生菌混合物(菊粉和低聚果糖的混合物)长达三个月后,产丁酸菌显著富集。有趣的是,功能型大麦可以增加丁酸产生菌的数量,并增加肠道中的丁酸水平。
乳果糖(由果糖和半乳糖组成)是一种常见的益生元,在结肠中被肠道菌群转化为低分子量有机酸,并通过保持水分软化大便,常用于治疗中风后便秘。尽管乳果糖不是一种典型的益生元,但体外研究发现,它可以剂量依赖性地增加肠道中短链脂肪酸的水平(每天5克乳果糖,持续5天,可以产生完全的益生元效应)。
一项研究发现,乳果糖(20 g/kg)干预6周后,小鼠的肠道和血清短链脂肪酸水平发生改变。有趣的是,最近的一项研究发现,补充乳果糖可改善中风的功能预后,并降低中风后的炎症反应。
为了更好地利用益生菌和益生元之间的协同作用,创建了产品“合生元”,它是活性微生物(益生菌)和基质(益生元)的混合物。
一项实验研究发现菊糖和产短链脂肪酸菌之间有协同作用;与单独使用菊糖或单独使用产短链脂肪酸的菌相比,使用产短链脂肪酸菌和菊糖可改善中风后小鼠的神经功能缺损评分和行为结果。
此外,近年来的证据表明,益生菌对人体的影响不一定与活性微生物直接相关,而是活性微生物的代谢产物或细菌成分(后生物)至关重要-短链脂肪酸,一种被肠道菌群分解的植物多糖产品。
FMT可能是未来改善中风的潜在选择。然而,现有证据仍然很少,通过动物研究观察到的比较结果:移植富含短链脂肪酸的粪便微生物群可以改善中风后的脑损伤。
为了更好地阐明FMT在缺血性中风中的作用,有必要进一步扩大对小鼠FMT的研究,以探索有利于脑损伤恢复的肠道微生物群组成,并评估其安全性。在阐明FMT的潜在益处后,开始将其转化为人体试验。
除了可以影响肠道菌群和短链脂肪酸的抗生素,中风患者常用的药物阿托伐他汀可以逆转微生物组成,增加粪便丁酸水平,并增强中风患者的肠道屏障功能。这表明肠道微生物群和短链脂肪酸可能参与阿托伐他汀的抗炎作用。然而,其他常用于治疗中风的药物(如抗血小板和抗高血压药物)是否也发挥类似作用仍有待研究。
白藜芦醇是一种潜在的HDAC抑制剂,可增加产短链脂肪酸菌的数量。此外,白藜芦醇和丙戊酸钠(一种结构类似于丁酸盐的短链脂肪酸)的联合使用,减轻了缺血性中风的脑损伤。
关于白藜芦醇,详见:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
总的来说,药物会引起肠道菌群的改变。这种改变对中风的发展是有益的还是有害的,对中风的预后是重要的还是无关紧要的,都需要根据药物的类型进行进一步的探索和发现。
本文讨论了有关短链脂肪酸作为肠道菌群和缺血性中风之间桥梁,是如何影响中风的,通过机制的阐明,发现它们可以通过调节饮食、饮食补充、FMT等干预措施,调节缺血性中风的预后。
虽然短链脂肪酸和缺血性中风之间的联系在动物研究中逐渐得到巩固,但人类研究并没有同步进行。需要进一步扩大研究,以探索特定肠道菌群或短链脂肪酸的长期益处,并随后扩大转化为人体试验。
短链脂肪酸作为缺血性中风的潜在调节剂,为缺血性中风的菌群靶向治疗开辟了新的可能性。
主要参考文献:
Fang Z, Chen M, Qian J, Wang C, Zhang J. The Bridge Between Ischemic Stroke and Gut Microbes: Short-Chain Fatty Acids. Cell Mol Neurobiol. 2022 Mar 28. doi: 10.1007/s10571-022-01209-4. Epub ahead of print. PMID: 35347532.
Battaglini D, Pimentel-Coelho PM, Robba C, et al. Gut Microbiota in Acute Ischemic Stroke: From Pathophysiology to Therapeutic Implications. Front Neurol. 2020;11:598. Published 2020 Jun 25. doi:10.3389/fneur.2020.00598
Pluta R, Januszewski S, Czuczwar SJ. The Role of Gut Microbiota in an Ischemic Stroke. Int J Mol Sci. 2021 Jan 18;22(2):915. doi: 10.3390/ijms22020915. PMID: 33477609; PMCID: PMC7831313.
Zeng X, Gao X, Peng Y, et al. Higher Risk of Stroke Is Correlated With Increased Opportunistic Pathogen Load and Reduced Levels of Butyrate-Producing Bacteria in the Gut. Front Cell Infect Microbiol. 2019;9:4. Published 2019 Feb 4. doi:10.3389/fcimb.2019.00004
Roy-O’Reilly M, McCullough LD. Age and Sex Are Critical Factors in Ischemic Stroke Pathology. Endocrinology. 2018;159(8):3120-3131. doi:10.1210/en.2018-00465