 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

嗜黏蛋白阿克曼菌(Akkermansia muciniphila, 简称A. muciniphila, Akk菌)的缺乏或减少与多种疾病(如肥胖、糖尿病、肝脂肪变性、炎症和对癌症免疫治疗的反应)有关。
关于AKK菌,我们之前的一篇文章也有详细介绍过,点击详见:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
谷禾肠道样本大数据库显示A. muciniphila缺乏或未检出情况在人群中很常见,尤其是那些有肠道问题的人。在健康个体中其约占肠道微生物群总数的0.5%–3%。
现如今,关于AKK菌的研究正在从动物模型转向人类验证试验,AKK菌与疾病之间的研究不仅仅停留在相关性,更是开始向因果性及具体产生作用的机制方面深入探讨。
– A. muciniphila –
本文我们将依次介绍A. muciniphila的起源,主要特性,以及它与不同疾病间的联系,并解释产生有益作用的主要机制。
一所在瓦格宁根(Wageningen)的微生物实验室的研究人员使用一种专门用于分离优势细菌的策略,即稀释到消亡(即基于连续稀释的分离),从一名健康成人身上分离出一株高度丰富的粘液降解菌株。
该菌株似乎是疣微菌门(Verrucomicrobiota)中一个新属的新种,被命名为嗜黏蛋白-阿克曼菌(Akkermansia muciniphila, A. muciniphila, Akk菌),并以典型菌株MucT为代表。
粘液主要由粘蛋白组成,粘蛋白是一种由粘多糖组成的保护肠道细胞的糖蛋白。
长期以来,粘液的降解被认为是一种可能导致宿主紊乱的不良特性。然而,对于结肠微生物群来说,粘蛋白在肠道中大量分泌,因此提供了持续的宿主产生的碳、能量和氮源。粘蛋白的代谢转换需要一组酶,如唾液酸酶和硫酸酯酶,这些酶参与顺序降解。
粘蛋白降解“专家”
A. muciniphila 是人类早期生命中存在的独特的粘蛋白降解“专家”。此外,对无菌小鼠的单体型关联研究表明,A. muciniphila MucT不会损害宿主,并在结肠中显示出特异性的代谢和免疫信号。其2.7Mb的基因组预测了粘蛋白降解的酶机制,比较生长分析表明,A. muciniphila是体外利用粘蛋白最有活性的菌株。
A. muciniphila MucT也可以利用人乳寡糖作为能量来源。值得注意的是,在纯培养中,只有少数其他底物被发现能刺激其生长,包括二甲双胍、甜菜碱和色氨酸。
由于A. muciniphila是人类肠道中疣微菌门的唯一代表,许多报道这一门的16S rRNA基因序列调查往往代表A. muciniphila 。最近的一项研究分析了2,000多个Akkermansia基因组,表明A. muciniphila是迄今为止具有高度相似(超过98%同一性)16S rRNA 序列的优势物种。
非工业化人群A. muciniphila下降
在这个大型宏基因组数据库中对四个已确定的A. muciniphila亚种的详细分析表明,它们的基因组通常存在于西方和中国人群中。对哈扎部落和其他非工业化人群的肠道微生物群与工业化世界个体的肠道微生物群进行分析比较,发现拟杆菌纲和疣微菌门微生物群的丰度减少。这些结果表明,非工业化种群的A. muciniphila丰度水平有所下降,但这一观察结果是否与粪便样本保存、DNA提取或测序深度的技术问题有关仍有待调查。
值得注意的是,A. muciniphila宏基因组已在非人类灵长类动物中发现,包括野生和圈养。类似地,与模式菌株MucT具有高度基因组同源性的A. muciniphila已从同样生活在野外的各种动物中分离出来。
部分A. muciniphila菌株产维生素B12
长期以来,A. muciniphila型菌株MucT是唯一可用的人类分离株然而,在过去的 5 年中,从不同的肠道环境中分离到了其他A. muciniphila菌株,包括野生哺乳动物和圈养哺乳动物,特别是人类。在临床前试验中报告了人类相关 A. muciniphila菌株之间的一些变异性,但尚不清楚观察到的差异的稳定性和可重复性如何。
迄今为止,观察到的菌株之间最显著的代谢差异是产生维生素B12的能力,而维生素B12是产生丙酸盐所必需的。大约三分之一的A. muciniphila分离株能产生类似于A. glycaniphila的维生素B12。多种结肠微生物可以产生可供A. muciniphila利用的维生素B12,正如霍氏真杆菌(Eubacterium hallii)(重命名为Anaerobutyricum soehn genii)所显示的那样,在共培养实验中,发现该细菌与菌株MucT形成微生物网络,导致从粘液中产生丙酸盐和丁酸盐。
代谢紊乱
由于观察到益生元补充剂(即低聚果糖)对肥胖发育的保护作用与啮齿动物疣微菌门的主要繁殖相吻合,因此引起了人们对A. muciniphila和代谢紊乱的兴趣。随后在人类和啮齿动物上进行的观察研究都表明,与瘦小的对应物相比,患有肥胖症的个体肠道中的A. muciniphila反复出现表达不足。代谢紊乱,包括肥胖、T2DM、非酒精性脂肪性肝病(NAFLD)和心血管疾病,都与Akkermansia spp.丰度减少有关。
研究发现,11名超重者和38名肥胖者体内A. muciniphila的丰度与更健康的代谢状态以及热量限制后较好的临床结果呈正相关。通过在小鼠和人类身上注射该模式菌株,研究了A. muciniphila在肥胖过程中的因果作用及其潜在的有益影响。首次证明,小鼠每天服用活的A. muciniphila MucT可以逆转高脂饮食引起的代谢紊乱,包括脂肪增加、代谢内毒素、脂肪组织炎症和胰岛素抵抗。
在合成培养基中生长的A. muciniphila MucT的巴氏杀菌增强了它减少小鼠脂肪团发育、胰岛素抵抗和血脂异常的能力。事实上,A. muciniphila MucT可以降低小鼠的胆固醇水平和血清甘油三酯水平。
代谢健康背景下黏质阿克曼菌的代谢效应及主要影响因素
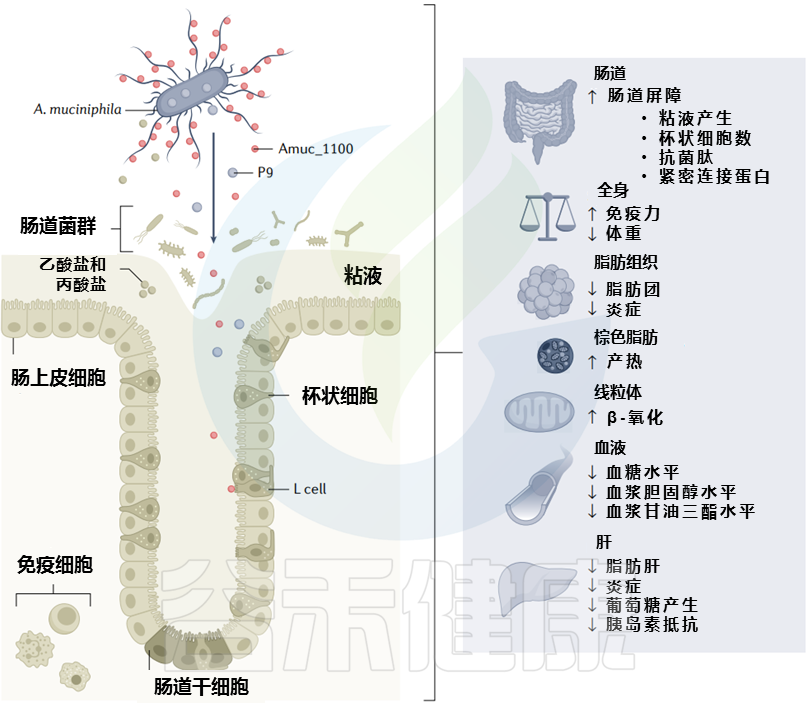
Cani PD, et al. Nat Rev Gastro Hepat. 2022
影响肝脏脂肪代谢
研究发现A. muciniphila MucT补充剂通过调节与脂肪合成有关的基因的表达(例如,降低肝脏中固醇调节元件结合蛋白的表达)和不同的炎症标志物(例如,降低IL-1β和IL-6的表达,ALT和髓过氧化物酶活性),可以积极地影响小鼠的肝脏脂肪代谢,预防非酒精性脂肪性肝病。
减轻动脉粥样硬化
在动脉粥样硬化发展的小鼠模型(载脂蛋白E缺陷(ApoE−/−)小鼠)中,A. muciniphila MucT的注射似乎减轻了动脉粥样硬化的损害。
降低糖尿病发病率
有趣的是,除了T2DM,在啮齿类动物和人类中,A. muciniphila通过降低肠道通透性、减少炎症和胰岛炎症的机制减少了T1DM的发病,从而有助于胰岛的保存。早期应用万古霉素可增加非肥胖型糖尿病小鼠(T1DM小鼠模型)的A. muciniphila丰度,降低糖尿病发病率。
神经退行性疾病
2016年至2020年间发表的几份报告表明,A. muciniphila在帕金森病和多发性硬化症中的作用,因为其相对丰度与受影响患者的疾病严重程度呈正相关。然而,尽管将患者的粪便微生物移植到无菌小鼠体内会导致疾病某些方面的发展,但这些研究都没有检测到受体小鼠粪便中的A. muciniphila,从而表明其他细菌可能参与了该病的发生表型。
多发性硬化症
对于多发性硬化症,在一项纳入62名复发缓解性疾病患者的研究中,作者发现脑脊液中的抗-Akkermansia IgG水平高于健康同行,并且局部脑脊髓特征与残疾评分呈正相关,而在同一个人的血液中检测到IgG水平没有明显的改变。
虽然在这些研究中观察到的抗-Akkermansia IgG水平的增加与肠道中嗜粘蛋白A. muciniphila丰度的改变无关,但另一项研究提供了支持 A. muciniphila在多发性硬化症中的积极和有益作用的机制解释。
这项研究表明,在多发性硬化症实验性自身免疫性脑脊髓炎小鼠模型的粪便和未治疗的多发性硬化症高峰期患者的粪便中发现的A. muciniphila的大量繁殖与miR-30d的富集有关。
有人发现,从这些小鼠或人类身上收集的粪便的转移导致A. muciniphila的丰度增加,并有利于调节性T (Treg)细胞的扩增,进而控制效应T细胞以抑制疾病症状。研究人员表明在患有多发性硬化症的小鼠中接种A. muciniphila可降低疾病评分、减少轴突损失的脱髓鞘和增加Treg细胞群。
相反,A. muciniphila衍生肽被确定为环境因素,与多发性硬化症(即HLA-DR15单倍体型)最强的遗传风险易感因素相结合,可以介导免疫调节介导的患者自身反应性T细胞的激活。
更具体地说,从患者体内分离出的 HLA-DR-SP反应性 CD4+ T细胞可以被某些外来因子(例如Epstein-Barr病毒和从A. muciniphila中分离出的一些肽)激活,然后对血液中的潜在致病多肽或自身抗原(如髓鞘碱性蛋白)产生反应,可能还会在脑脊液和/或脑中发生交叉反应,从而针对脑组织。
帕金森病
文献中关于阿尔茨海默病和A. muciniphila的发病机制存在差异,相关研究显示阿尔茨海默病患者的A. muciniphila含量较高,而干预研究清楚地报告了这种细菌在病理学中的有益作用。阿尔茨海默病是一种疾病,其最强的病理标志之一是淀粉样蛋白β肽42 (Aβ42)在老年斑中的积累。
由于肥胖和T2DM是痴呆的重要危险因素,一项机制研究探讨了在喂食高脂肪饮食的阿尔茨海默病小鼠模型中施用A. muciniphila的影响。除了抗肥胖作用外,无论饮食如何,接种都能显着减少大脑中的 Aβ并改善认知测试的表现。A. muciniphila给药还恢复了生命早期(生命3周时)暴露于高脂肪饮食的小鼠的认知能力下降和海马发育障碍。
癌症免疫治疗反应
免疫疗法是一种利用免疫系统对抗肿瘤形成细胞的癌症疗法,并已发展成为治疗各种癌症的成功方法。
肠道微生物组的相关性是增强对检查点抑制剂治疗的临床反应的标志物和辅助剂。
该疗法通过阻断程序性死亡受体1(PD1)等免疫检查点来恢复对抗癌细胞的活性。对100名对抗-PD1抗体反应良好的非小细胞肺癌和肾细胞癌患者的微生物组进行了详细的表征,结果显示A. muciniphila富集。此外,在疾病进展迅速的个体和后来死亡的个体中,A. muciniphila的患病率最低(34%)。
A. muciniphila菌株在用抗-PD1 药物治疗后,在移植无应答者粪便的无菌小鼠和预先暴露于抗生素的小鼠中改善了抗肿瘤活性。一项具有统计学意义的研究旨在专门评估338例非小细胞肺癌患者的A. muciniphila 基线检测与临床反应之间的关联。证实了A. muciniphila的存在与临床反应之间的密切关联。
在另一项研究中,42名主要使用抗-PD1药物治疗的转移性黑色素瘤患者的肠道微生物群也被证实富含多种分类群,包括Akkermansia。2020 年发表的一项研究确定肌苷是抗癌细胞活性的潜在因素,尽管这种核苷是由许多其他细菌产生的。
总之,这些研究表明,A. muciniphila是一种有望提高对检查点抑制剂免疫疗法的临床反应的候选菌。
肠道屏障和肠道炎症
最初发现A. muciniphila MucT 可以通过恢复小鼠的粘液层厚度以及抗微生物肽Reg3g的肠道表达来改善肠道屏障功能,这在肥胖和代谢紊乱期间都会发生改变。后来,在A. muciniphila MucT补充剂中观察到的粘液层厚度增加与小鼠粘液产生细胞数量的增加有关。
此外,来自A. muciniphila MucT (AmEVs)的细胞外囊泡,也显示通过调节小鼠的紧密连接来降低肠道通透性。
肠道炎症的情况下保护的肠道屏障
已有研究表明,与健康人相比,克罗恩病 (n = 26)和溃疡性结肠炎(n = 20和n = 15 ) 患者相比,A. muciniphila显著减少。这种相关性已在临床前模型中进行了因果研究。
改善结肠炎
已发现A. muciniphila MucT在结肠炎中的有益作用,AmEVs可保护葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎的进展。
随后,几项研究观察到A. muciniphila MucT细胞恢复肠道屏障功能并改善了:
改善衰老引起的变化
衰老是另一种肠道屏障减少和炎症增加的情况。各种人类研究报告称,与年轻成人(<50岁)和百岁老人相比,老年人(>65岁)的A. muciniphila丰度较低。
这一发现导致了旨在评估A. muciniphila MucT给药对不同衰老小鼠模型中几个年龄相关参数的影响的研究。
总之,这些研究表明,施用A. muciniphila MucT改善了一些与年龄相关的变化,包括炎症、屏障完整性和行为。
代谢综合征
在啮齿动物中,A. muciniphila被认为是健康的生物标记物。在啮齿类动物中,许多对A. muciniphila种群具有生长促进作用的膳食补充剂因其促进健康的作用而受到广泛关注。
在患有代谢综合征的人类中,给药被证实是可行的、安全的和有良好的耐受性。事实表明,与炎症、血液学、肾脏、肝脏和肌肉功能相关的任何标志物的变化,都可以用任何A. muciniphila MucT制剂来观察。这一结果是在不考虑所使用的形式以及短期(即2周)和长期(即3个月暴露)的情况下观察到的。
巴氏灭菌Akk菌比活菌效果好
以前的结果表明,高压灭菌灭活A. muciniphila可消除其对小鼠代谢综合征的保护作用。对植物乳杆菌或干酪乳杆菌菌株进行的研究表明,不剧烈的热诱导灭活,如巴氏杀菌,可以使细菌在稳定它们的同时保留部分有益的特性。
因此,有人在相同的饮食诱导肥胖小鼠模型上,通过比较活菌和巴氏灭菌菌的给药效果,检验A. muciniphila巴氏灭菌的效果。结果是,接受巴氏灭菌菌株的小鼠在体重、脂肪质量增加、血脂和胰岛素抵抗标志物方面的降幅甚至比接受活细菌的小鼠更大。除了提高A. muciniphila粘液的有效性,巴氏杀菌还具有提高菌稳定性和延长其保质期的好处,从而便于给人服用。
在未经治疗的患者中,给予巴氏灭菌A. muciniphila MucT成功地防止了与代谢综合征相关的参数的自然恶化。与补充安慰剂的志愿者相比,补充已过活的A. muciniphila MucT显著改善了胰岛素敏感性,降低了胰岛素血症和血浆总胆固醇水平。
为了进一步评估巴氏灭菌A. muciniphila MucT的安全性,对大鼠进行了一项强有力的毒理学长期评估。结果表明,口服90天,即使在测试的最高剂量(每公斤体重9.6×1010A. muciniphila MucT细胞,没有观察到不良反应的水平)下,也没有转化为亚慢性毒性,而体外遗传毒性试验显示阴性结果。
如前面所述,A. muciniphila可能有多种作用模式,所有这些都已用 MucT菌株进行了研究。当使用巴氏杀菌细菌时,可以观察到A. muciniphila MucT的几种有益效果和令人惊讶的功效增加。
产短链脂肪酸,作用于宿主代谢
最明显的答案是短链脂肪酸(如丙酸盐)的一般作用,因为A. muciniphila MucT在维生素B12存在下被称为丙酸盐生产者。虽然A. muciniphila对肠道中丙酸盐总水平的贡献可能相对于其他主要的丙酸盐生产者(例如拟杆菌)相对较低,尤其是在禁食条件下。但 Akkermansia似乎在动物和人类中都上调,并且可能对生产这种短链脂肪酸做出重大贡献。
在这种情况下,某些影响可能与肠道上皮细胞和肠道黏膜中存在的不同类型免疫细胞上表达的FFAR3和FFAR2受体(也分别称为GPR41和GPR43)有关。然而,值得注意的是,巴氏杀菌的 A. muciniphila MucT也可以作用于宿主代谢,不会改变丙酸盐的产生。
通过外膜上的蛋白质Amuc_1100发挥作用
2017年,有人确定了A. muciniphila MucT可以在宿主健康中发挥作用的特定和独特的分子机制。他们发现存在于A. muciniphila外膜中的一种特定蛋白质,称为Amuc_1100,概括了这种细菌的有益作用。A. muciniphila的所有有益作用是否都可归因于Amuc_1100目前尚不清楚,但其每个细胞的生产水平足以解释临床前模型中的作用。
重要的是,他们发现这种蛋白质在用于巴氏杀菌的温度下仍保持其活性构象,从而解释了为什么巴氏杀菌的A. muciniphila MucT在小鼠和人体实验中保持活性。
此外,发现Amuc_1100可激活Toll样受体2 (TLR2),单独给药可复制A. muciniphila MucT细胞的大部分有益作用,包括在肠道炎症和结肠癌的特定疾病模型中的作用。
这一发现表明,即使死亡(即巴氏杀菌后),A. muciniphila MucT仍然可以改善宿主健康,并反对需要潜在的分泌代谢物来观察细菌的有益作用。
外膜上的蛋白质 P9,刺激GLP1水平增加
2021年的一项研究确定了A. muciniphila MucT产生的另一种蛋白质。发现A. muciniphila处理的饮食诱导的肥胖小鼠在口服葡萄糖挑战期间表现出循环GLP1水平略有增加。
通过体外实验,作者鉴定了一种84kDa的蛋白质,命名为蛋白 9(P9;由早期鉴定的 Amuc_1831 基因编码),它负责体外刺激GLP1。
在体内,他们测试了 8周以非常高的剂量口服P9的效果,发现体重增加和脂肪量增加都有所减少,胰高血糖素前体(即GLP1的前体)的肠道表达增加。
这些影响怎么与较高的循环 GLP1 水平联系起来?
研究发现P9的药理作用激活 ICAM2,这些作用与可能的GLP1分泌有关,因为抗-ICAM2抗体在体外部分消除了P9对GLP1分泌的影响。
此外,A. muciniphila MucT增加了小鼠回肠中IL-6的表达。除了证实IL-6是一种促炎细胞因子外,这种细胞因子还在体外剂量依赖性地增加GLP1的分泌。
因此,有人假设A. muciniphila MucT也可以通过 IL-6-GLP1信号传导发挥作用。为了进一步支持他们的发现,研究人员使用了IL-6敲除小鼠,发现这些小鼠对P9诱导的GLP1分泌没有反应,而阻断GLP1受体也消除了P9对产热的影响。尽管这些发现是相关的,但应评估其他因素,例如P9的生理剂量和位置(可能被分泌)。
与Akkermansia或相关分子在疾病中的作用相关的主要机制
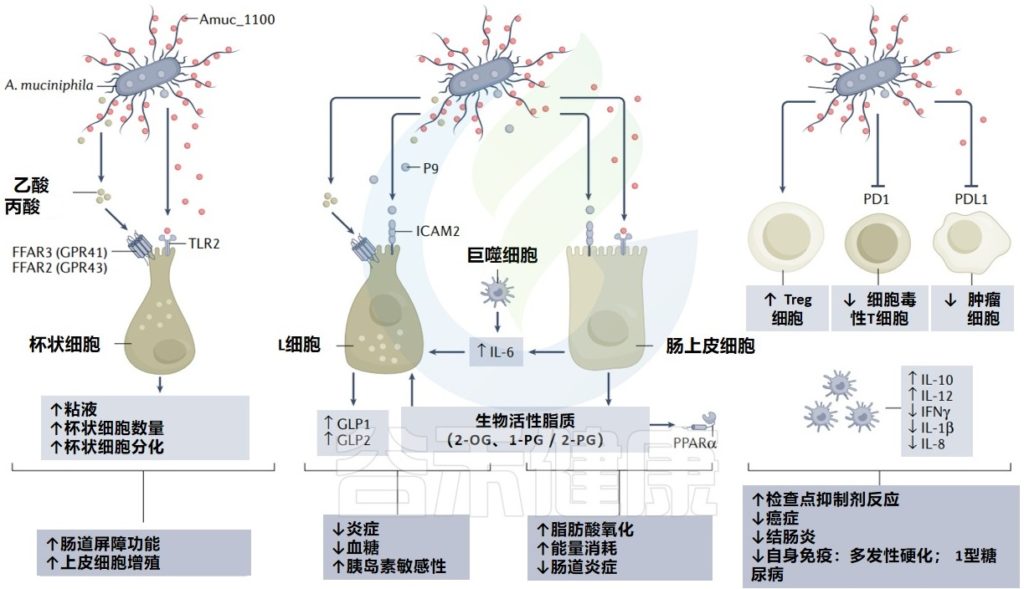
Cani PD, et al. Nat Rev Gastro Hepat. 2022
A. muciniphila MucT表达的酶潜在益处
一项研究证明天冬氨酸蛋白酶Amuc_1434*通过TRAIL介导的细胞凋亡途径抑制LS174T细胞活力。然而,没有进一步的位置、热稳定性或体内数据报告,因此尚无法评估这一发现的潜在和生理相关性。
第二项研究表明,A. muciniphila MucT表达的β-乙酰氨基己糖苷酶Amuc_2109*保护小鼠免受DSS诱导的结肠炎;然而,尚未报告热稳定性数据。
此外,已在人类身上表明,活的或巴氏杀菌的A. muciniphila MucT 改善了几种心脏代谢风险因素,包括胰岛素抵抗,而不增加 GLP1 的循环水平,也不影响 DPP4 活性,DPP4 是一种参与 GLP1 降解的酶。
有趣的是,无论使用何种形式的A. muciniphila MucT——活的或巴氏杀菌的,甚至是蛋白Amuc\U 1100,文献中的所有数据都通过作用于不同的关键标记物来强化肠道屏障。
事实上,所有的治疗都指向更高的粘液产量,紧密连接蛋白的恢复,抗菌因子的恢复,以及最终加强肠道屏障。
特异性调节
此外,一部分人通过对用活的或巴氏杀菌的 Akkermansia治疗的人体进行脂质组学和代谢组学分析。已经发现A. muciniphila MucT治疗诱导了不同生物活性脂质的特异性调节,这些被鉴定为 PPARα 激动剂(2-PG和1-PG)。
重要的是,在人类中使用非靶向代谢组学分析,他们已经能够重建一条指向通过β-氧化激活脂肪酸氧化的代谢途径,并且所有鉴定的代谢物都在PPARα的控制下趋向于增加线粒体活性,这些数据也在啮齿动物身上得到了证实。
除了对肠道屏障的影响,这可能涉及对几种疾病(即糖尿病、肥胖症、NAFLD和/或非酒精性脂肪性肝炎、炎症性肠道疾病、多发性硬化症)的保护作用,A. muciniphila对癌症的作用也是与依赖免疫系统的其他机制有关。
例如,使用检查点抑制剂(抗-PD1)的免疫疗法与动物数据中涉及 IL-12 依赖性效应的特定机制方面有关。此外,数据表明A. muciniphila菌株对抗-PD1反应的辅助作用增加了特定T细胞向肿瘤床的募集。
在炎症性肠病、T1DM或肠癌的小鼠模型中,A. muciniphila MucT或特定蛋白增加Treg细胞群的分化或降低结肠中浸润性巨噬细胞和CD8+细胞毒性T淋巴细胞的水平。
A. muciniphila MucT的代谢和抗炎作用是强大的,因为来自不同研究团队的许多结果已经证实了A. muciniphila菌株的各种健康特性。
A. muciniphila的生理和有益作用是多效性的(例如,能量、脂质、葡萄糖代谢、炎症、免疫、脑功能),重要的是要强调有许多汇聚的作用模式,可能是由于其特异性特性与其粘蛋白代谢的特化有关。
事实上,已经确定了几种常见的途径,都指向调节肠道屏障功能(即粘液产生和免疫系统)。肠道屏障的恢复,也有助于恢复几种改变的途径的正常功能,包括例如线粒体活性、肝脏代谢、脂肪组织和大脑活动。
最后,A. muciniphila MucT的有益作用已从临床前观察转化为代谢综合征背景下的人类干预。这种情况是独一无二的,是其他下一代微生物无法比拟的。
需要注意的是,虽然A. muciniphila具备各种有益特性,但是该菌丰度并不是越多越好,要保持在合适范围。谷禾肠道菌群检测结果中曾经有案例,发现该菌丰度过高,占比超50%。
该菌过量将过度消耗粘液蛋白而存活下来,这是大多数其他细菌所缺乏的生存优势,该菌增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、LPS 进入血液的增加、自身免疫性疾病有关。
该样本检测报告也显示菌群多样性低,肠炎和几项慢病注意风险:
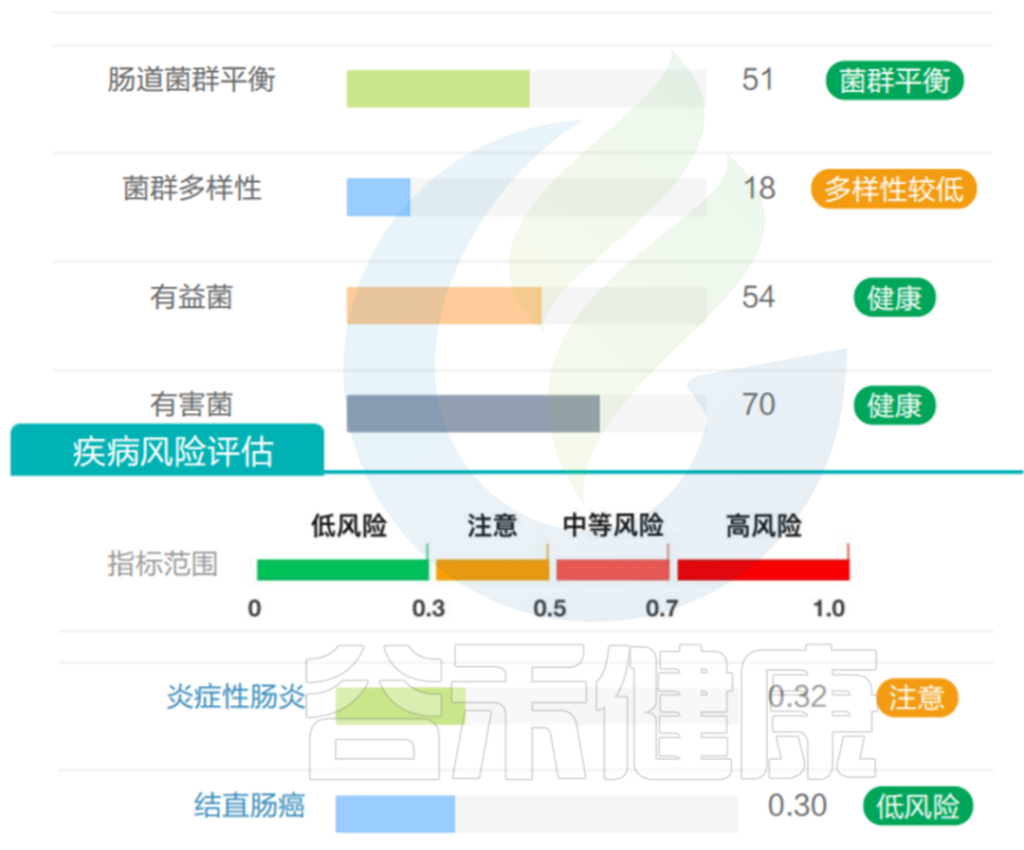
<来源:谷禾健康数据库>
总的来说,在合理范围内,A. muciniphila 带来有益影响。
当然也需要更多的研究来支持A. muciniphila的有益特性及临床治疗应用:
主要参考文献
Cani PD, Depommier C, Derrien M, Everard A, de Vos WM. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms. Nat Rev Gastroenterol Hepatol. 2022 May 31. doi: 10.1038/s41575-022-00631-9. Epub ahead of print. PMID: 35641786.
Kostopoulos I, Elzinga J, Ottman N, Klievink JT, Blijenberg B, Aalvink S, Boeren S, Mank M, Knol J, de Vos WM, Belzer C. Akkermansia muciniphila uses human milk oligosaccharides to thrive in the early life conditions in vitro. Sci Rep. 2020 Aug 31;10(1):14330. doi: 10.1038/s41598-020-71113-8. PMID: 32868839; PMCID: PMC7459334.
Yin J, Song Y, Hu Y, Wang Y, Zhang B, Wang J, Ji X, Wang S. Dose-Dependent Beneficial Effects of Tryptophan and Its Derived Metabolites on Akkermansia In Vitro: A Preliminary Prospective Study. Microorganisms. 2021 Jul 14;9(7):1511. doi: 10.3390/microorganisms9071511. PMID: 34361945; PMCID: PMC8305782.
Paone P, Cani PD. Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut. 2020 Dec;69(12):2232-2243. doi: 10.1136/gutjnl-2020-322260. Epub 2020 Sep 11. PMID: 32917747; PMCID: PMC7677487.

谷禾健康


嗜粘蛋白-阿克曼氏菌(Akkermansia muciniphila,A.muciniphila),简称为 AKK,于 2004 年发现,是一种从人类粪便中分离出来的椭圆形革兰氏阴性细菌。
该细菌以荷兰微生物生态学家 Anton DL Akkermans 的名字命名,以表彰他对该领域的贡献。A. muciniphila 是人类肠道共生菌,并可以依靠肠粘液层的黏蛋白生存。
在过去十年中,越来越多的研究证明,在糖尿病、心血管疾病、疾病性肠病、神经疾病发现A. muciniphila丰度降低。最近的干预研究还证实如茶或富含多酚水果的饮食可增加其丰度,有助于改善糖尿病和肥胖个体的代谢功能。
总的来说,来自动物和人类研究的越来越多的证据表明A. muciniphila将成为下一代有临床应用前景的益生菌。尤其是它在预防和治疗糖尿病、肥胖症及癌症,这对未来的研究具有重要意义和发展。
A. muciniphila是一种厌氧、革兰氏阴性、无运动、没有内生孢子的卵圆形肠道细菌,其最适生长温度是37℃,最适生长pH为6.5,该菌的倍增时间大约是1.5 h。A. muciniphila属于疣微菌门,事实上,它是人类粪便样本中发现的属于这个特殊门的唯一物种。
值得注意的是,A. muciniphila具有一定的耐氧性,其暴露在空气中24 h,仍然有1%以上的存活率。此外,研究还发现低氧气浓度(纳摩尔)下可以显著促进A. muciniphila的生长。
A. muciniphila单独或者成对存在,很少成链生长,其代谢产物为乙酸盐、丙酸盐、1,2-丙二醇等。
在提供蛋白源的基础培养基中,加入N-乙酰氨基葡萄糖、N-乙酰半乳糖胺和葡萄糖作为能源,A. muciniphila可以生长,但是在果糖和纤维二糖等其他糖类作为能源的培养基中A. muciniphila不能生长,说明该菌的生长繁殖需要蛋白质。
A. muciniphila的特别有趣之处在于,与大多数其他有益细菌不同,它不完全依赖于我们的饮食来喂养。即使消化道中没有营养物质,它也会以粘膜层中的粘蛋白为食。
Akkermansia Muciniphila一般通过母体获得, 通常在儿童中大量存在,并随着年龄和疾病而减少。将其恢复到最佳水平可以带来许多好处。
肠道中低浓度的Akkermansia muciniphila可能表明黏液层较薄,从而导致肠道屏障功能减弱,此外还会增加细菌毒素的易位,炎症性肠病、哮喘、肥胖症和 II 型糖尿病患者的Akkermansia muciniphila浓度往往较低。
我们知道整个胃肠道 (GI) 的粘膜完整性对于维持人体健康至关重要。这其中,粘液屏障的完整性是胃肠道的第一道防线。肠道黏液层的周转包括黏液的合成、分泌和降解,这是一个需要调节和平衡的微妙过程,以确保黏液保持最佳的保护功能。
粘液由多种成分组成:水 (90%–95%)、电解质、脂质 (1%–2%)、蛋白质等。这种粘液是一种稀的、水性和粘弹性的分泌物,这要归功于被称为粘蛋白的特定粘液蛋白,它是粘液中存在的主要结构和功能成分,浓度为 1%–5%。
粘蛋白是一个大的、复杂的、糖基化的蛋白质家族,其特征是一个重要的元素,即“粘蛋白结构域”。它由一个蛋白质核心组成,该核心由含有氨基酸残基脯氨酸 (Pro)、苏氨酸 (Thr) 和丝氨酸 (Ser) 的序列组成,称为富含 PTS 的序列,通常串联重复,其中 Ser 和 Thr 广泛为 O-糖基化并赋予“瓶刷”状构象。
MUC2(黏糖蛋白2)的化学结构和肠道粘液的合成
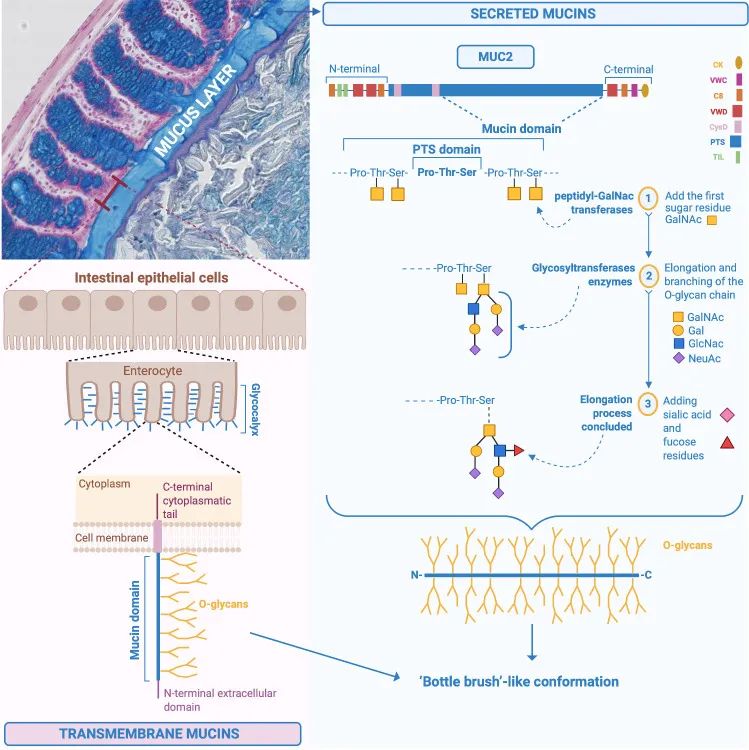

Paone P & Cani PD. Gut. 2020
肠道菌群在肠道中的分布梯度随其位置不同而变化;微生物密度从近端到远端肠道增加,每克肠道内容物的微生物细胞数量大约如下:
十二指肠中103 个
空肠中 104 个
回肠中 107个
结肠中1012 个
此外,微生物密度从上皮细胞向管腔增加,在后者中发现的细菌数量最多,与管腔相比,实际上很少有细菌物种能够很好地粘附和驻留在粘液层中。除了粘附这一重要功能外,肠道微生物群对调节肠道粘液层有很大贡献。
需要普及一个认知就是,当我们谈到构成微生物组的各种细菌物种时,有些菌似乎比其他细菌具有更显着的影响,比如肠道基石菌,核心菌,益生菌等,确保这些个体物种的最佳水平——不要太低,也不要太高——可以产生对健康深远的影响。这其中包括有益细菌的关键物种之一 Akkermansia Muciniphila。
谷禾肠道样本大数据库显示A. muciniphila缺乏或未检出情况在人群中很常见,尤其是那些有肠道问题的人。在健康个体中其约占肠道微生物群总数的0.5%–3%。
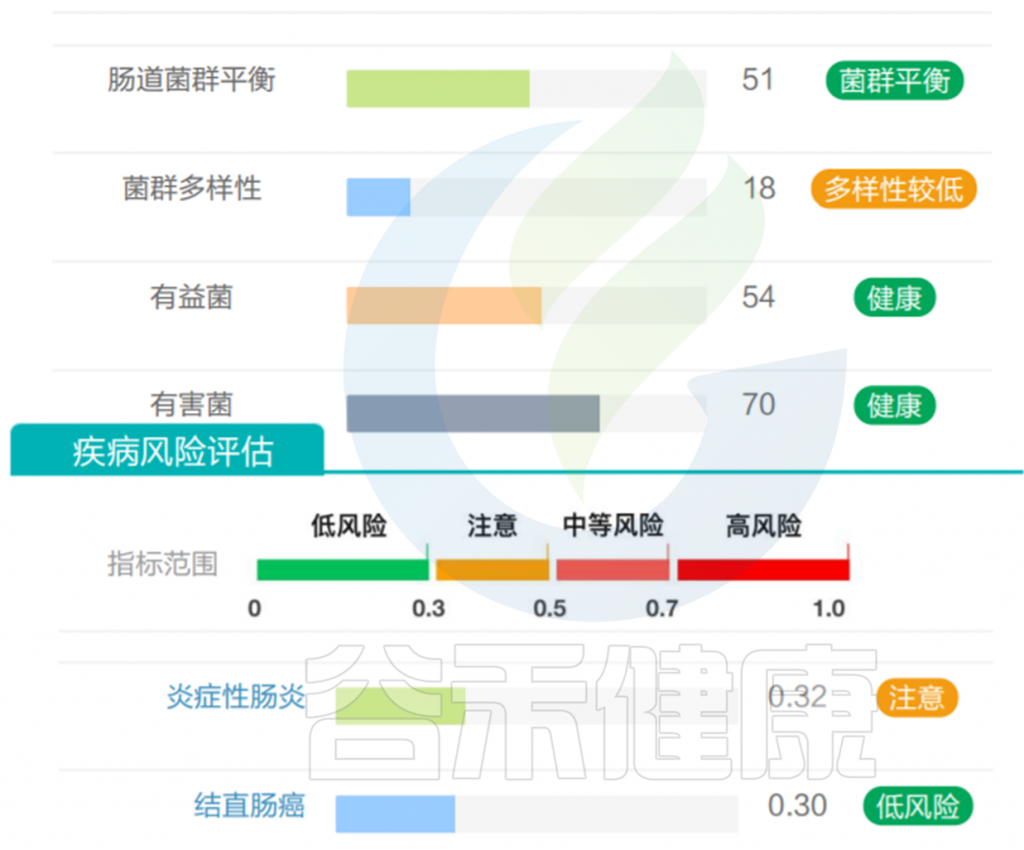
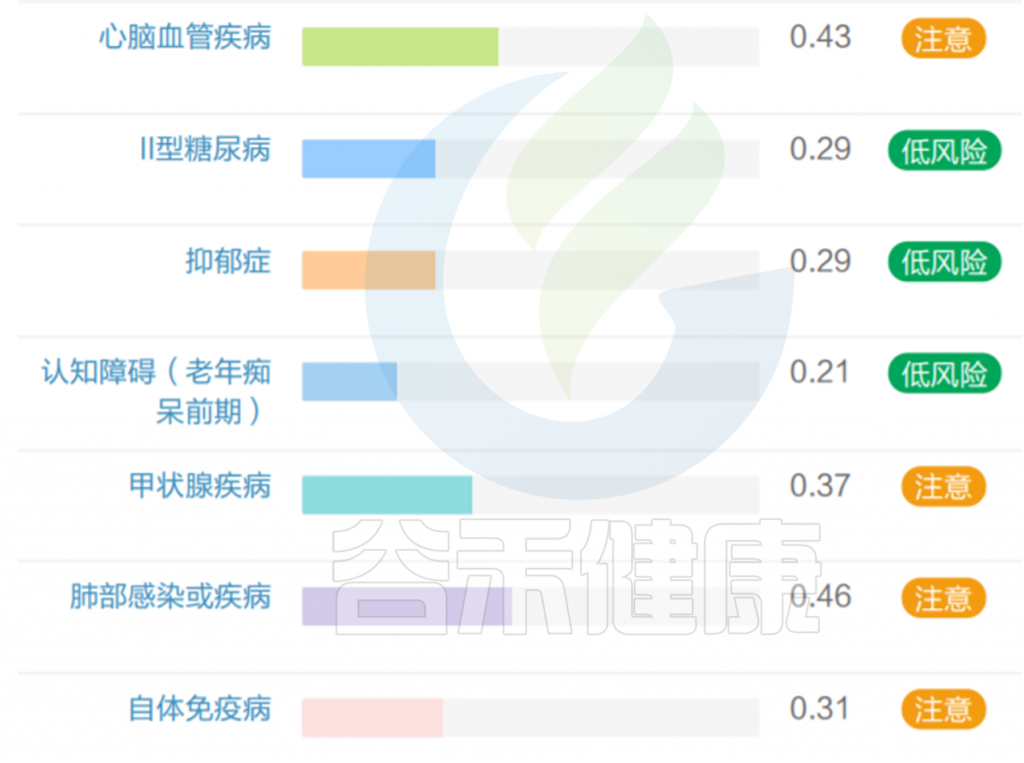
但是也有例外,在我们在最近的检测的一个56岁女士肠道内该菌的丰度占比超50%,菌群构成如下:


然而,好事太多也可能是坏事。它的名字——“muciniphila”的意思是粘液爱好者,指的是它独特的能力,降解黏蛋白和粘液层。过量的Akkermansia 将过度消耗粘液蛋白而存活下来,这是大多数其他细菌所缺乏的生存优势。在这种情况下,非粘液消耗物种的数量显着减少,导致物种多样性减少, Akkermansia 增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、LPS 进入血液的增加、自身免疫性疾病有关,神经退行性疾病等。
该样本检测报告也显示菌群多样性低,肠炎和几项慢病注意风险:


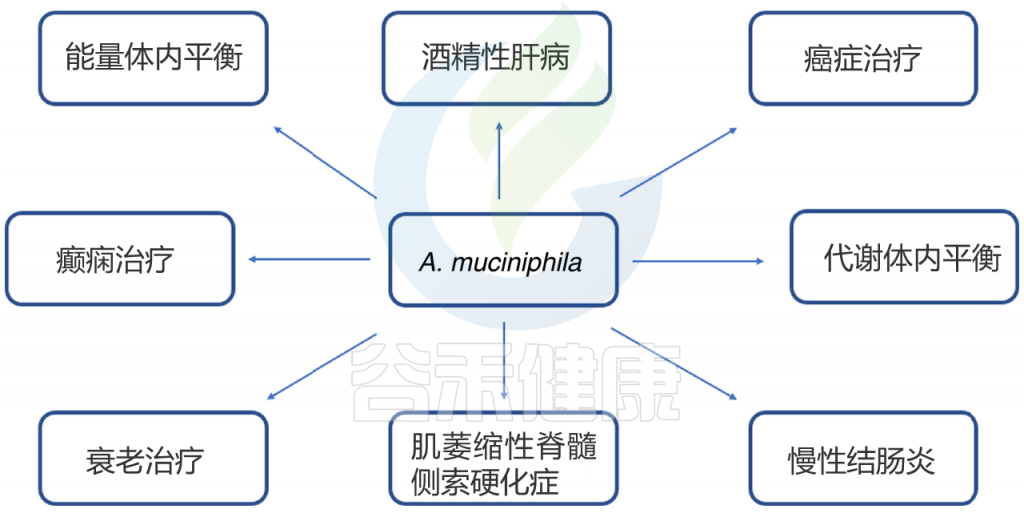
此外,在其它研究文献中也得出Akkermansia muciniphila丰度高的负面研究,如:
在中国人中,A. muciniphila菌的丰度与2型糖尿病呈正相关。
血红素在肠道中的过度增生,与A. muciniphila的粘膜溶解活性有关,在特定情况中,A. muciniphila参与促进代谢综合征。
北京协和团队发现Akkermansia muciniphila可能参与了系统性红斑狼疮的发生发展,致自身免疫亢进特征。
通过细菌16S rRNA测序表明其属于疣微菌门(Verrucomicrobia),与Verrucomicrobium spinosum有92%序列相似性,是现在唯一已知的人类肠道疣微菌门成员。其中文译名尚无统一,在文献中以阿克曼黏细菌、艾克曼黏细菌等名字出现。
为了揭示A. muciniphila的功能潜力,对其基因组进行了测序和注释。发现Akkermansia muciniphila在其相对较小的基因组中编码了大量黏蛋白降解酶,黏蛋白被其降解后其下游聚糖副产物可以交叉饲养其他肠道细菌。
根据DNA-DNA杂交(Digital DNA-DNA hybridiztion,dDDH)将23个Akkermansia属的菌株分为4种,分别为:
Akkermansia sp.CAG
Akkermansia sp.KLE
Akkermansia. muciniphila
Akkermansia. glycaniphila
但是发现它包含许多候选粘蛋白酶编码基因,但缺乏编码典型粘液结合域的基因。
种内存在多样性。在整个基因组中发现的大量噬菌体相关序列,表明病毒在该物种的进化中发挥了重要作用。此外,发掘了 37 个胃肠道宏基因组中,确定Akkermansia序列的存在和遗传多样性。在 37 个中,11 个包含 16S 核糖体 RNA 基因序列,与A. muciniphila 的相同 > 95% , 称为Akkermansia-like 微生物。
瓦赫宁根大学微生物实验室从蟒蛇体内分离培养出于A. muciniphila 基因序列具有94.4%相似度的新菌株,并且发现它们也具有相似的特性,将该微生物命名为Akkermansia glycaniphila。
Akkermansia muciniphila是一种肠道中的黏蛋白降解细菌。粘蛋白是肠上皮黏液层的重要组成部分。粘蛋白由杯状细胞产生肠上皮,是高度糖基化的分子,还包括丝氨酸、苏氨酸和半胱氨酸,它们在肠组织表面形成透明的粘液层,是大量肠道微生物栖息的主要部位。
A. muciniphila主要定植在胃肠道的外黏液层,以胃肠道的黏蛋白作为自身生长的碳和氮来源,其消耗黏蛋白与杯状细胞再生黏蛋白能够达到动态平衡,从而维持黏液层稳定。A.muciniphila以及其分泌物,如囊泡(Extracellular vesicles, EV)通过与结肠上皮细胞Toll受体(Toll-like receptor,TLR)结合及调节紧密连接蛋白的表达等来维持肠道稳态,从而改善高脂饮食诱导的肥胖和炎症性肠病等疾病。
此外,粘蛋白还覆盖在呼吸道、消化道和泌尿生殖道的细胞表面。许多癌症(胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌和其他组织)都会增加粘蛋白的产生。粘蛋白也在肺部疾病中过度表达,例如哮喘、支气管炎、慢性阻塞性肺病 (COPD) 或囊性纤维化。
Akkermansia muciniphila 高度适应从粘蛋白降解中生存——例如,它需要苏氨酸才能生长,并且具有多种适合利用粘蛋白寡糖中的特殊糖类的酶,如唾液酸酶和岩藻糖苷酶,甚至硫酸酯酶。表明宿主动物和AKK菌之间的共同进化进入了高级阶段,并暗示了这些疣状微生物对宿主的潜在功能意义。由于其向其他细菌物种提供粘蛋白降解产物,该物种也是肠道重要的共生菌属。
Akkermansia muciniphila 能够使用粘蛋白作为碳、氮和能量的唯一来源。尽管宿主肠道层中的许多黏液降解微生物可能具有致病性,但A. muciniphila不一样。Akkermansia muciniphila从粘蛋白发酵中产生乙酸盐、丙酸盐和乙醇,以调节宿主的生物学功能,包括宿主免疫反应和脂质代谢。由于A. muciniphila保留在外黏膜层并且不会渗透到内层,因此它的定植是有益的,因为细菌会促进外黏蛋白层的自然更新。
除了基因序列多样性外,这种细菌还表现出多种生物学功能,包括:
促进肠道屏障完整性;
调节免疫反应;
抑制炎症;
交叉喂养他微生物群;
降低某些心脏病风险,如胰岛素抵抗、总血胆固醇和脂肪组织储存;
防止体重增加。

DOI: (10.1111/jam.14911)
促进肠道屏障
肠道屏障是一个多层复杂的系统,它允许营养吸收,同时防止微生物及其产物的易位。肠道屏障的破坏导致管腔内容物进入血流,激活免疫反应并诱发炎症。
粘液覆盖外肠上皮细胞层,起到物理保护作用,防止微生物和有害化合物的渗透。除了降解粘蛋白外,A. muciniphila还被发现可以刺激粘蛋白的产生 。
A. muciniphila在防止人类肠道致病菌增殖中的作用
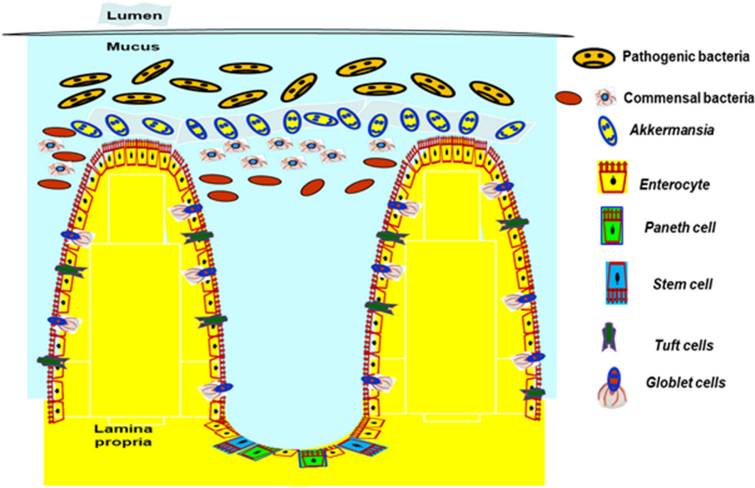
Kalia VC, et al., Indian J Microbiol. 2021
今年发表在Gut Microbes研究得出,虽然A. muciniphila 是一种粘蛋白降解细菌,但是通过促进分泌型 IEC 的分化,反而增加了粘液的产生。A. muciniphila处理以 Gpr41/43 依赖性方式增强了ISC 增殖,加速肠上皮再生,促进 IEC 发育并维持肠道稳态。
注释:哺乳动物肠上皮细胞(IEC)更新较快,每 3-5 天补充一次。所有类型的 IEC 都源自肠干细胞(ISC)
粘蛋白的周转率为 6-12 小时,内层的周转率约为 1 小时,据信其分泌受神经、激素和旁分泌作用的调节。
在动物模型中,A. muciniphila补充剂使结肠粘液层的厚度增加了大约 3 倍,明显高于由有益细菌植物乳杆菌引起的厚度增加。此外,在体外,发现A. muciniphila通过直接与肠细胞结合来改善肠细胞单层完整性 。
A. muciniphila如何促进粘液厚度尚不清楚。原因之一可能是A. muciniphila通过从降解的粘蛋白中制造短链脂肪酸来刺激粘液周转率,这是合成和分泌粘蛋白的宿主上皮的优选能源。事实上,A. muciniphila补充剂增加了小鼠产生粘蛋白的杯状细胞的数量。
抑制炎症
有证据表明A. muciniphila可以调节炎症。在加速衰老的小鼠模型中补充这种细菌可以减轻炎症 。其他研究也显示了A. muciniphila在不同小鼠模型中的抗炎特性,包括无菌模型、肝损伤模型和肥胖模型。
A. muciniphila可以减少由牙龈卟啉单胞菌引起的瘦或肥胖小鼠的炎症。
此外,A. muciniphila分泌的囊泡能够降低TLR4(Toll-like receptor 4, TLR4)的表达,从而调节NF-κB通路,减少促炎因子IL-6、IL-8的分泌。
调节免疫
A. muciniphila在小鼠体内平衡期间,在诱导肠道驻留 T 细胞方面发挥着宿主相关的作用。
在一项针对围产期 HIV 感染儿童和青少年的横断面研究中报告说,A. muciniphila丰度与升高的IL-6 和可溶性 CD14 相关 。
A. muciniphila降解黏蛋白,释放可以被周围非黏液降解细菌利用的短链脂肪酸(SCFAs)、寡糖等代谢物。SCFAs能抑制组蛋白脱乙酰基酶,从而调节NF-κB通路,减少炎症因子的表达。丁酸可以促进Treg细胞的外周活化,增加结肠中Treg细胞亚群的数量,抑制促炎免疫细胞CD4+T淋巴细胞、CD8+T淋巴细胞活性。
免疫相关的皮肤病——牛皮癣
银屑病(俗称牛皮癣)是一种免疫介导的慢性炎症性皮肤病。研究表明银屑病和肠道炎症之间存在关联。一项研究评估了来自巴西的21名银屑病患者与24名健康对照者的肠道微生物群组成和多样性。与对照组相比,银屑病患者的 Akkermansia muciniphila 数量有所减少。
扩展阅读:牛皮癣看似皮肤病,实则关系到肠道
交叉喂养
除了A. muciniphila外,粘液层中还常见其他微生物。产生丁酸盐的细菌不具有降解粘液的能力,而是利用被粘蛋白降解的物种(如A. muciniphila)降解的碳和氮,这些微生物包括细菌如Faecalibacterium prausnitzii,罗斯氏菌等其产生抗炎短链脂肪酸(SCFA)。
产生的乙酸能够促进粪厌氧棒状菌(Anaerostipes caccae),霍氏真杆菌(Eubacterium hallii)。
报道共培养A. muciniphila与非粘液降解丁酸盐产生细菌F. prausnitzii、A. caccae和Eubacteriumhallii导致同养生长和丁酸盐的产生。因此,A. muciniphila不仅自身在保护肠道上皮方面发挥重要作用,而且还支持抗炎肠道微生物群。
A. muciniphila和其他细菌之间的相互作用
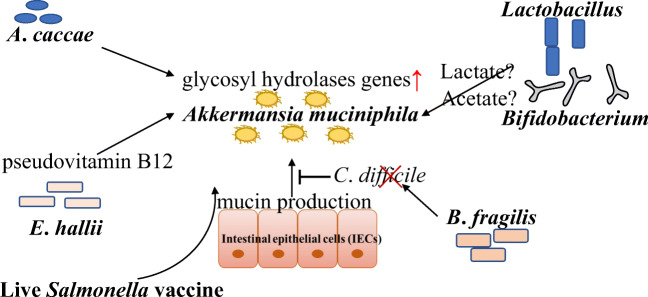
Hagi T, et al., Appl Microbiol Biotechnol. 2021
有些细菌不能降解粘蛋白,因此非粘蛋白降解细菌受益于粘蛋白降解细菌。
A. muciniphila产生来自粘液和短链脂肪酸的糖,如乙酸盐和丙酸盐。非粘液降解细菌,如Anaerostipes caccae, Eubacterium hallii and Faecalibacterium prausnitzii ,利用A. muciniphila从粘液中降解的糖进行生长。
A. muciniphila的粘蛋白降解支持了Anaerostipes caccae的生长和丁酸生产。Anaerostipes caccae诱导AKK中粘蛋白降解基因的表达增加,核糖体基因的表达减少。
防止体重增加
普遍发现A. muciniphila在瘦个体中更为丰富。在超重个体中,细菌的丰度较低。
在小鼠中,与肥胖小鼠的丰度相比,瘦动物粪便中A. muciniphila丰度增加之间的相关性表明了这种意义,并且观察到在数周内每天向高脂肪饮食诱导的肥胖小鼠喂食Akkermansia显然可以逆转这种诱导的肥胖以及改善上皮完整性和相关效应。
也有一些数据表明,A. muciniphila干预可能成为人类受试者肥胖改善方案的基础。但是强调只有活的Akkermansia菌才能在小鼠中产生这种效果,但是发现高温预处理杀菌的细胞甚至纯化的Akkermansia蛋白,与活细胞治疗的效果相比,Akkermansia的热杀死细胞似乎对高脂肪饮食肥胖小鼠具有相同甚至增强的有益效果。
此外,A. muciniphila通过分解粘蛋白产生醋酸盐这样的 SCFAs,对我们的体重产生积极影响。因为乙酸盐可以阻止我们感到饥饿,从而防止体重增加。
A.muciniphila治疗不会显著改变饮食诱导的肥胖小鼠的肠道微生物组成,但它可以逆转HFD诱导的代谢紊乱,包括脂肪质量增加、代谢内毒素血症、脂肪组织炎症和胰岛素抵抗,这表明它可能用于预防或治疗肥胖和相关的代谢紊乱。
人类肠道微生物群中丰富的A.muciniphila可预防疾病
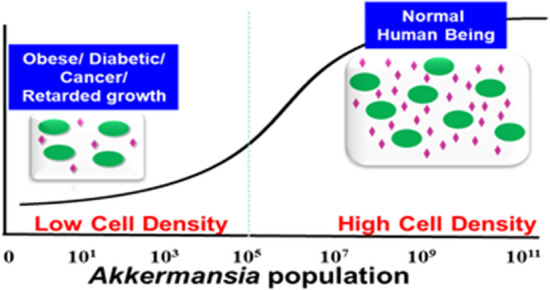
Kalia VC, et al., Indian J Microbiol. 2021
改善代谢
A. muciniphila补充剂能够恢复肥胖和 2 型糖尿病小鼠的粘液厚度,其中高脂肪饮食治疗破坏了肠道粘液;该治疗还导致血清脂多糖 (LPS) 显着减少,这是一种代谢性内毒素血症,并改善了代谢状况。
对肥胖小鼠施用Akkermansia还通过减少循环中的炎性脂多糖和减轻胰岛素抵抗而导致观察到的“代谢性内毒素血症”减少作为小鼠肥胖的心脏代谢并发症,如动脉硬化。至少来自小鼠模型的结论Akkermansia效应得到了许多不同研究的支持。
A. muciniphila及其衍生产物对宿主代谢的影响
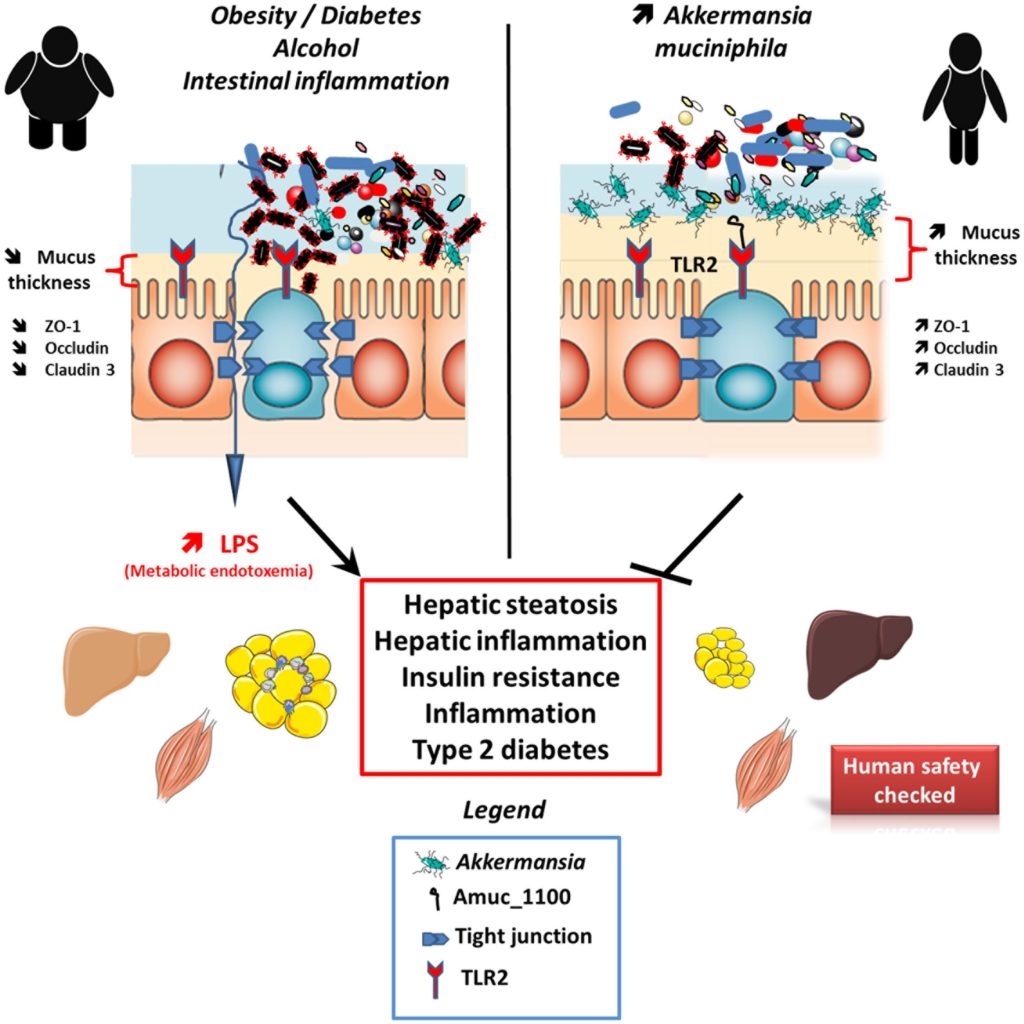
Cani PD,et al.,Front Microbiol. 2017
非酒精性脂肪性肝
与野生型小鼠相比,在NAFLD小鼠中观察到A. muciniphila丰度显著降低,而导致A.muciniphila丰度增加的干预措施改善了代谢参数。使用益生元(如低聚果糖)可以恢复A.muciniphila的丰度,并改善相关疾病。
酒精性肝病
酒精性肝病(ALD)由脂肪变性、纤维化和肝硬化发展为急性酒精性脂肪性肝炎,死亡率高,但治疗方法非常有限。结果发现,内毒素血症水平升高的酒精性肝病患者肝损伤程度增加。乙醇消耗引起的肠道紧密连接的破坏导致炎症信号通过病原体相关的分子模式,如脂多糖。
研究ALD患者队列时,发现与健康受试者相比,ALD患者粪便A. muciniphila数量减少。给乙醇喂养的小鼠口服粘液粘菌A. muciniphila可恢复该细菌的消耗,减少肠漏,增加Claudin-3和Occludin的紧密连接表达。因此,炎症和肝损伤促进细胞因子白介素1β (IL-1β)和肿瘤坏死因子α (TNF-α)明显减少,导致MPO +中性粒细胞浸润,改善肝损伤。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
改善血糖和胰岛素抵抗
A. muciniphila在糖耐量正常的人群中比糖尿病前期或 II 型糖尿病人群中的数量更多。
事实上,这些细菌已被证明可以增强称为二甲双胍的抗糖尿病药物的作用。在喂食高脂肪饮食的小鼠中,二甲双胍治疗增加了A. muciniphila的数量 并改善了它们的血糖水平。
同样,喂食高脂肪饮食的小鼠口服A. muciniphila但不服用二甲双胍,对葡萄糖的耐受性也有所提高。因此,这种细菌通过改变肠道微生物群,可能有助于在未来找到控制 2 型糖尿病的新方法。
扩展阅读:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
癌症免疫治疗
Akkermansia muciniphila也可以积极影响宿主对癌症免疫疗法的反应。研究发现,抗生素的消耗与对免疫治疗 PD-1 阻断剂的反应较差有关。进一步研究确定较低水平的Akkermansia muciniphila确实对反应率有直接影响,给抗生素治疗的小鼠口服细菌补充剂,发现它恢复了它们对免疫疗法的反应。根据这项研究,有人建议维持健康的肠道菌群,主要包括Akkermansia muciniphila,对于提高癌症免疫治疗有效性很重要。
此外,Akkermansia muciniphila通过刺激 DCs 产生 IL-12 并促进 CCR9 + CXCR3 + CD4 +的积累来增强 ICB 功效 上皮肿瘤和淋巴结中的 T 细胞。
根据美国癌症研究中心新研究显示Akkermansia muciniphila提升免疫检查点抑制剂的效果,还能产生大量调节T细胞反应的肌苷。食用高纤维食物可以有效地调节肿瘤微环境中的单核巨噬细胞的组成,而食用得越多,Akkermansia muciniphila的肠道菌数量就会更多。
该菌还能产生大量环二腺苷酸,即使是无菌小鼠,仅仅植入Akkermansia muciniphila,它们也能有更强的抗癌反应。未来,或许一种通过食物和环二腺苷酸联合的促进抗癌疗法就在眼前。
神经退行性疾病
肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, ALS)是一种复杂的神经退行性疾病,患者通常会出现运动神经元的过早死亡,导致诊断后的平均生存时间不足5年。然而,针对肌萎缩性侧索硬化症的药物所做的巨大努力却收效甚微。
急性ALS小鼠模型经抗生素治疗后显示,微生物群失调在渐冻症的进展和恶化中起着重要作用。
通过挑选11株与ALS相关的微生物菌株,包括A.muciniphila和单接种到经抗生素治疗的ALS小鼠中,只有A.muciniphila与运动神经元改善相关。
其他疾病,例如,帕金森病与对照组的肠道微生物组组成显著不同, Akkermansia 丰度增加。
年龄
年龄和地理环境等因素影响人体A. muciniphila的数量。从婴幼儿时期开始A. muciniphila在人类胃肠道定植,并在一年后迅速接近成年人的水平。随着年龄增长A. muciniphila在人体内的数量逐渐降低。
不同的是,另一研究发现大于60岁人群A. muciniphila的数量升高。此外,另外研究发现在百岁长寿老人中A. muciniphila数量显著增加,提示A. muciniphila水平的升高可能有助于延缓机体的衰老。
对两种类型的早衰综合征小鼠模型,外用该菌A. muciniphila可显著提高小鼠的健康寿命。
地理位置
另外,不同地理位置A. muciniphila在人群中定植也存在差别。如通过细菌16S rRNA分析发现,智利健康受试者粪便中的微生物菌群和巴布亚新几内亚受试者有明显不同;但与美国和阿根廷受试者接近;A. muciniphila在智利受试者的丰富度最高。
中国南方的男性和女性定植率没有差异,但是中国南方人群的A. muciniphila定植率低于欧洲人群。暨南大学理工学院在广州地区人群的A. muciniphila定植率为89.31%,平均丰度为5.825 lg(CFU/mL)。肠道消化模拟不同时间点的RT PCR结果显示,A. muciniphila在模拟人类肠道微生物菌群环境中具备生存能力;对Bifidobacterium属和Bacteroides属具有抑制效果,对Lactobacillus属具有促进作用。
2021年在Nature发表的文章中,研究人员将古肠道样本数据和一组来自于已测序的工业化及非工业化生活方式下现代人群的粪便样本数据进行对比。比起非工业化样本和古粪便,包括Akkermansia muciniphila(可降解人体粘液)在内的BloSSUM类群在工业化样本中更丰富。
工业化生活下微生物群落中的粘液降解菌和基因更普遍,这可能是由西方饮食导致的。
药物
药物是影响肠道A.muciniphila丰度的重要因素之一。首先,抗菌药物作用后可以直接影响肠道A.muciniphila的数量。
在小鼠出生后早期用万古霉素进行干预可以有效预防1型糖尿病,显著降低小鼠血糖值以及减轻胰岛炎症;而对8周龄小鼠未见明显预防效果。万古霉素作用于幼儿时期的小鼠使A. muciniphila成为胃肠道优势菌群,该研究提示A. muciniphila可能是推迟1型糖尿病的关键菌群。
对60例6~11个月的婴儿使用阿奇霉素治疗3 d后,婴儿A. muciniphila数量显著减少。此外Dubourg等的研究中,2例成人患者经过抗生素(强力霉素、哌拉西林、羟氯喹、亚胺培南等)治疗后,A. muciniphila数量显著增加,在肠道菌群的比例均大于40%。
有趣的是,在另外一项小鼠模型中也发现类似现象,给小鼠灌胃四联抗生素(氨苄青霉素,万古霉素,新霉素和甲硝唑)可显著逆转免疫抑制剂导致的A. muciniphila数量减少。这些研究表明抗菌药物等药物使用会影响肠道内A. muciniphila数量的变化,其对人体代谢产生的影响需进一步研究。
最新的研究发现,代谢综合征相关治疗药物对A.muciniphila丰度的影响可能参与其作用机制。如二甲双胍通常用作治疗代谢综合征(如肥胖和2型糖尿病)的一线用药。
对14例服用二甲双胍的糖尿病患者进行肠道菌群分析,与未服用二甲双胍的糖尿病患者以及健康受试者相比,A. muciniphila显著增加。在体外实验中,收集二甲双胍治疗组和对照组小鼠的粪便,发现二甲双胍培养组A. muciniphila的比例显著增加。
在另外一项研究使用另外一种代谢病治疗药物利拉鲁肽(Liraglutide)。对高脂饮食诱导的肥胖小鼠进行皮下注射给药,连续15 d给药后处死小鼠,收集肠道内容物进行菌群分析,发现治疗小鼠肠道中A. muciniphila显著增加。此外,抗肿瘤药物也可以影响肠道A.muciniphila的丰度。如在胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)异种移植的小鼠模型中发现,吉西他滨(Gemcitabine)治疗后使A. muciniphila在肠道中的数量显著增加(5%~33%)。
饮食方式
饮食对肠道A.muciniphila影响最显著。
与正常饮食组相比,高蛋白饮食显著降低大鼠肠道A. muciniphila。
Akkermansia 的数量随着短期(3 周)低FODMAPs饮食而减少。这不足为奇,因为 FODMAP 基本上与益生元纤维相同。
Akkermansia在生酮饮食中显着增加,并且与 Parabacteroides一起,可能是减少酮症癫痫发作的原因。
小鼠实验表明,A.muciniphila数量受到高脂饮食的强烈影响,高脂饮食三周后A.muciniphila丰度开始下降,并且A.muciniphila丰度与体脂呈负相关。
与高脂高糖饮食组相比,小鼠食用热带水果8周后,可以显著增加A. muciniphila在胃肠道中的丰度;同时干预后可以降低高脂高蔗糖饮食喂养小鼠的内毒素血症,改善其胰岛素敏感性。
饱和脂肪含量高的饮食与较高的炎症发生率有关。而富含多不饱和脂肪酸的饮食,如亚麻籽和鱼油中的那些,已被证明可以抵抗炎症,并且与更瘦的人有关。
这些膳食脂肪也会影响肠道中A. muciniphila的水平。

在一项研究中,老鼠被喂食由不同脂肪组成的不同饮食。一组喂猪油,另一组喂鱼油十一周,结果很有趣。
在鱼油喂养组中,A. muciniphila的丰度增加,乳酸杆菌的丰度也增加。
然后将两组的粪便材料移植到新的小鼠组中,在接受鱼油喂养小鼠粪便移植的小鼠中,它们的A. muciniphila水平增加,炎症水平降低。然而,接受猪油喂养小鼠移植的小鼠的炎症水平很高。
因此,摄入的膳食脂肪类型也会极大地影响肠道中A. muciniphila的数量。
我们已经知道多酚可以减少炎症并有助于预防许多疾病,因此高多酚食物可以增加Akkermansia.
多酚是强大的抗氧化剂,可以对抗体内的自由基(与多种疾病有关的化合物,包括糖尿病、心脏病和癌症)。
有许多不同类型的多酚。其中一些不能很好地被身体吸收留在肠道中,这对 Akkermansia来说是个好消息,它们吞噬了多酚并因此增强其力量,从而达到双赢。
此外,丁酸钠和菊粉、北极浆果提取物、绿茶提取物和异麦芽寡糖、膳食多酚等这些益生元也能增加Akkermansia丰度。
含有高水平多酚和鱼油的食物是提高A. muciniphila菌最好的食物。
高多酚食品
多酚使食物一般颜色丰富多彩,尝起来略带苦味或酸味。泡了很长时间的茶尝起来很苦:浸泡时间越长,茶多酚含量越高。浓橄榄油的青草味或红酒的味道也是很好的例子。

在自然界中,苦味可以抵御想要攻击植物的昆虫。有超过8000种多酚。一些例子是红酒中的白藜芦醇、辣椒中的辣椒素、百里香中的百里酚、肉桂中的肉桂酸、迷迭香中的迷迭香酸。
食物中多酚的含量在很大程度上取决于其生长的土壤、成熟度以及种植、运输和制备方式,因此以下列表仅供参考。
高多酚食品:
蔓越莓、石榴、山莓、黑莓、蓝莓、草莓、樱桃、李子、亚麻种子、黑巧克力、栗子、红茶、绿茶、苹果汁、苹果、黑麦面包、核桃、榛子、红酒。

其他常见的高多酚食物包括葡萄、橄榄、菠菜、李子和桃子。一般来说,颜色越深越好,所以选择绿色的黑橄榄和葡萄。
油性鱼
Akkermansia 喜欢鱼油,但目前还不清楚它们喜欢鱼油的特定成分——例如脂肪酸——或者它们喜欢所有的部分。所以目前,最好吃鱼。
尽管鱼油现在是有争议的,一些科学家认为它的好处被夸大了。研究人员发现,食用整条鲑鱼的一组人的 DHA(一种脂肪酸)水平是食用鱼油的一组人的 9 倍。食用鱼类的同时既增加鱼油,同时增加优质蛋白质摄入,均有助于A. muciniphila。
试着每周吃两到三份鱼:
沙丁鱼、鲭鱼、鲱鱼、三文鱼、鳟鱼、鳀鱼、旗鱼、金枪鱼

补充膳食纤维,选择有机产品。
含纤维的食物:
生菊苣根、绿色蒲公英 、麦麸 、芦笋 、大蒜、香蕉 、洋葱 、韭菜,也存在于燕麦片、红酒、蜂蜜、枫糖浆、豆类和其他食物中。
避免高脂肪饮食和酒精
微生物多样性是我们肠道健康的主要目标。实现这一目标的最佳方法是均衡饮食,吃能让肠道菌群快乐的食物,从而你的感觉也会良好。
难点
A. muciniphila与机体健康联系紧密,有潜力成为新型益生菌。但目前A. muciniphila是专性厌氧菌且难以培养,成为新型益生菌,还有以下几点重要问题亟待解决:
首先,需研发高效快速培养A. muciniphila的新技术。目前实验室或小规模已经成功在实验室中获得活性A. muciniphila,并且能够稳定,但是这只是实验室规模生产,大规模的工业生产仍是需要解决的问题。比如培养基中存在蛋白质来源问题,是否会对人体可能有过敏反应,工业化生产时需研发合理的工业化生产培养基。
其次,需确定安全有效的治疗人群。目前A. Muciniphila 与改善肝功能、降低葡萄糖毒性、减轻氧化应激和抑制炎症有强关联,但是,在炎症性肠病、动脉粥样硬化等其他疾病中的干预,不同研究中存在不同的结果,对于其作为药物面对的安全问题,其应用仍待商榷。
最后,需要优化A. muciniphila的补充或给药方式。在体外模拟胃肠道的释放实验中,发现包封的 A. muciniphila活性比直接分散在模拟胃肠道的系统中活性更高,并且能够定向在肠道释放细菌,显著增加A. muciniphila对胃的抵抗力,对于实现在肠道的定向给药还需要更多的实验进行优化。
最后,尽管已经有研究证明有活性的A. muciniphila或者是巴氏消毒的A. muciniphila对人体是安全的,但目前A. muciniphila的临床研究较少,在临床上应用还需要更多的实验验证。
主要参考文献
Hasani A, Ebrahimzadeh S, Hemmati F, Khabbaz A, Hasani A, Gholizadeh P. The role of Akkermansia muciniphila in obesity, diabetes and atherosclerosis. J Med Microbiol. 2021 Oct;70(10). doi: 10.1099/jmm.0.001435. PMID: 34623232.
Zhang T, Ji X, Lu G, Zhang F. The potential of Akkermansia muciniphila in inflammatory bowel disease. Appl Microbiol Biotechnol. 2021 Aug;105(14-15):5785-5794. doi: 10.1007/s00253-021-11453-1. Epub 2021 Jul 27. PMID: 34312713.
Druart C, Plovier H, Van Hul M, Brient A, Phipps KR, de Vos WM, Cani PD. Toxicological safety evaluation of pasteurized Akkermansia muciniphila. J Appl Toxicol. 2021 Feb;41(2):276-290. doi: 10.1002/jat.4044. Epub 2020 Jul 28. PMID: 32725676; PMCID: PMC7818173.
Kalia VC, Gong C, Shanmugam R, Lin H, Zhang L, Lee JK. The Emerging Biotherapeutic Agent: Akkermansia. Indian J Microbiol. 2021 Dec 16:1-10. doi: 10.1007/s12088-021-00993-9. Epub ahead of print. PMID: 34931096; PMCID: PMC8674859.
Yu Y, Lu J, Sun L, Lyu X, Chang XY, Mi X, Hu MG, Wu C, Chen X. Akkermansia muciniphila: A potential novel mechanism of nuciferine to improve hyperlipidemia. Biomed Pharmacother. 2021 Jan;133:111014. doi: 10.1016/j.biopha.2020.111014. Epub 2020 Nov 26. PMID: 33246225.
Cheng D, Xie MZ. A review of a potential and promising probiotic candidate-Akkermansia muciniphila. J Appl Microbiol. 2021 Jun;130(6):1813-1822. doi: 10.1111/jam.14911. Epub 2020 Nov 15. PMID: 33113228.
Hagi T, Belzer C. The interaction of Akkermansia muciniphila with host-derived substances, bacteria and diets. Appl Microbiol Biotechnol. 2021;105(12):4833-4841. doi:10.1007/s00253-021-11362-3
Anhê, F. F et al. (2016). Triggering Akkermansia with dietary polyphenols: A new weapon to combat the metabolic syndrome?. Gut microbes, 7(2), 146–153.
Schade L, Mesa D, Faria AR, Santamaria JR, Xavier CA, Ribeiro D, Hajar FN, Azevedo VF. The gut microbiota profile in psoriasis: a Brazilian case-control study. Lett Appl Microbiol. 2021 Dec 12. doi: 10.1111/lam.13630. Epub ahead of print. PMID: 34897759.
Belzer, C et al. (2017). Microbial Metabolic Networks at the Mucus Layer Lead to Diet-Independent Butyrate and Vitamin B12 Production By Intestinal Symbionts. American Society for Microbiology: 8(5).
Caesar, R et al. (2015). Crosstalk Between Gut Microbiota and Dietary Lipids Aggravates WAT Inflammation Through TLR Signalling. Cell Metab: 22(4), pp 658-668.
Dao, M, C et al. (2015). Akkermansia muciniphila and Improved Metabolic Health During a Dietary Intervention in Obesity: Relationship with Gut Microbiome Richness and Ecology. Gut.
de Vos, W, M. (2017). Microbe Profile: Akkermansia muciniphila: A Conserved Intestinal Symbiont that Acts as The Gatekeeper of our Mucosa. Microbiology: 163(5).
Derrien, M et al. (2017). Akkermansia muciniphila and its Role in Regulating Host Functions. Microbial Pathogenesis: 106, pp 171-181.
Everard, A et al. (2013). Cross-Talk Between Akkermansia muciniphila and intestinal Epithelium Controls Diet-Induced Obesity. PNAS: 110(22), pp 9066-9071.
Geerlings, S, Y et al. (2018). Akkermansia muciniphila in the Human Gastrointestinal Tract: When, Where, and How? Microorganisms: 6(3).
Krishnan, A. (2016). Akkermansia muciniphila: What You Need to Know About this Bacterium. uBiome.
Naito, Y et al. (2018). A Next-Generation Beneficial Microbe: Akkermansia muciniphila. J. Clin. Biochem. Nutr: 63(1), pp 33-35.
Ottman, N et al. (2017). Pili-Like Proteins of Akkermansia muciniphila Modulate Host Immune Responses and Gut Barrier Function. PLOS One.
Pierre, J, F et al (2015). Cranberry Proanthocynaidins Improve the Gut Mucous Layer Morpohology and Function in Mice Receiving Elemental Enteral Nutrition. JPEN J Parenter Enteral Nutr: 37(3), pp 401-409.
Shin, N, R et al. (2013). An Increase in the Akkermansia spp. Population Induced by Metformin Treatment Improves Glucose Homeostasis in Diet-Induced Obese Mice. Gut: 63, pp 706-707.
Zhang, T et al. (2019). Akkermansia muciniphila is a promising probiotic. Microbial Biotechnology.
Ouyang J, Lin J, Isnard S, et al. The Bacterium Akkermansia muciniphila: A Sentinel for Gut Permeability and Its Relevance to HIV-Related Inflammation. Front Immunol. 2020;11:645. Published 2020 Apr 9. doi:10.3389/fimmu.2020.00645
Zhou K. Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies. J Funct Foods. 2017;33:194-201. doi:10.1016/j.jff.2017.03.045
Naito, Y., Uchiyama, K. & Takagi, T. A next-generation beneficial microbe: Akkermansia muciniphila. J Clin Biochem Nutr 63, 33–35 (2018).
Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int. J. Syst. Evol. Microbiol. 54, 1469–1476 (2004).
Hansson, G. C. Role of mucus layers in gut infection and inflammation. Curr. Opin. Microbiol. 15, 57–62 (2012).
van der Lugt, B. et al. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1-/Δ7 mice. Immun. Ageing 16, 6 (2019).
Lukovac, S. et al. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids. MBio 5, (2014).
Dao, M. C. et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 65, 426–436 (2016).
Depommier, C. et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat. Med. 25, 1096–1103 (2019).
Png, C. W. et al. Mucolytic bacteria with increased prevalence in IBD mucosa augment in vitro utilization of mucin by other bacteria. Am. J. Gastroenterol. 105, 2420–2428 (2010).
Anhê, F. F. et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 64, 872–883 (2015).
Pierre, J. F. et al. Cranberry proanthocyanidins improve the gut mucous layer morphology and function in mice receiving elemental enteral nutrition. JPEN J Parenter Enteral Nutr 37, 401–409 (2013).
Vinson, J. A. & Cai, Y. Nuts, especially walnuts, have both antioxidant quantity and efficacy and exhibit significant potential health benefits. Food Funct 3, 134–140 (2012).
Mao, B. et al. Effects of different doses of fructooligosaccharides (FOS) on the composition of mice fecal microbiota, especially the bifidobacterium composition. Nutrients 10, (2018).

谷禾健康

感到疲惫?乏力?食欲不振?容易流血?皮肤发痒?腿肿?体重减轻?…这些有可能是慢性肝病的信号,慢性肝病是一个主要的健康问题,它可以发展为肝硬化和肝癌。
肝病按照病因划分,常见的有如下几大类:
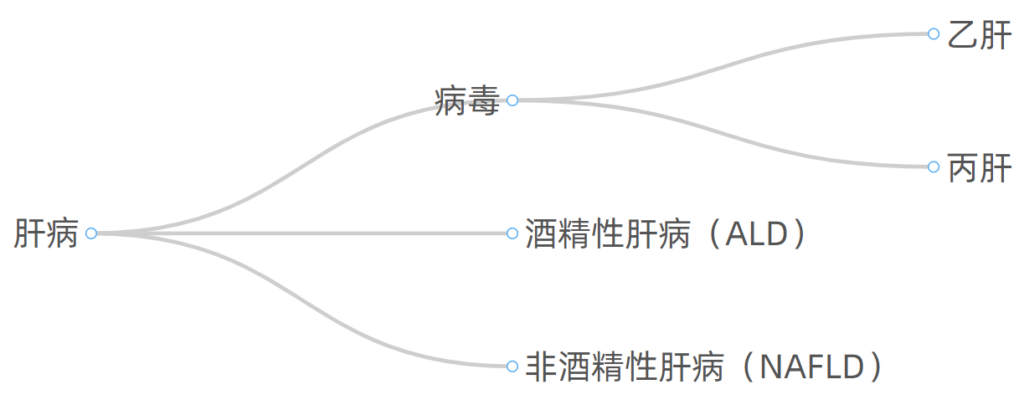
无论病因如何,肝病如果没有得到有效管理控制,进展的常见终末阶段是肝硬化。
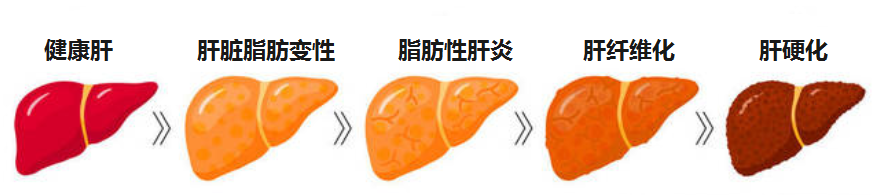

肝硬化可导致失代偿和肝细胞癌的发展。
发病率
目前由于疫苗接种计划和有效抗病毒治疗不断发展,乙肝和丙肝肝硬化的发病率正在下降,但由于以下两个原因导致另两种肝病发病率不断上升:
1、肥胖,导致非酒精性脂肪肝的发病率增加
2、饮酒,导致酒精性肝病的发病率增加。
本文带你详细了解肝病与肠道菌群:


肝脏也是胆汁产生的场所,在肠肝循环中具有重要作用。
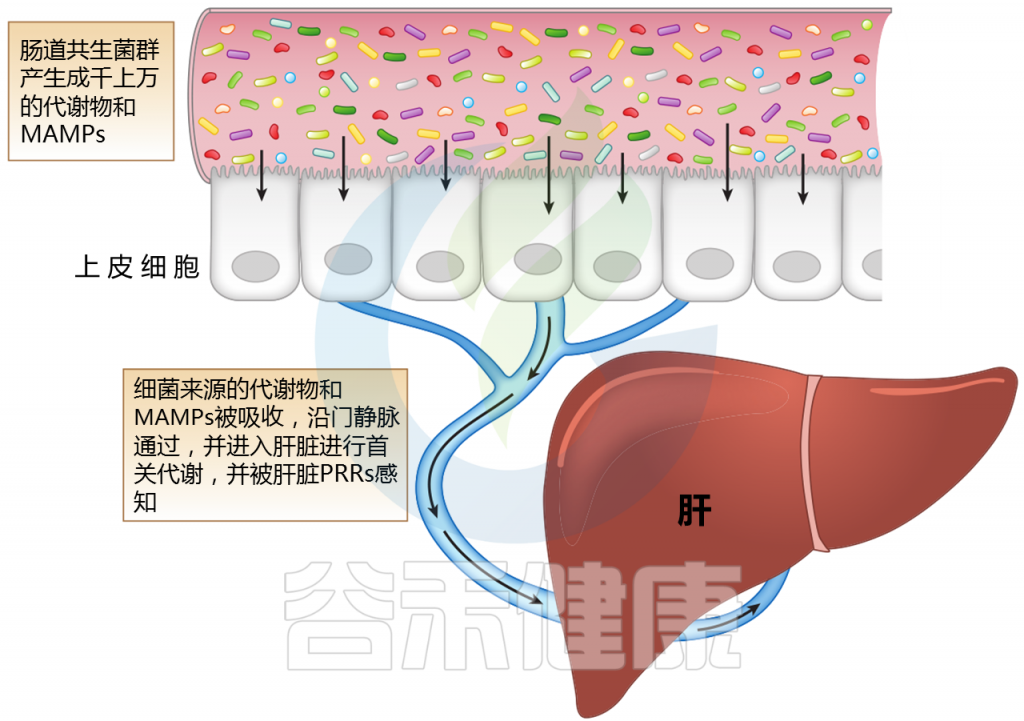
肝脏,作为第一个接触微生物产物进入门静脉循环的器官,可能受到肠道微生物群及其变化的多种影响。肠道微生物群的成分或代谢物通过各种机制与肝脏相互作用。
肝脏中产生的胆汁酸(如胆酸和鹅去氧胆酸)与葡萄糖醛酸酶结合。一旦分泌到十二指肠肠腔,肠道菌群代谢和解共轭,产生尿胆原(排泄)和初级胆汁酸被吸收和循环。胆汁酸还通过内在的微生物调节活动来控制和影响菌群。

Jones R M,et al.,Annual Review,2020
注:MAMPs——微生物相关分子模式;PRR——模式识别受体
肝脏位于体循环和来自肠道吸收活动的大量外源性分子和微生物相关分子模式(MAMPs)之间的界面。
微生物产生的代谢物会随着微生物群的组成而变化;它们沿着门静脉分流并引发多种信号通路的激活。MAMP暴露过多会导致炎症。
肝硬化前期肠道菌群总体变化:
整体多样性减少,厚壁菌门减少,拟杆菌门和变形菌门增加。
在三种类型的肝炎中,肝硬化前期微生物参与非酒精性脂肪肝病和酒精相关性肝病的证据相对更为有力。
—— 非酒精性脂肪肝病
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)是一种以肝细胞内脂质(主要是甘油三酯)的微泡或大泡状积聚为特征的肝病,并伴有不同程度的炎症浸润。
在非酒精性脂肪性肝病中,研究人员发现粪便、血液和肝活检中的致病菌(如肠杆菌科和大肠杆菌)的相对丰度增加。随着病原菌数量的增加和厚壁菌门数量的减少,菌群失调。
—— 酒精性肝病
长期摄入酒精可导致人类和动物模型中菌群结构的变化,肠道通透性增加,随着持续的酒精滥用,致病菌的多样性进一步减少,相对丰度增加,如肠杆菌科和肠球菌科。
在小鼠中,乙醇可以降低肠道屏障功能,并允许增加局部炎症。从机理上讲,乙醇也能抑制抗微生物凝集素的表达,在慢性乙醇消耗模型中,无Reg3β和Reg3γ的小鼠表现出增加的细菌移位和NASH的发生。这些发现表明乙醇可能介导了肝脏潜在的促炎性刺激,有多个长期后遗症。
尽管肝硬化的病因可能有所不同,但在肝病的末期,微生物群与肝脏的相互作用在很大程度上与病因无关。也就是说无论哪种都可能发展为肝硬化。
前面我们知道,肝炎如果不能得到有效控制,久而久之会对肝造成永久性损伤,也就是肝硬化。肝硬化又分为两种,一种是代偿性肝硬化,一种是失代偿肝硬化。
代偿性肝硬化虽然肝功能减退,但机体仍能正常运行。
失代偿性肝硬化指肝硬化发展到一定程度,出现肝功能衰竭,可能出现严重并发症,如肾功能衰竭、静脉曲张出血和肝性脑病等。
肝硬化患者最初没有症状,等到了肝硬化失代偿(定义为腹水、肝性脑病、黄疸和/或胃肠道出血),就是肝硬化过程中的转折点。
——肝硬化失代偿期会发生什么?
代偿性肝硬化患者可能会保持多年稳定,死亡率非常低,每年< 1%。然而,在第一次住院治疗后,35%的患者将在28天内出现后续的失代偿,需要频繁入院。肝硬化急性失代偿可导致慢加急性肝衰竭(ACLF)。
注:慢加急性肝衰竭是一种综合征,以一个或多个主要器官或系统(肝、肾、脑、凝血、循环或呼吸)衰竭为特征。
慢加急性肝衰竭是失代偿性肝硬化的主要死亡原因。他们的慢加急性肝衰竭(ACLF)的中位时间为2-3年,死亡率每年约为10%。


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
每次失代偿后,慢加急性肝衰竭在28天内的发展约为30%,在此阶段死亡率在28天内攀升至40%。这些器官衰竭患者通常在重症监护室接受治疗,肝移植是唯一的治疗方法。
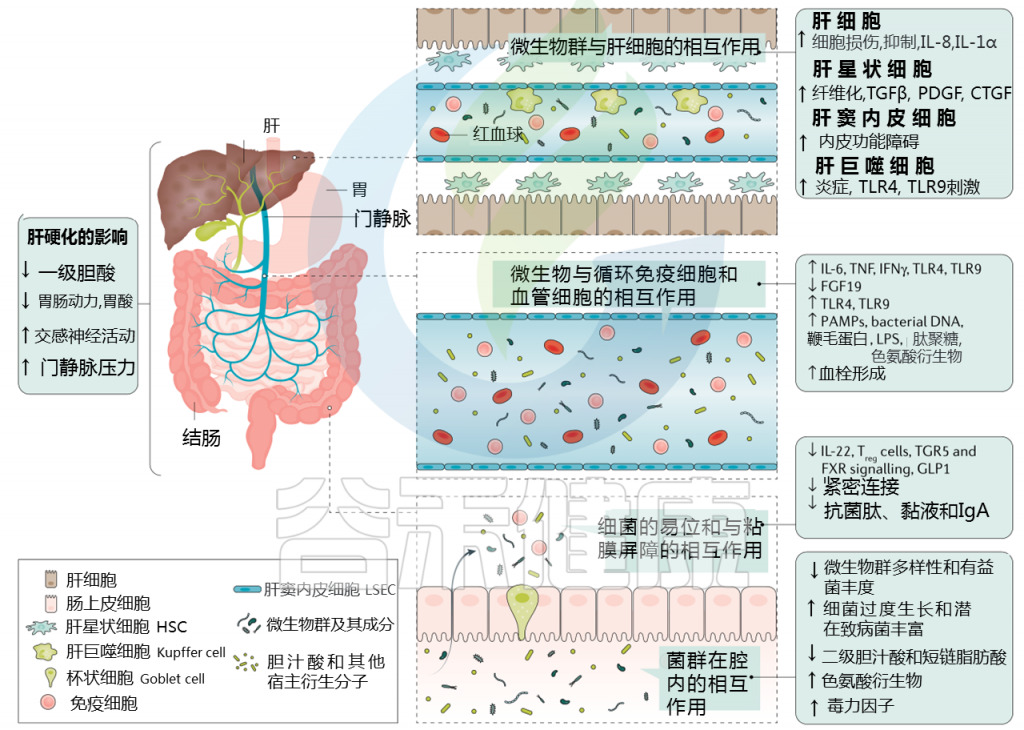
肠道菌群如何影响肝硬化失代偿?
肝硬化中微生物群-肠道-肝脏相互作用

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝硬化发展过程中肠道微生物群的变化在很大程度上归因于肠道微生物群组成及其产物,产物可能具有致病作用。短链脂肪酸(SCFAs)、次级胆汁酸和色氨酸衍生物增加,而粘液蛋白的变化、功能失调的紧密连接和抗菌肽的减少促进了微生物组成分和/或其代谢物(病原体相关分子模式(PAMPs))跨肠屏障的移位。
接下来,就肠道菌群与肠道屏障,病变肝脏的相互作用,菌群代谢产物与转运,门静脉高压和酒精的作用这4个方面展开讨论。
1. 与肠道屏障相互作用
肠漏:
一个不正常的微生物群可以影响肠道上皮屏障,并导致内容物从肠道到肝脏和其他地方难以控制的转移。这种肠上皮屏障的损伤被称为漏肠。
在肝脏疾病期间,由于肝肠循环、肠道炎症和门脉高压的改变,宿主生理和肠道完整性发生重大变化。与此同时,肠道微生物组和肝脏之间的串扰也发生了重大变化:
肠道中的宿主粘膜蛋白和通路(例如FXR信号)被肠道微生物群代谢物(例如短链脂肪酸)改变,并可能导致肝脏损伤;
肝脏疾病进展引起的肠道内化变化可能会影响肠道屏障,促进肠道炎症,降低抑菌肽;
而肠道相关淋巴组织可能通过驱动肠道炎症,从而增加肠屏障的通透性参与肠屏障的功能障碍
由于穿过肠道上皮屏障的细菌成分会引发免疫反应,因此肠道渗漏被认为会增加慢性全身炎症。例如,在肝病患者,尤其是肝硬化患者中,细菌细胞壁脂多糖(LPS)水平升高,也被称为内毒素血症。
2018年的一项研究表明,从失代偿期肝硬化患者的循环血和其他“无菌”隔室中分离出的细菌是可行的,这表明即使是活的细菌也可以在失代偿期肝硬化期间通过肠屏障转位。
2. 与病变肝脏的相互作用
从失代偿到慢加急性肝衰竭的进展与全身炎症的广泛激活有关,影响许多细胞因子和炎症系统。
释放危险相关的分子模式来促进失代偿和炎症
慢加急性肝衰竭的发展,不同衰竭器官的死亡细胞和细胞外基质的重塑,特别是在肝脏,都通过释放危险相关的分子模式来促进失代偿和炎症,最终可能是慢加急性肝衰竭发展的先决条件。
这种联系在乙肝病毒引起的肝硬化和/或慢加急性肝衰竭患者中尤其常见。慢性乙肝病毒的再激活可能导致肝损伤,从而释放危险相关的分子模式,进而导致器官衰竭和慢加急性肝衰竭。
在慢性肝病和肝硬化患者中,甲肝病毒和戊肝病毒重叠感染也可能诱发慢加急性肝衰竭。
对病原体相关分子模式的免疫反应导致器官功能障碍
另一方面,这种炎症的爆发是由微生物或其成分的转移引起的,也称为病原体相关分子模式。对病原体相关分子模式的免疫反应可能在免疫病理学过程中导致器官功能障碍,在这种过程中,免疫反应会导致感染造成损害。
炎症标志物水平升高
血浆中全身性炎症标志物(如IL-8或IL-6)水平升高,无论是否有明显的细菌感染,都与肝硬化和慢加急性肝衰竭的急性失代偿有关。新的数据强化了改变后的肠道微生物群和慢加急性肝衰竭之间的联系。
血浆代谢物特征
除了肠道菌群衍生代谢物与慢加急性肝衰竭发展之间的关联之外,血浆代谢物特征(可能也来自肠道菌群)也与全身炎症和慢加急性肝衰竭密切相关。
这些发现可能解释了为什么肠道微生物群的改变和细菌易位的增加可能为不同器官的免疫病理发展为器官衰竭,加重全身炎症和诱导ACLF的环境。
酒精性肝病
2019年研究表明,乙肝病毒相关ACLF患者的循环细菌DNA显著增加,并与炎症标记物(如CXCL10,一种已知的趋化因子)相关,在非乙肝病毒病因中也与ACLF相关,尤其是酒精性肝硬化。
另外,在急性酒精性肝炎(ACLF的一个亚型)中,研究表明,与没有这种特殊菌株的患者相比,具有一种产生细胞溶血素的肠球菌菌株的患者具有极高的死亡率(180天内的死亡率分别为89%和3.8%)。
我们知道,急性酒精性肝炎与微生物变化密切相关,这可能决定患者的临床特征及其结果。在几乎一半的急性酒精性肝炎患者中,失代偿和慢加急性肝衰竭都会发生,但没有任何可识别的促发事件,这表明这与内源性机制有关(例如,门静脉高压症或细菌易位)。
3. 门静脉高压症和酒精的作用
即使肝硬化的门静脉高压症得到有效治疗,例如通过放置经颈静脉肝内门体分流术(TIPS)支架,许多患者仍出现进一步失代偿和ACLF(2年内约47%),尤其是由于全身炎症和随后的器官衰竭。
此外,与肝静脉、右心房和外周静脉血相比,腹水的存在决定了门静脉循环微生物群的组成(腹水:一种失代偿的指标),以及与炎症标记物和ACLF的发生相关的特定循环微生物群。
然而,应该指出的是,TIPS支架本身可能会加重高动力循环,从而导致内毒素水平的增加。从长远来看,TIPS支架降低了失代偿率,可能主要是由于这些肝硬化患者腹水的发生率降低。
失代偿性肝硬化和ACLF先于酒精性肝硬化发生。这一发现可能很重要,不仅因为酒精是失代偿期肝硬化最常见的病因,而且可能是由于酒精本身对肠道微生物群和肠屏障功能的直接影响。
在健康个体和动物模型中,已经证明急性酗酒会增加循环中的内毒素和细菌DNA水平。
酒精显著改变肠道微生物群的组成,降低拟杆菌的相对丰度,增加变形菌。
它的代谢物,特别是乙醛,可以破坏肠道上皮细胞的紧密连接,导致肠道渗漏,促进细菌和真菌的易位,这两者都可能与肝硬化的进展有关。
在不同病因的肝硬化(例如,非酒精性脂肪性肝炎或乙型肝炎引起的肝硬化)中也观察到微生物群组成的改变以及肠道的渗漏。
4. 微生物代谢产物和转运
肝硬化发展过程中肠道微生物群的变化在很大程度上不仅归因于肠道微生物群的组成,还归因于其产物,这些产物可能具有致病作用。
一项研究表明,在肝硬化向失代偿和ACLF发展的过程中,血液代谢物特征明显改变。
针对903人的大规模研究为某些强预测代谢物模式的微生物起源带来了重要的见解,但很难对这些发现作出有力的陈述。
另一项对602名患者进行的研究表明,微生物群衍生代谢物与ACLF的存在有关。其他微生物成分,如次级胆汁酸、短链脂肪酸和色氨酸代谢物也在肝硬化中发生较大变化,与疾病的进展有关。尤其是,胆汁酸通过下调FXR受体来改变肠道屏障功能,这为临床FXR激动剂已经可用提供了新的治疗机会。
间接证据表明肠道微生物群可能会影响肝硬化的预后。
首先,研究表明,使用非选择性β受体阻滞剂(一种预防肝硬化失代偿的常用方法)治疗可改善肠道屏障,减少肠道转运时间,从而降低肝硬化患者细菌转移的可能性。
第二,在静脉曲张破裂出血期间或作为失代偿期肝硬化的长期预防措施,抗生素治疗是一种推荐的治疗方法,因为它可以改善结果,其机制可能与减少细菌移位有关。
尽管这一观点尚未得到确凿的证实,但我们知道,一种特定的微生物组表型(所谓的肠型)会导致肝功能的病理改变,并且考虑到微生物群中存在着广泛的成员,如真菌或病毒,微生物组标志物可能是非常有用的临床工具,以确定有失代偿和ACLF风险的患者。
肠道微生物群可以作为疾病进展、严重程度和治疗反应的生物标志物。
不同肝病的菌群特征
肝硬化:
瘤胃菌科、毛螺菌科与其他菌(包括肠杆菌科和拟杆菌科)进行比较,菌群比率失调。随着ACLF的发展,肝硬化菌群失调比率恶化。
该研究表明,肝硬化患者的菌群比率失调
对129名患者的研究显示,毛螺菌科减少,巴斯德氏菌科(Pasteurellaceae)的丰度可以预测死亡率。
其他研究也提供了证据,表明特定的微生物组群特征可以区分肝硬化和健康对照组,并且微生物组的变化可能能够监测病情的严重程度和进展情况。
一组45例肝移植受者中,肝移植改变了肠道菌群,使微生物多样性增加,原生细菌增加(如毛螺菌科),潜在致病菌减少(如肠杆菌科)。
该研究强调了患病的肝脏会影响肠道菌群。
肝硬化和慢加急性肝衰竭:
慢加急性肝衰竭和肝硬化的肠道微生物群特征


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
中国肝硬化患者宏基因组全关联研究(MWAS)显示,与健康个体相比,肝硬化肠道菌群组成有大于34个显著差异的菌群。肝硬化患者中韦荣球菌属和链球菌增多,而产丁酸共生菌包括Faecalibacterium prausnitzii 和Coprococcus comes减少。(下表)
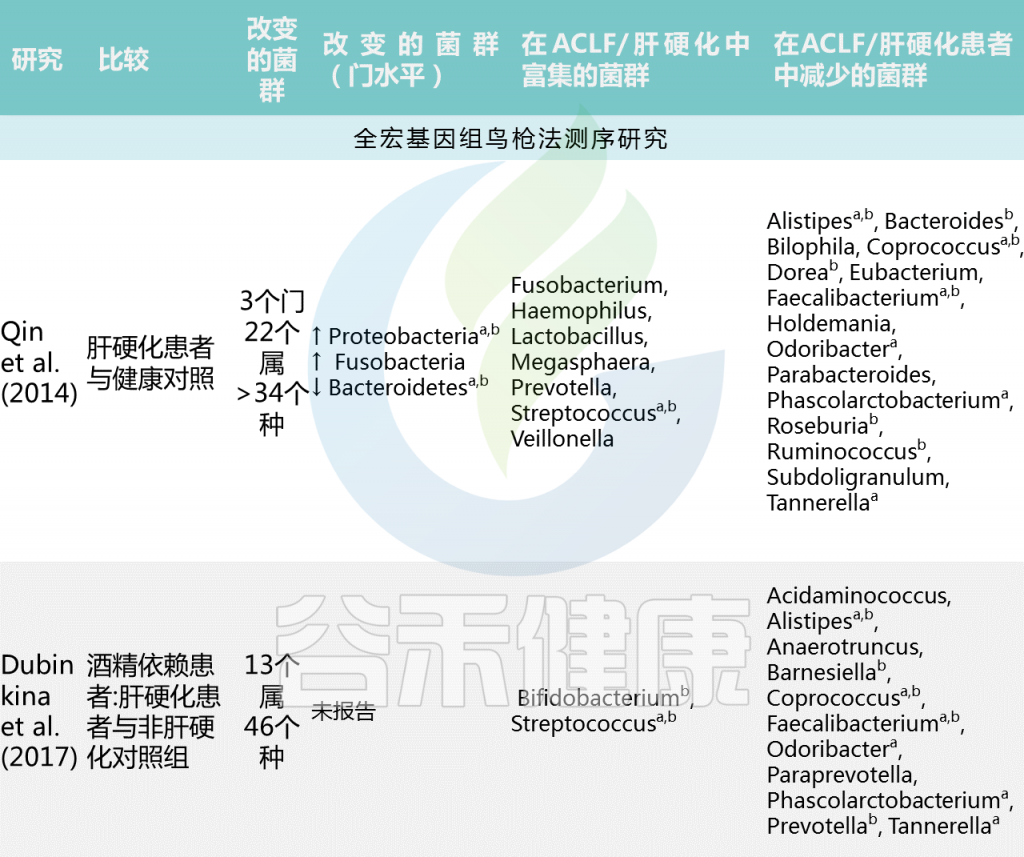

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝细胞癌(HCC)
持续的肝损伤和再生促进了肝细胞癌的发生,它是全球癌症死亡的第三大原因。
肝细胞癌HCC与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
在与非酒精性脂肪性肝病相关的HCC,一项来自意大利的研究注意到拟杆菌和瘤胃球菌科增加,双歧杆菌减少。
不同部位菌群功能
肠道菌群:
从门诊病人的角度来看,肠道菌群可以证明是预测入院,MHE和晚期纤维化患者的有用工具。
一项针对NAFLD肝硬化的研究发现,粪便微生物分析中的27种细菌特征以及年龄,性别和体重指数(BMI)可预测NAFLD肝硬化。
晚期纤维化是NAFLD死亡率的重要预测指标,可以从粪便菌群中推断出纤维化,以帮助识别高危人群。
鉴于失代偿性肝硬化中存在预测的失调模式,因此将CDR(肝硬化失调率-毛螺菌科+瘤胃菌科+韦荣氏菌科/肠杆菌科+拟杆菌科)视为预测失代偿风险的工具(适用于所有常见的CLD病因)较低的分数预示结果较差,并且具有较强的预测价值。
粪便菌群也可以用来预测谁会在90天内再次入院和急性肝性脑病复发,因为急性肝性脑病和其他失代偿的粪便菌群有所不同。
唾液菌群:
唾液菌群失调比率是一种简单实用的临床工具(Lachnospiraceae + Ruminococcaceae + Veillonellaceae/ Streptococcaceae),可以预测有和无肝性脑病的失代谢性肝硬化患者90天的入院情况。
其他部位菌群:
一些研究表明,粪便微生物群和结肠黏膜相关微生物群是不同的。事实上,回肠、空肠和十二指肠粘膜样本或抽吸物的微生物群是不同的,它们可能对肝硬化具有重要的预后能力,主要表现为肝性脑病。然而,这些样本并不容易获得,而且很难将其作为生物标志物进行常规的护理点采集。
微生物工具的潜力
需要进一步的研究才能使人信服结论:患者在不同的条件和疾病下,它们的肠道微生物群既表现出疾病特异性的变化,也表现出非特异性的共同反应。因此,在其作为生物标志物的潜力得以实现之前,确定强有力的疾病特异性肠道菌群特征至关重要。
生物标志物和基于微生物的工具的潜力

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
要更准确地估计疾病对肠道微生物群的影响程度,就需要从世界各地获得强有力的大规模纵向数据,同时考虑各种混杂因素。理解和解释其他相关的混杂因素将使我们更接近以微生物组为基础的肝硬化生物标志物。
微生物组的整体观点,包括微生物基因表达和微生物衍生的代谢物或蛋白质,可能导致更准确和全面的生物标志物,类似于整合宿主遗传学与基因表达和表观遗传学时的强大疾病关联。这种包含宿主-微生物全生物的整体观点也可能支持诊断、分层和治疗的个体化,并可能开创全生物群关联研究的新时代,扩大宏基因组全关联研究领域。
我们知道,即使在没有肝病的情况下,微生物组也在调节情绪和潜在的认知中发挥作用。慢性肝病患者的脑功能改变是肠-肝-脑轴的结果,甚至在肝硬化之前就可以影响病程。
酒精使用障碍(AUD)
一项关于酒精使用障碍(AUD)患者肠-肝-脑轴的重要研究发现,抑郁、焦虑和酒精渴求与肠通透性增加相关,即使在戒酒后,肠通透性高的患者仍然存在抑郁、焦虑和酗酒。
最近发表的一篇关于AUD中这一轴的操纵的文章显示,对于AUD患者,在粪菌移植后,这些渴望、消费和长期的与AUD相关的住院治疗可能会降低。
肝性脑病
肝硬化中普遍存在的认知功能障碍是一种记忆障碍型,称为轻度或隐性肝性脑病。这可以发展为明显的肝性脑病,表现为嗜睡,迷失方向,晕眩和昏迷。
肝性脑病是肠肝轴中与微生物组相关的经典并发症,是全身性内毒素血症和炎症的结果,最终加重了神经炎症,而神经炎症是支撑肝性脑病发病机理的重要因素。
多年来,氨被认为是肝性脑病发病的关键,但后来发现全身炎症对于氨发挥其神经毒性作用是必不可少的。越来越多地描述了特定微生物群在肝性脑病和全身性炎症(包括性别影响)进程中的作用。在小鼠中,发现肠道微生物组是肝性脑病所特有的全身性炎症和神经炎症所必需的。
轻度肝性脑病和PTSD
在临床上,轻度肝性脑病需要专门的认知测试,例如心理计量学肝性脑病评分(PHES),抑制性对照测试,脑卒中诊断等。但这些测试最好在专门的环境中进行,并且需要专业知识。
轻度肝性脑病(MHE)和创伤后应激障碍(PTSD)肠道菌群之间也存在协同作用,与其他人相比,PTSD患者的菌群失调更为严重。PTSD,酒精滥用和肝硬化常常并存。微生物变化可能有助于将MHE与PTSD区别开来,并且可以帮助我们定义较新的疗法。
老年肠道-肝-脑轴改变
利用肠脑轴的主要挑战是老年人群(慢性肝病患者)。老年人患者的致病菌往往更具致病性,随着合并症,住院和抗生素暴露于更大的革兰氏阴性病原体中,病情恶化。
与类似的老年非肝硬化对照组相比,年龄较大(> 65岁)的肝硬化患者往往会改变肠道-肝-脑轴,从而增加炎症并损害记忆的认知能力。在相关网络分析的研究中,更重要的是,在老年肝硬化和非肝硬化组中也发现了类似的模式,这表明老年患者已经具有潜在的肠脑轴改变。
这对肝移植具有重要意义,因为尽管进行了肝移植,但与年龄相关的肠脑轴变化仍可能持续。人口老龄化往往会导致多种其他合并症和精神疾病,需要额外的照顾以确保最佳的移植后效果。
针对肝硬化肠道微生物群的策略
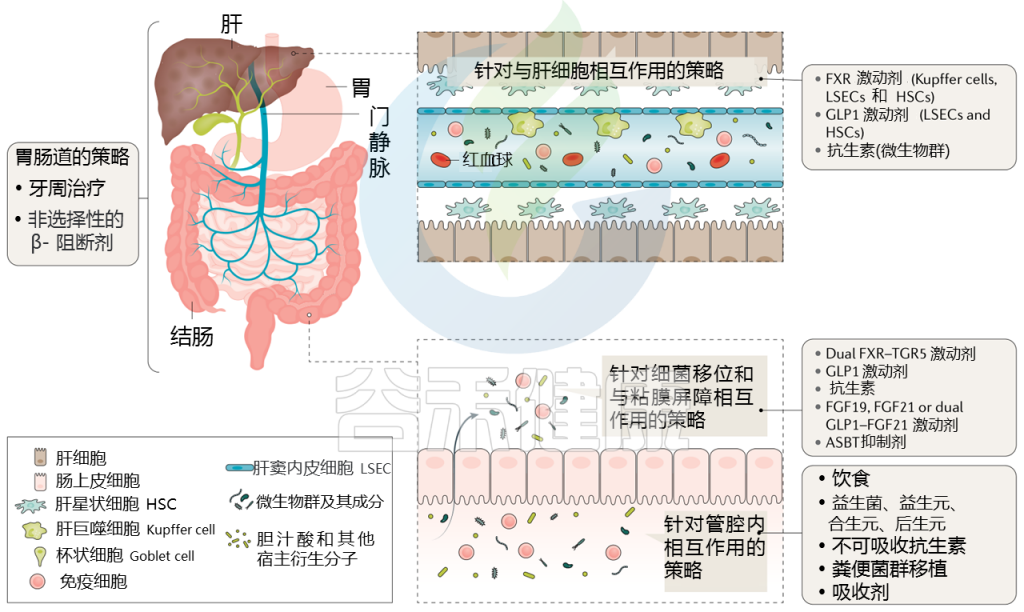

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
通过治疗(部分成立和部分试验)调节肠道微生物群可能改善肝硬化患者的预后,而微生物组生物标志物可能反映对这些治疗的反应。下表显示了不同的策略。
针对肠道微生物群的肝硬化干预措施

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
接下来主要介绍一些具体疗法:饮食、益生菌、抗生素、白蛋白、牙周、粪菌移植等,有些目前正在临床试验中。
饮 食
除其他因素外,饮食对肠道微生物群有重要影响,这一点已在各种疾病和条件下得到研究。一项针对国际肝硬化人群的研究报告称,咖啡、茶、蔬菜和酸奶的摄入都与微生物群落多样性的增加和住院率的降低有关,这为调节肠道微生物群落以促进肝脏健康提供了前景广阔的途径。(具体的饮食方面建议见文末附录部分)
益 生 菌
益生菌已经成为肝硬化临床研究的主题,特别是它们对脑功能的影响和肝性脑病的风险。
益生菌在肝硬化前可以改善NAFLD的组织学,在肝硬化中可以减少失调,对逆转OHE的二级预防有效,减少失代偿事件的住院率,但可能或不能改善认知能力(MHE)。
大多数制剂都含有乳酸菌,可产生短链脂肪酸,有利于结肠健康。一项短期(5天)口服两歧双歧杆菌和植物乳杆菌8PA3的小型试点研究表明,与单独标准治疗相比,口服两歧双歧杆菌和植物乳杆菌8PA3能恢复肠道菌群,并能更好地改善酒精性肝损伤。
以上是关于益生菌的前沿研究,如果想要尝试的话,最好是经过肠道菌群检测或者在医生的指导下服用更可靠。
抗 生 素
抗生素,也被用作失代偿期肝硬化的预防性治疗。
腹水患者发生自发性细菌性腹膜炎(SBP)的风险增加,接受抗生素预防来预防自发性细菌性腹膜炎的发展。这种SBP的一级预防已经被证明可以提高某些患者的生存率。
在一项多中心、随机对照试验中,对严重肝硬化患者使用抗生素,总体生存率没有任何益处,但是,同样,腹水中白蛋白浓度低的患者在接受抗生素治疗时,生存率得到了提高。
预防性抗生素治疗也同样有效建议用于其他临床情况,如静脉曲张破裂出血、既往SBP和复发性显性肝性脑病。然而,尽管对最脆弱的患者的短期效果可能是有益的,但在其他许多患者中,这些治疗不能阻止进一步的失代偿和ACLF。也许这种情况的部分原因是抗生素引起的微生物群落多样性减少。
因此,需要开发一种更具针对性的肠道微生物群来改善肝脏健康。
牙周卫生
也许你不知道,牙周卫生也会与肝硬化有关。已发表的人类MWAS表明,在肝硬化期间,肠道微生物组向口腔微生物组转变。
减少胃部充当天然屏障的酸性环境可能促成口腔微生物群转移到肠道,在肠道上皮屏障适应不同的微生物组分。如前所述,这些变化可能促进肠道微生物群通过肠道屏障的转移,进而导致并发症。因此,防止口腔微生物不必要的转移到肠道,可以成为未来肝硬化治疗的基础。
一项研究表明,与20名非肝硬化对照组相比,30名肝硬化患者的牙周卫生干预措施改变了肠道微生物群,改善了肝性脑病。
白蛋白作为潜在疗法
当肠道屏障被削弱时,它会双向泄漏,这也会导致重要的宿主分子从血液室泄漏到肠腔。例如,在酒精性肝病动物模型中,肠道通透性增加导致粪便白蛋白浓度升高。
随着肝硬化的进展,肝脏中的白蛋白合成受到损害:一方面,肝损伤导致肝细胞功能质量的丧失;
另一方面,肝脏僵硬程度的增加,白蛋白合成减少。不仅白蛋白减少,而且它能结合毒素和其他有害物质。这些观察结果将白蛋白水平定位为肝病严重程度的关键参数。
白蛋白还可通过前列腺素E2改善免疫B细胞功能,减少肝硬化患者的免疫反应,从而阻止与ACLF和死亡密切相关的全身炎症爆发。
长期白蛋白治疗肝损害和非自发性细菌性腹膜炎感染患者分别通过提高生存率和解决ACLF改善了临床结果。因此,白蛋白泄漏到肠腔可能会影响肠道微生物群并被其代谢,从而可能改变微生物组分,间接改变宿主。
粪菌移植(FMT)
失代偿期肝硬化中菌群移植的初步研究正在出现,其安全性也很高,为更大规模的研究铺平了道路。
菌群移植后变形菌减少,放线杆菌增多,肝脏疾病严重程度改善,严重酒精性肝炎患者3个月时的死亡率降低,1年生存率提高。
慢性乙型肝炎FMT组出现微生物改变,HBeAg降低。FMT减少了短期酒精渴求和消费,以及AUD相关的住院治疗。
一项包括20名复发性肝性脑病患者在内的开放性随机试验观察到,使用FMT灌肠剂减少了住院人数,改善了认知和菌群失调。
另一项研究也证明了这一点。使用口服胶囊制剂的FMT的新应用也显示出类似的安全性和对肝硬化和肝性脑病的治疗效果。然而,由于报告了一些由耐yao菌转移导致的FMT相关死亡病例,包括一些肝硬化患者,因此需要谨慎。因此,更好地理解和全面描述这些研究可能带来明确的微生物调节干预治疗失代偿期肝硬化。
加深菌群影响机制的理解
未来的研究应该探索和加深对肠道微生物组变化影响肝硬化进展和失代偿发展的动力学和机制的理解。
诊断、治疗
由于肝硬化表现为肠道微生物群与宿主的大量重要相互作用,微生物组诊断和治疗几乎是治疗疾病进展和失代偿发展的必经之路。需要进一步倡导基于微生物组检测和靶向疗法。
改善预后
针对不同水平微生物群与宿主相互作用的策略改善患者的预后。
产学研合作
使之更容易获得和更具成本效益,微生物检测需要更广泛地适应,因为它相对容易收集且信息量较大。可以帮助诊断,预测和潜在地个性化治疗。
多学科综合
多学科例如微生物学,宿主遗传学,基因组学,表观遗传学,代谢组学,营养学等相结合,更好地利用微生物帮助我们有效的进行慢病管理,预防为主,将指导落实到饮食、生活方式等具体应用上,用全新的视角帮助我们认识健康,保持健康。
饮 食 方 式
尽可能选择对肝脏友好的食物,帮你保护肝脏。以下是一些饮食技巧:
选择全麦谷物,面包和谷物。
多吃各种颜色的水果和蔬菜。
选择低脂乳制品。
选择瘦肉蛋白质。
选择植物油,例如橄榄油,而不是黄油。
零食坚果和种子食物。
减少钠摄入量。
每天喝8-10杯水。
避免含有反式脂肪的加工食品。
避免添加糖。
选择可以长期生活并遵循的饮食计划。
吃八分饱腹感
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
限 制 饮 酒 量
肝脏是负责代谢营养物质和其他摄入物质的主要器官。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
定期减少饮酒量很重要。医生甚至可能建议你完全戒酒。
增 加 运 动 量
运动的好处不仅限于减肥和控制体重,还可以帮助减少肝脏周围的脂肪。定期运动也可以改善你的情绪,助你维持在最佳的健康状态。
开始时要循序渐进,比如可以每周进行150分钟运动开始,尽量选择你喜欢的运动,例如,跑步和步行的组合,多人参与的活动增加趣味性(如各种球类运动),健身房的器械训练等。
睡 觉
充足的睡眠对于保持健康状态非常重要(包括慢性肝病治疗期间睡眠很重要)。如果你觉得入睡困难,开始慢慢尝试练习良好的睡眠习惯,例如:
每天都在同一时间上床睡觉和起床,作息规律。
避免咖啡因,烟草和其他刺激物。
尽量保持卧室环境清爽舒适。
运动尽量安排在清晨或午后,不要在睡前剧烈运动。
相关阅读:
膳食胆固醇通过调节肠道微生物群和代谢产物驱动脂肪肝相关的肝癌
参考文献:
Grat M, Wronka KM, Krasnodebski M, et al. Profile of Gut Microbiota Associated With the Presence of Hepatocellular Cancer in Patients With Liver Cirrhosis. Transplant Proc 2016;48:1687-91.
Jones R M, Neish A S. Gut Microbiota in Intestinal and Liver Disease[J]. Annual Review of Pathology:Mechanisms of Disease, 2020, 16.
Acharya Chathur,Bajaj Jasmohan S,Chronic Liver Diseases and the Microbiome: Translating Our Knowledge of Gut Microbiota to Management of Chronic Liver Disease.[J] .Gastroenterology, 2020
Bajaj JS, Sharma A, Dudeja PK. Targeting Gut Microbiome Interactions in Service-related Gastrointestinal and Liver Diseases of Veterans: Meeting Summary.Gastroenterology 2019.
Liu R, Kang JD, Sartor RB, et al. Neuroinflammation in Murine Cirrhosis Is Dependent on the Gut Microbiome and Is Attenuated by Fecal Transplant. Hepatology 2020;71:611-626
Ren Z, Li A, Jiang J, et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut 2019;68:1014-1023.
Trebicka Jonel,Bork Peer,Krag Aleksander et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure.[J] .Nat Rev Gastroenterol Hepatol, 2020
Lang S, Fairfied B, Gao B, et al. Changes in the fecal bacterial microbiota associated with disease severity in alcoholic hepatitis patients. Gut Microbes 2020;12:1785251.
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease. Hepatology 2019;69:107-120.
Gao B, Duan Y, Lang S, et al. Functional Microbiomics Reveals Alterations of the Gut Microbiome and Host Co-Metabolism in Patients With Alcoholic Hepatitis. Hepatol Commun 2020;4:1168-1182.
Duan, Y . et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505–51 1 (2019)