 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
锌与肠道微生物
锌(Zn)是人体必需的微量元素,是人体中第二丰富的矿物质。锌在细胞和器官功能中起着关键的催化、调节和结构作用。
★ 膳食锌缺乏或过量均不健康
锌缺乏与发育不良、免疫功能低下、味觉丧失、不良妊娠结局、脱发、皮肤损伤和神经行为异常有关。
世界卫生组织估计,全球三分之一的人口面临锌缺乏症的风险,他们的饮食锌摄入量不足或食物中锌的生物利用度低。
不过需要注意不可在没有医嘱下擅自过量补充,导致锌的摄入量超过既定的营养需求。锌摄入过量也不利于健康,容易导致氧化应激增加、长期记忆受损、肠道吸收和分泌能力改变以及内脏脂肪增加。
近年来的几项体内研究表明,膳食锌摄入缺乏或过量会影响肠道菌群的组成和功能,进而对人体健康产生一定的影响。
本文主要讲述锌缺乏或锌超载情况下细菌类群的一些改变,短链脂肪酸生成变化,细菌金属抗性和抗生素抗性基因增加,以及锌相关转运蛋白的变化。
有助于进一步了解膳食锌对人体肠道微生物组的影响,并阐明利用肠道微生物组作为潜在锌状态生物标志物的适用性。帮助人们更好地控制锌的摄入量来塑造自身健康。
锌(Zinc)是一种化学元素,也是第四”常见”的金属。在现代工业中,锌是电池制造上不可替代、相当重要的金属。
锌还是人体必需的微量元素之一,起着极其重要的作用。
•维持正常食欲,利于生长发育
缺锌会导致味觉下降,锌会影响舌黏膜的正常功能,缺锌时味觉敏感度会比较差,可能还会因此而产生食欲不振或厌食等。长时间厌食会影响营养物质吸收,产生营养不良。
锌有助于生长发育、智力发育,缺乏锌会对我们的身体,特别是生长发育造成严重影响。所以,补充足够的锌是必须的。
•增强人体免疫力
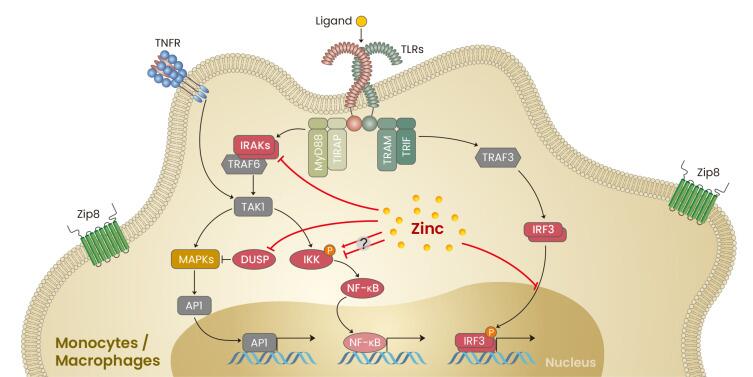
锌是免疫器官胸腺发育的营养素,只有锌充足才能有效保证胸腺发育,正常分化T淋巴细胞,促进细胞免疫功能。失调的锌稳态会损害整体免疫功能,从而增加对感染的易感性。
锌还以类似于钙的方式作为免疫反应的离子调节剂,通过作为细胞内信使参与信号通路。
锌在单核/巨噬细胞信号传导中的作用

Kim B,et al.Mol Cells.2021
•影响伤口恢复
锌作为许多转录因子和酶系统的辅助因子,包括锌依赖性基质金属蛋白酶,可在伤口修复过程中增强自体清创和角质形成细胞迁移。
缺锌易导致皮肤疾患,患口腔溃疡,受损伤口不易愈合,青春期痤疮等。
★ 锌对肠道微生物有重要影响
肠道微生物在宿主营养状况中发挥着重要作用,在免疫、与宿主细胞相互作用、代谢不可消化的营养素和合成必需维生素等方面发挥着关键作用。
锌结合蛋白占细菌蛋白质组的5%,突出了细菌定植胃肠道的主要锌。锌是一种重要的营养物质和抗菌剂,近年来的研究发现,膳食中锌含量的不同导致肠道微生物的组成和功能产生改变,进而对人体健康产生一系列影响。
膳食锌(锌缺乏或锌过量)对肠道菌群的影响
向上滑动阅览



Cheng J,et al.Crit Rev Food Sci Nutr.2023
接下来跟随谷禾了解一下膳食锌缺乏和过量情况下肠道微生物的具体改变
1. 在缺锌条件下,发现能够有效竞争锌的细菌(即肠杆菌科和瘤胃球菌科以及肠球菌属和脱硫弧菌属)增殖。
2. 与碳水化合物和糖代谢相关的微生物代谢途径的表达改变已被发现与锌缺乏相关,其中细菌可以将碳水化合物和糖代谢为短链脂肪酸。
3. 粘蛋白相关细菌丰度的改变(即粘嗜阿克曼氏菌和异源杆菌)也与锌缺乏有关。肠道粘蛋白由粘多糖和糖蛋白组成,细菌可以以这种粘蛋白为食并产生短链脂肪酸。
与锌缺乏相关的潜在结果包括细菌的定植和生长,这些细菌可以有效地竞争锌。
4. 此外,锌缺乏可能导致产生短链脂肪酸的细菌(即Blautia和Ruminococcus)的丰度降低。短链脂肪酸浓度与肠道pH值相关,由于短链脂肪酸含量降低导致的pH值升高会降低锌的溶解度,从而降低锌的生物利用度和吸收。
与锌缺乏相关的潜在宿主和肠道菌群
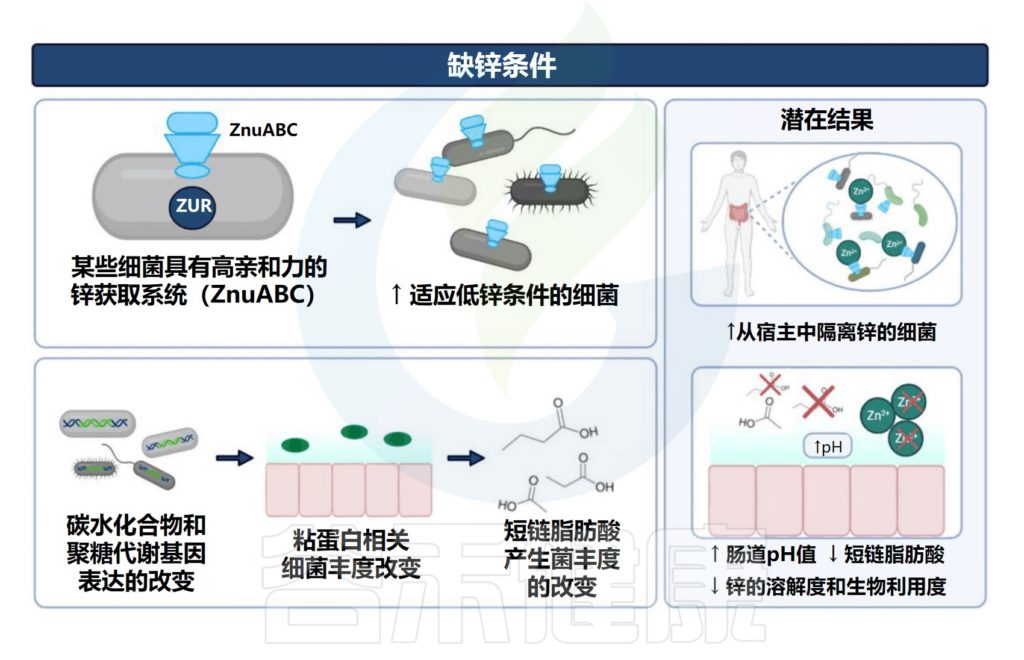
Cheng J,et al.Crit Rev Food Sci Nutr.2023
六项研究比较了锌缺乏相对于锌充足对肠道菌群的影响,其中五项研究通过膳食锌控制诱导锌缺乏。
与锌充足对照组相比,锌缺乏组血浆/血清、指甲、羽毛、肝脏、睾丸和粪便锌含量降低。
锌缺乏组的实验对象大部分生物多样性下降,尤其是粘蛋白相关细菌丰度降低,短链脂肪酸的产量也减少,微生物相关代谢也在一定程度上减弱。
以上实验研究主要是基于小鼠,大鼠,鸡和猪等动物实验,关于人类的临床实验还较少,但是动物的实验也可以为人类提供一定的参考价值。
锌缺乏影响微生物多样性
关于与锌缺乏相关的肠道菌群调节,所有六项研究都评估了α-多样性和β-多样性。
✦α多样性
关于缺锌对肠道菌群α-多样性的影响,六项研究尚无共识。总的来说,三项研究发现α-多样性的改变与缺锌相关,三项研究没有发现变化,其中大多数研究采用了不同的α-多样性测量方法。
缺锌对α多样性的影响具有差异
在锌缺乏的情况下,一项研究发现α-多样性以性别依赖的方式增加或减少(雄性小鼠增加,雌性小鼠减少)。
同样,在人类研究中,缺锌对α-多样性的影响也存在差异。在学龄儿童中,锌缺乏导致α-多样性增加,而在锌缺乏的母乳和配方奶喂养的婴儿中,α-多样性降低。
虽然每项研究中生物多样性变化的差异可能与不同的研究对象有关,但还需要在人类和动物模型中进一步研究锌缺乏对肠道微生物群改变的影响。
✦β多样性变化暂不明确
进行的六项研究中有五项发现了与锌缺乏相关的β多样性变化。
然而,在第六项研究中没有发现β-多样性的变化,该研究使用了θYC距离测量。β多样性的变化并不一定表明细菌类群的有益或消极变化。
●门水平
在门水平上,锌缺乏与变形菌门(Proteobacteria)和黑色素杆菌(Melainabacteria)的增加以及厚壁菌门(Firmicutes)的减少有关。
注:其中变形菌丰度的增加被认为是生态失调和疾病风险的潜在诊断标准,因为在健康的人类肠道中发现了低变形菌丰度。而厚壁菌门的许多成员都是有益菌
这或许可以从一部分角度解释锌缺乏对健康的不利影响
短期缺锌与长期缺锌菌群改变不同
短期缺锌会降低疣微菌门(Verrucomicrobia)的丰度(主要是Akkermansia muciniphila属),而长期缺锌则与疣微菌门丰度的增加有关。
菌群改变出现性别差异
发现与锌充足的野生型小鼠相比,通过ZnT7敲除诱导的锌缺乏导致了敲除(ZnT7-/-)和异质(ZnT7+/-)小鼠的红蝽菌科(Coriobacteriaceae)丰度和Allobaculum属丰度的增加,这种变化仅在雌性小鼠中发现。这表明锌的调节功能可能因性别而异。
注:因此锌对不同性别的人群影响可能不同
●属水平
在属水平上,研究发现双歧杆菌(Bifidobacterium)、希瓦式菌属(Shewanella)、Rheinheimera的减少与血浆锌水平相关。
除此之外还发现粪杆菌属(Faecalibaculum)增加,经黏液真杆菌属(Blautia)、乳杆菌(Lactobacillus)、Negativibacillus减少。
慢性缺锌的情况
在慢性锌缺乏的情况下,以下菌群丰度增加:
肠球菌(Enterococcus) ↑↑↑
肠杆菌(Enterobacteriaceae) ↑↑↑
瘤胃球菌科(Ruminococcaceae) ↑↑↑
而下列菌群丰度下降:
Clostridiales ↓↓↓
消化链球菌科(Peptostreptococcaceae) ↓↓↓
●物种水平
在物种水平上,Lachnospiraceae NK4A136和
真杆菌属(Eubacterium coprostanoligene)的丰度随着锌的缺乏而增加,而Ruminococcus gauvreauii的丰度随着锌的缺乏而降低。
此外还发现了一些菌群的增加和下降
增加的菌群:
吲哚梭菌(Clostridium indolis) ↑↑↑
未分类的某种拟杆菌 ↑↑↑,
减少的菌群:
酸奶瘤胃球菌(Ruminococcus lactaris) ↓↓↓
肠球菌(Enterococcus sp.) ↓↓↓
Clostridium lactatifermentans ↓↓↓
Clostridium clostridioformme ↓↓↓
// 注意
锌缺乏可能使得一些对人体有益的细菌丰度下降,而致病菌的丰度上升,从而对健康产生影响
虽然在上述研究中发现了从门到属水平的显著差异,但在一些学者的研究中,微生物群的相对丰度没有显著差异。
锌缺乏对菌群主要代谢产物——短链脂肪酸的影响
研究了锌缺乏与微生物代谢物(短链脂肪酸)生产和功能的变化。
✦锌缺乏影响短链脂肪酸的产量
锌缺乏时间不同对短链脂肪酸的影响不同
一项小鼠研究发现,短链脂肪酸产量在短期锌缺乏时增加,但在长期锌缺乏时减少。鸡的研究发现,相对于锌充足,锌缺乏会降低短链脂肪酸的产量。
具体而言,短期(4周)饮食锌不足会增加盲肠乙酸,并与各组短链脂肪酸产生细菌(Flavonifractor、Alistipes、Odoribacter、Anaerotruncus、 Alloprevotella、Bifidobacterium adolescentis、Paralactobacillus Leisner)呈正相关,表明在锌匮乏的条件下,肠道微生物群可以增加锌的利用率。
另一方面,长期锌不足(8周)与戊酸盐产量下降有关。发现与碳水化合物、氨基酸、萜类/聚酮、核苷酸代谢、聚糖生物合成和代谢以及异种生物降解和代谢相关的微生物代谢途径随着长期锌缺乏而降低。
✦短链脂肪酸浓度影响锌的利用与吸收
短链脂肪酸浓度与肠腔pH值相关,其中,由于短链脂肪酸含量增加而导致的pH值降低可增加锌的溶解度,从而增加锌的生物利用度和吸收。
说明锌与短链脂肪酸存在相互作用的关系
鉴于短链脂肪酸、宿主营养和肠上皮维持之间的联系,其中短链脂肪酸的产生与黏蛋白的产生有关,细菌发酵碳水化合物和抗性淀粉,短链脂肪酸被用作细菌能量来源。
一组研究人员发现锌缺乏导致乙酸盐产量下降,这可能是由于产生短链脂肪酸的细菌属,如梭状芽胞杆菌和瘤胃球菌的减少。
综上所述,锌缺乏情况下肠道菌群组成的改变及其相关代谢途径影响碳水化合物和糖基代谢、肠道黏蛋白降解,从而影响短链脂肪酸的产生。
锌缺乏与代谢通路变化
✦锌缺乏使微生物相关代谢减弱
在微生物代谢途径中,锌缺乏与碳水化合物代谢相关基因的表达降低有关、以及糖聚糖生物合成和代谢、核苷酸代谢、氨基酸代谢、抗生素耐药性、矿物质吸收、脂肪酸代谢、一级/二级胆汁酸合成和异种生物降解都有联系。
此外,发现与锌吸收、脂肪酸代谢和碳水化合物消化和发酵相关的KEGG途径表达减少,其中最后一种途径也可能导致短链脂肪酸产量减少,这与提高锌生物利用度有关,从而使锌缺乏状态持续存在。
注:基于人类疾病KEGG通路,分别在短期和长期锌缺乏症中发现了更多与物质依赖和心血管疾病相关的基因。
锌缺乏对肠道粘蛋白及相关菌的影响
额外的微生物类群改变与锌缺乏和肠粘蛋白丰富有关。由杯状细胞产生的黏液层由粘多糖和糖蛋白组成,并容纳有助于消化矿物质的肠道微生物群。
粘蛋白——黏蛋白关键特征是其形成凝胶的能力; 因此它们是大多数凝胶状分泌物的关键组成部分,提供润滑,细胞信号通路及化学屏障的功能。
✦锌缺乏影响粘蛋白相关细菌丰度
锌缺乏会影响与粘蛋白相关细菌丰度,例如嗜黏蛋白阿克曼菌的减少不利于肠道屏障的完整性,并在一定程度上影响乙酸和丙酸等短链脂肪酸的产生,从而对健康产生危害。下面是一些具体实验证据:
锌缺乏影响嗜黏蛋白阿克曼菌丰度
共生细菌以黏液蛋白为食并粘附在黏液蛋白上,与宿主相互作用并调节黏液蛋白基因的表达和分泌,与上皮细胞相互作用以维持黏液和上皮内稳态。
在短期锌缺乏的情况下,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在统计学上显著下降,这与之前的研究一致,这些研究表明嗜黏蛋白阿克曼菌相对丰度较低与锌缺乏相关。
嗜黏蛋白阿克曼菌(A.muciniphila)存在于大肠黏液层,调节肠道屏障的完整性,其丰度与代谢性疾病和炎症性肠病发病率呈负相关。此外,嗜黏蛋白阿克曼菌是一种粘蛋白降解物,可将粘蛋白转化为乙酸和丙酸以供能量使用。
锌缺乏与其他影响粘蛋白丰度的菌群相关
同样,在缺乏锌的情况下,发现经黏液真杆菌属(Blautia)和乳酸杆菌属,以及粪杆菌(Faecalibaculum)属的增加,这些都是可能影响粘蛋白丰度的类群。
乳酸菌的减少可能会减少肠道黏蛋白,因为某些乳酸菌会刺激黏液蛋白2 (MUC2)的产生,黏液蛋白2是杯状细胞表达的主要肠道黏蛋白。
经黏液真杆菌属(Blautia)含量降低,经黏液真杆菌属含有粘蛋白降解基因是一种短链脂肪酸(丁酸和乙酸)生产者,其丰度可能预测锌状态的差异。
异杆菌属丰度增加有利于结肠上皮健康
研究发现,与锌充足野生型(ZnT7+/+)相比,通过敲除ZnT7诱导的锌缺乏导致敲除(ZnT7-/-)小鼠和异质性(ZnT7+/-)小鼠的异杆菌属(Allobaculum)丰度在雌性小鼠中均有所增加。黏蛋白密度(酸性和中性黏蛋白减少,杯状细胞数量减少)与异杆菌属(Allobaculum)相对丰度呈负相关。
异杆菌属(Allobaculum)与发酵碳水化合物(即粘蛋白)有关,以产生短链脂肪酸(乳酸和丁酸),供异源菌群作为碳源利用,这表明异杆菌属(Allobaculum)丰度的增加可能与有利于结肠上皮健康的潜力有关。
小结
总的来说,锌缺乏通常会导致细菌生物多样性、从门到种水平的细菌丰度的降低、短链脂肪酸的产生减少以及与碳水化合物和糖基代谢相关的细菌代谢途径的减弱,锌相关蛋白基因表达也可能在一定程度上减弱。
注:这些变化影响了人体原本正常的代谢,可能导致一些疾病的产生。
注意
所有六项关于锌缺乏和肠道菌群改变影响的研究都使用了膳食锌作为锌源。对于α-多样性和短链脂肪酸产生的变化还缺乏共识,一个可能的解释可能是所使用的动物模型以及模型的生命阶段和性别的差异。
注:只有一项研究使用了大鼠模型,而所有其他研究都使用了小鼠模型。与其他研究相比,所使用的小鼠年龄最大,小鼠肠道菌群随着年龄的增长逐渐稳定。
三项研究仅使用男性受试者,一项研究仅使用女性受试者,两项研究同时使用女性和男性受试者,其中考虑到人类性别之间免疫功能的差异以及锌、免疫功能和肠道微生物组之间的联系,在设计阐明锌缺乏症对肠道微生物组组成和功能的影响的未来研究时,应考虑受试者的性别。
1.与高锌或锌过载相关的潜在结果包括具有高锌条件机制的细菌定殖和生长。
某些细菌具有通过有效的重金属排出系统来抵消高锌浓度的机制。在高锌条件下,发现了对增加金属锌暴露有进化适应的细菌(即梭状芽孢杆菌科、肠杆菌科和大肠杆菌)。
2.增加的细菌进化适应增加的金属暴露(金属抗性),已发现与抗生素耐药性相关的微生物基因表达增加有关。
此外,高锌条件可能会潜在地增加耐药肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐药现象。
与高锌或锌过载相关的潜在宿主和肠道菌
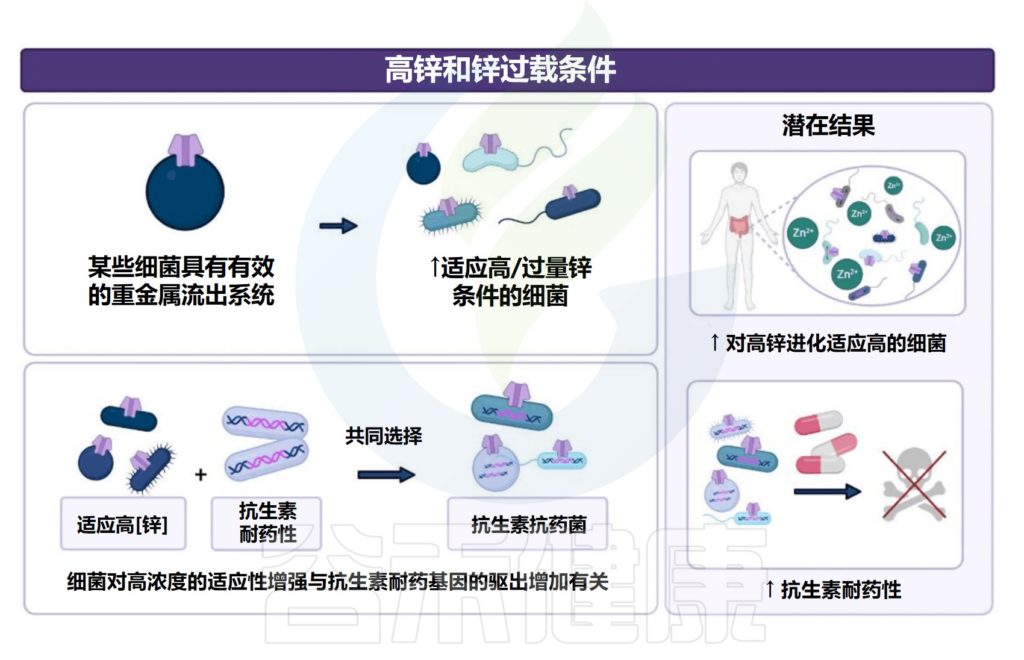
Cheng J,et al.Crit Rev Food Sci Nutr.2023
★锌过量的危害
1.一般情况下,补锌过量可能会导致机体出现锌中毒,大部分人群可能会出现胃肠道症状,如恶心、呕吐等。
2.抵抗力下降:过高的血锌会抑制白细胞的吞噬作用和杀菌作用,使人体的抵抗力下降,容易遭受致病菌侵袭。
3.记忆力下降:对于不缺锌的人,额外补充有可能造成体内锌过量,从而引发代谢紊乱,甚至会对大脑造成损害,可能损伤大脑神经元,导致记忆力下降。
4.贫血:有些家长误把锌制品当作营养品,给婴儿长期大量服用,殊不知补锌过量同样会带来危害,会使体内的维生素C和铁的含量减少,抑制铁的吸收、利用,容易引起、加重缺铁性贫血。
下面具体讲述一下锌过量状态下肠道微生物具体发生的变化
五项研究比较了高膳食锌或锌过载相对于锌充足对肠道菌群的影响。
锌过量与相关代谢基因
与锌充足对照相比,高锌或锌过载导致锌相关蛋白基因表达有所改变。
✦高锌摄入降低锌转运蛋白ZIP4基因表达
ZIP4是锌从肠腔进入肠上皮细胞的主要导入物,由饮食中的锌调节,随着锌摄入的增加,ZIP4的表达下调。
两项研究发现,高锌摄入量会降低ZIP4基因的表达。还发现,高锌摄入的小鼠ZnT2表达增加(仅回肠),MT1和MT2表达增加(回肠和结肠),而其他测试的ZnT(4-7,9)和ZIP(1,3,5-11,13,14)蛋白的基因表达没有变化。
✦脂质代谢基因表达降低
与短链脂肪酸产量降低一致,与脂质代谢相关的微生物基因表达也在高锌和过量锌饲粮中被发现降低。
✦抗性基因表达增强
在微生物代谢途径中,高锌和过量膳食锌与抗生素耐药性相关基因的表达增加有关、传染病和金属离子结合,以及与脂代谢、异种生物降解和酶活性(果胶酯酶、α-葡糖醛酸酶、α-l-阿拉伯糠醛苷酶)相关的基因表达降低。
抗生素耐药性增强
将抗生素抗性基因丰度的增加与肠杆菌的增加联系起来,其中高氧化锌饲粮已普遍用于猪,并导致促进抗生素耐药性。
具体而言,在猪肠道中发现耐多药大肠杆菌的患病率增加,这归因于高氧化锌饮食。
研究发现,饮食中锌过量会增加肠球菌,其中肠球菌具有质粒编码的耐药基因,本质上对许多常见抗菌剂不那么敏感。
尽管没有研究微生物代谢基因,但考虑到细菌类群对锌增加的适应性增加,考虑到金属耐药基因和抗生素耐药基因的共同共存,有可能存在抗生素耐药细菌基因的增加。
总的来说,高锌或锌过载似乎潜在地增加了耐抗生素的肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐抗生素现象,从而导致人体的抗生素和金属耐药性增强。
锌过量影响微生物多样性
评估了与高锌或锌过载相关的肠道菌群调节的多样性测量;4项研究评估了α-多样性,5项研究评估了β-多样性。
✦高锌下α多样性降低
利用Pielou的均匀度α-多样性测量发现,α-多样性随着高锌而降低。通过1/Simpson多样性测量也发现,α-多样性随着Zn过载而降低。
此外,短期(4周)高饲粮锌或锌过载被发现不会显著影响α-多样性,长期高锌被发现不会改变(观察物种)或降低α-多样性,长期(8周)锌过载也不会改变α-多样性。
注:这可能取决于所使用的评估方法
α多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌等增多,进而影响人体的的健康。
✦β多样性的变化未达成共识
关于高锌或锌过载对微生物组β-多样性的影响,在五项选定的研究中也没有共识,其中三项研究发现了与高锌或锌过量相关的β-多样性变化,并在其他两项研究中保持不变,尽管不同的研究使用了不同的距离测量。
疣微菌门的丰度与锌过载暴露时间有关
在小鼠中,高饲粮锌和锌过载在短期内增加了疣微菌门(Verrucomicrobia)丰度,但在长期暴露后会降低疣菌菌丰度,此前在仔猪中也有这种情况,其中长期高饲粮锌或锌过载会通过细菌金属间竞争、金属蛋白错金属、或与金属毒性和细菌金属稳态改变相关的氧化还原活性。
高锌显著增加了梭状芽孢杆菌科(Clostridiaceae)的丰度,其中梭状芽孢杆菌科被发现具有通过有效的重金属外排系统来抵消高锌浓度的机制,该系统可能是从携带重金属抗性基因的质粒转移而来的。
梭菌科更适应高锌的浓度
鉴于这些更强的抗锌机制,梭菌科可以适应高锌浓度,因此相对于其他细菌有更多的定殖。最后,在高膳食锌摄入量下,与金属离子结合和金属离子转运相关的微生物基因表达增加,支持了对高膳食锌环境具有特定进化适应的正向选择细菌类群的假设。
注:在所选研究中,在不同的分类水平上研究了肠道微生物群的组成和功能的变化。在这五项研究中都发现了细菌类群的显著变化,这些变化可以归因于微生物群对有效锌浓度增加的适应。
✦门水平
对于细菌类群的变化,在门水平上,两项研究发现高锌没有显著改变细菌丰度。
虽然在两项利用猪模型的研究中拟杆菌门(Bacteroidetes)丰度有所增加,但在门水平上的其他变化没有达成共识。
时间不同菌群丰度变化不同
研究发现短期(4周)高锌和锌过载会增加疣微菌门(Verrucomicrobia)的丰度,而长期暴露(8周)会降低疣微菌门(Verrucomicrobia)的丰度。
另一项研究发现,短期锌过载导致变形菌门丰度增加,长期锌过载导致放线菌门丰度增加。
✦科、属、种水平变化较小
与膳食锌含量过高或过量相关的科、属或种水平变化之间不明显。
在短期(4周)和长期(8周)暴露中,黑色素杆菌(Melainabacteria)与血清锌水平呈负相关,而Desulfovibrio sp. ABHU2SB与血清锌水平呈正相关。
✦锌过载时肠道菌群的具体变化
罗伊氏乳杆菌(L. reuteri)与短期锌过载呈负相关;然而,随着长期锌过载,该属与血清锌无显著相关性。
高锌显著增加了梭菌科(Clostridiaceae)丰度,降低了乳杆菌科(Lactobacillaceae)和肠杆菌科(Enterobacteraceae)丰度。
在利用猪模型的研究中发现, 普雷沃氏菌(Prevotella)和乳酸菌属增加,琥珀酸弧菌属(Succinivibrio) 减少。
另一组研究人员发现锌过载下列菌株丰度增加:
拟杆菌属(Bacteroides) ↑↑↑
副杆菌属(Parabacteroides) ↑↑↑
柯林斯菌属(Collinsella) ↑↑↑
醋弧菌属 (Acetivibrio) ↑↑↑
经黏液真杆菌属(Blautia) ↑↑↑
粪球菌属(Coprococcus) ↑↑↑
普拉梭菌(Faecalibacterium) ↑↑↑
霍尔德曼氏菌(Holdemania) ↑↑↑
Subdoligranulum ↑↑↑
Nestiinimonas ↑↑↑
Lachnoclostridium ↑↑↑
Pseudoflavonifractor ↑↑↑
而以下菌群减少:
巨型球菌属(Megasphaera) ↓↓↓
戴阿利斯特杆菌属 (Dialister) ↓↓↓
氨基酸球菌属(Acidaminococcus) ↓↓↓
瘤胃球菌(Ruminococcus) ↓↓↓
Treponema ↓↓↓
虽然生物多样性变化的差异可能与每项研究中不同的研究对象和不同的研究时间有关,但高膳食锌或锌过量对人类肠道微生物群的影响仍不确定,这突显了进一步研究的必要性。
锌过量对细菌主要代谢产物——短链脂肪酸的影响
✦高锌降低短链脂肪酸含量
长期(8周)高锌与对照组相比,短链脂肪酸总产量更低。具体而言,与锌充足相比,长期高饲粮锌导致盲肠戊酸、丁酸、乙酸、异戊酸、异丁酸和丙酸降低。
短链脂肪酸在管理炎症和促进肠上皮完整性方面发挥着重要作用,高锌除了抑制短链脂肪酸生成外,还发现导致结肠炎症增加。
锌过量与炎症及免疫
虽然锌通常被认为是安全的,因为它不具有氧化还原活性,但大量或过量的锌暴露与肠道功能的改变、免疫功能的改变和炎症有关,因此强调需要确定高剂量和锌过载剂量对肠道微生物组组成和功能的影响。
✦锌过量影响炎症疾病发病率
乳酸菌科的细菌与短链脂肪酸的产生有关,将碳水化合物发酵成乳酸。此外,乳酸菌,产生各种各样的胞外多糖,作为阳离子金属离子(如Zn2+)的结合位点,可以保护这些微生物免受金属毒性。
根据种类的不同,乳酸菌可以是促炎的,也可以是抗炎的。在一项研究中,来自乳酸菌科的细菌丰度增加(Lactobacillus spp.),但在两项研究中(罗伊氏乳杆菌)丰度下降,高膳食锌摄入量。人类罗伊氏乳杆菌丰度的降低与炎症疾病发病率的增加相关。
✦高浓度锌具有抗菌作用
此外,膳食中高浓度的锌在防御致病性大肠杆菌、单核细胞增生李斯特菌和链球菌方面发挥抗菌作用。
小结
总的来说,在大多数选定的研究中,高饲粮锌和锌过载状态与α-多样性降低或不变、短链脂肪酸产量降低以及金属和抗生素抗性基因增加有关。
这些因素都在一定程度上影响人体的健康,对其产生不利的影响。
不足之处
在每一项研究中,并没有量化短链脂肪酸和微生物代谢基因,这本可以更好地了解过量锌摄入相关的微生物群组成和功能。
饮食中高锌或锌过载对人类肠道菌群的影响研究较少。鉴于抗生素耐药性的潜在灾难性影响,未来的研究应了解微生物分类和多样性的变化,以及微生物代谢物产生的变化和驻留菌群的宏基因组潜力。
锌的每日推荐食用量
中国营养学会规定,婴幼儿(0-1岁)5毫克/天,儿童(1-10岁)10毫克/天。青春期男性15毫克/天,女性12毫克/天。
孕妇和哺乳期产妇因为母乳喂养,乳汁中的锌流失比较多,所以锌的摄入量也应多一点,每天20-25毫克。一般锌的摄入量不超过25毫克。
★ 含有锌的食物
海鲜类:如牡蛎、鱼、扇贝、虾仁等,不仅含有较多的锌元素,且含有较多的不饱和脂肪酸,有助于减少动脉硬化的发生风险,从而预防心血管疾病的发生,其中牡蛎的含锌量比较高;
肉禽类:如猪肝、瘦牛肉、猪肉、鸡肉等,通常会含有较多的蛋白质以及微量元素,如锌、铁、磷等,有助于补充锌元素以及预防缺铁性贫血的发生;
蛋类:如鸡蛋、鸭蛋中也含有一定的锌元素,还富含脂溶性维生素、磷脂等,有助于减少口唇干裂、皮炎等疾病的发生;
干果类:如花生、核桃、芝麻、蚕豆、黄豆、绿豆、板栗等,含有钙、锌等多种微量元素,以及胡萝卜素、核黄素等多种维生素和脂肪、碳水化合物,在补充锌元素的同时有助于能量的补充。
膳食锌缺乏与摄入过量都会影响肠道微生物组的组成和功能,进而影响人体正常代谢与健康。
缺锌时,肠道微生物组的改变包括α-多样性的改变、粘蛋白降解细菌丰度的下降、短链脂肪酸产生的减少以及影响碳水化合物和糖基代谢的代谢途径表达减弱。
过量摄入膳食锌的情况下,肠道微生物组变化包括α-多样性没有变化或减少,短链脂肪酸产量减少,细菌金属抗性和抗生素抗性基因的潜在增加。
未来期待更多关于锌等微量营养元素和肠道菌群互作以及影响机理的的人类试验,虽然人类膳食营养的研究中单一变量不太好控制,但是基于大人群的营养调查以及其他协变量控制情况下,去调查这些关键营养素与肠道菌群的扰动可以帮助进一步明确阐明营养在人体健康和疾病扮演的角色和作用机理,对于后续基于菌群或营养素的预防干预治疗有重要的指导价值。
主要参考文献:
Cheng J, Kolba N, Tako E. The effect of dietary zinc and zinc physiological status on the composition of the gut microbiome in vivo. Crit Rev Food Sci Nutr. 2023 Jan 23:1-20. doi: 10.1080/10408398.2023.2169857. Epub ahead of print. PMID: 36688291.
Kim B, Lee WW. Regulatory Role of Zinc in Immune Cell Signaling. Mol Cells. 2021 May 31;44(5):335-341. doi: 10.14348/molcells.2021.0061. PMID: 33986184; PMCID: PMC8175146.
Baholet D, Skalickova S, Batik A, Malyugina S, Skladanka J, Horky P. Importance of Zinc Nanoparticles for the Intestinal Microbiome of Weaned Piglets. Front Vet Sci. 2022 Jun 2;9:852085. doi: 10.3389/fvets.2022.852085. PMID: 35720843; PMCID: PMC9201420.
Chen, X., Y. Jiang, Z. Wang, Y. Chen, S. Tang, S. Wang, L. Su, X. Huang, D. Long, L. Wang, et al. 2022. Alteration in gut microbiotaassociated with zinc deffciency in school-age children. Nutrients 14 (14):2895.
Cheng, J., H. Bar, and E. Tako. 2021. Zinc status index (ZSI) for quantiffcation of zinc physiological status. Nutrients 13 (10):3399.
Chen, L., Z. Wang, P. Wang, X. Yu, H. Ding, Z. Wang, and J. Feng. 2021. Effect of long-term and short-term imbalanced Zn manipulation on gut microbiota and screening for microbial markers sensitive to zinc status. Microbiology spectrum 9 (3):e0048321.
Bombaywala, S., H. J. Purohit, and N. A. Dafale. 2021. Mobility of antibiotic resistance and its co-occurrence with metal resistance in pathogens under oxidative stress. Journal of Environmental Management 297:113315.
谷禾健康

抑郁症和抑郁情绪是不一样的,如果说抑郁情绪是一阵悲伤或沮丧,那么抑郁症可以具有巨大的深度和持久力。抑郁症不只是沮丧发作,也不是性格弱点,无法以“快刀斩乱麻”的方式轻松摆脱。
世界卫生组织统计,全球约10亿人正在遭受精神障碍困扰,新冠疫情后,全球精神障碍疾病负担更加沉重,抑郁症患者激增 5300万,增幅高达 27.6%。受抑郁症影响的女性多于男性。
抑郁症患者通常会出现持续的压抑,兴趣减退,动力不足;除了在情绪上的悲观冷漠之外,很多抑郁症患者还常伴有食欲不振、便秘等胃肠道症状。

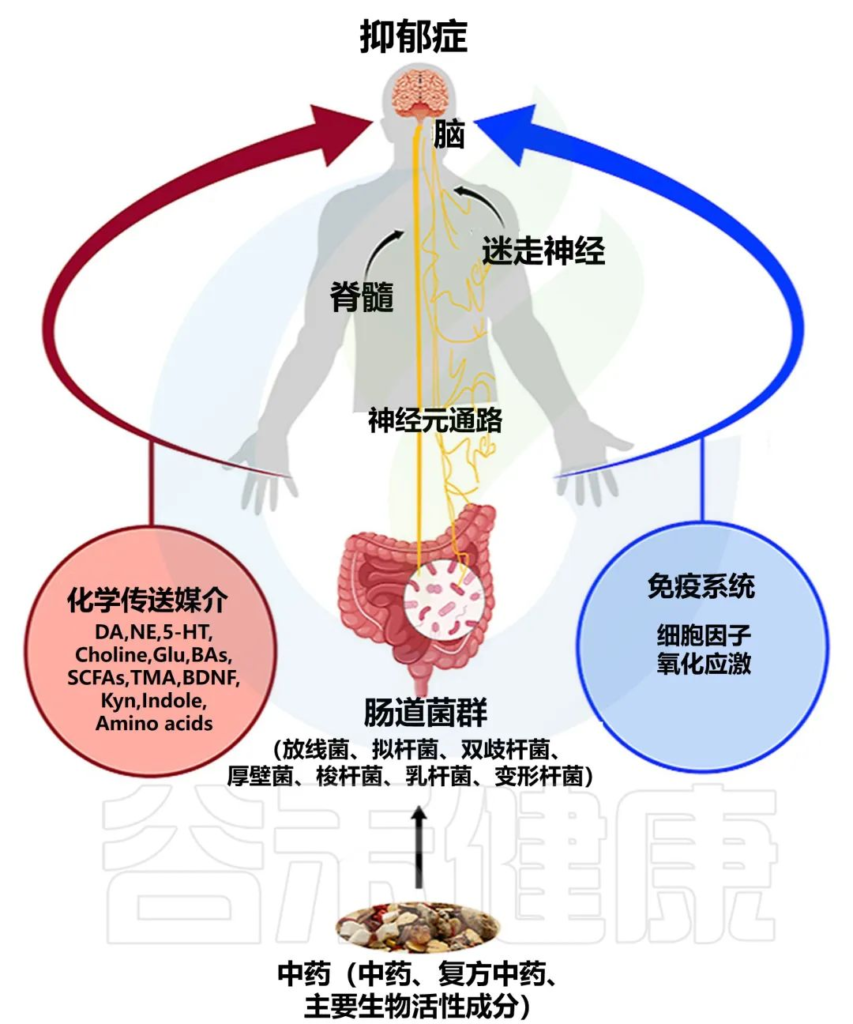
抑郁症是一种多因素,多重机制参与的复杂的疾病,病情绵长。它与神经递质表达异常、炎性因子分泌、神经细胞通路改变、下丘脑-垂体-肾上腺(HPA)轴持续紊乱、肠道菌群改变及线粒体结构异常等诸多因素有关。
抑郁症在中医中属于“郁证”的范畴,几千年前的书籍中就已有所记载。《黄帝内经》中所述 “心主血脉、心主神志” , 这里“神志之心”与现代医学脑的生理功能基本对应,中医学“心与小肠相表里”理论与现代医学提出的“脑-肠轴”理论相通,其部分内涵可以理解为中枢神经系统与肠道菌群的密切关系。
近年来,越来越多的中药、中药复方被证实可以发挥抗抑郁作用,人们开始认识到中医药通过调节肠道菌群而影响抑郁症发生发展,这为抑郁症的治疗提供新思路。
本文主要介绍肠道菌群和抑郁症之间的关联,窥探中医与肠道菌群之间的微妙关联,以及基于肠道菌群来探讨中医药改善抑郁症的相关机制。
本文主要内容如下:

抑郁症是一种常见的医学疾病,会对感受、思维方式和行为方式产生负面影响。它是一种复杂的疾病,有多种成因,包括各种生活方式、饮食、环境和遗传因素。
▼ 常见的抑郁症症状有哪些?
抑郁的人通常会出现以下几种症状:

▼ 抑郁症有哪些类型?
不同类型抑郁症的例子包括:
双相情感障碍、重度抑郁症(临床抑郁症)、持续性抑郁症和季节性情感障碍。
双相情感障碍的人会经历抑郁和躁狂(情绪异常升高)或轻躁狂(明显但不一定异常的情绪升高)交替状态。
重度抑郁症的特征是严重的症状会扰乱个人的日常生活,通常会影响食欲、睡眠、工作或享受生活的能力。
持续性抑郁症涉及持续两年或更长时间的症状,有时以严重抑郁症发作为特征。
其他类型的抑郁症包括产后抑郁症、精神病性抑郁症和季节性情感障碍,每一种都在特定情况下发生。
产后抑郁症发生在女性分娩后的时期。症状包括焦虑、对照顾婴儿缺乏兴趣,以及悲伤、绝望或无能为力的感觉。
精神病性抑郁症是在精神病的背景下出现的,精神病可能涉及妄想、幻觉或偏执的症状。
季节性情感障碍的特点是抑郁症状在秋季和冬季发作,随着春季和夏季暴露于自然光的增加而缓解。
▼ 哪些人群患抑郁症的风险相对较高?
▼ 有什么方法可以治抑郁症?
目前用的较多的是药物和心理疗法。
目前常用的药物包括:
抗抑郁药可能会在使用的第一周或两周内产生一些改善,但可能需要两到三个月才能看到效果。
心理疗法帮助一个人识别扭曲/消极的想法,以更积极的方式应对生活中的挑战。
例如与他人建立积极的互动关系,识别消极的信念和行为并改善,学习设定切实可行的人生目标等。
心理疗法或“谈话疗法”有时单独用于治疗轻度抑郁症;对于中度至重度抑郁症,心理治疗通常与抗抑郁药物一起使用。
其他疗法包括:
电惊厥疗法、经颅磁刺激、按摩疗法、音乐或艺术疗法、瑜珈(或太极或冥想)、时间疗法、针灸疗法、写作疗法、光疗、有氧运动、基于肠道菌群调节的补充剂非药物疗法(包括益生菌、益生元等)等。
▼ 什么原因可能导致抑郁症?
与抑郁症发生相关的因素可能有很多:
自尊心低、容易被压力压垮,对自己和世界产生消极想法,这样的人群似乎更容易患抑郁症。
持续暴露于暴力、忽视、虐待或贫困等不良环境,或不利的生活事件,会增加一个人患抑郁症的可能性或引发抑郁发作。
抑郁症可以在家族中遗传。例如,如果同卵双胞胎中的一个患有抑郁症,则另一个有 70% 的机会在一生中的某个时候患上抑郁症。
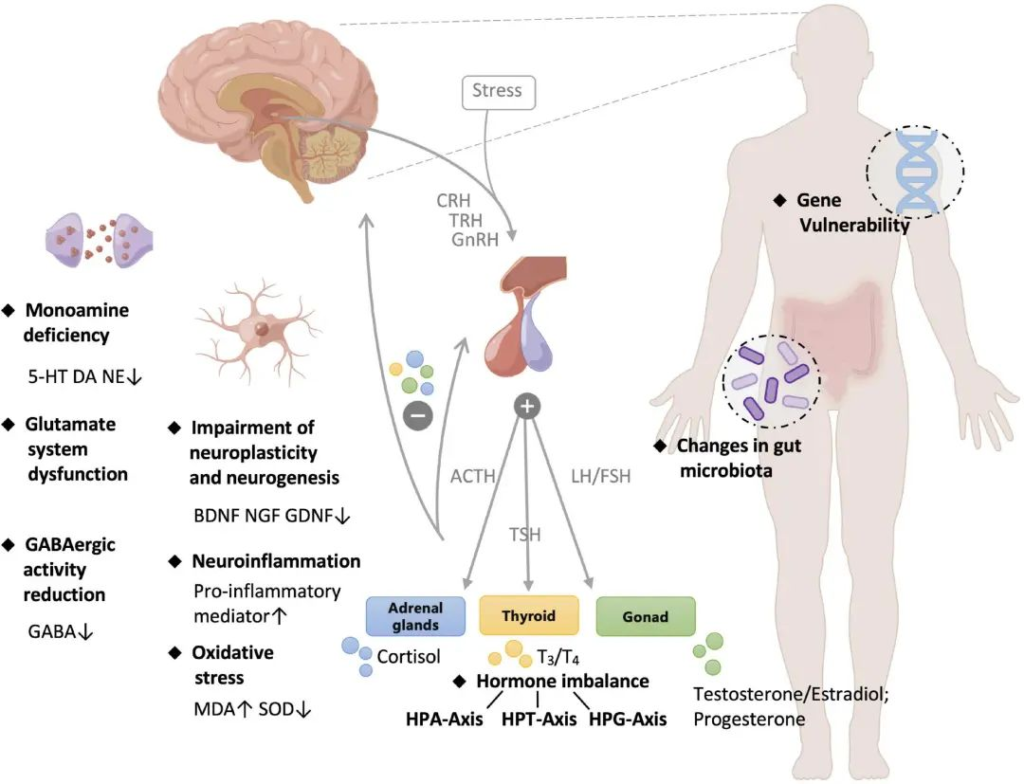
抑郁症的发病机制复杂且仍然难以摸透,目前已经提出了几种假说/理论来从不同的角度解释临床表现。
抑郁症的病理学
doi.org/10.3389/fpsyt.2022.1054726
单胺假说:
谷氨酸能假说和 GABA 能缺陷假说:
激素失调:
神经发生和神经可塑性假说:
肠道菌群理论:
关于肠道菌群如何通过微生物群-肠-脑轴影响抑郁症,我们在下一章节详细阐述。
肠道菌群与人体是共生互利密不可分的统一体, 又被称为人的 “ 第二大脑 ” ,它的作用不仅局限于胃肠道,还可以通过 “脑-肠轴” , 参与调控脑发育、应激反应、焦虑抑郁、认知功能等中枢神经系统的活动,从而对脑的功能和行为产生重大影响。肠道菌群、肠道、脑三者间密切的信息交流,共同影响人的喜怒哀乐。
抑郁患者常伴有胃肠功能障碍, 表现在食欲不振、代谢紊乱、胃肠功能紊乱及肠道菌群异常等方面的问题。即便不是抑郁症患者,我们回想一下,有时候对某些事件感到压抑,恐惧等情绪,或者一些状况感到焦虑的时候:是不是也会经历某种肠道不适,比如恶心、反胃、腹泻等。
胃肠道和大脑之间似乎有着某种联系,如果说大脑可以影响肠道,那么反过来肠道是不是也能影响大脑?这种联系究竟是怎么发生的?
本章节我们详细了解其中的故事。

近期发表在《自然通讯》杂志上的两项研究发现,肠道中的几种细菌与抑郁症状之间存在联系。
一 “抑郁症状的肠道微生物组关联研究” :

该研究调查了来自鹿特丹研究队列的 1,054 名参与者的粪便微生物组多样性和组成与抑郁症状的关系,并在 1,539 名受试者的阿姆斯特丹 HELIUS 队列中验证了这些发现。
研究人员确定了 13 个与抑郁相关菌群,包括:
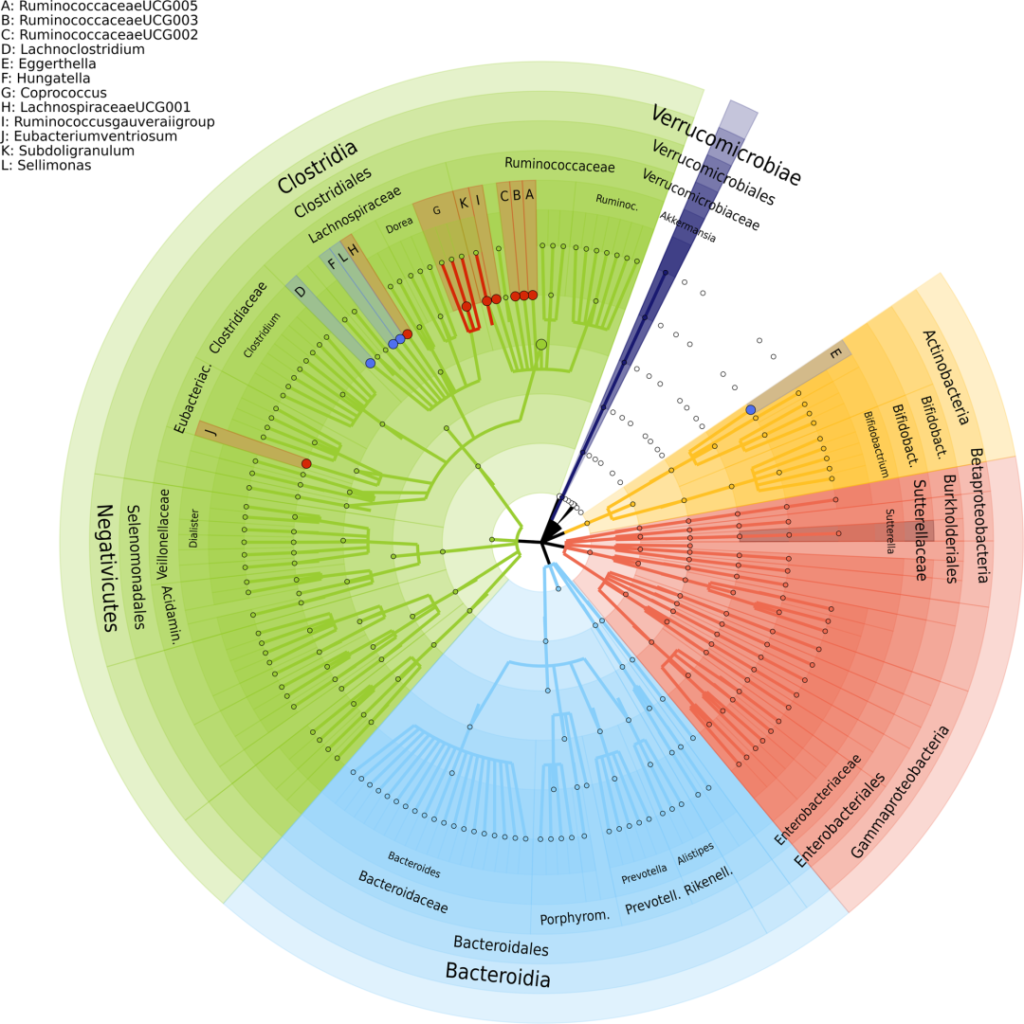
红点表示与抑郁症状负相关的属,蓝色点表示与抑郁症状正相关的属。最外层描述了门级,然后是纲、目、科和属级。
已知这些细菌参与谷氨酸、丁酸、血清素和γ-氨基丁酸 (GABA) 的合成,这些是抑郁症的关键神经递质。该研究表明,肠道微生物组成可能在抑郁症中发挥关键作用。
二 “跨种族的肠道菌群和抑郁症状”的研究:
不同种族群体的微生物组和抑郁症状水平差异很大。因此,任何针对微生物组的抑郁症干预都需要了解不同种族的微生物组抑郁症相关性。

通过分析HELIUS队列的数据,研究人员描述了生活在同一城市地区的6个种族群体(荷兰、南亚苏里南、非洲苏里南、加纳、土耳其、摩洛哥;N=3211)的肠道微生物群及其与抑郁症状的关联。
考虑到人口统计学、行为学和医学差异,肠道菌群在个体内部(α多样性)和个体之间(β多样性)可预测抑郁症状水平。
β多样性解释了29%-18%的抑郁症状的种族差异。与抑郁症状相关的细菌属属于多个科,主要包括:
该研究结果表明,肠道微生物群与抑郁症状水平相关,这种关联在不同种族群体中普遍存在。肠道微生物群的种族差异可能部分解释了抑郁症的平行差异。
以上我们了解到肠道菌群和抑郁症之间的关联。那么肠道菌群是如何影响抑郁症的?这就涉及到一个概念:
“ 微生物群-肠-脑轴 ”
1980 年,由于对神经元和脑细胞中胃肠内分泌系统的激素信号传导的研究发现,肠-脑轴的概念意外诞生。在接下来的几十年里,这一概念得到进一步加强和扩展,包括微生物群对肠-脑轴的贡献。
目前,微生物群-肠-脑轴更像一个复杂的循环而不是单向关系,它代表了宿主体内中枢神经系统、内分泌化学信号系统、免疫调节、微生物群和代谢效应,以及大脑和肠道的屏障功能之间的相互作用。
以上这些因素的协调对维持个体的健康状态起着重要作用。如果微生物群-肠-脑轴失衡,则会引起包括抑郁症等精神障碍。
我们前面的文章已经讨论过,肠道菌群可以通过许多潜在途径影响抑郁症,从大脑神经元到肠道小分子。
这里我们结合最新研究再了解一下,通常肠道菌群可以通过以下三种主要途径参与抑郁症,包括:
肠道微生物群和大脑之间的沟通途径
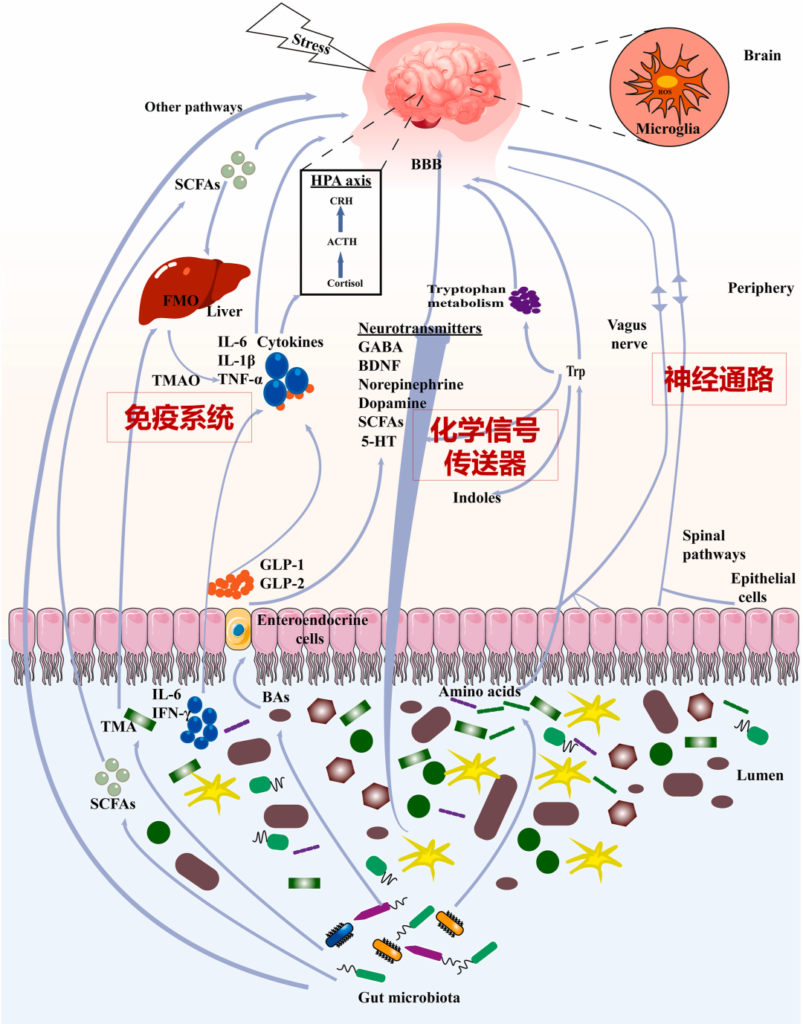
编辑
Li B, et al., J Ethnopharmacol. 2023
肠道菌群和大脑的沟通方式包括:
迷走神经、脊髓通路、短链脂肪酸(SCFA)、吲哚、色氨酸(Trp)、γ-氨基丁酸(GABA)、脑源性神经营养因子(BDNF)、去甲肾上腺素、多巴胺、5-羟色胺(5-HT)、细胞因子等。
接下来,我们就以上这些,逐一了解每个途径具体的运作方式。
Part 1 化学信号
▼
神 经 递 质 ——“信号兵”
神经递质是指脑内的化学物质,它们可以在神经元间的信息传递中起着重要作用,也就是充当“信号兵”的作用。根据其化学成分,神经递质分为:
神经递质——单胺
抑郁症的发病与单胺系统密切相关,多巴胺能、去甲肾上腺素能和血清素能神经元参与学习、记忆、行为、情绪和认知。
肠道微生物群影响单胺,包括多巴胺、去甲肾上腺素。例如,蜡样芽孢杆菌(Bacillus cereus)和蕈状芽孢杆(Bacillus mycoides)可以产生多巴胺。
神经递质——胆碱
胆碱是肠道、皮肤、神经系统和细胞中的必需营养素。胆碱水平会影响肠道菌群。如:胆碱缺乏可导致革兰氏阴性菌增加,并增强抑郁症患者的抑郁样行为。
肠道微生物群可以影响胆碱的生物利用度(如大肠杆菌可以抑制人体吸收胆碱的能力),从而导致胆碱缺乏和神经系统疾病的发生。
抑郁症患者的胆碱水平显著高于健康人。同时,抑郁症患者表现出肠道微生物群失衡。这表明影响胆碱代谢的肠道菌群可能参与中枢神经系统调节。
神经递质——谷氨酸
谷氨酸是大脑中的一种兴奋性神经递质,记忆、学习、行为、认知和发育与谷氨酸神经递质有关。突触传递通过谷氨酸受体实现,谷氨酸受体与神经递质释放和突触可塑性发育密切相关。
抑郁症患者的内侧前额叶皮质中谷氨酸水平降低。肠道细菌可影响谷氨酸代谢,如:
• 空肠弯曲杆菌 (Campylobacter jejuni)
• 谷氨酸棒状杆菌 (Corynebacterium glutamate)
• 乳酸发酵短杆菌 (Brevibacterium lactofermentum)
肠道微生物群将蛋白质分解为氨基酸,其中大部分被肠内肠细胞顶膜上的转运蛋白(如兴奋性氨基酸C1)吸收。因此,谷氨酸被肠道吸收并进入血液。谷氨酸转化为γ-氨基丁酸(GABA)。
部分肠道微生物群可以直接产生GABA。例如,双歧杆菌可以分泌大量GABA。
注:GABA作为大脑中的神经递质,促进神经系统的稳定。这些神经递质由肠道产生,通过肠脑轴进入中枢神经系统,发挥各种功能。
▼
胆 汁 酸
胆汁酸是胆汁的重要组成部分,在脂肪代谢中起着重要作用。胆汁酸在肝脏中产生,由肠道菌群产生的酶代谢,促进脂质的消化和吸收。
肠道微生物群介导的胆汁酸通过酶水解转化为次级胆汁酸,这会影响肠肝循环并导致中枢炎症。因此,胆汁酸代谢亢进与抑郁症的发展相关。
例如,Turicibacter 的相对丰度与抑郁症患者血液中的几种胆汁酸呈正相关,表明Turicibacter可能参与肠内胆汁酸的合成。
胆汁酸受体可以影响葡萄糖代谢,从而导致抑郁症的发生。肠道微生物群通过调节胆汁酸的变化,影响BA-TGR5-GLP-1途径,进而导致抑郁症的发作。
▼
短 链 脂 肪 酸
短链脂肪酸主要由乙酸、丙酸、丁酸和戊酸组成。可以通过肠道吸收并穿过血脑屏障,影响大脑功能。
短链脂肪酸可以改变血脑屏障的通透性,肠道菌群如如长双歧杆菌和短双歧杆菌产生的短链脂肪酸促进5-HT的合成和循环,从而实现抗抑郁作用。临床上没有针对短链脂肪酸的药物。外源性短链脂肪酸的补充还可能加重疾病。通过肠道微生物群调节短链脂肪酸可以改善抑郁症。
▼
三 甲 胺
三甲胺(TMA)是胃肠道化学递质的主要调节因子之一。肠道微生物群代谢肉类、高脂肪乳制品和其他食品中富含的胆碱和TMA。肠道微生物群产生的TMA由肝脏中的黄素单加氧酶3催化,生成三甲胺N-氧化物(TMAO),这会导致衰老、认知障碍、社会行为改变和脑部疾病。
TMA的产生可以通过调节肠道微生物群来抑制。
血清TMAO水平与心血管疾病和抑郁样行为相关。3,3-二甲基-1-丁醇(DMB)是人体中的一种重要神经递质,被证实可抑制肠道微生物群产生TMA,并降低高胆碱小鼠的TMAO水平。研究发现,DMB可以增加肠道中AKK菌的丰度。
TMA被肠道吸收,并穿过血脑屏障进入大脑,导致神经元兴奋性毒性、氧化应激和炎症。
TMA的结构与谷氨酸类似,谷氨酸是一种兴奋性神经递质。抑郁症患者表现出明显低于健康人的谷氨酸水平,TMA激活受体,导致分子损伤和氧化应激。因此,TMA影响抑郁症的发病机制。
通过抑制与TMA和TMAO相关的肠道微生物群,可以实现抗抑郁效果,并且可以减少药物直接作用引起的副作用。
▼
脑源性神经营养因子(BDNF)
BDNF是神经营养因子家族的一员,对海马和额叶皮层神经元的生长和存活至关重要。BDNF广泛分布于大脑中,与学习、记忆和神经发生密切相关。
BDNF——大脑和肠道细菌之间的重要纽带
肠道微生物群影响BDNF。例如,一些益生菌增加了血清BDNF水平,而补充真杆菌和梭状芽孢杆菌可降低BDNF的水平。肠道微生物群与BDNF密切相关,从而影响大脑功能。
肠道微生物群可以通过BDNF/TrkB信号通路实现双向肠道脑调节,这表明抑郁症的发病机制也与BDNF有关。
BDNF与抑郁症的发生和发展密切相关
肠道菌群失衡导致小鼠BDNF表达减少,导致认知功能和焦虑发生变化。同时,抑郁症患者大脑中BDNF和成熟BDNF的表达水平均降低。BDNF mRNA在海马和杏仁核(与抑郁症相关的区域)的表达显著降低。
在抑郁症模型中,发现将BDNF注射到中脑和海马的齿状回区域会产生类似抗抑郁的效果,通过注射TRK抑制剂可以逆转这种效果。
▼
色 氨 酸 代 谢
色氨酸是一种必需的氨基酸,可以影响人类的生长和健康。肠道微生物的变化可以通过调节色氨酸代谢来引起,而色氨酸代谢产物,如血清素、犬尿氨酸和吲哚,可以影响肠道微生物群和抑郁症之间的关系。
注:5-HT,5-羟色胺,又名血清素。
通过调节血清素的产生影响抑郁症
中枢神经系统中,色氨酸在酶的催化下生成血清素。血清素是参与控制睡眠、疼痛和情绪的关键神经递质。
肠道微生物群,例如乳球菌、乳杆菌、链球菌、大肠杆菌、克雷伯氏菌,通过表达色氨酸合酶来调节 5-HT 的产生, 脑肠轴进一步影响大脑中色氨酸的代谢。
通过肠道菌群代谢产物犬尿氨酸影响抑郁症
犬尿氨酸是色氨酸的代谢产物。犬尿氨酸具有抗氧化功能,可防止大脑皮层中的脂质氧化。肠道微生物群通过犬尿氨酸途径影响犬尿氨酸代谢。
抑郁症患者的血清 犬尿氨酸/喹啉酸 比率显着降低。犬尿氨酸和喹啉酸代谢之间的平衡与大脑结构和功能有关,尤其是在海马体中。
通过肠道菌群代谢产物吲哚影响抑郁症
吲哚是肠道菌群代谢的重要组成部分,与色氨酸代谢密切相关。
Part 2 神 经 通 路
▼
迷 走 神 经
迷走神经:脑-肠之间的一条高速公路,可以双向传递信息。
迷走神经是连接胃肠道和神经系统的最长神经之一,在肠道和大脑之间的主要沟通途径中起着重要作用。
一方面,肠道微生物群通过激活迷走神经来改变下游神经活动,如BDNF、GABA和催产素信号。肠道包含肠感觉上皮细胞,这些细胞与迷走神经神经元形成回路,使大脑能够直接感知肠道的变化。
另一方面,迷走神经可以通过刺激传出神经释放乙酰胆碱,从而影响巨噬细胞和α-7烟碱胆碱能神经受体,同时抑制炎症因子以实现抗抑郁作用。
补充乳酸杆菌JB-1菌株降低了前额叶皮层GABAα2受体的mRNA表达,从而降低了应激诱导的皮质酮水平和减轻抑郁。
▼
脊 髓
脊髓是自主神经系统的重要组成部分。脊髓连接大脑和肠道,肠道是中枢神经系统最重要的部分。脊髓损伤导致肠交感神经和自主神经张力失衡,导致胃肠道疾病。
肠道微生物群会影响脊髓
脊髓损伤会损害肠道神经系统,导致肠道运输功能障碍。脊髓损伤后的并发症,包括肠道功能障碍、焦虑和抑郁,可能是由于微生物群-肠-脑轴相互作用所致。
脊髓影响抑郁症的发病机制
脊髓中抑制性神经元的功能障碍导致脊髓层面传入感觉信息的放大,这是抑郁症患者疼痛的原因之一。疼痛和抑郁是密切相关的。事实上,前额叶和杏仁核与抑郁症密切相关。
Part 3 免 疫 系 统
免疫系统是肠脑轴的一部分,是从微生物到大脑的重要信号级联。肠道细菌失调导致肠道和血液之间的屏障变得可渗透,从而让“坏”细菌进入血液,可能引起炎症。
炎症可能是一个重要的免疫节点
免疫炎症反应机制:胃肠道系统是最大的免疫器官,抑郁症中存在一种慢性、低水平的炎症状态,肠道菌群可作用于免疫系统,降低外周血中促炎因子IL-1、IL-6、IL-8、IL-10、TNF-α、TGF-3等释放,并升高抗炎急性期蛋白、趋化因子、黏附分子、前列腺素等的表达,从而影响中枢神经系统,最终导致脑功能的改变。
临床上,抑郁症患者表现出细胞因子水平升高、神经发生减少和氧化应激水平升高。肠道菌群对免疫系统的调节是影响抑郁症的重要因素之一。
以上化学信号、神经通路、免疫系统三大途径,详细描述了微生物群-肠-脑轴之间的关联,以及肠道菌群是如何通过该轴影响抑郁症的发生发展。显而易见,肠道菌群其中扮演重要角色。
目前关于抑郁症的治疗,药物治疗是常见手段之一,化学合成药物因其疗效快、剂量低等优点被广泛使用,但容易引起耐药性,抑制质子泵,可能危害肠道健康。
药物对肠道菌群和肠道屏障的影响是药物安全性和有效性的重要评价指标。近年来,随着大众对肠道健康的日益重视,肠道已成为中药领域的研究热点。中药具有抗菌活性温和、修复作用以及人类不易对其产生耐药性等优点。
那么中药与肠道菌群有什么关联,与肠道菌群的相互作用及其肠道屏障的修复机制如何?下一章节我们来详细了解一下。
强调“整体性”
中医认为人与自然、社会环境具有整体性。自然界孕育人类的繁衍,人类活动顺应四时变化方能“精神乃治”,两者交互协作、对立统一,即通过“天人相应”实现“天人合一”。
作为人体内的微生态,肠道菌群与机体各项结构机能与内在环境共生共存,互根互用,构成一个有机整体。
“多因素”相关
中医提出体质是人体形态结构、功能活动的个体特征,与生命过程、遗传、后天环境等因素有关。
肠道菌群也受到饮食、生活方式、药物、社会环境、遗传、地理位置等多因素影响。
“个体化”防治
辨证论治作为中医基本原则之一,其核心目的是通过因人因时因地制宜辨证来更好地阐述个体疾病的易患因素和疾病发展的倾向性。
虽然人体肠道肠道菌群的核心菌群相似,但在不同宿主个体间,不同菌群的相对丰度和菌种存在很大差异。肠道菌群是健康的动态组成部分。个体化治疗计划的制定和实施与肠道菌群检测分析密切相关。
《黄帝内经》云:“胃足阳明之脉……是动则病洒洒振寒……心欲动,独闭户塞牖而处。甚则欲上高而歌,弃衣而走,贲响腹胀,是为骭厥。”
提示古人认为精神状态异常不仅与心失神明相关,亦与阳明胃病变关系密切。
中医学提出人体由“形”和“神” 构成,“形为神之宅”“神乃形之主”,即心理特征影响人的生理机能和形态结构,又同时受到机体生理病理情况反馈的影响。
现代医学提出心理压力或其他抑郁因素引起的饮食偏好、应激激素调节、炎症反应及自主神经反应可重塑肠道菌群,肠道菌群的代谢产物、毒素、神经激素等又能反过来调节宿主的饮食偏好或心情。
Li B, et al., J Ethnopharmacol. 2023
抑郁症可由“气”(生命能量)、血液循环障碍、“热”(炎症)、湿气和痰引起。
解气是抑郁症的常见治疗方法,从而促进血液循环、减少炎症和缓解疼痛。传统上,一些中药配方被用于治疗抑郁症,如逍遥散和小柴胡、甘麦大枣(GMDZD)和半夏厚朴汤。一些治疗胃肠道疾病的中药也具有抗抑郁类型的作用。
下面列一些常见的治疗抑郁症的复方中药配方:
逍遥散、解郁丸、四逆散、薯蓣散、小柴胡汤、柴胡温胆汤、柴胡桂枝汤
甘麦大枣汤、开心散、柴胡加龙骨牡蛎汤、酸枣仁汤
柴胡疏肝方、半夏厚朴汤、
补阳还五汤、血府逐瘀汤
百合地黄汤、小补心汤、归脾汤、桃红四物汤
栀子豉汤、栀子厚朴汤
大多数治疗抑郁症的中药都具有疏肝、益气、养血、活血、化痰的作用。
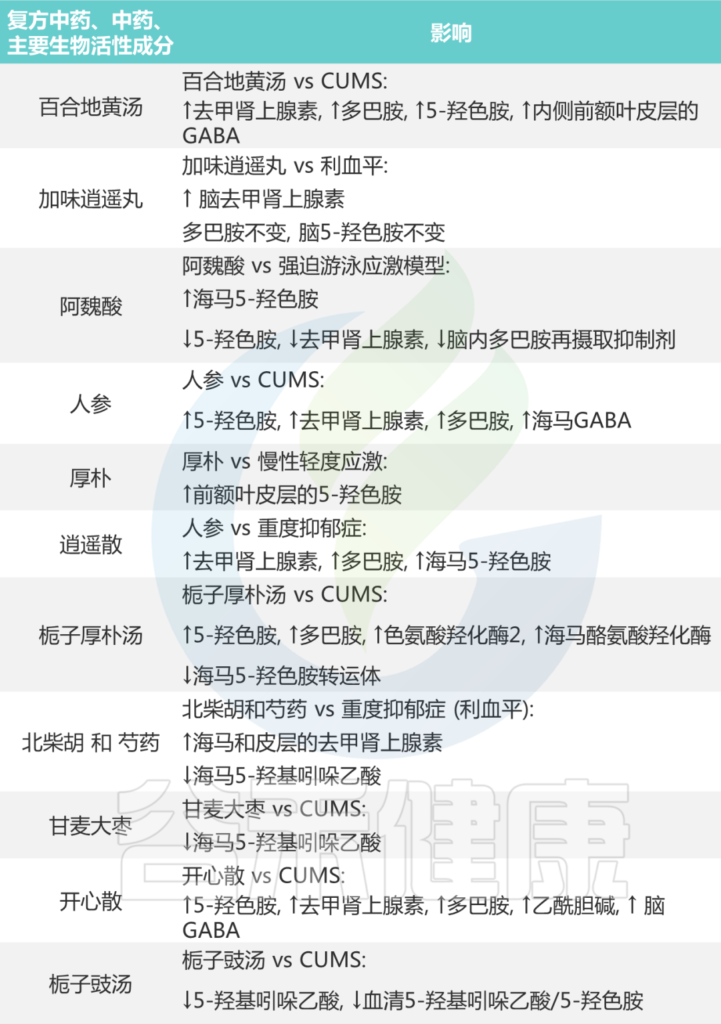
下表列出各种中药的主要生物活性成分:
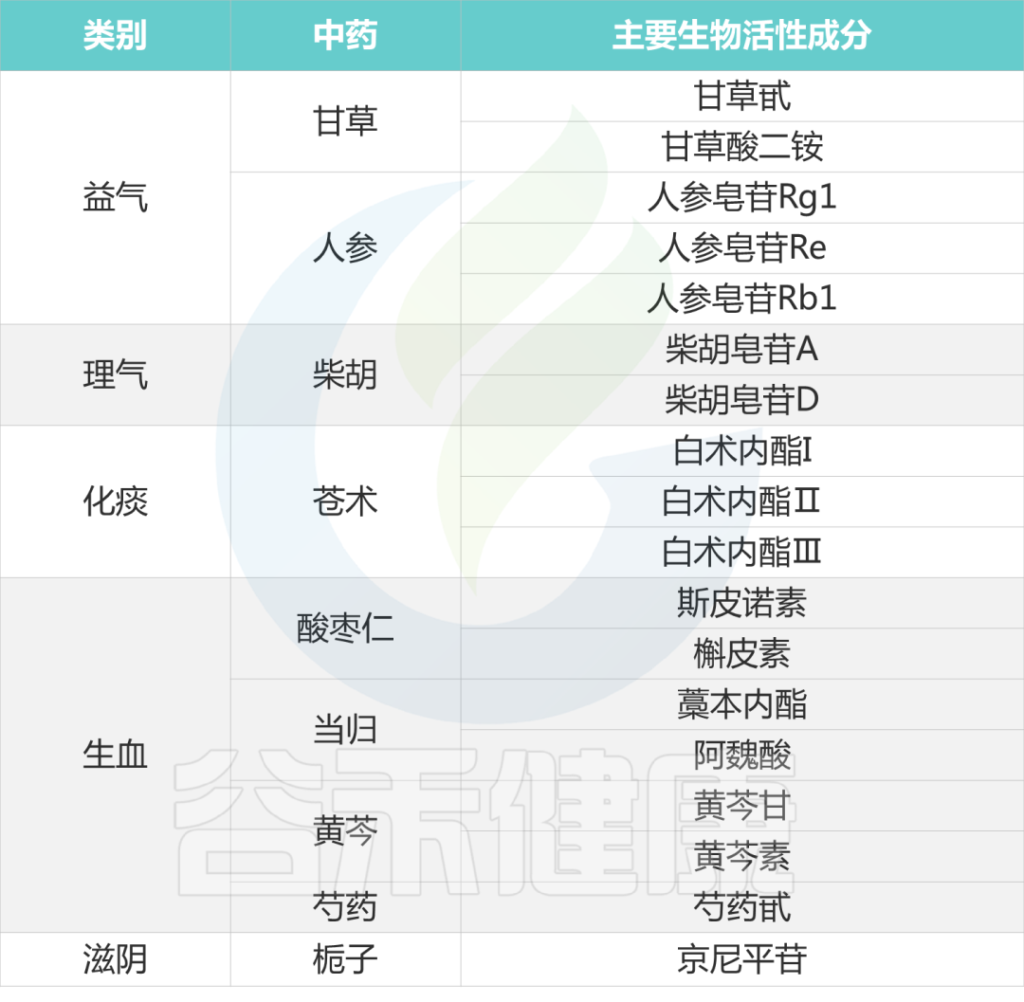
Li B, et al., J Ethnopharmacol. 2023
以上是中药与肠道菌群的整体关联,以及常见的一些具有抗抑郁作用的中药及其生物活性成分,这些中药是如何通过调节肠道菌群,从而达到抗抑郁的效果?下一章节我们继续。
虽然目前对于中医药抗抑郁作用的潜在机制相对模糊,但可能涉及多种机制,其中之一可能包括肠道微生物群的调节。本章节讨论了由调节肠道微生物群的化学递质和细胞介质诱导的中药抗抑郁作用。
传统中药配方,包括复方中药、中药和主要生物活性成分,它们影响肠道菌群改善抑郁症如下:
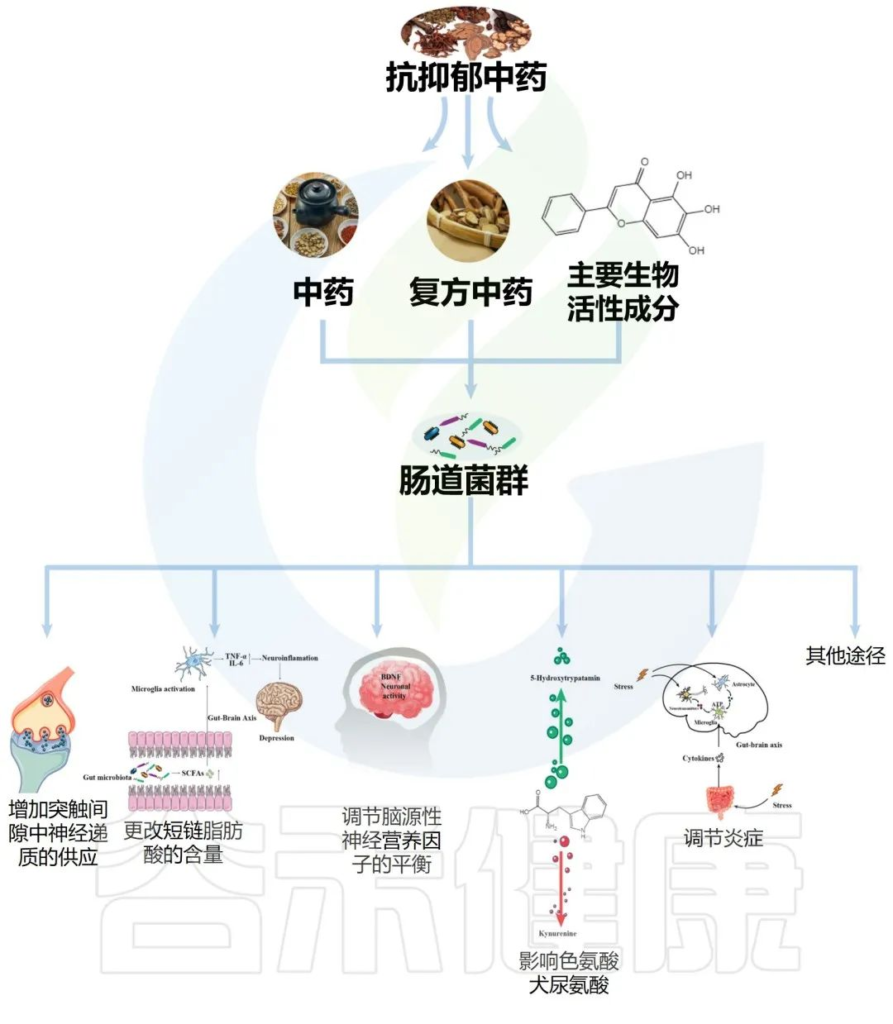
Li B, et al., J Ethnopharmacol. 2023
迄今为止,大多数抗抑郁药物都是神经递质再摄取抑制剂,通过抑制神经递质的再摄取和增加突触间隙的神经递质供应来改善神经传递。
中医药在中枢神经系统疾病的治疗方面有着丰富的历史。
开心散
开心散(KXS)、栀子豉汤(ZZCD)和甘麦大枣汤是用于治疗抑郁症的不同类型的中药。研究发现,这些物质参与调节肠道微生物群,最终缓解抑郁症状。
注:栀子豉汤(ZZCD)首载于《伤寒论》,在中国被广泛用于治疗抑郁症、发热性疾病和失眠症已有1000多年的历史。
开心散调节肠道和大脑功能的重要组成部分。开心散治疗改变了CUMS诱导抑郁症小鼠肠道微生物群的相对丰度,并通过增加Allobaculum、Turicibacter、双歧杆菌,改善了抑郁症症状。
栀子厚朴汤
相关的中药处方,如栀子厚朴汤,逆转了CUMS诱导抑郁症小鼠肠道神经递质(如5-HT、多巴胺和色氨酸)的抑制。
研究报告,栀子厚朴汤的抗抑郁类型效应由肠道微生物群介导,肠道微生物群影响神经递质的代谢。与未治疗组相比,栀子厚朴汤治疗组显著增加了Barnesiella和Lachnospiraceae的成分,但降低了链球菌。
总之,这些结果表明,栀子厚朴汤通过肠脑轴调节肠道微生物群以改善抑郁症,这影响了大脑中的相关神经递质。此外,在用栀子厚朴汤治疗后,CUMS诱导的齿状回中未成熟和新生神经元的丰度降低显著改善,抑郁样行为得到缓解。
潜在抗抑郁机制
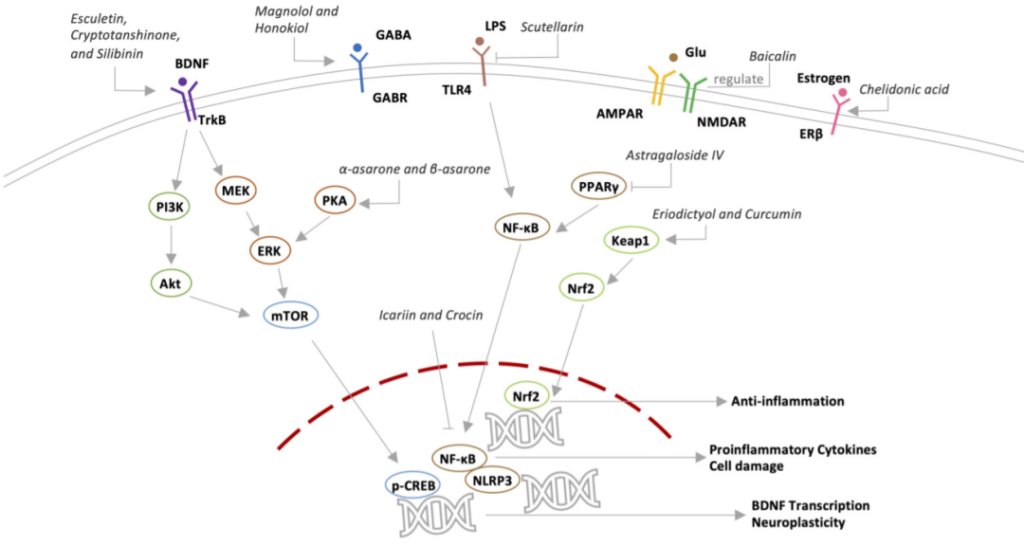
doi.org/10.3389/fpsyt.2022.1054726
甘麦大枣
甘麦大枣增加了大鼠肠道中的神经递质水平,缓解了抑郁症,这可能是由于活性成分甘草酸苷的作用。
其他
一些草药以 5-HT 受体为主要抗抑郁机制。
如来自葛根的葛根素不仅作为 5-HT2C 和 5-HT2A 受体的拮抗剂,而且作为 5-HT1A 受体的激动剂。
大量中药配方以及主要生物活性成分通过调节肠道微生物群中的神经递质发挥抗抑郁作用。如下表所示:
表 中药对抑郁症患者化学神经递质的影响
Li B, et al., J Ethnopharmacol. 2023
►⋙
总之,中药含有多种活性成分,这些成分旨在整合和调节人体内的多个环节、水平和靶点,通过调节肠道菌群和神经递质来实现抗抑郁效果。在临床实践中,除了用作抗抑郁药的补充外,它还为与神经递质紊乱相关的其他疾病提供治疗。
研究发现,短链脂肪酸作为肠脑轴的递质,会影响抑郁症。例如,患者体内可产生短链脂肪酸的Alloprevotella的相对丰度增加。一些中药配方及其活性成分可以通过改变肠道中的短链脂肪酸含量来诱导抑郁症样症状。
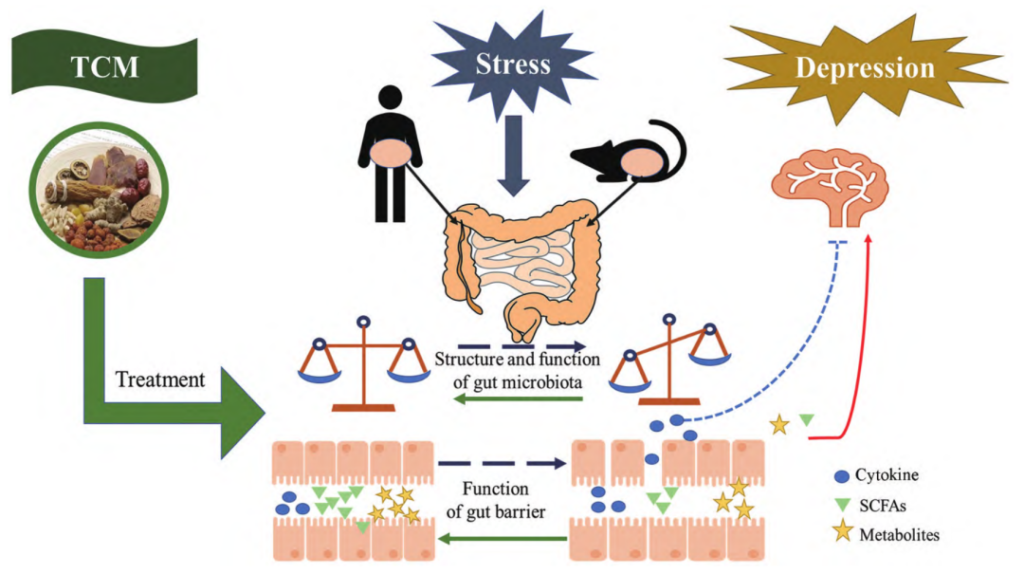
DOI: 10.16438/j.0513-4870.2022-0844
五味子素可以缓解抑郁小鼠肠道微生物群失衡,这与粪便短链脂肪酸水平的变化有关。
黄芩苷(BAI)是甘草的一种生物活性成分,通过促进肠道中产短链脂肪酸的细菌,影响抑郁症的发展。
栀子厚朴汤的抗抑郁类型效应通过调节肠道微生物群来促进丁酸分泌而发生。
用肉苁蓉(CTE)治疗CUMS模型大鼠显示,肠道微生物群的破坏与短链脂肪酸的产生之间存在强烈的相关性。
杏仁可以增加肠道微生物群的含量,如瘤胃球菌和真细菌。人参及其提取物通过改变肠道微生物群的代谢产物,从而影响血清短链脂肪酸水平和大脑中的神经递质,从而达到抗抑郁作用。
黄连素和淡豆豉通过调节短链脂肪酸达到抗抑郁作用。
总之,如下表所示,研究结果支持各种中药制剂可以通过介导肠道微生物群的短链脂肪酸来治疗抑郁症。
中药对抑郁症患者短链脂肪酸的影响
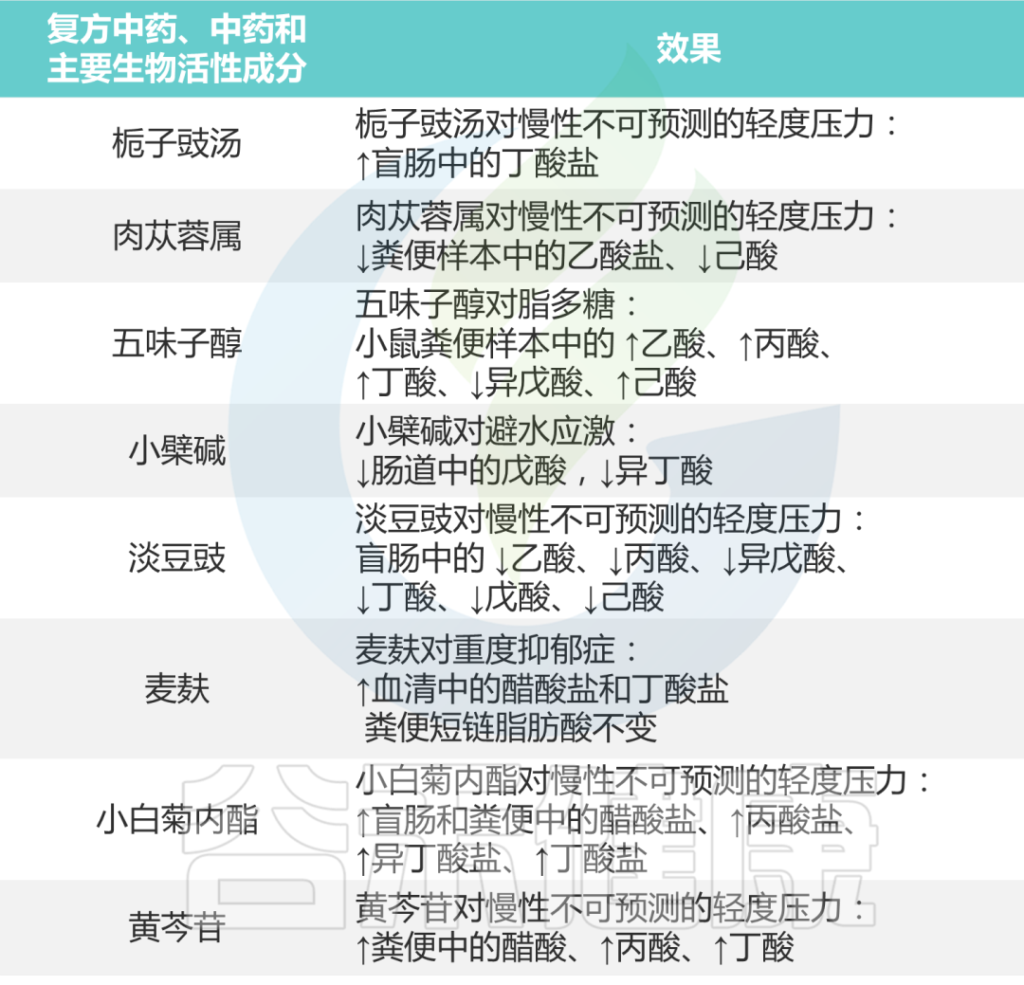
Li B, et al., J Ethnopharmacol. 2023
►⋙
目前,中医对短链脂肪酸的调节更广泛地用于治疗代谢性疾病,如肥胖症、糖尿病和高血脂,但通过中医调节肠道微生物组治疗抑郁症的研究相对较少。因此,将中医药作为深入研究抑郁症的切入点将有助于开发新药。
BDNF与抑郁症密切相关,是许多抑郁症中医治疗的目标,包括槲皮素、肉苁蓉、人参和柴胡。
槲皮素
槲皮素来源于多种植物多酚,据报道可以预防焦虑,缓解抑郁,提高记忆力。
值得注意的是,槲皮素已被证明可以改变肠道微生物群。例如,槲皮素处理增加了肠道微生物多样性以及下列菌群的相对丰度:
槲皮素的抗抑郁作用是通过调节BDNF相关蛋白CPNE6和TREM1之间的平衡实现的。
在一项研究中,槲皮素能够改善大鼠的抑郁样行为,同时降低肠道微生物群的含量,如Verrucomichobiae和脱硫弧菌。
此外,槲皮素改善了受损的结肠组织,增强了海马中BDNF的表达。
肉苁蓉
肉苁蓉可以改善抑郁大鼠肠道微生物群的含量,如拟杆菌的增加和瘤胃球菌的减少。此外,肉苁蓉增加了抑郁症患者的BDNF水平。这些发现支持BDNF可能影响抑郁症的治疗。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分也通过调节BDNF实现抗抑郁作用,如下表所示:
表 中药对抑郁症患者BDNF的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,没有药物直接调节大脑中的BDNF,大脑中每天的BDNF含量只能通过添加一些蔬菜来维持。如果中医能调节肠道微生物群中的BDNF,它不仅能改善抑郁症,还能治疗BDNF相关疾病。
一些中药配方通过影响色氨酸-犬尿氨酸代谢平衡来改善抑郁症样症状。
人参皂苷
人参和相关的中药配方富含人参皂苷,已表明人参皂苷可改善大肠杆菌K1诱导的小鼠抑郁和肠道失调。此外,据报道,人参皂苷改善了肠色氨酸-犬尿氨酸代谢紊乱和血清犬尿氨酸水平,导致海马犬尿氨酸含量显著变化。
此外,人参皂苷治疗抑制小胶质细胞过度激活,以改善抑郁样行为。
天丝饮
天丝饮是一种中药,可以提高肠道微生物群(乳杆菌和毛螺菌科)的含量,然后调节色氨酸-犬尿氨酸途径的代谢产物,以改善抑郁症状。因此,色氨酸-犬尿氨酸代谢可能影响肠道微生物群。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节犬尿氨酸水平实现抗抑郁作用,如下表所示。
中药治疗抑郁症对犬尿氨酸的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,已发现氯胺酮和右旋西帕明等抗抑郁药与犬尿氨酸密切相关,但尚未应用直接作用于犬尿氨酸的药物。因此,发现新的抗抑郁药或辅助药物作用于犬尿氨酸已成为一个悬而未决的问题。
中医药可以通过肠道微生物组调节犬尿氨酸来改善抑郁症状,具有安全性高、稳定性好的潜在优势。
与色氨酸-犬尿氨酸代谢相关的酶的调节,如QPRT(喹啉磷酸核糖转移酶)和IDO(吲哚胺2,3-二加氧酶),也是抑郁症治疗的理想靶点。因此,中药肠道微生物群对犬尿氨酸的调节将成为抗抑郁药物的新靶点。
越来越多的研究表明,改变肠道微生物群可以通过细胞因子调节影响抑郁症。
一些中药制剂通过影响血液和肠道中的细胞因子水平(如细胞因子IL-6和IL-1β)发挥抗抑郁作用,从而通过血脑屏障改变中枢神经系统的细胞因子,并影响脑小胶质细胞。作为中枢神经系统中最重要的免疫细胞之一,小胶质细胞与一系列神经退行性疾病有关,并与神经炎症密切相关。
秋葵
秋葵处理增加了Barnesiella、拟杆菌和乳杆菌的相对丰度。此外,秋葵抑制toll样受体4的表达、NF-κB的核易位、高水平的促炎细胞因子和增强的丝裂原活化蛋白激酶信号传导。最终,秋葵达到了抗抑郁类型的效果。
柴胡疏肝散
柴胡疏肝散的主要成分皂苷A和D,在CUMS模型大鼠中发挥抗抑郁作用,恢复HPA轴的平衡,并通过提高肠道和海马促炎因子(如IL-1β、IL-6和TNF-α)的水平,减少神经炎症。
这些研究进一步证明,肠道微生物群可以通过调节细胞因子来影响大脑的神经系统。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节细胞因子发挥抗抑郁作用,如下表所示。
中药对抑郁症患者细胞因子的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
在临床实践中,抑郁症患者菌群的相对丰度与免疫力密切相关,这表明特定菌株有可能影响免疫力。因此,在未来,中医不仅可以治疗抑郁症,还可以通过肠道微生物群调节免疫系统,这可能对其他神经疾病具有良好的治疗效果。
临床上,有几种方法可以通过刺激神经通路来治疗抑郁症,如脑深部刺激(DBS)和迷走神经刺激(VNS)。然而,这些技术存在一些并发症,例如需要手术和术后恢复。
肠道微生物群通过迷走神经调节脑-肠轴信号。例如,长双歧杆菌NC3001通过迷走神经缓解焦虑样行为。柠檬酸杆菌(Citrobacter)通过调节迷走神经的活动产生焦虑-抑郁样行为。
▸中药通过调节迷走神经缓解抑郁症
因此,影响肠道的某些类型的中药,如四逆散(SNS)、柴胡温胆汤、柴胡桂枝方和桂皮方,通过调节迷走神经来影响抑郁样行为。
柴胡温胆汤通过调节迷走神经的活动来影响乙酰胆碱含量的变化,从而缓解抑郁症。
看起来,就缓解抑郁症而言,在调节迷走神经活动方面,使用中医药调理肠道微生物群,比直接使用药物更有效;这是一个值得进一步研究的研究方向。
▸中药通过调节脊髓损伤缓解抑郁症
抑郁症常伴有慢性疼痛,疼痛信号主要存在于脊髓通路;因此,脊髓在与抑郁症相关的神经通路中起着重要作用。研究发现,脊髓损伤可导致肠道生态紊乱;肠道菌群的重塑可能会恢复肠道功能。
在脊髓损伤中,益生菌复苏可以改善脊髓损伤。用抗生素治疗的小鼠表现出更严重的脊髓损伤。因此,中医可以通过调节脊髓通道的活动来调节肠道微生物群以缓解抑郁症。
中医作用于多种神经通路,并在多个层面治疗抑郁症。它们不仅在抑郁症的快速治疗中发挥作用,还可以缓解与抑郁症相关的并发症。因此,中医显示出巨大的潜力。然而,中医治疗的手段五花八门,以上主要是服用各种药剂,其他还有包括食疗、针灸、太极、按摩等。
● 针灸影响肠道菌群
研究表明,针灸可以通过对胃肠动力、分泌和免疫的调节影响肠道菌群。
研究人员通过针刺应激性胃溃疡模型大鼠的百会、中脘、足三里穴位,结果表明,针刺能够有效改善应激性胃溃疡引发的胃黏膜损伤,可能与增加的菌群多样性,促使紊乱的肠道菌群水平回调有关。
研究人员对实验组溃疡性结肠炎的患者应用益阳愈溃汤结合针刺治疗,对照组仅给予益阳愈溃汤,治疗后实验组双歧杆菌、乳酸杆菌等优势菌种均高于对照组。
另外有研究人员认为早期针刺对中风患者的干预不仅可以促进神经功能的恢复,并可以有效降低中风后抑郁症的发病率,说明中医针灸治疗与肠道菌群也有某种联系,更有利于对肠道菌群的研究,从而拓宽抑郁症治疗的新方法和思路。
很少有研究报道了中药制剂在抑郁症临床治疗中的毒性。
柴胡皂苷D是柴胡中的主要生物活性成分,具有抗抑郁、肝毒性、神经毒性、溶血性和心脏毒性作用。因此,应注意中药配方中柴胡的用量。
黄芩苷在肠道中作为黄芩素代谢。黄芩苷在HepG2细胞中显示出比黄芩素更高的毒性,但肠道微生物群产生的黄芩苷代谢产物的毒性低于黄芩苷本身。因此,黄芩苷生产工艺应进一步优化,以治疗抑郁症。
开心散导致白细胞和淋巴细胞以及血糖水平升高,尽管所有患者在治疗30天后均表现出正常水平。因此,口服开心散被认为是相对安全的。
甘麦大枣汤与治疗抑郁症的不良反应有关,如口干、便秘、失眠和易怒。
补骨脂及其主要生物活性成分具有抗抑郁作用,但临床前安全性研究揭示了未知化合物和机制对肝脏和生殖系统的毒性作用。
►⋙
一般来说,中药配方不会刺激肝脏或肾脏,也不会损害胃肠道。与西医使用的抗抑郁药物相比,中医药治疗抑郁症的副作用一般较少,不会产生依赖或成瘾,疗效稳定,从而防止治愈后复发。
人体大多数疾病都与肠道有关,肠道菌群调节越来越被认为是疾病的立足点和突破口。
从中医的角度来看,人的各个器官并不是独立存在的,而是相互联系的,共同影响着全身的生理机能。中医擅长于动态和整体上把握疾病的发生发展,这与肠道菌群反映人体健康动态的理念不谋而合。
通过监控肠道菌群的动态预测易感疾病,并运用其与人体自身的共生关系和个体化的生物学特征,使中医在疾病诊治中突出整体观和辨证论治的优势。
抑郁症的发病机制尚不确定,单胺、神经营养因子、神经递质和肠道菌群被认为参与了抑郁症的发展。抑郁症研究的重点已经从大脑转移到其他系统,微生物群-肠-脑轴可通过形成复杂的内分泌、神经、免疫炎症的生物学免疫机制,在影响抑郁症的发生发展中发挥重要作用。
中药通过非常复杂的机制调节肠道功能。虽然中药调节肠道菌群的机制没有完全摸透,但其显著疗效已经受到越来越多的关注。中医身心一体观的临床实践经验在防治抑郁症方面具有潜在优势。
中药与肠道菌群之间抗抑郁的关系不仅仅有中药对于肠道菌群的影响, 还有肠道菌群对中药成分代谢和促进吸收的作用等值得探索。
目前仍需进行大量的研究以探寻中药与肠道菌群之间的相互作用,这对于研究抑郁症的发病机制和抗抑郁新药研发有深远意义。结合中医药理论,以肠道菌群为靶点,开发中药新药研究,将为中医药防治抑郁症提供新的思路和治疗方案。
主要参考文献:
Radjabzadeh, D., Bosch, J.A., Uitterlinden, A.G. et al. Gut microbiome-wide association study of depressive symptoms. Nat Commun 13, 7128 (2022). https://doi.org/10.1038/s41467-022-34502-3
Sun Y, Zhao J, Rong J. Dissecting the molecular mechanisms underlying the antidepressant activities of herbal medicines through the comprehensive review of the recent literatures. Front Psychiatry. 2022 Dec 22;13:1054726. doi: 10.3389/fpsyt.2022.1054726. PMID: 36620687; PMCID: PMC9813794.
Li B, Xu M, Wang Y, Feng L, Xing H, Zhang K. Gut microbiota: A new target for traditional Chinese medicine in the treatment of depression. J Ethnopharmacol. 2023 Mar 1;303:116038. doi: 10.1016/j.jep.2022.116038. Epub 2022 Dec 15. PMID: 36529248.
Asim M, Wang H, Waris A. Altered neurotransmission in stress-induced depressive disorders: The underlying role of the amygdala in depression. Neuropeptides. 2023 Jan 20;98:102322. doi: 10.1016/j.npep.2023.102322. Epub ahead of print. PMID: 36702033.
Wilkowska A, Szałach ŁP, Cubała WJ. Gut Microbiota in Depression: A Focus on Ketamine. Front Behav Neurosci. 2021 Jun 23;15:693362. doi: 10.3389/fnbeh.2021.693362. PMID: 34248517; PMCID: PMC8261217.
Park LT, Zarate CA Jr. Depression in the Primary Care Setting. N Engl J Med. 2019 Feb 7;380(6):559-568. doi: 10.1056/NEJMcp1712493. PMID: 30726688; PMCID: PMC6727965.
王凯新, 董晓梦, 苏毅鹏,等. 肠道菌群与抑郁症关系的研究进展[J]. 吉林大学学报:医学版, 2022(004):048.
Xu J, Chen HB, Li SL. Understanding the Molecular Mechanisms of the Interplay Between Herbal Medicines and Gut Microbiota. Med Res Rev. 2017 Sep;37(5):1140-1185. doi: 10.1002/med.21431. Epub 2017 Jan 4. PMID: 28052344.
Bosch, J.A., Nieuwdorp, M., Zwinderman, A.H. et al. The gut microbiota and depressive symptoms across ethnic groups. Nat Commun 13, 7129 (2022). https://doi.org/10.1038/s41467-022-34504-1
Ashraf H, Salehi A, Sousani M, Sharifi MH. Use of Complementary Alternative Medicine and the Associated Factors among Patients with Depression. Evid Based Complement Alternat Med. 2021 Mar 26;2021:6626394. doi: 10.1155/2021/6626394. PMID: 33854557; PMCID: PMC8019377.
鲍婷婷, 杨凯麟, 龙治勇,等. 基于”心与小肠相表里”探讨肠道菌群与抑郁症[J]. 中国中西医结合杂志, 2021.
Barandouzi ZA, Starkweather AR, Henderson WA, Gyamfi A, Cong XS. Altered Composition of Gut Microbiota in Depression: A Systematic Review. Front Psychiatry. 2020 Jun 10;11:541. doi: 10.3389/fpsyt.2020.00541. PMID: 32587537; PMCID: PMC7299157.
Zhao Y, Luan H, Gao H, Wu X, Zhang Y, Li R. Gegen Qinlian decoction maintains colonic mucosal homeostasis in acute/chronic ulcerative colitis via bidirectionally modulating dysregulated Notch signaling. Phytomedicine. 2020 Mar;68:153182. doi: 10.1016/j.phymed.2020.153182. Epub 2020 Feb 7. PMID: 32065953.
袁霞红, 刘林. 肠道菌群调节抑郁症机制及中医药防治研究进展[J]. 中华中医药学刊, 2022, 40(9):4.
Aktar R, Parkar N, Stentz R, Baumard L, Parker A, Goldson A, Brion A, Carding S, Blackshaw A, Peiris M. Human resident gut microbe Bacteroides thetaiotaomicron regulates colonic neuronal innervation and neurogenic function. Gut Microbes. 2020 Nov 1;11(6):1745-1757. doi: 10.1080/19490976.2020.1766936. Epub 2020 Jun 9. PMID: 32515657; PMCID: PMC7524364.
Dinan TG, Cryan JF. Gut microbes and depression: Still waiting for Godot. Brain Behav Immun. 2019 Jul;79:1-2. doi: 10.1016/j.bbi.2019.02.007. Epub 2019 Feb 13. PMID: 30771453.
丁书凝, 贾心如, 阮善明,等. 中医思辨体系中肠道菌群的共性分析和诊疗应用[J]. 时珍国医国药, 2022(007):033.

谷禾健康

随着大家陆续“阳康”,大家逐渐恢复以往的生活,城市的烟火气回来了。
然而阳康后真的万事大吉了吗?
还是有很多朋友处于这样的状态:感觉恢复了,又好像没有完全恢复,身体多少有点不适,开始关心:
这种新冠肺炎后遗症,也就是临床上常说的“长新冠”,已经成为部分人不得不面临的事实。
“长新冠”是一种多系统疾病,据估计,全球至少有 6500 万人患有长新冠,病例每天都在增加。由于许多未记录在案,这个数字实际可能要高得多。
“长新冠”与所有年龄段和急性期疾病严重程度相关,许多患者在多个器官系统中经历了数十种疾病,包括心血管、血栓、脑血管疾病、2型糖尿病、自主神经功能障碍等。基于对其超过 2 年的研究,如果不采取行动任其发展,很大一部分患有长新冠的人可能会有严重后果。
新出现的临床前和临床研究表明,肠道微生物群可能有助于理解 COVID-19 的发病机制和疾病结果;SARS-CoV-2 感染与肠道微生物群的改变有关,并与炎症和免疫反应相关。
本文基于多篇文献报道,主要介绍关于“二次感染”以及“长新冠”问题的最新研究进展,同时也着重介绍了多种与新冠恢复期调理相关的干预措施。
本文由于篇幅较长,主要分为上、中、下三大篇章,主要包括以下内容:
上篇: 关于“二次感染”
中篇: 关于“长新冠”
下篇: 关于“干预措施”
上 篇
关于 “二次感染”
已经阳康的朋友,可能关心会不会马上又来一波,出现“二次感染”?
我们先了解一下,二次感染指的是什么?
“二次感染” 也叫“再感染”或者“重复感染”,是指一个人感染了新冠之后,经过足够的时间,然后再次感染。一般而言,如果一个人在第一次阳性检测后 90 天或更长时间再次检测呈阳性,则被视为二次感染。
注:也有部分研究定义间隔>30天。
再感染后可能出现临床症状,患者因核酸载量高而具有传染性。
与没感染过的人群相比,已经感染过的人群再感染风险低87%
先看一组数据:
➪
一项Meta分析综合了先前感染SARS-CoV-2人群再感染风险的全球证据:先前感染SARS-CoV-2的人可能会再次感染,他们的感染风险比之前没有感染的人低。
SARS-CoV-2再感染发病率为:
0.7 / 10,000人日(标准差0.33).
以前感染过的人比从未感染过的人再次感染的可能性低87%(HR = 0.12)。
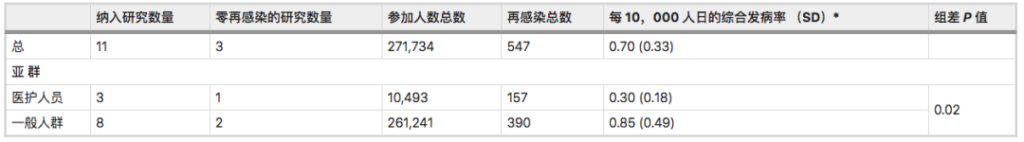
注:该研究荟萃分析和系统审查分别包括11项研究和11份病例报告(样本量都不小于100)。
看到这里是不是觉得可以放心了,再次感染的概率很低?
并不一定。需要注意的是,该研究虽在近期发表,但研究的数据是基于出现在2021年4月及之前的毒株,当时奥密克戎变种尚未出现。
研究表明,奥密克戎变异株的免疫逃逸,导致比其他变异株具有更高的传播。那么,有没有关于奥密克戎毒株的数据?
有。
与感染过德尔塔毒株的人群相比,在奥密克戎阶段,再感染风险显著高于德尔塔时期
➪
一项回顾性观察性研究,分析来自意大利北部利古里亚地区的感染者,在研究期间(2021年9月至2022年5月),利古里亚记录了335117例SARS-CoV-2感染病例,其中15715例再次感染。在奥密克戎阶段(从2022年1月3日开始占主导地位),再感染的风险是德尔塔阶段的4.89倍(p<0.001)。
其他也有来自意大利的研究(2021年8月至2022年3月)认为,奥密克戎时期的再感染风险比德尔塔时期高18倍。
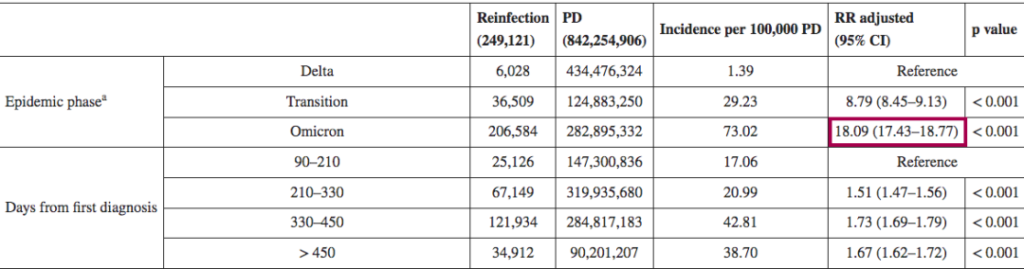
DOI: 10.2807/1560-7917.ES.2022.27.20.2200372
➪
英国爱丁堡大学的研究人员发现,奥密克戎变异株的可能再感染率约为德尔塔变异株的10倍。
➪
来自圣保罗大学医院281名医护人员的再感染率(2020年3月10日至2022年3月10日):
奥密克戎时期再感染率显著增加(0.8%到4.3%;相对风险5.45 [95%IC 3.80–7.81];p < 0.001)
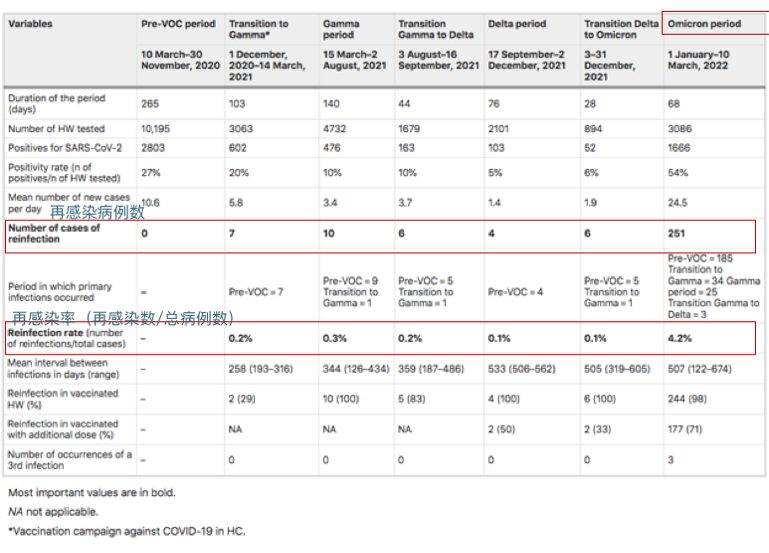
Guedes AR, et al., Sci Rep. 2023
关于奥密克戎再感染率上升的证据相当多,此处就不一一列举了。既往感染虽然可以在一定程度上防止新冠的再次感染,但对于奥密克戎来说,之前的抗体保护作用较弱,并且在一定期限后迅速减弱,接下来我们来看一下,既往感染的保护期限大概能维持多久。
队列研究证实,既往感染对奥密克戎变异株(BA.1、BA.2、BA.4 和 BA.5)再感染的保护作用低于对德尔塔和较旧变异株再感染的保护作用。
➪
50项研究共纳入118名再感染患者,从首次感染到再感染的最短时间为19日,最长为293日。
● 针对奥密克戎BA.1和BA.2毒株:
先前感染德尔塔变异株可将症状性感染的风险降低50%至67%.
➪
在丹麦的一项队列研究中,如果先前感染发生在3至6个月前,则对奥密克戎BA.1或BA.2的保护率为43.1%,如果先前感染至少发生在6个月前,则为22.2%.
● 针对奥密克戎BA.4和BA.5毒株:
BA.4 和 BA.5 这两个变体与 BA.2 的相似性高于 BA.1 菌株,携带着它们自己独特的突变,包括病毒刺突蛋白中 L452R 和 F486V 的变化,这些变化可能会调整其锁定宿主细胞并避开某些免疫反应的能力。
对卡塔尔人群的分析提供了关于奥密克戎BA.4和BA.5防护的详细信息:
在未接种疫苗的人群中,既往感染奥密克戎BA.1或BA.2可使任何感染奥密克戎BA.4或BA.5的风险降低至少68.7%(CI,64.0%至72.9%),而如果先前感染发生在奥密克戎变异株出现之前,则仅为27.7%(CI,19.3%至35.2%).
针对BA.4或BA.5免受BA.1或BA.2感染的保护作用在4个月内是强大的,但这种保护可能会迅速减弱。
关于再感染的风险和保护期限的研究
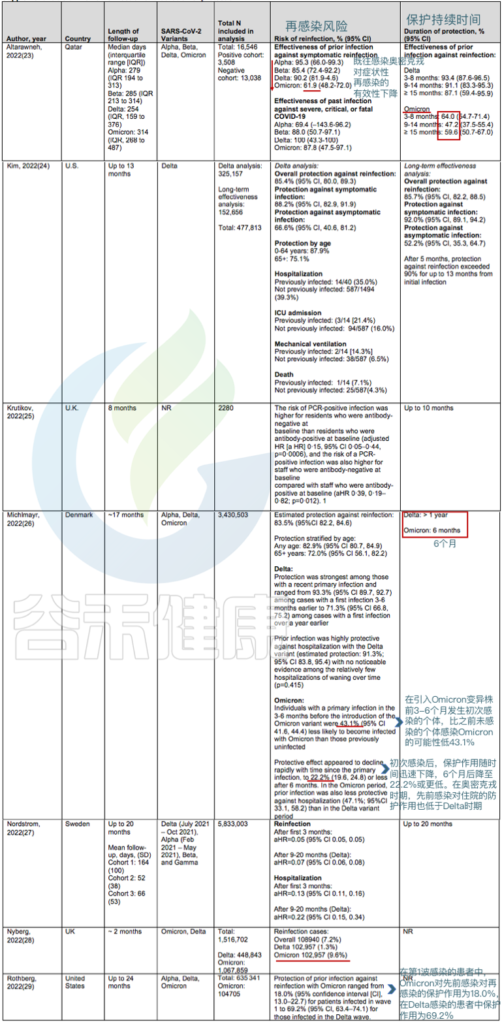
doi:10.7326/M22-1745
高龄和抑郁状态是奥密克戎再感染的危险因素
一项前瞻性队列研究,纳入了 933 名被诊断为 Omicron BA.2.2 感染且治疗后检测呈阴性的成年患者。
最终,683例符合标准,进行研究分析。
注:数据来源以及筛选标准:
患者来自四川省临水县,数据由四川省疾病预防控制中心提供。如果患者符合以下任何标准,则被排除在外:
感染前诊断为精神疾病,伴随需要住院治疗的严重疾病,以及交流障碍或拒绝参与。
在683名奥密克戎感染患者中,出院后30天内有116例再阳性,总体再阳性率为16.4%.
预测再阳性风险变量的单变量逻辑回归
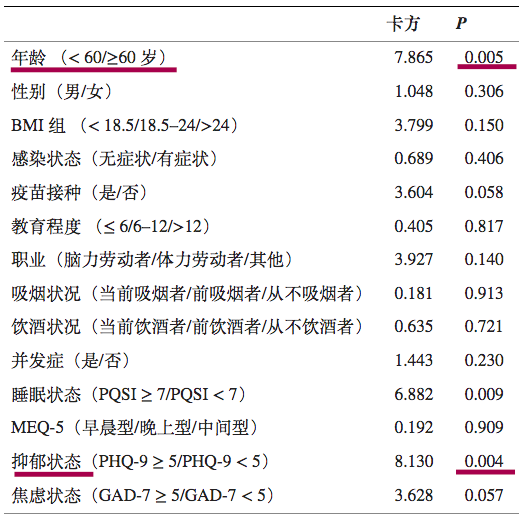
DOI:10.3389/fpubh.2022.1014470
注:PHQ-9,患者健康问卷九。PHQ-9量表的总分范围为0至27分,其中0至5分表示没有抑郁,得分>5表示抑郁状态;评分越高,抑郁症状越严重。
比较分析显示:
慢性肾功能衰竭、心血管疾病、支气管肺病、神经病变和自身免疫性等疾病患者再感染的风险相对增加
来自意大利北部地区的数据显示:
女性个体的再感染风险比男性高17%(OR为1.17,95%CI为1.13-1.21,p <0.0001)
在再感染者中,60岁及以上患至少一种潜在慢性病人群的风险比其他年龄组高7倍。
在慢性心血管疾病中,心力衰竭和脑血管病变与再感染风险的相关性最高,风险为1.24(95%CI为1.04-1.47,p = 0.0184)和1.49(95%CI为1.29-1.71,p <0.0001)是 未再感染个体的1.24倍(95%CI为1.29-1.71,p 0.0001).
在慢性肾衰竭患者中,接受透析的患者再感染风险几乎高出 3 倍(OR 为 2.77,95% CI 为 1.76–4.38,p < 0.0001).
与未再感染者相比,哮喘和呼吸衰竭/氧疗患者的再感染风险分别增加 1.17 倍(95% CI 为 1.05 –1.33,p = 0.0070)和 1.67 倍(95% CI 为 1.23–2.25,p = 0.0009).
在神经病变患者中,癫痫患者、帕金森病和阿尔茨海默病的再感染风险几乎是未再感染个体的两倍。
痴呆患者的风险大约高出四倍(OR为3.71,95%CI为3.04-4.52,p <0.0001).
在患有自身免疫性疾病的个体中,桥本甲状腺炎是再感染个体中最相关的疾病(OR为1.19,95%CI为1.00-1.44,p = 0.0479)
2021年9月至2022年5月期间与SARS-CoV-2再次感染患者有关的主要合并症的详细信息:
doi: 10.3390/vaccines10111885
此外,2022年发表的一篇系统评价报告了2019年12月1日至2021年9月1日的数据,发现高血压和肥胖是再感染患者中最常见的,其次是终末期肾衰竭、哮喘、慢性阻塞性肺病、痴呆、血脂异常和2型糖尿病。
其他研究也报道,终末期肾衰竭、高血压、糖尿病、慢性呼吸系统疾病、肝病和心血管疾病病史患者的再感染风险更高。
二次感染依然有症状
大多数再感染患者表现出临床症状,只有少数研究报告患者在第一次和继发感染时均无症状。
其他包括50项研究的数据显示再感染患者特征:


注:以上数据是2019年12月1日至2021年9月1日期间的研究
➪
二次感染相对首次感染严重程度有所减轻
韩国疾病控制和预防局于2020年1月20日至2022年5月7日在流行病学调查中通过综合系统报告的新冠肺炎病例数据库与健康保险审查和评估服务系统合并。使用具有二项分布的广义线性模型估计二次感染发作时与一次感染时的严重性比值比(SOR)。
结果发现,在所有患者中,再次感染的SOR为0.89(95%置信区间[CI]:0.82–0.95),与首次感染发作相比,严重程度有所减轻。
➪
一项研究显示,截至 2022 年 11 月 9 日,估计 94%(95% CrI,79%-99%)的美国人口至少感染过一次 SARS-CoV-2。
2022年11月针对SARS-CoV-2感染和重症的有效保护大大高于2021年12月
结果发现,2022年11月9日,在美国,对奥密克戎变异株SARS-CoV-2感染的保护估计为63%(51%-75%),对重症的保护率为89%(83%-92%).
11 月的人口免疫力高于最初奥密克戎激增后立即出现的情况。
对二次感染后的重症情况,不同研究结果不一致。
➪
发表在《Nature Medicine》的一项研究建立了一个包括5819264人的队列,其中SARS-CoV-2感染者(n = 443588)、再感染(两次或多次感染,n = 40947)和非感染对照(n = 5334729). 使用逆概率加权生存模型来估计死亡、住院和事件后遗症的风险和6个月的负担。
结果发现,与无再感染相比,再感染增加了死亡风险(危险比(HR) = 2.17,95%置信区间(CI)1.93–2.45),住院风险(HR = 3.32,95%可信区间3.13-3.51)和后遗症风险,包括肺部、心血管、血液学、糖尿病、胃肠道、肾脏、精神健康、肌肉骨骼和神经系统疾病。无论疫苗接种状况如何,风险都很明显。
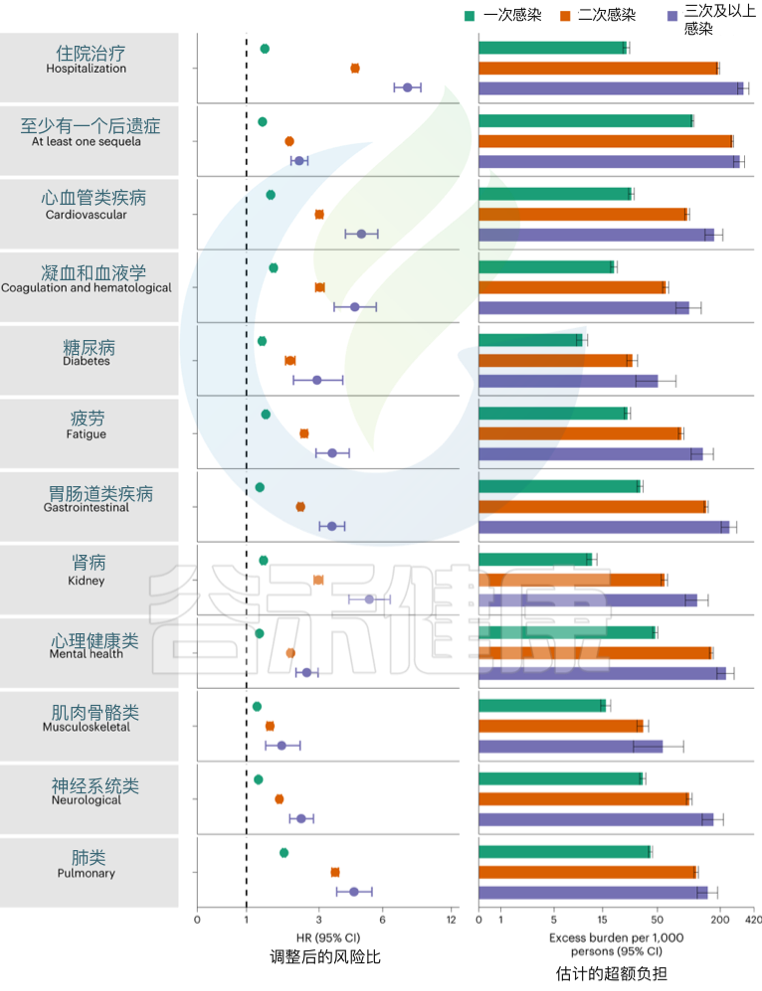
Bowe B, et al., Nat Med. 2022
风险在急性期最为明显,但在6个月后持续存在。与未感染的对照组相比,反复感染的累积风险和负担随着感染次数的增加而增加。
注:该研究数据主要来自美国退伍军人事务部国家医疗保健数据库,选取时间在2020年3月1日至2022年4月6日期间。退伍军人事务部的人口大多由老年人和男性组成,该队列也包括 10.3% 的女性,12% 在 38.8 岁以下(2021 年美国人口的中位年龄)。
关于未来:
英国牛津大学研究病毒进化的科学家认为,奥密克戎及其分支继续占据主导地位的时间越长,慢性感染产生全新变种的可能性就越小。
流行病学研究表明,连续的 COVID-19 浪潮正在变得温和。但这种趋势不应该被视为理所当然。
随着全球对反复接种疫苗和感染后免疫力的增强,研究人员预计 SARS-CoV-2 浪潮的频率将会放缓。
也有研究人员认为,SARS-CoV-2 的一个可能未来是,随季节起伏,通常在冬季达到顶峰,通常每三年左右重新感染一次。
关于其带来的症状是否会越来越轻等问题,研究人员还将持续关注。
总的来说,COVID-19疫情是一个高度动态的全球事件,各种流行病学驱动因素随着时间的推移而变化(包括新变异株的出现、疫苗吸收的增加和免疫力的减弱等各种因素),再感染的流行病学及其健康后果也可能随着时间的推移而改变。
对于已经感染过一次的人来说,继续保持警惕,降低再感染的风险,对于整体健康来说可能很重要。
以上是针对阳康后担心自己是否会二次感染的朋友的问题,然而也有一些朋友到现在,仍然觉得身体没有完全恢复,那就要考虑新冠可能带来的后遗症,也就是临床上说的“长新冠”,接下来章节,我们来了解一下关于“长新冠”及其持续时间,什么人群容易发生,会影响哪些器官功能,具体形成机制,与肠道菌群的关联等。
中 篇
关于“长新冠”
▾◆▽◆▽◆▾
►
“长新冠”是如何定义的?
2021年10月,世界卫生组织将其定义为:
有疑似或确诊新冠感染史,通常发生于起病三个月后,症状通常至少持续两个月,且不能被其他诊断所解释的症状。
►
“长新冠”会有哪些表现?
常见症状包括:
也包括其他一些症状,通常或多或少会影响日常生活。
症状可能是:
从新冠急性发作初步恢复后新出现的症状;
也可能从最初的疾病中持续存在;
也可能随着时间的推移而波动或复发。
►
“长新冠”什么时候发生发展?持续多长时间?
症状的发作和时间过程因个体和症状类型而异。
神经系统症状通常延迟发作数周至数月:在有认知症状的参与者中,43%的人报告在COVID-19至少1个月后才出现认知症状,延迟发作与年龄较轻有关。一些神经认知症状会随着时间的推移而恶化,并且往往会持续更长时间。而胃肠道和呼吸道症状更容易解决。
关节、骨骼、耳朵、脖子和背部的疼痛在1年时比2个月时更常见,感觉异常、脱发、视力模糊以及腿、手和脚肿胀也是如此。
麻痹症在初次感染后平均3个月发病;与其他神经认知症状不同,它通常会随着时间的推移而减少。
很少有长新冠患者能够完全康复,一项研究发现,在最初感染2个月后出现症状的患者中,85%在症状出现1年后出现症状。尽管ME/CFS和自主神经障碍的诊断通常是终身的,但未来的预后仍不确定。
►
有多少人会患“长新冠”?
据保守估计,全世界至少有 6500万 人患有长新冠,病例每天都在增加。
注:有许多未登记病例,这个数字实际上可能要高的多。
据估计,非住院病例的发病率为10-30%,住院病例为50-70%,接种疫苗病例为10-12%。
长冠肺炎与所有年龄段和急性期疾病严重程度相关,36岁至50岁之间的确诊率最高,大多数长冠肺炎病例发生在患有轻度急性疾病的非住院患者中,因为该人群占新冠肺炎总病例的大多数。
►
哪些人群更有可能患“长新冠”?
风险因素可能包括:
注:三分之一的长期 COVID 患者没有确定的原有疾病。
COVID-19 可能对任何患者产生长期影响,包括无症状或轻症患者。相比儿童和青少年,“长新冠”看起来在成人中更为常见。
►
“长新冠”的发病机制?
简单来说,潜在机制包括:
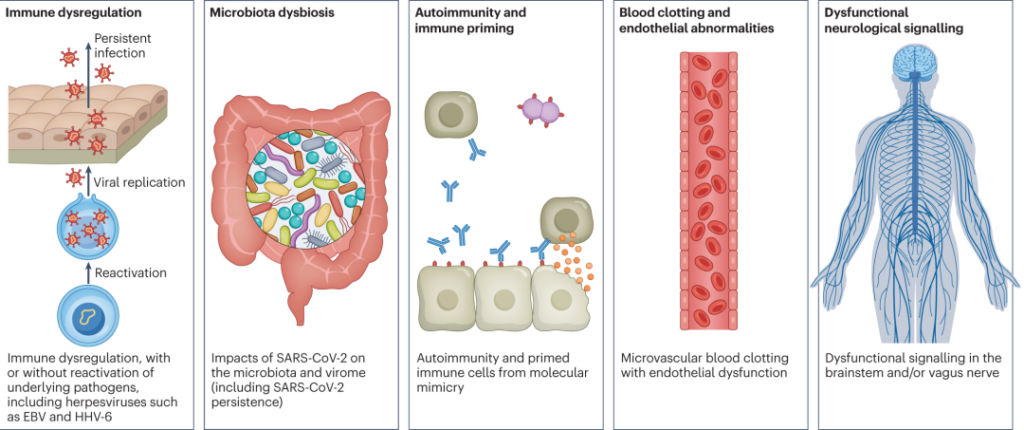
DOI: 10.1038/s41579-022-00846-2
以上是关于“长新冠”的一些基本科普,具体关于“长新冠”带来的多种不良后果,需要关注的疾病,形成机制,与菌群的关联等,我们将在接下来的小节详细介绍。
▾◆▽◆▽◆▾
长新冠包括多种不良后果,常见的新发疾病包括:心血管、血栓和脑血管疾病, 2型糖尿病、肌痛性脑脊髓炎/慢性疲劳综合征(ME/CFS)和自主神经功能障碍,体位性心动过速综合征 (POTS).
长新冠症状及其对多种不同病理器官的影响
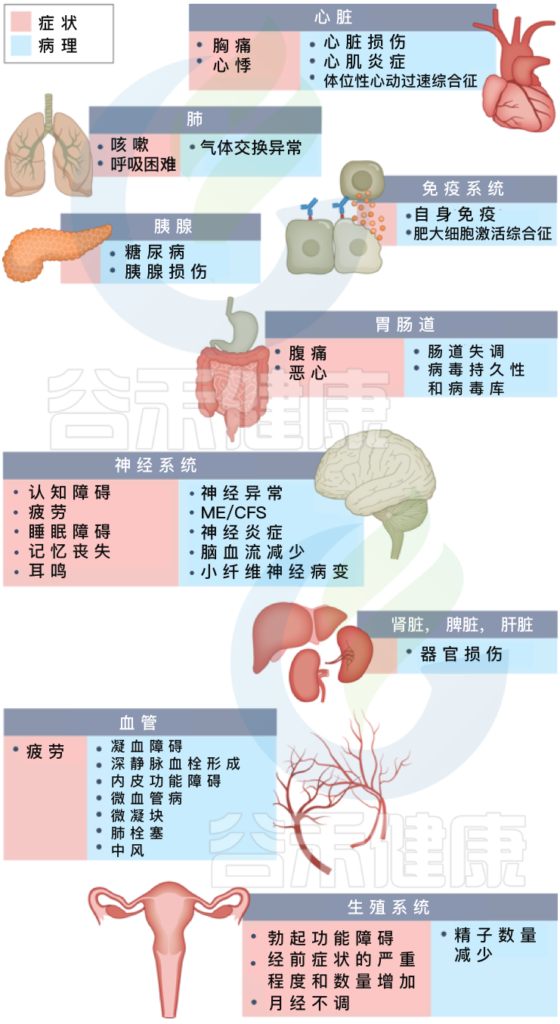
Davis HE, et al., Nat Rev Microbiol. 2023
★
血管问题和器官损伤
SARS-CoV-2会损害许多器官系统。在不同组织中已经证明的损伤主要归因于免疫介导的反应和炎症,而不是病毒对细胞的直接感染。
循环系统破坏包括内皮功能障碍和随后的下游影响,以及深静脉血栓形成、肺栓塞和出血事件的风险增加。
微凝块-> 促进血栓形成
在急性新冠肺炎和长冠肺炎中检测到的微凝块有助于血栓形成,在长新冠中也发现了血细胞大小和硬度的长期变化,有可能影响氧气输送。感染18个月后,长新冠患者的血管密度长期降低,特别影响小毛细血管。
心血管疾病风险增加
对美国退伍军人事务部数据库的分析显示,SARS-CoV-2感染1年后超过150000人患多种心血管疾病的风险显著增加,包括心力衰竭、心律失常和中风,与最初出现新冠肺炎的严重程度无关。
持久的心脏异常
心脏MRI研究显示,在100名既往有新冠肺炎发作史的患者中,78%的患者(感染后平均71天进行调查)和58%的长期冠状病毒感染者(感染后12个月进行研究)存在心脏损害,这增强了心脏异常的持久性。
新冠与多器官损害有关
除了心脏之外,新冠还与其他多种器官受损相关。
一项针对低风险个体的前瞻性研究,观察了心脏、肺、肝脏、肾脏、胰腺和脾脏,发现201名患者中70%至少有一个器官受损,29%有多个器官受损。
在同一研究小组对536名参与者进行的一项为期一年的随访研究中,研究作者发现,59%的人有单器官损伤,27%的人有多器官损伤。
一项针对VA数据的专门肾脏研究,包括89000多名患有新冠肺炎的患者,发现许多肾脏不良结果的风险增加。
另一项VA数据分析,包括181000多名患有新冠肺炎的患者,发现感染也会增加2型糖尿病的风险。
长新冠患者的心血管疾病风险增加,此外,器官损伤似乎是持久的,长期影响仍然未知。
★
神经和认知系统
神经和认知系统的症状是长新冠的主要特征,包括感觉运动症状,记忆丧失、认知障碍、感觉异常、头晕和平衡问题、对光和噪音的敏感性、嗅觉或味觉丧失(或幻觉)以及自主神经功能障碍,影响日常生活。长新冠的前庭听觉表现包括耳鸣、听力损失和眩晕。
认知障碍程度,类似酒驾上限
一项荟萃分析中,在感染后12周,32%的新冠肺炎患者出现疲劳,22%的患者出现认知障碍。长新冠患者的认知障碍会使人衰弱,与英国酒后驾驶限制的醉酒程度或认知衰老10年的程度相同,并且可能会随着时间的推移而增加。
犬尿氨酸途径的激活可能与认知障碍相关
一项研究发现,16%的患者在感染后2个月出现,26%的患者在感染后12个月出现。犬尿氨酸途径的激活,特别是代谢产物喹啉酸、3-羟基邻氨基苯甲酸和犬尿氨素的存在,已在长新冠中确认,并与认知障碍相关。
部分患者可能没有意识到认知障碍
在新冠康复的个体中也发现了认知障碍,当使用客观与主观测量时,认知障碍的比率更高,这表明有一部分认知障碍患者可能没有意识到和/或报告他们的障碍。
认知障碍是一种独立于焦虑和抑郁等心理健康状况的特征
认知障碍在住院和非住院患者中发生率相似。一份有130多万新冠肺炎患者参与的报告显示,随着时间的推移,焦虑和抑郁等心理健康状况恢复正常,但认知障碍(脑雾)、癫痫、痴呆、精神病和其他神经认知疾病的风险增加至少持续了2年。
神经病理学的可能机制包括:神经炎症、凝血病和内皮功能障碍对血管的损伤以及神经损伤
长新冠患者脑脊液异常,年龄较小可能延迟发作
研究发现,患有长新冠的患者存在阿尔茨海默病样信号,脑和脑干代谢低下与特异性症状和长新冠患者中的异常脑脊液发现相关,且年龄较小与神经症状延迟发作相关。
长新冠患者——“化疗脑”
在最近的一份预印本中,轻度感染的长新冠患者的多线细胞失调和髓磷脂丢失,其小胶质细胞反应性类似于化疗,即“化疗脑”。
即使非住院患者,认知能力也可能下降
英国生物银行(UK Biobank)的一项研究,包括新冠流行前后相同患者以及对照组的大脑成像,显示眶额皮层和海马旁回(初级嗅觉皮层相关区域的组织损伤标志物)的灰质厚度减少,与对照组相比,即使是非住院患者,新冠后患者的大脑整体缩小,认知能力下降更大。
尽管该研究将新冠感染者与对照组进行了比较,但并不是特别长的新冠患者,这可能对长新冠的认知成分有影响。在中枢神经系统中发现了线粒体蛋白以及SARS-CoV-2刺突蛋白和核衣壳蛋白的异常水平。在长新冠中也发现了四氢生物蝶呤缺乏症和氧化应激。
眼睛不适?可能与病毒在视网膜感染和复制有关
在眼睛中,在长新冠患者中发现角膜小神经纤维丢失和树突细胞密度增加,瞳孔光反应显著改变,视网膜微循环受损。SARS-CoV-2可以在视网膜和大脑类器官中感染和复制。长新冠的其他表现包括视网膜出血、棉絮斑和视网膜静脉闭塞。
焦虑和抑郁人群比例上升
在爱尔兰,研究报告了20-28%的普通人群出现焦虑和抑郁症状,多达4%的人有自残或自杀的想法。而在2018年爱尔兰健康调查(一项全国性的代表性调查),结果显示,在新冠大流行之前,自我报告的抑郁和焦虑发生率为6%.
仓鼠模型:持续炎症与焦虑和抑郁行为相关
轻度感染的小鼠模型显示小胶质细胞反应性和CCL11水平升高,这与认知功能障碍和受损神经发生有关。
仓鼠模型表现出持续的炎症状态,包括T细胞和髓细胞活化、产生促炎细胞因子和干扰素反应,与仓鼠的焦虑和抑郁行为相关,在新冠肺炎患者的组织中发现了类似的转录特征。轻度疾病感染的非人灵长类动物表现出神经炎症、神经元损伤和凋亡、脑微出血、慢性低氧血症和脑缺氧。
血液皮质醇水平较低,持续症状超过1年
最近的报告表明,与对照组相比,长新冠患者的血液皮质醇水平较低,持续症状超过1年。肾上腺产生的低皮质醇应通过垂体产生的促肾上腺皮质激素(ACTH)来补偿,但事实并非如此,这支持下丘脑-垂体-肾上腺轴功能失调。这也可能反映了潜在的神经炎症过程。此前,ME/CFS患者的皮质醇水平较低。
注:ME/CFS——肌痛性脑脊髓炎/慢性疲劳综合征,是一种多系统神经免疫性疾病。将在下一小节详细阐述。
★
ME/CFS、自主神经功能障碍和相关疾病
ME/CFS通常在病毒或细菌感染后发病。标准包括至少6个月的“疾病前从事职业、教育、社会或个人活动的能力大幅降低或受损”,伴随着无法通过休息缓解的严重疲劳,以及运动后不适、睡眠不足和认知障碍或直立不耐受(或两者兼有)。
高达75%的ME/CFS患者不能全职工作,25%的人患有重度ME/CFS,这通常意味着他们卧床,对感官输入极度敏感,并依赖他人照顾。
大约一半的长新冠患者符合ME/CFS标准
许多研究人员评论了ME/CFS与长新冠之间的相似性;据估计,大约一半的长新冠患者符合ME/CFS标准,在测量运动后不适的主要ME/CFS症状的研究中,大多数长新冠患者报告经历了运动后不舒服。
一项对长新冠患者和ME/CFS患者的直立压力的研究发现,与健康个体相比,两组患者的血流动力学、症状和认知异常相似。
• ME/CFS中一致的异常发现
包括自然杀伤细胞功能减弱、T细胞衰竭和其他T细胞异常、线粒体功能障碍以及血管和内皮异常,包括红细胞变形和血容量减少。
其他异常包括运动不耐受、耗氧量受损和无氧阈值降低,以及代谢异常,包括脂肪酸和氨基酸的使用改变。还观察到神经功能改变,包括神经炎症、脑血流减少、脑干异常和心室乳酸水平升高,以及眼睛和视力异常。反应性疱疹病毒(包括EBV、HHV-6、HHV-7和人巨细胞病毒)也与ME/CFS相关。
• 长新冠患者中观察到上述这些发现
长新冠研究发现,线粒体功能障碍包括线粒体膜电位丧失和可能的线粒体代谢失调、脂肪酸代谢改变和线粒体依赖性脂质分解代谢失调,与运动不耐受、氧化还原失衡、运动不耐受和氧提取受损的线粒体功能障碍一致。
研究还发现了内皮功能障碍、脑血流异常和代谢变化(即使是POTS症状减轻的长新冠患者)、广泛的神经炎症、疱疹病毒重新激活、红细胞变形以及其他地方讨论的许多发现。不仅在长新冠患者中,而且在ME/CFS患者中也发现了微裂纹和过度活化的血小板。
自主神经障碍,特别是POTS,通常与ME/CFS共病,也常伴有病毒性发作
POTS与G蛋白偶联的肾上腺素能受体和毒蕈碱乙酰胆碱受体自身抗体、血小板储存库缺陷、小纤维神经病变和其他神经病变有关。POTS和小纤维神经病变通常在长新冠中发现,一项研究发现67%的长新冠队列中存在POTS。
注:POTS——体位性心动过速综合征,一种随着姿势的改变而心率增加的情况,例如躺着坐起来或站着。这会导致头晕或昏厥。
肥大细胞激活综合征也通常与ME/CFS共病
与新冠前患者和对照组相比,长新冠患者肥大细胞激活综合征症状的数量和严重程度显著增加,组胺受体拮抗剂可改善大多数患者的症状。
注:肥大细胞活化综合征(MCAS)是一种由肥大细胞异常活化导致的慢性多系统性疾病.肥大细胞广泛分布于胃肠道,因此MCAS易累及胃肠道并出现相应症状。
其他可能共病的疾病
其他通常与ME/CFS共病的疾病包括结缔组织疾病,包括Ehlers–Danlos综合征和高移动性、神经矫形脊柱和颅骨疾病以及子宫内膜异位症。
长新冠中观察到与ME/CFS,自主神经障碍,肥大细胞激活综合征等疾病类似的发现,其他疾病也可能与长新冠合并。应进一步探讨病毒后条件与这些条件的重叠。
★
生 殖 系 统
长新冠中经常报告对生殖系统的影响。与无冠状病毒病史的女性以及患有新冠肺炎但不长时间冠状病毒的女性患者相比↓↓↓
患长新冠的女性更有可能发生月经改变
月经和月经前一周已被患者确定为长新冠症状复发的诱因。
在新冠肺炎患者中观察到卵巢储备下降和生殖内分泌紊乱,初步理论表明SARS-CoV-2感染会影响卵巢激素的产生和/或子宫内膜反应,因为卵巢和子宫内膜组织中ACE2受体丰富。
与那些没有月经变化的人相比,同时患有新冠和月经改变的人更容易出现疲劳、头痛、身体疼痛和气短,最常见的月经变化是月经不规律、经前症状增加和月经不频繁。
ME/CFS与多种妇科疾病存在关联
对ME/CFS的研究表明,ME/CFS与经前焦虑障碍、多囊卵巢综合征、月经周期异常、卵巢囊肿、绝经早期和子宫内膜异位症之间存在关联。妊娠、产后变化、围绝经期和月经周期波动会影响ME/CFS,并影响代谢和免疫系统变化。长新冠的研究应该关注这些关系,以更好地理解病理生理学。
病毒在阴茎组织中的持续存在,勃起功能障碍的风险也增加
这可能是由内皮功能障碍引起的。在一项研究中,与对照组相比,长新冠患者的精子计数、精液体积、活力、精子形态和精子浓度受损,并与细胞因子水平升高以及精液中胱天蛋白酶8、胱天蛋白酶9和胱天蛋白酶3的存在相关。
长新冠患者女性月经变化(月经不规律等),更容易出现疲劳,头痛等症状,男性精子质量变化,长期影响仍需进一步研究。
★
呼吸系统
呼吸系统疾病是长新冠的常见表现型,在一项研究中,新冠肺炎幸存者的发病率是普通人群的两倍。
呼吸短促和咳嗽是最常见的呼吸道症状,分别在40%和20%的长新冠患者中持续至少7个月。
几项包括长新冠患者的非住院患者的影像学研究显示了肺部异常,包括空气潴留和肺部灌注。
对感染后3-6个月的患者进行的免疫学和蛋白质组学研究表明,气道中的细胞凋亡和上皮损伤,但血液样本中没有。
进一步的免疫学特征比较了长新冠肺炎患者和新冠肺康复者,发现肺功能下降、全身炎症和SARS-CoV-2特异性T细胞之间存在相关性。



doi: 10.3389/fimmu.2021.686029
★
胃肠道系统
长新冠的胃肠道症状包括恶心、腹痛、食欲不振、胃灼热、便秘等。
持续的呼吸道和神经系统症状都与特定的肠道病原体有关。
SARS-CoV-2 RNA存在于新冠肺炎患者的粪便样本中,一项研究表明,12.7%的参与者在新冠肺炎确诊4个月后粪便中持续存在,3.8%的参与者在确诊7个月后持续存在。大多数感染7个月后出现长新冠症状和炎症性肠病的患者在肠粘膜中存在抗原持久性。
与没有长新冠或SARS-CoV-2阴性对照的患者相比,长新冠肺炎患者的血浆中发现了来自肠道和/或肺上皮的较高水平的真菌易位,可能会诱导细胞因子的产生。
长新冠患者的胃肠道症状可能与肠道菌群变化相关
与非新型冠状病毒肺炎对照组(疫情爆发前)相比,长新冠感染者中发现了较高水平的Ruminococcus gnavus和普通拟杆菌(Bacteroides vulgatus)和较低水平的普氏粪杆菌(Faecalibacterium prausnitzii),肠道失调持续至少14个月;低水平的产丁酸盐细菌与6个月时的长新冠密切相关。
将长新冠患者的肠道细菌转移到健康小鼠体内,导致小鼠认知功能丧失,肺部防御受损。
为什么长新冠患者的肠道菌群会发生变化?
胃肠道和呼吸道症状怎样将微生物群与SARS-CoV-2感染联系起来?
病毒是如何感染肠道的?
感染后的肠道菌群及宿主免疫会受到什么样的影响?
……
我们将在下一小节详细介绍。
▾◆▽◆▽◆▾
要了解病毒是如何感染,为什么会与肠道菌群相关联,我们来先从病毒的结构说起:
SARS-CoV-2是新冠肺炎的病原体。它是一种正向单链RNA病毒。它编码膜蛋白(M蛋白)、核衣壳蛋白(N蛋白)、刺突蛋白(S蛋白)和包膜结构蛋白(E蛋白)和多种非结构蛋白。
呼吸道胃肠道是人类微生物群的主要栖息地,也是SARS-CoV-2感染的目标
⇓⇓⇓
SARS-CoV-2病毒如何实现感染?
病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染。
在病毒体上,刺突蛋白(S蛋白)是包含S1和S2亚基的同源三聚体:
病毒劫持宿主细胞表面蛋白酶,如跨膜丝氨酸蛋白酶2(TMPRSS2),TMPRSS2反过来激活病毒S蛋白,切割ACE2受体,并促进病毒与宿主细胞膜的结合。
除了ACE2和TMPRSS2介导的进入外,SARS-Cov-2还可以利用宿主细胞的吞噬作用或内吞作用侵入某些免疫细胞类型,如巨噬细胞。
为什么SARS-CoV-2可感染肠道?
ACE2和TMPRSS2在呼吸道和胃肠道中强烈表达。由于后者与外部环境沟通,它们是SARS-CoV-2入侵的主要目标。
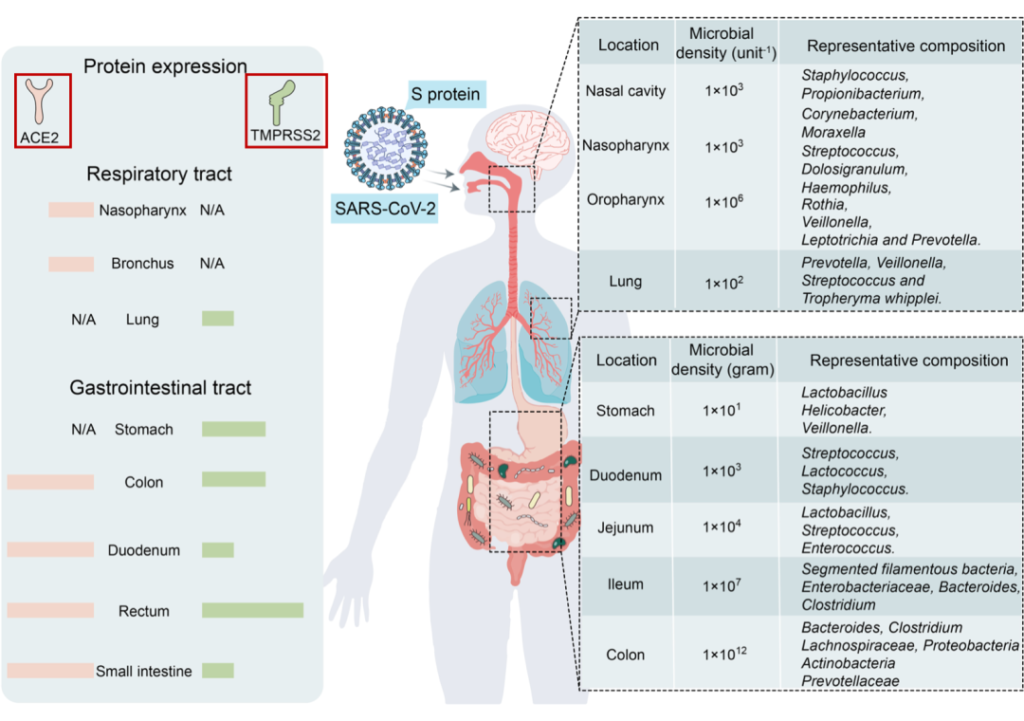
Wang B, et al., Signal Transduct Target Ther. 2022
SARS-CoV-2受体ACE2和TMPRSS2主要在呼吸道和胃肠道中表达,为微生物提供了许多合适的栖息地。
由于ACE2和TMPRSS2在胃肠道中高度表达,SARS-CoV-2也以肠道为靶点。一些研究报告称,新冠肺炎患者粪便样本中SARS-CoV-2病毒RNA呈阳性。
对一名新冠肺炎患者进行的活组织检查显示,SARS-CoV-2蛋白涂层存在于胃、十二指肠和直肠中。因此,SARS-CoV-2可感染肠道。
COVID-19的胃肠道和呼吸道症状将微生物群与SARS-CoV-2感染联系起来
⇓⇓⇓
几项临床研究报告,11-39% 的 COVID-19 患者有胃肠道症状,包括恶心、呕吐、腹泻和腹痛。
智利进行的一项研究报告称,在 7016 名 COVID-19 患者中,有 11% 表现出胃肠道症状。
在浙江的651例COVID-19患者中,8.6%表现出腹泻,4.15%表现出恶心或呕吐。
胃肠道症状与相对较高的住院风险和/或更高的疾病严重程度相关。在重症和/或危重患者中,疾病进展并引起并发症,例如急性呼吸窘迫综合征(ARDS),败血症,继发性病原体肺炎和终末期器官衰竭。
由于微生物群维持呼吸道和胃肠道稳态和健康,上述COVID-19相关症状可能将微生物群与SARS-CoV-2感染联系起来。
一些研究证实,肠道菌群有助于调节肠道免疫稳态和病原体感染。因此,肠道细菌可能对SARS-CoV-2感染的宿主免疫反应至关重要。
一些研究小组报告称,与新冠完全康复的患者相比,长新冠患者的肠道微生物群存在差异。在诊断时检测到微生物差异,但在6个月后被夸大。特别是,长新冠患者出院后,微生物群的丰富度没有恢复到正常状态。
持续的症状可能与免疫隔离组织中存在少量残余病毒有关,特别是身体中不受抗体直接保护的区域,如肠道。
一个重要的观察结果显示,病毒清除后,肠道失调持续了数月。与作为对照的健康个体相比,从新冠肺炎中恢复的患者在3个月时细菌多样性和丰富度降低,同时有益共生菌丰富度较低,机会性病原体丰富度较高。在随访6个月时,与对照组相比,COVID-19患者中双歧杆菌和瘤胃球菌的相对丰度显著降低(P < 0.001).
一项前瞻性研究追踪了香港106名新冠肺炎住院患者肠道微生物群的纵向动态,大约四分之三的患者在感染后6个月出现”长新冠”症状(通常是疲劳、记忆力差和焦虑)。
粪便样本的Shotgun宏基因组分析显示,与没有长新冠的个体和作为对照的健康个体相比,长新冠患者微生物多样性显著降低,细菌类型减少。
长新冠患者的Bacteroides vulgatus和Ruminococcus gnavus 的丰度增加,而P.prausnitzii的丰度减少。
有趣的是,与健康个体(n = 11)相比,PI-IBS患者(n = 11)的粪便样本中Bacteroides vulgatus也显示出6倍的升高;这一发现表明,Bacteroides vulgatus可能与长新冠和PI-IBS的发病机制有关。
注:因感染而导致的IBS被称为感染后肠易激综合征(PI-IBS)
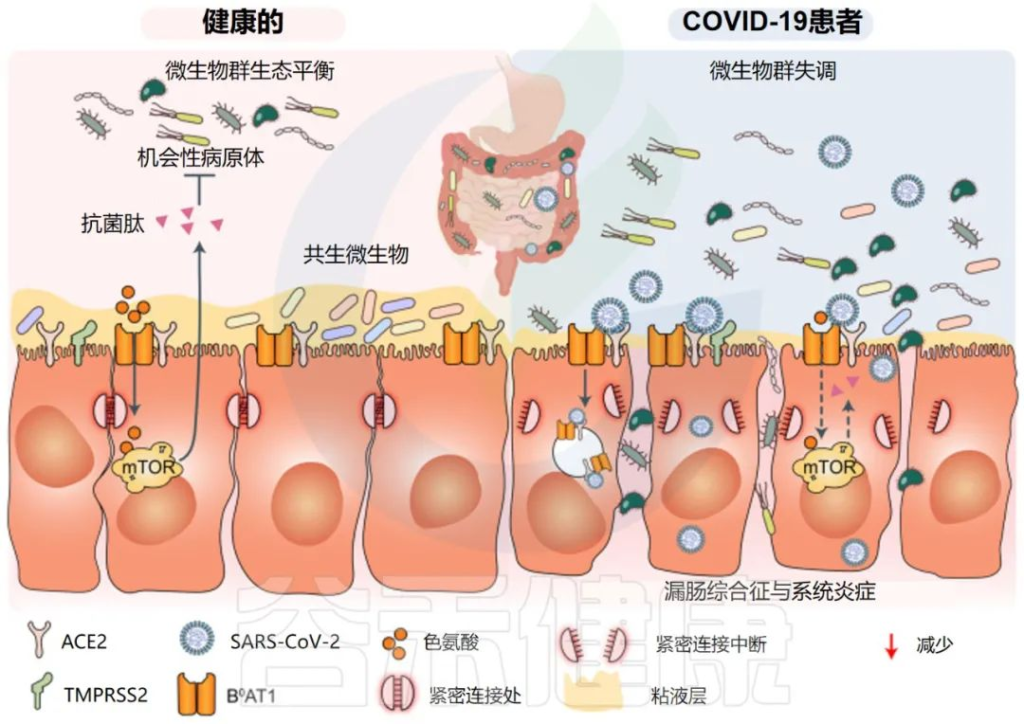
doi: 10.1038/s41392-022-00986-0
此外,SARS-CoV-2感染后6个月出现呼吸道症状与Streptococcus vestibularis和Streptococcus anginosus等机会性致病物种的水平升高有关。
而疲劳和神经精神症状与医院内病原体有关,如:Clostridium innocuum 和 Actinomyces naeslundii。
在脱发患者中,产丁酸盐细菌显著减少,某些细菌,如Bifidobacterium pseudocatenulatum和F. prausnitzii,与长新冠的发展具有最大的负相关。入院时的细菌种类,包括长双歧杆菌(B.longum)和Blautia wexlerae,与6个月时长新冠的发展呈负相关,这意味着这些细菌在恢复期具有潜在的保护作用。
相比之下,在长新冠患者中富集的菌有:
Atopobium parvulum
Actinoomyces johnsonii
Actinomyces sp. S6 Spd3
这些发现表明,一个人在感染时的肠道微生物组组成能会影响其对新冠长期并发症的敏感性。尽管如此,这些变化可能代表长新冠的反应性变化,未来的研究需要包括从感染到症状发展的非住院患者的前瞻性纵向研究,以描述肠道菌群失调对长新冠症状的确切影响。
持久战——免疫细胞数量变化
针对患有轻度急性新冠肺炎的长冠肺炎患者的免疫失调进行的研究发现,T细胞改变,包括耗尽的T细胞、CD4+和CD8+效应记忆细胞数量减少以及中央记忆细胞PD1表达升高,持续至少13个月。
研究还报道了高度活化的先天免疫细胞,缺乏初始T细胞和B细胞,I型和III型干扰素(IFN-β和IFN-λ1)的表达升高,持续至少8个月。
一项综合研究将长新冠患者与未感染者和无长新冠的感染者进行了比较发现,在感染后中位数14个月,长新冠患者的非经典单核细胞、活化B细胞、双阴性B细胞以及分泌IL-4和IL -6的CD4+ T细胞数量增加,常规树突状细胞和T细胞数量减少,皮质醇水平降低。
疲劳和神经认知功能障碍可能与细胞因子变化和EBV再激活相关
细胞毒性T细胞的扩增已被发现与长冠的胃肠道表现有关。更多的研究发现细胞因子水平升高,特别是IL-1β、IL-6、TNF和IP10,最近的预印本报道了CCL11水平的持续升高,这与认知功能障碍有关。
在长新冠患者中发现了包括EBV和HHV-6在内的反应性病毒(已在ME/CFS45中发现),并导致线粒体断裂,严重影响能量代谢。最近的一份预印本报告,在长新冠患者中,EBV再激活与疲劳和神经认知功能障碍相关。
抗体生成量低,可预测长新冠
几项研究表明,在新冠肺炎急性期,无论是住院患者还是非住院患者,SARS-CoV-2抗体生成量低或无,以及其他免疫反应不足,都可以预测6至7个月后长新冠。
这些不足的免疫反应包括IgG的低基线水平、受体结合域和刺突特异性记忆B细胞的低水平、核衣壳IgG的低水平和刺突特异性IgG的低峰值。
在最近的一份预印本中,发现严重长新冠患者的CD4+T细胞和CD8+T细胞应答较低或缺失,另一项研究发现,与无长新冠的感染对照组相比,长新冠患者的CD8+T淋巴细胞表达CD107a的水平较低,核衣壳特异性干扰素-γ-产生的CD8+T细胞下降。
二次感染可能与抗体水平低相关
长新冠患者体内高水平的自身抗体与保护性新冠肺炎抗体呈负相关,这表明高水平自身抗体的患者更有可能发生突破性感染。
SARS-CoV-2病毒在肠道内反弹,可能是由于病毒持续存在,也与受体结合域IgA和IgG抗体的水平较低和产生较慢有关。
长新冠驱动因素:病毒持续存在
一些报告指出,病毒持续存在可能是长新冠的驱动因素;在生殖系统、心血管系统、大脑、肌肉、眼睛、淋巴结、阑尾、乳腺组织、肝组织、肺组织、血浆、粪便和尿液中发现了病毒蛋白和/或RNA。胃肠道活检后的多份报告表明存在病毒,提示某些患者体内存在持久性病毒库。
ACE2——病毒感染人体细胞的“钥匙”
前面我们已经知道,病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染,可见,ACE2作为病毒进入的一个入口点,扮演者重要的角色。
ACE2能做什么?
ACE2在肾素-血管紧张素系统(RAS)中起主要作用,除此之外,其活性在肺部也有作用,因为它通过抑制des-Arg9-缓激肽调节缓激肽1受体信号传导,从而减少血管舒张和血管通透性。
ACE也在肠道肠细胞中表达,它可以调节微生物生态、先天免疫和饮食氨基酸稳态。
ACE2亦敌亦友
ACE2在肺部的保护作用可能是COVID-19中的一把双刃剑:
ACE2在肾素-血管紧张素系统(RAS)中的作用以及严重急性呼吸综合征SARS-CoV-2诱导的细胞表面ACE2表达下调的机制如下:
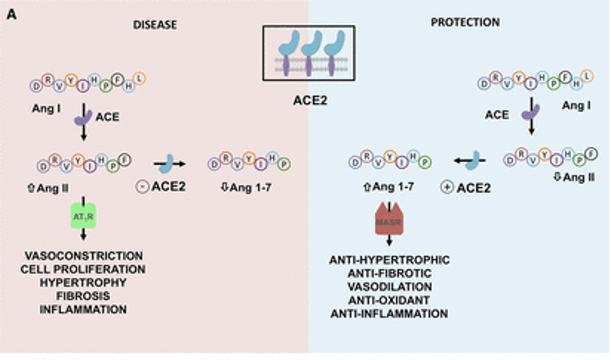
doi: 10.1161/CIRCULATIONAHA.120.047049
ACE2平衡肾素-血管紧张素系统的2个轴:
➭ 增加的ACE2促进保护性ACE2/Ang 1-7/MASR
➭ ACE2的丢失导致向以ACE/血管紧张素II(Ang II)/AngII受体1型(AT1)受体轴(AT1R)过度活性为特征的疾病状态转变。
doi: 10.1161/CIRCULATIONAHA.120.047049
SARS-CoV-2的病毒刺突糖蛋白与细胞表面ACE2相互作用,并通过内吞作用一起内化,导致表面ACE2表达降低。ACE2的丢失导致Ang II的积累,Ang II通过AT1受体也上调ADAM17,导致细胞表面ACE2的进一步裂解。
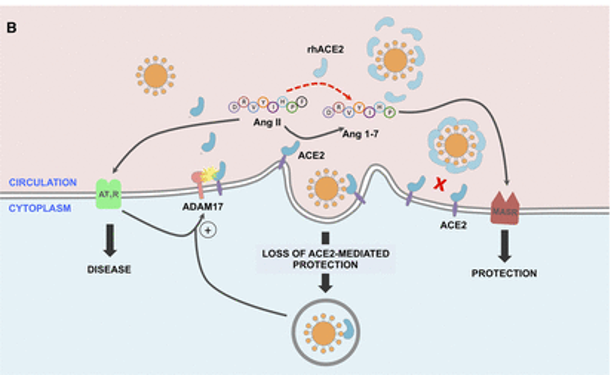
肠道微生物群对肠道ACE2表达的影响?
动物研究中,无菌小鼠的肠道和肺部ACE2表达水平明显高于常规小鼠。以不同微生物群定殖的促性腺激素小鼠显示出肠道ACE2表达的可变性,这可能部分归因于微生物组编码的蛋白酶和肽酶类型的差异。
2021发表的一项研究确定了调节肠道ACE2表达的转录因子,包括已知受肠道微生物群调节的GATA4。这些数据表明,肠道微生物群可能在调节ACE2表达中发挥作用。
特定肠道菌群抑制ACE2表达
在小鼠模型中,特定的细菌种类,如多氏拟杆菌(Bacteroides dorei)和长双歧杆菌,可以抑制结肠ACE2的表达。
与小鼠结肠ACE2表达下调相关的四种拟杆菌显示出显著性差异(P < 0.05),与粪便SARS-CoV-2载量呈负相关。
“阳”之前肠道菌群已经异常,促进易感性
死于新冠肺炎的高危人群通常是那些患有糖尿病、心血管疾病和肥胖症等共病的人群,这些疾病也与微生物异常有关,其特征是细菌多样性减少。
这一发现表明,感染前的肠道微生物群可能促进宿主对SARS-CoV-2和ACE表达的易感性。
拟议的感染前、中、后肠道菌群变化模型及新冠措施如何影响人一生中的菌群多样性
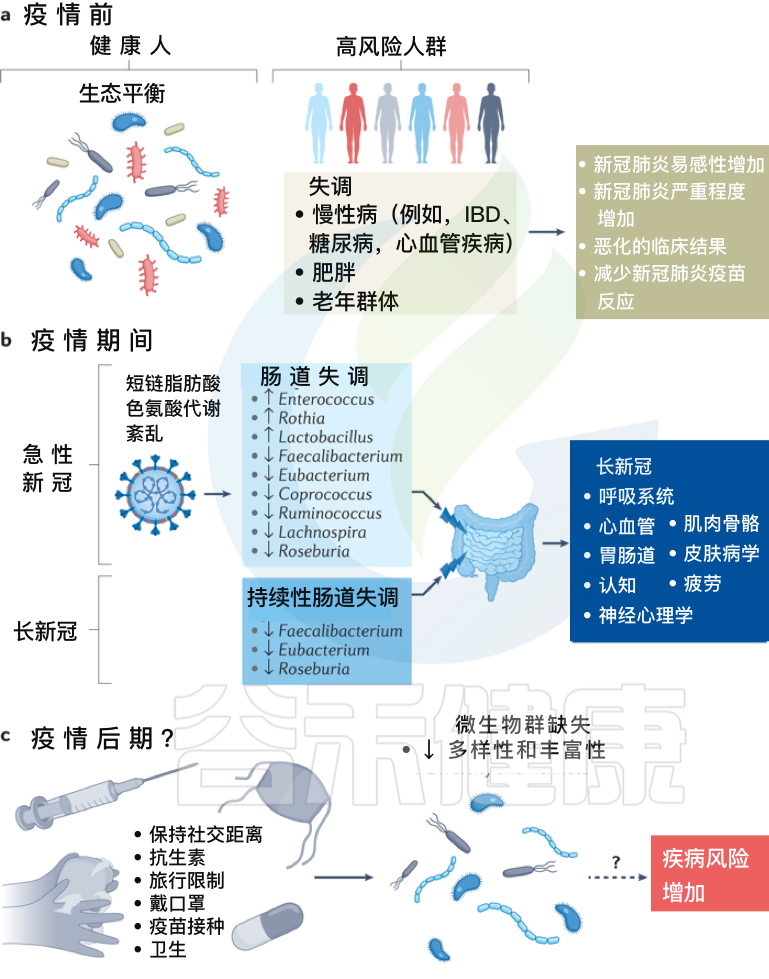
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
a、在新冠疫情之前,健康个体的肠道微生物群以“生态平衡”为特征,这是一个具有丰富微生物多样性的平衡肠道生态系统。
而某些个体,包括老年群体和患有炎症性肠病、糖尿病、心血管疾病和肥胖等慢性病的个体,肠道生态系统发生了变化,微生物多样性降低,肠道微生物组成失调可能导致严重急性呼吸综合征SARS-CoV-2感染的易感性增加,新冠肺炎严重程度增加,临床结局恶化和/或新冠肺炎疫苗反应降低。
b、在疫情期间,急性新冠感染与持续的肠道微生物群组成变化、短链脂肪酸生物合成受损和色氨酸代谢紊乱有关。
最初感染中出现的功能障碍也与急性后新冠肺炎综合征有关,包括慢性呼吸道症状(例如咳嗽或气短)、心血管症状(例如胸痛或心悸)、胃肠道症状(例如食欲不振或腹泻)、神经精神症状(例如焦虑或失眠)、肌肉骨骼症状(例如关节疼痛或肌肉无力)和皮肤病症状(例如皮疹或脱发)。
在急性新冠肺炎疫情后阶段,肠道微生物群持续受到破坏,其特征是产短链脂肪酸的细菌粪杆菌、真杆菌和Roseburia持续耗竭。急性期肠道菌群组成的改变也与多器官急性后新冠肺炎综合征有关。
c、除了大流行之外,现有的疫情控制做法,包括严格执行社交距离、广泛的卫生消毒措施、定期接种疫苗和限制旅行,可能会对婴儿的微生物组多样性产生负面影响,并对肠道中的早期细菌定植产生重大影响,对疾病风险产生未知后果。
需要做更多的工作来调查和确认新冠、微生物群丧失和未来疾病风险之间的潜在联系。未来导致微生物损失的感染控制措施需要与促进微生物多样性的战略相平衡,以确保子孙后代的健康益处。
迄今为止,大多数临床研究表明 SARS-CoV-2 感染与肠道菌群改变之间存在关联,但尚不清楚肠道菌群改变是感染的原因还是影响。
为此研究人员提出了两种假设,并推断了相应的机制。
SARS-CoV-2感染 ▬► 肠道菌群失调
那么研究人员假设了 SARS-CoV-2 可导致肠道菌群失调,推断了几种可能的机制:
1) SARS-CoV-2侵入肺部可导致组织损伤,可以激活以NF-κB和TNF途径上调为特征的强促炎途径,激活模式识别受体(TLR、RLR、NLR),这些受体被先天免疫细胞识别,导致各种促炎细胞因子的释放。
或者肠道感染可导致肠道结构的直接损伤和肠上皮屏障的破坏,可能损害肠道通透性,并促进肠道炎症。
激活的全身炎症和肠道炎症可能导致破坏肠道微生物群平衡,导致:
• 机会病原体(例如肠杆菌科和肠球菌)的丰度增加
• 共生菌(例如Faecaliberium、Eubacterium和Roseburia)的丰度降低
关于Faecaliberium详见:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
关于Eubacterium 详见:
肠道核心菌属——优/真杆菌属(Eubacterium),你为什么要关心它?
关于Roseburia 详见:
2) SARS-CoV-2感染可下调肠上皮细胞管腔表面ACE2和B0AT1(分子ACE2伴侣)的表达,这可能促进病原菌的生长。
3) 一项体外研究发现SARS-CoV-2可能直接感染细菌。揭示了SARS-CoV 2 影响肠道微生物群的另一种可能机制。
肠道菌群特征 ▬► 严重程度和免疫反应
动物研究提供了证据,SARS-CoV-2感染可能在驱动肠道微生物群生态变化中发挥作用。
➪
当用SARS-CoV-2攻击恒河猴和食蟹猴的非人灵长类动物模型时:
➪
仓鼠模型能够重现人类严重新冠的一些特征:
研究人员提出SARS-CoV-2感染点的特定内在“微生物组特征”,可以通过几种假设机制影响感染的严重程度和宿主免疫反应:
i) 增加的机会性病原体可能会被先天性淋巴细胞进一步识别,并强化肠道促炎反应。
ii)机会性病原体和毒素可能转移到循环系统中,导致菌血症,加剧系统炎症和疾病严重程度。
iii)有益菌逐渐减少耗尽,可能会对免疫细胞的募集产生负面影响,如激活的粘膜相关不变性T细胞(MAIT),从而影响呼吸道感染的易感性和严重性。
肠道菌群可能导致免疫反应功能失调和 COVID-19严重程度的潜在机制
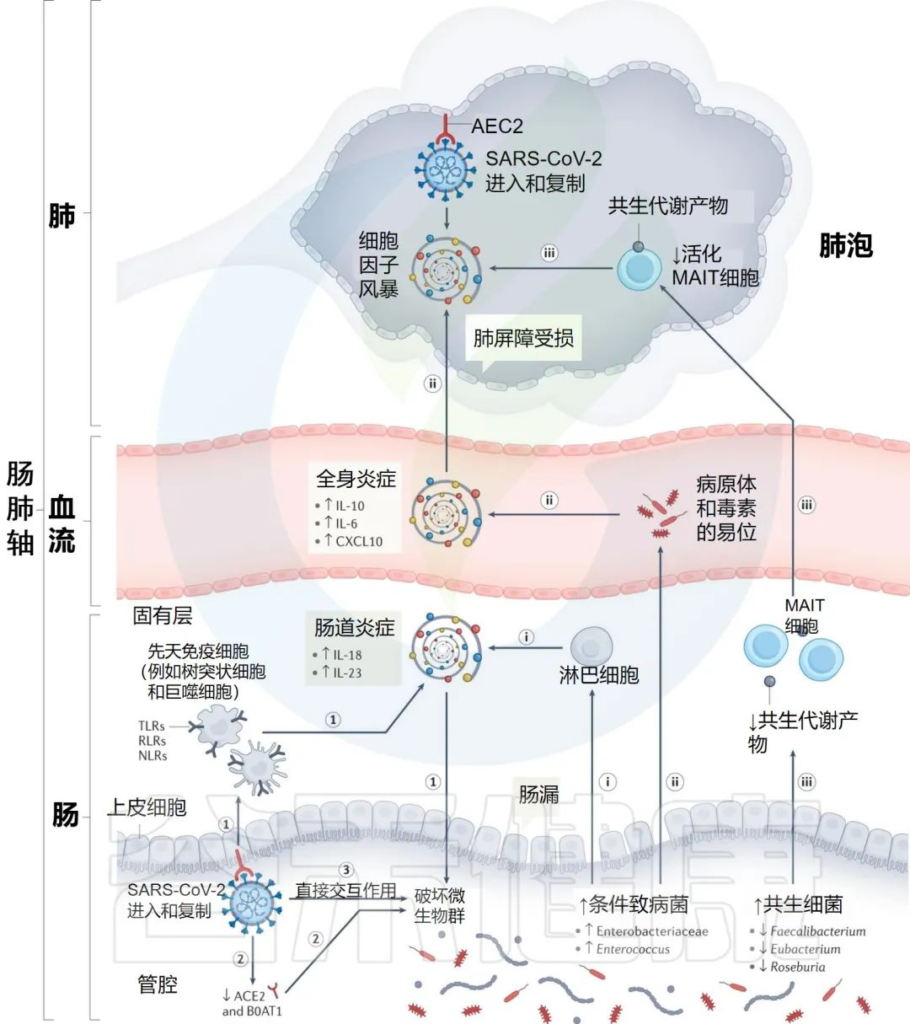
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
肠道菌群代谢产物
SARS-CoV-2感染与肠道微生物群的碳水化合物、脂质和氨基酸代谢改变有关。
——短链脂肪酸:合成受损
多项研究表明,COVID-19 患者的粪便样本中的短链脂肪酸生物合成受损。
在对66名新冠肺炎抗生素无效患者和70名未感染新冠的患者进行的宏基因组分析中,SARS-CoV-2感染患者的肠道微生物群合成短链脂肪酸的能力降低,这与疾病严重程度和血浆中促炎细胞因子IL-10和趋化因子CXCL10浓度升高呈负相关。
通过粪便代谢物的测量,19名与新冠相关的严重和/或危重疾病患者的粪便中短链脂肪酸(包括乙酸、丙酸、丁酸、戊酸和己酸)浓度持续下降。
短链脂肪酸可以激活免疫细胞的抗炎反应,抑制炎症信号通路,并保持肠道屏障的完整性,以防止肠道内毒素和细菌进入循环,从而减轻局部和全身炎症反应。
鉴于短链脂肪酸在调节宿主免疫反应中的重要性,新冠肺炎中短链脂肪酸生物合成不足可能与疾病发病机制和严重程度有关。然而,短链脂肪酸缺失是否是新冠感染的原因或后果尚待阐明。
——色氨酸代谢:受到干扰
一些测量新冠患者血浆代谢物的研究表明,与健康人作为对照组相比,色氨酸代谢受到干扰,与色氨酸新陈代谢有关的犬尿氨酸途径的激活增强。
色氨酸代谢通过调节调节性T细胞与TH17细胞的比率和B细胞活性与自身免疫、病毒感染和肠道健康相关。
在人类和动物研究中,犬尿氨酸途径代谢产物进入大脑的增加可能会引发疲劳、记忆力差和抑郁等症状,这是“长新冠”的常见症状。重要的是,色氨酸代谢产物是宿主-微生物群界面的关键介质。
根据人类和动物研究的证据,肠道微生物群可以直接使用色氨酸作为底物,并影响宿主色氨酸的吸收和代谢,以调节宿主的生理和免疫反应。内源性宿主色氨酸代谢产物可以深刻影响肠道微生物群的组成和功能,如阿克曼氏菌和乳杆菌。
综上所述,这些数据表明色氨酸代谢是肠道微生物群参与新冠肺炎的一种可能机制。
——胆汁酸代谢:菌群失调影响胆汁酸代谢,胆汁酸浓度升高破坏肠道屏障,引起炎症
初级胆汁酸由胆固醇、胆酸和鹅去氧胆酸通过与甘氨酸或牛磺酸结合在肝脏中合成。然后,它们被分泌到小肠,在那里它们被肠道菌群转化为次级胆汁酸,主要是脱氧胆酸(DCA)和石胆酸(LCA)。
次级胆汁酸在上皮细胞和内皮细胞以及肝细胞中充当核受体FXR、VDR和PXR的配体。它们还与TGR5相互作用。
注:TGR5是一种在肠、胰腺、淋巴组织和大脑中表达的膜结合受体。DCA和LCA都能够通过上述受体调节免疫系统。
研究人员根据疾病严重程度将新冠肺炎患者从无症状患者到处于关键阶段的患者进行分组。随着疾病严重程度的增加,来自患者的肠道菌群中厚壁菌/拟杆菌的比例逐渐受到更大的影响。
来自无症状患者的肠道菌群保留了有益菌种类,这些细菌与新冠肺炎的不良后果呈负相关:
此外,与危重症患者的微生物群不同,他们的微生物群的特征在于参与次级胆汁酸生物合成代谢途径的基因的高表达。
Harry Sokol等人观察了SARS-CoV-2感染对灵长类微生物群的影响,并发现总胆汁酸的数量随疾病严重程度而增加。值得注意的是,初级/次级胆汁酸的比率也明显较高。
这些数据表明,SARS-CoV-2感染对肠道菌群的破坏随着疾病的严重程度而加剧。随着菌群失调程度的增加,回肠的内在功能进一步改变,导致肠内转运增加,从而阻止胆汁酸的完全重吸收,从而增加其在结肠中的浓度。此外,重症新冠肺炎患者的肠道菌群功能有限,因此胆汁酸集中在这些患者的粪便中。
血清胆汁酸谱显示,急性呼吸窘迫综合征(ARDS)患者符合这些观察结果,因此可以推断,在严重的新冠肺炎中,胆汁酸浓度升高可能会破坏肠道屏障,并通过血流到达包括肺、心脏、肾和内皮在内的外周组织。它们的细胞毒性活性可能会损伤外周组织的细胞膜,导致局部和全身炎症反应,并在临床上表现出来。
——鞘脂:肠道微生物鞘脂代谢改变
据报道,新冠肺炎患者血清和粪便中鞘脂浓度降低,肠道微生物鞘脂代谢改变。鞘磷脂是生物膜的组成部分,介导信号转导和免疫激活。
拟杆菌产生的鞘脂可以增加外源鞘脂,从而增强体外或体内研究中观察到的调节性T细胞的分化,这可能抑制冠状病毒的复制。
这一观察支持肠道微生物群衍生的鞘脂可能调节宿主对SARS-CoV-2感染的防御的假设。
——蔗糖、葡萄糖:异常
与47名健康人作为对照组相比,56名新冠肺炎患者的粪便蔗糖水平升高,粪便葡萄糖水平降低。蔗糖和葡萄糖的异常水平可能与蔗糖酶-异麦芽糖酶活性受损有关。
这种变化可能与新冠肺炎常见的肠道症状有关,如腹泻、呕吐、肠胃气胀和腹痛。胀气通常是由细菌在肠道中发酵未吸收的碳水化合物引起的。
蔗糖水平的增加与放线菌和Streptococcus parasanguinis水平的增加有关,这意味着COVID-19 中的生态失调,可能会破坏肠道发酵并导致胃肠道症状。
▾◆▽◆▽◆▾
累积的证据表明,肠道菌群失调与 COVID-19 感染的严重程度和疾病恢复后的长期多系统并发症有关。
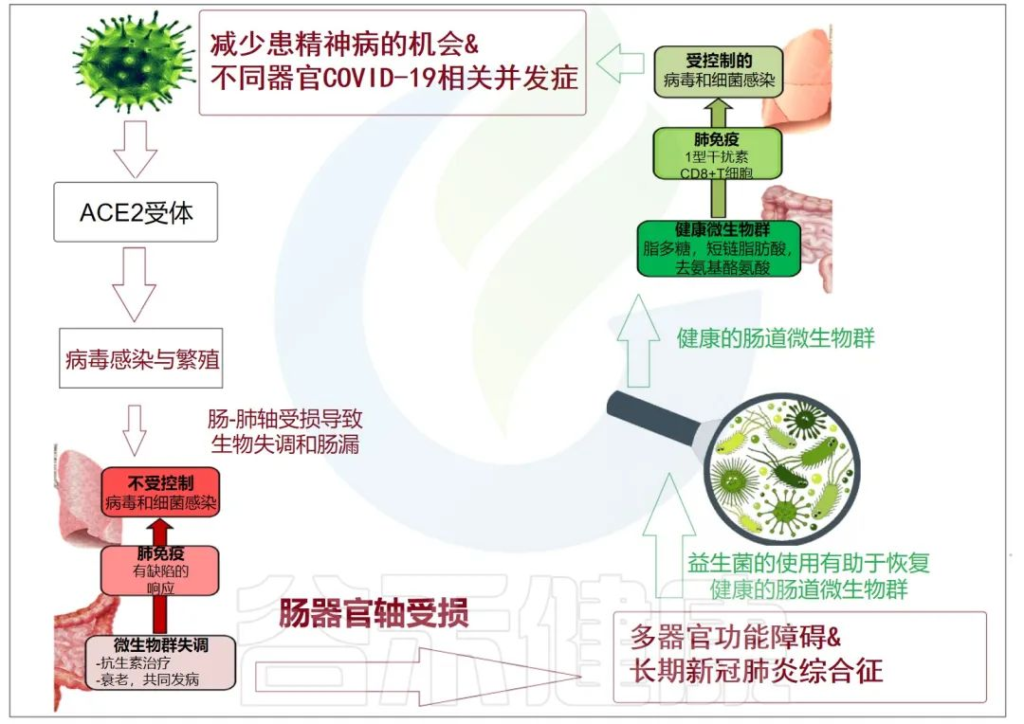
doi: 10.3390/metabo12100912
肠-肝轴是指肠道及其微生物群和肝脏之间的双向通路。这种相互作用是由门静脉建立的,通过门静脉,肠道菌群产物直接运输到肝脏,肝脏将胆汁和抗体反馈到肠道。
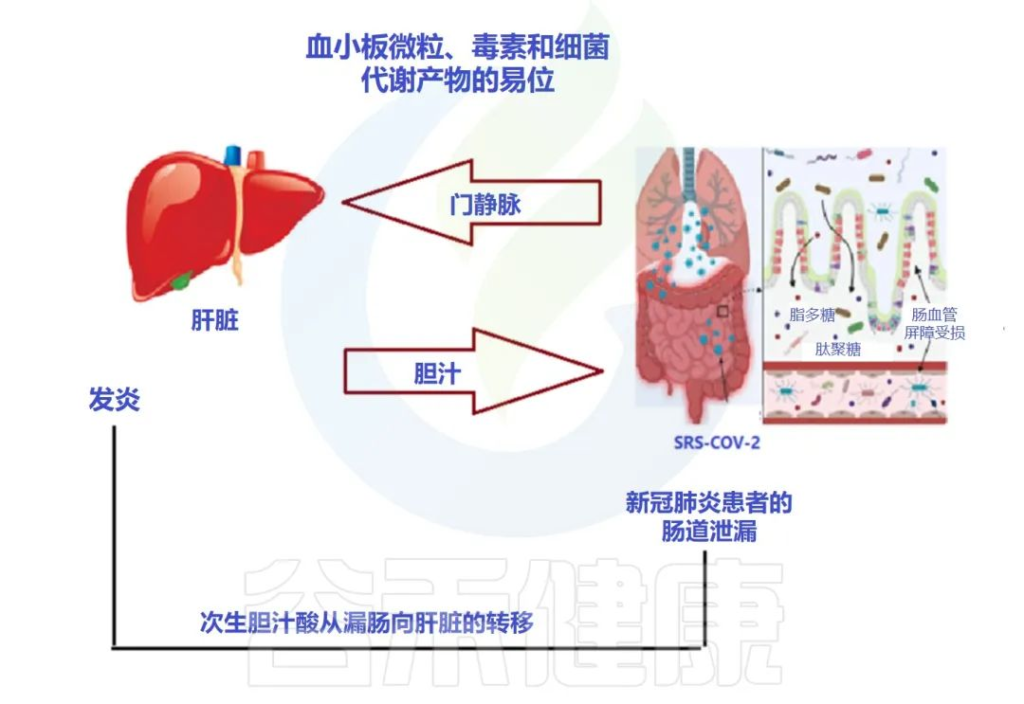
doi: 10.3390/metabo12100912
最近的两项研究表明:
代谢功能障碍相关性脂肪肝(MAFLD)是进展为严重和长期COVID-19的主要危险因素。
MAFLD征象的患者风险高
两项研究均证明,有MAFLD征象的患者发生呼吸系统疾病进展的风险高于无MAFLD的患者,年轻COVID-19患者的风险远高于老年COVID-19患者。
风险增加与病毒影响肠道通透性有关
研究人员认为,在MAFLD患者中观察到的风险增加可能与SARS CoV-2感染对肠道的影响有关,SARS CoV-2感染使肠道通透性和粘膜炎症恶化,从而加剧全身免疫功能障碍,这是严重COVID-19的特征。
当然,这个过程也可以阐明肥胖、2型糖尿病甚至炎症性肠病中 COVID-19 进展的较高风险,这与肠道微生物群改变、粘膜炎症和肠道通透性增加有关。
大量研究表明,腹泻、呕吐和腹痛等胃肠道症状在COVID-19患者中很常见,胃肠道症状的严重程度与呼吸系统疾病和肝功能障碍同时增加。
胃肠道中病毒进入受体表达的增加
已发现ACE-2 SARS CoV-2受体在肠细胞细胞上表达,因为粪便中高水平的SARS CoV-2病毒表明肠道是病毒感染和炎症的合理部位。
用于SARS-CoV-2进入的跨膜丝氨酸蛋白酶2在肠道细胞中也广泛表达。基于此,胃肠道中病毒进入受体表达的增加以及胃肠道症状的早期发作,意味着胃肠道异常可能是由病毒的直接恶化肠漏引起的,而不是对上呼吸道感染的继发性免疫致病反应的结果。
胃肠道症状的临床表现与肝功能不全的生物标志物呈正相关,支持了PAMPs向肝脏传播增加的观点。
SARS-CoV-2 感染会破坏肠道屏障,导致全身细菌脂多糖和肽聚糖升高,并有助于增强全身炎症。因此,肠漏和肠道菌群失调可能导致COVID-19重症患者发生细胞因子风暴。
基于此,已经开发的用于治疗肠漏的治疗方法,例如用于肠道粘膜保护/再生的益生菌和益生元,可以最大限度地减少进展为严重和长新冠的 MAFLD/肥胖/T2D 患者的数量。此外,在SARS CoV-2病毒感染期间,应避免使用干扰肠道微生物群的药物,例如抗生素。
充分证据表明,肠道微生物群改变和肠道细菌多样性减少,在心力衰竭合并冠状动脉疾病患者中很常见。
肠漏导致炎症,和心血管疾病相关
功能失调的肠道屏障会延缓菌群产物的被动泄漏,其中包括促炎脂多糖(LPS)进入血液,这可以通过炎症小体激活导致全身炎症。LPS结合蛋白(LBP)作为老年男性心血管风险高预测生物标志物的血浆水平显著升高,证明了这一点。
有趣的是已经发现,肠漏和炎症小体激活,与肌钙蛋白作为心肌损伤的标志物呈正相关。
肠道菌群-心轴在长新冠综合征中的作用
相当大比例的COVID-19住院患者有心脏问题。早期心血管疾病和心血管疾病危险因素(如肥胖)似乎是发生严重且长新冠并发症的关键危险因素。然而,高比例的COVID-19患者既往无心血管疾病的心脏受累。
在COVID-19患者中,心脏问题也被视为一个危及生命的实质性问题,从MI和心肌炎到伴有心脏应激的肺动脉高压。这种心脏受累的机制尚不清楚。
心肌感染可能与ACE2受体相关
ACE2在多个器官中表达,除肺、心脏和肾脏组织外,ACE2也在肠道中表达,肠细胞中的ACE2表达区可作为SARS-CoV-2进入和提示肠道感染的位点。继发于下调ACE2(SARSCoV-2受体)的抗炎和心脏保护性血管紧张素(AT)-1-7通路下调,通过表达ACE2的心脏细胞引导心肌感染,导致心脏炎症。
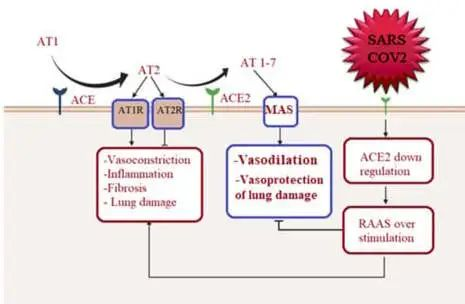
doi: 10.3390/metabo12100912
心脏成像的长期随访,结合肠道菌群分析,是进一步测试长冠状病毒肺炎患者肠道-心脏轴潜在影响的必要后续步骤。
肠道微生物群与肾脏疾病之间的致病性相互关联
肠道菌群参与广泛的临床表现,如慢性肾脏病(CKD),急性肾损伤(AKI)和高血压。
在肠漏的情况下,活细菌经常从肠道转移到其他肠外位置,例如肾脏。这种细菌易位可能伴有菌群失调、病原菌过度生长和宿主免疫系统低下。
在慢性肾病的情况下,肠道微生物群会产生许多毒素和尿毒症溶质,例如对甲酚硫酸盐 (PCS)、硫酸吲哚酯和三甲胺 (TMA) N-氧化物。另一方面,尿素水平升高可能导致肠道微生物群的改变(图3)。
尿毒症毒素可能导致慢性肾病患者出现疲乏、矿物质骨疾病、神经系统疾病和心血管损害。
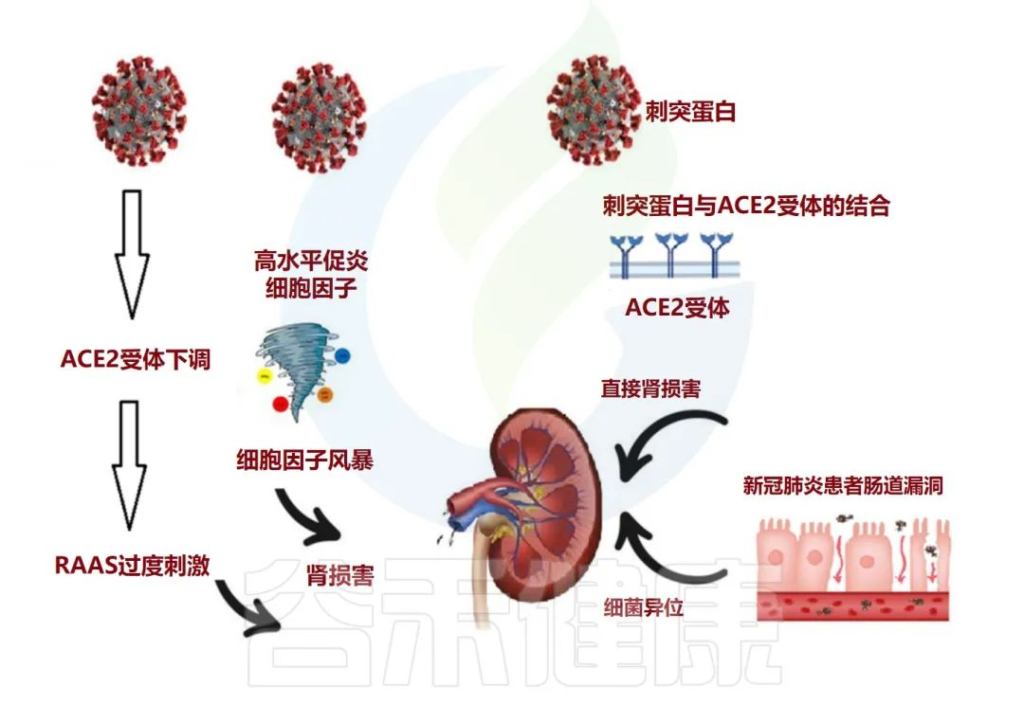
doi: 10.3390/metabo12100912
肠道生态失调在与 COVID-19 相关的长期肾脏问题中的作用
急性肾损伤 (AKI) 通常被视为 COVID-19 患者的并发症。除了先前存在的慢性肾病与COVID-19中的重症或死亡有关外,值得注意的是,解决SARS CoV-2通过AEC2受体进入肾脏,并诱导临床表现的不同途径。
人们普遍认为,该病毒可直接进入肾脏并复制,导致功能障碍,并且通过肾素-血管紧张素-醛固酮系统(RAAS)稳态的局部紊乱影响肾脏。
研究显示,既存慢性肾病患病率较高的群体可能更容易发生急性肾损伤。新出现的证据还表明,COVID-19的肾脏表现与长期严重COVID-19相关肾脏并发症的风险增加有关。
在菌群失调型COVID-19患者中,有益菌(主要是双歧杆菌和乳酸杆菌)逐渐消失,并且由于微生物群改变和病原体优势,观察到短链脂肪酸和胆汁酸水平下降。
短链脂肪酸,特别是丁酸盐是结肠细胞的重要能量来源,在上皮完整性中也起着重要作用。此外,短链脂肪酸受体GPR109A的激活与几种促炎介质的抑制有关。这可能解释了在 COVID-19 患者中出现的显著长期并发症。
作者报告说,慢性肾病患者的厌氧菌群减少,而有氧菌群增加,以肠杆菌科为主。所有这些机制都可以解释一些COVID-19患者的长期肾脏并发症。
在COVID-19住院期间监测肾功能,有助于识别后果更严重风险的患者,有助于早期和更有效的干预。
尽管 COVID-19 的主要临床表现与呼吸系统有关,但也会带来脑相关的问题,引发急性脑血管问题和颅内感染。
约35%的患者和高达85%的重症患者报告神经系统症状,包括头痛、头晕、肌痛或味觉和嗅觉丧失。
COVID-19感染可能导致神经系统疾病以及大脑结构和功能改变的机制有很多。
部分感染后的患者存在一致的记忆缺陷模式
认知问题是最常报告的症状之一,影响10%-25%的COVID-19患者,表现为SARS-CoV感染后的慢性疾病。作者发现,经历过COVID-19感染的人存在一致的记忆缺陷模式,随着自我报告的持续症状的严重程度,记忆缺陷也在增加。
此外,他们报告说,最初疾病期间的疲劳/混合症状和持续的神经系统症状可以预测认知能力。
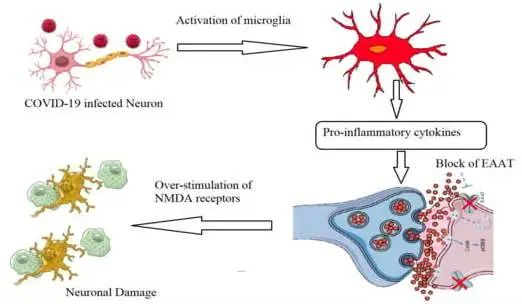
doi: 10.3390/metabo12100912
COVID-19与神经损伤有关,主要见于神经系统症状
对COVID-19死亡患者的尸检显示,有缺血性损伤的指征和神经炎症的证据是病因机制。许多研究记录了不同脑区的功能和结构畸形,如出血性损伤和癫痫样放电。
谷氨酸兴奋性毒性的作用:诱导促炎细胞因子产生
关于神经炎症,谷氨酸兴奋性毒性的作用应考虑为导致长新冠相关神经系统症状的原因。Ahmed等人(2020)报道,由于谷氨酸兴奋性毒性,SARS-CoV感染可诱导促炎细胞因子的产生和神经元变性显著增加。
简单地说,谷氨酸作为神经系统中的主要兴奋性神经递质,主要由神经元产生并在突触间隙中排出,之后它与配体依赖性AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)结合。这有助于钠离子的进入和神经冲动通过突触后神经元,导致N-甲基-D-天冬氨酸受体(NMDA)的激活,从而诱导钙离子进入。
新冠引起的神经元感染,扰乱谷氨酸稳态的控制
在新冠病毒引起的神经元感染过程中,小胶质细胞产生促炎细胞因子(TNF-α、IL-1β和IL-6),下调星形胶质细胞和突触前神经元上的谷氨酸转运蛋白1(GLT-1)。这将降低谷氨酸有效再摄取的速率,并导致谷氨酸 / GABA神经递质的不平衡和NMDA受体的过度刺激。这些事件扰乱了谷氨酸稳态的控制,突触间隙中谷氨酸的过量产生诱导神经元兴奋性毒性,钙显著进入,最终导致神经细胞变性和损失。
关于谷氨酸与大脑健康以及肠道菌群之间的关联,我们在之前的文章也有写过,详见:
新冠引起的肠道菌群失衡➔影响肠道屏障和血脑屏障通透性 ➔ 菌群代谢产物进入大脑➔脑功能障碍
肠道菌群维持肠上皮屏障、免疫稳态和防止病原体入侵。此外,肠道菌群可以通过增加紧密连接蛋白的表达来影响血脑屏障 (BBB) 的完整性和通透性。ACE2与肠道微生物稳态密切相关。
SARS-CoV-2 感染引起的肠道感染和 ACE2 表达下调可导致肠道菌群组成异常,包括乳酸杆菌和双歧杆菌等菌群水平降低。微生物失衡和肠道炎症势必会影响肠道屏障功能和血脑屏障的完整性和通透性,从而导致肠道细菌、毒素等肠道微生物代谢产物易位,通过血液循环进入大脑,最终导致脑功能障碍。
SARS-CoV-2侵入肠神经系统,出现异常,通过迷走神经影响大脑
迷走神经与肠神经系统中的神经元形成突触连接,并将肠道信息传输到NTS,在那里信息被整合并传递到大脑。
肠神经系统的异常不仅会导致胃肠功能障碍,还会通过肠-脑轴影响大脑功能。先前的研究表明,嗜神经病毒持续感染肠神经系统,并导致肠功能障碍。
SARS-CoV-2进入肠道后,通过与ACE2结合侵入肠神经系统,然后通过迷走神经进入大脑,影响中枢神经系统功能。
更重要的是,肠神经系统损伤导致肠道运动障碍、肠道血流异常和上皮屏障功能障碍,从而进一步促进肠道微生物和细菌代谢产物的毒素进入血液,加重大脑损伤。
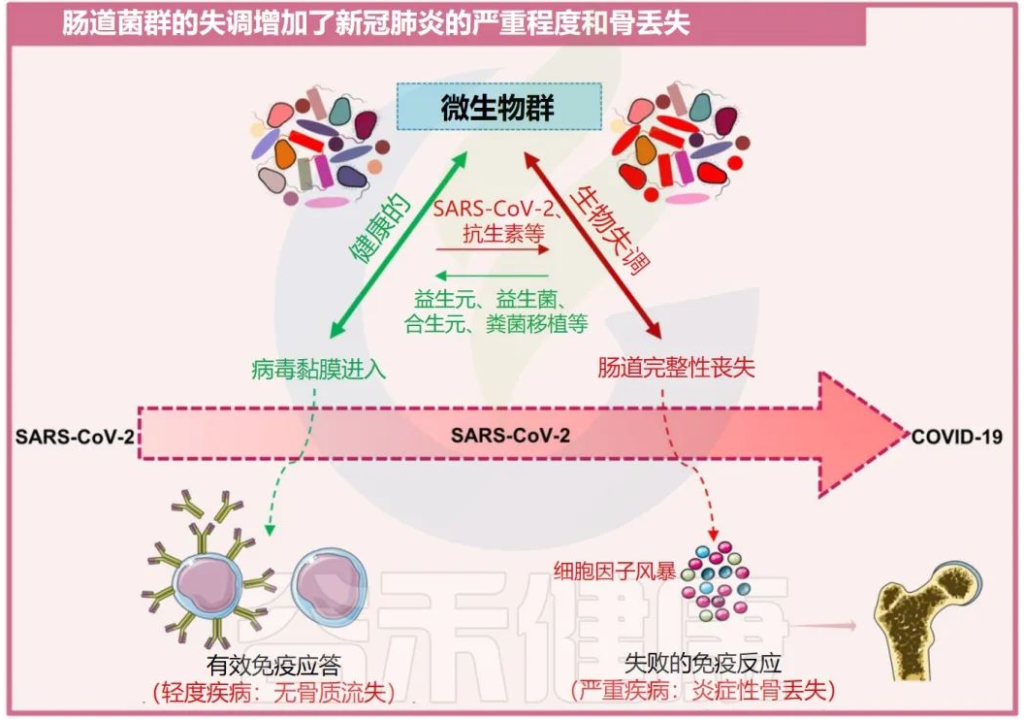
越来越多的证据表明,肠道菌群失调也被发现是增加骨质流失的关键因素,而骨质流失又反过来促进了几种骨相关疾病的发展,例如类风湿性关节炎和骨质疏松症。
一系列报告显示,肠道菌群通过改变骨组织的质量来影响骨强度。肠道菌群调节骨骼健康的机制是通过促进调节代谢产物的生成,如吲哚衍生物、三甲基胺N-氧化物(TMAO:氧化胺)、短链脂肪酸和气体递质,如硫化氢(H2S)。
在卵巢切除术(ovx)诱导的绝经后骨质疏松小鼠模型中,H2S供体化合物GYY4137通过激活Wnt10b生成,从而增加骨形成,减少小梁骨损失,从而增强骨健康。
短链脂肪酸如乙酸、丙酸和丁酸诱导骨吸收细胞的代谢重编程,导致糖酵解增强,从而降低破骨细胞的特异性基因,如NFATc1和TRAF6,这是骨骼稳态的有效调节因子。
肠道菌群失调会加剧COVID-19疾病的严重程度和骨质流失
Sapra L, et al., Inflamm Res. 2022
还需要在该领域进行更多研究,并对康复的 COVID-19 感染患者进行长期随访,以确定 COVID-19 引起的骨病变的机制。
★ 肠-脾轴
SARS-CoV-2 被证明可能通过 ACE-2 受体诱导脾脏的特定嗜性。人们认为脾功能障碍与其他机制一起导致B细胞和T细胞淋巴细胞减少,这是感染后COVID-19的典型特征。
与健康对照组相比,脾切除术或脾功能障碍患者的革兰氏阴性菌产物LPSs丰度较高,因此肠道微生物群组成改变是血浆LPS升高的主要原因,可能与长期COVID-19并发症有关。
下 篇
干 预 措 施
饮 食 模 式
坚持高质量的饮食模式与较低的COVID-19感染和住院风险相关
一项Meta分析纳入5项研究,包括4023663名受试者(3149784名高质量饮食者和873881名对照组)。
高质量饮食模式对SARS-CoV-2感染和住院的有效性分别为28%(95% CI 19% ~ 36%)和62% (95% CI 25% ~ 80%)。
基于不同类型的高质量饮食和COVID-19感染风险的亚组分析显示:
一项病例对照研究调查了来自六个国家(法国、德国、意大利、西班牙、英国、美国)的2884名一线医护人员的饮食模式与新冠肺炎之间的关系。
注:这些医护人员是根据与新冠肺炎患者的大量接触情况进行筛选的。这项研究依赖于主要由男性医生组成的自我报告人群,不包括受最严重COVID-19病例影响的个体。
报告食用植物性饮食或鱼素饮食(包括益生元食品在内的)的人,中度至重度 COVID-19 的几率分别降低了 73% 和 59%。
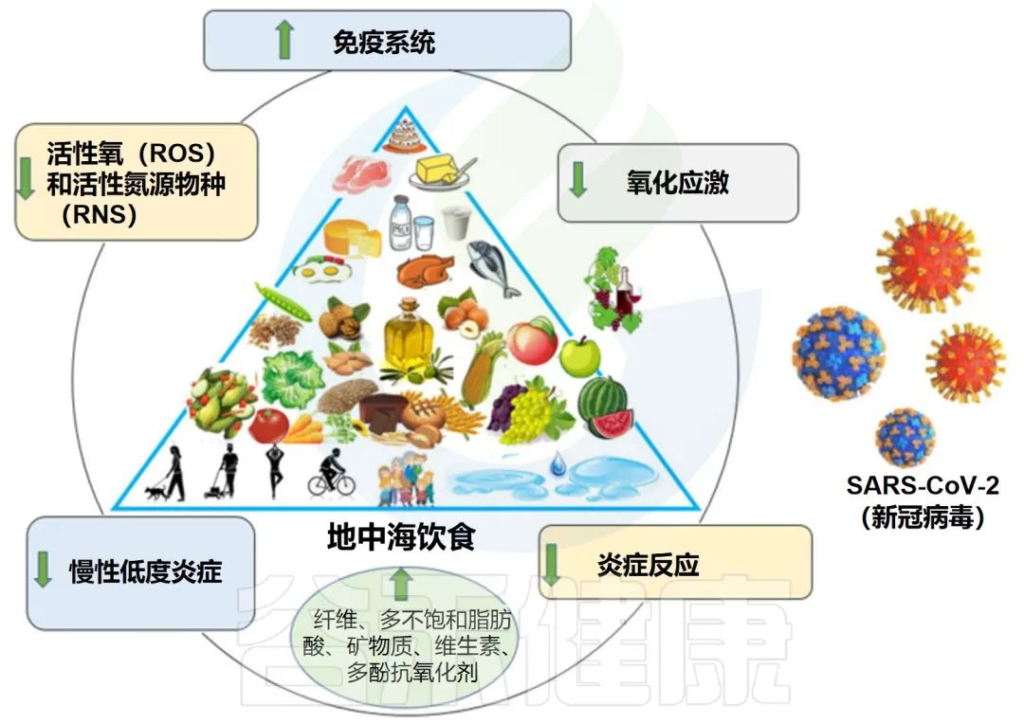
地中海饮食特征:
地中海饮食的依从性高,COVID-19严重程度和症状的可能性降低
一项横断面研究中,对 250 名年龄在 18 至 65 岁之间的 COVID-19 患者进行了检查。结果发现,对地中海饮食的依从性越高,COVID-19严重程度和症状的可能性降低,住院和康复时间缩短,炎症生物标志物也越短。
地中海饮食和COVID-19风险及相关死亡呈负相关
一项仅针对欧洲国家的生态学研究表明,地中海饮食与COVID-19相关死亡之间存在显着的负相关(r2= 0.771, p = 0.030).
一项观察性病例对照研究探讨了不同饮食模式与 COVID-19 事件和结局之间的可能关联。结果显示,病例的地中海饮食评分平均值(p=0.009)低于对照组,表明地中海饮食与COVID-19风险呈负相关。
地中海饮食有益地调节肠道微生物群和免疫系统
地中海饮食富含益生元物质,如半乳聚糖、果聚糖、纤维和菊粉。大量报道表明,这些化合物被宿主微生物使用,支持有利细菌的生长并促进有益代谢物的产生。
膳食纤维是影响复合碳水化合物对炎症影响的重要因素。研究表明,纤维消耗量的增加(约30g/d)与hs-CRP浓度的显着降低有关。膳食纤维摄入的另一个优点是对肠道微生物组组成更有利,可降低肠道和全身炎症。
多酚是地中海饮食中最丰富的次生植物化合物或植物化学物质之一,可能通过抑制NF-κB和AP-1以及激活Nrf2发挥许多抗氧化和抗炎作用。对肠道微生物群具有益生元作用。
地中海饮食:对抗冠状病毒感染的潜在策略
DOI:10.3390/medicina57121389
植物性饮食并不完全等于素食。在少量摄入动物源性食物的基础上,健康植物性饮食更倾向于新鲜蔬菜、坚果等健康的植物源性食物;而不健康的植物性饮食则更倾向于腌制蔬菜、糖等不健康的植物源性食物。
研究报告了植物性饮食是营养丰富的,包括高浓度的多酚,类胡萝卜素,纤维,维生素A,C和E,叶酸,铁,钾和镁。植物性饮食在预防高血压和心血管等疾病方面有益处。素食植物性饮食还可以增强免疫系统,减少炎症和氧化应激,并可能有助于预防慢性肾脏疾病和保持肾功能。
一项流行病学前瞻性队列研究表明,植物性食物与较低的COVID-19严重程度有关。
对来自美国和英国的五十多万参与者进行了一项研究,其中记录了 31815 例 COVID-19 病例。那些食用健康植物性饮食的人患 COVID-19 的风险降低了 10%,COVID-19 的严重程度降低了 40%.
对于年龄较大的COVID-19患者,研究人员发现,非素食饮食与COVID-19严重程度的风险较高有关。
对 2021 年 5 月至 2021 年 8 月期间在一家医疗中心被诊断为 COVID-19 的 509 名患者进行了回顾性评估。患者根据疾病严重程度分为三组。对于 ≥65 岁的患者,COVID-19 症状严重程度与坚持素食有统计学意义且呈负相关(p = 0.013).
水果、蔬菜摄入的重要性
一项针对COVID-19住院患者的横断面研究表明,水果、蔬菜和纤维的摄入量增加与 COVID-19 的严重程度、临床症状、住院和康复持续时间以及炎症标志物的浓度呈负相关。
水果和蔬菜富含纤维,是抗炎和增强免疫力的维生素,矿物质和抗氧化剂的良好来源。
为了确定饮食习惯对全球大流行期间COVID-19风险和严重程度的影响,需要进行进一步的研究。
间歇性禁食是一种潜在的补充疗法,不仅影响慢性病风险,而且有充分证据表明对传染病有影响。
SARS-CoV-2可能诱发肠道微生物群失调,导致致病菌的增殖增强,并导致有害的继发性病原体从肠道进入血流。
没有研究直接评估禁食对SARS-CoV-2感染者微生物组的影响,但由于其他观察结果,禁食塑造微生物组以支持与最佳代谢健康和低肥胖风险相关的物种,因此可以预期在预防不良变化方面产生影响。禁食期间,肠道微生物生长及其副产物(例如三甲胺N-氧化物)的产生受到抑制。
间接性禁食改变了微生物群丰度
间歇性禁食改变了各种微生物的丰度,例如脱硫弧菌科、Hydrogenoanaerobacterium、阿克曼氏菌、瘤胃球菌科等。
一项针对两种间歇性禁食(即限时进食和隔日禁食)的系统评价报道,禁食对微生物组有明显影响,例如改变厚壁菌/拟杆菌的比例,两种方案均增加了代谢保护微生物(如乳杆菌属和 Akkermansia municiphila)的丰度。
周期性禁食患者的死亡、住院和新诊断心力衰竭的风险也较低。特别是,禁食会在禁食期间急剧大幅降低葡萄糖水平,并在长期内降低基础葡萄糖水平,这在两种情况下都会使葡萄糖在感染期间减少使用,因此应该抵消SARS-CoV-2对糖酵解的刺激。
注意:禁食的安全问题包括轻微的潜在副作用,如饥饿、疲劳、头晕、便秘、头痛等,对健康的人是安全的。禁食会降低血糖,并可能导致低血糖。也可能导致脱水。2型糖尿病患者应谨慎禁食。其他安全问题可能包括身体过度紧张和营养缺乏等。
然而不可忽视的是间歇性禁食的一系列机制,使受损的人体免疫系统自我修复。在感染之前开始间歇性禁食方案可能对预防 COVID-19 等疾病的严重后果最有利。
总的来说,整体健康的饮食可能在预防SARS-CoV-2感染和降低感染严重程度方面发挥作用。需要更多的研究来证实这些发现,未来的研究应确定饮食质量与COVID-19感染风险之间关系的生物学机制。
生 活 方 式
注意,这里的运动并不是剧烈运动,特别是爬山、徒步等运动量大的活动更要注意量力而行。仍要加强健康监测。
刚阳康后需要进行一个休息阶段,尤其是老年“阳康”者,建议可循序渐进,先进行低等强度的温和运动,如适当散步、拉伸等。可以配合一些温和的养生方法,例如广播操,太极拳,八段锦等。
⇘⇘
太极拳作为中国传统运动之一,其特点是动作连贯、柔和,既能增强体质,调和身心,又能改善肺功能,避免运动时的呼吸短促。太极拳作为一种慢性病辅助治疗方法,已被临床证实能改善和缓解慢性阻塞性肺病。慢性阻塞性肺病,是一种常见的导致呼吸困难的慢性肺部疾病,被认为是COVID-19患者病情恶化的一个风险因素。
一项Meta分析共纳入11项随机对照实验,共纳入708名慢性阻塞性肺疾病患者。中期(3-6个月)或长期(12个月)太极拳运动对改善肺通气功能有效,且对改善慢性阻塞性肺疾病患者肺通气功能效果而言,干预时间在12个月以上的太极拳运动相较于中期运动更明显。
太极拳的简单易操作更容易让疫情期间老年人群体做出选择,同时也因为负荷量小更能够保证老年人的锻炼需求,从而达到免疫力提升的效果。
⇘⇘
八段锦具有运动强度小、动作幅度舒缓等特征,符合新冠肺炎患者年龄偏大、身体乏力、行动不便的需求,对于预防期新冠肺炎的发生以及预后呼吸功能的回复具有很好的预防和恢复作用。
90名亚健康状态学生为研究对象,随机分为对照组、散步组、八段锦组,30例/组。结果:八段锦组亚健康恢复率为50.00%(15/30),高于对照组的13.33%(4/30)和散步组的30.00%(9/30),差异有统计学意义(P<0.01). 八段锦练习能够显著改善亚健康状态,提高亚健康恢复率,且效果优于日常散步活动。
吸烟被认为与不良疾病预后有关,因为大量证据强调了吸烟对肺部健康的负面影响。吸烟会增加肺部感染的风险和严重程度,因为它会损害上呼吸道并降低肺部免疫功能。
吸烟已被证实是 COVID-19 负面进展的一个危险因素,尤其是在疾病严重程度和死亡方面。
Meta分析纳入 40 项研究,目前吸烟和以前吸烟都会显著增加疾病严重程度的风险(分别为:OR=1.58;95%CI:1.16–2.15,p=0.004;OR=2.48;95%CI:1.64–3.77,p<0.001),表现出中度异质性。
前吸烟者患疾病严重程度的几率是从不吸烟者的 1.58 倍。前吸烟者患疾病严重程度的几率是从不吸烟者的 2.48 倍。
同样,目前吸烟和以前吸烟也会显著增加死亡风险(分别为OR=1.35;95%CI:1.12–1.62,p=0.002;OR=2.58;95%CI:2.15–3.09,p<0.001;),并出现中度异质性。
对于死亡结果,当前和以前吸烟也分别使死亡风险显著增加 1.35 倍和 2.58 倍。
冥想练习调节注意力和情绪,向外关注特定的身体和感官刺激,向内转向精神体验和身体体验的躯体感觉。
由于冥想对包括抑郁症、焦虑症、慢性疼痛和药物滥用在内的精神病理学的特定领域产生积极影响,以及它与注意力障碍、创伤性压力、饮食失调和严重精神疾病的关联,冥想越来越多地被纳入心理健康干预措施。
与当地招募的对照组相比,长期冥想的佛教僧侣的肠道微生物群组成发生了显著变化。在属水平上,普氏菌属和拟杆菌属在冥想组中显着丰富。根据 LEfSe 分析,两个有益细菌属(巨型单胞菌属和粪杆菌属)在冥想组中显着增加。功能预测分析进一步表明,包括聚糖生物合成、新陈代谢和脂多糖生物合成在内的几种途径在冥想组中显着丰富。
这种改变的肠道微生物群组成可以降低焦虑和抑郁的风险,并改善身体的免疫功能。生化标志物概况表明冥想可以降低心身医学中心血管疾病的风险。这些结果表明,长期深度冥想可能对肠道微生物群产生有益影响,使身体保持最佳健康状态。
来自麻省理工学院、加州大学圣地亚哥分校、乔普拉综合研究图书馆和哈佛大学的研究人员探索后认为,某些冥想、瑜伽体式(姿势)和调息(呼吸)练习可能是治疗和/或预防SARS-CoV-2感染的有效辅助手段。
来自 13 个国家的 44 项研究,共 4023 人,时间范围从 20 到 4800 分钟不等。主要研究结果表明,瑜伽、冥想和调息,无论是单独使用还是组合使用,都可以通过调节抗炎和促炎生物标志物来有效提高健康和临床人群的免疫力,可能有效降低 IL-6、皮质醇和 TNF-α 患者的水平。
⇘⇘
晒太阳
时间可以选择在11点-15点,晒5-30分钟,尽量不隔着玻璃,夏季应注意避开紫外线最强的时候。
2022 年 1 月发表在《韩国家庭医学杂志》上的一项研究着眼于气候如何影响 COVID-19。研究人员发现,当涉及较高的湿度、气温和暴露在阳光下时,COVID-19 病例较少。
⇘⇘
卫生措施
阳康后依然有必要进行日常的防护措施,包括出门戴口罩,回家后勤洗手。
衣服上的病毒会传染吗?
2020 年 11 月发表的一项研究发现,虽然活病毒在皮肤上存在长达四天,但在衣服上,病毒存活不到八小时。
美国疾病控制与预防中心指出,COVID-19 主要通过三种方式传播:
受污染的衣服(或其他材料)不被视为主要传播方式。
马里兰州约翰霍普金斯健康安全中心资深学者、传染病专家认为,病毒的生长和存活在很大程度上取决于环境条件——温度和湿度。总的来说,衣服不是 SARS-CoV-2 的“主要传播媒介”。
衣服上的病毒可以被洗掉吗?
莱斯特德蒙福特大学的研究表明,使用洗涤剂在洗衣机中用热水洗衣服可以完全消除病毒。
⇘⇘
保暖
此外,天气寒冷时去户外应注意防寒保暖,天气寒冷时可适当减少外出。
以上是针对饮食、生活方式的调整,是所有调理方式的基石。当然可能还有许多没有列举出来的其他健康的生活方式,可以慢慢探索,找到一种适合自己的健康的生活方式,“病毒”就难以伤害你。
肠道菌群对免疫调节至关重要。针对肠道菌群的干预措施可能对COVID-19患者产生全身性有益作用。
益生菌和益生元是我们饮食中会影响微生物组的两个组成部分。营养状况和饮食在COVID-19中起着至关重要的作用,主要是由于肺和肠道微生物群之间的双向相互作用。
下图描述了人体肠道和肺部之间的相互作用以及益生菌和益生元引发的潜在阳性免疫反应。
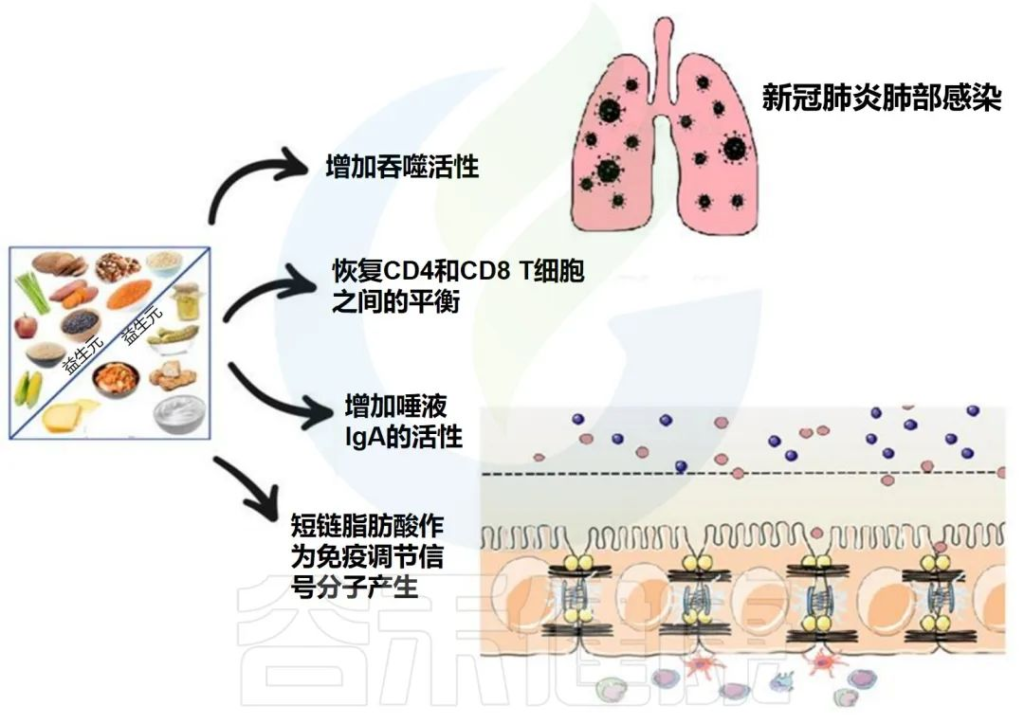
doi.org/10.3390/metabo12100912
益生菌和益生元都可以增强巨噬细胞的吞噬活性,平衡T细胞免疫以有利于更多的调节状态,增加唾液IgA的活性,并通过产生短链脂肪酸作为重要的信号分子,来发挥免疫调节细胞外和细胞内功能。
在临床研究中,使用益生元和益生菌操纵肠道微生物群是治疗肺部疾病的一种有前途的方法。
国家卫生健康委员会和国家中医药管理局指南建议重症COVID-19感染患者在常规治疗的同时食用益生菌,以改善肠道菌群平衡并预防继发细菌感染。
益生菌可能会改变肠道微生物群的组成,并在维持肠道微生物群的生态系统中发挥至关重要的作用。
益生菌通过调节肠道菌群有助于COVID-19治疗
益生菌有利于增强上皮屏障功能和改善肠道微生物多样性。此外,益生菌可对抗和阻断肠道中的有害细菌菌株或增强有益的信号通路。
尽管细菌引起的免疫反应与病毒引起的免疫反应相对不同,但许多临床研究得出结论,益生菌有助于治疗COVID-19。
注:已有超过 25 项注册临床试验旨在调查益生菌给药对 COVID-19 管理的生物学和治疗作用。
在迄今为止发表的有限试验中,关于益生菌给药的主要发现是:症状的更快改善,疲劳减少,并可能解决胃肠道问题。
已发表的研究:服用益生菌对COVID-19及其相关后遗症的影响

编辑
doi: 10.1016/j.clnesp.2022.08.023
益生菌通过调节宿主免疫系统带来益处
除了改善肠道微生物平衡外,最近的证据表明,益生菌还可以通过调节宿主免疫功能对宿主产生有益作用。一些研究报告了益生菌与ACE2相互作用的潜力,ACE2是SARS-COV2 进入宿主的受体。
例如,据报道,几种益生菌(主要是益生菌乳酸菌)在牛奶发酵过程中释放出对ACE2具有高亲和力的肽。同样,益生菌也可能通过ACE2途径改善呼吸道感染。
益生菌还可以提高肺免疫系统中自然杀伤细胞(NK细胞)、I.型干扰素、T和B淋巴细胞以及APC的水平。
注:NK细胞在针对病毒感染的早期免疫反应中起重要作用,主要是通过清除病毒感染。
先前的一项研究表明,益生菌会改变IL-10的表达并降低炎性细胞因子的表达。
益生菌还抑制其他促炎细胞因子,如TNF-a、CRP、IL-1b、IL2、IL-6、IL7、MCP1和LDH等。
益生菌通过细菌素抑制病毒与其受体的结合
除了抗炎作用、免疫调节和调节微生物组的机制外,益生菌还可以通过细菌素抑制 SARS-CoV-2 与其受体的结合。
益生菌植物乳杆菌(LPG)的独特菌株可以通过增强干扰素信号传导和抑制凋亡和炎症途径,在有效阶段和记忆阶段促进SARS-CoV-2特异性免疫反应。
由植物乳杆菌等益生菌分泌的植物素等细菌素参与抑制SARS-CoV-2的进入和复制
doi: 10.1016/j.clnesp.2022.08.023
分子对接研究预测,植物素结构可能通过靶向S蛋白或结合RNA依赖RNA聚合酶(RdRP)来阻碍病毒的进入,从而阻碍基因组的转录。
植物乳杆菌的PlnE和PlnF可以通过在解旋酶的ssRNA或ATP结合位点结合来抑制SARS CoV-2复制。
益生菌并不是治疗COVID-19的灵丹妙药,益生菌的功效和安全性在文献中存在争议,例如在接受Bacillus clausii 治疗的免疫功能低下患者中出现了菌血症等现象。因此,对一个病人有益的配方可能对另一个病人有害。还需要进行更多的研究。
此外,在推断临床试验结果时,重要的是要意识到混淆因素,如不同年龄组,不同免疫系统状态,不同季节,益生菌的成分,剂量,营养状况,正在服用的其他补充剂等。因此,也可能需要根据症状进行调整。
更有针对性的方法,包括肠道菌群检测等措施,以充分了解微生物群的作用及其在饮食和外部应激源之间的相互作用,以对抗SARS-CoV-2感染,可能会带来个性化治疗,以便益生菌能给每个需要的人带来真正益处。
益生元包括多不饱和脂肪酸、抗性淀粉、阿拉伯寡糖、低聚糖、果聚糖、低聚糖、半乳甘露聚糖、车前子、蔗糖乳糖、乳糖酸、多酚等。
大多数益生元是从植物多糖中合成或分离的,是低聚糖,例如:
含有益生元的食物,如纤维、低聚糖和多酚,可以改善细菌的生长。例如,富含菊粉的饮食刺激双歧杆菌和拟杆菌的生长;全麦谷物可以改变细菌谱,增加双歧杆菌和乳酸杆菌的相对数量。
益生元以与益生菌类似的方式调节肠道微生物群,从而抑制病原体并刺激免疫系统。同样,益生元通过直接和间接机制,对免疫系统和宿主的健康产生有益的改变。
益生元为益生菌的生长提供能量
此外,益生元选择性地刺激益生菌的有利生长并增强益生菌的活性。益生元通过增强益生菌的生长和生存能力,对 COVID-19 感染具有潜在作用。益生元也可能通过阻断ACE2对COVID-19引起的胃肠道症状产生潜在影响。
益生元明显降低了促炎IL-6的水平,这似乎是迄今为止描述的COVID-19严重预后的主要原因,并改善了抗炎IL-10的水平。
母乳低聚糖:在COVID-19中的潜在应用
母乳低聚糖在母乳中固体成分的比例排名第三。母乳低聚糖可以发挥多种功能,即抗感染(针对细菌和病毒),信号传导,抗炎/免疫调节和益生元作用。
母乳低聚糖对抗SARS-CoV-2的潜在作用模式
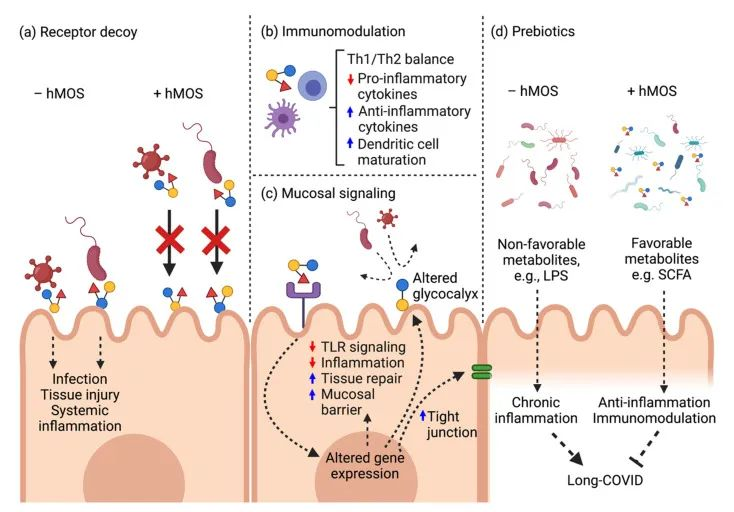
doi: 10.3390/biomedicines10020346
a) 母乳低聚糖分子结构类似于HBGA,并充当受体诱饵以阻止病毒进入。
b) 母乳低聚糖诱导局部防御和免疫调节。
c) 母乳低聚糖减弱TLR4介导的信号通路以维持粘膜稳态。
d) 母乳低聚糖在长新冠中缓解肠道菌群失调并恢复健康的肠道微生物群。
地中海饮食多酚:对 COVID-19 引起的炎症的潜在用途
研究人员发现,地中海饮食中存在的主要酚类化合物作为COVID-19预防/治疗剂的潜在用途,基于其抗氧化和抗炎作用。
目前的证据支持羟基酪醇、白藜芦醇、黄酮醇(如槲皮素)、黄烷醇(如儿茶素)和黄烷酮可能对 COVID-19 产生的潜在益处。
茶多酚:具有抗病毒固体和抗氧化特性,可能有助于降低出现严重COVID-19症状的风险
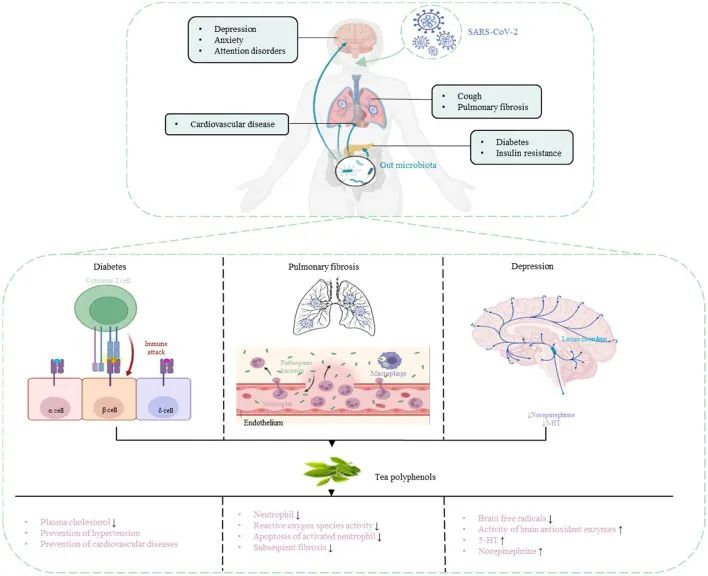
肠肺轴在SARS-CoV-2感染中起着重要作用,因此靶向肠肺轴治疗COVI-19尤为重要。茶多酚被认为是多功能生物活性分子,除了抗菌和调节肠道菌群以增强免疫功能外,还具有抗病毒作用。因此,茶多酚对COVID-19具有潜在的预防和治疗作用。
茶多酚降低 COVID-19 合并症风险

DOI:10.3389/fnut.2022.899842
茶多酚可以促进肠道中有益细菌的生长,并抑制肠道中病原微生物的生长,从而调节肠道菌群的组成。
研究人员研究了茶多酚对回肠损伤和肠道菌群紊乱的治疗和预防作用。结果表明,茶多酚可以减少炎症和氧化应激标志物,提高抗氧化酶和紧密连接蛋白的水平,有效改善肠道菌群失衡,减少对肠粘膜的损害,增强机体免疫力。
使用茶多酚预防和治疗COVID-19并发症
DOI:10.3389/fnut.2022.899842
在一项针对200名医护人员的随机双盲试验中,每天六粒胶囊(包括378毫克儿茶素和270毫克EGCG)持续5个月,在预防流感病毒方面优于安慰剂。
注意:在确定使用茶多酚治疗COVID-19之前,仍然需要大量实验来确认具体的药物给药(绿茶饮料、粉状绿茶提取物、儿茶素混合物、单独儿茶素)、剂量方案(不同剂量、不同治疗持续时间)和给药途径管理(饮食口服、饮料口服)。
针对COVID-19住院患者研究中,接受合生元患者临床症状缓解的比例更高
在一项针对55名COVID-19住院患者的开放标签研究中,与标准治疗组相比,接受双歧杆菌菌株和益生元的合生元配方(SIM01)4周的患者的临床症状得到缓解的比例更高(88%对63.3%),抗SARS-CoV-2的IgG抗体增加,IL-6、CCL2、M-CSF、TNF和IL-1RA等血液促炎标志物减少。
在接受SIM01的个体肠道菌群中,共生菌(如双歧杆菌、真杆菌和粪杆菌)的丰度也有所增加,而机会致病菌(如大肠杆菌和拟杆菌)的丰度则有所下降。
合生元配方 SIM01 可加速针对 SARS-CoV-2 的抗体形成,降低鼻咽病毒载量,减少促炎免疫标志物,并恢复住院 COVID-19 患者的肠道生态失调。
合生元辅助治疗两周可以有效调节针对COVID-19感染的炎症反应
一项随机安慰剂对照试验招募了 78 名确诊 COVID-19 感染的住院患者。干预组和对照组分别每天两次接受合生元或安慰剂胶囊,持续两周。
注:合生元胶囊含有多种菌株益生菌,如鼠李糖乳杆菌 、瑞士乳杆菌、干酪乳杆菌、乳双歧杆菌、嗜酸乳杆菌、短双歧杆菌、保加利亚乳杆菌、长双歧杆菌、植物乳杆菌、双歧双歧杆菌、格氏乳杆菌和嗜热链球菌,以及低聚果糖益生元剂。
结果发现:
后生元:在宿主中具有生物活性的微生物的非活细菌产物或代谢产物。也有研究人员称之为“幽灵益生菌”、“灭活益生菌”、“非活性益生菌”等。
短链脂肪酸、微生物细胞组分、功能蛋白、细胞外多糖(EPS)、细胞裂解物、替胆酸、肽聚糖衍生的多肽和毛状结构等多种代谢产物都算后生元。
后生元对抗 COVID-19 的抗病毒机制可以与以下作用相关联:
(a) 抗病毒抑制代谢物的产生
(b) 改善肠上皮衬里屏障功能
(c) 调节先天性和适应性免疫系统
(d) 对肠脑轴的影响
(e) 缓解继发性真菌感染
各种后生元对肠道屏障完整性的调节
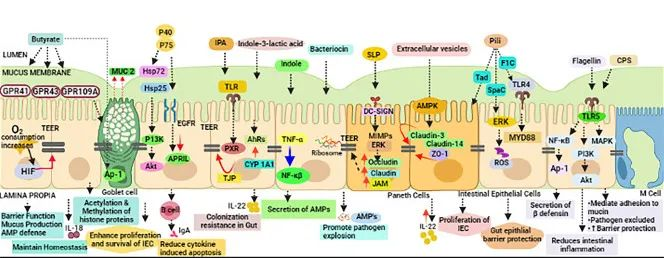
doi: 10.1007/s12602-021-09875-4
人们越来越热衷于利用益生菌,尽管由于宿主微生物组和侵入性病毒之间的固有复杂性和串扰,其详细的作用机制仍在研究中。后生元在降低致命的SARS-CoV-2感染严重程度方面可能比益生菌具有显着优势。
然而从治疗和调节的角度来看,还有一些关键问题需要回答,例如:最适合提取它们的方法,它们在宿主内的有效传递方法,它们的稳定性和保质期,后生元商业化的生物处理策略等。
未来,根据病原体变异的流行情况,将后生元用作个性化疗法或许是一种可行的选择。基于后生元在增强或调节个体免疫力方面的作用,也可以探索降低对其他病毒感染的易感性或严重程度。
在粪菌移植中,来自健康供体的体外培养或粪便物质纯化的粪便或复杂微生物群落被接种到患者的肠道中。粪菌移植已证明对结肠炎、糖尿病和复发性艰难梭菌感染有效。
11名COVID-19患者中有5名报告胃肠道症状有所改善,血液免疫标志物和肠道微生物群组成有良好的改善,双歧杆菌和粪杆菌的丰度增加。
在两名合并复发性艰难梭菌感染的 COVID-19 患者中,FMT 治疗似乎是安全的,并且 COVID-19 相关呼吸道症状在 FMT 后 1 个月内迅速消退。
一项注册临床试验(ClinicalTrials.gov 标识符号 NCT04824222),试图验证粪菌移植作为免疫调节风险降低剂,在与细胞因子风暴和炎症升级相关的COVID-19疾病进展中的功效。
对照组接受标准的药物治疗,而实验组也接受口服FMT,剂量为30–50,双层,耐胃酸,肠溶性冷冻60-g胶囊。
➳ 主要的结果指标是:
给药后第30天安全试验组的不良事件发生率。
➳ 另一个结果指标是:
研究组和对照组中需要升级无创氧疗方式的患者百分比
如增加FiO2、给予高流量鼻插管氧治疗(HFNOT)、持续气道正压(CPAP)或有创通气、呼吸机和/或ICU住院治疗,对应于新冠肺炎表现状态量表中5-7级疾病恶化。
这个试验仍在进行中。然而,考虑到肠道微生物群在免疫调节中的重要作用,研究人员认为FMT是抑制新冠肺炎诱导的细胞因子风暴和炎症的一种可能的治疗选择。
益生菌、益生元和FMT旨在增加有益细菌的丰度,而抗生素则用于抑制有害微生物群的丰度。世卫组织建议,患有可能患有严重急性呼吸道感染(SARI)和败血症的COVID-19患者可能需要广谱抗生素,这可以覆盖尽可能多的致病菌。
密歇根州38家医院新冠肺炎患者的随机数据显示,至少50%的患者接受了早期经验性抗生素治疗。抗生素在危重症患者中的应用也占很大比例,并在抑制患者继发感染方面发挥关键作用。
然而,抗生素治疗可以不加区别地消除正常的共生微生物群,同时消除病原体,导致肠道菌群失调。
与健康对照组相比,新冠肺炎患者的抗生素治疗对肠道微生物群有显著影响,有益于宿主免疫的共生菌较少,包括粪杆菌、粪球菌和直肠真杆菌,而铜绿假单胞菌和分枝杆菌,这已被证实与新冠肺炎的严重程度增加呈正相关。
特别是在疫情期间,抗生素的使用面临巨大挑战。
在早期大流行中,抗生素被普遍使用。一项荟萃分析估计,全球四分之三的新冠肺炎患者曾服用过抗生素,这一比例明显高于新冠肺炎中细菌合并感染的估计发生率,后者仅为8.6%。
45名中度新冠肺炎患者的临床结果显示,服用和未服用抗生素的患者之间没有差异,这表明抗生素对改善新冠肺炎的临床结局并无益处。
据报道,在住院期间接受抗生素治疗的新冠肺炎患者出现明显的肠道失调,抗生素诱导的肠道失调损害了人类对季节性流感疫苗的免疫反应。
一项对200名新冠肺炎患者的纵向研究表明,新冠肺炎爆发前一年抗生素摄入量的减少与疾病严重程度的减轻和SARS-CoV-2的快速清除有关。
因此,抗菌药物管理对于预防抗生素诱导的失调、严重的新冠肺炎和新冠肺炎患者的抗菌药物耐药性风险至关重要。抗菌治疗必须有明确严格的适应症,应谨慎选择病原学检测后敏感的抗生素,并根据患者的具体情况适当调整用药时间。
➤ 多 酚
多酚是源自植物的酚类化合物,富含抗氧化和抗炎特性。膳食多酚大致分为四类,包括酚酸、木脂素、二苯乙烯和类黄酮。
有大量证据强调了多酚对肠道的益生元作用。这可能有助于纠正据报道由SARS-CoV-2感染引发的肠道微生物群的生态失调。
——槲皮素
槲皮素被认为有助于预防严重的COVID-19症状,因为它具有已知的抗炎、抗氧化和免疫调节特性。分子对接和体外研究通过多种机制揭示了强大的抗病毒潜力,包括阻止与ACE2受体的附着和阻断病毒复制。
槲皮素的临床试验结果很有希望。在一项随机、开放标签试验中,研究人员测试了用向日葵磷脂配制的槲皮素提高吸收的有效性。
与标准护理相比,槲皮素组的住院风险降低了68.2%,住院时间缩短了76.8%,对氧气治疗的需求减少了93.3%。此外,槲皮素组没有患者入住ICU或死亡,对照组分别有10.5%和3.9%的患者入住ICU或死亡。同一组的进一步随访研究证实,槲皮素显著改善了病毒清除率,缩短了症状时间,改善了炎症标志物,与对照组的19%相比,槲皮素组的57%在7天后完全康复。
最近的一项小型研究证实了这些结果。槲皮素组的炎症标志物和住院时间显著减少。此外,槲皮素组入住ICU的患者数量减少,ICU天数减少,无死亡,而对照组有3例死亡。在所有情况下,这些结果都接近显著性,但很可能由于样本量小而没有统计学意义。
虽然缺乏大型临床试验,存在局限性,上述研究仍显示了症状减轻、进展至严重疾病和死亡率方面的益处。鉴于槲皮素在短期服用时具有良好的安全性,以及其广泛的可用性和众多其他健康益处,可以与患者讨论使用。
槲皮素可以从几种水果和蔬菜中获得,如浆果、芦笋,红叶生菜、洋葱、苹果、莳萝、萝卜、刺山柑、香菜、银杏叶、葡萄、葱、西红柿、西兰花、青椒、豌豆等。也可以从含有槲皮素或其一些合成衍生物的补充片剂中补充。
——姜黄素
姜黄素是姜黄中存在的生物活性化合物,具有多机制作用模式。
它可以抑制病毒进入细胞,包裹病毒和病毒蛋白酶。它调节各种信号通路。
姜黄素可能在治疗 COVID-19 感染中发挥有益作用,因为它能够调节负责 SARS-CoV-2 在许多器官(如肾脏、肝脏和心血管系统)中的附着和内化的各种靶点。它还可以抑制COVID-19感染时触发的纤维化相关通路和肺水肿。
研究表明,口服姜黄素可降低死亡率、恢复时间、对氧气的需求、机械通气、住院时间以及存在几种炎症标志物。
在三项安慰剂对照试验中,每天服用160 mg纳米姜黄素或1050 mg姜黄素和胡椒碱的患者的死亡率分别降低了80%、50%和82%。最近的一项荟萃分析表明,姜黄素治疗患者的死亡率总体降低了77%.
六项临床试验中,有五项也发现轻度、中度和重度新冠肺炎患者的症状持续时间显著缩短。
虽然还需要进行更大规模的试验,但现有数据表明姜黄素对降低新冠肺炎的严重程度非常有效。
鉴于几乎所有先前的临床试验都表明姜黄素补充剂是安全且耐受性良好的,即使剂量高达8000 mg/d,建议在症状出现时或首次阳性试验时每天服用1000 mg 较为合适。
虽然补充剂是达到试验中同等剂量的最佳方法,但用于烹饪的姜黄粉含有约3%的姜黄素。因此,一茶匙(5克)的姜黄粉含有大约150毫克。虽然姜黄素的低生物利用度一直存在问题,但胡椒碱(一种存在于黑胡椒中的化合物)已被证明可将生物利用度提高20倍,因此想要提高饮食中姜黄素摄入量的做法,可以在加姜黄粉的同时加入黑胡椒。
——白藜芦醇
白藜芦醇是一种多酚,白藜芦醇可能与SARS-CoV-2相互作用,至少部分是通过触发Nrf2,而Nrf2作为宿主防御机制对某些呼吸道病毒疾病(如呼吸道合胞病毒病)具有重要的调节作用。
白藜芦醇可以降低氧化应激,通过谷胱甘肽过氧化物酶的调节。这增强了谷胱甘肽的产生,并抵消了氧化应激介导的组织损伤。
白藜芦醇通过抗氧化和抗炎机制对SARS-CoV-2诱导的损害的主要潜在保护作用
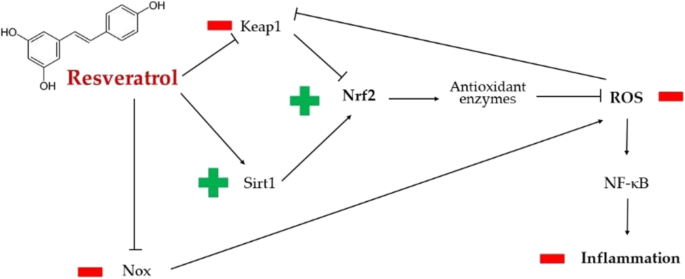
doi: 10.1007/s13105-022-00926-0.
白藜芦醇通过eIF2α和NADPH氧化酶途径降低氧化应激水平。
高血压和动脉粥样硬化是新冠病毒感染的两个危险因素。在这方面,白藜芦醇调节SIRT1和Nrf2通路的能力,以及ROS的产生,导致更大的一氧化氮(NO)生物利用度。因此,白藜芦醇介导的NO增加很可能是多酚的血管扩张剂和抗血小板作用的基础,这反过来又可以减轻许多患者的COVID-19严重程度。
白藜芦醇在内皮细胞中积累,由于其潜在的抗血栓作用,能够保护内皮屏障。
由于其抗氧化活性,白藜芦醇可以减轻与ROS介导的氧化应激相关的炎症反应。较低的ROS水平导致NF-κB和细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)的抑制。
对随机临床试验的各种荟萃分析强调了白藜芦醇的抗炎作用,这可能有助于缓解新冠肺炎特有的所谓“炎症形式”。
项研究利用网络药理学方法和生物信息学基因分析探讨了白藜芦醇对新冠肺炎患者作用的潜在机制。该研究表明,白藜芦醇可以通过抑制IL-17、TNF和NF-κB信号通路来减轻SARS-CoV-2产生的过度炎症。
白藜芦醇,自然存在于不同的食物来源中,浓度较低,典型的地中海饮食,包括葡萄、红酒、浆果和坚果。
关于白藜芦醇与肠道菌群的关联详见:
——羟基酪醇
羟基酪醇,存在于橄榄中,在橄榄成熟过程中由于橄榄苦苷水解而增加。它是从橄榄叶和果实中提取出来的,在特级初榨橄榄油中含量尤其丰富。
注:橄榄油是地中海饮食中最具特色的食物之一。
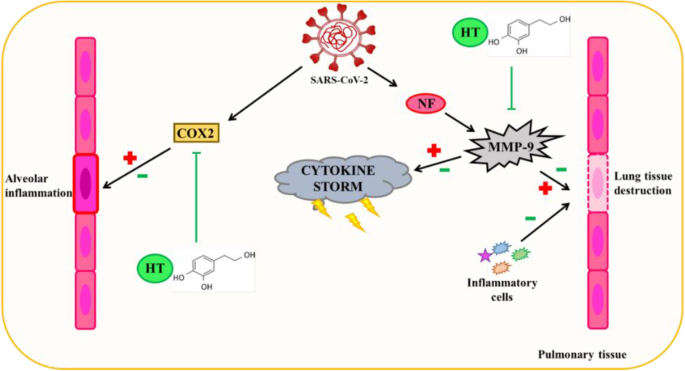
羟基酪醇的抗病毒能力是众所周知的,部分原因是其抗炎作用。不同的研究表明,这种酚类化合物抑制MMP-9和COX-2酶的活性。
MMP-9循环水平升高被认为是COVID-19患者呼吸衰竭的早期指标。在急性肺损伤(例如COVID-19中发生的肺损伤)中,MMP-9从中性粒细胞中释放出来,从而产生炎症和肺泡毛细血管屏障的退化,进而促进炎症细胞的迁移,导致肺组织的进一步破坏。
羟基酪醇诱导的MMP-9抑制可以通过该途径减轻和/或部分预防COVID-19产生的肺损伤。
羟基酪醇通过抗炎机制对 SARS-CoV-2 诱导的肺泡组织损伤的潜在保护作用
doi: 10.1007/s13105-022-00926-0.
➤ 类胡萝卜素
类胡萝卜素是四萜类。它们包括由植物、藻类和细菌产生的橙色、红色和黄色有机色素。一些常见的类胡萝卜素是α-和β-胡萝卜素、叶黄素、玉米黄质和番茄红素。类胡萝卜素以其抗氧化特性和抑制ROS而闻名。
因此,低水平的类胡萝卜素与氧化应激有关。叶黄素、胡萝卜素和玉米黄质的抗病毒作用已被报道。
一些类胡萝卜素可作为维生素A的前体,与免疫调节功能直接相关。据报道,类胡萝卜素可缓解COVID-19感染期间导致肺损伤的炎症反应。
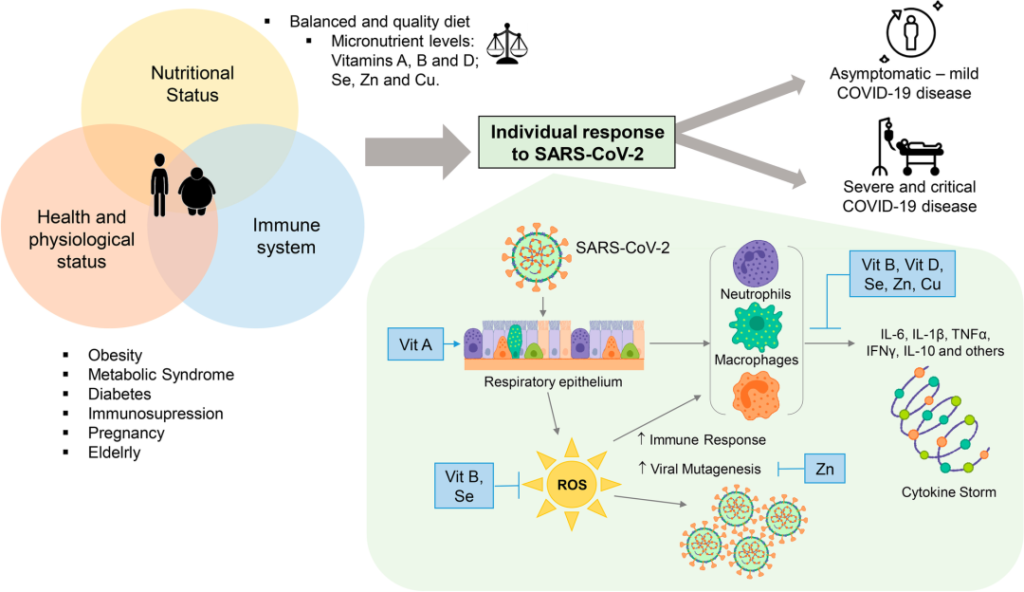
当通过饮食提供必要的微量营养素(如维生素 A、B 和 D)以及硒、锌和铜等必要质量和数量时,可以达到最佳健康状况。
随着新冠的持续,很明显,最容易感染的人是那些失去生理营养状况和免疫系统平衡的人。这种不平衡使SARS-CoV-2病毒得以发展并导致疾病的不同临床形式(无症状,轻度,中度和重度)。
SARS-CoV-2感染中个体反应的微量营养素调节
DOI:10.1007/s12011-022-03290-8
维生素A缺乏导致第一道防御屏障缺乏先天免疫的重要成分,从而增强了病毒的反应。
维生素B和硒在感染期间抵抗氧化应激的免疫和抗氧化反应中发挥作用。维生素B、D、硒、锌和铜以非常重要的方式参与,促进抑制促炎细胞因子的合成,促炎细胞素引发细胞因子风暴,从而通过抑制Th1反应和促进Th2细胞产生细胞因子来调节适应性免疫应答。
锌本身参与细胞信号转导,因此参与细胞和病毒基因表达模式,从而避免病毒突变。
➤ 维 生 素 A
维生素A,一种脂溶性维生素。是身体许多部位正常生长和功能所必需的,包括眼睛、皮肤和免疫系统。
维生素A或视黄酸在全身水平上作为一种激素,并通过核视黄酸受体(RAR和RXR)信号调节免疫系统中的I型干扰素(IFN)合成。此外,它还通过维甲酸诱导基因I(RIG-I)信号通路负责对病毒感染的永久性免疫系统反应。另外调节NF-kB的活化。
德国进行的一项多中心、观察性、横断面、前瞻性分析调查中,研究人员发现维生素A缺乏与ARDS的发展和死亡率之间存在很强的关联(OR 5.21 [1.06–25.5],p = 0.042)。
注:ARDS,呼吸窘迫综合征
该研究纳入了40名SARS-CoV-2感染住院患者,并被诊断为中度、重度和危重度ARDS。对照组由47例症状较轻且不需要住院治疗的康复患者组成,结果显示,随着ARDS严重程度的增加,维生素A缺乏症更高,康复组的维生素A缺乏症明显降低(p <0.01至p <0.001)。
最近一项针对155名老年患者(18-95岁)的研究显示,36.5%的患者缺乏维生素A (< 0.343 mg/L); 作者认为,COVID-19疾病患者耗尽了血清维生素A储存。
免疫反应机制从先天转变为适应性,阻止了维甲酸的使用,这表明炎症平衡了COVID-19严重程度和维生素A水平之间的关系。
维生素A缺乏会降低影响上皮机械屏障功能的先天免疫应答,并增强呼吸道和肠道感染。这些上皮中的粘蛋白产生受视黄酸调节;因此,中等剂量维生素A补充剂通过调节上皮生长因子和相关细胞因子的基因表达来改善屏障完整性。
食物来源:肝脏,鱼类,鸡蛋,乳制品等,还包括橙黄色蔬菜、绿叶蔬菜、西红柿、水果等。
注意:维生素 A 补充剂可能与某些类型的避孕、抗癌药物、痤疮治疗和血液稀释剂相互作用,服用任何这些类型药物的人在服用维生素A补充剂之前应咨询医生。
➤ B 族 维 生 素
B族维生素是多种细胞反应的辅助因子,介导氨基酸的合成。包括维生素 B1、B2、B3、B5、B6、B7、B9、B12等,对免疫系统对抗感染反应至关重要。
B族维生素在激活先天性和适应性免疫应答中起关键作用,下调促炎细胞因子和炎症的产生,并显著改善呼吸功能。B族维生素还可以减少胃肠道问题,预防高凝状态,并缩短COVID-19患者的住院时间。
一项研究的311名法国受试者中,与7455名健康受试者相比,SARS-CoV-2阳性患者的维生素B9摄入量较低(OR = 0.84 (0.72,0.98),p = 0.02)。
在以色列,162例诊断为重症COVID-19的患者叶酸水平低于中轻度病例(分别为9.6ng/mL vs 12.9ng/mL vs 18.2ng/mL,p=0.005),其中12%为免疫抑制,9%需要无创氧合,15%为插管。
一组来自新加坡的患者纳入了43例50岁以上的COVID-19患者,发现联合补充维生素B12、维生素D和镁入院后与疾病严重程度的降低有关。在补充的患者中,与未接受这些微量营养素补充剂的患者相比,对氧疗的需求减少(17.6 vs 61.5%,p = 0.006)和重症监护需求减少有关。
——维生素B12
维生素B12对DNA合成和调节至关重要。转钴胺素发挥其抗氧化机制,促进还原性谷胱甘肽在细胞质中的生物利用度,从而促进氧化性谷胱甘肽的合成。钴胺素由肠道微生物群产生,有助于调节肠-脑轴,防止肠道生态失调,并有利于产生适当比例的微生物代谢物。这些过程对DNA合成、细胞稳态、造血和免疫至关重要。
在生理条件下,VB12调节抗炎细胞因子和生长因子的表达,减轻全身炎症。此外,通过促进NK细胞和CD8 + T细胞的增加,提高免疫反应,调节抗病毒反应。
当维生素B12缺乏时,感染的风险更大,严重程度也会增加。
一些因素如年龄和某些药物的使用与维生素B12缺乏的风险较高有关。在老年人中,内因子(intrinsic factor)的产生减少导致B12吸收不良、营养不良或尿和肠损失增加。
二甲双胍作为2型糖尿病的治疗也与VB12吸收不良引发的缺乏有关。因此,这可能会使这些患者更容易受到感染。
➤ 维 生 素 C
维生素C在免疫功能和伤口愈合中很重要,并具有抗氧化,抗病毒和抗炎的特性。维生素C已被证明可以增加中性粒细胞向感染部位的迁移,引发活性氧(ROS)和吞噬作用的产生。
据报道,饮食中的抗坏血酸可以降低c反应蛋白的浓度。维生素C被认为通过增加干扰素蛋白的产生而表现出抗病毒活性。
维生素C被认为是严重疾病的潜在治疗方法,也是降低感染风险的预防措施,因为它能够调节免疫细胞活性并减少炎症。
小规模研究显示,在对ICU入院后24小时内循环维生素C水平的分析中发现,高达82%的COVID-19患者缺乏维生素C,许多患者的维生素C水平仅为0.1mg/dL(正常值为0.4-2mg/dL),18%的维生素C水平检测不到(低于0.1mg/dL)。
在 50 例 COVID 病例中进行了一项临床试验,其中给予了高剂量维生素C 静脉干预,结果显示 COVID 患者的氧合指数发生了积极变化。
有研究表明,高剂量(8000mg/d)口服维生素补充剂可使COVID-19恢复率提高70%.
仍需要进一步的临床试验来充分描述维生素 C 对 COVID-19 感染的影响。
维生素 C 静脉注射被 FDA 归类为药物,只有口服剂量才能被评估并用作膳食补充剂,儿童(取决于年龄)每天 400 至 1800 毫克,成人每天 2000 毫克被认为是安全的。
富含维生素C的食物包括:猕猴桃,橙子,辣椒,草莓,樱桃,苹果,西兰花,菠菜,青椒,甜菜,花椰菜等。
➤ 维 生 素 D
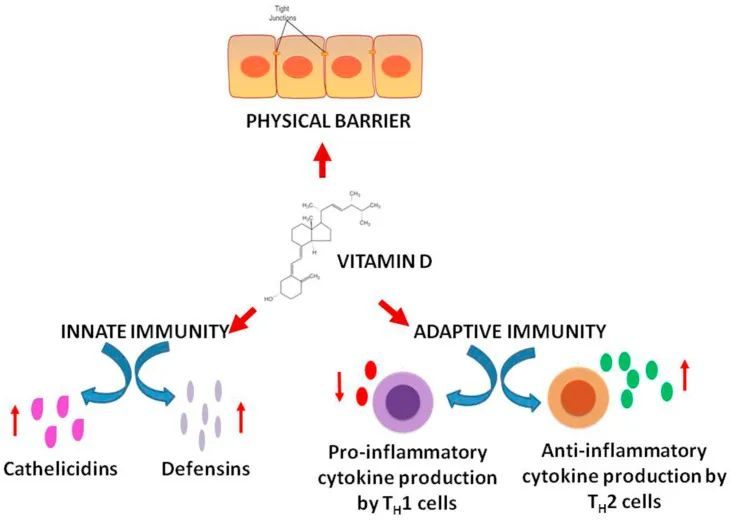
除了对钙的吸收和骨骼强度的强大影响外,维生素D对于维持免疫力至关重要。它还减慢病毒复制,降低炎症活动,并增加体内 T 调节细胞的数量。
维生素 D 还可以缓解传染病、感染性休克和 ARDS 疾病(由于维生素 D 水平低)等并发症,这可能有助于预防新型冠状病毒作为辅助补充剂。
维生素D通过中性粒细胞和巨噬细胞合成组织蛋白酶和防御素来提高先天免疫力。这些作用控制病毒复制,并下调肿瘤坏死因子TNFα和IFN-γ的表达。
维生素D在增强免疫力中的作用
DOI:10.1016/j.clnesp.2022.04.007
低水平的维生素D(<20 ng/mL)与慢性疾病的发展和进展有关,如心血管疾病、2型糖尿病、癌症和抑郁症,也与骨骼健康不良有关。一些研究认为,维生素 D 水平低的人更容易患上 COVID-19 并患有更严重的疾病。维生素 D 缺乏会导致宿主体内的 SARS-CoV-2 病毒存活和复制。
与维生素D充足(感染率8.1%)或最高(感染率5.9%)的患者相比,缺乏维生素D的患者更有可能感染COVID-19(感染率12.5%)。
一项研究比较了中国335名COVID-19患者和560名健康志愿者的血液25(OH)D水平,发现COVID-19患者的25(OH)D浓度(中位数为26.5 nmol·L−1 [10.6 ng·mL−1])明显低于健康志愿者(中位数为32.5 nmol·L−1 [13 ng·mL−1])。
维生素D不足[具体定义为血清25(OH) D低于30 nmol·L−1 (12 ng·mL−1)]在COVID-19患者中比健康志愿者更常见。
与轻度COVID-19相比,重度COVID-19症状与最显著的维生素D缺乏相关。
土耳其的95名住院COVID-19患者,向他们补充了25-羟基维生素D,显示纤维蛋白原浓度降低,补充维生素D减少了住院时间,即使存在合并症。
在对13项研究的荟萃分析中,Pal等人计算出补充维生素D的人患严重疾病的风险降低了73%。在COVID-19发病后进行补充的研究中,风险降低最为显著(降低88%,OR 0.12)。
对SARS-CoV-2感染确诊病例的回顾性分析表明,维生素D水平低与较高的死亡风险显着相关,特别是在既往患病的老年人和男性个体中。
补充维生素D可以帮助25(OH) D水平低于25 nmol·L−1 (10 ng·mL−1) 的患者避免呼吸道感染。
补充维生素D,可以通过多晒太阳;饮食补充富含脂肪的鱼类如鲑鱼,鳟鱼,鲫鱼,金枪鱼,鳗鱼等,其他包括蘑菇,肝脏,蛋黄,新鲜水果蔬菜等。
注:冬季日照不够的情况可以通过维生素D补充剂,推荐最低剂量是每日400IU.
➤ 维 生 素 E
维生素E是一种脂溶性维生素,包括生育酚和生育三烯酚。是一种有效的抗氧化剂。可以影响免疫系统细胞,因为它具有抗氧化活性、蛋白激酶C(PKC)抑制和通过酶调节的信号转导。
在巨噬细胞中,维生素E修饰环氧化酶活性,从而控制过氧亚硝酸盐的合成。这导致前列腺素E2的产生降低,T细胞介导的T淋巴细胞反应上调。此外,它通过一氧化氮调节提高自然杀伤(NK)细胞活性。
与健康对照组相比,COVID-19患者的维生素E水平较低。
补充维生素E既往已被证明可增加免疫活性,特别是T细胞增殖,改善老年患者对疫苗接种的反应,并将老年肺炎患者的再住院风险降低63%.
维生素E来源:如小麦胚芽、葵花籽、杏仁、榛子、松子、鳄梨和甜红辣椒等。
扩展阅读:
➤ 铁
先天免疫反应精心控制铁代谢。铁稳态的破坏与感染,癌症,心血管疾病,肾脏疾病和血液疾病密切相关。
铁在病毒感染中也起着重要作用。在病毒复制过程中,需要ATP,而ATP合成需要铁。此外,铁调节素铁调素的表达增加几种细胞因子(例如,IL-6、IL-1),已知铁调素水平升高与血浆铁水平低有关(一种基于铁剥夺入侵病原体的非特异性宿主防御机制)。
注:铁调素通过结合和介导铁转运蛋白的降解来发挥其作用,铁转运蛋白是唯一已知的细胞铁输出剂,存在于肠细胞和巨噬细胞的细胞膜中,从而防止铁从这些细胞外排到血浆中。
铁缺乏在预测从轻度到重度疾病的转变方面很有价值,低血清铁水平是COVID-19患者死亡的独立危险因素。
汇总研究结果显示,COVID-19患者、严重程度状态和非幸存者的铁水平分别明显低于对照组、非严重程度状态和幸存者。
最近的研究中,与对照组(1.87±0.66mg/L)相比,COVID-19患者的血清铁(重症患者为1.33±0.7mg/L)显著降低。
此外,铁稳态的紊乱可在疾病发作后持续数月,并与肺部病变未消退和体能受损密切相关。
细胞内铁水平的升高和降低都是危险信号,分别通过NF-κB和HIF-1激活炎症和抗菌途径。
与中度病例相比,重症病例的血红蛋白、红细胞计数较低,铁蛋白水平较高,而非幸存者的铁蛋白水平高于幸存者。
铁过量也被认为是COVID-19发病机制的一个因素,因为它在活性氧的产生中发挥了作用,但更重要的可能是由于诱导非凋亡细胞死亡的铁死亡。
富含铁的食物包括:肝脏、动物血、红肉、扇贝、干、木耳、紫菜、菠菜、海带、黑芝麻、李子、桃、杏、苹果等。
扩展阅读
➤ 锌
锌是最普遍和最重要的微量元素,它参与细胞代谢的许多方面和近 100 种酶的催化活性。
它刺激适应性和固有免疫力,以及有助于维持呼吸上皮等组织屏障的抗病毒和抗炎特性。初步证据表明,ACE-2表达受Sirtuin 1(SIRT1)调节。由于锌能够下调SIRT1活性,这可能导致ACE-2表达降低,并减少SARS-CoV 2 进入细胞。
锌缺乏会阻碍淋巴细胞的产生、刺激和成熟,导致免疫功能下降。它还影响免疫介质,抑制 T 细胞、白细胞介素-2 合成以及抑制自然杀伤和细胞毒性 T 细胞活性。此外,它的缺失与更多的促炎介质有关,这可能会增加对疾病和炎症性疾病的易感性,尤其是那些影响肺部的疾病和炎症性疾病。
补充锌可能减轻COVID-19症状,因为这种金属抑制细胞内SARS-CoV 2复制的pH依赖性步骤,增加细胞内小泡的pH.
COVID-19典型的细胞因子过度产生(即“细胞因子风暴”),能够影响多个器官,似乎与短暂缺锌显著相关。
在2020年报告的一项研究显示,COVID-19患者的高剂量锌盐(每天<200毫克)改善了治疗后24小时的氧合并减少了发烧。尽管评估的病例数量很少,但这项工作确定了锌在SARS-CoV-2病毒控制和COVID-19并发症中可能产生的有益作用。
一项横断面对照研究报道,血清锌水平相对于疾病严重程度下降(中位数56.61μg/dL,n=200),重度COVID-19患者的降幅最大。
锌的典型每日剂量为15-30毫克锭剂,直接保护上呼吸道。补锌前检测确定锌水平至关重要。
➤ 硒
硒(Se)具有广泛的作用,如抗氧化和抗炎。硒在病毒感染中的氧化还原信号传导、氧化还原稳态和抗氧化防御中具有重要作用。
硒在保护呼吸系统,特别是抵御病毒感染方面发挥着重要作用。大量证据表明,硒缺乏与RNA病毒感染的易感性和不良结局有关。
硒与辅酶Q10联合使用可降低非特异性炎症反应和心血管疾病的死亡率。当与乙酰半胱氨酸一起服用时,硒有助于实现细胞内GSH(还原型谷胱甘肽)的正常水平,这是GPX(谷胱甘肽过氧化物酶是最强的抗氧化硒酶之一)的最佳水平的原因。GPX模拟依布硒(ebselen,一种合成硒化合物)是主要SARS-CoV-2蛋白酶的强抑制剂。
硒在正常免疫系统功能中的作用与其抗氧化特性和增加白细胞介素IL-2产生的能力有关,白细胞介介素IL-2具有免疫调节特性;例如,它根据当前需求刺激或抑制免疫反应。
适当剂量的硒对SARS-Cov-2感染患者的免疫系统的有益作用很重要,因为它调节IL-6的分泌,IL-6在疾病的病理生理学中起关键作用。硒的剂量建议为每天100至200µg。
➤ 铜
铜(Cu)是一种必需的微量元素,具有两种主要的生物学功能,第一种是酶的结构/催化辅因子,第二种是关键转录因子的辅激活因子。
铜转运基因参与巨噬细胞介导的宿主防御,其缺乏会降低IL-2和T细胞的增殖,并降低循环中性粒细胞的数量及其产生超氧阴离子的能力。在病毒感染和ROS启动氧化反应时,铜下调NF-κB表达,导致炎症细胞因子、趋化因子和粘附分子受到抑制。
一项对铜消费的荟萃分析显示,中国儿童反复呼吸道感染的发生与免疫功能、遗传因素和营养状况有关。在这项研究的结果中,锌和铜缺乏可能是儿童易患呼吸道感染的因素。

编辑
DOI:10.1007/s12011-022-03290-8
微量元素锌和铜之间存在拮抗作用和竞争吸收关系。当锌摄入量长期超标时,会导致铜缺乏,反之亦然。
自行服用锌补充剂的COVID-19患者,极有可能缺铜。作为一种必需的微量元素,铜是维持生物机制和细胞稳态所必需的;因此,有必要注意保持平衡。
关于微量元素的补充,应考虑锌与其他微量金属和维生素的相互作用。锌、铜、铁的吸收和生物利用度取决于元素之间的竞争,当以等比例给予时,铁和铜的吸收约减少40%。因此,过量补充锌可能导致铜或铁不足。
从目前的角度来看,除临床试验外,COVID-19中的维生素和微量元素补充剂不应超过一般人群和年龄组的推荐剂量。
药用植物,作为抗病毒、抗感染、抗炎、抗氧化、退热和肺肠道免疫增强剂,已被用于治疗与新冠肺炎相关的症状。
药用植物,在免疫刺激和维持平衡肠道微生物组中具有支持作用,可能是管理COVID-19的有效策略。
doi: 10.1186/s43088-022-00277-1.
➦ 吉 洛 伊 (Giloy,Guduchi)
由于其免疫调节特性,粉末状吉洛伊植物在前病毒期和后病毒期被彻底使用。此外,吉洛伊植物也可用作抗氧化剂,因此可以降低体内的整体氧化应激。这进一步防止了体内重要生物分子的氧化分解。
在慢性新冠肺炎感染期间,吉洛伊表现出抗炎作用,这在冠状病毒诱导的肺炎和肺部炎症中有很大的作用。血液中的氧饱和度低于正常范围,导致缺氧、疲劳,甚至死亡。
临床试验评估其对新冠肺炎确诊的无症状至轻度症状患者的疗效。91名年龄在18岁至75岁之间的患者,其中11.7%的对照组在平均1.8天后出现轻微症状,试验组没有任何其他症状。研究人员从研究中建议,Guduchi Ghan Vati可以作为无症状新冠肺炎患者的预防和治疗药物(NCT04480398)。
➦ 甘 草 (Mulethi)
由豆科甘草的根和细根组成,其活性化学成分是甘草酸。甘草是一种阿育吠陀药,以其外围和中枢作用的抗咳特性而闻名。
研究表明,甘草酸苷具有止咳作用,可以抑制咳嗽和相关的呼吸短促;也就是新冠肺炎感染的主要症状。它已被证明可以阻止被SARS感染的细胞释放HMGB1核蛋白(高运动性基盒蛋白1)。这使巨噬细胞失效,巨噬细胞在激活免疫中发挥积极作用,并负责产生促炎细胞因子。因此,避免了“细胞因子风暴”的开始及其对健康的不利影响。
在伊朗进行了一项单中心、开放标签、随机、平行组临床试验,以评估甘草对60名年龄≥18岁(体重≥35 kg)的新冠肺炎患者的抗炎作用(IRCT20200506047323N2)。
➦ 茯 苓 (Poria cocos)
其活性成分为茯苓酸。蛋白酶负责生物在宿主细胞中的复制。在冠状病毒中发现的一种蛋白酶是Mpro酶。Mpro是SARS-CoV-2的关键酶,参与介导病毒复制和转录。茯苓的主要活性成分茯苓酸与Mpro酶结合并抑制,从而阻止生物体在宿主细胞中的进一步复制和生长。
在COVID-19重症病例中,很少患者可能出现肺炎并发症,65岁或以上人群的并发症甚至更高。在这种情况下,茯苓酸的抗炎特性可以被解释为提供缓解。在一项研究中,用茯苓酸治疗肺炎大鼠肺部,结果显示通过NF-κB通路抑制炎症因子的表达。
➦ 蒙古紫云英(Mongolian milkvetch)
它由豆科黄芪的根、茎和叶组成。活性植物化学物质为黄芪甲苷、熊竹素和毛蕊异黄酮。黄芪甲苷是黄芪根、茎和叶中发现的多糖,可调节促炎因子如细胞因子、TNFα、IL-1β和NFATc4的表达,从而发挥免疫调节作用。它已被发现有助于避免细胞因子风暴的状况。
熊竹素在一定程度上也能成功抑制Mpro酶。作为一种免疫调节剂,在COVID-19的情况下,作为一种预防措施,可以使用蒙古紫云英来增强免疫力。
研究人员对小鼠血浆进行了代谢组学研究。结果表明,蒙古紫云英与人参同时食用可提高大鼠的脾、胸腺指数、脾淋巴细胞增殖和NK细胞毒活性。
➦ 其 他
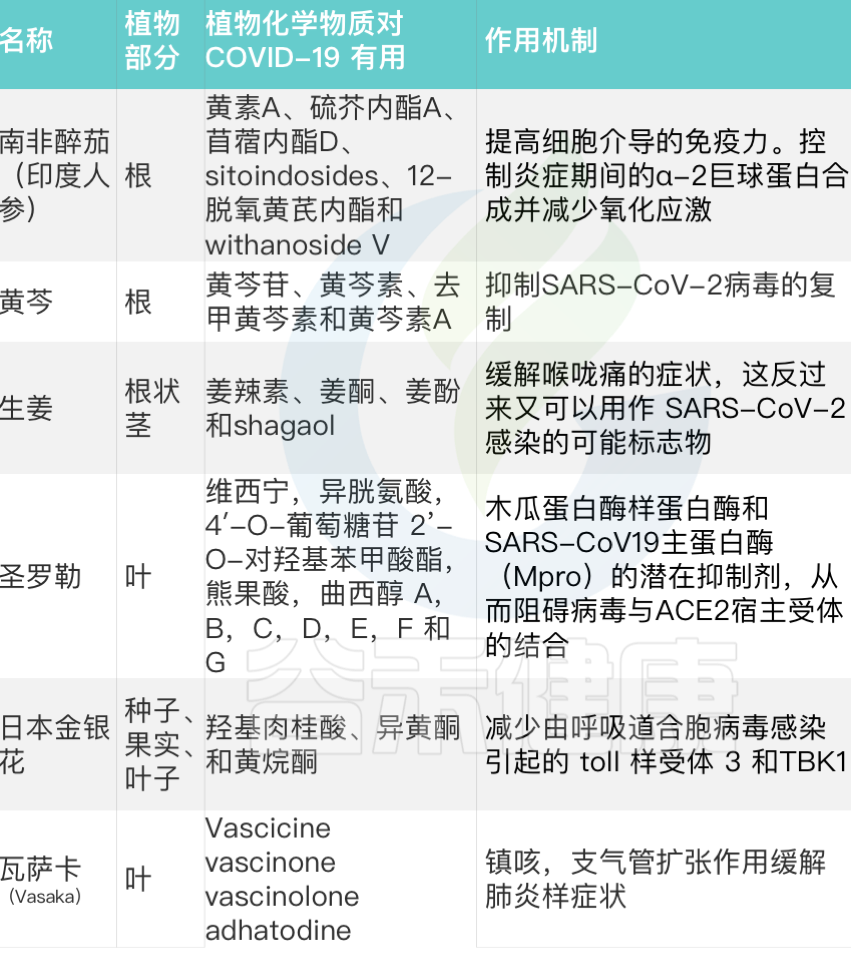
doi: 10.1016/j.ccmp.2022.100021.
改变的肠道微生物群或菌群失调可以作为全身炎症活动的调节剂,并可以通过多个肠道器官轴影响不同的器官。肠道通透性增加或者说肠漏,使细菌代谢物和毒素进入循环系统,并进一步恶化全身炎症反应,导致不同的新冠肺炎并发症。
肠道微生物群不仅显着影响COVID-19的发展和疾病的严重程度,而且还反映了COVID-19患者对长期并发症的易感性。
初步临床研究揭示了益生菌对 SARS-CoV-2 感染及恢复期的潜在调节作用。鉴于针对COVID-19的特定药物仍然是个谜,疫苗是有效的预防和控制策略;然而,病毒的持续突变加剧了这一难题。因此,通过益生菌、益生元、膳食补充剂、药用植物、FMT等多种方式,进行肠道菌群干预,是未来治疗COVID-19的有前途的补充策略。
尽管大规模临床试验有限,但相信这个领域正在发展,并蕴藏着巨大的机遇,一个个新诞生的研究可以在疫情的不同浪潮中推动微生物群的发现走向临床应用。
在此,也向一直奋斗在前线的医务工作者、在该领域辛勤耕耘的科研人员、其他相关工作者致敬。
对于个人而言,通过多种方式增强体质提高自身免疫力,是抵抗病毒侵袭的最好选择。
在新开启的2023里,希望大家都能找到属于自己的健康生活。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li M, Peng H, Duan G, Wang J, Yu Z, Zhang Z, Wu L, Du M, Zhou S. Older age and depressive state are risk factors for re-positivity with SARS-CoV-2 Omicron variant. Front Public Health. 2022 Oct 4;10:1014470. doi: 10.3389/fpubh.2022.1014470. PMID: 36268004; PMCID: PMC9576942.
Sacco C, Petrone D, Del Manso M, Mateo-Urdiales A, Fabiani M, Bressi M, Bella A, Pezzotti P, Rota MC, Riccardo F; Italian Integrated Surveillance of COVID-19 study group. Risk and protective factors for SARS-CoV-2 reinfections, surveillance data, Italy, August 2021 to March 2022. Euro Surveill. 2022 May;27(20):2200372. doi: 10.2807/1560-7917.ES.2022.27.20.2200372. PMID: 35593164; PMCID: PMC9121659.
Deng L, Li P, Zhang X, Jiang Q, Turner D, Zhou C, Gao Y, Qian F, Zhang C, Lu H, Zou H, Vermund SH, Qian HZ. Risk of SARS-CoV-2 reinfection: a systematic review and meta-analysis. Sci Rep. 2022 Dec 1;12(1):20763. doi: 10.1038/s41598-022-24220-7. PMID: 36456577; PMCID: PMC9714387.
Hansen CH, Friis NU, Bager P, Stegger M, Fonager J, Fomsgaard A, Gram MA, Christiansen LE, Ethelberg S, Legarth R, Krause TG, Ullum H, Valentiner-Branth P. Risk of reinfection, vaccine protection, and severity of infection with the BA.5 omicron subvariant: a nation-wide population-based study in Denmark. Lancet Infect Dis. 2022 Oct 18:S1473-3099(22)00595-3. doi: 10.1016/S1473-3099(22)00595-3. Epub ahead of print. PMID: 36270311; PMCID: PMC9578720.
Guedes AR, Oliveira MS, Tavares BM, Luna-Muschi A, Lazari CDS, Montal AC, de Faria E, Maia FL, Barboza ADS, Leme MD, Tomazini FM, Costa SF, Levin AS. Reinfection rate in a cohort of healthcare workers over 2 years of the COVID-19 pandemic. Sci Rep. 2023 Jan 13;13(1):712. doi: 10.1038/s41598-022-25908-6. PMID: 36639411; PMCID: PMC9837751.
Holmer HK, Mackey K, Fiordalisi CV, Helfand M. Major Update 2: Antibody Response and Risk for Reinfection After SARS-CoV-2 Infection-Final Update of a Living, Rapid Review. Ann Intern Med. 2023 Jan;176(1):85-91. doi: 10.7326/M22-1745. Epub 2022 Nov 29. PMID: 36442059; PMCID: PMC9707440.
Bowe B, Xie Y, Al-Aly Z. Acute and postacute sequelae associated with SARS-CoV-2 reinfection. Nat Med. 2022 Nov;28(11):2398-2405. doi: 10.1038/s41591-022-02051-3. Epub 2022 Nov 10. PMID: 36357676; PMCID: PMC9671810.
Davis HE, McCorkell L, Vogel JM, Topol EJ. Long COVID: major findings, mechanisms and recommendations. Nat Rev Microbiol. 2023 Jan 13:1–14. doi: 10.1038/s41579-022-00846-2. Epub ahead of print. PMID: 36639608; PMCID: PMC9839201.
O’ Mahony L, Buwalda T, Blair M, Forde B, Lunjani N, Ambikan A, Neogi U, Barrett P, Geary E, O’Connor N, Dineen J, Clarke G, Kelleher E, Horgan M, Jackson A, Sadlier C. Impact of Long COVID on health and quality of life. HRB Open Res. 2022 Apr 22;5:31. doi: 10.12688/hrbopenres.13516.1. PMID: 36101871; PMCID: PMC9440374.
Zhang F, Lau RI, Liu Q, Su Q, Chan FKL, Ng SC. Gut microbiota in COVID-19: key microbial changes, potential mechanisms and clinical applications. Nat Rev Gastroenterol Hepatol. 2022 Oct 21:1–15. doi: 10.1038/s41575-022-00698-4. Epub ahead of print. Erratum in: Nat Rev Gastroenterol Hepatol. 2023 Jan 12;: PMID: 36271144; PMCID: PMC9589856.
Sun K, Tempia S, Kleynhans J, von Gottberg A, McMorrow ML, Wolter N, Bhiman JN, Moyes J, Carrim M, Martinson NA, Kahn K, Lebina L, du Toit JD, Mkhencele T, Viboud C, Cohen C; PHIRST-C group. Rapidly shifting immunologic landscape and severity of SARS-CoV-2 in the Omicron era in South Africa. Nat Commun. 2023 Jan 16;14(1):246. doi: 10.1038/s41467-022-35652-0. PMID: 36646700; PMCID: PMC9842214.
Wang B, Zhang L, Wang Y, Dai T, Qin Z, Zhou F, Zhang L. Alterations in microbiota of patients with COVID-19: potential mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2022 Apr 29;7(1):143. doi: 10.1038/s41392-022-00986-0. PMID: 35487886; PMCID: PMC9052735.
Vaezi M, Ravanshad S, Rad MA, Zarrinfar H, Kabiri M. The effect of synbiotic adjunct therapy on clinical and paraclinical outcomes in hospitalized COVID-19 patients: A randomized placebo-controlled trial. J Med Virol. 2023 Jan 5. doi: 10.1002/jmv.28463. Epub ahead of print. PMID: 36602047.
Chutipongtanate S, Morrow AL, Newburg DS. Human Milk Oligosaccharides: Potential Applications in COVID-19. Biomedicines. 2022 Feb 1;10(2):346. doi: 10.3390/biomedicines10020346. PMID: 35203555; PMCID: PMC8961778.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Gang J, Wang H, Xue X, Zhang S. Microbiota and COVID-19: Long-term and complex influencing factors. Front Microbiol. 2022 Aug 12;13:963488. doi: 10.3389/fmicb.2022.963488. PMID: 36033885; PMCID: PMC9417543.
Xu L, Ho CT, Liu Y, Wu Z, Zhang X. Potential Application of Tea Polyphenols to the Prevention of COVID-19 Infection: Based on the Gut-Lung Axis. Front Nutr. 2022 Apr 14;9:899842. doi: 10.3389/fnut.2022.899842. PMID: 35495940; PMCID: PMC9046984.
Xu L, Yang CS, Liu Y, Zhang X. Effective Regulation of Gut Microbiota With Probiotics and Prebiotics May Prevent or Alleviate COVID-19 Through the Gut-Lung Axis. Front Pharmacol. 2022 Apr 25;13:895193. doi: 10.3389/fphar.2022.895193. PMID: 35548347; PMCID: PMC9081431.
Rahmati M, Fatemi R, Yon DK, Lee SW, Koyanagi A, Il Shin J, Smith L. The effect of adherence to high-quality dietary pattern on COVID-19 outcomes: A systematic review and meta-analysis. J Med Virol. 2023 Jan;95(1):e28298. doi: 10.1002/jmv.28298. Epub 2022 Nov 18. PMID: 36367218.
Pandey M, Bhati A, Priya K, Sharma KK, Singhal B. Precision Postbiotics and Mental Health: the Management of Post-COVID-19 Complications. Probiotics Antimicrob Proteins. 2022 Jun;14(3):426-448. doi: 10.1007/s12602-021-09875-4. Epub 2021 Nov 22. PMID: 34806151; PMCID: PMC8606251.
Horne BD, Bunker T. Pathogenic Mechanisms of the Severe Acute Respiratory Syndrome Coronavirus 2 and Potential Direct and Indirect Counteractions by Intermittent Fasting. Nutrients. 2022 Dec 21;15(1):20. doi: 10.3390/nu15010020. PMID: 36615679; PMCID: PMC9823718.
Hou YC, Su WL, Chao YC. COVID-19 Illness Severity in the Elderly in Relation to Vegetarian and Non-vegetarian Diets: A Single-Center Experience. Front Nutr. 2022 Apr 29;9:837458. doi: 10.3389/fnut.2022.837458. PMID: 35571931; PMCID: PMC9101048.
Karupaiah T, Lu KC. Editorial: Nutraceuticals for the recovery of COVID-19 patients. Front Nutr. 2022 Nov 14;9:1054632. doi: 10.3389/fnut.2022.1054632. PMID: 36451742; PMCID: PMC9703639.
Itsiopoulos C, Mayr HL, Thomas CJ. The anti-inflammatory effects of a Mediterranean diet: a review. Curr Opin Clin Nutr Metab Care. 2022 Nov 1;25(6):415-422. doi: 10.1097/MCO.0000000000000872. Epub 2022 Aug 30. PMID: 36039924.
Yue Y, Ma W, Accorsi EK, Ding M, Hu F, Willett WC, Chan AT, Sun Q, Rich-Edwards J, Smith-Warner SA, Bhupathiraju SN. Long-term diet and risk of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) infection and Coronavirus Disease 2019 (COVID-19) severity. Am J Clin Nutr. 2022 Dec 19;116(6):1672-1681. doi: 10.1093/ajcn/nqac219. PMID: 35945354; PMCID: PMC9384672.
Zargarzadeh N, Tadbir Vajargah K, Ebrahimzadeh A, Mousavi SM, Khodaveisi H, Akhgarjand C, Toyos FMP, Cerqueira HS, Santos HO, Taghizadeh M, Milajerdi A. Higher Adherence to the Mediterranean Dietary Pattern Is Inversely Associated With Severity of COVID-19 and Related Symptoms: A Cross-Sectional Study. Front Med (Lausanne). 2022 Jul 19;9:911273. doi: 10.3389/fmed.2022.911273. PMID: 35928288; PMCID: PMC9343686.
Xu J, Ren Z, Cao K, Li X, Yang J, Luo X, Zhu L, Wang X, Ding L, Liang J, Jin D, Yuan T, Li L, Xu J. Boosting Vaccine-Elicited Respiratory Mucosal and Systemic COVID-19 Immunity in Mice With the Oral Lactobacillus plantarum. Front Nutr. 2021 Dec 22;8:789242. doi: 10.3389/fnut.2021.789242. PMID: 35004816; PMCID: PMC8733898.
Gualtieri P, Marchetti M, Frank G, Cianci R, Bigioni G, Colica C, Soldati L, Moia A, De Lorenzo A, Di Renzo L. Exploring the Sustainable Benefits of Adherence to the Mediterranean Diet during the COVID-19 Pandemic in Italy. Nutrients. 2022 Dec 26;15(1):110. doi: 10.3390/nu15010110. PMID: 36615768; PMCID: PMC9824251.
Ferro Y, Pujia R, Maurotti S, Boragina G, Mirarchi A, Gnagnarella P, Mazza E. Mediterranean Diet a Potential Strategy against SARS-CoV-2 Infection: A Narrative Review. Medicina (Kaunas). 2021 Dec 20;57(12):1389. doi: 10.3390/medicina57121389. PMID: 34946334; PMCID: PMC8704657.
Chavda VP, Patel AB, Vihol D, Vaghasiya DD, Ahmed KMSB, Trivedi KU, Dave DJ. Herbal Remedies, Nutraceuticals, and Dietary Supplements for COVID-19 Management: An Update. Clin Complement Med Pharmacol. 2022 Mar;2(1):100021. doi: 10.1016/j.ccmp.2022.100021. Epub 2022 Feb 5. PMID: 36620357; PMCID: PMC8816850.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Renata RN, Arely GA, Gabriela LA, Esther MM. Immunomodulatory Role of Microelements in COVID-19 Outcome: a Relationship with Nutritional Status. Biol Trace Elem Res. 2022 Jun 6:1–19. doi: 10.1007/s12011-022-03290-8. Epub ahead of print. PMID: 35668151; PMCID: PMC9170122.
Li Y, Luo W, Liang B. Circulating trace elements status in COVID-19 disease: A meta-analysis. Front Nutr. 2022 Aug 12;9:982032. doi: 10.3389/fnut.2022.982032. PMID: 36034929; PMCID: PMC9411985.
Bego T, Meseldžić N, Prnjavorac B, Prnjavorac L, Marjanović D, Azevedo R, Pinto E, Duro M, Couto C, Almeida A. Association of trace element status in COVID-19 patients with disease severity. J Trace Elem Med Biol. 2022 Dec;74:127055. doi: 10.1016/j.jtemb.2022.127055. Epub 2022 Aug 4. PMID: 35985069; PMCID: PMC9349050.
Milton-Laskibar I, Trepiana J, Macarulla MT, Gómez-Zorita S, Arellano-García L, Fernández-Quintela A, Portillo MP. Potential usefulness of Mediterranean diet polyphenols against COVID-19-induced inflammation: a review of the current knowledge. J Physiol Biochem. 2022 Nov 8:1–12. doi: 10.1007/s13105-022-00926-0. Epub ahead of print. PMID: 36346507; PMCID: PMC9641689.
Sun Y, Ju P, Xue T, et al., Alteration of faecal microbiota balance related to long-term deep meditation. General Psychiatry 2023;36:e100893. doi: 10.1136/gpsych-2022-100893
Callaway E. What Omicron’s BA.4 and BA.5 variants mean for the pandemic. Nature. 2022 Jun;606(7916):848-849. doi: 10.1038/d41586-022-01730-y. PMID: 35750920.
Wang K, Gheblawi M, Oudit GY. Angiotensin Converting Enzyme 2: A Double-Edged Sword. Circulation. 2020 Aug 4;142(5):426-428. doi: 10.1161/CIRCULATIONAHA.120.047049. Epub 2020 Mar 26. PMID: 32213097.
Sapra L, Saini C, Garg B, Gupta R, Verma B, Mishra PK, Srivastava RK. Long-term implications of COVID-19 on bone health: pathophysiology and therapeutics. Inflamm Res. 2022 Sep;71(9):1025-1040. doi: 10.1007/s00011-022-01616-9. Epub 2022 Jul 28. PMID: 35900380; PMCID: PMC9330992.
Alenazy MF, Aljohar HI, Alruwaili AR, Daghestani MH, Alonazi MA, Labban RS, El-Ansary AK, Balto HA. Gut Microbiota Dynamics in Relation to Long-COVID-19 Syndrome: Role of Probiotics to Combat Psychiatric Complications. Metabolites. 2022 Sep 27;12(10):912. doi: 10.3390/metabo12100912. PMID: 36295814; PMCID: PMC9611210.
Shi Y, Li Z, Yang C, Liu C. The role of gut-brain axis in SARA-CoV-2 neuroinvasion: Culprit or innocent bystander? Brain Behav Immun. 2021 May;94:476-477. doi: 10.1016/j.bbi.2021.01.024. Epub 2021 Feb 15. PMID: 33600935; PMCID: PMC7883713.
De R, Dutta S. Role of the Microbiome in the Pathogenesis of COVID-19. Front Cell Infect Microbiol. 2022 Mar 31;12:736397. doi: 10.3389/fcimb.2022.736397. PMID: 35433495; PMCID: PMC9009446.

谷禾健康
久坐不动的生活方式已逐渐成为现代社会很多人的一种常态,因此导致2型糖尿病 、肥胖、心血管疾病和非酒精性脂肪肝等代谢性疾病的发病率上升。
★ 代谢性疾病严重危害人体健康
根据世界卫生组织数据库,2019年,代谢风险(即高体重指数 (BMI)、高血糖、高血压和高胆固醇)占全球总健康损失的近 20%。调查发现,2019年,高血压导致了近五分之一的死亡(近1100万人),其次是高血糖(650万人死亡)、高BMI(500万人)和高胆固醇(440万人)。
这些疾病对人们的健康造成了巨大影响,不过定期和适当水平的体育锻炼可以起到预防作用。
最新的研究发现,运动与饮食结合:通过肠道微生物群的相互作用能够更好地预防和调节代谢性疾病。
根据世界卫生组织和美国疾病控制与预防中心的数据,定期进行体育锻炼和饮食干预可以将妊娠糖尿病的患病率降低30%,将死亡风险降低20%至30%。
•运动与肠道微生物
肠道微生物在宿主的整个生命周期中参与影响健康的各种相互作用。
运动促进的微生物群结构和状态的变化在促进有益代谢物的产生、刺激/调节免疫系统、保护宿主免受病原体定植以及控制脂质积累和胰岛素信号。
规律的运动是对肠道的刺激性应激源,可促进有益反应并改善肠道屏障的完整性。
•饮食与肠道微生物
饮食对于塑造微生物群落或代谢物很重要。
微生物群暴露于健康的膳食成分,如膳食碳水化合物、蛋白质、维生素、矿物质和多酚,它们可以产生有益的代谢物,特别是短链脂肪酸和色氨酸代谢物。
这些代谢物参与维持肠粘膜完整性,还介导宿主免疫和稳态反应。相反,不健康的饮食,如高脂饮食,会增加促炎细胞因子的产生,从而导致全身慢性炎症和脂多糖易位,从而增加代谢疾病的风险。

本文讲述了肠道微生物与代谢性疾病的关联,主要包括肥胖、2型糖尿病、心血管疾病和非酒精性脂肪肝。
我们还提到了体育锻炼、饮食成分和饮食模式对肠道微生物的影响。并介绍了通过体育锻炼和饮食相结合来预防代谢性疾病的一些研究和相关机制,这可能为预防代谢性疾病提供一条新途径。
▸ 体育锻炼
体育锻炼被定义为有计划、结构化和重复的体育活动的一个子集,旨在改善或保持身体健康。
注意:定期锻炼是指每周5天,每次至少30分钟的中等强度体育锻炼,或每周3天,至少20分钟的高强度体育锻炼。
★运动与炎症及代谢疾病有关
研究表明,习惯性运动会抑制基础促炎细胞因子的表达,但过度运动会引发多种促炎介质的产生。合理和适度的体育锻炼可以减少代谢性疾病的风险,只有在极端情况下,才会增加体育锻炼相关并发症的风险。
事实上,定期运动会独立影响肠道功能和微生物组特征,进而对预防代谢疾病具有有益作用。
体育锻炼对肠道菌群和宿主健康的影响

编辑
Zhang L,et al.Nutrients.2022
肠道菌群受性别、遗传、年龄和种族(即不可改变的因素)和可改变的因素(如宿主健康、身体活动、饮食和最终的抗生素治疗)的调节。研究表明,运动对微生物群有独特的影响。
体育锻炼与肠道菌群生物多样性的积极调节有关;体育锻炼在塑造肠道微生物多样性和调节其分布方面的作用已经得到证明。如下表所示:
运动对微生物群与代谢的影响








Donati Zeppa S,et al.Nutrients.2019
•改变原因
体育锻炼引起的肠道菌群改变是由于肠道转运时间 、胆汁酸谱的改变、通过AMPK激活产生短链脂肪酸 、Toll样受体 (TLRs) 信号通路、免疫球蛋白 A (IgA)、B和CD4+T细胞的数量,最后到体重减轻。
AMPK即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子。它表达于各种代谢相关的器官中,能被机体各种刺激激活,包括细胞压力、运动和很多激素及能影响细胞代谢的物质。
•体重与菌群变化显著相关
在一项分析运动活跃和久坐的40岁以下女性的研究中,几种细菌类群的变化与体重指数 (BMI) 显著相关。即使所有参与者的微生物群组成在运动后的一段时间内发生变化,具有已知抗炎特性和产生短链脂肪酸能力的物种在瘦受试者中更高。
✦运动促进新陈代谢
在运动条件下,肠道微生物的变化会影响营养物质的吸收,进而影响宿主的新陈代谢。来自美国肠道计划的数据表明,进行适度运动(从不运动到每天运动)重塑了微生物组成和功能的变化,促进了老年人尤其是超重老年人更健康的肠道环境。
在动物身上也得到了类似的结果。进行体育锻炼的小鼠通常表现出双歧杆菌(Bifidobacterium)、乳酸杆菌和嗜黏蛋白阿克曼菌(Akkermansia muciniphila)丰度增加。
这些结果可能反映了运动更高的新陈代谢,因为阿克曼菌比例增加通常与更健康的新陈代谢特征相关。
✦对肠道屏障、免疫系统有积极作用
此外,运动可能会对肠道粘液层产生积极影响,肠道粘液层是粘膜相关细菌(如嗜粘蛋白-阿克曼氏菌)的重要基质。适度运动还可以减轻慢性应激诱导的小鼠肠道屏障损伤,减少细菌移位并维持肠道通透性。
罗氏菌属(R.hominis)和普拉梭菌(F.prausnitzii)产生的丁酸盐对健康有益,对肠道功能和脂质代谢有积极影响。普拉梭菌还产生具有抗炎作用的代谢物。
粪球菌属(Coprococcus)属是一种产丁酸盐的属,在经常运动的女性中更为丰富,促进了一些与运动相关的健康影响。
•瘦的人群产丁酸盐菌群丰度较高
在另一项比较瘦和肥胖成年人在饮食控制下参加为期六周的监督耐力运动计划的研究中,仅在瘦受试者中发现产生丁酸盐的分类群增加。
此外,瘦成人的普拉梭菌(Faecalibacterium Prausnitzii)增加,而肥胖成人则减少,而拟杆菌属(Bacteroides)有相反的趋势,证实了体重的影响。
注意:在体重、饮食和年龄正常化后,有氧适能水平较高的个体中产丁酸盐类群的丰度更高。
研究表明,这些微生物是已知的丁酸盐生产者,对促进肠道屏障完整性、调节宿主免疫系统和脂质代谢具有有益作用。
✦肠道微生物影响运动表现
在运动期间和之后,大量的乳酸会释放到血液中。乳酸在耐力表现中具有重要作用,因为它被用作多种器官和组织的燃料。这些器官和组织“学习”使用乳酸作为底物的次数越多,性能提高的越多。
最近证明,全身性乳酸可以穿过肠道屏障进入肠腔,然后可以被韦荣氏球菌属(Veillonella)转化为丙酸。
有报道说,肠道微生物群中的韦荣球菌丰度增加,其甲基丙二酰辅酶A在运动后过度表达。
•提高抗氧化活性
此外,他们证明在老鼠身上,韦荣氏球菌属(Veillonella)接种改善了跑步性能,通过结肠内输注给予丙酸盐也改善了这种性能。
在一项关于小鼠耐力游泳时间的研究中,证明了肠道微生物群的表现和抗氧化活性之间的关系,表明“肠道微生物群的状态可能对运动表现及其与运动员抗氧化酶系统相关的潜在作用至关重要”。
因此,这些研究表明,肠道微生物群对短链脂肪酸产生的调节会影响运动过程中的能量代谢,从而有助于运动诱导的适应。这些微生物群发酵产物也可用作肝脏和肌肉细胞的能量来源,通过长期维持血糖来提高耐力表现。
✦运动频率不同体内菌群不同
已发现运动员微生物组包含不同的微生物组成,这些微生物主要由韦荣氏球菌(Veillonella)、拟杆菌属(Bacteroides)、普雷沃氏菌属(Prevotella)、甲烷杆菌(Methanobacteriaceae)和嗜黏蛋白阿克曼菌(Akkermansia muciniphila)所组成。
参与能量和碳水化合物代谢的分类群的丰度,如普雷沃氏菌和史密森甲烷杆菌,被发现在职业自行车手中明显高于业余自行车手,并且与训练频率相关。
在超重的成年人中,遵循富含纤维和全谷物的饮食六周后,普雷沃氏菌的丰度可预测体重减轻,这表明应在个性化营养策略中考虑肠型以对抗肥胖。短链脂肪酸的产生,尤其是丁酸,是肠道健康的重要标志,在人类运动后会增加。
✦经常运动肠道菌群多样有助于促进健康
职业橄榄球运动员的肠道微生物表现出更大的α多样性和厚壁菌门与拟杆菌门比率的下降. 与久坐不动的女性相比,进行常规运动量的女性显示出更多的促进健康的分类群,例如
普拉梭菌(Faecalibacterium Prausnitzii)↑↑↑
罗氏菌属(Roseburia hominis)↑↑↑
嗜黏蛋白阿克曼菌(Akkermansia muciniphila) ↑↑↑
这些物种与促进健康的作用有关。先前已在运动员的微生物群中描述了高丰度的阿克曼菌,而低水平与炎症性肠病患者的代谢紊乱(肥胖、代谢综合征和 II 型糖尿病)有关。
•增加有益菌丰度预防疾病
检查了20名业余跑步者在半程马拉松比赛前后的粪便代谢物和微生物群。
根据α多样性分析,多样性几乎没有差异,但是,某些微生物群成员的丰度在跑步前后显示出差异。在门水平上,跑步后检测到在人体肠道中的功能未知的Lentisphaerae和Acidobacteria。
在物种水平上,Coriobacteriaceae和Succinivibrionaceae显著增加。
放线菌门(Actinobacteria)参与胆汁盐和类固醇激素的代谢以及人体肠道中膳食多酚的激活。Coriobacteriaceae与15种代谢物呈正相关,表明Coriobacteriaceae的代谢可能是运动预防疾病和改善健康结果的潜在机制。
这些增加的代谢物表明,跑步促进了微生物群衍生的新陈代谢。
•减少致病菌,具有抗炎作用
在属水平上,半程马拉松跑减少了粪便中Ezakiella、Romboutsia和放线杆菌(Actinobacillus)的丰度,但增加了粪球菌(Coprococcus)和Ruminococcus bicirculans。
放线杆菌属会导致几种不同的动物疾病,例如牛的放线菌病、新生马驹的烈性败血症和人类牙周病。
因此,对这种潜在病原体的抑制表明运动具有抗炎作用。还需注意,戊糖磷酸途径是一种与糖酵解平行并涉及葡萄糖氧化的代谢途径,是半程马拉松跑后最丰富的途径。这些发现强调了运动促进健康益处的微生物群衍生机制。
✦不同运动类型菌群组成不同
为了研究特定运动类型和运动员饮食对肠道微生物群的长期影响。比较了15名久坐不动的健康男性(作为对照组)、15名健美运动员和15名长跑运动员的粪便微生物群特征、膳食摄入量和身体成分。
运动类型与运动员饮食模式相关(即,健美运动员:高蛋白、高脂肪和低碳水化合物/膳食纤维饮食;长跑运动员:低碳水化合物和低膳食纤维饮食)。
虽然运动员类型在肠道微生物群α和β多样性方面没有差异,但它与几种细菌的相对丰度显著相关。例如,在属水平上,普拉梭菌(Faecalibacterium)、萨特氏菌(Sutterella)、Clostridium、嗜血杆菌、艾森氏菌属最高,而双歧杆菌和副双歧杆菌在健美运动员中最低。
在物种水平上,广泛用作益生菌的肠道有益菌(青春双歧杆菌、长双歧杆菌、清酒乳杆菌)和产生短链脂肪酸的有益菌(经黏液真杆菌属、霍氏真杆菌(Eubacterium hallii))在健美运动员中最低,在对照组中最高。
在长跑运动员中,蛋白质摄入量与多样性呈负相关,而在健美运动员中,脂肪摄入量与双歧杆菌呈负相关。这些差异可能与运动中的的营养状况有关。
✦不同生理状态下运动效果不同
此外,体育锻炼所产生的变化似乎取决于个人的生理状态。例如,无论是肥胖-高血压大鼠还是正常大鼠,规律的强迫运动都会对微生物群丰富度产生不同的影响。高脂肪饮食后运动对大鼠微生物群的改变与正常饮食的大鼠不同,糖尿病小鼠产生的改变也不同于对照小鼠。
•幼年运动对微生物群影响更显著
最后,据观察,与成年大鼠相比,运动对幼年大鼠的微生物群产生更有效的改变。在这些研究运动训练对肠道微生物组影响的小鼠研究中,一个共同发现是α多样性增加。使用基于小鼠的模型的其他几项研究也表明,与久坐不动的动物相比,运动的动物的α多样性增加。
高强度运动对肠道微生物不利
需要注意的是,高强度运动可能会对肠道功能产生有害影响。总共70%的运动员在剧烈运动后可能会出现腹痛、恶心和腹泻。
长时间运动还会导致微生物多样性减少,幽门螺杆菌(Helicobacter pylori)数量增加。过度运动会诱发增加肠道通透性的压力,这可能导致细菌及其有毒产物(包括微生物群衍生的脂多糖)进入血液并激活全身炎症。易位的脂多糖激活 TLR,促进NF-kB通路激活和炎性细胞因子的产生,最终导致内毒素血症。
运动强度是一个有争议的问题;我们必须考虑到各种运动形式,以及运动的持续时间。同时,要针对不同人群制定不同的干预方案;目的在于激励久坐不动的人摆脱不健康的生活方式。
小结
运动会改变参与代谢模式的分子的转换,并刺激神经内分泌激素的释放,这些激素直接或通过免疫系统间接与肠道相互作用。
总之,运动的强度、时间和类型会影响肠道微生物群的组成,因为它还与受试者的性别、年龄、健康状况和训练状态有关。已经证明,低水平但持续进行的身体活动可以增加微生物群的多样性,改善受试者的代谢特征和免疫反应,而急性剧烈运动可能会对运动员的微生物群及其总体健康造成有害影响。
碳水化合物是由碳、氢和氧三种元素组成,自然界存在最多、具有广谱化学结构和生物功能的有机化合物。
不同种类的水果、蔬菜和全麦谷物是膳食碳水化合物的主要来源。在人类基因组中,只有不到20种糖苷酶被鉴定为参与消化膳食碳水化合物的酶。
唾液淀粉酶首先在口腔内将复杂的碳水化合物分解为单糖,易消化的碳水化合物可通过胰淀粉酶、蔗糖酶、麦芽糖酶、半乳糖酶和乳糖酶等降解消化。复杂的不易消化的膳食碳水化合物驱使我们的肠道微生物进化出碳水化合物活性酶库,以便有效地竞争营养。
✦不同的碳水化合物对肠道影响不同
宿主的肠道不断被动态排列的碳水化合物淹没。而不同的碳水化合物对肠道的影响各不相同。
•简单的碳水化合物导致宿主代谢紊乱
已经注意到,简单的碳水化合物(例如蔗糖、果糖)会引起微生物群快速重塑,从而导致宿主代谢紊乱。
✦复杂的碳水化合物对健康有利
复杂的碳水化合物,特别是某些微生物群可接触的多糖和膳食纤维,为在该栖息地竞争的密集微生物群提供食物,对肠道微生物生态学和健康产生重大影响。
多糖含量高的饮食与上调的肠道微生物群落多样性有关,并促进有益微生物的生长,例如阿克曼氏菌、双歧杆菌和乳杆菌。同时,肠道微生物可以使用中间寡糖来生成对宿主有益的短链脂肪酸。
•增强肠道屏障
例如,铁皮石斛多糖 (DOPs) 不易消化和吸收,但会促进肠道微生物产生更多的丁酸,主要由Parabacteroides sp. HGS0025产生,从而介导肠道健康和免疫功能的改善。
铁皮石斛多糖干预还可以通过作用于嗜黏蛋白阿克曼菌(Akkermansia muciniphila)来促进粘蛋白合成,从而增强肠道屏障功能。
•参与抗炎保护
五味子的其他多糖还逆转了肠道微生物生态失调并上调了丁酸和丙酸的产生,这可能参与了抗炎保护机制。
膳食蛋白质是另一种关键的常量营养素,人们每天必须摄入一定量蛋白质,以获得氨基酸和一定量的氮元素,用于合成组织蛋白质。
★ 蛋白质摄入过高或过低都不健康
它还可以调节微生物组成和代谢产物的产生。蛋白质摄入量与健康之间的关系遵循U形曲线,其中较低的蛋白质摄入量与营养不良状态相关,而高于可耐受限度的摄入量与营养过剩疾病相关。
注:世界卫生组织建议普通成人每日蛋白质摄入量为0.83g/kg。
✦影响肠道环境
膳食蛋白质消化的产物是氨基酸。肠道微生物降解的氨基酸代谢物包括短链脂肪酸、支链脂肪酸、吲哚、酚、硫醇、硫化物、氨和胺。这些代谢产物参与与宿主健康和疾病相关的各种生理功能。
一方面,蛋白质降解提供必需的游离氨基酸作为结肠细胞的替代能源. 另一方面,这个过程也会释放出有毒的代谢副产物,如氨、硫化物和酚类,它们对局部肠道环境有害。
研究表明,适度限制日粮蛋白质可以塑造微生物群组成和多样性的和谐平衡,并改善成年猪的肠道屏障功能。
▸ 高蛋白饮食
•高蛋白饮食导致菌群减少和一些疾病
高蛋白饮食者毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)和嗜黏蛋白阿克曼菌(Akkermansia)的丰度减少。
此外,蛋白质,尤其是红肉和加工肉类中的蛋白质,是左旋肉碱和胆碱的来源,可被肠道微生物代谢并产生三甲胺 (TMA),随后被氧化为三甲胺N-氧化物 (TMAO)。高TMAO浓度与心血管疾病或死亡风险增加相关。
•经常运动蛋白质需求大
值得注意的是,运动员可能需要更多的蛋白质来支持骨代谢,保持足够的蛋白质合成和能量代谢,以及在强化/长时间的运动程序中保持足够的免疫功能和肠道完整性。
研究建议接受过耐力和力量训练的运动员的蛋白质摄入量为1.2-1.7克每公斤体重/天。
注:缺乏蛋白质可能导致女运动员月经失调。
膳食脂肪是指我们每日所吃各种食物含油脂的总和。来自植物和动物的膳食脂肪是人类生长发育的能量储备来源。
▸ 消化过程
脂肪首先被口腔中的舌脂肪酶和胃脂肪酶消化。接下来被胰脂肪酶水解成游离脂肪酸(FFA);大部分游离脂肪酸被小肠吸收,少数会通过胃肠道并直接改变肠道微生物成分。
✦膳食脂肪导致肠道微生物改变
与橄榄油或红花油相比,以棕榈油为基础的饮食可能会导致体重增加,对微生物群多样性产生负面影响,并增加厚壁菌门与拟杆菌门的比例。
•高脂饮食减少了有益菌和短链脂肪酸
饱和脂肪酸降低拟杆菌属、普雷沃氏菌属、乳酸菌属和双歧杆菌属。与低脂饮食相比,食用高脂饮食也显著减少了短链脂肪酸的释放。
✦高脂饮食不利于健康
•高脂饮食易导致结肠癌
膳食脂肪引起的肠道微生物群成分变化也可以调节微生物衍生的次级胆汁酸 (BA) 的产生。高脂饮食引发增强的胆汁酸放电,导致初级胆汁酸的结肠浓度增加。然而,5%到10%的胆汁酸没有被重吸收,而是被大肠中的微生物转化为次级胆汁酸,这对人体有害并会促进结肠癌发生。
•高脂饮食易导致炎症
此外,在高脂饮食小鼠中观察到的微生物群失调引起脂多糖从肠腔进入体循环,从而激活宿主促炎信号通路,然后引发低度全身炎症。
▸ 定义
膳食纤维的定义一直存在争议,一般将膳食纤维定义为具有三个或三个以上单元的可食用碳水化合物聚合物,对内源性消化酶有抵抗力,因此在小肠中既不水解也不吸收。
✦膳食纤维的作用
•重要能量来源
膳食纤维是盲肠和结肠微生物群的重要能量来源。特定肠道条件下的厌氧菌会激活其由关键酶和代谢途径组成的机制,这些机制可以代谢复杂的碳水化合物,从而导致产生短链脂肪酸等代谢物。
•影响微生物多样性
值得注意的是,限制膳食纤维不仅会导致微生物多样性的减少和短链脂肪酸的产生,还会改变肠道微生物的代谢以利用不太有利的底物,这可能对宿主有害。
Q1
什么是短链脂肪酸?
短链脂肪酸是主要由乙酸盐、丙酸盐和丁酸盐组成的有机产物。短链脂肪酸在调节宿主代谢、免疫系统和细胞增殖方面具有关键作用。
短链脂肪酸在盲肠和近端结肠中浓度很高,它们被用作结肠细胞的能量来源(尤其是丁酸盐),但也可以通过门静脉输送到外周循环,作用于肝脏和外周组织。尽管短链脂肪酸在外周循环中的水平很低,但现在人们普遍认为它们在宿主体内充当信号分子并调节不同的生物过程。
✦高纤维饮食有助于降低危害
为人类志愿者提供高蛋白、低碳水化合物的饮食不仅显著减少了总短链脂肪酸和丁酸盐的产生,还导致氨基酸发酵产生的潜在有害代谢物增加,包括支链脂肪酸、氨、胺、N-亚硝基化合物、酚类化合物、硫化物、吲哚化合物和氢气硫化物。这些代谢物的细胞毒性和促炎特性导致慢性疾病的发展,尤其是结直肠癌。
考虑到糖酵解发酵和蛋白水解发酵之间的权衡,高纤维饮食可能会抑制蛋白质发酵,抵消肉类和脂肪的许多不利影响,从而降低这些食物成分的危害。
稳定的肠道微生物群落受多种必需成分的影响,例如维生素、矿物质和多酚。
✦维生素
维生素是维持正常生理功能所需的少量辅助因子。人类无法合成大多数维生素来满足我们的日常需求,因此必须从外部获取。
•改变肠道微生物丰度和多样性
值得注意的是,肠道微生物有能力调节各种维生素的合成和代谢输出。随后,维生素还可以显著改变肠道微生物的丰度和多样性。
例如,维生素A可以上调对健康有益的微生物群,包括双歧杆菌、乳酸杆菌和阿克曼氏菌。
✦矿物质
与维生素一样,矿物质是微量营养素,它们在宿主新陈代谢和与肠道微生物群进行积极互动方面发挥着重要作用。
•影响肠道菌群和慢性疾病
已经证明,镁缺乏与慢性病发病率增加有关,并且镁缺乏小鼠体内的双歧杆菌含量会降低四天。不过,如果长期缺镁(21 天),双歧杆菌和乳酸杆菌的丰度会增加。
需要进行更多临床试验来确定缺镁和补充镁对避免不良反应的影响。
✦多酚
多酚是广泛存在于植物性食物中的一大类化合物,其中一些与肠道健康有关。
•抑制有害菌,促进益生菌
例如茶多酚可以抑制幽门螺杆菌和金黄色葡萄球菌等有害细菌的生长,并刺激或促进双歧杆菌和嗜黏蛋白阿克曼菌(Akkermansia muciniphila)等肠道有益菌的生长。
•调节肠道微生物
类黄酮可以影响和重塑肠道菌群的组成,发挥益生元和杀菌作用,尽管证据尚不确凿,它们的全身抗炎作用可能至少部分与微生物群的调节有关。
多酚的“益生元样”作用已经通过对人类肠道微生物群的体外研究以及临床前和临床试验中的体内观察到,在这些试验中,补充多酚和富含多酚的食物被证明可以调节肠道微生物群。
多酚有利于生长的其他有益物种包括:
嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、
普拉梭菌(Faecalibacterium Prausnitzii)
罗氏菌属(Roseburia spp)
✦多酚人体利用度较低
不幸的是,许多天然多酚,如浓缩或可水解的单宁和糖基化多酚衍生物(与葡萄糖、半乳糖、鼠李糖、核酮糖、阿拉伯吡喃糖等糖结合)的特点是人体肠道吸收率低。口服生物利用度的降低严重限制了这些化合物的潜在有益作用。
•经肠道微生物作用更容易吸收
有趣的是,这些通常在饮食中保持无活性的多酚在肠道微生物群去除糖部分后被生物转化为活性化合物。这些代谢物可以保留母体化合物的抗氧化和多效活性,同时还表现出增加的肠道吸收和更好的生物利用度。
因此,类黄酮通过微生物群的生物转化,可以更容易地到达血液并在全身水平发挥其生物学相关作用。
总的来说,微生物群和多酚之间的相互积极的相互作用可能会促进人们的健康。
除了个别营养素,饮食模式对肠道微生物群的代谢活动也有显著影响。
世界范围内的饮食习惯多种多样,包括西式饮食、地中海饮食、生酮饮食、间歇性禁食等。
饮食模式对肠道微生物群介导的健康的影响


Zhang L,et al.Nutrients.2022
▸ 西式饮食
西式饮食,是一种以高含量精加工糖和碳水化合物、高含量饱和脂肪酸、高含量动物蛋白以及低含量膳食纤维为特征的一种现代饮食方式。
•西式饮食影响肠道微生物群稳态
在西方饮食中,大部分能量由非细胞营养素提供,这些营养素更容易被微生物和人体细胞消化。易于获取的非细胞营养素的数量增加会影响pH值、肠道微生物群成分和新陈代谢的变化,从而影响肠道微生物群稳态的调节和维持。
•易导致炎症
另一方面,高脂饮食的消耗也增加了促炎细胞因子的产生,从而导致全身性慢性炎症和脂多糖易位。
不同饮食对肠道菌群和宿主生理功能的影响

Makki K,et al.Cell Host Microbe.2018
▸ 地中海饮食
“地中海式饮食”是指有利于健康的,简单、清淡以及富含营养的饮食。这种特殊的饮食结构强调多吃蔬菜、水果、鱼、海鲜、豆类、坚果类食物,其次才是谷类,并且烹饪时要用植物油(含不饱和脂肪酸)来代替动物油(含饱和脂肪酸)。
•降低免疫性疾病风险
与西方饮食不同,地中海饮食被认为是全球最健康的饮食模式之一。更好地坚持地中海饮食与总死亡率的显著降低以及免疫系统失调、心血管疾病、认知能力下降和癌症的风险降低有关 。
•改善微生物群组成
此外,地中海饮食改变了微生物群的组成,有利于有益细菌,例如狄氏副拟杆菌(Parabacteroides distasonis)、多形拟杆菌(Bacteroides thetaiotaomicron)和青春双歧杆菌(Bifidobacterium adolescentis),并抑制病原体的生长,恢复可能有益的微生物。
▸ 生酮饮食
生酮饮食是一种高脂肪、充足蛋白质和低碳水化合物的饮食。
身体通过限制碳水化合物的可用性来燃烧脂肪而不是碳水化合物来获取卡路里。研究表明,生酮饮食对肠道微生物群的影响有好有坏。
•有营养不足的风险
一方面,生酮饮食营养不足的风险更大,并且由于缺乏纤维、必需的维生素、矿物质和铁,可能无法维持健康的微生物群。
•缓解结肠炎
另一方面,研究表明,随着阿克曼氏菌丰度的急剧增加,生酮饮食在DSS诱导的接受者中赋予微生物群益处并缓解结肠炎和产丁酸的罗氏菌属(Roseburia) ; 此外,在喂食生酮饮食的小鼠中发现大肠杆菌(Escherichia)/志贺氏菌(Shigella)的丰度减少。
▸ 间歇性禁食
间歇性禁食是一种类似于热量限制的饮食干预,包括各种操纵进餐时间以改善身体成分和整体健康的计划。
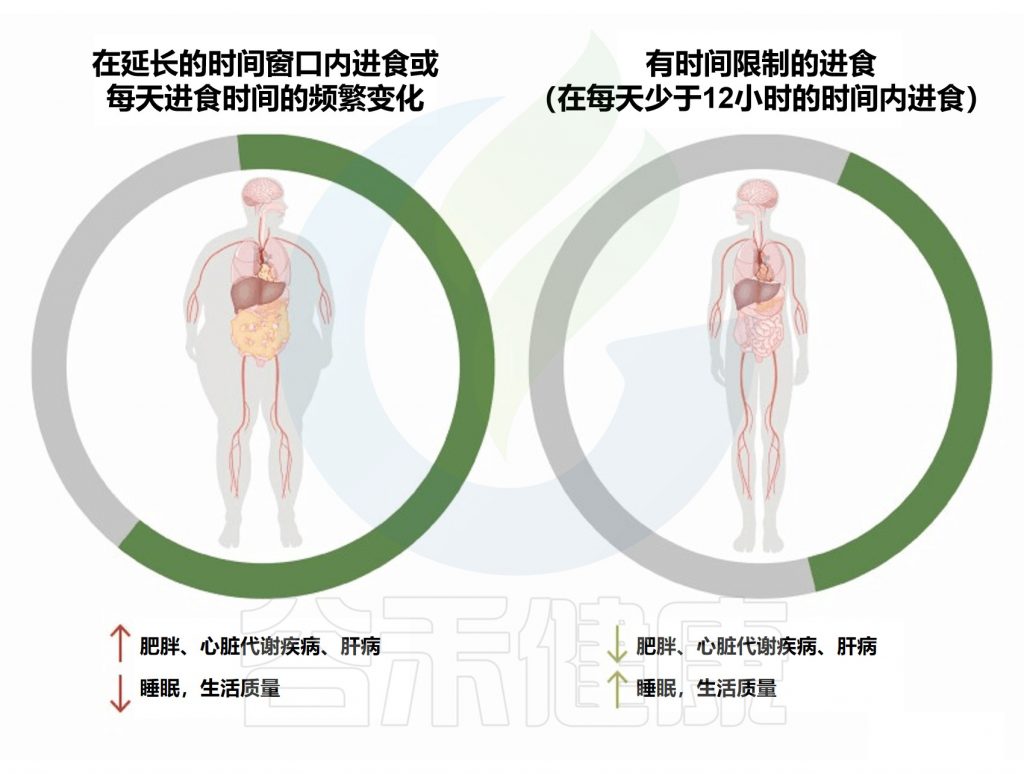

Chow LS,et al.Endocr Rev.2022
•缓解慢性疾病
研究发现间歇性禁食在动物模型中对广泛的慢性疾病(包括肝病、2型糖尿病、心血管疾病和脑功能)以及体重减轻具有强大的疾病缓解功效。
•增加肠道微生物丰富度
间歇性禁食似乎对肠道微生物群有积极影响。临床前研究一致表明,间歇性禁食有助于增加肠道微生物的丰富度,丰富嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和乳杆菌(Lactobacillus),减少假定的促炎类群脱硫弧菌属(Desulfovibrio)和Turicibacter,并增强抗氧化微生物代谢途径。
建议
我们应该合理搭配膳食,尽量做到高纤维低脂肪的摄入,并保证一定量的碳水和蛋白质,以及不可缺少的微量元素。有助于降低代谢性疾病风险,恢复肠道环境,提升健康水平。
遗传变异被认为是代谢疾病的主要驱动因素,但这些变异的遗传概率相当有限。最近肠道微生物群被怀疑是驱动代谢疾病的另一个因素。
与健康个体相比,大多数患有肥胖、2型糖尿病、心血管疾病和非酒精性脂肪肝的人群肠道微生物多样性降低。肠道微生物的组成如果被外部因素改变,会导致肠道微生物与宿主之间的共生关系发生巨大变化,这对于代谢疾病的发展至关重要。
肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。由于食物摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
✦肥胖个体的微生物能量获取显著增加
通过行为改变(例如高脂饮食和抗生素的使用)改变肠道微生物可能是肥胖大流行的强大驱动力。
关于肠道微生物群在介导肥胖发病机制中作用,基于动物模型的发现。肥胖的微生物群导致从饮食中获取的能量显著增加。
据观察,与接受瘦捐赠者微生物群的小鼠相比,将肥胖捐赠者的微生物群引入无菌 (GF) 小鼠会导致能量获取能力增加。同样,可转移的肥胖相关微生物群比“瘦微生物群”定植更有助于全身脂肪的积累。
✦菌群丰度发生变化
肠道微生物成分在肥胖和瘦弱个体之间存在差异。人体研究观察到,与非超重个体相比,超重个体的微生物群的特征是拟杆菌(Bacteroides)的丰度较低,而厚壁菌门(Phylum Firmicutes)的丰度较高 。
在属水平上,一项宏基因组关联研究揭示了多形拟杆菌(Bacteroides thetaiotaomicron)在肥胖个体中的不足。
有趣的是,用B. thetaiotaomicron灌胃可以减轻饮食引起的小鼠体重增加和肥胖,这意味着益生菌或微生物化合物可能是未来潜在的抗肥胖方式。
2型糖尿病也被认为受到肠道微生物成分和功能失调的影响。
✦肠道微生物丰度与2型糖尿病相关
临床报告表明,双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)和产丁酸细菌 (例如 Akkermansia muciniphila) 的相对丰度与2型糖尿病呈负相关,而梭菌属(Clostridium spp)、瘤胃球菌属(Ruminococcus)、梭杆菌属(Fusobacterium)和经黏液真杆菌属(Blautia)与2型糖尿病呈正相关。
•肠道屏障受损影响2型糖尿病
肠道微生物的失调可能通过破坏紧密连接蛋白 (TJP) 损害肠道屏障,随后导致粘膜渗漏和代谢性内毒素血症,这是胰岛素抵抗和2型糖尿病发展的主要因素之一。
此外,肠道微生物可能参与葡萄糖调节。一项研究表明,与未接受结肠切除术的患者相比,接受全结肠切除术的患者患2型糖尿病的风险增加。
因此,营造一个良好的肠道稳态有助于预防2型糖尿病。
心脑血管疾病是心脏血管和脑血管疾病的统称,泛指由于高脂血症、血液黏稠、动脉粥样硬化、高血压等所导致的心脏、大脑及全身组织发生的缺血性或出血性疾病。
心脑血管疾病是一种严重威胁人类,特别是50岁以上中老年人健康的常见病,具有高患病率、高致残率和高死亡率的特点。
肥胖、2型糖尿病、血脂异常、高血压和不健康的生活方式,如吸烟、缺乏运动和不良饮食习惯等,都涉及心血管疾病的病理过程和危险因素。
✦肠道微生物影响心血管疾病
值得注意的是,这些因素中的大多数都与肠道微生物有关,基因组测序和宏基因组分析也揭示了心血管疾病表型与特定微生物类群变化或肠道微生物丰富度和多样性之间的关联。
早期研究表明,在动脉粥样硬化斑块中检测到细菌 DNA(主要是Chryseomonas),其特征与疾病状态相关的分类群相匹配.
•肠道菌群丰度发生变化
此外,宏基因组分析表明,心血管疾病患者的肠道微生物组与健康个体不同,这主要表现为链球菌属(Streptococcus spp.)和肠杆菌属(Enterobacteriaceae spp.)的丰度升高。以及拟杆菌属(Bacteroides spp.)、普氏菌属(Prevotella copri)和Alistipes shahii的丰度下降。
•肠道微生物作用机制
在机制层面,肠道微生物对心血管疾病的影响与炎症、肠道屏障功能和代谢物的调节有关。肠道微生物群中与生态失调相关的变化会损害肠道屏障,导致循环脂多糖水平升高,而脂多糖可通过 Toll 样受体 (TLR)-MyD88信号通路激活炎症信号,从而释放促炎细胞因子,从而在宿主中协调炎症状态。
先前的研究表明,心力衰竭患者的肠道完整性受损,血液中促炎细胞因子水平升高与症状严重程度和较差的预后相关。在依赖代谢的途径中,肠道微生物裂解一些含三甲胺的化合物产生三甲胺,三甲胺可被黄素单加氧酶进一步氧化成氧化三甲胺。氧化三甲胺激活 MAPK、NF-κB 信号通路,促进炎症基因表达,从而影响心血管疾病患者的脂质代谢并增加甘油三酯,降低高密度脂蛋白。
非酒精性脂肪肝是一种与肥胖有关的疾病,通常被认为是代谢综合征的肝脏表现。
多项临床前和临床研究强调了肠道微生物群在非酒精性脂肪肝发病机制中的作用,尽管对因果关系还不确定。
✦微生物多样性较低
简而言之,与健康受试者相比,非酒精性脂肪肝患者的肠道微生物群多样性较低,Anaerobacter、链球菌(Streptococcus)、大肠杆菌(Escherichia)和乳酸杆菌(Lactobacillus)的物种丰度增加,普雷沃氏菌(Prevotella)、颤螺菌属(Oscillibacter)和Alistipes spp的丰度较低。
注:肠道微生物群影响非酒精性脂肪肝的机制可能是在肠-肝轴方面。
✦影响其他疾病
除了肠道微生物群失调外,非酒精性脂肪肝还与胆汁酸的肠肝循环、肠道微生物群介导的肠粘膜炎症和相关的粘膜免疫功能损伤有关。
高热量饮食和久坐不动的生活方式导致肥胖的发病率上升,这在很大程度上是由能量摄入超过能量消耗造成的。
大量流行病学证据表明,肥胖是诱发其他代谢性疾病(包括2型糖尿病、心血管疾病和非酒精性脂肪肝)的危险因素。
代谢性疾病严重影响人们的健康,这一疾病主要是日积月累的不良习惯引起的,那么有什么可以预防或是降低这类疾病发病率的方法呢?
✦运动加饮食效果更好
确定有效的干预措施是改善代谢性疾病的重要途径。前文已有讲到运动和饮食都会调节肠道微生物并改善代谢性疾病。
事实上,当一项计划包括饮食和体育锻炼时,与单独锻炼或饮食相比,会有更有效的改变。肠道微生物的多样性和功能也受到饮食和体育锻炼的影响。
锻炼与饮食结合通过调节肠道菌群来预防代谢性疾病
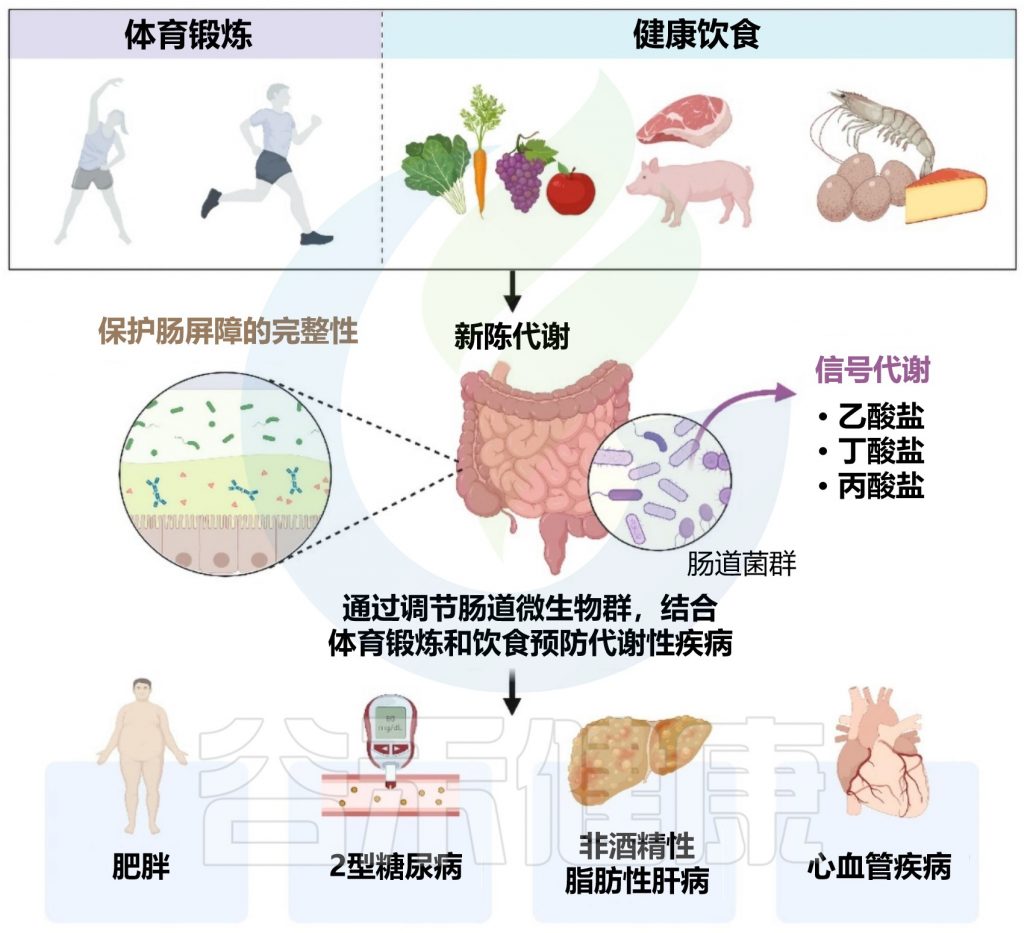

Zhang L,et al.Nutrients.2022
在这里,我们总结了一些动物和人类通过饮食加运动干预改善代谢性疾病的研究。
饮食诱导期间重复运动增加了免疫和代谢能力
在饮食诱导的肥胖期间,重复运动增加了小鼠远端肠道微生物群的α多样性和代谢能力。
适度运动和低脂饮食对高脂饮食诱导的肥胖小鼠的体重减轻和巨噬细胞免疫能力具有有益影响。
运动搭配低碳饮食减少了脂肪以及预防糖尿病
此外,一项为期6个月的随机干预计划表明,有氧运动和低碳水饮食提供了一种更有效的方法,可以通过改变肠道微生物群成分来减少肝脏脂肪和预防糖尿病。
低碳饮食加运动改善了心脏代谢
一项针对超重/肥胖中国女性表明,低碳水化合物饮食与运动训练相结合会增加产生短链脂肪酸的经黏液真杆菌属(Blautia)并减少与2型糖尿病相关的Alistipes属,导致显著的体重减轻,并改善血压、胰岛素敏感性和心肺健康,这表明低碳水饮食和运动干预可能通过调节肠道微生物在心脏代谢健康中发挥作用。
✦降低肝脏脂肪含量
最近的一项随机对照试验表明,与运动或单独饮食干预相比,饮食加运动干预可以显著降低肝脏脂肪含量并增加关键微生物的多样性和稳定性,这为制定饮食加运动干预策略提供了更有效的途径用于预防非酒精性脂肪肝。
✦有效控制血糖
在禁食状态下锻炼会产生有利的代谢适应,伴随着稳定的血糖浓度和升高的血液游离脂肪酸浓度,这可能更有效地改善胰岛素抵抗个体的胰岛素敏感性和控制血糖。
✦保护肠道屏障
肠道屏障是一种选择性的物理和免疫屏障,可促进营养、水和电解质吸收进入循环,同时阻止有害病原体和有毒管腔物质的转移。
如前所述,代谢疾病可能长期存在和加重的病理生理状态之一是肠道稳态失调释放内毒素,造成肠道渗漏,从而在宿主中诱发慢性低度炎症状态。
饮食和运动可以调节参与维持上皮膜完整性的紧密连接蛋白的表达,从而改善肠道通透性并降低慢性病风险。
从肠道微生物的角度来看,体育锻炼和饮食相结合可以缓和肠道屏障功能障碍,保持粘液厚度和肠道通透性。
✦影响代谢物的利用
饮食和运动的结合也会影响肠道微生物如何利用和合成代谢物。
肠道微生物和相应的代谢物以不同的方式与宿主协同作用,影响肠道稳态并为代谢性疾病提供保护性干预。具体而言,短链脂肪酸是微生物发酵或肠道中膳食多糖转化的主要终产物之一。而运动是短链脂肪酸的有效调节剂,对丁酸盐浓度具有特殊影响。
短链脂肪酸是肠上皮细胞的主要能量来源,参与维持肠粘膜完整性,改善糖脂代谢,控制能量消耗,调节免疫系统和炎症反应。在动物模型中,补充短链脂肪酸已被证明可以通过增加能量消耗和葡萄糖耐量来改善代谢,并且可能有助于延迟或减轻糖尿病并导致体重减轻。
益生菌、益生元等已被提议作为预防代谢性疾病的有效手段。
益生菌、益生元等对代谢性疾病的作用
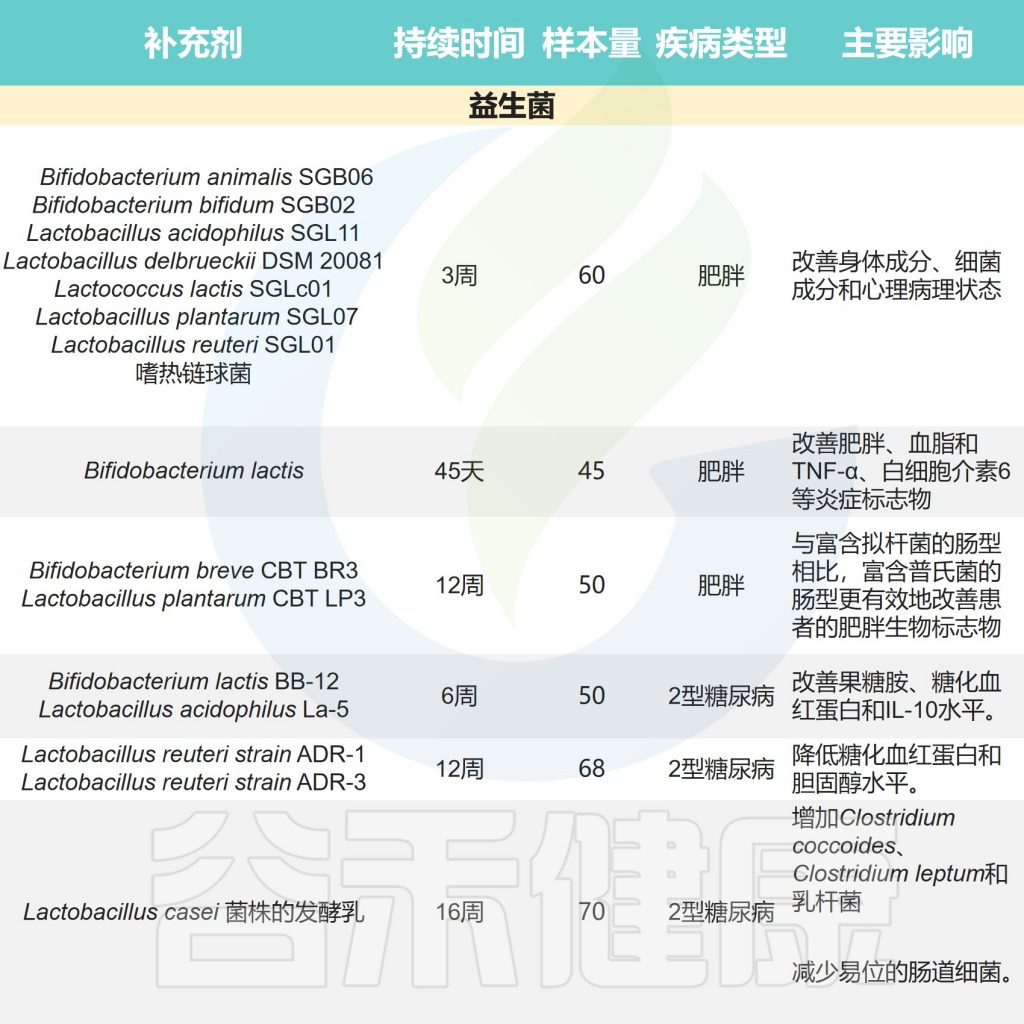



编辑


Li HY, et al.Nutrients.2021
✦调节肠道菌群
含有Bifidobacterium lactis LMG P-28149和Lactobacillus rhamnosus LMG S-28148的益生菌混合物可以调节肥胖相关肠道菌群的组成,恢复嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和Rikenellaceae的丰度,同时降低乳杆菌科的丰度。
✦改善代谢功能、减轻炎症
肠道微生物群被认为是肥胖和2型糖尿病代谢炎症的触发因素,罗伊氏乳杆菌(Lactobacillus reuteri)的给药可以通过抑制有害细菌(如小肠结肠炎耶尔森氏菌)的生长和改善TLR1-中的连四硫酸盐代谢来改善代谢功能有肠道炎症的缺陷小鼠。
此外,摄入干酪乳杆菌(Lactobacillus casei)可通过减少厚壁菌门和拟杆菌门来预防围产期大鼠代谢相关性高血压比率和血管紧张素转换酶 (ACE) 的表达,同时增加阿克曼菌和乳杆菌的丰度。
✦合生元有效改善肥胖
合生元被认为是预防肥胖的新领域,与单独的益生菌相比,omega-3脂肪酸与含有双歧杆菌、乳杆菌、乳球菌和丙酸杆菌的活益生菌混合物显示出更显著的肝脂肪变性和脂质积累减少。
此外,结合地衣芽孢杆菌和低聚木糖的口服补充剂可以更有效地改善肥胖大鼠的体重增加和脂质代谢,同时降低脱硫弧菌科和瘤胃球菌科的丰度。
Lactobacillus plantarum PMO 08与奇亚籽的混合物显示出对肥胖小鼠的协同抗肥胖作用,并为植物乳杆菌的生长创造了更有利的肠道微环境。
小结
益生菌(如双歧杆菌和乳酸杆菌)、益生元(如菊粉低聚果糖和其他多糖)、合生元(由益生菌菌株和益生元食品组成)等的干预可以使对代谢功能有重要影响。
主要通过调节肠道菌群组成、调节肠道微生物代谢物、改善肠道屏障功能这三个机制。
健康的饮食与体育锻炼相结合,可促进有益代谢物的产生并缓和肠屏障功能障碍,从而保护宿主免受入侵微生物的侵害,有助于维持体内平衡和预防代谢性疾病。
然而,虽然传统上这两种干预措施都被接受和实施,但很少有深入研究关注基于微生物群的策略。还需要更多的研究来确定肠道微生物是否可以作为对饮食和运动干预做出反应的代谢疾病的重要预测因子。
主要参考文献
Zhang L, Liu Y, Sun Y, Zhang X. Combined Physical Exercise and Diet: Regulation of Gut Microbiota to Prevent and Treat of Metabolic Disease: A Review. Nutrients. 2022 Nov 11;14(22):4774. doi:10.3390/nu14224774. PMID: 36432462; PMCID: PMC9699229.
Donati Zeppa S, Agostini D, Gervasi M, Annibalini G, Amatori S, Ferrini F, Sisti D, Piccoli G, Barbieri E, Sestili P, Stocchi V. Mutual Interactions among Exercise, Sport Supplements and Microbiota. Nutrients. 2019 Dec 20;12(1):17. doi: 10.3390/nu12010017. PMID: 31861755; PMCID: PMC7019274.
Makki K, Deehan EC, Walter J, Bäckhed F. The Impact of Dietary Fiber on Gut Microbiota in Host Health and Disease. Cell Host Microbe. 2018 Jun 13;23(6):705-715. doi: 10.1016/j.chom.2018.05.012. PMID: 29902436.
Allen JM, Mailing LJ, Niemiro GM, Moore R, Cook MD, White BA, Holscher HD, Woods JA. Exercise Alters Gut Microbiota Composition and Function in Lean and Obese Humans. Med Sci Sports Exerc. 2018 Apr;50(4):747-757. doi: 10.1249/MSS.0000000000001495. PMID: 29166320.
Mohr AE, Jäger R, Carpenter KC, Kerksick CM, Purpura M, Townsend JR, West NP, Black K, Gleeson M, Pyne DB, Wells SD, Arent SM, Kreider RB, Campbell BI, Bannock L, Scheiman J, Wissent CJ, Pane M, Kalman DS, Pugh JN, Ortega-Santos CP, Ter Haar JA, Arciero PJ, Antonio J. The athletic gut microbiota. J Int Soc Sports Nutr. 2020 May 12;17(1):24. doi: 10.1186/s12970-020-00353-w. PMID: 32398103; PMCID: PMC7218537.
Manoogian ENC, Chow LS, Taub PR, Laferrère B, Panda S. Time-restricted Eating for the Prevention and Management of Metabolic Diseases. Endocr Rev. 2022 Mar 9;43(2):405-436. doi: 10.1210/endrev/bnab027. PMID: 34550357; PMCID: PMC8905332.
Li HY, Zhou DD, Gan RY, Huang SY, Zhao CN, Shang A, Xu XY, Li HB. Effects and Mechanisms of Probiotics, Prebiotics, Synbiotics, and Postbiotics on Metabolic Diseases Targeting Gut Microbiota: A Narrative Review. Nutrients. 2021 Sep 15;13(9):3211. doi: 10.3390/nu13093211. PMID: 34579087; PMCID: PMC8470858.

谷禾健康
今年是新冠病毒影响的第三年了,在病毒的影响下,我们的生活方式发生了很大的变化。近日,多地政府颁布了疫情防控的新政策,除了一些特殊场所,出入其他场所不用扫场所码了。
从一方面说,这样的情况方便了我们日常的生活,但是从另一方面来讲,对于病毒的防范没有那么严格了。最终如果全面放开的话,我们可能需要通过自身的免疫来抵抗病毒,最终实现与病毒的共存。

★ 面对新冠病毒,健康仍是第一位
新冠疫情给全球带来了不可估量的损失。经济发展缓慢,生产制造受阻,人们精神压力增大。但是无论如何,健康仍然是第一位的,健康乃生死大事,是众多其他所愿所求之根本。
在疫情防范严格时尚且有那么多人感染,那么在逐渐放宽的今天,我们应该如何避免新冠病毒感染,并在感染后将影响降到最低呢?免疫在这其中发挥了关键的作用。
本文从人体内的免疫作用概述开始,讲述了免疫系统如何抵抗细菌及病毒的感染,影响免疫的诸多因素、新冠病毒下身体的免疫,以及微生物群对免疫的影响。
在文章的最后,提出了一些有助于提高免疫力的方法。希望可以帮助人们更好地了解免疫,以便在当下和未来拥有健康的身体,不受病毒所侵害。这对未来以微生物群为中心的预防和治疗方法也具有启示意义。
本文主要从以下几个方面讲述
●免疫与免疫系统
●免疫力的高低与评估
●新冠病毒在人体中的免疫反应
●影响免疫的因素
●肠道菌群对免疫的影响
●提高免疫力的方法
我们常说“一个人的免疫力好,就不容易生病”。那么,什么是免疫力呢?
免疫力
免疫力是人体自身的防御机制,是人体识别和消灭外来侵入的任何异物(病毒、细菌等);处理衰老、损伤、死亡、变性的自身细胞以及识别和处理体内突变细胞和病毒感染细胞的能力。
现代免疫学认为,免疫力是人体识别和排除“异己”的生理反应。数百万年来,人类生活在一个既适合生存又充满危险的环境,人类得以存续,也获得了非凡的免疫力。所以说免疫力是生物进化过程的产物。

▸ 非特异性免疫
非特异性免疫,也叫固有免疫。它和特异性免疫都是人类在漫长进化过程中获得的一种遗传特性,但是非特异性免疫是人一生下来就具有,而特异性免疫需要经历一个过程才能获得。
当细菌侵入到机体的不同部位,机体的免疫系统通过皮肤黏膜屏障作用对病原体的侵入开始攻击。当病原体突破体表和黏膜层进入机体内部遇到固有免疫细胞及分子所介导的固有免疫应答。
固有免疫应答是指固有免疫分子和细胞在遇到细菌后,被即刻激活且发挥生物学效应,将病原体和异物清除的过程。
固有免疫应答出现在宿主抗感染应答的早期阶段,以抗原非特异性方式识别和清除细菌。
✦特点
•作用范围广:机体对入侵抗原物质的清除没有特异的选择性。
•反应快: 抗原物质一旦接触机体,立即遭到机体的排斥和清除。
•有相对的稳定性: 既不受入侵抗原物质的影响,也不因入侵抗原物质的强弱或次数而有所增减。
•有遗传性:生物体出生后即具有非特异性免疫能力,并能遗传给后代。
▸ 特异性免疫
特异性免疫又称获得性免疫或适应性免疫,这种免疫只针对一种病原。是获得免疫经后天感染(病愈或无症状的感染)或人工预防接种(菌苗、疫苗、类毒素、免疫球蛋白等)而使机体获得抵抗感染能力。
一般是在微生物等抗原物质刺激后才形成的(免疫球蛋白、免疫淋巴细胞),并能与该抗原起特异性反应。
✦特点
•具有特异性(或称专一性):机体的二次应答是针对再次进入机体的抗原,而不是针对其他初次进入机体的抗原。
•有免疫记忆:免疫系统对初次抗原刺激的信息可留下记忆。
•有多种细胞参与:针对抗原刺激的应答主要是T细胞和B细胞,但在完成特异性免疫的过程中,还需要其他一些细胞(巨噬细胞、粒细胞等)的参与。
•有个体的特征:特异性免疫是机体出生后,经抗原的反复刺激而在非特异性免疫的基础上建立的一种保护个体的功能,这种功能个体上具有差别,不同于非特异性免疫。
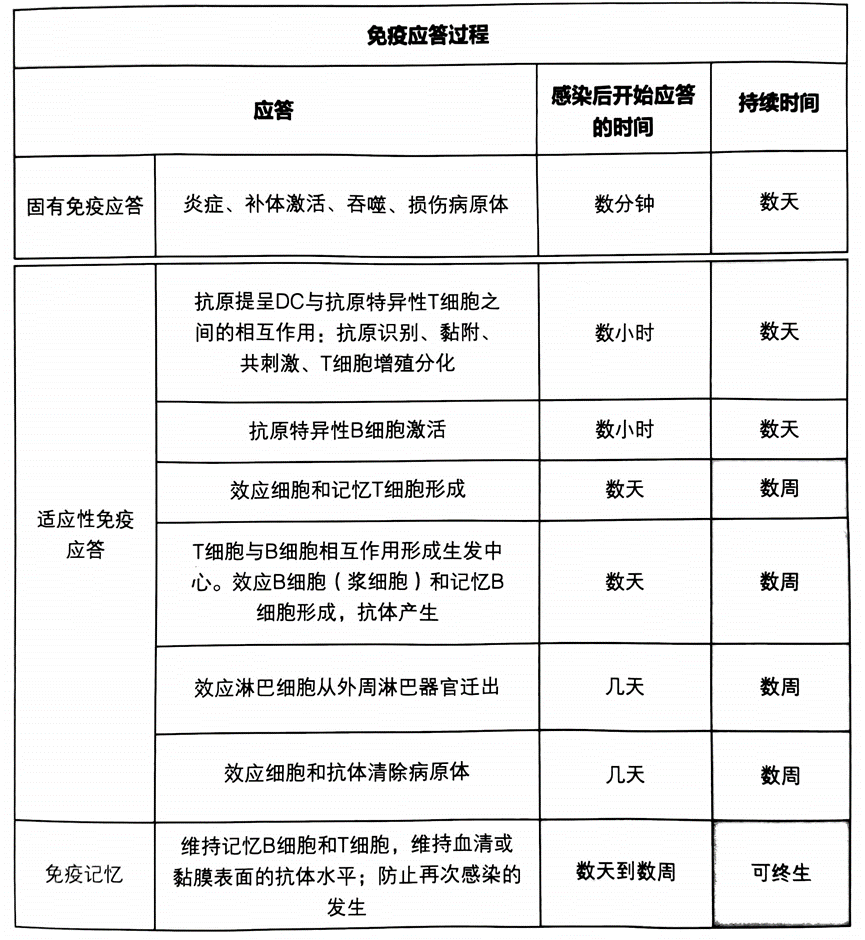
来源:詹韦免疫生物学(原书第九版)
提到免疫力,不得不提到的就是人类的免疫系统,免疫系统包括了免疫器官、免疫细胞和免疫活性物质三大类。
•免疫器官
常见的免疫器官有:骨髓、胸腺、扁桃体、脾、淋巴结、阑尾等。
免疫器官遍布全身
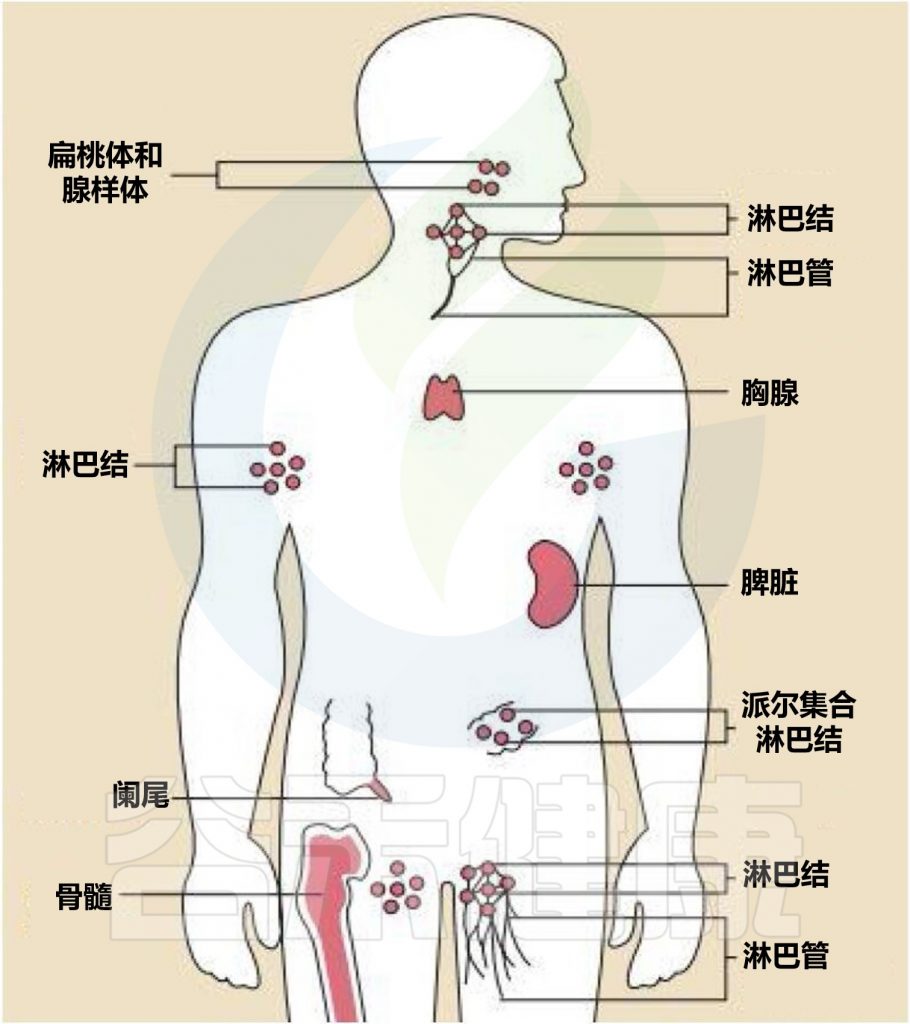

Chowdhury MA,et al.J Infect Public Health.2020
作用
免疫器官主要的作用就是产生、分化、成熟和储存免疫细胞,也是免疫应答发生的场所,还包括合成某些活性物质、建立和维持自身免疫耐受、对免疫细胞进行调节等作用。
•免疫细胞
常见的免疫细胞有:淋巴细胞、T细胞、B细胞、自然杀伤细胞、白细胞、吞噬细胞等。
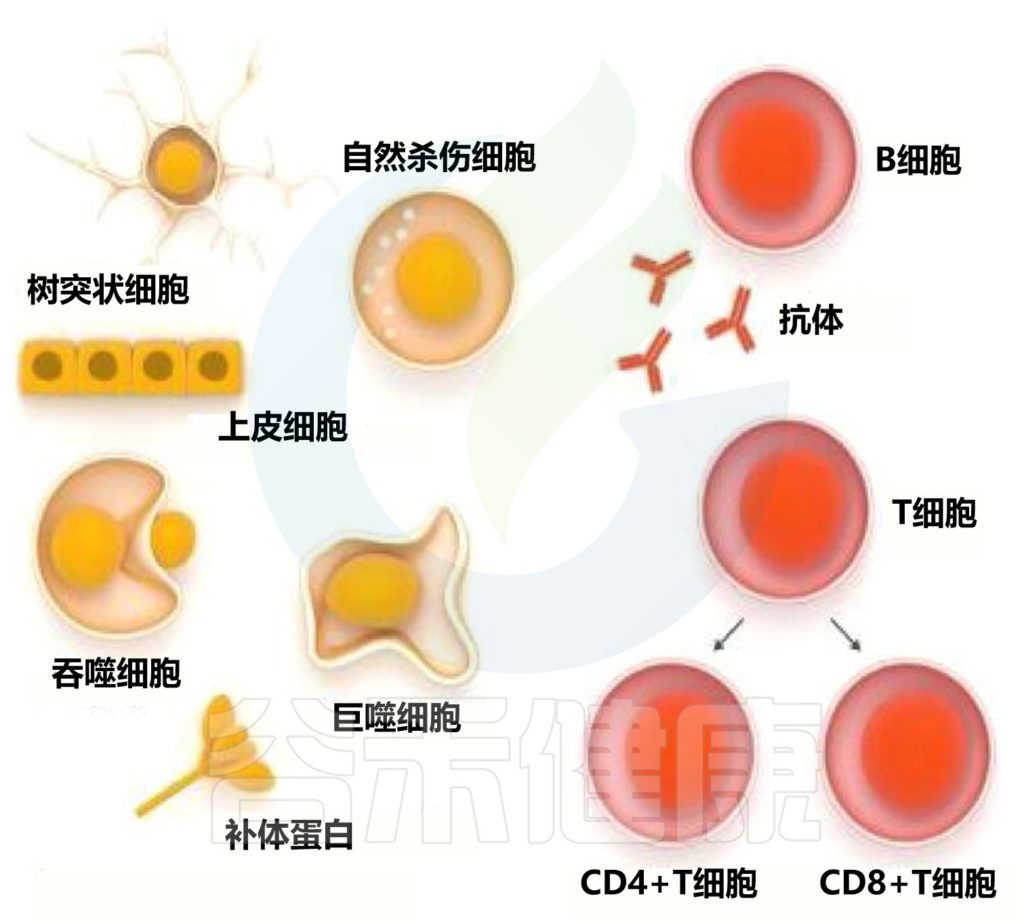
Chowdhury MA,et al.J Infect Public Health.2020
作用
免疫细胞就是战场上的“士兵”,负责巡视人体,一旦发现入侵的病原体,就会立刻展开吞噬和清除工作。
作用过程
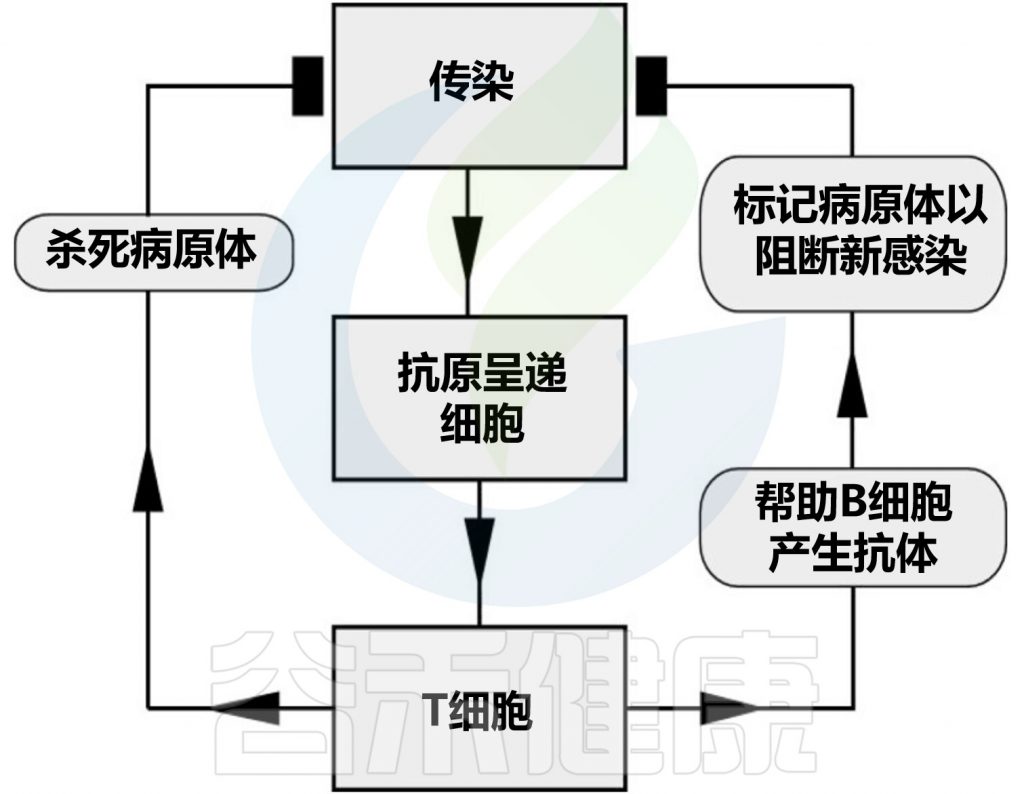

由巨噬细胞首先发起进攻,将病原体吞噬、分解,将分解的片段显示在细胞表面,并且提示T细胞,T细胞与巨噬细胞交流过后,就会向整个免疫系统发出“敌人入侵警报”,免疫系统收到后,会派出杀伤性T细胞,杀伤性T细胞找到并清除已经被感染的人体细胞,防止被感染的细胞继续繁殖,同时杀伤性T细胞会派出B淋巴细胞,在感染病原体的人体细胞被摧毁的同时,B淋巴细胞产生抗体,与细胞内的致病微生物结合,使其失去致病作用。
•免疫活性物质
常见的免疫活性物质有:抗体、免疫球蛋白、干扰素、细胞因子等。
作用
免疫活性物质可以辅助免疫细胞,使免疫性细胞的作用发挥的更强,放大其作用效果。
免疫系统的功能主要表现为三方面,即防御功能、稳定功能及免疫监视作用,这些功能一旦失调,即产生免疫病理反应。
•免疫防御
防御病原微生物侵害机体。就是人体抵御病原体及其毒性产物侵犯,使人免患感染性疾病。当该功能过于亢进,发生超敏反应;当该功能过于低下,发生免疫缺陷病。
•免疫自稳
人体组织细胞时刻不停地新陈代谢,随时有大量新生细胞代替衰老和受损伤的细胞。免疫系统能及时地把衰老和死亡的细胞识别出来,并把它从体内清除出去,从而保持人体的稳定。该功能异常时,发生自身免疫病。
•免疫监视
免疫系统具有识别、杀死并及时清除体内突变细胞,防止肿瘤发生的功能,称为免疫监视。免疫监视是免疫系统最基本的功能之一。
宿主通常采取三种策略应对病毒等微生物带来的威胁:
“规避”机制包括解剖学屏障和行为矫正,可防止机体暴露于微生物环境中。
机体被感染后,“抵抗”可减少或消除病原体。为了抵御不同种类的微生物,免疫系统包含众多调控分子和功能性细胞,称为免疫介质或效应机制。
“耐受”是指增强组织抵抗微生物诱导损伤的能力。“免疫耐受”是指阻止针对宿主自身组织的免疫应答。
注:“耐受性”被广泛用于植物的易感性而非动物免疫。例如,植物应对损伤的常见“耐受”机制是通过激活休眠的分生组织来促进更新,即未分化细胞分化为植物的新生部分。这应与术语“免疫耐受”进行区分。
解剖学和化学屏障是抵抗感染的最初屏障。
皮肤和黏膜属于一种“规避”策略,可防止机体内部组织暴露于病毒等微生物环境中。
在大多数解剖学屏障中,“抵抗”策略进一步增强了宿主的防御能力。例如,黏膜表面会产生多种抗菌蛋白,可作为天然抗生素防止病毒等微生物进入人体。
如果这些屏障被破坏,固有免疫系统的其他组分将立即发挥作用,比如前面提到的补体。补体系统由30余种协同作用的蛋白质分子组成,是血清和间质组织中最重要的免疫分子之一。
补体不仅能与抗体协同作用,还可以在没有特异性抗体存在时直接结合外来抗原,因此,它在固有免疫应答和适应性免疫应答中都发挥重要作用。
抵抗病原体的防御等级
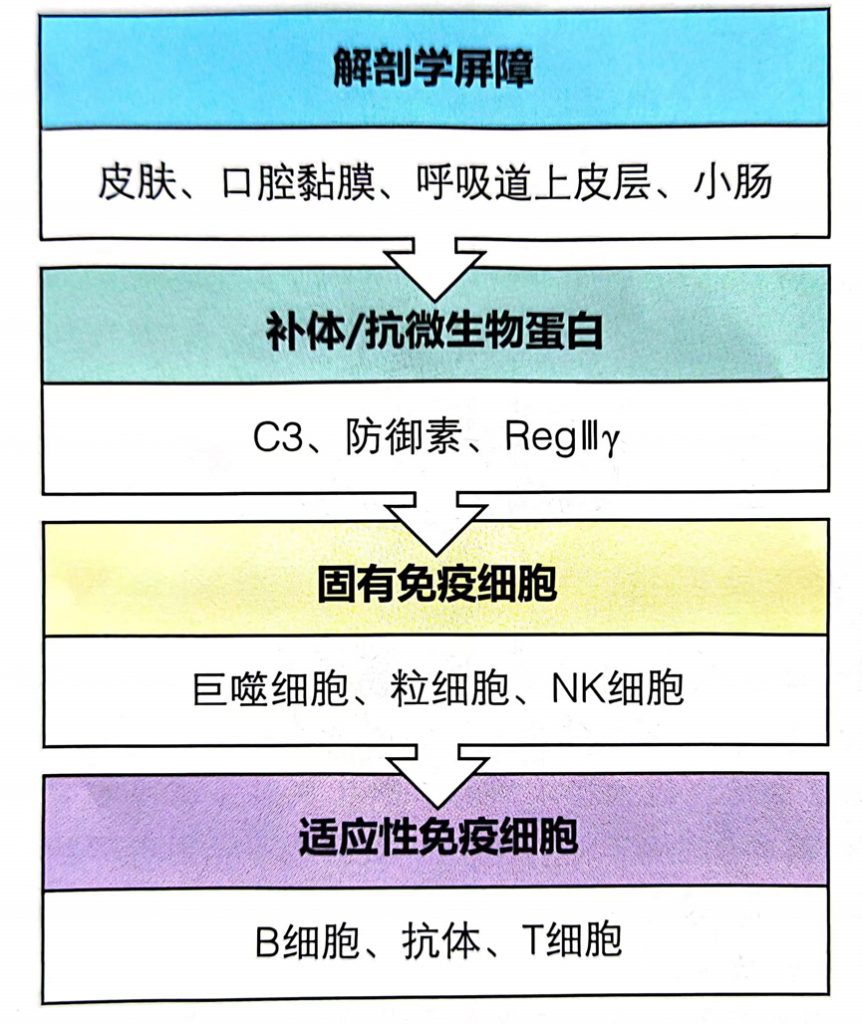

来源:詹韦免疫生物学(原书第九版)
既然免疫对我们如此重要,那是不是越高越好呢?免疫是否会影响一些疾病?以及我们如何了解自身的免疫能力呢?
各种原因使免疫系统不能正常发挥保护作用,在此情况下,极易招致细菌、病毒、真菌等感染,因此免疫力低下最直接的表现就是容易生病。
✦免疫力低下与生病容易恶性循环
免疫力低下或免疫力不健全,容易经常患病,加重了机体的消耗,所以一般有体质虚弱、营养不良、精神萎靡、疲乏无力、食欲降低、睡眠障碍等表现,生病、打针吃药便成了家常便饭。而营养不良这些又会使免疫力下降,形成恶性循环。
每次生病都要很长时间才能恢复,而且常常反复发作。长此以往会导致身体和智力发育不良,还易诱发重大疾病。
免疫力是越高越好吗?
答案是否定的。
随着医学专家对新冠肺炎的研究不断深入,又有一个专业名词“细胞因子风暴”,也就是“炎症风暴”,走进大众视野。它是指在患者体内结束潜伏期后爆发的病毒激发人体内免疫系统的强烈抵抗,会引起急性呼吸窘迫综合征和多器官衰竭,夺走患者的生命。
✦免疫力过高引起过敏
而且,免疫力过高容易使人体处于高度敏感状态,所有物质都可成为变应原,引发变应性鼻炎、过敏性哮喘、食物过敏等情况,严重的可致对身体内部自己的组织细胞产生反应,患自身免疫病。
如类风湿关节炎、系统性红斑狼疮、恶性贫血等疾病。
因此,健康适度的免疫力需要在清除外源物质和降低自身损伤之间做一个平衡。
免疫力的过高或过低以及在体内的不平衡都会引起一系列疾病
✦过敏性反应
无害的环境或饮食抗原触发2型免疫反应(涉及嗜酸性粒细胞、肥大细胞、固有淋巴样细胞、辅助T细胞和IgE),导致暴露组织的炎症和损伤。例如过敏性接触性皮炎、过敏性鼻炎、过敏性哮喘和食物过敏。
✦同种异体免疫
来自同一物种的非自抗原触发免疫反应,即体液(抗体介导)或细胞介导的免疫反应,导致外来组织或器官的细胞毒性和破坏。
反之亦然,移植到宿主体内的外来免疫细胞会攻击和损伤宿主组织。例如,移植物抗宿主病、输血反应和器官移植排斥反应
✦自身免疫
自我抗原被自身反应性的T和B细胞不适当地靶向,从而逃避耐受机制,导致抗体或细胞介导的组织损伤。自身免疫可分为器官特异性或系统性,根据主要影响一个或多个器官的临床表现。
例如,类风湿关节炎、干燥综合征和系统性红斑狼疮(系统性例子),I 型糖尿病、多发性硬化症和自身免疫性肝炎(器官特异性例子)。
✦自体炎症
在没有传染性药物的情况下,由于天然免疫细胞激活(中性粒细胞和巨噬细胞)而导致组织损伤后的自身炎症性疾病。
与自身免疫相反,损伤发生在没有明显的T和B细胞参与或自身抗体的情况下。自身炎症主要发生在单基因综合征和晶体驱动的疾病,如痛风,但也发生在一些自身免疫性疾病,具有突出的自身炎症成分(特别是炎症性肠病和脊椎关节病)。
例如,家族性地中海热和肿瘤坏死因子受体相关周期综合征。
✦食物不耐受引起的自身免疫性疾病
不适当的饮食成分在遗传易感性的个人中,导致自身免疫反应。这些疾病将与食物不耐受区分开来,而不依赖于免疫反应(例如,酶缺乏引起的乳糖不耐受)或复杂的非免疫超敏反应综合征(例如肠易激综合征)的功能障碍。
食物过敏的主要区别是饮食抗原引起的适应性免疫反应类型,例如腹腔疾病。
为什么要做免疫评估?
人的免疫系统就像一支精锐的军队24小时昼夜不停地守护着人类健康。免疫功能衰退会引发身体各种亚健康症状,各种疾病也随之到来。近年来随着人均寿命的延长、城市化的加快、不良生活习惯、职业压力、环境污染、遗传易感基因等因素的影响,身体的免疫力也会随之发生变化。
每个人的免疫系统都不一样,免疫能力自然也不一样,先天免疫能力较差的个体,应该在后天生活中选择更加健康的生活方式,以促进机体免疫系统的强大,每个人对营养的需求也都不相同,免疫力评估可以指导你如何为了更加健康而选择怎样的生活方式。
免疫力评估是一项全面评估免疫系统的检查,其中不仅包括了血常规中最基础的检查项目,还包括了免疫细胞的比例数目和T细胞亚群的检测,通过以上检测,可以评估人体三大防线的情况,还可以评估免疫的平衡作用,适合所有人群。判断免疫系统的强弱,指导更加健康的生活方式。

✦抽血查免疫球蛋白、补体
免疫球蛋白是检查机体体液免疫功能的一项重要指标,免疫球蛋白、补体的检测可以反映机体的免疫力。
✦淋巴细胞功能检查
淋巴细胞转化实验是为了检测免疫细胞的活性,根据淋巴细胞转化程度测定机体免疫应答功能,淋巴细胞转化率的高低可以反映机体细胞免疫水平。
形态学方法参考值:淋巴细胞转化率(LTT)为60.1%±7.6%。
✦细胞因子检测
细胞因子是由免疫细胞和一些非免疫细胞经刺激而合成分泌的一类具有广泛生物学活性的小分子蛋白质,调控免疫应答。
临床上有细胞因子6项检测,或细胞因子12项检测,包括白细胞介素-6、白细胞介素-2、干扰素、炎症细胞因子(TNF)等等。
小结
免疫系统评估通常包含了基因差异带来的先天免疫能力的不同,可以评估免疫的基础水平、对病毒的抵抗能力等,充分了解自身的免疫系统风险;还可以评估目前受检机体的营养吸收、代谢水平,根据基因找到最适宜的睡眠节律,结合以上检测,可以制定最适宜个体的健康方案。
COVID-19是指2019新型冠状病毒感染导致的肺炎。该病毒是一种具有冠状外观的RNA病毒。其直径约为60–140nm。我们一般称其为新冠病毒。
✦病毒传播
它通过咳嗽和打喷嚏产生的呼吸道飞沫传播,并通过吸入进入鼻腔系统并开始复制。研究表明,佩戴口罩等外在防护可以有效降低病毒的传播率。
ACE2是COVID-19病毒的主要受体。COVID-19表面存在的刺突蛋白(S蛋白),与ACE2受体结合。
接下来,病毒开始在体内传播,可以通过鼻咽拭子检测到。然后病毒传播并到达呼吸道,在那里它面临更强大的先天免疫反应。在此阶段,疾病具有临床表现,先天反应细胞因子可能预示着随后的临床过程。
✦病毒的影响

•大部分患者症状轻微
对于90%的受感染患者,这种疾病将是轻微的,并且主要局限于上呼吸道。通过保守的对症治疗即可治愈,这些人可能会在家中接受监测。
最常见的症状是发烧和呼吸道不适。也有胃肠道感染的报道,症状包括腹泻、恶心、呕吐、腹痛和食欲不振等。
•小部分患者症状比较严重
一小部分感染患者会出现肺部浸润,其中一些会出现非常严重的疾病。根据中国疾病预防控制中心的流行病学研究,新冠重症患者的死亡率可高达49%。
•患病率与年龄有关
在武汉,对292名COVID-19患者进行了研究。年龄是重症患者的危险因素。重症患者年龄每增加5岁,风险增加15.15%。COVD-19患者多为重症组老年患者,有基础疾病。慢性阻塞性肺疾病、高血压、恶性肿瘤、冠心病、慢性肾脏病在重症组中的发生率高于轻症组。
145例重症患者中,51例(34.69%)死亡,90.2%的死亡患者年龄在60岁以上。51例死亡患者中有40例患有基础疾病 (78.43%),大部分还是高血压的患者。
✦死亡原因
COVID-19患者死亡的主要原因是急性呼吸窘迫综合征引起的呼吸衰竭。继发性噬血细胞性淋巴组织细胞增生症 (sHLH) 的特征是伴有多器官衰竭的暴发性和致命性高细胞因子血症,并且未被充分认识。
病毒感染引发sHLH,发生在3.7%–4.3%的成人败血症病例中。sHLH,类似于细胞因子谱,与 COVID-19疾病严重程度相关,其特征是白细胞介素2、白细胞介素7、干扰素诱导蛋白10、粒细胞集落刺激因子、巨噬细胞炎症蛋白1、单核细胞增加趋化蛋白1和肿瘤坏死因子。
COVID-19感染的进展和潜在的辅助干预措施
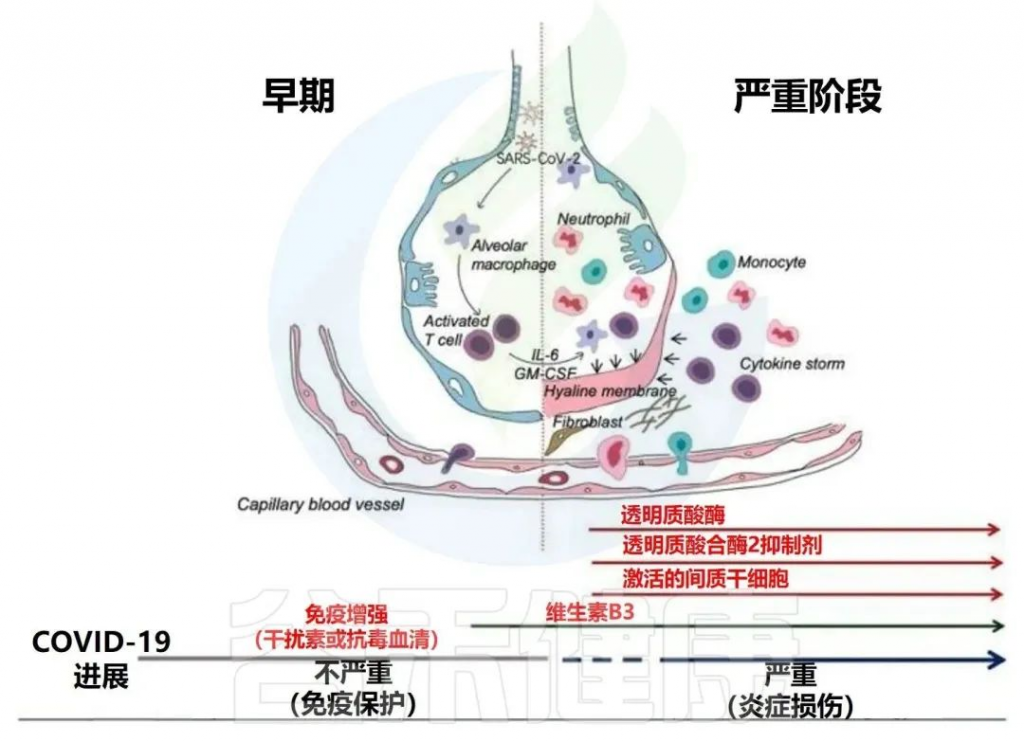

Chowdhury MA,et al.J Infect Public Health.2020
最近一项针对中国武汉150例COVID-19确诊病例的回顾性死亡预测多中心研究包括升高的铁蛋白和白细胞介素6,这表明死亡可能是由于病毒驱动的过度炎症所致。
✦第一次感染时无及时、有效的免疫
免疫的三种类型是先天免疫(快速反应)、适应性免疫(慢反应)和被动免疫。当身体第一次遇到病毒时,免疫系统无法正常运作,就会生病。这种情况就是COVID-19的情况。
注:按照获得方式的不同,可分为天然被动免疫和人工被动免疫。前者是人或动物在天然情况下被动获得的免疫力。例如,母体内的抗体可经胎盘或乳汁传给胎儿,使胎儿获得一定的免疫力。后者是用人工方法给人或动物直接输入免疫物质(如抗毒素、丙种球蛋白、抗菌血清、抗病毒血清)而获得免疫力。
当免疫系统的细胞收到信号时,它们通过在中央和外周淋巴器官之间再循环并通过血液从损伤部位迁移来完成它们的工作。
血液将幼稚和受过训练的免疫细胞从一个部位带到另一个部位,因为它流经全身,并充当免疫系统的管道。细胞再次进入血流,在通过传出淋巴管离开这些节点后被运送到全身组织。
✦病毒刺激免疫细胞进行分化工作
受病毒影响后免疫反应介导抗体。B细胞在T细胞的协助下分化为浆细胞,然后浆细胞产生针对病毒抗原的特异性抗体。中和性抗体能有效完全阻断病毒进入宿主细胞,限制感染,在感染后期起到很强的保护作用,防止感染复发。
相比之下,可以在受感染的细胞内观察到由T淋巴细胞介导的细胞免疫反应。整体适应性免疫反应由辅助性T细胞指导,细胞毒性T细胞在病毒感染细胞的清除和清洁中起着至关重要的作用。

✦免疫过程
•巨噬细胞先进行非特异性吞噬
当病菌再次进入到人体后,免疫系统中的巨噬细胞首先发起进攻,将它们吞噬到“肚子“里,然后通过酶的作用,把他们分解成一个个片断,并将这些微生物的片断显现在巨噬细胞的表面,成为抗原,表示自己已经吞噬过入侵的病菌,并让免疫系统中的T细胞知道。
•激活T细胞免疫
T细胞与巨噬细胞表面的微生物片断,或者说微生物的抗原,连着相遇后如同原配的锁和钥匙一样,马上发生反应。这时,巨噬细胞便会产生出一种淋巴因子的物质,他最大的作用就是激活T细胞。T细胞一旦“醒来”便立即向整个免疫系统发出“警报”,报告有“敌人”入侵的消息。这时,免疫系统会出动一种杀伤性T淋巴细胞,并由它发出专门的B淋巴细胞,最后通过B淋巴细胞产生专一的抗体。
•杀伤性T细胞直接作用,B淋巴细胞产生抗体
杀伤性T淋巴细胞能够找到那些已经被感染的人体细胞,一旦找到之后便像杀手那样将这些受感染的细胞摧毁掉,防止致病微生物的进一步繁殖。
在摧毁受感染的细胞的同时B淋巴细胞产生抗体,与细胞内的致病微生物结合使其失去治病作用。通过以上一系列复杂的过程,免疫系统终于保卫住我们的身体。
注意:当第一次的感染被抑制住以后,免疫系统会把这种致病微生物的所有过程用具的记录下来。如果人体再次受到同样的致病微生物入侵,免疫系统已经清楚地知道该怎样对付他们,并能够很容易、很准确、很迅速的作出反应,将入侵之敌消灭掉。
新冠病毒是RNA病毒,病毒是简单,也是多样的病原体,借助宿主细胞实现自身复制和传播。
病毒的遗传物质可以激活细胞内的PRR,进而引发固有和适应性免疫应答裂解被感染的细胞,也可以诱导 I 型干扰素反应,激活细胞内固有的级联反应限制病毒的复制。
尽管多种细胞可以产生 I 型干扰素,但pDC 是一种在病毒感染早期专门产生大量 I 型干扰素的细胞,它与NK 细胞一起,在适应性反应的的早期病毒宿主防御中发挥核心作用。后者涉及适应性免疫的各个方面:
病毒拮抗宿主免疫防御的策略复杂多样,这与病毒基因的类型有关,RNA病毒缺乏利用校对功能的RNA聚合酶来复制,所以与DNA病毒相比,这类病毒具有较高的突变率且基因组较小,有利于RNA病毒快速改变抗原表位,而抗原表位是适应性免疫靶向位点,是RNA病毒免疫逃逸的机制之一。
另外,一些RNA病毒基因组是分节段的,病毒复制有利于病毒基因组重组。流感病毒是一种常见的季节性病原体,引起急性感染并造成全球爆发,其利用以上2中策略实现免疫逃逸。
建议
佩戴口罩和一些外在防护,以及提前接种新冠疫苗,可以有效地降低病毒的感染率。并且接种疫苗的人群,在感染了病毒后,由于存在特异性免疫,身体会快速有效地做出反应,及时地清除病原体,将对身体的影响降到最低。
为了自己和他人的健康,建议大家外出佩戴口罩,尽量接种疫苗。
人体的免疫功能会受到多种因素影响:包括遗传因素以及很多环境因素,如年龄、温度、运动、压力等。
人体的免疫功能不论是体液免疫还是细胞免疫都与遗传有着密切的关系,由于遗传因素,子代体内抗体T淋巴细胞、吞噬细胞等数量减少或功能降低时,都可以使抗感染能力下降,而引起严重的反复感染,称之为原发性的免疫缺陷病。
主要有以下几种:
一,体液性免疫缺陷病即丙种球蛋白缺乏症。
二,细胞性免疫缺陷病,是由于胸腺发育不良,或缺乏胸腺而引起的体内T淋巴细胞缺乏。
三,联合性免疫缺陷病,也就是T淋巴细胞和B淋巴细胞都缺乏。
四,吞噬细胞缺陷病,是患儿吞噬细胞内缺乏溶菌酶,而不能将吞噬细胞杀死,临床表现为婴幼儿反复发生严重的化脓性感染。
同一个体不同发育阶段(年龄)、营养、健康状况都对免疫有影响。
✦年龄
•刚出生时抵抗力弱
刚出生或出生不久的动物对许多抗原的刺激通常不能激起有效地免疫反应。其原因:一是机体免疫应答的能力差;二是从母体获得的母源抗体。
所谓母源抗体,是指动物通过胎盘,初乳、卵黄等途径从母体获得的抗体。母源抗体方面可保护幼龄儿童免于感染但同时也能抑制或中和相应抗原,使其对机体的刺激强度大为减弱,从而削弱了机体对抗原的反应能力。
•衰老抵抗力变弱
另一方面,随着年龄的增长,身体的各种组织也以不同的方式衰老。其中也包括我们的免疫器官。
抗体由B细胞产生,并且产生途径非常复杂,涉及了许多前体细胞类型。该过程的所有早期步骤都发生在骨髓中,也正是在骨髓中从造血(产生血液)的干细胞产生了前体B细胞。
年龄增长的过程强烈影响了这些早期步骤,减少了前体B细胞的数量,也减少了这些细胞向分泌抗体的成熟B细胞的发育。重要的是,这降低了抗体库的多样性。
由于每个B细胞产生不同的抗体,这本身就像一个数字游戏:拥有的B细胞前体越少,产生能够应对任何感染产生抗体的成熟B细胞的可能性就越小。
✦病理因素
先天性的免疫球蛋白缺陷、自身免疫性疾病、艾滋病(获得性免疫缺陷综合征)、血液系统疾病、感染及慢性病等疾病都会导致患者的免疫功能受到影响。
甲状腺功能亢进症、白血病、肺炎、糖尿病,这些疾病会导致T淋巴细胞等细胞数量减少,使其功能降低,导致免疫功能失调,就会使患者免疫力受到影响。
注:艾滋病病毒是一种能攻击人体免疫系统的病毒。它把人体免疫系统中最重要的CD4T淋巴细胞作为主要攻击目标,大量破坏该细胞,使人体丧失免疫功能。
✦心理及生理
学习或者工作压力大,身体过渡劳累、睡眠不足、过度紧张,会加重植物性神经的负担,内分泌系统紊乱,植物性神经和内分泌系统及免疫系统有着紧密的联系,会带来不良影响,从而造成免疫力下降。
✦饮食对免疫非常重要
饮食具有很重要的影响力,因为有些食物的成分能够协助刺激免疫系统,增强免疫能力。如果缺乏这些重要营养素成分,会严重影响身体的免疫系统机能。
饮食失衡,饮食混乱、进食时间不规律、挑食等,都会使提供人体免疫系统所需的营养不足。
(在后面我们会介绍一些有助于增强免疫力的食物,帮助大家在平时增加免疫力)
✦适量运动增强免疫力
运动能够提高身体的免疫功能,一方面人体通过不断的长期运动,能够促进全身的血液循环,从而促进新陈代谢,包括免疫细胞的更新迅速,比如白细胞,淋巴细胞等,能够使这些免疫细胞的活性比较强。一旦身体有被细菌、病毒等病原体入侵,这些免疫细胞能够快速聚集起来,杀灭这些病原体。
另外在运动过程中,长时间的运动能够提高人体脏器的机能,比如肺功能会提高,心脏功能也会提高,这样会使人体的免疫反应增强,能够使心脏和肺脏的耐受力增强,从而最后提高人体整体的免疫力。
运动不足导致体力下降,体力跟不上就难以抵抗劳累,进而造成免疫力下降。
注:过量的运动使机体疲惫,在一定程度上也会降低免疫力,所以在剧烈运动后要注意自身防护。
免疫细胞监测并响应环境以及各种内源性触发因素,导致其功能改变。人类和动物研究表明,不同的环境温度可以改变细胞和体液方面的免疫反应。
环境温度对小鼠和人类的代谢和免疫影响


Wang H,et al.FEBS J.2022
✦寒冷使活性降低,免疫反应受限
寒冷降低了单核细胞上的主要组织相容性复合物II类(MHCII)并使其活性降低,这反过来又抑制了自身免疫过程中致病性T细胞的启动。
这导致T细胞细胞因子表达减少,从而减轻神经炎症。数据表明,由于小鼠免疫系统的能量可用性降低,资源优先用于产热,导致免疫反应受限。
✦热中性环境下增强了免疫细胞
此外,热中性环境增强了免疫细胞在肿瘤微环境中的渗透。这与不断积累的证据一致,即反复寒冷暴露会抑制小鼠的免疫活动,而温暖会激发更大的抗病毒免疫反应。
有趣的是,处于热中性环境的小鼠在骨髓中积累LyG6+单核细胞,但在循环血液中减少,从而对动脉粥样硬化产生保护作用。
寒冷期间对某些病毒感染的易感性也会增加,免疫的变化可以从一定程度上解释夏天新冠疫情的感染率较低,而到了冬天就比较严重。
抗原的性质对免疫应答的影响是多方面的。例如注射类毒素主要引起体液免疫,而细胞内慢性病毒感染则主要激发细胞免疫;可溶性抗原如类毒素的免疫潜伏期较长,而颗粒性抗原如细菌免疫潜伏期则简短。
✦通过接种疫苗来增强免疫
我们可以通过接种疫苗来增强对某一特殊疾病的预防免疫作用。疫苗的主要目的就是通过疫苗接种所产生的免疫应答,诱导机体产生对特异性抗原的特异性抗体,以便对这种特殊性的疾病,有着积极的预防作用。
注:活苗产生的保护力及免疫应答的持续时间都较死苗优越。
•抗原的次数和剂量都会影响免疫
在一定的限度内,抗体的产量随抗原用量的增加而相应增加,但超过了一定限度,抗体的行程反而受到抑制,这种现象称为“免疫麻痹”。剂量过小,不足以刺激机体产生抗体。
所以在进行疫苗接种时,疫苗的剂量必须严格按照规定,不能随意增减。
仅注射一次疫苗,抗体出现较慢,而且效价低,持续时间段。如果要建立强大的免疫,最好间隔一段时间连续注射2-3次。
注:一般菌苗需要间隔7-10天,类毒素至少间隔6周;注射弱活毒苗,由于活微生物可以在局部适当繁殖,能较长久地在机体内存在,对机体刺激较强,一次注射便可达到目的。
除了上述的因素,越来越多的研究发现肠道菌群对免疫有很大的影响。宿主与微生物相互作用是免疫系统发展的基础。
微生物群在免疫系统中起着基础性作用
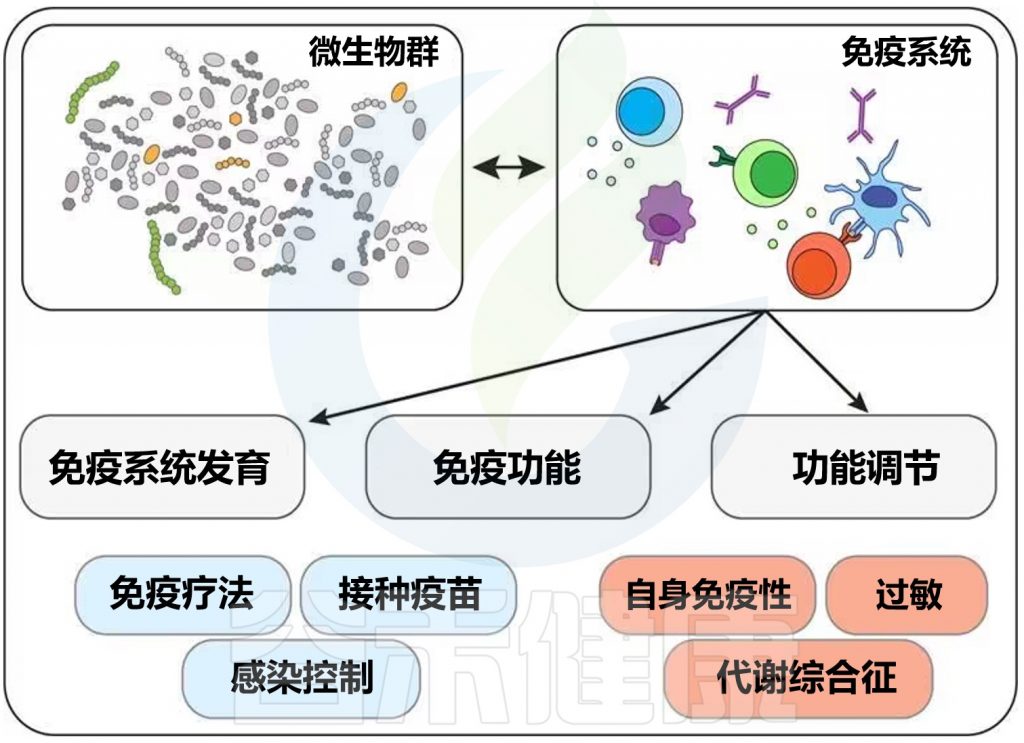

Belkaid Y,et al.Immunity.2017
哺乳动物免疫系统的进化与复杂微生物群的获得同时发生,证明了宿主免疫系统与其共生微生物群之间的共生关系。
这种共生状态的崩溃可能导致慢性炎症性疾病,包括自身免疫、过敏和代谢综合征。相反,微生物群的选择性调节在增强肿瘤免疫治疗、疫苗接种和对抗生素耐药微生物的耐药性方面具有巨大的治疗潜力。
什么是肠道菌群?
人体由大约30万亿个细胞组成,同时还有39万亿个细菌,真菌,病毒共同构成的巨大的微生物群。
这些菌群存在于我们人体的各个部位,有多达2000种不同的种类。其中最多的微生物是聚集在肠道里的细菌,我们称它们为肠道菌群。
肠道菌群并非人体与生俱来的。在母体子宫内,胎儿所处环境几乎是无菌的。在婴儿出生时,其肠道暂时处于无菌状态。
出生三个月后,细菌通过哺乳时口腔摄入、空气吸入等途径进入婴儿体内,并逐渐开始在肠道内定值,兼性厌氧菌首先定值,其后是厌氧菌。随着生长发育和集体功能的不断完善,肠道菌群种类与结构逐渐稳定,进而形成成熟的肠道菌群。在人体中起着至关重要的作用。
✦肠道菌群是肠道屏障的重要组成
肠道固有菌和肠黏膜在肠道内共同构成一道免疫屏障, 阻止细菌、病毒和抗原入侵。
防止产生过度免疫反应的最明显的方法是保持上皮屏障。然而,屏障需要有选择性地渗透,使营养物质进入宿主,有益的微生物与免疫细胞相互作用,以促进成熟和分化。
屏障功能是由复杂的细胞生物学过程维持的,这些过程受到严格的调控。多种微生物信号促进肠道稳态、屏障完整性和免疫成熟,部分是通过先天和适应性免疫信号来实现的。
例如,通过TLR途径激活强直性微生物是维持肠道屏障稳态的必要条件。
✦细菌代谢物影响屏障稳态
然而,影响适应性免疫成熟的共生物质的另一个例子是微生物衍生的短链脂肪酸促进抗炎环境,以诱导辅助性T细胞并促进屏障稳态。适应性调节机制的丧失、屏障功能障碍或先天免疫缺陷都是免疫介导的疾病的发病机制。
肠道屏障宿主-微生物群稳态的破坏增加了对微生物的过度免疫反应的可能性,从而促进炎症性肠病。同样,在这种情况下,对饮食成分的异常反应可能会发生,引发食物过敏和腹腔疾病。
✦影响免疫应答和免疫交流
免疫应答和免疫交流受到肠道菌群组成与数量的影响,在细菌入侵或抗原激活时,机体主要通过上皮内淋巴细胞维持肠道内环境稳定。
研究表明,白细胞介素-22诱导产生的固有淋巴细胞对一直肠道菌群的大面积弥散起重要作用。当健康的小鼠缺乏固有淋巴细胞时,可观察到炎性细胞扩散,同时远端多器官出现炎症,而补充白细胞介素-22后,炎症细胞扩展手限制且炎症消失。
•肠道微生物与免疫之间相互作用
在一项关于肠道菌群免疫应答关系的研究中,研究人员使每个参与者的免疫细胞受三种细菌刺激物刺激(共生细菌艰难梭菌、常见病原体金黄色葡萄球菌、大肠杆菌),进而分析了500名参与者的血液和粪便样本,通过分析病原体免疫应答的个体差异,肠道差异及两因素的相互影响,发现了肠道微生物群体及其功能与免疫应答之间的相互作用。
✦肠道菌群调节宿主免疫稳态
肠道菌群免疫保护作用的证据来自最近的研究,表明抗真菌药物对肠道真菌的靶向扰动对宿主免疫和健康产生持久影响。
巨噬细胞和单核细胞对真菌细胞壁成分(如β-葡聚糖和几丁质)具有记忆特性,可以保护小鼠免受真菌的二次攻击。
✦影响细菌和真菌病原体的感染
通过用白色念珠菌(Candida albicans)的人血液分离物在肠道定植,可以在小鼠体内诱导训练有素的免疫力通过抗生素治疗小鼠的胃肠道 。
该免疫保护机制效果持续时间短,依赖于白细胞介素6,并且可以在T细胞和B细胞缺陷小鼠中重现。然而,在类似的模型中,人类血液白色念珠菌分离株也可以防止随后的全身性白色念珠菌感染,这主要是由于诱导了Th17适应性免疫反应。
除了防止系统性真菌感染外,白色念珠菌在肠道中的定植还可以防止系统性金黄色葡萄球菌(Staphylococcus aureus)感染;这种保护是否取决于经过训练的免疫力或适应性念珠菌特异性Th17细胞,或两者的结合,仍然未知。
这些结果表明,经典的适应性免疫反应和先天免疫记忆都可以由肠道中的白色念珠菌(Candida albicans)引发,并表明菌株特异性特征可能会告知宿主免疫反应。
先天性和适应性免疫机制可能会协同维持体内平衡。用白色念珠菌或酵母菌对无菌小鼠进行单一定植,促进肠道稳态的建立。
✦益生菌促进免疫反应
共生细菌促进效应和调节性T细胞反应
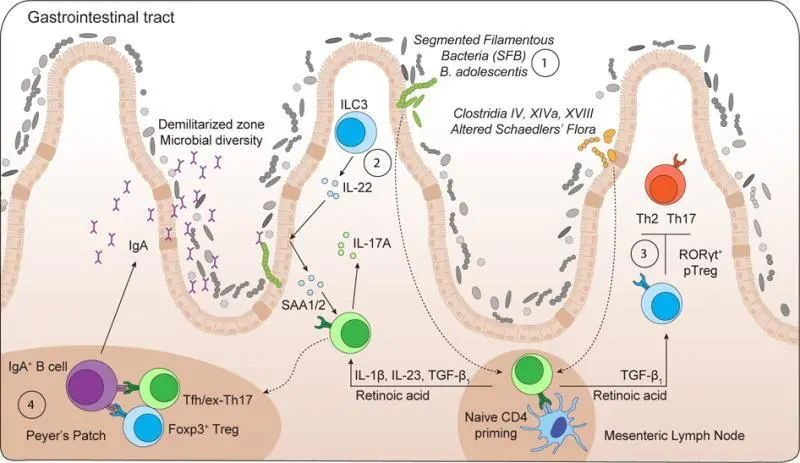
Belkaid Y,et al.Immunity.2017
除了微生物配体或代谢物在免疫系统功能中的多效性之外,现在越来越清楚的是,特定的微生物或细菌群可以在稳定状态下对免疫系统产生显著影响。
在生态系统中,那些具有最重要影响的生物被称为“关键物种”。分段丝状细菌 (SFB) 代表了胃肠道中关键物种的原型。这种形成孢子的革兰氏阳性厌氧菌定殖在小鼠回肠末端,通过促进小肠中Th17和Th1细胞的积累并驱动IgA的产生,对粘膜免疫系统产生显著影响。
•抵抗胃肠道病原体
宿主产生强大的分段丝状细菌特异性反应,这种现象与其促进抵抗胃肠道病原体的能力有关。
分段丝状细菌通过与淋巴结和上皮细胞的紧密粘附与粘膜组织密切相互作用,在接触部位诱导这些细胞的细胞骨架重组。这种与上皮细胞的密切接触是少数共生生物共有的特性,据信可以解释特定微生物提高组织免疫力的能力。
•青春双歧杆菌促进Th17细胞积累
最近的一项研究发现青春双歧杆菌(Bifidobacterium adolescentis)是一种人类共生体,也是一种可以促进Th17细胞在单克隆化小鼠肠道中积累的微生物。
值得注意的是,青春期双歧杆菌引发了一个不同于分段丝状细菌的转录程序,支持Th17细胞(淋巴细胞的一个子集,对屏障位点的稳态至关重要)的诱导可以通过不同或重叠的途径发生。
•皮肤微生物影响T细胞积累
皮肤微生物群还控制产生白细胞介素17的T细胞的积累。特定的皮肤微生物在调节适应性免疫系统不同分支的能力方面表现出高度专业化。
用确定的表皮葡萄球菌(Staphylococcus epidermidis)分离株定植小鼠,表皮葡萄球菌特异性T细胞通过其产生白细胞介素17的能力促进角质形成细胞产生AMP,从而促进针对真菌感染的异源保护。
肠杆菌(Enterobacteriaceae)定植可能有助于酿酒酵母对硫酸葡聚糖(DSS)诱导的结肠炎的保护作用,表明预先存在的肠道微生物群(真菌和细菌)可能进一步调节肠道炎症和保护性免疫的结果。
注:这些发现如何适用于不断暴露于真菌和细菌抗原的人类,仍不清楚。
小结
大量研究表明益生菌能够刺激人类分泌型免疫球蛋白A细胞增殖, 阻止肠道微生物及其毒素分子对肠黏膜的攻击。
益生菌对机体细胞免疫的影响, 主要包括激活巨噬细胞、B淋巴细胞和自然杀伤细胞, 促进白细胞介素和干扰素等细胞因子的产生。增强我们体内的免疫应答。
微生物在免疫疾病发病机制中的作用

Ruff W E,et al.Nature Reviews Microbiology.2020
✦肠相关疾病
•鸡肠球菌会导致多种免疫炎症
鸡肠球菌向肝脏的转移促进了自身免疫性肝炎,并与肺炎克雷伯菌和奇异变形杆菌一起,通过包括TH17细胞分化在内的多种机制导致原发性硬化性胆管炎。鸡肠球菌诱导的肝芳香烃受体(AhR)和内源性逆转录病毒(ERV)也参与了小鼠狼疮性肾炎的系统性抗ERV反应。
Leptotrichia goodfellowii能与小鼠Ⅰ型糖尿病自身抗原胰岛特异性葡萄糖-6-磷酸酶催化亚单位相关蛋白(IGRP)发生交叉反应。在小鼠Ⅰ型糖尿病中,未定义的微生物群易位到胰腺淋巴结并激活NOD2,而来自微生物群的NOD1配体的易位驱动自身免疫性胰腺炎。
NOD2作为一种胞内的模式识别受体在机体免疫系统抵抗胞内菌感染过程中起重要作用。
✦非肠相关疾病
微生物群对非肠道自身免疫性疾病的影响

Ruff W E,et al.Nature Reviews Microbiology.2020
鸡肠球菌影响多种免疫疾病
鸡肠球菌和乳杆菌(Lactobacillus)在系统性红斑狼疮模型中向肠系膜淋巴结、肝脏和脾脏转移,从而激活先天性(浆细胞样树突状细胞)途径。鸡肠球菌还刺激狼疮患者滤泡辅助因子和自身抗体的产生。
抗磷脂综合征是一种凝血性自身免疫性疾病,鸡肠球菌传染性支气管炎也加重了这种疾病,它诱导肝脏中的自身抗原β2GPI。
瘤胃球菌加重狼疮性肾炎
瘤胃球菌在狼疮性肾炎时扩张,可与狼疮双链DNA发生交叉反应。
粘附性侵袭性大肠杆菌可导致克罗恩病相关性脊柱炎。在关节炎模型中,分段丝状细菌还使CD4+T细胞向TFH细胞倾斜,并通过携带双TCRs的TH17细胞在同一模型中引发间质性肺病。
其他细菌
Ro60直系表达细菌在狼疮患者中引起Ro60自身免疫反应;肠道中的类泰奥托米克龙杆菌、口腔或肠道中的大量放线菌(Actinomycetes)和阿米巴棒状杆菌,除了狼疮外,还可能导致干燥综合征,丙酸杆菌与亚急性皮肤狼疮皮损通过交叉反应。
✦免疫特异性疾病
嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在多发性硬化症中增强TH1反应,并且未定义的微生物群与GDP-l-岩藻糖合酶(一种神经炎症疾病的自身抗原)交叉反应。
未定义的小鼠肠道微生物群与TH17细胞交叉反应,识别自身免疫性葡萄膜炎的自身抗原——视黄酸结合蛋白(IRBP)。
重要的是,微生物失调本身通过各种机制引起失调的免疫反应,包括辅助性T细胞倾斜、旁观激活、表位扩散、交叉反应和双T细胞受体(TCR)刺激,它们分别作用于疾病的易感性、引发和传播。
✦新冠患者肠道微生物改变
病毒感染可以改变胃肠道微生物群。一份报告确认了COVID-19患者粪便样本中乳酸杆菌和双歧杆菌(Bifidobacterium)的减少。同样,使用抗生素会干扰COVID-19患者的微生物组。
在新冠病毒清除后的30天内,肠道微生物组的改变依然存在,主要体现在以下菌属的减少:
普拉梭菌(Faecalibacterium Prausnitzii) ↓↓↓
直肠真杆菌(Eubacterium rectale) ↓↓↓
双歧杆菌(Bifidobacterium) ↓↓↓
✦微生物的变化导致免疫变化
某些微生物的变化可以增加对先天性免疫受体的刺激,例如核苷酸结合寡聚化域样受体和Toll样受体。该受体的刺激触发几个促炎症信号和细胞因子和趋化因子的产生,它们调节适应性免疫系统,影响局部和全身免疫反应。

✦肠外接种卡介苗增强肺部免疫力
最新的一项研究发现:肠外接种卡介苗,通过分枝杆菌(Mycobacterium)传播,引起肠道微生物组、屏障功能和微生物代谢物的时间依赖性改变,以及随后循环和肺代谢物的变化。
这些变化导致记忆巨噬细胞的诱导和肺部免疫力的增强。
注:这些数据确定了远端粘膜组织先天免疫记忆发育的肠道微生物群介导途径,并对开发针对呼吸道病原体的下一代疫苗策略具有重要意义。
小结
总而言之,这些研究表明,平衡的肠道菌群有助于维持宿主免疫稳态,而微生物失调本身通过各种机制引起失调的免疫反应。
可以说肠道菌群在促进免疫系统发育,维持正常免疫功能,协同拮抗病原菌入侵方面,发挥着重要作用。
既然免疫功能对我们如此重要,我们应该如何拥有一个健康的免疫系统来保卫我们的身体呢?谷禾在这里列举了一些可以提高免疫力的方法。
疫苗是将病原微生物,比如细菌、病毒等、以及细菌病毒的代谢产物经过人工减毒、灭活或利用转基因等方法,制成的用于预防传染病的自动免疫制剂。
预防传染病的疫苗已经彻底改变了医疗保健,延长了数百万人的生命。疫苗方法是安全、持久和有效的。鉴于致病菌与传染源具有相似的免疫靶点,这种方法可能对免疫介导的微生物感染性疾病也有用。
✦接种疫苗后免疫反应迅速高效
疫苗的作用是使身体产生专门对外部病毒、细菌或其他微生物的进行特异性免疫。通常,疫苗通过激活患者的免疫系统产生相应的抗体,在人体免疫系统进行特异性记忆,如果有同一种病毒或细菌攻击身体,免疫系统可以迅速反应,控制病毒、细菌或其他致病微生物。能有效的起到预防疾病、增强免疫力等作用。
疫苗在保护人类健康方面的影响是巨大的,疫苗使人类在面对传染病的威胁时,首次化被动为主动,在降低死亡率和提高人均预期寿命方面发挥了不可替代的作用。
在这里建议还未接种新冠疫苗的人们尽量都去接种,可以有效地保护我们的身体。
饮食和营养可以直接影响免疫系统或通过肠道菌群介导宿主免疫。饮食还可以加强肠道屏障,从而改善微生物群和宿主之间的界面。
✦营养不均衡导致免疫力下降
要吃出健康,进而增强身体的免疫力,最重要的就是营养充足及均衡,任何一种营养的缺乏都会导致经常性或长期性的疾病。
摄入不足也是不可取的,当人感觉到饥饿时,身体会分泌肾上腺素;如果体重每周减轻850g以上,抵御疾病和外来病毒的T细胞就会受到抑制。
专家建议,在搭配膳食时,要食用一些含不饱和脂肪酸的食物,摄入足够的蛋白质,多吃水果和蔬菜,多喝果汁和开水。而号称能提高免疫力的保健品作用并不明显。


✦维生素有助于增强免疫力
每天适当补充维生素和矿物质。专家指出,身体抵抗外来侵害的武器,包括干扰素及各类免疫细胞的数量与活力都和维生素与矿物质有关。例如维生素B、C、E等微量营养素,可以保护免疫细胞免受自由基的氧化损伤,维护上皮细胞组织,增强免疫力。
蔬菜、水果类
身体健康的人最好通过吃水果、蔬菜来提高免疫力,现在市场上销量较大的西红柿、草莓、胡萝卜、橘橙等都含有大量的维生素。
柑橘类水果:柑橘类水果富含维生素 C,能够促进免疫系统的发育和激活,例如:橘子、橙子、西柚、葡萄柚等。
浆果莓果:包括蓝莓、草莓、树莓、黑莓、蔓越莓、巴西莓、樱桃等,都是具备抗氧化,抗炎等功效的食物。
其他富含维生素或抗炎类的水果,例如:苹果、猕猴桃、番石榴(红心芭乐)、牛油果、葡萄、西瓜、哈密瓜、香蕉、杏、梨、芒果、山楂、桃子等。
蔬菜类食物:蔬菜类食物富含多种微量元素和维生素,例如:羽衣甘蓝、甜菜、菠菜、花菜、卷心菜、西兰花、芝麻菜、芥菜、芦笋、甜椒、抱子甘蓝、萝卜、香菜、甜叶菊、生菜、萝卜、番茄等都是对提高免疫力非常不错的食物。
豆类食物:豆类食物富含蛋白质和多种维生素,能够促进免疫系统的发育和激活,例如:鹰嘴豆、黑豆、扁豆等。
全谷类食物:全谷类食物富含纤维素和多种微量元素,能够提高免疫系统的活性。
鱼虾类食物:鱼虾类食物富含蛋白质和不饱和脂肪酸,能够促进免疫系统的发育和激活。例如:三文鱼、沙丁鱼、金枪鱼、鳟鱼、鲭鱼、鲱鱼等。
注意:有些鱼含有汞和其他污染物,孕妇和婴儿遵医嘱。
大蒜、洋葱
大蒜和洋葱都是热性食物,对改善体质有良好的作用。大蒜具有杀菌杀毒功能,吃大蒜最好生食,因为生蒜具有抗病毒、提高机体免疫力的作用。大蒜中所含的具有增强免疫力功能的有效成分大蒜素,在加热的过程中会失去功效。洋葱也是一种天然的杀菌杀毒食物,可以有效地抵抗病毒和细菌。
含锌食物
锌是人体不可缺少的微量元素,人体中许多种酶必须有锌参与才能发挥作用,锌对调节免疫功能十分重要。此外,它还有另一个功能,就是抗感染。每天摄入50~100毫克的锌,就可以预防流感。海产品、瘦肉、粗粮和豆类食品都富含锌。
食用菌类
蘑菇、猴头菇、草菇、黑木耳、银耳、百合等:都有明显增强免疫力的作用;
香菇所含的香菇多糖能增强人体免疫力。
鸡汤
喝鸡汤能够预防感冒和流感等上呼吸道感染性疾病。鸡肉中含有人体所必需的多种氨基酸,营养丰富,特别是其中所含的的半胱氨酸,可以增强机体的免疫力。此外,喝鸡汤对感染后加速痊愈也有积极作用。
姜黄
姜黄素是姜黄中的活性成分,研究表明它可以帮助对抗炎症、稳定血糖水平,甚至可以防止癌细胞生长。
生姜
生姜具有强大的药用价值,含有维生素C、镁和钾,与姜黄有着密切的关系。它还具有强大的抗炎和抗氧化特性。
蜂产品
蜂王浆:能提高机体免疫力及内分泌的调节能力,并含具有防癌作用的蜂乳酸(10-HDA);
蜂胶:蜂胶是蜜蜂采集胶源植物新生腋芽分泌物和蜜蜂自身分泌物(如蜂蜡)混合而成的天然产物,含有最为丰富的黄酮类化合物及其它生物活性成分。药理及临床证明,蜂胶能有效提高机体免疫功能,克服癌症的神奇功效。另外,长期服用蜂胶可减少成人慢性病的发生,对糖尿病、心脑血管病有改善的功效。
总之,多吃上述食物可以有效增强免疫力,帮助人体更好地抵抗外来物质的侵害。建议在饮食中搭配多种食物,以获得更多的营养,提高免疫力。
烹饪方式
相对健康的方式一般认为是:少糖、少盐、少人工调味料,运用各式香草、坚果、特级初榨橄榄油、适量海盐来调味。
总之,把握食材新鲜、多样的原则,简单清爽保留食物原味,避免过度烹调。
更多详见:
✦饮食对肠道菌群的影响也很大
在健康个体中,肠道微生物群的组成很容易因饮食而改变。有趣的是,饮食不仅会迅速影响人类肠道菌群,还会影响肠道病毒,这也可能有助于研究饮食如何影响免疫介导的疾病。
总体而言,特定宿主中饮食与微生物群落相互作用的复杂性和个体间差异使得为免疫介导的疾病制定特定饮食方案具有挑战性。然而,饮食调整仍然是一种提高免疫力的方法。
✦免疫需要充足的睡眠
睡眠与人体免疫力密切相关。良好的睡眠可使体内的两种淋巴细胞数量明显上升。睡眠时人体会产生一种称为胞壁酸的睡眠因子,此因子促使白血球增多,巨噬细胞活跃,肝脏解毒功能增强,从而将侵入的细菌和病毒消灭。
在黑暗中人体才会产生抵御疾病褪黑激素。睡眠不足或晚上长时间处于灯光下,都会减少褪黑激素的释放量,同时使雌激素的分泌增加,这样就很容易患乳腺癌。

✦适量的运动增强免疫
有规律、长期的适度锻炼能够增强身体的抵抗力。
研究显示,每天运动30到45分钟,每周5天,持续12周后,免疫细胞数目会增加,抵抗力也相对增加。
体育锻炼不仅有益于心血管,对改善情绪、减轻压力也很有好处。然而,活动强度要适当,如果感觉到吃力,超出了平常的承受能力,就要及时调整。
✦压力大抑制免疫作用
压力会使人体分泌类固醇激素和肾上腺素,这些荷尔蒙对人体免疫系统有抑制作用。这就很好地解释了为什么当人们处于压力状态下,如面临期末考试、情感出现危机时特别容易感冒。
噪音不仅伤害人们的听力,还会造成肌肉紧张、心跳加速、血管收缩和消化系统的不适———这和受到惊吓或感到压力时身体的反应是一样的。人如果长期处于噪音之中会导致血压、胆固醇水平和免疫功能的不良变化。
与朋友在一起时,由于感受到友情和社会认同,人的免疫系统会处于良好的状态。
为了证明此观点,巴黎身心健康中心的研究人员让参加实验的人与感冒病毒接触,然后由研究人员跟踪监测他们的社会交往情况。结果发现,和朋友、家人、同事相处时间越长的人感冒的几率越小。同时,拥抱、抚摸等身体接触也能使人体的免疫细胞更加活跃。
建议
免疫系统会受到思想和感觉的暗示,所以,我们应该保持积极向上的心态。最近的研究中也发现,消极、情绪低落、容易感觉到压力的人对肝炎病毒的抵抗力比乐观的同龄人弱得多。
注:美国的研究人员还发现,年轻时乐观的人比悲观的人多活12年。
考虑到宿主与微生物群相互作用对免疫的影响,针对微生物群的疗法在一定程度上也可以增强免疫能力。
✦益生菌、益生元疗法
益生菌或益生元或合生元、后生元(如短链脂肪酸)等单独或联合使用可能有助于增强宿主免疫,更好地控制感染,并随着我们年龄的增长产生适当的免疫反应。
益生菌产生代谢物可影响共生微生物群,肠屏障,免疫系统。益生菌还可以帮助预防或治疗细菌和病毒感染。益生菌的使用可以提高感染流感病毒的小鼠的存活率。除流感病毒外,研究还显示出对呼吸道合胞病毒感染的有益保护作用。
扩展阅读:
✦噬菌体
病毒以噬菌体为主导,而噬菌体与微生物群的细菌成员共同进化。天然噬菌体和合成噬菌体都可以代表一种针对性强的方法,与抗药性病原体类似,可以消灭免疫介导疾病中的致病菌。
例如,针对参与炎症性肠病发病机制的肺炎克雷伯菌菌株的噬菌体目前正被生物技术公司评估用于干预。
最近在动物模型中证明了在酒精性肝病中成功地将噬菌体靶向肠球菌。该方法对于其他与免疫介导的疾病有关的肠球菌属也是可行的,特别适合那些易患免疫介导疾病并被“关键病理生物”定植的个体。
还可以构想组合噬菌体疗法,以解决涉及免疫介导疾病的几种不同菌株,例如三个物种协同作用:肺炎克雷伯氏菌,变形杆菌和鸡肠球菌。
注:与疫苗接种方法类似,噬菌体疗法可能仍然存在理论上的风险,即在不同的情况下去除菌株可能是有益的。然而,这两种方法都比传统的抗生素更有针对性,会导致多种脱靶效应。
小结
鉴于肠道微生物对宿主免疫系统的影响越来越大,可以合理推测,通过个性化营养或补充,恢复相关的肠道微生物丰富度和功能,可能是一种对抗免疫适应性功能下降的预防措施。
免疫在身体中发挥着重要的作用。身体免疫力提高后能够阻断病毒的入侵,减少疾病发生,即使在生病以后恢复时间也比较快。
肠道微生物群是一个有待挖掘的宝藏,尤其在抵抗病原体包括病毒等方面。正如许多临床前研究所证明的那样,保持强壮丰富健康的微生物群可以通过维持免疫和营养需求等来提高宿主的活力和生存力。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Yeoh YK, Zuo T, Lui GC, Zhang F, Liu Q, Li AY, Chung AC, Cheung CP, Tso EY, Fung KS, Chan V, Ling L, Joynt G, Hui DS, Chow KM, Ng SSS, Li TC, Ng RW, Yip TC, Wong GL, Chan FK, Wong CK, Chan PK, Ng SC. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021 Apr;70(4):698-706. doi: 10.1136/gutjnl-2020-323020. Epub 2021 Jan 11. PMID: 33431578; PMCID: PMC7804842.
Ruff W E, Greiling T M, Kriegel M A. Host–microbiota interactions in immune-mediated diseases[J]. Nature Reviews Microbiology, 2020: 1-18.
Chowdhury MA, Hossain N, Kashem MA, Shahid MA, Alam A. Immune response in COVID-19: A review. J Infect Public Health. 2020 Nov;13(11):1619-1629. doi: 10.1016/j.jiph.2020.07.001. Epub 2020 Jul 14. PMID: 32718895; PMCID: PMC7359800.
Li XV, Leonardi I, Iliev ID. Gut Mycobiota in Immunity and Inflammatory Disease. Immunity. 2019 Jun 18;50(6):1365-1379.doi:10.1016/j.immuni.2019.05.023. PMID: 31216461; PMCID: PMC6585451.
Belkaid Y, Harrison OJ. Homeostatic Immunity and the Microbiota. Immunity. 2017 Apr 18;46(4):562-576. doi: 10.1016/j.immuni.2017.04.008. PMID: 28423337; PMCID: PMC5604871.
Kenneth Murphy,Casey Weaver 著,周洪 译。詹韦免疫生物学(原书第九版),科学出版社,2022.
Allert S, Forster TM, Svensson CM, Richardson JP, Pawlik T, Hebecker B, Rudolphi S, Juraschitz M, Schaller M, Blagojevic M, et al.(2018). Candida albicans-Induced Epithelial Damage Mediates Translocation through Intestinal Barriers. mBio 9.
谷禾健康

最杰出的物理学家之一的斯蒂芬·威廉·霍金想必大家都知道,以及曾经风靡全网的“冰桶挑战”,它们都与一种罕见疾病有关,那就是渐冻症。
媒体的宣传让渐冻症成为了较为“知名”罕见病之一;2000年丹麦举行的国际病友大会上正式确定6月21日为“世界渐冻人日”。但我们多数人对这种疾病的认知还不足。
什么是渐冻症?渐冻症是“肌萎缩侧索硬化症(简称ALS)”的通俗化叫法,该病一般以从四肢向中心进展,肢体肌肉逐渐消失,功能逐步丧失,直至呼吸肌消失,呼吸功能丧失,患者最后往往因呼吸衰竭而死。
渐冻症一般不会损害一个人的智力推理、视觉、听觉或味觉、嗅觉和触觉,这意味着,患者在保持清醒的状态意识到自己的情况在一步步恶化,感受自己的能力一点点退化。
渐冻症是一种罕见且严重的神经退行性疾病,会影响上下运动神经元,导致弥漫性肌肉麻痹,治疗选择较少。病因学和发病机制在很大程度上仍不清楚,但一些环境、遗传和分子因素被认为与疾病过程有关。
风险因素包括接触有毒物质、生活方式、饮食习惯、职业、体重等。研究表明,一些食物和营养素,包括红肉、钠、谷氨酸等,都可能是渐冻症的危险因素。我们知道饮食习惯、生活方式等因素都与肠道菌群状况息息相关。
新的研究确定了肠道菌群失调与神经退行性疾病(例如帕金森病、阿尔茨海默病、渐冻症)存在关联。
在这些疾病中,神经炎症越来越被认为是疾病发作和进展的驱动因素。肠道细菌在维持和调节免疫系统中起着至关重要的作用,肠道微生物组成的变化可以通过影响神经免疫相互作用、突触可塑性、髓鞘形成和骨骼肌功能来影响神经功能。
本文从渐冻症的症状、风险因素、形成原因、胃肠道和代谢功能障碍、与肠道菌群的关联和作用机理、可能的临床相关性、诊断(与其他一些神经退行性疾病的区别),带大家深入了解这一“特殊疾病”。文章的最后列举了一些现有的关于渐冻症干预方式的研究。
渐冻症
肌萎缩侧索硬化症 (ALS)
▪ 致命的神经退行性疾病
▪ 运动神经元退化,停止向肌肉发送信息
▪ 肌肉逐渐变弱、开始抽搐并萎缩
▪ 最终大脑失去启动和控制运动的能力
▪ 症状会随着时间的推移而恶化
▪ 晚期将背负巨大的心理压力和经济负担
不同的国家有不同的ALS发病频率。虽然这种疾病的世界平均发病率约为每100,000人每年1.9例。文献报道一些西方国家的ALS发病率很高,例如瑞典和苏格兰,每100,000人每年有3.8例,相反,东方国家,如中国每10万人年0.8例。
•中国渐冻症发病率相对较低
中国ALS患病率和发病率低于发达国家,并保持相对稳定的趋势。
一项研究调查研究共调查了7个省的城乡社区居民727,718人,其中城市居民占65.74%,农村居民占34.26%。
筛出肌萎缩侧索硬化患者9名,得出中国7个省肌萎缩侧索硬化总患病率为1.24/100,000。
•地区职业直接存在差异
不同省份患病率差别很大:
按区域划分:
按城乡划分:
从职业分布看:
7人职业为农民,占77.78%。
多在中年后发病,9例患者平均患病时间为50.33±13.90岁。
•医院渐冻症患者的性别占比:男性较多
在医院调查的169名肌萎缩侧索硬化患者中,117名男性,52名女性,男女性别比为2.25:1,在职业分布中,50.3%是农民,其中男性农民患者群体占比最高,共有63人,占所有医院调查患者的37.28%。
患病高峰年龄为60~69岁,男性平均患病年龄为61.43±12.66岁,女性平均患病年龄为59.98±12.76岁,男性较女性晚1~2年。医院调查中51.48%的患者没有慢性病史。
结论
(1)在中国7省的人群抽样调查中,肌萎缩侧索硬化的总患病率略低于世界其他国家和地区,农村患病率高于城市,发病时间略早于国际报道,而生存时间略低于国际报道。家族性肌萎缩侧索硬化患者较散发型发病时间早,生存时间长。
(2)人群调查和医院调查一致发现,筛查出的肌萎缩侧索硬化患者中男性占比高于女性,农民患者所占比例最高,大多数患者不伴有其他慢性病。
► 早期发病
发病主要分三种情况:一是从上肢发病;二是从腿部发病;三是从口腔肌肉发病
约 80%的ALS病例 通常表现为手臂或腿部持续无力或痉挛。
✦上肢发病最常见
上肢发病最常见,占比最高,发病过程表现为:
✦下肢发病
从下肢起病,患者可能表现为一侧肢体在走路时,脚背下垂,路面不平衡容易绊到,但没有麻木和疼感,只表现为走路越来越困难,下肢发病临床相对少见。
✦口腔肌肉发病非常罕见
第三种是患者说话不利索,此种临床最少见。疾病开始是说话不利索,感觉大舌头,容易与脑卒中相混淆,但又有区别。脑卒中患者出现的说话不利索是突发的,渐冻症则是逐渐出现说话不利索,是一个渐进过程,接着会出现吞咽困难。
早期发病主要表现为以下的特征:
注:肉跳可能是渐冻症早期比较明显的特征之一。
什么是肉跳?
肌肉出现不能控制的颤动,就是我们通常说的“肉跳”,其实是一群肌肉细胞不规则的不随意的收缩所引起的,在医学上称为肌束颤动(束颤), 肉跳可以仅发生在局部一小群肌肉,如眼皮跳动,也可以是较广泛地面部、肢体、躯干肌肉跳动。
肉跳也可分为两种情况,一种是良性的,另一种可能是渐冻症导致的。
良性“肉跳”常见的原因:运动、急性病毒感染、甲亢、手足抽搐、药物使用、焦虑等,其中,长时间运动是最主要的原因。
上述的良性“肉跳”,当然不是“渐冻症”了,但是,如果肌肉的跳动伴有肌肉的无力、萎缩,就应该高度警惕,可能的疾病包括:运动神经元病(渐冻症)、周围神经病变及少数的肌肉疾病,患者要尽快到神经内科神经肌肉疾病亚专科就诊!
发病共性
这三种发病情况都有一个共性,即感觉上没有特别明显的麻木和疼痛感。
注:上肢起病容易与颈椎病相混淆;下肢发病容易被怀疑成腰椎间盘突出;语言或吞咽困难发病时易与脑卒中相模糊。
► 中期
肌萎缩侧索硬化的病情是逐渐发展的,每个人的疾病表现不同,发展的速度也会不同,一般至少需要1年,通常不会超过5年。
随着病情的发展到了中期,可能会出现运动无力、呼吸困难等症状。
•吞咽困难
中期的肌萎缩侧索硬化症患者,由于身体内的神经系统受到了损伤,会连带咽喉周围的神经也受到一定的损害。这种情况严重时会压迫到患者的气管,就会导致患者出现吞咽困难的症状。
•肌肉无力
这种症状也是肌萎缩侧索硬化症中期患者比较常见的一种症状,这是由于患者的神经受到了损坏,导致大面积的肌肉和肌张力出现了减退的情况。这种情况严重时会使肌肉出现无力的症状,随着病情的发展,这种症状会更加明显,严重时会使患者丧失自理能力。
•呼吸受阻
当肌萎缩侧索硬化症中期的患者病情严重时,就会使患者的脑干神经元造成损害。一旦脑干神经元系统遭到破坏,就会使患者出现呼吸受阻的情况,严重时还可能会丧失说话能力,只能靠呼吸器来维持生命。
一小部分患者可出现运动系统以外的表现,如痴呆、感觉异常和膀胱直肠功能障碍等,少部分患者还可出现眼外肌运动障碍。
► 晚期
进入病程后期,除眼球活动外,全身各运动系统均受累,累及呼吸肌,出现呼吸困难、呼吸衰竭等。渐冻症晚期症状有肌肉萎缩、四肢僵硬等,具体如下:
•肌肉萎缩
肌肉萎缩明显,有肌无力、肌挛缩、四肢无力、不能动,有些患者出现舌肌萎缩、肌肉痉挛、病理反射阳性、腱反射亢进、吞咽困难、饮水呛咳,需要呼吸机辅助治疗;
•四肢僵硬
四肢僵硬:不能动弹,通过面部眼球活动来表达,称为闭锁状态,需要置胃管支持对症治疗,维持生命体征;
•体征紊乱
体征紊乱:呼吸、心跳、血压波动紊乱,以及全身电解质紊乱、内环境失衡。
渐冻症还会导致一些严重的并发症,例如营养不良、感染、压疮(褥疮)、沮丧、焦虑等问题。
肌萎缩侧索硬化(ALS)的患者可能因控制吞咽的肌肉损伤而出现营养不良和脱水。他们将食物、液体或唾液吸入肺部的风险也更高,这可能引起感染性肺炎。
注意
肌萎缩性侧索硬化症通常不会影响大脑或导致认知(思维)问题。然而,缺乏足够的营养会导致认知障碍,而这种疾病对身体造成的破坏性影响会导致抑郁。
一些患有肌萎缩性侧索硬化症的人在记忆和决策方面会存在问题,而另一些患者则会最终确诊患有额颞叶痴呆症。
值得注意的是:
一些ALS 患者的胃肠道不适其实是早于神经系统症状的。
年 龄
尽管该病可在任何年龄发作,但症状最常出现在 55 至 75 岁之间。
注:也有数据认为该病风险随着年龄增长而增长,最常见在40-65岁左右。
也有个别儿童渐冻症案例。
性 别
男性比女性更容易患肌萎缩侧索硬化。然而,随着年龄的增长,在70岁之后,男女之间的差异消失了。
生理指标
➤ 代谢类疾病
糖尿病:
糖尿病 和 ALS 之间实际的临床和病理生理学相关性尚不清楚,目前研究如下:
糖尿病对老年人 ALS 的发生具有保护作用,而对年轻受试者则相反。
预先存在的胰岛素依赖型糖尿病与较高的 ALS 风险相关(OR 5.38,95% CI 1.87-15.51)
➤ 炎症
有几条证据表明炎症是 ALS 的主要组成部分。通常,免疫细胞不会大量存在于中枢神经系统中。然而,肌萎缩侧索硬化患者的神经系统中存在免疫细胞,这些细胞会引起神经炎症(中枢神经系统炎症,包括大脑)。
其他包括氧化应激、线粒体功能障碍、谷氨酸毒性等都与引起肌萎缩侧索硬化或促进其进展有关。
这在后面章节会详细阐述。
生活方式:抽烟
吸烟和烟草烟雾暴露可能通过炎症、氧化应激和香烟烟雾中存在的重金属或其他化学物质引起的神经毒性增加 ALS 的几率。
美国的一项大型前瞻性研究(414493名男性和572736名女性参与者;617名男性ALS死亡,539名女性ALS死亡)报告称,甲醛暴露会增加ALS的风险,甲醛是香烟烟雾的一种成分。
身体创伤
头部创伤或电烧伤都可能与ALS相关。
一项研究招募了n=188名ALS患者,并从相同地区的普通人群中进行了2:1的对照。
头部创伤与ALS风险增加相关(调整后的比值比[OR]1.60 95%置信区间[CI]1.04-2.45),对症状发作前10年或更长时间发生的损伤影响更大(P=.037)。
报告严重电烧伤的患者ALS风险增加(调整后OR 2.86,95%CI 1.37-6.03),30岁后烧伤的比值比最高(OR 3.14),症状发作前10年或更长时间烧伤的比值比值比(OR 3.09).
繁重的劳动
一项早期的研究发现,繁重的劳动是一个危险因素,一项针对新英格兰建筑工人的病例对照研究(109例,253例对照)发现患病几率上升(OR = 2.9, 1.2–7.2).
注:具体关于身体活动在ALS病因中的作用的证据仍然没有定论。
种 族
白种人和非西班牙裔最有可能患上这种疾病。
研究人员正在研究环境因素的影响,例如接触有毒或传染性物质、病毒、饮食、抽烟、职业因素。
居住因素和化学品
ALS与许多化学品的接触有关,大多数支持证据都涉及农药、化肥、除草剂和杀虫剂等农业化学品。
澳大利亚报告了179对病例对照的类似发现。经常园艺(非职业接触)与ALS显著相关(OR = 6.64,95%置信区间 = 1.61–27.4)。按性别分层后,仅在男性中显示出显著的相关性(OR = 4.90,95%置信区间 = 1.11–21.7).
对60岁以下的人来说,靠近工业的住宅和污水处理厂或农场之间的联系也得到了证明。住在这些地方附近可能会接触到各种空气、水和土壤污染物。
最近,一项对66对年龄、种族和性别匹配的病例和对照进行的研究发现,职业接触杀虫剂与ALS之间的显著关联(OR = 6.50,95%置信区间 = 1.78–23.77).
重金属
重金属(铅、汞、镉等),尤其是铅,可能在ALS的发病和进展中发挥多种作用。
接触到铅或其他物质可能的场所或职业:
从事机械、绘画或建筑工作与ALS有关,其他职业包括农业、渔业、伐木和狩猎也可能与ALS有关。
在许多病例对照研究中,铅暴露与ALS有关。在新英格兰(109例和256例对照),血铅和骨铅水平升高与ALS发病率增加相关(OR = 1.9,95%置信区间 = 1.4–2.6).
在波士顿(95例和106例对照),自我报告的铅暴露与ALS相关(p = 0.02).
此外,还研究了其他金属,特别是汞和镉,但结果也不一致。重金属暴露(铅和汞)的复合测量与ALS风险增加显著相关(OR = 3.65). 虽然铅暴露与ALS相关,但尚未显示汞、镉或其他金属的关联和因果机制。
在一项小型日本研究(21例,36例对照)中,ALS患者晚期血浆和血细胞中的汞和硒水平显著低于对照组,这是由于他们的残疾,包括食用液体饮食。
在意大利进行的一项非常小的研究(9例)显示,患者的血镉水平明显高于对照组(排除了功能受损最严重的晚期患者)。
注:将不同金属的暴露分组在一起可能会导致暴露分类错误和检测关联的能力下降,这是目前和早期研究的局限性。
灰尘/纤维/烟雾
几项研究间接表明ALS职业性接触颗粒物。在某些职业环境中发现的空气尘埃、烟雾和纤维可能是空气中颗粒物的重要暴露。在许多研究中,已经对颗粒物暴露与神经系统结果进行了检查,并在几种职业环境中与ALS相关。
注:被调查的职业环境(兽医、美发师、分级和分拣师)可能会增加溶剂、金属和可能的其他介质的共暴露。没有研究直接评估暴露在环境中的颗粒物与渐冻症之间的关系。
辐射/电磁场
辐射已被认为是ALS的潜在危险因素,因为脊髓神经根病表现可能由长潜伏期的电损伤引起。
此前有三项研究报告了辐射或电磁场暴露之间的关联;有必要对此类风险进行进一步调查。
电气相关职业(OR = 1.3, 95% CI = 1.1-1.6),以及暴露于电磁场(OR = 2.3,95%置信区间 = 1.29–4.09)与ALS相关。
在美国五家大型电力公司(139905名男性)的队列死亡率研究中,ALS的死亡率与电磁场暴露工作的时间有关(RR = 2.0,95%置信区间 = 1.0–9.8) .
注意
由于以上部分实验样本量较小,再加上可能存在其他因素干扰,因此,应当谨慎关联。
大多数ALS病例都被认为是偶发性的。这意味着该病似乎是随机发生的,没有明确相关的危险因素,也没有该病的家族史。尽管散发性ALS患者的家庭成员患此病的风险增加,但总体风险很低,大多数人不会患ALS。
家族性(遗传性)ALS
大约5%到10%的ALS病例是家族性的,这意味着一个人从父母那里遗传了这种疾病。ALS的家族形式通常只需要父母一方携带致病基因。十几个基因的突变被发现会导致家族性ALS,例如C9ORF72、SOD1、SPTLC1、FUS、TARDBP、TDP-43、OPTN、TBK1等基因。
关于基因突变的作用机理将在下一章节详解。
ALS 的病理生理过程是多因素的,反映了遗传和环境因素之间复杂的相互作用。
本章节从以下几大方面来具体阐述渐冻症的发病机理:
截止目前,有几十个基因与肌萎缩侧索硬化有关,这些基因的突变约占所有家族性病例的三分之二。
1993 年至 2016 年间 ALS 的遗传图谱
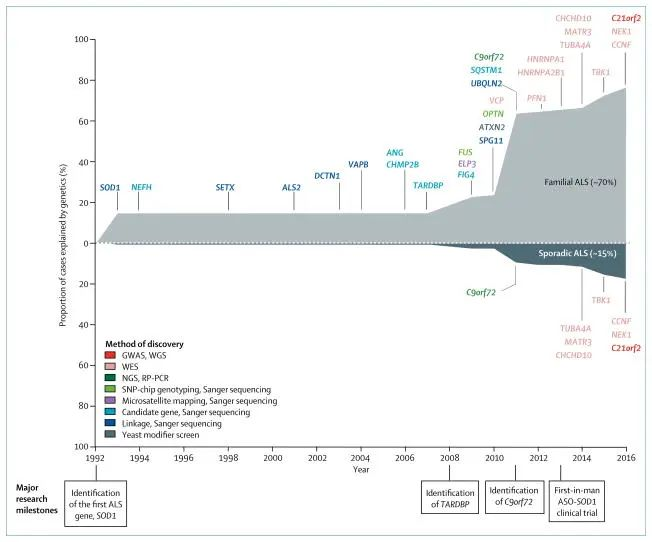
doi:10.1016/S1474-4422(17)30401-5
家族性肌萎缩侧索硬化病例约占所有肌萎缩侧索硬化病例的 10%。在这 10% 中,大约 70% 可以用遗传学来解释。
SOD1 :涉及运动神经元、神经胶质细胞和骨骼肌细胞
ALS家族病例与Cu/Zn超氧化物歧化酶(SOD1)的突变有关,这是一种保护细胞免受超氧化物自由基有害影响的关键抗氧化酶,表明SOD1功能的改变和/或异常的SOD1聚集对促进ALS发病有很大影响。
SOD1代谢的改变影响许多细胞功能,涉及不同的细胞类型(即运动神经元、神经胶质细胞和骨骼肌细胞),这些细胞类型可能相互作用以产生病理表型。
doi.org/10.3390/antiox11040614
在家族性肌萎缩侧索硬化症(FALS)和散发性肌萎缩侧索硬化症(SALS)中均发现了铜/锌超氧化物歧化酶-1(SOD1)基因,但在中国肌萎缩侧索硬化患者中研究较少,且大样本研究较少。
四川大学华西医院神经内科的 499 名 ALS 患者(487 名 SALS 和 12 名 FALS),并SOD1突变频率在SALS中为1.03%(5/487),在来自中国西南地区的FALS中为25%(3/12)。
OPTN :通过功能丧失突变引起ALS
OPTN是唯一已知的被认为通过功能丧失突变引起经典 ALS 的基因。
OPTN通常抑制 NF-κB 活性,这是先天免疫反应的一个关键组成部分,并且在其缺失或突变形式下,NF-κB 易位至细胞核并促进大量促炎基因的表达,从而增强小胶质细胞介导的神经炎症。
注:OPTN是否直接影响 NF-κB 是一个有争议的话题;然而,大多数研究都认为突变型OPTN与 NF-κB 通路失调有关,从而促进促炎反应。
TBK1 :参与多种 ALS 相关通路,如自噬和神经炎症
TBK1的突变与肌萎缩侧索硬化有关。TBK1 蛋白结合并磷酸化许多蛋白质,包括 OPTN 和 sequestosome-1/p62,并调节先天免疫和自噬。
TBK1 属于参与先天免疫信号通路的 IKK 激酶家族;具体而言,TBK1 是 1 型干扰素的诱导剂。TBK1 在自噬和线粒体自噬中也起着重要作用。
TBK1 的突变可能导致自噬受损,自噬缺陷可能导致运动神经元中蛋白质聚集体、自噬体和受损线粒体的积累。神经元损伤可能触发神经元周围细胞的先天反应,导致神经炎症,引发ALS。
在大约 1% 的家族性 ALS 患者和大约 1% 的散发性 ALS 患者中发现了TBK1突变。
TNIP1 :炎症信号传导的关键抑制因子
根据一项针对中国、欧洲和澳大利亚人群的大型全基因组关联研究,TNIP1的突变与肌萎缩侧索硬化有关。
TNIP1 在功能上与 OPTN 相关,并抑制 NF-κB 活化和肿瘤坏死因子 (TNF) 诱导的 NF-κB 依赖性基因表达。TNIP1 功能障碍或缺陷可能使健康细胞容易对其他无害的 TLR 配体暴露产生炎症反应。TNIP1还与几种免疫疾病有关,包括狼疮和牛皮癣。
SQSTM1 :损害聚集蛋白降解和自噬引起ALS
在 ALS 患者中发现了几种新的 SQSTM1突变。
SQSTM1基因编码 p62,一种调节自噬和氧化应激的主要病理蛋白(下图)。
自噬和炎性体通路在肌萎缩侧索硬化中的相互作用
doi.org/10.1016/S1474-4422(18)30394-6
SQSTM1中的突变会改变 p62 的功能,并通过损害聚集蛋白降解和自噬来促进 ALS 的病理生理学。
VCP : VCP突变会影响肌肉、骨骼和大脑
VCP基因的突变与家族性和散发性肌萎缩侧索硬化有关。
VCP 是自噬和泛素化-蛋白酶体途径(另一种降解和处理受损、错误折叠和过量蛋白质的细胞机制)的重要组成部分。VCP中的突变会损害整体蛋白质降解并导致 TDP-43 沉积,从而导致包涵体肌病、Paget 病、额颞叶痴呆或 ALS. VCP突变是 1%-2% 的家族性ALS 病例的原因。
CX3CR1 :突变会损害小胶质细胞的神经保护反应
CX3CR1 是小胶质细胞上的一种特异性受体,可与 fractalkine(一种从运动神经元释放的蛋白质)结合,从而促进神经保护反应。受体 CX3CR1 的突变会损害 fractalkine 结合并导致 ALS 患者的生存时间缩短,但不会增加患病风险。
CX3CL1/CX3CR1 通讯系统具有抗炎和神经保护作用,在维持自噬活性中起重要作用。
然而,CX3CR1是一种 ALS 疾病修饰基因;CX3CR1的多态性会损害先天免疫小胶质细胞的神经保护反应,为其在 ALS 疾病发病机制中对神经炎症的作用提供证据。
这些突变基因提供了免疫系统诱导的炎症机制参与 ALS 发病机制的直接证据。此外,这些突变基因表明自噬抑制了 NLRP3 炎症小体的激活,并且这些免疫相关基因的突变阻止了炎症小体介导的激活的生理抑制,因此激活了炎症通路(IL-1β 和 IL-18 ) 并有助于 ALS 发病机制。
TARDBP :突变对细胞造成损害
ARDBP的突变与 ALS 和额颞叶痴呆的家族病例有关。
TARDBP基因提供了构建一种称为TDP-43的蛋白质的指令,这种蛋白质通常位于细胞核中,并参与蛋白质生产的各个步骤。TARDBP基因突变导致TDP-43蛋白在细胞核外形成聚集体(团块),对细胞造成损害。
约97%的ALS患者中发现了TDP-43聚集体,包括TARDBP基因没有突变的人。
C9orf72 :与神经变性、炎症、免疫相互作用有关
多项研究探索了C9orf72介导的疾病的致病机制。C9ORF72 与神经变性、炎症和我们与环境的免疫相互作用的调节有关。
C9orf72 突变难以发现的原因之一是该突变位于C9orf72 基因的一个内含子中。
在 ALS 患者的C9orf72中记录了小胶质细胞炎症活动的显着增加,并且与更快的疾病进展相关。
注:激活的小胶质细胞是 ALS/FTD 病理学的普遍特征,C9orf72在骨髓细胞中具有重要作用。
三种主要的疾病机制:C9orf72蛋白的功能丧失和C9orf73重复RNA或由重复相关的非ATG翻译产生的二肽重复蛋白的功能毒性增加。
注:NEK1 和 C21orf2 相互作用,参与微管组装、DNA 损伤反应和修复以及线粒体功能。
MATR3 :突变与神经肌肉功能退化相关
MATR3 是一种 RNA 和 DNA 结合蛋白,可与TDP-43 相互作用,TDP-43 是一种与ALS和额颞叶痴呆相关的疾病蛋白。
在具有MATR3突变的 ALS 患者中,上运动神经元和下运动神经元受到影响,生存期为 2-12 年。
过表达MATR3 蛋白的转基因小鼠出现后肢麻痹和肌肉萎缩,表明神经肌肉功能对 MATR3 水平敏感。
2014 年,MATR3 的四个突变(p.S85C、p.F115C、p.P154S 和 p.T622A)通过外显子组测序在四个单独患有 ALS 或同时患有 ALS 和痴呆症的欧洲血统家族中被鉴定出来。自 2014 年以来,已描述了 11 种其他变异,主要发生在散发性 ALS 患者中。
CCNF :突变导致异常的蛋白停滞
CCNF是Skp1-cullin-F-box E3泛素连接酶复合物的底物识别成分,该复合物负责用泛素标记蛋白质,并通过泛素蛋白酶系统标记其降解。
CCNF的突变可能导致异常的蛋白停滞,而TDP43蛋白病可能会加剧这种情况。因此,提高蛋白质清除率或减少泛素化的疗法可能是可行的治疗方法。
其他相对较为罕见的突变基因还包括:
CCHHD10、TUBA4A等。
与肌萎缩侧索硬化相关的基因之间的相互作用
10.1016/S1474-4422(17)30401-5
外圈是核型表意文字,显示24条染色体(22条常染色体,X染色体,Y染色体);内圈显示每个基因的位置。基因之间的联系代表蛋白质或基因水平的相互作用。交互数据是从交互数据集的生物通用存储库中获得的。黑线表示细胞遗传学条带模式。与基因或相互作用有关的生物过程用颜色表示。
越来越多的证据表明整个 ALS 的免疫系统都存在异常。免疫细胞被激活并导致 ALS 周围和中枢神经系统中的慢性促炎微环境。
ALS的促炎症是全身性的,外周免疫系统(PIS)和中枢免疫系统(CIS)之间存在串扰。迄今为止,串扰还没有得到很好的定义。
随着对 ALS 的深入了解,研究人员已经意识到这两个系统持续互动和交流的重要性。CNS驻留免疫细胞和外周免疫细胞通过免疫分子相互作用。
功能失调的中枢神经系统屏障,包括血脑屏障(BBB)和血脊髓屏障(BSCB),为“串扰”打开了大门,也受到炎症环境的调节。因此,慢性全身炎症导致MN死亡、运动神经元轴突受损和神经肌肉接头功能障碍。
PNS和CNS之间的免疫串扰示意图
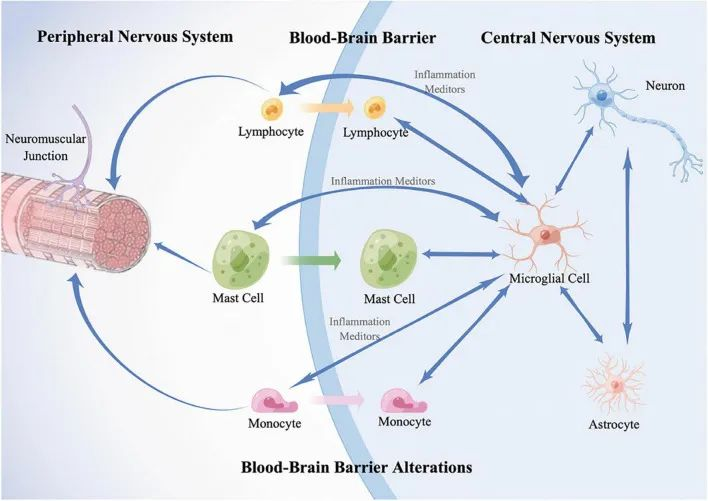
doi: 10.3389/fnagi.2022.890958
双头箭头表示两个细胞的通信。蓝色单箭头表示细胞释放炎症介质并影响其目标。橙色、绿色和紫色箭头分别表示外周细胞浸润到中枢神经系统。
在中枢神经系统中,常驻免疫细胞小胶质细胞被激活并通过释放促炎或抗炎物质(例如细胞因子)并与浸润的外周免疫细胞相互作用来介导神经炎症;星形胶质细胞控制小胶质细胞的活化、迁移和增殖。
在 PNS 中,常驻免疫细胞(包括 T 淋巴细胞、肥大细胞和单核细胞)被激活并沿外周运动神经和神经肌肉接头浸润。同时,它们渗入由小胶质细胞衍生的炎症介质触发的中枢神经系统。
此外,CNS 屏障功能障碍,包括血脑屏障 (BBB) 和血脊髓屏障 (BSCB),有助于外周免疫细胞浸润并加速有害相互作用。因此,跨越两个系统的炎症反应会导致运动神经元 (MN) 死亡、MN 轴突损伤和神经肌肉接头功能障碍。
▋ ALS中的中枢神经系统普遍存在炎症
神经胶质细胞,包括小胶质细胞和星形胶质细胞,触发神经炎症反应,与浸润的外周免疫细胞相互作用,最终诱导或加速 ALS 中枢神经系统的神经元死亡。
小胶质细胞 是中枢神经系统的常驻先天免疫细胞,通过释放包括细胞因子和趋化因子在内的免疫分子来介导神经炎症。小胶质细胞激活是异质的,取决于病理损伤的性质。
越来越多的研究证明,小胶质细胞在疾病发作时表现出抗炎表型并保护运动神经元,而终末期小胶质细胞转变为促炎表型并加重 ALS 中运动神经元的神经变性。
活化的小胶质细胞通过分泌活性氧和促炎细胞因子(包括 IL-1β、IL-6 和 TNFα)促进细胞毒性。
星形胶质细胞 是大脑中最常见的胶质细胞,维持中枢神经系统屏障,分泌神经营养和神经保护因子,调节神经递质摄取和循环,促进神经发生。研究已经确定星形胶质细胞作为免疫调节剂的作用,因为它们可以控制小胶质细胞的激活、迁移和增殖。
因此,星形胶质细胞和小胶质细胞释放的炎性细胞因子可能促进谷氨酸兴奋性毒性,从而将神经炎症和兴奋性毒性细胞死亡联系起来。
当达到临界阈值时,反应性星形胶质细胞和小胶质细胞可能引发不可逆的病理过程,随后导致 ALS 患者运动神经元的非细胞自主死亡。
在大脑和其他神经组织中,细胞因子在神经元、星形胶质细胞和小胶质细胞之间进行交流。
ALS 中主要病理生理事件的示意图
编辑
炎症通路失调不仅存在于 10% 的具有阳性家族史的 ALS 患者中,而且存在于 90% 的散发性 ALS 患者中。
散发性 ALS 患者的 CNS 反应性小胶质细胞和星形胶质细胞炎症也有所增加,并激活了浸润 CNS 的外周单核细胞和淋巴细胞。在散发性 ALS 患者中引发这种免疫失调的原因尚不清楚。炎症细胞因子 IL-6 由转基因 mSOD1 小鼠和 ALS 患者中活化的巨噬细胞和小胶质细胞分泌。
▋ ALS 外周的免疫激活
ALS 中存在外周免疫异常。一般来说,慢性外周免疫反应在 ALS 中是促炎性的。淋巴细胞、单核细胞(包括巨噬细胞)、中性粒细胞、自然杀伤 (NK) 细胞和肥大细胞 (MC) 是外周常驻免疫细胞。发现 ALS 患者血液中的总白细胞计数升高。
在外周血中大多数研究表明,神经保护性 CD4 T 淋巴细胞水平降低,而 ALS 患者的 CD4 T 淋巴细胞亚群,调节性 T 细胞 (Tregs) 减少和功能障碍。在 ALS 中,外周血中细胞毒性 CD8 T 淋巴细胞的数量存在争议。NK T 淋巴细胞被认为对 ALS 有害,并且在 ALS 患者的外周血中增加。
B 淋巴细胞仅在 ALS 中被讨论,研究表明它们在 ALS 的发病机制中起补充作用。据报道,单核细胞比例发生了变化,ALS 患者的循环单核细胞优先分化为促炎表型。外周血中的中性粒细胞数量增加,并显示与疾病进展显着相关。
NK 细胞是先天免疫细胞并介导细胞毒性。ALS 患者血液中的 NK 细胞水平升高,可能具有致病性。
在 ALS 小鼠中显示循环肥大细胞数量增加,而在 ALS 患者中缺乏证据。
远端轴索病变是 ALS 公认的病理特征 。在 ALS 中观察到活化的肥大细胞、巨噬细胞和中性粒细胞沿着坐骨神经和骨骼肌中退化的运动轴突募集。
外周免疫细胞也可渗入中枢神经系统,对运动神经元和神经胶质细胞产生影响,下文将对此进行讨论。外周免疫细胞在其预后作用方面的讨论越来越多。在这方面,随着技术和认识的发展,研究人员已经转向探索特定人群或单个骨髓亚群来对患者进行分类或监测。
▋ ALS中枢神经系统屏障的改变
CNS 屏障由一层内皮细胞形成,由内皮间紧密连接 (TJ)、粘附蛋白和细胞质连接。称为基底层 (BL) 的基底膜被周细胞和星形胶质细胞末端包裹,支持内皮细胞和相关的周细胞。
它们构成了 CNS 的物理屏障,而 CNS 的生化屏障是由各种运输系统赋予的。
在 ALS 患者和小鼠的早期观察到脑屏障的改变,表明损伤可能有助于发病机制。
这些变化总结如下:
CNS 障碍是中枢免疫系统和外周免疫系统之间基于体液的交流的中心点。更好地了解 CNS 屏障的完整性或功能是如何改变的,可能会提供终止 ALS 中有害串扰的方法。
★ 血脑屏障 (BBB) 和血脊髓屏障:维持CNS稳态
血脑屏障 (BBB) 和血脊髓屏障 (BSCB) 是基于毛细血管的屏障,分别将大脑和脊髓组织与外周血液循环分开。这两个屏障在形态上相似,因为它们都位于无孔毛细血管内皮细胞内,毛细血管内皮细胞通过紧密连接和粘附分子密封在一起。
虽然 BSCB 具有比 BBB 更高的连接渗透性,但这两个屏障严格调节营养物质、内源性化学物质、代谢物和异生素进出中枢神经系统 (CNS) 的细胞旁和跨细胞交换。 因此,它们在维持 CNS 微环境的稳态方面发挥着重要作用,这对于正常的神经元功能至关重要。
此外,这两种屏障都高度表达各种外源性外排传输泵,这些泵是 ATP 结合盒 (ABC) 转运蛋白超家族的成员。
★ 转运蛋白在两个屏障的表达水平的变化,改变大脑和脊髓组织中的药物浓度
P-糖蛋白 (P-gp)、乳腺癌耐药蛋白 (BCRP) 和多药耐药相关蛋白 2 (MRP2) 等多种外源性转运蛋白的管腔毛细管表达,是向大脑和脊髓输送药物的主要障碍脐带,因为它们的集中外排活性将药物从屏障内皮质膜或胞质溶胶隔室泵回血液以进行后续清除。
注:P-gp:P-糖蛋白是一个比较常见的保护细胞免受外来有害分子入侵的分子泵,它位于细胞膜上,不停的“搜查”着外来的疏水分子,就如同一个守护细胞的“保安”。
这些转运蛋白在两个屏障的表达水平的变化可以改变大脑和脊髓组织中的药物浓度。因此,了解 BBB 和 BSCB 的转运蛋白活动对于更准确地预测 CNS 中的药物药代动力学和药效学至关重要。
★ 利鲁唑在 CNS 中的全部治疗功效受这些转运蛋白的限制
在一些 ALS 患者的 CNS 屏障处诱导 P-gp 是可能的,并且可能解释了确定有效的 ALS 药物治疗的困难。此外,目前 FDA 批准的唯一用于 ALS 管理的药物利鲁唑被建议作为 P-gp 和BCRP底物。
由于利鲁唑是两种 ABC 异源外排转运蛋白 P-gp 和 BCRP 的底物,利鲁唑在 CNS 中的全部治疗功效可能会受到 BBB 和 BSCB 上的这些外排转运蛋白的限制。
最近在体内使用 ALS 小鼠模型的研究表明,在疾病进展的晚期,P-gp 和 BCRP 转运活性和表达在 CNS 屏障中被诱导。这些诱导可能会进一步限制利鲁唑在中枢神经系统中的治疗功效。
ALS 诱导的 P-gp 上调可进一步限制利鲁唑穿过 CNS 屏障的渗透性,并降低其在神经元靶位点的浓度,从而降低其治疗效果。在这种情况下,应在预期在 CNS 屏障处诱导 P-gp 的患者的整个 ALS 进展过程中,研究作为 P-gp 底物的 CNS 药物疗法的剂量或治疗窗口的适当调整。
总之,防止 P-gp 诱导或底物相互作用的药理学干预可用于提高在 CNS 屏障处显示 P-gp 诱导的 CNS 疾病(例如 ALS)的治疗效果。
★ ALS 物理屏障完整性的破坏
多项研究发现 ALS 患者 CNS 屏障的超微结构发生改变,包括微血管内皮细胞肿胀和细胞质空泡化、周细胞覆盖率降低以及 ALS 患者脊髓中星形胶质细胞末端足突与内皮细胞的分离。
在脑干、颈椎和腰椎脊髓中也观察到超微结构改变,但在 ALS 小鼠的运动皮层中没有观察到。已注意到这些改变发生在疾病的早期阶段,并随着疾病的进展而恶化。
TJ 由多种蛋白质形成,例如 zonula occludens-1 (ZO-1) 和 occludin,并阻止溶质的细胞旁运动。在 ALS 患者和小鼠的脊髓中观察到 TJ 和粘附蛋白(如 ZO-1 和 occludin)的表达显着降低。尽管粘附蛋白发生了变化,但在电镜下发现 ALS 患者死后脊髓中 TJ 的形态结构保存完好。尽管保留了 TJ 的形态结构,但 CNS 中内源性蛋白质的检测表明 CNS 屏障的细胞旁通透性和渗漏性增加。
ALS 患者和小鼠中均观察到基底层( BL )增厚:
内皮细胞的脱离使 BL 暴露于 BL 内的血浆蛋白、纤维蛋白和胶原蛋白 IV,然后积累,导致 BL 增厚。由于在 ALS 小鼠的早期阶段检测到 BL 异常,这些发现表明它可能作为补偿机制或修复过程发生。
基于这些发现,超微结构异常和 TJs 粘附蛋白表达减少可能导致连接完整性受损和细胞旁通透性增加,从而允许外周物质和细胞进入中枢神经系统。因此,它促进了外周免疫系统 和 中枢免疫系统 的交流,并加速了全身性炎症反应。
★ 生化中枢神经系统屏障的功能调节
生化中枢神经系统屏障由各种运输系统赋予,例如 ATP 结合盒 (ABC) 蛋白。它们可以有效地从内皮细胞中排除各种内源性和外源性毒素,以维持细胞稳态。研究最深入的 ABC 蛋白 P-糖蛋白 (P-gp) 是在 CNS 屏障上表达的脂溶性小分子的主要外排转运蛋白。
P-gp 的表达和活性在 ALS 患者和小鼠中均上调。 肿瘤坏死因子 α (TNF-α) 和生长因子-β 1(TGF-β1) 显示可上调小鼠和大鼠中 P-gp 的表达和活性。 由于 ALS 患者和小鼠体内 TNF-α 和 TGF-β1 水平升高,它们与 P-gp 的过度表达有关。
此外,星形胶质细胞也被怀疑是依赖于 ALS 基因型的 ALS 中 P-gp 表达增加的原因。例如,共培养的 ALS 相关突变体 SOD1 星形胶质细胞通过分泌 TNF-α、趋化因子和活性氧 (ROS) 等可溶性因子影响附近内皮细胞中的 P-gp。
同时,ALS 相关突变体 C9orf72 星形胶质细胞已被证明对内皮 P-gp 表达没有影响。此外,另一种外排转运蛋白乳腺癌耐药蛋白 (BRCP) 的表达在 ALS 患者和小鼠中上调。
一般来说,CNS 屏障中 P-gp 和 BRCP 丰度和活性的增加表明生化 CNS 屏障界面功能的调节,这可能最终影响 ALS 的发展。
▋ 屏障细胞分泌神经免疫相关物质
屏障细胞,包括内皮细胞、周细胞和星形胶质细胞,分泌神经免疫相关物质以响应外周或中枢免疫细胞的免疫刺激。脑内皮细胞 (BEC) 可以组成型分泌白细胞介素 6 (IL-6)、前列腺素和一氧化氮以响应不同的刺激。
由于 ALS 中周细胞数量减少,其炎症介导作用也可能导致 ALS 病理。与其他屏障细胞相比,周细胞对 TNF-α 最敏感,可以释放 IL-6 和巨噬细胞炎症蛋白-1α(MIP-1α,也称为 CCL3)作为反应。
炎症反应性周细胞通过释放 IL-8 和基质金属蛋白酶 9 (MMP-9) 支持中性粒细胞迁移,从而导致神经炎症的后续发展。
星形胶质细胞在 ALS 的免疫反应中被激活。
一方面,星形胶质细胞通过多种炎症因子控制小胶质细胞的激活、迁移和增殖,并分泌介导单核细胞迁移的 MCP-1 等蛋白质,从而放大 CNS 中的神经炎症。
另一方面,屏障上反应性星形胶质细胞释放的一氧化氮、血管内皮生长因子(VEGF)、胶质细胞源性神经营养因子(GDNF)和MM-9等生化物质调节TJ蛋白的表达和增殖内皮细胞,从而影响 CNS 屏障的完整性和渗透性。
因此,屏障细胞不仅可以将信息从一侧传递到另一侧(如 外周免疫系统 到 中枢神经系统),还参与介导炎症微环境。
在 ALS 中,受损的运动神经元与胶质细胞相互作用,它们释放一定水平的细胞因子和趋化因子,随后募集先天性和适应性免疫细胞浸润 CNS 以促进炎症。
促炎信号从中枢免疫系统传播到 外周免疫系统,从外周免疫系统传播到中枢免疫系统,从而促成了 ALS 的全身炎症环境。
▋ ALS中的细胞因子和趋化因子
许多细胞因子和趋化因子,例如 IL-1、IL-6、TNF 和 CC 趋化因子配体 2 (CCL2),已被证明可以穿过 中枢神经系统屏障,而这些屏障介导它们的运输、渗透和摄取。
一方面,由于免疫细胞的激活,ALS中细胞因子和趋化因子的水平发生显着变化(见表)
另一方面,促炎介质水平升高会增加 CNS 屏障的通透性,直接作用于它们的受体以改变驻留细胞的功能,诱导免疫细胞运输,并加剧屏障破坏和神经炎症。
细胞因子和趋化因子在 ALS 中的主要作用



doi: 10.3389/fnagi.2022.890958
▋ 周围免疫细胞的中枢神经系统浸润
越来越多的证据表明,许多外周血白细胞首先在外周免疫系统中被激活,然后在 ALS 中迁移到中枢免疫系统。
白细胞向中枢神经系统运输的调节是多方面的,取决于白细胞的激活状态、内皮界面的 TJ 复合物以及 中枢神经系统和 PNS 中的炎症微环境。
由于外周白细胞可以很容易地监测,并且鞘内或脑室内与多种风险相关,因此在 ALS 治疗中靶向外周白细胞可能是可行的。因此,需要更好地了解外周免疫细胞如何渗入中枢神经系统。
★ T 淋巴细胞
ALS 中 T 淋巴细胞的浸润是众所周知的。趋化因子和趋化因子受体对于实质浸润至关重要。慢性炎症环境诱导内皮细胞表面白细胞粘附的上调,内皮细胞与 T 淋巴细胞上表达的 CD6 结合,使其进入脑实质。此外,T 淋巴细胞衍生的 TNF-α 和 IL-17 诱导免疫细胞和运动神经元分泌 MM-9,促进 T 淋巴细胞浸润到 CNS。
大量证据强调了 T 细胞亚群之间的差异及其在 ALS 中进入 CNS 的特定机制。例如,内皮细胞分泌 CXCL9、CXCL10、CXCL11、CCL19、CCL21 和 MCP-1 等趋化因子,通过 CNS 屏障募集 CD4 + T 细胞。对神经炎症具有抑制作用的 Treg 细胞被激活并通过CCL5/CCR5 和 CCL6/CCR6 机制募集到 CNS,以抑制疾病早期小胶质细胞的激活。
CD8 + T 细胞显示出强烈的浸润,并通过在活化的小胶质细胞和受损的运动神经元中表达的 MHC-I诱导运动神经元死亡。
★ 肥大细胞
先前研究的结果表明,肥大细胞在 PNS 的早期退化中发挥作用,并对神经元损伤产生连锁反应。后来的研究证实了肥大细胞在 ALS 患者脊髓中的浸润。MC 上受体的表达受激活的小胶质细胞释放的 IL-6、CCL5 和 TNF-α 的影响,从而调节肥大细胞激活和 CNS 募集。
此外,肥大细胞可以向 TJs 和细胞外基质成分释放蛋白酶,从而影响 BBB 的通透性和完整性,导致 肥大细胞侵入 CNS。
★ 单核细胞
外周单核细胞可以很容易地取样。越来越多的证据表明,浸润性单核细胞来源的巨噬细胞是中枢神经系统小胶质细胞的同系物,并通过 ALS 中受损的血脑屏障进入中枢神经系统。人血单核细胞在体外很容易获得并且很容易分化成巨噬细胞。
有限数量的活化外周单核细胞浸润中枢神经系统, 并影响 ALS 中的神经炎症。先前的研究表明 ALS 中单核细胞的比例发生了变化。在快速进展的 ALS 患者中,外周循环中的单核细胞通常处于促炎状态。最近,外周单核细胞已被证明可以浸润 CNS,这与 ALS 中运动神经元存活率的提高有关,但浸润可能是有限的。
此外,单核细胞衍生的巨噬细胞在 ALS 中被激活。激活的巨噬细胞通过在疾病期间错误折叠蛋白质清除来发挥神经保护功能。巨噬细胞也显示出对中枢神经系统的有限浸润。
中枢神经系统中单核细胞的积累是由于浸润细胞的增殖,而不是积累的循环单核细胞的浸润。
★ Treg 细胞
Treg 是免疫耐受的细胞介质,具有抑制各种类型免疫反应的能力。Tregs 的主动抑制在控制自身抗原反应性 T 淋巴细胞和诱导体内外周耐受中起着关键作用。
Tregs 可防止激活的 Tresps 的激活和效应功能。
在从患有快速进展的 ALS 患者分离出的血液白细胞中,Tregs 的数量及其 FOXP3 蛋白表达均减少,并且这些水平与疾病进展率呈负相关。
FOXP3、TGF-β、IL-4 和 GATA-3(一种 Th2 转录因子)的 mRNA 水平在快速进展的患者中降低,并与进展率呈负相关;FOXP3 和 GATA3 都是进展率的准确指标。
在缓慢和快速进展的患者之间没有发现 IL-10、TBX21(Th1 转录因子)或 IFN-γ 表达的差异。
在表观遗传学上,Treg 特异性去甲基化区域的甲基化百分比在 ALS Treg 中更高。在体外扩增后,ALS Tregs 恢复了对对照 Tregs 水平的抑制能力,这表明扩增的 Tregs 的自体被动转移可能提供一种新的细胞疗法来减缓疾病进展。
★ 其他免疫细胞:中性粒细胞、自然杀伤细胞
很少有研究讨论中性粒细胞和 NK 细胞在神经免疫串扰中的作用。然而,考虑到外周血中中性粒细胞和 NK 细胞数量的增加与疾病进展之间存在显着相关性,以及它们在先天免疫反应中的作用, 它被认为以复杂的方式影响中枢神经系统的神经炎症。
例如,终末期 ALS 小鼠在脊髓中显示出高 NK 细胞频率。
NK 细胞衍生的 IFN-γ 诱导小胶质细胞向炎症表型发展,调节 CCL2 的释放,CCL2 是一种趋化因子,可调节来自运动神经元的 CNS 浸润,并损害 Treg 细胞迁移。
小 结
上文充分讨论了涉及中枢免疫细胞和外周免疫细胞、中枢神经系统屏障、细胞因子和趋化因子的串扰。所有这些元素的功能障碍导致运动神经元的非纤维素性死亡。这些交流在ALS的全身炎症环境中起着重要作用。
中枢神经系统屏障在串扰中起着至关重要的作用。值得注意的是,神经炎症的影响是双重的,因为它在疾病期间发挥神经毒性或神经保护作用。
使免疫串扰和稳态正常化而不是抑制炎症,可能为今后的研究提供潜在的治疗目标和方向。
与健康人相比,肌萎缩侧索硬化症(ALS) 患者的肠道微生物组发生了变化,其中包括潜在保护性菌群和其他具有促炎的菌群失衡。
编辑
最初进行的研究的特点是小规模和精选的患者队列,甚至只有不到 10 个个体,提供了相对一致的数据来支持 ALS 中的生态失调。
涉及肌萎缩侧索硬化的微生物群的系统发育分布
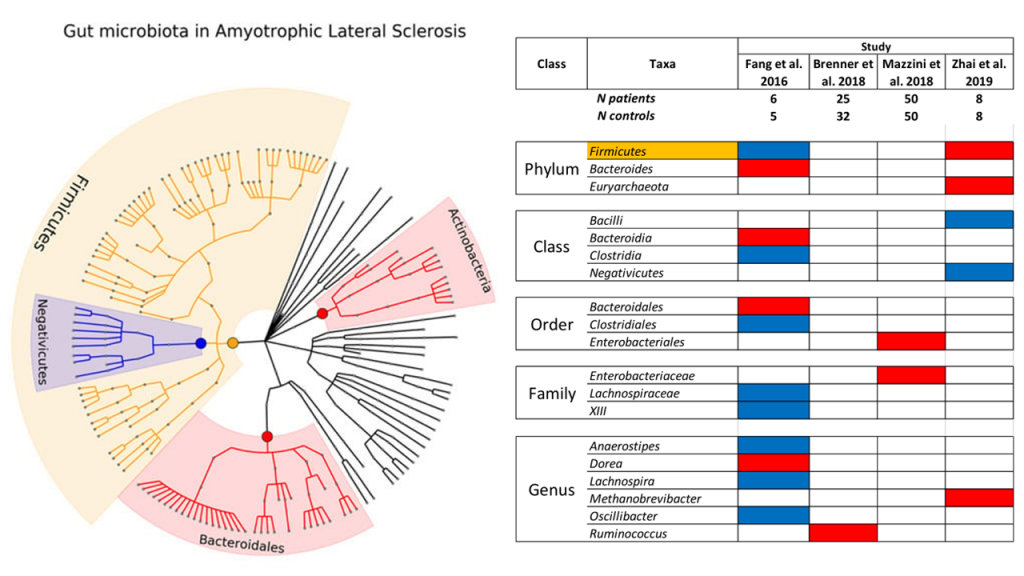

doi.org/10.3390/ijms232213665
以上数据来自六项关于 ALS 的研究,共涉及 159 名 ALS 患者和165名健康对照者。橙色表示不一致的结果,蓝色表示相对丰度下降,红色表示相对丰度增加。
综合一些研究报道,ALS 患者的肠道菌群主要变化如下:




Letizia Mazzin et al., Amyotrophic Lateral Sclerosis.2021 Jul 25
在2020年发表了一项关于ALS微生物群组成的前瞻性纵向研究,表明ALS患者的肠道菌群与对照组相比有所不同,与残疾程度无关。此外,他们观察到蓝细菌的增加(蓝细菌以神经毒性作用著称)。患者中蓝细菌门的成员明显高于对照组,支持蓝细菌在ALS发病机制中发挥基础作用的假设。
有研究发现,在ALS患者中,谷氨酸代谢细菌更丰富,主要丁酸盐产生细菌更低,这与谷禾渐冻症菌群分析结果相吻合。
现有的关于ALS的肠道菌群研究整理如下:






doi: 10.3389/fcimb.2022.839526
在这些研究中,促炎性生态失调的原因与微生物失衡有关,微生物失衡可能损害肠上皮屏障并促进免疫/炎症反应,从而导致改变并在 ALS 发病机制中发挥作用。
▋ ALS患者和配偶对照之间的肠道菌群差异
一项研究中,研究人员探讨了与ALS相关的微生物组组成的差异。
比较了ALS患者(n = 10) 其配偶(n = 10). 发现与配偶相比,ALS患者的肠道微生物群多样性更高,且普雷沃氏菌属缺乏。健康夫妇没有表现出这些差异。
ALS患者及其配偶的粪便和血浆炎症标志物相似。对微生物酶的预测分析显示,ALS患者在几种代谢途径中的活性降低,包括碳代谢、丁酸盐代谢以及涉及组氨酸激酶和反应调节剂的系统。
ALS患者的肠道菌群与配偶对照组相比存在差异。表明改变肠道菌群,例如通过改善普雷沃氏菌属缺陷和/或改变丁酸盐代谢,可能对ALS治疗具有转化价值。
使用109例渐冻症患者,相匹配的对照共442例
其中性别比例:
按年龄划分:
多样性上渐冻症人群稍低于对照人群,但差异不显著。
菌群特征总体存在一定差异:
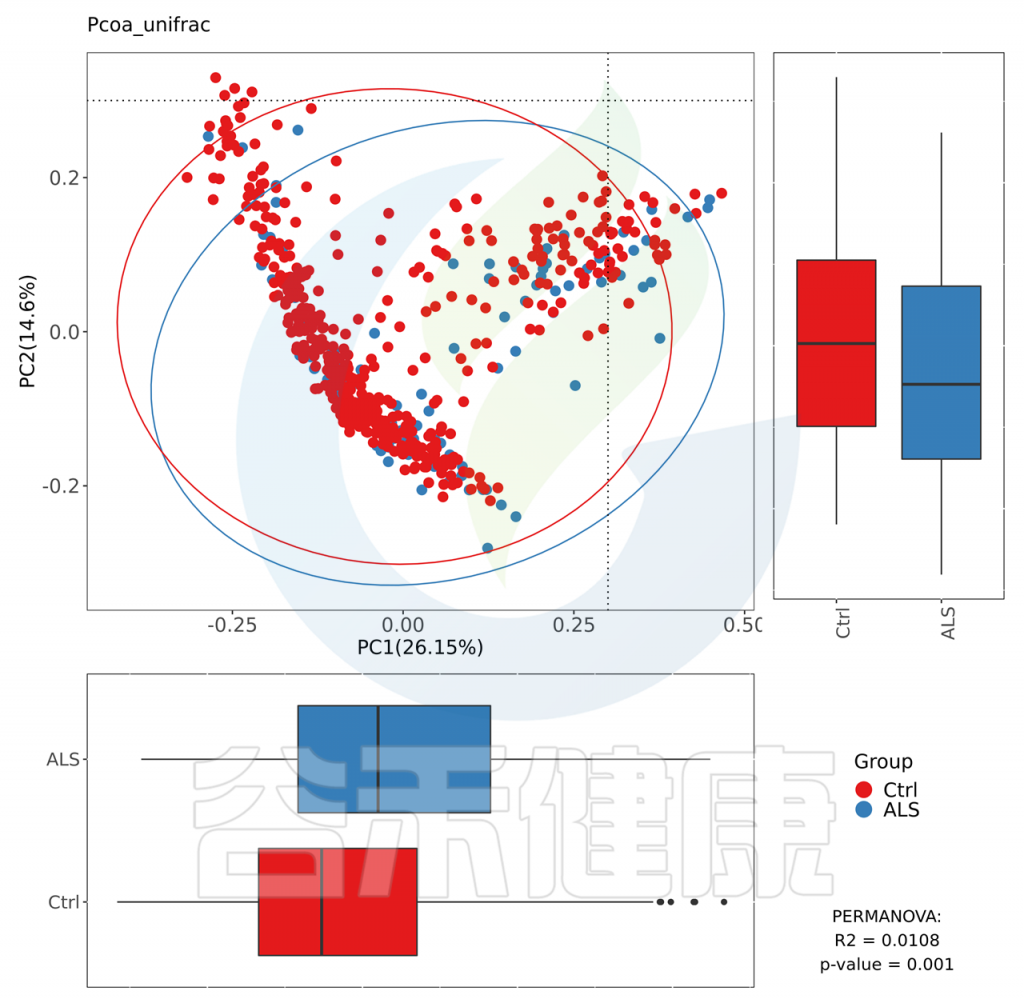

来看具体差异:
渐冻症人群拟杆菌显著高于对照;
Faecalibacterium则低于对照人群;
此外萨特氏菌属Sutterella渐冻症人群显著高于对照人群。
拟杆菌属(bacteroides)——重要的基石菌属,存在于人类肠道中,它们与人类具有共生关系。它们有助于分解食物并产生身体所需的营养和能量。然而,当拟杆菌进入到除胃肠区域以外的身体部位,可引起或加剧脓肿等感染,具体详见:
Faecalibacterium 是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。关于Faecalibacterium 的介绍详见:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
Sutterella 是变形菌门最丰富的菌之一,是一种厌氧或微需氧的、耐胆汁的菌,在人类胃肠道中具有轻度促炎能力,详见:

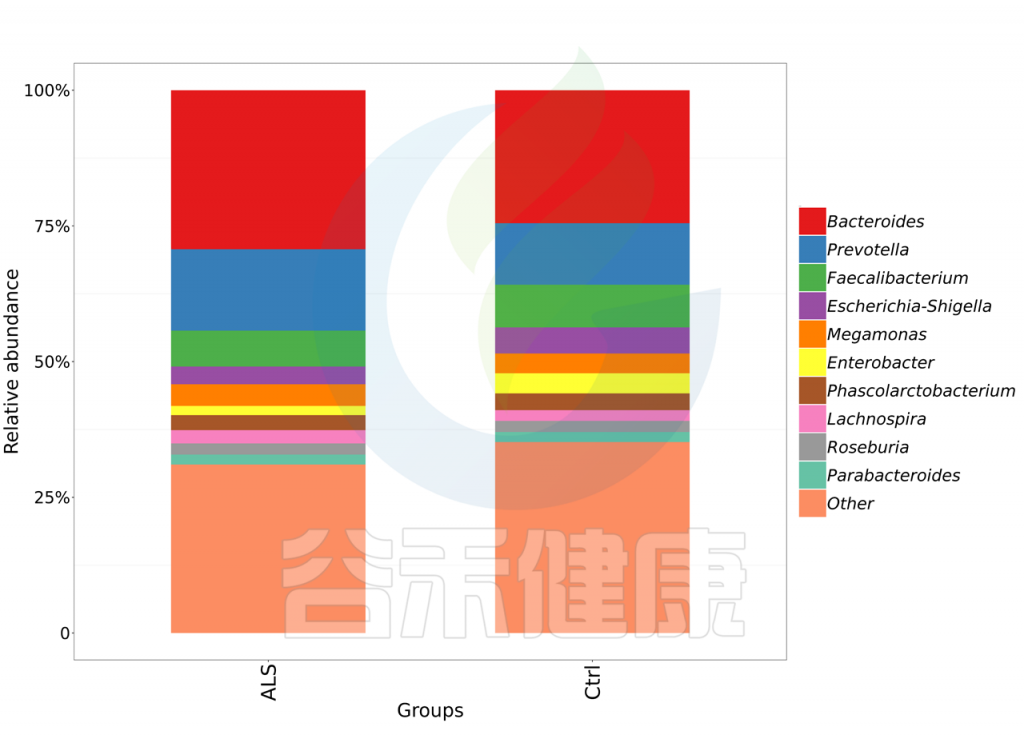
除了高丰度菌属外,双歧杆菌属和丁酸球菌属,渐冻症人群也低于对照:
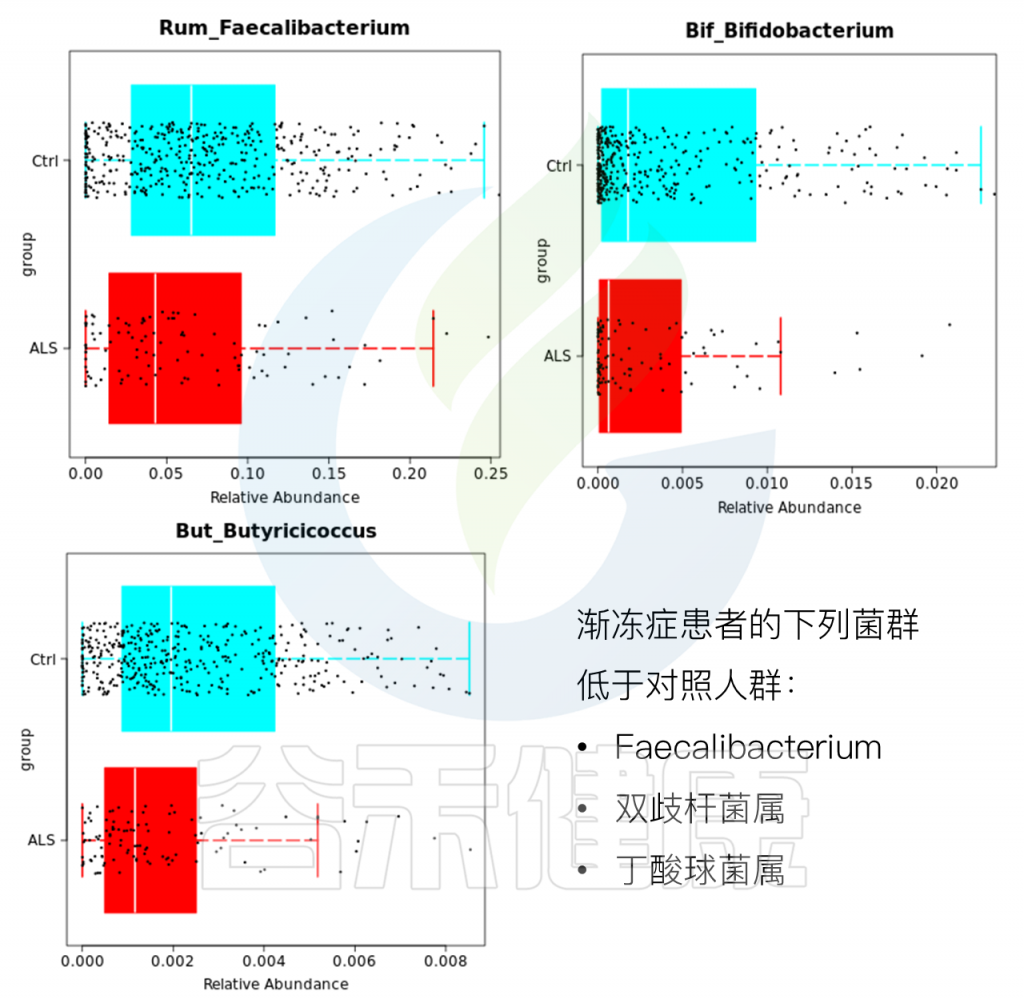

基于谷禾检测结果,渐冻症患者的有害菌丰度显著高于对照人群,益生菌和消化效率要低于对照人群。
此外维生素B1,维生素B12以及维生素C都显著低于对照人群,相对的维生素D水平要高于对照人群。
(来源:谷禾菌群数据库)
微生物群可能直接或间接的方式影响中枢神经系统和神经元健康:
■ 直接通过产生神经活性代谢产物和毒素
■ 间接通过调节免疫反应、饮食化合物或药物代谢
肠道微生物及其代谢产物可以直接刺激肠嗜铬细胞产生几种神经肽(如,肽YY、神经肽Y、胆囊收缩素)或神经递质(如,血清素),它们可以扩散到血液中,到达大脑,并影响中枢神经系统功能。
肠上皮调节特定细菌产物(如短链脂肪酸、维生素或神经递质)进入血液的易位,进而通过循环系统传播到中枢神经系统。通过这种方式,循环微生物群衍生的代谢产物、神经肽和神经递质可以进入中枢神经系统并直接影响其神经生物学。
ALS的微生物代谢产物调节
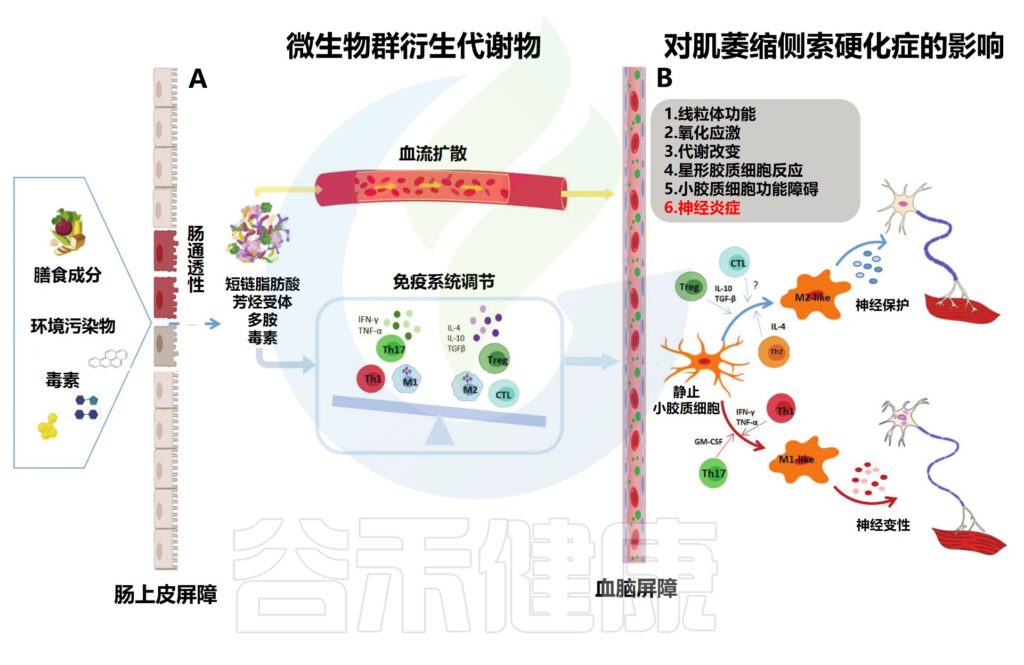
Letizia Mazzin et al., Amyotrophic Lateral Sclerosis.2021 Jul 25
A) 受损IEB或肠道细菌产生的毒素和神经活性代谢产物可以跨越血脑屏障,扩散到全身循环,并影响ALS发病机制;或者,微生物代谢终产物可能通过免疫系统调节间接影响中枢神经系统。
B) 细菌衍生的代谢产物可以改变能量稳态,促进氧化应激,并诱导线粒体功能障碍和神经炎症。特别是,外周免疫T淋巴细胞调节小胶质细胞的命运,从而调节神经元的退化或存活。
产生Th1、Th17和GM-CSF的CD4+T淋巴细胞有利于小胶质细胞M1样神经毒性表型;
Th2、Treg和某些CD8+T细胞类型可能有助于促进神经支持性M2样表型。
A.muciniphila给药可以改善小鼠的疾病进程,他们应用了非靶向血清代谢组学分析来确定可能的介体。有趣的是,A.muciniphila治疗的小鼠显示出NAM的血清水平升高,其直接给药显示出有益的效果,可能是通过调节线粒体功能和氧化应激途径。
注:NAM是能量转导、信号通路和抗氧化机制所需的辅酶的前体,可能在ALS相关的神经变性中受损。
与健康受试者相比,ALS患者的血清和脑脊液中的NAM浓度较低,粪便中NAM合成细菌基因的表达也较低,这支持了肠道菌群可以产生化合物,这些化合物能够渗透血脑屏障并影响神经元功能。
肠道菌群代谢物影响神经元健康
肠道内微生物代谢产物可通过中枢神经系统炎症直接或间接影响神经元健康。
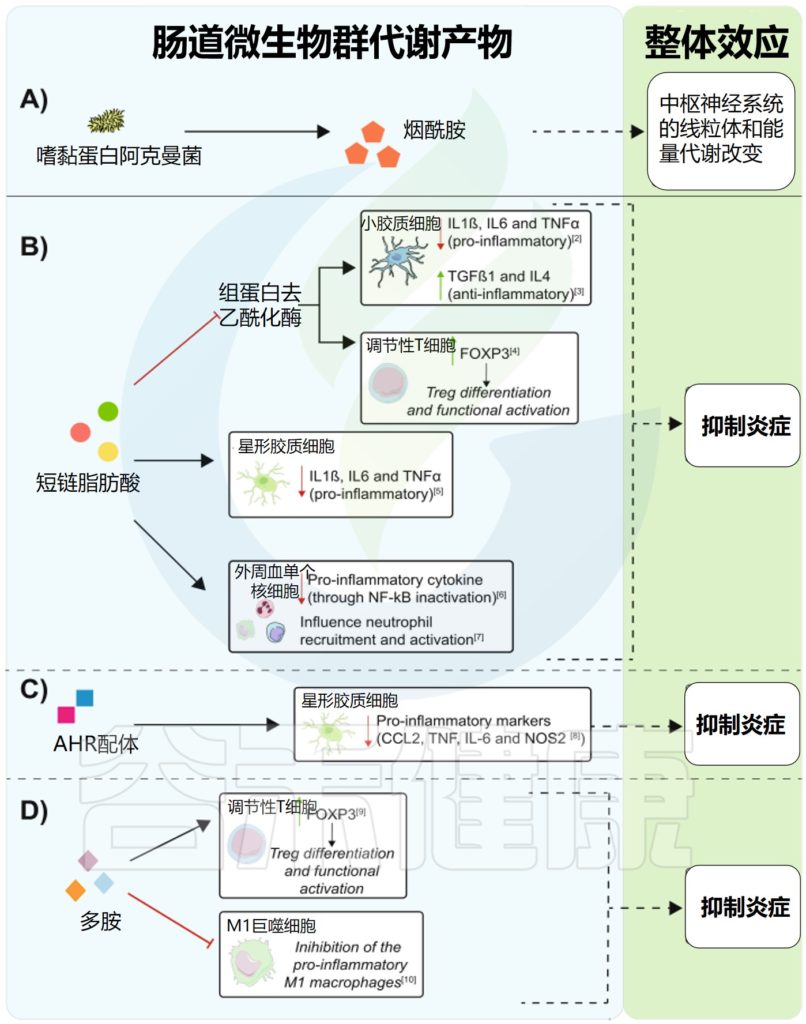
doi: 10.1186/s12916-020-01885-3
a) 肠道菌群释放的代谢物可以进入系统循环,在那里它们可以进入中枢神经系统;对于Akkermansia muciniphila释放的烟酰胺,这可能会改变能量稳态和氧化应激。
注:烟酰胺是 NAD 和 NADP 的前体,它们是能量转导和抗氧化途径以及其他细胞信号传导机制的适当功能所必需的辅酶,其中许多与 ALS 相关的神经变性有关。
b – d存在许多提议的机制,微生物代谢产物可以通过这些机制影响免疫反应并对中枢神经系统炎症状态产生影响:
b) 短链脂肪酸可通过抑制小胶质细胞内的HDAC来减少炎症,从而导致促炎因子(IL-1β、IL-6和TNF-α)的下调和抗炎标志物(TGF-β和IL-4)的上调。
c) 芳基烃受体(AHR)配体可调节星形胶质细胞活性并产生抗炎特性。
d) 多胺诱导Treg细胞中FOXP3表达,促进其分化和活化。这些分子还可以抑制炎性巨噬细胞(M1),从而防止巨噬细胞诱导的炎症。
在神经递质方面:
渐冻症患者的GABA(缺乏易焦虑、失眠等)、一氧化氮(抑郁、焦虑等),乙酸、丙酸(短链脂肪酸,缺乏导致炎症)水平均低于对照人群。
而对甲酚(毒性代谢物,引发便秘等)高于对照人群。这或许也与ALS患者中可能出现的便秘等胃肠道症状有关。
(来源:谷禾菌群数据库)
肠道菌群将饮食和环境化合物转化为神经毒素
β-甲基氨基-1-丙氨酸(BMAA)是一种众所周知的神经毒性氨基酸,在关岛的肌萎缩性侧索硬化症/PDC患者的大脑中发现,被认为是由肠道中的标准饮食化合物产生的。例如,蓝细菌和其他具有厌氧甲基化功能的细菌可以通过L-丝氨酸和L-丙氨酸的甲基化来生物合成BMAA。
肠道微生物还可以将L-色氨酸等氨基酸转化为吲哚等生物活性分子,一旦磺化,就会引发神经炎症和神经元损伤。肠道菌群可以将胆碱和L-肉碱代谢为三甲胺(TMA),然后将其脱甲基为二甲胺(DMA)和甲醛。
根据体外和体内研究,甲醛会导致线粒体膜损伤、危险自由基的产生以及神经元Tau蛋白的错误折叠和积累,从而导致ALS发病。
环境污染物也会通过微生物群的作用产生负面影响。
暴露于多环芳烃(PAHs)是ALS的危险因素,肠道微生物可以逆转PAHs的内源性解毒过程,将其再生为苯并[a]芘(BaP),其神经毒性作用已在斑马鱼中得到证实。
此外,肠道菌群失调可能是ALS中观察到的代谢改变的原因。有趣的是,肠道生物失调,特别是厚壁菌门的减少与更高的REE有关,这可能是ALS患者能量消耗增加的原因。
菌群诱导的炎症在ALS发病机制中的作用
▸ 肠道菌群影响先天性免疫系统和适应性免疫系统
ALS发病机制的一个既定关键点是神经炎症;它与驻留和外周免疫细胞的复杂失调有关(例如小胶质细胞和星形胶质细胞活化、T细胞浸润和促炎介质增加)。
肠道菌群与肠道免疫系统进行沟通,有助于维持免疫耐受性,并在炎症期间形成免疫反应。一旦病原体入侵或肠道内微生物渗漏,微生物相关的分子模式可以刺激先天细胞产生促炎细胞因子,进而激活适应性免疫细胞,从而促进免疫稳态的破坏。
除了先天免疫细胞外,肠道微生物还可以直接影响适应性免疫系统主要成分CD4+和CD8+T细胞的发育和分化。
▸ 肠道菌群失调会影响几个大脑生物学过程
无菌小鼠和抗生素治疗小鼠模型显示出广泛的免疫异常,包括改变小胶质细胞的密度、形态和成熟度,表明肠道菌群可以影响中枢神经系统免疫细胞的发育和功能。
▸短链脂肪酸影响Tregs,从而影响ALS
短链脂肪酸是膳食纤维的最终代谢微生物产物,主要由拟杆菌和厚壁菌门产生。已知它们通过组蛋白脱乙酰酶抑制介导调节性T细胞(Tregs)诱导。
ALS的特点是同时激活不同的淋巴细胞亚群Th1和Th17,并减少Tregs,Tregs在小鼠和人类中都具有保护作用;更多的Treg与疾病进展缓慢相关。
Tregs已被证明直接将巨噬细胞从M1状态分化为M2状态,M2小胶质细胞与稳定的疾病阶段相关,而Th1和M1小胶质细胞在快速进展阶段占主导地位,表明从保护转变为毒性。
▸肠道菌群改变影响ALS症状的发生和发展
一项研究发现,肠道菌群改变先于循环和CNS免疫系统的扩张和激活,以及症状的发生和发展。
肠道菌群驱动的促炎信号可能对神经胶质的生理功能、维持神经元健康至关重要。事实上,肠道菌群通过芳基烃受体(AHR)介导的涉及I型干扰素信号传导的机制调节星形胶质细胞活性。
肠道菌群对ALS药物疗效的影响
肠道菌群也可以通过肠道药物的代谢影响疾病。
2019年,一项研究评估了一组肠道细菌代谢一系列常用处方药物的能力,其中包括利鲁唑,这是唯一一种显示对ALS患者具有生存益处的药物。
筛选出的40种细菌对利鲁唑进行了显著的代谢,其中许多细菌在人群中的流行率不同。
据报道,与相对较高的患者间变异性相比,利鲁唑的血浆浓度显示患者内变异性较低,这不能通过肠道吸收后的代谢差异来解释。肠道菌群对利鲁唑生物利用度的修正可以解释患者间血浆水平的变化。
肠道菌群对非运动肌萎缩侧索硬化症状的影响
肠道菌群与影响ALS患者的其他症状有关,如抑郁、焦虑和便秘。肠道微生物群可以产生各种肽和神经递质,它们可以直接影响情绪,而大脑通过包括应激反应在内的多种机制影响肠道。解开肠道微生物群在调节与神经精神疾病相关的大脑功能方面的作用才刚刚开始,但这有可能成为改善ALS患者生活质量的一种手段。
关于便秘,ALS患者经常报告的另一种症状,管腔液中微生物组(胆汁酸的代谢、短链脂肪酸的产生和甲烷的产生)以及结肠粘膜层在调节液体进入血流中的吸收中的作用都已被提出。无论疾病进展如何,改善这些症状的管理都会提高生活质量。
以上我们可以知道肠道菌群可以通过代谢亢进和胃肠道异常影响 ALS,从而更深入地了解 ALS 背后的微生物组-宿主相互作用的复杂网络。
一些不太了解的人容易把渐冻症和其他神经退行性疾病搞混。四大常见的神经退行性疾病有:肌萎缩侧索硬化症(渐冻症)、亨廷顿氏病、阿尔兹海默症(老年痴呆)、帕金森氏病,在这里简单讲述一下区别。
▸ 阿尔兹海默症
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经系统退行性疾病。临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今未明。
该病起病缓慢或隐匿,病人及家人常说不清何时起病。多见于70岁以上老人,少数病人在躯体疾病、骨折或精神受到刺激后症状迅速明朗化。女性较男性多(女∶男为3∶1)。
✦与渐冻症的区别
渐冻症也叫做运动神经病。病变主要累及到上下运动神经元,主要表现为肢体无力,肌肉萎缩,肌束颤动,可以伴饮水呛咳,吞咽困难等表现。
阿尔茨海默病主要是影响患者的精神行为能力,执行能力,思维反应,生活能力。肢体上一般不会出现萎缩无力的症状。
▸ 帕金森氏病
帕金森氏病又称为震颤麻痹,是一种影响患者活动能力的中枢神经系统慢性疾病,多发生于中老年以上的人群。
•表现症状
本病早期主要表现包括静止性震颤、肌强直、行动缓慢、动作起动困难和姿势异常等。静止性震颤即患者的手或臂不受控制地发抖,在休息时出现或情绪紧张时加重。
后来人们发现除了震颤外、还有慌张步态(走路时小碎步且越走越快)、小写症(写字越来越小)、行走时上肢无前后摆动等其它症状。
✦与渐冻症的区别
•发病原因不同
帕金森病由于脑部纹状体出现损伤导致多巴胺分泌障碍而导致的一种疾病,其发病原因和脑部外伤、年龄增大等因素有一定的关系。
而渐冻症的发生多数情况下病因不明,少数是遗传因素所导致的,常常会出现运动神经元的损伤。
•临床表现不同
临床表现:帕金森病患者会出现四肢发抖、不灵活等异常症状,一般不会出现肌肉萎缩。但是渐冻症发生以后常常会有肌肉萎缩的情况发生,会使患者逐渐丧失正常的运动功能。
•危害性不同
帕金森病是神经性系统病变,主要表现是颤抖,可引起运动迟缓,步态异常。
渐冻症是运动神经元疾病,主要表现是肌肉逐渐萎缩和无力,可出现吞咽困难、语言困难以及呼吸衰竭等比较严重的情况。
▸ 亨廷顿氏病
又叫大舞蹈病或亨廷顿舞蹈症。一种常染色体显性遗传性神经退行性疾病,主要病因是患者第四号染色体上的基因发生变异,产生了变异的蛋白质,该蛋白质在细胞内逐渐聚集在一起,形成大的分子团,在脑中积聚,影响神经细胞的功能。
•表现症状
一般患者在中年发病,表现为舞蹈样动作,随着病情进展逐渐丧失说话、行动、思考和吞咽的能力,病情大约会持续发展10年到20年,并最终导致患者死亡。
✦与渐冻症的区别
•运动方面
亨廷顿氏病表现出肢体的跳动或抽动,但渐冻症是肌肉萎缩导致无力运动,抽动也不同与渐冻症初期的“肉跳”,这是一种类似于“舞蹈”的大幅运动。
•认知方面
渐冻症患者的意识清晰,不会出现认知障碍。
但亨廷顿氏病会表现出进行性痴呆。日常生活和工作中的记忆和计算能力下降,患者记住新信息仅有轻度损害,但回忆有显著缺陷。
情感障碍是亨廷顿氏病最多见的精神症状,包括焦虑、紧张、兴奋易怒、或淡漠、或兴趣减退。
亨廷顿病患者还可出现人格行为改变,出现反社会行为、精神分裂症、偏执狂和幻觉。
渐冻症的诊断
在诊断上,由于仍不明确渐冻症的发病原因及机制,该病还未筛选出特异性诊疗标记物。
此外,前面我们提及的渐冻症早期症状不具有典型性,必须与其他神经退行性疾病相鉴别,所以早期患者会花费大量人力物力财力及时间做鉴别诊断来排除。
✦表现诊断
(1)检查要评估咀嚼和吞咽的肌肉力量,包括口腔、舌及咽喉肌。
(2)下运动神经元(LMN)功能,如肌肉萎缩情况,肌肉力量或肌肉跳动(称为肌束震颤)。
(3)上运动神经元(UMN)功能,如腱反射亢进和肌肉痉挛(肌肉紧张和僵直的程度)。
(4)情绪反应失去控制,如哭或笑的情绪变化。思维的变化如丧失判断力或失去基本的社会技能。检查者也会评估患者言语流畅性及文字识别能力。这些症状不常见,不容易引起重视。
注意:神经科医生还将询问如疼痛,感觉丧失或锥体外系问题。
✦检测诊断
肌电图(EMG):将针状电极穿过皮肤插入到各种肌肉中。该测试评估肌肉收缩和休息时的电活动。在肌电图中看到的肌肉异常可以帮助医生诊断或排除渐冻症。
神经传导研究:这项研究测量神经向身体不同区域的肌肉发送冲动的能力。该测试可以确定是否有神经损伤或某些肌肉或神经疾病。
核磁共振:核磁共振可以生成大脑和脊髓的详细图像。显示脊髓肿瘤、颈椎间盘突出或其他可能导致症状的情况。
血液和尿液检查:在实验室分析您的血液和尿液样本可能有助于鉴别诊断。
脊椎穿刺(腰椎穿刺):获取脑脊液来完善检查,帮助诊断及排除渐冻症。
肌肉活检:如果医师认为患有肌肉疾病而不是渐冻症,这项检查将在局部麻醉状态下获取您的肌肉组织,再进行分析检查。
使用菌群特征对渐冻症和对照人群进行预测
综合代谢和其他指标后:综合准确度:0.88
可以理解为基于菌群特征,可以分辨出84%的ALS患者。
(来源:谷禾菌群数据库)
虽然渐冻症目前无法彻底治愈,但有一些治疗方法可以减缓身体功能的丧失,并改善患者的生活质量。
基于神经系统的药物
Riluzole (Rilutek,利鲁唑)
是一种口服药物,是 FDA 证明的 ALS 疾病缓解治疗药物。
据报道可通过降低谷氨酸水平来减少对运动神经元的损害,谷氨酸在神经细胞和运动神经元之间传递信息。对肌萎缩侧索硬化患者的临床试验表明,利鲁唑可延长几个月的生存期,尤其是延髓型疾病。
注:有吞咽困难的人可能更倾向于在舌头上溶解的增稠液体形式 (Tiglutik) 或片剂 (Exservan)。
依达拉奉(Radicava)
通过静脉输注给药,已被证明可以减缓 ALS 患者日常功能临床评估的下降。
研究人员认为,依达拉奉通过清除自由基起作用,从而减少对神经系统的损害并减缓疾病进展。
苯丁酸钠-牛磺酸二醇(Relyvrio)
Relyvrio 治疗 ALS 的疗效在一项为期 24 周的多中心、随机、双盲、安慰剂对照、平行组研究中得到证实。
在 ALS 患者中使用苯丁酸钠-牛磺酸二醇。据报道,根据 24 周内的 ALSFRS-R 评分,苯丁酸钠-牛磺熊二醇导致的功能下降速度比安慰剂慢。
Relyvrio 可以通过将一包与 8 盎司室温水中混合来口服。它也可以通过饲管给药。前三周的推荐剂量是每天一包(3 克苯丁酸钠和 1 克牛磺熊二醇)。三周后,剂量增加到每天两次一包。药物可以在吃零食或用餐前服用。
注意:
Relyvrio 最常见的不良反应是腹泻、腹痛、恶心和上呼吸道感染。Relyvrio 含有牛磺熊二醇,一种胆汁酸,可能会导致患有干扰胆汁酸循环的疾病的患者腹泻恶化。这些患者在服用 Relyvrio 之前应考虑咨询专科医生。
巴氯芬(Baclofen)
巴氯芬通过放松身体肌肉帮助缓解肌肉痉挛。
研究表明,当巴氯芬与辅助或无辅助的运动范围物理治疗一起使用时,它在缓解肌肉痉挛方面特别有效。
注意:必须密切监测巴氯芬的剂量,以避免患者过早服用高剂量(如40至80mg)时出现四肢和躯干无力。
基于消化系统的药物
格隆溴铵
多种药物可以降低唾液分泌量。随着吞咽变得更加困难,它通常会积聚在嘴里。最常见的药物之一是格隆溴铵( Robinul )。
硫酸阿托品
硫酸阿托品有助于缓解唾液过多。阿托品 0.4 mg片剂
三己基苯
三己基苯甲酰也有助于控制过多的唾液。
医生可能会开其他消化系统疾病的药,以帮助缓解 ALS 的其他症状,如便秘等。
基于人体其他系统的药物
替扎尼定(Tizanidine)
替扎尼定通过放松肌肉帮助缓解肌肉痉挛。
替扎尼定通过阻断从大脑发送到肌肉的神经信号起作用。
替扎尼的给药剂量范围为每天 2-10 毫克。
注意:副作用虽然不常见,但偶尔可能包括虚弱、便秘、头晕和其他问题。
甲基钴胺素
甲基钴胺素或甲基B12是一种每日注射的药物,用于提高能量和增强肌肉力量。这些成分需要处方:25 mg/1mL(pH 2.7-3.0)
谷胱甘肽
谷胱甘肽经常对四肢力量有效。它是静脉注射的。需要蝶形注射器。这些成分需要处方:复方谷胱甘肽200mg/ml。
硫酸奎宁
硫酸奎宁可减少痉挛。
睡前一晚应该停止或显著减少肌肉痉挛。需要324毫克胶囊的处方,不含填料/防腐剂。
通常,当替扎尼定和/或巴氯芬未成功治疗ALS患者时,使用硫酸奎宁。
注意:药物的副作用可能包括过敏反应、血栓形成(血管内形成血块)或肾脏问题。
Nuedexta
Nuedexta可以改善咀嚼和吞咽,此外还可以缓解假性延髓的影响——过度大笑和/或哭泣。即使这些不是当前的问题,Nuedexta也经常作为预防剂,可能会延迟延髓问题的发生。通用配方右莫特沙芬25毫克/奎尼丁10毫克
美西律Mexilitine
每天服用300毫克美西律可以缓解肌肉痉挛。这种药物可以由神经科医生或医生开具。200 mg胶囊(普通)
NeuRx隔膜起搏系统
NeuRx隔膜起搏器采用微创方法,经科学和临床证明可保持隔膜肌的力量和由此产生的肺活量。
其他,例如地西泮(Diastat、Valium )等止痛药或肌肉松弛剂有助于缓解痉挛。
非甾体抗炎药 (NSAIDs)
由于炎症 促进ALS的发展,研究人员推测NSAIDs(抗炎药)可能具有保护作用。然而,一些临床试验并未发现对ALS患者的总体生存率有任何有益的影响。
非甾体抗炎药,如布洛芬或萘普生,可能有助于缓解全身疼痛和不适。
注意:由于潜在的胃肠道和心血管副作用,非甾体抗炎药只能按照指示服用。
加巴喷丁 (Gabapentin)
加巴喷丁是抗癫痫药物,但也可用于ALS。
动物研究表明,加巴喷丁可以改善ALS患者的生存率,临床试验表明,它可以减少ALS患者肌肉痉挛和抽搐。
加巴喷丁通过调节谷氨酸水平(类似于利鲁唑)发挥作用。
注意:加巴喷丁的副作用包括疲劳、体重增加、消化不良、嗜睡、头晕、共济失调和震颤。
三环类抗抑郁药(Tricyclic antidepressants)
这些药物广泛用于ALS的治疗,具有多种作用。特别是,抑郁和焦虑在ALS中很常见,适当剂量的三环类药物可以缓解抑郁。
注意:副作用,如口干和体重增加,也可能帮助ALS其他症状,如口腔唾液过多和体重减轻。
吗啡(Morphine)
吗啡是一种阿片类药物,可用于治疗疼痛。吗啡有助于缓解晚期ALS患者呼吸不足的感觉。
在情绪不稳定的情况下,可以使用选择性 5-羟色胺再摄取抑制剂、阿米替林、苯二氮卓类药物和氢溴酸右美沙芬/硫酸奎尼丁等。
饮 食
营养对肠道微生物群有直接影响,肠道微生物群会影响局部肠道免疫反应,进而影响自身免疫反应。
饮食中存在具有抗氧化潜力的化合物,例如维生素、姜黄素、辅酶 Q10等,可用作治疗策略。
应排除或限制的食物
▸ 避免海鲜类
文献报道,日本Kii半岛ALS的高发病率可能与β-甲基氨基-L-丙氨酸(BMAA)有关。BMAA是一种天然的神经毒性非蛋白氨基酸,由苏铁种子根部的共生蓝藻产生,苏铁种子在该地区尤为常见。假设该区域的ALS患者无法阻止BMAA积聚。
BMAA的饮食来源可能是海鲜,如鱼、贻贝、螃蟹和牡蛎。关岛也报告了ALS的高发病率,该岛的人口使用潜在的苏铁衍生产品。BMAA污染的另一个可能来源可能是果蝠或飞狐,因为它们食用苏铁种子,它们是当地居民饮食的组成部分。
尽管还需要更多的研究,但最近研究人员使用斑马鱼幼虫模型证明了BMAA与微囊藻毒素亮氨酸和精氨酸(其他氰毒素)之间的关系。此外,暴露于BMAA的新生大鼠受到运动缺陷的影响,这表明神经发育过程中的暴露可能导致ALS。先前的研究研究了BMAA对神经变性的作用机制:BMAA杀死NADPH黄递酶阳性运动神经元,并对影响运动神经元损伤的神经胶质细胞起毒性作用。
▸ 避免高脂饮食 (有争议)
ALS患者过度摄入脂肪食物,尤其是饱和脂肪食物,以及ROS防御机制的丧失,如SOD1基因的突变,是ALS患者出现的主要方面。因此,将某些国家大量食用脂类食品与发现ALS病例的可能性更大联系起来是合理的。
这可以部分解释为什么在瑞典和苏格兰等州ALS发病率如此之高,众所周知,这些州的饮食特别注重脂肪食物的摄入。
然而,脂肪摄入在ALS中的作用存在争议,因为不同的研究显示了相反的结果。Nelson等人证明,高脂肪摄入与ALS发病相关。另一项研究显示了相反的结果:脂肪摄入量较高的受试者患ALS的风险降低。
▸ 避免谷氨酸盐饮食
据报道,ALS中存在谷氨酸的不良反应。它是大脑中的主要兴奋性神经递质,蘑菇、牛奶和富含蛋白质的食物中存在的高水平谷氨酸会导致细胞内钙水平升高,从而促进神经元死亡。
▸ 避免重金属饮食
暴露于金属被认为是ALS的一个可能的风险因素,但结果并不确凿。研究表明,镉和铅可能与患ALS和锌的风险增加有关,而根据疾病前血液中的金属水平,其风险降低,其中铅具有最强的先验联系。
汞被怀疑是ALS发病机制的一部分,但结果尚无定论,尤其是饮食中的汞暴露,尤其是海鲜消费。汞由几个行业生产,并储存在鲨鱼、旗鱼、鲭鱼和金枪鱼等水生食肉生物中。
汞可以产生氧自由基,促进兴奋毒性,减少DNA、RNA和蛋白质合成,所有这些过程都与ALS相关。然而,一些研究报告称,ALS患者和非ALS患者接触的汞量相同。差异可能是ALS患者由于遗传/表观遗传倾向而更易受汞影响。
注意
不同研究之间的差异可能是由于单一金属分析可能无法充分评估健康风险的相关性,这表明毒物暴露与添加剂或协同效应相互作用的可能性。
可以引入的饮食
早期研究表明,存在于水果、蔬菜、咖啡、茶和全谷物中的多酚(例如,白藜芦醇、姜黄素、表没食子儿茶素没食子酸酯、槲皮素和酚酸)可能对 ALS 具有良好的神经保护作用。
在体内和体外观察到,这些生物活性化合物可能具有调节线粒体生物发生、改善能量代谢、减少有毒蛋白质聚集、减少小胶质细胞和星形胶质细胞炎症以及改善运动功能和生存的潜力。
ALS 患者的营养护理应包括多摄入水果、蔬菜、高纤维谷物和瘦肉蛋白质来源,如鱼和鸡肉等。
——哥伦比亚大学临床流行病学和营养学副教授Nieves
多摄入水果蔬菜
一项包括超过 302 名 ALS 患者的研究中,水果、蔬菜、抗氧化剂和 β-胡萝卜素被证明与 ALS 功能增强有关。
在一项针对 77 名韩国人的小型研究中,当具体研究水果和 β-胡萝卜素的好处时,增加摄入量与散发性肌萎缩侧索硬化的风险降低有关。
遵循地中海饮食
一种已知的高酚饮食是地中海饮食,也被证明通过高橄榄油含量减少神经退化。暴露于高初榨橄榄油饮食的SOD1G93A小鼠寿命延长,运动能力提高。
第二项支持性研究表明,特级初榨橄榄油提取物在从SOD1G93A小鼠模型获得的培养物中充当神经保护剂。该提取物通过下调SOD1突变刺激的活化胶质细胞释放的一氧化氮的量来减少神经变性。此外,TLR4信号通路(ALS中已知的致病通路)被橄榄油提取物抑制。
另一组关注草莓中富含花青素的提取物,这是一种以抗氧化、抗炎和抗凋亡特性而闻名的化合物。花青素属于黄烷类,是一种植物酚类。他们发现,补充了该提取物的hSODG93A小鼠表现出延迟发病和延长生存期。
饮食习惯
ALS发病的主要因素之一似乎是以脂质为主的饮食,由于ROS的高释放,在神经退行性变中起着至关重要的作用。
25–68% 的 ALS 患者表现出能量消耗增加的代谢亢进表型,尤其是在休息时。
晚期ALS患者可能需要高脂饮食作为补偿热量摄入
最近的研究表明,与健康个体相比,症状前ALS患者可能会增加每日总能量消耗。
在 ALS 中,体重减轻是一个独立的预后因素,体重指数 (BMI) 每下降 1 点,死亡率就会增加 30%.
高脂肪含量的高热量食物补充剂可以稳定晚期ALS患者的体重减轻。这可以通过症状前小鼠的研究报告的代谢变化来解释。
ALS患者因吞咽困难和食欲不振而导致的食物摄入不足和体重减轻,可能反映出代谢过度和分解代谢需求增加(下图)。这可能导致ALS患者通过摄入脂肪食物来增加热量摄入,作为补偿措施。
健康个体与肌萎缩侧索硬化症患者之间的代谢差异
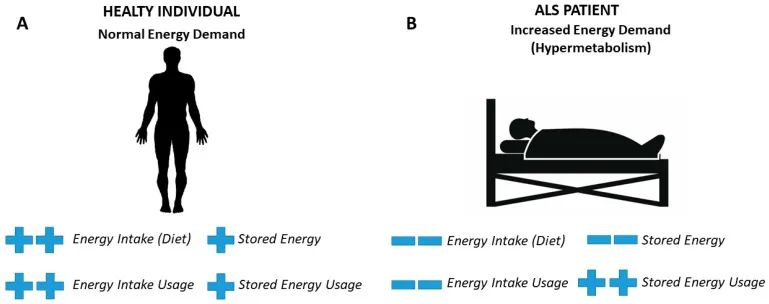
(A) 在健康个体中,在正常能量需求期间,能量摄入用于满足能量需求,但当存在过量能量时,能量储存在脂肪组织和肝脏中。无法维持能量供应会导致负能量平衡,在这种情况下,脂肪组织和肝脏中的能量储备用于满足能量需求。
(B) 肌萎缩侧索硬化症患者出现高代谢,即能量需求增加。事实上,在ALS中,能量摄入减少导致脂肪组织和肝脏中能量储存减少,并增加对储存能量使用的依赖性。因此,ALS患者体重指数的下降是负能量平衡和高代谢的结果。
益生菌
发表在《自然》杂志上的一项详细研究表明,肠道补充Akkermansia muciniphila(一种在肠道粘蛋白降解中起重要作用的肠道微生物)可以改善转基因SOD1G93A小鼠的ALS症状。
在代谢产物水平上,肠道补充的Akkermansia muciniphila的有益作用被证明依赖于SOD1G93A小鼠中枢神经系统中烟酰胺水平的增加,同时也证明ALS患者体内烟酰胺水平下调。然而,在ALS模型和患者中,粘蛋白降解产生短链脂肪酸,一些产生SCFA的细菌受到负面影响。
关于AKK菌详见:
在每天接受6个月益生菌治疗的ALS患者中,Rikenellaceae的丰度显著增加。
益生菌配方是五种乳酸菌的混合物:嗜热链球菌ST10–DSM 25246、发酵乳杆菌LF10–DSM 19187、德氏乳杆菌LDD01–DSM 22106、植物乳杆菌LP01–LMG P-21021和唾液乳杆菌LS03–DSM 22776。无因补充益生菌引起的不良事件。与对照组相比,可调节ALS患者的细菌多样性,ALS患者门、科和属水平的蓝细菌显著增加,益生菌组和安慰剂组的蓝藻丰度都随着时间的推移而减少,尽管差异并不显著。
益生元
2013年发表的研究报告了转基因SOD1G93A小鼠中最常用的益生元的有益效果,其中一项研究就是在该动物模型中施用低聚半乳糖,延缓了疾病的发作,延长了小鼠的寿命,显著减少了运动神经元的损失和肌肉萎缩,并改善SOD1G93A小鼠中枢神经系统的炎症反应。
其他被广泛使用的益生元化合物是多不饱和酸。特别是,在一项包括美国五个ALS患者的前瞻性队列的纵向研究中,表明摄入Omega-3多不饱和酸可以延缓疾病的发作。
然而,转基因SOD1G93A小鼠在症状前阶段的膳食中补充二十碳五烯酸加速了疾病的进展,缩短了小鼠的寿命,这表明这种多不饱和酸的毒性醛氧化产物在动物的脊髓中增加了,增加了反应性小胶质细胞。
后生元
后生元制剂是生物家族的最新成员,包括由食品级微生物在发酵过程中产生的生物活性化合物,如短链脂肪酸、微生物组分、功能蛋白、分泌多糖、细胞外多糖(EPS)、细胞裂解液、磷磷磷酸、肽甘聚糖衍生的肽和柱状结构。
丁酸盐的施用增加了血液中Treg淋巴细胞的水平,有利于降低炎性细胞因子IL-17的水平,并减缓SOD1G93A转基因小鼠的疾病进展。
粪菌移植
一例ALS女性患者,他们在12个月的随访中通过经内镜肠内管接受了冲洗微生物群移植(WMT),一种改良的粪便微生物群移植术(FMT)。
该病例报告首次展示了使用WMT治疗ALS的直接临床证据,表明WMT可能是控制这种所谓不治之症的新治疗策略。
值得注意的是,患者后来遭受的意外头皮创伤用处方抗生素治疗,导致ALS恶化。随后的抢救性WMT成功地阻止了病情的发展,并迅速改善。
其他补充剂
★ 肌酸
肌酸是一种膳食补充剂,因其有益效果值得关注。它是由精氨酸、甘氨酸和蛋氨酸合成的内源性化合物。由于大部分肌酸储存在骨骼肌中,运动员习惯于将其融入饮食中,以改善肌肉张力。
最近的研究描述了肌酸在预防或延缓神经退行性疾病发病方面的新用途。特别是长期补充肌酸可提高存活率和改善运动协调性。他们测量了肌酸的神经保护作用,研究了SOD1基因改变版本的转基因小鼠。结果表明,肌酸给药保护神经元免受氧化损伤。补充肌酸的运动员无不良副作用。
然而,2003年和2004年完成的两项临床试验测试了口服肌酸补充剂,仅在ALS患者的寿命和肌肉强度方面提供了很少的显著改善。因此,需要更多的研究来了解肌酸的实际作用量,因此,东北肌萎缩侧索硬化症联盟(NEALS)目前正在分析补充肌酸的长期影响。
★ 辅酶Q10
辅酶Q10(CoQ10)或泛醌,一种内源性产生的脂质,存在于我们的饮食中,作为线粒体呼吸系统的辅因子发挥作用。
泛素醇是辅酶Q10的还原形式,具有抗氧化和抗炎作用。它避免了自由基的形成、蛋白质、脂质和DNA的变化,并降低了脂质过氧化的浓度。
此外,在包括神经系统疾病在内的许多疾病中,ROS的增加与辅酶Q10的缺乏之间存在关联。
一些研究报告了CoQ10在不同疾病中的有益作用,如高血压、纤维肌痛和男性不育。辅酶Q10还用于几种神经退行性疾病,如ALS和帕金森病。均衡的饮食可以获得足量的辅酶Q10,但脆弱的受试者可能需要补充。尽管辅酶Q10耐受性良好,但研究仅限于孕妇和儿童。
注意:辅酶Q10可能会导致腹泻、呕吐和皮疹等副作用。此外,辅酶Q10可能会降低华法林等几种药物的治疗效果。
★ L-丝氨酸补充剂
氨基酸 L-丝氨酸的膳食补充剂也可作为神经保护剂。
L-丝氨酸的补充被确定为一种防止 BMAA 中毒的细胞保护剂,并导致 L-丝氨酸补充作为一种潜在的治疗方法。2018 年发表的 1 期临床试验报告称进展斜率降低了 34%.
★ 维生素
维生素参与神经系统的发育,可作为预后因素。由于其细胞抗氧化特性,它们也可用于ALS的治疗。它们通常具有良好的耐受性,不会造成显著的不良影响。然而,它们作为补充剂的用途仍存在争议。
——维生素E
补充维生素E对认知功能和神经系统疾病的影响是有争议的。几项研究表明,认知缺陷或阿尔茨海默病患者没有效果。其他研究发现,在ALS患者服用3个月的维生素E和利鲁唑后,维生素E可以降低OS标志物,这是一种有益的效果。然而,维生素E不影响患者的生存。
最近的研究表明,维生素E还具有调节功能,包括信号转导、抑制蛋白激酶C活性、炎症反应和基因表达调节。大量摄入维生素E(与鱼和海藻油中存在的多不饱和脂肪酸,如Omega-3相关)与患ALS的风险降低50-60%相关。尽管补充维生素E对神经退行性疾病有保护作用,但其疗效仍有待证明。
——维生素C
另一种在ALS中具有潜在作用的维生素是维生素C。已经进行了有限的研究,并使用了少量样本。在ALS之前,在动物模型中补充维生素C不会影响ALS的发病,但可以减少疾病导致的瘫痪的进展。
谷禾数据库中也发现,ALS患者肠道菌群检测结果中维生素C显著低于对照组。
——维生素A
据报道,在帕金森病和阿尔茨海默病等神经退行性疾病中,维生素A水平较低。然而,关于维生素A在ALS患者中的作用,存在着相互矛盾的结果。菲茨杰拉德等人报告说,类胡萝卜素中含有的维生素A摄入量高与ALS发病风险低相关。其他研究发现维生素A与ALS之间没有显著关联。
★ 植物化学物质
中国神经退行性疾病的低发病率可能是由于水果和蔬菜的广泛消费,这与植物化学物质的大量存在有关。
先前的研究表明,植物衍生的生物活性化合物,即植物化学物质,在神经退行性疾病中具有神经保护作用。事实上,越来越多的研究证实了它们的抗氧化特性。植物化学物质存在于蔬菜、谷物和水果中,在文献中通常被描述为“营养食品”。
植物化学物质包括广泛的化合物,如类胡萝卜素、酚类化合物和萜类化合物。
类胡萝卜素
类胡萝卜素是一种广泛存在于许多水果中的植物色素,具有典型的红色、黄色和橙色。它们的目标是过氧基。它们也是另一种抗氧化剂维生素A的前体。
文献报道了β-胡萝卜素与维生素E和C在清除活性氮物种方面的协同效应。先前的研究表明,类胡萝卜素的摄入与ALS风险呈负相关。
多酚
多酚是一类由多种分子组成的化合物。其特征在于存在至少一个对抗氧化和抗肿瘤活性重要的酚环,羟基、甲基或乙酰基取代氢。
在ALS动物模型中进行的几项研究表明,多酚具有神经保护作用。黄酮类化合物是酚类化合物的主要成分。它们属于一大类植物色素,其化学结构源自黄酮。它们由以下亚类组成:花青素、黄烷酮、黄烷-3-醇、黄酮、黄酮醇和异黄酮。
黄酮类化合物在神经炎症中发挥作用,抑制小胶质细胞激活并与神经元受体相互作用。人类神经元SH-SY5Y神经元细胞是一种神经退行性疾病模型,用几种黄酮类化合物,即槲皮素、异槲皮素和阿夫泽林进行治疗。治疗显示出下调环氧化酶-2表达和凋亡途径的有益效果。
白藜芦醇是一种在葡萄中发现的抗氧化化合物,由于其神经保护特性而受到广泛研究。它调节Sirtuin 1(SIRT1),Sirtuin脱乙酰化蛋白的主要成员,通过表观遗传基因沉默调节基因表达。一项研究表明,白藜芦醇增加了皮层和海马中SIRT1的表达,减少了认知障碍。
白藜芦醇可降低ALS 患者脑脊液 (CSF)的体外神经毒性,防止神经元丢失并改善 Ca2+ 稳态,这似乎与白藜芦醇的抗氧化能力有关。奇怪的是,与利鲁唑共同使用会抑制这种保护作用。
事实上,Ca 2+失稳与神经退行性疾病(包括肌萎缩侧索硬化)中自噬机制受损和毒性蛋白聚集有关。旨在调节自噬途径的治疗干预似乎是一种减少蛋白质聚集的有趣方法,主要是在 ALS 的早期阶段。
扩展阅读:
姜黄素
姜黄素是从姜科姜黄根茎中提取的,由于其抗炎和抗氧化特性,可能对神经退行性变具有有益作用,实验动物模型证明了这一点。然而姜黄素的临床疗效仍有争议。鉴于姜黄素作为抗氧化剂的强大活性,它可能在神经元退化中发挥关键作用。
事实上,活性氧(ROS)水平的增加会刺激促炎基因的转录和细胞因子的释放,如TNF-α、IL-1、IL-6以及导致神经炎症过程的趋化因子。因此,神经炎症的慢性可被认为是神经元变性的原因。
在小鼠模型中的几项研究表明,姜黄素可以降低氧化应激条件,增加抗氧化剂(如谷胱甘肽和超氧化物歧化酶)的水平。特别是,文献报道了家族性ALS中TAR DNA结合蛋白43(TDP-43)的过度表达和突变版本的存在。其结果是其在神经炎或细胞质中的聚集和定位错误。
研究人员使用突变的人类TDP-43产生的细胞ALS样模型分析了姜黄素作为治疗药物的潜在作用。他们证明姜黄素中存在的二甲氧基姜黄素对线粒体膜电位具有保护作用,降低了解偶联蛋白2的水平。
一项临床研究表明,纳米姜黄素和利鲁唑治疗1年可提高ALS患者的生存率。姜黄素对大鼠和人类均无不良毒理学影响。然而,在剂量反应研究中,一些患者表现出腹泻和恶心的发作,可能是副作用。
扩展阅读:
萜类化合物
萜类化合物是一个非常大的植物次级代谢产物家族。体外研究表明,从芳香植物中提取的二萜、单萜和倍半萜具有显著的抗氧化活性,表明它们是抗神经变性的化合物。
Omega-3 + 维生素E
并非所有显示出显著健康益处的天然化合物在神经系统疾病中也具有神经保护作用。例如,在ALS小鼠模型中补充Omega-3报告了细胞损伤的增加,可能会增加疾病进展。在最近的一项对家族性ALS小鼠模型的研究中也获得了类似的结果。然而,Omega-3和维生素E的组合可以降低ALS的风险。
其他疗法
物理治疗和特殊设备可以在ALS的整个过程中增强个人的独立性和安全性。
热疗或漩涡疗法以缓解肌肉痉挛。
建议适度锻炼,但可能有助于保持肌肉力量和功能。温和、低冲击的有氧运动,如散步、游泳和骑自行车,可以增强未受影响的肌肉,运动范围和拉伸运动有助于防止肌肉痉挛和挛缩。
物理治疗师可以推荐在不过度锻炼肌肉的情况下提供这些益处的锻炼。
职业治疗师可以建议使用夹板、坡道、矫正支架、助行器、扶手、伸展器、轮椅等设备,帮助个人节省能量并保持活动。
言语治疗和沟通训练,以尽可能多地保持口头沟通技巧。
特殊设备,如轮椅、电动床或床垫,以最大限度地提高功能独立性。
正念减压
发表在《欧洲神经病学杂志》上的一项研究结果,基于正念的计划可能有助于改善ALS患者的焦虑和抑郁。
进行了开放标签、随机临床试验,以评估正念练习是否改善了 100 名 ALS 患者在诊断后 18 个月的抑郁和焦虑。患者被分配接受常规护理或为期八周的正念减压 (MBSR) 计划。
注:
正念可以被认为是以非判断的方式,通过注意当前的时刻是如何新奇的,将注意力转移到时刻体验的过程。
MBSR计划的目标是将注意力转移到当下(“我现在在做什么;我现在的感觉如何”),并接受感觉、知觉和情绪,而不加评判。
研究表明,与接受常规护理的患者相比,使用 ALS 特异性 MBSR 的干预组报告了更好的生活质量和较低的抑郁水平。
注意:在疾病的所有阶段,都应考虑患者的个人意愿,并尽早开始预先护理计划。
ALS患者表现出不同的疾病严重程度,尽管已经确定了一些风险因素,但这些因素仍不足以充分解释这种异质性。肠道微生物组可能对解决这些差异至关重要,因为它可能直接或间接影响ALS。
进一步的研究对于识别ALS中的相关微生物参与者至关重要,以便在未来的治疗中将其作为目标,以改变肠道微生物群,调节疾病进展并改善生活质量。这种干预措施很可能会针对不同环境和不同基因型的患者进行个性化定制。
总的来说,有希望根据致病机制对病例进行更好的分类,以便进行具有有益效果的靶向治疗,并且ALS在未来将成为一种可治疗的疾病。
关爱渐冻症人群

编辑
目前虽然渐冻症难以彻底治愈,但科研人员从未放弃探索各种渐冻症的治疗方法。谷禾也将在肠道菌群领域帮助探索渐冻症患者的菌群特征,尽早发现疾病风险及时干预,同时也希望通过更多的数据和案例帮助像渐冻症一样的罕见病患者找到适合的基于自身菌群的干预方式。
注:本文未经作者授权不得转载。
本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Stopińska K, Radziwoń-Zaleska M, Domitrz I. The Microbiota-Gut-Brain Axis as a Key to Neuropsychiatric Disorders: A Mini Review. J Clin Med. 2021 Oct 10;10(20):4640. doi: 10.3390/jcm10204640. PMID: 34682763; PMCID: PMC8539144.
Zhang Y, Ogbu D, Garrett S, Xia Y, Sun J. Aberrant enteric neuromuscular system and dysbiosis in amyotrophic lateral sclerosis. Gut Microbes. 2021 Jan-Dec;13(1):1996848. doi: 10.1080/19490976.2021.1996848. PMID: 34812107; PMCID: PMC8632307.
D’Antona S, Caramenti M, Porro D, Castiglioni I, Cava C. Amyotrophic Lateral Sclerosis: A Diet Review. Foods. 2021 Dec 17;10(12):3128. doi: 10.3390/foods10123128. PMID: 34945679; PMCID: PMC8702143.
Yu W, He J, Cai X, Yu Z, Zou Z, Fan D. Neuroimmune Crosstalk Between the Peripheral and the Central Immune System in Amyotrophic Lateral Sclerosis. Front Aging Neurosci. 2022 May 3;14:890958. doi: 10.3389/fnagi.2022.890958. PMID: 35592701; PMCID: PMC9110796.
Beers DR, Appel SH. Immune dysregulation in amyotrophic lateral sclerosis: mechanisms and emerging therapies. Lancet Neurol. 2019 Feb;18(2):211-220. doi: 10.1016/S1474-4422(18)30394-6. PMID: 30663610.
Chan GN, Evans RA, Banks DB, Mesev EV, Miller DS, Cannon RE. Selective induction of P-glycoprotein at the CNS barriers during symptomatic stage of an ALS animal model. Neurosci Lett. 2017 Feb 3;639:103-113. doi: 10.1016/j.neulet.2016.12.049. Epub 2016 Dec 21. PMID: 28011392; PMCID: PMC5278641.
Chen L, Liu X, Tang L, Zhang N, Fan D. Long-Term Use of Riluzole Could Improve the Prognosis of Sporadic Amyotrophic Lateral Sclerosis Patients: A Real-World Cohort Study in China. Front Aging Neurosci. 2016 Oct 24;8:246. doi: 10.3389/fnagi.2016.00246. PMID: 27822184; PMCID: PMC5075535.
Chiu IM, Phatnani H, Kuligowski M, Tapia JC, Carrasco MA, Zhang M, Maniatis T, Carroll MC. Activation of innate and humoral immunity in the peripheral nervous system of ALS transgenic mice. Proc Natl Acad Sci U S A. 2009 Dec 8;106(49):20960-5. doi: 10.1073/pnas.0911405106. Epub 2009 Nov 20. PMID: 19933335; PMCID: PMC2791631.
Cragnolini AB, Lampitella G, Virtuoso A, Viscovo I, Panetsos F, Papa M, Cirillo G. Regional brain susceptibility to neurodegeneration: what is the role of glial cells? Neural Regen Res. 2020 May;15(5):838-842. doi: 10.4103/1673-5374.268897. PMID: 31719244; PMCID: PMC6990768.
Erickson MA, Banks WA. Neuroimmune Axes of the Blood-Brain Barriers and Blood-Brain Interfaces: Bases for Physiological Regulation, Disease States, and Pharmacological Interventions. Pharmacol Rev. 2018 Apr;70(2):278-314. doi: 10.1124/pr.117.014647. PMID: 29496890; PMCID: PMC5833009
Chua JP, De Calbiac H, Kabashi E, Barmada SJ. Autophagy and ALS: mechanistic insights and therapeutic implications. Autophagy. 2022 Feb;18(2):254-282. doi: 10.1080/15548627.2021.1926656. Epub 2021 May 31. PMID: 34057020; PMCID: PMC8942428.
Oakes JA, Davies MC, Collins MO. TBK1: a new player in ALS linking autophagy and neuroinflammation. Mol Brain. 2017 Feb 2;10(1):5. doi: 10.1186/s13041-017-0287-x. PMID: 28148298; PMCID: PMC5288885.
Peggion C, Scalcon V, Massimino ML, Nies K, Lopreiato R, Rigobello MP, Bertoli A. SOD1 in ALS: Taking Stock in Pathogenic Mechanisms and the Role of Glial and Muscle Cells. Antioxidants (Basel). 2022 Mar 23;11(4):614. doi: 10.3390/antiox11040614. PMID: 35453299; PMCID: PMC9032988.
Calvo AC, Valledor-Martín I, Moreno-Martínez L, Toivonen JM, Osta R. Lessons to Learn from the Gut Microbiota: A Focus on Amyotrophic Lateral Sclerosis. Genes (Basel). 2022 May 12;13(5):865. doi: 10.3390/genes13050865. PMID: 35627250; PMCID: PMC9140531.
Lu G, Wen Q, Cui B, Li Q, Zhang F. Washed microbiota transplantation stopped the deterioration of amyotrophic lateral sclerosis: the first case report and narrative review. J Biomed Res. 2022 Jun 28:1-8. doi: 10.7555/JBR.36.20220088. Epub ahead of print. PMID: 35821195.
Cox LM, Calcagno N, Gauthier C, Madore C, Butovsky O, Weiner HL. The microbiota restrains neurodegenerative microglia in a model of amyotrophic lateral sclerosis. Microbiome. 2022 Mar 11;10(1):47. doi: 10.1186/s40168-022-01232-z. PMID: 35272713; PMCID: PMC8915543.
Zeng, Q., Shen, J., Chen, K. et al. The alteration of gut microbiome and metabolism in amyotrophic lateral sclerosis patients. Sci Rep 10, 12998 (2020).
Alonso R, Pisa D, Carrasco L. Searching for Bacteria in Neural Tissue From Amyotrophic Lateral Sclerosis. Front Neurosci. 2019 Feb 26;13:171. doi: 10.3389/fnins.2019.00171. PMID: 30863279; PMCID: PMC6399391.
Boddy SL, Giovannelli I, Sassani M, Cooper-Knock J, Snyder MP, Segal E, Elinav E, Barker LA, Shaw PJ, McDermott CJ. The gut microbiome: a key player in the complexity of amyotrophic lateral sclerosis (ALS). BMC Med. 2021 Jan 20;19(1):13. doi: 10.1186/s12916-020-01885-3. PMID: 33468103; PMCID: PMC7816375.
Sun J, Huang T, Debelius JW, Fang F. Gut microbiome and amyotrophic lateral sclerosis: A systematic review of current evidence. J Intern Med. 2021 Oct;290(4):758-788. doi: 10.1111/joim.13336. Epub 2021 Jul 8. PMID: 34080741.
Martin S, Battistini C, Sun J. A Gut Feeling in Amyotrophic Lateral Sclerosis: Microbiome of Mice and Men. Front Cell Infect Microbiol. 2022 Mar 11;12:839526. doi: 10.3389/fcimb.2022.839526. PMID: 35360111; PMCID: PMC8963415.
Nicholson K, Bjornevik K, Abu-Ali G, Chan J, Cortese M, Dedi B, Jeon M, Xavier R, Huttenhower C, Ascherio A, Berry JD. The human gut microbiota in people with amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener. 2021 May;22(3-4):186-194. doi: 10.1080/21678421.2020.1828475. Epub 2020 Nov 2. PMID: 33135936.
Garofalo S, Cocozza G, Porzia A, Inghilleri M, Raspa M, Scavizzi F, Aronica E, Bernardini G, Peng L, Ransohoff RM, Santoni A, Limatola C. Natural killer cells modulate motor neuron-immune cell cross talk in models of Amyotrophic Lateral Sclerosis. Nat Commun. 2020 Apr 14;11(1):1773. doi: 10.1038/s41467-020-15644-8. PMID: 32286313; PMCID: PMC7156729.
Hertzberg VS, Singh H, Fournier CN, Moustafa A, Polak M, Kuelbs CA, Torralba MG, Tansey MG, Nelson KE, Glass JD. Gut microbiome differences between amyotrophic lateral sclerosis patients and spouse controls. Amyotroph Lateral Scler Frontotemporal Degener. 2022 Feb;23(1-2):91-99. doi: 10.1080/21678421.2021.1904994. Epub 2021 Apr 5. PMID: 33818222.
Andrew AS, Bradley WG, Peipert D, Butt T, Amoako K, Pioro EP, Tandan R, Novak J, Quick A, Pugar KD, Sawlani K, Katirji B, Hayes TA, Cazzolli P, Gui J, Mehta P, Horton DK, Stommel EW. Risk factors for amyotrophic lateral sclerosis: A regional United States case-control study. Muscle Nerve. 2021 Jan;63(1):52-59. doi: 10.1002/mus.27085. Epub 2020 Oct 18. PMID: 33006184; PMCID: PMC7821307.
Masrori P, Van Damme P. Amyotrophic lateral sclerosis: a clinical review. Eur J Neurol. 2020 Oct;27(10):1918-1929. doi: 10.1111/ene.14393. Epub 2020 Jul 7. PMID: 32526057; PMCID: PMC7540334.

谷禾健康
怀孕的母亲与体内的胎儿是息息相关的。由于婴儿接触母体微生物群,母亲和孩子之间的微生物联系在怀孕期间形成。而宿主与微生物群的联系在出生后成熟,并进化成为个体生命中最重要的共生关系之一,对响应营养和环境刺激的稳态调节至关重要。


最近,有报道称微生物群在子宫内发育,并在整个妊娠期间改变。这一发现表明,胎儿很可能通过胎盘早期暴露于母体微生物群。
✦多种因素共同作用婴儿的微生物群
婴儿的基因组成、分娩方式、抗生素使用、喂养类型、疾病状况和其他环境暴露可能影响新生儿微生物群的建立和成熟。
在子宫内和早期生活中的营养和环境暴露是形成健康肠道微生物群的关键因素。强大的微生物群有助于粘膜免疫系统的发育和成熟,有助于维生素合成和营养吸收,并在中枢神经系统的生化信号中发挥作用。
健康与疾病的发展起源

Mua B,et al.Comprehensive Gut Microbiota.2022
生命的前1000天,是发育可塑性窗口。这是一个快速成长和表观遗传调控的关键时期。
✦微生物群改变与许多疾病有关
这一发展时期允许通过多种因素调节妊娠结局和微生物组,包括母亲营养、药物滥用、吸烟、城市化、抗生素暴露以及婴儿的喂养类型。胎儿期对此类外部压力源的敏感性也会持续影响到成年的微生物组的组成和功能。
在这个早期时间点,微生物群多样性的改变还与许多疾病有关,包括但不限于慢性代谢紊乱、自身免疫性疾病和神经发育障碍。
本文总结了孕期和产后母婴微生物组的生理及病理变化。此外,我们将讲述常见的母体和营养因素对发育的影响及其在成年期疾病发病中的作用。
本文主要从以下几个方面讲述
●妊娠期间微生物组的变化
●影响婴儿微生物群的因素
●母体微生物对后代免疫的影响
●微生物对儿童疾病风险的影响
几十年来,人们对妊娠相关的激素和代谢变化进行了广泛研究,而对妊娠期间发生的微生物组成变化的研究则较少。
✦母体微生物群发生显著变化
母体微生物群在怀孕过程中发生了显著变化,其特征是微生物群落内丰度和多样性或α多样性降低,微生物群落间丰度或β多样性增加。
这些变化受育龄妇女营养、胎龄、遗传、种族和环境因素的差异影响。此外,孕期母体微生物群组成与母体饮食、孕前体重和孕期体重增加相关,并表明肠道、阴道、口腔和胎盘微生物群可能会根据母体生活方式和孕期环境暴露而发生变化。
孕期母体微生物组成变化
Mua B,et al.Comprehensive Gut Microbiota.2022
健康怀孕的特点是不同部位微生物组丰度和多样性的增加和减少。口腔、胎盘、肠道和阴道微生物组的改变与妊娠炎症和整体健康有关。
细菌的种类(放线菌属、变形菌属、厚壁菌门和拟杆菌门)分别按颜色(绿色、红色、蓝色和黄色)区分。微生物群落多样性在文本中用黑色箭头表示,它们各自的增加和减少。
在整个孕期,肠道微生物组对于营养素获取、免疫重塑和抵抗病原体至关重要。对人类微生物组的研究发现,肠道微生物组的组成在怀孕过程中发生变化,并与生理和代谢变化相关。
✦妊娠期间肠道微生物改变
妊娠前期体重指数较高或患有妊娠期糖尿病的女性在妊娠晚期发现β多样性微生物群落水平升高,且在产后持续存在。还发现,在适当的营养干预后,妊娠期糖尿病患者表现出α多样性增加。
这些发现表明,怀孕是一个动态过程,根据女性怀孕前和怀孕期间的身体状态(即体重和激素水平)、心理压力和环境因素,改变了微生物组特征;所有这些都会在怀孕期间影响肠道微生物组的组成。
•怀孕前三个月与正常妇女相似
例如,在怀孕的前三个月,母体肠道微生物组的组成与健康的非孕妇相似,其中厚壁菌(Firmicutes)比拟杆菌(Bacteroides)占优势。
•三个月后产丁酸的细菌减少
在头三个月后,母体肠道微生物群中产生丁酸的细菌(如普拉梭菌)减少,双歧杆菌(Bifidobacteria)、变形杆菌(Proteobacteria)和乳酸产生菌增加。
反过来,肠道微生物组的改变可能会对妊娠疾病的发生率、胎儿状况、妊娠结果和胎儿免疫发育产生重大影响。
✦激素变化影响细菌生长
•双歧杆菌增加
妊娠相关的激素变化也与宿主激素引起的微生物组组成改变有关。向雌性小鼠补充了孕激素,并确定双歧杆菌(Bifidobacteria)丰度增加,孕激素促进了孕晚期双歧杆菌的生长。
此外,母体胃肠粘膜免疫反应的变化,以及妊娠期间代谢激素的变化,可能引发低级促炎状态,从而诱导肠道通透性,促进葡萄糖从肠道上皮向内腔扩散。这可能会导致体重增加,进而改变肠道微生物组组成。
总的来说,最近的研究结果表明,整个孕期肠道微生物组组成发生了显著变化,与初始体重和饮食、体重增加、炎症水平和代谢参数有关。
✦怀孕对免疫性疾病存在有益影响
有趣的是,怀孕对某些自身免疫性疾病,包括炎症性肠病的病程有有益的影响。
炎症性肠病包括一组广泛的疾病,这些疾病具有潜在的免疫介导的失调和各种肠道炎症状态。
炎症性肠病的两种主要形式为溃疡性结肠炎(UC)和克罗恩病(CD)。
肠道微生物组的组成对炎症性肠病的临床过程很重要,在大多数炎症性肠病病例中,由于肠道失调,细菌多样性降低。
注:炎症性肠病与肠道菌群的关联在谷禾前不久的文章中有具体描述。
详见:肠道菌群失调与炎症性肠病的关联
•怀孕期间炎症性肠病改善
新出现的证据表明,在怀孕期间和怀孕后,炎症性肠病的总体病程有所改善。雌激素和孕酮通过积极调节肠道上皮,对疾病活动有有益影响。
这些激素缓解了压力,减少了促炎细胞因子的产生,刺激了伤口愈合,并增加了上皮屏障功能。
注意:妊娠对炎症性肠病的积极影响可能取决于患者的特征,例如潜在的遗传风险因素、妊娠前或妊娠期间持续的疾病严重程度、环境因素(即饮食、药物、酒精)以及随后对微生物组组成的影响。
阴道微生物组由许多细菌物种控制,包括乳杆菌属(Lactobacillus)以及梭状芽孢杆菌目(Clostridium)、拟杆菌(Bacteroidales)和放线菌目(Actinomycetales)的成员。
✦阴道微生物组在母婴健康中有重要作用
•抑制细菌和病毒
例如,乳杆菌属(Lactobacillaceae)的不同成员可以增强阴道健康的各种特征。这些产乳酸细菌在维持低pH值(<4.5)方面发挥了作用,从而形成了抵抗病原体入侵的屏障。它们还分泌可以抑制泌尿生殖道细菌和病毒感染的代谢物。
•产生细菌素,杀死病原体
此外,除了降低阴道pH值和增加阴道分泌物以防止致病菌进入子宫并引起感染外,乳酸杆菌还会产生细菌素,杀死入侵的病原体。
在母体阴道道中发现的某些细菌种类也可能具有抗菌特性,有助于预防细菌性阴道病和淋病奈瑟菌感染。
✦怀孕后阴道微生物多样性降低
在阴道分娩期间,新生婴儿接触阴道微生物群,这对婴儿微生物群的定植至关重要。重要的是,与未怀孕妇女相比,随着妊娠进展,母体阴道微生物组发生变化,总体细菌多样性降低,不过乳酸杆菌(Lactobacillales)、梭状芽孢杆菌(Clostridiales)、拟杆菌(Bacteroidales)和放线菌目(Actinomycetales)的优势增加。
最近证实,随着乳酸杆菌的增加,母体阴道微生物组的多样性降低,支原体和脲原体的含量降低,这两者都与早产和出生体重低等负面结果相关。
•微生物变化可能是为了保护胎儿
在孕妇体内观察到的阴道微生物组变化可能是保护胎儿健康和在出生时提供特定微生物种类的适应性反应的一部分,因为健康妊娠相关微生物组的变化可能会使母亲容易产生负面健康结果。
母体阴道微生物组组成取决于胎龄和种族。有趣的是,怀孕后期的母体微生物群落与未怀孕状态的相似。
注:也有研究整个怀孕期间没有发现阴道微生物组有任何显著变化。然而,他们发现产后阴道微生物群落与分娩后长达一年的肠道微生物群落更为相似。在他们的研究中,分娩后检测到从乳酸杆菌到各种厌氧细菌的转变,包括Peptoniphilus、Prevotella和Anaerococcus。
✦细菌性阴道病
通常,当阴道群落内的乳酸杆菌浓度改变时,会发生生物失调。阴道失调的特点是乳酸杆菌的丰度低,厌氧微生物增多。
细菌性阴道病(BV)是一种由阴道中自然发现的细菌过度生长引起的阴道炎症,是妊娠期最常见的一种生殖道感染。细菌性阴道病是一种由阴道环境变化引起的病症,它允许机会致病菌在阴道区域定居。怀孕期间的细菌性阴道病对母亲和孩子都是健康风险。
机会致病菌——正常菌群与宿主之间、正常菌群之间,通过营养竞争、代谢产物的相互制约等因素,维持着良好的生存平衡。在一定条件下这种平衡关系被打破,原来不致病的正常菌群中的细菌可成为致病菌,称这类细菌为机会性致病菌,也称条件致病菌。
•细菌性阴道病有更高的早产风险
一些初步研究表明,患有细菌性阴道病的孕妇存在更高的早产风险,这突出了怀孕期间阴道微生物组的重要性。
✦影响细菌性阴道病的因素
多年来,营养被认为是细菌性阴道病发展的一个因素。报告称,妊娠期缺铁和维生素D与细菌性阴道病风险增加有关。
扩展阅读:
人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长
维生素D与肠道菌群的互作
•富含纤维的饮食发病率降低
在一项平行研究中,维生素A、维生素C、维生素E和维生素b-胡萝卜素的血清浓度较低与细菌性阴道病相关。最近的一项发现表明,富含纤维的饮食与细菌性阴道病发病率降低相关。
•超重和肥胖发病率更高
此外,一项流行率研究得出结论,超重和肥胖女性的细菌性阴道病发病率更高。这些发现强调了饮食对阴道微生物组组成的影响,进而强调了微生物组对怀孕期间阴道健康的重要性。
▸ 口腔含有仅次于肠道的第二大的微生物组,里面居住着700多种不同的细菌,包括链球菌(Streptococcus)、乳酸杆菌、葡萄球菌(Staphylococcus)和棒状杆菌。
微生物定植于牙齿的硬表面和口腔粘膜的软组织,通常以生物膜的形式存在。
注:微生物组研究的一个局限性是在没有交叉污染(即肠道或肺部)的情况下对微生物组进行采样。然而,由于口腔微生物组采样的简便性,它已成为迄今为止研究最深入的微生物组。
口腔微生物组在促进健康或疾病进展中起着关键作用。它对于维持口腔稳态、保护口腔和预防疾病发展至关重要。
✦怀孕期间口腔微生物发生变化
•总活菌数显著增加
在怀孕的不同阶段,口腔微生物组的组成会发生变化。在对非怀孕妇女口腔中存在的七种常见细菌种类的丰度进行比较时,妊娠早期、妊娠中期和妊娠晚期发现,与非怀孕妇女相比,怀孕期间的总活菌数显著增加。与其他妊娠阶段相比,妊娠早期存活微生物计数最高。
•妊娠中期致病菌水平升高
与未怀孕妇女相比,妊娠早期和中期组牙龈卟啉单胞菌(Porphyromonas)和放线聚集杆菌(均为致病菌)的水平升高。
牙龈卟啉单胞菌是一种非酵解糖的革兰氏阴性厌氧球杆菌,是研究广泛且证据充足的重要牙周致病菌之一。
最后,念珠菌(Candida)水平在妊娠中期和末期显著升高。有趣的是,雌激素与念珠菌感染有关,并可能解释怀孕期间念珠菌的丰富。
尽管口腔微生物组已被广泛研究,但口腔微生物组与饮食和妊娠结合仍是未来研究的领域。
▸ 胎盘是孕期母亲和胎儿之间的主要营养和激素调节界面。它在感知和引导母体营养信号到胎儿方面发挥着重要作用。
✦胎盘连接母体和胎儿的物质交换
胎盘促进氧气和生长因子向胎儿的交换,并将废物从胎儿转移到母体循环系统。
虽然长期以来认为胎儿和胎盘是无菌环境,不过这是一个有争议的话题。
最近有证据表明,在分娩前通过胎盘进行微生物交换。健康孕妇的脐带血、羊水和胎盘中检测到微生物颗粒。然而,这种细菌DNA是否是细菌从母亲血液中定植或易位的证据尚不清楚。
•细菌可能由母体经胎盘进入胎儿
一些理论表明,细菌可能由免疫细胞通过血流和淋巴进入胎盘,并通过胎盘进入胎儿一侧,以帮助启动胎儿免疫系统。事实上,在健康新生儿的胎盘组织中检测到几种细菌种类,包括放线菌属(双歧杆菌、丙酸杆菌、链霉菌、红球菌)、厚壁菌属(乳杆菌)、拟杆菌属(拟杆菌)和变形杆菌属(大肠杆菌、肠杆菌)。
此外,在通过剖宫产分娩的健康母亲的所有29例胎盘活检中发现了乳酸杆菌和双歧杆菌(Bifidobacterium)。
✦胎盘中的微生物组暂不明确
尽管如此,最近一项更有力的研究表明,没有证据表明人类胎盘内存在微生物组,尽管它可能含有潜在的病原体。他们证明,胎盘样本中的大多数阳性细菌信号是出生或实验室污染的结果。
然而,在同一项研究中,该小组在临产前采集的约5%的样本中发现了无乳链球菌(S.agalactiae)的证据。由于无乳链球菌是新生儿败血症的主要原因,胎盘可能是败血症新生儿感染的起始部位。
注:新生儿的败血症和早产也归因于母体口腔感染,如牙周病。此外,胎盘中发现的细菌门与母体口腔中发现的菌门最为相似。尽管似乎有一些证据表明母亲和胎儿之间存在胎盘微生物组交换,但对分娩期间或分娩后以及实验室中污染的担忧仍然是科学界争论的话题。
母亲的健康状况和微生物群状况对儿童微生物群的定植和发展有着深远的影响。同样,在出生时和婴儿早期建立健康的肠道微生物群对儿童免疫系统的发育和成熟至关重要。
由于共生微生物群在肠道免疫中起着关键作用,任何改变其组成的环境或宿主因素都可能导致负面健康结果。我们在此罗列了一些影响婴儿微生物群定植和发育的主要因素:母体营养、分娩方式、妊娠期和围产期抗生素的使用、喂养类型和胎盘微生物群。
什么是营养不良?
世界卫生组织将营养不良定义为“人体能量或营养摄入的不平衡(不足和过量)”。营养不足和营养过剩都被认为是营养不良的表现形式;然而,过度摄入某些特定营养素通常被称为肥胖。
营养不良包括缺乏基本的宏观和微观营养素,发育迟缓、消瘦和体重不足。营养过剩包括超重和肥胖,其特征是营养消耗过量和体质指数超标。这两种形式的营养不良都可能导致非传染性饮食相关疾病的发展,如心脏病、中风、糖尿病甚至是癌症。
✦营养不良的影响
•增加了疾病和死亡率
营养不良是一个全球性的问题,它影响着每个国家的人民,最脆弱的人群是中低收入国家的五岁以下儿童和育龄妇女。营养不良增加了母亲和儿童疾病和死亡的可能性,是五岁以下儿童死亡的主要原因,占所有死亡人数的近一半(45%)。
•导致肠道微生物失调
营养不足和营养过剩都会导致屏障功能和肠道完整性失调,从而导致生物失调。如前所述,在怀孕期间,健康且平衡的微生物组保护母亲和胎儿免受机会病原体的侵害,产生妊娠发育所需的营养物质,并将营养物质吸收到血液中,以促进胎儿健康成长。
当微生物组因营养不良而受损时,这些有益功能就会丧失,导致母体肠道炎症水平升高。孕期营养不良还与围产期并发症、流产和早产风险增加、出生体重低以及婴儿后期心血管疾病、中风、糖尿病和癌症等非传染性饮食相关疾病的发生有关。
✦母体营养对微生物群影响的一些研究
大多数关于母体营养在促进婴儿健康微生物群中的作用研究都是在动物模型中进行的。
怀孕期间高脂饮食与微生物组成的差异相关
与正常饮食对照组相比,热量限制的怀孕小鼠的细菌组成和肠道微生物组的多样性没有显著差异。
然而,与正常饮食的雌性小鼠相比,怀孕前和怀孕期间喂养高脂肪饮食的雌性老鼠在怀孕后期肠道微生物群发生了变化。
营养与婴儿的生长结果相关
检查了营养不良婴儿的母乳,发现与健康婴儿母亲的母乳相比,唾液酸化的母乳低聚糖(HMO)的含量显著降低。
在小鼠和小猪后代的饮食中添加唾液酸化的母乳低聚糖可以改善婴儿的生长结果。不过目前只有少数研究关注了孕期母体营养在人类中的作用。
素食导致罗氏菌和毛螺菌丰度增加
另一项研究指出,素食导致微生物中罗氏菌属(Roseburia)和毛螺菌科(Lachnospiraceae)的丰度增加,而与杂食性饮食相比,未检测到a多样性的差异。高脂肪、低纤维摄入孕妇的细菌密度较低。
此外,在怀孕早期,不饱和脂肪酸的高摄入量也与微生物密度降低相关。一项队列研究表明,早产母亲在怀孕期间维生素D和视黄醇摄入量较高,与微生物a多样性降低和促炎性及变形杆菌丰度增加相关。
视黄醇又称为维生素A,对于人体的多项生命活动都具有非常重要的作用。
反过来,维生素E的摄入与促炎性的减少相关。在超重孕妇中,膳食纤维和多不饱和脂肪酸导致微生物群丰富度更高,血清中zonulin蛋白水平降低。
zonulin是一种不利调节肠道紧密连接通透性的蛋白质。
✦营养不良导致微生物缺乏
一项纵向比较研究报告称,与健康对照组相比,严重急性营养不良儿童(由食物和水不安全以及母乳喂养不足引起)存在肠道微生物组缺乏和发育不成熟。
含有严重急性营养不良微生物群的小鼠也被发现具有较高水平的无害梭状芽孢杆菌(Clostridium)和沃氏嗜胆菌属(Bilophila wadsworthia),这两种细菌分别与免疫受损患者和炎症性肠综合征有关。
产妇产后时期微生物群的变化显著。母亲的微生物群在出生一个月后仍未恢复到基线水平。产后的特点是激素发生剧烈变化,包括孕酮和雌激素水平大幅下降。孕期不饱和脂肪酸消耗量的增加与分娩后变形杆菌(Proteobacteria)和厚壁菌(Firmicutes)的丰度相对于其他门的减少有关。
注:由于只有少量关于产后期的研究,因此需要进一步调查,以更好地了解这一阶段的微生物群。
✦母体营养不良会影响营养输送
•营养不良易导致宫内生长受限
母亲营养不良也会影响胎盘的营养输送和大小,并与炎症途径增加导致的宫内生长受限(IUGR)相关。
低出生体重与宫内生长受限相关,这涉及胎盘结构、形态受损和胎盘血管系统异常发育,从而损害胎盘营养物质的运输。在这些条件下,发育中的胎儿表现出较低的代谢率和较慢的生长率,以弥补营养不足。因此,胎儿的生长潜力低于其胎龄的正常水平。
•非传染性疾病风险增加
妊娠期间的母体营养限制也可能以男性特有的方式影响妊娠后半期胎儿脑内大麻素系统的发育,这在母体营养限制的狒狒模型中提供了证据。宫内生长受限可能导致非传染性疾病的风险增加,如代谢综合征、胰岛素抵抗易感性、2型糖尿病和成年期心血管疾病。
注意:除了营养不足,胎盘功能不全还可能由母亲年龄、吸烟和吸毒、高海拔妊娠、胎盘血流异常(子痫前期)、感染、炎症和胎儿先天性疾病引起。
// 建议
为了使母亲和婴儿拥有更好的健康,需要关注孕期和产后的营养摄入,尽量保证饮食均衡且有营养,不缺乏也不过量。
✦分娩类型对婴儿早期微生物群有影响
分娩类型对婴儿早期微生物群的定植有影响。由于暴露于阴道、粪便和皮肤微生物群,大多数早期微生物定植发生在自然分娩期间。
•阴道分娩
阴道分娩期间,兼性厌氧菌(如大肠杆菌、葡萄球菌和链球菌)定植于新生儿肠道,并允许严格的厌氧菌(例如拟杆菌和双歧杆菌)增殖。
•剖腹产分娩
相比之下,剖腹产出生的婴儿改变了微生物组,这可能会影响以后的健康。剖腹产婴儿的双歧杆菌和拟杆菌定植延迟,艰难梭菌水平较高。
基于丙酸杆菌、棒状杆菌和链球菌(Streptococcus)在剖腹产婴儿中增加,新生儿肠道微生物组存在显著差异,这与皮肤微生物组相似,而在阴道产婴儿中观察到乳酸杆菌和普雷沃氏菌(Prevotella)水平增加,这与母体阴道微生物组相似。
✦出生地也会影响婴儿早期微生物
有趣的是,婴儿出生的地点也会影响婴儿早期微生物群的定植。发现,与家庭分娩相比,在医院阴道分娩的婴儿中梭状芽孢杆菌(Clostridium)和肠杆菌(Enterobacteriaceae)的水平更高。
通过对771名足月医院出生的婴儿和母亲进行纵向抽样和宏基因组分析,在剖腹产婴儿和阴道分娩时使用母体抗生素预防或未在新生儿期母乳喂养的婴儿中,拟杆菌的母体传播受到干扰,以及肠球菌、肠杆菌和克雷伯氏菌等机会性病原体的高度定植,观察到的影响持续到出生后一年。
// 建议
阴道分娩相较于剖腹产分娩微生物群更健康。作为一种在新生儿中引入阴道微生物群的方法,阴道接种是一种很有前途的方法,可以恢复剖腹产婴儿的微生物组成。
该方法需要对新生儿进行擦拭,新生儿通常缺乏双歧杆菌和拟杆菌,这些细菌在出生时存在于母亲的阴道微生物组中。使用这种方法,已经被证明剖腹产婴儿的微生物组组成部分得到恢复。
改变早期微生物组的另一个主要因素是妊娠期和围产期使用抗生素。怀孕期间的抗生素治疗与新生儿第一次粪便中细菌多样性的减少以及肠道中乳酸杆菌和双歧杆菌的丰度降低有关。
✦使用抗生素导致多样性降低
在生命早期使用抗生素也会导致物种和菌株水平上的微生物多样性降低,某些有益物种如梭状芽孢杆菌减少,抗生素抗性细菌如肠球菌的数量增加。抗生素暴露对后代微生物组更深远的影响将在后面继续讲述。
// 建议
由于抗生素的使用,婴儿的微生物多样性会降低,还会对健康造成一定影响。因此建议不是必要情况,尽量减少抗生素的使用。
✦母乳促进免疫发育
出生后,儿童微生物群发育的最重要因素是母乳喂养。母亲母乳是细菌、抗原、营养素和生物活性物质的唯一来源,所有这些都能促进婴儿免疫系统发育、新陈代谢和肠粘膜屏障功能。
•母亲的饮食影响母乳组成
母亲的饮食是母乳组成的重要因素。最近证明,母亲的饮食显著改变了母乳低聚糖的组成,地理位置和体重也在一定程度上影响母乳的组成。
一项全面系统综述得出结论,母亲饮食中脂肪酸、脂溶性维生素、维生素B1和维生素C都与母乳成分有关。
注:虽然强烈建议母乳喂养,但有时这是不可能的或不充分的,只能用配方奶粉代替。婴儿配方奶粉试图模仿母乳,通常以补充维生素、铁、脂肪酸和益生菌的大豆或牛奶等替代品为基础。
•母乳喂养下的主要菌群
尽管母乳成分因母亲健康状况、饮食、分娩方式和哺乳时间而异,但母乳主要由几个微生物属(葡萄球菌、链球菌、丙酸杆菌、鞘氨醇杆菌、双歧杆菌和乳酸杆菌)构成,并导致双歧杆菌、拟杆菌的早期定植,以及大肠杆菌和艰难梭菌的水平较低。
•配方奶喂养下的主要菌群
相比之下,配方奶喂养与母乳喂养婴儿相比,艰难梭菌(C. difficile)、脆弱拟杆菌(Bacteroides fragilis)和大肠杆菌(E. coli)的定植率更高,其肠道微生物组与更典型的成人模式相似。
✦母乳对于婴儿十分重要
母乳不仅作为细菌来源,还含有细菌抗原和其他生物活性物质,可刺激免疫系统的发育和成熟。最近,使用宏基因组方法发现,母乳喂养的样本中与免疫、代谢和生物合成活动相关的基因的共表达相比配方奶粉喂养的样本增加。
•促进免疫系统发育和调整
母乳中含有益生母乳低聚糖,可促进双歧杆菌生长,进而在免疫系统的发育和微调以及抑制致病物种生长方面发挥重要作用。这些研究证明了母乳喂养在早期婴儿微生物群发育和成熟中的重要性。
// 建议
条件允许的话,最好还是用母乳喂养婴儿(不过母乳喂养的前提需要保证母亲是健康的)。如果不行的话也应选用成分相似的配方奶进行喂养。
在婴儿期建立健康的肠道微生物群对于儿童日后免疫力的发育和成熟至关重要。孕期母体肠道微生物组可能通过细菌代谢物或免疫球蛋白直接或间接影响胎儿免疫发育。
肠-乳腺通路是肠道细菌在怀孕期间通过肠系膜淋巴网络从母体胃肠道向乳腺的生理易位机制,可能有助于后代的免疫发展。
尽管确切的机制尚待确定,但研究表明母体微生物组与胎儿免疫之间存在联系。
产前母子之间的微生物联系
Mua B,et al.Comprehensive Gut Microbiota.2022
怀孕期间,母婴界面存在定向微生物群影响。所谓的肠乳途径是怀孕期间肠道细菌通过肠系膜淋巴网络易位的潜在机制,被认为通过表观遗传变化诱导后代的免疫发育。
母体肠道细菌和代谢产物从母体胃肠道输送到乳腺,通过肠道-母乳轴影响产后肠道定植和免疫。母体的口腔和胎儿胎盘串扰会导致子宫内共生肠道细菌的早期定植,从而获得终身免疫。
怀孕期间,母体肠道中产生的代谢物(如短链脂肪酸)会转移到乳腺,在乳腺中通过母乳喂养传递给婴儿。
对微生物和代谢物的动物和人类研究为孕期微生物易位及其对胎儿免疫的影响提供了证据。例如,怀孕小鼠在妊娠晚期口服乳酸菌菌株乳酸乳球菌和唾液乳球菌,然后在小鼠的母乳和组织中检测到。
肠道微生物组产生代谢产物,在调节宿主免疫、生理和能量产生中发挥关键作用。
✦有助于婴儿生理发育
由于短链脂肪酸与人类微生物群、免疫和神经内分泌系统的相互作用,短链脂肪酸在人体稳态中发挥着关键作用,并可能有助于婴儿的神经、代谢和免疫发育。
母乳中由细菌或肠道人类细胞产生的代谢物,通过促进或抑制细菌生长的机制,帮助调节乳汁和婴儿微生物组组成。
将具有特应性表型的母亲与非特应性母亲的乳汁成分进行了比较,发现特应性妈妈的乙酸和丁酸水平明显较低,与婴儿体重指数呈负相关。
母亲特应性状态定义为有过敏症状,如特应性皮炎、哮喘和食物过敏等。同样,母乳激素瘦素和胰岛素水平的变化与婴儿肠道微生物多样性和通透性的差异有关。
✦调节宿主免疫
•母体视黄酸提高后代免疫力
母体视黄酸作为胎儿3型先天性淋巴细胞的调节因子,并通过诱导小鼠胎儿发育过程中的次级淋巴器官来提高后代的免疫力。
视黄酸——又称维A酸,是体内维生素A的代谢中间产物,主要影响骨的生长和促进上皮细胞增生、分化、角质溶解等代谢作用。
3型先天淋巴细胞(ILC3)具有抗原呈递作用,可以激活T细胞反应。
•短链脂肪酸调节肠道免疫,防止致病性感染
微生物短链脂肪酸(包括丁酸、乙酸盐和丙酸盐)影响肠道免疫,调节结肠调节性T细胞(一种免疫T细胞的特殊亚群),增强口腔对食物的耐受性,并防止肠道致病性感染。
•对哮喘有积极影响
同样,妊娠期间的细菌代谢产物和母体饮食通过补充纤维和乙酸盐增强调节性T细胞的丰度和功能,对哮喘的发展产生积极影响,这在人类哮喘小鼠模型研究中得到了证明。
细菌代谢产物在母体-胎儿之间的联系是母亲和社会普遍关注的一个话题,因此,应在进一步的实验和综合研究中加以解决。
在妊娠期间,母体免疫球蛋白(IgG)通过胎盘转移至胎儿,诱导出生前的被动体液免疫和出生后的先天免疫,以防止感染。
免疫球蛋白G(IgG)是血清中免疫球蛋白的主成分,约占血清中免疫球蛋白总含量的75%。
✦母体免疫球蛋白影响胎儿免疫力
母乳中的IgG抗体会影响产后微生物群和哺乳期的免疫力。母亲的母乳抗体也可以通过与细菌结合的胎盘运输,从而影响胎儿在子宫内的免疫规划。
母体IgG抗体在胎盘的合胞体滋养层细胞内主动运输并与新生儿Fc受体(FcRn)结合。一旦结合,IgG被包装到内体中,并保护其不被降解,直到其达到胎儿循环。
✦母体健康会影响免疫球蛋白
孕期母体健康状况也是免疫球蛋白转移至胎儿的关键因素。妊娠期高血糖降低了母亲母乳和血液中的免疫球蛋白丰度,并降低了IgG通过胎盘向胎儿的转移。
注:跨胎盘免疫调节也可能由其他细菌成分介导,如脂多糖、细胞因子和激素。
微生物的组成因身体部位而异,并在不同个体内部和个体之间形成了不同微生物群落的独特环境。
✦肠道是微生物最丰富的区域
胃肠道内发现了最丰富的微生物多样性和丰度,主要以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的兼性厌氧菌为特征。
✦微生物变化时会产生一系列影响
宿主-微生物关系复杂,当发生变化时,会对免疫、代谢和神经系统的稳态产生负面影响,导致对环境过敏原和营养刺激过敏。
这些影响主要通过免疫、神经、胃肠和内分泌调节肠-脑轴(一种调节体内稳态的双向神经体液系统)的组成部分对子宫中的后代进行表观遗传编程。
表观遗传机制是细胞分化的关键调节因子,通过在生物和病理条件下将环境线索印记到细胞和组织的生理学中来发挥作用。
注:与健康变化相关的所有暴露量的测量被称为暴露量,从怀孕开始就涉及环境和职业暴露。
在妊娠期间,DNA甲基化和组蛋白修饰打开和关闭基因,允许不同的细胞类型分化并获得胎儿暴露体的表观遗传记忆,这将在个体的整个生命周期中保存。
✦环境因素影响表观遗传
孕期母亲的生活方式、饮食、年龄、压力、感染和其他环境因素会影响母亲和胎儿的表观遗传途径,导致后代的遗传、代谢和神经发育改变。
在生命的前1000天,表观遗传调节和可塑性、胎儿器官发育和成熟与疾病易感性的印记一起被编程。如果外部因素不健康,可能会发生表观遗传变化,从而改变基因表达,增加成年后患病的风险。
后代的表观遗传调控是通过母亲在肠-脑轴中的饮食成分进行的。这些成分包括叶酸和营养素,它们在母体肠道中代谢和吸收,从而帮助维持健康的肠道微生物群落。
✦肥胖和正常体重的母亲微生物组成不同
怀孕肥胖母亲的微生物群组成与正常体重母亲的明显不同,其特征是葡萄球菌(Staphylococcus)和肠杆菌(Enterobacteria)水平升高,拟杆菌和双歧杆菌水平降低。
•影响后代的健康
胃肠道改变扰乱了母体微生物群,影响了后代对代谢紊乱的敏感性,并产生长期影响。
例如,高脂饮食的母亲因脂多糖增加而导致的叶酸水平变化会影响肠道通透性和微生物组,进而影响婴儿的微生物定植,从而增加成年后的疾病风险。
动物模型为这一假设提供了进一步的支持
在妊娠期高脂饮食的狒狒模型中发现,高脂饮食会影响妊娠前和妊娠期间后代肝脏内源性大麻素成分的发育调节。胎儿大麻素系统的改变会增加成年后肝脏损伤和肥胖的风险。
综上所述,母体微生物组间接影响后代的代谢发育,因此可能是预防成年期胃肠道疾病的有效靶点。
✦母体代谢成分对后代的影响
•增加后代心血管病风险
很少有研究探讨孕期母体代谢成分通过表观遗传机制在后代免疫中发挥的调节作用。母亲饮食中长链多不饱和脂肪酸摄入量低会诱导血管生成因子基因的DNA甲基化,导致胎盘排列、血管调节发生改变,并增加后代晚年的心血管疾病风险。
通过胰岛素生长因子(IGF-1)启动子的组蛋白修饰,母体高血糖可能会增加成年后对胰岛素抵抗的敏感性。
•调节炎症反应
母亲补充膳食DNA甲基化物,如叶酸、维生素B12、胆碱、蛋氨酸和锌,可能有助于在胎儿细胞快速生长和增殖期间调节炎症反应。
胎儿发育过程中的炎症也可能诱导免疫系统过度激活并增加疾病风险。
•影响胎儿发育及免疫功能
母亲补充胆碱会影响DNA和组蛋白甲基化,从而改善成年期胎儿大脑发育和功能。维生素D是另一种必需的微量营养素,当缺乏时,会改变表观遗传途径,并通过胎盘中的DNA甲基化和组蛋白修饰导致炎症、先兆子痫和不良妊娠结局。
细菌代谢物和其他环境分子也可能通过母胎界面驱动的表观遗传调节影响胎儿免疫发育。研究发现,怀孕期间接触醋酸可以增强调节性T细胞的数量和功能,抑制后代的过敏性呼吸疾病,最有可能是因为FoxP3启动子乙酰化程度增加。
妊娠期间胃肠道成分的调节已被证明对儿童的免疫和代谢发育有强烈的影响,因此应在该领域的未来研究中加以解决。
✦母乳喂养对儿童健康有积极影响
•不易发生肠道感染
母乳喂养对儿童的健康结果有积极影响。头两年的亚最佳母乳喂养与死亡率增加相关。母乳喂养的婴儿较不容易发生肠道感染,从而导致慢性炎症和腹泻概率降低。
•母乳喂养降低儿童肥胖和2型糖尿病风险
然而,如果过早暂停母乳喂养,以引入配方食品或固体食品,则会使婴儿的肠道微生物组向成人样成分转变,并与儿童肥胖风险增加相关。
有证据表明,母乳喂养的婴儿青春期肥胖和2型糖尿病的风险降低。剖腹产也会破坏母亲和孩子之间的正常微生物群交换,这与儿童期和成年期乳糜泻、1型糖尿病和肥胖的风险增加有关。
其他研究人员报告称,孕前和孕期母亲超重、剖腹产和婴儿微生物群丰富的厚壁菌增加了儿童肥胖的风险。反过来,儿童肥胖可能会导致其他负面的短期和长期健康后果,包括低自尊、心血管问题以及成人肥胖和糖尿病。
✦孕期使用抗生素与儿童感染有关
孕期母亲使用抗生素是影响母亲肠道和母乳微生物群的另一个因素,并与儿童肥胖风险增加相关。最近,研究了孕期母亲抗生素治疗与生命后期感染风险之间的关系。他们发现,妊娠期抗生素治疗会增加四岁以下儿童患扁桃体炎的风险。
此外发现,孕期抗生素治疗与儿童因感染而住院的风险增加有关,并且在临近分娩时服用抗生素的风险更高。
小结
这些研究强调了一个事实,即母亲的微生物多样性在新生儿微生物组组成和健康的发展中至关重要。
早产儿长期接受抗生素治疗会增加其败血症、坏死性小肠结肠炎和死亡的风险。此外,生命早期的抗生素治疗会增加生命后期超重和肥胖的风险。
孕期和生命早期的抗生素治疗可还能会改变婴儿微生物组组成的发育,导致生命后期的负面健康结果。
在婴儿和儿童中,包括皮肤、呼吸道和食物过敏在内的自身免疫性疾病是全球关注的问题。研究发现,新生儿和婴儿微生物组参与肠道耐受性的调节和免疫系统的调节。
最近的研究集中于肠道微生物组在先天性和适应性免疫发展以及过敏性疾病发病中的作用。晚年过敏症的发展与新生儿和婴儿期微生物组发育和成熟的变化有关。这些情况也可能源于导致不同表型和症状的遗传和环境因素。
✦皮肤过敏
健康的人类皮肤微生物组主要由丙酸杆菌属(主要在皮脂部位丰富)、棒状杆菌属和葡萄球菌属(主要存在于潮湿的微环境中)以及马拉色菌属组成。
皮肤微生物组的组成受性别、年龄、种族、环境暴露和生活方式等因素的影响。婴儿最典型的过敏表现之一是湿疹或特应性皮炎,这是新生儿对过敏原的先天反应改变和皮肤微生物多样性受损的结果。
•患有特应性皮炎婴儿的菌群变化
患有急性和慢性特应性皮炎的婴儿的特征是表皮葡萄球菌(Staphylococcus)的数量减少,多于金黄色葡萄球菌,这可能通过下调表皮蛋白和促进皮肤蛋白酶而增加过敏原致敏的风险,从而导致皮肤屏障损伤。
•特应性皮炎受到微生物的影响与调节
新生儿表皮葡萄球菌的皮肤定植与toll样受体2诱导的抗菌信号和调节性T细胞介导的宿主免疫应答的调节和激活有关。
特应性皮炎的发展也受到肠道微生物群的影响。特应性皮炎患者的肠道微生物组中双歧杆菌(Bifidobacterium)的浓度较低,普拉梭菌(Faecalibacterium prausnitzii)的丰度较高,这与克罗恩病患者中这些细菌的比例较低以及抗炎粪便细菌代谢物有关。
然而,一项大型前瞻性研究表明,在儿童期患上特应性皮炎的婴儿中,普拉梭菌(Faecalibacterium)和毛螺菌属(Lachnobacterium)的比例明显较低。
尽管有些矛盾,但这些结果表明,微生物类群丰度的改变可能对特应性皮炎的发病起到保护作用。产前和产后补充口服双歧杆菌和乳酸杆菌可以诱导T细胞介导的反应改变,降低婴儿特应性皮炎的风险。
✦食物过敏
动物和人类研究表明,肠道微生物组可能与生活早期对饮食抗原的口服耐受、食物致敏和过敏结果密切相关。
•饮食过敏影响微生物多样性
与健康婴儿相比,对食物敏感的婴儿的α多样性微生物群和拟杆菌(Bacteroidetes)数量减少,厚壁菌(Firmicutes)丰度增加。人类这些特定结果的可能原因包括抗生素的直接和间接使用以及膳食纤维的消耗减少。
早期喂养的类型也可能导致不同的健康结果。食用牛奶配方的奶粉会增加总厌氧菌的数量,并增加患牛奶过敏的风险。与肠杆菌和双歧杆菌相比,患有牛奶过敏的婴儿的乳酸杆菌感染率更高。
此外,从婴儿期到儿童期,牛奶过敏儿童中厚壁菌(Firmicutes)和梭状芽孢杆菌(Clostridia)的丰度均升高。有趣的是,与对照组相比,坚果过敏儿童的肠道微生物组显示拟杆菌(Bacteroidetes)种类比例增加,微生物多样性降低。
同样,与健康对照组相比,鸡蛋过敏儿童的毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)浓度增加。
•细菌可能有助于解决食物过敏
添加Lactobacillus rhamnosus GG的牛奶配方有助于解决婴儿早期的牛奶过敏,最有可能是通过肠道微生物组中丁酸盐产量的增加。
L. rhamnosus GG还可能诱导花生过敏儿童的免疫变化和口服耐受性。口服微生物补充剂可能是食物过敏的一种潜在治疗策略,但需要进一步研究以阐明微生物菌株对饮食中过敏原的持续敏感性的影响。
✦呼吸道过敏
•肠道微生物影响哮喘
与其他过敏表现相比,出生第一个月的肠道微生物组成是与学龄期哮喘发作相关的最相关因素之一。
在婴儿早期和整个儿童期进行的观察和纵向研究表明,毛螺菌属(Lachnospira)、普拉梭菌(Faecalibacterium)和小杆菌属(Dialister)细菌类群的减少,与儿童期哮喘风险增加有关。
•其他影响哮喘的因素
然而,与婴儿微生物组相关的其他因素也可能在哮喘风险中发挥重要作用,包括接触抗生素、动物皮毛、阴道分娩与剖腹产以及母体孕龄。
抗生素增加了哮喘风险
抗生素的使用和出生前后的暴露与小鼠的气道超敏反应和反应性有关,并增加了人类患哮喘的风险。
母乳喂养可降低哮喘风险
婴儿期的喂养类型也是婴儿早期形成肠道微生物群的一个重要因素,当婴儿长时间母乳喂养时,在生命的头两年内发生哮喘的风险可以降低。
•微生物多样性紊乱易导致儿童后期哮喘
婴儿微生物组多样性的紊乱也是儿童后期哮喘发病的关键因素。粪便杆菌和双歧杆菌的多样性降低是有哮喘风险的婴儿肠道微生物组的特征。
这些婴儿的无菌粪水用于刺激成人外周血单核细胞(PBMC),这导致调节性Foxp3细胞减少,CD4+IL-4产生细胞增加。
新生儿肠道微生物组环境的改变通过调节CD4+T细胞功能和增殖影响儿童过敏性哮喘的易感性。
•肺部微生物影响呼吸健康
生命早期的肺部微生物多样性影响呼吸健康。婴儿出生头两周内的肺部微生物组促进树突状细胞中程序性死亡配体1(PDL1)的表达,这是调节性T细胞抑制过敏性呼吸道免疫反应所必需的。
在出生的头两个月,婴儿的气道被链球菌、莫拉克氏菌或嗜血杆菌定植,这与婴儿和儿童的严重下呼吸道感染和哮喘有关。变形杆菌和拟杆菌也与哮喘和其他免疫相关的加重有关。
如前所述,这些细菌类群的副产物和代谢物可能介导其保护作用。丁酸盐和其他短链脂肪酸作为膳食纤维的发酵产物,如普拉梭菌(Faecalibacterium prausnitzii),它们通过诱导Tregs促进上皮屏障通透性和抗炎作用,和粘膜B细胞产生IgA。
实验研究和人体临床试验还表明,通过补充肠道微生物组衍生的丁酸,可以降低变应原敏感性和哮喘的发病率。
不足之处
过敏性疾病发病和严重程度的生理机制仍在研究中,一些介入性研究表明,补充益生菌和益生元可以预防和下调此类综合征,然而,与哮喘相关的研究报告,补充和不补充益生药的婴儿之间没有显著差异,因此需要更多的研究来进一步检验这些影响。
生命的前1000天除了肠道微生物组的建立,还是神经健康规划和中枢神经系统后期正常运作的关键时期。
肠-脑轴由肠道和中枢神经系统以及神经和下丘脑-垂体-肾上腺轴(HPA轴)调节。因此,该轴的任何损伤,包括神经元损伤或死亡,都会导致神经变性,并可能导致神经变性疾病的发生和发展。
✦营养不良对认知障碍有影响
母婴营养不良通常与认知技能、入学准备和表现、不良生长结果、感染和死亡等方面的损害有关。由于母亲健康和营养不良以及婴儿护理和喂养不当而发育不良的儿童会出现身体和认知延迟。孕期母亲炎症和高脂饮食影响微生物群定植,增加成年期神经退行性疾病的风险。妊娠期以性别特异性的方式影响发育中胎儿大脑中的内源性大麻素途径。
✦孕期母亲的生活方式会导致神经发育障碍
因此,孕期母亲的生活方式和环境暴露可能导致神经发育障碍的发作,包括胚胎神经管缺陷、唐氏综合征、自闭症、雷特综合征和其他神经心理缺陷。
✦肠道微生物调节认知与行为
微生物群组成与认知和行为发育改变之间的双向相互作用已在肠-脑轴中得到确认,有证据支持这种相关性。
缺乏肠道微生物群的无菌小鼠表现出与焦虑相关的表型增加,神经递质水平和与神经可塑性有关的代谢物发生变化,从而表明肠道定植对大脑发育和功能有积极影响。包括双歧杆菌和乳酸杆菌在内的一些细菌菌株以及摄入的益生菌与调节行为变化有关。
注意
需要注意的是,当无菌小鼠在早期生活中重建了正常的微生物群,但在成年后没有重建时,行为模式和神经递质浓度正常化。
母乳喂养被发现可以促进大脑发育,并对婴儿的认知能力产生积极影响。一些因素,包括文化和社会信仰以及对母乳喂养的污名化、缺乏营养和教育、母亲压力和抑郁,都可能导致过早停止母乳喂养;所有这些都会对婴儿的肠道微生物群和早期和后期的认知发育产生负面影响。
生命早期营养、肠道微生物组和健康之间的相互关联在个体一生的稳态中起着关键作用。
生命最初营养、肠道微生物组和健康之间的关系

Mua B,et al.Comprehensive Gut Microbiota.2022
母亲和新生儿营养不良、喂养习惯和营养/益生菌补充对子宫、婴儿和儿童期微生物组的建立有很大影响。母体微生物组变化和过敏原/抗生素暴露也会影响儿童早期的微生物组组成。
微生物组组成和丰富性的变化会影响妊娠结局和产妇健康,并通过表观遗传编程使发育中的孩子在以后的生活中易患自身免疫、认知和代谢障碍。
生命的前1000天是一个“可塑性窗口”,在这个窗口中,后代的健康会根据母体和环境的影响进行变化。
由于饮食生活方式以及暴露于外来生物和其他环境压力源,代谢、免疫学和神经退行性疾病的患病率在全球范围内不断增加。
在微生物组水平上理解母亲和孩子之间的独特联系,有助于研究对孕期和婴儿期肠道微生物组的变化及其对母婴健康的直接和间接影响,使母亲和孩子在未来都拥有更健康的生活。
主要参考文献
Mua B , Nga B , Fjaa B , et al. The Gut Microbiota, Nutrition, and Long-Term Disease Risk: A Mother and Child Perspective[J]. Comprehensive Gut Microbiota, 2022:289-307.
Apostol, A.C., Jensen, K.D.C., Beaudin, A.E., 2020. Training the fetal immune system through maternal inflammationda layered hygiene hypothesis. Front. Immunol. 11, 1–14.
Cortes-Macías, E., Selma-Royo, M., García-Mantrana, I., et al., 2021. Maternal diet shapes the breast milk microbiota composition and diversity: impact of mode of delivery and antibiotic exposure. J. Nutr. 151 (2), 330–340.
Cunha, A.J.L.A., Santos, A.C., Medronho, R.A., Barros, H., 2020. Use of antibiotics during pregnancy is associated with infection in children at four years of age in Portugal. Acta Paediatr. 110 (6), 1911–1915.
Forgie, A.J., Drall, K.M., Bourque, S.L., et al., 2020. The impact of maternal and early life malnutrition on health: a diet-microbe perspective. BMC Med. 18 (1), 1–15.
Mesa, M.D., Loureiro, B., Iglesia, I., et al., 2020. The evolving microbiome from pregnancy to early infancy: a comprehensive review. Nutrients 12 (1), 1–21.
谷禾健康
过敏性鼻炎是个全球性健康问题,易反复发作,困扰着全世界大约着4亿人。自20世纪60年代以来,过敏性鼻炎的患病率持续上升。近几年,我国主要大中城市过敏性鼻炎的平均患病率从11.1%升高到17.6%。
过敏性鼻炎主要临床表现包括发痒、打喷嚏、鼻塞等,这些症状不加以改善,严重的话会导致睡眠障碍、学习障碍和行为改变等,最终影响患者的生活质量。
过敏性鼻炎与普通感冒不一样,它不是由任何病毒引起的,因此不会传染。过敏性鼻炎主要由过敏原引起,常见过敏原包括花粉、灰尘、动物毛发、皮屑等。
目前过敏性鼻炎的治疗主要基于鼻用皮质类固醇以及鼻用和口服H1-抗组胺药等。但这些药物的有效性是有限的,并且还具有多种副作用,会产生药物依赖性,药效下降等问题。
目前越来越多的研究表明,过敏性鼻炎是一个较复杂的免疫炎症反应疾病,其中肠道微生物群在该病的发生发展过程中扮演了不可替代的角色,针对菌群的干预,无论在动物还是人类临床上均显示出了较大的改善,以及作为药物治疗的补充综合改善措施。
本文我们来详细了解关于过敏性鼻炎的症状,发生过程,风险因素,与肠道微生物群的关系,益生菌在该病中发挥的作用,其他过敏性鼻炎相关治疗干预措施包括饮食、生活方式、益生元、合生元等。
【全文概览】
01 关于过敏性鼻炎,你需要知道
发病率、症状、风险因素、易感人群
与普通鼻炎的区别;与感冒的区别
02 过敏性鼻炎是如何形成的?
发病机理、如何与肠道相关联
03 过敏性鼻炎与肠道菌群之间的关系
04 肠道菌群在过敏性鼻炎中的重要作用(机理)
肠道菌群 ⇄ Th1/Th2 平衡
肠道菌群影响ILC2:过敏中的重要作用
肠道菌群对血清炎症因子的影响
肠道菌群对Treg/Th17细胞平衡的影响
肠道菌群对耐受树突状细胞活性的影响
肠道菌群对Toll样受体的刺激
05 过敏性鼻炎的治疗
06 基于菌群的干预,对过敏性鼻炎的改善
益生菌
益生元
合生元
细菌裂解物
粪菌移植
饮食
07 关于改善过敏性鼻炎的其他自然疗法
草药或补充剂等
锻炼
生活方式
在了解过敏性鼻炎是如何形成之前,我们先了解一下,什么是过敏性鼻炎?

据不完全统计,我国过敏性鼻炎的发病率在5%-25%之间,各个地区发病率不太一样,城乡差异也十分显著,估计全国患病人数在1亿以上。
尘螨在南方的致敏率最高,艾蒿、豚草和蒲公英则是西北最常见的过敏原。
大约 80% 的过敏性鼻炎症状在 20 岁之前出现,并在 20-40 岁达到高峰,然后逐渐下降。据报道,出生后头 5 年儿童过敏性鼻炎的发病率为 17.2%,诊断时的高峰年龄为 24 ~ 29 个月 (2.5%) .
过敏性鼻炎是一个常见病、多发病,可分为季节性(间歇性)或常年性(慢性),大约 20% 的病例是季节性的,40% 是常年性的,40% 的病例同时具有这两种特征。
最初可能出现的症状包括:
可能还会遇到其他较多症状,包括:
当身体对大多数人无害的物质(如花粉)反应过度时,就会发生过敏性鼻炎。
通常在接触某些物质后会出现过敏性鼻炎,过敏原一般分为以下四大类:
我们稍作展开讨论:
➤ 来自屋尘过敏原
实际上,携带过敏原的并不是尘螨本身,而是一种化学物质,在尘螨的排泄物中发现,一般会以人类皮屑为生,常见于家中的以下位置:
地毯、床垫、枕头、床单、窗帘等
➤ 来自树、草等花粉过敏原
根据一年中的不同时间,会出现不同类型的过敏原,因为从春季到深秋,树木、草都会产生花粉
树木包括:
桦木(非常常见)、雪松、榛、扁柏、角树、七叶树、菩提树、橄榄、松树、白杨、柳树等
草包括:
黑麦草、蒂莫西、艾蒿、荨麻、芭蕉、豚草等
➤ 来自动物毛发的过敏原
注意过敏原携带在动物的毛发上。引起过敏原的不是真正的毛发,而是毛发上携带的动物死皮屑、唾液、尿液等。
研究表明,早年接触通常携带过敏原的动物会降低晚年患此类过敏性鼻炎的患病率。
这类动物包括:
猫、狗(这两种非常常见)
牛、马、兔子、啮齿动物等
➤ 来自工作中明确遇到的过敏原
某些特定物质会在一些人身上引起过敏性鼻炎,因此如果职业要求接触以下的一种或多种过敏原,那么患过敏性鼻炎的风险就会增加。
过敏性鼻炎是由遗传和环境因素相互作用引起的。
父母或家庭成员患有过敏性鼻炎,则患过敏性鼻炎的几率更大。
根据卫生假说,过敏性鼻炎发病率的增加与环境因素的变化有关,例如:
近期发表的在小鼠实验中,万古霉素诱导的肠道菌群失调,通过改变短链脂肪酸,加剧肠粘膜屏障的破坏,增加小鼠过敏性鼻炎的易感性和严重性。
鼻粘膜的 H&E 染色
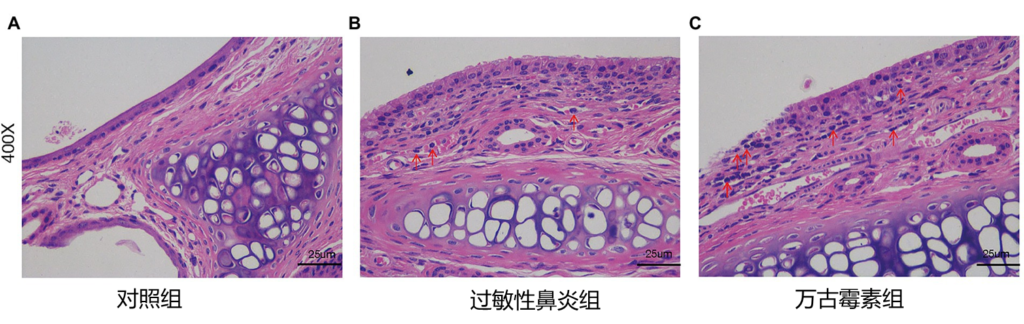
Zhen et al., Front. Microbiol. 2022
万古霉素诱导的肠道菌群失调加重了过敏性鼻炎的严重程度,加重了鼻粘膜的炎症细胞浸润和粘液分泌。
关于过敏性鼻炎,这里有几个需要注意的点:
鼻炎是鼻粘膜的炎症,它是一种上呼吸道疾病。鼻炎的临床症状包括阵发性打喷嚏、鼻塞、流鼻涕、流眼泪等,没有明显病因。而过敏性鼻炎作为鼻炎的一种,症状是由过敏原引发的。
很多人刚开始打喷嚏的时候,还以为是感冒了,赶紧吃感冒药,却发现并没有好转…
实际上过敏性鼻炎的症状往往与早期感冒的症状很相似。
一般来说,可以通过以下几点来区分到底是感冒还是过敏性鼻炎:
1
感冒通常伴有全身症状,如无力、发热、全身酸痛等,而过敏性鼻炎只是单纯的鼻部问题,除了可能有头痛,没有其他全身性疼痛症状。
2
过敏性鼻炎有可能会持续数周至数月,而感冒通常会在1-2周内自愈。
3
大多数过敏性鼻炎具有非常明显的季节性,尤其是春秋两季,而感冒一年四季都可能发生。
4
通过验血,大多数过敏性鼻炎在血液分析中显示嗜酸性粒细胞和 IgE 值升高,而其他值通常正常。相反,感冒通常具有升高的淋巴细胞值。
5
过敏性鼻炎过敏原阳性几率高,感冒几率低。
一旦过敏原吸入鼻腔,就会引起免疫反应。过敏原会和IgE抗体结合,激活肥大细胞。
也许对于普通人来说这没什么,但是对于过敏性鼻炎患者来说,就会引起过度反应,也就是说,免疫系统把花粉,灰尘等莫名扣上“通缉犯”,对其进行打击。
肥大细胞通过释放“组胺”,通知其他细胞,包括嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞和T细胞等,会导致炎症和鼻粘膜充血:
• 本来好好的通道变窄了,气体很难通过就是鼻塞;
• 炎症刺激到神经,就是鼻子痒;
• 鼻粘膜分泌过多的粘液,结果就是流鼻涕…
过度分泌的粘液会堵塞两个鼻子的重要开口:
鼻泪管的作用是将眼泪从眼睛排到鼻子,一旦因为过敏性鼻炎,粘膜肿胀就会导致鼻泪管堵塞,这时候看起来像是“泪汪汪”的。

咽鼓管引流中耳分泌物,一旦因为过敏性鼻炎被堵塞,就会让人感觉到耳朵被塞住。

最后鼻腔内的神经受到刺激会开始打喷嚏

甚至,过敏性鼻炎患者会感到呼吸困难…

过敏性鼻炎的发病机理
鼻粘膜中的树突状细胞(DC)吸收过敏原 ➞ 引流淋巴结 ➞ 呈递给原始CD4+T细胞 ➞ 分化为过敏原特异性Th2细胞 ➞ 诱导B细胞活化产生浆细胞 ➞ 分化产生特异性IgE抗体 ➞ 在效应细胞(如肥大细胞和嗜碱性细胞)表面进行再循环和相互作用 ➞ 与IgE受体(FcεRI)结合 ➞ 炎症介质(如组胺、前列腺素、白三烯)释放 ➞ 介质与鼻感觉神经、血管系统和腺体相互作用,导致过敏性鼻炎症状
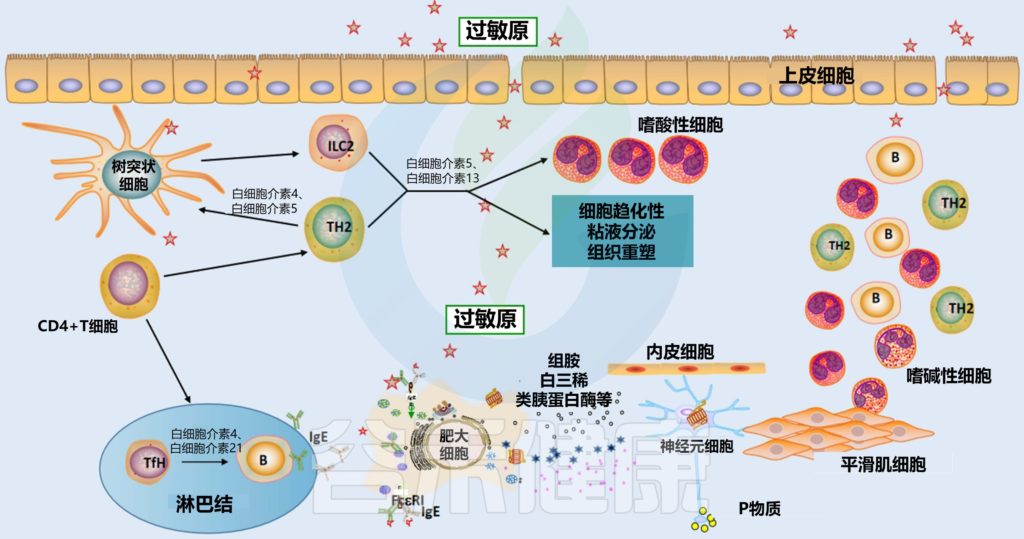
Liu P, et al., J Asthma Allergy. 2022
以上我们知道过敏性鼻炎涉及免疫反应,而人体内60%~70% 的免疫细胞集中在胃肠道中。肠道健康与过敏之间的联系始于免疫系统。
所有的免疫系统成分都直接或间接地受到微生物群的调节。
健康的微生物群会改变 Th1/Th2 细胞的比例,有利于 Th1 细胞,特应性疾病的特征在于对过敏原的 Th2 免疫反应。过敏性鼻炎以鼻腔黏膜Th2免疫反应为主的过敏性炎症反应,病变组织中存在大量Th2细胞因子浸润。
注:Th1细胞介导细胞免疫反应,直接攻击病原体或者促使其他细胞攻击病原体,就算病原体进入被感染的细胞,还会追进感染细胞里面去攻击;
Th2细胞介导体液免疫反应,它们会促使其他免疫细胞产生抗体,由这些抗体来攻击病原体。Th2细胞就不会进入被感染的细胞。
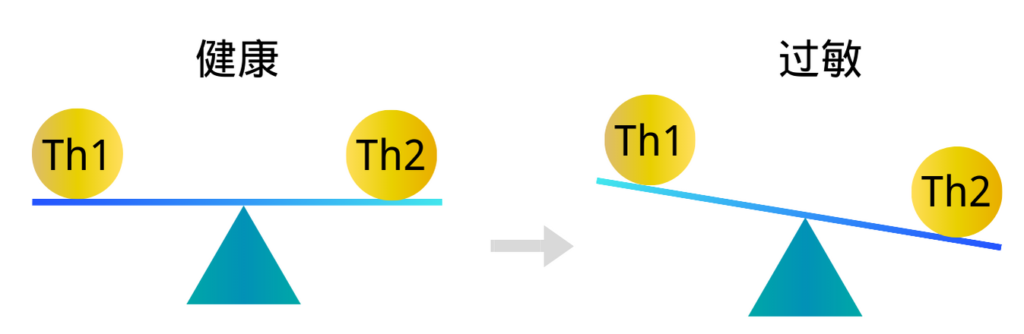
在免疫系统发育过程中,如果肠道失调通过将Th1/Th2细胞因子平衡向Th2反应转移,导致产生产生IgE的浆细胞,从而导致异常过敏反应。
越来越多的证据表明,平衡良好的肠道菌群对发育调节性T细胞(Tregs)至关重要,这对肠道耐受诱导至关重要。下一章节我们来讨论肠道菌群与过敏性鼻炎之间的关系。
注解:由于Th1细胞和Th2细胞都能分泌细胞因子促进自身的增殖并抑制对方的增殖,因此在正常情况下机体中 Th1细胞和Th2细胞处于相对平衡的状态。 但当机体发生功能异常时,常表现出平衡偏向其中一方,称为 “Th1/Th2漂移”。Th1细胞和Th2细胞之间的平衡状态被打破,会引起许多疾病的产生和发展。 包括肿瘤和一些自身免疫性疾病。
但是,不同的疾病表现出的Th1/Th2平衡漂移各不相同。如类风湿性关节炎、I型糖尿病、多发性硬化及慢性甲状腺炎等疾病中,Th1占优势状态;而在系统性红斑狼疮、硬皮病以及一些常见的变态反应性疾病比如过敏性鼻炎中,则Th2占优势状态。
我们知道,肠道菌群在人体中发挥着重要的生理作用,如影响维生素合成、免疫等,且与过敏性疾病的发生、发展相关。
肠道多样性的改变在过敏性疾病患者中较为常见。
目前已有的研究显示,与健康人相比,过敏性鼻炎患者的肠道菌群多样性显著较低(Chao1和Shannon多样性指数),其他菌群变化如下:
过敏性鼻炎患者肠道增加的菌群:
过敏性鼻炎患者肠道减少的菌群:
可见,健康个体和过敏性鼻炎患者的肠道菌群组成不同。
其中,普雷沃氏菌可能是影响免疫系统发育的重要微生物之一。
产丁酸盐的细菌,如梭状芽胞杆菌,可诱导调节性 T 细胞并通过预防肠道炎症来抑制过敏症状。
要解释肠道菌群是如何影响过敏性鼻炎的,我们要先从肠道菌群对免疫系统的塑造开始了解。
肠上皮细胞:将细菌和宿主的免疫系统连接起来
肠上皮细胞(IEC)翻译来自共生细菌的信号(细菌代谢物、细菌成分和细菌本身)并将它们发送到粘膜免疫细胞。可见,肠上皮细胞在肠道免疫中起关键作用。
微生物在肠道定植,并通过肠上皮细胞诱导血清淀粉样蛋白 A 的产生,从而改善 Th17 分化和 IL-22 的产生。
主要参与与定殖肠道细菌的串扰的免疫细胞主要见于固有层。其中,最常见的是树突状细胞(DCs)、Tregs、NK细胞和CD4+ T细胞。
树突状细胞:刺激 CD4+ T 细胞分化
树突状细胞在与先天性和适应性免疫反应的相互作用中起着至关重要的作用。它们迁移到次级淋巴组织并根据激活信号刺激 CD4+ T 细胞分化成亚型。
共生细菌衍生的代谢物影响树突状细胞的功能。例如,短链脂肪酸抑制 IL-12 并增加 IL-10 和 IL-23 的产生,降低 CCL3、CCL4、CCL5、CXCL9、CXCL10 和 CXCL11 的水平,间接调节 T 细胞功能。此外,它们通过树突状细胞的调制诱导 B 细胞IgA 类别转换和 IgA 产生,并调节其他适应性反应细胞功能。
巨噬细胞:摄取病原体
与肠上皮相关的巨噬细胞具有广泛的功能。它们可以摄取病原体,产生多种影响其他免疫细胞的细胞因子,并支持 Treg 的维持。
短链脂肪酸:促进巨噬细胞分泌抗炎 IL-10
微生物产生的短链脂肪酸促进巨噬细胞分泌抗炎 IL-10。此外,它们改变巨噬细胞的新陈代谢,降低 mTOR 激酶活性并增加抗菌肽的产生。
在正常情况下,微生物群和身体之间的相互作用是决定身体健康的基础,如果其中一个环节受损,可能会导致肠道菌群失衡。肠道微生物群的失调显著影响微生物群与宿主之间的代谢,并抑制宿主免疫系统。大多数过敏性疾病与肠道微生物群失衡有关,如过敏性鼻炎。
典型的过敏性鼻炎肠道菌群促进细胞因子的不利变化,从而促进过敏性鼻炎发展中涉及的 Th1/Th2 失衡。
过敏性鼻炎患者的肠道菌群失调及其对 Th1/Th2 平衡的影响
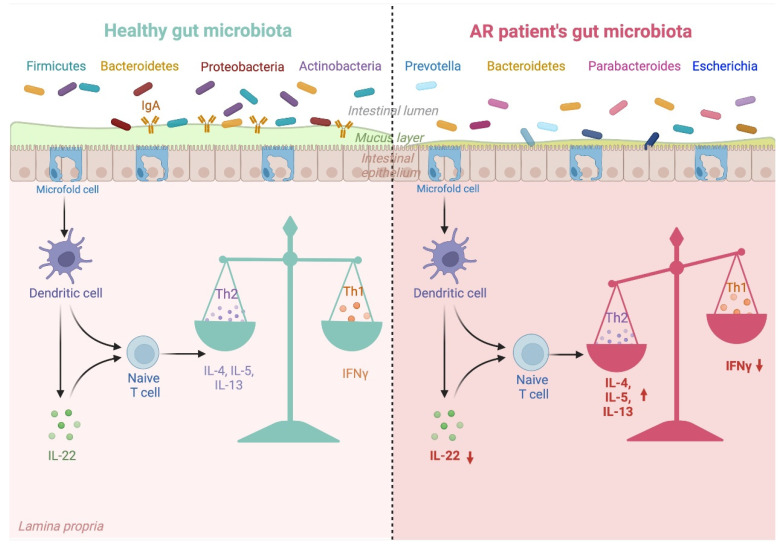
Kaczynska A, et al., Nutrients. 2022
肠道菌群的每一次紊乱都会对免疫系统产生负面影响,并破坏先天性和适应性反应。上图解释了改变的肠道微生物群组成与其对过敏性鼻炎患者免疫系统的影响之间的联系。
接下来章节,我们来详细了解,肠道菌群如何影响免疫系统从而引发过敏性鼻炎。
肠道菌群失调可能会破坏 Th1/Th2 细胞之间的稳态,这可能会对免疫耐受产生负面影响,破坏过敏原的正常清除,并增加过敏性鼻炎的风险。我们从以下六个方面详细展开讨论肠道微生物群在过敏性鼻炎中扮演的重要角色。
前面我们已经知道,过敏性鼻炎是一种I型过敏性疾病,与Th1/Th2平衡向Th2倾斜有关。
为什么生命早期肠道菌群多样性的变化会与过敏有关?
在生命早期,全身免疫反应偏向于Th2。研究表明,生命早期肠道菌群的多样性较低,会影响 IL-4 和 IFN-γ 的水平, IL-4 由Th2细胞产生的,IFN-γ由Th1产生,因此,这可能通过调节 Th1/Th2 平衡来影响气道炎症。
此外,在生命的前两年,较低的微生物多样性会延迟拟杆菌的定殖,并导致 Th1 型反应减少,从而导致Th1/Th2 平衡向Th2倾斜。
一些益生菌也能通过影响Th1/Th2 平衡,从而发挥作用。
植物乳杆菌(NR16)
从发酵韩国泡菜中提取的植物乳杆菌(NR16) 是一种强大的 Th1 诱导剂,当 NR16 与免疫细胞共培养时,它可以产生大量的 IFN-γ 和 IL-12,并且在同时口服 NR16 可降低小鼠气道高反应性和白细胞浸润。此外,口服 NR16 可以通过诱导 Th1 免疫反应来缓解过敏性鼻炎症状,这反过来又可以通过减少特定粘膜病变中 Th2 细胞因子的产生来重新平衡 Th1/Th2 比率。
植物乳杆菌可增加过敏性鼻炎小鼠模型中Th1型细胞因子(IFN-γ、特异性血清IgG2a)的产生,Th2型细胞因子(IL-4、IL-5、IL-13)减少并达到Th1/Th2的平衡。
泛福舒
一项随机对照研究表明,与对照组相比,泛福舒治疗后,泛福舒组鼻腔灌洗液中IL-4和IL-13的含量显著降低,而INF-γ的含量显著升高,导致IL-4/INF-γ的比值显著降低,泛福舒可以调节Th1/Th2细胞因子平衡,作为一种潜在的细胞信号机制,提高整体粘膜免疫。
短双歧杆菌
研究人员证实,口服短双歧杆菌可抑制 Th2 反应并诱导 CD4+CD25+Tregs 活性,但不引起 Th1 反应,但可调节 Th1/Th2 平衡并具有抗过敏作用。
其次,大剂量短双歧杆菌可显着减少打喷嚏的频率,同时降低血清IL-4和特异性IgE水平,增加脾脏中CD4+CD25+ Tregs的数量,显着降低鼻黏膜上皮的过敏反应,低剂量的短双歧杆菌只能轻微缓解过敏反应。
2型先天性淋巴细胞(ILC2)是一种先天性免疫细胞,缺乏表面标记物,因此难以识别。它们反映Th2型细胞,在过敏发展中发挥着重要作用。
我们知道,过敏性鼻炎是一种IgE介导的炎症,导致鼻粘膜中Th2细胞和II型细胞因子的数量增加。
研究人员发现鼻粘膜中ILC2的数量与过敏性鼻炎临床视觉模拟量表(VAS)评分呈正相关。
肠道微生物群失调如何影响过敏性鼻炎
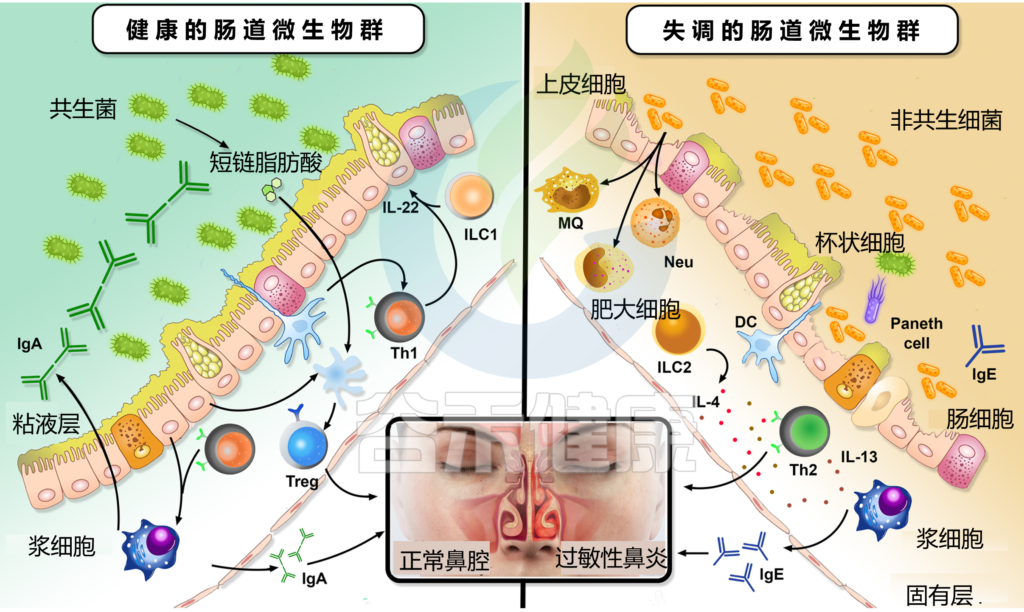
Li J, et al., Eur Arch Otorhinolaryngol. 2022
为什么ILC2在过敏性鼻炎的调节中起重要作用?
过敏性鼻炎患者中多种脂质受体上调,包括CysL1R(LTD4配体)和PGD2。尽管LTD4可激活ILC2中IL-4的产生,但过敏性鼻炎患者鼻分泌物中IL-4水平没有显著变化。
臭氧通过诱导ILC2释放IL-5和IL-13来加重过敏性鼻炎症状。
患有屋尘螨敏感的过敏性鼻炎的儿童外周血ILC2水平显著升高。所有这些发现表明ILC2在过敏性鼻炎的调节中起着重要作用。
肠道菌群对ILC2的影响
值得注意的是,肠道微生物群影响ILC2通过肠-肺轴从肠道向肺的迁移。例如,变形菌门显著促进了上述迁移,并促进了IL-33的产生。
此外,呼吸道过敏的发展与Ruminococcus gnavus的丰度增加有关联。
研究人员发现,肠道菌群失调刺激ILC2和树突状细胞产生2型细胞因子,并促进嗜酸性粒细胞和肥大细胞的肺浸润。
另一方面,肠道微生物群发酵膳食纤维产生的短链脂肪酸抑制ILC2的功能,防止肺部炎症。因此,研究表明ILC2s的活性受到肠道微生物群的调节,但其潜在机制尚未得到充分阐明。
益生菌可以通过抑制ILC2的激活来控制过敏性鼻炎的发生和发展
在一项木瓜蛋白酶诱导的BL6小鼠的研究中,益生菌大肠杆菌菌株Nisle 1917(ECN)的治疗导致IL-5的降低较小,IL-13,IL-33的水平显著降低。ECN处理的小鼠具有显著更低的CD3+CD4+IL5+和IL13+细胞频率。数据表明,ECN能够抑制Th2和ILC2的活化以及原型致敏IL-5和IL-13的产生。
然而目前的研究相对有限,需要更多的基础和临床研究来评估未来的长期治疗效果。
对于肠道菌群在人和动物过敏性鼻炎模型中的研究显示,在益生菌的作用下,大多数血清炎症因子都有不同程度的下降,如IL-4、IL-5、IL-13、IgE、特异性血清IgG1、嗜酸性粒细胞和嗜碱性粒细胞水平减少,但一些抗炎因子增加,如 IL-10、IFN-γ 和特异性血清 IgG2a 分泌增加。因此,益生菌可以通过提高血清中炎症因子的水平来缓解过敏性鼻炎患者的炎症反应,从而减轻他们的临床症状。
NVP-1703 益生菌混合物:IL-5↓ IL-13↓ IL-10↑
(长双歧杆菌IM55 和植物乳杆菌IM76)
一项关于多年过敏性鼻炎的成人研究评估了NVP-1703益生菌混合物(长双歧杆菌IM55和植物乳杆菌IM76)干预4周的疗效和安全性,IL-4血清中尘螨水平无明显变化,但尘螨特异性IgE水平显著降低。在第4周,与安慰剂组相比,NVP-1703组的血清IL-5和IL-13水平降低,而IL-10水平显著升高。
泛福舒:IL-4↓ IL-13↓ INF-γ↑
在早期研究中,60名过敏性鼻炎患者被随机分为泛福舒(BV)组和对照组。泛福舒治疗后,治疗组的药物评分明显低于对照组,且个体和总体鼻症状评分均显著低于对照组。
泛福舒组鼻腔灌洗液中的IL-4和IL-13水平显著降低,而干扰素γ(INF-γ)水平显著升高,这使得IL-4/INF-γ比值显著降低,嗜酸性粒细胞也显著减少,过敏性鼻炎患儿呼吸道病毒感染率/严重程度的增加可能由多种机制引起,但IFN-γ缺乏可能是其中之一,益生菌可以通过提高IFN-γ水平来改善呼吸道病毒感染。
植物乳杆菌:IL-4↓ IL-5↓ IL-13↓ IgE↓ IgG1↓ IFN-γ↑ IgG2↑
在过敏性鼻炎小鼠模型中,口服植物乳杆菌可减少过敏性鼻炎小鼠模型鼻腔和肺部浸润细胞数量,而支气管肺泡灌洗液和引流淋巴结标本显示免疫细胞计数减少,IL-4、IL-5、IL-13、血清IgE和特异性血清IgG1水平降低,IFN-γ和特异性血清IgG2a分泌增加,可改善过敏性鼻炎。
丁酸梭菌:IgE/G1↓ IL-10↑ 逆转Th1/Th2失衡
显着降低了肺阻力、肺气道炎症、肥大细胞脱粒、小鼠气道炎症重塑和 OVA 特异性 IgE/G1 表达。同时,它还逆转了Th1/Th2失衡,增加了抗炎血清因子IL-10.
益生菌发酵的红参:IL-4↓ IgE↓
益生菌发酵的红参(FRG)对卵白蛋白(OVA)诱导的小鼠过敏性鼻炎模型的影响是,FRG比红参更有效地降低支气管肺泡灌洗液、鼻液和血清中的IL-4和IgE水平,表明FRG比红参具有更好的免疫调节作用。 FRG 治疗可减少炎症。
瑞士乳杆菌SBT2171:IL-4↓ IL-13↓ IFN-γ↑ IL-10↑
瑞士乳杆菌SBT2171(LH2171)可在体外诱导抗原刺激的幼稚小鼠脾细胞产生细胞因子,从而抑制IL-4和IL-13的产生,并增加IFN-γ和IL-10的产生。
Treg作为免疫抑制性CD4+T细胞,而Th17作为炎性CD4+T细胞,两者之间的平衡是维持人体免疫系统稳定性的关键条件。 过敏性鼻炎患者Th1/Th2失衡。
益生菌可以通过调节Treg/Th17的平衡来改善过敏和免疫疾病的调节,并产生了一些具有相当效果的靶向治疗方法。
对变应性真菌性鼻窦炎患者的研究表明,血清中IL-1、IL-17、IL-21和TGF-β的分泌都有不同程度的增加,导致Th17/Treg平衡Th17方向的偏移。
研究数据证实,过敏性鼻炎患者外周血中炎性因子如IL-17、IL-35和Th17的分泌增加,炎性因子的增加导致Treg/Th17失衡,进而导致Th1/Th2失衡,导致一系列过敏性鼻炎典型临床症状和鼻粘膜纤毛破坏,鼻腺增生和炎性细胞浸润。
益生菌通过影响Treg / Th17的平衡调节自身免疫
梭菌孢子诱导CD4+FoxP3+Treg细胞可以抑制Th17细胞的促炎反应。
使用益生菌混合物VSL#3来诱导Treg细胞的增殖。
细胞实验表明,乳酸菌上清液可以减少CD4+T细胞、CD8+T细胞和粘膜相关恒定T细胞等的活化,乳酸菌的产物可以抑制这些细胞的增殖和脱颗粒。
其他研究表明,炎症引起的T细胞代谢变化会影响Treg细胞的免疫功能。例如,糖酵解过程中的烯醇化酶可以调节外显子中FoxP3的结合变体,以及应激状态引起的Treg代谢变化,这是触发自身免疫反应的重要部分。
使用干酪乳杆菌作为干预对照,结果表明,干预组脾脏中CD4+CD25+Foxp3+Treg的百分比增加,而CD4+IL-17A+Th17细胞的百分比降低,调节了Treg/Th17细胞比例的失衡。
另一项研究表明,鼠李糖乳杆菌GG(LGG)提取物可以通过Toll受体(TLR2)途径,降低IL-17+Th17的比率,增加CD25+Foxp3+Treg的比率,从而维持Treg/Th17的稳态。
树突状细胞(DC)是体内最有效的抗原呈递细胞(APC),通过调节对微生物抗原的耐受性和免疫性,可以有效诱导抗原特异性免疫应答。
益生菌可能通过调节树突状细胞成熟和免疫耐受性树突状细胞(TDC)产生,产生抗炎细胞因子,从而抑制炎症,影响免疫调节。
免疫耐受性树突状细胞在调节免疫耐受中发挥关键作用
其特征在于表达共刺激分子(CD80/CD86)的半成熟表型,其可通过TLR配体或通过暴露于特定细胞而激活,在因子环境中分化。
此外,它们还表达免疫调节分子并产生免疫抑制因子,半成熟的共刺激CD80/CD86信号通过CD28分子的作用影响T细胞上Treg的激活,进而诱导免疫耐受。
目前,一些临床试验正在进行,以探讨TDC作为免疫介导疾病的替代治疗方案的有效性。与抗炎分子相比,这些TDC具有半成熟表型,表现出低水平的T细胞共刺激特性,并且产生促炎细胞因子的能力降低,特别是通过调节性T细胞(Tregs)的扩增和/或诱导。
其他研究也表明,TDCs分泌抗炎细胞因子并调节T细胞,以促进小鼠和人类肠道中Foxp3+Treg的发育。在全球范围内,这些数据表明DC/Treg/B调节轴通过重新建立耐受性和调节Tregs在肠道中发挥中心作用。
菌群的免疫调节作用来自免疫细胞与肠道树突状细胞的相互作用
最近的证据表明,益生菌可能通过调节DC成熟和TDC产生,从而抑制炎症,从而影响体外和体内的免疫调节。益生菌的免疫调节作用来自免疫细胞与肠道DC的相互作用,从而调节先天和适应性免疫系统。
研究表明,益生菌能够与DC上的模式识别受体(PRR)反应,后者检测病原体上不同的进化保守结构(病原体相关分子模式,PAMP),或通过产生可溶性化合物,从而诱导TDCs。
不同种类和菌株的益生菌可能直接影响树突状细胞的成熟,益生菌可能调节抗炎细胞因子的水平,如转化生长因子β(TGF-β)、IL-10,并诱导Treg。
一项针对四种益生菌菌株(包括唾液乳杆菌、双歧杆菌、凝结芽孢杆菌和纳豆枯草杆菌)的研究,都诱导DC产生IL-10和TGF-β,双歧杆菌和凝结芽孢杆菌表现出更强的诱导IL-10和转化生长因子-β的能力。因此,益生菌诱导的树突状细胞活性产生抗炎细胞因子在免疫调节功能中起着关键作用。
总之,益生菌通过调节TDC活性是过敏性鼻炎治疗的潜在靶点。
Toll样受体(TLRs)是机体免疫的主要组成部分之一,是肠粘膜淋巴细胞和上皮细胞表面表达的识别受体,为入侵病原体和炎症反应提供防御屏障。
肠道共生菌群的一部分,可以通过与TLR相互作用,在控制免疫反应中发挥关键作用。
TLR位于细胞质膜和细胞内内体中,可检测细菌、病毒和真菌的一系列致病分子模式,树突状细胞中TLR的激活可影响适应性免疫反应。
许多微生物感染可以激活TLR4信号,而肠道共生微生物群的一部分,可以影响TLR4.
益生菌多糖胶囊可以通过调节Th1/Th2平衡、诱导T调节细胞分化和激活DC,进而通过TLR与肠道微生物群相互作用,在控制免疫反应中发挥关键作用。
在一项益生菌(鼠李糖乳杆菌GG)与舌下免疫疗法(SLIT)联合的研究中,组间分析表明,与SLIT维生素D组相比,SLIT益生菌组的CD4+CD25+Foxp3+诱导率显著增加,相比之下,TLR阳性细胞组的百分比降低更多。
研究表明,益生菌产生的瞬时蛋白可以诱导TLR的产生,这种蛋白可以缓解特定IgE引起的过敏反应。
此外,一些TLR可以刺激DC激活,进而导致Treg细胞产量增加。先前的研究指出,TLR可能是益生菌影响Treg细胞增殖和分化的潜在靶点。
菌群可以依赖TLR4/NF-κB途径调节过敏性炎症
在一项研究中,阐明了益生菌对TLR4/NF-kB通路在调节宿主对肺损伤和气道炎症的防御中的调节作用。过敏性婴儿哮喘和TLR有影响。
结果表明,β-乳蛋白刺激导致巨噬细胞TLR4/NF-κB信号通路的转导增加。
嗜酸乳杆菌KLDS 1.0738干预通过抑制TLR4通路显著减少过敏性炎症。此外,嗜酸乳杆菌KLDS 1.0738菌株可以显著降低TLR4转导和炎性细胞因子的产生,这与miR-146a水平的上调密切相关。
// 小结
总的来说,肠道菌群可以通过减少血清促炎因子、增加免疫细胞数量、调节Th1和Th2平衡、增加Treg数量和抑制Th17等方式来预防过敏性鼻炎的发生发展,此外,某些菌可以直接刺激TDC的形成或激活TLR通路以间接刺激DC,从而诱导Treg的形成。
通过增加有益细菌的水平可以调节肠道微生物群的稳定性,恢复肠道粘膜屏障,从而改善过敏性鼻炎。
可以根据疾病的具体严重程度、疾病类型和生活方式选择合适的治疗药物。
过敏性鼻炎的治疗选择

▸鼻用皮质类固醇
局部鼻用皮质类固醇起效迅速,尤其是缓解鼻塞。外用类固醇与特定的细胞质糖皮质激素受体 (GRs) 结合,激活抗炎基因转录并抑制促炎基因转录,外用类固醇的抗炎作用可减轻所有鼻部和眼部症状。
▸外用类固醇联合抗组胺药
MP Aze-Flu 是一种由盐酸氮卓斯汀和丙酸氟替卡松组成的鼻喷雾剂,在症状评分和生活质量方面比安慰剂或丙酸氟替卡松单独有效。
▸ 鼻塞减轻剂
由于鼻黏膜的反弹作用和习惯作用,连续使用最好不超过7天。大部分药物可使α肾上腺素受体起作用,引起血管舒张和收缩,可立即缓解鼻塞症状,主要包括伪麻黄碱、羟甲唑啉、三唑啉或去氧肾上腺素。
▸鼻用抗胆碱能药和色甘酸钠/肥大细胞稳定剂
主要影响鼻腔分泌物的鼻用色甘宁和抗胆碱能药有一些较早的研究,但没有足够的证据做出充分的推荐。
▸盐水冲洗
增加儿童的鼻腔冲洗是有益的,可以减少鼻嗜酸性粒细胞和中性粒细胞。
全身性糖皮质激素的所有机制均受 GR 的调节,GR 属于配体调节的核受体超家族,类固醇的抗炎作用可以通过三种广泛的分子机制来解释:促炎基因表达降低、抗炎炎症基因表达增加和非基因组机制。
▸口服抗组胺药
已在多种细胞上鉴定出四种组胺受体 H1 和 H2 受体,可刺激过敏反应的早期和晚期。第二代/第三代非镇静 H1 受体拮抗剂是过敏性鼻炎的首选抗组胺药。
许多研究表明西替利嗪是有效的,并且西替利嗪在症状缓解方面优于氯雷他定,并且具有良好的安全性。
▸白三烯受体拮抗剂(LTRA)
白三烯是炎症介质家族,包括LTA4、LTB4、LTC4、LTD4和LTE4,通过阻断半胱氨酸LT1(CysLT1)受体,LTRAs(如蒙特鲁甾醇)可以改善过敏性鼻炎和哮喘症状。目前,口服色甘酸作为肥大细胞稳定剂的研究不足。
迄今为止,过敏原免疫疗法是目前唯一可用于 IgE 介导的过敏性疾病患者的免疫调节和因果治疗。
过敏原免疫疗法的目的是对免疫系统进行重新编程以减少特异性IgE的产生,从而诱导对过敏原的耐受,可通过不同的给药途径分为皮下免疫和舌下免疫两种方式,通过不断增加过敏原剂量使患者脱敏。
同时,研究人员发现接种疫苗可以改善长期空气污染对过敏性呼吸道的负面影响。针对风疹、伤寒和天花的预防性免疫显示过敏性鼻炎的发生率较低,而麻疹疫苗的过敏性鼻炎发生率较高。
目前过敏性鼻炎的治疗仍然基于过敏原避免、症状缓解药物、抗炎治疗和过敏免疫治疗。现阶段过敏性鼻炎治疗药物不良反应多且无法治愈,症状易反复,免疫治疗疗程较长,依从性差,同时降低生活质量。
肠道微生物群正在成为早期治疗特应性疾病的新靶点,如过敏性鼻炎也是特应性疾病的一种。
益生菌可以用作宿主防御途径的免疫调节剂和激活剂,口服益生菌可以调节呼吸系统的免疫反应,并可以通过调节肠道微生物群和免疫反应的变化来预防和治疗上呼吸道疾病。
国际上对益生菌作为替代治疗方法的研究和应用正在增加,大多数研究表明益生菌可以显着改善过敏性鼻炎患者的症状。
接下来我们详细了解基于菌群干预的过敏性鼻炎疗法。
作为调节肠道菌群平衡的重要手段,益生菌包括多种细菌,其主要作用是维持免疫系统的平衡,改善菌群结构,恢复菌群平衡,同时,它可以减轻肠道局部黏膜炎症反应,恢复黏膜屏障,阻断外来病原体的入侵。
前面章节我们了解到,益生菌可以激活 Th1 或抑制 Th2,引起抗炎作用,还可以刺激免疫因子如IL-10的产生,其主要作用是抑制炎症反应。
因此益生菌治疗过敏性鼻炎的基础研究和临床应用越来越多。
➤ 关于益生菌改善过敏性鼻炎的研究
益生菌的使用可积极改善克雷伯菌与双歧杆菌的比例,并可预防过敏性疾病的发展。
对过敏性鼻炎大鼠的研究表明,婴儿双歧杆菌和长双歧杆菌的混合物LacB可以降低粘膜中H1受体和脱羧酶组氨酸的mRNA表达,从而减轻过敏性鼻炎表现。
在一项双盲安慰剂对照试验中,与安慰剂组相比,食用5个月的干酪乳杆菌(LcS)会导致IgG水平升高,IL-6、IL-5和干扰素γ(IFN-γ)水平显著降低。
研究人员还调查了嗜酸乳杆菌对患有实验性过敏性鼻炎的BALB/c小鼠的影响,并报告使用第二周后喷嚏明显减少,而对照干预措施在第四周减少了喷嚏。
在对1919名过敏性鼻炎患者的23篇论文进行的系统回顾和荟萃分析中,研究人员表明益生菌可能有效缓解过敏性鼻炎患者的症状和生活质量。
在另一项系统综述中,包括了11项关于使用益生菌治疗和预防过敏性鼻炎的随机对照试验。研究结果表明,益生菌的使用与过敏性鼻炎患者的生活质量和鼻腔症状的显著改善有关。
关于益生菌治疗过敏性鼻炎的研究


Liu P, et al., J Asthma Allergy. 2022
研究表明,添加益生菌可以通过恢复肠道菌群紊乱来调节过敏性鼻炎的免疫反应。
一项研究指出,用益生菌发酵乳治疗后,患者的血清特异性IgE显著降低,免疫功能显著改善,体内肠道菌群结构得到改善,肠道菌群平衡得到恢复,症状也显著缓解。
用从人类粪便和泡菜中分离的长双歧杆菌和植物乳杆菌的益生菌混合物(PM)进行过敏性鼻炎治疗,可以通过控制肠道菌群紊乱(显著抑制变形菌,增加拟杆菌和放线菌的组成)来缓解过敏性鼻炎。
也有结果表明,益生菌和L-谷氨酰胺可以有效调节过敏性鼻炎患儿治疗过程中胃肠肽的水平,恢复肠道菌群的平衡,并恢复肠黏膜的屏障功能,从而达到治疗目的。
基于上述研究结果,可以看出益生菌可以调节和恢复肠道微生物群紊乱以治疗过敏性鼻炎。
当然,也有研究中发现益生菌治疗后效果没有明显改善的,例如:
在一项关于益生菌治疗过敏性鼻炎疗效的研究中,患者的过敏症状没有明显缓解,但与治疗前相比,一些患者的鼻粘膜微环境有所改善。
17项纳入的研究发现,益生菌治疗至少在一个结果指标上比安慰剂有显著的治疗优势,而六项试验未发现效果。
目前,作为临床过敏性疾病研究的一个新方向,益生菌有望成为过敏性鼻炎控制和治疗的潜在新目标。益生菌治疗的可能机制如下图所示:
益生菌治疗过敏性鼻炎的简要机制

Liu P, et al., J Asthma Allergy. 2022
益生菌作为过敏性鼻炎的辅助疗法,不仅可以从深层次恢复肠道微生物群紊乱,缓解鼻过敏的典型症状,而且具有高性价比和低风险的优势。
然而需要注意的是,目前的关于益生菌的基础研究仍在进行中,益生菌的最佳菌株、剂量和持续时间还需要进一步探索,同时,在引入新的治疗方法的过程中,有必要注意其可能带来的副作用。
益生元是影响肠道微生物群组成和活性的特定膳食成分。常用的益生元是乳糖醇、乳果糖、菊粉、乳糖、低聚果糖、低聚半乳糖和大豆低聚糖等。
◣ 益生元对IgE水平高的过敏性鼻炎成人的影响
在52周内,患者接受乳糖,并测量其血清IgE水平。治疗一年后,血清IgE水平(尤其是花粉过敏原)显著降低,同时伴有过敏症状的缓解。
一项研究比较,干燥的Ma-al-Shaeer(一种富含纤维的传统伊朗药物,配方基于大麦)与非索非那定对成人过敏性鼻炎患者的影响。
受试者连续14天每天两次接受口头提及的制剂。两组过敏性鼻炎的临床病程均得到改善,而Ma al-Shaeer组的鼻塞、鼻后滴漏和头痛评分显著降低。
◣ 益生元被广泛用作婴儿配方奶粉的补充
一项研究评估了益生元寡糖对过敏的保护作用。
在这项随机对照试验中,具有特应性风险的健康婴儿在出生后的前六个月接受了补充益生元或补充安慰剂的配方奶粉喂养。随访期为五年。
补充益生元组的累计过敏表现发生率显著降低。该干预措施对预防过敏性鼻结膜炎和过敏性荨麻疹特别有益。
其他关于益生元预防/治疗哮喘或过敏性鼻炎的研究
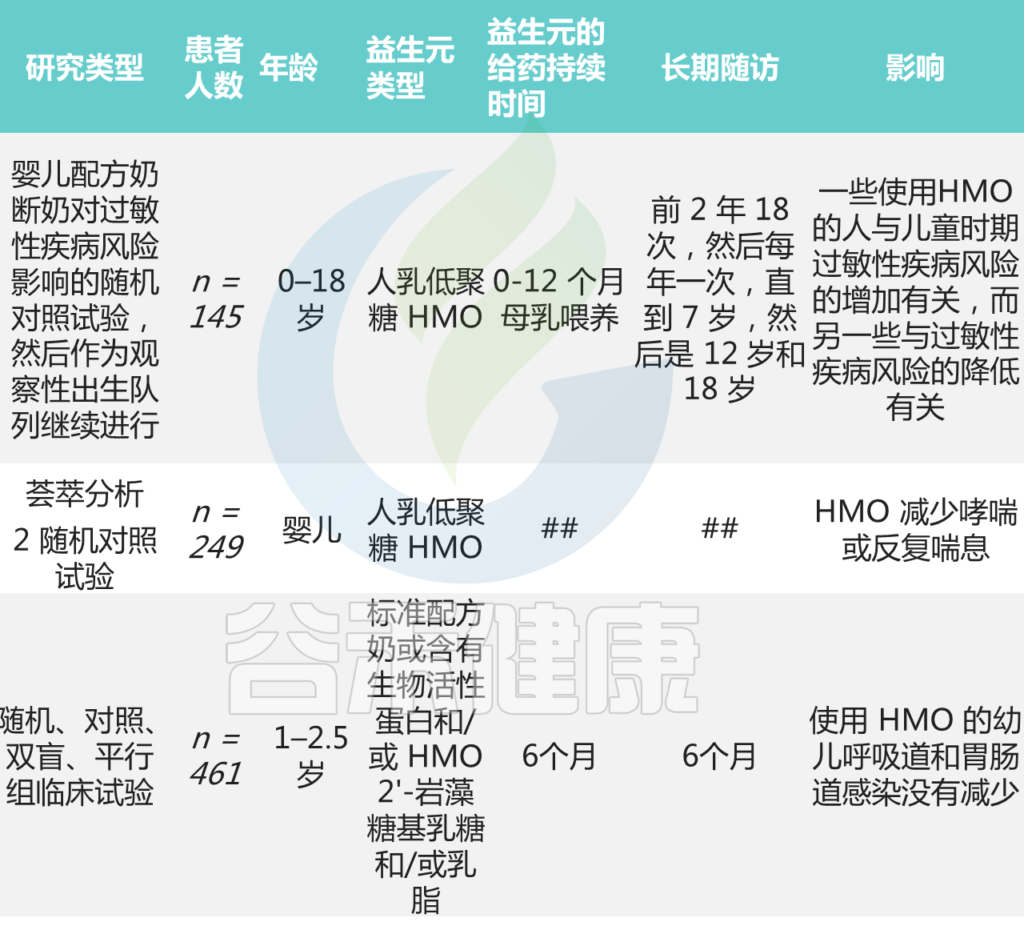
Meirlaen L, et al.,Nutrients. 2021
总之,关于益生元用于预防和治疗过敏性鼻炎的数据仍然不足。然而,它们调节细胞因子释放的能力,似乎是治疗过敏性疾病的一种新的、有前途的方法。
合生元治疗过敏性鼻炎的研究也很少,个别研究益生菌功效的试验实际上涉及合生元。
关于合生元预防/治疗过敏性鼻炎的研究
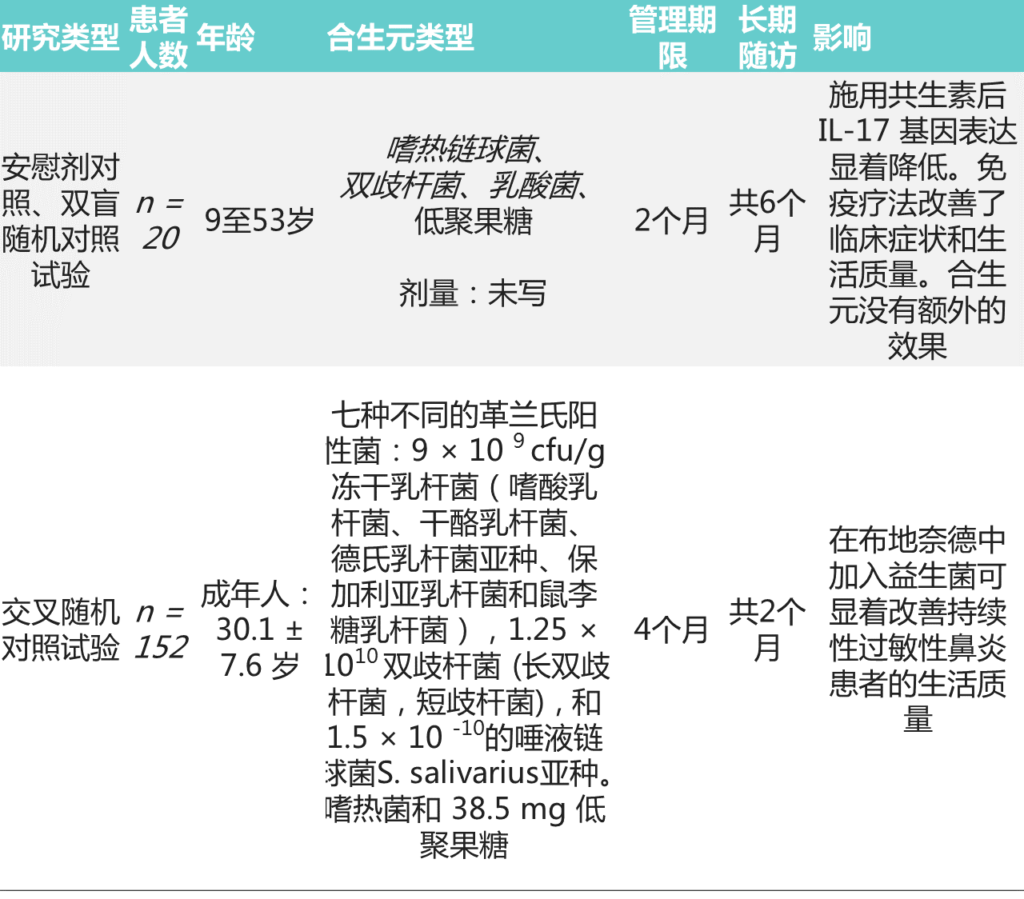
Meirlaen L, et al.,Nutrients. 2021
合生元对预防过敏性鼻炎的作用仍未得到解答,需要更多设计良好的研究,仅研究合生元对过敏预防和/或治疗的影响。
细菌裂解物是由源自呼吸道病原体的抗原组成的免疫调节制剂。最常见的是肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、化脓性链球菌、绿色链球菌、金黄色葡萄球菌、肺炎克雷伯菌和奥扎纳克雷伯杆菌。
该制剂可通过化学或机械裂解获得。不同的生产方法可以产生不同的免疫效果。细菌裂解物可以口服、鼻内和舌下给药。这里讨论了口服给药对肠道环境的影响。
细菌裂解物的作用机制基于自然暴露于病原体抗原和随后的免疫反应。它们通过Toll样受体激活DC,促进抗病毒细胞因子释放、NK细胞活化和Th1/Th2平衡的恢复。
只有五项研究调查了细菌裂解物对过敏性鼻炎的影响。其中两个使用口服OM-85。
OM-85
一项开放标签的顺序研究,研究了在过敏性鼻炎、哮喘或慢性阻塞性肺疾病患者中使用OM-85对呼吸道感染率、原发病加重率和症状严重程度的影响。
减少过敏性鼻炎发作次数,严重程度减轻
患者分三个周期接受制剂,包括连续10天的摄入,然后休息20天。他们表明,与前一年相比,OM-85治疗减少了呼吸道感染和过敏性鼻炎发作的次数,并缓解了过敏症状的严重程度,而前一年患者只接受了标准的优化护理。
已证明血清和唾液IgA水平增加。为了进一步扩大这项研究,评估了60名常年过敏性鼻炎患者的临床效果。参与研究的参与者按照与前述研究相同的方案服用OM-85。治疗后,OM-85组的总鼻部症状评分、瘙痒评分、鼻溢评分、喷嚏评分和药物评分均显著下降。此外,观察到鼻IFN-γ增加,鼻IL-4和IL-13水平降低,鼻拭子中嗜酸性粒细胞数量减少。
细菌裂解物不会直接影响肠道细菌;然而,它们刺激的细胞因子可能会影响肠道环境。关于细菌裂解物对过敏性鼻炎的影响还需要更多的研究。
粪菌移植是将健康供体的粪便转化为粪便悬浮液,并将其施用于患者的肠道,以重建肠道微生物群的平衡的过程。目前,没有关于其在过敏性鼻炎治疗中的应用的研究;然而,这可能是恢复肠道细菌组成的一种有前途的方法。潜在地,它可能比益生菌更有效,因为其显著更丰富的注入微生物和永久定植肠道的能力。
一项研究证实了这一假设,他们研究了粪菌移植对成年特异性皮炎患者的影响。结果表明,粪菌移植后特应性皮炎评分显著降低。此外,在研究和随访期间,每周局部使用皮质类固醇的情况有所减少。
肠道微生物群的宏基因组分析显示,从供体到患者的细菌菌株传播显著。未观察到治疗的不良反应。
然而,关于其在过敏性疾病中的应用,仍然没有足够的数据;因此,需要更多的大样本研究。
高质量的饮食结构,如水果和蔬菜、高纤维食物、鱼、低脂食物、蛋白适量,可以增加肠道多样性,维持肠道菌群平衡,有助于平衡免疫反应。
研究表明饮食习惯和肠道微生物群与过敏性疾病有关。
一项研究招募了 186 名有过敏性鼻炎症状的参与者和 106 名没有过敏性鼻炎症状的对照受试者,该研究结果深入了解膳食营养素、肠道微生物组、肠道免疫系统和过敏性鼻炎发展之间的复杂相互作用。

维生素A
关联分析表明,视黄醇、维生素 A、隐黄素(维生素A原的一种)、铜与经年龄和性别调整后的过敏性鼻炎几率相关。
维生素A的主要膳食来源是动物性食物中的视黄醇,水果、蔬菜、蛋黄和黄油中的维生素A类胡萝卜素原。
在该研究人群中,维生素A和视黄醇的膳食摄入水平高度相关(R = 0.96).
维生素A对人体的多种功能至关重要,包括胚胎发育、良好视力、上皮分化和维持免疫功能,特别是在幼稚T细胞分化中。
如果没有维甲酸(注:维甲酸是维生素A的代谢产物),转化生长因子β(TGF-β)促进初始T细胞分化为Th17细胞,后者参与炎症、自身免疫和过敏性疾病。
在视黄酸的存在下,TGF-β帮助肠道树突状细胞介导幼稚T细胞分化为Treg细胞,从而抑制自身免疫反应。
在该研究中检测的类胡萝卜素中,只有隐黄素与过敏性鼻炎相关。
铜 和过敏性鼻炎之间:反向J形关系
铜是一种重要的微量金属,是许多氧化还原酶的辅因子,它参与铁代谢、抗氧化活性、神经肽合成和免疫功能。缺铜和过量铜都会对健康产生不利影响。
在该研究中,观察到铜和过敏性鼻炎之间的反向J形关系。这种反向J形曲线可能分别与铜在适当浓度和高浓度下的抗氧化和促氧化活性有关。
高膳食摄入视黄醇与类胡萝卜素与高丰度普雷沃氏菌的结合,可能对过敏性鼻炎的发展具有保护作用
该研究认为四种营养素(视黄醇、维生素A、隐黄质和铜)和两种肠道菌属(普雷沃氏菌属和大肠杆菌属)与过敏性鼻炎的年龄和性别调整几率相关。
此外,还观察到视黄醇和普雷沃氏菌的组合保护作用,与低视黄醇摄入量和低普雷沃氏菌丰度的受试者相比,高视黄醇摄入和高普雷沃氏菌丰度受试者的年龄和性别调整后的过敏性鼻炎几率低25倍。
绿叶蔬菜、时令水果,含有多种维生素和矿物质,有助于对抗过敏性鼻炎。
绿叶蔬菜包括菠菜、羽衣甘蓝、生菜、芝麻菜等,对于提高免疫系统非常重要。其他还包括黄瓜、大蒜、番茄、红椒、南瓜、红薯、西葫芦、西芹等,都是非常好的食物。水果包括香蕉、柠檬、橙子、蓝莓等。
当然并不是马上有效,这个饮食结构调整需要持续一定的时间。
生姜
生姜的抗炎特性有助于治疗花粉症引起的眼睛、鼻子和喉咙的瘙痒、刺激和炎症。
柑橘类水果
柑橘类水果有助于治疗过敏性鼻炎的症状以及由此引起的上呼吸道刺激。葡萄柚、柠檬、酸橙、橙子、浆果是维生素 C的丰富来源。
姜黄
姜黄抗炎和抗氧化特性,有助于治疗缓解过敏性鼻炎引起的症状。它有助于减少过敏引起的刺激和肿胀。 姜黄可以通过茶、药丸或酊剂服用,甚至可以添加到烹饪时食用的食物中。
西红柿
番茄红素是西红柿中的一种抗氧化化合物,有助于减少过敏引起的炎症。
洋葱
洋葱有抗炎和抗氧化特性,同时富含榭皮素,榭皮素是一种天然抗组胺剂,有助于减轻过敏性鼻炎的症状。
omega-3 脂肪酸
鱼(金枪鱼,三文鱼等)、杏仁、核桃、南瓜和亚麻籽富含的omega-3 脂肪酸的饮食,可以降低儿童和成人发生过敏的风险。
怀孕期间和产后早期摄入 omega-3 脂肪酸的母亲可能会调节免疫系统并降低孩子发生过敏症的风险。
其他饮食建议
易过敏体质尽可能从饮食中去除蛋,乳制品,麸质谷物等容易造成过敏的食品。尽可能减少摄入添加糖和加工食品。
研究发现,一些草药对过敏性鼻炎具有治疗作用,并显示出一些治疗前景。
Septilin
Septilin是一种阿育吠陀草药配方,含有苦皮草、堇叶天花粉、茜草、山茱萸、辣木和甘草,也显示出治疗过敏性鼻炎的巨大潜力。
在一项双盲研究中,190人接受了以上草药组合或标准抗组胺药(扑尔敏)治疗。结果表明,两种治疗方法同样有效。
在这项对32名健康人进行的双盲安慰剂对照试验中,使用Septilin 4周可显著减少皮下注射组胺引起的过敏反应。Septilin也被用作提高免疫力的治疗方法。
在一项针对40名持续性低度感染(如慢性咽痛或鼻窦感染)儿童的双盲安慰剂对照研究中,与安慰剂相比,服用Septilin1个月可显著改善病情。
异株荨麻
一项初步研究表明,异株荨麻 ( Urtica dioica ) 的冻干胶囊可减少患者的打喷嚏和瘙痒。推荐剂量为 600-900 mg TID。荨麻在植物医学中具有治疗咳嗽、肺结核和关节炎的历史用途。体外研究表明它还可能具有抗炎作用。
蓍草(Achillea millefolium)
蓍草是一种多年生草本植物,在欧洲和亚洲很常见。这种多用途草本植物具有抗氧化、健胃、解痉、收敛和透明的特性。传统上用于治疗感冒、流感和发烧,蓍草也可以是对抗过敏性鼻炎的有效药物。
它的抗菌和抗卡他性作用使其成为呼吸系统的理想草药,这种天然的治疗剂还治疗鼻窦炎和粉尘过敏。可以以茶的形式或作为酊剂服用。这是一种强效草本植物,不建议超过连续两周的限度。此外,如果对豚草过敏,应该避免这种草药。
蜂斗菜 ( Petasites hybridus )
在一项开放标签研究中,580名季节性过敏性鼻炎患者服用了50-75 mg BID的蜂斗菜提取物2周(每片含8 mg petasine)。
与基线相比,90%的患者在治疗后,改善了鼻漏、鼻塞、眼睛和鼻子发痒、眼睛发红和皮肤刺激等症状。
蜂斗菜也是一种温和的白三烯抑制剂,在一项研究中发现其与180 mg非索非那定一样有效。但蜂斗菜含有潜在的肝毒性吡咯里啶生物碱(PA),所以应谨慎使用,或者可以使用不含PA的提取物。它属于豚草科,因此对豚草过敏的人也应谨慎使用。
生蜂蜜
生蜂蜜含有很多种活性植物化学物质,有助于体内激素水平恢复正常,有助于构建强大的免疫系统,从而有助于预防过敏性鼻炎。一项随机对照试验表明,食用桦树花粉蜂蜜的过敏患者过敏症状减少了60%,在桦树花粉季节无症状天数增加了一倍。
维生素E
维生素E也可用于治疗过敏性鼻炎,因为它是一种温和的白三烯抑制剂。
一项研究发现,112名患有过敏性鼻炎的成年人在连续10周每天服用800IU维生素E后,鼻部症状明显改善。富含维生素E的饮食也被证明有助于预防过敏性鼻炎的症状,维生素的保护作用随着剂量的增加而增加。建议使用混合生育酚,而不是单独使用α.
注:生育酚,是维生素E的水解产物。天然的生育酚都是D-生育酚(右旋型),它有α、β、ϒ、δ等8种同分异构体,其中以α-生育酚的活性最强。作为抗氧化剂使用的生育酚混合浓缩物,是天然生育酚的各种同分异构体的混合物。
维生素 C
维生素 C具有抗组胺特性,有助于减轻过敏症状。此外,维生素C也有助于增强免疫系统。因此,它有助于预防感染,同时缩短过敏性鼻炎的持续时间。
因此,每天应多吃橙子、灯笼椒、西红柿、柠檬、草莓、豆芽、土豆、奇异果、西兰花、柚子等富含维生素C的食物。
金钗石斛
金钗石斛具有抗炎和免疫活性,近期的一项小鼠研究发现,石虎提取物的治疗抑制了PI3K/AKT/mTOR通路,在门和属水平上恢复了肠道菌群的平衡,并改善了调节T细胞分化,从而有效地扭转了过敏性鼻炎症状。
适度运动
定期锻炼有助于减少过敏反应,适度运动对有过敏症的人无害,过敏体质的人可以按照普通人群的运动建议进行。这包括每周至少 150 分钟的中等强度有氧运动或 75 分钟的高强度运动。
这些活动包括步行、跑步、骑自行车、跑步机锻炼、游泳等。
瑜伽
瑜伽可以通过很多种方式帮助缓解和治愈身体,甚至有助于缓解过敏性鼻炎的症状。瑜伽中的呼吸练习被称为调息,已被用作治疗哮喘的方法。它可能在减轻与过敏性鼻炎相关的症状方面发挥作用。
注意选择正规教师,一开始不要追求动作的完美,重要的是注意调息。
避免触发因素
一旦确定了过敏原,请尽量远离。例如:
洗鼻子
洗鼻液可以帮助清除鼻子中的过敏原。使用生理盐水喷雾有助于减少接触过敏原。
改善不良习惯
与其他过敏性疾病相比,肠道菌群在过敏性鼻炎发病机制中作用的证据仍然较少,但肠道菌群失调与 过敏性鼻炎之间的关系是显而易见的。
肠道微生物群的高度多样性有助于平衡免疫反应,其机制涉及增加代谢物(如短链脂肪酸)和减少炎症介质的产生。
肠道菌群结构异常与过敏性鼻炎的发生率密切相关,这为我们提供了一个新思路,即肠道菌群失调可能是过敏性疾病的重要预测因子。
目前很多研究已经发现益生菌在临床上治疗过敏性疾病的初步效果,可能会减少过敏症状的发生率和持续时间。然而也有一些研究发现,益生菌治疗并没有显着改善临床症状,这可能是因为临床试验包括许多变量,例如伴随疾病、年龄、性别和许多其他因素,还需进一步探索研究。同时,益生菌辅助联合疗法也是一个值得关注的领域。
总的来说,通过各种方式调节肠道微生物群,恢复肠道粘膜屏障,恢复免疫平衡,抑制炎症,有助于改善过敏性鼻炎,肠道菌群或将成为过敏性鼻炎早期干预的新靶点。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li J, Fang F, Mei M, Wu D. The gut microbiome and allergic rhinitis; refocusing on the role of probiotics as a treatment option. Eur Arch Otorhinolaryngol. 2022 Oct 14. doi: 10.1007/s00405-022-07694-z. Epub ahead of print. PMID: 36239785.
Zhou MS, Zhang B, Gao ZL, Zheng RP, Marcellin DFHM, Saro A, Pan J, Chu L, Wang TS, Huang JF. Altered diversity and composition of gut microbiota in patients with allergic rhinitis. Microb Pathog. 2021 Dec;161(Pt A):105272. doi: 10.1016/j.micpath.2021.105272. Epub 2021 Nov 2. PMID: 34740809.
Zhu L, Xu F, Wan W, Yu B, Tang L, Yang Y, Du Y, Chen Z, Xu H. Gut microbial characteristics of adult patients with allergy rhinitis. Microb Cell Fact. 2020 Sep 1;19(1):171. doi: 10.1186/s12934-020-01430-0. Erratum in: Microb Cell Fact. 2020 Oct 8;19(1):192. PMID: 32873292; PMCID: PMC7466420.
Kaczynska A, Klosinska M, Chmiel P, Janeczek K, Emeryk A. The Crosstalk between the Gut Microbiota Composition and the Clinical Course of Allergic Rhinitis: The Use of Probiotics, Prebiotics and Bacterial Lysates in the Treatment of Allergic Rhinitis. Nutrients. 2022 Oct 16;14(20):4328. doi: 10.3390/nu14204328. PMID: 36297012; PMCID: PMC9607052.
Liu P, Hu T, Kang C, Liu J, Zhang J, Ran H, Zeng X, Qiu S. Research Advances in the Treatment of Allergic Rhinitis by Probiotics. J Asthma Allergy. 2022 Oct 7;15:1413-1428. doi: 10.2147/JAA.S382978. PMID: 36238950; PMCID: PMC9552798.
Sahoyama Y, Hamazato F, Shiozawa M, Nakagawa T, Suda W, Ogata Y, Hachiya T, Kawakami E, Hattori M. Multiple nutritional and gut microbial factors associated with allergic rhinitis: the Hitachi Health Study. Sci Rep. 2022 Mar 1;12(1):3359. doi: 10.1038/s41598-022-07398-8. PMID: 35233003; PMCID: PMC8888718.
Huang J, Zhang J, Wang X, Jin Z, Zhang P, Su H, Sun X. Effect of Probiotics on Respiratory Tract Allergic Disease and Gut Microbiota. Front Nutr. 2022 Feb 22;9:821900. doi: 10.3389/fnut.2022.821900. PMID: 35295917; PMCID: PMC8920559.
Zoabi Y, Levi-Schaffer F, Eliashar R. Allergic Rhinitis: Pathophysiology and Treatment Focusing on Mast Cells. Biomedicines. 2022 Oct 5;10(10):2486. doi: 10.3390/biomedicines10102486. PMID: 36289748; PMCID: PMC9599528.
Meirlaen L, Levy EI, Vandenplas Y. Prevention and Management with Pro-, Pre and Synbiotics in Children with Asthma and Allergic Rhinitis: A Narrative Review. Nutrients. 2021 Mar 14;13(3):934. doi: 10.3390/nu13030934. PMID: 33799367; PMCID: PMC7999316.

谷禾健康


什么是天然产物?
天然产物是指动物、植物、昆虫或微生物体内的组成成分或其代谢产物以及人和动物体内许多内源性的化学成分,是自然产生的小分子。值得注意的是,天然产物来源中,植物来源占85%以上。
谷禾在这里主要介绍植物来源的天然产物,包括营养素和药物。它们很容易与肠道微生物群相互作用,因为它们的成分复杂,在肠道中的停留时间长。通常,外源物质在小肠中的停留时间为1-6小时,在结肠中的停留时间为1-3天。特定的肠道微生物分解和转化天然产物,产生丰富的代谢物和功能化合物,具有宿主本身无法合成的生理活性。
天然产物在食品、药品、保健品领域均有运用。天然产物是极为重要的新药来源。近年来临床应用的药物,三分之二左右源自天然产物、天然产物衍生物以及天然的生物大分子,几乎涵盖了疾病治疗的各个方面。这在防治癌症及传染类疾病领域中的表现尤为明显。
天然产物在临床上得到了广泛的应用,其特点是多组分、多靶点、药效学物质多、作用机理复杂、生理活性多样。
对于口服天然产物,肠道菌群与临床疗效密切相关,但这种关系尚不明朗。肠道微生物在酶系统多样性引起的天然产物的转化和利用中起着重要作用。黄酮类化合物、生物碱、木酚素和酚类等有效成分不能通过人体消化酶直接代谢,但可以通过肠道微生物产生的酶转化,然后加以利用。因此,重点是通过肠道微生物群进行天然产物的代谢。
本文介绍了肠道微生物群及其对天然产物各组分生物转化的影响的研究,并强调了所涉及的常见菌群,反应类型,药理作用和研究方法。为临床疾病防治中的应用提供理论支持,以及日常的选择健康的药物提供一定的参考,并为基于肠道生物转化的天然产物研究提供新思路。
基于肠道微生物的天然产物的生物转化和代谢

Zhao Y,et al.Front Microbiol.2022
★人体肠道中的微生物
肠道微生物群由1000-1250种细菌组成,这些细菌以各种形式与人类相互作用,例如共生和寄生,这种相互作用通过微生物代谢物作为信号分子极大地影响人类健康。
肠道微生物构成了一个动态和多样化的微生态系统,这是抵抗致病细菌的天然屏障。肠道微生物具有丰富的酶系统,包括葡萄糖苷酶,还原酶,裂解酶,转移酶等,并大大扩展了人体内的代谢反应池。
✦肠道菌群影响口服给药的效果
口服给药是药物递送的首选途径,口服药物占市场最畅销药物的大部分。近年来,肠道微生物群对天然产物口服给药稳定性的影响受到广泛关注。
肠道具有丰富的细菌,有助于正常的消化功能,其中健康受试者中约98%的肠道微生物可分为四个门,厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。
一些肠道微生物如大肠杆菌,双歧杆菌,真杆菌,乳酸杆菌,拟杆菌和链球菌参与天然产物的生物转化,其部分代谢物有利于肠道吸收并发挥显著的药理作用。
关键肠道微生物对天然产物的生物转化

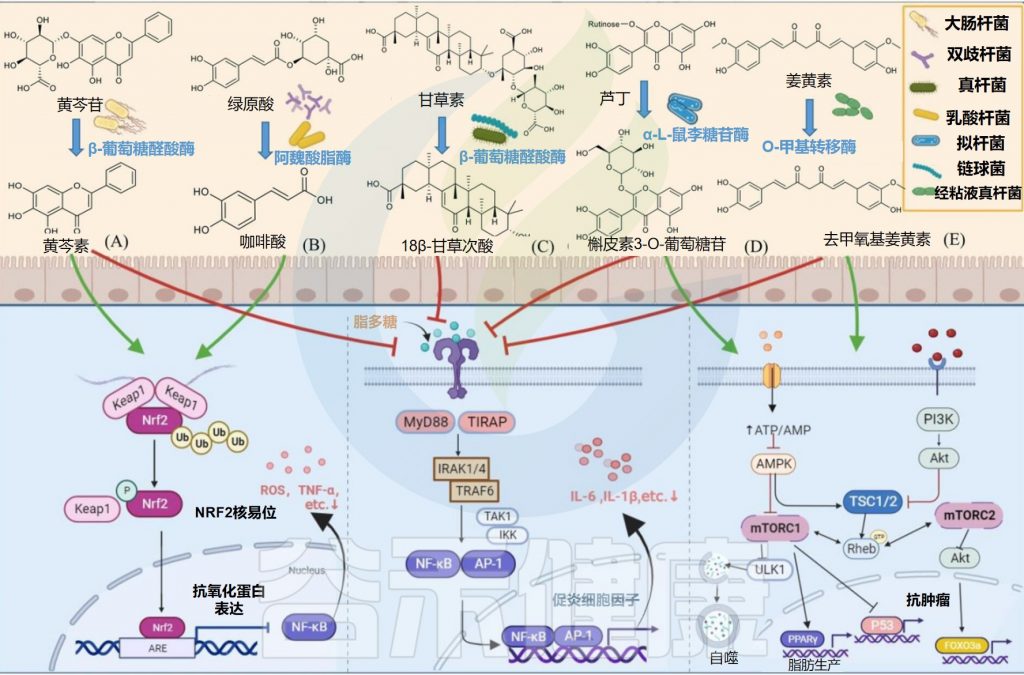
Zhao Y,et al.Front Microbiol.2022
▸
大肠杆菌(Escherichia coli),又叫大肠埃希氏菌,是一种革兰氏阴性,无孢子,兼性厌氧细菌,主要栖息在脊椎动物的肠道中。
✦水解黄芩苷而具有抗炎抗氧化作用
部分大肠杆菌可以产生糖苷酶参与外源物质的转化,从而产生其有益作用。例如,E.coli HGU-3产生β-葡萄糖醛酸酶,水解黄芩苷中的糖苷键以产生黄芩素。
在相同剂量下,黄芩素比黄芩蒿素更有效地抑制组胺诱导的抓挠行为,并通过抑制Nrf2-ARE和NF-κB信号通路而具有抗炎和抗氧化作用。
✦在脂肪肝变性中有治疗益处
一些大肠杆菌菌株具有较高的姜黄素转化活性。E.coli DH10B的高表达NADPH依赖性姜黄素/二氢姜黄素还原酶(CurA)将姜黄素还原为二氢姜黄素(DHC)和四氢姜黄素(THC),其全基因组序列已经确定。
NADPH是一种辅酶,叫还原型辅酶Ⅱ,学名烟酰胺腺嘌呤二核苷酸,在很多生物体内的化学反应中起递氢体的作用,具有重要的意义。
二氢姜黄素和四氢姜黄素通过调节SREBP-1C和PPARα的mRNA和蛋白质表达水平来降低细胞中的甘油三酯水平,并以依赖性方式衰减肝脏脂肪生成;二氢姜黄素和四氢姜黄素在肝脂肪变性中比姜黄素具有新的治疗益处。
✦水解肉桂酸后有抗氧化和抗癌特性
E.coli Nu, E.coli MC和E.coli WC-1具有肉桂酰酯酶活性,可通过水解共轭羟基肉桂酸和游离羟基肉桂酸酯释放羟肉桂酸,在体外和体内均显示出抗氧化和抗癌特性。
目前,对大肠杆菌的遗传和生化特征的良好理解可能有助于在体外合成具有各种健康活性的天然产物衍生物。
▸
双歧杆菌(Bifidobacterium)是属于放线菌门的广泛而丰富的属,是人类肠道微生物群的首批定植者之一。人类肠道中最常见的双歧杆菌包括青春期双歧杆菌,B.angulatum, B.bifidum, B. breve, B.catenulatum, B.dentium, B.longum, B.pseudocatenulatum和B.pseudolongum,占成人微生物组的10%,它们与宿主健康有关。
✦预防急性肝损伤
某些种类的双歧杆菌可以通过表达阿魏酰酯酶产生酚酸。例如,动物双歧杆菌的阿魏酰酯酶可以将绿原酸(CHA)水解成咖啡酸(CAA)。咖啡酸可以通过增加Nrf2转录来预防对乙酰氨基酚诱导的小鼠急性肝损伤。
✦调节胆汁酸和降低胆固醇
部分双歧杆菌的参与促进了黄烷酮,糖苷和皂苷在肠道中的代谢。B.longum R0175中的β-葡萄糖苷酶和去甲基化酶通过环裂解和脱甲基作用促进3-(3′-羟基苯基)丙酸和3-苯丙酸的产生。
B.longum SBT2928水解六种主要的人类和两种动物胆汁盐。因此,双歧杆菌可以调节胆汁酸代谢并降低体内胆固醇水平。
✦抗肿瘤和提高免疫
此外,B.breve ATCC 15700产生β-葡萄糖苷酶,在人参皂苷Rd的C-3和C-20位置裂解糖苷,生成脱糖基化的人参皂苷。
人参皂苷主要存在于人参和马铃薯药材中
人参皂甙的作用和功能是抑制肿瘤细胞的生长,诱导肿瘤细胞死亡,研究肿瘤的活性功能,肿瘤的异常逆行分化,提高人体免疫功能。
这些天然产物具有潜在的益处,代谢特征使双歧杆菌成为共生发展的主要候选者。
▸
真杆菌(Eubacterium)菌株的属是革兰氏阳性菌,它是人类肠道微生物群的核心属之一,并显示出在人类肠道的广泛定植。
一些真杆菌产生糖苷酶,还原酶等,并参与外源性物质的代谢。
✦抗炎抗氧化
E. ramulus是研究最广泛的类黄酮降解肠道细菌之一,它在人体肠道中很普遍。广泛存在于人体肠道中。来自E. ramulus的查尔酮异构酶和黄烷酮/黄烷醇裂解还原酶降解某些类黄酮产生查尔酮和二氢查尔酮。
二氢查尔酮及其代谢物具有抗炎和抗氧化作用,可以下调促炎细胞因子的分泌,并挽救脂多糖诱导的氧化磷酸化。
✦降解黄酮类化合物
研究了E.ramulus strain wK1对槲皮素和木犀草素的降解,发现静止细胞和酶制剂通过2,3位双键的还原和随后的环分裂将这些黄酮转化为3,4-二羟基苯基乙酸和3-(3,4-二羟基苯基)丙酸。
来自E.ramulus strain wK1的根皮素水解酶将邻近根皮素芳香A环的C-C键水解为3-(4-羟基苯基)丙酸和间苯三酚。
E.cellulosolvens ATCC 43171T可通过释放的葡萄糖部分的发酵促进类黄酮和葡萄糖苷的去糖基化。
注意:葡萄糖苷的去糖化仅由细菌酶催化。
✦预防气道过敏性炎症
Eubacterium L-8将甘草酸(GL)水解为18β-甘草次酸(18β-GA)。18β-甘草次酸通过抑制NF-κB磷酸化和增强Nrf2/HO-1通路来预防气道过敏性炎症。
NF-kB——核因子κB,参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中起到关键性作用
Nrf2/HO-1信号通路已成为细胞抗氧化应激的主要防御机制之一
这些代谢转化体现从真杆菌中获得的各种益处。然而,还需要进一步的体内研究,以最大限度地发挥真杆菌属的潜在益处。
▸
乳酸菌属(Lactobacillus)属于厚壁菌门,可以平衡微生物群落并保护胃肠粘膜。一些乳杆菌属富含代谢酶,如α-鼠李糖酶,单宁酶,没食子酸酯脱羧酶等,它们转化外源性物质。
✦抗炎、抗氧化作用
L. rhamnosus NCTC 10302具有β-葡糖苷酶和α-鼠李糖苷酶活性,通过水解,环裂变和脱氢将橙皮素7-O-葡萄糖苷和柚皮素-7-O-芸香糖苷转化为各自的糖苷元和3-(苯基)丙酸。
L. plantarum表达单宁酶水解没食子酸酯,具有短脂肪醇取代基的原儿茶酸酯和复杂的没食子单宁以产生没食子酸。没食子酸通过抑制MAPK/NF-κB途径并激活Akt/AMPK/ Nrf2途径,在脂多糖诱导的炎症和氧化应激中起保护作用。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者。
Akt,蛋白激酶B,又称PKB或Rac,在细胞存活和凋亡中起重要作用。
✦预防代谢紊乱
观察到,没食子酸和邻苯三酚是由L.plantarum WCFS1中没食子甘氨酸代谢酶降解没食子甘肽而产生的。这项研究意味着益生元-益生菌相互作用在预防饮食诱导的代谢紊乱方面的潜在作用。
✦改善骨质疏松
具有大豆苷元还原酶活性的Lactobacillus sp. Niu-O16。二氢大豆苷元抑制NF-κB活化和MAPK磷酸化,从而改善骨质疏松症。
L.casei, L.plantarum和L.acidophilus影响白藜芦醇苷到白藜芦醇的去糖基化。这种转化对于提高白藜芦醇苷的生物利用度和生物活性非常重要。来自L.reuteri, L.helveticus和L.fermentum的阿魏酰酯酶水解绿原酸以释放咖啡酸。
这些发现为乳杆菌在促进健康的制药和食品应用中的作用开辟了新的视角。然而,潜在的转化机制值得进一步研究。
▸
拟杆菌属(Bacteroides)的成员是革兰氏阴性专性厌氧菌,占结肠中细菌总数的25%,在人类肠道细菌组中起着多种作用。在临床中经常检测到拟杆菌物种,例如脆弱拟杆菌,B.distasonis, B.ovatus和B.thetaiotaomicron。
✦抑制炎症反应
拟杆菌属拥有一系列水解酶,并通过转化外来物质参与与其微生物邻居的物种间关联。体外共孵育实验表明,某些拟杆菌物种参与类黄酮的生物转化。
Bacteroides sp. 45表达α-L-鼠李糖苷酶和β-芦丁糖苷酶,用于将芦丁水解成槲皮素3-O-葡萄糖苷,槲皮素和白花青素。
槲皮素3-O-葡萄糖苷比其他形式的槲皮素吸收得更好,并且可以通过抑制NF-κB和MAPK信号通路来抑制结肠炎小鼠的炎症反应。
Bacteroides sp. 54将槲皮苷代谢为羟基槲皮素和去甲基槲皮素。槲皮苷也被α-L-鼠李糖苷酶降解为槲皮素,并通过Bacteroides sp.45进行进一步的环裂解以产生3,4-二羟基苯甲酸。
β-葡萄糖醛酸酶由拟杆菌J-37表达,将甘草酸代谢为18β-甘草次酸。
天然产物在拟杆菌作用下进行生物转化,产生具有不同功能活性的代谢物。了解人体内天然产物的整个过程以评估其对人体健康的影响是很重要的。
▸
链球菌属(Streptococcus)是革兰氏阳性菌,呈球形或卵形,通常成链排列或成对排列,广泛存在于人类粪便和鼻咽中。
宏转录组学分析表明,磷酸转移酶系统主要由链球菌表达,这表明这些细菌是小肠中可用碳水化合物的主要利用者。
✦抗癌、抗过敏作用
Streptococcus LJ-22表达β-葡萄糖醛酸酶将甘草酸代谢为18β-甘草次酸-3-O-β-D-葡萄糖醛酸(GAMG)。GAMG对脂多糖诱导的RAW264.7细胞具有抗过敏活性。
甘草酸和甘草次酸均有一定的防癌和抗癌作用。甘草次酸可抑制原癌细胞的信息传递和基因表达.甘草酸对多种恶性肿瘤均有抑制作用。甘草次酸还具有抗病毒感染的作用,对致癌性的病毒如肝炎病毒,EB病毒及艾滋病毒的感染均有抑制作用。
此外,单宁酸被Streptococcus gallolyticus subsp.Gallolyticus(SGG)的单宁酶降解以产生邻苯三酚。SGG可能通过消除单宁酸对肿瘤细胞的毒性来促进结直肠癌的发展。因此,有必要进行进一步的体内研究,以确定消除这些单宁酸降解微生物是否可以支持结直肠癌的有效治疗。
✦降低血压,抗氧化
S.thermophilus GIM 1.321很高的β-葡萄糖苷酶生产能力,用于将果实花青素降解为绿原酸,咖啡酸和阿魏酸。
CAA和CHA(10/15毫克/千克/天)的施用可以降低血压并发挥抗氧化作用。
链球菌菌株可能是肠道中的共生、致病和机会性病原体,需要更多关于其对人类健康影响的信息。更好地了解链球菌如何代谢天然产物,可以调节肠道微生物组以提高治疗效果。
▸
经黏液真杆菌(Blautia)属物种严格无氧,不可移动,通常为球形或椭圆形,广泛存在于哺乳动物的肠道和粪便中。越来越多的证据表明,经黏液真杆菌的益生菌特性对天然产物的生物转化有影响。
✦影响生物转化
在类黄酮生物转化过程中,Blautia催化的反应包括去甲基化,去糖基化以及环裂解,其可能被相应的酶催化,例如O-糖苷酶和β-葡萄糖苷酶。
研究表明,Blautia sp. MRG-PMF1菌株分别将5,7-二甲氧基黄酮和5,7,4-三甲氧基黄酮转化为生物活性白杨素和芹菜素,对芳基甲基醚官能团具有水解能力。Blautia sp. MRG-PMF1还具有去糖基化活性,并且发现各种异黄酮,黄酮和黄酮被代谢成相应的糖苷元。
✦去甲基产物具有抗炎、抗癌、抗氧化能力
Blautia sp. MRG-PMF1在菌株进一步代谢具有雌激素作用的去甲基香菜素。该菌株还可以催化姜黄素以产生具有抗炎和抗癌特性的去甲氧基姜黄素。
此外,Blautia sp. AUH-JLD56能够单独生物转化牛蒡子苷或牛蒡子苷元,制成具有更好抗氧化能力的去甲基化产物。
最近,关于Blautia对草本植物和功能性食品的生物转化和代谢研究越来越多。探索Blautia的生物转化对于开发新的酶和生物活性代谢物具有重要意义。
复杂的微生物酶催化肠道中天然产物的代谢,产生有利于宿主利用/排泄的亲脂性和低分子量代谢物。与人类遗传学不同,肠道微生物组的特征是可改变的,使其成为优化治疗的潜在治疗靶点。
口服天然产品进入消化道后,首先会接触大量肠道微生物及其产生的活性酶。因此,天然产物的肠道生物转化可能发生在通过肝脏的第一次传递效应之前,也可以被运输到肝脏进行修饰/结合,然后排泄到肠道,与肠道微生物反应形成一系列代谢产物。
因此,与健康或疾病相关的特定菌株、特定代谢途径和特定酶的组合对于确定肠道微生物对宿主的影响非常重要。
✦水解提高生物活性和生物利用度
某些天然产物具有高分子量和低脂溶性,并且它们难以在肠道中被人体吸收并且具有低生物利用度。通过肠道微生物介导的水解,它们的物理性质发生了变化,它们的生物活性和生物利用度大大提高。
大多数糖苷具有低活性,被认为是“天然前体药物”。在与肠道微生物相互作用后,糖苷的糖基被去除,然后,糖苷部分被肠细胞吸收以发挥生理作用。水解反应是进一步转化所必需的,产物(例如糖)参与促进肠道微生物的生长和存活。
肠道微生物对天然产物的水解反应



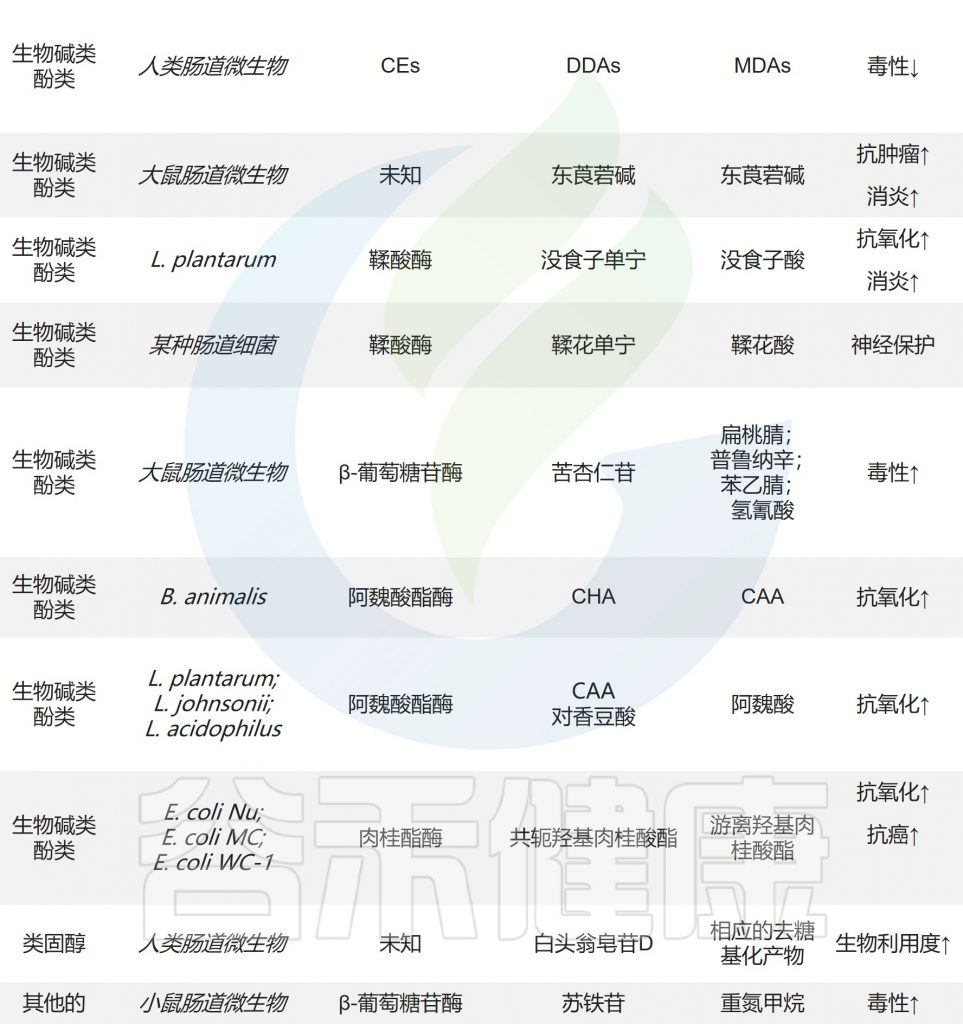




Zhao Y,et al.Front Microbiol.2022
✦类黄酮
类黄酮是天然酚类化合物,大量存在于水果和蔬菜中。肠道微生物可能是黄酮类化合物(糖苷形式)功效的部分原因,由于存在水溶性糖成分,其生物利用度较低。
具有3羟基黄酮碱和平面环体系的黄烷醇构成了一类重要的黄酮类化合物。异鼠李素-3-O-新橙皮苷首先被Escherichia sp.23脱糖基化为异鼠李苷-3-O–葡糖苷,去糖基化成苷元异鼠李甙。
•肠道酶代谢比肠道微生物更快
肠道微生物和衍生酶共同控制通过体外测定确定的淫羊藿类黄酮的代谢。在目前的研究中,肠道酶代谢类黄酮的速度比肠道微生物更快。
来自Bacteroides thetaiotaomicron VPI-5482的α-L-鼠李糖苷酶可以水解淫羊藿定C的α-1,2糖苷键以产生芸香苷。
芸香苷,又叫芦丁。具有抗炎、抗氧化、抗过敏、抗病毒等功效。
•肠道酶在水解中起着重要作用
E. ramulus和Clostridium saccharogumia将花青素-氰苷3-葡萄糖苷转化为氰苷。人类肠道酶如β-葡糖苷酶在汉黄芩苷水解成汉黄苷素中起着关键作用。
茶氨酸菌素A是红茶中发现的一种生物活性儿茶素二聚体,通过人类粪便微生物群脱乙酰产生茶氨酸霉素C。
•空间位阻会限制酶降解
观察了黄烷醇的代谢差异,结果表明,在肠道微生物发酵过程中,空间位阻可能限制细菌酶降解部分黄烷醇环。
在肠道微生物的作用下,许多其他类黄酮也会发生水解反应。值得注意的是,考虑到类黄酮的结构差异,肠道微生物对类黄酮的降解程度差异很大,从而影响其生物可利用性。需要进一步研究肠道代谢在类黄酮生物利用度和吸收中的作用,以及可能的细菌类黄酮相互作用活性。
✦萜类化合物
萜类化合物是具有抗癌,抗炎和神经保护作用的最大一类天然产物。部分萜类化合物也可被肠道微生物水解。
萜类化合物广泛存在于自然界,是构成某些植物的香精、树脂、色素等的主要成分。如玫瑰油、桉叶油、松脂等都含有多种萜类化合物。另外,某些动物的激素、维生素等也属于萜类化合物。
肠道微生物也可以水解部分萜类化合物。京尼平苷在Eubacterium sp. A-44表达的β-葡萄糖苷酶的作用下产生京尼平。芍药苷在β-葡萄糖苷酶的作用下转化为PM-I,该酶由L. brevis和脆弱拟杆菌(B. fragilis)表达。通过与大鼠厌氧肠道微生物群孵育,芍药苷也被脱糖并脱苯基为小分子量的白花苷和酰基白花苷。
•肠道微生物中的酶促进水解作用
研究证明,几种具有酯酶的双歧杆菌物种可以在体外将白芍苷水解为苯甲酸。体外研究表明积雪草苷被糖苷键水解酶逐渐去糖基化,并产生相应的苷元。柴胡皂苷B1在β-葡萄糖苷酶和β-D-聚焦酶的作用下逐渐水解为原柴胡皂素和柴胡皂甙A,由Eubacterium sp. A-44表达。
除上述化合物外,萜类人参皂苷Rh2、阿迪普西洛苷I、罗汉果苷III和具栖冬青苷也可在肠道微生物的作用下发生水解反应。
肠道微生物在萜类化合物代谢中起着重要作用,其代谢产物对肠道微生物组和人体健康的影响有待进一步研究。
✦其他化合物
具有极低生物利用度的尿石素只有在来自Gordonibacter urolithinfaciens, Gordonibacter pamelaeae和Ellagibacter isourolithinifaciens的鞣酸酶作用下水解成鞣花酸和尿石等衍生物时才能发挥药理作用。
尿石素——存在于水果和坚果中的一类化合物鞣花单宁的天然代谢产物
从大黄中提取的蒽醌糖苷被肠道微生物水解为蒽醌苷元。Sennoside A是大黄提取物的主要成分,通过Bifidobacterium sp. strain SEN的β-葡萄糖苷酶代谢为大黄蒽酮。
大黄蒽酮具有泻下攻积、清热泻火、解毒、活血祛瘀、利胆退黄等功效。
在肠道微生物表达的羧酸酯酶(CE)的作用下,二酯二萜生物碱(DDAs,如乌头碱)水解C-8和C-14的酯键,产生毒性较小的单酯二萜生物碱。生物碱东莨菪碱、类固醇化合物白头翁皂苷D和半胱氨酸在肠道微生物的作用下也会发生水解反应。
小结
水解反应是肠道微生物代谢天然产物的重要步骤,是生物活性表达和进一步生物转化所必需的。
应重点关注参与该反应的特定微生物和酶,以充分了解天然产物的最终命运及其对人体健康的影响,并为个性化治疗提供依据。
肠道微生物可以通过亲核取代反应表达转移酶并在两种底物之间移动官能团。
肠道微生物将甲基添加到外源物质中需要化学活化的辅底物,如乙酰辅酶A、三磷酸腺苷或腺苷甲硫氨酸,而去甲基化需要可以进行亲核催化的辅因子。
甲基化修饰可以优化天然产物的生理活性,去甲基化可以释放极性基团以进一步结合和排出体外,并为肠道微生物的生长提供碳源。
下图显示了肠道微生物作用下天然产物的甲基化和去甲基化以及带来的影响。
肠道微生物对天然产物的甲基化和去甲基化

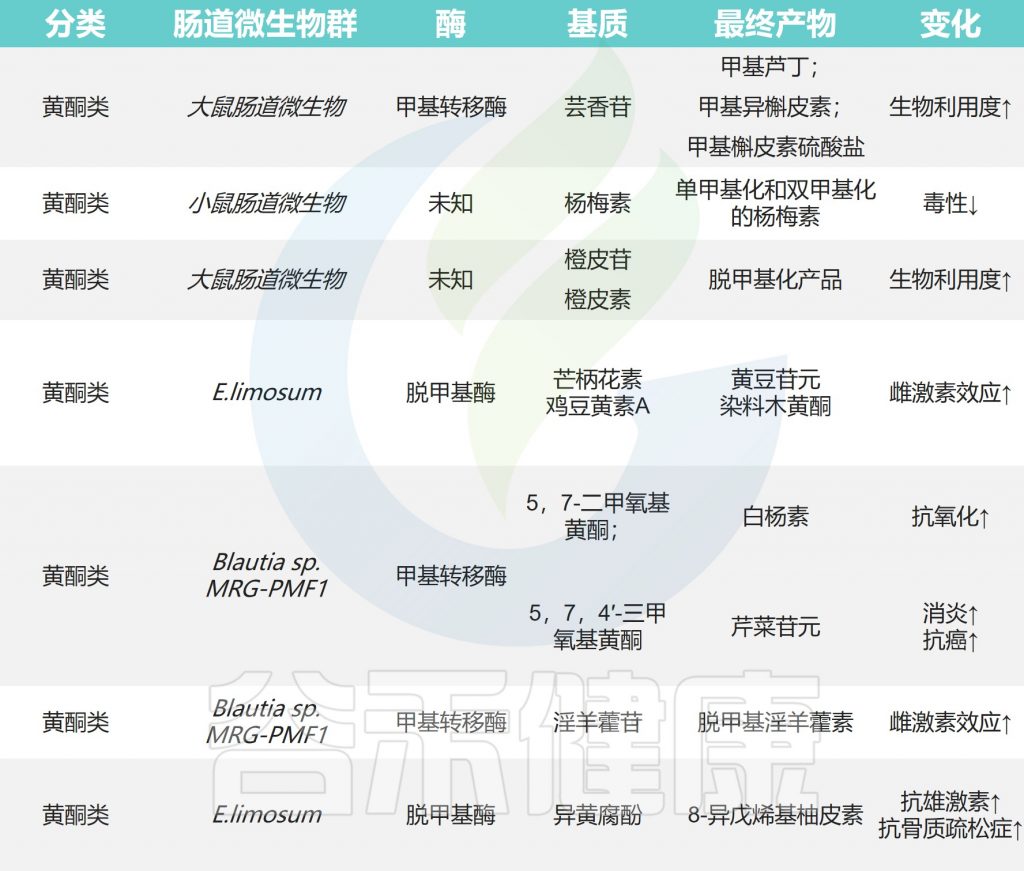


Zhao Y,et al.Front Microbiol.2022
✦类黄酮甲基化后具有抗癌活性
类黄酮甲基化修饰可以在类黄酮结构中的C-2,C-3,C-4,C-5,C-6,C-7和C-8位置进行,甲基化类黄酮的生物利用度大大提高。
甲基化类黄酮具有显著的抗癌活性和对肝脏代谢的抵抗力。在大鼠口服芦丁后,在粪便样品中检测到许多甲基化代谢物,如甲基芦丁,甲基异槲皮素和甲基槲皮素硫酸盐。
作用过程
甲基化的异黄酮类化合物在E.limosum ATCC 8486的作用下进行去甲基化以产生大豆苷元和染料木黄酮。异氧杂环丁酚通过苌香产生去甲基化产物8-异辛基柚皮素。橙皮苷,5,7-二甲氧基黄酮,黄腐酚和5,7,4′-三甲氧基黄酮也可以在肠道微生物的作用下进行去甲基化反应。
✦生物碱具有抗癌性和抗病毒活性
生物碱是含氮化合物,由海洋和陆地生物生物合成,它们具有抗癌性和抗病毒活性。
绝大多数生物碱分布在高等植物,尤其是双子叶植物中,如毛茛科、罂粟科、防己科、茄科、夹竹桃科、芸香科、豆科、小檗科等。
在肠道微生物表达的酶的作用下,苦木中的主要生物碱成分准碳质酮被甲基化为准碳质碱丁基。异喹啉生物碱巴马汀通过体外厌氧培养产生去甲基产物,如哥伦比亚胺、药根碱、去甲基小檗碱和去甲基小蘖碱。通过离子阱电喷雾电离串联质谱法证明了肠道微生物对乌头碱的去甲基作用,并产生了去甲基乌头碱。
✦木酚素可以抗炎防心血管疾病
膳食木酚素是植物雌激素,主要存在于种子,坚果,豆类和蔬菜中。
木酚素在微生物作用下的一些转化
牛蒡苷可由Eubacterium sp. ARC-2菌株去甲基化为二羟基内酯和其他产物。从人类粪便细菌中分离出一种名为Lautia sp. AUH-JLD56的细菌,该物种可以有效地将牛蒡苷或牛蒡苷元转化为去甲基化代谢物3′-去甲基牛蒡苷(3′-DMAG)。
Secoisoolaricinol是亚麻籽中最常见的木脂素之一,可在Blautia producta、Gordonibacter和Lactonifactor longoviformis的存在下去甲基,形成肠内酯和肠二醇。
芝麻素通过甲基化、去甲基化和肠道微生物的其他反应代谢为哺乳动物木脂素内酯和肠二醇。罗汉松树脂酚和连翘脂素也可以去甲基化以产生内酯。水飞蓟宾A和B被人类粪便微生物群去甲基为去甲基水飞蓟宾A和脱甲基水飞蓟宾B。
✦其他化合物
多酚化合物姜黄素被Lautia sp. MRG-PMF1去甲基化,以产生代谢物去甲基姜黄素(DMC)和双去甲基姜黄素(bDMC)。二氢异铁酸的去甲基化产物,如二氢咖啡酸,也在粪便代谢物中获得。
研究发现,甲基化反应发生在甘草皂苷22β-乙酰氧基甘草酸糖链的内部和外部葡萄糖醛酸残基处,产生22β-乙氧基甘草酸甲酯。
丹参素,萜类化合物,二苯乙烯类化合物和类固醇化合物在肠道微生物的作用下经历甲基化和去甲基化。
小结
甲基化和去甲基化反应是肠道微生物代谢的重要途径。甲基化能引起染色质结构、稳定性及蛋白质相互作用方式的改变,从而控制基因表达。去甲基化则诱导了基因的重新活化和表达。
然而,介导这种反应的基因/酶尚未完全确定,还需要进一步的实验研究。
肠道微生物可以表达许多氧化还原酶并通过调节各种官能团转化天然化合物,如烯烃、羧酸衍生物、硝基、氧化物和a,b不饱和羧酸衍生物,这些官能团影响体内天然产物的活性。
下图显示了肠道微生物作用下天然产物的氧化和还原反应。
肠道微生物对天然产物的还原和氧化反应






Zhao Y,et al.Front Microbiol.2022
✦类黄酮
黄酮类化合物大豆苷元在Clostridium sp. strain HGH6和Lactobacillus. sp. Niu-O16的作用下还原为二氢大豆苷元和进一步的四氢大豆苷元。还原产物二氢染料木黄酮是由染料木黄酮在人类粪便细菌的作用下产生的。
通过分析,在厌氧条件下与槲皮素一起孵育,在大鼠肠液培养液中鉴定出脱氧代谢物山奈酚和双键氢化还原产物西叶素等化合物。
从Flavonifractor plautii ATCC 49531中发现了黄酮还原酶,该酶特异性催化黄酮/黄烷醇C环的C2-C3双结合的氢化作用,并在黄酮类化合物整个生物降解途径的初始步骤中起作用。
去甲黄腐酚,一种查尔酮化合物,被分枝杆菌还原为去甲-α,β-二氢黄腐酚
•药理作用
黄酮类化合物分布广泛,具有多种生物活性。
1.黄酮类化合物具有抗自由基和抗氧化作用;2.防治心血管疾病方面均具有良好的效果;3.抑菌抗免疫作用;4.对动物激素的调节作用。
✦生物碱
•小檗碱具有杀菌消炎的功效
由肠道微生物产生的硝酸还原酶催化生物碱中的醚和配位键反应。小檗碱(BBR)作为黄连的主要成分,可以通过肠道微生物表达的硝基还原酶还原为二氢小檗碱,这种还原产物具有很高的极性。
二氢小檗碱可以在肠道中被吸收,然后被氧化成原型小檗碱进入血液。二氢小檗碱在肠道中的吸收率是小檗碱的五倍。同时还发现,肠道微生物可以通过氧化将小檗碱转化为氧小檗碱。
小檗碱的功效和作用主要就是起到杀菌消炎的作用,抗菌谱比较广,主要用于治疗各种肠道感染和菌痢等。
•其他生物碱产物
血红素是小檗碱的一种新代谢产物,可能是一种值得探索的生物活性剂。黄连碱是一种天然的原小檗碱生物碱,具有与小檗碱相同的母体结构。口服黄连后,C-O键打开并断裂,随后发生还原反应,生成氢化小檗碱。阿南酰胺被小鼠和人类肠道微生物群还原为二氢阿南酰胺,生物利用度更高。
✦苯丙酸
•咖啡酸具有抑菌、抗病毒作用
咖啡酸(CAA)作为食品和饮料中的主要膳食多酚,在酯化后很容易进入结肠并与肠道微生物群发生反应。
苯丙酸通过C4双键还原和脱氢作用转化为3-羟基苯基丙酸,然后通过体外肠道微生物的β氧化迅速转化为3-苯基丙酸。苯丙酸也可以脱羟基化为间香豆酸或氢化为二氢咖啡酸。
咖啡酸片具有较普遍的抑菌效果,可用于抑菌、抗病毒。除此之外,还具有中枢兴奋、解毒凝血等作用。
丹参素是丹参的主要单体酚酸,通过肠道微生物群进行脱氢和脱氧,生成3-苯基-2-羟基丙酸、3-(3,4-二羟基苯基)-2-丙烯酸(咖啡酸)和3-(3,4-二羟基苯)丙酸。
✦其他化合物
甘草次酸通过盲肠中的Ruminococcus sp. po1-3的3β-羟基类固醇脱氢酶生成3-氧代甘草次甲酸。
•通便作用
番泻甙是一类天然蒽醌衍生物和二聚糖苷,首先被β-葡萄糖苷酶水解生成番泻甙-8-O-单糖苷,然后在体内被链球菌还原为具有通便作用的大黄蒽醌。
二萜类白藜芦醇被Slackia equolifaciens和Eggerthella lentaATCC 4305还原为二氢白藜芦醇。
此外,二酮姜黄,类固醇化合物地高辛和其他化合物马兜铃酸也可以在肠道微生物的存在下减少。肠道微生物黄酮还原酶和硝基还原酶具有特殊的催化选择性,填补了肠道微生物转化途径的关键空白。
然而,介导肠道微生物减少的特定基因和酶尚未完全确定。
肠道微生物对天然产物的其他反应
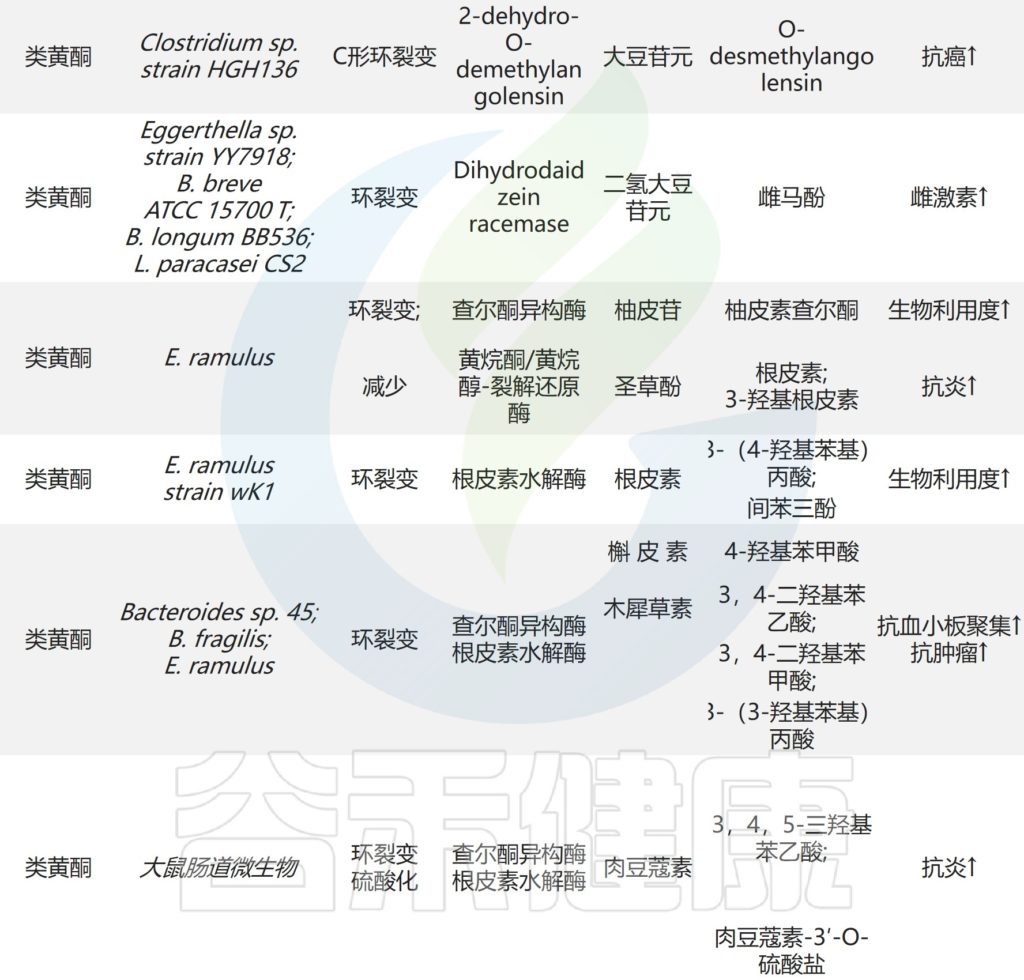
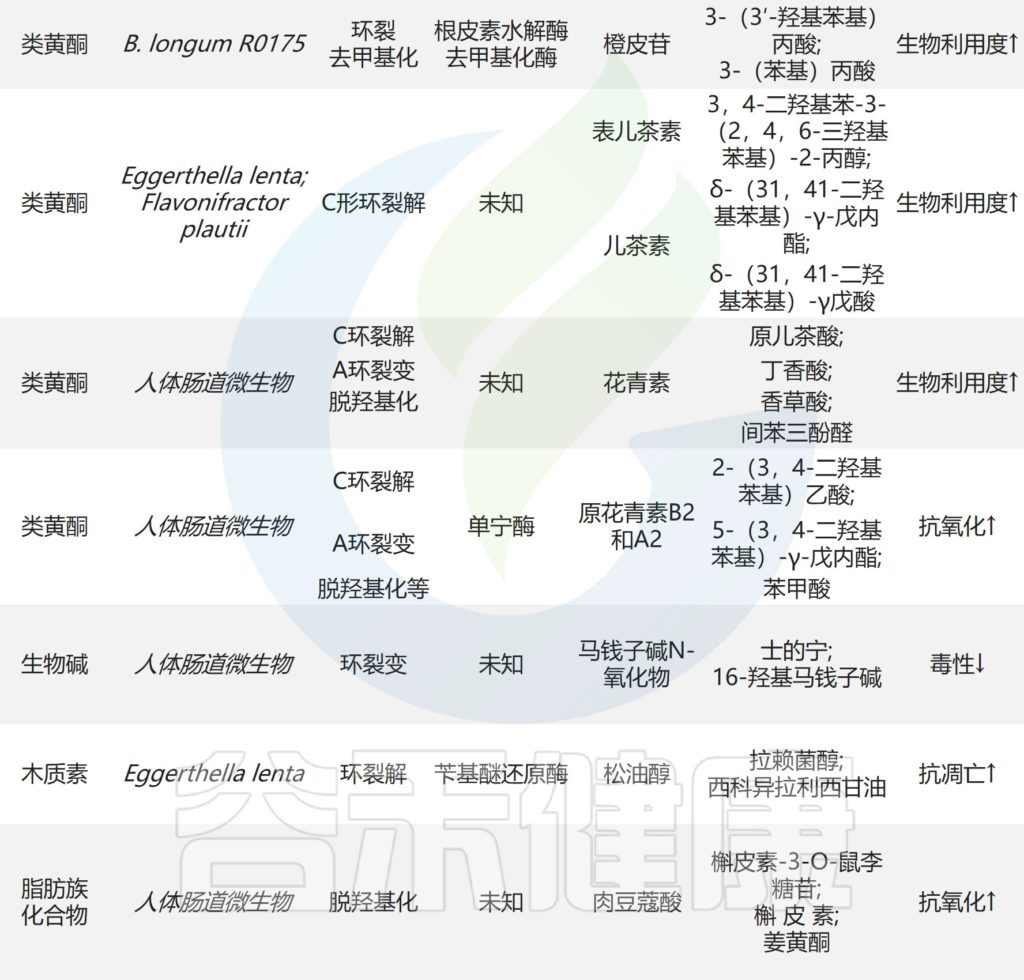
Zhao Y,et al.Front Microbiol.2022
如图中所示,肠道微生物也通过环分裂、硫化、芳构化和其他反应转化天然产物。
龙胆苦苷是一种天然的环烯醚萜苷,可通过肠道微生物β-葡萄糖苷酶水解为龙胆醛,然后通过N-杂环反应水解为含氮化合物。
京尼平丙酮醇的部分开环导致肠道微生物形成二醛。奎宁酸可以在肠道微生物存在下芳香化为马尿酸。
原花青素B2和A2与人类肠道微生物体外发酵,获得了主要的水解和环裂解代谢物,即苯甲酸、2-(3,4-二羟基苯基)乙酸和5-(3,4-二羟基苯)-γ-戊内酯。
口服木犀草素后,在大鼠粪便样品中检测到硫酸盐和氢还原代谢物。由肠道微生物促进的大豆苷元转化为雌马酚是另一个有趣的例子。
木犀草素,多以糖苷的形式存在于多种植物中,具有镇咳和祛痰作用。
雌马酚的作用:1.抗氧化,雌马酚属于多酚类物质,可作为氢/电子受体,清除自由基;2. 免疫调控,雌马酚的免疫保护作用可能是有其抗氧化作用所介导的,涂抹雌马酚对皮肤有免疫保护作用。
SesA是一种来自Sinomonas sp.no.22的芝麻素代谢酶,通过环裂解催化亚甲基从芝麻素或芝麻素单儿茶酚转移到四氢叶酸,产生芝麻素一儿茶酚或二儿茶酚和5,10-亚甲基四氢叶酸酯。
萜类化合物,类黄酮,苯酚,生物碱和脂肪酸都可以在肠道微生物的作用下进行生物转化反应,产生活性代谢物。
这些研究证明了各种肠道微生物组的巨大代谢潜力。天然产物的肠道微生物代谢及其在宿主健康中的作用应该是未来研究的重点。
小结
本节总结了来自单个反应的肠道微生物群介导的天然产物的生物转化。
但是,观察到一些限制。首先,考虑到肠道微生物的复杂性和肠道微生物酶的多样性,天然产物在肠道中经历复杂的转变。单个反应只能描述一定的新陈代谢过程。可以通过激活/抑制这一过程来优化治疗。
此外,考虑到肠道微生物含有各种潜在的多功能酶,可以预期肠道微生物会有更多的生物转化反应被天然产物所低估。
为了阐明肠道微生物代谢如何影响人类健康,研究人员应该将功能与基因和酶联系起来。
除了调节肠道微生物对天然产物的处置外,天然产物对肠道微生态学的调节作为潜在的功效机制也很重要。
越来越多的肠道微生物群研究逐渐揭示了大多数天然产品的高药理作用与低口服利用率之间的关系。大多数糖苷具有复杂的母体结构,很难被肠细胞吸收,从而限制了它们的组织特异性生物可及性。
这些化合物通过依赖于微生物/肠道微生物酶的降解反应转化为小分子代谢物/独特代谢物,从而对宿主产生广泛影响。肠道微生物还作用于膳食酚类物质,产生有助于宿主健康的功能代谢物。
✦增强抗肿瘤、抗炎、降脂作用
肠道微生物的生物转化促进了天然产物的治疗效果。人参皂苷对化合物K(CK)的典型代谢模型已被广泛报道,具有增强的抗肿瘤,抗炎和降脂作用。
人参皂苷的生物转化和代谢物化合物k的功效

编辑
Zhao Y,et al.Front Microbiol.2022
1 —降脂
在20μM时,化合物K通过激活AMPK减少人肝细胞癌细胞中的肝脂堆积
2–抗癌
在50μM时,化合物K通过上调半胱天冬酶-3,半胱天冬酶-8,半胱天冬酶-9和环磷酸腺苷依赖性蛋白激酶来抑制胶质母细胞瘤细胞的生长。
3–减弱炎症
化合物K通过自噬诱导和调节NF-κB、p38蛋白和JNK/MAPK信号来减轻巨噬细胞炎症和泡沫细胞形成。
✦姜黄素可以抑制炎症
姜黄素代谢物的生物利用度取决于微生物群依赖性。例如,去甲基姜黄素增加PPARγ表达,导致自噬和核转录因子κB抑制,随后抑制脂多糖诱导的炎症。
PPARγ——是一种过氧化物酶体增殖物激活受体
MAPK——即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子
去甲基姜黄素通过抑制炎症因子的分泌和MAPK和NF-κB途径的激活来减轻体内和体外的炎症反应。由于在其原型苯环结构中不存在甲基,去甲基姜黄素的化学稳定性增加,从而解释了姜黄素的强大有益作用。
姜黄素来源:姜黄素是从植物根茎中提取,主要来源于生姜,然后就是那些植物中,胡萝卜、番茄以及辣椒,咖喱,芥末中也含有一些姜黄素。
✦尿石素具有抗炎和神经保护等作用
值得注意的是,尿石素A(UA)是一种天然化合物,由肠道微生物从摄入的鞣花单宁和鞣花酸中产生,具有显著的抗炎和神经保护作用。
在1μM时,尿石素A足以降低聚(I:C)诱导的RAW264.7细胞中肿瘤坏死因子和MCP-1的产生,并使TLR3/TRIF信号失活。尿石素A提高高脂饮食小鼠的全身胰岛素敏感性并降低肝脏白细胞介素1β水平。
MCP-1,是一种由星形胶质细胞分泌的促进炎症的蛋白质。
Toll样受体3(TLR3)是TLR家族的成员,介导I型干扰素、促炎细胞因子和趋化因子的转录诱导
尿石素A通过降低皮层和海马体中白细胞介素6、白细胞介素1β和肿瘤坏死因子的水平来改善小鼠的认知障碍,并抑制神经炎症。
小结
这些研究强调了鉴定天然产物微生物代谢的重要性。此外,许多体外药理活性测量应与微生物代谢产物一起进行,微生物代谢产物实际上与体内的生化受体相互作用。
肠道微生物的组成,结构,功能和代谢物已成为天然产物发挥有益作用和降低毒性的潜在目标。
例如,肠道微生物可以通过羧基酯酶催化双酯型二萜生物碱的C-8和C-14的酯键水解,或催化C-8的酯交换以产生毒性较小的单酯二萜烯生物碱。
大肠杆菌的地高辛还原型菌株含有强心苷还原酶,它可以还原地高辛环上的α和β-不饱和内酯,并将其代谢为活性较低的二氢地高辛,从而抑制其可能的心脏毒性。
地高辛,主要用于心脏类疾病的治疗,对心脏的作用表现为正性肌力作用,减慢心率,抑制心脏传导。
然而,这种能力是有限的,并且50%的地高辛可以通过肠道微生物转化而失活。强心苷还原酶可能是地高辛失活的有效生物标志物,其表达可以被精氨酸抑制。
•饮食可能调节微生物代谢活动
饮食可以解释地高辛还原的个体间差异,并可能调节体内微生物代谢活动。相比之下,有毒化合物可以由肠道微生物产生。桦木素在来自肠道微生物的β-葡萄糖苷酶的作用下水解成致癌性重氮甲烷。
建议
应开发微生物肠道酶的小分子抑制剂,以在这个复杂的栖息地的特定转化中发挥调节作用。肠道微生物群转化的代谢物与前体物质之间的毒性差异值得进一步研究。
此外,过量的药物可能导致肠道微生物失衡和不良反应,不同剂量的天然产物对肠道微生物和新陈代谢的影响也需进一步研究。
考虑到肠道微生物可以增加宿主对药物或天然产物的复杂和可变反应,这一过程值得研究。
生物转化的方法
(1)肠液转化。转化产物的大规模制备可以通过肠液生物转化来实现;
(2)与宿主微生物群的样品一起孵育。原型药物和代谢物的类型和数量可以使用该方法检测。它具有准确表示个体的整个肠道微生物组的优点;
(3)代表性菌株的孵育。该方法具有高通量潜力,这对于大规模药物研究很有价值,并有助于有益代谢物的工业生产。
✦模型分析有利于认识微生物代谢
器官微生理系统,胃肠道类器官的各种预测/计算工具可能有助于提高我们对未来微生物代谢的理解。
此外,在动物模型中已经研究了天然产物代谢与肠道微生物之间的关系,其结果可用于研究代谢物的分布和形式。无菌/抗生素处理的动物与传统动物进行了比较,以证明肠道微生物在天然产物代谢中的关键作用。
这种方法的局限性在于人类和啮齿动物之间存在固有的胃肠道和微生物差异。在临床试验中从受试者收集的粪便进行详细微生物群和代谢物分析可以全面反映天然产物在体内的代谢过程,并用于解释个体差异。
✦增加测序技术的应用
增加测序技术的应用,以研究微生物的转录活性和代谢谱。通过使用单细胞法,可以表征肠道微生物的生理结构,以确定其代谢活性。
转录组测序技术(RNA-Seq)可以直接分析人体肠道中具有强代谢活性的微生物的基因表达谱。
单细胞方法,宏转录组学和宏基因组学的组合已被用于鉴定和表征肠道微生物群的活性亚群,并确定它们对天然产物的代谢反应。
肠道微生物群是编码各种代谢酶的基因库。大多数天然产物的生物活性和潜在健康益处的激活极度依赖肠道微生物作为底物加工工厂。
了解微生物如何独特地调整天然产物以及这些代谢物对宿主健康的影响。已经得出以下结论:
(1)肠道微生物可以改变天然产物;
(2)天然产物可以调节肠道微生物的组成和丰度;
(3)肠道微生物可以介导天然产物的多组分协同作用。
此外,肠道微生物的巨大可塑性和个体间差异是值得注意的。因此,需要提高对肠道微生物对天然产物代谢的生理,化学和微生物贡献的理解,以帮助解释天然产物反应的个体差异,并为个性化治疗提供支持。
确认生物转化中极其参与的象征性功能及其物质基础将有助于探索天然产物与肠道微生物群之间相互作用的治疗模式。
主要参考文献
Zhao Y, Zhong X, Yan J, Sun C, Zhao X, Wang X. Potential roles of gut microbes in biotransformation of natural products: An overview. Front Microbiol. 2022 Sep 29;13:956378. doi: 10.3389/fmicb.2022.956378. PMID: 36246222; PMCID: PMC9560768.
Abookleesh F. L., Al-Anzi B. S., Ullah A. (2022). Potential antiviral action of alkaloids. Molecules 27:903. doi: 10.3390/molecules27030903.
Agatonovic-Kustrin S., Kustrin E., Gegechkori V., Morton D. W. (2020). Anxiolytic terpenoids and aromatherapy for anxiety and depression. Adv. Exp. Med. Biol. 1260, 283–296. doi: 10.1007/978-3-030-42667-5_11.
Al-Ishaq R. K., Liskova A., Kubatka P., Büsselberg D. (2021). Enzymatic metabolism of flavonoids by gut microbiota and its impact on gastrointestinal cancer. Cancers 13:3934. doi: 10.3390/cancers13163934.
Augusti P. R., Conterato G. M. M., Denardin C. C., Prazeres I. D., Serra A. T., Bronze M. R., et al.. (2021). Bioactivity, bioavailability, and gut microbiota transformations of dietary phenolic compounds: implications for COVID-19. J. Nutr. Biochem. 97:108787. doi: 10.1016/j.jnutbio.2021.108787.
Berlinberg A. J., Brar A., Stahly A., Gerich M. E., Fennimore B. P., Scott F. I., et al.. (2022). A novel approach toward less invasive multiomics gut analyses: a pilot study. Microbiol. Spectr. 10:e0244621. doi: 10.1128/spectrum.02446-21.
Bess E. N., Bisanz J. E., Yarza F., Bustion A., Rich B. E., Li X., et al.. (2020). Genetic basis for the cooperative bioactivation of plant lignans by Eggerthella lenta and other human gut bacteria. Nat. Microbiol. 5, 56–66. doi: 10.1038/s41564-019-0596-1.

谷禾健康


You are what you eat
国庆放假除了玩玩玩,当然少不了吃吃吃,把各种一直想吃的都提上日程,应该是对假期最起码的尊重了…
有时候我们喜欢吃的并不是食材本身,而是喜欢融入食材中的“味道”,不知从什么时候开始,我们对“重口味食物”越来越上瘾,而“重口味食物”往往意味着过甜、过咸、过辣……
我们知道饮食可以影响肠道菌群,在之前的文章里也多次提到,诸如食物种类,饮食方式,饮食习惯等对肠道菌群的影响。
之前写过关于饮食对肠道菌群的文章:
间歇性禁食 & 肠道菌群 & 心血管疾病
利用饮食精准干预肠道微生物群
饮食-肠道菌群对心血管疾病的相互作用
正视暴饮暴食、厌食症等饮食失调问题
深度解析 | 炎症,肠道菌群以及抗炎饮食
饮食习惯或将引领新的健康革命
深度解读 | 饮食、肠道菌群与健康
本文试着从不同饮食口味的角度「包括甜、咸、辣」,来了解一下糖、盐、辣椒等对肠道菌群的影响,对健康的潜在影响机制,以及相关食用小妙招。
如果说厨房里只能有一款调料,那一定是盐。盐,号称”百味之王”,同时也是一把”双刃剑”。身体缺不了它,食用不当也会给身体带来很多伤害,例如体重增加,高血压,慢性肾病等。

氯化钠,“盐”,是日常食物的重要组成部分,对身体的体内平衡起着至关重要的作用。
盐参与调节人体内水分的均衡分布,增强神经肌肉兴奋性,为使机体内酸碱平衡和血压正常功能,保证体液的正常循环,参与胃酸的形成,促使消化液的分泌,能增进食欲。
一般成人每天摄入3克食盐就可以维持基本生理需求。2022年颁布的《中国居民膳食指南》中也将食盐摄入量再次严格限制,每人每日食盐摄入量从原先的6克以内改为不高于5克。
过多的盐摄入量,可能给健康带来危害。
饮食中高盐含量会导致肠道免疫系统的变化。血液中含有过多的钠会导致体内免疫细胞产生较少的能量,还会影响机体正常代谢和细胞的渗透压等,引发心脑血管疾病和代谢性疾病,业已知道盐摄入过量是心脑血管疾病的主要风险因素之一。
doi.org/10.1016/j.biopha.2020.111156
◣ 高盐饮食和体重增加相关
或许会有这样的疑惑,盐含的热量极少,为什么会与体重增加有关?
这个问题不在于热量,确实盐一点热量都没有。然而摄入大量的盐会导致体重暂时增加,是因为它会导致身体保留水分。
盐摄入过多会增加口渴感。身体消耗的额外液体被用来稀释身体无法足够快速排出的多余钠。
小鼠研究表明,高盐饮食也可能使身体对瘦素产生抵抗力。
注:瘦素是一种激素,负责防止饥饿,让你感到充实和满足。
高盐饮食也可能间接导致体重增加,因为它们通常与大量的超加工食品有关。高度加工的食物导致摄入更多的热量并增加体重。
当热量相等时,高盐饮食不会比低盐饮食增加或减少更多的体脂。
含盐量较高的食物:零食、薯条、西式快餐、披萨、油炸食品、加工食品、调味品,甚至面包,也含有较高的热量。
因此,如果你的饮食中含有大量这些经过高度加工的食物,那么胃很可能会感觉不到满足感和饱腹感,最终导致摄入更多的热量并增加体重。
◣ 高盐饮食和夜尿症相关
如果你有夜尿症,钠摄入量可能是罪魁祸首。
在一项研究中,当那些夜间排尿频繁且饮食中摄入高钠的人减少了钠的摄入量时,他们报告说夜间上厕所的次数减少了,而良好的睡眠习惯提高了生活质量。
在用餐期间和白天大量喝水可以帮助排出体内的钠,导致夜间小便减少。
◣ 高盐饮食和心血管疾病的关系
说到高盐饮食,就会联想到高血压。
有些人可以吃含钠量很高的食物,但血压水平不会有任何有意义的变化。其他人吃同样的饮食可能会导致高血压,这是为什么呢?
可能与“盐敏感性”有关。“盐敏感性”的人,如果从低钠饮食转向高钠饮食,血压会增加。盐敏感性的潜在原因很多,从遗传到环境。
研究表明,对盐敏感的人比中度敏感的人患高血压的可能性至少高40%.
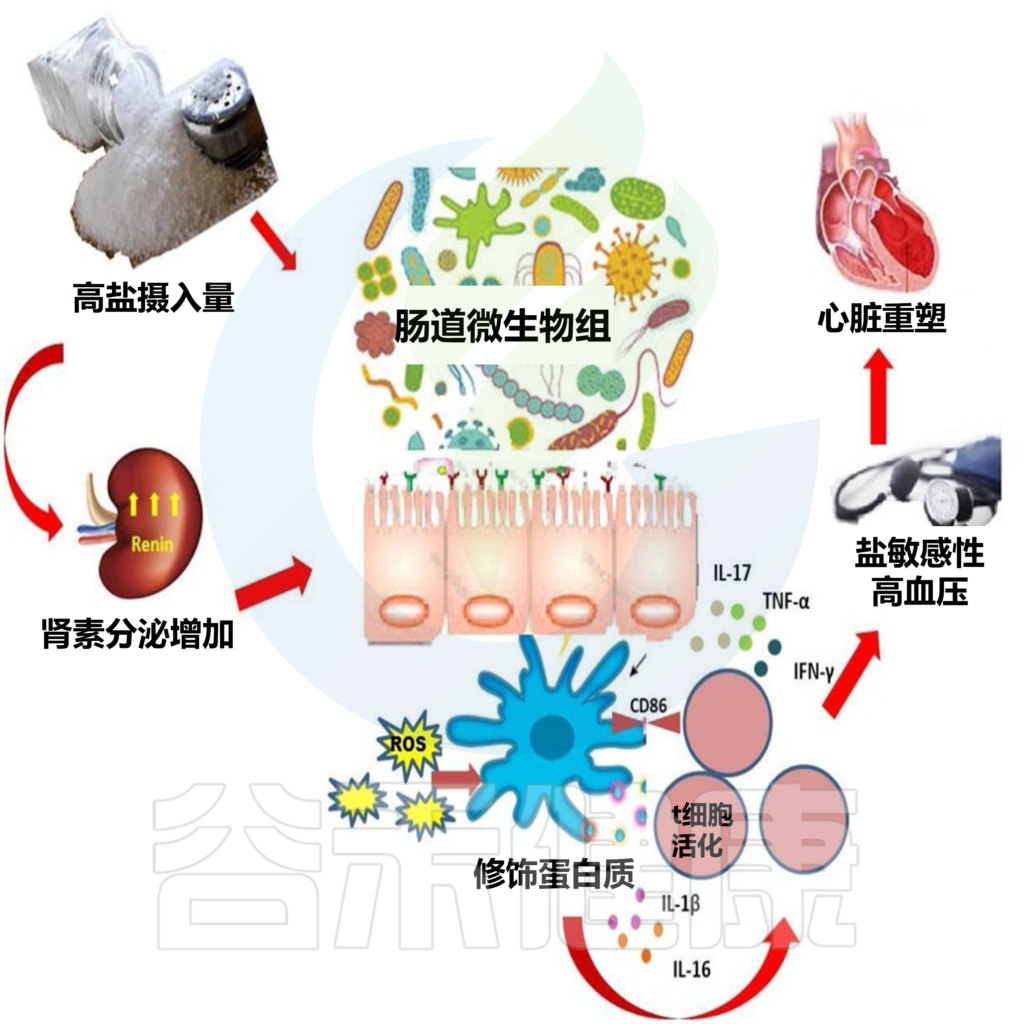
doi.org/10.1016/j.biopha.2020.111156
临床研究发现,较高的钠摄入量与心血管疾病和相关死亡有关。以下是重点研究:
研究人员测量了来自 32 个国家/地区的 10,000 多名成年人在 24 小时内排泄的钠量(这是盐摄入量的良好替代品)。平均每天接近 4,000 毫克钠。然而,范围很大,从巴西亚诺马莫人的每天 200 毫克到日本北部的 10,300 毫克。盐摄入量较高的人群平均血压较高,并且随着年龄的增长血压升高幅度较大。
两项预防高血压试验 (TOHP) 于 1987 年至 1995 年进行。他们测试了生活方式改变对血压的影响,例如减肥、压力管理、营养补充剂和摄入更少的钠。在每项研究中,在 18-36 个月内减少钠摄入后,血压略有下降。试验结束多年后,研究人员对参与者进行了调查,发现:
平均 10-15 年后,减钠组的 TOHP 参与者心脏病发作或中风的可能性降低 25%。需要手术打开或绕过胆固醇阻塞的冠状动脉,或死于心血管疾病的可能性降低。
参与者饮食中钾与钠的比例越高,患心血管疾病的机会就越低。这表明包括增加钾和降低钠的策略可能是对抗高血压的最有效方法。
◣ 高盐饮食与慢性肾病进展有关
对诊断为慢性肾病的患者进行的一项系统评价发现,每天摄入超过 4600 毫克的高钠盐与慢性肾病的进展有关。
与每天 2300 毫克的适度钠摄入量相比,每天摄入少于 2300 毫克的低钠盐没有显着影响。
一般来说,指南通常建议适度而不是低钠限制以防止慢性肾病的发展。
对于慢性肾病的整体管理,建议每日钠摄入量少于 4000 mg,对于伴有体液潴留或蛋白尿症状的慢性肾病,建议每日钠摄入量少于 3000 mg.
◣ 高盐饮食与骨质疏松症有关
身体通过排尿流失的钙量随着你摄入的盐量而增加。如果血液中钙供应不足,它会从骨骼中流失。因此,高钠饮食可能会产生额外的不良影响,即骨质疏松症。
一项对绝经后妇女的研究表明,两年内髋骨密度的下降与研究开始时24小时尿钠排泄有关,而且与骨质流失的联系与钙摄入量的联系一样强烈。
其他研究表明,减少盐的摄入量会导致钙的正平衡,这表明减少盐的摄入可以减缓随着年龄增长而发生的骨骼中钙的流失。
◣ 高盐饮食可能和胃癌相关
世界癌症研究基金会和美国癌症研究所的结论是,盐和咸的食物都是“胃癌的可能病因”。
高盐饮食通过肠道菌群影响健康
我们吃的东西和其中的盐,在某个阶段到达我们的肠道,是否会影响肠道微生物?
肠道菌群最有可能参与体内盐分的吸收,钠通过钠质子交换剂 3 (NHE3) 在结肠中被高度吸收。在小鼠 NHE-3 缺失时观察到肠道微生物环境的改变和血压的降低。
高盐消耗会影响蛋白质的消化并改变肠道菌群的多样性,菌群变化例如:棒状杆菌科的增加,乳酸杆菌的减少,详见下表:
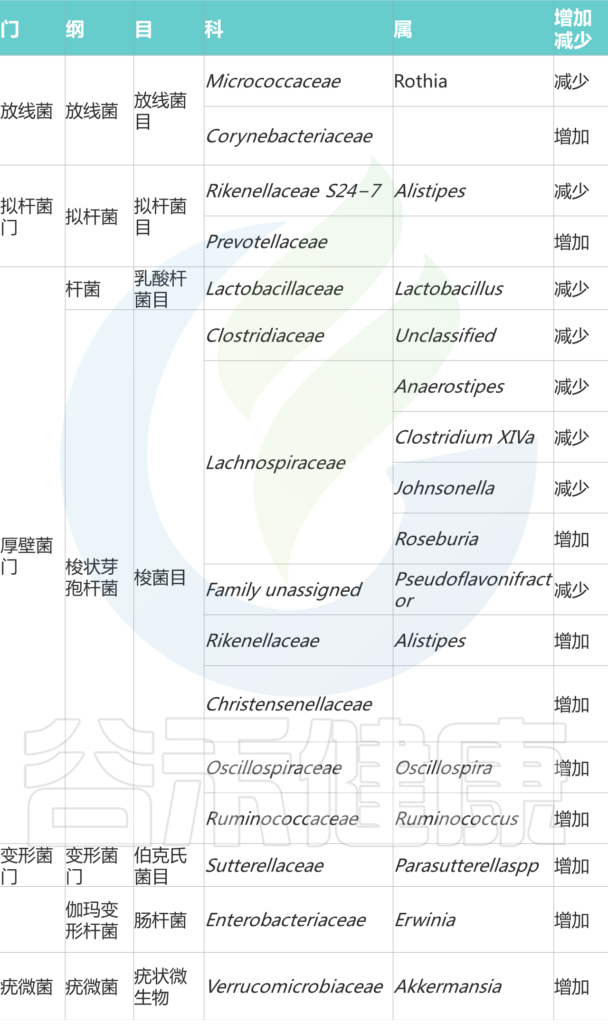
doi.org/10.1016/j.biopha.2020.111156
在大鼠模型中,食盐摄入降低了鼠乳杆菌的丰度,并增加了促炎性脾Th17细胞数量。
反过来想,作为一种益生菌疗法,每天服用鼠乳杆菌可显著减少治疗大鼠的Th17细胞并改善血压。
另一项研究发现,8周的高盐摄入显著改变了小鼠的肠道微生物组成。结果显示,拟杆菌和变形杆菌分别显著减少50.53%和2.96%,厚壁菌显著增加42.77%。
同时,在高盐饮食喂养的小鼠中,发现下肠中的短链脂肪酸水平显著降低,这归因于细菌发酵受到抑制。
饮食中钠的适度减少可以增加循环中的短链脂肪酸,从而增加肠道微生物群。短链脂肪酸水平的增加反过来降低血压并改善动脉顺应性。
以上是高盐饮食带来的危害,然而最近的研究表明高盐饮食也有可能带来某些益处。
▸ 高盐饮食:介导NK细胞和肠道微生物群之间的相互作用,诱导有效的肿瘤免疫
发表在《Science Advances》的一项研究报道了高盐饮食通过抑制PD-1表达,同时增强IFNγ和血清马尿酸水平,诱导自然杀伤(NK)细胞介导的肿瘤免疫。盐与次优剂量的抗PD1抗体联合使用可增强肿瘤免疫。
虽然高盐饮食诱导的肿瘤免疫随着肠道微生物群的减少而减弱,但高盐饮食小鼠的粪便微生物群移植恢复了与NK细胞功能相关的肿瘤免疫。
高盐饮食增加了双歧杆菌的数量,并导致肠道通透性增加,导致双歧杆菌在肿瘤内定位,从而增强NK细胞功能和肿瘤消退。瘤内注射双歧杆菌激活NK细胞,抑制肿瘤生长。
这些结果表明,高盐饮食通过潜在的平移作用调节肠道微生物组,诱导NK细胞依赖性肿瘤免疫。
▸ 高盐饮食:抵消高米饭饮食带来的肥胖影响
一项研究发现,高盐摄入可改善与大米饮食相关的代谢变化,包括粪便微生物群组成的变化。
研究将小鼠分为三组(n = 9),分别喂食正常饮食(ND)、高米饭饮食(HRD)、补充高盐(HRS)的高米饭饮食12周。
与正常饮食的小鼠相比,喂食高米饭饮食的小鼠厚壁菌门与拟杆菌门的比率(p < 0.01)和变形菌门与拟杆菌门的比率(p <0.001)显着增加。然而,高盐摄入减弱了这些影响,尽管变形杆菌的比例没有减少。
高盐摄入降低了高米饭饮食引起的体质量和白色脂肪组织重量的增加。另外,高盐饮食并没有逆转葡萄糖耐量和胰岛素抵抗的增加。
高盐饮食改变了高米饭诱导的微生物组成,高盐饮食调节高米饭饮食诱导的PPAR-γ和脂质代谢相关蛋白表达的增加。
注:PPAR-γ——过氧化物酶体增殖物激活受体-γ
此外,在白色脂肪组织中,高盐饮食可以逆转高米饭饮食诱导的脂联素的减少和PPAR-γ表达的增加。在体外,高氯化钠浓度也显著降低了3T3-L1细胞的分化和调节脂质代谢,而不会引起细胞毒性。
▸ 适度增加盐摄入量对中枢神经系统自身免疫病具有多方面和潜在的有益影响
研究人员用自发 EAE 小鼠模型评估了高盐饮食对启动中枢神经系统自身免疫所必需的早期致病事件的影响。
高盐饮食消耗增加了糖皮质激素皮质酮的循环血清水平。皮质酮增强了脑内皮细胞上紧密连接分子的表达,促进了血脑屏障 (BBB) 的收紧,从而控制了炎症性 T 细胞进入中枢神经系统。
注:需要进一步的研究来证实以上结果,以确保高盐摄入不会加剧高碳水化合物饮食引起的代谢紊乱。
以上高盐饮食带来的益处尚处于动物模型研究阶段,不宜擅自应用在个人健康。
调整烹调方法减少食盐摄入量应当注意烹饪时少放盐 , 控制烹调时和餐桌上的用盐,一家3口每日用盐不宜超过 250 克 , 也就是全家每日总共用一小汤勺(约8克 )。
大多数新鲜水果和蔬菜天然含钠量低。鲜肉比午餐肉、培根、热狗、香肠和火腿含钠量低。
习惯咸味的人, 为满足口感的需要,可在烹制菜肴肘放少许醋,提高菜肴的鲜香味,帮助自己适应少盐食物。
或者可以考虑有些时候用无盐香草和香料代替,例如迷迭香、百里香、大蒜粉,辣椒粉等。
还要注意减少酱菜 、 腌制食品以及其他咸食品的摄入量。
从燕麦粥到汤面到土豆,一切都可以以“速食”的形式获得。通常,这些速食食品比非速食食品含盐量高得多。例如,普通即食燕麦片含有近200毫克的盐。
例如,添加了盐的冷冻蔬菜可以在蒸或煮之前用漏勺冲洗一下。这个简单的步骤可以减少高达23%的盐量。
糖或甜味食物无处不在,很多人喜欢吃糖或者甜味食物,它在许多人心中占据重要的位置,甜食可能会唤起我们的舒适和美好的回忆。
然而需要注意的是,它让人上瘾的同时,可能会喂养有害菌,有害菌大量增殖的同时有益菌也在减少……
糖,正在悄悄地破坏着肠道菌群原有的平衡。

研究表明腹泻和某些糖的消化不良有关,患有乳糜泻、克罗恩病和慢性腹泻的人在肠道中产生异常高量的粘液,这阻碍了消化,阻止了这些淀粉和二糖的吸收。
糖摄入可能会扰乱微生物群的平衡,增加促炎性,降低调节上皮完整性和粘膜免疫的能力。
大量摄入添加糖和加工食品,包括典型的西方饮食,都会损害有益菌,使我们更容易受到有害物质的影响。
肠道内层很薄,没有肠道内有益菌产生的保护性粘膜层,一些东西会渗入血液中,这就会导致炎症。
也就是说,持续摄入过量糖可能会带来肠漏、慢性炎症增加和各种健康问题的风险。
身体无法分解和吸收的多余糖分将留在肠道中发酵。这种糖通过大肠的速度更慢,喂养了有害细菌和酵母,并导致气体的积累。这种气体会导致抽筋、痉挛和疼痛。
乳糖是牛奶中的糖分。当身体不能产生分解乳糖所需的酶时,就会发生乳糖不耐症,导致胀气、腹胀和其他消化不适。
同样,高果糖玉米糖浆会抑制消化,因为身体也不能分解它。果糖停留在肠道中,导致胃肠胀气和不适。
虽然吸收水分是大肠的主要工作,但糖可以将水分吸入大肠,或者至少阻止水分被正常吸收。这可能会导致腹胀或肠道沉重。
消化是由肝脏刺激的。果糖只能由肝脏处理,所以摄入的所有果糖都被一次性送到肝脏,使其超载并造成潜在的损害,进而损害消化。
果糖无法刺激胰岛素,而胰岛素又无法抑制“饥饿激素”。结果,饱腹荷尔蒙瘦素也没有被刺激,这导致吃得更多。
这就容易导致体重增加、腹部肥胖、胆固醇升高、血糖升高等各种代谢疾病。
而这些代谢疾病的发生离不开肠道菌群的运作,接下来我们来了解一下,糖是如何通过影响肠道菌群,从而引发代谢疾病的?
糖通过影响肠道菌群引发代谢疾病的机制
一项新的研究发表在8月29日在线出版的《细胞》杂志上,科学家们发现:
糖可能会破坏肠道菌群,从而耗尽关键的免疫细胞,导致肥胖等代谢综合征。
简单来说高糖饮食带来的影响如下:
高糖饮食
↓↓↓
刺激Faecalibaculum rodentium 的生长
↓↓↓
挤走了特定菌群SFB, SFB丢失
↓↓↓
改变了吸收膳食脂肪的方式
↓↓↓
出现“代谢综合征”的特征
注:SFB是小鼠肠道中的特定细菌,即分段丝状细菌。
我们来看下研究过程:
研究人员给小鼠喂食含蔗糖和麦芽糊精的高糖饮食,高糖饮食刺激了Faecalibaculum rodentium的生长,这种细菌基本上挤走了SFB。SFB的突然丢失在小鼠肠道内引发了连锁反应,最终改变了动物吸收膳食脂肪的方式。
吸收脂肪的改变导致小鼠肥胖,并出现“代谢综合征”的特征。代谢综合征如高血压、高血糖和胰岛素抵抗,共同增加了患心脏病、中风和2型糖尿病的风险。
也就是说:SFB在某种程度上可以防止代谢综合征和过度体重增加。那么,SFB是如何发挥作用的?
研究发现,随着小鼠逐渐失去SFB,它们的Th17细胞总数也下降,体重增加,出现胰岛素抵抗和葡萄糖不耐症等代谢综合征的症状。
这里不得不提一下,该过程中重要的细胞——Th17.
SFB会与免疫系统进行“对话”,促进产生一种特定类型的免疫细胞——Th17。
可以这么说,Th17细胞是一种保护小鼠免受代谢疾病影响的“盔甲”。
这些免疫细胞释放影响肠壁的蛋白质,防止多余脂肪被组织吸收进入血液。这些免疫细胞产生的分子可以减缓肠道对‘坏’脂质的吸收,并减少肠道炎症。也就是说,它们保持肠道健康,保护身体不吸收致病的脂质。
当喂食高脂肪、高糖饮食时,小鼠肠道中的Th17细胞发生了什么变化?
小鼠迅速发展出代谢疾病的几个特征(体重增加、葡萄糖不耐受),并显示出肠道Th17细胞的减少。
更具体地说,研究人员发现Th17水平的下降是由于饮食诱导的肠道微生物群的变化。已知促进Th17的细菌被其他种类的肠道细菌所取代。尤其是糖似乎增加了有害菌的数量,最终降低了Th17的水平。
也就是说,糖通过干扰微生物组分间接破坏了这种盔甲。
研究人员认为,只要动物保持高水平的诱导Th17的肠道细菌,高脂饮食就不会导致负面的代谢效应。
doi.org/10.1016/j.cell.2022.08.005
如果没有健康的肠道菌群,减糖也不能避免疾病
在另一个实验中,研究小组从一组小鼠中去除了SFB,然后喂它们无糖、高脂肪的饮食,发现这些小鼠尽管没有吃糖,但体重也增加了,并患有代谢疾病。那么,是什么导致体重增加呢?
本质上,如果没有健康的肠道菌群,小鼠就不会产生足够的Th17细胞,因此也就缺乏前面所说的“盔甲”。
研究小组发现可以通过两种方式提供这种盔甲:
这表明,如果小鼠的肠道中已经耗尽了SFB,那么减少糖的摄入并不能帮助小鼠避免代谢疾病。
如果把这一发现放到人类身上,那就意味着如果一个人的肠道微生物群已经被破坏,那么减少摄入糖不一定会有帮助。
我们可以想象,一些流行的饮食干预,如尽量减少糖,可能只对微生物群中有某些细菌种群的人有效。
研究人员说,可能需要额外的干预措施来恢复这些人的肠道细菌或Th17细胞。
当然也需要更多的研究来了解类似的机制是否在人体肠道中起作用。
通过以上研究,我们可以大致了解糖对肠道菌群的影响,及带来的危害,因此,一定程度上减少糖的摄入会带来好处。
重新控制饮食习惯,试着对糖说不
当对糖强烈的渴望袭来时,试着忽略它,深呼吸几次,然后问自己:

意识到微生物只是利用你来喂养它自己,是很好的第一步,也就是重新控制饮食习惯。
当你减少糖的摄入量时,这些以糖为食的微生物会进入饥饿模式,与此同时,你对糖的渴望会变得更加强烈,可能会“说服自己”去得到它。

编辑
识别糖的触发因素
有时候会在特定的情况下渴望吃糖。
想想上一次吃甜食是什么时候,是感到有压力吗?疲劳?抑郁?焦虑?压抑?紧张?……
可以把这些糖分触发因素想象成某个按钮。这个按钮一触碰就想吃甜食类食物,每个人的按钮可能不一样,有些人是焦虑,有些人是疲劳…
了解属于你自己的糖分触发因素,会帮助你在渴望到来时安然度过。有意识地关注你的渴望,是减少 对甜食不受控的一个强有力的方法。
喂养健康的肠道细菌
相对较为健康的做法是多吃真正的食物,并在饮食中加入更多的植物,来自植物的益生元可以喂养我们的微生物群,例如:
菊苣、朝鲜蓟、蒲公英嫩叶、芦笋、大蒜、洋葱、苹果、浆果类、香蕉、菠菜、羽衣甘蓝、胡萝卜、番茄、山药、黄瓜、芝麻菜等。
酸奶、泡菜、味噌、开菲尔、康普茶等。
尽可能避免加工和包装食品、含糖食物、酗酒等。
养成良好的生活方式
研究表明,如果你在吃饭时看电视或刷手机看各类小视频等,可能会吃得更快,嚼得更少,吃得更多。
吃饭时,试着把手机放在一边,关掉电视,有意识地彻底咀嚼每一口食物,并真正品尝味道,可能会吃的更少,消化更好。
看到一些新闻或对即将截止的工作任务感到压力,你会很难从膳食中吸收营养。因此,坐下来吃饭之前,试着深呼吸让自己平静下来。
其他还包括:适当运动、规律作息、保持充足的睡眠、适量沐浴阳光,保持良好的心情等方式。
扩展阅读:
菌群多样性是如何形成的,与健康的关系,如何改善?
20种有效改善肠道健康的科学方法
此外,减少糖的摄入并不意味着转向人工甜味剂。经常食用人工甜味剂可能会对微生物群产生负面影响,导致代谢紊乱和肥胖。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
现代人的嗜辣程度日益走高,很多人已经到了无辣不欢的境界。
「辣」准确地说并不是一种味觉,可以说是痛觉,是舌、口腔和鼻腔粘膜受到刺激产生的辛辣、刺痛、灼热的感觉。
「辣」让人一边痛不欲生,一边欲罢不能。
「辣」对身体的影响褒贬不一。有人说吃辣上火,腹泻,长痘痘;有人说吃辣抗氧化,助消化,降胆固醇…

辣椒素的吸收部位:
辣椒素在胃和小肠上部被被动吸收的效率超过80%。
吃辣的健康益处
• 支持正常的血液循环,有利于心血管健康,以及降低患心脏病的风险。
• 促进新陈代谢和脂肪燃烧。一些研究表明,随着时间的推移,食用辛辣食物与体重增加较少之间存在联系,因为辛辣香料可能会增加卡路里燃烧。
• 增强消化健康,支持肠道微生物群中的有益菌生长。
• 提供抗氧化剂,包括抗氧化应激的酚类化合物。
• 减少炎症,包括胃肠道,以及影响关节和动脉的炎症。
• 通过表现出抗菌活性来支持免疫功能。
• 可能降低慢性病风险,包括高血压、高低密度脂蛋白胆固醇、二型糖尿病、心脏病和中风。
• 降低某些癌症的风险,包括食道癌和直肠癌等。
• 潜在地降低了过早死亡的风险。在一项研究中,与每周吃少于一次辛辣食物的成年人相比,那些每周吃六到七天辛辣食物的人受益于降低14%的风险总死亡率。
……
看到这里全是吃辣的益处,是不是想赶紧吃吃吃,先别急,这也要看辣的程度。
辣椒素(CAP)是辣椒的主要辛辣成分。
接下来我们来了解一下,不同剂量的辣椒素引起的肠道菌群变化,以及肠道菌群在辣椒素对抗疾病(肥胖,糖尿病等)中的作用。
一项研究评估了辣椒素对胃肠道健康的影响,并研究辣椒素是否调节短链脂肪酸和肠道微生物群的组成。
以40、60和80 mg/kg的剂量给小鼠施用辣椒素。
高剂量的辣椒素会损害胃肠道组织
对照组小鼠的结肠组织显示出丰富的杯状细胞和具有整齐绒毛的健康隐窝结构;
而辣椒素干预组小鼠显示出炎性细胞浸润,以及隐窝和杯状细胞的丧失。
与对照组中的小鼠相比,用60 mg/kg 辣椒素处理的小鼠显示出产生粘液的杯状细胞的损失;
在80 mg/kg 辣椒素处理的小鼠中,炎症细胞浸润明显。
doi.org/10.3390/foods11050686
辣椒素引起的炎症反应,与剂量有关
辣椒素影响胃和回肠中的抗炎细胞因子水平,但不会导致严重的炎症损伤
炎症反应与胃肠道损伤密切相关。研究表明,辣椒素诱导小鼠胃肠道炎症的主要特征是炎症细胞因子水平升高,尤其是IL-10、IL-1β和TNF-α。
注:IL-10是一种关键的细胞因子,可以减少炎症介质的释放,并显示抗炎特性。
IL-1β和TNF-α是引起粘膜炎症和肠屏障损伤的重要促炎细胞因子。
高剂量辣椒素可能导致空肠和结肠的炎症损伤
结果表明,80 mg/kg 辣椒素干预组可导致所有胃肠组织中IL-10水平降低,空肠和结肠中IL-1β和TNF-α水平升高。
多样性下降
与对照组相比,40 mg/kg 辣椒素组的香浓指数显著下降(p<0.001),Chao1指数略有下降。同时,与对照组相比,60 mg/kg辣椒素组显著降低了Chao1指数。
使用加权UniFrac距离的PCoA测量β多样性,揭示了对照组和不同剂量辣椒素组之间的不同菌群。
在门的水平上,对照组小鼠中:
与对照组相比,40 mg/kg 辣椒素干预显著降低了拟杆菌的丰度至34.17%,但增加了厚壁菌的丰度(56.64%)(p<0.0001)。
80 mg/kg的辣椒素干预显著降低了拟杆菌的相对丰度,增加了放线菌和变形杆菌的丰度。
变形杆菌的存在是肠道微生物群稳态失衡的标志,与腹泻症状和炎症密切相关。
辣椒组的优势细菌标记物
对照组、40、60和 80mg/kg 辣椒素干预组中分别发现了优势细菌标记物。
差异最大的属包括丁酸杆菌属、乳杆菌属、粪杆菌属、科氏杆菌属_UCG_002、双歧杆菌属、Rikenellaceae_RC9_肠组、拟杆菌属、Alistites属和Dubosiella属。
高剂量增加了:双歧杆菌和粪杆菌的比例
对具有显著差异的选定属的相对丰度进行了分析,表明辣椒素处理以剂量依赖的方式增加了双歧杆菌和粪杆菌的比例,但仅在80 mg/kg 辣椒素干预组中显示出显著变化。
Faecalibacterium被认为是胃肠道疾病的生物指示剂,并与丁酸生成呈正相关。这可能是60和80 mg/kg 辣椒素组小鼠盲肠丁酸水平显著升高的原因。
在辣椒素干预组中,尤其是在40 mg/kg 辣椒素干预的组中,乳酸杆菌和Alistites的相对丰度显著降低。
与对照组相比,40 mg/kg 辣椒素干预显著提高了Dubosiella的比例,但减少了拟杆菌、丁酸单胞菌和Rikenellaceae_RC9_gut_group的丰度。
注:有研究曾报道,Dubosiella可以抑制小鼠的肥胖。
80 mg/kg 辣椒素干预后:Coriobacteriaceae_UCG_002的丰度增加。
注:Coriobacteriaceae_UCG_002可以通过产生必需氨基酸和发酵膳食蛋白而对宿主有利。
辣椒素的抗肥胖作用
辣椒素已被证明能够引起饱腹感,减少热量摄入,增加能量消耗,并增强脂肪氧化,这反过来可能导致体重减轻。
厚壁菌/拟杆菌 ↑↑↑↑
大量研究表明,在以辣椒素作为补充的高脂肪诱导小鼠模型中,厚壁菌/拟杆菌的比率会更高。
发现肠道菌群失调可减少拟杆菌,并增强在肥胖人类和动物肠道中观察到的分泌革兰氏阴性病原体的厚壁菌和脂多糖。
AKK菌 ↑↑↑
最近,还研究了辣椒素的抗肥胖作用,与肠道微生物群的变化、喂食高脂肪辣椒素小鼠中变形菌门的减少以及对宿主新陈代谢有益的粘液降解细菌Akkermansia muciniphila 的高丰度有关。
Faecalibacteria ↑↑↑
辣椒素对肠道和微生物群有消炎作用。辣椒素可以增加Faecalibacteria,从而有助于防止肥胖,调节血糖水平,防止肠道炎症。
产丁酸菌 ↑↑↑
此外,饮食中的辣椒素可以诱导产生丁酸盐的瘤胃球菌科和拉氏螺旋菌科的水平增加,但也可以刺激盲肠产丁酸细菌和丁酸盐水平的升高,以抑制结肠CB1受体,并减少LPS的生物合成。
注:丁酸盐的好处:保护肠道内壁,有助于肠漏的愈合,保护大脑和神经系统,它能增强免疫系统,更有效地对抗感染。
刺激微生物群减少饥饿激素——饥饿素
胃内产生的一种肽被称为“饥饿激素”.它是肠道在肠道微生物的帮助下产生的一种激素。它不仅能影响食欲,还能促进身体储存脂肪的能力。
辣椒素通过刺激微生物群向身体发送信号,告诉它减少饥饿素,从而帮助你控制饥饿。
综上所述,辣椒素是一种有效的抗肥胖化合物。补充后,它会激活肠道内的某些受体,称为TRPV1受体。一旦打开,这些受体向身体发送信号,告诉身体增加肠道菌群Akkermansia muciniphila。更高比例的Akk菌促进减肥和调节血糖水平,因此有助于控制糖尿病和肥胖症。
辣椒素抗糖尿病作用
大量体内和体外研究表明,辣椒素在改善葡萄糖代谢方面发挥着重要作用。早些时候已经证明,在糖尿病大鼠中,系统性辣椒素激活可导致辣椒素敏感细胞变性和葡萄糖诱发胰岛素分泌的长期变化。
补充辣椒素(100 mg/kg)的雄性肥胖Zucker大鼠的血浆CGRP水平升高,同时通过辣椒素诱导的感觉神经脱敏改善糖耐量。
新生辣椒素治疗SD大鼠(50 mg/kg)胰岛素介导的糖代谢增加,通过辣椒素诱导的含有神经肽的感觉神经增强体内胰岛素敏感性。
患有糖尿病的雄性Wistar大鼠以1 mg/kg·天的剂量长期服用辣椒素8周,表明辣椒素具有利尿作用,并增加了尿液表皮生长因子水平。含有高酚和辣椒素含量的红辣椒茎(9.7 mg/g,DW)具有较强的α-淀粉酶和α-葡萄糖苷酶抑制作用。
所有这些发现表明,辣椒素敏感结构一定参与了调节胰岛素分泌和血糖。
一项随机双盲临床试验表明,含有辣椒素的辣椒补充剂(5 mg/d辣椒素)定期改善妊娠期糖尿病妇女的餐后高血糖和高胰岛素血症以及空腹脂代谢紊乱。
膳食辣椒素通过对肠道微生物群的调节作用影响葡萄糖稳态和肥胖的拟议途径
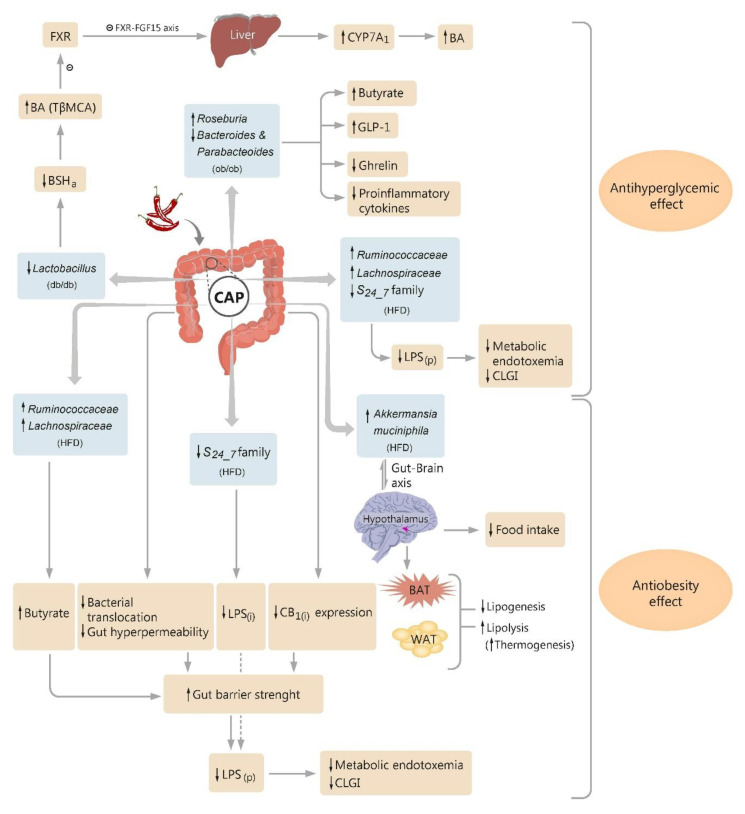
doi: 10.3390/molecules25235681
辣椒素可降低2型糖尿病小鼠体内乳酸杆菌的丰度(db/db),从而降低胆汁盐水解酶活性(BSHa),增加肠道中结合胆汁酸(BA)的水平,尤其是法尼样X受体(FXR)拮抗剂牛磺酸-β-鼠胆酸(TβMCA)。FXR信号发生改变,肠肝FXR-FGF15轴(FGF15成纤维细胞生长因子15)也受到抑制,导致胆固醇7α-羟化酶(CYP7A1)表达上调,肝BA合成增强。在肥胖糖尿病小鼠中,辣椒素增加Roseburia并抑制拟杆菌和副杆菌的丰度,随后粪便丁酸水平和血浆胰高血糖素样肽-1(GLP-1)增加,血浆总ghrelin和促炎细胞因子减少。
辣椒素通过调节肠-脑(下丘脑)轴,最终针对棕色脂肪组织、白色脂肪组织和小鼠食物摄入量,在高脂饮食喂养的小鼠中发挥抗肥胖作用。辣椒素减少了能够分泌LPS(i)(肠道细菌脂多糖)的革兰氏阴性病原体的数量,如S24_7科成员,并增加了高脂饮食小鼠中产丁酸菌的数量(例如,瘤胃球菌科和Lachnospiraceae),从而增加了粪便丁酸盐。辣椒素可减弱高脂饮食小鼠肠道通透性增加和细菌移位,并抑制肠道大麻素受体1型(CB1(i))的表达。
通过这些途径,辣椒素增加了这些肥胖小鼠的肠道屏障强度,同时减少了肠道菌群改变所产生的高水平LPS(i),从而降低了高水平血浆循环LPS.
TRPV1通道在感觉异常中起着核心作用,并在糖尿病动物模型中显示出高表达水平。
“恶性循环假说”指出,肥胖期间TRPV1对感觉神经的激活可能导致持续的神经肽物质P(SP)和CGRP释放,从而阻止胰岛素介导的葡萄糖摄取,最终导致代偿性高胰岛素血症(下图)。因为CGRP可以减少胰岛素分泌,而SP可以诱导胰岛素抵抗,它们会引发一个恶性循环,从而导致2型糖尿病发病。
而辣椒素作为一种TRPV1激动剂,可能会打破这种恶性循环,并有可能改善胰岛素分泌和胰岛素敏感性。
辣椒素抗肥胖、抗糖尿病和抗高血压的可能机制
doi.org/10.1080/10408398.2021.1884840
抗肥胖机制:
通过磷酸化激活AMPK抑制ACC,抑制ACC降低丙二酰辅酶a浓度,导致CPT-1抑制解除,脂肪酸(FA)氧化增加,减少肌肉内脂质堆积。此外,辣椒素(CAP)没有增加HFD喂养的动物中UCP3的表达,但增加了正常肌肉细胞中的表达,因此影响产热。此外,CAP可能增加PRDM-16的表达,并促进其与PPARγ的相互作用,以及增加PGC-1α的表达来触发BAT分化和WAT褐变,从而增加产热和能量消耗来对抗肥胖。
抗糖尿病机制:
TRPV1在感觉神经上的激活可能导致神经肽P物质(SP)和降钙素基因相关肽(CGRP)的持续释放,从而阻断胰岛素介导的葡萄糖摄取。
抗高血压机制:
CAP诱导TRPV1激活Ca2+内流和PKA介导的内皮一氧化氮合酶(eNOS)磷酸化。此外,通过CAP激活TRPV1,通过增加α-平滑肌肌动蛋白(α-SMA)和SM22α的表达,减少骨桥蛋白(OPN)的表达,抑制PI3K/Akt信号通路,抑制高血压期间血管平滑肌细胞(VSMC)的表型转化,从而减轻颅内小动脉重塑。
辣椒素抗高血压作用
几项动物研究显示了辣椒素或辣椒摄入量与高血压之间的密切关系。
辣椒素对体内血压影响的关键研究综述

doi.org/10.1080/10408398.2021.1884840
一项包含9273名健康成年人的横断面研究表明,女性参与者中高频率的辛辣食物消费与高血压的低风险显著相关,但男性参与者中没有。
在1991年至2011年的中国健康与营养调查中,一项对13670名20-75岁成年人的队列研究表明,每1000人中不食用辣椒或每天食用1-20、20.1-50、> 50.1克辣椒的高血压发病率分别为30.5、33.4、31.9和24.0,表明辣椒食用量与高血压风险呈负相关。
辣椒素抑制高血压的机制可能涉及一些关键酶和不同的信号通路。
包括通过TRPV1激活、PKA活性激活和eNOS磷酸化增加以及p38/MAPK途径释放血管舒张神经肽。此外,抑制PI3K/AKT途径,刺激尿钠排泄和利尿,ACE抑制活性和L型钙2+平滑肌细胞中的通道抑制也涉及抗高血压机制。
因此,食用辣椒素可能是一种潜在的抗高血压干预手段。
辣椒素在炎症性肠病中的作用
克罗恩病患者的回肠粘膜碎片显示,Faecalibacterium prausnitzii的丰度较低,这与6个月后内镜下复发有关。众所周知,Faecalibacterium prausnitzii具有抗炎特性,在外周血单核细胞培养物和结肠炎动物模型中,分别减少促炎细胞因子的产生,并增加抗炎细胞因子IL-10的分泌。
扩展阅读:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
富含 CAP 的饮食可能对克罗恩病产生有益的影响,因为它们会增加厚壁菌门/拟杆菌门的比例和粪杆菌的丰度,从而将免疫平衡改变为对食物抗原和共生细菌更具耐受性的状态。
辣椒素抗癌症作用
体外和体内研究表明辣椒素对不同种类的癌症具有抗癌作用,如胃癌、结肠癌、前列腺癌、胰腺癌、肺癌、乳腺癌、膀胱癌等。
辣椒素潜在的抗癌机制可能与其对肿瘤细胞凋亡、自噬和转移的影响有关。
辣椒素通过诱导凋亡和抑制血管生成来抑制各种永生化或恶性细胞系的生长。
辣椒素可以通过调节其广泛的分子靶标来调节细胞增殖和凋亡,这些分子靶标包括转录因子、生长因子及其受体、细胞因子、酶和基因。
除了细胞凋亡之外,辣椒素在防止体液细胞转移方面也起着重要的作用。
体内研究评估辣椒素在各种癌症中的抗癌机制

doi.org/10.1080/10408398.2021.1884840
总之,辣椒素的抗癌机制如下图,包括细胞凋亡的激活、细胞生长停滞、细胞自噬以及血管生成和转移的抑制。
辣椒素可能的抗癌作用机制:
因此,辣椒素有可能成为一种预防和治疗癌症的新疗法。
辣椒素抗癌的关键机制
doi.org/10.1080/10408398.2021.1884840
CAP通过抑制Akt/mTOR途径抑制Akt磷酸化并诱导自噬。此外,CAP可以增加磷酸酶和张力蛋白同源物(PTEN)的表达,导致己糖激酶-2(hk2)表达的减少,从而抑制肿瘤细胞糖酵解。此外,TPPV1激活了Ca2+内流可以激活MAPK,进而阻断Hedgehog通路,抑制细胞增殖。此外,细胞内GSH水平的降低可能导致ROS的增加,进而激活线粒体死亡途径。CAP可能上调促凋亡基因,包括Cyc、AIF、Bax和裂解的caspase-3和-9,同时下调抗凋亡基因BCl2。P38和JNK MAPK通路以及AMPK/p53通路的激活也参与诱导细胞周期阻滞和凋亡。此外,CAP通过AMPK-SIRT1和AMPK-IκBα信号通路抑制NF-κB p65,从而抑制肿瘤细胞的迁移和侵袭,并引起基质金属蛋白酶-9 (MMP-9)的下调。
辣椒素的认知干预作用
在动物研究中,辣椒素在认知功能中的作用是有争议的。一些研究表明辣椒素具有神经毒性。
然而,辣椒素也被证明对认知功能或老年痴呆症有积极作用。例如,已经证明辣椒素对大鼠大脑中应激诱导的阿尔茨海默样变化具有预防作用。
具体而言,辣椒素可以部分减轻冷水应激诱导的大鼠空间记忆保留缺陷、LTP抑制、树突形态异常和突触相关蛋白丢失。
此外,辣椒素可以降低含辣椒素的高脂饮食喂养的SD大鼠患阿尔茨海默的风险。
关于食用辣椒与认知功能之间关系的流行病学研究有限。
目前,一项针对338名40岁以上参与者的调查表明,高水平的辣椒素饮食可能对中老年人的认知功能和AD血清Aβ水平产生有利影响,中国健康与营养调查(CHNS)在4582名中国成年人中收集了15年的数据,这些数据支持辣椒摄入量与认知功能之间存在正相关。
研究表明,与非消费者相比,那些累积平均辣椒摄入量超过50克/天的人,其总体认知功能的回归系数(和95%CI)为−1.13 (−1.71至0.54),自报记忆力差和自报记忆能力下降的比值比(和95%CI)分别为2.12(1.63–2.77)和1.56(1.23–1.97).
与食物一起摄入的辣椒素可以通过胃肠道中的非主动过程被迅速吸收。在被运输到门静脉,然后进入人和啮齿动物的全身后,约5%的未改变的辣椒素穿过血脑屏障并进入脑组织。
辣椒素受体TRPV1被证实可增加海马胰岛素信号通路,从而抑制GSK-3β,防止ad相关的tau蛋白过度磷酸化。
此外,自噬在β-淀粉样蛋白的生成和代谢中也起着重要作用,tau的组装及其功能障碍可能导致阿尔茨海默病的进展。
总之,辣椒素可以通过抑制tau蛋白过度磷酸化来减轻阿尔茨海默样神经病理改变和认知障碍,这表明它可能是一种有前途的阿尔茨海默治疗干预方法。
扩展阅读:
阿尔茨海默病de饮食-微生物-脑轴
辣椒素抗抑郁作用
膳食辣椒素可改善LPS诱导的抑郁样行为小鼠的抑郁样行为,如厌恶刺激、快感缺失和绝望等得到缓解。
辣椒素可以恢复抑郁症相关微生物群的异常变化。特别是在属水平上,辣椒素增加了某些关键微生物的相对丰度,如瘤胃球菌、普雷沃菌、 Allobaculum, Sutterella, Oscillospira.
相关分析显示,微生物群落组成的变化与抑郁行为改善、5-HT下降和TNF-α水平密切相关。
注:5-HT是一种代表性的单胺类神经递质,涉及调节几种生理活动和行为,包括与情绪和焦虑有关的活动和行为,并且低水平的5-HT已被证明与抑郁有关。
这些结果表明,膳食辣椒素可以调节肠道菌群的结构和数量,并在预防抑郁方面发挥重要作用。
▸ 健康的辛辣食物有哪些?
▸ 什么人群不适合吃辣?
虽然辛辣食物不会引起溃疡,但在部分人中也会引发腹痛。
一项研究特别强调,经常食用辛辣食物会引发一些消化不良患者的上消化道症状。对于肠易激综合征(IBS)患者,辛辣食物也会引发症状。
对于炎症性肠病(或IBD-克罗恩病或溃疡性结肠炎)患者,辛辣食物也会引发一些症状。
如果患有肛裂,可能会感觉到烧灼感。一项研究表明,辛辣食物会加重与肛裂相关的症状。
其他患胃酸倒流、胃灼热、腹泻、胃痛、怀孕期间的晨吐或恶心等人群,则需注意谨慎吃辣。
▸ 准备辣椒食物要注意什么?
准备辣椒时要戴手套,或者至少处理完后要彻底洗手。
保护眼睛和其他敏感区域。切辣椒时考虑戴眼镜。洗手前不要揉眼睛、鼻子或嘴巴等部位。
▸ 如何适应辛辣食物?
从微辣的食物开始,每周吃点辣的,舌头会慢慢习惯这种感觉,身体就像对酒精和咖啡因产生耐受性一样,慢慢也会对辣椒素产生耐受性。
▸ 一不小心吃太多辣如何缓解?
——牛奶或酸性饮料中和辣
辣的受不了的时候,可以喝点牛奶缓解,牛奶中的脂肪和蛋白质会中和食物中的香料,如果没有牛奶,可以喝冰水或酸性饮料。
普通的一杯水不会对解辣有帮助,因为水会将辣椒素扩散到嘴里,而柠檬水、橙汁或葡萄汁之类的酸性饮品都可以。
——不同质地的食物分散注意力
不同食物的质地可能会分散你对辣的注意力,吃口卷饼、饼干、面包丁之类的固体食物,它们本身其实并不能对抗辣椒素,但会给舌头一些不同的东西来关注。
——碳水化合物有助于吸收辣椒素
淀粉类碳水化合物会形成一道屏障,使辣椒素更难进入味蕾。
——吃饭的时候用嘴呼吸
每一口之间,慢慢呼气,把辣吹走,让嘴冷却下来。如果真的很痛,想象自己真的把辣椒片吹向空中,可能有助于减轻压力。
——提前吃点抗酸剂来防止胃不舒服
可以提前吃点抗酸剂或吃点小零食,比如三明治或土豆泥来填饱肚子,让辣椒素进入肠道后有所保留。注意不要过量使用抗酸剂,吃太多会扰乱胃产生酸的方式。
——记住熬过15分钟
辛辣食物的辣劲儿只需要15分钟就可以消散。如果感觉嘴巴着火一样,只要提醒自己这种感觉不会永远持续下去,不用害怕。
主要参考文献:
Naqvi S, Asar TO, Kumar V, Al-Abbasi FA, Alhayyani S, Kamal MA, Anwar F. A cross-talk between gut microbiome, salt and hypertension. Biomed Pharmacother. 2021 Feb;134:111156. doi: 10.1016/j.biopha.2020.111156. Epub 2021 Jan 2. PMID: 33401080.
Do MH, Lee HB, Oh MJ, Jhun H, Ha SK, Park HY. Consumption of salt leads to ameliorate symptoms of metabolic disorder and change of gut microbiota. Eur J Nutr. 2020 Dec;59(8):3779-3790. doi: 10.1007/s00394-020-02209-0. Epub 2020 Mar 3. PMID: 32125529.
Czesnikiewicz-Guzik M, Müller DN. Scientists on the Spot: Salt, the microbiome, and cardiovascular diseases. Cardiovasc Res. 2018 Aug 1;114(10):e72-e73. doi: 10.1093/cvr/cvy171. PMID: 30052920.
Na SY, Janakiraman M, Leliavski A, Krishnamoorthy G. High-salt diet suppresses autoimmune demyelination by regulating the blood-brain barrier permeability. Proc Natl Acad Sci U S A. 2021 Mar 23;118(12):e2025944118. doi: 10.1073/pnas.2025944118. PMID: 33723078; PMCID: PMC7999868.
National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division; Food and Nutrition Board; Committee to Review the Dietary Reference Intakes for Sodium and Potassium. Dietary Reference Intakes for Sodium and Potassium. Oria M, Harrison M, Stallings VA, editors. Washington (DC): National Academies Press (US); 2019 Mar 5. PMID: 30844154.
Ma Y, He FJ, Sun Q, Yuan C, Kieneker LM, Curhan GC, MacGregor GA, Bakker SJL, Campbell NRC, Wang M, Rimm EB, Manson JE, Willett WC, Hofman A, Gansevoort RT, Cook NR, Hu FB. 24-Hour Urinary Sodium and Potassium Excretion and Cardiovascular Risk. N Engl J Med. 2022 Jan 20;386(3):252-263. doi: 10.1056/NEJMoa2109794. Epub 2021 Nov 13. PMID: 34767706; PMCID: PMC9153854.
Rizvi ZA, Dalal R, Sadhu S, Kumar Y, Kumar S, Gupta SK, Tripathy MR, Rathore DK, Awasthi A. High-salt diet mediates interplay between NK cells and gut microbiota to induce potent tumor immunity. Sci Adv. 2021 Sep 10;7(37):eabg5016. doi: 10.1126/sciadv.abg5016. Epub 2021 Sep 10. PMID: 34516769; PMCID: PMC8442882.
Kawano Y, Edwards M, Huang Y, Bilate AM, Araujo LP, Tanoue T, Atarashi K, Ladinsky MS, Reiner SL, Wang HH, Mucida D, Honda K, Ivanov II. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome. Cell. 2022 Sep 15;185(19):3501-3519.e20. doi: 10.1016/j.cell.2022.08.005. Epub 2022 Aug 29. PMID: 36041436.
Xia J, Gu L, Guo Y, Feng H, Chen S, Jurat J, Fu W, Zhang D. Gut Microbiota Mediates the Preventive Effects of Dietary Capsaicin Against Depression-Like Behavior Induced by Lipopolysaccharide in Mice. Front Cell Infect Microbiol. 2021 Apr 27;11:627608. doi: 10.3389/fcimb.2021.627608. PMID: 33987106; PMCID: PMC8110911.
Wang F, Xue Y, Fu L, Wang Y, He M, Zhao L, Liao X. Extraction, purification, bioactivity and pharmacological effects of capsaicin: a review. Crit Rev Food Sci Nutr. 2022;62(19):5322-5348. doi: 10.1080/10408398.2021.1884840. Epub 2021 Feb 16. PMID: 33591238.
Xiang Q, Tang X, Cui S, Zhang Q, Liu X, Zhao J, Zhang H, Mao B, Chen W. Capsaicin, the Spicy Ingredient of Chili Peppers: Effects on Gastrointestinal Tract and Composition of Gut Microbiota at Various Dosages. Foods. 2022 Feb 25;11(5):686. doi: 10.3390/foods11050686. PMID: 35267319; PMCID: PMC8909049.