 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
幽门螺杆菌(helicobacterpylori,H.pylori)是一种独特的,能持续定植于人类胃粘膜并能引起胃感染的细菌。
幽门螺杆菌是革兰氏阴性,螺旋形,微需氧细菌,定居于人类胃粘膜中。世界上有超过一半的人感染了幽门螺杆菌,但很多没有临床症状。幽门螺杆菌及其患病率在某些人群中高达80%。
据推测,幽门螺杆菌可能是人类土著微生物组的一部分,它与人类宿主之间有着很复杂的关系。
本文主要讨论幽门螺杆菌是如何与人类共同进化的,可能的机制可以解释基于人群的研究中幽门螺杆菌感染与几种疾病的发展之间的正相关性和负相关性,以及炎症和/或微生物组的变化是如何联系的各自的结果。
大多数幽门螺杆菌感染者并没有明显症状,但当症状出现时,一般是以下几种:
恶心,胃痛或胃灼热,空腹时腹部疼痛加剧。
怎样的情况有可能感染此菌?
幽门螺杆菌可能通过接触感染者的唾液、呕吐物或粪便传播,食用受污染的食物或水也会感染。
大多数感染幽门螺杆菌的人都是在儿童时期感染的。
有些因素可能会增加感染幽门螺杆菌的风险:
比如在拥挤的空间生活,没有干净的水,和患有幽门螺杆菌的人一起生活等。
什么情况下需要看医生?
当感觉有不寻常的胃痛或不适时,尤其是持续或反复发作的胃痛;
吞咽困难;
血腥,黑色或柏油样的粪便;
呕吐物带血或看起来像咖啡渣;
…
以上情况,最好去看医生。
( 如自行随意服用抗生素,效果不好的同时很可能带来抗生素耐药 )
如何诊断幽门螺杆菌?
目前最常见也实惠的方法是呼气检测,从分析到出结果只需数分钟,简单准确。
胃镜检查:做胃镜检查也包括幽门螺杆菌检测,因为可以取到胃里活性组织做病理切片检查。
抗体检查:通过抽血检查,以确定是否感染过幽门螺杆菌以及目前处于感染状态。
幽门螺杆菌会导致并发症?
包括溃疡,胃炎和胃癌。
溃疡约有10%的幽门螺杆菌患者会发展为胃溃疡(疼痛)。当幽门螺杆菌破坏保护胃和小肠内壁的粘膜时,就会发生这种情况,胃酸会渗透到衬里并造成伤害。
幽门螺杆菌可导致90%以上的肠道溃疡和80%的胃溃疡。
溃疡本身也会导致严重的并发症:
• 内部出血胃酸或溃疡渗入血管可能导致出血。
•阻塞溃疡会阻止食物离开您的胃。
•穿孔溃疡可能会深入并穿透胃或肠壁。
•腹膜炎 当溃疡引起感染或发炎时,可能发生腹膜炎症(腹膜)。
胃炎胃炎是胃黏膜炎症。幽门螺杆菌是处于患有这种病症的风险增加。
如果不治疗胃炎,可能会导致严重失血,并可能增加患胃癌的风险。胃癌是世界上与癌症相关的死亡的第二大最常见原因。
此外,幽门螺杆菌感染还与其他疾病有关,例如缺血性心脏病,2型糖尿病,贫血,肥胖受试者的不良代谢特征和胰岛素抵抗等。
幽门螺杆菌(Hp)感染会在胃微环境中产生剧烈变化,进而影响胃微生物群组成,并可能与肠道微生物群变化有关。可能会触发肠道共生稳态的重大改变,从而出现新的胃肠道平衡。
同时,用于根除幽门螺杆菌的治疗策略可以调节这种生理共生,但也可能相反,受到其特性的影响。感染,饮食,抗生素和/或生活方式会干扰这种共生关系。
幽门螺杆菌感染对胃微生物群的干扰
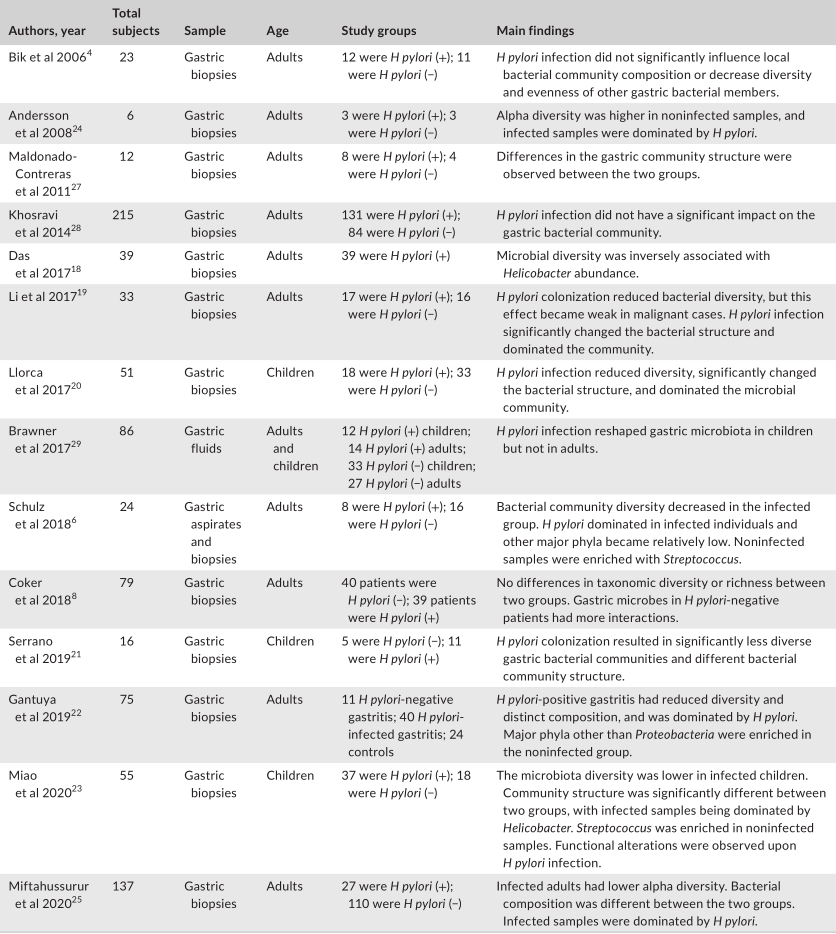
下一代测序对胃液和活检标本中的人体胃微生物群进行了研究,结果表明胃中存在多种细菌类群,主要由五个门组成,包括放线菌门、拟杆菌门、厚壁菌门、梭菌门和变形菌门。幽门螺杆菌感染极大地改变了胃微生物群的特征。
一项初步研究报道,幽门螺杆菌定植改变了胃微生物群,降低了微生物多样性,根除幽门螺杆菌可以恢复微生物多样性。
幽门螺杆菌可以利用几种机制来调节胃微环境。通过干扰质子泵的表达,幽门螺杆菌可以调节胃腔的酸度,从而使微环境与通常不能在胃中生长的微生物相容。
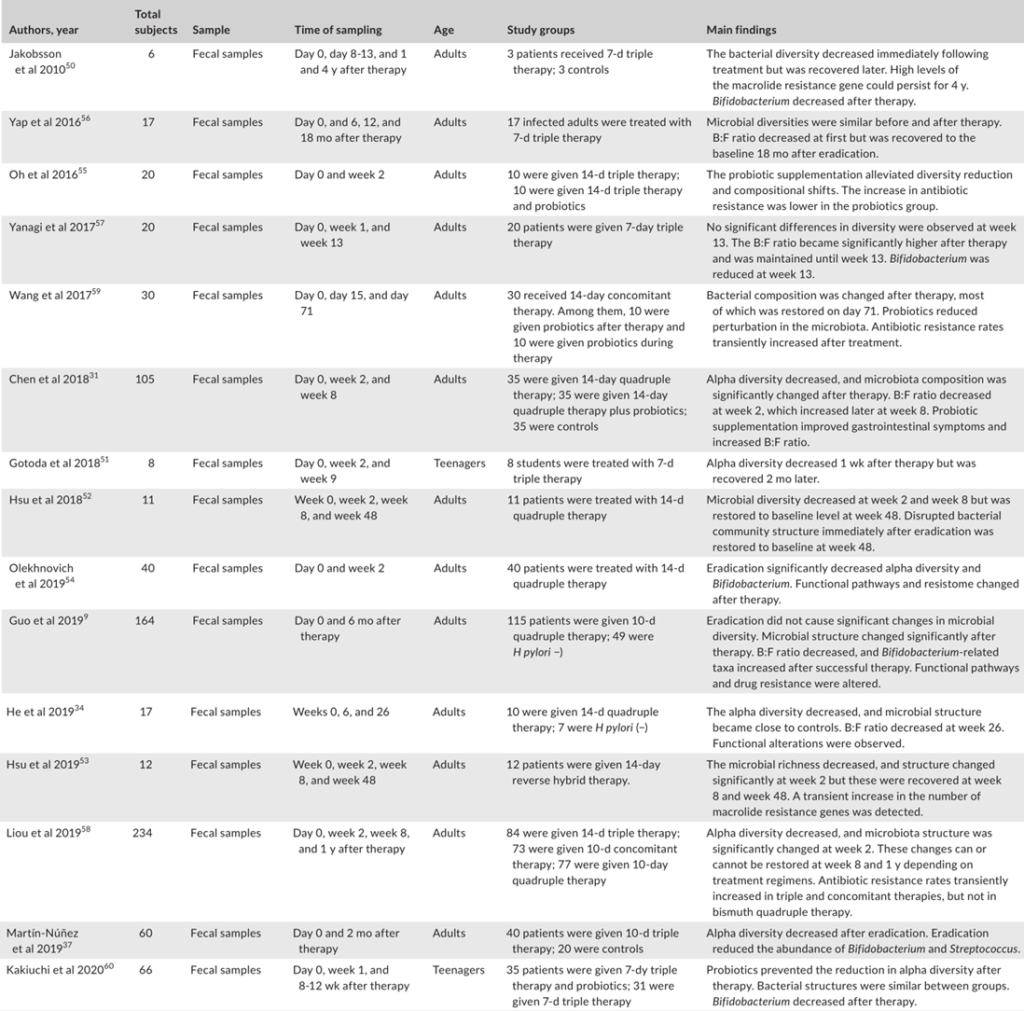
评估幽门螺杆菌感染对胃微生物群影响的研究
Tao et al., Helicobacter, 2020
此外,由于幽门螺杆菌的存在而改变的免疫反应可能会影响其他微生物群。幽门螺杆菌还可能通过动员抗菌肽或通过营养竞争来改变其他微生物群的生长。一般来说,研究人员表明,幽门螺杆菌的定植与α多样性的显著降低有关。微生物多样性和幽门螺杆菌丰度之间存在反比关系。
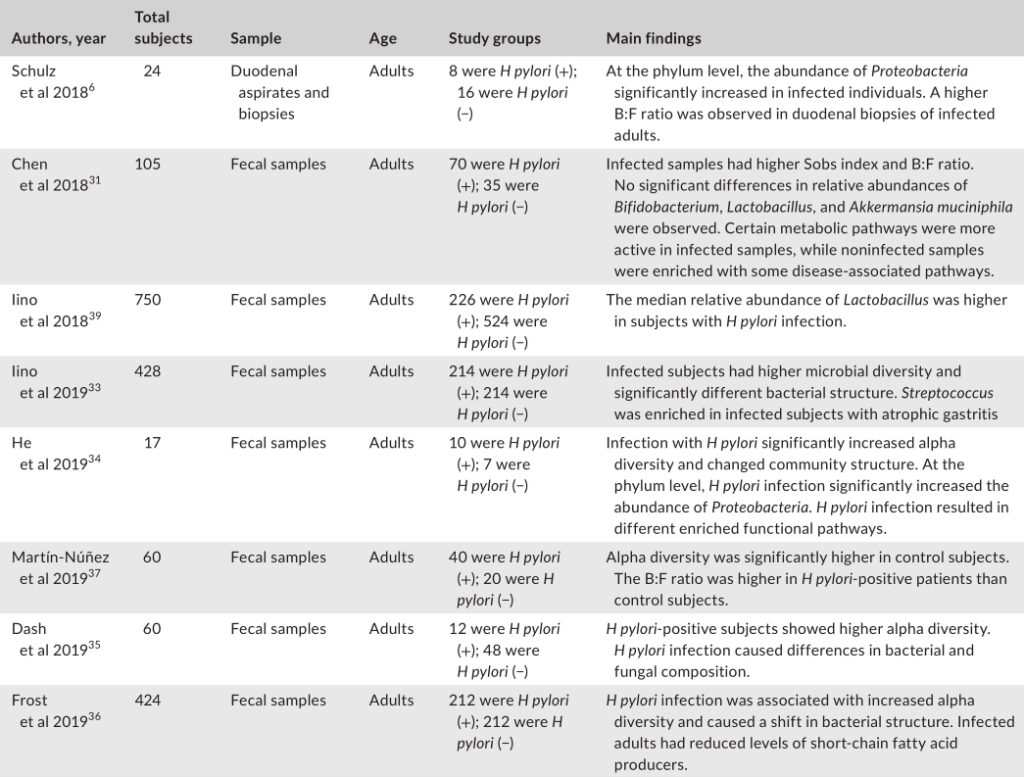
幽门螺杆菌感染对肠道微生物群的影响
与幽门螺杆菌阴性对照组相比,胃内有大量幽门螺杆菌的个体具有不同的肠道菌群,这表明胃肠段之间存在相互作用。
大多数研究表明,幽门螺杆菌感染与肠道微生物多样性之间的呈正相关。由于较高的微生物多样性通常与总体较好的健康状况有关,因此,探讨幽门螺杆菌感染后肠道微生物多样性的增加是否对宿主有一些有益的影响将是一个有趣的问题。
幽门螺杆菌感染对肠道微生物群影响的研究分析
Tao et al., Helicobacter, 2020
幽门螺杆菌感染组和阴性对照组的微生物群落结构存在显著差异。
在门水平上的成分分析发现,受感染个体中变形菌的丰度显著增加,这可能是由于幽门螺杆菌从胃转移到肠腔所致。值得注意的是,拟杆菌与厚壁菌(B:F)的比率在幽门螺杆菌阳性组中更高。改变的B:F比值与临床相关,因为发现厚壁菌和拟杆菌与宿主的脂质代谢和能量平衡有关。
受感染与没感染组相比,双歧杆菌、乳酸杆菌和嗜粘液阿克曼菌的丰度没有显著差异。其他研究人员发现,幽门螺杆菌感染者体内乳酸杆菌的丰度更高。
一项研究发现,在幽门螺杆菌感染的患者中,萎缩性胃炎患者的肠道微生物群中链球菌更为丰富。
另一项研究发现,幽门螺杆菌感染的个体表现出短链脂肪酸(SCFA)产生者(如丁酸盐)水平的下降,SCFA对宿主产生有益的代谢作用。
此外,鉴于SCFAs受体在免疫细胞中的普遍表达,这些代谢物被认为在调节肠道内稳态中发挥重要作用。因此,幽门螺杆菌感染时抑制SCFAs的输出可能对人类健康有害。
有功能分析指出,在幽门螺杆菌阴性人群中,疾病相关途径更活跃。相比之下,许多代谢途径在感染的患者中的比例过高。因此,微生物群中的功能变化可能是特定于部位的,因为在肠道中观察到的变化与在胃中观察到的变化呈现不同的趋势。
根除疗法对胃微生物群的影响
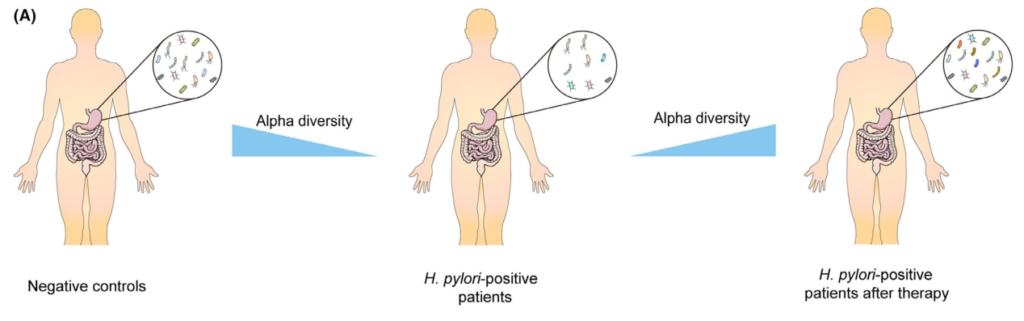
Tao et al., Helicobacter, 2020
充分的证据表明,成功清除幽门螺杆菌后,胃微生物多样性显著增加,但显示治疗失败后没有改善。研究人员认为恢复可能需要一定的时间,因为他们认为多样性从第0周到第6周和第26周逐渐增加。
此外,研究表明,成功根除幽门螺杆菌后,α多样性可以完全恢复到未感染对照组的水平。相反,尽管在清除幽门螺杆菌后,群落结构也可以部分恢复,但对于是否仍存在显著差异存在争议在根除后组和阴性对照组之间。
一些研究人员发现,接受抗幽门螺杆菌治疗的患者在治疗2个月后,胃微生物群落的组成恢复到未感染儿童的水平,然而,其他研究确定,成功治疗6个月后的成人样本仍显示出不同的菌群结构,阴性对照组则不同。
纳入分析的不同年龄组可能解释了相反的结论,因为另一项招募儿童的研究也发现根除组的菌群结构在治疗4周后与幽门螺杆菌阴性组的菌群结构接近。
根除治疗后评估胃微生物群变化的研究

Tao et al., Helicobacter, 2020
成分分析揭示了幽门螺杆菌的相对丰度治疗后幽门螺杆菌显著下降,而其他主要菌门,包括放线杆菌、拟杆菌、厚壁菌和梭杆菌,则增加。
在属水平上,治疗后乳酸杆菌和双歧杆菌(两种公认的益生菌)的数量显著增加。
两项研究的功能分析表明,成功治疗后,蛋白质和碳水化合物代谢途径上调。因此幽门螺杆菌感染期间,胃微生物群营养代谢功能受损,根除治疗可部分恢复。然而,预测的功能改变还需要进一步的验证。
根除治疗后肠道微生物群的变化
通过降低酸度,质子泵抑制剂(PPIs)已被证明对肠道微生物群产生显著影响。因此,抗幽门螺杆菌治疗对肠道微生物群的影响是PPIs、抗生素、铋联合应用的共同结果。总的趋势是,α多样性在根除后立即下降,随后又恢复。
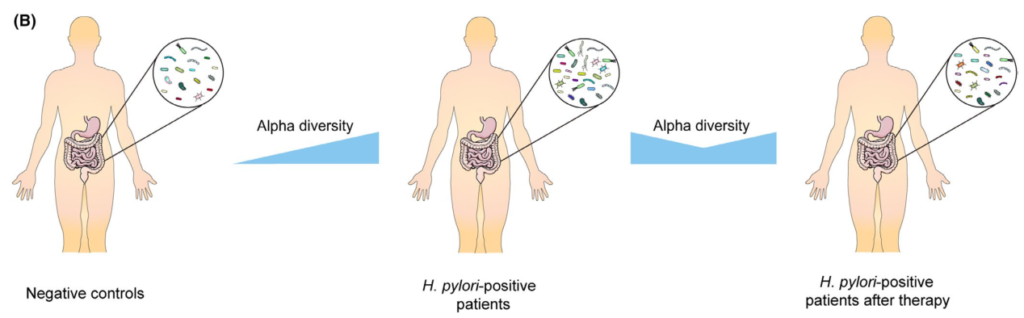

Tao et al., Helicobacter, 2020
具体来说,恢复需要多长时间仍有待阐明。大多数研究收集了随访2个月内的信息显示α多样性降低,而此后报告与基线无显著差异。
然而,一项研究报告,从第0周到第6周和第26周,Sobs指数和Chao指数都在下降没有达到统计学意义。值得注意的是,另一项研究发现,不同的治疗方案对肠道微生物群的影响可能不同。
在临床试验中,三种不同的治疗方案,包括三联疗法、联合疗法和铋四联疗法。结果表明,所有组的α多样性在第2周时都有所下降,但只有接受三联疗法的患者在第8周时才具有基本α多样性,而其他两组的α多样性在治疗后1年也无法恢复。
希望将来的研究验证根除疗法是否会导致肠道菌群的持续紊乱,以及不同的治疗方案如何影响可逆性。
分析根除疗法对肠道微生物群影响的研究

Tao et al., Helicobacter, 2020
益生菌的补充可以缓解抗生素引起的多样性和结构紊乱
益生菌,已被证明可稳定微生物群并改善胃肠道症状。在门水平上,治疗6个月后观察到厚壁菌群增加和拟杆菌减少,表明在幽门螺杆菌感染的个体中观察到的高B:F比率逆转。在另一项研究中报告了9个类似的结果。
临床证据支持肥胖与B:F比率降低相关。因此,这些研究中检测到的B:F比率降低可能为根除治疗后体重增加提供了一种可能的解释。然而,一些研究人员说明,在根除18个月后,降低的B:F比率可以逆转。有趣的是,益生菌补充被证明与根除治疗后较高的B:F比率相关。值得注意的是,报告的结果不一致。
一项研究表明,治疗后B:F比率立即增加,并在第13周保持高于基线水平。宏基因组研究的分类图谱显示,治疗后双歧杆菌的相对丰度下降。然而,另一项研究表明,双歧杆菌在成功根除6个月后增加。
在幽门螺杆菌阳性萎缩性胃炎的肠道微生物群中富集的链球菌在根除治疗后显著减少。
尽管不同研究中肠道微生物群的长期变化不同,但根除引起肠道内稳态的短期紊乱似乎是一致的。
根除疗法对肠道菌群抗生素耐药性的影响
随着根除疗法的广泛应用,抗生素耐药性的出现已成为临床实践中的一个重要问题。
根除幽门螺杆菌感染后,抗生素耐药性的上升以及根除治疗后的长期安全性是重要的问题。
通过药敏试验指导的个性化治疗可以在一线治疗中提供可靠的优异根除率,但贵且无法广泛获得。根据局部地区的抗生素耐药性,针对特定人群的经验疗法可能是一种替代策略。
已证明会改变幽门螺杆菌相关疾病风险的宿主因素包括宿主的年龄、在幽门螺杆菌的获得和幽门螺杆菌感染之间的持续时间,但更重要的是宿主免疫介质(多态性)和酸分泌状态。
除宿主因素外,吸烟和饮食等环境因素还会影响幽门螺杆菌定植的生态位,因此可能会影响疾病风险。

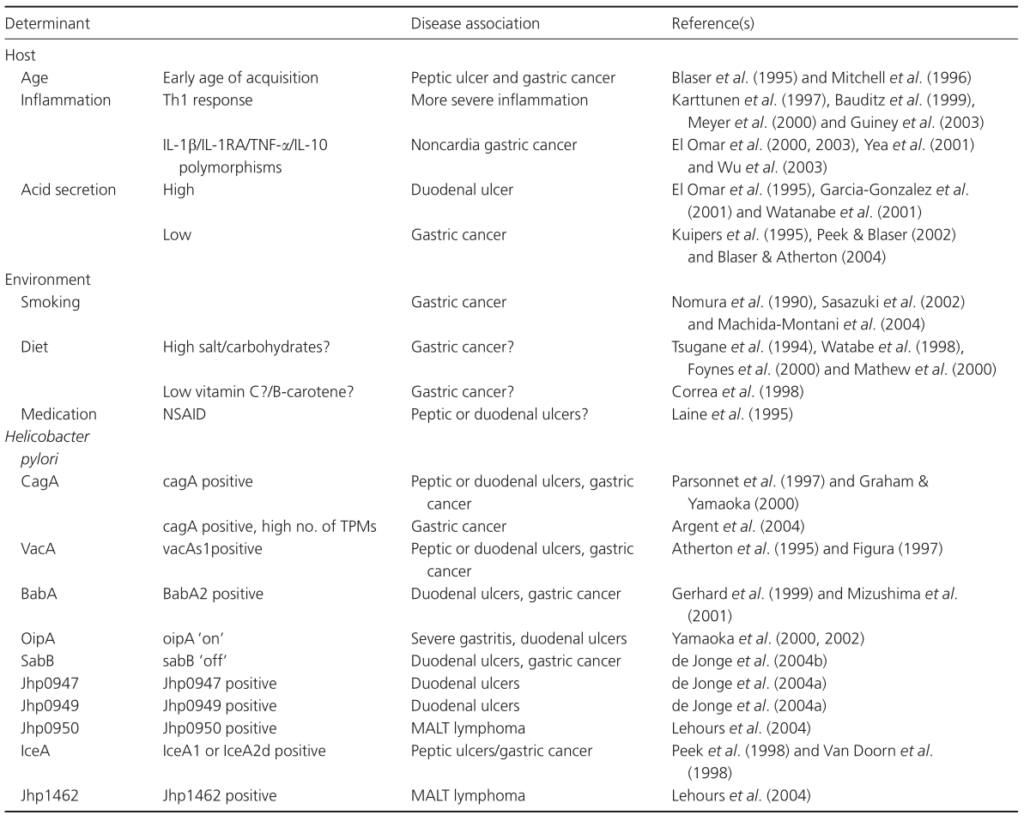
Karin et al., FEMS Microbiol Rev. 2006
在年幼时期感染幽门螺杆菌会增加患胃溃疡和胃癌的风险。 胃溃疡和胃癌的发展需要幽门螺杆菌的长期感染,因此,推测这些疾病是在慢性感染幽门螺杆菌的患者中更为常见。
此外,这种关联被认为是由不同年龄组的宿主免疫反应的差异所决定的。
感染幽门螺杆菌后,宿主胃上皮细胞释放细胞因子IL-8。这种细胞因子参与了巨噬细胞、中性粒细胞、肥大细胞、B细胞和T细胞募集到炎症部位。这些细胞通过分泌其他炎症介质,如干扰素(IFN-g)、肿瘤坏死因子(TNF-a)和白细胞介素(IL-1b),进一步增强免疫反应。
幽门螺杆菌相关发病机制的示意图

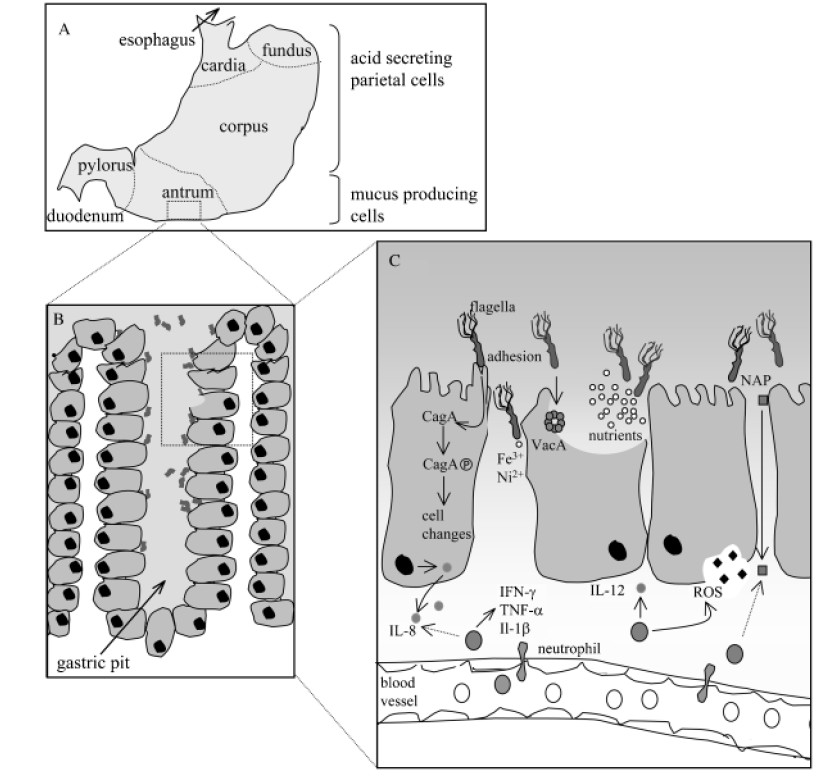
Karin et al., FEMS Microbiol Rev. 2006
A)在人类胃中,幽门螺杆菌主要定植于缺乏胃酸分泌壁细胞的胃窦中;
B)在胃小凹中,幽门螺杆菌尤其在上皮细胞紧密连接处附近增殖;
C)幽门螺杆菌对定植、持续和疾病发展具有重要作用的因子。
针对幽门螺杆菌的免疫反应进一步表现为活化的人类中性粒细胞中的氧化爆发。这种爆发会导致活性氧(ROS)的释放,活性氧是一种低分子量的代谢物,可破坏包括核酸在内的重要生物分。ROS可能损伤控制细胞生长的基因;并刺激癌症的发展。因此,免疫介质的存在会导致胃上皮的完整性受损。这种损伤是引起大多数与幽门螺杆菌感染相关的病理学,而不是直接的幽门螺杆菌活动。
幽门螺杆菌感染期间存在的免疫细胞主要是促炎细胞,而不是抗炎细胞。促炎介质由辅助性T细胞1(Th1)分泌。原始T细胞受多种因素驱动分化为Th1细胞,如TNF-a和IL-12。
在幽门螺杆菌刺激下,单核细胞大量产生细胞因子IL-12。因此,通过刺激IL-12的释放,幽门螺杆菌增强了促炎反应。这导致更多的损伤胃上皮,这容易发展胃萎缩。
一些编码免疫调节因子的宿主基因含有多态区域。这些基因的多态性将改变它们的转录,从而影响炎症过程。因此,幽门螺杆菌相关疾病的风险可能会改变。到目前为止,IL-1b、IL-1受体拮抗剂、IL-10和TNF-a基因的多态性已被证明与远端胃癌显著相关。
人类白细胞抗原(HLA)通过将病原体衍生的肽片段呈递给适当的T细胞,有助于消除病原体。HLA基因具有高度多态性,某些HLA等位基因与胃腺癌的发生有关。幽门螺杆菌感染也与胃腺癌的发生有关,但其存在与这些HLA等位基因的存在无关。因此,HLA等位基因在幽门螺杆菌介导的腺癌中的重要性仍然存在争议。
因此,遗传上预定的显性促炎性Th1反应与幽门螺旋杆菌疾病相关。
另一方面,Th1反应的强度可能受到抗炎Th2细胞因子IL10的产生的限制,从而延长感染时间。Th2型反应是由寄生虫引起的。因此,感染幽门螺杆菌的人的炎症反应和病理改变逐渐减弱。这可能导致这些个体慢性胃炎进展为胃癌的时间延迟。另外,不同的促炎反应可能直接导致幽门螺杆菌相关病理学的不同途径。
前面提到Th1反应导致胃壁细胞抑制其酸分泌。酸性较低的环境可能促进幽门螺杆菌的传播和持续。此外,当胃酸水平较低时,幽门螺杆菌以外的微生物可能在人体胃中生长,从而增强局部炎症反应。促炎细胞因子和胃酸分泌减少的联合作用增加了患消化性溃疡病和胃癌的风险。
另一方面,当酸的分泌减少时,十二指肠溃疡就不太可能发生。当酸的分泌增强时,十二指肠溃疡发生的风险增加。然而,同样在低酸性条件下,幽门螺杆菌感染后十二指肠溃疡的风险可能会增加。
胃壁细胞控制其产酸的能力在幽门螺杆菌相关疾病的发展中是重要的。幽门螺杆菌感染主要发生在人类胃中酸性较弱的部位,如胃窦。因此,胃酸分泌量高的宿主胃窦内幽门螺杆菌密度高,且主要发展为胃窦性胃炎。随后,胃体中完整的壁细胞被刺激分泌酸,从而诱导十二指肠的胃化生。幽门螺杆菌定植于这种胃化生,这可能导致十二指肠溃疡。
另一方面,胃酸分泌量低的宿主不仅胃窦易受幽门螺杆菌感染,而且胃体也易受幽门螺杆菌感染。感染的幽门螺杆菌可进一步抑制胃壁细胞的酸分泌。这可刺激胃上皮细胞持续增殖,导致胃腺进行性丧失,最终导致胃萎缩和癌症。
吸烟
一些环境因素与幽门螺杆菌相关的发病机制有关。吸烟是胃癌发展的主要因素。烟草烟雾含有致癌的亚硝胺,引发癌症的发展。
高盐饮食
一些饮食因素与幽门螺杆菌疾病有关。高盐饮食与幽门菌定植率、胃炎和胃癌风险增加。高盐浓度导致壁细胞萎缩,粘膜屏障破坏。然而,只有长期高盐摄入才会增加幽门螺杆菌相关疾病的风险。
高米饭摄入量
高米饭摄入量与胃癌之间存在正相关关系。米饭含有碳水化合物,可能会刺激胃粘膜。
水果和蔬菜摄入量低
水果和蔬菜摄入量低可能会增加胃癌的风险。水果和蔬菜含有抗氧化剂维生素C和β-胡萝卜素,通过中和活性氧来防止致癌。
因此,尽管有几个环境因素被认为与幽门螺杆菌相关疾病的发生有关,但它们的作用往往是有争议的。据推测,不同环境因素以及宿主和细菌因素之间的复杂相互作用妨碍了对研究结果的解释。
幽门螺杆菌因素在疾病发展中的总体影响是复杂的。到目前为止,已经描述了几种与幽门螺杆菌相关疾病的发生有关的幽门螺杆菌特异性蛋白。这些蛋白质被认为是导致幽门螺杆菌持续存在的原因。作为副作用,这些幽门螺杆菌蛋白诱导和改变炎症过程,损伤胃上皮,从而决定幽门螺杆菌感染后的结局。
CagA
与感染cagA阴性幽门螺杆菌分离株的患者相比,携带细胞毒素相关基因A(cagA)的幽门螺杆菌分离株的定植与严重胃炎、消化性溃疡病和远端胃腺癌的风险增加有关。
幽门螺杆菌cagA基因的存在或不存在经常被用作幽门螺杆菌中致病岛(PAI)存在或不存在的标记。 cag PAI由大约30个基因组成,并且在所有幽门螺杆菌分离株中占50%–70%。 位于cag PAI侧翼的两个31 bp重复序列之间的重组可能导致整个cag区域的缺失或获得。
cag PAI上的18个基因对于产生IV型分泌系统至关重要。 IV型分泌系统将细菌细胞中的蛋白(与毒力相关)转运到宿主细胞的胞质溶胶中。 这通常导致上皮细胞反应的级联反应的启动,例如细胞骨架的变化和细胞因子IL-8的分泌。
在幽门螺杆菌中,IV型分泌系统的成分将CagA蛋白转运到胃上皮细胞中。 随后,CagA蛋白被磷酸化。 然后,这种磷酸化的CagA与宿主磷酸酶SHP-2相互作用,引起细胞骨架的重排。 这导致宿主细胞形态发生变化,也称为“蜂鸟”表型。该表型的特征在于细胞扩散,上皮细胞的延长生长以及片状脂蛋白和丝状伪足的存在。
作为抵消事件,磷酸化的CagA与宿主Src激酶相互作用,从而减弱宿主SHP-2磷酸酶的信号传导。 这个过程减少了细胞骨架的重排,并阻止了CagA的进一步磷酸化。
最近,已经证明幽门螺杆菌菌株在体内诱导较高水平的CagA磷酸化。上皮细胞诱导更多的细胞骨架变化,并且更可能与胃癌有关。CagA磷酸化水平的差异是由cagA基因的30个区域内酪氨酸磷酸化基序(TPM)数量的差异引起的。
幽门螺杆菌人群,需要最低限度的免疫识别。因此,在萎缩的生态位中,这些TPM数量减少的亚克隆诱导了较弱的宿主免疫反应。
另一方面,较高水平的CagA磷酸化可引起强烈的炎症反应。 这种炎症会导致萎缩,并可能在限制高酸输出的生态位酸应激中发挥作用。
通过观察发现,缺乏cagA基因的幽门螺杆菌菌株是从消化性溃疡或胃癌患者中分离出来的,尽管其频率比cagA阳性幽门螺杆菌菌株的频率更低。
cagA和幽门螺杆菌相关疾病之间的关联在不同的地理区域中有所不同。 这种变异可能与CagA表达的差异有关。
然而,CagA并不是唯一的。幽门螺杆菌蛋白负责屏障功能障碍,而这一过程并没有随着CagA的清除而丢失。下一节讨论的VacA蛋白也很重要。
VacA
最初显示真核细胞在带有幽门螺杆菌的体外测试系统中经历空泡化和连续变性。 后来证明这种现象是由幽门螺杆菌毒素诱导的,现在被称为空泡细胞毒素A(VacA)。
VacA或CagA不能单独用作临床结果的决定因素。
VacA如何发挥作用,导致细胞死亡?
幽门螺杆菌VacA是一种高度免疫原性的95-kDa蛋白。VacA结合上皮细胞的顶端部分,形成阴离子选择性孔。
通过这些孔,碳酸氢盐,氯化物和尿素从细胞质中释放出来,然后,VacA被内吞进入晚期的内体区室,并改变这些区室的通透性。
在弱碱(例如氨)的存在下,这会导致水涌入,从而导致囊泡肿胀和液泡形成。 细胞内内吞途径的损伤最终导致细胞死亡。
这导致了上皮细胞抗性的降低,因此低分子量分子如Fe3+和Ni2+可以很容易地穿过上皮细胞层。Fe3+和Ni2+分子分别是幽门螺杆菌生长和脲酶活性的关键因子。
因此,推测通过降解上皮细胞屏障,幽门螺杆菌可以更容易地获得这些关键因子。
幽门螺杆菌VacA也与壁细胞的降解有关,这导致酸分泌减少,使宿主容易患上胃癌。 持续感染过程中VacA表达水平的差异导致毒性改变。 因此,溃疡的消长可以通过随时间变化的VacA表达变化来解释。
在体外在胃上皮细胞附近诱导vacA基因的转录。 这一发现证实了VacA与宿主细胞相互作用的重要性。 此外,VacA可以逃避适应性免疫反应,从而增强幽门螺杆菌在胃粘液层中的持久性。
幽门螺杆菌外膜蛋白(HOPs)
在革兰氏阴性细菌中,外膜介导与其周围环境的相互作用。 在感染期间,假定存在于幽门螺杆菌外膜上的蛋白质被改变,使得宿主免疫系统的识别作用降至最低。
幽门螺杆菌分离物含有约30种不同的外膜蛋白(HOP)。 其中几种是粘附素。 在革兰氏阴性细菌中,粘附素最常形成聚合菌毛结构。 但是,在幽门螺杆菌中,这些粘附素已经适应了胃环境,其中酸性条件可能会使这种聚合物菌毛结构解聚。
岩藻糖基化的糖蛋白和唾液酸化的糖脂都已被证明是胃上皮中幽门螺杆菌的结合位点。
与宿主细胞的粘附可保护幽门螺杆菌免受蠕动和粘膜脱落。
此外,推测粘附力可以使幽门螺杆菌更好地获取从胃上皮释放的营养物质,并更有效地将细菌毒素传递至宿主细胞。
另一方面,在剧烈炎症的部位,粘附特性的丧失可能使幽门螺杆菌逃脱宿主免疫细胞的杀伤。目前为止,一些HOP与疾病的发展有关。
幽门螺杆菌BabA (HopS)介导幽门螺杆菌粘附于人Leb血型抗原,这些抗原存在于胃上皮细胞上。BabA黏附促进幽门螺杆菌定植,增加上皮细胞分泌IL-8,导致粘膜炎症增强。
BabA调节的两种机制都有助于促进慢性感染的动态反应。
在慢性炎症期间,选择增加或减少粘附的周期可在所有血型的人群中获得所有类型的Leb结合。
宿主粘膜糖基化模式导致BabA进化,使幽门螺杆菌菌株适应其个体宿主,这有助于避免宿主反应,并在全世界范围内造成幽门螺杆菌感染的异常长期性。
幽门螺杆菌可塑性区域毒力因子
两个单独菌株基因组序列的比较表明,一个菌株中存在的幽门螺杆菌基因中约有6%-7%不存在于另一个菌株中,反之亦然。
大约一半的菌株特异性基因存在于高变区;可塑性区。 位于这种可塑性区域的基因通常与毒力增加相关。
在幽门螺杆菌中,可塑性区确实编码了与IV型分泌有关的Vir型ATP酶。 在幽门螺杆菌中,该分泌系统在例如分泌CagA细胞毒素中很重要。目前为止,一些位于可塑性区的幽门螺杆菌基因与幽门螺杆菌相关的疾病有关。
幽门螺杆菌Jhp0947和Jhp0949与十二指肠溃疡疾病相关。这两个基因均位于幽门螺杆菌菌株J99可塑性区,在幽门螺杆菌介导的IL-12释放中很重要。
在体外测试系统中从单核细胞中提取。 细胞因子IL-12对于使免疫反应偏向促炎性Th1应答是必不可少的,并且与十二指肠溃疡的形成密切相关。
由jhp0947和jhp0949编码的蛋白质的功能未知。 然而,已经假设这些蛋白通过与单核细胞的相互作用诱导促炎细胞因子IL-12的产生。
IL-12水平升高会导致幼稚T细胞分化为活化的Th1细胞,从而导致炎症反应增强和组织损伤增加。
幽门螺杆菌Jhp0950,编码一种未知功能的蛋白质,也是J99可塑性区的一部分。该基因的存在与cagA、cagE、vacA s1m1、babA2、hopQ T1、oipA有关。
在幽门螺杆菌J99基因组中,Jhp0950与Jhp0949相邻。与Jhp0949不同,Jhp0950与十二指肠溃疡风险增加无关。然而,它与疾病的关联支持了位于可塑性区域的幽门螺杆菌基因可能与毒性相关的观点。
其他幽门螺杆菌毒力因子
在美国和荷兰,幽门螺杆菌iceA1基因(iceA基因的两个等位基因变体之一)在幽门螺杆菌感染的消化性溃疡患者中比仅在幽门螺杆菌感染的胃炎患者中更为普遍。
与许多其他与毒力相关的基因相似,IceA表达与幽门螺杆菌相关疾病之间的联系是群体依赖性的。
在东南亚,未发现iceA1与幽门螺杆菌相关疾病之间的关联。 有趣的是,对iceA1呈阳性的南非幽门螺杆菌分离株在幽门螺杆菌感染的胃癌患者中比仅在幽门螺杆菌感染的胃炎患者中更普遍。
注:幽门螺杆菌iceA1最初是在与胃上皮细胞接触后转录上调后被鉴定的,iceA1基因编码的核酸内切酶与乳球菌中的限制性核酸内切酶NlaIIIR非常相似,伴随的高度保守的脱氧核糖核酸腺嘌呤甲基转移酶的活性,由幽门螺杆菌编码,似乎与控制幽门螺杆菌的基因表达有关。
幽门螺杆菌Jhp1462与MAL T淋巴瘤、十二指肠溃疡和胃腺癌的风险增加相关。由Jhp1462编码的蛋白质的功能是未知的,其在严重胃十二指肠疾病发展中的重要性仍有待阐明。
以上,我们看到幽门螺杆菌通过各种方式给人体带来种种不利影响,它似乎不应该在人体中长期生存,然而,幽门螺杆菌在人体内存在有着的悠久的历史,那么幽门螺杆菌是如何保护自己在人体中安稳生存下来?
幽门螺杆菌在疾病发生之前会长期感染人胃粘膜。 因此,导致幽门螺杆菌定植和持续存在的因素与幽门螺杆菌相关的发病机理具有内在联系。 在胃腔进入后,幽门螺杆菌必须应付胃酸。
幽门螺杆菌通过其耐酸性在这种酸性条件下得以生存:然后穿过粘液层到达其接近胃上皮细胞的位置。趋化性,运动性和粘附性是胃上皮细胞定殖的重要过程。
为了在人胃粘膜中长期持久存在,幽门螺杆菌还不断需要宿主提供营养。 这是通过降解粘液层和下面的胃上皮细胞的完整性来实现的。 此外,通过抑制宿主免疫系统,抗原变异和抗原拟态避免了幽门螺杆菌的清除。
耐酸性
幽门螺杆菌生长的下限pH值是5.0-5.5,具体取决于测试的分离物。在胃粘膜层中,pH也是酸性的,大约在4-6.5之间变化。而且,当粘液层被破坏时,pH值可能会偶尔下降。
酸冲击(pH<3)后幽门螺杆菌的存活取决于幽门螺杆菌蛋白脲酶的活性,该酶将尿素转化为氨和碳酸氢盐。这导致幽门螺杆菌的周质或细胞质被中和。幽门螺杆菌尿素酶活性对于在酸性pH下体外存活以及在动物模型中胃粘膜定植至关重要,这证明了尿素酶在幽门螺杆菌感染中的重要性。
在中性pH下高度活跃的脲酶和酸调节的尿素通道的结合解释了为什么幽门螺旋菌在人类胃部的生存能力是独特的。有效抑制UreI蛋白,将提供一种从正常的,分泌酸的胃中根除幽门螺杆菌的方法。
除耐酸性外,脲酶还具有与胃定植有关的其他基本功能
尽管尿素酶对于酸休克的生存是必不可少的,但是幽门螺杆菌尿素酶在处理胃上皮细胞附近的慢性酸性环境时还是不够的。 用酸抑制剂治疗不能恢复尿素酶阴性突变体定殖在生侏儒仔猪胃中的能力。
脲酶参与幽门螺杆菌的氮代谢,脲酶活性产生的氨和碳酸氢盐被认为会影响宿主的许多细胞过程,包括细胞裂解。
除脲酶外,非脲酶基因也有助于耐酸,并且在酸性pH下的存活和生长与脲酶无关。 在这些非脲酶基因中,已显示三种调节蛋白(Fur,NikR和HP0166)对幽门螺杆菌的适应性有贡献。 这表明严格调节耐酸机理的重要性。
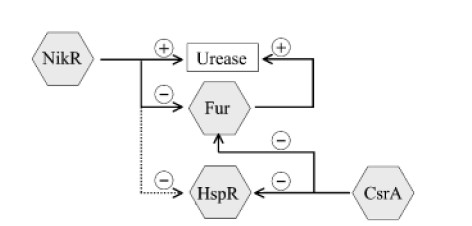
Karin et al., FEMS Microbiol Rev. 2006
NikR通过Fur调节系统直接和间接调节脲酶的表达。CsrA调节Fur和HspR调节系统的表达。通过不同基因调节蛋白的相互作用,幽门螺杆菌能够感知和响应多种信号。
细胞的趋化作用与运动
胃上皮细胞层覆盖着一层厚厚的粘液。假定该层甚至对于小分子也相对不可渗透。幽门螺杆菌的能动性和趋化性是有效穿透这一粘液层的关键。
在小鼠感染模型中,几乎任何运动和趋化性系统基因的诱变都消除了幽门螺杆菌感染胃粘膜的能力,强调了这些因素对定殖的重要性。
运动性
幽门螺杆菌的运动性是通过存在两到六个极性的带鞘鞭毛而实现的。鞭毛由三个结构元素组成:基体,钩子和细丝。迄今为止,超过50种蛋白质与鞭毛的结构或调控组织有关。
鞭毛丝由两个亚基FlaA和FlaB组成。幽门螺杆菌flaA和flaB突变体无法在感染仔猪的模型中定植,表明幽门螺杆菌鞭毛对定殖是必需的,幽门螺杆菌的毒力也因此而增加。
幽门螺杆菌motB基因编码鞭毛运动旋转蛋白。 幽门螺杆菌motB基因敲除突变体仍包含鞭毛,但不能运动。该突变体在小鼠中定植的能力降低,证实了运动性是完全传染性所必需的。
鞭毛基因转录的调控不同于许多其他细菌。与许多其他带鞭毛的革兰氏阴性细菌相反,幽门螺杆菌没有转录调控因子来调控鞭毛基因的转录。
据推测,幽门螺杆菌的运动不需要严格的调节,因为它在任何时候都是不可或缺的。然而,在幽门螺杆菌中仍然可以看到一些转录调控。例如,蛋白质FlhA和FlhF,基体的组成部分,需要在中后期鞭毛基因转录之前出现。
趋化性
除了运动性,趋化性对于幽门螺杆菌的定植也是必不可少的。趋化性允许幽门螺杆菌将其运动导向胃上皮细胞层。
由HP0099编码的幽门螺杆菌趋化性受体传感器识别碳酸氢盐和精氨酸作为引诱剂。幽门螺杆菌外膜上这种传感器蛋白与反应调节剂CheY偶联。
反应调节剂CheY调节鞭毛运动蛋白的表达,使幽门螺杆菌游向其生态位。
应答调节因子CheY的一个敲除突变体未能在非生物小猪体内定殖,强调了趋化性在最初定殖中的重要性。
反应调节因子CheY及其组氨酸激酶的敲除突变体显示出对粘蛋白的趋化性反应减弱。
免疫逃避
在长期的定殖过程中,宿主对多种幽门螺杆菌抗原产生强大的免疫反应。然而,这些抗原通常没有表面暴露。
另一方面,表面暴露的抗原通常高度多样化,使宿主清除幽门螺杆菌变得更加困难。幽门螺杆菌感染极少产生足够的免疫反应,能够清除细菌。 实际上,幽门螺杆菌能够有效规避先天性和适应性免疫反应。
先天的免疫反应不能实质上识别幽门螺杆菌。大肠杆菌脂多糖(LPS)通过TLR4激活先天免疫应答。然而,幽门螺杆菌LPS远不是TLR4介导的基因表达的有效诱导剂。
在幽门螺杆菌中,TLR5介导的免疫应答激活效率也较低。 与肠沙门氏菌血清型鼠伤寒鞭毛蛋白相比,幽门螺杆菌鞭毛蛋白没有被释放,并且在通过TLR5激活IL-8分泌中也没有那么强。
先天性免疫反应未能识别幽门螺杆菌可能导致适应性免疫反应失败以随后清除感染。
自适应免疫系统的逃避至少由两个重要机制介导:抗原模拟和免疫抑制。抗原模拟导致宿主免疫系统无法正确识别幽门螺杆菌。例如,幽门螺杆菌LPS上的Le血型抗原也在人类上皮细胞上表达。结果,幽门螺杆菌LPS免疫原性差,从而支持幽门螺杆菌的持久性。在其LPS上缺少O抗原的幽门螺杆菌菌株在小鼠中定殖的能力显着降低。因此,幽门螺杆菌LPS的典型结构在定植中很重要。
除了通过抗原模拟来逃避免疫外,免疫抑制也有助于幽门螺杆菌感染的慢性化。
免疫应答可能偏向更抗炎的应答,或者下调(VacA)。幽门螺杆菌VacA可以阻断巨噬细胞中的吞噬体-溶酶体融合,导致巨噬细胞无法杀死幽门螺杆菌。
此外,VacA表达阻断T细胞活化并因此增殖,活化T细胞凋亡,并抑制T细胞中的抗原呈递。
B淋巴细胞的抗原加工可能被阻止,可能是通过将内体的成熟限制在发生抗原加载的MHC II类区室中。因此,VacA限制了针对幽门螺杆菌的T细胞和B细胞应答。
幽门螺杆菌的存在可以预防某些疾病?
通过以上各种方式,幽门螺杆菌得以在人体中生存下来,从某种程度上来说,幽门螺杆菌并不总是对人类宿主有害。
研究表明,幽门螺杆菌的存在可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。 幽门螺杆菌的发病率下降与儿童过敏性疾病和自身免疫性疾病,多发性硬化,腹腔疾病的发病率上升相关。
因此,从某种程度上来说,幽门螺杆菌有其存在的价值。这引起了关于是否需要根除幽门螺杆菌的讨论。
需要明确的是,幽门螺杆菌感染后不会立即对人体产生致死性危害和严重后果,所导致的慢性胃炎、消化道溃疡和胃癌等疾病是长期存在并慢性与其他因素共同作用的结果。
第五次全国幽门螺杆菌感染处理共识报告中有如下陈述:
根除幽门螺杆菌的获益在不同个体之间存在差异
根除幽门螺杆菌促进消化性溃疡愈合和降低溃疡并发症发生率,根除幽门螺杆菌可使约80%早期胃 MALT 淋巴瘤获得缓解。与无症状和并发症的 幽门螺杆菌感染者相比,上述患者根除幽门螺杆菌的获益显然更大。胃癌发生高风险个体有胃癌家族史、早期胃癌内镜下切除术后和胃黏膜萎缩和(或)肠化生等。根除幽门螺杆菌预防胃癌的获益高于低风险个体。

在做出可靠的功能性消化不良诊断前,必须排除幽门螺杆菌相关消化不良。
幽门螺杆菌胃炎伴消化不良症状的患者,根除幽门螺杆菌后可使部分患者的症状获得长期缓解,是优选选择。
幽门螺杆菌感染是消化性溃疡主要病因,不管溃疡是否活动和是否有并发症史,均应该检测和根除幽门螺杆菌。
…
总的来说,对于无抗衡因素 ( 高龄、伴存疾病、社区再感染率、卫生经济因素等 ) 的个体,根除幽门螺杆菌治疗利大于弊。
儿童:
不推荐对 14 岁以下儿童行常规检测幽门螺杆菌。推荐对消化性溃疡儿童进行幽门螺杆菌检测和治疗,因消化不良行内镜检查的儿童建议行幽门螺杆菌检测与治疗。
与成人相比,儿童根除治疗不利因素较多,包括抗菌素选择余地小,对药物不良反应耐受性低。此外,儿童幽门螺杆菌感染有一定自发清除率,根除后再感染率也可能高于成人。
老年人:
老年人根除幽门螺杆菌治疗药物不良反应风险增加,因此对老年人根除幽门螺杆菌治疗应该进行获益-风险综合评估,个体化处理。
问卷调查显示,多数临床医生对老年人根除幽门螺杆菌治疗的态度趋向保守。一般而言,老年人(年龄>70 岁)对根除幽门螺杆菌治疗药物的耐受性和依从性降低,发生抗生素不良反应的风险增加;另一方面,非萎缩性胃炎或轻度萎缩性胃炎患者根除幽门螺杆菌预防胃癌的潜在获益下降。
合理看待幽门螺杆菌感染后果至关重要,对自然人群中幽门螺杆菌感染是否需要进行干预,需要综合权衡利弊。对于有根除治疗指征的患者,需要给予规范治疗,提高首次根除率,减少耐药性发生。
在慢性感染过程中,多株菌株同时定植于一个宿主,并且幽门螺杆菌分离株的遗传变异使幽门螺杆菌相关的发病机理难以从单个因素中预测。 幽门螺杆菌与其宿主的共同进化使它得以终生定居。
随着现代卫生环境改善及抗生素的大量使用,幽门螺杆菌的生长和传播越来越难,年轻一代中感染率较低,在未来几十年中幽门螺杆菌感染率将进一步下降。
更好地理解幽门螺杆菌和其他胃肠道微生物群之间的对话可能为预防或治疗其感染提供新的方向。如在肠道菌群健康检测报告中发现幽门螺杆菌感染,则应引起重视。当需要治疗时,应评估新的治疗策略和药物,或者应该制定替代策略来控制细菌的毒力,从而避免出现溃疡和胃癌而不消除其积极影响。
附录: 幽门螺杆菌的发现史
在1980年代初,幽门螺杆菌首次被发现是引起胃部疾病的原因。该发现帮助研究人员将幽门螺杆菌感染与胃炎,溃疡和胃癌等联系起来。
1982年,两名澳大利亚研究人员巴里·马歇尔和罗宾·沃伦描述了幽门螺杆菌感染的作用。
然而,沃伦和马歇尔关于幽门螺杆菌功能的理论并未立即被医学界接受。当时,大多数科学家都不相信细菌可以在人的胃中生活。
马歇尔无法在实验室小鼠中进一步测试他的工作,也不允许在人身上进行实验。马歇尔这位勇敢的科研工作者想到了一个办法。
他决定亲自吃下幽门螺杆菌。他从病人的肠道中提取该菌,将其放入肉汤中,然后饮用。
几天后,马歇尔出现了肠道症状,例如恶心,呕吐,口臭和疲劳。他做了胃活检,且能够培养幽门螺杆菌,证明是细菌引起了他的症状。
医学界最终接受了幽门螺杆菌引起溃疡和其他肠道问题的观念,但是接受的道阻且长。
1994年,美国国立卫生研究院共识发展会议正式承认幽门螺杆菌与溃疡之间的紧密联系。该小组建议对溃疡患者进行抗生素治疗。
1996年,FDA批准了首个针对幽门螺杆菌引起的溃疡的抗生素疗法。
一年后,疾控中心(CDC)与其他政府机构和学术机构合作发起了一项全国运动,为医患相关人员提供有关幽门螺杆菌与溃疡之间的联系。
2005年,马歇尔和沃伦获得了诺贝尔生理学或医学奖。溃疡不再被视为无法治愈的慢病,而是一种可以通过短期的抗生素和酸分泌抑制剂治疗的疾病。
【参考文献】
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Camilo V, Sugiyama T, Touati E. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12405. PMID: 28891130.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Mentis A, Lehours P, Mégraud F. Epidemiology and Diagnosis of Helicobacter pylori infection. Helicobacter. 2015 Sep;20 Suppl 1:1-7. doi: 10.1111/hel.12250. PMID: 26372818.
Thorell K, Lehours P, Vale FF. Genomics of Helicobacter pylori. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12409. PMID: 28891132.
Julie Marks.Robert Jasmer, MD What Is H. Pylori? Symptoms, Causes, Diagnosis, Treatment, and Prevention. 2020.9
History of H. Pylori: What We Do and Don’t Know Before the discovery of the bacterium, doctors thought stomach ulcers were due to stress and spicy foods.
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Kamboj AK, Cotter TG, Oxentenko AS. Helicobacter pylori: The Past, Present, and Future in Management. Mayo Clin Proc. 2017 Apr;92(4):599-604. doi: 10.1016/j.mayocp.2016.11.017.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Yang JC, Lu CW, Lin CJ. Treatment of Helicobacter pylori infection: current status and future concepts. World J Gastroenterol. 2014 May 14;20(18):5283-93. doi: 10.3748/wjg.v20.i18.5283.
Sun Y, Zhang J. Helicobacter pylori recrudescence and its influencing factors. J Cell Mol Med. 2019 Dec;23(12):7919-7925. doi: 10.1111/jcmm.14682. Epub 2019 Sep 19.
Tao Zhi-Hang,Han Ji-Xuan,Fang Jing-Yuan,Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota.[J] .Helicobacter, 2020, 25: e12754.
Algood HM, Cover TL. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses. Clin Microbiol Rev. 2006 Oct;19(4):597-613. doi: 10.1128/CMR.00006-06.
Kori M, Daugule I, Urbonas V. Helicobacter pylori and some aspects of gut microbiota in children. Helicobacter. 2018 Sep;23 Suppl 1:e12524. doi: 10.1111/hel.12524. PMID: 30203591.
van Amsterdam K, van Vliet AH, Kusters JG, van der Ende A. Of microbe and man: determinants of Helicobacter pylori-related diseases. FEMS Microbiol Rev. 2006 Jan;30(1):131-56.
Waskito LA, Yamaoka Y. The Story of Helicobacter pylori: Depicting Human Migrations from the Phylogeography. Adv Exp Med Biol. 2019;1149:1-16. doi: 10.1007/5584_2019_356. PMID: 31016625.
Pereira-Marques J, Ferreira RM, Pinto-Ribeiro I, Figueiredo C. Helicobacter pylori Infection, the Gastric Microbiome and Gastric Cancer. Adv Exp Med Biol. 2019;1149:195-210.
RU Nan, DU Yi-qi, LI Zhao-shen. 幽门螺杆菌根除指征的演变[J]. 中国实用内科杂志, 2019, 39(006):515-519.
中华医学会消化病学分会幽门螺杆菌和消化性溃疡学组, 全国幽门螺杆菌研究协作组, 刘文忠,等. 第五次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学, 2017(6).

谷禾健康
肠道菌群检测的第一步是取样,取样的重要程度不言而喻,实验人员只有在拿到合格样本后才能开展后续实验。
如果储存和运输不当菌群结构就会发生变化,进而导致菌群测序不准确,因此,便捷可靠是关键。
谷禾经过多年肠道菌群检测实践和研发,开发出适用于肠道菌群取样和常温储存的取样管,可以采集并稳定DNA,用于定量肠道菌群组成分析。

整个取样盒包括:
取样管(内含裂解液和稳定液);
无菌棉签;
回寄袋;
每个取样管上均有唯一条码。
主要特点:
在家中轻松自行采样高质量样品
起始样品需要量低至0.01g,快速且稳定
常温保存运输
标准样品适合手动或高通量自动处理
获得适用于16S ,qPCR,宏基因组的高质量DNA
条形码化全样本可追溯性
谷禾取样管的独特特点使得取样变的异常简便,下面是取样演示:
仅需使用棉签从厕纸上沾取粪便,然后洗脱到取样管的保存液中即可,使保存液可见粪便颜色即表示取样量足够。

适用于-20°C至65°C下保持DNA完整性
室温下有效存储长达60天
与新鲜样本一致的菌群构成特征
低成本
下面来看一下取样管在不同条件下的保存效果,我们使用凝胶电泳来检测不同保存处理条件下提取菌群DNA的状态:
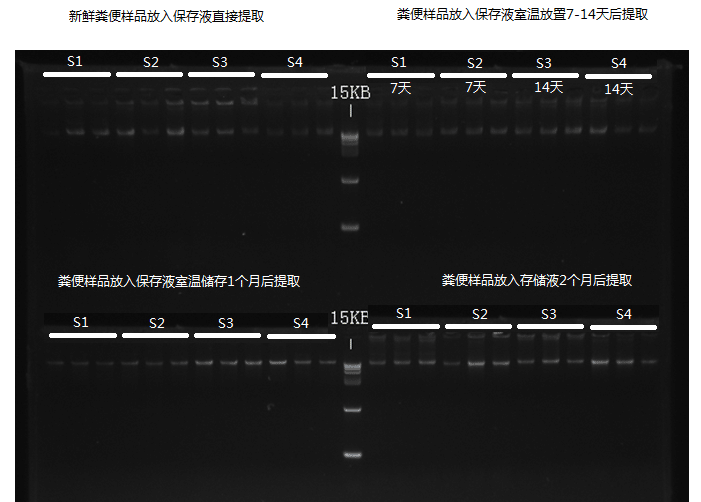
可以看到,使用谷禾保存管的DNA样品即便在存储至60天仍然没有出现明显的DNA降解情况。
专利号:ZL201511009389.7
配合谷禾肠道菌群取样保存管
适用于提取极低当量菌群DNA
具备以下特点:
磁珠法-适用于自动化高通量提取
起始量限制低
与MoBio试剂盒一致性高
现有样本处理量450例/天

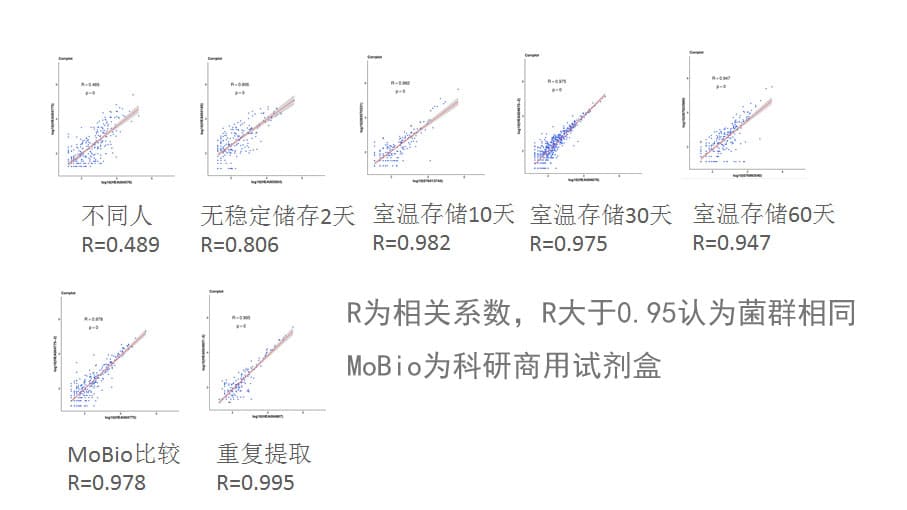
下图可以看到我们使用谷禾提取方法与MoBio试剂盒比较以及重复提取的菌群相关性。另外同时比较了使用谷禾取样管保存不同天数后的提取菌群结果。
专业的实验环境
让整个实验操作
得以高效可靠运行
二级生物安全实验室

注:生物安全实验室的分级

生物安全实验室一般实施两级隔离。一级隔离通过生物安全柜、负压隔离器、正压防护服、手套、眼罩等实现;二级隔离通过实验室的建筑、空调净化和电气控制系统来实现。

谷禾健康
当生命逐渐衰老时,肠道微生物群的脆弱性和随之而来的疾病易感性显得更加突出。
老年人肠道菌群中双歧杆菌、普氏栖粪杆菌(Faecalibacterium prausnitzii)和XIVa梭菌的丰度减少,而产气荚膜梭菌(Clostridium perfringens)、大肠杆菌、肠球菌、链球菌、葡萄球菌、肠杆菌的丰度增加。
因此,衰老的人类肠道微生物群显示出与短链脂肪酸(SCFAs)生产相关的基因缺失和糖分解能力下降,淀粉、蔗糖、半乳糖、糖酵解和糖异生代谢途径的表达降低;伴随着纤维分解微生物的损失;以及蛋白水解功能的全面增强。
益生元低聚半乳糖(GOS)对肠道健康有广泛的有益影响。近日,来自美国北卡罗莱纳大学医学院的研究人员在《Microbiome》上发表文章,题为《益生元低聚半乳糖对衰老肠道的多效性作用》。

在这项研究中,研究人员确定了GOS饮食对肠道老化特征的影响。
在艰难梭状芽胞杆菌感染的小鼠模型中,研究人员还评估了短期喂养低聚半乳糖是否会影响衰老的肠道对抗生素挑战的反应。最后,评估结肠类器官是否能复制体内观察到的低聚半乳糖应答-非应答表型。
老年动物有一个独特的微生物组,其特征是非糖化细菌与糖化细菌的比例增加,相应地,β-半乳糖苷酶的丰度较低。
低聚半乳糖降低了总体多样性,增加了特定的糖化细菌(拟杆菌和乳酸杆菌的种类)的丰度。
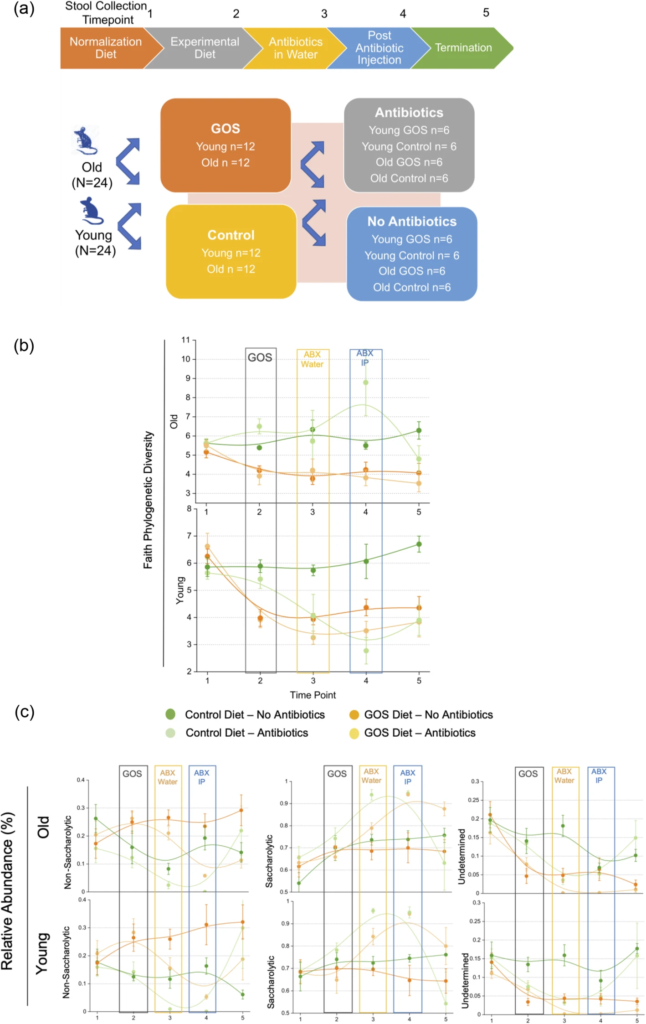
增加了幼年和老年动物中β-半乳糖苷酶的丰度,并增加了非糖化生物;但是,没有观察到强有力的、均匀的双歧作用。
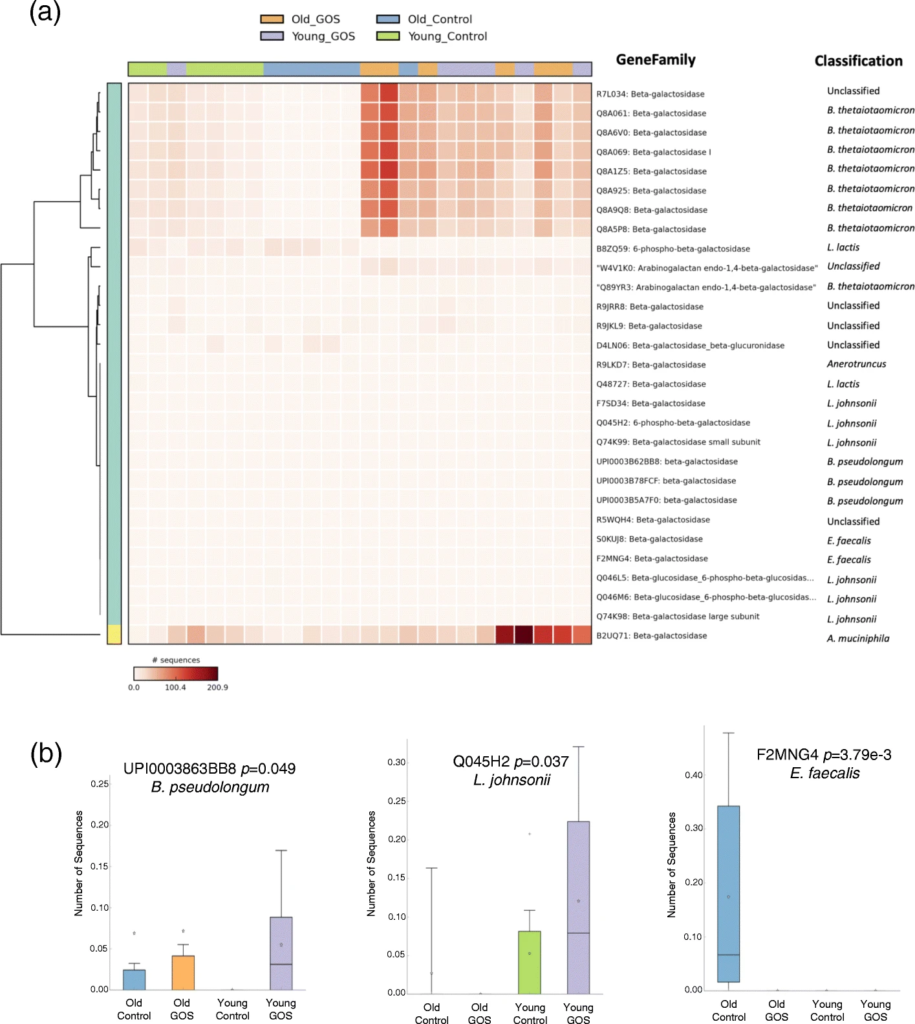
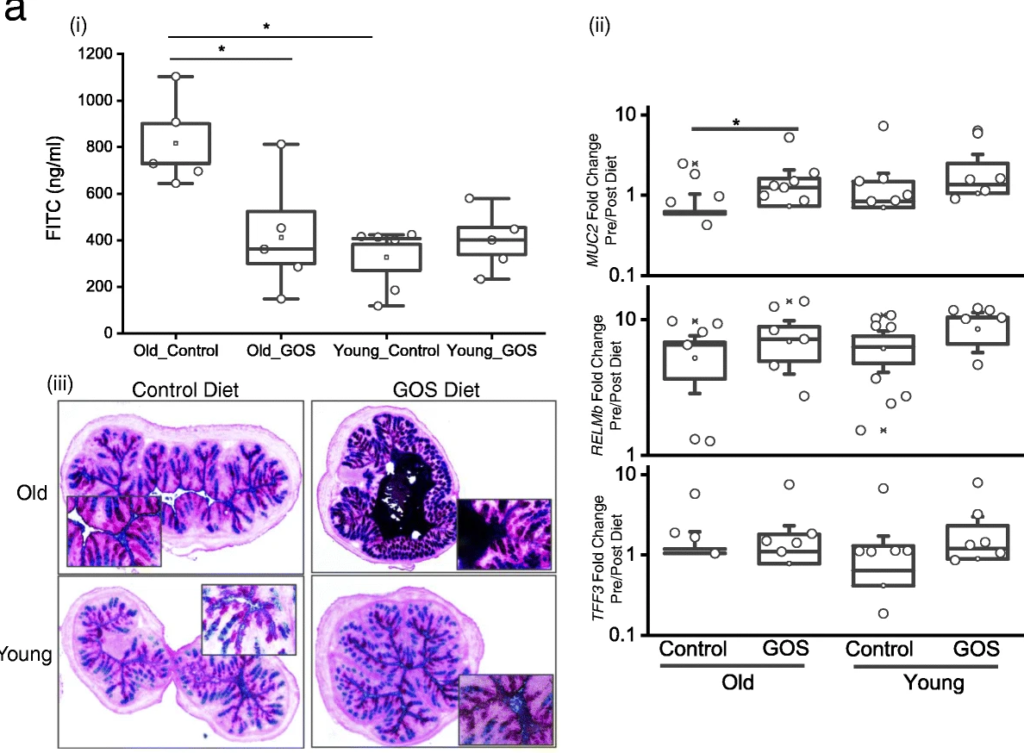
低聚半乳糖降低了老年小鼠与年龄相关的肠通透性增加,增加了MUC2 的表达和黏液厚度。
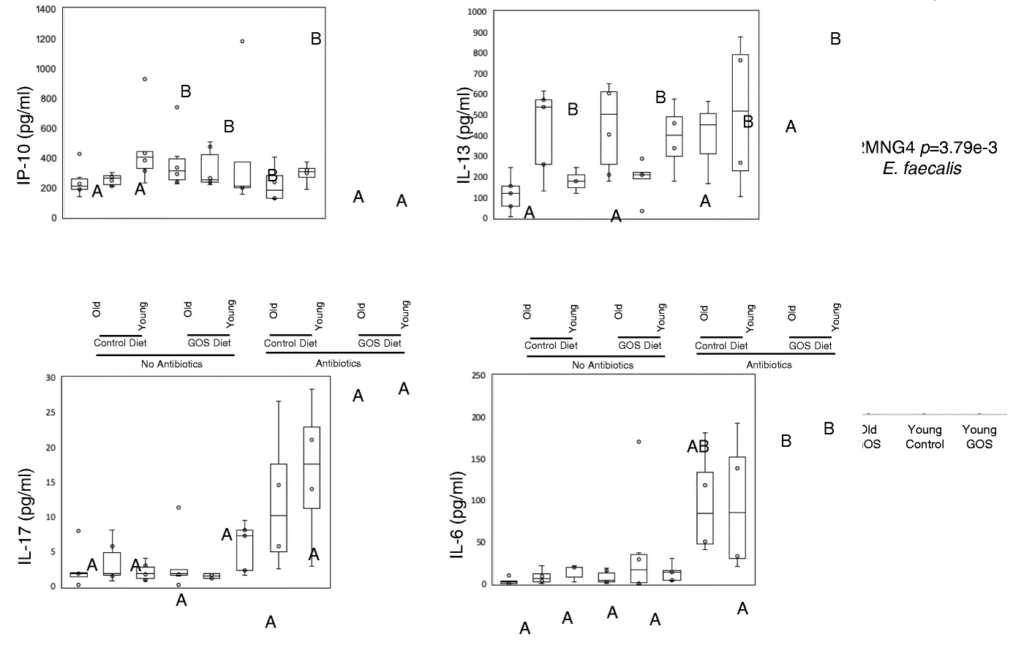
抗生素降低了老年小鼠双歧杆菌的丰度,同时增加了阿克曼菌、梭状芽孢杆菌、粪球菌、芽孢杆菌、拟杆菌和瘤胃球菌。
抗生素在调节血清炎症标志物方面比低聚半乳糖更有效。在抗生素组的对照组和低聚半乳糖饮食中观察到较高的血清IL-17和IL-6水平,并且在这些组中,无论年龄大小,低聚半乳糖组的IL-6水平较高,并且与对照饮食组的幼年动物相比,老年动物的IL-6水平较高。
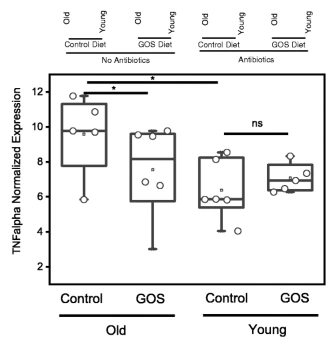
RTqPCR显示老年小鼠远端结肠组织中TNFα的基因表达显著增加,低聚半乳糖饮食降低了这种表达。
结肠转录组学分析显示,在年老的动物中,小分子代谢过程,特别是呼吸体相关基因的表达增加,这可能表明氧化代谢和能量效率增加。
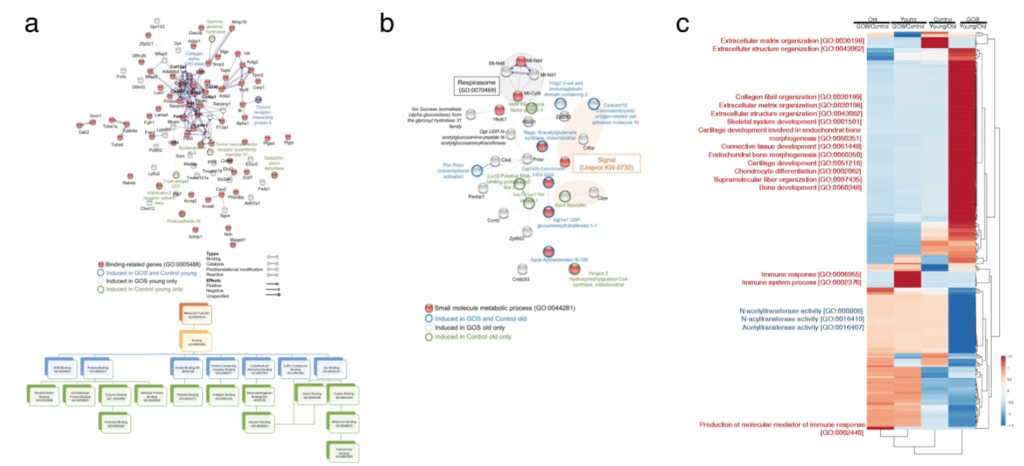
在幼龄小鼠中,低聚半乳糖诱导了结合相关基因的表达。半乳糖凝集素基因Lgals1是一种β-半乳糖结合凝集素,通过其糖基连接分子,是免疫应答的重要调节剂,PI3K-Akt和ecm受体相互作用通路也在年轻小鼠中被诱导。
在益生元存在的情况下,将GOS注射到结肠类有机物中,小鼠粪便显示出不同的双歧作用,重现了体内观察到的应答和非应答表型,这表明微生物群的组成和功能是表型的主要贡献者。
膳食GOS通过促进微生物组分和宿主基因表达的变化来调节老化肠道的内稳态,这种变化转化为降低肠道通透性和增加粘液生成。
年龄是益生元如何影响肠道上皮细胞的微生物组和表达的决定因素,尤其是在年轻而非老年小鼠中诱导半乳糖凝集素-1时更为明显。
相关阅读:
参考文献:
Arnold Jason W,Roach Jeffery,Fabela Salvador et al. The pleiotropic effects of prebiotic galacto-oligosaccharides on the aging gut.[J] .Microbiome, 2021, 9: 31.0人点赞日记本

谷禾健康
今日,两条关于睡眠问题登上热搜。
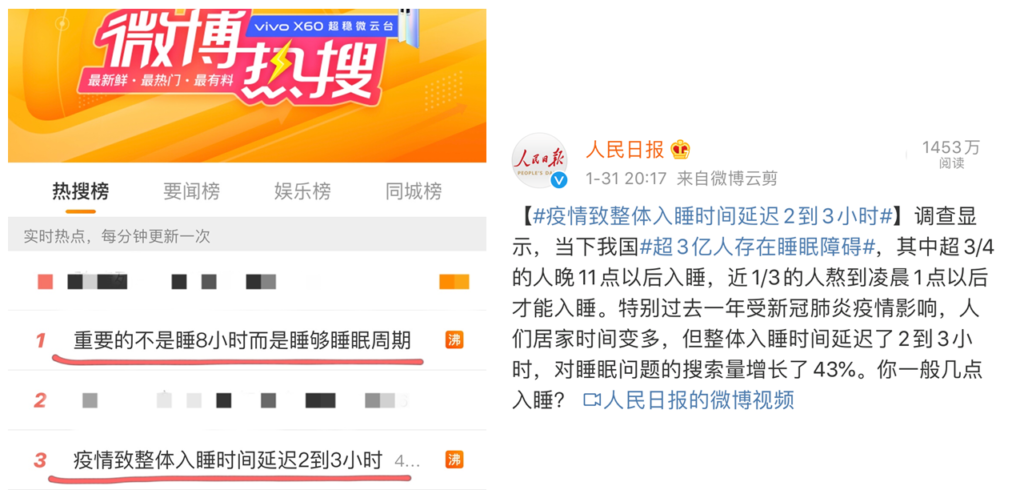
我国有超3亿人存在睡眠障碍,尤其过去这一年,人们整体入睡时间延迟2-3小时,对睡眠搜索量增长43%,看来睡眠问题正在影响越来越多人。
疫情致使整体入睡时间晚2-3小时_腾讯视频
睡眠是由人脑控制的一种复杂的生理行为过程,与免疫功能同为正常生活所必要的生理机能。睡眠是在漫长的一天之后舒缓和恢复的良好方式,睡眠可以让身体和大脑补充能量,良好的睡眠对于巩固记忆、处理信息、生长身体、修复肌肉,增强免疫,抵御疾病至关重要的。
睡眠障碍与各种疾病的发生和发展有关,例如肥胖,II型糖尿病,心血管疾病,抑郁症,癌症等。睡眠不足也会影响判断力和智力。
本文我们来详细了解下,睡眠障碍——这个大多数人都有可能遇到的难题。
首先,关于热搜第一条“睡够睡眠周期”到底什么意思呢?
要了解睡眠障碍之前,我们的先看下,正常生理性睡眠。
正常睡眠结构的特征是轻度睡眠,更深的慢波睡眠和快速眼动(REM)睡眠周期。
第一阶段睡眠(清醒和睡眠的过渡期)
第一阶段睡眠是睡眠周期的开始,被视为清醒和睡眠之间的过渡期。这段睡眠时间仅持续5-10分钟,其特征是混合频率的theta波(非常慢的脑波)。
第二阶段睡眠(体温下降,心率减慢)
第2阶段持续约20分钟,涉及混合频率的脑电波,具有快速的节奏性脑电波活动。在第2阶段,体温开始下降,心率开始减慢。
第三阶段睡眠(从轻度到深度过渡期)
第3阶段睡眠的特征是20%-50%的缓慢脑电波(称为δ波)。这是从轻度睡眠到深度睡眠的过渡时期。
第四阶段睡眠(缓慢脑电波)
阶段4的δ波大于50%,在此期间发生了缓慢的脑电波。阶段4持续约30分钟。
第五阶段睡眠(快速眼动睡眠)
睡眠的第5个阶段,即快速眼动(REM)睡眠,是大多数做梦的时候。第五阶段的特征是呼吸频率增加,大脑活动增加,体内各种代谢功能都显著增加。REM睡眠具有混合频率的EEG和theta波。成年人大约每90分钟出现一次REM睡眠。
睡眠以正常顺序开始,但随后以不规则的顺序循环进行。它开始于阶段1,然后进入阶段2、3和4。在阶段4睡眠之后,在开始REM(阶段5)睡眠之前,重复阶段3和2。REM睡眠结束后,身体通常会返回第2阶段睡眠。REM睡眠的第一个周期是入睡后约90分钟,并且只能持续很短的时间。每个周期,REM睡眠持续时间更长。


失眠是最普遍的睡眠障碍。判断失眠的标准:

标准一: 3个30分钟
入睡时间 [ 入睡时间超过30分钟 ]
睡眠维持困难 [ 醒后再入睡超过30分钟 ]
早醒 [ 比平时提前醒来超过30分钟 ]
标准二:
以上情况 一周超过三天
标准三:
社会功能受损,第二天身体不适
如何判断失眠?权威专家来解答_腾讯视频
影响睡眠质量和持续时间的因素如下,多种内部和外部因素都会对其进行干扰。
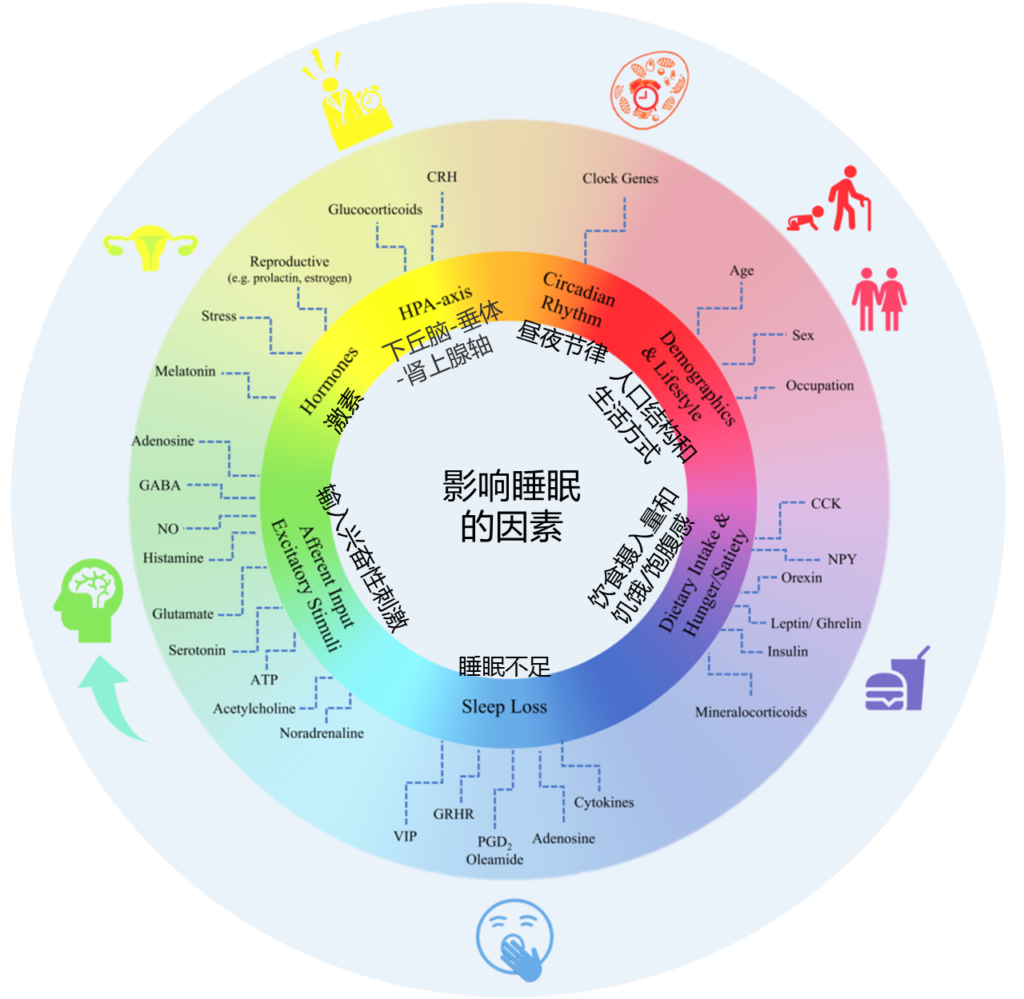
Matenchuk Brittany A,et al., Sleep Med Rev, 2020
睡眠障碍与多种原因有关,通常与不良饮食以及饮食习惯、昼夜节律、压力情绪、生活方式、疼痛炎症、以及慢性疾病等有关。
引起睡眠障碍的原因有很多,但有一个容易被忽略,那就是肠道菌群。
人类微生物群是体内复杂,动态的生态系统。越来越多的研究表明它似乎以许多重要的方式与睡眠相互沟通,相互作用。
菌群改变与睡眠密切相关
研究表明失眠症患者和健康人群肠道微生物的组成、多样性和代谢功能发生了显著变化。随机森林结合交叉验证确定了两种标志性细菌,可用于区分失眠患者和健康人群——拟杆菌属,梭菌属。
对微生物组组成的分析表明,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度与睡眠质量呈正相关,而Lachnospiraceae、棒状杆菌(Corynebacterium)、Blautia等几种菌与睡眠质量测量值呈负相关。
Faecalibacterium是肠道微生物群中产丁酸菌,可能有助于双相患者减轻疾病负担和改善睡眠质量。其潜在机制可能是产生促进睡眠的丁酸盐。
高质量的睡眠与肠道菌群相关,包括Verrucomicrobia菌和Lentisphaerae菌 ,占比偏高,与认知功能改善相关。
乳酸菌数量与睡眠呈负相关。干酪乳杆菌对健康成年人的应激性睡眠障碍有有益作用。短乳杆菌对小鼠的睡眠节律有好处。
微生物组多样性(丰度,香农多样性和辛普森多样性)与睡眠质量和总睡眠时间增加呈正相关。
研究发现,睡眠不足与肠道微生物的多样性降低有关,睡眠越好,微生物组的多样性就越丰富。
一项2019年的研究发现,睡前60分钟(这是衡量睡眠量和睡眠质量的指标)与肠道微生物多样性降低26%有关。这是在控制了可能影响微生物组成的其他因素之后,包括饮食中纤维和脂肪的摄入量,体力活动和身体质量指数。
肠道微生物的多样性高有助于减轻压力和改善睡眠。除了睡眠不足之外,微生物组多样性的降低还与一系列健康问题有关,包括情绪障碍,焦虑,抑郁,免疫系统功能障碍和自身免疫性疾病。
失眠患者肠道菌群的α和β多样性发生了显著改变。睡眠时间减少可能会导致肠道菌群失调。
肠道菌群是如何影响睡眠的呢?
可以通过肠道菌群与大脑之间的持续不断的相互作用来影响。主要有以下途径:
· 免疫系统途径
大脑和肠道微生物组都影响免疫细胞的活性,并依次相互影响。
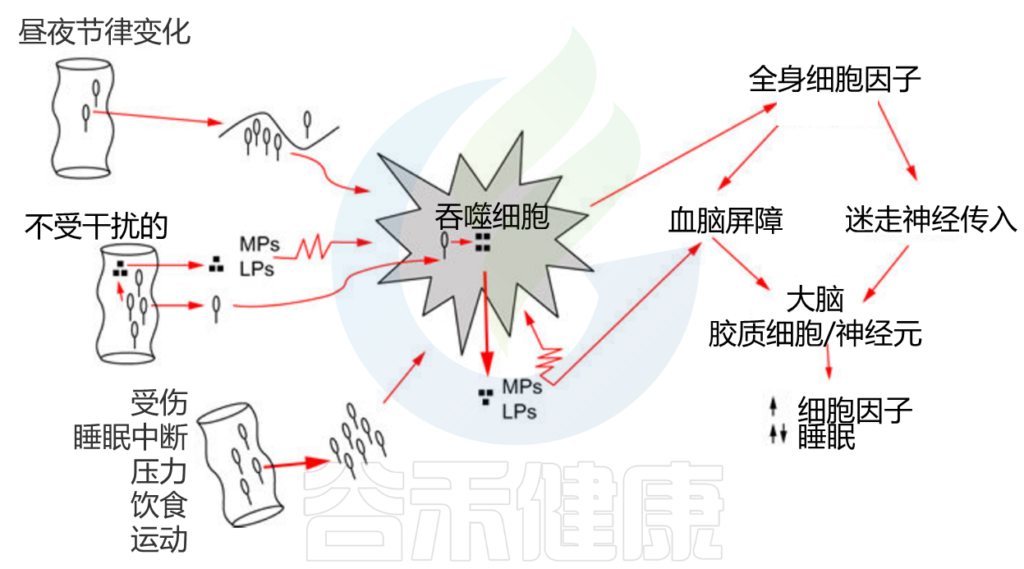
肠道细菌被吞噬细胞(如巨噬细胞或中性粒细胞)吞噬并被消化;消化产物(如MPs、LPS)被释放到周围的细胞间液中。MPs和LPS反过来激活吞噬细胞(如锯齿状细胞膜所示),然后释放细胞因子。全身性细胞因子通过至少两种途径(迷走神经和血脑屏障)进入大脑。
免疫细胞在保持肠道微生物组健康方面发挥了重要作用,并且帮助免疫系统发挥最佳功能。这些细胞执行许多关键功能,包括:
帮助调控微生物组的组成
调节新陈代谢
限制炎症
保护肠道不受感染
保持肠壁坚固(并避免所谓的“漏肠”)
——细菌细胞壁结构成分影响睡眠
微生物细胞壁的结构成分不断刺激先天免疫系统产生细胞因子,产生一种免疫激活的基本状态,从肠粘膜表面开始,影响全身。
当细菌分裂、生长或死亡时,肽聚糖、脂多糖和其他成分被细菌酶降解或改变。宿主吞噬细胞如巨噬细胞和中性粒细胞也可以消化肽聚糖产生胞壁肽(小糖肽)。从革兰氏阳性或革兰氏阴性细菌中分离出来的肽聚糖,诱导睡眠反应,例如,非快速眼动睡眠的持续时间和强度会增强几个小时。如果给吞噬细胞喂养细菌,它们就会释放出具有生物活性的胞壁酰肽;其中一些胞壁酰肽诱导睡眠反应与完整的肽聚糖和热杀死的整个细菌所诱导的睡眠反应相似。
细菌肽诱导肠巨噬细胞和T细胞产生细胞因子白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNFα);细菌细胞壁脂多糖(LPS)诱导IL-18的合成。
IL-1β,TNFa22,IL-18是非快速眼动睡眠的诱导因子。
其他微生物,如病毒及其组分也通过内源性受体(识别病原体相关分子模式,如Toll样受体)促进细胞因子的产生,从而影响睡眠。
· 神经内分泌途径
肠道内有20多种肠内内分泌细胞,构成最大的内分泌器官。
肠道菌群直接参与多种神经递质,细胞因子和代谢产物的产生,例如5-HT,多巴胺,γ-氨基丁酸(GABA),SCFA和褪黑激素等。
某些乳酸杆菌和双歧杆菌可以产生GABA。在失眠患者中经常观察到GABA mRNA的异常表达。
大肠杆菌产生去甲肾上腺素、5-羟色胺和多巴胺;
链球菌和肠球菌产生5-羟色胺;
芽孢杆菌产生去甲肾上腺素和多巴胺。
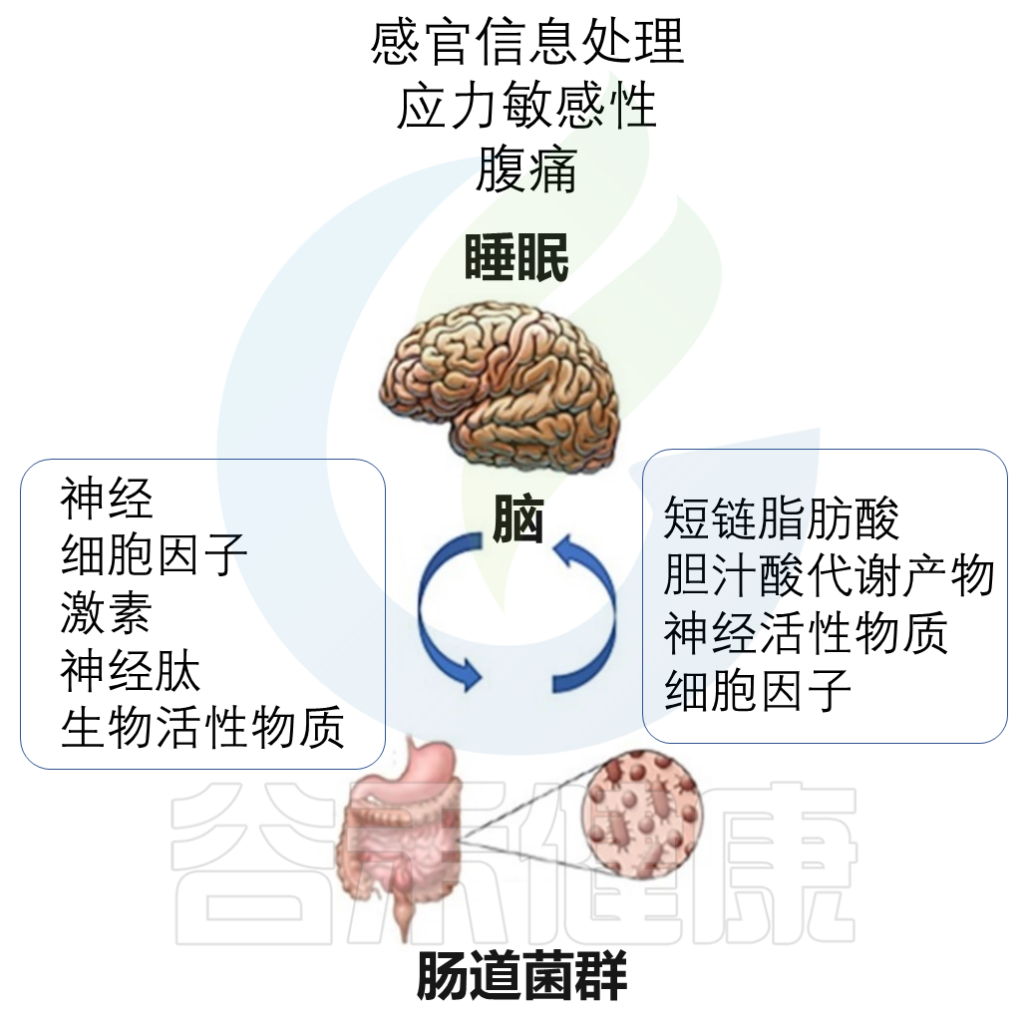
Vernia F,et al., Int. J. Med. Sci.2021
这些代谢物直接作用于肠神经系统和迷走神经,并影响中枢神经系统的活性。
此外,肠道菌群还影响下丘脑-垂体-肾上腺(HPA)轴。
HPA轴参与稳态,参与对新刺激的反应。HPA轴是一种自适应系统,目的是在不断变化的环境中保持体内动态平衡。越来越多的研究表明,睡眠与HPA轴活动之间存在相互关系。
HPA轴亢进会对睡眠产生负面影响,导致睡眠碎片化,深度慢波睡眠减少和睡眠时间缩短。反过来,包括失眠和阻塞性睡眠呼吸暂停在内的睡眠障碍会进一步加剧HPA轴功能障碍。
干预以使HPA轴异常正常化,减少夜间CRH亢进和降低皮质醇可能对治疗失眠和其他睡眠障碍有益。详见本文后面改善睡眠章节。
说起HPA轴,就不得不提到皮质醇。它的作用不容小觑。
皮质醇如何产生?
HPA轴被激活,下丘脑促肾上腺皮质激素释放激素(CRH)的分泌,然后刺激垂体前叶释放促肾上腺皮质激素。然后促肾上腺皮质激素刺激肾上腺释放皮质醇,导致交感神经系统的各种生理反应(如肾上腺素的释放、心率加快和血压升高)。
皮质醇升高可能是睡眠障碍的主要原因
HPA轴障碍可能导致皮质醇升高,当皮质醇水平较高时,会激活糖皮质激素受体。在压力时期去甲肾上腺素和糖皮质激素受体可以优先激活,从而增加促肾上腺皮质激素释放激素。这种升高的促肾上腺皮质激素释放激素会增加睡眠脑电波频率,减少短波睡眠,并增加轻度睡眠和频繁醒来。
皮质醇还与昼夜节律相关,这部分我们在下一章节昼夜节律篇讨论。
· 迷走神经途径
肠肌层神经丛的感觉神经元通过调节肠蠕动和肠激素分泌而接触肠道菌群。肠神经系统也与迷走神经形成突触连接,迷走神经将肠道与大脑连接起来。
细胞因子通过迷走神经传入向大脑发出信号,迷走神经的动作电位进一步诱导胶质细胞和神经元在大脑中产生细胞因子。细胞因子浓度高低与睡眠有关。
低浓度的脑细胞因子能促进睡眠,而高浓度的脑细胞因子则不利于睡眠。
睡眠障碍与肠道菌群失调存在循环关系
前面我们知道,肠道菌群会通过多种途径影响睡眠。
Krueger JM,et al .,Int Rev Neurobiol. 2016
反过来睡眠也会影响肠道菌群。
睡眠不足或者其他因素如受伤、食物摄入、压力、昼夜节律和运动等,可致肠屏障损伤和细菌移位,增加感染易感性,激活HPA轴从而影响菌群。
大多数人(和其他哺乳动物)都存在昼夜节律–控制进食和睡眠等过程的代谢时钟。最常见的昼夜节律周期是控制睡眠的周期,科学家们已发现存在着多种控制着不同生物系统的昼夜节律。
过去的研究已表明如果昼夜节律紊乱,人们可能会遇到健康问题。比如,改变工作时间的轮班工人更容易患睡眠障碍、肥胖、糖尿病等。
昼夜节律——皮质醇
前面提到的皮质醇分泌就有昼夜节律。皮质醇的最低点出现在午夜左右。睡眠开始后约2-3小时,皮质醇水平开始上升,并一直持续到清晨。
早晨醒来时,皮质醇开始迅速升高,并持续升高约60分钟。皮质醇的峰值大约是上午9点。随着一天的继续,水平逐渐下降。随着睡眠的开始,皮质醇持续下降直至最低点。
此外,越来越多的研究都表明,机体的昼夜节律能够调节肠道的免疫反应。
昼夜节律——免疫系统
昼夜节律调节免疫系统,并随之调节炎症水平。
第3组先天淋巴细胞(ILC3s)是昼夜脑-肠信号转导的关键介质。ILC3s表达高水平的昼夜节律基因,光-暗周期的反转导致ILC3s主要的昼夜节律振荡。这种作用依赖于中枢神经系统(CNS)和下丘脑SCN中ARNTL的存在,并进一步与肠道菌群组成的变化有关,特别是变形菌门和拟杆菌门丰度的改变。
注:ARNTL——芳香烃受体核转位因子样蛋白
当昼夜节律被破坏时,正常的免疫功能也会被破坏。这样的情况下,人更容易患上各种疾病。
昼夜节律——肠道菌群
研究发现肠道菌群的两个主要组成部分拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度从白天到晚上呈周期性变化。
肠道菌群受昼夜节律信号的影响,同时也对生物钟基因的表达产生交互作用。
来自美国德克萨斯大学西南医学中心的研究人员发现小鼠小肠中的微生物参与肠道昼夜节律。该研究发现改变受试小鼠中组蛋白乙酰化的过程,即在组蛋白末端添加乙酰基的过程,细菌便可开启HDAC3在位于小肠内壁的上皮细胞中的表达。这进而导致了参与基因表达的同步振荡,这些基因表达与脂质代谢和营养物运输有关。相比之下,肠道无菌的小鼠没有表现出这种节律性调节。
肠道微生物的昼夜节律振荡导致血清代谢产物的振荡,并与周围组织的转录和表观遗传波动有关。
昼夜节律——肠道菌群代谢产物
短链脂肪酸影响生物钟基因表达和睡眠模式
肠道微生物代谢产物,短链脂肪酸乙酸、丙酸、丁酸在一天中会发生变化,粪便样本中的最高浓度出现得较早,并且在一天中不断降低。短链脂肪酸可能会影响生物钟基因的表达。
研究发现,肠道微生物群的缺乏,以及微生物代谢物的缺乏,导致中枢和肝脏生物钟基因表达明显受损,这表明肠道微生物群在分子水平上传播生物钟的可能性。
在体外,发现在给予乙酸钠和丁酸钠后,小鼠肝细胞中时钟基因Bmal1和Per2的表达发生了显著变化。
在不同的光照-暗期和摄食周期下,添加乙酸后Per2表达量较高,添加丁酸后Per2表达量较低;短链脂肪酸处理后Bmal1表达持续升高,尤其是丁酸处理。
在无菌小鼠体内,关灯两小时后用丁酸盐治疗5天(小鼠处于活跃期),导致肝细胞中Per2:Bmal1 mRNA比值显著增加。此外,同样的处理也导致了中基底下丘脑细胞中Per2:Bmal1 mRNA比值的非显著增加(p=0.053)。Bmal1和Per2等时钟基因在分子水平上调控昼夜节律;它们的比率是肝脏代谢调节网络的标志。
丁酸盐在肠道菌群与大脑产生睡眠的机制之间提供重要联系。
进一步的研究表明,门静脉注射丁酸盐可导致小鼠非快速眼动睡眠增加70%;全身皮下和腹腔注射丁酸盐对睡眠无影响。这些结果表明,丁酸盐的睡眠诱导作用是由肝脏感觉机制介导的。
昼夜节律——肠上皮屏障
肠道菌群通过肠上皮细胞昼夜节律因子调节。
肠上皮细胞协调消化、免疫和神经内分泌功能,是人体最重要的屏障之一。胞壁肽(MPs)或脂多糖(LPS),通过肠上皮屏障转运。
通过受损的伪反应调节器(PRR)信号,导致过氧化物酶体增殖物激活受体α(PPARα)的永久表达,肠道微生物群的消失会破坏肠上皮细胞中Bmal1和Cry1时钟基因的表达,导致肠上皮细胞活动的完全丧失。
此外,肠道菌群也受饮食周期调控,我们将在下一章节详细了解它们之间的关联。
睡眠与昼夜节律、食物摄入、运动和压力源密切相关;这些变量还相互影响,使它们在睡眠中的行为复杂化。饮食、进餐时间和睡眠之间的联系是相互的,因为昼夜节律驱动着代谢模式的变化,而代谢和营养状况的改变则影响着昼夜节律。
我们常听说健康的饮食,生活方式以及合理的饮食习惯有助于心理和身体健康。
辛辣食物、兴奋剂和不良食物反应(不耐受和食物过敏)影响睡眠可以理解。然而,为什么说不吃饭,吃得太快或吃得过饱,吃饭时间不规律,食物质量差,这些也都是导致睡眠障碍的饮食原因?
从本质上讲,饮食摄入与肠道菌群组成有关,因为我们摄入的食物是微生物生长的主要基质。我们饮食的改变可以在几天内导致我们肠道菌群重塑。
摄食节律和昼夜节律的破坏会导致肠道细菌的时间特异性变化。昼夜节律紊乱也会增加肠上皮屏障的通透性。
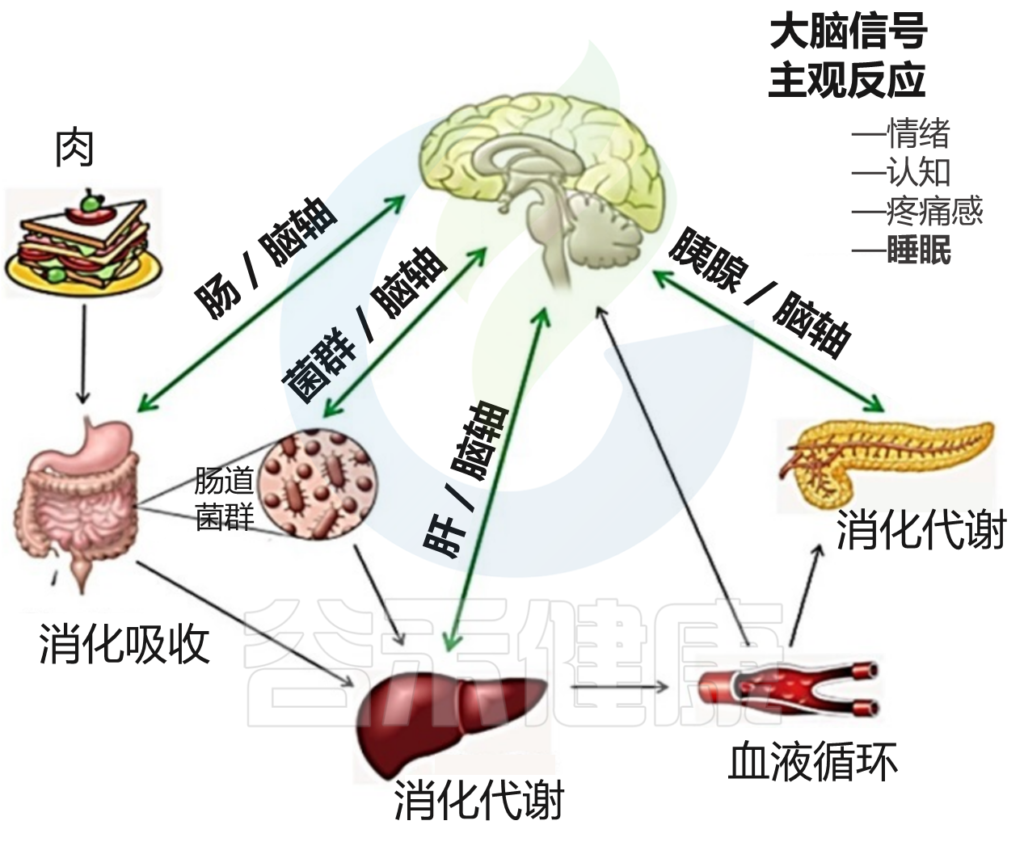
Vernia F,et al., Int. J. Med. Sci.2021
饮食行为影响人类睡眠的时间和质量。睡眠时间短和高能量摄入之间有一致联系。
食物中营养物质影响睡眠
营养物质影响激素的产生,包括生长激素、催乳素、睾酮、褪黑素和血清素,所有这些都在调节生物钟中发挥作用。
食物中存在的氨基酸,如苯丙氨酸、组胺和酪氨酸,促进肾上腺素、去甲肾上腺素和其他刺激性神经递质的产生和释放,可能损害睡眠。
影响色氨酸供应或血清素和褪黑素合成的食物则促进睡眠。一些维生素(B1和B6)也能诱导褪黑素和血清素的产生和释放。
饮食习惯影响睡眠
进餐的时间,特别是零食的频率,使昼夜节律失去同步,影响新陈代谢,并促进肥胖。这与生物钟在调节激素和神经递质释放中的作用是一致的。
不吃饭、或者晚餐十分丰盛的现象越来越普遍。然而将主要热量摄入转移到一天结束时会对消化产生不利影响,并使睡眠困难;如果膳食丰富且脂肪丰富,则更是如此。
相反,碳水化合物对睡眠模式的作用仍有争议,碳水化合物的重量与热量负荷的关系也有争议。
为什么很想吃垃圾食品?
压力在影响饮食模式方面很重要,可能是通过改变下丘脑-垂体-肾上腺轴,让人对垃圾食品(高脂肪和精制糖)产生强烈的渴望。
久坐的生活方式,睡眠时间短同样会让人想吃高能量食物。
为什么睡眠不足与想吃高能量食物有关?
下丘脑外侧神经元通过不同的回路表达神经肽,如黑色素浓缩激素和食欲素/下视黄醇,在调节食物摄取、觉醒、运动行为和自主神经功能方面发挥重要作用。
睡眠限制与饱食因子瘦素浓度降低、促饥饿激素ghrelin浓度增加有关,从而改变了它们发出正确热量需求信号的能力。于是又会促进代谢综合征和肥胖,并再次对生物钟产生不利影响。
注:Ghrelin是一种神经肽,参与睡眠-觉醒调节。
此外,食欲素Orexins在能量稳态和警觉状态之间提供联系,并参与多巴胺能奖赏系统。在动物模型中,产生食欲素的基因突变导致了睡眠表型的改变。有假设说,在清醒时,产生食欲素的细胞的高活性,而在睡眠时几乎没有这种活性,也会影响睡眠。
越来越多的证据也表明睡眠会影响饮食选择。睡眠较少的人更可能喜欢高能量的食物(如脂肪和精制碳水化合物),吃较少的蔬菜,并选择不规律的饮食模式。
糖摄入与睡眠
糖会对肠道健康产生特定作用。有大量证据表明,标准的西方饮食(加工糖和高脂)会导致肠道微生物群的组成发生变化。
上一小节提到的多巴胺奖赏系统与糖摄入也有关系。研究表明,糖是一种有力的触发剂,含糖的食物足以刺激大脑的奖赏系统,从而对食物产生更多的渴望,
糖还有其他间接影响我们肠道健康的方法。高糖饮食会加剧慢性炎症,而炎症则会损害肠道菌群的多样性和功能。经常食用添加糖的饮食可能导致体重增加。
另外添加糖还会升高胆固醇,这与炎症增加有关。关于炎症和睡眠的关系将在下一章节详述。
所有含糖食物(例如水果)都会影响睡眠吗?
不是的。水果之类的天然含糖的食物提升人血糖的速度,远没有含添加糖的食物快。天然食品中纤维含量很高,人体吸收糖的速度变慢,阻止血糖水平飙升。
炎症和睡眠障碍也是双向联系的。
炎症是免疫系统的一种天然的,保护性的生物反应,可以抵抗有害的外来病原体(细菌,病毒,毒素),并帮助身体从受伤中恢复健康。急性炎症的症状包括肿胀和发红,发烧,发冷,疼痛和僵硬以及疲劳,这些迹象表明人体的免疫系统处于“战斗模式”。
睡眠障碍会加剧慢性低度炎症,这是导致疾病的重要因素。不需要几年或者几个月,哪怕只是一晚上的完全睡眠不足就足以提高促炎生物标志物、肿瘤坏死因子α(TNFα)和C反应蛋白(CRP)的循环水平;血清CRP水平随着4天的完全睡眠不足而逐渐升高。
有研究发现,一晚上完全睡眠不足,白细胞介素(IL-6)细胞因子升高,一周失眠不足(每晚4-6小时),IL-6和TNFα的24小时分泌量也会增加。
全身性炎症也会破坏健康的睡眠。通过触发生理和心理变化,让人难以获得良好的睡眠。
细胞因子升高与睡眠困难有关。炎症会在体内造成疼痛和僵硬,使人难以入睡。身体上的疼痛是失眠和其他睡眠问题的常见因素。关于慢性疼痛将在下一章节详细介绍。
炎症涉及较高水平的皮质醇,皮质醇前面了解过,可刺激机敏并导致心理压力。压力是健康睡眠的最重要的常见障碍之一。
7.1 压力,抑郁与睡眠障碍
压力与睡眠
2017年进行的一项研究,压力对大鼠睡眠和肠道健康的影响。通过对小鼠尾部冲击睡眠模式中断。结果发现肠道菌群失去了多样性。少数菌群控制着肠道微生物,失去平衡是不健康的。当他们给小鼠服用益生元时,肠道菌群变得更加多样化,并包含了更多有益菌,如鼠李糖乳杆菌,睡眠变得更好,包括REM和非REM睡眠。
昼夜节律引发情绪波动和睡眠障碍
临床经验表明,扰乱昼夜节律挑起时差综合征或减少睡眠可以触发情绪波动和睡眠障碍。
核心时钟基因突变会引起肠道菌群失调。多种时钟基因变异易患精神疾病,例如重度抑郁症(MDD),双相情感障碍(BD),注意力缺陷多动障碍(ADHD),精神分裂症等。
微生物GABA产生(这是中枢神经系统的主要抑制性神经递质,已证实GABA受体的激活有利于睡眠)对抑郁症和肠道微生物多巴胺代谢物的能力的潜在贡献。
3,4-二羟基苯乙酸(一种主要包含在浆果、水果和蔬菜中的膳食多酚)的合成,与较高的心理生活质量感知相关。
7.2 慢性疼痛与睡眠障碍
慢性疼痛可以对睡眠有不同的影响并取决于疼痛的性质。
疼痛可能在夜间无法缓解,导致睡眠不足。除了缩短总体睡眠时间外,最常见的,慢性疼痛还会导致夜间频繁起床。我们会在轻度睡眠,慢波睡眠和快速眼动(REM)睡眠之间循环。破坏该周期会干扰睡眠阶段的进展,并导致睡眠不足和第二天的疲倦。
疼痛带来的情绪不佳
疼痛也可能伴有焦虑,压力或抑郁。据估计,三分之一的慢性疼痛患者也符合临床抑郁症。这些状况本身会导致睡眠问题。
慢性疼痛间接影响睡眠
患有慢性疼痛的人白天可能会感到疲劳。那么他们不太能做到锻炼或遵循健康饮食,然而这两者对于获得良好的睡眠很重要。
慢性疼痛导致的不稳定睡眠也会打扰夫妻同床,对他们的睡眠质量和健康产生相应的影响。
睡眠对疼痛的影响
新的研究表明,睡眠对疼痛的影响甚至可能比疼痛对睡眠的影响还要强。
睡眠不好导致对疼痛敏感性增强
研究人员发现,睡眠时间短,睡眠分散和睡眠质量差等问题通常会导致第二天对疼痛的敏感性增强,诸如类风湿关节炎。患有睡眠问题的人似乎更有可能最终患上诸如肌痛和偏头痛等疾病。当失眠引起的疼痛加剧时,女性比男性更敏感,年轻人比老年人更有弹性。
慢性疼痛与睡眠障碍的不良循环
患有慢性疼痛的人可能患有自我延续的周期,疼痛,失眠,抑郁或焦虑。例如,遭受痛苦的人在无法入睡时可能会感到焦虑,睡眠不好,醒来时会感到沮丧,这增加了他们对疼痛的敏感性。第二天晚上又开始疼痛,无法入睡,周期一直循环。久而久之,状况可能更加恶化。
前面提到的褪黑素,除了它在调节昼夜节律中的作用,新的研究开始发现褪黑激素在我们对疼痛的感知中产生作用。维生素D、多巴胺也似乎在睡眠和疼痛中都起着作用。
7.3 消化系统疾病与睡眠障碍
胃食管反流性疾病
胃食管反流病以病理性酸或非酸反流为特征,并与多种可能影响上消化道(反流、烧心、疼痛)和/或诱发呼吸道症状(声音嘶哑、发音困难、慢性喉炎、咳嗽、哮喘和慢性支气管炎)的紊乱有关。
有强有力的证据表明胃食管反流病与睡眠障碍之间存在双向关系,因为胃食管反流病的症状会导致入睡困难、睡眠分裂和清晨醒来,而睡眠障碍又会诱发食管痛觉过敏。
因此,有睡眠障碍的胃食管反流病患者比没有睡眠障碍的患者有更严重的症状和更差的生活质量。据报道,在这些患者中,焦虑和抑郁的患病率很高,在某种程度上是由睡眠障碍直接介导的。
IBS
IBS患者的睡眠障碍是有据可查的,入睡困难、睡眠时间短、频繁觉醒等。最近的一项荟萃分析有63620名参与者,结果显示IBS患者睡眠障碍的患病率为37.6%。
IBD
前面章节我们已经知道,炎性细胞因子如肿瘤坏死因子-α(TNF-α)、IL-1和IL-6可引起睡眠障碍,而睡眠障碍可上调细胞因子,尤其是IL-1和TNF-α。(IL-1参与生理性睡眠调节和睡眠对微生物的反应)
临床研究发现睡眠障碍、亚临床炎症和IBD复发风险之间存在关联。最近的一项研究报道,使用匹兹堡睡眠质量指数评估睡眠质量差与粘膜愈合不良有关(P<0.05)。
7.4 肝病与睡眠障碍
睡眠障碍可能发生在急性和慢性肝炎,但更常见于肝硬化患者。相当一部分肝硬化和急慢性肝衰竭患者患有失眠、睡眠延迟和白天过度嗜睡。
肝硬化
最近一项对341名病毒性肝硬化患者的研究证实了这种关联,报告称匹兹堡睡眠质量指数显著升高。多导睡眠图异常也存在。
肝性脑病
睡眠障碍通常是肝性脑病的早期症状,导致日常嗜睡,增加受伤风险,降低生活质量。
肝脏和大脑之间的神经和体液通讯途径尚不完全清楚,但炎症细胞因子如TNF-α、IL-1和IL-6发挥了作用,它们改变了中枢神经递质(血清素和促肾上腺皮质激素释放激素)的浓度。
60%的慢性丙型肝炎患者存在睡眠障碍。
脂肪性肝炎
脂肪性肝炎患者的睡眠障碍可能与肝细胞活性受损和多余脂质处理受损有关。酒精对肝脏和中枢神经系统有直接毒性作用。
最近的分析(2272名参与者)表明,阻塞性睡眠呼吸暂停与脂肪变性、小叶炎症、气球样变性和纤维化显著相关。
瘙痒在慢性肝病患者中很常见,在原发性胆管炎等胆汁淤积性肝病患者中更常见。随之而来的往往是睡眠障碍和生活质量低下。
肝病中瘙痒的患病率从慢性丙型肝炎的5%到原发性胆汁性肝硬化的70%不等。胆汁盐、组胺、5-羟色胺、孕酮代谢物浓度的增加可能与此有关。
7.5 肥胖与睡眠障碍
前面饮食章节我们已经知道,睡眠不足会使身体发出错误信号导致饮食过量,对高热量食物难以抗拒,吃过多自然容易肥胖。
当然,肥胖也会导致睡眠障碍。
超重和肥胖通过胃食管反流病和非酒精性脂肪肝以及阻塞性睡眠呼吸暂停患病率的增加而导致睡眠障碍。
肥胖与阻塞性睡眠呼吸暂停综合征之间存在着相互关系。阻塞性睡眠呼吸暂停会促进行为、代谢和/或激素的变化,促使体重增加和/或减肥困难。阻塞性睡眠呼吸暂停综合征(OSA)与激素水平有关,其特点是瘦素和胃饥饿素水平高,进而促使能量摄入过高。
体重增加10%与患阻塞性睡眠呼吸暂停综合征的概率增加50%有关。当然,体重减轻会减少严重的阻塞性睡眠呼吸暂停,改善睡眠,进一步减轻体重。
因此,阻塞性睡眠呼吸暂停、睡眠时间短和体重增加之间存在关系。一些证据表明,嗜睡与肥胖有关,在没有睡眠呼吸暂停的情况下也是如此。
营养物质改善睡眠
维生素B6
在失眠研究中分析失眠患者中肠道菌群中的维生素B6分解代谢(ko00750)显着增强,导致宿主体内维生素B6缺乏。据报道,维生素B6是失眠症的一种常见治疗方法,维生素B6缺乏会导致疲劳和抑郁。因此,补充维生素B6可以改善失眠症状。
维生素B6食物来源:麦麸、葵花子、大豆、糙米、香蕉、动物肝脏及肾脏、鱼类、瘦肉、坚果等。
叶 酸
叶酸参与髓鞘的形成,在脑脊液和细胞外液中分布较多,可缓解因抑郁导致的失眠,对于人体精神和情绪方面的健康起到重要性的作用。
叶酸食物来源:芦笋,西兰花,胡萝卜,燕麦,奇异果等。
镁
镁补充剂有时用于治疗睡眠障碍,改善睡眠质量并减少睡眠潜伏期(即入睡时间)。一项研究发现,每天服用500mg可以改善老年人的失眠症状。
同时,补充镁也有助于减轻抑郁症症状。
镁食物来源:南瓜子,煮熟的菠菜,黑豆,藜麦,杏仁,腰果,鳄梨,三文鱼等。
锌
除了镁,锌也有促进睡眠的作用,可以改善大脑神经细胞的代谢,平时可以适当多吃一些海鲜、坚果类食物以及全谷类食物,都有助于为身体补充锌元素。
L-茶氨酸
L-茶氨酸:一种氨基酸,L-茶氨酸可以改善放松和睡眠。
益生菌干预
益生菌是一种活的微生物,当其存在的量足够时,可以为宿主带来健康益处,例如发酵食品,如酸奶,开菲尔,豆豉,泡菜,康普茶等。
很少有研究测试通过控制肠道微生物群来改善睡眠的有效性。在一项32名医科学生参加的临床试验中,发现益生菌加氏乳酸杆菌CP2305能显著改善睡眠质量,这可以通过PSQI评分的变化来衡量。在服用了益生菌的男性参与者中,这种改善更为明显,在床上入睡时间的减少。
注:匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)是美国匹兹堡大学精神科医生Buysse博士等人于1989年编制的。该量表适用于睡眠障碍患者、精神障碍患者评价睡眠质量,同时也适用于一般人睡眠质量的评估。
同时,15种肠道微生物的相对丰度在对照组和益生菌组之间有所不同,包括Bact. Vulgatus的减少,在使用益生菌后增加了Dorea Longicatena.
额外的双盲随机对照试验发现,补充益生菌混合物(含Lactobacillus fermentum LF16, L.rhamnosus LR06, L.plantarum LP01,长双歧杆菌 Bifidobacterium longum BL04 ),在年轻健康的参与者中,随着时间的推移,导致PSQI得分下降。
注:PSQI得分越高,表示睡眠质量越差。
高皮质醇诱发的睡眠问题的替代方法
解决慢性皮质醇水平升高的有效方法是确保肾上腺得到适当的营养支持。维生素B6,维生素B5(泛酸)和维生素C通常会由于肾上腺活动时间过长和皮质醇的产生而耗尽。这些营养物质在肾上腺的最佳功能和肾上腺激素的最佳制造中起关键作用。在压力时期,这些营养素的水平可以降低 。
改善睡眠的另一种方法是针对GABA(γ-氨基丁酸)活性。增加GABA活性将降低蓝斑,下丘脑室旁核和HPA轴活性。支持GABA功能的一种方法是减少谷氨酸信号。谷氨酸和GABA活性彼此相反。因此,降低谷氨酸的活性将支持健康的HPA轴活性。
Tips
1 不要在深夜吃东西,破坏微生物生物钟,还会促进胃反流。
2 多吃纤维。纤维有助于有益菌生长。纤维食物包括朝鲜蓟,芦笋,洋葱,豆类,绿叶蔬菜和大多数非淀粉类蔬菜。

3 尝试睡前禁食,禁食会使身体处于“待机”状态,可以自我修复。身体在睡眠过程中会继续燃烧卡路里。睡前禁食,早晨更有可能感到饥饿。可能会促使早起。
4 如果一定要吃,尽量吃易消化食物。消化过程让人清醒睡不着,因此最好在睡前避免食用难消化的食物。包括:脂肪或油炸食品、辛辣食物、酸性食品、碳酸饮料等。
5 多吃各种食物,有益于维持人体健康的微生物群。均衡饮食,食物中的营养素在产生褪黑素以及其他有助于调节睡眠的重要神经递质中起着巨大作用。

6 尝试补充益生元。已显示许多益生元可在人类受试者中发挥作用。如低聚果糖和低聚半乳糖等。
7 创建理想睡眠环境。
关闭电子产品(就寝前30分钟至1小时),保持卧室适宜温度(在16至19°C之间)等

8 调整灯光。晚上关掉灯或调暗灯,黑暗下人体会分泌更多褪黑素,有助于睡眠,当然,早上拉开窗帘享受阳光,可以帮你清醒。
9 舒适的床是最佳睡眠环境。旧的床垫和枕头会引起疼痛和酸痛,难以获得优质的睡眠。通常,专家建议每10年更换一次床垫,每两年更换一次枕头。当然也取决于床垫枕头质量。

10 保持规律作息。最好每天在同一时间上床睡觉,早上同一时间起床,确保人体昼夜节律时钟正常运作。即使在周末或休息日最好也是如此。

11 避免白天睡过多。如果已经出现睡眠障碍,那么白天尽量不要睡觉。如果有午睡习惯,尽量控制在30分钟之内,且在下午3点之前完成。
12 睡前放松,可以进行温水浴,泡脚,深呼吸,做些伸展运动,适量阅读,听听舒缓的音乐等,这些准备工作都有助于良好的睡眠。当有压力或焦虑时,身体会产生更多的皮质醇,皮质醇过高可能导致夜间频繁醒来。

13 如果实在在20分钟或更长时间内无法入睡,请起床并做一些容易累的事情。最重要的是离开床。
14 运动是帮助睡眠的良好方式,如果可以的话,每天至少20-30分钟锻炼,每周五次左右,但不要在睡前剧烈运动。

15 随着年龄的增长,褪黑素水平会下降。可以购买褪黑激素补充剂,该补充剂已被证明可以帮助55岁以上的人们更快入睡和更长的睡眠。睡前一个小时服用。褪黑激素还可以增强肠道微生物的健康多样性。如长期服用需咨询医生。

【附录】
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
相关阅读:
主要参考文献:
Vernia F, Di Ruscio M, Ciccone A, Viscido A, Frieri G, Stefanelli G, Latella G. Sleep disorders related to nutrition and digestive diseases: a neglected clinical condition. Int J Med Sci. 2021 Jan 1;18(3):593-603. doi: 10.7150/ijms.45512.
Krueger JM, Opp MR. Sleep and Microbes. Int Rev Neurobiol. 2016;131:207-225. doi: 10.1016/bs.irn.2016.07.003. Epub 2016 Aug 31.
Matenchuk Brittany A,Mandhane Piush J,Kozyrskyj Anita L,Sleep, circadian rhythm, and gut microbiota.[J] .Sleep Med Rev, 2020, 53: 101340.
Hertenstein E., Feige B., Gmeiner T., Kienzler C., Spiegelhalder K., Johann A., Jansson-Frojmark M., Palagini L., Rucker G., Riemann D., et al. Insomnia as a Predictor of Mental Disorders: A Systematic Review and Meta-Analysis. Sleep Med. Rev. 2019;43:96–105.
Poroyko V.A., Carreras A., Khalyfa A., Khalyfa A.A., Leone V., Peris E., Almendros I., Gileles-Hillel A., Qiao Z., Hubert N., et al. Chronic Sleep Disruption Alters Gut Microbiota, Induces Systemic and Adipose Tissue Inflammation and Insulin Resistance in Mice. Sci. Rep. 2016;6:35405.
Kinnucan J.A., Rubin D.T., Ali T. Sleep and Inflammatory Bowel Disease: Exploring the Relationship between Sleep Disturbances and Inflammation. Gastroenterol. Hepatol. (N.Y.) 2013;9:718–727.
Bowers S.J., Vargas F., Gonzalez A., He S., Jiang P., Dorrestein P.C., Knight R., Wright K.P., Jr., Lowry C.A., Fleshner M., et al. Repeated Sleep Disruption in Mice Leads to Persistent Shifts in the Fecal Microbiome and Metabolome. PLoS ONE. 2020;15
Smith R.P., Easson C., Lyle S.M., Kapoor R., Donnelly C.P., Davidson E.J., Parikh E., Lopez J.V., Tartar J.L. Gut Microbiome Diversity is Associated with Sleep Physiology in Humans. PLoS ONE. 2019;14:e0222394.
Durgan DJ. Obstructive sleep apnea-induced hypertension: role of the gutmicrobiota. Curr Hypertens Rep. 2017; 19: 35
Reynolds AC, Paterson JL, Ferguson SA, Stanley D, Wright KP Jr, Dawson D.The shift work and health research agenda: considering changes in gutmicrobiota as a pathway linking shift work, sleep loss and circadianmisalignment, and metabolic disease. Sleep Med Rev. 2016; 34: 3-9.
Parisi P, Pietropaoli N, Ferretti A, Nenna R, Mastrogiorgio G, Del Pozzo M, etal. Role of the gluten-free diet on neurological-EEG findings and sleepdisordered breathing in children with celiac disease. Seizure. 2015; 25: 181-183
Michalopoulos G, Vrakas S, Makris K, Tzathas C. Association of sleep qualityand mucosal healing in patients with inflammatory bowel disease in clinicalremission. Ann Gastroenterol. 2018; 31: 211-216.
Wang B, Duan R, Duan L. Prevalence of sleep disorder in irritable bowelsyndrome: A systematic review with meta-analysis. Saudi J Gastroenterol.2018; 24: 141-150.
谷禾健康

现在经济飞速发展,随着生活条件改善,人们的寿命开始变长,对健康长寿的研究也逐渐开始增多。
然而寿命变长却不一定健康,越来越多人开始患上各种慢性疾病。
慢性疾病怎么来的?
首先从炎症开始。炎症其实是身体在与自身有害的物质(例如感染,毒素)作斗争来自愈的过程。当细胞要被破坏时,身体就会释放化学物质,从而触发免疫系统的反应。
当这种反应持续存在时,就会发生慢性炎症,身体处于持续的警觉状态。随着时间的流逝,慢性炎症可能会对组织和器官造成负面影响。于是各种疾病就开始了。
那慢性疾病为什么与肠道健康有关呢?
看过我们文章的朋友,大概已经开始有了这样的概念:许多疾病始于肠道。
因为免疫系统有很大一部分在肠道,具体来讲,这要涉及到肠道通透性的问题。
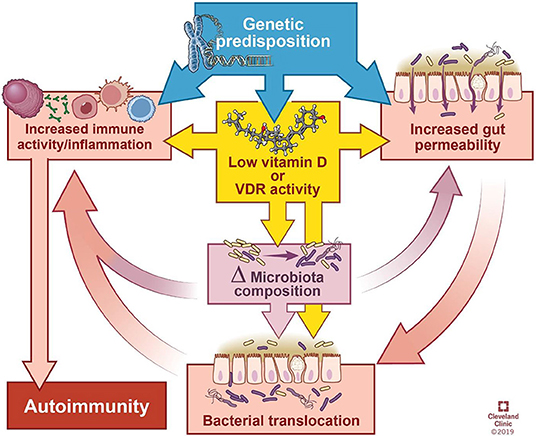
来自麻省总医院儿童医院腹腔研究和治疗中心主任Fasano博士和他的团队发现了zonulin蛋白(连蛋白),这为研究肠道通透性功能的新方法打开了大门,不仅因为它影响肠道,而且还影响了整个过程中炎症和自身免疫的作用。
除了基因组成和暴露于环境诱因外,还有三个引起慢性炎症性疾病的额外因素:
肠道通透性的不适当增加(可能受肠道菌群组成的影响);
负责耐受性免疫应答平衡的“超好战”免疫系统;
肠道菌群的组成及其对免疫系统的表观遗传影响宿主基因组的表达。
近十年来,人们开始越来越多关注到人类遗传学、肠道微生物组学和蛋白质组学,表明粘膜屏障功能的丧失,特别是胃肠道粘膜屏障功能的丧失,可能会严重影响抗原的运输,最终影响肠道微生物组和免疫系统之间密切的双向相互作用。
这种相互作用对宿主肠道免疫系统功能的形成有很大影响,并最终将遗传易感性转化为临床结果。这一观察导致了对慢性炎症性疾病流行的可能原因的重新审视,表明肠道通透性的关键致病作用。
临床前和临床研究表明,连蛋白家族是调节肠通透性的一组蛋白质,与多种慢性炎症性疾病有关,包括自身免疫性,感染性,代谢性和肿瘤性疾病。这些数据为多种慢性炎症性疾病提供了新的治疗靶点,其中连蛋白途径与它们的发病机理有关。
Fasano指出,根本没有足够的基因来解释众多慢性疾病,基因也不能解释疾病发作的时间。他说,要解决这些谜团,我们必须关注微生物组,因为“决定个人临床命运的是个体之间的相互作用和我们所生活的环境。”
除了微生物本身,肠粘膜的状况也起着重要作用。Fasano解释说:“尽管这种巨大的粘膜界面(200 m2)看不见,但它通过与周围环境中各种因素的动态相互作用而起着关键作用,这些因素包括微生物,营养素,污染物和其他物质。”
虽然过去人们认为细胞内紧密连接是静态且不可渗透的,但我们现在知道并非如此。正如Fasano所解释的,连蛋白是肠道渗透性的强大调节剂。然而,尽管连蛋白是肠道通透性的生物标志物,并在许多慢性炎性疾病中起着致病作用,但并非所有慢性炎症性疾病都是由肠道渗漏引起的。
在他的综述中,一篇题为“Zonulin,一种上皮和内皮屏障功能的调节因子,及其在慢性炎症疾病中的作用”的文章,详细描述了“导致慢性炎症疾病的连锁反应”。
在正常情况下,你的肠道会保持健康的内稳态,当遇到抗原时,不会发生过度的免疫反应。在图中第2点,肠道菌群失调(即肠道菌群的数量和多样性不平衡)正在形成,导致连蛋白的过量生产,从而使肠道内壁更容易渗透。
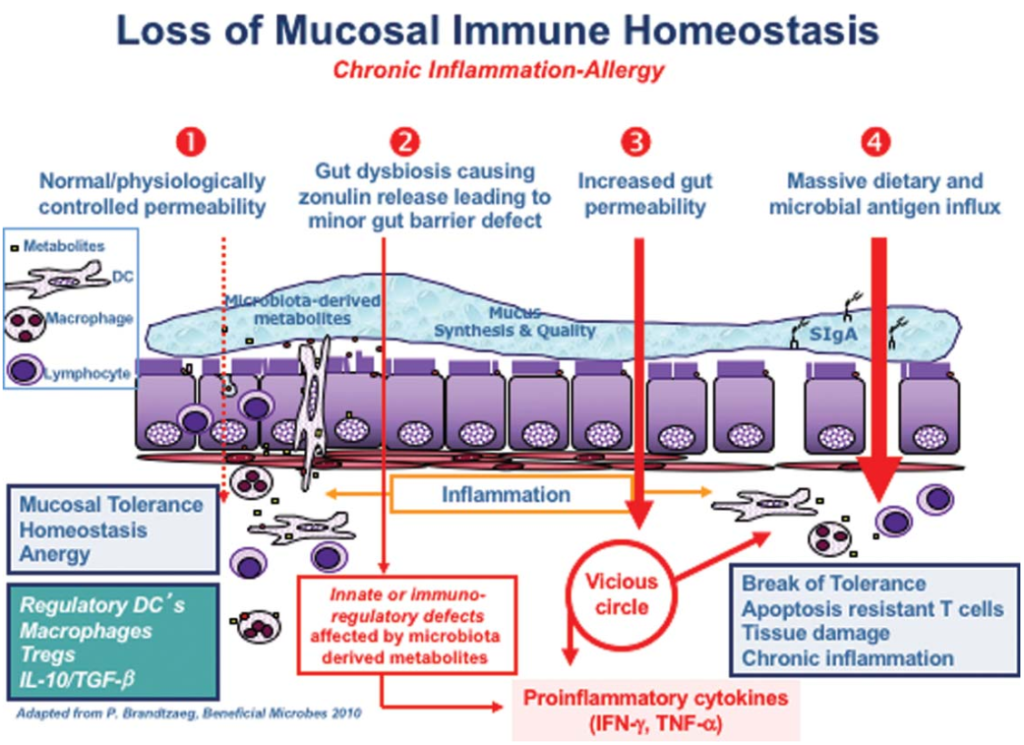
Sturgeon C et al., Tissue Barriers, 2016
两个最强大的触发连蛋白释放是细菌过度生长和谷蛋白。连蛋白是对坏细菌的反应产生的——它通过打开紧密连接帮助细菌排出体外,所以细菌过度生长是有意义的。但是为什么它对谷蛋白有反应呢?
有趣的是,连蛋白途径将谷蛋白误解为微生物的潜在有害成分。这就是为什么谷蛋白会触发连蛋白的释放。虽然Fasano没有提到,除草剂草甘膦也触发连蛋白,而且是谷蛋白10倍的效力!
随后的通透性允许微生物群衍生的抗原和内毒素从管腔迁移到固有层(肠粘膜的结缔组织),从而引发炎症。
随着过程的继续恶化(上图中第3阶段),适应性免疫反应开始,触发促炎性细胞因子的产生,包括干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)。这些细胞因子使通透性进一步恶化,从而形成恶性循环。
最终(第4阶段),粘膜耐受性被完全破坏,导致慢性炎症性疾病的发作。
最终出现的特定的慢性炎症性疾病,部分取决于你的基因组成,部分取决于你所接触的类型以及部分取决于肠道菌群组成。
除了遗传易感性和环境触发因素外,各种慢性炎症性疾病的发病机理还涉及到相互影响的肠道通透性/ Ag转运,免疫激活以及肠道菌群的组成/功能的变化。
连蛋白是上皮和内皮屏障功能的调节剂,肠营养不良可能导致连蛋白的释放,从而导致腔内物质穿过上皮屏障的释放,导致促炎性细胞因子的释放,而促炎性细胞因子本身会导致通透性增加,形成恶性循环,从而导致大量的饮食和微生物Ag大量涌入,触发了T细胞的活化。
根据宿主的遗传组成,活化的T细胞可能保留在胃肠道内,导致肠道慢性炎症性疾病或迁移到几个不同的器官以引起全身性慢性炎症性疾病。”
与zonulin通路失调相关的慢性炎症疾病包括:
自身免疫性疾病如腹腔疾病、1型糖尿病、炎症性肠病、多发性硬化症和强直性脊柱炎
代谢紊乱如肥胖、胰岛素抵抗、非酒精性脂肪肝、妊娠期糖尿病、高脂血症和2型糖尿病
肠道疾病如肠易激综合征、非腹腔麸质敏感性和环境肠道功能障碍
神经炎症性疾病如自闭症谱系障碍、精神分裂症、重度抑郁症和慢性疲劳/肌痛性脑脊髓炎
癌症脑癌和肝癌
2018年,发现的肠道菌群实际控制肝脏中的抗肿瘤免疫应答,并且抗生素可以改变免疫细胞的组成在肝脏中触发肿瘤生长。
哈佛医学院的研究人员已经确定了肠道微生物的特定种群,可以调节局部和系统的免疫反应来抵御病毒入侵。
某些肠道细菌也会促进炎症,炎症是几乎所有癌症的潜在因素,而其他细菌则会抑制炎症。某些肠道细菌的存在甚至可以增强患者对抗癌药物的反应。
肠道菌群提高癌症治疗效果的一种方法:
激活你的免疫系统,让它更有效地发挥作用。
研究人员发现,当这些特定的微生物缺失时,某些抗癌药物可能根本不起作用。
最近的研究表明,肠道细菌也参与了抗病毒防御。
哈佛医学院的研究人员第一次确定了特定的肠道微生物群,这些菌群调节局部和全身免疫反应,抵御病毒侵略者。这项工作确定了一组肠道微生物,以及其中的一个特定物种,它能使免疫细胞释放出抗病毒化学物质——1型干扰素。
研究人员进一步确定了许多肠道细菌共有的确切分子,它开启了免疫保护级联反应。研究人员指出,这种分子并不难分离,可能成为增强人类抗病毒免疫的药物的基础。”
虽然这些发现还需要重复和证实,但它们指出了一种可能性:你也许可以通过在肠道中重新播种脆弱拟杆菌和拟杆菌科的其他细菌,来增强你的抗病毒免疫。
这些细菌启动一个信号级联,诱导干扰素的释放,通过刺激免疫细胞攻击病毒,并导致病毒感染的细胞自我毁灭来保护免受病毒入侵。
具体来说,驻留在细菌表面的一个分子通过激活所谓的TLR4-TRIF信号通路触发干扰素的释放,这种细菌分子刺激免疫信号通路,该通路由9种toll样受体(TLR)之一启动,TLR是先天免疫系统的一部分。
最近的研究还强调了维生素D在肠道健康和全身自身免疫中的作用。一篇综述文章发表于《免疫学前沿》中:
自身免疫性疾病往往会导致维生素D缺乏症,这会改变微生物组和肠道上皮屏障的完整性。
这篇综述总结了肠道细菌对免疫系统的影响,探讨了自身免疫疾病研究中出现的微生物模式,并讨论了维生素D缺乏症如何通过其对肠道屏障功能,菌群组成的影响而有助于自身免疫,和/或对免疫反应的直接影响。
维生素D对免疫系统具有多种直接和间接的调节作用,包括促进调节性T细胞(Tregs),抑制Th1和Th17细胞的分化,损害B细胞的发育和功能,减少单核细胞的活化和刺激来自免疫细胞的抗菌肽。
也就是说,维生素D与自身免疫之间的关系很复杂。除了免疫抑制,维生素D还通过影响菌群组成和肠道屏障的方式改善自身免疫性疾病。
该文章引用了一些研究,这些研究表明维生素D会改变肠道微生物组的组成。一般而言,维生素D缺乏倾向于增加拟杆菌和变形杆菌,而更高的维生素D摄入量则倾向于增加普氏杆菌并减少某些类型的变形杆菌和厚壁菌。
虽然关于维生素D对肠道细菌的影响的研究仍很薄弱,尤其是在患有自身免疫性疾病的患者中,但已知维生素D缺乏症和自身免疫性疾病是合并症,通常建议这些患者补充维生素D。
众所周知,维生素D支持肠道和免疫细胞的防御。维生素D是维持紧密连接所需的关键成分之一。
肠上皮与外部环境不断相互作用。上皮表面适当的屏障完整性和抗菌功能对于维持内稳态和防止特定微生物物种的入侵或过度定殖至关重要。
健康的肠上皮和完整的粘液层对于防止病原性生物入侵至关重要,而维生素D有助于维持这种屏障功能。多项研究发现,维生素D3 / VDR信号调节紧密连接蛋白的数量和分布。
作为一种可使离子进入肠腔的“泄漏”蛋白,在功能性维生素D缺乏症的情况下,claudin-2表达可能会导致结肠炎。
维生素D上调抗菌肽的mRNA和蛋白质表达,包括抗菌肽,防御素和溶菌酶。
抗菌肽主要由肠道Paneth细胞分泌,是微生物组组成的重要介质。
防御素由上皮细胞,Paneth细胞和免疫细胞分泌,并且是肠道固有免疫反应的重要组成部分。
维生素D缺乏症可能通过以下方式影响微生物组和免疫系统,从而导致自身免疫疾病:
1 维生素D缺乏或补充会改变微生物组,细菌丰度或组成的操纵会影响疾病的表现。
2 由于饮食不足而缺乏维生素D信号传导会损害肠道的物理和功能屏障完整性,从而使细菌之间的相互作用刺激或抑制免疫反应。
3 如果缺乏维生素D,先天免疫防御能力可能会受到损害。
Yamamoto Erin A et al.,Front Immunol, 2019
以上所有,我们可以看到,优化肠道菌群和维生素D水平对于保持健康至关重要。通过肠道菌群检测,查看自己的肠道菌群的构成,适当补充益生菌,维生素D将有助于避免肠道泄漏。
对肠道微生物组产生重大影响的最简单,最有效和最便宜的方法:定期食用发酵食品。
健康的选择包括酸奶,纳豆和各种发酵蔬菜。
避免破坏或杀死微生物组,其中包括:
如果可以的话,尽量避免抗生素。抗生素杀菌一视同仁,不管好坏。
尽量少吃常规饲养的肉类和其他动物产品,因为这些可能会被喂食低剂量的抗生素。
尽量避免经基因工程处理和/或草甘膦处理的谷物。
少吃加工食品(由于过量的糖会滋生病原菌)
相关阅读:
参考文献:
Krautkramer KA, Kreznar JH, Romano KA, Vivas EI, Barrett-Wilt GA, Rabaglia ME, Keller MP, Attie AD, Rey FE, Denu JM. Diet-Microbiota Interactions Mediate Global Epigenetic Programming in Multiple Host Tissues. Mol Cell. 2016 Dec 1;64(5):982-992. doi: 10.1016/j.molcel.2016.10.025. Epub 2016 Nov 23. PMID: 27889451; PMCID: PMC5227652.
Guglielmi Giorgia,How gut microbes are joining the fight against cancer.[J] .Nature, 2018, 557: 482-484.
Larsen Nadja,Vogensen Finn K,van den Berg Frans W J et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults.[J] .PLoS One, 2010, 5: e9085.
Sturgeon Craig,Fasano Alessio,Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases.[J] .Tissue Barriers, 2016, 4: e1251384.
Yamamoto Erin A,Jørgensen Trine N,Relationships Between Vitamin D, Gut Microbiome, and Systemic Autoimmunity.[J] .Front Immunol, 2019, 10: 3141.
谷禾健康
关于肺癌,可能有以下误解:

你对肺癌了解吗?
肺癌是第三大常见癌症(占所有癌症的11.6%)。2018年全球诊断209万例以上,死亡170万人。
肺 癌 类 型
肺癌中最常见的类型是非小细胞肺癌(NSCLC),约占所有病例的80%—85%。
小细胞肺癌(SCLC)约占肺癌的15%—20%。SCLC的增长和传播速度比NSCLC快。
它的可怕之处在于大多数患者被诊断时为晚期,死亡率高。在没有有效治疗的情况下,治疗前后多器官转移和复发是死亡的关键原因。
肺部微生物群和癌症之间的相互作用:
肺癌的发生、驱动因素和治疗
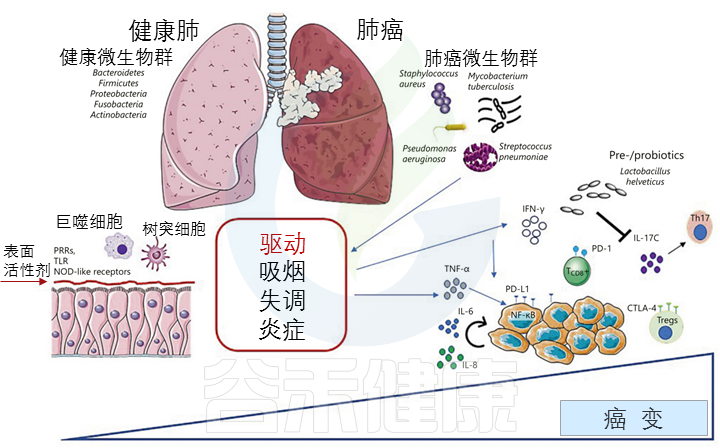
Martins D,et al., Pathobiology. 2020
肺癌是由宿主和环境因素之间的相互作用引起的复杂疾病。在各种环境风险因素中,微生物在维持微生态平衡和调节宿主对多种治疗的免疫反应中起着至关重要的作用。
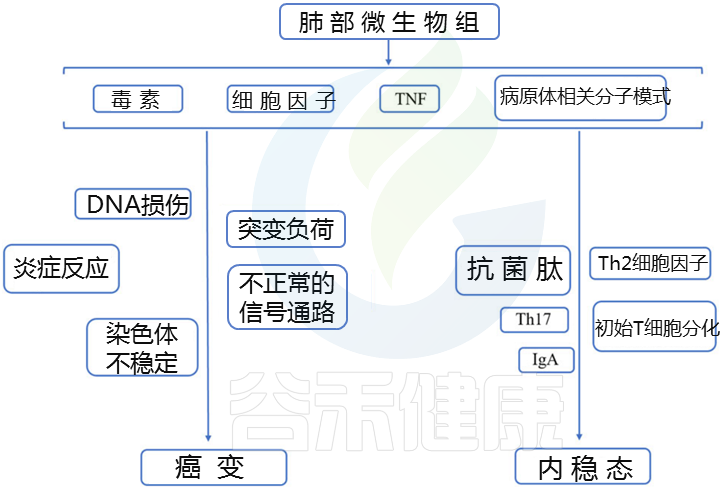
肺部是人体表面积最大的黏膜部位,也是与外部环境的主要接触面。肺里面藏有多种微生物。
肺微生物群由细菌,真菌和病毒组成,这些细菌是由吸入粘膜分泌物,鼻咽,口咽和环境空气交换而产生的。和肠道、皮肤等微生物组不同。
在健康的肺中,普雷沃氏菌(Prevotella),链球菌(Streptococcus), 韦荣氏球菌属(Veillonella), 奈瑟菌属(Neisseria),嗜血杆菌属 (Haemophilus),梭杆菌属(Fusobacterium)是最丰富的细菌属。与真菌曲霉菌(Aspergillus), 青霉菌(Penicillium), 念珠菌(Candida)等真菌共存,不会引起健康人肺的感染。
而在在慢性阻塞性肺疾病(COPD)和囊性纤维化等肺部疾病中,肺微生物群处于失调状态。
正常情况下,人体是动态平衡的,并且各个身体部位的微生物可以直接相互作用,或者通过系统循环中的炎性物质,细胞因子和代谢物间接相互作用,如下图所示。
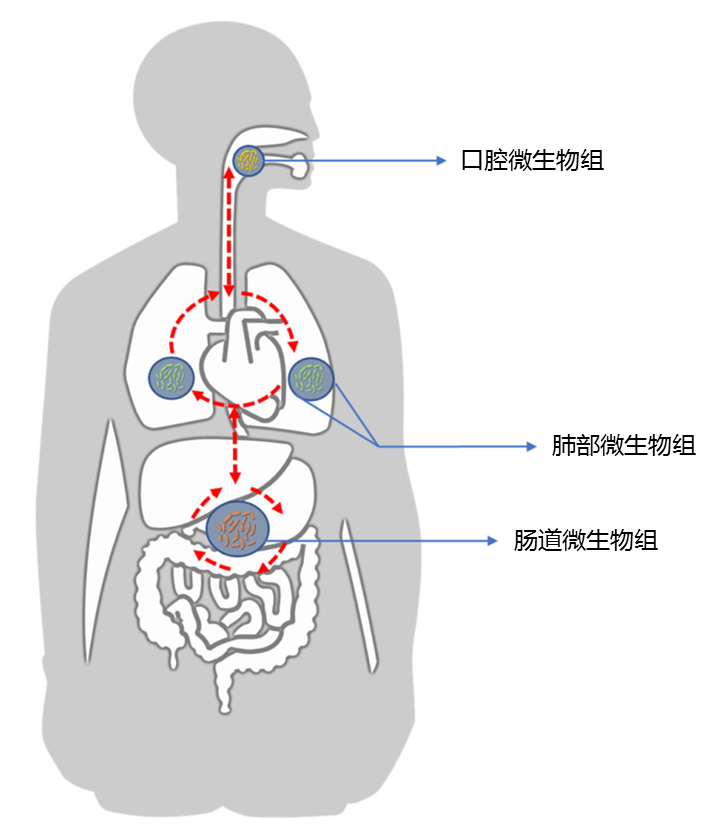
Liu NN,et al., NPJ Precis Oncol.2020
口腔微生物组可能是肺微生物组的主要来源。 呼吸道和肠道可以通过包括微抽吸和吸入在内的生物学过程相互交流。
人类呼吸道和胃肠道中微生物群的早期形成和免疫环境可能源自皮肤和外部环境。
尽管肠道和肺微生物群的微观解剖特征,组成和种群动态存在明显差异,但这两个器官具有相似的体内平衡和某些生理特征,例如微生物群成熟过程,粘膜免疫系统,共同进化以及与免疫细胞的沟通和持续不断暴露于外部环境。
胃肠道疾病患者更容易出现多种肺部疾病
肠道菌群已被证实可导致慢性阻塞性肺疾病,哮喘的进展以及急性肺损伤的恶化。
肠道和肺中特定微生物代谢产物通过循环的联系和调节作用。 例如,与健康对照相比,观察到支气管哮喘患者粪便中的微生物代谢产物(包括脂肪酸,乙酸盐,丁酸和丙酸以及异酸)显着减少。
普氏栖粪杆菌(Faecalibacterium prausnitzii)和阿克曼氏菌(Akkermansia muciniphila)可通过诱导抗炎细胞因子IL-10并抑制促炎细胞因子(如IL-1247)的分泌来抑制小儿过敏性哮喘的炎症反应。
肠道菌群可诱导小鼠肺部对细菌性肺炎的炎症反应,并通过TLR4增强中性粒细胞浸润。
复杂的介入性生态系统调节各种病理过程,维持肠道和肺的生理平衡。因此,科学家基于在大量长期流行病学观察的基础上建立的多样而复杂的肠-肺微生物群网络,提出了“微生物群-肠-肺轴”。
新陈代谢在许多病理和生理过程中对维持人体内环境稳定至关重要。有新的研究探讨了与宿主代谢相关的肺部微生物群。
与细菌生物体相关的特定代谢谱与甘油磷脂和亚油酸盐途径相关,它们在HIV感染者的肺炎发病中起重要作用。还发现铜绿假单胞菌利用粘菌Rothia mucilaginosa产生的底物分泌的主要代谢物在其囊性纤维化进展的发病机制中起作用。
说起代谢产物,不得不说的是短链脂肪酸(SCFA)。它是由大量共生微生物产生的,并在宿主细胞中起着至关重要的信号分子的作用。
肠道中缺乏短链脂肪酸的小鼠容易受更多的细菌负荷,如金黄色葡萄球菌,这可能受肺Th17免疫力调节。饮食中添加短链脂肪酸(SCFA)可以通过调节小鼠T细胞和树突状细胞的活性来改善哮喘易感性。
临床前模型中肠道微生物组的调节可以改变宿主的免疫反应和对肺部感染因子的敏感性。
肠-骨髓-肺轴
短链脂肪酸可调节骨髓细胞的分化并维持宿主免疫稳态。在某些情况下,SCFA可以调节肠道微生物组的组成并诱导骨髓生成,从而在呼吸道中产生抗炎环境。
微生物组通过介导宿主对各种致病因素和治疗结果的敏感性,直接或间接调节宿主的免疫活性。微生物组与免疫系统之间的动态相互作用,让宿主能够识别并预防细菌或真菌的入侵和感染。
在临床前研究中,缺乏肠道微生物组的无菌(GF)小鼠表现出严重的免疫发育不良,具有不完整的粘液层,免疫球蛋白分泌障碍以及淋巴结大小和数量减少。
特殊亚群CD4+ Th17细胞在微生物相互作用、粘膜免疫功能和宿主对肠道、肺和皮肤炎症性疾病的反应中起重要作用。
肠道菌群可以刺激Th17反应并调节IL-17的产生,这与某些病原体的消除有关。IL-17途径还参与了多种肺部疾病的发病机制,包括哮喘,结节病,闭塞性细支气管炎和与骨髓移植有关的肺炎。
驻留在肺中的细菌调节某些先天免疫基因的表达,包括IL-5,IL-10和IFN,而CD11bC 树突状细胞和FoxP3+CD25+Treg细胞上PD-L1的表达水平较高。 微生物相关的代谢产物脱氨基酪氨酸(DAT)通过增强I型IFN刺激和降低肺癌的免疫病理学来保护宿主免于流行性感冒。
共生菌群可以通过炎症小体调节呼吸道粘膜的免疫力,并提供稳定的免疫激活信号。
可发酵纤维菊粉能改变肠道菌群结构和相关代谢产物
例如短链脂肪酸,最终通过抑制中性粒细胞诱导的损伤和增强抗病毒CD8+ T细胞反应来改善小鼠对流感病毒感染的反应。
发现口腔分类群中肺微生物群的富集与Th17炎症相关,其中TLR4反应受肺微生物群组成的影响。 此外,共生菌被证明可促进肺癌中Vg6 +Vd1 + T细胞的增殖和活化。 然而,对于健康或有益的肺部微生物菌群并没有一致的定义,部分原因是由于对肺部微生物群与宿主免疫之间的关联了解有限。
在人体内有越来越多的共生微生物和致病微生物被报道具有致癌特性,并且大多数微生物在流行病学上与癌变密切相关。
癌症通常是一个多因素的病理过程,正常细胞开始以非程序化的方式增殖,导致细胞凋亡、自噬、炎症和DNA损伤。
如何诱发癌症?
表面边界肿瘤的发生通常与宿主粘膜免疫屏障破坏有关。当粘膜表面受损时,如果无法及时修复损伤,将重建原始组织和共生微生物组的微环境。否则,这种损害将继续加剧并导致反复发作的炎症,最终可能诱发癌症。
位于表面结合的肿瘤或肿瘤内的微生物组有可能利用肿瘤来源的碳源和其他营养物质在长期共存的情况下与肿瘤免疫微环境相互作用。
发 病 机 制
肿瘤内微生物与癌症发展之间的联系,并已证明了三种主要机制是潜在的作用方式:
(1)直接通过增加诱变来促进肿瘤发生
(2)调节癌基因或致癌途径
(3)通过调节宿主免疫系统来降低或增强肿瘤进展
微生物与肿瘤细胞之间的相互作用
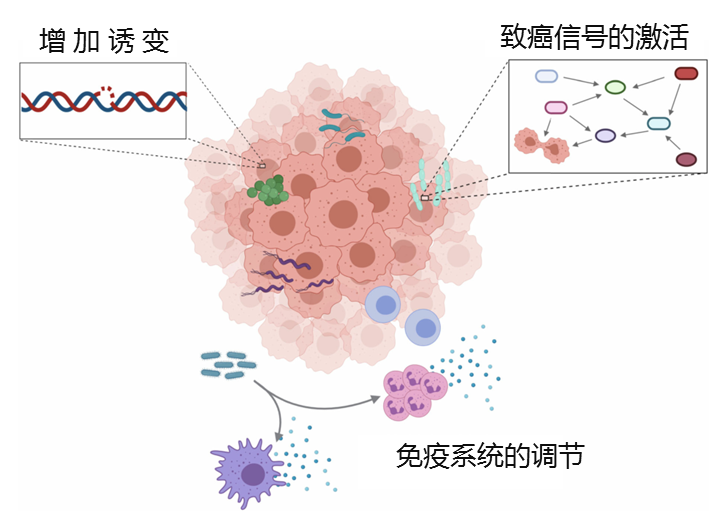
Wong-Rolle A,et al., Protein Cell.2020
许多微生物已经进化为产生可导致DNA损伤,细胞周期停滞和遗传不稳定的化合物。产生此类化合物的细菌的存在会直接增加所占组织的诱变作用。
肺微生物群可改变免疫微环境以促进肿瘤进展,慢性炎症与癌症息息相关。细胞因子,趋化因子和其他促炎因子可以促进肿瘤的生长和扩散。肺由于广泛暴露于外部环境,是免疫-微生物群落相互作用的关键部位。
先前的研究已经发现微生物组与肺部炎症和组织结构之间的某些相关性,包括COPD(慢性肺部疾病),IPF(特发性纤维化),哮喘,CF(囊性纤维化)和非CF支气管扩张等。
微生物失调可能会引起宿主生理机能失调,并加剧慢性肺部疾病的恶化。
在慢性阻塞性肺疾病(COPD)患者的呼吸标本中鉴定出呼吸道病毒39–56%,而在临床基线为6–19%。
病情加重期间病原菌存在于51-70%的患者中,而最初的稳定临床基线中则存在25-48%。
一项大型队列研究称,CXCL8/IL-8与肺微生物组多样性和群落结构显著相关。在某些受试者中,COPD加重期间CXCL8/IL-8可以介导宿主炎症反应。
特发性纤维化(IPF),已证实其具有不同于健康肺部状况的微生物组,一项随机试验报告说抗生素治疗可能有益于IPF患者的生存。
此外,包括细菌或病毒感染在内的肺微生物组可能会侵入气道上皮细胞,从而诱导宿主免疫反应或触发慢性病原性刺激中伤口愈合的级联反应。
与肺癌相关的微生物群
从全球角度来看,假单胞菌、链球菌、葡萄球菌、韦荣球菌属和莫拉克斯氏菌属经常被报道为与肺癌最相关的微生物群。

Liu NN,et al., NPJ Precis Oncol.2020
在不同的条件下,肺微生物群在促进致癌和维持体内平衡方面起着双重作用。
Liu NN,et al., NPJ Precis Oncol.2020

肺部微生物群可以直接影响肺癌细胞的生长。在上一小节提到过微生物在癌症进展中作用的三个主要机制中,局部免疫环境的调节和致癌途径与肺癌有关。
肺微生物群落的失调可能通过特定的微生物成分促进致癌途径的改变。
研究人员在一个原位小鼠模型中证明了微生物群-免疫相互作用在促进炎症和肺癌发展中的重要性。发现与健康肺相比,某些细菌科如草螺菌属Herbaspirillum和鞘脂单胞菌科Sphingomonadaceae在含肿瘤的肺组织中富集,而其他分类群包括Aggregatibacter和乳杆菌属在健康肺中富集。
增加的局部细菌负担和改变的肺微生物群的组成刺激myd88依赖的IL-1β和IL-23从骨髓细胞产生。这些细胞因子诱导Vy6+Vδ1+γδT细胞的激活和增殖,产生IL-17,促进炎症和中性粒细胞浸润。此外,这些γδ T细胞产生白细胞介素-22和其他促进肿瘤细胞增殖的效应分子。
无菌(绿色荧光)小鼠或经抗生素处理的小鼠显著降低了肺部肿瘤的生长,证明共生细菌显著促进了肺癌的发展。
利用雾化抗生素证明,细菌生物量的减少与通过T细胞和NK细胞活化增强抗肿瘤免疫反应和减少免疫抑制调节性T细胞有关。
此外,发现益生菌鼠李糖乳杆菌能够克服免疫抑制并抑制肺肿瘤植入,并且在抗生素和益生菌条件下肿瘤转移减少。
总之,这些发现支持了微生物群通过调节局部免疫反应和靶向肿瘤相关微生物群在肺癌发展中起关键作用的观点,为肺癌的预防和治疗提供了潜在的新途径。

研究人员发现成年小鼠的过敏性气道炎症显著减弱,这是由于HDM(室内尘螨)治疗后,表面配体PD-L1、PD-L2和CD40的表达增加。
目前的知识不能详细说明伴随疾病进展的肺微生物群变化的因果关系,因为大多数研究是基于长期观察和队列研究。更有可能的是,肺微生物群可能在维持身体稳定性和促进癌症方面发挥双重作用。
当前,肺癌的传统疗法可分为手术切除,放射疗法,化学疗法和免疫疗法。 即使是现在,在诊断时(III / IV期),仍有近75%的肺癌患者已进入晚期。
因此,对肺癌的早期发现和改善的治疗变得越来越紧迫。目前对微生物临床应用的探索仍处于早期阶段,包括临床前模型中的益生菌,饮食干预和FMT(粪便微生物群移植)。
了解人类微生物群,尤其是肠道微生物群与肺癌之间的关系,可能会为肺癌的诊断和治疗开辟新的窗口。
微生物标志物
目前,临床上广泛使用和有效的肺癌诊断工具是胸部X光和CT。然而,由于CT的检查成本高且不便,因此仍不能完全普及。
肺癌筛查的最佳选择是检查具有高危疾病特征的人群,包括年龄,性别,长期吸烟和职业接触。更好地探索肠道菌群与肺癌之间的相互作用,并尝试找到与肺癌密切相关的微生物改变和特定微生物,从而可以提供更好的目标来选择高危人群,包括胸部X线和CT高危人群。
有许多长期观察和流行病学研究,根据各种样本来源检测出微生物群与肺癌之间的显著相关性。确定并建立了特定的肠道微生物特征来预测早期肺癌将具有重要意义。
肺癌患者唾液中的奈瑟氏球菌,链球菌和卟啉单胞菌明显更高,这可能是疾病检测/分类的潜在生物标志物。 肺组织中大量的拟杆菌科,毛螺菌科和瘤胃菌科与无复发(RFS)和无病生存(DFS)的风险降低显著相关。当然,进一步的临床研究是必要的,以建立用于预测未来肺癌的微生物标记。
放疗和化疗
晚期肺癌的放疗已成为临床实践中的常规治疗方法,虽然有副作用,例如免疫损伤和辐射诱发的毒性。
最近的一项研究表明,小鼠粪便微生物群移植可以减少辐射诱发的损害,而不会促进体内癌细胞的增殖和迁移。此外,在放疗后的小鼠模型组织中观察到与原始微生物相比,具有增强的IL-1β,IL-6和TNF-α表达的独特微生物特征。 将对辐射高度敏感的微生物鉴定为可改善治疗效果的预测性生物靶标是有希望的。
微生物群可能是减少放射线引起的毒性并改善放射治疗后肺癌患者预后的一种治疗策略。
肠道微生物组在yao物代谢,化疗诱导的毒性和宿主反应敏感性方面起着至关重要的作用。 肠道菌群可以通过微生物和微生物酶直接调节yao物的吸收和代谢。 此外,肠道菌群还可以通过调节基因表达,局部粘膜屏障反应和远处器官的生理状况来间接影响口服和全身给yao的代谢率。
体内和体外实验表明,化学治疗剂与人类微生物群之间存在复杂且多层次的干预关系。
目前,大多数微生物组和化学治疗的研究仍处于动物实验阶段,很少有研究直接探讨肺癌化疗后患者肠道菌群的改变和功能。 仍需要进行其他临床试验,以研究肠道菌群的调节模型是否可以成为一种有效的临床方法,以辅助化疗治肺癌并使yao物诱导的毒性降至最低。
免疫治疗
先前有报道称肠道菌群失调可能影响对癌症的免疫治疗效果。
例如,法国研究小组检查了接受PD-1免疫治疗的249名癌症患者的微生物组。 其中,有69名患者在治疗开始时因其他疾病而接受了抗生素治疗,这将破坏肠道菌群。 接受抗生素治疗的患者比未接受抗生素治疗的患者癌症复发时间和生存时间更短,这表明抗生素的使用会大大降低免疫疗法的有效性。
一项后续研究比较了两组患者的肠道菌群,并从康复患者的粪便中分离了阿克曼菌(Akkermansia muciniphila).[一种益生菌,曾被证明可以有效预防肥胖和糖尿病]
这项研究证明了其有助于癌症免疫疗法。此外,研究人员将恢复患者的粪便植入无菌小鼠中,接受“有效”粪便的人对PD-1抑制剂反应迅速。口服阿克曼菌也可以恢复相同的免疫治疗效果。
一个可能的原因是,更高的微生物群多样性可能与T细胞活性呈正相关,这反过来又导致癌细胞被更彻底地杀死。相反,患有“坏细菌”的患者具有更多的调节性T细胞,可以抑制宿主的免疫反应。
一项对晚期非小细胞肺癌患者进行免疫检查点抑制剂PD-1治疗的最新研究表明,肠道菌群多样性较高的患者对抗PD-1免疫检查点抑制剂的反应更好。

益生菌,益生元和靶向微生物
目前,益生菌,益生元和合生元,它们在不同的临床实践中普遍显示出安全性。
临床数据不断增加所揭示的一般效果包括促进胃肠道的稳态和完整性,通过产生短链脂肪酸(SCFA)和维生素或次级胆汁盐来调节代谢,参与消化活动以及中和炎症和致癌物。
益生菌、益生元作用:

但是,当前有关有益菌和分子机制的有限研究和知识尚不能提供剖析宿主微生物组的最佳方法。 微生物的变化是否会引起意想不到的局部稳态失调,炎症反应或什至是癌前病变尚不清楚。 最近,FDA就使用FMT发出安全警告,警告由于致病性生物的传播而造成严重不良事件的风险,需要注意和谨慎。
宿主,微生物组和环境之间的三重相互作用在健康功能中维持了肺稳态。

Liu NN,et al., NPJ Precis Oncol.2020
此外,微生物组在促进传统的肺癌治疗包括放射疗法,化学疗法,手术切除和免疫疗法方面可能具有不可估量的治疗策略。
尽管微生物组的巨大潜力为肺癌的预防和治疗画出了广阔的前景,但普遍认为,这一领域的发展需要更多的多学科和深入的探索。 更好地了解癌症发生过程中的微生物组以及对多种治疗方法的不同反应可能会为促进肺癌患者的诊断和预后提供巨大的机会。
肺癌的饮食建议
有胃口就吃饭。
如果胃口不大,请尝试全天少食。
如果需要增加体重,请补充低糖,高热量的食物和饮料。
如果胃很容易不适或有口疮,请避免食用香料并坚持清淡的食物。
如果出现便秘问题,可多吃高纤维食物。
虽然说没有明确哪种饮食可以治愈癌症,但均衡饮食有助于抵抗副作用,感觉舒适。
相关阅读:
参考文献:
Liu NN, Ma Q, Ge Y, Yi CX, Wei LQ, Tan JC, Chu Q, Li JQ, Zhang P, Wang H. Microbiome dysbiosis in lung cancer: from composition to therapy. NPJ Precis Oncol. 2020 Dec 10;4(1):33.
doi: 10.1038/s41698-020-00138-z.
Tsay, J. A.-O. et al. Airway microbiota is associated with upregulation of the PI3K pathway in lung cancer. Am. J. Respir. Crit. Care Med. 198, 1188–1198 (2018)
Huang, D. et al. The characterization of lung microbiome in lung cancer patients with different clinicopathology. Am. J. Cancer Res. 9, 2047–2063 (2019).
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2020 Dec 9. doi: 10.1007/s13238-020-00813-8. Epub ahead of print. PMID: 33296049.
Liu, Y. et al. Lung tissue microbial profile in lung cancer is distinct from emphysema. Am. J. Cancer Res. 8, 1775–1787 (2018).
Martins D, Mendes F, Schmitt F. Microbiome: A Supportive or a Leading Actor in Lung Cancer? Pathobiology. 2020 Dec 22:1-10. doi: 10.1159/000511556. Epub ahead of print. PMID: 33352574.
Peters, B. A. et al. The microbiome in lung cancer tissue and recurrence-free survival. Cancer Epidemiol. Biomark. Prev. 28, 731–740 (2019).

谷禾健康
过完今天,这个魔幻的2020就要过去了。面临工作、学习、出行等方方面面一而再地按下暂停键,很多人都希望这一年能够重启。
这一年发生了太多故事
每一个都足以让人痛惜
“活着”、“健康”这样的字眼在这一年显得尤为珍贵。简单的道理往往在经历重大的事件后才会尤为深刻。
古有求仙药,今有各种医疗技术的不断革新,大家对于长寿有着一致的追求。当基本的生活有了一定的保障后,人们不仅想要活得长久,还要健健康康地活着。
我们可以看到,人类的预期寿命已开始延长,并且仍在继续提高。“健康长寿”不再停留于一句祝福语,而是可行的人生目标。
长寿是多种变量复杂组合的结果。由于不同地区自然环境、社会制度、社会经济发展状况和人口构成等因素千差万别。
根据相关研究,影响人类寿命的因素至少包括:
遗传因素如线粒体状态、染色体稳定性、端粒长短、疾病、干细胞活性;
环境因素如肠道微生物、饮食、运动、空气质量以及生活环境;
其他因素如情绪压力、社交爱情、目标成就、投入预防等等。
人们在迈向健康长寿的过程中处于不同的阶段和水平。若干年后,也许有相当多的人进入百岁人生。
在2020年的最后一天,我们就来聊聊肠道菌群和长寿的故事。

伊卡里亚岛
伊卡里亚岛
该岛位于萨摩斯岛西南约10海里,这是爱琴海的一个小岛,是世界上寿命最长的地区之一。他们是90岁以上人群中世界上人口最多的国家,百岁老人在岛上已有400多年的历史了。科学家将那里长寿的机会与空气,水,社区精神,饮食习惯和遗传倾向等因素相关联。

意大利
提起意大利,你想到的是足球还是意大利面,其实这个国家还盛产长寿老人,根据欧盟统计,意大利为欧洲第一长寿国,女性平均寿命为84岁,男性平均寿命为78.3岁。
研究发现100岁意大利老人的肠道菌群种类分布与30岁意大利人相比,出现了较明显的变化,厚壁菌门中的拟杆菌XIVa明显减少,而芽孢杆菌上升,身体的炎症反应状况高,因此科学家得出长寿的关键因素:菌群种类的改变,更好的应对和调节炎症反应。

中国 新疆和田,广西巴马,四川都江堰青城山等
中国新疆和田,广西巴马以及四川都江堰市青城山等地区都很大比例的长寿健康老人。动物遗传育种研究所李英团队在《Current Biology》发表的一项关于寿老人和年轻人群肠道菌群研究发现长寿老人肠道菌群多样性和菌群丰度显著高于年轻组,这一结论在意大利相应人群中也得到了证实,提示更多有益菌群以及更丰富的菌群多样性可能是人类健康长寿的重要原因之一。
对长寿的研究可能有助于我们理解人类是如何延缓衰老,如何战胜与年龄相关的疾病。
肠道微生物群被认为是监测和可能支持健康衰老的变量之一。事实上,宿主-肠道微生物体内平衡的破坏与炎症和肠道通透性以及骨骼和认知健康的普遍下降有关。肠道微生物群作为健康衰老可能的介质,通过对抗炎症、肠道通透性以及认知和骨骼健康的恶化来保持宿主环境的稳态。
健康老年人的肠道菌群如何定义?
考虑到大多数老年人都患有肠道相关合并症,因此在该人群中定义健康的肠道微生物组极具挑战性。肠道环境的变化,例如炎症,肠道渗漏,活性氧的产生以及药物的使用,都可能影响肠道微生物组。在这方面,健康百岁老人一直被用作健康老龄化的典范,因为他们有能力推迟或避免慢性疾病。因此,该队列中的肠道微生物组可用于定义健康的肠道微生物组。
长寿者肠道菌群多样性水平高
一般认为,随着年龄增长时,肠道微生物多样性通常会降低。可能是由于生理,饮食,药物和生活方式的变化所致。
是不是所有老人的肠道菌群多样性都会降低?
研究人员检测了一群健康的长寿老人的肠道微生物组,来自中国四川都江堰市的长寿老人,包括“90-99岁”和“≥100岁”两个年龄段。
他们发现长寿人群的肠道菌群比年轻成年人的肠道菌群更多样化,这与传统观点相矛盾。
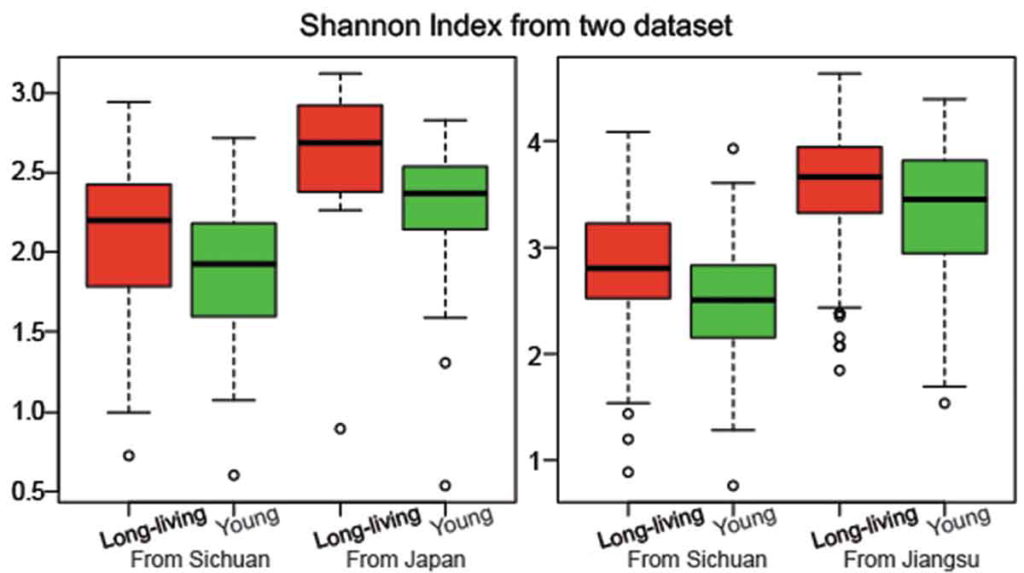
他们还发现了产短链脂肪酸菌在长寿老人中开始增加,例如梭状芽胞杆菌XIVa。
国内外研究结果一致
为了验证他们的发现,他们分析了来自一个意大利小组的独立数据集。
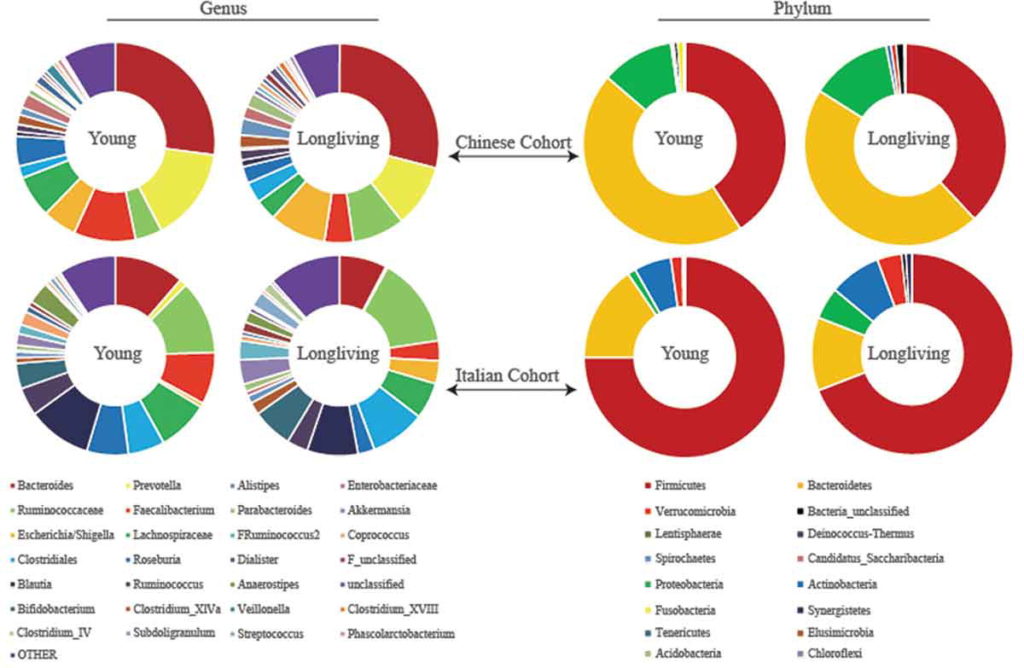
出现一致的结果:长寿的意大利人也比年轻的人群的肠道菌群多样化水平更高 。
庆幸的是,谷禾肠道菌群数据库中也有比较长寿的老人肠道菌群数据。
我们抽取其中一例相对较为健康的长寿老人的数据:
编号:083*****97 ,98岁(谷禾肠道菌群数据库)
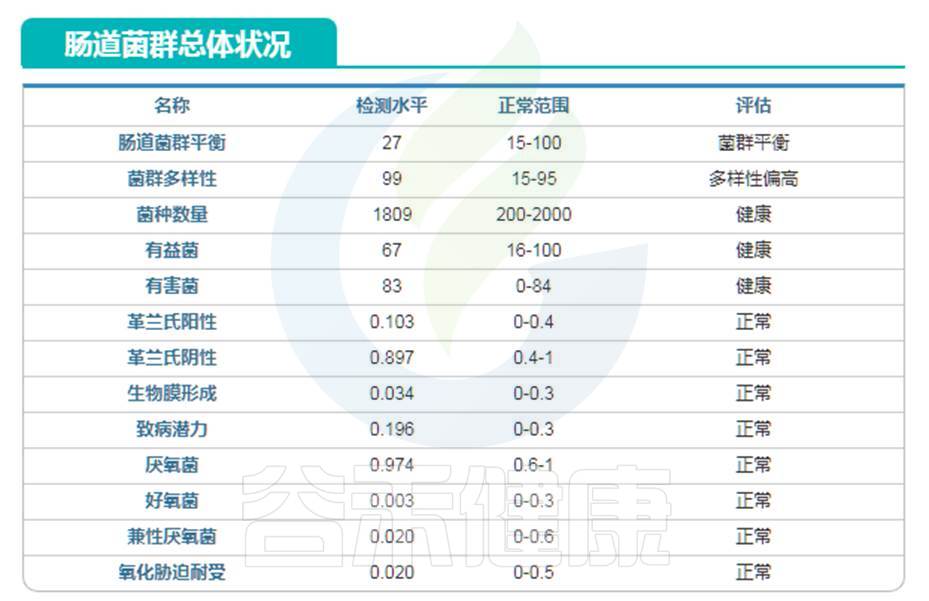
谷禾健康数据库
可以看到肠道菌群多样性水平也是明显增高,与文献报道相符。大部分指标都处于正常水平。
长寿者产短链脂肪酸菌增多
结合意大利和中国的数据集,发现尽管肠道微生物群结构存在显著差异(可能是由于饮食、基因和环境的差异),但区分长寿个体和年轻群体的前50种细菌特征中,有11种特征是相同的。同样,这些特征包括肠道菌群多样性水平更高和几个产短链脂肪酸菌丰度更高。
一项后续研究中,另外两个独立的队列中也观察到了长寿人群中更大的肠道微生物组多样性:一个来自中国江苏省,另一个来自日本。
以上这些研究都清楚地表明,健康长寿的人存在更多样化且平衡的肠道菌群,而在患有不同合并症的老年人中观察到肠道菌群紊乱。
因此,研究人员假设调节肠道微生物组(如通过饮食、益生菌)来维持健康的肠道微生物组将有利于健康地衰老。
进一步假设,在患有慢性疾病的老年人中,将紊乱的肠道菌群调节为健康的肠道菌群将减轻他们的症状,提高他们的生活质量。
肠道微生物组和健康衰老的有效假设
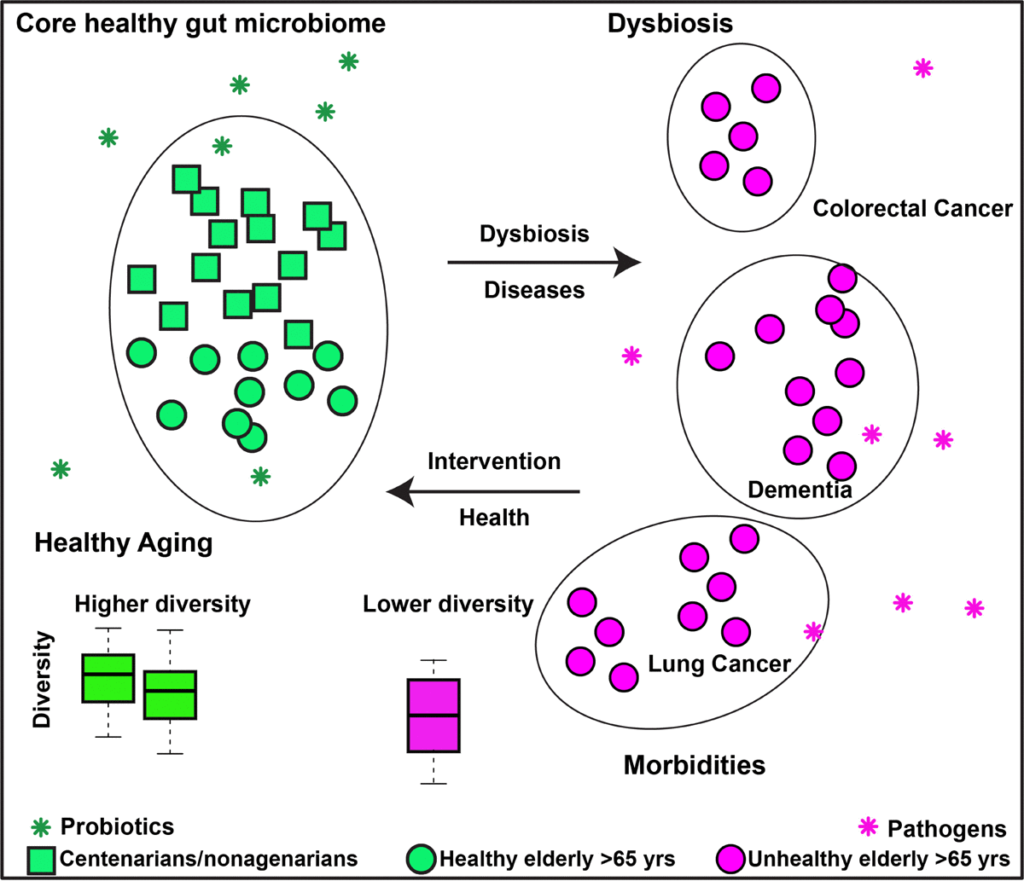
该假设背后的一个基本原理是慢性炎症,即老年人中慢性低度炎症的增加,这与不同的慢性疾病有关。
短链脂肪酸对维持肠道止血很重要。短链脂肪酸为结肠上皮细胞提供主要能量,并具有抗炎特性。这些产短链脂肪酸菌在长寿老人中的富集表明,这些细菌可能会减轻炎症及由此造成的损害,这可能是他们能够健康衰老的原因。
以上我们知道长寿老人的产短链脂肪酸菌增多,那么其他菌群会有什么样的变化?
在门类水平上,大多数研究都证明了变形菌丰度的增加。
长寿者菌群变化,潜在有益菌较多
· 不同地区比较:
一项研究分析并比较了长寿村庄中百岁老人与同一地区和城市化城镇中的老年人和成年人的肠道菌群。采集长寿村的百岁老人、老年人和年轻人的粪便样本,以及来自韩国城市城镇的老年人和年轻人的公共数据库获得肠道菌群数据。
与城镇化老年人相比,长寿村老人:
康复医院百岁老人的肠道菌群也不同于居家。这些差异可能是由于饮食方式和生活环境的差异。
· 不同年龄比较:
我们来看一项研究,对62个人的粪便微生物组进行宏基因组测序,年龄从22岁至109岁不等。
下图可以看到,随着年龄的增长,肠道微生物群发生了变化。
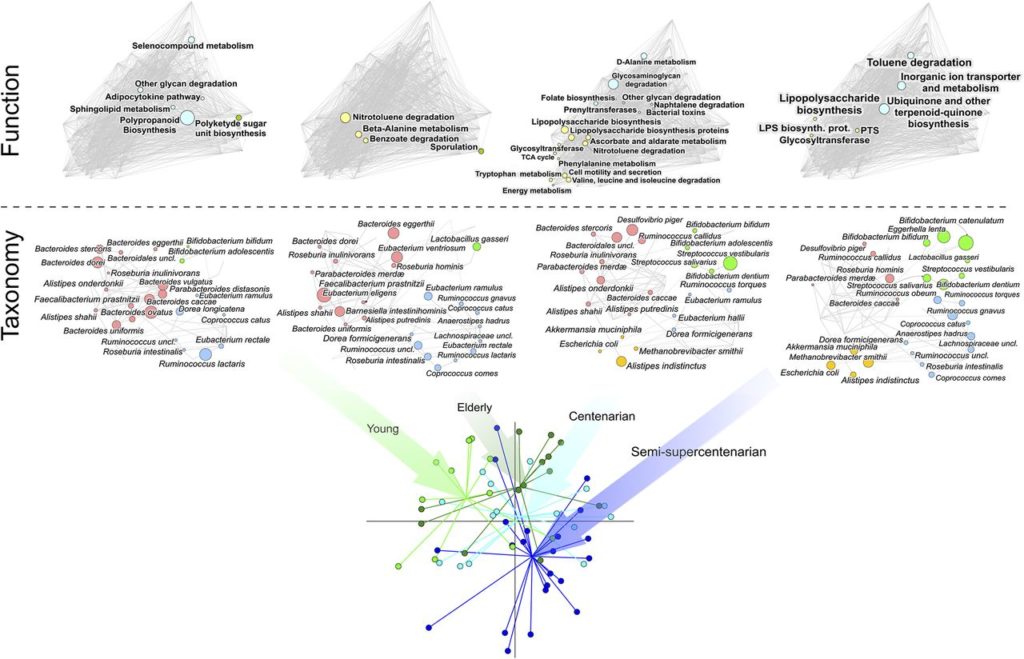
注:4个年龄组的肠道微生物组:
11个年轻人 (22 – 48岁,young);
中年13人 (65 – 75岁,elderly);
15名百岁老人 (99至104岁, centenarian);
23名半超百岁(105至109岁,semisupercentenarian)
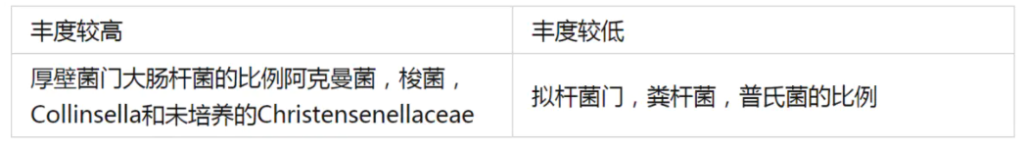
研究人员发现与年轻人相比,长寿者菌群变化如下:

编号:083*****97 ,98岁(谷禾肠道菌群数据库)
我们发现同样,变形菌门增加,另外有益菌如阿克曼菌增多。
长寿者碳水化合物代谢相关基因减少
有趣的是,当研究人员将分析集中在功能规模上时,发现与碳水化合物代谢有关的基因减少。
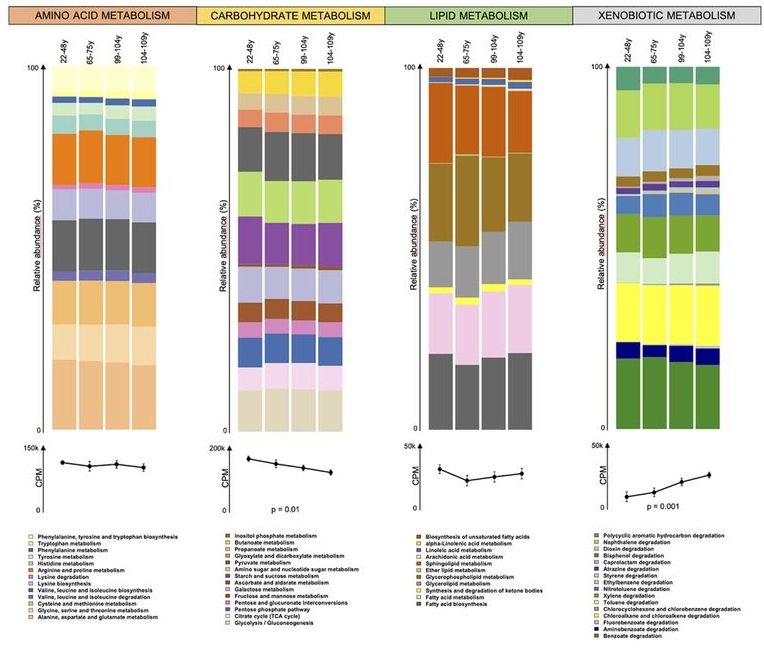
这种功能重塑在百岁老人和半超百岁老人的肠道微生物组中更为明显,研究人员观察到淀粉和蔗糖(KEGG途径编号ko00500),磷酸戊糖(ko00030)以及氨基糖和核苷酸糖(ko00520)途径的贡献减少。
异种生物降解有关的基因数量增加
同时,研究人员发现了和甲苯(ko00623),乙苯(ko00642),己内酰胺(ko00930)以及氯环己烷和氯苯(ko00361)降解途径的随之增加。
乙苯,氯苯,氯环己烷,甲苯是主要来源于工业生产和城市排放的普遍化学物质,由于其毒性作用,是世界各地监测的主要环境污染物之一。这些分子的主要人造来源实际上是汽车和废气汽车的排放,以及香烟烟雾。
此外,众所周知,它们是在加工精制石油产品(如塑料)的过程中产生的,并包含在普通消费产品(如油漆和漆、稀释剂和橡胶产品)中。
己内酰胺是尼龙的原料,用于生产合成纤维、树脂、合成皮革、增塑剂等多种室内产品。先前的研究表明,这些分子在室内的负担比在室外环境中更高,并强调了室内暴露对人类健康的特殊重要性。
生活在强人为下的环境中,例如意大利的艾米利亚-罗马涅区(工业发达),导致持续不断地暴露于这些普遍的异生物质中,促进它们在身体组织(包括肠道)中的维持和累积。
研究人员认为,这可以为人类宿主创造合适的条件,以选择能够解毒此类化合物的肠道微生物组成分,就微生物组和宿主在人类环境中的适应性而言互惠互利。
百岁和半百岁的人都是长寿的人,他们接触异生生物刺激的时间更长,他们的微生物群更适合降解这些异生生物。
脂质代谢基因变化
除了异物降解基因和糖代谢相关基因外,我们还发现了其他代谢途径中与年龄相关的差异,包括与脂质代谢有关的差异。
百岁老人和半超百岁老人显示出更多的α-亚油酸(KEGG途径编号ko00592)和甘油脂(ko00561)代谢的信息。另一方面,年轻人显示鞘脂(ko00600)和甘油磷脂(ko00564)代谢相关基因的贡献更大。
鉴于已知甘油磷脂和鞘脂在动物源性食品中更为丰富,而α-亚油酸主要来自植物源食物,这些特征可能与饮食习惯有关,特别是长寿者的植物源性脂肪摄入量高于年轻人的动物脂肪摄入量。
氨基酸代谢基因变化
此外,涉及氨基酸代谢的功能途径:
色氨酸(ko00380),酪氨酸(ko00350),甘氨酸,丝氨酸和苏氨酸(ko00260)的代谢基因随着年龄的增长而逐渐增加。
另一方面,发现年轻人中丙氨酸,天冬氨酸和谷氨酸代谢的基因(ko00250)更为丰富。色氨酸和酪氨酸的代谢被认为是蛋白水解代谢增强的指标。
此外,血清中色氨酸的生物利用度降低,以及尿液中酪氨酸代谢引起的酚类代谢产物水平升高。
慢性炎症水平低
研究人员发现随着衰老,脂多糖生物合成基因(ko00540)逐渐增加,这可能与病原菌(即肠杆菌科的成员)的存在和慢性炎症的水平低有关。
然而,更长的寿命并不一定等于健康的衰老。随着年龄的增长,人们更有可能患上各种疾病,如心脏病、中风、高血压、认知障碍、癌症等。
前面章节有一项研究(长寿村老人与城镇化老人肠道菌群)提到,来自不同地区的老人,虽然都是长寿,但菌群情况不尽相同。
因此,我们想更具体地了解,同样是长寿老人,健康长寿和不健康长寿具体到个人,在哪些方面会有区别。我们抽取谷禾肠道菌群数据库中两例报告来进行直接比较分析。
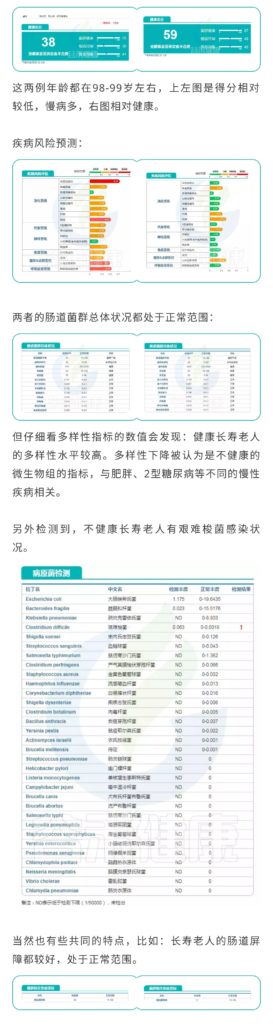
以上只是数据库中的两个案例,在经过谷禾肠道菌群数据库筛查后,我们总结了一些关于长寿老人(90岁以上)的肠道菌群的趋势,分享关于报告中的一些指标判断,供大家参考。
健康总分
健康总分能很好的反映一个人的总体健康水平,有慢病或其他问题的老人一般低于55分。
菌群多样性
菌群多样性健康长寿老人的菌群多样性水平最好能高于50,菌种数量在1000~1800左右较好,超过2000则可能会伴有病原菌感染的情况。
慢病情况
主要是心脑血管及糖尿病和部分消化道疾病,涉及慢性炎症和代谢疾病。
病原菌
病原菌感染是老人中最常出现的问题,包括呼吸道和肠道病原菌,随着衰老,肠杆菌科的部分机会致病菌比例会上升,需要注意饮食健康,以及呼吸道健康和口腔健康。
肠道屏障及炎症水平
长寿老年人中Akk菌水平普遍较中年人群较高,Akk菌有助于降低肥胖等代谢疾病,但是Akk菌丰度过高会导致肠粘膜黏蛋白降解,破坏肠道屏障,也是需要注意的指标。
短链脂肪酸水平
短链脂肪酸生成的菌的水平与短链脂肪酸和炎症水平密切相关,短链脂肪酸缺乏通常是慢性炎症的推手。
益生菌水平
在谷禾检测的90岁以上人群中,益生菌水平普遍较高,基本超过人群平均水平。
06 长寿者避雷专区——谣言粉碎机
信息爆炸的时代,我们可以轻易获得大量关于营养保健的信息,然而其中大多数可能是不正确或者过时的观念。
1. 减肥仅靠控制热量?
我们都知道,减肥需要燃烧比摄入更多的能量,但这不是唯一。那些遵循“卡路里摄入,卡路里消耗”方法的人通常只专注于食物的卡路里值,而不是其营养价值。这对于整体健康而言,并非最佳选择。
如果出现体内激素失调,甲状腺功能低下,代谢状况,药物使用等健康问题,可能即使在严格饮食下也难以减轻体重。
2. 高脂食物不健康?
许多人仍然担心高脂肪的食物并遵循低脂肪的饮食习惯,认为减少脂肪的摄入有益于整体健康。
膳食脂肪对于保持最佳健康至关重要。另外,低脂饮食与包括代谢综合征在内的健康风险更高有关,并且可能导致胰岛素抵抗和甘油三酸酯水平升高,这是已知的心脏病危险因素。
而且,在鼓励减肥方面,高脂肪饮食已被证明比低脂肪饮食有效(甚至更高)。
当然,无论是低脂还是高脂饮食,任何一种极端情况都可能危害健康。尽可能遵循“中庸之道”。
3.非营养性甜味剂是健康的?
市场上出现越来越多的非营养性甜味剂(NNS)的产品有所增加。显然,高糖饮食会大大增加疾病的风险,但摄入NNS也会导致不良的健康后果。
例如,摄入NNS可能会引起肠道菌群产生负面变化并促进血糖失调,从而增加2型糖尿病的发病率。
该领域的研究仍正在进行中,未来需要高质量研究来确认这些潜在的联系。
4. 你必须很瘦才能健康?
我们知道,肥胖与许多健康状况相关,包括2型糖尿病,心脏病,抑郁症,某些癌症等。
尽管如此,降低疾病风险并不是说要你必须要达到模特身材。最重要的是营养饮食并保持积极的生活方式,因为这些行为通常会改善体重和体内脂肪百分比。
5. 所有食物都用低脂和减肥食品来代替?
去超市你会发现各种标有“清淡”,“低脂”,“无脂”的产品。虽然这些产品对那些想要减少体内多余脂肪的人来说很诱人,但它们通常是不健康的选择。
研究表明,许多低脂和减肥食品所含的糖和盐要比普通脂肪食品多得多。最好不要经常食用这些产品,有时候也可以享受一下正常食物,例如全脂酸奶,奶酪和坚果黄油。
6. 钙补充剂对骨骼健康必不可少?
很多人听说添加钙补充剂以保持骨骼系统健康。但是,目前的研究表明,补充钙可能弊大于利。
例如,一些研究已将钙补充剂与心脏病风险增加联系起来。此外,研究表明,它们不会降低骨折或骨质疏松症的风险。
当然,如果你担心缺钙,最好注意下钙的饮食来源,例如全脂酸奶,沙丁鱼,豆类和种子食物等。
7.所有果汁和果汁都是健康的 ?
某些果汁营养丰富。例如,主要由非淀粉类蔬菜制成的新鲜果汁可以是增加维生素,矿物质和抗氧化剂摄入量的好方法。
然而,要知道外面买到的大多数果汁中都含有糖和卡路里。如果过量食用,会促进体重增加和其他健康问题,例如蛀牙和血糖失调。

8. 每个人都需要补充益生菌?
益生菌的概念现在越来越火。但是,研究表明,不是所有人补充益生菌都有用,搞不好有副作用。
某些人的消化系统对益生菌的定殖有抵抗力,而且通过补充剂引入益生菌可能会导致肠道细菌产生负面变化。另外,与益生菌使用相关的小肠细菌过度生长会导致腹胀,气体和其他不良副作用。
益生菌不应作为千篇一律的补充剂,而应更加个性化,最好在做完肠道菌群检测之后再确定是否需要补充益生菌,补充哪一类益生菌,这样才能真正让身体恢复健康。
9. 减肥很容易?
你可能看过很多生动的减肥前后的图片,甚至还有传奇的故事,几乎不费吹灰之力就可以迅速减肥的故事,不要随意相信。
减肥其实并不容易。它需要坚持不懈,自律,努力和耐心。另外,由于遗传或其他药物因素使某些人的减肥困难很大,我们需要正视这一切,面对它,慢慢来,给自己多一点耐心,找到一种对你有效的可持续的模式最重要。

10. 纤维补充剂是高纤维食品的良好替代品?
许多人缺乏足够的膳食纤维,这就是为什么纤维补充剂如此受欢迎的原因。尽管纤维补充剂可以改善肠蠕动和血糖控制,从而有益于健康,但它们不应代替真正的食物。
高纤维全食(例如蔬菜,豆类和水果)包含营养物质和植物化合物,它们可以协同工作以促进您的健康,并且不能完全由纤维补充剂替代。
LONGEVITY
随着时代的不断发展,旧的观念也在不断更新。曾经的认知也许是“七十古来稀”,而现如今更多的是百岁人生。
我们的追求也会越来越高,不仅是长寿,更是健康的长寿。可以预见,长寿时代将促使健康产业结构升级。
是的,微生物产业作为健康领域的其中一块,发展迅速。值得庆幸的是,在应对突如其来的疫情下,肠道微生态也在被应用于治疗,技术的革新为提高健康水平提供有力支撑,各个制度完善也在为健康领域的可持续发展构建强大保障,人类命运共同体正彰显其感召力。

而谷禾健康作为微生物产业的一员,自2012年创立起,对于科研事业一直贡献着自己的力量,与此同时,这么多年来,谷禾一直希望将科研真正服务于大众,将科研成果带给每一个人,这是我们的使命。
现如今,我们也已经看到阶段性硕果。曾经,“肠道菌群”还只是一个概念,谷禾健康从肠道菌群的研究构思,到取样专利的落地,肠道菌群检测报告逐步完善,再到样品运输的细节管理,我们都在经历从0到1的过程,勇于创新,不断摸索,在微生物产业的道路上,迈着坚定的步伐。
令我们感到欣慰的是,“肠道菌群”现已逐渐从研究过渡到临床甚至普通人群,并且从模糊的健康概念走向精准检测甚至个性化辅助治疗。
2021寄语
愿你所有努力都有回报
所有的美好都如期而至
参考文献:
Kong F, Deng F, Li Y, Zhao J. Identification of gut microbiome signatures associated with longevity provides a promising modulation target for healthy aging. Gut Microbes.
2019;10(2):210-215. doi: 10.1080/19490976.2018.1494102. Epub 2018 Aug 24. PMID: 30142010; PMCID: PMC6546316.
Rampelli S, Soverini M, D’Amico F, Barone M, Tavella T, Monti D, Capri M, Astolfi A, Brigidi P, Biagi E, Franceschi C, Turroni S, Candela M. Shotgun Metagenomics of Gut Microbiota in Humans with up to Extreme Longevity and the Increasing Role of Xenobiotic Degradation. mSystems. 2020 Mar 24;5(2):e00124-20. doi: 10.1128/mSystems.00124-20. PMID: 32209716; PMCID: PMC7093822.
Deng F, Li Y, Zhao J. The gut microbiome of healthy long-living people. Aging (Albany NY). 2019 Jan 15;11(2):289-290. doi: 10.18632/aging.101771. PMID: 30648974; PMCID: PMC6366966.
Kim BS, Choi CW, Shin H, Jin SP, Bae JS, Han M, Seo EY, Chun J, Chung JH. Comparison of the Gut Microbiota of Centenarians in Longevity Villages of South Korea with Those of Other Age Groups. J Microbiol Biotechnol. 2019 Mar 28;29(3):429-440. doi: 10.4014/jmb.1811.11023. PMID: 30661321.

谷禾健康

感到疲惫?乏力?食欲不振?容易流血?皮肤发痒?腿肿?体重减轻?…这些有可能是慢性肝病的信号,慢性肝病是一个主要的健康问题,它可以发展为肝硬化和肝癌。
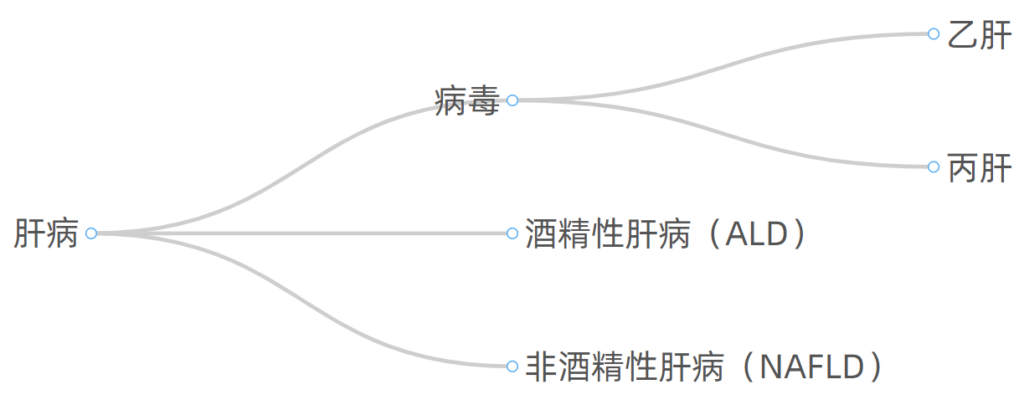
肝病按照病因划分,常见的有如下几大类:
无论病因如何,肝病如果没有得到有效管理控制,进展的常见终末阶段是肝硬化。
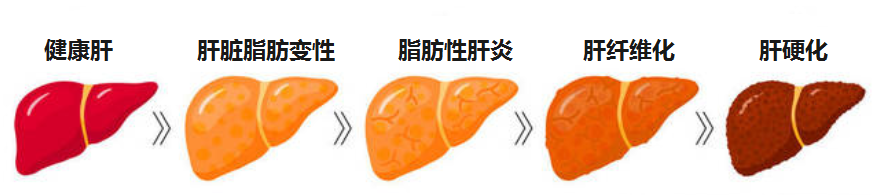

肝硬化可导致失代偿和肝细胞癌的发展。
发病率
目前由于疫苗接种计划和有效抗病毒治疗不断发展,乙肝和丙肝肝硬化的发病率正在下降,但由于以下两个原因导致另两种肝病发病率不断上升:
1、肥胖,导致非酒精性脂肪肝的发病率增加
2、饮酒,导致酒精性肝病的发病率增加。
本文带你详细了解肝病与肠道菌群:


肝脏也是胆汁产生的场所,在肠肝循环中具有重要作用。
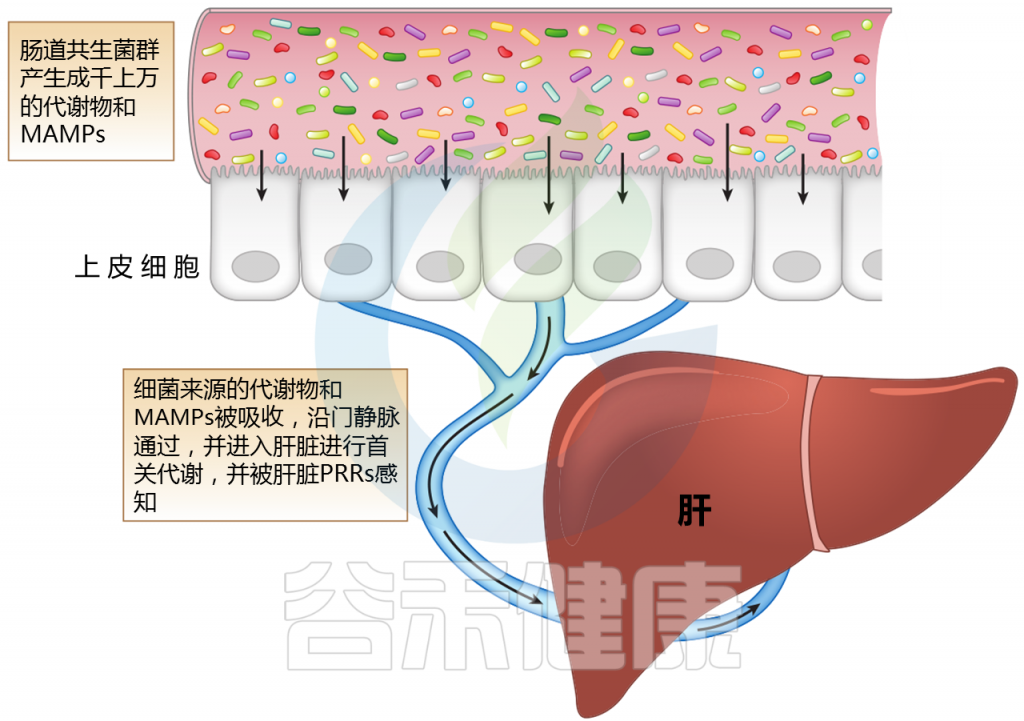
肝脏,作为第一个接触微生物产物进入门静脉循环的器官,可能受到肠道微生物群及其变化的多种影响。肠道微生物群的成分或代谢物通过各种机制与肝脏相互作用。
肝脏中产生的胆汁酸(如胆酸和鹅去氧胆酸)与葡萄糖醛酸酶结合。一旦分泌到十二指肠肠腔,肠道菌群代谢和解共轭,产生尿胆原(排泄)和初级胆汁酸被吸收和循环。胆汁酸还通过内在的微生物调节活动来控制和影响菌群。

Jones R M,et al.,Annual Review,2020
注:MAMPs——微生物相关分子模式;PRR——模式识别受体
肝脏位于体循环和来自肠道吸收活动的大量外源性分子和微生物相关分子模式(MAMPs)之间的界面。
微生物产生的代谢物会随着微生物群的组成而变化;它们沿着门静脉分流并引发多种信号通路的激活。MAMP暴露过多会导致炎症。
肝硬化前期肠道菌群总体变化:
整体多样性减少,厚壁菌门减少,拟杆菌门和变形菌门增加。
在三种类型的肝炎中,肝硬化前期微生物参与非酒精性脂肪肝病和酒精相关性肝病的证据相对更为有力。
—— 非酒精性脂肪肝病
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)是一种以肝细胞内脂质(主要是甘油三酯)的微泡或大泡状积聚为特征的肝病,并伴有不同程度的炎症浸润。
在非酒精性脂肪性肝病中,研究人员发现粪便、血液和肝活检中的致病菌(如肠杆菌科和大肠杆菌)的相对丰度增加。随着病原菌数量的增加和厚壁菌门数量的减少,菌群失调。
—— 酒精性肝病
长期摄入酒精可导致人类和动物模型中菌群结构的变化,肠道通透性增加,随着持续的酒精滥用,致病菌的多样性进一步减少,相对丰度增加,如肠杆菌科和肠球菌科。
在小鼠中,乙醇可以降低肠道屏障功能,并允许增加局部炎症。从机理上讲,乙醇也能抑制抗微生物凝集素的表达,在慢性乙醇消耗模型中,无Reg3β和Reg3γ的小鼠表现出增加的细菌移位和NASH的发生。这些发现表明乙醇可能介导了肝脏潜在的促炎性刺激,有多个长期后遗症。
尽管肝硬化的病因可能有所不同,但在肝病的末期,微生物群与肝脏的相互作用在很大程度上与病因无关。也就是说无论哪种都可能发展为肝硬化。
前面我们知道,肝炎如果不能得到有效控制,久而久之会对肝造成永久性损伤,也就是肝硬化。肝硬化又分为两种,一种是代偿性肝硬化,一种是失代偿肝硬化。
代偿性肝硬化虽然肝功能减退,但机体仍能正常运行。
失代偿性肝硬化指肝硬化发展到一定程度,出现肝功能衰竭,可能出现严重并发症,如肾功能衰竭、静脉曲张出血和肝性脑病等。
肝硬化患者最初没有症状,等到了肝硬化失代偿(定义为腹水、肝性脑病、黄疸和/或胃肠道出血),就是肝硬化过程中的转折点。
——肝硬化失代偿期会发生什么?
代偿性肝硬化患者可能会保持多年稳定,死亡率非常低,每年< 1%。然而,在第一次住院治疗后,35%的患者将在28天内出现后续的失代偿,需要频繁入院。肝硬化急性失代偿可导致慢加急性肝衰竭(ACLF)。
注:慢加急性肝衰竭是一种综合征,以一个或多个主要器官或系统(肝、肾、脑、凝血、循环或呼吸)衰竭为特征。
慢加急性肝衰竭是失代偿性肝硬化的主要死亡原因。他们的慢加急性肝衰竭(ACLF)的中位时间为2-3年,死亡率每年约为10%。


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
每次失代偿后,慢加急性肝衰竭在28天内的发展约为30%,在此阶段死亡率在28天内攀升至40%。这些器官衰竭患者通常在重症监护室接受治疗,肝移植是唯一的治疗方法。
肠道菌群如何影响肝硬化失代偿?
肝硬化中微生物群-肠道-肝脏相互作用
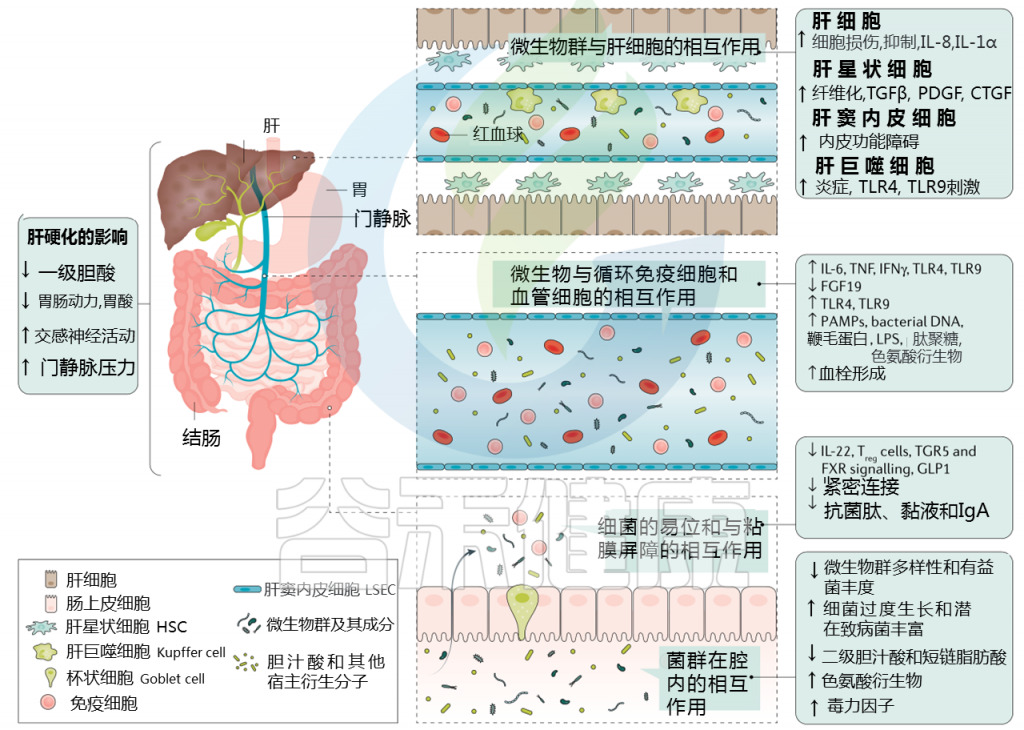

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝硬化发展过程中肠道微生物群的变化在很大程度上归因于肠道微生物群组成及其产物,产物可能具有致病作用。短链脂肪酸(SCFAs)、次级胆汁酸和色氨酸衍生物增加,而粘液蛋白的变化、功能失调的紧密连接和抗菌肽的减少促进了微生物组成分和/或其代谢物(病原体相关分子模式(PAMPs))跨肠屏障的移位。
接下来,就肠道菌群与肠道屏障,病变肝脏的相互作用,菌群代谢产物与转运,门静脉高压和酒精的作用这4个方面展开讨论。
1. 与肠道屏障相互作用
肠漏:
一个不正常的微生物群可以影响肠道上皮屏障,并导致内容物从肠道到肝脏和其他地方难以控制的转移。这种肠上皮屏障的损伤被称为漏肠。
在肝脏疾病期间,由于肝肠循环、肠道炎症和门脉高压的改变,宿主生理和肠道完整性发生重大变化。与此同时,肠道微生物组和肝脏之间的串扰也发生了重大变化:
肠道中的宿主粘膜蛋白和通路(例如FXR信号)被肠道微生物群代谢物(例如短链脂肪酸)改变,并可能导致肝脏损伤;
肝脏疾病进展引起的肠道内化变化可能会影响肠道屏障,促进肠道炎症,降低抑菌肽;
而肠道相关淋巴组织可能通过驱动肠道炎症,从而增加肠屏障的通透性参与肠屏障的功能障碍
由于穿过肠道上皮屏障的细菌成分会引发免疫反应,因此肠道渗漏被认为会增加慢性全身炎症。例如,在肝病患者,尤其是肝硬化患者中,细菌细胞壁脂多糖(LPS)水平升高,也被称为内毒素血症。
2018年的一项研究表明,从失代偿期肝硬化患者的循环血和其他“无菌”隔室中分离出的细菌是可行的,这表明即使是活的细菌也可以在失代偿期肝硬化期间通过肠屏障转位。
2. 与病变肝脏的相互作用
从失代偿到慢加急性肝衰竭的进展与全身炎症的广泛激活有关,影响许多细胞因子和炎症系统。
释放危险相关的分子模式来促进失代偿和炎症
慢加急性肝衰竭的发展,不同衰竭器官的死亡细胞和细胞外基质的重塑,特别是在肝脏,都通过释放危险相关的分子模式来促进失代偿和炎症,最终可能是慢加急性肝衰竭发展的先决条件。
这种联系在乙肝病毒引起的肝硬化和/或慢加急性肝衰竭患者中尤其常见。慢性乙肝病毒的再激活可能导致肝损伤,从而释放危险相关的分子模式,进而导致器官衰竭和慢加急性肝衰竭。
在慢性肝病和肝硬化患者中,甲肝病毒和戊肝病毒重叠感染也可能诱发慢加急性肝衰竭。
对病原体相关分子模式的免疫反应导致器官功能障碍
另一方面,这种炎症的爆发是由微生物或其成分的转移引起的,也称为病原体相关分子模式。对病原体相关分子模式的免疫反应可能在免疫病理学过程中导致器官功能障碍,在这种过程中,免疫反应会导致感染造成损害。
炎症标志物水平升高
血浆中全身性炎症标志物(如IL-8或IL-6)水平升高,无论是否有明显的细菌感染,都与肝硬化和慢加急性肝衰竭的急性失代偿有关。新的数据强化了改变后的肠道微生物群和慢加急性肝衰竭之间的联系。
血浆代谢物特征
除了肠道菌群衍生代谢物与慢加急性肝衰竭发展之间的关联之外,血浆代谢物特征(可能也来自肠道菌群)也与全身炎症和慢加急性肝衰竭密切相关。
这些发现可能解释了为什么肠道微生物群的改变和细菌易位的增加可能为不同器官的免疫病理发展为器官衰竭,加重全身炎症和诱导ACLF的环境。
酒精性肝病
2019年研究表明,乙肝病毒相关ACLF患者的循环细菌DNA显著增加,并与炎症标记物(如CXCL10,一种已知的趋化因子)相关,在非乙肝病毒病因中也与ACLF相关,尤其是酒精性肝硬化。
另外,在急性酒精性肝炎(ACLF的一个亚型)中,研究表明,与没有这种特殊菌株的患者相比,具有一种产生细胞溶血素的肠球菌菌株的患者具有极高的死亡率(180天内的死亡率分别为89%和3.8%)。
我们知道,急性酒精性肝炎与微生物变化密切相关,这可能决定患者的临床特征及其结果。在几乎一半的急性酒精性肝炎患者中,失代偿和慢加急性肝衰竭都会发生,但没有任何可识别的促发事件,这表明这与内源性机制有关(例如,门静脉高压症或细菌易位)。
3. 门静脉高压症和酒精的作用
即使肝硬化的门静脉高压症得到有效治疗,例如通过放置经颈静脉肝内门体分流术(TIPS)支架,许多患者仍出现进一步失代偿和ACLF(2年内约47%),尤其是由于全身炎症和随后的器官衰竭。
此外,与肝静脉、右心房和外周静脉血相比,腹水的存在决定了门静脉循环微生物群的组成(腹水:一种失代偿的指标),以及与炎症标记物和ACLF的发生相关的特定循环微生物群。
然而,应该指出的是,TIPS支架本身可能会加重高动力循环,从而导致内毒素水平的增加。从长远来看,TIPS支架降低了失代偿率,可能主要是由于这些肝硬化患者腹水的发生率降低。
失代偿性肝硬化和ACLF先于酒精性肝硬化发生。这一发现可能很重要,不仅因为酒精是失代偿期肝硬化最常见的病因,而且可能是由于酒精本身对肠道微生物群和肠屏障功能的直接影响。
在健康个体和动物模型中,已经证明急性酗酒会增加循环中的内毒素和细菌DNA水平。
酒精显著改变肠道微生物群的组成,降低拟杆菌的相对丰度,增加变形菌。
它的代谢物,特别是乙醛,可以破坏肠道上皮细胞的紧密连接,导致肠道渗漏,促进细菌和真菌的易位,这两者都可能与肝硬化的进展有关。
在不同病因的肝硬化(例如,非酒精性脂肪性肝炎或乙型肝炎引起的肝硬化)中也观察到微生物群组成的改变以及肠道的渗漏。
4. 微生物代谢产物和转运
肝硬化发展过程中肠道微生物群的变化在很大程度上不仅归因于肠道微生物群的组成,还归因于其产物,这些产物可能具有致病作用。
一项研究表明,在肝硬化向失代偿和ACLF发展的过程中,血液代谢物特征明显改变。
针对903人的大规模研究为某些强预测代谢物模式的微生物起源带来了重要的见解,但很难对这些发现作出有力的陈述。
另一项对602名患者进行的研究表明,微生物群衍生代谢物与ACLF的存在有关。其他微生物成分,如次级胆汁酸、短链脂肪酸和色氨酸代谢物也在肝硬化中发生较大变化,与疾病的进展有关。尤其是,胆汁酸通过下调FXR受体来改变肠道屏障功能,这为临床FXR激动剂已经可用提供了新的治疗机会。
间接证据表明肠道微生物群可能会影响肝硬化的预后。
首先,研究表明,使用非选择性β受体阻滞剂(一种预防肝硬化失代偿的常用方法)治疗可改善肠道屏障,减少肠道转运时间,从而降低肝硬化患者细菌转移的可能性。
第二,在静脉曲张破裂出血期间或作为失代偿期肝硬化的长期预防措施,抗生素治疗是一种推荐的治疗方法,因为它可以改善结果,其机制可能与减少细菌移位有关。
尽管这一观点尚未得到确凿的证实,但我们知道,一种特定的微生物组表型(所谓的肠型)会导致肝功能的病理改变,并且考虑到微生物群中存在着广泛的成员,如真菌或病毒,微生物组标志物可能是非常有用的临床工具,以确定有失代偿和ACLF风险的患者。
肠道微生物群可以作为疾病进展、严重程度和治疗反应的生物标志物。
不同肝病的菌群特征
肝硬化:
瘤胃菌科、毛螺菌科与其他菌(包括肠杆菌科和拟杆菌科)进行比较,菌群比率失调。随着ACLF的发展,肝硬化菌群失调比率恶化。
该研究表明,肝硬化患者的菌群比率失调
对129名患者的研究显示,毛螺菌科减少,巴斯德氏菌科(Pasteurellaceae)的丰度可以预测死亡率。
其他研究也提供了证据,表明特定的微生物组群特征可以区分肝硬化和健康对照组,并且微生物组的变化可能能够监测病情的严重程度和进展情况。
一组45例肝移植受者中,肝移植改变了肠道菌群,使微生物多样性增加,原生细菌增加(如毛螺菌科),潜在致病菌减少(如肠杆菌科)。
该研究强调了患病的肝脏会影响肠道菌群。
肝硬化和慢加急性肝衰竭:
慢加急性肝衰竭和肝硬化的肠道微生物群特征


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
中国肝硬化患者宏基因组全关联研究(MWAS)显示,与健康个体相比,肝硬化肠道菌群组成有大于34个显著差异的菌群。肝硬化患者中韦荣球菌属和链球菌增多,而产丁酸共生菌包括Faecalibacterium prausnitzii 和Coprococcus comes减少。(下表)
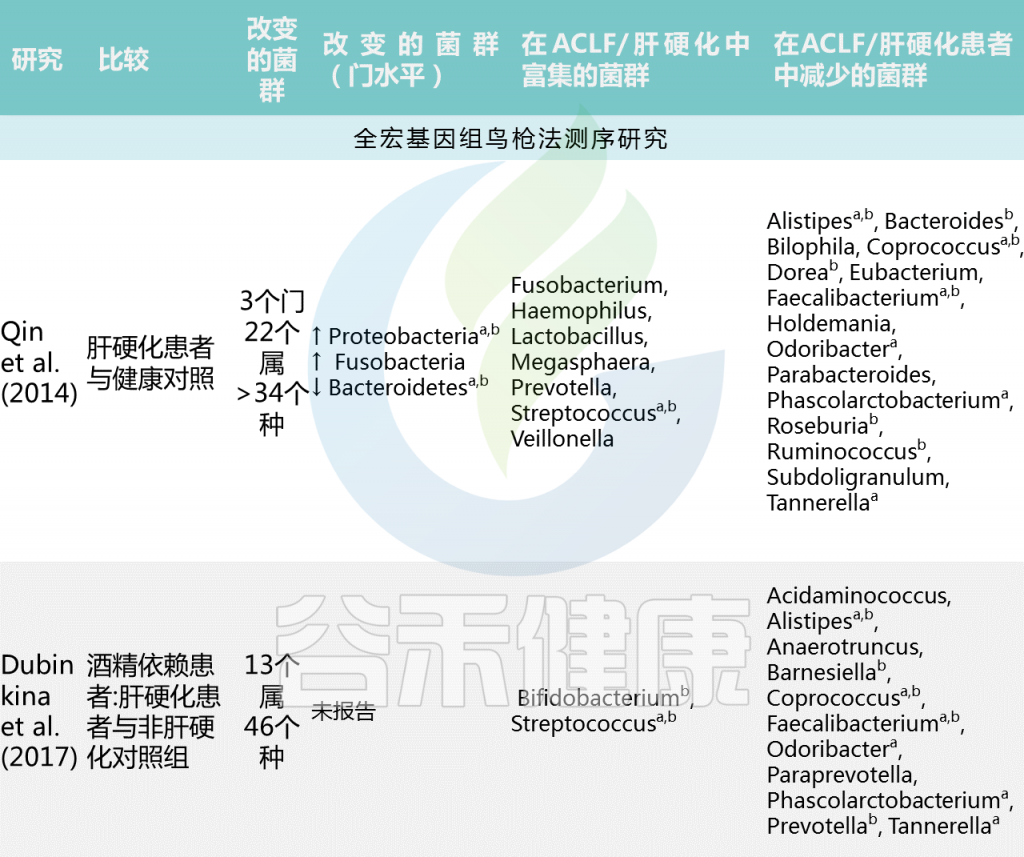

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝细胞癌(HCC)
持续的肝损伤和再生促进了肝细胞癌的发生,它是全球癌症死亡的第三大原因。
肝细胞癌HCC与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
在与非酒精性脂肪性肝病相关的HCC,一项来自意大利的研究注意到拟杆菌和瘤胃球菌科增加,双歧杆菌减少。
不同部位菌群功能
肠道菌群:
从门诊病人的角度来看,肠道菌群可以证明是预测入院,MHE和晚期纤维化患者的有用工具。
一项针对NAFLD肝硬化的研究发现,粪便微生物分析中的27种细菌特征以及年龄,性别和体重指数(BMI)可预测NAFLD肝硬化。
晚期纤维化是NAFLD死亡率的重要预测指标,可以从粪便菌群中推断出纤维化,以帮助识别高危人群。
鉴于失代偿性肝硬化中存在预测的失调模式,因此将CDR(肝硬化失调率-毛螺菌科+瘤胃菌科+韦荣氏菌科/肠杆菌科+拟杆菌科)视为预测失代偿风险的工具(适用于所有常见的CLD病因)较低的分数预示结果较差,并且具有较强的预测价值。
粪便菌群也可以用来预测谁会在90天内再次入院和急性肝性脑病复发,因为急性肝性脑病和其他失代偿的粪便菌群有所不同。
唾液菌群:
唾液菌群失调比率是一种简单实用的临床工具(Lachnospiraceae + Ruminococcaceae + Veillonellaceae/ Streptococcaceae),可以预测有和无肝性脑病的失代谢性肝硬化患者90天的入院情况。
其他部位菌群:
一些研究表明,粪便微生物群和结肠黏膜相关微生物群是不同的。事实上,回肠、空肠和十二指肠粘膜样本或抽吸物的微生物群是不同的,它们可能对肝硬化具有重要的预后能力,主要表现为肝性脑病。然而,这些样本并不容易获得,而且很难将其作为生物标志物进行常规的护理点采集。
微生物工具的潜力
需要进一步的研究才能使人信服结论:患者在不同的条件和疾病下,它们的肠道微生物群既表现出疾病特异性的变化,也表现出非特异性的共同反应。因此,在其作为生物标志物的潜力得以实现之前,确定强有力的疾病特异性肠道菌群特征至关重要。
生物标志物和基于微生物的工具的潜力

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
要更准确地估计疾病对肠道微生物群的影响程度,就需要从世界各地获得强有力的大规模纵向数据,同时考虑各种混杂因素。理解和解释其他相关的混杂因素将使我们更接近以微生物组为基础的肝硬化生物标志物。
微生物组的整体观点,包括微生物基因表达和微生物衍生的代谢物或蛋白质,可能导致更准确和全面的生物标志物,类似于整合宿主遗传学与基因表达和表观遗传学时的强大疾病关联。这种包含宿主-微生物全生物的整体观点也可能支持诊断、分层和治疗的个体化,并可能开创全生物群关联研究的新时代,扩大宏基因组全关联研究领域。
我们知道,即使在没有肝病的情况下,微生物组也在调节情绪和潜在的认知中发挥作用。慢性肝病患者的脑功能改变是肠-肝-脑轴的结果,甚至在肝硬化之前就可以影响病程。
酒精使用障碍(AUD)
一项关于酒精使用障碍(AUD)患者肠-肝-脑轴的重要研究发现,抑郁、焦虑和酒精渴求与肠通透性增加相关,即使在戒酒后,肠通透性高的患者仍然存在抑郁、焦虑和酗酒。
最近发表的一篇关于AUD中这一轴的操纵的文章显示,对于AUD患者,在粪菌移植后,这些渴望、消费和长期的与AUD相关的住院治疗可能会降低。
肝性脑病
肝硬化中普遍存在的认知功能障碍是一种记忆障碍型,称为轻度或隐性肝性脑病。这可以发展为明显的肝性脑病,表现为嗜睡,迷失方向,晕眩和昏迷。
肝性脑病是肠肝轴中与微生物组相关的经典并发症,是全身性内毒素血症和炎症的结果,最终加重了神经炎症,而神经炎症是支撑肝性脑病发病机理的重要因素。
多年来,氨被认为是肝性脑病发病的关键,但后来发现全身炎症对于氨发挥其神经毒性作用是必不可少的。越来越多地描述了特定微生物群在肝性脑病和全身性炎症(包括性别影响)进程中的作用。在小鼠中,发现肠道微生物组是肝性脑病所特有的全身性炎症和神经炎症所必需的。
轻度肝性脑病和PTSD
在临床上,轻度肝性脑病需要专门的认知测试,例如心理计量学肝性脑病评分(PHES),抑制性对照测试,脑卒中诊断等。但这些测试最好在专门的环境中进行,并且需要专业知识。
轻度肝性脑病(MHE)和创伤后应激障碍(PTSD)肠道菌群之间也存在协同作用,与其他人相比,PTSD患者的菌群失调更为严重。PTSD,酒精滥用和肝硬化常常并存。微生物变化可能有助于将MHE与PTSD区别开来,并且可以帮助我们定义较新的疗法。
老年肠道-肝-脑轴改变
利用肠脑轴的主要挑战是老年人群(慢性肝病患者)。老年人患者的致病菌往往更具致病性,随着合并症,住院和抗生素暴露于更大的革兰氏阴性病原体中,病情恶化。
与类似的老年非肝硬化对照组相比,年龄较大(> 65岁)的肝硬化患者往往会改变肠道-肝-脑轴,从而增加炎症并损害记忆的认知能力。在相关网络分析的研究中,更重要的是,在老年肝硬化和非肝硬化组中也发现了类似的模式,这表明老年患者已经具有潜在的肠脑轴改变。
这对肝移植具有重要意义,因为尽管进行了肝移植,但与年龄相关的肠脑轴变化仍可能持续。人口老龄化往往会导致多种其他合并症和精神疾病,需要额外的照顾以确保最佳的移植后效果。
针对肝硬化肠道微生物群的策略
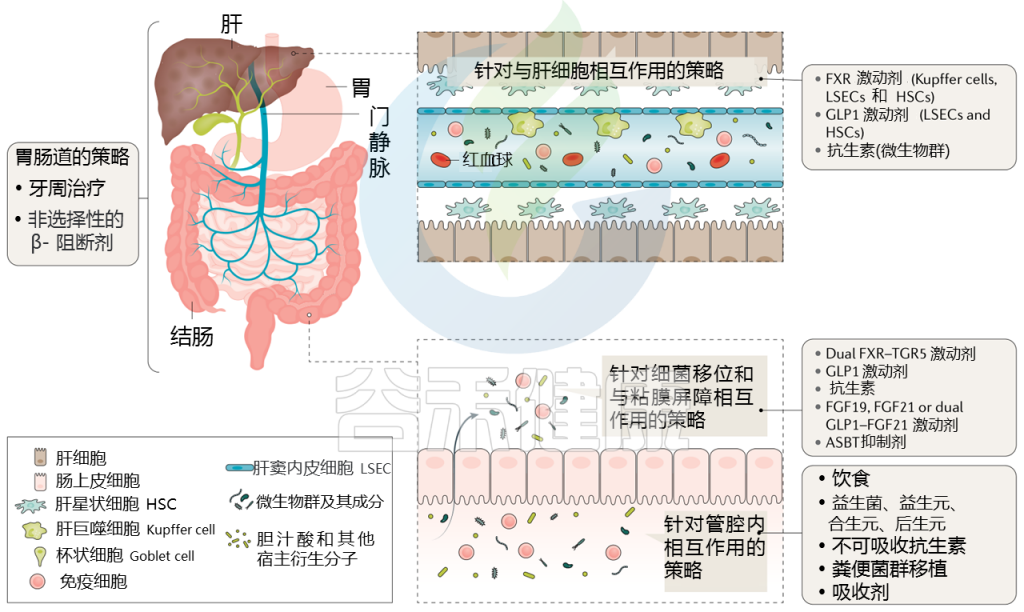

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
通过治疗(部分成立和部分试验)调节肠道微生物群可能改善肝硬化患者的预后,而微生物组生物标志物可能反映对这些治疗的反应。下表显示了不同的策略。
针对肠道微生物群的肝硬化干预措施

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
接下来主要介绍一些具体疗法:饮食、益生菌、抗生素、白蛋白、牙周、粪菌移植等,有些目前正在临床试验中。
饮 食
除其他因素外,饮食对肠道微生物群有重要影响,这一点已在各种疾病和条件下得到研究。一项针对国际肝硬化人群的研究报告称,咖啡、茶、蔬菜和酸奶的摄入都与微生物群落多样性的增加和住院率的降低有关,这为调节肠道微生物群落以促进肝脏健康提供了前景广阔的途径。(具体的饮食方面建议见文末附录部分)
益 生 菌
益生菌已经成为肝硬化临床研究的主题,特别是它们对脑功能的影响和肝性脑病的风险。
益生菌在肝硬化前可以改善NAFLD的组织学,在肝硬化中可以减少失调,对逆转OHE的二级预防有效,减少失代偿事件的住院率,但可能或不能改善认知能力(MHE)。
大多数制剂都含有乳酸菌,可产生短链脂肪酸,有利于结肠健康。一项短期(5天)口服两歧双歧杆菌和植物乳杆菌8PA3的小型试点研究表明,与单独标准治疗相比,口服两歧双歧杆菌和植物乳杆菌8PA3能恢复肠道菌群,并能更好地改善酒精性肝损伤。
以上是关于益生菌的前沿研究,如果想要尝试的话,最好是经过肠道菌群检测或者在医生的指导下服用更可靠。
抗 生 素
抗生素,也被用作失代偿期肝硬化的预防性治疗。
腹水患者发生自发性细菌性腹膜炎(SBP)的风险增加,接受抗生素预防来预防自发性细菌性腹膜炎的发展。这种SBP的一级预防已经被证明可以提高某些患者的生存率。
在一项多中心、随机对照试验中,对严重肝硬化患者使用抗生素,总体生存率没有任何益处,但是,同样,腹水中白蛋白浓度低的患者在接受抗生素治疗时,生存率得到了提高。
预防性抗生素治疗也同样有效建议用于其他临床情况,如静脉曲张破裂出血、既往SBP和复发性显性肝性脑病。然而,尽管对最脆弱的患者的短期效果可能是有益的,但在其他许多患者中,这些治疗不能阻止进一步的失代偿和ACLF。也许这种情况的部分原因是抗生素引起的微生物群落多样性减少。
因此,需要开发一种更具针对性的肠道微生物群来改善肝脏健康。
牙周卫生
也许你不知道,牙周卫生也会与肝硬化有关。已发表的人类MWAS表明,在肝硬化期间,肠道微生物组向口腔微生物组转变。
减少胃部充当天然屏障的酸性环境可能促成口腔微生物群转移到肠道,在肠道上皮屏障适应不同的微生物组分。如前所述,这些变化可能促进肠道微生物群通过肠道屏障的转移,进而导致并发症。因此,防止口腔微生物不必要的转移到肠道,可以成为未来肝硬化治疗的基础。
一项研究表明,与20名非肝硬化对照组相比,30名肝硬化患者的牙周卫生干预措施改变了肠道微生物群,改善了肝性脑病。
白蛋白作为潜在疗法
当肠道屏障被削弱时,它会双向泄漏,这也会导致重要的宿主分子从血液室泄漏到肠腔。例如,在酒精性肝病动物模型中,肠道通透性增加导致粪便白蛋白浓度升高。
随着肝硬化的进展,肝脏中的白蛋白合成受到损害:一方面,肝损伤导致肝细胞功能质量的丧失;
另一方面,肝脏僵硬程度的增加,白蛋白合成减少。不仅白蛋白减少,而且它能结合毒素和其他有害物质。这些观察结果将白蛋白水平定位为肝病严重程度的关键参数。
白蛋白还可通过前列腺素E2改善免疫B细胞功能,减少肝硬化患者的免疫反应,从而阻止与ACLF和死亡密切相关的全身炎症爆发。
长期白蛋白治疗肝损害和非自发性细菌性腹膜炎感染患者分别通过提高生存率和解决ACLF改善了临床结果。因此,白蛋白泄漏到肠腔可能会影响肠道微生物群并被其代谢,从而可能改变微生物组分,间接改变宿主。
粪菌移植(FMT)
失代偿期肝硬化中菌群移植的初步研究正在出现,其安全性也很高,为更大规模的研究铺平了道路。
菌群移植后变形菌减少,放线杆菌增多,肝脏疾病严重程度改善,严重酒精性肝炎患者3个月时的死亡率降低,1年生存率提高。
慢性乙型肝炎FMT组出现微生物改变,HBeAg降低。FMT减少了短期酒精渴求和消费,以及AUD相关的住院治疗。
一项包括20名复发性肝性脑病患者在内的开放性随机试验观察到,使用FMT灌肠剂减少了住院人数,改善了认知和菌群失调。
另一项研究也证明了这一点。使用口服胶囊制剂的FMT的新应用也显示出类似的安全性和对肝硬化和肝性脑病的治疗效果。然而,由于报告了一些由耐yao菌转移导致的FMT相关死亡病例,包括一些肝硬化患者,因此需要谨慎。因此,更好地理解和全面描述这些研究可能带来明确的微生物调节干预治疗失代偿期肝硬化。
加深菌群影响机制的理解
未来的研究应该探索和加深对肠道微生物组变化影响肝硬化进展和失代偿发展的动力学和机制的理解。
诊断、治疗
由于肝硬化表现为肠道微生物群与宿主的大量重要相互作用,微生物组诊断和治疗几乎是治疗疾病进展和失代偿发展的必经之路。需要进一步倡导基于微生物组检测和靶向疗法。
改善预后
针对不同水平微生物群与宿主相互作用的策略改善患者的预后。
产学研合作
使之更容易获得和更具成本效益,微生物检测需要更广泛地适应,因为它相对容易收集且信息量较大。可以帮助诊断,预测和潜在地个性化治疗。
多学科综合
多学科例如微生物学,宿主遗传学,基因组学,表观遗传学,代谢组学,营养学等相结合,更好地利用微生物帮助我们有效的进行慢病管理,预防为主,将指导落实到饮食、生活方式等具体应用上,用全新的视角帮助我们认识健康,保持健康。
饮 食 方 式
尽可能选择对肝脏友好的食物,帮你保护肝脏。以下是一些饮食技巧:
选择全麦谷物,面包和谷物。
多吃各种颜色的水果和蔬菜。
选择低脂乳制品。
选择瘦肉蛋白质。
选择植物油,例如橄榄油,而不是黄油。
零食坚果和种子食物。
减少钠摄入量。
每天喝8-10杯水。
避免含有反式脂肪的加工食品。
避免添加糖。
选择可以长期生活并遵循的饮食计划。
吃八分饱腹感
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
限 制 饮 酒 量
肝脏是负责代谢营养物质和其他摄入物质的主要器官。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
定期减少饮酒量很重要。医生甚至可能建议你完全戒酒。
增 加 运 动 量
运动的好处不仅限于减肥和控制体重,还可以帮助减少肝脏周围的脂肪。定期运动也可以改善你的情绪,助你维持在最佳的健康状态。
开始时要循序渐进,比如可以每周进行150分钟运动开始,尽量选择你喜欢的运动,例如,跑步和步行的组合,多人参与的活动增加趣味性(如各种球类运动),健身房的器械训练等。
睡 觉
充足的睡眠对于保持健康状态非常重要(包括慢性肝病治疗期间睡眠很重要)。如果你觉得入睡困难,开始慢慢尝试练习良好的睡眠习惯,例如:
每天都在同一时间上床睡觉和起床,作息规律。
避免咖啡因,烟草和其他刺激物。
尽量保持卧室环境清爽舒适。
运动尽量安排在清晨或午后,不要在睡前剧烈运动。
相关阅读:
膳食胆固醇通过调节肠道微生物群和代谢产物驱动脂肪肝相关的肝癌
参考文献:
Grat M, Wronka KM, Krasnodebski M, et al. Profile of Gut Microbiota Associated With the Presence of Hepatocellular Cancer in Patients With Liver Cirrhosis. Transplant Proc 2016;48:1687-91.
Jones R M, Neish A S. Gut Microbiota in Intestinal and Liver Disease[J]. Annual Review of Pathology:Mechanisms of Disease, 2020, 16.
Acharya Chathur,Bajaj Jasmohan S,Chronic Liver Diseases and the Microbiome: Translating Our Knowledge of Gut Microbiota to Management of Chronic Liver Disease.[J] .Gastroenterology, 2020
Bajaj JS, Sharma A, Dudeja PK. Targeting Gut Microbiome Interactions in Service-related Gastrointestinal and Liver Diseases of Veterans: Meeting Summary.Gastroenterology 2019.
Liu R, Kang JD, Sartor RB, et al. Neuroinflammation in Murine Cirrhosis Is Dependent on the Gut Microbiome and Is Attenuated by Fecal Transplant. Hepatology 2020;71:611-626
Ren Z, Li A, Jiang J, et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut 2019;68:1014-1023.
Trebicka Jonel,Bork Peer,Krag Aleksander et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure.[J] .Nat Rev Gastroenterol Hepatol, 2020
Lang S, Fairfied B, Gao B, et al. Changes in the fecal bacterial microbiota associated with disease severity in alcoholic hepatitis patients. Gut Microbes 2020;12:1785251.
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease. Hepatology 2019;69:107-120.
Gao B, Duan Y, Lang S, et al. Functional Microbiomics Reveals Alterations of the Gut Microbiome and Host Co-Metabolism in Patients With Alcoholic Hepatitis. Hepatol Commun 2020;4:1168-1182.
Duan, Y . et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505–51 1 (2019)

谷禾健康
感觉疲惫?沮丧?容易出汗?经常感冒?免疫力下降?骨痛?脱发?…
这些都可能与维生素D缺乏有关。
维生素D对人体健康很重要。然而流行病学研究表明,全世界近十亿人口受维生素D缺乏症的影响。
一项针对北京和上海50-70岁人群调查显示:

注:VD水平缺乏(低于20ng/ml);VD水平不足(低于30ng/ml)
首先我们来看下维生素D在人体中扮演怎样的角色。
维生素D
· 维生素D是脂溶性维生素
· 参与钙和磷的吸收,骨骼健康以及肌肉的生长和发育(生理过程)
· 刺激肌肉细胞的增殖和分化(影响肌肉系统)
· 其充足的供应可预防呼吸道感染,间接参与具有抗生素特性的化合物的生产(免疫系统)
· 其最佳含量对皮肤的状况和健康以及男性和女性生殖过程的调节都有积极的作用(皮肤)
为什么会有这么多人出现维生素D缺乏?
1. 饮食摄入和/或吸收减少
某些吸收不良综合症,如腹腔疾病,短肠综合症,胃搭桥,炎性肠病,慢性胰腺功能不全和囊性纤维化,可能导致维生素D缺乏。老年人中口服维生素D摄入量较低的情况更为普遍。
2. 减少阳光照射
大约50%-90%的维生素D通过阳光通过皮肤吸收,其余的来自饮食。为了防止维生素D缺乏,每天需要20分钟的阳光照射,皮肤暴露在40%以上。维生素D的皮肤合成随着年龄的增长而下降。黑皮肤的人皮肤维生素D的合成较少。在住院或长期住院的患者中减少的日光照射也会导致维生素D缺乏。持续使用防晒霜的人的有效日晒量降低。
3.内源性合成减少
患有慢性肝病(例如肝硬化)的个体可能具有缺陷的25-羟化作用,导致活性维生素D缺乏。1-α25-羟化作用的缺陷可见于甲状旁腺功能亢进,肾衰竭和1-α羟化酶缺乏症。
4.肝分解代谢增加
某些yao物会诱导肝p450酶,从而激活维生素D的降解。
5.维生素D 抵抗
在遗传性抗维生素D佝偻病中可以看到维生素D受体抵抗。
维生素D缺乏症的大多数患者无症状。
轻度的慢性维生素D缺乏症,也可能会导致慢性低钙血症和甲状旁腺功能亢进,特别是在老年人群中,可能导致骨质疏松,跌倒和骨折的风险。
长期严重维生素D缺乏症患者会出现与继发性甲状旁腺功能亢进有关的症状,包括骨痛,关节痛,肌痛,疲劳,肌肉抽搐(束缚)和无力。脆性骨折可能是由于长期缺乏维生素D导致骨质疏松所致。
在儿童中可能产生的症状:烦躁,嗜睡,发育迟缓,骨骼变化或骨折等。
其他一些症状可能会被忽视,其实也与维生素D缺乏有关,例如:
感到疲惫,免疫力下降,反复感染,容易出汗,脱发,伤口愈合慢,头晕,心脏问题,超重或肥胖,情绪低落,认知功能障碍等。
25(OH)D是血中维生素D的主要存在形式, 而且血清或血浆中25(OH)D受机体调节的影响较小, 可以在较长时间内维持稳定,可以体现膳食摄入维生素D和阳光维生素D的总量,这是评估维生素D水平是否正常的首选临床措施。
临床上,血清25(OH)D水平标准如下:
足够: 大于20–30 ng/ml 或50–75 nmol/L
安全上限: 不超过60 ng / ml 或 150 nmol/L
有毒: 高于150 ng/mL 或 375 nmol/L
毒 副 作 用
高维生素D水平是由于过量摄入而不是由于过度日光照射引起的。
急性中毒可导致急性高钙血症,可引起混乱,厌食,呕吐,多尿,多饮和肌肉无力。
慢性中毒可导致肾钙化和骨痛。
维生素D缺乏与许多非传染性疾病的发生有关,如结肠癌,乳腺癌,卵巢癌,肾癌,胰腺癌,精神分裂症,阿尔茨海默,多发性硬化,骨软化症,佝偻病,骨质疏松,糖尿病等。
4.1 呼吸道疾病
一些研究表明,维生素D补充剂可以增强免疫反应并预防呼吸道感染。
一项来自14个国家/地区的11,321人的研究表明,补充维生素D可以使维生素D缺乏和适当水平的人降低急性呼吸道感染(ARI)的风险。
来自三项随机对照试验的Meta分析研究中,发现补充维生素D可以降低维生素D水平低于25 nmol / L的患者慢性阻塞性肺疾病恶化率。
4.2 新 冠 肺 炎
与呼吸道疾病相关的,例如COVID-19。
最近的一项研究表明,血液中25(OH)D的浓度至少为30 ng / mL有助于住院的COVID-19患者减少临床预后不良和死亡的可能性。
研究分析了235例COVID-19患者的住院资料。与维生素D缺乏症患者相比,在40岁以上的患者中,维生素D含量适当的患者发生不良后果(包括失去知觉,缺氧和死亡)的可能性降低51.5%。
在疫情期间,我们可能常听到这样的词:“细胞因子风暴”。而维生素D缺乏会增强细胞因子风暴的过程。
注:细胞因子是蛋白质,是免疫系统不可或缺的一部分。它们可以同时具有促炎和抗炎作用,并发挥重要作用,有助于预防感染和疾病。但是,在某些情况下,细胞因子也会引起组织损伤。
细胞因子风暴是指响应感染或其他因素而发生的促炎性细胞因子的失控释放。细胞因子的这种失调和过度释放会导致严重的组织损伤,并增强疾病的进展和严重程度。
细胞因子风暴是导致多器官功能衰竭和急性呼吸窘迫综合征(ARDS)的主要原因,也是导致COVID-19进程和严重程度的重要因素。例如,已显示严重病例COVID-19的患者释放大量细胞因子,尤其是IL-1和IL-6。
维生素D缺乏与免疫功能降低有关,并可能增强细胞因子风暴。当然该领域还在研究中。
需要特别注意,单独服用补充维生素D并不能让你免受COVID-19的侵害。不过,缺乏维生素D可能会损害免疫功能,从而增加感染风险和对疾病的敏感性。
4.3 自 闭 症
自闭症是遗传和环境因素共同作用导致的神经发育异常,自闭症人群中维生素D的缺乏较常见,而维生素D能够促进儿童的大脑神经发育,因此可能在自闭症的病因学上起着重要作用。
采用随机双盲对照临床试验(RCT)设计,纳入109名自闭症儿童(85名男孩和24名女孩;年龄为3-10岁)。将自闭症患儿随机分组,分别接受维生素D3或安慰剂治疗4个月。结果发现,自闭症儿童可很好地耐受高剂量的维生素D3,且临床疗效较好。
这项研究是第一个证明维生素D3补充剂有益于自闭症患者的随机双盲对照试验,但是仍需更大规模的随机对照试验来严格验证维生素D对自闭症患者的疗效。
4.4 癌 症
对包括57,000多名受试者的18项随机对照试验(RCT)进行的荟萃分析发现,每天摄入维生素D补充剂可降低总死亡率。补充钙和维生素D降低了罹患总癌症,乳腺癌和结直肠癌的风险。
一项RCT显示,钙和维生素D可以大大降低绝经后妇女的所有癌症风险。
近几年来的人群研究还发现,机体维生素D水平与肠道菌群之间也存在密切联系。
生命早期生长发育与维生素D有关
我们知道,婴儿在出生6 个月内身体生长发育迅速,所以需要充足的营养。维生素D 缺乏是婴儿早期营养不足的主要原因之一,维生素D 补充不足会严重影响婴儿的骨骼发育。
有研究显示,婴儿体重与维生素D 缺乏具有明显关联性。婴幼儿缺乏维生素D 也会影响肠道菌群的定植能力和数量平衡,导致消化系统功能失调造成吸收功能障碍。

婴儿期肠道菌群数量的改变受多种因素影响。研究显示,维生素D可通过信号传导来增强肠道结构屏障的完整性和提高肠道免疫反应能力,进而稳定菌群在肠道的定植和数量平衡。
婴儿在1 岁以内是肠道内菌群定植、演替和达到平衡的主要阶段,特别是肠道内双歧杆菌、大肠杆菌、乳杆菌等主要菌体在婴儿出生半年内完成定植、演替和数量的平衡,对增强机体免疫力和促进消化吸收起到了重要作用。
在最近对3-6 个月大的婴儿肠道微生物群的研究中,研究人员发现脐带血维生素D 水平与乳球菌减少有关。

正常成年人补充维生素D 后,普氏菌属(Prevotella)的丰度随维生素D 的摄入量增加而增加,嗜血杆菌(Haemophilus)和韦荣氏球菌(Veillonella)的丰度随维生素D 的摄入量增加而降低,粪球菌属(Coprococcus)和双歧杆菌属(Bifdobacterium)的丰度与血清25-OH-D 水平呈负相关。
上述资料表明从婴儿期到成人期,维生素D 对肠道菌群的组成具有调节作用。
维生素D减少与肥胖有关
有研究显示,饮食中类固醇类物质的缺乏会影响肠道菌群的定植和平衡状态,使菌群数量明显增加,可能与肥胖的发生均有一定关系,但仍需进一步研究证实。
维生素D 还可促进脂肪细胞内Ca2 + 的吸收,使脂肪酸合成酶的活性增强进而减少脂肪的分解,增强脂肪细胞的储脂能力。所以体内维生素D 含量减少时,体内脂质代谢会明显增强和细胞内储脂能力降低,导致肥胖发生。
国内学者发现,超重和肥胖患者血清中维生素D 水平明显低于正常水平,且维生素D 与BMI 和腰围指标呈独立负相关性。
维生素D 缺乏的婴儿体重和BMI 指标明显高于维生素补充充足的婴儿。肠道菌群数量的增加与肥胖具有密切联系,特别是乳酸杆菌和双歧杆菌以及肠球菌能增加体重和引起肥胖。
该研究发现,观察组婴儿补充维生素D 后乳酸杆菌、双歧杆菌、肠球菌含量明显低于对照组。
活性维生素D代谢产物
多项研究表明,肠道菌群会改变肠道维生素D的代谢,而益生菌补充剂会影响循环中的维生素D水平。维生素D缺乏会降低防御素的生成,防御素是一种对于维持健康肠道菌群非常重要的抗菌分子。正如研究人员期待的那样,口服合成防御素分子能够恢复肠道菌群平衡,降低血糖水平,并改善脂肪肝症状。

最近Nature Communications上发表的一项横断面研究,对567名老年男性的血清维生素D代谢产物及粪便菌群进行深入分析后发现,8种特定肠道细菌分类群与维生素D活性形式——1,25(OH)2D的水平相关,而更高的1,25(OH)2D水平与更健康的肠道菌群(更多的丁酸盐产生菌)相关。同时,1,25(OH)2D水平较高的男性具有更大的多样性。
这些结果提供了强有力的证据,表明宿主维生素D信号和老年人肠道菌群健康之间存在重要的相互作用。肠道中CYP27B1-和CYP24A1-24-羟化酶的共定位表达可能会被存在的微生物群增强或抑制。
无论是通过饮食干预和/或在临床上给合适的人群补充维生素D,发现与更有利的肠道微生物多样性相关的活性维生素D代谢产物(包括已知的丁酸盐生产者的特定微生物)可能会为临床提供潜在的干预目标。
自闭症儿童维生素D水平较低现象
大量研究证实,自闭症儿童的维生素D 水平低于同龄健康人群,并且足量、规范地补充维生素D 可改善其自闭症核心症。
动物实验研究表明,发育早期维生素D 缺乏会导致永久性的大脑发育异常,如神经生长因子(NGF)表达减少、侧脑室增大、神经结构或神经递质相关基因(如MAP2, NF-L,GABA-Aa4)表达降低、脑组织氨酰胺水平普遍降低、去甲肾上腺素和丝氨酸水平升高、多巴胺水平升高、5-HT 水平下降等。
维生素D——神经保护剂
而维生素 D的存在,可以改善由于脑部炎症和神经毒性引起的脑损伤,促进NGF表达,延缓神经元细胞死亡。因此,维生素D 可以作为一种神经保护剂保护大脑皮层神经元避免兴奋性毒性。
自闭症儿童肠道患病率更高
自闭症儿童存在免疫系统功能紊乱,胃肠道紊乱患病率高于正常发育儿童。一项超过14,000 例自闭症患者的多中心研究显示,自闭症患者炎症性肠道疾病患病率为0.83%,而全院患者患病率为0.54%;自闭症患者其他胃肠道紊乱疾病患病率为11.74%,而全院患者患病率为4.5%,表明自闭症肠道患病率更高。
Wang L 等研究发现,在自闭症患者和正常人群中发现鲍氏梭状芽孢杆菌存在明显差异。自闭症患者肠道中的脱硫菌属比正常人群明显增多,且普通拟杆菌属含量丰富,自闭症患者与对照组正常人群肠道中的放线菌及变形菌属含量也有差异。
还有研究观察到自闭症患者肠道中有更高水平的萨特菌和瘤胃球菌属。国外通过自闭症小鼠模型肠道菌群宏基因组的研究发现,其脆弱拟杆菌属、梭菌属比例较对照组明显异常,口服脆弱拟杆菌可改善自闭症样行为症状。
维生素D通过影响Th17/Treg细胞平衡改善菌群紊乱
维生素D 可调节Th 细胞以及Treg 细胞功能,可抑制Th17 细胞,并促进Treg 细胞的增殖。Th17/Treg细胞平衡可能是维持正常的机体整体免疫功能和肠道免疫屏障功能中关键的因素。
维生素D 通过影响Th17/Treg细胞平衡调节自闭症肠道的菌群紊乱,进而通过脑肠轴作用改善神经系统的发育。
这些研究提示,自闭症存在肠道微生物生态失衡,肠道微生物失衡的改善很有可能作为自闭症治疗新的发展方向。
VD与肠道菌群相互影响,从而影响肠道疾病
结直肠癌
2009 年Volker Mai 团队研究了非裔美国人结直肠癌高于白种美国人,研究发现非裔美国人饮食中的环杂胺明显增高,维生素D 摄入量明显减少,两组人群的粪便微生物群组成也存在差异,推测环杂胺、维生素D 与肠道菌群的组成有相互影响,从而影响肠道环境促进结直肠癌的发生。
克罗恩病
维生素D 缺乏与克罗恩病(Crohn’s disease,CD)的发病有关,研究表明补充维生素D3 会改变CD 患者肠道细菌组成,参与者口服维生素D3,从第1 天至第3天每天服用20000 IU,然后每隔一天服用一次,共4 周,CD 患者口服一周后,Alistipes 菌、Barnesiella 菌、紫单胞菌科(Porphyromonadaceae)、Roseburia 菌、Anaerotruncus 菌、Subdoligranulum 菌和Ruminococaceae(均为厚壁菌门)的丰度显著增加。
炎症性肠病
1,25-OH2-D3 治疗还可在炎症性肠病中改变肠道菌群的组成,从而对小鼠有保护作用。
在肠道性疾病中肠道细菌组成多发生改变,补充维生素D 则可调节已经发生改变的肠道菌群组成。通过补充维生素D可以改变肠道内不同菌种的含量,调节肠道菌群的组成,增加双歧杆菌,拟杆菌,降低大肠杆菌和肠球菌的含量和比例。
肠炎
此外,益生菌治疗沙门氏菌肠炎的研究显示益生菌在维生素D 受体(VDR)缺陷小鼠中没有显示出保护作用,而在野生型小鼠中可抑制沙门氏菌诱导的炎症和损伤。
VDR基因消融降低肠道中DEFA5和MMP7表达,肠道通透性增加,肠道内环境紊乱,维生素D参与ß-防御素-2的表达,通过ß-防御素-2的表达与肠道菌群相互作用,改善肠道环境以及影响肠道炎症,并且存在剂量关系。溃疡性结肠炎急性期用维生素D能够缓解急性期症状,改善肠道粘膜和肠道菌群。此外,推测益生菌对个体起效可能依赖于VDR 基因。
以上,我们看到在各种肠道疾病的条件下,补充维生素D在一定程度上能改善肠道菌群。那么在缺乏维生素D的健康个体中,补充维生素D对肠道菌群是否有益?
近日,一项研究对80位健康维生素D缺乏的女性进行补充维生素D的治疗。

该研究主要是解决两个问题。
1. 补充维生素D对受试者的肠道菌群的影响
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
2. 评估受试者菌群是否与他们的无反应状态有关。
注:无反应状态指一部分人群口服高剂量的维生素D也无效。
已有研究表明,Bacteroides acidifaciens可以预防肥胖和提高胰岛素敏感性,也是大肠中促进IgA抗体产生的主要共生菌之一。在该研究中,无反应者中较低的Bacteroides acidifaciens以及补充维生素D后的额外消耗表明,这种细菌可能与补充维生素D的反应有关。
因此,研究人员有这样一个设想,维生素D的补充促进有益菌生长,以维持免疫微生物的体内平衡。当然,需要开展更大队列的实验研究,以充分代表有反应者/无反应者,来证实该研究的发现。
6.1 鱼 类
鲑鱼
鲑鱼是一种受欢迎的脂肪鱼,也是维生素D的重要来源。

根据USDA食物成分数据库显示,一份3.5盎司(100克)大西洋鲑鱼每份含526 IU维生素D。
一些研究发现野生鲑鱼的含量更高,每份高达1300 IU。而鲑鱼养殖平均含量为250 IU。
鲱鱼
鲱鱼也是维生素D的最佳来源之一。每100克新鲜大西洋鲱鱼可提供216 IU,如果不是新鲜的鱼,腌鲱鱼也是维生素D的良好来源,每100克提供112 IU。

其他鱼类包括沙丁鱼,大比目鱼和鲭鱼等,都是维生素D的良好来源。
金枪鱼罐头
每包100克可含多达268 IU的维生素D,然而金枪鱼罐头中一般含有甲基汞(甲基汞是许多鱼类中发现的一种毒素)。可以选择淡金枪鱼(通常比白金枪鱼更好),每周不超过170克,可以防止甲基汞过多。

鱼肝油
鱼肝油每匙(4.9毫升)含维生素D约448 IU。同时也富含维生素A,omega-3脂肪酸等,但是不要服用过量。
6.2 蛋 黄
不吃鱼的人应该知道,海鲜不是维生素D的唯一来源。全蛋是另一种良好的来源,也是一种营养丰富的食品。
鸡蛋中的蛋白质大多在蛋清中,而脂肪、维生素和矿物质主要在蛋黄中。一颗标准的蛋黄含有37 IU的维生素D。

蛋黄中的维生素D含量取决于阳光照射和鸡饲料中维生素D的含量。当使用相同的饲料时,在阳光下漫游的牧场饲养的鸡所产卵的水平要高3-4倍。
从饲养的鸡中选择鸡蛋,或者从市场上购买富含维生素D的鸡蛋,可以满足日常需求。
6.3 蘑 菇
蘑菇是维生素D的唯一良好植物来源。蘑菇有点像人类,蘑菇在暴露于紫外线时也可以合成维生素D。不同的是,蘑菇产生维生素D2,而动物产生维生素D3。
某些野生蘑菇每100克包装含维生素D高达2300 IU。总的来说,只有野生蘑菇或经紫外线照射的蘑菇才是维生素D的良好来源。

6.4 强化食品
注:强化食品指向食品中添加一定量的食品营养强化剂,以提高其营养价值。
牛奶
有些牛奶中富含维生素D。每杯牛奶(237毫升)通常含有115-130 IU。
豆浆
通常会含维生素D以及牛奶中常见的其他维生素和矿物质。一杯(237毫升)通常含有107-117 IU的维生素D。
橙汁
一杯(237毫升)强化橙汁,包括高达100 IU的维生素D,当作早餐开启一天的活力。

燕麦片
半杯(78克)可提供维生素D量为54–136 IU。
注意以上食物中维生素D计算是强化食品中的含量。
最后,要提醒大家的是,“过犹不及”。维生素D虽然好,但不能补充过量。一旦维生素D过量,就会对身体带来伤害。
大剂量的维生素D服用一开始没有症状,但过几个月或几年就开始显现了,严重的情况下甚至可能导致肾脏衰竭和动脉钙化。
每天摄入1000-4000IU(25-100微克)的维生素D应该足以确保大多数人的最佳血液水平。
附 录 : 特殊人群维生素D补充剂量
维生素D缺乏引起的骨软化需要起始每日使用3000-40000IU的维生素D,随后使用每日400IU的维持剂量。
肠道吸收不良或肝脏疾病引起的维生素D缺乏通常需要每日使用40000IU(成人)治疗,每日10000-25000IU(儿童)。
甲状旁腺功能减退引起的低钙血症需要使用每日最多100000IU维生素D
——参考自:《DK家庭用药指南》
相关阅读:
参考文献:
Sizar O, Khare S, Goyal A, et al. Vitamin D Deficiency. [Updated 2020 Jul 21]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan
Nair R, Maseeh A. Vitamin D: The “sunshine” vitamin. J Pharmacol Pharmacother. 2012 Apr;3(2):118-26.
Holick MF. Vitamin D: important for prevention of osteoporosis, cardiovascular heart disease, type 1 diabetes, autoimmune diseases, and some cancers. South Med J. 2005 Oct;98(10):1024-7.
Czernichow S, Fan T, Nocea G, Sen SS. Calcium and vitamin D intake by postmenopausal women with osteoporosis in France. Curr Med Res Opin. 2010 Jul;26(7):1667-74. [PubMed] 4.
Naeem Z. Vitamin d deficiency- an ignored epidemic. Int J Health Sci (Qassim). 2010 Jan;4(1):V-VI.
Singh Parul,Rawat Arun,Alwakeel Mariam et al. The potential role of vitamin D supplementation as a gut microbiota modifier in healthy individuals.[J] .Sci Rep, 2020, 10: 21641.
Thomas MK, Lloyd-Jones DM, Thadhani RI, Shaw AC, Deraska DJ, Kitch BT, Vamvakas EC, Dick IM, Prince RL, Finkelstein JS. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998 Mar 19;338(12):777-83.
Gröber U, Kisters K. Influence of drugs on vitamin D and calcium metabolism. Dermatoendocrinol. 2012 Apr 01;4(2):158-66.
Pereira-Santos M, Costa PR, Assis AM, Santos CA, Santos DB. Obesity and vitamin D deficiency: a systematic review and meta-analysis. Obes Rev. 2015 Apr;16(4):341-9.
Elliott ME, Binkley NC, Carnes M, Zimmerman DR, Petersen K, Knapp K, Behlke JM, Ahmann N, Kieser MA. Fracture risks for women in long-term care: high prevalence of calcaneal osteoporosis and hypovitaminosis D. Pharmacotherapy. 2003 Jun;23(6):702-10.
Kennel KA, Drake MT, Hurley DL. Vitamin D deficiency in adults: when to test and how to treat. Mayo Clin Proc. 2010 Aug;85(8):752-7
Palacios C, Gonzalez L. Is vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol. 2014 Oct;144 Pt A:138-45.
Zadka K, Pałkowska-Goździk E, Rosołowska-Huszcz D. The State of Knowledge about Nutrition Sources of Vitamin D, Its Role in the Human Body, and Necessity of Supplementation among Parents in Central Poland. Int J Environ Res Public Health. 2018;15(7):1489. Published 2018 Jul 14.
Sordillo JE, Zhou Y, McGeachie MJ, et al. Factors influencing the infant gut microbiome at age 3-6 months: Findings from the ethnically diverse Vitamin D Antenatal Asthma Reduction Trial (VDAART) [J]. J Allergy Clin Immunol, 2017, 139(2):482-491.
Luthold RV, Fernandes GR, Franco-de-Moraes AC, et al. Gut microbiota interactions with the immunomodulatory role of vitamin D in normal individuals[J]. Metabolism, 2017,69:76-86.
Mai V , Mccrary Q M , Sinha R , et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers[J]. Nutrition Journal, 2009, 8(1):49.
White JH. Vitamin D deficiency and the pathogenesis of Crohn’s disease[J]. Steroid Biochem Mol Biol, 2018,175:23-28.
Schäffler H, Herlemann DP, Klinitzke P, et al. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn’s Disease patients, but not in healthy controls[J]. Journal of Digestive Diseases, 2018, 19(4): 225- 234.
Ooi JH, Li Y, Rogers CJ, et al. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis[J]. J Nutr, 2013,143(10):1679-1686.
Shang M, Sun J. Vitamin D/VDR, Probiotics, and Gastrointestinal Diseases[J]. Curr Med Chem, 2017,24(9):876-887.
李子傲. 母乳喂养对肠道菌群的影响[J]. 营养与健康,2016, 10( 8) : 97-99.
汪英,袁莉,李广利,等. 肥胖与血清维生素D 水平的关系研究[J]. 中华内分泌代谢杂志,2011,27 ( 7) :589-590.
祝海波,周苗苗,王海,张晓宇.婴儿早期维生素D补充水平对生长发育和肠道菌群的影响[J].中国食物与营养,2018,24(12):87-89.
李苹,昌雪莲,尚煜,刘雅静,陈晓宇,梁爱民,齐可民.婴儿早期维生素D补充对生长发育及肠道菌群的影响[J].公共卫生与预防医学,2018,29(01):12-16.
杜琳. 维生素D介导的Th17/Treg细胞稳态调节对孤独症大鼠肠道菌群失调作用的研究[D].吉林大学,2019.

谷禾健康
“ 在人类适应中整合宿主-微生物群的相互作用可以提供新的方法来提高我们对人类健康和进化的理解。”

面对快速的环境变化,生物如何适应新环境是进化生物学中的一个核心问题。
刚刚,来自德国马克斯·普朗克研究所研究人员在science发表了最新文章:

回顾了人类适应新环境的例子,这些例子表明宿主基因和微生物群之间的相互作用。提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。寻找微生物群与人类遗传适应性有关的其他例子。
当人类在基因上适应新环境时,他们的微生物群也可能参与这个过程。微生物可以比宿主进化得更快,这使它们能够对环境变化做出快速反应。微生物群还过滤宿主的环境,从而改变宿主的选择性压力。
图1 人类及其微生物的局部适应

举例说明适应性宿主等位基因和适应性微生物群功能之间的相互作用。
选择压力的差异,包括饮食、气候和病原体暴露,导致了人类群体在性状上的差异,与消化、生理和免疫相关。这些差异是由跨多代发生的局部遗传适应造成的,与宿主一生中免疫系统的适应或生理适应是有区别的。
在许多情况下,主要的遗传变异体被确定为如下:
乳糖消化所需的乳糖酶:(由基因区域LCT编码)突变和截短
缺氧诱导因子2α:(由PAS1编码)在高原适应中产生作用
β-珠蛋白基因单倍型或镰状细胞性状:(由血红蛋白编码)在疟疾抗性中产生作用
此外,人类微生物群的组成和功能变化已被广泛描述。Amato等人最近回顾了可能影响人类本地适应性的微生物群的有益功能,例如微生物群增强营养和预防传染病。然而,在人类局部适应过程中,宿主适应性等位基因和适应性微生物群功能之间的特定相互作用仍有待研究。
接下来的两小节,作者详细研究了LCT–双歧杆菌和AMY1–瘤胃球菌之间的相互作用。在这些例子中,适应性宿主等位基因和适应性微生物功能是相联系的。
婴儿的主要能量来源于乳糖。在上消化道(GIT,下同),宿主酶乳糖酶将乳糖分解成葡萄糖和半乳糖。饮食中没有牛奶,乳糖酶的生产就会停止。乳糖酶非持续性LNP(乳糖不耐受)是祖先的条件。
注:由于乳糖酶活性的不同,人群中存在三种基因型,即纯合乳糖酶持续性(LP)、纯合乳糖酶非持续性(LNP)和杂合子(heterozygotes)。LNP是人群中最常见的表型。因乳糖酶的相对或绝对缺乏而导致的以腹泻为主的相关消化道症状的现象称之为乳糖不耐受。LNP是原发性乳糖不耐受的生理基础。
不同大陆的动物驯化(2500年到10000年前)和对非人类牛奶的反复消费导致了强烈的选择压力,使乳糖酶的生产持续到成年,即乳糖酶持久性LP(乳糖耐受)。LP是突变,在有长期放牧和挤奶历史的人群中常见。
宿主和微生物共争乳糖
许多肠道微生物群中常见的微生物可以使用β-半乳糖苷酶来裂解乳糖,然后发酵,乳糖可能被乳酸菌隔离。不管如何加工,微生物利用乳糖的副产物给宿主产生的能量更少。这意味着宿主和微生物在争夺乳糖,宿主有强烈的动机去战胜微生物。
乳糖耐受——宿主赢
乳糖耐受宿主胜过微生物,因为乳糖酶在微生物生物量较低的上层消化道中具有活性。
乳糖不耐受——微生物赢
相比之下,乳糖不耐受宿主主要在较低的消化道中获取微生物乳糖代谢的低能量密度产物。
因此,未消化的乳糖进入结肠可以被认为是一种需要微生物酶来处理的纤维形式。
就像结肠中的纤维降解一样,来自发酵的微生物,和它们的发酵产物[短链脂肪酸(SCFAs)]组成,虽然微生物群吸收了乳糖的一部分能量,但乳糖不耐受宿主的另一种选择是完全失去能量来源。
LCT位点的相同变异与肠道微生物群中双歧杆菌的相对丰度有关。
这种关联是迄今为止微生物组全基因组关联研究最一致的信号,该关联取决于牛奶消费量。
乳糖耐受基因型和双歧杆菌相对丰度之间的反比关系支持了哺乳动物乳糖酶和细菌β-半乳糖苷酶直接竞争乳糖的观点。
双歧杆菌是重要的乳糖降解菌,可能在产奶动物驯化后和选择乳糖耐受等位基因前帮助成年宿主从牛奶中提取能量。在畜牧业兴起后,乳糖代谢细菌可能在缺乏乳糖耐受等位基因的情况下对宿主的适应性产生积极影响。后来,有益的宿主等位基因出现并取代了微生物群的功能,在一些人群中变得几乎固定。
双歧杆菌(或功能过剩的微生物)产生的β-半乳糖苷酶也可能通过降低LCT基因型之间的适应度差异而减轻了对乳糖耐受等位基因的选择压力。
此外,如果微生物摄入乳糖能最大限度地减少与乳糖消化不良相关的疾病后果,并促进牛奶摄入,从而带来额外的益处,则微生物群可能会减轻能量权衡并维持人类群体中的乳糖酶多态性。
乳糖的例子表明,由微生物组和宿主基因组编码的活性可能特别容易受到宿主和微生物组之间竞争的影响。
与乳糖相反,人类饮食中的各种淀粉为宿主提供了一种机会,在较高的消化道中获得一种带有淀粉酶的淀粉,而在较低的消化道中为微生物群消化留下抗性淀粉。
事实上,淀粉有许多不同的形式,包括难以被宿主淀粉酶降解的结构,淀粉酶将淀粉分解成葡萄糖亚基。宿主和微生物群分配淀粉底物的程度可能取决于宿主基因型。
由AMY1基因编码的唾液淀粉酶在口腔中开始淀粉分解为葡萄糖的过程。唾液淀粉酶活性的个体差异与AMY1基因的拷贝数呈正相关,通常在2到15之间。
与AMY1 拷贝数含量低的个体相比,AMY1 拷贝数含量高的个体在食物到达较低的消化道及其微生物群之前,更彻底地消耗了给定饮食中对淀粉酶敏感的淀粉(图2,C和 D)。
图2 宿主基因型和微生物群之间联系的例子
在(A) 乳糖不耐受宿主和(B) 乳糖耐受宿主中,乳糖酶基因型与双歧杆菌相对丰度呈负相关关系。
AMY1基因拷贝数(CN)和瘤胃球菌相对丰度之间的正相关性被描述为(C)低AMY1 拷贝数宿主和(D)高AMY1 拷贝数宿主。
不同类型的糖分以不同的形状和颜色显示。
AMY1 拷贝数为2是祖先的情况:AMY1 拷贝数在人类中的扩展可能是由从低淀粉饮食到高淀粉饮食的饮食转变所驱动的。
随着农业的发展,唾液淀粉酶水平的提高可能会促进高淀粉饮食人群的健康。与乳糖耐受的进化相似,宿主淀粉酶通过其比微生物发酵产物更大的能量产量而具有适应性优势。
具有AMY1高拷贝数的宿主还能从结肠微生物对抗性淀粉的强化降解中获益。
抗性淀粉发酵中的重要属——Ruminococcus
与AMY1低拷贝数个体的肠道微生物群相比,高AMY1拷贝数宿主的肠道微生物群富含瘤胃球菌属(Ruminococcus)。
在AMY1 低拷贝数宿主中,肠道细菌优先发酵淀粉酶敏感型淀粉,宿主不能使用这些淀粉,因为它们的唾液淀粉酶水平较低。
乳球菌,或功能冗余的微生物,可能通过放大AMY1高拷贝数和低拷贝数个体之间的相对适应度差异,增强了对AMY1 拷贝数扩增的选择压力,并可能增强了宿主基因-微生物的关联(图2,C和D)。因此,这种动态可能导致基于宿主基因型的微生物补充。
以上,作者提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。接下来的章节,作者寻找微生物群与人类遗传适应性有关的其他例子,其中适应性的遗传基础得到了很好的描述。
有新的证据表明,微生物参与了其他几种人类遗传适应(图3),之前在这些适应中,微生物的作用没有得到充分认识。
图3 人类的局部适应性与微生物群有关
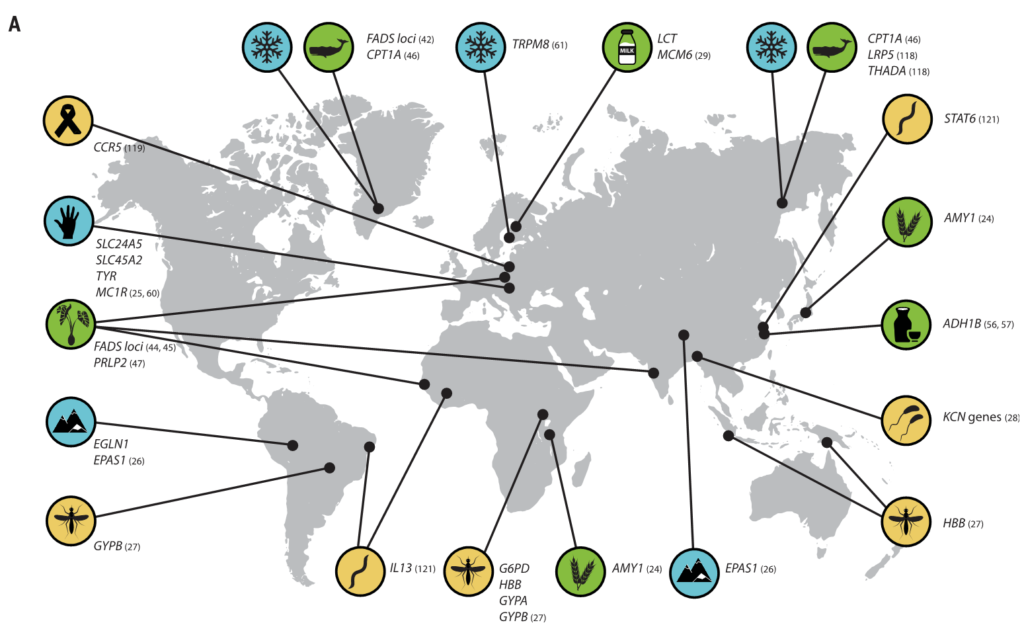
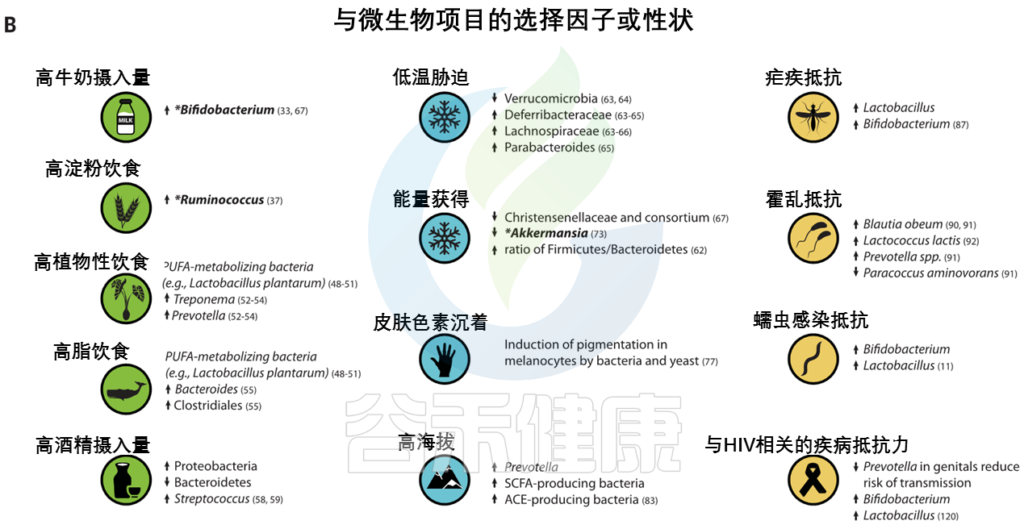
(A) 与适应性性状相关的人类基因位点的全球分布。这些符号对应于(B)中的选择因子和/或特征。
向上和向下的箭头分别表示微生物类群相对丰度与阳性或阴性相关的趋势。
微生物群的研究群体与宿主基因位点的研究群体不匹配.
星号和黑体字表示正向选择下与宿主基因位点相关的微生物类群: LCT和双歧杆菌,AMY1和Ruminococcus,PLD1和Akkermansia
乳糖和淀粉消耗可能是第一个已知的与饮食相关的基因-微生物相互作用的例子,可以进一步研究其在人类适应中的作用,但其他例子可能会出现。例如,长链多不饱和脂肪酸(LC-PUFAs)是关键的营养物质,可以直接从动物性饮食中获得,或者使用宿主衍生的酶从植物衍生的前体中合成。
脂肪酸代谢相关基因【包括脂肪酸去饱和酶(FADS)、肉碱棕榈酰转移酶1A (CPT1A) 和胰脂肪酶相关蛋白2 (PLRP2)】的正向选择证据与多种人群的饮食适应有关。
FADS基因区域的祖先等位基因与食用植物性食物的人群相关,衍生等位基因与当前和历史上偏爱高脂肪食物的人群相关。属于至少10个门的细菌似乎能合成长链多不饱和脂肪酸。
在人类肠道微生物中,植物乳杆菌和其他细菌已被证明能代谢植物来源的前体,并影响多不饱和脂肪酸来源的代谢物在体外和体内的生物利用度。分别通过植物性饮食或动物性饮食富集的人类肠道微生物 。
类似地,酒精脱氢酶1B (ADH1B)位点在人类中显示出正向选择的证据,并与脱脂摄入有关,人们认为这是伴随着农业的发展而产生的。
人和细菌的酶可以将乙醇转化为乙醛;肠道微生物群的变异与饮酒和相关疾病有关。
这些观察表明:
我们已经适应了自己所在地的气候。生活在高纬度地区的人面临冷胁迫,与温度感应(TRPM8)和能量收获(如FADS和CPT1A)相关的基因与气候相关的适应有关。
气候是参与常见代谢紊乱基因的重要选择压力
人类微生物群也因纬度而异,并可能通过提高从饮食中提取能量和随后储存脂肪的效率来促进与气候相关的适应。微生物群中的一些变异与环境温度和宿主体型有关。对小鼠的实验研究表明,仅环境温度的变化就能引起肠道菌群的变化。
低温
低温暴露宿主的微生物表现出更高的吸收能力和能量收获能力,以及棕色脂肪组织产生的热量增加。然而,微生物介导的产热和TRPM8多态性在人类中是否相关仍有待确定。
· Christensenellaceae
人类肠道中最紧密和高度可遗传的分类单元,细菌家族christensenellaceae,它与较低的体重指数(BMI) 和代谢紊乱有关。甲烷菌科、脱水杆菌科 和Tenericutes在多个人类群体中也表现出遗传性,并与Christensenellaceae共存。
最近的证据表明,这些菌群之间的代谢相互作用可能会影响宿主对代谢物的利用。
GWASs没有发现显著的宿主遗传变异。这表明,一些明显可遗传的分类群可能具有多基因性质,其中许多基因的影响很小。
· Akkermansia
Akkermansia是一种微生物降解菌,也与体重指数有关,在多项研究中显示为一个可遗传的分类群。Akkermansia的相对丰度与PLD1 中的宿主遗传变异有关,PLD1是之前与BMI相关的基因。PLD1显示了非洲人群中正向选择的证据,但选择剂尚不清楚。
太阳辐射
生活在低纬度地区的人群面临高水平的太阳辐射,与皮肤色素沉着相关的基因是人类本地适应的典型例子(图3)。
皮肤中的黑色素保护皮肤免受紫外线辐射,其抗菌特性被认为是皮肤色素沉着纬度梯度的替代假设。因此,人类黑素细胞中皮肤色素沉着的增加可以通过暴露于微生物产物如脂多糖来诱导。
Guéniche等人报道了乳酸菌对皮肤的保护作用,紫外线照射后的全身免疫反应。鉴于肠道微生物群在调节皮肤内环境稳定中的新兴作用,进一步的研究可能有助于确定色素沉着基因与皮肤和肠道微生物之间的潜在相互作用。
高海拔环境
高海拔环境也带来了许多生理挑战,包括缺氧应激,这也可能被微生物群改变。在高海拔环境中,已经鉴定出与氧呼吸和血液循环相关的多种适应性特征和基因,这些特征和基因通常涉及血压的调节(图3)。
最近,肠道微生物群被证明通过产生短链脂肪酸来调节血压,短链脂肪酸有可能在高海拔环境中帮助调节血压。
包括丁酸盐在内的短链脂肪酸的产生影响小鼠缺氧诱导因子的活性,这也是多个人类群体中参与高海拔适应的关键途径。作用于肾素-血管紧张素系统的细菌血管紧张素转换酶(ACEs)的产生也可能改变高海拔环境中的血压。细菌ACEs已被证明能在体外转化哺乳动物血管紧张素。
病原体被认为是人类适应性进化的主要驱动力之一(图3),微生物群与病原体防御和免疫之间的界面已被广泛研究。
人类本地适应的一个典型例子是疟疾抗性的遗传基础,由疟原虫属的几种寄生原生动物引起。皮肤和肠道微生物可能影响疟疾的不同阶段。
相同细胞因子相关基因的遗传变异,包括IL10、IL12、肿瘤坏死因子、干扰素α和干扰素γ,与疟疾严重程度和微生物群组成的变异有关。
Ippolito等人总结了微生物群在疟疾抗性中可能扮演的多重角色的几种假说:
1 皮肤细菌产生可改变蚊子媒介吸引力的挥发性化合物
2 由肠道微生物诱导的抗原表达,该抗原表达诱导针对疟原虫传播的保护性抗体
3 影响血液阶段疟原虫感染严重性的微生物群的差异
其他可能受到微生物群和宿主遗传变异组合影响的感染包括霍乱、艾滋病毒和蠕虫感染。
霍 乱
霍乱毒素针对几个带有显示选择信号的基因的离子通道。已经在人群中鉴定出与霍乱易感性和从霍乱中恢复相关的肠道微生物分类群。实验研究已经确定了提供定殖抗性和抑制霍乱弧菌毒性的细菌分类群。
鉴于在胃肠疾病中离子通道的表达和功能经常被改变,探索微生物群和离子通道基因之间的联系对于治疗或预防腹泻疾病可能是有价值的。
艾滋病毒和蠕虫感染
阴道微生物群在艾滋病毒的获得和传播中起作用,
肠道微生物群与蠕虫相互作用并改变疾病结果。
对研究充分的宿主适应性等位基因和新兴有益微生物群功能之间的相互作用的进一步研究可能会揭示以前未知的抗病机制。
这里提到的所有宿主基因-微生物例子(图3)仍处于研究的早期阶段。但是在每一种情况下,微生物群都有可能通过改变适应性景观来影响宿主的进化。这些微生物可能改变了宿主的环境,导致宿主表型选择压力的改变。
在未来关于适应性宿主基因型和适应性微生物群功能之间关系的研究中,GWASs、候选基因方法或使用基因敲除模型的移植实验可以帮助确定维持有益微生物群功能的宿主遗传机制,并测试微生物群的替代和补充是否是适应性的一般特征。
基因研究已经将越来越多的群体纳入考虑范围,微生物群的特征研究也是如此。但到目前为止,包括宿主遗传学和微生物群的研究,除了少数例外,主要是在西方人群中进行的。
需要将人类基因研究的范围扩大到更广泛的人群和地点,其中包括微生物组成分。这些类型的研究结果将测试当前发现的普遍性,并描述更多微生物介导的适应情况。
还可以进一步研究特定分类群的遗传力,以更好地表征潜在的遗传多态性。遗传性既适用于分类群,也适用于微生物功能,因此通过宏基因组学将与人类遗传变异相关的性状从分类群扩展到功能群,将有助于进一步阐明微生物群在人类适应中的作用。
在这里关注的是宿主(主要是人类)的进化,但是微生物也在快速进化以适应它们的宿主环境。在适应性进化的背景下,对宿主基因组和微生物群之间相互作用的更好理解将阐明人类和其他动物及其微生物群是如何适应不断变化的世界的。
参考文献:
Suzuki Taichi A,Ley Ruth E,The role of the microbiota in human genetic adaptation.[J] .Science, 2020, 370
Bayless Theodore M,Brown Elizabeth,Paige David M,Lactase Non-persistence and Lactose Intolerance.[J] .Curr Gastroenterol Rep, 2017, 19: 23.
S. Fan, M. E. B. Hansen, Y. Lo, S. A. Tishkoff, Going global by adapting local: A review of recent human adaptation. Science 354, 5 4–59 (2016). doi: 10.1126/science.aaf5098; pmid: 27846491
M. Fumagalli et al., Greenlandic Inuit show genetic signatures of diet and climate adaptation. Science 349, 1343–1347 (2015). doi: 10.1126/science.aab2319; pmid: 26383953
T. A. Suzuki, F. M. Martins, M. W. Nachman, Altitudinal variation of the gut microbiota in wild house mice. Mol. Ecol. 28, 2378–2390 (2019). doi: 10.1111/mec.14905; pmid: 30346069