 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
中风是全球范围内最具破坏性的最严重的脑部疾病之一,治疗选择非常有限。中风和其他神经系统疾病与微生物群破坏有关。反过来,中风诱发的菌群失调会通过调节免疫反应而对疾病结果产生重大影响。
了解肠细菌-脑串扰的性质可能会导致基于微生物组的治疗方法,从而可以改善患者的康复。
本文主要介绍关于肠道微生物组在中风中的作用的最新知识,以及肠-免疫-脑串扰的潜在机制。
肠道微生物群和周围器官之间的信号传导是由微生物组相关分子模式(MAMP)和微生物组分泌的代谢产物介导的,这些代谢产物可以与粘膜上皮和肠道免疫细胞相互作用,刺激迷走神经或到达全身循环以向大脑发出信号和可能调节神经元和免疫应答。
反过来,支配肠壁的副交感神经和交感神经纤维会从大脑传递输入信号,从而影响肠蠕动,免疫细胞活性,并能诱导肠成分改变。
01
中风改变了微生物群的组成
我们知道,肠道微生物群稳态的破坏,就会容易患病。
实验和临床研究中越来越多的证据表明中风会改变肠道菌群的组成。对中风患者肠道菌群的分析显示,与健康个体相比,微生物组成发生了变化,而菌群失调程度与病变的严重程度相关。
同样,观察小鼠的粪便微生物丰度的变化,发现严重中风要比轻微中风更为明显。但是,在分析菌群多样性和特定菌群时,在临床和实验研究中有些不同结果。
为什么会出现不同结果?
Yin 等人发现与无症状对照组相比,中风患者粪便样本的多样性增加,Stanley等人发现假手术组和中风小鼠之间的微生物群多样性没有变化。相反,其他研究人员则在实验和临床环境中观察到某些菌减少和其他细菌的过度繁殖导致多样性降低,表明多样性程度不一定能预测中风的严重程度。
不同的研究发现,沙门氏菌总体上减少了,同时伴有拟杆菌的过度生长。然而,当在较低的生物分类等级上分析微生物群变化时,在临床和实验性中风中特定细菌变化方面缺乏一致性。
可能的混淆因素
粪便采样位置的差异(在小鼠的胃肠道和患者的粪便中),用于基因组DNA提取和16S rRNA基因分析的方法,中风模型的严重程度以及基线的差异微生物群组成(人类的小鼠起源或个体间和个体内变异)可能是造成矛盾结果的混淆因素。
影响肠道菌群组成的另一个混杂因素是饮食类型。
严重的中风病例总是住院治疗,他们将接受药物治疗并接受医院控制的饮食,而实验性中风后对小鼠的干预很少,这将以啮齿动物和人类的不同方式影响微生物群的组成。
总体而言,临床和实验数据表明中风后微生物群组成发生了变化。然而,迄今为止,尚不清楚哪种类型的肠道细菌参与中风的病理生物学机制。
年龄对微生物群状态的重要性
衰老会改变肠道菌群的组成,并与炎症和肠道通透性增加有关。中风后,与年轻小鼠相比,有高龄微生物群的小鼠具有更高的死亡率,运动功能受损和促炎性细胞因子反应。
粪便微生物群移植(FMT)可以在年轻和老年小鼠中恢复中风的结果。这些实验强调了年龄对微生物群状态的重要性及其对疾病发展的影响,以及微生物群的操纵如何能够导致非侵入性疗法以预防和改善中风预后。
虽然实验结果表明与年龄、肠道生物失调和中风结果相关,但其他风险因素(糖尿病、高血胆固醇水平、饮酒、高脂肪饮食、缺乏锻炼)和性别差异对肠道微生物群和中风结果的影响仍有待实验和临床研究解决。
脑损伤改变微生物组组成的机制
由于中风后自主神经系统(ANS)的失调而降低肠道运动性和粘膜屏障的完整性。脑损伤后,肠道内胆碱能活性下降,肾上腺素能信号传导增加,这与肠屏障的破坏有关。
因此,使用β受体阻滞剂抑制β肾上腺素能活性可显着恢复中风诱导的肠道通透性,并减少细菌向周围器官的扩散。
在这方面,Singh等人证明了回肠瘫痪本身就可以驱动微生物群变化,这是一种中枢神经系统介导的生态失调。
肠道细菌可以感觉到来自胃肠道的激素和神经递质,并且在体外培养中,在应激激素去甲肾上腺素(NE)存在下,某些条件致病菌能够增殖更多。
有趣的是,在实验性中风后,盲肠中的去甲肾上腺素释放增加,这可能是某些病原体或共生菌过度生长的原因。
另外,ANS调节肠粘液分泌,大脑对肠信号的扰动可能对肠粘液层的大小和质量产生重要影响。
Houlden等人观察到,中风后盲肠内,粘液蛋白产生的失调和产粘液的杯状细胞降低。中风后粘液层的形成受损可能使共生膜与上皮直接接触,转移并引发免疫反应,以及中风后感染。此外,还需要更多关于细菌移位导致实验性中风感染的直接影响的数据。
脑损伤触发肠道中胆碱能和肾上腺素能信号的失衡,增加释放的NE的浓度,降低肠道运动性,并改变与微生物群失调有关的肠脑屏障。所有这些事件都将影响肠道微生物的功能输出,并可能进一步扰乱肠道的免疫稳态。
02
中风的肠-免疫-脑轴
迄今为止,使用动物模型进行的研究提供了最有力的证据,并有助于阐明中风后肠-免疫-脑相互作用的潜在机制。
T淋巴细胞的关键作用
已知T淋巴细胞在脑损伤后继发的组织损伤中起关键作用。促炎性T辅助1细胞(Th1),T辅助17细胞(Th17)和γδT-IL-17+细胞与中风后神经毒性有关,而调节性T细胞(Treg)发挥作用抗炎和神经保护特性。
越来越多的证据,支持微生物群通过调节胃肠道中促炎Th17细胞与抗炎Treg细胞之间的平衡来维持免疫稳态。
通过诱导促炎Th1和Th17介导的反应,具有中风后遗症粪便含量的无菌(GF)小鼠的定殖导致中风结果的恶化,这表明中风诱导的微生物失调触发促炎性免疫反应,从而加剧脑损伤。
这组作者证明,来自派尔氏淋巴集结(Peyer’s patches)的T细胞会侵袭梗塞周围组织,并在中风的急性期产生免疫反应。
肠道菌群的免疫调节作用对于中风恢复至关重要
此外,通过健康捐献者的FMT恢复肠道微生物群的稳态,减少了损伤大小并增加了缺血性脑中Treg细胞的数量。
然而,单独存在的微生物群具有神经保护作用,因为与定殖小鼠相比,完全根除GF小鼠的肠道细菌导致更大的梗塞体积。
同样,这种微生物群介导的对中风的有益作用取决于淋巴细胞反应,表明肠道细菌的免疫调节作用对于中风恢复至关重要。通过显示在缺血性损伤之前使用抗生素对微生物群组成进行控制可减少梗塞体积并改善感觉运动功能,从而证明了肠-脑双向沟通在中风中的关键参与。
在这项研究中,他们表明神经保护作用是由微生物依赖性的肠道树突状细胞(DC)引发的,介导小肠Treg的扩增,通过抑制促炎性γδT-IL-17+细胞发挥作用。
此外,他们还认为IL-10是Treg细胞介导的γδT细胞增殖抑制的主要协调器,因为IL-10-/- 小鼠不受保护作用的影响。由于较少的促炎IL-17 +γδT细胞积聚在脑膜中,因此肠道中的这种抗炎环境会传导到大脑,这与较小的梗死面积有关。
有趣的是,肠道T细胞从肠道迁移到脑膜和脑实质中,表明中风有直接的肠脑沟通途径。
另外,肠道微生物群组成的修饰可通过致耐受性DC使肠道免疫应答偏向抗炎环境。
这些研究表明中风后微生物群受到影响,中风后细菌数量的变化会促进促炎性T细胞反应,肠道免疫细胞迁移至脑膜,这可能会参与继发性脑损伤并恶化中风结果。
也突显了通过肠道淋巴细胞从肠道运输到大脑的过程,沿着肠道-脑轴的直接联系,在那里它们调节了对中风的神经炎症反应。
当然,对于肠免疫细胞是否直接导致脑损伤或修复机制还不是很清楚。重要的是,这种肠道细菌-DC之间相互作用的分子途径仍然难以捉摸。
图 肠道代谢物——中风中的免疫系统干扰
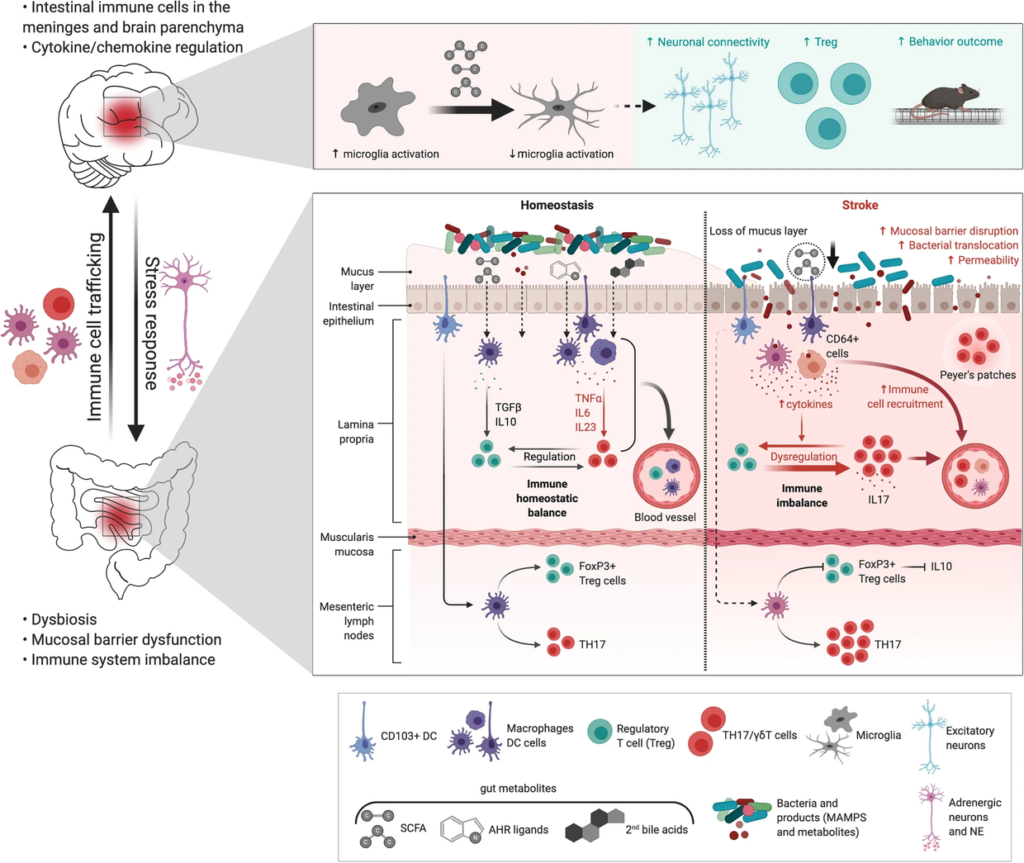
Delgado.et al., Neuromolecular Med, 2020.
中风后肠道微生物对免疫系统的调节。
下图:在肠道中,中风引起生物失调、粘膜屏障功能障碍、肠道通透性增加、细菌移位、中风后感染和通过树突细胞的促炎性T细胞反应(DC)。中风后,免疫细胞,特别是T细胞、CD64 +巨噬细胞和树突状细胞从肠道迁移到脑膜和大脑。肠道代谢物(AHR,次生胆汁酸,MAMPs)作为肠道免疫细胞免疫调节剂的作用尚未明确。中风后微生物来源的SCFA减少,可能引发γδT-IL-17 +细胞和调节性T细胞(Treg)的失衡。
上图:补充SCFA调节神经元活动和突触密度,并且与小胶质细胞激活减少和Tregs增加以及中风后更好的恢复相关。
03
中风肠道菌群的操纵
Benakis等人证明了在诱导缺血性损伤之前用氨苄西林或万古霉素治疗小鼠具有神经保护作用,而使用新霉素则不能保护小鼠免于中风。这种神经保护作用与微生物组组成中的抗生素特异性变化有关,变形菌和厚壁菌门增多,而拟杆菌属的减少。
此外,当他们分析与有益菌群变化相关的预测酶途径时,他们发现异种/芳香族化合物代谢可预测缺血性病变的大小。
微生物代谢产物是细菌-宿主串扰的主要沟通渠道之一
与中风的肠道免疫脑轴有关的一个可能的缺失环节可能是仅由细菌产生的代谢产物。
已知必需芳香族氨基酸色氨酸的代谢产物可通过在DC和T细胞中表达的芳烃受体(AHR)调节免疫细胞功能。一些菌群能够将肠道中的色氨酸分解为AHR的配体。
在小鼠中,微生物群衍生的吲哚激活AHR通过诱导免疫细胞中IL-22促进肠道稳态。在星形胶质细胞的AHR通过激活在多发性硬化的小鼠模型中色氨酸代谢物的神经保护作用的驱动器。
然而,保护作用是配体依赖,其他色氨酸代谢产物已报告加重病程。有趣的是,负责色氨酸分解代谢的内源性犬尿氨酸途径的活性被上调下列缺血性中风和已与炎性反应和恶化的结果。因此,AHR受体的药理和遗传阻断改善了中风恢复。
这些发现暗示了色氨酸衍生化合物在中风中的关键作用。尚不清楚微生物源性色氨酸代谢产物在缺血性损伤中的免疫调节作用。
短链脂肪酸(SCFA)是细菌发酵的生物产物,具有免疫调节作用:它们能够根据免疫情况直接诱导T细胞分化为效应细胞和调节细胞。
小鼠中风后血浆SCFA的水平显着降低,这与恶化的结果有关。
中风之前在小鼠中补充SCFA改善了行为恢复,改善了皮质网络的连通性,并改变了突触可塑性的组织学标志,这与改善中风的长期中风有关。这些作用与小胶质细胞形态向稳态状态的改变和侵袭性淋巴细胞的减少有关。
菊粉改善中风后神经功能缺损
在另一项研究中,他们观察到,与年幼小鼠相比,口服菊粉(产生SCFA的细菌和制造SCFA的细菌基质),可减少老年小鼠中风后的神经功能缺损和改善抑郁样行为。
此外,这些变化伴随着缺血性脑中IL-17 +γδT细胞百分比的降低,但SCFA是否直接影响T细胞极化和迁移尚未解决。出人意料的是,在两项研究中,梗死面积均不受SCFA干预的影响。
所有这些证据表明,微生物代谢产物SCFA在中风后恢复中起重要作用,并且可能参与中风后肠道菌群发挥的免疫调节作用。
04
结 语
本文总结了微生物群组成如何通过调节免疫反应影响中风预后的最新发现。肠道菌群的变化引起主要的促炎性T细胞反应,这与更大的梗塞体积和恶化的预后相关。
由于肠道菌群是一个非常复杂的生态系统,受环境和宿主的影响,具有冗余功能和协同关系,因此,研究微生物组代谢组学特征以将其转化为临床实验研究是一种更好的策略。
然而,尚无实验数据将特定微生物群合成的化合物与脑损伤后的免疫反应之间的因果关系联系起来。为了在中风患者中成功应用这些发现,有必要进一步研究中风后共生细菌和免疫系统之间相互作用的分子机制。
相关阅读:
参考文献:
Singh, V., Roth, S., Llovera, G., Sadler, R., Garzetti, D.,Stecher, B.,et al. (2016). Microbiota dysbiosis controls the neuroinflammatory response after stroke. Journal of Neuroscience, 36(28), 7428–7440.
Houlden, A., Goldrick, M., Brough, D., Vizi, E. S., Lénárt, N., Martinecz, B., et al. (2016). Brain injury induces specific changes in the caecal microbiota of mice via altered autonomic activity and mucoprotein production. Brain, Behavior, and Immunity, 57, 10–20.
Lee, J., d’ Aigle, J., Atadja, L., Quaicoe, V., Honarpisheh, P., Ganesh, B. P., et al. (2020). Gut microbiota-derived short-chain fatty acids promote poststroke recovery in aged mice. Circulation Research, 127(4), 453–465.
Delgado Jiménez Rosa,Benakis Corinne,The Gut Ecosystem: A Critical Player in Stroke.[J] .Neuromolecular Med, 2020.
Yin, J., Liao, S. X., He, Y., Wang, S., Xia, G. H., Liu, F. T., et al. (2015). Dysbiosis of gut microbiota with reduced trimethylamine-N-oxide level in patients with large-artery atherosclerotic stroke or transient ischemic attack. Journal of the American Heart Association.
Stanley, D., Mason, L. J., Mackin, K. E., Srikhanta, Y. N., Lyras, D., Prakash, M. D., et al. (2016). Translocation and dissemination of commensal bacteria in post-stroke infection. Nature Medicine.
Benakis, C., Brea, D., Caballero, S., Faraco, G., Moore, J., Murphy, M., et al. (2016). Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells. Nature Medicine, 22(5), 516–523.
Lamas, B., Natividad, J. M., & Sokol, H. (2018). Aryl hydrocarbon receptor and intestinal immunity. Mucosal Immunology, 11(4), 1024–1038.