 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

肠道微生物除了在肿瘤发生过程有重要作用,在抗癌治疗过程中也有着不可忽视的价值。
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。研究表明,肠道微生物群的调节不仅有助于增强机体免疫力,抑制肿瘤细胞的增殖和侵袭,还可以改善治疗的耐受性和减轻不良反应。
例如,研究发现化疗中伊立替康的毒性取决于肠道微生物群的组成;
毛螺菌科、肠球菌科通过产生短链脂肪酸减轻放疗毒性;
在晚期黑色素瘤患者中,双歧杆菌科、瘤胃球菌科、毛螺菌科等关键细菌与抗PD1治疗后的良好结果有关。
因此,如何通过将肠道微生物群结合现有的癌症治疗方式,更好地促进肿瘤患者的康复和疗效,值得深入挖掘和探讨。
本文我们就来详细了解一下,微生物群与各类癌症疗法,最主要是免疫疗法及其与免疫相关的不良反应。根据患者微生物群组成训练的机器学习方法,可以准确预测患者对免疫疗法的反应能力。
粪菌移植或饮食、益生元等干预可在临床上用于提高癌症患者免疫治疗的成功率,这里讨论了基于微生物群的癌症治疗的新策略。
理解肠道微生物群与肿瘤治疗之间的相互关系,可以为创新的治疗方法提供有力的支持,并为肿瘤治疗领域带来新的突破。
化疗是指使用药物来杀死或控制癌细胞的生长。这些药物可以通过静脉注射、口服或局部应用的方式给予患者。
缺点
由于化疗中使用的药物可能对癌症没有特异性,无法区分细胞好的坏的,会影响身体的其他健康组织,引起副作用,比如脱发、口腔溃疡、恶心、精疲力竭等。
肠道菌群影响化疗药代动力学、疗效和毒性
一个代表性的例子是:伊立替康的毒性取决于肠道微生物群的组成。
注:伊立替康用于治疗结直肠癌的拓扑异构酶 I 抑制剂。
肝脏中:
葡萄糖醛酸转移酶将活性形式的伊立替康 SN-38 解毒成无活性的 SN-38-G。
肠道中:
许多表达 β-葡萄糖醛酸酶的细菌将 SN-38-G 转化回 SN-38,从而引发腹泻。
这种毒性可以通过广谱抗生素或 β-葡萄糖醛酸酶抑制剂来预防。
肠道菌群可优化肿瘤治疗、增强免疫抗癌效果
肠道微生物群可以通过提供有利于药物对癌症细胞毒性作用的肿瘤微环境,并在药物诱导的免疫原性细胞死亡后维持抗癌适应性免疫,从而调节化疗效果。
奥沙利铂、顺铂
无菌或抗生素处理的小鼠中,铂基化合物奥沙利铂和顺铂显示出降低抗肿瘤功效。这些药物仍然可以在微生物群耗尽的小鼠的肿瘤中形成铂-DNA加合物,但没有观察到DNA损伤。肠道微生物群通过NOX2(NADPH氧化酶2)启动肿瘤中的髓细胞产生活性氧(ROS),这是铂治疗诱导的DNA损伤所需的。
肠道微生物发酵的膳食纤维产物——丁酸盐,可以通过 IL-12 信号传导调节 TME 中 CD8+ T 细胞的功能,从而增强奥沙利铂的抗癌作用。
烷化剂环磷酰胺(CTX)
同样,烷化剂环磷酰胺疗效也取决于肠道菌群。
注:烷化剂环磷酰胺既是一种化疗剂,也是一种免疫抑制剂。
CTX减少了小肠中厚壁菌门和螺旋体门,同时增加了其他细菌类群的丰度,其中一些细菌转移到肠系膜淋巴结。CTX诱导免疫原性肿瘤细胞死亡,这依赖于微生物群调节的致病性辅助T细胞17(TH17)和记忆性TH1细胞。
CTX治疗后, Enterococcus hirae移位至淋巴结和Barnesiella intestinihominis在结肠中的积聚促进了癌症免疫。
此外,接受化疗免疫治疗的癌症或卵巢癌患者的存活率与E. hirae和B. intestinihominis特异性TH1反应相关。
吉西他滨
吉西他滨是胰腺导管腺癌常用的化疗药物。肠道微生物参与化疗药物的药代动力学,吉西他滨治疗胰腺导管腺癌的疗效可能受到肠道微生物的影响。
γ-变形菌能够代谢吉西他滨并将其转化为无活性的2′,2′-二氟脱氧尿嘧啶。因此,未来有可能通过将抗γ-变形菌的抗生素与化疗相结合来提高吉西他滨的抗癌效果。
除了负面影响外,肠道微生物代谢产物丁酸盐,还可以通过诱导细胞凋亡来增强吉西他滨对抗癌症细胞的功效。
除了肠道微生物群,肿瘤内细菌促进肿瘤生长并干扰化疗效果,这表明:
肿瘤内微生物群可能是癌症治疗的靶向菌
肿瘤内微生物群已显示在人类乳腺癌、骨癌、胰腺癌、卵巢癌、肺癌、黑色素瘤、胶质母细胞瘤以及原发性和转移性结直肠癌中。肿瘤微生物群可能在肿瘤发生、肿瘤进展和治疗反应中发挥着重要作用。
肿瘤相关γ-变形菌表达细菌胞苷脱氨酶,该脱氨酶使细胞毒性药物吉西他滨失活;使用抗生素环丙沙星可以清除细菌,恢复对吉西他滨的敏感性。然而,吉西他滨治疗也通过增加变形杆菌的丰度来改变肠道微生物群。
↓↓↓
因此,抗生素治疗是否通过对肿瘤相关的γ-变形菌或其他与肠道或肿瘤相关的微生物成分的特异性影响来影响肿瘤生长,目前没有确切的证据。
*************************************************************************
小鼠乳腺癌模型:
通过循环肿瘤细胞携带的肿瘤内细菌,重组了细胞骨架,促进了宿主细胞的存活。通过肿瘤微生物群落中分离的菌株直接注入肿瘤,增强了转移形成。
在原发性人类结肠癌和远处转移中检测到:
——梭杆菌门(Fusobacteria)
使用甲硝唑抗生素治疗可以消除梭杆菌,并减小肿瘤生长速度。
肝癌和肝硬化患者:
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
↓↓↓
这些数据表明,抗生素有可能靶向肿瘤微生物群,但抗生素治疗的全身效应与肿瘤局部效应可能是拮抗的,特别是考虑到抗生素对免疫检查点阻断的有害影响。
*************************************************************************
细胞内细菌可能逃避RAB11介导的吞噬作用,并寄居于稳定的含有细菌的液泡中,使其对抗生素无效。
↓↓↓
因此,使用细胞穿透肽和核酸可能会最大限度地增强抗生素对肿瘤相关细菌的效力。
肠道微生物群调节癌症治疗,可以有针对性地提高治疗效果并预防不良反应
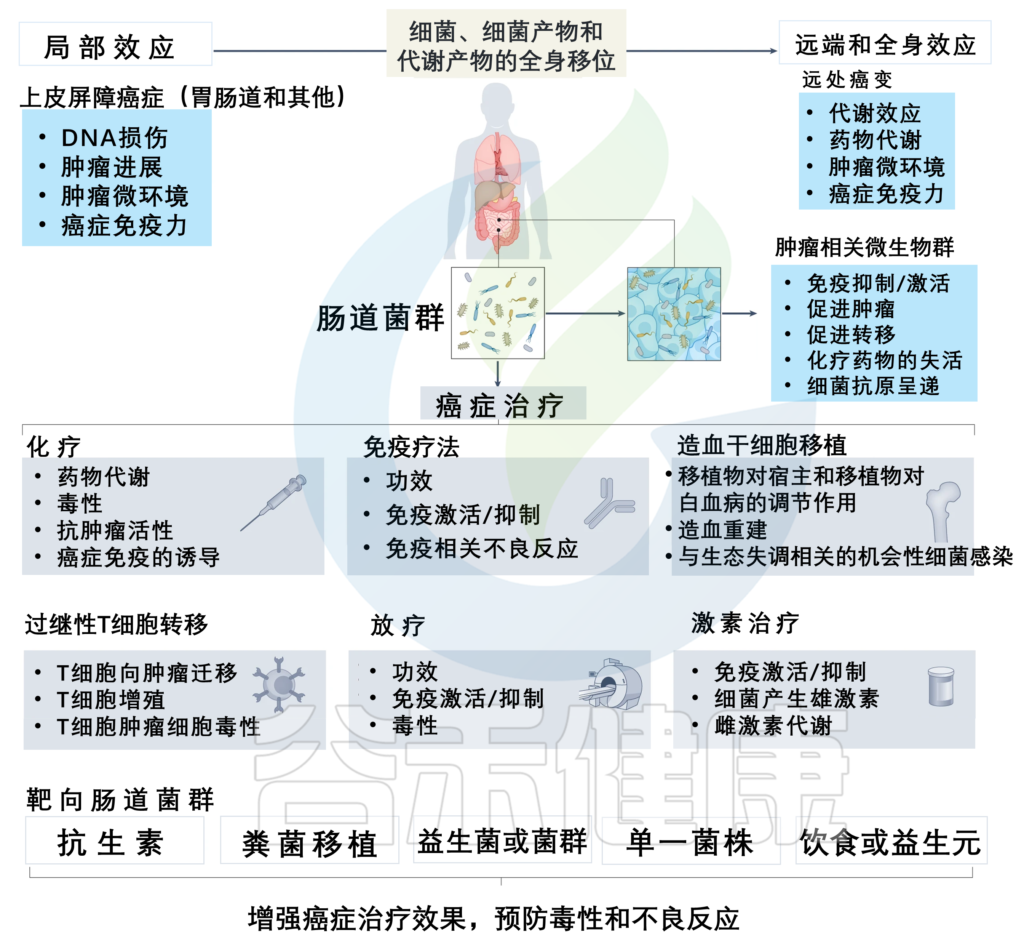
doi: 10.1038/s41568-022-00513-x
放射治疗在于缩小或破坏肿瘤,但过程不同。
辐射是一种高能不可见光波,可以针对癌细胞破坏其遗传物质,最终杀死它们。辐射波会损害癌细胞,癌细胞会随着时间的推移而死亡并被身体清除,从而导致肿瘤缩小。
与化疗不同,放疗通常是一种局部治疗,也就是说一般不会传播到全身。
缺点
如果附近的健康组织在治疗过程中受损,局部放射可能会产生副作用,比如恶心、口腔溃疡、喉咙问题导致进食困难、皮肤干燥、精疲力竭等。
不同癌症类型在毒性和敏感性方面存在差异,这是影响电离放射治疗安全性和有效性的主要障碍。
肠道微生物群的细菌和真菌成分都可能导致患者间的异质性
在实验动物中,对革兰氏阳性细菌有选择性的抗生素万古霉素通过消耗产短链脂肪酸的肠道细菌,提高RTX的有效性,并增强树突状细胞抗原呈递和癌症免疫。
向万古霉素处理的小鼠施用丁酸盐,部分通过抑制树突状细胞功能,包括它们产生IL-12的能力,消除了这种作用。
使用广谱抗生素治疗肠道微生物群会导致酵母菌类真菌肠道扩张,通过β-葡聚糖受体Dectin 1的信号传导抑制肿瘤免疫,从而降低RTX有效性。使用抗真菌药物治疗可提高未经治疗小鼠的RTX有效性,尤其在抗生素治疗的对RTX反应较差的小鼠中。
在乳腺癌患者中,肿瘤内髓细胞中Dectin1的表达与生存率呈负相关,这一观察结果表明真菌免疫抑制作用可能与临床相关。
短链脂肪酸在癌症治疗中的复杂功能:对抗毒性 与 免疫调节
传统饲养的小鼠比无菌小鼠更容易受到全身照射(TBI)毒性的影响,因为微生物群抑制ANGPTL4的表达。
注:ANGPTL4,血管生成素样4,也称为FIAF,是一种支持组织修复的脂蛋白脂肪酶抑制剂。
然而,产短链脂肪酸菌通过诱导ANGPTL4,来保护接受RTX治疗的患者免受结肠炎和粘膜炎的侵袭。
毛螺菌科、肠球菌科→产丙酸→减轻毒性
在全身照射存活的小鼠中,产生色氨酸代谢产物和短链脂肪酸(特别是丙酸盐)的细菌,毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)大量存在,并且可以将对TBI毒性的耐药性转移到其他小鼠。
在进行异基因造血干细胞移植(allo-HSCT)预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗(TBI)时出现的肠道毒性较轻。
这些发现可以解释为什么产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防TBI毒性。
总体而言,几项研究表明,不同的短链脂肪酸可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
因此,短链脂肪酸在放疗和其他癌症治疗中的功能似乎很复杂,需要进一步研究。
最新的癌症疗法利用宿主免疫系统来对抗癌症。免疫细胞通过识别和消灭癌细胞来抑制肿瘤的发生。
CTLA-4充当淋巴结中 T 细胞激活的“关闭”开关,而 PD-L1/PD-1降低肿瘤部位的晚期免疫反应。
免疫检查点抑制剂(ICI) 是一种单克隆阻断抗体,可以释放免疫系统的“刹车”,使免疫细胞能够更有效地识别和攻击癌细胞。
这种方法给一些难治癌症患者带来了显著的持久缓解,如晚期和转移性黑色素瘤、肾细胞癌、非小细胞肺癌等。目前用于超过25种不同的肿瘤类型。
缺点
免疫治疗(ICI)每年每个患者的费用超过10万元,成功率仅为20%-40%,同时许多患者会出现与免疫相关的不良事件。
因此,迅速发展的需求突显了将免疫疗法的有效性扩展到所有癌症患者的必要性。
微生物群维持对病原体的抵抗力和疾病耐受性,防止对无害抗原的过度炎症反应。
饮食、生活方式、抗生素和其他药物使用的变化可能会改变这种健康保护生态平衡。与对急性感染的抗原特异性耐药性不同,肿瘤通过劫持疾病耐受机制抑制癌症免疫。因此,肠道微生物群的改变,可能会影响患者对免疫疗法的反应和免疫相关不良事件(irAE)的程度。
过继性T细胞疗法(ACT):万古霉素增强ACT抗肿瘤,其他抗生素降低抗肿瘤
万古霉素的治疗增加了肠道中变形杆菌门的丰度,但耗尽了厚壁菌门和拟杆菌门的大多数物种,增强了ACT在小鼠中的抗肿瘤作用。
而其他抗生素,特别是新霉素和甲硝唑,分别消耗革兰氏阴性需氧菌和厌氧菌,降低了ACT的抗肿瘤作用。
万古霉素修饰的微生物群诱导产生刺激T细胞的IL-12,维持过继转移的细胞毒性T细胞。
Toll样受体激动剂:CpG-ODN、ICB疗法
革兰氏阴性菌与诱导坏死的CpG-ODN的有利先天反应,以及维持适应性CD8+T细胞介导的抗癌免疫的肿瘤微环境的重定向有关。
ICB 疗法增强的适应性免疫(如后面所讨论的)与几种革兰氏阳性细菌的存在相关,包括:
在这种情况下,革兰氏阴性菌与免疫抑制性局部和全身炎症状态有关。
在一项临床试验(NCT03618641)中,证明了 CpG-ODN和ICB组合的功效,抗PD1治疗下,初始CpG-ODN诱导的坏死和维持无复发生存,与革兰氏阴性细菌(变形菌门、拟杆菌门和革兰氏阴性Oscillospiraceae)的粪便丰度相关。
免疫检查点阻断
一般来说,只有20-40%的患者对ICB有反应,因此需要确定响应标志物并开发克服耐药性的治疗方法。
而肠道微生物群已成为预测ICB响应的肿瘤外部生物标志物。
CTLA4
➦ 无菌小鼠对抗CTLA4治疗反应不佳。
➥ 向微生物群耗尽的小鼠注射多形拟杆菌(Bacteroides thetaiotaomicron)或脆弱拟杆菌(Bacteroides fragilis),通过诱导肿瘤中的DC成熟和引流淋巴结中的TH1反应,恢复抗CTLA4反应。
PDL1
相反,小鼠对肿瘤生长的抵抗力和对抗PDL1的反应性与几种双歧杆菌的粪便丰度有关。
在晚期黑色素瘤患者中,放线菌门(双歧杆菌科和Coriobacteriaceae)和厚壁菌门(瘤胃球菌科和毛螺菌科)的关键细菌种类的粪便丰度与抗PD1治疗后的良好结果有关。
在肺癌、肾细胞癌或肝细胞癌患者中,粘蛋白降解的Akkermansia muciniphila在抗PD1治疗中发挥抗肿瘤作用。然而,在一些接受抗生素治疗的患者中,粪便中A. muciniphila的高丰度与抗PD1治疗的耐药性有关,这可能表明AKK菌在抗PD1疗法反应中具有双峰效应。
在抗PD1治疗无反应的患者粪便中,溶血性葡萄球菌和Corynebacterium aurimucosum的更高,在有反应的肾癌和肺癌患者中,E. hirae菌的粪便频率更高。
研究中发现的细菌种类的一致性有限,可能是由于ICB介导的免疫机制的变化。
TIM3
抗生素治疗对抗TIM3癌症治疗的损害,也表明了肠道微生物群在维持这种类型的ICB的疗效中的作用。
肠道菌群、血液相关菌群和肿瘤相关菌群的组成不同,对不同类型的癌症具有特异性,导致不同的细菌种类对免疫治疗的反应产生影响。
对相同类型肿瘤和相同ICB治疗的患者队列的研究,即使仍然受到队列内微生物群异质性的影响,也报告了更一致的结果。
事实上,复杂微生物群落中的未知变异阻碍了稳健的特征识别。未来的研究依赖于细菌亚种和菌株的新特征,并分析单个细菌基因或途径的关联,将更好地识别特定细菌与治疗反应的关联及其作用机制。
肠道菌群对抗PD1免疫检查点阻断反应的调节
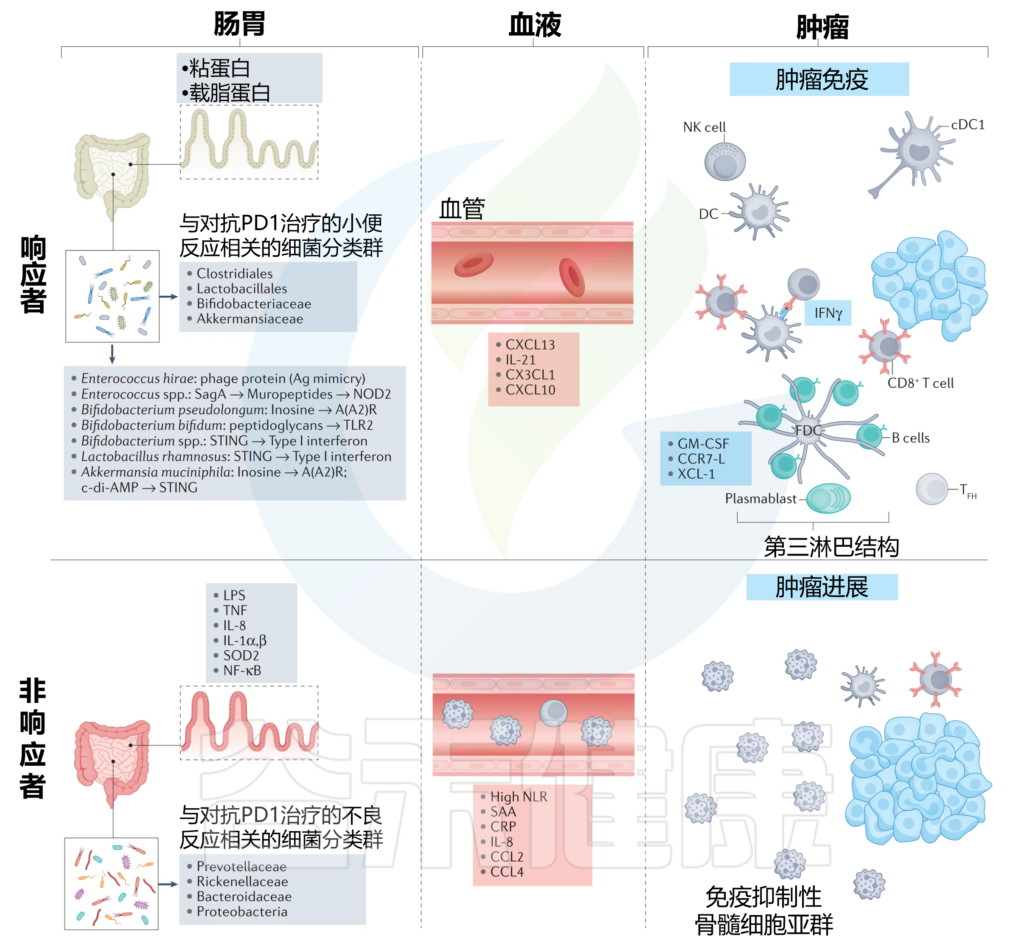
doi: 10.1038/s41568-022-00513-x
在大多数接受抗PD1治疗的癌症患者的研究和荟萃分析中,与有利或不利治疗反应普遍相关的细菌已得到一致定义。
在对抗PD1治疗有反应的患者中观察到一种健康、无炎症的肠粘膜,其特征是编码抗炎载脂蛋白和跨膜粘蛋白的转录物。在这些患者的血液中,参与T细胞和B细胞募集的细胞因子和趋化因子升高,这对抗肿瘤免疫很重要。左上角列出了与抗PD1治疗的有利反应相关的确定细菌种类及其在调节抗肿瘤免疫中的作用机制。
在对抗PD1治疗没有反应的患者中,观察到肠粘膜发炎和炎症细胞脱落,而在他们的血液中,通常存在全身炎症的生物标志物。所列的肠道革兰氏阴性菌群与抗PD1治疗的不良反应以及局部和全身炎症的生物标志物有关,可能反映了免疫抑制肿瘤微环境。
早期临床反应取决于肿瘤内在因素或宿主因素;而肠道菌群的调节作用在治疗开始约1年后更具影响力
一项针对黑色素瘤患者的抗PD1治疗研究报告称,较高的肠道微生物群α多样性与良好反应之间存在关联。但没有更多研究证实,α多样性用于区分健康个体和癌症患者,它不能预测对免疫疗法的反应性。
对已发表的接受抗PD1治疗的黑色素瘤患者队列的数据进行的荟萃分析显示,不仅在单个物种水平上,而且在更大的分类分支中,识别出的细菌之间存在共性。
大多数研究认为有利的微生物群特征,包括放线菌门的多个成员,以及在厚壁菌门中,瘤胃球菌科和Lachnospiraceae科。
而一个不利的特征包括拟杆菌门和变形菌门。
对黑色素瘤患者的免疫治疗反应进行的两项荟萃分析使用了大队列,研究发现,肠道微生物群的基线组成在3个月时进行放射学评估时,区分有反应的患者和没有反应的患者的能力有限,但它可以更好地区分在治疗开始后约1年有进展或没有进展的患者。此外,长期无进展生存期患者在开始抗PD1治疗后数年保持良好的微生物群。
为什么没有在队列中一致地识别出某些菌作为生物标志物?
一项研究的样本来自三个欧洲国家和一些公开的数据集,并包括用抗CTLA4、抗PD1或两者联合治疗的黑色素瘤患者。这里涉及到,地理和治疗类型的异质性。
即使同卵双胞胎,每个个体的肠道微生物组都是独特的,并且这种独特性的很大一部分是在单个菌株水平上编码的。需要分析方法更深入探索这种个体特异性的微生物多样性。
不同地理区域的肠道微生物类型不同,因为人类肠道微生物组受到种族和地理起源的影响。利用美国肠道项目的7000多个样本,对微生物类型进行了地理测绘,揭示了美国各地理区域的分布不均。
接受抗PD1治疗的黑色素瘤患者队列中的微生物类型代表性也不一样,并反映了他们的地理环境。此外,对抗PD1治疗有反应的概率与肠道微生物类型相关。
因此,通过微生物类型视角分析肠道微生物群与免疫疗法反应之间的关系,为先前研究的不一致性提供了可能的解释,并可作为纠正地理和临床中心特异性偏见的工具。
肠道菌群中的肽聚糖酶介导的抗癌
一些肠球菌在小鼠中维持ICB作用的能力是由一簇肽聚糖水解酶介导的,包括分泌抗原a(SagA),它产生NOD2激活的胞壁肽(muropeptides),增强抗PDL1诱导的肿瘤免疫。
当给予小鼠时,SagA转染的乳酸乳球菌抑制肿瘤生长并提高抗PD1反应性。某些与小鼠抗PD1和奥沙利铂癌症治疗协同作用的双歧双歧杆菌菌株富集了肽聚糖合成基因,通过TLR2刺激癌症免疫。
肠道菌群调控干扰素
肠道菌群维持I型干扰素表达,增强肿瘤免疫
在微生物群耗尽的小鼠中,肿瘤内先天免疫细胞中的干扰素信号减弱,改变巨噬细胞极化、树突状细胞分化和DC-自然杀伤(NK)细胞串扰,并使肿瘤微环境从抗肿瘤变为促肿瘤。
肠道微生物通过诱导免疫细胞产生干扰素,通过一系列的受体和信号通路来增强免疫应答。
注:一些列受体如TLR3、TLR4、TLR7、TLR9、Dectin 1、干扰素基因刺激因子(STING)、DDX41、RIG-I等。
微生物群诱导的细胞和基因表达特征激活了小鼠的STING-干扰素途径,并与黑色素瘤患者的良好ICB反应有关。
某些共生菌如AKK菌、双歧杆菌、鼠李糖乳杆菌,通过激活干扰素途径来抑制肿瘤进展,并增强免疫治疗的效果。
干扰素的作用也与肿瘤类型和治疗阶段有关
I型干扰素信号传导并不总是与抑制肿瘤生长有关。肝脏中持续的I型干扰素信号传导,分别通过诱导一氧化氮或改变尿素循环,诱导对抗PD1治疗的耐药性或抑制抗病毒T细胞反应。
不同刺激产生的干扰素还会对肿瘤生长和免疫反应产生不同的影响。在肿瘤治疗中,详细了解干扰素在不同时间点对不同细胞的作用,以及如何影响肿瘤环境和免疫治疗效果,还需深入研究。
肠道促炎:预测ICB疗效不佳
系统性炎症的许多外周血生物标志物,如高中性粒细胞与淋巴细胞比率(NLR)和C反应蛋白(CRP)、IL-8和血清淀粉样蛋白a(SAA)水平升高,是对ICB反应不佳的预测因素。
黑色素瘤患者粪便微生物群中,高NLR与革兰氏阴性拟杆菌门的丰度增加有关。人类粪便转录组分析显示,对抗PD1治疗没有反应的患者肠道中存在促炎特征,主要由脱落的中性粒细胞和其他髓细胞引起,这与LPS和NF-κB信号传导有关,导致产生促炎细胞因子,如TNF、IL-1和IL-8。
革兰氏阴性菌:阻碍ICB反应
总体而言,这些数据表明,肠道微生物群中的革兰氏阴性菌可能通过LPS产生和TLR4信号传导,诱导免疫抑制性局部肠道和全身炎症,从而阻碍ICB反应。
实验诱导的小鼠胆汁淤积诱导革兰氏阴性菌从肠道转移到肝脏,导致TLR4依赖性炎症反应,产生CXCL1,募集免疫抑制性中性粒细胞,抑制抗肿瘤免疫,导致胆管癌生长增强。此外,革兰氏阴性菌Fusobacterium nucleanum与原发性和转移性结直肠癌癌症的关联,通过吸引髓细胞而具有免疫抑制性。
自身抗原和微生物异种抗原之间交叉反应
自身抗原和微生物异种抗原之间的交叉反应在自身免疫性疾病中很常见,可能与癌症免疫有关。身体不仅对病原体产生免疫反应,而且对共生微生物产生免疫反应。尽管这种反应得到了很好的控制,但失调可能会引发免疫病理,并可能在接受ICB治疗的患者中被重新激活,导致免疫相关不良反应,并可能与肿瘤新抗原发生交叉反应。
ICB治疗的患者中鉴定的一些肿瘤新抗原,可能与微生物抗原具有交叉反应
在抗CTLA4处理的小鼠中,通过过继转移B.thetaiotaomin特异性或B.fragilis特异性T细胞导致其活化,进而抑制MCA-205肉瘤肿瘤生长,支持肿瘤和微生物抗原之间分子模拟的观点。
小鼠细菌共生体E.hirae与对环磷酰胺和ICB的有利反应相关的,E.hirae携带表达肽的原噬菌体,针对该肽引发主要组织相容性复合物(MHC)I类反应,并与癌症细胞中过表达的非突变蛋白酶体组分中的表位交叉反应。
在人类中,相同的原噬菌体在肠球菌属中表达。除毛滴虫外,其MHC限制性表位与甘油-3-磷酸脱氢酶1-样蛋白(GPD1L)中的表位发生交叉反应,后者也在肿瘤中过表达。
在人类黑色素瘤转移中,表达人类白细胞抗原(HLA)I类和II类限制性肽的细菌物种存在于造血细胞和肿瘤细胞中。当对表达肿瘤匹配HLA等位基因的EB病毒转化的B细胞进行脉冲时,其中一些肽能够特异性激活肿瘤浸润淋巴细胞。
因此可以推测,在患者中,这些肽通过传统抗原呈递细胞或黑色素瘤细胞的呈递,引发了可能影响抗癌免疫的T细胞免疫反应。
有望成为预测免疫疗法反应的生物标志物
前面第二章节有提到短链脂肪酸与放疗,这里我们主要看短链脂肪酸对接受 ICI 的癌症患者的预测作用。
在日本进行的一项研究中,52名接受抗PD-1抗体治疗的实体瘤患者的粪便短链脂肪酸与良好的临床结果相关。高浓度的粪便乙酸盐、丙酸盐、丁酸盐和戊酸盐以及血清异戊酸盐与PFS的延长有关。
相比之下,另有研究发现,高血清丁酸盐和丙酸盐水平与黑色素瘤患者对抗CTLA4抗体的耐药性和Treg细胞数量的增加有关。
鉴于临床前肿瘤模型也揭示了短链脂肪酸对抗CTLA4抗体或放射治疗的疗效的负面影响,在利用血液或粪便中的任何短链脂肪酸作为ICI疗效的生物标志物之前,需要进一步的研究来验证不同地理位置的大型队列中短链脂肪酸的预测价值。
不同的细菌种类,包括假长双歧杆菌、约氏乳杆菌和粘球菌,产生肌苷及其代谢产物次黄嘌呤。这些分子结合腺苷受体A2a(A2aR),激活抗肿瘤T细胞并提高小鼠的ICB效率,特别是抗CTLA4疗法。
肌苷增强抗PD1治疗效果
除了A2aR介导的T细胞活化外,肌苷是葡萄糖限制下CD8+T细胞的替代碳源,并增强了对不能利用肌苷作为能量来源的肿瘤的抗PD1治疗功效。表明肌苷活性增强了ICB疗效,并且像腺苷一样激活了A2aR,在临床癌症治疗的试验中,A2aR是一个免疫抑制的检查点,增强ICB效果。
肌苷也可能抑制自身免疫
罗伊氏乳杆菌(Lactobacillus reuteri)可以预防ICB诱导的结肠炎,但不会影响ICB在小鼠中的抗肿瘤功效,它通过增强作用于A2aR110的肌苷的产生,来抑制Treg细胞缺陷的Scurfy小鼠的自身免疫。
这些高度矛盾的结果可能可以通过肌苷对T细胞的直接刺激效应与上下文相关的事实来加以解释;在无菌动物中或在没有共生细菌提供的促炎启动的体外,肌苷需要在这些实验条件下分别由CpG-ODN或IFNγ提供的炎症刺激。由于缺乏这种炎症刺激,肌苷确实会抑制T细胞。
因此,在癌症免疫疗法中靶向肌苷依赖性途径需要更好地理解肌苷的这些对比效应,同时考虑到腺苷和肌苷通过A2aR的信号可能不相同,并且肌苷通过A2aR或A3R影响不同的全身炎症模型。
两项研究调查了接受ICIs的晚期癌症患者的犬尿氨酸与色氨酸(Kyn与Trp)比率的临床意义。
Kyn/Trp比率高,与总生存期缩短有关
第一项研究中,早期疾病进展患者(3个月内)的Kyn/Trp比率显著高于有反应者(P = 0.017)。
第二项研究中,在接受nivolumab治疗的黑色素瘤和肾细胞癌患者中,开始治疗4-6周后Kyn与Trp比率的增加(>50%)与中位总生存期的缩短密切相关(P ≤ 0.026)。
有争议的发现
鉴于代谢适应在癌症免疫疗法中的重要性,以及在黑素瘤患者中选择性IDO1抑制剂与ICI联合治疗的疗效不佳(在ECHO-301/KEYNOTE-252第三期试验中),这些发现不仅对未来试验中基于血清肾上腺素/色氨酸比率监测而进行患者分层的必要性提出了质疑,还对ICI治疗期间肠道菌群动态调节的分析提出了质疑。
事实上,色氨酸不仅由肿瘤和髓系细胞代谢,而且由肠道菌群中的不同种类代谢成吲哚和吲哚衍生物,包括吲哚乙酸、吲哚-3-醛(I3A)和吲哚丙酸等,这些物质能够与芳香烃受体结合。
可能支持富含色氨酸的饮食,或基于I3A或3-IAA 的益生元与ICI的组合
当罗伊氏乳杆菌与ICI联合给小鼠口服时,它可以从回肠转位到黑素瘤部位,释放I3A,激活CD8阳性T细胞的TCR信号通路,促进IFNγ的释放和抗肿瘤效应。
这些实验发现的临床意义已在一项涉及接受ICI治疗的黑素瘤患者的研究中得到证实,为基于色氨酸的饮食干预在癌症患者中的应用开辟了道路。
细胞内L-精氨酸浓度也直接影响T细胞的代谢适应度和存活率,从而影响它们在小鼠模型中介导有效抗肿瘤免疫反应的能力。
L-精氨酸水平升高诱导了整体代谢变化,包括活化T细胞从糖酵解向氧化磷酸化的转变,并促进了中枢记忆样T细胞的产生。
在发现组和验证组中,低血清L-精氨酸水平(<42 µM)与减少的临床获益率、无进展生存期和总生存期显著独立相关(P = 0.004)。此外,低血清L-精氨酸水平与髓系细胞中PD-L1的表达增加相关。因此,血浆L-精氨酸监测可能成为ICI疗效的适宜预测生物标志物。

doi: 10.1038/s41571-023-00785-8.
尽管广谱抗生素可能会导致真菌过度生长,从而降低放疗效率
万古霉素消耗产短链脂肪酸菌,提高放疗效果
一项正在进行的临床试验(NCT03546829),测试在接受立体定向身体放射治疗的非小细胞癌症(NSCLC)患者中,通过IFNγ的产生评估,万古霉素是否增加抗肿瘤免疫力。
万古霉素还通过增强自然杀伤T细胞(NKT)在肝脏中的迁移和IFNγ的产生,削弱小鼠原发性和转移性癌症的生长。
万古霉素耗尽革兰氏阳性菌,调控胆汁酸
万古霉素耗尽革兰氏阳性菌,特别是Clostridium scindens,它将初级胆汁酸转化为次级胆汁酸。微生物群衍生的胆汁酸影响炎症、免疫和致癌物的许多方面。初级胆汁酸,如鹅去氧胆酸,通过肝窦内皮细胞诱导趋化因子CXCL16的产生,该细胞通过CXCR6吸引NKT细胞,而次级胆汁酸,特别是ω-鼠胆酸,抑制CXCL16产生。
还计划进行临床试验(NCT03785210),测试万古霉素是否改善原发性肝癌或转移患者对抗PD1治疗的反应。然而,即使是特定的抗生素也会引起肠道微生物群组成的广泛变化,这可能会对癌症治疗产生相反的影响。
胆汁酸对免疫反应的调节也是复杂的
黑色素瘤患者FMT后,次级胆汁酸水平与抗PD1治疗的良好临床反应有关。
然而在小鼠中,拟杆菌属部分地将抑制TH17细胞的次级胆汁酸3-oxoLCA,转化为激活Treg细胞的isoalloLCA,从而限制自身免疫和癌症免疫。
万古霉素提高ADT疗效
去势抵抗性前列腺癌与促癌的肠道菌群变化有关,使用含有万古霉素的抗生素混合物来消耗小鼠体内产生雄激素的细菌,这种抗生素可以专门减少厚壁菌门的细菌,包括产生雄激素的梭菌属,从而提高ADT(雄激素剥夺疗法)的效果。因此,如果抗生素与ADT一起使用,它们的性质应该是选择性地消耗产生雄激素的细菌,而不是免疫刺激物种。
抗生素治疗仍有挑战,更特异性的方法有待探索
一般来说,在ICB期间或之前使用抗生素对临床反应产生不利影响,很可能是因为它们改变了肠道生态以及有利和不利细菌之间的平衡。尽管通过抗生素来靶向肠道菌群可能具有益处(如上面例子所述),但总体而言,这面临着大部分抗生素的广泛反应性以及可能诱导抗生素耐药性的挑战。
除了抗生素,其他更具特异性的方法,如噬菌体治疗以及更有效、更具特异性的噬菌体介导的CRISPR-Cas3抗微生物药物,可以在我们对直接影响抗肿瘤反应的细菌种类以及由其消除引起的生态变化的认识更加精确之后使用。
FMT可解决80-90%的抗生素耐药性艰难梭菌感染,其他包括各种机会性感染、炎症性肠病等也在研究中。
对免疫疗法后的结肠炎,FMT效果好
抗CTLA4治疗免疫相关不良反应中常见的有结肠炎,这类结肠炎可能比较严重,皮质类固醇或TNF拮抗剂的治疗难以治愈。
两名癌症患者在接受ICB治疗后出现结肠炎,经健康捐赠者FMT治疗后,病情迅速恢复。供体菌群确实发生了定植,厚壁菌门和变形菌门的丰度降低,拟杆菌门和Verrumicrobiae的丰度增加。随后的一份初步报告显示,在FMT治疗的15名癌症患者中,有11人从ICB诱导的结肠炎中恢复。
FMT:提高黑色素瘤患者的抗PD1治疗效果
两项临床试验证明,FMT可以靶向微生物群,以提高黑色素瘤患者的抗PD1治疗效果。由于预测微生物群组成尚不可行,这可能支持抗PD1治疗反应,以选择健康的粪便微生物群供体,两项试验都使用了黑色素瘤患者和对抗PD1疗法有持久反应的患者作为供体。
*****************************************************************************
第一项试验
10名进展中的黑色素瘤患者接受了抗生素治疗(其中6人之前对ICB有阳性反应),并通过结肠镜检查。这10个人做了FMT,供体是两名对抗PD1治疗有反应的捐赠者中的其中一人,随后重复胶囊形式的FMT和抗PD1疗法。
● 在从供体1接受移植的5名患者中,一个完全反应和两个部分反应;
● 在从供体2接受移植的五名患者没有反应。
两个供体的微生物群都包含有利于抗PD1治疗反应的菌群,供体1在梭菌属和放线菌属中更富集。FMT后,供体1受体的微生物组成变化比供体2受体更一致,人类粪便转录组中炎症和抗原呈递特征的表达增加。治疗后,三名有反应的患者表现出更显著的肿瘤排斥反应,其特征是I型干扰素反应和单核细胞、DC、NK细胞和T细胞浸润。
*****************************************
第二项试验
15名对抗PD1治疗原发性无反应的黑色素瘤患者在结肠清洗后(没有抗生素治疗),接受了来自6名抗PD1疗法有反应的供体中的1名,随后接受了持续的抗PD1治疗;1名患者完全缓解,2名患者部分缓解,3名患者病情稳定超过18个月。
这些反应良好的患者的菌群怎么样了?
在反应良好的患者中,FMT后的粪便微生物群变得更像供体,并且针对供体菌群的IgG抗体更显著诱导。有益菌的丰度增加,如毛螺菌科、瘤胃球菌科和双歧杆菌科,有害菌如拟杆菌属减少。
其他指标有什么变化?
在这些有反应的患者的血液中,IL-8水平下降,而CXCR13和IL-21水平上升,表明T卵泡辅助细胞(TFH)有反应。
初级和次级胆汁酸的水平以及苯甲酸盐降解的产物都增加了,苯甲酸盐是微生物群多样性,与抗PD1治疗反应相关的某些菌群的存在的标志。
******************************************************************************
尽管规模小且单臂试验,但这两项初步研究中的整体临床反应率为36%,高于其他联合治疗方案在难治性抗PD-1治疗患者中的反应率,且没有额外严重毒副作用。
FMT后菌群有效定植,干扰时长超1年
总的来说,即使没有抗生素调理,单次结肠镜进行FMT,也会干扰微生物群组成超过1年。宏基因组分析表明,大多数存在于供体而不在受体患者身上的菌属(和微生物基因),可以有效且持久地定植,除非受体接受了抗生素治疗。
供体菌株定植与治疗效果之间可能存在不一致?
事实上,FMT后的微生物群组成不仅反映了供体特异性菌群的定植情况,还反映了FMT引起的肠道生态变化,改变了来自供体或接受者的不同菌群的丰度。
对抗PD1治疗无效的黑色素瘤患者来说,FMT可能只有当患者存在针对肿瘤的免疫反应,但受到免疫抑制或微生物组成不利的影响,导致缺乏免疫促进的微环境时,才会产生对继续抗PD1治疗的反应。FMT可以纠正这种不利的微生物组成。
自体FMT,重建肠道微生物群
供体可以提供更健康、更多样的微生物群,能够重建受体微生物群的多样性。然而,将病原体或抗生素耐药性病原体转移到免疫抑制受体中存在风险,这也说明了患者自体微生物群的储存是合理的。
接受自体FMT的患者每种白细胞谱系的数量都更高,这表明FMT是有利的。Faecaliberium、Ruminococcus、Akkermansia与白细胞数量增加有因果关系的是通过自体FMT重建的。
癌症患者对抗PD1治疗产生抗药性的原因各不相同,可能导致FMT治疗失败
其中原因包括:
1)由于免疫抑制或肿瘤可能缺乏新抗原,无论微生物群组成如何,都无法对肿瘤做出反应
2)FMT供体可能缺乏对抗-PD4治疗做出反应所需的菌群
3)由于供体与受体微生物群的不相容性,FMT不能使微生物群扰动足够大
4)FMT模式的递送方法和频率可能不是最佳的
FMT在癌症免疫治疗中的未来发展
需要重点评估患者预处理和微生物群转移的最佳方案,确定最有可能受益于FMT的患者和合适的供体。
许多计划中以及正在进行的试验将通过评估FMT在不同肿瘤类型中的有效性,以及将FMT与其他方法(如益生菌、饮食和益生元)进行比较或结合,调节肠道微生物群的组成,来确定FMT是否成为治疗对ICB无反应患者的常规方法。
益生菌制剂含有具有抗炎和粘膜保护能力的菌群,如乳酸杆菌属和双歧杆菌属,用于预防化疗和放疗引起的毒性。
临床和小鼠研究,都确定了可能对特定机会性感染产生耐药性的细菌,以及可能纠正微生物群失衡的潜在益生菌。
乳杆菌属:抑制肿瘤生长,改善对ICIs的反应
鼠李糖乳杆菌、嗜酸乳杆菌和发酵乳杆菌对结肠癌发展的缓解作用已在小鼠模型中得到证实。
鼠李糖乳酸杆菌GG可通过cGAS/STING信号传导途径刺激I型干扰素,从而改善对ICIs的反应。
乳酸菌(LAB)可有效减少结直肠癌的发生,这可能归因于炎症因子的减少。此外,LAB还影响肠道微生物群落,其特征是拟杆菌丰度的降低。因此,LAB有利于抑制癌症的发生和发展。
罗伊氏乳杆菌能促进肠上皮的更新和修复,刺激宿主免疫。它能将上皮内CD4+T细胞转化为CD4+CD8αα双阳性上皮内淋巴细胞,从而缓解炎症性肠病,预防部分消化道癌症的发生。
罗伊氏乳杆菌抑制 ICI相关结肠炎的能力,与第 3 组先天淋巴细胞分布的减少有关。
罗伊氏乳杆菌通过产生三种色氨酸降解产物,抑制黑色素瘤、肝癌和结直肠癌的生长:
双歧杆菌属:增强抗PDL1疗效
对无特定病原体或微生物群耗尽的小鼠,给予与ICB反应相关的各种菌群可提高治疗反应。
为了验证双歧杆菌属支持小鼠抗PDL1治疗,施用含有四种双歧杆菌属菌株的非处方商业益生菌制剂可提高对抗PDL1疗法的反应。在对抗PD1治疗有反应的患者中,双歧杆菌也会增加。
只有一些双歧杆菌菌株能够在小鼠中与抗PD1治疗协同作用。这些协同菌株表达参与合成肽聚糖途径的基因,表明它们有助于产生免疫刺激分子。
Faecalibaculum rodentium: 抑制肿瘤生长
F.rodentium和Holdemanella biformis(人类同源物)在肿瘤发生过程中缺失或丢失,这两者都可以产生短链脂肪酸,通过抑制钙调神经磷酸酶和NFATc3激活来控制肿瘤细胞的增殖和蛋白质乙酰化。
当将F.rodentium应用于ApcMin/+小鼠时,80%以上的结直肠癌中会发生结肠腺瘤样息肉(APC)基因突变,或者用偶氮甲烷和右旋糖酐硫酸钠治疗可以减轻小鼠的肿瘤生长。同样,在ApcMin/+模型中,H.biformis在通过丁酸盐抑制肿瘤生长方面似乎与F.rodentium相似。因此,H.biformis可以应用于癌症治疗的设计。
嗜热链球菌:分泌β-半乳糖苷酶,释放叶酸
嗜热链球菌(Streptococcus thermophiles)是一种强大的益生菌,具有消化和免疫益处,通常在结直肠癌患者中被耗尽。更重要的是,嗜热链球菌对肿瘤发生有抑制作用。
具体而言,在结直肠癌小鼠中经口灌胃嗜热链球菌将显著减少肿瘤形成。嗜热链球菌分泌的β-半乳糖苷酶是抑制结直肠癌生长的活性成分;β-半乳糖苷酶可以增加另外两种益生菌乳酸杆菌和双歧杆菌的丰富性,这表明了协同作用。
嗜热链球菌通过释放叶酸来影响肿瘤生长。叶酸是一种主要的膳食元素,在细胞代谢和DNA复制、修复、甲基化和核苷酸合成中发挥重要作用。研究表明,叶酸缺乏在人类中相当普遍,嗜热链球菌释放的叶酸可能与肿瘤抑制有关。此外,嗜热链球菌对淋巴细胞特征、结肠炎的严重程度和调节性T细胞反应有影响。
大肠杆菌Nissle 1917: 减少并发症
大肠杆菌Nissle 1917 菌株可以调节肠道屏障上皮功能,缓解肠道菌群失调,最终减少伊立替康引起的肠道并发症。
丁酸梭菌588菌株:改善抗PD1治疗后患者生存率
相反,在一项回顾性分析中,一种单一的益生菌制剂,在日本和中国广泛用于治疗与胃肠道病理学相关的微生态失调的丁酸梭菌(CBM)588菌株,显著改善了接受抗PD1治疗的小细胞肺癌癌症患者的客观反应、PFS和总生存率。丁酸梭菌通过增加乳酸杆菌和双歧杆菌来改善微生态失调。
然而,一项对接受联合ICB治疗的肾细胞癌症患者的随机试验证实,接受丁酸梭菌治疗的患者临床反应有所改善,但未能检测到双歧杆菌的增加。
多种菌组合,效果 1+1>2
虽然单一益生菌菌株显示出前景,但细菌群落可能更好地维持肠道微生物群内的生态平衡。人类和小鼠种,某些种类的梭状芽孢杆菌与对结肠癌的耐药性有关。
小鼠口服下列四种梭菌菌株:
诱导了激活的CD8+T细胞在肿瘤内的积聚,并成功治疗了化学诱导的结肠癌和可移植结肠癌。
该联合体作为一种独立的治疗方法以及单个物种,在小鼠中比单独的抗PD1治疗更有效。所有四个菌株都产生短链脂肪酸,包括丁酸盐;然而,它们的免疫刺激作用独立于丁酸盐。
鉴定免疫激活细菌群落的另一种方法涉及鉴定罕见的人类共生菌株,该菌株可以激活小鼠肠道中产生IFNγ的CD8+T细胞。一个由11个物种组成的群落在无菌小鼠中对单核细胞增多性李斯特菌感染保持耐药性,并具有与抗PD1治疗相加的抗肿瘤作用。值得注意的是,7种本身没有抗癌活性的拟杆菌目物种确实对该群落的总活性有贡献,这支持了多物种细菌生态学在重建肠道微生物群中的重要性。因此,使用单一菌株和联合体的试验正在进行中。
免疫治疗期间,益生菌的服用也需谨慎
与不服用益生菌的患者相比,服用非处方益生菌的黑色素瘤患者对抗PD1治疗的反应并没有改善,反而有所下降。
这些结果,再加上商业益生菌的配方是异质的,缺乏严格的成分和生存能力质量标准,表明在免疫治疗期间使用这些产品时应谨慎。
饮食的变化会迅速改变肠道微生物群的组成,以及食物发酵衍生的细菌代谢产物的产生,从而产生代谢和免疫后果。
不同的饮食策略,包括热量限制、间歇性禁食、模拟禁食饮食、高纤维饮食、生酮饮食、发酵食物,都已在小鼠或患者中提出或测试,以改善癌症的治疗,至少在某些情况下,显示出通过改变肠道微生物群的组成来影响免疫力。
在T细胞过继转移模型中,小鼠的饮食热量限制促进了记忆性T细胞在骨髓中的积累,并增强了T细胞对细菌感染和肿瘤的免疫力。
发酵食品饮食持续增加了微生物组的多样性,并通过整体抗炎作用改变了其组成。
高纤维饮食对微生物组多样性和组成的影响更为温和,对免疫细胞的频率和细胞因子的表达没有显著影响,但对免疫细胞中的内源性信号传导产生了不同的影响,在一组具有高炎症指数的个体中,内源性信号传导增加,而在另外两组具有低炎症指数特征的个体中则减少炎症指数。
饮食可能通过改变菌群影响抗癌免疫
接受抗PD1治疗的黑色素瘤患者,在纤维充足的饮食超过20g/天时有更好的反应和存活率 ,每5 g纤维的增加相当于进展或死亡风险降低30%。
与另一项研究一致,不同纤维摄入量的人类肠道微生物群在组成或细菌丰富度方面没有显示出重大变化,但从小鼠食物中去除大部分纤维含量导致微生物群迅速变化,双歧杆菌属减少,AKK菌增加。低纤维饮食的小鼠对抗PD1癌症治疗反应较差,与临床结果相似。因此,在无菌小鼠中,高纤维和低纤维饮食不会影响对抗PD1治疗的反应,这表明该饮食可能通过改变微生物群影响抗癌免疫。
跨物种网络分析表明,小鼠的高纤维饮食通过扩大发酵纤维的瘤胃球菌属来维持有效的肿瘤免疫。瘤胃球菌属诱导T细胞的激活和肿瘤浸润,包括表达诱导型T细胞共刺激因子(ICOS)的CD8+和CD4+T细胞。
模拟禁食饮食(FMD)可降低癌症患者的毒性,并改善其对化疗的反应,但大多数关于这种饮食干预的研究尚未解决肠道微生物群改变的作用。
禁食对化疗的积极作用体现在四个方面:
二甲双胍、维生素 C、铂和曲美替尼与禁食联合使用可以增强化疗的效果。
对于三阴性乳腺癌,模拟禁食饮食激活癌细胞中的饥饿逃逸途径,并减少癌症干细胞的表面标志物,从而导致化疗药物的识别增加。
生酮饮食在小鼠中通过诱导由酮体3-羟基丁酸介导的T细胞癌症免疫,来增强抗PD1治疗的抗肿瘤作用。在小鼠和人类中,尽管在低碳水化合物饮食在增加Eisenbergiella massiliensis等细菌种类的丰度方面与抗癌效应相一致,但饮食对肿瘤免疫的影响是由3-羟基丁酸盐的增加介导的,并不依赖于肠道微生物群的改变。
菊粉和果胶是许多蔬菜和水果中天然存在的可溶性纤维,不能被胃肠道酶消化,但可以被细菌发酵。因此,它们通过改变肠道微生物群的组成、增强粘膜屏障、增强上皮完整性以及激活或抑制先天免疫细胞来发挥益生元的作用。
菊粉→产短链脂肪酸菌→增强抗PD1疗效
在小鼠中,菊粉凝胶的口服治疗增加了产短链脂肪酸菌的丰度,并增强了抗PD1疗法的抗肿瘤活性。
↘
果胶增强抗肿瘤免疫,有两种不同的机制。
果胶→产短链脂肪酸菌→增强抗PD1疗效
果胶喂养增强了移植有癌症患者粪便微生物群的小鼠对抗PD1治疗的反应能力,通过扩大纤维喂养和产生短链脂肪酸的Lachnospiraceae和Ruminococceae,通过丁酸盐激活肿瘤免疫。
果胶→AKK菌→激活STING→提高肿瘤免疫
果胶喂养也可以通过导致AKK菌的扩张来提高肿瘤免疫力,从而产生环状二磷酸腺苷(cyclic-di-AMP)并激活STING;由此产生的I型干扰素依赖性免疫肿瘤微环境特征,与小鼠和黑色素瘤患者的免疫介导的肿瘤抵抗相关。
卡姆果→增加多样性,有益菌→增强抗PD1疗效
小鼠研究中,从卡姆果(camu camu)中分离的多酚——栗木鞣花素(castalagin,一种可水解的单宁)的口服给药具有抗肿瘤作用,并通过增加肠道微生物群的多样性,增加有望对抗PD1治疗有益的菌(如瘤胃菌科,颤螺旋菌科Oscillospiraceae和AKK菌)来改变其组成,从而增强小鼠的抗PD1治疗效果。
栗木鞣花素通过影响肠道微生物群组成,重新编程肿瘤免疫微环境,并在一定程度上通过直接结合而不内化于共生细菌(如Ruminococcus bromii)来促进抗癌反应,这可能有助于扩大这种细菌和其他有益细菌的种类,促进抗PD1治疗反应。这表明,栗木鞣花素和其他传统食品添加剂或其成分可能是益生元的来源,通过靶向微生物群来提高免疫疗法的反应性。
人参多糖→增加戊酸→增强抗PD1疗效
人参多糖是一种来源于人参的益生元,可以通过降低犬尿氨酸/色氨酸的比例,增加微生物代谢产物戊酸来增强癌症对PD1抑制剂的反应,从而促进Teff细胞的诱导和调节T细胞的抑制。
肠道微生物群在癌症治疗中,可以通过多种机制影响肿瘤的发展和治疗效果。
研究表明,肠道微生物群可能成为多种癌症类型的预后和预测标记。肠道微生物群有望增强抗癌力,改善放疗化疗效果和增强免疫治疗效果,以降低死亡率和提高生活质量。初步临床试验表明,对抗PD1治疗有反应的患者的FMT可以克服对ICB治疗的原发性和获得性耐药性,这证明可以靶向微生物群增强治疗反应。
然而,在这些临床治疗研究的进展中存在许多障碍和局限性。个体生物学差异可能会阻碍微生物策略的应用。该领域的挑战包括需要在不同的癌症类型、分期、地理区域、年龄、遗传、性别、生活方式、伴随疾病、治疗和合并症中进行前瞻性验证。将小鼠的结果推广到人类也应该谨慎。
虽然存在挑战,但相应的解决方案也在不断研究中。目前应用机器学习方法分析,在考虑了不同群体和地理差异的患者肠道菌群的组成方面取得了进展,这可能很快使肠道菌群成为一个可靠的生物标志物,用于预测患者对治疗的反应,从而实现个性化选择最适合的治疗方法。
将肠道微生物群与独立调节 ICI 功效的其他生物标志物(例如 PD-L1、TMB、IL-8 或某些代谢物等)结合起来,预测免疫疗法效果的能力可能会提高。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症治疗具有积极和负面效应的因果关系,并了解其作用机制,因此需要进行更广泛的试验。
改进的细菌或许可以作为抗癌治疗药物,甚至可以被改造成指导性的“微型机器人”用于药物传递。
总的来说,这一领域的发展为癌症患者提供了新的治疗选择和希望,但同时也需要谨慎评估和监测,确保安全性和有效性。
肠道微生物群对于开发新的抗癌策略的重要性和潜力值得强调,并且有必要探索一种将微生物调节疗法纳入当前癌症管理的整体方法系统。未来我们有望实现更加精准和个性化的肠道菌群调节策略,为癌症治疗带来更大的突破和进展。
主要参考文献
Thomas AM, Fidelle M, Routy B, Kroemer G, Wargo JA, Segata N, Zitvogel L. Gut OncoMicrobiome Signatures (GOMS) as next-generation biomarkers for cancer immunotherapy. Nat Rev Clin Oncol. 2023 Sep;20(9):583-603.
Fernandes MR, Aggarwal P, Costa RGF, Cole AM, Trinchieri G. Targeting the gut microbiota for cancer therapy. Nat Rev Cancer. 2022 Dec;22(12):703-722.
Lee KA, Thomas AM, Bolte LA, Björk JR, de Ruijter LK, Armanini F, Asnicar F, Blanco-Miguez A, Board R, Segata N et al., Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma. Nat Med. 2022 Mar;28(3):535-544.
Zhao LY, Mei JX, Yu G, Lei L, Zhang WH, Liu K, Chen XL, Kołat D, Yang K, Hu JK. Role of the gut microbiota in anticancer therapy: from molecular mechanisms to clinical applications. Signal Transduct Target Ther. 2023 May 13;8(1):201.
Liu L, Shah K. The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm: A Review. JAMA Oncol. 2022 Jul 1;8(7):1059-1067.
McCulloch JA, Davar D, Rodrigues RR, Badger JH, Fang JR, Cole AM, Balaji AK, Vetizou M, Prescott SM, Fernandes MR, Costa RGF, Yuan W, Salcedo R, Bahadiroglu E, Roy S, DeBlasio RN, Morrison RM, Chauvin JM, Ding Q, Zidi B, Lowin A, Chakka S, Gao W, Pagliano O, Ernst SJ, Rose A, Newman NK, Morgun A, Zarour HM, Trinchieri G, Dzutsev AK. Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1. Nat Med. 2022 Mar;28(3):545-556.
Guillot N, Roméo B, Manesh SS, Milano G, Brest P, Zitvogel L, Hofman P, Mograbi B. Manipulating the gut and tumor microbiota for immune checkpoint inhibitor therapy: from dream to reality. Trends Mol Med. 2023 Nov;29(11):897-911.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康

Alistipes是拟杆菌门的一种革兰氏阴性细菌,也是相对新的细菌属,主要从医学临床样本中分离出来。该菌的生态失调,可能是有益的也可能是有害的。
Alistipes可能对某些疾病有保护作用,包括肝纤维化、癌症免疫治疗和心血管疾病。相比之下,其他研究表明Alistipes在结直肠癌中具有致病性,并且与抑郁症有关。
该菌避开富含植物性食物的饮食,可以在高脂肪饮食中茁壮成长,并且在肥胖患者的肠道微生物群中生长得特别好,表明与肥胖相关。
Alistipes 是拟杆菌门中的一个属,革兰氏阴性,专性厌氧,是肠道共生的细菌,G+C 含量为55–58%,直径为 0.2–0.9 µm,长度为 0.5–4 µm 的直或略微弯曲的棒状,末端为圆形。不会形成孢子。细胞通常单独或成对出现,偶尔以较长的细丝出现。
不运动,可产生吲哚。不能还原硝酸盐,不水解精氨酸和尿素,葡萄糖代谢终产物是琥珀酸和少量的乙酸,丙酸。
microbiomology
在分类学上,Alistipes 是在 2003 年在患有阑尾炎的儿童的组织样本中发现后描述的一个属。第一个被发现的Alistipes物种是Alistipes Finegoldii,它是以美国厌氧细菌学和传染病临床研究学家Sydney M. Finegold 的名字命名,极大地促进了我们对厌氧菌的理解。
根据NCBI分类数据库,目前Alistipes由13个物种组成:
2017 年从肠易激综合征患者的结肠中分离出来一种名为Tidjanibacter massiliensis Marseille-P3084 的新物种,与A. putredinis具有 92.1% 的序列同源性,不过该菌株尚未被官方认可或存放在公共菌株生物储存库中。
此外,三个较新的亚种:
从生态学角度来看,Alistipes主要存在于健康人的肠道中。然而,Alistipes也从其他液体中分离出来、如尿液、阑尾、腹部、直肠周围和脑脓肿中分离出来,突出了它们在人类疾病中潜在的机会致病作用。
A. putredinis(ATCC 29800 T型菌株)已从各种标本中分离出来,例如粪便、急性阑尾炎患者的阑尾组织、腹部和直肠脓肿、甚至农场土壤。该菌株对克林霉素、头孢西丁、氯霉素、红霉素和甲硝唑敏感,对四环素和强力霉素有中度耐药。
Alistipes finegoldii 已被认为是肉鸡的生长促进剂,并且已观察到在人类中,A. putredinis随着十字花科蔬菜摄入量的增加而增加,因此可以合理假设不同的Alistipes物种在营养和健康方面可能具有不同的作用。
A. onderdonkii和 A. shahii 分别从腹部脓肿和阑尾组织以及尿液中分离出来。它们具有圆形菌落。这两个种都对 20% 的胆汁具有抗性,并将色氨酸水解为吲哚。它们是过氧化氢酶、氮还原酶和脲酶阴性。琥珀酸是主要的代谢终产物,少量产生乙酸和丙酸。
其他两个种,A. senegalensis 和 A. timonensis 最初是从健康患者的粪便菌群中分离出来的。它们有圆形菌落并产生色素,可以将色氨酸水解为吲哚。A. senegalensis会发酵甘露糖,而A. timonensis 不会。这些细菌菌株对青霉素、阿莫西林加克拉维酸、亚胺培南和克林霉素敏感。此外,A. senegalensis菌株对甲硝唑耐药,A. timonensis 菌株对甲硝唑敏感。
Alistipes inops从人类粪便中分离出物种。它对吲哚产生呈阳性,对过氧化氢酶、硝酸还原酶和脲酶呈阴性。这种细菌是非发酵的,主要代谢终产物是琥珀酸和乙酸。
A. megaguti (Marseille-P5997 T型菌株)是从一名年轻健康女性的新鲜粪便样本中分离出来的。
A. megaguti是过氧化氢酶、脲酶和氧化酶阴性。
A. provencensis (Marseille-P2431 T型菌株) 分离自一名患有高血压和糖尿病的男性患者。该种属氧化酶和脲酶阴性,而过氧化氢酶阳性。
A.ihumii 已从患有神经性厌食症的患者的粪便中分离出来,而A.obesi则从患有病态肥胖症的患者中分离出来。
该菌属大部分耐胆汁,因此,有必要确定对胆汁酸的抗性是否确实决定了Alistipes胃肠道内的区域性富集,或临床上以胆汁改变为特征的疾病,其与Alistipes菌的关系。
肝病和短链脂肪酸中的 Alistipes
肝细胞癌 (HCC) 是全球第二大致命癌症。HCC 通常是由肝硬化、非酒精性脂肪肝病 (NAFLD) 或非酒精性脂肪性肝炎 (NASH) 引起的晚期肝纤维化发展而来的。这些肝脏疾病与“微生物-肝轴”有关,表明生态失调是潜在原因之一。
肝纤维化中Alistipes减少
在对微生物群组成和肝纤维化进行的研究中可以看出,在纤维化的整个进展过程中,Alistipes减少。
例如,在代偿性和失代偿性肝硬化 (LC) 患者中,来自健康志愿者和各种类型 LC 患者的新鲜粪便宏基因组序列表明,与健康对照组相比,A. shahii和A. putredinis菌减少。
针对 LC 患者粪便和活检的研究中,与 LC 患者相比,健康对照患者的Alistipes丰度增加。
代偿发展到失代偿,Alistipes减少
随着疾病从代偿发展到失代偿,观察到Alistipes indistinctus 的减少。一旦个体出现失代偿性肝硬化,患者就会开始产生多种严重并发症,例如肝性脑病。
另一项研究表明,在比较失代偿性肝硬化和急性肝性脑病患者的粪便微生物群时,Alistipes具有保护作用,其丰度的降低与肝性脑病复发的增加相关。因此,Alistipes的减少与肝硬化进展为失代偿状态有关。
NASH 和 NAFLD中 Alistipes 降低
在NASH 和 NAFLD 等其他纤维化疾病中可以看到肝纤维化患者的Alistipes丰度降低。有实质性纤维化的 NAFLD 患者粪便中乙酸盐和丙酸盐浓度降低,丁酸盐浓度无显着差异。当将健康对照与 NASH 患者进行比较时,A. finegoldii 显着减少,标准化计数平均值从 542 减少到 19。在具有显着纤维化的 NAFLD 患者中,观察到 A. onderdonkii 的显着减少从 285 到 31。
Alistipes生产短链脂肪酸
值得注意的是,这些晚期纤维化患者的粪便乙酸盐和丙酸盐水平降低。
Alistipes是一种丙酸生产者,表达甲基丙二酰辅酶A差向异构酶,其中该酶的基因位于具有乙酰辅酶A羧化酶基因的操纵子上。
此外,Alistipes是乙酸盐生产者,由于先前的研究表明短链脂肪酸具有抗炎机制,因此可以表明Alistipes 减少促使短链脂肪酸减少,可能加剧这些 NAFLD 患者中的晚期纤维化。
心血管疾病、高血压和上皮中的 Alistipes
心血管疾病 (CVD) 是发展中国家和发达国家死亡和发病的主要原因。随着全球人口老龄化,预计心血管疾病在未来会上升,因此对与肠道微生物群关系的评估进行了更广泛的研究。
Alistipes与高血压等心血管疾病风险因素以及心房颤动 (AF)、充血性心力衰竭 (CHF) 和动脉粥样硬化性心血管疾病 (ACVD) 等多种心血管疾病相关。
各种研究表明,Alistipes在心血管疾病中起保护作用。
心房颤动患者Alistipes减少
Alistipes与心房颤动 (AF) 等心血管疾病直接相关。心房颤动是最常见的心律失常,在高血压、心力衰竭和肥胖患者中普遍存在。
为了量化肠道微生物组和心房颤动之间的关系,对来自中国参与者的 100 个粪便样本全基因组鸟枪序列进行分析,显示在心房颤动患者肠道中Alistipes急剧减少。
Alistipes和链球菌的拮抗作用
然而,研究中提出在心房颤动期间急剧增加的细菌,如链球菌,可能是导致Alistipes下降的原因,这表明Alistipes和链球菌之间存在潜在的拮抗作用。这种趋势在其他心脏病中很常见,例如 ACVD和 CHF。
但是Alistipes在心血管疾病中证据是矛盾的,尚不清楚关联是保护性的、有益的还是致病的。因为大多数心血管疾病具有共同的病理生理特征,例如内皮功能障碍 ,Alistipes的作用可能取决于多个心血管疾病共享的疾病机制。因此,更多关于肠心轴的研究可能会导致未来对微生物组相关疾病和潜在疗法的理解。
高血压中Alistipes有助于炎症和上皮细胞的改变
宏基因组分析研究了 22 名高血压患者和 18 名对照患者的粪便样本。数据显示A. finegoldii和A. indistinctus的增加与收缩压呈正相关,表明该物种是高血压患者肠道屏障功能障碍和炎症的潜在驱动因素,但是该研究样本量较少,证据力度不大。
肠道炎症和结直肠癌中不一样的 Alistipes
由于胃肠道中微生物群的多样性,菌群失调与炎症性肠病(IBD)之间存在很强的相关性。
人群中最常见的炎症性肠病是克罗恩病 (CD) 和溃疡性结肠炎 (UC)。溃疡性结肠炎是一种主要针对结肠的慢性炎症性疾病。有人提出A. Finegoldii是一种针对结肠炎的保护性物种,因为A. Finegoldii在患有结肠炎的小鼠中减少。
基于这个事实,进行了一项研究,其中微生物群耗竭的小鼠用口服 DSS 治疗以诱发结肠炎。当用 A. finegoldii 灌胃时,结肠炎的严重程度与野生小鼠相似。当给患上结肠炎小鼠添加了A. finegoldii和 Bacteroides Eggerthii (一种结肠炎诱导细菌)时,与单独添加B. Eggerthii 或添加其他细菌(如Parabacteroides distasonis或Prevotella falsenii)的小鼠相比,结肠炎的严重程度显着降低,这进一步表明A. Finegoldii是一种减轻结肠炎的细菌。
具有对比临床意义的是,已从严重克罗恩病的肠壁海绵状瘘管 (CavFT) 微病变中分离出与其他拟杆菌有关的 A. finegoldii. 对自发性克罗恩病回肠炎小鼠模型粪便样本的宏基因组研究显示,与亲代 AKR/J 小鼠群体相比,Alistipes 富集。
8 周龄 NOD2 敲除小鼠富含Alistipes、抗炎细胞因子(TGF-β 和 IL-10)和 CD4 + LAP + FoxP3 –调节性 T 细胞。这些观察结果的一个可能联系来自对姜黄素的研究,姜黄素是一种已被证明可通过 IL-10增加 CD4 + LAP + FoxP3 -细胞来调节肠道炎症的香料。
有趣的是,有炎症的患者服用益生菌后,Alistipes增加了。迄今为止,尚不清楚该属与肠道中的其他微生物(包括食物和益生菌菌株)之间存在哪些相互作用机制。
诱发结直肠癌
已发现Alistipes作为潜在的病原体可能会诱发结直肠癌。A. Finegoldii 通过 IL-6/STAT 3 途径促进右侧结直肠癌。报告指出Alistipes能产生磺脂,已知磺脂类药物可作为血管性血友病因子受体的拮抗剂并抑制肿瘤坏死因子-α (TNF-a),这些物质与微炎症和血管内皮功能障碍有关。
Lipocalin 2 (LCN 2) 是一种与铁载体结合的抗微生物蛋白,最终会降低铁的利用率。
在 IBD 患者中,LCN 2 在黏膜和粪便样本中的浓度很高。从本质上讲,这可以减少Alistipes的繁殖,因为铁是A. finegoldii 生长的调节因子。
小鼠研究表明A. finegoldii在 WT、LCN 2 KO 和 IL-10 KO C57BL/6J 小鼠中口服给药 1 周后引起肠道炎症。因此,该论文得出结论,Alistipes在缺乏 LCN 2 并促进炎症和肿瘤形成的发炎环境中茁壮成长。此外,他们发现在盲肠中发现Alistipes finegoldii的丰度高于大肠内的其他位置。
癌症免疫疗法中的Alistipes
该属已被证明可以通过调节肿瘤微环境在癌症免疫治疗中发挥有益作用。癌症的主要标志之一是逃避免疫系统。因此,一种形式的抗癌治疗是操纵肿瘤微环境。
免疫疗法的一个例子是通过诱导肿瘤相关骨髓细胞产生肿瘤坏死因子 (TNF) 来操纵微环境,最终导致肿瘤根除。
一种方法是使用肿瘤内 CpG-寡脱氧核苷酸 (ODN) 的组合来激活 TLR9 和抑制性 IL-10R 抗体。这种免疫疗法通常会阻止肿瘤生长并通过肿瘤相关的骨髓细胞诱导肿瘤坏死因子依赖性出血性坏死,从而导致肿瘤抑制。
免疫疗法效果依赖微生物群的存在
由于 TNF 产生减少,抗生素导致肿瘤根除效率降低。然后,研究人员怀疑这是否取决于肠道中的细菌负荷。因此,具有 MC38 肿瘤的无菌 (GF) 小鼠接受了抗 IL-10R/CpG-ODN 治疗。与无特定病原体 (SPF) 小鼠相比,经处理的 GF 小鼠产生的 TNF 量显着降低。
这表明肿瘤相关的先天性骨髓细胞由微生物群引发,以响应抗 IL-10R/CpG-ODN 产生炎性细胞因子,并且抗生素治疗或无菌状态导致的细菌负荷减少会降低这种反应,并且TNF依赖的早期肿瘤坏死。
为了更好地了解抗生素的作用和肠道微生物群的作用,用 LPS 灌胃 MC38 荷瘤小鼠并重建 TNF 表达。Alistipes属和 TLR4 引发/TNF 产生的作用,两者之间存在正相关。
TNF 恢复是由于促炎性革兰氏阴性菌A. shahii与 TLR4 结合,启动 TNF 产生表达的作用。
为了进一步证明他们的假设,作者随后显示了抗生素治疗后A. shahii恢复的延迟,这也与抗生素给药后约 4 周的 TNF 恢复阶段平行。
此外,他们表明,当用抗生素预处理并用A. shahii灌胃的小鼠时,与肿瘤相关的骨髓细胞产生 TNF 的功能得到恢复。临床相关,该研究表明,当Alistipes减少,对癌症免疫疗法的最佳反应平行减少 。陆续其他人也确定了Alistipes在癌症免疫治疗中的作用。
精神健康中的 Alistipes
虽然Alistipes常见于肠道,但它已被证明对定位于肠道外的疾病有显着影响,例如抑郁症、焦虑症、慢性疲劳综合征、自闭症、肝硬化和衰老。肠道内的生态失调会影响肠脑轴,并用于解释肠道微生物群、抑郁症和其他情绪障碍(如焦虑)之间的关系。
抑郁患者中Alistipes增加
与健康对照组相比,重度抑郁症患者的粪便中肠杆菌科和Alistipes水平升高,粪杆菌水平降低。Alistipes属吲哚阳性,影响血清素前体色氨酸,而Faecalibacterium具有抗炎特性。
在一项对 BALB/c 小鼠进行的研究中,该小鼠置于压力环境中,Alistipes丰度显着增加。此外,还发现挪威患有慢性疲劳综合症的患者的Alistipes浓度增加了近 4 倍。这些发现与抑郁症患者Alistipes增加的证据相关,因为抑郁症患者通常与疲劳和压力作斗争 。
Aistipes丰度的增加可能与GABA增加有关
研究指出,Alistipes的增加扰乱了肠-脑轴,因为Alistipes是一种吲哚阳性生物体,因此会降低血清素的可用性。色氨酸是血清素的前体,血清素的减少与抑郁症有关。此外,Alistipes已被证明可表达谷氨酸脱羧酶,这是一种在鸡体内将谷氨酸代谢为 γ-氨基丁酸 (GABA) 的酶。因此Alistipes丰度的增加也可能与 GABA 的增加有关。然而,应该进行研究以证明 GABA 是否被分泌到肠腔中。
自闭症患者中Alistipes研究不一致
此外,自闭症谱系障碍患者的大脑和肠道之间存在关联。研究发现自闭症谱系障碍患者的Alistipes减少。然而,另一项针对不同形式的自闭症 PDD-NOS 的研究表明,儿童中存在大量Alistipes。据推测,这可能来自丙酸的产生,丙酸已被证明对大鼠具有神经生物学作用。需要对Alistipes进行更多研究及其对肠脑轴的影响,因为关于其在两个系统中的保护/致病作用存在矛盾的证据。
磺胺类和生化标志物
Alistipes是一种细菌,具有许多与上述疾病相关的免疫和生化途径。一个重要的意义是Alistipes通过 IL-6/STAT 3 途径促进结直肠癌。
因此,未来的研究可以考虑使用Alistipes物种作为结直肠癌的潜在生物标志物,利用我们基于微生物组 DNA 数据的理解以及对疾病发病机制的生化概念的整合。
实现这一目标的一种潜在方法是寻找磺基脂,这是一类独特的鞘脂,在鞘氨醇碱基中具有磺酸基团。
Alistipes产生磺基脂
研究表明,当 C57BL/6N 小鼠喂食含有红花油或猪油脂肪的高脂肪饮食 3 周时,与喂食正常食物的小鼠相比,磺胺脂以及体重都会增加。进行了宏基因组分析并筛选了这些小鼠盲肠中参与磺胺脂生物合成的细菌基因。发现除A. inops外的所有Alistipes物种都产生磺基脂(关于最新物种 A. megaguti、A.provencensis和磺基脂生产的信息仍然未知)。
为了进一步证明磺基脂是细菌的产物和Alistipes的标志物,科学家们对带有Alistipes的无菌 (GF) 小鼠进行了单定殖研究并检测到单定殖小鼠盲肠中明显出现了以前在无菌小鼠中不存在的磺基脂。
因此,由于结直肠癌的常见风险因素是高脂肪饮食、肥胖和年龄,除了这些结肠疾病中Alistipes的丰度增加外,还有一个有趣的提议是使用磺基脂类作为结直肠癌患者风险的标志物。此外,应进行研究以验证Alistipes丰度是否在息肉中增加,癌前与癌性,息肉是结直肠癌的另一个危险因素。
有害代谢产物与结直肠癌相关
此外,Alistipes在共生细菌中具有最多的腐败途径。腐败是肠道微生物群在胃肠道中发酵未消化的蛋白质,通常会导致细菌产生有害代谢物。据报道,这些产物有害并与结直肠癌相关。此类产品包括氨、H2S、甲酚、吲哚和苯酚。
在一项旨在确定肠道细菌使用的主要腐败途径的研究中,发现Alistipes有助于组氨酸降解/四氢呋喃产生、吲哚产生和苯酚产生。已发现组氨酸降解/THF 产生会释放过量的氨,当吸收时会损害结肠细胞。还发现氨会增加肠细胞增殖并有助于结直肠癌中癌细胞的生长。当患者有结直肠癌风险时,发现过量氨和其他Alistipes产生的腐败产物可能对临床医生有用。
Alistipes是一种从临床样本中分离出来的相对较新的细菌属,尽管与拟杆菌门中的其他细菌相比,其分离率较低。全基因组蛋白质系统发育分析表明,与拟杆菌门中的其他成员相比,该属可能具有独特的功能特性。
一般,超过一定量的Alistipes在临床和临床前研究中已被认为是导致疾病的原因。有趣的是,其他研究表明它们的存在与促进健康表型相关,例如Alistipes在结肠炎、自闭症谱系障碍以及各种肝脏和心血管纤维化疾病等疾病中的保护作用。
尽管Alistipes在健康表型中发挥作用,但与之形成鲜明对比的是,Alistipes在焦虑、肌痛性脑脊髓炎/慢性疲劳综合征、抑郁症、PDD-NOS 和 CRC 等疾病中具有致病作用。
根据相关研究的结论,该属可能在疾病的调节中起主导作用,或者可能只是具有辅助作用或共同诱导作用。将进一步需要动物研究来破译其复杂多模式疾病机制,以及亚型表型的有针对性研究。
使用无菌动物和模型将有助于了解该属在疾病和健康中的作用以及与宿主免疫防御耐受性的相互作用,例如应该有研究调查Alistipes及其生产的 SCFAs 的作用对各种肝病的影响和Alistipes对T细胞分化的直接作用。
主要参考文献
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917