 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


写在前面
《基于肠道菌群思考饮食》
所谓“病从口入”,饮食是人类健康的核心。
有没有发现这样一种现象?我们的日常饮食正在向西式饮食过渡,与此同时,各类慢性病正日渐侵蚀。
近期在《CELL》子刊上接连发表了好几篇关于肠道菌群和健康饮食以及疾病的发生等循证科研研究和综述,谷禾长期的肠道菌群检测实践中也发现各种干预措施和用药治疗均需要考虑饮食营养的部分,结合肠道菌群的干预将起到更有效更长期的效果,例如炎症性肠病患者干预治疗期间,需要结合营养调整或补充来重塑肠道菌群和免疫平衡。
一系列严格的前瞻性队列研究和随机对照试验为健康饮食的特征提供了有力的验证:
蔬菜和水果、全谷物带来益处,加工食品带来有害影响。
然而,仍然存在许多争议,大家可能对“健康饮食”这个概念停留在模糊层面,依然存在许多困惑例如:


本文我们试着从微生物组科学的角度,讨论基于食物的饮食指南和健康饮食的各个方面,尽可能将我们已了解的科学知识融入其中,当然讨论仅限于针对普通人群的健康促进和疾病预防建议,这也是基于肠道菌群和食物营养的饮食推荐的目的。
以食物为基础的饮食指南提供了关于食物、食物组分和饮食模式的建议,以实现营养素的参考摄入量,预防慢性病,并维持普通人群的整体健康。
下表显示了过去10年中更新的国外基于食品的饮食指南的关键信息的非详尽概述,这些指南分为最常见和补充食品组:蔬菜和水果、谷物制品、乳制品、肉类和肉类替代品和加工食品。
非详尽的国家以食物为基础的膳食指南清单和一般成年人的食物组推荐摄入量



doi.org/10.1016/j.chom.2022.04.016
2022年4月26日,《中国居民膳食指南(2022)》发布,提出了平衡膳食八准则:
不同的饮食文化国家的指导原则,有很强的一致性,所有指南都在告诉我们:
建议限制或避免添加高糖、高盐和高饱和脂肪的食品,一些国家特别提到避免加工、超加工和/或包装食品。
一半以上的饮食应包括蔬菜、水果和谷物产品,全谷物优先于精制谷物。这些饮食需要补充少量的动物性蛋白质(鱼类、瘦肉、家禽、鸡蛋和乳制品)和/或植物性蛋白质(豆类、坚果)。
下面,我们在微生物组的背景下讨论饮食指南,重点是人类研究,尽管存在局限性(例如,大剂量给药和向人类转化),但动物模型在建立分子机制和因果关系方面存在优势。
在所有饮食指南中:
✔建议食用蔬菜、水果、全谷类、豆类和坚果等全植物食品
✖ 应限制摄入添加糖、盐或饱和脂肪的加工食品
膳食纤维
全植物食品是膳食纤维的唯一相关天然来源,膳食纤维是一种难以消化的碳水化合物聚合物,在化学成分、物理化学性质和生理效应方面有很大的不同。
与肠道微生物群特别相关的是可发酵纤维,也称为微生物群可获得碳水化合物(MAC),如果它们显示出与对微生物群的选择性影响相关的既定健康益处,则为益生元。
纤维为抑制粘液聚糖代谢的微生物提供生长基质,防止肠道粘液耗尽、细菌侵入粘液层、下游炎症和感染。
纤维发酵的主要最终产物是短链脂肪酸 (SCFA),即乙酸盐、丙酸盐和丁酸盐,它们会引起多种生理效应。
这些影响包括:
高纤维饮食可降低心脏病发作、中风和心血管疾病的风险。
近期,一项纵向、随机、交叉设计主要研究两种流行的纯化纤维,阿拉伯木聚糖 (AX) 和长链菊粉 (LCI),结果发表在《CELL Host & Microbe》.
该研究显示了单个纯化纤维对微生物组的影响,深入了解了纤维补充剂的影响以及纤维诱导的胆固醇降低背后的机制。
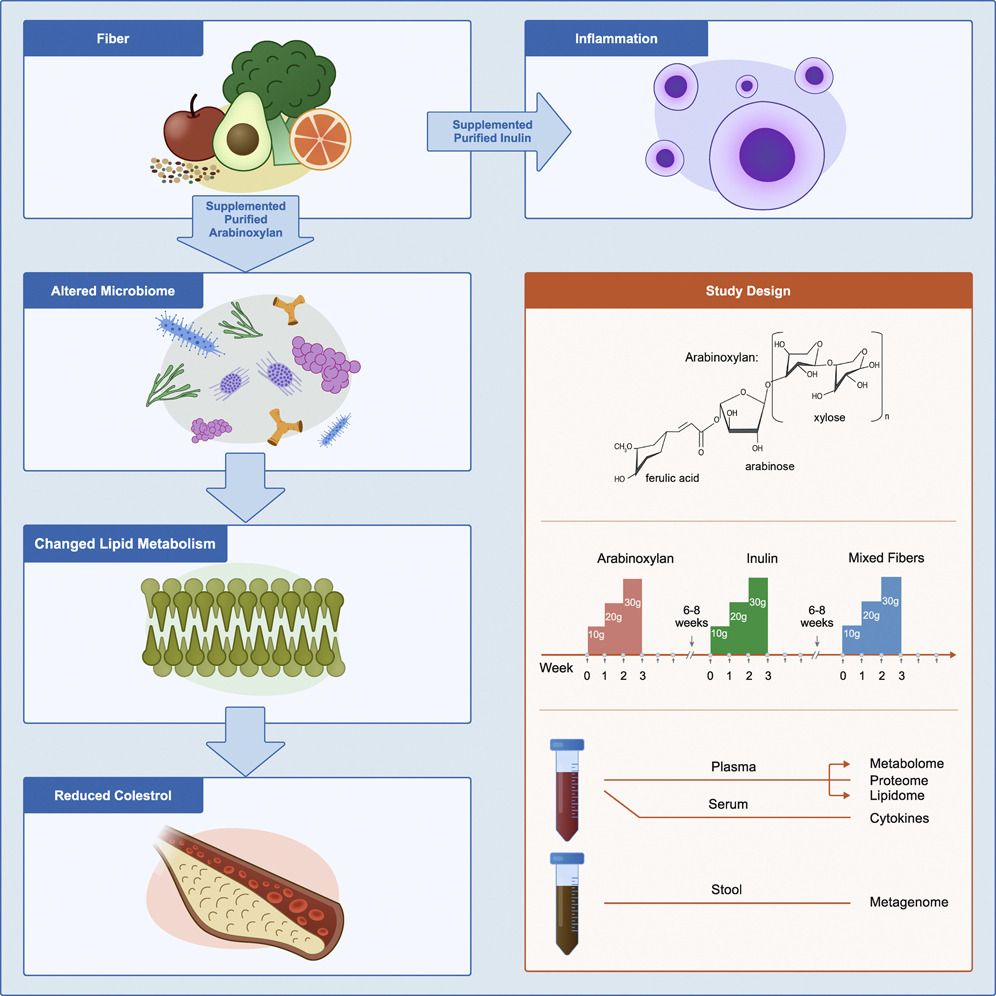
doi.org/10.1016/j.chom.2022.03.036
结果表明 ↓↓↓
阿拉伯木聚糖:
长链菊粉:
总的来说,每一种纤维都可引起个体化和纤维特异性的生化和微生物群反应,因此,膳食纤维对健康的益处因人而异,可能还取决于具体摄入的纤维类型和摄入剂量。
植物化学物质
全植物食品的另一个关键成分是植物化学物质,它们是非营养和生物活性化合物,通常与膳食纤维结合,赋予植物颜色、风味、气味和涩味。
大多数 (90%–95%) 的植物化学物质不会被小肠吸收,因此会与肠道微生物群进行双向相互作用。
肠道微生物负责通过去甲基化、开环和脱羟基等过程对植物化学物质进行生物转化,从而增加它们的生物利用度、吸收以及抗氧化和免疫调节作用。
全植物食品对肠道微生物群的影响及对宿主生理、免疫、代谢和疾病风险的影响
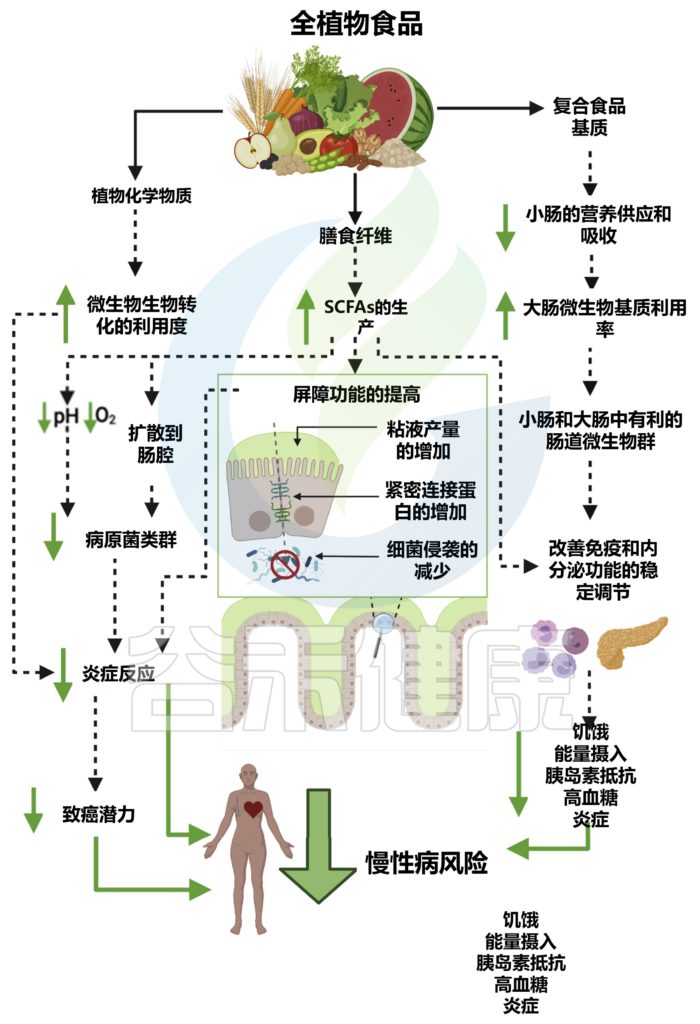
doi.org/10.1016/j.chom.2022.04.016
尽管全植物食品具有有益的效果,但工业化国家的全植物食品消费量始终低于建议的水平,而包装食品经过不同程度的加工。
根据NOVA食品分类工具,食品加工程度是饮食质量的主要驱动因素,加工程度最高的食品被归类为“超加工食品”。其有害影响(增加能量摄入和体重增加)已在严格控制喂养研究中得到实验验证。然而,超加工食品的定义或此类食品的示例几乎没有一致性,关于避免所有超加工食品而不考虑其个别营养属性的全面建议存在争议。
加工食品如何带来不利影响?
加工食品的功能特性与全植物食品有着根本的不同。加工食品通常具有较高的能量密度,并且缺乏植物细胞中存在的三维结构。因此,营养素主要是无细胞的(即不包含在细胞内),更容易被宿主消化,这增加了营养素吸收动力学。
这些容易发酵的营养素可能会促使小肠中的细菌过度生长,以及不利的微生物组成和代谢状况,从而对免疫和内分泌功能产生负面影响,而结肠微生物群无法获得这些营养素。
例如,高果糖玉米糖浆已被证明会导致小鼠脂肪肝和葡萄糖不耐受,其方式与肠道微生物群组成和功能变化有关。
加工食品:食品添加剂影响菌群
加工食品中的食品添加剂,可以进一步提高口感和保质期,但是会影响肠道微生物群。
合成乳化剂羧甲基纤维素(CMC)和聚山梨酯-80损害肠道屏障功能,导致微生物群侵占上皮,促进野生型小鼠的代谢异常和轻度炎症,以及遗传易感小鼠的结肠炎,其方式与肠道微生物群有因果关系。
在另一种乳化剂甘油单月桂酸盐的小鼠中也观察到类似的结果。人类短期食用CMC也会显著改变微生物群组成,降低粪便短链脂肪酸水平,并诱导细菌侵入粘液层。
加工食品中的高盐含量也可能改变微生物群。盐的摄入降低了乳酸菌的丰度,这与小鼠小肠固有层淋巴细胞和人类外周血淋巴细胞中辅助性T细胞17的数量增加以及血压升高有关。
另一项针对小鼠的研究报告了类似的结果,其中高盐饮食降低了乳酸菌的丰度,增加了促炎基因的表达,并加剧了两种不同疾病模型中的结肠炎。
因此,现有证据表明,加工食品和全植物食品对人类健康的对比效应部分是由肠道微生物组介导的。
加工食品对肠道微生物群的影响及对宿主生理、免疫、代谢和疾病风险的影响
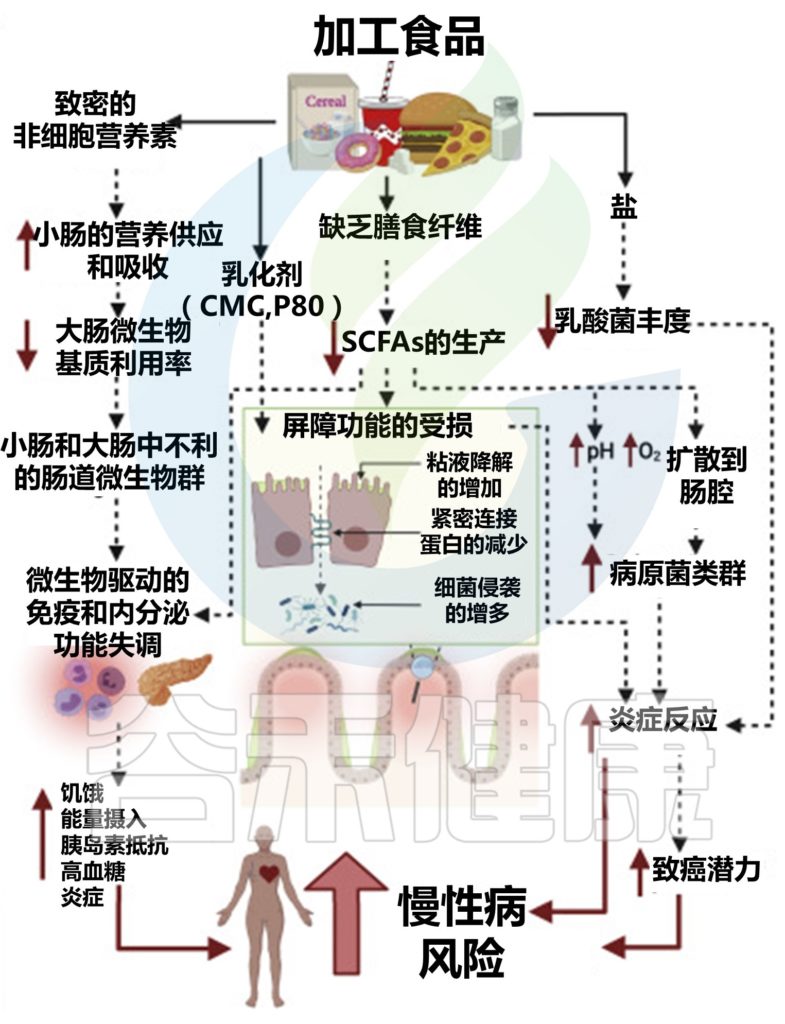
doi.org/10.1016/j.chom.2022.04.016
更多关于食品添加剂与菌群详见之前的文章:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
根据饮食指南,健康饮食的最大组成部分应该是蔬菜和水果。目前关于蔬菜水果预防多种慢性病的能力的科学证据十分有力。
▸蔬菜水果富含膳食纤维
水果和蔬菜每份可提供高达 8g 的膳食纤维,并含有多种纤维,包括果胶、菊糖、纤维素、木聚糖、棉子糖和水苏糖。这些纤维引发微生物组独立(例如延迟的大量营养素吸收)和微生物组依赖(例如短链脂肪酸介导的胰岛素抵抗衰减)生理效应。
人类对照喂养实验发现,富含菊糖的蔬菜可提高双歧杆菌水平,促进饱腹感,并减轻体重。
在喂食高脂肪饮食的小鼠中,抗生素治疗降低了菊糖的代谢益处,比如降低这些益处:在小肠中诱导肠促胰岛素激素胰高血糖素样肽1和对代谢综合征的保护,这表明微生物群的因果作用。
▸蔬菜和水果也是植物化学物质的重要来源
包括多酚、硫代葡萄糖苷、萜类、植物甾醇和生物碱。
蔓越莓提取物是一种多酚类物质的丰富来源,在高脂高糖饮食的小鼠中诱导代谢改善(例如,减少内脏肥胖和改善胰岛素敏感性),这与 Akkermansia muciniphila的增加有关。
注:Akkermansia muciniphila菌在动物和人类中都显示出有益生理效应。关于该菌详见之前文章:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
Nature | AKK菌——下一代有益菌
从临床研究和临床前研究中,也有新的证据表明微生物组在西兰花的生理效应中发挥作用。后者为西兰花衍生的硫代葡萄糖苷生物活性转化为化学预防性异硫氰酸酯奠定了拟杆菌的遗传和生化基础。
总的来说,现有证据支持肠道微生物群在调解蔬菜和水果对健康的影响方面的作用。
食物对宿主-微生物相互作用的影响以及它们如何与膳食指南中的建议保持一致

doi.org/10.1016/j.chom.2022.04.016
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
大多数饮食指南建议食用全谷物而非精制谷物。全谷物的麸皮层被去除以生产精制谷物,含有植物化学物质(如阿魏酸、类黄酮)和膳食纤维。
▸ 全谷物含有独特纤维,抗炎作用与菌群相关
全谷物含有独特的半纤维素纤维,如木聚糖和β-(1→ 3,1 → 4)—除纤维素、抗性淀粉和低聚糖外,还有葡聚糖。全谷物能够降低慢性病风险的证据基础是令人信服的。人类干预试验表明,全谷物的抗炎作用与肠道微生物群的变化是并行的。
在健康成年人中,显示了对健康有益微生物的富集,如双歧杆菌和产丁酸菌(直肠真杆菌Eubacterium rectale、Roseburia faecis, Roseburia intestinalis),产短链脂肪酸菌Lachnospira增多,粪便乙酸盐和总短链脂肪酸增加,肠杆菌科减少。
虽然微生物组的变化为抗炎作用提供了潜在的解释,但这些研究之间并不一致;进一步的研究报告没有任何影响,也没有确定因果关系。
▸ 全谷物的部分代谢益处是由肠道菌群介导的
将人类研究与小鼠实验相结合的研究表明,微生物组对全谷物的健康影响具有因果关系。
食用大麦仁面包的人被分为“响应者”和“无响应者”,“响应者”的葡萄糖代谢因干预而得到改善。
响应者普氏菌/拟杆菌属比率和Prevotella copri丰度升高,以及编码复杂多糖降解的微生物基因在应答者中升高。
关于Prevotella copri菌详见:肠道重要基石菌属——普雷沃氏菌属 Prevotella
无菌小鼠灌胃普氏杆菌或含有P.copri的“应答者”人源性微生物群后,喂食标准食物后,葡萄糖耐量有所改善,这在机制上与肝糖原储存增加有关。
进一步的研究证实,在基线时含有高水平的普雷沃氏菌,会导致体重过重,且食用富含全谷物的饮食的个体的体重减轻。
一些饮食指南(加拿大的食品指南、巴西人口的饮食指南和英国的Eatwell指南)建议经常食用植物蛋白食品(如豆类、坚果),因为它们对人类健康有益。
豆类
豆类富含纤维,特别是纤维素、果胶、甘露聚糖、水苏糖、棉子糖和抗性淀粉。
豆科植物还含有黄酮醇等植物化学物质,黄酮醇是一种已知的抗炎类黄酮亚类,还含有酚酸,与谷物中的酚酸相比,豆类中酚酸的生物利用率更高。
新出现的证据表明,肠道微生物群在豆科植物的健康影响中发挥着作用。
例如,绿豆补充剂减少了喂食高脂肪饮食的小鼠的体重增加和脂肪积累,但没有减少喂食相同饮食的无菌小鼠的体重增加和脂肪积累。
坚果
坚果是不饱和脂肪酸、纤维和植物化学物质的来源,所有这些都可能影响宿主与微生物的相互作用。
在一项控制喂养研究中,每天补充核桃可增加粪杆菌属(Faecalibacterium)、罗氏菌属(Roseburia)、梭菌(Clostridium)和戴阿利斯特菌(Dialister)。
在一项杏仁对照喂养研究中观察到了类似的成分变化,显示罗氏菌属(Roseburia)、梭菌(Clostridium)、戴阿利斯特菌(Dialister)和毛螺菌属(Lachnospira)的相对丰度增加。
坚果对罗氏菌属丰度的影响也已在meta分析中得到证实。
主要产丁酸菌如Roseburia intestinalis能够将坚果中难以消化的聚糖β-甘露聚糖代谢为丁酸盐。
坚果中的omega-3脂肪酸也可能增强罗氏菌属,因为在人类中,补充核桃的饮食和不含核桃的具有相同脂肪酸组成的饮食都增加了罗氏菌属的相对丰度。
除了坚果中的纤维和不饱和脂肪酸外,肠道微生物还将植物化学物质鞣花单宁和鞣花酸代谢为尿石素,尿石素是一种生物活性抗炎化合物。
总之,增加坚果摄入量似乎在一定程度上通过影响微生物群的功能成分对宿主健康有益。
抗炎看到目前研究将植物性蛋白质食品的益处与微生物组联系起来,但该领域的研究仍处于初步阶段。
植物性蛋白质比动物性蛋白质更不易消化并因此为结肠微生物提供潜在的底物,这可能导致产生有益的生物活性代谢物,例如色氨酸代谢。然而,蛋白水解微生物发酵也可能有害(见下文讨论——红肉和加工肉)。目前尚不清楚植物蛋白微生物发酵产生的代谢结果是否不同于动物蛋白,需要进一步研究。
饮食指南一直鼓励把鱼类作为优质蛋白质来源和良好的脂肪酸组成。
多脂鱼类
多脂鱼类是长链ω-3脂肪酸二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的主要天然膳食来源之一。
观察研究和干预研究的有力证据表明,多脂鱼摄入量的增加具有心脏保护作用,肠道微生物群可能是这些健康影响的潜在中介。
鱼油
小鼠实验表明,与猪油(富含饱和脂肪)相比,鱼油降低了 Toll 样受体激活和白色脂肪组织炎症,这与改善胰岛素敏感性有关。
除了这两种脂肪对微生物群组成的不同影响(猪油增加Bilophila菌)之外,与传统猪油喂养的小鼠相比,喂食鱼油的无菌小鼠和喂食抗生素的小鼠的盲肠微生物群定植后,体重减轻,白色脂肪组织炎症减轻。
这项研究为肠道微生物群在饱和脂肪的炎症作用中的因果作用提供了证据。
尚未在人类身上做出因果推论,但在多脂鱼和其他饮食来源中发现的 omega-3 脂肪酸已被提议作为候选益生元,因为它们被特定的肠道微生物利用。
在一项随机对照试验中,鱼源性 omega-3 补充剂增加了Coprococcus的丰度,与富含甘油三酯的脂蛋白水平呈负相关。
因此,肠道微生物组可能是多不饱和脂肪酸心脏保护作用的介质。
以上各种饮食推荐都接近一种饮食模式,那就是地中海饮食,作为现在十分流行的饮食模式之一,
地中海饮食有什么独特之处?
对菌群有哪些影响?
接下来详细了解一下地中海饮食。
我们逐渐开始有这样一个认识,健康不止是受个别食物的影响,而是受其相互联系和协同效应的影响。因此,最近更新的几项饮食指南,如《中国饮食指南2022》、《2020-2025年美国人饮食指南》、《加拿大食品指南》等对饮食模式的关注发生了转变。
食物之间的相互作用也与它们对肠道微生物群的影响有关,人们对饮食模式,尤其是那些具有既定健康益处的饮食模式(如地中海饮食)如何通过微生物群组成和功能变化影响宿主健康感兴趣。
▸ 地中海饮食结合了许多对宿主微生物相互作用具有有利影响的食物组
地中海饮食推荐蔬菜、水果、全谷类、豆类、坚果和橄榄油作为主食,适度摄入鱼类、家禽、鸡蛋和乳制品,并限制摄入红色和加工肉类及加工食品。
在对体重超标的个体进行的一项随机对照试验中,与对照饮食相比,坚持地中海饮食可降低血浆胆固醇浓度,并增加了产丁酸菌普拉梭菌(F. prausnitzii)和罗氏菌属(Roseburia) 的丰度。F.prausnitzii和Roseburia也是通过随机森林模型确定的分类群,这些模型可以最好地预测饮食依从性得分。
▸ 地中海饮食改善老年人认知
在一项大型多中心随机对照试验中,该试验涉及了连续12个月食用地中海饮食的老年人。这些分类群与认知功能的改善呈正相关,与炎症标志物和虚弱呈负相关。
▸ 地中海饮食降低心肌梗死风险
在一项前瞻性队列研究中,长期坚持地中海饮食与F. prausnitzii, Eubacterium eligens, Bacteroides cellulosilyticus 呈正相关。这项研究进一步表明,与那些携带P.copri的人相比,P.copri丰度较低且坚持地中海饮食的人心肌梗死风险较低。
对地中海饮食的微生物组学研究强调了其在饮食建议中的重要性。最近部分国家更新的饮食指南推荐了类似地中海饮食的饮食模式,如阻止高血压的饮食方法(DASH)饮食,并对微生物组在调节其健康影响中的作用进行了研究。
虽然饮食指南已经演变为反映新的可用证据,并普遍同意其建议,但争议仍然存在。
在这里,我们讨论了宿主-微生物相互作用如何提供洞察力来帮助解决这些争议。
红肉含有必需的微量营养素,是重要的优质蛋白质来源。然而,大多数饮食指南建议只适度食用,同时建议避免食用加工肉类(盐腌、腌制和烟熏的肉类)(表1)。
▸ 红肉和加工肉类引争议?
在癌症预防方面,这些评估由国际癌症研究机构(IARC)和世界癌症研究基金会共同进行。尽管有这些一致的建议,但2019年的一系列系统性审查得出结论,成年人应该继续目前的红肉和加工肉摄入量,理由是它们与不良健康结果的联系的证据不足。这引发了营养领域的争议。
肠道菌群为这场争论提供了另一个视角
肠道微生物对红肉和加工肉类的蛋白水解发酵会导致产生潜在的有害代谢物,例如氨、对甲酚和硫化氢。
▸ 红肉和加工肉→产硫化物菌发酵→可能致癌
硫化氢是由脱硫弧菌等细菌发酵含硫氨基酸产生,并作为粘液溶解剂,可以增加小鼠肠道通透性。
这使得同样存在于红肉和加工肉类中的血红素能够增加肠道中的过度增殖和增生,抑制肿瘤抑制基因,并激活致癌基因,所有这些都是致癌的潜在原因。
抗生素给药抑制了小鼠的这些影响,表明肠道微生物群的因果作用。在人类中,产生硫化物的细菌和途径与晚期结直肠癌密切相关。
▸ 红肉和加工肉→TMAO→心血管疾病
肠道微生物将肉制品中大量存在的左旋肉碱和磷脂酰胆碱转化为三甲胺,三甲胺被含肝黄素的单加氧酶 (FMO) 氧化为三甲胺-N-氧化物 (TMAO)。
TMAO 在血浆中循环并由肾脏有效排泄,并在动物模型中与心血管疾病有因果关系。观察性研究报告了 TMAO 水平与心血管疾病风险之间的强正相关关系。然而,动物实验并不一致,而人类中的 TMAO 水平经常被混淆并可能由肾功能下降引起。
此外,TMAO 范式与将富含 TMAO 及其前体的脂肪鱼与有益的心脏代谢结果联系起来的流行病学发现不一致。
肉类以外的食物(即十字花科蔬菜)可以抑制 FMO3 的活性,使研究结果更加复杂。
为了阐明源自肉类产品的 TMAO 的因果贡献,需要在人类中进行足够持续时间的控制喂养试验,以评估经过验证的心血管疾病的替代标志物。
▸ 加工肉类含有瘦红肉中不存在的其他化合物,这些化合物可能会放大微生物介导的有害影响
大多数加工肉类富含饱和脂肪,可刺激小肠中的肝胆汁酸分泌。
一些初级胆汁酸逃脱肠肝再循环并进入大肠,在那里它们被微生物转化为次级胆汁酸。其中,脱氧胆酸和石胆酸可引起氧化应激和 DNA 损伤,并与结肠癌发生有关。
一项荟萃分析发现,在结直肠癌患者中,肠道微生物组功能特征的特征是次级胆汁酸的产生增加。而一项系统评价表明饱和脂肪会降低微生物的丰富度和多样性。
此外,加工肉类中使用的固化剂硝酸盐和亚硝酸盐构成微生物生物转化为N-亚硝基化合物的底物,它们会导致 DNA 烷基化损伤,因此具有致癌性。
▸ “适度食用瘦肉红肉和避免加工肉” 的科学依据
鉴于上述几点,红肉和加工肉类产生的肠道微生物代谢物的毒性与解释它们对健康的影响有关。
尽管有证据表明红肉是结肠癌的危险因素,但蛋白质发酵产生的代谢物(如硫化氢和氨)毒性较低,目前还没有归类为人类致癌物。
相比之下,仅来自加工肉类的微生物代谢产物(N-亚硝基化合物和次生胆汁酸)具有更高的毒性和致癌性。
考虑到可能的剂量-反应关系,毒理学考虑证明了IARC/世界卫生组织专家小组对红肉(2A组,可能致癌物)和加工肉(1组,致癌物)进行风险分类的合理性,以及当前的饮食指南:适度食用瘦肉红肉和避免加工肉。
▸ 长期存在争议:乳制品应在多大程度上纳入健康饮食?
大多数饮食指南建议使用脱脂和低脂(0%-2%)乳制品,并避免使用高脂乳制品(>25%,如某些奶酪、奶油制品和黄油)。然而,对于全脂乳制品还没有达成共识(∼3.5%),其有害影响受到质疑,一些饮食指南(表1)不鼓励使用。
▸ 乳脂肪和肠道微生物群之间的相互作用
一项开创性的研究表明,乳源性饱和脂肪诱导牛磺酸结合胆汁酸,促进产生硫化氢的致病菌Bilophila wadsworthia的爆发,从而引发遗传易感小鼠的结肠炎。
另一项针对小鼠的研究证实了这些发现,其中主要来源于乳脂的高脂肪饮食增加了B. wadsworthia的丰度和盲肠胆汁酸水平,从而导致肠道屏障功能障碍和代谢综合征。
这些动物模型强调了乳源性饱和脂肪对微生物群动态平衡的潜在有害影响,支持了建议限制高脂肪乳制品的饮食指南。
据我们所知,目前缺乏评估全脂乳制品中饱和脂肪水平是否影响微生物群的良好控制的人类干预试验,此类研究有必要,能为未来的饮食指南提供信息。
“低脂”、“低碳”,这对减肥人士来说,是非常熟悉的。
目前的膳食指南没有涉及到限制脂肪或碳水化合物摄入是否会支持最佳健康。
▸ 这些饮食如何影响微生物群代谢以及对健康的长期影响?
低脂饮食通常富含蔬菜、水果、全谷物和植物蛋白质,因此提供有益的饮食成分,改变微生物代谢。
相反,低碳水化合物饮食通常脂肪和/或蛋白质含量较高,因此纤维含量较低,这导致产生对结肠健康有害的代谢物。
这在一项随机对照试验中得到证实,在该试验中,高蛋白低碳水化合物饮食增加了N-亚硝基化合物的浓度,降低了丁酸盐和抗炎酚类化合物的水平。
在另一项研究中,高脂肪、低碳水化合物饮食导致健康年轻人的肠道微生物群、粪便代谢组学特征和血浆促炎介质发生不利变化。
这些发现引起了人们对低碳水化合物饮食的长期健康结果的担忧,并与前瞻性队列研究的荟萃分析一致,该研究显示,食用动物性低碳水化合物饮食的参与者死亡率最高。
因此,有必要通过针对微生物组的方法改善低碳水化合物饮食。
当代国家饮食指南高度一致,与研究人员对饮食如何影响与健康相关的微生物-宿主相互作用的理解一致。
这种一致性是显著的,证实饮食指南的观察性和干预性研究没有考虑微生物组。这表明肠道微生物群是饮食生理效应的关键中介,鉴于哺乳动物解剖学、生理学、免疫和代谢的中心方面在整个进化过程中都是由饮食-微生物-宿主相互作用形成的,这一功能可能在进化上根深蒂固。
虽然营养学和微生物组学学科之间的一致性在很大程度上验证了当前的饮食指南,但研究人员认为,更系统地结合营养素影响宿主-微生物相互作用的分子基础知识,有可能加强和创新人类营养。
下面概述了微生物组学观点可以推进营养策略的机会,然后提出了一个整合肠道微生物组学的研究框架,以进行实验验证。
对人类及其肠道微生物群共同进化的假设最有说服力的支持来自对母乳低聚糖(HMO)功能特征的解释。母乳构成了饮食、微生物组和人类健康之间进化关系重要性的范例。
现代饮食可能在进化上与人类生理不匹配,这可能是慢性病流行的重要驱动因素。
目前建议女性和男性每天摄入 25 克和 38 克纤维。一系列系统评价和荟萃分析支持了更高摄入量的论点,表明每天摄入超过25–29克的纤维将带来额外的益处。参与者每天从蔬菜、水果和坚果饮食中摄入100克以上的纤维,可以显著降低血清胆固醇水平,增加粪便中的短链脂肪酸。
在一项人体试验中,非裔美国人和南非农村人(分别习惯食用低纤维和高纤维饮食)交换了他们的饮食,导致非裔美国人的黏膜增殖率和结肠炎症(结肠癌风险的生物标志物)下降,而南非农村人在这些试验中经历了不利的变化。
饮食交换的效果与次级胆汁酸丰度和短链脂肪酸生成的相反变化相关。对饮食微生物群相互作用如何影响人类生理学的进化考虑,可以为饮食建议、有针对性的营养策略以及对抗慢性病风险的食品开发提供信息。进化的考虑也为微生物组的恢复策略奠定了基础。
工业化造成了非传染性慢性病的增加和微生物组的枯竭,其特征是微生物多样性减少,利用碳水化合物的酶的能力降低,发酵减少,以及黏液降解生物的富集。
尽管将微生物群恢复到祖先的状态可能是不现实的,也可能是不可取的,但人们对开发微生物群恢复策略、重建与健康相关的功能特征的兴趣越来越大。
全植物食物
这种策略得到了一项人类干预研究结果的支持,该研究测试了富含全植物食物(每天提供45克纤维)的饮食,这会提高短链脂肪酸的产量,并增加聚糖降解碳水化合物活性酶的相对丰度。
仅关注膳食纤维的微生物群落恢复方法不太可能补充丢失的微生物物种。已经提出了重新引入因工业化而丢失的菌群的建议。虽然从长远来看这是一种很有希望的方法,但许多消失物种的致病性未知,这使得它们转化为营养策略具有挑战性。
发酵食品
另一种方法是发酵食品,定义为通过理想的微生物生长和膳食成分的酶转化生产的食品,其结果通常具有增强的营养特性。
发酵食品的例子有开菲尔、酸奶、康普茶、豆豉、泡菜等。发酵食品在当前的饮食趋势中排名很靠前,在全球范围内广受欢迎。如果生吃,发酵食品通常含有大量的活微生物,这些微生物具有长期的安全食用历史。
▸ 关于发酵食品健康益处的研究
发酵食品的益处已通过一项定性系统综述进行了总结,该综述对观察性和实验性研究进行了评估,报告称酸奶、开菲尔和其他发酵牛奶与胃肠道健康、2型糖尿病和癌症风险以及体重管理的良好结果相关。
此外,一项针对120000多名参与者的大型观察性研究发现,体重增加与酸奶摄入量之间存在显著的负相关关系。然而,来自随机对照试验的证据非常稀少,发酵食品才刚刚开始被推荐到饮食指南中。
一项随机对照试验对每天包括6份发酵食品的饮食进行了试验,发现增加了微生物组的多样性,并减少了几种促炎细胞因子和趋化因子。
需要额外的设计良好的随机对照试验,并验证替代终点,以证明将发酵食品纳入饮食建议的合理性。此类研究应考虑到一些发酵食品(如发酵香肠、一些奶酪和加糖酸奶)的有害营养方面,如大量的盐、饱和脂肪、糖和固化剂,可能会超过活微生物的潜在益处。
益生菌、合生元
理论上,也可以通过饮食益生菌和合生元(益生菌和益生元的组合)来实现微生物群落的恢复策略。
有大量研究在许多临床环境中探索这些策略,并提出了不同的机制,例如其免疫调节作用。如果使用人体胃肠道固有的细菌菌株,益生菌可以成功地长时间定植。
这种策略可以使微生物群多样化,但据了解,这一点尚未得到系统的测试。
也有人提议探索每日摄入活微生物的饮食建议,以促进健康。为了使这一概念可行,需要进行流行病学研究和随机对照试验,以测试益生菌在预防慢性病方面的价值。
为了提高全人口的饮食质量,建议重新配方而不是取消加工食品。
这样的尝试将需要食品工程的创新,这将受益于饮食-微生物-宿主相互作用的考虑。例如,可以用不可消化的可发酵淀粉和其他纤维部分替代食品中的白面粉,从而改变加工食品的固有特性(如纤维含量、血糖生成指数和营养物质消化率),以抵消对肠道菌群和宿主代谢的有害影响。
在一项统计模型研究中,这一方法已具有广泛的影响,该研究预测,如果英国50%的加工食品的市场份额中添加约3克纤维,2型糖尿病和心血管疾病的风险将降低70%以上。
类似的方法可以应用于重新引入其他生物活性化合物,如植物化学物质,可能与膳食纤维联动。
与其依靠个人改变他们的饮食习惯改善健康,不如用更多的重新配方加工食品来改善饮食质量,而不显著改变饮食习惯。
确定“健康微生物群”
虽然很难定义什么是“健康”微生物群,但肠道微生物群的特定分类群和功能特征,特别是受饮食影响的分类群和功能特征(例如,与健康相关的SCFA和次生胆汁酸)与健康结果有关。
一旦确定了促进健康的分类群和微生物群特征,就可以用营养策略来针对它们。
例如,代谢有害的低碳水化合物或高肉类饮食,可通过补充可发酵纤维,以将微生物代谢从蛋白质转化为碳水化合物发酵,改善肠道屏障完整性,并通过短链脂肪酸诱导全身代谢益处。鉴于膳食纤维和低碳水化合物饮食的独立代谢效应,它们的结合可能产生协同效应。
扩展阅读:健康的人类微生物组
使用膳食纤维增强假定的健康菌群
通过这种方式促进菌群及其代谢产物。这种方法基本上符合益生元的概念,益生元被定义为宿主微生物选择性利用的底物,具有健康益处。
不幸的是,这一定义并没有就什么构成“选择性”效应、这种效应如何与健康益处因果关联以及如何区分益生元和膳食纤维提供明确的指导。这些担忧导致欧洲食品安全局规定,益生元不能标记为益生元,但必须标记为膳食纤维。
饮食指南中也没有提到食物来源的益生元,这很不幸,因为目标微生物组调节的总体概念很有希望。
▸ 用膳食纤维获得可预测的微生物群组成变化
研究人员提出了一个概念框架,利用该框架,可以使用含有离散结构的膳食纤维(定义为“一种独特的化学结构……与细菌基因组中编码的基因簇相一致”),来获得可预测的和理想的微生物群组成变化。
在人体试验中对该框架进行了实验测试,在该试验中,IV型抗性淀粉的细微结构差异将短链脂肪酸输出导向丙酸盐或丁酸盐,丙酸盐或丁酸盐具有不同的代谢和生理功能。
有针对性的营养微生物组调节对于饮食指南和治疗性食品都有巨大的前景,但关于微生物组的哪些方面应该有针对性的问题仍然存在,需要进行随机对照试验来证明这些策略是否能转化为改善健康的结果。
即使控制良好的饮食干预措施也会对个体产生不同的影响。这对目前在饮食指南中应用的“一刀切”方法提出了质疑。
精确营养(也称为“个性化营养”)的新兴领域旨在利用人类的个性,首先确定哪些特定的特征可以预测对饮食干预的反应,然后相应地调整营养,以实现不同人群的相同反应。
考虑到肠道微生物群对饮食的高度个性化反应,微生物群检测是针对慢性病预防和治疗的精准营养策略的关键组成部分,以及其他个人特定因素(例如,遗传学、基线代谢和体力活动)。
▸ 应用:同样的减肥方式,哪类人群更容易达到效果?——机器学习帮你预测
机器学习方法可以应用于大型参与者队列,以确定哪些特征可以预测健康结果。例如,机器学习算法利用参与者关于血液参数、饮食习惯、微生物组组成和其他因素的数据,准确预测标准化膳食的餐后血糖反应。
这类预测可以受益于微生物组和宿主遗传数据的结合,如一项研究所示,基线Prevotella/拟杆菌比率高,可以预测唾液淀粉酶基因拷贝数较低的受试者,在食用富含膳食纤维、全谷物、水果和蔬菜的饮食后体重减轻更大。
▸ 应用:微生物组结合手机用于饮食监测——机器学习为你提供高维数据,最终实现个性化建议
国家饮食指南目前没有考虑精确或个性化的方法,其实施将在人口规模上具有挑战性。然而,这样做的技术已经存在,并且可以利用微生物组测序和智能手机应用程序用于饮食监测的组合,最终为机器学习算法提供高维数据,以便将个性化营养建议反馈给用户。
▸ 精准营养可持续的条件
预测模型的多中心验证必须在不同人群(包括非西方国家和发展中国家)中进行,以确定其广泛适用性并鼓励进一步完善。精确营养方法将取决于营养和微生物学科之间的持续合作,其在全人口范围内的实施将需要监管机构、专业协会和决策者的大量额外投入。
有关饮食微生物组与宿主相互作用的信息有可能进一步验证、完善和创新饮食建议。
将肠道微生物组纳入饮食指导,需要有证据证明微生物组在饮食生理效应中的机制和因果作用。确定肠道微生物群在人类疾病易感性中的作用的因果关系仍然是一个挑战,这在营养学研究中更加复杂,因为饮食、肠道微生物群和人类健康之间的相互作用是复杂和多方向的。
饮食、肠道微生物群和人类健康之间复杂的、多向的因果关系
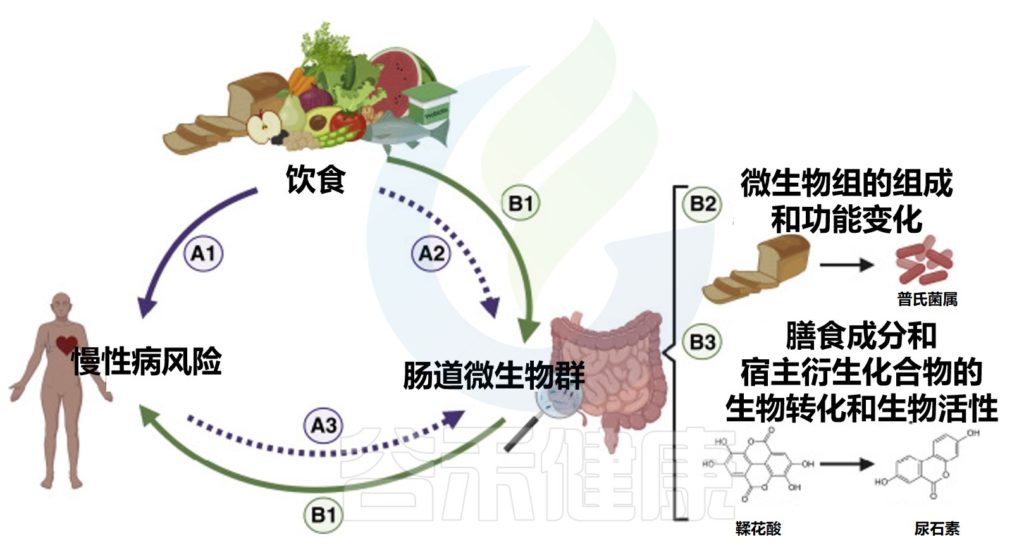
doi.org/10.1016/j.chom.2022.04.016
评估微生物组在营养中作用的人类研究因微生物组的复杂生态特征(个体间、地理和时间变异性)和营养研究的局限性(甚至适用于随机对照试验)而变得更加复杂(例如,难以评估饮食摄入和遵守研究方案、饮食成分的共线性和混杂因素)。
在设计未来的营养研究时,必须考虑这些复杂性,以阐明哪些因素(包括微生物组)介导了饮食对健康的影响。
研究人员推荐概述饮食微生物组研究最佳实践指南的优秀评论,并通过使用三大支柱将肠道微生物组整合到营养研究的所有阶段的实验框架来扩展这些评论。
一、微生物群的发现为健康饮食提出假设
肠道微生物群可以在既定饮食策略验证之外为营养提供信息,并有助于确定微生物群特征作为未来的营养目标。
目前已经确定了肠道菌群与人类疾病状态之间的关联。多元组学技术(如宏基因组学、宏蛋白质组学、代谢组学)和先进分析方法的使用,已经建立了支撑生物途径的潜在机制和因果基础。高质量、大规模队列研究有助于为饮食指南提供证据基础。
最近的研究扩展了这一框架,并将微生物组学和营养流行病学结合起来,以阐明微生物组学在饮食诱导的生理效应中的作用。可以发现微生物组、健康和特定饮食或饮食成分之间的联系。
这些相互作用的潜在机制和生物学合理性及其作为营养靶点和诊断标记的价值可在实验系统中得到证实。
二、微生物组与人类干预试验的整合
▸随机对照试验:营养学金标准
▸交叉设计:允许消除个人特定因素的个体间差异
▸干预试验:确定因果关系,直接告知饮食指南
随机对照试验是建立人类因果关系的营养学金标准,如果它们表现良好,在证据层次结构上要高于观察性试验。这种层次结构也适用于微生物研究。营养随机对照试验可以使用微生物组流行病学中应用的相同多组学方法进行扩展,以整合肠道微生物组并有效测试特定饮食微生物组的相互作用。可以将有效预测疾病风险的替代标记物与微生物组终点(例如成分变化、功能和代谢物)和生物过程的分子标记物相结合,假设这些生物过程将肠道微生物组的代谢活动与宿主免疫代谢相联系(即肠道激素、细胞因子、TMAO和肠道屏障完整性标记物),以证实研究结果并提供假定的机制解释。
交叉设计对于以微生物组为终点的随机对照试验具有优势,因为参与者作为自己的对照,这允许消除个人特定因素的个体间差异(例如微生物组、遗传学、代谢物谱和基线临床测量)。研究应进一步控制其他混杂变量,如人口统计学(年龄和性别)和生活方式因素(习惯性饮食和药物使用)。在这种情况下,大便稠度和饮酒是意外的混杂因素。应使用分层随机化来平衡参与者根据年龄和性别等因素分配给治疗组的情况,并应收集有关混杂变量的详细信息,以便在统计分析中对其进行控制。通过对自由生活或定居的参与者进行充分的控制喂养研究,提供所有食物,包括足够的磨合期,可以消除习惯性饮食的实质性混杂因素。这样的研究进行起来困难且昂贵,但已经在微生物组领域成功应用。
干预试验可以确定饮食对健康影响的因果关系,从而直接告知饮食指南。如果微生物组被整合,随机对照试验也可以为微生物组在饮食健康影响中的作用提供假定的机制解释,并为精确营养策略提供基于诊断微生物组的生物标记。回归和相关分析可用于确定饮食诱导的微生物组分/功能变化与临床和机械终点之间的关联。此外,机器学习模型可以确定是否可以通过对微生物组或受微生物组影响的宿主生物过程的影响来预测饮食诱导的生理变化。然而,除非这些试验和分析采用特定的实验和统计方法进行扩展,否则它们无法确定肠道微生物群在饮食影响中的因果作用。
三、关于微生物组在饮食影响中作用的机制洞察和因果推断
▸收集纵向数据,使用数学方法,解开因果
▸通过动物模型扩展确定潜在机制
▸最常用和最复杂的建立菌群因果关系的模型
▸动物模型存在局限性,但对完善假设很宝贵
可以在随机对照试验中收集纵向数据,以便进行因果推断,因为必须使用中介分析等方法,在时间上先于效应。其他数学方法,如结构方程建模和贝叶斯网络,也可以解开饮食、微生物组和人类健康之间的因果关系。可以说,最有希望直接在人类身上进行因果推理的实验设计是“干预主义框架”,当针对假定原因的干预产生有利影响时,就可以推断因果关系。这种方法可适用于具有良好特征效果的饮食干预,以测试针对微生物组特征或给予微生物代谢物(假定原因)是否能产生预期效果。
人类研究可以通过动物模型扩展,以确定微生物组的因果作用,确定微生物组中的因果成分,并确定潜在机制。可以在无菌动物疾病模型中测试单独或作为群落的特定微生物(灵知动物)或与人类饮食干预生理效应相关的微生物代谢产物。灵长类动物允许去除或添加特定的微生物,以确定微生物群落中的致病成分,并且可以用模仿人类饮食的饲料进行挑战。
人类微生物相关(HMA)啮齿动物是最常用和最复杂的建立微生物组因果关系的模型,将人类粪便微生物群移植到啮齿类动物的疾病模型中。HMA动物可以非常有效地比较对饮食干预有或没有反应的人类微生物组,特别是如果假设差异是由特定微生物的存在或不存在引起的。然而,HMA动物在做出关于饮食诱导的人类微生物组组成变化的因果推断方面有很大的局限性。不提供活微生物的饮食不太可能从微生物群中添加或移除微生物物种,但只会改变群落中的相对比例。这种变化不太可能在受体动物身上复制,因为形成微生物群的生态和进化力量与供体中的不同。
尽管存在局限性,但动物模型,尤其是如果其微生物群得到良好控制并与多组学方法相结合,有能力补充人类研究,因为它们建立了饮食影响的机制基础。通过使用更好地模仿人类生理学的动物,如猪和灵长类动物,这些研究可以进一步改进。虽然不需要从机理和因果研究中获得见解,来确定和确认饮食成分的健康影响或基于微生物组的生物标记物的效用,但这对于完善假设非常宝贵,可以创新制定有针对性的营养策略,并为饮食建议提供额外的证据。
将肠道微生物组整合到营养学研究的所有阶段的实验框架,以促进对微生物组在健康饮食中的作用的理解:
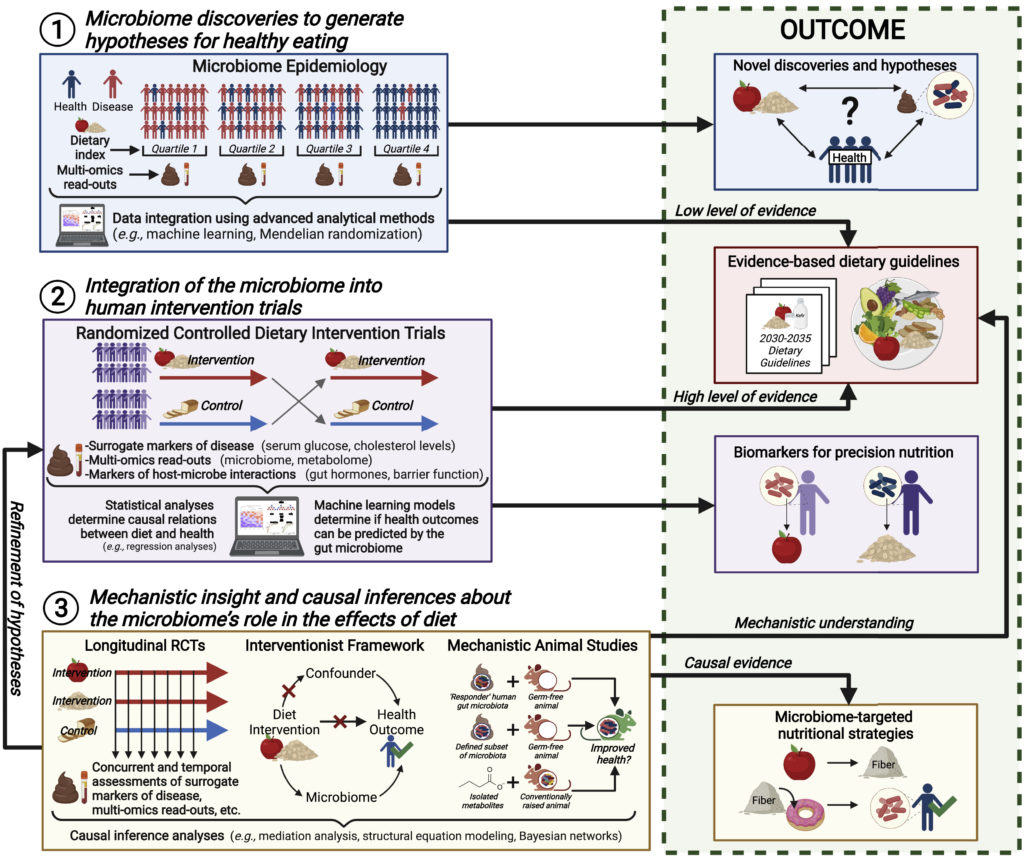
doi.org/10.1016/j.chom.2022.04.016
饮食与疾病密切相关,而疾病又与微生物群相关。肠道微生物群可能是构成营养研究的“黑匣子”,饮食—微生物群的相互作用可能有助于建立饮食生理效应的机制基础。
这两个领域有很强的生物学和进化论理由来扩展已经活跃和正在进行的合作,以加深对如何通过饮食优化健康的理解。
应将以微生物组为中心的终点纳入营养科学的各个方面,以加强饮食指南的证据基础。营养微生物学研究有可能全面了解健康饮食的各个方面,从而有助于解决饮食相关疾病的预防和管理。
谷禾也将不断提供关于肠道微生物群如何影响和介导饮食化合物、特定食物和饮食模式的生理效应的机制的前沿研究进展,应用到肠道菌群健康检测,不断更新已有框架,为大众提供针对微生物群的营养策略。
主要参考文献:
Armet AM, Deehan EC, O’Sullivan AF, Mota JF, Field CJ, Prado CM, Lucey AJ, Walter J. Rethinking healthy eating in light of the gut microbiome. Cell Host Microbe. 2022 Jun 8;30(6):764-785. doi: 10.1016/j.chom.2022.04.016. PMID: 35679823.
Lancaster SM, Lee-McMullen B, Abbott CW, Quijada JV, Hornburg D, Park H, Perelman D, Peterson DJ, Tang M, Robinson A, Ahadi S, Contrepois K, Hung CJ, Ashland M, McLaughlin T, Boonyanit A, Horning A, Sonnenburg JL, Snyder MP. Global, distinctive, and personal changes in molecular and microbial profiles by specific fibers in humans. Cell Host Microbe. 2022 Jun 8;30(6):848-862.e7. doi: 10.1016/j.chom.2022.03.036. Epub 2022 Apr 27. PMID: 35483363; PMCID: PMC9187607.
Deehan EC, Walter J. The Fiber Gap and the Disappearing Gut Microbiome: Implications for Human Nutrition. Trends Endocrinol Metab. 2016 May;27(5):239-242. doi: 10.1016/j.tem.2016.03.001. Epub 2016 Apr 11. PMID: 27079516.
Guthrie L, Spencer SP, Perelman D, Van Treuren W, Han S, Yu FB, Sonnenburg ED, Fischbach MA, Meyer TW, Sonnenburg JL. Impact of a 7-day homogeneous diet on interpersonal variation in human gut microbiomes and metabolomes. Cell Host Microbe. 2022 Jun 8;30(6):863-874.e4. doi: 10.1016/j.chom.2022.05.003. Epub 2022 May 27. PMID: 35643079.