 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

银屑病,又叫牛皮癣,会导致出现皮疹伴发痒的鳞状斑块,最常见于膝盖、肘部、躯干和头皮。通常呈周期性发展,发作数周或数月,然后消退一段时间,长期的发作和复发会给患者带来很大的痛苦和困扰,严重影响到生活质量和日常工作。银屑病影响着全球超过 6000 万成人和儿童。
银屑病是一种免疫介导的炎症性皮肤病,涉及遗传和环境因素之间复杂的相互作用。免疫学和遗传学研究确认IL-17和IL-23是银屑病发病机制中的关键驱动因子。然而,由于银屑病的反复发作和难治性质,目前还没有简单治愈方法。
在有遗传倾向的个体中,非遗传因素也是触发牛皮癣发病和复发所必需的,其中包括感染、皮肤和肠道微生物群失调、脂质代谢失调、性激素失调、精神疾病等,其他环境因素也可能诱发牛皮癣,例如皮肤创伤、不健康的生活方式和药物。
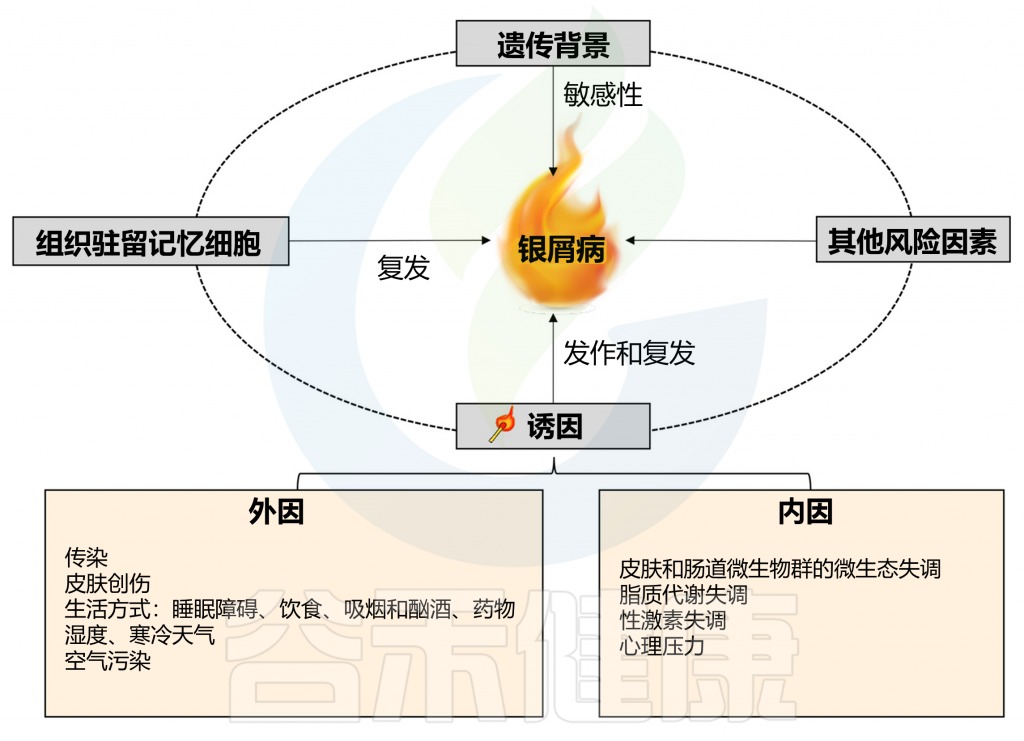
Liu S, et al., Cell Communication and Signaling, 2024
大量研究发现,银屑病不再被认为是仅影响皮肤的疾病,而是被视为一种全身性炎症性疾病,这与多种共病相关,包括结肠直肠癌、代谢综合征、肥胖、克罗恩病和溃疡性结肠炎等。微生物感染被认为是银屑病的重要病因,尤其是链球菌上呼吸道感染。
肠道和皮肤之间存在很强的双向联系,在肠道-皮肤轴中,皮肤炎症会影响肠道健康,而肠道微生物群也会影响皮肤健康,与健康对照相比,牛皮癣患者的肠道菌群失调,多样性降低,Firmicutes/Bacteroidetes(F/B)异常,大肠杆菌水平往往更高,Lachnospira、Akkermansia muciniphila、Blautia、Faecalibacerium减少,这种变化与人类结肠微生物群中丁酸盐代谢和产丁酸菌相关。丁酸与调节多种炎症因子有关,包括脂多糖、TNF-α、IL-10、IL-1β等。
扩展阅读:
其他菌群变化也与银屑病患者中与炎症相关标志物的程度相关联,特别是IL-2受体,其与Phascolarctobacterium呈正相关,与Dialister呈负相关。Phascolarctobacterium和Dialister的相对丰度可作为银屑病活动的预测指标。详见:
肠道核心菌属——考拉杆菌属(Phascolarctobacterium)
近日,来自华中科技大学同济医学院附属协和医院皮肤科的研究人员,总结了牛皮癣发病和复发的触发因素,发表在《Cell Communication and Signaling》上。

本文结合牛皮癣与肠道菌群的关联,更新了有关这些因素如何引发该疾病的潜在机制的当前证据。了解这些触发因素如何在银屑病的发病和复发中发挥作用,可以深入了解银屑病的发病机制,并更好地进行临床治疗。
银屑病是一种常见的红斑鳞屑性皮肤病,具有多种皮肤表现和全身参与,可影响任何皮肤部位,发生于任何年龄和任何地理区域。
在牛皮癣患者中,免疫系统错误地攻击了健康的皮肤细胞,导致皮肤细胞生长过快,形成皮肤表面的鳞屑。
银屑病的常见体征和症状包括:
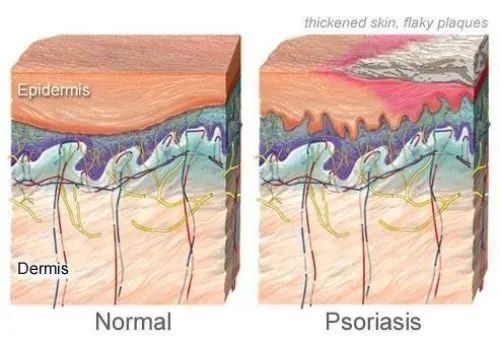
图源:WebMD
根据银屑病临床表现的不同,通常分为以下类型:
其他还包括:
牛皮癣和湿疹一样吗?
牛皮癣和湿疹是两种不同的皮肤病。这两种情况都会引起类似的症状,如皮肤变色、皮疹和瘙痒。
牛皮癣会传染吗?
牛皮癣不会传染。接触他人的牛皮癣皮疹不会感染牛皮癣。
牛皮癣是一种慢性炎症性皮肤病,世界卫生组织最近的报告指出,牛皮癣的患病率正在上升,在发达国家从 1.5% 到 5% 不等。
据统计,中国的牛皮癣发病率在1.3%-2.4%之间,约有1000万-2000万的患者。男性的发病年龄在30-39岁和60-69岁,而女性的发病时间大约要早十年,年轻人群体中发病率也有上升的趋势。
许多银屑病患者可能持续数年毫无症状,直至某种环境因素诱发这种疾病。常见的银屑病诱发因素包括:
银屑病关节炎
一般来说,银屑病越严重,患银屑病关节炎的风险就越高。2015 年欧洲一项研究发现,十分之一的银屑病患者患有未确诊的银屑病关节炎。未确诊的银屑病关节炎患者的生活质量受到很大影响。
心血管疾病
研究表明牛皮癣与心血管疾病之间存在联系,慢性炎症可能是心血管疾病和中风风险增加的原因,因为随着时间的推移,炎症会对动脉造成损害。
代谢综合征
根据一项研究,患有牛皮癣的人患代谢综合征的风险,是其他没有牛皮癣的人的六倍。
肥胖
研究表明,与一般人群中的其他人相比,牛皮癣患者更有可能肥胖。
炎症性肠病
牛皮癣和炎症性肠病 之间存在联系。《JAMA Dermatology》杂志 2018 年的系统综述和荟萃分析结果表明,牛皮癣与炎症性肠病相关。
抑郁症
抑郁症是银屑病的首要合并症。患有皮肤问题会导致抑郁。对于某些人来说,治疗牛皮癣可以帮助减轻抑郁症状并提高生活质量。
以上我们了解了关于银屑病的基本情况,接下来,我们从感染,微生物群失调,脂质代谢失调,心理压力和精神障碍,性激素失调,其他环境因素等方面来了解银屑病的相关触发机制。
多种微生物是银屑病的触发因素,见下表。
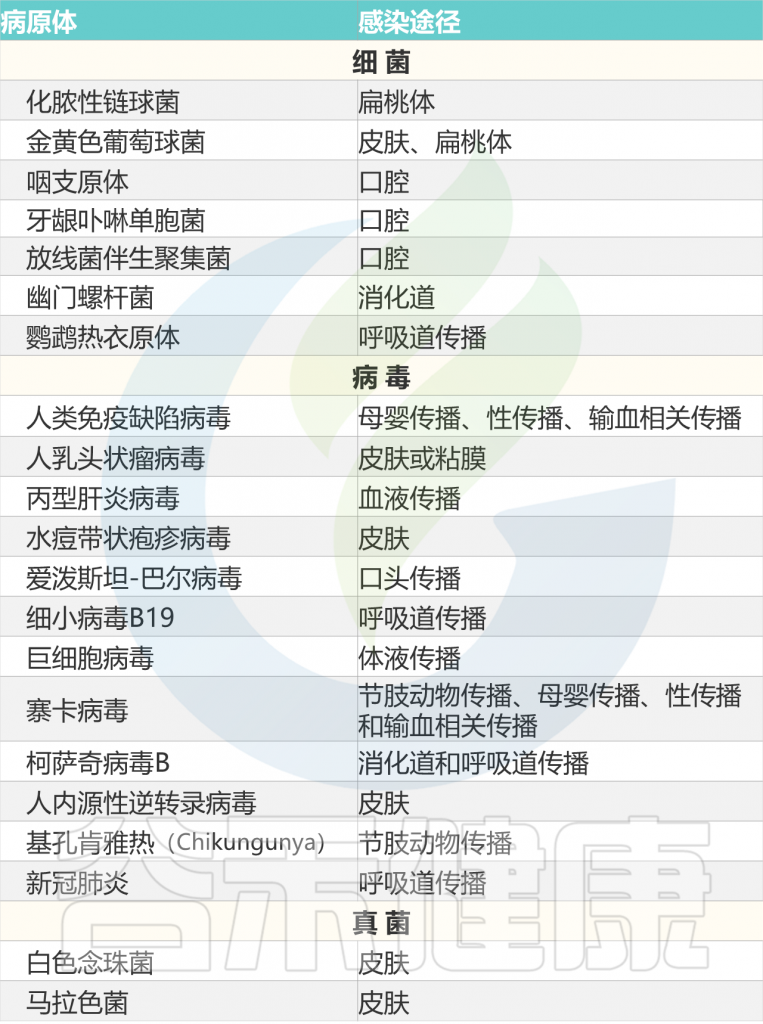
Liu S, et al., Cell Communication and Signaling, 2024
化脓性链球菌引起的扁桃体感染,可引发或加剧斑块状和滴状银屑病中的银屑病皮肤病变。
研究人员通过遗传关联研究将链球菌咽喉感染与银屑病联系起来,表明公认的银屑病风险等位基因HLA-C06:02是链球菌扁桃体炎的风险因素,而推断的银屑病风险单倍型HLA-C06:02/HLA-B*57:01是扁桃体炎最强的风险因素。
儿童银屑病与复发性扁桃体炎密切相关
一项临床队列研究还报道,年龄从10岁-11岁的儿童银屑病与复发性扁桃体炎密切相关。在银屑病患者的皮肤和扁桃体组织中发现了相同的T细胞克隆,提示在链球菌感染后的疾病中扁桃体内产生致病性T细胞。因此,建议将扁桃体切除术作为解决银屑病的干预措施,这可以减少循环T细胞的数量。
但仍应进行长期随访,验证扁桃体切除术的适应症和长期益处。同时,没有确凿的证据表明抗链球菌干预措施的有效性。有趣的是,肛周链球菌感染也会引发喉结型银屑病,但它不如喉咙感染常见。
化脓性链球菌喉咙感染和银屑病之间发病联系
链球菌扁桃体炎可能通过以下多种机制来引发牛皮癣:
a) 化脓性链球菌(SP)的M蛋白模仿人类 K17
CD8 + T细胞识别银屑病患者中链球菌M蛋白和人角蛋白17(K17)共享的表位,K17可以成为CD8的自身抗原和靶点 + 以HLA-C*06:02限制性模式浸润银屑病皮肤病变的T细胞。
b) SP超抗原激活IL-12的释放,然后促进CD4+T 细胞中皮肤归巢CLA的表达
皮肤寻求性皮肤淋巴细胞相关T细胞(CLA + T细胞)与化脓性链球菌的相互作用,为理解银屑病的免疫发病机制提供了新的概念。通过刺激IL-12的产生途径,化脓性链球菌超抗原诱导T细胞上皮肤特异性归巢受体(CLA抗原)的表达,并促进CLA+ T细胞向皮肤的迁移。
此外,在携带HLA-C*06:02的银屑病患者中,如果他们患有化脓性链球菌引起的扁桃体炎,其CLA+ T细胞和表皮细胞的培养中观察到高Th17反应。化脓性链球菌能够在斑块型和滴状银屑病中诱导循环CLA+ T细胞产生IL-17,这进一步在CLA+ T细胞迁移到皮肤后诱导银屑病自身抗原(如ADAMTS样蛋白5和LL-37)的产生。在体外银屑病模型中,化脓性链球菌提取物诱导CLA+ T细胞产生IL-9,从而上调IL-17A的产生。
c) 化脓性链球菌肽聚糖 (PG) 的辅助作用
含有PG的巨噬细胞与PG特异性CD4+密切接触银屑病病变中的T细胞,然后是PG特异性CD4 + T细胞以HLA-DR等位基因限制的方式增殖并产生IFN-γ。此外,PG固有识别的改变增强了T细胞对化脓性链球菌的反应,并诱导银屑病。
图2 感染和皮肤微生物失调可能诱发银屑病
Liu S, et al., Cell Communication and Signaling, 2024
金黄色葡萄球菌在大约60%的银屑病患者的皮损和鼻孔中,而在5%至30%的健康个体中定植。
从22名银屑病患者中的11名患者的喉咙中分离出金黄色葡萄球菌。
一项研究显示,与健康对照组相比,银屑病受试者对超级抗原毒素的炎症皮肤反应增加,银屑病表皮中TNF-αmRNA水平增加。
然而,在银屑病病变中没有发现表达特异性T细胞受体Vβ的T细胞的选择性扩增,这是超抗原刺激的标志。这种T细胞依赖性反应可能是由于角质细胞中HLA-DR的高表达,增强了皮肤对超级抗原的炎症反应。
此外,银屑病的严重程度与葡萄球菌肠毒素的产生显著相关。
牙周炎患者患银屑病的风险较高
牙周炎期间,口腔微生物群可能影响银屑病的发展和恶化。一项涉及13项研究的荟萃分析显示,牙周炎患者患银屑病的风险高于对照组。
口腔微生物(尤其是咽支原体)在银屑病发展中的作用
一名患者最初患有滴状银屑病,后来发展为斑块型银屑病,其皮肤感染了咽支原体(Mycoplasma faucium),属于口腔软壁菌门,这种细菌出现在银屑病棘层角质形成细胞中,以及银屑病损害上层真皮的细胞外。
与对照组(骨关节炎)相比,在银屑病关节炎(PsA)患者的血清和滑液中也发现了更多种类和更高浓度的口腔细菌(牙龈卟啉单胞菌和Prevotella nigrescens)DNA。
牙龈病原体(尤其是牙龈卟啉单胞菌)在牙周炎与银屑病发病机制中的桥梁作用
牙龈卟啉单胞菌和放线菌聚集杆菌(Aggregatibacter actinomycetemcomitans)是与牙龈炎相关的病原体,可激活人CD14 + 单核细胞在体外增强Th17分化和IL-17产生。牙龈卟啉单胞菌蛋白酶可以通过降解其他关键细胞因子如IL-12,增强Th17系列反应,而髓样抗原呈递细胞(APCs)被触发产生与Th17相关的细胞因子IL-1β、IL-6、IL-23。然而,与健康受试者相比,牙周炎患者的牙龈组织中IL-17+细胞的频率增加,而在外周血中没有增加。
牛皮癣的皮肤炎症可以通过宿主的抗病毒免疫反应失调由病毒感染引发。
视黄酸诱导基因I (RIG-I)是病毒的主要细胞质传感器。通过激活RIG-I抗病毒信号传导,病毒感染可以在遗传易感个体中触发CD11c+树突细胞产生IL-23的表达,从而导致银屑病的发展。
HIV
与普通人群相比,人类免疫缺陷病毒(HIV)患者的银屑病标准化发病率更高。HIV可以直接作为超抗原或抗原呈递的共刺激因子触发银屑病,在HIV感染期间,活化的CD8 +T细胞产生更多的IFN-γ。神经肽物质P可以从HIV感染的免疫细胞中释放,然后调节炎症和免疫反应,刺激角质细胞的增殖。
HPV
人乳头瘤病毒(HPV)也与银屑病相关。一项针对66274名HPV感染患者的全国性人群队列研究显示,HPV感染后银屑病的患病率更高。
SARS-CoV2
严重急性呼吸综合征冠状病毒2型(SARS-CoV2)也被认为是银屑病恶化的原因。在严重急性呼吸系统综合征冠状病毒感染患者的血浆中炎性细胞因子水平升高,粒细胞集落刺激因子和TNF-α的浓度与疾病严重程度相关。
此外,一些接种新冠肺炎疫苗的患者患有慢性免疫介导的皮肤病,如牛皮癣,但皮肤反应通常轻微且自限性的。
NLRP1炎症小体
NLRP1是已鉴定的炎症小体形成模式识别受体(PRRs)之一,先天免疫系统可以通过该受体检测病原体。在正链RNA病毒感染过程中产生的长双链RNA(dsRNA),例如Semliki Forest病毒,可以结合并激活人类角质形成细胞中的NLRP1炎症小体。NLRP1炎症体在促进银屑病发病的过程中发挥作用,无论是通过增加对银屑病的易感性,还是通过促炎细胞因子(包括IL-1β和IL-18)的失调释放。
同样,NLRP1具有感知细菌病原体外毒素的能力,如铜绿假单胞菌分泌的外毒素A和白喉棒状杆菌分泌的白喉毒素,并诱导细胞死亡和IL-1β / IL-18分泌。
注:NLRP1,核苷酸结合域和富含亮氨酸重复pyrin结构域的蛋白质1(NLRP1),一种在人体免疫系统中发挥作用的蛋白质。
银屑病皮肤中的多种真菌已被鉴定为通过遗传易感个体的先天免疫系统激活银屑病。
白色念珠菌
来自白色念珠菌等微生物的超级抗原可能导致感染患者银屑病的恶化。接触白色念珠菌也可在银屑病皮肤中引发对IL-17的临床相关反应。银屑病CLA + T细胞/表皮细胞共培养物通过增加IL-9、IL-17A和IFN-γ的产生,对白色念珠菌提取物产生反应。
此外,皮肤白色念珠菌感染通过产生IL-17的CD4 + TRM诱导复发性银屑病。在小鼠模型中,CD4 + TRM在感染30天后成为IL-17的主要来源。
除白色念珠菌外,马拉色菌可能与头皮银屑病的恶化有关。
幽门螺杆菌
与对照组相比,幽门螺杆菌感染在中度和重度银屑病患者中显著增加,但在轻度银屑病患者中没有增加。在幽门螺杆菌感染的银屑病患者中,银屑病面积和严重程度指数(PASI)评分较高,银屑病相关细胞因子IL-1β、IL-6、IL-8和TNF-α的粘膜水平也较高。然而,2015年的一项发现表明,银屑病患者的幽门螺杆菌患病率没有比健康对照组增加。还需进一步研究。
目前,许多研究都致力于人类微生物组在银屑病发病机制中的作用,特别是皮肤和肠道微生物组之间的关系,即“肠道-皮肤轴”。
银屑病患者厚壁菌门增加
几位研究人员推测,银屑病可能与宿主皮肤微生物群的失调密切相关(图2)。与非病变皮肤和对照组相比,银屑病病变皮肤的细菌载量更高,但细菌多样性更低。厚壁菌门和放线菌门分别是银屑病患者和健康对照组中最常见的细菌门,病变皮肤中厚壁菌的增加和放线菌的相应减少是显著的。然而,另一项研究报道了银屑病病变中放线菌门和厚壁菌门都增加。这种差异可能是由于采样方法、皮肤部位、药物和分析方法的多样性。
棒状杆菌丰度与银屑病严重程度相关
根据新的证据,与未受影响和健康的皮肤相比,银屑病病变的棒状杆菌(Corynebacterium)浓度更高,Cutibacterium更低。棒状杆菌丰度与疾病严重程度相关,大多数种类的棒状杆菌在小鼠皮肤中诱导强烈的IL-23依赖性反应。在小鼠皮肤上涂抹假白喉棒状杆菌后,皮肤IL-1β蛋白水平升高,真皮中γδT17细胞增多。
银屑病耳朵皮肤显示葡萄球菌过度表达
较低丰度的表皮葡萄球菌和痤疮丙酸杆菌可能促进金黄色葡萄球菌在银屑病中的定植,这可以刺激小鼠模型中的Th17极化并引发IL-17介导的皮肤炎症。
为了解释银屑病的发病机制,提出了从屏障破坏到微生物群紊乱,再到病变加重的循环来解释银屑病的发病机制。
具有表皮屏障缺陷的小鼠具有增加的细菌载量和抗微生物肽(AMP)表达。在施用局部抗生素后,通过减少皮肤上的细菌负荷,以及减少IL-17和IL-22的产生,可以缓解小鼠的银屑病样表型。
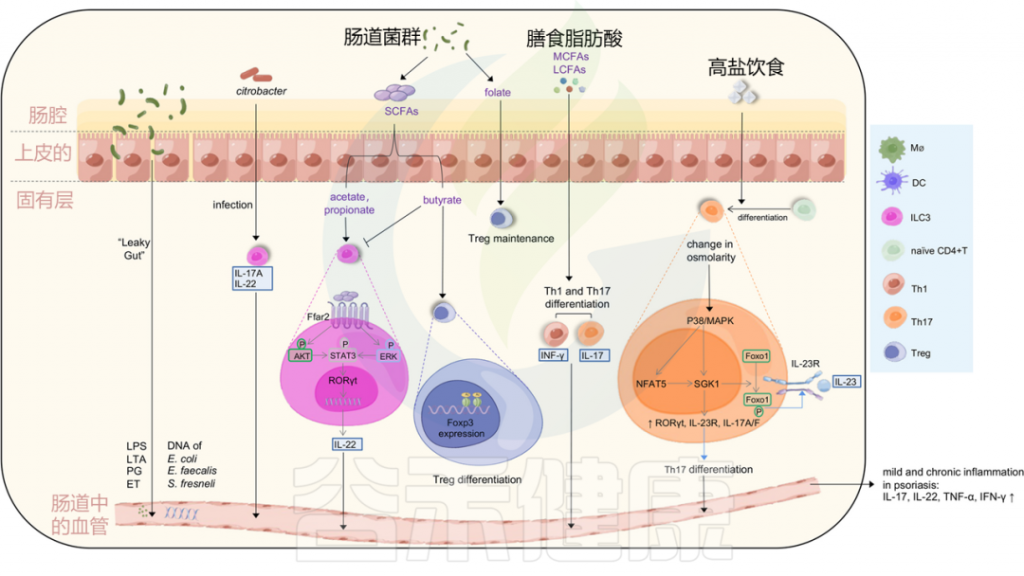
除了皮肤微生物群的微生态失调外,紊乱的肠道微生物群也会影响银屑病的病理生理学(图3)。与健康对照组相比,银屑病患者的肠道微生物群在组成和功能潜力方面都发生了变化。银屑病患者的肠道微生物群特征显著紊乱,细菌多样性低,厚壁菌门/拟杆菌门(F/B)比率升高,并与PASI评分呈正相关。除了厚壁菌门和拟杆菌门外,银屑病患者和健康对照组16种属水平上的类群也存在显著差异。
银屑病患者肠道微生物的相关研究

doi.org/10.3390/ijms25041984
肠道屏障完整性与银屑病严重程度呈正相关
肠道脂肪酸结合蛋白(FABP)是肠道屏障完整性的生物标志物,其水平与银屑病的严重程度呈正相关。肠道微生物群失调可能通过减少粘液层的厚度、干扰肠道上皮细胞的增殖和代谢以及影响AMPs的产生来增加肠道通透性,也称为“肠漏”。
肠道微生物失调导致肠漏,促进细菌和抗原转移
肠道细菌可以通过DC通过上皮细胞之间的过程逃逸到血液中,而不影响紧密连接功能,或者通过覆盖在Peyer贴片上的微折叠细胞,将微生物产物呈递给APC。渗漏的肠道促进细菌移位,并允许外部抗原从肠腔进入血液和淋巴循环,从而驱动局部和全身免疫反应。
银屑病患者中细菌DNA易位与全身炎症的增加
与其他患者和健康对照组相比,斑块型银屑病患者血液样本中细菌DNA易位增加,主要是由肠道细菌引起的,包括大肠杆菌、粪肠球菌和弗氏志贺菌。细菌DNA易位的患者也表现出更高水平的全身炎症反应。
另一项研究还报道,在25%的斑块型银屑病患者的血液中观察到细菌DNA,与其他肠道类型的患者相比,肠型2(普雷沃氏菌占优势)的患者更容易发生细菌移位。这些微生物在被重新激活后可能会释放出高效的炎症因子,如脂多糖(LPS)和脂磷壁酸(LTA),这可能会导致宿主机体中的轻度和慢性炎症,银屑病患者会受此困扰。从肠道吸收的细菌内毒素(ET)和PGs也会加剧银屑病,银屑病的治疗已通过阻止其吸收或破坏内毒素来证明这一点。
短链脂肪酸促进Treg分化,调节免疫活性
微生物群可以通过肠道中的微生物代谢产物来改变免疫活性。短链脂肪酸(SCFAs)是肠道微生物组不可消化碳水化合物的主要发酵产物,主要包括乙酸盐、丁酸盐和丙酸盐。其中,丁酸盐可增强Foxp3基因座启动子区的组蛋白H3乙酰化,表明其有可能影响Treg细胞的分化。
微生物群对T细胞分化的影响:叶酸与色氨酸代谢途径
叶酸来自肠道微生物群和饮食,而饮食中的叶酸对维持Foxp3+Tregs有选择性作用。作为宿主色氨酸代谢途径之一,犬尿氨酸途径可以通过吲哚胺2,3双加氧酶将成熟的DC转化为耐受性DC,从而增强Tregs并抑制效应T细胞。这些结果可能表明,微生物群代谢产物通过触发肠道T细胞的分化,成为银屑病的非感染性风险因素。
固有淋巴细胞ILC3的调控:微生物代谢产物的双重作用
近年来,第3组固有淋巴细胞(ILC3)的功能受到了广泛关注。ILC3主要在肠道和皮肤中发现,并通过产生IL-17A和IL-22在银屑病中发挥致病作用。
当身体感染某些细胞外病原体(如柠檬酸杆菌)时,ILC3产生IL-22和/或IL-17,用于对抗病原体的粘膜免疫。ILC3的功能也可以受到微生物代谢产物的调节,如短链脂肪酸。丁酸盐可由厚壁菌门产生,而乙酸盐和丙酸盐主要由拟杆菌门产生。
图3 肠道微生物失调和饮食可能会在银屑病中诱导轻度和慢性炎症
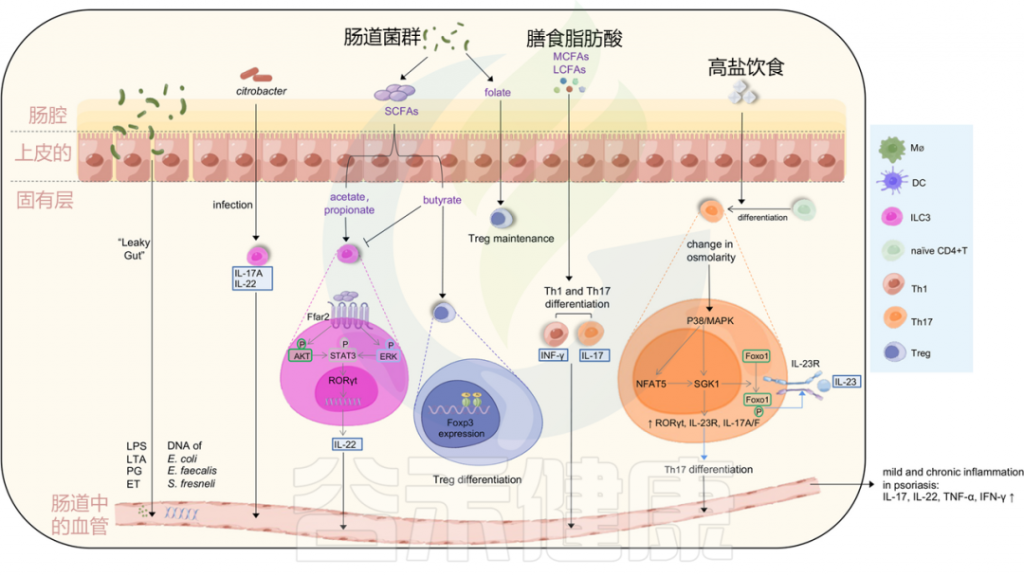
Liu S, et al., Cell Communication and Signaling, 2024
肠道通透性增加导致的“渗漏性肠病”可以诱导脂多糖(LPS)、脂蛋白(LTA)、外毒素(ET)和肽聚糖(PG)等强效炎症介质的释放,以及肠道细菌DNA进入血液。
柠檬酸杆菌感染可以刺激ILC3s产生IL-22和IL-17A,从而有助于黏膜免疫。ILC3s的功能也受到微生物代谢产物短链脂肪酸(醋酸、丁酸和丙酸)的影响。
乙酸和丙酸与结肠ILC3s上的FFAR2受体相互作用,激活AKT或ERK信号通路,并通过STAT3轴释放IL-22;
而丁酸则降低ILC3s的数量,同时,丁酸增强Treg细胞的分化,叶酸有助于维持Treg细胞,中长链脂肪酸支持Th1和Th17细胞的分化。
高盐饮食导致渗透压改变激活P38/MAPK通路,进而上调下游靶点NFAT5和SGK1,这反过来驱动转录因子RORγt、IL-23R、IL-17A和IL-17F的表达,导致Th17分化。上调的SGK1通过磷酸化Foxo1促进IL-23R的表达和稳定Th17分化。
益生菌的治疗已证明在改善银屑病方面具有潜在的益处,尽管尚未制定标准化的治疗方法。粪菌移植提供了另一种可能的治疗策略,因为它们通过允许健康粪便微生物组的“真生物”在受影响患者的肠道中重新定居来缓解自身免疫性疾病。未来更好地了解微生物群失调无疑将有助于缓解银屑病的治疗方法,我们在后面第八章也有具体的介绍。
许多研究已经表明肥胖和血脂异常与银屑病的关系,肥胖是银屑病的一个重要风险因素。而且,肥胖会加重已有的银屑病,这种自身免疫性疾病与肥胖之间的可能联系依赖于脂肪组织。
一般来说,脂肪组织可能通过肥大脂肪细胞分泌大量激素和细胞因子(也称为脂肪因子),包括IL-6、TNF-α和瘦素,在脂质代谢失调的患者中充当免疫器官,这些因子调节炎症途径和免疫细胞的活动。各种银屑病RNA-seq数据集表明,脂质代谢途径与银屑病的发病机制密切相关。
图4 将血脂异常与银屑病联系起来的潜在机制
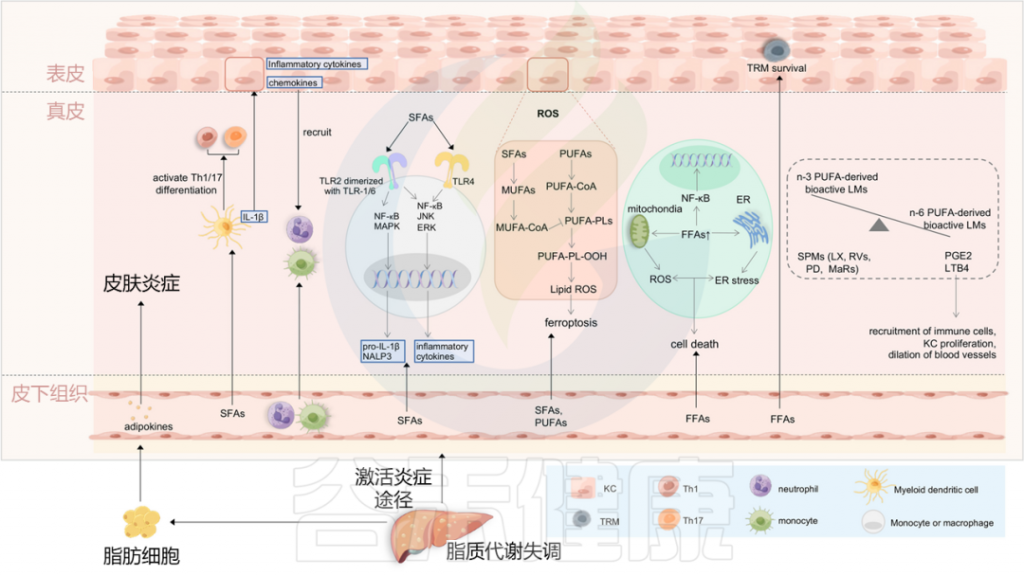
Liu S, et al., Cell Communication and Signaling, 2024
最近的研究表明,与肥胖相关参数无关的饮食成分,可能在银屑病的恶化中发挥关键作用。一项使用小鼠银屑病模型的研究提供了证据,证明饮食中的游离脂肪酸(FFAs),特别是饱和脂肪酸(SFAs),是银屑病皮炎的关键放大器。
饱和脂肪酸:加重银屑病皮炎的可能潜在机制
循环中的饱和脂肪酸被转运到皮肤中,并诱导骨髓源性树突细胞产生各种促炎细胞因子,如IL-1β。这些促炎细胞因子随后促进角质形成细胞分泌趋化因子和炎性细胞因子,导致中性粒细胞和单核细胞募集到皮肤,并导致银屑病皮炎放大。
饱和脂肪酸还可以通过激活TLR2和TLR4,来调节单核细胞或巨噬细胞中的NALP3炎症小体和炎症小体介导的IL-1β分泌。饱和脂肪酸在银屑病皮炎恶化中的另一种机制是通过激活DC来促进Th1/Th17分化。
体内游离脂肪酸的增加可能通过支持表皮中TRM细胞的存活而促使银屑病的复发。此外,膳食游离脂肪酸、中链和长链脂肪酸(MCFA和LCFA)的成分指导肠形Th细胞分化,这与上述丁酸盐诱导的Treg分化相反(图3)。
多不饱和脂肪酸(PUFA)及其衍生的生物活性脂质介质
除饱和脂肪酸外,多不饱和脂肪酸(PUFA)和多不饱和脂肪酸衍生的生物活性脂质介质(LMs)也可介导银屑病的炎症反应。
其中,生物活性LMs来源于两种多不饱和脂肪酸,亚油酸(LA,n-6 PUFA)和α-亚麻酸(ALA,n-3 PUFA),它们分别因其在银屑病中的促银屑病和抗炎特性而闻名。
n-6
作为代表性的n-6 多不饱和脂肪酸衍生的LMs,LTB4有助于中性粒细胞趋化,PGE2有助于角质细胞增殖。
n-3
衍生自 n-3 多不饱和脂肪酸的专门的促分解脂质介质(SPMs),包括脂氧素(Lxs)、resolvins (Rvs)、保护蛋白(PD) 和Maresins (MaRs),在银屑病中具有抗炎和免疫调节功能。
一个研究小组专注于基于液相色谱-串联质谱(LC–MS/MS)分析鉴定人类银屑病中的生物活性LMs和SPMs。根据他们的研究,衍生自n-6 多不饱和脂肪酸的生物活性LMs在银屑病皮肤中丰富,同时resolving D1(RvD1)、resolving D5(RvD5)、保护蛋白D1(PD1)及其双加氧异构体10S,17S diHDHA(又名PDx),阿司匹林触发形式的脂氧素A4和脂氧素B4(AT-LXA4和AT-LXB4)可能是解决银屑病病理生理学中炎症反应的专门的促分解脂质介质。
脂质代谢与铁死亡(Ferroptosis)密切相关,铁死亡促进银屑病角质形成细胞引发炎症,这涉及一系列连续事件,即活性氧(ROS)的积累导致脂质过氧化并进一步诱导铁死亡。
PUFA促进银屑病角质形成细胞铁死亡和炎症的机制
在银屑病期间,脂质过氧化与Th22/Th17通路在单细胞水平上呈正相关,证明了脂质过氧化的增强。
角质形成细胞对铁死亡也具有时间和浓度依赖性。在角质形成细胞的脂质代谢中,循环中积累的PUFA被催化为关键底物PUFA-CoA,最终酯化为PUFA-PLs,当存在生物活性铁时,PUFA-PL-OH可以过氧化为PUFA-PL-OH。随后,PLOOH可以通过产生脂质羟基自由基和脂质过氧自由基使细胞对铁死亡敏感。
MUFA-CoA和Fer-1通过抑制脂质过氧化抑制银屑病铁死亡
相反,来自饱和脂肪酸的单不饱和脂肪酸(MUFA)的产物MUFA-CoA可以通过抑制PUFA-PLs的过氧化来减少脂质过氧化的可用底物,从而抑制铁死亡。
此外,各种研究表明,Ferrostatin-1(Fer-1)是一种有效的脂质过氧化抑制剂,可以抑制铁死亡并阻断银屑病中的炎症反应。
除了氧化应激外,脂质还可以启动内质网(ER)应激,这具有双向作用:
饱和游离脂肪酸通过诱导ROS和ER应激参与银屑病发病机制
在非脂肪细胞中,过量的饱和游离脂肪酸通过脂质代谢和信号通路诱导ROS和ER应激。随后的线粒体和ER功能障碍是导致终末细胞死亡的关键步骤。此外,长期的内质网应激可导致氧化应激,脂质诱导的ROS也可能间接触发内质网应激,尽管确切机制尚不清楚。
脂质抗原激活限制性T细胞促进银屑病炎症反应
脂质自身抗原在驱动血脂异常相关自身免疫性疾病中的作用也引起了关注。银屑病病变含有高水平的磷脂酶A2(PLA2),其参与新脂皮肤抗原的产生。在IFN-α的诱导下,细胞质PLA2组IVD(PLA2G4D)可以以外泌体的形式从银屑病肥大细胞中释放,并转移到邻近的表达CD1a的Langerhans细胞。然后,新脂质抗原被脂质特异性CD1a反应性T细胞识别,释放IL-22和IL-17A。
自身脂质反应性T细胞在高脂血症与银屑病关联中的角色
除了CD1a限制性T细胞外,其他CD1分子(如CD1b和CD1c)限制性T淋巴细胞也对自身脂质产生反应并诱导细胞因子的产生。
在一项研究中,通过皮肤病变中积累的磷脂和胆固醇的一些自身抗原直接激活了CD1b自身反应性HJ1 T细胞。在患有高脂血症血清的小鼠中,CD1b+树突细胞增加了IL-6的产生,以及HJ1 T细胞分泌IL-17A,表明高脂血症和银屑病之间的潜在联系可能在于自身脂质反应性T细胞。
心理压力与银屑病的发病、严重程度和复发之间可能存在相关性
在31-88%的患者报告压力是银屑病的诱因,在过去12个月内经历压力事件的受试者中,银屑病的发病率更高。
另一项病例对照研究利用Holmes和Rahe的社会适应评定量表来评估压力生活事件,得出结论,压力在银屑病的发展中起着重要作用,特别是在复发和延长方面。
然而,一项荟萃分析报告称,没有令人信服的证据表明应激事件与银屑病之间存在这种关联。因此,未来应在基于人群的研究中前瞻性地审查这种关系,利用标准化的压力测量工具,并结合额外的生理和生化压力标志物。
心理压力激活HPA轴促进银屑病发病
压力可能通过下丘脑-垂体-肾上腺(HPA)轴、免疫途径和外周神经系统在银屑病的病理生理学中发挥作用。(图5)
作为对心理压力的反应,下丘脑产生促肾上腺皮质素释放激素(CRH),进一步激活垂体促肾上腺皮质激素(ACTH)和肾上腺皮质醇的分泌。CRH能够抑制角质细胞的凋亡,这是银屑病的典型现象。
另一方面,CRH通过刺激血管内皮生长因子(VEGF)增强血管生成,并增加血管通透性,促进银屑病斑块中炎症细胞的渗透。肥大细胞(MC)也可以被CRH激活,然后释放细胞因子和趋化因子,包括IL-1、IL-6、IL-31、TNF和CXCL-8。
此外,压力刺激皮肤外周神经末梢神经肽的释放,导致MC激活后神经源性炎症的发展。这些神经肽包括神经降压素(NT)、物质P(SP)、神经生长因子(NGF)和垂体腺苷酸环化酶激活多肽(PACAP)。
重度抑郁、PTSD、焦虑
除压力外,重度抑郁障碍或创伤后应激障碍患者患银屑病的风险显著高于对照组。
甚至父母常见的精神障碍(焦虑和抑郁)与后代患银屑病风险之间的关系也已确定。
双相情感障碍
另一项研究报告称,一名患有双相情感障碍的女性随后发展为银屑病,并在每次躁狂发作期间银屑病病变加重。
自闭症
根据自闭症谱系障碍患者银屑病炎症的临床升高,自闭症小鼠模型中高水平全身炎症,表明自闭症与银屑病活动之间存在联系。此外,先前的研究已经证实,严重精神障碍和银屑病之间存在遗传重叠。
越来越多的研究阐明了性激素对皮肤的多种生物和免疫调节作用。银屑病的自然病程似乎受到妊娠、月经和更年期的调节,从而暗示女性激素诱导的机制可能参与调节皮肤炎症。此外,研究表明,与女性相比,男性银屑病的患病率和严重程度更高,尤其是在雌激素充足的年龄,这表明不同性激素对银屑病的调节作用不同。
雌激素对银屑病具有保护作用
研究发现,雌激素通过下调中性粒细胞和巨噬细胞产生的IL-1β,这一过程通过雌激素受体α和β(ERα和ERβ)介导,具有潜在的抗银屑病作用。
同样,一项体内研究表明,雌二醇通过调节中性粒细胞和巨噬细胞的功能,在咪喹莫特(IMQ)诱导的小鼠银屑病炎症中发挥保护作用。体外,17β-雌二醇阻断了10 kDa的IFN-γ/干扰素诱导蛋白(IP-10)的正反馈回路,支持银屑病中Th1介导的炎症。
雌激素在银屑病中也可能具有促炎特性
一些孕妇的银屑病症状有所改善,而另一些孕妇的症状则有所恶化。
一份病例报告表明,一名患者在接受三苯氧胺治疗(一种抗中风药物)后,银屑病症状得到缓解,但在围绝经期症状恶化。值得注意的是,与对照组相比,男性银屑病患者的血清雌二醇水平显著升高,这表明雌激素可能参与银屑病的发展。
此外,一项使用咪喹莫特诱导的银屑病模型的体内研究也表明,雌激素通过Erα诱导IL-23,在银屑病中发挥促炎作用。
总之,这些证据支持雌激素在特定情境下对银屑病有双重影响,这导致了偶尔出现的相互矛盾的观察结果。
孕激素在银屑病中具有保护作用
临床观察证明银屑病通常在妊娠期间改善或消退,但在分娩后再次出现。
一项病例对照研究确定了孕妇受影响体表面积的改善与雌二醇、雌三醇、雌激素与孕酮比例升高之间的相关性。一些研究人员已经证明,角质细胞通过在银屑病皮肤中表达孕酮受体(PR)而成为孕酮的靶标。此外,孕酮在妊娠期间诱导转录改变,这些改变富含与银屑病相关的基因。STAT1和STAT3显著下调,其下游靶点,包括IL-12β、OSM和CXCL10,受到影响。
睾酮
一些研究强调雄性激素在牛皮癣中的作用。他们表明,严重的牛皮癣与低血清睾酮水平有关。无论患者年龄(40 岁以上或以下)如何,总睾酮和游离睾酮与 PASI 之间均呈负相关。
睾酮可以作为一种免疫抑制因子,下调树突状细胞的活性,干扰B细胞的分化,减少促炎细胞因子的释放。此外,在动物模型中,睾酮可以通过降低 IL-17 的水平来充当肝脏炎症的抑制剂,IL-17 是一种已知在银屑病发展中发挥关键作用的白细胞介素。
雄激素剥夺疗法(ADT)在晚期前列腺癌中作为加剧或缓解银屑病因素
一份病例报告显示一名前列腺癌患者ADT后银屑病加重。相反,一项调查发现ADT与银屑病风险降低之间存在相关性。另一项研究显示,无论年龄组如何,总睾酮或游离睾酮与PASI之间存在显著的负相关。
催乳素:刺激角质形成细胞的增殖
催乳素是垂体前叶分泌的一种多肽激素,刺激角质形成细胞的增殖,充当血管生成的诱导剂,并促进 Th1 细胞浸润银屑病病变。
此外,催乳素在调节免疫反应方面具有复杂的作用。它可以作为体液和细胞免疫反应以及 Th1 和 Th17 反应的刺激剂。
催乳素可以刺激角质形成细胞的增殖。最近的一项荟萃分析支持了激素在银屑病发病机制中发挥重要作用,该分析评估了循环催乳素水平与银屑病严重程度之间的关系。该荟萃分析包括 12 项研究,总共涉及 446 名银屑病患者和 401 名健康受试者。银屑病患者的循环催乳素水平显著较高,并且与疾病严重程度呈正相关。
总之,目前探索性激素对银屑病影响的研究主要依赖于观察性研究,缺乏深入的机制探索。这些关于雌激素和雄激素的矛盾发现表明,需要更多高质量的证据来更好地理解性激素与银屑病发病机制之间的复杂联系。
一些触发因素的潜在机制无法归类为感染因素、皮肤微生物群失调、肠道微生物群失调或脂质代谢失调,如下图。
图5 与银屑病发生相关的其他诱因
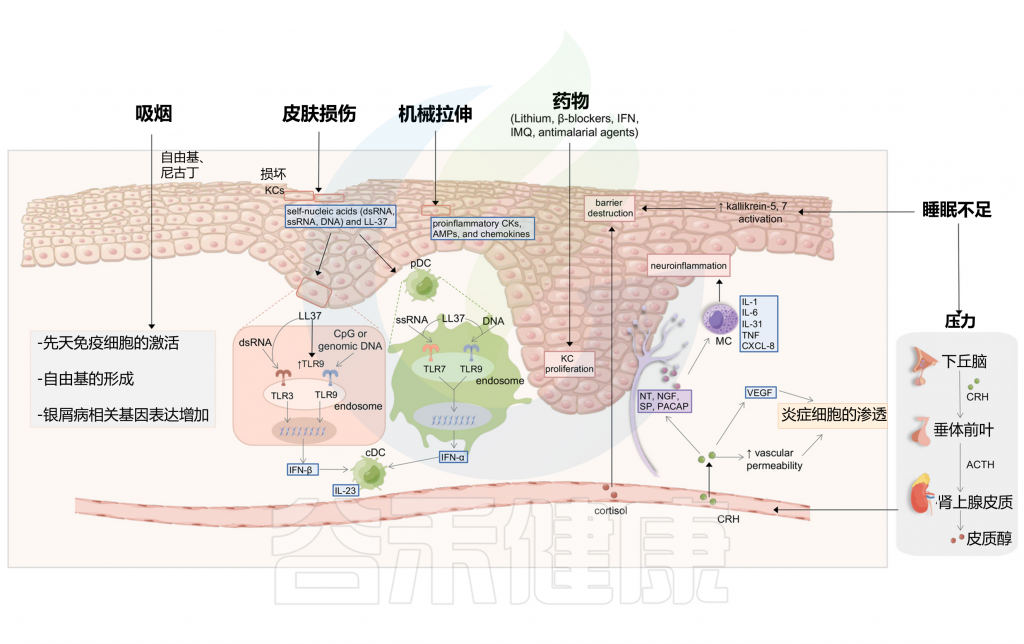
Liu S, et al., Cell Communication and Signaling, 2024
科布内氏现象与银屑病:皮肤损伤诱发疾病
皮肤创伤或压力可引发银屑病,称为科布内氏现象(Koebner phenomenon,KP)。
注:科布内氏现象,也称同形反应,是指在某些皮肤病患者健康皮肤区域受到损伤后出现的与原发皮肤病相同的皮损。
拔罐疗法与银屑病:传统治疗方法的争议
拔罐疗法作为一种传统的中医药,曾被用于治疗银屑病,但现在却存在争议,因为一些银屑病患者通过同形反应产生局部皮肤病变,而没有达到预期的治疗效果。
在银屑病患者中,拔罐治疗会导致拔罐部位出现同形反应,而Hijama(中东国家进行的一种湿拔罐)只会导致切口区域出现同形反应。
皮肤损伤激活角质细胞和免疫细胞参与银屑病发病
在皮肤损伤过程中,受损的角质细胞释放自身核酸,包括dsRNA、单链RNA(ssRNA)和DNA,并诱导LL-37的表达。
LL-37能够通过TLR7或TLR9在浆细胞样树突状细胞(pDC)中识别ssRNA或DNA,这最终导致IFN-α的分泌。LL-37暴露也可以通过DNA-LL-37复合物非依赖性机制或通过TLR3对dsRNA的识别诱导IFN-β的产生。对于前一种机制,LL-37增加TLR9的表达,从而促进TLR9配体的识别,如CpG或基因组DNA。浆细胞样树突状细胞的IFN-α和角质细胞的IFN-β促进常规树突状细胞的成熟。银屑病在创伤部位的复发归因于创伤部位TRM细胞的积聚和再激活。
机械拉伸与皮肤损伤:银屑病病变潜在触发因素
一份病例报告描述了一名患寻常型银屑病的妇女在插入组织扩张器后发展出新的银屑病病变。机械拉伸被怀疑会触发角质细胞释放ATP(5’-三磷酸腺苷),并随后产生Th17极化细胞因子,如前IL-1β和IL-6。被释放的ATP也可以激活表皮兰氏细胞。
在小鼠皮肤扩张模型中,观察到表皮过度增殖、皮肤屏障功能受损以及表皮角质细胞中银屑病相关细胞因子的上调。在人类角质细胞中,连续拉伸可以导致银屑病相关促炎细胞因子、抗微生物肽和趋化因子的产生。
除了拉伸,角质细胞的抓伤损伤可以通过细胞因子或趋化因子CCL20触发科布内氏现象,在较小程度上,这种触发作用与抓痕线数有关,也与CXCL8有关。
吸烟强度和持续时间与银屑病有关
与普通人群相比,银屑病患者中吸烟患病率更高,并揭示了吸烟开始和戒烟对银屑病的因果影响。吸烟强度和持续时间可能对银屑病的发病率具有剂量依赖性影响。作为银屑病发展的一个独立风险因素,吸烟对银屑病患者有许多负面影响,包括较高的PASI评分、指甲受累增加和心血管疾病的发展。
吸烟可能通过炎症、氧化和遗传机制引发银屑病
尼古丁通过释放炎性细胞因子刺激先天免疫细胞,如DC、巨噬细胞和角质细胞。此外,吸烟会引发自由基的形成,从而激活银屑病相关的蛋白质信号通路。
吸烟上调银屑病相关基因表达
在遗传学方面,吸烟上调银屑病相关基因的表达,包括HLA-C*06:02、HLA-DQA1*0201和CYP1A1。
烟草与银屑病:保护作用or风险因素?
最近的一项研究阐明了烟碱受体基因CHRNA5在银屑病的发展和发病机制中的作用。沉默的CHRNA5可以抑制人类角质细胞的增殖和迁移。有趣的是,吸烟也会增加普通人群患银屑病的风险,但吸烟在银屑病患者中表现出保护作用,这被称为“吸烟悖论”。然而,最近的一项孟德尔随机化研究涵盖了105912名具有生活方式因素、生物化学和基因型数据完整信息的个体,该研究表明吸烟是银屑病的一个独立风险因素,但不是银屑病的因果风险因素。
睡眠障碍:促炎因子显著增加,影响表皮屏障,加剧银屑病
睡眠障碍通常是银屑病的危险因素之一。一个具有全国代表性的基于人群的数据集表明,当发生阻塞性睡眠呼吸暂停时,银屑病和精神分裂症的风险增加。睡眠不足可能通过失眠的心理压力改变屏障稳态和角质层完整性。研究人员发现,银屑病小鼠在睡眠不足后,促炎细胞因子(IL-1β、IL-6和IL-12)显著增加,抗炎细胞因子(如IL-10)减少。
睡眠不足也促进了银屑病皮肤中kallikrein-5和kallikrein-7的活性,从而影响表皮屏障,导致银屑病的发展。此外,皮质醇在失眠等一些睡眠障碍中会增加。皮质醇刺激皮肤MC,破坏皮肤屏障功能,并上调促炎细胞因子,从而进一步加剧银屑病。
饮食因素在银屑病发病机制中的作用
73%的患者在坚持无麸质饮食三个月后出现临床改善,银屑病真皮中的Ki67淋巴细胞也减少了。
除麸质外,氯化钠(NaCl)摄入量的增加被认为对银屑病的发病机制有潜在影响(图3)。在高盐条件下,活化的p38/MAPK通路可以上调下游靶向活化T细胞核因子5(NFAT5)和血清/糖皮质激素调节激酶1(SGK1)。靶基因的上调可以驱动转录因子RORγt、IL-23R、IL-17A和IL-17F的表达,从而导致银屑病Th17细胞从初始CD4 + T细胞分化。SGK1对于通过Foxo1的磷酸化促进IL-23R表达和稳定Th17细胞分化至关重要。
银屑病与饮酒之间存在着复杂的多因素关系
银屑病患者的过度饮酒率高于普通人,酗酒会增加银屑病的严重程度并降低治疗效果。中重度银屑病患者的死亡风险也会增加,酒精是一个主要因素。然而,一项调查报告称,饮酒与银屑病的发展没有显著联系,孟德尔随机化研究也没有发现饮酒与银屑病之间的因果关系。目前还没有足够的证据来确定饮酒是否与银屑病的发病和复发有关。
许多药物都能引发银屑病,如锂、β受体阻滞剂、抗疟药、非甾体抗炎药、血管紧张素转换酶抑制剂、IFN、IMQ、特比萘芬、他汀类药物、贝特类药物和抗程序性细胞死亡蛋白1(PD-1)或抗程序性死亡配体1(PD-L1)抗体。在罕见病例中,TNF抑制剂也可能自相矛盾地诱发银屑病。
银屑病是锂的最常见皮肤不良反应
锂诱发和加重银屑病的发病率范围从3.4%至45%不等。
β受体阻滞剂治疗引发的角质细胞过度增殖及T细胞活性变化
当用β受体阻滞剂治疗时,负责促进细胞分化和抑制增殖的细胞内信使CAMP在表皮显示减少,最终导致角质细胞过度增殖。
此外,银屑病T细胞与对照组在蛋白酪氨酸磷酸化活性方面存在重要差异,蛋白酪氨酸激酶的诱导对包括淋巴细胞和角质细胞在内的细胞的激活和增殖至关重要。
抗PD-1/PD-L1诱导银屑病及潜在疗法
随着抗PD-1或PD-L1抗体在晚期恶性肿瘤治疗中的应用迅速增长,抗PD-1/PD-L1诱导的银屑病病例逐渐被报道。有研究者认为,PD-1的抑制通过加速表皮CD8 + 的浸润而促进皮肤炎症参与与角质细胞致病性串扰的T细胞。他们进一步证明了IL-6靶向疗法对抗PD-1/PD-L1诱导的银屑病的潜在疗效。
其他药物也通过不同的机制与银屑病有关
银屑病也可以由生物制剂引发
这被认为是一种自相矛盾的反应。一项研究显示,216例疑似TNF抑制剂诱导或加重的银屑病报告病例,英夫利昔单抗治疗银屑病的发生率更高,在克罗恩病和类风湿关节炎治疗的第一年最为普遍。对TNF抑制剂诱导的银屑病患者的回顾性分析也得出了一致的结果,表明英夫利昔单抗是主要的触发因子,而克罗恩病和类风湿关节炎是最常见的原发性疾病。这种自相矛盾的反应可能与通过抑制易感个体TNF活性而诱导的免疫改变有关。其发病机制也与IL-23/Th17轴参与TNF抑制的设定有关。
其中一个悬而未决的重大谜团是,在靶向TNF-α、IL-23和IL-17A/IL-17RA的生物制剂停用后,银屑病病变往往在相同的区域复发。目前最流行的观点是,现有生物制剂主要用于抑制致病性免疫细胞的活性,而不是完全消除它们。
地中海饮食(MeD),因为它具有抗炎作用。重点是增加蔬菜、橄榄油和豆类等富含营养和抗氧化剂的食物的消费,同时限制肉类和奶制品的摄入。
一项针对 3557 名银屑病患者的队列研究发现,与地中海饮食更一致的饮食模式与较低的银屑病严重程度相关。
一种方式是通过增加拟杆菌门细菌来降低F/B比例,从而帮助恢复短链脂肪酸的平衡,并促进丁酸盐的产生,这反过来又可以减轻肠道和全身炎症,对牛皮癣具有重要影响。
肠道中其他产丁酸菌包括Akkermansia和普拉梭菌,地中海饮食通过增加这些细菌也促进了短链脂肪酸的产生。
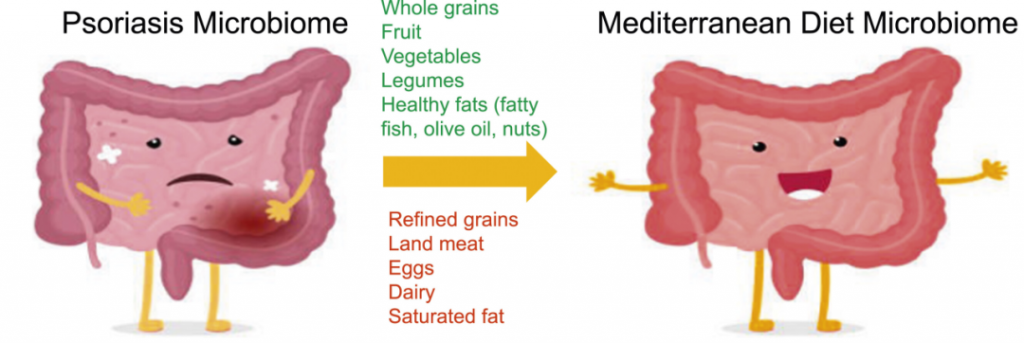
doi.org/10.1177/24755303241226626
食用特级初榨橄榄油含有高含量的多酚,已在健康患者中显示出能减少IFNy和IL7R的基因表达,表明减少银屑病患者炎症的潜在途径。
间歇性禁食可能为难以遵循低热量饮食的患者提供另一种策略。尽管关于这种饮食的研究仅限于斋月禁食,这增加了几个混杂因素,但总的来说有益处。以减重为重点的饮食改善可能的原因可能是由于腹部脂肪和脂肪率的减少,随后降低脂肪因子水平并减少银屑病进展所依赖的炎症。
血清脂肪因子之一的脂联素与PASI评分呈正相关,IL-22也是如此。肥胖加剧银屑病的机制因此可能是由于脂肪因子诱导Th-17相关细胞因子的增加。对于这些建议,应避免严重的饮食改变,以防止营养不良。低热量饮食和间歇性禁食可能推荐给有适当动机的患者。
无麸质饮食意味着避免摄入小麦、大麦和黑麦中的这种蛋白质,这对患者有益。银屑病患者食用无麸质饮食 3 个月后发表了积极结果,显著改善了PASI 评分。其他研究小组证实,一年的无麸质饮食可以改善抗麦胶蛋白肽 IgA 水平较高的群体的 PASI 评分。
高脂饮食破坏IL-23和胆汁酸信号通路的稳态,促进皮肤的γδT细胞浸润并增强其产生IL-17A的能力来诱发银屑病样皮炎。也会通过改变粘液屏障和肠道微生物群来加剧银屑病皮肤炎症,从而导致全身 IL-17 反应增强,从而加剧银屑病。
极低热量生酮饮食(VLCKD)可以显著减少炎症,是缓解肥胖银屑病患者症状的有效手段,可能与微生物群-肠道-皮肤轴有关,但无论短期还是长期都有一定的副作用。
鱼油已被加入到许多银屑病患者用来缓解症状的补充剂中。2014 年,对几项有关在银屑病患者中补充鱼油的研究进行荟萃分析发现,虽然一些研究显示了中等结果,但其他研究尚未发现任何相关性。
最近,在一大群个体(超过 25,000 名男女登记受试者)中,在他们的饮食中补充了维生素 D(2000 IU/天)和/或 omega-3 脂肪酸(1000 毫克/天),并且该组随访 5 年,记录了银屑病 与其他自身免疫性疾病的发病率。研究结果表明,在补充组中,包括银屑病在内的自身免疫性疾病的发病率降低了 22% 以上。
姜黄素是一种抗炎的天然化合物,口服后会在胃肠道中积聚,并可能通过调节肠道微生物群的微生物多样性和组成来发挥其调节作用。一项人类随机安慰剂对照试验,补充组每天接受6000 mg姜黄提取物,并在治疗开始时和8周后进行微生物群分析。大多数梭菌属、拟杆菌属、柠檬酸杆菌属、Cronobacter、肠杆菌属、肠球菌属、克雷伯菌属、拟副杆菌属和假单胞菌属在反应参与者中均匀增加。
产生丁酸的细菌数量和粪便丁酸水平增加,对银屑病患者口服补充姜黄素12周进行评估,结果PASI评分显著降低,IL-22血清水平降低。
在斑块型银屑病患者的局部光疗的同时口服姜黄素似乎可以诱导对治疗的更快、更渐进的治疗反应。考虑到这些炎症发病机制与银屑病受试者的发病机制相似,补充姜黄素可能代表了该病理管理的未来前景。
白藜芦醇是一种抗炎的非黄酮类多酚化合物。在小鼠实验中也发现了白藜芦醇对肠道菌群的有利效果。口服白藜芦醇能够增强肠道屏障功能,同时减少通透性和炎症。白藜芦醇治疗后肠道菌群拟杆菌属、Alistipes、Rikenella、Odoribacter、Parabacteroides和Alloprevotella分类的丰度水平增加,白藜芦醇治疗恢复了小鼠的菌群失调。
此外,白藜芦醇的给药,8周内每公斤400毫克白藜芦醇,增加了高脂饮食喂养的大鼠中产丁酸菌Blautia和Dorea。因此,白藜芦醇补充可能改善患者肠道微生物多样性。
槲皮素是一种植物黄酮醇,它可能存在于各种水果、蔬菜、叶子、种子和谷物中。以其抗炎、细胞保护和免疫抑制特性闻名。
最近的一项研究针对亚甲基丙烯酰亚胺诱导的小鼠,探讨了槲皮素补充(30、60和120 mg/kg)的效果,显示PASI评分显著降低,银屑病斑块改善。此外,槲皮素成功降低了小鼠血清中的TNF-α、IL-6和IL-17水平,加强了抗炎效果。
此外,研究表明口服补充槲皮素,减少了亚甲基丙烯酰亚胺诱导的小鼠类银屑病样皮炎,显著降低了角质形成细胞的增殖和异常分化,以及炎症细胞的浸润。口服槲皮素后,观察到IL-23/Th17轴上的细胞因子表达降低和Th17细胞反应减少。
其他中草药如雷公藤等,也对银屑病患者有用,改善了他们的临床参数,可作为辅助治疗。
回顾性分析显示,83.7% 的银屑病患者在接受唾液链球菌K-12治疗 24 周后,PASI 评分改善了 100%,并且随着治疗持续时间的延长,疗效持续改善。
一项随机对照试验发现,持续口服婴儿双歧杆菌35624(B.fantis)可显著改善银屑病的进展,并降低C反应蛋白和肿瘤坏死因子TNF-α的表达,显示出免疫调节作用。人体微生物群的作用不仅限于粘膜免疫系统,还延伸到全身免疫系统。
在明确单一益生菌的作用机制后,益生菌的组合应用以及相应的标准和方法仍需探索。不同的饮食和环境,可能会导致肠道微生物群的差异。
一项为期12周的开放标签、单中心临床试验评估了益生菌[印度芽孢杆菌(HU36)、枯草杆菌(HU58)、凝结芽孢杆菌(SC208)、草绿芽孢杆菌(SL307)和克劳氏芽孢杆菌(SC109)]和精确益生元(低聚果糖、低聚木糖和低聚半乳糖)对接受局部治疗的银屑病患者的有效性。接受抗银屑病局部治疗和益生菌及益生元补充的患者,在疾病活动性的测量中表现更好,包括银屑病面积和严重性指数、皮肤病生活质量指数、炎症标志物和皮肤厚度。肠道菌群发生了有利的变化,转变为抗炎的特征。
喂食富含菊粉的高纤维饮食(HFD)降低了咪喹莫特诱导的皮炎的增厚和总严重程度评分,并降低了表皮厚度、炎症浸润,包括Ly6G+中性粒细胞和表皮Ki67+增殖细胞。
富含菊粉的高纤维饮食增加了拟杆菌门和拟杆菌属的相对丰度,增加了血清和粪便中丙酸盐的浓度。膳食菊粉补充剂部分通过丙酸盐改善银屑病样皮炎,可能是一种很有前途的银屑病辅助治疗方法。
当然,何时使用益生菌、益生元以及针对不同个体的精准应用,还需结合肠道菌群检测进一步研究。
FMT是纠正肠道菌群失调、重建肠道微生态平衡的方法。近年来,这种疗法已用于治疗牛皮癣、系统性红斑狼疮、肠易激综合征、帕金森病疾病等。
FMT治疗的效果取决于不同的疾病、移植的形式和数量、给药途径以及所使用的供体。
在一项为期五周的干预性临床试验中,一名患有斑块型银屑病和IBS的受试者通过内窥镜和结肠镜接受了两次FMT。身体表面积、PASI评分、皮肤病学生活质量指数、肠道症状和血清TNF-α水平在干预后都有所改善,没有观察到不良反应。
然而,在周围性银屑病关节炎患者中,FMT在治疗活动性疾病方面并不那么有效。FMT可能在减轻银屑病患者的疾病严重程度方面带来一些益处,但需要更多的临床试验来证明这一点。
其他相关预防干预措施,皮肤护理等详见我们之前的文章:
以上我们了解了银屑病发病和复发的危险因素和潜在病理机制。银屑病的发展是复杂的,可能是由多种触发因素引起的。这些触发事件可能在不同条件下独立发生,或者表现出累积或协同效应。因此,很难确切地将这种疾病归因于特定的诱因。
鉴于银屑病是由遗传基础上的环境风险因素引发的,疾病的预防和管理值得应有的重视。根据这些明确的触发因素,可以制定银屑病风险评估和疾病管理指南,有助于轻症或非典型病例的早期诊断和银屑病的精准管理。例如,感染史(不仅是化脓性链球菌感染,还包括这里列出的其他感染)、肥胖和高血脂水平、过度的心理压力、吸烟、睡眠障碍、高盐饮食、服用特定药物史都应被视为银屑病的风险因素。
从患者的角度来看,消除这些风险因素对于他们个人对疾病的管理至关重要。结合肠道菌群检测报告查看相关菌群超标或缺乏情况例如链球菌,AKK菌,产丁酸菌等,以及整体菌群平衡情况,对于疾病预警有着重要作用。通过及时调整生活方式、饮食习惯和适当药物治疗,可以有效地降低银屑病的发病风险,提高患者的生活质量。
从治疗角度来看,患者可能受益于早期治疗,包括但不限于结合菌群的抗生素治疗、标准化益生菌补充、抗高脂血症治疗等方式。了解触发因素在银屑病发病机制中的作用,与肠道菌群的关联,也将为开发针对银屑病发病和复发期间触发机制的新疗法提供线索。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Zhu Q, Wu K, Yang Q, et al. Advances in psoriasis and gut microorganisms with co-metabolites[J]. Frontiers in Microbiology, 2023, 14: 1192543.
Liu S, He M, Jiang J, et al. Triggers for the onset and recurrence of psoriasis: a review and update[J]. Cell Communication and Signaling, 2024, 22(1): 108.
Kranyak A, Haran K, Smith P, et al. The Mediterranean Diet as a Potential Solution to the Gut Microbiome Dysbiosis in Psoriasis Patients[J]. Journal of Psoriasis and Psoriatic Arthritis®, 2024: 24755303241226626.
Ryguła I, Pikiewicz W, Grabarek B O, et al. The Role of the Gut Microbiome and Microbial Dysbiosis in Common Skin Diseases[J]. International Journal of Molecular Sciences, 2024, 25(4): 1984.
Buhaș, M.C.; Candrea, R.; Gavrilaș, L.I.; Miere, D.; Tătaru, A.; Boca, A.; Cătinean, A. Transforming Psoriasis Care: Probiotics and Prebiotics as Novel Therapeutic Approaches. Int. J. Mol. Sci. 2023, 24, 11225.
Constantin, C.; Surcel, M.; Munteanu, A.; Neagu, M. Insights into Nutritional Strategies in Psoriasis. Nutrients 2023, 15, 3528.
Tampa, M.; Mitran, M.I.; Mitran, C.I.; Matei, C.; Georgescu, S.R. Psoriasis: What Is New in Markers of Disease Severity? Medicina 2024, 60, 337.
Zang C, Liu J, Mao M, Zhu W, Chen W, Wei B. Causal Associations Between Gut Microbiota and Psoriasis: A Mendelian Randomization Study. Dermatol Ther (Heidelb). 2023 Oct;13(10):2331-2343.
谷禾健康

链球菌咽喉炎是一种细菌感染引起的呼吸道疾病,可导致喉咙痛,喉咙痒。全世界每年有超过6亿人感染链球菌性咽喉炎。
链球菌咽喉炎是由化脓性链球菌(A族乙型溶血性链球菌)引起的,通常在患者咳嗽或打喷嚏时通过飞沫传播。
链球菌性咽喉炎的症状包括如下:
喉咙痛,扁桃体肿胀、发红,喉咙后面有白斑,发热,恶心想吐,头疼,浑身疼痛,皮疹等。
这些症状中有许多与病毒感染的症状类似。有这些症状的同时流鼻涕或咳嗽,更有可能是病毒感染,如普通感冒。
与普通感冒有所区分,最常见的链球菌咽喉炎症状是:突然出现喉咙痛,吞咽困难或吞咽困难,发烧以及扁桃体上有红斑。
链球菌咽喉炎的症状也可能与COVID-19的症状类似,COVID-19是由一种冠状病毒引起的。
如果因感冒引起喉咙痛,通常会在一两天后好转或消失。对于链球菌,喉咙痛持续存在,而且往往更加严重。
2019年2月发表在《科学转化医学》杂志上的一项新研究发现,基因变异和免疫力低下可能是一部分儿童反复遭受链球菌感染的原因。
当然,任何人都有可能患链球菌咽喉炎。但在以下符合以下条件的人群更容易得:
年龄:在5到15岁之间
季节:冬天或初春
环境:一大群人在室内封闭环境
兄弟姐妹,或者是同一班级的孩子中有人感染上了,其他人就可能会被传染,出现类似症状。
成年人中虽然少见,但与儿童接触的家长或其他成年人也可能会被传染。
如果怀疑自己或孩子可能患有链球菌性喉炎,建议去医院检查。医生诊断链球菌性咽喉炎的方法是进行快速抗原测试或咽喉培养。
两者都涉及在喉咙和扁桃体的背面擦拭无菌棉签以获取分泌物样本。
通常,医生会先进行快速抗原测试。通过在喉咙中查找,在几分钟内检测出链球菌。
如果测试结果呈阴性,但医生仍怀疑是链球菌,则下一步可能是咽喉培养。有些医生会根据当地规程同时进行两项检查。
从喉咙后部收集的样品在实验室中进行培养(繁殖)以发现细菌的存在。咽喉培养时间可能需要两天。
潜伏期:2-5天;
一般人经过治疗,会在10天内恢复正常。
由于链球菌性咽喉炎是一种细菌感染,因此需要使用抗生素。不过需要注意的是,使用抗生素后,虽然症状会很快缓解,但仍需坚持服用一个疗程或遵医嘱。
另外,常规非处方药也有助于缓解症状。
补充疗法:
家庭疗法不能治愈链球菌性咽喉炎,但可以对抗不适。美国疾病控制与预防中心建议,简单的如喝蜂蜜,柠檬茶或用温盐水漱口,可以缓解症状,减轻肿胀。

也可以使用加湿器来增加空气中的水分,可以缓解干燥、喉咙痛,并缓解充血。

充足的睡眠。睡眠有助于身体抵抗感染,自主修复。

不吸烟,远离二手烟。香烟烟雾会刺激喉咙痛,并增加诸如扁桃体炎等感染的可能性。
避免油漆或灰尘刺激喉咙和肺部。
链球菌咽喉炎也会引起并发症(虽然不是很常见)。
如果细菌传播到身体的其他部位,就会导致所谓的侵入性感染。
并发症包括:
扁桃体周围有脓肿
颈部肿大的淋巴结
鼻窦感染
耳部感染
链球菌感染后肾小球肾炎
未经治疗的链球菌性咽喉炎也会引起风湿热,这是一种罕见但严重的感染,会对心脏造成损害(风湿性心脏病)。
链球菌感染和风湿热之间的联系还不清楚,但似乎是可以欺骗免疫系统。人体免疫系统转而攻击自己的组织,特别是心脏、关节、皮肤和中枢神经系统的组织,进而导致持续几周到几个月的炎症或肿胀。
其他与链球菌咽喉炎相关的病包括:
猩红热(A组溶血性链球菌感染引起的急性呼吸道传染病)
当A组链球菌产生一种毒素,导致典型的红疹时,就会发生这种疾病。猩红热的最初症状是发烧和喉咙痛。症状还包括寒战、呕吐或腹痛。
猩红热通常是一种轻微的感染。接触到A组链球菌的人通常需要两到五天的时间才会生病。
发病后一两天,颈部和胸部通常会出现红色凹凸不平的“草莓状”皮疹,然后蔓延到全身。皮疹约7天后消退。
熊猫病(与链球菌感染有关的儿童自身免疫性神经精神障碍)
根据美国国家精神健康研究所研究显示,当免疫系统对链球菌感染的反应错误地攻击大脑时,就会出现熊猫病。导致类似强迫症的症状和身体抽搐,通常是戏剧性的“一夜之间,突然发生”。
孩子们也可能变得喜怒无常或易怒,焦虑发作,或表现出与父母或所爱的人分离的担忧。
链球菌性咽喉炎具有高度传染性。当感染者咳嗽或打喷嚏时,通过空气飞沫传播细菌。
另外,接触携带细菌的表面,比如门把手,然后细菌就可能转移到其他人的眼睛、鼻子或嘴巴,其他人可能会感染链球菌咽喉炎。因此病人在咳嗽或打喷嚏时尽量遮住口鼻。

目前还没有疫苗可以预防,但可以通过一些措施减少感染。
· 建议经常洗手(可以随身携带一瓶洗手液),尤其在咳嗽或打喷嚏之后,烹饪食物或进食之前。
· 在病人用完杯子、盘子等餐具后及时清洗。
· 空调通风系统应注意清洗消毒。
· 病人在治疗期间(尤其是服用抗生素还没超过24小时的时候)尽量待在家里,不去公共场所包括学校,工作单位等地方,以免传染给其他人。
相关阅读:
主要参考资料:
Sore Throat. Centers for Disease Control and Prevention. August 30, 2019
Dan Jennifer M,Havenar-Daughton Colin,Kendric Kayla et al. StreptococcusRecurrent group A tonsillitis is an immunosusceptibility disease involving antibody deficiency and aberrant T cells.[J] .Sci Transl Med, 2019, 11: undefined.
Strep Throat: Diagnosis and Treatment. Mayo Clinic. September 28, 2018.
Vekemans J, Gouvea-Reis F, Kim JH, et al. The Path to Group A Streptococcus Vaccines: World Health Organization Research and Development Technology Roadmap and Preferred Product Characteristics. Clinical Infectious Diseases. September 1, 2019
PANDAS — Questions and Answers. National Institute of Mental Health. 2019
Strep Throat or Sore Throat? Best Ways You Can Tell. Cleveland Clinic. March 6, 2020
王亚莉, 孙丽娟, 刘桂兰. 儿童链球菌性咽炎的发病年龄、季节及诊治[J]. 人民军医, 2000(11):671-672.