 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


看过往期文章的小伙伴都知道,人体微生物群维持体内的共生关系,促进新陈代谢功能,抵御病原体,训练和发展免疫系统,直接或间接影响我们的大部分生理功能。
每个人都拥有属于自己的独特的微生物组,人与人之间这种显著的个体差异性是疾病易感性差异的潜在来源。
基因是从出生开始确定了,很大程度上伴随着人的一生,微生物组是否也是遗传决定的呢?
2018年的研究显示,家庭中的遗传血统或单个多态性变体在肠道微生物组组成中的作用很小(<2%),而微生物组多样性中超过20%的变异可以从共享的环境因素中推断出来,例如与饮食和生活方式。可见环境是影响微生物组的重要因素。
那么:
影响微生物组环境因素包括哪些?
环境如何对人类微生物组产生影响?
环境如何通过微生物组影响人的健康?
环境对人类微生物组的影响研究会有哪些挑战?
这对理解非传染性疾病的微生物基础带来哪些启示?
本文我们来详细阐述以上问题。
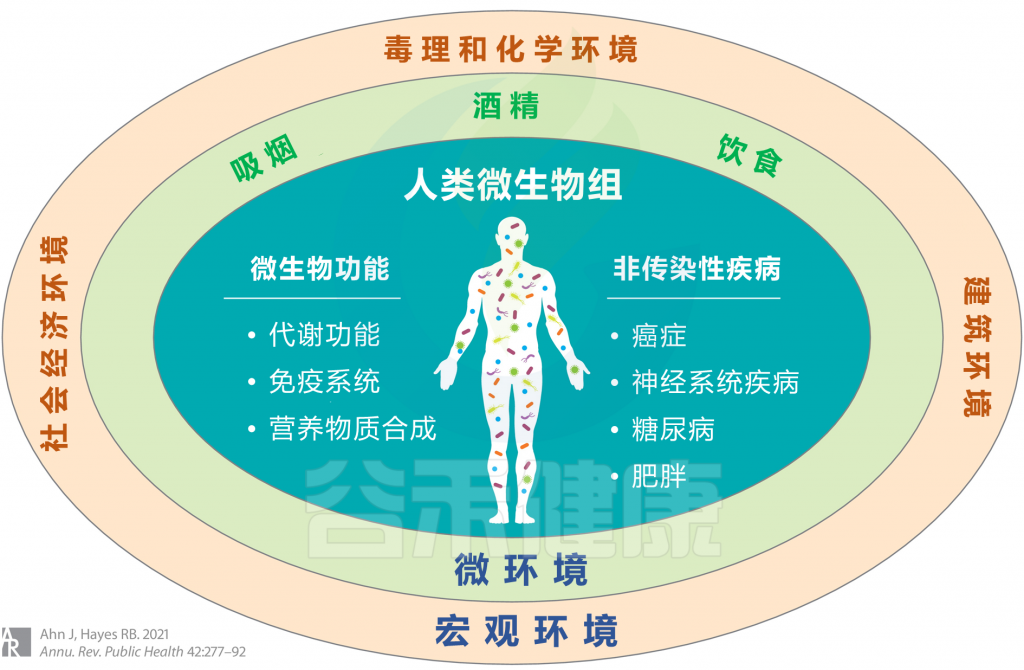
<从广义上考虑环境,涉及宏观环境和微环境,并考虑个人行为,包括吸烟,饮酒和饮食摄入等>

口腔消化道癌症
微生物诱发了至少60%的人类口腔消化道癌症,这表明控制微生物相关过程在预防和治疗口腔消化道癌症方面具有巨大的潜力。
流行病学研究一致报告口腔疾病与口腔消化道癌症(包括头颈部、食道癌、胃癌和胰腺癌)风险之间的联系。由于口腔疾病具有重要的微生物基础,这些观察导致了口腔微生物组与口消化癌的发生有关的假设。
基于大量人群的队列研究中的病例对照研究发现,用漱口水样本评估的诊断前口腔微生物组与随后发生的头颈部、食道和胰腺消化道癌症的相关。一些研究也明确指出了肠道微生物组梭菌属Fusobacterium和其他菌群与结肠癌之间的联系,以及肠道微生物组与炎症性肠病和结直肠腺瘤之间的联系。
微生物来源的信号通过不同的机制调节癌症的许多特征。一般来说,细菌不能直接诱发癌症;这一过程通常伴随着慢性炎症,并需要致癌信号通路的独立突变。
进一步的研究表明,微生物组与宿主之间的交互作用通过调节肿瘤微环境中的先天和适应性免疫功能,对口腔消化道肿瘤发生至关重要。
细菌-癌症模型提出,革兰氏阴性细菌促进致癌作用,因为脂多糖细菌外膜通过Toll样模式识别受体为先天免疫系统反应提供免疫原性刺激,导致由核转录因子NF-κB原瘤细胞因子释放、免疫细胞募集和活性氧释放引起的基因突变。
因此,微生物在形成肿瘤免疫微环境中的作用在癌症的发病机制中具有重要的潜在意义,特别是在口腔消化道。
神经系统疾病
肠道和中枢神经系统通过肠-脑轴相互作用,调节中枢神经系统功能,包括情感行为、认知表现、疲劳和睡眠。
研究表明,肠道微生物组通过影响肠-脑轴,可能在某些神经精神和神经发育障碍中发挥作用,改变行为,并可能影响神经系统障碍的发作和/或严重程度。
无菌小鼠和用抗生素治疗的小鼠表现出大量的神经免疫功能障碍和行为缺陷。主要在临床前模型中,肠道微生物组与大脑障碍有关,包括焦虑、抑郁、癫痫以及自闭症谱系障碍。
在人类中,胃肠道病理和神经精神疾病之间相互作用的证据已经在焦虑、抑郁和自闭症等情况中报告;然而,因果关系仍未得到证实。
揭示微生物组介导肠-脑连接的机制可能为靶向治疗肠道提供新的机会,以预防和治疗神经疾病。
糖尿病
大量的文献已经为肠道菌群在糖尿病前期和2型糖尿病病因学中的作用提供了证据。一份2020年的综述总结了40多项已发表的人类研究。
例如,在糖尿病前期研究中发现,基于肠道微生物群、炎症和免疫标志物的分子特征预测了2型糖尿病的发病。
两项开创性研究发现,2型糖尿病患者和非糖尿病对照组的肠道微生物组不同。
随后一项研究表明,2型糖尿病患者的肠道微生物群介导了用于控制糖尿病的二甲双胍的治疗效果。

还有研究人员开发了个性化饮食以优化2型糖尿病患者的血糖水平,同时考虑了个性化饮食习惯、体育活动和肠道微生物群。研究人员随后在一项盲法随机对照饮食干预试验中表明,应用这种算法可以改善餐后血糖反应。
目前面临的挑战是搞清楚,具体精确到哪些肠道微生物组组成部分,能驱动异质性、多因素、多器官疾病。
肥 胖
肥胖在全球范围内日益流行,导致过早死亡和许多慢性非传染性疾病。虽然肥胖的根本原因是能量摄入和输出之间的不平衡,但肠道微生物组成是导致体重增加的公认因素,当然还有其他机制,如遗传变异和表观遗传调节。


从野生型小鼠、肥胖小鼠或肥胖人类转移到无菌小鼠的肠道菌群实验表明,在该试验系统中,肠道菌群在体重增加和肥胖中起着关键作用,与肥胖表型的建立有关。这些实验结果引出了这样一个问题:
肠道的微生物组成是否会影响人类体重增加(无论是基因决定的还是饮食诱导的)?
一份早期的小规模人类样本报告与小鼠的研究结果一致,即肥胖状态与厚壁菌门(Firmicutes)的相对丰度增加和拟杆菌门(Bacteroidetes)的相对丰度减少有关。
然而,对人类的研究并没有证实这一特定模式:一些研究发现拟杆菌门(Bacteroidetes)的减少(但没有发现厚壁菌门(Firmicutes)的增加)与肥胖有关,而另一些研究则发现相反或未发现这两种门水平与体重指数(BMI)有关。
此外,研究已经确定了与BMI或肥胖相关的不同属和种水平的分类群。
点击此处查看 体重增长:目前为止我们所知道的一切
未来在动物模型和人类中的下游实验可以确定这些候选菌群是否在肥胖的病因学中起作用,如果是,建议干预肥胖的预防和治疗。
目前也有通过各种治疗方法(如益生菌、益生元、抗生素)改变菌群的潜力,微生物组是预防和治疗肥胖的一个不错的方式。


宏观环境
——毒理和化学环境
在人体中,消化道和呼吸系统是环境毒物进入和加工的主要途径。在这些器官系统中,人类微生物组丰富的代谢系统具有强大的转化外来生物化学物质的能力,有时与宿主的生物转化模式相反。
宿主代谢酶的典型特征是氧化和结合排泄,而微生物的酶反应主要是还原、水解和去甲基化,生成碳源进一步生长和分裂。
环境砷形态与心血管疾病和其他健康影响有关;证据表明,口腔消化道微生物组的甲基化能力可能会影响这些毒性。
肠道乳酸菌Lactobacillus对金属(如镉和铅)的固定化可能会影响金属毒性,降低重金属积累。
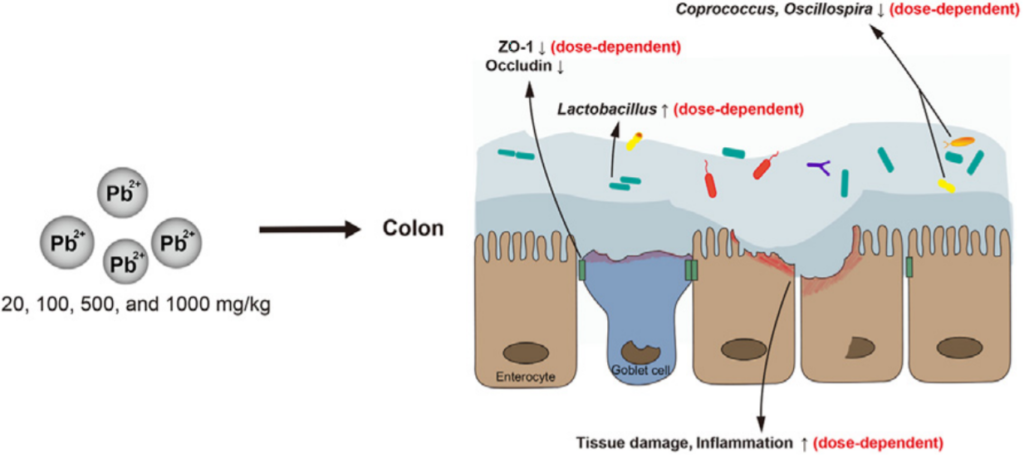
Yu.Let al., chemosphere2020
某些肠道细菌表达偶氮还原酶来代谢潜在致突变的偶氮化合物。个人护理产品中对环境具有持久性的化学物质,如三氯卡班(TCC)和三氯生(TCS)普遍存在,并与啮齿类动物微生物群的潜在变化有关。
肠道微生物群对化学物质(包括内分泌干扰物)的代谢会伴随微生物的失调:改变微生物群落结构,诱导特定细菌基因,改变微生物分子转化。此外,内分泌干扰物可以被吸收并运输到肝脏,然后被结合并通过胆汁分泌排泄回肠道,进一步进行微生物代谢。
酶如偶氮还原酶、酯酶、甲基酶、硫代还原酶、脂肪酶、硝基还原酶、β-葡萄糖醛酸苷酶、硫酸盐酶和β-裂解酶也参与环境化学物质的微生物代谢。
——建筑环境与新兴假说
建筑环境包括人类建造的所有建筑,包括家、工作场所、学校、车辆等。研究人员认识到许多微生物病原体可能存在于建筑环境中。
例如,细菌病原体,如结核分枝杆菌;真菌病原体,如烟曲霉菌Aspergillus fumigatus;致病性病毒,如鼻病毒和流感病毒,以及SARS-CoV-2冠状病毒等,均可通过在建筑环境中直接吸入传播。其他病原体,如艰难梭菌和粪肠球菌,以及诺如病毒和流感病毒,可通过皮肤或黏液接触传播给人,原因是病菌从表面传播。
除了直接的微生物传播,建筑环境中的微生物代谢产物也可能涉及人类健康,包括细菌和真菌毒素、细胞壁的致敏成分和微生物衍生的挥发性有机化合物。
室内空气和表面与灰尘和微生物化学产物有关。环境中相对湿度的增加导致灰尘和表面微生物代谢物的增加。室内潮湿和发霉条件(例如,可见的霉菌和霉菌气味)与许多不同的疾病状态有关,但建筑环境中微生物及其代谢产物的组成和浓度与疾病之间的联系仍然难以捉摸。

通过靶向细菌16S rRNA测序和宏基因组测序的应用,研究人员对建筑环境微生物生态的复杂性有了更全面的认识,包括可培养和非培养因子的多样性。认识到环境样品中微生物DNA序列的组成可能是由大量的不可活残留物组成的,环境微生物相关DNA表现出丰富的复杂性,反映了人类微生物来源,室内建造环境和人类来源的微生物来源之间的关系特别强。
卫生假说认为,卫生条件的改善可能与自身免疫性疾病的增多有关,这一概念也适用于有益菌暴露的概念。
研究人员研究了人类微生物组和建筑环境微生物组之间的相关关系,重点关注家庭环境,并绘制居住者和他们的家庭之间的细菌共享。这项调查表明,与表面有关的大多数细菌有很大的可能来自该住宅的居住者。暴露于室内灰尘中的复杂微生物群与患哮喘的可能性呈负相关。在另一项研究中,与没有接触到农业环境的儿童相比,接触到农场附近家庭灰尘并在农场积极参与工作的儿童患哮喘的风险有统计学上显著降低。

总之,越来越多的证据表明,建筑环境、微生物群和健康之间存在相互关系,但要了解建筑环境中微生物的生态和进化与人类健康之间的关系,还需要做大量的工作。
其他与建筑环境有关的著名假说也出现了。其中一个在文献中越来越流行的假说是野化假说,该假说认为,改变城市绿地使其恢复到更自然的状态,有可能改变环境中的微生物群,进而改变人类微生物群。对人和动物的研究表明,野化可能会影响微生物组和宿主的免疫反应。
除其他环境因素外,2018年的研究表明,吸入颗粒物空气污染会改变肠道微生物组的组成。
此外,日光暴露可以调节家庭灰尘细菌群落,这也可能表明阳光和紫外线辐射影响人体微生物群落组成,例如皮肤上的细菌群落。
微生物在皮肤老化中的作用模式
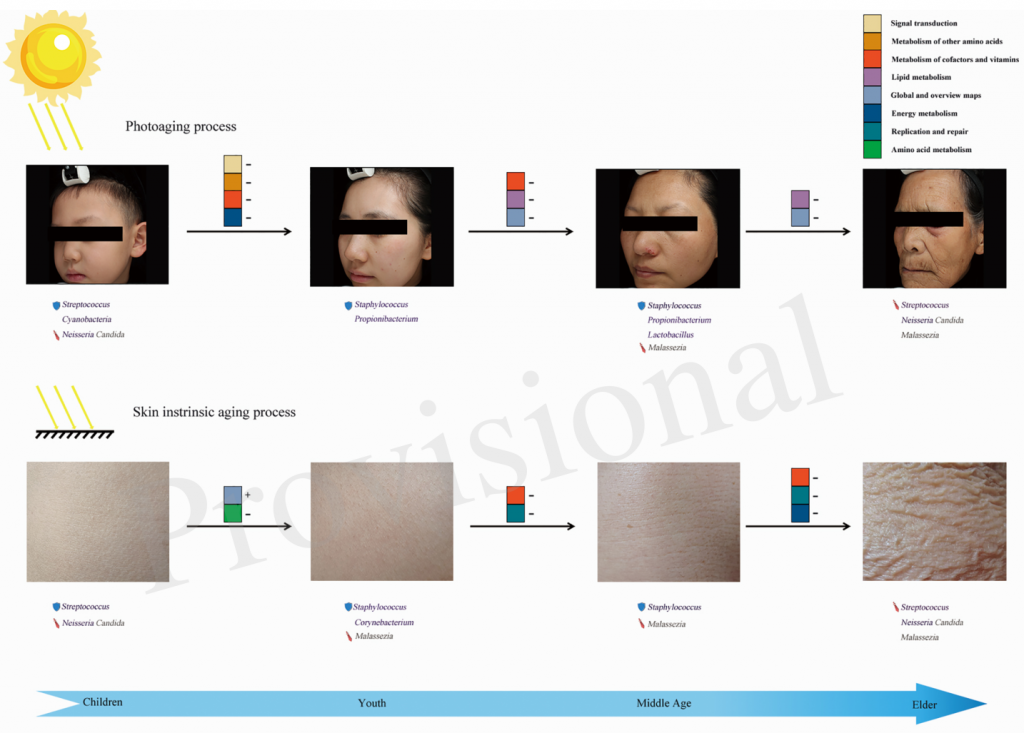

Li Zichao,et al., Front Microbiol, 2020
气候变化和极端高温也可能引发生理变化,可能有利于周围环境、食物或体内的某些微生物群。
此外,在应对将大量微生物菌群与无数已建立和新出现的暴露物结合起来的挑战时,将细菌宏基因组与环境暴露物结合起来的无针对性评估和发现可能是前瞻性研究议程的一部分。
——社会经济环境
较低的社会经济地位与多种与健康有关的行为有关,如获得医疗和牙科护理的机会减少,增加参与不健康行为(如吸烟和酒精依赖),减少对积极健康行为(如健康饮食和锻炼)的参与。低社会经济地位与较高的发病率和死亡率以及其他一些健康状况如肥胖、糖尿病和癌症的高发病率相关。
微生物群在调节社会经济地位和健康之间关系中的作用正在研究中。许多与低社会经济地位社区和生活方式相关的特征(例如,加工食品、久坐的生活方式、社会心理压力、暴露于污染物和内分泌干扰物)也与肠道微生物多样性减少有关。


研究已经检验了高社会经济地位和低社会经济地位群体之间微生物组成的差异。在美国,较高的社会经济地位与肠道微生物群中特定微生物的α多样性和种群丰度相关。
更好地理解微生物组在社会经济地位相关疾病易感性中的中介关系需要综合研究,包括调查社区和个人水平的暴露。建筑环境是考虑的一个部分。
微环境
——吸烟
香烟烟雾是大量有毒物质的来源,直接接触口腔和上呼吸道的细菌;这些毒物可以通过抗生素作用、缺氧或其他潜在机制扰乱微生物生态。由于吸烟而失去有益的口腔菌群可导致病原体定植并最终导致疾病;吸烟在微生物依赖性牙周炎的发病和发展过程中所起的既定作用有力地支持了这一论点。

实验室调查发现,与从不吸烟的人(变形菌门11.7%)相比,吸烟人群口腔微生物组的总体多样性降低,变形菌门的相对丰度降低(4.6%) (FDR q = 5.2×10−7)。
当前吸烟者体内三羧酸(TCA)循环和氧化磷酸化等微生物有氧代谢途径相关基因的丰度降低,糖酵解等非氧碳水化合物代谢途径的丰度增加。
当前吸烟者所消耗的其他途径包括与甲苯、一硝基甲苯、苯乙烯、氯环己烷和氯苯降解有关的某些外来生物降解途径以及细胞色素P450的外来生物代谢。相反,多环芳烃(PAH)和二甲苯降解在当前吸烟者中富集。这些化学物质是香烟烟雾的组成部分,因此口腔菌群降解这些物质的能力的改变可能会对宿主产生毒性后果。
除了创造一个厌氧、酸性和/或选择性有毒的环境,吸烟还被认为对人体免疫有显著的影响,这反过来可以影响宿主阻止病原体殖民的能力。
总之,越来越多的证据表明:
吸烟影响口腔微生物群的整体组成和许多种群丰度;吸烟可促进厌氧口腔环境和具有减少的异种生物降解能力的菌群。
观察性和介入性研究也提示吸烟者肠道微生物组的多样性降低,总的来说,变形菌门、拟杆菌门和梭菌属、拟杆菌属、普雷沃氏菌属呈上升趋势,放线菌门、厚壁菌门和双歧杆菌属、乳球菌属呈下降趋势。
可能解释吸烟对肠道微生物组影响的机制包括氧化应激增强、肠道紧密连接和肠道粘蛋白组成的改变以及酸碱平衡的改变。一些吸烟引起的肠道微生物组改变类似于炎症性肠病和肥胖等情况下的改变。应该进行进一步的研究来研究这种联系。吸烟会影响肠道微生物群,建议改变其组成。吸烟和肠道微生物组之间的相互作用可能有助于肠道和全身疾病的发展。
——酒精
酒精摄入可能通过几种方式影响人体口腔微生物群:
首先,口腔细菌和真菌将酒精和膳食糖代谢成致癌的乙醛,与香烟烟雾冷凝液相互作用,产生致癌的亚硝胺,并在实验上促进口腔癌变。无论是在体内还是体外,在吸烟者中,口腔微生物群有更强大的能力从乙醇中产生乙醛。
体外和动物实验也指出了口腔微生物群参与口腔癌变的可能机制,包括抑制细胞凋亡,激活细胞增殖,促进细胞侵袭,诱导慢性炎症,以及口腔多菌群中细菌和真菌的合作。
第二,酒精可能对细菌产生直接的细胞毒性作用。动物研究表明,摄入20%的酒精会增加变形链球菌Streptococcus mutans的定植,并显著减少大鼠口腔生物膜中可检测到的细菌种类。

在人类研究,饮用红酒与物种丰度降低以及龈下和龈上菌斑中某些厌氧菌的减少有关,而过量同时使用烟草和酒精与物种丰富度降低以及口腔粘膜生物膜中奈瑟菌Neisseria、Aggregatibacter和梭杆菌Fusobacteria丰度降低有关。
酒精除了直接作用外,还可能通过干扰宿主防御系统间接影响口腔微生物群,从而导致宿主介导的牙周炎。
大量以人群为基础的研究表明,每天至少喝一杯标准饮料会增加牙周炎15-27%的风险,并与糟糕的口腔健康有关。有证据表明,口腔微生物群与口腔健康状况密切相关。
酒精和肠道微生物组的研究主要是在大量饮酒的背景下进行的,酒精可能改变肠道屏障功能,导致肠道渗漏,产生促炎病原微生物产物,并扰乱肝脏代谢途径。
大量饮酒和肝硬化患者的研究表明,拟杆菌门细菌的相对丰度随着变形菌门的增加而降低,肝硬化患者中梭杆菌门的独特增加。
大量饮酒与肠道失调有关,而红酒作为膳食多酚的丰富来源,如果适量饮用,可能有利于改变胃肠道微生物群的组成。红酒多酚能显著增加变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的丰度,而杜松子酒则能显著减少这些细菌门。
——饮食
西方饮食的特点是高脂肪,高糖,大量食用红肉和加工肉类,大量食用精制谷物,而纤维摄入量较低。
许多研究表明,西方饮食与炎症、糖尿病、心血管疾病、肥胖、代谢综合征和癌症有关。而西方饮食有着广泛的生理影响,影响许多不同的细胞类型,如脂肪细胞,免疫细胞和内分泌细胞。
这个饮食习惯也与肠道菌群的变化密切相关,其特征是微生物多样性和物种丰富度降低,厚壁菌门增加,拟杆菌门减少。在属水平上,西方饮食显示双歧杆菌和乳酸菌减少,而肠杆菌增加。
纤维摄入量,是一个诱人的可改变的饮食因素,因为其假定有益的生物效应。一些研究表明,纤维可以预防2型糖尿病、心血管疾病、结肠癌和肥胖等疾病。纤维加速结肠运输,并可能减少结肠上皮细胞暴露于摄入的致癌物质。


此外,纤维经过微生物群发酵,产生短链脂肪酸如丁酸,对结肠能量代谢和上皮细胞增殖至关重要,在小鼠模型中,通过抑制组蛋白去乙酰化酶,显示出肿瘤抑制活性。因此,人们越来越关注膳食纤维对肠道微生物组成的影响,这可能最终影响一个人患癌症和其他疾病的风险。
高纤维饮食与更高的胃肠道微生物丰富度和多样性有关,特别是与普氏菌Prevotella和密螺旋体Treponema的丰富度有关,还与炎症信号的减少有关,对肥胖的保护,以及可能减少结肠直肠癌的存在。尽管短期饮食干预试验已经证明,不同数量的纤维摄入量可以在几周内显著改变肠道微生物群的组成,但很少有研究在人类中评估长期摄入纤维的饮食习惯对肠道微生物群的影响。
点此查看 你吃的膳食纤维对你有帮助吗
人类微生物组、健康、环境科学的这三个要素每一个都是复杂的,整合具有挑战。环境因素往往是复杂的;要考虑的环境因素众多,更不用说对微生物组的不断深入了解,难以全面把握外部环境如何在疾病发生率和死亡率中起因果作用。在现实生活中,这些因素通常相互影响,随着时间的推移是动态变化的。
化学毒物经常在混合物中出现,例如,与化妆品和内分泌干扰物的混合物。此外,在整个生命过程中暴露的风险可能随年龄而变化,即易感性窗口。由于这种复杂性,确定直接或间接影响人类健康和疾病的微生物特征仍然具有极大的挑战性。
需要新的方法来充分评价可能影响微生物组和人类健康的现有和尚未确定的因素。前瞻性队列研究是环境和人类健康研究的支柱,特别是因为这项研究设计在建立因果关系的自然时间序列方面很重要,而这在横断面或回顾性研究中往往很难理清。
对粪便样本和人体其他部位样本进行前瞻性收集,以及连续的纵向样本收集也只是在最近才达到一定规模。需要以大量人群为基础的队列,包括不同社会经济地位和地理群体等。

此外,环境和微生物组对健康状况的多维影响,加强了整合其他组学的需要,包括代谢组学、转录组学、基因组学和免疫组学。需要开发相关的数据集成工具和流程。
结语
以上强调了环境中通过影响人类微生物群与非传染性疾病相关的许多因素。必须考虑复杂的相互作用、上游因果因素和多种因果路径。以大数据驱动的技术正为微生物组研究和临床运用带来许多便捷。
随着深入研究,不久的将来我们会对环境,微生物组,健康三者之间的关系有进一步认识,结合公共政策领域,有效地从多方面去实现健康的改善。
相关阅读:
主要参考文献:
Li Zichao,Bai Xiaozhi,Peng Tingwei et al. New Insights Into the Skin Microbial Communities and Skin Aging [J]. Front Microbiol, 2020, 11: 565-549.
Ahn Jiyoung,Hayes Richard B,Environmental Influences on the Human Microbiome and Implications for Noncommunicable Disease [J] .Annu Rev Public Health, 2021, 42: 277-292.
Yu L, Yu Y, Yin R, Duan H, Qu D, Tian F, Narbad A, Chen W, Zhai Q. Dose-dependent effects of lead induced gut injuries: An in vitro and in vivo study. Chemosphere. 2021 Mar, 266: 129-130.
Hayes RB, Ahn J, Fan X, Peters BA, Ma Y, et al. 2018. Association of oral microbiome with risk for incident head and neck squamous cell cancer. JAMA Oncol. 4:358–65
Sampson TR, Mazmanian SK. 2015. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 17:565–76
Daisley BA, Monachese M, Trinder M, Bisanz JE, Chmiel JA, et al. 2019. Immobilization of cadmium and lead by Lactobacillus rhamnosus GR-1 mitigates apical-to-basolateral heavy metal translocation in a Caco-2 model of the intestinal epithelium. Gut Microbes 10:321–33
Gilbert JA, Stephens B. 2018. Microbiology of the built environment. Nat. Rev. Microbiol. 16:661–70
Rook GAW, Raison CL, Lowry CA. 2014. Microbial ‘old friends’, immunoregulation and socioeconomic status. Clin. Exp. Immunol. 177:1–12