 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

拟杆菌门细菌是革兰氏阴性菌的代表,具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。是最耐氧的厌氧菌之一。
参与人体结肠中许多重要的代谢活动包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
多糖而不是单糖是拟杆菌的主要能量来源,拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。
很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。但是,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
本文再次聚焦拟杆菌门,拟杆菌属,及其代表菌种多形拟杆菌(B.thetaiotaomicron),以多形拟杆菌讲述了一个基于动态环境下共生菌群或菌种与其他菌互作及其生存进化的复杂故事范例。请注意拟杆菌,不仅交叉喂养病原体,而且在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
拟杆菌属细菌属于人类肠道微生物群中最普遍和最丰富的成员。虽然偶尔充当肠道外的病原体,但这些细菌被认为是结肠腔和粘膜层的共生定殖者,并且长期以来已知可提供针对肠道病原体的定殖抵抗力。然而,基于粪便微生物组学的相关性研究经常会得出关于它们对宿主健康与疾病的贡献相互矛盾的结果,尤其在肠道感染中的作用比预期的更加微妙。
我们结合谷禾大量检测实践,越来越认识到拟杆菌介导的定植抗性背后的复制和矛盾性,以及不同肠道病原体利用它们来建立感染的可能性。
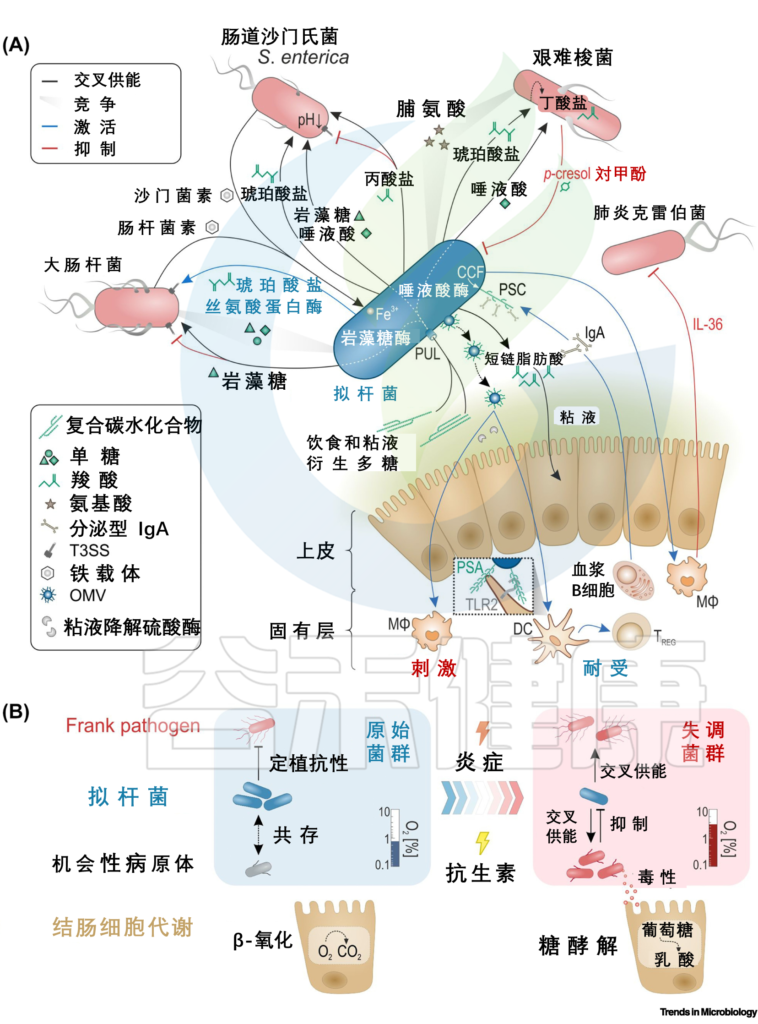
DOI: 10.1016/j.tim.2021.11.009
A) 互利拟杆菌属的相互作用。与肠粘膜以及与直接病原体肠出血性大肠杆菌(EHEC)和鼠伤寒沙门氏菌以及机会性病原体艰难梭菌和肺炎克雷伯菌有关。根据最近的文献汇编。肠道拟杆菌属也可能相互影响,例如,通过分泌的抗菌蛋白或通过某种“共享物”。
(B)通过病原体诱导(炎症)或治疗诱导(抗生素)破坏微生物群滋养免疫力,从原始微生物群向生态失调转变的简单化观点。
结肠细胞线粒体中的β-氧化会消耗氧气,造成管腔厌氧,而糖酵解则不消耗氧气,从而导致上皮氧合增加。拟杆菌属,不仅交叉喂养病原体,还在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
多形拟杆菌(Bacteroides thetaiotaomicron,B. thetaiotaomicron)是成人肠道的主要组成部分,已被用作研究人类细菌共生的有用模型。
降解植物多糖
它对人类的代谢不可忽缺功能是降解植物多糖,这是人类肠道非常重要的能力。此外,在产后母乳和富含植物淀粉的饮食之间的过渡过程中,这一点也有非常重要。
由于多形拟杆菌感应潘氏细胞发出微生物信号,它可以刺激肠道内的血管生成(从现有血管中生长出新血管)。B. thetaiotaomicron 通过为其他微生物帮助处理的营养物质提供足够的吸收能力来使其宿主受益。
塑造肠道粘膜屏障
多形拟杆菌介导的肠道内另一个出生后发育过程是肠粘膜屏障的形成,它通过调节物种特异性蛋白质抗生素的表达来帮助保护宿主免受病原体入侵。B. thetaiotaomicron 中存在的环境感知“调节装置”允许适应性食物寻找,从而稳定食物网,进而有利于群落的稳定和长寿。这种适应性“觅食”的能力是生物技术感兴趣的领域。
有异常大的“糖生物组”
多形拟杆菌是人类肠道远端的厌氧共生体,具有异常大的糖生物组,参与多糖获取和代谢的基因库。当膳食多糖受到限制时,这种糖生物组使 B. thetaiotaomicron 能够转向宿主多糖。B. thetaiotaomicron 不仅可以水解宿主衍生的聚糖,还可以主动确定肠道上皮细胞产生的聚糖的类型。
促进微生态系统稳定
B. thetaiotaomicron 诱导宿主衍生的聚糖可能具有适应性功能,为自身创造一个其他亲糖生物可以利用的生态位,从而促进生态系统的稳定性和功能多样性。这些独特的特征促使 B. thetaiotaomicron 被定性为关键物种。
B. thetaiotaomicron 可能稳定微生物生态以实现健康的宿主-微生物群关系的另一种机制涉及其能够诱导抗菌肽血管生成素,从而杀死机会性或致病性生物体,与此同时不能杀死 B. thetaiotaomicron 或其他共生体。
抵抗炎症变化
此外,B. thetaiotaomicron 通过过氧化物酶体增殖物激活受体-γ (PPARγ) 依赖性核因子-κB 亚基 p65 的核输出来抑制促炎基因的转录,从而潜在地抵抗可能破坏共生微生物群稳定的炎症变化。
例如,细胞毒性 T 淋巴细胞蛋白 4 (CTLA4) 阻断免疫疗法依赖于特定拟杆菌属物种(多形拟杆菌和脆弱拟杆菌)。这些结果表明,深入了解对拟杆菌类群的肠道微生物群特定成员的免疫反应,可能有助于为癌症治疗奠定基础。
“
根据微生物群滋养免疫概念,宿主应用栖息地过滤器来主动塑造其微生物群并维持互利共生状态。其中一种栖息地过滤器是上皮缺氧(关于这个详细的介绍我们在氧气与肠道共生菌那篇文章里讲过,详见:肠道漏氧会发生什么,健康的肠道是什么样?),这是成熟结肠细胞中线粒体β-氧化的结果。
粘膜表面的低氧浓度促进了专性厌氧细菌(包括拟杆菌属和一些产丁酸菌)的优势。反过来,这些细菌积极调节其肠道环境并影响宿主生理(例如,负责的免疫调节分子至少部分地通过外膜囊泡细菌表面衍生的双层球体,可以通过粘液屏障扩散)递送至真核靶细胞。
确保“正确的微生物”做“正确的事”
宿主栖息地过滤器不仅确保“正确”的微生物保留在肠道中,而且还确保它们做“正确的事情”。例如,血浆 B 细胞产生针对具有促炎潜力的拟杆菌表面结构的免疫球蛋白(主要是 IgA) ;这些免疫球蛋白减轻粘膜炎症,维持细菌分类群的多样性(关于IgA调节菌群多样性和菌定植的详细介绍可以参考我们以前的文章,详见对抗病原菌,帮助共生菌定植的“重要开关”),并调节拟杆菌代谢。
有趣的是,最近的发现表明某些拟杆菌属,增选 IgA 反应。例如,脆弱拟杆菌有意表达 IgA 反应性表面多糖C,使其被抗体修饰,从而改善粘液粘附,使细菌能够进入确定的空间生态位并促进与宿主的长期共生。
“
枢纽
拟杆菌属对宿主生态位的抢占、免疫系统的教育以及“益生菌”细菌的交叉喂养提供了针对病原入侵者的定植抵抗力。此外,拟杆菌与病原体竞争宿主来源的氨基酸(特别是脯氨酸和羟脯氨酸)和单糖(包括核糖、岩藻糖、阿拉伯糖、鼠李糖和果糖)并产生短链脂肪酸(SCFA),可以直接对抗发病机制。
从机制上讲,后者最好是丙酸盐,其质子化形式扩散到肠沙门氏菌(可能还有其他肠杆菌科)中,酸化受体的细胞质并减缓生长。此外,肠道拟杆菌属产生共生定植因子(CCF),即物种特异性碳水化合物利用系统,以强化肠道免疫屏障,保护宿主免受肺炎克雷伯菌定植和传播。
然而,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
肠出血性大肠杆菌(EHEC) 和其他病原体分泌的效应蛋白引起上皮炎症,在此过程中结肠细胞的能量代谢从β-氧化转向无氧糖酵解。这破坏了宿主栖息地过滤器,并开辟了新的生态位,这些生态位优先由肠杆菌科成员填充。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
反过来,艰难梭菌释放抑菌化合物来抑制革兰氏阴性竞争者(包括拟杆菌属)的生长。然而,拟杆菌属已经进化出适应与肠道发炎、菌群失调相关的新环境的机制。例如,多形拟杆菌,利用其“异铁载体利用系统”(由xusABC_操纵子编码)来劫持沙门氏菌和大肠杆菌。大肠杆菌铁螯合剂,使其在结肠炎期间能够接触到这种必需的辅助因子。
拟杆菌属对于肠道感染来说是一把双刃剑
在提供针对病原体入侵的初始定植抵抗力的同时,它们可以被相同的病原体利用作为炎症和抗生素治疗期间的“利基”指标和资源提供者。
截至目前,我们还不完全了解除了感染剂量之外还有哪些因素会导致这些接触的结果对宿主有利或有害,但随着微生物分子组学发展包括转录组学领域的最新进展可能会成为这个任务中的改变者。
“
以多形拟杆菌为例,因为多形拟杆菌是研究最广泛的人类肠道共生体之一。2001有研究就使用与多形拟杆菌单一关联的无菌小鼠,并通过DNA 微阵列分析全局宿主转录反应。发现多形拟杆菌定植后上调的宿主基因包括:
这些基因共同证明共生细菌可以帮助强化宿主上皮屏障。受与多形拟杆菌单关联影响的其他宿主基因涉及出生后成熟(腺苷脱氨酶)、营养吸收和代谢(SGLT-1、辅脂肪酶和 L-FABP)以及血管生成处理(血管生成素-3)的调节。这项研究证明了单一物种的共生生物如何恢复以前无菌宿主的许多结构、代谢和发育缺陷。
随着B. thetaiotaomicron基因组被测序了解后,人们对驱动这种共生关系的分子机制有了更深入的了解。B. thetaiotaomicron含有 4,779 个成员的蛋白质组,缺乏与已知粘附素同源的蛋白质。然而,它已经进化出两种外膜多糖结合蛋白(SusC和SusD)的163个旁系同源物、226个预测的糖苷水解酶和15个多糖裂解酶。
B.thetaiotaomicron的全基因组转录分析揭示,与在由基本培养基组成的肉汤中生长相比,当把B.thetaiotaomicron引入无菌小鼠肠道时,B.thetaiotaomicron表达不同的碳水化合物和葡萄糖(MM-G)利用基因。
通过比较采用标准富含多糖的食物饮食或缺乏可发酵多糖的简单糖饮食的无菌小鼠的细菌基因表达,发现富含多糖的饮食诱导了碳水化合物利用基因(如木聚糖酶、阿拉伯糖苷酶和果胶酸裂合酶)的上调,而仅葡萄糖和蔗糖饮食则导致参与从粘液聚糖中回收碳水化合物的不同基因子集的表达增加,如己糖胺酶、α-岩藻糖苷酶和唾液酸酶。这些基因还可以介导细菌附着于粘液聚糖,以避免细菌从肠道中流失。
在荚膜多糖合成(CPS)位点中发现了体外与体内生长期间以及饮食控制过程中另一个值得注意的基因表达变化,这表明B. thetaiotaomicron能够改变其表面碳水化合物,作为宿主免疫逃避策略改变聚糖觅食行为。
B. thetaiotaomicron讲述了一个基于营养代谢的宿主-细菌互利共生的复杂故事范例。具有从宿主无法消化的营养物质回收能量的能力为细菌维持在宿主肠道中的驻留提供了进化驱动力。尽管缺乏粘附细胞器,B. thetaiotaomicron可以通过其外膜聚糖结合蛋白的全部介导将自身附着到营养支架(食物颗粒、粘液层和脱落的上皮细胞 )上。
由于其灵活的聚糖觅食能力,当膳食多糖变得稀缺时,B.thetaiotamicron通过转向宿主多糖来赋予肠道生态系统稳定性。这种非常成功的人类肠道共生体已经进化出一个复杂而庞大的基因组,可以针对不断变化的营养环境调动功能多样的适应性反应,从而保证与宿主的永久和互惠关系。
“
铁是许多生物体和细胞的必需营养素和生长限制元素,同时也是促炎剂。在人体内,大多数铁与原卟啉 IX (PPIX) (PPIX) 形成亚铁或三价铁络合物,此处简称为“血红素”,它在 O2和电子的运输和存储中发挥着多种作用,并且在催化作用中。
在检测到入侵病原体后,作为人类和动物先天免疫反应的一部分,促生长铁以血红素和非血红素形式被螯合。因此,环境微生物和病原微生物,包括经过充分研究的假单胞菌属、卟啉单胞菌属和葡萄球菌属成员,都进化出了多种机制来释放和同化血红素和非血红素铁的不同化学物质。
虽然许多兼性病原体大量产生和消耗血红素铁,但大多数胃肠道厌氧菌是血红素营养缺陷型微生物。拟杆菌是许多健康胃肠道菌群中的优势细菌群。其中B. thetaiotaomicron是一种共生血红素营养缺陷型,是该群体的代表,该菌优先使用并最终以血红素形式超积累铁,但是似乎不会从添加非血红素铁中获得进一步的生长益处。
胃肠道微生物组可能拥有足够的铁储备,足以替代人类几天的典型营养铁需求,构成大量的铁储存库和潜在的贫血缓冲剂。生物信息学分析表明,hmu操纵子编码拟杆菌门成员中血红素摄取和代谢的厌氧机制,在拟杆菌门中广泛存在,但仅限于拟杆菌门。
来自该操纵子的基因同样广泛存在于从健康人类收集的宏基因组样本中。因此,我们预计拟杆菌,特别是hmu介导的血红素代谢将构成代表微生物组和宿主从宿主饮食血红素中调动铁的主要机制。这种机制必须是稳健的,因为粪便中检测到的血红素通常归因于宿主衍生的潜血,可以诊断下消化道出血 。
营养研究表明,与典型的植物源性非血红素铁复合物相比,血红素是人类膳食铁的生物利用度更高的来源;然而,即使是血红素铁也不能被宿主完全吸收,这表明它必须与微生物组共享。
拟杆菌门对血红素的优先使用可能使它们在胃肠道环境中具有选择性优势。血红素促进拟杆菌的强劲生长。由于血红素依赖性富马酸还原酶增强了富马酸向琥珀酸的转化,从而发酵葡萄糖。反过来,相对于另一个优势门厚壁菌门的成员,复含血红素密集红肉的宿主饮食与结肠微生物组中更大比例的拟杆菌门相关。
拟杆菌密集的微生物群和红肉饮食都与结肠癌的诱发有关。目前尚不清楚这些宿主病理是否与血红素或卟啉本身的促炎特性有关,它们是否是由微生物组中受血红素刺激的部分的其他代谢活动引起的,还是两者的某种组合。
简而言之,拟杆菌门在共生环境中优先积累血红素,而不是直接促进发病机制,反而可能导致物种失衡(生态失调)以及随后对宿主生态系统的生化破坏。
这些例子说明了肠道病原菌和拟杆菌属之间从稳态到病理学之间复杂的种间相互作用。这也是谷禾健康不断积累和迭代不同人群样本库,以及长期纵向追踪不同人群疾病发生或症状改善以及与微生物群的潜在因果关系的价值所在。通过研究更大、更多样化的人群,检查不同疾病甚至同一疾病亚型内的微生物群组成,我们可以更全面、更准确地了解微生物群反馈及其对健康的影响。
分析肠道微生物群不仅仅涉及检测单个细菌种类或属。确定每种细菌的正常阈值需要全面了解大样本全局微生物群落以及种间互作等。
附录:
以下为本门当中比较著名的种属及其所属的纲目
主要参考文献:
Bornet E, Westermann AJ. The ambivalent role of Bacteroides in enteric infections. Trends Microbiol. 2022 Feb;30(2), pp.104-108.
A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection. Cell Host Microbe, 24 (2018), pp. 296-307 e7
Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat. Microbiol., 5 (2020), pp. 304-313
Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature, 502 (2013), pp. 96-99

谷禾健康
一般在肠道菌群健康检测报告中,会有主要菌属构成比例,类似下图:
图源:谷禾肠道菌群健康检测报告我们可以看到图中列举了拟杆菌门,厚壁菌门…等。很多小伙伴拿到报告之后,对于这些细菌门表示困惑。
这些细菌门都代表了什么意思?
某个细菌门比例高了会怎么样?
某个细菌门比例高,是好是坏?
是不是与某些疾病相关?
…….
实际上,这几大类门的丰度和构成比例变化与人类健康和疾病发生息息相关。
两个主要门类,拟杆菌门和厚壁菌门,构成人类肠道细菌的大部分。七岁以后,拟杆菌和厚壁菌之间的比例相对稳定,而它们比例紊乱可能会导致肥胖和糖尿病等代谢综合征。
本文,我们就给大家详细介绍一下这其中最常见的几大细菌门:
拟杆菌门、厚壁菌门、变形菌门、放线菌门。
为什么选这四大细菌门?
依据自然属性分类,人类肠道菌群已经鉴定出细菌的几十个门,包括:拟杆菌门、厚壁菌门、变形菌门、放线菌门、疣微球菌门、梭杆菌门、蓝藻菌门、螺旋体门等。 但是其中98%的肠道菌可以归属为前四类,拟杆菌门、厚壁菌门、变形菌门和放线菌门,大多数人这4个门的菌占据肠道细菌数量的99%。 了解这四大细菌门,可以说你对大部分人体内肠道菌群的有了一定的了解。
▲ 拟杆菌 :革兰氏阴性菌
不形成孢子 厌氧菌 杆菌 ▲
它们具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。
包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
据估计,只有约 2% 的单糖通过上消化道到达结肠。因此,单糖可能不是拟杆菌的主要能量来源。然而,来自植物纤维的多糖,如纤维素、木聚糖、阿拉伯半乳聚糖和果胶,以及植物淀粉,如直链淀粉和支链淀粉,在结肠中更为普遍。
多糖还被证明可以诱导来自拟杆菌的多种葡糖苷酶活性,包括负责海带多糖降解的 β-1,3-葡糖苷酶活性以及多种 α、β-1,4 和 α、β–1,6 木糖苷酶和葡糖苷酶活性。大部分拟杆菌成员蛋白质组包括水解这些多糖的蛋白质。
表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。由但是,在短链脂肪酸存在下,弱酸性 pH 值会抑制生长。诸如脆弱拟杆菌之类的致病物种已经开发出逃避宿主免疫系统的策略。
作为多糖降解联盟的成员,它们有助于从膳食纤维和淀粉中释放能量,它们很可能是丙酸盐的主要来源;然而,它们也参与了蛋白质分解过程中有毒产物的释放,这个群体的成员有一些可能有助于抑制炎症的活动,但他们也有可能促进炎症,有些是已知的机会性病原体。

谷禾健康
有证据表明,从地球生命的开始,细菌就能够形成固着群落。尽管如此,科斯特顿(Costerton)等人创造了“生物膜”这个术语(Bill Costerton教授是世界著名生物膜专家,他首先在世界上提出了生物膜概念及理论),作为描述表面上各种各样微生物聚集体的一个简单表达,至今还不到50年。此后,环境微生物学家报告了几乎所有自然和工业生态系统中都存在生物膜。
就像在自然界中一样,微生物在人类栖息地中可以定居各种生态位。 称为生物膜的多细胞群落的主要定居形式是在人类组织表面。胃肠道是大量微生物的家园,它们的生活方式相互交织,但并不完全相同。
定义
生物膜
微生物在生长过程中为适应生存环境而形成了生物膜。微生物生物膜是由微生物群体及其包被的细胞外多聚物和基质网组成,它们彼此黏附或者黏附到组织或物体的表面。微生物生物膜与微生物的耐药性形成,基因的转移以及疾病发生的持续性感染等都密切相关。
长期以来,与粘膜组织接触的异常有害生物膜与人类疾病有关,包括外科植入物感染、牙龈疾病、导管引起的尿路和肺部感染以及一些肠道疾病。
然而,生物膜表型也有助于肠道内稳态、组织定植抗性、群落稳定性和恢复力、宿主防御成熟、食物消化和化学药物修饰。生物膜的这些有益作用尚未完全纳入我们目前对肠道微生物群的认识。
近年来有几项研究已经在成分、遗传和行为方面明确区分了粪便和粘膜附着的微生物群落。因此,粘膜多微生物群落对于寻找新的疾病生物标志物(例如,结直肠癌CRC和炎症性肠病IBD)尤其重要。
从相关性到这些疾病的潜在病因,将需要对粘膜群落进行进一步的研究,重点放在宿主与其自然生物膜表型下的微生物群之间的相互作用。
分类
目前对粘膜和粪便微生物群在微生物结果表明粘膜和粪便微生物群在微生物组成是不同的。粘膜生物膜的需要从粘膜取样推断,而不是粪便样本。
不同生态位的菌群构成也不一样。
在人类结肠中,健康人的结肠活检样本被薄薄的生物膜所覆盖,这些生物膜主要由拟杆菌科、乳酸菌科和肠杆菌科组成,位于右升结肠,拟杆菌科和乳酸菌科位于左降结肠。
健康成人的口咽组织通常定植有厌氧共生菌属,如:
韦荣球菌属Veillonella, 普氏菌属Prevotella, Leptotrichia 和 梭菌属Fusobacterium 潜在致病菌如 链球菌Streptococcus, 嗜血杆菌Haemophilus 和 奈瑟氏菌属Neisseria。
而在在小鼠小肠中,多糖和氨基酸的代谢有利于兼性厌氧菌,如变形杆菌和乳酸杆菌。小鼠结肠主要是富含梭状芽胞杆菌簇XIVa成员的粘膜群落(如羊肠球菌科和瘤胃科的物种),以及在较小程度上富集于拟杆菌科、肠球菌科和乳酸杆菌科的粘膜群落。
稳定性和弹性
除了分类学方面的考虑,微生物群的稳定性和微生物群的恢复力也是至关重要的。
从生态学的角度来看,生物膜内的这种持久竞争导致了整个群落的稳定,部分原因是可用生态位的划分。在多物种生物膜环境中,细菌之间的相互作用对群落的最终结果功能起着关键作用,因为一些生物体依赖于其他生物体的代谢活性生长。
实际上,从人类粪便样本中回收的拟杆菌、梭状芽胞杆菌、梭杆菌、金黄色葡萄球菌、普雷沃氏菌和韦荣氏球菌属的厌氧菌分离物在体外不同地粘附并形成单种生物膜。有趣的是,这项利用肠道相关分类群的研究表明,不会单独形成生物膜的细菌物种可以从与其他形成生物膜的强物种共存的混合生物膜群落中获益。
在抗生素治疗、粪便微生物群移植和益生菌定植后,粘膜相关群落可能在促进微生物群复原力方面发挥关键作用。我们可以期待关于生物膜生活方式在与肠道内稳态相关的微生物群的稳定性和恢复力特性方面的重要发现。
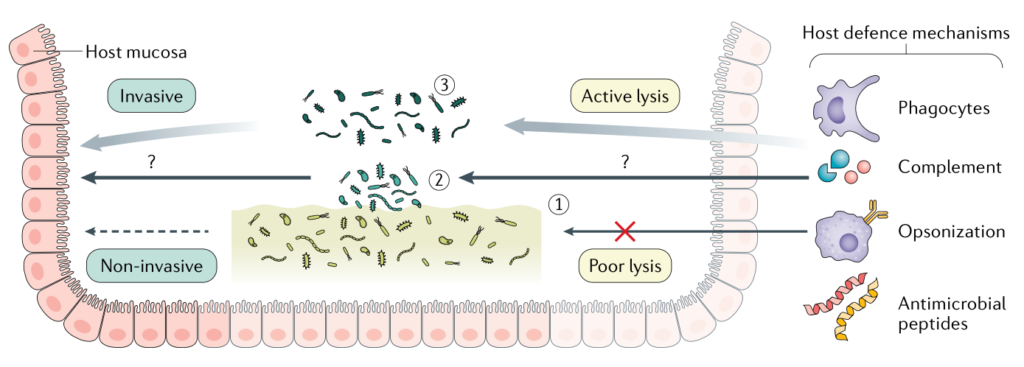
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
定植抗力
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
共栖物种确实拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸(SCFA)的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
共生体也在体内与病原体竞争营养物质、获取金属和封存残余氧。最后,共生菌株(特别是大肠杆菌)的生物膜表型驱动了对占据类似生态位的相关分类群如:为肠聚集性大肠杆菌和肺炎克雷伯菌的定植抗性。
多微生物和跨生态位相互作用
与胃肠道表面相关的微生物群包含所有4个生命域(古细菌、原核生物和真核生物)和病毒。肠道生物膜内的细菌相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,也可能在疾病中起着重要作用(称为失调)。
发生这种情况的机制在很大程度上虽然还不清楚,但是越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
随着测序技术的进步,微生物组成的变异在每个个体之间都可以观察到,在单个人体器官(如消化道)的景观中也可以观察到。利用显微镜和测序方法对小鼠和非人灵长类动物进行的研究表明,在不同的空间尺度和轴上,共生微生物群落确实在整个胃肠道的地理上是分层的。
最高的微生物密度通常出现在富含粘液的区域,靠近胃肠上皮和食物颗粒周围,在管腔中形成斑片状聚集体(下图)。因此,肠道生物膜利用形成凝胶的粘液层作为基质在活体中附着。
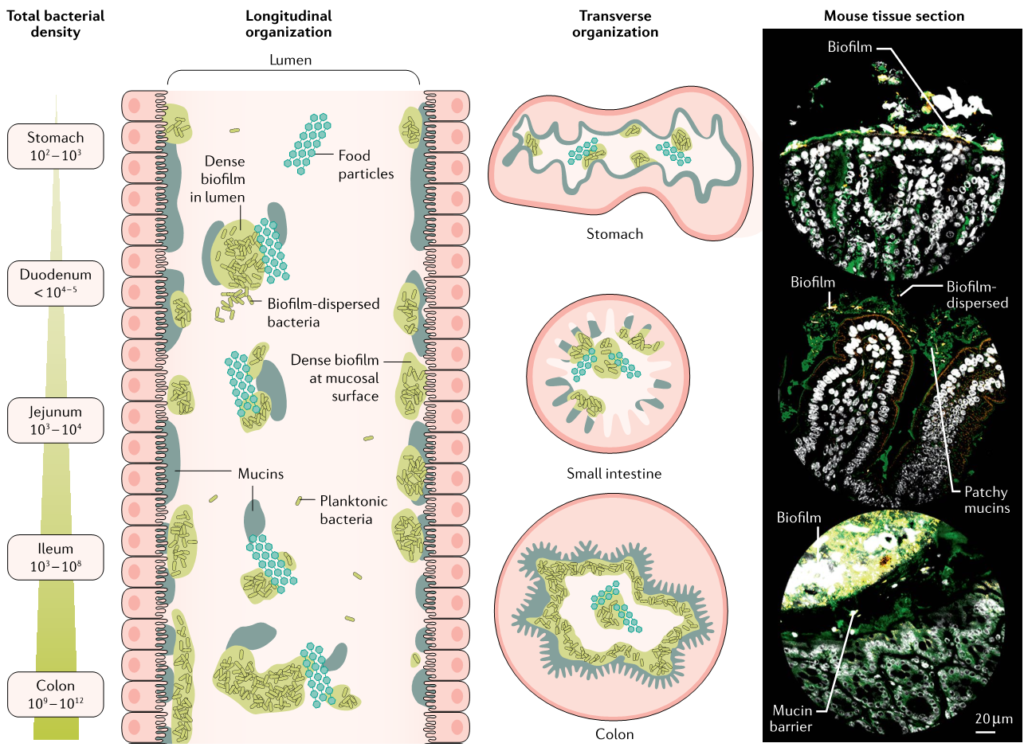
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
在微米尺度上,每个微生境都被混合类群的群落所占据,这些类群在物理上相互粘合。这个组织不太可能是随机的,尽管它的生物学重要性还不清楚。
总的来说,小鼠的生物地理学被认为受动态因素的控制,包括运动、粘液流量、胃肠道上皮细胞分泌、对宿主和食物颗粒的亲和力,以及微生物之间的生态相互作用。
粘膜相关微生物群的生物地理、组成和代谢活动也受到每日振荡的影响,这有助于使肠道生理在昼夜节律上同步。
现在,重要的工作仍然是精确描述整个胃肠道的微生物微生境,确定每个分类群在粘膜生物膜中的确切位置,以及更好地理解微生物生物地理学对肠道健康的生理贡献(下图)。
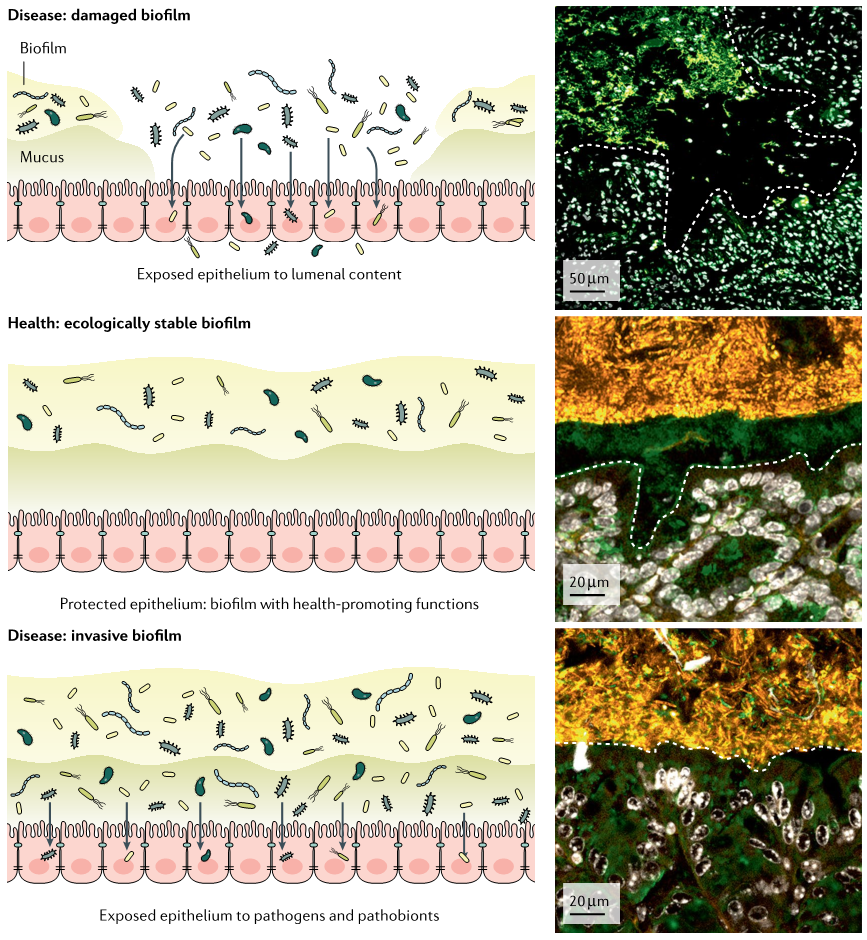
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
生物膜组分诱导宿主反应
肠道生物膜刺激独特的粘膜反应。宿主粘膜防御系统对肠道生物膜的每一个组成部分都有不同的识别和反应,即使这些分子可以隐藏在生物膜基质中。
在体内平衡的背景下,这些相互作用可能在培养宿主防御和塑造肠道生理学方面发挥重要作用。
多糖
生物膜基质可由参与多种结构和代谢功能的多糖家族组成。体外实验证明鼠伤寒生物膜以及其作为一个屏障,以防止非生产者的基质成分从进入已建立的生物膜。
植物乳杆菌Lactobacillus plantarum, ,伯克霍尔德菌Burkholderia cepacia和肠炎沙门氏菌亚种Salmonella enterica subsp分泌的多糖(也称为胞外多糖)。伤寒降低人和猪免疫细胞在体外的细胞因子产生并抑制趋化性和氧爆发反应和人类结肠组织外植体。 鉴定肠道生物膜在体内自然产生的多糖,并了解宿主对此类成分的反应,可能有助于开发新的疗法,以防止病原性生物膜在粘膜表面生长。
蛋白质
基质相关蛋白是体外生物膜基质的重要组成部分,其总生物量与多糖相当。它们具有结构功能,促进细菌扩散,保护宿主介质并参与细胞间的通讯。
作为生物膜生长的特定细菌的基质相关蛋白质组不同于同等浮游生物培养物的分泌体。例如,在生物膜中,毒力蛋白的表达上调,其表达谱在作为单一菌种生长的生物膜和带有白色念珠菌的多菌种生长的生物膜之间不同。
宿主对体内生物膜蛋白质组分的反应可分为先天性和适应性机制。天然反应和抗菌防御蛋白可通过激活甲酰肽受体介导,该受体可识别含有N-甲酰蛋氨酸衍生物的生物膜相关寡肽。
与同一病原体的浮游培养物相比,在生物膜的刺激下,对金黄色葡萄球菌的先天性和适应性免疫反应被证明是不同的,这在小鼠白细胞和兔子中得到了证实。这些研究表明,20种金黄色葡萄球菌生物膜特异性蛋白具有免疫原性,可引起特定的宿主反应。
有趣的是,一组微生物胞内蛋白(特别是核糖体蛋白、RNA聚合酶和精氨酸脱氨酶)包裹在体外生长的人肠道多微生物生物膜的生物膜基质中,也可以被肠上皮蛋白酶凝血酶切割。这一发现可能表明生物膜相关细菌利用宿主蛋白酶来切割包裹在生物膜基质中的微生物蛋白。
这种裂解的目的是激活还是降解微生物蛋白质还有待研究。然而,这一观察结果提供了一个潜在的基于蛋白质的生物膜——宿主信号传递的额外例子。
膜泡和疏水化合物
膜泡(也称为外膜泡)由细菌和古细菌释放,是其生物膜基质的重要组成部分。基质相关蛋白主要来源于膜囊泡,如铜绿假单胞菌生物膜。
膜泡的产生依赖于细菌的应激反应。膜泡在体内的假定生物学作用可能是保护分泌的细菌分子不被降解或充当抗菌剂的诱饵。与可溶性分子相比,铜绿假单胞菌膜泡在体外增强了人巨噬细胞的活化。
虽然在肠道生理学的背景下说明的不充分,但生物膜囊泡的研究有望增强我们对肠道生物膜成分对肠道内稳态的贡献的理解。生物膜基质中存在的其他疏水性化合物是糖脂和肽脂。
鼠李糖脂是一类糖脂表面活性剂(如粘蛋白和表面蛋白),存在于变形杆菌生物膜中。它们介导群菌(一种集体运动行为)并增加中的生物膜分散。葡萄球菌在体外产生的肽脂参与其生物膜表面的疏水性。这一过程有助于确定生物膜对环境分子的不可渗透性。
核酸
细胞外核酸在一些肠道相关菌属如大肠杆菌、柠檬酸杆菌、李斯特菌、肠球菌、链球菌、假单胞菌和奈瑟菌作为生物膜基质的结构支架发挥作用。它们促进水平基因转移,并有助于细菌粘附和聚集到表面。
铜绿假单胞菌生物膜基质细胞外DNA中的非甲基化胞嘧啶-磷酸鸟嘌呤(CpG)基序可触发人中性粒细胞TLR9的激活。体外实验证明,铜绿假单胞菌的胞外DNA与多糖结合形成阳离子受限的环境,以保护生物膜不被抗菌肽(AMPs)溶解。
致病性变形杆菌(P.aeruginosa和E.coli)分泌的RNA可通过膜泡到达宿主粘膜,抑制小鼠膀胱(尤其是尿路致病性E.coli)、人气道上皮细胞系和小鼠肺(尤其是P.aeruginosa)的免疫应答。
当一个细菌群落达到一个临界值时,细菌可以同步它们的新陈代谢,并参与类似群落的行为,形成生物膜。这种机制被称为群体感应。
群体感应由革兰氏阴性细菌中的两亲性小分子和革兰氏阳性细菌中的小肽介导。铜绿假单胞菌衍生的群体感应分子(例如,3-氧代-C12-HSL)可以改变免疫细胞和肺上皮及内皮细胞凋亡的体外细胞因子产生和趋化性。铜绿假单胞菌群体感应分子在肠道中的类似作用有待证实。相反,大肠杆菌通过群体感应途径识别肾上腺素和去甲肾上腺素等肠道激素。
阿片类物质(例如内啡肽和强啡肽)也能被小鼠体内的铜绿假单胞菌识别,并作为群体感应分子。有趣的是,去甲肾上腺素增强了短螺旋体粘附和附着于人类肠上皮细胞系的能力,这一特性可以解释人类体内肠螺旋体病期间结肠上皮上生物膜的形成。
其他几种肠道相关分类群,如:伤寒沙门菌Salmonella typhi,单核细胞增生李斯特菌Listeria monocytogenes,弗氏柠檬酸菌 Citrobacter freundii,阪崎肠杆菌Cronobacter sakazakii,粪肠球菌Enterococcus faecalis,幽门螺杆菌Helicobacter pylori,空肠弯曲杆菌Campylobacter jejuni,梭杆菌属Fusobacterium spp对人体肠道激素(如去甲肾上腺素)有反应,多巴胺和肾上腺素),直接影响动物模型的感染结果。
总之,宿主和肠道微生物生物膜之间通过群体感应途径存在着明显的跨生态位对话。未来对体内多微生物生物膜的研究将成为“微生物内分泌学”这一朝阳领域。
控制生物膜的宿主因素不仅取决于宿主的遗传和免疫状况,而且还取决于生物膜及其亚基因组的分类组成。宿主和/或微生物方面这种微妙平衡的改变可能是肠道疾病的主要驱动因素,并可能解释与许多肠道疾病相关的失调。
宿主-生物膜相互作用的相关因素:对肠道健康和疾病的贡献和意义

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
为了开发旨在恢复肠道内稳态的改良疗法,确定宿主组织控制粘膜表面肠道生物膜生长的因素和途径非常重要(下图)。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
粘蛋白
粘蛋白是上皮杯状细胞分泌的一类高度糖基化的蛋白质。它们是覆盖在肠上皮上的粘液屏障的主要蛋白质成分。这种粘液层的组成和屏障特性在胃肠道的不同部分有所不同(图2)。
共生细菌和病原细菌已经进化出几种机制,使它们能够粘附在粘液上,并相互竞争,利用粘液作为有益的栖息地。空肠弯曲菌和霍乱弧菌等病原体利用粘蛋白作为信号,促进毒力因子的表达,并诱导形成生物膜。
在健康的远端结肠中,粘液层由内层组成,内层致密,无细菌,牢固地附着在上皮上。松散粘附的外层容纳了大多数细菌群落。粘液层可能更紧密地附着于生物膜群落而不是肠上皮本身。因此,体内肠道生物膜可定义为粘液包埋、粘液粘附的微生物聚集体。
胃肠道自然含有非溶粘液细菌的分类群。由于粘蛋白的消耗需要大量酶活性的组合,非溶粘液性肠道细菌将共同受益于多微生物生物膜生活方式的代谢特性。最后,人们普遍认为胃肠道中的粘蛋白层阻止病原体以及共生体到达和接触肠上皮细胞。
然而,粘液层的组成,厚度和粘弹性沿胃肠道变化很大。微生物聚集体和上皮之间的接触在上肠道和近端结肠中很常见。体外研究表明,胃源性粘蛋白通过诱导鞭毛运动引起铜绿假单胞菌生物膜的扩散。
下消化道粘蛋白(如MUC2)在肠道生物膜上的确切作用仍有待澄清。虽然粘蛋白在防止生物膜与粘膜表面接触方面的作用在结肠中已被明确确立,但这种粘蛋白也可能对生物膜内的细菌种类有特定(但尚未发现)的作用。
抗菌肽
AMPs是一类广泛分布于自然界的宿主防御肽。它们由真菌、昆虫、两栖动物、哺乳动物和原核生物产生。大多数AMP是阳离子的,这种性质有助于通过破坏膜、形成孔隙、渗透和抑制细菌细胞内分子和酶以及抑制细胞壁合成来杀死浮游细菌。
AMPs在体外对多种药耐药和临床分离的细菌群具有很强的抗生物膜活性。它们通过减少生物膜对表面的粘附力、杀死嵌入的细菌或直接干扰生物膜形成的代谢途径,在体外分散生物膜。
体内实验的研究表明,防御素(例如,人α-防御素6)可以形成称为“纳米网”的自聚合结构,然后可以捕获细菌并防止其与肠上皮细胞物理接触。
有趣的是,这种聚合可以通过不同于肠隐窝和绒毛顶部的氧化还原条件进行微调。总的来说,AMPs可以被认为是对抗有害生物膜的传统抗生素的良好替代品。
硫化氢
硫化氢(H2S)是胃肠道炎症、稳态和修复的介质。肠道共生菌群是H2S的主要来源,其中一些作为能量来源。
此外,一些报告表明,微生物产生的H2S(由硫酸盐还原细菌以及其他肠道菌株,如大肠杆菌、梭状芽孢杆菌和肠杆菌)具有遗传毒性,可能在大肠癌和溃疡性结肠炎的病理生理学中起作用。另外,H2S的局部作用也会对肠道组织产生一些有益的影响。例如,H2S抑制NF-κB的活化,具有抗氧化活性,并抑制caspase-3的裂解,从而限制凋亡。研究还表明,H2S可保护健康的远端结肠生物膜组织。
根据一项体外研究,表明大肠炎患者炎症发作中存在微生物群衍生的H2S 可能与结直肠癌的发生有关。结肠上皮本身也通过胱硫醚-β-合酶、胱硫醚-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶产生H2S。
结肠内源性H2S生成已被证明有助于促进健康结肠微生物群生物膜的形成和粘液屏障功能。在结肠炎期间将释放H2S的化合物直接注入小鼠结肠可促进粘液的正常产生并恢复健康的微生物群生物膜。
有趣的是,大蒜中富含H2S的膳食化合物在体外对各种病原体(如伤寒杆菌、金黄色葡萄球菌、恶性疟原虫、布氏锥虫和白色念珠菌)具有抗菌、抗真菌和抗寄生虫的特性。
此外,一种释放H2S的抗炎药(Antibe therapeuticals)可降低IBD患者体内生物膜的毒性。然而,如果要在人类身上实现基于H2S的疗法的转化应用,还需要进一步研究H2S在生理肠道生物膜上的确切作用。
免疫球蛋白
肠腔分泌免疫球蛋白(特别是IgA)和微生物毒素并包裹细菌,防止其粘附在上皮细胞上。高亲和力IgA涂层表明炎症细菌的一个亚群,其侵入粘液层的能力增强,激活炎症小体途径,从而导致肠道疾病,如IBD。由于许多其他肠道相关细菌在其生物膜基质(例如,大肠杆菌和铜绿假单胞菌)中产生卷曲或卷曲样淀粉样蛋白,这种新的生物膜特异性免疫疗法有可能应用于多种致病性生物膜。
虽然细菌的生长通常受到IgA涂层的损害,但在体外,共生微生物可以被IgA涂层,而不会对其生长产生实质性的改变。事实上,IgA可以促进肠道内的微生物定植,因为肠道细菌(大肠杆菌和幽门螺杆菌)表达识别IgA糖蛋白基因的受体。IgA与这些表面受体的结合确实可以促进细菌与宿主表面的初始粘附,例如在牙菌斑生物膜中。
肠道上皮细胞表面的肠道生物膜形成(如人类细胞系单层所示)也通过向环境中添加分泌性IgA(但不是通过添加IgG)来帮助。相反,体外生物膜的形成是由IgA特异性蛋白酶阻止的。
因此,免疫球蛋白可以对肠道生物膜发挥免疫排斥和免疫包容功能。它们可以促进肠腔中的生物膜表型,同时防止浮游元素或最终生物膜分散元素侵入粘液层,接触并穿过上皮屏障。
蛋白酶体
存在于肠腔中的真核蛋白酶,例如从丝光绿蝇蛆中提取的糜蛋白酶,对细菌生物膜的形成具有负面影响。有趣的是,宿主胰蛋白酶样蛋白酶在小鼠泌尿道传播粪肠球菌生物膜的形成。
通过体内方法(小鼠模型)和体外人体肠道微生物群生物膜培养,上皮凝血酶被确定为结肠粘膜表面内稳态生物膜抑制的关键因子。以生物膜的基质相关蛋白骨架为靶点,例如通过蛋白酶引起的酶解,似乎是一种很有希望的方法来控制或根除医学和宿主表面的生物膜。
有趣的是,肠杆菌科如铜绿假单胞菌和大肠杆菌可以释放其生物膜基质中的蛋白酶抑制剂ecotin,以保护其免受中性粒细胞弹性蛋白酶的溶解。胃肠道含有多种来源的蛋白酶,其中许多蛋白酶的产生和活性在疾病条件下发生改变。
肠道生物膜有什么临床意义?
生物膜相关感染的临床相关性很重要,因为人体内绝大多数持续性感染源于生物膜。生物膜特征的改变与IBD、癌症和传染病有关,并与分类组成的改变、生物地理分布、抗生素耐受性或耐药性以及生物膜分散的病理生物出现有关。
生物膜是肠道微生物的一种自然生活方式,不一定是疾病的标志物,因此未来的治疗方向可能侧重于恢复宿主生物膜稳态,而不一定消除粘膜表面的生物膜。由于整个胃肠道的生物膜组织可能会有所不同,因此这些方法也需要区域特异性。
微生物生物膜群落有助于维持整个胃肠道内各个方面的稳态。然而,在某些临床情况下,这些生物膜需要保存或修复时破坏,而在其他上皮附着生物膜可能需要根除。因此,在尝试开发治疗性生物膜特异性控制策略方面花费了巨大的研究努力
胃肠道管腔化合物、生物膜和宿主之间的相互作用是复杂的,需要在健康和疾病方面加以考虑。
生物膜可以以多种不同的方式管理胃肠道管腔化合物。管腔化合物,无论是微生物、饮食分子、污染物还是外源性物质,都可以自由扩散穿过生物膜并到达宿主上皮细胞,或者被生物膜阻断,生物膜起着严密的屏障作用。这些管腔化合物也可以通过生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤的作用。
消化过程中产生的一些饮食分子、外源物质或污染物也可以通过生物膜工厂进行化学转化(下图),然后产生新的化合物,释放到宿主细胞附近。这些转化生物膜的化合物对宿主是有益还是有害,当然取决于生物膜的组成及其代谢。
最后,宿主和生物膜可能相互竞争的管腔化合物。因为生物膜与管腔的内容物接触更紧密,它可能比宿主有优势。然而,在上消化道,上皮的某些区域似乎与管腔化合物密切接触。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
综上所述,可以合理地认为,根据生物膜的组成,更重要的是根据生物膜的代谢,宿主识别的管腔化合物可能具有不同的性质和不同的浓度。当这些分子来源于健康的生态稳定的生物膜时,它们可能是有益的;当它们来源于不健康的不稳定的生物膜时,它们可能是有害的。因此,综合了解生物膜的组成、代谢活性及其空间分布具有重要意义。
结肠可被视为一个中央发酵器官,参与消化残渣的发生和加工。肠道微生物群可以改变几乎所有种类的膳食化合物,包括复杂的多糖、脂类、蛋白质和植物化学物质(图5)。早期观察表明,在粪便中心、粘液-粪便界面和食物颗粒附着的微生物群落上,细菌的生长存在差异。这些研究为生物膜表型对微生物结肠发酵的贡献提供了有用的信息。
肠道生物膜对未消化碳水化合物复合物(如饮食中的碳水化合物复合物以及与粘蛋白相关的碳水化合物复合物)的代谢可导致SCFA的产生,主要是乙酸盐、丙酸盐和丁酸盐。SCFAs的其他来源是氨基酸,如缬氨酸、亮氨酸和异亮氨酸,它们是由蛋白质分解产生的。
SCFAs在肠道中的生物学作用是多方面的:它们可以作为肠上皮的能量来源,有助于降低肠腔pH值,直接抑制病原菌的生长,促进T调节细胞的分化,改善上皮紧密连接的完整性。有趣的是,在喂食不同纤维来源的模型猪的肠腔中,SCFA的浓度从结肠的近端到远端减少。这一观察结果有些令人惊讶,因为远端结肠的细菌密度高于近端结肠。
生物膜表型为细胞在其环境中代谢氨基酸提供了有利条件,这一特性已在工业生物技术过程中得到利用。蛋白质的微生物代谢可导致最终产物的形成,如多胺(来自精氨酸、赖氨酸、酪氨酸或组氨酸)、H2S(来自蛋氨酸和半胱氨酸)、酚类和吲哚类化合物(来自色氨酸),以及N-亚硝基化合物(亚硝胺和亚硝胺)的产生,它们是动物模型中肠道肿瘤的有效诱导物。
维生素B12(一种用于DNA合成、脂肪酸和氨基酸代谢的关键维生素)和维生素K(一种用于合成凝血级联蛋白酶的关键维生素)是由肠道微生物群落中一小部分分类群合成的。假单胞菌属合成维生素B12的所有维生素体(也称为钴胺素),包括氰钴胺、羟基钴胺素、腺苷钴胺素和甲基钴胺素。
假单胞菌还利用维生素B12在生物膜形成过程中通过氧依赖途径合成蛋氨酸和核糖核苷酸。因此,在人类IBD中观察到的维生素B12的可利用性降低可以部分解释为在炎症过程中蛋白细菌的粘膜丰度增加和氧张力的改变。
维生素K缺乏症在接受大剂量抗生素治疗的人中发生得很快,这种缺乏症与严重的胃肠道损伤(出血和溃疡)有关。枯草芽孢杆菌的生物膜表型有利于体外特定的发酵途径,显著提高维生素k的产量。尽管生物膜对止血和粘膜组织本身的生理学至关重要,但生物膜表型对维生素K产生的贡献仍有待阐明。
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。尽管宿主的新陈代谢通常会将外源物质从体内清除,但肠道微生物可以将这些化合物用作营养和能源。
肠道微生物群确实可以直接代谢外源性物质(例如,胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
越来越清楚的是,肠道微生物群的代谢谱比人类细胞的代谢谱要大。不幸的是,在绝大多数情况下,具体的微生物或微生物群落,以及介导这些反应的酶,都是未知的。此外,胃肠道内的不同生境可导致不同的分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
生物膜生活方式在地球上的每一个自然栖息地中都占主导地位,包括胃肠道表面。然而,生物膜在医学上的概念只有50年的历史,不仅应被视为一种病理性慢性感染,而且应被视为一种生活在粘膜表面的微生物的普通生活方式。
微生物生物膜是许多肠道疾病病理生理学的核心,但它们也是肠道稳态发育的关键因素。肠道生物膜的调节可能是新疗法的关键。
我们需要将微生物生态学的重要概念转化为我们目前对肠道生理和宿主-微生物群相互作用的看法。这些概念包括微生物群稳定性、复原力和微生物生物地理学,并要求我们确定它们如何影响胃肠健康。有机会使用生物膜的代谢能力超过浮游生物培养中所描述的,以帮助代谢外来的优势。
未来的研究将有助于更好地了解肠道粘膜生境中多微生物的多样性和复杂性。这一认识构成了开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
为了迎接这一挑战,我们将受益于跨学科的合作,不仅是微生物学家、生理学家和临床医生之间的合作,而且还将受益于与生物物理学家开发临床相关的生物膜模型,生物信息学家分析大数据集,以及微生物生态学家的理论框架来理解这样一个异常复杂的栖息地。
相关阅读:
参考文献:
Motta Jean-Paul,Wallace John L,Buret André G et al. Gastrointestinal biofilms in health and disease.[J] .Nat Rev Gastroenterol Hepatol, 2021
Tomkovich, S. et al. Human colon mucosal biofilms and murine host communicate via altered mRNA and microRNA expression during cancer. mSystems 5, e00451-19 (2020).
Raffatellu, M. Learning from bacterial competition in the host to develop antimicrobials. Nat. Med. 24, 1097–1103 (2018)
Zmora, N. et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell 174, 1388–1405. (2018)
Rumbaugh, K. P. & Sauer, K. Biofilm dispersion. Nat. Rev. Microbiol. 10, 571–586 (2020)
Guilhen, C. et al. Colonization and immune modulation properties of Klebsiella pneumoniae biofilm-dispersed cells. NPJ Biofilms Microbiomes 5, 25 (2019).
Jalili-Firoozinezhad, S. et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat. Biomed. Eng. 3, 520–531 (2019).