 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

你是否有时会感到心悸、心慌、胸闷、气短、头晕、乏力?你是否有时感觉自己的心跳过快或过慢?
如果有上述情况,就要引起重视了,你可能存在心律失常。心律失常是最常见的心脏疾病之一,涉及到心脏的电活动节奏异常。根据发病机制和心电图特征被可以为不同类型,包括窦性心律失常、房性心律失常和室性心律失常。
长期熬夜,不健康的饮食,吸烟酗酒,压力大,过度劳累等各种因素都导致心律失常发病率越来越高和越来越年轻化。
与此同时,新冠肺炎的爆发也引起了人们对心律失常的关注。心律失常的治疗和预防,对于维持心脏健康和预防并发症的发生具有重要意义。
已有大量证据表明肠道微生物群及其代谢物对心血管健康具有重大影响,这为心律失常的治疗和预防带来了新的思路。

本文我们讨论了肠道微生物及其代谢物如何通过多种机制影响心律失常。目前公认的心律失常机制,包括结构重塑、电生理重塑、神经系统调节异常以及其他与心律失常相关的疾病。
最后介绍了与肠道微生物群相关的潜在的治疗策略,包括使用益生菌和益生元、粪便微生物移植和免疫调节剂等。
目录
1.了解心律失常
-心律失常的症状
-心律失常的分类
-发病率及高发人群
-心律失常的风险因素
2.心律失常患者的肠道微生物特征
-房性心律失常患者的肠道微生物
-室性心律失常患者的肠道微生物
-肠道菌群代谢物对心律不齐的影响
3.肠道微生物失调和心律失常的发生
-结构改造
-电生理重塑
-神经系统调节
4.其他疾病与心律失常的关系
-胃肠道疾病易诱发心律失常
-房颤患者易得胃肠道疾病
-与心律失常相关的其他疾病
5.心律失常的治疗
-饮食调整:多吃有益的脂质和膳食纤维
-补充益生菌、益生元
-药物与肠道微生物的相互作用
-粪菌移植
-免疫调节剂
-病因治疗和药物治疗
6.总结
以下是谷禾写过关于心血管疾病系列的文章,点击可查看:
-正文-
心律失常(cardiac arrhythmia)是指心脏电传导系统异常所引起的心跳不规则、过快或过慢等症状的总称。
正常心律起源于窦房结,频率60次~100次/分(成人),比较规律。窦房结冲动经正常房室传导系统顺序激动心房和心室,传导时间恒定(成人0.12~1.21秒)。
然而随着我国人口老龄化的进展和生活方式的改变,心律失常发病率快速上升,且呈年轻化和不断增长的趋势。
▼
心律失常的症状轻重不一,取决于发病的类型以及持续的时间,以及原发病的严重程度。
随着疾病的发生发展,患者发病早期可有心悸、出汗、乏力、透不过气等症状,此时,若心律恢复正常则无严重不适,若进一步发展可导致头晕、黑朦、晕厥,甚至猝死等。
▸ 心律失常可能伴随的症状
心律失常伴有明显的外周血流动力障碍时,还会出现相应器官受损的症状:
•脑:视力模糊、头晕、黑朦、晕厥等;
•胃肠道:腹胀、腹痛、腹泻等;
•肾:尿频、尿急、多尿等;
•肺:胸闷、气促、呼吸困难等。
▼
临床上根据心律失常的发生部位、机制及频率不同,可细分为许多种。
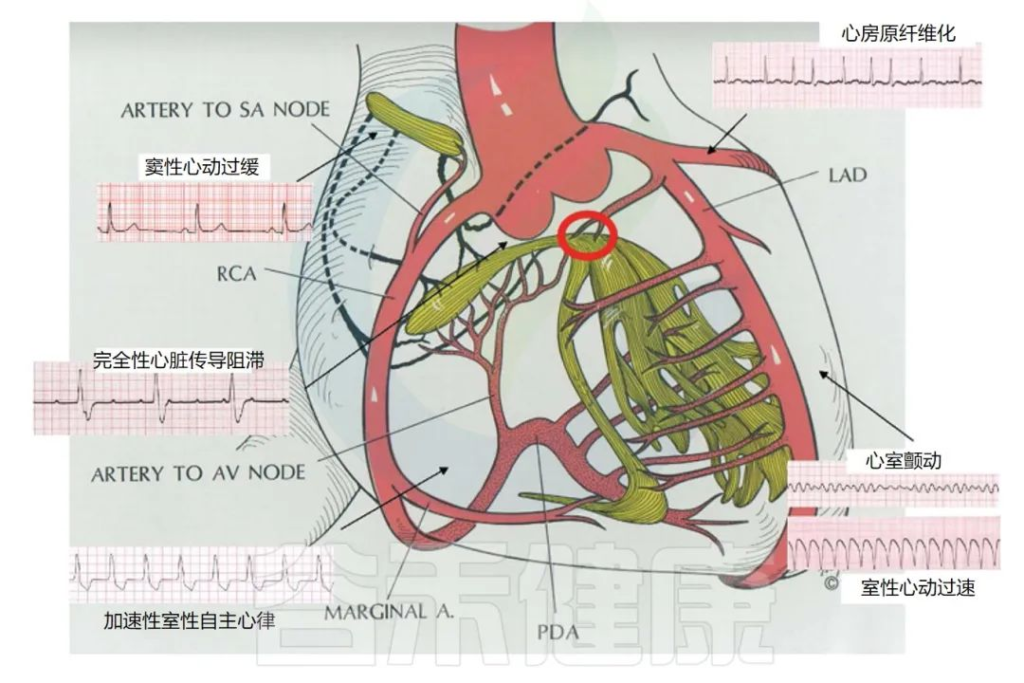
Frampton J,et al.Yale J Biol Med.2023
▸ 根据发病部位区分
按照心律失常发病部位可以分为窦性心律失常、房性心律失常、交界性心律失常、室性心律失常和束支心律失常。具体如下:
•窦性心律失常:包括窦性心动过速、窦性心动过缓、窦性停博、窦房传导阻滞、病态窦房结综合征;
•房性心律失常:包括房性早搏、房性心动过速、房室折返性心动过速、房室结折返性心动过速、房扑、房颤等;
•交界性心律失常:包括交界性早搏、交界性心动过速、房室传导阻滞等;
•室性心律失常:包括室性早搏、室性心动过速、室扑、室颤、室内传导阻滞等;
•束支心律失常:包括左束支传导阻滞、右束支传导阻滞、左前分支阻滞、左后分支阻滞等。
注:心房颤动(AF)是较为常见的心律失常。
▸ 根据发病机制区分
按发生机制可以分为冲动形成异常和冲动传导异常两大类:
•冲动形成异常:包括窦性心律失常,比如窦性心动过速、窦性心动过缓、窦性心律不齐、窦性停搏,还有异位心律失常,比如房性逸搏和逸搏心律,交界性逸搏和逸搏心律、室性逸搏和逸搏心律。
•冲动传导的异常:这种情况其实主要是包括传导阻滞,比如窦房传导阻滞、房室传导阻滞,另外还有完全性左束支传导阻滞、完全性右束支传导阻滞。
▸ 根据心律快慢区分
临床上常以心率快慢进行分类,分为快速型与缓慢型失常两大类。
•常见的缓慢型心律失常(心率<60次/分)包括:窦性心动过缓、窦性停搏、病态窭房结综合征、窦房传导阻滞。
•常见的快速型心律失常(心率>100次/分)包括:早搏、窦性心动过速、房性心动过速(心房扑动、心房颤动)、室上性心动过速、室性心动过速(心室扑动、心室颤动)等。▼
心律失常的确切发病率较难统计,根据研究数据显示,全球范围内心律失常的发病率大约在2%至4%之间,其中老年人中的患病率可能高达10%左右。
其中窦性心律不齐发病率最高,约占25%-27;窦性心动过速次之,约为20%-22%;窦性心动过缓,约13%-15%;室性早搏,约14%-16%;房颤,约11%-15%;房室传导阻滞,约5%-7%,其他各种心律失常约为5%-8%。
▸ 老年人和心血管疾病患者易发生心律失常
老年人和心血管疾病患者是心律失常的高发人群。
随着年龄的增长,心脏功能开始下降,心律失常的患病率也逐渐增加。
同时,存在高血压、冠心病、心力衰竭等心血管疾病的人群也更容易患上心律失常。
其他一些潜在因素,如家族史和遗传因素,也可能增加个体患上心律失常的风险。
▼
•年龄
随着年龄增长,心脏的功能会逐渐下降,从而增加心律不齐的风险。
•遗传
某些心律不齐类型可能与家族遗传有关,如果家族中有人患有心律不齐,那么你也可能面临较高的风险。
•心脏疾病
一些心脏疾病,如冠心病、心肌病、心脏瓣膜病等,可以增加心律不齐的风险。
•高血压
长期存在的高血压会对心脏造成损害,增加心律不齐的发生率。
•代谢紊乱
糖尿病、甲状腺功能异常等代谢紊乱疾病会对心脏功能产生影响,增加心律不齐的风险。
•药物滥用
某些药物(如某些心脏药物、精神类药物)滥用会干扰心脏的正常搏动。
•胸部手术
尤其是心脏手术、麻醉过程、心导管检查、各种心脏介入性治疗等可诱发心律失常。
此外,日常生活中也存在着很多诱发心律失常的因素,例如大量饮酒或咖啡、饮浓茶、情绪激动、剧烈运动等均可导致正常人发生快速性心律失常。
健康成年人体内存在数万亿微生物。值得注意的是,肠道微生物被称为与人类细胞基因组并列的“第二大基因组”。
几十年来,研究人员一直致力于探索心律失常的病因、机制和治疗方法。同时,不断更新的证据表明,肠道菌群不仅与人体健康和体内平衡维持密切相关,而且与包括心律失常在内的多种疾病的发生和发展密切相关。
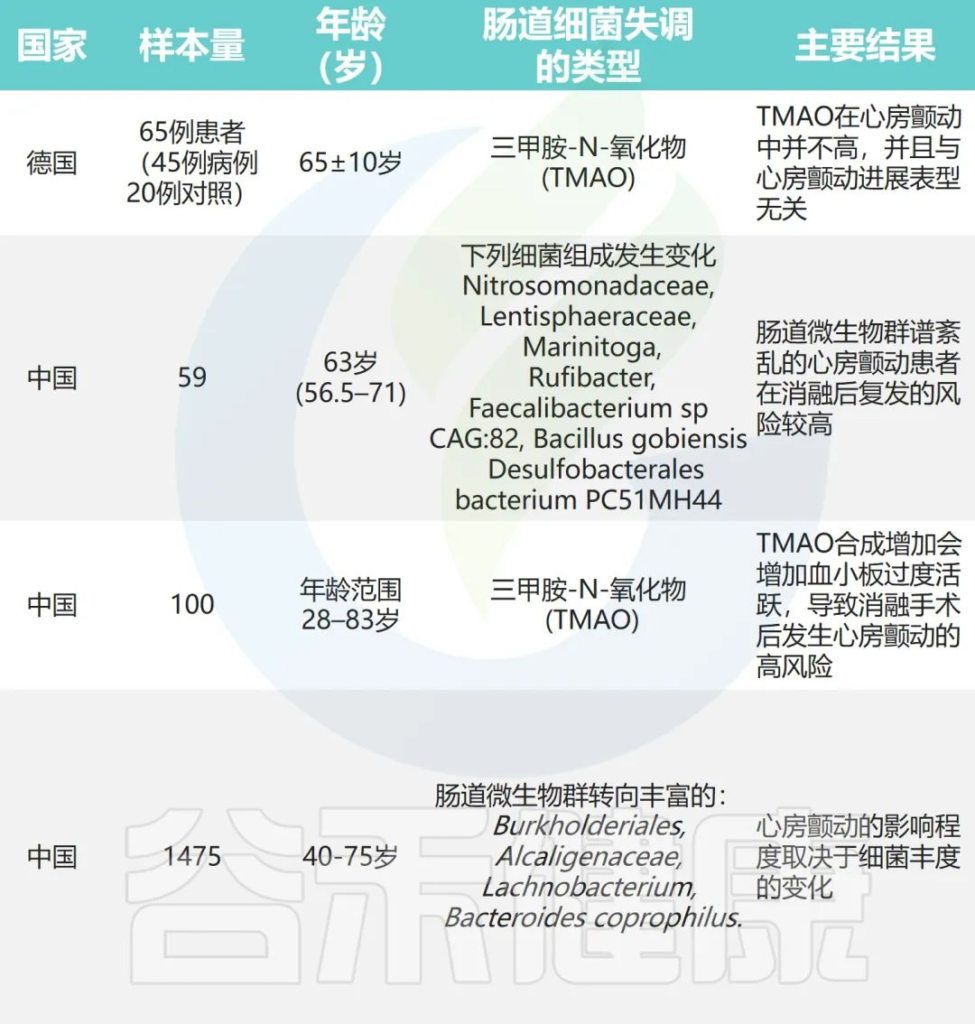


Rashid S,et al.Ann Noninvasive Electrocardiol.2023
▼
房颤,作为心律失常的一种重要类型。肠道微生物组与房颤的关系已得到初步认识,肠道微生物组及其代谢产物在心房结构重塑和电重塑方面与房颤的发生密切相关。
宏观基因组学和代谢组学分别作为研究肠道微生物组组成及其代谢物变化的重要研究工具,在探索肠道微生物组与心律失常的关系中发挥着重要作用。
最近,一些研究报告了与健康对照组相比,房颤患者中肠道微生物群变化的特征。
▷房颤患者体内有害细菌过度生长
使用宏观基因组学和代谢组学技术分析了50名健康对照者与50名房颤患者的肠道微生物群及其代谢物的组成。
研究发现,房颤患者的肠道微生物群中基因数量显著增加,样本内多样性(香农指数)也增加,这表明他们的肠道菌群具有更高的丰度和多样性。
较多的基因和属种表明房颤患者体内可能存在多种有害细菌过度生长。瘤胃球菌(Ruminococcus)、链球菌(Streptococcus)、韦荣氏球菌(Veillonella)和肠球菌(Enterococcus)等属在房颤患者中更为富集。
瘤胃球菌具有与炎症性肠病发展相关的促炎特性;链球菌在患有高血压、慢性心力衰竭和急性心血管事件的人群中也被证明是升高的。
来自日本的一项研究表明,与对照组相比,房颤患者的肠杆菌(Enterobacter)减少,而副拟杆菌(Parabacteroides)、Lachnoclostridium、链球菌(Streptococcus)和另枝菌属(Alistipes)增加。
▷胆汁酸、油酸含量显著下降
对健康受试者和房颤患者的粪便和血清样本进行代谢组学分析,其中胆汁酸、油酸、亚油酸和α-亚麻酸的含量显著降低。
研究表明,油酸、亚油酸和α-亚麻酸具有心脏保护作用,亚油酸和α-亚麻酸可以预防和终止由溶血磷脂酰胆碱或酰基肉碱引起的心律失常。
▷丁酸弧菌等有益菌的减少
心房颤动是一种进行性疾病。根据发作持续时间可分为阵发性房颤和持续性房颤。
采用宏基因组学和代谢组学相结合的分析方法来研究房颤持续时间与肠道微生物群之间的关系。
该研究包括20名健康个体、20名持续性房颤患者、12名房颤持续时间小于12个月和8名房颤持续时间大于12个月的患者。
与对照组相比,阵发性房颤组和持续性房颤组瘤胃球菌和链球菌等的丰度增加。丁酸弧菌属随病程呈下降趋势,丁酸弧菌属可产生短链脂肪酸并对宿主有有益作用。
粪弧菌属(Vibrio faecalis spp.)随时间呈上升趋势,粪弧菌可以极大地促进慢性精神分裂症患者发生冠心病。
心律失常组和对照组之间肠道微生物群的变化
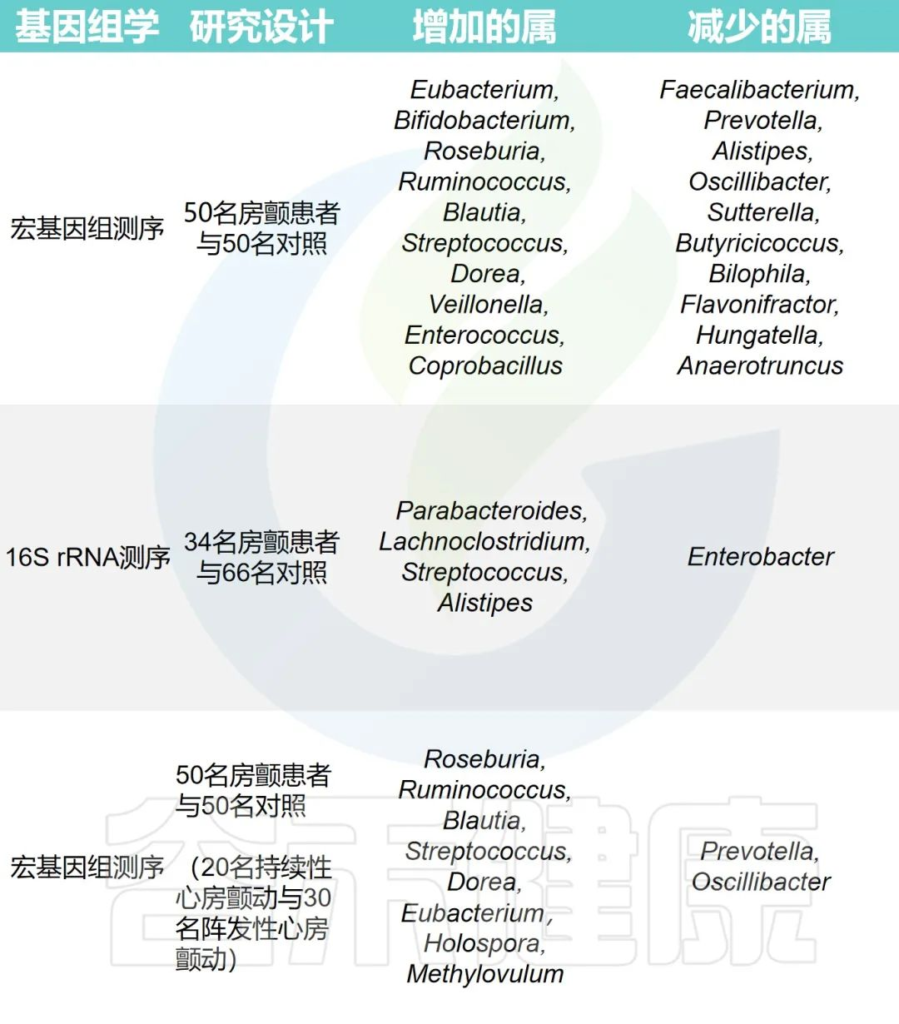

Fan H,et al.Front Cell Infect Microbiol.2023
这些证据表明,有益菌的减少或致病菌的增加以及代谢物的改变可能与心房颤动密切相关,甚至可能在心脏结构重塑中发挥关键作用。
▼
室性心律失常是临床最常见的心律失常之一。之前的一项研究发现左心室间隔或后壁厚度是室性心律失常发病率和复杂性增加的重要因素。而胎儿左心室生长可能是室性心律失常的原因之一。
▷新生儿肠道微生物多样性较低影响左心室后壁厚度
研究发现胎儿左心室生长与出生时肠道微生物群的组成有关,其中新生儿左心室后壁的厚度与肠道微生物群多样性较低有关,以及抗重塑作用相关的细菌(乳杆菌等)的耗竭和与炎症功能相关的细菌的富集(肠杆菌类等)。
肠道微生物群诱导的促炎特征在胎儿发育过程中促进心室生长,孕妇早期基于微生物群的调节可能会降低室性心律失常的发生率和不良结局。
肠道可以通过促进全身炎症和感染来影响危重患者。宿主防御机制在应激和粘膜缺氧的情况下分解,导致细菌和毒素的转移,从而通过内源性和外源性炎症反应引起心肌损伤。
▷婴儿早期室性心律失常与肠道微生物相关
根据研究,室性快速心律失常与50%至75%的心源性猝死直接相关。最近发现,与健康对照婴儿相比,在婴儿猝死综合症婴儿的肠道中发现了更高比例的艰难梭菌、Cl. innocuum和多形拟杆菌(B.thetaiotaomicron)。
多形拟杆菌(B.thetaiotaomicron)似乎介导粘膜-肠道屏障的形成,并通过其对物种特异性蛋白质抗生素表达的影响来帮助抵御病原体入侵。
致病性梭菌会破坏EC紧密连接或引发炎症反应,这两者都会损害肠壁的完整性。因此,婴儿早期室性心律失常可能与异常肠道微生物的建立有关。对于婴儿的健康和早期发育,创造健康的肠道微生物被认为是至关重要的。
▼
肠道微生物代谢就会产生生物活性代谢物,这些代谢物可以直接或间接影响宿主的生理过程。
肠道微生物群衍生的代谢物可以被宿主肠道吸收,影响肠道免疫细胞,并在宿主循环中检测到。它们充当信号分子影响重要的代谢途径。一些代谢物已被证明可以调节心律不齐的促进机制。
肠道微生物群衍生代谢物对心律失常的影响
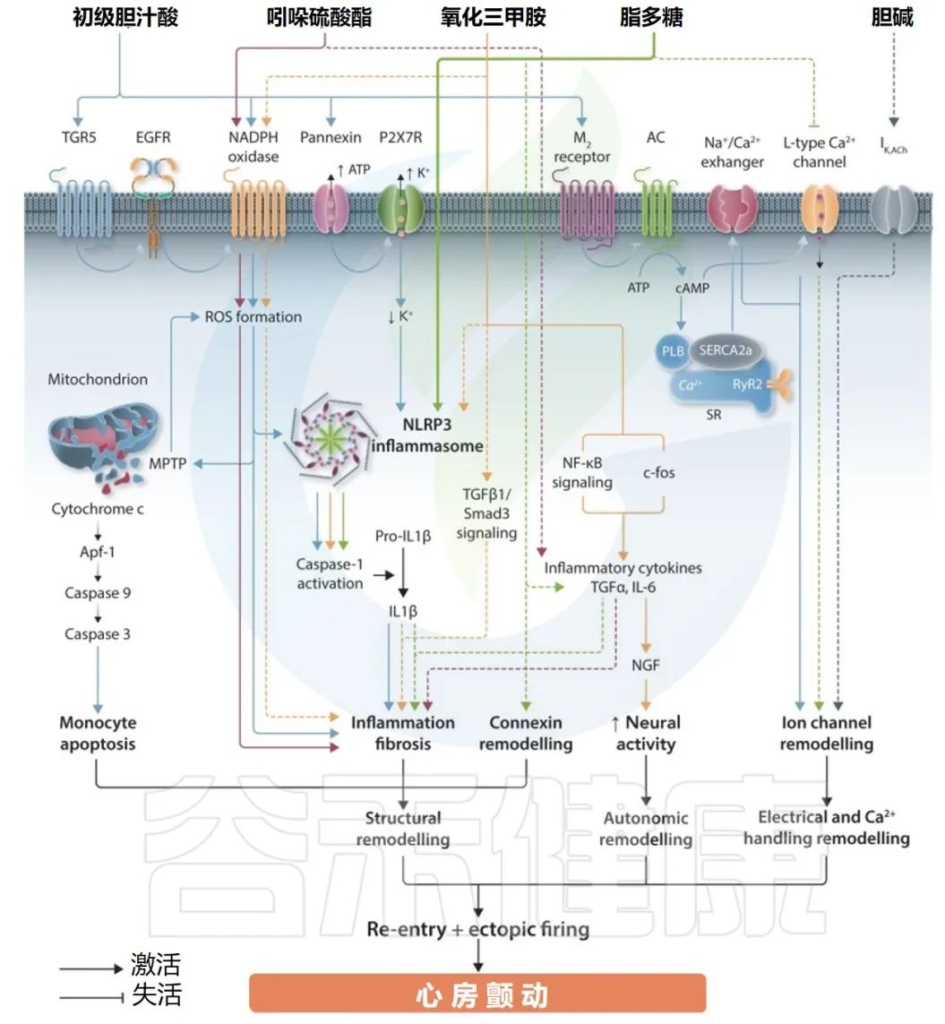
Gawałko M,et al.Cardiovasc Res.2022
1
氧化三甲胺
氧化三甲胺(TMAO)是含有肝黄素的单加氧酶氧化三甲胺的产物,也是参与房颤发病机制研究最广泛的微生物代谢产物。
氧化三甲胺过高影响房颤的发生
在犬模型中,局部注射氧化三甲胺激活心房自主神经节丛并促进心律失常,可能通过激活核因子-κB p65信号传导和增加炎症细胞因子的表达。
此外,在房颤患者的肠道中观察到三甲胺形成的微生物基因和三甲胺微生物生产者的显著增加。
尽管小型研究表明,血清氧化三甲胺水平升高可预测房颤患者的血栓栓塞事件,但这种关联的有效性和重要性需要在更多的房颤人群中进一步评估。
氧化三甲胺促进心律不齐的危险因素
此外,氧化三甲胺可能通过促进各种心律不齐危险因素(例如通过促动脉粥样硬化作用产生的代谢综合征和高血压、肾素-血管紧张素系统调节和主动脉硬化)来增强对房颤的易感性。
在蛋白质组学分析中,与非房颤受试者相比,房颤患者的心耳和血浆样本中的胆碱(TMAO前体)含量更高。
在对三个前瞻性队列进行的汇总分析中,血浆和膳食中胆碱的摄入量与后期房颤风险呈正相关。
2
硫酸吲哚酚
硫酸吲哚酚会引起氧化应激导致心律失常
在实验研究中,硫酸吲哚酚通过引起氧化应激和心肌细胞钙处理失调,增加肺静脉和左房心律失常的发生,并减少窦房结起搏器的活性。
在临床环境中,高浓度硫酸吲哚酚(≥0.65 μg/mL)可预测房颤复发风险3.7倍。相反,房颤的导管消融与硫酸吲哚酚血清浓度降低相关,这表明房颤本身可能会增加硫酸吲哚酚的产生。
在动物研究中,硫酸吲哚酚会增加促炎和促纤维化信号分子的表达,并引起氧化应激,从而可能导致房颤。
注:在这些实验研究中,所使用的硫酸吲哚酚浓度大大超出了其在血浆中的生理范围,使其在促进房颤中的潜在作用还不确定。
3
脂多糖
脂多糖是一种存在于革兰氏阴性菌(特别是埃希氏菌属)外层的内毒素。
脂多糖增加了心房促炎因子浓度
在犬模型中,给予脂多糖会增加心房促炎细胞因子的浓度,从而增加连接蛋白43的表达并导致连接蛋白偏侧化。
脂多糖会下调L型钙通道(α1C和β2亚基)的表达并缩短有效不应期。异常的钙处理和连接蛋白调节是诱导房颤的潜在机制。
L-型钙通道是一种电压依赖性钙通道。
脂多糖水平过高增加心血管疾病风险
尽管脂多糖对房颤发病机制的直接影响尚未研究,但脂多糖水平升高的房颤患者似乎有较高的不良心血管事件风险。
脂多糖可能通过加速动脉粥样硬化间接导致心律不齐,并可能诱发左心室功能障碍和心力衰竭,这两者都会增加心律不齐的风险。
4
胆汁酸
初级胆汁酸,例如鹅去氧胆酸,通过与氨基酸(牛磺酸或甘氨酸)结合形成胆汁盐,并进一步分泌到小肠中。
牛磺酸结合的胆汁酸可以通过心脏钠钙交换体刺激诱导膜电位变化并激活心肌细胞中毒蕈碱M2受体/乙酰胆碱调节的钾电流,这可能促进心房颤动。
鹅去氧胆酸等胆汁酸的水平影响心脏
鹅去氧胆酸已被证明可引起心房心肌细胞凋亡,这可能导致房颤的演变,促进结构重塑,通过法尼素X受体促进心脏损伤和纤维化,并通过NLRP3炎症小体激活加重炎症过程。
另一方面,熊去氧胆酸通过稳定细胞膜电位在预防心律失常中发挥作用。胆汁酸还可能通过参与葡萄糖和脂质代谢间接诱导房颤,并通过调节皮质醇和醛固酮水平的11β-羟基类固醇脱氢酶将血压维持在正常范围内。
5
短链脂肪酸
结肠微生物群发酵葡萄糖和膳食纤维会产生短链脂肪酸,主要是乙酸盐、丁酸盐和丙酸盐。
短链脂肪酸是房颤发病的潜在促成因素。短链脂肪酸负责促进粘液产生,从而改善肠道屏障功能,并且对于其中一些来说,还可以通过抑制组蛋白脱乙酰酶影响免疫调节。
短链脂肪酸水平过低会导致心律不齐风险升高
短链脂肪酸水平低会导致代谢物感应G蛋白偶联受体结合不良,从而损害肠道完整性并促进脂多糖等物质进入血液和组织。
丙酸盐刺激胰高血糖素样肽-1和肽YY的释放,降低肥胖风险并增加肾素释放,从而改变两个重要的心律不齐风险因素。
另外,乙酸盐会导致血脂异常,并通过大脑中副交感神经系统的激活增强胰岛素(由胰腺)和生长素释放肽(由胃粘膜)的分泌,从而促进肥胖。
心律不齐组和对照组之间的肠道微生物代谢
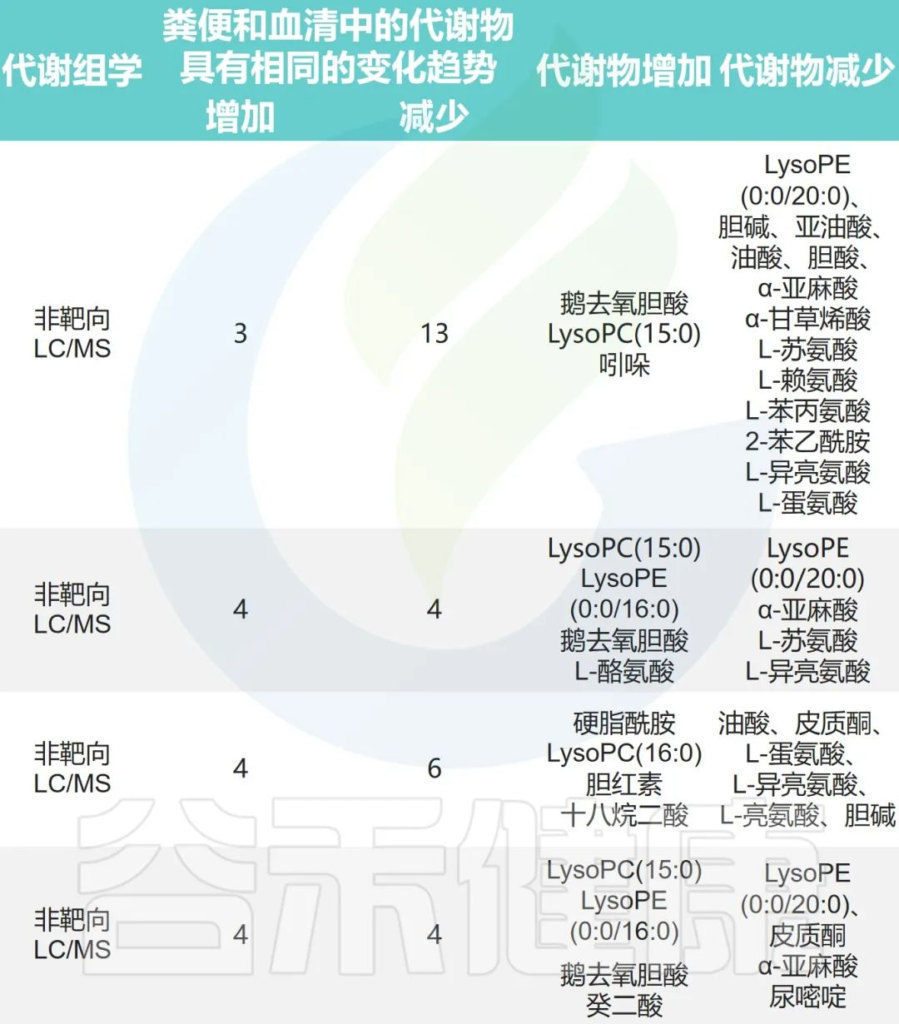
Fan H,et al.Front Cell Infect Microbiol.2023
小结
总之,这些研究表明:与健康人群相比,心律不齐人群经常伴随着肠道有益细菌的减少、心血管保护性代谢物的减少以及对健康有害的代谢物的增加。
近年来,越来越多的相关研究证明,肠道微生物紊乱与缺血性心肌病、心力衰竭、甚至心律失常有关。
下面将讲述肠道微生物如何利用代谢物、炎症因子、免疫细胞作为介质,通过神经、血液、直接作用于心肌组织,最终导致心律失常的发生。
肠道微生物群和代谢物引起心律失常的机制
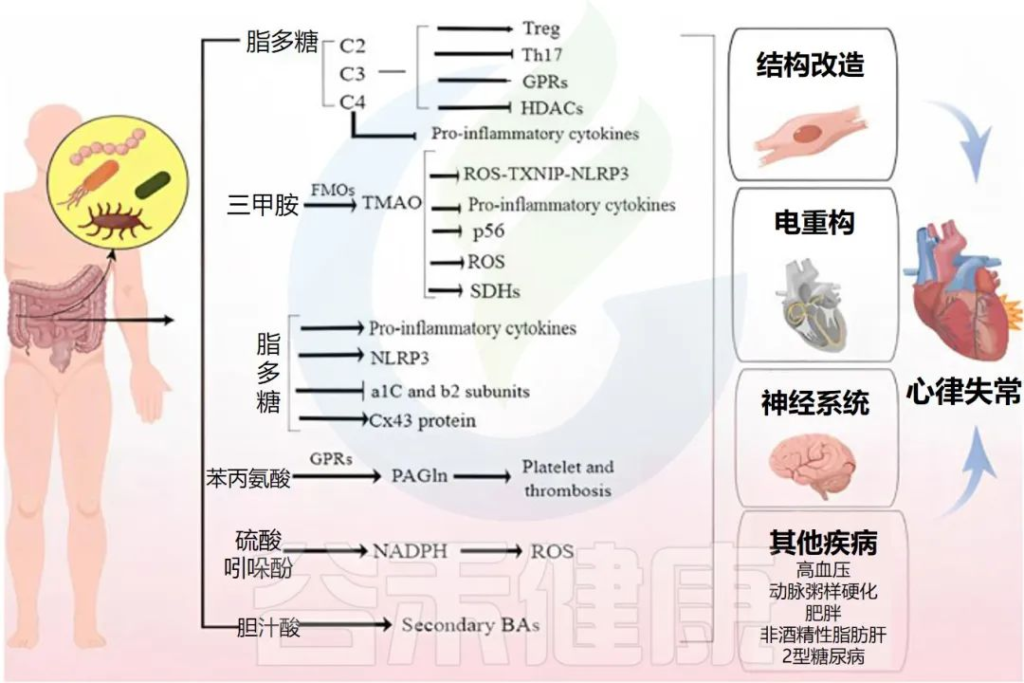
Fan H,et al.Front Cell Infect Microbiol.2023
▼
心肌重塑是指在快速心律失常的进展过程中,心肌原有的电生理和组织学特征发生了一定的变化。心肌重塑的主要表现之一是结构重塑,包括心肌细胞凋亡、心房基质纤维化等。
这主要是由于高血压、冠心病、糖尿病、肥胖等多种原因,导致心肌细胞内质网、线粒体等细胞器的结构、形态和数量发生变化,导致心肌细胞肥大、凋亡、坏死和心肌间质纤维化。
最后,肌壁不断增厚,心腔容积不断扩大,最终促进快速心律失常的发生。
短链脂肪酸通过减少炎症反应保护心血管
免疫炎症的减少可以通过肠道细菌产生的短链脂肪酸减轻心脏肥大、纤维化、血管功能障碍和高血压。
对免疫细胞的抗炎作用是通过短链脂肪酸实现的,例如丙酸可以诱导CD25+Foxp3+ Treg的分化和抑制功能。丙酸还通过抑制组蛋白脱乙酰酶或通过GPRs和嗅觉受体发挥心脏保护作用。
丙酸对心脏的保护主要取决于调节性T细胞的作用。
短链脂肪酸可以通过减少炎症反应对心血管的不利影响来预防或延缓心律失常的发生。
其他肠道代谢物通过炎症途径对心律失常的影响
肠道微生物产生的其他代谢物也可能通过炎症途径引起心律失常。
氧化三甲胺
氧化三甲胺激活NLRP3炎症小体导致人脐静脉炎症和内皮功能障碍。随着炎症标志物显著增加,活化的白细胞被招募来诱导血管炎症,这表明氧化三甲胺增强动脉粥样硬化和心血管风险的可能机制。
硫酸吲哚酚
硫酸吲哚酚可以通过氧化应激诱导肺静脉和房性心律失常。在窦性心律的患者中发现,射频电流导管消融后,患有高硫酸吲哚酚的房颤患者血清硫酸吲哚酚水平降低,这表明血清硫酸吲哚酚不仅可能诱发房颤,而且可能受到房颤的影响。
心肌肥厚和心肌纤维化影响心律失常
心肌肥厚和心肌纤维化是心律失常的重要原因。肠道微生物可以产生琥珀酸、乳酸、乙酰辅酶A,并进一步代谢成短链脂肪酸。其中一些与心肌肥大和心肌纤维化密切相关。
研究表明,丙酸可以在T细胞的帮助下减轻炎症反应,减轻小鼠心肌肥厚、纤维化、血管功能障碍和高血压。
亚油酸和α-亚麻酸抑制活性氧的产生并下调p38 MAPK途径β生长因子的激活和转化、发挥保护作用。它在心房纤维化中发挥调节作用,影响房颤的进展。
总之,有充分的证据表明,肠道微生物及其代谢物可以通过多种方式影响心肌肥大和纤维化,这很可能是心律失常发生的基础。
心肌细胞凋亡
鹅去氧胆酸已被证明可引起心房心肌细胞凋亡,这可能有助于结构重塑。鹅去氧胆酸与左心房低电压区呈正相关,可能促进心房肌细胞凋亡。
此外,丁酸通过抑制增殖和凋亡来促进血管平滑肌细胞的生长。氧化三甲胺通过琥珀酸脱氢酶复合物B亚基上调诱导活性氧促进血管内皮细胞凋亡,这可能有助于动脉粥样硬化病变的进展。
▼
心脏的功能就像机械泵一样,确保向全身和肺部持续供应血液。因此,人类心脏每天会进行100,000 次成功且协调的收缩。
由于心脏收缩受到严格的电调节,失衡会导致心律失常。这些收缩是由称为动作电位的电信号控制的。肠道微生物失衡引起的心肌重塑还反映在电生理重塑(心肌细胞膜表面离子通道的改变)。
通过钠离子通道影响心肌电活动
众所周知,钠通道是产生动作电位的关键通道,由此产生的细胞内和细胞外钠离子浓度的变化对心脏动作电位的产生很重要。
肠道微生物参与胆汁酸的代谢,胆汁酸诱导的心律失常发生的可能机制是与细胞膜和细胞膜离子通道或转运蛋白的相互作用。
研究发现牛磺胆酸通过刺激心肌中的钠钙交换诱导膜电位变化,导致内向电流密度增加和静息膜电位去极化,进而影响心肌电活动。
然而,也发现熊去氧胆酸在诱导心律失常方面无效,熊去氧胆酸偶联保护富含胆固醇的质膜免受疏水性胆汁酸的毒性作用,从而保护细胞免受心律失常的影响。
注:房颤患者的血清熊去氧胆酸偶联物水平明显较低,非熊去氧胆酸水平较高。
这表明,较高水平的毒性(致心律失常)和较低水平的保护性胆汁酸创造了一个心律失常阈值较低的环境,因此可能导致心律失常。
钾离子通道与持续性房颤相关
钾离子通道代表心脏中最多样化的离子通道,其中心脏乙酰胆碱激活的内向整流钾电流(IKACh)通道的激活是副交感神经系统对心脏功能的生理控制的重要组成部分。
目前,越来越多的研究证实,激活的内向整流钾电流被认为是持续性房颤中的背景内向整流器,因此有助于缩短动作电位持续时间并稳定高频电转子的形成,从而导致持续性房颤。
钙离子通过多种机制影响心律失常
Ca2+是一种普遍存在的第二信使,调节多种生物过程,包括激素产生、肌肉收缩、突触传递、增殖和死亡。越来越多的证据表明房颤和其他心脏疾病,与Ca2+相关。
因此,对心脏钙通道的任何影响都可能导致心律失常。在一项实验研究中,硫酸吲哚酚通过引起心肌细胞的氧化应激和钙处理失调,增加了肺静脉性心律失常和左心房心律失常的发生,并降低了窦房结起搏器的活性。
脂多糖还可以上调NLRP3系统,这除了引起结构重塑外,还可以导致心房动作电位的重新进入,促进收缩和舒张期间自发肌浆网Ca2+释放频率的增加,这可能导致去极化后延迟并触发异位活动,从而影响心肌电活动。
这些机制为钙调节促进心律失常提供了证据。
▼
人们对肠脑轴自下而上的信号传导知之甚少。然而,心脑轴的自上而下信号传导已被广泛研究。通过自主神经系统和迷走神经系统,神经系统可以控制心率。
心律失常可能是由于中枢神经系统限制副交感神经张力同时提高交感神经张力的能力而引起的。
注:神经系统调节心脏的机制非常复杂。植入的神经节丛中可能有数百到数千个自主神经元。
自主神经系统
心律失常的形成和维持在很大程度上取决于自主神经系统。
大脑和脊髓中的神经元以及连接心脏的神经组成了外源性心脏自主神经系统。在心脏本身以及沿着胸腔的大静脉中,自主神经元和神经构成了内在心脏自主神经系统的大部分。
•通过心脏自主神经系统调节房颤和室性心律失常
在犬模型中,局部注射氧化三甲胺可能通过激活 p65 核因子-κB 信号传导和增加炎症细胞因子的表达来激活心房自主神经丛并促进心律失常。
已经证明,房颤或室性心律失常的病理生理学是由心脏自主神经系统调节的。有证据表明,在发生室性心律失常之前,左心交感神经就已过度活跃,而左星状神经节的激活可大大增加室性心律失常发生的可能性。
研究结果表明,与对照组相比,静脉注射和局部氧化三甲胺治疗显著增强了左星状神经节功能和活性,从而提高了心脏交感神经张力,并恶化了缺血引起的室性心律失常。
同时,氧化三甲胺可显著促进促炎标志物的表达,如IL-1、IL-6、TNF-α,这可能进一步导致交感神经过度活跃并影响室性心律失常的发展。
迷走神经系统
调节心律受到迷走神经的负面影响。迷走神经放电增强钾通道电流,减少动作电位持续时间并稳定折叠转子。
•肠道微生物及其代谢物通过迷走神经影响心律
微生物群可以通过肠道内分泌细胞直接或间接触发迷走神经传入纤维。迷走神经传入纤维通过中枢自主神经网络刺激中枢神经系统。迷走神经传入纤维可以通过炎症反射触发传出纤维。
根据物质的不同,微生物群产生的不同代谢物可能以不同的方式激活迷走神经传入纤维。例如,油酸,一种长脂肪酸,通过胆囊收缩素介导的机制作用于迷走神经传入纤维;而丁酸,一种短脂肪酸,直接影响传入末梢。
Part 1
胃肠道疾病易诱发房颤
√较高的C反应蛋白增加心房颤动风险
炎症似乎在心律失常的发病机制中发挥着重要作用。C反应蛋白 (CRP) 升高与心房颤动相关,持续性心房颤动的平均C反应蛋白水平高于阵发性心房颤动中观察到的水平,表明炎症状态可能会促进心房颤动的持续存在。
C反应蛋白是一种非特异性炎性标志物,由肝脏合成的用于保护身体的急性时相反应蛋白。
在纵向研究中,较高的C反应蛋白会相应增加心房颤动风险。最后,在没有心血管合并症的情况下,严重败血症和急性全身炎症反应与新发心房颤动相关。
√炎症性肠病患者心房传导发生了改变
在一项研究中,观察到炎症性肠病患者的心房传导发生了改变,这是通过心电图上P波离散度的增加来衡量的。
在两项针对炎症性肠病患者的小型研究中,与参考对象相比,经胸超声心动图测量的心房机电传导时间延长。
丹麦的一项病例对照研究涉及24499例炎症性肠病病例和236275名年龄和性别匹配的对照,观察到在活动性炎症性肠病发作期间,房颤风险增加两倍,中风风险增加1.5倍。在炎症性肠病缓解期间,未观察到与房颤或中风的关联。
▼
在一些病例对照研究中,胃肠道恶性肿瘤,包括结直肠癌和食道癌,与房颤风险增加有关。
√结直肠癌患者发生房颤的风险更高
在一项研究中,与非癌症队列参与者相比,结直肠癌患者发生房颤的风险增加了一倍。
丹麦一项基于人群的病例对照研究观察到,结直肠癌患者的房颤患病率较高 [比值比为11.8],但患病率的增加仅限于癌症诊断后的前90天,这表明手术治疗癌症可能在很大程度上推动了这种关联。
√胃肠道手术后房颤风险增加
胃肠癌手术治疗后房颤的发生率很高,并且与手术结果不佳相关,包括肺部并发症、败血症、住院时间延长。
此外,在回顾性分析中,胃肠道癌症手术后发生房颤的患者在1年内发生心血管事件和60天内死亡的风险增加。
据报道,经胸食管切除术后房颤的发生率为10%至46% 。
Part 2
房颤患者易得胃肠道疾病
▼
在房颤患者中,缺血主要继发于心脏栓塞事件,而不是原位血栓栓塞。房颤患者心脏栓塞事件的主要风险因素包括既往卒中或短暂性脑缺血发作史,年龄大于75岁、高血压和结构性心脏病。
√房颤患者易发生肠系膜缺血
特别是,患有房颤的女性发生血栓栓塞的风险增加,包括肠系膜缺血。内脏-肠系膜血管系统栓塞是外周血栓栓塞疾病的第二常见部位,仅次于上肢和下肢的血管。
在一项基于房颤患者研究中,随着房颤评分的增加,发生肠系膜缺血的风险更高,评分为⩾2的患者与评分为0的患者相比,风险增加了三倍。
Part 3
与心律失常相关的其他疾病
▼
肠道微生物可以影响血压,而高血压患者通过多种作用方式参与心律失常。
√房颤、室性心律失常的发生率与高血压呈正相关
房颤、室性心律失常和猝死的发生率与以心脏重构为表现的高血压病程呈正相关。高血压患者心律失常发生的机制和表现通过心脏环境的宏观和微观变化影响心律失常的发展,导致电学和结构的改变。
高血压进一步促进左心室肥厚,这是心律失常的危险因素。长期升高的后负荷和心内压会导致心肌细胞肥大并激活心肌成纤维细胞。心肌细胞肥大和心肌成纤维细胞胶原沉积增加导致心肌质量增加,导致左心室肥厚。
已经确定,左心室肥厚可能通过诱发心肌缺血、心肌需氧量增加以及左心室舒张功能障碍而增加发生心律失常的风险。
肠道微生物群也会影响血压
据了解,缺乏肠道微生物的无菌小鼠的血压比传统小鼠的血压要低。与此同时,将人类高血压捐献者的粪便移植到无菌小鼠体内会导致这些小鼠血压升高。高血压中具有产生舒张代谢产物特性的细菌种类数量的减少也表明肠道微生物群会影响血压。
▼
动脉粥样硬化也是诱发心律失常的危险因素之一。当动脉粥样硬化影响传导系统,阻碍冲动传导时,就会引起各种心律失常。
√动脉粥样硬化会导致急性心肌梗塞与心律失常
急性心肌梗死是动脉粥样硬化的严重后果,经常与 心律失常一起发生,这会增加患者在医院接受治疗时突然死亡的风险和预后不良。
肠道微生物通过其代谢物参与动脉粥样硬化。具体而言,动脉粥样硬化患者的大肠杆菌(Escherichia coli)、克雷伯氏菌属(Klebsiella spp.)和产气肠杆菌(Enterobacter aerogenes)的丰度显著增加,而两种产生丁酸的细菌——Roseburia gutis和粪杆菌的丰度则下降。
肠道微生物的代谢产物可通过增加内皮活性氧的产生和损害内皮介导的血管舒张而参与动脉粥样硬化。
▼
肠道微生物研究表明,正常微生物群的失衡可能导致多种炎症性疾病,其中肥胖和胰岛素抵抗是肠道微生物失衡和能量失衡引起的主要疾病。
√糖耐量异常和肥胖是心律失常的重要原因
同时,糖耐量异常和肥胖也是心律失常的重要原因之一。糖尿病患者动脉粥样硬化和血栓形成的概率会增加,从而导致急性冠状动脉缺血性心脏病或心律失常。
细菌多样性的整体减少和细菌基因表达的改变被认为是影响代谢途径的主要原因,这可能与肥胖有关。
心律失常是一个缓慢发生且具有复杂机制的过程。从肠道菌群及其代谢物的角度出发,临床医生可以获得预防和治疗糖尿病/肥胖合并心律失常的新视角。尽管如此,还需要大量实验来证实。
▼
非酒精性脂肪性肝病是一种以肝脏细胞内脂肪过度沉积为主要特征的临床病理综合征,是最常见的肝脏疾病。
√非酒精性脂肪肝病提高了心律失常的易感性
非酒精性脂肪性肝病是一种多系统疾病,可能导致脂质和葡萄糖等代谢不良、炎症和氧化应激以及其他全身性有害后果。这些改变可能协同作用,增强心脏的结构、电和自主神经重塑,从而提高心律失常的易感性。
此外,心包脂肪体积或厚度与房颤的患病率和严重程度相关,大多数报告显示非酒精性脂肪肝病与心外膜脂肪体积或厚度呈正相关。
√肠道微生物通过肠-肝轴影响心律失常
肠-肝轴是肠道微生物群与肝脏之间的联系。肠道菌群功能障碍可能导致病原体相关分子模式的产生、粘膜屏障通透性增加导致肝脏炎症以及肝病的发生和进展,并且发现与健康人相比,肝病患者的微生物群多样性较低。
肠道及肝脏问题以多种方式显著影响心律失常。总之,非酒精性脂肪肝与心律失常密切相关,但现有证据并不完善,需要我们继续研究。
▼
阻塞性睡眠呼吸暂停综合征是一种在睡眠时导致呼吸暂停和通气不足的疾病,其特征是打鼾、睡眠模式紊乱、血氧饱和度频繁下降以及白天疲劳。
√睡眠呼吸暂停综合征通过多种途径诱发心律失常
阻塞性睡眠呼吸暂停综合征患者通过多种病理生理途径与心律失常的发生有关,包括呼吸暂停引起的缺氧、胸内压力变化、交感神经失衡、心房重塑、氧化应激、炎症和神经体液激活。
睡眠期间的缺氧会促进交感神经活动,这是诱发心房颤动的关键机制。因此,阻塞性睡眠呼吸暂停综合征本身可能促进心房颤动的发展。
现有的研究表明,患有心房颤动的人肠道中Ruminococcus gnavus为主的类型有所增加。因此,我们推测阻塞性睡眠呼吸暂停综合征和心房颤动病理生理过程的共同原因可能是由于肠道微生物群的改变,尤其是瘤胃球菌的增加。
▼
前不久的新冠肺炎对人类的影响是巨大的。SARS-CoV-2病毒主要影响上呼吸道,但也可能导致危及生命的肺部问题。在一些患有轻度至重度 COVID-19的人中,肠道微生物受到广泛干扰,这种干扰可能会持续长达一个月甚至更久。
√新冠肺炎是心律失常的危险因素
研究表明,新冠肺炎患者中存在心律失常的情况。这可能是由于病毒直接感染心肌细胞,或是由于免疫系统的异常反应所引起的。心律失常在新冠肺炎患者中可能表现为心率不齐、心动过速或心动过缓等症状,严重情况下甚至可能导致心脏骤停。
与其他呼吸道病毒感染一样,COVID-19可能与恶心、呕吐、腹痛和腹泻等胃肠道症状有关。由于影响肠道的途径是通过免疫和神经系统存在的,它们不仅对肠道微生物做出反应,而且还调节其组成。
循环淋巴细胞是两个器官之间的直接免疫接触,因为这些细胞不会停留在一个地方,它们在肠道和气道粘膜上巡逻。“肠肺轴”是这些器官“交流”的串扰。
综上所述,肠道微生物会通过各种分泌物引发心律失常,而SARS-CoV-2病毒由于“肠肺轴”的存在,可能是心律失常的危险因素。
心律失常作为一种心脏疾病,会给患者的健康和生活质量带来严重负面影响。因此,需要不断努力追求治疗心律失常的方法和策略。
在治疗心律失常方面,致力于整合多种治疗方法,包括药物治疗、手术治疗和其他创新疗法(例如肠道微生物干预)。需要根据患者的具体情况和心脏功能,制定最适合其需求的个性化治疗。
1
饮食调整: 多吃有益的脂质和膳食纤维
一些研究调查了不同食物成分和饮食模式对肠道菌群的影响,这可能是未来通过肠道微生物群治疗心律失常的重要目标。
•脂肪摄入过多会导致心律失常
最近的一项研究表明,房颤患者倾向于从动物脂肪中获取更多能量。至于肠道微生物群与脂肪摄入量之间的相关性,拟杆菌门与房颤患者的脂肪摄入量(特别是动物脂肪)呈弱负相关,而厚壁菌门则呈现相反的相关性。
•地中海饮食有助于降低心律不齐风险
代谢性内毒素血症和慢性炎症可能是脂肪摄入诱发房颤的机制。摄入油酸可以显著降低心血管疾病的风险,因为它可以抑制氧化应激,从而减轻心肌细胞损伤。
地中海饮食可以有益地影响肠道微生物群和相关代谢。以蔬菜为主的饮食人群具有更好的微生物代谢组。一项针对房颤患者的研究表明,地中海饮食可以降低氧化应激,从而降低房颤风险。
2
补充益生菌、益生元
研究表明,肠道微生物的失衡与心律失常的发生有关。肠道微生物在治疗心律失常方面具有潜力。因此,调整肠道微生物的组成可能成为未来心律失常治疗的一种新方法。
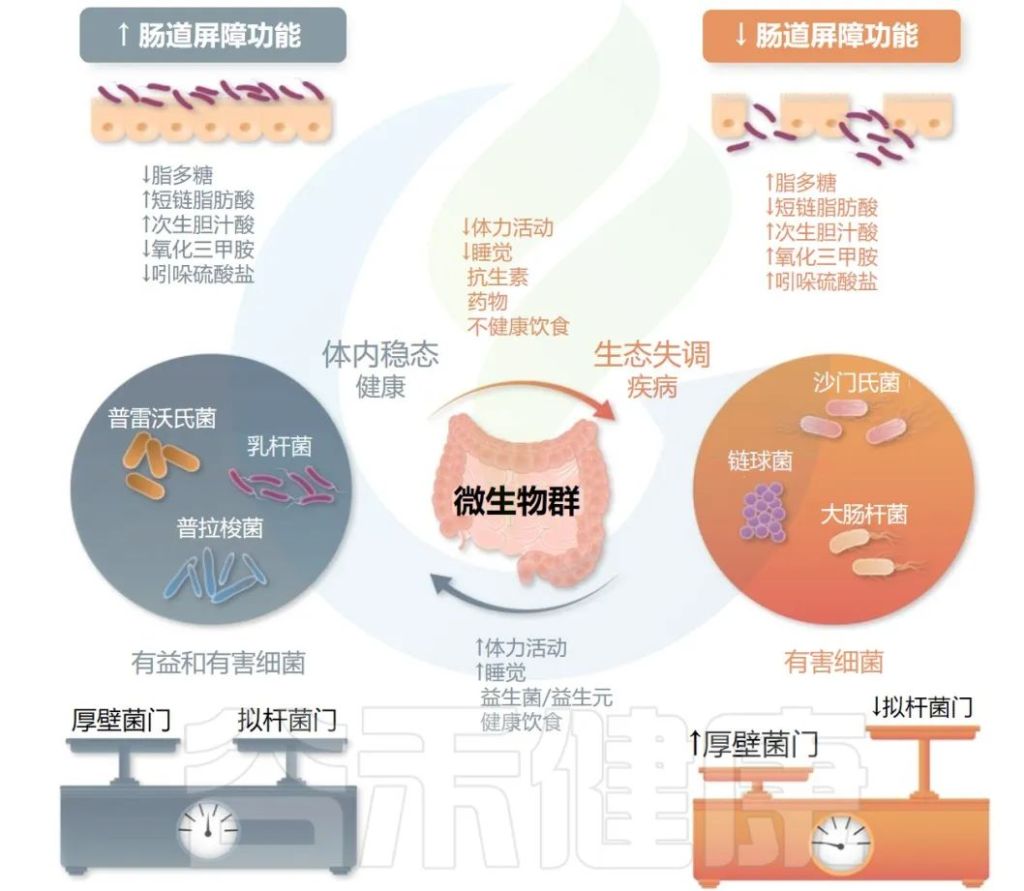
编辑
Gawałko M,et al.Cardiovasc Res.2022
•服用益生菌缓解了动脉粥样硬化
几项临床研究发现,口服嗜酸乳杆菌(L.acidophilus ATCC 4356)可以通过调节小鼠的氧化应激和炎症过程来缓解动脉粥样硬化的进展。
•益生菌促进了残留药物的降解
益生菌还可以影响药物的代谢。胺碘酮是市场上主要的抗心律失常药物,具有心外毒性,因此研究人员重点寻找改善体内残留胺碘酮代谢的方法。
研究发现酿酒酵母菌株OBS2是一种具有治疗潜力的益生菌,可以在体外和体内促进残留胺碘酮的降解。
•益生元可以减少心肌损伤
益生元是一类可促进肠道益生菌生长和活性的物质,其健康益处取决于微生物的新陈代谢。目前果聚糖(低聚果糖和菊粉)和半乳聚糖(低聚半乳糖)在益生元类别中的主导地位已被数十项研究证实。
一项在大鼠缺血再灌注模型中进行的研究得出结论,阿拉伯半乳聚糖可以抑制细胞凋亡,从而减少心肌损伤。
此外,源自红酒的多酚白藜芦醇通过抑制细胞内钙的释放而具有抗心律失常特性。在小鼠模型中,白藜芦醇通过肠道微生物群重塑降低氧化三甲胺水平并增加肝脏胆汁酸合成,从而减轻动脉粥样硬化。
3
药物与肠道微生物的相互作用
大量研究表明药物和肠道微生物群之间存在双向作用,这也可能调节药物代谢。例如,迟缓埃格特菌(Eggerthella lenta)通过还原内酯环产生无活性产物来灭活地高辛。
•肠道微生物增强了心血管药物的利用度
此外,肠道微生物酶活性参与了一些心血管药物的首次通过清除,包括钙通道阻滞剂和非甾体抗炎药,当患者接受抗生素预处理时,增加了这些药物的生物利用度。
•心血管药物对肠道微生物存在显著影响
同时,许多临床使用的药物可以增强或降低肠道微生物群或肠道微生物群衍生代谢物的生长速度。对荷兰一项队列研究的1135名参与者的粪便样本进行宏基因组测序显示,使用多种心血管药物,包括他汀类药物、抗血栓药物、 受体阻滞剂和血管紧张素转换酶抑制剂,对肠道微生物组有显著影响。
4
粪菌移植
粪便微生物移植作为一种安全的治疗方法被广泛应用于胃肠道疾病及胃肠外疾病的治疗。
•粪菌移植可以有效减轻甚至治愈疾病
从健康受试者到患有菌群失调相关疾病的受试者的菌群移植可以减轻甚至治愈这种疾病。在一项研究中,将血压正常大鼠的盲肠内容物移植到自发性高血压大鼠体内可降低血压,而对自发性高血压大鼠进行粪菌移植后,血压正常的大鼠会出现高血压。
最近,将来自高脂肪饮食喂养的小鼠的粪便微生物移植到正常饮食喂养的小鼠中,他们发现对房颤的易感性显著增加。
接受高脂饮食小鼠粪菌移植的小鼠遭受由脱硫弧菌(Desulfovibrionaceae)引起的代谢内毒素血症,该血症循环脂多糖升高,破坏肠道组织结构,并增加左心房促炎因子。
5
免疫调节剂
组蛋白脱乙酰酶在钙稳态、房颤发生和心力衰竭中起着至关重要的作用,因此组蛋白脱乙酰酶抑制剂可能是潜在的治疗方法。
•组蛋白去乙酰酶抑制剂降低了心律失常的发生
组蛋白去乙酰化酶抑制剂通过拯救线粒体生物能量学来治疗心脏功能障碍,即TNF-α诱导的线粒体功能障碍,降低能量利用率。
另一项在房颤兔身上进行的研究表明,组蛋白去乙酰化酶抑制剂可以降低钙稳态诱导的房颤和肺静脉心律失常的发生,房颤持续时间缩短。
注:MPT0E014处理的心肌细胞钙瞬态振幅、钠钙交换电流和ryanodine受体表达的降低可能是组蛋白去乙酰化酶抑制剂治疗心律不齐的潜在机制。
6
病因治疗和药物治疗
•病因治疗
病因治疗包括纠正心脏病理改变、调整异常病理生理功能(如冠脉动态狭窄、泵功能不全、自主神经张力改变等),以及去除导致心律失常发作的其它诱因(如电解质失调、药物不良副作用等)。
•药物治疗
药物治疗缓慢心律失常一般选用增强心肌自律性或加速传导的药物,如拟交感神经药(异丙肾上腺素等)、迷走神经抑制药物(阿托品)或碱化剂(克分子乳酸钠或碳酸氢钠)。
治疗快速心律失常则选用减慢传导和延长不应期的药物,如迷走神经兴奋剂(新斯的明、洋地黄制剂)、拟交感神经药间接兴奋迷走神经(甲氧明、苯福林)或抗心律失常药物。
多项证据表明肠道微生物群的变化可能是心律失常的重要诱发因素。肠道微生物可以通过短链脂肪酸、胆汁酸等代谢物,改变心肌细胞的电活动,从而调节心律。
其次,肠道微生物的失衡可能导致免疫系统的异常活化,诱发心律失常的发生。某些肠道菌群的代谢产物,如脂多糖、细菌毒素等,可能引发炎症反应,损伤心肌细胞,进而导致心律失常。
然而,肠道微生物与心律失常的具体关联和机制仍需进一步的研究和探索。目前,通过调整饮食结构、补充益生菌和使用粪菌移植等策略,可以尝试改善肠道微生物组成,从而对心律失常的治疗产生积极的影响。
但需要强调的是,个体差异和复杂性限制了一刀切的推广,治疗方案应当根据具体情况进行调整和制定。
主要参考文献
Fan H, Liu X, Ren Z, Fei X, Luo J, Yang X, Xue Y, Zhang F, Liang B. Gut microbiota and cardiac arrhythmia. Front Cell Infect Microbiol. 2023 Apr 25;13:1147687.
Gawałko M, Agbaedeng TA, Saljic A, Müller DN, Wilck N, Schnabel R, Penders J, Rienstra M, van Gelder I, Jespersen T, Schotten U, Crijns HJGM, Kalman JM, Sanders P, Nattel S, Dobrev D, Linz D. Gut microbiota, dysbiosis and atrial fibrillation. Arrhythmogenic mechanisms and potential clinical implications. Cardiovasc Res. 2022 Aug 24;118(11):2415-2427.
Frampton J, Ortengren AR, Zeitler EP. Arrhythmias After Acute Myocardial Infarction. Yale J Biol Med. 2023 Mar 31;96(1):83-94.
Li W, Li C, Ren C, Zhou S, Cheng H, Chen Y, Han X, Zhong Y, Zhou L, Xie D, Liu H, Xie J. Bidirectional effects of oral anticoagulants on gut microbiota in patients with atrial fibrillation. Front Cell Infect Microbiol. 2023 Mar 24;13:1038472.
Zuo K, Yin X, Li K, Zhang J, Wang P, Jiao J, Liu Z, Liu X, Liu J, Li J, Yang X. Different Types of Atrial Fibrillation Share Patterns of Gut Microbiota Dysbiosis. mSphere. 2020 Mar 18;5(2):e00071-20.
Li N, Durgan DJ, Wehrens XHT. Gut microbiota: a key regulator of ageing-associated atrial fibrillation? Cardiovasc Res. 2022 Feb 21;118(3):657-659.
Long MT, Ko D, Arnold LM, Trinquart L, Sherer JA, Keppel SS, Benjamin EJ, Helm RH. Gastrointestinal and liver diseases and atrial fibrillation: a review of the literature. Therap Adv Gastroenterol. 2019 Apr 2;12:1756284819832237.

谷禾健康


如果说前一篇文章《微生物组-神经免疫轴:心血管疾病的预防和治疗希望》更多的是借助心血管疾病(CVD),来宏观地阐述肠道-神经免疫-菌群之间的关联,那么这篇文章更多地是具体讨论肠道菌群及其代谢产物参与CVD疾病的发生发展,以及饮食和微生物群的串扰机制,基于上述理论,从更实际具体的角度来了解饮食相关的干预措施及其对健康的影响。
越来越多的研究表明,肠道菌群作为一个不可或缺的“隐形器官”,在人类新陈代谢和包括心血管疾病在内的疾病状态中发挥着至关重要的作用。
在可能影响肠道微生物群的许多内源性和外源性因素中,饮食成为宿主-微生物群关系的重要组成部分,可能与 CVD 易感性有关。
本文主要介绍肠道微生物群饮食调节的主要概念,及其参与心血管疾病发展。还讨论了调节 CVD 进展的饮食-微生物群串扰的机制,包括内毒素血症、炎症、肠道屏障功能障碍和脂质代谢功能障碍。也阐述了关于微生物群产生的代谢物,包括三甲胺-N-氧化物、次级胆汁酸、短链脂肪酸以及芳香族氨基酸衍生的代谢物如何在 CVD 发病机制中发挥作用。最后,列举了与肠道微生物群相互作用的潜在饮食干预措施,作为 CVD 管理的新型预防和治疗策略。
在了解CVD中基于菌群的饮食干预之前,首先我们来了解一下,饮食变化对肠道微生物群可能产生哪些影响?
主要可概括为三个方面:
(1) 快速/短期效应
对在植物性(高纤维)之间切换的人类受试者和以动物为基础的(高脂肪)饮食的研究表明:
所有受试者的微生物群组成在 1-2 天内发生变化,厚壁菌门在植物性饮食中代谢膳食纤维的丰度增加,在动物性饮食中耐胆汁微生物Alistipes和Bilophila增加。然而,即使经过 10 天的干预,短期饮食改变对肠型也没有影响。
(2) 长期影响
尽管微生物群落迅速调节,但长期的饮食干预不仅与成分改变有关,还与生理变化有关。
例如,用高脂肪饮食 (HFD) 喂养大鼠 8 周或 12 周会导致肠杆菌门(变形杆菌门)的丰度增加,这与全身炎症、肠道通透性和肥胖表型的升高相结合。相反,人类队列干预 3 个月的低碳水化合物或低脂肪健康饮食导致 14 或 12 种与体重减轻相关的菌群变化,这表明长期干预是必要的。此外,肠型主要与长期饮食影响而不是短期影响有关。
(3) 特定饮食引起的特定微生物变化
例如,膳食纤维的摄入促进了肠道微生物群的丰度或多样性以及厚壁菌门的增加。抗性淀粉饮食干预下 Ruminococcus bromii 增多。
有趣的是,不仅是微生物组成,还有特定的微生物代谢与特定的饮食和疾病模式相关。例如,富含红肉饮食的受试者血浆中的三甲胺-N-氧化物 (TMAO)(红肉中胆碱的肠道微生物代谢产物)比素食者多。已在人类受试者中发现 TMAO 水平升高,肠型普氏菌比例较高,并且与 CVD 风险增加有关。
人类队列中与心血管疾病相关的肠道微生物群的改变


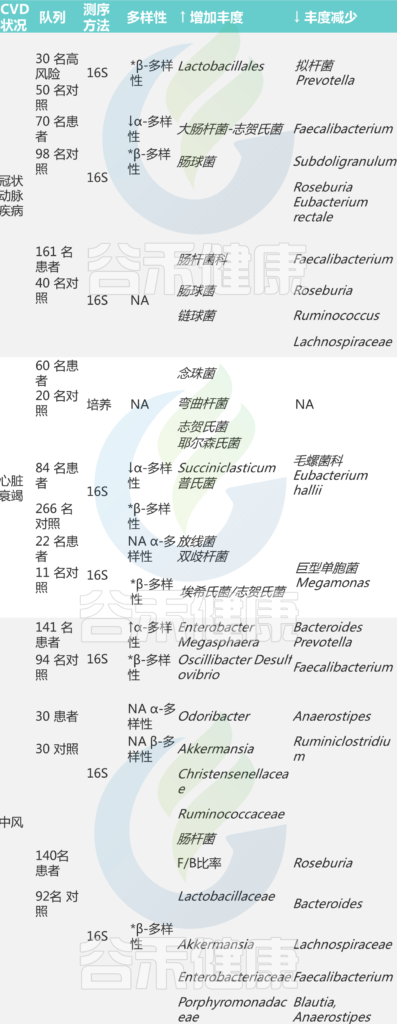
Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
在健康状态下,适当的肠道屏障提供了抵御病原体的关键第一道防线,它由多种生理成分支持,包括粘液层、由紧密连接蛋白连接的上皮细胞和免疫细胞。
然而,心力衰竭或高血压的 CVD 患者经常观察到肠道屏障功能障碍,伴随全身微生物成分LPS和炎症的增加。
那么CVD过程中,引发肠道渗漏和炎症的风险因素是什么?
其中一个假设是,长期食用西方饮食或 HFD 会导致生态失调并损害肠道屏障,从而增强 LPS 易位和全身炎症,导致心血管疾病风险增加。
有鉴于此,富含饱和脂肪或反式脂肪酸的饮食摄入量较高与 CVD 风险的增加高度相关,而饮食中饱和脂肪的摄入量较低可使 CVD 降低约 30%。
在大型队列研究中,长期(6 个月)食用 HFD 会导致微生物菌群失调,其中革兰氏阴性菌(如Alistipes和Bacteroides)的比例增加,同时参与 LPS生物合成的基因水平更高。同时,已发现膳食脂肪通过激活促炎细胞因子(例如 TNF-α、IFNγ 和 IL-1β)的分泌来损害肠道屏障。促炎细胞因子的上调进一步激活 MLCK(肌球蛋白轻链激酶)信号通路,重组紧密连接蛋白,包括occludin、ZO-1(Zonula occludens-1)并导致肠漏。
当肠道屏障被破坏时,LPS或病原体可能转移到循环中,引起内毒素血症,从而刺激全身性促炎细胞因子的释放。一旦在血流中易位,内毒素可以通过与细胞表面的 TLR-4(Toll 样受体 4)相互作用来触发内皮细胞的损伤,并增强 ROS(活性氧)的产生,从而降低内皮细胞 NO(一氧化氮)的生物利用度导致形成斑块和动脉粥样硬化病变。
这一假设已在动物模型中得到证实,其中 ApoE-/-西方饮食下的小鼠动脉粥样硬化病变加重,变形菌(革兰氏阴性促炎细菌)和全身 LPS 水平显着增加。
此外,西方饮食促进炎症细胞因子(如 TNF-α 和 IL-1β)的上调,增加肠道通透性,同时修饰 ApoE-/- 小鼠中的紧密连接蛋白(如 occludin)。
然而,在人类队列中仍然缺乏数据来解释,由于西方饮食导致的肠道屏障受损和相关的内毒素血症增加在什么情况下会诱发CVD发病机制。
除了饮食-微生物群对炎症和肠道屏障功能的相互作用外,肠道微生物还通过宿主脂质代谢影响 CVD。
越来越多的动物和人类研究表明,肠道微生物群与脂质代谢紊乱有关,如血脂异常或高脂血症,它们是 CVD 发展的主要危险因素。
肠道微生物群将胆固醇转化为粪(甾)醇降低胆固醇
例如,GF 小鼠的胆固醇代谢发生了改变 ,而ApoE -/-小鼠肠道微生物群的消耗导致与传统的 ApoE -/-小鼠相比,血浆胆固醇伴有更大的主动脉病变。
此外,从高血浆胆固醇人类到小鼠的微生物群移植引发了上调循环胆固醇的表型以及肝脏胆固醇合成 的减少。
这可能是由于肠道微生物群将胆固醇转化为粪(甾)醇,这可以促进体内胆固醇的消除和降低胆固醇血症。
胆固醇代谢的数学模型已经证实了这一点,最近发现肠道菌群的胆汁盐代谢和胆固醇向粪(甾)醇的转化都会影响血液中的胆固醇水平。
此外,最近对人类队列进行的一项有趣的研究也证实了这一点,并确定了含有胆固醇代谢酶ismA的Eubacterium coprostanoligenes等粪(甾)醇形成菌的个体,粪便胆固醇水平显著降低,血清总胆固醇显著降低。
然而,在斑块面积较小的无菌 ApoE-/- 小鼠中也发现了有争议的结果,尽管血浆总胆固醇(TC)上调可能是由于缺乏与无菌状态相关的内毒素。
有趣的是,肠道微生物群的缺失似乎减弱了长期膳食脂质消耗的致动脉粥样硬化作用。
具体而言,与传统小鼠相比,HFD 喂养的无菌 Ldlr-/- 小鼠的血栓大小显着减小。尽管无菌和常规 Ldlr-/- 喂食 HFD 小鼠的血浆 TC 水平没有差异,但与喂食的无菌小鼠相比,富含脂质的饮食仍然诱导无菌小鼠的 TC 水平(TC≈1.6 mg/dlx103)约两倍配合食物(TC≈0.8 mg/dlx103)。
相比之下,HFD 诱导常规小鼠血浆 TC 增加约 8 倍(TC ≈1.6 mg/dlx103) 与以食物喂养的小鼠相比 (TC≈0.2 mg/dlx103 )。在这项研究中也发现了 VLDL 的类似发现。富含脂质的饮食还加剧了 Ldlr -/-小鼠的微生物群失调,梭菌科、葡萄球菌科、芽孢杆菌科的丰度增加,乳酸杆菌科的丰度降低。然而,最近的研究表明,在晚期主动脉粥样硬化方面,无菌Ldlr-/-与常规小鼠之间没有发现显着差异。
总之,不同的研究表明肠道微生物群对血脂代谢。这种影响对 CVD 发展是否具有保护作用或加重作用仍不清楚。这种差异可能取决于动物模型、动物年龄、饮食类型、喂养期以及住宿条件。未来的研究可以将这些因素纳入考虑范围,以便进行更好的调查。
TMAO,是一种饮食诱发的心血管疾病风险微生物生物标志物。
★ 饮食-肠道菌群代谢物TMAO(三甲胺-N-氧化物)
这是一种从饮食营养素衍生的肠道微生物共同代谢物,十年前首次被发现并被报道预测CVD的风险。饮食前体磷脂酰胆碱、胆碱和L-肉碱通常存在于奶酪、红肉、海鲜、蛋黄和其他西式营养素中,主要由特定的肠道微生物酶代谢,产生高水平的三甲胺(TMA)。
具体而言,含有功能性微生物CutC/D基因的TMA裂解酶负责胆碱相关TMA转化。TMA进一步被血液吸收,并在肝脏中被黄素单加氧酶(FMO,主要是FMO3)氧化,生成TMO。
在人类肠道中发现了七种不同的表达TMA裂解酶CutC/D的菌株,包括:
此外,TMA可以通过微生物里斯克型左旋肉碱加氧酶CntA/B从左旋肉碱合成。
虽然CntA/B编码基因已在变形杆菌中鉴定,但尚未证明共生肠道微生物群形成依赖于L-肉碱的TMA。然而,最近的一项研究发现,两种细菌菌株Emergencia timonensis和Ihubacter Massilensis的新组合在肉碱转化的TMA积累中具有潜在的重要作用。
有趣的是,最近发现的细菌E.timonensis通过L-肉碱促进TMAO的产生→ γ-BB(γ-丁基甜菜碱,肉碱的前体)→ TMA→ TMAO途径。然而,与肉碱TMA转化途径相关的特定共生微生物群仍需进一步发现。
★ 饮食-微生物群衍生的TMAO在CVD发病机制调节中的作用
最初的研究表明,高胆碱或肉碱饮食饲养的小鼠循环TMAO水平升高,巨噬细胞泡沫细胞形成的增加和主动脉粥样斑块形成的增强(图1)。
相反,在无菌或抗生素治疗的ApoE−/−小鼠中,TMAO产生能力和胆碱或肉碱饮食相关的动脉粥样硬化斑块负荷分别被消除或抑制 (C57BL/6株)。有趣的是,ApoE−/− 研究发现,当从高TMA/TMAO产生的供体C57BL/6小鼠接受盲肠微生物群移植时,小鼠比从低TMA/TMAO产生的供体NZW/LacJ小鼠产生更高的胆碱饮食依赖性主动脉病变聚集。
类似地,在无菌小鼠体内移植产生高TMA的微生物可诱导血小板高反应性,并增强与高血浆TMAO水平相关的血栓形成。
因此,微生物群对于TMAO的产生是必要的,TMAO通过以下几种机制参与动脉粥样硬化的进展:
1)泡沫细胞形成
微生物群衍生的TMAO可以激活应激诱导的热休克蛋白(HSP)HSP70或HSP60的表达,这可能触发巨噬细胞中清道夫受体(例如SR-A1)和CD36的激活,以刺激氧化低密度脂蛋白(ox-LDL)的摄取和泡沫细胞的形成。
2)炎症
TMAO通过激活Ldlr中的丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,诱导促动脉粥样硬化炎症标志物表达,包括IL-6、环氧合酶2(COX-2)和细胞内粘附分子 Ldlr−/− 小鼠吃富含胆碱的食物。
循环TMAO的增加与促炎细胞因子TNF-α和IL-1β的升高以及抗炎细胞因子IL-10的降低有关。
3) 脂质代谢
TMAO可抑制胆固醇逆向转运(RCT),导致动脉胆固醇沉积,加速动脉粥样硬化病变。
4) 血小板高反应性和血栓形成
饮食诱导的高水平微生物TMAO可刺激血小板激活次最大刺激物,包括凝血酶、二磷酸腺苷(ADP)和胶原,并诱导细胞内钙的释放,导致血小板高反应性。
然而,一些研究显示了相反的结果,表明饮食中的TMAO、胆碱或肉碱不会诱发ApoE−/− 的动脉粥样硬化或者Ldlr−/− 小鼠模型。这种差异可能是由于居住条件和小鼠模型造成的,但确切的原因仍有待进一步发现。
最近证明,TMA(而非TMAO)降低了心肌细胞和血管平滑肌细胞的活力。在大鼠体内静脉注射TMA时,平均动脉血压显著升高,表明TMA对CVD有有害影响。
进一步证实TMA在CVD发病机制中的作用并验证相关机制,还需要进行更多的体内和体外研究。
图1 肠道菌群产生的膳食代谢物在心血管疾病发病中的潜在机制

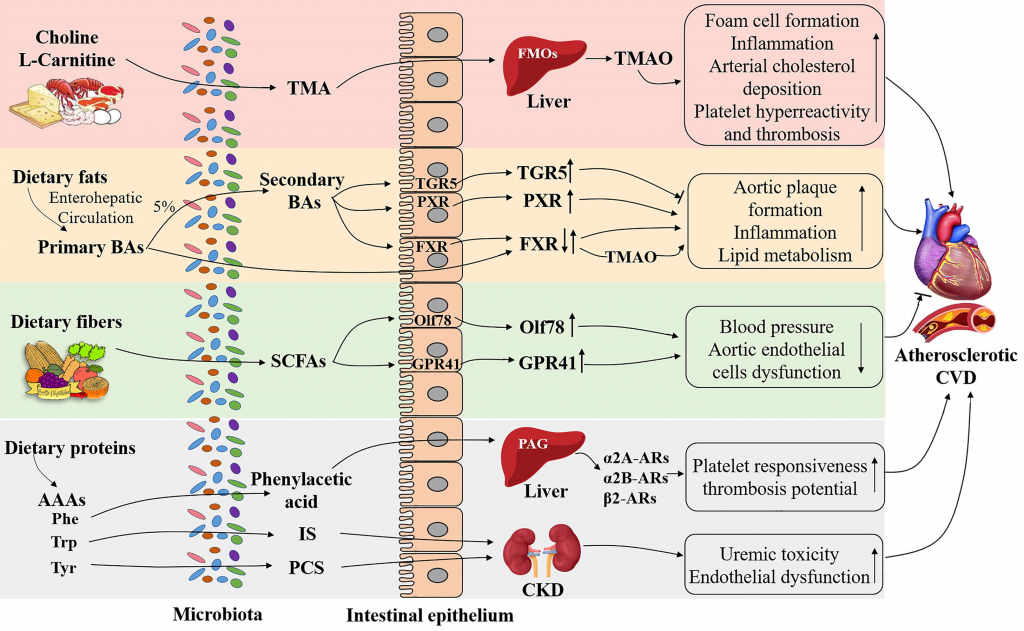
Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★人体循环TMAO在心血管疾病预测和预后中的研究
大量人体研究已经证明肠道微生物衍生的TMAO在预测CVD风险中的作用。
最初的研究调查了1800多名受试者的人类队列,发现血浆TMAO升高与多种CVD亚型的发生有关,包括外周动脉疾病(PAD)、冠状动脉疾病和心肌梗死史。
在临床结果研究中,大量参与者表明,循环TMAO与主要不良心血管事件、事件死亡率和动脉梗死的风险增加呈正相关。在许多研究中,血浆TMAO的临界值超过6μM,以预测全因死亡率的风险,最近对10000多名受试者进行的荟萃分析提出,CVD预后的血浆TMAO临界值为5.1μM。
此外,已发现高水平的TMAO与人类队列中促炎性单核细胞和心血管风险的增加有关。
同样,一项系统回顾和剂量反应荟萃分析招募了13000多名参与者,发现血浆TMAO水平升高与炎症标志物C反应蛋白(CRP)升高之间存在非线性关联。然而,并非所有的人体研究都发现了类似的数据。例如,无症状动脉粥样硬化患者的肠道微生物群和血液TMAO水平没有明显变化。然而,中风和短暂性脑缺血发作患者表现出肠道微生物群的显著失调,但血浆TMAO水平降低。
相比之下,在一组35-55岁的参与者(n=817)中,在10年的随访中,TMAO浓度与动脉粥样硬化进展之间没有显著关系。
有趣的是,最近的一项研究发现,TMA而非TMAO与高血压负荷和CVD风险因素有关,并与早期慢性肾病(CKD)受试者中Akkermansia属、粪杆菌属、Ruminococcus、Subdoligranulum的丰度降低有关。
然而,仍需对人类队列进行进一步研究,以调查TMAO前体TMA是否是早期CVD发病机制调节中被遗忘的毒素或预测因子。
胆汁酸(BAs)是羟基化和饱和类固醇,有助于乳化和肠道吸收膳食脂肪和脂溶性分子。
在人类肝细胞中,初级胆汁酸(胆酸和鹅去氧胆酸)由胆固醇通过催化酶合成,如胆固醇7a羟化酶(CYP7A1)、甾醇27羟化酶(CYP27A1)、氧化甾醇7a羟化酶(CYP7B1),其表达受肠道微生物群的调节。
然后,初级胆汁酸与甘氨酸或牛磺酸结合,95%以上的初级胆汁酸被重新吸收并再循环回肝脏。非再吸收的胆汁酸可通过催化酶胆盐水解酶(BSH)解结合,该酶由几种共生肠道细菌表达,包括革兰氏阳性双歧杆菌、梭菌、肠球菌、乳酸杆菌和革兰氏阴性拟杆菌。
除了去结合,肠道微生物如梭菌和真杆菌也是7-脱氢酶的来源,以生成次级胆汁酸,包括来自CDCA的石胆酸(LCA)和来自CA的脱氧胆酸(DCA)。
此外,胆汁酸的氧化和差向异构化是通过羟类固醇脱氢酶(HSDHs)催化的,这种酶已在各种细菌中发现,包括放线杆菌、变形杆菌、梭菌和其他细菌。
一旦微生物代谢的胆汁酸进入循环血液,胆汁酸受体就可以介导信号通路来调节宿主代谢,有助于CVD的发展。
最重要的胆汁酸受体之一是FXR,它是肝脏初级胆汁酸和肠道次级胆汁酸的主要传感器。FXR在调节脂质和葡萄糖代谢方面已被证实。
有趣的是,在动脉粥样硬化易感小鼠中FXR的激活在动脉粥样硬化病变的形成中显示出保护作用。相应地,ApoE−/−中FXR的缺失导致脂质代谢缺陷的严重程度增加,主动脉斑块形成增强。相比之下,对FXR/ApoE或FXR/Ldlr双缺陷小鼠的其他研究显示主动脉病变和血浆LDL胆固醇降低。有趣的是,FXR还通过调节FMO3活性来调节TMAO途径。
另一个重要的胆汁酸受体是TGR5,通过继发性胆汁酸激活该受体,可通过减少斑块内炎症、斑块巨噬细胞含量和脂质负荷来减轻血管病变的形成。
PXR是另一种与胆汁酸代谢相关的核受体,由次级胆汁酸(如LCA)激活。
与其他受体相比,PXR的激活提高了脂蛋白VLDL、LDL和CD36的表达水平,从而聚集动脉粥样硬化形成中的ApoE−/− 小鼠,而PXR在载脂蛋白E中的抑制作用ApoE−/− 小鼠,通过减少巨噬细胞的脂质摄取和CD36表达减轻了主动脉病变区域。
尽管大多数关于胆汁酸在CVD发病机制中的研究都是在小鼠模型上进行的,但在临床队列中发现胆汁酸的循环水平与CVD表型相关。
例如,研究发现,人类受试者的初级和次级胆汁酸水平降低,慢性心力衰竭患者的总体生存率降低。此外,较低的空腹血浆总胆汁酸与冠状动脉疾病、MI和冠状动脉病变的严重程度显著相关。
总之,肠道微生物群衍生的胆汁酸通过多种类型的胆汁酸受体调节CVD的发展,而血浆胆汁酸可能是CVD发生的另一个重要预测因子,仍需进一步研究。
短链脂肪酸是膳食纤维(主要是多糖)发酵的主要微生物产物,主要由乙酸盐、丁酸盐和丙酸盐组成。肠道微生物群的特定成员参与短链脂肪酸合成的特定发酵途径。
肠道微生物群调节富含纤维的饮食与心血管疾病风险之间的保护性关联。具体而言,许多研究已经阐明了膳食纤维或短链脂肪酸在缓解高血压或其他CVD亚型中的功能作用(图1)。
其中一项研究发现,高纤维饮食和补充乙酸盐都可以降低收缩压和舒张压、心肌纤维化和左心室肥厚,这与改善肠道失调和增加拟杆菌的数量有关。
类似地,丙酸盐治疗可保护小鼠免受高血压心血管损伤,而产丁酸盐的细菌(如Roseburia intestinalis)可减少主动脉粥样硬化病变面积。
研究发现,Olfr78和GPR41参与调节宿主血压和内皮功能。具体而言,丙酸盐通过调节Olfr78和GPR41表达的中断,在野生型小鼠中诱导急性低血压反应。然而,抗生素治疗Olfr78−/− 小鼠(而非野生型小鼠)血压升高,GPR41升高,与野生型小鼠相比,小鼠也有收缩性高血压。
此外,最近的一项研究表明,乙酸盐和丁酸盐通过仅对丁酸盐进行GPR41/43激活,从而提高NO的生物利用度,从而改善大鼠主动脉内皮功能障碍。为了揭示短链脂肪酸在CVD发病机制中的机制作用,还需要进行进一步的研究。
★ 人类研究
在人类中,大多数关于CVD风险的研究都与短链脂肪酸相关的血压调节有关。早期临床干预研究发现,增加膳食纤维摄入量与高血压患者的血压降低有关。
在一项荟萃分析研究中也发现了粘性可溶性纤维对血压的类似保护作用。
相比之下,最近的一项干预研究报告称,高纤维高蛋白饮食可能通过上调循环短链脂肪酸水平增加CVD的风险。具体来说,高蛋白高纤维饮食诱导丙酸水平升高,这与LDL胆固醇和血压的上调有关;较高的丁酸水平与葡萄糖的上调和高密度脂蛋白胆固醇的下调有关。然而,它仍然局限于短链脂肪酸对人类CVD风险或保护作用的直接证明,需要进一步澄清。
芳香族氨基酸(AAA)是含有芳香环的氨基酸,包括苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)。
芳香族氨基酸的主要来源是膳食蛋白质,如牛肉、猪肉、鸡肉或鱼。有趣的是,研究人员发现了肠道微生物群产孢梭菌Clostridium sporogenes产生芳香族氨基酸代谢物的途径。
最近,几项研究发现,苯丙氨酸衍生的微生物代谢物苯乙酰谷氨酰胺(PAG)与主要心脏不良事件(如心肌梗死、急性缺血性中风或冠状动脉疾病)之间存在密切关系。
具体来说,膳食中的苯丙氨酸通过富含porA基因的肠道微生物群转化为苯乙酸,随后在肝脏中转化为PAG。PAG进一步激活G蛋白偶联受体,包括α2A、α2B和β2肾上腺素能受体,以促进动脉损伤动物模型中的血小板反应性和血栓形成潜能。
同样,来自Trp的肠道微生物衍生代谢物吲哚硫酸酯(IS)和来自Tyr的对甲酚硫酸酯(PCS)也被确定为预测CKD患者CVD事件的有价值标记物。
这可能是由于IS和PCS通过诱导尿毒症毒性和内皮功能障碍而产生的有害影响。
然而,一些研究发现IS、PCS或PAG与CVD结果无关。这种差异可能是由于不同研究的阈值效应造成的。这些肠道微生物代谢物在心血管疾病进展中的作用尚需进一步研究。
健康饮食模式已被建议预防 CVD 进展(图 2),包括地中海饮食(Med-diet)、阻止高血压的饮食方法(DASH)和间歇性禁食(IF)等喂养模式。
图2 针对肠道微生物群的饮食干预在预防心血管疾病方面的潜在疗法

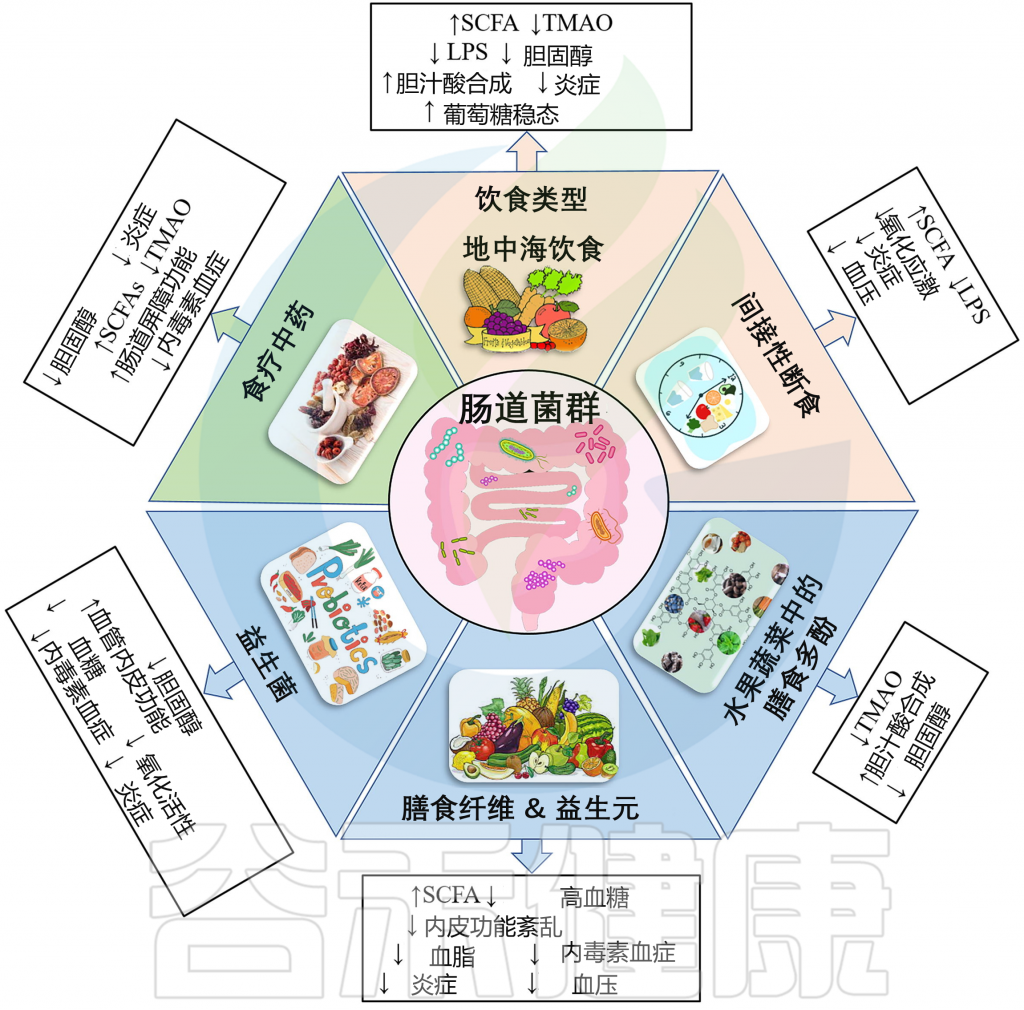
Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★ 饮食类型
多项临床试验证实了地中海饮食对主要血管事件、冠状动脉事件、中风和心力衰竭的保护作用。这种效应与微生物群多样性和微生物代谢物短链脂肪酸的增加以及TMAO 和血浆LPS水平的降低有关。
然而直到最近,才发现地中海饮食的长期干预可以通过肠道微生物群调节来预防 CVD。
具体来说,地中海饮食的长期干预可以通过富含膳食纤维代谢物(如Faecalibacterium prausnitzii和Bacteroides cellulosilyticus )显着改变整体肠道微生物组。
特别是,在没有普氏菌的情况下,地中海饮食对 CVD 危险因素(包括脂质代谢、炎症和葡萄糖稳态)显示出强大的保护作用。
尽管多项数据表明 DASH 饮食可以通过降低血压和血脂异常来改善心脏危险因素,仍然缺乏关于 DASH 饮食与 CVD 预防中微生物群改变之间直接联系的数据。
★ 喂养模式
间歇性禁食(IF)是一种重要的饮食喂养模式,是一种周期性能量限制的做法,可以通过改变肠道微生物群来降低CVD风险。
具体而言,自发性高血压卒中易感大鼠在IF干预50天后,肠道微生物群β多样性发生显著变化,这与通过调节胆汁酸代谢降低血压有关。这些发现已通过对GF大鼠的粪便移植得到证实。
此外,在8周内对患有IF的人群进行临床干预,显著改善了血管舒张参数,减轻了氧化应激、与微生物群产生的短链脂肪酸增加相关的炎症,并降低了血浆LPS。有趣的是,短期禁食5天也可以降低血压和体重,调节微生物群,包括脱硫弧菌科、阿克曼菌和瘤胃菌科。
★水果和蔬菜中的多酚
多酚是一大类常见于植物产品中的有机化合物,尤其是水果和蔬菜。超过90%的总多酚在小肠中不可吸收,并被大肠中的肠道微生物群进一步代谢。
越来越多的研究支持膳食多酚对肠道微生物群的修饰和CVD保护的作用。
白藜芦醇(在葡萄、苹果和浆果等水果中发现)已被确定通过下调TMAO水平和上调BAs合成来减轻ApoE-/-小鼠的动脉粥样硬化,而BAs合成与有益菌拟杆菌、乳酸杆菌、双歧杆菌和阿克曼菌的丰度增加有关。
口服槲皮素(在洋葱、西兰花和西红柿等蔬菜中发现)可以抑制体重增加,改善动脉粥样硬化病变的程度,降低胆固醇水平、致动脉粥样硬化溶血磷脂酰胆碱水平,减少革兰氏阴性菌疣状芽胞菌的丰度,同时增加微生物多样性。
在人类受试者中,富含多酚的饮食干预发现,饮食多酚可以显著增加微生物多样性和Ruminococcaceae,这些与心脏代谢危险因素(如血浆甘油三酯和大 VLDL 中的胆固醇)的改善有关 。
总的来说,水果和蔬菜中的多酚可能是心血管疾病的潜在治疗干预措施,它们的部分保护作用可以通过肠道微生物群的修饰来介导。
关于多酚详见这篇文章:肠道微生物群与膳食多酚互作对人体健康的影响
★膳食纤维
膳食纤维是不易消化的碳水化合物,包括水溶性或不溶性形式,通常存在于水果、蔬菜、全谷物、坚果和豆类等中。
膳食纤维不能被小肠吸收,“喂养”健康的肠道微生物群,导致短链脂肪酸的多样性和产量增加。
如前所述,短链脂肪酸激活特异性受体,从而改善高血压和主动脉内皮细胞功能障碍。
最近的一项研究发现鹰嘴豆膳食纤维提高了微生物多样性,增加了拟杆菌和乳酸杆菌的相对丰度,并提高了丙酸水平。鹰嘴豆膳食纤维也可以通过对肠道微生物群进行类似的修饰来改善高血糖症。
全谷物燕麦还能降低血浆胆固醇水平,提高胰岛素敏感性,这与微生物群中有益乳酸杆菌的增加有关。同样,人类食用全谷物产品时,总胆固醇和低密度脂蛋白胆固醇水平较低,双歧杆菌含量较高。
关于膳食纤维详见这篇文章:你吃的膳食纤维对你有帮助吗?
益生元是植物源性或不易消化的食物成分,可刺激胃肠道中“友好”微生物的生长。
大多数益生元是膳食纤维,而不是所有膳食纤维都可以归类为益生元。常见的益生元包括低聚糖和多糖,如菊粉、低聚果糖、β-葡聚糖,它们通常能诱导肠道微生物群的特定修饰。
许多研究通过三个主要方面有趣地研究了益生元对宿主代谢的有益影响,以改善CVD状况(图2):
1)降低血脂
补充益生元纤维(例如菊粉)可以降低血浆胆固醇水平,并减少肝脏中的TAG积累;
2)减少内毒素血症和炎症
益生元低聚果糖可以增加双歧杆菌的数量,与血浆和脂肪组织中的内毒素血症和炎症呈负相关;
3)降低血压
补充富含益生元纤维的饮食可以通过GPR43信号通路降低收缩压和舒张压。
益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。人类饮食中的大量发酵食品,如酸奶、酸菜、开菲尔、泡菜,都含有益生菌菌株。
作为益生元,益生菌菌株也被确定在更多方面防止CVD进展(图2):
1) 改善血管内皮功能
服用植物乳杆菌299v可改善冠心病患者阻力动脉的内皮依赖性血管舒张功能。同样,发酵乳杆菌CECT5716治疗可降低大鼠的血管氧化应激并改善内皮功能。
2) 降低血糖和氧化活性
益生菌酸奶的干预显著降低血糖,提高总抗氧化状态。
3) 降低胆固醇
补充长双歧杆菌BB536对降低总胆固醇、肝脏脂质沉积和脂肪细胞大小有显著效果。
4) 减轻内毒素血症和炎症
通过恢复肠道屏障功能,通过改善系统性内毒素血症诱导的炎症,口服粘液阿克曼菌已被证明可减少动脉粥样硬化病变。此外,补充乳酸杆菌 L.reuteri V3401可降低炎症标志物水平,如TNF-α、IL-6、IL-8,这与降低CVD风险有关。
更多益生菌、益生元等介绍详见这篇文章:
如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
一些来自中药的天然成分也通过调节肠道微生物群被用作潜在的CVD疗法(图2)。
小檗碱(BBR),一种生物活性异喹啉生物碱,广泛存在于各种中草药中并从中提取,已被证明具有许多有益的作用。
最近发现,高剂量的小檗碱不仅通过降低总胆固醇和极低密度脂蛋白胆固醇水平来改善脂质代谢,还下调促炎细胞因子TNF-α、Il-1β、Il-6和上调的抗炎性Il-10水平,这些水平与参与短链脂肪酸产生的Alistipes和Roseburia的丰度增加有关。
Roseburia菌 详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
此外,BBR可以通过重塑肠道微生物群成分来抑制TMAO的产生,从而减轻胆碱诱导的动脉粥样硬化。
红曲米(RYR)可以通过降低总胆固醇和低密度脂蛋白水平来缓解斑块的形成,而总胆固醇和低密度脂蛋白水平与厚壁菌/拟杆菌的比例降低有关,同时也降低了黄曲霉和黄酮类提取物的丰度。
RYR干预还能改善肠道屏障功能,并通过TLR信号通路减轻炎症。
灵芝是一种药用蘑菇,通过降低携带内毒素的变形菌水平和增加有益细菌(包括梭菌和真杆菌),来减少肥胖、内毒素血症、慢性炎症以及恢复肠屏障功能。
肠道微生物群与心血管疾病之间存在着重要而复杂的联系。作为肠道微生物群中重要的调节剂之一,膳食成分可改变与全身内毒素、炎症、肠道屏障功能障碍以及脂质代谢功能障碍相关的微生物成分,从而增加CVD风险。
然而,更多的研究数据表明,肠道微生物群对饮食代谢在调节CVD发病机制中的主要作用包括:
1) 代谢饮食胆碱或L-肉碱以诱导TMAO的释放,促进动脉粥样硬化的进展;
2) 调节胆汁酸代谢,可能通过多种受体途径调节动脉粥样硬化的形成;
3) 产生芳香族氨基酸代谢物PAG、IS、IPA或PCS,加速动脉粥样硬化形成;
4) 发酵膳食纤维以产生短链脂肪酸,这对CVD的进展起到了一些有益的作用。
这些发现为开发CVD的新型潜在预防和治疗方法提供了一些极好的支持,例如可以通过健康饮食和喂养模式、含有健康膳食成分的饮食等干预措施改善菌群,从而预防改善CVD。当然也包括:来自水果和蔬菜的膳食多酚、膳食纤维和益生元、益生菌以及饮食中药等干预措施。主要参考文献:
Xufei Zhang, PhilippeGérard. Diet-gut microbiota interactions on cardiovascular disease. Computational and Structural Biotechnology Journal. 2022,Mar: 1528-1540. doi: org/10.1016/j.csbj.2022.03.028
Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell Mol Life Sci. 2019 Apr;76(8):1541-1558. doi: 10.1007/s00018-019-03011-w. Epub 2019 Jan 25. PMID: 30683985.
Bapteste E, Gérard P, Larose C,et al., The Epistemic Revolution Induced by Microbiome Studies: An Interdisciplinary View. Biology (Basel). 2021 Jul 12;10(7):651. doi: 10.3390/biology10070651. PMID: 34356506; PMCID: PMC8301382.
Tang WHW, Li DY, Hazen SL. Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol. 2019 Mar;16(3):137-154. doi: 10.1038/s41569-018-0108-7. PMID: 30410105; PMCID: PMC6377322.