 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

为什么一种药物对一位患者反应良好,但对另一位患者反应不佳,甚至在某些情况下会导致严重的药物不良反应?
研究表明,一些药物的反应率在50%-75%,也就是说很多人服用药物后其实没有得到实际的改善,这并不代表该药物没用,可能只是对一些人效果不大,这是什么原因导致的呢?
这其实与药物反应个体差异(简称IVDR)相关。这种差异归因于多种因素,包括遗传、年龄、性别、生活方式、疾病状态、周围环境、肠道微生物群和药物相互作用等。
在精准医学正在加速来临的时代,根据个人的遗传、环境和生活方式因素制定量身定制的医疗干预措施成为可能,然而,药物反应的个体差异是实施精准医疗的主要障碍。因此,需要更好地了解药物反应的个体差异,以提高药物疗效或预防不良反应。
研究表明,在肠道中,药物和微生物群之间存在复杂的相互作用:
▸ 一方面,药物可以导致肠道微生物群的组成和功能的改变,导致微生物代谢和免疫反应的变化。
例如,二甲双胍可以减少肠道中的脆弱拟杆菌,降低该菌的胆盐水解酶活性,使GUDCA水平升高,以不依赖于肠道AMPK的方式,抑制肠道FXR信号,发挥改善代谢的作用。
▸ 另一方面,肠道微生物群可能改变药物,包括产生催化或降解药物分子的酶、改变药物在宿主体内的代谢水平以及与药物分子竞争代谢酶等方式,直接或间接地改变药物的吸收、分布、代谢和排泄,从而影响药物疗效。
例如,同样使用华法林的心血管疾病患者,有些人对该药物反应较低,这部分患者的肠道中拟杆菌、志贺氏菌、克雷伯氏菌较多,华法林是一种抗凝血药物,通过抑制维生素K的活性来减少血液凝块的形成。志贺氏菌有助于产生维生素K。因此,如果肠道中的志贺氏菌数量较多,它们可能会提供足够的维生素K,从而减少华法林的抗凝血效果。
本文我们来了解一下,常用药物和肠道微生物组之间复杂的双向相互作用,通过人体各个系统中的不同例子来阐述具体的机制。对这方面的逐步了解,有助于改善药物的效果,同时最大程度地减少不良反应,也有助于推动精准医疗的发展。
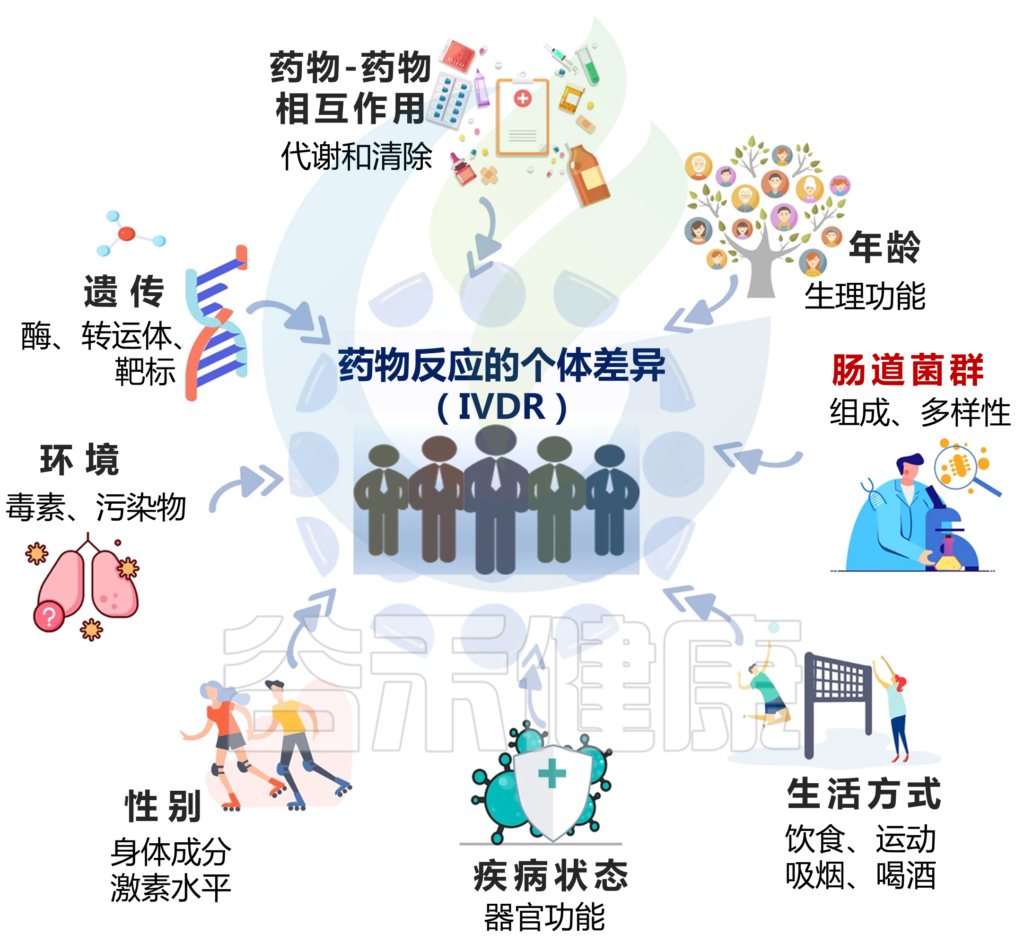
药物反应的个体差异(IVDR)是指不同个体在使用相同药物时表现出的不同反应情况。这种差异可以涉及药物的吸收、分布、代谢、排泄等方面。
了解个体差异可以帮助医生更好地调整药物剂量和选择合适的药物,以最大程度地提高治疗效果并减少不良反应的发生。
Zhao Q, et al., Signal Transduct Target Ther. 2023
IVDR是多种因素共同作用的结果,包括:
1)遗传学
编码药物代谢酶、转运蛋白和靶标的单个基因的变异会影响其代谢和对药物的反应,导致IVDR。
2)年龄
由于生理功能的差异,如肝肾功能、身体成分和激素水平的变化,年轻和老年患者可能会经历不同的药物反应。例如,老年患者可能肾功能和肝代谢降低,导致PK改变。
3)性别
男性和女性之间的生物差异会影响药物反应。由于身体成分和激素水平的差异,女性可能有更高的药物浓度,这将影响药物代谢和清除。
4)生活方式
饮食、运动、吸烟等因素,酒精摄入可以通过改变药物代谢和从体内清除的方式来影响药物反应。
5)疾病状态
患有某些疾病或病症的患者可能会因器官功能变化、药物代谢改变或药物受体表达改变而经历IVDR。例如,肝病患者的药物代谢可能会降低,肾病患者的药物清除率可能会降低。
6)药物-药物相互作用
同时使用多种药物可能会导致药物-药物的相互作用,从而改变药物的吸收、分布、代谢、排泄。
7)环境因素
暴露于环境毒素和污染物会影响药物代谢和清除,可能导致IVDR.
8)肠道微生物群
肠道微生物群也可能影响药物药代动力学(PK)和药效学(PD),个体之间肠道微生物群组成的变化会导致IVDR。
肠道微生物群与药物治疗之间的关联
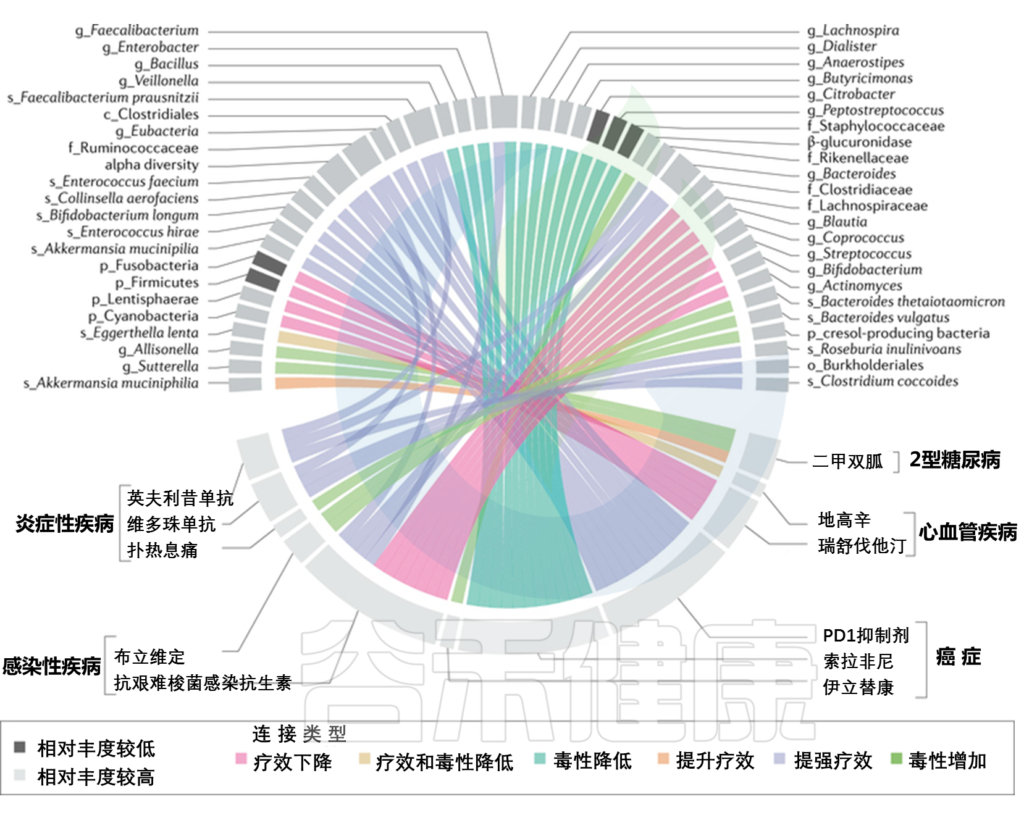
doi: 10.1038/s41575-021-00499-1
总体而言,了解这些因素对于优化药物治疗和将药物不良反应风险降至最低至关重要。
药物遗传学专注于识别影响药物代谢、转运、药效学 (PD) 等的遗传变异。
药物基因组学是一个更广泛的领域,考虑整个基因组及其对药物反应的影响。
尽管药物遗传学和药物基因组学取得了进展,人类基因组贡献的变异性可能在20%-95%,因此,仅遗传因素不足以解释药物反应的个体差异,其他因素,例如肠道微生物群也很重要。
肠道微生物群可以通过直接转化药物或调节宿主的代谢或免疫系统,来改变药物的药效学和药代动力学。
药物微生物组学一词,用来描述肠道微生物群和药物反应之间的相互作用,这些相互作用可以改变药效学(即药物吸收、分布、代谢、排泄及其血浆药物浓度动态的变化)或药代动力学(即药物靶点或生物途径的变化,导致生物体对药物作用的不同易感性)。
接下来,我们就从人体八大系统的具体疾病中来一一了解,微生物群与药物之间的相互作用。了解这种相互作用有助于开发针对微生物群的方法,以提高药物疗效并减少不良反应。
现代医疗体系下的药物种类很多,我们按照以下几大类来介绍常见的药物:心血管系统、内分泌系统、消化系统、神经系统、运动系统、泌尿生殖系统、呼吸系统、癌症。
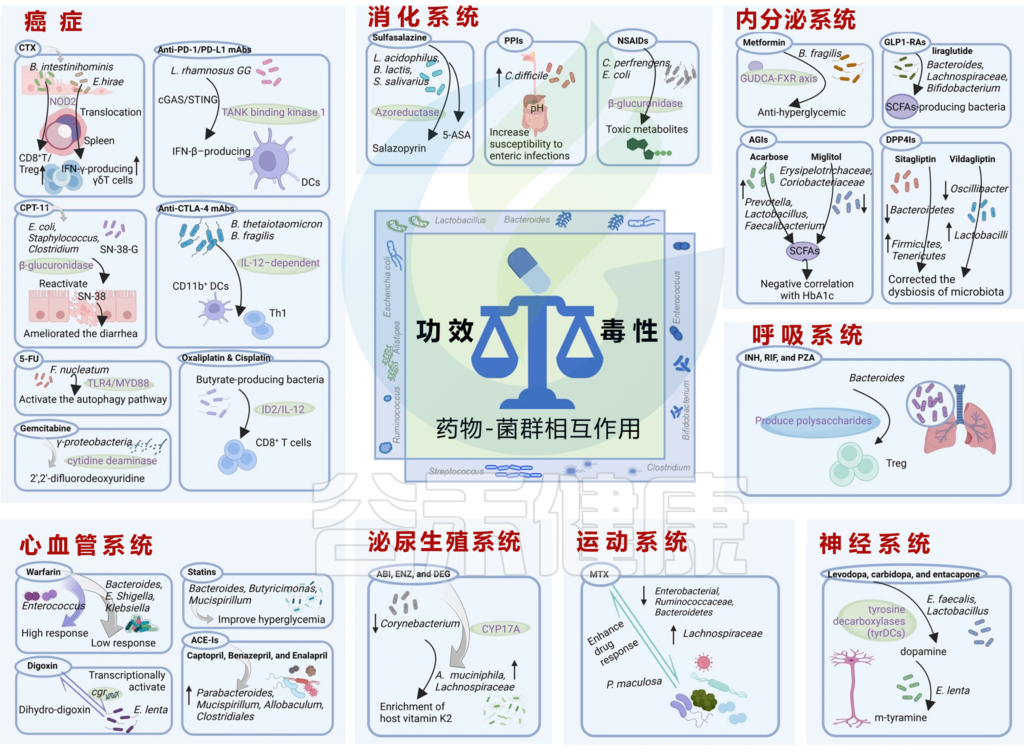
Zhao Q, et al., Signal Transduct Target Ther. 2023
华 法 林
华法林:防治血栓,但治疗窗口有限
华法林是一种维生素K拮抗剂,用于预防和治疗血栓形成和栓塞的疾病,然而,其治疗窗口有限,IVDR明显,促使许多研究确定影响治疗结果的遗传因素。
对华法林低反应者,志贺氏菌等菌群较多
已知肠道微生物群和维生素K代谢之间有联系。一项研究首次建立了肠道微生物群和IVDR与华法林之间的联系。针对200名对华法林有不同程度反应的患者的试验表明,拟杆菌、志贺氏菌、克雷伯氏菌在低反应者中表现突出。
华法林是通过抑制维生素K的作用,来防止血液凝结,维生素K参与合成凝血因子,在血液凝固过程中起着重要的角色,而志贺氏菌具有产生维生素K所必需的酶,可能出现一边抑制一边合成的情况,这可能是患者对华法林反应较弱的原因。相比之下,肠球菌与对华法林的反应增加有关。
▸
还需要更多的研究来证实和完善结果。
他汀类药物
他汀类药物:降胆固醇、抗炎、抗血栓
他汀类药物通常用于降低“坏”胆固醇,治疗心血管疾病。通过抑制HMG-CoA,减少肝脏中胆固醇的从头合成。
注:“坏”胆固醇,是指低密度脂蛋白胆固醇,简称LDL-C。
HMG-CoA,3-羟基-3-甲基戊二酰辅酶A,是一种参与胆固醇和同化代谢的重要酶。
近几十年的研究表明,他汀类药物具有许多多效性作用,包括抗炎、抗血栓形成和抗氧化,这可能与其心血管保护特性有关。他汀类药物可抑制Rho激酶和Rac1蛋白的功能,这两种蛋白与动脉粥样硬化的进展有关,动脉粥样硬化是心血管疾病的主要危险因素。他汀类药物还激活PPAR-γ.
注:PPAR-γ,过氧化物酶体增殖物激活受体γ,这是一种有助于调节炎症、脂肪代谢和糖代谢的核受体。
他汀类药物可以改变肠道微生物群的结构
一项研究发现,他汀类药物治疗显著增加了某些抗炎相关菌(如拟杆菌、Butyricimonas、 Mucispirillum),这可能有助于改善高血糖。
另一项研究表明,他汀类药可能通过PXR(孕酮X受体)介导的机制改变胆汁酸的复杂性,从而导致肠道失调,带来不良影响。
他汀类药物→改变胆汁酸→菌群失调
胆汁酸是在肝脏中从胆固醇合成的,对膳食脂肪的消化和吸收至关重要。他汀类药物通过直接抑制新生胆固醇的合成,可以抑制肝脏中的胆汁酸合成,从而改变人体肠道中的胆汁酸。肠道中胆汁酸的数量和结构的改变,可能通过改变肠道菌群直接或间接诱导出复杂而显著的生理反应。
▸
要更多的研究了解他汀类药物治疗对肠道微生物组的长期影响,以及这些变化是否始终对心血管疾病有益。此外,评估他汀类药物治疗和IVDR的可能风险和益处至关重要。
地高辛
地高辛:提高心脏泵送效率,但对10%患者无效
地高辛,是一种可以提高受损或虚弱心脏泵送效率的药物,从而提高临床稳定性和运动能力。然而,在低流量充血性心力衰竭中,由于特定菌株的失活,地高辛可能对10%的患者无效,这突出了IVDR对人类和微生物群的重要性。地高辛的失活是通过Eggerthella lenta将地高辛转化为失活状态二氢地高辛介导的。
E. lenta:可能成为地高辛失活的微生物标志物
在另一项开创性研究中,发现一个编码E. lenta细胞色素、心脏甙还原酶(cgr)的操纵子,被鉴定为地高辛转录激活,表明这可能是地高辛失活的可预测的微生物组生物标志物。
精氨酸增加→调节E.lenta→抑制地高辛失活
研究人员还探索了内源性地高辛相关物质可能被选择失活的可能性,并确定了合理的饮食干预是否可以调节体内地高辛的灭活。如前所述,E.lenta的增殖与精氨酸有关,精氨酸不仅能改善增殖,还能防止地高辛失活。因此,无论是饮食还是微生物群产生的精氨酸浓度的增加,都可能抑制这种不需要的微生物群功能。
饮食中增加蛋白质→提高地高辛水平
为了验证这一假设,研究人员使用两种不同饮食的小鼠进行了一项体内实验:一种不含任何蛋白质,另一种含有蛋白质总热量摄入的20%。结果表明,蛋白质摄入的增加显著提高了血液和尿液中的地高辛水平,但仅在携带地高辛减少菌株的小鼠中。
▸
总之,这些发现对受益于地高辛治疗的心力衰竭患者,具有重要的临床应用价值。此外,鉴定药物失活的预测性微生物群标志物,可能有助于制定个体微生物群落为基础的个性化治疗指南。
血管紧张素转换酶抑制剂(ACE-Is)
一代ACE-Is药:卡托普利,降压
卡托普利是第一代ACE-Is药物,通过抑制中枢和外周部位的肾素-血管紧张素系统(RAS)用于治疗高血压。除了其抗高血压作用外,卡托普利也会影响肠道微生物群的组成。研究表明,卡托普利在停药后保持其抗高血压活性。
一项用卡托普利治疗大鼠的实验中,下列菌群丰度增加:
此外,卡托普利可减少自身区域的神经元炎症,并减少交感神经驱动,它平衡了肠道微生物群。
最近的研究结果还表明,接受卡托普利治疗的母亲通过重建肠道微生物群、改善肠道病理和通透性以及恢复雄性后代失调的肠脑轴,具有持续的降压作用。
卡托普利治疗的怀孕大鼠中,梭菌属和梭菌目的存在率较高
与没有治疗的怀孕大鼠相比,用卡托普利治疗的怀孕大鼠在肠道微生物群中下列梭菌目平均丰度更高,例如:
因此,卡托普利可能会影响人类肠道微生物群的生长和组成,从而改变药物的有效性。
二代ACE-Is药:贝那普利和依那普利,治疗心血管疾病
贝那普利和依那普利是第二代血管紧张素转换酶抑制剂,主要用于治疗心血管疾病,如动脉高血压、充血性心力衰竭。这些药物通过抑制ACE的活性发挥作用,导致血管紧张素II生成减少。
注:ACE,血管紧张素转化酶,参与调节血管张力、血压以及体液平衡等生理过程。
血管紧张素Ⅱ,是一种使血管变窄并升高压力的激素。
最近研究表明,贝那普利和依那普利都有能力对肠道微生物群产生积极影响。
贝那普利治疗:促进肠道微生物群结构的恢复
贝那普利主要在肝脏中代谢,并转化为二酸贝那普利的形式,这会影响肠道微生物群。
依那普利治疗:改变肠道菌群,降低TMAO
依那普利可以降低血液中TMAO的水平。高浓度的TMAO与心血管疾病的高发病率有关。依那普利通过改变肠道微生物群的组成和控制尿液中甲胺的排泄,来影响血浆TMAO水平。
注:TMAO,三甲胺N-氧化物,一种由肠道微生物群代谢某些营养物质产生的化合物
心血管系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
▸
这些发现表明,ACE-Is可能在改善肠道微生物群组成和心血管健康方面有效。通过促进肠道微生物群结构的恢复和降低TMAO水平,贝那普利和依那普利可能有助于降低心血管疾病的风险。
其他降血压药物:药物-微生物相互作用
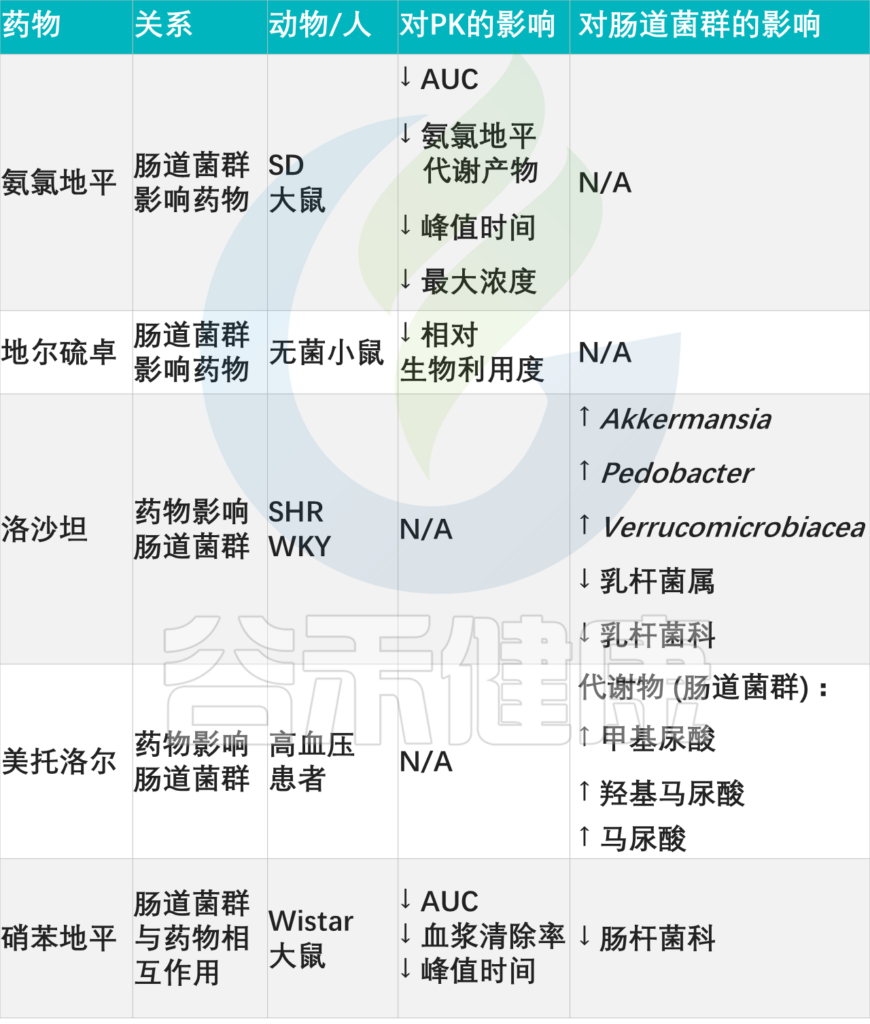
doi: 10.3389/fmed.2021.742394
内分泌系统是一个复杂的腺体系统,产生激素,负责调节各种身体功能,目前的证据表明,微生物群在内分泌系统的调节中发挥着重要作用,并可影响内分泌疾病的IVDR。
下面列出抗糖尿病药物和肠道微生物群之间相互作用的几个案例。
二甲双胍
二甲双胍是一种常见的抗糖尿病药物,也可以减少肥胖、降低心血管疾病和癌症的发病率等。
研究逐步发现,肠道微生物群调节葡萄糖代谢和能量平衡的机制,特别是可能参与IVDR的机制。
肠道菌群如何影响二甲双胍的抗高血糖作用
将未经治疗的2型糖尿病患者的粪便,移植到无菌小鼠身上,与对照小鼠相比,葡萄糖耐量显著改善。确定A.muciniphila及其金属结合蛋白的表达,是二甲双胍-微生物群相互作用的关键因素。
另一项研究表明,二甲双胍的抗高血糖作用涉及一种新的机制——脆弱拟杆菌-GUDCA-FXR轴。该途径依赖于肠道微生物群,并涉及肠道FXR信号的激活,以改善代谢功能障碍。发现二甲双胍可减少脆弱拟杆菌,防止GUDCA降解。
注:GUDCA,甘氨熊脱氧胆酸,一种FXR的拮抗剂
二甲双胍→抗炎→对心血管疾病的保护作用
包括激活AMPK途径和抑制NF-κB途径。越来越多的证据表明,微生物群介导的途径可能与二甲双胍的治疗作用有关。例如,二甲双胍治疗引起的肠道微生物群结构变化可能导致葡萄糖、激素、胆汁酸、短链脂肪酸和免疫的改变。
二甲双胍→调节肠道菌群→改善认知功能
二甲双胍不仅具有抗炎和抗氧化作用,还与神经保护有关,有研究表明二甲双胍的使用与2型糖尿病患者患痴呆症的风险降低有关,轻度认知障碍得到改善。这其中部分有益作用通过肠道微生物群的组成和功能来调节,从而增加短链脂肪酸和胆汁酸的产生。
二甲双胍对肠道菌群的影响

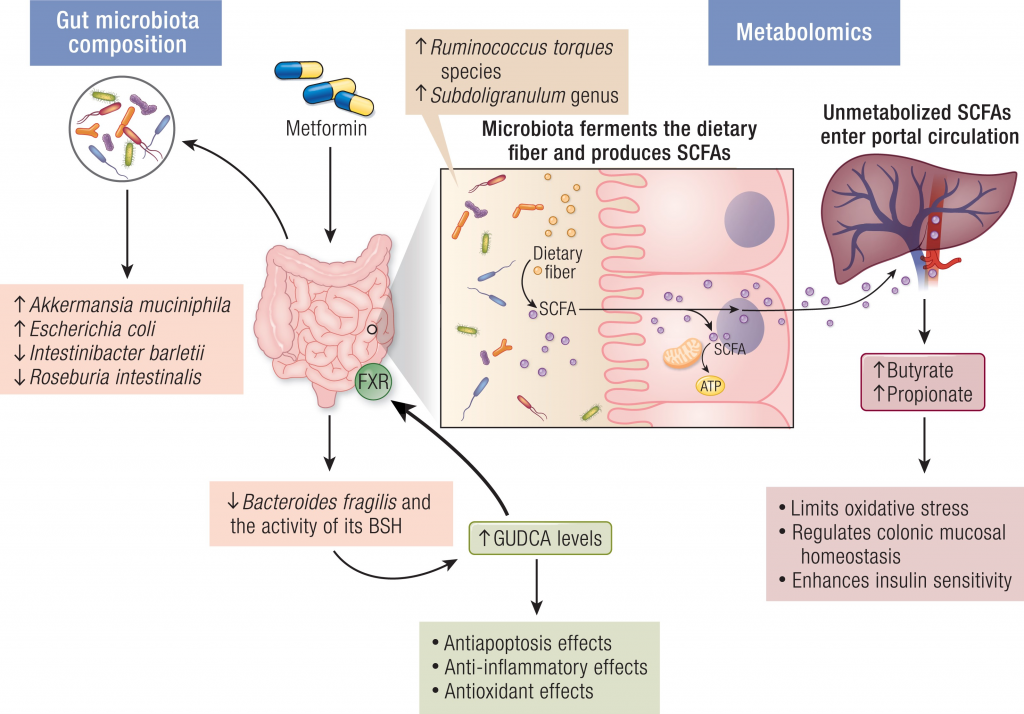
doi.org/10.1210/endrev/bnad029
▸
总的来说,新出现的证据表明,微生物群介导的肠道微生物群结构变化机制,可能是其多效性作用的原因。这对开发针对肠道微生物群及其与IVDR相互作用的新疗法具有重要意义。
α-葡萄糖苷酶抑制剂(AGI)
AGI是一类改变小肠中碳水化合物吸收和代谢的药物。这些药物会显著影响肠道微生物群的结构和变异性,这可能对管理代谢疾病(如2型糖尿病)有重要意义。阿卡波糖和米格列醇是两种常用的AGI。
阿卡波糖:产短链脂肪酸菌,乳杆菌 ↑↑
拟杆菌科、肠杆菌科、部分梭菌属 ↓↓
在体外,实验表明,阿卡波糖通过抑制麦芽糖导入物选择性地抑制大肠杆菌的生长,而临床试验表明,阿卡波糖增强了产短链脂肪酸菌的丰度,例如普雷沃氏菌属、乳杆菌属、粪杆菌属(Faecalibacterium)。短链脂肪酸对代谢健康有益,用乳杆菌治疗可以降低血糖。
此外,一项研究表明,在肠道微生物群中发现的Dialister在阿卡波糖治疗后增强,并与HbA1c呈负相关,这表明它可能在控制葡萄糖代谢中发挥作用。阿卡波糖也被证明可以增加双歧杆菌和乳杆菌,并减少高脂血症或2型糖尿病患者粪便中有害的拟杆菌科、肠杆菌科和卵磷脂酶阳性梭菌。
注:HbA1c在医学中指糖化血红蛋白,以反映最近两到三个月内的平均血糖水平
米格列醇:抗炎,逆转高能量饮食引起的菌群变化
米格列醇在小鼠中具有抗炎特性,可以抑制炎症反应的组织学和分子指标,并减少高脂肪高糖饮食产生的肠道转运时间。摄入高能量饮食会增加Erysipelotrichaceae和Coriobacteriaceae,但米格列醇可以逆转这种作用。据推测,肠道炎症的减少与肠道微生物群的这些变化有关。
▸
总的来说,AGI特别是阿卡波糖,可能有助于重建2型糖尿病患者的肠道微生物群平衡。通过增加产短链脂肪酸菌和减少潜在的有害菌,这些药物可能会对代谢健康产生积极影响。需要更多的研究来充分阐明其影响。
胰高血糖素样肽-1受体激动剂
GLP-1(胰高血糖素样肽-1)是肠内分泌细胞通过饮食产生的一种肠内激素,GLP-1在增强葡萄糖诱导的胰岛素分泌、抑制胰高血糖素分泌、抑制食欲和胃排空方面的作用,使其成为治疗糖尿病和超重的有力靶点。
最近的研究强调了肠道微生物群通过诱导GLP-1分泌来调节饱腹感和葡萄糖稳态的功能,GLP-1受体激动剂(如利拉鲁肽)作为一类新兴的抗糖尿病药物,已被证明可以调节肠道微环境,并改变肠道微生物群组成。
利拉鲁肽:改变厚壁菌门/拟杆菌门比例,有争议
通常,厚壁菌门与拟杆菌门的比例是肠道微生物群结构的重要指标。这在我们之前的一篇文章有讲述这方面内容,详见:
研究表明,利拉鲁肽可以使正常体重的糖尿病小鼠的肠道菌群比例向瘦体比例转变,从而使厚壁菌门与拟杆菌门的比例更高。
有趣的是,另一项研究表明,利拉鲁肽降低了厚壁菌门与拟杆菌门的比例,以降低单纯超重和糖尿病超重个体的体重,而与血糖状况无关。
这种差异可能归因于不同水平的高血糖和使用的不同模型系统。
GLP1受体激动剂已被证明可极大改变糖尿病雄性大鼠的肠道微生物群结构。这些变化包括选择性增强几种产短链脂肪酸菌,如拟杆菌、毛螺菌科和双歧杆菌。此外,GLP1受体激动剂可至少部分重建肠道微生物群的稳态。
二肽基肽酶-4抑制剂(DPP4Is)
DPP4Is(例如西格列汀和维达格利汀)是用于2型糖尿病的一线抗2型糖尿病药物。DPP4Is主要通过抑制GLP-1降解来降低血糖。先前的研究表明,肠道微生物群与DPP-4相关功能可能是DPP4Is的目标,可能为DPP4Is调节肠道微生物群不一致性开辟新的治疗应用。
研究表明,DPP4Is可以通过增加拟杆菌门来改善血糖控制,从而大大恢复高脂饮食诱导的肠道微生物群改变。
西格列汀:产短链脂肪酸菌↑↑适度恢复菌群失调
西格列汀对肠道微生物群影响的研究表明,拟杆菌门减少,厚壁菌门和软壁菌门(Tenericutes)增加。然而,西格列汀适度恢复了2型糖尿病大鼠的微生物群失衡,并改变了产短链脂肪酸菌的丰度。
维达利汀:乳杆菌↑↑ Oscillibacter↓↓
类似地,维达利汀给药与糖尿病大鼠的拟杆菌门增加和厚壁菌门减少,厚壁菌与拟杆菌门比例降低有关。此外,维达利汀通过调节肠道微生物群产生益处,导致乳杆菌增加和Oscillibacter减少。为了阐明变异机制,研究人员通过实验证实,维达利汀抑制盲肠内容物中的TLR配体,并恢复抗菌肽水平和回肠隐窝深度。研究还表明,DPP4Is可能通过对肠道微生物群的影响,间接减少肝脏中促炎细胞因子的分泌。
▸
总的来说,这些研究强调了DPP4Is对肠道微生物群的重要性,并揭示了改善葡萄糖稳态和IVDR的有希望的策略。
内分泌系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
消化系统是药物微生物组学最广泛的领域之一,对药物代谢和疗效至关重要。肠道微生物群会影响用于治疗各种消化系统疾病的药物的结果,例如,炎症性肠病(IBD)和肠易激综合征(IBS)。IBD患者的肠道微生物群组成和功能发生了改变,这可能会影响IVDR。
柳氮磺吡啶(SAS)
SAS是一种最初开发的药物,旨在治疗细菌感染引起的炎症。后来发现它在治疗溃疡性结肠炎方面有效。该药物由氨基水杨酸盐和磺胺吡啶组成,它们通过偶氮键连接在一起。SAS的一个独特特性是它不会在上游胃肠道中快速吸收。相反,它被结肠中的肠道微生物群分解为其各个组成部分。
随后,磺胺吡啶被吸收到血液中,而美沙拉秦(5-氨基水杨酸,5-ASA)可以在结肠中失活。
SAS+益生菌:5-ASA和磺胺嘧啶恢复
一项针对健康受试者的PK研究表明,肠道微生物群对激活SAS至关重要。这一发现或许可以解释为何该药物在治疗溃疡性结肠炎(UC)方面比克罗恩病(CD)更为有效。
通过给予益生菌菌株(例如嗜酸乳杆菌L10、乳酸双歧杆菌B94、唾液链球菌K12),可以增强肠道菌群SAS的功能。
在一项体外试验中,研究人员在厌氧条件下将大鼠结肠的内容物与SAS单独或SAS与益生菌联合孵育。发现益生菌具有偶氮还原酶活性,使其能够代谢SAS。经与SAS和益生菌共同培养后,样本中的5-ASA和磺胺嘧啶含量得到了更大程度的恢复。
尽管SAS是一种有效且廉价的溃疡性结肠炎治疗方法,但一些患者在使用时报告了不良反应,如恶心、皮疹和厌食症。这可能是由SAS通过肠道微生物群代谢引起的。因此,SAS不如其他溃疡性结肠炎治疗方法受欢迎。
质子泵抑制剂
PPIs是广泛用于治疗酸性疾病的药物,包括消化性溃疡、胃食管反流、消化不良、胃十二指肠病、出血。
PPI 有效,但长期使用可能存在不良反应
基于其疗效和安全性特点,质子泵抑制剂治疗在近几十年快速扩大。然而,与长期使用PPIs相关的安全性和可能的不良反应仍存在争议。据估计,高达70%的PPIs处方被认为是不必要的。一旦开始使用,很少重新评估PPIs的原始适应症,试图停药后不必要的长期使用也随之产生。
PPI:肠道菌群多样性↓↓ 部分口腔菌群增加↑↑
荷兰一项基于患者的大规模临床试验表明,PPI与肠道微生物群多样性减少和分类学变化之间存在很大相关性。
分析来自不同队列的16S数据发现,PPI的使用导致部分肠道微生物群丰度下降,口腔微生物群增加。

例如,肠杆菌科、肠球菌科和乳杆菌科增加,瘤胃球菌科和双歧杆菌科减少。而典型口腔微生物群的改变表现为下列菌群增加:
此外,观察到的变化似乎是PPI的一类功效,剂量的增加与微生物群的更大变化有关。
PPI的使用与可预测的功能变化
最近的研究表明,PPI的使用与24个分类群和133个途径高度相关,具有可预测的功能变化,包括脂肪酸生物合成、脂质生物合成和L-精氨酸的生物合成增加,嘌呤脱氧核糖核酸的降解。
PPI→胃酸↓↓→增加肠道感染的易感性
另一项受流行药物直接影响肠道微生物群的体外实验表明,生长速度发生了显著变化,这意味着PPIs与细菌H+/K+ATP酶的结合可能介导直接影响。 PPIs引起的胃酸减少,使口腔微生物群能够定植肠道微生物群,导致分类稳态改变,并可能增加对肠道感染的易感性,例如艰难梭菌、弯曲杆菌和沙门氏菌。
儿童期使用PPI,可能与日后肥胖相关
此外,PPI的启动和停用可能导致肠道微生物群的改变,可能加剧肝硬化。长期使用PPI,特别是在儿童时期,会导致肠道微生物群的永久性改变,可能导致日后的肥胖。
▸
虽然PPI被广泛认为是无害和有效的,但临床上应该重新评估其广泛、长期的影响和OTC的可及性。PPI使用的快速而广泛的转变导致了肠道微生物群的变化,影响了多达五分之一的人群。仔细评估PPIs诱导的肠道微生物群改变带来的长期影响,特别是在早期发育过程中,以及对晚年健康和疾病的潜在影响,这一点很重要。
非甾体抗炎药
非甾体抗炎药通常用于缓解疼痛和炎症,但它们的使用会导致不良反应,如胃溃疡和小肠粘膜损伤。
这是由于细菌葡萄糖醛酸酶在肠道中代谢非甾体类抗炎药,类似于CPT-11的情况,它将药物转化为损害肠道粘膜的有毒代谢产物。肝脏中产生的非甾体抗炎药的葡萄糖醛酸苷通过胆汁到达肠道,在胆汁中细菌GUSs将其水解为苷元。这些苷元随后被细胞色素P450重吸收并转化为潜在的细胞毒性中间体,从而引起肠道毒性。
注:CPT-11属于盐酸伊立替康注射液
与CPT-11一样,最近的一项研究表明,Inh1(抑制剂1)是一种新型的微生物特异性GUSs抑制剂,可以减少双氯芬酸的肠道药物不良反应。这表明抑制GUSs是减少某些药物不良反应的一种很有前途的方法。
虽然肠道微生物群产生对生物体具有有益功能的GUS,但条件致病菌或肠道致病菌,如产气荚膜梭菌和大肠杆菌,负责对药物进行去葡萄糖醛酸化反应,产生有害代谢产物。这是由于GUSs的细胞内变化,包括构象、疏水性和迁移率的变化。细菌GUSs诱导的ADR的增强潜力,尤其是肠道损伤,并非NSAIDs和CPT-11独有。
其他药物,包括抗肿瘤酪氨酸激酶抑制剂,瑞格菲尼和静脉补剂类黄酮,是GUSs 的底物。这些证据强调了了解细菌酶在IVDR中的重要性,以制定减少药物不良反应的策略的价值。
消化系统:药物-微生物相互作用
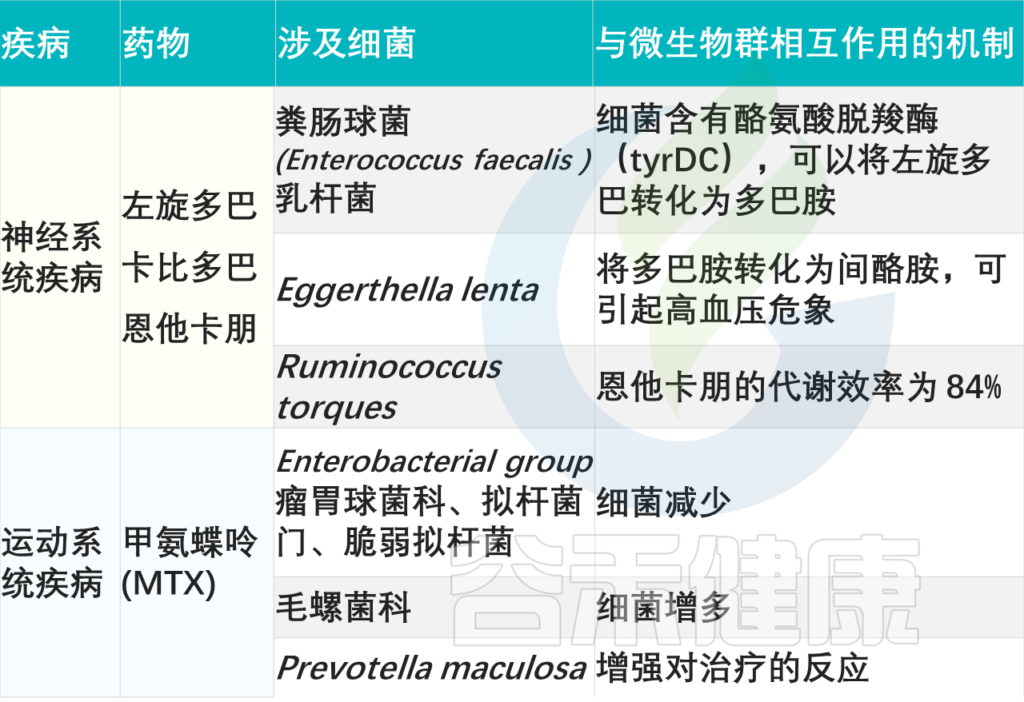
Zhao Q, et al., Signal Transduct Target Ther. 2023
初步研究表明,微生物群可能在调节神经系统IVDR中发挥关键作用。其中一个例子是使用益生菌来提高抗抑郁药物的有效性。多项研究表明,某些肠道微生物群菌株可以产生神经递质,如血清素和γ-氨基丁酸(GABA),可以调节情绪和焦虑。
通过补充益生菌,研究人员希望增加这些神经递质的可用性,改善对抗抑郁药治疗的反应。另一个领域是微生物群对神经退行性疾病的影响,例如帕金森病,常用的治疗药物是左旋多巴。
左旋多巴、卡比多巴和恩他卡朋
左旋多巴是一种治疗帕金森病的药物,帕金森病是一种神经系统疾病,表现为震颤、僵硬和行动困难。左旋多巴口服,必须通过小肠重新吸收才能到达大脑,在那里它被酪氨酸脱羧酶(tyrDC)转化为多巴胺。该药物的有效性取决于大脑的生物利用度,该药物通常与儿茶酚胺代谢抑制剂(如卡比多巴和戊卡彭)一起使用,以抑制脑外代谢。
E.lenta 代谢左旋多巴,可能与高血压风险相关
新出现的证据表明,肠道微生物群可以代谢左旋多巴。某些物种,如粪肠球菌(E.faecalis)和乳杆菌含有酪氨酸脱羧酶。然而,这种微生物群代谢减少了大脑中可获得的左旋多巴的量,导致药效降低。此外,左旋多巴的微生物群代谢也会导致药物不良反应,因为E.lenta和其他十个物种可以进一步将多巴胺转化为间酪胺,从而导致高血压危机。
残留左旋多巴也可以与微生物群相互作用
绝大多数左旋多巴通过肠道氨基酸转运载体输送到循环系统,还有10%左右残留,也可以与微生物群相互作用,通过其代谢产物影响肠道稳态。Clostridium sporogenes 能够将L-多巴胺脱氨化为3-(3,4-二羟基苯基)丙酸,后者可以体外抑制回肠运动。
粪肠球菌:98.9%效率代谢左旋多巴和恩他卡朋
肠道微生物群也可以直接代谢卡比多巴和恩他卡朋。例如,粪肠球菌能以98.9%的效率代谢左旋多巴和恩他卡朋。反过来,恩他卡朋会减少一些物种,例如Ruminococcus torques,后者仍能以84%的效率代谢恩他卡朋。
▸
这些发现说明了肠道微生物群和IVDR之间的复杂相互作用,这可能会影响药物的疗效和安全性。这些有利于拓宽我们对药物-微生物群相互作用的了解,并探索神经和精神疾病的新治疗策略。
运动系统的健康可能受到各种疾病的影响,例如骨关节炎、类风湿性关节炎和骨质疏松症,这些疾病会导致疼痛、僵硬和活动能力下降。近年来,人们越来越关注肠道微生物群在这些疾病的病理学和治疗中的影响,如甲氨蝶呤、非甾体抗炎药等。
甲氨蝶呤(MTX)
甲氨蝶呤是一种用于治疗自身免疫性疾病(如类风湿关节炎)的强效细胞毒性药物。其潜在作用基于抑制二氢叶酸还原酶和胸苷酸合成酶,从而防止嘧啶和嘌呤的从头合成。虽然甲氨蝶呤是有效的,但它也有很高的不良反应发生率,包括胃肠道、血液学、肾毒性和肝毒性。
甲氨蝶呤:E.faecium↓↓ Lachnospiraceae↑↑
可能影响对甲氨蝶呤反应的一个潜在因素是肠道微生物群。研究表明,甲氨蝶呤治疗可以改变肠道微生物群的组成,降低肠道细菌的丰度,尤其是粪肠球菌(E.faecium)的丰度,并增加Lachnospiraceae的丰度。然而,部分有益菌(如瘤胃球菌科、拟杆菌科、脆弱拟杆菌)的减少可能会加剧胃肠道药物不良反应,特别是肠道粘膜炎。
甲氨蝶呤和肠道微生物群之间的联系是双向的
肠道微生物群的变异性可能会影响甲氨蝶呤的治疗反应。研究发现,肠道微生物群多样性较高的患者,具有丰富的Prevotella maculosa,对甲氨蝶呤的反应更好。尽管看起来不错,但甲氨蝶呤的应答率极其不稳定,介于10%-80%之间,只有40%的患者能够达到治疗所需的药物浓度,并且不良反应显著。
▸
已经探索了遗传因素来预测甲氨蝶呤的IVDR,但尚未达到临床相关性。需要更多的研究来评估。肠道微生物群可能在甲氨蝶呤的PD中发挥重要作用,进一步的探索可能有助于患者个性化治疗。
神经、运动系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
泌尿生殖系统的微生物群会影响几种药物的疗效和毒性,导致该系统出现了药物微生物组学领域。特别是,泌尿生殖微生物群会影响雄激素剥夺治疗(ADT)的有效性,这是癌症的常见治疗方法。ADT通常涉及使用雄激素合成抑制剂(如醋酸阿比特龙),或雄激素受体拮抗剂(如恩扎鲁胺、醋酸德格雷)。
醋酸阿比特龙、恩扎鲁胺、醋酸地加瑞克
最近的研究揭示了ADT对免疫系统和肠道微生物群的影响,以及这如何影响前列腺癌症的进展。
醋酸阿比特龙是ADT中广泛使用的药物,研究强调了胸腺依赖性T细胞在调节前列腺癌进展中的关键作用,由于CD4+和CD8+T细胞的消耗,导致IVDR控制的肿瘤发展的部分减少。
醋酸阿比特龙→ A.muciniphila ↑↑ → 维生素K2 ↑↑
前列腺癌患者接受醋酸阿比特龙治疗后,重塑肠道微生物群并促进抗炎菌A.muciniphila的增殖,从而提高微生物群产生维生素K2。
此外,研究表明,具有较高α-多样性的微生物群和特定的肠道微生物群,如A.muciniphila,与更好的疗效相关。
进一步研究发现,接受口服雄激素靶向治疗(ATT)的男性的泌尿生殖微生物群组成,与接受促性腺激素释放激素(GnRH)激动剂或拮抗剂单一治疗或不接受ADT的男性有所不同。例如,A. muciniphila、瘤胃菌科等能够合成类固醇的菌,在接受口服ATT治疗的男性的微生物群中丰富,这可能会影响疾病进展和免疫疗法。
肠道菌群→调节循环性激素→促进ADT耐药性
另一项研究表明,肠道微生物群可以通过对人体细胞的影响,也可以通过直接的生物转化或合成来调节循环性激素的水平,从而促进ADT耐药性。前列腺癌患者表现出更高水平的菌株,如A. muciniphila、瘤胃菌科,它们能够通过CYP17A1样细菌酶合成类固醇激素。使用CYP17A1抑制剂醋酸阿比特龙培养细菌可抑制雄激素生物合成。然而,微生物群对雄激素水平降低的反应导致能够合成雄激素的菌株的扩增,尚待阐明。
▸
总之,微生物群调节循环性激素的能力和能够合成雄激素的细菌的扩张,可以驱动对ADT的耐药性。未来的研究有必要澄清肠道微生物群、前列腺癌和治疗之间的复杂相互作用。
药物可能会影响呼吸微生物群的组成和功能,相反,微生物群可能会影响药物代谢和反应。例如,抗生素可以减少微生物群的多样性,并促进可能导致慢性呼吸道疾病的机会性病原体的生长。吸入皮质类固醇可以增加微生物群的多样性,降低致病菌的丰度,这可能有助于其治疗效果。
此外,呼吸道微生物群会影响药物向肺部的输送。最著名的例子之一是使用抗生素异烟肼(INH)、利福平(RIF)和吡嗪酰胺(PZA)进行抗结核治疗。
异烟肼、利福平、吡嗪酰胺
研究抗结核抗生素对结核分枝杆菌感染小鼠肠道微生物群结构的影响,发现在小鼠模型中,异烟肼、利福平、吡嗪酰胺治疗三个月会导致显著和持久的生态失调。肠道微生物群的组成发生了改变:
研究进一步表明,单剂量利福平降低了微生物群的多样性,而与未用抗生物治疗的小鼠的肠道微生物群相比,单独使用异烟肼或吡嗪酰胺会导致微生物群组成的改变。
具体而言,异烟肼富集Gordonibacter,而吡嗪酰胺富集Marvinbryanti。 结核病感染不会显著改变肠道微生物群组成,但它被发现可以调节粘膜免疫反应。
在人类中,一线抗结核药物治疗似乎对肠道微生物群的影响很小。然而,一些菌株可以调节宿主的免疫反应,如:
研究还发现,抗结核病药物可以减少肠道稳态所需的微生物群,增加复发结核病的风险。与无结核病患者相比,先前治疗的患者的T细胞对2型表位的识别能力也较差。人类肠道中的2型表位与分枝杆菌(mycobacteria)有关。
▸
抗结核病治疗的多年试验有助于更深入地了解微生物群在结核病进展中的重要性。抗结核抗生素和宿主调节剂的组合,可以缩短结核病的治疗时间,减轻严重程度,减少再次感染的风险。对宿主-病原体相关性、宿主免疫学和宿主靶向治疗的研究表明,这种方法可能对结核病的治疗有益。
呼吸系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
在癌症方面,肠道微生物群对于几种癌症的发病机制、进展和 IVDR 至关重要。这里介绍几种代表性药物和肠道微生物群在癌症患者中相互作用的机制,见下表。
Zhao Q, et al., Signal Transduct Target Ther. 2023
关于癌症药物与微生物群之间的相互作用,在我们之前的文章也有介绍,详见:
肠道微生物群通过酶修饰结构和生物活性或毒性的改变来影响药物的有效性和可接受性。肠道微生物群可以通过多种方式影响IVDR,包括以下:
1) 药物代谢的改变
微生物群可以影响体内代谢药物的酶的活性,从而影响药物的疗效和副作用。
2) 产生耐药性
随着时间的推移,微生物群会对药物产生耐药性,使其在治疗感染方面的效力降低。这种耐药性可能是由于微生物群DNA突变或从他人那里获得耐药性基因所致。
3) 药物靶点的修饰
微生物群可以修饰体内的药物靶点,使其不易受药物影响。如微生物群可以修饰氟喹诺酮类抗生素的靶位点,从而降低其结合和抑制酶的能力。
4) 与药代动力学相互作用
微生物群影响药代动力学,影响药物的疗效和安全性。例如,肠道微生物群可以改变药物的吸收、分布、代谢、排泄,从而改变其治疗效果和毒性。
5) 宿主微生物群的破坏
使用抗生素会干扰宿主微生物群中的自然生态系统,导致致病菌(如艰难梭菌)过度生长。这会导致感染和其他不良反应,从而影响药物安全。
6) 宿主免疫反应的调节
肠道微生物群可以调节宿主的免疫功能,这可能会影响靶向免疫系统的药物的活性和毒性。例如,肠道微生物群可以通过调节宿主免疫反应来调节免疫疗法在肿瘤治疗中的有效性。
7) 肠道屏障功能的调节
肠道微生物群可能影响肠道屏障的完整性,从而影响药物吸收和肠道-宿主相互作用。例如,肠道微生物群可以调节肠道中紧密连接蛋白的表达水平,从而影响药物的吸收。
肠道菌群编码的一些酶及其对药物的影响

Zhao Q, et al., Signal Transduct Target Ther. 2023
在一项重要全面的研究中,作者评估了1000多种药物的抗微生物特性,其中835种是影响人体细胞的靶向药物。其中,24%表现出抗菌作用,影响了至少50%的受试菌株的增殖。
药物影响肠道微生物群的机制有几个:
1) 直接抗生素效应
抗生素可以杀死包括有害菌和有益菌,可能导致肠道微生物群失衡,对人类健康产生负面影响。
2) 肠道运动能力改变
食物通过肠道的速度,会影响肠道微生物群的增殖和功能。某些药物,如阿片类止痛药,会减缓肠道运动,从而导致有害细菌过度生长。这可能会导致便秘和腹胀等胃肠道症状,在某些情况下还会导致感染(如艰难梭菌)。
3) 免疫功能的调节
肠道微生物群在调节肠道免疫方面具有关键功能。几种药物,如免疫检查点抑制剂,会影响肠道免疫,进而影响肠道微生物群。
4) pH值的变化
肠道的pH值会影响不同类型细菌的生长和存活。一些药物,如用于治疗胃酸倒流的质子泵抑制剂,可以改变肠道的pH值,从而影响不同微生物群的增殖,从而影响肠道微生物群的整体组成。
5) 干扰微生物代谢
肠道微生物群在代谢肠道中的化合物方面具有重要功能。一些药物,如非甾体抗炎药,会干扰微生物代谢,这可能会对肠道微生物群产生影响。特别是,非甾体抗炎药会干扰胆汁酸的肠道微生物群代谢,导致肠道微生物群的变化。
6) 饮食变化
某些药物,如泻药或抗腹泻药,会改变肠道的饮食环境。这可能会通过改变肠道微生物群生长和生存所需的营养素和其他化合物的可用性来影响肠道微生物群。
▸
药物对肠道微生物群的影响可能是积极的,也可能是消极的。例如,某些益生菌或益生元能够调节肠道微生物群,这可能对个体的健康产生积极影响。然而,服用对肠道微生物群产生负面影响的抗生素或其他药物可能导致微生态失调,对人类健康产生负面影响。
因此,必须仔细评估药物对肠道微生物群的潜在影响,并开发考虑个体肠道微生物群组成和功能的个性化药物治疗方法。
以上我们了解到微生物群和常见药物之间复杂的相互作用对药物效果的影响,肠道微生物群在药物治疗中的重要性意味着,肠道微生物群驱动的精准医疗,明确靶向肠道微生物群或将提高临床疗效。
未来多元化应用
通过测定肠道微生物群的组成、数量及代谢产物相对丰度,可以预测药物在体内的疗效和毒性。肠道微生物特征可作为非侵入性辅助诊断方法或提供预后评估。因此,开发能够预测药物疗效和毒性的改进生物标志物,对于成功实施精准医疗至关重要。
设计小分子抑制体内与药物生物转化为有毒代谢物相关的微生物代谢活性。
可以通过引入益生菌、益生元、粪菌移植等方式来调节微生物群的组成和比例,提高药物的生物利用度,减少不良反应。
药物微生物组学领域正在兴起
整合多个高通量多组学数据集,提供药物反应的个体差异的全面概况。这些将辅助全面揭示药物与微生物之间相互作用背后的决定因素,可以有效地满足对患者进行聚类和预测以及发现新生物标志物的需求。
多组学策略促进药物微生物组学走向人类精准医学

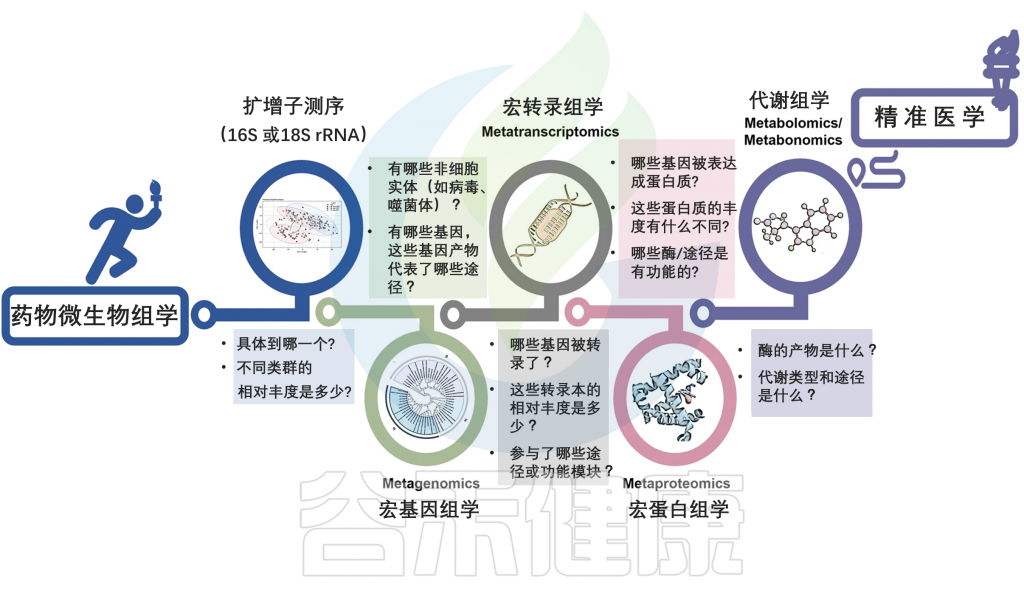
Zhao Q, et al., Signal Transduct Target Ther. 2023
高通量数据需要使用先进的计算技术通过人工智能算法进行建模。开发模拟药物与微生物相互作用的预测模型和软件对于减少研究时间和成本至关重要。
仍然存在一些挑战
——研究还需更加深入
对药物-微生物之间相互作用背后的机制仍然缺乏全面的了解。肠道菌群是一个复杂且不断变化的生态系统,受到饮食、年龄、性别、生活方式、宿主遗传学等多种因素的影响。很难将这些因素的影响与药物引起的微生物群变化分开。
——临床转化需要克服的障碍
例如,开发基于微生物群的药物反应生物标志物将需要大规模的验证研究和监管部门的批准。
许多药物微生物组学研究的样本量通常有限,可能限制其统计能力和概括研究结果的能力。需要更大规模的研究来确认和扩展初步结果。
应对这些挑战需要研究人员、临床医生和行业合作伙伴之间的合作,加深我们对药物-微生物相互作用机制的理解,并确保研究结果转化为安全有效的临床实践,为患者提供更好的治疗策略,共同推动精准医学领域的进步。
主要参考文献
Zhao Q, Chen Y, Huang W, Zhou H, Zhang W. Drug-microbiota interactions: an emerging priority for precision medicine. Signal Transduct Target Ther. 2023 Oct 9;8(1):386.
Rosell-Díaz M, Fernández-Real JM. Metformin, cognitive function, and changes in the gut microbiome. Endocr Rev. 2023 Aug 21:bnad029.
Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut. 2020 Aug;69(8):1510-1519.
Schupack DA, Mars RAT, Voelker DH, Abeykoon JP, Kashyap PC. The promise of the gut microbiome as part of individualized treatment strategies. Nat Rev Gastroenterol Hepatol. 2022 Jan;19(1):7-25.
Chen HQ, Gong JY, Xing K, Liu MZ, Ren H, Luo JQ. Pharmacomicrobiomics: Exploiting the Drug-Microbiota Interactions in Antihypertensive Treatment. Front Med (Lausanne). 2022 Jan 19;8:742394.
Daisley BA, Chanyi RM, Abdur-Rashid K, Al KF, Gibbons S, Chmiel JA, Wilcox H, Reid G, Anderson A, Dewar M, Nair SM, Chin J, Burton JP. Abiraterone acetate preferentially enriches for the gut commensal Akkermansia muciniphila in castrate-resistant prostate cancer patients. Nat Commun. 2020 Sep 24;11(1):4822.
Jia L, Huang S, Sun B, Shang Y, Zhu C. Pharmacomicrobiomics and type 2 diabetes mellitus: A novel perspective towards possible treatment. Front Endocrinol (Lausanne). 2023 Mar 23;14:1149256.
Khan I. Drugs and gut microbiome interactions-an emerging field of tailored medicine. BMC Pharmacol Toxicol. 2023 Aug 30;24(1):43.
Pant A, Maiti TK, Mahajan D, Das B. Human Gut Microbiota and Drug Metabolism. Microb Ecol. 2023 Jul;86(1):97-111.
谷禾健康
生物累积(Bioaccumulation)是什么?
分解这个术语“生物累积”时,你会得到什么?accumulation ‘’积累’ 这个词意味着某种东西的积累,而前缀 bio- 意味着生命。把它放在一起,就是生物体内积累一些东西来定义生物累积。
那么生物物累积用于指生物体内化学物质的积累。这些物质没办法被代谢 ,便累积于生物体内,经由食物链中各阶层消费者的食性关系而累积,越高级消费者的体内其累积浓度越高的现象。
生物累积是如何发生的?
一种方法是让一定数量的化学物质进入生物体的速度快于生物体分解和使用它的速度。这意味着进入的比排出的多,导致化学物质在生物体内积累。
另一种主要方式是化学物质进入生物体,而生物体无法以某种方式将其分解或排泄。于是化学物质会继续积累,直到最终对生物体变得致命。
所有生物体面临的问题都是吸收和消除之间动态平衡的结果。生物蓄积发生的程度决定了所表现出的毒性作用。在某些情况下,保护机制免受沉积在特殊部位的某些不良物质的影响,以防止它们参与代谢反应。
本文的生物累积描述是用于评估药物及其有害代谢物的在肠道细菌内的积累。
治疗药物会对肠道微生物群产生强烈影响,反之亦然。潜在的药物-细菌相互作用可以通过生物转化降低微生物适应性或改变药物可用性。后者可以对药物活性和功效产生正面或负面影响。尽管洛伐他汀( lovastatin )和柳氮磺吡啶(sulfasalazine)等药物会被肠道细菌化学转化为活性形式,但细菌代谢可以使地高辛(digoxin)等药物失活,或者像伊立替康(irinotecan)一样引起毒性作用。为了进一步增加易感药物的多样性,最近报道,肠道细菌对一百多个分子进行了化学修饰。然而,这些相互作用的机制观点主要限于药物生物转化。
洛伐他汀(Lovastatin)
洛伐他汀(Lovastatin)可使胆固醇的合成减少,也使低密度脂蛋白受体合成增加,主要作用部位在肝脏,结果使血胆固醇和低密度脂蛋白胆固醇水平降低,由此对动脉粥样硬化和冠心病的防治产生作用(来源:百度百科)。
柳氮磺吡啶(sulfasalazine)
柳氮磺吡啶(sulfasalazine)磺胺类抗菌药。属口服不易吸收的磺胺药,吸收部分在肠微生物作用下分解成5-氨基水杨酸和磺胺吡啶。5-氨基水杨酸与肠壁结缔组织络合后较长时间停留在肠壁组织中起到抗菌消炎和免疫抑制作用,如减少大肠埃希菌和梭状芽孢杆菌,同时抑制前列腺素的合成以及其他炎症介质白三烯的合成(来源:百度百科)。
地高辛( digoxin)
地高辛是中效强心苷类药物,为白色结晶或结晶性粉末;无臭;味苦。在治疗时,对心脏的作用表现为正性肌力作用, 减慢心率,抑制心脏传导。适用于低输出量型充血性心力衰竭、心房颤动、心房扑动、阵发性室上性心动过速。
肠道中的细菌可以调节治疗药物的可用性和功效。然而,药物与细菌之间相互作用潜在机制是微生物对药物的化学转化或生物转化。
德国海德堡和英国剑桥科学家团队刚刚发在《Nature》上,成功研究了 25 种代表性肠道细菌菌株对 15 种结构不同的药物的消耗。揭示了 70 种细菌和药物相互作用,其中 29 种以前没有报道过。超过一半的新相互作用可归因于生物积累。
肠道细菌的这种生物累积可能是改变药物可用性和细菌代谢的常见机制,该机制会对个体微生物群组成、药代动力学、副作用和药物反应产生影响。
为了更详细调查药物与细菌之间相互作用的系统图谱,科学家使用两种分析方法核磁共振(NMR)光谱和液相色谱-质谱联用(LC-MS)系统地分析了 15 种人类靶向药物和 25 种人类肠道细菌(长双歧杆菌、大肠杆菌和均匀拟杆菌的其他亚种或同种菌株之间的相互作用)。选择细菌种类以涵盖代表健康微生物群的广泛系统发育和代谢多样性。在药物方面,选择了 12 种口服小分子药物(分子量小于 500 Da),这些药物可以基于超高效液相色谱结合紫外检测(UPLC-UV)进行定量,以跨越不同的化学,适应症区域和副作用概况。
细菌-药物相互作用网络。左网络:肠道细菌对药物的生物转化或生物累积。右网络:至少在两个独立筛选中检测到的药物对肠道细菌生长的影响(Student’s t检验,α = 0.05)。文中未提及的细菌全名如下:脆弱拟杆菌、普通拟杆菌、动物双歧杆菌亚种。乳杆菌BI-07, Coprococcus come ,梭菌,梭菌,副干酪乳杆菌, Ruminococcus gnavus。