 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

消化是人体生命活动的重要组成部分,分解食物提供能量、促进生长发育、参与免疫功能,然而越来越多的人出现了消化不良。
★ 消化不良在人群中很常见
消化不良在全球范围内都是一种常见的疾病,其发病率在不同地区和人群中有所不同。在中国,消化不良的发病率较高,尤其是城市人群中更为常见。据统计,中国城市居民中消化不良的发病率约为20%-30%。
消化不良主要分为器质性消化不良和功能性消化不良(本文主要讲述功能性消化不良)。功能性消化不良其广义上是一种胃肠道多种症状的综合征,主要包括上腹痛或灼热感,餐后饱胀感及早期饱腹感。
随着对功能性消化不良了解的深入,目前研究发现,消化不良病理生理与脑–肠–微生物群轴紊乱、内脏高敏感性、局部低度炎症、胃肠道感染等因素相关。
肠道菌群可以帮助人体消化吸收,同时还可以合成一些对人体有益的物质,在消化过程中扮演着重要角色。肠道菌群作为新的研究切入点,将有助于探索新的改善功能性消化不良的方法。
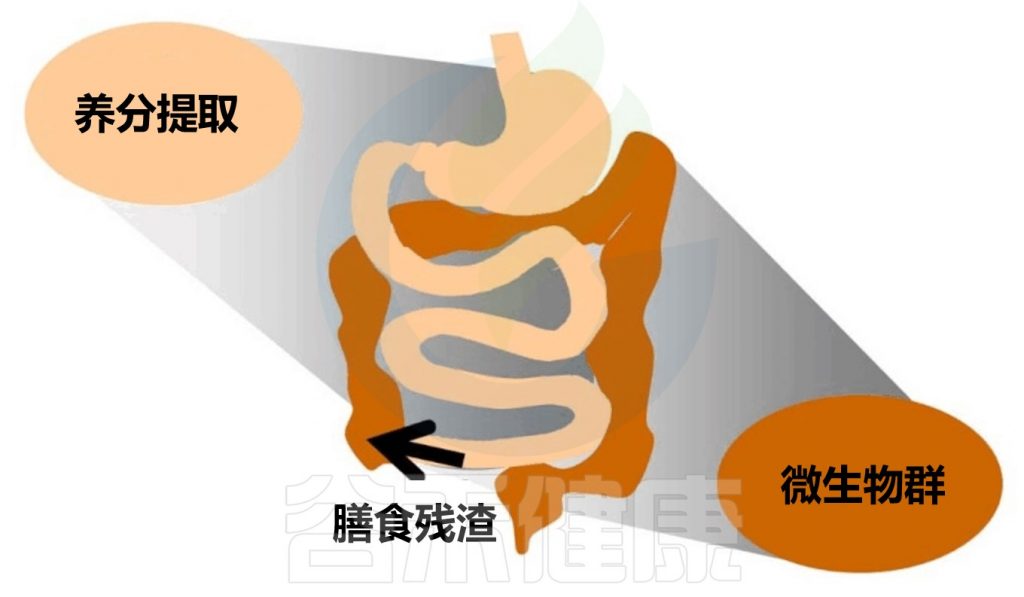
在了解消化不良前,我们先来看看人体消化的生理过程:
膳食摄入的消化反应

Livovsky DM,et al.Nutrients.2020
在禁食期间,胃肠道会进行周期性的运动,这种运动被称为迁移运动复合体(MMCs)。迁移运动复合体的功能是将残留物从小肠推进到结肠,以便在新的食物进入之前清空肠道。迁移运动复合体包括静止期和强烈的运动和分泌活动期之间的交替,这种刻板模式有助于保持肠道的健康和功能正常。
在进食开始之前,消化系统已经开始做准备工作,例如,预期即将进食的膳食会刺激唾液和胃液的分泌。当食物进入口腔并被吞咽后,消化系统会进入消化间期运动模式。
食物进入胃后,胃壁会收缩并几乎塌陷,这种主动放松被称为胃适应。固体颗粒通过蠕动活动激活胃窦,启动研磨过程,将食物转化为食糜。
餐后阶段胃会逐渐重新收缩,将食糜推入小肠。胃和小肠的活动会适应消化过程的要求,从口腔开始并延伸到末端回肠,食物被消化并随后被吸收。未被吸收的残留物最终到达结肠,成为肠道微生物群的底物,这些微生物会影响宿主的生理和消化功能。
因此,消化系统的正常活动对于人体的健康和营养摄入非常重要。如果消化系统不正常,可能会导致消化问题和其他健康问题。
消化不良是一种常见的临床症状,主要分为器质性消化不良和功能性消化不良。
器质性消化不良是指由某种器官疾病引起的消化不良。一般通过检查,可以明确诊断是由某个器官的病变引起的消化不良症状,例如肝病、胆道疾病、胰腺疾病、糖尿病等。
✦疾病影响消化
这些疾病会影响到消化道内部的消化酶分泌、肠道蠕动、食物吸收等消化过程,导致消化不良症状的出现,如腹胀、腹泻、便秘、恶心、呕吐、胃痛等。

功能性消化不良是最常见的消化系统疾病,大部分消化不良患者都是属于功能性消化不良。功能性消化不良没有明显的器质性病变,但出现了消化不良症状。
由于功能性消化不良患者病情的反复性与迁延不愈,其生活质量明显降低,同时,所带来的社会医疗成本的增加和生产力的下降也不容忽视。
▸ 发病率
在全球范围内,功能性消化不良女性发病率普遍高于男性。不同地区功能性消化不良的患病率也存在明显差异 :西方国家总体较高,约为10%~40%,亚洲国家较低约为5%~30%。
▸高发人群
•饮食不规律的人群:饮食不规律、暴饮暴食、偏食等不良饮食习惯容易导致消化不良。
•长期服用药物的人群:长期服用某些药物,如抗生素、非甾体抗炎药等,可能破坏肠道菌群平衡,导致消化不良。
•精神压力大的人群:精神压力大、情绪波动较大的人群容易出现消化不良症状。
•高龄人群:随着年龄的增长,人体消化功能逐渐下降,高龄人群容易出现消化不良症状。
•婴幼儿:婴幼儿是消化不良的高发人群之一。由于婴幼儿的消化系统尚未完全发育成熟,消化酶的分泌不足,肠道菌群的构成不稳定等因素,使得婴幼儿容易出现消化不良的症状。

▸ 诊断标准与症状
功能性消化不良的诊断标准:
•餐后饱胀感:即在正常量的膳食后感到不舒服;
•早饱:进食后不久即有饱感,以致摄入食物明显减少,无法完成正常量的膳食;
•上腹疼痛或灼痛:上腹胀多发生于餐后,或呈持续性进餐后加重。
注:满足以上一项或多项,并且没有可以解释这些症状的任何结构性疾病(包括上消化道内窥镜检查)的证据;则可以判断为功能性消化不良
根据主要临床症状可大致分为上腹痛综合征和餐后不适综合征两种亚型。
✦持续时间长,并伴有精神症状
在病程中症状也可发生变化,起病多缓慢,经年累月,持续性或反复发作,不少患者有饮食,精神等症状。
早饱和上腹胀常伴有嗳气。恶心、呕吐并不常见,往往发生在胃排空明显延迟的患者,呕吐多为当餐胃内容物。
不少患者同时伴有失眠、焦虑、抑郁、头痛、注意力不集中等精神症状。这些症状在部分患者中与“恐癌”心理有关。
▸ 功能性消化不良和其他胃肠道疾病的关系
伴有肠易激综合征
许多功能性消化不良患者报告伴有肠易激综合征症状,并且这两种症状经常一同出现在更严重的患者中。
注:虽然这两种情况或多或少都与特定的胃肠道症状有关,但没有结构或生化异常可以解释这些症状。
胰腺功能异常
少数但一定人群的功能性消化不良患者存在胰酶异常或胰腺外分泌功能障碍。胰酶异常和胰腺外分泌功能障碍是否直接影响功能性消化不良症状尚不清楚。
肝脏疾病与消化不良直接存在关联
肝脏疾病如肝硬化、肝炎等也可能导致功能性消化不良症状,如腹胀、食欲不振等。这些疾病可能会影响肠道菌群的平衡,导致消化不良。
功能性消化不良的发病机制尚未完全阐明,可能与胃肠运动异常、内脏超敏反应、肠道菌群紊乱、病原微生物感染、遗传因素、社会心理和神经因素、环境因素等多方面调控异常有关。
需要注意的是,肠道菌群数量和紊乱是功能性消化不良的重要病因之一,将在下文中重点讲述。
➤ 1
√功能性消化不良患者胃排空受损
功能性消化不良的发病机制涉及胃调节、胃排空和十二指肠运动的紊乱。
胃排空——食物由胃排入十二指肠的过程称为胃排空。
一项随机、双盲对照研究发现,功能性消化不良患者的症状与胃调节受损之间存在密切关系 。几份报告表明,一些功能性消化不良患者胃排空受损,一项荟萃分析表明,几乎35%的功能性消化不良患者胃排空明显延迟。
√内脏高敏感性影响功能性消化不良
内脏高敏感性是导致功能性消化不良发展的关键病理生理机制。内脏超敏反应可以通过对肠道机械化学刺激的感知增加,这通常表现为疼痛和灼痛感加重。
辣椒素受体(Trpv1)的激活由神经生长因子 (NGF)、热刺激、辣椒素、前列腺素、酸性pH值和炎症介质触发,进一步释放加剧内脏痛觉的神经肽。
那么一般哪些因素会引起或导致人体胃排空受损或内脏高敏感性,常见的原因如下:
1.神经调节失衡:人体内部的神经系统对内脏的感知和调节非常重要。如果神经系统出现失衡,会导致内脏高敏感性,从而引起胃排空受损以及消化不良等症状。
2.饮食不当:食物的种类、质量和摄入量都可能影响胃排空。比如,吃得太快、咀嚼不充分、进食过多或者过少都会导致胃排空受损。
饮食中过多的刺激性食物(如辛辣、油腻的食物)或者过多的咖啡因、酒精等刺激物质,都可能刺激内脏,导致内脏高敏感性。
3.精神压力:长期的精神紧张、焦虑、抑郁等情绪问题,也会影响人体内部神经系统的平衡,进而导致胃排空受损或内脏高敏感性。
4.慢性疾病:一些慢性疾病,如炎症性肠病、胃溃疡等,也会引起胃排空受损以及内脏高敏感性,从而导致消化不良等症状。
5.长期用药:某些药物,如非甾体类抗炎药、抗生素等,长期使用也可能导致内脏高敏感性。
➤ 2
社会心理因素会导致功能性消化不良症状。
√心理对功能性消化不良具有重要影响
一项针对瑞典人群的研究表明,在10年的随访后,焦虑会使患功能性消化不良的风险增加近8倍。在日本,儿童时期的被虐待与功能性消化不良和功能性消化不良症状的严重程度有关。
此外,病理生理学研究表明,社会心理因素和精神障碍可能通过调节大脑中的信号处理在功能性消化不良中发挥作用以及应激激素对痛觉的影响。
社会心理因素和应激激素也会影响胃肠道的其他方面,例如运动、免疫系统激活、渗透性和微生物群。
√功能性消化不良对精神疾病也有反作用
多项研究强调,与健康人相比,功能性消化不良患者的焦虑和抑郁患病率显著增加。这些观察结果表明,精神疾病在功能性消化不良的发病机制中起着重要作用。
另一方面,由于低度肠道炎症中的细胞因子反应,功能性消化不良症状被认为会诱发焦虑或抑郁,这在功能性消化不良患者心理困扰的发展中起着重要作用。
➤ 3
家族史和遗传多态性可能与功能性消化不良相关。许多研究报告了功能性消化不良风险与遗传多态性之间的关联。
遗传多态性是在同一群体中,某个基因座上存在两个或两个以上的等位基因,且等位基因的频率大于0.01的现象。
GNB3 825C>T、SCL6A4 5HTTLPR、CCK-1R 779T>C等基因多态性被认为与功能性消化不良相关。最近的一项荟萃分析发现,GNB3 825C>T中的次要等位基因 (T) 与上腹疼痛综合征亚型的易感性增加有关。
➤ 4
运动不足、睡眠障碍、高脂肪摄入和饮食不规律等生活方式因素与功能性消化不良的病理生理学有关。
√不健康生活方式导致功能性消化不良发病率高
研究发现,睡眠障碍和运动不足与功能性消化不良相关;脂肪摄入过多会加重功能性消化不良的临床症状,不规律的饮食模式也与功能性消化不良相关。
➤ 5
研究表明,沙门氏菌、幽门螺杆菌、空肠弯曲菌、蓝氏贾第鞭毛虫和诺如病毒等病原微生物导致的急性肠胃炎均与功能性消化不良症状有关。
其机制可能与导致胃肠道Cajal间质细胞(ICC)和肌间神经节受损有关,其发生率在功能性消化不良患者约为10%。
√病因微生物感染会加重消化不良症状
最近的一项荟萃分析证实,根除病原体后症状改善比未治疗的对照组效果更好。在持续时间超过4-12周且内镜检查已排除器质性原因的消化不良患者中,成功根除幽门螺杆菌可使症状缓解率提高10%至15%(或至少症状改善)。
➤ 6
来自动物和临床研究的证据表明,肠道菌群在功能性消化不良中起着重要的作用,影响许多致病机制,包括胃肠动力受损、内脏敏感性、免疫激活、粘膜通透性增加和肠脑轴功能改变等。
在人体中,微生物(包括细菌、古细菌、病毒和真菌)的数量远远超过宿主细胞的数量。
微生物组在调节生理功能(包括胃肠运动功能、上皮屏障保护以及肠道和中枢神经系统之间的相互作用)中发挥着重要作用。然而,微生物失调在功能性消化不良患者中非常常见。
•普雷沃氏菌丰度降低
一项研究将功能性消化不良患者的胃液成分与健康对照组进行了比较,报告称与对照组相比,功能性消化不良中普雷沃氏菌属(Prevotella)的频率显著降低。
这种生态失调的原因可能是胃排空延迟,这可能会改变胃的酸度、粘液稠度和部分氧合作用,从而改变胃的细菌定植。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
•拟杆菌与变形菌比例增加
功能性消化不良患者胃液的微生物群显示拟杆菌与变形菌的比例增加,而未检测到酸杆菌(Acidobacteria)。然而,健康人的胃液中含有酸杆菌,并且拟杆菌与变形菌的比例较低。
•细菌代谢物分泌出现异常
与对照组相比,功能性消化不良患者的胆汁酸阳性胃液样本比例增加更多。由于胆汁酸从十二指肠反流到胃中,生理上发生在胃运动期间,功能性消化不良患者可能会出现胃动力障碍。
物种丰富度的增加表明胃液微生物群的数量和多样性足以使细菌的代谢物和成分影响胃。因此,可能表明肠道的有毒细菌细胞成分,如脂多糖,刺激白细胞产生促炎细胞因子,引发胃部炎症,从而增加粘膜通透性,这可能导致胃肠神经系统功能障碍。
由于脂多糖和胆汁酸会增加粘膜的通透性,因此患者的炎症可能是由含有此类潜在毒性物质的液体回流引起的。
当比较功能性消化不良患者和健康对照组的上消化道微生物组时,功能性消化不良组口腔、食道、胃和十二指肠中的链球菌(Streptococcus)水平较高。
链球菌丰度与上消化道不适呈正相关,表明链球菌与功能性消化不良患者的胃肠道症状之间存在联系。此外,功能性消化不良组表现出更高水平的厚壁菌门。
• 厚壁菌、变形菌丰度增加
根据这些发现,在一项比较功能性消化不良患者和健康受试者十二指肠粘膜微生物群的不同研究中,十二指肠粘膜中最普遍菌属中也有链球菌。
此外,通过分析功能性消化不良和肝郁脾虚综合征大鼠的粪便样本的微生物组成,与对照组相比,该模型中厚壁菌门、变形菌门(Proteobacteria)和蓝藻门(Cyanobacteria)的水平升高,而拟杆菌门的丰度较低。
上述研究表明,功能性消化不良中的微生物改变并不局限于胃肠道中的一个部位,突出了稳态失衡在这些疾病的发病机制中的潜在重要性。
小肠细菌过度生长 (SIFO) 的定义是小肠中存在过量的细菌,并且与胃肠道症状有关。
最近的研究分析了功能性消化不良患者十二指肠的细菌属水平。
链球菌相对丰度增加
澳大利亚的一项研究报道,与对照组相比,功能性消化不良患者的链球菌(Streptococcus)相对丰度增加,尽管不显著(这可能是因为样本量小),并且链球菌的丰度与厌氧属普雷沃氏菌、韦荣球菌(Veillonella)和放线菌(Actinomyces)的丰度之间存在负相关,这些菌群功能性消化不良患者中显著减少。
β多样性发生显著变化
此外,报告的十二指肠的β多样性在患者和对照组之间存在显著差异,而α多样性保持不变,表明该疾病可能涉及更复杂的微生物群结构变化,而不是仅特定属的相对丰度变化。
奈瑟菌和卟啉单胞菌丰度降低
最近的一项研究表明,在使用质子泵抑制剂(PPI)治疗之前,功能性消化不良患者和对照组的十二指肠粘膜奈瑟菌(Neisseria)和卟啉单胞菌(Porphyromonas)丰度降低,但微生物负荷没有差异。
总体而言,研究证实功能性消化不良患者中确实发生了微生物数量和多样性方面的明显变化。
功能性消化不良患者的微生物变化




Brown G,et al.Neurogastroenterol Motil.2022
谷禾还检测了一些功能性消化不良人群的肠道菌群,虽然个体直接存在一定差异,但是共同之处是菌群紊乱,核心菌异常较多,多项病原菌超标。
案例一
基本信息和病症:
1岁3个月,食物过敏,厌食,功能性消化不良,生长发育不良
菌群构成:
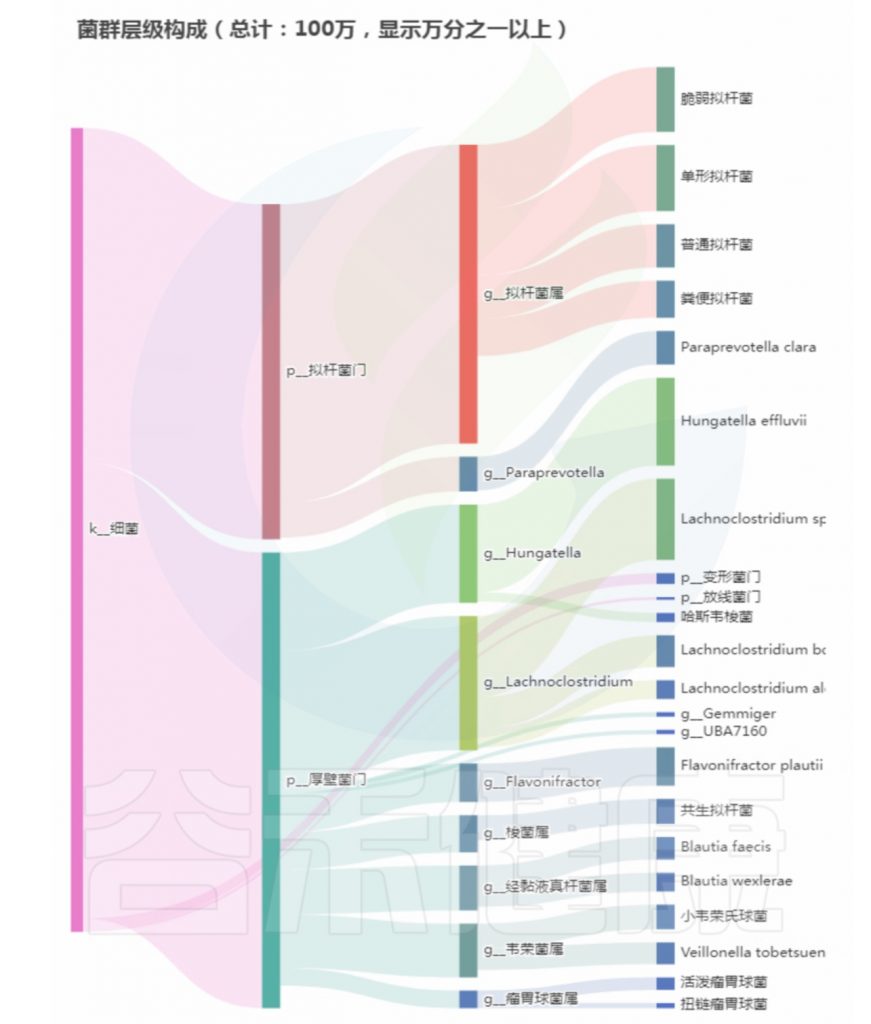

重要菌群情况:
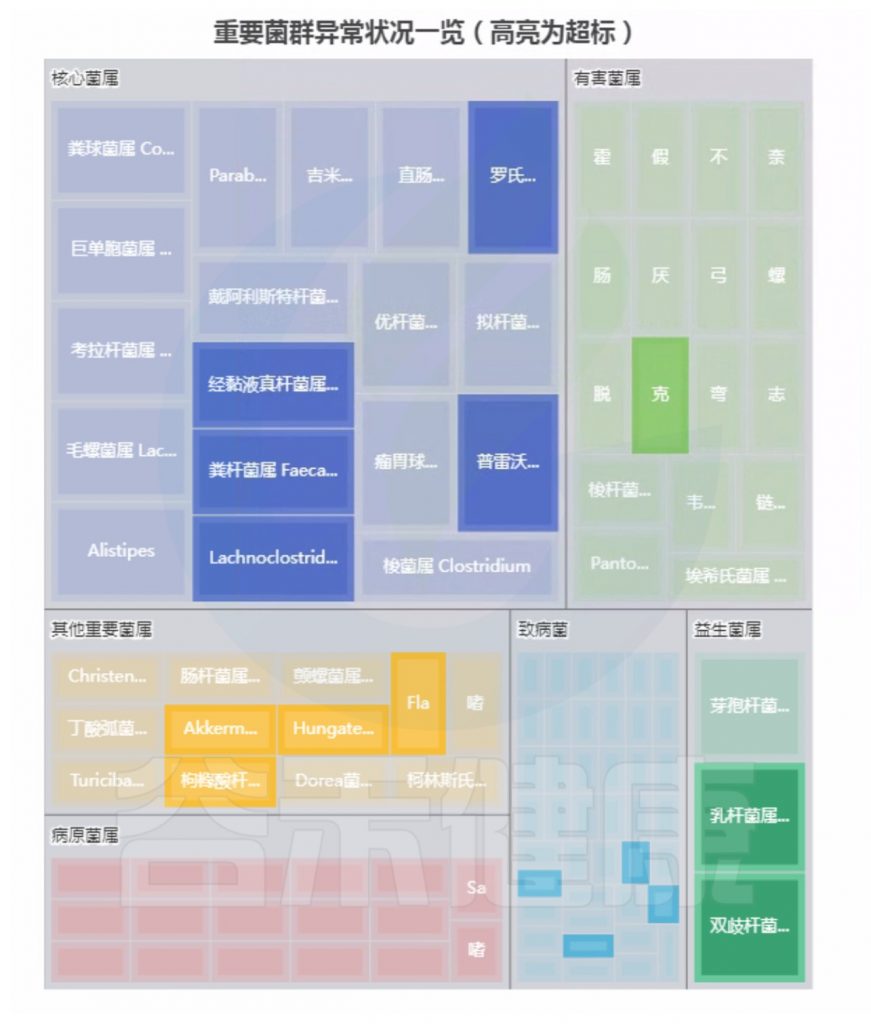



注:高亮部分是异常菌属。
总结:菌群失衡,核心菌属异常较多,普雷沃氏菌属(Prevotella)缺乏,多种致病菌超标。
案例二
基本信息和病症:
43岁,每天大便不成形;容易急性肠胃炎;消化不良
菌群构成:
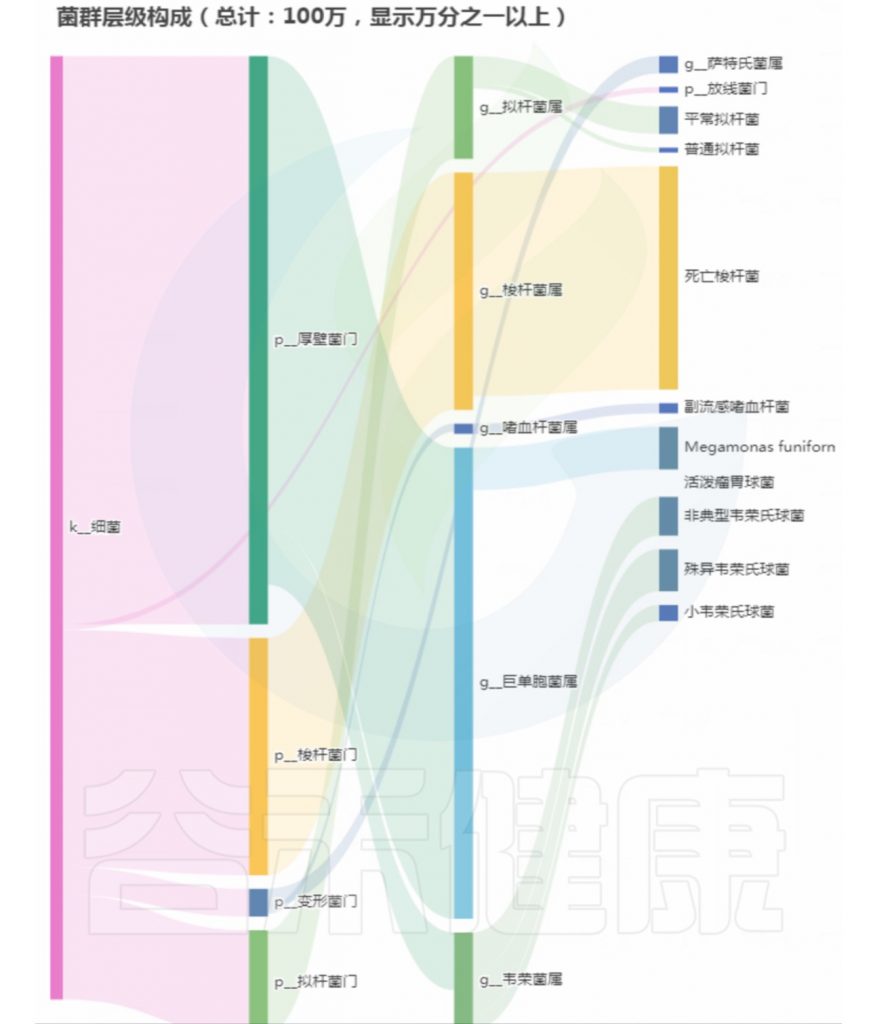

重要菌群情况:
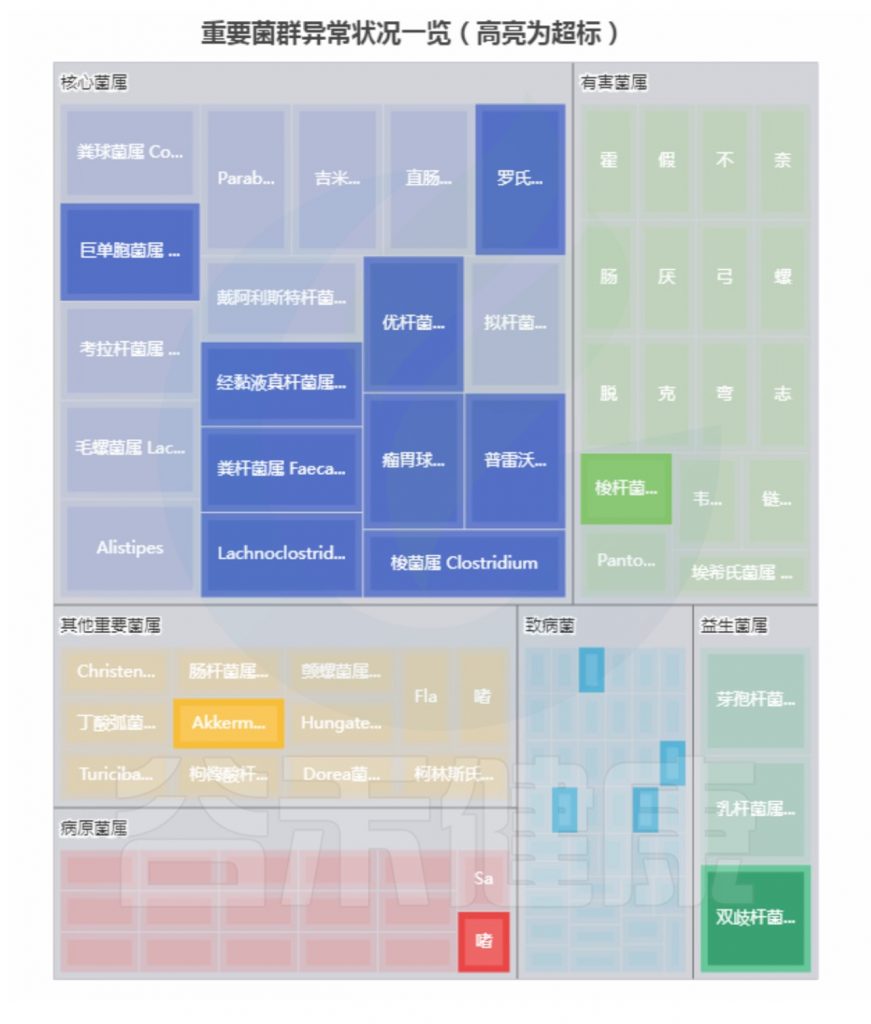



<来源:谷禾健康肠道菌群检测数据库>
总结:菌群失衡,菌群多样性低,核心菌属大量异常,致病菌和病原菌多项超标。
功能性消化不良是一种复杂的多因素导致的功能性胃肠疾病,目前其确切的发病机制尚不明确。
★ 肠道菌群在功能性消化不良中起重要作用
多个研究表明,肠道菌群紊乱在功能性消化不良的发生发展起着重要作用,是功能性消化不良的重要发病机制。影响包括胃肠动力受损、内脏高敏感性、免疫激活、粘膜通透性增加和中枢神经系统疾病。
肠道微生物群参与功能性消化不良发病机制
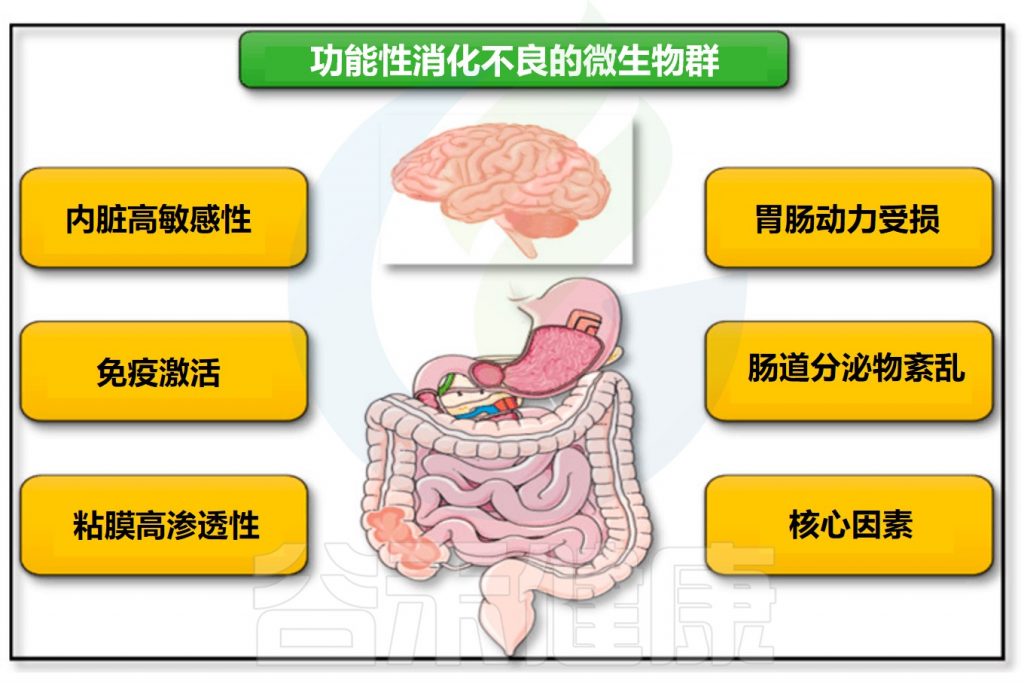

Tziatzios G,et al.Microorganisms.2020
胃肠运动异常是功能性消化不良的基本病理机制,包括胃排空延迟、胃容受性舒张受损及消化期间移行性复合运动(MMC)III期异常。
✦外来菌的增殖抑制胃肠道蠕动
消化期胃和小肠移行性复合运动可将胃肠内容物和致病菌机械性地迁移向远端肠道,而功能性消化不良患者经常出现非传播性和逆传性活动,这可能诱导或加重近端小肠细菌随反流十二指肠液迁移到胃。
而胃排空延迟又导致反流菌能较长时间保留在胃和十二指肠中,引起菌群分布失调的同时,外来菌的增殖可产生内毒素脂多糖刺激免疫应答,进而,抑制胃肠道蠕动,加重功能性消化不良症状。
✦细菌代谢物是胃肠动力的重要来源
短链脂肪酸是肠道共生菌发酵膳食纤维代谢物,除了作为胃肠动力的重要能量来源,也可直接激活肠神经系统以调控肠内分泌细胞合成和分泌某些胃肠激素,如肠激素肽、胆囊收缩素、胰高血糖素样肽等,进而调节胃肠道动力及胃排空。然而在代谢组学研究中发现功能性消化不良大鼠存在短链脂肪酸水平显著降低。
更准确地说,细菌产生的短链脂肪酸不仅调节功能性消化不良中十二指肠碳酸氢盐的分泌,同时它们在十二指肠的快速吸收也可能影响管腔细菌定植抑制。
5-羟色胺影响胃肠道动力
相关研究证实肠道微生物群在调节5-羟色胺(5-HT)合成中起着关键作用,而5-羟色胺水平是影响胃肠道动力的重要因素之一。
大肠杆菌产生的脂多糖延迟胃排空
此外,已发现大肠杆菌(Escherichia coli)产生的细菌脂多糖会导致胃排空显著延迟 ,而双歧杆菌当用作益生菌使用时时可显著增强小肠蠕动。
由上述研究可知,胃肠动力异常可能诱发菌群失调,而菌群失调可反过来进步一步影响胃肠动力,介导功能性消化不良发生发展,但菌群失调与功能性消化不良的因果关系仍需更深入的研究加以验证。
✦心理因素和肠道炎症相互影响
功能性消化不良患者处于十二指肠低度炎症状态。这种慢性低级别的炎症反应会引起疼痛和敏感性。
此外,焦虑或抑郁等心理学因素似乎与慢性炎症反应相互影响,心理压力和由此产生的皮质醇释放激素分泌也会增加十二指肠的局部炎症和全身炎症反应。
✦炎症状态下肠屏障功能发生改变
多项研究报道了功能性消化不良患者肠道中免疫细胞(如肥大细胞、巨噬细胞和嗜酸性粒细胞)数量的增加。
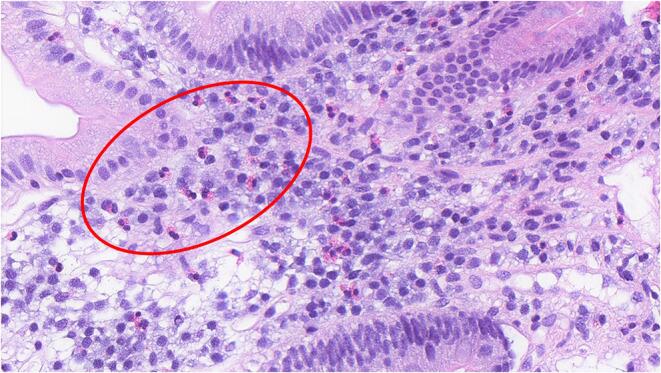
十二指肠活检切片中嗜酸性粒细胞增多

Hari S,et al.Front Allergy.2022
活化的肥大细胞释放细胞因子、组胺、前列腺素和类胰蛋白酶,它们与肠屏障功能障碍和伤害感受通路的改变有关。
嗜酸性粒细胞影响肠道通透性
在生理条件下,十二指肠屏障由粘液层、上皮和下面的固有层组成。在功能性消化不良中,屏障的功能障碍体现为粘膜完整性丧失和通透性增加。
此外,功能性消化不良中嗜酸性粒细胞的募集和激活也发生,这可能使组织损伤和屏障功能障碍持续存在。
正常与功能性消化不良的屏障功能对比
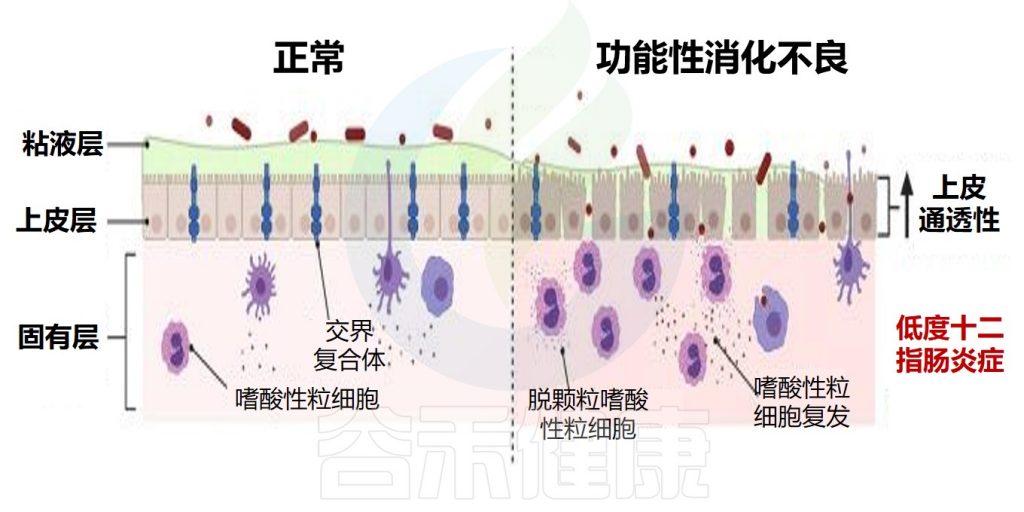

Hari S,et al.Front Allergy.2022
✦肠道菌群也会破坏肠道通透性
肠腔黏膜表面是毒性和免疫原性颗粒面对黏膜相关免疫系统的第一道屏障。肠道微生物菌群失调在功能性消化不良中非常常见。
有害菌破坏紧密连接增加肠道通透性
有研究表明,霍乱弧菌(V.cholera)、艰难梭菌(Clostridium difficile)和产毒素的大肠杆菌的各种菌株已显示可通过直接破坏紧密连接(TJ)、毒素或蛋白酶的产生以及炎症级联反应的活化来增强肠道通透性。
益生菌可以促进屏障完整性
相反,肠道益生菌可以通过增加闭合蛋白、紧密连接蛋白ZO-1和ZO-2的表达来促进屏障完整性。
另外,肠道菌群的某些代谢产物也能够破坏肠道通透性,例如,细菌细胞壁脂多糖易位可以诱导免疫反应和炎症反应,加剧肠道屏障损害并进一步增加肠道的通透性。
扩展阅读:什么是肠漏综合征,它如何影响健康?
除了影响黏膜屏障功能,微生物群也参与调节免疫系统的发育和功能,在先天免疫系统中起关键作用。
✦肠道菌群调节肠上皮免疫功能
研究发现,肠道微生物区系通过激活肠上皮细胞的模式识别受体和内质网应微信号促进免疫系统的发育,从而促进肠上皮细胞的增殖、抗菌肽和黏液的产生,调节与免疫功能相关细胞因子的分泌,如白细胞介素1β、白细胞介素18和白细胞介素25。
✦微生物代谢物也可促进免疫反应
肠道微生物群及其代谢物还通过Toll样受体(TLRs-TLR2、TLR4)干扰信号,并促进促炎细胞因子的产生和免疫反应。
此外,它们的代谢物也可能具有炎症特性或对T细胞分化产生直接影响。
小结
综上所述,肠道菌群失调在影响黏膜生物屏障的同时,可能也导致黏膜机械屏障、化学屏障及免疫屏障等多种屏障功能低下,并可能介导黏膜低度炎症和内脏高敏性的发生。
生物失调的影响
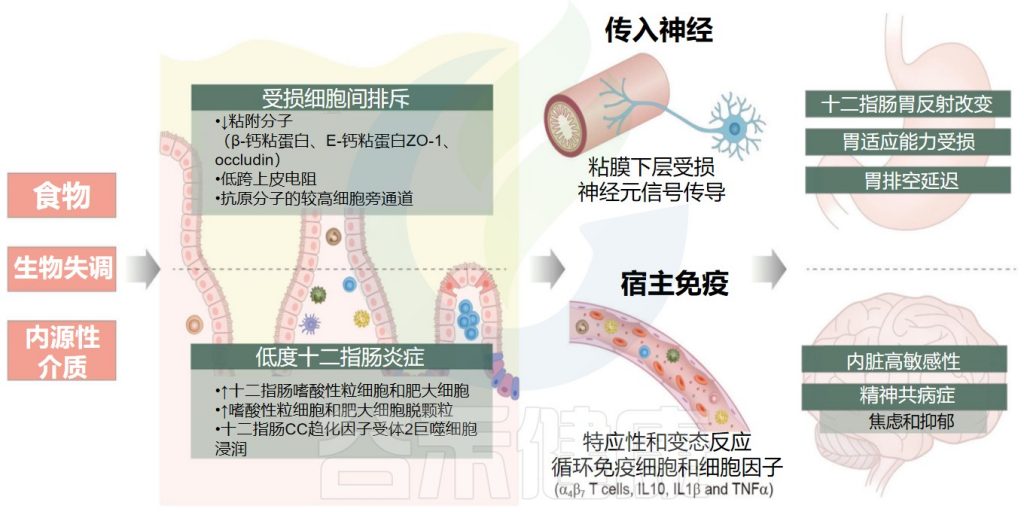

Kim SH.Korean J Gastroenterol.2022
脑-肠轴是连接胃肠道和中枢神经系统的传导通路,包括中枢神经系统、脑和脊髓、自主神经系统、肠神经系统和下丘脑垂体肾上腺轴。
肠道菌群与脑-肠轴存在双向交互作用:
肠道菌群通过神经、内分泌、免疫等至少三种途径与中枢神经系统相通;中枢神经系统调节肠道的运动、分泌及肠道黏膜通透性来影响肠道菌群,或通过肠腔分泌的激素直接调节菌群的基因表达而影响肠道菌群的组成和功能。
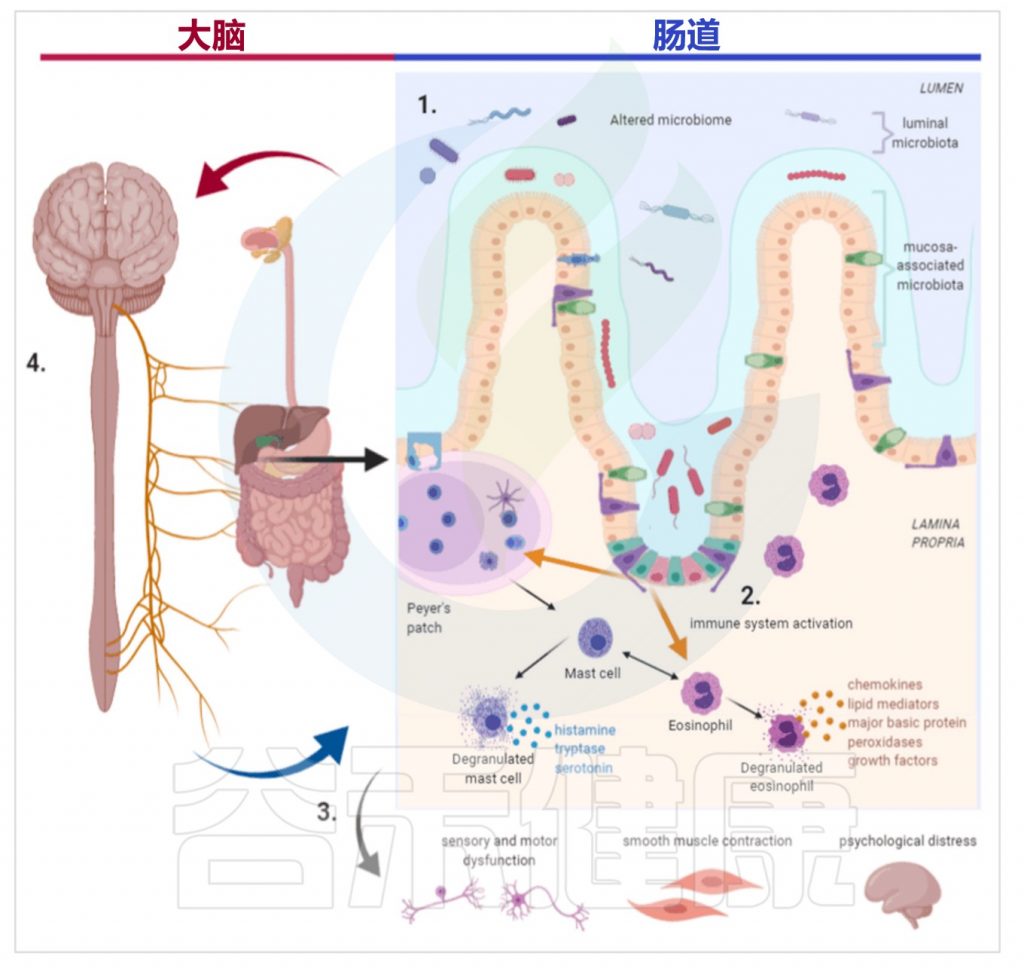

Brown G,et al.Neurogastroenterol Motil.2022
肠道菌群通过肠-脑轴影响5-羟色胺、脑源性神经营养生长因子(BNDF)等神经递质的合成、释放和下丘脑-垂体-肾上腺轴的发育,调节中枢神经系统的发育、功能和行为,影响焦虑、抑郁样情绪障碍和应激反应。
✦功能性消化不良患者伴有精神症状
功能性消化不良属于典型的身心疾病,常有焦虑、抑郁的表现。一项为期12年的前瞻性研究也说明功能性消化不良患者中有1/2~2/3先出现焦虑再有胃肠道症状,提示了功能性消化不良的中枢发病机制。
功能性消化不良患者的中枢神经系统改变
功能性神经影像学,如功能核磁共振,使我们能直接观察到中枢神经系统的改变,证明其与功能性消化不良症状的相关性。
结果显示功能性消化不良患者额叶皮层、感觉皮层、脑岛、前扣带皮层、丘脑、海马体和杏仁核的改变,与功能性消化不良内脏超敏反应、消化不良症状、生活质量及焦虑和抑郁有关。
精神心理应激影响内脏高敏感性
有研究认为功能性消化不良患者在精神心理应激的情况下可通过刺激中枢神经系统的情感活动系统参与患者内脏高敏感性的形成,从而对胃肠道产生影响。
因此,研究人员推测肠道菌群通过脑-肠轴对中枢神经系统的调节,导致消化不良伴焦虑抑郁的发生发展。
✦肠道菌群对肠脑轴具有重要作用
随着研究不断深入,越来越多证据证实肠道菌群与脑-肠-菌群轴功能密切相关。
菌群代谢物影响中枢神经系统信号
一方面,肠道微生物能通过合成和释放短链脂肪酸、次级胆汁酸和色氨酸等代谢物,与肠内分泌细胞,自下而上影响激活内源性中枢神经系统信号机制。
此外,肠道菌群失调会增加脂多糖的产生和分泌,而脂多糖不仅是影响中枢神经系统功能的一个强有力的因素,还会促进其他炎症因子的产生,如肿瘤坏死因子﹣α、白细胞介素﹣1β等,以上炎症因子可影响中枢神经系统的功能, 紊乱神经肽的合成和分泌。
激活肠神经系统信号
另一方面,肠道微生物也可独立完成或促进某些神经活性物质的合成和分泌,如5-羟色胺、γ-氨基丁酸、去甲肾上腺素、多巴胺等,这些小分子物质能通过与肠内分泌细胞相互作用,激活肠神经系统信号机制。
上述研究表明,肠道菌群失调可能诱导脑-肠-微生物群轴功能紊乱,其机制涉及神经、免疫和内分泌信号传导。
✦迷走神经的作用
在生态失调和胃肠道不适的精神状况的背景下,应该注意的一个重要方面是迷走神经的作用。
众所周知,压力会增加肠道通透性并通过各种神经调节剂改变胃肠道微生物组的组成,同时压力可以减少迷走神经活动,这可能会促进胃肠道炎症。
注:虽然目前还没有关于迷走神经刺激对胃肠道微生物组影响的数据,但可以推测迷走神经可能通过其对肠道通透性的影响对肠道微生物组产生影响。
迷走神经的传出可能在肠道中具有抗炎作用,同时降低肠道通透性——这两种作用都可能归因于通过迷走神经活动加强紧密连接。
心理治疗对功能性消化不良患者微生物群和胃肠道症状的影响,也可以用迷走神经的影响来解释。
心理疾病对功能性消化不良的表现有影响
现在人们可能想知道心理疾病的患病率是否在不同的功能性消化不良亚组中有所不同。
已经表明情绪和焦虑障碍在非疼痛主导型功能性消化不良患者中,比在疼痛主导型功能性消化不良患者中更常见。
另一项研究还表明上腹痛与神经质、虐待和躯体化之间存在相关性。
这些发现强调了未来重点关注功能性消化不良患者的心理合并症和特定症状之间的可能联系,研究心理治疗对功能性消化不良患者特别是微生物组的这些有趣影响。
未来随着研究深入,有望更好地理解脑-肠-微生物组轴,功能性消化不良的治疗方法也能更加个性化。
药物经口服途径进入人体,不可避免地与肠道菌群发生相互作用。
多项研究表明,肠道微生物能通过编码多种酶,影响口服药物在体内的吸收、代谢、转化等过程,进而影响药物活性成分的有效性和毒性。
改变微生物群的药物在治疗消化不良中得到了有效证实。
利福昔明是一种广谱抗生素,具有革兰氏阳性、革兰氏阴性、需氧和厌氧覆盖,在胃肠道腔内生物利用度高,全身不良反应极小。
•消化不良症状缓解
在一项随机试验中,利福昔明治疗优于安慰剂治疗,其中79%的患者在服用利福昔明后报告消化不良症状缓解,而安慰剂组在8周时这一比例为47%。
•利于有益细菌生长
在其他胃肠道疾病中,利福昔明治疗已被证明可以保护结肠菌群,增加乳酸杆菌和双歧杆菌(Bifidobacterium)的丰度,从而产生积极效应,利于有益细菌的生长,从而改变整体成分。
扩展阅读:肠道核心菌属——双歧杆菌,你最好拥有它
•益生菌治疗后餐后腹胀改善
益生菌可能在功能性消化不良中发挥治疗作用,三项研究表明,在幽门螺杆菌阳性和阴性消化不良患者中服用益生菌加氏乳杆菌(Lactobacillus gasseri OLL2716)12周后,餐后饱腹感和腹胀症状得到改善。
35.5%的幽门螺杆菌阴性功能性消化不良患者的症状得到了缓解,而安慰剂患者的症状缓解率为17%。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
•恢复胃液微生物群
加氏乳杆菌还被证明可以“恢复”功能性消化不良患者异常的胃液微生物群。在服用益生菌12周之前,功能性消化不良患者的胃液显示拟杆菌比变形菌占优势,并且不存在酸杆菌(Acidobacteria),益生菌治疗后,这些比例发生了变化,以反映与健康志愿者相似的微生物群组成。
此外,虽然没有收集小肠细菌数据,但用凝结芽孢杆菌(Bacillus coagulans MY01)和枯草芽孢杆菌(Bacillus subtilis MY02)治疗8周后,功能性消化不良患者的有效率比安慰剂提高了28%。
这些发现提供了初步证据,表明患者症状与肠道微生物群中某些属的丰度有关,这些微生物群可以通过治疗性抗生素和益生菌制剂进行调节。
尽管有这些显著的具体变化,但仍需要对更多不同地理区域的患者群体进行进一步研究,以验证疾病中的微生物组变化。
15项观察性研究和一项随机对照试验的系统回顾发现,高脂肪、小麦、FODMAP(可发酵低聚糖、双糖、单糖和多元醇)和咖啡因等天然食品化学物质含量高的食物与功能性消化不良有关。
扩展阅读:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
饮酒与功能性消化不良症状的关联尚不明确,可能取决于酒精的类型。
以下是一些饮食调理建议:
•少食多餐:每天分成5-6餐,每餐食量适中,避免暴饮暴食。
•避免过度饮酒和吸烟:酒精和烟草会刺激胃肠道,加重消化不良症状。
•避免食用刺激性食物:如辛辣、油腻、烧烤等食物,容易引起胃肠道不适。
•增加膳食纤维摄入量:膳食纤维可以促进肠道蠕动,缓解便秘症状。建议多食用蔬菜、水果、全谷类食品等富含膳食纤维的食物。
•注意饮食卫生:避免食用过期食品、生冷食物等容易引起胃肠道感染的食物。
•喝足够的水:保持足够的水分摄入可以促进肠道蠕动,缓解便秘症状。
•食用易消化的食物:如米粥、面条、煮熟的蔬菜等,可以减轻胃肠道负担,缓解消化不良症状。
注意:饮食调理虽然可以缓解功能性消化不良症状,但如果症状持续或加重,建议及时就医进行诊断和治疗。
扩展阅读:20种有效改善肠道健康的科学方法
胃酸抑制的主要药物包括两类药物:质子泵抑制剂(PPI)和组胺H2受体拮抗剂。
•上腹痛和反流症状缓解
一项荟萃分析发现,在两到八周内服用标准剂量的质子泵抑制剂,在减少功能性消化不良症状方面优于安慰剂。
注:治疗益处仅出现在有上腹灼痛和反流样疼痛的患者身上,而不出现在有运动障碍相关问题的患者身上。
•消化不良症状的风险降低
组胺H2受体拮抗剂也是功能性消化不良治疗的一种选择。十二项随机对照试验将H2拮抗剂与安慰剂进行了比较,显示消化不良症状的相对风险降低了23%。
对于以进餐相关症状为特征的功能性消化不良伴餐后窘迫综合征的患者,促胃肠动力药可以减轻症状。
对29项比较促动力药(主要是西沙必利)与安慰剂的试验的回顾发现,功能性消化不良的整体症状显著减少。
对功能性消化不良患者的12项随机对照试验的回顾发现,心理治疗(即认知行为治疗和其他形式的心理治疗)比对照组具有统计学上的显著益处。
认知行为疗法:是一种心理治疗方法,旨在通过调整患者的思维方式和行为习惯,来改善其身体和心理健康问题。在功能性消化不良患者治疗中,认知行为疗法可以帮助患者意识到自己不良的思维和行为习惯,如过度焦虑、负面情绪、饮食习惯不当等,从而通过改变这些不良习惯,减轻和预防消化不良症状的发生。
此外,认知行为疗法还可以帮助患者学会应对压力和情绪问题的技巧,提高其身心健康水平。
•症状严重程度、疼痛强度减弱
认知行为疗法 (CBT)导致症状严重程度、疼痛强度减弱,并进一步降低疾病对患者生活的影响。
•胃动力显著增加
此外,与对照组相比,干预组胃排空率显著增加,胃动力参数发生变化。基于这些结果,认知行为疗法可被视为功能性消化不良患者的有效治疗选择。
注:心理治疗不应作为功能性消化不良的一线治疗,因为数据质量低,缺乏盲法心理干预和主观症状评分导致偏倚风险高。如果药物治疗无效,可以考虑心理治疗。
中药具有多成分、多靶点和多途径的优势,目前中医对功能性消化不良肠道菌群的研究仍处于探索阶段。
中药在治疗功能性消化不良方面具有一定的疗效,可以缓解消化不良症状,改善消化功能,提高生活质量。研究证实,中药能逆转肠道菌群失调,维持肠道微生态平衡。
注:中药治疗功能性消化不良应根据患者的具体情况进行个体化治疗,避免不必要的药物过敏或不良反应。同时,中药治疗应在专业医生的指导下进行。
基于菌群干预后,原先消化不良患者的肠道菌群有了好转:
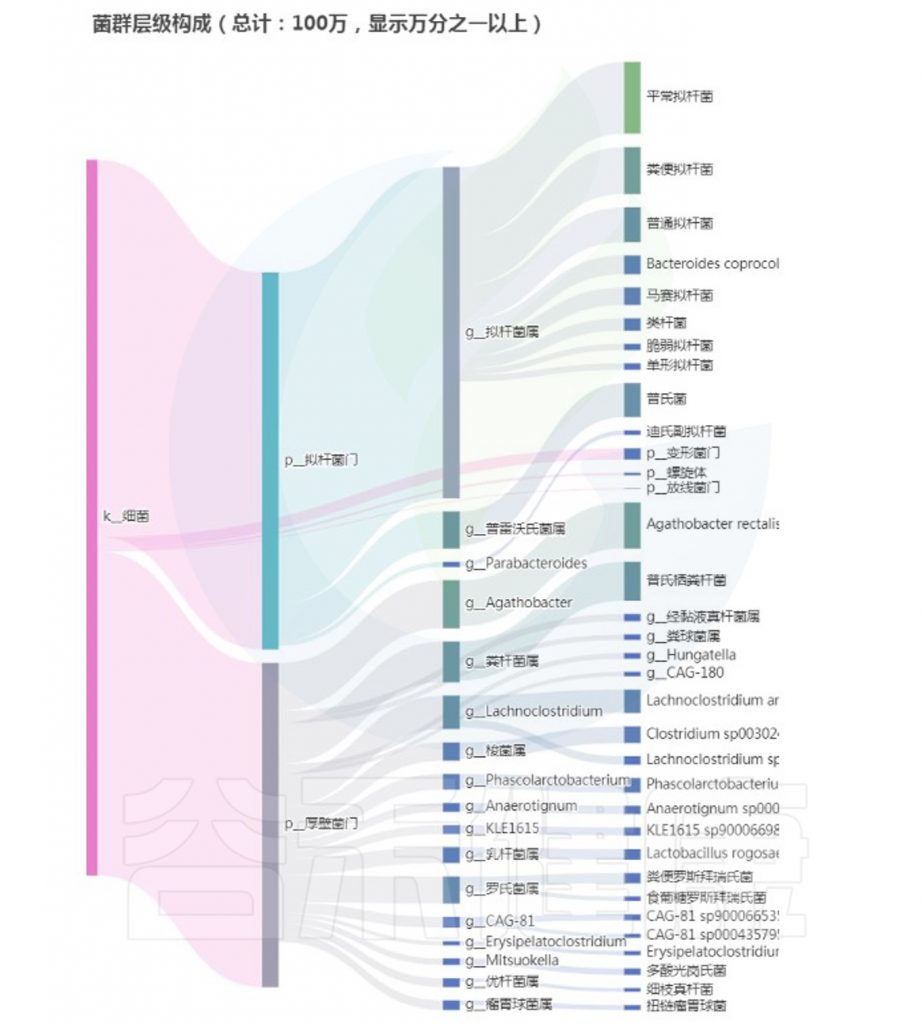







<来源:谷禾健康肠道菌群检测数据库>
从以上菌群评估报告显示,核心菌属和重要菌属没有异常,整体菌群平衡和多样性良好,健康评分显著提升,检测者反馈消化不良症状大幅减轻。
功能性消化不良是一种常见的消化系统疾病,其症状包括腹胀、腹泻、便秘等,给患者带来很大的困扰和痛苦。目前,传统的治疗方法主要是针对症状进行缓解,但效果并不理想。近年来的研究表明,肠道微生物与功能性消化不良密切相关,肠道菌群干预成为了治疗功能性消化不良的新途径。
谷禾的肠道菌群检测经验和研究表明肠道菌群的紊乱和异常特征可以对部分功能性消化不良患者症状背后的病理进行分类和解析,为针对性干预和改善提供了新的可能。对肠道微生物与功能性消化不良之间的关系的进一步深入研究和应用有望带来更有效的治疗方法。
主要参考文献
Singh R, Zogg H, Ghoshal UC, Ro S. Current Treatment Options and Therapeutic Insights for Gastrointestinal Dysmotility and Functional Gastrointestinal Disorders. Front Pharmacol. 2022 Jan 25;13:808195. doi: 10.3389/fphar.2022.808195. PMID: 35145413; PMCID: PMC8822166.
Martinez-Guryn K, Hubert N, Frazier K, Urlass S, Musch MW, Ojeda P, Pierre JF, Miyoshi J, Sontag TJ, Cham CM, Reardon CA, Leone V, Chang EB. Small Intestine Microbiota Regulate Host Digestive and Absorptive Adaptive Responses to Dietary Lipids. Cell Host Microbe. 2018 Apr 11;23(4):458-469.e5. doi: 10.1016/j.chom.2018.03.011. PMID: 29649441; PMCID: PMC5912695.
Shah A, Talley NJ, Holtmann G. Current and Future Approaches for Diagnosing Small Intestinal Dysbiosis in Patients With Symptoms of Functional Dyspepsia. Front Neurosci. 2022 May 6;16:830356. doi: 10.3389/fnins.2022.830356. PMID: 35600619; PMCID: PMC9121133.
Miwa H, Nagahara A, Asakawa A, Arai M, Oshima T, Kasugai K, Kamada K, Suzuki H, Tanaka F, Tominaga K, Futagami S, Hojo M, Mihara H, Higuchi K, Kusano M, Arisawa T, Kato M, Joh T, Mochida S, Enomoto N, Shimosegawa T, Koike K. Evidence-based clinical practice guidelines for functional dyspepsia 2021. J Gastroenterol. 2022 Feb;57(2):47-61. doi: 10.1007/s00535-021-01843-7. Epub 2022 Jan 21. PMID: 35061057; PMCID: PMC8831363.
Mounsey A, Barzin A, Rietz A. Functional Dyspepsia: Evaluation and Management. Am Fam Physician. 2020 Jan 15;101(2):84-88. PMID: 31939638.
Tziatzios G, Gkolfakis P, Papanikolaou IS, Mathur R, Pimentel M, Giamarellos-Bourboulis EJ, Triantafyllou K. Gut Microbiota Dysbiosis in Functional Dyspepsia. Microorganisms. 2020 May 8;8(5):691. doi: 10.3390/microorganisms8050691. PMID: 32397332; PMCID: PMC7285034.
Brown G, Hoedt EC, Keely S, Shah A, Walker MM, Holtmann G, Talley NJ. Role of the duodenal microbiota in functional dyspepsia. Neurogastroenterol Motil. 2022 Nov;34(11):e14372. doi: 10.1111/nmo.14372. Epub 2022 Apr 11. PMID: 35403776; PMCID: PMC9786680.
Hari S, Burns GL, Hoedt EC, Keely S, Talley NJ. Eosinophils, Hypoxia-Inducible Factors, and Barrier Dysfunction in Functional Dyspepsia. Front Allergy. 2022 May 31;3:851482. doi: 10.3389/falgy.2022.851482. PMID: 35769556; PMCID: PMC9234913.
Rupp SK, Stengel A. Bi-Directionality of the Microbiota-Gut-Brain Axis in Patients With Functional Dyspepsia: Relevance of Psychotherapy and Probiotics. Front Neurosci. 2022 Feb 28;16:844564. doi: 10.3389/fnins.2022.844564. PMID: 35295092; PMCID: PMC8919856.