 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


肠道蛋白酶
蛋白水解平衡失调通常与疾病有关。例如丝氨酸蛋白酶和基质金属蛋白酶参与多种生物过程,尤其是炎症反应。
胃肠道拥有数以万亿计的微生物,并暴露于高水平的蛋白酶。研究表明蛋白酶在维胃肠道稳态中的关键作用,它们的上调会导致组织损伤和炎症 。基质金属蛋白酶 (MMP) 被认为是 IBD 发病机制及其相关并发症(如瘘管和纤维化)。
微生物蛋白酶在肠道中的作用在很大程度上已被忽视,部分原因是将宿主蛋白酶与其微生物对应物区分开来的工具有限。早期的研究已经确定了细菌蛋白酶对人类大肠蛋白水解的重要贡献 。大多数已鉴定的蛋白酶属于拟杆菌属、链球菌属和梭状芽孢杆菌属物种。鉴于蛋白酶经常被作为毒力因子进行研究,病原体衍生的蛋白酶主要被探索其在胃肠道中的作用。
此类蛋白酶已被描述为:
(i) 帮助细菌在感染期间成功地与常驻微生物群竞争
(ii) 促进细菌适应性和在恶劣条件下存活的关键因素。
多年前,高温丝氨酸蛋白酶 A (HtrA) 被定义为单核细胞增生李斯特菌的关键毒力因子。
蛋白酶是一种进化上保守的酶家族,可降解肽键,并与几种常见的胃肠道 (GI) 疾病有关。管腔蛋白酶,其中许多是由微生物群产生的,可以调节膳食抗原的免疫原性,降低粘膜屏障功能并激活促炎和促伤害性宿主信号传导。
蛋白水解活性的增加归因于蛋白酶产量的增加和管腔蛋白酶抑制剂的减少。
本文将讨论管腔蛋白酶过度活性如何导致乳糜泻、肠易激综合征、炎症性肠病和胃肠道感染的病理生理学的理解的最新进展。
了解蛋白酶复合物在肠道中的生理作用可以为疾病的发展提供新的见解,以及预防和治疗肠道疾病的新方法。
蛋白酶存在于所有生命形式中,这些酶在基本生理过程中发挥着多功能作用,包括膳食蛋白质的消化、细胞凋亡、细胞分化、炎症和伤害感受等等。对所有生物体的生存至关重要。
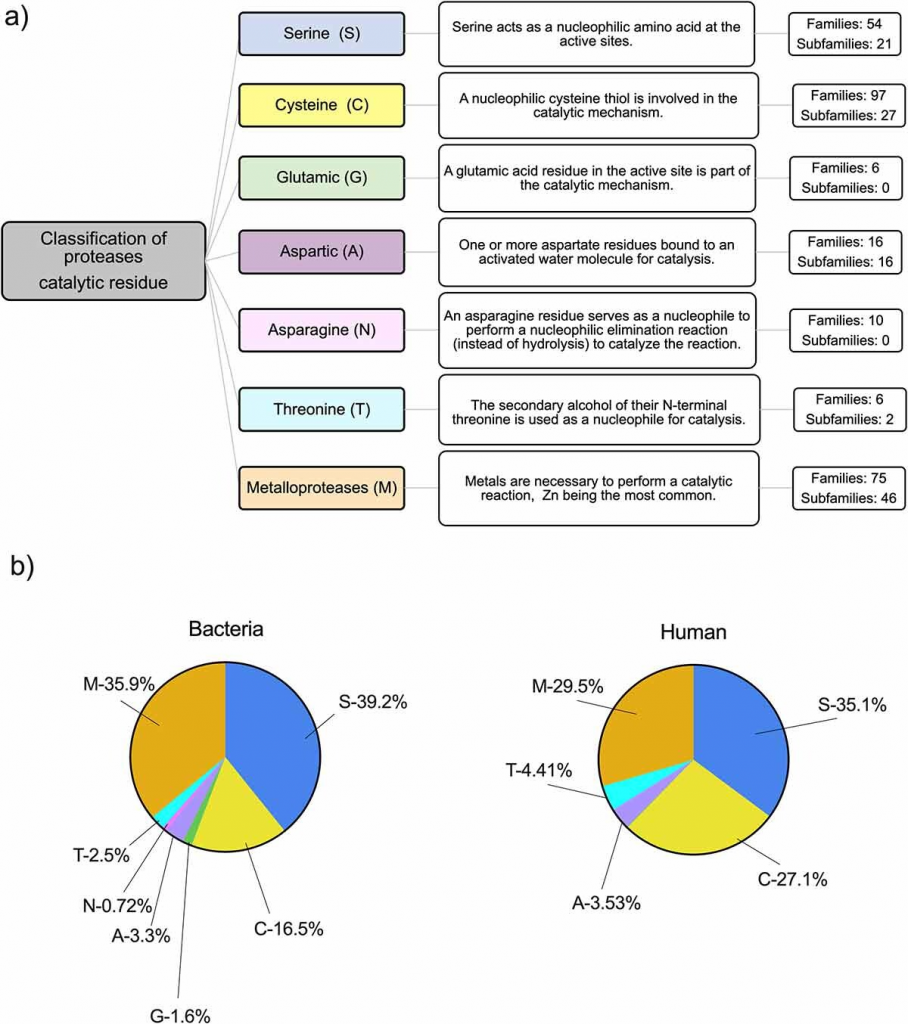
根据它们的催化机制,它们分为丝氨酸、苏氨酸、半胱氨酸、天冬酰胺、谷氨酸、天冬氨酸或金属蛋白酶(MEROPs 数据库)。
这些酶使用位于活性位点的氨基酸残基(分别为丝氨酸、苏氨酸、半胱氨酸、天冬酰胺、谷氨酸或天冬氨酸)进行催化反应,金属蛋白酶除外,它使用金属进行催化, Zn2+是最常见的。
▼
在人类中,蛋白酶是最大的酶家族之一,占人类基因组的 2%,已描述超过 500 种不同的蛋白酶。丝氨酸 (35.1%) 和金属蛋白酶 (29.5%) 是最密集的类别。
除了众所周知的膳食消化功能外,宿主蛋白酶在肠道中发挥着非常重要的作用,包括细胞增殖和分化、组织形态发生和重塑、血管生成、伤口修复、干细胞动员、炎症、免疫、自噬和细胞凋亡。
根据催化位点对蛋白酶进行分类和分布

Caminero A, et al. Gut Microbes. 2023
a) MEROPs 数据库根据用于进行催化过程的催化位点的氨基酸对蛋白酶进行分类。每组蛋白酶通过代表催化类型的氨基酸字母来识别。所有成员都根据结构相似性进行识别和分类。
b) 细菌和人类基因组中蛋白酶家族的相对丰度,包括假定的蛋白酶。丝氨酸 (S)、半胱氨酸 (C)、谷氨酸 (G)、天冬氨酸 (A)、天冬酰胺 (N)、苏氨酸 (T) 和金属蛋白酶 (M)。
▼
与哺乳动物蛋白酶相比,细菌蛋白酶在机制、结构和功能上具有高度多样性。
除了谷氨酸蛋白酶之外,微生物还能产生大量与人类宿主相同种类的蛋白酶,而谷氨酸蛋白酶迄今尚未在哺乳动物中发现。
最丰富的细菌蛋白水解酶是:
虽然属于相似的类别,但细菌蛋白酶具有不同的功能活性或底物特异性,并不总是被很好地表征。
事实上,在细菌中发现的许多蛋白酶类的结构域结构与在真核生物中观察到的非常不同,这表明蛋白酶在原核生物中的作用截然不同。
此外,不同蛋白酶的类型和比例因分类群和菌株而异。
从功能的角度来看,蛋白酶在细菌的细胞间通讯、细胞活力、应激反应和致病性方面起着重要作用。
细菌蛋白酶根据功能位置更好地分类为:
细胞相关蛋白酶复合物
包括细胞内、保守和高度调节的蛋白酶,它们位于多聚体复合物中,对细胞活力至关重要。
这些蛋白酶在真细菌界中普遍存在,包括丝氨酸蛋白酶 Clp、Lon 和耐高温丝氨酸蛋白酶 A (HtrA)、Zn2+金属蛋白酶 FtsH 和苏氨酸蛋白酶 HslUV。
除HtrA外,这些蛋白质属于 AAA+ 酶(与多种细胞活动相关的 ATP 酶)的大类。
胞外酶
细胞外酶通常是具有高底物特异性的单体。它们通常被合成为无活性的酶原,保护细胞在分泌前不受不受控制的活动的影响。
许多这些分泌的蛋白酶被认为是毒力因子,并且是某些分类单元或菌株所独有的。
▼
蛋白酶受到严格调节,以防止宿主蛋白质过度降解或不适当的免疫激活,并且在患有不同胃肠道 (GI) 疾病的患者中描述了蛋白水解和抗蛋白水解活性之间的不平衡。例如,炎症性肠病 (IBD) 和肠易激综合征 (IBS) 患者的结肠组织丝氨酸蛋白水解活性 (PA) 增加,暗示在疾病的病理生理学中的作用。
微生物释放的蛋白酶与宿主蛋白酶不同
过去,大多数 IBD 和 IBS 研究主要集中在研究宿主释放的蛋白酶上。然而,肠道拥有一个庞大而多样的微生物生态系统,即微生物群,它对人类体内平衡和疾病具有重要影响。
肠道微生物群是蛋白酶的丰富来源,因为微生物释放不同的蛋白酶用于代谢、防御和宿主入侵。肠道微生物也会产生蛋白酶抑制剂和蛋白酶降解酶,反映出严格调节蛋白水解活性的重要性。
在肠道中,微生物蛋白酶首先被确定为病原体的毒力机制
与健康受试者的样本相比,在 IBD 和 IBS 患者的粪便上清液中也观察到结肠组织丝氨酸蛋白水解活性( PA ) 升高,这表明 IBD 和 IBS 中 PA 增强可能是由于宿主和微生物来源的 PA 升高。
例如,病原体铜绿假单胞菌代谢后产生肽,从而增加乳糜泻 (CeD) 患者的免疫原性,和来自肠道细菌联合体的丝氨酸蛋白酶通过激活蛋白酶激活受体 4 (PAR-4) 调节伤害感受器的兴奋性。
然而,肠道疾病中蛋白酶等特定细菌产物的机制表征仍然是一个巨大的挑战。随着越来越多的证据表明细菌蛋白酶在胃肠道疾病中起着关键作用,这里我们主要强调一些关于它们参与炎症性肠病、肠易激综合征、乳糜泻和胃肠道感染发展的关键发现,并考虑它们的生理意义。
IBD 是一个涵盖性术语,包括与胃肠道慢性复发和缓解炎症相关的多种疾病。
IBD 的两种主要亚型是:
虽然这两种疾病在肠道炎症的性质和位置上存在差异,但它们有一些共同的症状,包括疼痛、排便习惯改变、体重减轻和贫血。
尽管可获得针对关键炎症过程以诱导缓解的药物和单克隆抗体,但随着时间的推移,许多 IBD 患者反应迟钝或失去反应。因此,需要针对 IBD 的新疗法,并且一种有希望的候选方法是靶向管腔蛋白水解活性。
IBD 患者结肠组织中宿主蛋白水解的失调
据报道,在克罗恩病和溃疡性结肠炎患者中,结肠组织产生的宿主丝氨酸蛋白酶增加。与健康对照相比,IBD 患者结肠组织上清液中的组织蛋白酶 G 和凝血酶等蛋白酶过度活跃。弹性蛋白酶样活性在 IBD 中也引起了相当大的关注。
显示结肠上皮细胞是弹性蛋白酶样活性的主要来源,并且这种活性在 IBD 患者中显着增加。同一项研究特别确定弹性蛋白酶 2A (ELA2A) 在 IBD 患者中增强。
粪便样本中蛋白酶的来源
与结肠组织不同,粪便样本中含有来自宿主和细菌的蛋白酶,破译粪便样本中蛋白酶的来源仍然是一个挑战。
丝氨酸蛋白酶抑制剂:缓解小鼠结肠炎
与蛋白水解过度活跃在疾病发病机制中的作用一致,丝氨酸蛋白酶抑制剂在 IBD 小鼠模型中具有有益作用。Elafin 是一种乳杆菌的丝氨酸蛋白酶抑制剂,可降低暴露于葡聚糖硫酸钠 (DSS) 或三硝基苯磺酸的小鼠结肠炎的严重程度。
粪便蛋白水解活性:作为疾病早期生物标志物的可能性
2021 年,有研究提议使用细菌蛋白酶作为溃疡性结肠炎患者疾病的标志物。在溃疡性结肠炎患者的纵向队列中,发现溃疡性结肠炎患者的粪便蛋白水解活性增加,甚至在疾病发作之前。这表明增加的粪便蛋白水解活性可用作疾病的早期生物标志物。
更重要的是,由于蛋白水解对粘膜屏障功能和免疫调节的影响,增强的粪便蛋白水解活性可能是 溃疡性结肠炎发病机制的早期步骤。由于鸟枪法宏基因组检测到细菌蛋白酶基因表达增加,因此提出了这种粪便蛋白水解活性的细菌来源。
细菌对粪便蛋白水解活性有贡献
作者还发现溃疡性结肠炎患者粪便弹性蛋白酶样活性增加。弹性蛋白酶样活性与普通拟杆菌,一种已知具有高蛋白水解活性的分类单元。
重要的是,在疾病发作前将溃疡性结肠炎患者的粪便微生物群转移到小鼠体内会增加结肠中的粪便蛋白水解活性并激活宿主炎症反应。这些结果表明细菌对粪便蛋白水解活性有贡献,并提供了 溃疡性结肠炎患者微生物群的蛋白水解活性足以诱发肠道炎症的概念证明。
细菌蛋白酶的增加与溃疡性结肠炎发病机制有关
后来的研究使用蛋白质组学和代谢组学,可以检测蛋白酶是真核生物来源还是原核生物来源。临床活动性溃疡性结肠炎患者的一个子集具有过量的源自普通拟杆菌(Bacteroides vulgaris,B. vulgatus)。一些相关的蛋白酶包括丝氨酸和金属蛋白酶,它们主要在细胞外空间发挥作用,可能会加剧疾病活动。
总之,有证据表明细菌蛋白酶的增加与溃疡性结肠炎发病机制有关,但这些蛋白酶在多大程度上导致疾病严重程度以及克罗恩病中是否发生类似现象仍有待确定。
普通拟杆菌蛋白酶是治疗溃疡性结肠炎的潜在靶点
为测试B. vulgatus蛋白酶是否促进溃疡性结肠炎疾病进程,作者首先分析了在患者和细菌培养物中发现的B. vulgatus蛋白酶。使用广谱蛋白酶抑制剂可改善B. vulgatus诱导的体外屏障功能损伤,并预防在IL10 缺陷小鼠中B. vulgatus 诱导的的结肠炎。此外,将具有高丰度 B. vulgatus蛋白酶的溃疡性结肠炎患者的粪便移植到无菌小鼠体内会诱导依赖于蛋白酶活性的结肠炎。
这些结果综合显示普通拟杆菌(Bacteroides vulgatus)蛋白酶是治疗溃疡性结肠炎的潜在靶点。
金属蛋白酶 MMP
基质金属蛋白酶(MMP) 是内切蛋白酶,在其催化位点包含一个保守的锌结合基序。该酶家族共享一个由前肽、催化结构域、铰链区(接头)和血红素结合蛋白结构域组成的共同结构域组织。
MMP 表达和活性的失调与多种病理过程有关,例如癌症、心血管疾病、肌肉骨骼疾病和慢性炎症。在 IBD 的背景下,许多 MMP 被发现被上调。
金属蛋白酶的失调可通过五个主要过程促成 IBD:细胞因子加工、粘液耗竭、紧密连接失稳、中性粒细胞募集和刺激以及 Th1/Th17 反应。
如下图:
基质金属蛋白酶在健康状况(正常)和炎症性肠病发病机制中的作用机制示意图
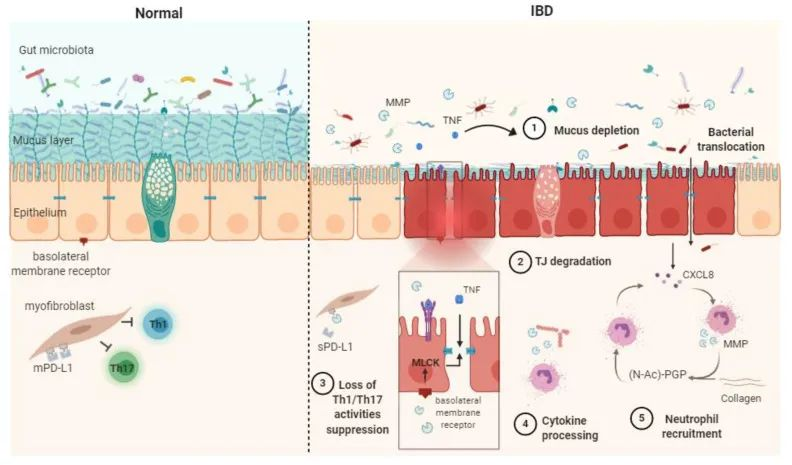

Mariaule V, et al. Int J Mol Sci. 2021
由 MMP 脱落膜结合 TNF 引起的可溶性 TNF-α 的释放导致粘液耗竭 ( 1 ) 和紧密连接不稳定 ( 2 ),从而导致上皮通透性和细菌易位增加。
丝氨酸蛋白酶
胃肠道经常暴露于来自宿主和肠道细菌的高水平蛋白水解酶 。从宿主方面,这些蛋白酶可以由常驻细胞或浸润细胞释放。
在浸润性免疫细胞中,中性粒细胞是丝氨酸蛋白酶的主要来源。它们的颗粒含有大量的弹性蛋白酶 (HNE)、蛋白酶 3 (PR3) 和组织蛋白酶 G (catG),它们在炎症时分泌。
丝氨酸蛋白酶对 IBD 的贡献可以通过四种主要机制来描述:TJ 去稳定化/降解、粘液降解、PAR 激活和细胞因子加工。
如下图:
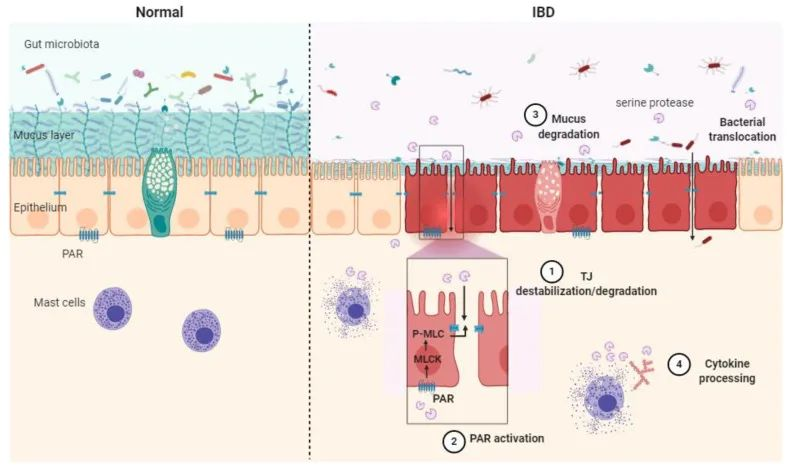

Mariaule V, et al. Int J Mol Sci. 2021
丝氨酸蛋白酶在健康环境(正常)和炎症性肠病(IBD)病理学中的作用模式示意图。上皮屏障损伤与丝氨酸蛋白酶通过直接切割对紧密连接的作用有关。( 1 ) 间接不稳定源自蛋白酶激活受体 (PAR) 激活 ( 2 )、粘液降解 ( 3 ) 和细胞因子加工 ( 4 )。
乳糜泻是一种慢性自身免疫性炎症性肠病,发生在对摄入麸质蛋白有反应的遗传易感个体中。它的全球患病率为 1.4%。
乳糜泻主要影响小肠,产生以上皮内淋巴细胞增加、绒毛萎缩和隐窝增生为特征的粘膜免疫反应。目前,唯一被接受的乳糜泻治疗是严格的终生无麸质饮食。
微生物在乳糜泻中的作用最近受到了相当大的关注,这是基于乳糜泻患者肠道微生物组的改变以及纵向研究中肠道感染与乳糜泻发病之间的关联。
蛋白酶在乳糜泻发病机制中起着关键作用
随着微生物组成的变化,一些研究表明蛋白酶在乳糜泻发病机制中起着关键作用。与蛋白酶在乳糜泻中的有益作用相反,在乳糜泻患者的十二指肠和粪便中观察到对麸质蛋白的蛋白水解活性增加。
麸质的蛋白水解活性增加,假单胞菌增加
虽然这些蛋白酶的性质尚不清楚,但最近的报告表明微生物起源。来自活动性乳糜泻患者的十二指肠活组织检查显示,针对麸质的蛋白水解活性增加,这与假单胞菌(一种众所周知的蛋白水解分类群)的丰度增加相关。
事实上,铜绿假单胞菌通过不同的机制在临床前小鼠模型中诱导食物敏感性,如下所述。
这些研究表明,病原体表达的蛋白酶会影响乳糜泻患者小肠中的麸质代谢和免疫激活。
与乳糜泻中蛋白水解活性的致病作用一致,长双歧杆菌产生的丝氨酸蛋白酶抑制剂可减少临床前小鼠模型中麸质诱导的免疫病理学。
缺少消化蛋白酶可能是导致乳糜泻的原因
几十年来,人们一直怀疑缺少消化蛋白酶可能是导致乳糜泻的原因。该理论认为,由于易感个体缺乏未知的宿主消化蛋白酶,乳糜泻中的麸质消化不良。
口服酶疗法是乳糜泻中广泛研究的一种治疗方法
其重点是通过补充肽酶来消化人体胃肠道中的免疫原性谷蛋白肽。在这方面,来自口腔的微生物已成为有可能产生降解管腔麸质的酶的候选者。
细菌蛋白酶在治疗乳糜泻方面具有广阔的潜力
体外研究表明,Rothia菌株(R. mucilaginosa和R. aeria)是专门针对免疫显性面筋肽的面筋降解酶的潜在来源。随后,由R. aeria产生的酶被分离并鉴定为属于 S8 枯草杆菌蛋白酶家族,具有高效降解面筋的能力。
其他研究人员表明,来自Flavobacterium meningosepticum、Sphingomonas capsulate和Myxococcus xanthus在乳糜泻的治疗中具有广阔的应用前景。来自这些微生物的重组蛋白能够分解具有不同亚位点特异性的谷蛋白肽。
这些发现表明细菌蛋白酶在治疗乳糜泻方面具有广阔的潜力,一些制剂已经进入 II 期临床试验。
迄今为止的证据表明,一些蛋白酶可以预防乳糜泻,而另一些则会加剧疾病:这取决于所讨论的蛋白酶的底物特异性及其降低或增加麸质分解代谢产物免疫原性的能力。
未来十年,对有助于面筋代谢的细菌来源蛋白酶的研究可能会显着增加,因为无论疾病如何,人体消化酶都只会部分消化它。
IBS 是一种常见的消化系统疾病,与慢性腹痛和排便习惯改变有关。
由于 IBS 没有伴随 IBD 的明显炎症损伤,因此通常被视为肠-脑沟通障碍。除了中枢神经系统处理肠道信号的改变外,IBS 患者肠道内的一些变化也与肠-脑通讯的改变有关,包括肠嗜铬细胞释放 5-羟色胺的改变、肥大细胞-神经元通讯的改变和微生物的改变。
宿主和细菌衍生的蛋白酶可能促进发病机制和症状的产生
例如,在 IBS 患者的结肠活检中,胰蛋白酶样活性和类胰蛋白酶释放增加。
在最近的一项研究中,对感染后 IBS 患者粪便样本的宏基因组分析显示,与对照组相比,特定宿主丝氨酸蛋白酶驱动的肠道微生物群组成发生了改变,肠道蛋白水解活性升高。
作者还表明,共生微生物释放的 β-葡萄糖醛酸酶抑制宿主 PA,从而保护肠上皮细胞,并表明微生物 β-葡萄糖醛酸酶活性的降低可能有助于 IBS 的发病机制。
与增强 IBS 中蛋白酶活性的作用一致,丝氨酸蛋白酶抑制剂萘莫司他减少炎症后 IBS 啮齿动物模型中的内脏痛觉过敏。
胃肠道感染是急性和慢性疾病的一大负担,而蛋白酶对于许多微生物感染宿主的能力至关重要。
细菌病原体在感染过程中出于各种目的依赖蛋白水解
细胞内和膜蛋白酶如 Clp、Lon 或 HtrA 通过毒力调节剂的及时降解和间接地通过提供对宿主不利条件的耐受性来促进毒力。相反,病原体依赖性细胞外蛋白酶通过降解宿主细胞外基质成分或干扰宿主细胞和免疫信号来促进宿主入侵,这个我们下面讨论。
一个很好的例子是幽门螺旋杆菌,这种细菌感染了世界上大约一半的人口,是消化性溃疡病和胃癌的主要危险因素。尽管在幽门螺杆菌中描述了不同的毒力因子,锌蛋白酶 PqqE 和丝氨酸蛋白酶 HtrA 破坏胃粘膜完整性,从而促进细菌入侵。
扩展阅读:正确认识幽门螺杆菌
蛋白酶也是与胃肠炎相关的感染因子的关键毒力因子
肠胃炎是一种以排便频率和粪便含水量增加为特征的腹泻病,伴或不伴发热、呕吐和腹痛。
肠道感染引起的腹泻是全球发病率和死亡率的一个主要因素。虽然已知有 20 多种微生物病原体会引起急性胃肠炎,但几种大肠杆菌菌株是最常见的,对人类健康构成重大风险,并且仍然是发展中国家婴儿死亡的重要原因。
这组细菌包括不同的致病型,例如产肠毒素 (ETEC)、肠致病性 (EPEC)、肠侵袭性 (EIEC)、肠出血性 (EHEC) 或肠聚集性大肠杆菌(EAEC)。
引起腹泻的其他临床相关微生物有:
肠道病原体利用各种复杂的策略在肠道定植、逃避免疫系统、增殖和损害宿主。与这些细菌相关的毒力因子具有广泛的活性,包括粘附素、毒素、铁获取因子、脂多糖、多糖胶囊、侵入素和蛋白酶。
SPATE 会降解宿主细胞内或细胞外底物,产生不利影响
来自肠杆菌科的丝氨酸蛋白酶自转运体(SPATE) 构成了一个毒力因子超家族。这些是高分子量丝氨酸蛋白酶,通常通过自转运途径分泌到外部环境中,并且在肠病原体中非常普遍,包括志贺氏菌、沙门氏菌、柠檬酸杆菌和所有致病大肠杆菌。
一些研究结果表明,SPATE 会降解宿主细胞内或细胞外底物,从而引发对宿主细胞的各种不利影响。
SPATE 可以分为 2 个类型
1 类 SPATE 靶向细胞内底物,对宿主产生细胞毒性和内毒素作用。
2 类 SPATE 似乎会破坏粘膜屏障并通过靶向宿主糖蛋白来调节免疫反应。在这一类中,由大肠杆菌(EAEC)、福氏志贺菌产生的丝氨酸蛋白酶 Pic是一种与先天免疫系统的粘附、定植和逃避相关的毒力因子。
福氏志贺菌产生的 2 级 SepA也是破坏屏障不可或缺的。最后,大肠杆菌分泌的锌金属蛋白酶 StcE 和 SslE有助于这些细菌与宿主细胞的紧密粘附,这一过程对于定植至关重要。
其他蛋白酶已被描述为肠胃炎的毒力因子。由于幽门螺杆菌、鼠伤寒沙门氏菌和空肠弯曲杆菌(一种负责食源性感染的细菌)与宿主细胞上皮细胞相互作用并通过 HtrA 建立感染。
弧菌溶血素与霍乱弧菌的致病性有关
细胞外锌依赖性金属蛋白酶血凝素 (HA) 也称为弧菌溶血素,与霍乱弧菌的致病性有关,霍乱弧菌可引起霍乱,这是一种严重的腹泻病,如果不及时治疗可能会迅速致命,通常通过受污染的水和人与人之间的接触传播。
虽然霍乱毒素是感染的主要驱动因素,但弧菌溶血素具有广泛的潜在致病活性,包括粘液屏障的降解或上皮紧密连接的破坏。
致病性艰难梭菌释放的毒素对感染具有决定性作用
蛋白酶也可以间接介导感染。艰难梭菌就是这种情况,它是许多国家医疗保健相关感染和腹泻的主要原因之一。艰难梭菌会导致轻度至重度腹泻,并可能导致危及生命的情况,例如结肠穿孔、伪膜性结肠炎和中毒性巨结肠。
致病性艰难梭菌释放的毒素 A 和 B(分别为 TcdA 和 TcdB)对感染具有决定性作用。内部 Cys 蛋白酶结构域激活毒素,从而对宿主细胞产生下游影响。
由于蛋白酶对于许多细菌感染宿主和引起疾病的能力至关重要,因此有人提议阻断特定蛋白酶以预防常见的胃肠道感染;但是,仍然没有批准的具有这种作用方式的药物。
与胃肠道疾病有关的细菌和宿主来源的蛋白酶总结

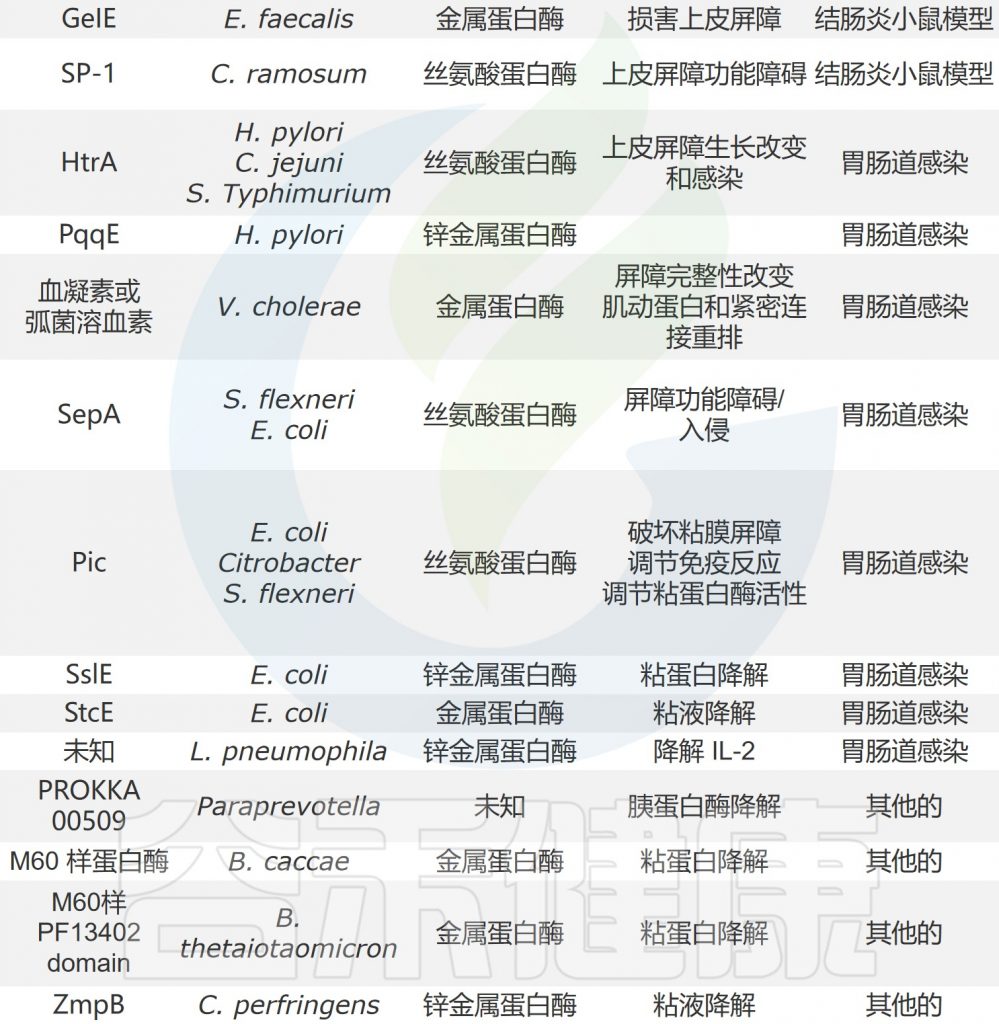






doi.org/10.1080/19490976.2023.2181922
在以下部分中,将在管腔作用、对粘膜屏障功能的影响、细胞和免疫信号以及对内脏感觉的影响的背景下讨论胃肠道疾病中蛋白水解活性的病理生理学后果。
饮食是微生物组成和功能的主要驱动因素。肠道微生物群能够使用不同的膳食成分来产生具有生物活性特性的微生物代谢物。
微生物蛋白酶活性会受到饮食选择的影响
就像在哺乳动物中发生的那样,微生物使用蛋白酶通过水解宿主或饮食中可用的蛋白质来满足其营养氨基酸需求。因此,微生物蛋白酶活性会受到饮食选择的影响。患有慢性炎症或功能性胃肠道疾病的患者将饮食视为症状发作/严重程度的驱动因素。
在研究微生物蛋白酶在炎症或功能障碍中的作用时应考虑饮食
事实上,微生物蛋白酶可以通过多种机制通过饮食影响体内平衡。
首先,西方饮食的特点是蛋白质含量高,许多消化不当的膳食蛋白质能够在肠道中引起异常的免疫反应。
人类肠道微生物群的功能多样性意味着有参与消化膳食成分的大量代谢途径,甚至是难以被人类酶消化的蛋白质。
因此,宿主未使用的膳食蛋白质成为微生物蛋白酶的底物。这在乳糜泻等食品敏感性中尤为重要。
乳糜泻的主要环境诱因、麸质未被宿主消化酶完全消化。已经表明,人体胃肠道中存在具有代谢麸质能力的细菌。这些包括共生细菌,例如放线菌、芽孢杆菌、Rothia、葡萄球菌、链球菌、乳杆菌或梭状芽孢杆菌,但也包括机会性病原体,例如铜绿假单胞菌。
微生物蛋白酶通过改变麸质的粘膜吸收和免疫原性
在最近的一项研究中,微生物谷氨酸羧肽酶基因与有效的面筋降解有关。另一方面,铜绿假单胞菌是一种从乳糜泻患者的十二指肠中分离出来的机会性病原体,通过产生能够更好地跨肠屏障转运的肽来提高面筋的免疫原性,并激活乳糜泻患者的面筋特异性T细胞。
铜绿假单胞菌通过 LasB 降解面筋,这种金属蛋白酶还通过蛋白酶激活受体 (PAR)-2 激活导致炎症通路的面筋非依赖性上调。在表达乳糜泻风险基因的小鼠中,铜绿假单胞菌LasB 与麸质协同作用,诱导与中度绒毛钝化相关的更严重的炎症。
因此,人体肠道是微生物蛋白酶的丰富来源,有助于消化常见的膳食蛋白质,从而增加或降低其最终免疫原性。
其他顽固的膳食蛋白质如小麦淀粉酶胰蛋白酶抑制剂 (ATI) 也证实了类似的现象。ATI 能够通过 toll 样受体 4 激活在肠道中诱导先天免疫激活,并对肠道炎症和抗原致敏产生下游影响。
肠道微生物蛋白酶能够消化 ATI,从而减少与小麦蛋白相关的肠道功能障碍。例如,乳杆菌菌株会降解面筋和 ATI 肽,从而降低其免疫原性。
微生物还会释放大量影响宿主稳态的代谢物
除了由于蛋白质的分解代谢而导致微生物蛋白酶对宿主产生直接影响外,微生物还会释放大量影响宿主稳态的代谢物,例如支链脂肪酸、氨基酸、氨、酚类、硫化氢。
有趣的是,酪氨酸代谢物,如对甲酚和 4-乙基苯基硫酸盐,可能有助于肠道-大脑交流,在 IBS 中发生了改变。
另一种细菌代谢物硫化氢在肠道生理过程中具有多种作用,并与肠道炎症和结直肠癌有关。
最后,色氨酸是合成多种重要生物活性分子的前体,例如 5-羟色胺、褪黑激素、烟酰胺和维生素 B3,以及许多其他重要的生理中间体。
扩展阅读:色氨酸代谢与肠内外健康稳态
色氨酸一种必需的芳香族氨基酸,存在于不同的饮食来源,例如家禽、鱼、燕麦和乳制品。这种独特的氨基酸可以被肠道微生物群代谢成一系列吲哚化合物,其中一些化合物可以激活关键的稳态受体,如芳基烃受体 (AhR) 或孕烷 X 受体 (PXR)。
事实上,这些受体与肠道炎症有关,并且微生物色氨酸代谢在 IBD 和乳糜泻患者中发生了改变。
因此,微生物蛋白酶可以通过改变常见的饮食抗原或促进肠道中生物活性代谢物的释放来间接调节不同的肠道状况。
肠粘膜屏障
宿主抵御共生细菌和入侵肠道病原体的第一道防线是肠粘膜屏障,它是一种物理屏障,包括生化和免疫成分。物理屏障由通过紧密连接的上皮细胞组成,并受到宿主分泌的粘液层的保护。
肠道中的粘液层在宿主上皮细胞和肠道微生物群之间形成物理屏障。
粘液层不断更新,这一动态系统的缺陷与胃肠道疾病和结肠癌有关。粘液的主要成分是形成凝胶的粘蛋白 2 (MUC2) 蛋白,它由杯状细胞合成。MUC2 缺陷小鼠更易患自发性结肠炎引用与健康对照相比,溃疡性结肠炎和克罗恩病中的MUC2 基因水平被发现发生了变化。
结肠中的粘液组织与小肠中的粘液组织大不相同。小肠中的粘液形成单一且可穿透的层,但细菌通过抗菌介质远离上皮细胞。结肠中的粘液形成双层。内部粘液层牢固地附着在上皮细胞上,细菌无法穿透,并且对于抑制微生物与上皮细胞上的宿主受体的相互作用至关重要。结肠中的外层粘液层(分泌的)被扩张并作为微生物群的栖息地。
尽管分泌的粘液的主要功能是保护宿主上皮免受共生体和病原体的侵害,但该屏障中的糖蛋白也为某些结肠微生物创造了营养来源。粘蛋白为细菌提供碳源和氮源,暴露的 O-聚糖链作为细菌定植的附着位点。粘附在粘蛋白上的共生微生物群通过定植抵抗来保护宿主。几十年来,人们一直在讨论粪便样本中发现的内容物可以降解结肠粘液的想法。
蛋白酶对粘液层的影响
近年来,对粘液降解所需的微生物碳水化合物活性酶 (CAZymes) 进行了深入研究,尤其是拟杆菌属和瘤胃球菌属的成员。来自不同微生物的蛋白酶也表现出很强的蛋白水解粘蛋白酶活性。
来自产气荚膜梭菌的锌金属蛋白酶 ZmpB在糖基化丝氨酸和/或苏氨酸残基附近进行切割。来自不同感染因子的蛋白酶,例如致腹泻大肠杆菌和志,或霍乱弧菌,可降解结肠粘液,这是促进上皮细胞入侵的关键步骤。
StcE 和 SslE,来自致腹泻性大肠杆菌菌株的金属蛋白酶,也可切割粘蛋白糖蛋白,这可能有助于病原体到达上皮细胞。
此外,M60 样蛋白酶家族以依赖于特定聚糖侧链结构存在的方式切割粘蛋白糖蛋白主链。
许多病原体表达这种蛋白酶家族以入侵宿主
不同的粘蛋白降解蛋白酶也已在拟杆菌属(人类肠道的常见共生菌)中得到描述这些包括B. thetaiotaomicron (BT4244) 或Bacteroides caccae中的蛋白酶。
尽管粘蛋白降解能力被认为是许多胃肠道病原体的毒力因子,但其对特定慢性肠道疾病的影响尚不清楚。
蛋白酶可以破坏粘膜屏障的上皮成分
上皮屏障功能需要连续的细胞层以及密封它们之间细胞旁空间的紧密粘附连接。肠道屏障功能受损与许多疾病状态有关,包括肠道和全身性疾病。
微生物蛋白酶也会裂解肠细胞间连接
由粪肠球菌产生的金属蛋白酶 GelE降解 E-钙粘蛋白,导致屏障功能丧失,这在自发性结肠炎小鼠模型的炎症发生前就很明显。紧密连接也是感染因子的目标,例如铜绿假单胞菌(通过 LasB)、幽门螺杆菌(PqqE 和 HtrA),空肠弯曲杆菌(HtrA),霍乱弧菌(弧菌溶素),志贺氏菌、沙门氏菌或致病性大肠杆菌(SepA)。
因此,微生物利用蛋白酶入侵宿主,对肠道具有重要意义。紧密连接和粘附连接的改变导致上皮屏障的细胞旁通透性增加,这是 IBD 和 IBS 的病理生理学标志。由于粘蛋白和连接降解细菌会造成损害,因此这些酶可能为蛋白酶抑制剂提供治疗或预防肠道疾病的靶点。
管腔蛋白酶激活肠细胞膜上表达的蛋白酶激活受体
管腔蛋白酶可以调节上皮屏障功能的另一种机制是通过激活肠细胞膜上表达的蛋白酶激活受体 (PAR)。关于 PAR 在肠道功能中的作用,PAR-2 激活配体的顶端给药导致前列腺素和干扰素释放以及由于 ZO-1 降解导致的细胞旁通透性增加。
PAR-4 被组织蛋白酶 G 激活,组织蛋白酶 G 是一种蛋白酶,在溃疡性结肠炎患者的粪便样本中升高,导致小鼠体内当 PAR-2 激活受阻时,肠道病原体艰难梭菌感染会很明显。
与 IBD、IBS、CeD 和GI感染有关的蛋白酶
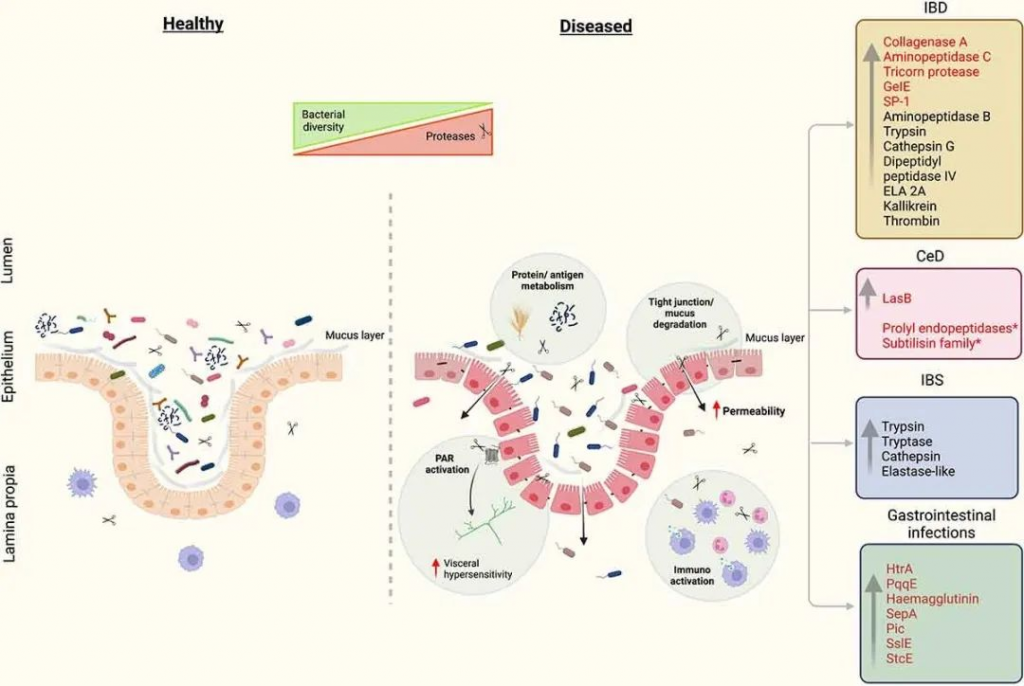

Caminero A, et al. Gut Microbes. 2023
在与疾病相关的情况下,蛋白酶通过多种作用机制诱导肠道结构和功能发生变化,包括对膳食蛋白质代谢、粘膜屏障功能、神经元兴奋性和免疫调节的影响。Luminal 蛋白酶通过 PAR 依赖和独立效应的组合影响 GI 功能。微生物来源的蛋白酶以红色突出显示。*具有治疗潜力的蛋白酶。
蛋白酶是信号酶,可以通过不同的机制途径特异性调节细胞和免疫信号,包括那些由 PAR 激活介导的途径。
PAR 是 G 蛋白偶联受体,具有七个跨膜结构域、一个细胞外 N 末端和一个细胞内 C 末端。N 末端的蛋白水解裂解通过显示栓系配体启动细胞内信号传导。
PAR家族的激活对肠道生理功能的影响
PAR 家族不同成员(PAR-1、2、3 和 4)的激活是蛋白酶特异性的,受到严格调控并影响肠道的许多生理功能,例如运动性、通透性和伤害感受。
特定蛋白酶激活 PAR 的功能结果取决于哪个 PAR 被激活及其下游信号通路是什么,包括是否启动了规范或偏向信号通路。
PAR与肠道疾病发病机制相关
PAR 在胃肠道(上皮细胞、神经元、肥大细胞、成纤维细胞等)中普遍表达,并在被蛋白酶激活后介导广泛的促炎、伤害感受和增殖作用。PARs与结直肠癌、炎症和功能性肠道疾病的发病机制有关。
溃疡性结肠炎患者结肠组织中 PAR-2的不同的微生物蛋白酶已被提议作为活化剂 PAR。
相关的,来自铜绿假单胞菌,粪肠球菌的GelE降解 PAR-2 的 N 末端,导致临床前小鼠模型中的食物敏感性和肠道炎症。然而,微生物蛋白酶在胃肠道疾病中激活PARs的全部意义仍有待解决。
蛋白酶还能够刺激或减少关键宿主免疫介质的产生
例如细胞因子或免疫球蛋白 (Ig)。细胞因子的产生是一个受到严格监管的动态事件。
其动力学紊乱会在宿主中引起加剧的反应,因为它们参与细胞内信号的多个级联。
例如,牙龈卟啉单胞菌中的牙龈蛋白酶-R 对人中性粒细胞上的 PAR-2 进行切割和激活会诱导促炎细胞因子的释放,例如白细胞介素 (IL)-6、IL-8 和肿瘤坏死因子 (TNF)-α。
细胞因子也可以被细菌蛋白酶降解
以前的报道表明,来自铜绿假单胞菌可以降解 IL-2 和干扰素 (INF)-γ。
来自嗜肺军团菌的锌金属蛋白酶也具有降解 IL-2 的能力。同样,牙龈蛋白酶,一种由牙龈卟啉单胞菌产生的胰蛋白酶样半胱氨酸蛋白酶,可以切割 IL-1β、IL-6 和 IL-1ra。
其他基于蛋白质的介质(例如免疫球蛋白)也可以观察到相同的现象。Ig 是由浆细胞产生的糖蛋白,它通过特异性识别特定抗原在适应性免疫反应中发挥重要作用。除了微生物群在宿主体内刺激不同 Ig 亚型的能力外,微生物还可以降解 Ig 帮助免疫系统逃避。许多感染粘膜表面的病原体编码可切割免疫球蛋白的蛋白酶,例如脑膜炎奈瑟菌、淋病奈瑟菌或肺炎链球菌。
肠道微生物群可以降解 IgA
IgA 在粘膜免疫学中起着关键作用,并且记录到分泌性 IgA 降解的小鼠更容易患化学诱导的结肠炎。胰蛋白酶等宿主蛋白酶能够降解 IgA,而Paraprevotella(普雷沃氏菌)可防止其在肠道中降解。
扩展阅读:对抗病原菌,帮助共生菌定植的“重要开关”
大多数研究都侧重于了解细菌外毒素与免疫系统在预防疾病方面的相互作用。然而,要了解共生体释放的蛋白酶是否分别促进或中和抗炎和促炎介质的产生,还有很多工作要做。
在过去的二十年里,宿主来源的蛋白酶对 PAR 的激活与腹痛有关。PARs 的激动剂激发支配胃肠道的脊髓传入神经元。
PAR-2 激活——伤害感受器激活
来自 IBS 患者的活检上清液也被证明可以通过 PAR-2 激活来激发脊髓传入神经元。这些兴奋效应归因于瞬时受体电位 (TRP) 通道的敏化,包括 TRPV1、TRPV4 和 TRPA1 以及电压门控 K+通道的抑制。
结肠炎模型也有证据表明 PAR-2 激活会导致伤害感受器过度兴奋。
PAR-4 的激活——抑制伤害感受器兴奋
重要的是,在啮齿动物中,PAR-4 的激活对伤害感受器的激活与 PAR-2 的激活具有相反的作用。PAR-4激活在体外和体内抑制结肠伤害感受器的兴奋性。
细菌蛋白酶在调节腹痛中的作用
IBD 或 IBS 患者的粪便上清液进行的体内实验首次提出了细菌蛋白酶在调节腹痛中的作用。通过量化对结肠直肠扩张的内脏运动反应来测量大鼠和小鼠的腹痛敏感性。来自 IBS-D 和 IBS-C 患者的粪便上清液的结肠内给药增加了对扩张的内脏运动反应,有异常性疼痛和痛觉过敏的证据。
相比之下,溃疡性结肠炎患者的粪便上清液具有相反的效果,以 PAR-4 依赖性方式降低内脏运动反应。
因此,粪便蛋白酶似乎可以加剧或抑制啮齿动物的腹痛,这取决于发生的 PAR-2 或 PAR-4 激活的相对量。
粪便蛋白酶的作用位点与疼痛调节相关
PARs 在肠壁内的许多细胞上表达,包括脊髓传入神经元和肠细胞。
基于对 IBS-C 患者粪便蛋白酶的研究,腹痛的加重似乎不是由于蛋白酶对神经元 PAR 的直接兴奋作用。相反,将 IBS-C 粪便上清液中的半胱氨酸蛋白酶结肠内给药给小鼠,会增加结肠通透性并导致闭塞降解,进而导致内脏疼痛增加。
与来自健康对照的活检相比,来自 IBS-C 患者的粘膜活检也显示出上皮 occludin 降解的证据。
然而,由于本研究未评估粪便蛋白酶对神经元激活的作用,因此对肠道 neu 伤害感受器神经末梢的直接影响仍然可能导致内脏痛,因为粘膜屏障完整性的降低会促进管腔进入脊髓传入神经末梢的蛋白酶。
普拉梭菌的抗伤害感受作用
随后的研究已将Faecalibacterium prausnitzii(普拉梭菌)鉴定为抗伤害性介质的潜在来源,包括 PAR-4 激活丝氨酸蛋白酶。使用导致体内内脏痛觉过敏的两种成熟的 IBS 啮齿动物模型,发现在给予F. prausnitzii后,增强的内脏运动对结直肠扩张的反应被逆转。
这些镇痛作用是由于粘膜通透性增加的逆转,这是这些 IBS 模型的一个特征。背根神经节神经元的体外F. prausnitzii的抗伤害感受作用。
来自F. prausnitzii培养物的培养基上清液直接作用于 DRG 神经元,以抑制它们由于电压门控 K+电导增加而引起的兴奋性。这是激活神经元 PAR-4 的组织蛋白酶 G 样丝氨酸蛋白酶的结果。
扩展阅读:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
总之,PAR 激活能够抑制或加重腹痛,这取决于哪种蛋白酶占主导地位以及它们激活了哪些受体。对腹痛患者样本的研究表明,宿主和细菌蛋白酶都可能导致疼痛。鉴于与腹痛相关的疾病(包括 IBD 和 IBS)中管腔蛋白水解失衡的证据,未来旨在进一步描绘这些蛋白酶的细菌来源和细胞靶标的研究将很有价值。
这些见解可能会导致下一代益生菌的开发,这些益生菌通过将 PAR 激活的平衡转移到屏障恢复和伤害感受器抑制作用来抑制腹痛。
近年来,共生菌释放的蛋白酶对胃肠道疾病的影响越来越受到关注。很明显,蛋白酶、它们的宿主靶标和蛋白酶抑制剂之间的复杂平衡维持了肠道的功能和完整性。这种平衡的失调对肠道健康有直接影响,其严重后果会导致病理生理状况。
此外,许多致病菌利用蛋白酶定殖宿主组织并引起疾病。随着蛋白酶活性与疾病之间因果关系的确定,以及对细菌蛋白酶如何促进或预防疾病的机制的深入了解,可能会带来治疗常见胃肠道疾病和感染的新机会。
主要参考文献:
Mills, R.H., Dulai, P.S., Vázquez-Baeza, Y. et al. Multi-omics analyses of the ulcerative colitis gut microbiome link Bacteroides vulgatus proteases with disease severity. Nat Microbiol (2022).
Mariaule V, Kriaa A, Soussou S, Rhimi S, Boudaya H, Hernandez J, Maguin E, Lesner A, Rhimi M. Digestive Inflammation: Role of Proteolytic Dysregulation. Int J Mol Sci. 2021 Mar 10;22(6):2817.
Mills RH, Dulai PS, Vázquez-Baeza Y, Sauceda C, Daniel N, Gerner RR, Batachari LE, Malfavon M, Zhu Q, Weldon K, Humphrey G, Carrillo-Terrazas M, Goldasich LD, Bryant M, Raffatellu M, Quinn RA, Gewirtz AT, Chassaing B, Chu H, Sandborn WJ, Dorrestein PC, Knight R, Gonzalez DJ. Multi-omics analyses of the ulcerative colitis gut microbiome link Bacteroides vulgatus proteases with disease severity. Nat Microbiol. 2022 Feb;7(2):262-276.
Carroll IM, Maharshak N. Enteric bacterial proteases in inflammatory bowel disease- pathophysiology and clinical implications.

谷禾健康
幽门螺杆菌(helicobacterpylori,H.pylori)是一种独特的,能持续定植于人类胃粘膜并能引起胃感染的细菌。
幽门螺杆菌是革兰氏阴性,螺旋形,微需氧细菌,定居于人类胃粘膜中。世界上有超过一半的人感染了幽门螺杆菌,但很多没有临床症状。幽门螺杆菌及其患病率在某些人群中高达80%。
据推测,幽门螺杆菌可能是人类土著微生物组的一部分,它与人类宿主之间有着很复杂的关系。
本文主要讨论幽门螺杆菌是如何与人类共同进化的,可能的机制可以解释基于人群的研究中幽门螺杆菌感染与几种疾病的发展之间的正相关性和负相关性,以及炎症和/或微生物组的变化是如何联系的各自的结果。
大多数幽门螺杆菌感染者并没有明显症状,但当症状出现时,一般是以下几种:
恶心,胃痛或胃灼热,空腹时腹部疼痛加剧。
怎样的情况有可能感染此菌?
幽门螺杆菌可能通过接触感染者的唾液、呕吐物或粪便传播,食用受污染的食物或水也会感染。
大多数感染幽门螺杆菌的人都是在儿童时期感染的。
有些因素可能会增加感染幽门螺杆菌的风险:
比如在拥挤的空间生活,没有干净的水,和患有幽门螺杆菌的人一起生活等。
什么情况下需要看医生?
当感觉有不寻常的胃痛或不适时,尤其是持续或反复发作的胃痛;
吞咽困难;
血腥,黑色或柏油样的粪便;
呕吐物带血或看起来像咖啡渣;
…
以上情况,最好去看医生。
( 如自行随意服用抗生素,效果不好的同时很可能带来抗生素耐药 )
如何诊断幽门螺杆菌?
目前最常见也实惠的方法是呼气检测,从分析到出结果只需数分钟,简单准确。
胃镜检查:做胃镜检查也包括幽门螺杆菌检测,因为可以取到胃里活性组织做病理切片检查。
抗体检查:通过抽血检查,以确定是否感染过幽门螺杆菌以及目前处于感染状态。
幽门螺杆菌会导致并发症?
包括溃疡,胃炎和胃癌。
溃疡约有10%的幽门螺杆菌患者会发展为胃溃疡(疼痛)。当幽门螺杆菌破坏保护胃和小肠内壁的粘膜时,就会发生这种情况,胃酸会渗透到衬里并造成伤害。
幽门螺杆菌可导致90%以上的肠道溃疡和80%的胃溃疡。
溃疡本身也会导致严重的并发症:
• 内部出血胃酸或溃疡渗入血管可能导致出血。
•阻塞溃疡会阻止食物离开您的胃。
•穿孔溃疡可能会深入并穿透胃或肠壁。
•腹膜炎 当溃疡引起感染或发炎时,可能发生腹膜炎症(腹膜)。
胃炎胃炎是胃黏膜炎症。幽门螺杆菌是处于患有这种病症的风险增加。
如果不治疗胃炎,可能会导致严重失血,并可能增加患胃癌的风险。胃癌是世界上与癌症相关的死亡的第二大最常见原因。
此外,幽门螺杆菌感染还与其他疾病有关,例如缺血性心脏病,2型糖尿病,贫血,肥胖受试者的不良代谢特征和胰岛素抵抗等。
幽门螺杆菌(Hp)感染会在胃微环境中产生剧烈变化,进而影响胃微生物群组成,并可能与肠道微生物群变化有关。可能会触发肠道共生稳态的重大改变,从而出现新的胃肠道平衡。
同时,用于根除幽门螺杆菌的治疗策略可以调节这种生理共生,但也可能相反,受到其特性的影响。感染,饮食,抗生素和/或生活方式会干扰这种共生关系。
幽门螺杆菌感染对胃微生物群的干扰
下一代测序对胃液和活检标本中的人体胃微生物群进行了研究,结果表明胃中存在多种细菌类群,主要由五个门组成,包括放线菌门、拟杆菌门、厚壁菌门、梭菌门和变形菌门。幽门螺杆菌感染极大地改变了胃微生物群的特征。
一项初步研究报道,幽门螺杆菌定植改变了胃微生物群,降低了微生物多样性,根除幽门螺杆菌可以恢复微生物多样性。
幽门螺杆菌可以利用几种机制来调节胃微环境。通过干扰质子泵的表达,幽门螺杆菌可以调节胃腔的酸度,从而使微环境与通常不能在胃中生长的微生物相容。
评估幽门螺杆菌感染对胃微生物群影响的研究
Tao et al., Helicobacter, 2020
此外,由于幽门螺杆菌的存在而改变的免疫反应可能会影响其他微生物群。幽门螺杆菌还可能通过动员抗菌肽或通过营养竞争来改变其他微生物群的生长。一般来说,研究人员表明,幽门螺杆菌的定植与α多样性的显著降低有关。微生物多样性和幽门螺杆菌丰度之间存在反比关系。
幽门螺杆菌感染对肠道微生物群的影响
与幽门螺杆菌阴性对照组相比,胃内有大量幽门螺杆菌的个体具有不同的肠道菌群,这表明胃肠段之间存在相互作用。
大多数研究表明,幽门螺杆菌感染与肠道微生物多样性之间的呈正相关。由于较高的微生物多样性通常与总体较好的健康状况有关,因此,探讨幽门螺杆菌感染后肠道微生物多样性的增加是否对宿主有一些有益的影响将是一个有趣的问题。
幽门螺杆菌感染对肠道微生物群影响的研究分析
Tao et al., Helicobacter, 2020
幽门螺杆菌感染组和阴性对照组的微生物群落结构存在显著差异。
在门水平上的成分分析发现,受感染个体中变形菌的丰度显著增加,这可能是由于幽门螺杆菌从胃转移到肠腔所致。值得注意的是,拟杆菌与厚壁菌(B:F)的比率在幽门螺杆菌阳性组中更高。改变的B:F比值与临床相关,因为发现厚壁菌和拟杆菌与宿主的脂质代谢和能量平衡有关。
受感染与没感染组相比,双歧杆菌、乳酸杆菌和嗜粘液阿克曼菌的丰度没有显著差异。其他研究人员发现,幽门螺杆菌感染者体内乳酸杆菌的丰度更高。
一项研究发现,在幽门螺杆菌感染的患者中,萎缩性胃炎患者的肠道微生物群中链球菌更为丰富。
另一项研究发现,幽门螺杆菌感染的个体表现出短链脂肪酸(SCFA)产生者(如丁酸盐)水平的下降,SCFA对宿主产生有益的代谢作用。
此外,鉴于SCFAs受体在免疫细胞中的普遍表达,这些代谢物被认为在调节肠道内稳态中发挥重要作用。因此,幽门螺杆菌感染时抑制SCFAs的输出可能对人类健康有害。
有功能分析指出,在幽门螺杆菌阴性人群中,疾病相关途径更活跃。相比之下,许多代谢途径在感染的患者中的比例过高。因此,微生物群中的功能变化可能是特定于部位的,因为在肠道中观察到的变化与在胃中观察到的变化呈现不同的趋势。
根除疗法对胃微生物群的影响
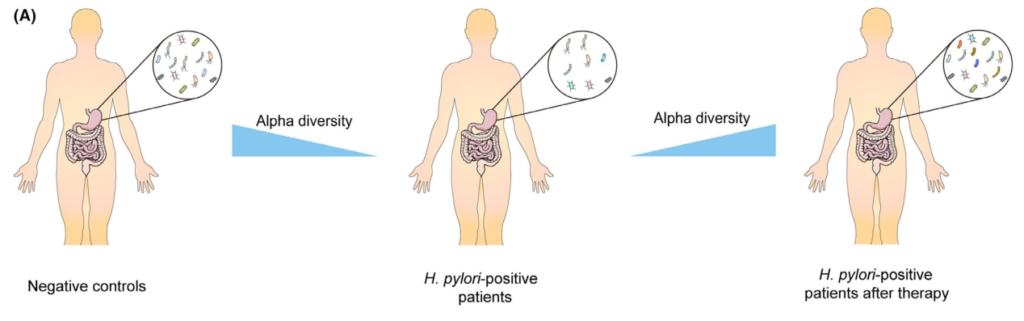
Tao et al., Helicobacter, 2020
充分的证据表明,成功清除幽门螺杆菌后,胃微生物多样性显著增加,但显示治疗失败后没有改善。研究人员认为恢复可能需要一定的时间,因为他们认为多样性从第0周到第6周和第26周逐渐增加。
此外,研究表明,成功根除幽门螺杆菌后,α多样性可以完全恢复到未感染对照组的水平。相反,尽管在清除幽门螺杆菌后,群落结构也可以部分恢复,但对于是否仍存在显著差异存在争议在根除后组和阴性对照组之间。
一些研究人员发现,接受抗幽门螺杆菌治疗的患者在治疗2个月后,胃微生物群落的组成恢复到未感染儿童的水平,然而,其他研究确定,成功治疗6个月后的成人样本仍显示出不同的菌群结构,阴性对照组则不同。
纳入分析的不同年龄组可能解释了相反的结论,因为另一项招募儿童的研究也发现根除组的菌群结构在治疗4周后与幽门螺杆菌阴性组的菌群结构接近。
根除治疗后评估胃微生物群变化的研究

Tao et al., Helicobacter, 2020
成分分析揭示了幽门螺杆菌的相对丰度治疗后幽门螺杆菌显著下降,而其他主要菌门,包括放线杆菌、拟杆菌、厚壁菌和梭杆菌,则增加。
在属水平上,治疗后乳酸杆菌和双歧杆菌(两种公认的益生菌)的数量显著增加。
两项研究的功能分析表明,成功治疗后,蛋白质和碳水化合物代谢途径上调。因此幽门螺杆菌感染期间,胃微生物群营养代谢功能受损,根除治疗可部分恢复。然而,预测的功能改变还需要进一步的验证。
根除治疗后肠道微生物群的变化
通过降低酸度,质子泵抑制剂(PPIs)已被证明对肠道微生物群产生显著影响。因此,抗幽门螺杆菌治疗对肠道微生物群的影响是PPIs、抗生素、铋联合应用的共同结果。总的趋势是,α多样性在根除后立即下降,随后又恢复。
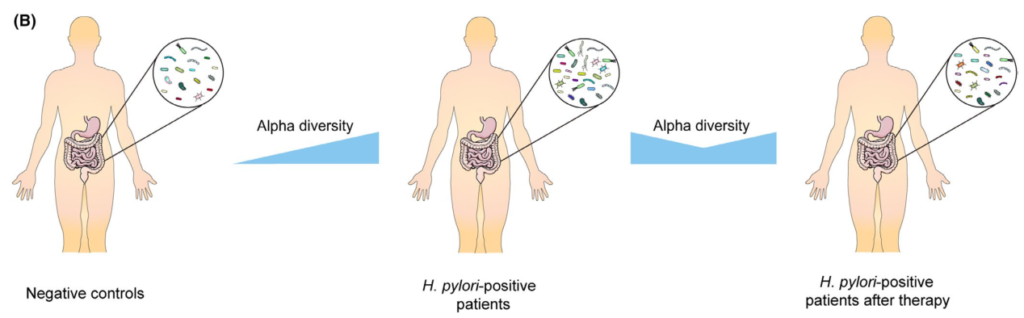

Tao et al., Helicobacter, 2020
具体来说,恢复需要多长时间仍有待阐明。大多数研究收集了随访2个月内的信息显示α多样性降低,而此后报告与基线无显著差异。
然而,一项研究报告,从第0周到第6周和第26周,Sobs指数和Chao指数都在下降没有达到统计学意义。值得注意的是,另一项研究发现,不同的治疗方案对肠道微生物群的影响可能不同。
在临床试验中,三种不同的治疗方案,包括三联疗法、联合疗法和铋四联疗法。结果表明,所有组的α多样性在第2周时都有所下降,但只有接受三联疗法的患者在第8周时才具有基本α多样性,而其他两组的α多样性在治疗后1年也无法恢复。
希望将来的研究验证根除疗法是否会导致肠道菌群的持续紊乱,以及不同的治疗方案如何影响可逆性。
分析根除疗法对肠道微生物群影响的研究

Tao et al., Helicobacter, 2020
益生菌的补充可以缓解抗生素引起的多样性和结构紊乱
益生菌,已被证明可稳定微生物群并改善胃肠道症状。在门水平上,治疗6个月后观察到厚壁菌群增加和拟杆菌减少,表明在幽门螺杆菌感染的个体中观察到的高B:F比率逆转。在另一项研究中报告了9个类似的结果。
临床证据支持肥胖与B:F比率降低相关。因此,这些研究中检测到的B:F比率降低可能为根除治疗后体重增加提供了一种可能的解释。然而,一些研究人员说明,在根除18个月后,降低的B:F比率可以逆转。有趣的是,益生菌补充被证明与根除治疗后较高的B:F比率相关。值得注意的是,报告的结果不一致。
一项研究表明,治疗后B:F比率立即增加,并在第13周保持高于基线水平。宏基因组研究的分类图谱显示,治疗后双歧杆菌的相对丰度下降。然而,另一项研究表明,双歧杆菌在成功根除6个月后增加。
在幽门螺杆菌阳性萎缩性胃炎的肠道微生物群中富集的链球菌在根除治疗后显著减少。
尽管不同研究中肠道微生物群的长期变化不同,但根除引起肠道内稳态的短期紊乱似乎是一致的。
根除疗法对肠道菌群抗生素耐药性的影响
随着根除疗法的广泛应用,抗生素耐药性的出现已成为临床实践中的一个重要问题。
根除幽门螺杆菌感染后,抗生素耐药性的上升以及根除治疗后的长期安全性是重要的问题。
通过药敏试验指导的个性化治疗可以在一线治疗中提供可靠的优异根除率,但贵且无法广泛获得。根据局部地区的抗生素耐药性,针对特定人群的经验疗法可能是一种替代策略。
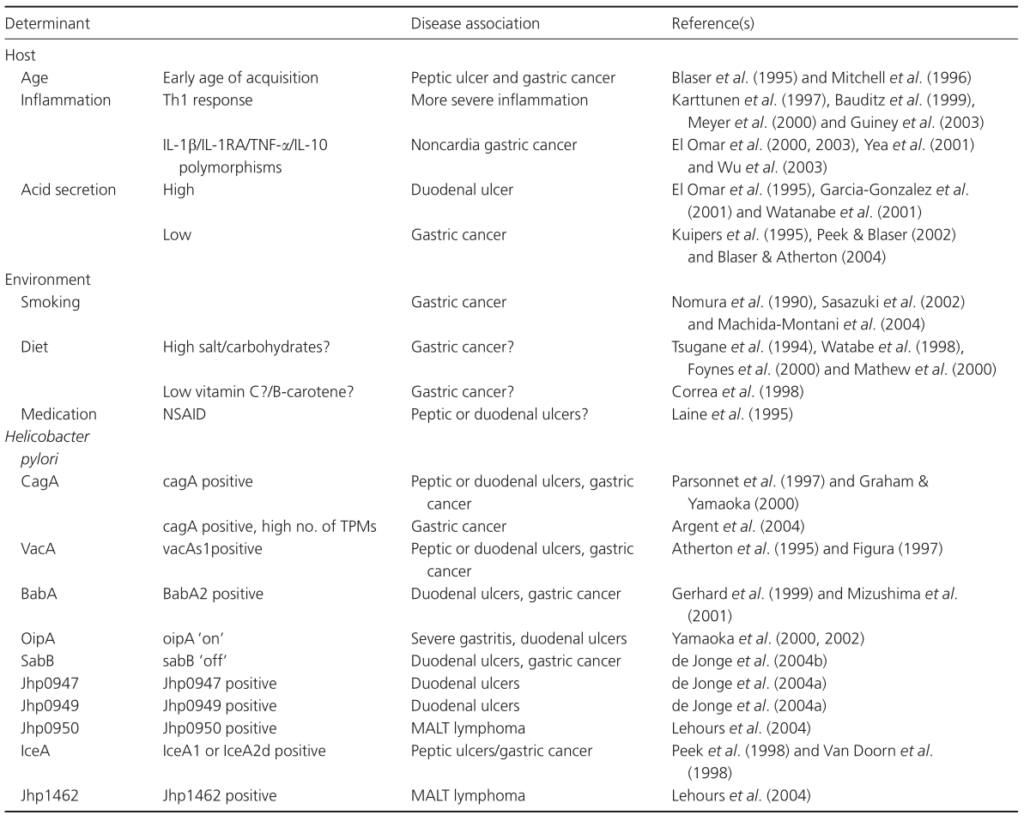
已证明会改变幽门螺杆菌相关疾病风险的宿主因素包括宿主的年龄、在幽门螺杆菌的获得和幽门螺杆菌感染之间的持续时间,但更重要的是宿主免疫介质(多态性)和酸分泌状态。
除宿主因素外,吸烟和饮食等环境因素还会影响幽门螺杆菌定植的生态位,因此可能会影响疾病风险。

Karin et al., FEMS Microbiol Rev. 2006
在年幼时期感染幽门螺杆菌会增加患胃溃疡和胃癌的风险。 胃溃疡和胃癌的发展需要幽门螺杆菌的长期感染,因此,推测这些疾病是在慢性感染幽门螺杆菌的患者中更为常见。
此外,这种关联被认为是由不同年龄组的宿主免疫反应的差异所决定的。
感染幽门螺杆菌后,宿主胃上皮细胞释放细胞因子IL-8。这种细胞因子参与了巨噬细胞、中性粒细胞、肥大细胞、B细胞和T细胞募集到炎症部位。这些细胞通过分泌其他炎症介质,如干扰素(IFN-g)、肿瘤坏死因子(TNF-a)和白细胞介素(IL-1b),进一步增强免疫反应。
幽门螺杆菌相关发病机制的示意图

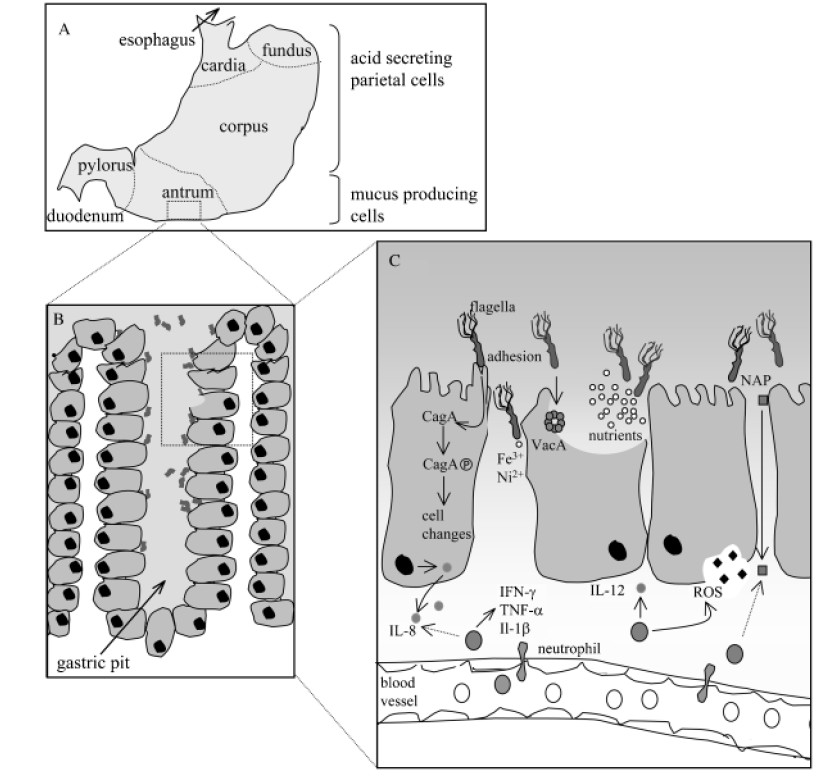
Karin et al., FEMS Microbiol Rev. 2006
A)在人类胃中,幽门螺杆菌主要定植于缺乏胃酸分泌壁细胞的胃窦中;
B)在胃小凹中,幽门螺杆菌尤其在上皮细胞紧密连接处附近增殖;
C)幽门螺杆菌对定植、持续和疾病发展具有重要作用的因子。
针对幽门螺杆菌的免疫反应进一步表现为活化的人类中性粒细胞中的氧化爆发。这种爆发会导致活性氧(ROS)的释放,活性氧是一种低分子量的代谢物,可破坏包括核酸在内的重要生物分。ROS可能损伤控制细胞生长的基因;并刺激癌症的发展。因此,免疫介质的存在会导致胃上皮的完整性受损。这种损伤是引起大多数与幽门螺杆菌感染相关的病理学,而不是直接的幽门螺杆菌活动。
幽门螺杆菌感染期间存在的免疫细胞主要是促炎细胞,而不是抗炎细胞。促炎介质由辅助性T细胞1(Th1)分泌。原始T细胞受多种因素驱动分化为Th1细胞,如TNF-a和IL-12。
在幽门螺杆菌刺激下,单核细胞大量产生细胞因子IL-12。因此,通过刺激IL-12的释放,幽门螺杆菌增强了促炎反应。这导致更多的损伤胃上皮,这容易发展胃萎缩。
一些编码免疫调节因子的宿主基因含有多态区域。这些基因的多态性将改变它们的转录,从而影响炎症过程。因此,幽门螺杆菌相关疾病的风险可能会改变。到目前为止,IL-1b、IL-1受体拮抗剂、IL-10和TNF-a基因的多态性已被证明与远端胃癌显著相关。
人类白细胞抗原(HLA)通过将病原体衍生的肽片段呈递给适当的T细胞,有助于消除病原体。HLA基因具有高度多态性,某些HLA等位基因与胃腺癌的发生有关。幽门螺杆菌感染也与胃腺癌的发生有关,但其存在与这些HLA等位基因的存在无关。因此,HLA等位基因在幽门螺杆菌介导的腺癌中的重要性仍然存在争议。
因此,遗传上预定的显性促炎性Th1反应与幽门螺旋杆菌疾病相关。
另一方面,Th1反应的强度可能受到抗炎Th2细胞因子IL10的产生的限制,从而延长感染时间。Th2型反应是由寄生虫引起的。因此,感染幽门螺杆菌的人的炎症反应和病理改变逐渐减弱。这可能导致这些个体慢性胃炎进展为胃癌的时间延迟。另外,不同的促炎反应可能直接导致幽门螺杆菌相关病理学的不同途径。
前面提到Th1反应导致胃壁细胞抑制其酸分泌。酸性较低的环境可能促进幽门螺杆菌的传播和持续。此外,当胃酸水平较低时,幽门螺杆菌以外的微生物可能在人体胃中生长,从而增强局部炎症反应。促炎细胞因子和胃酸分泌减少的联合作用增加了患消化性溃疡病和胃癌的风险。
另一方面,当酸的分泌减少时,十二指肠溃疡就不太可能发生。当酸的分泌增强时,十二指肠溃疡发生的风险增加。然而,同样在低酸性条件下,幽门螺杆菌感染后十二指肠溃疡的风险可能会增加。
胃壁细胞控制其产酸的能力在幽门螺杆菌相关疾病的发展中是重要的。幽门螺杆菌感染主要发生在人类胃中酸性较弱的部位,如胃窦。因此,胃酸分泌量高的宿主胃窦内幽门螺杆菌密度高,且主要发展为胃窦性胃炎。随后,胃体中完整的壁细胞被刺激分泌酸,从而诱导十二指肠的胃化生。幽门螺杆菌定植于这种胃化生,这可能导致十二指肠溃疡。
另一方面,胃酸分泌量低的宿主不仅胃窦易受幽门螺杆菌感染,而且胃体也易受幽门螺杆菌感染。感染的幽门螺杆菌可进一步抑制胃壁细胞的酸分泌。这可刺激胃上皮细胞持续增殖,导致胃腺进行性丧失,最终导致胃萎缩和癌症。
吸烟
一些环境因素与幽门螺杆菌相关的发病机制有关。吸烟是胃癌发展的主要因素。烟草烟雾含有致癌的亚硝胺,引发癌症的发展。
高盐饮食
一些饮食因素与幽门螺杆菌疾病有关。高盐饮食与幽门菌定植率、胃炎和胃癌风险增加。高盐浓度导致壁细胞萎缩,粘膜屏障破坏。然而,只有长期高盐摄入才会增加幽门螺杆菌相关疾病的风险。
高米饭摄入量
高米饭摄入量与胃癌之间存在正相关关系。米饭含有碳水化合物,可能会刺激胃粘膜。
水果和蔬菜摄入量低
水果和蔬菜摄入量低可能会增加胃癌的风险。水果和蔬菜含有抗氧化剂维生素C和β-胡萝卜素,通过中和活性氧来防止致癌。
因此,尽管有几个环境因素被认为与幽门螺杆菌相关疾病的发生有关,但它们的作用往往是有争议的。据推测,不同环境因素以及宿主和细菌因素之间的复杂相互作用妨碍了对研究结果的解释。
幽门螺杆菌因素在疾病发展中的总体影响是复杂的。到目前为止,已经描述了几种与幽门螺杆菌相关疾病的发生有关的幽门螺杆菌特异性蛋白。这些蛋白质被认为是导致幽门螺杆菌持续存在的原因。作为副作用,这些幽门螺杆菌蛋白诱导和改变炎症过程,损伤胃上皮,从而决定幽门螺杆菌感染后的结局。
CagA
与感染cagA阴性幽门螺杆菌分离株的患者相比,携带细胞毒素相关基因A(cagA)的幽门螺杆菌分离株的定植与严重胃炎、消化性溃疡病和远端胃腺癌的风险增加有关。
幽门螺杆菌cagA基因的存在或不存在经常被用作幽门螺杆菌中致病岛(PAI)存在或不存在的标记。 cag PAI由大约30个基因组成,并且在所有幽门螺杆菌分离株中占50%–70%。 位于cag PAI侧翼的两个31 bp重复序列之间的重组可能导致整个cag区域的缺失或获得。
cag PAI上的18个基因对于产生IV型分泌系统至关重要。 IV型分泌系统将细菌细胞中的蛋白(与毒力相关)转运到宿主细胞的胞质溶胶中。 这通常导致上皮细胞反应的级联反应的启动,例如细胞骨架的变化和细胞因子IL-8的分泌。
在幽门螺杆菌中,IV型分泌系统的成分将CagA蛋白转运到胃上皮细胞中。 随后,CagA蛋白被磷酸化。 然后,这种磷酸化的CagA与宿主磷酸酶SHP-2相互作用,引起细胞骨架的重排。 这导致宿主细胞形态发生变化,也称为“蜂鸟”表型。该表型的特征在于细胞扩散,上皮细胞的延长生长以及片状脂蛋白和丝状伪足的存在。
作为抵消事件,磷酸化的CagA与宿主Src激酶相互作用,从而减弱宿主SHP-2磷酸酶的信号传导。 这个过程减少了细胞骨架的重排,并阻止了CagA的进一步磷酸化。
最近,已经证明幽门螺杆菌菌株在体内诱导较高水平的CagA磷酸化。上皮细胞诱导更多的细胞骨架变化,并且更可能与胃癌有关。CagA磷酸化水平的差异是由cagA基因的30个区域内酪氨酸磷酸化基序(TPM)数量的差异引起的。
幽门螺杆菌人群,需要最低限度的免疫识别。因此,在萎缩的生态位中,这些TPM数量减少的亚克隆诱导了较弱的宿主免疫反应。
另一方面,较高水平的CagA磷酸化可引起强烈的炎症反应。 这种炎症会导致萎缩,并可能在限制高酸输出的生态位酸应激中发挥作用。
通过观察发现,缺乏cagA基因的幽门螺杆菌菌株是从消化性溃疡或胃癌患者中分离出来的,尽管其频率比cagA阳性幽门螺杆菌菌株的频率更低。
cagA和幽门螺杆菌相关疾病之间的关联在不同的地理区域中有所不同。 这种变异可能与CagA表达的差异有关。
然而,CagA并不是唯一的。幽门螺杆菌蛋白负责屏障功能障碍,而这一过程并没有随着CagA的清除而丢失。下一节讨论的VacA蛋白也很重要。
VacA
最初显示真核细胞在带有幽门螺杆菌的体外测试系统中经历空泡化和连续变性。 后来证明这种现象是由幽门螺杆菌毒素诱导的,现在被称为空泡细胞毒素A(VacA)。
VacA或CagA不能单独用作临床结果的决定因素。
VacA如何发挥作用,导致细胞死亡?
幽门螺杆菌VacA是一种高度免疫原性的95-kDa蛋白。VacA结合上皮细胞的顶端部分,形成阴离子选择性孔。
通过这些孔,碳酸氢盐,氯化物和尿素从细胞质中释放出来,然后,VacA被内吞进入晚期的内体区室,并改变这些区室的通透性。
在弱碱(例如氨)的存在下,这会导致水涌入,从而导致囊泡肿胀和液泡形成。 细胞内内吞途径的损伤最终导致细胞死亡。
这导致了上皮细胞抗性的降低,因此低分子量分子如Fe3+和Ni2+可以很容易地穿过上皮细胞层。Fe3+和Ni2+分子分别是幽门螺杆菌生长和脲酶活性的关键因子。
因此,推测通过降解上皮细胞屏障,幽门螺杆菌可以更容易地获得这些关键因子。
幽门螺杆菌VacA也与壁细胞的降解有关,这导致酸分泌减少,使宿主容易患上胃癌。 持续感染过程中VacA表达水平的差异导致毒性改变。 因此,溃疡的消长可以通过随时间变化的VacA表达变化来解释。
在体外在胃上皮细胞附近诱导vacA基因的转录。 这一发现证实了VacA与宿主细胞相互作用的重要性。 此外,VacA可以逃避适应性免疫反应,从而增强幽门螺杆菌在胃粘液层中的持久性。
幽门螺杆菌外膜蛋白(HOPs)
在革兰氏阴性细菌中,外膜介导与其周围环境的相互作用。 在感染期间,假定存在于幽门螺杆菌外膜上的蛋白质被改变,使得宿主免疫系统的识别作用降至最低。
幽门螺杆菌分离物含有约30种不同的外膜蛋白(HOP)。 其中几种是粘附素。 在革兰氏阴性细菌中,粘附素最常形成聚合菌毛结构。 但是,在幽门螺杆菌中,这些粘附素已经适应了胃环境,其中酸性条件可能会使这种聚合物菌毛结构解聚。
岩藻糖基化的糖蛋白和唾液酸化的糖脂都已被证明是胃上皮中幽门螺杆菌的结合位点。
与宿主细胞的粘附可保护幽门螺杆菌免受蠕动和粘膜脱落。
此外,推测粘附力可以使幽门螺杆菌更好地获取从胃上皮释放的营养物质,并更有效地将细菌毒素传递至宿主细胞。
另一方面,在剧烈炎症的部位,粘附特性的丧失可能使幽门螺杆菌逃脱宿主免疫细胞的杀伤。目前为止,一些HOP与疾病的发展有关。
幽门螺杆菌BabA (HopS)介导幽门螺杆菌粘附于人Leb血型抗原,这些抗原存在于胃上皮细胞上。BabA黏附促进幽门螺杆菌定植,增加上皮细胞分泌IL-8,导致粘膜炎症增强。
BabA调节的两种机制都有助于促进慢性感染的动态反应。
在慢性炎症期间,选择增加或减少粘附的周期可在所有血型的人群中获得所有类型的Leb结合。
宿主粘膜糖基化模式导致BabA进化,使幽门螺杆菌菌株适应其个体宿主,这有助于避免宿主反应,并在全世界范围内造成幽门螺杆菌感染的异常长期性。
幽门螺杆菌可塑性区域毒力因子
两个单独菌株基因组序列的比较表明,一个菌株中存在的幽门螺杆菌基因中约有6%-7%不存在于另一个菌株中,反之亦然。
大约一半的菌株特异性基因存在于高变区;可塑性区。 位于这种可塑性区域的基因通常与毒力增加相关。
在幽门螺杆菌中,可塑性区确实编码了与IV型分泌有关的Vir型ATP酶。 在幽门螺杆菌中,该分泌系统在例如分泌CagA细胞毒素中很重要。目前为止,一些位于可塑性区的幽门螺杆菌基因与幽门螺杆菌相关的疾病有关。
幽门螺杆菌Jhp0947和Jhp0949与十二指肠溃疡疾病相关。这两个基因均位于幽门螺杆菌菌株J99可塑性区,在幽门螺杆菌介导的IL-12释放中很重要。
在体外测试系统中从单核细胞中提取。 细胞因子IL-12对于使免疫反应偏向促炎性Th1应答是必不可少的,并且与十二指肠溃疡的形成密切相关。
由jhp0947和jhp0949编码的蛋白质的功能未知。 然而,已经假设这些蛋白通过与单核细胞的相互作用诱导促炎细胞因子IL-12的产生。
IL-12水平升高会导致幼稚T细胞分化为活化的Th1细胞,从而导致炎症反应增强和组织损伤增加。
幽门螺杆菌Jhp0950,编码一种未知功能的蛋白质,也是J99可塑性区的一部分。该基因的存在与cagA、cagE、vacA s1m1、babA2、hopQ T1、oipA有关。
在幽门螺杆菌J99基因组中,Jhp0950与Jhp0949相邻。与Jhp0949不同,Jhp0950与十二指肠溃疡风险增加无关。然而,它与疾病的关联支持了位于可塑性区域的幽门螺杆菌基因可能与毒性相关的观点。
其他幽门螺杆菌毒力因子
在美国和荷兰,幽门螺杆菌iceA1基因(iceA基因的两个等位基因变体之一)在幽门螺杆菌感染的消化性溃疡患者中比仅在幽门螺杆菌感染的胃炎患者中更为普遍。
与许多其他与毒力相关的基因相似,IceA表达与幽门螺杆菌相关疾病之间的联系是群体依赖性的。
在东南亚,未发现iceA1与幽门螺杆菌相关疾病之间的关联。 有趣的是,对iceA1呈阳性的南非幽门螺杆菌分离株在幽门螺杆菌感染的胃癌患者中比仅在幽门螺杆菌感染的胃炎患者中更普遍。
注:幽门螺杆菌iceA1最初是在与胃上皮细胞接触后转录上调后被鉴定的,iceA1基因编码的核酸内切酶与乳球菌中的限制性核酸内切酶NlaIIIR非常相似,伴随的高度保守的脱氧核糖核酸腺嘌呤甲基转移酶的活性,由幽门螺杆菌编码,似乎与控制幽门螺杆菌的基因表达有关。
幽门螺杆菌Jhp1462与MAL T淋巴瘤、十二指肠溃疡和胃腺癌的风险增加相关。由Jhp1462编码的蛋白质的功能是未知的,其在严重胃十二指肠疾病发展中的重要性仍有待阐明。
以上,我们看到幽门螺杆菌通过各种方式给人体带来种种不利影响,它似乎不应该在人体中长期生存,然而,幽门螺杆菌在人体内存在有着的悠久的历史,那么幽门螺杆菌是如何保护自己在人体中安稳生存下来?
幽门螺杆菌在疾病发生之前会长期感染人胃粘膜。 因此,导致幽门螺杆菌定植和持续存在的因素与幽门螺杆菌相关的发病机理具有内在联系。 在胃腔进入后,幽门螺杆菌必须应付胃酸。
幽门螺杆菌通过其耐酸性在这种酸性条件下得以生存:然后穿过粘液层到达其接近胃上皮细胞的位置。趋化性,运动性和粘附性是胃上皮细胞定殖的重要过程。
为了在人胃粘膜中长期持久存在,幽门螺杆菌还不断需要宿主提供营养。 这是通过降解粘液层和下面的胃上皮细胞的完整性来实现的。 此外,通过抑制宿主免疫系统,抗原变异和抗原拟态避免了幽门螺杆菌的清除。
耐酸性
幽门螺杆菌生长的下限pH值是5.0-5.5,具体取决于测试的分离物。在胃粘膜层中,pH也是酸性的,大约在4-6.5之间变化。而且,当粘液层被破坏时,pH值可能会偶尔下降。
酸冲击(pH<3)后幽门螺杆菌的存活取决于幽门螺杆菌蛋白脲酶的活性,该酶将尿素转化为氨和碳酸氢盐。这导致幽门螺杆菌的周质或细胞质被中和。幽门螺杆菌尿素酶活性对于在酸性pH下体外存活以及在动物模型中胃粘膜定植至关重要,这证明了尿素酶在幽门螺杆菌感染中的重要性。
在中性pH下高度活跃的脲酶和酸调节的尿素通道的结合解释了为什么幽门螺旋菌在人类胃部的生存能力是独特的。有效抑制UreI蛋白,将提供一种从正常的,分泌酸的胃中根除幽门螺杆菌的方法。
除耐酸性外,脲酶还具有与胃定植有关的其他基本功能
尽管尿素酶对于酸休克的生存是必不可少的,但是幽门螺杆菌尿素酶在处理胃上皮细胞附近的慢性酸性环境时还是不够的。 用酸抑制剂治疗不能恢复尿素酶阴性突变体定殖在生侏儒仔猪胃中的能力。
脲酶参与幽门螺杆菌的氮代谢,脲酶活性产生的氨和碳酸氢盐被认为会影响宿主的许多细胞过程,包括细胞裂解。
除脲酶外,非脲酶基因也有助于耐酸,并且在酸性pH下的存活和生长与脲酶无关。 在这些非脲酶基因中,已显示三种调节蛋白(Fur,NikR和HP0166)对幽门螺杆菌的适应性有贡献。 这表明严格调节耐酸机理的重要性。
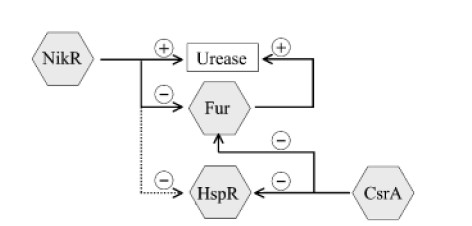
Karin et al., FEMS Microbiol Rev. 2006
NikR通过Fur调节系统直接和间接调节脲酶的表达。CsrA调节Fur和HspR调节系统的表达。通过不同基因调节蛋白的相互作用,幽门螺杆菌能够感知和响应多种信号。
细胞的趋化作用与运动
胃上皮细胞层覆盖着一层厚厚的粘液。假定该层甚至对于小分子也相对不可渗透。幽门螺杆菌的能动性和趋化性是有效穿透这一粘液层的关键。
在小鼠感染模型中,几乎任何运动和趋化性系统基因的诱变都消除了幽门螺杆菌感染胃粘膜的能力,强调了这些因素对定殖的重要性。
运动性
幽门螺杆菌的运动性是通过存在两到六个极性的带鞘鞭毛而实现的。鞭毛由三个结构元素组成:基体,钩子和细丝。迄今为止,超过50种蛋白质与鞭毛的结构或调控组织有关。
鞭毛丝由两个亚基FlaA和FlaB组成。幽门螺杆菌flaA和flaB突变体无法在感染仔猪的模型中定植,表明幽门螺杆菌鞭毛对定殖是必需的,幽门螺杆菌的毒力也因此而增加。
幽门螺杆菌motB基因编码鞭毛运动旋转蛋白。 幽门螺杆菌motB基因敲除突变体仍包含鞭毛,但不能运动。该突变体在小鼠中定植的能力降低,证实了运动性是完全传染性所必需的。
鞭毛基因转录的调控不同于许多其他细菌。与许多其他带鞭毛的革兰氏阴性细菌相反,幽门螺杆菌没有转录调控因子来调控鞭毛基因的转录。
据推测,幽门螺杆菌的运动不需要严格的调节,因为它在任何时候都是不可或缺的。然而,在幽门螺杆菌中仍然可以看到一些转录调控。例如,蛋白质FlhA和FlhF,基体的组成部分,需要在中后期鞭毛基因转录之前出现。
趋化性
除了运动性,趋化性对于幽门螺杆菌的定植也是必不可少的。趋化性允许幽门螺杆菌将其运动导向胃上皮细胞层。
由HP0099编码的幽门螺杆菌趋化性受体传感器识别碳酸氢盐和精氨酸作为引诱剂。幽门螺杆菌外膜上这种传感器蛋白与反应调节剂CheY偶联。
反应调节剂CheY调节鞭毛运动蛋白的表达,使幽门螺杆菌游向其生态位。
应答调节因子CheY的一个敲除突变体未能在非生物小猪体内定殖,强调了趋化性在最初定殖中的重要性。
反应调节因子CheY及其组氨酸激酶的敲除突变体显示出对粘蛋白的趋化性反应减弱。
免疫逃避
在长期的定殖过程中,宿主对多种幽门螺杆菌抗原产生强大的免疫反应。然而,这些抗原通常没有表面暴露。
另一方面,表面暴露的抗原通常高度多样化,使宿主清除幽门螺杆菌变得更加困难。幽门螺杆菌感染极少产生足够的免疫反应,能够清除细菌。 实际上,幽门螺杆菌能够有效规避先天性和适应性免疫反应。
先天的免疫反应不能实质上识别幽门螺杆菌。大肠杆菌脂多糖(LPS)通过TLR4激活先天免疫应答。然而,幽门螺杆菌LPS远不是TLR4介导的基因表达的有效诱导剂。
在幽门螺杆菌中,TLR5介导的免疫应答激活效率也较低。 与肠沙门氏菌血清型鼠伤寒鞭毛蛋白相比,幽门螺杆菌鞭毛蛋白没有被释放,并且在通过TLR5激活IL-8分泌中也没有那么强。
先天性免疫反应未能识别幽门螺杆菌可能导致适应性免疫反应失败以随后清除感染。
自适应免疫系统的逃避至少由两个重要机制介导:抗原模拟和免疫抑制。抗原模拟导致宿主免疫系统无法正确识别幽门螺杆菌。例如,幽门螺杆菌LPS上的Le血型抗原也在人类上皮细胞上表达。结果,幽门螺杆菌LPS免疫原性差,从而支持幽门螺杆菌的持久性。在其LPS上缺少O抗原的幽门螺杆菌菌株在小鼠中定殖的能力显着降低。因此,幽门螺杆菌LPS的典型结构在定植中很重要。
除了通过抗原模拟来逃避免疫外,免疫抑制也有助于幽门螺杆菌感染的慢性化。
免疫应答可能偏向更抗炎的应答,或者下调(VacA)。幽门螺杆菌VacA可以阻断巨噬细胞中的吞噬体-溶酶体融合,导致巨噬细胞无法杀死幽门螺杆菌。
此外,VacA表达阻断T细胞活化并因此增殖,活化T细胞凋亡,并抑制T细胞中的抗原呈递。
B淋巴细胞的抗原加工可能被阻止,可能是通过将内体的成熟限制在发生抗原加载的MHC II类区室中。因此,VacA限制了针对幽门螺杆菌的T细胞和B细胞应答。
幽门螺杆菌的存在可以预防某些疾病?
通过以上各种方式,幽门螺杆菌得以在人体中生存下来,从某种程度上来说,幽门螺杆菌并不总是对人类宿主有害。
研究表明,幽门螺杆菌的存在可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。 幽门螺杆菌的发病率下降与儿童过敏性疾病和自身免疫性疾病,多发性硬化,腹腔疾病的发病率上升相关。
因此,从某种程度上来说,幽门螺杆菌有其存在的价值。这引起了关于是否需要根除幽门螺杆菌的讨论。
需要明确的是,幽门螺杆菌感染后不会立即对人体产生致死性危害和严重后果,所导致的慢性胃炎、消化道溃疡和胃癌等疾病是长期存在并慢性与其他因素共同作用的结果。
第五次全国幽门螺杆菌感染处理共识报告中有如下陈述:
根除幽门螺杆菌的获益在不同个体之间存在差异
根除幽门螺杆菌促进消化性溃疡愈合和降低溃疡并发症发生率,根除幽门螺杆菌可使约80%早期胃 MALT 淋巴瘤获得缓解。与无症状和并发症的 幽门螺杆菌感染者相比,上述患者根除幽门螺杆菌的获益显然更大。胃癌发生高风险个体有胃癌家族史、早期胃癌内镜下切除术后和胃黏膜萎缩和(或)肠化生等。根除幽门螺杆菌预防胃癌的获益高于低风险个体。

在做出可靠的功能性消化不良诊断前,必须排除幽门螺杆菌相关消化不良。
幽门螺杆菌胃炎伴消化不良症状的患者,根除幽门螺杆菌后可使部分患者的症状获得长期缓解,是优选选择。
幽门螺杆菌感染是消化性溃疡主要病因,不管溃疡是否活动和是否有并发症史,均应该检测和根除幽门螺杆菌。
…
总的来说,对于无抗衡因素 ( 高龄、伴存疾病、社区再感染率、卫生经济因素等 ) 的个体,根除幽门螺杆菌治疗利大于弊。
儿童:
不推荐对 14 岁以下儿童行常规检测幽门螺杆菌。推荐对消化性溃疡儿童进行幽门螺杆菌检测和治疗,因消化不良行内镜检查的儿童建议行幽门螺杆菌检测与治疗。
与成人相比,儿童根除治疗不利因素较多,包括抗菌素选择余地小,对药物不良反应耐受性低。此外,儿童幽门螺杆菌感染有一定自发清除率,根除后再感染率也可能高于成人。
老年人:
老年人根除幽门螺杆菌治疗药物不良反应风险增加,因此对老年人根除幽门螺杆菌治疗应该进行获益-风险综合评估,个体化处理。
问卷调查显示,多数临床医生对老年人根除幽门螺杆菌治疗的态度趋向保守。一般而言,老年人(年龄>70 岁)对根除幽门螺杆菌治疗药物的耐受性和依从性降低,发生抗生素不良反应的风险增加;另一方面,非萎缩性胃炎或轻度萎缩性胃炎患者根除幽门螺杆菌预防胃癌的潜在获益下降。
合理看待幽门螺杆菌感染后果至关重要,对自然人群中幽门螺杆菌感染是否需要进行干预,需要综合权衡利弊。对于有根除治疗指征的患者,需要给予规范治疗,提高首次根除率,减少耐药性发生。
在慢性感染过程中,多株菌株同时定植于一个宿主,并且幽门螺杆菌分离株的遗传变异使幽门螺杆菌相关的发病机理难以从单个因素中预测。 幽门螺杆菌与其宿主的共同进化使它得以终生定居。
随着现代卫生环境改善及抗生素的大量使用,幽门螺杆菌的生长和传播越来越难,年轻一代中感染率较低,在未来几十年中幽门螺杆菌感染率将进一步下降。
更好地理解幽门螺杆菌和其他胃肠道微生物群之间的对话可能为预防或治疗其感染提供新的方向。如在肠道菌群健康检测报告中发现幽门螺杆菌感染,则应引起重视。当需要治疗时,应评估新的治疗策略和药物,或者应该制定替代策略来控制细菌的毒力,从而避免出现溃疡和胃癌而不消除其积极影响。
附录: 幽门螺杆菌的发现史
在1980年代初,幽门螺杆菌首次被发现是引起胃部疾病的原因。该发现帮助研究人员将幽门螺杆菌感染与胃炎,溃疡和胃癌等联系起来。
1982年,两名澳大利亚研究人员巴里·马歇尔和罗宾·沃伦描述了幽门螺杆菌感染的作用。
然而,沃伦和马歇尔关于幽门螺杆菌功能的理论并未立即被医学界接受。当时,大多数科学家都不相信细菌可以在人的胃中生活。
马歇尔无法在实验室小鼠中进一步测试他的工作,也不允许在人身上进行实验。马歇尔这位勇敢的科研工作者想到了一个办法。
他决定亲自吃下幽门螺杆菌。他从病人的肠道中提取该菌,将其放入肉汤中,然后饮用。
几天后,马歇尔出现了肠道症状,例如恶心,呕吐,口臭和疲劳。他做了胃活检,且能够培养幽门螺杆菌,证明是细菌引起了他的症状。
医学界最终接受了幽门螺杆菌引起溃疡和其他肠道问题的观念,但是接受的道阻且长。
1994年,美国国立卫生研究院共识发展会议正式承认幽门螺杆菌与溃疡之间的紧密联系。该小组建议对溃疡患者进行抗生素治疗。
1996年,FDA批准了首个针对幽门螺杆菌引起的溃疡的抗生素疗法。
一年后,疾控中心(CDC)与其他政府机构和学术机构合作发起了一项全国运动,为医患相关人员提供有关幽门螺杆菌与溃疡之间的联系。
2005年,马歇尔和沃伦获得了诺贝尔生理学或医学奖。溃疡不再被视为无法治愈的慢病,而是一种可以通过短期的抗生素和酸分泌抑制剂治疗的疾病。
【参考文献】
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Camilo V, Sugiyama T, Touati E. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12405. PMID: 28891130.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Mentis A, Lehours P, Mégraud F. Epidemiology and Diagnosis of Helicobacter pylori infection. Helicobacter. 2015 Sep;20 Suppl 1:1-7. doi: 10.1111/hel.12250. PMID: 26372818.
Thorell K, Lehours P, Vale FF. Genomics of Helicobacter pylori. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12409. PMID: 28891132.
Julie Marks.Robert Jasmer, MD What Is H. Pylori? Symptoms, Causes, Diagnosis, Treatment, and Prevention. 2020.9
History of H. Pylori: What We Do and Don’t Know Before the discovery of the bacterium, doctors thought stomach ulcers were due to stress and spicy foods.
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Kamboj AK, Cotter TG, Oxentenko AS. Helicobacter pylori: The Past, Present, and Future in Management. Mayo Clin Proc. 2017 Apr;92(4):599-604. doi: 10.1016/j.mayocp.2016.11.017.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Yang JC, Lu CW, Lin CJ. Treatment of Helicobacter pylori infection: current status and future concepts. World J Gastroenterol. 2014 May 14;20(18):5283-93. doi: 10.3748/wjg.v20.i18.5283.
Sun Y, Zhang J. Helicobacter pylori recrudescence and its influencing factors. J Cell Mol Med. 2019 Dec;23(12):7919-7925. doi: 10.1111/jcmm.14682. Epub 2019 Sep 19.
Tao Zhi-Hang,Han Ji-Xuan,Fang Jing-Yuan,Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota.[J] .Helicobacter, 2020, 25: e12754.
Algood HM, Cover TL. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses. Clin Microbiol Rev. 2006 Oct;19(4):597-613. doi: 10.1128/CMR.00006-06.
Kori M, Daugule I, Urbonas V. Helicobacter pylori and some aspects of gut microbiota in children. Helicobacter. 2018 Sep;23 Suppl 1:e12524. doi: 10.1111/hel.12524. PMID: 30203591.
van Amsterdam K, van Vliet AH, Kusters JG, van der Ende A. Of microbe and man: determinants of Helicobacter pylori-related diseases. FEMS Microbiol Rev. 2006 Jan;30(1):131-56.
Waskito LA, Yamaoka Y. The Story of Helicobacter pylori: Depicting Human Migrations from the Phylogeography. Adv Exp Med Biol. 2019;1149:1-16. doi: 10.1007/5584_2019_356. PMID: 31016625.
Pereira-Marques J, Ferreira RM, Pinto-Ribeiro I, Figueiredo C. Helicobacter pylori Infection, the Gastric Microbiome and Gastric Cancer. Adv Exp Med Biol. 2019;1149:195-210.
RU Nan, DU Yi-qi, LI Zhao-shen. 幽门螺杆菌根除指征的演变[J]. 中国实用内科杂志, 2019, 39(006):515-519.
中华医学会消化病学分会幽门螺杆菌和消化性溃疡学组, 全国幽门螺杆菌研究协作组, 刘文忠,等. 第五次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学, 2017(6).