 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

肠道微生物群与人类宿主共同进化,对于我们的消化、代谢、神经、免疫等系统具有重要贡献,影响着人类身体和心理健康。
肠道微生物群从出生时就开始形成。生命早期的多种因素,如分娩方式、婴儿喂养方式以及母体微生物群等,都会影响肠道微生物群的初期定植。早期微生物群的组成和功能可能对宿主长期健康产生影响。
人类肠道微生物群的变化与人类生存策略的演变密切相关,随着人类从狩猎采集社群向农耕与城市生活方式的转变,肠道微生物群的多样性经历了一系列的变化。而种族、地理、文化和行为特征等宿主因素,也会对全球范围内人类肠道微生物群的多样性和组成产生影响。
近日,来自《Trends in Molecular Medicine》杂志发表的文章,从生态学的角度探讨影响不同人类种群肠道微生物群的基本驱动因素,并考察生活方式、社会经济地位和人类迁移等因素,如何通过影响肠道微生物群而对不同人群的健康产生差异。

人类肠道中有高度多样的微生物群落,最显著的变化与工业化水平有关。
城市化、西方化的生活方式与细菌多样性减少、本地菌群(如普雷沃氏菌)和纤维降解功能丧失有关。这些差异可能导致非传染性免疫、代谢和神经系统疾病的发病率增加。
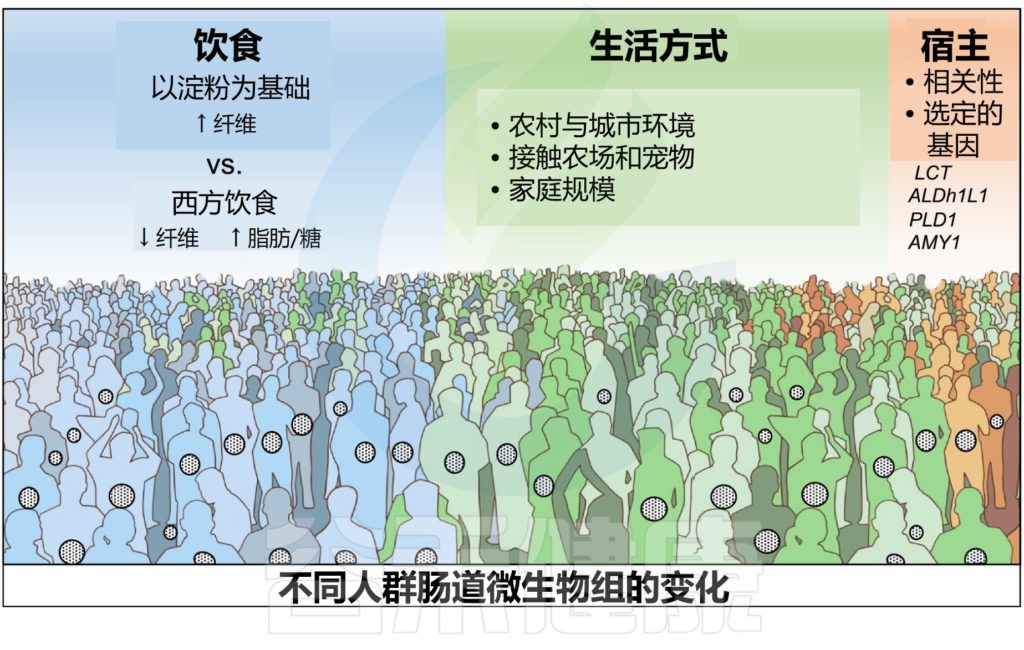
在所研究的许多生活方式和遗传因素(地理位置、遗传相关性、饮食、种族、内在环境、家庭组成等)中,饮食和生活方式实践对肠道微生物群落的形成最具影响力。
人类迁移可以揭示肠道微生物群在不同生活方式下对健康的影响。
这些信息的重要性在于,健康的或不健康的肠道微生物群不能简单适用于所有人,而应当根据特定的微生物组特征来设计适应各种人类群体的菌群失调策略。进一步了解和应对微生物组变化的探索,将成为未来疾病预防和治疗的重要方向。
通过研究微生物群落的组成,我们可以更好地了解微生物组的形成过程。这里面我们来了解几个概念:
微生物传播、环境选择、生态漂移
微生物物种在不同地点之间的传播能力,解释了微生物在人类和身体部位之间的垂直和水平传播。
另一种机制被称为环境选择,解释了微生物群落之间的适应度差异或基于生态位的相互作用,这有利于某些物种在特定环境中生存。例如,双歧杆菌属(Bifidobacterium)具有代谢母乳的能力,因此在婴儿的肠道中非常常见。
生态漂移是指人类微生物组中微生物物种丰度的随机变化。生态漂移可以减少群落内殖民化和竞争互动的作用,增加群落之间的差异。
注:扩散和环境选择在生态选择和形成微生物相互作用中发挥着更强的作用,克服了人类肠道微生物组中生态漂移的影响。
微生物之间的相互作用影响肠道微生物组的组成
有些微生物物种依赖于与其他物种的共生或互利关系。例如:
这表明在肠道微生物组中存在着合作和竞争的相互作用。
在炎症性肠病和肥胖等疾病中,已经确定了一些关键细菌物种的共存或其作用途径,这表明它们在调节疾病相关的微生物组中发挥着重要作用。
真菌在微生物组成和共生中起着重要作用
例如,肠道-真菌-细菌的相互作用有助于在生命早期形成微生物组组成,细菌和真菌α多样性之间的负相关性表明,抑制机制限制了许多真菌物种在人类肠道中的生长。
肠道中的原生动物捕食细菌
肠道中的原生动物与细菌多样性和群落组成变化有关,这表明原生动物可能通过捕食细菌产生自上而下的影响,从而增加细菌多样性。
来自不同国家的肠道微生物群研究也表明,人芽囊原虫(Blastcystis)是一种在人体肠道中常见的原生动物,与史密斯甲烷杆菌(Methanobrevibacter smithii)以及肠道优势细菌普雷沃菌(Prevotella copri)和瘤胃球菌(Ruminococcus gnavus)的丰度有关。史密斯甲烷杆菌的丰度与产短链脂肪酸菌(如Collinsella aeroffaciens、P.copri、Roseburia fadis)呈正相关。
扩展阅读:
这些研究结果强调了理解控制肠道微生物组成的生态过程和相互作用的重要性,因为我们的饮食习惯、生活方式、社会地理和其他环境因素会影响人体肠道微生物组。
人类肠道微生物组已经通过遗传相关性和同居关系的梯度进行了研究,揭示了宿主遗传和肠道微生物组成之间有趣的联系。
宿主遗传学影响特定肠道微生物类群的丰度
家庭成员拥有相似的肠道微生物组,特别是,基因相同的双胞胎表现出最高水平的相似性。为了研究宿主遗传学对肠道微生物群落的影响,研究人员分析了来自以下群体的单卵和双卵双胞胎的几个粪便样本数据集:
i)TwinsUK群体,由977个个体组成的数据集,包括1081个单卵和二卵双胞胎、具有未知结合度的双胞胎和无关个体的粪便样本
ii)Yatsunenko数据集,包括来自委内瑞拉亚马逊地区的531名美洲印第安人、马拉维农村社区居民和美国大都市地区居民的粪便样本
iii)密苏里双胞胎数据集,包括54对双胞胎
这些研究表明:宿主遗传学影响特定肠道微生物类群的丰度。
宿主遗传学的影响因类群和种群而异,例如,Christensenellaceae是TwinsUK和Yatsunenko种群中最具遗传性的细菌科,瘤胃球菌科和毛螺菌科是TwinsUK和密苏里种群中最具有遗传性的操作分类学单元。
宿主环境超过了宿主基因对肠道微生物组成的影响
相比之下,这项研究以及芬兰的一项单卵双胞胎研究都表明,拟杆菌属是一个包括主要肠道微生物物种的分类单元,是不可遗传的,其存在主要由饮食来解释。因此,虽然某些分类群受到宿主遗传学的影响,但同卵双胞胎的高度同质环境可能比遗传学更能推动其肠道微生物组成之间的相似性。这得到了几项研究的支持,这些研究表明,与非共享家庭双胞胎相比,共享家庭和饮食的非遗传相关个体之间的微生物组具有显著的相似性,这表明宿主环境超过了宿主基因对肠道微生物组成的影响。
尽管如此,人类的遗传多样性导致了与常驻微生物物种直接相关的人类种群之间的生理差异。
基因 & 肠道菌群 & 症状或饮食方式
全基因组关联研究报告了:某些宿主数量性状基因座与一些可遗传细菌类群的相对丰度和功能之间的显著联系。LCT基因座与双歧杆菌属之间的相关性在这些研究中最强,其随乳制品摄入量的变化而变化。
其他发现包括:
i)与缺血性中风相关的人类甲酸盐氧化基因乙醛脱氢酶1家族成员A1(ALDH1L1)与细菌SHA-98之间的相关性;
ii)PLD1基因和Akkermansia,其与降低肥胖风险有关;
iii)ABO血型基因和乳杆菌。
基因拷贝数的变化也与人类微生物组成有关。已知在富含淀粉的饮食人群中,负责消化过程中可消化淀粉水解的淀粉酶基因AMY1的拷贝数更高。AMY1拷贝数还与普雷沃氏菌、卟啉单胞菌、瘤胃球菌科分类群的增加有关,所有这些都可以降解耐膳食淀粉,AMY1的低拷贝数可能导致未消化的淀粉到达大肠,增加下肠道的简单淀粉发酵,并调节肠道微生物群落。
分析和制定标准化方法的重要性,尤其是在处理地理或种族分布的乳糖不耐受等特征时。值得注意的是,组成肠道微生物组的大多数微生物物种似乎不受宿主基因的影响,这表明它们大多是环境获得的。
doi.org/10.1016/j.molmed.2023.07.002
人类历史上的生活方式转变伴随着饮食、社会人口特征以及其他环境和文化因素的变化,这些因素反映在人类群体中肠道微生物多样性和组成的显著变化中。
城市环境的饮食、生活方式
如今,世界上一半以上的人口生活在城市环境中,据估计,到2050年,这一比例将增至约70%。向城市生活方式的转变带来了膳食蛋白质和脂肪摄入的增加,以及卫生条件的变化和药物负担的增加。相比之下,目前的现代狩猎采集人群以淀粉为基础,纤维摄入量要高得多,并且经常被真正的胃肠道病原体或寄生虫定植。
人类肠道微生物群随着对这些饮食变化的反应和对宿主代谢需求的适应而发生了变化。
▼
狩猎采集者的肠道菌群
例如,一组与西方生活方式接触有限的南美洲亚诺马米狩猎采集者的肠道微生物组在其他研究人群中显示出组成和功能多样性较高。
哈扎狩猎采集者的微生物多样性也高于西方城市人口。它们独特的肠道微生物组成,包括参与支链氨基酸和广谱碳水化合物代谢的基因,表明它们适应了饮食习惯和传统的觅食生活方式。狩猎采集群体表现出更高丰度的梭状芽孢杆菌、变形杆菌、螺旋体和其他与纤维降解有关的分类群,如丁酸弧菌、乳杆菌、普雷沃氏菌、瘤胃杆菌、琥珀酸弧菌和密螺旋体,以及氨基酸、毒力和维生素代谢功能。
扩展阅读:
工业化城市人群的肠道菌群
工业化城市人群的特点是以拟杆菌属、双歧杆菌属、厚壁菌门成员和将纤维发酵成短链脂肪酸的细菌为主,包括Blautia和Faecalibacterium。工业化还与更高的水平基因转移率和抗生素抗性基因的增加以及碳水化合物和外源代谢的预测代谢途径有关,这表明城市化导致了许多微生物功能和性状的消失和替代。
偏远、非工业化地区介于狩猎采集和西方生活方式之间
从生态学的角度来看,狩猎采集者的生活习惯以及这些种群与环境的接触有利于更高的微生物传播率,这是一种受西方生活方式限制的机制。微生物之间对生态位空间的竞争性相互作用也通过选择使宿主能够降解新底物的特殊类群来塑造肠道微生物多样性。其他在偏远、非工业化地区从事自给农业的非游牧传统社会,如非洲的农业学家班图人,表现出与坦桑尼亚的哈扎人相似的饮食习惯,在狩猎采集和西方生活方式之间,微生物α多样性和丰富性处于中间状态。
▼
社会经济地位显著影响健康差异,包括肠道菌群
除了与偏远或农村地区传统生活方式的差距拉开之外,人口的社会经济地位(SES)也会显著影响健康差异和不平等,推动各种因素当然也会影响微生物组的组成。其中包括食物供应和营养状况、体育活动、饮用水、空气污染、卫生和药物、寄生虫、分娩和婴儿喂养法。
影响婴儿肠道微生物组的因素
通过影响拓荒者和早期殖民者,对该生态系统产生了重要的生态影响。与母乳喂养的婴儿相比,配方奶粉喂养加速了婴儿肠道微生物组的成熟,剖腹产分娩和围产期抗生素暴露是关键因素,它们会在出生时中断初级微生物的继承和定植。
由于社会经济和文化因素,全球剖腹产出生率估计将从2018年的21.1%增加到2030年的28.5%,其中近80%的病例发生在中低收入国家。
围产期和婴儿微生物组的改变导致双歧杆菌减少、病原体增加和微生物组成熟加速,这可能导致肠道微生物失衡(微生态失调),从而导致随后的疾病,如哮喘、过敏和1型糖尿病。
扩展阅读:
社会经济地位通过饮食影响菌群
社会经济地位的影响不能与饮食实践的影响脱节,因为不良的社会经济条件与低多样性饮食有关,这可能导致肠道微生物多样性低。社会经济地位、妇女教育和产假时间也与母乳喂养的开始率和持续时间有关。有趣的是,较低社会经济地位对微生物多样性的影响在普雷沃氏菌丰度较高的个体中更为明显。普雷沃氏菌是一种工业化程度较低的细菌群。
这些发现将饮食视为人类社会中人类肠道微生物组差异的决定性媒介,与社会经济地位等社会人口学特征和健康差异密切相关。
扩展阅读:
▼
肠道真菌群的差异也与生活方式、社会人口和环境因素有关
这些差异从早期就可以识别,例如真菌属曲霉属和毕赤酵母属与念珠菌属和马拉色菌属在非工业化和工业化城市人群中的优势。先前的研究也表明,原生芽囊虫在非工业化城市人群的微生物群中更为丰富。
此外,城市生活方式与个体间和个体内古菌多样性以及古菌与细菌比率的降低有关。农村的饮食习惯与史密斯分枝杆菌数量的增加有关,史密斯分枝杆菌是一种在农村人群中更常见的古菌。
肠道病毒群之间的个体差异增加
某些肠道病毒物种与地理位置、生活方式、种族特定饮食和其他环境因素、一些药物以及传染病和慢性病有关。研究表明,随着城市化的发展,肠道病毒群之间的个体差异增加,长期城市生活与几种噬菌体(如乳酸杆菌和乳球菌噬菌体)以及一些细菌病原体相关噬菌体(包括沙门氏菌和志贺氏菌噬菌体)之间存在明显关联。
在其中一项研究中,从中国两个地区(香港和云南)的城市和农村地区收集了来自六个不同种族(白人、傣族、汉族、哈尼族、苗族和藏族)的930名健康成年人的粪便DNA病毒群。他们的研究结果表明,肠道病毒组α的多样性在不同种族之间存在显著差异。与云南居民相比,香港居民的肠道病毒组含有更多的微小病毒科噬菌体,而较少的Myoviridae、Podoviridae和Siphoviridae噬菌体。在所有城市居民中富集的病毒在汉族、苗族和藏族城市居民中也比农村居民更丰富,而在傣族和哈尼族城市居民中比农村居民不那么丰富。
对非细菌微生物在人类肠道微生物组生态学中的作用的探索才刚刚开始,但新出现的证据表明,它可以极大地塑造细菌群落。因此,非细菌微生物很可能有助于解释人类种群之间的组成和功能微生物组差异。最近的报告也将真菌在疾病发病机制中与已知的微生物组贡献联系起来,包括癌症和IBD,这表明人类社会中非细菌微生物的差异应纳入微生物组和宿主疾病范式。
人种是指定义人类群体的社会学和文化因素。微生物组成变化的种族相关模式可以用许多与宿主祖先、种族、生活方式、饮食习惯、医疗保健以及社会文化和社会经济因素相关的协变量来解释,这些协变量很难相互脱节。
种族与微生物组成的相关性
人类对几个分类群的丰度和存在与否进行了显著的选择。一项针对新加坡106名婴儿在出生前两年的多民族人群的纵向队列研究报告称,从三个月大开始,在给婴儿介绍固体食物之前,种族对个体间微生物组差异的显著影响。
在本研究的三个种族(中国人、印度人和马来人)中,印度婴儿的双歧杆菌属和乳酸杆菌属丰度较高。相比之下,中国婴儿的阿克曼菌属和拟杆菌属的丰度更高。这些发现受到母亲饮食摄入缺乏和母乳成分信息的限制,这些信息可以解释研究人群之间的种族差异。
扩展阅读:
另一项比较阿姆斯特丹六个不同种族2084人微生物组成的研究表明,某些肠道微生物类群在不同种族之间存在差异。例如,拟杆菌在苏里南更为丰富,在荷兰的梭状芽孢杆菌和在加纳人、摩洛哥人和土耳其人的普雷沃特拉属更为丰富。荷兰和南亚苏里南的参与者分别表现出最高和最低的微生物α多样性。
移民对肠道微生物组的影响与种族相关的饮食和生活方式等多因素都有关
研究的一个重要因素是移民的影响。在这项研究中,94%的非荷兰人在成年后移民到荷兰。迁移时的年龄和停留时间与它们的肠道微生物群没有显著相关性。相反,种族与所有这些因素相结合,对肠道微生物多样性和组成的影响比单独或结合但不包括种族的这些因素更强。尽管长期生活在同一环境中,但与种族相关的协变量反映了这些参与者肠道微生物组的组成,这表明移民后保持与种族有关的饮食和生活方式因素,有助于保持与荷兰居民群体的肠道微生物组差异。
种族与相似起源的人群的基因模式之间的联系
有趣的是,一些与种族密切相关的分类群也属于可遗传和/或遗传相关的微生物分类群,如Christensenellaceae、Odoribacteriaceae、Rikenellaceae,强调了种族与具有相同或类似地理和祖先起源的人群的基因模式之间的联系。微生物类群共现的模式也与人类宿主种族有关。TwinsUK群体显示,Christensenellaceae与其他可遗传细菌(Dehalobacteriaceae,RF39和SHA-98)和古菌(甲烷杆菌科)共存。
共现模式也与宿主功能调节相关
另一项针对美国1673人的多民族群体的研究也显示,Christensenellaceae12个属在不同种族(非裔美国人、亚洲或太平洋岛民、高加索人和西班牙裔)中的共现模式与人类ALDH1L1基因的遗传变异有关。Christensenellaceae相关微生物中心的共有性和可遗传性,以及它们与ALDH1L1基因(叶酸代谢和细胞增殖)表达调节的重要宿主功能的关联,可能构成了宏生物(metaorganism)水平上的共同进化策略。然而,也有可能某些分类群与宿主遗传学有关,只是因为它们与其他可遗传分类群共存,如Christensenellaceae。目前,这些有趣的发现仍然只是联系在一起,需要检验因果关系。
种族是人类社会健康差异的一个重要决定因素,可能会导致种族对肠道菌群多样性和组成的影响
例如,在一项针对80名生活在英国的黑人和白人女性的研究中,双歧杆菌在白人女性中更为丰富,这一发现与压力增加有关。相比之下,尽管饮食习惯没有显著差异,但黑人女性的微生物β多样性和拟杆菌属丰度更高。
微生物组与种族相关的结直肠癌风险
这些模式可能具有临床相关性,因为此前已经发现低丰度的双歧杆菌属以及高丰度的拟杆菌属和瘤胃球菌属与结直肠癌(CRC)有关。
在一项将该人群与美国非裔美国人进行比较的研究中,在非洲农村地区也发现了较低丰度的拟杆菌属。然而,在引入西方饮食后,该人群的结直肠癌风险才有所增加。即使将压力作为一个风险因素加以控制,非洲裔美国女性的低拟杆菌属与结直肠癌之间的关联仍然显著,这表明微生物组在种族相关因素与结直肠癌风险之间的既定联系中发挥了作用。
在非裔美国人人群中,微生物组是否可能起到中介、调节或仅仅与结直肠癌风险增加相关的作用,在人类研究中仍未得到解决。然而,脆弱拟杆菌在结肠炎相关结直肠癌小鼠模型中具有抑制肿瘤形成的作用,这表明该分类单元可能按种族依赖的方式对结直肠癌风险有因果性贡献。
扩展阅读:
从出生到成年,地理位置一直被认为是与微生物组成变化有关的因素。然而,很难将其影响与宿主的特定特征和当地环境因素脱钩。
▼
地理位置与生活方式、饮食等变量相关
一项研究比较了20个不同变量(包括人口统计、生活方式和饮食)对中国63个城市8个民族2678人肠道微生物组成的影响。这一比较表明,生活在同一地理位置的汉族和其他不同少数民族(白族、回族、苗族、蒙古族、纳西族、藏族和维吾尔族)具有相似的肠道微生物组成,这与其他城市的群体不同。虽然地理位置是个体间微生物组成变化的最强驱动因素,但作者将这一发现与生活方式和饮食等其他变量联系起来。
环境可以影响与遗传和种族有关的人类微生物群落的形成
在更精细的范围内,一项针对居住在同一省份14个区的7000多名来自同一种族(中国少数民族,包括99%的汉族)的中国人的肠道微生物组研究也显示,在共享相同地理位置的个体中,微生物组相似,这表明环境也可以塑造共享遗传和种族相关因素的人类微生物群落。需要在这些因素不同的地方进行额外的微生物组研究,以进一步了解地理位置本身的影响。
▼
地理位置对肠道微生物组组成的作用也可以从人类迁移的角度进行研究
人们永久或半永久地迁移到一个新的地方,可能会在一代或几代人的时间内对人类的生物学和健康产生深远影响。
根据《世界移民报告》,自1970年以来,移民人数增加了三倍多。2020年,全球约有2.81亿国际移民,这意味着每30人中就有一人生活在出生国以外的国家。近几十年来,由于冲突、战争和侵犯人权而被迫流离失所的人数也有所增加。截至2022年5月,联合国难民事务高级专员报告称,全球有1亿被迫旅行者和难民。
旅行和移民会改变食物供应、饮食习惯、生活方式、抗生素和抗寄生虫药物的使用、饮用水、文化和社会经济条件、心理创伤和压力、获得医疗服务的机会、气候、空气污染、环境过敏原等。
移民对藏族肠道菌群影响:微生物群的恢复力
一项研究评估了移民对30名移民咸阳的藏族妇女的影响。西藏人的微生物群与汉族人不同,这可能是由于两个群体在环境、文化、饮食和基因构成方面存在巨大差异。这项研究调查了从迁移到10个月后的微生物组,发现尽管他们的饮食发生了变化,但迁移对肠道微生物多样性、组成和基因途径没有显著影响,这表明微生物组对这些变化有较高的恢复能力。
爱尔兰旅行者饮食接近西方化,肠道菌群仍然保持着类似非工业化群体的特征
第二项研究评估了爱尔兰旅行者的微生物组,爱尔兰流浪者是爱尔兰本土的少数民族。虽然与其他欧洲游牧民族相比,他们在基因上更像爱尔兰人,但他们作为一个独特的民族生活,拥有自己的游牧文化和语言。然而,爱尔兰政府的持续压力导致2022年立法限制他们获得土地临时生活,并强制停止他们的游牧生活。
这项研究比较了118名爱尔兰旅行者的肠道微生物组,他们在游牧生活中长大,但现在永久居住在科克附近,而非爱尔兰旅行者则生活在同一地理位置。两组之间存在重要的微生物组差异,爱尔兰游民的微生物组类似于非工业化的微生物组,但主要是那些留在原地的游民(与居住在社会住房中的游民相比),有更多的兄弟姐妹,并且与动物生活在一起。
虽然是横断面的,但这项研究揭示了从小生活方式的改变,特别是与家庭条件有关的生活方式的变化,对肠道微生物组的影响。重要的是,爱尔兰旅行者的饮食转变为类似西方的饮食,但他们的微生物组仍然更接近非工业化成分。
来自爱尔兰旅行者和西藏妇女的研究表明,工业化程度较低的微生物组的保留与人口采用新生活方式的程度呈负相关,这种影响可能比饮食的变化更强烈。从生态学的角度来看,大家庭和靠近动物有助于微生物的水平扩散和增加微生物多样性。
移民的生活方式对微生物组有何影响?
专注于人类迁移模式的微生物组研究也表明,更高程度地采用新的生活方式和随后的微生物组变化可能会导致适应不良的健康后果。
例如,过渡到社会住房而不是停留在原地的爱尔兰游民群体显示出与工业化国家更常见的慢性病相关的功能性微生物组变化,尽管目前尚不清楚这些变化是否导致了爱尔兰游民与非游民爱尔兰人之间的健康差异。
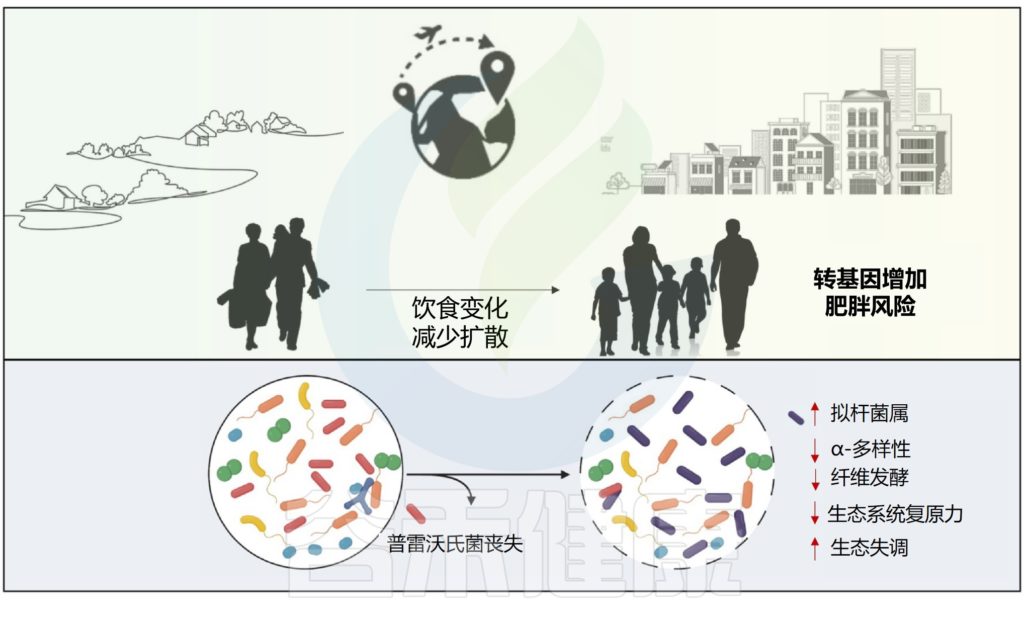
移民定居后微生物多样性和功能丧失,肥胖风险增加
另一项研究检查了514名苗族和克伦族个体(包括来自泰国的第一代和第二代移民)以及19名移居美国前后的克伦族个体的肠道微生物组。移民在美国定居后,经历了微生物多样性和功能的丧失,以及微生物组成的变化。
在移民前,个体原生的普雷沃氏菌菌株以及与植物纤维降解相关的细菌酶迅速消失,与之交替出现的是拟杆菌属。同时,该研究报告称,患肥胖症的风险增加。移民时的年龄,尤其是儿童早期的年龄,以及作为第二代移民等因素增加了肥胖风险,这表明移民后代谢程序的跨代失调可能至少部分由微生物组的变化介导。
移民带来的肥胖危机:可能与饮食相关
西班牙裔/拉丁裔也描述了美国移民肥胖风险增加之间的关系,这一群体的肥胖率非常高,而且随着移民或儿童早期移民的持续时间而增加。一项针对美国西班牙裔/拉丁裔人群的肠道微生物组研究表明,与肥胖风险显著相关的细菌属也与美国接触有关,并可能与西方饮食有关。
研究还表明,一些微生物类群的共存可能解释了个体肠道微生物分类组成与环境因素的关系,如暴露于美国、饮食和肥胖。这些研究提供了证据,证明新移民获得的生活方式后肠道微生物的变化可能会加剧已知风险因素(即西方饮食)对肥胖的有害影响。
从生态学的角度来看,普雷沃氏菌等主要本土物种的丧失可能会导致人类肠道微生物群的广泛组成和功能差异,从而降低生态系统对干扰的抵御能力。当这种情况发生在生命早期,宿主发育途径更容易接受微生物组信号时,这种微生态失调可能会对宿主发育稳态造成更严重的损害,从而增加免疫和代谢性慢性疾病的风险。
doi.org/10.1016/j.molmed.2023.07.002
基于人群的微生物组研究为微生物群落如何适应人类生活方式和遗传因素的梯度提供了一个窗口。从这些研究中,生活方式和饮食因素成为塑造肠道微生物群落的最具影响力的变量,尽管宿主基因和地理位置也发挥着重要作用。这些发现有力地证明了健康或失调肠道微生物群的普遍规模。
需要进行更多的微生物组研究,以特定人群的方式进一步调查人类微生物组组成的变化,特别是关于疾病的微生物组特征和研究不足人群中基于微生物组的治疗。这对于设计临床策略,预防或治疗世界不同地区的传染病和非传染病至关重要。
到目前为止,研究工作主要局限于更富裕的国家,忽略了社会不平等在人类微生物组中的大部分作用。将这项研究扩大到更大规模的人群的初步努力表明,工业化的城市生活方式和西方饮食与个体间细菌多样性的增加和个体内细菌多样性下降有关。换句话说,城市肠道微生物群更加个体化,每个宿主的物种数量减少。了解和解释这些差异对于定义每个群体的微生态失调和基于微生物组的诊断以及群体内的个性化药物至关重要。
将生态学理论与人类微生物组研究相结合,可以帮助人们了解更多关于早期微生物建立、对扰动的恢复力和功能多样性的生态驱动因素。通过观察早期生态系统建立过程中的微生物-微生物相互作用、人类迁徙研究中观察到的物种的损失和入侵,以及人们对非细菌微生物(古细菌组、病毒组和真菌生物组)的作用,可以更好地了解微生态失调的发展和解决。了解微生物变异的驱动因素对微生物共存的影响,可以为未来的微生物研究和治疗提供深刻的见解。
最后,对迁徙前后个体微生物组成的差异进行更多的研究,可以更深入地了解种群和人类各代肠道微生物组的稳定性或变化。移民往往发生在工业化、城市化地区,以寻求更好的生活条件。比较大型多民族和多文化社会中肠道微生物在迁移时间梯度上的变化,将有助于了解种群之间的微生物交换及其对健康或疾病轨迹的影响。
主要参考文献:
Parizadeh M, Arrieta MC. The global human gut microbiome: genes, lifestyles, and diet. Trends Mol Med. 2023 Jul 27:S1471-4914(23)00152-1. doi: 10.1016/j.molmed.2023.07.002. Epub ahead of print. PMID: 37516570.

谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
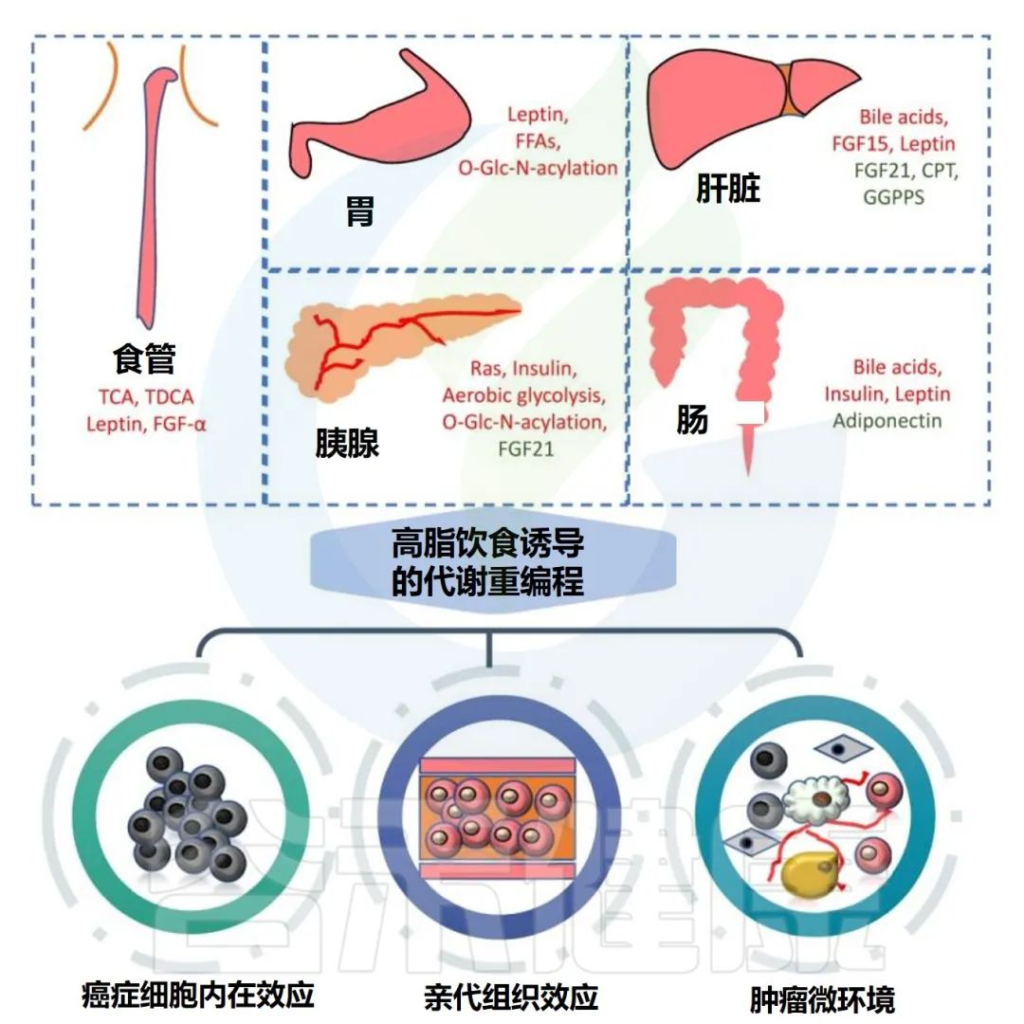
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
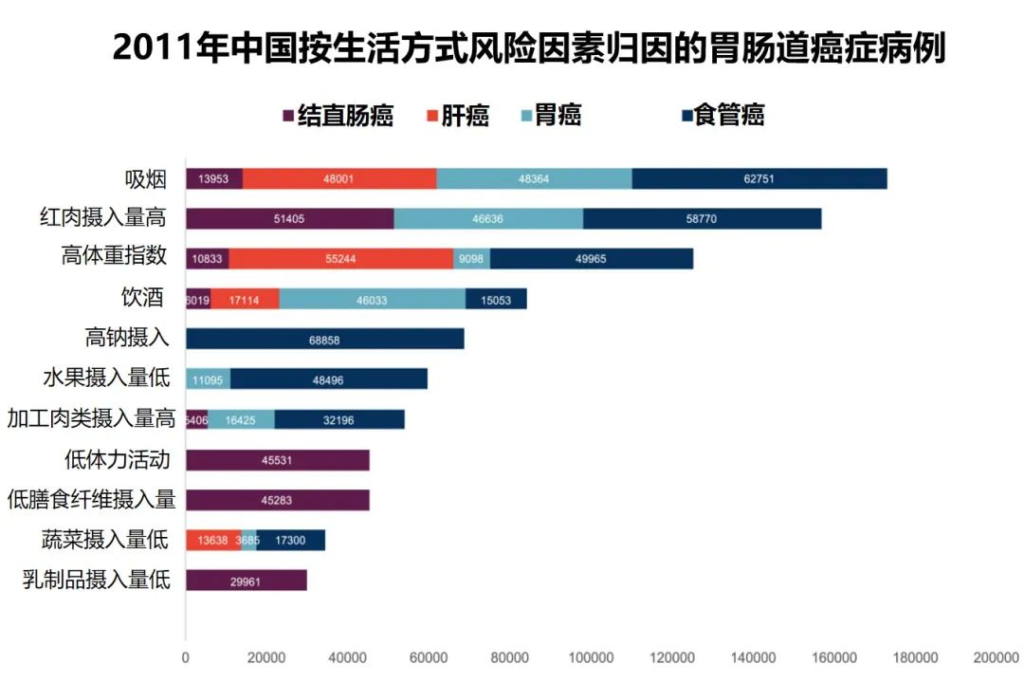
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
2011年中国不同生活方式危险因素的胃肠癌归因分数
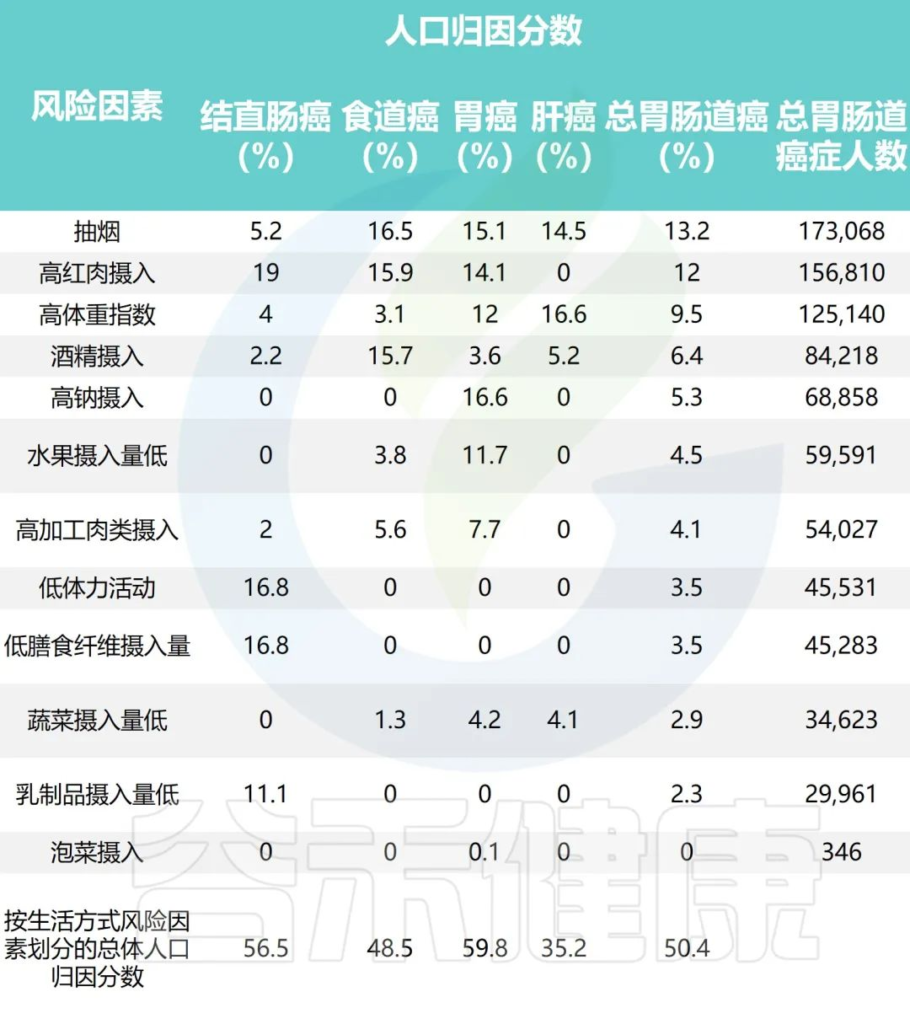
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
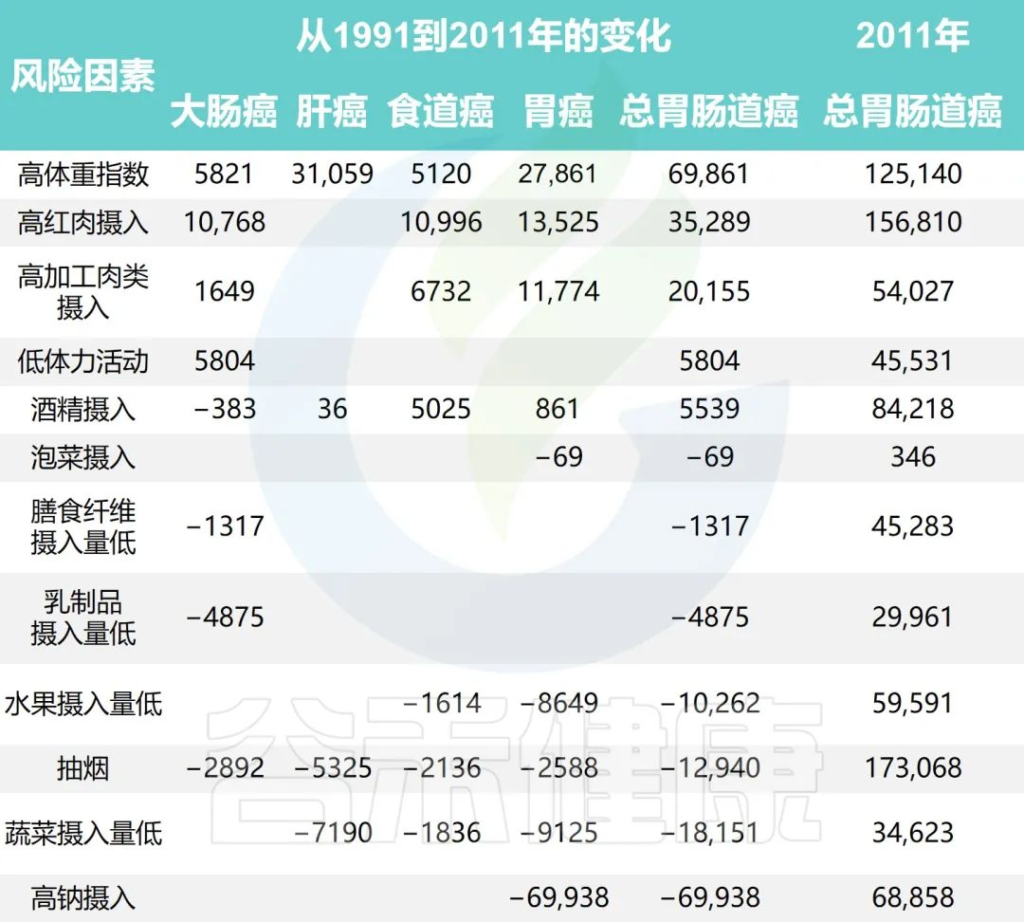
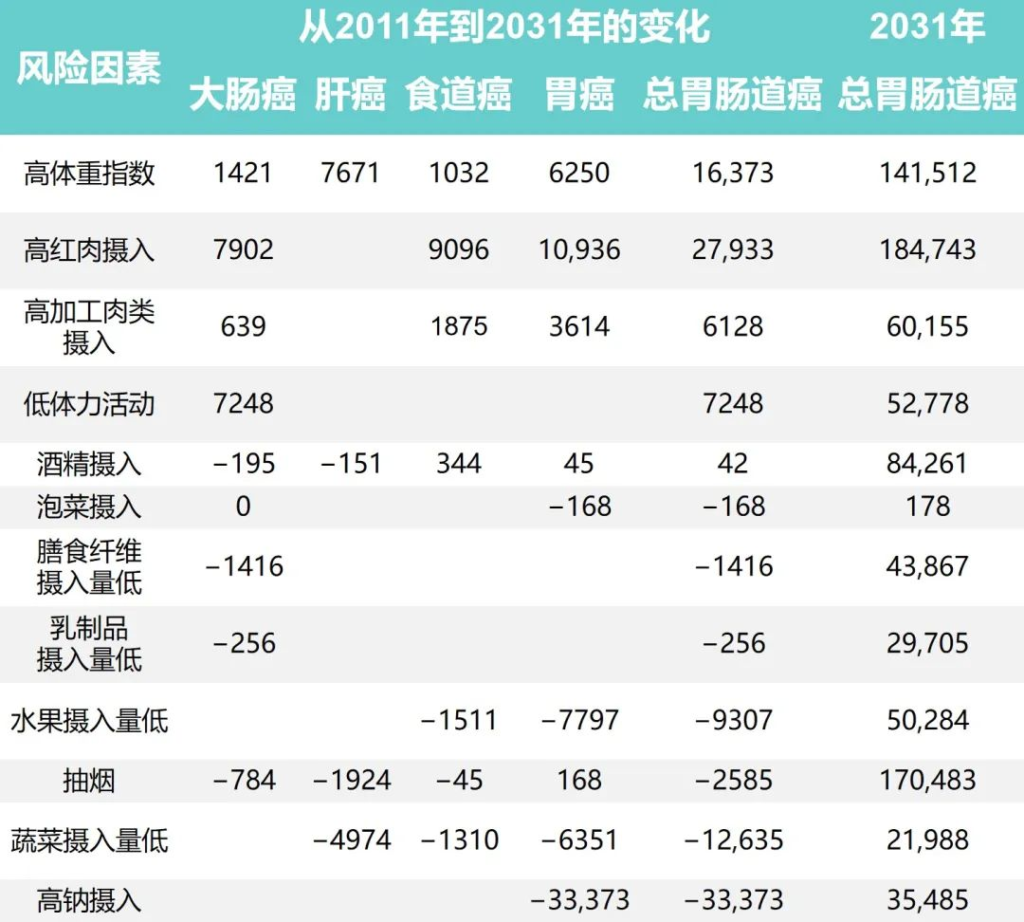
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
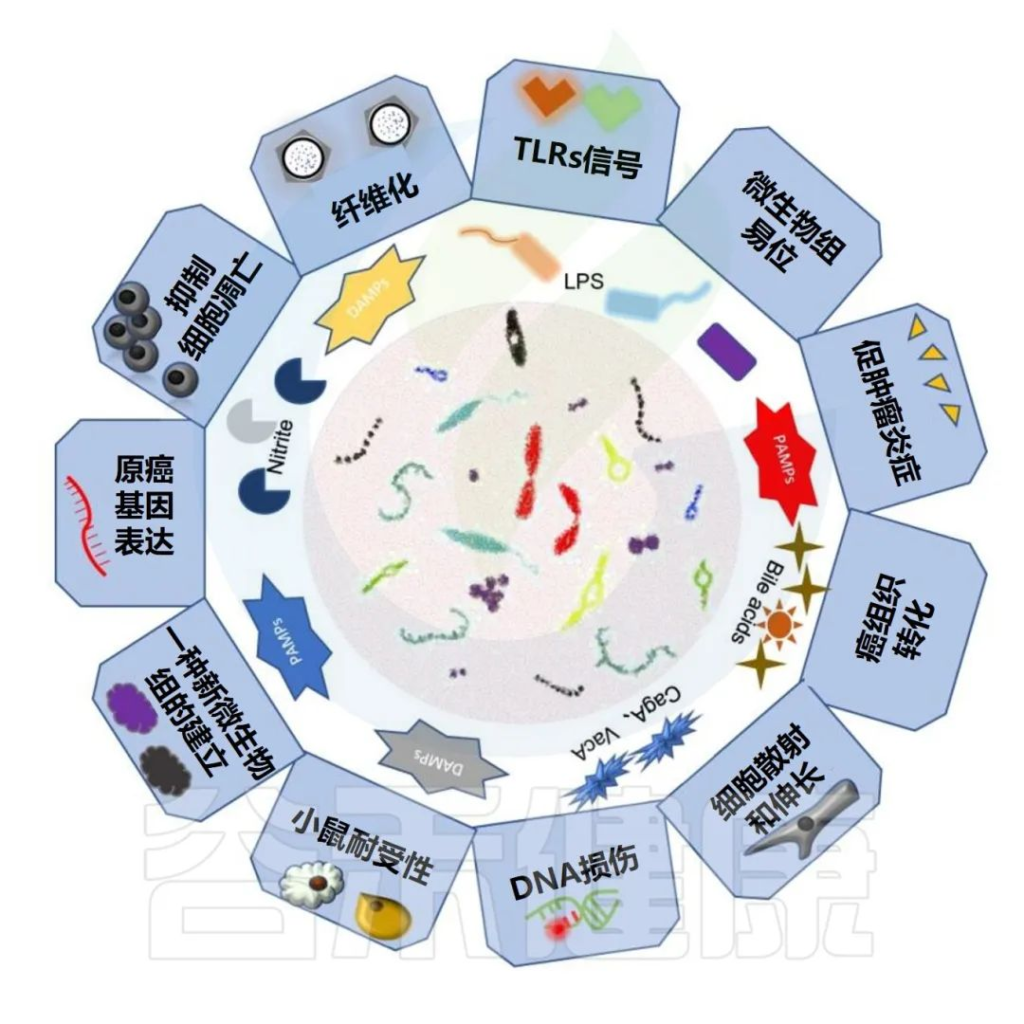
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
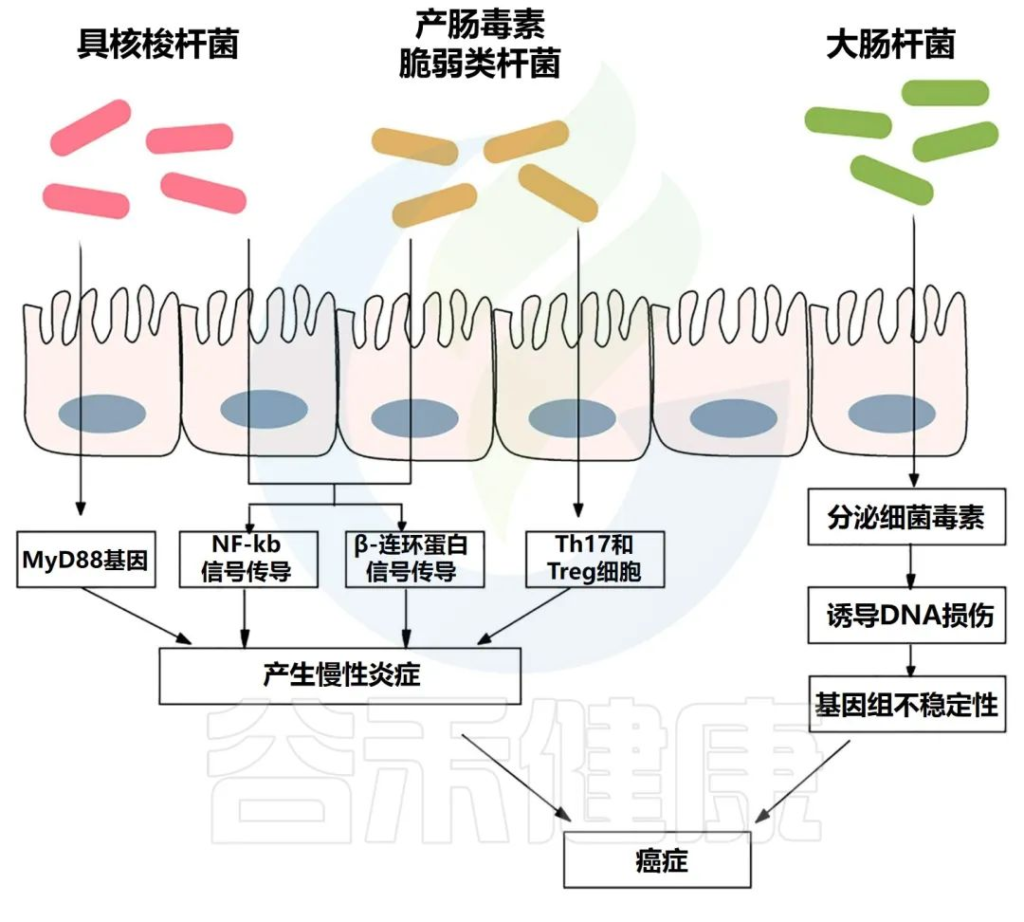
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640