国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

一听到高脂饮食,很多人就会想到会增加患心脏病和其他慢性疾病的风险。然而,低碳水化合物、高脂肪的生酮饮食却在各个方面越来越受欢迎,从减肥到自身免疫疾病等。
生酮饮食的支持者认为,通过减少碳水化合物的摄入,可以帮助控制血糖和胰岛素水平,从而降低患糖尿病和肥胖的风险。甚至有人选择生酮饮食是为了提高生产力、精力和思维清晰度。
一些研究表明,生酮饮食可能会对肠道健康产生积极影响,如减少肠道炎症、改善肠道通透性和促进有益菌群的生长。然而,也有研究认为生酮饮食会减少肠道菌群多样性,可能引发代谢紊乱等情况,这是为什么呢?
这些研究之间是否相互矛盾?
许多人对这种饮食方法可能对肠道及肠道微生物组健康产生的影响有担忧。
有一种普遍的观念认为,唯一能为有益肠道微生物提供营养的物质是复合碳水化合物,如果我们没有膳食纤维,我们的肠道屏障也会受到影响。
但事实真的如此吗?
生酮饮食真的会给肠道带来很大危害吗?
生酮饮食对肠道菌群的影响是快速的吗?
生酮饮食中的高脂肪不会增加LPS吸收吗?
为什么说生酮饮食对一些疾病具有保护作用?
生酮饮食到底是促炎多还是抗炎多?
什么人群更适合生酮饮食呢?
……
在本文中,我们将深入探讨生酮饮食对肠道健康的影响,并对证据进行完整的讨论,包括目前知道什么和不知道什么,更全面地了解这种饮食方法,可以更好地选择适合自己的饮食方式。

我们与肠道微生物的关系是数千代共同进化的产物。数百万年来,进化不仅作用于我们 23,000 个人类基因,还作用于我们体内和体表的近 400 万个基因(包括人类和微生物)。之所以成为今天的我们,是因为我们是与微生物一起进化的。
什么是代谢灵活性?
我们进化的环境需要定期适应不断变化的条件。我们的祖先并不能总是稳定地获得食物,当食物匮乏时,他们会偶尔禁食。因此,当食物充足时,我们的身体有能力燃烧和使用碳水化合物,而当食物或碳水化合物稀缺时,我们的身体有能力将膳食脂肪或储存的身体脂肪转化为酮以获取能量。这种根据饮食摄入量变化而改变新陈代谢的能力称为代谢灵活性。
那么问题来了:为什么我们的身体具有代谢灵活性来应对食物供应的变化,而我们的肠道微生物群却没有同样的代谢灵活性?
当淀粉类碳水化合物变得稀缺时,我们的祖先真的会产生“患病”的微生物组吗?
不一定。
我们可以考虑一下因纽特人等传统文化。
因此,所谓“健康”微生物组,就是你个人健康时所拥有的微生物组,对你来说健康的东西可能对其他人来说并不健康。
打个比方,选择任意两个人,平均而言,他们只会分享大约三分之一的肠道微生物群。另外三分之二的肠道菌群将因遗传、地理位置、抗生素和药物使用史、出生方式、饮食以及其他未知的因素而存在显著差异。没有足够的信息来证明一个人的“三分之二”比另一个人的“三分之二”更好。
我们在肠道菌群检测的时候,并不能以单一的指标去武断地认为这个人就是不健康,而是要结合他自身其他指标来综合判断是否需要采取某些干预措施。
我们继续来看研究数据。
很多项研究表明,给动物喂养“高脂肪饮食”会导致严重的肠道菌群失调、肠道通透性增加和全身炎症,表明高脂肪饮食可能对人类肠道微生物群不利。
不过仔细观察会发现,大多数动物研究中使用的“高脂肪饮食”,更准确地说是富含精炼大豆油、猪油和精制糖且纤维含量极低的饮食。
加州大学戴维斯分校教授 Craig Warden 博士称其为“相当于小鼠吃猪皮、排骨、可乐”。换句话说,经典的动物“高脂肪饮食”比任何精心设计的生酮饮食更能反映标准美国饮食换句话说,典型的动物“高脂肪饮食”其实更多地反映了标准西方饮食,而不是精心设计的生酮饮食。
进化来说:人易适应高脂饮食,小鼠适应低脂
低碳饮食下,经过基因筛选的小鼠容易代谢紊乱
最常用于此类研究的小鼠品系 C57Bl/6 小鼠经过基因筛选,因其能够响应“高脂肪饮食”而增加体重和升高血糖。
Richard Feinman 等人写道:
“结果表明,肥胖的啮齿动物模型,在理解代谢机制如何以与人类效应不同的方式工作方面可能最有价值。”
因此,我们不能简单地将针对经过选择性育种、喂食高度精炼“高脂肪饮食”的小鼠的研究结果,直接应用到具有健康意识的人类身上,这是对基础科学的严重误解。
那么,我们来看看人类研究。
2014 年在《自然》杂志上发表了一项研究,研究人员让健康的人类志愿者短期接受植物性饮食或动物性饮食。他们发现独特的肠道微生物群在短短三天内就出现了。
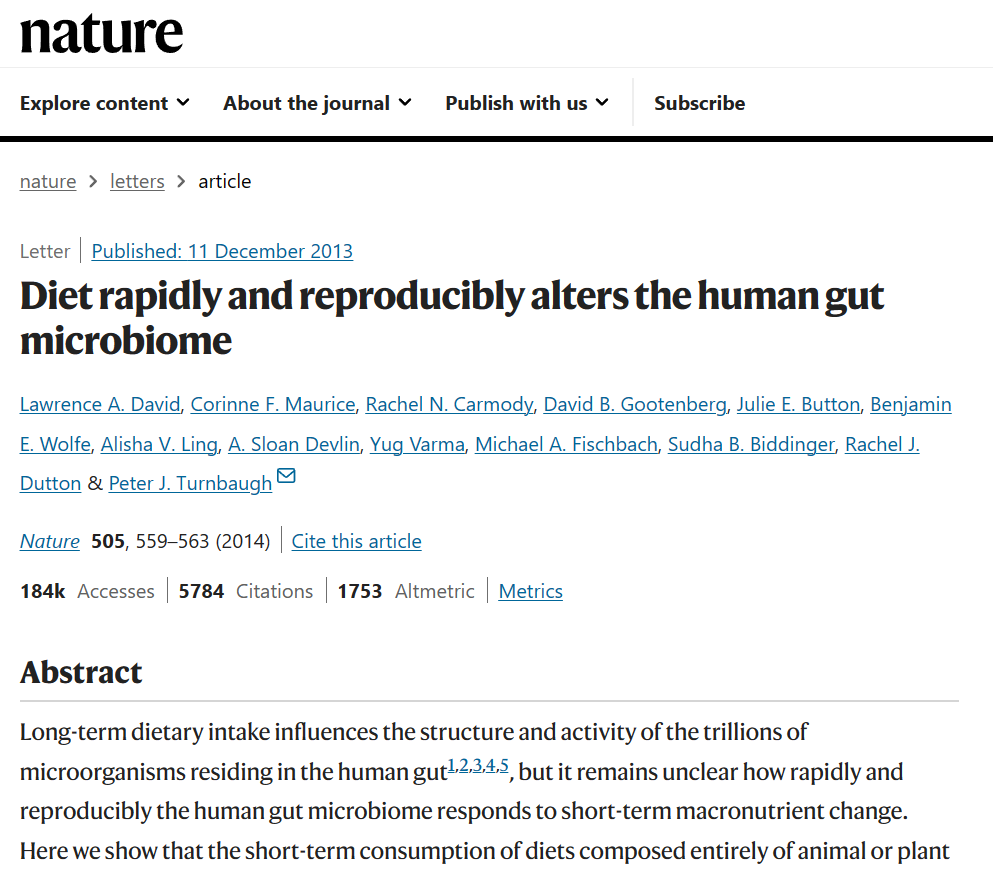
这是微生物组研究领域的一项开创性研究,自 2014 年以来已被引用超过 2700 次。其实这篇文章里面说的动物性饮食是生酮饮食。
– 植物性饮食每天包含 300 克来自谷物、蔬菜、大米、扁豆和水果的碳水化合物;
– 动物性饮食每天包含的碳水化合物少于 3 克,其中 30% 的热量来自蛋白质,70% 的热量来自蛋白质来自鸡蛋、肉和奶酪的脂肪。这种常量营养素比例与生酮饮食一致。研究人员甚至通过尿酮测量证实受试者在动物性饮食的第二天就处于酮症状态。
那么他们发现了什么?
动物性生酮饮食的参与者微生物α多样性没有变化。他们发现耐胆汁微生物相对丰度有所增加,如Bilophila、Alistipes、Bacteroides。已知代谢复杂膳食植物纤维的微生物的相对丰度减少,如Roseburia、Eubacterium rectale、 Ruminococcus bromii。
该文作者写道:
研究结果表明,人类肠道微生物组可以在草食性和肉食性功能特征之间快速切换,这可能反映了人类进化过程中过去的选择压力。
我们的祖先吃动物食品可能是不稳定的,依赖于季节和随机的觅食成功;
而现成的植物性食物提供了热量和营养的后备来源。微生物群落能够迅速、适当地改变其功能,以应对饮食变化,从而增强人类的饮食灵活性。
换句话说,我们的肠道微生物群只是在适应当前不同食物来源的可用性,它不一定会因饮食中碳水化合物或脂肪的数量而变得或多或少具有致病性。
注意:生酮饮食可能会加剧一些菌过度生长——稍后会详细介绍。
那么,更长期的研究呢?
2017 年《微生物学前沿》杂志上发表的一项研究检查了生酮饮食对 25 名多发性硬化症患者粪便微生物群的长期影响。
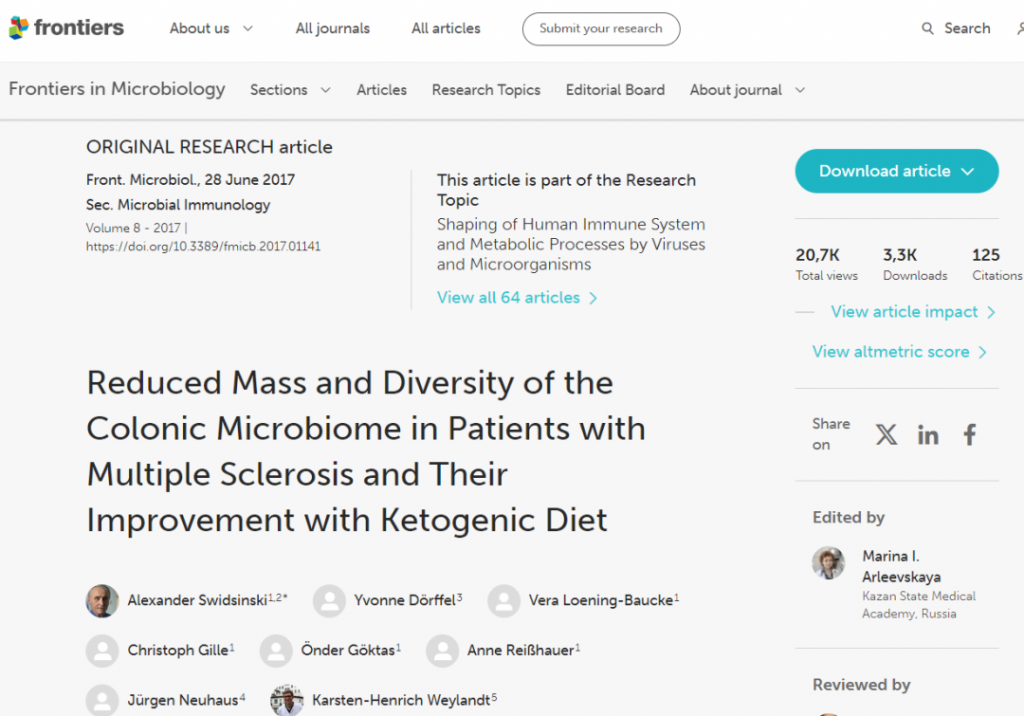
多发性硬化症 (MS) 是一种影响神经系统的自身免疫性疾病,与肠道病变有关。事实上,一些研究人员怀疑肠道菌群失调和肠道通透性可能先于自身免疫的发展。因此,如果生酮饮食可以显著改善多发性硬化症的症状,它可能不太会损害肠道,甚至可能改善肠道健康。
与健康个体相比,多发性硬化症患者在基线时的Roseburia、拟杆菌属和普拉梭菌属数量往往减少。然后他们进行了六个月的生酮饮食。
作者写道:
生酮饮食的影响是双向的。短期内,细菌浓度和多样性进一步降低。他们在第 12 周开始恢复,并在生酮饮食 23-24 周后显著超过基线值。
这表明,虽然短期饮食变化可以迅速改变肠道微生物群的组成,但我们可能需要关注长期饮食变化,并在多个时间点收集样本,以确定生酮饮食干预的真正效果。
最近发表的一项研究证实,生酮饮食可以改变肠道微生物群的结构和功能。

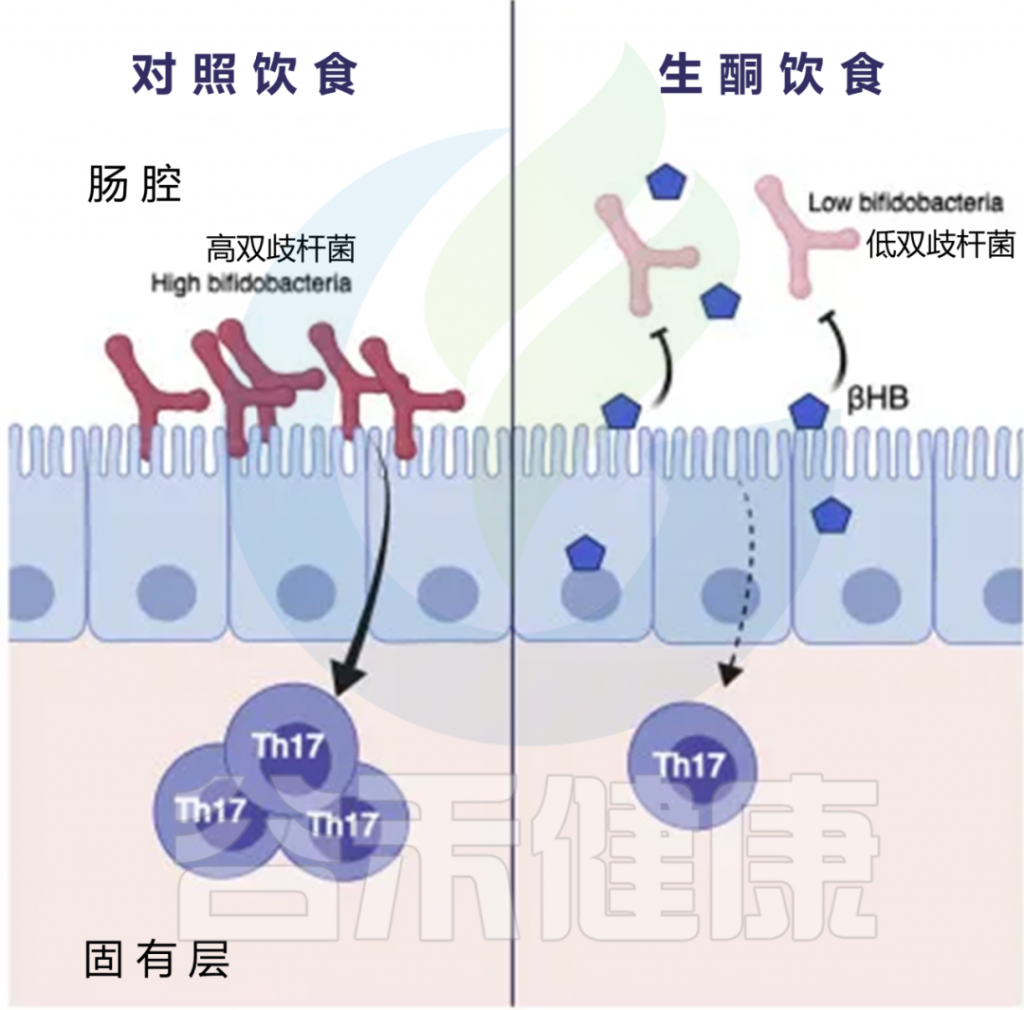
该小组招募了 17 名超重和肥胖男性参与研究的第一部分。让他们吃基线控制饮食四个星期,然后再吃四个星期规定的生酮饮食。生酮饮食最显着的变化是,几种双歧杆菌物种丰度的显著减少。
研究人员接下来对小鼠进行了控制喂养研究。相对于传统的高脂肪饮食,生酮小鼠饮食对肠道微生物组具有独特的影响,随着碳水化合物限制的增加,双歧杆菌的丰度减少。进一步的实验发现,生酮饮食或酮酯补充剂都会导致肠腔和结肠组织中β-羟基丁酸的增加。
酮体直接抑制双歧杆菌的生长
有趣的是,这与小肠 Th17 细胞的减少有关。Th17 细胞是T辅助细胞的一个亚群,可产生促炎细胞因子 IL-17,作为适应性免疫反应的一部分。这些细胞在维持肠粘膜屏障方面发挥着重要作用,并有助于清除粘膜表面的病原体。然而,Th17 细胞也与自身免疫和炎症性疾病有关,包括类风湿性关节炎、多发性硬化症和牛皮癣。
为了完善这个发现,他们将在基线饮食或生酮饮食期间收集的人类捐赠者的粪便,移植到无菌小鼠体内,以确定 Th17 细胞的变化是否依赖于酮诱导的微生物群变化。接受酮类微生物群的小鼠肠道 Th17 细胞显著降低。
doi.org/10.1016/j.cell.2020.04.027
有趣的是,与生酮饮食相比,基线饮食的总体胆汁酸池没有变化。
生酮饮食不会破坏肠道粘液层
之前的研究表明,喂食无纤维饮食的小鼠结肠粘液层有显著破坏。然而,在生酮饮食中却没有看到这一点。
作者写道:
尽管缺乏可发酵碳水化合物,生酮饮食仍能保持强健的粘液层。
这是一个关键发现。低碳水化合物者可以放心,如果处于酮症状态,肠道粘液层可能不会破坏。生酮饮食不仅维持了粘液宽度,还维持了肠道粘液主要成分 Muc2 的表达。
我们现在已经在人类身上看到了大量关于生酮饮食引起肠道微生物组变化的证据,并且看到了生酮饮食如何影响小鼠的肠道微生物群和粘液层。
让我们看看其他一些设计良好的动物研究。
生酮饮食经常用于治疗对药物治疗无反应的癫痫症。虽然生酮饮食非常有效,但几十年来,生酮饮食到底如何给大脑活动带来好处仍然难以捉摸。
然而,Elaine Hsiao 团队于 2018 年 5 月在《细胞》杂志上发表的一项研究表明,生酮饮食对癫痫的有益作用是通过肠道微生物组介导的。换句话说,如果生酮饮食不能改变微生物群,它就不能有效预防癫痫发作。
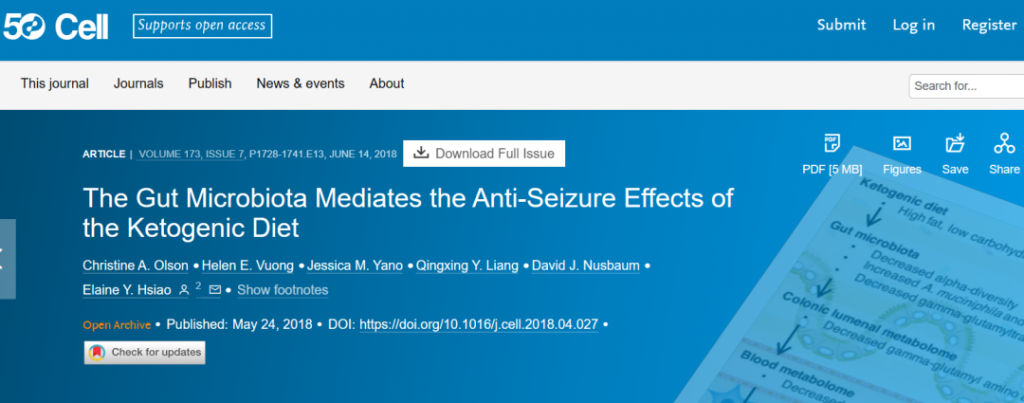
这项研究是在小鼠癫痫模型中进行的。与之前的研究一样,他们能够证明给小鼠喂食生酮饮食可以保护它们免受癫痫发作。
然而,他们进一步证明,用广谱抗生素治疗小鼠会消除对癫痫发作的保护作用。同样,在无菌培养箱中饲养且没有肠道微生物组的无菌小鼠,即使在食用生酮饮食时也无法预防癫痫发作。
doi.org/10.1016/j.cell.2018.04.027
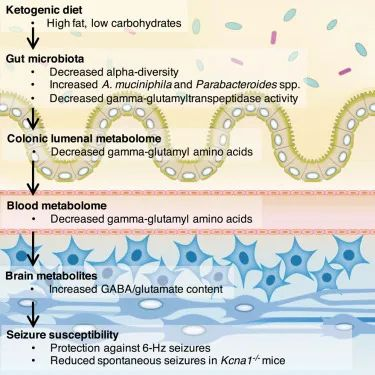
有趣的是,本研究中的生酮饮食降低了微生物多样性,但增加了Akkermansia muciniphila(简称AKK菌)和副拟杆菌(Parabacteroides)丰度。
扩展阅读:
研究人员想知道这两种微生物是否负责癫痫发作保护,并尝试用阿克曼氏菌和副杆菌来治疗喂食正常高碳水化合物食物的小鼠。令人惊讶的是,这可以防止癫痫发作。
进一步的机制实验发现了一条细菌途径,该途径提高了大脑中抑制性神经递质GABA与兴奋性神经递质谷氨酸的比例。GABA 可以镇静大脑的活动,因此这可以解释癫痫发作的减少,也可以解释为什么许多人发现生酮饮食有助于减少焦虑。
扩展阅读:
癫痫中的微生物群-肠-脑轴
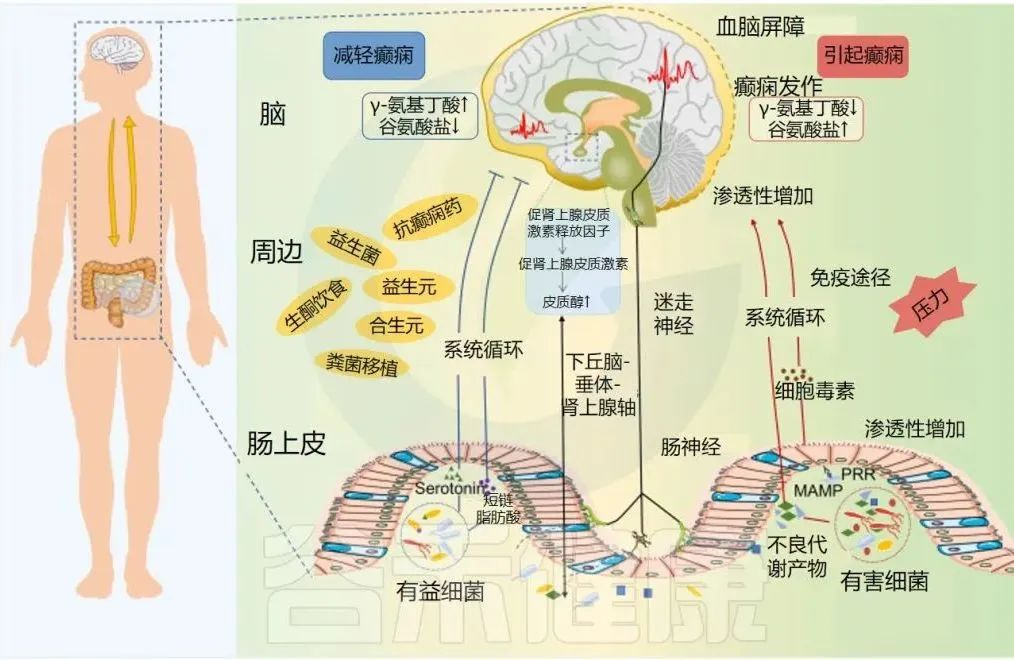
Ding M,et al.Front Immunol.2021
基于相关的人类和动物实验数据,我们深入探讨生酮饮食引起的肠道生理学变化的一些机制。
你可能会问,如果没有任何可发酵碳水化合物,肠道如何生存?
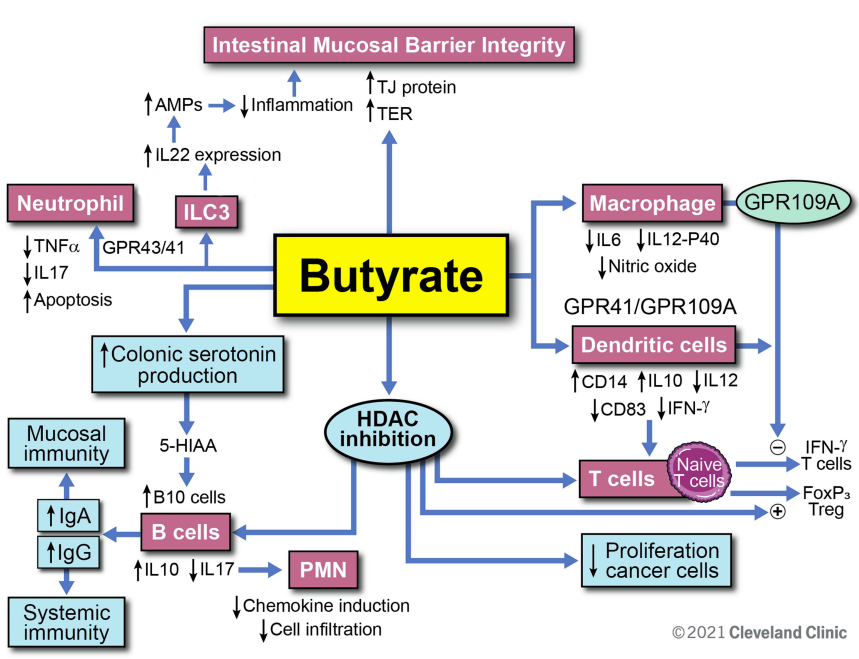
我们知道肠道细菌代谢复杂的碳水化合物,产生短链脂肪酸(SCFA),如乙酸盐、丙酸盐和丁酸盐。丁酸盐在肠道中具有重要的信号传导功能,并且是肠上皮细胞的首选燃料来源。已发表的研究表明,丁酸盐提供了结肠上皮细胞约 70% 的能量需求。
丁酸盐对免疫功能的调节作用
我们需要定期供应丁酸盐来维持肠道屏障功能吗?
不。事实证明,还有其他几种分子可以执行丁酸盐的许多信号传导功能,并作为肠上皮细胞的燃料来源。事实上,这种“首选”燃料来源的想法可能偏离了对食用大量碳水化合物的人(和啮齿动物)的研究。换句话说,生酮饮食中丁酸盐的产生可能会减少,但其他分子可以代替它来帮助维持肠道屏障功能。
扩展阅读:
有三种分子可以替代丁酸:异丁酸、乙酰乙酸、β-羟基丁酸。
异丁酸替代丁酸,刺激肠道受体
异丁酸是蛋白质发酵的代谢产物,其产生量通常低于丁酸。当丁酸较少时,异丁酸可以被肠上皮细胞从肠腔吸收并代谢为能量。前面提到的 2014 年研究发现,食用动物性生酮饮食的人类粪便异丁酸含量升高。
此外,异丁酸可以刺激肠道中与丁酸相同的受体(GPR41、GPR43和GPR109a),从而刺激粘液分泌、抗菌肽释放和免疫调节。
异丁酸浓度不足,效力来补
虽然中等高蛋白饮食中产生的异丁酸水平可能低于高碳水化合物饮食中产生的丁酸水平,但异丁酸已被证明是GPR41(FFAR3)的更强效刺激剂,这是丁酸的主要受体之一。换句话说,异丁酸在浓度上的不足,但在效力上可能弥补了这一不足。
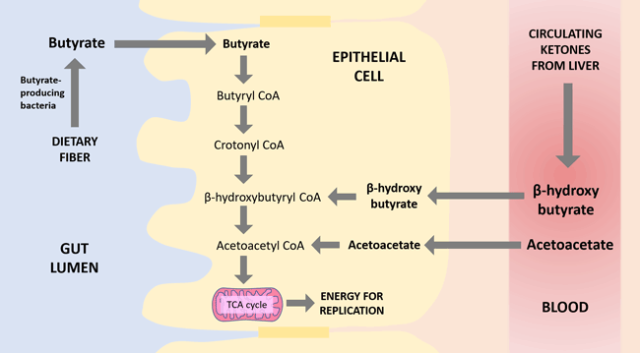
乙酰乙酸 和 β-羟基丁酸 (βHB)
是肝脏产生的两种主要酮体。与丁酸盐一样,βHB 也可以刺激 GPR109a,减少肠道炎症。然而,最值得注意的是,βHB 和乙酰乙酸都是丁酸代谢途径中的中间体。
换句话说,当丁酸盐被肠道上皮细胞吸收时,它实际上首先转化为βHB,然后转化为乙酰乙酸,然后进一步分解为能量。参考下图:
编辑
已知肠道上皮细胞在基底外侧表面(最靠近血流的细胞一侧)表达单羧酸转运蛋白 MCT1 。MCT1 可以转运酮,并且特别在使用酮体获取能量的细胞中表达。几篇论文表明,肠道上皮细胞确实能够利用血管床中的酮体。
酮体与丁酸盐在肠道健康中的角色
使用酮代替丁酸盐的能力可能看起来没有优势,但考虑到许多肠道发炎的人都存在粘膜损伤,丁酸盐的吸收受损。
那么这意味着什么呢?如果你有一个健康的微生物群和肠黏膜,丁酸可能足以应对你肠道的所有需求,不需要酮体。
但是,如果你:
尝试治疗性营养生酮来支持肠道上皮细胞代谢,至少在治疗潜在的肠道病理和治愈肠道粘膜之前是这样。
生酮饮食在治疗肠道疾病中的应用
可惜,很少有研究是针对克罗恩病、溃疡性结肠炎或肠易激综合症的生酮饮食。
一份病例报告发现,旧石器时代的生酮饮食使一名患有严重克罗恩病的小男孩完全缓解。
第二份病例报告发现,补充酮酯的低碳水化合物饮食可显著减少克罗恩病患者的炎症并提高生活质量。
另一项针对 13 名腹泻型肠易激综合征 (IBS-D) 患者的研究发现,10 名患者在 4 周生酮饮食期间症状得到缓解。

有趣的是,许多溃疡性结肠炎的患者发现生酮饮食可以缓解症状。
目前极少有研究评估酮或生酮饮食对肠道屏障功能的影响,在这方面可进一步研究。
鉴于生酮饮食相当严格,许多人开始使用酮酯或盐来实现酮症。其他人可能会在生酮饮食的基础上使用酮酯或盐来达到更深层次的酮症状态。
酮酯或酮盐对肠道微生物和丁酸盐水平的潜在影响
有趣的是,一些体外数据表明,至少在某些个体中,酮酯或酮盐可能会增加肠道丁酸盐水平。《科学报告》 2020 年发表的一项研究调查了体外发酵室中 12 种人类粪便微生物群样本的 β-羟基丁酸盐的动态。
编辑
在 7 个样本(βHB 利用者)中,超过 54% 的 βHB在发酵 30 小时后被代谢,这与已知的丁酸盐生产者粪球菌属丰度的增加有关,而粪球菌属又与丁酸盐产量的增加相关。
在其他五个粪便样本(βHB 非利用者)中,只有不到 19% 的 BHB 被代谢,并且粪便丁酸盐没有变化。
作者推测:
微生物正在将 βHB 转化为丁酸盐
这一观点得到了 2018 年发表在《细胞代谢》杂志上的一项研究的支持,该研究发现啮齿动物的间歇性禁食,导致与酮体合成和降解相关的微生物途径丰富。
另一种可能的机制是通过激活 PPAR-γ 并维持肠道低氧状态,这反过来又会支持肠道中的产丁酸菌。
一项由麻省理工学院的一组研究人员在2019年末发表在《细胞》杂志上的研究发现:
酮体信号调节了肠干细胞的正常功能及其对伤害的响应能力
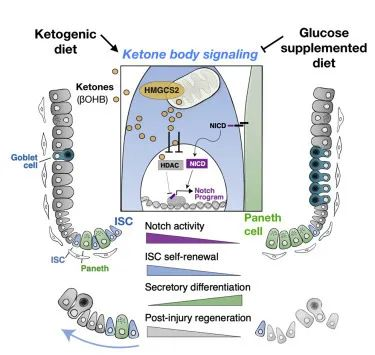
肠道上皮广泛折叠,上皮表面有峰(绒毛)和谷(隐窝)。肠道干细胞(ISC)位于每个隐窝的底部,负责每隔几天更新整个肠道上皮或修复损伤。
肠道干细胞受到许多影响其发育的不同生长因子的严格控制。之前的研究表明,膳食营养素在决定肠道干细胞功能方面发挥着重要作用,但尚未有人研究酮体及其潜在作用。
Cheng C W et al., cell,2019
酮体生产酶HMGCS2对肠道健康的影响
研究小组首先发现,生成酮体的酶HMG-CoA合成酶2(HMGCS2)在小肠干细胞中富集。HMGCS2 存在于许多不同的组织中,已知可以限制酮的形成速率。
消除肠道中的Hmgcs2基因会降低隐窝中的 β-羟基丁酸水平,并损害干细胞功能以及后肠道上皮的再生。给予外源性(补充)βHB 可挽救干细胞功能并部分恢复肠道再生。
生酮饮食对肠道干细胞和上皮再生的影响
他们接下来研究了生酮饮食的影响,发现它增加了 HMGCS2 表达、ISC 数量、功能和损伤后再生。相比之下,补充葡萄糖的饮食抑制了肠道干细胞的生酮作用,并使干细胞向杯状细胞和潘氏细胞倾斜分化。
值得注意的是,一旦干细胞分化为成熟的上皮细胞并迁移出隐窝,它们就表达很少的 HMGCS2。这表明成熟的上皮细胞不具备通过经典生酮途径(通过两个乙酰辅酶A分子的缩合)产生大量酮的能力,尽管我们了解到它们确实有能力利用酮。
因此,如果我们在生酮饮食中看到成熟肠上皮细胞中存在高水平的酮,并且这些酮不是在成熟的上皮细胞中产生的,那么酮几乎肯定来自循环。
沿着这些思路,作者写道:
因为外源性酮在体外和体内都能纠正 Hmgcs2 的缺失,肝脏或其他非肠道来源的酮体可能会替代或补充肠道干细胞生成的酮体,在生酮饮食介导的再生过程中,其中循环酮水平高度升高。
避免高脂肪饮食的另一个常见论点是,它们会增加肠道对脂多糖 (LPS) 的吸收。LPS 是一种存在于革兰氏阴性细菌细胞壁中的分子。如果它进入循环,可能会引起低度的全身炎症。
要真正理解这一机制,我们需要了解一下:
脂肪是如何消化和吸收的?
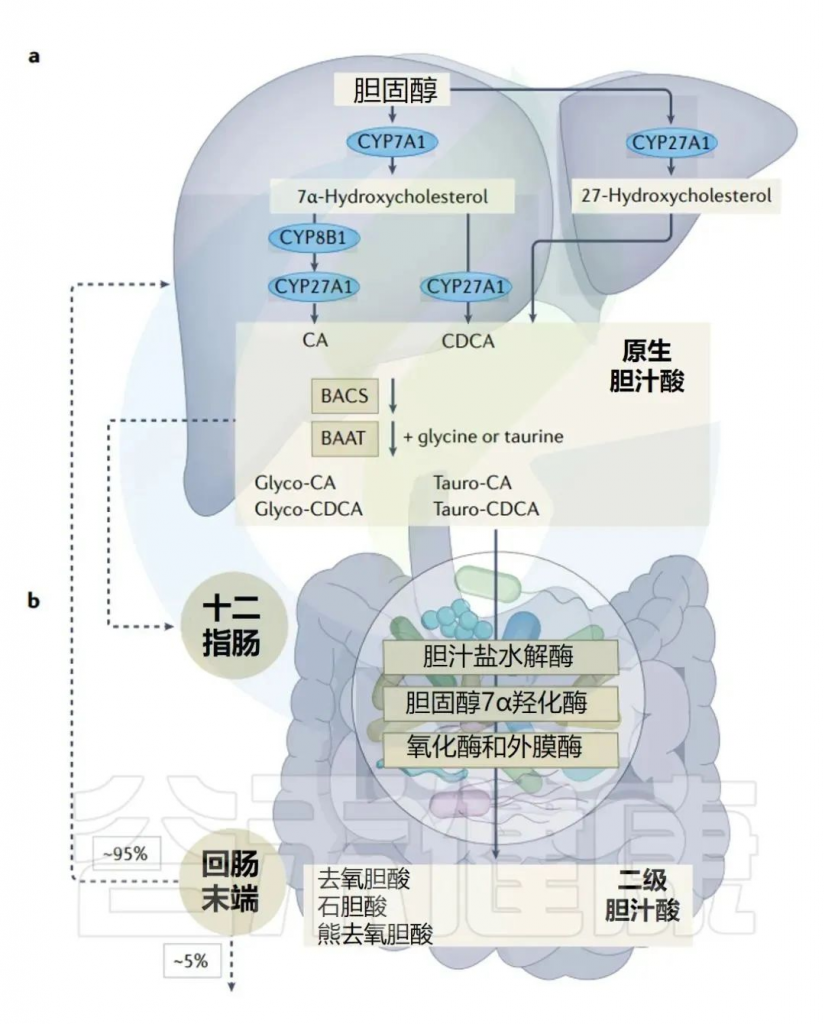
当我们吃脂肪时,小肠中的特殊细胞会释放一种叫胆囊收缩素(CCK)的激素。胆囊收缩素刺激胆囊分泌胆汁进入小肠。在这里,胆汁酸包围脂肪分子,帮助它们变成水溶性的(就像洗洁精有助于乳化油一样)。
人体胆汁酸的肠肝循环
Collins SL,et al.Nat Rev Microbiol.2023
LPS的肠道吸收与运输
事实证明,LPS 对这些称为胶束的水溶性包裹具有很高的亲和力。胶束最终扩散到肠上皮,在那里它们的内容物(包括 LPS)被肠上皮细胞吸收。上皮细胞将脂质和脂多糖重新包装成乳糜微粒,然后乳糜微粒可以通过淋巴管(携带免疫系统淋巴的血管)输送到肝脏。
关于高脂饮食增加LPS吸收的思考
当我们摄入更多的长链脂肪酸时,我们的身体就会产生更多的乳糜微粒,因此更多的脂多糖可以以这种方式搭便车。事实上,富含脂肪的膳食已被证明可以适度增加小鼠和人类的血清 LPS 水平。
虽然这绝对是一个真实的现象并且值得考虑,但其实这个问题不大,原因如下:
LPS 吸收的增加可以减少肠道粘膜的炎症
首先,一些研究表明,乳糜微粒运输 LPS 可能具有优势,因为它有利于肝脏清除 LPS,从而降低 LPS 的毒性。此外,乳糜微粒还具有灭活 LPS 的先天能力。总而言之,LPS 吸收的增加可以减少肠道粘膜的炎症。
乳糜微粒诱导的 LPS 吸收与肠漏相比——小巫见大巫
这一点尤其重要,因为全身接触 LPS 的主要方式不是通过脂肪吸收,而是通过肠漏。当肠道具有渗透性时,大量脂多糖会渗漏到粘膜下层和血液中,引起局部肠道免疫反应和全身炎症。
换句话说,与完全的肠道通透性相比,乳糜微粒诱导的 LPS 吸收可能只是杯水车薪。事实上,对于那些患有严重肠道渗透性的人来说,乳糜微粒诱导的 LPS 解毒甚至可以减少炎症,足以促进肠道上皮的愈合。
生酮饮食的受试者全身炎症减轻
反过来说,如果脂肪诱导的 LPS 吸收是一个问题,那些食用高脂肪生酮饮食的人会出现全身炎症增加?
实际上相反,接受生酮饮食的受试者几乎普遍出现全身炎症减轻的情况。
不必担心高脂肪饮食缺乏丁酸盐或增加 LPS 的吸收。在下一节中,我们将了解胆汁酸如何促进肠道健康。
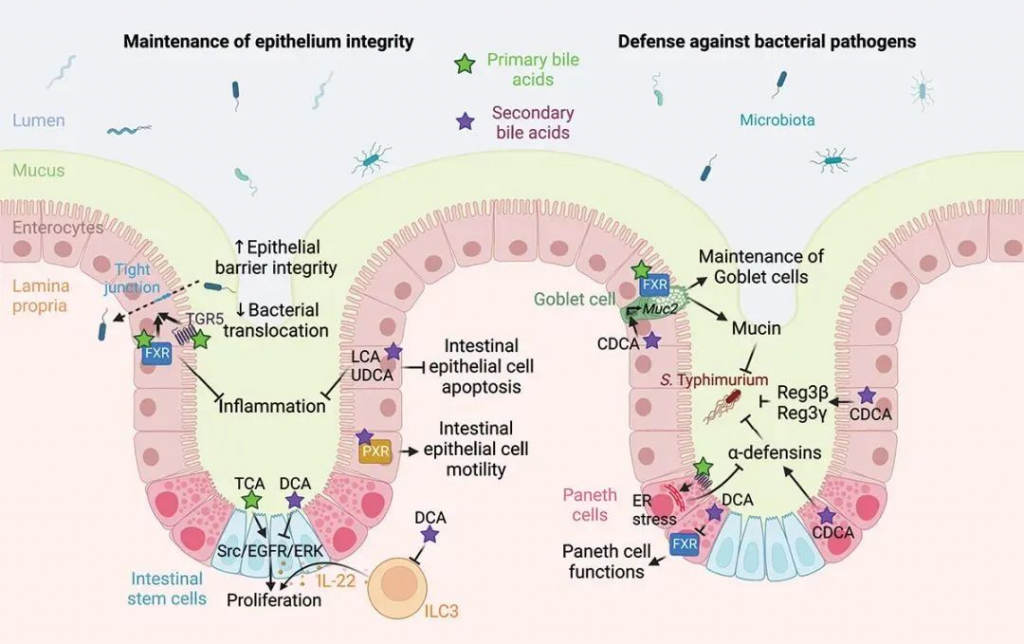
一些人还认为,高脂肪饮食可能对肠道微生物群和肠道屏障有害,因为它会刺激胆汁酸分泌增加。一般来说,吃的脂肪越多,释放到小肠的胆汁就越多。
事实上,一些研究表明,肠道屏障持续暴露于高浓度胆汁酸会导致肠道通透性增加。然而,生理剂量的胆汁酸已被证明可以支持屏障功能,诱导杯状细胞分泌粘液,促进上皮细胞迁移,并增强肠道先天免疫防御。
胆汁酸介导的肠道屏障功能调节
Larabi AB,et al.Gut Microbes.2023
胆汁酸还具有抗菌特性,有助于调节肠道微生物群,尤其可以防止小肠菌群失调。多项研究还表明,胆汁酸可激活肠内分泌细胞释放血清素,从而有助于促进肠道蠕动。
篇幅有限,每种类型的结合和解结合胆汁酸的来龙去脉就不详细阐述了,总的来说,没有足够的证据表明,生酮饮食中胆汁酸的生理增加对肠道微生物群或肠道屏障功能有害。
肉食动物饮食有时候被吹捧为治疗多种疾病的灵丹妙药。虽然全肉饮食作为短期治疗饮食可能是有益的,而且许多人的症状得到改善,但有关这种饮食方法的长期安全性的数据有限。
理论上,假设你从鼻子到尾巴吃遍动物的所有部分,从动物性饮食中获取所有营养素是可能的。有趣的是,上面提到的研究中的短期动物性饮食与维生素生物合成细菌基因表达的增加有关。作为低残渣饮食,肠道炎症的减少也可能在短期内改善营养状况。然而,我们对肉食动物饮食如何长期影响营养状况、激素、生育能力和甲状腺功能知之甚少。
此外,没有证据表明任何祖先只吃肉类或植物为生。即使是因纽特人和生活在极北纬度地区的其他人群,也会不遗余力地采集植物,或以其他方式提高他们的生育能力。
韦斯顿·普莱斯 (Weston A. Price) 在他的著作《营养与身体退化,原始与现代饮食及其影响的比较》中写道:
在北极圈附近驼鹿国家的印第安人中,六月份出生的孩子比例最高。
这是通过父母双方在雄性驼鹿从高山地区下来进入交配季节时,大量食用雄性驼鹿的甲状腺来实现的,此时喉咙下方携带甲状腺的大突起大大增大。
换句话说,这些文化有传统智慧,可以用其他动物的甲状腺进行自我用药,以弥补由于缺乏植物性食物而导致的生育能力下降。大多数现代“肉食动物”并没有这样做,许多人只吃肌肉。
话虽如此,相信在大多数情况下,治疗性生酮饮食可能同样有效,并且需要完全食肉来缓解症状,这是潜在肠道感染的一个迹象。一旦解决了这个问题,理想的饮食可能包括某种形式的植物性食物。
看到这里,希望你已经感觉到生酮饮食对于肠道健康来说一般没有什么可担心的。但这里确实有一个潜在的警告要聊,那就是硫化氢过度生长的个体。
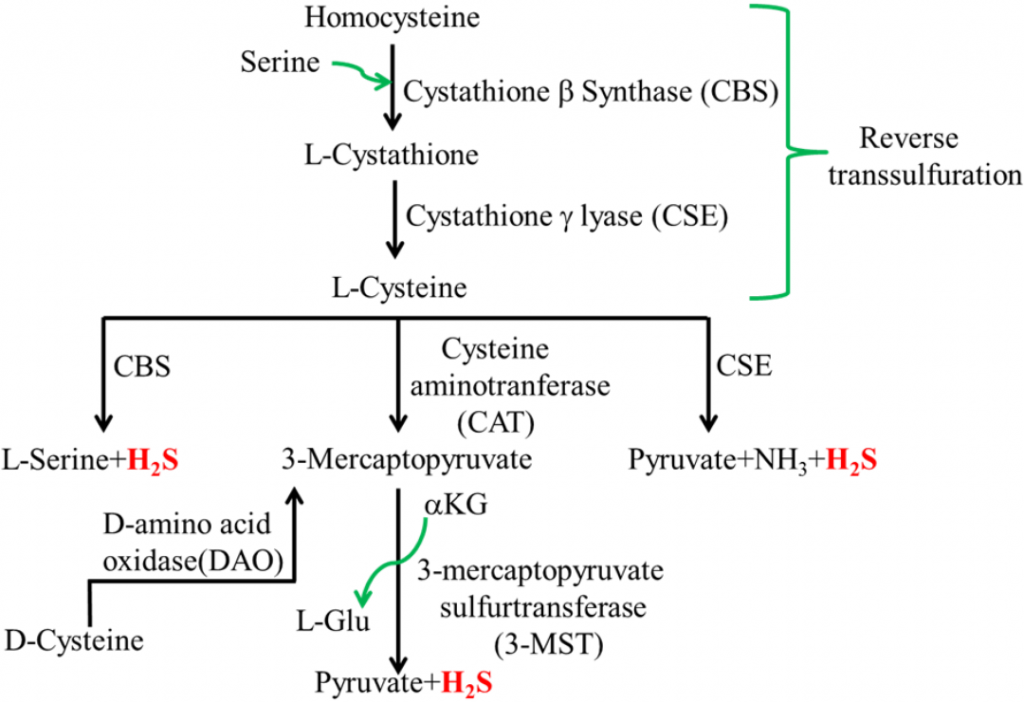
硫化氢 (H2S) 是一种无色气体,通常在体内产生,在低浓度下可作为重要的信号分子。
哺乳动物细胞硫化氢的生物合成
doi.org/10.3390/microorganisms3040866
然而,某些肠道细菌也会产生硫化氢,这些细菌的过度生长会导致硫化氢过量。H2S与腹泻、肠道过敏、IBS、IBD 和结直肠癌有关。
人类肠道中最常见的H2S产生者是Desulfovibrio、Bilophila wadsworthia和Fusobacter nucleatum。这些细菌往往在富含动物蛋白和脂肪的饮食中大量繁殖。
因此,如果有H2S过度生长,最好避免食用生酮饮食,解决了这个问题肠道重新平衡之后再尝试。
注:营养食品多酚(浆果提取物)可将H2S氧化为有效的抗氧化多硫化物,从而引发细胞保护作用。该机制表明,多酚会自动氧化为相应的半醌类物质,然后与H2S反应生成巯基,最终形成多硫化物和硫代硫酸盐。
那H2S过度生长的人适合什么饮食呢?一般来说,高纤维、以植物为主的地中海饮食实际上可能最适合。
扩展阅读:
总而言之, 没有明确的证据表明精心设计的高脂肪或生酮饮食对肠道微生物群或肠道屏障功能有害。事实上,生酮饮食带来的肠道微生物群和肠道屏障的变化甚至可能是我们从生酮饮食中看到如此多益处的原因。
此外,我们并不真正知道健康的肠道微生物群是由什么构成的,而酮和异丁酸酯可以取代丁酸。一些病例报告表明,生酮饮食可以减少 IBS 和 IBD 患者的炎症并改善生活质量。
这里强调的是,并不是说生酮饮食适合每个人。本文的目的并不是建议每个有肠道问题的人都去生酮饮食。只是对生酮饮食与肠道健康相关的证据进行更完整的讨论,让大家有个正确全面的认识。
就肠道健康而言,生酮饮食也有正确和错误的方法。下面两种饮食为肠道带来的治疗效果不同:
就此而言,以下是在食用高脂肪或生酮饮食时遵循肠道健康的一些建议:
1) 关注优质脂肪
如牛油果、牛油果油、橄榄油、多脂鱼、椰子油、放牧酥油、黄油、牛脂等。尽量摄入单不饱和脂肪、多不饱和脂肪和饱和脂肪的混合物。避免高度脂肪加工和精炼油,如菜籽油、玉米油和大豆油。

如果计划长期保持生酮饮食,建议在采用生酮饮食 1-2 个月后检查一下完整的心血管概况。一小部分人的低密度脂蛋白LDL数量会增加,可能需要调整脂肪摄入量或考虑改良生酮饮食,以确保他们不会增加心血管风险。
2)吃非淀粉类蔬菜
不一定需要丁酸盐并不意味着应该减少蔬菜的摄入量。尝试购买各种类型和颜色的生蔬菜和熟蔬菜。
3)多吃浆果
浆果是一种很好的低碳水化合物来源,提供益生元纤维,有助于促进有益细菌的生长。

4)喝咖啡,吃可可
多酚可促进有益细菌的生长,可以适量饮用咖啡和可可。具有严重肠漏或自身免疫性疾病的患者最初可能需要避免这些食物。
5)考虑营养密度,从头到尾吃
食用内脏、贝类、海鲜,并确保富含蛋氨酸的肌肉与富含甘氨酸的动物食品(如胶原蛋白和骨头汤)之间的平衡。
6)亲自实践找到最佳方案
了解生酮是否适合自己的最佳方法是尝试几周,看看感觉如何。特别注意自身能量、皮肤、情绪、生产力、消化、排便等方面。
7)灵活选择生酮饮食
没有必要无限期地处于生酮饮食状态。通过保持 20-120 克的碳水化合物摄入量(取决于自身活动水平),可以轻松地进入和退出生酮状态。实际上,这可能有助于肠道和微生物组保持最高的代谢灵活性。
全面的粪便测试是指除了标准粪便培养之外还可以提供有关肠道健康的更详细信息的任何测试。通常提供以下信息:
而肠道菌群检测使用更彻底的 DNA 测序来更细微地了解到菌属层面的肠道细菌的整体平衡。
谷禾肠道菌群检测还通过复杂的模型构建及大数据分析等方式解读人体健康状况,除了菌群详情之外,还包括疾病风险,营养构成,药物代谢等综合信息。
全面的粪便测试和肠道菌群检测都很有用,它们通常可以相互补充。
哪些人需要全面的粪便或肠道菌群检测?
如果感觉自己有以下症状或一些健康小问题,可能会需要肠道菌群检测:
消化问题、胃酸反流、胀气或腹胀、腹痛、便秘、腹泻、肠易激综合症、炎症性肠病、憩室炎、体重快速增加或减轻等。
患有肠道外其他症状的人也可以进行粪便和/或微生物组检测,例如:
食物不耐受、湿疹或荨麻疹、粉刺、情绪紊乱、抑郁或焦虑、疲劳、失眠、脑雾、关节疼痛、慢性鼻窦问题或过敏、哮喘、痛风等。
这些检测可以帮助自己了解肠道菌群的状况,为制定个性化的治疗方案提供重要参考。
主要参考文献
Singh SB, Lin HC. Hydrogen Sulfide in Physiology and Diseases of the Digestive Tract. Microorganisms. 2015 Nov 12;3(4):866-89.
Austin GL, Dalton CB, Hu Y, Morris CB, Hankins J, Weinland SR, Westman EC, Yancy WS Jr, Drossman DA. A very low-carbohydrate diet improves symptoms and quality of life in diarrhea-predominant irritable bowel syndrome. Clin Gastroenterol Hepatol. 2009 Jun;7(6):706-708.e1.
Cignarella F, Cantoni C, Ghezzi L, Salter A, Dorsett Y, Chen L, Phillips D, Weinstock GM, Fontana L, Cross AH, Zhou Y, Piccio L. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metab. 2018 Jun 5;27(6):1222-1235.e6.
Zambrano-Zaragoza JF, Romo-Martínez EJ, Durán-Avelar Mde J, García-Magallanes N, Vibanco-Pérez N. Th17 cells in autoimmune and infectious diseases. Int J Inflam. 2014;2014:651503.
Olson CA, Vuong HE, Yano JM, Liang QY, Nusbaum DJ, Hsiao EY. The Gut Microbiota Mediates the Anti-Seizure Effects of the Ketogenic Diet. Cell. 2018 Jun 14;173(7):1728-1741.e13.
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23;505(7484):559-63.
Jiang W, Chen J, Gong L, Liu F, Zhao H, Yan Z, Li Y, Zhang J, Xiao M, Mu J. Microbiota-derived short-chain fatty acids may participate in post-stroke depression by regulating host’s lipid metabolism. J Psychiatr Res. 2023 May;161:426-434.
Clemens Z, Kelemen A, Fogarasi A, Tóth C. Childhood absence epilepsy successfully treated with the paleolithic ketogenic diet. Neurol Ther. 2013 Sep 21;2(1-2):71-6.
Sasaki K, Sasaki D, Hannya A, Tsubota J, Kondo A. In vitro human colonic microbiota utilises D-β-hydroxybutyrate to increase butyrogenesis. Sci Rep. 2020 May 22;10(1):8516.

谷禾健康

嗜胆菌属
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科的一种厌氧、革兰氏阴性、耐胆汁、过氧化氢酶阳性杆菌。目前通过数据库发现在越来越多的人群,尤其男性,甚至低龄儿童中检出了高丰度的该菌。
该菌被认为是“喜欢动物脂肪喜欢胆汁”的微生物——在以动物为基础的饮食,尤其富含肉类和乳制品脂肪时,其肠道中Bilophila丰度会增加和积累。
目前为止,该属下研究最多和证据充分的菌种是沃氏嗜胆菌(Bilophila wadsworthii, B.wadsworthii),它是从穿孔和坏疽性阑尾炎患者的临床材料中回收的第三大最常见的厌氧菌。
Bilophila是机会致病菌,其丰度的增加的负面影响对肠道炎症的影响已经得到证实,B. wadsworthia与高脂肪饮食协同促进更高炎症反应、肠屏障功能障碍和胆汁酸代谢异常,导致更高的葡萄糖代谢异常和肝脂肪发生。
2021年《Cell》子刊最新研究发现生酮饮食会加剧间歇性缺氧引起的认知障碍,并认为这是由肠道菌群介导的。在生酮饮食和间歇性缺氧的双重条件下,Bilophila大量繁殖富集,进而对海马体功能造成损伤,增加认知障碍风险。
此外,证据显示Bilophila 在便秘,白赛病,重症感染,脑脓肿,帕金森,结直肠癌,卵巢癌患者中增加。
但是Bilophila属中的一些物种是有用的共生细菌,促进宿主新陈代谢并有利地塑造免疫反应。来自mSystems上发表的一项最新研究,发现Bilophila的基因组中存在遗传密码扩张现象,使三甲胺(TMA)甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生氧化三甲胺(TMAO)。该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险,但是这一结论需要更多的样本支持和验证。
Bilophila 作为正常菌群存在于人类粪便中,偶尔也存在于唾液和阴道中。来自人类的分离物通常是β-内酰胺酶阳性,因此该菌对某些β-内酰胺抗生素具有抗药性。部分的菌株也对克林霉素有抗药性。
本文基于文献调查和谷禾数据库讨论和介绍肠道重要菌属——嗜胆菌属 (Bilophila)。
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科除了脱硫弧菌属(Desulfovibrio) 的第二类重要菌属。一种革兰氏阴性厌氧菌,包括 B. wadsworthia,可引起腹腔内和其他感染。
Bilophila 属下代表物种是:Bilophila wadsworthia。该菌最初从坏疽和穿孔性阑尾炎患者的感染中分离出来。后来在包括来自阴囊脓肿、下颌骨髓炎和腋窝化脓性汗腺炎的胸水、关节液、血液和脓液的临床组织样本中也逐渐发现。
Bilophila wadsworthia 是一种革兰氏阴性、专性厌氧、过氧化氢酶阳性、耐胆汁和解酶杆菌。单独或成对出现;偶尔观察到长丝。没有观察到孢子形成。菌落宽度约为 0.7 μm,长 1.0-10.0 μm,细胞呈多形性,细胞壁不规则,约 75% 的菌株为脲酶阳性。DNA G + C 含量约为59.2。
已鉴定菌种:
Bilophila wadsworthia
Bilophila sp. 4_1_30
基于核糖体 RNA 的系统发育研究表明 Bilophila与 脱硫弧菌科另外一个成员 脱硫弧菌属(Desulfovibrio)物种关系最密切。
基于数据库和文献Bilophila和其他肠道菌属的关系如下图:
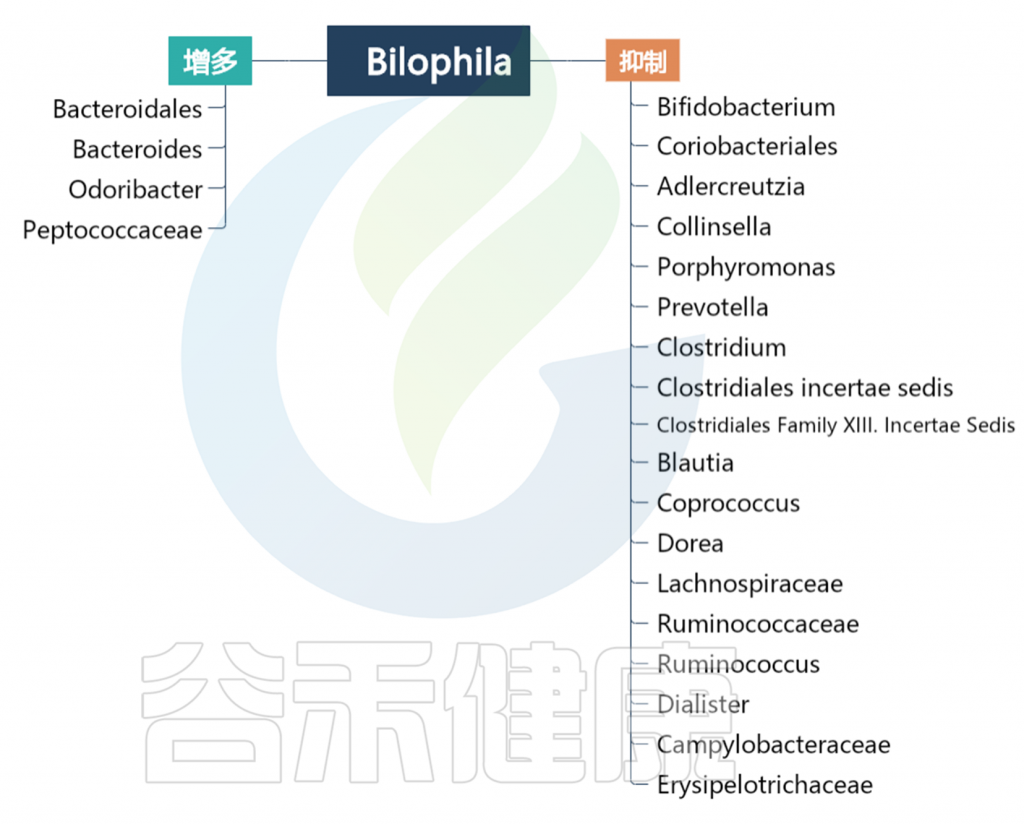

编辑
▸ 代谢牛磺酸,嗜好胆汁
该菌具有呼吸型新陈代谢,化学有机异养和非发酵。代谢蛋白底物,但不代谢碳水化合物。蛋白底物的主要产物是乙酸,含有少量至痕量的琥珀酸。能将硝酸盐还原为亚硝酸盐。
硫化物由含硫氨基酸和亚硫酸盐产生,有时由硫代硫酸盐产生,但Bilophila不会还原硫。过氧化氢酶强阳性。在甲酸盐存在的情况下,B. wadsworthia利用牛磺酸作为电子受体产生乙酸盐并将磺酸盐硫还原为硫化物。
Bilophila是机会致病菌,培养实验等得出硫,蛋白胨,L-牛磺酸,丙酮酸以及胆汁酸是B. wadsworthia扩张的基础。其代谢产物主要为硫化物,硫化氢,乙酸盐,琥珀酸等。
胆汁酸是胆固醇在肝脏分解以及肠肝循环中的一组代谢产物。在肝脏中,牛磺酸与甘氨酸一起用于结合胆汁酸以产生初级胆汁酸。胆汁酸经历肠肝循环,并被微生物群转化为次级胆汁酸。饱和动物源性脂肪先前已被证明可促进牛磺酸结合胆汁酸的产生。至少在高脂环境中,已经提出增加牛磺酸结合胆汁酸的产量是B. wadsworthia扩张的基础。
所有高脂肪喂养小鼠脂多糖(LPS)生物合成和牛磺酸代谢途径的活化显着提高,而涉及氨基酸、糖、淀粉和氮代谢的许多途径显着减少。
B. wadsworthia进一步加剧了高脂饮食情况下的胆汁酸失调,也表明该菌可能加强了高脂饮食诱导的代谢障碍和宿主功能障碍,特别是炎症和屏障功能障碍的一种机制。
▸ 喜欢动物脂肪和乳脂
小鼠和人类实验表明以动物脂肪和乳源性饱和脂肪为基础的饮食可以增加耐胆汁菌Bilophila wadsworthia.
研究人员称并没有刻意去衡量Bilophila的丰度,但当比较哪种细菌含量增加最快时,Bilophila排在首位。
不同的饮食可以快速且可重复地改变肠道微生物群的组成和功能。
《Nature》杂志的一项研究发现,当人们从素食转变为以肉类和奶酪为主的饮食结构上时,他们肠道里的细菌Bilophila几乎立即增加,但植物性为主的饮食结构可以降低该菌群的数量。一项人群研究实验,在清肠后 5 至 7 天收集素食者和杂食者的粪便样本。发现Bilophila和Lachnoclostridium与膳食动物蛋白呈正相关,与膳食植物蛋白来源呈负相关。
《Cell Metabolism》发表了一项研究,发现经常伴随红肉的饱和脂肪,还可能让人变肥胖,脂肪还会出现炎症。与之相反,以鱼肉为代表的白肉所包含的不饱和脂肪则健康很多。线性判别分析(LDA)表明,拟杆菌, Turicibacter和嗜胆菌(Bilophila)属细菌在猪油组小鼠肠道中显著增多,而在鱼油组小鼠中,主要是双歧杆菌和另一种菌 (Bifidobacterium,Adlercreutzia),乳酸菌(lactic acid)等增加。
当前西方化饮食(低纤维、高糖、高脂肪和高动物蛋白)饮食持续增加粪便中Bilophila丰度,所以在越来越多的人群水平中发现Bilophila的富集。研究表明Bilophila可以将亚硫酸盐还原为硫化氢(H2S气体),诱发炎症以及免疫和代谢障碍。这对那些尝试许多流行的“品牌”饮食(例如生酮、旧石器时代、食肉动物等)的个体具有临床意义。
▸ 产生硫化氢
硫代喹诺酮糖是葡萄糖的磺酸衍生物,在菠菜和生菜等所有绿色蔬菜中都能找到。专门的细菌配合利用磺基糖产生硫化氢(H2S)。
这种气体以臭鸡蛋味著称,也对人类健康有不同的影响:在低量的情况下,硫化氢可以对肠黏膜产生抗炎消炎作用。另一方面,肠道微生物产生的硫化氢增多,与慢性炎症性疾病和甚至癌症有关。
研究表明,与葡萄糖等喂养肠道内大量微生物不同,硫代喹诺酮糖刺激肠道微生物组中非常特定的关键微生物的生长。这些关键生物包括Eubacterium rectale物种的细菌,它是健康人常见的肠道微生物之一。E.rectale细菌通过发酵硫代喹诺酮糖,产生一种硫化合物,即二羟基丙烷磺酸盐,而这种硫化合物又是其他肠道细菌如Bilophila wadsworthia的能量来源。
Bilophila wadsworthia最终会通过一种新陈代谢途径从二羟基丙烷磺酸盐中产生硫化氢,这种途径也是最近才发现的。
以往认为主要是由于富含肉类或脂肪的饮食导致肠道中的硫酸盐和牛磺酸含量增加,已知它们是微生物的硫化氢来源。目前发现来自菠菜和藻类等绿色食物的硫代奎诺糖也有助于肠道内气体的产生,这让人感到意外。
病原菌,与肠道炎症有关
B. wadsworthia具有固有的促炎特性。然而,尚不清楚这种B. wadsworthia特征在多大程度上在宿主代谢障碍的发展中发挥作用。炎症是代谢综合征的一个重要特征;因此,尚不清楚与B. wadsworthia相关的代谢障碍是否仅继发于B. wadsworthia-驱动炎症。
为了解决这些问题,研究用广泛使用的免疫抑制剂环孢素抑制了喂食高脂饮食(HFD)的小鼠的炎症。
发现环孢素 (Ci) 有效地消除了高脂饮食喂养小鼠的炎症反应,无论它们是否含有低密度或高密度的B. wadsworthia,因此,可以清楚地推断出B. wadsworthia 的直接代谢作用。
高脂饮食 —— B. wadsworthia过度积累
为了更好地确定更高密度的B. wadsworthia是否会影响代谢功能,特意通过灌胃将B. wadsworthia给予小鼠。
结果强调高脂饮食不是B. wadsworthia在宿主肠道中茁壮成长所必需,但却是B. wadsworthia 的持续增长必不可少的。这个结果比较有意义,表明B. wadsworthia的过度积累离不开高脂饮食的喂养。
B. wadsworthia 诱发的全身炎症相关疾病
B. wadsworthia增加了高脂饮食诱导的代谢综合征,这是一种通常与低程度全身炎症相关的疾病。同时,B. wadsworthia已被证明会加剧遗传易感小鼠的肠道炎症并在野生型动物中诱发全身炎症。较高的炎症状态的特征是消瘦和体重减轻,而代谢综合征的特征是低度炎症和较高的体重指数。
因此,一个关键问题是:
B. wadworthia 如何影响两种相反的病理?
通过药理学抑制炎症,揭示了B. wadsworthia直接诱导对宿主代谢功能的负面影响的能力。
具体来说,不同的代谢障碍,即葡萄糖清除率降低和脂肪肝表型,受B. wadworthia的影响,它们并不完全依赖于其促炎特性。
尽管如此,B. wadworthia驱动的炎症仍然是一个重要因素,它进一步使平衡向更强的代谢功能障碍倾斜。因此,这可以解释为什么B. wadworthia能够在两种截然不同的环境中发挥病态作用。
B. wadsworthia通过恶化高脂饮食诱导的肠道炎症、抑制参与代谢稳态的途径、有利于增加 LPS 的产生和易位,以及减少微生物群的丁酸盐产生来作用于宿主和微生物群。这些与B. wadsworthia相关的改变中的大多数被鼠李糖乳杆菌CNCM I-3690 给药完全或部分逆转。
导致认知障碍
2021年cell最新研究,喂食生酮饮食并间歇性缺氧的小鼠的肠道微生物群中,嗜胆菌属(Bilophila)的细菌浓度急剧增加。他们还发现,沃氏嗜胆菌(Bilophila wadsworthia)沃氏嗜胆菌损害海马体,导致小鼠的认知能力下降。
减轻心血管疾病
目前导致心血管疾病(CVD)发生的心血管风险因素并没有减少,反而在增加。因此,想要防止这种疾病发生,仅靠控制传统风险因素是不够的。虽然许多二级预防患者的传统风险因素控制较好,但仍会出现新的心血管事件。
已证实肠道菌群导致胆汁酸功能性改变,决定了其与法尼酯X受体或G蛋白偶联胆汁酸受体(TGR5)等潜在受体的结合。
动物性饮食是三甲胺(TMA)的主要来源,肠道菌群代谢TMA产生的氧化三甲胺(TMAO)与心血管疾病风险的增加密切相关。
来自mSystems上发表的一项最新研究,发现嗜胆菌属(Bilophila)的基因组中存在遗传密码扩张现象,使TMA甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生TMAO。
该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险。这个结果让临床看到了机会,后续这一机制希望能尽快完成临床实验验证。
扩展阅读:
饮食-肠道微生物群对心血管疾病的相互作用
结直肠癌
结直肠癌是最常见的恶性肿瘤之一,与年龄和生活习惯密切相关,饮食风险因素包括红肉、加工肉类以及酒精,另一个风险因素是炎症性肠病,包括克罗恩病和溃疡性结肠炎。
根据已有报道发现结直肠癌患者中生成硫化物的细菌增加:
美国黑人的结肠直肠癌发病率显著高于非西裔白人,研究假设:硫酸盐还原菌在结肠粘膜中的丰度可能是导致美国黑人结肠直肠癌发病风险较高的环境因素。
无论是结肠直肠癌患者还是健康人,美国黑人的结肠硫酸盐还原菌丰度均高于非西裔白人;沃氏嗜胆菌(Bilophila wadsworthia)特异性dsrA在美国黑人结肠直肠癌患者中高于健康美国黑人;美国黑人日常摄入的脂肪及蛋白质显著高于非西裔白人,多种饮食组分与硫酸盐还原菌的丰度较高相关。
扩展阅读:
结直肠癌防治新策略——微生物群
白塞病(BD)
贝塞特氏病(Behctet,白塞病,BD)是一是一种顽固的多系统性炎症性疾病,可导致不可逆转的失明。
微生物因子被认为是造成这种疾病的原因,但其潜在机制仍不清楚。来自活动性BD患者的粪便样品富含Bilophila spp,一种硫酸盐还原细菌(SRB)和一些机会病原体。活跃的BD患者的荚膜多糖转运系统,氧化还原过程,III型和IV型分泌系统也有所增加。
网络分析表明,富含BD的硫酸盐还原细菌和机会性病原体彼此呈正相关。动物实验表明,粪便微生物群与BD患者粪便的移植增加了包括IL-17和IFN-γ在内的炎性细胞因子的产生。
帕金森病进展
对比分析了帕金森患者与对照的菌群组成及代谢功能差异,发现帕金森相关的特定菌群组成变化与疾病严重程度相关,特定的菌群代谢功能也与疾病表型相关,例如:Hoehn-Yahr分级与Paraprevotella菌属呈负相关,与嗜胆菌属(Bilophila)呈正相关;
帕金森相关菌群变化与甲硫氨酸等9种菌群代谢产物的变化相关,菌群产生泛酸的能力与帕金森患者的特定非运动症状相关。
扩展阅读:
肠道微生物与帕金森以及相关影响因素
重症病人
许多重症医学科室住院患者有严重感染。这部分是由于危重患者经常接受各种各样的药物治疗,这些药物影响肠道菌群多样性,部分是由于患者病情不稳定,可导致缺氧病变、炎症、上皮完整性破坏、运动障碍、腔内pH值变化或肠道免疫功能受损。在一项多中心研究中,ICU患者的菌群显示与炎症密切相关的微生物丰度增加,如拟杆菌属、梭菌属和嗜Bilophila菌属。
脑脓肿:病例报告
研究报道了一例20 年慢性中耳炎病史的患者并发胆脂瘤和脑脓肿的病例。使用对比材料的 CT 扫描显示右小脑半球有三个脓肿腔。
胆脂瘤标本的培养物和脑脓肿的脓液中分离出了大量的 Bilophila wadsworthia、Bacteroides fragilis 和 Prevotella oris。不存在需氧菌。患者接受了开颅手术,最大的脓肿与胶囊一起被切除。抗菌治疗包括青霉素加甲硝唑和后来的增效素。治疗的结果是患者完全治愈并完全康复。这是在慢性中耳炎和脑脓肿中分离出 B. wadsworthia 的一个典型案例。
衰老相关
Cell 子刊一项研究分析了251位18-80岁个体十二指肠菌群多样性,发现多样性受年龄、伴随疾病和用药情况多因素影响,与衰老过程呈负相关;
十二指肠核心菌群随衰老进程变化,变形菌门相对丰度增加,大肠杆菌和克雷伯菌增加,拟杆菌进行性降低;该研究显示克雷伯氏菌属增加仅与药物服用相关,梭菌属和嗜胆菌属增加则与伴随疾病相关。
症状性手骨关节炎
我国湘雅医院2021年纳入1388名平均年龄为61.3岁的受试者分析研究症状性手骨关节炎患者的肠道菌群变化,发现粪便菌群的β-多样性(而非α-多样性)与手骨关节炎显著相关;手骨关节粪便菌群中有更高的嗜胆菌属(Bilophila)与脱硫弧菌属、更低的罗斯氏菌属。
功能分析显示,手骨关节炎患者的粪便菌群中,与氨基酸、碳水化合物及脂质代谢相关的通路发生显著变化。
“
降 低
鼠李糖乳杆菌CNCM I-3690 (Lr) 的每日口服管饲导致粪便 B. wadsworthia 丰度显着降低。同样,鼠李糖乳杆菌CNCM I-3690 能够进一步减少盲肠和小肠中的 B. wadsworthia 扩张。表明除了通过阻止其在体内扩张来抑制与 B. wadsworthia 相关的代谢功能障碍外,它还通过其调节胰岛素水平的固有能力来改善代谢功能。
菊苣根纤维(低聚果糖和菊粉)是益生元营养素,可滋养有益的肠道微生物,尤其是双歧杆菌。众多人体临床研究表明,这些益生元增加了肠道内的有益双歧杆菌,同时可以减少Bilophila菌。
大枣与巴豆霜合用可减缓巴豆霜的快速利尿作用。研究发现大枣合用高剂量巴豆霜后Bilophila水平降低。巴豆霜为大戟科植物巴豆Croton tiglium L.(CT)的干燥成熟果实经去皮制霜后制得的炮制品,具有峻下冷积、逐水退肿、豁痰利咽、蚀疮的功效。因其有大毒,临床应用受到一定限制。
酵母 β-葡聚糖 (Y-BG) 是一种以其免疫调节作用而闻名的膳食补充剂,在健康小鼠中进行了为期 4 周的膳食补充剂,发现 2% 的 Y-BG 颗粒物诱导强大的肠道微生物群落变化,包括粪便Bilophila丰度的显着减少。
水果和蔬菜富含纤维、维生素 B、维生素 C、β-胡萝卜素、钾和生物活性化合物,如番茄红素和白藜芦醇。食用水果可以在维持肠道菌群平衡和改善肠道生态方面发挥作用。健康成年人食用十字花科蔬菜(西兰花、花椰菜)显示出拟杆菌门与厚壁菌门的比例呈正变化,硫酸盐还原菌(SRB) ,包括嗜胆菌和脱硫弧菌丰度下降。
扩展阅读:
常见水果对肠道菌群、肠道蠕动和便秘的影响
在患有轻度便秘的健康成年人中,食用菊粉可能会导致厌氧菌、嗜胆菌和双歧杆菌的相对丰度发生变化。特别是,食用菊粉后Bilophila丰度的下降与较软的粪便和便秘特异性生活质量指标的有利变化有关。
扩展阅读:
排便困难?便秘反复?不要忽视肠道菌群
“
增 强
主要参考文献
Natividad JM, Lamas B, Pham HP, Michel ML, Rainteau D, Bridonneau C, da Costa G, van Hylckama Vlieg J, Sovran B, Chamignon C, Planchais J, Richard ML, Langella P, Veiga P, Sokol H. Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice. Nat Commun. 2018 Jul 18;9(1):2802. doi: 10.1038/s41467-018-05249-7. PMID: 30022049; PMCID: PMC6052103.
Kivenson V, Giovannoni SJ. An Expanded Genetic Code Enables Trimethylamine Metabolism in Human Gut Bacteria. mSystems. 2020 Oct 27;5(5):e00413-20. doi: 10.1128/mSystems.00413-20. PMID: 33109749; PMCID: PMC7593587.
Yazici C, Wolf PG, Kim H, Cross TL, Vermillion K, Carroll T, Augustus GJ, Mutlu E, Tussing-Humphreys L, Braunschweig C, Xicola RM, Jung B, Llor X, Ellis NA, Gaskins HR. Race-dependent association of sulfidogenic bacteria with colorectal cancer. Gut. 2017 Nov;66(11):1983-1994. doi: 10.1136/gutjnl-2016-313321. Epub 2017 Feb 2. PMID: 28153960; PMCID: PMC5575988.
Sun Y, Ma Y, Lin P, Tang YW, Yang L, Shen Y, Zhang R, Liu L, Cheng J, Shao J, Qi T, Tang Y, Cai R, Guan L, Luo B, Sun M, Li B, Pei Z, Lu H. Fecal bacterial microbiome diversity in chronic HIV-infected patients in China. Emerg Microbes Infect. 2016 Apr 6;5(4):e31. doi: 10.1038/emi.2016.25. PMID: 27048741; PMCID: PMC4855070.
Baron EJ. Bilophila wadsworthia: a unique Gram-negative anaerobic rod. Anaerobe. 1997 Apr-Jun;3(2-3):83-6. doi: 10.1006/anae.1997.0075. PMID: 16887567.
Baldini F, Hertel J, Sandt E, Thinnes CC, Neuberger-Castillo L, Pavelka L, Betsou F, Krüger R, Thiele I; NCER-PD Consortium. Parkinson’s disease-associated alterations of the gut microbiome predict disease-relevant changes in metabolic functions. BMC Biol. 2020 Jun 9;18(1):62. doi: 10.1186/s12915-020-00775-7. PMID: 32517799; PMCID: PMC7285525.
Wei J, Zhang C, Zhang Y, Zhang W, Doherty M, Yang T, Zhai G, Obotiba AD, Lyu H, Zeng C, Lei G. Association Between Gut Microbiota and Symptomatic Hand Osteoarthritis: Data From the Xiangya Osteoarthritis Study. Arthritis Rheumatol. 2021 Sep;73(9):1656-1662. doi: 10.1002/art.41729. Epub 2021 Aug 6. PMID: 33760399; PMCID: PMC8457181.
Leite G, Pimentel M, Barlow GM, Chang C, Hosseini A, Wang J, Parodi G, Sedighi R, Rezaie A, Mathur R. Age and the aging process significantly alter the small bowel microbiome. Cell Rep. 2021 Sep 28;36(13):109765. doi: 10.1016/j.celrep.2021.109765. PMID: 34592155.
Marina M, Ivanova K, Ficheva M, Fichev G. Bilophila wadsworthiain brain abscess: case report. Anaerobe. 1997 Apr-Jun;3(2-3):107-9. doi: 10.1006/anae.1997.0084. PMID: 16887572.
Chen Y, Zhang S, Zeng B, Zhao J, Yang M, Zhang M, Li Y, Ni Q, Wu D, Li Y. Transplant of microbiota from long-living people to mice reduces aging-related indices and transfers beneficial bacteria. Aging (Albany NY). 2020 Mar 16;12(6):4778-4793. doi: 10.18632/aging.102872. Epub 2020 Mar 16. PMID: 32176868; PMCID: PMC7138539.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.
So SY, Wu Q, Leung KS, Kundi ZM, Savidge TC, El-Nezami H. Yeast β-glucan reduces obesity-associated Bilophila abundance and modulates bile acid metabolism in healthy and high-fat diet mouse models. Am J Physiol Gastrointest Liver Physiol. 2021 Dec 1;321(6):G639-G655. doi: 10.1152/ajpgi.00226.2021. Epub 2021 Oct 13. PMID: 34643089.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.

谷禾健康

现代化疗,放射疗法在摧毁癌细胞的同时,对健康细胞也造成了伤害,引发相关毒性,反应例如便秘,腹泻,疲劳,恶心,呕吐等。
癌症患者的营养状况可能是癌症治疗相关毒性的核心决定因素,也是癌症症状的指标。
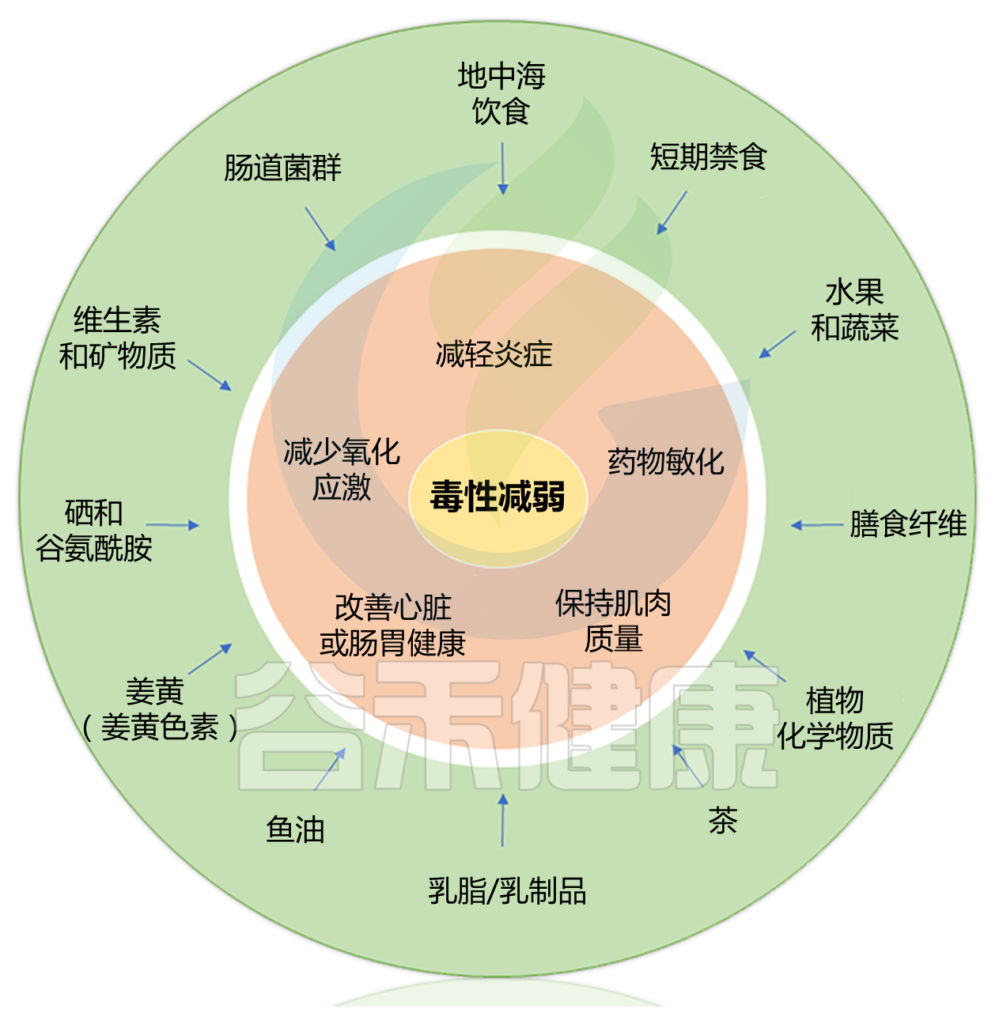
一些临床前研究和初步临床试验表明,饮食干预可能会减轻某些癌症治疗相关的症状和毒性。可能机制包括影响炎症、氧化应激、肌肉质量、心脏健康和调节肠道菌群。
本篇涵盖了三大块内容,包括:
Alan J. Kim et al.,Cancer Treatment Reviews, 2022
地中海饮食模式,其特点是大量摄入水果、蔬菜、豆类、橄榄、全谷物、不饱和脂肪、坚果和鱼类;适度饮酒;减少红肉和加工肉类以及高脂肪乳制品的摄入,对减少炎症,改善心血管健康,抗肥胖,改善血脂以及对肠道菌群和免疫调节有积极作用。
↓↓ 降低心源性猝死
在一项大型前瞻性研究中,调查了激素替代疗法、钙和维生素D或饮食调整对健康绝经后妇女的影响,发现地中海饮食模式与降低心源性猝死的风险有关。
↓↓ 缓解癌症相关的疲劳
一项随机对照试验中,23名前列腺癌男性患者接受了至少3个月的雄激素剥夺治疗,被随机分成两组,一组接受12周常规治疗,另一组接受地中海饮食并同时接受六次个性化营养咨询,与常规治疗相比,坚持地中海饮食与缓解癌症相关的疲劳以及提高总体生活质量有关。
↓↓ 减轻妇科肿瘤患者症状
一项对22名接受铂类化疗的妇科肿瘤患者的观察研究表明,坚持地中海饮食的患者胃肠道毒性较小,恶心、胃痛、腹胀和干扰日常活动的频率和严重程度差异有统计学意义。
周期性禁食即在给定的时间内部分或完全不吃除水以外的食物和饮料。在动物模型和人类患者中,周期性禁食与降低癌症治疗中的毒性密切相关。
↓↓ 延缓肿瘤进展
例如,在一项临床前研究中证明,禁食条件增加了对化疗药物的敏感性,并延缓了肿瘤的进展。还有人发现,在荷尔蒙受体阳性乳腺癌的小鼠模型中,周期性禁食或类似禁食的饮食(FMD)可增强激素治疗的活性(如他莫昔芬和氟维司群),并通过降低循环中胰岛素、瘦素和IGF1的水平以及抑制AKT-mTOR信号传导来促进长期的肿瘤消退。
↓↓ 提升生活质量
在一项针对131名HER2阴性的II/III期乳腺癌患者的II期临床研究证实了4天FMD的潜在益处。在新辅助化疗前3天和新辅助化疗当天,接受了植物性、低氨基酸替代饮食(包括肉汤、汤、液体、维生素片和茶)的患者报告称,与对照组(常规饮食)相比,总体幸福感有所提高,情绪、身体、认知和社会功能都有所改善。
↓↓ 减少化疗相关毒性
在一项对照交叉初步研究中,调查了30名接受化疗的妇科癌症患者,结果表明,短期禁食的改良形式减少了化疗相关的毒性,包括口腔炎、头痛、虚弱和总体毒性。
据报道,FMD是安全可行的,可以减少脂肪量,降低循环中胰岛素生长因子1、胰岛素和瘦素的水平。禁食强烈影响新陈代谢和细胞途径,导致循环中类胰岛素一号生长因子(IGF-1)和葡萄糖水平下降。这些变化反过来影响几个癌基因,包括RAS和AKT信号通路,导致细胞生长和增殖的下调。
禁食和FMD(低卡路里、低蛋白质和低糖的饮食)可能与减少化疗副作用有关,即当营养素缺乏时,正常细胞,而不是肿瘤细胞,可以切换到抑制生长和增殖途径的保护模式,这一过程被称为差异应激抵抗。
↓↓ 增强免疫
此外,禁食和/或FMD已被证明可以增强免疫系统,减少炎症,减缓小鼠的骨密度损失,并减少HER2阴性的II期乳腺癌患者化疗引起的淋巴细胞DNA损伤。
生酮饮食的特点通常是碳水化合物消耗量低,占每日总热量摄入量的5%-10%,但其他产生能量的大量营养素,即脂肪和蛋白质的含量却不同。生酮比用来定义饮食的生酮能力,定义为脂肪克数与碳水化合物和蛋白质克数之和的比值。
在癌症中研究最多的生酮饮食包括经典生酮饮食(CKD),其特征是生酮比为4:1或3:1,每日87%-90%的热量来自脂肪)和中链甘油三酯生酮饮食[MCTKD,其中30%-60%的总热量来自中链脂肪酸,如己酸(C6)、辛酸(C8)、葵酸(C10)和月桂酸(C12)]。
↓↓ 血糖,体重更可控,生活质量高
在接受放化疗和辅助化疗的胶质母细胞瘤患者中,那些生酮饮食患者的血糖水平低于那些标准饮食的患者。有人研究发现,在接受放疗的非转移性乳腺癌患者中,以天然食物为基础的生酮饮食与未指定标准饮食相比,体重和脂肪减少得更多,生活质量水平更高。
↓↓ 降低癌症治疗相关毒性
生酮饮食降低癌症治疗相关毒性的机制可以用瓦氏效应(Warburg effect)来解释,在瓦氏效应中,癌细胞利用糖酵解而不是氧化磷酸化,能预防由活性氧引起的氧化损伤。
生酮饮食(通常是高脂肪低葡萄糖),可以利用这种代谢差异,要么让癌细胞挨饿,要么迫使它们转而利用氧化磷酸化。与正常细胞相比,癌细胞中氧化应激的增加可以使它们对化疗和放射更加敏感,从而减少治疗所需的剂量,降低与治疗相关的毒性。
↓↓ 注意高脂肪生酮饮食的副作用
有限的依据支持在临床实践中使用生酮饮食,而且,根据总含量和相对常量营养素组成,不同类型的生酮饮食可能对治疗相关的毒副作用产生不同的影响。例如,长期食用高脂肪生酮饮食可能会增加心血管或脑血管疾病的风险,特别是与特定的抗癌药物联合使用时。高脂生酮饮食还可能增加严重脂肪性肝炎的风险,促进肝纤维化的进展。此外,研究表明,高脂肪生酮饮食增加了酮体乙酰乙酯的循环水平,并促进了异种移植小鼠中表达BRAF-V600E致癌基因的人类黑色素瘤细胞的肿瘤生长潜力。
因此,根据目前对营养的理解,接受癌症治疗的患者的饮食应该包括所有的常量营养素,以降低营养不良的风险。
膳食纤维与多种肿瘤类型的胃肠道毒性和症状的预防有关。在一项随机对照试验中,在放疗期间服用高剂量膳食纤维(18克/天)的盆腔癌患者报告称辐射引起的胃肠道毒性发生率较低,证明了膳食纤维在预防放射治疗相关毒性方面存在潜在影响。
膳食纤维还可以促进健康的肠道菌群,从而降低毒性并增强治疗效果,例如纤维与促进免疫的普拉梭菌和短链脂肪酸丁酸盐的有关。有人发现在黑色素瘤患者中,膳食纤维会影响肠道菌群,并与免疫检查点阻断反应的增强有关。

Spencer CN, et al.,Science. 2021
tips
对于腹膜癌、肠癌进展或原发性胃肠癌的患者来说,可能需要低膳食纤维饮食,以降低肠梗阻的风险。
增加水果和蔬菜的摄入量与改善胃癌幸存者的身体和认知功能、减少疲劳和食欲不振有关。
水果和蔬菜含有过多的植物化学物质,并且已经检查了几种植物化学物质的影响,并在下表中进行了总结。

Alan J. Kim et al.,Cancer Treatment Reviews, 2022
例如,葡萄产品的抗氧化和抗炎作用归因于它们的植物化学物质,即芪类、花青素和原花青素,包括白藜芦醇。
其他几种水果,包括黑醋栗、李子、石榴和苹果,已经被证明具有抗癌和细胞毒性作用,这归因于植物化学物质,特别是多酚和黄酮类物质的抗氧化和抗炎作用。
tips
对于肠梗阻风险较高的患者,应避免过量摄入水果和蔬菜相关的膳食纤维。
据报道,在70多种植物中发现的一种植物化学物质白藜芦醇可以增加结直肠癌细胞系对化疗药物的敏感性,包括阿霉素、索拉非尼、5-氟尿嘧啶、依托泊苷、丝裂霉素、奥沙利铂和姜黄素。
关于白藜芦醇在该文有详细介绍:
注意:高剂量(每天>2.5克)会引起轻微的毒性(包括腹泻、胃肠道症状和前额头痛),即使在健康的人身上也是如此。
其他多酚也可能具有抗炎和抗氧化作用。
▸槲皮素是浆果中一种常见黄酮醇,它通过作用于炎症介质,包括白细胞介素6、白细胞介素8、干扰素γ、诱导型一氧化氮合酶、环氧合酶2和肿瘤坏死因子α来诱导抗炎作用,并在对促凋亡刺激敏感的癌细胞系中提供促凋亡作用。
▸非瑟素是一种存在于草莓、苹果和柿子中的类黄酮类化合物,在结构上与槲皮素相似,具有类似的抗炎和抗癌活性。
▸番茄红素是番茄和红色水果(包括木瓜和西瓜)中的一种植物化学物质,具有高抗氧化活性,并通过减少氧化应激以及染色体和膜的异常来减轻致癌损害。此外,番茄红素具有神经保护作用,并被认为可以通过减少氧化应激和神经炎症来预防神经毒性。
喝茶,尤其是绿茶,与抗癌作用、减轻药物引起的毒性以及对化疗药物的敏感性有关。
↓↓ 抑制继发性肿瘤
茶中存在的儿茶素在促进健康的作用中起着重要作用。表没食子儿茶素没食子酸酯在体外和体内乳腺癌模型中显示了抗氧化和抗炎活性(尤其是在他莫昔芬诱导的氧化应激情况下),能够抑制头颈部或盆腔癌症患者的放射性皮炎,并抑制继发性肿瘤的继发发展。
↓↓ 防止辐射带来的不良反应
据报道,表没食子儿茶素没食子酸酯还可用于预防暴露于γ辐射或以顺铂为基础的治疗后的唾液腺细胞功能障碍,防止辐射引起的不良血液学变化(如贫血、血小板减少),以及预防博莱霉素引起的肺纤维化。
↓↓ 减少药物引起的毒性
此外,表没食子儿茶素没食子酸酯可减少伊立替康治疗期间的胃肠紊乱、顺铂引起的肾毒性和耳毒性,以及阿霉素和柔红霉素治疗引起的心脏毒性。
在药物致敏方面,绿茶显示了许多与化疗的协同作用,其中一些包括与4-羟基他莫昔芬联合使用可以提高细胞毒性水平,通过降低大B细胞淋巴瘤(Bcl-xL)基因(编码抗凋亡蛋白)的表达使得MCF7细胞对5-氟尿嘧啶增敏,以及4只接种T1的Balb/c小鼠对紫杉醇的敏感性。这种致敏作用通过降低所需化学治疗药物的剂量有效地降低了药物引起的毒性的严重程度。
乳制品/奶制品与癌症治疗之间的关系一直存在争议。尽管据报道在Balb/c小鼠中,乳制品/乳脂可以增强紫杉醇治疗的有效性,并减少与该制剂相关的毒性,例如,器官损伤、腓肠肌丧失、附睾脂肪组织减少、红细胞和白细胞损失以及空肠形态、绒毛长度和肠 γ-谷氨酰转肽酶活性的破坏。
tips
有研究表明,在被诊断患有早期浸润性乳腺癌的女性中,高脂牛奶与乳腺癌、全因和非乳腺癌死亡率的增加有关,以及与绝经前妇女乳腺癌进展的风险增加有关。
鱼油富含omega-3脂肪酸,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),在减少癌症和癌症治疗相关症状和毒性方面的作用已被广泛研究。
↓↓ 减少化疗引起的毒性
一项随机临床试验表明,在宫颈癌患者(n=40)中,补充鱼油可以减少化疗引起的毒性,如厌食、恶心、口干和味觉障碍。一项对88例癌症患者补充精氨酸、谷氨酸和鱼油的研究表明,补充精氨酸、谷氨酸和鱼油可显著减少3-4级血液毒性,并提高两年总生存率。
↓↓ 增强抗肿瘤作用
一些体外和体内研究表明,与单纯化疗相比,化疗期间给予EPA和DHA可以增强抗肿瘤作用,减少化疗对正常组织的毒性,抑制全身炎症,改善癌症患者的营养状况。同样,在紫杉醇和顺铂/卡铂治疗期间,在等卡路里饮食中添加EPA与非小细胞肺癌患者的疲劳减轻、食欲改善和化疗引起的神经病变减少有关。
↓↓ omega-3脂肪酸减少化疗毒性
omega-3脂肪酸还可以减少癌症相关的恶病质,增加免疫调节作用,从而增强结直肠癌和食道癌患者的化疗与放疗,减少食道癌患者化疗引起的毒性(如口腔炎,3/4级腹泻,以及天冬氨酸转氨酶和丙氨酸转氨酶水平的升高)。
已经提出了多种机制来解释omega-3脂肪酸在降低癌症治疗相关毒性方面的作用。其中一种假设是细胞膜的组成,这表明不饱和脂肪酸掺入癌细胞膜中,导致细胞膜组成模式与正常细胞不同。考虑到细胞膜是细胞内信号传导和基因表达调控的中心,癌细胞和正常细胞之间细胞膜上脂肪酸分布的不同可能导致信号通路的不同激活(例如,PKC激活和NF-KB 通路)。
尽管omega-3脂肪酸在临床试验中显示出了益处,但在临床前模型中,omega-3脂肪酸十六碳-4,7,10,13-四烯酸已证明可以抑制铂化合物的肿瘤导向细胞毒性,这可能会对患者造成潜在的伤害。
因此,在建议临床食用鱼油之前,有必要进一步研究普通鱼油成分与纯化的EPA/DHA对特定化疗药物的细胞毒性的影响。
姜黄是一种开花植物,可从中提取姜黄素。它们与预防和治疗化疗和放疗相关的不良事件有关。姜黄/姜黄素对癌症的有益作用归因于它们的抗氧化和抗炎特性,以及它们在抑制细胞增殖和肿瘤干细胞发展方面的作用,以及它们对肠道菌群和免疫系统的积极作用。
↓↓ 姜黄油降低化疗4级毒性发生率
姜黄油具有保肝作用,并缓解刀豆蛋白A诱导的氧化应激和炎症,从而减少人类患者的多种症状和毒性。同样,与其他草本物质:发酵大豆提取物、绿茶提取物、樟芝菌丝体、螺旋藻和葡萄籽提取物相结合,可显著降低接受亚叶酸钙/5-氟尿嘧啶化疗患者的4级毒性发生率。
↓↓ 姜黄/姜黄素减轻粘膜炎严重程度
一项评估的结论是,局部应用姜黄和姜黄素可以控制接受化疗和/或放疗的癌症患者的口腔粘膜炎,而接受姜黄/姜黄素治疗的患者报告称疼痛较轻,红斑强度较低,溃疡区域较少。一项评估32名接受放射治疗的头颈部癌症患者的临床试验也得出结论,口服纳米胶束姜黄素显著减轻了放疗引起的粘膜炎的严重程度。
↓↓ 姜黄/姜黄素有助于控制癌症相关的疼痛
一项针对绝经后乳腺癌患者的多中心临床试验(n=45)显示,联合应用羟基酪醇(一种在橄榄油中发现的具有强大抗氧化作用的酚类植物化学物质)、omega-3脂肪酸和姜黄素可以减轻患者报告的疼痛,并降低炎症生物标志物的水平。
↓↓ 姜黄与常见化疗药物的协同 / 拮抗作用
姜黄素在I期临床试验中协同增强化疗药物FOLFOX(5-氟尿嘧啶、亚叶酸钙、奥沙利铂)和达沙替尼对经FOLFOX处理的HCT116和HT-29细胞有抗增殖作用。
尽管这些结果提示了有希望的进一步研究领域,但对人乳腺癌细胞株(即MCF-7、MDA-MB-231和BT-474)的体外实验表明,姜黄素与以伊立替康或环磷酰胺为基础的化疗之间存在拮抗作用,饮食补充姜黄素可能会抑制基于化疗的肿瘤消退。这些发现表明,需要更多的研究来确定乳腺癌患者是否应该在化疗期间避免补充姜黄素。
谷氨酰胺是巨噬细胞、淋巴细胞和肠细胞的主要燃料来源,具有多种有益作用,包括改善免疫系统、减少炎症和分解应激状态。
↓↓ 化疗配合谷氨酰胺补充,降低血液学毒性发生率
一项针对接受同步放化疗的癌症患者的随机研究表明,除了常规饮食外,还接受精氨酸、谷氨酰胺和鱼油营养补充剂的患者与未接受补充剂的患者相比,发生3级或4级血液学毒性的发生率较低。
↓↓ 补硒改善免疫系统
据报道,补硒在脂质过氧化方面具有抗氧化作用,刺激自然杀伤细胞的细胞毒活性,减少肿瘤内血管生成,并在体外改善免疫系统。硒与重金属的解毒作用有关。这些影响的产生可能是因为硒是硒蛋白和酶的重要组成部分,这些硒蛋白和酶有助于抗氧化防御、减少炎症、甲状腺激素产生、DNA合成。
一项对关于硒和放射治疗的文章进行了评估,得出的结论是,每天服用300-500微克的硒,持续10天到6个月,可以减少放疗的副作用,包括腹泻、唾液腺损伤和辐射伤口,不会产生不良影响。
tips
高剂量的硒(>400微克/天)会产生严重的副作用,像指甲变脆、脱发、胃肠功能障碍、皮疹、神经紊乱等。
维生素补充剂在减少癌症和癌症治疗相关症状和毒性方面的功效研究显示出相互矛盾的结果。
例如,尽管许多研究表明维生素C补充剂具有潜在的抗癌作用和降低毒性作用,但对接受化疗的癌症患者的维生素C进行的系统审查发现,没有明确的证据表明服用维生素C补充剂可以减少毒性或改善治疗的抗癌效果。
同样,尽管维生素D补充剂已被证明可以预防癌症治疗引起的骨质流失,并恢复许多早期乳腺癌患者经历的维生素D不足,但在各种研究中报告的维生素D的抗肿瘤效果仍然很差。
tips
由于维生素补充剂在癌症治疗期间的效果尚不清楚,强烈建议患者遵守饮食建议,通过水果和蔬菜等天然食物摄入维生素,而不是依赖膳食补充剂。
一个健康人体胃肠道中的各种复杂的微生物群已显示出显著的生理益处,如增强肠道功能和消化能力、抵御病原体和调节免疫力。
虽然“健康”肠道菌群的定义并不明确,但数据表明,具有高度功能冗余度的多样化和稳定的微生物群是健康状态的关键标志。
肠道菌群对癌症患者的治疗反应有显著影响。例如,白血病或淋巴瘤患者在造血干细胞移植后具有高水平的粘液真杆菌,其复发或肿瘤进展的可能性较低。
↓↓ 肠道菌群失调影响抗PD-L1治疗效果
人类、动物和体外研究表明,肠道菌群的免疫调节影响靶向免疫治疗的疗效,如细胞毒性T淋巴细胞相关4(CTLA-4)阻断和抗PD-L1治疗。与这些发现一致的是,一部分接受抗PD-L1治疗和广谱抗生素治疗的上皮性肿瘤患者经历了失败治疗,其原因可能是导致了微生物群的失调。
进一步支持这些发现的是,从应答者和无应答者患者向有免疫活性小鼠的粪便转移导致小鼠对抗PD-L1抗体产生了与相应粪便移植供体相同的反应,从而证明了肠道菌群对抗PD-L1治疗的效果。
↓↓ 肠道菌群调节化疗的疗效和毒性
化疗药物环磷酰胺和阿霉素能诱导革兰氏阳性菌(约氏乳杆菌、鼠乳杆菌和海氏肠球菌)转移到小鼠的次级淋巴器官中。一旦转移到淋巴器官,微生物就会刺激17型和1型T辅助细胞反应的积累,从而增强免疫反应。
临床前和临床证据都表明,抗生素会降低化疗的疗效。例如,长期使用抗生素已被证明会降低环磷酰胺治疗荷瘤小鼠P815肥大细胞瘤的疗效,支持了肠道细菌易位的重要性。
一项对C57BL/6(B6)和129SvEv(129)小鼠化疗所致周围神经病变的临床前研究表明,肠道细菌在确定紫杉醇诱导的疼痛敏感性中起主导作用;在对紫杉醇诱导的疼痛敏感和抵抗的小鼠之间,观察到肠道微生物群组成的显著差异。
↓↓ 肠道菌群与胃肠道不良反应的发生率有关
一项对接受放化疗的宫颈癌患者进行的临床研究(n=35)得出结论,肠道微生物多样性与胃肠道毒性的发生率呈负相关。
同样,一项针对儿童急性淋巴细胞性白血病患者(n=51)的临床研究确定,化疗期间肠道微生物群的变化与胃肠道不良反应的发生率有关,如全身炎症和肠道粘膜炎。Toll样受体(TLRs)和肠道微生物之间的免疫调节相互作用可能调节结肠的炎症和愈合,防止甲氨蝶呤化疗的毒性。
↓↓ 肠道菌群从根本上与粘膜炎的发病机制相关
粘膜炎是一种常见的胃肠道毒性,会导致腹泻、疼痛、体重减轻和剂量限制。例如,伊立替康是一种已知会引起严重腹泻的化疗剂。这种毒性的一种机制可能是某些细菌β-葡萄糖醛酸酶的作用,这些酶已被证明通过将伊立替康的活性代谢物SN-38释放到肠腔中来诱导腹泻。
与这一假设一致,通过喹诺酮类抗生素环丙沙星抑制此类酶可抑制伊立替康治疗小鼠的腹泻,从而证明肠道微生物群的调节可以降低伊立替康的毒性。
↓↓ 肠道菌群影响癌症治疗相关的心理神经症状
一项系统评价评估了肠道微生物群与化疗之间关系的研究,得出的结论是,肠道微生物群可能会影响癌症治疗相关的心理神经症状,例如疲劳、焦虑、抑郁和睡眠障碍。
因此,相对健康的肠道微生物群可以改善癌症患者的健康,通过增强治疗效果和减少免疫疗法和化学疗法的副作用以及通过免疫调节等方式。
饮食影响肠道微生物种类的组成和多样性。膳食纤维的高摄入量有利于膳食纤维消化细菌的增加。作用机制是消化膳食纤维的细菌产生丁酸等短链脂肪酸,滋养肠道上皮细胞,从而加强肠道黏膜屏障,增强黏膜和全身免疫。
↓↓ 食品补充剂调节微生物群驱动的化学治疗毒性
由于肠道屏障和微生物群稳态的潜在损害,化疗通常与肠道菌群的改变有关。因此,预防和治疗与化疗相关的肠道菌群改变可能有助于预防与化疗相关的胃肠道毒性。
▸从鱿鱼墨汁中提取的多糖在小鼠给药环磷酰胺后可富集双歧杆菌,并减少拟杆菌,从而改善肠道微生物群功能障碍。
▸人参化合物可以增强化疗药物5-氟尿嘧啶对结直肠癌细胞系的作用,特别是当这些化合物被肠道微生物群菌群代谢时。
▸鞣花酸,一种常见于草莓、葡萄和黑莓等蔬菜和水果中的多酚,被肠道菌群代谢释放尿石素,这对人类结肠癌具有抗增殖作用。
↓↓ 益生元和益生菌在癌症治疗中发挥作用
益生元(促进有益肠道微生物生长的难消化的食物成分,例如香蕉、芦笋和朝鲜蓟)和益生菌(引入体内以发挥有益作用的微生物,例如酸奶、克非尔、酸菜、豆豉,和泡菜)与肠道菌群的组成密切相关,这些物质在癌症治疗过程中的作用很关键。
许多动物和人类研究表明,益生元、益生菌在预防化疗期间的粘膜炎方面具有强大的作用。
对于接受同步放化疗的鼻咽癌患者,益生菌与放射治疗相结合,可以通过改变肠道菌群,显着增强宿主免疫力,缓解放化疗相关的口腔黏膜炎。
VSL #3(包括Streptococcus thermophiles, Bifidobacterium breve, B. longum, B. infantis, Lactobacillus paracasei, L. delbrueckii subsp. bulgaricus, L. acidophilus, L. plantarum),在伊立替康治疗期间,减少大鼠腹泻和体重减轻。
L. casei, L. rhamnosus, B. bifidum 通过抑制肿瘤坏死因子α、白细胞介素-1b和白细胞介素-6 mRNA的表达减少化疗诱导的小鼠腹泻。
鼠李糖乳杆菌GG补充可减少人类大肠癌患者在5-氟尿嘧啶化疗期间的严重腹泻和腹部不适。
在接受化疗的儿童中使用养乐多的短双歧杆菌菌株可预防发烧并减少静脉注射抗生素的频率。
膳食补充益生元低聚果糖和菊粉可放大药物对小鼠的作用(5-氟尿嘧啶、多柔比星、长春新碱、环磷酰胺、甲氨蝶呤、阿糖胞苷),从而证明了益生元与化疗之间的协同作用。
编辑
大量临床前数据以及有限的临床证据表明,饮食因素可能在预防和/或治疗癌症以及癌症治疗相关的症状和毒性方面发挥作用,寻求特定饮食干预措施的数据仍在不断涌现。
人们对肠道菌群的性质和对癌症治疗的影响也越来越感兴趣。期待更大样本量的随机对照试验,进一步研究饮食干预措施。
最好的饮食是患者愿意并且能够坚持的饮食,因此在将这些策略引入临床时可能需要一定程度的个性化。
如果能开发出,通过调节肠道菌群来改善治疗效果的药物,其潜力是巨大的。
主要参考文献
Spencer CN, McQuade JL, Gopalakrishnan V, McCulloch JA, Vetizou M, Cogdill AP, Khan MAW, Zhang X, White MG, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science. 2021 Dec 24;374(6575):1632-1640. doi: 10.1126/science.aaz7015. Epub 2021 Dec 23. PMID: 34941392; PMCID: PMC8970537.
Yu ZK, Xie RL, You R, et al. The role of the bacterial microbiome in the treatment of cancer. BMC Cancer. 2021;21(1):934. Published 2021 Aug 19. doi:10.1186/s12885-021-08664-0
Kim AJ, Hong DS, George GC. Dietary influences on symptomatic and non-symptomatic toxicities during cancer treatment: A narrative review. Cancer Treat Rev. 2022 May 13;108:102408. doi: 10.1016/j.ctrv.2022.102408. Epub ahead of print. PMID: 35623220.
Barrea L, Caprio M, Tuccinardi D, Moriconi E, Di Renzo L, Muscogiuri G, Colao A, Savastano S; Obesity Programs of nutrition, Education, Research and Assessment (OPERA) group. Could ketogenic diet “starve” cancer? Emerging evidence. Crit Rev Food Sci Nutr. 2022;62(7):1800-1821. doi: 10.1080/10408398.2020.1847030. Epub 2020 Dec 4. PMID: 33274644.
Baguley BJ, Skinner TL, Jenkins DG, Wright ORL. Mediterranean-style dietary pattern improves cancer-related fatigue and quality of life in men with prostate cancer treated with androgen deprivation therapy: A pilot randomised control trial. Clin Nutr. 2021 Jan;40(1):245-254. doi: 10.1016/j.clnu.2020.05.016. Epub 2020 May 25. PMID: 32534948.

谷禾健康
热门综艺《向往的生活》第四季中,嘉宾岳云鹏的“吃了就困”,“吃了睡,睡了吃”…意外抢镜。
他说自己,吃完饭就犯困 ↓↓↓

对于 “饭后就困” 这件事,网友们表示太真实,自己也一样 ↓↓↓

生活中,我们会发现很多人吃完就会感到疲倦,想睡觉,那么,
为什么吃完饭会想睡觉?
所有人都是这样的吗?
有没有可能通过一些方法改善?
……
饭后感到疲倦的程度可能会因人而异,因为它可能取决于许多因素,包括年龄、健康状况、食物的数量和类型、一天中就餐时间等等。
本文将归纳整理“餐后疲劳”的一些原因,从而帮助预防和改善餐后疲劳。
关于人们饭后感到困倦的原因,科学家们有许多假设。
根据一项实验假设,困倦的原因之一与下丘脑有关。这个假设主要在动物身上进行了测试。
科学家认为几个下丘脑区域,例如视交叉上核 (SCN)、外侧下丘脑 (LH) 和下丘脑腹内侧核 (VMH),与睡眠、清醒和食物摄入的调节有关。
睡眠和进食之间有很强的双向互动。
我们知道,身体需要能量来运作和生存。人体从食物中获取能量,食物通过消化过程分解并转化为燃料或葡萄糖,然后大量营养素为身体提供能量。这个消化代谢过程触发体内的各种反应。
以下列举的每一种原因都可能与餐后疲倦有关,虽然每个原因都是不同的,但餐后疲劳可以由这些因素的任意组合引发。
01 糖和精制碳水化合物
单糖和精制碳水化合物会迅速分解成葡萄糖,这可能会引发更突然和明显的疲劳。
研究表明,高血糖会抑制控制清醒的食欲素。食欲素在下丘脑中最为活跃。
这里要提到orexin/hypocretin(食欲素/下丘脑分泌素)。
食欲素是一种调节清醒和食欲的神经递质。大脑在下丘脑中包含大约 10,000 到 20,000 个神经元,但这些神经元的轴突延伸到整个大脑和脊髓,那里也有食欲素的受体。
它有什么作用?
科学表明,大脑食欲素神经元刺激清醒、警觉、进食、寻求奖励和健康的葡萄糖平衡。食欲素被认为是迄今为止最重要的唤醒刺激剂。
因此,将白面包等精制碳水化合物换成高纤维(低升糖指数)碳水化合物对整体健康更好。
02 炎症和食物敏感性
研究人员认为,有些人饭后感到疲倦的另一个可能原因与炎症有关。TNF和IL-1b等炎性细胞因子似乎会抑制促进清醒的食欲素。