 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

拟杆菌门细菌是革兰氏阴性菌的代表,具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。是最耐氧的厌氧菌之一。
参与人体结肠中许多重要的代谢活动包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
多糖而不是单糖是拟杆菌的主要能量来源,拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。
很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。但是,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
本文再次聚焦拟杆菌门,拟杆菌属,及其代表菌种多形拟杆菌(B.thetaiotaomicron),以多形拟杆菌讲述了一个基于动态环境下共生菌群或菌种与其他菌互作及其生存进化的复杂故事范例。请注意拟杆菌,不仅交叉喂养病原体,而且在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
拟杆菌属细菌属于人类肠道微生物群中最普遍和最丰富的成员。虽然偶尔充当肠道外的病原体,但这些细菌被认为是结肠腔和粘膜层的共生定殖者,并且长期以来已知可提供针对肠道病原体的定殖抵抗力。然而,基于粪便微生物组学的相关性研究经常会得出关于它们对宿主健康与疾病的贡献相互矛盾的结果,尤其在肠道感染中的作用比预期的更加微妙。
我们结合谷禾大量检测实践,越来越认识到拟杆菌介导的定植抗性背后的复制和矛盾性,以及不同肠道病原体利用它们来建立感染的可能性。
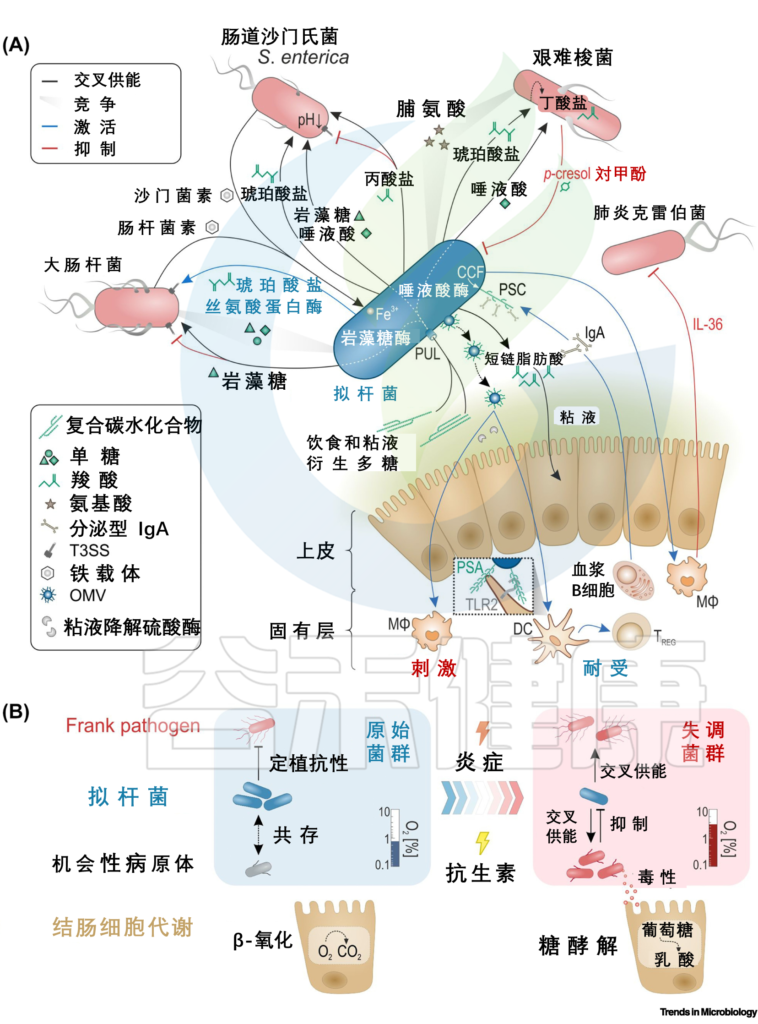
DOI: 10.1016/j.tim.2021.11.009
A) 互利拟杆菌属的相互作用。与肠粘膜以及与直接病原体肠出血性大肠杆菌(EHEC)和鼠伤寒沙门氏菌以及机会性病原体艰难梭菌和肺炎克雷伯菌有关。根据最近的文献汇编。肠道拟杆菌属也可能相互影响,例如,通过分泌的抗菌蛋白或通过某种“共享物”。
(B)通过病原体诱导(炎症)或治疗诱导(抗生素)破坏微生物群滋养免疫力,从原始微生物群向生态失调转变的简单化观点。
结肠细胞线粒体中的β-氧化会消耗氧气,造成管腔厌氧,而糖酵解则不消耗氧气,从而导致上皮氧合增加。拟杆菌属,不仅交叉喂养病原体,还在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
多形拟杆菌(Bacteroides thetaiotaomicron,B. thetaiotaomicron)是成人肠道的主要组成部分,已被用作研究人类细菌共生的有用模型。
降解植物多糖
它对人类的代谢不可忽缺功能是降解植物多糖,这是人类肠道非常重要的能力。此外,在产后母乳和富含植物淀粉的饮食之间的过渡过程中,这一点也有非常重要。
由于多形拟杆菌感应潘氏细胞发出微生物信号,它可以刺激肠道内的血管生成(从现有血管中生长出新血管)。B. thetaiotaomicron 通过为其他微生物帮助处理的营养物质提供足够的吸收能力来使其宿主受益。
塑造肠道粘膜屏障
多形拟杆菌介导的肠道内另一个出生后发育过程是肠粘膜屏障的形成,它通过调节物种特异性蛋白质抗生素的表达来帮助保护宿主免受病原体入侵。B. thetaiotaomicron 中存在的环境感知“调节装置”允许适应性食物寻找,从而稳定食物网,进而有利于群落的稳定和长寿。这种适应性“觅食”的能力是生物技术感兴趣的领域。
有异常大的“糖生物组”
多形拟杆菌是人类肠道远端的厌氧共生体,具有异常大的糖生物组,参与多糖获取和代谢的基因库。当膳食多糖受到限制时,这种糖生物组使 B. thetaiotaomicron 能够转向宿主多糖。B. thetaiotaomicron 不仅可以水解宿主衍生的聚糖,还可以主动确定肠道上皮细胞产生的聚糖的类型。
促进微生态系统稳定
B. thetaiotaomicron 诱导宿主衍生的聚糖可能具有适应性功能,为自身创造一个其他亲糖生物可以利用的生态位,从而促进生态系统的稳定性和功能多样性。这些独特的特征促使 B. thetaiotaomicron 被定性为关键物种。
B. thetaiotaomicron 可能稳定微生物生态以实现健康的宿主-微生物群关系的另一种机制涉及其能够诱导抗菌肽血管生成素,从而杀死机会性或致病性生物体,与此同时不能杀死 B. thetaiotaomicron 或其他共生体。
抵抗炎症变化
此外,B. thetaiotaomicron 通过过氧化物酶体增殖物激活受体-γ (PPARγ) 依赖性核因子-κB 亚基 p65 的核输出来抑制促炎基因的转录,从而潜在地抵抗可能破坏共生微生物群稳定的炎症变化。
例如,细胞毒性 T 淋巴细胞蛋白 4 (CTLA4) 阻断免疫疗法依赖于特定拟杆菌属物种(多形拟杆菌和脆弱拟杆菌)。这些结果表明,深入了解对拟杆菌类群的肠道微生物群特定成员的免疫反应,可能有助于为癌症治疗奠定基础。
“
根据微生物群滋养免疫概念,宿主应用栖息地过滤器来主动塑造其微生物群并维持互利共生状态。其中一种栖息地过滤器是上皮缺氧(关于这个详细的介绍我们在氧气与肠道共生菌那篇文章里讲过,详见:肠道漏氧会发生什么,健康的肠道是什么样?),这是成熟结肠细胞中线粒体β-氧化的结果。
粘膜表面的低氧浓度促进了专性厌氧细菌(包括拟杆菌属和一些产丁酸菌)的优势。反过来,这些细菌积极调节其肠道环境并影响宿主生理(例如,负责的免疫调节分子至少部分地通过外膜囊泡细菌表面衍生的双层球体,可以通过粘液屏障扩散)递送至真核靶细胞。
确保“正确的微生物”做“正确的事”
宿主栖息地过滤器不仅确保“正确”的微生物保留在肠道中,而且还确保它们做“正确的事情”。例如,血浆 B 细胞产生针对具有促炎潜力的拟杆菌表面结构的免疫球蛋白(主要是 IgA) ;这些免疫球蛋白减轻粘膜炎症,维持细菌分类群的多样性(关于IgA调节菌群多样性和菌定植的详细介绍可以参考我们以前的文章,详见对抗病原菌,帮助共生菌定植的“重要开关”),并调节拟杆菌代谢。
有趣的是,最近的发现表明某些拟杆菌属,增选 IgA 反应。例如,脆弱拟杆菌有意表达 IgA 反应性表面多糖C,使其被抗体修饰,从而改善粘液粘附,使细菌能够进入确定的空间生态位并促进与宿主的长期共生。
“
枢纽
拟杆菌属对宿主生态位的抢占、免疫系统的教育以及“益生菌”细菌的交叉喂养提供了针对病原入侵者的定植抵抗力。此外,拟杆菌与病原体竞争宿主来源的氨基酸(特别是脯氨酸和羟脯氨酸)和单糖(包括核糖、岩藻糖、阿拉伯糖、鼠李糖和果糖)并产生短链脂肪酸(SCFA),可以直接对抗发病机制。
从机制上讲,后者最好是丙酸盐,其质子化形式扩散到肠沙门氏菌(可能还有其他肠杆菌科)中,酸化受体的细胞质并减缓生长。此外,肠道拟杆菌属产生共生定植因子(CCF),即物种特异性碳水化合物利用系统,以强化肠道免疫屏障,保护宿主免受肺炎克雷伯菌定植和传播。
然而,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
肠出血性大肠杆菌(EHEC) 和其他病原体分泌的效应蛋白引起上皮炎症,在此过程中结肠细胞的能量代谢从β-氧化转向无氧糖酵解。这破坏了宿主栖息地过滤器,并开辟了新的生态位,这些生态位优先由肠杆菌科成员填充。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
反过来,艰难梭菌释放抑菌化合物来抑制革兰氏阴性竞争者(包括拟杆菌属)的生长。然而,拟杆菌属已经进化出适应与肠道发炎、菌群失调相关的新环境的机制。例如,多形拟杆菌,利用其“异铁载体利用系统”(由xusABC_操纵子编码)来劫持沙门氏菌和大肠杆菌。大肠杆菌铁螯合剂,使其在结肠炎期间能够接触到这种必需的辅助因子。
拟杆菌属对于肠道感染来说是一把双刃剑
在提供针对病原体入侵的初始定植抵抗力的同时,它们可以被相同的病原体利用作为炎症和抗生素治疗期间的“利基”指标和资源提供者。
截至目前,我们还不完全了解除了感染剂量之外还有哪些因素会导致这些接触的结果对宿主有利或有害,但随着微生物分子组学发展包括转录组学领域的最新进展可能会成为这个任务中的改变者。
“
以多形拟杆菌为例,因为多形拟杆菌是研究最广泛的人类肠道共生体之一。2001有研究就使用与多形拟杆菌单一关联的无菌小鼠,并通过DNA 微阵列分析全局宿主转录反应。发现多形拟杆菌定植后上调的宿主基因包括:
这些基因共同证明共生细菌可以帮助强化宿主上皮屏障。受与多形拟杆菌单关联影响的其他宿主基因涉及出生后成熟(腺苷脱氨酶)、营养吸收和代谢(SGLT-1、辅脂肪酶和 L-FABP)以及血管生成处理(血管生成素-3)的调节。这项研究证明了单一物种的共生生物如何恢复以前无菌宿主的许多结构、代谢和发育缺陷。
随着B. thetaiotaomicron基因组被测序了解后,人们对驱动这种共生关系的分子机制有了更深入的了解。B. thetaiotaomicron含有 4,779 个成员的蛋白质组,缺乏与已知粘附素同源的蛋白质。然而,它已经进化出两种外膜多糖结合蛋白(SusC和SusD)的163个旁系同源物、226个预测的糖苷水解酶和15个多糖裂解酶。
B.thetaiotaomicron的全基因组转录分析揭示,与在由基本培养基组成的肉汤中生长相比,当把B.thetaiotaomicron引入无菌小鼠肠道时,B.thetaiotaomicron表达不同的碳水化合物和葡萄糖(MM-G)利用基因。
通过比较采用标准富含多糖的食物饮食或缺乏可发酵多糖的简单糖饮食的无菌小鼠的细菌基因表达,发现富含多糖的饮食诱导了碳水化合物利用基因(如木聚糖酶、阿拉伯糖苷酶和果胶酸裂合酶)的上调,而仅葡萄糖和蔗糖饮食则导致参与从粘液聚糖中回收碳水化合物的不同基因子集的表达增加,如己糖胺酶、α-岩藻糖苷酶和唾液酸酶。这些基因还可以介导细菌附着于粘液聚糖,以避免细菌从肠道中流失。
在荚膜多糖合成(CPS)位点中发现了体外与体内生长期间以及饮食控制过程中另一个值得注意的基因表达变化,这表明B. thetaiotaomicron能够改变其表面碳水化合物,作为宿主免疫逃避策略改变聚糖觅食行为。
B. thetaiotaomicron讲述了一个基于营养代谢的宿主-细菌互利共生的复杂故事范例。具有从宿主无法消化的营养物质回收能量的能力为细菌维持在宿主肠道中的驻留提供了进化驱动力。尽管缺乏粘附细胞器,B. thetaiotaomicron可以通过其外膜聚糖结合蛋白的全部介导将自身附着到营养支架(食物颗粒、粘液层和脱落的上皮细胞 )上。
由于其灵活的聚糖觅食能力,当膳食多糖变得稀缺时,B.thetaiotamicron通过转向宿主多糖来赋予肠道生态系统稳定性。这种非常成功的人类肠道共生体已经进化出一个复杂而庞大的基因组,可以针对不断变化的营养环境调动功能多样的适应性反应,从而保证与宿主的永久和互惠关系。
“
铁是许多生物体和细胞的必需营养素和生长限制元素,同时也是促炎剂。在人体内,大多数铁与原卟啉 IX (PPIX) (PPIX) 形成亚铁或三价铁络合物,此处简称为“血红素”,它在 O2和电子的运输和存储中发挥着多种作用,并且在催化作用中。
在检测到入侵病原体后,作为人类和动物先天免疫反应的一部分,促生长铁以血红素和非血红素形式被螯合。因此,环境微生物和病原微生物,包括经过充分研究的假单胞菌属、卟啉单胞菌属和葡萄球菌属成员,都进化出了多种机制来释放和同化血红素和非血红素铁的不同化学物质。
虽然许多兼性病原体大量产生和消耗血红素铁,但大多数胃肠道厌氧菌是血红素营养缺陷型微生物。拟杆菌是许多健康胃肠道菌群中的优势细菌群。其中B. thetaiotaomicron是一种共生血红素营养缺陷型,是该群体的代表,该菌优先使用并最终以血红素形式超积累铁,但是似乎不会从添加非血红素铁中获得进一步的生长益处。
胃肠道微生物组可能拥有足够的铁储备,足以替代人类几天的典型营养铁需求,构成大量的铁储存库和潜在的贫血缓冲剂。生物信息学分析表明,hmu操纵子编码拟杆菌门成员中血红素摄取和代谢的厌氧机制,在拟杆菌门中广泛存在,但仅限于拟杆菌门。
来自该操纵子的基因同样广泛存在于从健康人类收集的宏基因组样本中。因此,我们预计拟杆菌,特别是hmu介导的血红素代谢将构成代表微生物组和宿主从宿主饮食血红素中调动铁的主要机制。这种机制必须是稳健的,因为粪便中检测到的血红素通常归因于宿主衍生的潜血,可以诊断下消化道出血 。
营养研究表明,与典型的植物源性非血红素铁复合物相比,血红素是人类膳食铁的生物利用度更高的来源;然而,即使是血红素铁也不能被宿主完全吸收,这表明它必须与微生物组共享。
拟杆菌门对血红素的优先使用可能使它们在胃肠道环境中具有选择性优势。血红素促进拟杆菌的强劲生长。由于血红素依赖性富马酸还原酶增强了富马酸向琥珀酸的转化,从而发酵葡萄糖。反过来,相对于另一个优势门厚壁菌门的成员,复含血红素密集红肉的宿主饮食与结肠微生物组中更大比例的拟杆菌门相关。
拟杆菌密集的微生物群和红肉饮食都与结肠癌的诱发有关。目前尚不清楚这些宿主病理是否与血红素或卟啉本身的促炎特性有关,它们是否是由微生物组中受血红素刺激的部分的其他代谢活动引起的,还是两者的某种组合。
简而言之,拟杆菌门在共生环境中优先积累血红素,而不是直接促进发病机制,反而可能导致物种失衡(生态失调)以及随后对宿主生态系统的生化破坏。
这些例子说明了肠道病原菌和拟杆菌属之间从稳态到病理学之间复杂的种间相互作用。这也是谷禾健康不断积累和迭代不同人群样本库,以及长期纵向追踪不同人群疾病发生或症状改善以及与微生物群的潜在因果关系的价值所在。通过研究更大、更多样化的人群,检查不同疾病甚至同一疾病亚型内的微生物群组成,我们可以更全面、更准确地了解微生物群反馈及其对健康的影响。
分析肠道微生物群不仅仅涉及检测单个细菌种类或属。确定每种细菌的正常阈值需要全面了解大样本全局微生物群落以及种间互作等。
附录:
以下为本门当中比较著名的种属及其所属的纲目
主要参考文献:
Bornet E, Westermann AJ. The ambivalent role of Bacteroides in enteric infections. Trends Microbiol. 2022 Feb;30(2), pp.104-108.
A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection. Cell Host Microbe, 24 (2018), pp. 296-307 e7
Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat. Microbiol., 5 (2020), pp. 304-313
Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature, 502 (2013), pp. 96-99

谷禾健康

大多数细菌对我们的生活是有帮助和必要的,某些细菌可以帮助消化,为身体提供能量,分解毒素,保护肠道,增强免疫力等,从而有益健康;也有一些细菌会给我们的健康带来一些危害。
然而有些菌并不是天生注定就是致病菌,也许正常状况下,它只是体内默默地存在着,但可能在某种特定条件下突然变身,彰显其致病威力。
事实上,许多严重的疾病是由健康个体的皮肤、粘膜或肠道中常见的细菌引起的。在这些情况下,致病菌根本不是专性病原体,而是遵循新的生态轨迹的共生体,通常会迁移到与宿主不再和谐相处的侵入性生态位。
细菌从共生到致病的转变在肺炎、脑膜炎、全身感染和医院获得性感染等疾病中发挥重要作用。当然,宿主环境扰动可能会提供感染机会。
因此,我们需要对致病菌的个性、不同环境下的状态有个基本的了解。
在谷禾肠道菌群健康检测报告中,我们会看到关于有益菌,有害菌,致病菌的检测:
有小伙伴有疑问,这里既显示有害菌又有致病菌,有害菌不是致病菌吗?
携带致病菌就一定会生病吗?
条件致病菌是如何引起感染的?
有害菌很多,该如何改善?
…
本文也将围绕着这些问题,展开一些讨论。
致病菌是引起疾病的细菌,也称为病原菌。当它进入身体时,就会破坏细胞或干扰身体的正常活动,人可能会患上轻微疾病或致命疾病。
✦ +
致病菌通过多种方式导致宿主生病。最明显的方法是在复制过程中直接破坏组织或细胞,通常是通过产生毒素,使病原体到达新组织或离开它复制的细胞。细菌毒素是已知的最致命的毒物之一,包括著名的例子,如破伤风、炭疽等。
然而,对宿主的损害通常是通过强烈的或有时是过度的免疫反应自行造成的,这种免疫反应会不加选择地杀死受感染和未感染的细胞并损害宿主组织。免疫系统过度反应的典型例子包括乙型肝炎中的肝硬化和肝癌。
一些病原体受益于宿主的免疫反应,可以在受感染的宿主内传播或增加它们向未感染宿主的传播。
流感主要通过它引起的打喷嚏和咳嗽产生的气溶胶传播。
霍乱弧菌在肠道粘膜中引发强烈的炎症反应,导致水样腹泻,并确保其在环境中的释放,从而感染更多的宿主。
✦ +
从概念上来讲,致病菌和病原菌意思差不多。需要注意的是,这里我们报告用的两个词分别是:
肠道致病菌,病原菌。
✦ +
正常情况下,肠道内是存在少量的病原菌,但是其丰度相对较低,丰度低于健康人群98%以下,不一定会导致疾病的发生。
这里我们可以了解一下关于“细菌感染”:
细菌感染:
病原菌侵入宿主体内并引起病理变化称为“感染”。
也就是说,如果报告中只是检出极少的病原菌,同时并没有症状,那么可能只是表面有病原菌摄入,需要注意饮食和生活卫生,这并不能称之为病原菌感染,因此不需要过于恐慌。
如果报告中病原菌检出已经超过98%人群,则代表可能存在感染的风险,需要结合相应症状和具体菌群丰度比例综合进行判断。
此外,如果出现多种病原菌或病原菌丰度水平很高,则需要引起注意。
✦ +
需要注意的是,谷禾肠道菌群检测报告中的疾病风险,是综合了多项指标判别的,并不只是考虑了致病菌。
慢病是每一种病单独构建模型,不一定和有害菌或菌群平衡指标直接有关。
下面我们来看一些致病菌,这些致病菌一旦感染可能会给人体带来较大危害。
✦ +
★ 炭疽杆菌 Bacillus anthracis
炭疽杆菌是革兰氏阳性、非运动、兼性厌氧、孢子形成和杆状细菌。
炭疽杆菌是一种人畜共患病的病原体,是一种专性病原体,因为细菌的繁殖周期只发生在合适的宿主中。
编辑
图源:tvmdl.tamu.edu . by Mallory Pfeifer
炭疽杆菌的发病机制主要由两种毒力因子引起:三方外毒素和聚γ-d-谷氨酸(γ-DPGA)。
人类可以通过四种不同的方式感染炭疽:吸入、摄入、通过皮肤和注射。
吸入性炭疽被认为是最致命的炭疽形式。如果不进行治疗,病死率接近95%,而立即干预可以将病死率降至50%。
胃肠道炭疽的发生是由于食用了来自感染炭疽的动物制备不当的肉类或肉制品。死亡率是可变的,通过适当的抗生素治疗可以达到≤40%.
皮肤炭疽通常通过皮肤接触受感染的动物或动物产品而发生。这种形式的炭疽病占全球人类病例的 95%。治疗后病死率<1%。潜伏期为 3-7 天。临床表现从轻度到重度不等。
抗生素疗法用于治疗炭疽感染。青霉素、强力霉素、环丙沙星。抗生素治疗必须在接触后立即开始,因为其有效性会随着毒血症的进展而降低。炭疽疫苗在治疗中也很重要。在确诊或疑似接触炭疽孢子的情况下,建议进行 60 天抗生素治疗。
★ 鼠疫耶尔森菌 Yersinia pestis
鼠疫耶尔森菌是一种小型、非运动的革兰氏阴性细菌,属于肠杆菌科。鼠疫耶尔森氏菌是鼠疫的病原体,鼠疫是一种罕见但高度致命的人畜共患病。
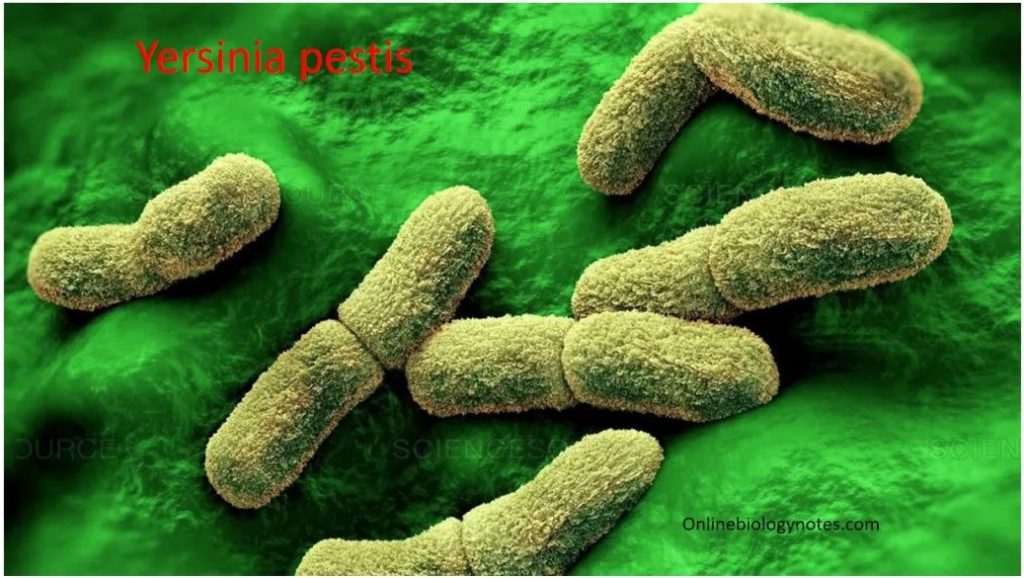
图源:onlinebiologynotes
大多数人类感染是由于与受感染的动物接触或被受感染的跳蚤叮咬造成的。
鼠疫在全球超过 25 个国家流行。尽管有有效的抗生素治疗,流行地区的死亡率仍超过 10%,这主要是由于发病机制的快速发展。
鼠疫主要以三种形式发生:肺鼠疫、腺鼠疫和败血症鼠疫。
鼠疫最严重的表现,发展最快的是肺鼠疫,在没有治疗的情况下死亡率接近100%.
肺鼠疫通过呼吸道飞沫在人与人之间传播。经过 2-4 天的潜伏期后,疾病的各种症状包括发烧、头痛、恶心、不适、呕吐、咳痰带血、呼吸困难和胸痛。如果在症状出现后 24 小时内给予适当的抗生素治疗,死亡率可降低高达 50%。
腺泡形式是最常见的,腺鼠疫是鼠疫的主要形式,占病例的 80-95%。死亡率为 10–20%。腺鼠疫由受感染的跳蚤叮咬引起。腺鼠疫的特点是形成淋巴结(淋巴结肿大)。通常的潜伏期从 2 到 6 天不等,有时更长。
如果腺鼠疫没有在适当的时间得到诊断和治疗,它会通过血液传播细菌而发展成败血性鼠疫。这种形式的瘟疫也可能是由传染性跳蚤叮咬通过受损的皮肤或粘膜直接进入鼠疫耶尔森氏菌引起的。通常的潜伏期为 2-7 天,但这种类型的鼠疫甚至在临床表现出现之前就可能导致死亡。
败血性鼠疫的症状包括腹痛、皮肤和其他器官出血。皮肤和其他组织可能会坏死,尤其是鼻子、手指和脚趾。此外,可以观察到发烧、腹泻、呕吐和虚弱。败血症性鼠疫以高菌血症为特征,并伴有危险的内毒素血症。
★ 土拉弗朗西斯菌 Francisella tularensis
土拉弗朗西斯菌是一种革兰氏阴性、非运动、非产孢球杆菌。它是一种小的细胞内病原体,具有高毒力和低感染剂量(1-10 个细胞)的特点。
细菌可以通过接触受污染的水进一步传播。吸入受感染的气溶胶,或直接接触受感染动物的组织和液体,也可用作细菌传播的途径。
细菌进入体内后,在局部繁殖,引起溃疡和坏死,然后侵入血液和淋巴管,扩散至肝、脾、肺、肾、浆膜、骨髓等淋巴结和器官,引起多发性凝固性坏死灶。
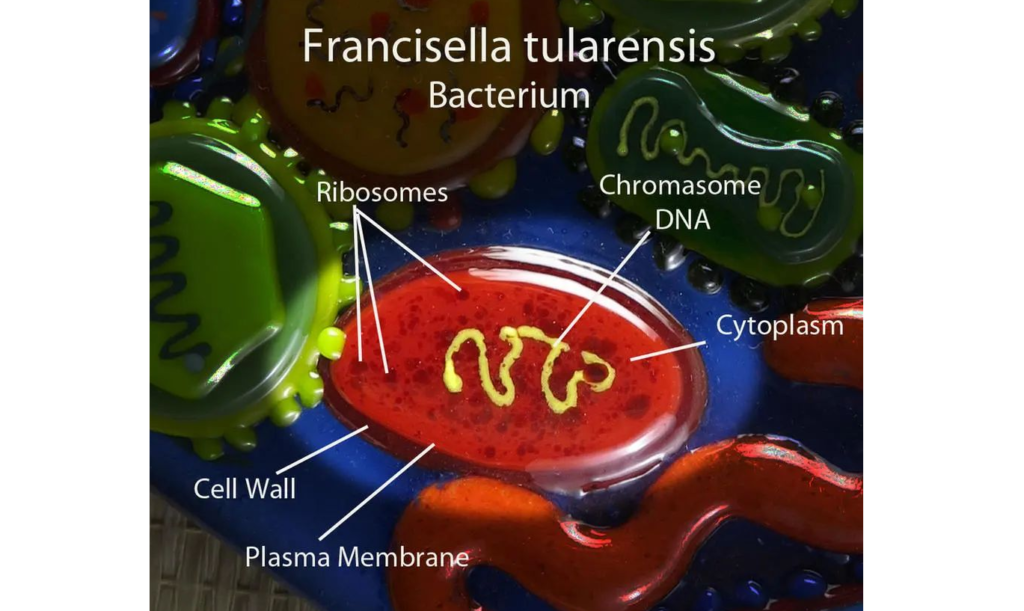
图源:DeviantArt
土拉弗朗西斯菌不仅容易在巨噬细胞中生长,而且还可以感染许多其他细胞类型,如上皮细胞、肝细胞、肌肉细胞和中性粒细胞。
有六种主要形式的土拉菌病,根据症状分类:肺病、腺病、溃疡腺病、口咽病、伤寒病和眼腺病。
该病的潜伏期通常为暴露后3-5天。
溃疡腺形式是最常见的,是节肢动物媒介叮咬或在与受感染动物接触期间通过皮肤获得感染的结果。
细菌通过磨损进入生物体后,可能会发生腺体形式的土拉菌病。
食用未煮熟、受感染的食物或受污染的水后,可能会形成口咽形式,之后细菌会感染咽部。患者常出现发热、咽痛、颈淋巴结肿大伴耳下淋巴结受累。
在疾病的严重形式中,可能会出现由于肠溃疡导致的胃肠道出血。
当细菌进入循环系统并从另一个感染部位扩散到肺部时,就会出现继发性肺炎性土拉菌病。症状包括高烧、干咳、胸痛和肺门淋巴结肿大;也可能出现肺部浸润或胸腔积液。
伤寒形式的主要症状是发烧、发冷和严重疲劳。然后出现呕吐、腹泻、谵妄和腹痛。临床表现还包括全身疲劳、败血症和死亡。伤寒形式是最难诊断的,因为它的一般症状没有明显的外部病变或区域淋巴结肿胀。
★ 肉毒杆菌 Clostridium botulinum
革兰氏阳性菌,厌氧菌,可运动,致病菌。
它会引起一种罕见但严重的疾病。产生一种特殊类型的外毒素,通过抑制神经肌肉连接的活动来影响神经系统。因此,肉毒杆菌毒素表现为一种神经毒素,它会阻止神经递质的释放。
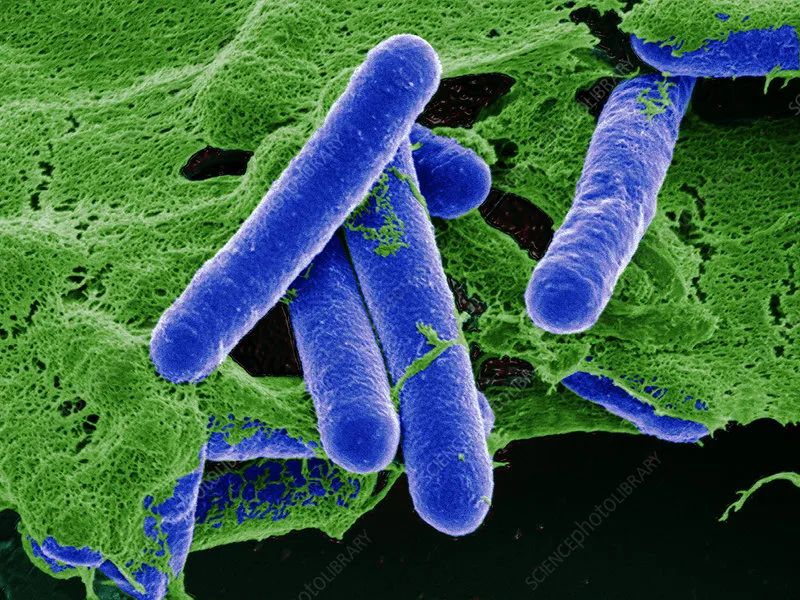
图源:Science Photo Library
肉毒中毒的症状通常始于控制眼睛,面部,嘴巴和喉咙的肌肉无力。
这种无力可能会蔓延到脖子,手臂,躯干和腿部。肉毒杆菌中毒还会削弱呼吸所涉及的肌肉,从而导致呼吸困难甚至死亡。
分为五种传播类型:
预防:
包括减少微生物污染水平,酸化,减少水分水平,以及尽可能破坏食物中所有肉毒杆菌孢子。
易感食物包括罐装芦笋、绿豆、油蒜、玉米、汤、熟橄榄、金枪鱼、香肠、午餐肉、发酵肉、沙拉酱和熏鱼。食用前,考虑将这些食物煮沸10分钟。
以上列举了一些常见的致病菌。致病菌与非致病菌并不是绝对的,是一个动态作用的过程。我们知道肠道中还有大量其他菌群,这些菌群在特定条件下,也可能转为致病菌,我们把这类细菌称为条件致病菌,接下来章节我们来详细了解一下条件致病菌的特点。
正常菌群与宿主、其他菌群之间,通过营养竞争、代谢产物的相互制约等因素,维持着良好的生存平衡。
然而,在一定条件下这种平衡关系被打破,一部分平时看起来正常的细菌就开始“作妖”,变成可以致病的细菌,这就是所谓的 “条件致病菌”。
条件致病菌包括引起肺炎、血流感染、脑膜炎和其他疾病的细菌。它们存在于环境中,可以通过皮肤上的伤口或吸入含有细菌的灰尘进入人体。
健康的免疫系统可以对抗许多病原体,但如果它受损,条件致病菌通常会引起感染。
与免疫系统受损相关的因素有:
遗传易感性;
癌症化疗;
给予免疫抑制药物以防止移植后排斥反应;
艾滋病感染;
严重营养不良;
长期抗生素治疗;
天生免疫系统较弱的婴儿和老年人;
导致白细胞生成减少的骨髓疾病;
怀孕;
正所谓 “橘生淮南则为橘,生于淮北则为枳”。某些细菌在肠道内是乖乖成长的,可一旦冲破束缚,例如在肠漏的情况下,细菌或其代谢物泄露到循环中,可能会变身“有害菌”,可以通过诱导慢性或急性炎症反应,导致疾病发生,包括损害肝脏和胰腺等重要器官,肝癌和胰腺癌可能与细菌易位有关。
如果没有健康的器官和器官系统来适当调节正常的身体功能,条件致病菌就有下手的机会,利用此环境推动疾病的发生。
手术通常涉及切口和伤口,这些切口和伤口为病原体进入身体创造了入口。这也为条件致病菌创造了有利条件。
长期使用会破坏体内正常的微生物群,杀死有益细菌,并导致条件致病菌增殖。
其实细菌(即便是致病菌),它们要生存下来并没有我们想象的容易,生活在复杂的群落中,多个物种和菌株存在相互竞争。
例如,在共生葡萄球菌中,分泌蛋白酶的表皮葡萄球菌菌株,会抑制金黄色葡萄球菌的生物膜形成和鼻腔定植。此外,生物膜破坏介导与其他物种的相互作用,并增加金黄色葡萄球菌对宿主免疫反应成分的易感性。可以看到宿主和共生细菌发出协同反应以排除其他物种。
然而你以为只有宿主和其他菌会带来威胁吗?不,另一种威胁来自与它们同居的同一物种的另一个谱系,同种内部也会互相竞争。这种种内争夺优势的斗争在金黄色葡萄球菌中得到了例证。
关于细菌之间如何交流详见:
金黄色葡萄球菌
Staphylococcus aureus
金黄色葡萄球菌是一种需氧的革兰氏阳性细菌,通常在健康人的鼻腔和皮肤上定植。
但当存在于假体关节和静脉输液管等内部装置中时,可能会导致感染,感染可能导致严重的败血症。
铜绿假单胞菌
Pseudomonas aeruginosa
铜绿假单胞菌是一种需氧、不发酵、高度运动的革兰氏阴性菌。
当感染宿主时,铜绿假单胞菌需要铁。因此铜绿假单胞菌合成了两种铁载体:pyochelin和pyoverdin。铜绿假单胞菌随后将这些嗜铁细胞秘密地存在于细胞的外部,与铁紧密结合并将铁带回细胞。铜绿假单胞菌还可以利用肠杆菌素中的铁来满足其铁需求。
其优先代谢是呼吸,通过将电子从葡萄糖(还原的底物)转移到氧(最终的电子受体)来获得能量。当处于厌氧状态时,铜绿假单胞菌使用硝酸盐作为末端电子受体。
形成生物膜,附着在金属,塑料,医疗植入材料和组织表面。
症状:
肺部感染:发烧和发冷、呼吸困难、胸痛、疲倦、咳嗽
尿路感染:强烈尿频冲动、小便疼痛、尿液中难闻的气味、尿液混浊或带血、骨盆区域疼痛
伤口感染:伤口发炎、漏液
耳部感染:耳痛、听力下降、外耳发红或肿胀、发热
也可能是囊性纤维化患者或机械呼吸机患者呼吸道感染的重要原因。
传播:
当暴露于受该菌污染的水或土壤中时,可以传播到医院患者。还可以在医院中通过被污染的手,设备或表面从一个人传播到另一个人。
治疗:
抗生素治疗
注:铜绿假单胞菌感染通常难以治疗,因为该细菌对许多抗生素具有抗性,并且具有形成生物膜的非凡能力。
易感人群:
免疫力低下人群
使用呼吸机患者、使用导管等装置、有手术或烧伤的伤口患者
预防:
患者和护理人员应保持双手清洁,避免感染。尤其是在护理伤口或触摸医疗设备之前和之后要彻底洗净双手。每天打扫房间。避免共享个人物品。
艰难梭菌
Clostridium difficile
革兰氏阳性,厌氧菌。经过氨基酸发酵,以产生ATP作为能量来源,并且还可以利用糖。
产生两种毒力因子:在70%的菌株中发现肠毒素(毒素A)和在所有菌株中发现的细胞毒素(毒素B)。毒素通过糖基化使Rho-gtpase失活,破坏肠上皮细胞的紧密连接,导致细胞旁通透性增加,从而导致体液分泌(腹泻)、粘膜损伤和炎症。
艰难梭菌存在于整个环境中,包括土壤,空气,水,人类和动物的粪便以及食品(例如加工肉)中。
疾病症状:
艰难梭菌通常影响住院的老年人。
常见症状有:严重腹泻、发热、排便频繁、胃部压痛或疼痛、食欲不振、恶心。
更严重的症状可能包括:
水样腹泻,每天10至15次;
脱水、心跳加快、体温升高、食欲不振、严重的腹部绞痛和疼痛、粪便中有脓液或血、体重下降、腹部肿胀、肾功能衰竭等。
传播:
通过粪-口途径在人与人之间转移。感染通常在医院发生。
该菌可以从粪便传播到食物,然后传播到其他物体表面,如果不洗手或者不正确洗手,就容易感染。
治疗:
抗生素(万古霉素,非达霉素)治疗。患有艰难梭菌感染的人容易脱水,可能需要住院治疗。但是,使用抗生素治疗可能会攻击体内有益细菌。
其他治疗感染的方法,包括:
脆弱拟杆菌
bacteroides fragilis
无芽孢,专性厌氧革兰氏阴性杆菌,人类结肠正常菌群的一部分。
BF毒素引起剧烈的炎症和“细胞间附着物的丧失”,从而引起典型的腹痛和腹泻。
某些脆弱类芽孢杆菌菌株无毒,甚至对其宿主生物有益。
疾病症状:
菌血症、阑尾炎、褥疮、化脓性关节炎、脑膜炎、喉咙发炎、上呼吸道感染、皮肤感染、心内膜炎、软组织感染、心包炎
该菌是正常肠道菌群成员,但是如果转移到周围组织中也会引起腹腔内感染。
这些感染包括产后子宫内膜炎,盆腔脓肿,会阴切开后软组织感染,微管卵巢脓肿和盆腔炎。
菌血症定义为血液中细菌的存在。脆弱拟杆菌是血液培养后最常见的厌氧菌。细菌在腹部,软组织和女性生殖道中的存在是最常见的菌血症来源。
该菌不是人体皮肤微生物菌群的一部分。如果这种细菌进入任何组织,则会引起皮肤感染,例如坏疽和坏死。糖尿病患者还容易受到该菌引起的皮肤感染的影响。
该菌还与引起心包炎,心内膜炎,脑膜炎,阑尾炎和咽喉发炎有关。
传播:
如果细菌被转移到任何其他人体组织,则可能导致该组织的疾病;可能由于外伤,割伤,烧伤,异物侵入或由于不当的外科手术做法造成感染。
治疗:
单一药物治疗或组合治疗
易感人群:
患有腹腔内感染的患者,糖尿病患者易感染
预防:
产气荚膜梭状芽胞杆菌
Clostridium perfringens
革兰氏阳性细菌,是嗜温菌,最适生长温度为37℃,产生内生孢子的非运动性菌。
通过无氧呼吸产生能量,使用硝酸盐作为其电子受体。可能导致许多胃肠道疾病,严重程度从轻微的肠毒血症到致命的气性坏疽。
还具有进行糖酵解和糖原代谢所需的所有酶,利用各种糖酵解酶将糖化合物分解为更简单的形式。
可以在人体肠道,污水和土壤中正常发现。
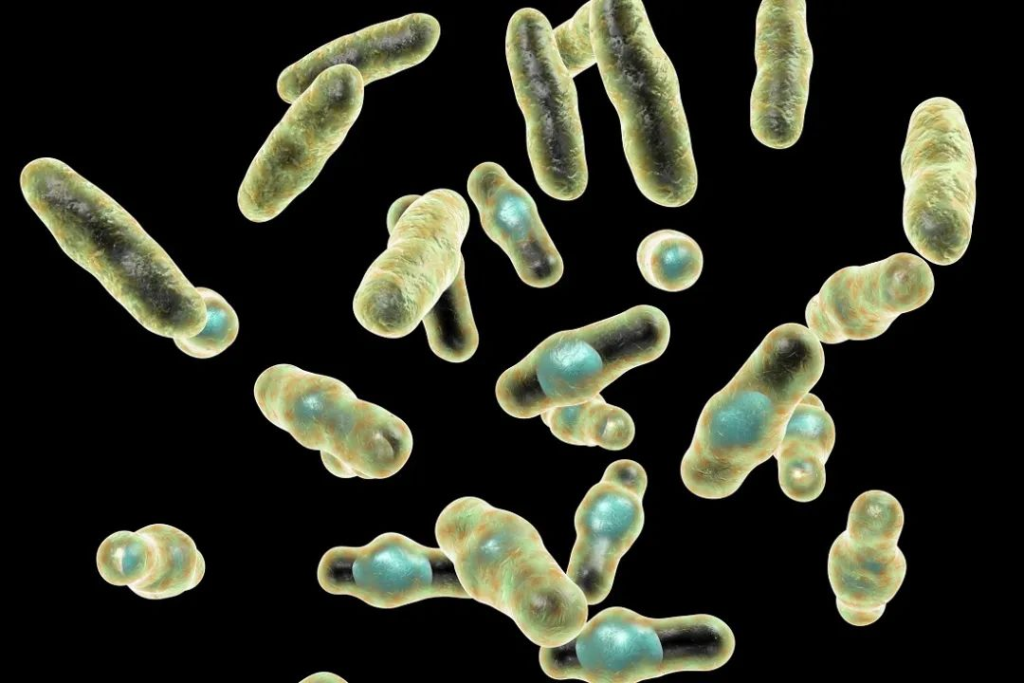
图源:Food Safety News
疾病症状:
食源性疾病(食物中毒)的最常见原因之一。
关于食源性疾病详见:正值夏季,警惕食源性疾病,常见的食物中毒的病原菌介绍
大多数感染了产气荚膜梭菌的人在食用受污染的食物后6-24小时内会出现腹泻和胃痉挛。这种疾病通常突然发作,持续不到24小时。
这种感染通常不会引起发烧或呕吐。
传播:
营养和食品卫生状况较差的地区人群;
糖尿病和动脉粥样硬化等患者;
产气荚膜梭菌感染也与多发性硬化症有关
危险因素:
常见感染来源包括肉类,禽类,肉汁和其他不安全温度下的食物。
爆发往往发生在医院,学校食堂,监狱和疗养院,以及带有餐饮的活动。最常发生在11月和12月。
治疗:
大多数人未经抗生素治疗即可恢复。
如持续腹泻应多喝水,多休息。
对于源自深层伤口的感染, 必须尽可能清洁该区域,并应使用抗生素。
预防:
将食物煮至安全温度;
食物煮熟后应保持在大于60度或低于4度
可以将热食直接放入冰箱,从冰箱拿出来后加热食用。
结核分枝杆菌
Mycobacterium tuberculosis
革兰氏阳性,专性需氧菌,无运动能力,无孢子形成,细胞内生长的细菌。
通常感染单核吞噬细胞。
在感染的潜伏期,结核分枝杆菌利用一系列效应蛋白将宿主免疫系统弄混,并使其生活方式驻留在肉芽肿中,肉芽肿是宿主为应对持续感染而建立的复杂和有组织的免疫细胞结构。肉芽肿中的结核分枝杆菌通常被限制在具有免疫能力的宿主中,但是当宿主免疫力受损时,它可能导致结核病复发。
常见的症状:
低烧、盗汗、疲劳、厌食(食欲不振)、体重下降。肺结核患者通常会产生咳嗽,并伴有低烧发冷,肌痛(疼痛)和出汗。
潜伏期没有症状。
引发疾病:
传播:
吸入飞沫(咳嗽或打喷嚏)
治疗:
抗生素治疗
预防:
肺炎链球菌
Streptococcus pneumoniae
柳叶刀形,革兰氏阳性,兼性厌氧菌,α-溶血性,条件致病菌。
该菌通过胞外酶系统获得大量的碳和氮,胞外酶系统允许多糖和己糖胺的代谢,并对宿主组织造成损害并使其定植。
荚膜多糖的组成和数量在毒力中起主要作用。产生最大量多糖的菌株可能是最强毒的。
图源:Science Photo Library
疾病症状:
从无症状的咽部定植到粘膜疾病(中耳炎,鼻窦炎,肺炎)再到侵袭性疾病(通常在无菌部位的细菌;菌血症,脑膜炎,脓胸,心内膜炎,关节炎)
传播:
通过呼吸道飞沫直接进行人与人接触,上呼吸道携带细菌的人自动接种。
易感人群:
治疗:
抗生素;静脉注射疗法
预防:
无乳链球菌
Streptococcus agalactiae
革兰氏阳性双球菌,不耐酸,不形成孢子,不易动,兼性厌氧的条件致病菌。
通常称为B组链球菌(GBS),是四种Beta-溶血性链球菌之一,可导致血琼脂上细菌菌落周围宽阔清晰区域显示的血细胞完全破裂。
使用葡萄糖作为能源。该细菌能够通过氧化磷酸化合成ATP。
是一种异养菌,能够导入多种碳源。能够将不同的碳源发酵成多种副产物,如乳酸,乙酸盐,乙醇,甲酸盐或乙酰丙酮。
需要许多氨基酸才能生长,因为它不存在任何TCA循环来合成氨基酸。
毒力因子: 多糖胶囊, β溶血素毒素
属于生殖道的正常菌群。5-20%的女性阴道定植。
疾病症状:
尿路感染, 新生儿和幼儿败血症,脑膜炎
患有基础疾病的成年人:肺炎,心内膜炎,皮肤和软组织感染等。
传播:
GBS阴道或直肠定植的母亲所生的婴儿中,有1%至2%的婴儿发生早发感染。
通过孕妇在怀孕或分娩期间的生殖器官和/或肠道,以及来自其他新生儿或妇产医院的医院工作人员。
治疗:
抗生素治疗
易感人群:
预防:
流感嗜血杆菌
Haemophilus influenzae
革兰氏阴性杆菌。有6种囊化血清型(指定为a至f)具有不同的囊化多糖。
该菌在人的鼻子和喉咙中,通常不会造成伤害。但有时会移动到身体的其他部位并引起感染:
肺炎(肺部感染),菌血症,脑膜炎,喉咙肿胀,蜂窝织炎(皮肤感染);
引起儿童耳部感染和成人支气管炎;
较不常见的感染包括心内膜炎和骨髓炎。

图源:ecdc.europa.eu
易感人群:
5岁以下和65岁以上感染风险增加,免疫力低下的(如艾滋病患者,癌症患者)感染风险增加。
传播方式:
咳嗽或打喷嚏;新生儿可以通过吸入羊水或与含有该菌的生殖道分泌物接触而感染。
治疗:
服用抗生素
预防:
婴儿接种Hib疫苗
衣氏放线菌
Actinomyces israelii
直径为1μm的革兰氏阳性杆菌,厌氧细菌,它是肠道正常菌群的一部分,条件致病菌。
浸润性,组织渗透/破裂;可引起慢性化脓性感染,放线菌病。
通过在各种手术(牙科,胃肠道),抽吸或病理性疾病(例如憩室炎)过程中破坏粘膜屏障来建立感染。
感染部位:
口腔,宫颈,面部疾病是最常见形式,有时感染可能发生在胸部(肺放线菌病),腹部,骨盆或身体其他部位。
当细菌进入人体时,它可以在软组织上形成脓肿。随着脓肿随着时间的流逝而扩大,它会穿透皮肤表面,引起皮肤溃疡。这些脓肿或肿块通常会影响头和颈部,并且会引起肌肉痉挛,阻止下巴正常运动。
其他常见症状包括:
发烧,体重减轻,咳嗽,胸痛和窦腔过度引流。症状可能发展缓慢,但是早期治疗是迅速康复的关键。
易感人群:
治疗:
抗生素;如果与宫内节育器有关,则须卸下
预防:
良好的口腔卫生和定期看牙医可能有助于预防某种形式的放线菌病。
嗜肺军团菌
Legionella pneumophila
具有一定铁含量的细胞内多形革兰氏阴性细菌,条件致病菌。
普遍存在于水环境中,例如饮用水系统、温泉、冷却水,可引起人类感染军团菌肺炎。
通过抽吸或直接吸入到达肺部后,会附着在呼吸道粘膜上。

图源:apotheekteirlinck.be
症状:
高烧(可能到40℃或更高),发冷,咳嗽,肌肉酸痛和头痛。
传播:
可以在人类制造的水系统(例如空调)中繁殖。大多数人吸入含有军团菌细菌的微小水滴时会被感染。这可能来自淋浴,水龙头或漩涡浴池中的喷雾,或者来自大型建筑物中通风系统中的水。
如何避免致病菌感染?
尽快恢复免疫力,减少致病菌感染的发生率。
个人应通过煮熟鸡蛋和肉类来避免传染源,饮用巴氏杀菌乳制品,避免感染个人和医院的潜在感染源,避免与粪便、灰尘或农场动物接触,这些是主要的感染源。
不要饮用未经处理的水,例如直接来自湖泊或河流的水。避免在国外饮用自来水。使用瓶装水或滤水器。
不要共用针头、注射器或其他药物注射设备。
有害菌和肠道内的其他共生菌共同构成菌群微生态,也是大部分人群肠道内常见的菌群。
有害菌是相对而言的。正常肠道菌群也包含许多有害菌,但有害菌比例或个别菌属丰度超标可能预示着肠道菌群的健康状况受到破坏。
有害菌过多会影响肠道内环境,如pH值,含氧量以及肠道内毒素等,可能会导致出现一些机会感染和机会致病菌入侵,进而诱发炎症和疾病。
谷禾肠道菌群检测报告中的有害菌包含了原发致病菌和条件致病菌,以及属内主要菌种为致病菌的属。
为便于统计,我们在计算的时候统一按照属层级进行计算比例。
报告中的有害菌包括了以下的菌属:韦荣氏球菌属、葡萄球菌科、变形菌属、弓形菌属、弯曲菌属、螺杆菌属、厌氧螺菌属以及弧菌属等。
具体每个菌相关介绍详见:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
慢病是每一种病单独构建模型,不一定和有害菌或菌群平衡指标直接有关。
肠道菌群中的有害菌过多,也就是说肠道菌群趋向于失衡,这会给身体带来诸多麻烦。
当肠道内的有害菌增多时,起初可能会有些症状出现,例如:
随着时间的推移,如果没有采取相应的干预措施,有害菌变得过多,则可能会对身体方方面面产生影响:
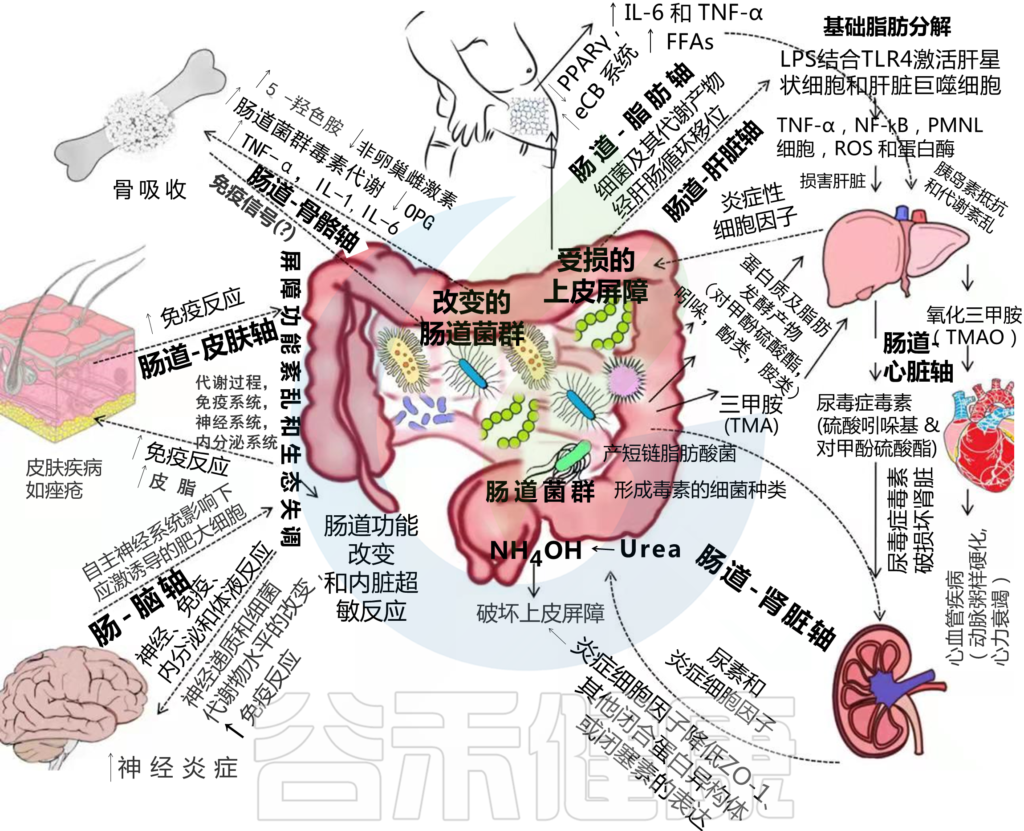
特殊类型的细菌会产生一种化学物质,肝脏会将其转化为三甲胺- n -氧化物(TMAO)。
TMAO产生的增加会导致血管中胆固醇的积聚,从而可能导致心脏病。
详见:
TMAO产生的增加也与慢性肾脏疾病有关。也会导致肾结石的发展。
与健康对照组相比,终末期肾病患者体内的TMAO浓度可高出20倍。
对终末期肾病患者的类似研究表明,从普雷沃氏菌向拟杆菌转变,产丁酸菌减少。

有害细菌将纤维转化为脂肪酸。身体可能会把它们沉积在肝脏中,如果不及时治疗,可能导致代谢综合征的发展。
肝硬化患者中韦荣球菌属和链球菌增多。
肝细胞癌与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
在2型糖尿病患者普遍具有相对高丰度的特定属:
Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella
2型糖尿病患者肠道菌群详见:
谷禾数据库统计发现,在有害菌属的丰度水平分布上,肥胖人群要高于对照人群。进一步对具体菌属进行分析,发现肺炎克雷伯氏菌的丰度水平肥胖人群更高。
肥胖患者肠道菌群详见:
肠道有许多直接与大脑沟通的神经末梢,称为肠脑轴。肠道炎症和菌群失调与心理健康不良有关。过多的有害肠道细菌会导致:
详见:
不良的肠道细菌会影响你的整体健康。它会增加消化问题的风险,这些症状通常伴有体重减轻和腹痛。比如:
肠道上皮、免疫系统和共生细菌之间的串扰是启动全身炎症反应的关键。有益菌和有害菌的失衡,抗炎和促炎细胞因子之间的失衡,包括白细胞介素(IL)-1β、肿瘤坏死因子、干扰素(IFN)-γ、白细胞介素-6、白细胞介素-12和白细胞介素-17,在参与RA发病机制的炎症过程中起着核心作用。
为了支持肠道菌群成分变化在类风湿性关节炎发病和进展中起重要作用的假说,已经提出了肠道菌群与关节炎相关的几种机制。
这些包括调节宿主免疫系统(触发T细胞分化)、通过作用Toll样受体(TLR)或NOD样受体(NLR)激活抗原呈递细胞(APC)、通过酶促作用促进肽的瓜氨酸化、抗原模拟和增加肠粘膜通透性。关于对APCs TLRs表达的影响,这可能导致Th17/Treg细胞比率失衡,这种局部免疫反应可能导致系统性自身免疫。
有害菌过多会导致肠道通透性和肠道屏障破坏。肠黏膜屏障功能障碍可能导致血清脂多糖 (LPS) 水平升高,从而导致代谢性内毒素血症。早期研究表明,LPS 可促进体内股骨的骨质流失和体外破骨细胞的。
与骨骼疾病相关的肠道菌群变化如下:

编辑
详见:
鉴于具有高度稳定性的平衡肠道微生物群与宿主的免疫系统具有共生相互作用,能够抑制有害菌增长。然而不稳定的状态例如肠道紊乱,慢性疾病,由遗传易感性、化学物质或肠道病原体感染引起的肠道炎症会导致有害菌增加。
其他包括饮食、生活方式、环境等因素也会影响肠道微生物群的分类和功能组成。例如,西方饮食、高糖饮食,饮食结构过于单一,加工食品过多摄入等不健康的饮食方式,睡眠不足,作息不规律,不运动等不良生活习惯,压力过大,服用药物等因素都会导致有害菌增多。
有害菌和肠道内的其他共生菌共同构成菌群微生态,如果有害菌过多,通常我们可以通过服用益生菌或益生元的方式首先增加有益菌的比例,相应的有害菌比例就会降低。
双歧杆菌和乳酸杆菌有助于发酵碳水化合物,同时会产短链脂肪酸,有助于维持良好的消化系统。
乳酸杆菌
乳酸杆菌菌株产生乳糖酶。它有助于分解乳制品中的乳糖,有助于维持肠道的酸度水平,对于吸收关键矿物质至关重要。
双歧杆菌
保护肠壁;维持肠道的酸度;限制产生硝酸盐菌的生长;生产 B 族维生素和维生素 K 等。
益生菌抑制其他菌群的生长:
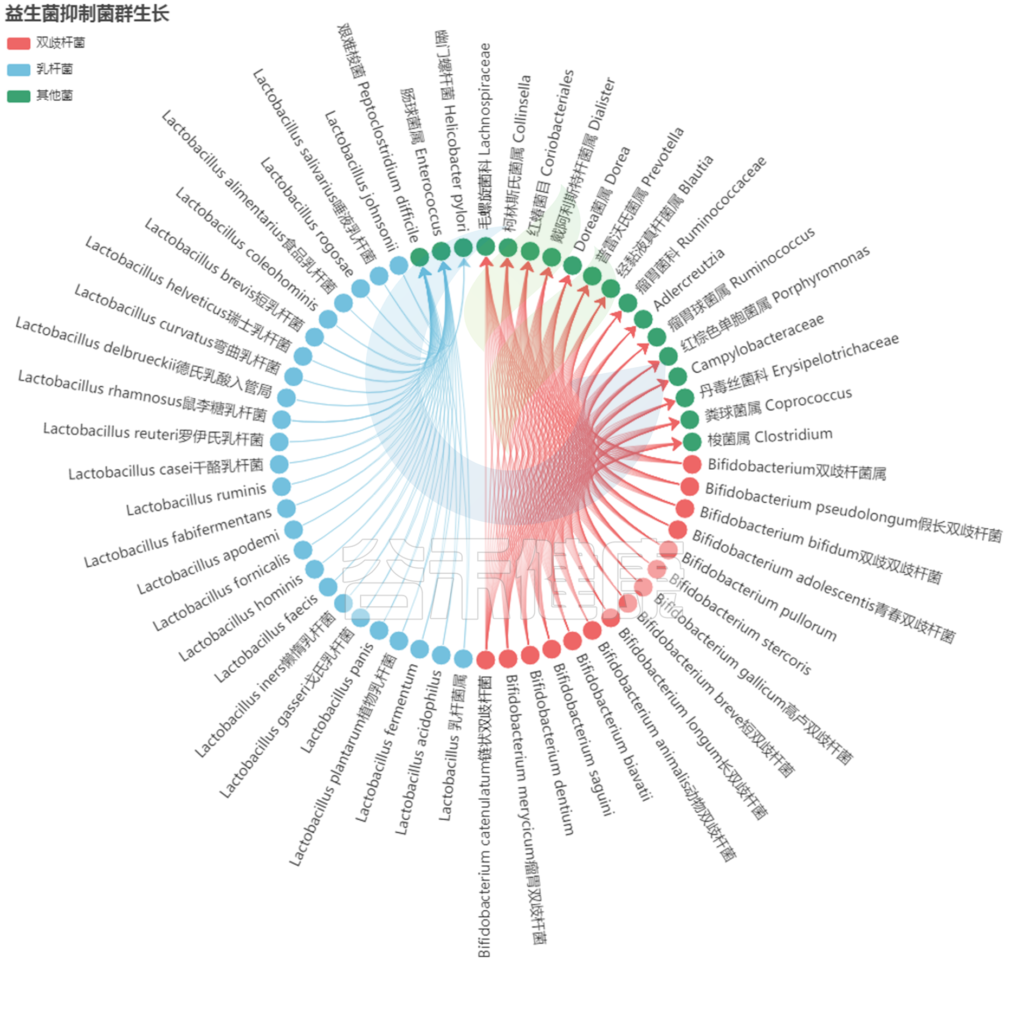
编辑
<来自谷禾健康数据库>
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
乳制品:酸奶、牛奶、开菲尔等
发酵食品:泡菜、酸菜、味噌汤、豆豉等
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
含益生元的食物包括:菊芋、青香蕉或青香蕉粉、大麦和燕麦、魔芋根、菊苣根、牛蒡根、亚麻籽、海藻、苹果、土豆等。
关于益生菌,益生元的补充详见:
想要持久的改善菌群结构降低有害菌水平就需要改善生活方式,适当增加抗性淀粉等膳食纤维并规律饮食和睡眠,增加运动等。
下面介绍一些日常生活中可以自行调整的饮食及生活方式。
尝试食用多种食物,避免每天食物一样
饮食多样性更有利于菌群维持健康平衡。体内的微生物群就好比一群挑剔的孩子,每个孩子都会去吃自己喜欢的食物。当你吃下各种食物时,就相当于喂食了各种微生物。
如果可以的话,一个星期的饮食中可以摄入 40 种及以上不同类型的天然食物,尽可能地提高肠道多样性。
减少西方饮食
西方饮食(其特点是大量摄入脂肪、蛋白质、糖、盐和加工食品),可能增加有害菌,与伴随的导致自身免疫疾病发展的微生物变化之间的联系越来越明显。
尝试地中海饮食
其他可以参考地中海饮食结构摄入,适量食用纤维,多吃各种颜色的水果和蔬菜。将红肉的摄入限制在每月两三次,可以将其视为一种“奢侈品”,每周食用两到三次家禽。它的饱和脂肪和胆固醇比红肉少得多,选择健康的脂肪,每周可以食用两次三文鱼等,做菜选择橄榄油,适量食用坚果(杏仁、巴西坚果、榛子、松子、开心果和核桃都是非常健康的坚果类型),它们是单不饱和脂肪的重要来源。
尝试抗炎饮食
很多种食物均具有抗炎特性,其中包括抗氧化剂和多酚含量高的食物。肠道抗炎饮食推荐的食物包括:浆果类,西兰花,牛油果,辣椒,姜黄,洋葱,大蒜等。
详见:
避免膳食纤维过多或过少
膳食纤维细菌发酵的产物(短链脂肪酸、乙醇和乳酸)过多会破坏细菌。纤维也会让人“上瘾”,其发展方式:随着发酵破坏细菌,需要越来越多的纤维来形成粪便。
但是膳食纤维摄入不足或突然停止所有纤维摄入,也会发生菌群失衡,导致便秘或其他肠道问题,从而导致有害菌增加。
减少摄入加工和包装食品
食用的加工食品越多,饮食越无菌,加工食品会减少我们体内有益细菌的数量,相应的有害菌会逐渐增多,破坏肠道菌群原有的平衡。
具体来说,防腐剂,比如聚山梨酯80和羧甲基纤维素(CMPF),它们是许多加工食品中常见的乳化剂,直接改变了肠道微生物群的组成。
食品添加剂对菌群的影响详见:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
尽量避免含糖饮食
对于我们大多数人来说,糖在我们的饮食中太普遍了。
在现代饮食中,糖无处不在,而且形式多种多样。我们大多数人现在都知道,过度消费“游离糖”的精制糖并不健康。糖也是造成菌群失调的主要因素。然而在忙碌的现代生活中,很难不过度摄入糖分。
高糖食物的常见罪魁祸首包括碳酸饮料、能量饮料、糖果、饼干、甜点、蛋糕、果汁和谷物等,它们都会导致菌群失调。
还有一些食物,含有的糖分更加隐蔽。这些包括:即食食品、腌泡汁、酸辣酱和泡菜、一些酒精饮料、调味酱、白面包、白米饭和土豆。
糖对菌群的影响详见:
吃八分饱
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
间歇性禁食
间歇性禁食是一种越来越流行的健康实践,研究发现间歇性禁食导致肠道菌群结构改变,进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
关于间歇性禁食详见:
维生素维持肠道菌群稳态和减少肠道炎症以预防癌症的机制;肠道菌群帮助吸收营养,并参与维生素代谢。几项观察表明,微生物群失调和维生素缺乏是相互关联的。
例如:
补充维生素 C 可减少肠杆菌科细菌的数量,增加乳酸杆菌的丰度,抑制有害菌的生长,促进有益菌的增加。
维生素 D 的缺乏会增加拟杆菌门、变形杆菌门和螺杆菌科的丰度。
维生素E对变形菌有抑制作用,而维生素E(和纤维)的摄入量较低与Sutterella水平较高相关。


详见维生素的文章:
当肠道渗漏也就是屏障受损时,大量的有害菌及微生物代谢毒素、食物中的有毒物质逃离肠道,涌入血液循环,这可能会产生炎症并导致组织损伤,器官从感染到炎症再到功能缺失,甚至是到癌症。
关于什么情况会导致肠漏,肠漏带来的危害详见:
即使是很小的压力也会触发体内激素和化合物的释放。压力会慢慢积累,如果你是一个压力大的人,经常烦躁,愤怒,那么会对微生物群产生负面影响,扰乱 HPA 轴。不过这是双向的,肠道中的某些细菌菌株也会影响体内神经递质的方式。
适当给自己减压,可以帮助菌群恢复平衡。减压的方式包括:
农村环境和微生物群与过敏患病率的降低有关。通过暴露于农村室内灰尘来调节肠道微生物群可以改善过敏预防。
城市儿童和小鼠暴露在城市灰尘提取物中,肠道菌群向拟杆菌类的变化是明显的。相比之下,农村儿童和接触农村粉尘提取物的小鼠肠道菌群分别富含普雷沃氏菌属和梭状芽孢杆菌属。
环境对菌群的文章详见:
环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
睡眠质量与肠道菌群组成之间存在双向关系。

编辑
拟杆菌门和厚壁菌门的丰度与睡眠质量呈正相关,而毛螺菌科(Lachnospiraceae)、棒状杆菌(Corynebacterium)、Blautia等几种菌与睡眠质量测量值呈负相关。
睡眠不足或者其他因素如受伤、食物摄入、压力、昼夜节律和运动等,可致肠屏障损伤和细菌移位,增加感染易感性,激活HPA轴从而影响菌群。
详见睡眠对肠道菌群的影响的文章:
抗生素
正常情况下,强大的免疫系统会追捕并消灭病原体,但在系统较弱的情况下,人体的免疫防御系统无法控制病原菌的生长。
服用抗生素会杀死体内的许多好细菌和坏细菌。在瑞典的一项临床试验中,研究人员发现,在服用抗生素仅一周后,一些参与者在一整年后就破坏了微生物组。
抗生素使用对肠道菌群变化的不同影响

Yang L, et al., AMB Express. 2021
我们之前写过抗生素对菌群的影响文章,详见:
其他包括非甾体抗炎药、质子泵抑制剂 (PPI)等也会影响肠道菌群的组成。
限制饮酒量
酒精诱导的胃肠道菌群组成和代谢功能的变化可能有助于建立酒精诱导的氧化应激、肠道对菌群产物的高通透性和随后发展的酒精性肝病和其他疾病之间建立明确联系。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
坚持适量运动
运动锻炼与肠道微生物群组成之间可能存在密切关联。经常中等强度的耐力运动对肠道微生物产生最有益的影响,促进健康和抗炎细菌增加;长期运动的人菌群多样性更高。
运动改善菌群多样性,增加菌群种类,有益于提高菌群稳定性,降低有害菌的相对比例。
运动对菌群的影响详见:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
在我们的检测实践中,以上的这些干预调节方式可以有效的定向改善特定有害菌和致病菌的超标,并最终带来整体健康状况的改善。
主要参考文献:
Janik E, Ceremuga M, Niemcewicz M, Bijak M. Dangerous Pathogens as a Potential Problem for Public Health. Medicina (Kaunas). 2020 Nov 6;56(11):591. doi: 10.3390/medicina56110591. PMID: 33172013; PMCID: PMC7694656.
Sheppard SK. Strain wars and the evolution of opportunistic pathogens. Curr Opin Microbiol. 2022 Jun;67:102138. doi: 10.1016/j.mib.2022.01.009. Epub 2022 Feb 12. PMID: 35168173.
Balloux F, van Dorp L. Q&A: What are pathogens, and what have they done to and for us? BMC Biol. 2017 Oct 19;15(1):91. doi: 10.1186/s12915-017-0433-z. PMID: 29052511; PMCID: PMC5648414.
Kinnula H, Mappes J, Sundberg LR. Coinfection outcome in an opportunistic pathogen depends on the inter-strain interactions. BMC Evol Biol. 2017 Mar 14;17(1):77. doi: 10.1186/s12862-017-0922-2. PMID: 28288561; PMCID: PMC5348763.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36. PMID: 26695747; PMCID: PMC4590619.
Kouzu K, Tsujimoto H, Kishi Y, Ueno H, Shinomiya N. Bacterial Translocation in Gastrointestinal Cancers and Cancer Treatment. Biomedicines. 2022 Feb 4;10(2):380. doi: 10.3390/biomedicines10020380. PMID: 35203589; PMCID: PMC8962358.

谷禾健康
导 语:关于抗体,免疫和微生物
肠道微生物群的组成因个体而异,肠道微生物群中的特定细菌类群可能是某些肠内外疾病的独特有效驱动因素。对人类而言,精准且优先识别影响疾病易感性和严重性的细菌仍然是一项重大挑战。
很多时候我们想知道:
微生物群是如何选择与我们定居下来的?
它们如何表现出成分多样性和功能稳定性?
它们如何适应我们生活方式的变化?
为什么有的人肠道菌群容易失调,有益菌不易定植?
想要通过一篇文章来破译这个话题比较困难,但是以上问题很关键一个原因是与我们身体的免疫抗体和免疫耐受性有关。
接下来的主题我们将持续关注和讨论免疫,抗体以及微生物之间的对话及其在人体健康或疾病中的作用。
人类复杂的饮食结构让胃肠道环境对免疫系统提出了巨大的挑战。经典的耐受机制受到来自饮食和共生微生物群的大部分无害外来抗原以及偶尔有害病原体的复杂和动态混合物的挑战。
免疫系统既要有效阻挡和消灭病原入侵,又要识别和保留肠道中的良性细菌,使得肠道达到动态平衡。这两年国际权威期刊《Cell》 《Science》《Nature》等主刊和子刊研究成果不断揭开了控制肠道菌群这一机制的“重要开关”——免疫球蛋白(IgA)。一致认为IgA是帮助肠道细菌“定居”肠道和保持物种多样性的关键,也是抵御微生物群和病原体的第一道防线。
免疫球蛋白 (Ig),也称为抗体,通过识别、结合和消除特定的细菌、真菌和病毒抗原,参与体内外来颗粒的清除和中和,人体内的五种免疫球蛋白 Ig :
IgA、IgD 、IgE、IgG 和IgM;
其中IgA最初发现于50年前,是机体黏膜分泌最多的抗体之一,负责防御病原体入侵。
人类每天生成3-5g IgA抗体,约占人体抗体总表达量的75%。一旦缺乏免疫球蛋白A,炎症微生物将繁殖,共生微生物将无法在肠道中长久寄居。IgA抗体能以多种方式来影响细菌的适应度,比如细菌的运动性被限制,或者其阻碍细菌所需的营养尤其糖类的摄入,或改变菌群基因的转录表达等。
IgA 在控制人类肠道微生物群组成方面起着关键且非冗余的作用。IgA 缺乏或过量均与疾病的发生发展有重要关系。
低水平会增加过敏、感染和自身免疫性疾病的风险,也意味着肠道屏障和/或肠道微生物群失衡。IgA 缺陷的常见自身免疫病包括类风湿关节炎、狼疮、乳糜泻或炎性肠病。
而高 IgA 可能是慢性感染和低度炎症以及代谢综合征的标志。目前比较关注的是IgA肾病,尽管 IgA肾病是一种影响肾脏的疾病,但它的起源也与肠道微生物群 – 肾轴密切相关。分泌型 IgA (SIgA) 与肠道中的这些微生物结合,从而调节它们的定植、增殖和潜在致病性。
一般遗传性的IgA缺乏症无法治愈。免疫疗法不能治疗它。但可以采取措施降低患病或感染的风险,其中包括生病或感染时服用抗生素。此外,预防也很重要,通过经常洗手和远离人群来限制细菌和疾病的传播。尤其在感冒和流感季节,甚至可以提前接种疫苗。
IgA 的测试一般用血液或脑脊液,我们通过长期的粪便检测和研发,构建了通过粪便检测来间接评估IgA 水平,对于判别感染,炎症,菌群失调等有一定的辅助作用。
本文将基于最新研究进展,全面讨论 IgA 尤其分泌型IgA (SIgA) 的来源及其结构形式,缺乏或过量的原因和症状,以及IgA如何决定微生物群的反应性,以维持宿主和细菌都受益的多样化生态位。IgA 与微生物群在生理、感染和疾病方面的密切相互作用以及生理条件下潜在的 IgA 和微生物群依赖性机制。另外基于目前许多病原体已经进化出阻止IgA 介导的清除的机制,探讨针对 IgA 和/或微生物群的疗法的发展。
本文预览:
01- 免疫球蛋白A(IgA)
02- IgA 功能
03- IgA 对微生物群的反应
04- SIgA:宿主-微生物群动态互作中的盟友
05- SIgA 介导的肠道病原体清除和稳态特性
06- IgA-微生物轴的缺陷导致病理疾病
07- 低IgA和选择性IgA缺乏:原因和症状及改善措施
08- 高IgA水平的原因和改善
09- IgA 的治疗潜力
-正文-
免疫球蛋白 A (IgA) 是一种由浆细胞(效应B细胞)产生的抗体,可保护身体免受感染。
注解:浆细胞(plasma cell),又称效应B细胞,常见于消化管和呼吸道固有膜的结缔组织内。浆细胞来源于B细胞。
浆细胞具有合成、贮存抗体即免疫球蛋白的功能,参与体液免疫反应。
正常机体浆细胞存在在脾、淋巴结的相应组织结构处,浆细胞生成抗体并将它们释放到周围的组织液中,最后汇集成静脉出淋巴结。所以抗体先进入组织液,而不是直接分布在血浆中。
抗体是指机体由于抗原的刺激而产生的具有保护作用的蛋白质,可结合并中和细菌和病毒等病原体。
在人体中,每天产生的 IgA 比所有其他抗体的总和还要多。
▸ 分泌型IgA
IgA 由浆细胞产生后被转运到粘膜细胞分泌的液体中。这种 IgA 称为分泌型 IgA(SIgA)。分泌型是IgA 是的优势抗体,主要在以下粘膜组织中产生:
IgA 也是血液中第二丰度的抗体(仅次于 IgG)。
循环 IgA 是单体形式;
分泌型 IgA 是二聚体(以两个连接的 IgA 单体的形式)。
效应位点包括B细胞和浆细胞,主要产生(>90%)IgA。这种保护性体液反应是全身最有效的免疫球蛋白途径,每天产生大量的免疫球蛋白A。在固有层有淋巴循环通过组织连接到肠系膜淋巴结,是免疫反应开始的部位。
每个抗体由四种较小的蛋白质组成。其中两种蛋白质称为轻链,另外两种称为重链。抗体通常根据它们所含的轻链和重链蛋白质类型进行分类。
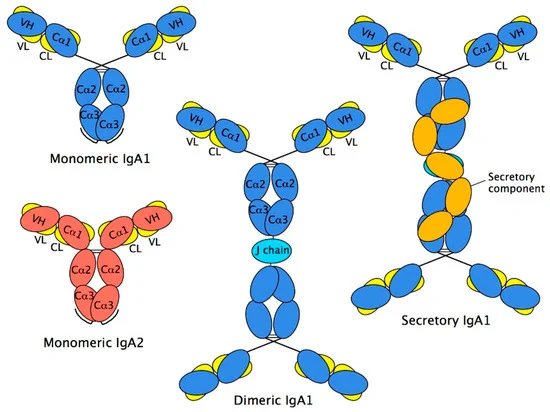
IgA 的分子大小为 160 kDa,血液中的 IgA 以单体形式出现,而身体分泌物中的 IgA 以二聚体或多聚体形式出现。
在分泌物中,除了 κ 或 λ L 链和 IgA 重链 α 外,IgA 还含有另外两条多肽链——分泌成分(SC)和 J 链(连接链)。
分泌链有助于外分泌 IgA 的胞吞作用并稳定 IgA 以防止蛋白水解降解。
人类表达两种IgA 亚型(小鼠只表达一种),称为 IgA1 和 IgA2。基因序列分析已证实 IgA 在所有类别的哺乳动物和鸟类中都存在。
存在显着的物种差异
大多数哺乳动物具有单一的 IgA 同种型。与人类相似的 IgA1 和 IgA2 亚类仅存在于相关的灵长类动物中,包括黑猩猩、大猩猩和长臂猿。
人类IgA1和IgA2的结构差异
就结构差异而言,人 IgA1 显示出一个延伸的铰链区,该铰链区由 IgA2 中不存在的两个 8 个氨基酸长的重复序列(每个轻链一个)组成。人类IgA1和IgA2的区别在于IgA1分子的铰链区域有13个不同氨基酸,导致其对细菌蛋白酶的敏感性增加,这个扩展的铰链区域赋予IgA1一个T型结构,有利于远程抗原识别。
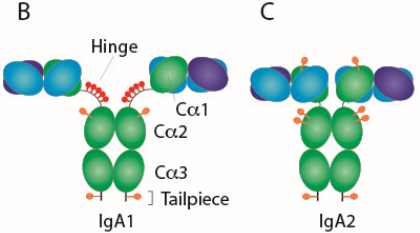

IgA1和IgA2的CH1和CH2结构域中都有高度的N-糖基化,糖约占其含量的6%。IgA1在铰链区含有由N-乙酰半乳糖胺、半乳糖和唾液酸组成的额外O联聚糖。
在黏膜部位,IgA常以二聚体IgA(dIgA)形式存在。
J链的存在是IgA在上皮细胞间的转运及其在黏膜表面分泌的先决条件。如下图:
聚合物Ig受体(pIgR)在上皮细胞的基底外侧极上表达,与J链结合,将IgA释放到管腔中,如SIgA。在此过程中,称为分泌成分(SC)的pIgR外结构域仍然以共价方式附着在IgA上。重N-糖基化SC稳定IgA并防止被蛋白酶快速水解,从而保护IgA在消化道中不被降解。
在粘膜表面发现的主要分子形式,称为分泌型 IgA (SIgA),是二聚体,尽管也存在一些较高分子量的物质,包括三聚体和四聚体。这里两个子类的相对比例更接近;平均分布约为 40% IgA1 和 60% IgA2,但这取决于取样的特定粘膜部位。
值得注意的是,IgA1铰链区的糖组成不均匀。有报道称异常糖基化参与了IgA肾病的发病。
肠道中 IgA2 转换的一般是由肠上皮细胞介导的,肠上皮细胞在通过 Toll 样受体感知共生细菌后分泌 APRIL。因此,局部肠道中不依赖 T 细胞的 IgA 产生对于确保宿主和微生物群之间适当的粘膜免疫至关重要。
注释:Toll样受体(Toll-likereceptors,TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。
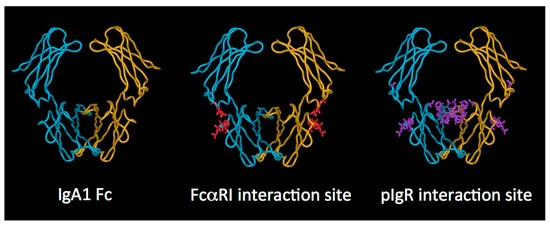
IgA与各种宿主受体相互作用,包括pIgR、转铁蛋白受体(CD71)、asialoglycoprotein receptor、dectin-1、Fcα/μR、DC-SIGN和FcαRI(CD89)。这些相互作用是通过抗体的FC段聚糖,或辅助分子(如J链或SC)结合来介导的。
IgA可以和一些细菌蛋白结合,如A群链球菌的M蛋白,B群链球菌的β抗原等。

doi.org/10.3390/antib8040057
小鼠和人的 IgA差异:
小鼠只有一个 IgA 亚类,并且可能使用替代受体,例如 Fcα/μR、转铁蛋白受体 (CD71) 和 pIgR,因为它们缺乏 FcαRI(别名CD89),这是主要的人体中的 IgA 受体。其他显着差异包括:
小鼠而非人类在脾脏中表现出 IgA 浆细胞的 B-1 B 细胞前体;
小鼠的体细胞超突变率是人类的三倍;
与人类相比,小鼠的产生中心或组织边界不明确
由于肝脏 pIgR 将血清 IgA 转运到胆汁中,然后进入肠腔,小鼠的全身 IgA 水平较低。
以下是 IgA 的近似值,具体取决于年龄:
根据大多数检测数据的说法,60-400 mg/dL 是成人的正常范围。
正常 IgA 水平会略有不同,具体取决于用于测试的实验室或机构。IgA 随着儿童的年龄和体重增长而逐渐增加,直到在成人中达到稳定水平。男性的血 IgA 水平高于女性。
总结:IgA 是免疫防御和耐受的重要参与者
低水平IgA 通常意味着免疫系统被削弱。低 IgA 水平和 IgA 缺乏是不一样的。大多数实验室认为任何低于 60 mg/dL 的 IgA 值都较低,但只有低于 7 mg/dL 的值才意味着缺乏。症状取决于根本原因。
慢性压力、睡眠不佳、疲惫和某些遗传疾病都可能导致 IgA 水平低或缺乏。虽然需要更多的研究,但一些研究也将低 IgA 与感染、过敏、自身免疫和肠道疾病联系起来。
高 IgA 通常表示慢性感染或炎症,尽管多种疾病可以提高其水平。在成人中,大多数实验室认为高于 300 mg/dL 的值很高。高水平不会引起任何症状。症状取决于根本原因和健康状况,应由医生进行评估。
如果出现大量感染,尤其是鼻窦、肺、胃或肠道感染,医生可能会要求进行免疫球蛋白A检测,尤其有下列情况:
一般还需要同时监测的其它指标:
检测样本有血液,脑脊液,还有肠道菌群也可以辅助。
要讲清楚IgA 的生产分泌,需要先了解下肠道相关淋巴组织,肠道实际上是最大的外周免疫器官。
肠道相关淋巴组织
人体肠道拥有人体内最大的淋巴组织,肠相关淋巴组织遍布整个肠道,覆盖面积约为260–300平方米,是粘膜相关淋巴组织的一个组成部分,它在免疫系统中起作用。
肠道相关淋巴组织 (GALT) 包括一系列的多泡结构,比如扁桃体、阑尾、结肠和盲肠斑片,Peyer’s斑片(派尔斑,PPs)、盲肠斑、以及一些称为孤立淋巴滤泡 (ILFs) 的较小的单个滤泡结构,这些组织遍布胃肠道,它们与肠系膜淋巴结(mesenteric lymph nodes, mLN)一起帮助保护宿主免受感染。
注释:
肠系膜淋巴结(mLN)指的是分布在肠系膜上的淋巴结,而且需要强调的是当患者出现肠系膜淋巴结炎的时候,患者会出现腹部疼痛、腹胀、发热等临床症状。
潘氏斑(或聚集性淋巴结节)是有组织的淋巴滤泡,以17世纪瑞士解剖学家约翰康拉德派尔的名字命名。
它们是肠道相关淋巴组织的重要组成部分,通常见于人类小肠的最下部,主要见于远端空肠和回肠,也可见于十二指肠。研究发现潘氏斑或能通过增加不同B细胞亚群的数量和效应功能来感知、增强并传递益生菌信号,从而就会导致IgA的产生、肠道菌群的改变以及保护机体抵御炎症的发生。
肠道相关淋巴组织是 IgA 诱导的主要部位
这些包括派尔斑 (PP)、肠系膜淋巴结(mLN)、孤立淋巴滤泡(ILF) 和盲肠斑。初始 B 细胞在 GALT 中分化和成熟;在该组织中,PPs 被认为是 IgA 的主要诱导位点。
在 PPs 中,微生物抗原通过滤泡相关上皮 (FAE) 上的 M 细胞转运到位于 FAE 下方的上皮下圆顶 (SED) 区域的树突状细胞 (DC),以启动 IgA 的产生。
肠道中的 IgA 是通过与许多免疫细胞和上皮细胞合作产生的
此外,在小肠固有层中发现了最大的 IgA + 浆细胞(PC )种群,而结肠固有层仅含有少量种群。
在唾液腺、肺以及哺乳期的肠外组织如肝脏、骨髓、乳腺中可检测到额外的少量 IgA 。
人类 IgA亚型显示出不同的表达模式,IgA1 在血清中占主导地位,而 IgA2 在远端肠道中占主导地位。
小肠中的 Peyer 斑和固有层分别是 T 细胞依赖性和独立稳态 IgA 产生的中心枢纽。然而,应该注意的是,据报道,结肠表现出不依赖于 T 细胞的 IgA 类转换重组,但仅在有组织的淋巴滤泡存在时。
无论如何,树突状细胞是主要的抗原呈递细胞,它们可以识别 T 细胞依赖性抗原和微生物分子模式,从而分别在派尔氏斑或固有层中刺激肠道 IgA 的产生。
此外,提到的肿瘤坏死因子(TNF)配体(CD40L、BAFF 和 APRIL)和细胞因子(TGFβ),其他研究也显示了其他环境因素,如视黄酸(RA)和其他白细胞介素(例如,IL-5、IL-6、IL-21 ),是 IgA 合成协同所需的。这些表明肠道中的 IgA 是通过与许多免疫细胞和上皮细胞合作产生的。
对肠道免疫系统至关重要的小分子是通过饮食和微生物提供的
例如,视黄酸参与表达醛脱氢酶的 DC 的功能,因此对于 IgA 的产生以及调节性 T 细胞 (Treg) 极化至关重要。这种分子被认为来源于饮食中的维生素 A,维生素 A 缺乏确实会降低小肠 IgA 的产生 。
膳食抗原也可能影响 PPs 和 ILFs 中 IgA 的产生,从而特别影响小肠 IgA 的产生。
另一方面,膳食纤维被肠道微生物群发酵,产生短链脂肪酸(SCFAs),对肠道免疫发挥各种作用。
SCFA 为B 细胞提供燃料以促进 IgA 的产生并通过 SCFA 受体 (GPR43) 以及组蛋白脱乙酰酶抑制活性激活 DC,以支持 IgA 类别转换。脂多糖和鞭毛蛋白等微生物成分可刺激 DC 和 CD4 T 细胞中的 toll 样受体,从而促进 IgA 的产生。
其他研究发现某些细胞因子,如 IL-21,在存在微生物抗原的情况下会增加 IgA 的产生。由于 T 细胞非依赖性 IgA 是响应内源性微生物群而产生的,因此 IgA 被确定为为相对非特异性和多反应性抗体。
虽然肠道是 IgA 合成的主要位点,但 IgA +PC (浆细胞)也存在于许多肠外组织中,包括骨髓 (BM) 和泌乳乳腺 (LMG)。而且 BM IgA + PC 可能是大多数血清 IgA 抗体的来源,这些抗体的特异性已通过用血清染色粪便细菌和 IgA-seq 来分析确定。
这些实验表明,血清 IgA 抗体通常会针对与肠道 IgA 靶向的微生物群相似的亚群起反应。
值得注意的是,血清 IgA 显着地与变形杆菌菌群结合,这些微生物在肠道中的相对丰度可能会影响 BM IgA +的大小PC 响应。
对从 BM IgAs 克隆的 mAb 的分析表明,这些单克隆抗体包括许多与变形杆菌菌群结合存在多反应特异性。
然而,与肠道 IgA 库相比,几乎所有 BM IgA 都是通过T细胞依赖反应产生的,这可能是因为诱导整合素等分子需要 T 细胞衍生的信号α4β1 和趋化因子受体(如 CXCR4)促进迁移和归巢至骨髓。
虽然在未怀孕女性的乳腺中发现了很少的 IgA + PC,但在怀孕和产后哺乳期间这些细胞大量积累,在哺乳停止后逐渐减弱。这些细胞可能会分泌在母乳中发现的高滴度 IgAs,这也是提倡母乳喂养的重要原因。
许多研究已经描述了 IgA 在粘膜防御肠道病原菌的背景下的功能,例如通过免疫排斥清除它们、限制它们的运动性和通过束缚来抑制它们的生长。
此外,IgA一直被描述为对抗黏膜表面病原体的第一个障碍,可以凝集细菌、干扰细菌运动、中和细菌毒素、抑制细菌对上皮的黏附,从而防止病原体传播到循环系统。
IgA对多种胃肠病原体如鼠伤寒沙门菌、志贺菌、艰难梭菌和一些病毒(仙台病毒、人类免疫缺陷病毒、流感病毒、SARS-CoV-2等)发挥中和作用。
病原体对 IgA 功能的规避
在系统发育和多样性分析的基础上,IgA-FcαRI 相互作用被认为是病原体和人类之间进化军备竞赛的焦点。IgA 上相互作用的中心位点,为了结合 FcαRI 而被保留下来,已经受到某些病原体产生的 IgA 结合蛋白进化的压力。
这些 IgA 结合蛋白已经进化为与同一位点相互作用,从而颠覆 IgA 反应,并推动了一个迭代的选择过程,在这个过程中,哺乳动物和病原体蛋白都在继续进化,试图“智取”另一个。事实上,靶向 FcαRI 相互作用位点只是病原微生物用来规避 IgA 保护能力的策略之一。不同 IgA 靶向机制的存在,以及这些机制似乎在不同生物体中独立出现的事实,表明它们通过允许更容易的粘膜定植和传播为微生物提供显着益处。
IgA 的保护能力也可能因许多重要病原细菌产生的蛋白水解酶的作用而受到损害。这些蛋白酶都在 IgA 的铰链区切割。除了少数例外,它们特异性地作用于 IgA1 的延伸铰链区,并且不切割 IgA2。
此类 IgA1 蛋白酶由引起口腔感染的细菌(如血链球菌、缓症链球菌和口腔链球菌)和生殖道感染的细菌(如淋病奈瑟菌)产生,这表明它们为细菌提供了优势来获得立足于黏膜表面。有人提出 IgA1 蛋白酶可用作治疗选择,以降解 IgA 肾病中异常糖基化 IgA1 的致病性免疫复合物,这是肾脏疾病的常见原因。
早期免疫——在每一个成人身上,都有曾经的孩童时候的印记;在每一个孩子身上,都有将来的成人的缩影,免疫也一样。
从逻辑上讲,IgA结合作为致病条件下潜在促炎性分类群的标记物的可能性应该是:IgA在建立肠道微生物与其宿主的早期生命平衡中很重要。
乳汁成分对微生物群的发展有着深远的影响
例如乳铁蛋白和乳低聚糖等其他乳蛋白会影响早期肠道中微生物群的营养和竞争。
缺乏针对特定细菌表位的IgA已被证明增加了肠内先天免疫系统激活的转录证据。母乳中分泌的抗体保护幼年哺乳动物免受自身粘膜免疫系统的过早刺激,并对其获得的微生物群的组成产生长期影响。
聚合免疫球蛋白保护早期粘膜,防止菌群转移
在某些情况下,机制可以从某些分类群的代谢能力推断,例如代谢特定糖类,或抗体中和病原体的潜力。然而,实验表明,通过这种转运机制主动分泌的聚合免疫球蛋白(IgA和IgM)可以形成幼犬获得的长期肠道微生物群。
也就是说,主动分泌的聚合免疫球蛋白的保护作用,不仅能够在其自身固有和适应性免疫机制发展之前保护脆弱的早期粘膜,包括防止肠道微生物穿透上皮防御系统转移到肠系膜淋巴结,同时也形成了长期组成的微生物群,这些微生物群落先后在早期肠道中繁殖。
IgA抗体是人类免疫系统中最常见的抗体,由黏膜中的专门细胞分泌,在人类免疫球蛋白中占三分之二。
机体产生的大多数IgA抗体都是针对肠道菌群中的良性细菌的。如果没有这种免疫保护,这些微生物也可能对健康产生不利影响,并引起肠内外疾病。
IgA抗体能在多个层面上特异性地限制良性细菌的适应度,这或许会促进免疫系统能够更好地微调肠道中的微生物平衡,如今研究人员成功阐明,免疫系统能识别并特异性地限制这些细菌的生长。
一个有用的起点是哺乳动物肠道表面IgA功能的多样性。这些措施包括中和毒素和病毒,阻止过度活的细菌粘附或易位,清除不需要的大分子结构在上皮表面,并定向采集管腔抗原。
研究人员进行了三年的研究,他们成功地以高度的精确度追踪了无菌小鼠肠道中的体外和体内效应。发现该抗体在几个方面影响细菌的适应性。例如,细菌的迁移率受到限制,或者它们阻碍了细菌代谢的糖结构单元的摄取。该效应取决于被特异性识别的表面成分。
研究支持抗体在肠道中的作用是介导耐受性的观点。肠道内的耐受性可被视为基于对其微生物群成员的免疫识别的静态稳态。
产生过量 IgA 的细菌可能比产生低至中等量 IgA 的细菌面临更大的竞争劣势。这需要长期的‘居民’不断地调节免疫显性决定因素,这可能为在肠道生态系统中观察到的异常水平的菌群多样性提供了一种解释。
研究表明适应性免疫系统是这些表面结构多样化的驱动力一致,其有益结果是促进肠道共生体和宿主之间的非炎症关系。
对细菌的先天免疫反应,包括 NO 的产生,在无脊椎动物和脊椎动物中是高度保守的。
适应性免疫系统在脊椎动物中的一个关键进化作用可能是适应更复杂的微生物群落,即使存在病原体定植和/或自身免疫易感性的额外风险。
适应性免疫系统的主要作用是通过选择性地对刺激先天系统的细菌产生免疫反应来维持与肠道微生物群的“联系”。这种安排允许宿主检测新的细菌系统发育型,并忽略它以前遇到过的那些(记忆)的存在,结果才能更大的多样性,而不会牺牲先天免疫系统在维持粘膜屏障方面的基本保护作用。在这个过程中几种抗体,尤其IgA、IgM以及IgG发挥关键性配合作用。
炎症性肠病 (IBD) 至少在一定程度上可以被视为未能对常驻肠道微生物群产生有效的适应性免疫反应:这种反应通常会阻止微生物抗原呈递给 T特定于社区成员的细胞。与该模型一致,TCRα-/-小鼠对肠道微生物的抗体反应在发生结肠炎时从多克隆变为寡克隆。此外,将 Ig 被动转移到该模型中可以改善疾病。
因此,不仅仅是寻找富含 IBD 相关抗体库的微生物靶标,确定库中存在“漏洞”的位置可能会提供信息,并可以提出基于主动或被动免疫的新治疗策略。
天然存在的全身性 IgA 主要是调节免疫的,与微生物几乎没有直接接触,部分原因是血液的无菌环境。先前的研究已经证明血清 IgA 能够通过抑制补体系统有效消除抗原而不会提醒宿主免疫系统。这使得血清 IgA 在清除体内抗原物质时充当“沉默的恐慌按钮”。
然而,当单体、非抗原携带 IgA1 与髓系 IgA Fc相互作用时受体、FcαRI,然后是含有 Src 同源区 2 结构域的磷酸酶 1 (SHP-1) 以 ERK 依赖性方式募集到名为抑制性免疫受体酪氨酸激活基序 (ITAM) 的对接位点 。
注释:FcR是一类能够和免疫球蛋白(Ig)重链羧基末端的功能区Fc段特异结合的细胞表面蛋白,在抗体依赖性免疫应答过程中至关重要。不同类型的细胞可以表达不同类型的FcR,不同结构类型的Ig也和不同类型的FcR结合,从而诱导后续的不同类型的免疫反应。按FcR所结合的Ig种类不同可将其分为五类,即IgG(FcγR)、IgE(FcεR)、IgA(FcαR)、IgM(FcμR)和IgD(FcδR)。
当 FcαRI 和 ITAM 与周围的脂筏共定位时,它们的复合物形成称为 ITAMi 的抑制体簇,由此产生的下游磷酸化受损会阻断免疫反应。
脂筏:膜脂双层内含有特殊脂质及蛋白质的微区。
与循环中 IgA 介导的免疫耐受相比,来自固有层的二聚体 IgA2 可以作为 SIgA 转移到肠腔中,并将其自身锚定在外粘膜表面上,与肠道细菌强有力地相互作用,以获得适当的免疫微生物群稳定性。这共同确立了血清和粘膜 IgA 在稳态条件下对免疫功能的重要参与。
血清和分泌型 IgA 的结构和功能

Abokor et al., Microorganisms. 2021
在左栏中,IgA,主要是单体 IgA,由骨髓中的成熟浆细胞分泌并进入体循环。循环血清 IgA 与位于骨髓细胞上的跨膜 Fc 受体形成免疫复合物,以诱导维持免疫稳态所必需的下游效应信号。
在右栏中,肠浆细胞通过两个 IgA 单体与连接 (J) 链的二价连接产生二聚体 IgA。J 链与位于肠上皮基底外侧表面的聚合 IgA 受体 (pIgR) 的分泌成分 (SC) 结合。IgA 以分泌型 IgA (SIgA) 的形式迅速转入肠腔。游离 SC 也被转胞吞到管腔中并用作抗菌肽。
与肠道微生物群相互作用,a ) 对各种细菌物种具有跨物种(多反应性)反应性,( b ) 物种特异性反应性或 ( c ) 菌株特异性反应性。对于病原体去除,SIgA 可以 ( i ) 与细菌结合并凝集,从而阻碍微生物附着和侵入宿主肠上皮细胞,这一过程称为免疫排斥,( ii ) 通过链式生长防止细菌结合以限制细菌增殖,以及 ( iii ) ) 加速细菌通过微折叠 (M) 细胞转移到派尔斑块中,以便常驻树突细胞 (DC) 进行抗原采样。
在局部细菌传播的情况下,当 SIgA 的前线防御不足时,二聚体 IgA2 通过与驻留的 Fcα/μR +滤泡树突细胞交联并募集 Fcα/μR +中性粒细胞来调理抗原。当交联时,Src 激酶 Lyn 磷酸化相关 ITAM 中的酪氨酸,这促进激酶/生长因子的募集,这些激酶/生长因子刺激与吞噬作用、呼吸爆发和炎性细胞因子分泌相关的免疫细胞。
同时,分泌白三烯 B4 (LTB4) 作为趋化信号,将更多的中性粒细胞募集到感染部位,从而形成正反馈回路以消除入侵的病原体。如果细菌感染和传播严重到足以到达门静脉循环,血清 IgA 会调理抗原,与枯否细胞(常驻肝巨噬细胞)交联,并诱导促炎反应。
注:白三烯B4是一种与炎症反应有关的白三烯类物质。它由响应炎症介质的白细胞产生,让白细胞活化并依附在内皮上,允许其穿过组织。
枯否细胞,被誉为人体肝脏内有一忠诚“卫士”,守护监视着进出肝脏这一人体化工厂的所有物体,以防机体受到任何外来侵害,它的名字叫枯否细胞(Kupffer Cells)。枯否细胞是定居于肝内的一种巨噬细胞,是我们人体内最大的固有巨噬细胞群,约占固有巨噬细胞总数的 80%~90%。
枯否细胞具有吞噬、免疫调节与监视、分泌等作用。生理条件下,枯否细胞不仅能非特异的吞噬和清除血流中的细菌、异物等抗原性物质,而且还具有特异性的免疫应答、抗肿瘤免疫、内毒素解毒、抗感染、调节微循环等方面的作用。病理条件下,枯否细胞可以释放肿瘤坏死因子、转化生长因子、干扰素、白介素、氧自由基及一氧化氮等多种炎性介质。
治疗策略——靶向自身抗体糖基化
值得注意的是,天然二聚体 IgA2 和单体 IgA1 的本身抗炎和促炎效应功能分别归因于它们不同的糖基化谱。两种抗体都含有几个N-糖基化位点,但只有 IgA1 具有多个O-糖基化位点,因此每个聚糖具有更多的末端唾液酸。
据报道,通过神经氨酸酶处理的去唾液酸化增加了 IgA1 的促炎能力,这反映了 IgA2由于循环糖基化 IgA 可促进各种自身免疫性疾病的进展,因此靶向自身抗体糖基化可能是一种潜在的治疗策略。
总而言之,如果我们将身体视为抵御病原体入侵者的堡垒,那么 SIgA 与肠道上皮细胞一起充当“封锁墙”,作为中和微生物不可或缺的第一道防线。当细菌侵入 SIgA 并突破黏膜层时,二聚体 IgA 充当第二道天然黏膜免疫防御,然后血清 IgA 和枯否细胞的协同作用成为消灭病原体的第三道也是最后一道防线。
IgA 对微生物群的反应通过T细胞依赖 (TD) 和非依赖(TI) 途径发生。

microbiology
SIgA抑制致病菌,结合有益菌
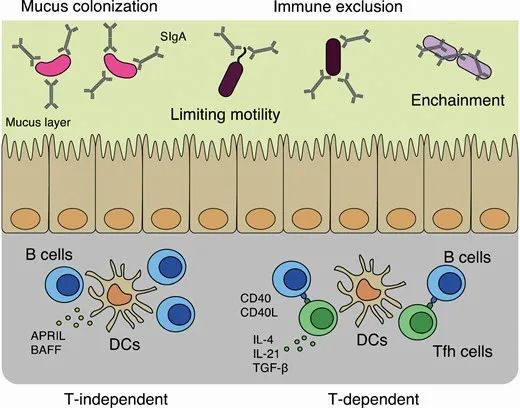
越来越多的证据表明,通过 T 细胞依赖性途径产生的亲和力成熟和特异性 SIgA 会影响肠道微生物群,特别是致病菌,以影响其运动性,将它们排除在肠道表面(免疫排斥)或通过束缚来抑制它们的生长。相比之下,IgAs 还可以与有益微生物结合,并将它们固定在粘液层中(粘液定植)。
IgA 促进拟杆菌在肠道内定植
拟杆菌属是肠道共生微生物群的一个核心菌属,一些报告表明,IgA 可以促进拟杆菌在肠道内定植。例如,脆弱拟杆菌可以以依赖于表面荚膜多糖的方式粘附在肠上皮细胞上,而 SIgA 在功能上参与了这一过程。SIgA 介导肠道定植Bacteroides thetaiotaomicron通过改变参与多糖利用的基因的表达。这些研究表明 SIgA 还可以直接改变拟杆菌属的功能以促进在肠道中的定植。
肠道环境影响IgA-微生物之间的互动
尽管许多研究都集中在 IgA 与肠道微生物群的相互作用中的特征,但同样重要的是要注意某些肠道环境也可能影响微生物的基因表达和功能,从而影响 IgA 微生物互动。SIgA在营养不良的情况下不太可能覆盖肠道乳酸杆菌。他们认为,某些乳酸杆菌菌株可以在营养不良期间进行代谢适应,从而逃避 SIgA 的识别。
稳态 IgA 反应的机制
在全身免疫的经典模型中,TI 反应发生在对多价抗原(例如细菌多糖)的反应中,并且涉及快速的细胞分化,几乎没有体细胞超突变。
相比之下,TD 反应通常针对蛋白质抗原,并涉及基于与 CD4+ T 滤泡辅助细胞 (Tfh) 的同源相互作用在抗体生发中心中进行的 SHM 和亲和力选择的迭代轮次。
然而,稳态粘膜 IgA 反应与这些过程相似的程度仍不清楚,并且有几条证据表明不同的机制和调节。
注:CD4并不是一种细胞是一种蛋白质“标签”,存在于在某些免疫细胞,如巨噬细胞、T细胞和单核细胞表面。具有CD4“标签”的细胞被称为CD4细胞。
CD4 +T细胞通常是作为是免疫系统中的“辅助”角色,它们大多数情况并不能直接中和感染,而是引导并触发机体对感染源的免疫应答,类似于免疫系统的“哨兵”。在CD启动免疫应答后,后再由CD8+T细胞来扮演“行刑官”的角色,清除感染源。
首先,尚未证实稳态 IgA 抗体对单个微生物抗原的特异性和高亲和力识别。相反,对单克隆抗体 (mAb) 的研究表明,IgA 衍生的抗体通常具有多反应性,并且与许多微生物抗原(包括脂多糖、DNA、鞭毛蛋白和荚膜多糖)具有低亲和力结合。
Peyer 斑块中 IgA 选择的机制
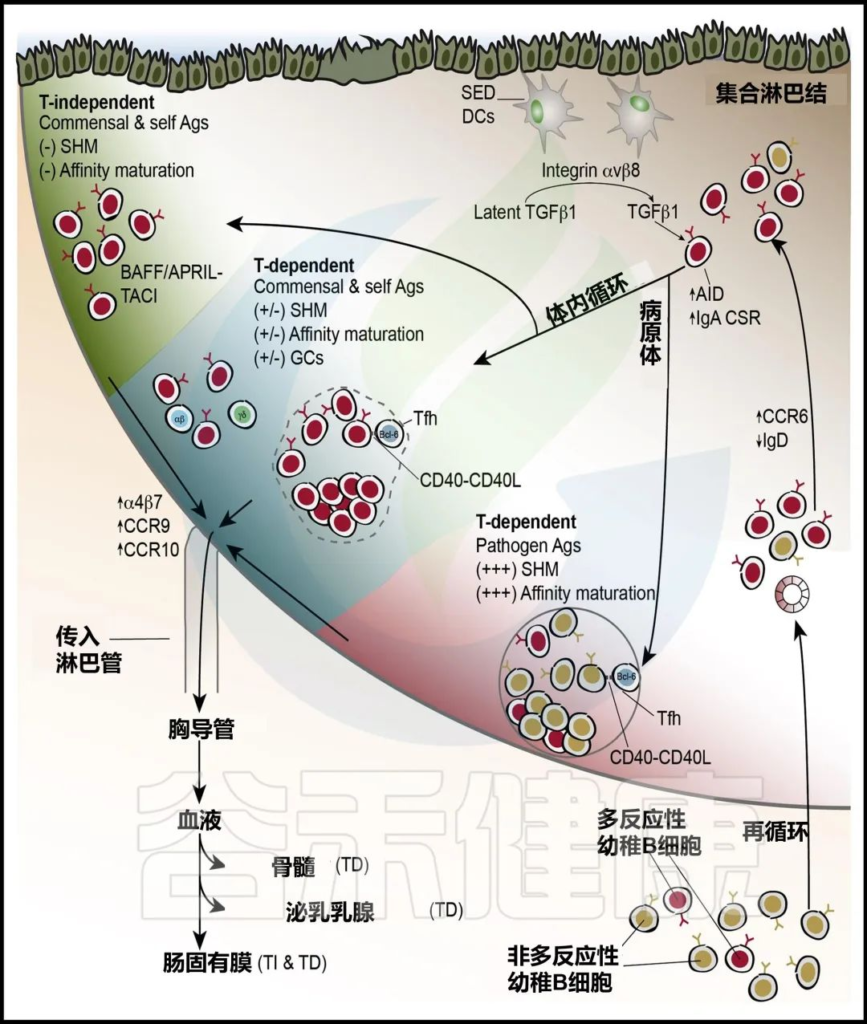
doi.org/10.1016/j.immuni.2018.08.011
此外,从幼稚 B 细胞或流感特异性反应克隆的随机多反应性 mAb 与体内涂有 IgA 的相同微生物群亚群结合。由病原体引发的聚糖反应性但非多反应性抗体通常也与共生细菌发生交叉反应。
总之,这些数据表明抗体多反应性和相关的自身反应性可能是 IgA 选择的主要驱动因素,并支持 IgA 多反应性能够与多种细菌表面分子低亲和力结合的模型。
在我们的一生中,微生物群塑造了先天和适应性免疫系统,在生命的前三年是细菌定植的最大变异性的关键时间点。我们已经讨论过不依赖 T 细胞的 SIgA 合成是通过微生物刺激来促进的,这可以被认为是在宿主和微生物群之间创造共生环境的有目的行为。
在以下部分中,我们将描述产生不同 SIgA 反应类型的机制以及这些 SIgA 亚群如何识别其清除的细菌目标。
SIgA 对肠道微生物群有选择性反应
SIgA 与微生物群相互作用以维持体内平衡,其稳态特性在很大程度上取决于抗体对各种微生物群落的特异性。据估计,在人类肠道中,单个细菌被近 19,000 个 SIgA 分子包被,而在小鼠中,这个数字增加到大约 60,000 个分子,用于包被 SIgA 的细菌。
三类SIgA 反应
这些抗体-微生物群的相互作用可以根据 SIgA 反应性明显分为三类:
(i) 跨物种
(ii) 物种特异性
(iii) 菌种特异性反应性 (如下图)
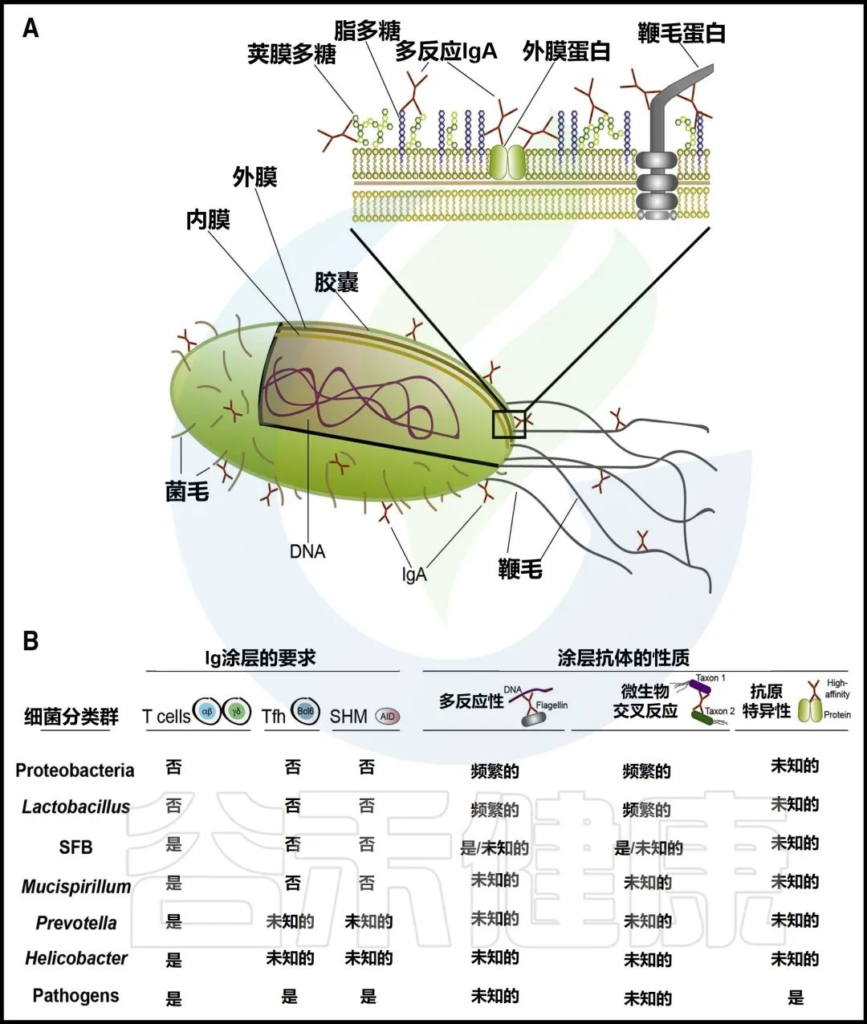
doi.org/10.1016/j.immuni.2018.08.011
跨物种反应性SIgA 是指具有结合各种不同种类细菌能力的 IgA 抗体,并且通常具有多反应性,因为它们能够结合结构上不同的抗原(例如 LPS、CpG)。
然而,最近发现 SIgA 体细胞超突变,而不是多反应性,赋予跨物种结合和高微生物群反应性。跨物种反应性 SIgA 在浆细胞分化之前先天在所有幼稚 B 细胞亚群中出现,并与广泛的微生物群亚群结合,其中包括变形菌门中的大多数成员,但这些 SIgA 在很大程度上缺乏与主要分类群拟杆菌门和厚壁菌门的结合。
这是意料之中的,因为如前所述,只有 7% 的肠道 SIgA 具有跨物种反应性,而大多数 IgA 是抗原特异性的。然而,尽管数量较少,但跨物种反应性 SIgA 在维持微生物群多样性方面和清除病原菌方面发挥着重要作用。
物种特异性反应性SIgA 是指仅与肠道中存在的不同细菌物种结合的 IgA 抗体。虽然尚不清楚 IgA 如何区分不同的细菌物种,但人们普遍认为细菌表面碳水化合物部分在 IgA 跨分类物种的选择性中发挥重要作用。
在用Bacteroides thetaiotaomicron (B. theta) 单克隆化的无菌小鼠中,诱导了高度特异性的肠道 SIgA 反应,而与其他密切相关的拟杆菌的交叉反应性较低。
还确定了抗B.theta IgA 靶向 B.theta 上的蛋白质多糖利用基因座 (PUL),这表明细菌果聚糖是物种特异性 SIgA 选择性所需的潜在表位。
另一项具有可逆体内无菌定植模型的研究进一步证实了物种特异性 SIgA 的高精度。
在这个模型中,无菌小鼠接受了营养缺陷型大肠杆菌 K-12突变体的三重突变体(称为 HA107 菌株)的诱导,但由于该菌株不能分裂也不能在体内持续存在,因此小鼠在体内恢复到无菌状态。72 小时,再次暴露于大肠杆菌HA107 后,无菌小鼠对该菌株产生了明显的黏膜 SIgA 反应,而首次暴露于鼠伤寒沙门氏菌(Salmonella typhimurium)在预处理的大肠杆菌HA107 无菌小鼠中没有引起物种特异性 SIgA 反应。
与此一致,经过大肠杆菌HA107 预处理的无菌小鼠后来被确定为缺乏大肠杆菌的微生物群定植,但缺乏具有大肠杆菌结合能力的SIgA,尽管总 IgA 产量没有减少。该证据表明,物种存在与否可能是 SIgA 物种特异性的先决条件。
有趣的是,对 B 细胞对肠道微生物群反应的功能分析检测到了针对普氏菌的 SIgA 抗体。
在一个人类队列中的健康个体的血浆和粪便中,这些人的肠道微生物群中显然缺乏普雷沃氏菌(Prevotella)。研究人员将这种现象归因于在某些时候之前接触过细菌的个体,并且在从系统清除后很长时间可能会产生针对普雷沃氏菌的抗体,他们认为这与之前对其他菌的其他研究一致。
菌株特异性 SIgAs 是对细菌物种内的各种遗传变异或亚型具有选择性的 IgAs。
最近证明,用卵形拟杆菌单菌定殖的小鼠引起强烈的粘膜 SIgA 反应。然而,已确定某些卵形双歧杆菌变体在诱导结肠 IgA 分泌浆细胞方面比其他变体更有效,导致这些特定亚型具有高IgA 分类—卵形双歧杆菌。
同样,观察到特定的双歧杆菌菌株能够在体外诱导大量的 IgA,而其他菌株只能微弱地诱导 IgA。此外,B.theta型菌株 VPI-5482 的单殖化引发了一种菌株特异性 IgA 库,被 B.theta VPI-5482 上发现的荚膜多糖吸引,而不是其他B.theta菌株。
同样,与突变株相比,IgA在体外极化上皮细胞单层上阻止了野生型伤寒杆菌的细菌粘附和侵袭,因为 IgA 识别野生型伤寒杆菌上的特定碳水化合物表位。这些发现共同突出了能够被 SIgA 识别的特定表位的多样性,并表明 IgA 反应利用大量的多反应库来广泛性结合分类众多的微生物群亚群。
SIgA 是 IgA 的主要形式,在保护宿主免受病原体侵害和塑造肠道微生物群组成以促进宿主-微生物群稳态方面发挥着动态作用。
与单体 IgA 相比,聚合 SIgA 对 Fc受体的激活效果较差,无法获得足够的下游效应信号。出于这个原因,SIgA 开发了几种机制,利用其交联能力和肠道环境来有效消除病原体。
SIgA 介导的微生物中和的第一个机制是称为免疫排斥的过程,其旨在以逐步方式拦截微生物进入肠上皮:
(i) 抗体凝集和交联
(ii) 粘液中的病原体截留
(iii) 通过蠕动去除
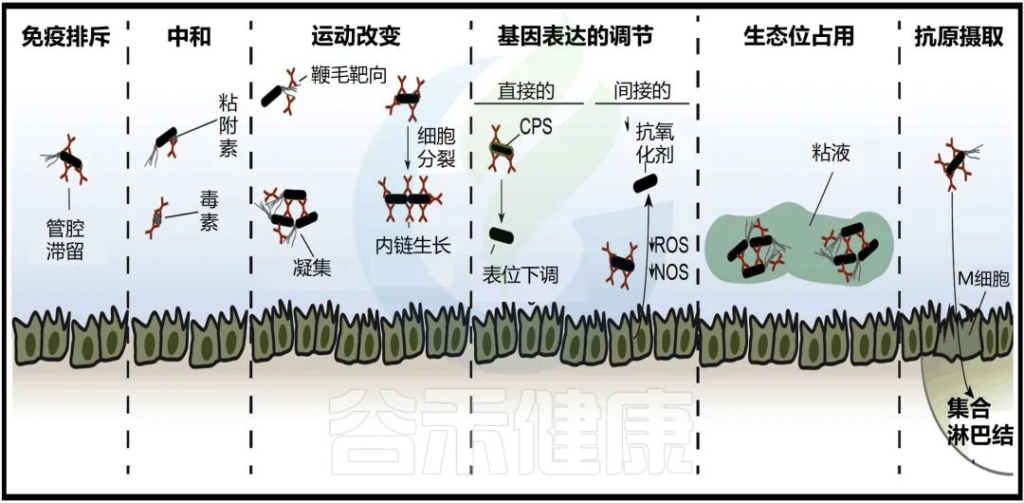
doi.org/10.1016/j.immuni.2018.08.011
在这方面,SIgA 更像是一道“阻挡墙”,以抑制微生物从管腔转移到血液中。例如,SIgA 可以预防口服接种鼠伤寒沙门氏菌的小鼠的全身感染,但 SIgA 无法预防相同细菌腹腔攻击后的菌血症和全身感染。
后来的研究结果表明,SIgA 的免疫排斥是在粘膜内特别指定的。另一项体内研究证实,志贺氏菌的免疫排斥需要 IgA 分泌糖基化残基来辅助定位抗体分子和最佳预防粘膜感染。
此外,IgA 介导的免疫排斥不仅发生于病原体细菌,也发生在共生真菌中。最近发现,SIgA 还可以靶向负责菌丝粘附和宿主细胞侵袭的细胞表面粘附蛋白,以防止白色念珠菌的附着和随后的人类感染。
免疫排斥的一个限制是它仅在高病原体密度下有效,这与典型感染不同。
出于这个原因,最近提出了另一种被称为“链式生长”的 SIgA 介导的病原体消除机制,在较低的病原体数量下相对有效。SIgA 介导的链式生长通过链式和分离细菌质粒供体和受体克隆来防止接合质粒转移。
然而,链式生长是有限的,尽管受到限制,但聚集的病原体生长可能会发生,直到获得一定的大小,然后破裂形成由密切相关的细菌组成的亚群。
链式生长的一个缺点是它对快速生长的细菌最有效。事实上,研究人员指出,具有高生长速率的细菌在子细菌之间的联系破裂之前复制,并产生更大的簇,而具有较慢生长和复制速率的细菌很可能更早遭受簇断裂并在复制时逃脱 SIgA 链式生长。
除了上述两种机制之外,SIgA 还具有一种称为“涂层”的独特功能,可增加派尔斑块中的细菌易位,从而无意中改善了常驻树突细胞的抗原采样和激活。例如,发现 SIgA 包被的福氏志贺菌(S. flexneri)被迅速转胞吞入派尔氏斑并被树突细胞内化,而未包被的S. flexneri无法穿透肠上皮。
据报道,SIgA 涂层对小肠中的共生细菌占优势,这反过来又有助于菌群定植,而不含 IgA 的细菌大多是结肠的固有细菌。
重要的是,尽管有足够的 SIgA 可用于覆盖几乎整个微生物群,但 SIgA 的这种“包被”作用似乎受到高度“监控”,因为 <5% 的 SIgA 被用于细菌包被,这可以推断是为维持与肠道微生物群共生的基本机制,而在疾病条件下,SIgA 涂层变得更加普遍。比较特别的是,IgG 和 IgM 几乎没有包裹厌氧菌的能力,更突显了 SIgA 是针对肠道抗原的主要反应性免疫成分。
已发现 SIgA 通过重塑肠道微生物群组成以促进肠道共生体生长和抑制病原菌增殖,对维持肠道稳态具有很大影响。
例如,专门覆盖粘液共生体 B.theta 的 SIgA已被证明可以上调一组临时命名为粘液相关功能因子 (MAFF) 的基因,这些基因的功能是确保厚壁菌门细菌之间的共生,并且还可以提供针对结肠炎的化学保护物质。
此外,SIgA通过共生定植因子 ( ccf ) 对共生脆弱拟杆菌的黏膜定植和单菌株稳定性至关重要。脆弱拟杆菌介导的荚膜多糖上调以吸引 IgA 结合。有趣的是,脆弱拟杆菌具有内切糖苷酶活性,因此可以利用在 SIgA 上重度修饰的复杂 N-聚糖进行必要的共生细菌生长,这最终有助于该细菌在特定的粘膜生态位内定植。这也是我们很多的粪便检测实践中发现脆弱拟杆菌的丰度占比较高。
此外,粘膜 IgA 通过限制共生真菌增殖来维持微生物群的稳态,因为已观察到 SIgA 对人类粪便中发现的光滑念珠菌、白色念珠菌、酿酒酵母和热带念珠菌具有反应性 。
SIgA 还促进出生时肠道微生物群中的健康生物多样性。研究发现母乳会转移某些细菌,例如链球菌属和Veillonella dispar,这导致了后代微生物群的整体变化 。
以上证据表明 IgA 对于微生物粘附到上皮表面至关重要,并且可以同时去除这些细菌以进行清除以保持适当的多样性。此外,抗体具有多种结合亲和力,可以覆盖肠道微生物群的大部分,目的是维持而不是消除微生物的多样性。
宿主 SIgA 和细菌之间的这种相互作用促进了肠道中额外的宿主免疫反应,从而产生了一个共生的调节回路来维持肠道稳态。
有趣的是,在厚壁菌门中属于簇 IV 和 XIVa 的梭状芽胞杆菌被观察到是多样化 IgA 生产所必需的 Foxp3 + T 细胞的有效诱导剂。反过来,依赖于 T 细胞的 IgA 对共生体Akkermansia muciniphilia的反应提供了针对肠道感染的“旁观者保护”,以进一步促进肠道健康和维持体内平衡。
尽管 SIgA 的肠道稳态功能仍然很微妙,但 IgA 反应的程度以及分泌黏膜 IgA 抗体支持其功能意义。尽管尚不清楚 IgA 抗体是否可能对 IgA 靶向微生物产生有利或有害的影响,但 IgA 包被的共生体的组成性存在表明任何有害影响通常不足以引起消除。
事实上,IgA 与细菌荚膜多糖的结合可能会被一些微生物群抑制以允许粘液层附着,从而防止竞争物种的生态位入侵。
肠道微生物群的组成和活性可以受到环境和宿主衍生因素的调节。其中,免疫球蛋白 A (IgA) 对胃肠道共生菌的稳态功能最近已在IgA 缺乏症患者中得到证实。
IgA 通过聚糖和脂多糖 (LPS) 相互作用调节肠道菌群组成,与 IgA 同源抗原识别无关
具体而言,IgA通过聚糖-聚糖相互作用(IgA-聚糖和 LPS)与细菌共生亚群如多形拟杆菌Bacteroides thetaiotaomicron ( B. theta )、B. vulgatus、B. fragilis和Parabacteroides distasonis 等结合。此外,IgA 增强了结肠外膜中细菌与宿主粘液和饮食衍生多糖的结合。
粘液相关的B. theta特别容易受到 IgA 涂层的影响
研究人员发现,暴露于 IgA 会导致B. theta上调两种未发现的蛋白质——称为粘液相关功能因子 (MAFF) C 和 D——它们在结构上与其他肠道细菌共享,并增强了B. theta的代谢活性。
在小鼠和人类的结肠粘液中,B. theta 诱导 MAFF 系统表达,这取决于与梭状芽孢杆菌等厚壁菌门成员的相互作用。同样,B. theta 产生的代谢物可诱导梭菌属成员的扩增,从而驱动更多样化的微生物群。
这些发现强调,IgA 驱动的B. theta MAFF 表达是调节网络的结果,不仅涉及肠道微生物群组成,还涉及其在粘膜生态位内的遗传结构和潜在功能。
在化学诱发结肠炎的小鼠模型中,接种了野生型 B.theta 的小鼠结肠在用硫酸葡聚糖钠治疗 10 天后恢复。相比之下,接种了缺乏 MAFF 蛋白的B.theta菌株的小鼠的结肠仍然显示出损伤和肠道炎症的迹象。这些结果表明,MAFF 诱导的肠道菌群增强了结肠上皮细胞的增殖和再生,同时也增加了肠道菌群的多样性。
总之,共生类拟杆菌的最佳体内代谢能力取决于 IgA-多糖相互作用。IgA 对肠道稳态的作用取决于不同微生物群之间的相互作用,并且由 MAFF 微生物基因的表达调节。
正如前面部分所述,IgA 由于其结构意义、分泌、糖基化、定位和受体相互作用而在免疫系统中发挥着重要作用以及 IgA 强烈影响各种共生微生物的微生物群组成及其相关基因表达的方式。
重要的是,持续的研究强调微生物群组成是越来越多疾病的牵连病因,包括肠胃病(如结肠炎,结直肠癌)、肾病、过敏、哮喘,精神类疾病和代谢疾病甚至人类寿命。由于 IgA 生物学功能障碍也可导致多种疾病,因此了解 IgA -微生物群轴的缺陷可以帮助预防和治疗各种疾病的发展。
高和低 IgA 水平都与死亡风险增加有关。不过,需要更多的研究才能得出任何结论。
与死亡率的关联
在 4,255 名越战老兵中,较高的 IgA 水平死于传染病的风险增加 2 倍有关。
在 90 – 99 岁的人群中,较高的 IgA 水平与较高的死亡率相关。
同样,在 8 岁儿童中,高 IgA 水平(>400 mg/dl)与较高的死亡率相关。IgA 水平与男性癌症死亡率有关。
较高的IgA与癌症(特别是非肺癌)和呼吸系统疾病死亡风险的降低有关。
严重的 IgA 缺乏与诊断后前 10 至 15 年内较高的死亡率相关。
高和低 IgA 水平可能有许多潜在原因。因此,引发异常 IgA 水平的健康状况比 IgA 水平本身更可能影响一个人的死亡风险。
选择性 IgA 缺乏症 (SIgAD)
无法检测到的血清 IgA 含量低于 7 mg/dL。人类 IgA 缺乏症的临床表现被称为选择性 IgA 缺乏症 (SIgAD) 。SIgAD 是最常见的原发性免疫缺陷,其余 Ig 水平正常。20-30% 的 SIgAD 患者患有自身免疫性疾病。研究表明 SIgAD 患者的一级亲属有 10% 的自身免疫性疾病发生率,是一般人群中估计的 5% 的两倍。
重要的是要注意,即使 B 细胞或 IgA 不存在,肠上皮细胞也可以启动其他保护性防御,例如诱导干扰素诱导的免疫反应途径,但前提是存在微生物群。
关于人类 SIgAD 是否与肠道微生物生态学的重大变化有关,存在相互矛盾的报道。
有趣的是,最近的一项研究表明,SIgAD 患者的体循环中存在代偿性 IgG 反应,其中 IgG 对共生体具有抗菌特性。另一项宏基因组研究表明,SIgAD 患者的微生物多样性降低,但富含大肠杆菌等机会性细菌。
常见可变免疫缺陷 (CVID)
除 SIgAD 外,还有一种称为常见可变免疫缺陷 (CVID) 的疾病,原因是抗体产生无效,主要是 IgG 和 IgA,这是由于普遍的 B 细胞缺陷。
Omenn 综合征 (OS)
由亚型 RAG 突变引起的 Omenn 综合征 (OS),会在不经意间导致 IgA 缺乏。CVID 和 OS 患者感染细菌感染的风险自然更高,但他们也可能有非感染性自身免疫并发症,例如炎症性肠病和肠病。尽管对该主题的研究很少,但暗示不稳定的肠道微生物确实在 CVID 和 OS 患者的自身免疫反应中起作用。
炎症性肠病 (IBD) 是整个胃肠道剧烈炎症的结果,每年估计有 70,000 例新的 IBD 病例被诊断出,全球有 680 万例。微生物群在 IBD 中起着不可或缺的作用,但其作用是原因、结果还是相关性是 IBD 研究中的一个持续问题。
细菌诱导IBD -> IBD -> 菌群失调 -> IBD 加重
一方面,某些细菌可能是导致 IBD 进展中必不可少的炎症过程升级的抗原刺激物。事实上,无菌小鼠表明微生物群是自发性结肠炎的诱导物和侵袭物。
另一方面,当研究缺乏上皮特异性极化分选因子衔接蛋白 (AP)-1B 的小鼠的自发性结肠炎时,发现 IBD 的易感性引发了微生物群组成向生态失调的不利变化,其中大量减少硫和产生乳酸的细菌可能解释了加重的结肠炎。
其他小鼠研究支持某些个体细菌作为前结肠炎,包括人类衍生的产生丁酸盐的菌株Anaerostipes hadrus BPB5 、吃粘蛋白的AKK菌 、肺炎克雷伯菌和奇异变形杆菌等。这与观察到IBD 患者肠杆菌科和变形菌门增加的人类研究相关。
这些变化同时被认为是人类 IBD 的生物标志物和治疗相关的靶点,以减少微生物群加剧 IBD。
虽然这些研究表明微生物群组成差异只是炎症的并发症,但值得注意的是转化乙酸丁酸的Roseburia的减少。最近发现,在健康对照组中,在 IBD 之前并在 IBD 期间持续存在,这表明微生物群参与了疾病本身的病因学。
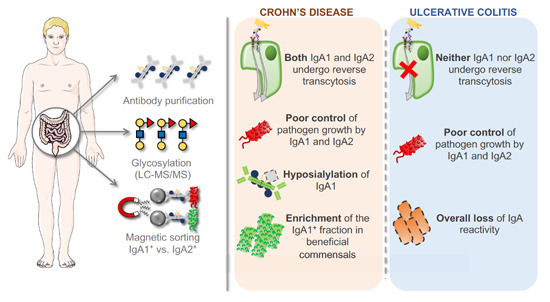
doi.org/10.15252/emmm.202115386
鉴于其先前确定的影响肠道微生物群组成的能力,SIgA 在微生物群-IBD 关系中非常重要,其中 IBD 患者可能对共生真菌和细菌的粘膜耐受性功能障碍。
例如,pIgR 基因敲除小鼠由于 SIgA 转运缺陷和微生物群不稳定而更容易患结肠炎。关于真菌,几种念珠菌属与 IBD 病理学有关,特定的念珠菌菌丝形态与 IBD 严重程度增加有关。此外,观察到 SIgA 靶向病原真菌中的粘附和菌丝细胞,以防止结肠炎期间念珠菌相关的损伤。
关于细菌,缺乏诱导型共刺激配体 (ICOSL) 的小鼠对 IBD 自发敏感,其 IgA 减少,并且对来自毛螺菌科粘液相关细菌的鞭毛蛋白的抗原识别受损。
此外,激活转录因子 3 (ATF3) 缺陷的小鼠表现出肠道菌群失调,这有利于促炎性普氏菌的丰度,并显示肠道中 T FH细胞发育受损,导致 SIgA 产生显着降低。这种反应在缺乏先天效应蛋白、骨髓分化初级反应 88 (MyD88) 的小鼠中是相似的,它通过诱导 CD4 + T 细胞和调节性 T 细胞在调节 IgA 对肠道微生物群的反应中起关键作用。
IgA 对 IBD 和肠道菌群失调的反应需要 MyD88 信号传导
MyD88 缺陷型小鼠的结肠炎严重程度加重,肠道菌群失调突出,分段丝状细菌过多和细菌负荷增加,表明 IgA 对 IBD 和肠道菌群失调的反应需要 MyD88 信号传导。相比之下,甲基化控制的 J 蛋白(一种线粒体内膜蛋白)的缺失导致 IBD 相关细菌Ruminococcus gnavus 大量繁殖,但令人惊讶地增加了 SIgA 水平。
升高的SIgA可能是一种补偿反应,准备对抗病原体
同样,吲哚胺 2,3-双加氧酶 (IDO) 敲除小鼠对柠檬酸杆菌具有较高的 SIgA 基础水平,并且对柠檬酸杆菌诱导的结肠炎具有抗性。最后两项研究表明,在某些情况下,升高的 SIgA 可能是一种补偿反应,以确保共生清除并创造一个准备好对抗病原体的环境。
IBD 患者的粪便中含有更多的 SIgA 涂层细菌
最近的一项研究表明,与对照组相比,IBD 患者的粪便中含有更多的 SIgA 涂层细菌。因此,IgA-Seq 已被用于分析 SIgA 包被的细菌,从而识别 IBD 相关微生物。例如,通过 IgA-Seq 选择 SIgA 包被的细菌,从 IBD 患者中分离和厌氧培养这些微生物,然后在无菌小鼠中定殖,进行了一项具有里程碑意义的研究。
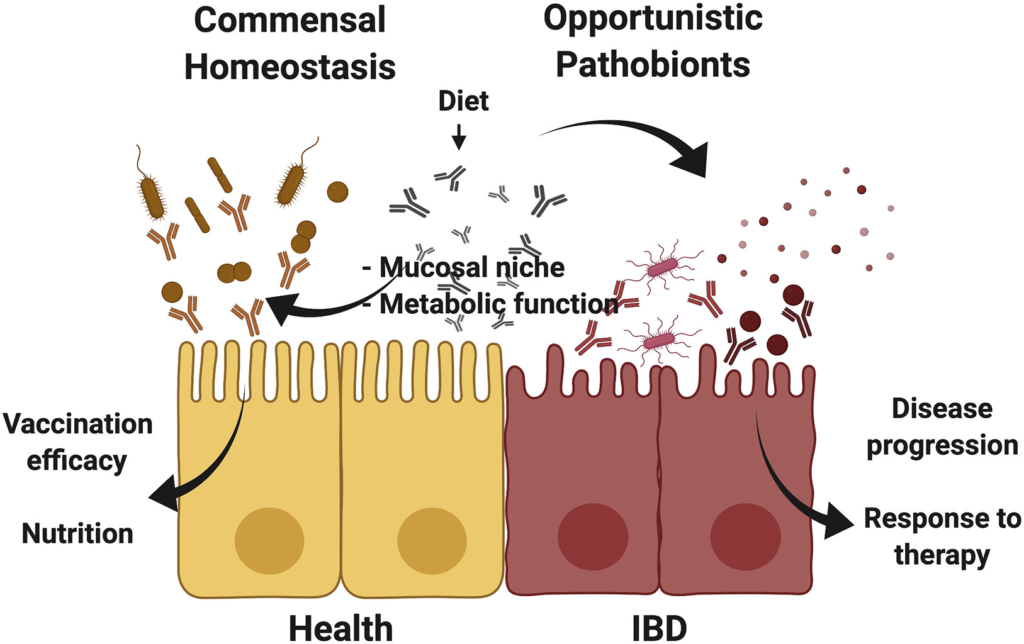
doi.org/10.1016/j.chom.2020.12.014
SIgA 涂层作为免疫介导的降低肠道细菌负荷的目标
除了作为生物标志物外,SIgA 涂层似乎还可以作为免疫介导的降低肠道细菌负荷的目标。因为 SIgA 高的小鼠品系 CBA/CaJ (CBA) 对葡聚糖硫酸钠 (DSS) 诱导的急性结肠炎具有抗性,因为它继承了增加的 SIgA 涂层和减少的粪便细菌负荷,而 SIgA 低的小鼠品系C57BL/6 (B6) 易患结肠炎。
令人印象深刻的是,最近的一份报告发现了一部分克罗恩病患者在含有核苷酸结合寡聚结构域(NOD2)发生突变,携带抗原的 SIgA 逆行转运到派尔斑块中增加。作者在 NOD2 缺陷小鼠中证实了这一观察结果,这支持了粘膜炎症增加可能是由于过度活跃的 SIgA 逆行转运的概念。
注:核苷酸结合寡聚结构域(NOD2)肽聚糖(细菌细胞壁)的产物,是一种位于上皮细胞和免疫细胞内的胞质 ,能够感知胞壁酰二肽。这种胞质对于病原体入侵和几种炎症性疾病期间的免疫反应至关重要,从而调节粘膜细菌定植。
一般来说,这一证据表明,人类的高 IgA 反应可以预防结肠炎,因此,消除或抑制 SIgA 包被的细菌是潜在治疗的途径。
研究发现与同种型对照相比,对 IL-10 缺陷小鼠进行丁酸钠治疗可减少 SIgA 涂层细菌的数量,同时增加肠道生物多样性。
利用IgA靶向和抑制有害菌
作为一种更直接的方法,最近开发了一种工程化 IgA 克隆 W27,它靶向和抑制有害共生细菌,但不抑制有益细菌,从而在几种小鼠模型中预防结肠炎和提高肠道微生物群多样性。
另一个需要考虑的来源是母乳衍生的 SIgA。证明其早期暴露可改善葡聚糖硫酸钠诱导的上皮损伤。研究这一观察结果是否可能是由于表达 RORγ 的调节性 T 细胞在多代传递中的免疫调节是很有趣的。针对 IgA 微生物群轴的持续研究肯定会推进治疗 IBD 的临床困境。
坏死性小肠结肠炎(NEC)是易感婴儿最严重、最常见的肠道疾病。早产儿小肠结肠炎的风险在中度至极低体重的新生儿中增加,后者婴儿的死亡率估计为 20-30% 。
坏死性小肠结肠炎进展的促成因素集中在新生儿期肠道不成熟和不适当的微生物定植。
NEC 通常在出生后 8-10 天出现,此时肠道被变形菌和厚壁菌门的兼性厌氧菌定植。当早产儿进入新生儿重症监护室 (NICU) 时立即使用抗生素可能会干扰适当的细菌定植,因此会导致坏死性小肠结肠炎。实质上,细菌侵入肠壁引起局部感染,随后是上皮损伤、潘氏细胞耗竭、屏障功能受损、炎症、坏死、菌血症和内毒素血症。
在潘氏细胞破坏坏死性小肠结肠炎啮齿动物模型中,添加配方奶会加剧肠道损伤,而与肠道微生物菌群失调无关。这一结果强调了早产儿喂养需要谨慎。
母乳降低坏死性小肠结肠炎发病率,与IgA有关
相比之下,发现母乳显着降低坏死性小肠结肠炎发病率,这表明母乳中的抗菌成分负责保护。
最近的一项开创性研究发现母乳是出生后第一个月 SIgA 的主要来源,当时 IgA 涂层有助于减少肠杆菌科细菌并保护小鼠免受坏死性小肠结肠炎。
这一发现进一步得到了以下观察结果的支持:暴露于母乳的 IgA 缺陷幼崽仍然易患坏死性小肠结肠炎。值得注意的是,γ-变形杆菌特异性 IgA 负责从未成熟微生物群到成熟微生物群的转变,而 IgA 缺乏会导致 γ-变形杆菌大量繁殖。
回顾到成熟微生物群的最终转变是从 γ-变形菌到梭状芽孢杆菌,可以假设梭状芽孢杆菌耗竭可能是坏死性小肠结肠炎婴儿微生物群成熟停滞的指标。
因此,对于未来的研究来说,了解母体 IgA 的供应是否与成熟微生物群相关,即NEC 保护婴儿中梭状芽胞杆菌的恢复,这一点很重要。
上述证据强调了坏死性小肠结肠炎中提高 IgA 和调节 IgA 相关微生物群的治疗潜力。
然而,在坏死性小肠结肠炎中靶向 IgA 并不一定是新的方法,1988 年的一项研究发现口服 IgA-IgG 补充剂可有效预防早产儿坏死性小肠结肠炎。
无论如何,促进和/或维持 IgA 水平的治疗方法可能会挽救生命。考虑到患有炎症性肠病的母亲通过母乳水平转移给婴儿的 IgA 可用性较低,其中,母亲和孩子都可能需要补充 IgA。
然而,通过最近的一项研究,必须意识到 IgA“过度涂层”的可能性。产前压力增加了后代微生物群中的 IgA 涂层,并以性别依赖的方式加重了坏死性小肠结肠炎。因此,其他微生物方法(即益生菌)也可用于治疗坏死性小肠结肠炎,特别是乳杆菌属。
结直肠癌 (CRC) 是癌症相关死亡的第二大常见原因,而 IBD 恰好是 CRC 发展的主要前兆。与任何癌症一样,早期发现对于降低死亡率至关重要。
IgA 作为一种重要的结直肠癌筛查工具
几项研究调查了自身反应性抗体,特别强调 IgA 作为一种重要的 CRC 筛查工具。特别是,与肿瘤相关抗原癌胚抗原 (CEA) 反应的 IgA 已成为 CRC 患者的重要特征。
最近用水凝胶生物芯片证明,在诊断中结合抗 CEA 和抗聚糖抗体可提供更好的预测值。特别值得注意的是,在用重组 CEA 对 CRC 患者进行免疫时,发现 IgA 抗 CEA 抗体对肿瘤细胞具有细胞毒性并提高了患者的存活率。对某些细菌(如具核梭杆菌和产毒素的艰难梭菌)特异的 IgA也已被证明具有高度特异性和敏感性的诊断价值。
虽然 IBD 患者 IgA 不足,但最近的文献可能表明 IgA 的缺乏实际上可能是预防侵袭性 CRC 的一种保护机制。
在Apc Min/+ CRC 小鼠模型中,确定了肿瘤微环境中 IgA +淋巴细胞的扩增。这与 CRC 患者晚期肿瘤中浆细胞的优势相匹配,其中 B 细胞亚群 IgA + IGLC2 +与预后不良有关。
值得注意的是,前 B 样细胞可能在 CRC 发展的早期阶段具有抗肿瘤功能 ,但是当它们在晚期 CRC 中分化为浆细胞时,这可能会变得不那么有效。
IgA 维持微生物群稳态
具体而言,通过研究研究表明与宿主故意限制 IgA 可用性本身的想法相反,IgA 迁移到结肠肿瘤细胞的缺乏,理论上可以促进支持致癌生长的促炎环境。研究表明,缺乏 IL-33 的小鼠 IgA 水平显着降低、菌群失调、结肠炎和最终发生 CRC ,这支持了 IgA 是维持微生物群稳态以预防肠道疾病所必需的传统观念。
肠道微生物组和 IgA 与 CRC 之间的关系相对未描述,未来的研究可能会揭示筛选和治疗这种致命癌症的新方法。一个值得的研究方向是了解 IgA 涂层对 CRC 相关细菌(如具核梭菌和脆弱拟杆菌)在疾病进展中的作用。可能还有许多其他肠道微生物可能在 CRC 中发挥作用,需要进一步研究。
中枢神经系统(CNS)的复杂疾病是由遗传和环境因素共同引起的。人体研究和动物模型表明,宿主体内的共生微生物可以影响中枢神经系统疾病(下图)。
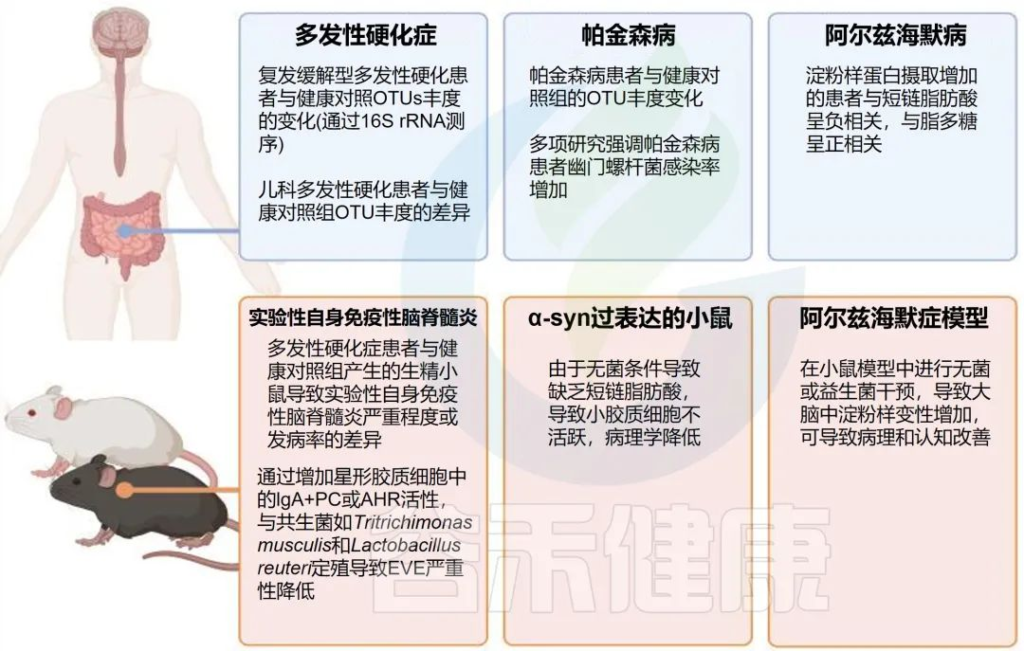
doi: 10.3389/fimmu.2021.742173
有两个关键宿主因素,肠道 IgA 和衰老,它们对微生物组的形成具有深远的影响。且而且宿主因素(IgA 和衰老)之间的相互作用会塑造微生物组,进而影响中枢神经系统疾病背景下的淋巴细胞和神经胶质细胞行为。
肠道微生物组与中枢神经系统神经炎症和神经退行性变之间的假定联系:
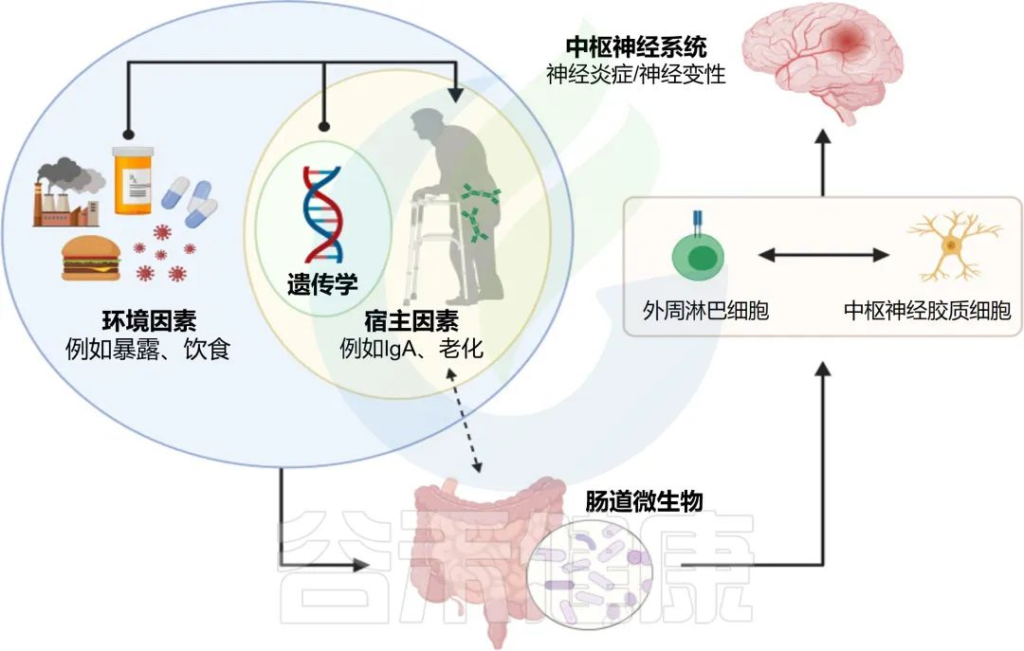
doi: 10.3389/fimmu.2021.742173
实验性自身免疫性脑脊髓炎
虽然 IgA + ASCs (抗体分泌细胞)可以在体内平衡期间归巢到硬脑膜 ,但在稳态中枢神经系统中不存在克隆扩增的 IgA,并且仅在炎症期间出现。在实验性自身免疫性脑脊髓炎期间,SILP 中的 IgA + ASC 显着减少。
此外,在中枢神经系统疾病中发现过继转移的肠道来源的 IgA + ASC 对小鼠来源的肠道细菌有反应,并显示通过在实验性自身免疫性脑脊髓炎(EAE)的慢性阶段产生 IL-10 来减轻神经炎症。
过量的 IgA + ASC 能够减少 T 细胞产生的 GM-CSF,这是一种促进神经炎症的重要细胞因子。毛滴虫( T.mu ) 是一种啮齿类共生动物,可促进 IgA 的产生。T.mu +小鼠的 EAE 发生率和严重程度以及脊髓炎症和脱髓鞘减少。T.mu +小鼠还表现出血清和粪便 IgA 水平升高,肠道、骨髓和大脑中 IgA + ASCs 的频率增加。
虽然以上强调了动物模型的主要发现,但也有早期证据表明微生物群驱动的 IgA 反应在人类疾病中的重要性。
多发性硬化:肠道菌群 IgA降低,脑脊液 IgA 相应升高
由 IgA-seq 鉴定的细菌在多发性硬化患者与健康对照中的表达差异很大。按疾病活动分层,与缓解患者相比,复发的多发性硬化患者粪便样本中 IgA 结合的肠道细菌百分比降低,脑脊液 IgA 相应升高。
中枢神经系统浸润的 IgA + B 细胞对肠道微生物抗原具有特异性,表明在复发期间产生 IgA 的细胞从肠道迁移。
多发性硬化患者的脑脊液中IgA也升高。重要的是,共生特异性 IgA +在多发性硬化患者的炎性病变中观察到 ASCs。然而,这种现象可能不是 IgA 独有的,因为已发现多发性硬化患者脑脊液中的 IgG 对多发性硬化相关的肠道细菌裂解物具有反应性。这些细菌反应性 IgG 在疾病中的影响尚未完全阐明。
最后,虽然 IgA + ASC 现在已经在发炎的 EAE 和 多发性硬化中进行了描述,但现在人们认识到这些细胞在体内平衡中起着重要作用。具体而言,已在健康小鼠和人类的软脑膜中检测到肠道共生特异性 IgA + ASC,但在无菌小鼠中不存在。这些细胞可能在硬脑膜窦附近维持屏障完整性;然而,它们也可能有助于中枢神经系统的静止。
总而言之,除了在塑造微生物组方面广受赞赏的作用外,产生 IgA 的 ASC 在健康和多发性硬化/EAE 中枢神经系统中同样发挥着重要作用。
IgA肾病(IgAN)
1968 年首次发现IgA 肾病(IgAN,别名Berger 病)描述了由于在肾脏中形成炎性免疫复合物而导致半乳糖缺乏的 IgA1 在肾小球系膜中沉积和随后的肾小球肾炎。
IgAN 是全世界最常见的原发性肾小球肾炎,其临床特征通常是无症状血尿和进行性肾病。
最近的估计表明,大约四分之一的 IgAN 患者在 20 年内最终发展为终末期肾病,因此死亡风险增加。
IgAN 背后的病因似乎始于固有层中肠激活 B 细胞和抗体分泌细胞 (ASC) 的扩张。
小鼠和人类研究均表明,APRIL 或高同源性 BAFF 的转基因表达会导致IgA1 铰链区的异常O-糖基化和 IgA1 产生的高反应性。当 IgA + ASC 离开次级淋巴组织进入循环时,它们可以进一步分化为长寿命的 IgA +浆细胞。半乳糖缺乏的 IgA1 的系膜沉积物会过度激活补体系统 和/或与 IgG 自身抗体复合,这共同导致促炎反应和肾损伤。
尽管 IgAN 是一种影响肾脏的疾病,但它的起源也与肠道微生物群—肾轴密切相关。2011 年发现四个新的 IgAN 基因座富含与“用于 IgA 产生的肠道免疫网络”相关的 KEGG 途径,包括与粘膜免疫即局部病原体多样性的强正相关。
IgA 血管炎的发病机制
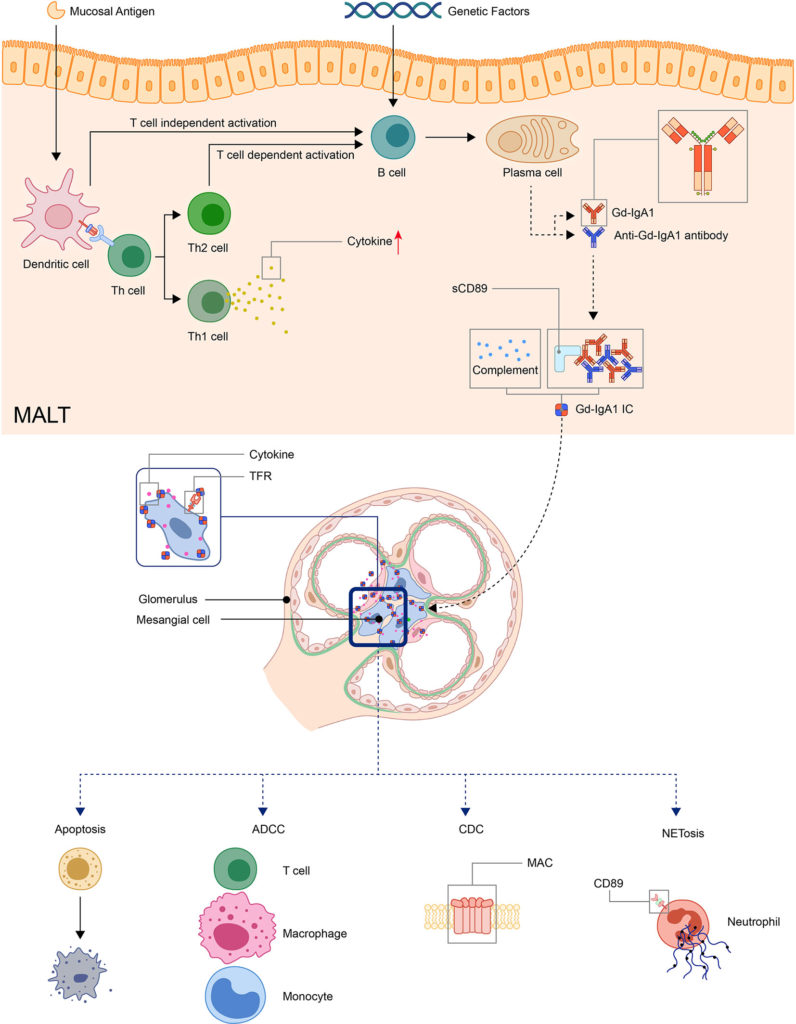
doi.org/10.3389/fimmu.2021.771619
黏膜抗原可以通过T细胞依赖或独立的方式激活MALT中的B细胞。后者通过 TLR 途径激活 B 细胞。在遗传因素的作用下,活化的 B 细胞变成浆细胞并产生 Gd-IgA1。Gd-IgA1 和抗 Gd-IgA1 自身抗体与其他成分(包括 sCD89 或补体)一起形成循环免疫复合物。然后,免疫复合物沉积在器官中并激活炎症反应。在肾脏中,免疫复合物可以通过 TfR 激活系膜细胞,导致肾细胞凋亡和炎症细胞的募集。
最近,在 2021 年发现了几个与 IgAN 中微生物组成变化相关的微生物组数量性状基因座,例如,Dialister和Bacilli的丰度降低,但Lachnobacterium的丰度增加。IgAN 患者的关键细菌有显着的分类学改变,包括埃希氏菌、志贺氏菌水平升高和罗氏菌属、毛螺菌科、梭菌属水平降低。
有趣的是,在 IgAN 患者中,某些肠道代谢物(如短链脂肪酸)与其细菌产生物同时显着减少。
值得注意的是,对人源化小鼠进行抗生素治疗足以显着降低 IgAN 的病理生理特征,包括 IgA1 系膜沉积、免疫复合物和肾小球炎症。因此,肠道微生物群似乎是产生粘膜来源的肾毒性 IgA1 的重要因素,但需要更多的研究来进一步确定 IgAN 中的肠道微生物特征。
值得注意的是,微生物蛋白酶可以从肾小球中去除 IgA 免疫复合物 ,这表明有机会以依赖微生物群的方式治疗性解决 IgAN。
近日研究发现:IgAN患者志贺氏菌属的显着扩增
该研究选取127名IgA肾病(IgAN)患者和127名对照,随机分为发现和验证队列,对 77 名患者的亚组进行了前瞻性随访,以进一步剖析 6 个月免疫抑制治疗后肠道菌群变化与治疗反应之间的关系。
结果发现,治疗前,α-多样性降低(Shannon,P = 0.03),变形菌门-γ变形菌纲-肠杆菌目-肠杆菌科-埃希氏杆菌-志贺氏菌属显著扩增,这种情况在免疫抑制治疗 6 个月后达到临床缓解的患者中逆转。
IgAN患者肠道菌群失调的标志,以埃希氏菌-志贺氏菌属的显着扩增为特征,可作为 IgAN 有前景的诊断生物标志物和治疗靶点。
IgA 血管炎(IgAV)
在 IgAN 患者中经常同时发现的是 IgA 血管炎 (IgAV),也称为过敏性紫癜,一种 IgA 沉积在血管中导致炎症的疾病。关于 IgAV 和 IgAN 是否是同一疾病在不同组织中的两种临床表现,一直存在争议。两种疾病的病原学概念基本相同,但在症状和流行病学方面存在细微差别。
与 IgAN 主要发生在成人和血尿是第一个临床指标相比,IgAV 患者在儿科人群中更常见,他们表现出症状:
IgAV 患者的多样性显着下降,但IgAV 患者的梭杆菌数量增加。IgAV 患者与Dialister (梭状芽胞杆菌家族的前一个成员)和更丰富的大肠杆菌科的志贺氏菌呈负相关。
有趣的是,其他血管炎病例,如川崎病,也表现出更多的梭杆菌,而 Behçet 综合征患者的丁酸生成细菌较低,例如Roseburia和Clostridia.
这暗示梭杆菌最有可能是血管炎中的病原菌,而短链脂肪酸丁酸盐则是一种有益的代谢物,在血管炎和肾病期间的可用性有限。
尽管如此,仍需要更大规模的临床研究来了解微生物群在肾病和血管炎中的相关性,并评估微生物群依赖性预后和 IgAN 和 IgAV 的治疗策略。
胆汁是一种黄绿色的分泌产物,负责乳化饮食中的脂质和脂溶性维生素。肝脏负责胆汁合成并将其运输到胆囊中进行储存。在人类中,每天大约有 5–50 µg/mL 的蛋白质以胆汁的形式从肝脏排出。
IgA 进入胆囊的机制
IgG 在肝胆汁中占优势,IgA 在胆囊胆汁中含量最高。具体来说,胆囊胆汁含有聚合 IgA、聚合 SIgA 和游离分泌成分 (SC)。IgA 进入胆囊的机制因物种而异。例如,在人类中,聚合 IgA 由沿肝胆树的相邻浆细胞产生,然后被胆管上皮细胞上表达的 SC-pIgR 复合物捕获,以分泌到胆汁中。
IgA 从循环到胆汁的转运是去除抗原的自然途径
胆汁中大量存在 SIgA 表明 IgA 在肝胆系统中具有重要的生物学功能。胆汁中的 IgA 有几个提议的功能 。1980 年代的大量研究得出结论,IgA 从循环到胆汁的转运是去除抗原的自然途径。将各种免疫球蛋白静脉注射到小鼠体内的放射性标记抗原显示 IgA,而不是 IgG 或 IgM,是抗原转运到胆汁中的主要抗体。
胆汁 IgA减轻继发性肝胆感染
除了预防原发性肝脏感染外,胆汁 IgA 的这一功能对于减轻肠道细菌和寄生虫感染的继发性肝胆感染至关重要。通过将杀死的大肠杆菌菌株注射到 Peyer 斑块中对大鼠进行免疫,产生胆道 IgA 特异性抗大肠杆菌可防止肝胆感染、胆管炎和全身性败血症。
肝胆疾病患者发生胆囊感染的风险更大,与IgA有关
必须注意的是,患有肝胆疾病(例如胆汁淤积、胆石症)的患者发生胆囊感染的风险更大,因为胆管上皮细胞的损伤会导致肝胆 IgA 清除受损和胆汁 IgA 回流到血液中。与此一致,SIgAD 患者自然更容易患肝胆疾病,例如原发性胆汁性肝硬化和胆囊感染 。有趣的是,胆汁液中 IgA 包被细菌的检测可能与肝胆感染患者的临床症状有关,例如发热和白细胞增多。
肝脏中的局部 IgA 具有微生物群反应性
没有太多研究调查肠道微生物群是否会影响肝胆感染中的 IgA。直到最近的研究表明,肝脏中的局部 IgA 被鉴定为具有微生物群反应性,并且来源于离开派尔斑的抗体分泌细胞(即浆母细胞)。
先前的研究还表明,胆结石患者表现出肠道菌群失调,大约 70% 的肠道细菌 OTU 在胆道中可检测到;然而,这是否会影响肝脏和胆汁 IgA尚不清楚。
胆道感染引起的胆汁微生物群变化
最近,人们对胆道感染引起的胆汁微生物群变化给予了更多的认识。与肠道微生物群平行,胆汁微生物群中的四个优势门是变形菌门,厚壁菌门、拟杆菌门和放线菌门。肝吸虫Opisthorchis felineus感染的存在导致胆汁微生物群的 β 多样性增加,螺旋体门的成员增加,克雷伯氏菌属、具合杆菌属、乳酸杆菌属、密螺旋体属、副流感嗜血杆菌和金黄色葡萄球菌的丰度增加。
肝吸虫感染后肠道菌群也发生变化
例如毛螺菌科、瘤胃球菌科和乳杆菌科增加,但紫单胞菌科、丹毒科和真杆菌科减少。
未来的研究应确定胆道和肠道微生物群之间的单一或同时变化是否会影响 IgA 功能,以及这是否可以确定肝胆感染的严重程度。
免疫球蛋白 A 是抵御有害微生物的第一道防线,但它也能维持免疫耐受性。正常的 IgA 水平可以平衡免疫系统。低水平会增加过敏和自身免疫的风险。
低 IgA 水平
较低的 IgA 可能意味着免疫力减弱。此外,最近的研究结果现在暗示它可能表明肠道屏障和/或肠道微生物群失衡。
在成人中,大多数实验室认为低于 60 mg/dL 的 IgA 值较低。
慢性压力、睡眠不足和疲惫会降低唾液中需要第一防御功能的 IgA。单独的血液 IgA 测试不会显示这种降低的免疫反应。
低IgA会增加过敏、感染和自身免疫性疾病的风险。
一些潜在的原因包括睡眠不足、慢性压力、肠道疾病、过敏、某些药物以及罕见的遗传疾病。
85% 到 90% 的 IgA 缺乏症患者没有症状。他们可能只表现出潜在感染或免疫疾病的症状。
IgA 缺乏的人更容易出现过敏症,包括哮喘、过敏性鼻炎/结膜炎、药物过敏或食物过敏等。
过敏性鼻炎患儿的 IgA 水平降低。较低的水平与更严重的症状相关。
母乳中的 IgA 可预防婴儿特应性皮炎。一项研究发现,在生命的第一年摄入母乳中的 IgA 可降低特应性皮炎的风险,直至 4 岁。
较高的血液 IgA 水平与 18 个月大的湿疹发生率较低有关。
婴儿中较高水平的 IgA 似乎与 4 岁时较少发生的过敏有关 。
唾液中的高 IgA 水平与儿童较少的过敏症状相关。
在对牛奶过敏的患者中,自然产生耐受性的患者血液 IgA 水平升高。
在严重哮喘患者的肺中发现了低 IgA 水平。较低的 IgA 水平与更严重的症状相关。
然而,在严重哮喘中,IgA 可能会加重现有炎症而不是促进耐受性。
此外,IgA 缺乏的人,痤疮和慢性自发性荨麻疹的患病率也较高。
如溶血性贫血、1 型糖尿病、类风湿性关节炎、甲状腺疾病和狼疮在 IgA 缺乏的人群中也更常见。
这种情况没有特定的治疗方法(例如用于其他免疫缺陷的免疫球蛋白替代品)。抗生素用于细菌感染患者,对预防严重并发症非常重要。
没有药物治疗的重度抑郁症患者在缓解状态(当他们没有症状时)血液 IgA 水平显着降低。
即使在健康人中,当参与者回忆起使他们沮丧的事件时,IgA 也会减少。
对 IgA 和自闭症的研究好坏参半。自闭症在 IgA 缺乏的受试者及其亲属中更为普遍。
一项研究表明,自闭症与低正常 IgA (<97 mg/dL) 之间存在关联。
然而,另一项研究并未发现自闭症患者的 IgA 水平较低 。
在小型研究中,低 IgA 水平与抑郁症和自闭症有关,但还需要更多的研究。
关于 IgA 和肥胖的研究也参差不齐,尚无定论。
与体重正常的人相比,肥胖的人血液中的 IgA 水平更高。
在同一项研究中,代谢综合征患者的血液 IgA 水平也较高。这包括甘油三酯升高、高血糖或高血压的人。
然而,其他研究发现肥胖人群的 IgA 水平正常,肥胖儿童的IgA水平甚至较低。
这种相互矛盾的研究可能是由于肥胖的原因并不单一。一些引发肥胖的潜在因素可能会增加 IgA 水平,而其他因素可能会降低IgA 水平。需要额外的研究来明确肥胖和IgA之间的联系。
感染风险
IgA 缺陷患者的一级亲属的自身免疫风险也增加(10%,而普通人群中估计为 5%)。
IgA 保护肺部和肠道免受有害微生物的侵害。IgA 缺乏症患者感染的风险更高,包括呼吸系统、肠道、关节和泌尿道感染 。
长时间运动会降低 IgA, 与超马拉松运动员的呼吸道感染增加有关。
选择性 IgA 缺乏
低 IgA 可能由选择性 IgA 缺乏引起,此时只有 IgA 水平低,而其他抗体(IgG、IgM、IgD 和 IgE)正常。
选择性 IgA 缺乏可以遗传或自发发生(由于感染、药物或未知原因)。导致人们缺乏 IgA 的遗传疾病在高达 1% 的人口中被发现。
IgA 缺乏是最常见的原发性免疫缺陷。白人的患病率较高,而亚洲人的患病率较低。
选择性 IgA 缺乏是指 IgA 水平 <7 mg/dL 但 IgM 和 IgG 正常。它可能是由遗传疾病和非遗传因素引起的。
85% 到 90% 的 IgA 缺乏症患者没有症状。有症状的人通常有呼吸道或肠道感染。
感染和乳糜泻
IgA 缺乏的人有发生肠道感染和疾病的倾向,例如吸收不良、乳糖不耐症、乳糜泻和溃疡性结肠炎。
患有选择性 IgA 缺乏症(无法检测到 IgA,但 IgG 和 IgM 水平正常)的患者患乳糜泻的风险要高出 10 – 20 倍。
多项研究报告了乳糜泻患者中 IgA 缺乏症的患病率增加,以及 IgA 缺乏症患者的乳糜泻患病率增加。
肠易激综合征和肠易激综合征
在一项针对 12 名 IBS 患者和 11 名健康对照者的初步研究中,IBS 患者的 IgA 产生细胞较少。虽然应该记住,这项研究非常小,需要更多的跟进。
IBD 与 IgA 缺乏有关。
在克罗恩病和溃疡性结肠炎患者中,肠道中 IgA 的产生减少了。
在多达 8% 的 IBD 患者中发现了低 IgA 。
然而,肠道中较高的 IgA 产量可能导致 IBD 。
涂有高水平 IgA 的细菌可能是 IBD 患者肠道炎症的原因。当移植到患有溃疡性结肠炎的小鼠体内时,涂有 IgA 的细菌会增加肠道炎症。
一些研究将 IgA 缺乏症与 IBD 和 IBS 联系起来,但研究仍无定论。
癌症风险
患有 IgA 缺乏症的人患癌症的风险会适度增加,尤其是肠癌。这项研究是作为一个队列进行的,并且在随访的第一年显示风险增加,这表明存在监测偏差。需要更多的研究来确定癌症风险的程度。
其他疾病
IgA 缺乏症患者与 1 型糖尿病(高达 10 倍)、狼疮、幼年特发性关节炎、IBD(克罗恩病和溃疡性结肠炎)、类风湿性关节炎和甲状腺疾病的相关性更高。
饮食因素
禁食
在 15 名肥胖受试者中,14 天的禁食增加了血液 IgA 水平。
间歇性禁食的小鼠具有更高的 IgA 水平,并且对感染的抵抗力更强。
高蛋白饮食
膳食蛋白质是分泌性IgA产生的主要驱动因素,高蛋白饮食可以通过肠道菌群分泌的细胞外囊泡或代谢产物琥珀酸盐激活Toll样受体4,增加细胞因子APRIL水平,从而促进分泌性IgA的水平增加。
蘑菇
在 24 名志愿者中,食用白蘑菇的人的 IgA 产量增加了。

编辑
白蘑菇增加了小鼠的 IgA 。
在灵芝中发现的化合物会增加小鼠的 IgA。
生活方式
减少慢性压力
持续数天、数周或数月的慢性压力会降低免疫反应。在中年和老年受试者中,慢性压力与较低的 IgA 相关。
牙科学生的自感压力与低IgA相关。
在母亲中,那些经历更多焦虑、抑郁、愤怒、疲劳和混乱的人的母乳 IgA 较低。
接受托儿服务的幼儿中,托儿质量较低的儿童的 IgA 水平较低。
管理压力可以帮助扭转 IgA 的减少。
在24名志愿者中,20分钟的放松显著增加了IgA的产生。此外,那些连续三周每天放松一次的人,其IgA水平比第一次放松的人增加幅度更大。
十分钟的放松使79名日本女性医务人员的IgA增加。
在14名乳腺癌患者中,那些参与放松的患者术后IgA水平较高。
音乐
听音乐提高了 87 名本科生的基线 IgA 水平。
在一组 66 名大学生中,接触背景音乐 30 分钟的人 IgA 水平升高。

参与音乐可能会产生更大的影响。
在 33 名受试者中,那些积极唱歌或演奏打击乐的人的 IgA 水平比只听音乐的人增加得更多。
另一项研究表明,在合唱团中唱歌会增加 IgA。
短期/中度运动,避免剧烈运动
IgA 水平会随着短期或适度运动而增加。这有助于降低呼吸道感染的风险。
与 10 名久坐不动的对照组相比,9 名受试者在休息时有规律的适度运动增加了 IgA。
几项研究表明,适度运动会增加老年人的 IgA。
在 45 名老年人中,每周一次的 60 分钟阻力和 60 分钟中等耐力训练在 12 个月后显着增加了 IgA。
IgA 水平会根据运动的强度和持续时间以及身体活动的类型而变化。短期和适度运动会增加IgA水平,而长时间运动会降低IgA水平。
在 155 名超级马拉松运动员中,IgA 水平在比赛后下降。
因此如果想要增加IgA水平要避免剧烈运动。
足够的睡眠
在一项对32名志愿者的研究中,在快动眼睡眠(REM睡眠)剥夺的四个晚上,IgA水平下降,但在完全睡眠剥夺后没有下降。即使在三个晚上的睡眠恢复后,IgA水平也没有恢复到基线水平。
一些药物可以阻止REM睡眠,并可能降低IgA水平。这些药物包括抗抑郁药和拟交感神经药(模拟肾上腺素和多巴胺作用并激活交感神经系统的药物)。
唾液IgA在睡眠中增加。在昼夜节律紊乱的小鼠中,唾液IgA在睡眠期间没有增加。研究表明,IgA的增加依赖于交感神经系统(战斗或逃跑)的激活,这与REM睡眠有关。
戒烟
一些研究表明,吸烟会降低 IgA 水平。
与不吸烟者相比,嚼烟者和吸烟者的 IgA 水平降低。此外,吸烟者的 IgA 水平明显低于咀嚼者。
在小鼠中,流感病毒感染前三个月的香烟烟雾暴露导致 IgA 水平降低和肺部炎症增加。
然而,一些研究表明吸烟者的 IgA 水平没有差异。
幽默感
使用幽默作为应对技巧的人具有更高的基线 IgA 水平。
看喜剧增加了 15 名大学生和 39 名女性的 IgA。
同样,与观看教育演示的 18 名同学相比,有趣的演示提高了 21 名五年级学生的 IgA 水平。
压力事件会降低 IgA 水平。在 40 名受试者中,具有幽默感的人不太可能因压力而降低 IgA。
光线充足
在一项针对 7 名女性的研究中,与暴露在昏暗光线下相比,白天暴露在强光下会增加 IgA 水平。
母乳喂养婴儿
婴儿通过母乳接受 IgA。然后,肠道内的IgA生成逐渐受到肠道微生物群的刺激。
几项研究表明,母乳喂养的婴儿的IgA水平较高。
益生菌
在一项包含 47 人的研究 (DB-RCT) 中,每天摄入三周的益生菌罗伊氏乳杆菌会增加 IgA 水平。
在 30 名运动员中,安慰剂组训练后 IgA 显着下降,但服用瑞士乳杆菌的运动员没有(DB-RCT)。
含有罗伊氏乳杆菌的口香糖显着增加唾液中的 IgA (DB-RCT) 。
益生菌增加了 40 名烧伤儿童的 IgA 水平并改善了恢复。
在一项针对 66 名孕妇的研究 (DB-RCT) 中,大剂量多菌株益生菌导致婴儿的 IgA 水平更高并改善了肠道功能。
每天摄入干酪乳杆菌会增加 14 名受试者的 IgA 水平。
在一项针对 98 名新生儿的研究中,双歧杆菌增加了低出生体重婴儿的 IgA 水平。
在一项针对 413 名婴儿的研究中,那些服用富含乳酸杆菌的配方奶粉的婴儿的 IgA 水平较高,与母乳喂养婴儿的水平相似。
益生元
益生元是有益细菌的食物。它们改善了肠道菌群。
益生元混合物增加了 45 名超重成人 (DB-RCT)的IgA 水平并改善了代谢参数(CRP、胰岛素、总胆固醇和甘油三酯) 。
在一项针对 187 名婴儿的研究 (DB-RCT) 中,仅喂食配方奶粉并给予益生元的婴儿的 IgA 水平高于接受安慰剂的婴儿。
雪莲果粉含有 50 – 70% 的益生元纤维,服用 18 周后,59 名学龄前儿童的 IgA 增加。
谷氨酰胺
一项对 13 项研究和 1,034 名患者的荟萃分析得出结论,谷氨酰胺增加了肠癌患者的 IgA 并减少了感染并发症。
在 13 名跑步者的高强度间歇训练期间,谷氨酰胺增加了鼻腔但不增加唾液 IgA。
小球藻
4 周的小球藻补充剂增加了 15 名男性的 IgA。
小球藻还增加了 26 名接受强化训练的受试者的静息 IgA。
小球藻增加了 18 名孕妇母乳中的 IgA 浓度。
人参
人参增强了小鼠肠道 IgA 的产生。
然而在其较高的剂量下,它也阻止了 IgA 的释放。
维生素A
分泌型 IgA 穿过黏膜的运输和释放需要维生素 A。
缺乏维生素 A 的大鼠和小鼠肠道中总 IgA 水平降低,但它们的血液 IgA 水平正常。
补充维生素 A 的女性母乳中的 IgA 水平较高。
总的来说,通过健康的饮食和生活方式,保持轻松的状态避免慢性压力、保证充足的睡眠和适度的运动、戒烟、保持良好的幽默感,必要的时候可以配合益生菌、益生元、谷氨酰胺、维生素 A 和间歇性禁食的生活方式可以增强免疫反应并增加 IgA.
研究表明,高 IgA 可能是慢性感染和低度炎症的标志。
没有与高 IgA 水平相关的症状。IgA 高的人可能只会出现感染或炎症性疾病的症状。这时候医生可能会进行其它的测试,以确定IgA高水平的真正原因。
高 IgA 通常表示慢性感染或炎症,尽管许多疾病可以提高其水平。高 IgA 不会引起症状。人们表现出潜在健康问题的症状。
当 IgA 在血管中积聚时发生IgA 血管炎;当 IgA 在肾脏中积聚时,就会发生IgA 肾病。两者都可能产生严重的健康后果。
在 IgA 血管炎中,IgA 沉积在引起炎症的小血管中。常见的症状是皮疹、关节疼痛和肿胀。
IgA 血管炎在儿童中更为常见,这种疾病通常会在数周内消退,无需治疗。在成人中,它可能更复杂、更持久,伴有更严重的肾脏疾病。
在 IgA 肾病中,IgA 复合物沉积在肾脏中。大约 20%-50% 的患者会出现进行性肾功能衰竭。
正常的 IgA 水平可保护身体免受感染、过敏和自身免疫。
IgA 水平是免疫健康的标志。如果没有症状不用太担心,低或高水平不一定表示有问题。
提高 IgA 水平不一定会直接导致免疫平衡的任何改善,但它可以用作免疫健康的生物标志物。
以下是改善免疫健康的补充方法列表,这些方法也被发现可以平衡高 IgA 水平。
尽管研究表明各种饮食和生活方式因素可能会降低 IgA 水平,但仍需要进行更多的大规模研究。
除了下面列出的因素外,请记住 IgA 是炎症的非特异性标志物。要告知医生以解决高 IgA 水平的根本原因,例如慢性炎症或感染。
有关降低炎症的补充方法,例如服用姜黄素或黑孜然油、锻炼或练习瑜伽,以及遵循地中海式饮食。
IgA 指向慢性炎症或感染。医生可能会建议采取措施来降低炎症并监测其他炎症标志物。
可能减少炎症的因素(通过降低高 IgA 来衡量)
可可
在动物研究中,可可降低了血液、肠道和唾液中的 IgA。
避免饮酒
血液 IgA 水平往往会随着饮酒而增加。在 460 人中,大量饮酒者的 IgA 水平很高。
白葡萄酒增加了 5 名男性的血液 IgA 。
然而,虽然血液 IgA 增加,但肠道 IgA 实际上可能会因酒精而减少。在小鼠中,酒精增加了总 IgA,但减少了肠道 IgA。酒精可能会减少 IgA 释放到肠道中。
禁食
避免禁食。在一项研究中,禁食增加了肥胖受试者的血液 IgA 水平。
愤怒管理
在 18 名有愤怒和抑郁症状的健康男性和女性中,容易表达愤怒的人中 IgA 升高。
容易表达愤怒的家庭虐待者的 IgA 水平较高。
愤怒管理技巧可以帮助人们学习如何控制愤怒。
雌激素水平
在 86 名女性中,雌二醇(主要雌激素)较高的女性 IgA 水平较高。
在细胞研究中,雌激素会增加 IgA 向粘液中的转运,从而减少细菌入侵。
虽然雌激素有助于女性保持健康和强大的免疫系统,但理论上过多的雌激素可能会过度提高 IgA。检查雌激素水平以确保激素平衡。
高 IgA 表示慢性炎症。建议采取措施来减轻炎症。一些补充方法包括瑜伽、草药补充剂(姜黄素)和遵循健康饮食。研究表明,可可、避免大量饮酒和避免禁食也可以减少炎症和降低 IgA 水平。
从微生物学的角度来看,关键问题仍然是关于如何靶向 IgA。从其独特的功能能力来看,有必要考虑IgA的临床应用。
免疫后血清和/或分泌物中通常会发现特异性 IgA 升高。虽然通过全身途径接种疫苗往往会产生血清反应,但通过鼻内或口服途径接种疫苗可以引发保护性粘膜反应。作为一个典型的例子,口服霍乱疫苗作为一种诱导保护性黏膜 IgA 反应的手段已得到广泛认可。
使用从捐献血浆中纯化的抗体的免疫球蛋白替代疗法已作为 IgA 缺乏症的常规治疗方法实施。
包括合成工程多价双特异性抗体 (BsAbs) 在内的新疗法已经开发出来,并在临床上被批准用于治疗各种癌症,例如急性淋巴细胞白血病和小细胞肺癌,但目前没有 BsAb 被批准,并且仅限于治疗 IgA 相关疾病。啮齿动物模型的阳性报告支持 BsAb 可有效缓解 IBD.
微生物群中的某些共生体(例如乳酸乳杆菌)已被证明是一种释放这些 BsAb 的传递系统,可用于改善 IgA 相关疾病,例如结肠炎。可以预期,基于 IgA 的 BsAb 与一线微生物群靶向治疗药物(即益生菌和益生元)相结合,将支持免疫疾病和传染病治疗的范式转变。
肠道黏膜 IgA 对微生物群的反应可以为疾病分类、评估肠道病原体感染/负担的影响,以及评估当前或新治疗干预措施提供有效性的方法。
以上我们基本了解IgA-微生物组轴的破坏如何导致结肠炎、结直肠癌和肾病等病理生理状况。此外,甚至在哮喘、食物过敏和肥胖症中都记录了 IgA 对肠道微生物群的反应改变,这进一步说明了在免疫疾病范围之外对 IgA 进行额外研究的必要性。
技术的最新进展促进了我们对各种类型的 SIgA 不同地调节肠道微生物群的理解。关于 IgA-微生物群相互作用的知识可能会为有效调节微生物群的新型基于 IgA 的疗法打开一扇大门。
主要参考文献:
Bunker JJ, Bendelac A. IgA Responses to Microbiota. Immunity. 2018 Aug 21;49(2):211-224.
Furusawa, Y. et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 504, 446–450 (2013).
Takeuchi, T. et al. Acetate differentially regulates IgA reactivity to commensal bacteria. Nature (2021). doi:10.1038/s41586-021-03727-5
Palm, N. W. et al. Immunoglobulin A coating identifies colitogenic bacteria in inflammatory bowel disease. Cell 158, 1000–1010 (2014).
Kau, A. L. et al. Functional characterization of IgA-targeted bacterial taxa from undernourished Malawian children that produce diet-dependent enteropathy. Sci. Transl. Med. 7, 276ra24 (2015).
Nakajima, A. et al. A soluble fiber diet increases Bacteroides fragilis group abundance and immunoglobulin a production in the gut. Appl. Environ. Microbiol. 86, e00405-20 (2020).
de Sousa-Pereira P, Woof JM. IgA: Structure, Function, and Developability. Antibodies (Basel). 2019 Dec 5;8(4):57.
Huus KE, Bauer KC, Brown EM, Bozorgmehr T, Woodward SE, Serapio-Palacios A, Boutin RCT, Petersen C, Finlay BB. Commensal Bacteria Modulate Immunoglobulin A Binding in Response to Host Nutrition. Cell Host Microbe. 2020 Jun 10;27(6):909-921.e5.
Moll JM, Myers PN, Zhang C, Eriksen C, Wolf J, Appelberg KS, Lindberg G, Bahl MI, Zhao H, Pan-Hammarström Q, Cai K, Jia H, Borte S, Nielsen HB, Kristiansen K, Brix S, Hammarström L. Gut Microbiota Perturbation in IgA Deficiency Is Influenced by IgA-Autoantibody Status. Gastroenterology. 2021 Jun;160(7):2423-2434.e5.
Bunker JJ, Erickson SA, Flynn TM, Henry C, Koval JC, Meisel M, Jabri B, Antonopoulos DA, Wilson PC, Bendelac A. Natural polyreactive IgA antibodies coat the intestinal microbiota. Science. 2017 Oct 20;358(6361):eaan6619.
Nakajima A, Vogelzang A, Maruya M, et al. IgA regulates the composition and metabolic function of gut microbiota by promoting symbiosis between bacteria. J Exp Med. 2018; 215(8):2019-34.
Abokor AA, McDaniel GH, Golonka RM, Campbell C, Brahmandam S, Yeoh BS, Joe B, Vijay-Kumar M, Saha P. Immunoglobulin A, an Active Liaison for Host-Microbiota Homeostasis. Microorganisms. 2021 Oct 8;9(10):2117.
Planer JD, Peng Y, Kau AL, Blanton LV, Ndao IM, Tarr PI, Warner BB, Gordon JI. Development of the gut microbiota and mucosal IgA responses in twins and gnotobiotic mice. Nature. 2016 Jun 9;534(7606):263-6. doi: 10.1038/nature17940. Epub 2016 May 25.
Moll JM, Myers PN, Zhang C, Eriksen C, Wolf J, Appelberg KS, Lindberg G, Bahl MI, Zhao H, Pan-Hammarström Q, Cai K, Jia H, Borte S, Nielsen HB, Kristiansen K, Brix S, Hammarström L. Gut Microbiota Perturbation in IgA Deficiency Is Influenced by IgA-Autoantibody Status. Gastroenterology. 2021 Jun;160(7):2423-2434.e5.
Pu A, Lee DSW, Isho B, Naouar I, Gommerman JL. The Impact of IgA and the Microbiota on CNS Disease. Front Immunol. 2021 Sep 15;12:742173.

谷禾健康


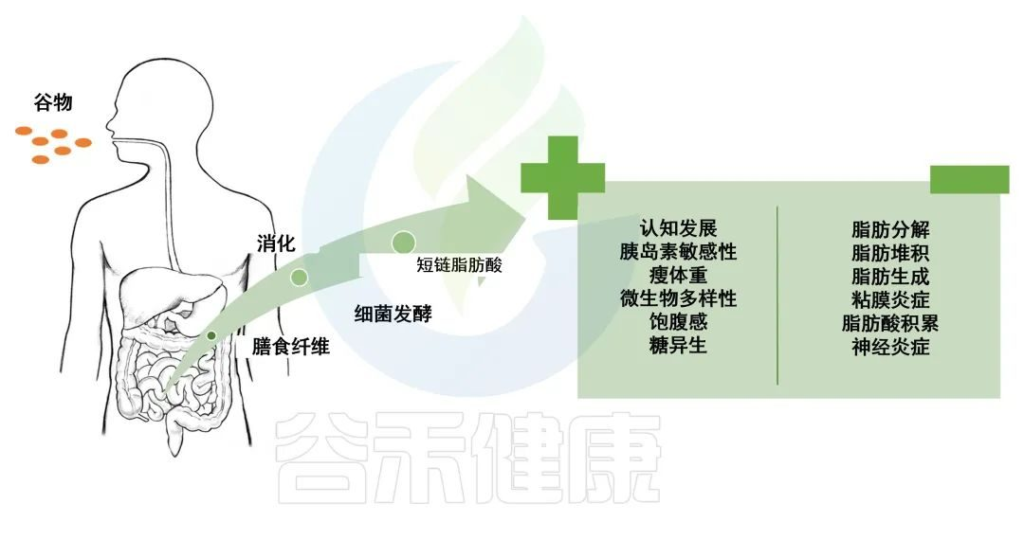
饮食可以调节人体肠道微生物群的组成和功能,以维持宿主微生物群的互惠共生。
谷物富含特定的功能元素,是维持人类健康的重要膳食成分。谷物可以改变肠道微生物群,并可能改善能量和葡萄糖稳态,干扰宿主能量稳态、食欲、血糖调节、胰岛素敏感性和宿主代谢的调节。
什么是全谷物
全谷物是禾本科植物的可食用种子,由胚(或胚芽)、胚乳和外部麸皮组成。
全谷物是一种富含膳食纤维的食物,而膳食纤维可以调节肠道微生物群,从而调节人体的特定生物过程,例如调节免疫、炎症、碳水化合物和脂肪代谢以及肠-脑神经回路。
全谷物是营养和植物化学物质的极好来源,可能对心血管疾病、高血压、糖尿病、不同类型癌症和肥胖症等多种慢性疾病具有保护作用。
全谷物的摄入还与健康肠道微生物群的增加有关,这一点可以从它们的丰富度和多样性以及短链脂肪酸的产生中看出。
短链脂肪酸,作为发酵终产物并促进有益细菌的生长。短链脂肪酸还可以降低结肠 pH 值,防止病原菌生长,并改善结肠上皮细胞的完整性。
本文讨论了不同谷物如何通过调节肠道微生物群对宿主产生有益的健康影响。主要从以下几个方面讲述:
• 谷物通过调节肠道菌群在动脉粥样硬化中的作用
• 谷物通过调节肠道菌群在高血压中的作用
• 谷物通过调节肠道菌群在肥胖中的作用
• 谷物通过调节肠道菌群在II型糖尿病中的作用
• 谷物通过调节肠道菌群在结肠健康中的作用
动脉粥样硬化是一种以胆固醇积聚和巨噬细胞聚集到动脉壁为特征的状态,它是心血管疾病的主要危险因素。
肠道微生物群组成的平衡很重要,平衡一旦破坏可能会导致毁灭性的病理生理后果。
在高脂饮食的Apo E−/−小鼠中,某些菌群的丰度,如Bilophila和Mucispirillum,与动脉粥样硬化斑块大小呈正相关。
物种丰富度也是肠道健康的一个主要标志,因为高细菌丰富度和多样性往往反映了生态系统的稳定性和复原力,以及疾病与粪便样本中物种数量减少之间的一致联系。
▸野生稻:具有抗脉粥样硬化作用
野生稻主要作为全谷物食用,食用后对健康有很多好处。野生稻含有抗性淀粉,可以作为益生元。
野生稻具有显著的抗动脉粥样硬化作用,但其作用机制尚不清楚。这些影响可能是由于血浆胆固醇水平的降低。
细菌代谢产物如短链脂肪酸和三甲胺-N-氧化物(TMAO)是动脉粥样硬化中的重要化合物。
▸抗动脉粥样硬化作用可能与肠道菌群改变有关
最近的研究还发现,肠道微生物群与动脉粥样硬化的形成之间存在关联。短链脂肪酸主要参与碳水化合物、脂肪和胆固醇代谢,其免疫调节功能可能有助于心血管疾病的治疗。动脉粥样硬化斑块中细菌DNA的存在为肠道微生物群与动脉粥样硬化的相关性提供了证据。
▸野生稻:影响菌群丰度和多样性,预防动脉粥样硬化
另一项研究调查了野生稻对小鼠粪便细菌物种丰度和多样性的影响。结果表明,在低密度脂蛋白受体基因敲除(LDL-r-KO)的小鼠中,长期食用60%的野生稻与预防动脉粥样硬化有关。
参与预防的机制可能是粪便细菌数量和多样性的显著改变,以及几种炎症和代谢生物标志物的显著变化。
与对照组相比,在野生稻喂养的小鼠粪便中发现了下列菌群丰度更高:
治疗组和对照组小鼠血浆中的细胞因子谱存在显著差异。白细胞介素-10(IL-10)和促红细胞生成素(EPO)水平的升高可以解释野生稻的抗动脉粥样硬化特性。然而,需要使用动物模型进行额外的研究支持该结果。
许多研究表明,维持健康的心血管系统可能有助于维持认知功能,因为一些心血管疾病与认知障碍和阿尔茨海默病的风险增加有关。
▸ 燕麦和燕麦制品:降胆固醇,产生短链脂肪酸,调节菌群,降低肠道通透性,抑制炎症
燕麦和燕麦制品是谷物纤维的其他重要来源,它们富含β-葡聚糖。β-葡聚糖是一种粘性和可溶性纤维,具有有益的降胆固醇潜力。
动物研究表明,燕麦纤维可以上调肝组织中低密度脂蛋白(LDL)受体的表达。
研究表明,膳食燕麦纤维可延缓动脉粥样硬化所致小鼠认知功能障碍的进展。燕麦纤维通过为人体产生短链脂肪酸,很好地恢复了微生物群的丰度和多样性。这些短链脂肪酸可降低肠道通透性,抑制神经系统的神经炎症。
▸ 小米:保护肠道屏障,重塑肠道菌群,防止动脉粥样硬化
另一种越来越受消费者欢迎的谷物是小米。使用喂食高脂肪饮食的Apo E−/−小鼠研究小米壳多酚的抗动脉粥样硬化潜力。
结果表明,小米壳多酚通过保护肠道屏障和重塑肠道菌群,防止主动脉粥样硬化斑块的形成。
微生物群组成的特征是颤螺菌属(Oscillospira)和瘤胃球菌(Ruminococcus)丰度较高,以及Allobaculum丰度降低,抑制动脉粥样硬化斑块的形成。
大多数以动脉粥样硬化为研究重点的体外、动物和人体研究报告的结果不一致,这可能是由于实验对象的数量有限(包括研究中人体受试者的数量较少),以及实验对象的性质(实验对象之间存在的可变性会影响结果),如采样技术,也可能是由于饮食成分的相互作用的影响。
相关阅读:
高血压是心血管疾病的重要危险因素,受遗传易感性和环境因素的影响。
近年来,对肠道菌群与高血压的关系进行了研究。研究对象是老鼠和人类。在两个实验对象中都观察到了肠道菌群的改变。
▸ 高血压患者:梭状芽胞杆菌大量存在
梭状芽孢杆菌在小鼠和人类高血压患者体内都发现大量存在。此外,高血压人群中Bacterodiales增加,但在小鼠中与血压呈负相关。
在饮食中加入富含纤维的食物,如谷物,可以改变肠道菌群的组成。膳食纤维的降血压机制尚不完全清楚。
▸ 短链脂肪酸降压:通过激活受体
有研究发现,发酵产生的短链脂肪酸可以激活在肾脏和血管中的G蛋白偶联受体和嗅觉受体,这些受体抑制肾素的释放,从而降低血压。
▸ 纤维:通过短链脂肪酸,促进有益菌生长,加强肠道屏障完整性
一项研究表明,健康女性在怀孕过程中,纤维摄入量越高,可以缓解肠道通透性增加的程度。
可发酵纤维促进有益菌的生长,并产生短链脂肪酸作为发酵最终产物。短链脂肪酸可以通过降低结肠pH值来阻止致病菌的生长。
此外,短链脂肪酸还可以提高结肠上皮细胞紧密连接的完整性。这加强了肠道壁屏障的完整性,降低了肠道通透性。
然而,纤维摄入并不影响未来妊娠高血压疾病女性的肠道渗透性。这项研究表明,纤维干预可能不会通过改善肠道屏障功能来阻止高血压疾病的发展。
大部分的研究都是研究分离纤维对高血压的影响;需要更多的研究来了解习惯性纤维摄入通过调节肠道菌群对高血压的影响。
短链脂肪酸对宿主代谢的有益作用
Kulathunga J,et al.Curr Nutr Rep.2022
▸ 燕麦麸(谷物分离物):降血压,菌群改变
对谷物分离物的研究也将为营养保健品和功能性食品开辟新的途径和机会。研究对象为食用燕麦麸12周的参与者(30 g / 天)。结果显示,摄入膳食纤维的参与者的收缩压和舒张压低于对照组。与对照组相比,双歧杆菌(Bifidobacterium)和螺旋菌(Spirillum)等细菌物种的丰度显著升高。
需要进一步的研究来阐明本研究的现有发现。例如,研究人员没有量化短链脂肪酸水平,对于双歧杆菌和螺旋菌的变化是否与短链脂肪酸的变化有关不清楚。
▸ 藜麦蛋白降压(动物研究)
在动物模型研究中,研究了藜麦蛋白摄入对自发性高血压大鼠的降压作用。结果显示血压显著降低,肠道中Turicibacter和Allobaculum属的丰度与血压呈负相关。
血压与肠道菌群之间存在双向关系。血压水平及相关病理状态导致微生物群变化,微生物来源的代谢物有助于调节血压。然而,大多数谷物蛋白的体内降压作用尚不清楚,需要更广泛的研究。
相关阅读:认识肠道微生物及其与高血压的关系
已知肠道微生物群参与控制体重、代谢改变和与肥胖相关的炎症性疾病。
文献表明,肥胖的发病机制与下列菌群正相关:
肥胖的发病机制与下列菌群负相关:
肥胖症与肠道菌群代谢产物之间的关系尚不完全清楚。然而,提出了以下假设。据估计,短链脂肪酸等微生物的代谢物对人体能量平衡的贡献高达约200千卡/天,并有助于脂肪细胞中的脂肪生成和积累,从而获得能量。
▸ 高粱多酚:可能增加有益菌丰度
使用不同体重等级(正常和超重)的人类受试者评估高粱多酚对肠道微生物群的影响。结果表明,正常体重和超重/肥胖组之间的短链脂肪酸总产量没有显着变化。
一项最新营养学报告研究发现,高粱多酚和低聚果糖的组合可增加双歧杆菌和乳酸杆菌的数量,高粱多酚可独立增加罗氏菌属(Roseburia)和普雷沃氏菌属(Prevotella)的丰度。
关于罗氏菌属详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
普雷沃氏菌属详见:肠道重要基石菌属——普雷沃氏菌属 Prevotella
▸可溶性玉米纤维:使变形菌减少,厚壁菌增加
在小鼠中添加可溶性玉米纤维长达8周的高纤维饮食表明,变形菌(Proteobacteria)数量减少,这种细菌门通常与肥胖呈负相关。
厚壁菌的增加抵消了高纤维饮食,并诱导了与肥胖相关的菌的增加,如瘤胃球菌、嗜胆汁菌Bilophila、脱硫弧菌Desulfovibrio、颤螺菌属Oscillospira和Paenibacillus.
关于瘤胃球菌属详见:瘤胃球菌属——消化降解关键菌?炎症标志菌?
脱硫弧菌详见: 肠道有害菌——脱硫弧菌属(Desulfovibrio)
▸麦麸:补充影响菌群变化,或与减肥相关(多项研究结果不一)
在一项动物研究中,添加5%麦麸的高纤维饮食增加了微生物群的多样性和某些细菌物种的丰度。Akkermansia muciniphilia的数量增加,这与体重增加有关。此外,双歧杆菌物种的丰度增加。已知包括短双歧杆菌在内的双歧杆菌可防止脂肪积聚。
在另一项研究中,连续8周麦麸补充剂(7.5%)可以减轻体重和肥胖,这与乳酸菌丰度降低有关。
然而,在另一项研究中,麦麸补充量的增加表明盲肠乳酸菌的增加,尽管体重或肥胖没有变化。
▸含有抗性淀粉的全麦面粉:减少腹部脂肪
最近的研究发现,在肥胖的糖尿病脂肪大鼠中,含有抗性淀粉的全麦面粉,比分离的抗性淀粉产生更大的发酵,更大的发酵会产生不同的微生物群,减少腹部脂肪,提高胰岛素敏感性。
肥胖大鼠服用抗性淀粉可增加拟杆菌门与厚壁菌门的比率,并可能导致胰岛素敏感性的改善。
▸玉米抗性淀粉:调节菌群,影响体脂等指标
在临床研究中,向人类志愿者提供玉米抗性淀粉饮食可显著增加链球菌和Ruminococcaceae_UCG-005的丰度,并降低厌氧菌、拟杆菌、Blautia的丰度,它们可有效调节体脂、短链脂肪酸、早期胰岛素和胰高血糖素样肽-1(GLP-1)的分泌。
由于人与人之间肠道微生物群的差异,补充抗性淀粉的饮食对人的影响不同。补充抗性淀粉会增加粪便丁酸盐浓度。然而,对抗性淀粉补充剂的反应因个人而异。
因此,为了有效地设计人体试验,应该考虑几个限制因素。根据性别、饮食习惯、健康和生活方式的不同,不同个体的微生物群组成有显著差异。
▸ 小米:增加有益菌,改善葡萄糖耐量,但不影响体重增加
小米补充剂的摄入增加了有益菌丰度,包括乳酸杆菌、双歧杆菌、阿克曼菌和罗氏菌属(Roseburia),小米改善了葡萄糖耐量,抑制了血清胆固醇和血脂参数的增加,但不影响体重增加。
这类研究的结果取决于谷物品种的性质及其生物活性成分的组成。此外,谷物成分在很大程度上取决于生长位置、农艺措施和其他生长因素,如温度和施肥。
相关阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
关于谷物通过调节肠道微生物群的降血糖作用的研究较少。
肠道微生物群在宿主的大多数代谢功能中起着至关重要的作用,如氨基酸合成、膳食脂肪和脂溶性维生素的吸收、短链脂肪酸的产生、葡萄糖稳态的激活、脂质能量代谢、热量去除和调节胆汁酸转化等。
▸ 糖尿病患者的菌群特征
与瘦人相比,II型糖尿病患者的微生物群多样性和普拉梭菌(Faecalibacterium prausnitzii)丰度显著降低。II型糖尿病与厚壁菌门丰度较低有关,而拟杆菌门和变形菌门丰度较高。
▸ 高直链玉米淀粉:降低II型糖尿病风险
最近利用动物模型进行的研究发现,食用高直链淀粉玉米会增加拟杆菌和某些厚壁菌分类群(乳酸杆菌和Erysipelotrichaceae)。此外,这种饮食可以增强肠道免疫和内分泌反应,从而降低II型糖尿病的风险。
▸谷子:降血糖作用
最近的一项研究,评估谷子在高脂饮食和糖尿病大鼠中的降血糖作用。根据结果,乳酸杆菌和瘤胃球菌的相对丰度增加,与空腹血糖和2小时血糖呈负相关。
▸可溶性玉米纤维:改变菌群,产生短链脂肪酸
另一项研究侧重于在人类饮食中添加10克或20克纤维,其中含有85%的可溶性玉米纤维,持续4周,导致较高比例的菌群,如:
已知这些细菌会消化淀粉并产生短链脂肪酸,而健康的老年人在每天补充6克可溶性玉米纤维3周后,Parabacteroides的丰度有所增加。
▸抗性淀粉(RS2)降血糖
开展了多项研究,以评估小麦抗性淀粉II型(RS2)对血糖反应和肠道微生物群的影响。
在一项研究中,评估了食用富含II型抗性淀粉的小麦卷1周的效果,结果表明,富含II型抗性淀粉的小麦卷可以降低餐后葡萄糖和胰岛素反应。
粪便内容物中的瘤胃球菌属和Gemmiger比例增加,反映了远端肠道的组成。抗性淀粉干预还降低了肠道微生物群落的生物多样性和丰富度。
关于抗性淀粉详见:你吃的膳食纤维对你有帮助吗?
▸抗性淀粉(RS2)增加氢气和甲烷
此外,在食用富含II型抗性淀粉的小麦期间,空腹呼气中,氢气和甲烷增加。氢气和甲烷气体是微生物代谢产物,是微生物发酵的标志物。
关于肠道气体详见:肠道气体带来什么影响,饮食如何对其产生作用?
▸抗性淀粉(RS2):短链脂肪酸与菌群变化呈正相关
对照组和添加抗性淀粉的小麦卷消耗量之间的粪便短链脂肪酸浓度没有显著变化,但丁酸盐和总短链脂肪酸与下列菌群的相对丰度呈正相关:
▸短链脂肪酸能调节与肥胖相关的脂肪因子的表达,降低血糖,提高发酵活性
短链脂肪酸浓度与胰岛素敏感性有关。丁酸可降低胰岛素敏感性。短链脂肪酸还刺激肠内分泌L细胞产生饱腹激素,如肽YY(PYY)和胰高血糖素样肽(GLP-1)。
此外,短链脂肪酸调节瘦素、脂联素和抵抗素等脂肪因子的表达。它们通过调节肠道和全身炎症间接导致肥胖,促进或加剧心脏代谢功能障碍。
这些影响表明,与野生型小麦相比,食用富含II型抗性淀粉的小麦可以降低餐后血糖,改变肠道微生物组成,提高发酵活性。
▸ 小麦胚芽:产短链脂肪酸菌的种类显著增加,提高免疫力
现有文献表明,在饮食中补充小麦胚芽可以改善小鼠的肠道微生物群。此外,与对照组相比,拟杆菌门水平减少,厚壁菌门水平增加。产生短链脂肪酸的细菌种类显著增加:
其中,Roseburia的百分比增加了三倍以上。
此外,细胞因子和免疫球蛋白的变化与肠道微生物群有关。小麦胚芽可以提高免疫力,作为一种增强免疫力的功能性食品具有潜在的应用价值。
▸ 短链脂肪酸促进食欲刺激激素,葡萄糖刺激的胰岛素分泌增加
另一项研究发现,血液中较高水平的乙酸盐会导致胰岛素抵抗并增加胃中生长素释放肽(一种食欲刺激激素)的产生,而丁酸盐水平的降低也会促进胰岛素抵抗。
此外,啮齿动物肠道菌群改变导致乙酸盐的产生增加,会导致副交感神经系统激活,从而促进葡萄糖刺激的胰岛素分泌增加、生长素释放肽分泌增加、食欲过盛、肥胖和相关后遗症。
还需要开展额外的研究工作来确定肠道微生物群在帮助预防2型糖尿病方面的遗传和代谢潜力。此外,任何未来的研究都应该明确定义,可以通过在2型糖尿病患者的饮食中加入不同谷物来调节的菌群种类。此类研究还应解决这种调节是否与谷物剂量有关。
相关阅读:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
▸米糠:调节肠道菌群代谢,促进益生菌生长
米糠具有益生元特性,对结肠健康有益。米糠含有大量的生物活性化合物,包括各种氨基酸、小肽、脂类、核苷酸、维生素和辅助因子,以及可供宿主消化和不可消化的植物化学物质。
肠道微生物群可以在动物和人类体内发酵米糠碳水化合物、植物化学物质、脂质和氨基酸。
研究发现,米糠成分有助于调节宿主和肠道微生物代谢,与对照组相比,摄入米糠显著促进肠道益生菌菌株的生长。然而,还需要更多的研究来提高对米糠发酵如何影响结肠组织微生物群的理解。
▸大米:减缓肿瘤和病原体生长
大米可以通过改变细胞增殖、对抗氧化应激、减少炎症、调节肠道微生物组和代谢来减缓肿瘤和病原体的生长。
研究了大米抗性淀粉(RS)和脂肪水平对C57BL/6小鼠肠道微生物群的影响。处理是三个品种的三个水平的抗性淀粉作为碳水化合物的主要来源,两个脂肪水平,低(10%)和高(39%)。
抗性淀粉导致厚壁菌与拟杆菌的比率降低,增加拟杆菌科和S24-7的短链脂肪酸产量。
米饭中的抗性淀粉含量(0.44%)可以调节小鼠的肠道微生物群,并且与防止肥胖饮食的有害影响有关。
此外,微生物类群与碳水化合物和脂质代谢相关的组织基因表达之间存在相关性。
▸ 米糠和槲皮素等组合:有利于排除肠道病原体
另一项研究发现,槲皮素和米糠的联合作用减少了致病性肠杆菌科细菌的数量,并且减少量与丙酸水平高度相关。
因此,米糠和槲皮素等底物的组合将有助于排除肠道内的肠道病原体。
▸ 麦麸:增加有益菌,改善肠道完整性,减少炎症
麦麸是面粉加工的另一个重要副产品,也是膳食纤维最丰富的来源之一。麦麸中的膳食纤维可改善矿物质代谢基因表达和肠道功能,并增加体内促进健康的细菌数量。
膳食中添加麦麸可以改变肠道微生物群,从而改善肠道完整性,减少炎症。麦麸补充水平的增加表明盲肠乳酸菌数量增加,肠道炎症减少,补充麦麸后炎性细胞因子TNF-α和IL-6减少,与内毒素血症和抗炎细胞因子减少相关的紧密连接蛋白增加。
需要进一步研究以了解谷物和肠道微生物群在维持结肠健康方面的相互作用。特别是,适当控制饮食干预的人类干预试验可以证实全麦谷物对肠道相关健康的益处,并允许在个人基础上得出更有效的结论。
谷物通过调节肠道菌群发挥健康益处的研究总结


Kulathunga J,et al.,Curr Nutr Rep.2022
肠道微生物群在日常饮食和健康状况之间起着重要作用。大多数研究报告了谷物通过调节肠道微生物群对调节代谢疾病的有益作用。
膳食摄入谷物可以预防动脉粥样硬化、高血压、防止体重增加和脂肪积累、改善血糖耐受性和血脂水平、通过调节肠道微生物群组成减少全身炎症,并促进包括短链脂肪酸在内的不同代谢物的释放。
通过调节肠道菌群健康检测,了解适合的饮食方式,合理调整膳食,可以在预防慢性病方面起重要作用。
主要参考文献
Kulathunga J, Simsek S. A Review: Cereals on Modulating the Microbiota/Metabolome for Metabolic Health. Curr Nutr Rep. 2022 Jun 3. doi: 10.1007/s13668-022-00424-1. Epub ahead of print. PMID: 35657489.
Marcelino G, Hiane PA, Freitas KC, Santana LF, Pott A, Donadon JR, Guimarães RCA. Effects of olive oil and its minor components on cardiovascular diseases, inflammation, and gut microbiota. Nutrients. 2019;11:1826.
Toral M, Robles-Vera I, de la Visitacion N, Romero M, Sanchez M, Gomez- Guzman M, Rodriguez-Nogales A, Yang T, Jimenez R, Algieri F, Galvez J, Raizada MK, Duarte J. Role of the immune systemin vascular function and blood pressure control induced by faecal microbiota transplantation in rats. Acta Physiol. 2019;227:e13285.
Zhang L, Ouyang Y, Li H, Shen L, Ni Y, Fang Q, Wu G, Qian L, Xiao Y, Zhang J, Yin P, Panagiotou G, Xu G, Ye J, Jia W. Metabolicphenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci Rep. 2019;9:4736.

谷禾健康
前面的文章中,我们已经了解到,在肝病的发生发展中肠道菌群的变化,详见:
深度解析 | 肠道菌群与慢性肝病,肝癌
到目前为止,大多数研究都集中在细菌多样性及其代谢物与靶癌细胞表型的关联上,而没有考虑环境的微调。实际上生态系统中,个体在环境中与其他个体相互作用、相互影响和限制。
在肿瘤微环境中,特定的微生物会影响其他细胞(微生物或宿主细胞)并受其影响。
微生物群及其代谢物影响肠-肝轴的组织细胞。肠道微生物群以及肿瘤本身的细菌可以影响肿瘤微环境,包括通过调节癌症、基质和炎症/免疫细胞中的基因转录以及促进或抑制肿瘤进展。
同时,微生物群也受饮食、环境等因素影响,在环境扰动后会适应,从而影响宿主-微生物的相互作用。
本文主要阐述了微生物群在肝脏稳态中的作用,肠道菌群及其代谢物直接和间接地调节肝脏基因表达,导致肠-肝轴失衡,从而促使肝病的发生发展,甚至致癌,并对肿瘤微环境产生影响。
我们的健康和生存能力取决于共生微生物(微生物群)的存在,它们主要存在于上皮细胞界面上,在下消化道中特别丰富。
菌群维持肠道稳态
肠道微生物群中的平衡生态有助于食物加工和吸收,调节宿主新陈代谢,并通过防止病原体和病原菌的扩张或通过调节宿主免疫力和维持肠道上皮的完整性来防止感染。
肠道-肝脏-胰腺轴
在物理上,肝脏和胰腺通过胆管和胰管与肠道相通,而门静脉将肠道菌群产物输送到肝脏。因此,肠道菌群与肝脏和胰腺之间的串扰(肠道-肝脏-胰腺轴)可以将信号整合为一个相互关联的系统。
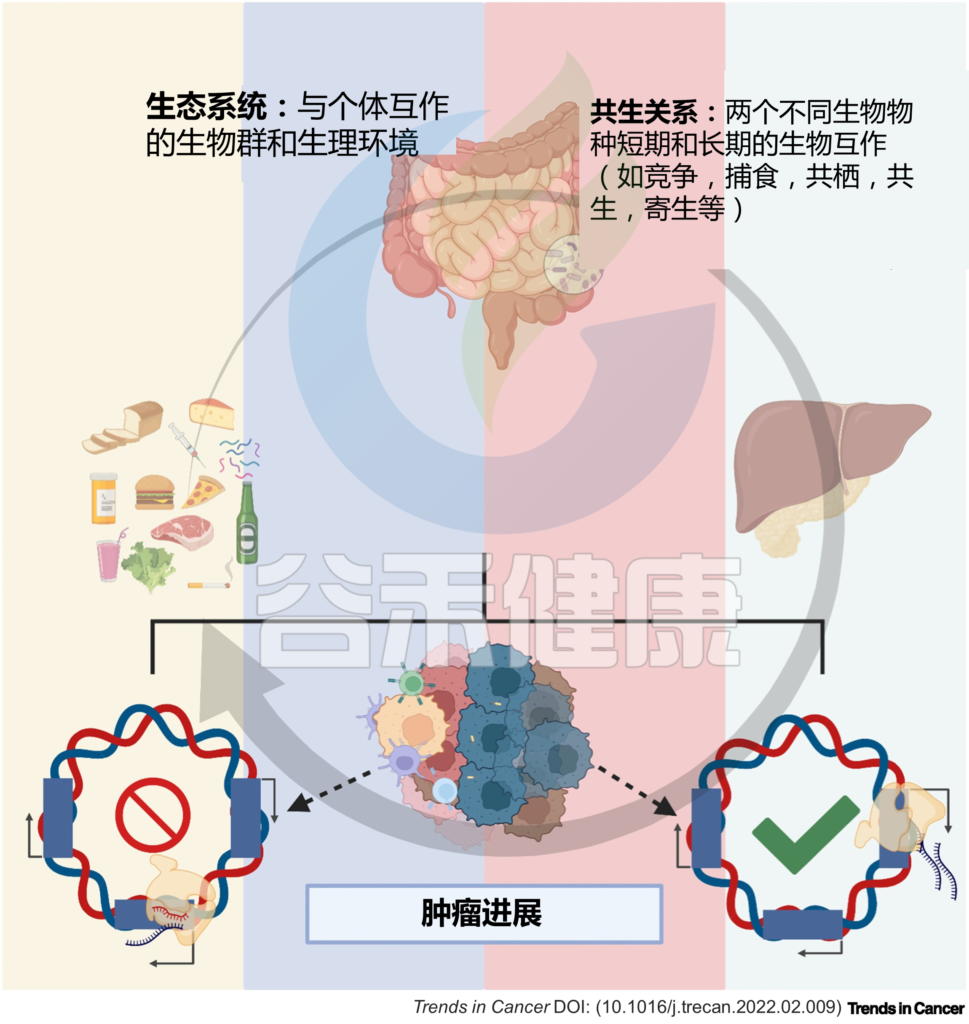
宿主与微生物群之间复杂而高度协调的相互作用代表了一个自然生态系统。共生相互作用,如互利共生、共栖、捕食、寄生和竞争,是微生物、微生物-宿主和宿主-宿主细胞之间相互作用的基础。
因此,肠-肝轴中的细胞处于稳态平衡,环境扰动会改变这种平衡,从而调节局部和全身的转录反应,并影响健康和疾病,例如癌症。
图1 微生物与宿主的相互作用调节体内平衡和疾病
关于微生物群在致癌中的作用的研究,最初集中在上皮屏障界面的肿瘤上,如胃癌和结肠癌,但胰腺导管腺癌 (PDAC) 为口腔和肠道微生物群以及癌症相关微生物群的作用提供了很多证据。
微生物群对致癌作用的影响,及细菌调节肿瘤微环境的一些机制如下:
胰腺癌研究解决了肠道菌群失调、瘤内细菌和癌症之间的联系
人类胰腺癌前体病变显示被产生 IL-17 的Th17 细胞浸润,加速了癌症的发生和进展。
几项研究表明,胰腺导管腺癌与口腔微生物组的组成、口腔病原体(如牙龈卟啉单胞菌Porphyromonas gingivalis、伴放线聚合杆菌Aggregatibacter actinomycetemcomitans)的丰度增加或口腔微生物抗体的存在有关。胰腺癌中出现了较低的α多样性,产生LPS的细菌增加,产丁酸盐菌减少。
基于与胰腺导管腺癌相关的口腔和肠道微生物群落的概况,已经提出了将胰腺导管腺癌患者与健康个体区分开来的无创诊断模型。
此外,胰腺导管腺癌研究已经确定,胰腺含有与组织相关的细菌和真菌,这些细菌和真菌在胰腺癌中比在正常胰腺组织中的含量更高。胰腺导管腺癌中的细菌主要存在于免疫细胞和癌细胞内。
在分析的每种肿瘤类型中,肿瘤内细菌的组成是不同的,可用于预测肿瘤与正常组织和肿瘤类型。
尽管在大约三分之二的胰腺导管腺癌中观察到细菌,并且数量高于大多数其他肿瘤类型,但与人类细胞相比,它们在肿瘤中的绝对数量仅为约 1/40 – 1/400。
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria较少。
胰腺导管腺癌相关微生物群的组成与十二指肠微生物群相似,这一事实表明细菌可能是通过胆胰管逆行迁移。
肿瘤相关微生物通过各种机制参与胰腺癌的发生或对治疗产生抵抗
例如,表达胞苷脱氨酶长同工型的细菌(如 Gammaproteobacteria)将吉西他滨代谢成无活性形式,导致胰腺导管腺癌出现耐药性。
瘤内细菌可能通过诱导 MDSCs 和抑制 M1 巨噬细胞分化和 CD4 +和 CD8 + T 细胞活化来重新编程肿瘤微环境;通过抗生素治疗进行的细菌消融可重新编程胰腺肿瘤免疫微环境,防止癌变并使免疫检查点抑制治疗产生反应。
然而,肿瘤内细菌也可能是有益的,并且 胰腺导管腺癌的长期幸存者在肿瘤相关微生物群中表现出更高的微生物 α 多样性和独特的特征(假黄单胞菌属Pseudoxanthomonas、链霉菌属Streptomyces、糖多孢菌属Saccharopolyspora),这可能诱导有效的免疫细胞浸润和抗肿瘤免疫。
最近有多项综述回顾了微生物调节在胰腺导管腺癌中的作用。这些研究支持胰腺导管腺癌患者的肿瘤外和肿瘤内微生物群与发育和临床进展的易感性之间的直接联系。
作为一个相互关联的系统,肠-肝轴中的微生物-宿主串扰有望成为肝癌发生的一个重要因素,就像在胰腺导管腺癌中一样。
细菌通过微生物-宿主和宿主-宿主相互作用参与致癌作用
幽门螺杆菌,已被正式确定为胃癌的明确人类致癌物。然而,新出现的证据表明,细菌,无论是存在于上皮屏障界面上还是存在于肿瘤中,都与局部或远处组织的癌变和肿瘤进展有关。
细菌在肿瘤微环境中产生选择性压力以促进肿瘤发生,部分原因是引发 ROS 的产生,影响对 pH 变化的反应,竞争有限的营养物质,增加 DNA 损伤和诱变,调节癌基因途径,影响化学疗法的代谢药物,或调节免疫。
携带产生大肠杆菌素的聚酮化合物-非核糖体肽合酶操纵子 (pks) 的大肠杆菌菌株在结直肠癌中诱导了明显的突变特征,这为细菌在基因组突变中的作用提供了证据。
微生物群对致癌基因诱导的肿瘤进展的影响得到以下观察结果的支持:
突变的p53仅在远端结肠中致癌,因为存在微生物产生的没食子酸,通过破坏 WNT 通路阻止突变的 p53 作为肿瘤抑制因子。相反,肿瘤会对局部组织细胞施加的竞争压力可能会影响肿瘤微环境、周围组织和肠道中的细菌。
宿主-宿主相邻细胞之间的肿瘤微环境竞争动态是生态系统模型的基础,在结肠和肝脏中均发现有致癌作用,并且可以为细菌调节肿瘤微环境提供底物。
恶性干细胞分泌促进邻近干细胞分化为含有促癌突变的克隆的因子。微生物群的改变可能代表另一个触发因素,结合宿主细胞串扰中涉及的其他多个信号,不仅影响癌症前体靶细胞,而且通过调整局部组织环境影响所有细胞。
此外,肿瘤相关细菌大多存在于癌细胞和免疫细胞的细胞内,可能影响癌细胞的信号传导,并在抗原呈递细胞表面以 MHC 限制性肽的形式呈递,从而刺激宿主免疫。
尽管在改进低生物量正常和肿瘤组织样本中稀有细菌的鉴定和分析技术方面取得了很大进展,但这些结果仍需谨慎解读。不过,这支持肿瘤微环境选择居住的微生物群并反过来受微生物群影响的新概念。
此外,肝脏和胰腺之间的生理联系提出了一个问题,即:最近在胰腺导管腺癌中建立的模型是否可以应用于肝细胞癌 (HCC)?
在此阐述了微生物群在维持肠-肝轴稳态中的作用,并关注环境扰动如何直接(通过诱导微生物相对丰度/多样性的变化)或间接(通过微生物代谢物的作用)触发与肝癌发生相关的基因反应。
微生物群的组成是在婴儿早期建立的,并在成年后保持相对稳定。然而,由于生活方式、饮食、疾病、感染和抗生素的使用,细菌种类的相对丰度可能会迅速改变。
微生物群与宿主之间的串扰对健康和疾病产生关键影响
微生物群通过其扩张/收缩、占据不同的解剖生态位以及遗传物质的突变和交换来适应环境变化并调节宿主反应。
微生物群在宿主从出生开始的先天性和适应性免疫系统发育中发挥着重要作用,免疫系统也塑造了宿主-微生物的相互作用。这个过程依赖于肠道黏膜表面的分隔、微生物群感应和信号传递以及免疫细胞启动,以产生特定的反应并维持体内平衡。
结合起来,上皮屏障、其微生物群落和局部免疫系统不仅可以耐受环境中的共生细菌,还可以使免疫系统对条件致病菌或微生物产物做出反应。
当这些防御机制失败时,例如由于肠道通透性增加(肠道渗漏)或生态失调(与疾病相关或与疾病有因果关系的微生物群组成的变化),就会出现细菌代谢物的涌入或先前被分隔,并且有害微生物可能通过肠道血管屏障(GVB)并通过门静脉循环延伸到肝脏。
微生物群在肝脏稳态中的关键作用
在肝脏中,环境扰动会触发肝脏免疫反应,这种反应依赖于常驻免疫细胞以及来自肠道微生物群的循环抗原和内毒素。由与肠道相关淋巴组织 (GALT) 相关的免疫监视形成,证实了微生物群作为一个相互关联的系统在肝脏稳态中的关键作用。
为什么肠道屏障的紊乱会改变肝脏的微环境?
小肠细菌过度生长(SIBO)也与肠漏和细菌流入肝脏有关。
细菌产物或微生物易位的增加会刺激与慢性肝病相关的促炎反应。相反,肝脏通过胆道在肠道中释放胆汁酸和其他生物活性介质,这些介质可能会被肠道微生物群进行生物转化,然后被吸收并释放到体循环中。
生理组织稳态的改变可能导致癌症等疾病。此外,通过将饮食模式与微生物组对免疫和代谢状态的影响和癌症治疗反应联系起来,这种关系揭示了微生物群和肝脏之间的联系,这是由局部环境扰动引发的一系列相互关联的反应。
总的来说,肠-肝轴生态系统可以触发局部和远处的反应,并勾勒出肠道微生物群与肝脏之间的直接和间接相互作用(图 2)。
图2 肠肝轴的双向关系调节体内平衡
(A) 粘液从物理上将微生物群与上皮衬里分离,而抗菌肽使内部粘液几乎无菌。(B) 因此,微生物群与宿主之间的相互作用主要是间接的,并由代谢产物介导,这些代谢产物可能穿过粘液和上皮屏障,到达固有层中的免疫细胞和基质细胞,或通过淋巴和血管系统到达肝脏和体循环。(C) 免疫细胞通过产生生长因子和细胞因子来巡逻上皮细胞,并加强上皮和粘液屏障。这些产物对微生物产生选择性压力。(D) 树突状细胞感知环境并诱导T细胞和B细胞反应,从而产生IgA抗体,这些抗体转移到管腔,并通过调节微生物组成和多样性来促进粘膜免疫保护。代谢产物通过(E)肠血管屏障通过门静脉流入肝脏。(F) 在肝窦中,免疫细胞扫描异物。(G) 反过来,肝脏通过释放胆汁酸和其他生物活性介质进入胆道与小肠沟通;这些代谢物可被回肠和大肠末端丰富的微生物群生物转化,部分通过门静脉再循环到肝脏,从而可能影响局部和全身功能。
健康的肠道屏障对一些微生物代谢产物是可渗透的,但大多数完整的微生物却不能通过。
然而,饮食和其他环境因素的影响会迅速丰富或消耗特定的营养物质和细菌。这种效应会对微生物代谢物的产生和胆汁酸的转化产生影响,这有可能塑造局部微环境并与包括癌症在内的慢性肝病的发展相关。
例如,酒精会导致肠漏。与 SIBO 一起,它允许内毒素进入循环,导致肝脏疾病。SIBO 是肠道微生物菌群失调的一种表现,其特征是 α 多样性降低,在某些情况下,β 多样性增加,这可能导致全身性炎症。
增加的细菌易位会促进肝硬化进展(肝细胞癌的前体),包括:导致纤维化,通过增加肝细胞与微生物和细菌代谢物的接触,或通过在肝脏中创造转移前的小生境,改变环境以利于转移细胞的募集和增殖,从而促进肝硬化进展。
最后,在某些慢性肝病中,活细菌的易位可能导致 GALT 的免疫麻痹,表明微生物平衡的变化直接影响局部环境的机制。
下文将阐述肠道细菌如何通过扩散到肝脏、影响环境或改变其他细胞中的串扰直接影响肝癌发生。
饮食改变肠道微生物组,对免疫和新陈代谢状况、癌症风险和对癌症治疗的反应产生影响。因此,摄入食物的来源和类型在调节肠道微生物组中起着关键作用,并对宿主-微生物相互作用产生影响。
人类肠道中主要有三种类型(肠型)(拟杆菌属Bacteroides、普氏菌属Prevotella和瘤胃球菌属Ruminococcus)。
在工业化和非工业化人群中观察到的蛋白质和动物脂肪(拟杆菌属Bacteroides)与碳水化合物或植物性食物(普氏菌属Prevotella)的摄入比例不同。工业化与天然富含纤维食品的减少有关。
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
菊粉 是果糖聚合物的异质混合物。果糖摄入转化为乙酸盐,并通过微生物群衍生的乙酸盐经门静脉到达肝脏触发从头脂肪生成。在肠道中,菊粉对成年人微生物组组成的影响:
下列菌增加:
双歧杆菌Bifidobacterium
厌氧菌Anaerostipes
粪杆菌Faecalibacterium
乳杆菌属Lactobacillus
下列菌减少:
拟杆菌属Bacteroides
普氏菌Prevotella、密螺旋体Treponema、琥珀弧菌属Succinivibrio的丰度增加主要与蔬菜的纤维和碳水化合物发酵相关的饮食有关。
高纤维饮食增加了微生物组编码的聚糖降解碳水化合物活性酶,而不影响群落多样性。相比之下,高发酵食品饮食增加了微生物组的多样性并减少炎症。
从机制上讲,缺乏纤维的饮食可以使结肠粘液降解细菌增多,增强柠檬酸杆菌粘液层翻转和相关的结肠炎。这表明饮食模式可能影响肠-肝轴的多种机制。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
丁酸盐是一种短链脂肪酸,通过肠道内膳食纤维的微生物发酵产生。丁酸盐有助于黏膜稳态和肠道内壁的完整性,从而提供肠细胞的大部分能量需求,并通过与几种 G 蛋白偶联受体结合并作为组蛋白脱乙酰酶抑制剂发挥抗炎作用。在小鼠模型中,增加的膳食纤维以微生物群和丁酸盐依赖的方式防止结直肠肿瘤发生。
总的来说,这些研究强调了饮食对微生物群落的深远影响及其对宿主的影响,具体取决于摄入的食物来源。
先前的研究表明,地中海饮食与拟杆菌门Bacteroidetes和某些有益梭菌群Clostridium的富集以及变形杆菌门Proteobacteria和芽孢杆菌门Bacillota的减少有关,可以减少肝脏脂肪,被推荐用于预防非酒精性脂肪性肝病 (NAFLD)。
调节与饮食相关的微生物组是预防肝癌的潜在途径
长期食用可发酵的富含纤维的食物(如可溶性纤维菊粉或富含菊粉的高脂肪饮食)容易导致生态失调的小鼠出现炎症、胆汁淤积和肝细胞癌。总细菌负荷增加,多样性减少,变形杆菌和纤维发酵细菌(如梭菌属)的特定增加。消除这些产生丁酸盐的细菌成功地预防了富含菊粉的肝细胞癌,这表明调节与饮食相关的微生物组是预防肝癌的潜在途径。
由于肠道微生物群失调,高胆固醇/高脂肪饮食依次导致小鼠阶段进展为脂肪变性、脂肪性肝炎、纤维化,最终导致 NAFLD-肝细胞癌。
在每个阶段都富集了不同的微生物群组成,因为在肝细胞癌患者中:
Mucispirillum、Desulfovibrio、Anaerotruncus和 Desulfovibrionaceae依次增加,
而Bifidobacterium、Bacteroides被耗尽。
综合这些发现,饮食模式会通过富集与健康或疾病相关的特定细菌来影响肠道微生物组,从而对肝脏产生潜在影响。
许多微生物群代谢物是肝癌发展的危险因素。考虑到环境塑造和选择特定的微生物群,推测某些物种可能获得哪些竞争优势以及特定微生物群的富集如何影响肝癌的进展。
相似或不同的微生物群组成是否可能参与肝细胞癌和胆管癌 (CCA) 的发展?现在下结论还为时过早,在这部分讨论这两种类型的肝癌。
肝脏中肿瘤和非肿瘤区域之间菌群不同
最近有报道称,病毒和非病毒病因的肝细胞癌中的 16S rRNA 基因测序确定了肝脏中肿瘤和非肿瘤区域之间不同的微生物组成,其中拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形杆菌门Proteobacteria的物种占肿瘤相关菌群的主导地位。相关微生物群Ruminococcus gnavus被确定为感染肝炎病毒的 肝细胞癌患者的特征分类群。
肝硬化、肝细胞癌患者的肿瘤微生物群显示出更高丰度的嗜麦芽窄食单胞菌Stenotrophomonas maltophilia,这与肝星状细胞 (HSC) 中的衰老相关分泌表型 (SASP) 相关,证实了菌群失调与肝细胞调节之间的关联。
NAFLD肝硬化中,伴或不伴肝细胞癌的患者菌群不同
肝细胞癌患者的拟杆菌属Bacteroides和瘤胃球菌科Ruminococcaceae丰度增加,双歧杆菌Bifidobacterium丰度降低,这与粪便钙卫蛋白水平升高和全身炎症相关。同样,与肝硬化患者相比,早期肝细胞癌患者的肠道菌群中产生脂多糖 (LPS) 的菌群增加,而产生丁酸盐的菌群减少。
这些数据表明,在患有 NAFLD 和肝硬化的肝细胞癌患者中,肠道菌群组成与全身炎症相关,并可能促进肝癌的发生。
乙肝病毒感染进展的肝细胞癌的菌群特点
从乙型肝炎病毒 (HBV) 感染进展的肝细胞癌患者显示出丰富的抗炎细菌(例如,普氏菌Prevotella、乳酸杆菌Lactobacillus、双歧杆菌Bifidobacterium、粪杆菌Faecalibacterium)和减少的促炎细菌(例如,大肠杆菌-志贺氏菌Escherichia-Shigella、肠球菌Enterococcus),肠道微生物群可能与调节宿主免疫生物学途径的 HBV 感染有关的成分。
这些研究强调了在肝细胞癌中观察到的微生物多样性,这代表了已知风险因素与肝细胞癌发展之间的相关性。
作为饮食和其他环境因素影响微生物组的相互关联的系统,有必要在多个评估部位(肿瘤和非肿瘤)和组织中表征局部微生物群的组成和多样性,与单细胞分析相关并可能相关与环境因素。此外,突出特定细菌物种富集的潜在因果关系的功能分析是超越相关性的关键步骤。
胆管相关的微生物群
一些细菌科,如Dietziaceae、Pseudomonadaceae、Oxalobacteraceae主导了胆管相关微生物群,表明独特的微生物群落存在于这一解剖学定位中。
肝外胆管癌患者有大量肠球菌Enterococcus、链球菌Streptococcus、拟杆菌属Bacteroides、克雷伯氏菌属Klebsiella、锥体杆菌属Pyramidobacter。
此外,与胆总管结石患者相比,胆管癌患者的胆汁样本富含肠杆菌属Enterobacter、假单胞菌属Pseudomonas、窄食单胞菌属Stenotrophomonas。
最后,与肝细胞癌或肝硬化患者和健康个体相比,肝内胆管癌患者肠道菌群中的4个细菌属增加:
乳酸杆菌Lactobacillus、放线菌Actinomyces、消化链球菌Peptostreptococcus、异体卡多菌Alloscardovia。
肠道微生物群特征可以来区分胆管癌和胆石症
在胆管癌中富集的菌群:拟杆菌属Bacteroides、Muribaculaceae_unclassified、Muribaculum、Alistipes属的物种。
而不同的微生物物种在胆石症组中富集,这表明在从良性肝胆疾病到恶性肝胆疾病的演变过程中微生物关联发生了变化。
总的来说,这些过程可能解释了肠道细菌易位直接导致建立有利于肝癌发展和进展的发炎肝脏环境之间的联系。然而,很难根据与微生物相对丰度的相关性来唯一地假设因果关系,微生物相对丰度由于多种环境因素而迅速改变。
因此,全面的跨界网络分析比较肝细胞癌和胆管癌,并将局部肠道和组织微生物群的组成和多样性以及环境因素对代谢、免疫和转录改变的影响联系起来,对于剖析微生物群在肝癌的发生及其作用机制调节中的因果作用至关重要。
“
强调了微生物群变化对肝脏环境的间接影响(可能通过环境中其他细胞或微生物代谢物的串扰)及其与肝癌发生和进展的关系。
为了了解特定微生物群在肝肿瘤中的潜在影响,有必要将潜在机制以及微生物与其他细胞之间的串扰联系起来。
小鼠中肝细胞癌发展的演变
从这个意义上说,最近的一项研究描述了Mdr2 缺陷小鼠中肝细胞癌发展的时间演变,这些小鼠缺乏从肝脏将磷脂分泌到胆汁中的能力,从而经历胆汁淤积和肝细胞癌发展。
在这些代表炎症诱导肝细胞癌的有用模型的小鼠中,肠道菌群失调诱导肠道屏障功能障碍,先于 LPS 介导的肝脏转录改变,从而导致肝细胞癌发展。
此外,肝内炎症基因谱从肝损伤早期的促炎表型转变为肝细胞癌的免疫抑制表型。这种变化与通过微生物组功能从碳水化合物向氨基酸代谢的转变来重新调整能源利用有关。
菌群改变通过代谢和炎症影响肿瘤发生
微生物群的改变通过影响肝脏碳水化合物和脂质代谢调节炎症,从而导致 NAFLD 及其进展为非酒精性脂肪性肝炎 (NASH)。代谢和炎症的调节可能同样影响肝脏肿瘤发生。
肠道微生物组受饮食和其他环境因素的影响,微生物与营养物质的竞争是调节新陈代谢和免疫反应的关键步骤。例如,通过微生物群介导的膳食纤维发酵产生 SCFA 与胆汁淤积型肝细胞癌相关。
有人认为,细菌产物的易位可能会刺激炎症并释放 GALT 中的活性氧 (ROS),从而影响机械和分泌屏障以及局部微生物群。
这些研究强调需要继续进行系统和全球研究,将肠-肝轴中微生物物种的多样性和丰度作为一个生态系统进行表征,同时也需要开始剖析这些表型背后的机制。
最近有人提出,母亲在怀孕期间摄入丁酸盐和谷氨酰胺会影响新生小鼠的粪便微生物群和代谢物,这与拟杆菌和梭状芽胞杆菌的粪便特征有关。
此外,这些新生小鼠对肝脏免疫激活有抵抗力,导致胆管炎症和损伤。
从机制上讲,细菌代谢物在宿主细胞中触发基因反应的影响可能取决于环境中的转录改变。
对急性肝衰竭动物模型中不同的转录特征进行了检查,表明肠道微生物群和 Toll 样受体 (TLR) 信号激活肝星状细胞、枯否细胞和肝窦内皮细胞 (LSEC) 中的 MYC 依赖性转录程序,导致 Ly6C 阳性炎性单核细胞浸润和肝功能衰竭。
图3 微生物代谢产物和多样性是肝癌进展的触发因素


(A)一些细菌可能会穿透粘液屏障或参与其降解,在某些情况下导致上皮屏障的破坏或破坏,从而允许(B)微生物和微生物代谢物和免疫细胞之间的直接接触,诱导促炎细胞因子的产生和全身传播。粘液/上皮屏障的破坏也可能促进(C)细菌转移到肝脏(D),这为癌细胞的播散创造了一个有利的生态位。因此,先前划分的细菌和微生物产物的涌入影响了局部肝细胞的基因表达。例如:(E)肝细胞可能表达CXCR1并诱导CRCX2+多形核髓系衍生抑制细胞(PMN-MDSCs)的积累,创造免疫抑制环境促进胆管癌(CCA);(F)激活的肝星状细胞在肝细胞癌(HCC)和癌症转移中发挥多种功能,可能通过CXCL12-CXCR4相互作用破坏肝脏中自然杀伤细胞(NK)的功能,改变NK细胞介导的免疫,促进乳腺向肝脏转移;而(G)其他的肝脏免疫细胞可能通过脂多糖(LPS) – toll样受体4 (TLR4)或脱氧胆酸(DCA) -TLR2调节而被激活,并诱导促进肝细胞癌发生的炎症反应。相比之下,(H)被肠道菌群修饰后的肝脏产生的胆汁酸可能会激活肝脏自然杀伤T细胞(NKTs)在肝脏中的趋化因子依赖性积累,从而控制肿瘤的生长。
LPS调节影响肝细胞癌
循环水平的LPS通过TLR4 激活并诱导肝星状细胞分泌生长因子、调节肝脏慢性炎症状态和抑制细胞凋亡,这些过程与肝细胞癌促进有关。门静脉区域 LPS-TLR4 相互作用下游的转录调节因子 YAP1 的激活调节肝细胞的干性。
因为肝细胞周转的位点定位在激活基础稳态和再生的分子途径中很重要。推测 LPS 也可以通过调节局部微环境重编程来调节这些机制以影响肝细胞癌。
肠道微生物群调节肝细胞的基因表达程序,促进肝细胞癌和胆管癌
在胆管癌中,增加的肠道通透性诱导微生物 LPS 易位进入肝脏,通过 TLR4 依赖性机制诱导肝细胞中 CXCL1 的表达。这种表达反过来导致 CCR2 +多形核髓源性抑制细胞 (MDSCs) 的积累。
肝硬化肝细胞癌患者的瘤内S. maltophilia丰度更高。 通过激活 TLR4/NF-κB/NLRP3 通路诱导衰老肝星状细胞中衰老相关分泌表型SASP因子和促炎因子的表达,从而促进肝纤维化,随之而来的肝纤维化加重并发展为肝细胞癌。
肝星状细胞增殖是肝纤维化发展的关键事件。最后,胆汁酸通过激活表皮生长因子受体诱导肝星状细胞增殖。
饮食会迅速改变人体肠道微生物组。饮食衍生的微生物代谢物对甲酚硫酸盐、4-乙基苯基硫酸盐和 4-甲基儿茶酚会影响肝细胞癌亚型。
人类肠道微生物组编码的代谢途径通过众多生物活性分子不断与宿主基因产物相互作用。例如,营养过剩会增加 IL-17A,进而诱导白色脂肪组织中的中性粒细胞浸润和 NASH 诱导的肝细胞癌。
IL-17A 是一种促肿瘤细胞因子,通过调节Kupffer细胞和骨髓源性单核细胞的炎症反应和脂肪变性肝细胞的胆固醇合成,调节酒精诱导的肝脂肪变性、炎症、纤维化和肝细胞癌的进展。
地高辛,一种类视黄醇孤儿受体 γ t (RORγt) 拮抗剂,降低了 IL-17A 水平并稳定了体重。表明其在代谢紊乱中的关键作用。
此外,TNF和IL-17A 与骨髓来源细胞中NLRP3 炎性体激活诱导的肝脏炎症和纤维化的发展有关。
总的来说,这些研究表明饮食代谢物、细胞因子和肝癌疾病之间存在机制联系。
初级胆汁酸在肝细胞中合成,释放到十二指肠,大部分在小肠中重新吸收。一小部分初级胆汁酸逃逸到结肠,肠道共生细菌将其转化为次级胆汁酸,次级胆汁酸对新陈代谢和宿主先天免疫反应具有多种重要功能。
饮食和微生物胆汁酸代谢物均可调节 RORγt 阳性调节性 T 细胞(Treg) ,有助于维持宿主免疫稳态和改善肠道炎症。此外,胆汁酸代谢物可以通过调节 Th17 和 Treg 细胞的平衡来控制宿主免疫反应。
胆汁酸可以在高脂肪饮食中发挥积极作用
膳食胆固醇诱导肠道细菌代谢物改变,包括增加牛磺胆酸和减少 3-吲哚丙酸,从而在小鼠中驱动 NAFLD-肝细胞癌。因此,胆固醇抑制疗法和肠道菌群操作可能是预防 NAFLD-肝细胞癌的有效策略。
石胆酸 (LCA) 衍生物直接影响 CD4+ T 细胞(3-oxoLCA 和 isoalloLCA)
3-oxoLCA 通过直接结合转录因子 RORγt 抑制 Th17 细胞分化,而 isoalloLCA 增强 Treg 细胞分化,证实肠道微生物群可能控制宿主免疫反应。
对于肝内胆管癌,观察到甘熊去氧胆酸和牛磺脱氧胆酸血浆:粪便比率增加,血浆牛磺胆酸和 IL-4 呈正相关,表明肠道微生物群、代谢物、细胞因子和胆汁酸之间存在相互关系。
肥胖诱导的菌群失调促进肝癌发生
最近的一项综合组学研究揭示了一种胆汁酸代谢物升高、胆固醇代谢失调和与 BMI 增加相关的独特炎症反应的胆管癌亚型,这表明肥胖诱导的肠道微生物群失调促进肝癌发生的模型。
从机制上讲,胆汁酸/致癌轴涉及胆汁酸受体,例如法尼醇 X 受体 (FXR) 和 G 蛋白偶联胆汁酸受体 1,它们可能代表癌症的重要治疗靶点。胆汁酸如脱氧胆酸 (DCA) 被证明可阻断 FXR 的功能及其抑制肠癌干细胞增殖的能力,从而影响肠-肝轴稳态。
此外,胆汁酸传感器 FXR 或 G 蛋白偶联受体 TGR5 的激活通过抑制 NF-κB 依赖性信号通路和 NLRP3 依赖性炎症小体活性来抑制炎症信号传导。因此,饮食-肝脏-胆汁酸-微生物群的串扰在胃肠道炎症以及结直肠癌和肝癌的发生中起重要作用,可用于预防癌症的发生或进展。
菌群利用胆汁酸作为信使影响抗肿瘤免疫
肠道微生物组可以利用胆汁酸作为信使,来控制趋化因子依赖性肝脏自然杀伤 T 细胞 (NKT) 的积累,从而影响肝脏中的抗肿瘤免疫。这一过程是由共生肠道细菌的改变、初级和次级胆汁酸的平衡以及 LSEC 中的 CXCL16 表达介导的,LSEC 是最早暴露于肝脏中肠道衍生代谢物的细胞之一。
相反,NKTs 通过与肝细胞的相互作用与 CD8 T 细胞合作,促进 NASH 和 NASH相关的肝细胞癌。
NK 细胞和肝星状细胞之间的相互作用——癌症休眠和转移的主要开关
基质反应阻碍了 NK 细胞和干扰素 γ 介导的肿瘤细胞休眠的维持,并通过组织损伤和活化的肝星状细胞分泌 CXCL12 的过程诱导肝转移,CXCL12 通过 CXCR4 保留和使 NK 细胞静止,抑制免疫监视和促进转移性生长。
某些与肥胖相关的细菌具有增加次级胆汁酸脱氧胆酸的能力
脱氧胆酸的增加会导致肝星状细胞中的 DNA 损伤,从而诱导衰老相关分泌表型,导致炎症和肿瘤促进因子以及 COX2 诱导的免疫抑制性 PGE2 在肝脏中的产生,从而促进肝细胞癌的发展。
肥胖还与微生物群改变有关,导致 TLR2 激动剂脂磷壁酸 (LTA)这一革兰氏阳性菌的主要细胞壁成分的积累增加。脱氧胆酸增加肝星状细胞上 TLR2 的表达,并与 LTA 协同诱导衰老相关分泌表型因子和 COX2,后者通过 PGE2 诱导免疫抑制,并在化学致癌物暴露后促进肥胖相关的肝细胞癌。
总之,这些研究支持了一个模型,即平衡状态的改变会对环境中的连接细胞产生影响,证实微生物组及其代谢物是肠道和肝脏基因反应的关键影响因素,对肝癌发生具有影响。
本文主要介绍了影响肝细胞癌的微生物群的复杂相互作用,强调了微生物群多样性或肠-肝轴中微生物代谢物的改变触发局部细胞中的基因反应。
与肝细胞癌相比,微生物群和PDAC对患者预后的相关性已得到更彻底的研究,并已明确开始确定特定机制,通过这些机制,微生物群可以局部或系统地影响肿瘤微环境,以及肿瘤进展和对治疗的反应。因此,胰腺导管腺癌研究中使用的一些策略可以应用于肝细胞癌研究。
可以看到,目前的研究分析环境中局部细胞内微生物群介导的直接和间接变化,研究视角已逐渐从靶细胞转向微环境/生态系统。肠道微生物群以及肿瘤本身的细菌通过调节癌症、基质和炎症/免疫细胞中的基因转录程序以及促进或抑制肿瘤进展来影响肿瘤微环境。
癌症干细胞和免疫细胞之间的串扰在癌症进展中起着重要作用,那么癌症干细胞是否容易被微生物/代谢物的改变触发?这也是值得关注的问题。由于物理和生理上的联系,评估微生物群对癌症干细胞分化的影响以及作为一个综合系统对肠-肝轴生态系统的影响也非常重要。
主要参考文献:
Silveira MAD, Bilodeau S, Greten TF, Wang XW, Trinchieri G. The gut-liver axis: host microbiota interactions shape hepatocarcinogenesis. Trends Cancer. 2022 Mar 21:S2405-8033(22)00045-0. doi: 10.1016/j.trecan.2022.02.009. Epub ahead of print. PMID: 35331674.
Komiyama S, Yamada T, Takemura N, Kokudo N, Hase K, Kawamura YI. Profiling of tumour-associated microbiota in human hepatocellular carcinoma. Sci Rep. 2021 May 19;11(1):10589. doi: 10.1038/s41598-021-89963-1. PMID: 34012007; PMCID: PMC8134445.
Zhang T, Zhang S, Jin C, Lin Z, Deng T, Xie X, Deng L, Li X, Ma J, Ding X, Liu Y, Shan Y, Yu Z, Wang Y, Chen G, Li J. A Predictive Model Based on the Gut Microbiota Improves the Diagnostic Effect in Patients With Cholangiocarcinoma. Front Cell Infect Microbiol. 2021 Nov 23;11:751795. doi: 10.3389/fcimb.2021.751795. PMID: 34888258; PMCID: PMC8650695.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980. doi: 10.1126/science.aay9189. PMID: 32467386; PMCID: PMC7757858.

谷禾健康

铁 (Iron)作为人体不可或缺的元素之一,在氧气运输,新陈代谢和免疫防御中起着基本作用。铁元素的良好调控是人体健康的保障,过多过少都会对人体产生不利影响。铁稳态的失调与各种疾病的发生和发展息息相关:铁缺乏会导致宿主发育迟缓,免疫低下,而铁过载更易引发炎性反应和代谢问题, 还可能与癌症的发生发展密切相关。
在人类中,小肠作为宿主体内铁的主要吸收场所,大约每天吸收2-3mg铁,但是在一些病理条件下,小肠并不能完全将食物中的铁吸收,而相当一部分铁进入结肠中与肠道菌群发生密切的交互作用,并影响肠道菌群的“生态系统”,从而进一步调节宿主的健康和代谢。
自法国国家农业研究院与法国国家健康与医学研究院(INSERM)的研究人员首次发现肠道菌群如何影响肠道内铁元素的转运与储备成果后,多项研究表明,铁失衡会导致肠道菌群的改变,进而改变微生物多样性,增加病原体丰度并诱导肠道炎症的发生发展。
谷禾在多年的肠道菌群研究和检测实践中,也发现饮食中的铁水平是导致肠道菌群改变的重要因素。我们基于机器学习算法,建立了预测模型,可以预测评估膳食摄入和铁的菌群代谢的总体水平,这有助于避免缺铁和铁过量引起的肠道菌群失调及其可能导致的宿主健康损害和疾病风险。
铁和微生物组之间相互作用

Botta A, et al., J Lipid Atheroscler. 2021
铁是人类必需的营养素,在环境中含量非常丰富,并参与了许多生物过程,如氢气的产生、呼吸和DNA 生物合成。它还在宿主细胞内的许多代谢途径中起到辅助因子的作用。
在人类中,由于没有排泄铁的途径,小肠上皮细胞对铁的吸收是一个非常严格的调节过程。
吸收效率取决于饮食中铁的潜在可用性,并受生理铁需求的调节,包括体内铁储存,铁调素在控制吸收中起核心作用。
膳食铁大致分为两种类型,非血红素铁和血红素铁。两种形式的膳食铁都有单独的肠细胞吸收途径:


这里主要关注的是非血红素铁(口服铁通常以非血红素铁的形式给予)。
肠上皮细胞对非血红素铁的吸收
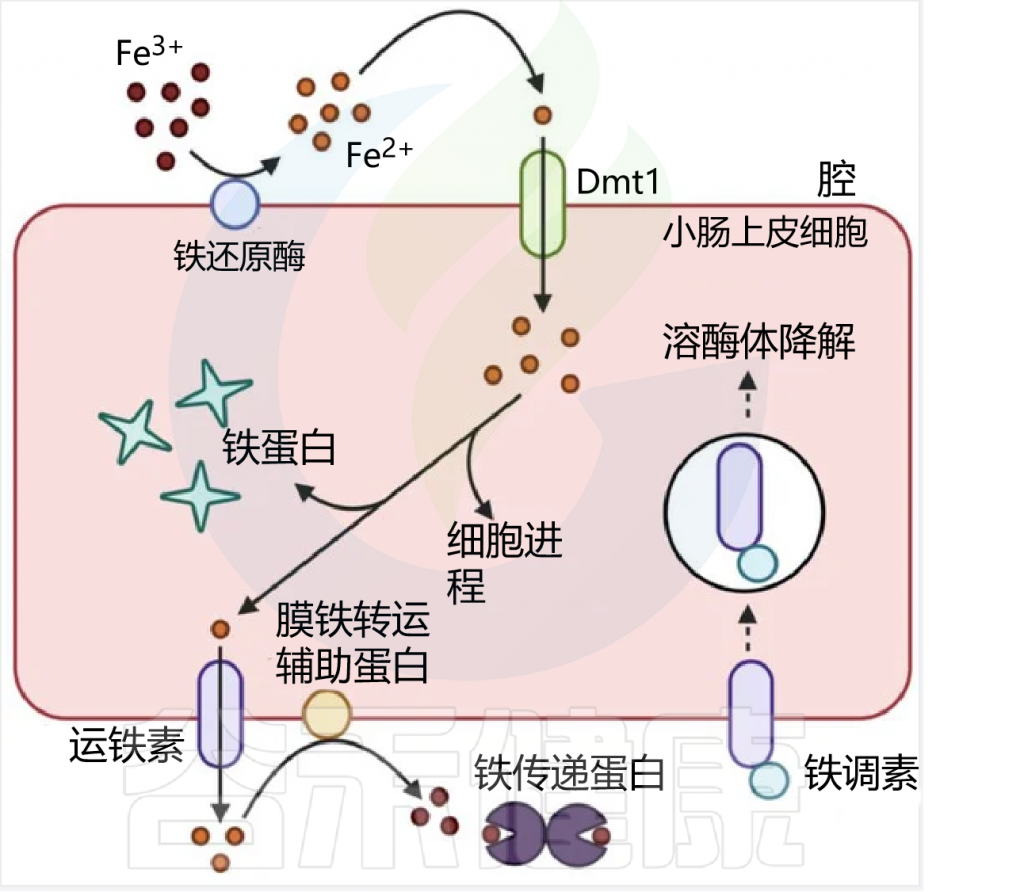

日常生活中,缺铁的常见症状包括:
一般我们常见的缺铁,主要是以下几个原因:
这很好理解。我们的身体不能制造铁,需要从食物中获取。如果你每天摄入的铁量没有达到身体需要的量,就会出现缺铁。
快速生长会增加铁需求,因此儿童、孕妇和哺乳期女性更可能缺铁。此外,进行耐力锻炼的人更容易患低铁症。
出血和失血会增加铁的流失,包括:月经出血、分娩、溃疡、痔疮、因受伤或手术而出血、献血等。长期使用消炎药(布洛芬、萘普生、双氯芬酸)会增加肠道出血的可能性。
需要注意的是,缺铁性贫血的一个常见且常被忽视的原因是月经过多。随着时间的推移,这种缓慢的血液流失通常会导致铁流失过多。
在慢性炎症性疾病中也会出现缺铁,例如自身免疫性疾病、慢性感染、慢性肾病或癌症。这被称为慢性病性贫血。
因为铁对病原体和癌细胞的生长很重要,所以当发生感染或炎症时,身体会试图通过锁定铁来抑制病原体或恶性细胞的生长。
受感染或炎症影响的组织会释放降低铁血水平的细胞因子,从而导致贫血的发展。
消化系统的疾病会降低铁的吸收,包括:
乳糜泻、炎症性肠病、胃炎、幽门螺杆菌感染、小肠细菌生长过度等,此外,减肥手术也会减少营养吸收,包括铁。
铁吸收不足的其他原因包括大量摄入抑制铁吸收的食物或药物,包括:植酸盐(全谷物、豆类)、多酚(茶、咖啡、葡萄酒)、抗酸药、H2受体阻滞剂、四环素或消胆胺等药物等。还有一个很重要的我们可能会忽略的环节,就是菌群。
细胞铁浓度是感染性的关键决定因素之一。肠道病原体在宿主细胞中的存活可能部分取决于宿主铁的状态。铁也可以促进肠道病原体的复制和毒力,例如沙门氏菌属、志贺氏菌属和弯曲杆菌属。
利用铁载体获取铁的一些细菌还包括如:
大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和结核分枝杆菌。
这些病原菌的定植会与宿主进行铁的竞争吸收,同时诱发肠道炎症,改变肠腔环境,影响菌群构成,进一步导致缺铁加剧。


大多数细菌都依赖于铁的存在来进行呼吸和各种代谢过程。在细菌内部,铁在生长和增殖中起着至关重要的作用,例如,某些细菌蛋白质和酶的正常功能需要铁。此外,铁还可以调节某些毒力因子的表达。
铁浓度的波动会产生病理影响,对肠道微生物群组成产生负面影响。铁的波动有两种情况,过多或者缺乏,接下来我们逐一来看铁过量和缺乏会对菌群造成什么影响。
宿主铁稳态的改变可能会影响肠道的管腔铁含量,从而影响肠道菌群的组成。在无菌小鼠中,铁转运蛋白表达减少两倍,细胞铁含量较低,在移植肠道细菌定植后,上皮细胞利于铁的能力增加,细胞内铁含量增加。
铁过量
肠道中富含铁的环境有利于变形菌。对儿童的研究表明,过量的铁会导致炎症和病原菌的生长。这些病原菌可能会诱发炎症性肠病或结直肠癌。铁的强化增加了粪便钙卫蛋白的水平,显示了肠道的炎症。
患有铁过载综合征(包括血色素沉着症和难治性贫血)的人更容易受到细菌感染,包括:
耶尔森菌属Yersinia
单核细胞增生李斯特菌Listeria monocytogenes
创伤弧菌Vibrio vulnificus
膳食铁过量摄入可影响大鼠正常的生长发育,并引起小肠粘膜炎性损伤。过量铁摄入可引起大鼠肠道菌群失调,肠道菌群丰度有所降低,其中乳酸杆菌、双歧杆菌降低,血清中肿瘤坏死因子和内毒素水平升高可能与肠道菌群紊乱有关。
铁缺乏
当铁水平下降时,也会对肠道微生物群组成产生影响,诱发肠道感染。缺铁会抑制细菌细胞繁殖过程,从而损害细菌生长。
在啮齿类动物模型中,缺铁导致微生物群组成的显著重组,微生物多样性降低。
在铁含量非常低的条件下(0.9 mg Fe/L),Roseburia,肠杆菌减少,丁酸盐水平也降低,而Lactobacillus增加。此外,低铁条件下生长的Roseburia gutis优先产生乳酸而不是丁酸盐。
图 铁和炎症之间相互作用
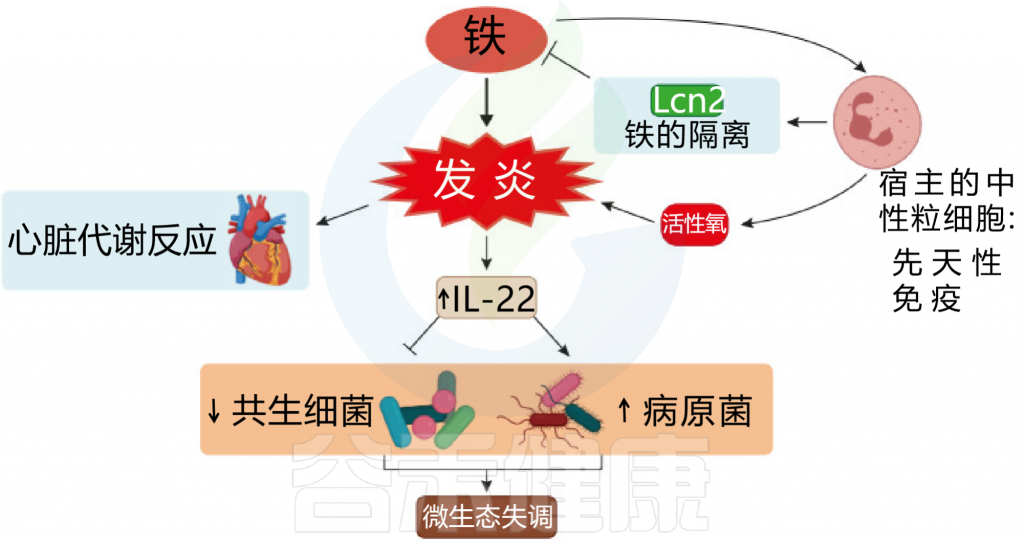

Botta A, et al., J Lipid Atheroscler. 2021
铁补充
铁的补充和强化对人体肠道细菌组成有不同的影响。
接受低剂量(0-10 mg Fe/天)或高剂量(大于60 mg Fe/天)铁补充剂的孕妇在肠道菌群任何分类水平上均没有显著差异。
接受含铁微量营养素粉(12.5 mg/天)的肯尼亚婴儿的病原体丰度增加。在健康、非贫血的瑞典婴儿中,食用高铁配方奶粉(6.6 mg Fe/天)45天不会增加病原菌的生长;然而,双歧杆菌的相对丰度降低。
但是,值得注意的是在同一项研究中,与服用高铁配方奶粉的婴儿相比,服用铁滴剂(6.6 mg Fe/天)的婴儿的乳酸菌种类相对丰度较低。尽管剂量相当,但这项研究表明,给药形式(即配方奶粉与滴剂)对肠道微生物组成的影响存在差异。
此外,由于铁滴剂会导致乳酸杆菌的减少,乳酸杆菌是重要的共生细菌,因此铁滴剂可能会增加感染的易感性。
在疟疾流行地区补充铁被证明会增加严重不良事件的发生率,包括因疟疾和其他感染而住院。疟疾感染恶化的潜在机制被认为是过量铁抑制铁转运蛋白(ferroportin,防止红细胞中铁过量,防止感染)。
口服铁补充剂和强化对 4-59 个月儿童腹泻发病率的影响。在19项研究中发现,12项研究中铁不会影响腹泻发病率,在其余的研究中,四项记录的腹泻发病率显着增加,三项记录在特定亚群中的增加。
为什么有些研究表明补铁导致腹泻增加?
有两个主要假设可以解释有时观察到的效果。
首先,铁可以在肠道内产生活性氧,从而导致肠道损伤,并导致炎症性腹泻。这一假设得到了体外实验的支持,在体外实验中,铁暴露后,肠上皮细胞失去了完整性。
其次,铁可以改变肠道细菌的组成,创造一个更具炎症性的环境。
口服铁剂后结肠腔内的微生物和代谢变化
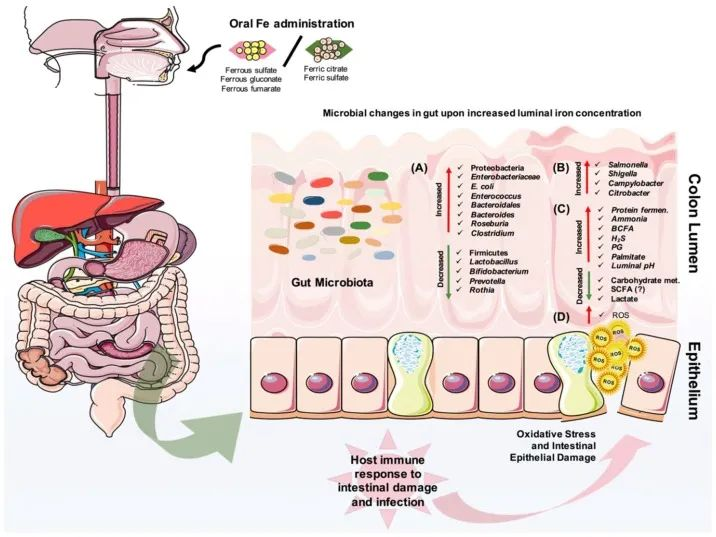
Yilmaz B, Li H. Pharmaceuticals (Basel). 2018
口服铁对肠道微生物组成的改变有直接影响。
(A)它可以导致有益微生物群的减少和致病菌的扩张,
(B)也可以为肠道病原体的扩张提供机会。
(C)此外,蛋白质发酵的增加和碳水化合物代谢的减少也会影响宿主的代谢。
(D)重要的是,铁可以在肠道中诱导活性氧(ROS)的产生,从而导致氧化应激,从而导致肠上皮损伤。
· 反过来,宿主的肠道免疫系统会对炎症、肠道损伤和可能的感染做出反应。
对于缺铁个体的补铁,可以改善肠道微生物的组成,降低致病菌的数量。但是在一些研究中,缺铁性贫血的个体口服补铁常会伴随胃肠道症状和肠道感染等副作用。在非洲的研究中,接受了铁强化剂饼干的儿童,铁补充并未改善机体贫血状况,反而增加了肠道致病菌肠杆菌数量,减少了乳酸菌和双歧杆菌数量,这些现象的发生可能与宿主的肠道高炎症水平密切相关,受到肠道内铁含量和微生物的影响。
当人体存在低肠道病原体负担时,补充铁剂对于肠道优势菌群或肠道炎症没有明显的影响;当人体不存在肠道病原负担的时候,补充铁剂可恢复肠道菌群,显著增加粪便中抗炎短链脂肪酸浓度并且降低肠道炎症,改善肠道微环境。
铁与病原菌
在哺乳动物中,大多数铁在血红素的卟啉结构中被螯合。由于病原菌生长需要铁,有的病原菌如霍乱包含的基因使霍乱弧菌能够从血红素中获取铁。霍乱毒素通过堵塞末端的毛细血管增加管腔血红素的生物利用度,导致宿主铁利用降低。
图 铁和代谢功能之间联系
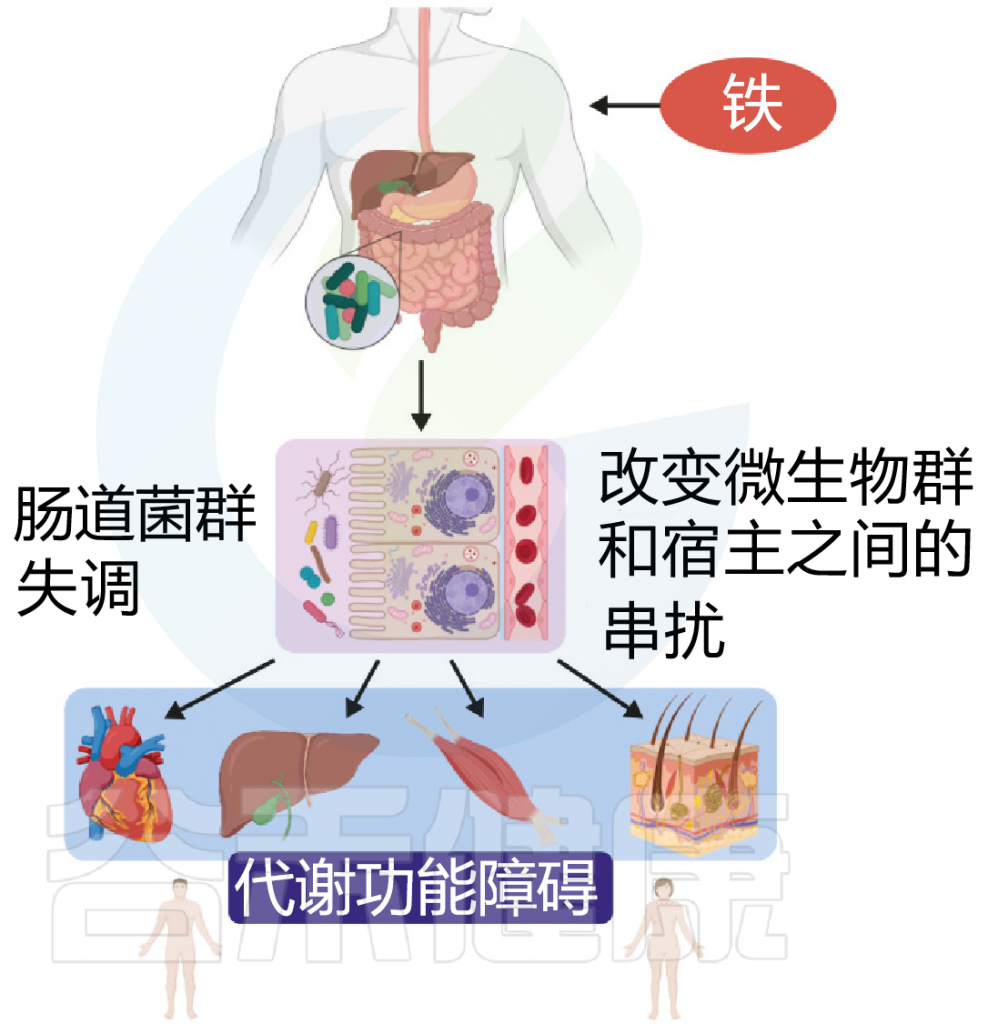

Botta A, et al., J Lipid Atheroscler. 2021
此外,霍乱弧菌产生一种称为弧菌素的铁载体。与肠杆菌素等其他儿茶酚酸酯铁载体不同,这种独特的协同作用有助于逃避宿主免疫系统。霍乱毒素还会增加管腔内的长链脂肪酸和L-乳酸代谢产物,从而导致编码TCA循环含铁硫簇酶的霍乱弧菌基因上调。
因此,霍乱和霍乱毒素的产生在肠道中创造了一个缺铁代谢生态位,通过获得宿主来源的血红素和脂肪酸,选择性地促进霍乱弧菌的生长。
空肠弯曲菌也能捕获宿主铁并在宿主内引起感染。空肠弯曲菌感染是通过食用生的或未煮熟的家禽、海鲜、肉类和未经处理的饮用水发生的,当空肠弯曲菌通过胃时,它必须首先在极端酸性环境中存活。铁的存在增强了它在酸胁迫环境中的生存能力,因此它含有与铁介导的酸保护有关的基因,包括鞭毛生物发生基因、细胞膜生物发生基因、热休克蛋白(GroEL、GroES),这些基因有助于它的生存。
膳食铁可抑制肠道病原体柠檬酸杆菌的生长,并促使选择无症状的柠檬酸杆菌菌株;这些反应与胰岛素抵抗和抑制病原体毒力的葡萄糖水平升高有关。
除了促进胰岛素抵抗外,膳食铁还增加了肠道葡萄糖水平,这是抑制病原体毒力的关键肠道环境变化,并推动了无症状柠檬酸杆菌菌株的选择。然而,相比之下,其他研究表明,铁可用性的降低是有益的,因为它可以减少潜在致病性肠道细菌的生长。
铁对促、健康的 SCFAs 产生的影响
细菌代谢对我们的肠道健康很重要。短链脂肪酸是结肠中的主要代谢物,对肠道健康非常有益,并且是肠细胞和更远距离组织的能量来源。
铁与短链脂肪酸
两项研究首次描述了铁和短链脂肪酸产生之间的联系。
具体来说,体内大鼠管腔缺铁期间丁酸盐和丙酸盐水平较低,并通过补铁恢复。尽管不能排除饮食干预会改变肠道对短链脂肪酸的摄取,但这些结果表明,补铁可以通过增加短链脂肪酸的产生对肠道健康产生有益的影响。
然而,相比之下,高铁条件下似乎没有太大刺激体外短链脂肪酸的产生,而在极低铁条件下丁酸盐和丙酸盐的产生最明显受到损害。这种产量下降伴随着产生短链脂肪酸的菌Roseburia spp./ E. rectale和Clostridium Cluster IV 成员的减少。
体外发酵研究表明,补充铁会略微增加丙酸盐水平,但总短链脂肪酸水平没有显着变化。
与补充铁饮食的大鼠相比,缺铁饮食大鼠的盲肠乙酸盐、丙酸盐和丁酸盐水平降低。他们还表明,与对照组饮食(并且没有首先耗尽铁)的大鼠相比,补充铁饮食的大鼠的丙酸盐和丁酸盐水平更高。因此可以假设,缺铁饮食(与缺铁相结合)可能对肠道健康无益,因为在这些条件下,腔内短链脂肪酸水平会降低。相反,铁补充剂可能会增加促进健康的肠腔短链脂肪酸水平。
值得注意的是,短链脂肪酸可能会影响肠道病原体的毒力。丁酸盐的减少也可能会降低肠内 AMP 导管素的表达,从而削弱宿主的防御能力。
铁与支链氨基酸(BCFA)
与碳水化合物发酵相比,肠道细菌的蛋白质发酵会产生有毒或潜在有毒的代谢物,例如氨、H2S、BCFA(例如异丁酸和异戊酸)、吲哚和酚类化合物。
在体外,低铁条件下 BCFAs 的产生减少,也就是说:铁增加了成人粪便微生物群的 BCFA 的产生以及有毒氨的产生。
值得注意的是,BCFAs 和氨被认为是蛋白质发酵的指标。研究表明铁会刺激蛋白质发酵,这可能会导致更腐败、潜在有毒或致癌的环境。相比之下,在体外发酵研究中发现乳酸(主要来自碳水化合物)水平会随着铁的反应而降低。
虽然在多项体外研究中显示了源自蛋白质发酵的产品毒性的证据,但体内毒性是有限的,最近的一项试验不支持蛋白质发酵在人体肠道毒性中的作用。
另一方面,蛋白质发酵通常与病原菌的生长有关。因此,有必要在体内研究铁对蛋白质发酵和毒性的影响。
重要的是要认识到微生物代谢物的影响不仅限于肠道,因为它们被吸收,并且可能对远处部位和全身宿主代谢产生影响。目前我们还不知道这如何影响人类健康和疾病,但研究暗示铁诱导的肠道微生物活性变化也可能具有全身性影响。
在稳态条件下,肠道内的微生物必须相互竞争,并与宿主竞争可用铁。因此,细菌发展了不同的吸收系统,如铁运输系统和铁载体(铁螯合分子),以便在铁有限的环境中更有利地竞争。
前面我们知道,铁对于细菌的生长繁殖至关重要,但过量的铁也会产生毒性,因此,细菌对铁离子的摄取必须受到精确严格的调控。
细菌已经进化出了铁源的摄取系统。
细菌获取铁的机制
细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。
铁载体能够与宿主体内的转铁蛋白、乳铁蛋白等铁结合蛋白竞争Fe3+,从而形成可溶性的Fe3+-铁载体复合体,这种复合体可以特异性地与细菌细胞外膜上的铁载体受体蛋白(OMRs)相结合,最终被转运至细胞周质中,转运过程通过TonB系统提供能量。
细胞周质中的Fe3+-铁载体复合体与周质结合蛋白(PBPs)相结合,形成Fe3+-铁载体-PBPs复合物。最后Fe3+-铁载体-PBPs复合物由ABC转运蛋白介导,通过内膜进入胞浆。进入细胞后,Fe3+-铁载体-PBPs复合物中的Fe3+被铁还原酶还原为Fe2+,Fe2+与铁载体的亲和力低,从而被释放。
除了分泌高亲和力的铁载体竞争Fe3+外,一些细菌还进化出直接利用转铁蛋白或乳铁蛋白中Fe3+的机制。
大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统。
细菌外膜上的血红素受体可以直接与血红素或血红蛋白结合,并将血红素或血红蛋白转运至周质,通过ABC转运蛋白转运至胞质降解或利用,整个过程由TonB系统提供能量。
金黄色葡萄球菌铁依赖性表面决定系统(Isd)可从血红蛋白中获取Fe2+。
除直接的血红素转运系统外,还存在间接的血红素转运系统。如革兰氏阴性菌中存在的Hemophore蛋白介导的血红素转运系统。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+。其中Feo转运系统最为重要,大约80%的革兰氏阴性菌都存在Feo转运系统。
调节铁稳态
铁储存蛋白通过以可溶且无毒的形式储存细胞内游离铁来降低其浓度。在铁缺乏时,例如当存在于哺乳动物宿主细胞内或血液中时,铁可以从这些细菌储存中释放出来。
例如,大肠杆菌可以通过FieF输出铁,而且已经描述了一种用于伤寒杆菌的柠檬酸铁外排转运体(IceT);这些铁外流系统的目的是防止细胞内高水平的游离铁造成的压力。此外,血红素输出机制(HrtAB或同源蛋白)已被证明可以缓解某些细菌中血红素的铁胁迫。
最后,双歧杆菌科能够将铁结合到其表面,从而减少周围环境中自由基的形成,并可能在结肠腔中起到铁螯合的作用,以防止病原菌吸收铁。
铁的形态、可用性和结肠腔中的铁之争

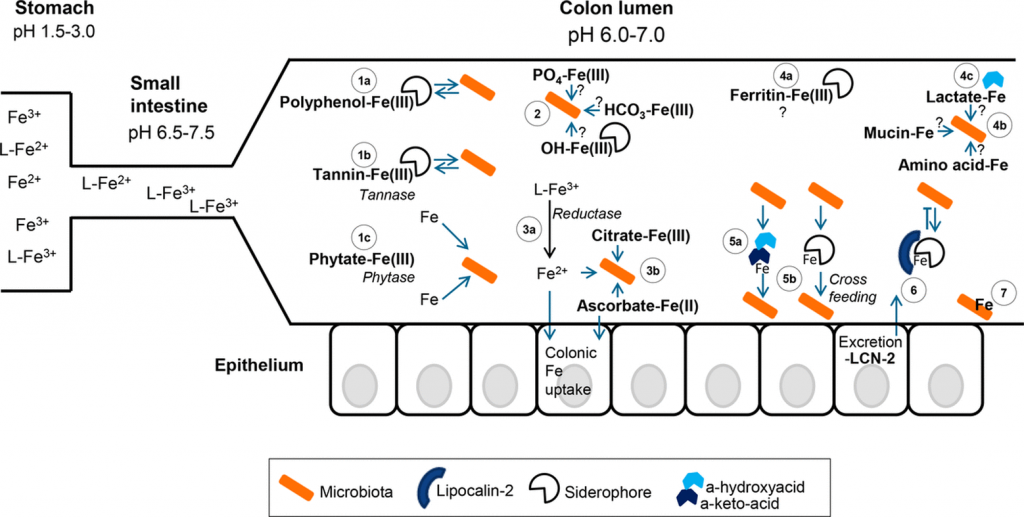
Kortman GA, et al., FEMS Microbiol Rev. 2014
胃肠道中的铁形态可能对肠道微生物群获取铁起着重要作用。
低pH值有利于铁和亚铁的溶解性,不一定需要配体(L)来溶解。
当小肠内的pH值升高时,主要是三价铁的溶解度降低,并与食物成分和宿主排泄物形成更多的络合物。
在结肠内,由于微生物群产生乳酸和短链脂肪酸等,pH值略有下降。图中结肠部分的微生物群以橙色表示(有益的)常驻物种和致病物种。
铁调素(Hepcidin)是一种由肝脏产生的肽激素,是全身铁稳态的主要调节剂。铁调素结合并降解铁转运蛋白,从而影响铁被巨噬细胞回收、被肠上皮细胞吸收以及被肝细胞储存的过程。
当体内缺铁时,铁调素浓度较低,从而有利于铁的吸收和从储存部位输送到血浆;
但当体内铁含量充足时,较高的铁调素浓度会降低铁的吸收,并损害铁的释放。
体内“铁稳态”

Anderson GJ, et al., Am J Clin Nutr. 2017
铁在饮食中以血红素和非血红素形式存在。非血红素铁通过DMT1穿过肠上皮细胞的根尖膜,通过FPN1穿过基底外侧膜后进入血液循环。铁与血浆TF结合,分布到全身组织。
菌群会通过代谢物信号传导途径调控系统铁稳态平衡。美国密西根大学研究人员在《Cell-Metabolism》上发表的研究证明了,细菌具有铁依赖性机制,可以抑制宿主铁的运输和储存。肠道菌群产生的代谢物能抑制肠道铁吸收主要转录因子低氧诱导因子 2α (HIF-2α),并增加铁存储蛋白铁蛋白 (Ferritin),从而抑制宿主的铁吸收。
两种菌群代谢物——1,3-二氨基丙烷 (DAP) 和 Reuterin,通过抑制异二聚化作用作为 HIF-2α 抑制剂,可以有效缓解全身铁超负荷。
与铁摄取相关的抗菌治疗
针对细菌生存繁殖对铁稳态的严重依赖,可将病原菌的铁获取系统作为抗菌治疗的靶点,开发针对病原菌铁稳态的化合物治疗细菌感染,同时可基于该系统研发疫苗。
大鼠和家兔服用抗生素后,铁的吸收也减少了。然而,小鼠研究发现,抗生素治疗后,铁的吸收增加了。这些发现表明,抗生素的使用可能改善铁缺乏症患者的铁吸收。
铁是饮食变化、微生物组改变和代谢功能障碍之间串扰的关键节点。
代谢综合征指的是一组异常,包括肥胖、血脂异常、胰岛素抵抗和2型糖尿病,这些疾病共同增加了心血管疾病的风险,包括心力衰竭(HF)和非酒精性脂肪性肝病。
通过血清中非转铁蛋白结合铁的存在、高铁蛋白血症、肝铁超载与胰岛素抵抗的相关性,明确了代谢综合征患者中轻度铁过量的患病率。
铁过量与胰岛素抵抗的结合通常被称为代谢异常铁过量综合征,15%-30%的代谢综合征患者会出现这种情况。因此,目前铁过量与代谢当量的关系已被充分认识,但导致代谢功能障碍的机制尚不完全清楚。
降低代谢疾病中铁的效果

在铁储量较高的MetS患者中,男性对心脏和肝脏疾病的易感性较高。
通过静脉切开或使用螯合剂等降低铁含量的干预措施,在某些情况下可以提高胰岛素敏感性,延缓2型糖尿病(T2DM)和心力衰竭的发病,但并不总是成功的。
在长期病态肥胖后,缺铁是一种常见现象,同样也可导致2型糖尿病和心力衰竭。因此,之前的研究表明铁和葡萄糖稳态或心肌病之间存在双向关系,表明最佳铁水平的平衡至关重要。
可能铁在代谢综合征发病机制及其并发症中的作用仍未得到充分重视,而微生物群的修饰是铁代谢影响的一种重要且相对未被探索的中介物。特别是,肠道内饮食中的铁水平改变了微生物群的组成。预计随后会影响微生物组的代谢组谱功能,包括短链脂肪酸和支链氨基酸。这种改变的后果将是宿主的外周胰岛素抵抗和代谢功能障碍。
炎症性肠病 (IBD) 的特征是胃肠道的慢性炎症。炎症与溃疡性结肠炎 (UC) 和克罗恩病 (CD) 中的肠道溃疡有关。IBD 也可能出现出血和吸收不良,三分之一的患者会出现缺铁性贫血。
一项IBD小鼠模型的研究发现,铁含量的改变显着影响 DSS 在小鼠中诱导的结肠炎的严重程度,铁含量的过多或过少都会加剧结肠炎的严重程度。
DSS治疗的高铁饮食小鼠的体重减轻程度不如低铁饮食小鼠,但粪便钙卫蛋白测定的肠道炎症更严重。这些喂食高铁饮食的小鼠经历了变形菌的增加,同时厚壁菌和拟杆菌的减少。
膳食铁水平与结肠炎症的 DSS 治疗和粪便钙卫蛋白水平之间似乎存在协同作用。
摄入两倍于标准水平铁(400 ppm)的饮食会导致微生物组的关键变化,这意味着观察到的这些变化不仅仅是由炎症的严重程度驱动的,还有管腔游离铁也会导致导致IBD中经常观察到的异源状态发展的复杂因素相互作用。
还需要更多了解的是,管腔铁如何影响IBD。此外,还需要研究管腔铁的增加对肠道微生物群的生理影响,以及这可能如何影响菌群多样性。未来也需要更多人体干预研究,进一步确定不同剂量的治疗性口服铁对人体肠道微生物群的复杂影响,尤其是代谢后果。
研究表明,缺铁和铁过量都与结直肠癌的发病机制有关,这表明必须谨慎平衡最佳铁摄入量。
在 965 名 50-75 岁的人群研究中,发现铁摄入量与结直肠息肉之间存在 U 型关系,铁摄入量高(>27.3 毫克/天)或低量(<11.6 毫克/天)的人更容易患上结直肠息肉,这是结直肠癌的前兆病变。
缺铁
由于铁在维持免疫功能中至关重要,铁的可用性不足可能会通过削弱对肿瘤变化的免疫监测,并潜在地改变肿瘤免疫微环境而增强致癌性。来自临床研究的数据表明,在结直肠癌患者中,缺铁与较差的预后和较低的治疗反应相关。
铁过量
大多数强有力的研究证实,膳食铁和铁储存过量都会增加结直肠癌的风险。
五项前瞻性人类队列研究,包括566607名个体和4734例结肠癌患者的数据,表明高血红素铁摄入量与结肠癌风险增加有关(虽然有一个队列没有发现任何关联)。
在防御方面,长双歧杆菌和嗜酸乳杆菌是肠道保护性共生菌。它们形成了一道保护屏障,防止病原菌定植,并产生丁酸盐,作为一种抗癌剂。双歧杆菌科可通过将铁结合到其表面来影响自由基的形成,并促进结肠上皮的日常更新,而乳酸杆菌菌株可降低胆汁酸的诱变效应。
大多数致病菌都具有增强的铁获取机制,因此往往比保护性细菌更容易获得游离铁。也就是说,铁可以促进致病菌和肠道共生菌之间比例的变化,增加肠道中的特定代谢物和炎症。
研究显示,拟杆菌/普氏杆菌、梭状芽孢杆菌、牛链球菌和粪肠球菌可产生遗传毒性代谢物,如硫化氢和次生胆盐,这可能会促进炎症和致癌。
基于抗生素的肠道致病菌清除降低了结肠癌的发病率,并改变了小鼠的肠道微生物群。这些发现得到了人体研究的支持。
可见,针对肠道微生物群的饮食干预有望治疗结直肠癌,但这些方法仍需要进一步研究。
过量的铁对身体会带来不良影响,因此如果体内铁过量则需要采取相应措施。
多酚-铁:结合牢固,防止铁被吸收
饮食中通常含有单宁和儿茶酚等多酚,它们大量存在于茶和咖啡中。这些化合物可以非常牢固地结合铁,从而防止宿主吸收铁,但也防止细菌吸收铁。
然而,在铁缺乏的环境中,致病菌可以产生和/或占用含铁细胞可能受益于铁多酚提取机制,很可能通过清除铁绑定到多酚。
目前尚不清楚这种机制是否在肠腔中发挥重要作用,但可能与此有关,因为肠环境中可能同时存在多酚和铁载体。
此外,某些细菌,如甘蓝链球菌或卢格敦葡萄球菌,可以降解多酚鞣酸盐,并通过这种方式暂时将铁从这种有效的铁粘合剂中释放出来。
可以通过在用餐后一小时内饮用以下饮料来减少铁的吸收:


植酸盐-铁:结合物通过菌群降解,释放铁
另一种具有强铁结合活性的化合物是植酸盐,在食用谷物和豆类为主的饮食后,其肠道可利用性很高。
与单宁酸类似,某些肠道微生物(如大肠菌和双歧杆菌科)可以降解植酸盐,这可能是一种特殊的释放铁的方式,铁可能被降解生物体或其他细菌物种利用。因此,与植酸盐结合的铁可能是结肠肠道微生物群的相关铁源。
然而,应该注意的是,铁与植酸盐的复合物到达结肠时大多是不溶性的,因此不易被降解。然而,之前在常规大鼠的结肠中发现了只能通过微生物作用产生的植酸盐降解产物,但在无菌大鼠中却没有发现。这些发现表明微生物降解的植酸发生在结肠。
在每餐 2-10mg 植酸盐的极低浓度下,植酸盐会降低铁的吸收。
大豆蛋白(存在于豆腐、组织化植物蛋白和一些加工肉制品中)可以减少铁的吸收,因为它含有植酸盐。
钙
钙对骨骼很重要,但它也可能抑制铁的吸收。为了更好地吸收铁,避免在吃富含铁的食物的同时服用钙补充剂。
牛奶和鸡蛋中的蛋白质
虽然动物肉中的蛋白质会增加铁的吸收,但牛奶和鸡蛋中的蛋白质(卵清蛋白除外)在与低铁食物一起食用时会减少铁的吸收。
锌
过量摄入锌(由于过度使用锌补充剂)也会损害铁的吸收。
考虑到缺铁对人体健康影响重大,因此实施适当的策略来解决这一问题至关重要。
最常见的策略是食物中的铁补充、益生菌、益生元、铁药物补充剂等方法。
富含铁的食物
前面我们知道,膳食铁有两种形式:血红素和非血红素。血红素铁具有较高的生物利用度,膳食因素对其吸收的影响最小,而非血红素铁的吸收要低得多,并受到其他食物类型的强烈影响。
大多数对年轻女性的研究发现铁状态(铁蛋白和铁)与肉类和其他血红素铁的消耗量之间存在正相关关系。
增加富含铁的食物的摄入量,以补充铁储备,确保饮食健康均衡。
其中常见的富含铁元素的食物包括:
红肉、家禽(包括肝脏类)、鱼、豆类、扁豆、豆腐、豆豉、坚果、种子等
非血红素形式的铁含量高的植物性食物(但也可能含有高含量的阻止铁吸收的物质)包括:
● 豆类,包括鹰嘴豆、豆类、豌豆和小扁豆
● 种子,包括芝麻和南瓜子
● 绿叶蔬菜,包括西兰花和羽衣甘蓝
以上是富含铁元素的食物,同时其他富含维生素的食物也能辅助铁的吸收,例如,维生素A,维生素C.
维生素C:促进铁的吸收
如果膳食中含有大量维生素C,那么蔬菜膳食的吸收量可能会增加六倍。维生素C和柠檬酸以剂量依赖的方式促进铁的吸收,部分是通过充当弱螯合剂来帮助溶解小肠中的铁。
一项研究发现,维生素 C 的摄入量与女性的铁含量呈正相关。
在存在抑制铁吸收的物质(包括植酸盐、多酚、钙和蛋白质)的情况下,维生素 C 还有助于铁的吸收。
如果同时服用,维生素 C可将植物性食物中的非血红素铁的吸收提高 2 至 3 倍。因此,为了提高铁的摄入量,可以将富含铁的植物性食物与富含维生素 C 的食物结合起来。
水果或蔬菜中都会包含维生素 C,包括:
● 柑橘类水果
● 奇异果
● 草莓
● 番茄
● 辣椒
● 西兰花
● 卷心菜
● 菠菜


维生素A:克服植酸盐的影响促进铁的吸收
维生素 A直接影响铁转运和红细胞生成。
全谷物和豆类中的植酸盐会降低铁的吸收,但如果加入富含维生素A和β-胡萝卜素的食物可以增加铁的吸收,并可以克服植酸盐的影响。
维生素A(视黄醇)有助于治疗缺铁性贫血,并能改善儿童和孕妇的铁状况。
常见的富含维生素A和β-胡萝卜素的食物:
● 胡萝卜
● 红薯
● 鱼
● 哈密瓜
● 甜椒
● 南瓜
● 葡萄柚
益生菌
大多数益生菌产生乳酸,这可能会降低 pH 值,从而增加铁的溶解度,帮助其吸收。
例如,植物乳杆菌 299v 有助于预防缺铁性贫血。这种益生菌可以改善活跃的高加索欧洲人的膳食非血红素铁吸收。
发酵乳杆菌是人类微生物群中的一种主要益生菌,具有显著的铁还原活性。对羟基苯乳酸是该菌株产生的代谢物,通过DMT1转运体将Fe3+还原为Fe2+来增加肠细胞对铁的吸收。
与益生菌菌株给药相关的铁吸收

Rusu IG,et al., Nutrients. 2020
益生元
益生元是功能性食品成分,可刺激肠道中有益细菌的生长和定植,最终改善身体健康。肠道微生物群定植在肠道生理学中起着重要作用。
几项研究将益生元和/或合生元的摄入与铁可用性的增加联系起来,主要是通过将 Fe 3+转化为 Fe 2+(由于它们的铁还原活性),并促进肠细胞对铁的吸收。
例如,在肯尼亚儿童中进行的一项补铁试验报告称,在服用益生元期间铁吸收更高半乳糖寡糖 (GOS)底物。
不同类型铁缺乏症的益生元和合生元摄入量及其对机体铁水平的影响
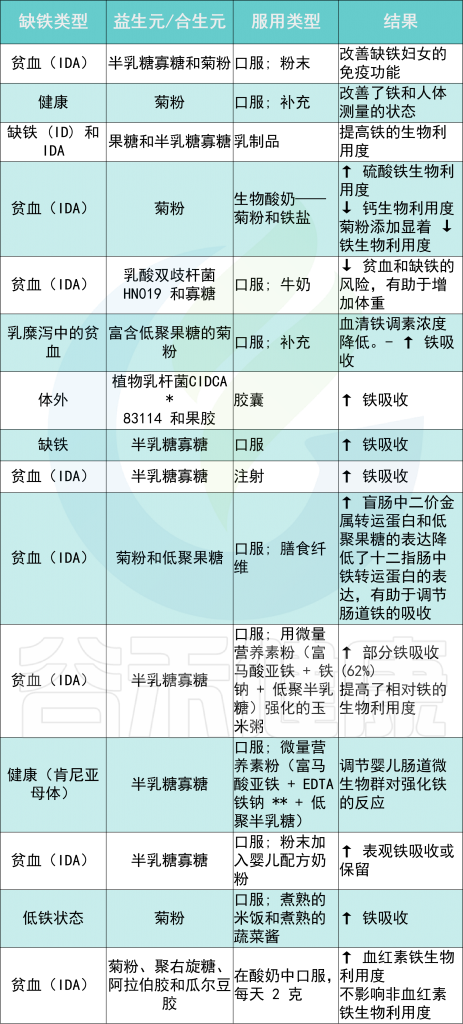

Rusu IG,et al., Nutrients. 2020
* CIDCA——食品冷冻技术研发中心
** EDTA——乙二胺四乙酸
补充剂
不同形式的铁补充剂补充铁以亚铁(+2)和铁(+3)的形式存在。由于铁形态必须在体内转化为亚铁形态以供吸收,因此亚铁形态更具生物利用度。
常用的口服亚铁补充剂包括:
● 柠檬酸亚铁
● 硫酸亚铁
● 葡萄糖酸亚铁
● 铁琥珀酸亚铁
● 氨基酸螯合物(如双甘氨酸铁、天冬氨酸铁)
● 血红素铁
虽然最常研究的铁补充剂是硫酸亚铁,但食品强化和补充剂研究表明,氨基酸螯合形式的铁(如甘氨酸)更好或同样好地被吸收。
例如,在一项针对孕妇的研究中,25mg甘氨酸亚铁能够将铁水平提高到与50mg硫酸亚铁相同的水平。
较新配方的铁补充剂可能比亚铁盐更容易耐受,胃肠道副作用更少,如:
然而,在提高产品螯合率、安全性,降低产品成本等方面有待进一步研究。
铁注射需要医疗监督。当口服铁补充剂不能耐受时,可以注射,这通常适用于患有腹腔疾病和炎症性肠病的患者。在手术或输血后血红蛋白必须迅速增加的情况下,也建议使用。注射铁剂比口服疗法更昂贵,而且不能在怀孕的前三个月用。
建议注射羧麦芽糖铁和异麦芽糖铁,因为它们能够以更大剂量给药,且安全性好。


另外,特殊人群对铁的需求量不同:
健身人群补铁
运动会加快铁在机体中的代谢,长期的运动使组织内储存铁的含量明显下降,是红细胞的更新速度加快,运动还导致机体对铁的吸收率降低,这些都增加了健身人群对铁的需要量。
我国对健身人群每日膳食的推荐的摄入量为:男性20毫克/天,女性25毫克/天。
妊娠期补铁
孕妇对铁的需求量比一般人群更高,每天 27 毫克。
妊娠期间,受母体铁状态调节的铁调素血清浓度极低。由于铁调素是肠道铁吸收的负调节剂,低水平表明对铁的需求高。
妊娠早期和中期缺铁与孕产妇发病率增加和不良妊娠结局风险增加有关,包括低出生体重、早产或宫内生长受限。
大多数产前维生素都含有足够的铁来弥补这种增加,但由于对血液产生的需求增加,缺铁性贫血在怀孕期间很常见。因此需要合理补铁。
具体补铁方式可参考上面列出的形式。
铁对于维持宿主肠道菌群稳态和肠道微生物的生长定植有重要作用。一些菌群,尤其是致病菌的生存,必须依靠铁的存在,因此形成了多种摄取铁的机制,并且参与调节宿主的肠道铁吸收。同时,铁与宿主的肠道微生物和微生物代谢产物共同作用,可对肠道乃至整体健康产生影响。
在补铁的同时,需要防止补铁带来的代谢紊乱和炎症损伤,也就是说铁的补充要在允许的条件下适度补充。那么怎么知道是否在合理范围内?目前对铁的监测以血液检测较常见,但血液检测波动较大。
此外,既已发现了铁与肠道菌群相关性,肠道菌群检测也是一个可行方向。谷禾肠道菌群健康检测报告中包含铁的水平,这是基于菌群代谢计算得到的,与血液检测有所不同,肠道菌群检测反映的是一段时间(2周左右)的长期状态。
未来需要更多的研究来证明铁、宿主与肠道菌群的相互作用机制,以及其与肠道炎症疾病等多种慢性疾病发生发展之间的因果关系,为铁补充的个性化策略提供更多支持。
各类人群的铁需求量


►►►
铁补充的副作用及相关禁忌
► 可能出现的副作用
► 禁忌症
铁补充剂不应用于以下人群:
声明:本账号发表的内容用于信息的分享,仅供学习参考使用。在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018;11(4):98. Published 2018 Oct 5. doi:10.3390/ph11040098
Botta A, Barra NG, Lam NH, et al. Iron Reshapes the Gut Microbiome and Host Metabolism. J Lipid Atheroscler. 2021;10(2):160-183. doi:10.12997/jla.2021.10.2.160
Finlaysontrick E C , Fischer J A , Goldfarb D M , et al. The Effects of Iron Supplementation and Fortification on the Gut Microbiota: A Review[J]. Gastrointestinal Disorders, 2020, 2(4):327-340.
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018 Oct 5;11(4):98. doi: 10.3390/ph11040098. PMID: 30301142; PMCID: PMC6315993.
Kortman GA, Raffatellu M, Swinkels DW, Tjalsma H. Nutritional iron turned inside out: intestinal stress from a gut microbial perspective. FEMS Microbiol Rev. 2014 Nov;38(6):1202-34. doi: 10.1111/1574-6976.12086. Epub 2014 Sep 29. PMID: 25205464.
Georgieff MK. Iron deficiency in pregnancy. Am J Obstet Gynecol. 2020;223(4):516-524. doi:10.1016/j.ajog.2020.03.006
Rusu IG, Suharoschi R, Vodnar DC, et al. Iron Supplementation Influence on the Gut Microbiota and Probiotic Intake Effect in Iron Deficiency-A Literature-Based Review. Nutrients. 2020;12(7):1993. Published 2020 Jul 4. doi:10.3390/nu12071993
Anderson GJ, Frazer DM. Current understanding of iron homeostasis. Am J Clin Nutr. 2017 Dec;106(Suppl 6):1559S-1566S. doi: 10.3945/ajcn.117.155804. Epub 2017 Oct 25. PMID: 29070551; PMCID: PMC5701707.
LIU Fang-Tong, FAN Hao-Nan, SHEN Li-Xin, LI Bo. Iron acquisition by bacterial and adaptive immune responses[J]. Microbiology China, 2019, 46(12): 3432-3439.
Tolkien Z, Stecher L, Mander AP, Pereira DI, Powell JJ. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PLoS One. 2015;10(2):e0117383. Published 2015 Feb 20. doi:10.1371/journal.pone.0117383
GUAN Lingjuan,CAO Congcong,TU Piaohan,et al. Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J]. Food and Fermentation Industries,2020,46(19):264 -270
高鹤, 杨浕滢, 应晓玲,等. 铁,宿主和肠道菌群相互作用的研究进展[J]. 现代预防医学, 2020, 47(20):4.

谷禾健康
人的身体拥有数千种细菌,这些细菌在维持健康方面发挥着重要作用。当这些细菌失控繁殖并侵入身体的其他部位或将有害细菌引入身体的系统时,可能会发生细菌感染。
细菌感染的严重程度取决于所涉及的细菌类型和所感染的部位等。细菌最常感染肠道、皮肤和呼吸系统,包括肺、泌尿道和阴道。
目前应对细菌感染的主要治疗方法还是使用抗生素,但是抗生素管理,或改进抗生素的处方和使用方式,对于优化感染患者的治疗、保护患者免受伤害和对抗抗生素耐药性至关重要。
今天我们重点了解下什么是细菌感染,感染的症状、原因和类型,包括诊断测试和治疗方案,抗生素什么时候使用,什么时候不用,抗生素的耐药性如何产生以及使用抗生素的注意事项等。
了解什么是细菌感染以及如何治疗细菌感染,我们应该先了解细菌的概念。
来源:MedicineNet
地球上所有的生物都是由两种基本类型的细胞中的一种组成:
真核细胞,其遗传物质被包裹在核膜内;
原核细胞,其遗传物质与细胞的其他部分不分离。
传统上,所有的原核细胞都被称为细菌,被归为原核生物界。
1970年代后期,美国微生物学家卡尔·沃斯(Carl Woese)率先在分类上进行了重大变革,将所有生物分为真核生物、细菌(原名真细菌)和古细菌(原名古细菌)三个领域,以反映三条古老的进化路线。原核生物以前被称为细菌,然后被分为两个领域,细菌和古细菌。

published by Woese et al.
细菌和古细菌在表面上是相似的,例如,它们没有细胞内的细胞器,它们有环状DNA。但是,它们在本质上是截然不同的,它们的分离是基于其古老而又独立的进化谱系的遗传证据,以及其化学和生理学的根本差异。这两个原核域的成员彼此之间的区别与它们和真核细胞中的区别一样。
细菌细胞在几个方面不同于动物细胞和植物细胞。一个根本的区别是细菌细胞缺乏动物细胞和植物细胞中都存在的细胞内细胞器,例如线粒体,叶绿体和细胞核。细菌体积小,设计简单,代谢能力强,使它们能够迅速生长和分裂,并在几乎任何环境中生存和繁衍。
细菌,动物和植物细胞的比较

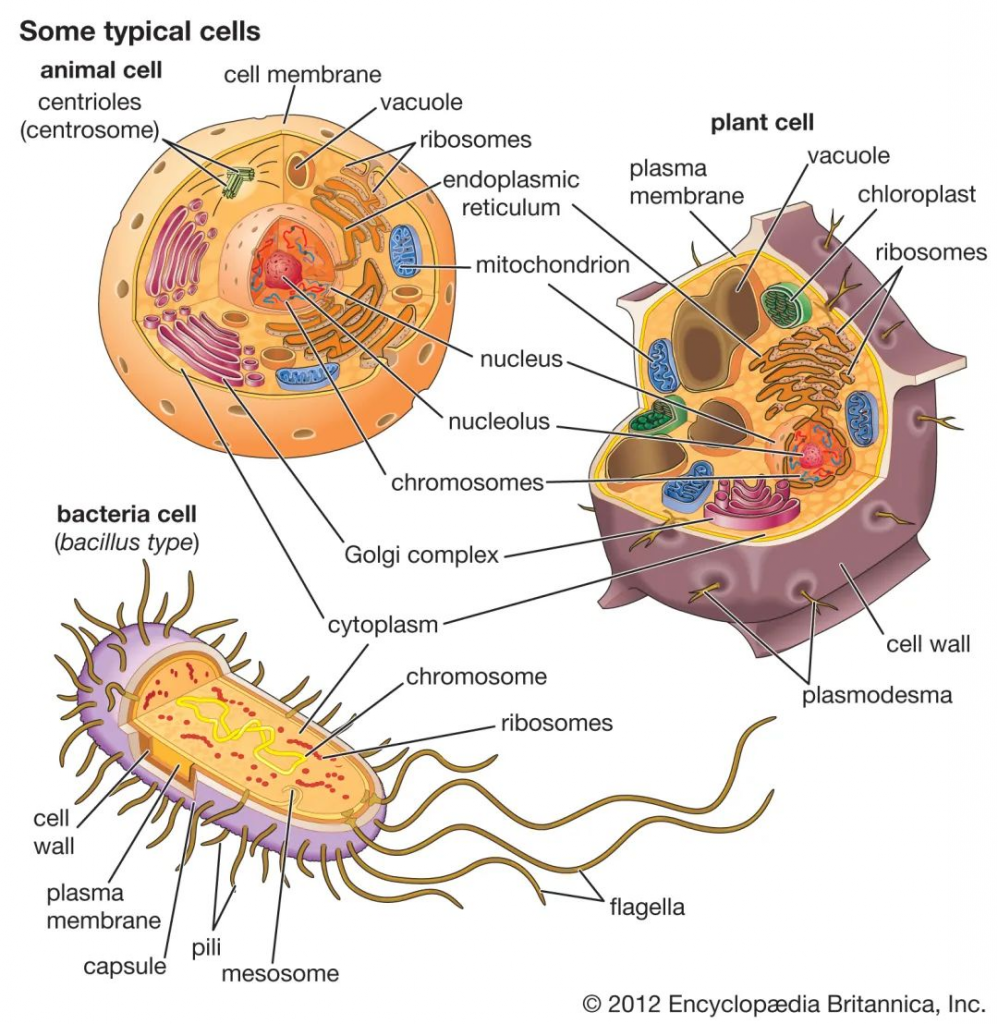
除此之外,原核和真核细胞在许多其他方面有所不同,包括脂质组成,关键代谢酶的结构,对抗生素和毒素的反应以及遗传信息的表达机制。
真核生物包含多个线性染色体,这些染色体的基因比编码蛋白质合成所需的基因大得多。遗传信息的核糖核酸(RNA)副本(脱氧核糖核酸或DNA)的大部分被丢弃,剩余的信使RNA(mRNA)在被翻译成蛋白质之前已被充分修饰。相反,细菌具有一个包含所有遗传信息的环形染色体,它们的mRNA是其基因的精确副本,不会被修饰。
细菌细胞在结构上比真核细胞小得多,也简单得多,但细菌是一个在大小、形状、生境和代谢上都有差异的极其多样化的有机体群体。
许多关于细菌的知识来自对致病细菌的研究,这些细菌比许多自由生活的细菌更容易在纯培养中分离出来,也更容易被研究。必须注意的是,许多自由生活的细菌与适应作为动物寄生虫或共生体生活的细菌有很大的不同。因此,关于细菌的组成或结构没有绝对的规则,任何说法都会有许多例外。
大多数细菌对地球上的生命都是有益的,甚至是生命所必需的,但少数细菌却对人类有害。目前,没有一种古细菌被认为是病原体,但是包括人类在内的动物不断遭到大量细菌的“轰击和居住”。
口腔,肠道和皮肤被大量特定类型的细菌定殖,这些细菌适应这些栖息地的生活。这些微生物在正常情况下是无害的,并且仅在它们以某种方式穿过身体的屏障并引起感染时才变得危险。
一些细菌擅长入侵宿主,被称为病原体或疾病产生者。一些病原体作用于人体的特定部位,例如:
在食物中传播的许多致病菌的毒素在摄入时会引起食物中毒。
由金黄色葡萄球菌(Staphylococcus aureus)产生的毒素,能引起迅速、严重但有限的胃肠道不适。
肉毒梭菌(Clostridium botulinum)的毒素,通常是致命的。在密封前未完全煮熟的罐装非酸性食品中可能产生肉毒杆菌毒素。肉毒梭菌形成耐热孢子,可以发芽为营养细菌细胞,在厌氧环境中茁壮成长,这有利于产生其极强的毒素。
其他食源性感染实际上是由受感染的食物处理者传播的,包括伤寒、沙门氏菌病(沙门氏菌属)和志贺氏菌病(痢疾志贺氏菌属)。
关于食物中毒相关细菌详见:正值夏季,警惕食源性疾病,常见的食物中毒的病原菌介绍
细菌感染是指病原菌侵入宿主组织。当有害细菌进入人体或伤口并繁殖,导致疾病、器官损伤、组织损伤或疾病时,就会发生细菌感染。细菌可以感染身体的任何部位。
细菌感染很常见,但它们并不完全相同。细菌有很多种,每种对身体都有不同的影响。广义上来讲,细菌感染也可以是由任何细菌引起的任何内部或外部疾病的广义术语。
细菌存在于与人体的各种关系中。它们在体表内定殖并提供益处,正常情况下细菌可以与人类身体共存不会产生有害的影响(在共生关系中)。但是有时候,通常无害地存在于我们体内或皮肤上,而不会造成任何异常问题的细菌会失控并导致感染。这种情况通常发生在我们的免疫系统不够强大,无法保持它们的平衡,或者我们的微生物区系的组成发生了一些变化,对某些细菌生存繁殖更有利。
细菌感染是由体内的坏细菌引起的。一些细菌感染可能危及生命。标准的医学治疗通常涉及一剂抗生素。细菌感染很容易与病毒感染混淆。但是他们并不一样,后面我们会单独解释。
当皮肤粘膜有破损或发生化脓性炎症时,细菌则容易侵入体内。
人体的免疫反应可分为非特异性免疫反应及特异性免疫反应两种,后者又可分为细胞免疫与体液免疫两方面。当机体免疫功能下降时,不能充分发挥其吞噬杀灭细菌的作用时,即使入侵的细菌量较少,致病力不强也能引起感染;条件致病菌所引起的医源性感染也逐渐增多。
人体免疫功能正常时,进入血中的细菌迅速被血中防御细胞如单核细胞、嗜中性粒细胞等所清除,而患肝硬变、糖尿病、血液病、结缔组织病等慢性病者,可因代谢紊乱、体液免疫及细胞免疫功能减低,易招致败血症发生;各种免疫抑制药物的使用、放射治疗亦是导致败血症发病率高的原因。广谱抗菌药物使用后,对药物敏感的细菌虽被抑制或杀灭,而一些耐药菌乘机繁殖,亦可酿成败血症。
细菌侵入人体后是否引起感染,除了与人的防御、免疫功能,还与细菌的毒力及数量有关。毒力强或数量多的致病菌进入机体,引起感染的可能性较大。
严重烧伤时,创面为细菌敞开门户,皮肤坏死、血浆渗出又为细菌繁殖提供了良好环境,故极易发生感染。
尿路、胆道、胃肠道、呼吸道粘膜受破坏后,若同时有内容物积滞、压力增高,细菌更易进入血中,保留导尿管、静脉等血管内留置导管、人工辅助呼吸时插管等,也使细菌易于侵入。
细菌是微观的,通常是单细胞生物,到处都可以找到(例如,在我们体内、皮肤上、空气中、水里、土壤中或我们吃的食物里)。细菌具有传染性,因此,它可以通过与患者的密切接触在人与人之间传播。接触受污染的表面、食物、水以及打喷嚏和咳嗽就是例子。
发生感染的几个条件:
此外,细菌还可以导致急性感染(快递治疗)和慢性感染(持续很长时间甚至终生),以及潜伏感染(最初可能没有任何明显迹象或症状但可以过段时间自然发展)。症状可以从轻度、中度到重度不等。在严重的情况下,导致数百万人死亡;例如,许多人死于黑死病或鼠疫。
细菌感染的常见特征:
常见的各部位细菌感染的症状

细菌性感冒
细菌性感冒(Bacterial cold)是指继发细菌感染引起的感冒。感冒在习惯上分为病毒性感冒和细菌性感冒。
病毒性感冒有:普通感冒、流行性感冒和病毒性咽炎等。其主要不同是致病因素不同,病毒性感冒是由于病毒所致,而细菌性感冒是由于细菌所致。
注:流行性感冒(流感通过病毒传播,不是细菌性感冒,注意区分),是由流感病毒引起的急性呼吸道传染病。
细菌的感染还取决于受感染细菌的类型,常见的细菌感染例如:
细菌感染具有高度传染性,因此需要特别注意避免通过洗手、打喷嚏和咳嗽时遮盖以及不共用杯子和饮料瓶来传播感染。
细菌有多种传播方式,包括:

当你忍不住咳嗽或打喷嚏时,用纸巾捂住口鼻或用手肘内侧。
在下述情况下需要洗手,至少洗20秒:
如果没有肥皂和水,可以使用酒精含量至少为 60% 的酒精类洗手液。
除此之外,其他需要注意的:
接种疫苗。如轮状病毒是一种导致婴儿和幼儿严重肠胃炎的病毒。所有婴儿都应在 6 周和 4 个月大时接种轮状病毒疫苗。
流感疫苗。当患上流感时,免疫系统会被削弱。这使细菌有机会侵入肺部并引起感染。每年注射一次流感疫苗可以防止感染肺部细菌。
肺炎球菌多糖疫苗。美国疾病控制与预防中心 (CDC) 推荐 65 岁及以上的人接种肺炎球菌多糖疫苗 (PPSV)。它也适用于免疫系统较弱或患肺炎风险较高的成年人。
治疗取决于感染的严重程度、患者的年龄、免疫系统有多强、是否存在任何并存症状以及现有的医疗条件。
治疗可能包括:
扩展阅读:
细菌素——对抗感染、保存食品、重塑肠道菌群
还在滥用抗生素?15种天然抗生素助你调节肠道菌群
这里我们主要来了解一下,用于细菌感染的药物——抗生素。
目前抗生素是对抗细菌感染的常用药物。它们通过破坏细菌细胞生长和增殖所需的过程来发挥作用。
抗生素根据抗菌谱可以分为:
广谱抗生素,中谱抗生素和窄谱抗生素。
✓ 广谱抗生素
广谱抗生素可对抗多种细菌。广谱抗生素可治疗革兰氏阳性菌和阴性菌,因此如果医生不确定有哪些细菌,他或她可能会开出其中一种抗生素。
阿莫西林、奥格门汀、头孢菌素(第 4 代和第 5 代)、四环素氨基糖苷类和氟喹诺酮类(环丙沙星)是广谱抗生素的例子。
✓ 中谱抗生素
中谱抗生素针对一组细菌。青霉素和杆菌肽是流行的中谱抗生素。
✓ 窄谱抗生素
窄谱抗生素用于治疗一种特定的细菌。多粘菌素属于这一小类抗生素。当确定患有哪种细菌感染时,治疗会更容易和更有效。
抗菌活性通常分为五种机制:
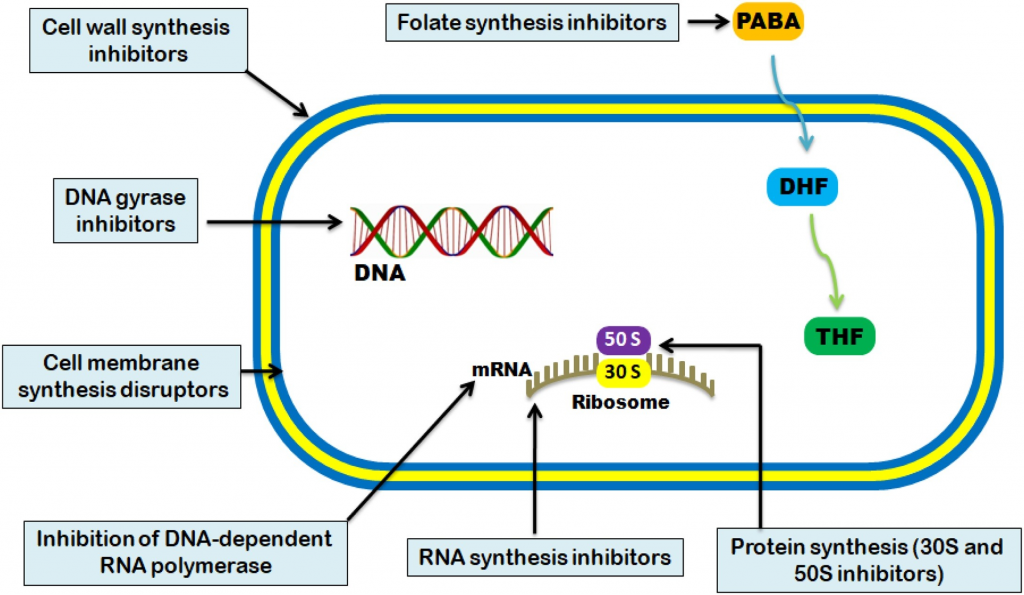

Uddin TM, et al., J Infect Public Health. 2021
不同种类抗生素作用的方式


Uddin TM, et al., J Infect Public Health. 2021
青霉素
最初的青霉素仅用于革兰阳性菌感染的治疗,由于金黄色葡萄球菌很快产生一种青霉素酶对青霉素产生了耐药,人们研制出了以甲氧西林、苯唑西林为代表的耐酶青霉素,用于产青霉素酶的葡萄球菌( 甲氧西林耐药者除外) 感染。
之后,以氨苄西林、阿莫西林为代表的广谱青霉素由仅对革兰阳性(G+) 菌有效扩展到对革兰阴性(G-) 菌( 主要为肠杆菌科细菌) 也具有抗菌活性。在广谱青霉素的基础上又发展为对铜绿假单胞菌等非发酵菌也具抗菌活性者,当前应用主要为脲基类青霉素,包括: 哌拉西林、阿洛西林、美洛西林。
代表药物: 阿莫西林(amoxicillin)
阿莫西林是一种抗细菌的青霉素抗生素。
阿莫西林用于治疗由细菌引起的多种不同类型的感染,例如扁桃体炎、支气管炎、肺炎以及耳、鼻、喉、皮肤或泌尿道感染。
阿莫西林有时还与另一种称为克拉霉素( Biaxin ) 的抗生素一起用于治疗由幽门螺杆菌感染引起的胃溃疡。这种组合有时与一种称为兰索拉唑(Prevacid)的胃酸减少剂一起使用。
四环素
四环素是一类抗生素,可用于治疗由易感微生物引起的感染,例如革兰氏阳性菌和革兰氏阴性菌、衣原体、支原体、原生动物或立克次体。
它们是在 1940 年代发现的,第一个四环素是从链霉菌中获得或衍生的。
四环素抑制微生物 RNA 中的蛋白质合成(一种重要的分子,作为 DNA 的信使)。它们主要是抑菌剂,这意味着它们可以防止细菌繁殖,但不一定会杀死它们。
四环素类药物现今应用的品种除四环素外,更常用有多西环素( 强力霉素) 和米诺环素( 二甲胺四环素) 。由于常见病原菌对本类药物耐药性普遍升高及其不良反应多见,当前本类药物临床应用已受到很大限制。
代表药物:强力霉素(doxycycline)
强力霉素是一种四环素抗生素,可以对抗体内的细菌。
强力霉素用于治疗许多不同的细菌感染,例如痤疮、尿路感染、肠道感染、呼吸道感染、眼部感染、淋病、衣原体、梅毒、牙周炎(牙龈疾病)等。
强力霉素也用于治疗由红斑痤疮引起的瑕疵、肿块和痤疮样病变。
某些形式的强力霉素用于预防疟疾、治疗炭疽或治疗由螨虫、蜱虫或虱子引起的感染。
什么是林可霉素衍生物?
林可霉素衍生物是一小类抗生素,可抑制细菌蛋白质的合成,而细菌蛋白质对细菌的生存至关重要。林可霉素衍生物保留用于治疗由肺炎球菌、葡萄球菌和链球菌的敏感菌株引起的感染。一种衍生物也可用于治疗恶性疟原虫(疟疾)。
林可霉素类包括林可霉素及克林霉素。克林霉素的体外抗菌活性优于林可霉素,主要可应用于敏感肺炎链球菌、其他链球菌属( 肠球菌属除外) 及甲氧西林敏感金葡菌所致的各种感染。该类药物对厌氧菌有良好的抗菌活性常与其他抗菌药物联合用于腹腔感染及盆腔感染,也由于其骨组织浓度较高适用于骨和关节的G + 菌感染。使用本类药物时,应注意假膜性肠炎的发生,如有可疑应及时停药。本类药物有神经肌肉阻滞作用,应避免与其他神经肌肉阻滞剂合用,应注意静脉滴注速度宜缓慢滴注,不可静脉推注。
代表药物:克林霉素(Clindamycin)
克林霉素是一种抗生素,可以对抗体内的细菌。
克林霉素用于治疗由细菌引起的严重感染。
服用此药前 如果对克林霉素或林可霉素过敏,则不应使用该药。
为确保克林霉素的安全,请告诉医生是否曾经有过:结肠炎、克罗恩病或其他肠道疾病; 湿疹或皮肤过敏反应; 肝病; 哮喘或对阿司匹林的严重过敏反应; 对黄色食用色素过敏。
什么是喹诺酮类药物?
喹诺酮类是一种抗生素。抗生素杀死或抑制细菌的生长。
有五种不同的喹诺酮类。此外,另一类抗生素,称为氟喹诺酮类,是从喹诺酮类通过氟修饰其结构衍生而来的。氟喹诺酮类抗生素可导致严重或致残的副作用,这些副作用可能不可逆。
喹诺酮类药物和氟喹诺酮类药物有许多共同点,但也有一些区别,例如它们对哪些生物有效。有些人互换使用喹诺酮和氟喹诺酮这两个词。
喹诺酮类和氟喹诺酮类对细菌产生的两种酶(拓扑异构酶 IV 和 DNA 促旋酶)的功能产生不利影响,因此它们不能再修复 DNA 或帮助其制造。
现今临床主要应用为氟喹诺酮类,常用有诺氟沙星、环丙沙星等主要用于单纯性下尿路感染或肠道感染。但应注意,现今国内尿路感染的主要病原菌大肠埃希菌中,耐药株已达半数以上。环丙沙星尚与β-内酰胺类抗生素联合用于治疗中、重度革兰阴性杆菌感染包括铜绿假单胞菌的感染。
近年来研制的新品种左氧氟沙星、莫西沙星等对肺炎链球菌、化脓性链球菌等G + 球菌的抗菌作用增强,对衣原体属、支原体属、军团菌等细胞内病原或厌氧菌的作用亦有增强,但对G-菌活性增强不明显,对铜绿假单胞菌的抗菌活性仍以环丙沙星为最强。左氧氟沙星、莫西沙星除可用于尿路感染或肠道感染外也可用于呼吸道感染,特别适合于肺炎链球菌( 包括耐青霉素肺炎链球菌) 、支原体、衣原体、军团菌等所致社区获得性肺炎的治疗,此外亦可用于皮肤软组织感染。
在治疗腹腔、胆道感染及盆腔感染时除莫西沙星外需与甲硝唑等抗厌氧菌药物合用。部分品种可与其他药物联合应用作为治疗耐药结核分枝杆菌和其他分枝杆菌感染的二线用药。
代表药物:环丙沙星(Ciprofloxacin)和左氧氟沙星(Levofloxacin)
环丙沙星和左氧氟沙星是一种氟喹诺酮抗生素,用于治疗不同类型的细菌感染。也用于治疗接触过炭疽或某些类型鼠疫的人。环丙沙星和左氧氟沙星应仅用于无法用更安全的抗生素治疗的感染。
左氧氟沙星、莫西沙星:对肺炎链球菌、A 组溶血性链球菌等革兰阳性球菌、衣原体属、支原体属、军团菌等细胞内病原或厌氧菌的作用强。
环丙沙星、左氧氟沙星:主要适用于肺炎克雷伯菌、肠杆菌属、假单胞菌属等革兰阴性杆菌所致的下呼吸道感染。
头孢霉素
头孢菌素是一大类从霉菌顶孢菌(以前称为头孢菌素)中提取的抗生素。头孢菌素具有杀菌作用(杀死细菌),其作用方式与青霉素相似。它们结合并阻断负责制造肽聚糖的酶的活性,肽聚糖是细菌细胞壁的重要组成部分。它们被称为广谱抗生素,因为它们对多种细菌有效。
自 1945 年发现第一个头孢菌素以来,科学家们一直在改进头孢菌素的结构,以使其对更广泛的细菌更有效。每次结构发生变化,都会产生新的“一代”头孢菌素。迄今为止,头孢菌素已有五代。所有头孢菌素均以 cef、ceph 或 kef 开头。请注意,该分类系统在不同国家/地区的使用并不一致。
第一代头孢菌素是指发现的第一组头孢菌素。它们的最佳活性是对抗革兰氏阳性细菌,如葡萄球菌和链球菌。它们对革兰氏阴性菌几乎没有活性。
第二代头孢菌素尚可应用于由流感嗜血杆菌、大肠埃希菌、奇异变形杆菌等中的敏感株所致的尿路感染、皮肤软组织感染、败血症、骨及关节感染和腹腔、盆腔等感染。但如用于腹腔感染和盆腔感染时需与抗厌氧菌药合用。头孢呋辛尚可用于脑膜炎球菌、流感嗜血杆菌所致脑膜炎的治疗,也可作为围术期预防用药。
第三代头孢菌素:对肠杆菌科细菌等革兰阴性杆菌具有强大抗菌作用,头孢他啶和头孢哌酮对铜绿假单胞菌亦具较强抗菌活性;注射品种有头孢噻肟、头孢曲松、头孢他啶、头孢哌酮等,口服品种有头孢克肟和头孢泊肟酯等,口服品种对铜绿假单胞菌均无作用。应注意的是,不是所有的三代头孢菌素都可用于非发酵菌( 如铜绿假单胞菌、不动杆菌等) 感染的治疗,除了头孢哌酮和头孢他啶;外,如头孢曲松和头孢噻肟不可以用于非发酵菌感染的治疗。
第四代头孢菌素:常用者为头孢吡肟,对肠杆菌科细菌作用与第三代头孢菌素大致相仿,对铜绿假单胞菌的作用与头孢他啶相仿,对革兰阳性球菌的作用较第三代头孢菌素略强。其不同于三代头孢菌素之处为对产头孢菌素酶( AmpC) 的肠杆菌属有效,其次是增强了对作用靶位细菌青霉素结合蛋白( PBP) 的亲和力以及其抗革兰阳性菌的抗菌活性亦较三代头孢菌素增强。
第五代(或下一代)头孢菌素头孢洛林( Teflaro ) 对耐甲氧西林金黄色葡萄球菌(MRSA)具有活性。Avycaz 含有β-内酰胺酶抑制剂avibactam。
代表药物:头孢氨苄(Cephalexin)
头孢氨苄是一种头孢菌素(SEF 一种低孢子)抗生素。它通过对抗体内的细菌起作用。
头孢氨苄用于治疗由细菌引起的感染,包括上呼吸道感染、耳部感染、皮肤感染、尿路感染和骨骼感染。
头孢氨苄用于治疗成人和至少 1 岁儿童的感染。
注意事项:
如果对头孢氨苄或类似抗生素(如Ceftin、Cefzil、Omnicef等)过敏,则不应使用该药。如果对任何药物(尤其是青霉素或其他抗生素)过敏,请告诉医生。
对任何药物(尤其是青霉素)过敏;
肝脏或肾脏疾病;要么肠道问题,例如结肠炎,请告诉医生。
头孢氨苄可以进入母乳。如果正在哺乳婴儿,请咨询医生。
β-内酰胺酶抑制剂
β-内酰胺酶抑制剂是一类阻断 β-内酰胺酶(也称为 β-内酰胺酶)活性,防止 β-内酰胺类抗生素降解的药物。本类药物适用于因产β-内酰胺酶的细菌感染,其抗菌谱主要依据原有抗生素的活性而酶抑制剂仅有对抗细菌产酶的作用,一般不增加抗菌活性。
β-内酰胺酶由以下细菌的某些菌株产生:拟杆菌属、肠球菌属、流感嗜血杆菌、卡他莫拉菌、淋病奈瑟菌和葡萄球菌属,无论是组成型还是暴露于抗微生物剂。
β-内酰胺酶裂解易感青霉素和头孢菌素的 β-内酰胺环,使抗生素失活。一些抗微生物药物(如头孢唑啉和氯唑西林)对某些 β-内酰胺酶具有天然耐药性。β-内酰胺类:阿莫西林、氨苄青霉素、哌拉西林和替卡西林,可以通过与β-内酰胺酶抑制剂组合来恢复和扩大其活性。
克拉维酸、舒巴坦和他唑巴坦都是β-内酰胺酶抑制剂。
大环内酯类
大环内酯类药物主要作为青霉素过敏患者的替代药物,用于治疗β-溶血性链球菌、肺炎链球菌中的敏感菌株所致的上、下呼吸道感染、敏感β-溶血性链球菌引起的猩红热及蜂窝织炎等感染。
大环内酯类是从红糖多孢菌(原名红链霉菌)中提取的一类抗生素,一种土壤传播的细菌。
红霉素是第一个发现的大环内酯类;其他大环内酯类包括阿奇霉素、克拉霉素和罗红霉素。
它们的作用主要是抑菌,但在高浓度时可能具有杀菌作用,或取决于微生物的类型。
代表药物:红霉素
红霉素为大环内酯类原型代表药物,由于其胃肠道反应大、口服吸收差使其疗效受到影响。当下在临床应用的主要为大环内酯类新品种罗红霉素、阿奇霉素和克拉霉素等,其他大环内酯类疗效多不如该三种药物。
罗红霉素主要是改善了其药代动力学,口服生物利用度明显提高、给药剂量减小、不良反应明显减少,但其抗菌谱没有明显的改善,是红霉素的替代药物。
氨基糖苷类
临床常用的氨基糖苷类药物主要有: 链霉素、卡那霉素、丁胺卡那霉素、庆大霉素、妥布霉素、奈替米星、依替米星。
其中链霉素当前主要用抗结核治疗,其次可用于治疗鼠疫及布鲁菌病; 庆大霉素、妥布霉素、奈替米星、依替米星肠杆菌科细菌和铜绿假单胞菌等G - 杆菌具强大抗菌活性,对葡萄球菌属亦有良好作用者。所有氨基糖苷类药物对肺炎链球菌、溶血性链球菌的抗菌作用均差。
链霉素、卡那霉素:对肠杆菌科和葡萄球菌属细菌有良好抗菌作用,但对铜绿假单胞菌无作用者。
庆大霉素、妥布霉素、奈替米星、阿米卡星、异帕米星、小诺米星、依替米星:对肠杆菌科细菌和铜绿假单胞菌等革兰阴性杆菌具强大抗菌活性,对葡萄球菌属亦有良好作用。
碳青霉烯类
碳青霉烯类药物是当下抗菌药物中抗菌谱最广的药物,对各种革兰氏阳性球菌、革兰氏阴性杆菌( 包括铜绿假单胞菌的非发酵菌) 和多数厌氧菌具强大抗菌活性,对大多数β-内酰胺酶高度稳定,但对甲氧西林耐药葡萄球菌和嗜麦芽窄食单胞菌等抗菌作用差。
当下在国内应用的碳青霉烯类抗生素有亚胺培南-西司他丁、美罗培南、帕尼培南-倍他米隆、比阿培南。厄他培南与上述品种不同对非发酵菌缺乏抗菌活性,而其他抗菌作用与上述药品基本相同,适合于治疗社区与医院早期特别是G-杆菌感染的重症患者。
碳青霉烯类对各种革兰阳性球菌、革兰阴性杆菌(包括铜绿假单胞菌、不动杆菌属)和多数厌氧菌具强大抗菌活性,对多数β-内酰胺酶高度稳定,但对甲氧西林耐药葡萄球菌和嗜麦芽窄食单胞菌等抗菌作用差。
现用于细菌感染的抗生素被认为是医学史上最重要的突破之一。不幸的是,细菌的适应性很强,抗生素的过度使用让许多人对抗生素产生了耐药性,造成了严重的问题,尤其是在医院的环境里。
抗生素耐药性是细菌抵抗抗生素杀伤力的能力。换句话说,以前治疗感染的抗生素没有效果了,或者说根本无法杀死细菌。
由于过度使用抗生素,抗生素耐药率持续上升,新的抗菌药物开发缓慢。感染耐药细菌可能导致住院时间更长、费用更高,并增加死于感染的风险。
抗生素耐药性是对全球健康的紧迫威胁,包括后来逐渐出现危险耐药细菌——“超级细菌”。
疾病控制和预防中心 (CDC)发布了对美国的前 18 种耐药性威胁的清单,至少包括:
注:以上这些并未全面列出所有耐药菌。抗生素耐药性模式不断演变,细菌可能并不总是对每位患者的选择抗生素表现出耐药性。在正常情况下,抗生素的选择应基于感染部位和由医疗保健专业人员评估的临床表现、培养/敏感性和其他所需的实验室结果、局部耐药性/敏感性模式以及患者的特定特征。
细菌通过以某种方式调整其结构或功能作为防御机制,从而对抗生素产生抗药性。
当细菌以某种方式发生变化时,细菌会抵抗药物。这种变化可以保护细菌免受药物的影响或限制药物接触细菌。或者这种变化可能导致细菌改变药物或破坏药物。
细菌可以用以下方式与抗生素抗争:
如果说以上列举的是抗生素产生耐药性的内因,那么除细菌本身外的因素也会导致抗生素耐药性的出现。
早前,医生有时会依赖不可靠或不准确的知识,开具抗生素“以防万一”,或在特定窄谱抗生素可能更合适时却开出广谱抗生素。这些情况加剧了选择压力并加速了抗菌素耐药性。
当医生不清楚是细菌或病毒加剧了感染时,他们可能会开抗生素。抗生素对病毒感染不起作用,可能会产生耐药性。
抗生素自我治疗(SMA)与药物使用不当的可能性有关,这会使患者面临药物不良反应的风险,掩盖潜在疾病的迹象,并在微生物中产生耐药性。
过度使用抗生素,尤其是在不正确治疗的情况下服用抗生素,会促进抗生素耐药性。根据疾病控制和预防中心的数据,人类使用大约三分之一的抗生素既不需要也不合适。
抗生素可以治疗由细菌引起的感染,但不能治疗由病毒引起的感染(病毒感染)。例如,抗生素是可以治疗由细菌引起的链球菌性咽喉炎。但对于大多数由病毒引起的喉咙痛,并不是正确的治疗方法。
每天都有成千上万的患者、工作人员和访客到达医院,每个人的衣服上和身体上/体内都有自己的一套微生物组。如果医院没有适当的程序和规程来帮助保持空间清洁,细菌就会传播。
抗生素被用作动物的生长补充剂和生长促进剂。在家畜中发现的耐抗生素细菌可能对人类致病,很容易通过食物链传播给人类,并通过动物粪便在生态系统中广泛传播。在人类中,这可能会导致复杂的、无法治疗的和长期的感染。
由于技术挑战、缺乏知识、对抗细菌生理学的重大困难,制药业对新抗生素的发明在很大程度上放缓了,当新抗生素普及时,耐药性的发展(在相对较短的时间内)几乎是不可避免的。
世界范围内抗生素的过度使用和滥用正在导致抗生素耐药性的全球医疗问题。可能会发生抗生素耐药性感染,在最坏的情况下,可能会没有有效的抗生素。这种情况在严重感染时可能会危及生命。
大多数病毒性疾病不需要特殊药物并且是“自限性”的,也就是说患者自身的免疫系统可以抵抗疾病。病毒性疾病的患者可以休息、多喝水并使用对症治疗。
由病毒引起的疾病包括:
有时,在复杂或长期的病毒感染中,细菌也可能侵入,并导致所谓的“继发感染”。在这些情况下,如果需要,可以使用抗生素。
在感染由病毒引起的疾病中,例如咳嗽、感冒或流感,患者不应要求医生开抗生素。抗生素不能治愈病毒感染,患者可能会因不必要的药物而产生副作用。医生可以用其他方法来帮助患有病毒性疾病的患者进行治疗。
如果感染没有得到正确治疗,抗生素耐药细菌也可能传播给其他人。
——有以下几个原因:
它可能不是治疗感染的正确抗生素
它可能已过时且无效
整个疗程可能没有足够的药物
如果新疾病是病毒感染,则不需要抗生素
一些疫苗可以预防细菌性疾病。抗病毒疫苗,例如流感疫苗或COVID-19 疫苗,可以帮助预防可能与继发性细菌感染(如严重的肺部肺炎)相关的原发性疾病。
在治疗的最初几天感觉好些了的时候,仍应完成整个抗生素疗程。
抗生素使用注意事项
✓ 按照指示使用抗生素
按照医生的指示治疗感染。医生会选择最能对抗导致感染的特定细菌的抗生素类型。目前市面上有许多不同种类的抗生素,大部分需要医生开出的非处方抗生素。
✓ 了解抗生素
有的抗生素需要进行皮试,比如青霉素,以防过敏,不同的抗生素杀菌的作用原理不尽相同,比如青霉素是通过能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用的一类窄普抗生素,杀菌作用强,可用于敏感菌所致的严重感染,由于该类药物作用的靶位为细菌细胞壁,而人体的细胞没有细胞壁,因此毒性低,用于老年人,新生儿和孕妇时安全性相对较高。
✓ 确保清楚抗生素的使用方式
确保明确知道应该服用多少抗生素,以及何时服用。有些抗生素需要与食物一起服用,有些需要在晚上服用等。特别注意要用完整的病征疗程抗生素,有些人担心抗生素对身体有副作用,病情稍微好转就会停止服用或注射抗生素,但是这可能导致体内的致病细菌未完全清楚,再次发生感染,或引起形成抗生素抗药性,使得以后的感染治疗变得困难。
✓ 清洁伤口以防止细菌感染
通过立即正确清洁和包扎伤口来预防皮肤感染。适当的急救治疗对于帮助预防细菌感染至关重要,但不应尝试自己治疗严重的皮肉伤口。如果伤口很深、很宽或出血很多,应该立即寻求医疗帮助。
治疗伤口前先洗手。如果你用脏手治疗伤口,会增加细菌感染的机会。用温水和抗菌肥皂洗手 20 秒,然后擦干。如果有条件可以戴上手套。
细菌感染性疾病起病急、进展快,重症疑难患者病原细菌复杂,诊断及治疗困难,可危及生命。早期、准确地明确病原微生物对感染判定至关重要,有助于改善预后。
准确诊断细菌感染对于避免不必要的抗生素使用和集中适当的治疗至关重要。
细菌感染是细菌的存在与炎症或全身功能障碍的结合;因此,通常需要不止一种诊断方式进行确认,确定患者是否符合临床病例定义的病史和检查。
不同的病原微生物检测技术对感染的判定价值不同,临床上也会根据患者的病情,可能感染的部位,可供采集的标本等选择适宜的检测技术。


当前,病原微生物检测技术层出不穷,能识别的微生物种类越来越多,但如何正确利用和分析微生物检测结果仍是临床关注的难题。值得注意的是,感染首先是个临床诊断,所有的判定必须基于临床。
定植容易对感染判定产生混淆。正常生理状态下人体口腔、胃肠道、呼吸道及体表等部位均有细菌、真菌存在,患者无感染症状时称为定植菌。当定植菌的致病力改变或机体防御能力下降时,可大量繁殖或被带入机体深部引起感染成为致病菌。
临床医生应如何判断所获取的病原体为定植还是感染,是长久以来的难题,且未形成成熟统一的解决方案。
呼吸道定植菌的综合分析:
就呼吸道定植菌而言,既往认为可根据菌落数量或菌种拷贝数来判定定植与感染,但结果存在偏差。越来越多的学者认为,临床上判定是定植还是感染,需结合患者症状、体征及其他检查结果综合分析。
若患者存在与检测阳性结果相匹配的临床症状和体征,如发热、咳嗽、咳痰等,感染指标升高,肺部出现新发病灶,应考虑感染并给予相应的抗感染治疗。如仅培养阳性,患者无任何感染相关临床表现,则倾向于定植菌。
念珠菌定植的综合分析:
念珠菌可广泛定植于呼吸道、胃肠道及泌尿生殖道,正常屏障破坏、免疫功能受损或局部菌群失调时,定植的念珠菌可生长繁殖引起感染。痰和尿标本中分离出的念珠菌亦应根据临床症状和体征鉴别是定植还是感染,念珠菌血培养阳性时要高度警惕念珠菌血症。
此外,病原微生物检测结果阳性,并不意味着患者一定存在感染或感染一定由检出的病原体所致,需结合标本质量、采集部位、病史及其他检测结果综合分析。
不同部位标本检测出同一种病原体,其代表的临床意义可能并不相同。
以肺炎克雷伯氏菌为例,从肠道粪便样本中检出肺炎克雷伯氏菌,其中丰度占比超过1%的人群有3765例,占比28.2%【谷禾健康数据库】。但是当肺炎克雷伯菌进入血液并感染时,通常会发生细菌血症。症状可能包括发冷,发烧,发抖,肌肉酸痛,疲劳和嗜睡。当肺炎克雷伯菌感染肝脏时,会引起脓性病变,也被称为化脓性肝脓肿。这种类型的感染更常见于患有糖尿病一段时间或已经服用抗生素多年的人。
因病原微生物种类不同,微生物检测方法的选择也不相同;即便检测同一种微生物,因采集部位不同所选择的检测方法也有所差别。
如大肠埃希菌,血培养阳性时需考虑血流感染,怀疑致病性大肠埃希菌感染肠道时需特殊培养或者血清学、PCR,16s测序检测等。因普通大肠埃希菌可寄居在肠道中,粪便普通培养有大肠埃希菌生长并不能直接考虑大肠埃希菌肠道感染。
病原微生物检测技术快速发展,能识别的微生物种类越来越多,但感染首先是个临床诊断,所有的判定必须基于临床。随着检测技术革新带来的是临床辅助手段的进步和多样化,更快、更准确地判定感染一直都是病原学检测的挑战,不同方法各有优劣。当前,并没有一项技术可通过从标本中识别微生物来直接判定机体是否感染该病原体,甚至依靠检测的阴性结果来排除感染都很难实现。
在面对细菌感染诊疗过程中始终需要思考3个问题:患者是否存在感染?如果有感染,致病病原体是什么?如何治疗干预?
充分利用现有的病原微生物检测方法和其他实验室检查手段,综合判定,给出合适的抗菌治疗或其他综合治疗方法,是科学可持续的手段。
主要参考文献:
Uddin TM, Chakraborty AJ, Khusro A, Zidan BRM, Mitra S, Emran TB, Dhama K, Ripon MKH, Gajdács M, Sahibzada MUK, Hossain MJ, Koirala N. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766. doi: 10.1016/j.jiph.2021.10.020. Epub 2021 Oct 23. PMID: 34756812.
Cheung GYC, Bae JS, Otto M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 2021 Dec;12(1):547-569. doi: 10.1080/21505594.2021.1878688. PMID: 33522395; PMCID: PMC7872022.
Tshibangu-Kabamba E, Yamaoka Y. Helicobacter pylori infection and antibiotic resistance – from biology to clinical implications. Nat Rev Gastroenterol Hepatol. 2021 Sep;18(9):613-629. doi: 10.1038/s41575-021-00449-x. Epub 2021 May 17. PMID: 34002081.
BRM, Mitra S, Emran TB, Dhama K, Ripon MKH, Gajdács M, Sahibzada MUK, Hossain MJ, Koirala N. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766. doi: 10.1016/j.jiph.2021.10.020. Epub 2021 Oct 23. PMID: 34756812.
Carmen Fookes, BPharm, Bacterial Infection. January 13, 2020 Medicine
Spagnolo F, Trujillo M, Dennehy JJ. Why Do Antibiotics Exist? mBio. 2021 Dec 21;12(6):e0196621. doi: 10.1128/mBio.01966-21. Epub 2021 Dec 7. PMID: 34872345; PMCID: PMC8649755
Baquero F, Coque TM, Cantón R. Counteracting antibiotic resistance: breaking barriers among antibacterial strategies. Expert Opin Ther Targets. 2014 Aug;18(8):851-61. doi: 10.1517/14728222.2014.925881. Epub 2014 May 31. PMID: 24881465.
武洁, 王荃. 病原微生物检测在感染判定的意义[J]. 中国小儿急救医学, 2020, 27(3):6.
李丹鹤, 荣爱国, 马瑞芝,等. 病原微生物检验在抗感染经验治疗中的临床意义[J]. 医学理论与实践, 2019, 32(09):127-129.

谷禾健康
想起写作和整理这篇文章的契机,除了夏季即将来临,还要从我们的一位消费者来咨询的内容说起。他的肠道菌群检测报告里有一个病原菌检出超标,这个病原菌就是赫赫有名的Borrelia burgdorferi (伯氏疏螺旋体,也称莱姆病螺旋体)。

谷禾肠道菌群检测报告
说到这个菌,大家可能不熟悉,但应该听过或者患过“莱姆病”,或者听过有关莱姆病的新闻。

著名加拿大歌手贾斯汀·比伯和摇滚小天后艾薇儿都曾因为莱姆病不得不暂别歌坛数年,2018年,艾薇儿用一首《Head Above Water》诠释了与莱姆病战斗的过程。病情最严重的时候,她感觉:
“自己的身体停止运转,
像在慢慢沉入水底,
需要浮上来呼吸一口气”
莱姆病是全球性的疾病,但大家可能还不够重视。
地区分布
这种疾病于上世纪70年代在美国康涅狄格州的莱姆镇被发现,四十多年来,莱姆病在亚洲、欧洲、非洲都有病例报道,以北半球较为多见。
我国于1985年,在黑龙江省林区,发现了国内首个莱姆病病例,目前,东北林区仍是我国莱姆病最常见的地区。
发病率
2015 年 9 月发表在《新发传染病》上的一份报告估计,该国每年发生329,000 例莱姆病病例——是通常向 CDC(Centers for Disease Control and Prevention ) 报告的 30,000 例确诊和可能病例的10 倍以上。欧洲每年报告大约 85,000 例莱姆病病例。
莱姆病只发生在某些生态条件适宜的地区。在美国的高度流行地区,如康涅狄格州和纽约南部,每年的发病率约为每1000人0.5例,但在局部地区可能要高得多。报告的发病率在5至10岁儿童中最高,几乎是成人发病率的两倍。
莱姆病的“罪魁祸首”,是一种叫做“伯氏疏螺旋体(Borrelia burgdorferi)”的病原体,也就是我们前面报告中检出的病原菌。
下面我们就从“伯氏疏螺旋体”开始说起,详细了解一下究竟什么是莱姆病,感染之后为什么会这么严重,需要注意事项等。
伯氏疏螺旋体(Borrelia burgdorferi)是真细菌门螺旋体的一员。这类菌具有独特的形态,包括螺旋状或波浪状的身体和鞭毛(运动器官),鞭毛被包裹在外膜和内膜之间。
图源:医学百科全书
螺旋体包括几种人类病原体,例如:
梅毒螺旋体(梅毒病原体)、钩端螺旋体、脊螺旋体属和几种引起复发性发热的螺旋体。虽然医学界早就知道这些其他螺旋体,但莱姆病的病原菌是70年代才被发现的。
伯氏疏螺旋体的发现
1977年,Alan Steere博士及其同事在临床上将莱姆病描述为一种传染病。Steere等人认为,由于农村地区患者的地理聚集和症状的季节性发生,莱姆病的流行病学表明是通过节肢动物媒介传播的。随后,Willy Burgdorfer博士及其同事在莱姆病流行区采集的蜱中肠组织中观察到螺旋体。
当这些螺旋体注射到兔子体内时,会产生类似于红斑移行症的皮疹,莱姆病患者的血清在间接免疫荧光分析中与细菌发生反应。为了确认这一发现,这种细菌被命名为伯氏疏螺旋体。
美国,伯氏疏螺旋体是唯一导致莱姆病的病原体。 然而,在欧洲和亚洲,除伯氏疏螺旋体外,B. burgdorferi sensu strictu (s.s.),B. garinii 和B. afzelii也会引起莱姆病。
但是欧洲和北美莱姆病的临床表现具有一些共同特征,例如红斑游走性皮疹和流感样疾病。 随后,可能会出现与感染物种大致相关的其他症状。 关节炎经常伴随 B. burgdorferi s.s. 感染,而神经系统症状与 B. garinii 相关,皮肤病与 B. afzelii 相关,尽管这些临床关联不是绝对的。
尽管尚未确定导致疾病差异的潜在遗传特征,但释放的三个疏螺旋体基因组序列应该有助于了解更多。这些基因组具有几个共同的特点,包括线性染色体和大量的较小的DNA分子(质粒),其中一些是线性和其他环状。
染色体和许多质粒的线性结构在细菌世界中是不寻常的,虽然这种形式的 DNA 的进化优势尚不清楚。然而,它可能会给疏螺旋体属带来一些好处,因为所有特征成员都保留线性 DNA 分子。
传播这种病原菌的节肢动物主要为蜱虫(如下图)。

莱姆病最常见于6 月、7 月和 8 月,在这季节蜱很活跃,人们在户外的时间也较长。这些蜱虫会在春季和夏季觅食。
大多数蜱经历四个生命阶段:卵、六足幼虫、八足若虫和成虫。从卵孵化后,蜱必须在每个阶段吃血才能生存。需要这么多宿主的蜱虫可能需要长达 3 年的时间才能完成它们的整个生命周期,而且大多数会因为找不到宿主进行下一次喂养而死亡。
不同生命阶段几个蜱的相对大小

图源:CDC
像肩胛硬蜱的生命周期通常持续两年。在此期间,它们经历四个生命阶段:卵、幼虫、若虫和成虫。卵孵化后,蜱虫必须在每个阶段吃血才能生存。
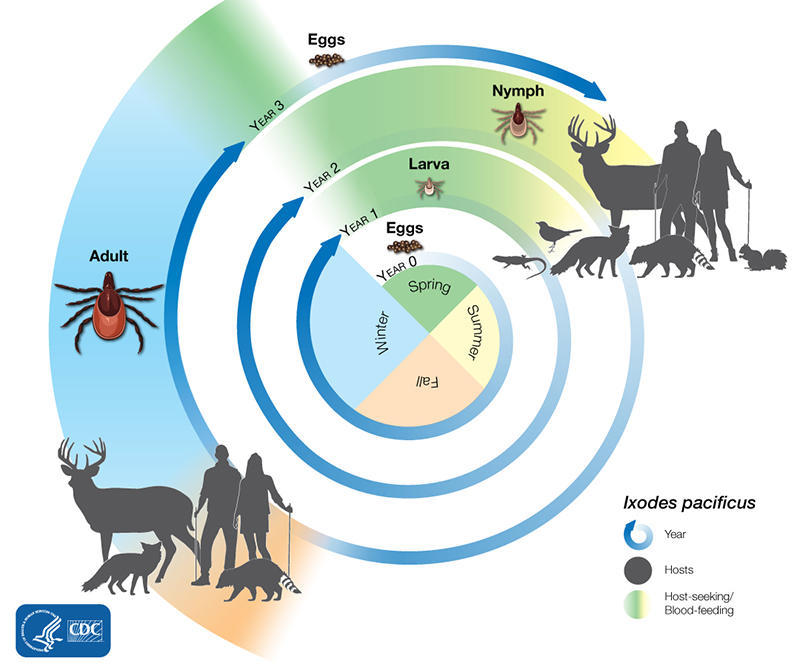
图源:CDC
蜱可以以哺乳动物、鸟类、爬行动物和两栖动物为食。大多数蜱虫喜欢在其生命的每个阶段拥有不同的宿主动物,如下所示:
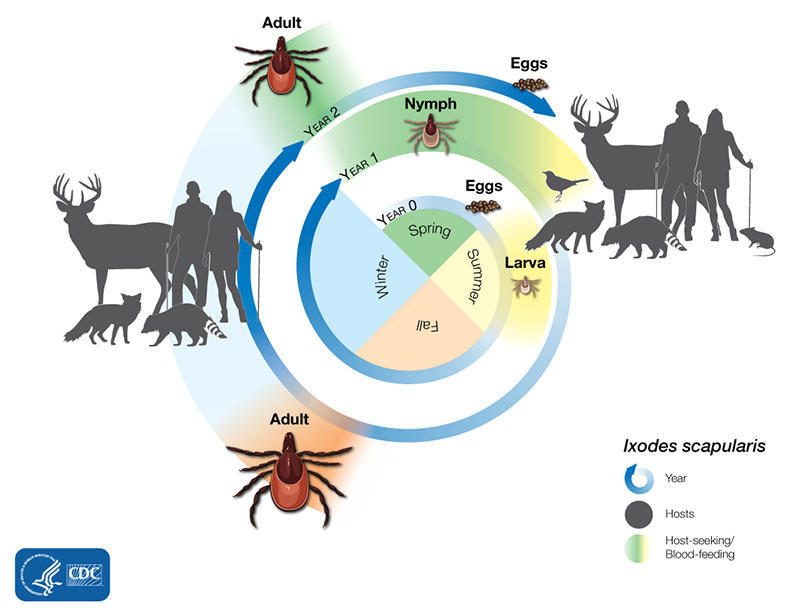
蜱虫可能会在其生命周期的任何阶段被感染,因为它是伯氏疏螺旋体的天然宿主。幼虫在地上过冬,次年春天以若虫的形式出现。 若虫蜱最有可能传播感染,因为它们很小,很难看到,而且在人类经常感染蜱虫的地区数量众多。 若虫在秋天蜕皮成为成虫。 成年雌性通常在冬天依附于鹿等大型动物(因此俗称鹿蜱),在第二年春天死亡前产卵,2年的生命周期再次开始。
注:不完全变态昆虫的幼虫被称为若虫(nymph)。故若虫不是某一种昆虫,而是一类昆虫发育至某一段时期的称谓,即营陆生生活的不完全变态昆虫的幼体。
当然,必须感染蜱才能传播伯氏疏螺旋体。
蜱虫如何找到宿主
蜱通过探测动物,或通过感觉身体热量,水分和振动,找到宿主的呼吸和身体气味。有些物种甚至能认出影子。此外,蜱虫通过识别使用良好的路径来选择一个等待的地方。然后,它们在草和灌木的顶端等待宿主。蜱不能飞也不能跳,但许多蜱类在一个做“任务”的位置等待。
在执行任务时,蜱通过它们的第三和第四对腿抓住树叶和草。他们伸出第一双腿,等待着爬到主人的身上。当寄主经过一个蜱虫等待的地方,它很快爬上。有些蜱虫会很快附着,有些则会四处游荡,寻找耳朵等皮肤较薄的地方。

蜱如何传播疾病
根据蜱类及其生活阶段的不同,准备可能需要10分钟到2小时。当蜱虫找到一个觅食点时,它会抓住皮肤并切入表面。
然后,蜱虫插入它的喂食管。许多物种还会分泌一种类似水泥的物质,使它们在进餐时牢牢地附着在一起。喂食管可以有倒钩,这有助于保持蜱虫在适当的位置。

SCIENCE PHOTO LIBRARY
蜱还能分泌少量具有麻醉性质的唾液,使动物或人感觉不到蜱附着在自己身上。如果蜱虫在一个隐蔽的地方,它可能会被忽视。
螺旋体生活在蜱的中肠中,然后细菌迁移到唾液腺和唾液,通过唾液将螺旋体注入宿主。
伯氏疏螺旋外表面蛋白的OspA显示出是细菌驻留在蜱表面,但在蜱喂养和传播给哺乳动物的过程中下调。随后的研究表明,OspA 是一种粘附素,对于将螺旋体保留在蜱中肠直到进食很重要。
OspB,另一种潜在的中肠粘附素,BptA,一种功能未知的脂蛋白,以及 BB0690 基因的产物,可能与抗氧化应激有关 ,似乎也有助于蜱中的细菌存活。
一只蜱会慢慢地吸血好几天。如果宿主动物有血源性感染,蜱虫会将病原体与血液一起摄入体内。
蜱虫的少量唾液也可能进入宿主动物的皮肤。如果蜱虫含有病原体,那么可能通过这种方式传染给宿主动物。
这一过程结束后,大多数蜱虫会脱落,为下一个生命阶段做准备。在下一次进食时,它可以将获得性疾病传染给新的宿主。
莱姆病典型症状包括发烧、头痛、疲劳以及称为游走性红斑的特征性皮疹。如果不及时治疗,感染会扩散到关节、心脏和神经系统。症状可能因疏螺旋体的具体类型而异。
在北美的主要种类是B.burgdorferi sensu strictu,它特别容易引起关节炎。相比之下,欧洲物种B. garinii和B. afzelii分别与神经和慢性皮肤病表现更相关。
莱姆病的进展通常分为三个阶段:
第一阶段
局部莱姆病,感染集中在身体一个区域
第二阶段
早期播散性莱姆病,其中细菌已开始传播
第三阶段
晚期播散性莱姆病,其中细菌已扩散到全身
莱姆病的早期症状
莱姆病通常以明显的皮疹开始,但也可能导致流感样症状。
莱姆病的早期体征和症状可能非常轻微,可能会被遗漏。这种疾病在发病时可能类似于流感。其最明显的症状是牛眼状皮疹。但美国国家过敏和传染病研究所 (NIAID) 指出,至少有四分之一的莱姆病患者没有出现明显的皮疹。
局限性莱姆病最常见的特征是缓慢扩大的皮肤病变或皮疹,称为游走性红斑 (EM)。这种皮疹通常在传播疾病的蜱叮咬后 3 到 30 天(平均 7 天)出现。
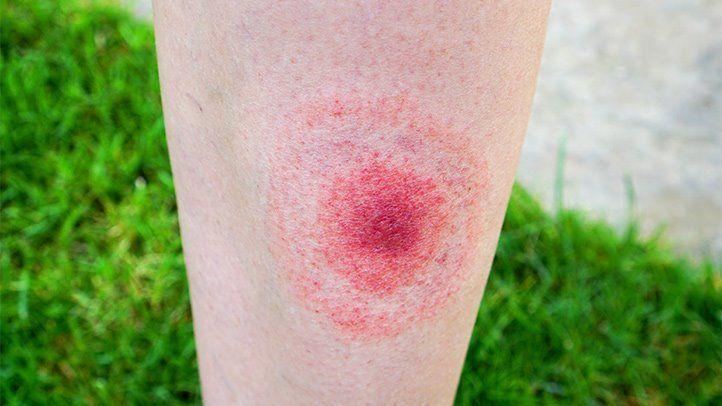
Anastasia Kopa/Shutterstock
在向疾控中心报告的莱姆病病例中,约有 70% 的莱姆病病例,游走性红斑是该病的最早征兆。
某些特征可以帮助识别游走性红斑: 它从蜱虫叮咬处的扁平或略微凸起的红点开始,然后扩展为直径达73 厘米(28.7 英寸)的圆形皮疹(如上图)。
它可以出现在身体的任何部位(咬伤部位),但最常见于成人的下肢、臀部和腹股沟,以及儿童的头部和颈部。
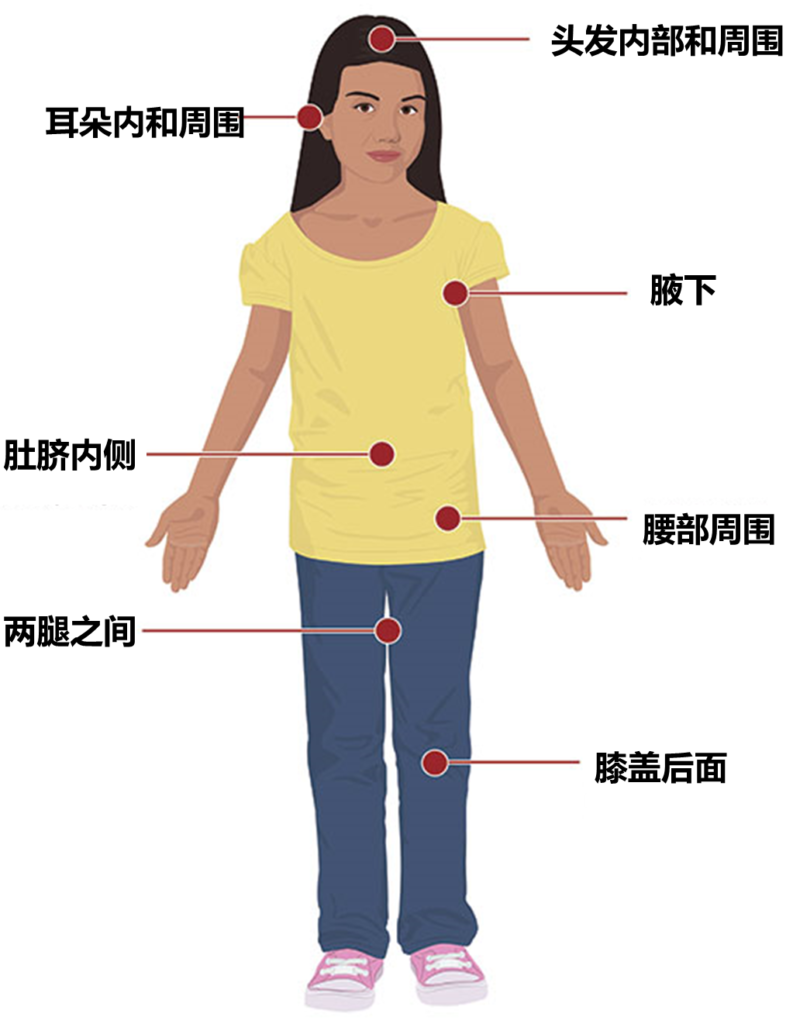
皮疹中心周围可能会出现一个清晰的环,使其看起来像牛眼(中心圆圈周围有一个清晰的环,周围环绕着一个更大的皮疹)。
它摸起来可能是发热的,但很少疼痛或发痒。
虽然典型的莱姆病皮疹呈牛眼状,但并非所有的游走性红斑病例看起来都一样。患者可能会出现红色、扩大的病灶,中央有皮肤结痂;多处红色病变;红色椭圆形斑块;根据疾病预防控制中心的说法,或出现蓝色皮疹。
除了游走性红斑外,局部莱姆病患者可能会出现类似流感的症状,包括发烧和发冷、头痛、疲劳、肌肉和关节疼痛、全身不适(不适)和淋巴腺肿胀。
莱姆病会导致关节疼痛急剧增加和大量肿胀,所以有些人觉得特别累。但是也有大约 20% 的莱姆病患者除了游走性红斑症外没有任何症状。
如果莱姆病得不到治疗,皮疹通常自行消退,但是细菌会进入血小管,并传播到身体其他部位。
神经系统并发症可在早期播散性(第二阶段)莱姆病中开始发展。
莱姆病并发症可能包括:
——视力障碍
——注意力不集中
——易怒
——睡眠和记忆障碍
——腿部和手臂的神经损伤(神经病)
也可能出现其他非神经系统并发症,例如严重的关节炎、持续性疲劳、情绪障碍以及危及生命的心脏、肺和神经系统疾病。
莱姆病的后期症状
在早期播散性(第二阶段)莱姆病中,在蜱叮咬后数周至数月发生,可能会出现其他症状,包括:
额外的红斑移行病变神经疼痛;
面部麻痹或贝尔麻痹,面部一侧肌肉麻痹或无力;
莱姆心脏炎:莱姆病细菌进入心脏组织并干扰协调心脏跳动的正常过程,症状包括心悸、胸痛或气短。

晚期播散性(第三阶段)莱姆病在感染开始后数月至数年发生,可能导致:
伴有严重关节疼痛和肿胀的关节炎,尤其是膝盖等大关节
肌腱、肌肉、关节和骨骼疼痛
肌肉运动异常
手或脚麻木和刺痛
认知问题,包括言语和短期记忆问题
脑膜炎 引起的严重头痛和颈部僵硬 (覆盖脊髓和大脑的膜发炎)
什么情况下,从蜱到人类传播风险较大?
受感染蜱的比例因地理区域和蜱在其生命周期中的阶段而异。 在新英格兰南部的高度流行地区,若虫感染的几率约为20%-30%,成年蜱的感染率为30% -50%。
根据动物的实验研究,要传播伯氏疏螺旋体,受感染的若虫蜱通常必须至少进食 36 至 48 小时,受感染的成年蜱必须至少进食 72 小时,然后传播风险才会变得很大。 这些实验结果在一项人类研究中得到证实,在该研究中,对于已进食至少 72 小时的若虫蜱,从蜱(可以评估其进食持续时间)到人类的传播风险为 25%。
研究表明,在大多数被蜱虫叮咬的情况下,蜱虫进食的时间不到 48 小时,这在一定程度上解释了在流行地区被蜱虫叮咬后患莱姆病的风险低(1%–3%)。未被识别的叮咬可能会导致莱姆病的风险更高,因为蜱虫可能会吃饱并更有可能传播感染。
什么情况下容易被蜱叮咬?
一个人被蜱虫咬伤和患莱姆病的几率取决于他们居住、旅行或谋生的地方。
感染莱姆病的常见风险因素包括:

长时间在树木繁茂的地方或草地,田地,庭院,特别是在美国东北部和中西部
裸露的皮肤,会让蜱虫更容易附着或叮咬
不正确地去除蜱虫或在它们附着在皮肤上 48 小时或更长时间后才去除,这会使叮咬处的细菌进入皮肤
在评估莱姆病患者时,首先应考虑:
莱姆病的体征和症状 ,患者接触感染蜱的可能性,其他疾病可能引起类似症状的可能性。
然后进行CDC建议的对莱姆病的两步检测。
这两个步骤都是必需的,并且可以使用相同的血液样本完成。如果第一步是阴性的,则不建议进行下一步测试。
如果第一步是阳性的或不确定的(“模棱两可”),则应执行第二步。仅当第一次测试为阳性(或模棱两可)而第二次测试为阳性(或某些测试模棱两可)时,总体结果才是阳性。
抗体产生
要记住,大多数莱姆病测试旨在检测身体对感染产生的抗体。
抗体可能需要数周时间才能产生,因此如果最近才感染,患者可能会检测为阴性。
感染消失后,抗体通常会在血液中持续存在数月甚至数年;因此,该测试不能用于确定治愈。
检测的准确性
感染其他疾病,包括一些蜱传疾病,或一些病毒、细菌或自身免疫性疾病,可能导致假阳性检测结果。
不过莱姆病的血液检测只有 65% 或更少是正确的。与其他传染病的血清学检测一样,检测的准确性取决于被感染的时间。在感染的最初几周内,例如当患者出现游走性红斑皮疹时,预计检测结果为阴性。
一些测试会给出两种抗体的结果,IgM 和 IgG。如果患者患病超过 30 天,则不应考虑阳性 IgM 结果。
感染几周后,FDA 批准的测试具有非常好的敏感性。
感染初期,在被蜱虫叮咬后的最初几周内接受抗生素的人可能没有完全发展的抗体反应,或者可能因产生抗体反应的水平太低而无法检测到。
针对莱姆病细菌的抗体通常需要几周的时间才能产生,因此即使被感染,在此之前进行的检测也可能呈阴性。在 4-6 周后,测试才可能呈阳性。
PCR,测序和培养
PCR或测序可以提供各种样本中伯氏疏螺旋体核酸的高度特异性证据,包括滑液、皮肤活检组织、血液和脑脊液 。然而,其临床效用受到低灵敏度(尤其是血液和脑脊液样本)及其潜在污染的限制。
滑液PCR 对莱姆关节炎的敏感性 > 75%,可能与其他滑液分析结合使用,以区分莱姆关节炎和其他关节炎 。
对血液 PCR 的研究发现,它的高特异性被其缺乏临床敏感性和污染的可能性所抵消。因此,PCR 尚未被普遍标准化或优化用于诊断莱姆病。然而,一些临床实验室提供了疏螺旋体属的 PCR 检测,血液 PCR 已显示出检测新基因种B. miyamotoi 和B. mayonii 的效用。
由于伯氏疏螺旋体是一种生长缓慢的菌,目前的培养方法敏感性较差。通常不建议将培养用于研究以外的目的,或用于证实在以前未被识别有感染风险地区感染的疾病。
根据我们的检测,可以看出粪便菌群检测结果也可以辅助判别是否感染了伯氏疏螺旋体,而且粪便里检测到有一定概率表明血液里也存在了。这种情况可以根据自身症状和是否接触过蜱虫活动区进一步判别,不过目前类似PCR和粪便菌群测序等测试目前都只能作为辅助判别。
如果你被蜱虫咬过并且它嵌入你的皮肤,最好的去除方法是使用细尖镊子。

图源:CDC
将镊子尽可能靠近皮肤,将蜱虫稳步向上拉以取出它的身体(包括它的嘴部),并彻底清洗咬伤处和手。即使没有看到蜱虫,如果在去过可能有蜱虫的区域后出现皮疹、发烧、发冷或头痛,也要特别留意和检查身体。
Thinkstock; Getty Images
抗生素治疗
抗生素是目前唯一已知的有效治疗莱姆病的方法。
在大多数情况下,莱姆病可以通过两到三周的抗生素疗程来解决,通常是强力霉素(也具有抗炎特性)或阿莫西林。
通常,治疗开始(和完成)越早,恢复就越快。
成人和儿童早期莱姆病的标准治疗方法是口服抗生素。 不过不同的人群使用抗生素不同,要遵循医生的建议。
如果莱姆病进展到更晚期并累及神经系统,则可能需要静脉注射抗生素。这些通常开处方 14 到 28 天,可以消除感染,但它们可能会引起副作用,包括白细胞计数降低、轻度至重度腹泻,或其他与莱姆病无关的抗生素耐药生物定植或感染。
替代和补充疗法
除抗生素外, 科学家们还在探索莱姆病的补充和替代医学。有针对莱姆病患者销售的替代或补充疗法,但没有科学证据证明它们有效,甚至可以安全使用。
发表在 2020 年 2 月出版的《医学前沿》杂志上的一项研究发现,相对低浓度 (1%) 的七种天然草药提取物可能对伯氏疏螺旋体有效,但是临床使用还需要进一步证明。
【1】避开木质、灌木丛和草地,尤其是在 5 月、6 月和 7 月。
【2】穿浅色衣服,如果蜱爬到身上时你可以及时发现它。
【3】穿长裤、长袖衬衫和覆盖整个脚的鞋子(不要穿凉鞋),把裤腿塞进袜子或鞋子里,把衬衫塞进裤子里。戴帽子保护头部。
【4】在衣服和裸露的皮肤区域喷洒含有避蚊胺的驱虫剂。
【5】如果在林荫小道上,请走在中间,尽量避开灌木和草地。
【6】从户外进来时,请立即脱掉衣服,并在高温下洗涤并晾干。
【7】户外活动后仔细检查身体和头部是否有蜱虫。尤其是身体的这些部位:
腋下、耳朵内和耳朵周围、肚脐内侧、膝盖后面、在头发内部和周围、两腿之间、腰部周围。
附录:关于莱姆病的常见问题
被蜱虫叮咬了,患莱姆病了吗?
被蜱虫叮咬后感染莱姆病的几率取决于蜱虫的类型、感染地点以及它附着在身上的时间。
在美国,许多类型的蜱虫会咬人,但只有黑腿蜱虫会传播导致莱姆病的细菌。此外,只有美国东北部和中北部高度流行地区的黑腿蜱通常被感染。最后,黑腿蜱需要附着至少 24 小时才能传播莱姆病。
对于被蜱虫叮咬,要引起重视,除了莱姆病之外,也有传染其他疾病的可能性。
莱姆病会通过性传播吗?
没有可靠的科学证据表明莱姆病是通过性接触传播的。已发表的动物研究不支持性传播(Moody 1991;Woodrum 1999),并且莱姆病螺旋体与这种暴露途径不兼容(Porcella 2001)。传播莱姆病的蜱虫非常小,很容易被忽视。因此,即使其中一方或双方不记得被蜱虫叮咬,生活在同一家庭的性伴侣也有可能因蜱虫叮咬而被感染。
莱姆病会通过母乳传播吗?
没有关于莱姆病通过母乳传播给婴儿的报告。如果在被诊断出患有莱姆病的时候还在母乳喂养,请告知医生,尽可能开出在母乳喂养时可以安全使用的抗生素。
莱姆病会通过输血途径传播吗?
尽管没有莱姆病病例与输血有关,但科学家们发现莱姆病细菌可以生活在一个活跃的感染者的血液中。接受抗生素治疗的莱姆病患者不应献血。
怀孕了,怀疑有患莱姆病,该怎么办?
怀孕期间未经治疗的莱姆病可导致胎盘感染。从母亲传播到胎儿是可能的,但很少见。幸运的是,通过适当的抗生素治疗,不良分娩结果的风险不会增加。
* 没有已发表的研究评估母亲在怀孕期间患上莱姆病的儿童的发育结果。
如何知道是否已经彻底治愈?
没有任何测试可以“证明”治愈。
莱姆病测试检测人体免疫系统产生的抗体,这些抗体可以在感染消失后持续很长时间。这意味着,如果血液测试呈阳性,那么即使细菌不存在,它也可能会持续数月甚至数年呈阳性。
如果说PCR研究工具可以检测某些患者的细菌 DNA。但研究表明,死细菌的 DNA 片段在治疗后数月内仍可检测到。剩余的 DNA 片段没有传染性。仅仅因为感染的 DNA 片段还存在, 并不意味着细菌是活的或有活力的。
一旦得了莱姆病,就会一直持续下去吗?
不会。在感染早期接受抗生素治疗的患者通常会迅速完全康复。大多数在疾病晚期接受治疗的患者也对抗生素反应良好,尽管有些患者可能对神经系统或关节造成长期损害。
但也有可能存在,接受推荐的 2 至 4 周抗生素疗程的莱姆病患者在完成治疗时出现疲劳、疼痛或关节和肌肉酸痛等症状。
在少数情况下,这些症状可持续 6 个月以上。这些症状无法通过更长疗程的抗生素治愈,但随着时间的推移,它们通常会自行改善。
主要参考文献
Shapiro ED. Borrelia burgdorferi (Lyme disease). Pediatr Rev. 2014;35(12):500-509. doi:10.1542/pir.35-12-500
Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin North Am. 2008;22(2):217
Imaging in Lyme neuroborreliosis.Insights into Imaging(2018)9:833–844.
Lyme borreliosis:diagnosis and management.BMJ 2020;369:m1041.
Brainstem encephalitis in neuroborreliosis:typical clinical course and distinct MRI findings.J.Neurol.2020 Aug 28.
Centers for Disease Control website. Lyme disease. www.cdc.gov/lyme. Updated December 16, 2019. Accessed April 7, 2020.
Steere AC. Lyme disease (Lyme borreliosis) due to Borrelia burgdorferi. In: Bennett JE, Dolin R, Blaser MJ, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia, PA: Elsevier; 2020:chap 241.
Wormser GP. Lyme disease. In: Goldman L, Schafer AI, eds. Goldman Cecil Medicine. 26th ed. Philadelphia, PA: Elsevier; 2020.
What Is Lyme Disease? Symptoms, Causes, Diagnosis, Treatment, and Prevention. Joseph Bennington, Sanjai Sinha, 2020, 11
Lyme Disease Treatment. Joseph Bennington, Joseph Bennington, Castro Medically, 2018, February 23
How ticks spread disease, Content source: Centers for Disease Control and Prevention, National Center for Emerging and Zoonotic Infectious Diseases (NCEZID), Division of Vector-Borne Diseases (DVBD)
Shapiro ED. Borrelia burgdorferi (Lyme disease). Pediatr Rev. 2014;35(12):500-509

谷禾健康
说起蟑螂,大部分人都不太喜欢,甚至生理性恐惧…
你可能有100个讨厌它的理由,见到它就想消灭它,然而怎么都灭不完…


算起来,蟑螂早在3亿年前就已经存在了。蟑螂在线数据库中登记了4685种蟑螂(截止2020.8)。它拥有极强的适应力,亿万年来生生不息,广泛分布在世界各个角落。


可以忍受很长时间的饥饿和脱水。例如,美洲大蠊在没有食物和水的情况下可以存活1个月。
一些雌性蟑螂在交配后会吃掉雄性蟑螂。
蟑螂也可以通过单性生殖繁殖。
一些雌性蟑螂可以在一次交配后终生储存精子,使卵在没有雄性存在的情况下受精。
几乎所有的蟑螂都有内共生细菌,能够将尿素和氨水中的氮回收到氨基酸中。

的确,蟑螂可以通过粪便等方式传播潜在的致病菌,给我们造成了一定的困扰;然而,从另一方面考虑,尽管蟑螂可能携带致病细菌,但大多数菌株是无害的,细菌产生代谢物或蛋白质,具有潜在的工业应用价值。
那么,如何“变害为宝”,在生物技术应用中发挥价值?本文来为你详细介绍下。
超过99%的蟑螂不是寄居性害虫,而是生活在腐烂的树叶中、树皮下、石头下或土壤中,而这一巨大而未开发的资源很可能提供丰富的微生物多样性来源。
Blattabacterium 菌株 BPLAN基因组详细分析显示,13%的蛋白质编码基因用于氨基酸生物合成,7.8%用于辅酶的生产。昆虫宿主将尿酸(以尿酸盐的形式储存在尿细胞中)转化为尿素,然后由Blattabacterium 输入并转化为氨。
布拉德细菌酶谷氨酸脱氢酶(GdhA)催化将氨加到2-氧代戊二酸中,生成D-谷氨酸,然后可以将其转化为大多数其他氨基酸。
此外,蟑螂粪便中的真菌活性与微生物产生的化合物有关。
昆虫被认为是产生生物活性分子的微生物的重要来源,尤其是蟑螂,鉴于其独特的进化历史和弹性,它们是具有代谢能力细菌的家园。
蟑螂是人类住所和医疗环境中的危险害虫,是细菌感染的载体。两项经典的研究将卫生中心消灭蟑螂与较低的感染频率,特别是鼠伤寒沙门氏菌和肝炎发病率联系在一起。
有强有力的证据表明,幽门螺杆菌、分枝杆菌、铜绿假单胞菌、沙门氏菌和其他细菌能够通过蟑螂消化系统存活下来。它们通常以腐烂的有机物质为食,因此能传播致病菌。此外,蟑螂的一些细菌分离物显示出抗生素耐药性。
然而,没有直接证据表明蟑螂会传播医院感染,根除蟑螂与降低感染率之间的联系可能与更普遍的清洁度改善有关。最近一项强调蟑螂与传染病之间关系的综述得出结论,尽管蟑螂会增加风险,医院不应容忍蟑螂,但目前还没有确切证据证明蟑螂直接参与了传染病向患者的传播。
从蟑螂中培养出来的大多数细菌是变形菌门。
培养方法的一个主要优点是它有助于对分离的细菌进行基因组、转录组学、蛋白质组学和代谢组学分析,允许直接的生物技术开发。
另一方面,非培养方法可以更真实地了解微生物生态位的真实多样性,是分析细菌群落的金标准。然而,对数据的解释应谨慎,因为随着时间的推移,菌群组成的变化以及同一菌群个体之间的差异,很难对数据进行概括。
微生物组学研究结果受到生物因素的影响,如年龄、性别和健康状况;环境因素,如饮食、温度和湿度;以及分析方法(DNA提取、引物、测序、数据库和生物信息学流程)的差异,虽然影响程度较小。
据研究,蟑螂菌群主要的门是厚壁菌,其次是拟杆菌,最后是变形菌,三者加起来占细菌多样性的80%以上。
厚 壁 菌 门
厚壁菌在蟑螂的中肠最丰富( 43%),前肠30%,后肠34%,中肠的碱性更强(pH值6.1–8.9),大量嗜碱需氧细菌属芽孢杆菌、拟杆菌属和肠球菌在那里大量繁殖。

芽孢杆菌
芽孢杆菌属很容易从蟑螂中培养出来,特别是与蜡样芽孢杆菌和枯草芽孢杆菌有关的菌株。
分子微生物学研究表明,在蟑螂中广泛存在芽孢杆菌科的不同分支,包括芽孢杆菌属、地芽孢杆菌属Geobacillus、海洋芽孢杆菌属Oceanobacillus、尿素芽孢杆菌属Ureibacillus以及其他相关分类群,如类芽孢杆菌属Paenibacillus和赖氨酸芽孢杆菌属Lysinibacillus以及几个未分类群。
蜡样芽胞杆菌的丝状形态被称为节状体,附着在肠道上皮细胞上。蜡样芽孢杆菌和相关菌,如炭疽芽孢杆菌和苏云金芽孢杆菌可以分泌裂解酶和毒素,可在人类和其他动物中引起疾病。
蜡样芽胞杆菌B1分离自克氏芽胞杆菌Blaberus craniifer, 对马德拉大蠊具有高致病性,磷脂酶C对这种作用负责。
从蟑螂中分离出的枯草芽孢杆菌BGI-1菌株,对球孢白僵菌Beauveria bassiana表现出很强的杀菌活性。
另一种从Pe. americana分离出来的芽孢杆菌菌株29K,在其他芽孢杆菌菌株中表现出最强的角质溶解和蛋白水解活性,在7天内完成羽毛消化。
由此我们可以看到蟑螂芽孢杆菌的潜力,特别是生物活性代谢物和工业上有价值的酶的生产,以及作为生产重组蛋白的平台。
葡萄球菌
金黄色葡萄球菌是最常见的分离种。葡萄球菌大量存在于樱桃蟑螂的后肠中,其他蟑螂中较少。
虽然金黄色葡萄球菌是一种共生细菌,无症状地寄居在约30%的人类群体的皮肤和口腔粘膜上,但它也能获得毒力并引起危险的感染。
蟑螂体内金黄色葡萄球菌的显著存在,使蟑螂有了传播病原体的坏名声,尤其是一些医院蟑螂中分离出了抗生素抗性金黄色葡萄球菌菌株。
乳杆菌
乳杆菌目在蟑螂中普遍存在,特别是肠球菌属和链球菌属。乳酸杆菌属是东方蜚蠊和Pe. americana的一个属。
在无培养方法中,乳杆菌科在枯叶蟑螂Ergaula capuchina和 Byrsotria fumigata 中特别丰富,占40%以上。
肠球菌和乳酸杆菌是常见的肠道细菌,尽管它们的确切作用尚不清楚,但它们可能通过将糖类转化为易于吸收的乙酸盐和乳酸来提高食物的消化率。
一些肠球菌是与医院感染相关的条件致病菌,在昆虫中,它们转移到血淋巴与疾病有关。另一方面,用肠球菌或乳酸杆菌喂养昆虫可以防止苏云金芽孢杆菌引起的死亡。
肠球菌可以产生细菌素来抑制竞争细菌的生长
并且由于它们自然存在于许多手工食品中,因此它们可以直接用作发酵剂培养物或纯化抗生素肽的来源。
例如, 乳酸链球菌肽是一种授权食品防腐剂,用于香肠、奶酪和其他肉类和奶制品。在食品加工过程中,它是安全的、耐热的,但可被胃蛋白酶和胰蛋白酶降解,因此对天然肠道微生物没有影响。
从尼日利亚一只蟑螂中分离出的粪肠球菌E18菌株被证明能产生肠毒素或具有强抗菌活性的细菌素混合物。
我们知道从蜜蜂中分离出的乳酸杆菌已经被提议作为替代益生菌,那么类似的概念也适用于蟑螂的乳酸杆菌。
梭状芽孢杆菌
蟑螂中肠和后肠的缺氧部分是厌氧菌的家园,尤其是梭状芽胞杆菌,梭菌已从Blatta orientalis,Eu. posticus 和 Pe. americana 分离。其他还有属于梭状芽孢杆菌科(梭菌属、Paeniclostridium、Paraclostridium、八叠球菌Sarcina)、真杆菌科(真杆菌属)、毛螺菌科(Blautia、丁酸弧菌属Butyrivibrio、粪球菌属Coprococcus)、颤螺菌科Oscillospiraceae(粪杆菌属、瘤胃球菌属)、Peptoniphilaceae(Finegoldia)和消化链球菌科(梭状芽孢杆菌属、消化链球菌属)
另外还有两个不太常见的厚壁菌纲也从蟑螂身上培养出来的,Tissierellia、Erysipelotrichia。
B. blatticola是一种厌氧杆状细菌,能从D-葡萄糖中产生甲酸盐、乙醇和乙酸盐。
此外,梭状芽孢杆菌目的毛螺菌科和疣微菌科在所有蟑螂的后肠中有特别好的代表性(5-28%)。
有趣的是,韦荣球菌科被认为是畜牧业中益生菌的潜在来源,因为它减少了瘤胃中乳酸的积累,提高了整体生产力,同时也阻止了致病菌在猪和鸡的定殖。
克里斯滕森菌科(Christensenellaceae)是2012年根据从人类粪便中提取的一种物种确定的,它是当今研究的重要焦点,因为它能促进健康,被认为是一种益生菌。这个菌也已通过分子方法在蟑螂(蜚蠊)中检测到,但尚未从蟑螂中培养出。
从蟑螂中分离出的一些梭状芽孢杆菌菌株可以降解羧甲基纤维素,并可用于生物炼制和生物转化过程,将廉价且丰富的纤维素转化为可发酵糖,然后将其转化为乙酸、丙酮、丁醇、乙醇,或其他产物。
富含复杂碳水化合物(如麸皮)的饮食可以提高蟑螂肠道中氢气的生成。这可能是由大量梭菌介导的,也可能是在拟杆菌的帮助下。
由CO2还原产生的乙酰化也发生在蟑螂的内脏和梭状芽孢杆菌Lowell cluster A中,它们是这种转化的部分原因。利用这种过程捕获大气中的二氧化碳有助于减缓气候变化。
拟 杆 菌 门
非培养方法研究表明,拟杆菌门的相对丰度仅次于厚壁菌门。但在某些物种中,如大蠊属和小蠊属的室内蟑螂,拟杆菌目通常是最突出的一门。拟杆菌物种优先定居在蟑螂后肠,其特点是缺氧和还原。拟杆菌是非产孢的专性厌氧菌。
拟杆菌目在蟑螂中最丰富,最常见的科是以树叶和木材为食的蟑螂中的紫单胞菌科Porphyromonadaceae,以及杂食性蟑螂中的理研菌科Rikenellaceae.
拟杆菌属存在于以落叶为食的蟑螂的中肠和后肠,但在以木材为食的蟑螂中尚未发现,这表明这些细菌能够消化纤维素、淀粉和果胶等复杂多糖。
对蟑螂来源的拟杆菌、Dysgonomonas、Paludibacter、Parabacteroides分离株的全基因组测序和体外试验证实了这一发现。这些细菌产生强大的降解酶,在食品/饲料、纺织、造纸和化妆品行业以及农业中具有潜在的应用。
从蟑螂后肠分离得到黄色金黄杆菌菌株FR2。Blattabacterium属于黄杆菌目,蟑螂中现存的代表黄杆菌目的可培育细菌很有趣,因为它们可能是Blattabacterium进化的中间形式。
此外,黄杆菌在工业生物技术的背景下是有用的,因为它们产生柔红霉素色素以及水解酶。
变 形 菌 门
变形菌是蟑螂中最常被培养的细菌,其中丙型变形菌纲尤其丰富。变形菌在前肠最为丰富(~ 48%),中肠(~ 31%)和后肠(~ 19%)较少,可能反映了前肠的酸性和需氧环境(pH 5.0–6.8)。

根据分子研究,肠杆菌目(特别是肠杆菌科)最丰富,其次是黄单胞菌目和假单胞菌目。
沙雷氏菌
沙雷氏菌是蟑螂中最常见的分离属。共有21种得到验证,其中5种(液化沙雷氏菌Serratia liquefaciens、粘质沙雷菌Serratia marcescens、气味沙雷菌Serratia odorifera、普城沙雷菌Serratia plymuthica和深红沙雷菌菌Serratia rubidaea)已被分离。
然而,所有病例的鉴定都是基于表型和生化特征的,并不像16srRNA基因测序那样精确。在健康、生病和死亡的昆虫中都发现了沙雷菌,它们是正常昆虫的菌群。
它们也可能是条件致病菌,尤其是粘质沙雷菌通常在拥挤的群体中引起红色疾病。粘质沙雷菌分泌的几丁质酶和蛋白酶在昆虫血腔中是剧毒的。
嗜虫沙雷氏菌Serratia entomophila通过表达质粒编码的Sep毒素(抑制消化酶的分泌)介导引起新西兰蛴螬的琥珀病。
其他沙雷氏菌物种显然是共生的,例如,沙雷氏菌共生菌是蚜虫中布氏沙雷氏菌的共生菌,为宿主提供必需的代谢物。
肠杆菌科的其他成员,尤其是柠檬酸杆菌属、肠杆菌属、埃希氏菌属和克雷伯氏菌属经常从蟑螂中分离出来,而其他属则不太突出。虽然许多肠杆菌科细菌可以成为重要的人类病原体,但生活方式广泛,基因型和表型多样,因此,致病性无法从分类学推断。
昆虫源性肠杆菌科的生物技术应用包括它们向害虫传递有毒基因的能力,它们被用作植物刺激源和抗菌素代谢物及其在昆虫饲养设施中的用途。Shimwellia blattae最初是从东方小蠊以及后来从其他蟑螂中分离出来的,有趣的是,它可以从头合成钴胺素,并已被开发为维生素B12的生物技术来源。
假单胞菌目
不动杆菌属和假单胞菌属属于假单胞菌目,常从蟑螂中培养出来,而培养方法的研究也表明,它们在潜伏蟑螂中非常丰富(相对丰度>16%)。
由于普遍存在抗生素耐药性,鲍曼不动杆菌Acinetobacter baumanii 或铜绿假单胞菌引起的人类感染在临床实践中难以治疗,但在从蟑螂分离的铜绿假单胞菌菌株中未发现耐药性证据。
假单胞菌在生物技术中非常重要,不仅因为它们产生生物活性代谢物,而且还用于生物修复,是工业过程中强大的溶解酶(蛋白酶、脂肪酶)的来源。
从东方小蠊分离到的嗜麦芽乳杆菌OG2可降解有毒有机氯农药硫丹,将其用作硫源,并将其转化为毒性较低的代谢物。
醋杆菌科
醋杆菌科在昆虫中广泛分布,这一分支菌在工业氧化反应中是有用的(如山梨糖和醋酸的生产),所以蟑螂衍生的醋杆菌科将来有可能被用于这一用途。
鞘氨醇单胞菌
鞘氨醇单胞菌 Sphingomonas paucimobilis 是一种与医院感染相关的条件致病菌,也被应用于生物修复,并且可以合成结冷胶。
粪产碱菌
粪产碱菌Alcaligenes faecalis存在于昆虫病原线虫体内,注射到大蜡螟的血腔内可造成损伤。
昆虫源Alcaligenes表现出抗真菌活性,并与无色杆菌属(Achromobacter)共同产生生物活性特异性代谢产物,类似于嗜酸杆菌Xenorhabdus和发光杆菌Photorhabdus.
脱硫菌
在杂食性蟑螂的后肠,尤其是脱硫菌目和脱硫弧菌目对生物技术过程非常有用,因为它们将硫酸盐还原为硫化物。已应用于受污染的土壤中,降低了可溶有毒镉的生物有效性,而镉仍不溶于硫化物。
放 线 菌 门
放线菌是重要类,因为链霉菌科产生一系列特殊的代谢产物。该门通常在蟑螂中大量存在(相对丰度为13-21%),但在以落叶为食的物种中则较少,双歧杆菌目和棒状杆菌目是最普遍的。
放线菌也存在于木虱蟑螂的产物中,但数量较少(1.7-4.1%)。分枝杆菌是一个经常被培养的属,并且因为一些物种是人类致病菌,能够通过蟑螂消化系统存活下来,蟑螂与分枝杆菌病的传播有关。
微球菌属、棒状杆菌属和角质杆菌属也常从蟑螂中培养出来。值得注意的是,白蚁是链霉菌科细菌的丰富来源,它们具有保护和维持菌落的功能,但从蟑螂中分离出的物种很少。首次报道的与蟑螂相关的链霉菌种被发现由反复感染蟑螂的线虫携带,但“leidnematis链霉菌”这一物种并未得到验证,目前在任何采集中都没有发现。
球形链霉菌WA5-2-7是近年来从蟑螂肠道培养出来的。并被发现与白化链球菌的昆虫分支相匹配。从40 L球形芽孢杆菌WA5-2-7培养液中纯化出具有抗耐甲氧西林金黄色葡萄球菌(MRSA)活性的抗生素放线菌素X2和柯利霉素A。强调蟑螂相关链霉菌的生物技术潜力。
梭 杆 菌 门
梭杆菌门主要见于以木材为食的蟑螂的中肠,相对丰度为2-7%,杂食性蟑螂的后肠中相对丰度为0.2-6.3%。
梭杆菌与拟杆菌相似(它们是革兰氏阴性、无孢子、厌氧菌),但根据16srRNA序列,它们聚集在不同的组中。它们是人类口腔和肠道的正常菌群,但有些物种是致病的,例如,坏死梭杆菌引起口咽感染,称为Lemierre综合征,而F.nucleatum与结肠癌有关。
F.necrophorum从Eu. posticus分离出坏死菌。这种蟑螂也是多形性物种变种的家,在它的生命周期中在杆状和球菌状之间转换。
梭杆菌用于生产琥珀酸的生物技术过程中,也是生物转化应用中作为酶的来源。
螺旋体门(Spirochaetes)
从一些蟑螂中分离出螺旋体门的螺旋形和一般厌氧菌,特别是钩端螺旋体属和密螺旋体属是相关的,因为这些属的一些物种是公认的人类病原体。
分子生物学研究表明,在蟑螂C. punctulatus和E. capucina的后肠中有大量的螺旋体,相对丰度达到8%左右,Py. surinamensis的中肠也有。
在从食木蟑螂C.punculatus分离出菌株JC227后,提出了一个新的属(碱性螺旋体),并在该属中添加了其他嗜碱螺旋体,其中包括从白蚁中分离出的一个物种。
碱性纤维素纤维素JC227可在高pH值和高盐浓度下降解纤维素,因此适用于洗涤剂工业中纤维素材料的生物转化。
浮霉菌门(Planctomycetes)
浮霉菌存在于以木材为食的蟑螂和杂食性蟑螂的后肠中,其相对丰度为0.2-8.4%。
浮霉菌能产生多种特殊的代谢物,发现具有未知代谢潜力的新物种可能会在医药和农药工业中带来新的应用。
疣微菌门(Verrucomicrobia)
据培养方法研究,该门在木食和杂食性蟑螂中有所代表,但从蟑螂中只培养出一种疣微菌门的单一菌株。
从蟑螂Sh. lateralis后肠中分离到一种微需氧植物黄褐假丝酵母(Ereboglobus luteus)。这种细菌可以代谢果胶,但不能在好氧环境下发育。
疣微菌是厌氧污泥降解群落的主要组成部分,因此可以开发用于厌氧生物炼制。
大多数与蟑螂相关的细菌都属于变形菌,厚壁菌和拟杆菌,合起来占微生物总数的80%以上。
在蟑螂中易于培养的细菌中,大多数研究集中在革兰氏阴性大肠菌,葡萄球菌和分枝杆菌的分离上,因此,蟑螂被认为是不健康的害虫,对健康构成威胁。的确,蟑螂可在粪便中传播病原体,应从食物制备区域和医疗机构中消除。
但是,蟑螂也可以是生物技术上有用有前途的微生物资源,因为蟑螂与细菌共同进化,因此与土壤细菌相比,它们可能产生毒性较小的抗菌剂,以确保宿主存活。
当然也许更重要的是扩大微生物在生物精炼厂,生物修复以及药物和农用化学产品以及工业酶的开发中的生物技术应用。
参考文献:
Lee B, Hwang JS, Lee DG (2019) Induction of apoptosis-like death byperiplanetasin-2 in Escherichia coli and contribution of SOS genes.Appl Microbiol Biotechnol 103(3):1417–1427
Chen Z, Ou P, Liu L, Jin X (2020) Anti-MRSA activity of actinomycinX2 and collismycin a produced by Streptomyces globisporus WA5-2-37 from the intestinal tract of American cockroach (Periplanetaamericana). Front Microbiol 11:555
Shi Y-M, Bode HB (2018) Chemical language and warfare of bacterialnatural products in bacteria–nematode–insect interactions. Nat ProdRep 35(4):309–335
Ali SM, Siddiqui R, Ong S-K, Shah MR, Anwar A, Heard PJ, Khan NA(2017) Identification and characterization of antibacterial compound(s) of cockroaches (Periplaneta americana). Appl MicrobiolBiotechnol 101(1):253–286
Guzman Juan,Vilcinskas Andreas,Bacteria associated with cockroaches: health risk or biotechnological opportunity?[J] .Appl Microbiol Biotechnol, 2020
Rosas T, García-Ferris C, Domínguez-Santos R, Llop P, Latorre A, MoyaA (2018) Rifampicin treatment of Blattella germanica evidences afecal transmission route of their gut microbiota. FEMS MicrobiolEcol 94(2):fiy002