 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

“肚子里有蝴蝶”这句话的词源最早出现在弗洛伦斯·匡威(Florence Converse) 于 1908 年撰写的《祈祷之家》一书中。一百多年来,这句话一直被广泛用作成语,它描述了一个人面对压力或惊心动魄的事件时的不安感。
扑腾的蝴蝶不仅隐喻我们体内扑动的感觉,它也是一个术语,描述了一个巨大事件的一系列连锁反应中的最初动作。
特别令人迷惑和应该注意的是,人们将这种感觉描述为起源于肠道而不是其他地方的东西。二十多年来,科学家们一直在追寻这些“蝴蝶”及其起源,他们意识到这种成语可能与受胃肠道(GI)共生微生物影响的“感觉”有关。这些年科学家们在了解共生肠道微生物在人类生理学和病理生理学中的重要性方面取得了惊人的发现。

肠道中的共生微生物通过“肠-脑轴”对宿主行为产生各种影响。 “肠脑轴”是胃肠道系统和中枢神经系统之间的远端连接;它由跨越两个身体系统的复杂信号转导途径组成(这方面详细的文章可以翻看以往谷禾发的相关文章)。肠道细菌及其代谢物发挥“蝴蝶效应”,将信号传播到大脑,最终改变宿主的行为。
下丘脑-垂体-肾上腺 (HPA) 轴是压力调节的经典途径,是将共生肠道微生物、胃肠道、大脑和行为相互连接的最有前途的途径之一;这也反映了肠道内的颤动感。此外,压力信号可以通过迷走神经和传入/传出神经元连接传输到大脑。
面临威胁时通常会感到压力、紧张、担心和焦虑。最近的研究结果表明,应激反应和肠道微生物会相互影响宿主的许多行为结果。为了了解共生肠道微生物在应激调节和反应中的作用,许多研究使用限微生物动物、16S rRNA 测序、宏基因组测序、粪便微生物群移植、抗生素治疗和益生菌来揭示宿主-微生物之间相互交织的相互作用。
本文重点关注啮齿类动物作为模式生物,探索肠道微生物群、压力和行为之间的因果关系。还纳入了一些临床观察结果来深入说明问题。
✓
心理压力是一个全球性问题,影响着全世界至少三分之一的人口,并增加了患多种精神疾病的风险。这几年越来越多的证据表明,肠道及其栖息的微生物可以调节压力和与压力相关的行为异常。
当面临厌恶压力刺激时,压力感知、整合和应对是大脑的重要功能。压力相关信息被整合到感觉皮层,然后将信号发送到边缘系统、下丘脑和脑干,以激活 HPA 轴以及交感神经和副交感神经。
交感神经和副交感神经传播应激反应以引起体内各个系统的快速适应。检测来自外部环境的压力信号的大脑区域与参与情绪的大脑区域重叠,从而协调一致地协调动物或人类的压力反应。
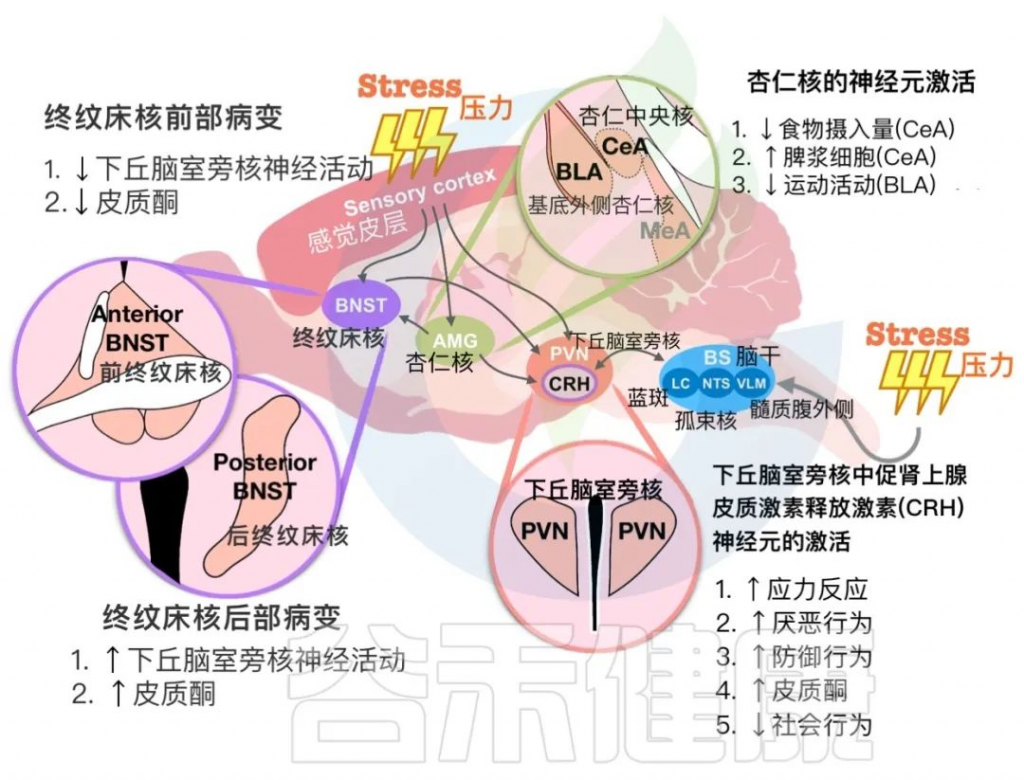
下丘脑室旁核的核心作用:整合压力信号和调节应激反应
在参与调节应激反应的大脑区域中,下丘脑室旁核 (PVN) 在整合来自环境刺激的信号并进一步触发下游神经传递方面发挥着核心作用。 PVN 接受来自边缘系统和脑干的神经支配,调节 HPA 轴并整合应激后的反应。 PVN 中分布着各种类型的神经元。主要是,PVN 和其他相关大脑区域中的促肾上腺皮质激素释放激素 (CRH) 神经元对不同形式的压力做出反应。
注:促肾上腺皮质激素释放激素 (CRH) 是一种由下丘脑室旁核 (PVN) 产生的神经肽。它是下丘脑-垂体-肾上腺轴 (HPA轴) 中的关键调节因子之一。CRH的主要功能是刺激垂体前叶分泌促肾上腺皮质激素 (ACTH)。ACTH进而刺激肾上腺皮质分泌皮质醇和其他类固醇激素。CRH的释放通常受到多种刺激因素的调控,如应激、体内环境的变化和生物节律。CRH的异常释放与许多疾病和症状有关,如抑郁症、焦虑症和肾上腺皮质功能不全等。
在下图中,总结了PVN中的CRH神经元与终纹床核(BNST)和杏仁核细胞在应激反应中相互作用的发现。这些大脑区域对于确定循环皮质酮水平和动物行为输出至关重要。
下丘脑室旁核(PVN)与其他大脑区域对压力暴露的反应
doi: 10.1186/s12929-023-00984-6
注:循环皮质酮是指在血液中循环的一种皮质酮激素,也被称为血浆皮质酮。皮质酮是由肾上腺皮质分泌的一种类固醇激素,它在机体的应激反应中起着重要的作用。循环皮质酮的水平在应激反应中通常会升高,它可以促进葡萄糖的产生、调节蛋白质和脂肪代谢,并参与免疫和炎症反应。
作为应激反应的中枢,PVN CRH 神经元可以被应激刺激触发,随后引发多种内在行为反应。
研究表明,在迫在眉睫的严峻任务中可以检测到 PVN 中 CRH 神经元活动的增加,这是一种模仿来自天空的捕食者威胁的方法,其中大多数小鼠表现出逃避行为,对迫在眉睫的阴影几乎没有冻结反应。
注:冻结反应是指在面对威胁或危险时,个体表现出明显的静止和冻结的反应。这种反应是动物和人类在面对潜在的威胁时的一种自我保护机制。当个体感知到威胁时,自主神经系统会释放肾上腺素等应激激素,导致身体进入一种高度警觉和紧张的状态。在这种状态下,个体可能会减少运动、停止呼吸、固定目光等,以最大程度地减少被威胁的可能性。这种反应在野生动物中常见,并且在人类中也可以观察到,尤其是在面对极端的恐惧、惊吓或创伤性事件时。增加冻结反应有助于个体在危险环境中保持相对安全,但在某些情况下也可能导致无助和无法应对的感觉。
PVN中的CRH神经元:与逃避行为和冻结反应的调节有关
沉默 PVN CRH 神经元会减少逃避行为,但会增加冻结反应。此外,PVN CRH 神经元预测迫在眉睫的威胁并编码压力可控性。同样,另一项研究表明,PVN 中的 CRH 神经元会对厌恶刺激做出反应,例如强迫游泳、尾巴约束、头顶物体、迫近,甚至腹腔注射。
PVN中的CRH神经元:与易感内脏疼痛的关联性
在一项研究中,与弹性小鼠相比,在小鼠经历母体分离后,易感内脏疼痛的小鼠在下丘脑室旁核(PVN)中显示出c-Fos阳性的促肾上腺皮质激素释放激素(CRH)神经元数量增加。
c-Fos是一种早期基因转录因子,它在神经元受到刺激后会被激活,并表达出来。因此,c-Fos的阳性表达可以作为神经元活动的标志。
在这种情况下,研究发现,在经历母体分离后易感内脏疼痛的小鼠中,PVN中的CRH神经元数量增加。这表明这些神经元在应激反应中被激活,并可能参与调节内脏疼痛的感受和处理。
PVN中的CRH神经元:在光遗传学刺激下对小鼠行为和压力信号传递的调控作用
研究发现,通过光遗传学刺激PVN 中的 CRH 神经元,可以增加小鼠的自我梳理行为,并改变其他家庭笼行为,类似于经历了足部电击的小鼠。通过增加环境的威胁水平,可以减弱刺激下丘脑下垂体后叶神经元的光遗传刺激对自我梳理行为的影响。研究还发现,从受压小鼠到未受压小鼠的压力信号传递需要激活两者的下丘脑下垂体后叶神经元。在社交互动测试中,刺激下丘脑下垂体后叶神经元会抑制社交行为并增加挖掘行为,同时导致皮质酮水平升高。
与此相反,并非所有的应激反应都与下丘脑下垂体后叶神经元有关。通过光遗传学激活下丘脑向腹外侧延髓的兴奋性投射,而不是下丘脑下垂体后叶神经元,可以在未经应激暴露的情况下在小鼠中重现应激诱导的高血糖现象。尽管如此,这些研究表明,当面临迫在眉睫的威胁时,下丘脑下垂体后叶神经元对于控制应激反应和行为至关重要。
BNST中CRH神经元:在应激反应调节中的作用
BNST(终纹床核)是连接与情绪有关的各个脑区的中继站。杏仁核-BNST和BNST-PVN回路参与应激反应调节。先前的研究表明,BNST由几个亚区组成,并向下丘脑下垂体发送不同的投射。在BNST回路中光遗传学激活基底侧杏仁核可以预防接受社交挫败应激的小鼠的焦虑行为。BNST的前部病变抑制了应激刺激后下丘脑和下丘脑-垂体-肾上腺轴的激活。
注:终纹床核是是应激反应神经回路中的关键节点,与身体的压力反应、焦虑和成瘾有关。BNST 损伤会改变与压力相关的皮质醇释放。
BNST后部损伤会增加急性束缚应激后下丘脑下垂体中的皮质酮水平和c-Fos阳性细胞数。应激暴露也会影响BNST的神经活动。捕食者应激、十字迷宫和束缚应激可增强BNST中CRH神经元的神经活动。然而,抑制BNST中的CRH神经元无法恢复应激引起的社交障碍,表明BNST可能受应激影响但不直接调节应激反应。
杏仁核:在压力和情绪调节中的作用
杏仁核是一个关键结构,与情绪处理和对压力的生理反应相关。杏仁核的各个子区域参与不同的机制来调节不同类型的压力源暴露。急性心理压力会增加内侧杏仁核 (MeA) 中 c-Fos 阳性细胞的数量,并增强中央核中的抑制性神经元活动杏仁核 (CeA)。
然而,杏仁核和 PVN 之间有限的直接连接可以调节应激反应。应激引起的免疫失调与 CeA 中不同的神经元群有关。确定了 CeA/PVN 和脾神经之间在应激相关免疫调节中的回路。人工激活 CeA 和 PVN 中的 CRH 神经元可增加脾浆细胞的形成。
将小鼠置于高架平台上不仅增加了CRH神经元活性,还促进了脾浆细胞形成,表明CeA和PVN参与了应激诱导的免疫反应。当小鼠暴露于捕食者气味时,抑制 mSTN 中的 CRH 神经元会增加冻结和隐现行为的潜伏期,并缩短适应捕食者威胁的快速眼动-睡眠反应的持续时间。
其他大脑区域的CRH神经元:在应激反应中发挥作用
捕食者刺激促进小鼠从快速眼动睡眠中快速唤醒。 最近的一项研究。研究表明,在快速动眼睡眠期间,内侧底丘脑核 (mSTN) 中的 CRH 神经元因外部刺激而被捕食者气味暴露所激活焦虑和抑郁样行为 和 BLA 中的神经活动,从而增加食物摄入量。
其他研究还表明,外周注射脂多糖 (LPS) 会增加 CeA 中的神经活动,从而减少食物摄入。CeA 病变在全身注射白细胞介素 (IL)-1 后阻止了 CRH 和促肾上腺皮质激素 (ACTH) 的释放。
总体而言,压力暴露会触发 PVN CRH 神经元与其他大脑区域对各种刺激做出反应。 PVN CRH 神经元似乎是连接其他大脑区域以启动压力反应和应对机制的中枢。了解应激反应的中心通路对于发现肠道微生物调节的信号通路非常重要。
✓
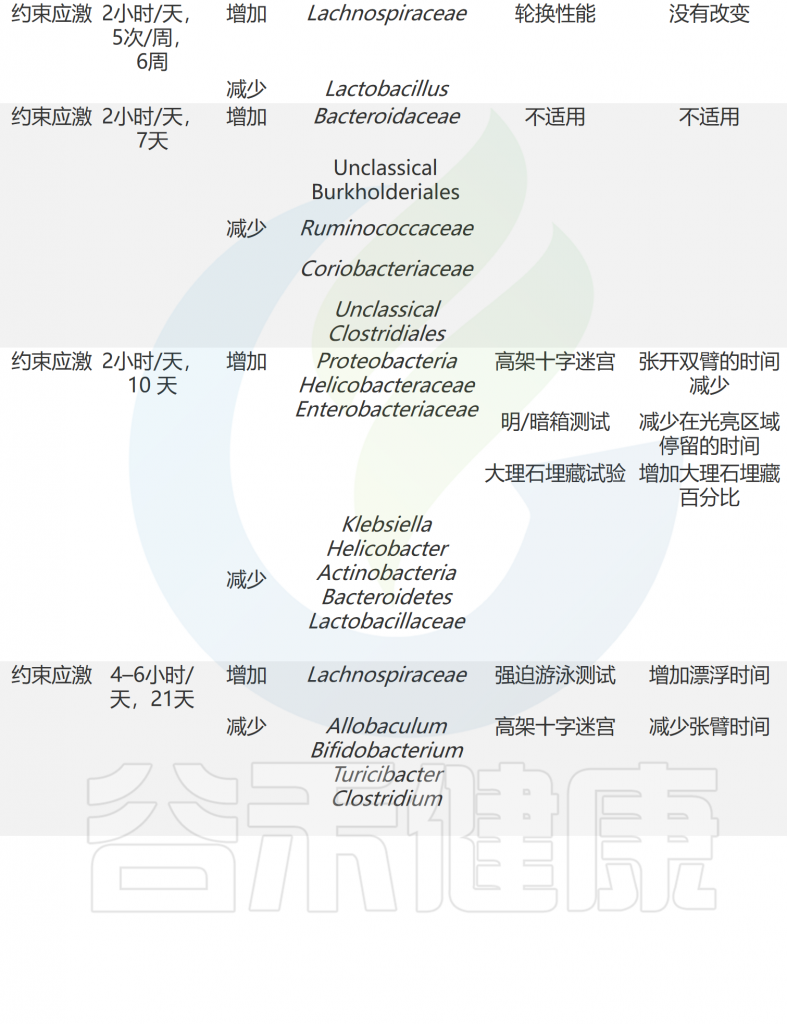
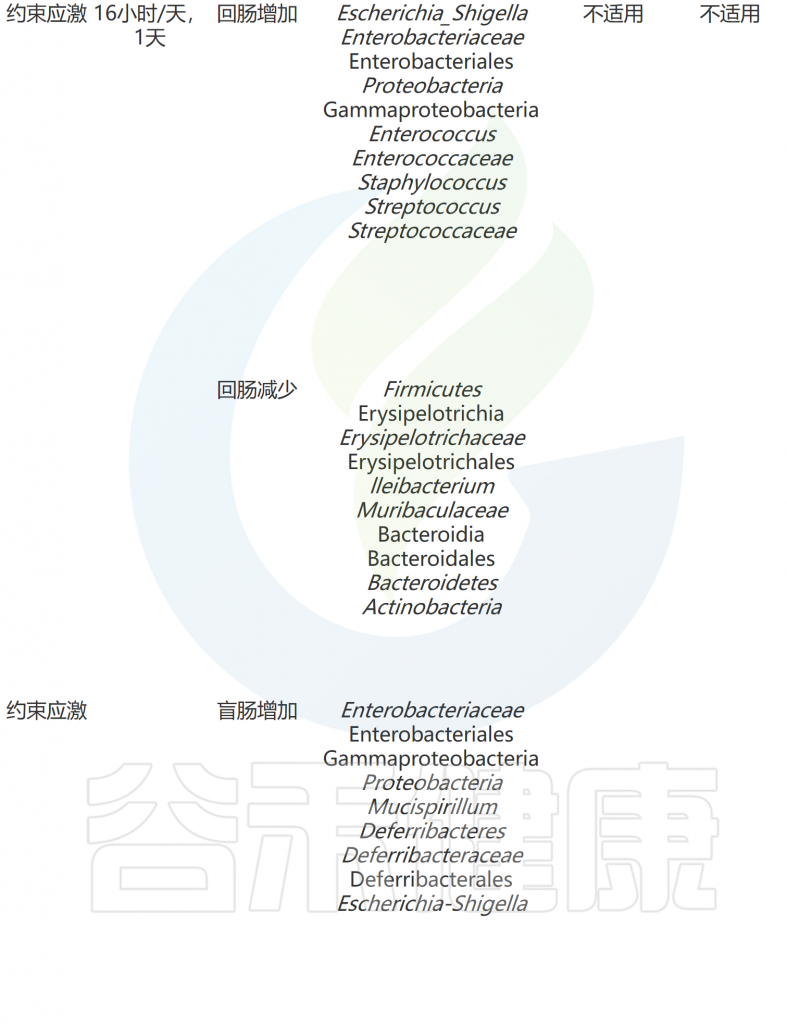
压力应对机制和适应对于生存至关重要。动物以多种方式应对压力,包括生理和行为的变化。有趣的是,科学家通过啮齿动物模型发现压力暴露会影响肠道微生物群(下表)。
急性和慢性应激条件下共生微生物组和行为的适应





doi: 10.1186/s12929-023-00984-6
不可预测的慢性轻度应激
不可预测的慢性轻度应激 (UCMS) 是一种实验条件,会引起类似于慢性且未解决的应激暴露的生理和神经变化。该实验条件下的小鼠通常表现出抑郁样行为,与抑郁症患者相似,但焦虑样行为没有明显变化。
有趣的是,改变后的厚壁菌门和软壁菌门(Phylum Tenericutes)在 UCMS 动物中得到一致观察。
注:软壁菌门是细菌界下的一个门,典型物种如支原体。
值得注意的是,UCMS中乳杆菌科细菌减少了 。 而且肠道核心菌属-粪球菌属(Coprococcus)在 UCMS 小鼠和人类抑郁症队列中减少。
慢性社会挫败压力
慢性社会挫败压力(CSDS)是一种社会心理压力,具有非凡的面部、结构和预测有效性。CSDS后的行为结局很复杂,包括抑郁样行为、焦虑样行为增加,以及社交行为减少。同样,CSDS转移的微生物组分析比UCMS转移的微生物组分析更复杂。
慢性社交失败压力是一种实验动物模型,用于研究社交压力对动物行为和生理的影响。这个模型通常用于研究抑郁症和焦虑症等精神疾病的机制和治疗方法。
在CSDS模型中,实验动物(通常是小鼠)被暴露于反复的社交失败和攻击中,例如与更强壮的同种异性动物进行斗争。这种持续的社交失败经历会导致动物出现一系列的行为和生理改变,包括社交退缩、抑郁样行为、焦虑、食欲和睡眠紊乱等。
研究人员一般使用CSDS模型来研究社交压力对大脑神经回路、神经递质系统和免疫系统的影响,以及潜在的治疗策略,例如抗抑郁药物和行为疗法。这个模型有助于理解社交压力对心理健康的影响,并为精神疾病的研究提供了一个可靠的实验基础。
研究发现CSDS后的行为结果是复杂的,包括抑郁样行为、焦虑样行为的增加以及社交行为的减少。同样,CSDS引起的微生物组轮廓变化比UCMS引起的更为复杂。CSDS后,拟杆菌门和Helicobacteracea 的数量增加。相反,厚壁菌门中的一些细菌,如瘤胃菌科(Ruminococcaceae),在CSDS后发生了改变,唯独乳杆菌没有变化。
社交过度交叉
社交过度交叉(SOC)是一种模拟增加住房密度的方法。SOC对行为的影响很小。小鼠只在高架十字迷宫中显示出速度增加和进入光/暗盒中的黑暗室次数增加。然而,SOC后微生物组的变化更为显著。SOC增加了Akkermansia muciniphila和Anaerostipes的相对丰度,并减少了Erysipelotrichaceae家族、Lactobacillus和Bacteroides acidifaciens(产酸拟杆菌)物种的相对丰度。
约束压力
约束压力是限制啮齿动物运动的经典方法。啮齿类动物在受到约束压力后会出现类似焦虑和抑郁的行为。虽然肠道中的许多细菌类群发生了改变,但厚壁菌门似乎是最容易被慢性束缚应激改变的细菌,尤其是乳杆菌科、毛螺菌科(Lachnospiraceae)。
WAS小鼠是一种实验动物模型,用于研究自闭症和相关神经发育障碍。WAS代表”Wiskott-Aldrich syndrome”,是一种罕见的遗传性免疫缺陷病,患者通常表现出免疫功能异常、血小板减少和湿疹等症状。
WAS小鼠是通过基因突变技术,使小鼠的WAS基因发生突变,从而模拟人类WAS综合征。这些小鼠在行为和神经发育方面表现出与自闭症相关的特征,例如社交互动减少、沟通障碍、刻板行为和认知功能障碍等。
WAS是一种强烈的心理压力因素,会破坏肠道上皮紧密连接的完整性。与其他压力模型相比,单独的WAS对行为产生的影响不大。然而,WAS会影响粪便微生物组,导致拟杆菌门减少、厚壁菌门增加和变形菌门增加。当分析小肠和结肠的内容物时,WAS小鼠的乳杆菌科和未分类的拟杆菌门数量较低。
根据我们调查和总结,微生物组对压力的适应可能受到不同类型的压力、压力暴露时间、动物来源、饮食等因素的影响(下表)。在接受不同类型压力暴露后,已报道有几个细菌分类在不同研究中存在差异。
压力暴露会下会减少的细菌:
相反,压力暴露会增加的细菌:
注:研究人员观察到Anaerofustis菌与睡醒后30分钟内唾液皮质醇水平升高呈正相关
注:代表菌种幽门螺杆菌(Helicobacter pylori)
在这些研究中,Lactobacillus物种是在压力暴露后最一致减少的细菌分类。其余菌谷禾会逐步为大家科普。
✓
对小鼠的研究表明,压力暴露会改变肠道微生物组的组成并改变细菌分类群,这引出了另一个问题:肠道细菌是否在压力反应调节中发挥积极作用?
无菌和抗生素处理模型:揭示肠道微生物对应激反应的影响
为了解决这个问题,无菌和抗生素处理的啮齿动物是“敲除”共生菌群的理想模型,无论是持续性还是有条件的。令人惊讶的是,大多数研究表明,啮齿动物中的微生物群耗竭会增强应激反应并增加应激激素皮质酮。皮质酮是啮齿动物中的一种糖皮质激素(人类中的皮质醇),它是应激反应时分泌的重要类固醇激素。
然而,并非所有的研究都显示无菌啮齿动物在暴露于应激条件后会表现出过度的应激反应和更高水平的皮质酮。在测量无菌啮齿动物基线皮质酮水平时,尚未得出一致的结果。这些研究发现,下丘脑-垂体-肾上腺皮质轴(HPA)是肠道微生物改变宿主生理的重要调节因子;这引发了肠道微生物在应激抑制中可能发挥关键作用的可能性。
无菌啮齿动物明确表明肠道微生物的耗竭会导致异常的应激反应,包括皮质酮增加、与应激信号传导相关的基因表达改变以及异常的行为后果。虽然无菌模型是研究微生物对应激应对机制影响的宝贵工具,但需要注意下无菌模型的局限性。
无菌模型和抗生素给药模型:在研究应激反应时的局限性
无菌动物从出生开始就缺乏与微生物的接触,与常规饲养动物相比,它们可能表现出几个发育差异。这些差异包括肠道形态的改变、未成熟的黏膜免疫系统、口服耐受发育的延迟、上皮细胞周转减缓以及神经内分泌功能的改变,尤其是在早期生命阶段。对于这些差异的警告意识到了无菌模型在人体生理背景下的人为性质。
与无菌小鼠模型并行,广泛采用抗生素给药,以阐明肠道微生物在应激反应中扮演的角色。抗生素给药是一种控制共生微生物清除时间的有力工具。但是,年龄、治疗时间窗口、抗生素种类和剂量都是获得与无菌啮齿动物一致结果的关键因素。
此外,由于胃肠道不同区域对不同种类肠道细菌有地理选择性,完全清除肠道微生物还是一个挑战。只有少数研究能通过给予抗生素在无菌小鼠体内成功再现应激反应增强情况。
两项研究采用了类似的广谱抗生素药物组合(ABX),显示ABX的慢性治疗会导致小鼠基础皮质酮水平升高以及社交暴露后也会升高。
另外两项研究显示,口服单一抗生素的急性或慢性给药会导致小鼠在受到急性应激后,皮质酮水平升高。
皮质酮
皮质酮是一种 21-羟基类固醇,由在11和21位被羟基基团和氧代基团取代的孕 4-烯组成在位置3和20。皮质酮是在肾上腺皮质中产生的皮质类固醇类型的21碳类固醇激素。它具有人类代谢物和小鼠代谢物的作用。
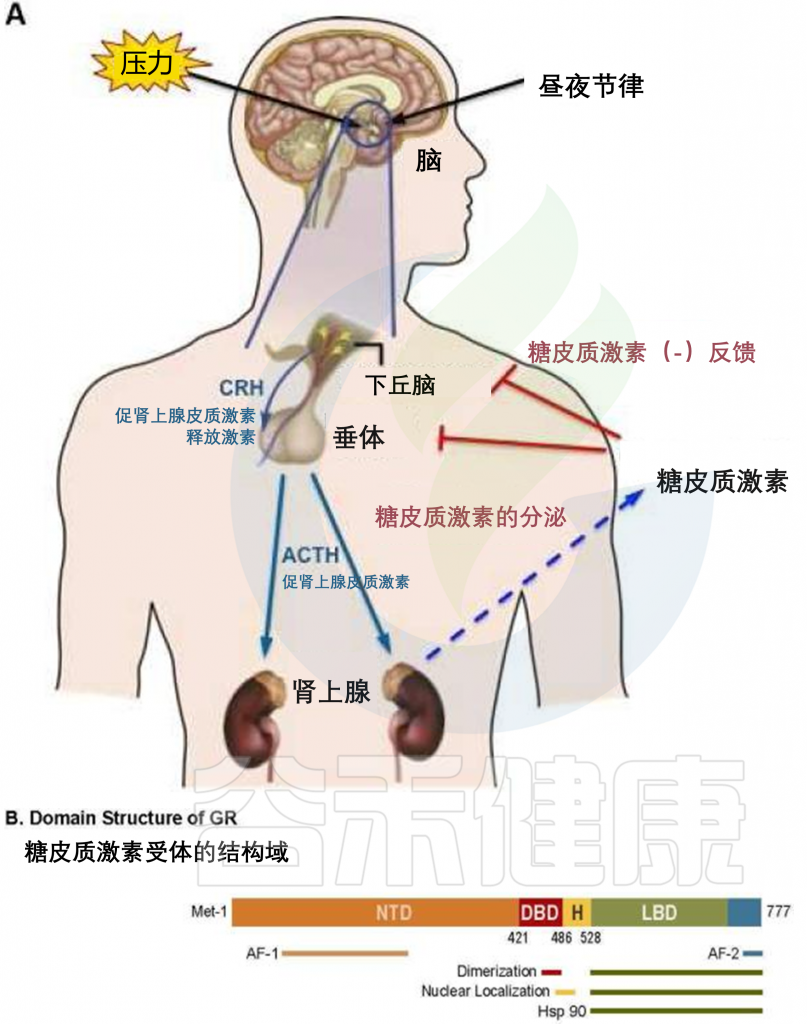
糖皮质激素(人类为皮质醇,啮齿类动物为皮质酮)是类固醇激素,由肾上腺根据生理信号和压力以昼夜节律方式合成和释放。
肾上腺释放糖皮质激素的昼夜节律受下丘脑-垂体-肾上腺 (HPA) 轴调节。来自视交叉上核 (SCN) 的输入刺激下丘脑的室旁核 (PVN),释放促肾上腺皮质激素释放激素 (CRH) 和精氨酸加压素 (AVP)。
这些激素作用于垂体前叶,激活促肾上腺皮质激素细胞,将促肾上腺皮质激素 (ACTH) 分泌到体循环中。
随后,ACTH作用于肾上腺皮质,刺激糖皮质激素的合成和释放。一旦从肾上腺释放到血液循环中,糖皮质激素就会进入靶组织,调节多种生理过程,包括新陈代谢、免疫功能、骨骼生长、心血管功能、生殖和认知。
由于其亲脂性,糖皮质激素不能预先合成并储存在肾上腺中,但必须在 ACTH 刺激下快速合成(使用许多酶促反应)。 HPA 系统内的这种前馈机制通过作用于垂体前叶和下丘脑内的糖皮质激素的负反馈来平衡,以分别抑制 ACTH 和 CRH 的进一步释放。
因此,人类血清皮质醇浓度在早晨达到峰值,在夜间最低。 HPA 轴是中央应激反应系统,负责应激反应的适应部分,试图恢复体内平衡。应激反应的不当调节与多种疾病有关,包括自身免疫性疾病、高血压、情感障碍和重度抑郁症。全身血清糖皮质激素水平由肾上腺糖皮质激素合成维持,但糖皮质激素的可用性在组织或细胞水平上进一步调节。
有趣的是,用抗生素对小鼠进行发育期治疗在各种条件下降低了皮质酮水平。对大鼠进行抗生素治疗也会降低皮质酮水平,表明存在模型依赖效应。其他研究表明,抗生素对皮质酮水平没有影响。虽然抗生素给药是研究肠道菌群对大脑和行为影响的有效方法,但在实验设计中需要仔细考虑。
✓
小鼠大脑应激反应失调的现象在无共生微生物的小鼠中被广泛观察到。一些研究调查了肠道微生物耗竭小鼠中糖皮质激素受体(GR)、CRH及下游信号通路的基因表达水平。发现在应激暴露后,无菌小鼠海马CA1区和颗粒回(DG)中观察到皮质酮水平升高和GR mRNA水平降低。
无菌小鼠下丘脑中CRF表达水平较高。皮质中GR基因表达水平较低,但下丘脑和海马中未观察到这种情况。
在基线条件下,GF小鼠海马中的GR下游信号通路,包括Slc22a5、Aqp1、Stat5a、Ampd3、Plekhf1和Cyb561等基因表达上调。
在WAS后,与SPF小鼠相比,GF小鼠海马CA1区的神经活动减少。
最近的研究发现,肠道共生微生物对于抑制宿主的应激反应和增加社交行为至关重要。在与陌生老鼠进行短暂社交互动后,无菌小鼠的应激激素皮质酮水平升高。
与此同时,多个与应对应激有关的大脑区域的神经活动也得到了上调,包括下丘脑旁室核(PVN)、海马齿状回(DG)和肾上腺背侧床核(adBNST)。
在成年阶段接受抗生素治疗的小鼠中,这种应激激素和神经活动的上调现象也得到了重复。此外,这项研究还表明,GF小鼠的海马(Arc、Fos、cJun、JunB、Egr1、Egr2、Gadd45b、Gadd45g、Bdnf)和下丘脑(Arc、Fos、Egr1)中的即时早期基因表达上调,而脑干(cJun、JunB、Egr1、Gadd45b、Gadd45g、Bdnf)中的即时早期基因表达下调。
然而,在基线和应激条件下,接受抗生素治疗的小鼠中应激相关基因表达并没有发生改变。只有在社交互动后,ABX小鼠的Crh基因表达上调,而在暴露于新环境后,ABX小鼠的Ucn基因表达上调。
以上小编概括起来就是:
最新的研究发现,肠道微生物对于调节宿主的应激反应和社交行为非常重要。在实验中,当无菌的小鼠与陌生的老鼠进行短暂的社交互动后,它们的应激激素皮质酮水平会增加。
在接受抗生素治疗的成年小鼠中,这种应激激素和神经活动的增加现象也得到了重复。此外,研究还发现,没有微生物的小鼠的海马和下丘脑中的即时早期基因表达上调,而脑干中的即时早期基因表达下调。
然而,在接受抗生素治疗的小鼠中,无论是在正常状态还是应激条件下,与应激相关的基因表达并没有发生改变。只有在社交互动后,接受抗生素治疗的小鼠的某些基因表达会增加。这些研究结果表明,肠道微生物对于调节应激反应和社交行为起着重要作用。
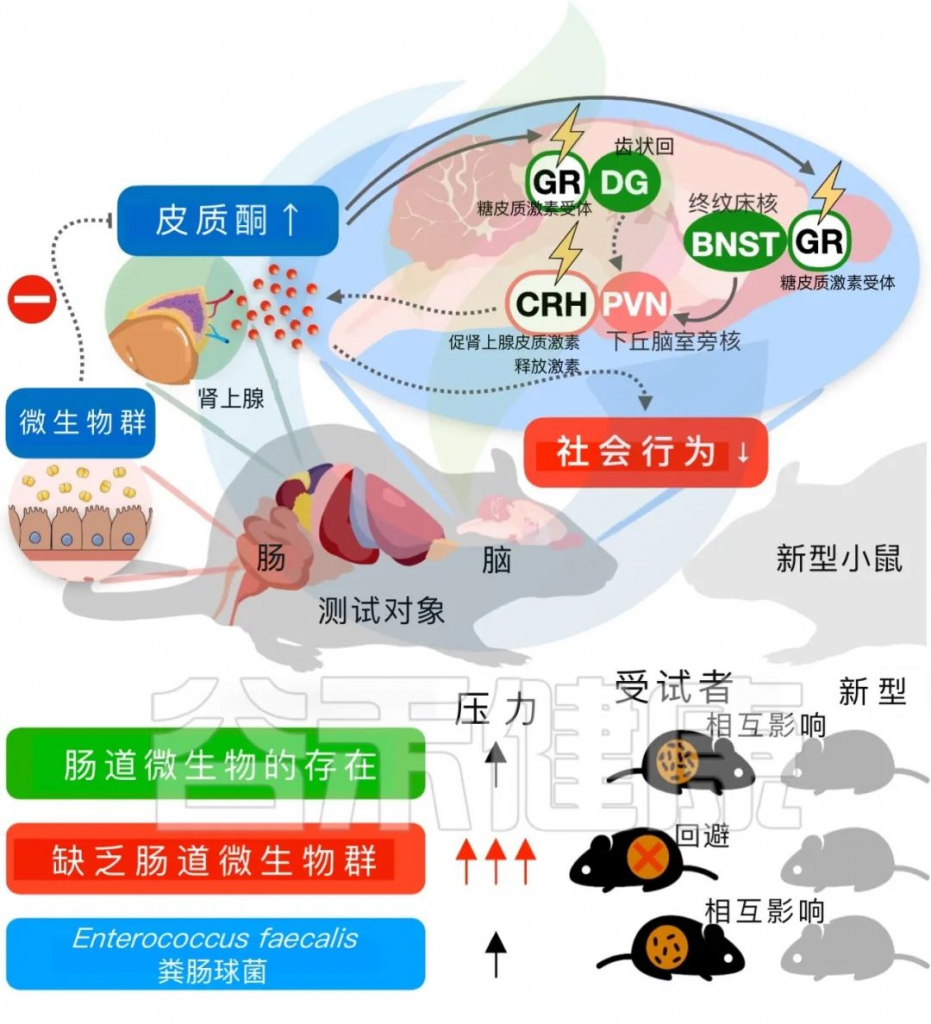
应激反应神经元的干扰可以改变小鼠的社交行为和皮质酮水平
为了进一步研究神经元在脑回路中的干扰是否能够改变小鼠的应激激素和社交行为,采用了基因消除策略和化学遗传学方法来干扰接受抗生素治疗的小鼠中的应激反应神经元。
该研究通过对接受抗生素治疗的小鼠进行基因消除和化学遗传学方法的干预,发现破坏应激反应神经元可以恢复社交缺陷并抑制皮质酮水平。特别是在下丘脑中基因消除GR会降低社交行为,并在社交互动后增加皮质酮水平。沉默PVN CRH神经元可以抑制皮质酮水平的增加并阻止社交缺陷的发展(下图)。
肠道共生微生物是抑制宿主应激反应神经元增加社会行为所必需的
编辑
doi: 10.1186/s12929-023-00984-6
PVN中CRH神经元活动的改变,可能是社交行为和应激反应失调的原因
与此相反,adBNST CRH神经元的这些效应在ABX小鼠中未观察到。此外,去肾上腺和药物阻断GR以及皮质酮合成可以恢复微生物缺失小鼠的社交互动行为。因此,该研究认为,在没有微生物组的小鼠中,社交行为和应激反应的失调更可能是由于PVN CRH神经元的神经活动改变,而不是应激相关基因表达的改变或PVN相关神经回路的结构改变。这项研究为共生菌通过特定途径驱动宿主行为的应激应对提供了证据。
神经科学技术的进步使科学家能够精确地研究受微生物组调节的神经回路,并进一步发现微生物组介导的与应激相关的神经回路的机制。
✓
压力条件下大脑中的神经元已经得到了广泛的研究,但肠道源的压力信号尚未完全阐明。糖皮质激素是一类肾上腺皮质激素,主要由肾上腺分泌,部分由肾上腺外系统分泌。
尽管肾上腺糖皮质激素在应对压力中起着作用,但肠道中肾上腺外糖皮质激素的生理作用仍未被理解。
肾上腺中的糖皮质激素合成途径涉及线粒体中的一系列步骤:
基于合成皮质酮的生化过程的基本区别,肾上腺外糖皮质激素的生理作用被认为与应对压力无关。
肠道上皮细胞对肾上腺外糖皮质激素的合成贡献
肠道上皮细胞是肾上腺外糖皮质激素合成的主要产生者。小肠、大肠和阑尾中表达了参与类固醇合成的关键酶,包括Cyp11a1和Cyp11b1。肠道糖皮质激素被认为对肠道微环境有贡献。研究表明,系统免疫挑战会上调糖皮质激素合成,并与肠道免疫细胞相互作用。炎症因子肿瘤坏死因子α(TNFα)和脂多糖(LPS)诱导的免疫系统激活促进肠道糖皮质激素合成。然而,白细胞介素1β(IL-1β)在体外模型中抑制肠道上皮细胞的糖皮质激素信号传导。
糖皮质激素在肠道屏障功能和免疫调节中的作用
糖皮质激素激动剂地塞米松可增加上皮细胞的屏障功能,但与细胞因子联合处理可能影响屏障功能。长期使用地塞米松可能影响上皮细胞通透性和基因表达,从而改变细胞的结构和功能。细菌内毒素LPS注射后,肾上腺外组织产生的皮质酮水平显著增加。因此,肾上腺外糖皮质激素主要具有免疫调节功能,与典型的应激信号有所不同。
肠道糖皮质激素合成在IBD中的降低及其与疾病发展的关系
肠道糖皮质激素合成在炎症性肠病(IBD)患者中表达水平显著降低,暗示肠道糖皮质激素合成障碍可能参与了IBD的发展。肠道糖皮质激素在炎症期间起到抑制肿瘤发展和生长的关键作用。然而,在肿瘤期间,Cyp11b1介导的糖皮质激素合成抑制抗肿瘤免疫反应,促进免疫逃逸。这为肿瘤治疗提供了有希望的治疗靶点。这些发现突显了肠道糖皮质激素合成在调节胃肠道疾病中的重要作用。
通过对无菌小鼠的研究,了解到失去菌群会如何改变肠道的应激反应。在基线、免疫挑战和应激暴露条件下,无菌小鼠的肠道应激相关基因表达发生改变。
在社会挫败和急性束缚应激条件下,糖皮质激素合成基因表达差异
在社会挫败和急性束缚应激条件下,比较了SPF(无特定病原体动物)小鼠和无菌小鼠的垂体、肾上腺和肠道的糖皮质激素合成基因表达。简而言之,社会挫败应激后,SPF小鼠的结肠中的Crh和Ucn2基因表达上调,而GF小鼠中则保持不变,部分原因是GF小鼠基线水平的增加。
有趣的是,无论GF小鼠基线水平是否增加,在社会挫败应激后,Hsd11b1的下调在SPF小鼠和GF小鼠中都观察到。另一项研究调查了GF小鼠肠道中糖皮质激素合成的肠段特异性。急性束缚应激和菌群的存在改变了GF小鼠回肠和结肠中Nr5a2(编码LRH-1)和Hsd3b2的表达。然而,与回肠相比,结肠中的糖皮质激素合成基因的改变更为显著。
HPA轴对糖皮质激素分泌的调节
doi: 10.1016/j.rdc.2015.08.002
这些研究表明:肠道糖皮质激素合成可能是肠道细菌调节应激反应的关键途径。肠道细菌如何影响下丘脑-垂体-肾上腺轴(HPA轴)的精确机制尚不清楚。肠道外肾上腺糖皮质激素合成是一个值得研究的有希望的途径。
✓
乳杆菌(Lactobacillus)
鼠李糖乳杆菌 (L. rhamnosus GG)
鼠李糖乳杆菌作为益生菌已经使用了几十年。
鼠李糖乳杆菌GG减轻了母体分离大鼠和高脂饮食小鼠中急性约束应激诱导的皮质酮。
鼠李糖乳杆菌JB-1通过膈下迷走神经以应变依赖的方式降低急性约束应激诱导的皮质酮水平。母鼠分离后,幼鼠立即表现出高皮质酮水平。
口服鼠李糖乳杆菌R0011菌株(95%)和瑞士乳杆菌R0052菌株(5%)可以防止皮质酮水平增加。
除了鼠李糖物种外,副干酪乳杆菌、植物乳杆菌、干酪乳杆菌和其他物种已被证明在各种模型中调节应激。
副干酪乳杆菌 (L. paracasei )
副干酪乳杆菌Lpc-37的给药慢性降低了由慢性日常约束应激引起的皮质酮水平。
副干酪乳杆菌HT6有效地防止了早期生活压力社会经历引起的大脑GR表达变化。
副干酪乳杆菌PS23和植物乳杆菌PS128降低了早期生活压力诱导的皮质酮水平。
干酪乳杆菌(L. casei)
干酪乳杆菌Shirota菌株降低了大鼠WAS诱导的皮质酮水平和人类学业压力诱导的皮质醇水平。
干酪乳杆菌DKGF7抑制慢性约束应激诱导的皮质酮。
植物乳杆菌 (L. plantarum)
植物乳杆菌CCFM8610和干酪乳杆菌M2-01-R02-S01(M2S01)在WAS和柠檬酸杆菌诱导的肠易激综合征(IBS)模型中抑制皮质酮水平。
植物乳杆菌LRCC5310、植物乳杆菌LRCC5314和天然乳杆菌BNR17抑制了慢性冷应激和高脂饮食诱导的皮质酮升高。
路氏乳杆菌(L. reuteri)
路氏乳杆菌胞外多糖抑制氨苄青霉素诱导的皮质酮。路氏乳杆菌ATCC-PTA-6475在伤口愈合过程中下调皮质酮水平。
路氏乳杆菌NK33、约氏乳杆菌(L. johnsonii)分离株、约氏乳酸杆菌BS15和粘膜乳杆菌NK41抑制固定应激诱导的皮质酮升高。
其他乳杆菌
发酵乳杆菌(L. fermentum)CECT 5716减轻了WAS和母体分离诱导的皮质酮水平。用热灭活的发酵乳杆菌和德氏乳杆菌(ADR-159)治疗可降低皮质酮的基线水平并增加社交能力。
L.helveticus NS8可减少慢性约束应激诱导的皮质酮。用L.farciminis ML-7处理成功抑制了部分约束应力诱导的HPA轴的激活。
然而,并非所有乳杆菌物种都对应激反应产生下调作用,包括副干酪乳杆菌N1115、植物乳杆菌LP12407、植物乳菌LP12418,唾液乳杆菌UCC118、干酪乳杆菌CRL431、唾液乳杆菌HA113。此外,与安慰剂组相比,著名的益生菌鼠李糖乳杆菌JB-1不能改变皮质醇并释放压力。
双歧杆菌 (Bifidobacterium)
除了乳酸杆菌外,双歧杆菌是另一个已被广泛研究用于应激调节的细菌属。
B. subtilis在GF小鼠中的单克隆作用减弱了约束应激诱导的ACTH和皮质酮水平的增加。
青春双歧杆菌NK98、青春双歧杆菌IM38和长双歧杆菌NK46抑制固定应激诱导的皮质酮升高。
假链状双歧杆菌B. pseudocatenulatum CECT 7765和双歧双歧杆菌B.bifidum G9-1(BBG9-1)减轻了母体分离引起的皮质酮水平升高。
B.breve菌株M2CF22M7和CCFM1025减少了UCMS诱导的皮质酮产生。
在一项临床研究中,长双歧杆菌1714的给药降低了应激诱导事件后的应激激素水平。
同样,并非所有双歧杆菌物种都参与应激调节,包括婴儿双歧杆菌35624、短双歧杆菌UCC2003、长双歧杆菌1714、短芽孢杆菌1205。
益生菌混合物
结合乳酸杆菌和双歧杆菌的益生菌混合物也具有应激调节作用。L.helveticus R0052和B.longum R0175(Probio’Stick®)降低了WAS诱导的皮质酮升高。
用益生菌瑞士乳杆菌、鼠李糖乳杆菌、干酪乳杆菌和长双歧杆菌联合治疗可抑制UCMS大鼠的ACTH和皮质酮水平。
然而,不同细菌相互作用的机制可能很复杂。相反,母体使用B. animalis subsp. actis BB-12®和Propionibacterium jensenii 702可以增加新生儿皮质醇的水平。
其他不常见的益生菌
其他不常用作益生菌的细菌也在较小程度上调节应激诱导的激素。GF小鼠中大肠杆菌而非脆弱拟杆菌的单克隆作用降低了皮质酮的基础水平。给予克雷伯菌和大肠杆菌增加了皮质酮的基线水平。吴等人用抗生素(氨苄青霉素、万古霉素和甲硝唑;AVM)联合治疗小鼠,发现与全谱ABX治疗的小鼠相比,社交行为得到了保护,应激反应受到了抑制。当将AVM肠道微生物群移植到GF受体小鼠时,保留的社会行为和减少的应激反应被转移,表明AVM微生物群中的肠道细菌发挥了积极作用。
粪肠球菌——在社交活动中促进社交行为并抑制皮质酮水平升高的关键细菌
粪肠球菌(Enterococcus faecalis)是一种乳酸菌,对抗生素和许多其他压力源具有耐药性。粪肠球菌在宿主中的功能作用是多方面的,并且具有菌株特异性。
粪肠球菌是一种常见于尿路感染的常见病原体。另一方面,粪肠球菌已被广泛用作益生菌或食品添加剂。
粪肠球菌在ABX和GF小鼠中的定殖可以促进它们的社交行为,但只抑制ABX小鼠的皮质酮水平,而不是GF小鼠。
粪肠球菌可以调节神经系统和宿主行为
粪肠球菌EC-12菌株降低了焦虑反应,并改变了前额叶皮层中去甲肾上腺素和加压素的受体。
粪肠球菌SF3B菌株和EF-2001菌株已被证明可以缓解结肠炎诱导的肠道神经传递和病理。此外,粪肠球菌可以合成酪胺和苯乙胺,这两种神经活性分子被称为微量胺,能够调节宿主神经系统。
物质P刺激粪肠球菌V583菌株中酪胺和乳酸的产生,并增强肠道体外模型中的细胞毒性和细菌移位。
粪肠球菌AG5可增加宿主中的长链和短链脂肪酸,这可能通过间接方式间接影响神经系统。
一份报告发现,小鼠感染致病性粪肠球菌菌株K9和CP-1,会急性增加皮质酮,这表明粪肠球菌可以改变宿主中的糖皮质激素信号。临床上,粪肠球菌存在于89.3%的健康对照组中,而只存在于58.3%的神经发育障碍、58.3%的混合特异性发育障碍和55.6%的表达和接受语言障碍。
此外,粪肠球菌的给药对母体免疫激活的后代的重复行为和焦虑样行为没有产生任何影响。
总之,肠道细菌对宿主情绪和应激反应产生影响的分子和细胞机制将在未来进行研究。尽管在动物研究中微生物群对HPA轴有显著影响,但还需要更多的临床研究来支持使用益生菌缓解人类压力水平的概念。
✓
益生元是从食物中提取的不可消化成分,用于促进微生物(主要在胃肠道中)的生长。
合生元是将益生元和益生菌结合起来,对宿主产生协同作用。
先前的研究表明,益生元和合生元治疗都可以改变啮齿动物模型中的皮质酮水平。很少有研究调查益生元和压力暴露之间的相互作用及其对控制皮质酮水平的影响。
低聚果糖和低聚半乳糖
低聚果糖(FOS)和低聚半乳糖(GOS)治疗对成年小鼠产生抗焦虑和抗抑郁作用。
此外,GOS 和 FOS + GOS的组合可有效下调强迫游泳试验引起的急性应激诱发的皮质酮。有趣的是,FOS 和 GOS 处理中 Akkermansia、Bacteroides、Parabacteroides 的相对丰度有所增加,而脱硫弧菌、瘤胃球菌、Allobaculum、Turicibacter、乳酸杆菌、双歧杆菌的相对丰度降低。
然而,另外两项使用不同益生元化合物的研究并没有对不可避免的压力(GOS、聚葡萄糖和糖蛋白乳铁蛋白)或社会破坏压力(人乳低聚糖3 ‘唾液酰基乳糖或6 ‘唾液酰基乳糖)引起的皮质酮产生抑制作用。研究人员推测各种化合物、治疗持续时间和治疗开始时间都会影响益生元的效果。
低聚甘露糖
除了压力暴露之外,低聚甘露糖 (MOS) 的长期治疗降低了 5xFAD 转基因阿尔茨海默氏病小鼠模型血清中皮质酮和 CRH 的基线水平,但野生型小鼠没有这种情况。此外还发现 MOS 会增加血清和粪便中的丁酸盐水平,并与血清皮质酮呈负相关。然而,另一项研究结果表明,MOS 治疗降低了野生型 Whistar 大鼠成年期的血浆皮质酮水平。有趣的是,药物诱导的便秘大鼠模型表现出较高的 ACTH 和较低的皮质酮水平,而菊粉和低聚异麦芽糖可使其正常化。
其他益生菌和益生元联合治疗
益生元和益生菌的合生治疗很复杂,并且有多种组合。迄今为止,还没有研究使用相同的细菌菌株和益生元化合物配方来调节压力。
在暴露于慢性日常约束应激的大鼠中,将麦芽糊精L. paracasei DKGF1与仙人掌提取物相结合,以时间依赖的方式抑制约束应激诱导的皮质酮水平。
益生菌L.gasseri 505抑制UCMS诱导的皮质酮。添加柘树叶提取物不会对皮质酮产生额外影响。在急性应激中,在大鼠中,L. casei 54-2-33和菊粉的联合治疗可以降低加迷宫诱导的皮质酮升高。很少有研究采用合生元策略来缓解应激反应和皮质酮,这可能是因为缺乏关于益生菌和益生元的机制观点的基础。
✓
类固醇生成是在宿主体内将胆固醇转化为类固醇的生物合成过程。在糖皮质激素中,胆固醇通过几种关键酶(包括孕烯醇酮、黄体酮和脱氧皮质酮)经过几个步骤转化为皮质酮。然后皮质酮代谢为醛固酮。有趣的是,一些研究支持本地微生物直接调节宿主体内类固醇合成的假设。本节讨论从头细菌将胆固醇转化为类固醇的潜在候选细菌,这可能会干扰糖皮质激素类固醇的合成。
细菌中类固醇的生物合成——是直接影响类固醇激素水平的一种方式
在瘤胃球菌 (R.) gnavus、Bacteroides (B.) Acidifaciens 和 Clostridium (C.) scindens 培养物中发现孕烯醇酮治疗无氧条件下48小时可合成雄激素类固醇;研究人员使用液相色谱-串联质谱测量了类固醇途径中间体的水平。
在细菌条件培养基中检测到羟基孕烯醇酮、孕酮、脱氢表雄酮、睾酮。同样,相同的细菌菌株可以在体外将羟基孕烯醇酮代谢为黄体酮、脱氢表雄酮和睾酮。然而,R. gnavus 和 B. Acidifaciens 没有表现出任何胆固醇、皮质醇或醛固酮的代谢能力。
此外,孕烯醇酮和羟基孕烯醇酮在其他共生菌株中的处理,包括粪肠球菌、阴沟肠杆菌、肺炎克雷伯菌27、奇异变形杆菌、粘质沙雷氏菌、溶血葡萄球菌、大肠杆菌,产生了阴性结果,表明细菌在类固醇中间体代谢中的特异性。
类固醇激素代谢——可能是细菌影响宿主激素水平的另一种途径
从水甲虫的肠道中分离出两种芽孢杆菌菌株,HA-V6-3 和 HA-V6-11,并表明它们能够代谢孕烯醇酮。
其他证据表明,吲哚和粪臭素这两种肠道细菌衍生的色氨酸发酵代谢产物,可以抑制类固醇生成的限速酶CYP11A1,从而减少孕烯醇酮。
此外,睾酮缺乏与抑郁症状有关。最近发现从抑郁症患者中分离出的新金分枝杆菌(Mycobacterium neoaurum)可以将睾酮降解为雄烯二酮。
在新金分枝杆菌中鉴定出一个编码3β-羟基类固醇脱氢酶的基因,该基因可降解睾酮。将3β-羟基类固醇脱氢酶引入大肠杆菌中,产生3β-羟类固醇脱氢酶产生菌。产生3β-羟基类固醇脱氢酶的大肠杆菌在ABX小鼠中的定殖诱导了抑郁样行为。
最近进行的一项研究调查了给C57BL/6小鼠服用Thauera菌株GDN1的效果。GDN1是一种具有分解代谢睾酮能力的β变形菌。结果表明,GDN1菌株的给药导致血清雄激素水平显著降低,并在粪便提取物中检测到雄激素环切割代谢产物,这表明能够分解代谢雄激素的肠道细菌,可能调节宿主循环雄激素水平,并有可能作为益生菌用于高雄激素血症的替代治疗。
C. scindens细菌,通过侧链裂解将糖皮质激素皮质醇转化为雄激素
尽管没有研究表明特定细菌的能力可以直接影响皮质酮水平,但弗吉尼亚联邦大学的 Hylemon 实验室发现,C. scindens 是一种从人类粪便中分离出来的细菌,可以通过侧链裂解的机制将糖皮质激素皮质醇转化为雄激素。
C. scindens通过desD编码的钠依赖性皮质醇转运蛋白将皮质醇转运到细菌中。然后,皮质醇可以通过甾体-17,20-脱模酶(一种由desAB编码的假定转酮醇酶)代谢为11β-OHA(11β-氢-氰基甾-4-烯-3,17-二酮)。11βOHA可以通过ABC转运蛋白被泵出细胞。目前尚不清楚是否有细菌具有将皮质酮转化为其他类固醇的相似机制。
微生物参与皮质酮合成的新机制
Hylemon实验室的另一项研究在Eggerthella lenta(以前称为真杆菌)的细胞提取物中发现了一种皮质类固醇21-羟化酶。有趣的是,21羟化酶使用脱氧皮质酮、脱氧皮质醇、脱氢皮质酮和皮质酮作为底物。这可能是哺乳动物中微生物将类固醇转化为皮质酮的另一种机制。
然而,在压力暴露后的啮齿类动物中均未报告C.scindens和Eggertella lenta,也没有发现它们在微生物组缺乏的啮齿动物的肠道中定植。
从皮质酮的生物合成和代谢角度来看,一些细菌可以促进皮质酮前体,而另一些细菌则有相反的效果。因此,确定一种单一的途径来阐明在无菌和ABX(类似的广谱抗生素药物组合)治疗的小鼠中发现的高皮质酮仍然具有挑战性。该领域在肠道中面临着一种高度复杂的情况,这种情况会调节应激激素和应激诱导的行为异常。
✓
与压力相关的疾病,例如肠易激综合症(IBS),通常涉及微生物失调。 IBS 是一种胃肠道并发症,其特征是腹部不适、排便方式改变以及伴随的焦虑等症状,影响着 5-10% 的人口。尽管进行了广泛的研究,IBS 的确切病因仍然难以捉摸,公认的危险因素包括遗传、饮食、心理压力和肠道微生物组组成。
IBS患者中微生物代谢物的改变
研究表明,与健康对照相比,IBS 患者的 α 多样性降低,并且 21 种细菌种类的相对丰度存在显著差异。 IBS 亚型在肠道微生物群衍生的代谢物中表现出明显的改变:
微生物群在IBS患者中的作用
研究表明,IBS-D 中的特定细菌,如瘤胃球菌Ruminococcus gnavus,可以通过产生苯乙胺和色胺来刺激血清素生物合成,从而加速肠道蠕动。
研究发现,在一些 IBS 患者中发现的产气克雷伯菌(Klebsiella aerogenes)可增强组胺的产生,通过组胺 4 受体信号传导导致内脏痛觉过敏。
值得注意的是,可以通过人类 IBS 患者的粪便微生物群移植 (FMT) 到 GF 接受者来建立 IBS 动物模型。这种方法有效地复制了在人类 IBS 患者中的胃肠道和焦虑症状。
IBS 患者的应激反应激素水平
压力暴露是发生 IBS 的已知危险因素,通常影响肠道蠕动和 HPA 轴。 IBS 患者的应激反应激素水平与健康人不同。
研究表明,急性精神压力会导致 IBS 患者血浆 CRH 和 ACTH 显著升高。此外,Dinan组显示,CRH输注后,IBS患者的ACTH和皮质醇释放增加。
结肠扩张(CRD)是一种检测内脏敏感性的方法,在IBS动物模型中,导致PVN CRH神经元中c-Fos表达升高,血浆CRH、ACTH和皮质酮水平升高。
总之,这些发现表明,与健康受试者相比,患有IBS的个体表现出应激激素分泌增加和微生物群失调。
✓
应对压力是动物面对可能对身体有害的危及生命事件的重要策略。压力失调与情感性疾病密切相关。新冠肺炎大流行使压力相关疾病的全球流行率急剧上升,这对社会产生了深远影响。
最近的研究表明,肠道微生物群不仅出现在压力暴露的背景下,而且还起着“活性调节剂”的作用,调节神经和内分泌系统。这也就是我们开头提到的“胃里有蝴蝶”的扑腾感源于肠道微生物。
肠道微生物直接和局部调节类固醇生成,可能改变应激激素水平。然后,应激激素信号可以通过确定的途径、肾上腺外类固醇生成、自主神经系统和各种细菌成分传播到大脑。最终,大脑接收来自微生物的信息,并对PVN和其他大脑区域做出充分反应。
此外,大脑决定的应对和适应机制可以改变基于行为和内分泌功能的输出。然后,微生物可以进一步适应宿主在压力下的生理机能。这种从肠道微生物群开始的控制环路是基于目前对肠道微生物和压力之间相互作用的理解。
肠道微生物调节行为的分子和细胞机制、途径和回路在很大程度上尚未完全探索。识别导致和影响应激反应的关键细菌和细菌相关因素,将有利于使用基于微生物组的疗法进行替代医学创新。
随着对微生物与宿主交互作用机制的深入研究,肠-脑轴在心理疾病发生和治疗中的重要性将越来越受到重视。肠道菌群将成为预防和干预这类疾病的新靶点。
主要参考文献
Lai TT, Liou CW, Tsai YH, Lin YY, Wu WL. Butterflies in the gut: the interplay between intestinal microbiota and stress. J Biomed Sci. 2023 Nov 28;30(1):92.
Ramamoorthy S, Cidlowski JA. Corticosteroids: Mechanisms of Action in Health and Disease. Rheum Dis Clin North Am. 2016 Feb;42(1):15-31, vii.
Huang ST, Wu K, Guo MM, Shao S, Hua R, Zhang YM. Glutamatergic and GABAergic anteroventral BNST projections to PVN CRH neurons regulate maternal separation-induced visceral pain. Neuropsychopharmacology. 2023 Nov;48(12):1778-1788.
Avery S N, Clauss J A, Blackford J U. The human BNST: functional role in anxiety and addiction[J]. Neuropsychopharmacology, 2016, 41(1): 126-141.

谷禾健康
今日,两条关于睡眠问题登上热搜。
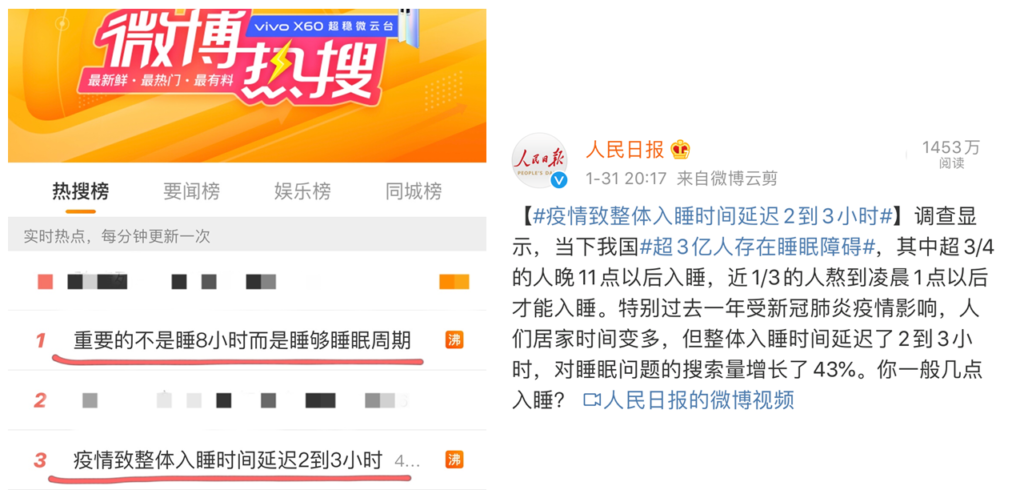
我国有超3亿人存在睡眠障碍,尤其过去这一年,人们整体入睡时间延迟2-3小时,对睡眠搜索量增长43%,看来睡眠问题正在影响越来越多人。
疫情致使整体入睡时间晚2-3小时_腾讯视频
睡眠是由人脑控制的一种复杂的生理行为过程,与免疫功能同为正常生活所必要的生理机能。睡眠是在漫长的一天之后舒缓和恢复的良好方式,睡眠可以让身体和大脑补充能量,良好的睡眠对于巩固记忆、处理信息、生长身体、修复肌肉,增强免疫,抵御疾病至关重要的。
睡眠障碍与各种疾病的发生和发展有关,例如肥胖,II型糖尿病,心血管疾病,抑郁症,癌症等。睡眠不足也会影响判断力和智力。
本文我们来详细了解下,睡眠障碍——这个大多数人都有可能遇到的难题。
首先,关于热搜第一条“睡够睡眠周期”到底什么意思呢?
要了解睡眠障碍之前,我们的先看下,正常生理性睡眠。
正常睡眠结构的特征是轻度睡眠,更深的慢波睡眠和快速眼动(REM)睡眠周期。
第一阶段睡眠(清醒和睡眠的过渡期)
第一阶段睡眠是睡眠周期的开始,被视为清醒和睡眠之间的过渡期。这段睡眠时间仅持续5-10分钟,其特征是混合频率的theta波(非常慢的脑波)。
第二阶段睡眠(体温下降,心率减慢)
第2阶段持续约20分钟,涉及混合频率的脑电波,具有快速的节奏性脑电波活动。在第2阶段,体温开始下降,心率开始减慢。
第三阶段睡眠(从轻度到深度过渡期)
第3阶段睡眠的特征是20%-50%的缓慢脑电波(称为δ波)。这是从轻度睡眠到深度睡眠的过渡时期。
第四阶段睡眠(缓慢脑电波)
阶段4的δ波大于50%,在此期间发生了缓慢的脑电波。阶段4持续约30分钟。
第五阶段睡眠(快速眼动睡眠)
睡眠的第5个阶段,即快速眼动(REM)睡眠,是大多数做梦的时候。第五阶段的特征是呼吸频率增加,大脑活动增加,体内各种代谢功能都显著增加。REM睡眠具有混合频率的EEG和theta波。成年人大约每90分钟出现一次REM睡眠。
睡眠以正常顺序开始,但随后以不规则的顺序循环进行。它开始于阶段1,然后进入阶段2、3和4。在阶段4睡眠之后,在开始REM(阶段5)睡眠之前,重复阶段3和2。REM睡眠结束后,身体通常会返回第2阶段睡眠。REM睡眠的第一个周期是入睡后约90分钟,并且只能持续很短的时间。每个周期,REM睡眠持续时间更长。


失眠是最普遍的睡眠障碍。判断失眠的标准:

标准一: 3个30分钟
入睡时间 [ 入睡时间超过30分钟 ]
睡眠维持困难 [ 醒后再入睡超过30分钟 ]
早醒 [ 比平时提前醒来超过30分钟 ]
标准二:
以上情况 一周超过三天
标准三:
社会功能受损,第二天身体不适
如何判断失眠?权威专家来解答_腾讯视频
影响睡眠质量和持续时间的因素如下,多种内部和外部因素都会对其进行干扰。
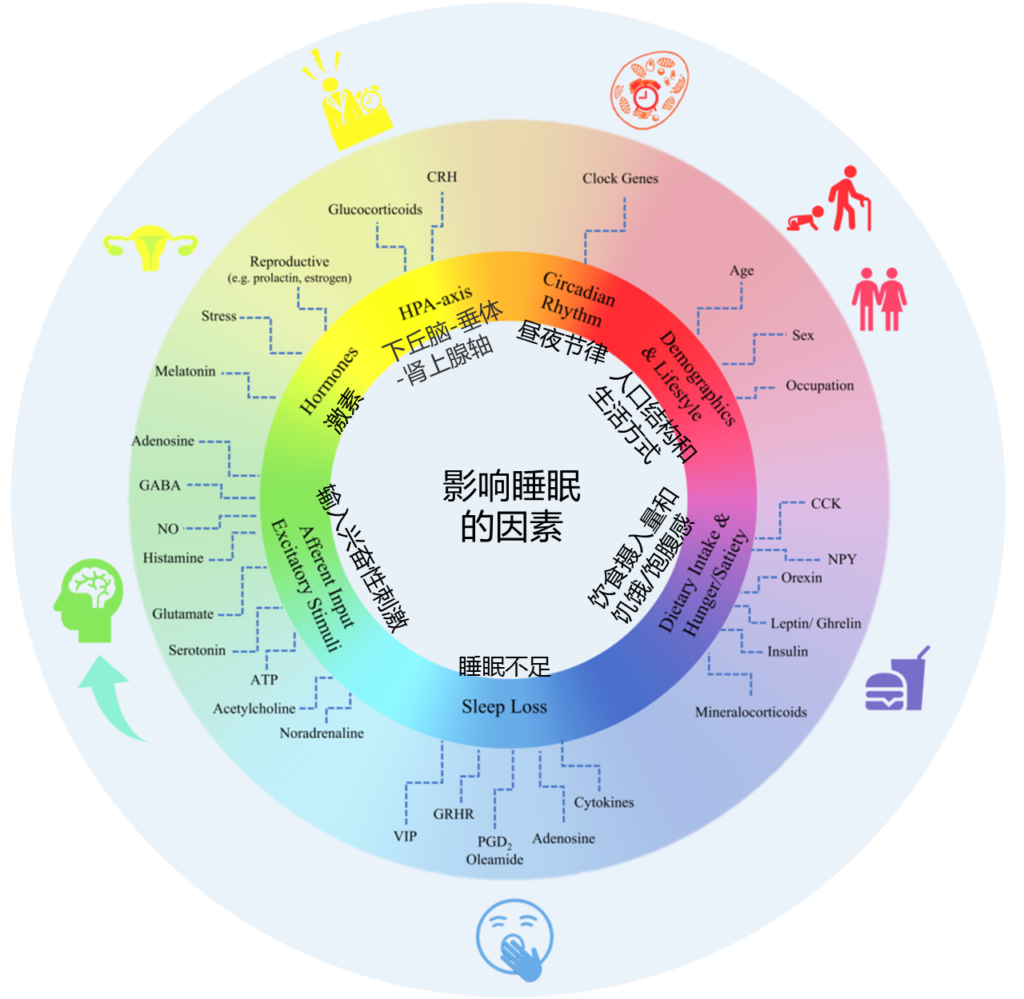
Matenchuk Brittany A,et al., Sleep Med Rev, 2020
睡眠障碍与多种原因有关,通常与不良饮食以及饮食习惯、昼夜节律、压力情绪、生活方式、疼痛炎症、以及慢性疾病等有关。
引起睡眠障碍的原因有很多,但有一个容易被忽略,那就是肠道菌群。
人类微生物群是体内复杂,动态的生态系统。越来越多的研究表明它似乎以许多重要的方式与睡眠相互沟通,相互作用。
菌群改变与睡眠密切相关
研究表明失眠症患者和健康人群肠道微生物的组成、多样性和代谢功能发生了显著变化。随机森林结合交叉验证确定了两种标志性细菌,可用于区分失眠患者和健康人群——拟杆菌属,梭菌属。
对微生物组组成的分析表明,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度与睡眠质量呈正相关,而Lachnospiraceae、棒状杆菌(Corynebacterium)、Blautia等几种菌与睡眠质量测量值呈负相关。
Faecalibacterium是肠道微生物群中产丁酸菌,可能有助于双相患者减轻疾病负担和改善睡眠质量。其潜在机制可能是产生促进睡眠的丁酸盐。
高质量的睡眠与肠道菌群相关,包括Verrucomicrobia菌和Lentisphaerae菌 ,占比偏高,与认知功能改善相关。
乳酸菌数量与睡眠呈负相关。干酪乳杆菌对健康成年人的应激性睡眠障碍有有益作用。短乳杆菌对小鼠的睡眠节律有好处。
微生物组多样性(丰度,香农多样性和辛普森多样性)与睡眠质量和总睡眠时间增加呈正相关。
研究发现,睡眠不足与肠道微生物的多样性降低有关,睡眠越好,微生物组的多样性就越丰富。
一项2019年的研究发现,睡前60分钟(这是衡量睡眠量和睡眠质量的指标)与肠道微生物多样性降低26%有关。这是在控制了可能影响微生物组成的其他因素之后,包括饮食中纤维和脂肪的摄入量,体力活动和身体质量指数。
肠道微生物的多样性高有助于减轻压力和改善睡眠。除了睡眠不足之外,微生物组多样性的降低还与一系列健康问题有关,包括情绪障碍,焦虑,抑郁,免疫系统功能障碍和自身免疫性疾病。
失眠患者肠道菌群的α和β多样性发生了显著改变。睡眠时间减少可能会导致肠道菌群失调。
肠道菌群是如何影响睡眠的呢?
可以通过肠道菌群与大脑之间的持续不断的相互作用来影响。主要有以下途径:
· 免疫系统途径
大脑和肠道微生物组都影响免疫细胞的活性,并依次相互影响。
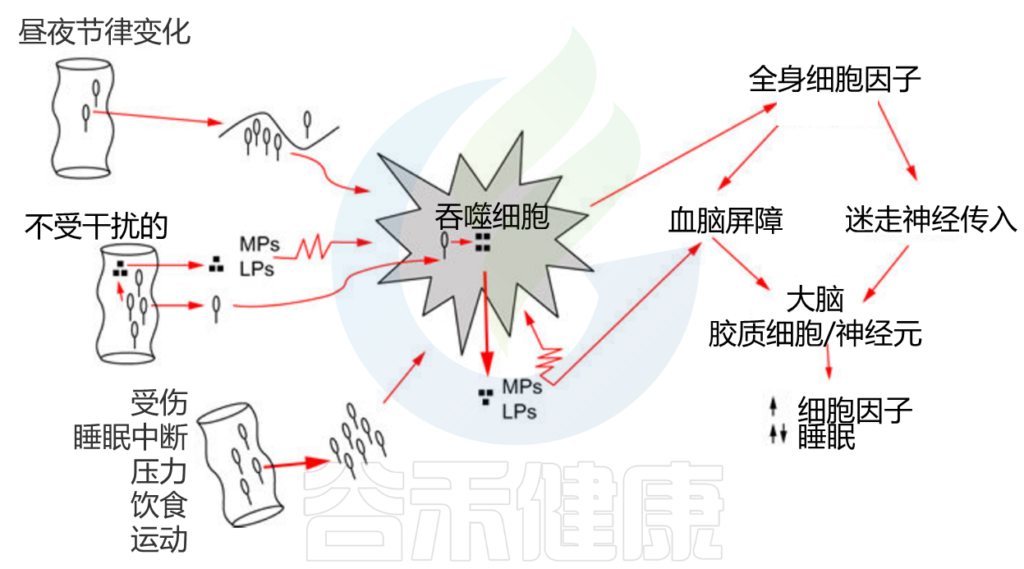
肠道细菌被吞噬细胞(如巨噬细胞或中性粒细胞)吞噬并被消化;消化产物(如MPs、LPS)被释放到周围的细胞间液中。MPs和LPS反过来激活吞噬细胞(如锯齿状细胞膜所示),然后释放细胞因子。全身性细胞因子通过至少两种途径(迷走神经和血脑屏障)进入大脑。
免疫细胞在保持肠道微生物组健康方面发挥了重要作用,并且帮助免疫系统发挥最佳功能。这些细胞执行许多关键功能,包括:
帮助调控微生物组的组成
调节新陈代谢
限制炎症
保护肠道不受感染
保持肠壁坚固(并避免所谓的“漏肠”)
——细菌细胞壁结构成分影响睡眠
微生物细胞壁的结构成分不断刺激先天免疫系统产生细胞因子,产生一种免疫激活的基本状态,从肠粘膜表面开始,影响全身。
当细菌分裂、生长或死亡时,肽聚糖、脂多糖和其他成分被细菌酶降解或改变。宿主吞噬细胞如巨噬细胞和中性粒细胞也可以消化肽聚糖产生胞壁肽(小糖肽)。从革兰氏阳性或革兰氏阴性细菌中分离出来的肽聚糖,诱导睡眠反应,例如,非快速眼动睡眠的持续时间和强度会增强几个小时。如果给吞噬细胞喂养细菌,它们就会释放出具有生物活性的胞壁酰肽;其中一些胞壁酰肽诱导睡眠反应与完整的肽聚糖和热杀死的整个细菌所诱导的睡眠反应相似。
细菌肽诱导肠巨噬细胞和T细胞产生细胞因子白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNFα);细菌细胞壁脂多糖(LPS)诱导IL-18的合成。
IL-1β,TNFa22,IL-18是非快速眼动睡眠的诱导因子。
其他微生物,如病毒及其组分也通过内源性受体(识别病原体相关分子模式,如Toll样受体)促进细胞因子的产生,从而影响睡眠。
· 神经内分泌途径
肠道内有20多种肠内内分泌细胞,构成最大的内分泌器官。
肠道菌群直接参与多种神经递质,细胞因子和代谢产物的产生,例如5-HT,多巴胺,γ-氨基丁酸(GABA),SCFA和褪黑激素等。
某些乳酸杆菌和双歧杆菌可以产生GABA。在失眠患者中经常观察到GABA mRNA的异常表达。
大肠杆菌产生去甲肾上腺素、5-羟色胺和多巴胺;
链球菌和肠球菌产生5-羟色胺;
芽孢杆菌产生去甲肾上腺素和多巴胺。
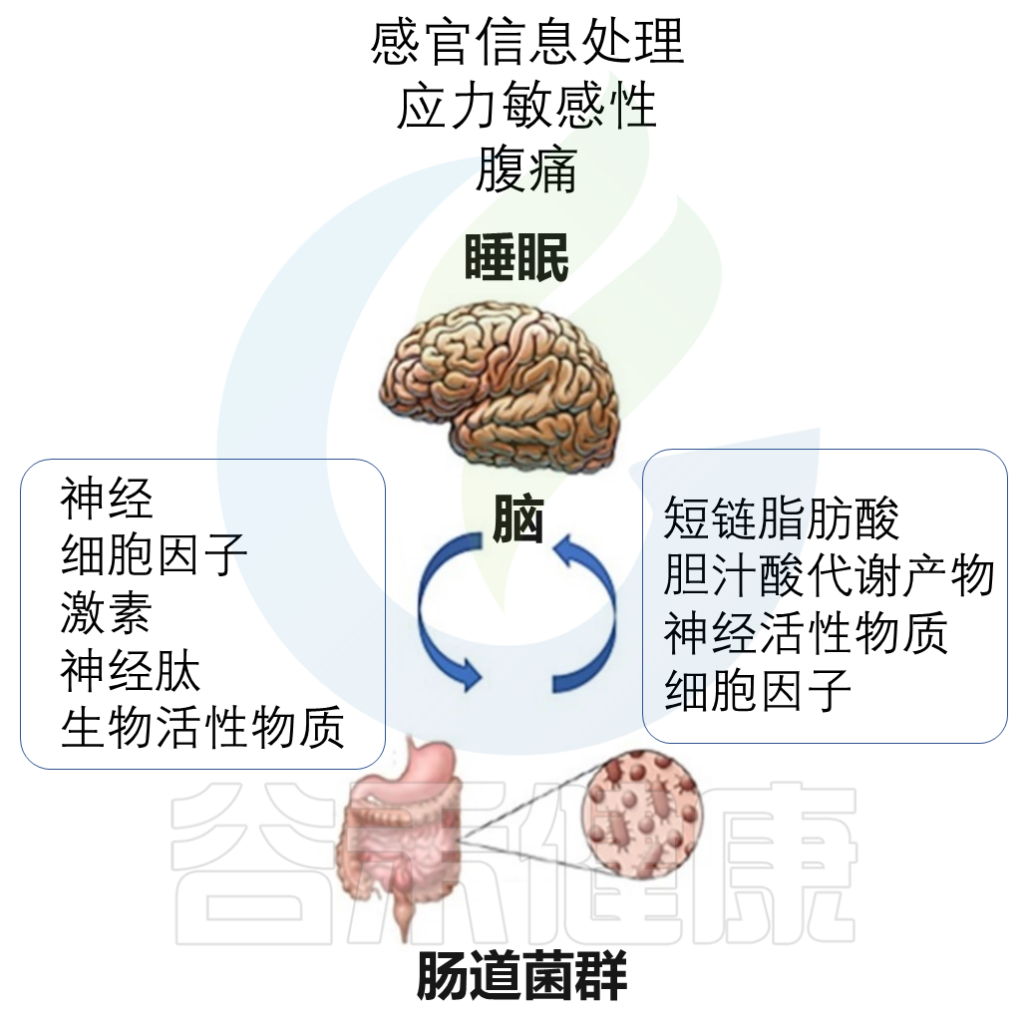
Vernia F,et al., Int. J. Med. Sci.2021
这些代谢物直接作用于肠神经系统和迷走神经,并影响中枢神经系统的活性。
此外,肠道菌群还影响下丘脑-垂体-肾上腺(HPA)轴。
HPA轴参与稳态,参与对新刺激的反应。HPA轴是一种自适应系统,目的是在不断变化的环境中保持体内动态平衡。越来越多的研究表明,睡眠与HPA轴活动之间存在相互关系。
HPA轴亢进会对睡眠产生负面影响,导致睡眠碎片化,深度慢波睡眠减少和睡眠时间缩短。反过来,包括失眠和阻塞性睡眠呼吸暂停在内的睡眠障碍会进一步加剧HPA轴功能障碍。
干预以使HPA轴异常正常化,减少夜间CRH亢进和降低皮质醇可能对治疗失眠和其他睡眠障碍有益。详见本文后面改善睡眠章节。
说起HPA轴,就不得不提到皮质醇。它的作用不容小觑。
皮质醇如何产生?
HPA轴被激活,下丘脑促肾上腺皮质激素释放激素(CRH)的分泌,然后刺激垂体前叶释放促肾上腺皮质激素。然后促肾上腺皮质激素刺激肾上腺释放皮质醇,导致交感神经系统的各种生理反应(如肾上腺素的释放、心率加快和血压升高)。
皮质醇升高可能是睡眠障碍的主要原因
HPA轴障碍可能导致皮质醇升高,当皮质醇水平较高时,会激活糖皮质激素受体。在压力时期去甲肾上腺素和糖皮质激素受体可以优先激活,从而增加促肾上腺皮质激素释放激素。这种升高的促肾上腺皮质激素释放激素会增加睡眠脑电波频率,减少短波睡眠,并增加轻度睡眠和频繁醒来。
皮质醇还与昼夜节律相关,这部分我们在下一章节昼夜节律篇讨论。
· 迷走神经途径
肠肌层神经丛的感觉神经元通过调节肠蠕动和肠激素分泌而接触肠道菌群。肠神经系统也与迷走神经形成突触连接,迷走神经将肠道与大脑连接起来。
细胞因子通过迷走神经传入向大脑发出信号,迷走神经的动作电位进一步诱导胶质细胞和神经元在大脑中产生细胞因子。细胞因子浓度高低与睡眠有关。
低浓度的脑细胞因子能促进睡眠,而高浓度的脑细胞因子则不利于睡眠。
睡眠障碍与肠道菌群失调存在循环关系
前面我们知道,肠道菌群会通过多种途径影响睡眠。
Krueger JM,et al .,Int Rev Neurobiol. 2016
反过来睡眠也会影响肠道菌群。
睡眠不足或者其他因素如受伤、食物摄入、压力、昼夜节律和运动等,可致肠屏障损伤和细菌移位,增加感染易感性,激活HPA轴从而影响菌群。
大多数人(和其他哺乳动物)都存在昼夜节律–控制进食和睡眠等过程的代谢时钟。最常见的昼夜节律周期是控制睡眠的周期,科学家们已发现存在着多种控制着不同生物系统的昼夜节律。
过去的研究已表明如果昼夜节律紊乱,人们可能会遇到健康问题。比如,改变工作时间的轮班工人更容易患睡眠障碍、肥胖、糖尿病等。
昼夜节律——皮质醇
前面提到的皮质醇分泌就有昼夜节律。皮质醇的最低点出现在午夜左右。睡眠开始后约2-3小时,皮质醇水平开始上升,并一直持续到清晨。
早晨醒来时,皮质醇开始迅速升高,并持续升高约60分钟。皮质醇的峰值大约是上午9点。随着一天的继续,水平逐渐下降。随着睡眠的开始,皮质醇持续下降直至最低点。
此外,越来越多的研究都表明,机体的昼夜节律能够调节肠道的免疫反应。
昼夜节律——免疫系统
昼夜节律调节免疫系统,并随之调节炎症水平。
第3组先天淋巴细胞(ILC3s)是昼夜脑-肠信号转导的关键介质。ILC3s表达高水平的昼夜节律基因,光-暗周期的反转导致ILC3s主要的昼夜节律振荡。这种作用依赖于中枢神经系统(CNS)和下丘脑SCN中ARNTL的存在,并进一步与肠道菌群组成的变化有关,特别是变形菌门和拟杆菌门丰度的改变。
注:ARNTL——芳香烃受体核转位因子样蛋白
当昼夜节律被破坏时,正常的免疫功能也会被破坏。这样的情况下,人更容易患上各种疾病。
昼夜节律——肠道菌群
研究发现肠道菌群的两个主要组成部分拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度从白天到晚上呈周期性变化。
肠道菌群受昼夜节律信号的影响,同时也对生物钟基因的表达产生交互作用。
来自美国德克萨斯大学西南医学中心的研究人员发现小鼠小肠中的微生物参与肠道昼夜节律。该研究发现改变受试小鼠中组蛋白乙酰化的过程,即在组蛋白末端添加乙酰基的过程,细菌便可开启HDAC3在位于小肠内壁的上皮细胞中的表达。这进而导致了参与基因表达的同步振荡,这些基因表达与脂质代谢和营养物运输有关。相比之下,肠道无菌的小鼠没有表现出这种节律性调节。
肠道微生物的昼夜节律振荡导致血清代谢产物的振荡,并与周围组织的转录和表观遗传波动有关。
昼夜节律——肠道菌群代谢产物
短链脂肪酸影响生物钟基因表达和睡眠模式
肠道微生物代谢产物,短链脂肪酸乙酸、丙酸、丁酸在一天中会发生变化,粪便样本中的最高浓度出现得较早,并且在一天中不断降低。短链脂肪酸可能会影响生物钟基因的表达。
研究发现,肠道微生物群的缺乏,以及微生物代谢物的缺乏,导致中枢和肝脏生物钟基因表达明显受损,这表明肠道微生物群在分子水平上传播生物钟的可能性。
在体外,发现在给予乙酸钠和丁酸钠后,小鼠肝细胞中时钟基因Bmal1和Per2的表达发生了显著变化。
在不同的光照-暗期和摄食周期下,添加乙酸后Per2表达量较高,添加丁酸后Per2表达量较低;短链脂肪酸处理后Bmal1表达持续升高,尤其是丁酸处理。
在无菌小鼠体内,关灯两小时后用丁酸盐治疗5天(小鼠处于活跃期),导致肝细胞中Per2:Bmal1 mRNA比值显著增加。此外,同样的处理也导致了中基底下丘脑细胞中Per2:Bmal1 mRNA比值的非显著增加(p=0.053)。Bmal1和Per2等时钟基因在分子水平上调控昼夜节律;它们的比率是肝脏代谢调节网络的标志。
丁酸盐在肠道菌群与大脑产生睡眠的机制之间提供重要联系。
进一步的研究表明,门静脉注射丁酸盐可导致小鼠非快速眼动睡眠增加70%;全身皮下和腹腔注射丁酸盐对睡眠无影响。这些结果表明,丁酸盐的睡眠诱导作用是由肝脏感觉机制介导的。
昼夜节律——肠上皮屏障
肠道菌群通过肠上皮细胞昼夜节律因子调节。
肠上皮细胞协调消化、免疫和神经内分泌功能,是人体最重要的屏障之一。胞壁肽(MPs)或脂多糖(LPS),通过肠上皮屏障转运。
通过受损的伪反应调节器(PRR)信号,导致过氧化物酶体增殖物激活受体α(PPARα)的永久表达,肠道微生物群的消失会破坏肠上皮细胞中Bmal1和Cry1时钟基因的表达,导致肠上皮细胞活动的完全丧失。
此外,肠道菌群也受饮食周期调控,我们将在下一章节详细了解它们之间的关联。
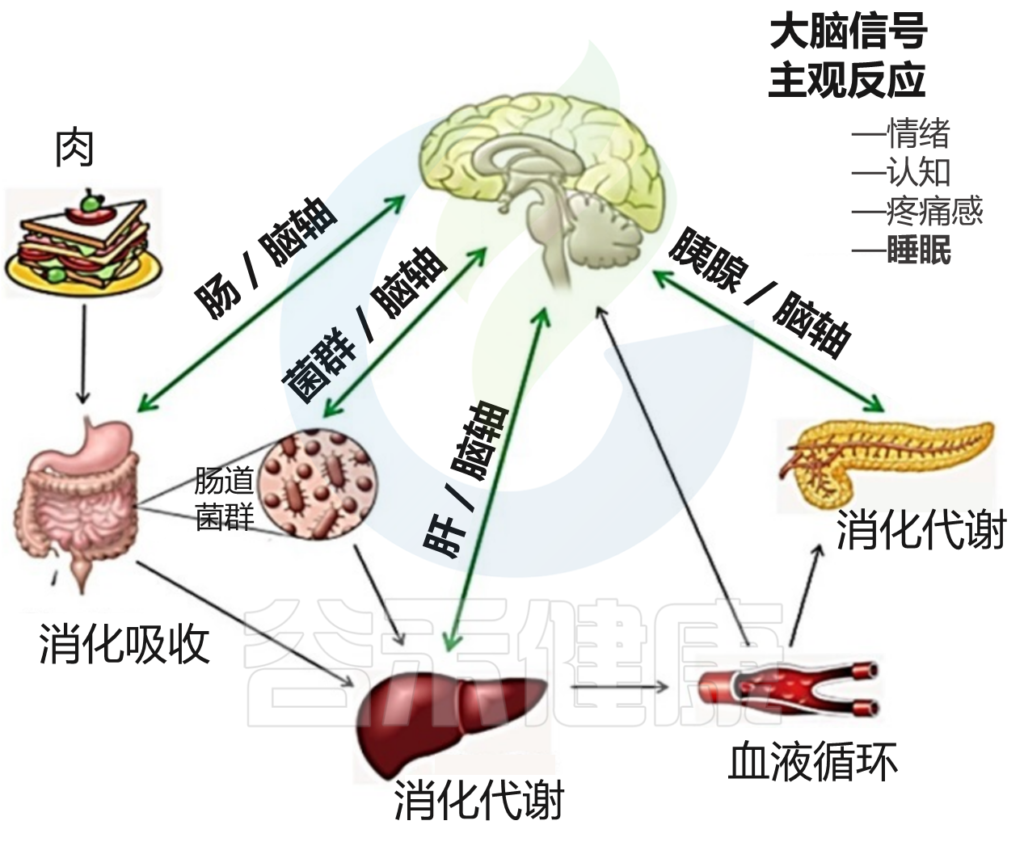
睡眠与昼夜节律、食物摄入、运动和压力源密切相关;这些变量还相互影响,使它们在睡眠中的行为复杂化。饮食、进餐时间和睡眠之间的联系是相互的,因为昼夜节律驱动着代谢模式的变化,而代谢和营养状况的改变则影响着昼夜节律。
我们常听说健康的饮食,生活方式以及合理的饮食习惯有助于心理和身体健康。
辛辣食物、兴奋剂和不良食物反应(不耐受和食物过敏)影响睡眠可以理解。然而,为什么说不吃饭,吃得太快或吃得过饱,吃饭时间不规律,食物质量差,这些也都是导致睡眠障碍的饮食原因?
从本质上讲,饮食摄入与肠道菌群组成有关,因为我们摄入的食物是微生物生长的主要基质。我们饮食的改变可以在几天内导致我们肠道菌群重塑。
摄食节律和昼夜节律的破坏会导致肠道细菌的时间特异性变化。昼夜节律紊乱也会增加肠上皮屏障的通透性。
Vernia F,et al., Int. J. Med. Sci.2021
饮食行为影响人类睡眠的时间和质量。睡眠时间短和高能量摄入之间有一致联系。
食物中营养物质影响睡眠
营养物质影响激素的产生,包括生长激素、催乳素、睾酮、褪黑素和血清素,所有这些都在调节生物钟中发挥作用。
食物中存在的氨基酸,如苯丙氨酸、组胺和酪氨酸,促进肾上腺素、去甲肾上腺素和其他刺激性神经递质的产生和释放,可能损害睡眠。
影响色氨酸供应或血清素和褪黑素合成的食物则促进睡眠。一些维生素(B1和B6)也能诱导褪黑素和血清素的产生和释放。
饮食习惯影响睡眠
进餐的时间,特别是零食的频率,使昼夜节律失去同步,影响新陈代谢,并促进肥胖。这与生物钟在调节激素和神经递质释放中的作用是一致的。
不吃饭、或者晚餐十分丰盛的现象越来越普遍。然而将主要热量摄入转移到一天结束时会对消化产生不利影响,并使睡眠困难;如果膳食丰富且脂肪丰富,则更是如此。
相反,碳水化合物对睡眠模式的作用仍有争议,碳水化合物的重量与热量负荷的关系也有争议。
为什么很想吃垃圾食品?
压力在影响饮食模式方面很重要,可能是通过改变下丘脑-垂体-肾上腺轴,让人对垃圾食品(高脂肪和精制糖)产生强烈的渴望。
久坐的生活方式,睡眠时间短同样会让人想吃高能量食物。
为什么睡眠不足与想吃高能量食物有关?
下丘脑外侧神经元通过不同的回路表达神经肽,如黑色素浓缩激素和食欲素/下视黄醇,在调节食物摄取、觉醒、运动行为和自主神经功能方面发挥重要作用。
睡眠限制与饱食因子瘦素浓度降低、促饥饿激素ghrelin浓度增加有关,从而改变了它们发出正确热量需求信号的能力。于是又会促进代谢综合征和肥胖,并再次对生物钟产生不利影响。
注:Ghrelin是一种神经肽,参与睡眠-觉醒调节。
此外,食欲素Orexins在能量稳态和警觉状态之间提供联系,并参与多巴胺能奖赏系统。在动物模型中,产生食欲素的基因突变导致了睡眠表型的改变。有假设说,在清醒时,产生食欲素的细胞的高活性,而在睡眠时几乎没有这种活性,也会影响睡眠。
越来越多的证据也表明睡眠会影响饮食选择。睡眠较少的人更可能喜欢高能量的食物(如脂肪和精制碳水化合物),吃较少的蔬菜,并选择不规律的饮食模式。
糖摄入与睡眠
糖会对肠道健康产生特定作用。有大量证据表明,标准的西方饮食(加工糖和高脂)会导致肠道微生物群的组成发生变化。
上一小节提到的多巴胺奖赏系统与糖摄入也有关系。研究表明,糖是一种有力的触发剂,含糖的食物足以刺激大脑的奖赏系统,从而对食物产生更多的渴望,
糖还有其他间接影响我们肠道健康的方法。高糖饮食会加剧慢性炎症,而炎症则会损害肠道菌群的多样性和功能。经常食用添加糖的饮食可能导致体重增加。
另外添加糖还会升高胆固醇,这与炎症增加有关。关于炎症和睡眠的关系将在下一章节详述。
所有含糖食物(例如水果)都会影响睡眠吗?
不是的。水果之类的天然含糖的食物提升人血糖的速度,远没有含添加糖的食物快。天然食品中纤维含量很高,人体吸收糖的速度变慢,阻止血糖水平飙升。
炎症和睡眠障碍也是双向联系的。
炎症是免疫系统的一种天然的,保护性的生物反应,可以抵抗有害的外来病原体(细菌,病毒,毒素),并帮助身体从受伤中恢复健康。急性炎症的症状包括肿胀和发红,发烧,发冷,疼痛和僵硬以及疲劳,这些迹象表明人体的免疫系统处于“战斗模式”。
睡眠障碍会加剧慢性低度炎症,这是导致疾病的重要因素。不需要几年或者几个月,哪怕只是一晚上的完全睡眠不足就足以提高促炎生物标志物、肿瘤坏死因子α(TNFα)和C反应蛋白(CRP)的循环水平;血清CRP水平随着4天的完全睡眠不足而逐渐升高。
有研究发现,一晚上完全睡眠不足,白细胞介素(IL-6)细胞因子升高,一周失眠不足(每晚4-6小时),IL-6和TNFα的24小时分泌量也会增加。
全身性炎症也会破坏健康的睡眠。通过触发生理和心理变化,让人难以获得良好的睡眠。
细胞因子升高与睡眠困难有关。炎症会在体内造成疼痛和僵硬,使人难以入睡。身体上的疼痛是失眠和其他睡眠问题的常见因素。关于慢性疼痛将在下一章节详细介绍。
炎症涉及较高水平的皮质醇,皮质醇前面了解过,可刺激机敏并导致心理压力。压力是健康睡眠的最重要的常见障碍之一。
7.1 压力,抑郁与睡眠障碍
压力与睡眠
2017年进行的一项研究,压力对大鼠睡眠和肠道健康的影响。通过对小鼠尾部冲击睡眠模式中断。结果发现肠道菌群失去了多样性。少数菌群控制着肠道微生物,失去平衡是不健康的。当他们给小鼠服用益生元时,肠道菌群变得更加多样化,并包含了更多有益菌,如鼠李糖乳杆菌,睡眠变得更好,包括REM和非REM睡眠。
昼夜节律引发情绪波动和睡眠障碍
临床经验表明,扰乱昼夜节律挑起时差综合征或减少睡眠可以触发情绪波动和睡眠障碍。
核心时钟基因突变会引起肠道菌群失调。多种时钟基因变异易患精神疾病,例如重度抑郁症(MDD),双相情感障碍(BD),注意力缺陷多动障碍(ADHD),精神分裂症等。
微生物GABA产生(这是中枢神经系统的主要抑制性神经递质,已证实GABA受体的激活有利于睡眠)对抑郁症和肠道微生物多巴胺代谢物的能力的潜在贡献。
3,4-二羟基苯乙酸(一种主要包含在浆果、水果和蔬菜中的膳食多酚)的合成,与较高的心理生活质量感知相关。
7.2 慢性疼痛与睡眠障碍
慢性疼痛可以对睡眠有不同的影响并取决于疼痛的性质。
疼痛可能在夜间无法缓解,导致睡眠不足。除了缩短总体睡眠时间外,最常见的,慢性疼痛还会导致夜间频繁起床。我们会在轻度睡眠,慢波睡眠和快速眼动(REM)睡眠之间循环。破坏该周期会干扰睡眠阶段的进展,并导致睡眠不足和第二天的疲倦。
疼痛带来的情绪不佳
疼痛也可能伴有焦虑,压力或抑郁。据估计,三分之一的慢性疼痛患者也符合临床抑郁症。这些状况本身会导致睡眠问题。
慢性疼痛间接影响睡眠
患有慢性疼痛的人白天可能会感到疲劳。那么他们不太能做到锻炼或遵循健康饮食,然而这两者对于获得良好的睡眠很重要。
慢性疼痛导致的不稳定睡眠也会打扰夫妻同床,对他们的睡眠质量和健康产生相应的影响。
睡眠对疼痛的影响
新的研究表明,睡眠对疼痛的影响甚至可能比疼痛对睡眠的影响还要强。
睡眠不好导致对疼痛敏感性增强
研究人员发现,睡眠时间短,睡眠分散和睡眠质量差等问题通常会导致第二天对疼痛的敏感性增强,诸如类风湿关节炎。患有睡眠问题的人似乎更有可能最终患上诸如肌痛和偏头痛等疾病。当失眠引起的疼痛加剧时,女性比男性更敏感,年轻人比老年人更有弹性。
慢性疼痛与睡眠障碍的不良循环
患有慢性疼痛的人可能患有自我延续的周期,疼痛,失眠,抑郁或焦虑。例如,遭受痛苦的人在无法入睡时可能会感到焦虑,睡眠不好,醒来时会感到沮丧,这增加了他们对疼痛的敏感性。第二天晚上又开始疼痛,无法入睡,周期一直循环。久而久之,状况可能更加恶化。
前面提到的褪黑素,除了它在调节昼夜节律中的作用,新的研究开始发现褪黑激素在我们对疼痛的感知中产生作用。维生素D、多巴胺也似乎在睡眠和疼痛中都起着作用。
7.3 消化系统疾病与睡眠障碍
胃食管反流性疾病
胃食管反流病以病理性酸或非酸反流为特征,并与多种可能影响上消化道(反流、烧心、疼痛)和/或诱发呼吸道症状(声音嘶哑、发音困难、慢性喉炎、咳嗽、哮喘和慢性支气管炎)的紊乱有关。
有强有力的证据表明胃食管反流病与睡眠障碍之间存在双向关系,因为胃食管反流病的症状会导致入睡困难、睡眠分裂和清晨醒来,而睡眠障碍又会诱发食管痛觉过敏。
因此,有睡眠障碍的胃食管反流病患者比没有睡眠障碍的患者有更严重的症状和更差的生活质量。据报道,在这些患者中,焦虑和抑郁的患病率很高,在某种程度上是由睡眠障碍直接介导的。
IBS
IBS患者的睡眠障碍是有据可查的,入睡困难、睡眠时间短、频繁觉醒等。最近的一项荟萃分析有63620名参与者,结果显示IBS患者睡眠障碍的患病率为37.6%。
IBD
前面章节我们已经知道,炎性细胞因子如肿瘤坏死因子-α(TNF-α)、IL-1和IL-6可引起睡眠障碍,而睡眠障碍可上调细胞因子,尤其是IL-1和TNF-α。(IL-1参与生理性睡眠调节和睡眠对微生物的反应)
临床研究发现睡眠障碍、亚临床炎症和IBD复发风险之间存在关联。最近的一项研究报道,使用匹兹堡睡眠质量指数评估睡眠质量差与粘膜愈合不良有关(P<0.05)。
7.4 肝病与睡眠障碍
睡眠障碍可能发生在急性和慢性肝炎,但更常见于肝硬化患者。相当一部分肝硬化和急慢性肝衰竭患者患有失眠、睡眠延迟和白天过度嗜睡。
肝硬化
最近一项对341名病毒性肝硬化患者的研究证实了这种关联,报告称匹兹堡睡眠质量指数显著升高。多导睡眠图异常也存在。
肝性脑病
睡眠障碍通常是肝性脑病的早期症状,导致日常嗜睡,增加受伤风险,降低生活质量。
肝脏和大脑之间的神经和体液通讯途径尚不完全清楚,但炎症细胞因子如TNF-α、IL-1和IL-6发挥了作用,它们改变了中枢神经递质(血清素和促肾上腺皮质激素释放激素)的浓度。
60%的慢性丙型肝炎患者存在睡眠障碍。
脂肪性肝炎
脂肪性肝炎患者的睡眠障碍可能与肝细胞活性受损和多余脂质处理受损有关。酒精对肝脏和中枢神经系统有直接毒性作用。
最近的分析(2272名参与者)表明,阻塞性睡眠呼吸暂停与脂肪变性、小叶炎症、气球样变性和纤维化显著相关。
瘙痒在慢性肝病患者中很常见,在原发性胆管炎等胆汁淤积性肝病患者中更常见。随之而来的往往是睡眠障碍和生活质量低下。
肝病中瘙痒的患病率从慢性丙型肝炎的5%到原发性胆汁性肝硬化的70%不等。胆汁盐、组胺、5-羟色胺、孕酮代谢物浓度的增加可能与此有关。
7.5 肥胖与睡眠障碍
前面饮食章节我们已经知道,睡眠不足会使身体发出错误信号导致饮食过量,对高热量食物难以抗拒,吃过多自然容易肥胖。
当然,肥胖也会导致睡眠障碍。
超重和肥胖通过胃食管反流病和非酒精性脂肪肝以及阻塞性睡眠呼吸暂停患病率的增加而导致睡眠障碍。
肥胖与阻塞性睡眠呼吸暂停综合征之间存在着相互关系。阻塞性睡眠呼吸暂停会促进行为、代谢和/或激素的变化,促使体重增加和/或减肥困难。阻塞性睡眠呼吸暂停综合征(OSA)与激素水平有关,其特点是瘦素和胃饥饿素水平高,进而促使能量摄入过高。
体重增加10%与患阻塞性睡眠呼吸暂停综合征的概率增加50%有关。当然,体重减轻会减少严重的阻塞性睡眠呼吸暂停,改善睡眠,进一步减轻体重。
因此,阻塞性睡眠呼吸暂停、睡眠时间短和体重增加之间存在关系。一些证据表明,嗜睡与肥胖有关,在没有睡眠呼吸暂停的情况下也是如此。
营养物质改善睡眠
维生素B6
在失眠研究中分析失眠患者中肠道菌群中的维生素B6分解代谢(ko00750)显着增强,导致宿主体内维生素B6缺乏。据报道,维生素B6是失眠症的一种常见治疗方法,维生素B6缺乏会导致疲劳和抑郁。因此,补充维生素B6可以改善失眠症状。
维生素B6食物来源:麦麸、葵花子、大豆、糙米、香蕉、动物肝脏及肾脏、鱼类、瘦肉、坚果等。
叶 酸
叶酸参与髓鞘的形成,在脑脊液和细胞外液中分布较多,可缓解因抑郁导致的失眠,对于人体精神和情绪方面的健康起到重要性的作用。
叶酸食物来源:芦笋,西兰花,胡萝卜,燕麦,奇异果等。
镁
镁补充剂有时用于治疗睡眠障碍,改善睡眠质量并减少睡眠潜伏期(即入睡时间)。一项研究发现,每天服用500mg可以改善老年人的失眠症状。
同时,补充镁也有助于减轻抑郁症症状。
镁食物来源:南瓜子,煮熟的菠菜,黑豆,藜麦,杏仁,腰果,鳄梨,三文鱼等。
锌
除了镁,锌也有促进睡眠的作用,可以改善大脑神经细胞的代谢,平时可以适当多吃一些海鲜、坚果类食物以及全谷类食物,都有助于为身体补充锌元素。
L-茶氨酸
L-茶氨酸:一种氨基酸,L-茶氨酸可以改善放松和睡眠。
益生菌干预
益生菌是一种活的微生物,当其存在的量足够时,可以为宿主带来健康益处,例如发酵食品,如酸奶,开菲尔,豆豉,泡菜,康普茶等。
很少有研究测试通过控制肠道微生物群来改善睡眠的有效性。在一项32名医科学生参加的临床试验中,发现益生菌加氏乳酸杆菌CP2305能显著改善睡眠质量,这可以通过PSQI评分的变化来衡量。在服用了益生菌的男性参与者中,这种改善更为明显,在床上入睡时间的减少。
注:匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)是美国匹兹堡大学精神科医生Buysse博士等人于1989年编制的。该量表适用于睡眠障碍患者、精神障碍患者评价睡眠质量,同时也适用于一般人睡眠质量的评估。
同时,15种肠道微生物的相对丰度在对照组和益生菌组之间有所不同,包括Bact. Vulgatus的减少,在使用益生菌后增加了Dorea Longicatena.
额外的双盲随机对照试验发现,补充益生菌混合物(含Lactobacillus fermentum LF16, L.rhamnosus LR06, L.plantarum LP01,长双歧杆菌 Bifidobacterium longum BL04 ),在年轻健康的参与者中,随着时间的推移,导致PSQI得分下降。
注:PSQI得分越高,表示睡眠质量越差。
高皮质醇诱发的睡眠问题的替代方法
解决慢性皮质醇水平升高的有效方法是确保肾上腺得到适当的营养支持。维生素B6,维生素B5(泛酸)和维生素C通常会由于肾上腺活动时间过长和皮质醇的产生而耗尽。这些营养物质在肾上腺的最佳功能和肾上腺激素的最佳制造中起关键作用。在压力时期,这些营养素的水平可以降低 。
改善睡眠的另一种方法是针对GABA(γ-氨基丁酸)活性。增加GABA活性将降低蓝斑,下丘脑室旁核和HPA轴活性。支持GABA功能的一种方法是减少谷氨酸信号。谷氨酸和GABA活性彼此相反。因此,降低谷氨酸的活性将支持健康的HPA轴活性。
Tips
1 不要在深夜吃东西,破坏微生物生物钟,还会促进胃反流。
2 多吃纤维。纤维有助于有益菌生长。纤维食物包括朝鲜蓟,芦笋,洋葱,豆类,绿叶蔬菜和大多数非淀粉类蔬菜。

3 尝试睡前禁食,禁食会使身体处于“待机”状态,可以自我修复。身体在睡眠过程中会继续燃烧卡路里。睡前禁食,早晨更有可能感到饥饿。可能会促使早起。
4 如果一定要吃,尽量吃易消化食物。消化过程让人清醒睡不着,因此最好在睡前避免食用难消化的食物。包括:脂肪或油炸食品、辛辣食物、酸性食品、碳酸饮料等。
5 多吃各种食物,有益于维持人体健康的微生物群。均衡饮食,食物中的营养素在产生褪黑素以及其他有助于调节睡眠的重要神经递质中起着巨大作用。

6 尝试补充益生元。已显示许多益生元可在人类受试者中发挥作用。如低聚果糖和低聚半乳糖等。
7 创建理想睡眠环境。
关闭电子产品(就寝前30分钟至1小时),保持卧室适宜温度(在16至19°C之间)等

8 调整灯光。晚上关掉灯或调暗灯,黑暗下人体会分泌更多褪黑素,有助于睡眠,当然,早上拉开窗帘享受阳光,可以帮你清醒。
9 舒适的床是最佳睡眠环境。旧的床垫和枕头会引起疼痛和酸痛,难以获得优质的睡眠。通常,专家建议每10年更换一次床垫,每两年更换一次枕头。当然也取决于床垫枕头质量。

10 保持规律作息。最好每天在同一时间上床睡觉,早上同一时间起床,确保人体昼夜节律时钟正常运作。即使在周末或休息日最好也是如此。

11 避免白天睡过多。如果已经出现睡眠障碍,那么白天尽量不要睡觉。如果有午睡习惯,尽量控制在30分钟之内,且在下午3点之前完成。
12 睡前放松,可以进行温水浴,泡脚,深呼吸,做些伸展运动,适量阅读,听听舒缓的音乐等,这些准备工作都有助于良好的睡眠。当有压力或焦虑时,身体会产生更多的皮质醇,皮质醇过高可能导致夜间频繁醒来。

13 如果实在在20分钟或更长时间内无法入睡,请起床并做一些容易累的事情。最重要的是离开床。
14 运动是帮助睡眠的良好方式,如果可以的话,每天至少20-30分钟锻炼,每周五次左右,但不要在睡前剧烈运动。

15 随着年龄的增长,褪黑素水平会下降。可以购买褪黑激素补充剂,该补充剂已被证明可以帮助55岁以上的人们更快入睡和更长的睡眠。睡前一个小时服用。褪黑激素还可以增强肠道微生物的健康多样性。如长期服用需咨询医生。

【附录】
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
相关阅读:
主要参考文献:
Vernia F, Di Ruscio M, Ciccone A, Viscido A, Frieri G, Stefanelli G, Latella G. Sleep disorders related to nutrition and digestive diseases: a neglected clinical condition. Int J Med Sci. 2021 Jan 1;18(3):593-603. doi: 10.7150/ijms.45512.
Krueger JM, Opp MR. Sleep and Microbes. Int Rev Neurobiol. 2016;131:207-225. doi: 10.1016/bs.irn.2016.07.003. Epub 2016 Aug 31.
Matenchuk Brittany A,Mandhane Piush J,Kozyrskyj Anita L,Sleep, circadian rhythm, and gut microbiota.[J] .Sleep Med Rev, 2020, 53: 101340.
Hertenstein E., Feige B., Gmeiner T., Kienzler C., Spiegelhalder K., Johann A., Jansson-Frojmark M., Palagini L., Rucker G., Riemann D., et al. Insomnia as a Predictor of Mental Disorders: A Systematic Review and Meta-Analysis. Sleep Med. Rev. 2019;43:96–105.
Poroyko V.A., Carreras A., Khalyfa A., Khalyfa A.A., Leone V., Peris E., Almendros I., Gileles-Hillel A., Qiao Z., Hubert N., et al. Chronic Sleep Disruption Alters Gut Microbiota, Induces Systemic and Adipose Tissue Inflammation and Insulin Resistance in Mice. Sci. Rep. 2016;6:35405.
Kinnucan J.A., Rubin D.T., Ali T. Sleep and Inflammatory Bowel Disease: Exploring the Relationship between Sleep Disturbances and Inflammation. Gastroenterol. Hepatol. (N.Y.) 2013;9:718–727.
Bowers S.J., Vargas F., Gonzalez A., He S., Jiang P., Dorrestein P.C., Knight R., Wright K.P., Jr., Lowry C.A., Fleshner M., et al. Repeated Sleep Disruption in Mice Leads to Persistent Shifts in the Fecal Microbiome and Metabolome. PLoS ONE. 2020;15
Smith R.P., Easson C., Lyle S.M., Kapoor R., Donnelly C.P., Davidson E.J., Parikh E., Lopez J.V., Tartar J.L. Gut Microbiome Diversity is Associated with Sleep Physiology in Humans. PLoS ONE. 2019;14:e0222394.
Durgan DJ. Obstructive sleep apnea-induced hypertension: role of the gutmicrobiota. Curr Hypertens Rep. 2017; 19: 35
Reynolds AC, Paterson JL, Ferguson SA, Stanley D, Wright KP Jr, Dawson D.The shift work and health research agenda: considering changes in gutmicrobiota as a pathway linking shift work, sleep loss and circadianmisalignment, and metabolic disease. Sleep Med Rev. 2016; 34: 3-9.
Parisi P, Pietropaoli N, Ferretti A, Nenna R, Mastrogiorgio G, Del Pozzo M, etal. Role of the gluten-free diet on neurological-EEG findings and sleepdisordered breathing in children with celiac disease. Seizure. 2015; 25: 181-183
Michalopoulos G, Vrakas S, Makris K, Tzathas C. Association of sleep qualityand mucosal healing in patients with inflammatory bowel disease in clinicalremission. Ann Gastroenterol. 2018; 31: 211-216.
Wang B, Duan R, Duan L. Prevalence of sleep disorder in irritable bowelsyndrome: A systematic review with meta-analysis. Saudi J Gastroenterol.2018; 24: 141-150.