 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

Desulfovibrio,脱硫弧菌,也被称为硫酸盐还原菌(SRB)属于变形菌门。这类细菌比较受关注,其中一个重要原因是这组细菌可以“呼吸”硫酸盐而不是氧气。由于硫化氢(H2S)的产生,SRB 被认为会对肠道上皮具产生毒性,导致胃肠道疾病。
脱硫弧菌属无处不在,可以在土壤、水和污水中以及动物和人类的消化道中找到。它们是硫酸盐还原性、非发酵性、厌氧性、革兰氏阴性杆菌,细胞直径约为 0.7 微,具有中温生长模式,在25至40摄氏度之间的温度下生长速率理想。
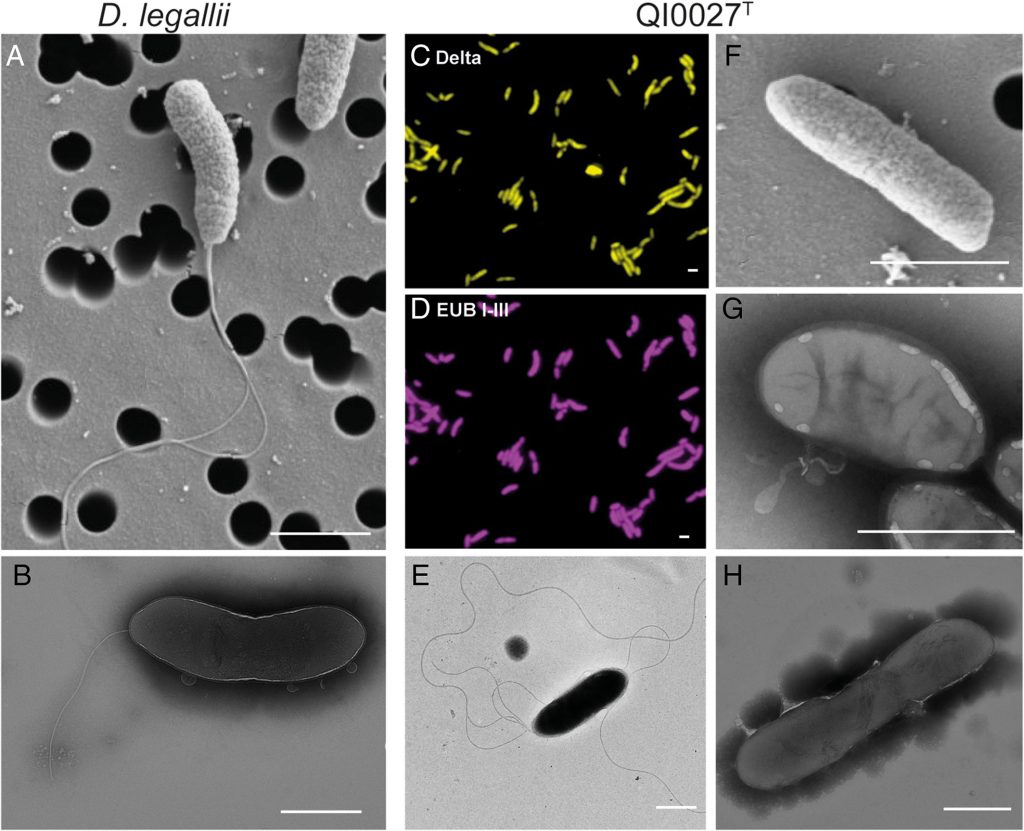

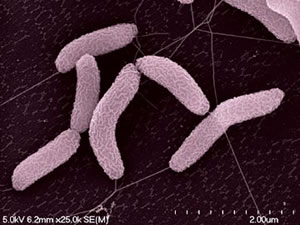
脱硫弧菌又被称为硫酸盐还原菌,由于其金属腐蚀能力,从而导致工业中的许多健康和安全问题。然而,该生物体也显示出生物修复的潜力,因为它可以对土壤中的污染物进行厌氧转化。
脱硫弧菌的物种被确定为生物修复剂,它能减少铀 (VI)、铬 (VI) 和铁 (III) 等几种有毒金属,在环境中,脱硫弧菌具有非常有用和有害的潜力。
结构和分类
由于惰性生长模式持续 4 至 7 天,因此很难通过常规方法从临床标本中分离。出于这个原因,所以目前通常使用分子技术鉴别该物种。
到目前为止,四种脱硫弧菌种均与人类感染有关(主要是腹部):
Desulfovibrio. fairfieldensis、
Desulfovibrio. desulfuricans、
Desulfovibrio. piger
Desulfovibrio. vulgaris
据不完全统计,SRB已有12个属40多个种 ,SRB的分类学研究进展比较缓慢。已知的SRB从生理学上分为两大亚类。
Ⅰ类:如脱硫弧菌属Desulfovibrio、脱硫单胞菌属Desulfomonas、脱硫叶菌属Desulfobulbus和脱硫肠状菌属Desulfotomaculum,其特点是可利用乳酸、丙酮酸、乙醇或某些脂肪酸为碳源及能源,将硫酸盐还原为硫化氢。
Ⅱ类:如脱硫菌属Thiobacillus、脱硫球菌属Desulfococcus、脱硫八叠球菌属Sporosarcina和脱硫线菌属Desulfotalea,它们的特别之处是可以氧化脂肪酸,并将硫酸盐还原为硫。随着研究的进展,陆续又有一些新的种属被命名。
由于脱硫弧菌的历史重要性,已经对两种菌株进行了基因组测序,一种正在进行中。这些菌株包括Desulfovibrio desulfuricans G20(已完成)、Desulfovibrio vulgaris subsp.
两个完全测序的基因组都显示Desulfovibrio具有一条染色体长度超过3 Mbp。两次测序还发现蛋白质的数量都在 3000 以上。
生态属性
培养和分离
大多数脱硫弧菌可以耐受少量暴露于空气中;然而,电镀介质中的氧气可以延迟或抑制该菌落的生长。因此,如果培养该菌,操作和生长应在厌氧生长室中进行。即使塑料物品(培养皿、eppendorf 管、移液管吸头、锥形管等)有氧气,也会阻碍Desulfovibrio. vulgaris和其他脱硫弧菌菌株生长。因此,塑料制品在使用前应在厌氧室内“脱气”至少 7天。
如果将含有合适碳源和硫酸盐的细菌盐混合物与接种物在 pH 7.5下厌氧培养,则会产生脱硫弧菌属。通过添加化学还原剂,Eh应低于 -150 mV。亚铁盐过量存在表明硫酸盐通过变黑而减少脱硫弧菌属的共养生活方式。主要与氢营养型产甲烷菌有关。
环境特性
硫酸盐还原菌(例如Desulfovibrio spp. 和Desulfotomaculum spp.)主要在深层地下水中产生气味,释放硫化氢。这些细菌还在热分层的湖泊和水库的厌氧低水层中产生硫化物气味。由其它细菌,尤其是产生的“沼泽”气味假单胞菌和单胞菌。这种现象是由在厌氧条件下具有强烈气味的有机硫化物(例如二甲基多硫化物)引起的。
Desulfovibro desulfuricans菌株为研究汞甲基化提供了一个极好的机会,因为它是典型的厌氧嗜温细菌,对 pH 和盐度具有广泛的耐受性,它也能在富马酸盐作为电子受体的情况下生长良好,从而防止硫化物对汞甲基化的抑制。
脱硫弧菌能利用乙醇或乳酸还原硫酸盐产生乙酸代谢产物。其中Desulfovibrio sp.strain JY菌株在淡水和海水环境中均具有很强的产电能力,最大电流输出密度可达243.2mA/m2。该菌株是目前报道的首例电活性脱硫弧菌,可为探索微生物胞外电子传递在腐蚀中的作用提供模式菌株,进而为海洋金属腐蚀防控技术提供策略。
与人体健康相关的双重特性
约 50% 人的口腔和肠道中存在Desulfovibrio,也就是硫酸盐还原菌 (SRB)。它在肠道中茁壮成长,释放硫化氢 (H2S) 作为硫酸盐还原的产物。
在厌氧条件下微生物将硫酸盐还原为H2S的过程称为反硫化作用。参与这一过程的微生物称为硫酸盐还原菌。反硫化作用具有高度特异性,主要是由脱硫弧菌属(Desulfovibrio)来完成。如脱硫脱硫弧菌(D.desulfuricans)是一典型反硫化作用的代表菌,其反应式为:
C6H12O6+3H2SO4→6CO2+6H2O+3H2S+能量
产生的H2S与铁化学氧化产生的Fe2+形成FeS和Fe(OH)2,这是造成铁锈蚀的主要原因。
H2S作为第三种气体信号分子广泛参与动物体内的多种生化反应,是胃肠道内一种重要的生理分子,调节细胞和组织的生理功能。硫化氢参与了对消化系统许多疾病的自然预防,但这种分子在胃肠道中的活性取决于这种气体介质在特定组织中的浓度。
肠道细菌中包括Desulfovibrio是胃肠道硫化氢的主要生产者,细菌释放的硫化氢扩散到上皮下区域由肠细胞和结肠细胞控制。这种相互作用对调节粘膜功能和肠道内环境很重要。
肠道炎症
H2S在肠道炎症中的作用是复杂的,有时是矛盾的。
一些实验和临床数据表明H2S与慢性结肠疾病和大肠炎症有关。同样,一些脱硫弧菌物种的存在与慢性牙周炎、细胞死亡和炎症性肠病如溃疡性结肠炎和克罗恩病有关,或者至少增加复发的风险。
但是同时也有研究表明H2S可以直接促进血管生成,其对胃肠道溃疡愈合的有益作用可能部分是由于溃疡边缘的粘膜血流增强,这对溃疡修复至关重要。
内脏敏感性
H2S在刺激肠道内脏敏感性方面也具有双重作用。
硫化氢可以调节胃肠道的伤害敏感性,对脊髓和脊髓上内脏运动反应产生抗伤害作用。
硫化氢同时也可以通过激活T型钙通道对结肠扩张引起的内脏运动反应具有促痛作用。锌的螯合作用通常通过硫化氢与T型钙通道结合,似乎是结肠传入激活的关键步骤。硫化氢的促伤害作用来自硫化氢直接激活空肠肠系膜传入。
硫化氢通过几个确定的分子靶点调节胃肠道的伤害性反射,包括:
T型电压门控钙通道(VGCC)
TRPV1受体
TRPA1受体
信号分子 / 能量来源
H2S还可以作为线粒体的信号分子或能量来源。
通过使用氢气,SRB 有助于高效能量获取和发酵细菌产生的底物的完全氧化。因此,SRB 可以在肠道微生物组中发挥双重作用。来自健康个体的相对较少的菌株已被表征。在从西方国家获得的样本中,Desulfovibrio. piger被描述为最丰富的。
肥胖/代谢紊乱
一项研究来自广东肠道微生物组计划 (GGMP) 的广泛的肠道菌群数据集,该数据包含来自中国广东省 14 个地区的 7009 个人,研究结果表明Desulfovibrio piger 可能是广东人群肠道中最常见和最丰富的Desulfovibrio物种。
而且Desulfovibrio的主要 sub-OTU 与细菌群落多样性呈正相关。Desulfovibrio与Oscillospira,Coprococcus,瘤胃球菌属,Akkermansia,罗斯氏,Faecalibacterium和Bacteroides呈正相关,而与有害菌属负相关,例如梭菌属、埃希氏菌属、克雷伯氏菌属等。
Desulfovibrio的相对丰度与体重指数、腰围、甘油三酯水平和尿酸水平呈负相关。
另有研究也表明,肥胖和超重儿童Desulfovibrio显著低于正常体重儿童。
帕金森
对 20 名帕金森 患者和 20 名健康对照的粪便进行常规和定量实时 PCR 分析表明,所有帕金森患者的肠道微生物群中都含有脱硫弧菌,并且这些细菌在帕金森患者中的含量高于健康对照。此外,脱硫弧菌物种的浓度与帕金森的严重程度相关。脱硫弧菌产生硫化氢和脂多糖,可能诱导α-突触核蛋白的寡聚化和聚集。
肝脏脂质代谢
宏基因组学显示富含黄芪多糖 的D. vulgaris可能通过产生乙酸和调节小鼠肝脏脂质代谢来有效减轻肝脏脂肪变性。
关节炎
临床报告了一例由脱硫弧菌引起的髋关节化脓性关节炎。患者接受了清创术,随后进行了靶向抗生素治疗,感染消退。
结直肠癌
D. longreachensis 分别在 III/IV 期和 0 期结直肠癌中增加。
系统性硬化症
系统性硬化症患者的肠道微生物群的特征是促炎性有害属增加,尤其是Desulfovibrio。
妊娠期糖尿病
Desulfovibrio在妊娠期糖尿病女性中大量存在。
IBS
便秘型肠易激综合征患者肠道微生物群中的Desulfovibrio高于健康人。
菌血症
Desulfovibrio fairfieldensis和D. desulfuricans与菌血症有关。
但是这些样本量、研究对象和部分缺乏健康对象参数。可能需要进行大规模的队列分析。
总结
Desulfovibrio是一类还原硫酸盐产生H2S的厌氧菌,内源性的H2S会毒害肠道上皮细胞,会造成肠道敏感性,肠漏或者腹痛等,多项临床研究证实脱硫弧菌属数量的增多是息肉和溃疡性结肠炎疾病的一个重要特征。
随着时间的推移,粘膜下层持续暴露于炎症和免疫诱因会导致身体产生抗体。抗体是识别和对抗病毒和细菌的特殊蛋白质。这些抗体还可以开始识别和攻击宿主的身体组织。
谷禾大数据显示,如果脱硫弧菌同时和几个其他的菌超标,如,肺炎链球菌、克雷伯氏菌、嗜胆菌属、甲烷短杆菌也超标,对应菌群代谢产物如胆汁酸,对甲酚等代谢问题,引发腹胀,便秘和情绪等问题。也有研究证实便秘组克里斯滕森菌(christensenella)和脱硫弧菌(desulfovibrio)的相对丰度较高。
但值得注意的是,脱硫弧菌一般具有产生乙酸,消耗乳酸,和具有成为电子受体特征中的一种或多种。由于惰性脱硫弧菌细菌的这些具体特征对于与Faecalibacterium prausnitzii (F.prausnitzii,普氏栖粪杆菌,又名:普拉梭菌)的共生关系非常重要,我们知道,普拉梭菌与其它菌相比,会产生更高的乳酸,在生产更多乳酸时为脱硫弧菌提供了更多的底物。因此,脱硫弧菌与普拉梭菌同时存在,将有助于肠道产生更多的丁酸,从而用于治疗或预防与丁酸水平降低相关的任何疾病。
因此,一个菌的好坏及其健康特性,需要将其置于整个微生物生态中去综合考量,通过整个生态菌群构成和代谢来判别其丰度阈值和功能特性。
主要参考文献
Cabrera G, Perez R, Gomez JM, Abalos A, Cantero D. “Toxic effects of dissolved heavy metals on Desulfovibrio vulgaris and Desulfovibrio sp. strains.” J Hazard Mater. 2005 Dec 28.
Devereux R, He SH, Doyle CL, Orkland S, Stahl DA, LeGall J, Whitman WB. “Diversity and origin of Desulfovibrio species: phylogenetic definition of a family.” Journal of Bacteriology. 1990 Jul;172(7):3609-19.
ITQB. Instituta de Technologia Quimica e Biologica. Universidade Nova de Lisboa. “Desulfovibrio gigas.”
NCBI. Genome Project > Desulfovibrio desulfuricans G20 project at DOE Joint Genome Institute.
Pires RH, Venceslau SS, Morais F, Teixeira M, Xavier AV, Pereira IA.”Characterization of the Desulfovibrio desulfuricans ATCC 27774 DsrMKJOP Complex-A Membrane-Bound Redox Complex Involved in the Sulfate Respiratory Pathway.” Biochemistry. 2006 Jan 10;45(1):249-62.
Verstreken I, Laleman W, Wauters G, Verhaegen J. Desulfovibrio desulfuricans bacteremia in an immunocompromised host with a liver graft and ulcerative colitis. J Clin Microbiol. 2012 Jan;50(1):199-201. doi: 10.1128/JCM.00987-11. Epub 2011 Nov 9. PMID: 22075582; PMCID: PMC3256723.
Xu Y, Shao M, et al. Antipsychotic-induced gastrointestinal hypomotility and the alteration in gut microbiota in patients with schizophrenia. Brain Behav Immun. 2021 Sep 24;99:119-129. doi: 10.1016/j.bbi.2021.09.014.
Murros KE, Huynh VA, Takala TM, Saris PEJ. Desulfovibrio Bacteria Are Associated With Parkinson’s Disease. Front Cell Infect Microbiol. 2021 May 3;11:652617. doi: 10.3389/fcimb.2021.652617. PMID: 34012926; PMCID: PMC8126658.
Marquis TJ, Williams VJ, Banach DB. Septic arthritis caused by Desulfovibrio desulfuricans: A case report and review of the literature. Anaerobe. 2021 Aug;70:102407. doi: 10.1016/j.anaerobe.2021.102407. Epub 2021 Jun 18. PMID: 34153468.
Chen YR, Jing QL, Chen FL, Zheng H, Chen LD, Yang ZC. Desulfovibrio is not always associated with adverse health effects in the Guangdong Gut Microbiome Project. PeerJ. 2021 Aug 18;9:e12033. doi: 10.7717/peerj.12033. PMID: 34466295; PMCID: PMC8380029.

谷禾健康


↑出现以上症状,可能是身体缺乏蛋白质的信号。
★ 蛋白质有多重要?
蛋白质不仅是构建人体组织的主要原料,而且对新陈代谢至关重要。膳食蛋白质及其代谢产物氨基酸是人类的必需营养素。
蛋白质提供能量,调节代谢;我们的皮肤、骨骼、毛发都有它的参与;当然免疫系统也少不了它。
★ 肠道菌群参与蛋白质代谢
肠道微生物群介导蛋白质代谢和宿主免疫反应之间的相互作用,在代谢过程中发挥重要作用。
小肠细菌能代谢部分氨基酸,进而影响宿主整体氨基酸的代谢。大肠拥有更丰富的菌群和更长的蠕动时间。
一方面,进入大肠的氮营养素会影响大肠菌群的代谢和群落结构;另一方面,大肠菌群也能广泛参与氮营养素的代谢与利用,生成许多代谢产物,进而影响人体健康。
因此,本文详细讨论蛋白质对人体的影响,肠道菌群与蛋白质的相互作用,肠道微生物群代谢产物的影响,文末有人体对蛋白质的需求量及相关食物补充说明。
我们先来看一下蛋白质的消化分解过程。
蛋白质的消化分解
小肠上皮细胞消化膳食蛋白质,然后吸收氨基酸和肽是一个高效的过程。高可消化的蛋白质可能部分逃脱小肠的消化,大量的含氮物质可能从小肠转移到大肠。未消化的蛋白质和多肽通过肠道微生物和残留的胰腺蛋白酶进行蛋白水解,产生大量的微生物代谢物。
胃肠道中的蛋白质分解代谢物
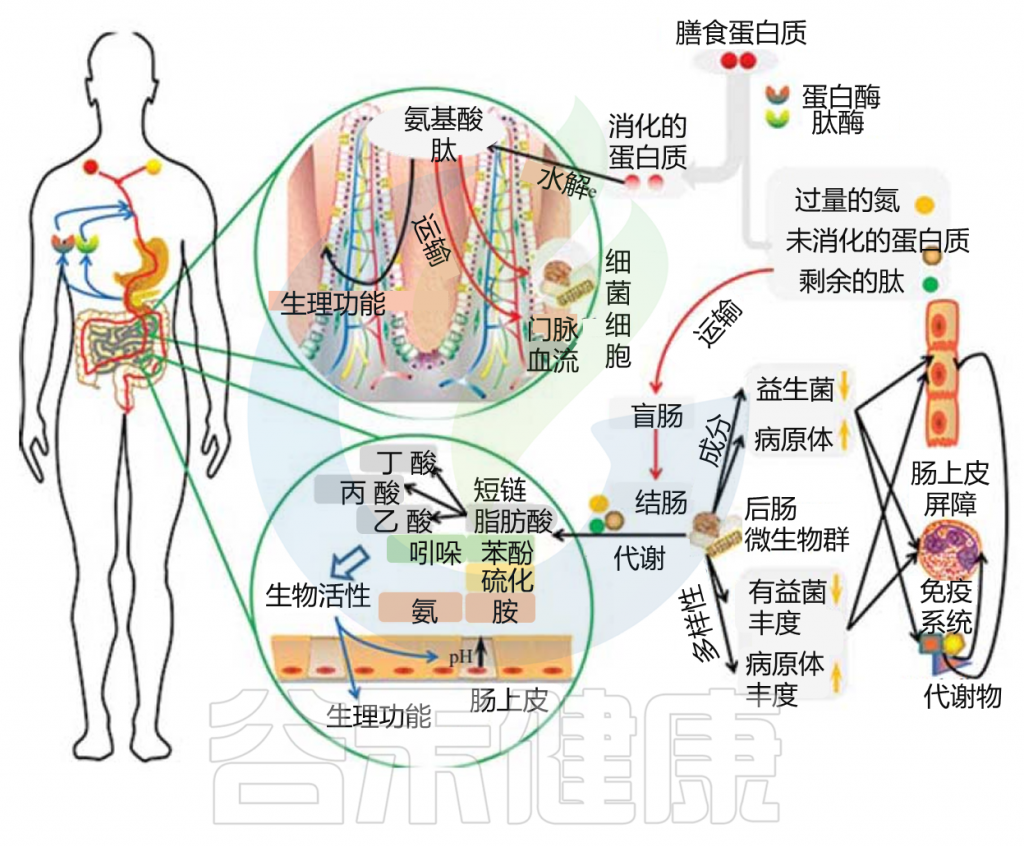

Zhao J, et al., Curr Protein Pept Sci. 2019
这些微生物代谢物中有些是中间产物,有些是最终产物。大量的最终产物主要是短链脂肪酸、氨、多胺、硫化氢、酚类和吲哚类化合物。
这些细菌代谢物中的一些可以被运输到结肠细胞,并根据其在腔内的浓度对这些上皮细胞产生有益或有害的影响。一些细菌代谢产物被输送到门脉血,对肝脏和周围器官组织产生各种生理作用(这些代谢物在健康中发挥的作用详见本文后面章节)。
肠道微生物群在膳食蛋白质分解代谢中作用
宿主饮食对肠道微生物群的分布和活性有很大影响。膳食蛋白质或氨基酸调节可作为调节发酵细菌的一种方法。
在研究不同动物蛋白质来源(牛肉、鸡肉和鱼类)对人类粪便微生物群的影响的研究中,与牛肉蛋白孵育2天后,产气荚膜梭菌的数量显著增加,双歧杆菌的数量显著减少。
微生物分泌的酶直接降解分解蛋白
肠道微生物群在促进氨基酸调节以及氨基酸消化和吸收过程中的分泌方面起着至关重要的作用。
蛋白质的转换主要发生在肠道中,结肠细菌降解内源性或外源性蛋白质的效率较高。
拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。
粪便微生物群与结肠微生物群具有不同的蛋白水解活性。粪便微生物的活性仅在球状蛋白质的蛋白质水解方面较高。
发酵过程中,复杂蛋白质首先被各种细菌肽酶、蛋白酶和内肽酶切割,释放出游离氨基酸和短肽。氨基酸和短肽然后进行发酵。蛋白质发酵产生支链脂肪酸(2-甲基丁酸酯、异丁酸酯、异戊酸酯)、有机酸、气体(H2和CO2)以及微量酚、胺、吲哚和氨。
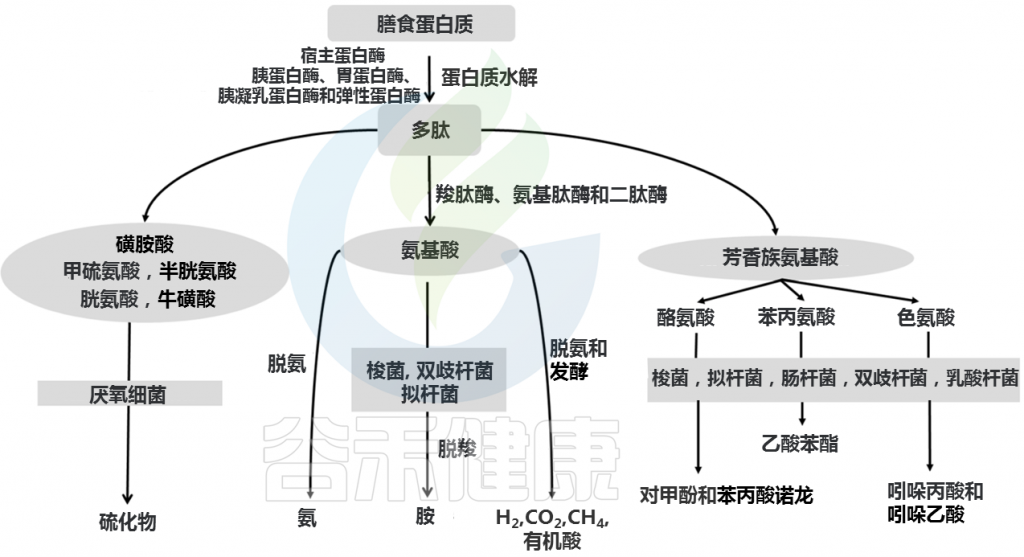

Yadav M, et al., Arch Microbiol. 2018
肠道微生物参与氨基酸代谢
一些菌群可能在肠道中的氨基酸代谢中发挥重要作用,例如梭杆菌属、拟杆菌属和韦荣球菌,Megasphaera elsdenii, Selenomonas ruminantium.
肠道内的梭菌属细菌(赖氨酸或脯氨酸利用的基础细菌)是氨基酸发酵的关键驱动因素,而消化链球菌属细菌是谷氨酸或色氨酸利用的关键驱动因素。
其他例如瘤胃细菌,Selenomonas ruminantium, Megasphaera elsdenii, Prevotella ruminicola, Misuokella multiacidas, Butyrivibrio fibrisolvens, Streptococcus bovis等含有极为活跃的二肽基肽酶和二肽酶。
微生物从头合成氨基酸
肠道微生物群在产生氨基酸方面也起着关键作用,这包括从头生物合成。
例如,一些体外研究项目表明,瘤胃细菌种类,如Streptococcus bovis,Selenomonas ruminantium, Prevotella bryantii,在生理肽浓度存在的情况下参与氨基酸的从头合成。
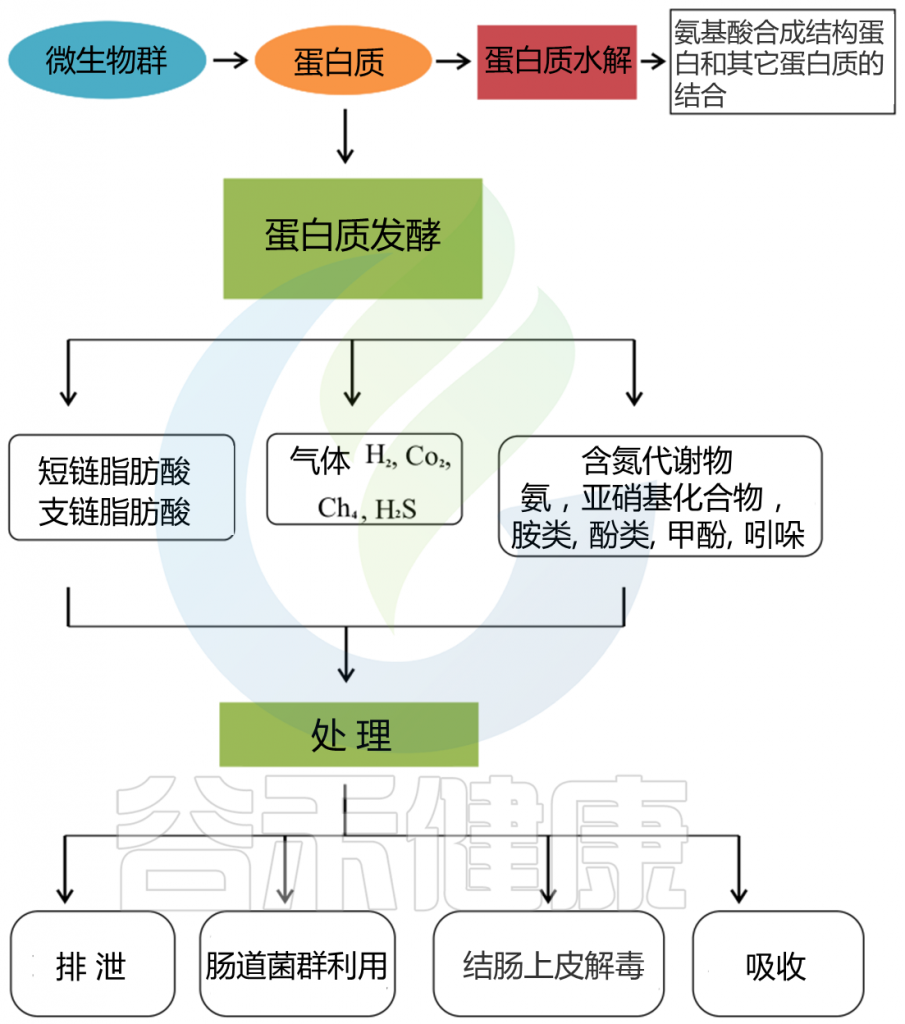

Lin R, et al., Amino Acids. 2017
体内研究还表明,微生物衍生的赖氨酸(一种必需氨基酸)被吸收并并入宿主蛋白质。在无菌和常规化大鼠体内,将15NH4CL中的15N并入赖氨酸的比较表明,检测到的所有15N赖氨酸均来自微生物来源。在后续研究中,这些研究人员确定约75%的微生物15N标记的赖氨酸被小肠吸收。
此外,其他体内研究项目表明,微生物衍生的赖氨酸被吸收并整合到宿主蛋白质中。与动物研究相一致,六名健康男性的样本以15NH4Cl的形式口服15N与标记肠道微生物来源的微生物蛋白和苏氨酸有关,这些微生物来源存在于活体门静脉血流中。
对18岁以上的人样本进行了检查,这些人被提供了氮充足的饮食,并发现微生物衍生的赖氨酸和苏氨酸对游离血浆赖氨酸和苏氨酸库有显著贡献。
此外,Gill等人报告说,大肠中微生物群的富集是通过与必需氨基酸(EAA)生物合成相关的基因进行的,该生物合成基于人血浆池产生的前体。
蛋白质或氨基酸摄入对肠道微生物的影响
膳食蛋白质是均衡饮食的重要组成部分。人类无法合成多种氨基酸,因此这些氨基酸必须从食物中获取以维持健康。胃肠道微生物群组成和功能的差异可能是由于膳食蛋白质的变化。
进入结肠的蛋白质量和尿液中检测到的发酵代谢物量取决于蛋白质的消化率,蛋白质消化由蛋白质水平和来源的共同作用决定。
当进展到结肠的远端部分时,碳水化合物被消耗,pH值增加,蛋白质发酵变得更加有效。在消化过程中,蛋白质摄入量的增加总是与消化率的相对降低有关,通常会导致更多可发酵的大量营养物质进入结肠。
不同形式蛋白对肠道微生物群影响不同
蛋白质来源主要来自植物或动物来源,每种类型都具有独特的消化率和不同的降解模式,具体取决于所涉及的微生物。结肠中的细菌属参与蛋白质代谢,主要包括可能致病的拟杆菌属、大肠杆菌属和梭菌属。抑制这些潜在病原体通常与通过减少肠毒素和有害微生物代谢物的释放来恢复微生态系统平衡有关。
考虑到蛋白质来源在消化中的作用,动物来源的蛋白质,如乳品和动物蛋白的消化率普遍高于植物蛋白。然而,酪蛋白的热分解显著降低了蛋白质的消化率,增加了蛋白质的发酵程度。下面就详细来看蛋白质来源如何调节肠道微生物群。
植物蛋白
与动物蛋白相比,植物蛋白通常具有较低的蛋白质消化率,因为植物细胞壁不能消化。大豆和花生蛋白都在调节肠道有益细菌组成方面有积极的作用。
添加20%花生蛋白的饲粮改变了大鼠肠道菌群多样性,增加了双歧杆菌,降低了肠杆菌和产气荚膜梭菌的数量。增加的双歧杆菌有助于产生更多的微生物代谢物,包括乙酸和乳酸,导致肠道pH值降低,抑制有毒代谢物,如胺和苯并吡咯。
大豆已被广泛应用于人类和动物,它可以改变肠道微生物的组成,增加了埃希氏杆菌属和丙酸杆菌。系统发育分析显示,埃希氏杆菌属与志贺菌的同源性最高,两者都能在不损害肠道黏膜的情况下调节盐和水的代谢。但大豆中含有的抗营养因子会对生产性能产生负面影响,限制了其在非反刍动物中的应用。
植物蛋白被用于动物饲料行业,因为它的价格普遍低于动物蛋白,并且在食品安全方面具有一些优势。
动物蛋白
与植物蛋白相比,动物蛋白对于牲畜来说是高度易消化的。酪蛋白、脱脂奶粉和鱼粉通常用作猪的饲料,它们可以被消化成丰富的蛋白质底物并在到达大肠之前被吸收。这些动物蛋白的代谢特性有利于宿主健康,特别是,对环境应激导致仔猪断奶后腹泻的预防作用及一些植物蛋白中的抗营养因子。
酪蛋白可以被近端肠道中的宿主酶消化,从而减少大肠中细菌的降解。具体而言,酪蛋白可以增加乳杆菌和双歧杆菌,并减少粪便中葡萄球菌、大肠菌群和链球菌的数量。此外,酪蛋白可以调节直肠真杆菌和Marvinbryantia formatexigens的减少。
补充脱脂干牛奶可以增加总厌氧菌和需氧菌,而膳食鱼粉可以减少需氧菌,包括大肠菌群,并增加厌氧菌的数量,如乳酸杆菌属。
此外,动物蛋白的特点是 短链脂肪酸减少,肠道 pH 值和氨浓度增加。
显然,蛋白质来源对肠道微生物群的影响并不一致,需要更多的研究来评估不同蛋白质类型对蛋白质消化率和代谢以及肠道微生物群组成的影响。
蛋白质摄入量与肠道菌群
膳食蛋白质的浓度是影响蛋白质发酵和肠道微生物组成的主要因素。
更高的水平和未消化的蛋白质会导致致病微生物的增加,从而增加代谢疾病的风险。
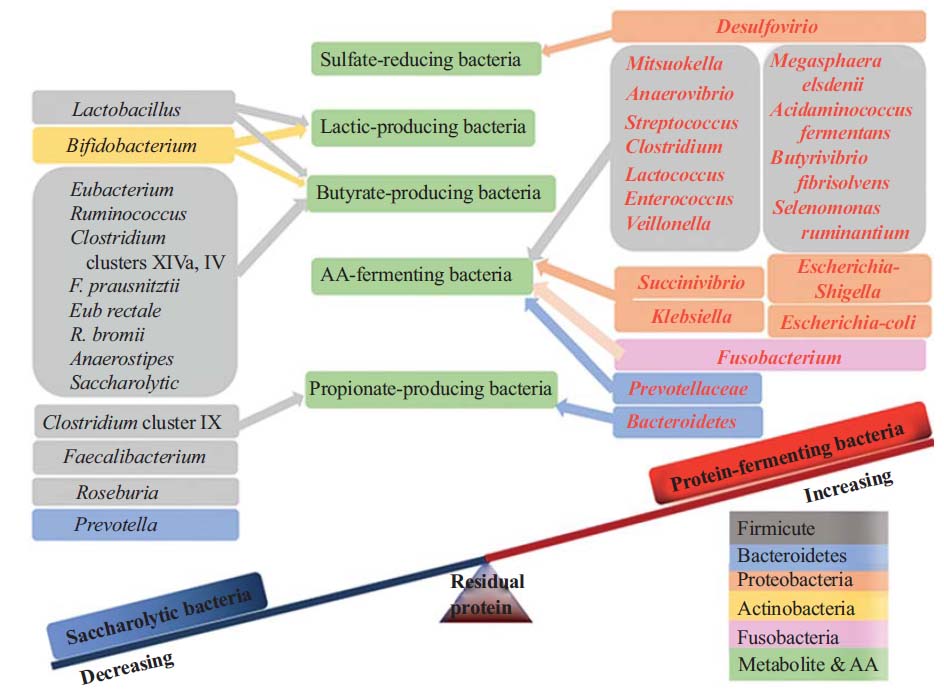

Zhao J, et al., Curr Protein Pept Sci. 2019
未被小肠吸收的残留含氮化合物将被转移到远端肠道,并被该位置微生物代谢。微生物代谢物的数量和种类均受膳食蛋白质摄入量的影响。
有些微生物代谢物是有毒的,例如硫化氢、氨和吲哚化合物,并可能对宿主健康产生负面影响。有些代谢物是参与宿主各种生理过程的生物活性分子。
此外,由于肠道微生态系统的稳态破坏和有益菌的减少,高浓度的蛋白质补充会导致潜在病原体数量增加。膳食蛋白质改变的肠道微生物群,通过调节肠道屏障功能、肠道运动和免疫系统来影响宿主代谢。
结肠中过量蛋白质发酵影响肠道微生物群变化
未消化蛋白质的增加与蛋白质摄入水平高、蛋白质消化率相对降低和氨基酸组成不平衡有关。结肠中多余蛋白质的降解始于细菌蛋白酶和肽酶将蛋白质水解成较小的肽和氨基酸。这些含氮化合物会影响肠道微生物群,尤其是结肠。
-3.png)
稍低蛋白浓度有助于减少大肠杆菌,但蛋白浓度过低会增加潜在致病菌
相对低浓度的膳食蛋白质会减少致病菌增殖的底物量。例如,人类饮食中低浓度的蛋白质导致粘膜表面的大肠杆菌群落减少。在较低蛋白质条件下肠道微生物的变化会产生毒性较小的含氮细菌代谢物,例如多胺。
然而,当饮食中蛋白质的浓度过低而不能满足宿主的基本需要时,就会增加潜在病原体的丰度,减少有益菌的数量。
具体来看一项关于蛋白浓度变化对肠道菌群影响的研究。
断奶动物
蛋白水平适量:
当断奶动物饲喂100-200g/kg的膳食蛋白质时,粪便中需氧菌和厌氧菌的数量会增加,这些蛋白质水平会导致肠道中乳酸杆菌的增加以及大肠菌群和葡萄球菌的减少。
蛋白水平过高:
然而,当膳食蛋白质水平大于 200 g/kg 时,致病菌数量会增加,例如大肠菌群、链球菌和芽孢杆菌。
蛋白水平过低:
低浓度的膳食蛋白质会减少产丁酸菌(这些菌群是抗癌和其他肠道疾病的抗炎剂),包括乳酸杆菌、双歧杆菌、saccharolytic(糖酵解菌)。
成年动物
成年动物中,在蛋白质水平的微小变化下,肠道微生物群相对稳健。例如,当成年动物分别用 190 g/kg 和 150 g/kg 蛋白质喂养时,粪便样本中的细菌数量几乎没有差异。
在成年动物中,只有当蛋白质水平发生重大变化时,才能观察到微生物群的变化。
低蛋白饮食还与低浓度的氨、血浆尿素氮和回肠食糜中的短链脂肪酸含量有关。肠道中的氨不是来自宿主脲酶活性,而是来自蛋白水解和微生物活动。因此,回肠食糜中低浓度的氨可能表明蛋白质代谢降低。
蛋白质发酵产物对肠道微生物的影响
大部分膳食蛋白质在小肠中消化,但蛋白质摄入过多会导致结肠输入量增加。结肠中多余蛋白质的降解始于蛋白质被细菌蛋白酶和肽酶水解成更小的肽和AA,这些蛋白酶和肽酶在中性至碱性pH下更为活跃。这些残余蛋白质不仅提高了肠道pH值,而且还可供结肠微生物进一步代谢。
然而,碱性pH有利于病原体增殖,对肠道健康不利。此外,由于向肠道微生物群过量供应膳食蛋白质而导致的蛋白质发酵也被视为肠道疾病发展的一个因素。
虽然有报道称结肠蛋白输注过多会产生有害影响,仍有一些争议,但似乎较低量的蛋白到达远端肠道可能会降低腹泻的发生率,并抑制病原菌的增殖,特别是在应激情况下,如感染高压。
蛋白质的发酵通常与蛋白质发酵细菌以及潜在致病菌的生长有关。通过培养基分析,至少拟杆菌属和丙酸杆菌以及各种杆菌被鉴定为蛋白水解细菌,其中一些细菌的基因组中携带丝氨酸和其他蛋白酶的基因。
氨基酸为细菌提供代谢底物
饮食和内源性来源的蛋白质和氨基酸对于肠道微生物群的生长和存活是必要。
蛋白质水解后,释放的肽和氨基酸被宿主和胃肠道中的细菌用于各种代谢活动,虽然一些细菌缺乏使用细胞外氨基酸的特定转运体。
胃肠道中许多细菌的理想氮源是氨基酸和NH3,可能是因为它们缺乏必要的肽转运蛋白。然而,如瘤胃前置杆菌等细菌利用肽作为氮的唯一来源。这些肽最初被输送到瘤胃前置杆菌的细胞中,然后直接使用或水解成FAAs。通常,肽、氨基酸和NH3可用于细菌细胞成分的生产或通过各种途径分解代谢。这些过程可能对身体产生有利或不利的影响。
蛋白质摄入与肠道屏障
肠道是一个具有高度蛋白水解活性的部位,主要由微生物群介导。这些蛋白水解代谢物以及肠道微生物(可通过蛋白质水平改变)通过调节紧密连接蛋白和Zonulin在调节肠粘膜屏障中发挥重要作用。
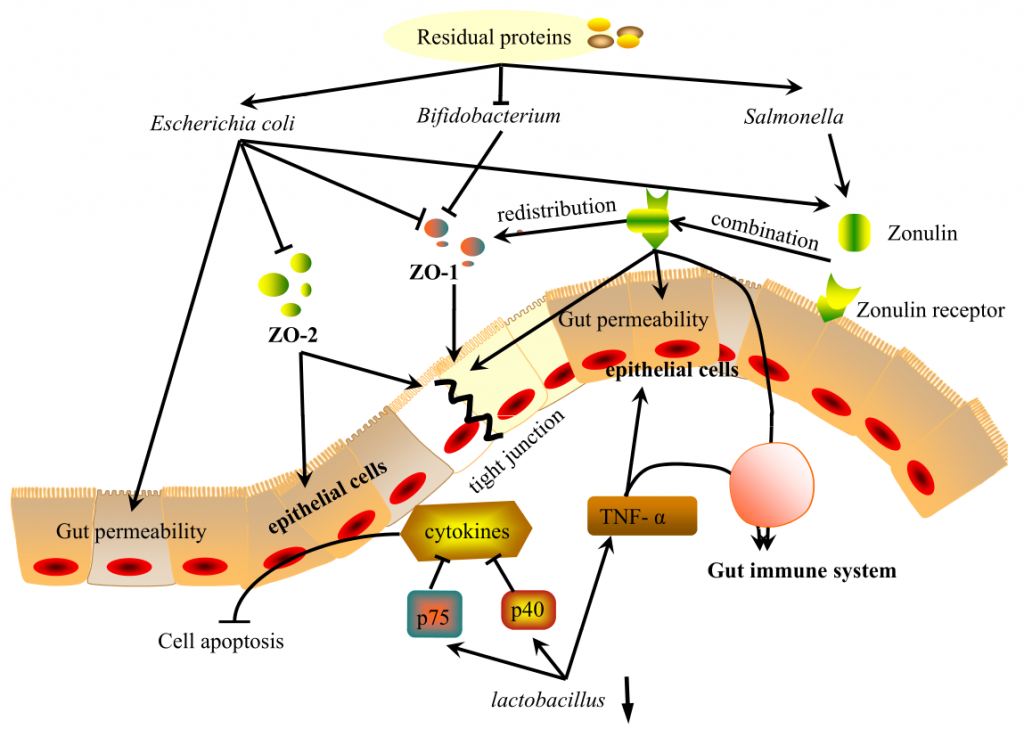

Ma N, et al., Curr Protein Pept Sci. 2017
肠道微生物通过调节紧密连接蛋白ZO-1和ZO-2的表达来影响肠道上皮屏障。研究表明,在高蛋白饮食(HPD)中增加双歧杆菌可有效缓解结肠上皮细胞膜屈曲,上调ZO-1表达,有利于紧密连接修复。
相反,低蛋白饮食(low-protein diet, LPD)或正常蛋白饲粮(normalprotein diet, NPD)通过降低肠上皮通透性,降低大肠杆菌水平,从而上调ZO-1的表达。抑制大肠杆菌生长也可上调ZO-2的表达,从而保护肠上皮细胞,修复上皮屏障。
连蛋白Zonulin是唯一已知的细胞间紧密连接的生理调节剂,可能是微生物群和紧密连接蛋白之间的一种可能的调节剂。
Zonulin可逆且快速地调节肠道通透性,其在遗传易感个体中的上调可能导致免疫介导的疾病。其释放将由细菌数量的变化触发。
在上皮细胞中结合其受体后,该复合物导致紧密连接的开放并增加肠道通透性。
研究人员选择了4种细菌菌株作为兴奋剂,包括3种大肠杆菌菌株和1种沙门氏菌菌株,它们都是病原体,HPD增加。它们都释放了Zonulin并改变了细胞旁通透性。同时,观察到ZO-1从紧密连接复合物重新分布到细胞单层。
此外,不同的细菌会导致不同水平的Zonulin分泌,这会在不同程度上改变肠道屏障功能,反映微生物和肠道之间的急性调节。
氨基酸不均衡会诱发肠道问题
膳食蛋白质中的氨基酸可通过调节肠道微生物群组成间接影响肠道形态。此前有研究报道,低赖氨酸玉米蛋白会导致肠道绒毛高度降低,隐窝深度加深,提示肠道黏膜的损伤是由于饲粮中氨基酸比例失衡所致。
小肠上皮细胞可将氨基酸和其他营养物质吸收到血液和器官中,营养不良对肠道微生物群的干扰和影响可能导致肠道形态受损。
断奶时观察到的腹泻可以通过低蛋白质水平和平衡氨基酸组成来缓解。然而,饮食中氨基酸的不平衡可能损害肠道形态,增加腹泻风险。因此,饮食中氨基酸失衡会抑制蛋白质吸收,导致肠上皮增生。
注意蛋白过敏或不耐受诱发的肠道问题
大豆中的粗蛋白质相对较高,约为40%,主要由球蛋白组成,球蛋白由伴大豆球蛋白和大豆球蛋白组成。这些球蛋白具有免疫原性和热稳定性。
大豆蛋白补充剂中抗原复合物的形成,如大豆球蛋白、β-伴大豆球蛋白和免疫球蛋白抗体,可能是刺激过敏反应和腹泻的原因。大部分膳食蛋白质在消化后降解为肽和氨基酸。
然而,还有一种可能性是,其他分子如一种抗营养因子,可以通过肠上皮细胞进入血液和淋巴。大豆中具有抗原活性的抗营养因子可刺激宿主的免疫应答。
免疫反应由具有IgE分泌的T淋巴细胞介导,其对肠道形态具有负面影响,导致绒毛损伤和隐窝细胞增殖。
此外,上皮细胞中消化酶活性的降低可能与吸收功能失调和肠道微生物群组成多样性减少有关。
由于其抗原性,膳食大豆蛋白可能有利于病原体增殖,这些抗原也可能是对粪便微生物群一致性产生不利影响的因素。
对大豆蛋白的超敏反应可能导致对病原体过度生长的更高易感性,主要包括蛋白质代谢细菌以及肠致病性大肠杆菌。
大豆蛋白和其他植物蛋白通常含有抗营养因子,包括可溶性非淀粉多糖含量升高,可能增加断奶仔猪腹泻的发生率。
在大豆蛋白质代谢过程中,会产生各种毒素,如组胺、尸碱和腐胺,这些毒素会破坏肠壁,增加肠上皮细胞的通透性。当病原体在管腔内定植时,可能发生肠道微生态失调。
大豆蛋白被认为是一种相对健康的蛋白质来源。大豆经加工处理后,抗原活性有所降低,抗营养因子显著降低。Pepsin-hydrolysate conglycinin (PTC)是一种治疗后从球蛋白中提取的小肽,具有降低高血压、抗氧化和免疫刺激等药理和生理活性。
伴大豆球蛋白是大豆贮藏蛋白的组分之一,经消化和酶处理后以PTC的形式发挥作用。PTC可以抑制病理性大肠杆菌的生长,无时间依赖性,并且在 大肠杆菌E. coli O138激发后也被激活以预防疾病。
伴胰球蛋白-胃蛋白酶水解物参与调节肠道微生物群落平衡和维持肠道完整性。当肠道微生态系统的稳态受到干扰时,生物活性肽可在预防与肠道疾病相关的疾病中发挥重要作用。PTC还通过产生胃蛋白酶介导的双歧杆菌生长刺激肽促进双歧杆菌的生长。然而,PTC对E. coli O138的抑制作用的潜在机制尚不清楚,需要进一步的研究来阐明。
酪蛋白与肠道微生物群
酪蛋白具有特殊的氨基酸组成,可以诱导肠道氨基酸转运蛋白基因的转录水平。肠道微生物群的组成和功能也受到氨基酸平衡改变的影响。
CAT1
阳离子氨基酸转运蛋白(CAT1)参与赖氨酸和精氨酸的转运。研究表明,对十二指肠和回肠中的CAT1没有显著影响。相反,与空肠中的膳食玉米醇溶蛋白相比,补充酪蛋白的CAT1表达水平更高。
因此,可以合理地得出结论,酪蛋白可促进赖氨酸和精氨酸的积累,这与补充酪蛋白的赖氨酸含量高于膳食玉米醇溶蛋白的报告一致。
肠道中赖氨酸和精氨酸的变化可能有助于酪蛋白对肠道微生物群的影响。CAT1的表达随着饮食中赖氨酸水平的增加而上调。
EAAC1
兴奋性氨基酸载体1(EAAC1)参与天冬氨酸和谷氨酸的转运,其作用类似于CAT1。EAAC1在十二指肠中的表达水平被膳食玉米醇溶蛋白下调,而在空肠和回肠中,补充酪蛋白的EAAC1表达水平高于玉米醇溶蛋白或大豆蛋白。
PePT1
此外,肽转运蛋白1(PePT1)的表达也受到不同蛋白质来源的调控。与植物蛋白相比,膳食酪蛋白在所有肠段都有更高的PepT1表达。
因此,具有平衡氨基酸组成的膳食酪蛋白可以促进氨基酸和肽转运蛋白的表达。这种表达可以加速功能性氨基酸在肠道环境中的运输。
赖氨酸、天冬氨酸和谷氨酸在管腔中的浓度受不同蛋白质来源的不同处理的影响。这些变化可以影响特定代谢物的衍生和转化途径,改变生理功能,改变肠道内的微生态平衡。
氨基酸还通过合成细菌蛋白质以及与肠道微生物群的相互作用对微生物组成起重要作用。
菌群发酵蛋白质主要副产物
短链脂肪酸
短链脂肪酸(SCFA)是细菌在大肠内代谢的最终产物,主要成分为乙酸、丁酸和丙酸。短链脂肪酸的基质主要来自膳食纤维和抗性淀粉。
然而,未消化的蛋白质也是短链脂肪酸产物的底物。膳食蛋白质在大肠中释放的几种氨基酸是短链脂肪酸合成的前体。肠道微生物可以从甘氨酸、丙氨酸、苏氨酸、谷氨酸、赖氨酸和天冬氨酸中产生乙酸盐。
谷氨酸和赖氨酸可以合成丁酸,丙氨酸和苏氨酸可以合成丙酸。
短链脂肪酸产物的数量和形态主要取决于营养物质的底物可得性、肠道菌群组成和肠道传递时间。短链脂肪酸是已知的氧化和使用作为燃料的结肠上皮。
此外,SCFA可以靶向游离脂肪酸受体(FFAR)配体转运到结肠肠细胞,FFAR代谢感知的激活在调节肠道脂肪沉积和营养物质吸收中发挥重要作用。
短链脂肪酸与肠道血流相互作用,促进5-羟色胺的释放,这可能受到肠道-脑内分泌轴的调节。这有助于增加肠道运动和离子转运,从而改变肠道菌群组成和免疫防御。
SCFA参与多种生理过程,在维持肠道完整性、葡萄糖稳态和食欲调节中发挥重要作用。除了为结肠细胞提供能量外,丁酸盐也是SLC5A8的底物。该蛋白编码基因抑制组蛋白去乙酰化酶的活性,而组蛋白去乙酰化酶是一种表观遗传调节因子,在多种肿瘤中诱导细胞凋亡。丁酸可以通过上调宿主防御肽的表达来刺激中性粒细胞群体,有利于破坏病原体,增强抗病能力。
氨
氨在大肠中以毫摩尔浓度存在。与远端结肠相比,近端结肠的特点是pH值低,碳水化合物含量高。因此,从升结肠到降结肠,氨浓度升高,这与远端结肠的蛋白质代谢率高于近端结肠是一致的。
大肠中的氨浓度主要是与氨基酸脱氨和尿素水解有关的微生物代谢物。肠道菌群可利用氨,氨可被上皮细胞吸收。尿素在肠道内的水解是通过细菌脲酶活性进行的。
虽然幽门螺杆菌的脲酶活性已经得到了充分的研究,但关于其他大肠微生物的脲酶活性的信息却很少。最近的一项研究报道,部分氨被谷氨酰胺合成酶的活性与l -谷氨酸缩合,使谷氨酰胺合成。这是一种可能的机制,以控制氨细胞内浓度在结肠细胞。
硫化氢 (H2S)
硫化氢(H2S)是蛋氨酸、半胱氨酸等含硫氨基酸发酵产生的一种微生物代谢物。H2S也来源于无机硫酸盐和亚硫酸盐添加剂的还原,以及肠道磺胺类物质的分解代谢。
肠道微生物能够通过脱硫酶从半胱氨酸碳链中获得能量。甲硫氨酸可转化为α-酮丁酸酯、氨和甲硫醇。这些代谢物归因于一个特定的分类组的细菌,包括大肠杆菌、肠沙门氏菌、梭菌和产气肠杆菌,通常在大肠中发现。
肠杆菌、肠球菌、肠链球菌、梭杆菌和真细菌能够发酵含硫氨基酸。
多胺
多胺是由精氨酸、鸟氨酸和蛋氨酸等氨基酸前体的结肠细胞产生的聚阳离子分子。从结肠癌中分离出来的结肠上皮具有高的多胺合成能力,这可能是由于肿瘤细胞持续有丝分裂需要高的多胺。
肠道微生物可从鸟氨酸、精氨酸、赖氨酸、酪氨酸和组氨酸等氨基酸前体产生腐胺、胍胺、尸胺、酪胺和组胺等多种多胺。
多胺参与细菌细胞的生长、增殖、分泌和运输活动。大肠生态系统中能够产生多胺的大肠细菌有多种,包括拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、Veillonella、双歧杆菌属(Bifidobacterium)和梭状芽胞杆菌属(Clostridium)。因此,肠道菌群组成是影响结肠多胺分布和分配的因素之一。
苯酚和吲哚
结肠中苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸可被特定的肠道微生物代谢为酚类和吲哚类化合物。
然而,芳香氨基酸的代谢与结肠微生物群的特定组分之间的相互作用还没有充分的研究。一些代谢产物如酚和吲哚,被怀疑为共致癌物和结肠癌促进剂。
已知发酵芳香氨基酸的厌氧菌包括大肠中的拟杆菌、乳酸菌、双歧杆菌、梭状芽胞杆菌和胃链球菌。与结肠中的其他氨基酸相比,芳香氨基酸在细菌中代谢缓慢。它们可以生产一系列的酚类和吲哚类化合物作为最终产品,如对甲酚、吲哚、酚和粪臭酚。
据报道,酪氨酸可产生苯酚和对甲酚,而苯乙酸和色氨酸在人体浆发酵过程中分解为吲哚乙酸盐和吲哚。
在一项研究中,远端结肠中的酚类化合物浓度增加,表明大肠远端区域的氨基酸代谢较高。吲哚和酚类代谢物的浓度取决于细菌产生率和结肠吸收率之间的平衡。酚类化合物似乎大部分被结肠内容物吸收。它们在从管腔转移到血液和肝脏的过程中部分代谢,最后通过尿液排出。
对无菌和常规小鼠血浆代谢物的对比分析表明,无菌小鼠的色氨酸和酪氨酸水平至少增加了1.5倍。涉及这些芳香族氨基酸的细菌代谢产物包括硫酸吲哚氧基、硫酸苯酯、硫酸对甲酚和苯丙酰甘氨酸,仅在常规小鼠中发现。
关于酚类和吲哚类化合物对结肠上皮细胞的影响知之甚少。体外实验表明,苯酚会降低屏障功能的完整性。需要注意的是,当苯酚浓度高于1.25 mM时,它会损害结肠上皮细胞。
如果蛋白质摄入过量,或者肠道里消化蛋白质的菌群构成不理想,那么蛋白质发酵发生的胺,硫化氢,苯酚等肠道毒素过量积累,会诱发肠道炎症,便秘,腹胀等问题,因此正确摄入适量优质蛋白对于维持肠道菌群和身体健康很重要。
蛋白质摄入要因人而异
实际上,我们摄入的一些蛋白质可以转化为葡萄糖,特别是当蛋白质的消化速度快且人体糖原储存量低时,有些蛋白质可以被微生物群发酵,特别是当蛋白质的消化速度慢时。
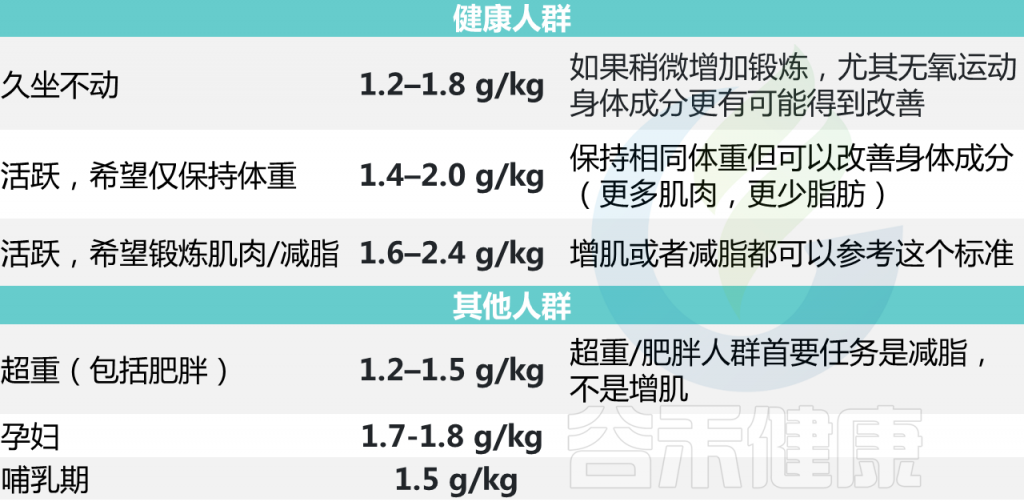
每个人对蛋白质的需求量各不相同,比如经常运动人群和久坐人群对蛋白质的需求量不一样,孕妇、老人、儿童、肥胖等群体都有各自不同的需求。当然,每个人的不同状态对蛋白质的需求量也都不同,比如爬山的一天,和在家刷剧的一天,也是不一样的。
因此,我们说最佳每日蛋白质摄入量取决于你的身高体重、健康状况、目标、身体活动水平。

素食主义者对蛋白质的需求较高,因为植物蛋白在生物利用度上通常不如动物蛋白。植物蛋白消化率为 60-80%,而动物蛋白消化率超过90%.
注意植物蛋白的较难消化吸收
因为植物含有抑制蛋白质消化和吸收的抗营养物质,如胰蛋白酶抑制剂、植酸盐和单宁。虽然烧熟后确实降低了抗营养物质的浓度,但并不能完全消除它们。
另外,植物性蛋白质也含有限制性氨基酸,这些氨基酸是必须氨基酸但数量太少,以至于不够蛋白质的合成所需。
注:限制性氨基酸是指食物所含必需氨基酸的量与动物所需的蛋白质必需氨基酸的量相比,比值偏低的氨基酸。比如说一种食物里特别缺少某一种氨基酸,即使其它的氨基酸含量很高,因为这个氨基酸导致它的各个氨基酸比例不平衡。人体对这种食物的吸收依然不理想,这种氨基酸就叫限制性氨基酸。
结合不同的植物性蛋白质可以帮助弥补它们各自的不足。
摄入蛋白注意其氨基酸构成
比如说,赖氨酸是最常见的限制性氨基酸,特别是在谷类中,如小麦和水稻。坚果往往也含有赖氨酸作为限制性氨基酸。另一方面,豆类含有足够的赖氨酸,可以弥补,但缺乏硫氨基酸,如蛋氨酸和半胱氨酸。
蛋白质能否被人体吸收利用,还应该考虑蛋白质的氨基酸组成。
因此,了解一下评估蛋白质的另一个标准:氨基酸的组成。
氨基酸组成
蛋白质由氨基酸组成,身体可以合成其中一些氨基酸,而另一些则不能。
需要但不能合成、需要从食物中摄取的九种氨基酸被称为必需氨基酸(EAA)。
氨基酸:成人的需求和不同食物的含量
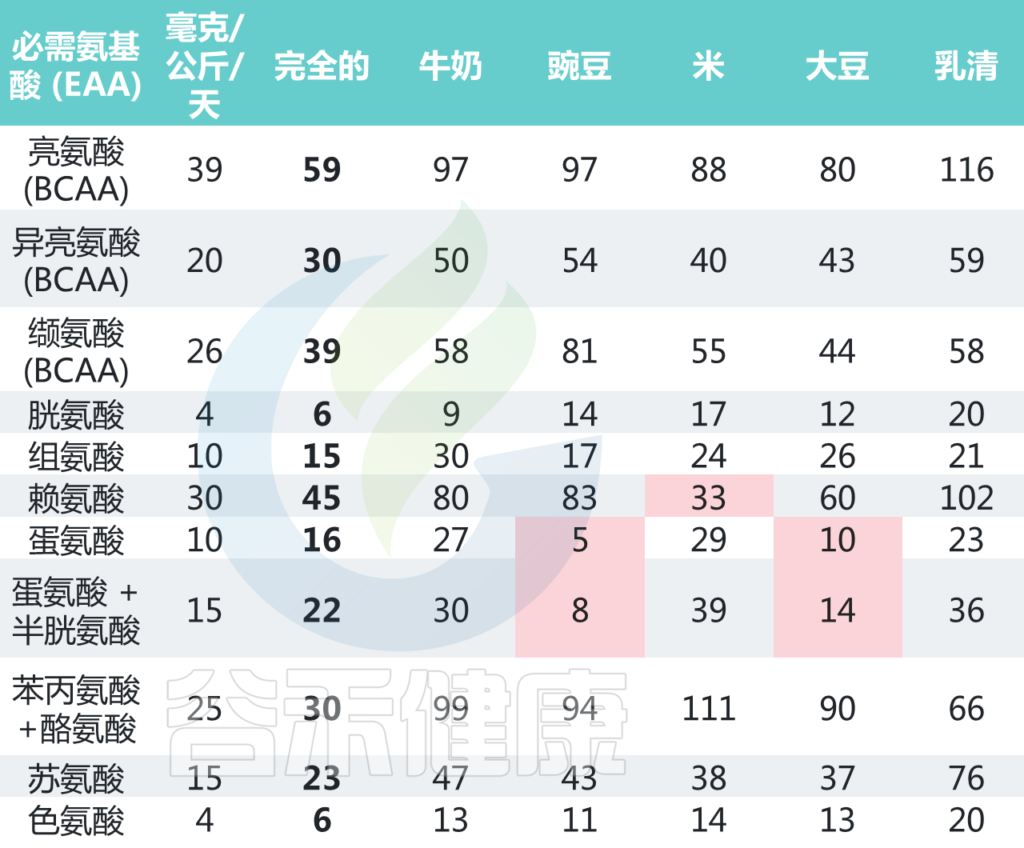
World Health Organization. Protein and Amino Acid Requirements in Human Nutrition
人群范围蛋白质摄入量如何?
使用谷禾检测人群,基于肠道菌群分析营养膳食摄入构成,图中给出了蛋白质占总能量摄入的占比,正常比例在10~20%范围。可以看出0~3岁蛋白质占比较高,3~15岁蛋白质占比较低,80~100岁比例又进一步下降。
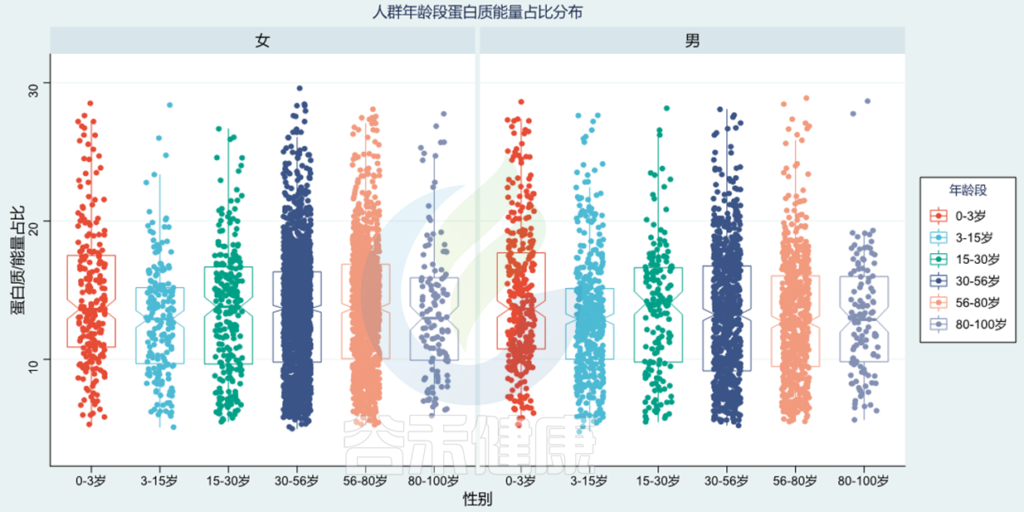
<谷禾健康肠道菌群检测数据库>
结 语
蛋白质代谢与肠道菌群密切相关。膳食蛋白质在小肠中被蛋白酶和众多肽酶代谢,膳食蛋白质释放的氨基酸可用于肠道微生物合成蛋白质。这反过来又促进了饮食、微生物群和宿主之间的氮循环和利用。
不同的细菌有不同的代谢能力,依靠我们摄入的营养物质繁殖生存,其中拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。通过肠道菌群检测评估的蛋白质摄入水平显示不同人蛋白质摄入及营养占比差异很大,过高或者过低均伴随肠道菌群问题,包括过低导致潜在病原体数量增加,有益菌减少,同时导致部分氨基酸缺乏,过高又导致例如大肠菌群、链球菌和芽孢杆菌增殖,蛋白质发酵产生的副产物如,腐胺,苯酚,硫化氢等增诱发便秘,腹痛等健康问题。
除了蛋白质的摄入量,不同的蛋白形式,如植物蛋白,乳蛋白、动物蛋白以及蛋白质与其他营养摄入的相对比例构成,如膳食纤维、抗性淀粉、脂肪、微量元素等的比例都会影响肠道菌群进而反过来影响其消化降解,改变氨基酸的合成和代谢,最终影响宿主营养代谢健康。
总之,我们提倡膳食平衡,没有特殊情况不建议盲目补充蛋白粉等,建议从膳食结构调整保证营养均衡,从而使各种营养都能达到生长发育和身体健康的生理需要量,这同时要关注肠道菌群状况,因为他们是相辅相生。
常见食物中氨基酸含量见附录。
附录
供人类食用的植物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸) mg/g
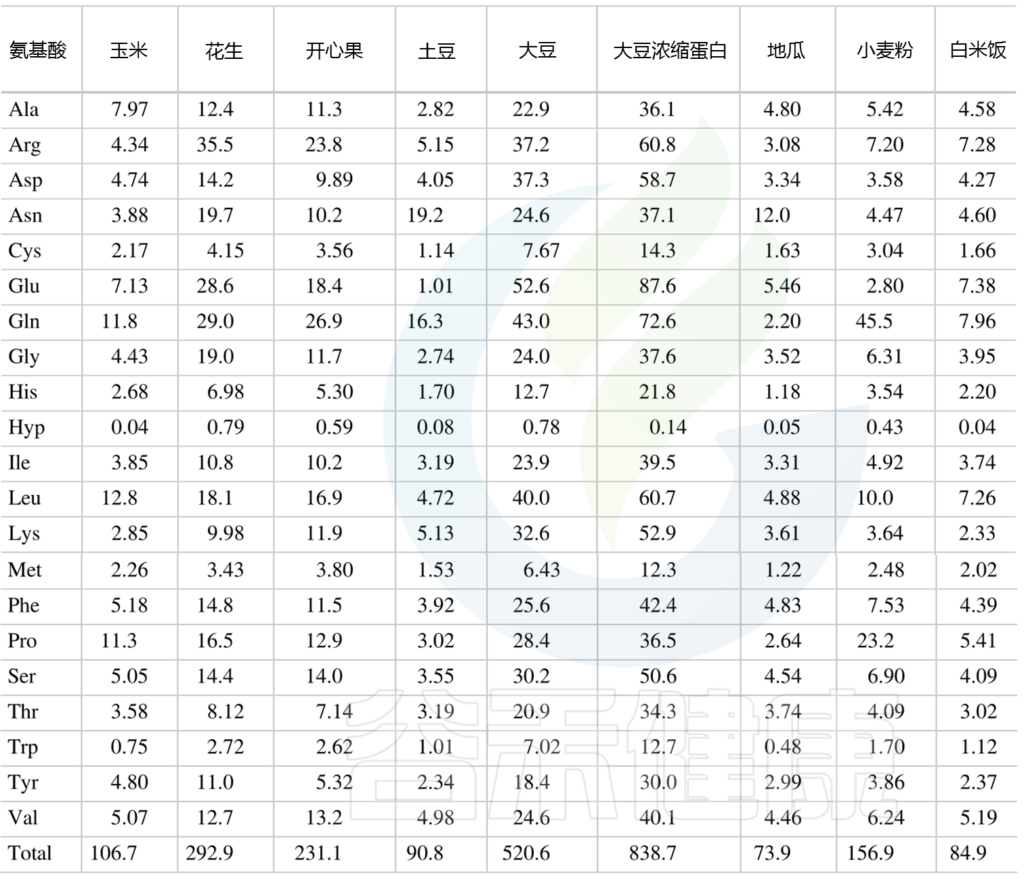
Amino Acids in Nutrition and Health, 2021
人类动物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸)mg/g
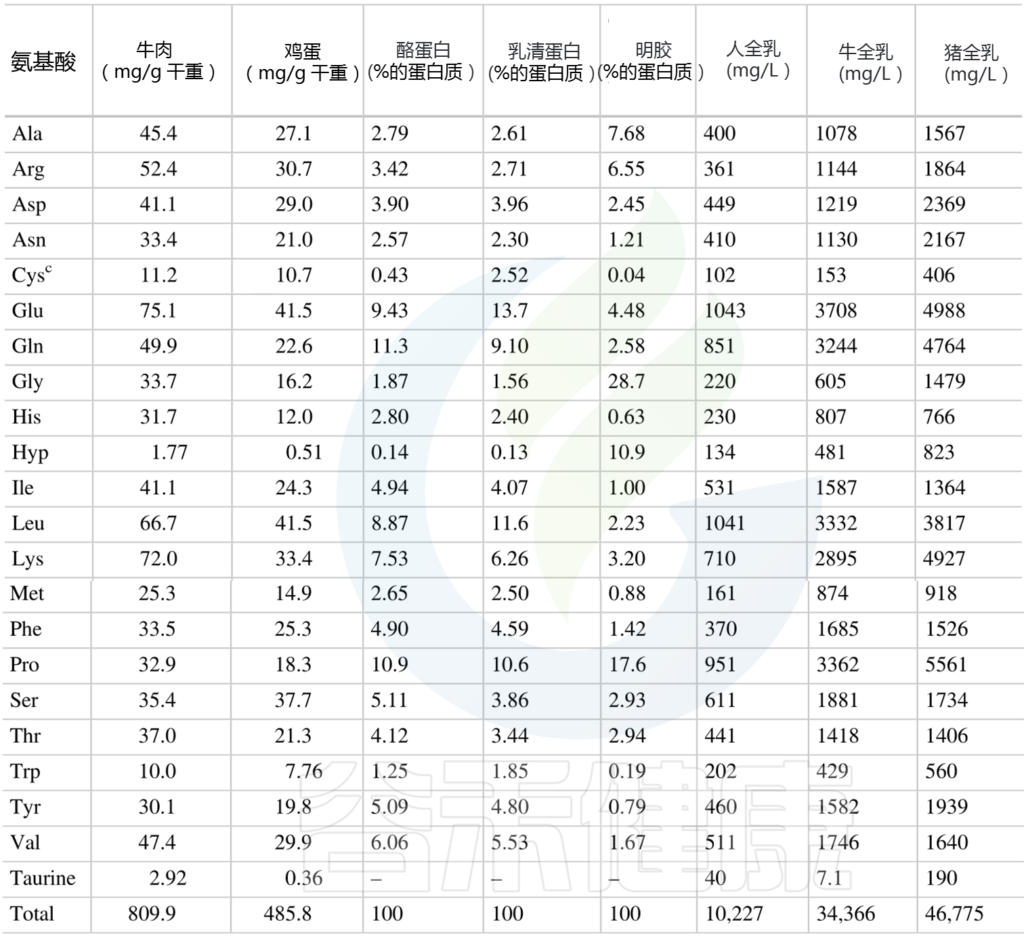
Amino Acids in Nutrition and Health, 2021
主要参考文献:
向上滑动阅览
Abdallah A, Elemba E, Zhong Q, Sun Z. Gastrointestinal Interaction between Dietary Amino Acids and Gut Microbiota: With Special Emphasis on Host Nutrition. Curr Protein Pept Sci. 2020;21(8):785-798.
doi: 10.2174/1389203721666200212095503. PMID: 32048965.
Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808.
Yadav M, Verma MK, Chauhan NS. A review of metabolic potential of human gut microbiome in human nutrition. Arch Microbiol. 2018 Mar;200(2):203-217. doi: 10.1007/s00203-017-1459-x. Epub 2017 Nov 29. PMID: 29188341.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154.
Lin R, Liu W, Piao M, Zhu H. A review of the relationship between the gut microbiota and amino acid metabolism. Amino Acids. 2017 Dec;49(12):2083-2090. doi: 10.1007/s00726-017-2493-3. Epub 2017 Sep 20. PMID: 28932911.

谷禾健康
每个人身上都有“独特的味道”。有些人身上的味道几乎感受不到,而有些人身上却会出现令人尴尬的“体臭”。
慢性体臭可能带来许多不便,焦虑,自尊降低和生活质量下降,社交困难,甚至导致严重的心理问题。

人体会通过呼吸,唾液,汗水(皮肤),尿液或生殖器官液体释放出有气味的物质,主要的气味物质是小的挥发性化合物。
越来越多的证据表明,微生物群在人类的生理过程中起着至关重要的作用。它可能通过产生大量有气味的分子(例如氨,挥发性硫化合物或三甲胺)来加剧人体臭味。
本文我们来讨论下关于体臭最常见的原因,以及潜在的治疗选择。
化合物的过度积累会产生难闻的气味。与体液中细菌代谢物积聚相关的体臭可能由以下一种或多种原因引起:

主要的细菌气味物质及其散发部位
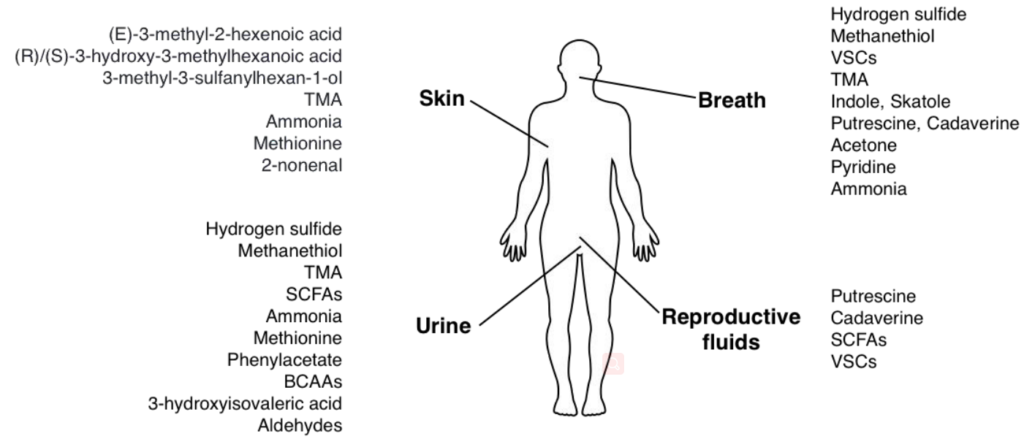
Mogilnickaet al., Int J Mol Sci, 2020
接下来,我们针对身体各个部位气味及其原因逐一解读。
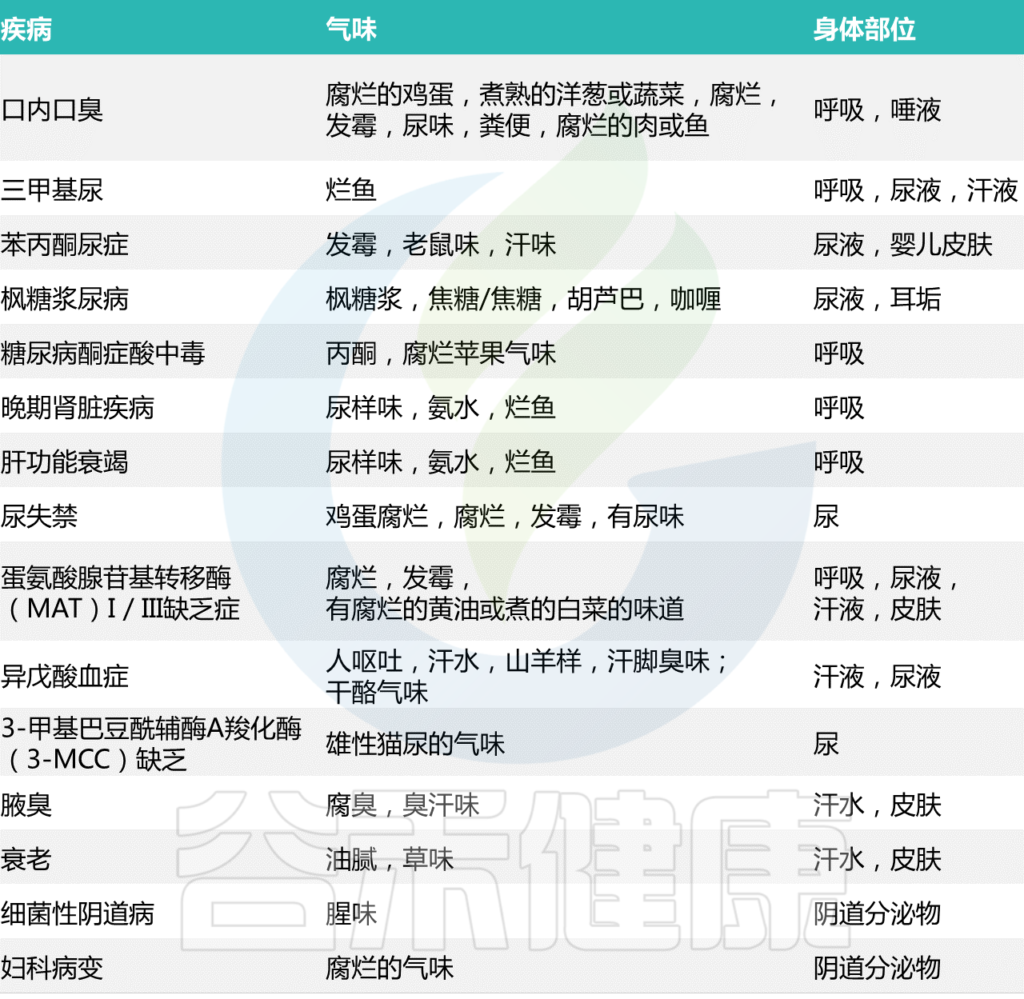
口臭(口腔之味或呼吸之味)是一种以口腔内或口腔外的口臭为特征的疾病。全世界约有20-50%的成人或青少年患有口臭。[更精确的数字,为31.8%(95%可信区间24.6–39.0%)]

在绝大多数(80-90%)持续口臭的患者中,口臭的原因是口腔原因,其中舌苔和牙周病最为普遍。
在口臭的口外(非口)原因中,还包括糖尿病酮症酸中毒,先天性代谢性疾病,胃肠道或呼吸疾病等。
当然,尽管口臭可能是一些严重疾病的征兆,但食用洋葱或大蒜等几种食物以及吸烟也可能导致口臭。
口臭患者呼吸中存在的主要物质是挥发性硫化合物,如硫化氢(H2S)、乙硫醇、硫代乙酸乙酯、二乙基二硫化物、二甲基硫化物((CH3)2S) 和甲硫醇(CH3SH或甲硫醇)。
一些革兰氏阴性菌与食物或唾液中含硫底物产生挥发性硫化合物有关,如:
福赛拟杆菌Bacteroides forsythus、牙龈卟啉单胞菌Porphyromonas gingivalis、放线共生放线杆菌Actinobacillus actinomycetemcomitans 、中间普雷沃氏菌Prevotella intermedia.
最常见的细菌气味
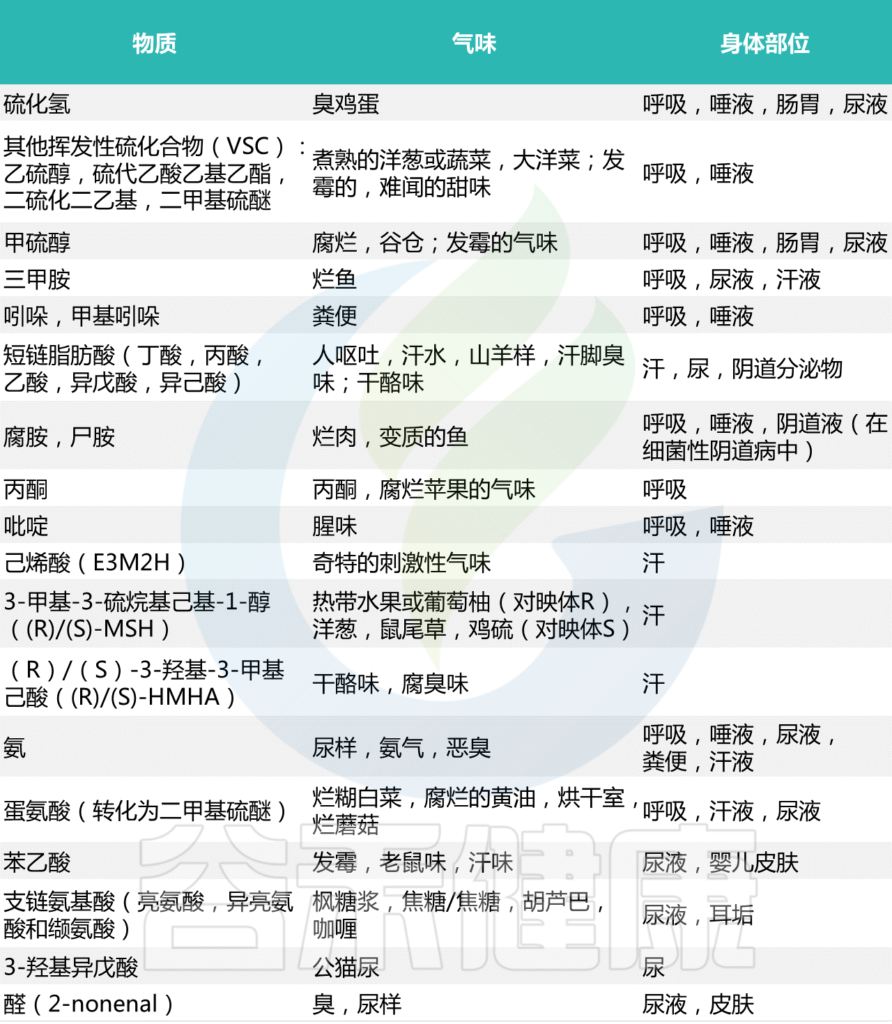
Mogilnickaet al., Int J Mol Sci, 2020
与恶臭相关的疾病
Mogilnickaet al., Int J Mol Sci, 2020
H2S——臭鸡蛋的气味
在低浓度下,硫化氢(H2S)是一种重要的生物介质,类似于其他气体递质,如一氧化氮或一氧化碳。然而,在较高的浓度下,H2S最出名的是它的毒性作用和特殊的臭味,经常被比作臭鸡蛋的气味。H2S即使浓度很低,也会产生明显的气味。
众所周知,口腔中存在的厌氧菌(龈下微生物群)可能会将含有氨基磺酸半胱氨酸的脱硫物质降解为有气味的挥发性硫化合物,而H2S是难闻呼吸气味的重要来源。
几十年前,已经报道了产生硫化氢的菌属,如:
多齿拟杆菌Treponema denticola 和中间拟杆菌Bacteroides intermedius,以及其他属如消化链球菌Peptostreptococcus、真细菌Eubacterium和梭杆菌Fusobacterium。
多年后确定,口腔异味患者以韦荣氏球菌属Veillonella、放线菌属Actinomyces、普雷沃氏菌属 Prevotella 为主。
另一方面有研究认为,在呼出高浓度H2S的患者口腔中占优势的菌:奈瑟氏球菌属 Neisseria、梭杆菌属Fusobacterium、卟啉单胞菌属 Porphyromonas.
而以CH3SH为主的患者口腔中以韦荣氏球菌属Veilonella和普雷沃氏菌属Prevotella为主。
在某些食品中,可能存在由细菌还原酶生产H2S的底物。例如,洋葱,大蒜,葡萄酒,卷心菜,花椰菜,蘑菇,坚果,土豆和干果含有硫化物和亚硫酸盐(用作抗菌和抗氧化剂)。
甲硫醇(CH3SH/MT/MeSH) ——腐败、霉味
在口臭患者的呼吸中检测到的另一种分子是甲硫醇。研究表明CH3SH是口腔内口臭的主要致病因素。MT的气味常被形容为腐臭、霉味,可比作谷仓气味。
事实上,口臭患者的恶臭通常更类似于臭鸡蛋的气味(H2S的特征)。客观存在的阈值为0.5 nM (12 ppb) 。与H2S类似,口外(血源性)口臭患者的口腔空气中也检测不到甲基叔丁基醚,而其他口腔鳞状细胞癌在其中起着至关重要的作用。
研究人员报告说,在口臭患者唾液中,普雷沃氏菌 Prevotella、韦荣氏球菌Veillonella、阿托波毕姆菌Atopobium、巨形球菌Megasphaera和硒单胞菌Selenomonas的丰度很高,并怀疑这些菌群参与CH3SH的产生。
对口腔恶臭患者口腔气体中的金属硫蛋白含量测量,发现在患有牙周病的个体中显著增加的浓度。
其他挥发性硫化合物——熟洋葱的甜味和霉味
口臭患者的呼吸和唾液中检测到的其他挥发性含硫化合物包括乙硫醇、硫代乙酸乙酯、二乙基二硫化物和二甲基硫化物。这些化合物与蔬菜独特的、甜的、发霉的气味有关,通常类似于熟洋葱的气味。
二甲基硫(DMS,CH3SCH3)是血液传播(口外)臭味的主要来源。相比之下,口腔内口臭患者口腔和鼻子呼吸中的二甲基硫浓度在正常范围内,未达到气味阈值。
血液中存在二甲基硫的可能原因是代谢紊乱。文献中报道的其他原因包括肝衰竭、高硫氨酸血症(一种主要与甲硫氨酸水平升高相关的遗传性甲基化障碍)和治疗性摄入二甲亚砜或半胱胺。
三甲胺——鱼腥味
三甲胺(TMA)是一种挥发性的脂肪族叔胺,因其腐烂鱼的特有气味和高浓度的毒性作用而闻名。它是由肠道细菌产生的过量胆碱和其他含TMA的膳食营养素形成的。
已经表明,许多肠道中的共生细菌通过代谢膳食中含有TMA的物质来产生TMA,
例如,厌氧球菌属Anaerococcus、普罗维登夏氏菌属Providencia、爱德华氏菌属Edwardsiella、梭菌属Clostridium、柯林塞拉氏菌属Collinsella、脱硫弧菌属Desulfovibrio、乳杆菌属Lactobacillus 和 变形杆菌属Proteus.
从肠道吸收后,TMA被肝脏氧化成几乎无味的三甲胺氧化物(TMAO)。在三甲基胺尿症(也叫TMAu或“鱼味综合征”)中,由于缺乏含鸟苷的单加氧酶3 (FMO3),一种氧化TMA的肝酶,TMA积累并排泄到体液中。
继发性(获得性)TMau在患有严重肝脏或肾脏疾病患者中。文献中还描述了儿童(与含胆碱的食物补充剂摄入有关)和妇女(与月经有关)的短暂形式。这种代谢障碍导致底物超载和独特的体臭,可以在包括呼吸在内的多个身体部位检测到。
吲哚和甲基吲哚——粪便的气味
吲哚代表一组微生物来源的化合物,由色氨酸产生,色氨酸是一种必需氨基酸,是色胺、血清素和褪黑激素内源性合成的前体。
被怀疑导致口臭的吲哚包括吲哚和甲基吲哚,它们是由口腔内厌氧革兰氏阴性菌产生的,如:
中间卟啉单胞菌Porphyromonas intermedia、具核梭杆菌Fusobacterium nucleatum和牙龈卟啉单胞菌Porphyromonas gingivalis.
它们的气味可以等同于粪便的气味,而这两种化合物的气味更浓。与挥发性含硫化合物相比,吲哚和甲基吲哚的挥发性要低得多,因此,它们对口臭的影响相当小。
然而,有些口臭患者呼吸中可能存在无法检测到的VSCs浓度以及高水平的吲哚,在这样一组患者中,常用的用于测定口气气味的工具(如检测VSCs的口臭计)可能不够充分并延误诊断。
腐胺和尸胺——腐肉或鱼的气味
腐胺和尸胺这两种二胺一直被怀疑是造成口臭的原因,都与牙菌斑中的细菌引起的食物腐败有关。
它们在唾液中通过氨基酸脱羧(分别是赖氨酸和鸟氨酸)或转氨作用产生。
腐胺的气味常被比作变质的鱼或腐肉的气味,而尸胺的气味除了上述气味之外,还可能会让人联想到尿液或精液的气味。口臭和唾液中存在尸胺有强相关性。
丙酮——水果味
丙酮是一种三碳挥发性酮,来源于乙酰乙酸酯(通过脱羧或酶促转化)。长期以来,它的水果味(常被比作烂苹果的味道)一直与糖尿病(DM)有关。
高浓度的呼吸丙酮与糖尿病酮症酸中毒有关。它也随着禁食、高脂肪或生酮饮食而增加。
吡啶——鱼腥味、汗味
吡啶是一种芳香的含氮挥发性化合物,有一种鱼腥味和汗味,可能会导致口臭。在中度和重度牙周病患者的培养唾液中发现了吡啶及其类似物(2-,3-和4-甲基吡啶)。相比之下,这些分子在口腔健康患者的样本中是不存在的。
氨——类似尿液的气味
氨(NH3)以铵离子(NH4+)的形式存在于所有体液中,但其高浓度是有毒的,因此它由尿素循环精确调节。氨在肝脏和肾脏疾病以及口臭中作为生物标志物发挥着重要作用。
去除舌苔和牙菌斑后呼吸中氨水平的降低,这可能表明口腔中存在的一些微生物是口腔内口臭中氨产生的原因。
在患有终末期肾病(ESRD)的患者中,尿毒症呼吸气味是由唾液中的高浓度尿素引起的,尿素被分解成氨。多达34.1%的ESRD患者主诉尿毒症恶臭。
肝衰竭历来与尿样胎儿肝性脑病(肝性呼吸)有关。比较肝硬化患者和非肝硬化患者的血氨和呼吸氨水平,患有肝性脑病的患者的呼吸氨水平明显高于对照组。此外,呼吸和血氨随着高氨血症的治疗而降低。
肠道细菌是哺乳动物体内氨形成的重要因素。胃肠道细菌(主要是革兰氏阴性肠杆菌科)产生脲酶,将尿素水解成二氧化碳和氨。其他细菌菌株,例如大肠杆菌和肠道沙门氏菌,能够通过半胱氨酸脱硫酶从半胱氨酸形成氨。
此外,大肠杆菌还可以将硝酸盐还原成氨。源自肠道的氨被肠道细菌用于蛋白质再合成,通过GBB(肠道-血液屏障)被吸收到循环中,或者随粪便排出体外。在正常情况下,肠道中产生的氨在肝脏中代谢。然而,在肝衰竭状态下,它不能转化为无毒衍生物,如尿素或谷氨酰胺。
因为氨也是在蛋白质分解代谢过程中形成的,所以可以假设富含蛋白质的饮食可能会增加其血液水平,并导致更多的口呼出氨。研究表明,蛋白质的摄入导致血清和唾液尿素增加,从而导致呼吸氨浓度增加。这一点需要认识到,尤其是因为许多流行的、不健康的时尚饮食是基于高蛋白的摄入。
尿液成分受身体新陈代谢的影响,但也受消耗的食物和饮料的影响。因此,需要强调的是,并不是尿液中发现的每一种气味都是不好的。
例如,在摄入芦笋后不久,有些人的尿液可能会有明显的硫磺味(想象煮熟的卷心菜)。虽然导致这种气味的确切分子还没有被明确地鉴定出来,但是一些类似甲硫醇或二甲基硫醚的挥发性物质是可疑的。
尿液中特殊气味化合物的鉴定可能有助于诊断苯丙酮尿症,高硫氨酸血症或枫糖尿症。值得一提的是,多种有气味的物质是由肠道菌群产生的,它们可以在从肠道吸收到循环系统后出现在尿液中。
下面将介绍几种影响尿液气味的物质。
H2S ——臭鸡蛋的味道
在尿失禁(UI,不自觉的尿液泄漏,显著影响生活质量)患者中,出现难闻的气味,也是造成社会尴尬的重要原因。
研究尿液和吸收性失禁垫主要挥发性气味物质,与甲硫醇和醛类等其他分子一起,硫化氢被检测到高于气味阈值。此外,在尿路感染中,大肠杆菌是恶臭硫化氢的常见产生者。
甲硫醇 ——腐败、霉味
健康人尿液中的气态甲硫醇低于检测阈值。在用半胱胺治疗的患者,肝甲硫氨酸腺苷转移酶缺乏症和UI 中发现水平升高。甲硫醇产生的主要因素是肠道细菌群,如大肠杆菌、柠檬酸杆菌和变形杆菌。甲硫醇从肠道吸收,进入循环,然后可以随尿液排出。
三甲胺——鱼腥味
在三甲胺尿中,过量的三甲胺不能被氧化成无味的TMAO,分泌到包括尿液在内的多种体液中。需要强调的是,一些患者只有间歇性TMAu,这使得建立正确的诊断更加困难,因为尿液测试可能在气味不明显的期间呈阴性,必须重复进行。
例如,来月经的女性应该在月经期间或之前进行测试,以最大限度地增加检测TMAu的机会,因为在此期间TMA的排泄会增加。
尿中TMA的另一个来源可能是肠道菌群,主要是
厌氧球菌Anaerococcus,普罗维登夏氏菌 Providencia, 爱德华氏菌Edwardsiella,梭状芽孢杆菌Clostridium, 柯林塞拉氏菌Collinsella, 脱硫弧菌Desulfovibrio,乳杆菌Lactobacillus,变形杆菌Proteus.
短链脂肪酸——干酪味
异戊酸血症(IA)通常与“汗脚”或人体呕吐物的特殊干酪样体臭有关,这在代谢危机期间可以注意到。这种疾病是异戊酰辅酶a脱氢酶(IVD)缺乏导致亮氨酸代谢异常的结果。在IA患者的尿液中可以检测到的病理物质是异戊酰甘氨酸。
氨——类似尿液的气味
氨是第一批被认为会在尿失禁患者周围引起恶臭的分子之一。根据这一概念,细菌尿素酶(主要是大肠杆菌、奇异变形杆菌Proteus mirabilis和粪肠球菌 Enterococcus faecalis)会将尿素分解成难闻的氨。然而,也有研究人员对这一假设提出质疑。
蛋氨酸及其代谢物——腐臭黄油或煮卷心菜的气味
甲硫氨酸腺苷转移酶(MAT) I/III缺乏是甲硫氨酸代谢的遗传性错误,主要在新生儿筛查中发现。它是由导致蛋氨酸及其代谢物积累的MAT1A基因突变引起的。是持续性孤立性高硫血症最常见的原因。
苯乙酸盐——霉味、鼠味
另一个导致尿液有独特的类似老鼠气味的原因是苯丙酮尿症(PKU)。
支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)及其酮酸——焦糖或枫糖浆的气味
枫糖浆尿病(MSUD,亮氨酸病)是另一种代谢紊乱,其症状之一是有明显的尿气味。
3-羟基异戊酸——雄性猫尿的气味
在3-甲基巴豆酰辅酶a羧化酶(3-MCC)缺乏的其他症状中,一些研究人员报告了尿液的特殊气味。
醛类(乙醛、丁醛、异戊醛)——类似尿液的气味
在尿失禁患者的尿液样本和尿失禁卫生垫中检测到少量有气味的醛类物质。据报道,乙醛、丁醛、异戊醛(具有恶臭、类似尿液的气味)的浓度高于检测阈值,可以假设它们有效地增加了UI患者的气味强度。尿醛的来源至少部分是肠道及其微生物群。
从皮肤表面散发出的气味分子大多来自汗液,汗液是汗腺分泌的产物。人体汗腺主要分三种类型:大汗腺、小汗腺和大小汗腺(混合型)。
小汗腺产生大量的汗液,主要含有水和电解质,它们几乎分布在整个身体表面。
大汗腺大多位于腋窝、会阴、生殖器区域和乳头周围。它们在青春期后变得活跃,分泌的汗液比外分泌腺少。
大汗腺分泌的汗液类似于小汗腺产生的汗液,但其分泌速率较高,尤其出现在腋窝部位。这些特征使得大汗腺成为腋窝出汗的重要原因。
顶泌汗液是无味的,它只有被皮肤表面的微生物分解后才会变得有气味,如微球菌科Micrococcaceae、好氧类白喉菌aerobic diphtheroids 和丙酸杆菌Propionibacteria。
激素平衡的变化、消耗的食物和新陈代谢的变化可能会对汗水的数量和质量构成产生影响。
皮肤微生物群的任何变化以及细菌感染都可能改变汗液的成分,通常会产生独特的气味,因为人类有机体与几种能够转化汗液化合物的微生物物种保持共生关系。
据报道,在链球菌性皮炎中,患者皮肤有一种独特的臭味。
此外,许多代谢疾病的特征是皮肤散发出各种气味。其中一些疾病包括苯丙酮尿症,甲硫氨酸吸收不良综合征,高硫氨酸血症,或TMAu。
下面将讨论已知会导致皮肤散发气味的物质。
E3M2H,HMHA,MSH——发臭、发臭的汗味
体臭,是一种令人尴尬痛苦的疾病,特别是在腋窝、生殖器或脚等部位。
这三种类型的汗腺都在这种疾病的发病机制中起作用。过度出汗后,细菌分解汗液成分,会产生难闻的汗味。与小汗腺腋臭相反,大汗腺腋臭在青春期后出现,是这种疾病最常见的形式。
细菌将顶泌汗液分解成许多挥发性分子,如氨和短链脂肪酸,例如(E)-3-甲基-2-己烯酸(E3M2H) ,这是一种C7支链和不饱和酸。它有一种非常强烈的刺鼻气味。
Natsch等人报道了有气味的E3M2H及其水合类似物,(R)/(S)-3-羟基-3-甲基己酸((R)/(S)-HMHA)是由位于腋窝皮肤上的共生棒状杆菌物种的特定锌依赖性N-α-酰基-谷氨酰胺氨酰酶(N-AGA)从谷氨酰胺缀合物(存在于腋窝分泌物中)中释放出来的。
HMHA(以腐臭、奶酪味为特征)是最丰富的。3-甲基-3-磺酰己-1-醇的(S)-异构体((R)/(S)-MSH)及其洋葱味和类似鼠尾草的气味是引起腋臭的另一种颗粒。
此外,多种因素与小汗腺腋臭有关。这些包括摄入某些食物产品,如大蒜或洋葱,角蛋白的细菌降解,代谢紊乱和多汗症。
三甲胺——鱼腥味
在TMAu患者中,过量的未代谢的三甲胺也会从皮肤表面渗出(伴有汗液),引起特有的鱼腥味体臭,无论患者的个人卫生状况如何,都会有这种体臭。
在对患有特发性恶臭的患者进行的一项研究中,约三分之一的患者三甲基胺尿检测呈阳性。在这些个体中,自我识别的体臭是主要症状(29.9%),其次是体臭和口臭(21.4%)。
然而,只有5%的TMAu阳性患者确实在手掌上检测到明显的恶臭,并且他们中没有人在社交距离处发出明显的体臭。在摄入胆碱(合成TMA的一种底物)后,多达10%受试者在社交距离内有明显的体臭。
氨——类似尿液的气味
研究表明,汗液中含有氨。然而,汗液中的氨来源尚未得到证实。一些研究人员认为它是从血浆中运输的,而其他人则认为它直接来自汗腺。
比较呼吸和汗液中氨浓度的研究结果也没有定论。一项研究表明,有气味的氨的皮肤释放量高于呼气。另一项研究则认为,皮肤气体中的氨含量比呼吸中的低。
蛋氨酸及其代谢物——腐臭黄油或煮卷心菜的气味
在新生儿筛查中未确诊的蛋氨酸腺苷转移酶I/III缺乏症(导致高蛋氨酸血症)患者,不仅在呼吸或尿液中,而且在汗液中可能会发现类似水煮卷心菜或腐臭黄油的特殊气味。这种独特的气味很可能是由蛋氨酸形成的有气味的二甲基硫引起的。
2-壬烯醛–油腻、青草味
自然身体气味的化学成分、强度和宜人性在一生中都会发生变化。众所周知,老年人有一种特殊的体臭,有时称“老人气味”。
研究人员对与衰老相关的体臭变化进行研究,发现了一种特殊的粒子,2-壬烯醛,它是老年人和中年人身体气味的特征。
这种不饱和醛具有独特的油腻和青草气味,是由皮肤表面脂质中的ω-7单不饱和脂肪酸降解产生的。

正常阴道分泌物:几乎无气味或有类似酸奶的气味。
与生殖液体一起释放的干酪味或鱼腥味可能是位于生殖器区域的感染(例如,细菌性阴道病、滴虫病或念珠菌病)以及非感染疾病(例如尿失禁、恶性溃疡、三甲基铵尿症或慢性便秘)的症状。
细菌性阴道病是阴道气味最常见的原因。其他症状包括阴道分泌物、瘙痒和刺激。这种情况下阴道液的异常腥味是由阴道加德纳氏菌Gardnerella vaginalis 等细菌产生的挥发性胺(腐胺、尸胺、TMA)引起的。在大多数情况下,细菌性阴道病可以用抗生素迅速治愈。然而,在大约三分之一的患者中,常规治疗并不能改善症状。
阴道气味的非感染性原因比感染性原因更不常见,因此它们构成了更大的临床挑战。医生也应该认识到,阴道的气味可能有不同的来源,如肛管或尿道。生殖器汗味的难闻气味也可能被误认为是阴道气味。
胃肠疾病,如慢性便秘和大便失禁,也应被视为肛门生殖器区域散发恶臭的可能原因。在这些状态下,挥发性有气味的化合物包括硫化氢、甲硫醇和二甲基硫化物,它们是造成屁和粪便气味的原因。这些患者的阴道检查不会显示任何异常。
最后,一些妇科肿瘤和病变患者抱怨阴道分泌物带有恶臭。例如,伴有坏死的外阴恶性溃疡可能导致腐烂气味,这可能是由于细菌形成腐胺、尸胺、短链脂肪酸(异戊酸和丁酸)和含硫化合物。
遗憾的是,缺乏管理体臭的循证指南,也没有普遍的治疗方法。医学文献中已经讨论了几种临时解决方案,如刷牙、漱口、嚼口香糖或经常用抗菌肥皂洗澡和使用除臭剂。然而,这些方法不能解决潜在的问题,而是掩盖或减少不愉快的气味到可接受的水平。只有把原因考虑进去,才能取得令人满意的结果。
一般来说,与体液中细菌代谢物积累相关的恶臭是由气味物质的合成和排泄之间的不平衡引起的。
可能是由以下一个或多个因素引起的:
(1) 含有气味物质或其产生底物的饮食
(2) “前气味”细菌组成和细菌的代谢活性
(3) 增加从肠道对气味物质或其前体的吸收(增加肠道转运时间,增加肠道-血液屏障通透性)
(4) 减少气味物质的肝脏代谢
(5) 减少尿排泄
基于以上所述,除了标准的卫生程序之外,还可以建议一些一般的但不是基于证据的预防措施。
1. 减少产生气味的食物基质。
2. 经常排便以减少通过时间(缩短肠道细菌代谢时间和细菌代谢物吸收时间),治疗便秘。
3. 益生菌和益生元治疗(尝试改变肠道细菌组成)。
4. 多喝水,以增加代谢物随尿液的排泄。
下表总结了与细菌气味剂有关体味的治疗选择。根据气味类型进行管理:

Mogilnickaet al., Int J Mol Sci, 2020
目前为止,已经确定了几种导致体臭的化合物,其中大多数是细菌来源的。虽然没有基于证据的管理身体恶臭的指南,一些针对饮食、肠道菌群组成的治疗措施可能会减轻症状。需要提高临床认识以及进一步的研究来解决体臭问题。
相关阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
参考文献:
Li, M.; Al-Sarraf, A.; Sinclair, G.; Frohlich, J. Fish odour syndrome. CMAJ 2011, 183, 929–931.
Rath, S.; Heidrich, B.; Pieper, D.H.; Vital, M. Uncovering the trimethylamine-producing bacteria of the human gut microbiota. Microbiome 2017, 5, 54
Piotr, K.; Marcin, U. Indoles – Gut Bacteria Metabolites of Tryptophan with Pharmacotherapeutic Potential.Curr. Drug Metab. 2018, 19, 883–890
Mogilnicka Izabella,Bogucki Pawel,Ufnal Marcin,Microbiota and Malodor-Etiology and Management.[J] .Int J Mol Sci, 2020, 21.
Bielinska, K.; Radkowski, M.; Grochowska, M.; Perlejewski, K.; Huc, T.; Jaworska, K.; Motooka, D.; Nakamura, S.; Ufnal, M. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition 2018, 54, 33–39
Suzuki, N.; Nakano, Y .; Watanabe, T.; Yoneda, M.; Hirofuji, T.; Hanioka, T. Two mechanisms of oral malodorinhibition by zinc ions. J. Appl. Oral Sci. 2018, 26, e20170161

谷禾健康
有证据表明,从地球生命的开始,细菌就能够形成固着群落。尽管如此,科斯特顿(Costerton)等人创造了“生物膜”这个术语(Bill Costerton教授是世界著名生物膜专家,他首先在世界上提出了生物膜概念及理论),作为描述表面上各种各样微生物聚集体的一个简单表达,至今还不到50年。此后,环境微生物学家报告了几乎所有自然和工业生态系统中都存在生物膜。
就像在自然界中一样,微生物在人类栖息地中可以定居各种生态位。 称为生物膜的多细胞群落的主要定居形式是在人类组织表面。胃肠道是大量微生物的家园,它们的生活方式相互交织,但并不完全相同。
定义
生物膜
微生物在生长过程中为适应生存环境而形成了生物膜。微生物生物膜是由微生物群体及其包被的细胞外多聚物和基质网组成,它们彼此黏附或者黏附到组织或物体的表面。微生物生物膜与微生物的耐药性形成,基因的转移以及疾病发生的持续性感染等都密切相关。
长期以来,与粘膜组织接触的异常有害生物膜与人类疾病有关,包括外科植入物感染、牙龈疾病、导管引起的尿路和肺部感染以及一些肠道疾病。
然而,生物膜表型也有助于肠道内稳态、组织定植抗性、群落稳定性和恢复力、宿主防御成熟、食物消化和化学药物修饰。生物膜的这些有益作用尚未完全纳入我们目前对肠道微生物群的认识。
近年来有几项研究已经在成分、遗传和行为方面明确区分了粪便和粘膜附着的微生物群落。因此,粘膜多微生物群落对于寻找新的疾病生物标志物(例如,结直肠癌CRC和炎症性肠病IBD)尤其重要。
从相关性到这些疾病的潜在病因,将需要对粘膜群落进行进一步的研究,重点放在宿主与其自然生物膜表型下的微生物群之间的相互作用。
分类
目前对粘膜和粪便微生物群在微生物结果表明粘膜和粪便微生物群在微生物组成是不同的。粘膜生物膜的需要从粘膜取样推断,而不是粪便样本。
不同生态位的菌群构成也不一样。
在人类结肠中,健康人的结肠活检样本被薄薄的生物膜所覆盖,这些生物膜主要由拟杆菌科、乳酸菌科和肠杆菌科组成,位于右升结肠,拟杆菌科和乳酸菌科位于左降结肠。
健康成人的口咽组织通常定植有厌氧共生菌属,如:
韦荣球菌属Veillonella, 普氏菌属Prevotella, Leptotrichia 和 梭菌属Fusobacterium 潜在致病菌如 链球菌Streptococcus, 嗜血杆菌Haemophilus 和 奈瑟氏菌属Neisseria。
而在在小鼠小肠中,多糖和氨基酸的代谢有利于兼性厌氧菌,如变形杆菌和乳酸杆菌。小鼠结肠主要是富含梭状芽胞杆菌簇XIVa成员的粘膜群落(如羊肠球菌科和瘤胃科的物种),以及在较小程度上富集于拟杆菌科、肠球菌科和乳酸杆菌科的粘膜群落。
稳定性和弹性
除了分类学方面的考虑,微生物群的稳定性和微生物群的恢复力也是至关重要的。
从生态学的角度来看,生物膜内的这种持久竞争导致了整个群落的稳定,部分原因是可用生态位的划分。在多物种生物膜环境中,细菌之间的相互作用对群落的最终结果功能起着关键作用,因为一些生物体依赖于其他生物体的代谢活性生长。
实际上,从人类粪便样本中回收的拟杆菌、梭状芽胞杆菌、梭杆菌、金黄色葡萄球菌、普雷沃氏菌和韦荣氏球菌属的厌氧菌分离物在体外不同地粘附并形成单种生物膜。有趣的是,这项利用肠道相关分类群的研究表明,不会单独形成生物膜的细菌物种可以从与其他形成生物膜的强物种共存的混合生物膜群落中获益。
在抗生素治疗、粪便微生物群移植和益生菌定植后,粘膜相关群落可能在促进微生物群复原力方面发挥关键作用。我们可以期待关于生物膜生活方式在与肠道内稳态相关的微生物群的稳定性和恢复力特性方面的重要发现。
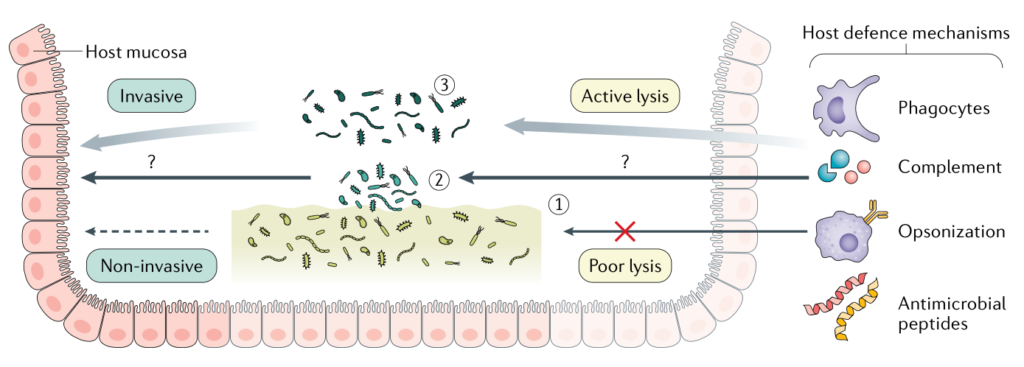
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
定植抗力
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
共栖物种确实拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸(SCFA)的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
共生体也在体内与病原体竞争营养物质、获取金属和封存残余氧。最后,共生菌株(特别是大肠杆菌)的生物膜表型驱动了对占据类似生态位的相关分类群如:为肠聚集性大肠杆菌和肺炎克雷伯菌的定植抗性。
多微生物和跨生态位相互作用
与胃肠道表面相关的微生物群包含所有4个生命域(古细菌、原核生物和真核生物)和病毒。肠道生物膜内的细菌相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,也可能在疾病中起着重要作用(称为失调)。
发生这种情况的机制在很大程度上虽然还不清楚,但是越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
随着测序技术的进步,微生物组成的变异在每个个体之间都可以观察到,在单个人体器官(如消化道)的景观中也可以观察到。利用显微镜和测序方法对小鼠和非人灵长类动物进行的研究表明,在不同的空间尺度和轴上,共生微生物群落确实在整个胃肠道的地理上是分层的。
最高的微生物密度通常出现在富含粘液的区域,靠近胃肠上皮和食物颗粒周围,在管腔中形成斑片状聚集体(下图)。因此,肠道生物膜利用形成凝胶的粘液层作为基质在活体中附着。
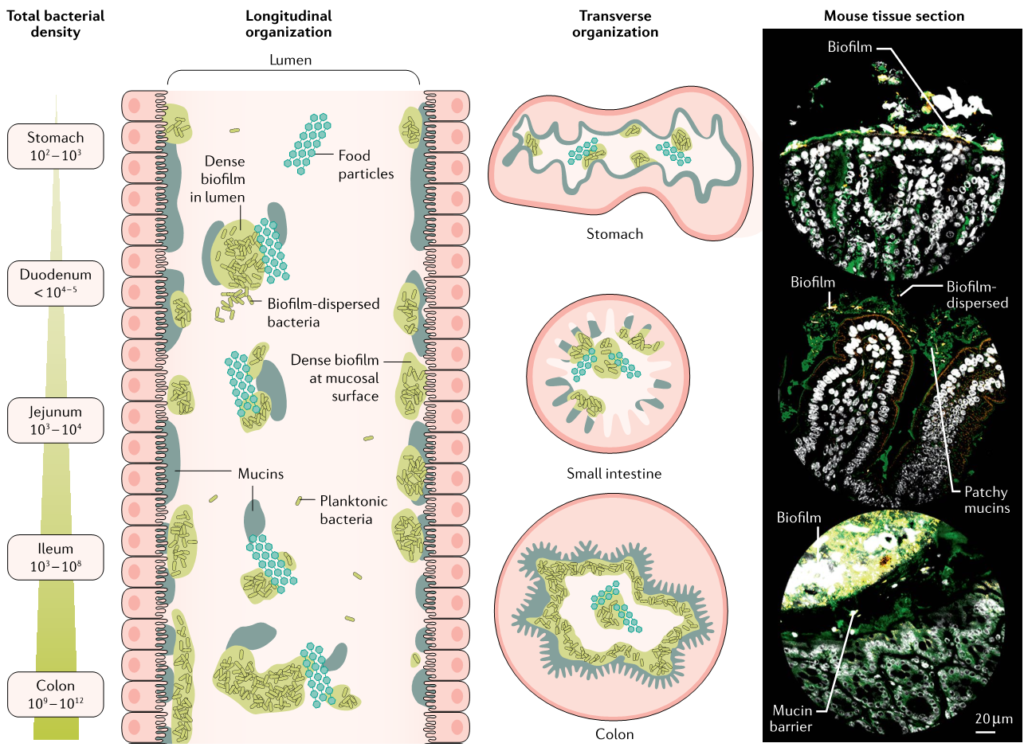
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
在微米尺度上,每个微生境都被混合类群的群落所占据,这些类群在物理上相互粘合。这个组织不太可能是随机的,尽管它的生物学重要性还不清楚。
总的来说,小鼠的生物地理学被认为受动态因素的控制,包括运动、粘液流量、胃肠道上皮细胞分泌、对宿主和食物颗粒的亲和力,以及微生物之间的生态相互作用。
粘膜相关微生物群的生物地理、组成和代谢活动也受到每日振荡的影响,这有助于使肠道生理在昼夜节律上同步。
现在,重要的工作仍然是精确描述整个胃肠道的微生物微生境,确定每个分类群在粘膜生物膜中的确切位置,以及更好地理解微生物生物地理学对肠道健康的生理贡献(下图)。
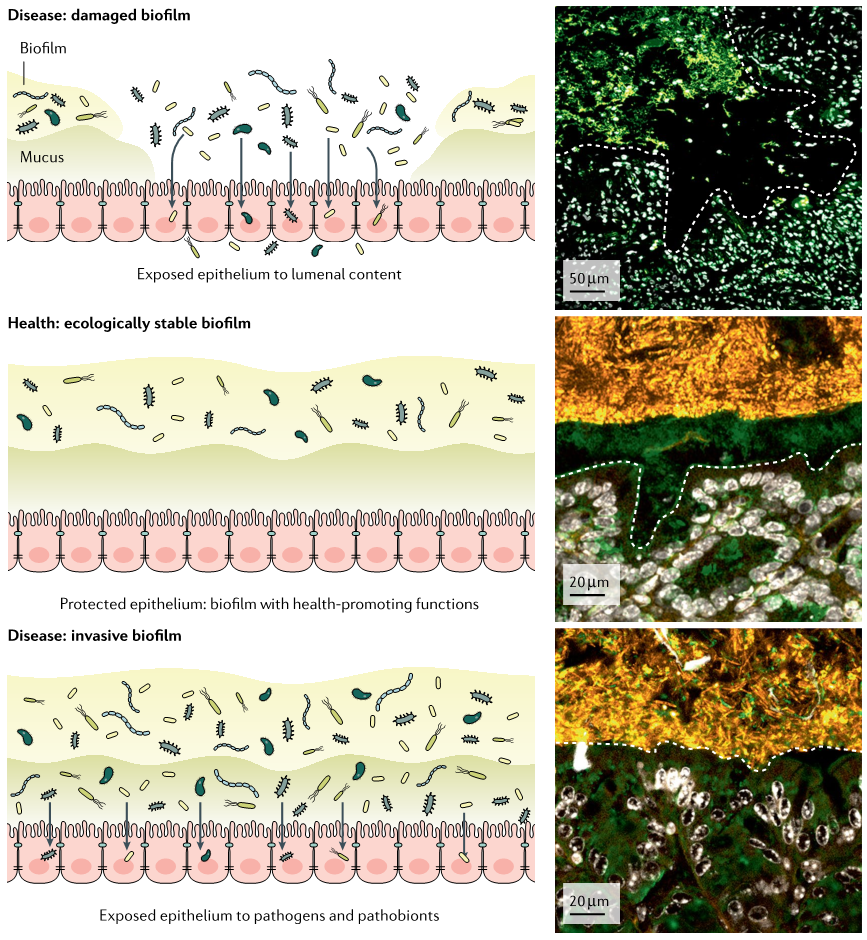
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
生物膜组分诱导宿主反应
肠道生物膜刺激独特的粘膜反应。宿主粘膜防御系统对肠道生物膜的每一个组成部分都有不同的识别和反应,即使这些分子可以隐藏在生物膜基质中。
在体内平衡的背景下,这些相互作用可能在培养宿主防御和塑造肠道生理学方面发挥重要作用。
多糖
生物膜基质可由参与多种结构和代谢功能的多糖家族组成。体外实验证明鼠伤寒生物膜以及其作为一个屏障,以防止非生产者的基质成分从进入已建立的生物膜。
植物乳杆菌Lactobacillus plantarum, ,伯克霍尔德菌Burkholderia cepacia和肠炎沙门氏菌亚种Salmonella enterica subsp分泌的多糖(也称为胞外多糖)。伤寒降低人和猪免疫细胞在体外的细胞因子产生并抑制趋化性和氧爆发反应和人类结肠组织外植体。 鉴定肠道生物膜在体内自然产生的多糖,并了解宿主对此类成分的反应,可能有助于开发新的疗法,以防止病原性生物膜在粘膜表面生长。
蛋白质
基质相关蛋白是体外生物膜基质的重要组成部分,其总生物量与多糖相当。它们具有结构功能,促进细菌扩散,保护宿主介质并参与细胞间的通讯。
作为生物膜生长的特定细菌的基质相关蛋白质组不同于同等浮游生物培养物的分泌体。例如,在生物膜中,毒力蛋白的表达上调,其表达谱在作为单一菌种生长的生物膜和带有白色念珠菌的多菌种生长的生物膜之间不同。
宿主对体内生物膜蛋白质组分的反应可分为先天性和适应性机制。天然反应和抗菌防御蛋白可通过激活甲酰肽受体介导,该受体可识别含有N-甲酰蛋氨酸衍生物的生物膜相关寡肽。
与同一病原体的浮游培养物相比,在生物膜的刺激下,对金黄色葡萄球菌的先天性和适应性免疫反应被证明是不同的,这在小鼠白细胞和兔子中得到了证实。这些研究表明,20种金黄色葡萄球菌生物膜特异性蛋白具有免疫原性,可引起特定的宿主反应。
有趣的是,一组微生物胞内蛋白(特别是核糖体蛋白、RNA聚合酶和精氨酸脱氨酶)包裹在体外生长的人肠道多微生物生物膜的生物膜基质中,也可以被肠上皮蛋白酶凝血酶切割。这一发现可能表明生物膜相关细菌利用宿主蛋白酶来切割包裹在生物膜基质中的微生物蛋白。
这种裂解的目的是激活还是降解微生物蛋白质还有待研究。然而,这一观察结果提供了一个潜在的基于蛋白质的生物膜——宿主信号传递的额外例子。
膜泡和疏水化合物
膜泡(也称为外膜泡)由细菌和古细菌释放,是其生物膜基质的重要组成部分。基质相关蛋白主要来源于膜囊泡,如铜绿假单胞菌生物膜。
膜泡的产生依赖于细菌的应激反应。膜泡在体内的假定生物学作用可能是保护分泌的细菌分子不被降解或充当抗菌剂的诱饵。与可溶性分子相比,铜绿假单胞菌膜泡在体外增强了人巨噬细胞的活化。
虽然在肠道生理学的背景下说明的不充分,但生物膜囊泡的研究有望增强我们对肠道生物膜成分对肠道内稳态的贡献的理解。生物膜基质中存在的其他疏水性化合物是糖脂和肽脂。
鼠李糖脂是一类糖脂表面活性剂(如粘蛋白和表面蛋白),存在于变形杆菌生物膜中。它们介导群菌(一种集体运动行为)并增加中的生物膜分散。葡萄球菌在体外产生的肽脂参与其生物膜表面的疏水性。这一过程有助于确定生物膜对环境分子的不可渗透性。
核酸
细胞外核酸在一些肠道相关菌属如大肠杆菌、柠檬酸杆菌、李斯特菌、肠球菌、链球菌、假单胞菌和奈瑟菌作为生物膜基质的结构支架发挥作用。它们促进水平基因转移,并有助于细菌粘附和聚集到表面。
铜绿假单胞菌生物膜基质细胞外DNA中的非甲基化胞嘧啶-磷酸鸟嘌呤(CpG)基序可触发人中性粒细胞TLR9的激活。体外实验证明,铜绿假单胞菌的胞外DNA与多糖结合形成阳离子受限的环境,以保护生物膜不被抗菌肽(AMPs)溶解。
致病性变形杆菌(P.aeruginosa和E.coli)分泌的RNA可通过膜泡到达宿主粘膜,抑制小鼠膀胱(尤其是尿路致病性E.coli)、人气道上皮细胞系和小鼠肺(尤其是P.aeruginosa)的免疫应答。
当一个细菌群落达到一个临界值时,细菌可以同步它们的新陈代谢,并参与类似群落的行为,形成生物膜。这种机制被称为群体感应。
群体感应由革兰氏阴性细菌中的两亲性小分子和革兰氏阳性细菌中的小肽介导。铜绿假单胞菌衍生的群体感应分子(例如,3-氧代-C12-HSL)可以改变免疫细胞和肺上皮及内皮细胞凋亡的体外细胞因子产生和趋化性。铜绿假单胞菌群体感应分子在肠道中的类似作用有待证实。相反,大肠杆菌通过群体感应途径识别肾上腺素和去甲肾上腺素等肠道激素。
阿片类物质(例如内啡肽和强啡肽)也能被小鼠体内的铜绿假单胞菌识别,并作为群体感应分子。有趣的是,去甲肾上腺素增强了短螺旋体粘附和附着于人类肠上皮细胞系的能力,这一特性可以解释人类体内肠螺旋体病期间结肠上皮上生物膜的形成。
其他几种肠道相关分类群,如:伤寒沙门菌Salmonella typhi,单核细胞增生李斯特菌Listeria monocytogenes,弗氏柠檬酸菌 Citrobacter freundii,阪崎肠杆菌Cronobacter sakazakii,粪肠球菌Enterococcus faecalis,幽门螺杆菌Helicobacter pylori,空肠弯曲杆菌Campylobacter jejuni,梭杆菌属Fusobacterium spp对人体肠道激素(如去甲肾上腺素)有反应,多巴胺和肾上腺素),直接影响动物模型的感染结果。
总之,宿主和肠道微生物生物膜之间通过群体感应途径存在着明显的跨生态位对话。未来对体内多微生物生物膜的研究将成为“微生物内分泌学”这一朝阳领域。
控制生物膜的宿主因素不仅取决于宿主的遗传和免疫状况,而且还取决于生物膜及其亚基因组的分类组成。宿主和/或微生物方面这种微妙平衡的改变可能是肠道疾病的主要驱动因素,并可能解释与许多肠道疾病相关的失调。
宿主-生物膜相互作用的相关因素:对肠道健康和疾病的贡献和意义

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
为了开发旨在恢复肠道内稳态的改良疗法,确定宿主组织控制粘膜表面肠道生物膜生长的因素和途径非常重要(下图)。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
粘蛋白
粘蛋白是上皮杯状细胞分泌的一类高度糖基化的蛋白质。它们是覆盖在肠上皮上的粘液屏障的主要蛋白质成分。这种粘液层的组成和屏障特性在胃肠道的不同部分有所不同(图2)。
共生细菌和病原细菌已经进化出几种机制,使它们能够粘附在粘液上,并相互竞争,利用粘液作为有益的栖息地。空肠弯曲菌和霍乱弧菌等病原体利用粘蛋白作为信号,促进毒力因子的表达,并诱导形成生物膜。
在健康的远端结肠中,粘液层由内层组成,内层致密,无细菌,牢固地附着在上皮上。松散粘附的外层容纳了大多数细菌群落。粘液层可能更紧密地附着于生物膜群落而不是肠上皮本身。因此,体内肠道生物膜可定义为粘液包埋、粘液粘附的微生物聚集体。
胃肠道自然含有非溶粘液细菌的分类群。由于粘蛋白的消耗需要大量酶活性的组合,非溶粘液性肠道细菌将共同受益于多微生物生物膜生活方式的代谢特性。最后,人们普遍认为胃肠道中的粘蛋白层阻止病原体以及共生体到达和接触肠上皮细胞。
然而,粘液层的组成,厚度和粘弹性沿胃肠道变化很大。微生物聚集体和上皮之间的接触在上肠道和近端结肠中很常见。体外研究表明,胃源性粘蛋白通过诱导鞭毛运动引起铜绿假单胞菌生物膜的扩散。
下消化道粘蛋白(如MUC2)在肠道生物膜上的确切作用仍有待澄清。虽然粘蛋白在防止生物膜与粘膜表面接触方面的作用在结肠中已被明确确立,但这种粘蛋白也可能对生物膜内的细菌种类有特定(但尚未发现)的作用。
抗菌肽
AMPs是一类广泛分布于自然界的宿主防御肽。它们由真菌、昆虫、两栖动物、哺乳动物和原核生物产生。大多数AMP是阳离子的,这种性质有助于通过破坏膜、形成孔隙、渗透和抑制细菌细胞内分子和酶以及抑制细胞壁合成来杀死浮游细菌。
AMPs在体外对多种药耐药和临床分离的细菌群具有很强的抗生物膜活性。它们通过减少生物膜对表面的粘附力、杀死嵌入的细菌或直接干扰生物膜形成的代谢途径,在体外分散生物膜。
体内实验的研究表明,防御素(例如,人α-防御素6)可以形成称为“纳米网”的自聚合结构,然后可以捕获细菌并防止其与肠上皮细胞物理接触。
有趣的是,这种聚合可以通过不同于肠隐窝和绒毛顶部的氧化还原条件进行微调。总的来说,AMPs可以被认为是对抗有害生物膜的传统抗生素的良好替代品。
硫化氢
硫化氢(H2S)是胃肠道炎症、稳态和修复的介质。肠道共生菌群是H2S的主要来源,其中一些作为能量来源。
此外,一些报告表明,微生物产生的H2S(由硫酸盐还原细菌以及其他肠道菌株,如大肠杆菌、梭状芽孢杆菌和肠杆菌)具有遗传毒性,可能在大肠癌和溃疡性结肠炎的病理生理学中起作用。另外,H2S的局部作用也会对肠道组织产生一些有益的影响。例如,H2S抑制NF-κB的活化,具有抗氧化活性,并抑制caspase-3的裂解,从而限制凋亡。研究还表明,H2S可保护健康的远端结肠生物膜组织。
根据一项体外研究,表明大肠炎患者炎症发作中存在微生物群衍生的H2S 可能与结直肠癌的发生有关。结肠上皮本身也通过胱硫醚-β-合酶、胱硫醚-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶产生H2S。
结肠内源性H2S生成已被证明有助于促进健康结肠微生物群生物膜的形成和粘液屏障功能。在结肠炎期间将释放H2S的化合物直接注入小鼠结肠可促进粘液的正常产生并恢复健康的微生物群生物膜。
有趣的是,大蒜中富含H2S的膳食化合物在体外对各种病原体(如伤寒杆菌、金黄色葡萄球菌、恶性疟原虫、布氏锥虫和白色念珠菌)具有抗菌、抗真菌和抗寄生虫的特性。
此外,一种释放H2S的抗炎药(Antibe therapeuticals)可降低IBD患者体内生物膜的毒性。然而,如果要在人类身上实现基于H2S的疗法的转化应用,还需要进一步研究H2S在生理肠道生物膜上的确切作用。
免疫球蛋白
肠腔分泌免疫球蛋白(特别是IgA)和微生物毒素并包裹细菌,防止其粘附在上皮细胞上。高亲和力IgA涂层表明炎症细菌的一个亚群,其侵入粘液层的能力增强,激活炎症小体途径,从而导致肠道疾病,如IBD。由于许多其他肠道相关细菌在其生物膜基质(例如,大肠杆菌和铜绿假单胞菌)中产生卷曲或卷曲样淀粉样蛋白,这种新的生物膜特异性免疫疗法有可能应用于多种致病性生物膜。
虽然细菌的生长通常受到IgA涂层的损害,但在体外,共生微生物可以被IgA涂层,而不会对其生长产生实质性的改变。事实上,IgA可以促进肠道内的微生物定植,因为肠道细菌(大肠杆菌和幽门螺杆菌)表达识别IgA糖蛋白基因的受体。IgA与这些表面受体的结合确实可以促进细菌与宿主表面的初始粘附,例如在牙菌斑生物膜中。
肠道上皮细胞表面的肠道生物膜形成(如人类细胞系单层所示)也通过向环境中添加分泌性IgA(但不是通过添加IgG)来帮助。相反,体外生物膜的形成是由IgA特异性蛋白酶阻止的。
因此,免疫球蛋白可以对肠道生物膜发挥免疫排斥和免疫包容功能。它们可以促进肠腔中的生物膜表型,同时防止浮游元素或最终生物膜分散元素侵入粘液层,接触并穿过上皮屏障。
蛋白酶体
存在于肠腔中的真核蛋白酶,例如从丝光绿蝇蛆中提取的糜蛋白酶,对细菌生物膜的形成具有负面影响。有趣的是,宿主胰蛋白酶样蛋白酶在小鼠泌尿道传播粪肠球菌生物膜的形成。
通过体内方法(小鼠模型)和体外人体肠道微生物群生物膜培养,上皮凝血酶被确定为结肠粘膜表面内稳态生物膜抑制的关键因子。以生物膜的基质相关蛋白骨架为靶点,例如通过蛋白酶引起的酶解,似乎是一种很有希望的方法来控制或根除医学和宿主表面的生物膜。
有趣的是,肠杆菌科如铜绿假单胞菌和大肠杆菌可以释放其生物膜基质中的蛋白酶抑制剂ecotin,以保护其免受中性粒细胞弹性蛋白酶的溶解。胃肠道含有多种来源的蛋白酶,其中许多蛋白酶的产生和活性在疾病条件下发生改变。
肠道生物膜有什么临床意义?
生物膜相关感染的临床相关性很重要,因为人体内绝大多数持续性感染源于生物膜。生物膜特征的改变与IBD、癌症和传染病有关,并与分类组成的改变、生物地理分布、抗生素耐受性或耐药性以及生物膜分散的病理生物出现有关。
生物膜是肠道微生物的一种自然生活方式,不一定是疾病的标志物,因此未来的治疗方向可能侧重于恢复宿主生物膜稳态,而不一定消除粘膜表面的生物膜。由于整个胃肠道的生物膜组织可能会有所不同,因此这些方法也需要区域特异性。
微生物生物膜群落有助于维持整个胃肠道内各个方面的稳态。然而,在某些临床情况下,这些生物膜需要保存或修复时破坏,而在其他上皮附着生物膜可能需要根除。因此,在尝试开发治疗性生物膜特异性控制策略方面花费了巨大的研究努力
胃肠道管腔化合物、生物膜和宿主之间的相互作用是复杂的,需要在健康和疾病方面加以考虑。
生物膜可以以多种不同的方式管理胃肠道管腔化合物。管腔化合物,无论是微生物、饮食分子、污染物还是外源性物质,都可以自由扩散穿过生物膜并到达宿主上皮细胞,或者被生物膜阻断,生物膜起着严密的屏障作用。这些管腔化合物也可以通过生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤的作用。
消化过程中产生的一些饮食分子、外源物质或污染物也可以通过生物膜工厂进行化学转化(下图),然后产生新的化合物,释放到宿主细胞附近。这些转化生物膜的化合物对宿主是有益还是有害,当然取决于生物膜的组成及其代谢。
最后,宿主和生物膜可能相互竞争的管腔化合物。因为生物膜与管腔的内容物接触更紧密,它可能比宿主有优势。然而,在上消化道,上皮的某些区域似乎与管腔化合物密切接触。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
综上所述,可以合理地认为,根据生物膜的组成,更重要的是根据生物膜的代谢,宿主识别的管腔化合物可能具有不同的性质和不同的浓度。当这些分子来源于健康的生态稳定的生物膜时,它们可能是有益的;当它们来源于不健康的不稳定的生物膜时,它们可能是有害的。因此,综合了解生物膜的组成、代谢活性及其空间分布具有重要意义。
结肠可被视为一个中央发酵器官,参与消化残渣的发生和加工。肠道微生物群可以改变几乎所有种类的膳食化合物,包括复杂的多糖、脂类、蛋白质和植物化学物质(图5)。早期观察表明,在粪便中心、粘液-粪便界面和食物颗粒附着的微生物群落上,细菌的生长存在差异。这些研究为生物膜表型对微生物结肠发酵的贡献提供了有用的信息。
肠道生物膜对未消化碳水化合物复合物(如饮食中的碳水化合物复合物以及与粘蛋白相关的碳水化合物复合物)的代谢可导致SCFA的产生,主要是乙酸盐、丙酸盐和丁酸盐。SCFAs的其他来源是氨基酸,如缬氨酸、亮氨酸和异亮氨酸,它们是由蛋白质分解产生的。
SCFAs在肠道中的生物学作用是多方面的:它们可以作为肠上皮的能量来源,有助于降低肠腔pH值,直接抑制病原菌的生长,促进T调节细胞的分化,改善上皮紧密连接的完整性。有趣的是,在喂食不同纤维来源的模型猪的肠腔中,SCFA的浓度从结肠的近端到远端减少。这一观察结果有些令人惊讶,因为远端结肠的细菌密度高于近端结肠。
生物膜表型为细胞在其环境中代谢氨基酸提供了有利条件,这一特性已在工业生物技术过程中得到利用。蛋白质的微生物代谢可导致最终产物的形成,如多胺(来自精氨酸、赖氨酸、酪氨酸或组氨酸)、H2S(来自蛋氨酸和半胱氨酸)、酚类和吲哚类化合物(来自色氨酸),以及N-亚硝基化合物(亚硝胺和亚硝胺)的产生,它们是动物模型中肠道肿瘤的有效诱导物。
维生素B12(一种用于DNA合成、脂肪酸和氨基酸代谢的关键维生素)和维生素K(一种用于合成凝血级联蛋白酶的关键维生素)是由肠道微生物群落中一小部分分类群合成的。假单胞菌属合成维生素B12的所有维生素体(也称为钴胺素),包括氰钴胺、羟基钴胺素、腺苷钴胺素和甲基钴胺素。
假单胞菌还利用维生素B12在生物膜形成过程中通过氧依赖途径合成蛋氨酸和核糖核苷酸。因此,在人类IBD中观察到的维生素B12的可利用性降低可以部分解释为在炎症过程中蛋白细菌的粘膜丰度增加和氧张力的改变。
维生素K缺乏症在接受大剂量抗生素治疗的人中发生得很快,这种缺乏症与严重的胃肠道损伤(出血和溃疡)有关。枯草芽孢杆菌的生物膜表型有利于体外特定的发酵途径,显著提高维生素k的产量。尽管生物膜对止血和粘膜组织本身的生理学至关重要,但生物膜表型对维生素K产生的贡献仍有待阐明。
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。尽管宿主的新陈代谢通常会将外源物质从体内清除,但肠道微生物可以将这些化合物用作营养和能源。
肠道微生物群确实可以直接代谢外源性物质(例如,胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
越来越清楚的是,肠道微生物群的代谢谱比人类细胞的代谢谱要大。不幸的是,在绝大多数情况下,具体的微生物或微生物群落,以及介导这些反应的酶,都是未知的。此外,胃肠道内的不同生境可导致不同的分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
生物膜生活方式在地球上的每一个自然栖息地中都占主导地位,包括胃肠道表面。然而,生物膜在医学上的概念只有50年的历史,不仅应被视为一种病理性慢性感染,而且应被视为一种生活在粘膜表面的微生物的普通生活方式。
微生物生物膜是许多肠道疾病病理生理学的核心,但它们也是肠道稳态发育的关键因素。肠道生物膜的调节可能是新疗法的关键。
我们需要将微生物生态学的重要概念转化为我们目前对肠道生理和宿主-微生物群相互作用的看法。这些概念包括微生物群稳定性、复原力和微生物生物地理学,并要求我们确定它们如何影响胃肠健康。有机会使用生物膜的代谢能力超过浮游生物培养中所描述的,以帮助代谢外来的优势。
未来的研究将有助于更好地了解肠道粘膜生境中多微生物的多样性和复杂性。这一认识构成了开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
为了迎接这一挑战,我们将受益于跨学科的合作,不仅是微生物学家、生理学家和临床医生之间的合作,而且还将受益于与生物物理学家开发临床相关的生物膜模型,生物信息学家分析大数据集,以及微生物生态学家的理论框架来理解这样一个异常复杂的栖息地。
相关阅读:
参考文献:
Motta Jean-Paul,Wallace John L,Buret André G et al. Gastrointestinal biofilms in health and disease.[J] .Nat Rev Gastroenterol Hepatol, 2021
Tomkovich, S. et al. Human colon mucosal biofilms and murine host communicate via altered mRNA and microRNA expression during cancer. mSystems 5, e00451-19 (2020).
Raffatellu, M. Learning from bacterial competition in the host to develop antimicrobials. Nat. Med. 24, 1097–1103 (2018)
Zmora, N. et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell 174, 1388–1405. (2018)
Rumbaugh, K. P. & Sauer, K. Biofilm dispersion. Nat. Rev. Microbiol. 10, 571–586 (2020)
Guilhen, C. et al. Colonization and immune modulation properties of Klebsiella pneumoniae biofilm-dispersed cells. NPJ Biofilms Microbiomes 5, 25 (2019).
Jalili-Firoozinezhad, S. et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat. Biomed. Eng. 3, 520–531 (2019).