 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
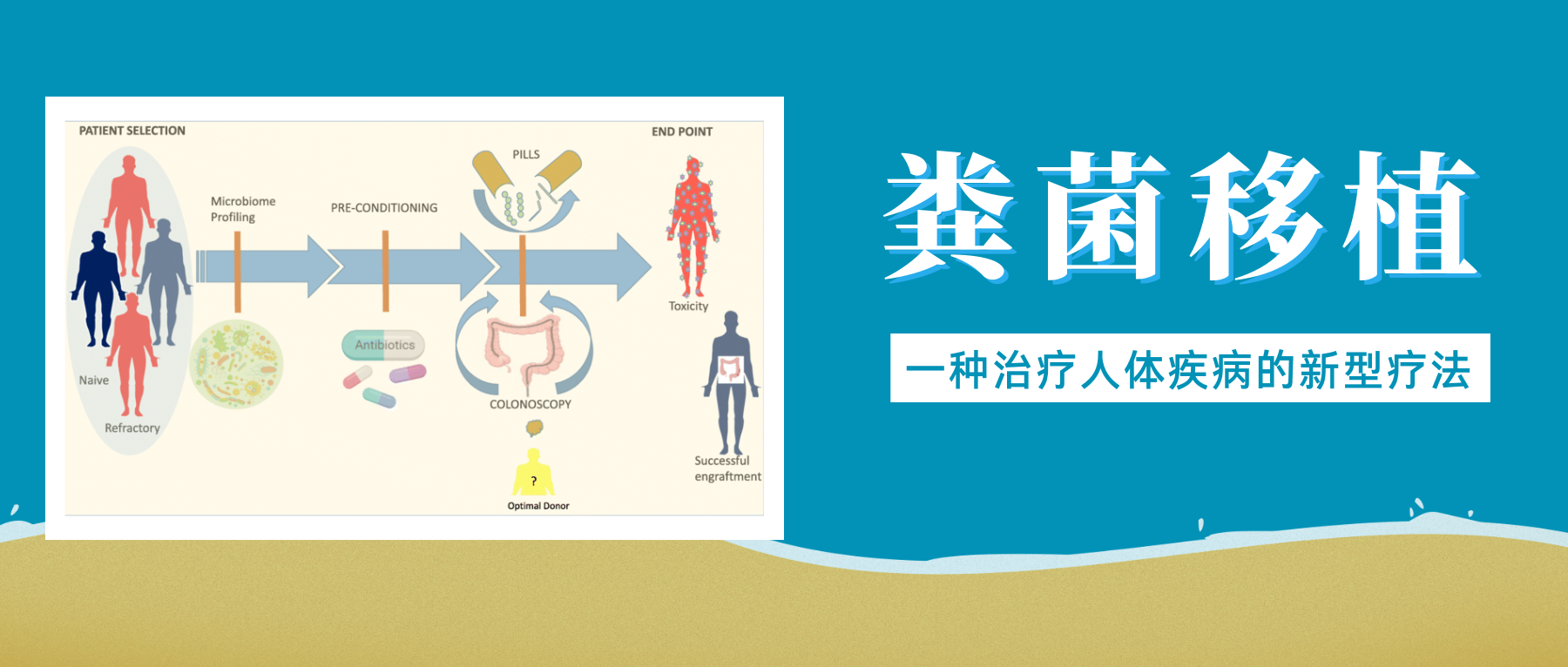
粪菌移植是一项近年来备受关注的医疗技术,它涉及将健康捐赠者的粪便物质转移至患有疾病或障碍患者的胃肠道。

简单来说就是选择健康合适的人粪便,通过科学方法提取出有用的微生物,去除有害与无用的部分,然后制成制剂,给病人口服或者直接注入肠道,目的是恢复健康的肠道微生物群并改善整体健康状况。
粪菌移植的历史悠久
粪菌移植在传统中医中已有数百年的应用,粪菌移植的第一个记录可以追溯到四世纪的中国,当时人类粪便被称为黄汤,用于治疗严重腹泻的患者。
15到16世纪的中国明朝,有关于将新鲜或发酵的粪便悬浮液用于治疗腹泻、便秘和腹痛等胃肠道疾病的记载。
但直到20世纪50年代晚期,它才首次用于现代医学,以治疗由抗生素耐药菌引起的严重腹泻。
在20世纪80年代和90年代,粪菌移植主要用于治疗反复发作的艰难梭菌感染。然而,随着肠道微生物群的发现及其在健康和疾病中的作用,粪菌移植开始被探索作为治疗其他疾病的潜在方法,包括炎症性肠病、肠易激综合征甚至神经系统疾病等。

粪菌移植在未来拥有巨大前景
近年来,粪菌移植受到医学界和公众越来越多的关注,许多临床试验和研究正在进行,以评估其疗效和安全性。
粪菌移植的疗效已经在多种肠道疾病中得到证实,如艰难梭菌感染、肠炎、炎症性肠病等。粪菌移植的出现,为肠道微生物失调带来了新的治疗思路和方法,也为人类健康提供了新的希望。
随着我们对肠道微生物群研究的不断发展,粪菌移植很可能成为治疗其他疾病越来越重要的工具。谷禾在本文中将为大家介绍粪菌移植。
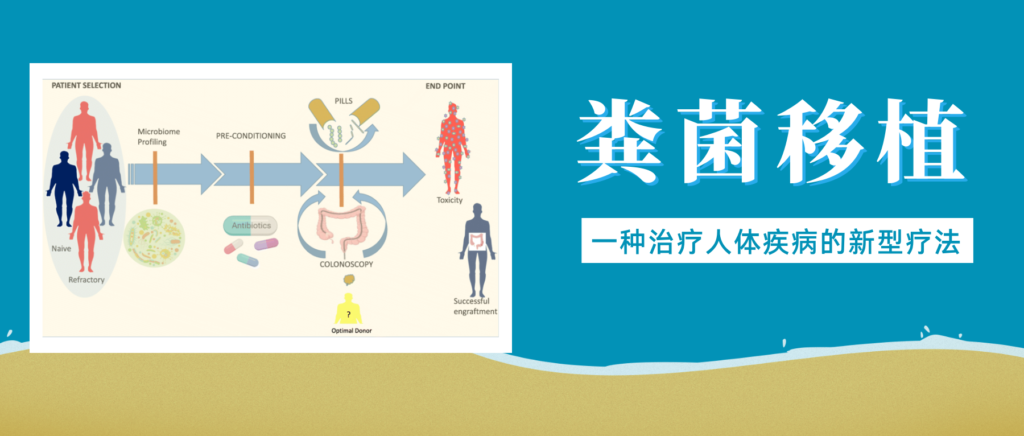
粪便微生物群移植 (粪菌移植) 是一种医疗程序,涉及将粪便从健康供体转移到受体的胃肠道中。已发现粪菌移植可有效治疗各种胃肠道疾病,包括艰难梭菌感染、炎症性肠病和肠易激综合征。
来自大量临床试验的数据表明,粪菌移植也可能对许多其他疾病具有治疗潜力,从胃肠道到肝脏疾病,神经系统疾病、自身免疫性疾病、皮肤疾病、心血管疾病、脑部疾病、肥胖和代谢综合征。
根据这些相关研究,谷禾带大家了解粪菌移植在治疗人体疾病中的作用。
人类疾病中的粪菌移植
Biazzo M,et al.J Clin Med.2022
▼
粪菌移植主要用于治疗反复发作的艰难梭菌感染(CDI),这是一种细菌感染,会引起严重的腹泻和结肠炎症。
√粪菌移植对治疗艰难梭菌感染特别有效
研究表明,粪菌移植在治疗复发性艰难梭菌感染方面特别有效,已发现粪菌移植在治疗艰难梭菌感染方面的成功率超过90%,而且几乎没有副作用。
▼
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,包括炎症性肠病(IBD)、肠易激综合征(IBS)。
炎症性肠病是一种复杂的炎症和慢性疾病,其特征是免疫失调,最终导致消化道免疫介导的损伤,包括溃疡性结肠炎(UC)和克罗恩病(CD)。肠道微生物群失调被认为是炎症性肠病发展中的关键调节事件,因此粪菌移植代表了一种可能的治疗策略。
√缓解溃疡性结肠炎患者症状
最近一项随机对照试验的荟萃分析发现,粪菌移植可有效诱导溃疡性结肠炎患者症状缓解,缓解率为36%,而对照组仅为9%。对核糖体 16S RNA 的分析表明,粪菌移植后微生物多样性增加并持续存在。
对活动期溃疡性结肠炎的儿科患者(4至17岁)进行了随机临床试验。粪菌移植组中92%的患者在第6周实现了小儿溃疡性结肠炎活动指数的改善(与安慰剂组的50%相比)。
√短期内改善了克罗恩病患者症状
评估了25名患有腹腔内炎症性肿块的克罗恩病患者使用多种新鲜粪菌移植(初始粪菌移植随后每三个月重复粪菌移植)的疗效和安全性。
超过一半的患者在第一次粪菌移植后三个月表现出临床反应的缓解,这一比例在12个月和18个月时有所下降。
注:这表明尽管粪菌移植在短期内缓解了临床症状,但未能产生持久的临床效果。
√对肠易激综合征有积极影响
六项不同的临床试验发现粪菌移植对肠易激综合征症状有积极影响:
(1) 在一项只有10名患者入组的小型临床试验中,在粪菌移植后4周,6 名患者有所改善;有趣的是,作者发现报告改善的患者接受了来自双歧杆菌含量高于无效供体的粪菌移植,这表明富含双歧杆菌的粪便供体可能是粪菌移植成功的预测因素。
(2)观察到65%的患者在通过结肠镜检查接受粪菌移植治疗三个月后症状缓解以及粪菌移植之后微生物特征向供体特征的转变,包括增加的α和β多样性。
(3)报告了腹泻型肠易激综合征患者的症状和生活质量的改善,这些患者通过胃镜接受新鲜粪便,并且(在连续分析中)增加了短链脂肪酸。
(4)报告显示,在接受来自健康供体(同种异体移植)或来自他们自己(自体移植)的粪便材料的患者中,肠易激综合征症状出现短暂改善;接受同种异体移植的患者抑郁评分有所下降。
(5)使用仅从一名健康、特征良好的供体获得的粪便样本通过胃镜粪菌移植治疗肠易激综合征患者,发现了疲劳和生活质量的改善以及细菌微生物群概况的变化、粪便短链脂肪酸的变化。
(6)在最近的一项临床试验中,招募了难治性肠易激综合征患者,主要是腹胀,并通过鼻空肠给药接受一次粪菌移植治疗;粪菌移植一年后,56%的患者报告肠易激综合征症状和生活质量有所改善。
▼
复发性肝性脑病是肝硬化的并发症(与饮酒无关),由肝功能衰竭和肠-肝-脑轴受损引起,可导致意识障碍和昏迷 。
√粪菌移植改善肝性脑病患者认知和微生态失调
粪菌移植最近被研究为一种可能的新治疗工具。第一项试验描述,通过灌肠递送的单一粪菌移植在短期内减少了肝性脑病患者的住院时间,改善了他们的认知和微生态失调。
粪菌移植治疗后一年内,与对照组相比,降低了住院率并改善了认知功能。
√粪菌移植展现出肝病的治疗潜力
广泛的研究支持粪菌移植作为一种控制肝病的疗法。粪菌移植改善了高脂肪饮食引起的肝损伤和脂质代谢,同时增加了小鼠肠道微生物群的多样性。来自对酒精性肝病有抵抗力的供体小鼠的粪菌移植可以预防酒精性肝损伤。
此外,粪菌移植已经用于慢性肝病患者。最近一项针对严重酒精性肝炎患者的初步研究表明,粪菌移植与存活率提高和腹水消退有关。
▼
多项研究探索了粪菌移植在治疗神经系统疾病方面的潜在益处,例如帕金森病、多发性硬化症和自闭症谱系障碍。
√改善帕金森病患者症状
发表在《神经病学》杂志上的一项研究发现,粪菌移植改善了帕金森病患者的症状,如便秘和睡眠障碍。
在帕金森病小鼠模型中,来自正常小鼠的粪菌移植可以减少黑质的病理特征并减轻身体损伤。
√改善多发性硬化症患者症状
发表在《神经炎症杂志》上的另一项研究发现,粪菌移植改善了多发性硬化症患者的症状,例如疲劳和抑郁。
√影响抑郁症、阿尔兹海默症状态
此外,来自重度抑郁症患者的粪菌移植在正常小鼠中诱导了抑郁症的行为/生理特征。
最后,在阿尔茨海默病小鼠模型中,源自正常对照小鼠的粪菌移植改善了认知功能。
▼
除神经系统疾病外,粪菌移植在治疗其他非胃肠道疾病(如肥胖、糖尿病和代谢综合征)方面也显示出前景。
√改善代谢综合征患者胰岛素敏感性
几项临床试验研究了粪菌移植对代谢综合征患者的的影响,显示出改善:报告说,患有代谢综合征的男性参与者接受了来自健康人群的肠道微生物群输注六周后胰岛素敏感性增加。
研究人员概括了关于胰岛素抵抗增加的发现,并补充说它取决于粪菌移植后肠道微生物群的变化。
最后,与移植正常供体粪便的受试者相比,使用代谢综合征供体粪便移植肥胖和胰岛素抵抗的男性受试者时,胰岛素敏感性降低,从而显示代谢综合征中胰岛素敏感性和微生物群之间的因果关系。
发表在《胃肠病学》杂志上的一项研究也发现,粪菌移植改善了代谢综合征患者的胰岛素敏感性。
注:代谢综合征是糖尿病的前兆。
除了这些已经确定的应用,粪菌移植还有一些新兴的用途。例如,粪菌移植被探索作为治疗肥胖和2型糖尿病的潜在方法。
▼
在过去的几年中,肠道微生物群在致癌过程中的作用已得到越来越多的认可。肠道微生物失调和个别细菌可以通过激活致瘤途径、诱发炎症和破坏宿主DNA来诱发癌症或影响癌症进程。
细菌影响癌症的具体机制
几种细菌拥有或产生促进β-连环蛋白与E-钙粘蛋白分离的蛋白质,激活参与癌发生的β-连环蛋白信号通路。
肠道生态失调导致细菌衍生的短链脂肪酸的产生减少。肠道生态失调通过Toll 样受体 (TLR) 的微生物相关分子模式发挥促炎作用,增加细胞产生促炎因子,从而增加致癌作用。
除了诱发炎症外,许多细菌还能够通过释放特定代谢物来破坏DNA,从而促进癌症进展。
β-连环蛋白(β-catenin)是一种细胞骨架蛋白,主要位于细胞膜,在乳腺上皮中,β-catenin游离量较少,通过介导与E-cadherin的相互作用,将细胞外黏附因子与细胞质内细胞骨架相互连接,以保持质膜的完整性,并参与细胞的黏附、迁徙与转移等过程。
β-catenin异常表达时脱离细胞间连接进入细胞质或细胞核,将失去介导细胞间链接、黏附的功能,并引起某些癌基因的表达,导致细胞癌变、转移。
β-catenin还是介导Wnt信号传导的关键分子,其在细胞核中决定着Wnt信号通路的开放或关闭,通过调节基因表达过程,在乳腺发育以及肿瘤发生的调控中起到了重要的作用。
细胞膜中β-catenin的丢失以及细胞质、细胞核中β-catenin的高表达都可以经过不同的调节途径独立发生,诱导乳腺癌的发生,并影响乳腺癌的预后。
E-钙粘蛋白(E-cadherin)是钙黏蛋白家族成员,在上皮细胞中连接细胞骨架与细胞外环境,参与细胞信号传导。在正常乳腺组织中,E-cadherin在肌上皮中呈颗粒状膜阳性,在腺上皮细胞中呈细胞膜强阳性,是区分DCIS和小叶原位癌的标志物;E-cadherin几乎在所有的DCIS细胞上呈线状膜染色,而小叶原位癌的细胞膜大多不表达E-cadherin。
令人惊讶的是,特定的微生物群物种具有调节癌症治疗的功效,显著影响癌症患者的临床预后。
√粪菌移植有助于治疗黑色素瘤
黑色素瘤是一种皮肤癌,涉及产生黑色素的黑色素细胞。最近,新工具利用免疫检查点抑制剂来增强患者对肿瘤的免疫反应(这种治疗方法称为“癌症免疫疗法”),并且有趣地发现肠道微生物组调节这种反应。
注:谷禾前面的文章中也有讲过癌症免疫疗法。
在两个具有不同肠道微生物组成的小鼠中,黑色素瘤的生长及其对抗程序性死亡配体1(PD-L1)免疫疗法的反应显著不同。
如果将来自对抗PD-1治疗有积极反应的黑色素瘤患者的粪便样本移植到无菌小鼠体内,则PD-1阻断的抗肿瘤作用会得到改善。
粪菌移植似乎有望通过转移有利的肠道微生物群来增强黑色素瘤患者的抗肿瘤免疫力。
通过粪便微生物群移植治疗癌症
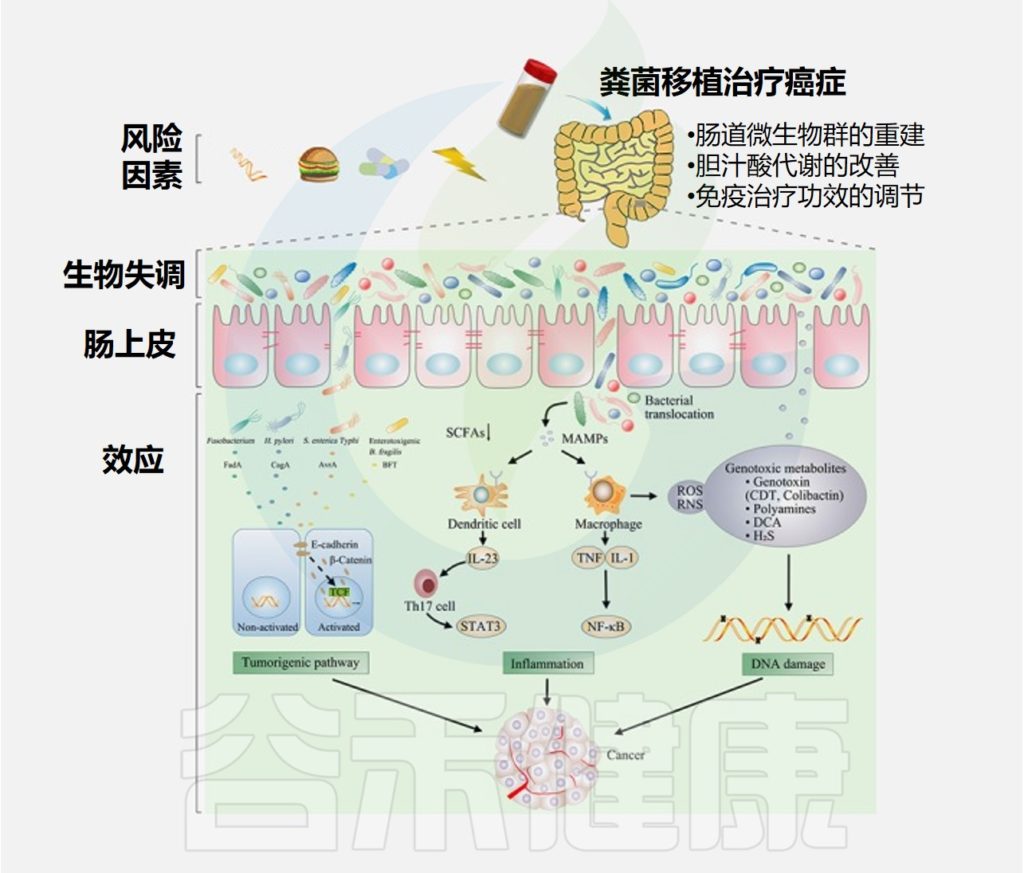
Chen D,et al.Int J Cancer.2019
▼
根据最近的研究,粪菌移植可能是治疗各种皮肤病症(包括湿疹和牛皮癣)的潜在治疗选择。人体肠道微生物群在免疫调节中起着至关重要的作用,肠道微生物群的改变与各种皮肤病有关。
一些案例报告了湿疹和牛皮癣患者经粪菌移植后成功治疗。
√改善了牛皮癣患者的严重程度
在研究皮肤病学杂志上发表的一项研究中,研究人员发现粪菌移植改善了四分之三的牛皮癣患者的严重程度。
√湿疹症状有了显著改善
此外,发表在美国皮肤病学会杂志上的一项研究报告说,粪菌移植使三分之二的患者的湿疹症状有了显著改善。
总之,粪菌移植显示出作为治疗湿疹等皮肤病的巨大潜力。同样重要的是要注意粪菌移植具有潜在的风险,包括感染和不良反应。
需要更多的研究来确定粪菌移植治疗皮肤病的最佳频率和剂量。因此,在考虑将其作为皮肤病的治疗选择之前,必须彻底评估粪菌移植的潜在益处和风险。
▼
关于微生物群和粪菌移植干预在心血管疾病中的作用,只有有限的证据可用,而且大多是在动物模型中获得的。
√菌群影响房颤的易感性
最近提出了老年人肠道菌群失调在房颤发病机制中的因果作用。研究表明,将患有心房颤动的老年大鼠粪菌移植移植到年轻大鼠体内会导致更高水平的脂多糖和更高的疾病易感性。
√菌群移植改善了心肌损伤
仍然在动物模型中,实验性自身免疫性心肌炎(EAM)小鼠模型中对照小鼠的粪菌移植增加了微生物的丰富度,包括厚壁菌门/拟杆菌门的比例增加,并且由于炎症减轻而改善了心肌损伤。
尽管科学文献中很少有证据表明粪菌移植策略在心血管疾病中有治疗价值,但在动物模型和人类中获得的这些数据肯定会为进一步研究提供坚实的基础。
本章小结
未来,粪菌移植也可能用于治疗自身免疫性疾病,如类风湿性关节炎和红斑狼疮,以及精神健康状况,如抑郁症和焦虑症。
值得注意的是,这些新兴应用仍处于研究的早期阶段,需要进一步的研究来确定它们的疗效和安全性。
总的来说,目前粪菌移植主要用于治疗反复发作的艰难梭菌感染和一部分胃肠道疾病,但它在治疗其他疾病和障碍方面具有巨大的潜力,正在进行研究探索其在各个医学领域的潜在应用。
▼
移植所需的粪菌来自经过严格筛查的供体,供体捐赠样本后,用一套全自动化的机器进行分离,经过注水、搅拌、过滤、离心、沉淀等步骤,得到纯化的细菌。
粪便菌群移植过程示意图
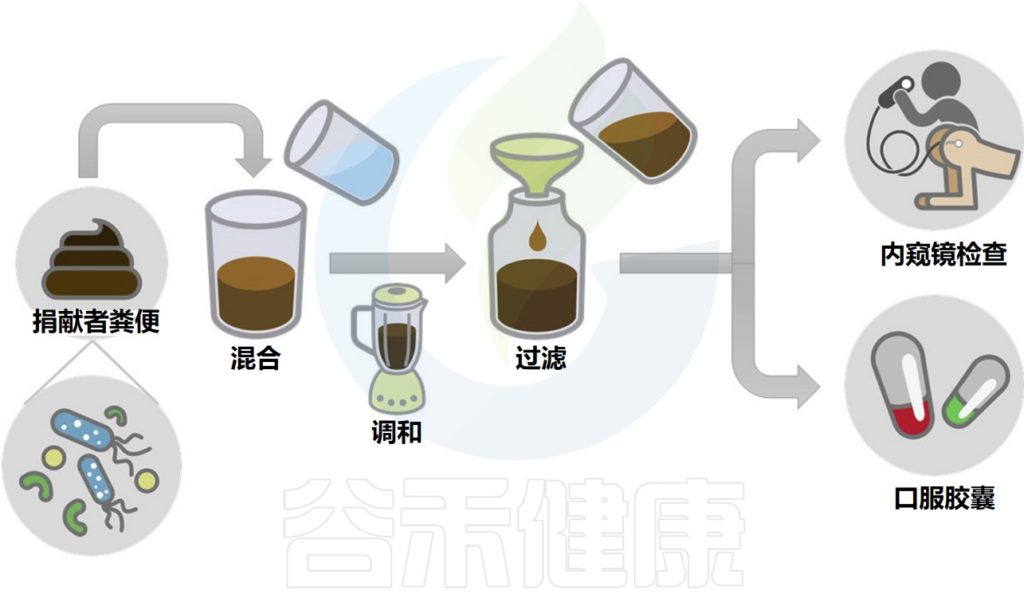
Wang JW,et al.J Formos Med Assoc.2019
其中单单过滤的步骤就要重复数次,每一道过滤用的滤网孔径都比前一道滤网的孔径更小,最后一道滤网的孔径只有0.07毫米,基本上可以把所有的杂质去除,只剩下细菌这些微生物。
分离出来的粪菌再用生理盐水制成混悬液供移植使用。
▼
“移植”过程不是简单粗暴的将一个人的粪便直接注入患者的肠道,主要是将健康供体的粪便离心纯化,获得功能菌,然后通过上消化道、中消化道和下消化道转移至受体肠道。从而重建稳定的肠道微生态环境,缓解相关症状,治疗疾病。
★ 粪菌移植的途径与治疗目的有相关性
例如,想要治疗溃疡性结肠炎可以采取经结肠镜灌肠。要治疗慢性乙型肝炎,则是经上消化道,可以采取:经麻醉胃镜、普通胃镜、经鼻饲管,或者用粪菌胶囊,经典方式是通过麻醉胃镜。
粪便微生物群移植的方法
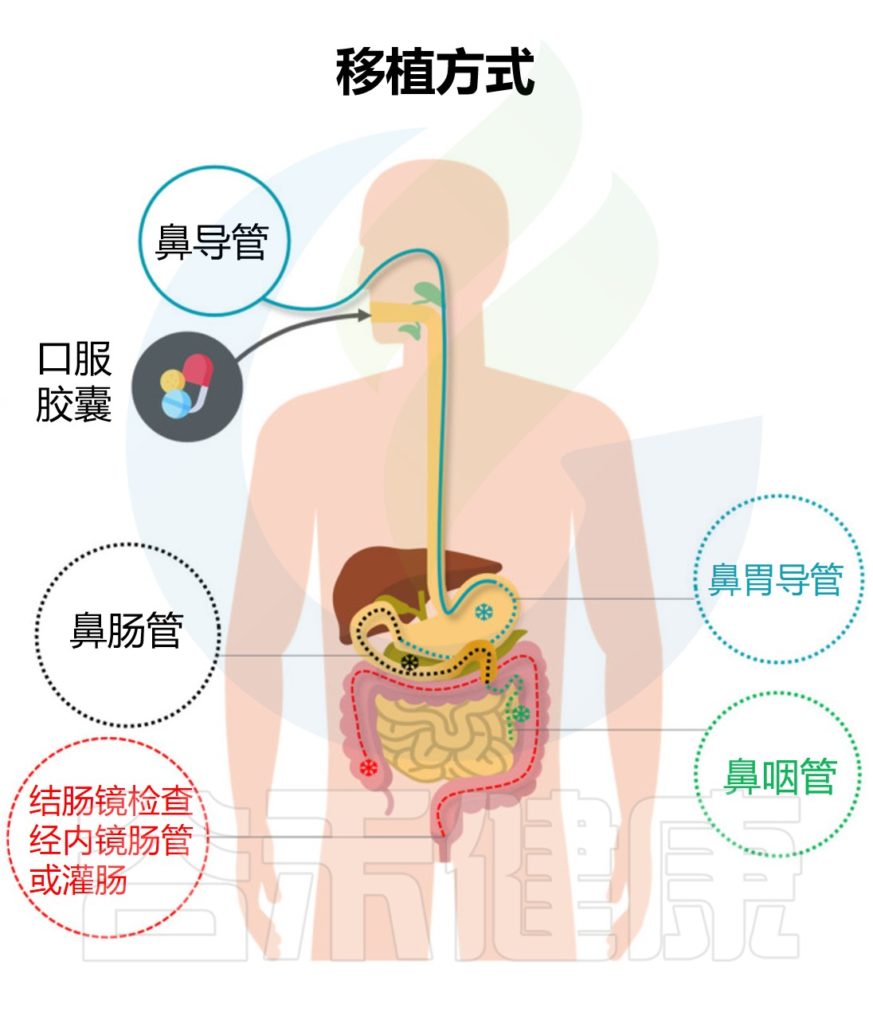
Biazzo M,et al.J Clin Med.2022
不同的粪菌移植方式具有各自的优缺点,下面谷禾具体来讲述经不同部位消化道进行粪菌移植的特点。
▸ 上消化道
操作简单,总体风险较低
上消化道途径中,口服给药和鼻胃管应用广泛,操作简单,总体风险较低。但在此过程中,可能会因菌液反流或吸出而导致窒息,如果机体本身存在梗阻,则移植的菌液可能无法准确到达肠道。
其中,口服途径主要指包封粪菌材料,通过将提取的粪菌与冷冻保护剂(主要是甘油)混合制备,然后进行多重包装以保护粪菌移植材料免受胃肠道环境的影响。同时,操作人员可以根据预期的释放位置进一步选择胶囊壳的材料。目前,市售的胶囊壳通常针对胃或结肠的释放,并被配制以确保细菌的存活率和定植。
降低潜在疾病传播的概率
此外,在制作胶囊的过程中,也可以去除无症状供体中可能存在的真菌、寄生虫、病毒和部分炎症介质,以降低潜在的疾病传播概率。
总的来说,通过上消化道途径的粪菌移植具有无需昂贵器械、重复使用对患者损伤小、患者耐受性好等优点。该途径适用于不能耐受鼻肠管和胃镜移植的患者,以及需要口服定制菌的患者。
▸ 中消化道
减少移植时的细菌位移
中消化道途径主要是指鼻肠移植和经内镜肠道植管术,能够实现全肠道给药。其中鼻肠管通过导丝拉伸拉直,在胃肠蠕动正常的情况下自动通过幽门,进一步减少粪菌移植时的细菌移位。
在一项随机对照试验中报道,通过鼻肠管的粪菌移植优于单独使用万古霉素治疗艰难梭菌感染,但粪菌移植组患者也出现了腹泻、痉挛和便秘等不良事件。
什么是经内镜肠道植管术?
经内镜肠道植管术(TET)具体指的是在内镜下辅助植入固定管并固定在肠道深处,同时外端沿肠道与外部相通。TET主要包括结肠途径介导的TET和中胃肠道途径介导TET。
结肠通路介导的TET需要应用结肠镜检查,并且使用这种途径进行重复粪菌移植是昂贵的。相比之下,中胃肠道途径介导的TET更方便,更容易维持。
由于中胃肠道介导的TET不需要在内镜手术后通过X射线或其他医疗仪器进一步确认肠道位置,对于无法进行结肠镜检查肠道准备的患者,或需要重复粪菌移植的患者,中胃肠道中介导的经内镜肠道植管术也是主要选择。
▸下消化道
下消化道通路主要指灌肠、结肠镜检查、结肠通路介导的经内镜肠道植管术等操作。
灌肠侵入性较小且相对简单
其中,灌肠是一种侵入性较小且相对简单的操作。灌肠法患者耐受性好,不需要昂贵的器械,有效降低了手术风险。但这种方法需要将输注的粪悬液保留较长时间,患者保持仰卧位以减少粪便排泄,同时反复灌肠易于被患者接受。
注意:粪菌移植的细菌是否可以通过灌肠的方式保留在肠段的命题尚不明确,而且这种方式也伴随着无法到达结肠和脾曲的风险,需要多次灌注才能获得疗效和更长的手术时间,以弥补肠道菌群保留率低的缺陷。同时,由于细菌液的滞留,这种方法可能不适用于肛门括约肌松弛或尿失禁的患者。
此外,在结肠镜检查和结肠通路介导的经内镜肠道植管术方面,它具有多种优势,主要包括:
(1)能够完整显示结肠和活检可疑组织的情况,有利于疾病的诊断、识别和分期;
(2) 允许操作人员直接评估肠道炎症,并在适当的部位注入足量的供体粪便细菌;
(3) 可将肠道菌群准确移植到受影响的肠段,并进一步将细菌保留在目标肠段;
(4)可以准确地输入足量的供体粪便菌,可以在一定程度上提高治疗效率。
然而,这些手术也伴随着部分不良事件,包括加重肠道反应。
粪菌移植的主要操作方式及优缺点


Zhang YW,et al.J Bone Miner Metab.2022
▼
粪菌移植的安全性主要与两方面因素有关,即供体的生物安全性、移植的操作安全性。
•供体的生物安全性
供体不仅要筛查排除乙肝、丙肝、梅毒、艾滋病、这些已知传染病,还要排除寄生虫、条件致病菌感染,甚至连饮食习惯、排便习惯、情绪状态、肿瘤家族史都要进行调查,不符合要求的都要排除。
供体的筛查可以说是“百里挑一”,要成为一个合格的供体是非常困难的。所有这些筛查工作都是为了保证供体的生物安全性。
•移植的操作安全性
移植的操作安全性主要与移植的方式有关。经胃镜、结肠镜的移植操作风险与常规胃镜、结肠镜检查的风险基本一致。
注:在后面的章节我们会详细讲述粪菌移植操作的具体要求。

为了评估粪菌移植的安全性,上海同济粪菌移植工作组主任等研究人员对8547名采用过粪菌移植的患者进行跟踪研究,得出以下结论:
1、回顾性分析数据表明,粪菌移植的短期和长期(从2周到5年)安全性都是比较好的,患者不要担心;
2、短期不良事件与粪菌移植给药方法有关,多为轻中度、较短暂,包括恶心、呕吐、腹泻等,只有42名(0.5%左右,很低比例)患者发生胃肠症状恶化;
3、长期随访期间的新发疾病主要是胃肠道和呼吸道疾病,发病率与一般人群无异;
4、 随访期间无粪菌移植相关感染传播事件,11例死亡与粪菌移植无关;
5、通过规范适应症和给药时机后,短期安全性和患者满意度升高。
所以,粪菌移植还是比较安全的。
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,然而,粪菌移植的潜在长期影响以及粪菌移植的最佳频率和剂量仍未得到很好的了解。
本章节旨在回顾有关粪菌移植潜在长期影响的现有文献,并为未来的研究和临床实践提供建议。
▼
虽然粪菌移植已被证明在短期内有效,但对粪菌移植长期影响的研究有限,粪菌移植对肠道微生物组和整体健康的长期影响仍不清楚。
✦可能导致抗生素抗性基因的转移
粪菌移植是一种医疗程序,它将健康捐赠者粪便中的微生物移植到受体的肠道中,以恢复或改善肠道微生物平衡。虽然粪菌移植已被证明在治疗某些疾病方面非常有效,但它的使用也存在一定争议。
一些研究表明,粪菌移植可能会产生意想不到的后果,例如抗生素抗性基因的转移或致病菌的引入。
✦病毒或其他感染因子可能通过粪菌移植传播
此外,人们还担心病毒或其他感染因子可能通过粪菌移植传播。需要更多的研究来充分了解粪菌移植的长期影响,并制定安全有效地使用该程序的指南。
▼
✦粪菌移植的监管
粪菌移植的监管因国家而异,一些国家如美国对其使用采取更为严格的方法。在美国,粪菌移植被美国食品药品监督管理局作为生物制品进行监管,只批准用于治疗未对其他治疗方法产生反应的复发性艰难梭菌感染。
在欧洲,粪菌移植通常被视为医疗程序,并由国家卫生部门进行监管。
✦粪菌移植的伦理问题
粪菌移植的伦理考虑包括知情同意、捐赠者选择以及对捐赠者和受体的潜在风险。捐赠者必须接受广泛的筛查,以确保他们健康且没有传染病,并且必须同意他们的粪便用于粪菌移植。
受体也必须提供知情同意,并且必须完全了解该程序的潜在风险和好处。粪菌移植的主要争议之一是该程序缺乏标准化。目前没有粪菌移植的标准化方案,粪便成分在捐赠者之间可能会有很大的差异。
▼
✦粪菌移植的剂量会影响其疗效
目前,粪菌移植的最佳频率和剂量仍不确定。一些研究表明,粪菌移植的剂量可能会影响其疗效,但目前还没有确定最佳剂量的标准。
✦一般需要多次粪菌移植
关于粪菌移植的频次,目前尚无明确的建议。一些研究表明,单次粪菌移植可能无法完全恢复肠道微生物群的平衡,需要多次粪菌移植才能达到最佳疗效。
单次粪菌移植可以有效治疗某些疾病,如复发性艰难梭菌感染。然而,对于其他疾病,可能需要多次粪菌移植才能获得最佳效果。
但是,多次粪菌移植也可能增加感染和其他不良反应的风险。因此,粪菌移植的频次应根据患者的具体情况和病情进行个体化的决策。
总之,粪菌移植的最佳频次和剂量应根据患者的具体情况和病情进行个体化的决策,同时应注意监测和预防不良反应的发生。
需要更多的研究来确定粪菌移植的最佳频率和剂量,以便在临床实践中更好地使用该程序。
根据《上海市菌群移植技术管理规范(2021年版)》,以下是部分粪菌移植操作要求:
▼
(一)严格遵守粪菌移植治疗操作规范和诊疗指南,严格掌握粪菌移植治疗适应证和禁忌证。
▷粪菌移植适用于治疗以下消化系统疾病
(1)艰难梭状芽胞杆菌感染:复发性/难治性艰难梭状芽胞杆菌感染。
(2)其他消化系统疾病:溃疡性结肠炎、克罗恩病、功能性便秘、肠易激综合征、菌群紊乱相关腹泻等。
▷粪菌移植治疗的其他疾病
(1)神经系统疾病:帕金森病、阿尔兹海默症、癫痫等。
(2)精神疾病:自闭症、情绪障碍、多动症、抽动症等。
(3)代谢相关疾病:代谢综合征、糖尿病等。
(4)肿瘤相关疾病:免疫治疗及放化疗所致肠炎等。
(二)除复发性/难治性艰难梭状芽胞杆菌感染外,出于其他治疗目的使用粪菌移植治疗均须以临床研究形式开展,并通过本机构伦理审查与备案。
(三)实施粪菌移植治疗前应当向患者及其家属告知治疗目的、风险、注意事项及可能发生的并发症等,并签署知情同意书。
(四)医疗机构应当建立完整的电子化临床数据库及严格的术后随访制度,在完成每例粪菌移植治疗后应当按照有关规定将治疗相关信息上报卫生健康行政部门。
▼
(1)有明确与肠道菌群紊乱有关的肠道内疾病,如肠功能障碍性疾病、肠道感染性疾病(复发性艰难梭菌感染)、肠道炎症性疾病及假性和麻痹性肠梗阻等;
(2)有明确与肠道疾病或者肠道菌群紊乱有关的肠道外疾病,如便秘合并帕金森病、便秘或腹泻合并自闭症、便秘或腹泻合并过敏性皮炎;
(3)患者需充分理解粪菌移植治疗过程及机制,并签署知情同意书。
!
出现以下情况之一不宜进行粪菌移植:
(1)肠道大面积溃疡、出血;
(2)移植通道梗阻;
(3)移植操作本身(内镜、置管、灌肠、经口饮食)的禁忌证;
(4)未通过伦理审核的临床试验或患者拒绝接受粪菌移植。
(5)生命体征(体温、心率、血压、呼吸)不稳定;
(6)严重免疫系统紊乱;
(7)孕妇或哺乳期妇女;
(8)代偿或者失代偿肝功能障碍。
▼
(1)个人情况:作息规律,饮食健康,家庭和睦,无不良性交,无吸烟、饮酒、吸毒等嗜好,无药物成瘾,近6个月未接种过疫苗或参加药物试验,近6个月未接受纹身或出现皮肤破损,近6个月无热带地区旅居史;无胃肠道病变家族史,无恶性肿瘤家族史,无传染病家族史;非孕期,非经期。
(2)开展病史和身体检查,评估供体的健康状况和是否符合粪菌移植的供体资格;选择无传染病史、无抗生素使用史、无消化系统疾病等方面的供体。
身体状态:年龄18-30周岁,体重指数(BMI)18.5-23.9 kg/m2,儿童医院开展粪菌移植,供体要求可放宽至15-30周岁。
心理状态:心理科医师或心理咨询师访谈认定心理状态良好;抑郁自评量表(SDS)、焦虑自评量表(SAS)、匹兹堡睡眠质量指数(PSQI)等评分正常。
(3)进行多项检测,如血液化验、粪便检测、病原菌检测、URTI检测等,确保找到适合的健康供体;以确保其不携带有害微生物和多重耐药菌。同时,需要考虑供体的肠道微生物组成和短链脂肪酸水平,以选择最适合的供体。
血液学检测:包括血常规、肝肾功能、电解质、C反应蛋白正常,肝炎病毒、HIV、梅毒、EB病毒、巨细胞病毒、COVID-19抗体、线虫、阿米巴等病原检测阴性;
粪便检测:粪便常规检查正常,隐血实验阴性,艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、小肠结肠耶尔森菌、致病性弧菌(副溶血弧菌、霍乱弧菌)、气单胞菌、阿米巴、孢子、诺如病毒、轮状病毒和新型冠状病毒(COVID-19)等病原学检测阴性。
(4)评估供体的肠道微生物组成,多样性和稳定性,包括菌群、真菌群和病毒群,并建立数据库;在选择供体时,除了肠道微生物群的总体多样性外,还应考虑到益生菌的丰富度,如乳酸菌、双歧杆菌等,选择粪便丁酸浓度高的供体微生物组。
(5)根据评估结果选择合适的供体,注意进行家族成员偏向,判别成熟度和完整性,同时避免与患者组群共同优势菌种重合等;一些研究表明,供体微生物组成与受体的微生物组成相似,可以提高移植成功率。
(6)移植前需对受体进行评估和准备,包括清洁肠道和停用抗生素等;为了提高移植效果,一些研究还使用抗生素预处理和肠道灌洗等方法来增强供体菌株的移植。
限食耐受性:通过限食实验完成。部分受体存在食物过敏及食物不耐受(如鸡蛋、牛奶等),根据受体要求,供体需在捐赠粪便前5天限制食物种类,如该供体不可耐受,则不可作为本次移植的捐赠者。
(7)进行移植后,对受体的微生物组成进行多次采样和分析,以评估移植效果和持续时间;
①每2个月复查以上条目,仍然符合上述要求;
②每次捐赠的粪便均留样行宏基因或者16s rDNA测序(根据各自单位检测能力),保证菌群组成及多样性稳定;
③每次捐献粪便应留样行代谢组学检测。
(8)监测受体的生理状况和不良反应,及时采取措施进行处理。
▼
(1)粪便采集:应采用无菌容器采集,粪便重量不少于100g,性状为Bristol评分标准中3-5分方为合格,立即进入菌液制作流程,或立即密封后2-8℃保存。
(2)制作流程:每次需取不少于50g粪便与无菌生理盐水以1∶3比例混合,充分搅拌混匀后过滤,从粪便排出体外至菌液制作完成应保证在2小时以内,整个处理过程应在无菌环境下操作。
注:为了避免感染窗口期的问题,菌液或胶囊制备后应待21 天后经过病毒细菌等检验合格后出库,每批产品留样至少6个月以供追溯。
(3)冻存与复融:菌液制备完成后置于-80℃保存,6个月之内使用不影响疗效;如置于-20℃保存,应在1-4周内使用。使用前置于室温复融,6小时内输注;如使用水浴锅复融,则水温不得超过37℃。
(4)质控标准:每次制作完成的菌液应随机抽样,进行致病菌监测、细胞计数及宏基因或16s rDNA菌群测序。
每50mL菌液中活细胞数应不小于2.5×10^12个,同供体同批次样本应达到菌群组成一致,6个月内同供体不同批次样本应达到菌群组成差异无统计学意义。
制作完成的菌液应有独立包装与标签。如制作胶囊,还应取胶囊内容物进行细菌活性监测与活细胞计数,其中细菌活性应不低于85%,每克内容物包含活菌数不小于10^9CFU。
▼
(1)菌液输注前需结合患者自身情况及疾病种类行肠道准备。
(2)应根据指南及操作规范选择上消化道或下消化道进行菌液输注。
(3)操作时应观察患者耐受情况,并及时处理不良反应。
▼
(1)管理原则:医疗安全(不良)事件的管理,遵循预防为主、紧急处理、合理控制、防微杜渐、持续改进的原则。
(2)上报要求:凡科室职工均有权上报医疗安全(不良)事件,可通过网络、书面、电话上报,上报时限要求在不良事件发生后24小时之内。
(3)审核、处置要求:科室负责人24小时内审核、处置科室发生的不良事件,并呈报至相关职能部门。
注意:主管职能部门自接报之日起,24小时内审核、处置不良事件;对于接报的Ⅱ级及以上不良事件,应呈报至主管院领导。
主管院领导对于接报的Ⅱ级及以上不良事件,必要时组织委员会进行讨论分析,并提交院务会。
▼
(1)每次菌液输注后密切观察患者耐受情况24小时,如有不良反应立刻处理并及时上报。
(2)1个疗程治疗结束后4周内应对患者症状学和肠道菌群改善情况进行评估,粪菌移植治疗疾病的随访及疗效判断指标主要遵循原发疾病的治疗指南。移植前后重复检测粪便及血液中传染病相关指标,有条件者可行免疫相关检测。
注意:如第1个疗程结束3周后病情无改善,可尝试更换供体,重新给予1个疗程粪菌移植,若有效可继续治疗,若仍无效则应视为粪菌移植无反应性,此时不应继续给予粪菌移植,以免耽误病情;如患者接受粪菌移植治疗后症状明显改善,可重复3-5次粪菌移植后结束治疗。
随访至末次粪菌移植结束后至少8周,有条件者应进行大于1年甚至5年以上的长期随访。
随着对微生物与宿主相互作用的了解不断加深,肠道微生物群的参与已成为一种新颖、巧妙且不可忽视的调节宿主健康的方式。
粪菌移植是一种治疗胃肠道疾病的有效方法,还有望治疗其他更多疾病。未来的研究应该重点关注粪菌移植对肠道微生物组和整体健康的长期影响,并制定安全有效地使用该程序的指南。
此外,需要进一步研究如何提高粪菌移植的改善效果,供体和受体的配型以及移植肠道菌群的定植和效果的长期性,以便在临床实践中更好地使用。
主要参考文献:
Zhang YW, Cao MM, Li YJ, Zhang RL, Wu MT, Yu Q, Rui YF. Fecal microbiota transplantation as a promising treatment option for osteoporosis. J Bone Miner Metab. 2022 Nov;40(6):874-889.
Biazzo M, Deidda G. Fecal Microbiota Transplantation as New Therapeutic Avenue for Human Diseases. J Clin Med. 2022 Jul 15;11(14):4119.
Quaranta G, Guarnaccia A, Fancello G, Agrillo C, Iannarelli F, Sanguinetti M, Masucci L. Fecal Microbiota Transplantation and Other Gut Microbiota Manipulation Strategies. Microorganisms. 2022 Dec 7;10(12):2424.
Vendrik KEW, Ooijevaar RE, de Jong PRC, Laman JD, van Oosten BW, van Hilten JJ, Ducarmon QR, Keller JJ, Kuijper EJ, Contarino MF. Fecal Microbiota Transplantation in Neurological Disorders. Front Cell Infect Microbiol. 2020 Mar 24;10:98.
Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, Hu HM, Hsu PI, Wang JY, Wu DC. Fecal microbiota transplantation: Review and update. J Formos Med Assoc. 2019 Mar;118 Suppl 1:S23-S31.
Chen D, Wu J, Jin D, Wang B, Cao H. Fecal microbiota transplantation in cancer management: Current status and perspectives. Int J Cancer. 2019 Oct 15;145(8):2021-2031.
Stallmach A, Steube A, Stallhofer J, Grunert PC, Merkel U, Hartmann M. Fäkaler Mikrobiomtransfer – Indikationen, Risiken und Chancen [Fecal microbiota transplantation: indications, risks and opportunities]. Inn Med (Heidelb). 2022 Oct;63(10):1036-1042. German.

谷禾健康

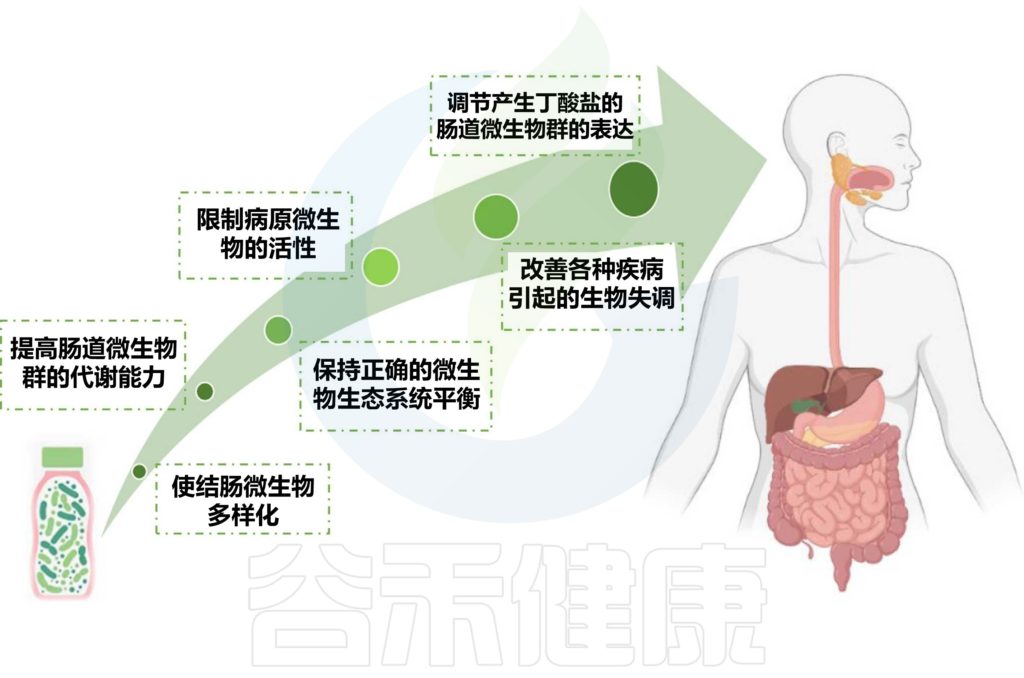
我们知道,肠道微生物群对人类健康和福祉很重要,调节宿主代谢,塑造免疫系统并防止病原体定植。
通过粪便微生物群移植(FMT)恢复平衡多样的微生物群,已成为研究疾病发病机制中微生物群因果关系的潜在治疗策略和有前途的工具。
然而,FMT 带来了后勤方面的挑战和潜在的安全风险,如病原微生物的转移、不期望的表型(如肥胖)的潜在转移,或在生命后期发展疾病的风险增加。
因此,一种更可控、更个性化的培养有益微生物混合物可能是更好的选择。
这些有益微生物中的大多数将是宿主的内源性共生体,没有长期安全有益的使用历史,因此通常被称为下一代益生菌(NGP)或活生物治疗产品(LBP)。
植物乳杆菌菌株,其益生菌和功能特性及其促进健康的作用脱颖而出,可以很好地调节肠道菌群组成。
一项FMT研究发现共生产丁酸菌Anaerobutyricum spp.(以前称为Eubacterium hallii)与代谢综合征受试者胰岛素敏感性的提高有关。因此,着手进一步研究和开发这种潜在的有益微生物,并将重点放在Anaerobutyricum soehngenii L2-7等,因为它的特征最好。
在小鼠模型中使用Anaerobutyricum soehngenii 完成临床前试验后,在受控条件下生产菌株,并进行了几项临床研究,以评估其在人体中的安全性和有效性。
本文将以植物乳杆菌为例,介绍其益生菌特性;以A.soehingeii为例,介绍用于临床的的开发,为下一代益生菌的开发和测试提供了实践指导。
传统的益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。这些微生物使用历史悠久,被认为是安全的。
注:在美国具有公认安全(GRAS)状态,在欧盟具有合格安全推定(QPS)状态。
益生菌的使用可能代表一种调节肠道微生物群和改善人类疾病的治疗策略。
doi.org/10.1016/j.micres.2022.127289
相比之下,下一代益生菌(NGP)是一种没有长期安全有益使用历史的微生物,与传统益生菌一样,当以足够的量给药时,下一代益生菌对宿主健康有益。
2012年,美国食品和药物管理局引入了活生物治疗产品(LBP)一词,定义为“一种生物产品”,其:
(1)含有活生物体,如细菌;
(2)适用于预防、治疗或治愈人类疾病或病症;
(3)不是疫苗。
LBP在《欧洲药典》(Ph.Eur.)中被定义为“含有活微生物(细菌或酵母)的供人类使用的医药产品”。然而,由于LBP除了微生物外还包括最终产品的配方,并且被定义为药物产品,因此不应系统地使用该术语来替代NGP。
NGP一词更为广泛,包括LBP中存在的微生物和目前正在研究的、尚未在最终产品中配制的微生物。此外,NGPs既可以用作传统益生菌等食品补充剂,也可以用作预防、治疗或治愈疾病的医药产品。最后,转基因微生物也可以被视为NGP,尽管最有可能作为LBP上市。
下图示意性地描述了各种定义。
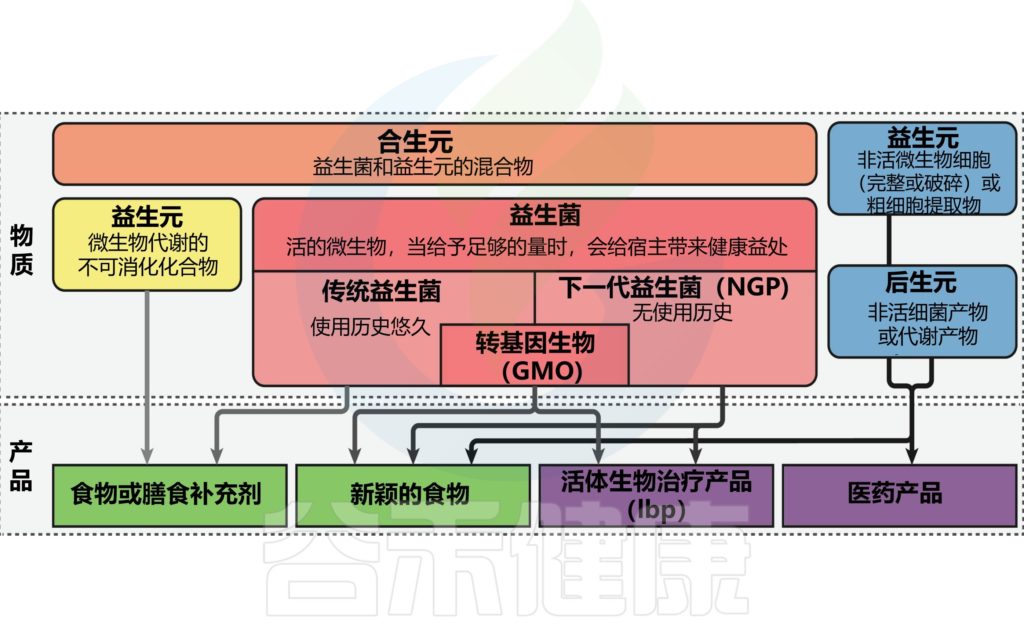
doi.org/10.3389/fmed.2022.1077275
植物乳杆菌是乳杆菌中最重要的成员之一,由于其出色的益生菌特性(良好的 GI 耐受性、粘附性、抗氧化性和抗菌性),它通常被用作益生菌。
✔ 抵抗胃肠道疾病
将微生物视为益生菌的一个基本特征是能够在人类胃肠道的恶劣条件下存活。
植物乳杆菌MA2菌株和B23菌株表现出良好的耐受性,可以在低pH值(2.5-3)下存活。植物乳杆菌KU15149 具有胃和胆汁盐耐受性。
✔ 对肠粘膜和/或细胞外基质成分的粘附能力
粘附到上皮细胞的粘膜或粘附到肠道细胞外基质的成分是益生菌微生物的理想特征,因为它们将有利于益生菌在宿主中的定植和持久存在。
两种植物乳杆菌菌株DKL3 和 JGR2 分别显示出 82.8% 和 79.6% 的粘附程度。
植物乳杆菌菌株 KACC11451 和 Wikim0112 的肠上皮粘附率约为 60–62%.
✔ 抗氧化活性
一些益生菌已被证明具有抗氧化活性,可减少氧化反应造成的损害。
✔ 细菌素生产
细菌素可以在食物和宿主中发挥各种益处,因为它们可以分别延长保质期和防止不必要的定植。许多植物乳杆菌菌株已被证明能够产生细菌素,赋予这种微生物益生菌特性。
植物乳杆菌产生通常称为 plantaricin 的细菌素。
KLDS1.0391、ZJ5、TN635、B23 和 AA135 菌株分别是细菌素 Plantaricin MG、Plantaricin ZJ5、细菌素 ST28MS 和 ST26MS、细菌素 BacTN635、细菌素 Lac-B23 和 Plantaricin AA135 的生产者,它们具有对几种革兰氏阴性菌的抗菌作用。
✔ 抗菌活性
益生菌的特点是抑制病原微生物的生长、发育和定植。
在植物乳杆菌的发酵代谢过程中,它会产生多种抗菌化合物(除细菌素外),其中可能包括有机酸,例如乳酸、柠檬酸、异丁酸和乙酸、乙醇、双乙酰和 H2O2. 植物乳杆菌还可以产生具有天然抗真菌活性的胞外多糖。
✔ 本土肠道调节
构成肠道微生物组的不同物种的生态平衡,对于预防传染性和非传染性疾病以及阻止微生物群平衡的紊乱至关重要。益生菌具有调整肠道菌群组成和纠正免疫系统异常反应的能力,从而对宿主产生不同的有益作用。
植物乳杆菌ZJ316 在体外肠道模型中发挥了微生物群的调节作用,增加了Veillonella的生长,这可以提高人体呼吸系统和消化系统的免疫力。同时减少了 Blautia 的存在。
注:Blautia与肥胖儿童的肠道炎症有关。
此外,ZJ316 菌株减少了肠杆菌科,包括共生生物和原发性和机会性病原体。
注:这些病原体很容易在发炎的肠道中繁殖,从而导致微生物群失衡。
不同植物乳杆菌菌株对肠道菌群的影响
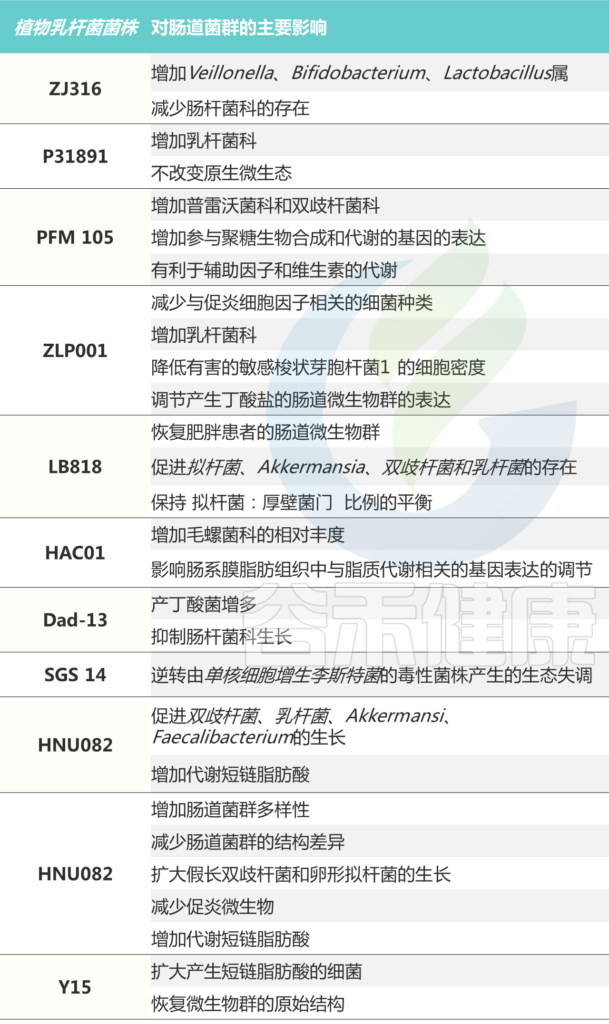
doi.org/10.1016/j.micres.2022.127289
更多关于植物乳杆菌的介绍详见:客观认识植物乳杆菌 (L. plantarum) 及其健康益处
随着全球肥胖流行病的恶化,代谢综合征的发病率急剧增加,比较容易患上心血管疾病和2型糖尿病。肠道微生物群的动态变化与代谢综合征的出现相关。
进一步研究肠道微生物群在代谢综合征中的因果作用 ↓↓↓
研究人员先前向患有代谢综合征的男性受试者输注了来自瘦健康供体的粪便微生物群。输注供体微生物群6周后,与自体FMT组相比,外周胰岛素敏感性随着丁酸产生菌的水平而增加。
在这些产生丁酸的细菌中,厌氧产丁酸菌在小肠中更为丰富,这表明其在通过丁酸产生调节胰岛素敏感性方面具有潜在作用。
由于胰岛素抵抗代谢综合征受试者的特点是产短链脂肪酸菌水平降低,口服丁酸盐可改善饮食诱导的肥胖小鼠的胰岛素抵抗和血脂异常。
因此研究人员得出结论,A.soehingenii可能是一种有前途的下一代益生菌,可改善胰岛素抵抗。
//
1996年,从婴儿粪便中分离出的A.soehngenii菌株L2-7,以前被命名为E.hallii,是一种严格厌氧、革兰氏阳性、过氧化氢酶阴性的Lachnospiracae科细菌。A.soehngenii菌是人类胃肠道核心菌群的一部分。与其他已知的丁酸盐生产物种(如Roseburia和Faecalibacterium spp.)不同,A.soehingenii有能力在乙酸盐存在下利用D-和L-乳酸盐。此外,基因组中含有胆汁酸钠共转运蛋白和胆碱水解酶基因,表明A.soehngenii 可以影响宿主胆汁酸代谢。
学习要点和方向
下一代益生菌的开发通常采用两种策略。
第一种方法是将特定菌株的存在与健康表型相关联,并探讨该菌株是否对疾病表型有因果影响。
迄今为止,已经使用测序技术确定了许多NGP候选株,以选择患病受试者中丰度耗尽的菌株或与FMT治疗成功相关的菌株。
第二种策略是采用具有良好特征的益生菌菌株,并对该菌株进行基因修饰,例如通过生物活性分子的生产和递送,从而赋予健康益处。
后一种方法将导致转基因生物(GMO)在世界各地受到特定法规的约束,如欧盟。
无论用于识别或生成NGP的策略如何,在体内研究任何健康益处之前,需要在体外充分表征候选菌株。
下图总结了除了菌株的基因分型和表型外,必须评估的最重要特征。
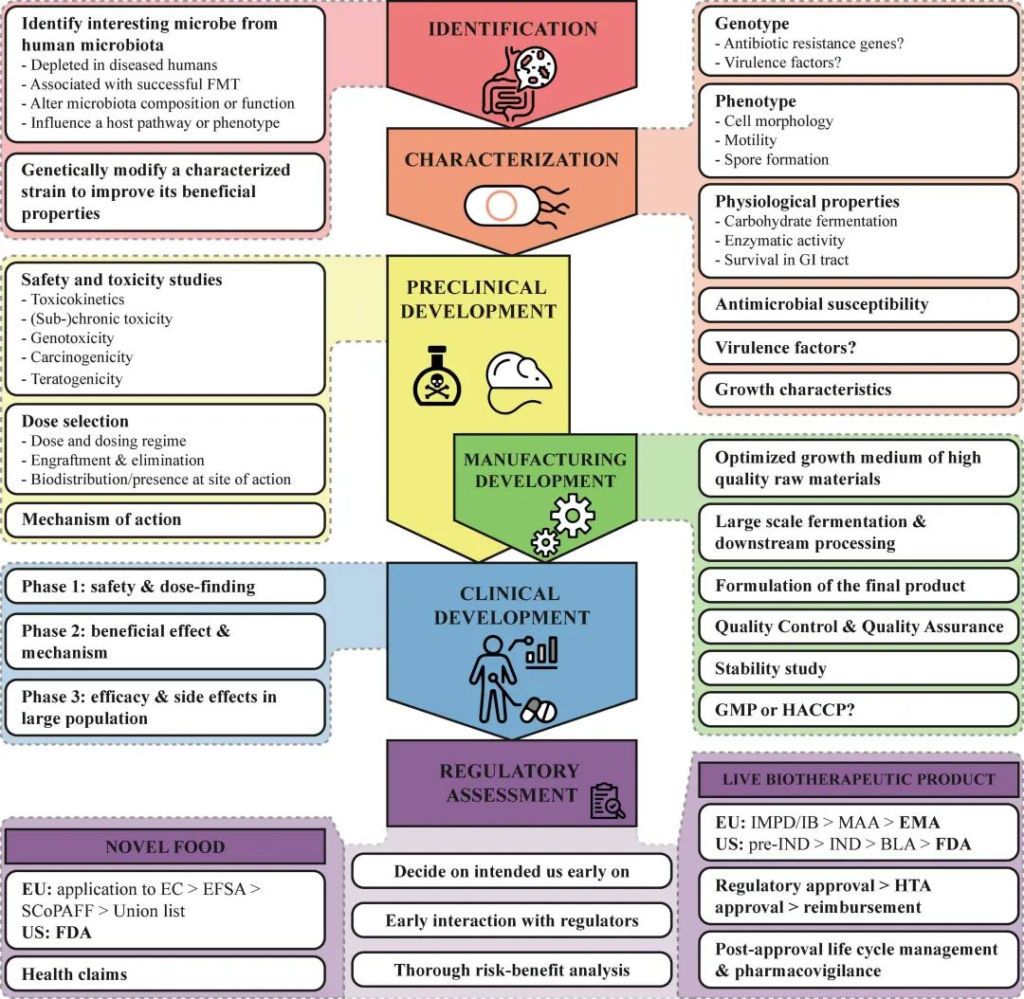
doi.org/10.3389/fmed.2022.1077275
此外,必须记录菌株的起源和随后的操纵或基因修饰。如果存在任何抗微生物耐药基因或毒力基因,则应评估人体微生物群向其他微生物传播的可能性,并采取措施减轻这种风险。
当下一代益生菌用于患有免疫抑制的上皮屏障损伤的患者时,应确定细菌易位的风险。彻底的菌株特征评估对于在健康或患病人群中使用NGP的潜在安全问题至关重要。
在对A.soehngenii进行体外测试后,研究人员转向动物模型,以评估该菌株对胰岛素敏感性的安全性和有效性。
首先,在厌氧条件下生产了一批临床前的A.soehngenii。
简而言之,培养物在厌氧条件下生长至指数阶段结束,通过厌氧离心浓缩,用磷酸盐缓冲盐水(PBS)洗涤,最后用10%甘油稀释至100μl的106、108和1010菌落形成单位(CFU)浓度。
通过16S rRNA测序和细胞形态学的显微评估来评估纯度。
通过最可能数(MPN)分析评估生存能力,并通过显微分析确认。样品直接储存在−80°C下,并在生产6个月内使用,在此期间生存能力稳定。
此外,其中一些样品在2年内进行了稳定性测试,以支持临床试验的产品开发。
接下来,研究人员在雄性糖尿病(db/db)小鼠中进行了一项剂量发现研究,以测试口服A.soehingeii对胰岛素敏感性和脂质代谢的安全性和有效性。
每天用A.soehingeii或安慰剂(10%甘油)治疗小鼠达4周,期间未观察到不良事件(正常生命体征)。在胰岛素耐受试验期间观察到胰岛素敏感性的显著改善,这在108CFU剂量下最强。这伴随着肝脏脂肪的减少和Fasn和Acc1基因的表达减少,两者都参与脂肪生成。
为了证实这些发现并进一步剖析A.soehingeii的治疗机制,Bäckhed教授的实验室对db/db小鼠进行了第二项研究。
用108 CFU的A.soehingeii或热灭活A.soehingeii处理小鼠4周。当体重保持不变时,在活跃的A.soehingeii治疗后观察到静息能量消耗增加。此外,与热灭活的A.soehingeii相比,活性A.Soehingeii增加了粪便丁酸水平,并改变了胆汁酸代谢。
这两项小鼠研究表明,用 A.soehingeii 进行治疗是安全的,并对代谢产生有益影响,这可能由丁酸盐的产生和胆汁酸代谢的变化介导。这些数据用于获得我们在人类中进行的临床研究的伦理批准。
最近,对A.soehingeii CH106(一种来自A.soehingeii 菌株L2-7T的四环素敏感衍生物)进行了毒理学安全性评估,表明以推荐剂量摄入是安全的。
根据欧洲食品安全局(EFSA)和美国食品和药物管理局(FDA)对新的不可吸收食品成分进行安全评估的要求,对A.soehingeii进行了遗传毒性和亚慢性毒性评估。细菌反向突变和体外哺乳动物细胞微核试验均未显示出遗传毒性作用。
此外,大鼠的90天亚慢性毒性没有发现与A.soehingeii 喂养相关的任何不良事件,即使在最高剂量(5×1011 CFU/kg体重/天)下,也没有发现超过人类建议每日摄入量100倍以上的不良事件。
这些研究结果支持口服A.soehingeii 作为食物补充剂是安全的。
学习要点和方向
在临床前开发期间,应提供足够的药理学和毒理学信息,以支持拟议的临床试验。
NGP的安全性和毒性研究具有挑战性↓↓
由于该产品通常不会到达全身循环,但其代谢产物或其活性可能直接或间接影响身体的生理功能,因此疗效和毒性不一定与剂量有关。
人体生理学和微生物群组成等其他因素可能会影响安全性和疗效。
由于大多数NGP与人类宿主(全生物概念)共同进化,很难将动物研究的结果转化为人类环境。
因此,强烈建议将体外、离体和体内模型结合起来,以建立适应预期人群风险的全球安全性概况。
通常根据经济合作与发展组织(OECD)的良好实验室规范(GLP)原则进行安全性和毒性研究。然而,由于需要创新的方法和模型(例如,人类胃肠道的人工模型),而这些方法和模型可能既无法验证,也无法在GLP水平上验证,因此这可能很困难。
对于食品成分和膳食补充剂,EFSA建议采用毒理学研究的分级方法。
该分级方法评估NGP的毒代动力学、遗传毒性、亚慢性和慢性毒性、致癌性和致畸性,平衡数据要求和风险。该方法也用于A.soehingeii CH106的毒理学安全性评估。如果NGP打算用作患病人群中的药物产品,则必须证明目标人群的安全性。
前面的图总结了必须解决的最重要的问题,例如治疗剂量和持续时间对毒性反应的影响,以及致畸、致癌和遗传毒性的可能性。
在能够口服 A. soehngenii 给人类之前,必须制造出适合临床试验的产品。
在独立伦理委员会批准时(2014年),A.soehngenii被视为益生菌,必须遵守荷兰“Warenwet”,这符合欧盟膳食补充剂法规。这意味着必须根据危害分析和关键控制点(HACCP)标准进行生产。可根据HACCP标准进行临床干预研究。
首先,为了大规模生产食品级产品,进一步优化了生长培养基。该组合物基于先前的经验:
(1)实验室化学物质转化为食品级来源
(2)仅使用无动物成分(无血红素或肉蛋白胨)
(3)复杂性降低(微量矿物质、维生素、碳源和有机酸的去除/减少)
(4)生物量产量进一步提高。原材料来源于经过审计的可靠供应商,以确保高质量。发酵前,在大型发酵罐系统中制备并消毒生长培养基,通过氮气(N2)冲洗使其完全厌氧。
发酵分四个连续步骤进行,如下图所示:
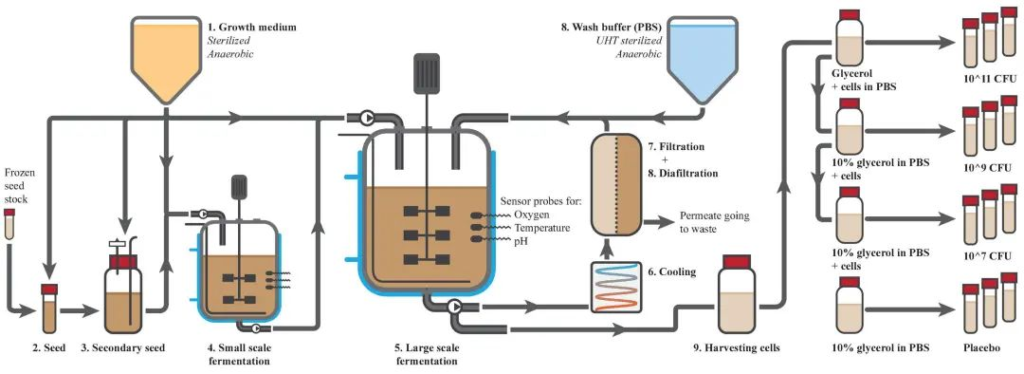
doi.org/10.3389/fmed.2022.1077275
首先,用精心准备的A.soehngenii 冷冻种子储备接种少量食品级培养基。动物研究中使用了相同的菌株,因此,该菌株具有良好的特性,是可行的、纯净的,没有任何细菌或病毒污染物。在37°C下发酵24小时后,使用培养物接种1 L培养基,再次发酵18小时。
然后,使用该二级种子培养物在小型发酵罐中接种30 L培养基。该发酵罐发酵17小时,作为大规模发酵的试车。
最后,用10L小发酵罐的接种物接种大发酵罐中的290L培养基。控制小型和大型发酵罐的温度、pH和氧气水平,并使用培养物的光密度(OD)确定发酵时间(14至18小时)。在大型发酵罐中发酵16小时后,A.soehngenii生长至OD约为10.
使用中空纤维膜(Koch膜系统;HF3043-25-43-PM500;HF3043-16-106-PM500)和PBS渗滤,浓缩并洗涤细胞。将发酵液冷却至10°C,泵送通过厌氧膜装置,并在3小时内浓缩至40–50 L。
在第二阶段进行渗滤以降低培养基成分和发酵产物的水平。使用超高温对洗涤缓冲液进行灭菌、脱气并直接添加到返回的细胞流中进入发酵罐。6小时后,将细胞浓缩约20倍至15升,99.8%的培养基化合物被丢弃成废物,最终浓缩物中只剩下2.9%的培养基组分。
最后,可将9L产品从系统中收获到10L的无菌N2冲洗容器中。
为临床研究生产了四个不同的批次,包括600个试管和一个安慰剂批次,其中PBS中含有浓度为106、108和1010 CFU/mL的10mL A.soehngenii,PBS+10%甘油,PBS中只有10%甘油。
对于每一批,用甘油和PBS制备7L瓶用于进一步稀释,将其高压灭菌、冷却并用N2冲洗。从9L收获的浓缩液中,向这些瓶中加入必要的体积以获得正确的浓度。在连续搅拌和N2冲洗下,将瓶子置于冰上。
首先用N2填充10mL管,然后用定量管泵填充10mL产品。立即关闭试管,贴上标签,并在灌装后10分钟内将其置于−30°C的冰箱中。所有填充均在消毒层流柜内进行。
在制造过程中,持续监测温度、pH值和氧气水平。此外,在过程中的每一步都测定了细胞计数和OD,以及是否存在任何污染物。由于厌氧菌很难在琼脂平板上定量计数,因此在厌氧条件下进行MPN分析以获得活细胞的数量,并用显微镜评估细胞形态。所有上述质量控制均针对符合人类消费标准的包装小瓶进行。
Anaerobutyricum soehingeii 中间体和最终产品规范

doi.org/10.3389/fmed.2022.1077275
随后,每6个月测试生产的小瓶的稳定性。生产完成后,这些小瓶的“保质期”为6个月,这是荷兰法律要求的食品。如果满足生存能力和纯度标准,有机会延长小瓶的有效期。
下表显示了在3年时间段内具有最高剂量 A. soehngenii 的小瓶的效力和纯度。
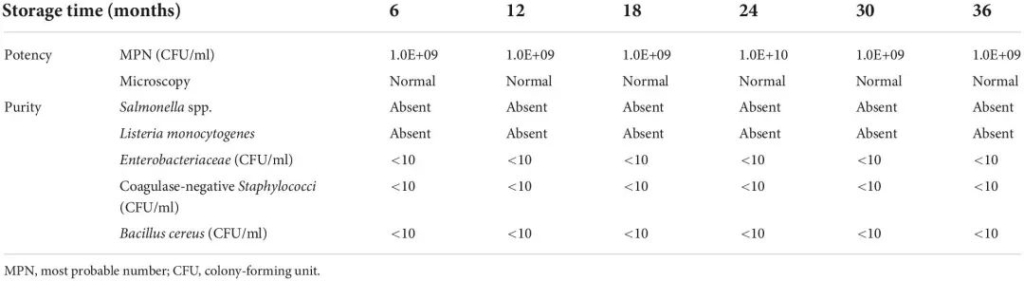
doi.org/10.3389/fmed.2022.1077275
学习要点和方向
▸ 工业规模生产是技术挑战
与实验室规模培养相比,以工业规模生产菌株对菌株和培养基的要求不同。因此,当一种菌株符合潜在NGP的条件时,应采取措施,看看该菌株是否可以在工业规模上培养。
培养NGPs所需的严格条件是技术挑战之一,例如需要特定的营养、缺氧、稳定的温度和合适的pH。此外,更长的保持时间、泵送的绝对压力、下游净化过程和储存可能会对细菌细胞的生存能力产生负面影响。
▸ 将菌株加入产品后需要有效策略,将其输送到作用部位
接下来,必须将菌株加入产品中,如胶囊、粉末或液体悬浮液。由于大多数NGP是严格的厌氧菌或兼性厌氧菌,因此应尽量减少接触氧气。为此,应降低容器中的氧气渗透性,并可添加抗氧化剂以降低氧化还原电位。
摄入产品后,NGP必须在胃肠道的恶劣环境中生存。肠溶胶囊和微胶囊是保护细菌并将其运送至其作用部位的有效策略。
▸ 有效期之前,足够量的递送剂量
最终,制造需要产生一种强健、稳定的产品,该产品将允许在有效期之前以足够数量的NGP递送有效剂量。
▸ 质量控制和质量保证计划需要到位
对于医药产品或LBP,需要按照良好生产规范(GMP)进行生产。对于食品和膳食补充剂,HACCP认证工厂的生产是标准。无论如何,质量控制和质量保证计划需要到位,以确保成分和最终产品的一致质量,并确保可靠的生产过程。
应从所用原材料、细胞库系统、细胞生长和收获、纯化和下游加工到过程中测试,应清楚记录菌株的制造过程。
▸ 彻底描述最终产品的制造
同样,必须彻底描述最终产品的制造,包括生产记录和配方、填充、标签和包装说明。对于菌株和产品制造,必须评估与同一房间或同一接触设备生产的其他产品交叉污染的风险。
▸ 必须描述菌株和产品的规格
包括采样程序和验证测试方法的说明。这些规范应描述身份、效力、纯度、污染、外观,如果适用,还应描述活细胞百分比、颗粒物、热原、pH和残留水分的附加测试。
▸ 必须生成稳定性数据
证明产品在计划的使用期限内,在效力和污染方面是稳定的。
对于冷冻产品,应评估多次冻融循环的影响,而对于冻干产品,应探讨重构后的保质期。
▸ 需要评估该产品对环境的影响
特别是当该菌株经过基因修饰、致病、生态上比野生型更适合或难以根除时。
为了验证人类环境中的小鼠数据,研究人员建立了一项单盲、I期/II期剂量递增试验,以确定Anaerobutyricum soehingeii 在肥胖、胰岛素抵抗受试者中的安全性和有效性。
在这项研究中,27名患有代谢综合征的肥胖高加索男性被纳入并分配接受soehngenii,剂量为107、109或1011个细胞/天,持续28天。
当受试者对其各自的治疗剂量进行盲测时,前9名受试者必须在剂量增加到更高浓度之前成功完成最低剂量的研究方案。
受试者在家中的−20°C温度下储存冷冻瓶,每天解冻一个10mL瓶,与100mL牛奶混合并口服。添加牛奶以增加胃中的pH值,从而在胃肠道通过期间保护活细胞。主要结果是安全性,此外,治疗4周后评估了对胰岛素敏感性和脂解的影响。
使用高达1011个细胞/天的A.soehngenii治疗耐受性良好,无任何严重不良事件。
当所有治疗组合并时,A.soehngenii 的粪便丰度与改善的外周胰岛素敏感性相关,并伴有胆汁酸分布的有益变化。
出乎意料的是,没有观察到粪便丁酸盐水平的增加,这可以通过短链脂肪酸的挥发性和化验的检测限来解释,这使得丁酸盐难以测量。
A.soehngenii 丰度的增加是短暂的,大多数在停止后2周消失。给药菌株的生存能力受到胃酸和氧气的负面影响。
然而,如接受最高剂量的受试者粪便中的最高复制信号所示,A.soehngenii部分能够在胃肠道中存活。通过包封和/或冷冻干燥更好地保护菌株免受酸性和含氧环境的影响,可以进一步提高生存能力(和治疗效果)。
为了进一步阐明A.soehngenii在人体中的作用模式,进行了一项随机安慰剂对照交叉试验,在该试验中,直接在十二指肠中施用该菌株,从而避免胃酸并减少氧气暴露。
由于小肠在葡萄糖增敏、调节胰岛素敏感性/分泌和葡萄糖稳态中起着核心作用,因此假设十二指肠直接输注A.soehngenii 可以进一步提高治疗效果。
同样,患有代谢综合征(N=12)的肥胖受试者被纳入并随机接受单次鼻十二指肠输注,输注最高剂量的A.soehngenii(1011个细胞)或安慰剂(PBS中的10%甘油)。6小时后,进行十二指肠活检和混合膳食试验。
此外,受试者监测了24小时血糖,并收集了一些粪便样本。经过4周的冲洗期后,受试者转为另一个治疗组,在第一次试验中,该治疗组被确定为足够长的时间来减轻压力。
再次,这项研究表明,A.soehngenii 的给药安全且耐受性良好。该菌株的治疗增加了促胰岛素激素胰高血糖素样肽1(GLP-1)的餐后漂移,伴随着葡萄糖变异性的降低。
鉴于A.soehngenii 具有产生丁酸盐的能力,并且在A.soehngenii处理后,粪便中的丁酸盐水平趋于较高,GLP-1分泌增加可能是丁酸盐激活肠L细胞上的G蛋白偶联受体43(GPR43)的结果。
由于A.soehngenii表达胆汁酸钠共转运蛋白和胆汁酸水解酶,并且二级胆汁酸的血浆水平升高,GLP-1表达增加也可能是TGR5被二级胆汁酸类激活的结果。
注:TGR5是G蛋白偶联受体超家族成员,TGR5不仅是胆汁酸受体,也是多种选择性合成激动剂的受体,调节不同信号通路的衍生物。参与能量稳态、胆汁酸平衡及葡萄糖代谢。
此外,用A.soehingeii治疗导致十二指肠核法尼素X受体(FXR)及其靶基因OSTa的表达降低,这也可能是GLP-1可用性增加的原因。
最后,葡萄糖变异性的改善可以通过GLP-1和丁酸盐的胰岛素增敏作用来解释。
此外,A.soehingeii改变了73个基因的十二指肠转录,最显著的是诱导REG1B和REG1A的表达,后者编码生成胰岛衍生蛋白1A/B。
注:Reg1A和Reg1B在肠隐窝底部的Paneth细胞中强烈表达,在管腔中分泌,可能通过诱导祖细胞或L细胞增生局部发挥作用。
此外,发现REG1B的诱导与施用A.soehngenii后24小时GLP-1分泌增加和葡萄糖变异性降低相关。单剂量A.soehingeii 的治疗不会影响微生物群的组成或多样性,正如之前的研究中所见。
此外,粪便A.soehngenii的丰度没有随时间变化,排除了交叉时微生物群介导的遗留效应。
学习要点和方向
第一次临床研究的主要目的是确定安全性,并根据产品的耐受性确定适当的剂量范围和方案。这包括确定最小有效剂量或最佳有效剂量范围,如果可能,还包括最大安全剂量。
除给药外,重点应是获取安全数据,以识别常见的产品相关不良事件。这些早期临床研究通常在健康志愿者中进行,但纳入患者可能更合适,例如当NGP应纠正生物失调时。应考虑确保研究参与者安全的风险缓解措施,如连续入组、剂量递增和独立数据监测委员会的监测。
此外,监测易位、炎症和感染以及确定NGP的持久性及其在最终给药后的作用是有利的。
重要的是考虑影响微生物群功能或组成的其他混杂因素,如年龄、饮食、生活方式和环境因素。在这方面,采用安慰剂对照交叉设计的研究非常有用,因为它们可以限制这种外在和内在混杂因素的影响,从而允许更小的样本量。不用说,盲板非常重要,应仔细考虑冲洗期。
越来越多地,基线微生物群组成也被纳入筛选标准,例如寻找特定肠道类型中特定细菌群的存在或集群。这将导致更具可比性的研究组,并且当特定的菌群参与作用机制时,可以优化干预的效果。
根据粮农组织和世界卫生组织对益生菌的定义,益生菌可分为膳食补充剂和药物,但两者在监管上存在着巨大的差异。同样,含下一代益生菌的产品可以作为食品、膳食补充剂或药物进入市场,具体取决于预期用途。
在欧盟,食品由欧洲食品安全局监管,药品由欧洲药品管理局监管,而在美国,食品和药物管理局负责这两类产品。当预期用途与预防、缓解或治疗疾病有关时,该产品将被视为医疗产品或医疗器械。
与增强生理功能或降低疾病风险因素有关的口服摄入产品可被归类为功能性食品或食品补充剂。此外,具有纯美容功能的局部应用产品可被评定为化妆品。为了确保法规遵从性,在临床前研究和制造之前,必须决定缩进的用途和随后的法规分类。
在欧盟,“食品” 被定义为“任何物质或产品,无论是加工的、部分加工的还是未加工的,旨在或合理预期被人类摄入”。根据标签、展示和广告的一般要求和规定,对每一类进行了相应的管理。
当NGP被用作食品或膳食补充剂时,它们很可能被认为是一种新型食品。然而,如果NGP经过了基因改造,它将作为转基因食品受到监管。为了使NGP作为一种新型食品进入市场,它需要获得授权并列入欧盟名单。
最重要的条件之一是NGP不会对人类健康造成风险,这必须得到科学证据的支持。这包括一项综合风险评估,结合预期人类接触的生物和毒理学研究,评估对人类健康的潜在风险。此外,申请应包含NGP、制造工艺、产品成分、使用的分析方法、标签和预期用途条件的详细说明。
除安全性外,该产品不得促进食品链或环境中抗微生物耐药性的传播,需要对抗微生物耐药性进行表型和基因型评估。
即使“含有益生菌/益生元”的声明在欧盟也被视为健康声明。为了接受健康声明,需要对NGP进行适当的描述,并通过高质量的研究证明其对健康有益的影响和因果关系。
自2012年和2019年以来,FDA和EDQM明确了LBP的质量要求,其中LBP被描述为含有供人类使用的活微生物的医药产品。除这些质量要求外,目前没有具体的LBP法规。
然而,由于LBP含有活微生物,它们被视为生物医药产品,因此必须遵守立法和监管框架。如果没有特定的LBP子类别,开发商将不得不依赖其他子类别生物医药产品的监管概念。
其中一个概念是基于从临床前和临床研究中获得的质量、安全性和疗效数据进行彻底的风险效益分析。
临床前和临床研究设计的其他相关指南包括:
迄今为止,没有LBP进入欧盟市场,这部分是由于缺乏明确的监管框架。在缺乏明确指导方针的情况下,尽早与主管当局进行互动,以讨论不确定性和减少风险的重要性。
随着对我们肠道微生物群的了解越来越多,将发现和开发越来越多的潜在下一代益生菌。本文以A.soehingeii为例,介绍了将其开发为下一代益生菌的经验。
重要的是,这些新菌株具有良好的特性、高质量和安全性。对NGPs进行彻底的安全评估非常重要(虽然很复杂),特别是因为疗效和毒性不一定与剂量有关。
由于这个领域相对稚嫩,目前还没有具体的LBP监管,因此在开发的早期阶段与监管机构进行沟通有助于降低风险并澄清任何不确定性。这需要在开发初期对市场(食品或药品)的路线有明确的看法。
在FMT干预后,A.soehingeii 这种微生物被确定为潜在的有益微生物,在临床前的体外和体内研究以及人类研究中都显示出很有前景的结果。它在改善胰岛素敏感性、增加GLP-1分泌和降低葡萄糖变异性方面显示出良好的效果。
这些效应可能通过丁酸和次生胆汁酸的产生介导。通过更好地保护菌株免受酸性和含氧环境的影响,例如通过冷冻干燥和封装,可以潜在地提高生存能力,从而提高治疗效果。
主要参考文献:Wortelboer K, Koopen AM, Herrema H, de Vos WM, Nieuwdorp M, Kemper EM. From fecal microbiota transplantation toward next-generation beneficial microbes: The case of Anaerobutyricum soehngenii. Front Med (Lausanne). 2022 Dec 5;9:1077275.
Kumari M, Singh P, Nataraj BH, Kokkiligadda A, Naithani H, Azmal Ali S, Behare PV, Nagpal R. Fostering next-generation probiotics in human gut by targeted dietary modulation: An emerging perspective. Food Res Int. 2021 Dec;150(Pt A):110716.
Echegaray N, Yilmaz B, Sharma H, Kumar M, Pateiro M, Ozogul F, Lorenzo JM. A novel approach to Lactiplantibacillus plantarum: From probiotic properties to the omics insights. Microbiol Res. 2022 Dec 22;268:127289.
Garcia-Gonzalez N, Battista N, Prete R, Corsetti A. Health-Promoting Role of Lactiplantibacillus plantarum Isolated from Fermented Foods. Microorganisms. 2021 Feb 10;9(2):349.
Seegers JFML, Gül IS, Hofkens S, Brosel S, Schreib G, Brenke J, Donath C, de Vos WM. Toxicological safety evaluation of live Anaerobutyricum soehngenii strain CH106. J Appl Toxicol. 2022 Feb;42(2):244-257.
谷禾健康
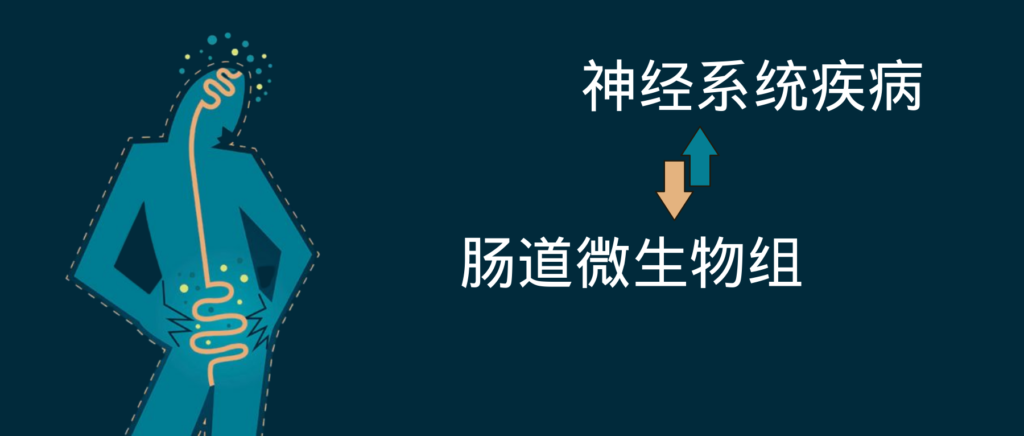
你知道肠道和大脑之间的秘密吗?
大脑自闭了,为什么是肠道的锅?
肠道真的会影响大脑嘛,原理是啥?
……
已经有越来越多人开始好奇肠道和大脑之间的联系,关于这方面的前沿研究也在不断更新,人们开始逐渐深入了解相关机制。

中枢神经系统功能与肠道微生物之间存在关联,即大脑和肠道之间的串扰,与迷走神经、肠神经系统、免疫系统和循环相互作用。胃肠道微生物群可以影响神经系统,无论是通过迷走神经直接输入大脑,还是通过间接激活整个胃肠道的肠神经系统。
以下是我们整理过相对较全面的关于肠道和神经系统相关的文章:
深度解读 | 肠道菌群和中枢神经系统的关系
肠道微生物群在神经系统疾病中的作用
本文在这个基础上,结合最新研究进展,再次阐述人类肠道微生物组在神经系统疾病发病机制中的潜在作用,讨论了精神药物、益生菌、益生元、合生元、后生元、粪菌移植等方式治疗神经系统疾病的潜在作用。

大家越来越有这样的认知:胃肠道微生物群的不平衡会影响大脑的生理、认知和行为。
肠道微生物群通过神经、免疫、体液和内分泌联系参与肠-脑双向相互作用。我们先来了解一下以下它们之间几种“交流方式”:
肠道主要通过两条神经解剖学途径与大脑进行沟通。
首先,大脑和肠道直接通过迷走神经(VN)和脊髓中的自主神经系统(ANS)进行沟通。
其次,细菌通过迷走神经和肠神经系统传入神经元的刺激在大脑和胃肠道微生物群之间建立直接的神经联系。
此外,迷走神经激活表现出抗炎作用,迷走神经活动对肠道微生物群及有益菌的产生积极影响。
迷走神经可以将胃肠道中的内分泌、神经元和微生物改变转移到大脑。
几项临床前研究表明,肠道疾病的病理生理学和发病机制,包括炎症性肠病(IBD)和肠易激综合征(IBS),以及神经系统疾病和精神疾病,包括焦虑、抑郁、自闭症、阿尔茨海默、多发性硬化和帕金森病,与肠道微生物群失衡有关。
由于微生物群-肠-脑轴(MGBA)内存在多种相互作用机制,胃肠道微生物组主要通过免疫相关、神经、内分泌和代谢信号通路与中枢神经系统进行通信。
肠道微生物可通过在肠腔中产生大量代谢物与宿主交换感官信息,包括神经递质、GABA、血清素、多巴胺和去甲肾上腺素,激素(如下丘脑-垂体-肾上腺轴中促肾上腺皮质激素释放激素的分泌)、组胺、乙酰胆碱、儿茶酚胺,以及几种维生素和短链脂肪酸。其中一些分子可以通过血脑屏障进入大脑,并影响神经回路。在这些代谢物中,短链脂肪酸是结肠细菌发酵膳食纤维产生的主要代谢物,在调节神经免疫内分泌、代谢稳态、感染和炎症方面发挥着关键作用。
许多种类的乳酸杆菌和双歧杆菌产生γ-氨基丁酸(GABA),这是大脑中主要的抑制性神经递质。
念珠菌、大肠杆菌和肠球菌会产生神经递质5-羟色胺,而一些芽孢杆菌会产生多巴胺。
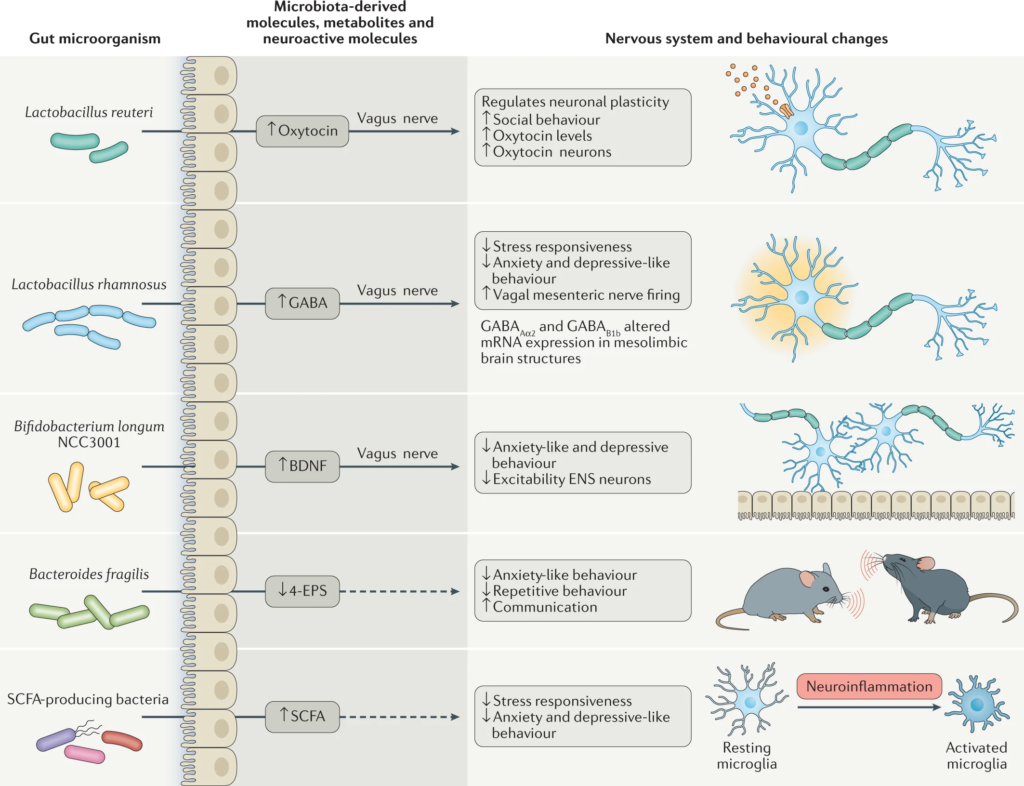
Morais LH, et al. Nat Rev Microbiol. 2021.
微生物群代谢产物,包括维生素、神经活性代谢物(如短链脂肪酸)和神经递质,介导双向微生物群-肠-脑轴相互作用以调节宿主神经生理学和免疫。
微生物代谢产物——短链脂肪酸,如乙酸、丙酸、丁酸,也可以通过进入体循环影响中枢神经系统。
短链脂肪酸能够刺激交感神经系统,粘膜血清素的释放,从而影响大脑的记忆或学习过程。
大约95%血清素(5-羟色胺)由肠粘膜嗜铬细胞产生。在外周,5-羟色胺参与Gl分泌、运动(平滑肌收缩和放松)和疼痛感知的调节,而在大脑中,5-羟色胺参与情绪和认知的调节。
肠道微生物群在色氨酸代谢中也起着重要作用,色氨酸代谢是产生5-羟色胺的前体。例如,婴儿双歧杆菌通过增加血浆色氨酸影响中枢5-羟色胺的传递。
我们知道了以上化学信使,那么它们通过什么途径去发挥作用?
细菌神经活性代谢物和饮食分子可以通过多种方式改变大脑和行为,例如影响上皮细胞以影响上皮屏障的功能,肠内分泌细胞释放激素,通过树突状细胞调节小胶质细胞和免疫细胞的功能。
代谢产物在通过血脑屏障运输后直接影响,或通过神经内分泌、免疫或迷走神经途径间接影响。
血脑屏障
细菌可以直接将因子释放到体循环中或可以转移到血液中。一旦进入血液,微生物组及其因子可以改变外周免疫细胞,促进与血脑屏障的相互作用,并最终与神经血管单元的其他元素相互作用。菌群代谢产物,例如短链脂肪酸,可穿过血脑屏障以影响脑功能。
肠道屏障
肠道微生物群还可以影响肠道屏障的完整性,控制信号分子从肠腔到固有层(包含免疫细胞和ENS神经元末端)或门静脉循环的通道。肠道屏障的完整性在某些神经精神疾病中会被破坏,如焦虑症、自闭症谱系障碍和抑郁症。
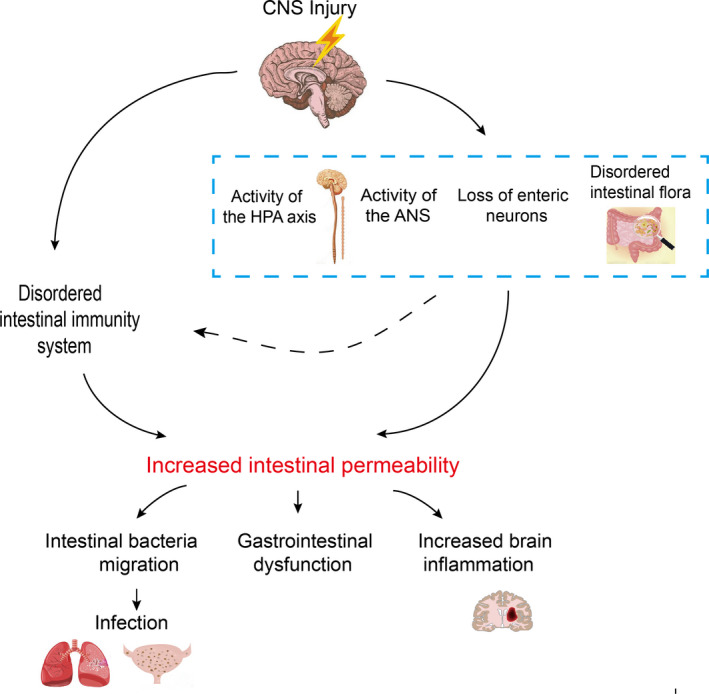
Li XJ,et al., CNS Neurosci Ther. 2020
肠道通透性
慢性应激可改变肠道通透性(肠漏综合征),这与低度炎症有关,在功能上与抑郁症等精神疾病有关。
在许多情况下,循环中细菌内毒素(脂多糖,LPS)的增加是导致疾病的基本危险因素。
肠道屏障和肠道通透性区别:
肠屏障
是将肠腔与内部宿主分开的功能实体,由机械元件(粘液、上皮层)、体液元件(防御素、IgA)、免疫元件(淋巴细胞、先天免疫细胞)、肌肉和神经元件组成
肠道通透性
指给定部位肠道屏障的功能特征,可通过分析整个肠壁或跨壁成分的定义分子的通量率进行测量
神经内分泌(HPA轴)
在神经系统内,应激是如何激活HPA轴反应?
该反应涉及下丘脑神经元,该神经元向大脑或门静脉循环分泌激素,如促肾上腺皮质激素受体激素(CRH),触发促肾上腺皮质激素(ACTH)的释放,然后启动皮质醇的合成和释放。
皮质醇调节神经免疫信号反应,进而影响肠屏障的完整性。
肠道渗漏导致促炎状态,循环中TNF-A、干扰素-y和IL-6水平升高。已知IL-6激活HPA轴。
随着时间的推移,它也下调糖皮质激素受体。这些受体是抑制HPA轴的反馈机制,然而,它们的下调导致HPA轴过度活跃和过度敏感。
有研究表明,这些变化导致海马5-羟色胺的减少以及BDNF表达的减少。BDNF表达降低是抑郁症发病的危险因素。
应激激素、免疫介质和CNS神经递质可激活肠神经系统的神经细胞和迷走神经的传入通路,从而改变肠道环境和微生物群组成。
目前,已经表明胃肠道微生物群在发展大脑免疫和神经发育中起着核心作用。
大脑并非免疫“特权”器官
免疫系统和中枢神经系统都是复杂而有组织的系统,在运作模式和发育过程中具有共同的特征。大脑中可以产生参与先天免疫的分子,如Toll样受体(TLR)、细胞因子、以及适应性免疫相关分子,如抗体受体和主要组织相容性复合体(MHC),这些分子在脑发育中起着关键的调节作用。
脑膜淋巴细胞和血脑屏障
尽管以前认为大脑是一个免疫特权器官,但它包含脑膜淋巴管。脑膜中淋巴管的存在使我们能够深入了解中枢神经外周免疫系统之间的可能联系,从而影响自身免疫。
此外,淋巴细胞和小胶质细胞可以调节认知,对神经元回路的正确连接也是必不可少的。小胶质细胞是巨噬细胞,占所有神经细胞的10%。它们负责中枢神经系统主动免疫防御的基本作用。而且大脑大部分区域的血管系统发展出选择性血脑屏障的组织特异性,允许所需分子进入大脑,并限制潜在有毒物质或细胞的渗透。
免疫影响大脑和神经
免疫细胞具有渗透大脑的能力。浸润性免疫细胞或小胶质细胞能够与中枢神经系统有效地相互作用,并影响大脑功能和病理学。
小胶质细胞从胚胎祖细胞中出现,并可在中枢神经系统中经历自我更新的过程。它们不仅参与典型的免疫功能,如吞噬和抗原递呈,还参与一些大脑生理活动。
免疫细胞如中性粒细胞、巨噬细胞、T细胞和自然杀伤(NK)细胞从大脑的外周循环血液进入。小胶质细胞对行为和某些神经系统疾病有着巨大的影响,如神经退行性疾病。
通常,成人大脑神经发生受宿主肠道微生物群的影响。成年小鼠的抗生素治疗影响肠道微生物群的多样性和海马的神经发生,而且益生菌具有重建肠道微生物群的能力并显示神经发生改善。
菌群与免疫
最近的许多研究表明肠道微生物组与大脑以及肠道微生物组与免疫系统调节之间存在联系。对无菌和对照啮齿动物的研究表明,肠道微生物组的缺失会加剧焦虑样行为。此外,如果肠道微生物群在生命早期恢复,这种行为完全可以治愈。微生物代谢产物可通过血液循环转移到大脑,并影响迷走神经或免疫系统和炎症反应,这表明由于生态失调引起的微生物代谢紊乱可对焦虑相关疾病产生巨大影响。
菌群招募免疫细胞
肠道微生物群落通过在各种免疫条件下招募不同的免疫细胞,直接或间接调节肠道内的免疫反应。胃肠道微生物的动态和异质性特征是宿主体内平衡的基础。据报道,与野生型小鼠相比,以胃肠道淋巴细胞水平降低为特征的免疫系统发育不平衡减少了无菌小鼠中免疫球蛋白a(IgA)、抗菌肽(AMP)和未成熟肠道相关淋巴组织(GALT)的数量,强调胃肠道微生物组在宿主免疫形成中的重要作用。
病原识别和抗体反应
此外,肠道免疫系统在区分共生动物和病原体以及确定导致免疫耐受的因素方面至关重要。因此,肠道菌群可以调节免疫系统的发育和功能,形成肠道微生物群落并调节肠道粘膜表面的病原体。例如,据报道,无菌小鼠中辅助性T细胞1(Th1)和Th17细胞数量的减少,以及IL-22和IL-17的减少,导致固有层数量减少。
影响T和B细胞发育和反应
肠道微生物组影响肠道T和B细胞反应的诱导和发展。肠道微生物群在肠道CD81 T淋巴细胞的激活中起着重要作用。
胃肠道微生物组影响固有层处肠道驻留B淋巴细胞的发育,因为无菌小鼠的固有层处B细胞计数较低。此外,这种类型的细胞也能够产生IgA,作为微生物成分的强调节因子。这表明在促进对共生微生物的免疫耐受以及在固有层中实现IgA的广泛多样化方面具有突出作用。
菌群代谢物参与免疫
对短链脂肪酸的研究表明,除了增强肠道系统中调节性T淋巴细胞的功能和数量外,它们还可以通过抑制转录因子NF-kB和HDAC活性来促进抗炎作用和肠道屏障功能。微生物肠道菌群与芳香烃受体(AhR)结合产生的色氨酸衍生物影响肠道免疫系统的功能。肠道菌群可产生精氨酸衍生物,包括二胺、精胺、亚精胺和多胺,通过增强常驻免疫细胞和肠粘膜的内环境平衡来调节免疫反应 。
微生物群与大脑之间通过肠脑轴的分子通讯途径
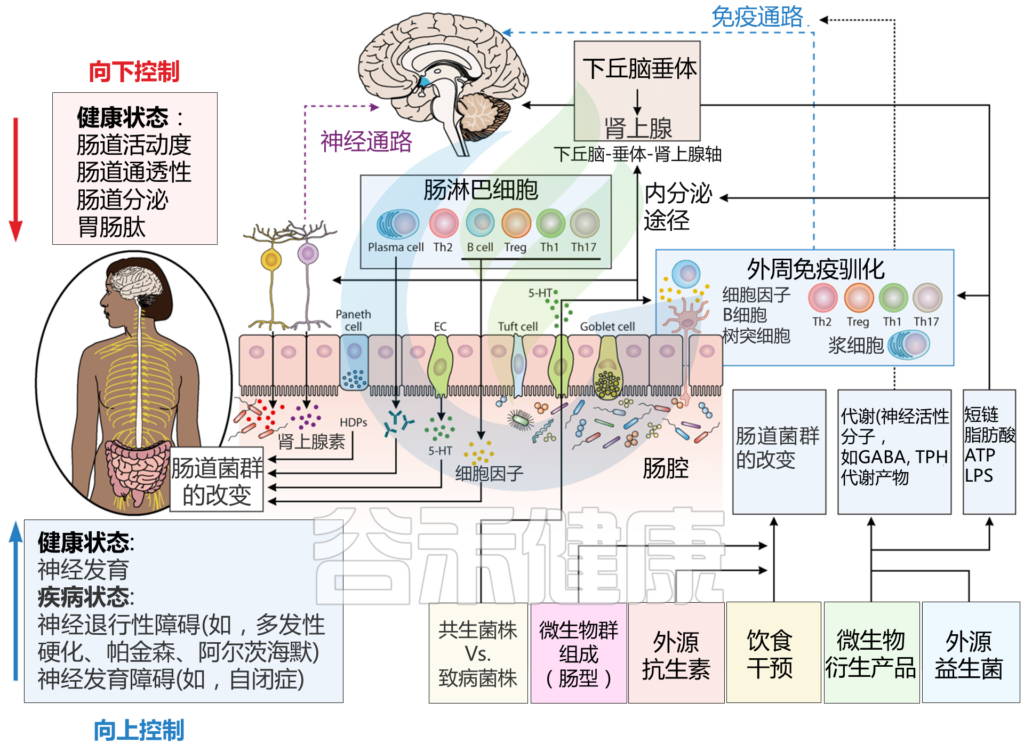
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠神经系统在人的一生中经历了一个巨大的发育变化,同时在病理生理功能方面保持了灵活性。因此,随着年龄的增长,肠神经系统开始衰弱,宿主微生物群、免疫系统和生理学也开始衰弱。
注:肠道神经系统是周围神经系统中最复杂、最重要的部分之一,由小神经节和神经元组成。这些神经元分布在整个胃肠道膜。
在了解菌群与神经衰退之前,首先看一下菌群与神经发育的关系。
大脑发育是一个复杂的过程,通常从妊娠第三周开始,一直持续到青春期晚期,生命的前3年被认为是胃肠道微生物群和脑突触形成的中心时期。
对无菌(GF)小鼠模型的研究表明,胃肠道微生物群、行为表现和大脑功能之间存在相关性。应激反应比无特定病原体(SPF)小鼠强烈得多。据报道,无菌小鼠模型中突触形成标记物水平的降低,包括分别负责突触成熟的突触素和PSD95,突出了共生细菌在大脑发育中的重要性。基于这些结果,肠道菌群似乎在大脑发育过程中对神经网络的形成起着核心作用。
部分自闭症患者表现出慢性便秘、肠道通透性增高、腹痛和肠道微生物群紊乱的症状,从而提供了生态失调和神经发育障碍之间的可能联系。微生物从母亲转移到胎儿、分娩方式、抗生素暴露和饮食习惯都会改变婴儿微生物群的定植和成熟。
怀孕期间补充抗生素会导致母体和新生儿肠道菌群的破坏,随后运动活动的减少,以及新生儿行为的改变。因此,临床证据支持抗生素诱导的失调与几种神经发育障碍的发展相关,包括精神分裂症、抑郁症和双相障碍。
尽管需要更多的研究来阐明上述因素与神经发育障碍之间的分子联系,但操纵早期生命微生物群可以被认为是预防自闭症和其他神经疾病的有益手段。
肠神经系统是否随年龄增长而变化?
一些研究认为随着年龄的增长,肌间神经元的数量和功能都会减少,而其他研究则没有报道这种后果。因此,肠神经系统是否会随着年龄的增长而发生变化仍在激烈争论中。
肠神经系统随年龄变化的研究表明,肠神经节的形态发生了变化,变性神经纤维的识别,α-突触核蛋白(α-syn)和脂褐素积累。这些报告表明老化和肠神经系统退化之间存在相关性。
肠神经系统在肠道细胞活动、营养吸收和肠道激素分泌中具有重要作用。针对肠神经系统的研究虽多,但机制不明确。根据以上研究证据,有理由假设肠神经系统发生了退化性变化,与宿主生理学、代谢、微生物群以及与衰老相关的免疫系统的变化相一致。
考虑到肠神经系统细胞不同的功能和形态特征,不同的细胞类型在年龄相关疾病的易感性中起主要作用。代谢活跃的神经细胞中氧化DNA损伤和活性氧(ROS)产生的负担可能是肠神经系统衰老的另一个潜在因素。
根据强调在老年动物模型中降低钙结合蛋白表达的重要性的研究,钙失调也可被认为与肠神经系统衰老有关。也有报道称,在衰老过程中,肠神经细胞中的钠通道基因表达显著改变。
对肠神经系统的年龄相关影响的额外研究是必要的,可能有助于对这些复杂的衰老和胃肠道关联的新理解,也可能带来新机会,发现治疗各种年龄相关神经疾病的新治疗方法,以及改善老年人的生活质量。
肠道微生物群与肠神经系统
考虑到胃肠道肠道神经元附近定植的微生物,肠神经系统似乎与肠道微生物群高度相关或可能受其影响。
几项研究表明,新生儿肠神经系统的发育是由早期暴露于肠道常驻微生物形成的。此外,肠道微生物群可以调节神经胶质细胞对固有层的初始定植以及稳态。
随着年龄的增长,拟杆菌和变形杆菌(尤其是Gammaproteobacteria)数量增加,厚壁菌和双歧杆菌数量显著减少。
与衰老过程中肠道微生物群的实质性变化类似,成人肠道神经元对年龄相关损伤的敏感性更高。肠道微生物群平衡的改变,包括条件致病菌的增加和有益菌或共生菌的减少,可导致胃肠道的不同微生物代谢产物谱。
因此,由肠道菌群的年龄相关改变引起的肠道炎症水平升高会影响肠神经系统,并导致肠道神经元不同生理和神经化学功能的损害或丧失,从而导致年龄相关疾病的发生。
肠神经系统还可以调节肠道微生物群落组成,维持和促进肠道健康。此外,肠道微生物群落的缺失可导致肠神经系统功能的异常和改变。
也有研究表明,肠道失调和肠道病理的发展与胃肠动力紊乱相关,表明肠神经系统在肠道微生物群维持和预防可导致宿主疾病的病原菌过度生长中的重要作用。
尽管确切的机制仍需澄清,但从肠-脑轴和老年人群神经病变的角度来看,肠道微生物群、粘膜免疫系统、肠道神经元和肠上皮细胞之间复杂的相互作用和相互作用强调了该领域研究的重要性,并强调了进一步研究的必要性。
胃肠道菌群和神经-肠内分泌系统中与年龄相关的变化可能通过肠-脑信号通路功能障碍影响大脑健康的分子通路图如下。
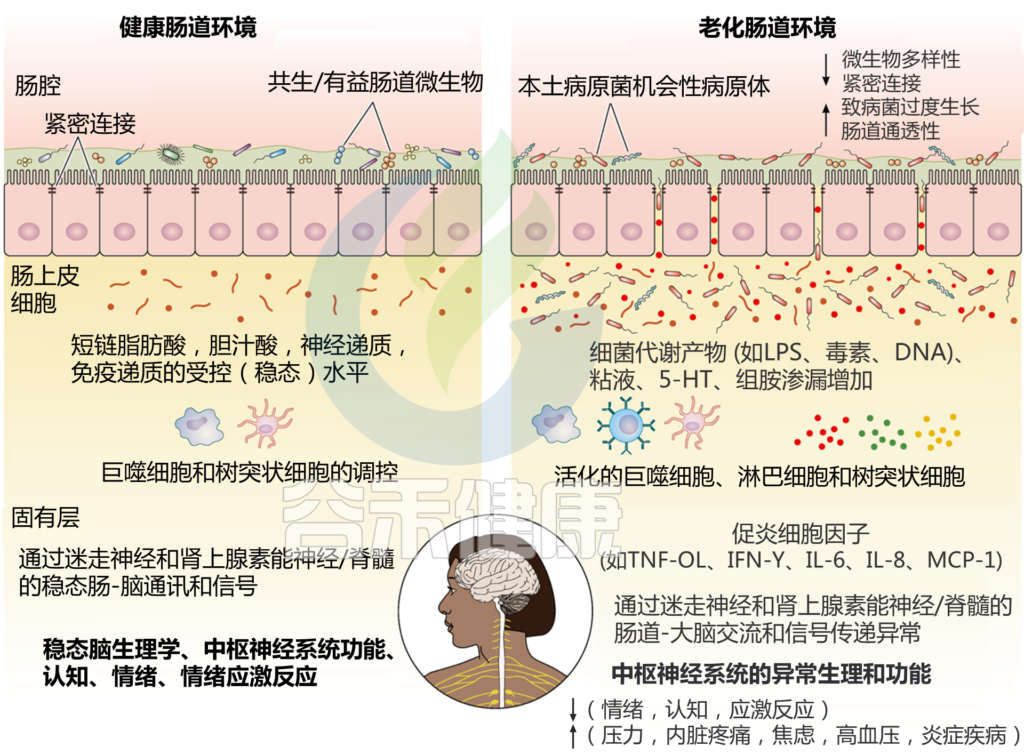
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在健康成人中,平衡的肠道菌群和肠道屏障完整性有助于维持平衡的微生物群落及其代谢产物,包括短链脂肪酸。胃肠道中神经递质的适当产生有助于通过巨噬细胞和树突状细胞的平衡增殖维持受控的肠道炎症和免疫系统,最终导致受控的肠脑通讯和中枢神经系统的适当功能。
然而,在衰老宿主中,胃肠道微生物群落多样性的改变和肠道屏障完整性的破坏,通过短链脂肪酸、LPS、5-羟色胺、组胺、葡萄糖和葡萄糖水平的不平衡,导致胃肠道上皮细胞衬里的生化和微生物微环境发生扰动,分泌性免疫球蛋白(sIgA)等。因此,在肠道环境中诱导过度激活的炎症环境导致健康肠道-大脑沟通中断。
老化的微生物组本身足以导致认知障碍
微生物群移植研究表明,老化的肠道微生物群可导致年轻受体发病。从老年供体小鼠到无菌受体小鼠的肠道微生物群移植有助于促进肠道炎症和增加通透性,这表明与较高水平的变形菌和TM7细菌相关。
最近的一项研究表明,来自老年供体小鼠的粪便微生物群移植导致年轻受体小鼠的空间学习和记忆障碍,产短链脂肪酸菌显著减少,包括Faecalibaculum、毛螺菌科和瘤胃菌科。
从老龄小鼠模型到无菌小鼠的粪菌移植导致粪便短链脂肪酸生成减少、促进抑郁样行为和短期记忆障碍,表明老龄肠道微生物组能够降低宿主的短链脂肪酸水平和随后的认知能力下降。
从老龄供体到年轻受体大鼠的粪菌移植导致受体小鼠的认知行为损伤、突触结构改变、糖基化终产物水平升高以及炎症和氧化应激增加。
自闭症谱系障碍
精神分裂症
抑郁症
自闭症谱系障碍(ASD) 包括一系列复杂的神经发育障碍症状,包括社交和交流障碍,以及限制性和重复性行为模式。
谷禾参与组织的一项多中心合作的自闭症谱系发育障碍与肠道菌群研究,该项目共包括 773 名自闭症受试者(16 个月至 19 岁)和 429 名神经典型 (NT) 发育受试者(11 个月至 15 岁)。该研究已发表的在《GUT》。【实际上这个研究仍在继续,目前我们已经构建了超过3000例的自闭症样本队列】
这项研究详细分析了不同年龄发育阶段自闭症儿童的菌群与正常儿童的差异和变化,并揭示了临床症状相关的自闭症儿童肠道微生物组发育动态特征。
研究显示多种菌、菌群代谢功能的改变与自闭症儿童的行为、睡眠和胃肠道症状的严重程度有关。
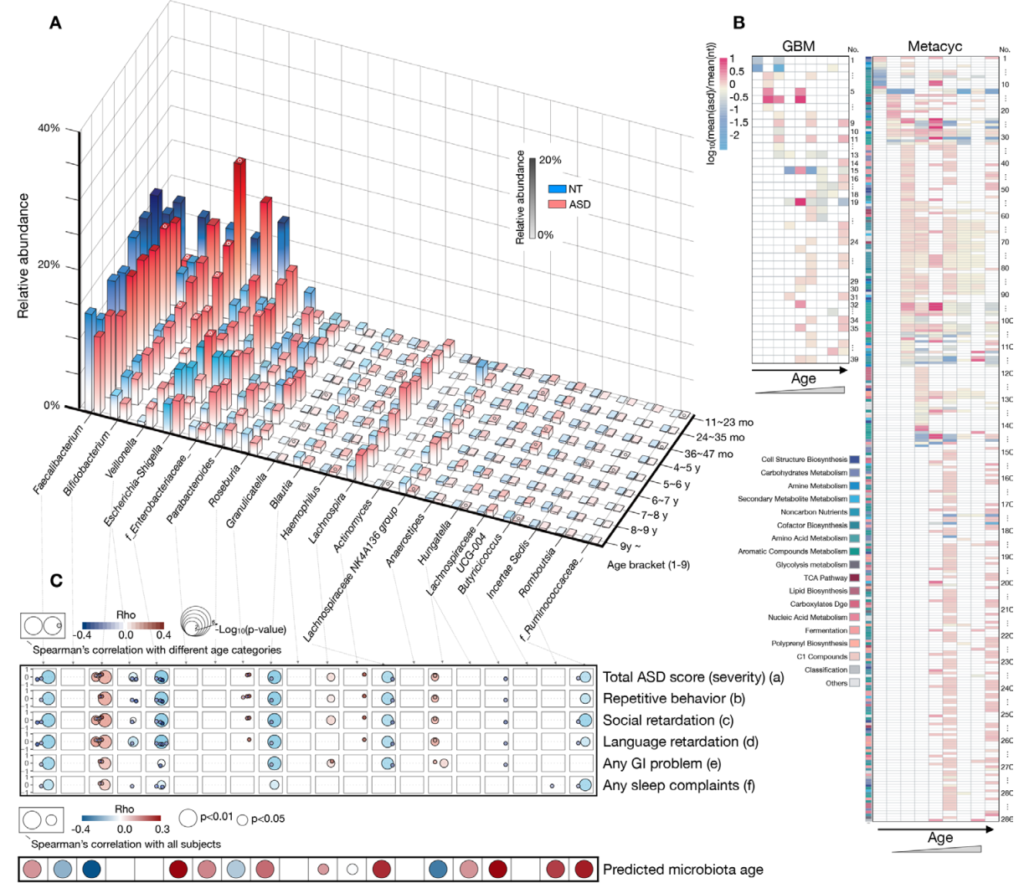
Lou M, et al., Gut. 2021
为了更好的应用于临床,我们尝试并给出了基于微生物群的疾病诊断模型,并在不同年龄和地区显示出很好的模型效果。
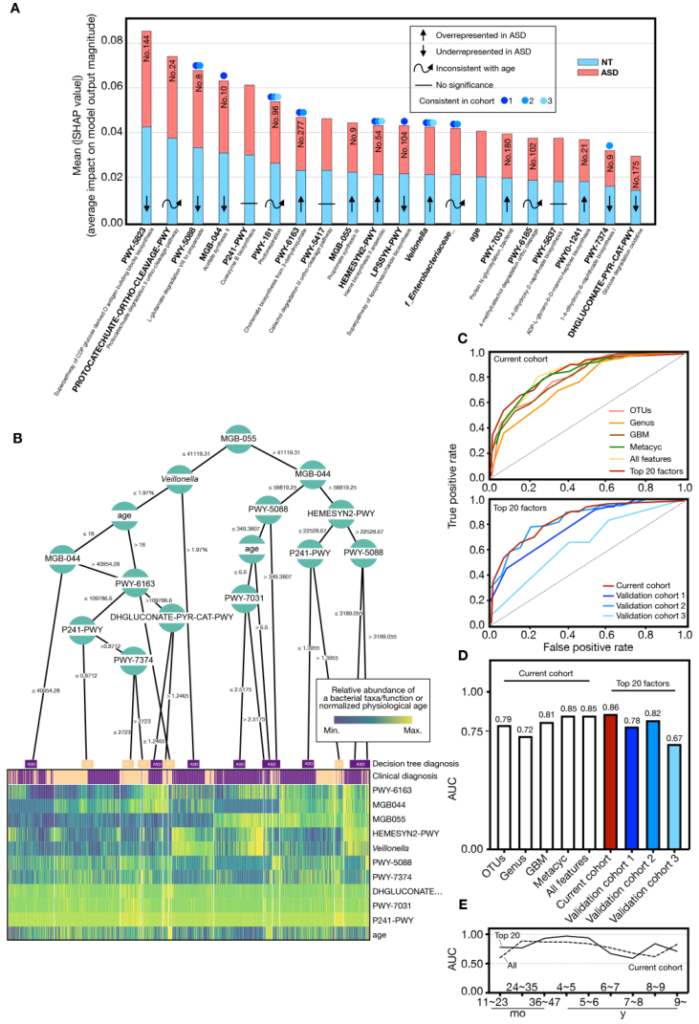
Lou M, et al., Gut. 2021
尤其是在早期,基于肠道菌群的模型对于临床鉴别和评估有更大价值。因为很难对低龄幼儿进行行为学评估,而错误的评估很容易错过早期干预的黄金时机,肠道菌群模型可以更加量化的评估,而不依赖问询或行为学,可以很好的对现有临床诊疗进行补充。
遗传和环境因素
自闭症的确切病因尚不确定。然而,有大量的临床证据表明,遗传和环境因素在该病的发病中起着至关重要的作用。已经确定了100多个影响中枢神经系统发育的基因和基因组区域,这些基因和基因组区域可能与自闭症的发展有关。
环境因素,如营养不良、病毒和婴儿期发育错误,特别是发育中大脑中七种蛋白质的母体自身抗体,也与自闭症有关。这些环境因素现在已经被证明对自闭症有着比以前认为的更重要的作用。
微生物群-大脑重要作用
大约40%的自闭症患者经历更多的胃肠功能障碍,包括肠功能改变和腹部痉挛(疼痛)、腹泻、反流和呕吐。
胃肠道症状与自闭症严重程度之间的相关性表明了肠道与大脑之间联系的重要性。
人们逐渐发现肠道中的微生物群和大脑相互作用在自闭症等神经精神疾病中起着关键作用。
肠道微生物群的组成与年龄有关。肠道微生物群正常组成的改变会增加致病菌的数量,从而导致感染。
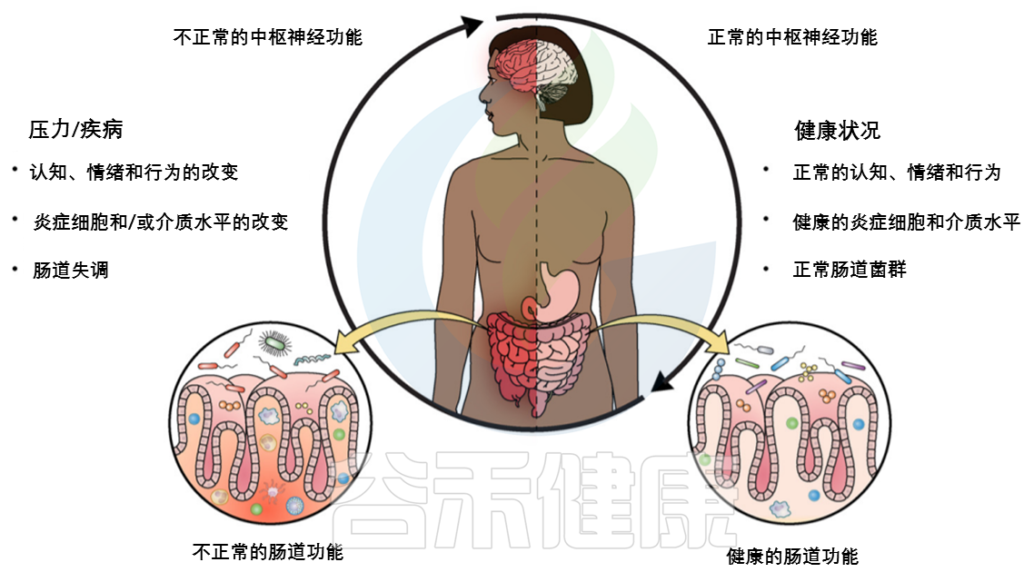
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠道失调 -> 炎症
自闭症患者的胃肠道紊乱和中枢神经系统症状可能与肠道失调引起的炎症状态有关。
根据最新研究,自闭症儿童的肠道微生物群组成发生了显著变化,胃肠道症状可能代表了炎症过程。炎症与肠粘膜屏障对细菌神经毒性肽(如脂多糖)的通透性增加和炎性细胞因子的产生有关。细菌代谢产物在肠-脑轴中起着至关重要的作用;因此,肠脑信号中断可能与自闭症和帕金森等神经精神疾病有关。
最近关于微生物干预预防和治疗自闭症的潜力的研究
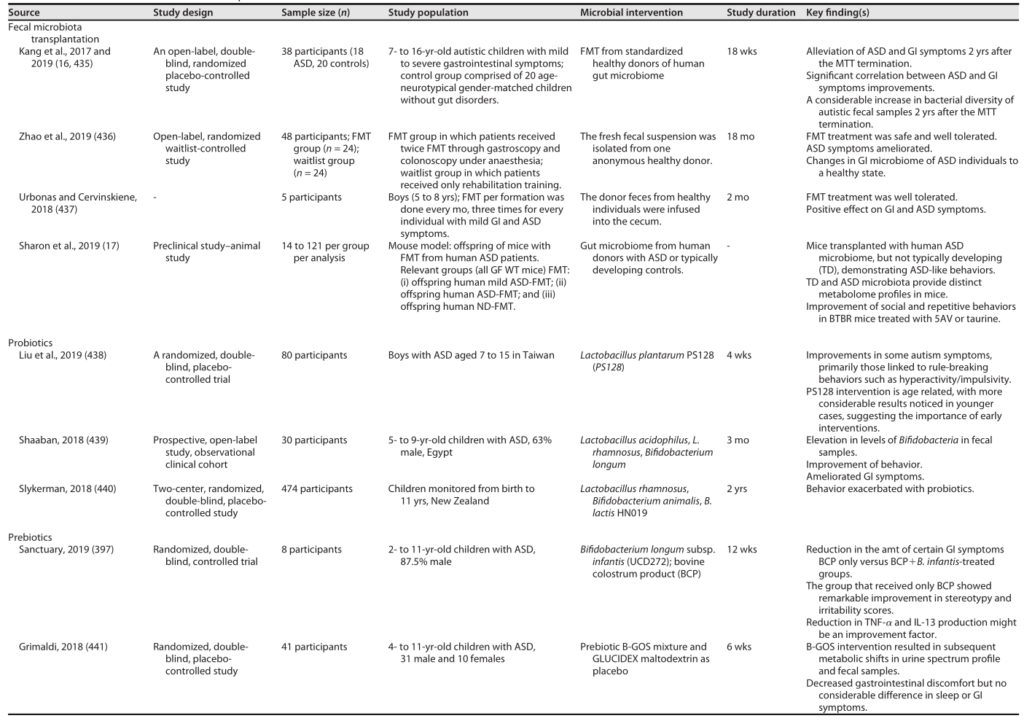
Sorboni SG, et al.,Clin Microbiol Rev. 2022
自闭症患者肠道菌群变化
自闭症儿童甚至成人的肠道微生物群与健康对照组完全不同。
对自闭症儿童粪便样本的调查表明,由于拟杆菌数量减少,拟杆菌/厚壁菌比例降低。
在患有自闭症的儿童中,乳酸杆菌、梭状芽孢杆菌、脱硫弧菌、Caloramator、Alistipes、Sarcina、Akkermansia、Sutterellaceae、肠杆菌科的水平升高。
许多研究人员已经评估了梭菌的丰度及其作为危险因素的作用。对自闭症儿童每周使用万古霉素治疗可显著改善神经行为和胃肠道症状。
发送信号 -> 控制肠通透性
除了肠道微生物群在免疫系统发育中的作用外,梭状芽孢杆菌通过肠上皮或迷走神经的传入纤维向大脑发送信号,并控制肠道通透性。
代谢
据报道,肠道微生物可通过产生酚类、短链脂肪酸和游离氨基酸等代谢物在肠道通透性中发挥重要作用。自闭症儿童丙酸和乙酸的比率较高,但丁酸的比率较低。非消化性碳水化合物的最终产物可能与自闭症发病机制有关。
详见:如何通过喂养菌群产生丁酸调节人体健康
自闭症儿童和正常发育儿童的粪便和血浆代谢组比较显示线粒体功能障碍;自闭症儿童中不同水平的酚类微生物代谢产物、脂质、氨基酸和外源性代谢可能被用作自闭症的分子生物标记物。
在另一项研究中对患有自闭症的儿童的血浆代谢物进行精确评估后,血浆代谢物的水平,包括烟酰胺核糖苷、IMP、亚氨基二乙酸、甲基琥珀酸、半乳酸、丙氨酸甘氨酸、肌氨酸和亮氨酸甘氨酸,明显较低。
然而,在微生物群转移疗法(MTT)后,这些代谢物发生了实质性变化,使其中一些与典型发育中儿童的代谢产物相似。
干预(饮食、微生物等)
已经证明,影响孕妇胎儿微生物群的高脂肪饮食也可能与自闭症有关。此外,母乳喂养6个月降低了自闭症表现的机会,而配方奶粉喂养与肠道艰难梭菌数量增加相关。
《cell》发表的关于自闭症的文章显示,与自闭症相关的行为与饮食多样性的减少有关。并提示在对精神疾病患者的微生物组分析时,应考虑饮食相关因素。
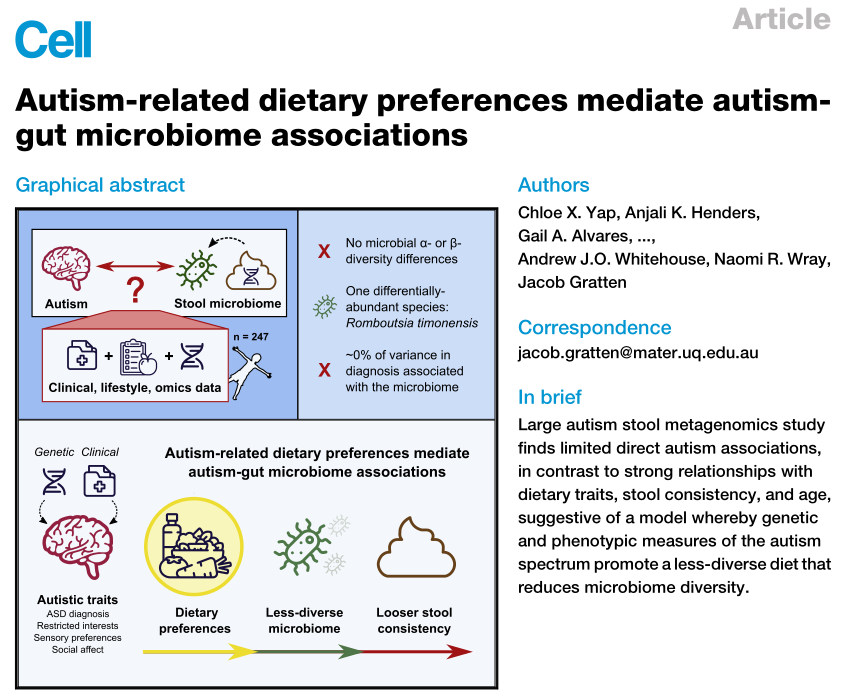
由于益生菌可以发挥抗炎作用并减轻IBD受试者的胃肠道症状,据报道微生物干预,如益生菌,可有助于减少自闭症患者的社会行为症状和炎症水平。
总的来说,自闭症患者肠道微生物群改变已得到证实。然而,考虑到参与患者的异质性和几个相互矛盾的结果,很难建立自闭症的独特特征。考虑到肠道功能障碍与自闭症患者社会行为障碍严重程度的不一致,这些数据提示我们应该考虑两种不同类型的自闭症,这些炎症类型与胃肠道并发症相关。
在各种治疗自闭症的方法中,益生菌治疗的结果很有潜力,同时也应考虑耐受性和安全性评估。鉴于微生物群分析方法的局限性,有必要进一步使用随机、安慰剂对照临床试验,以验证益生菌治疗自闭症的有效性。
精神分裂症(SCZ) 是一种严重的精神疾病,与幻听、妄想、思维和行为紊乱有关,损害日常功能和社会交往。
精神分裂症的生理病理学尚未得到解释,但最近的研究表明,环境因素增加了可能具有该疾病遗传易感性的个体发生精神分裂症的风险。
神经递质在多个系统中的功能障碍已被广泛研究,特别强调了信号异常的重要性,包括多巴胺、5-羟色胺、谷氨酸和GABA。
此外,炎症的重要性以及胃肠系统在精神分裂症病因中的可能作用正在考虑之中。
肠道菌群及其代谢物的影响
胃肠道微生物群在神经生成途径和肠道微生物组中起着至关重要的作用,微生物代谢物扰动已被证明会影响情绪和行为。
肠道微生物组的改变与几种神经发育和神经系统疾病相关。最近有研究表明,来自精神分裂症受试者的粪便移植到无菌受体小鼠,可诱发精神分裂症相关的行为症状。这与海马中GABA、谷氨酰胺和谷氨酸水平的改变有关。这表明精神分裂症患者的微生物群可能对神经化学产生影响,这可能与这些人类条件有关。
目前还没有报告可以促进受试小鼠模型行为改变的特定细菌功能。根据各种研究显示,放线菌、变形菌、拟杆菌和厚壁菌群在精神分裂症患者中的差异最大。
抗生素或许发挥作用
有趣的是,在一项体外研究中,补充抗生素减少了小胶质细胞对突触的吞噬。小胶质细胞降低了中枢神经系统突触的密度,这被认为是精神分裂症发育的一个重要步骤。
在对一组青少年的电子健康记录进行检查后,服用二甲胺四环素与精神分裂症的发病率略有降低有关,这意味着需要更多的研究来调查精神分裂症中微生物群的相关性。
益生菌缓解精神分裂症的消化障碍
根据SCZ的严重性和复杂性,尚未有研究证实精神分裂症患者通过补充益生菌来缓解任何行为症状。然而,一些研究认为,服用益生菌至少可以缓解与精神分裂症相关的消化障碍。
精神分裂症的微生物干预
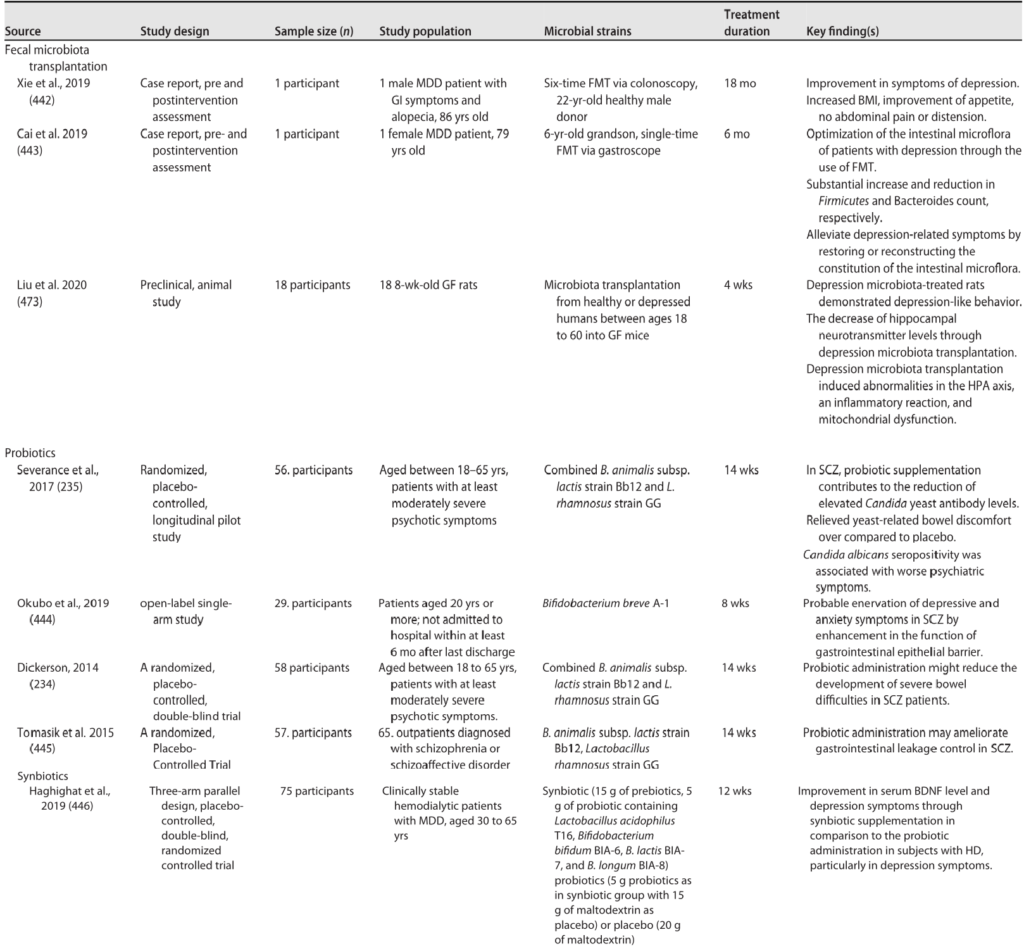
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在一项人类临床试验中,严重的胃肠道问题减少了,精神分裂症患者的精神症状没有任何改变。
另一项人体试验证明了白色念珠菌与胃肠道问题之间的相关性,在服用特定益生菌补充剂(包括鼠李糖乳杆菌GG和动物乳双歧杆菌Bb12)的男性患者中,精神症状有所改善,且白色念珠菌血清阴性。
已经发现了一整套针对严重精神病性疾病的新颖、可能的治疗干预措施,包括考虑肠道舒适性。需要进行更多的研究,通过纵向数据分析和更大的样本量来提高我们对胃肠道微生物群参与精神分裂症的理解。胃肠道微生物的功能和分类对于全面精神分裂症至关重要。
抑郁症是世界范围内导致严重残疾的一种常见的异质性疾病,其特征是情绪低落,经常伴随着对个人通常认为是愉快的活动失去兴趣。其严重形式为重度抑郁症,被归类为心境障碍。抑郁症对人们的健康有着更大的负面影响,并且它带来了与吸烟、血压和饮酒类似的死亡风险。它是癫痫和主要神经退行性疾病(下节内容)的相关共病,其病因包括代谢、神经内分泌和神经免疫因子。
抑郁症主要是一种脑部疾病,但大脑并不是孤立存在的,它存在于包括肠道在内的整个身体生理系统中。如果说成年健康个体的肠道菌群主要由拟杆菌和厚壁菌门组成(90%),那么重度抑郁症患者的肠道菌群在拟杆菌门、厚壁菌门、变形菌门和放线菌门的不同属的丰度上表现出显著变化。
在人类和动物模型中研究发现,临床抑郁症与肠道微生物群丰富度和多样性降低有关。来自抑郁症患者或对照组的粪便微生物群样本移植到微生物群缺陷大鼠模型中,诱发了抑郁症的行为和生理特征,包括快感丧失和焦虑样行为。
慢性炎症可能在重度抑郁症(MDD)的发病机制中发挥重要作用,肠道菌群的内环境平衡失调可能导致此类炎症,这表明胃肠道菌群在影响大脑发育、情绪和行为方面起着中心作用。
这些作者得出结论,生理和情绪压力会影响肠道微生物组的组成。
抑郁症通常与肠易激综合征共存,肠易激综合征的特征是肠道功能的改变,从动物研究中获得的数据表明,肠道微生物群可能影响抑郁症的神经生物学特征。
利用小鼠双侧嗅球切除术(已知会诱发抑郁样行为)来研究其是否会导致微生物群组成的变化:球切除术诱导的慢性抑郁导致肠道微生物谱改变,同时结肠运动、c-Fos活性和5-羟色胺水平增加。
由于抑郁症是肥胖患者的常见症状,研究人员从肥胖小鼠(表现出抑郁症样行为)移植到非肥胖对照小鼠体内的微生物组,观察发现在体重无显著差异的情况下,对照组非肥胖小鼠中肥胖衍生的微生物群重新定植导致探索、认知和定型行为的中断。
抑郁样行为也可以通过应激模型在小鼠中诱导,例如慢性社会挫败应激(CSDS)范式,在该范式中,小鼠反复遭受更大、更具攻击性的小鼠的社会挫败。应激小鼠表现出抑郁样行为,并表现出微生物多样性的变化,其中脱硫弧菌科、Rikenellaceae、毛螺菌科的数量增加,Allobaculum、Mucispirillum的数量减少。
现有证据表明,肠道微生物群可能在抑郁症的发展中起到因果作用,并且可能被认为是治疗/预防这种疾病的一个有价值的靶点。
神经退行性疾病是一类复杂疾病,脑和脊髓的神经元随时间发展而损害逐渐加剧,以特异性神经元的大量丢失为主要特征。这里介绍几种常见的神经退行性疾病及其与肠道微生物群的关系:
多发性硬化
帕金森病
阿尔茨海默
癫痫症
中风和脑损伤
多发性硬化
多发性硬化症(MS)是一种免疫介导的慢性中枢神经系统疾病,涉及受损轴突和脱髓鞘,影响全球约230万人,女性发病率较高。
多发性硬化的致病特征
在中枢神经系统中形成炎性局灶性脱髓鞘斑块,包括脊髓和大脑的灰质或白质,并触发神经炎症反应,导致包括少突胶质细胞在内的特殊细胞脱髓鞘,并导致神经退行性变。
脱髓鞘如何形成?
由于血脑屏障的异常通透性,免疫系统的各种细胞渗入中枢神经系统,导致脱髓鞘的发生。髓鞘抗原特异性T细胞(CD81和CD41 T细胞)穿过这一屏障,导致一系列事件导致脱髓鞘病变的形成。
多发性硬化发病的免疫机制
最近对多发性硬化小鼠模型(包括实验性自身免疫性脑脊髓炎模型)的研究表明,CD41 T淋巴细胞在多发性硬化发病机制中起主要作用。尤其是,CD41Th17和Th1淋巴细胞在多发性硬化发病中具有最突出的作用。
Th1有助于分泌δ干扰素(IFN-d),在活化后促进巨噬细胞酶的产生。此外,IFN-d刺激活性氮和活性氧的产生,分别导致细胞结构的亚硝化和氧化损伤。Th1细胞还能够产生IL-12,从而诱导肿瘤坏死因子(TNF-a)和IFN-d的分泌,导致慢性炎症反应和进一步的组织损伤。
由Th17细胞介导的特定细胞因子(包括IL-22、IL-21和IL-17)的产生导致慢性炎症进展。识别中枢神经系统自身抗原(如Th1和Th17)的CD41 T淋巴细胞参与多发性硬化的病理生理学。
除了CD81和CD41细胞外,其他免疫细胞也与多发性硬化发病有关,包括NK细胞、小胶质细胞和巨噬细胞。这些细胞与其细胞因子之间的分子相互作用维持了中枢神经系统内的炎症级联反应。
多发性硬化的几种临床变异
包括最常见的复发缓解型多发性硬化和进行性复发型多发性硬化,以及原发性进行性多发性硬化和继发性进行性多发性硬化(SPMS)。
遗传易感性和环境因素在多发性硬化症的病因中都起着重要作用。
肠道微生物群参与免疫调节
最近的研究表明,肠道共生微生物群落也与多种免疫介导的疾病(如多发性硬化)有关,可以认为是一种新的环境风险因素。换句话说,肠道微生物群负责免疫调节,改变血脑屏障的完整性和功能,刺激自身免疫脱髓鞘过程,并与中枢神经系统中存在的各种细胞类型直接相互作用。
与肠道微生物群α或β多样性的广泛差异不同,横断面调查主要揭示了多发性硬化儿童与健康个体相比在分类上的明显改变。
一些研究评估了多发性硬化患者微生物移植到两种不同的实验性自身免疫性脑脊髓炎(EAE)模型中的效果;这些研究强调了产生IL-10的CD1 T细胞在胃肠道微生物群介导的免疫调节中的重要性。
此外,胃肠道中SFB的存在,可能在Th17细胞活化中起作用 ,显著影响EAE小鼠的多发性硬化样症状。根据多发性硬化作为脱髓鞘疾病的定义,临床前抗菌研究表明,在汇集来自无菌小鼠模型的数据后,胃肠道微生物群可以调节小鼠模型前额叶皮质髓鞘的生成。
肠道菌群在血脑屏障调节中的基本作用
无菌小鼠研究表明,作为多发性硬化的一个主要标志,微生物组与血脑屏障完整性的丧失之间可能存在关联。
研究还表明,在膳食中补充短链脂肪酸或产短链脂肪酸的菌,可以逆转血脑屏障完整性的丧失。此外,饮食诱导的肠道微生物群落结构变化也参与了EAE的表现。
有证据表明,肠道微生物群可以调节大量的神经炎症途径。然而,补充研究对于理解多发性硬化病因的确切作用机制至关重要。动物和人类研究表明,肠道菌群可能与多发性硬化生理病理学的许多方面有关。
干预措施
关于如何有效地控制肠道微生物组作为一种干预措施,以最大程度地阻止复发和缓解症状,问题仍然悬而未决。
在一项试点实验中,补充一种特定的益生菌制剂(含有双歧杆菌、乳酸杆菌和链球菌)可以逆转微生物群的改变并调节炎症反应,这表明这种微生物群靶向治疗是有希望的(下表),尽管需要进一步调查以确认这些结果。
多发性硬化的微生物干预
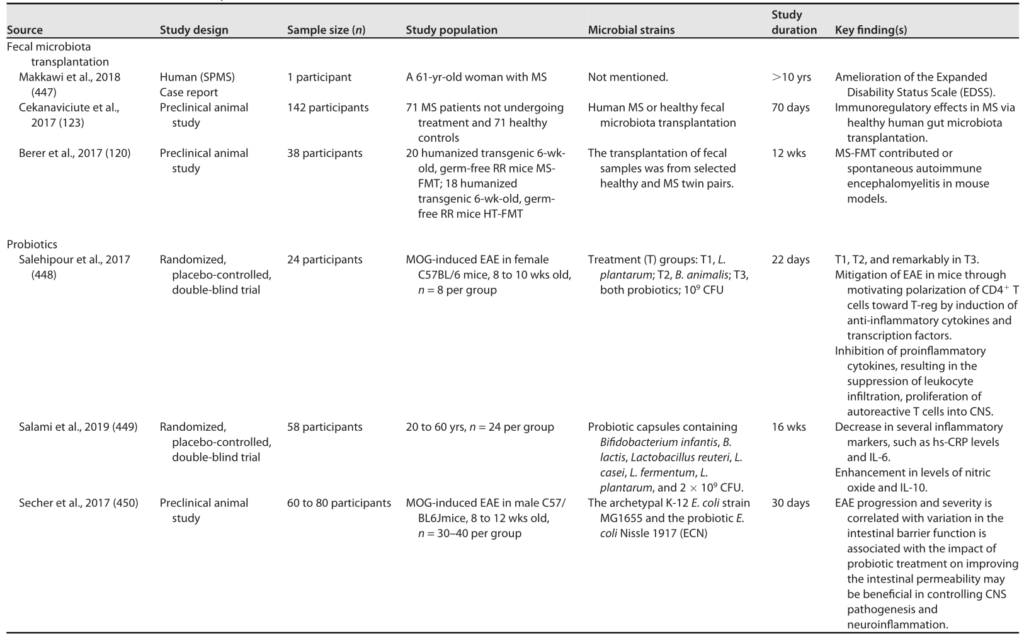
Sorboni SG, et al.,Clin Microbiol Rev. 2022
帕金森病
帕金森病(PD)是一种进行性多中心神经退行性疾病,由α-突触核蛋白(α-syn)沉积在部分大脑中心黑质的多巴胺能神经细胞中引起。这些过程促进了圆形片状嗜酸性细胞质内含物的逐渐聚集,称为Lewy小体。
然而,帕金森发病机制的确切机制仍不明确,它可能是一种多因素疾病,在这方面引入了各种理论。
衰老是帕金森发展和进展的重要风险因素
影响多种细胞途径,导致这些过程受损,并导致神经退行性变。可以想象,年轻神经元可以容忍的相同分子扰动在老年神经元中显示出一些灾难性后果。
帕金森病的临床症状主要表现为运动障碍症状,包括肌肉僵硬、静止性震颤、运动迟缓和姿势不稳 。帕金森病在50岁之前很少见,但随着年龄的增长,发病率会增加5到10倍。它主要发生在男性,每年每100000人中有5-35例新病例。
多巴胺能神经元逐渐退化,非运动和运动症状如抑郁症、痴呆症和胃肠道问题(包括便秘、唾液分泌异常、排便功能障碍、恶心和吞咽困难)之间存在着强相关。帕金森症状因个体而异。
几项研究表明,帕金森受试者的胃肠道异常与肠神经系统中的肠道失调和α-突触核蛋白沉积有关。
肠道菌群如何影响帕金森?
由于最初的胃肠道参与帕金森,并且宿主微生物组之间的生理相互作用潜力很大,因此有人认为胃肠道菌群可能影响帕金森。胃肠道功能异常,尤其是便秘,影响多达80%的帕金森病患者,并且可能在出现运动症状前几年发生。
特发性便秘是帕金森的主要相关因素,与肠神经系统的神经退行性改变有关。肠神经系统中的α-syn神经退行性变可能是帕金森的运动前临床症状之一。它与慢性便秘和胃肠道壁的生理改变有关。
肠道微生物群可能影响参与α-syn分泌的肠道神经元。这些变化在运动症状出现之前的帕金森开始时就已出现,可认为是运动前生物标记物。
——Prevotellaceae减少
对肠道微生物组与帕金森患者之间的相关性进行了不同的研究。一项研究观察到帕金森病患者粪便样本中Prevotellaceae种类显著减少。与对照组相比,Prevotellaceae的丰度显著降低(77.6%)。
Prevotellaceae通过膳食纤维发酵和肠道中的粘蛋白率先产生短链脂肪酸。Prevotellaceae减少引起的细菌内毒素全身暴露和肠道通透性的增强可触发α-syn结肠的不受控制的表达和错误折叠。
这种肠型负责硫胺素、叶酸和神经活性短链脂肪酸的生物合成。因此,补充这些维生素和短链脂肪酸可能有助于治疗帕金森。
最近的研究首次承认,帕金森病患者的机会性病原体数量显著增加。
——肠杆菌科丰度增加
步态困难姿势不稳的严重程度与肠道内肠杆菌科丰度呈正相关。肠杆菌科细菌在肠道中的过度生长导致作为血清中革兰氏阴性细菌细胞壁一部分的LPS滴定增强 。因此,研究表明,由于帕金森患者血液样本中LPS的吸收增加,LPS结合蛋白的全身浓度异常高。
——乳酸杆菌科的丰度增加
与Prevotellaceae一样,乳酸杆菌科与胃肠激素ghrelin有关。也有报道称帕金森患者的ghrelin分泌减少。
总的来说,研究结果揭示了胃肠道微生物群和帕金森作用之间的联系。进一步的微生物组学分析可能会提高准确性,澄清关系以及机制。
帕金森患者中菌群失衡可能会影响炎症,因为菌群失调会损害肠道屏障功能并触发免疫激活和全身炎症反应。
帕金森的持续存在会影响微生物群,肠道菌群可能在一些腹部症状中起作用,如便秘和炎症。
肠道屏障破坏
简而言之,LPS和其他细菌神经毒素在穿过肠壁后进入血液,导致肠上皮屏障的破坏。血液中细菌LPS的存在导致通过核因子kB(NF-kB)和TLR4产生炎症细胞因子,导致全身炎症。细菌LPS和炎性细胞因子(包括TNF-a、IL-1b和IL-6)诱导的血脑屏障破坏触发α-syn的积累。位于黑质的多巴胺能神经元丢失可能是血脑屏障分解的结果。由于帕金森的肠屏障破坏导致微生物易位升高和促炎症基因谱升高,结肠活检标本显示TLR4或细菌内毒素特异性配体、CD31 T 细胞和其他细胞因子的表达增强。
产短链脂肪酸的细菌减少
帕金森病患者在肠道失调期间产短链脂肪酸的细菌减少。TLR4介导的炎症在脑或肠道炎症中发挥重要作用,这可能是导致帕金森神经退行性变的重要因素之一。因此,增强肠道内肠杆菌科后LPS的相对增强与帕金森的发生相关。
闭塞和其他紧密连接蛋白对肠屏障结构至关重要。肠道生态失调,使闭塞素降解,导致肠道通透性增强。
促炎细胞因子升高
另一项针对帕金森病患者的研究调查了其粘膜中Ralstonia、肠球菌和变形菌浓度的增加,导致促炎细胞因子的升高。
帕金森受试者粪便样本中被认为具有抗炎作用的产丁酸菌(如布氏杆菌、粪球菌、粪杆菌和罗氏菌)数量显著减少。
此外,据报道,帕金森患者粪便样本的微生物群中LPS生物合成基因表达增加。有趣的是,幽门螺杆菌感染可被认为是帕金森发病机制中的一个重要触发因素。
小肠细菌过度生长(SIBO),与运动功能障碍有关,尤其是在帕金森患者中。
牙龈假单胞菌感染在帕金森的病因/危险因素中的重要作用
牙龈卟啉单胞菌的牙龈蛋白酶和LPS导致帕金森样本中出现异常血凝块。研究发现只有帕金森样本的凝块中观察到了牙龈蛋白酶抗体信号,这证实了这种细菌在帕金森病理学中的潜力。他们进一步指出,据报道,牙龈假单胞菌诱导的外周炎症导致肠道微生物群失衡,黑质多巴胺能神经元减少,肠道通透性增加,以及富含亮氨酸重复激酶2(LRRK2)相关帕金森病理生理学中小胶质细胞活化增强。
益生菌缓解症状
益生菌,包括乳酸杆菌和双歧杆菌,已被证明可以缓解帕金森样症状。
帕金森的微生物干预

Sorboni SG, et al.,Clin Microbiol Rev. 2022
芽孢杆菌作为一种益生菌,能够将L-酪氨酸转化为L-多巴,L-多巴是多巴胺的重要前体分子,其转化为多巴胺是通过多巴脱羧酶进行的。
据报道,定期服用含有干酪乳杆菌shirota的发酵乳饮料可通过减少帕金森患者粪便中葡萄球菌的数量促进排便。
肠道微生物群从二芳基黄烷醇中积极产生多酚,干扰α-突触核蛋白的错误折叠和毒性,是帕金森和其他α-突触核蛋白病的基本病理机制。
对口服富含拉法诺制剂(FRP)的异源性人源化侏儒小鼠的研究表明,FRP衍生代谢物的产生存在特殊差异,影响α-突触核蛋白的错误折叠或炎症。
对果蝇α-突触核蛋白病模型的研究表明,它对运动功能障碍有影响,从而导致其发病和进展的调节。
体外研究表明,在细菌发酵过程中,特定的细菌可以产生这些具有生物活性的酚酸。
总之,已经得出结论,个体间异质肠道微生物群诱导的二芳基黄烷醇的变化证明了益生菌、益生元和共生策略在调节帕金森和其他共核病变进展中的潜力。
目前,关于微生物组与帕金森病之间的相关性的不同研究结果并不一致。微生物组的结果产生了有价值的信息。帕金森患者使用的药物与肠道微生物之间存在联系,因为肠道微生物群在处方药物代谢中发挥作用,甚至药物对微生物组成产生影响。
对胃肠道微生物组和肠-脑轴的相互作用有一个完整的认识,可能阐明帕金森的病因和进展因素,以提供新的治疗视野和手段。例如,FMT和肠道微生物组作为帕金森临床诊断的新生物标记物的评估可能揭示传统治疗方法的替代治疗。
肠道不适可发生在帕金森的初始阶段;这有助于在出现震颤和强直等运动症状之前对该疾病进行早期诊断。微生物组学研究可以提供关于帕金森病的有用信息,但目前,我们不能依赖它们作为生物标志物。
阿尔茨海默病是一种慢性不可逆的大脑疾病,脑细胞的进行性退化导致记忆障碍、认知能力下降。它是老年人最常见的痴呆类型。阿尔茨海默患者表现出严重的学习、行为和记忆障碍,严重到足以影响日常活动。
阿尔茨海默的特征
阿尔茨海默患者的大脑中的神经元细胞死亡和进行性突触衰竭,伴随着神经元周围或外部的β淀粉样蛋白(amyloid-β,简称Aβ)沉积,伴随着皮质神经元树突和轴突中微管相关蛋白tau异常磷酸化的聚集。Aβ的积累和tau蛋白的聚集有助于微管稳定性的降低、突触失效和神经元钙稳态的紊乱,最终导致神经元凋亡。
尽管已经对阿尔茨海默的病因进行了大量研究,但阿尔茨海默的潜在机制尚不完全明确,目前的Aβ疗法对症状的缓解作用有限。据报道,淀粉样蛋白可能在大脑中充当AMP。
与中枢神经系统炎症有关
最近的研究发现阿尔茨海默的发病机制与周围感染引起的中枢神经系统炎症有关。在感染单纯疱疹病毒1型(HSV-1)的小鼠中,可以看到阿尔茨海默受试者中tau和Aβ沉积的共同特征。病毒感染诱导的高细胞内胆固醇25羟化酶(CH25H)水平对于调节Aβ产生和阿尔茨海默易感性至关重要。
阿尔茨海默 & 微生物群
此外,先前的研究已经证明阿尔茨海默与其他微生物感染(包括真菌、肺炎衣原体和螺旋体感染)之间存在潜在联系。阿尔茨海默患者脑脊液中肠道菌群微生物驱动代谢物的测定与阿尔茨海默生物标记物(如磷酸化tau和tau/Aβ42)相关,表明肠道微生物群在阿尔茨海默发病中的意义。
一项研究报告,根据Aβ前体蛋白转基因小鼠(APP)粪便样本的细菌16S rRNA序列分析,与野生型小鼠模型对照组相比,肠道微生物组成存在显著差异。研究还表明,具有阿尔茨海默表型的转基因小鼠模型具有多种肠道微生物。
对无菌小鼠的研究表明,在没有微生物的情况下,不会出现淀粉样斑块和神经炎症症状。
根据横断面研究结果,与健康对照组相比,阿尔茨海默患者粪便样本中参与炎症反应的两种细菌大肠杆菌和志贺菌的丰度显著增加。在患有认知障碍和脑淀粉样变性的患者中,可能与外周炎症状态有关的两种主要情况包括促炎性大肠杆菌和志贺菌的增加以及抗炎性直肠真杆菌的降低。
菌群失调 & 全身炎症
肠道微生物群失调和全身炎症之间存在联系,这可能是阿尔茨海默患者大脑中发生的神经退行性变的一个促成因素。
这些观察结果基于小规模研究,需要更多具有较大统计组的研究来评估肠道微生物群与阿尔茨海默进展的关系。一些科学家指出,在阿尔茨海默患者大脑中发现的感染因子可能与该疾病的发展有关,但在这方面,强有力的证据是必不可少的。
牙龈卟啉单胞菌在患者大脑中定植
在最近的一项阿尔茨海默治疗研究中,使用合成的神经毒性抑制剂是有益的。在这项研究中,牙龈卟啉单胞菌与慢性牙周炎有关,在阿尔茨海默患者的大脑中被发现。这些细菌在大脑中的定植导致Aβ1-42的产生增加。此外,神经毒性姜黄素对tau蛋白Aβ1-42有破坏性影响。
NLRP3炎症小体与阿尔茨海默
肠道微生物群失调与阿尔茨海默相关神经炎症之间的潜在关联。肠道NLRP3异常表达的增加与外周炎性体的激活呈正相关,后者随着阿尔茨海默的进展而增强神经炎症。因此,观察到,与年龄匹配的对照组小鼠相比,年轻和老年5xFAD小鼠模型的肠道微生物群组成发生了相当大的变化。
与非转基因小鼠相比,com 5xFAD小鼠由于粘附蛋白和紧密连接蛋白的丢失而表现出肠道屏障功能受损。此外,已经证明肠道微生物炎症体蛋白的高表达可能是激活下游细胞毒性和炎症介质的重要主导因素。因此,NLRP3炎症体介导的神经炎症可能通过胃肠道NLRP3促进。因此,肠道微生物群调节可能是治疗遗传易感个体阿尔茨海默相关神经系统疾病的一种可能策略。
将Tg2576小鼠阿尔茨海默模型(包括症状前和症状中转基因)与野生型进行比较,研究人员观察到肠上皮屏障(IEB)中血管A β肽的沉积破坏了IEB,并且吸收失调发生在其脑聚集之前。得出结论,肠-脑轴的改变与较高水平的炎症血浆细胞因子(如IL-9、IP-10和VEGF)相关。
考虑到阿尔茨海默患者的肠道功能障碍,阿尔茨海默治疗的未来治疗策略可能涉及肠道微生物群的早期调理。根据肠道微生物群参与阿尔茨海默Aβ病理学的发展,研究人员开发了一个新的框架,通过肠-脑轴确定阿尔茨海默的潜在机制,并将肠道微生物群的操作转化为临床实践。
抗生素疗法
用接受来自老年(16个月)APPSWE/PS1DE9小鼠的粪便供体移植的APPSWE/PS1DE9小鼠进行短期抗生素鸡尾酒疗法,收集粪便颗粒进行进一步分析。
抗生素治疗前小鼠的FMT重建主要归因于供者来源,如梭状芽孢杆菌和Coriobacteriae,有助于Aβ斑块的更高沉积。有趣的是,在微生物群植入后,Aβ斑块周围星形胶质细胞的激活受到抑制,而不是小胶质细胞。
在阿尔茨海默小鼠模型中,长期服用广谱抗生素也可以减少Aβ积累并调节影响Aβ淀粉样变的先天免疫反应。此外,在转基因小鼠中,通过定期使用抗生素鸡尾酒疗法,海马淀粉样斑块周围的小胶质细胞和星形胶质细胞聚集以及不溶性Aβ斑块减少 。
也有报道称,通过比较不同年龄的野生型和阿尔茨海默小鼠模型之间的粪便短链脂肪酸和微生物组成,观察到具有阿尔茨海默表型的小鼠中的丁酸球菌和瘤胃球菌数量显著减少,变形菌和疣状菌数量增加,提供改变的微生物组成和多样性。短链脂肪酸水平的下降表明至少有30条代谢途径受到干扰。
先前的一项研究也表明,小胶质细胞激活抑制Aβ清除和降解,Aβ的进一步积累导致阿尔茨海默的病理学。此外,Aβ沉积水平的升高有助于小胶质细胞内几种促炎介质的释放,如ROS、iNOS、NF-kB和COX2,从而促进阿尔茨海默患者的神经炎症。
阿尔茨海默的微生物干预
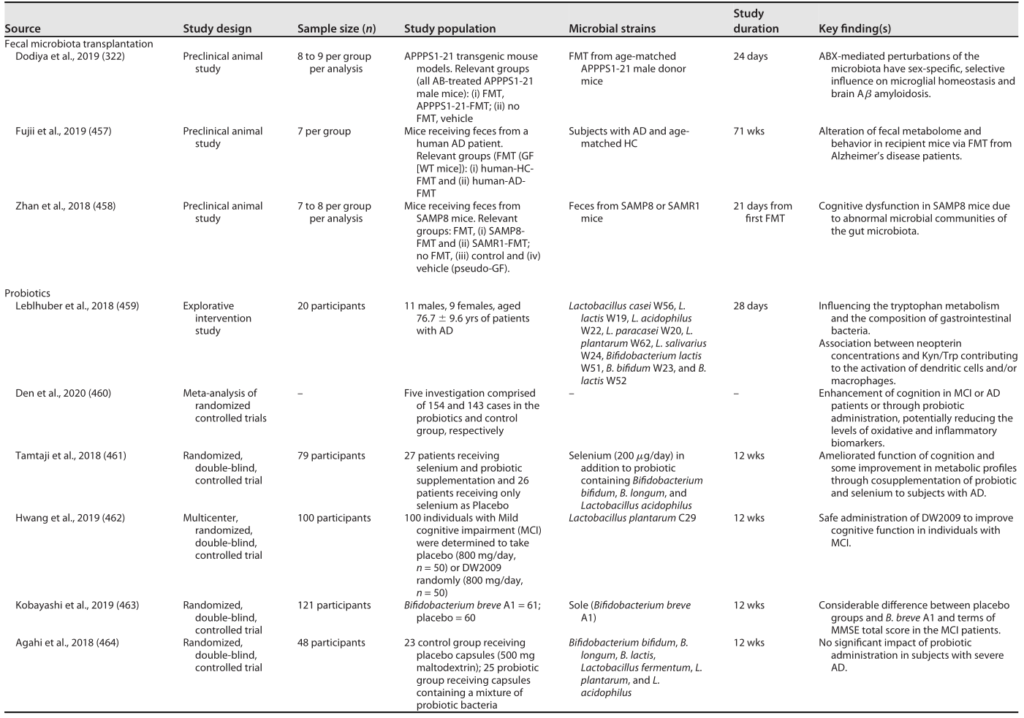
Sorboni SG, et al.,Clin Microbiol Rev. 2022
这些研究表明,某些种类的肠道微生物可激活Aβ信号通路,参与阿尔茨海默的发病机制,并在阿尔茨海默的分子调节中发挥关键作用。益生菌补充和营养干预可能成为阻碍阿尔茨海默进展的一种有希望的治疗方法。
癫痫是一种使人衰弱的神经系统疾病,影响全世界约6500万人。尽管医学上有许多新的进展,但确切的病因仍需完全阐明。大约一半的癫痫患者病因不明。据报道,癫痫患者的医疗费用是正常人的13倍。癫痫显著的社会经济影响是由于其死亡率和致残率高于正常人群。尽管正在使用抗癫痫药物(AEDs)进行药物治疗,但只有70%的癫痫患者能够完全控制癫痫发作。因此,大约三分之一的癫痫患者会出现难治性癫痫,影响他们的日常生活活动。
环境和遗传因素都决定癫痫的易感性。
此外,一些研究表明肠道细菌种类与癫痫的病理生理学之间存在关联。肠道微生物组失调与癫痫等神经精神疾病的发生有关。平衡的肠道微生物群与健康的大脑和免疫系统之间存在相关性。
最近的研究表明,慢性炎症在癫痫的发病和进展中起着重要作用。研究还表明,肠道菌群可以调节免疫和炎症反应。因此,操纵肠道微生物组作为癫痫的治疗策略具有潜力。
腹腔注射LPS诱导大鼠更易发生癫痫发作,同时增加血脑屏障的通透性和大脑中更高水平的促炎细胞因子。
未控制癫痫的替代治疗策略包括迷走神经刺激和生酮饮食。因此,控制肠道微生物群的多样性可以被认为是一种潜在的治疗方法。
癫痫患者肠道菌群变化
在几项研究中发现,与健康人群相比,采用各种治疗方法的癫痫患者的肠道微生物特征存在差异。
所有这些研究表明,在未控制的癫痫中,厚壁菌/拟杆菌比率增加。一些属于厚壁菌门的细菌能够调节神经递质水平。对肠道微生物群(包括α-多样性)的进一步分析表明,结果存在显著差异。在另一项研究中,与拟杆菌相比,厚壁菌的数量增加。
此外,与药物反应性患者相比,耐药患者的α-多样性测量结果与健康受试者相似。实质上,更高水平的α-多样性与罕见肠道细菌种类的异常增加有关。此外,在属水平上,报告了显著差异。根据这些结果,可以认为细菌在癫痫的有效治疗中起作用。
有趣的是,肠道微生物群可以调节唑尼沙胺代谢,唑尼沙胺是一种抗癫痫药物。此外,乳酸杆菌和双歧杆菌数量的增加与每年较少的癫痫发作相关。
在临床前和临床研究中,关于抗生素给药是否能诱导或预防癫痫发作,也有争议的发现。值得注意的是,潜在传染病在治疗过程中可能产生的促癫痫作用或抗生素直接引起的神经毒性副作用可能更为重要。
生酮饮食降低癫痫发作率
据报道,癫痫患者的生酮饮食可降低癫痫发作率,并与肠道菌群组成和功能的改变有关。
生酮饮食在颞叶癫痫的无菌小鼠模型中介导抗癫痫作用。事实上,这些研究人员发现,SPF小鼠在移植生酮饮食的微生物群或长期治疗细菌后癫痫发作阈值升高(长期治疗细菌包括Akkermansia muciniphila, Parabacteroides distasonis, Parabacteroides merdae)。
一些研究表明补充益生菌对癫痫有积极作用。
癫痫的微生物干预
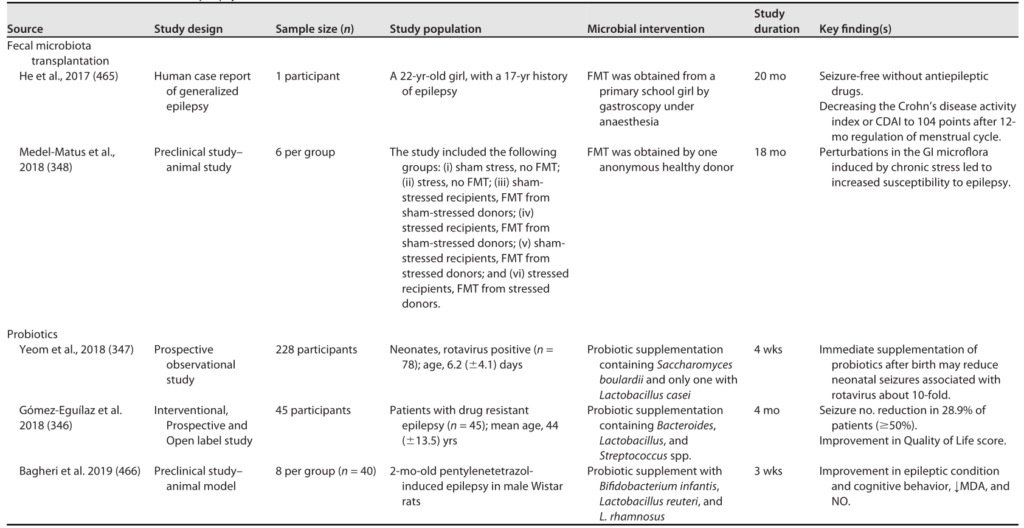
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在全球范围内,中风和脑损伤是发病率和死亡率的重要原因。肠道菌群中的共生细菌可能通过调节多种脑血管疾病的危险因素(包括动脉粥样硬化、糖尿病、血脂异常和动脉高血压),与中风的发生有关。饮食也是一个重要的危险因素。
将动脉粥样硬化和失调联系起来会直接影响微生物组的组成和多样性。然而,越来越多的证据表明,肠道微生物群可能在脑血管疾病和中风中发挥更直接的作用。
三甲胺n-氧化物(TMAO)升高
三甲胺n-氧化物(TMAO)作为微生物群衍生的代谢物,可以从膳食胆碱中合成,可在体液和组织中检测到。最近的研究表明,TMAO与脑血管和心血管疾病的风险增加有关,这表明可能通过这种代谢物的治疗潜力调节肠道微生物群。
横断面调查表明,与健康对照组相比,中风患者的肠道微生物群组成不平衡。在一项对4000多例患者的纵向研究中,血浆样本中TMAO水平升高与卒中和心血管事件的高风险呈剂量依赖性相关。
抗生素补充引起的TMAO水平降低突出了肠道细菌在该化合物合成中的重要性。
同时,与无症状动脉粥样硬化患者相比,中风和短暂性脑缺血发作患者的TMAO水平相对较低。
磷脂酰胆碱代谢物
临床前研究表明,服用磷脂酰胆碱代谢物(如胆碱和TMAO)可上调参与动脉粥样硬化的巨噬细胞清除受体的表达,这可能是由于肠道中存在的细菌物种所致。
对无菌小鼠的研究表明,胆碱的服用与较高的动脉粥样硬化率无关,并且有助于减少主动脉斑块的体积。然而,关于饮食对TMAO和胆碱的影响以及肠道微生物群在动脉粥样硬化发病和进展中的有害和保护作用,重要的是不要过度解释临床前研究的结果。
健康的微生物组在动脉粥样硬化病变的恢复中起着重要作用。
大脑中动脉闭塞后补充广谱抗生素与小鼠存活率降低相关。抗生素诱导的胃肠道菌群改变也导致IL-17相关趋化因子表达下调和促炎性IL-17gd T细胞迁移减少。
因此,肠道细菌通过调节肠道T细胞向大脑的浸润来调节中风后的神经炎症。
卒中后含有短链脂肪酸产生菌的粪菌移植,包括发酵乳杆菌、长双歧杆菌、Faecalibacterium prausnitzii、Clostridium symbiosum,可缓解卒中后的认知障碍和炎症,还可增加血浆、肠道和大脑短链脂肪酸浓度,促进老年模型卒中后恢复。也有报道称,将中风患者粪菌移植到抗生素给药的小鼠,以及从中风模型转移到无菌小鼠,会增加缺血性脑损伤和相关功能损伤的大小。
中风和脑损伤的微生物干预
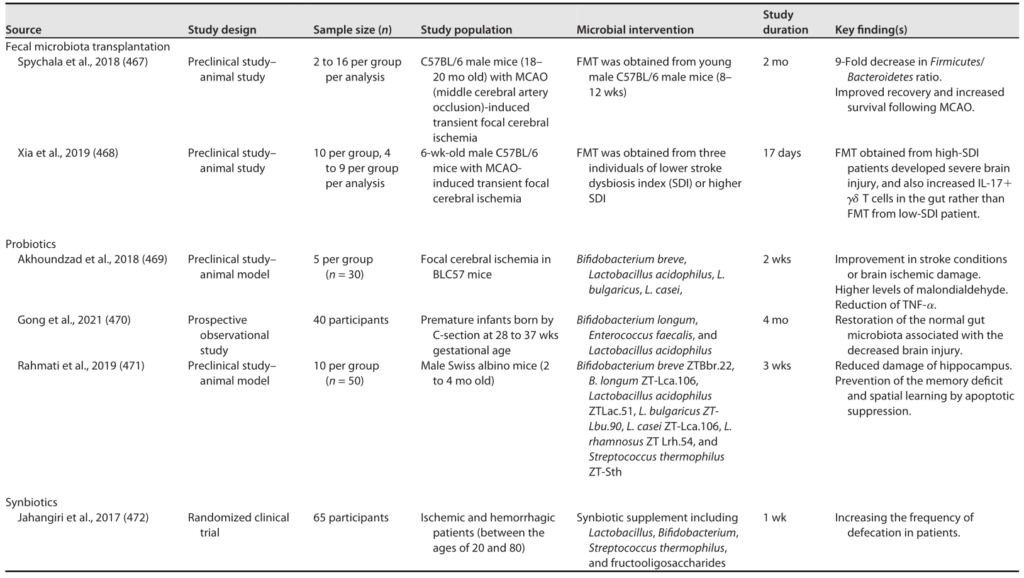
Sorboni SG, et al.,Clin Microbiol Rev. 2022
据报道,中风后拟杆菌的数量和多样性减少。另一项研究表明,短暂性脑缺血发作和中风患者的机会性病原体数量较多,包括脱硫弧菌、肠杆菌、巨球形杆菌和Osicillibacter,有益或共生菌属的数量较少,如拟杆菌、粪杆菌和Prevotella。此外,Prevotellaceae和Peptococcaceae的丰度增加与中风严重程度相关。
用一种特殊的细菌菌株,即丁酸梭菌进行治疗,可改善缺血/再灌注小鼠模型的认知功能,并减少神经元损伤。
根据这些解释,肠道微生物群在中风和脑损伤发病和进展中的作用尚不完全清楚。虽然临床前和临床研究提供了有趣的结果(表7),但还需要进一步的研究。有人建议在饮食中补充精神生物素,以减少创伤性脑损伤后的精神后果和共病。然而,需要更多的临床研究来阐明这种微生物治疗干预的潜力。
药物
益生元
益生菌
合生元
后生元
粪菌移植
其他
越来越多的证据表明,人们越来越认识到肠道微生物组在调节不同药物(如精神药物)的疗效和副作用方面的重要性。
抗生素
抗生素是影响胃肠道菌群的最有效和最直接的方法。
对1135名个体的肠道微生物组的深度测序表明,肠道微生物组与各种药物组之间存在关联。抗生素与胃肠道微生物组的改变密切相关。
值得注意的是,作者提供了其他几种治疗药物对胃肠道微生物群影响的证据,如二甲双胍、泻药、他汀类药物和质子泵抑制剂(PPI)。
多药疗法
同时使用多种药物治疗患者,也与肠道微生物群的改变有关。一项调查显示,服用药物的数量与微生物多样性之间存在显著的负相关。尤其是抗抑郁药、PPI和抗精神病药与分类单元丰度的相关性最大。
非抗生素药物
同时,新证据表明,除了药物药代动力学的调节外,非抗生素药物还可以改变肠道微生物组结构,对情绪和行为产生潜在影响。
另一方面,人们越来越重视肠道微生物组与药物之间的相互作用,这支持了肠道菌群可影响药物代谢和吸收的观点。在一项大规模队列研究发现,包括抗生素、抗抑郁剂、苯二氮卓类药物等在内的医疗干预可以改变肠道微生物组的组成。
精神药物
此外,研究了精神药物对40名焦虑症和/或重度抑郁症患者胃肠道菌群的影响。在其队列研究中,研究人员得出结论,抗精神病药物降低了胃肠道微生物组α多样性。这些研究人员确定抗精神病药物的剂量与这些患者的α-多样性呈负相关。
已经进行了多项体外研究,以评估非抗生素药物的抗菌活性,所有这些药物都具有抗菌活性,可能通过与特殊分子靶相互作用影响中枢神经系统功能。
其他报告显示抗抑郁药选择性5-羟色胺再摄取抑制剂(SSRIs)、氟西汀、舍曲林、西酞普兰和帕罗西汀对芽孢杆菌、梭状芽孢杆菌、肠球菌、假单胞菌和葡萄球菌菌株具有抗菌活性。
在最近的一项研究中,作者测试了不同类别的抗抑郁药对12种肠道菌群共生细菌菌株的抗菌活性。大多数被检查的抗抑郁药对被检查菌株的生长具有相当大的浓度依赖性抑制作用。此外,在对雄性BALB/c小鼠肠道微生物群的体内研究中,作者发现与对照组相比,地昔帕明可增加β-多样性并降低丰富度。
这些作者还发现,在补充了地昔帕明的小鼠模型中,Adlercreutzia、瘤胃球菌和未分类的α-变形杆菌的数量减少。三环类抗抑郁药,包括阿米替林,也被证明对致病细菌菌株,如芽孢杆菌属、葡萄球菌属和霍乱弧菌具有体外抗菌活性,而丙咪嗪分别对小肠结肠炎耶尔森菌和大肠杆菌具有生长抑制作用。
在一项老年住院患者队列研究中,研究了精神药物对肠道微生物群组成的影响。在受试药物中,与PPI和抗抑郁药相比,抗精神病药物与微生物群落α多样性的负相关性最高。
在另一项对双相情感疾病受试者的调查中,非典型抗精神病药物(APP)治疗与女性的微生物多样性降低相关,但与APP治疗的男性患者无关。在这一队列中,服用APPs的患者,其衣原体科和阿克曼氏菌的数量分别显著增加和减少。
在针对40种肠道共生菌代表的1000多种药物的大规模体外筛选研究中,据报道,24%的受试药物对至少一种细菌菌株表现出生长抑制。这些药物对相当相似的物种模式具有抗菌活性,表明直接抗菌活性可能是其药理作用的一部分,不应将其视为副作用。因此,迫切需要评估精神药物对胃肠道菌群的潜在影响。
阿片类药物
肠-脑轴的双向方面也反映在这样一个事实,即肠道神经胶质细胞的 GDNF 等分泌因子也通过粘膜免疫系统的成熟以及通过加强上皮紧密连接功能来调节微生物稳态。阿片类药物介导的 GDNF 表达降低也与肠道通透性增加和肠粘膜表面免疫监视改变有关。这些因素有助于维持阿片类药物治疗观察到的促炎环境,导致下游阿片类药物相关的合并症,如阿片类药物耐受、依赖和戒断。

Jalodia R, et al., J Neuroimmune Pharmacol. 2022
此外,来自肠神经元的神经元介质(例如,VIP、ACh、NO)的阿片类药物抑制释放会导致胃肠道分泌减少、水和电解质吸收增加、蠕动减少,从而导致阿片类药物诱导的便秘,进一步导致微生物群失调。总之,虽然 OUD 的药物治疗是可用的,但它们并非对所有患者都有效。
根据国际益生菌和益生元科学协会(ISAPP)的说法,“益生元是指宿主微生物群体专门利用的、对健康有益的非活性食品成分。”作为益生菌补充的替代品,益生元可用于调节肠道菌群。
这组化合物通过其影响胃肠道健康的能力进行鉴定,包括不可消化低聚糖(NDO)、母乳低聚糖(HMO)和可溶性可发酵纤维。尽管益生元疗法在增强有益细菌(如双歧杆菌和乳酸杆菌)方面具有潜力,但只有少数研究检测了这些化合物对人类和动物肠道菌群的有益影响。对低聚半乳糖和低聚果糖或其组合对雄性小鼠的作用的研究表明,这些化合物具有抗抑郁、抗焦虑作用,并逆转慢性应激的作用。
在一项安慰剂对照临床试验中,服用N-乙酰半胱氨酸8周后,自闭症婴儿的易怒性和重复行为有所下降。此外,补充商业益生元药物B GOS(Bimuno)和限制性饮食可改善自闭症儿童的行为,这可能是由于乳酸杆菌和双歧杆菌含量较高。
最近的一项研究还表明,益生元乳果糖可以通过自噬和抗炎途径改善阿尔茨海默小鼠模型的认知缺陷。因此,这些发现似乎表明益生菌和益生元是神经系统疾病的有效治疗选择。然而,考虑到仅仅是相关性并不一定表明因果关系,需要进行额外的调查以详细了解潜在的机制。
健康个体和患者肠道微生物群组成和功能的变化已被确定为各种神经系统疾病。人们已经认识到,饮食可以影响微生物组成,改变肠-脑轴的功能。多种治疗干预措施已用于治疗肠道微生物群落失调,恢复肠道微生物群落平衡,改善神经系统疾病的临床结果,包括使用益生菌。
益生菌在普通食品和药片中的应用越来越流行。益生菌主要由双歧杆菌和乳酸产生菌组成,例如乳酸杆菌。越来越多的证据表明,益生菌合成的代谢物是饮食诱导的宿主-微生物相互作用的基本介质。此外,一些肠道细菌种类,如拟杆菌、梭菌、双歧杆菌、消化链球菌、乳酸杆菌和瘤胃球菌,可产生多种色氨酸分解代谢产物,包括吲哚、3-甲基吲哚、吲哚乙酸(IAA)、色胺等。
新出现的数据表明,微生物组衍生的色氨酸分解代谢影响宿主健康。已经证明,这些代谢物可与AhR结合,从而激活免疫系统,改善肠道屏障功能,刺激胃运动活动(以及胃肠激素的分泌),发挥全身或局部抗氧化、抗炎作用,并可能调节肠道微生物组和代谢组。
据报道,由共生微生物群合成的色氨酸分解代谢物可诱导小胶质细胞AhR激活,抑制NF-kB信号、VEGF-B和TGF-α的激活。此外,AhR在树突状细胞中高度表达,控制分化和功能。树突状细胞中维甲酸、犬尿氨酸和AhR驱动的细胞因子的产生增强T-reg细胞的分化,抑制EAE作为多发性硬化动物模型的发展。
AhR信号在肠道和大脑中的作用
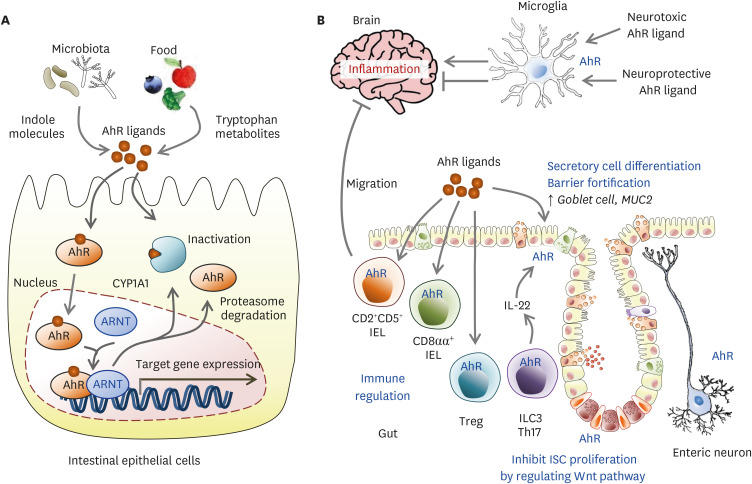
Gwak MG, et al., Immune Netw. 2021
星形胶质细胞在炎症介导的神经退行性变中发挥关键作用,发挥神经毒性作用,激活和招募与中枢神经系统发病机制有关的其他细胞。据报道,在EAE和多发性硬化动物模型中,星形胶质细胞的转录谱显示AhR表达上调。
最近的研究得到了几种神经系统疾病相关临床证据的支持,证明越来越重视使用益生菌和益生元来调节胃肠道微生物群。
使用小鼠模型进行的几项研究表明,益生菌的施用可有益于几种神经系统疾病(如自闭症、癫痫和阿尔茨海默),从而改善认知结果。然而,关于益生菌给药对人类神经功能障碍的有效性,临床证据仍然很少。
对几名患有焦虑和胃肠道症状的3-12岁自闭症儿童进行的调查发现,使用名为Visbome的特殊配方,包括八种不同的益生菌菌株,主要是乳酸杆菌,是安全的,并导致保留乳酸菌患者的自闭症和胃肠道症状的健康改善。
此外,当使用益生菌治疗人类神经退行性疾病(包括阿尔茨海默)时,已经发现了有希望的结果。首先,据报道,植物乳杆菌能够改善阿尔茨海默小鼠模型的认知能力并增加大脑中乙酰胆碱酯酶的水平。在患有阿尔茨海默的啮齿动物散发模型中,用嗜酸乳杆菌、发酵乳杆菌、乳酸双歧杆菌和长双歧杆菌进行Ab注射也发现类似结果。另一项随机临床研究表明,益生菌与鼠李糖乳杆菌GG(ATCC 53103)合用可能减少75名自闭症婴儿的多动症发展,并可能减少神经精神疾病的发展。
证据还表明益生菌对帕金森病患者的影响。最近的一项研究表明,长期服用由六种细菌组成的益生菌可减轻帕金森病遗传小鼠模型的运动损伤,并对多巴胺能神经元具有神经保护作用。
合生元是指益生元和益生菌的混合物,其中益生元有利于益生菌微生物的生长和代谢,提高其生存能力和效益,通过增加胃肠道中有益微生物的丰度来影响宿主。
合生元中使用的组合必须适当,以支持益生菌微生物在胃肠道中的存活。研究表明,使用合生元比单独使用益生菌或益生元更有效。结果表明,由GOS和包括瑞士乳杆菌和长双歧杆菌在内的多序列益生菌组成的合生元制剂可减少抑郁症症状,并改善重度抑郁症中的色氨酸信号。
随机对照试验中使用含合生元的多序列益生菌和益生元治疗的结果导致帕金森队列中功能性胃肠道症状的改善。婴儿双歧杆菌和低聚糖作为合生元被证明对缓解自闭症中的肠道相关疾病有效。然而,合生元对微生物群-肠-脑轴的影响还需要更多的研究 。
后生元,也称为代谢、生物原或CFSs(无细胞上清液),由细菌发酵代谢产物和从活细菌中获得或在细菌细胞裂解后释放的可溶性因子组成,如短链脂肪酸、酶、AMP、磷壁酸、胞内和胞外多糖、细胞表面蛋白、维生素、血浆素和有机酸。
非活性益生菌paraprobiotics被定义为不可存活或失活的微生物细胞,而一些研究人员将其作为后生物的一个亚组。非活性益生菌是一种结构成分,若给予适量,可能会触发宿主的生物活性。
灭活可通过各种方法实现,如物理(热灭活益生菌、紫外线照射或超声波)或化学方法。生物活性化合物,如肠道肽,是细菌与宿主相互作用的结果,被认为是益生元。热灭活副干酪乳杆菌PS23缓解了皮质酮诱导的焦虑样表型,改善了海马和前额叶皮质中的多巴胺水平。
关于大脑健康,对患有心理社会应激的小鼠进行短链脂肪酸组合(乙酸盐、丙酸盐和丁酸盐)治疗的研究显示了抗焦虑作用。
根据最近发现的微生物干预在调节肠道失调引起的神经系统疾病方面的潜力,粪便微生物群移植(FMT)似乎是一种有希望的治疗策略。
这种相对较新的治疗方法包括从健康粪便样本捐赠者及其微生物和代谢物转移到接受者。这种方法目前被用于治疗艰难梭菌感染,与抗生素治疗一起使用。
通过FMT,健康微生物群通过繁殖自我替换,并产生生物活性代谢物。口蹄疫是通过使用内窥镜、灌肠和冷冻干燥材料口服喂养来完成的。该方法的潜力已被用于治疗帕金森病、自闭症和多发性硬化症等神经系统疾病。这种方法的优点之一是没有明显的副作用报告,即使在高危患者中也被认为是安全的。
在最近一项关于自闭症小鼠的研究中,评估了体外培养的肠道微生物移植(GMT)的效果,该移植显著减轻了小鼠的焦虑样行为。在另一项研究中,对接受FMT的自闭症患者进行了结肠镜检查,结果证明自闭症相关症状显著改善,他们的肠道微生物群改变为健康状态。然而,需要更多的研究来进一步阐明FMT对自闭症患者的影响。
在动物模型中对阿尔茨海默进行了大量研究,但没有对人类患者进行具体研究。对阿尔茨海默小鼠模型的研究结果表明,认知功能障碍与肠道微生物群组成的变化有关;因此,通过FMT对该微生物群进行修饰被证明能有效缓解阿尔茨海默患者的认知功能障碍。许多关于FMT的神经系统疾病的研究已经完成,许多试验正在进行中。因此,很快就会有大量证据。
通过治疗性微生物干预调节肠道微生物群
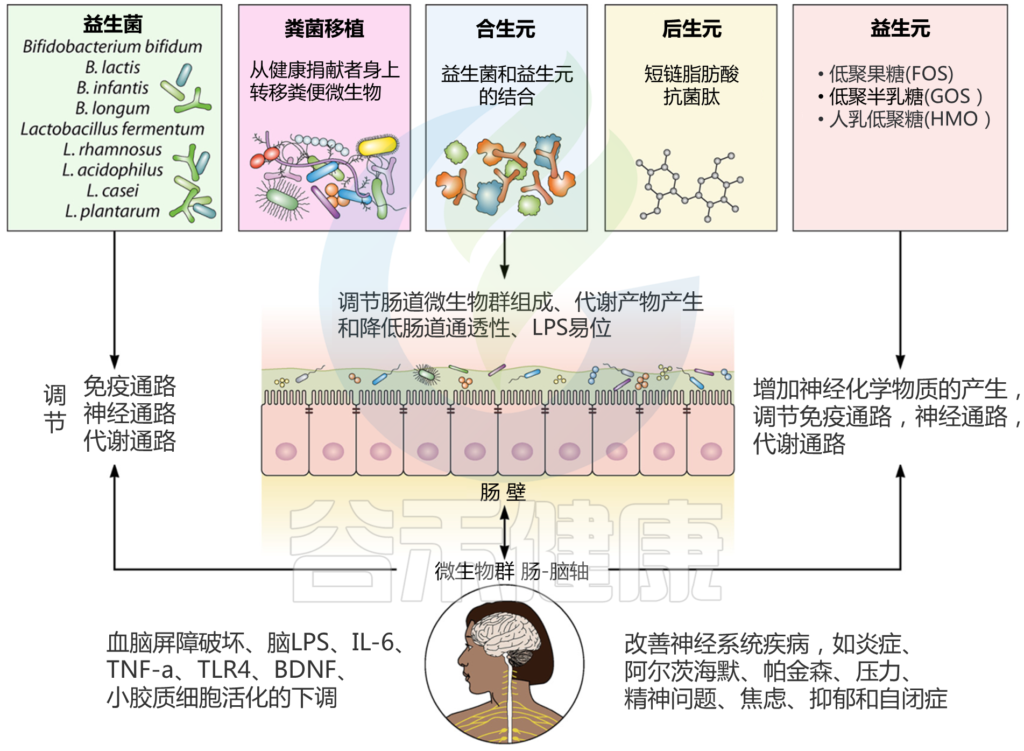
Sorboni SG, et al.,Clin Microbiol Rev. 2022
其他(食物及补充剂)
改善肠脑轴的食物
食物已被证明可以改善肠脑功能。其中许多含有精神生物化合物,包括:
Omega-3 脂肪
存在于油性鱼类和亚麻籽中,已被证明可以改善青春期和成年期的微生物群多样性。这可以降低患精神分裂症和抑郁症等脑部疾病的风险。
发酵乳制品
如酸奶和奶酪中发现的各种益生菌菌株。这些已被证明可以调节大脑活动。
富含纤维的食物
如水果和蔬菜、全谷物和坚果。这些含有益生元纤维,可降低皮质醇水平并改变情绪偏见。
富含多酚的食物
肠道菌群失调导致肠上皮黏膜屏障和血脑屏障通透性增高,并通过肠-脑轴的免疫、内分泌和肠神经途径影响阿尔茨海默的发生发展。多酚类化合物可能通过上述机制发挥防治阿尔茨海默的作用。
详见:肠道微生物群与膳食多酚互作对人体健康的影响
食用蘑菇类
香菇含有大量的维生素B6。因为维生素 B6 会影响血清素和神经递质的产生,所以健康的 B6 水平与积极的情绪和自然地减轻压力有关。
在动物研究中,它也被证明可以有效治疗抑郁症等情绪障碍。
坚果
如杏仁、腰果、核桃和巴西坚果。研究表明,食用这些会提高血清素的水平,血清素是一种让人感觉良好的化学物质,血清素降低,人会感到沮丧。
富含酪氨酸的食物
如杏仁、蛋鱼和鸡肉,富含酪氨酸,酪氨酸是一种能提高大脑多巴胺水平的氨基酸。
其他:
L-苏糖酸镁
镁对大脑至关重要,它是制造许多参与大脑功能的酶的必要辅助因子。它对于维持和发展突触之间的联系也至关重要,突触是学习和记忆的核心任务。大脑和脑脊液中高水平的镁与阿尔茨海默病和大脑衰老的发病率降低有关。补充剂 L-苏糖酸镁比其他镁形式更有效地通过血脑屏障,并且不会引起消化不良。
维生素 D3 和 维生素 K2
血清维生素 D 高水平对于维持大脑健康和降低阿尔茨海默病和其他神经退行性疾病导致的认知障碍风险极为重要。维生素 D 的抗炎和抗氧化特性也很重要。
相反,低维生素 D 会导致大脑中的钙含量增加,这与抑郁症有关,并且会导致表征痴呆的淀粉样蛋白斑块增加。
维生素 D 与维生素 K 协同作用以调节钙并防止其在软组织中积累,例如滋养大脑的血管。
补充剂应包括最易吸收的胆钙化醇(维生素 D3)形式的维生素 D,以及甲基萘醌(维生素 K2)形式的维生素 K,以帮助调理肠道。这种组合对预防血管钙化最有效。
姜黄素
姜黄根中的活性化合物姜黄素使咖喱粉呈现鲜艳的黄色。姜黄素激活 Nrf2 抗氧化信号通路,开启参与解毒和消除自由基的基因。
在大脑中,姜黄素补充剂具有强大的抗炎和抗氧化特性。姜黄素还通过抑制淀粉样蛋白的形成来帮助预防痴呆。姜黄素补充剂可以显著提高 BDNF(脑源性神经营养因子)的血清水平。BDNF 在保护现有神经元和刺激新神经元生长方面发挥着重要作用。
高水平可以帮助预防认知障碍,并有助于从脑震荡和脑损伤中恢复。
肠道微生物群不仅与消化吸收相关,还与大脑密切相关,从而影响各类神经系统疾病,如常见的自闭症、抑郁症、精神分裂症等。改善肠道健康后,通过肠脑轴的连接减少全身炎症,同时也改善心理健康。在现代社会普遍压力较大的情况下,注意减压的同时更不能忽视肠道健康。
主要参考文献:
Li XJ, You XY, Wang CY, et al. Bidirectional Brain-gut-microbiota Axis in increased intestinal permeability induced by central nervous system injury. CNS Neurosci Ther. 2020;26(8):783-790. doi:10.1111/cns.13401
Deidda G, Biazzo M. Gut and Brain: Investigating Physiological and Pathological Interactions Between Microbiota and Brain to Gain New Therapeutic Avenues for Brain Diseases. Front Neurosci. 2021;15:753915. Published 2021 Oct 12. doi:10.3389/fnins.2021.753915
Gwak MG, Chang SY. Gut-Brain Connection: Microbiome, Gut Barrier, and Environmental Sensors. Immune Netw. 2021;21(3):e20. Published 2021 Jun 16. doi:10.4110/in.2021.21.e20
Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan 5;35(1):e0033820. doi: 10.1128/CMR.00338-20. Epub ahead of print. PMID: 34985325; PMCID: PMC8729913.
Suganya K, Koo BS. Gut-Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. Published 2020 Oct 13. doi:10.3390/ijms21207551
Jalodia R, Abu YF, Oppenheimer MR, Herlihy B, Meng J, Chupikova I, Tao J, Ghosh N, Dutta RK, Kolli U, Yan Y, Valdes E, Sharma M, Sharma U, Moidunny S, Roy S. Opioid Use, Gut Dysbiosis, Inflammation, and the Nervous System. J Neuroimmune Pharmacol. 2022 Jan 7. doi: 10.1007/s11481-021-10046-z. Epub ahead of print. PMID: 34993905.
Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol. 2021 Apr;19(4):241-255. doi: 10.1038/s41579-020-00460-0. Epub 2020 Oct 22. PMID: 33093662.

谷禾健康
Sutterella——萨特氏菌
Sutterella是一种革兰氏阴性杆细菌,主要从肠道和胃肠道感染中分离出来的。其属的成员已从横膈膜下方的人类感染中分离出来。
来源:spectrumnews
Sutterella(萨特氏菌)是变形菌门最丰富的菌之一,是一种厌氧或微需氧的、耐胆汁、解糖 、非运动性且不形成孢子和球杆菌形的短杆状革兰氏阴性球杆菌。
Sutterella菌的体型极小,约0.4 到 2 微米,只能在培养基上形成小型菌落。当收集的细菌聚集成一团时,呈现为红色的特征。
肠道Sutterella中主要分为两大类,分别为华德萨特菌(Sutterella wadsworthensis)和粪链球菌(Sutterella stercoricanis)。
其中Sutterella wadsworthensis 菌是一种不溶性、硝酸盐阳性、脲酶阴性的有机体,需要甲酸盐、富马酸盐或氢作为生长添加剂,并可在琼脂培养基中培养。
扫描电子显微镜图像(S. wadsworthensis)
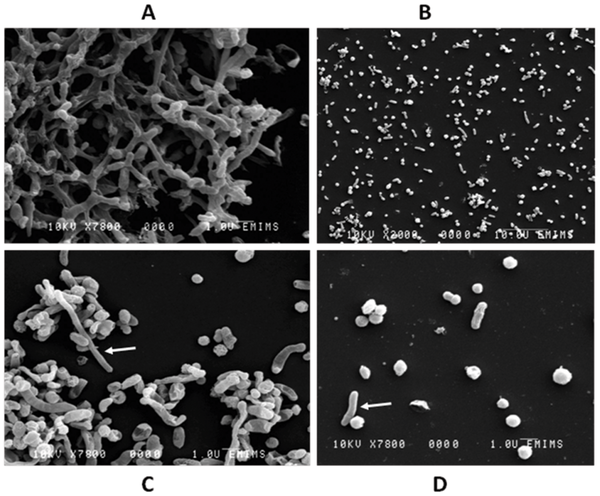
Mukhopadhya I, et al., PLoS One. 2011
Sutterella通常与人类疾病有关,例如自闭症、唐氏综合症和炎症性肠病 (IBD),但这些细菌对健康的影响仍不清楚。
Sutterella 属的成员是肠道重要的共生菌,在健康成人的十二指肠中含量丰富,朝向结肠的梯度逐渐减小。在人类胃肠道中具有轻度促炎能力,并且对与微生物群失调和变形菌增加相关的上皮稳态破坏没有显著贡献。
母体传播,IgA缺乏
——Sutterella可以将肠道疾病从母亲传给后代
一项发表在《自然》杂志上报告说,该研究发现,母鼠可以通过一种名为 Sutterella的肠道细菌,将肠道疾病的易感性传递给她的后代,例如炎症性肠病。
长期以来,科学家们一直推测,母亲可以通过分娩过程,然后通过母乳喂养和接吻将有益细菌传递给她的后代。这些无数的细菌迅速传播并覆盖婴儿的皮肤、口腔和消化道。
到目前为止,大多数医生都认为 IgA 缺乏症(见于慢性腹泻、克罗恩病和溃疡性结肠炎等疾病)主要是遗传性的,这意味着这种缺乏症是通过基因遗传的。这一新发现是首次鉴定出后代可以遗传的特定特征——是一种称为免疫球蛋白 A 或 IgA 的血液蛋白缺乏,它是肠道疾病的根源——由特定的可以从母亲传给后代的细菌基因引起。
研究发现成年小鼠通过粪便将 Sutterella 细菌传播给彼此,而母鼠在出生后不久将 Sutterella 细菌直接传播给它们的后代,从而传递了这种低 IgA 的特征。Sutterella 抑制 IgA 的分泌。但是注意Sutterella 可能只是改变人类疾病易感性的众多细菌之一。
炎症
——Sutterella具有抑制降解IgA的能力
Sutterella会过分泌IgA蛋白酶,降解IgA,从而降低肠粘膜中IgA的浓度,损害肠道抗菌免疫反应功能。但有实验指出Sutterella并不会引起大量的炎症反应,但是因为这项研究并没有确切以及多项的实验进行证明,所以并不能得出决定性的结论。
粪菌移植研究中发现,Sutterella的丰度和UC(溃疡性结肠炎)缓解程度呈负相关;并且,在临床队列的研究中发现,Sutterella丰度和炎症细胞因子(IL-12, IL-13,IFN-γ)水平呈负相关。
同样的,在一组体外实验中Sutterella能黏附于肠上皮细胞,促进IL-8的分泌,有轻微促炎作用,但不破坏单层上皮细胞完整性。
炎症性肠病 (IBD) 发生在遗传易感个体中,这是由于未知的环境触发因素所致,可能是迄今为止未知的细菌病原体。
儿科炎症性肠病或乳糜泻患者与健康对照组之间 Sutterella 丰度未检测到显著差异。
另一项研究中表明,炎症性肠病成人结肠活检中 Sutterella wadsworthensis 的丰度与对照组没有差异, Sutterella parvirubra 比其他两种 Sutterella 粘附性更好。
S. wadsworthensis 最初更频繁地从 IBD 受试者中分离出来,因此进行了这项综合研究以阐明其在 IBD 中的作用。利用这些样本,开发了一种新设计的 PCR,以研究这种细菌在成人溃疡性结肠炎患者中的流行情况。
发现83.8% 的成年溃疡性结肠炎患者检测到Sutterella wadsworthensis,对照组为86.1% (p= 0.64). Sutterella 16S rRNA 基因序列也在克罗恩病和溃疡性结肠炎患者的肠活检和粪便样本中得到鉴定。但因缺乏相关流行病学以及致病潜力的证明,所以对其是否存在人类感染以及炎症部位的物种代表原因还有待研究。
腹泻
——Sutterella对于腹泻具有正相关影响
在一项对健康仔猪进行的实验中,采用16srRNA基因测序和宏基因组等技术测序粪便菌群得到其在属水平中,断奶前腹泻仔猪粪便菌群Prevotella、Sutterella和Anaerovibrio相对丰度都具有显著的增加。
在对关于抗生素性腹泻(Antibiotic-associated diarrhea,AAD)的相关实验中,30只七周龄SPF级雄性大鼠的粪便样本进行高通量测序发现,中药制剂在缓解抗生素性腹泻的同时,也显著改变了肠道菌群结构组成。其中,Sutterella属的相对丰度与SLBZS的给药呈负相关,与AAD病情的发展呈正相关,表明Sutterella属对于AAD的发生发展可能有重要作用。
而在属水平上,Sutterella属和Bacteroides属可能与AAD的发生发展关系密切。
粪菌移植FMT治疗效果
研究发现Sutterella可能在FMT治疗反应中起重要作用。在FMT治疗前后收集的患者粪便和结肠样本中,与未获得缓解的患者相比,FMT后未达到缓解患者体内的Fusobacterium gonidiaformans、Sutterella wadsworthensis和大肠杆菌种类增多,血红素和脂多糖生物合成水平增加。
一系列微生物类群与缓解不足有关,包括梭杆菌属(Fusobacterium)、萨特氏菌(Sutterella)、嗜血杆菌、大肠杆菌、嗜双歧杆菌等。
Sutterella、Eshcerichia和血红素生物合成可能允许为溃疡性结肠炎的FMT治疗精心选择合适的供体和患者,并告知如何修改FMT治疗或更明确的(如窄谱)治疗微生物操作,以提高其治疗效果。
自闭症
研究人员发现,被诊断患有自闭症和胃肠道紊乱的儿童中,超过一半的肠道活检组织中存在 Sutterella菌,而通常发育中的胃肠道紊乱儿童的活检组织中没有 Sutterella。
胃肠道症状,如便秘、腹泻、腹痛和腹胀,在自闭症儿童中很常见。但目前尚不清楚胃肠道不适是自闭症的核心特征还是挑食或其他疾病症状的结果。
研究人员已从阑尾炎等感染和克罗恩病(一种导致胃肠道炎症的自身免疫性疾病)患者中分离出Sutterella。然而,目前尚不清楚这些细菌是感染的原因还是后果,也不知道它们是否总是存在于健康个体中。
目前尚不清楚儿童的胃肠道症状是否是由Sutterella引起的,但这种细菌可能会取代有益的共生细菌,从而导致症状。
11名孤独症儿童和1名对照儿童也携带与Sutterella交叉反应的抗体,Sutterella是感染和炎症的迹象。根据PCR分析,其中三名儿童对Sutterella不呈阳性,这表明总共有15名儿童可能携带该细菌。
肥胖
Sutterella是 LPS 的重要来源之一,可影响肠道通透性,导致血浆中 LPS 浓度增加(内毒素血症),与肥胖受试者典型的慢性低度炎症有关。大部分研究表示体重和脂肪量的增加以及空腹胰岛素与拟杆菌、梭状芽孢杆菌、Sutterella 和肠杆菌科呈负相关。
运动健身锻炼可以有助于减肥,一项研究证实高效有氧健身锻炼与Sutterella丰度增加和物种多样性呈正相关。
其他
● 由21号染色体三体所引发的神经发育遗传病——唐氏综合症,其患者的异常行为评分与大量的Sutterella显著相关。
● 通过对Roux-en-Y胃转流术(RYGB)和SG后二型糖尿病(T2D)的特定肠道微生物群的研究发现,其Sutterella可能对RYGB后T2D患者的糖代谢产生有益的影响。
Sutterella对于人体健康的影响并不仅限于以上病症,大多可归类为胃肠道类紊乱以及神经系统性疾病。
岩藻多糖
岩藻多糖具有降低Sutterella丰度的作用。
岩藻多糖是一种从褐藻中获取的复杂硫酸多糖,被认为是一种蛋白益生元。它可以改变肠道菌群,减缓环磷酰胺诱导的肠道粘膜损伤,减少宿主中的抗原负载和炎症反应。并且,岩藻多糖对减少Sutterella 的丰度,以及提高Prevotella的丰度具有显著的效果。
一项健康成年人多酚干预研究显示Sutterella增加。
低聚半乳糖
低聚半乳糖和低聚果糖的组合可以改善抑郁的症状。
补充低聚半乳糖(GOS)以及低聚果糖(FOS)的混合补充物,可以改善啮齿动物的焦虑以及抑郁的行为。
一项研究指出给狗服用益生元后检测出更多的Sutterella。
由于现今对Sutterella 相关的临床性实验以及具有说服力的研究数据不足,无法支持证明其作用完全性。Sutterella 决定性作用以及对人体的确定性影响还有待研究。
维生素D
与所有营养素一样,维生素适量会帮助身体健康。但是高剂量的维生素会导致小鼠发生严重的结肠炎,Sutterella 的增加,表明高剂量维生素D导致向促炎症微生物群的转变。此外,高剂量维生素D小鼠的血清维生素D水平显著下降,并伴有结肠炎,这可能是由于维生素D代谢产物因摄入过量维生素D引起的肠道炎症所致。
提高维生素D还应该多晒太阳和补充维生素D的丰富的食物,如鱼油等。
此外,Sutterella显示对甲硝唑的耐药性。
主要参考文献:
Targeting Gut Microbiota Dysbiosis: Potential Intervention Strategies for Neurological Disorders[J].Engineering,2020, 6(4):415-423.
Williams BL, Hornig M, Parekh T, Lipkin WI. Application of novel PCR-based methods for detection, quantitation, and phylogenetic characterization of Sutterella species in intestinal biopsy samples from children with autism and gastrointestinal disturbances. mBio. 2012 Jan 10;3(1):e00261-11
Xue M, Ji X, Liang H, et al. The effect of fucoidan on intestinal flora and intestinal barrier function in rats with breast cancer[J]. Food & Function, 2018, 9(2).
Sutterella Species, IgA-degrading Bacteria in Ulcerative Colitis,
10.1016/j.tim.2020.02.018,2020-03-23.
Hiippala K, Kainulainen V, Kalliomäki M, Arkkila P, Satokari R. Mucosal Prevalence and Interactions with the Epithelium Indicate Commensalism of Sutterella spp. Front Microbiol. 2016 Oct 26;7:1706.
Williams BL, Hornig M, Parekh T, Lipkin WI. Application of novel PCR-based methods for detection, quantitation, and phylogenetic characterization of Sutterella species in intestinal biopsy samples from children with autism and gastrointestinal disturbances. mBio. 2012 Jan 10;3(1):e00261-11.
Lv W, Liu C, Ye C, et al. Structural modulation of gut microbiota during alleviation of antibiotic-associated diarrhea with herbal formula[J]. International Journal of Biological Macromolecules, 2017.
Adams JB, Johansen LJ, Powell LD, Quig D, and Rubin RA. 2011. Gastrointestinal flora and gastrointestinal status in children with autism—comparisons to typical children and correlation with autism severity. BMC Gastroenterol. 11:22.
Greetham HL et al. 2004. Sutterella stercoricanis sp. nov., isolated from canine faeces. Int. J. Syst. Evol. Microbiol. 54:1581–1584.