 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

糖,作为我们日常饮食中不可或缺的一部分,不仅为我们提供能量,还影响着我们的健康。然而,糖与健康的关系比我们想象的要复杂得多。
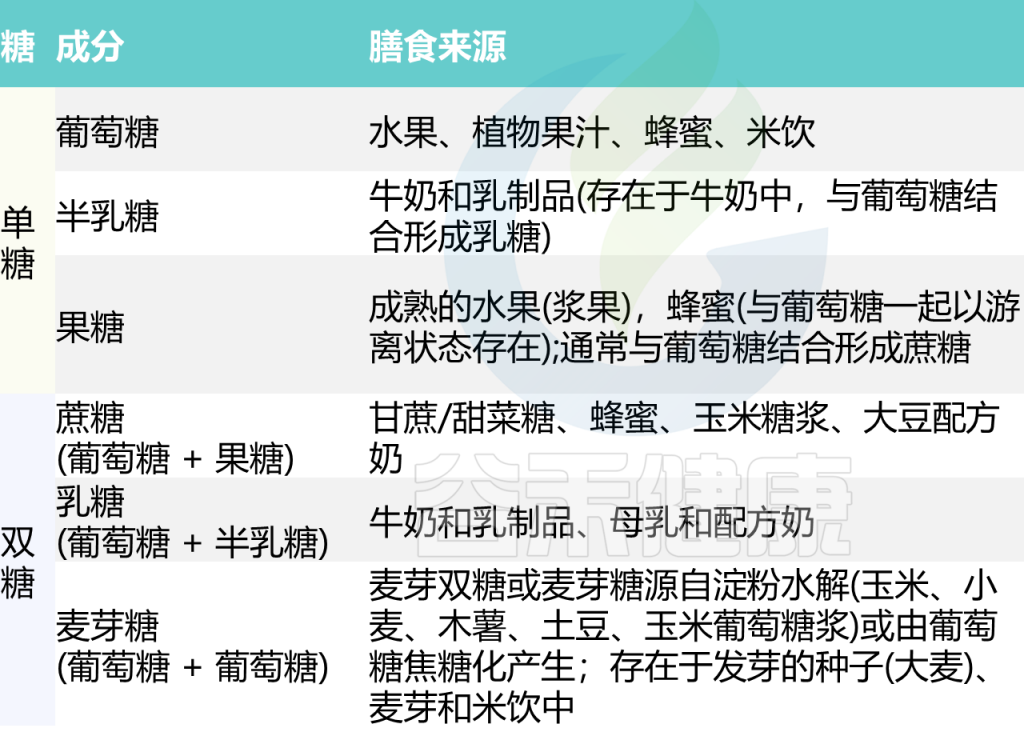
它们可以是单糖(例如葡萄糖、果糖、半乳糖)或二糖(例如蔗糖、麦芽糖、乳糖)或更复杂的形式(例如聚合物或多糖)。
然而,当这些类型的糖作为成分添加到加工食品中以赋予甜味时,它们通常与慢性疾病相关的过量糖摄入有关。例如,添加糖与代谢综合征、肥胖、心脏病、胰岛素抵抗、脂肪生成、糖尿病和相关的视网膜病、肾脏疾病和炎症有关。
糖与这些疾病之间的联系至少部分是通过肠道微生物组实现的,这意味着现有糖和新型甜味剂消耗的增加,改变了微生物组可用的碳水化合物库,在肠道中创造了独特的环境,包括充满了外源微生物或经过适应的内源微生物,其中一些是致病性的。
高糖摄入量会通过肠道微生物群的平衡,例如,改变变形菌门和拟杆菌门的比例,从而增加促炎特性、降低免疫调节功能和降低调节上皮完整性的能力。高肪高糖饮食通过消耗 Th17 诱导微生物促进代谢疾病。
有时候明明知道糖或甜食不能吃多,可就是忍不住… 超加工食品和垃圾食品以及添加糖和人造甜味剂等成分会改变肠道中的微生物组成。这会增加有害菌数量,不利于健康,然而,当我们吃这些食物越多,相关有害菌越繁殖,增加我们对某些食物的渴望,从而陷入恶性循环中。
为了了解糖类对我们健康的影响,我们需要清楚地了解它们是什么、有何不同,以及为什么某些类型被认为“不太健康”,而另一些类型“更有利于健康”,不同种类的糖会影响不同的菌群,本文我们来了解一些关于糖的基本知识,探讨不同种类的糖对肠道菌群和健康的影响,以及如何通过饮食调节来优化肠道菌群,从而促进全身健康。
▼
糖从哪里来?
最早人们从咀嚼甘蔗中感受到甜味,甘蔗种植可以追溯到公元前9000年~6500年之间的大洋洲。后来甘蔗种植传到中国。
起初,糖仅限于医疗用途,是贵族的奢侈品。但在17世纪,南美和加勒比地区出现了奴隶经营的糖料种植园,降低了糖的成本,增加了糖的供应。从那时起,糖被添加到日常食品中,如茶、水果、面包和肉类,工人阶级也能享用,成为西方生活的必需品。
随着人们对糖的了解越来越深入,从最初对糖的简单使用,到逐渐认识到糖的多样性和复杂性。
膳食糖包括不同来源的糖,可以是天然存在的或添加的。目前有几种膳食糖的定义,其中包括添加糖、游离糖、总糖等。认识不同类型的糖之间的区别,对于更好地理解糖摄入量与健康之间的关联至关重要。
“天然糖”: 即天然存在于食物中的糖,如水果中的果糖和葡萄糖,牛奶中的乳糖等。这些糖是食物固有的成分,通常与食物中的其他营养成分(如纤维、维生素和矿物质)共同存在。
“添加糖”,即在食品加工和制备过程中添加的所有糖和糖浆。它们不包括牛奶、水果和蔬菜中的天然糖分。
含糖饮料是饮食中添加糖的最大来源。这些糖不是食物固有的成分,而是额外添加的。添加糖常见于加工食品、饮料、甜点和调味品中。过量摄入添加糖与肥胖、糖尿病、心脏病等健康问题密切相关。
“游离糖”,根据世界卫生组织的定义,包括制造商、厨师或消费者添加到食品中的所有单糖和双糖,以及天然存在于蜂蜜、糖浆和果汁中的糖。成人摄入量要控制在每日能量的10%以内。
完整水果中天然存在的糖以及母乳或婴儿配方奶粉、牛/羊奶中天然存在的乳糖,以及无糖奶制品不是游离糖。
可以看到,一般来说,游离糖和添加糖没有太大区别。因此,如果看到一些食品标签写着「无游离糖」、「无添加糖」其实都是差不多意思。
“总糖”,包括食物中天然存在的所有糖以及添加的糖。例如牛奶和水果中的糖以及产品中可能存在的任何添加糖。
这些定义自然包括所有单糖和双糖。
注:单糖如葡萄糖、果糖、半乳糖,是最基本的糖单元,不能再分解为更简单的糖。
双糖如蔗糖、乳糖、麦芽糖,由两个单糖分子组成。
糖的常见膳食来源
10.1097/MPG.0000000000001733
首先,根据《GB28050-2011预包装食品营养标签通则》:
当食物或饮料中的单双糖含量≤ 0.5g/100(固体)或100 mL(液体)时,可以标注为“无糖”、“不含糖”或“0糖”。
低糖一般指固体产品每100克中含糖量不超过5克,或液体每100毫升中含糖量不超过2.5克。
“0蔗糖”,就是没有添加蔗糖。我们常见的糖,比如说白砂糖、冰糖、红糖、黄糖、黑糖的主要成分都是蔗糖。也就是没有添加白砂糖这类糖。
市面上所谓的无糖食品,如无糖糕点、无糖月饼、无糖粽子等,这些食品只是不放蔗糖,但是有别的果糖,木糖醇等。所以严格来说,也不是没有糖。
果糖GI(升糖指数)较低,对血糖更友好;不易产生龋齿;增强口感等诸多优势,成为了不少所谓无糖食品的甜味来源。
不要以为只有蛋糕、饼干、甜甜圈和糖果等含有添加糖,添加糖隐藏在许多意想不到的食物中,例如加工冷冻食品、婴儿食品、干果、谷物、麦片、即食燕麦片、沙拉酱、番茄酱、烧烤酱、意大利面酱、调味酸奶、蛋白质棒等,甚至一些有机食品和其他健康食品中。
加工食品中的隐形糖
食品制造商在生产“低脂”和“脱脂”产品时,通常会提高糖含量以保持风味和质地。有些高档饮料可能含有比你想象的更多的糖,有时候午餐吃的“健康”沙拉上的“精简”调味料也是如此。
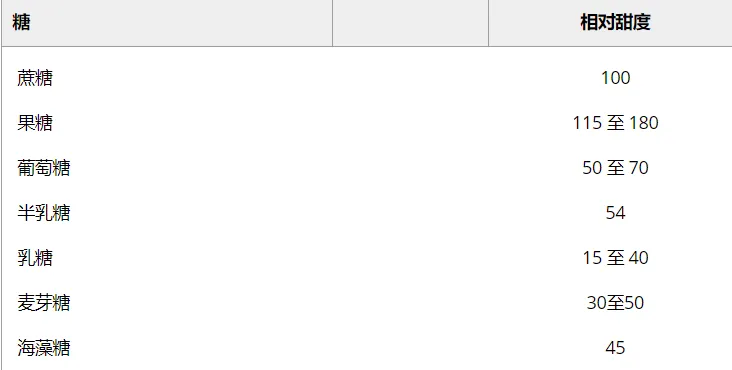
糖的主要功能是它们的甜味。所有糖都会传达一定的甜味感觉,但甜味的强度、质量和时间分布(定义为强度随时间的变化)因糖的类型而异。
普通糖的相对甜度值占等浓度蔗糖甜度的百分比
doi.org/10.1111/1541-4337.12194
不同糖类食物升高血糖的速度和程度不同,用GI值表示。葡萄糖的GI值定义为100,其他食物与之比较。
也就是说,高GI的食物会快速升高血糖,身体分泌大量胰岛素使血糖快速下降,造成饥饿感,导致吃的更多,恶性循环。
高 GI 被定义为 70 或更高,与面包、早餐麦片或大米有关,精制的糖通常GI值较高,蔗糖的GI为65。
用加工过的谷物或其他碳水化合物来源代替蔗糖可能会导致升糖指数更高,从而对血糖反应产生更大的影响。
而低 GI 被定义为 55 或更低,与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
果糖的GI值非常低。
并非所有加工食品都具有高 GI,也有中等 GI 的加工食品与蔗糖相当,包括各种巧克力或谷物棒、蛋糕或某些早餐谷物。
很多人都喜欢各式各样的糖,它为食物和饮料增添了风味,包括甜点、糖果、奶茶、冰淇淋、汽水等。然而,随着人们对健康饮食意识的提高,糖分摄入对健康影响的讨论也日益增多。糖分的摄入不仅关系到口感享受,更与我们的身体健康紧密相连。
注:适用于人类饮食的糖一词是一个统称。例如,食糖基本上是纯蔗糖,而果汁、蜂蜜和糖浆通常含有蔗糖、葡萄糖、果糖和不同的低聚糖。这里说的“糖”包括所有这些术语。
从有利的角度来说,糖是身体的首选燃料来源,也是日常活动的必需营养素。当我们吃糖时,我们的系统中有消化酶将其分解成葡萄糖,这是细胞所需的能量形式。糖也会以糖原的形式储存在肌肉和肝脏中,以供将来用作能量。
当你处于饥饿或禁食状态时,肝脏中储存的葡萄糖会通过糖原分解和糖异生的过程释放出来,为肌肉提供稳定的燃料流并保持血糖稳定。
当你吃东西时,胰岛素激素会刺激糖酵解的过程,将吃的糖分解成能量。身体需要持续供应葡萄糖,这就是为什么每隔几个小时吃一次各种碳水化合物来源很重要。
没有糖,你可能会难以集中注意力和记住事情,如果糖不足,可能会感到疲劳,甚至出现脑雾等。
糖能让我们快乐,有些人甚至经常渴望吃糖。当吃糖时,大脑中会释放负责愉悦奖励和动机的神经递质多巴胺。吃糖和甜食的动力很大程度上是由多巴胺系统控制的,这就是为什么当你吃甜食时,情绪会发生变化。
但任何食物都讲究适量,过量摄入糖分也会给身体带来一系列的健康问题。
影响大脑功能
过多的添加糖会改变大脑的功能,并与认知能力下降和退行性疾病(如阿尔茨海默病和痴呆)有关。
2019 年一项针对 1,200 多名 60 岁以上马来西亚成年人的研究发现,过量摄入糖与较差的认知功能有关。
影响血糖
食用大量精制碳水化合物和添加糖会导致血糖急剧上升,你可能会在一段时间内感到精力充沛,但是这种短期修复可能会让你更加难受,陷入迟钝和疲劳。
它还可能导致胰岛素抵抗,从而导致长期高血糖。随着时间的推移,高血糖会对神经、心脏、眼睛和肾脏的小血管造成损害。
对于患有糖尿病或其他代谢疾病的人来说,即使是适量的糖也可能过多,这涉及代谢的问题,我们后面会详细讲。
影响体重
含糖产品,尤其是饮料,不会让你感到饱腹,而糖分的飙升会让你感觉更饿。饥饿感的增加会导致你吃得比你需要的多,甚至暴饮暴食。
增加压力
吃糖还会让人上瘾。甜食可以在短期内降低压力荷尔蒙皮质醇的水平,但从长远来看,它们可能会引起问题。糖会在大脑中释放舒缓的化学物质。问题在于,这种感觉良好的效果是暂时的,一旦消失,就会导致摄入更多的糖。
皮肤老化更快
过量糖分与皮肤老化加速有关,皮肤的弹性和紧致度主要依赖于胶原蛋白。糖化产物AGEs通过与这些蛋白质结合,使它们硬化和断裂,导致皮肤失去弹性和紧致度,加速出现皱纹和松弛。
糖化过程还会产生自由基,增加氧化应激,损伤皮肤细胞,干扰细胞的正常功能和修复过程,还可能激发炎症反应。
增加患慢性病的风险
过量添加糖会增加体内炎症和氧化应激,从而损害器官和组织。过量食用添加糖还与心血管疾病、 2型糖尿病、非酒精性脂肪肝和认知能力下降等慢性疾病的风险增加有关。
以上是我们了解到糖对人体直接影响,接下来我们逐步深入到糖在体内如何被处理,以及它如何间接通过影响肠道微生物群来影响健康。
糖进入人体内是如何消化的?
食用后,糖代谢在口腔内开始。口腔微生物组具有代谢糖的能力;然而,并非所有口腔微生物都以同样的方式代谢糖。变形链球菌被认为是口腔中与龋齿有关的关键微生物。
● 蔗糖长期以来被认为是最容易致龋的糖源。
● 乳糖致龋性低于葡萄糖、果糖、麦芽糖和蔗糖。
● 海藻糖的致龋性比蔗糖低,并且可能具有抗致龋特性。
注:糖并不是导致龋齿的唯一饮食因素。膳食来源的淀粉还可以直接通过微生物的新陈代谢或通过其在口腔中有限的水解成糖来促进龋齿。
在胃中糖的消化较少。食物进入小肠后,消化过程加速。胰腺分泌的胰液中含有多种消化酶,如淀粉酶,继续分解糖分子。小肠壁上的细胞也产生酶,如蔗糖酶、乳糖酶和麦芽糖酶,这些酶帮助将双糖分解成单糖,如葡萄糖和果糖。
单糖通过小肠壁的特殊运输蛋白被吸收进入血液。葡萄糖的吸收主要通过两种机制进行:
葡萄糖和半乳糖的“搬运工”:SGLT1、GLUT2
它们主要通过一种叫做SGLT1的”搬运工“被吸收。它位于肠细胞面向食物的一侧。SGLT1会抓住葡萄糖和半乳糖,同时也会抓住钠离子,然后把它们一起带进肠细胞内。这个过程像坐电梯,要消耗能量,通过Na+K+-ATP酶把钠离子泵出肠上皮细胞。
注:SGLT1,钠葡萄糖连接转运蛋白-1,是肠道中主要的葡萄糖转运蛋白(和传感器)
当葡萄糖和半乳糖进入肠细胞后,会遇到另一位”搬运工”叫GLUT2。GLUT2会把它们从肠细胞的另一侧送出去,进入我们的血液。然后,血液会把这些糖类运送到肝脏,供身体使用。
GLUT2 的神经元在大脑的不同区域充当葡萄糖传感器,有助于控制葡萄糖稳态和进食行为。
果糖:GLUT5搬运工数量有限,果糖吸收不良
而果糖的吸收方式有点不同。它主要通过一位叫做GLUT5的”搬运工”进入肠道细胞内,这个过程不需要消耗能量。然后和葡萄糖、半乳糖一样,果糖也通过GLUT2进入血液,最后到达肝脏。
不过,由于GLUT5这个”搬运工”的数量有限,而且很容易被果糖占满,所以果糖的吸收速度比葡萄糖和半乳糖要慢一些。
当单独大量摄入果糖(不含葡萄糖)时,会超过正常的果糖吸收能力,导致果糖在远端小肠和结肠中通过。这会导致胃肠道不适,包括痉挛和腹泻。这种现象被称为果糖吸收不良。
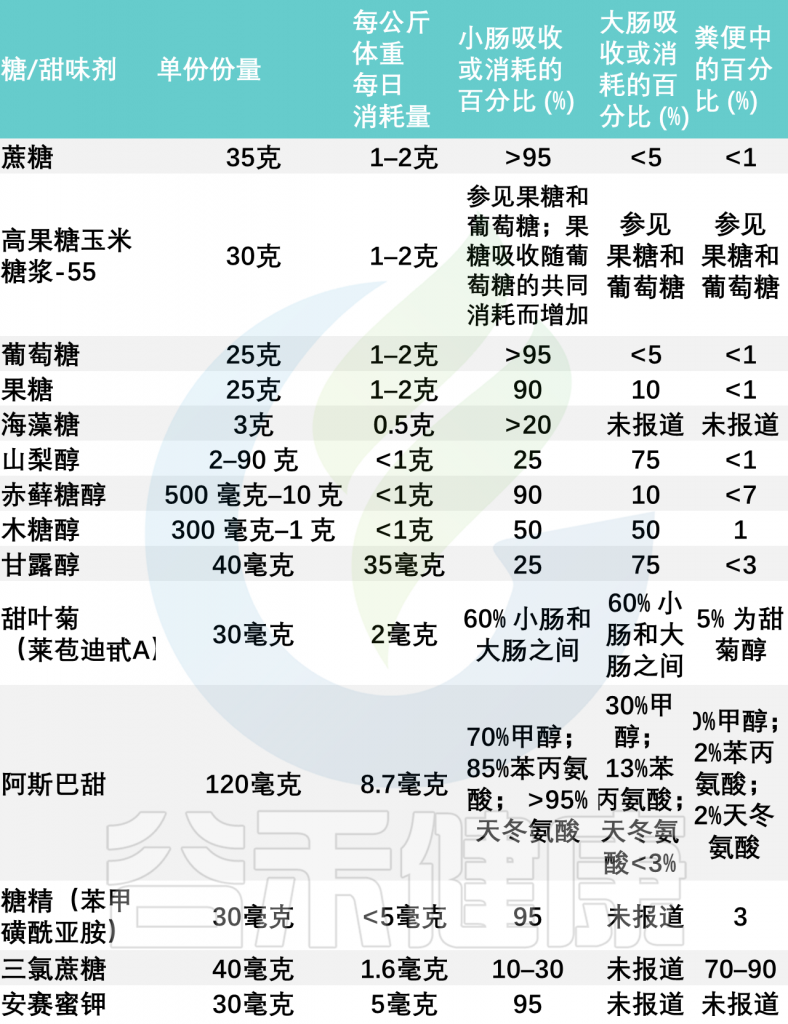
常见膳食糖和甜味剂的使用和吸收
doi: 10.1093/advances/nmz118
大多数糖和甜味剂通过糖转运蛋白在小肠中被主动吸收,因此,与大肠相比,小肠肠道环境中的糖和甜味剂含量丰富约10倍。这些可用糖是小肠微生物的重要底物。
当然,大肠中也并不缺乏糖和甜味剂。果糖、糖醇和一些甜味剂(例如三氯蔗糖)在小肠中被动地、缓慢地或非常差地吸收,高达 30-90% 的糖和甜味剂会进入大肠。过量食用这些糖和甜味剂很容易导致吸收不良并溢出到大肠。在那里它们成为肠道微生物的食物来源。这可能带来肠道菌群的变化,导致胃肠道不适和其他健康问题。
肠道菌群对糖的适应
宿主糖/甜味剂吸收、微生物产物和不同肠道条件的复杂性,会导致肠道内产生过多的肠道微环境。
“餐厅假说”——不同微生物觉得舒适的区域不同
在餐厅假说中,每一个环境都可以看作一家提供不同食物的餐厅,微生物在最能满足其营养和环境需求的环境中茁壮成长,这个环境就是它的生态位,且这个环境中来自其他微生物的竞争最少。
肠道从头到尾像是一个微生物主题公园,不同区域有不同的”餐厅“和”居民“。这就是肠道微生物的”生物地理学”。
沿着肠道找到的微生物变化,可能取决于肠道不同部位存在的糖/甜味剂的变化。微生物就好比食客,环境提供什么,它们就吃什么,最终你在哪里找到它们,取决于哪里有它们最爱的食物。
当然,相同的微生物可以存在于多个不同的、空间上分离的微环境中。也就是说微生物可以在不同的餐厅吃,为了最好地利用每种微环境,相同的微生物可能需要不同的调节、代谢和遗传适应。
这就可以理解为什么有些微生物在适应的环境是好的,在特定条件或特定肠道位置就开始致病。
微生物对糖的适应能力让它们在各种环境中生存并发挥作用,从而也会影响到人体健康。
碳水化合物改变肠道菌群的能力主要依赖于这些底物的不可消化或可消化性质。
可消化的碳水化合物,例如蔗糖或乳糖,通过一系列胃肠道酶降解为单糖(例如葡萄糖、果糖)后在小肠中被吸收。
果糖、糖醇和一些非营养性甜味剂(例如三氯蔗糖)在小肠中被动、缓慢或吸收很差,并溢出到大肠。这种动态会导致肠道菌群发生显著改变,包括微生物多样性减少以及与代谢健康状况相关的某些细菌门的相对丰度改变。
高糖饮食:拟杆菌门↓↓ 变形菌门↑↑
促炎,破坏肠道屏障
摄入大量葡萄糖、果糖或蔗糖的饮食模式会导致肠道微生物多样性的丧失,其特征是拟杆菌门比例降低和变形菌门比例增加。
变形菌占健康肠道微生物群的一小部分,但如果它们批量增加,可能会发生炎症。该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS)分子,这些分子是炎症反应的强烈触发因素。
该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS,内毒素)分子,这些分子是炎症反应的强烈触发因素。
在肠上皮细胞中,LPS 诱导IL-8的释放,这是一种负责诱导炎症反应的关键趋化因子,进而改变紧密连接并导致上皮完整性受损。
而拟杆菌属是拟杆菌门中的优势属,它能很好地适应竞争激烈的肠道环境,并利用复杂的植物和宿主衍生的多糖。该属与许多健康益处有关,包括下调肠道炎症反应。
变形菌门和拟杆菌门之间的平衡,在维持肠黏膜的免疫稳态和上皮完整性方面发挥作用。与此一致,一项研究表明,IBD患者粪便微生物群中肠细胞IL-8表达水平与肠杆菌科呈正相关,而拟杆菌属、普雷沃氏菌属和脆弱拟杆菌的丰度降低。
高糖饮食:短链脂肪酸↓↓ 促炎,破坏肠道屏障
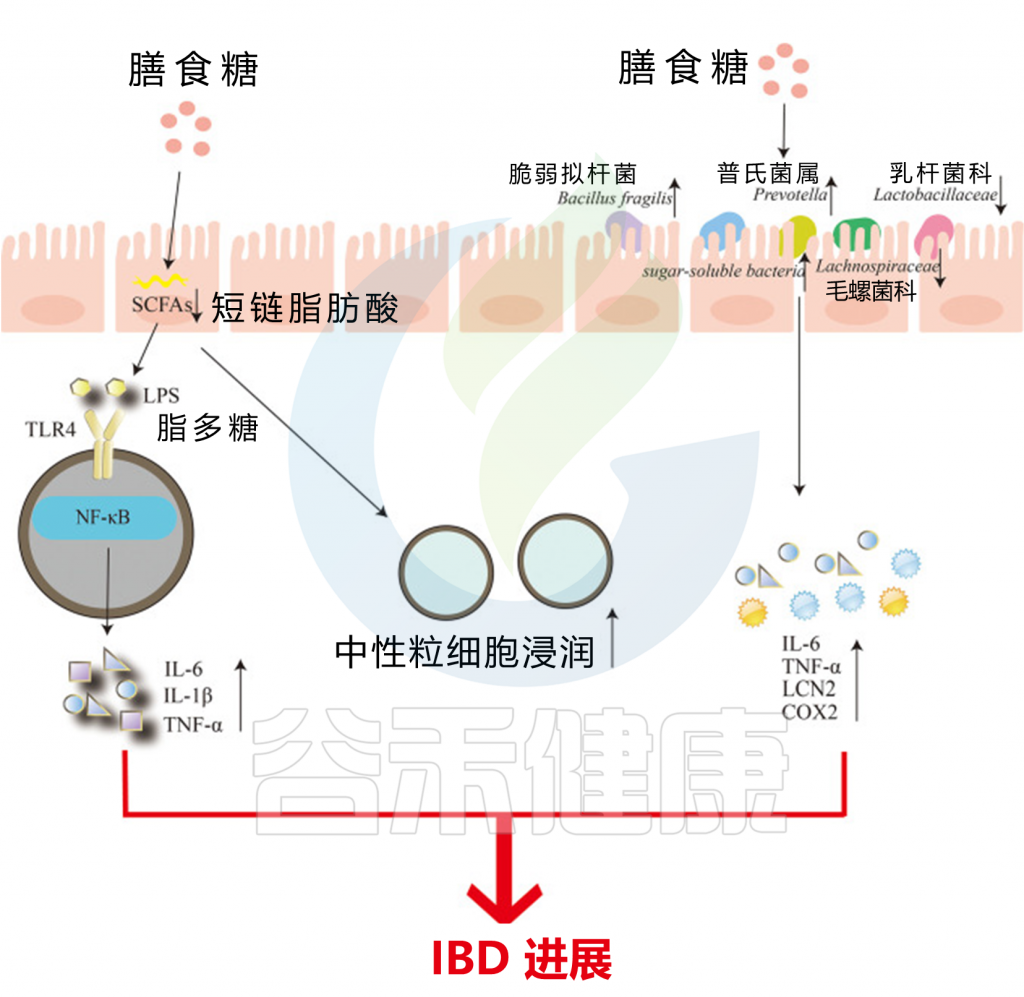
过量摄入膳食糖会减少肠道中短链脂肪酸的产生,这可能导致肠道屏障受损。这会导致中性粒细胞浸润迅速增加,同时加速脂多糖(LPS)的转移。LPS与TLR4结合,激活核因子-κB(NF-κB)信号通路,最终诱导炎症因子IL-6、IL-1β和TNF-α的产生。
另一方面,过量的膳食糖含量使脆弱拟杆菌和普雷沃氏菌大量繁殖,从而破坏肠黏膜。同时,可溶性糖细菌Sutterellaceae的相对丰度增加,而属于厚壁菌门的Lachnospiraceae和Lactobacillaceae的丰度下降,最终增加了炎症细胞因子IL-6、TNF-a、Lcn2、Cox2的水平。中性粒细胞浸润增加和炎症因子产生加重了IBD的发生和发展。
膳食糖对肠道微生物组的调节
doi : 10.3389/fimmu.2022.988481
糖介导的巨噬细胞炎症
高水平的饮食糖导致TLR4活性增加,进而激活下游的NF-κB和MAPK信号通路,从而促进炎症因子IL-6、IL-1β和TNF-α的上调。此外,膳食糖介导的树突状细胞和中性粒细胞炎症也是通过激活 TLR4 来实现的。
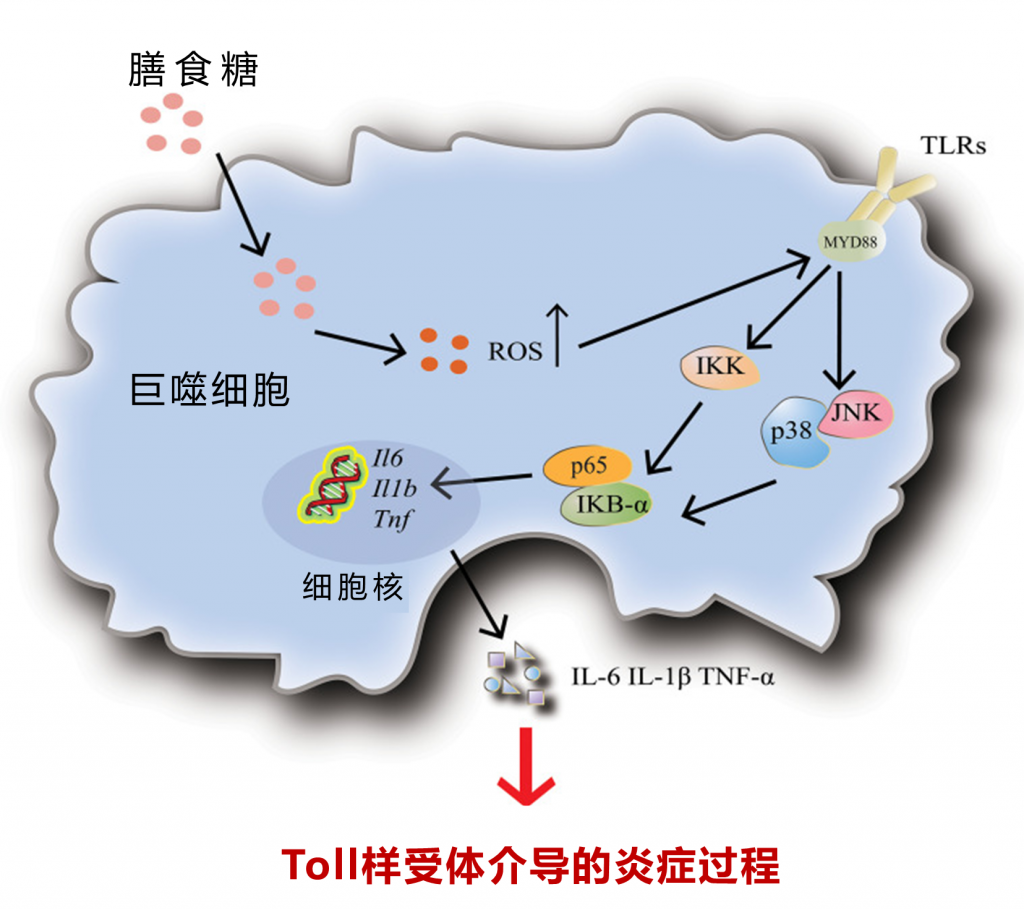
doi : 10.3389/fimmu.2022.988481
类风湿关节炎(RA)是由遗传、环境和内源性因素引起的最常见的全身性慢性自身免疫性疾病之一。其特点是全身炎症和持续性滑膜炎。
近年来大量研究表明,含糖饮料在类风湿性关节炎的发病机制中发挥着关键作用。在一项后续调查中,研究人员发现,与不喝含糖饮料的女性相比,每天喝 1 美元含糖饮料的女性患血清阳性类风湿关节炎的风险更高,尤其是 55 岁以上的女性。
随后的一项研究表明,含糖饮料导致类风湿关节炎,除了在自身免疫镶嵌中发挥重要作用外,还在于它更有可能改变微生物群,从而影响下游炎症途径。大量摄入葡萄糖、果糖和含糖饮料会减少肠道中的有益菌群,尤其是普雷沃氏菌,它被发现与类风湿关节炎的发病机制有关。此外,与高糖西方饮食相比,地中海饮食可以降低类风湿关节炎的发病率。
多发性硬化症(MS)是一种中枢神经系统自身免疫性疾病,其症状影响全身多个系统,包括视力障碍、运动障碍、疲劳、认知和情绪障碍、疼痛等。
一项研究指出,患有多发性硬化症的受试者比对照组摄入更多的碳水化合物。
虽然高糖饮食对多发性硬化症的影响尚未在临床研究中得到证实,但在多发性硬化症的疾病模型中发现,高葡萄糖和高蔗糖饮食可以加重实验性自身免疫性脑脊髓炎(EAE)的病情进展。
一方面,高糖饮食可以直接作用于CD4+ T细胞,通过诱导T细胞分化为Th17细胞,从而增加EAE小鼠体内Th17细胞的比例。
另一方面,高糖饮食通过改变肠道微生物组结构刺激 Th17 细胞分化并加剧 EAE。
牛皮癣是一种慢性炎症性皮肤病,其特征是表皮角质形成细胞异常增殖和分化。
新的研究数据表明,饮食成分(简单的糖和脂肪)而不是肥胖本身会加剧牛皮癣。西方饮食激活了IL-23信号通路,进一步增加了IL-23刺激后γδT细胞中IL-17A的产生。细胞因子IL-17A对于皮肤炎症的全面发展是必需的。
同时,IL-23 过度表达,导致喂食西方饮食的小鼠微生物多样性下降和明显的肠道菌群失调。当 IL-23 释放后,小鼠从西方饮食转向标准饮食时,皮肤炎症减少,肠道微生物群部分逆转。
因此,牛皮癣患者应考虑少糖的健康饮食模式。
炎症性肠病(IBD)是一种慢性炎症性胃肠道疾病,主要包括克罗恩病和溃疡性结肠炎。肠道中的共生菌群和粘液层对于体内平衡至关重要,因为它可以防止病原微生物的入侵和粘附,并有助于维持肠道屏障的完整性。
近年来,由于西方饮食(即高脂和高糖饮食)在世界各地的同步兴起,IBD也已成为全球健康问题。最近的临床和实验研究表明,高脂肪饮食可能是IBD的触发因素,但高糖在IBD发病机制中的作用仍存在争议。
一项具有里程碑意义的研究表明,2 型糖尿病可通过肠上皮细胞的转录重编程和改变紧密粘附连接的完整性而导致肠屏障功能障碍;它还可以通过引起肠道微生物代谢敏感性的变化来增加疾病风险。
此外,基于人群的研究表明,约 10% 的 IBD 患者认为吃含糖食物会引发病情发作并使症状恶化。在一些前瞻性研究中,还发现食用高果糖玉米糖浆和 含糖饮料与 IBD 风险呈正相关。
生命早期过量摄入添加糖会通过肠道微生物群对记忆功能产生负面影响。
糖改变了肠道菌群,尤其是显著增加了Parabacteroides丰度,特别是P. distasonis和P. johnsonii,与记忆表现呈负相关。
在幼年大鼠中实验性富集这些Parabacteroides物种也会损害记忆功能,表明糖诱导的Parabacteroides在认知缺陷中起因果作用。这些发现突出了肠-脑轴在介导早期生活饮食对神经认知发育影响方面的重要性。
在采用回顾性和纵向方法的情况下,发现高糖饮食与重度抑郁或抑郁症状之间存在显着相关性。
我国的一项大型研究发现,每周饮用四杯或以上 含糖饮料(特别是软饮料或苏打水)的人,与饮用少于一杯的人相比,抑郁症状的患病率增加了一倍。另一项研究发现,每天摄入超过 500 mL 含糖饮料的人患抑郁症和自杀意念的风险增加 60%。
其他研究表明高糖饮食会导致焦虑、压力、多动和行为问题。当然,研究要应对大量混杂因素,需进一步研究其相关性。
成瘾和多巴胺能改变
摄入美味食物,包括糖,刺激下丘脑腹侧被盖区(VTA)释放多巴胺,激活奖赏通路(从VTA到NAcc),这可以超越饱食信号。
反复接触美味食物会改变中脑边缘多巴胺回路,破坏稳态控制,强化食物线索,增加进食。
这些多巴胺能信号通路被认为对奖赏动机和记忆至关重要,特别是情景记忆和工作记忆。
奖赏通路的激活导致糖的寻求和摄入增加。多巴胺信号传导的改变可导致NAcc可塑性降低,这会导致成瘾病例中的记忆损害。
在大鼠模型中,过量摄入糖会引起成瘾的迹象,表现为暴饮暴食、戒断、抑郁样行为、奖赏寻求增加等。
间歇性糖摄入导致NAcc胞外多巴胺增加,脑啡肽mRNA表达减少,以及与戒断相关的阿片样修饰。糖还激活下丘脑(饱食和饥饿行为的主要调节器),抑制生长素和瘦素的产生,减少饱腹感,促进过度摄入。
肠道菌群紊乱和神经炎症
高脂肪和高糖饮食通过减少保护性微生物数量、影响肠黏膜、破坏紧密连接和增加细菌易位而损害肠壁通透性,导致炎症细胞因子信号增加。
人类和动物研究表明,糖摄入会显著改变肠道菌群。
果糖与粪肠球菌和嗜热链球菌(两种具有抗炎特性和促进肠道健康的有益菌)显著负相关。
使用高果糖饮食的啮齿动物研究,微生物群的剧烈变化、促炎细胞因子增加、抗炎细胞因子减少、肝脏脂质积累和神经炎症。这些损伤被观察到独立于体重或热量摄入而发生。
肠壁通透性的结构损伤使脂多糖进入血流,激活Toll样受体-4,导致促炎细胞因子过度产生。
这种低度全身炎症被称为代谢性内毒素血症,可导致几种慢性炎症状况,果糖诱导的菌群失调引发小鼠海马神经炎症和神经元丢失,可能突出了与糖和肥胖相关的神经和精神障碍的潜在机制。
代谢综合征是一组健康状况,例如高血糖,它们共同增加心血管疾病和糖尿病的风险。
根据小鼠实验,饮食、肠道细菌和免疫细胞之间错综复杂的关系有助于预防肥胖和其他代谢状况。
哥伦比亚大学的研究人员发现,在小鼠体内,某些肠道细菌通过诱导辅助性T17(TH17)细胞水平上升,有助于预防代谢综合征的疾病。作者发现,这些免疫细胞减少了肠道对脂质的吸收。
高脂肪、高糖饮食消除了有益细菌,但给小鼠补充细菌可以防止它们患上肥胖和代谢综合征。仔细观察该饮食中的成分发现,其高糖含量促进了Erysipelotrichaceae的生长,从而杀死了免疫调节细菌。
从饮食中去除糖可以防止小鼠出现肥胖或代谢综合征,但前提是这些动物仍然含有细菌诱导的 TH17细胞。
糖尿病是最常见与糖摄入相关的疾病。糖是否是糖尿病的独特原因或促成因素是另一个有争议的问题。许多前瞻性和回顾性研究的结果各不相同且不一致。然而,大多数研究发现糖,特别是果糖和含糖饮料摄入量与2 型糖尿病 (T2DM) 风险呈正相关。
食用含糖饮料会导致胰岛素信号受损以及空腹血糖和胰岛素增加,这种关联在女性中尤其明显。
来自 175 个国家的重复横截面数据的计量经济学模型表明,糖分与糖尿病风险呈剂量依赖性显着相关,糖分减少与糖尿病发病率下降相关。
也有一项对照干预试验的荟萃分析显示,在能量匹配的替代研究中,当糖被替换为其他宏量营养素时,含糖饮料并不会对血糖控制产生不利影响。只有当饮食摄入过多卡路里时,含糖饮料才会对血糖控制产生有害影响,这表明能量平衡而不是饮食中的糖本身是导致2型糖尿病发展的关键因素。
膳食糖可扩大病原体,并消除在代谢疾病中协调保护性肠道免疫反应的共生细菌
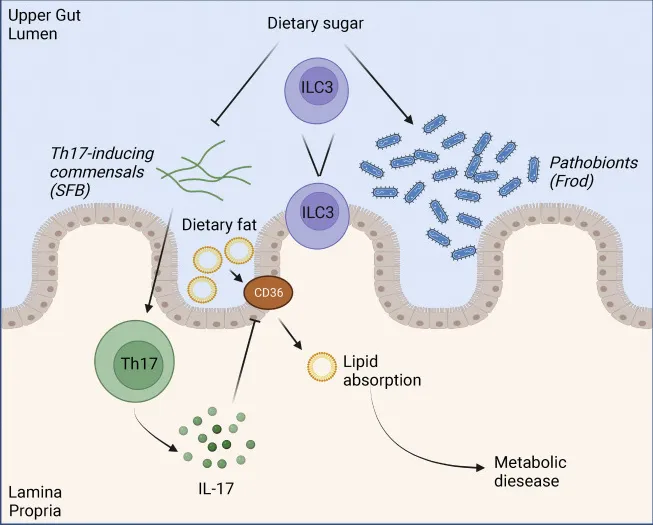
doi.org/10.1016/j.cmet.2022.09.006
注:Frod, Faecalibaculum rodentium; SFB, 分节丝状菌
膳食蔗糖支持一种致病菌(Frod)的生长,该致病菌在上肠中超过SFB,这是一种需要ILC3的反应。共生SFB诱导Th17免疫,通过下调脂肪酸转运蛋白CD36的表达来抑制脂质吸收。膳食糖导致诱导Th17的SFB丢失,促进过度脂质吸收,在小鼠饮食诱导的代谢性疾病早期阶段促进过度肥胖。
自 1975 年以来,全球肥胖率增加了两倍,而糖消费量的下降以及肥胖人数的持续增加,这是为什么呢?一种解释认为这种转变是由代际延迟引起的。由于儿童消费往往预示着成人肥胖,因此成人肥胖(例如,40-70 岁)的增加反映了 20 世纪50年代-80年代儿童饮食不良。
另一种提出的解释是从传统糖向糖替代品(低热量、人工甜味剂)的转变,2008 年至 2015 年间,全球糖替代品的年增长率约为 5.1%。近年来的研究开始调查这些糖替代品的影响,并发现特定甜味剂与肥胖、心血管疾病及其他疾病之间的联系。
接下来,我们来看看甜味剂对肠道菌群有哪些影响,如何通过肠道菌群影响健康。
多元醇(也称为糖醇),多元醇的常见例子是木糖醇、山梨糖醇、赤藓糖醇、甘露醇、异麦芽糖醇、麦芽糖醇和乳糖醇。
多元醇与肠道菌群组成和功能之间的关系在不同的动物模型中也得到了强调。
木糖醇是一种五碳多元醇,天然存在于水果、浆果、蔬菜、燕麦和蘑菇中,其甜度为蔗糖的95%。人体也会产生一小部分。木糖醇常用于无糖糖果和口香糖。
在较高剂量下,木糖醇引起双歧杆菌属、乳酸杆菌属和Erysipelotrichaceae的丰度增加,而Blautia和葡萄球菌的含量减少。
山梨糖醇,是一种异构多元醇,天然存在于苹果,梨,桃子,杏子和一些蔬菜中。IBS患者对山梨糖醇有不良的胃肠道反应,对健康个体是安全的,在高剂量时具有通便作用,大多数健康个体可耐受∼10 g 山梨糖醇/天,仅伴有轻微的胃肠道不适,例如肠胃胀气或腹胀。
几项研究表明,山梨糖醇的摄入会扰乱肠道菌群。相应地,接受10%山梨糖醇(2.07 g/day)16天的雄性Wistar大鼠表现出盲肠和结肠中乳酸杆菌丰度和丁酸盐水平的增加。
异麦芽酮糖醇用于泡泡糖、明胶、巧克力、涂料、烘焙食品和酸奶。它能量低,不致龋,并且与其他多元醇一样甜。异麦芽酮糖醇的未消化或未吸收部分到达结肠并由肠道微生物群发酵;摄入的异麦芽酮糖醇的发酵部分为∼90%。
临床试验:
一项研究测试了19个人连续4周每天消费30克异麦芽糖醇在交叉设计中的效果,以及额外4周的安慰剂对照干预,每天30克蔗糖。与安慰剂相比,异麦芽糖醇显著提高了双歧杆菌数量。因此,异麦芽糖醇可能有助于健康的结肠环境。
乳糖醇是一种非天然存在的糖醇,通过乳糖氢化而得。与其他多元醇相比,其甜味能力有限,因此通常与强甜味剂结合使用。乳糖醇可作为益生元增强肠道微生物群,不致龋。
临床试验:
低剂量的乳糖醇(每天10克)在75个人身上测试7天,增加了双歧杆菌群,这导致了乙酸和乳酸的增产。这一事实可能有助于交叉喂养,其他细菌可以产生丙酸和丁酸。
在40个人身上测试了通过巧克力棒逐步补充麦芽糖醇,持续6周,达到每天45.6克,增加了双歧杆菌。
注:这几项研究都是在2006年到2010年间发表的,文献中极少有其他关于多元醇的最新人类研究。

doi.org/10.3390/diabetology3040042
口服不同的非营养性甜味剂会也出现肠道菌群失调的情况。
糖精是一种水溶性酸,在pH值较低的环境中易被吸收。在人体中,85%-95%的摄入糖精作为完整分子被吸收,因为它不经历胃肠道代谢。一旦被吸收,它就会与血浆蛋白结合,分布到全身,并通过主动管状运输从尿液中排出。少量未吸收的糖精通过粪便排出,高浓度的非营养性甜味剂可能改变肠道微生物群的组成。
当给予 0.1 mg/mL 糖精 10 周时,肥胖雄性小鼠表现出葡萄糖耐量受损、罗伊氏乳杆菌减少以及粪便拟杆菌属和梭状芽胞杆菌目增加。
连续 6 个月服用 0.3 mg/mL 糖精,引发肝脏 TNF-α 和 iNOS(诱导型一氧化氮合酶)过度表达,同时Turicibacter、棒状杆菌、Roseburia丰度增加,瘤胃球菌含量和Anaerostipes降低。
临床试验:
一项研究调查了7天内相当于每天360毫克的糖精补充对七名健康人的葡萄糖耐受性和微生物变化的影响。研究人员发现,在补充前后发展出较差的血糖反应的个体中,微生物群的变化更为明显,即拟杆菌属过度,而Clostridiales不足。
每天补充180毫克糖精(可接受日摄入量[ADI]的20%)对20个个体的肠道微生物群、血液代谢组和葡萄糖耐受性的影响,并与另外五组各包含20个个体的对照组和非营养性甜味剂补充组进行了比较。
糖精显著增加了普雷沃氏菌和Bacteroides xylanisolven的水平。普雷沃氏菌与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Bacteroides xylanisolven与此曲线呈负相关。作者认为这些变化是有害的。实验期间丁酸也增加了。大多数微生物顶级负荷与糖酵解和葡萄糖代谢有关。
三氯蔗糖(E-955)是一种低热量、无营养的合成甜味剂,其结构与蔗糖非常相似。像糖精一样,三氯蔗糖不会被人体代谢;然而,与糖精不同的是,大多数摄入的三氯蔗糖通过胃肠道在粪便中被排出,其余到达肾脏进行尿液排泄。
大鼠每天服用 1.1、3.3、5.5 或 11 毫克/公斤的三氯蔗糖 12 周后,体重增加,拟杆菌、双歧杆菌、梭菌和乳杆菌数量减少。
临床试验:
一项研究调查了高剂量的三氯蔗糖(每天780毫克)连续7天对34名男性干预组和对照组的肠道微生物群及代谢反应的影响,补充后肠道微生物群没有变化。
然而在另一项研究中,20个个体每天补充102毫克的三氯蔗糖,为期2周,确实改变了肠道微生物群,在试验期间增加了Eubacterium 和Dorea longicatena。Eubacterium与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Eubacterium与之呈负相关。作者认为这些变化是有害的。大多数微生物顶级负荷与嘌呤代谢相关。
阿斯巴甜是市场上使用最广泛的糖替代品之一,当它被人体加工时,在肠道酯酶和肽酶的作用下产生3种常见的代谢产物包括天门冬氨酸、苯丙氨酸和甲醇,类似于水果、果汁、发酵饮料在体内的分解。
甜叶菊是一种灌木,属于菊科,由于甜味强度高,由甜菊糖苷引起,因此被用作天然无热量甜味剂。
临床试验:
一项研究测试了240毫克/天(占ADI的8%)阿斯巴甜对20个健康个体2周内的影响,并发现它改变了肠道微生物群,Bacteroides fragilis(脆弱拟杆菌)、Bacteroides acidifaciens(产酸拟杆菌)和Bacteroides coprocola(粪拟杆菌)的丰度增加,许多微生物顶级负荷与多胺代谢有关。
此外,在这次干预中,每天摄入180毫克(占ADI的75%)的甜叶菊也改变了肠道微生物群:
两种Prevotella减少了,而Bacteroides coprophilus、Parabacteroides goldsteinii和一种Lachnospira增加了。几种微生物顶级负荷与脂肪酸生物合成有关。
甜味剂对肠道菌群的影响

doi.org/10.3390/diabetology3040042
低聚糖在自然界中广泛存在,常见于某些蔬菜、水果和全谷物中。低聚糖是由3-10个单糖分子通过糖苷键连接而成的碳水化合物,准确来说,它们不属于单糖双糖类的范畴,比单糖和双糖的结构更复杂一些,且低聚糖对甜味影响微乎其微,这里我们主要来了解一下它们的益生元作用以及对肠道健康的其他益处。
肠道益生菌通过细胞外降解和/或完整内化以进行细胞内水解,将功能性低聚糖用作能量来源。不可消化的功能性低聚糖的同化可改善益生菌的生长和活性,同时改变短链脂肪酸、氨基酸和胆汁酸代谢物的产生。肠道微生物群及其代谢物相结合,可以逆转宿主肠道微生物群的动态平衡失调并修复肠道损伤。这些代谢物还激活肠道中的先天性和适应性免疫反应,有助于减轻肠道炎症和屏障功能障碍。
低聚半乳糖在食品加工过程中具有较高的稳定性,可用于食品应用。此外,低聚半乳糖比果糖玉米糖浆具有更高的溶解度、更好的保湿能力、更低的甜度(蔗糖的三分之一)和更高的粘度。这些特性为食品提供了令人愉悦的味道、质地特性和口感的改善。
低聚半乳糖的益生元潜力
实验和临床研究证明, 低聚半乳糖选择性地促进双歧杆菌的生长,增加乙酸盐和丙酸盐的产量。
在含有成人型微生物群的动态且经过验证的大肠模型中,确定了长双歧杆菌、双歧杆菌、链状双歧杆菌、加氏乳杆菌、唾液乳杆菌参与 GOS 发酵和代谢。
低聚半乳糖对肠道健康的影响
低聚半乳糖可有效缓解小鼠结肠炎,改善体重减轻症状并减少结肠缩短。它通过抑制结肠分泌白介素 (IL)-6、肿瘤坏死因子 (TNF)-α 和髓过氧化物酶来调节炎症反应。
低聚木糖因其成本竞争力、热稳定性和 pH 稳定性、感官特性以及对人类健康的多维影响,而具有作为食品成分的巨大潜力。
低聚木糖天然存在于竹笋、水果和蔬菜中,而商业低聚木糖通常源自木质纤维素材料,如玉米芯、稻草、麦麸、甘蔗渣、竹子等。
XOS已显示出多种有益作用,包括刺激益生元的生长、减少肠道内的腐败产物、降低血液胆固醇水平和抑制血糖水平。
低聚木糖的益生元潜力
XOS可以抵抗上胃肠道的消化,并选择性地刺激结肠中有益细菌的生长/活性,从而有利于宿主的健康。 DP 为 2-5 的低聚木糖作为唯一碳源可显着改善体外乳杆菌、双歧杆菌和拟杆菌的生长。
支链低聚木糖的发酵速度缓慢可能有利于益生菌的生长和丁酸的积累。此外,低聚木糖还能抑制病原微生物的生长,如肠球菌、大肠杆菌、艰难梭菌和产气荚膜梭菌。
低聚木糖对肠道健康的影响
与传统化疗策略相比,低聚木糖可能是肠道免疫干预的有用替代品。来自杏仁壳的部分O-乙酰化和脱乙酰木寡糖对大鼠胸腺细胞表现出直接的免疫刺激作用,增强了T细胞有丝分裂原诱导的增殖。
甘露寡糖是新兴的益生元,具有许多生物活性特性,可以刺激各种类型肠道益生菌的生长,并在胃肠道的不同部位释放有益的发酵产物。此外,甘露寡糖通过在结肠细胞中诱导不同的基因标记物,表现出抗癌和免疫调节作用。
甘露寡糖的益生元潜力
不同来源的甘露寡糖表现出不同的益生元活性。
甘露寡糖的结构影响其被益生菌利用的情况。分子量较低的甘露寡糖具有更好的细胞扩散性和分子移动性,因此更容易被利用。
甘露寡糖对肠道健康的影响
甘露寡糖可以直接激活肠道巨噬细胞,并抑制DSS诱导的促炎介质的产生。
壳寡糖表现出良好的理化性质,如低粘度和高溶解度。而且它们在人体肠道内很容易降解消化并进入血液循环,是理想的营养食品添加剂。
壳寡糖的益生元潜力
壳寡糖作为一种天然抗菌剂,不仅能抑制多种致病细菌、真菌和病毒的生长,而且对益生菌具有增殖作用。
带正电的壳寡糖与带负电的细胞壁成分结合,从而改变微生物膜的渗透性、细胞质膜屏障功能和/或微生物细胞的营养物质运输。
抗菌活性与壳寡糖的结构特征和靶微生物的类型有关。
壳寡糖对肠道健康的影响
壳寡糖已被公认具有抗炎活性,因此可能在炎症性肠病治疗中具有巨大潜力。
壳寡糖可以在生长、侵袭和转移阶段干扰癌细胞的增殖。
婴儿配方奶和母乳之间的主要区别之一是 HMO。 HMO 是母乳中继乳糖和脂质之后的第三大固体成分,占母乳总量的 1%。可以帮助肠道菌群增殖,抑制病原体粘附,从而有助于婴儿身体和免疫系统的发育。
人乳低聚糖的益生元潜力
到目前为止,已经研究了几种 HMO 成分的益生元作用,可以改变肠道微生物组成。
HMO 对病原微生物具有抗粘附作用。
HMO 的益生元活性,高度依赖于其组成和结构特征以及菌株特异性。
人乳低聚糖对肠道健康的影响
人乳低聚糖可通过调节肠道微生物群的生长和代谢,以及激活黏膜和全身免疫应答,有益于肠道健康。
母乳喂养可显著保护婴儿和幼儿期腹泻,降低发病率和死亡率。

HUIZENG HU / Getty Images
世界卫生组织建议,成人和儿童每日添加糖摄入量不应超过总能量摄入的10%,进一步降低到5%会有额外的健康益处。但是控糖不是马上能做到,以下方式或许能帮你控制糖摄入量。
调节肠道菌群缓解糖摄入的危害
★ 增加膳食纤维的摄入
膳食纤维是有益菌群的”粮食”,可以促进有益菌的生长,抑制有害菌的繁殖。同时,膳食纤维还能增加饱腹感,减少对糖的渴求。
关于膳食纤维详见:膳食纤维对代谢健康和肥胖的影响
★ 特定植物化学物质
姜黄素是一种从姜黄中提取的主要生物活性化学成分,已被发现具有一系列神经保护作用,包括减少淀粉样蛋白负荷、神经炎症、氧化应激、感染和炎症。
研究表明,姜黄素通过多种途径抑制高果糖引起的炎症。
在一些临床试验中,食用姜黄素后,血浆葡萄糖和甘油三酯的降低以及β细胞功能和afamin水平的改善也很明显。
姜黄素丰富了有益的肠道菌群,包括科水平上的Oscillospiraceae和Rikenellaceae ,属水平上的Oscillibacter、Alistipes、Pseudoflavonifractor、Duncaniella、Flintibacter。这些微生物组与改善代谢综合征、减少炎症以及对肝脏和心血管健康的潜在积极作用有关。
★ 选择低GI食物
低GI食物释放糖分较慢,不会引起血糖的快速升高,有助于维持肠道菌群的稳定。相反,高GI食物会导致血糖的快速波动,刺激有害菌群的生长。与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
★ 摄入益生元
益生元是一类能够选择性地刺激肠道有益菌群生长的物质,如我们前面章节提到的低聚果糖、低聚半乳糖等。摄入益生元可以优化肠道菌群的组成,减少对糖的渴求。
★ 尽可能避开高脂饮食
研究表明,含糖饮料和高脂饮食的共同摄入会破坏肠道微生物的平衡。这样的肠道微生态变化会使小鼠易感化学诱导性结肠炎。肠道炎症的增强与病原体的有利定植相关。
蔗糖溶液摄入使高脂饮食背景下Prevotellaceae和Enterobacteriaceae的相对丰度显著升高。通常Prevotellaceae成员与加重肠道炎症相关。
因此,选择低脂低糖,富含膳食纤维的饮食方式可以帮助肠道稳态,可参考地中海饮食。
其他有利控糖的措施
★ 设定具体、实用的目标
可以寻找逐步减少糖摄入量的实用方法通常更容易实现。
逐步做到少喝或不喝额外的含糖饮料,包括普通苏打水、运动饮料、果汁、许多瓶装茶、调味拿铁和咖啡奶精都含有大量糖。
可以尝试水、不加糖的茶或咖啡、100% 果汁等代替。
★ 选择天然食品,而非加工食品
从天然来源摄入足够的糖,对于维持充足的能量水平和全天保持血糖稳定是必要的。
因此,最好选择尽可能接近自然状态的食物。
水果是大自然的糖果。可以将它们用作原味酸奶、煎饼和烘焙食品等食品中的甜味剂。它们还可以很好地融入冰沙和果汁中。
除了甜味和风味外,水果还富含维生素、矿物质和抗氧化剂。
整个水果是健康饮食的重要组成部分。
一些专家建议从不同的食物类别中选择一些天然食品,例如:
全谷物:燕麦片(未调味)
蛋白质:亚麻籽或奇亚籽
可以尝试自制食品
减少外出就餐或外带食物,避免食用过多不了解的添加糖成分。
同时,也可以避开一些沙拉酱、意大利面酱等,可能含较多糖。
★ 烘焙时更换糖
如果想避免添加糖,那么需要限制蛋糕和饼干等烘焙食品。但这并不意味着彻底放弃。
不要使用全糖版本,而是尝试使用其他成分来尝试最喜欢的食谱。流行的糖替代品包括苹果酱、磨碎的水果或蔬菜、干果或花生。当然也可以少用糖而不添加其他成分。
一些人造甜味剂(例如阿斯巴甜和糖精)不适合烘焙。
尝试用香料代替食糖进行烘焙,比如说:
香草(天然且不加糖)、肉桂、肉豆蔻、丁香、甘草、干根或提取物(来自植物的天然甘草,而不是糖果)等。
★ 可以适当阅读食物标签
查看营养成分表中的”总糖“或”碳水化合物-糖“项,了解食品中糖的总含量。
查看配料表,了解食品中所含糖的种类。常见的糖包括蔗糖、葡萄糖、果糖、麦芽糖、乳糖等。
很多时候,配料表中的成分按照重量从高到低排列。如果糖出现在配料表的前几位,说明该食品中糖的含量较高。
注意营养成分表中的”每份含量”或”每100克/毫升含量”,了解每份食品或每100克/毫升食品中糖的具体含量,算一下总量,要不要吃完。
★ 如果一定需要甜味剂,可以尽量选择天然的
天然甜味剂有多种选择,热量不一定低。但一些天然甜味剂,如罗汉果和甜叶菊,也可以尝试,下表供参考,总的来说取决于自身健康状况、口味偏好以及如何使用。

注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
McDougle M, de Araujo A, Singh A, et al. Separate gut-brain circuits for fat and sugar reinforcement combine to promote overeating[J]. Cell metabolism, 2024, 36(2): 393-407. e7.
Gillespie, K.M.; Kemps, E.; White, M.J.; Bartlett, S.E. The Impact of Free Sugar on Human Health—A Narrative Review. Nutrients 2023, 15, 889.
Kawano Y, Edwards M, Huang Y, et al. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome[J]. Cell, 2022, 185(19): 3501-3519. e20.
Prinz P. The role of dietary sugars in health: molecular composition or just calories?[J]. European Journal of Clinical Nutrition, 2019, 73(9): 1216-1223.
Garcia, K.; Ferreira, G.; Reis, F.; Viana, S. Impact of Dietary Sugars on Gut Microbiota and Metabolic Health. Diabetology 2022
Pessoa, J.; Belew, G.D.; Barroso, C.; Egas, C.; Jones, J.G. The Gut Microbiome Responds Progressively to Fat and/or Sugar-Rich Diets and Is Differentially Modified by Dietary Fat and Sugar. Nutrients 2023
Yang S, Wu C, Yan Q, et al. Nondigestible functional oligosaccharides: enzymatic production and food applications for intestinal health[J]. Annual Review of Food Science and Technology, 2023, 14: 297-322.
Satokari R. High intake of sugar and the balance between pro-and anti-inflammatory gut bacteria[J]. Nutrients, 2020, 12(5): 1348.
Noble E E, Olson C A, Davis E, et al. Gut microbial taxa elevated by dietary sugar disrupt memory function[J]. Translational Psychiatry, 2021, 11(1): 194.
Ma X, Nan F, Zhang D. Excessive intake of sugar: An accomplice of inflammation[J]. Frontiers in immunology, 2022, 13: 988481.
Conz, A.; Salmona, M.; Diomede, L. Effect of Non-Nutritive Sweeteners on the Gut Microbiota. Nutrients 2023, 15, 1869
Shon W J, Jung M H, Kim Y, et al. Sugar-sweetened beverages exacerbate high-fat diet-induced inflammatory bowel disease by altering the gut microbiome[J]. The Journal of Nutritional Biochemistry, 2023, 113: 109254.
Lamichhane, G.; Liu, J.; Lee, S.-J.; Lee, D.-Y.; Zhang, G.; Kim, Y. Curcumin Mitigates the High-Fat High-Sugar Diet-Induced Impairment of Spatial Memory, Hepatic Metabolism, and the Alteration of the Gut Microbiome in Alzheimer’s Disease-Induced (3xTg-AD) Mice. Nutrients 2024, 16, 240.

谷禾健康

菌群.营养.炎症.免疫
营养在整个生命周期中对免疫和炎症以及最终的健康有深远影响。最新研究表明,饮食对肠道微生物组成和代谢产物具有显著影响,从而对宿主免疫和炎症产生重要影响。
研究发现,我们日常饮食中的特定食物成分和代谢产物在感染、慢性炎症和癌症过程中可能表现为促炎或抗炎,这突显了饮食与微生物代谢产物对免炎调节的重要影响。这将对精准营养和治疗干预方法产生重要影响。
小鼠研究表明,饮食-微生物轴对免疫介导性疾病(包括炎症性肠病和过敏)产生影响,同时在感染、疫苗接种和癌症免疫治疗等情况下优化免疫功能。例如,人类中,膳食纤维摄入量增加与黑色素瘤免疫检查点阻断治疗反应改善相关,而长期服用抗生素可能会损害微生物群,从而降低流感疫苗的效果。
这重新激发了科学界和公众的兴趣,健康饮食意味着什么,它到底如何通过微生物群影响健康免疫系统?
本文我们就来了解一下,饮食与微生物相互作用对免疫应答调节的影响,以及对感染、慢性炎症、代谢健康和抗肿瘤免疫背景下微生物代谢产物的机制作用的新见解。
膳食成分既有直接作用,又有依赖于微生物的影响,本文侧重于后者。这也为我们提供了一个“精准营养”的新视角,根据遗传、饮食习惯、社会经济地位、微生物群等多种因素为个体或人群提供营养建议,可作为传染性、炎症性、代谢性疾病和癌症整体治疗方法的一部分。
哺乳动物与驻留在屏障部位(包括肠道)的微生物群共同演化。宿主与微生物之间的相互作用塑造了多种生理过程,包括哺乳动物的免疫应答。屏障组织及其相关微生物群暴露于各种外部因素,包括膳食摄入、药物、感染和环境污染物,统称为“暴露组”。
人类饮食的历史变化
膳食是塑造我们进化、社会和文化的最具影响力的外部因素之一。值得注意的是,在过去一个世纪,人类饮食与历史上逐渐变化的膳食相比发生了急剧而显著的变化。
这些主要变化包括:
1)植物、蔬菜和复杂碳水化合物(包括未加工的全谷物)的减少;
2)精制碳水化合物、植物脂肪、简单糖、盐和加工食品摄入量的增加;
3)广泛使用人工甜味剂、乳化剂、增稠剂、胶凝剂、稳定剂以及色素和防腐剂等化学物质。
这些变化在工业化国家更为明显,并且在与全球化增长相关的较不工业化国家中迅速发展。
饮食与肠道菌群、炎症的关联
一系列比较了世界各地人群的饮食和微生物群的人口研究表明,我们的饮食模式深刻影响肠道微生物群。例如,西方饮食改变了细菌组成并降低了微生物群的多样性或丰富度。相反,微生物群也可以改变饮食对宿主生理的影响。
人类研究表明,膳食纤维干预可以降低血液中炎症标志物;然而,在微生物多样性降低的个体中,它却会增加炎症。值得注意的是,过去100年中,炎症性疾病,包括炎症性肠病、过敏和糖尿病也一直在增加,研究揭示了与饮食和炎症相关的多样免疫调节途径。
动物来源的食物是许多营养素的高效(有时是唯一的)来源,包括铁、钙、锌、牛磺酸、肌酸、肉碱、维生素A、维生素B12、维生素D3和包括 EPA 和 DHA 在内的omega-3 脂肪酸,农业的工业化提高了这些食物的全球可获得性。
不同饮食结构影响肠道微生物组成
然而,基于动物的西方饮食会促进一种与植物为基础的饮食所促进的微生物组成不同的肠道微生物群。在小鼠和人类中,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是两大微生物门,往往覆盖总微生物组的90%以上。
传统植物为基础饮食:普雷沃氏菌属主导
西方动物为基础的高脂饮食:拟杆菌属主导
通过饮食干预或由于迁徙至西方风格国家而从植物为基础的饮食转变为动物为基础的饮食,会导致拟杆菌属取代普雷沃氏菌属成为主导。因此,普雷沃氏菌属和拟杆菌属被认为是传统植物为基础饮食高纤维和西方动物为基础饮食高脂肪的生物标志物。高脂肪、高糖饮食及与之相关的肥胖在小鼠和人类中已被证明会降低拟杆菌属的总体相对丰度并增加Bacillota的丰度。
肠道菌群及其代谢产物如何影响宿主免疫反应和生理过程
饮食中的组分可以直接调节小鼠的免疫系统,然而最近的研究表明,饮食引起的微生物群变化也深刻影响宿主的免疫反应。在屏障表面的免疫系统可以检测微生物群及其结构成分,这种直接的相互作用建立了一种免疫反应的耐受状态。
然而,肠道微生物群产生成千上万种代谢产物,这些产物被吸收到我们的体内,并通过血液循环。许多这些代谢产物是由微生物群特异性产生的,而不是宿主产生的。它们属于不同的化学类别,包括短链脂肪酸(SCFAs)、非结合和结合的胆酸、酚类化合物、吲哚、胺类、黄酮类和气态化合物。
迄今为止已经确定的许多代谢产物是通过微生物群对饮食组分的直接转化而生成的,这些微生物群表达了能够消化特定膳食物质的专门酶。例如,短链脂肪酸是由膳食纤维的微生物发酵产生的。因此,微生物群从我们的饮食中提取和产生必需营养素,包括宿主无法产生的维生素。微生物群产生的代谢产物也是通过微生物将宿主代谢产物转化而生成的。
例如,初级结合胆酸被微生物群转化为初级非结合胆酸,进一步转化为次级胆酸或额外的结合胆酸。这些代谢产物可以在宿主的整个身体中循环,作为细胞表面或胞核受体的配体,并调节多种生物过程,包括新陈代谢、认知、组织稳态和免疫反应。
饮食可以迅速改变微生物群的组成
已经证明,饮食变化,例如从植物为基础的饮食转向动物为基础的饮食,可以在暴露于新饮食后的第一天就改变人类微生物群的组成。小鼠研究表明,饮食变化也会影响微生物群的代谢活动,因此可能会改变微生物群产生的代谢产物的浓度。
虽然某些饮食成分,包括特定类型的膳食纤维,可以促进有益菌的扩张,但其他成分可能导致菌群失调,即微生物群组成异常或微生物群产生的代谢产物失调的状态。
对于饮食对一些微生物群依赖的免疫调节效应,微生物群物种、微生物组分和宿主受体尚未完全表征。未来,揭示这些元素对于开发基于饮食和微生物群的精准营养和个性化医学将至关重要。
小鼠研究表明,在稳态条件下,黏膜免疫系统建立了对肠道微生物的耐受状态。参与这种耐受性反应的免疫细胞包括调节性T细胞(Treg细胞)和第3组固有淋巴细胞(ILC3s)等。然而,微生物群失调或异常免疫激活可能会破坏耐受性并引发慢性炎症病症。在这里以炎症性肠病为例来讨论。
饮食和微生物群在膳食纤维和炎症性疾病的背景下的作用是最受关注的。
膳食纤维是一种复杂的碳水化合物,哺乳动物无法消化,而是被肠道微生物群发酵。微生物群利用膳食纤维作为营养源,并将其转化为包括乙酸、丙酸和丁酸在内的短链脂肪酸(SCFAs)。
短链脂肪酸激活几种G蛋白偶联受体,包括GPR41和GPR43,并抑制组蛋白去乙酰化酶(HDACs)。最近的研究表明,在各种炎症性疾病背景下,这些受体配体相互作用通过不同机制有助于抑制炎症。
短链脂肪酸对免疫细胞的影响
2009年一项开创性研究表明,乙酸能够通过GPR43依赖的方式促进小鼠肠道损伤和炎症模型中炎症的缓解。调节性T细胞在抑制炎症中起着关键作用,并且在维持免疫稳态和自身耐受性方面至关重要。Treg细胞对于控制自身免疫疾病和包括炎症性肠病在内的慢性炎症病症至关重要。
饮食对慢性炎症性疾病的影响
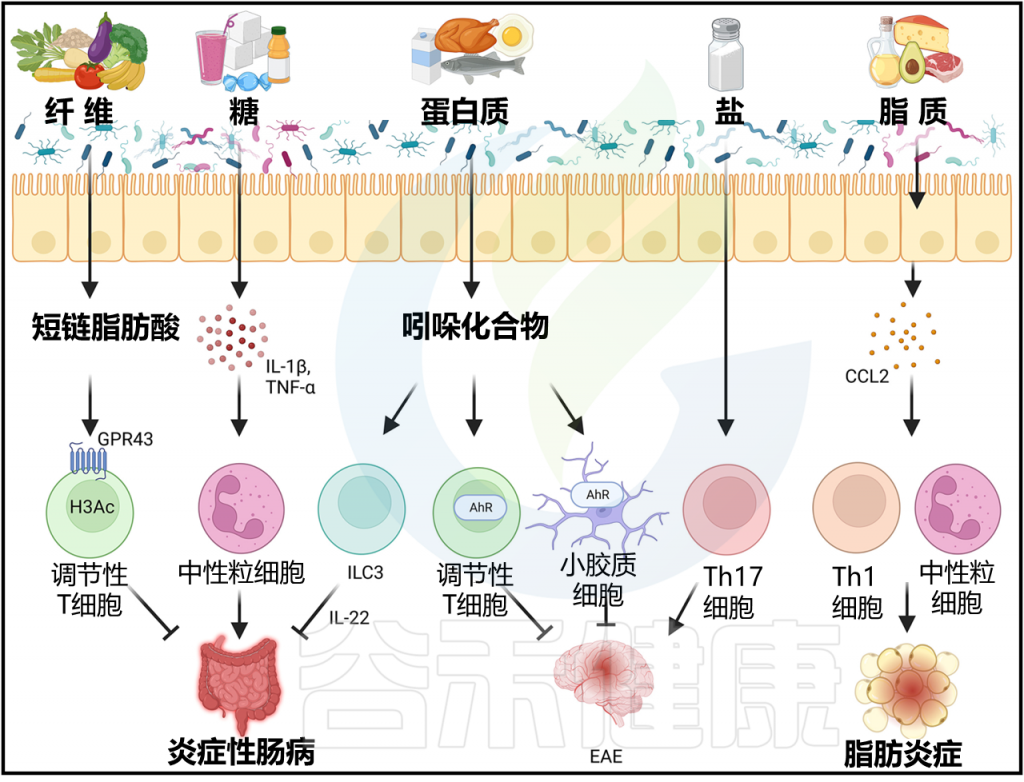
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
2013年,微生物群研究取得了重要里程碑,发现短链脂肪酸通过激活GPR43和抑制HDACs促进小鼠Treg细胞的分化和扩张。此外,无菌小鼠或饲养低纤维饮食的特定无特定病原体(SPF)小鼠显示短链脂肪酸和结肠Treg细胞减少。
最后,研究表明短链脂肪酸对小鼠T细胞转移结肠炎模型具有保护作用。这些研究是早期揭示微生物代谢产物直接调节免疫细胞的一些报告之一。从那时起,已经证明短链脂肪酸在小鼠各种炎症性疾病模型中具有抗炎作用,包括哮喘、关节炎和实验性自身免疫性脑脊髓炎(EAE)。
值得注意的是,短链脂肪酸介导的抑制HDACs的作用不仅限于促进Treg细胞,因为乙酸和丙酸也可以在适当细胞因子的预处理下促进Th1或Th17细胞的产生。
短链脂肪酸调节肠道微生物群
罗伊氏乳杆菌(Lactobacillus reuteri)是一种与人体共生的细菌物种,在系统性红斑狼疮(SLE)小鼠模型中,可以通过促进外周树突状细胞的聚集和在肠道和脾脏中提高Ⅰ型干扰素基因表达,来加重疾病结果。
通过饮食中的抗性淀粉,可以逆转罗伊氏乳杆菌(Lactobacillus reuteri)加重SLE的效应。从机制上讲,抗性淀粉诱导的短链脂肪酸通过直接抑制罗伊氏乳杆菌的生长来改善疾病。
注:抗性淀粉,一种被认为是膳食纤维的淀粉形式,因为它逃避了消化并被微生物群发酵。
膳食纤维还发挥着独立于短链脂肪酸的重要抗炎作用
膳食纤维可以保护肠壁的粘液层。如果小鼠缺乏膳食纤维,肠道微生物群就会利用宿主上皮细胞分泌的粘液糖蛋白,导致粘液层降解。这种保护性结肠粘液屏障的侵蚀,会导致肠道病原体Citrobacter rodentium(啮齿类柠檬酸杆菌)进入上皮的机会增加,从而促进结肠炎。
总的来说,这些研究突出了膳食纤维和短链脂肪酸通过多样化的免疫调节途径发挥抗炎作用。
值得注意的是,除了膳食纤维外,发酵食品(包括泡菜、酸菜、乳酪、开菲尔等)也改变了肠道微生物组成和代谢产物,这与人体中炎症标志物的降低相关。这些食物可以作为益生菌,通过提供特定的微生物种群(例如乳杆菌属)以及作为益生元,促进其他微生物种群(例如梭菌和拟杆菌属),从而改善微生物多样性。然而,发酵食品和涉及的微生物种群和代谢产物的抗炎作用机制尚未完全理解,需要进一步研究。
膳食蛋白质,特别是富含色氨酸的食物,如鸡肉、牛奶,也可以影响具有抗炎特性的微生物代谢产物。色氨酸是一种必需氨基酸,存在于富含蛋白质的食物中,人体利用它来产生神经递质5-羟色胺,稳定情绪,褪黑素,调节睡眠的激素,以及维生素B3,作为辅酶。
然而,微生物群也将色氨酸代谢为色胺和吲哚衍生物,包括吲哚-3-醛、吲哚乙酸、吲哚-3-丙酸和吲哚磺酸酯。这些代谢产物可以作为芳香烃受体(AhR)的激动剂,AhR是一个转录因子,在许多哺乳动物细胞类型中调节关键基因表达。
微生物来源的色氨酸代谢产物吲哚、吲哚-3-磺酸盐、吲哚-3-丙酸和吲哚-3-醛在小胶质细胞中的AhR信号传导改变了星形胶质细胞的免疫信号,并减轻了实验性自身免疫性脑脊髓炎的疾病严重程度。
值得注意的是,AhR还可以被各种植物来源、外源化合物和内源配体激活。通过芥蓝科蔬菜(例如西兰花和抱子甘蓝的代谢物)产生的一种代谢产物吲哚-3-甲醇(indole-3-carbinol)激活AhR已被证明促进ILC3s的扩增及其产生组织保护性IL-22,有助于增强多种结肠炎实验模型中的组织保护作用。
通过外源配体2,3,7,8-四氯二苯并二恶英(TCDD)激活AhR可以促进T调节细胞的扩增并抑制实验性自身免疫性脑脊髓炎。相反,内源配体6-甲醛吲哚[3,2-b]咔唑(FICZ)抑制T调节细胞的发育并促进T辅助17细胞的分化,导致实验性自身免疫性脑脊髓炎加重。这些研究表明,AhR在免疫细胞中的功能通常是配体特异的。
关于芳香烃受体(AhR)和色氨酸的详细代谢可以关注下谷禾以前发表的文章:
西方饮食逐渐缺乏膳食纤维,脂肪含量增加,添加盐和糖的浓度也增加,包括蔗糖和高果糖玉米糖浆。尽管西方饮食常常与动物脂肪摄入增加有关,但增加的脂肪含量主要来自全球范围内变得更加普遍的植物油和脂肪。
高脂饮食导致微生物群失调与炎症关联
与高脂饮食或肥胖相关的微生物群组成变化已与小鼠和人类的炎症联系在一起论。高脂饮食会导致小鼠和人类肠道微生物群失调,降低微生物多样性或“丰富度”。在小鼠中,这种微生物群失调已与肠道通透性增加相关联。这导致小鼠在四周内出现低级别肠道炎症。这种初始的炎症反应最终发展成涉及脂肪组织和肝脏炎症的全身性炎症状态,导致胰岛素抵抗。
Ccl2介导的炎症反应在代谢紊乱中的作用
肠道中增加上皮趋化因子Ccl2的表达引发了炎症反应,导致结肠粘膜下层的促炎性巨噬细胞的招募。随后CCL2的全身性升高导致促炎性巨噬细胞渗入脂肪组织,随后是其他炎症免疫细胞类型的积累,包括Th1细胞、CD8+T细胞、自然杀伤细胞(NK细胞)和中性粒细胞。
敲除Ccl2或其受体(Ccr2)可以改善脂肪组织炎症、肝脂肪变性和葡萄糖耐量。在人类肥胖的情况下,胰岛素抵抗主要是由肌肉内炎症驱动的,其特征是肌肉和肌周脂肪组织内免疫细胞的大量浸润。在肥胖的人类中,炎症和胰岛素抵抗与微生物群丰富度降低有关。
此外,减重会降低各种炎症标志物的浓度,包括肿瘤坏死因子α(TNF-α)、IL-6和C-反应蛋白。综上所述,这些数据突出了微生物群在促进炎症和相关代谢紊乱方面在高脂饮食和肥胖背景下的影响。
膳食脂肪促进硫还原致病菌增殖,导致慢性肠道炎症
除了微生物群失调和相关的低级别肠道炎症外,已经显示膳食脂肪可以促进特定微生物物种的积累,这些微生物可以直接导致慢性肠道炎症。例如,高脂饮食会促进牛磺胆酸(TCA)的产生,TCA被释放到肠道中溶解脂肪。研究表明,TCA的高浓度增加了肠道中有机硫的可用性,导致硫还原致病菌(Bilophila wadsworthia)的大量增殖,从而促进Il10−/−小鼠的结肠炎。这些研究需要进一步调查,以更好地表征膳食脂肪相关微生物群与炎症性肠病之间的关联。
扩展阅读:
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
除了膳食脂肪外,添加的糖和盐也以微生物群依赖的方式促进肠道和其他器官的炎症。
高浓度简单糖改变肠道菌群,加重炎症
高浓度的简单糖(如葡萄糖、蔗糖和果糖)改变小鼠的微生物群组成,并与粘蛋白降解致病菌的增加、粘液层侵蚀和肠道通透性增加相关。这导致结肠中IL-1β、IL-6和TNF-α的表达增加,中性粒细胞浸润,并在多种实验性结肠炎模型中以微生物群依赖的方式加重疾病严重程度。
高量的食用食盐(氯化钠)也以微生物群依赖的方式加重化学诱导的结肠炎
高量的食用食盐还通过改变微生物群促进致病性Th17细胞的产生,并加重EAE中的炎症和疾病结果。此外,高量的食用食盐会减少人类和小鼠中的几种乳酸菌菌株。值得注意的是,补充乳酸菌菌株可以预防食盐诱导的EAE加重,表明乳酸菌在神经炎症中具有保护作用。
膳食成分对感染免疫力的影响
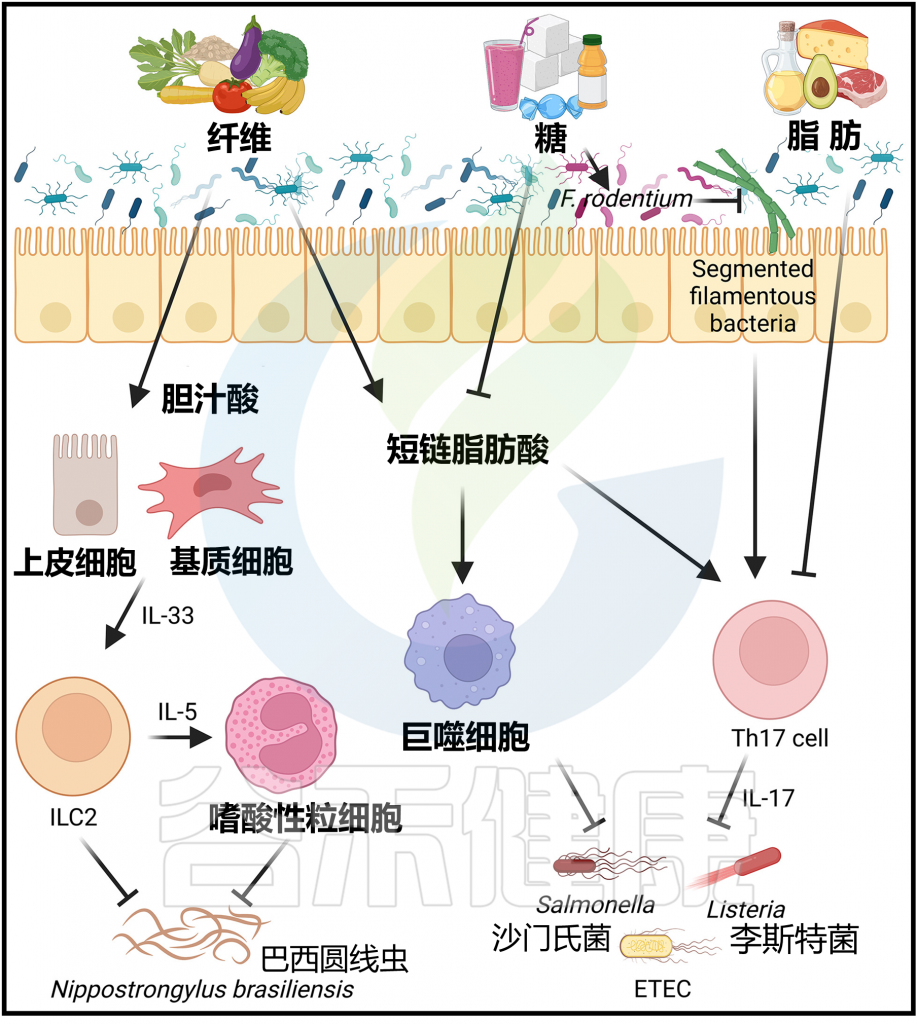
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
膳食纤维在结肠炎中的作用存在争议
尽管膳食纤维来源的短链脂肪酸(SCFAs)在多种结肠炎小鼠模型中减少肠道炎症,如前文所述,但使用各种高纤维饮食进行的类似研究报道了矛盾的结果。
例如,基于阿拉伯木聚糖的车前子、基于半乳糖的果胶和瓜尔胶具有抗炎或组织保护作用,而基于果糖的菊粉则加重炎症。已进行了多项临床试验来调节IBD患者的膳食纤维,尽管效果不一。此外,通常建议IBD患者避免富含纤维的饮食,因为膳食纤维可能加重疾病。然而,膳食纤维介导疾病恶化的机制尚不清楚。因此,在IBD背景下膳食纤维的作用仍存在争议。值得注意的是,最近的一项研究发现,低聚果糖,即菊粉纤维的结构单位,可以激活人类巨噬细胞产生与结肠炎相关的促炎细胞因子,包括IL-1β和IL-23。
此外,一项随机对照试验表明,给溃疡性结肠炎(UC)患者服用菊粉会增加结肠中的炎症细胞因子,包括IL-1β、IL-23和IL-5,并导致部分患者症状复发。在小鼠中,基于菊粉的高纤维饮食上调微生物群来源的胆酸代谢产物,促进IL-33的产生。这导致自然淋巴细胞群2(ILC2s)的激活和IL-5的产生,导致结肠中的嗜酸性粒细胞炎症。
菊粉纤维饮食还会触发肺部嗜酸性粒细胞增多,并加重小鼠过敏性气道炎症模型的疾病结果,而果胶纤维具有保护作用。
这些研究强调了假设膳食纤维的作用与SCFAs相同是误导性的。
但是以上数据表明饮食-微生物群轴对免疫细胞稳态和炎症性疾病具有深远影响。
除了影响各种炎症性疾病外,饮食和微生物群也被证明能够塑造对抗各种感染的免疫反应。尽管膳食纤维大多能够保护免受感染,但膳食脂肪和糖分却可能促成病原体发病过程。
正如前面所讨论的,膳食纤维通过维持肠道屏障完整性来保护免受肠道感染的影响,因为膳食纤维不足会促使以粘蛋白为食的微生物群破坏小鼠肠道的保护性黏液层。
丁酸对肠道病原体的多种抗菌机制
来源于纤维的丁酸盐有助于体外维持结肠上皮细胞的紧密连接完整性。丁酸也可以通过HDAC3抑制促进单核细胞向巨噬细胞的分化。因此,丁酸增强了小鼠巨噬细胞对一系列肠道病原体(包括沙门氏菌伤寒沙门氏菌和粘附侵袭性肠毒素产生大肠埃希菌)的抗菌活性,这与增强的抗菌肽产生和吞噬能力有关。丁酸还降低了上皮细胞的氧化程度,从而限制了沙门氏菌的需氧生长。
丙酸,另一种SCFA,可以通过破坏细胞内pH稳态直接抑制伤寒沙门氏菌的生长。最后,对口服感染的小鼠进行丁酸补充可以促进细菌清除,并防止这些病原体的全身传播。
微生物群对抗病毒免疫的重要性
微生物群在天然和适应性抗病毒免疫中也发挥着至关重要的作用。涉及微生物群消耗或改变的小鼠研究表明,微生物群对包括诺如病毒、黄病毒和流感病毒在内的病毒感染的保护性免疫反应至关重要。
已经证明微生物群对于最佳激活不同抗病毒机制是必不可少的,包括干扰素反应、CD4+和CD8+ T细胞反应以及抗体产生。虽然膳食纤维和SCFA通过增强效应细胞CD8+ T细胞功能在抗病毒免疫中发挥着关键作用,但饮食和微生物群来源的代谢产物在许多微生物群调节的抗病毒免疫机制中的作用仍需要进一步研究。
膳食纤维在蠕虫感染免疫中的保护作用
膳食纤维还通过其他代谢产物在小鼠中提供对蠕虫感染的保护性免疫。富含菊粉的高纤维饮食促进了细菌去共轭胆酸,提高了体内各种未共轭胆酸的浓度,包括胆酸。这些微生物群来源的胆酸增加了肺上皮细胞和肠间质基质细胞产生IL-33,导致ILC2s的激活。
当小鼠感染蠕虫寄生虫巴西圆线虫(Nippostrongylus brasiliensis),这种寄生虫会感染肺部,然后迁移到肠道,与对照组饮食喂养的小鼠相比,富含菊粉的饮食会增加肺部的杯状细胞和肠系膜淋巴结中的嗜酸性粒细胞。
这些由菊粉纤维诱导的2型免疫反应导致了肠道中蠕虫的加速排出,表明了膳食纤维在抵御寄生性蠕虫方面的益处。这些研究可能有助于增加全球对食物和补品的了解,特别是在那些细菌性肠道感染和蠕虫感染仍然地方性流行的地区。
肠道微生物群对传染性疾病疫苗效果的调节
肠道微生物群及其相关代谢产物在小鼠对传染性疾病疫苗的有效性中也发挥着重要作用。例如,小鼠巨噬细胞通过检测肠道微生物群菌株产生的鞭毛蛋白,促进巨噬细胞内固有产生浆细胞生长因子,直接促进浆细胞产生抗体。
此外,B淋巴细胞可以利用来源于膳食纤维衍生的SCFA产生的乙酰辅酶A作为细胞代谢的燃料,从而支持抗体的产生。
在人类中,许多研究将微生物群与对各种传染性疾病的疫苗反应联系起来。例如,已经证明抗生素介导的微生物群失调会损害那些预先抗体滴度较低的受试者对季节性流感的抗体反应,并且与抗生素治疗导致次生胆酸系统浓度降低有关。然而,各种饮食在微生物调节疫苗反应中的作用仍未得到充分探讨。
高脂饮食快速影响微生物群组成和免疫反应
正如前面讨论的那样,高脂饮食会增加小鼠肠道微生物群中Bacillota的数量,并以微生物群依赖的方式促进肠道通透性和炎症。尽管高脂饮食诱导的小鼠肥胖需要数月的膳食干预,但微生物群组成的转变和相关的免疫反应变化是迅速的,可以在几天内检测到。相关研究表明,进行为期两周的高脂饮食干预足以加重小鼠对病原细菌感染的情况。例如,口服李斯特菌单胞菌感染的小鼠,高脂饮食组的盲肠、肠系膜淋巴结和脾脏中细菌负荷增加,比饲喂常规饮食组高。
在人类中,饮食引起的微生物群变化也会在饮食发生重大改变后立即开始。一个典型的饮食变化例子是从以植物为基础的饮食转变为以动物为基础的饮食,这在社交活动期间的宴会中经常发生,比如参加宴会。这些宴会饮食通常富含脂肪和糖分,而纤维含量较低。
饮食改变对抗肿瘤免疫和癌症免疫疗法的影响
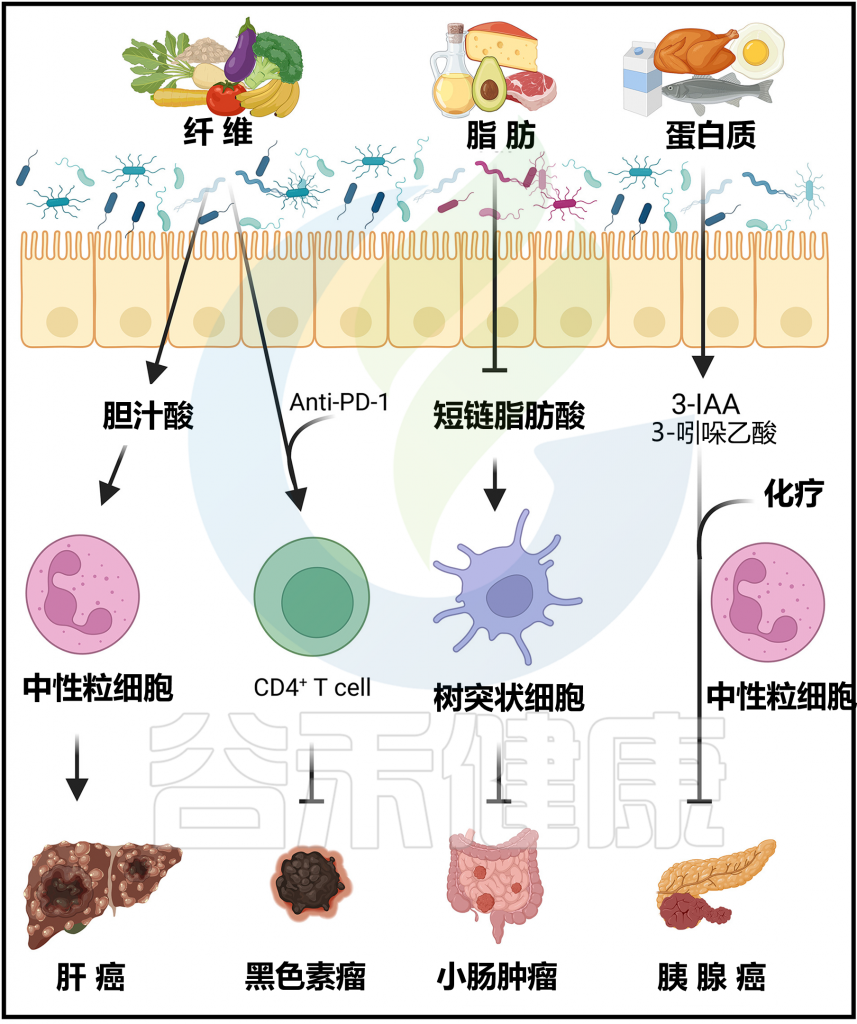
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
短期宴会饮食通过影响微生物群和Th17细胞抑制小鼠肠道免疫
一项研究使用了一种高脂肪、富含糖分(双糖和寡糖)、富含胆固醇、低纤维的饮食,因此模拟了“宴会饮食”。
研究发现,短暂接触这种宴会饮食会改变小鼠的微生物群组成,并抑制对细菌感染的黏膜免疫。在小鼠的回肠内容物中观察到了微生物群的快速和可逆性变化,宴会饮食3天后微生物群多样性减少,但在停止宴会饮食3天后迅速恢复到基线组成。
值得注意的是,这种为期3天的宴会饮食足以降低小肠Peyer氏板中Th17细胞的数量,降低回肠中Il17a、Il17f和Il22等3型细胞因 子的表达,这些细胞因子在维持肠道上皮屏障和抵御细菌病原体方面起着关键作用。
因此,这种饮食转变可能导致对沙门氏菌和李斯特菌感染的更高敏感性。与接受常规饮食小鼠回肠内容物的无菌小鼠相比,接受宴会饮食小鼠回肠内容物的无菌小鼠Il17a和Il17f的表达也减少,表明这种饮食介导的免疫抑制依赖于并可通过肠道微生物群传播。
高脂饮食(其中≥90%的热量来自脂肪)也会降低小鼠肠道中的Th17细胞,这与酮体介导的双歧杆菌耗竭有关。
值得注意的是,在不添加任何脂肪的低纤维、高糖饮食中,小鼠Th17细胞和细胞因子的减少情况也相似,这表明免疫表型的变化不取决于膳食脂肪,而是取决于饮食的能量密度和缺乏纤维。
宴会饮食降低SCFA,蔗糖促进Faecalibaculum rodentium 扩增,影响Th17细胞水平
宴会饮食会降低盲肠内容物中的乙酸和丁酸浓度,给予这两种短链脂肪酸(SCFA)的补充可以恢复Th17细胞数量并增强对沙门氏菌的保护。此外,另一项研究表明,向以普通饲料为基础的小鼠提供蔗糖饮水足以减少Th17细胞数量,这意味着小肠Th17细胞的减少也可能是由于高量的膳食糖引起的。
蔗糖会促使Faecalibaculum rodentium(该菌属于芽孢杆菌门下的Erysipelotrichaceae家族)的扩张。Faecalibaculum rodentium的扩增导致分段丝状细菌的替代,而后者已知能诱导和维持Th17细胞。
综合这些数据表明,虽然膳食纤维通过微生物群来源的短链脂肪酸和胆酸代谢产物对抗感染具有益处,但缺乏膳食纤维同时高量的脂肪和糖可能会削弱对各种肠道细菌病原体的肠道免疫力。
过去的十年里,许多临床前和临床研究报告指出,微生物群的组成在免疫系统对肿瘤的控制中起着重要作用,并可以促进对治疗的反应。
无菌小鼠或接受抗生素治疗的小鼠对化疗和免疫疗法表现出增强的抗药性。相比之下,口服具有益生菌Bacteroides fragilis有助于提高SPF小鼠对黑色素瘤的抗CTLA-4或抗PD-L1反应。
另外,缺乏膳食纤维的小鼠对黑色素瘤的抗PD1免疫检查点疗法没有反应,这与Ruminococcaceae的减少有关。这些小鼠中膳食纤维的抗肿瘤效果与CD4+T细胞增加有关。
在黑色素瘤和上皮癌患者中,对抗PD-1疗法的反应者和非反应者之间微生物组成存在显著差异。治疗反应与肿瘤中CD4+和CD8+T细胞的浸润增加有关,这与肠道微生物多样性高的几种菌,包括Akkermansia muciniphila、粪杆菌属(Faecalibacterium)、毛螺菌科(Lachnospiraceae) 等有关。这些菌谷禾专门科普过,详见:
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
膳食纤维增强抗肿瘤效果,瘤胃球菌、粪杆菌属等与癌症免疫治疗反应有关
抗生素治疗可能降低上皮癌患者抗PD-1疗法的临床益处。黑色素瘤患者对免疫检查点抑制剂疗法的反应不佳与膳食纤维摄入不足(<20克/天)有关。
与无反应者相比,反应者的微生物群显示出瘤胃球菌科(Ruminococcaceae)和粪杆菌属(Faecalibacterium)的富集。值得注意的是,发挥抗肿瘤作用的有益微生物群是可传播的。
与无反应患者的粪便微生物群移植 (FMT) 相比,来自有反应患者的无菌或抗生素治疗小鼠,对抗 PD-1 和抗 PD-L1 治疗黑色素瘤和肉瘤的反应更好。
此外,来自应答患者的 FMT 可以促进免疫细胞(包括 CD8 + T 细胞)的数量和激活状态,并提高黑色素瘤患者抗 PD-1 治疗的临床获益。
这些发现表明,膳食纤维通过维持微生物群分类群(包括瘤胃球菌科和粪杆菌属)来促进癌症免疫治疗,从而改善治疗结果。然而,需要进一步的研究来确定微生物菌株和相关代谢物在这些疗法的有效性中的具体作用。
吲哚-3-乙酸增强胰腺癌化疗效果
微生物群来源的代谢产物已被证明可以调节多种癌症小鼠模型的临床结果。从膳食色氨酸的微生物代谢中产生的吲哚-3-乙酸可以以中性粒细胞依赖的方式增强小鼠对胰腺癌的化疗效果。从理论上讲,中性粒细胞来源的髓过氧化物酶氧化吲哚-3-乙酸,氧化产物可以阻止癌细胞的增殖。
除了上述关于饮食和微生物群在抗肿瘤疗法中的作用的研究外,还有几项研究强调了饮食和微生物群在肿瘤发生中的作用。
高脂饮食降低短链脂肪酸,促癌
高脂饮食会降低小鼠粪便中的短链脂肪酸浓度,并以微生物群依赖的方式促进易感基因小鼠肠道肿瘤的发展。通过丁酸的给药可以减轻高脂饮食介导的肿瘤进展,丁酸可以促进树突状细胞的招募。
菊粉纤维可能促癌
尽管膳食纤维通常被认为对抗肿瘤疗法有益,但特定类型的纤维可能会以依赖环境的方式发挥促肿瘤作用。例如,菊粉纤维通过改变与升高的胆酸代谢物和肝内中性粒细胞炎症相关的微生物群,促进小鼠肝细胞癌的发展。
综合这些研究表明,通过膳食调节微生物群来源的代谢产物影响肿瘤发生和治疗结果,这可以用于精准营养学以预防和治疗癌症。
肠道微生物群与免疫系统之间的相互作用形成了两者的组成和功能,从而在外周组织中维持稳态平衡。
关键是,饮食可以维持或扰乱这种平衡,导致有益或有害的影响。饮食可以调节微生物组成和菌群失调,取决于微生物群的状态和膳食暴露的类型。
挑战
剖析特定菌株与识别微生物来源代谢产物
虽然膳食纤维的抗炎作用以及膳食糖和脂肪的促炎后果已被充分确立,但我们对其他膳食成分如何影响免疫系统的了解仍然有限。此外,剖析调节这些过程的特定微生物菌株和代谢产物是具有挑战性的。基于代谢组学的最新进展已经允许在各种宿主组织部位检测和定量低丰度代谢产物。
最近可用的公共数据库和生物信息学工具有助于在质谱数据中识别微生物来源的代谢产物。此外,基于CRISPR的细菌遗传学正在使得难以培养或操作的微生物菌株的操纵成为可能。
新兴工具和技术
研究免疫介导性疾病中微生物群和代谢产物
通常,一个蛋白质的合成由一个基因介导,而一种代谢产物的合成涉及多个代谢酶(因此,多个基因),这增加了微生物群介导的宿主代谢产物生产的复杂性。据统计,在非靶向代谢组学分析中,只有不到2%的光谱被注释;即98%的光谱与现有数据库中的化合物不匹配。据推测,这些“暗物质”的相当一部分具有微生物起源。
额外的计算工具,如CSI:FingerID,将有助于通过质谱观察到的这些光谱的注释。
在微生物群的基因操纵中,可以确认微生物菌株及其代谢途径在微生物驱动的表型中的作用。然而,以往,由于许多非模式菌株的遗传可操作性存在限制,这种策略是难以实现的。
基于CRISPR-Cas9的技术的最新发展已经允许针对非模式微生物进行遗传研究。这些遗传工具还可以有助于因果关系或干预研究以及未来基于代谢产物的治疗。外部提供的代谢产物的剂量和数量可能无法准确模拟微生物来源的剂量和数量。因此,一种精确地探究微生物群衍生分子在其产生环境中的方法是通过删除负责基因,从而“切断”各种共生微生物来源的代谢产物的产生。这些额外的遗传和生物信息学工具将有助于推动机制研究,并确定特定微生物菌株和微生物来源的代谢产物在调节各种免疫途径中的不可替代作用。
潜力
微生物群与个性化治疗性饮食
我们目前对营养调节炎症的了解仅限于个别营养素或食物类别。饮食模式和摄食行为也可以影响肠道微生物群和人体健康。我们通过神经元和化学感受味觉受体感知饮食方式,可以影响与饮食相关疾病的病理生理学。
然而,对微生物群在这些过程中的作用的理解仍然不完整。通过个性化治疗性饮食和营养干预的精准营养的当前愿景需要更深入的机制理解饮食-微生物群相互作用和摄食行为,并将其与年龄、性别和疾病相关参数相结合。
对饮食-微生物群-代谢物三者之间关系的更好理解为在三个层面开发有针对性的治疗提供了潜力:
1)益生元,促进特定微生物群的饮食
2)益生菌,特定野生型或基因工程微生物群
3)后生元,特定微生物群衍生代谢产物或具有更好疗效的合成类似物。
结合我们对微生物代谢产物在基因、细胞、分子和化学生物学水平的了解,可以更好地理解它们在调节宿主炎症和免疫中的作用,并通过操纵饮食-微生物群轴促进健康。
主要参考文献:
Arifuzzaman M, Collins N, Guo CJ, Artis D. Nutritional regulation of microbiota-derived metabolites: Implications for immunity and inflammation. Immunity. 2024 Jan 9;57(1):14-27.
Akagbosu B, Tayyebi Z, Shibu G, et al. Novel antigen-presenting cell imparts Treg-dependent tolerance to gut microbiota[J]. Nature, 2022, 610(7933): 752-760.
Montrose D C, Nishiguchi R, Basu S, et al. Dietary fructose alters the composition, localization, and metabolism of gut microbiota in association with worsening colitis[J]. Cellular and molecular gastroenterology and hepatology, 2021, 11(2): 525-550.
Bisanz J E, Upadhyay V, Turnbaugh J A, et al. Meta-analysis reveals reproducible gut microbiome alterations in response to a high-fat diet[J]. Cell host & microbe, 2019, 26(2): 265-272. e4.
Alexander M, Turnbaugh P J. Deconstructing mechanisms of diet-microbiome-immune interactions[J]. Immunity, 2020, 53(2): 264-276.

谷禾健康

肠道菌群是居住在肠道中各种微生物。微生物群的建立甚至在个体出生之前就开始了,随着时间的推移而改变,并在体内持续存在,直到个体死亡。这些微生物群的组成是宿主特定的,在个体的一生中不断进化,并且容易受到各种因素的影响。
胎龄、分娩方式、饮食(母乳与配方奶)、卫生、抗生素,激素、疾病、衰老等都会影响并塑造肠道菌群。肠道菌群的定植、发育、成熟、稳定,老化与我们人类发育以及免疫成熟等高度吻合,不同阶段不同部位的菌群的构成以及丰度有不同特征。
肠道细菌是免疫系统发育和功能的重要组成部分。肠道菌群的变化可能是许多炎症性疾病发生的重要因素。而生活方式的改变可能改变了肠道菌群的初始发育或稳定维持。
本文从肠道菌群的功能,初始构建,到菌群健康/失衡的状态,以及相应的改善措施等进行全面阐述。
肠道菌群,居住在肠道(宿主)内的所有本土细菌的总和,被视为一个器官,执行着一系列重要的、对健康至关重要的功能,而这些功能无法通过任何其他方式复制。
研究人员通过比较无菌实验动物(没有任何肠道菌群)和正常菌群对照动物来确定这些功能。这些发现也在人群中得到了证实。
以下是肠道菌群最重要功能的简要概述:
◥ 粪便中的水分滞留
粪便主要是由水组成(平均水含量75%;各项研究的平均范围为63-86%)。单细胞生物,如细菌,主要含有水,被无法穿透的膜包围。
◥ 形成正常粪便
由于细菌是正常粪便中最主要的成分,它们的缺失可能会导致持续性慢性腹泻。
◥ 生产必需维生素
细菌会合成各种物质,包括某些复合维生素 B、维生素 B12 和维生素 K,这些物质对血液正常凝固至关重要。
◥ 保护肠道上皮(粘膜)免受病原体侵害
正常的肠道菌群控制着不良细菌的数量,例如白色念珠菌(酵母)或大肠杆菌的感染性菌株。保护机制有很多种,食物供应的竞争、对肠粘膜的粘附、维持所需的 pH 值平衡以及产生过氧化物和酶,从而杀死外来细菌。
◥ 组织发育和再生
与健康动物相比,无菌实验动物的肠粘膜(上皮)和淋巴组织(派尔氏斑)发育不良,肠道健康黏膜薄弱、免疫淋巴组织不发达等存在许多缺点。
◥ 免疫
正常肠道细菌负责实现吞噬作用:吞噬细胞在全身范围内破坏致病细菌、病毒、过敏原和其他异物,吞噬细胞是负责非特异性(抗体前)免疫系统防御的专门血细胞。
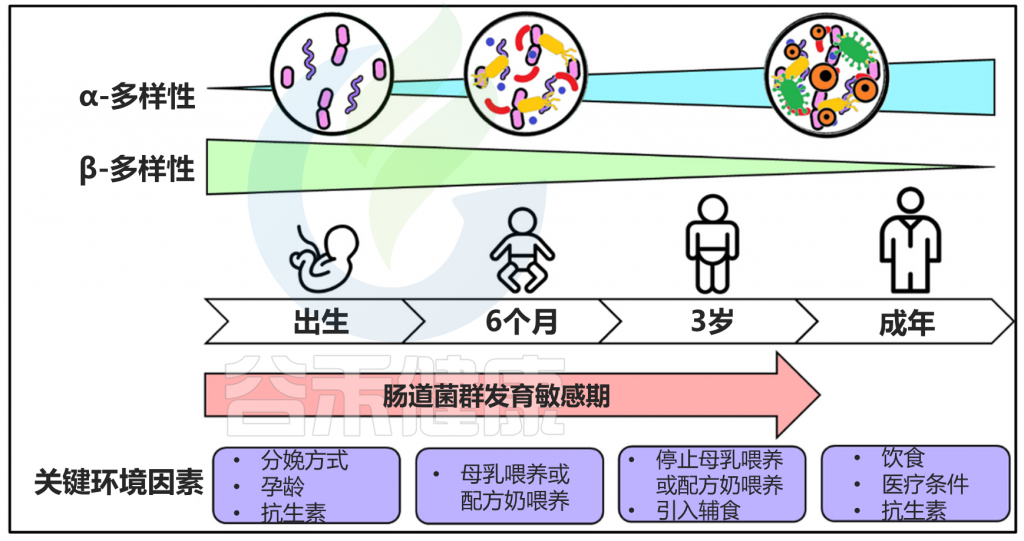
生命的前三年是可塑性增强的时期,肠道微生物群的发育很容易受到环境因素的影响。在婴儿期人与人之间的肠道微生物组差异变化最大,在成年期变得更加相似。
★ 婴幼儿
当婴儿出生后,在几口初乳后,大肠得到“培养”,初乳是一种淡黄色的液体,包含母亲的细菌,富含必需的营养。初乳先于富含脂肪和蛋白质的母乳流出。这个过程在母乳中继续,新生儿的肠道菌群在第6个月开始逐渐成熟,直到“成人”状态。
肠道微生物群的发育及主要影响环境因素

Parkin K et al., Microorganisms,2021

谷禾健康
痤疮(俗称“痘痘”)是一种常见的皮肤病,会影响全球近10%的人口。导致痤疮发展的因素很多,包括皮脂和角蛋白的产生,引起痤疮的细菌,激素,毛孔阻塞和炎症。
饮食与痤疮之间的联系一直存在争议,但最近的研究表明饮食在痤疮的发生中可以发挥重要作用。
本文将列举以下7种可能引起痤疮的食物,并提供一些相应的饮食建议。


吃大量精制碳水化合物可能会增加血糖和胰岛素水平,并促进痤疮的发生。
与很少或没有痤疮的人相比,有痤疮的人往往消耗更多的精制碳水化合物。
富含精制碳水化合物的食物包括:
用白面粉制成的面包,饼干,谷类食品或甜点;
白面粉意面;
白米饭和米粉;
苏打水和其他含糖饮料;
甜味剂,如蔗糖,枫糖浆,蜂蜜;
…
一项研究发现,经常食用添加糖的人患痤疮的风险增加30%,而那些经常吃糕点和蛋糕的人患痤疮的风险则增加20%。
这可以通过精制碳水化合物对血糖和胰岛素水平的影响来解释。
精制的碳水化合物会迅速吸收到血液中,从而迅速提高血糖水平。当血糖升高时,胰岛素水平也会升高,以促进血糖从血液中传出并进入细胞。
但是,高水平的胰岛素对痤疮患者并不友好。胰岛素可使雄激素更加活跃,并增加胰岛素样生长因子1(IGF-1)。通过使皮肤细胞更快生长并促进皮脂生成,这有助于痤疮的发展。
另一方面,低升糖指数饮食法不会显著提高血糖或胰岛素水平,却可以减少痤疮的严重程度。
当然,仍需要进一步研究,来了解精制碳水化合物如何促进痤疮。


经常食用乳制品与痤疮严重程度的增加有关
许多研究发现,乳制品与青少年痤疮严重程度之间存在关联。
两项研究还发现,经常食用牛奶或冰淇淋的年轻人患粉刺的几率是不经常吃的人的 4 倍。
但是,迄今为止的研究主要集中在青少年和年轻人,并且仅显示了牛奶和痤疮之间的相关性,而不是因果关系。尚不清楚牛奶如何促进痤疮的形成,但是有几种理论:
已知牛奶会增加胰岛素水平,而不受其对血糖的影响,这可能会使痤疮严重程度恶化。
牛奶还含有刺激肝脏产生更多IGF-1的氨基酸,这与痤疮的发生有关。
需要进行更多的研究,以确定是否存在特定数量或类型的乳制品,可能加剧痤疮。
西式快餐

经常吃西式快餐与痤疮发生的风险增加有关
痤疮与进食富含卡路里,脂肪和精制碳水化合物的西式饮食密切相关。
西式快餐食品,例如汉堡,矿块,热狗,炸薯条,苏打水和奶昔,是典型西方饮食中常见的食物,可能增加痤疮的风险。
一项针对 5000 多名中国青少年的研究发现,高脂饮食会使痤疮发生风险增加43%。定期吃西式快餐会增加17%的风险。
另一项针对 2300 名土耳其男子的单独研究发现,经常吃汉堡或香肠与痤疮发生风险增加24%有关。
目前尚不清楚为什么吃西式快餐会增加患痤疮的风险,但一些研究人员提出,它可能以促进痤疮发展的方式影响基因表达并改变激素水平。
必须要说明的是,大多数有关西式快餐和痤疮的研究都使用了自我报告的数据。这种类型的研究仅显示饮食习惯和痤疮风险的关联,而不能证明西式快餐会直接导致痤疮。因此,需要更多的研究。
富含Omega-6脂肪的食物

富含omega-6脂肪酸和omega-3含量低的饮食具有促炎作用,并且可能使痤疮恶化。
跟典型的西方饮食一样,含有大量omega-6脂肪酸的饮食与炎症和痤疮的增加有关。
这可能是因为西方饮食中含有大量的玉米和豆油,它们富含omega-6脂肪,而很少包含omega-3脂肪的食物,例如鱼和核桃。
omega-6和omega-3脂肪酸的这种不平衡会促使人体进入炎症状态,这可能会加剧痤疮的严重性。相反,补充omega-3脂肪酸可降低炎症水平,并可减轻痤疮严重程度。
尽管Omega-6脂肪酸和痤疮之间有关联,但尚未对此主题进行随机对照研究,需要进行更多研究。
巧克力

研究支持食用巧克力和痤疮之间的联系
自上世纪二十年代以来,巧克力就一直被认为是痤疮的诱因,但到目前为止,尚未达成共识。
多项非正式调查已将食用巧克力与增加痤疮的风险联系起来,但这不足以证明巧克力会引起痤疮。
最近的一项研究发现,易长粉刺的男性每天食用25克99%黑巧克力,仅在两周后出现了更多的痤疮病变。
另一项研究发现,与服用安慰剂的男性相比,每天服用100%可可粉胶囊的男性,在一周后的痤疮病变明显更多。
至于巧克力为什么会增加痤疮的确切原因还不太清楚,有一项研究发现,吃巧克力会增加免疫系统对引起痤疮细菌的反应,这可能有助于解释上述发现。
乳清蛋白粉

少量数据表明,服用乳清蛋白粉与痤疮之间存在联系。
乳清蛋白粉是一种流行的膳食补充剂。
它是氨基酸、亮氨酸和谷氨酰胺的丰富来源。这些氨基酸可使皮肤细胞生长和分裂更快,这可能有助于痤疮的形成。
乳清蛋白中的氨基酸还可以刺激人体产生更高水平的胰岛素,这与痤疮的发生有关。
一些案例研究报告了男性运动员乳清蛋白消耗与粉刺之间的联系。另一项研究发现痤疮严重程度与乳清蛋白补充剂天数之间的直接相关性。
这些研究支持乳清蛋白和痤疮之间的联系,但需要更多的研究来确定乳清蛋白是否引起痤疮。
个人过敏食物
食物敏感性反应可增加体内的炎症程度,理论上可能会加剧痤疮。
有人提出,痤疮从根本上说是一种炎症性疾病。事实证明,抗炎药如皮质类固醇是治疗严重痤疮的有效方法,而且痤疮患者血液中的炎症分子水平升高。
食物导致炎症的一种方法是通过食物敏感性,也称为迟发型超敏反应。
当免疫系统错误地将食物识别为威胁并对其发起免疫攻击时,就会出现食物过敏。这会导致高水平的促炎分子在体内循环,从而加剧痤疮。
尽管炎症和痤疮之间似乎存在联系,但尚无研究直接调查食物敏感性在其发展中的特定作用。这是一个值得研究的领域,有助于更好地了解食物,免疫系统和炎症如何影响痤疮的发生。
知道自己对哪些食物过敏,就别吃了吧~
以上7种是可能引起痤疮的食物,那么到底该吃什么呢?
以下建议可供参考。
Omega-3脂肪酸
Omega-3具有抗发炎作用,经常食用富含Omega-3的食物可降低痤疮的发生风险。
益生菌
益生菌可促进健康的肠道和平衡的微生物组,这与减少炎症和降低痤疮发生的风险有关。
绿 茶
绿茶含有多酚,与减少发炎和降低皮脂产生有关。绿茶提取物被发现可以减少痤疮的严重程度。
姜 黄
姜黄含有抗炎多酚姜黄素,可帮助调节血糖,提高胰岛素敏感性并抑制引起痤疮细菌的生长,从而减少痤疮。
维生素A,D,E和锌
这些营养物质在皮肤和免疫健康中起着至关重要的作用,可能有助于预防痤疮。
旧石器时代饮食
旧石器时代饮食富含瘦肉,水果,蔬菜和坚果,而谷物,奶制品和豆类则少。与降低血糖和胰岛素水平有关。
地中海式饮食
地中海式饮食富含水果,蔬菜,全谷物,豆类,鱼和橄榄油,而乳制品和饱和脂肪则少。它也与降低痤疮严重程度有关。
结 语
你可以不必完全避免与痤疮有关的所有食物(一般也做不到
),但应与上述其他营养丰富的食物一起,保持均衡饮食。

小 妙 招
如果有时间,可以坚持把吃的东西记录下来,看看某些症状是否与特定食物有关联。
长此以往,你可以慢慢去寻找正在吃的食物和皮肤健康之间的某种关系,那也将会是属于你个人的饮食宝典。
主要参考文献:
向上滑动阅览
Burris J, Rietkerk W, Woolf K. Acne: the role of medical nutrition therapy. J Acad Nutr Diet. 2013 Mar;113(3):416-30. doi: 10.1016/j.jand.2012.11.016. PMID: 23438493.
Burris J, Rietkerk W, Shikany JM, Woolf K. Differences in Dietary Glycemic Load and Hormones in New York City Adults with No and Moderate/Severe Acne. J Acad Nutr Diet. 2017 Sep;117(9):1375-1383. doi: 10.1016/j.jand.2017.03.024. Epub 2017 Jun 9. PMID: 28606553.
Blasbalg TL, Hibbeln JR, Ramsden CE, Majchrzak SF, Rawlings RR. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century. Am J Clin Nutr. 2011 May;93(5):950-62. doi: 10.3945/ajcn.110.006643. Epub 2011 Mar 2. PMID: 21367944; PMCID: PMC3076650.
Khayef G, Young J, Burns-Whitmore B, Spalding T. Effects of fish oil supplementation on inflammatory acne. Lipids Health Dis. 2012 Dec 3;11:165. doi: 10.1186/1476-511X-11-165. PMID: 23206895; PMCID: PMC3543297.
Aksu AE, Metintas S, Saracoglu ZN, Gurel G, Sabuncu I, Arikan I, Kalyoncu C. Acne: prevalence and relationship with dietary habits in Eskisehir, Turkey. J Eur Acad Dermatol Venereol. 2012 Dec;26(12):1503-9. doi: 10.1111/j.1468-3083.2011.04329.x. Epub 2011 Nov 10. PMID: 22070422.
Adebamowo CA, Spiegelman D, Danby FW, Frazier AL, Willett WC, Holmes MD. High school dietary dairy intake and teenage acne. J Am Acad Dermatol. 2005 Feb;52(2):207-14. doi: 10.1016/j.jaad.2004.08.007. PMID: 15692464.
Melnik BC, John SM, Schmitz G. Milk is not just food but most likely a genetic transfection system activating mTORC1 signaling for postnatal growth. Nutr J. 2013 Jul 25;12:103. doi: 10.1186/1475-2891-12-103. PMID: 23883112; PMCID: PMC3725179.
Vongraviopap S, Asawanonda P. Dark chocolate exacerbates acne. Int J Dermatol. 2016 May;55(5):587-91. doi: 10.1111/ijd.13188. Epub 2015 Dec 29. PMID: 26711092.
Bar-Peled L, Sabatini DM. Regulation of mTORC1 by amino acids. Trends Cell Biol. 2014 Jul;24(7):400-6. doi: 10.1016/j.tcb.2014.03.003. Epub 2014 Mar 31. PMID: 24698685; PMCID: PMC4074565.
Silverberg NB. Whey protein precipitating moderate to severe acne flares in 5 teenaged athletes. Cutis. 2012 Aug;90(2):70-2. PMID: 22988649.
Pietschmann N. Food Intolerance: Immune Activation Through Diet-associated Stimuli in Chronic Disease. Altern Ther Health Med. 2015 Jul-Aug;21(4):42-52. PMID: 26030116.