 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
消化是人体获取能量和营养的过程。膳食脂质因其在水中的不溶特性,从而导致其难以被小肠中的消化酶有效地识别和分解,而胆汁酸在脂质消化吸收中发挥关键作用,缺少胆汁酸会导致脂肪吸收不良和脂溶性维生素缺乏。
在过去,胆汁酸主要被认为是帮助消化和吸收脂肪及脂溶性维生素的消化剂。它们在消化过程中起到分解脂肪,使之能够在小肠中被水溶化和吸收的作用。
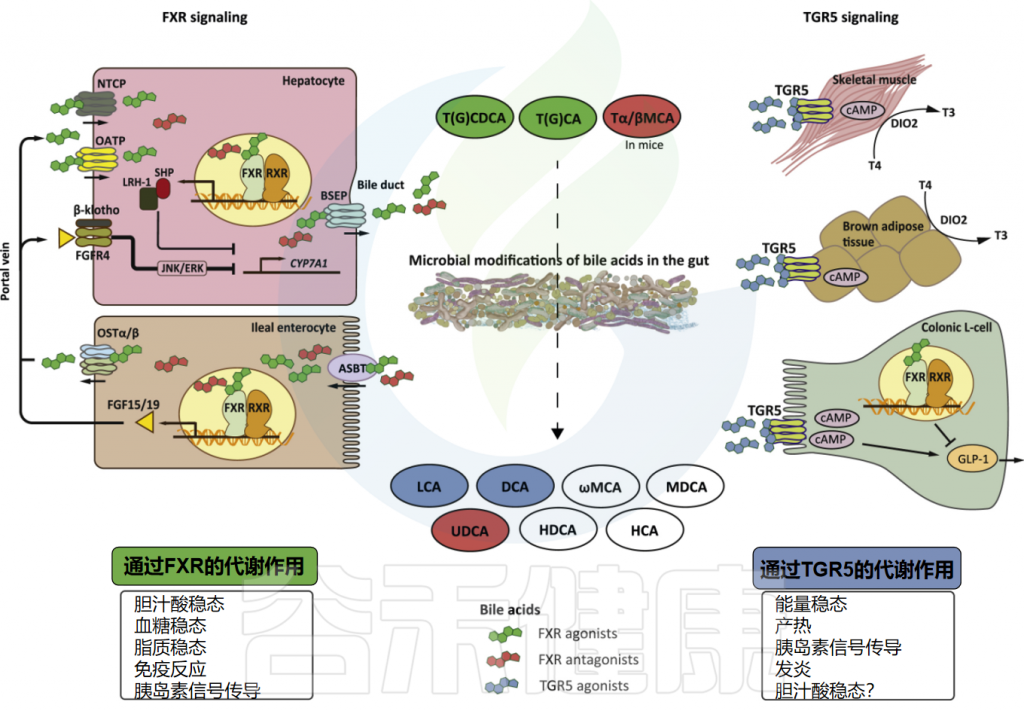
然而,随着科学研究的深入,人们对胆汁酸的理解发生了变化。胆汁酸被发现不仅仅是消化助手,它们还是强大的营养信号激素。胆汁酸通过真核生物、细菌和古细菌酶的作用进行结构调整,通过与特定的受体相互作用,如法尼醇X受体(FXR)和G蛋白偶联受体(TGR5),参与调节多种生理过程,包括脂质和葡萄糖代谢、能量平衡、炎症反应以及细胞增殖和死亡等。
Wahlström A,et al.Cell Metab.2016
这些发现极大地扩展了我们对胆汁酸功能的认识,将其从单一的消化辅助因子转变为重要的内分泌调节因子,影响着包括胃肠道疾病和人体健康的多个方面。
在肠肝循环中,肠道微生物将来自宿主的初级胆汁酸转化为众多代谢物,即次级胆汁酸。胆汁酸的这种转化被认为是微生物与宿主之间交流的主要方式之一,同时也是宿主感知、反应并影响其共生微生物组成的关键双向互动模式。
值得注意的是,微生物代谢生成的疏水性次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA),成为众多宿主受体的首选配体,优于它们的原始初级胆汁酸。在过去几十年里,由于相对缺乏运动,以及偏好低纤维、高加工碳水化合物和饱和脂肪的饮食,导致胃肠道中胆汁量和胆汁酸库的疏水性增加,进而提高了人类患肝胆疾病和胃肠癌的风险。
微生物通过它们的代谢产物以独特的方式与我们沟通。在本文中,我们重点介绍了肠道微生物对一些次级胆汁酸的代谢影响。这些反应可能改变胆汁酸池以及它们的结构和功能,我们还总结了关于次级胆汁酸衍生物如何影响宿主免疫功能的最新发现。并希望通过采取相应的措施来调节受微生物代谢的胆汁酸所影响的多种人类疾病。
胆汁酸是生理清洁剂,可促进肠道吸收和运输脂质、维生素等营养物质。胆汁酸也是激活核受体和细胞通路的信号分子和炎症因子。
胆汁酸作为肝脏合成的一种重要物质,是人体胆汁的主要成分,具有多种重要作用,主要包括以下几点。
胆汁酸的结构与功能
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
1
促进脂质消化吸收、调节代谢
胆汁酸促进脂肪与脂溶性维生素(如维生素A、D、E、K)的消化吸收,通过乳化作用将大块脂肪球分解为细小颗粒,增加其与消化酶的接触面积,提升脂肪消化效率。
胆汁酸还激活多种核受体(例如FXR、TGR5),参与调控脂质和糖的代谢以及能量平衡,对保持代谢健康发挥着关键作用。
2
调节胆汁分泌、保护肝脏
胆汁酸参与调节胆囊的收缩,通过负反馈机制影响胆汁的储存和释放,维持体内胆汁酸水平平衡。当食物进入小肠时,胆汁酸的浓度变化会促使胆囊收缩,将胆汁排入小肠中,参与消化过程。
胆汁酸还能通过激活肝细胞核受体(FXR受体)促进肝细胞再生和修复,抑制多种促炎和促氧化应激的信号通路,减少肝脏中的炎症反应和氧化损伤,从而起到保护肝脏的作用。
3
排泄毒素、参与药物代谢
胆汁酸是肝脏排泄胆红素(血红蛋白代谢产物)和其他代谢废物的重要途径。通过与这些物质结合,胆汁酸有助于将它们从体内排出,维持体内环境的稳定。
胆汁酸还通过影响肝脏的药物代谢酶,参与药物的代谢过程,影响药物的清除速率和生物利用度。
4
调节胆固醇水平、预防胆结石
胆汁酸的合成是消耗胆固醇的主要途径之一。通过将胆固醇转化为胆汁酸,肝脏可以调节体内胆固醇的水平,有助于降低血清胆固醇,从而维持血脂平衡。
胆固醇结石形成的基础为胆固醇、胆汁酸以及卵磷脂等成分的比例失调,进而发生结晶、析出、结聚成石。而胆汁酸有助于减少胆固醇,进而预防胆固醇结石的形成。
5
免疫调节、抑制肠道中细菌的过度生长
胆汁酸通过影响肠道免疫系统,参与调节机体的免疫反应,有助于维持免疫系统的平衡。
胆汁酸具有一定的抗菌作用,能够抑制小肠中过度的细菌生长,保持肠道微生态的平衡。
胆汁酸在一些疾病中也发挥着重要作用,详细内容可见谷禾之前的文章。
胆汁酸在人体中的这些作用说明了它对于维持正常的生理功能和健康状态的重要性。然而,胆汁酸的异常代谢或积累也可能导致或加剧某些疾病,如胆石症、肝病和胆汁淤积性皮肤病等。
因此,维持胆汁酸的正常代谢与平衡对于健康极为重要。接下来,我们将重点介绍最新研究所总结的肠道微生物群对胆汁酸代谢影响的内容。
在人体复杂的生理系统中,肠道微生物群扮演着不可或缺的角色,尤其是在胆汁酸的代谢过程中。胆汁酸作为重要的消化液成分,不仅参与脂肪的消化和吸收,还与体内多种代谢途径紧密相关。
在这个过程中,肠道微生物群通过其多样化的酶系统,对胆汁酸进行一系列复杂的生物转化作用,影响着胆汁酸的结构和功能。
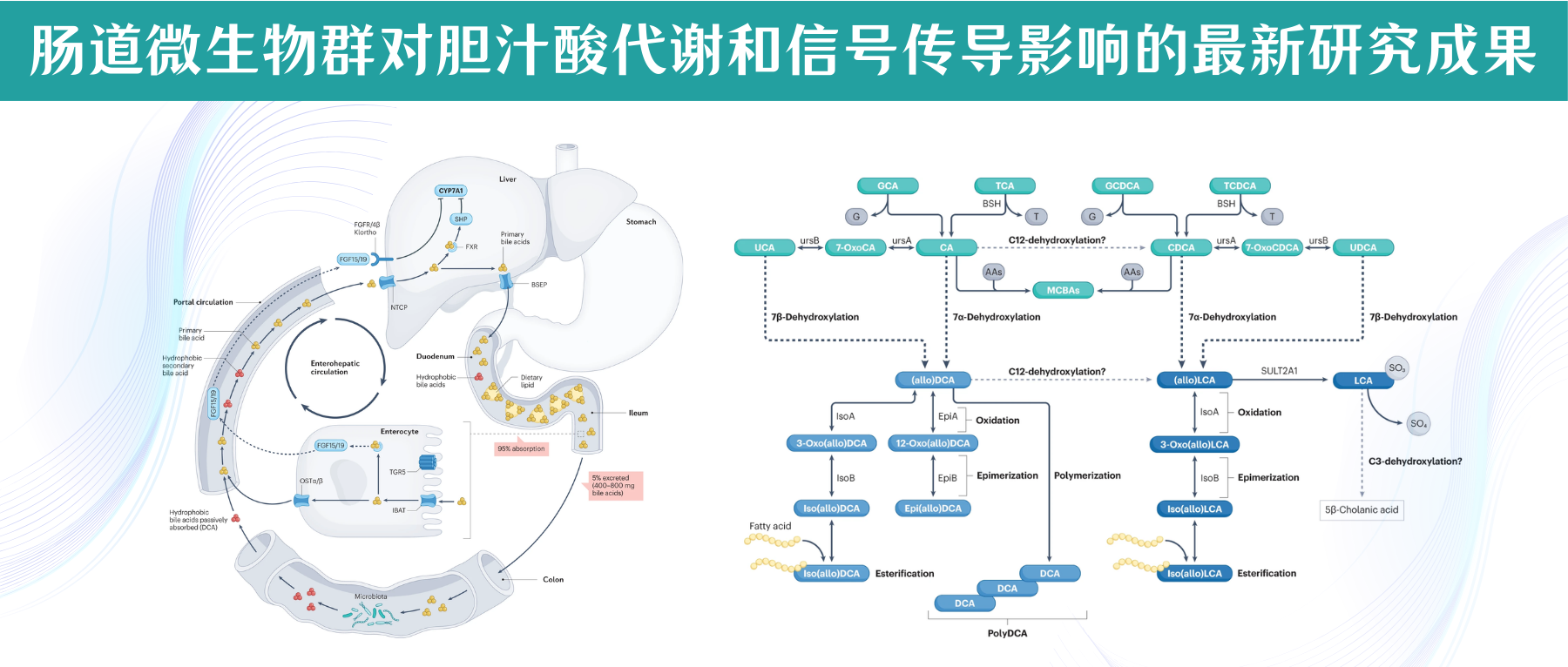
初级胆汁酸由胆固醇在肝细胞中合成,并通过转运蛋白BSEP分泌到胆汁中。吃饭时,胆囊会收缩,把胆汁释放至十二指肠,在那里与磷脂、脂肪酸、胆固醇及脂溶性维生素形成混合胶束,这些胶束由两亲性的共轭胆汁酸包裹。使其在通过肠细胞顶侧和底外侧的高亲和力转运蛋白通过门静脉循环转运回肝脏之前能够被吸收。
胆盐输出泵(BSEP)位于肝细胞胆小管面的细胞膜上,是胆汁酸外排最重要的转运蛋白,负责将胆盐从肝细胞输送到胆小管。
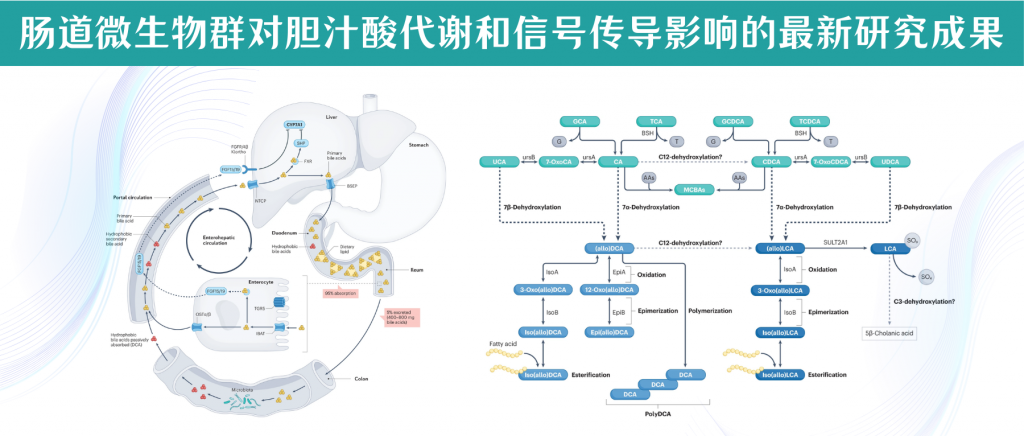
每天,数百毫克结合的胆汁酸脱离肠肝循环进入大肠,在大肠中被细菌胆盐水解酶(BSH)迅速解除结合,释放出牛磺酸或甘氨酸和游离胆汁酸。
注:胃肠道中存在几种利用牛磺酸的途径;然而,厌氧菌对牛磺酸的微生物呼吸导致硫化氢的形成,在人体研究和动物模型中硫化氢的过量形成与结直肠癌有关。
胆汁酸的反应与细菌胆盐水解酶相关
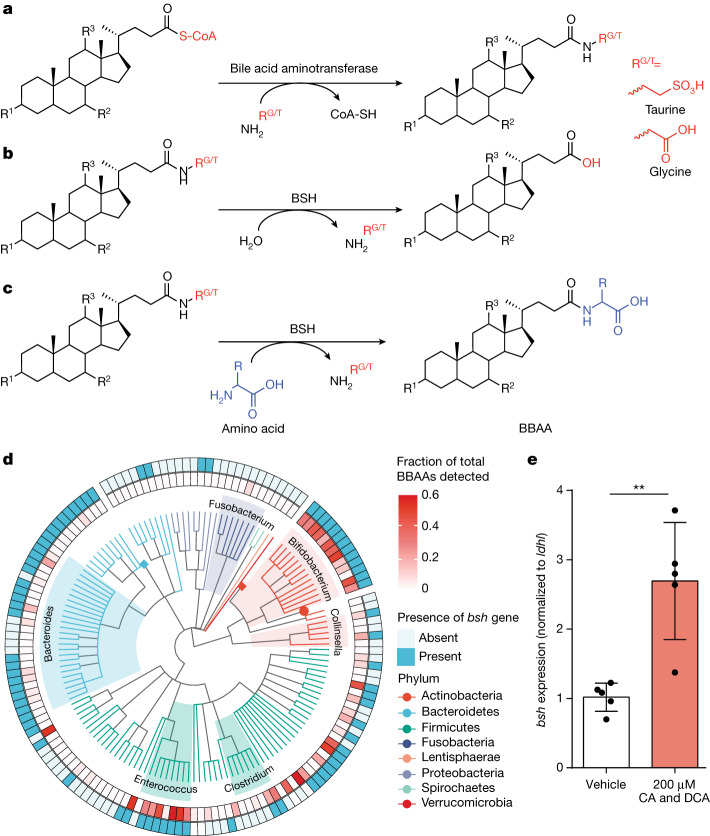
Rimal B,et al.Nature.2024
当结合胆汁酸到达回肠末端时,它们通过回肠钠-胆汁酸共转运蛋白(IBAT)转运到肠细胞中,与重组人脂肪酸结合蛋白6(FABP6)结合并通过肠细胞基底外侧表达的OSTα和OSTβ转运到门静脉循环中。
• 负反馈调节使胆汁酸水平保持稳定
作为胆汁酸合成负反馈功能的一部分,细胞内胆汁酸激活肠上皮细胞中的核法尼醇X受体(FXR),导致FGF15/19蛋白合成和分泌到门静脉循环中的上调。FGF15/19以依赖成纤维细胞生长因子受体FGFR4/β-Klortho受体的方式结合,导致肝脏胆汁酸生物合成的限速酶(CYP7A1)受到抑制。
返回肝脏的胆汁酸由牛磺胆酸共转运蛋白(NTCP)运输。肝细胞中FXR的激活抑制依赖于小异二聚体伴侣(SHP)和肝脏相关同源物1(lr h1)的CYP7A1表达。这个过程使胆汁酸水平保持在稳定状态。
• 肠道微生物改变胆汁酸的结构和功能
肠干细胞中TGR5的激活促进肠细胞的再生。大约5%的胆汁酸(每天400-800毫克)从回肠运输中逃逸并进入大肠,大肠是胆固醇排出体外的主要途径。在大肠中,胆汁酸的结构和功能因肠道微生物群而变化。这种多样化的一部分是增加大肠中胆汁酸的疏水性,允许结肠细胞被动吸收并进入门静脉循环,其中次级胆汁酸(主要是脱氧胆酸)积累到健康人体胆汁酸库的大约四分之一。
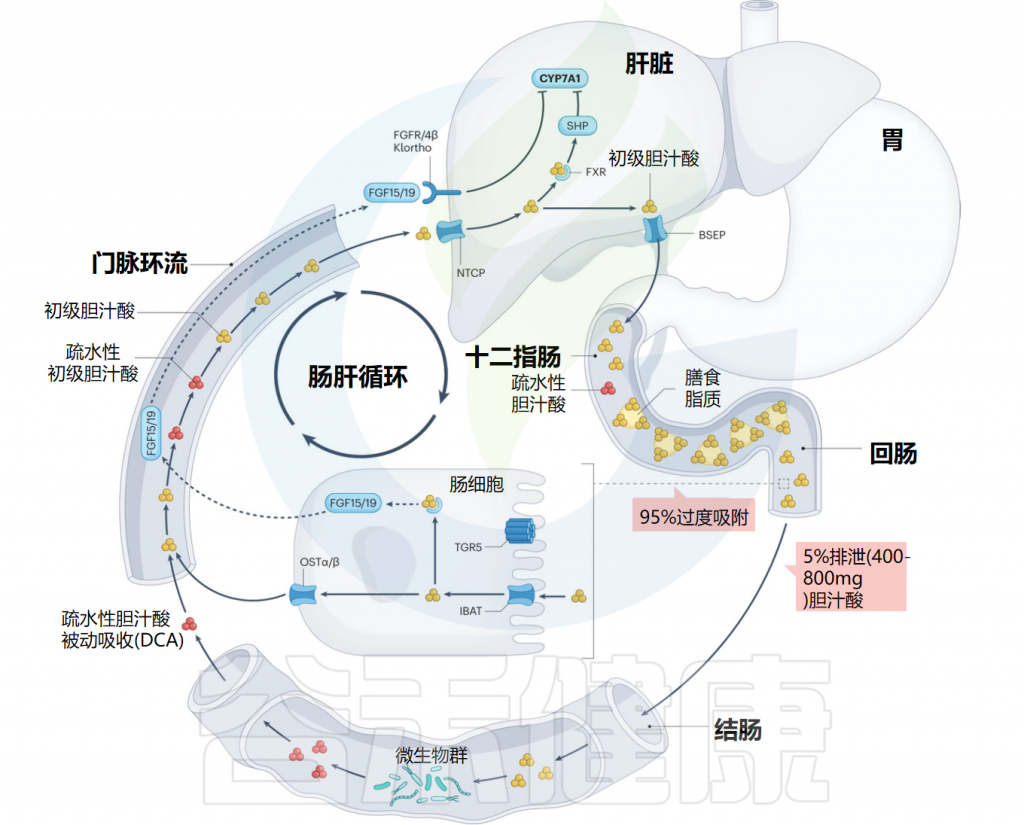
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
宿主的初级胆汁酸通过肠道微生物代谢的首个证据是混合粪便细菌和微生物分离物对结合胆汁酸的解偶联。
• 众多肠道细菌中都存在胆汁酸代谢酶
胆盐水解酶(BSH)是研究最广泛的微生物胆汁酸代谢酶之一,在肠道微生物组内广泛存在,涵盖多个门类的各种物种。包括乳杆菌、双歧杆菌属和肠球菌在内的革兰氏阳性共生细菌,以及在拟杆菌属等革兰氏阴性菌,均表现出BSH活性。
哺乳动物胃肠道中常见的古细菌也表达BSH。系统发育分析表明BSH基因从芽孢杆菌(Bacillota)向肠道产甲烷菌的水平基因转移。BSH是病原体胃肠道定植所必需的,包括流产布鲁氏菌(Brucella abortis)和单核细胞增多性李斯特菌(Listeria monocytogenes)。
• 胆汁酸的检测可为胃肠道定植提供信号
结合胆汁酸的检测为胃肠道定植提供了重要的环境信号。BSH基因可能是一种定居因子,提供碳、氮、硫和能量来源的氨基酸组合;防止结合胆汁酸的去污剂特性,促进胃肠定植和持续存在;并增强细菌膜的抗张强度、流动性和电荷,保护细菌免受宿主免疫攻击。
应注意,BSH在不同分类群中发挥不同作用,且在可能的情况下,对BSH基因的同源性应通过产生突变体来确定其在细菌生理和宿主生理中的具体功能。
• BSH酶活性影响胆汁酸水平进而影响宿主代谢健康
相比之下,小肠中的BSH活性产生的非结合胆汁酸极性较低,并且通过回肠钠-胆汁酸共转运蛋白(SLC10A2)的转运效率较低,导致粪便中胆汁酸排泄增加。这种增加的胆汁酸排泄促使胆固醇更多地转化为胆汁酸或通过胆固醇反向转运回肝脏,从而降低血清胆固醇。BSH活性通过减少胶束脂质和胆固醇的重吸收以及增加粪便中胆汁酸的损失,并刺激胆固醇转化为胆汁酸,促使血清胆固醇降低。
一项针对2-7岁儿童的研究支持BSH与大环内酯类抗生素治疗引起的体重增加之间的负相关关系。最新的组学应用表明,BSH活性对宿主的生理影响可能主要通过肠道和肝脏中的细胞信号传导介导,而不仅仅是通过其洗涤剂作用和脂质吸收。
BSH活性影响宿主胃肠成熟并改变与昼夜节律、肝脏葡萄糖和脂质稳态以及免疫功能相关的肝脏和肠道基因表达。由于BSH酶在氨基酸缀合物(如甘氨酸和牛磺酸)和甾醇核底物特异性方面的差异,靶向BSH酶的子集可能是实现特定临床结果所需的。大规模宏基因组调查揭示了BSH基因与人类慢性病之间的联系,提示需要进一步的功能表征。
针对BSH酶的特异性抑制剂已被开发,对这些酶的不同亚群的药理学抑制的进一步改进可能对人类疾病和动物生产都有治疗作用。
肠道微生物产物能调节胆汁酸在肝脏的结合,展现出潜在的治疗优势。”三级胆汁酸”一词用以指代由二级胆汁酸在肝脏代谢后形成的特殊胆汁酸。
• 一些“三级胆汁酸”具有抗糖尿病效果
二级胆汁酸石胆酸(LCA)的II期代谢可产生三级胆汁酸3-磺基石胆酸。此外,石胆酸的微生物转化及其在回肠的吸收也促进了肝脏中其他胆汁酸的硫酸化。2021年的研究显示,接受部分袖状胃切除手术的人和小鼠粪便中,石胆酸诱导了7-硫酸胆酸的增加,这种胆酸是肠道特异性TGR5激活剂,能刺激胰高血糖素样肽1的释放,具有抗糖尿病的效果。
肠道微生物通过表达芳基硫酸酯酶,能从三级胆汁酸移除硫酸盐,这一过程与Peptococcus, Clostridium, Pseudomonas和Fusobacterium有关。但是,参与的微生物硫酸酯酶的具体身份还未确定。
肠道微生物群也可能在肠道内进行胆汁酸的硫酸化,这一机制过去被认为完全依赖宿主酶。如果这一假设得到验证,细菌对胆汁酸的硫酸化作用将淡化二级胆汁酸与三级胆汁酸之间的区别。
“异二级胆汁酸”(是一类特殊的胆汁酸,它们在化学结构上与常见的二级胆汁酸有所不同。在正常情况下,胆汁酸主要由肝脏合成,并以初级胆汁酸的形式分泌到小肠中。当初级胆汁酸进入肠道后,部分会被肠道微生物通过各种酶作用转化为二级胆汁酸。这一过程称为胆汁酸的微生物代谢。
“异二级胆汁酸”是在这一微生物代谢过程中,通过非典型或不常见的代谢途径生成的二级胆汁酸。这意味着它们的化学结构或代谢途径与通常所见的二级胆汁酸有所区别。
研究已经发现了生成异二级胆汁酸的两种途径。
• 直接途径通过酶催化转变
我们将第一种途径称为“直接途径”,其中初级胆汁酸通过hylemon–bjӧrkhem途径转化为alloDCA或alloLCA。
在限速的7α-脱水步骤(由BaiE催化)后,形成3-oxo-4-DCA或3-oxo-4-LCA中间体。在Hylemon–Björkhem途径中,3-氧代-4-DCA通过BaiCD(胆汁酸5β-还原酶)和BaiA(3α-羟基类固醇脱氢酶)的催化还原转化为脱氧胆酸。或者,3-氧代-4-DCA可经由BaiP或BaiJ(胆汁酸5α-还原酶)和BaiA的催化还原转化为alloDCA。
• 间接途径还需要细菌参与反应
第二种途径,我们称之为“间接途径”,首先依赖于能产生DCA或LCA的胆汁酸7-脱羟基细菌,如C.scindens。在此情境下,表达3α-HSDH、胆汁酸5β-还原酶和胆汁酸5α-还原酶的肠道微生物通过代谢调节DCA和alloDCA间的平衡,通过3-氧代-4-DCA中间体的环立体化学重置,产生异二级胆汁酸。
直接与间接途径对异二级胆汁酸形成的贡献程度目前尚不明确,这可能在不同个体之间存在差异。
石胆酸(LCA)是由鹅去氧胆酸(CDCA)和熊去氧胆酸(UDCA)经C7脱羟基反应后的微生物产物,属于单羟基化胆汁酸,是脊椎动物中最主要的胆汁酸之一。
• 石胆酸是一种潜在的致癌物
作为潜在的致癌物,石胆酸能产生活性氧和DNA加合物,通过抑制DNA修复酶,发挥肿瘤启动作用,促进体外抗凋亡细胞增殖。研究CDCA或UDCA治疗胆结石期间的人类石胆酸代谢揭示,LCA经过广泛硫酸化,形成3-磺基LCA(3-sulfoLCA)。
DNA加合物是DNA片段与致癌化学物质结合形成的复合物,在科学实验中通常作为暴露的生物标注物。
• 微生物代谢可产生不属于胆汁酸的新型物质
已知LCA是VDR的强配体,能诱导磺基转移酶SULT2A1表达。LCA的硫酸化在II期代谢中形成亲水性衍生物,促进其排泄,不易被肠道吸收。肠道细菌通过表达芳基硫酸酯酶,使3-磺基LCA解偶联,释放LCA,形成宿主II期代谢与微生物解偶联的“来回”过程。有证据显示,存在一种微生物代谢路径能跳出此循环,产生不再定义为胆汁酸的产物。
• C3脱羟基是胆汁酸代谢的一种重要方式
虽然胆汁酸脱羟基研究主要聚焦于Hylemon–Björkhem途径,但也报道了包括C3脱羟基在内的其他胆汁酸脱羟反应。C3脱羟基将胆汁酸转变为5β-胆烷酸衍生物,对胆汁酸代谢谱构成特殊挑战。
研究显示,人类粪便悬浮液能将3-磺基LCA转化为异LCA、Δ3-cholenic acid和5β-cholanic acid,肠道微生物在其中可能起到了重要作用。加入万古霉素抑制了3-sulfoLCA的代谢,而选择性培养3-sulfoLCA 代谢的革兰氏阳性孢子形成细菌(如经加热和酒精处理的粪便)则不受影响。梭菌纯培养物能从3-磺基LCA产生异LCA、Δ3-胆酸和5β-胆酸。
研究报告鹅去氧胆酸在人类粪便悬浮液中转化为7α-羟基-5β-胆甾烷-24酸,显示Hylemon–Björkhem途径产生LCA不需C3脱羟基先行。需要进一步研究以确定C3脱羟基及其机制,及其胆汁酸底物范围。
★ 胆汁酸C3脱羟基可能是预防胃肠道癌症的策略
5β-胆烷酸的生理影响尚不明确,但胆汁酸C3脱羟基可能是降低胃肠道胆汁酸浓度,预防胃肠道癌症的策略之一,类似于通过肠道细菌增强胆固醇转化为粪甾醇以降低血清胆固醇的方法。
一系列5β-胆烷酸衍生物被证明有效激活FXR,比羟基化胆汁酸更为有效。肝胃肠疾病背景下,肝细胞癌原位小鼠模型使用显示,FXR激动剂与TGR5拮抗剂结合使用,显著抑制肿瘤生长。因此,确认宿主或微生物衍生的5β-胆烷酸衍生物的生理相关性应非常重要。
拓展:胆汁酸7α-脱羟基的几个关键方面
在该领域的研究中,胆汁酸7α-脱羟基化的几个关键方面已经显现出来。首先,胆汁酸C24酰胺(结合胆汁酸)不是底物。因此,胆汁酸水解是胆汁酸7α-脱羟基的先决条件。值得注意的是,BSH抑制剂确实被观察到能使宿主富含初级胆汁酸。
第二,胆汁酸7α-脱羟基作用似乎只存在于相对较少的杆菌属物种中(Ruminococcaceae, Peptostreptococcaceae, Lachnospiraceae and Oscillospiraceae)。
第三,根据胆酸转化为脱氧胆酸的相对速率,将这些物种种群分为两组(低活性与高活性),其差异相差很大,约为100倍。
第四,尽管种群数量很小,但已确定的微生物群落的复杂性从少数到100个成员不等,这表明具有bai操纵子的生物体是脱氧胆酸和石胆酸形成所必需的。
第五,微生物中的bai途径酶已经演化出对其宿主产生的内源性胆汁酸的识别能力。因此,虽然肠道微生物可以将βMCA转化为脱氧胆酸,但在无菌小鼠中定植的人类肠道微生物群却无法将胆汁酸转化为脱氧胆酸或鹅去氧胆酸转化为石胆酸,熊去氧胆酸(UDCA)是个例外,它可以通过7β-脱羟基转化为石胆酸(LCA)。
最后,bai途径是一个涉及净双电子还原的氧化还原过程,即胆汁酸充当电子受体,这一点对其演化至关重要。在结肠这样一个高度还原、厌氧的环境中,微生物需要处理还原当量,而通过还原不饱和胆汁酸的脱羟基过程,微生物在一定程度上完成了这一任务。然而,还可能有同等或更重要的潜在动机,包括但不限于通过增加有毒胆汁酸的产生和增强与宿主之间的结构性信号交流来消除对关键营养素的微生物竞争,从而提高胆汁酸生产者在肠道环境中的适应性。
• 肠道菌群通过生物转化形成微生物结合胆汁酸
下一代测序技术的兴起和计算能力的增强共同推动了肠道微生物学的快速发展。非靶向代谢组学的显著进步为化学信息学家揭示新的微生物代谢产物铺平了道路。
这种化学信息学方法已成功鉴定了微生物结合胆汁酸(MCBA),微生物结合胆汁酸(MCBA)是一类由肠道微生物群通过生物转化作用产生的化合物。在这一过程中,肠道细菌(例如Enterocloster boltaea)通过特定的酶作用,将非传统的氨基酸或其他分子与胆汁酸发生结合(酰胺化反应),从而形成MCBA。
两项新研究表明,BSH酶能够产生具有特定氨基酸序列和结合特异性的MCBA。MCBA主要在小肠产生,且BSH酶活性最高。研究表明MCBA能够通过PXR和FXR发出信号,从而影响人体代谢。
• 肠道菌群通过短链脂肪酸等酯化胆汁酸可能降低毒性
胃肠道细菌能够通过醇类、短链脂肪酸和长链脂肪酸酯化胆汁酸。据报道,乳酸杆菌、真杆菌和拟杆菌相关的胆汁酸酯化过程依赖于乙醇的添加。细菌还能产生胆汁酸脂肪酸酯,其中长链脂肪酸(如C16和C18脂肪酸)以及短链脂肪酸(如乙酸盐)与异脱氧胆酸和异石胆酸的C3位点相连。
有研究描述了DCA(脱氧胆酸)分子的C24羧基与另一个DCA分子的3α-羟基通过低聚反应形成聚酯链。这些反应被认为是一种降低排泄物中疏水性次级胆汁酸以及有毒脂肪酸和醇浓度的解毒策略。
需要注意的是,粪便样本中的胆汁酸酯测量相对较少。健康人粪便样本的比较分析显示,总胆汁酸(主要是异DCA和异LCA)的10%至30%形成了酯化物。
因此,在设计粪便胆汁酸提取方案以解决特定临床和研究问题时,考虑细菌胆汁酸结合物的多样性和数量是至关重要的。目前,方法学的进步使得我们能够鉴定新的胆汁酸代谢产物,发现新的胆汁酸代谢酶,并通过靶向微生物菌株和生化途径来改变胆汁酸代谢。
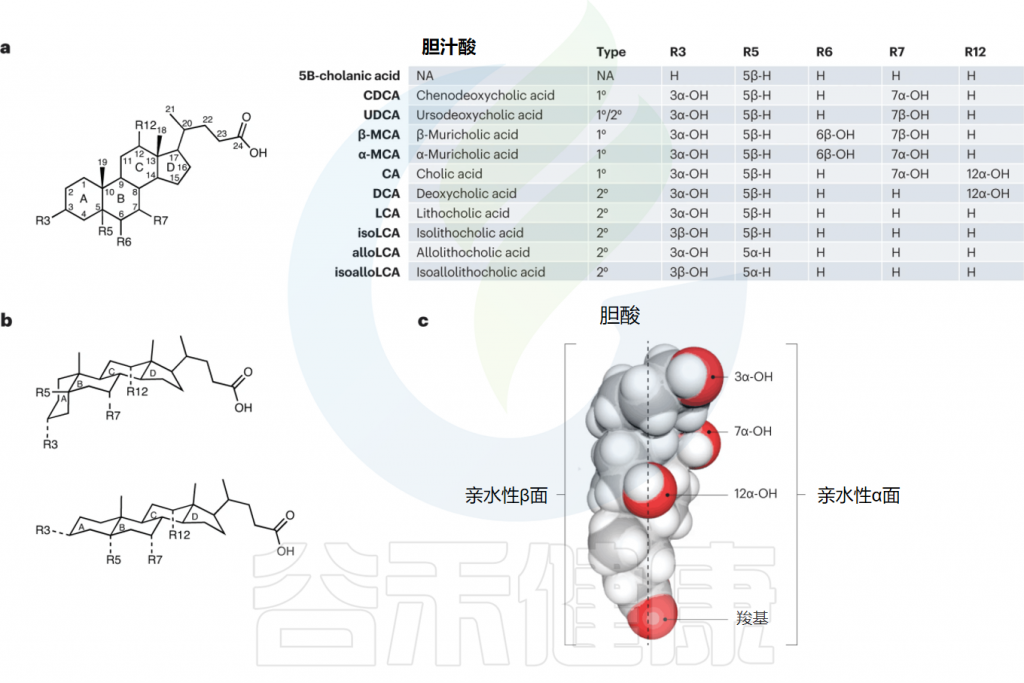
历史上,初级胆汁酸被定义为含有7α-羟基的胆汁酸,而去除7α-羟基的过程产生的胆汁酸则被定义为次级胆汁酸。如今,次级胆汁酸被认为是宿主初级胆汁酸经过微生物反应产生的产物,这包括通过微生物氧化、差向异构化和脱羟基等过程的产物。胆汁酸结构的多样性反映了胃肠道中分布广泛的细菌和古菌门中存在多种酶途径。
• 过高疏水性次级胆汁酸与胃肠道癌症和结石相关
研究表明,过高的疏水性次级胆汁酸水平与胃肠道癌症和胆固醇结石的形成有关。因此,识别出负责产生脱氧胆酸和石胆酸的肠道细菌,了解这些转化过程中产生的胆汁酸中间体,以及鉴定催化这些生物转化的酶基因和每种反应的催化机制对于解释微生物组数据和设计预防或治疗疾病的胆汁酸代谢组干预措施至关重要。
据报道,bai操纵子在体内和体外都能催化胆酸转化为脱氧胆酸。人类粪便样本中bai基因的测量现在正成为炎症性肠病和抗生素治疗中胆汁酸失调或胃肠道癌症中胆汁酸过量的标记。
• 胆汁酸的水平可以反映出一些疾病
与胃肠道癌症密切相关的疏水性次级胆汁酸(如脱氧胆酸和石胆酸)在宿主免疫功能、血清素产生、细胞信号传递、预防艰难梭菌定植、营养吸收以及抵抗肠道病毒感染方面发挥着重要生理作用。
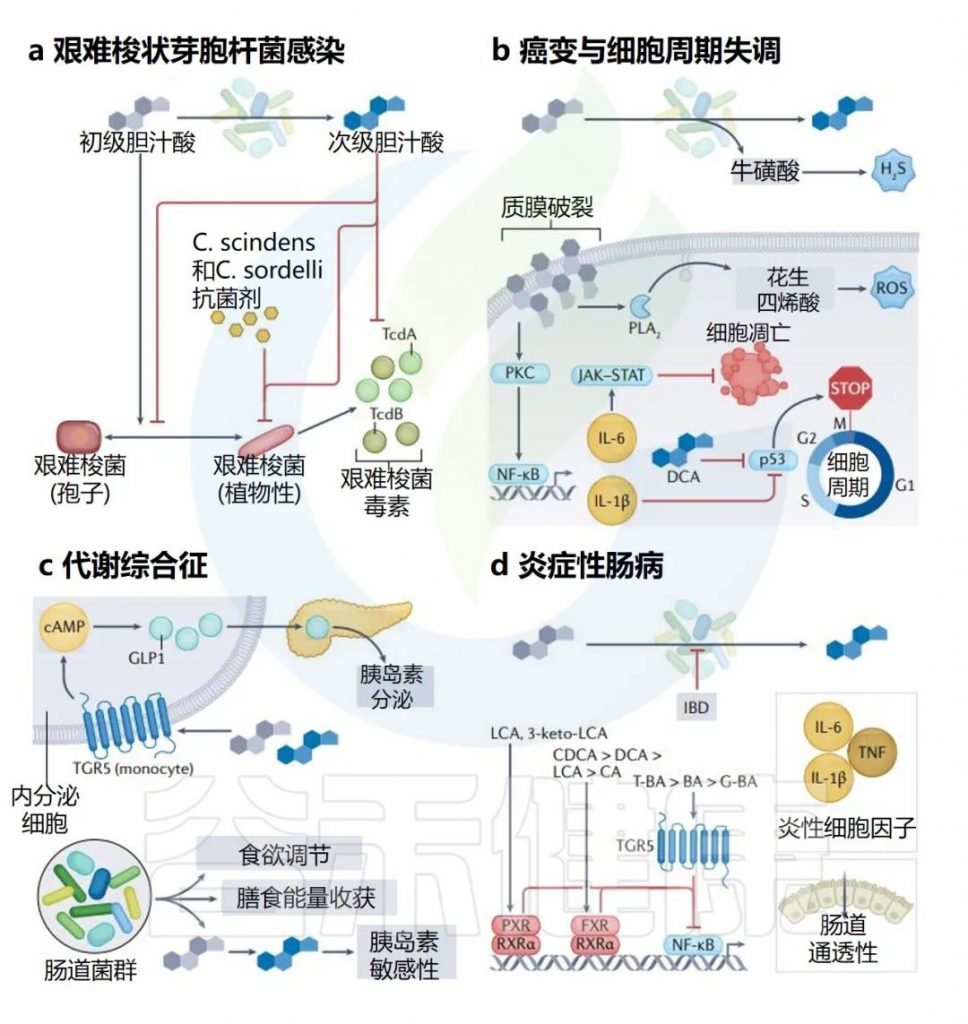
Collins SL,et al.Nat Rev Microbiol.2023
通过采用低动物蛋白和脂肪、高复合碳水化合物和纤维的饮食,可以降低肠道胆汁酸水平,保持疏水性胆汁酸的益处,同时减少因粪便中胆汁酸水平升高和脱氧胆酸富集而带来的风险。
与同龄健康人相比,肝硬化患者的胆汁酸库显著减少,7α-脱羟基胆汁酸生成细菌的丰度降低,粪便中脱氧胆酸和石胆酸含量减少,伴随有以毒性革兰氏阴性菌为特征的微生态失调。而肝硬化患者接受肝移植后,观察到胆汁酸分泌增加、粪便中次级胆汁酸含量上升、肠道微生物多样性提高和全身炎症减轻。
• 通过调节肠道菌群改善次级胆汁酸水平
粪便微生物群移植能恢复认知功能,改善炎症状况,与此同时,粪便中脱氧胆酸和石胆酸含量增加,伴随着与次级胆汁酸形成相关的革兰氏阳性菌数量增加。
此外观察到预后不佳的患者血清和粪便中次级胆汁酸水平显著降低,与次级胆汁酸生成相关的细菌基因数量减少,这些发现突显了维持疏水性次级胆汁酸和肝肠轴平衡的重要性。
人体肠道中胆汁酸的生物转化
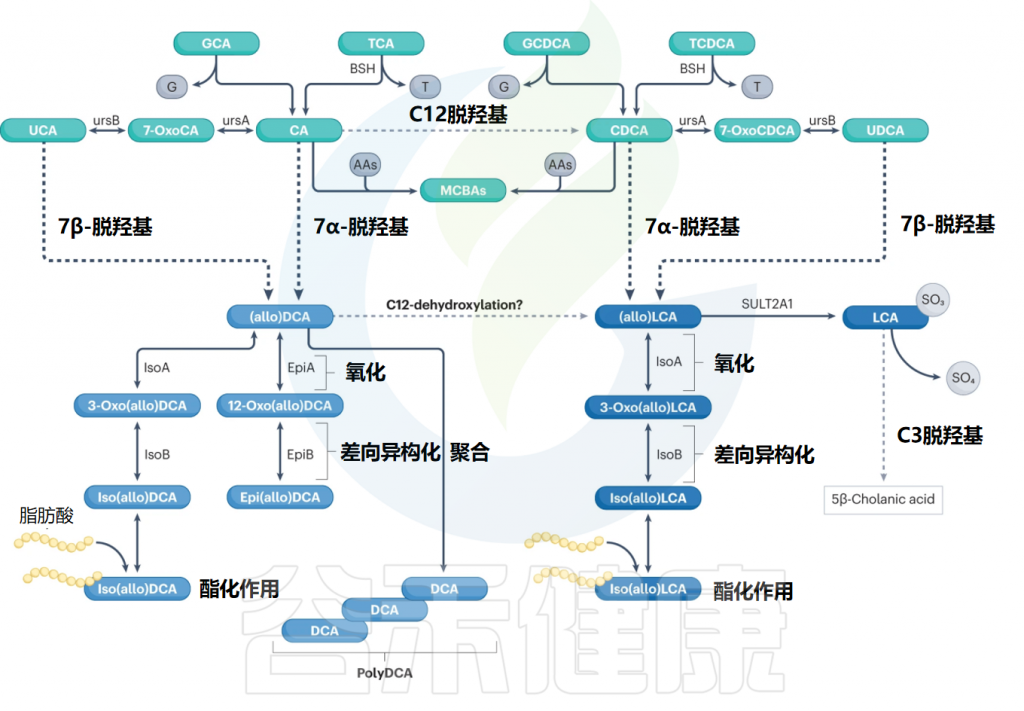
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
人类结肠中参与胆汁酸代谢的细菌类群
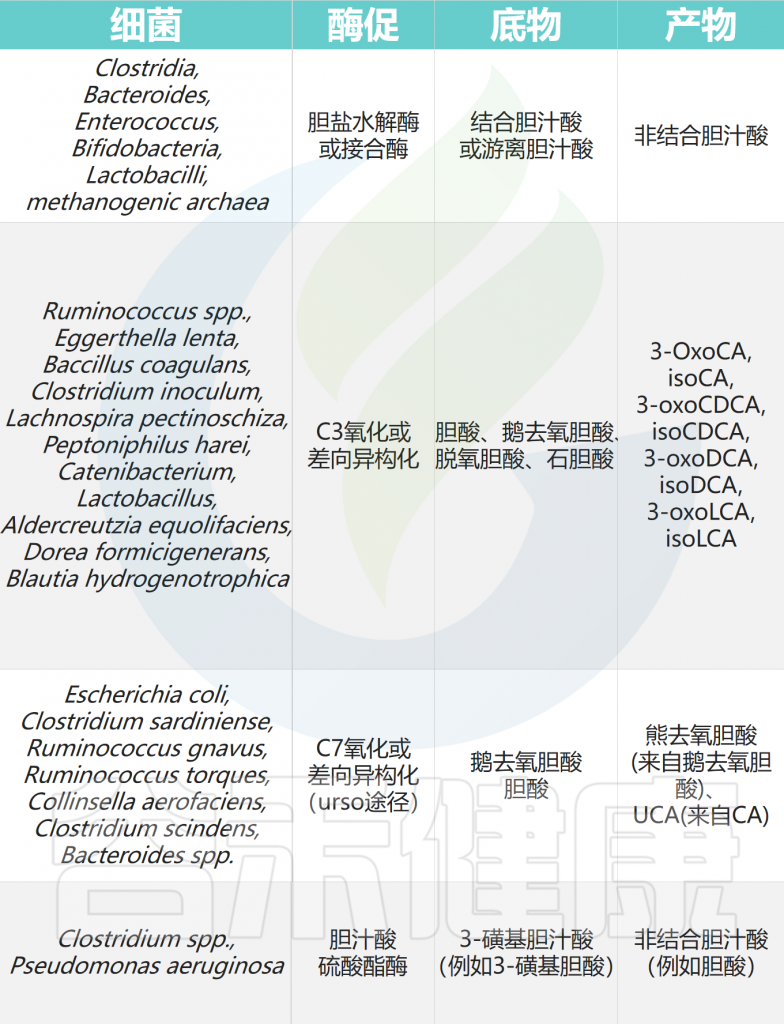
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
重点:靶向微生物群-胆汁酸相互作用
作为胃肠和代谢疾病的潜在治疗方法
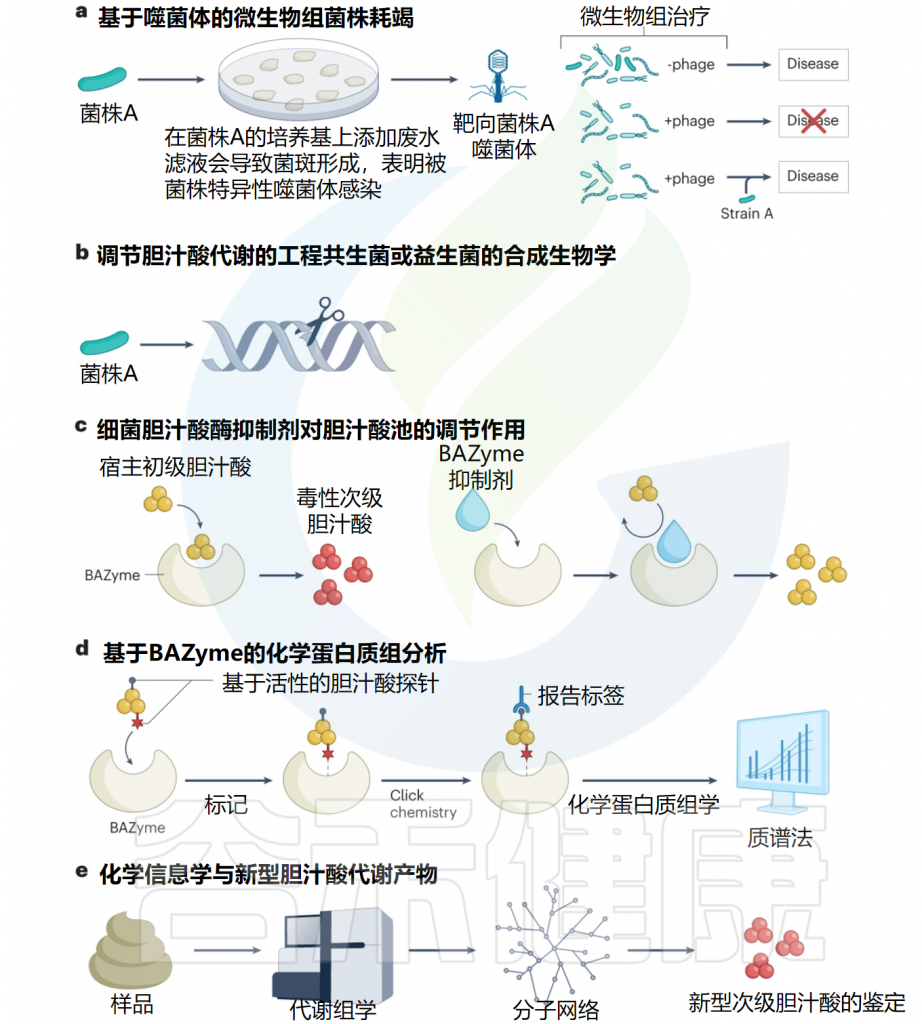
编辑
a.研究表明,选择细菌菌株依赖性噬菌体来去除在炎症性肠病等疾病中起因果作用的微生物菌株具有潜在的实用性。
b.合成生物学提供了合理设计共生菌或益生菌以调节活体胆汁酸代谢的潜力。
c.针对微生物组的特异性抑制剂的开发有望提供治疗潜力。胆汁盐水解酶(BSH)酶抑制剂的开发使人们能够探究改变胆汁酸代谢的影响。
d.使用化学胆汁酸探针的化学蛋白质组分析允许发现参与胆汁酸代谢的新型细菌酶。在胆汁酸探针与胆汁酸结合酶(BAZyme)共价结合后,蛋白质组学质谱法可以鉴定候选基因序列。
e.化学信息学将代谢组学与计算相结合,以获得代谢网络,其中一些节点代表揭示先前未知细菌代谢的新代谢产物。
胆汁酸羟基的氧化和差向异构化显著增加了胆汁酸代谢产物的多样性。早期研究发现,E.lenta、Blautia producta、Clostridium absonum、产气荚膜梭菌、副腐败梭菌、大肠杆菌、脆弱拟杆菌和瘤胃球菌等物种能够氧化和还原胆汁酸,这对于鉴定和表征编码这些酶的HSD基因至关重要。
这些过程涉及羟基在三个稳定位置(例如3α-OH、3-3-oxo氧代和3β-OH)之间的转换,由特异性和立体特异性的吡啶核苷酸依赖性HSDH酶催化。
•胆汁酸的异构化对代谢和免疫至关重要
含氧胆汁酸和胆汁酸差向异构体对生理具有重要影响。例如,7-OxoCDCA能够竞争性抑制肝脏11β-HSD2,影响糖皮质激素代谢。
研究还发现,破坏11β-羟基类固醇脱氢酶1(11β-HSD1)亚型的活性可增加饮食中普雷沃氏菌(Prevotellaceae)和西方饮食中拟杆菌(Bacteroidaceae)的相对丰度。
次级含氧胆汁酸如3-oxoLCA能够抑制胃肠道中辅助T细胞17的发育。胆汁酸和其衍生物的差向异构化,如鹅去氧胆酸和胆酸的可逆氧化及差向异构化,产生了熊去氧胆酸。熊去氧胆酸因其在治疗胆道和胃肠道疾病中的应用而具有悠久历史,是治疗原发性硬化胆管炎的一种疗法。
长期以来,次级胆汁酸与慢性炎症相关的胃肠疾病有关,包括炎症性肠病和结肠直肠癌,大量文献提供了与多种作用机制一致的数据,包括直接细胞毒性、直接DNA损伤、与NF-κB活化相关的炎症、活性氧诱导导致的细胞氧化还原平衡扰动以及通过激活各种细胞周期和炎症信号通路增强的细胞增殖。
一般认为,这些作用在不同程度上反映了次级胆汁酸的疏水性,导致宿主细胞的膜损伤,以及它们通过与细胞表面和核受体的相互作用激活许多细胞信号级联。还有大量报道称次级胆汁酸在离体和体外系统中发挥抗炎和免疫抑制反应。
“
通过微生物和宿主细胞控制次级胆汁酸的代谢可能是防止局部炎症的一种方式
如前所述,现在很清楚的是,通过多种酶促途径,肠道微生物群能够产生高度多样化的次级胆汁酸代谢组,由于分析技术不完善和缺乏次级胆汁酸含量较低的化学标准,很少对其衍生物进行测量。
正是这种多样的次级胆汁酸代谢组整体上可能有助于设定结肠中的炎症张力和肿瘤细胞生长的调节。需要更多的工作和新的组织和细胞工程方法来更完整和准确地了解次级胆汁酸代谢组如何促进局部炎症和生长控制。有了这些新知识,就有可能确定一系列无害的方法,通过微生物和宿主细胞来控制次级胆汁酸的共代谢,以防止局部炎症或恢复正常生长控制。
尽管如此,通过使用一种无菌小鼠,微生物工程和各种基于组学的方法,一些以前被忽视的胆汁酸衍生物的贡献正在出现新的见解,这些衍生物似乎可以调节致病性TH17炎症和具有抗炎特性的Treg细胞之间的平衡;简要总结如下。
“
石胆酸的衍生物对T细胞具有关键调节作用
研究通过在TH17细胞或Treg细胞分化条件下的体外试验中筛选30种初级和次级胆汁酸代谢产物的文库,发现了两种LCA衍生物——3-oxoLCA和isoalloLCA——对小鼠原始CD4+T细胞分化具有关键调节作用。
具体来说,3-oxoLCA能够抑制TH17细胞的分化,表现为IL-17a表达的减少,而异alloLCA则增强了Treg细胞的诱导,表现为FOXP3表达的增加。
FOXP3是一种调节性T细胞特异性转录因子,主要在调节性T细胞中表达,被认为是调节性T细胞的主要标志物之一。
进一步的研究表明,3-oxoLCA通过直接与关键转录因子视黄酸受体相关孤儿受体γt(RORγt)结合来抑制TH17细胞的分化,而异alloLCA则通过增强线粒体活性氧的产生来促进Treg细胞的分化,进而增加FOXP3的表达。
“
其他次级胆汁酸对TH17细胞和Treg细胞的调节作用
之前的研究已经表明,多种氧化甾醇能够与RORγt转录因子相互作用,这为3-oxoLCA通过直接与RORγt结合来抑制TH17细胞分化提供了先例。与此同时发布的其他研究进一步强调了次级胆汁酸在调节TH17细胞和Treg细胞分化中的重要作用。
研究发现石胆酸(LCA)和3-oxoLCA通过与核受体VDR相互作用调节表达RORγ+的FOXP3+Treg细胞的证据。通过筛选在小鼠和人类中发现的主要去偶联胆汁酸在体外提高Foxp3诱导能力的研究中,还发现异DCA(脱氧胆酸)通过降低树突状细胞的免疫刺激特性,从而增加Foxp3的诱导。
异DCA增强Treg细胞的生成依赖于树突状细胞中FXR的表达,这为异DCA与FXR在髓系细胞中相互作用的参与提供了证据,并可能有助于在小鼠肠道中诱导外周的Treg细胞。
次级胆汁酸异等位LCA通过与核激素受体NR4A1相互作用增强Treg细胞的分化,激活了Foxp3基因的转录,并在肠道拟杆菌门中鉴定了一个生物合成基因簇,该基因簇将3-oxoLCA转化为异等位。
通过分析HMP2 IBDMDB队列中132名参与者(包括克罗恩病、溃疡性结肠炎患者及对照组)的粪便样本的代谢组学和宏基因组图谱,发现炎症性肠病患者中异alloLCA及其生物合成基因显著减少。
值得注意的是,在HMP2队列的代谢组学数据中,与对照组相比,克罗恩病和溃疡性结肠炎患者中异alloLCA的倍数变化是所有已鉴定胆汁酸中最大的。
次级胆汁酸衍生物对炎症和免疫细胞分化及功能的调节
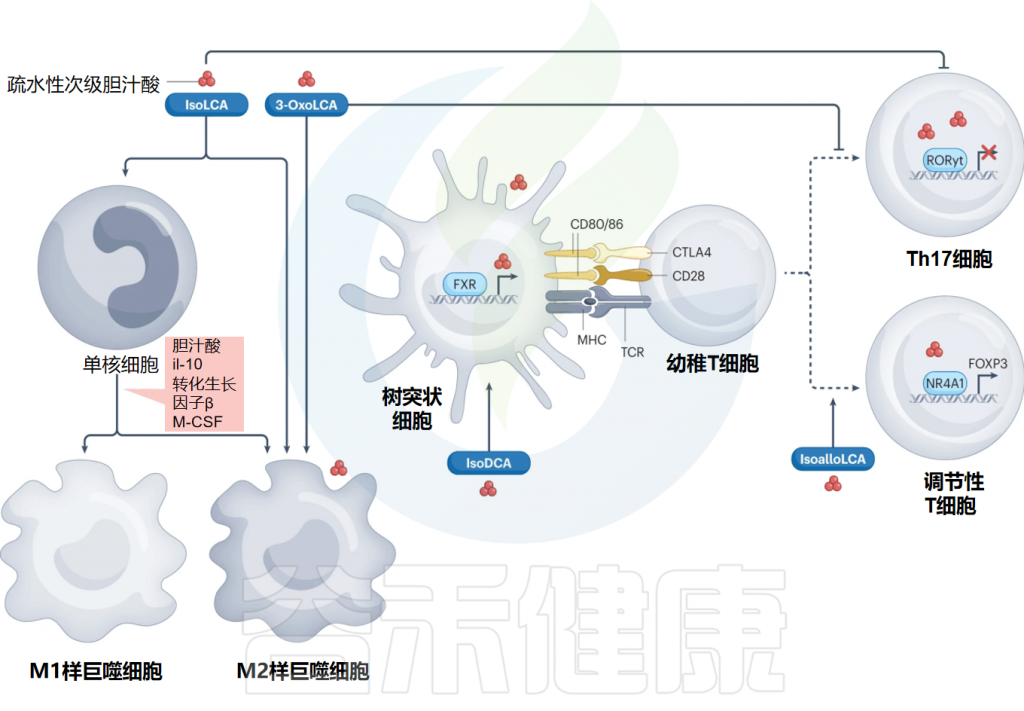
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
小结
数据揭示了特定次级胆汁酸衍生物对巨噬细胞前体的分化、树突状细胞的抗原呈递能力以及CD4+T细胞早期分化过程有着不同的作用,这对胃肠道炎症的调节产生影响。
简而言之,异石胆酸(isoLCA)和3-oxoLCA影响巨噬细胞的极化状态,异脱氧胆酸(isoDCA)通过诱导树突细胞中FOXP3的表达来减弱其免疫激活特性,平面型异石胆酸通过与核激素受体NR4A1相互作用促进调节性T细胞(Treg)的分化,激活FOXP3基因的转录,而3-oxoLCA则抑制辅助性T细胞17的分化。
因此,多项研究证明了次级胆汁酸衍生物通过调节TH17细胞和Treg细胞之间的平衡,有效地影响肠道的炎症状态。
本文讲述了有关肠道微生物群对胆汁酸代谢和信号传导影响的最新研究进展,包括胆汁酸的水解、氧化、差向异构化以及C3脱羟基作用等。还介绍了异二级胆汁酸和三级胆汁酸等特殊胆汁酸的产生方式和作用。
特别强调了这些微生物修饰的胆汁素代谢产物与人类健康及疾病之间的联系,尤其是在免疫功能方面。考虑到胆汁酸在调节葡萄糖、脂质和能量代谢中的作用,它们可能成为肠道微生物群与代谢疾病之间联系的基础,包括肥胖、糖尿病和代谢功能障碍相关的脂肪性肝病。
了解肠道微生物对胆汁酸的多重作用,所获得的知识将推动基于微生物组的新干预措施的发展,通过调控胆汁酸库,以预防和治疗胃肠道疾病甚至是更多人类疾病。
主要参考文献
Ridlon JM, Gaskins HR. Another renaissance for bile acid gastrointestinal microbiology. Nat Rev Gastroenterol Hepatol. 2024 Feb 21.
Rimal B, Collins SL, Tanes CE, Rocha ER, Granda MA, Solanki S, Hoque NJ, Gentry EC, Koo I, Reilly ER, Hao F, Paudel D, Singh V, Yan T, Kim MS, Bittinger K, Zackular JP, Krausz KW, Desai D, Amin S, Coleman JP, Shah YM, Bisanz JE, Gonzalez FJ, Vanden Heuvel JP, Wu GD, Zemel BS, Dorrestein PC, Weinert EE, Patterson AD. Bile salt hydrolase catalyses formation of amine-conjugated bile acids. Nature. 2024 Feb;626(8000):859-863.
Mancin L, Wu GD, Paoli A. Gut microbiota-bile acid-skeletal muscle axis: (Trends in Microbiology, corrected proof). Trends Microbiol. 2023 Mar;31(3):322.
Garcia M, Thirouard L, Sedès L, Monrose M, Holota H, Caira F, Volle DH, Beaudoin C. Nuclear Receptor Metabolism of Bile Acids and Xenobiotics: A Coordinated Detoxification System with Impact on Health and Diseases. Int J Mol Sci. 2018 Nov 17;19(11):3630.
Pushpass RG, Alzoufairi S, Jackson KG, Lovegrove JA. Circulating bile acids as a link between the gut microbiota and cardiovascular health: impact of prebiotics, probiotics and polyphenol-rich foods. Nutr Res Rev. 2022 Dec;35(2):161-180.
Frisch K, Alstrup AKO. On the Evolution of Bile Salts and the Farnesoid X Receptor in Vertebrates. Physiol Biochem Zool. 2018 Mar/Apr;91(2):797-813.
Cai J, Sun L, Gonzalez FJ. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022 Mar 9;30(3):289-300.

谷禾健康

感到疲惫?乏力?食欲不振?容易流血?皮肤发痒?腿肿?体重减轻?…这些有可能是慢性肝病的信号,慢性肝病是一个主要的健康问题,它可以发展为肝硬化和肝癌。
肝病按照病因划分,常见的有如下几大类:
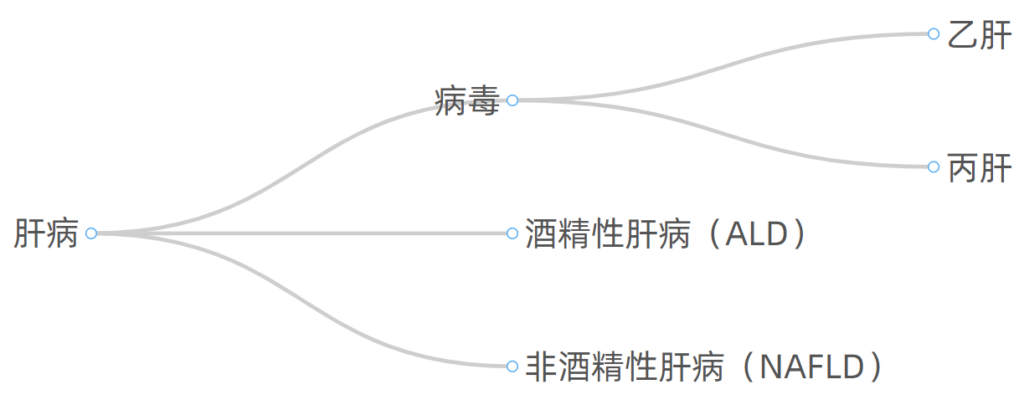
无论病因如何,肝病如果没有得到有效管理控制,进展的常见终末阶段是肝硬化。
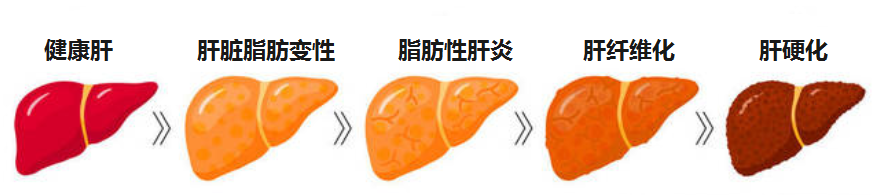

肝硬化可导致失代偿和肝细胞癌的发展。
发病率
目前由于疫苗接种计划和有效抗病毒治疗不断发展,乙肝和丙肝肝硬化的发病率正在下降,但由于以下两个原因导致另两种肝病发病率不断上升:
1、肥胖,导致非酒精性脂肪肝的发病率增加
2、饮酒,导致酒精性肝病的发病率增加。
本文带你详细了解肝病与肠道菌群:


肝脏也是胆汁产生的场所,在肠肝循环中具有重要作用。
肝脏,作为第一个接触微生物产物进入门静脉循环的器官,可能受到肠道微生物群及其变化的多种影响。肠道微生物群的成分或代谢物通过各种机制与肝脏相互作用。
肝脏中产生的胆汁酸(如胆酸和鹅去氧胆酸)与葡萄糖醛酸酶结合。一旦分泌到十二指肠肠腔,肠道菌群代谢和解共轭,产生尿胆原(排泄)和初级胆汁酸被吸收和循环。胆汁酸还通过内在的微生物调节活动来控制和影响菌群。
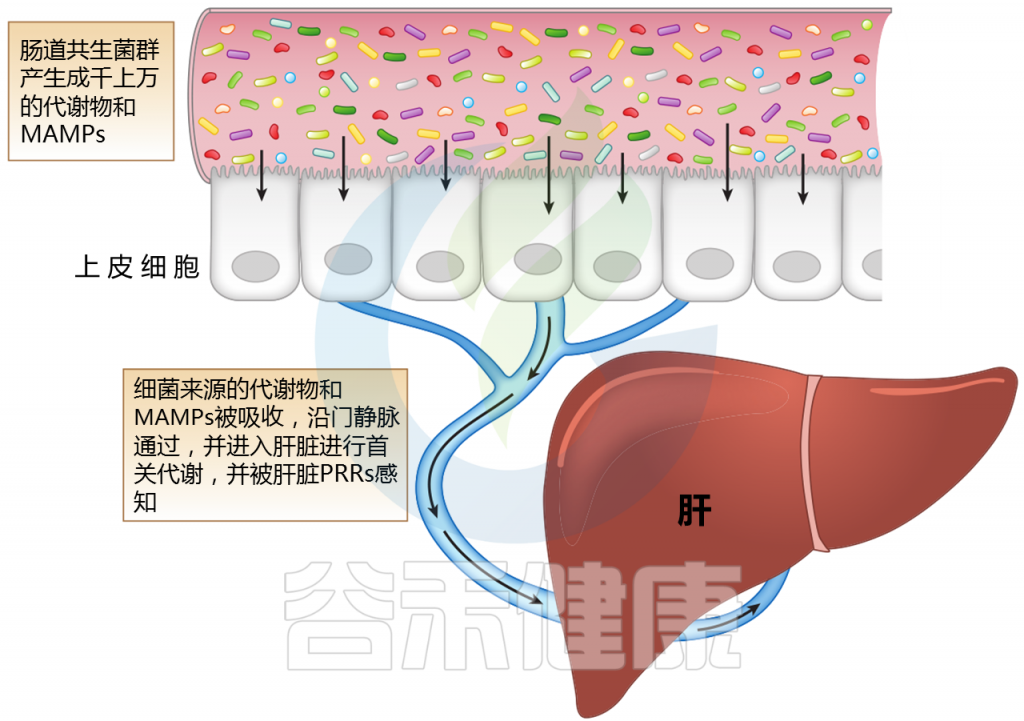

Jones R M,et al.,Annual Review,2020
注:MAMPs——微生物相关分子模式;PRR——模式识别受体
肝脏位于体循环和来自肠道吸收活动的大量外源性分子和微生物相关分子模式(MAMPs)之间的界面。
微生物产生的代谢物会随着微生物群的组成而变化;它们沿着门静脉分流并引发多种信号通路的激活。MAMP暴露过多会导致炎症。
肝硬化前期肠道菌群总体变化:
整体多样性减少,厚壁菌门减少,拟杆菌门和变形菌门增加。
在三种类型的肝炎中,肝硬化前期微生物参与非酒精性脂肪肝病和酒精相关性肝病的证据相对更为有力。
—— 非酒精性脂肪肝病
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)是一种以肝细胞内脂质(主要是甘油三酯)的微泡或大泡状积聚为特征的肝病,并伴有不同程度的炎症浸润。
在非酒精性脂肪性肝病中,研究人员发现粪便、血液和肝活检中的致病菌(如肠杆菌科和大肠杆菌)的相对丰度增加。随着病原菌数量的增加和厚壁菌门数量的减少,菌群失调。
—— 酒精性肝病
长期摄入酒精可导致人类和动物模型中菌群结构的变化,肠道通透性增加,随着持续的酒精滥用,致病菌的多样性进一步减少,相对丰度增加,如肠杆菌科和肠球菌科。
在小鼠中,乙醇可以降低肠道屏障功能,并允许增加局部炎症。从机理上讲,乙醇也能抑制抗微生物凝集素的表达,在慢性乙醇消耗模型中,无Reg3β和Reg3γ的小鼠表现出增加的细菌移位和NASH的发生。这些发现表明乙醇可能介导了肝脏潜在的促炎性刺激,有多个长期后遗症。
尽管肝硬化的病因可能有所不同,但在肝病的末期,微生物群与肝脏的相互作用在很大程度上与病因无关。也就是说无论哪种都可能发展为肝硬化。
前面我们知道,肝炎如果不能得到有效控制,久而久之会对肝造成永久性损伤,也就是肝硬化。肝硬化又分为两种,一种是代偿性肝硬化,一种是失代偿肝硬化。
代偿性肝硬化虽然肝功能减退,但机体仍能正常运行。
失代偿性肝硬化指肝硬化发展到一定程度,出现肝功能衰竭,可能出现严重并发症,如肾功能衰竭、静脉曲张出血和肝性脑病等。
肝硬化患者最初没有症状,等到了肝硬化失代偿(定义为腹水、肝性脑病、黄疸和/或胃肠道出血),就是肝硬化过程中的转折点。
——肝硬化失代偿期会发生什么?
代偿性肝硬化患者可能会保持多年稳定,死亡率非常低,每年< 1%。然而,在第一次住院治疗后,35%的患者将在28天内出现后续的失代偿,需要频繁入院。肝硬化急性失代偿可导致慢加急性肝衰竭(ACLF)。
注:慢加急性肝衰竭是一种综合征,以一个或多个主要器官或系统(肝、肾、脑、凝血、循环或呼吸)衰竭为特征。
慢加急性肝衰竭是失代偿性肝硬化的主要死亡原因。他们的慢加急性肝衰竭(ACLF)的中位时间为2-3年,死亡率每年约为10%。


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
每次失代偿后,慢加急性肝衰竭在28天内的发展约为30%,在此阶段死亡率在28天内攀升至40%。这些器官衰竭患者通常在重症监护室接受治疗,肝移植是唯一的治疗方法。
肠道菌群如何影响肝硬化失代偿?
肝硬化中微生物群-肠道-肝脏相互作用
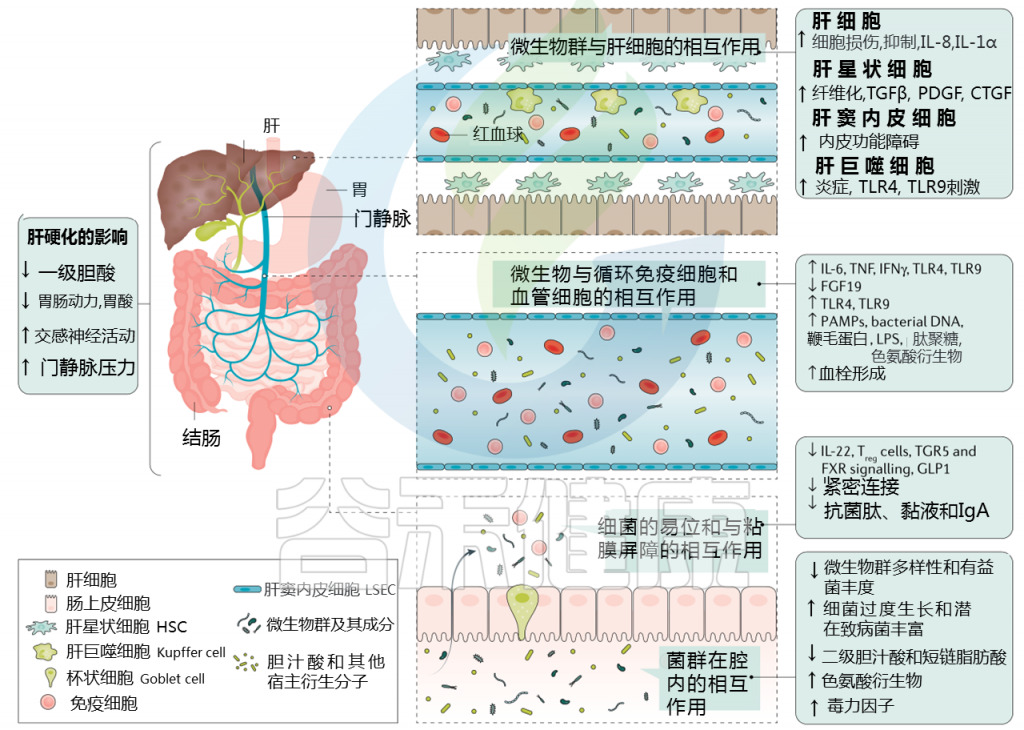

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝硬化发展过程中肠道微生物群的变化在很大程度上归因于肠道微生物群组成及其产物,产物可能具有致病作用。短链脂肪酸(SCFAs)、次级胆汁酸和色氨酸衍生物增加,而粘液蛋白的变化、功能失调的紧密连接和抗菌肽的减少促进了微生物组成分和/或其代谢物(病原体相关分子模式(PAMPs))跨肠屏障的移位。
接下来,就肠道菌群与肠道屏障,病变肝脏的相互作用,菌群代谢产物与转运,门静脉高压和酒精的作用这4个方面展开讨论。
1. 与肠道屏障相互作用
肠漏:
一个不正常的微生物群可以影响肠道上皮屏障,并导致内容物从肠道到肝脏和其他地方难以控制的转移。这种肠上皮屏障的损伤被称为漏肠。
在肝脏疾病期间,由于肝肠循环、肠道炎症和门脉高压的改变,宿主生理和肠道完整性发生重大变化。与此同时,肠道微生物组和肝脏之间的串扰也发生了重大变化:
肠道中的宿主粘膜蛋白和通路(例如FXR信号)被肠道微生物群代谢物(例如短链脂肪酸)改变,并可能导致肝脏损伤;
肝脏疾病进展引起的肠道内化变化可能会影响肠道屏障,促进肠道炎症,降低抑菌肽;
而肠道相关淋巴组织可能通过驱动肠道炎症,从而增加肠屏障的通透性参与肠屏障的功能障碍
由于穿过肠道上皮屏障的细菌成分会引发免疫反应,因此肠道渗漏被认为会增加慢性全身炎症。例如,在肝病患者,尤其是肝硬化患者中,细菌细胞壁脂多糖(LPS)水平升高,也被称为内毒素血症。
2018年的一项研究表明,从失代偿期肝硬化患者的循环血和其他“无菌”隔室中分离出的细菌是可行的,这表明即使是活的细菌也可以在失代偿期肝硬化期间通过肠屏障转位。
2. 与病变肝脏的相互作用
从失代偿到慢加急性肝衰竭的进展与全身炎症的广泛激活有关,影响许多细胞因子和炎症系统。
释放危险相关的分子模式来促进失代偿和炎症
慢加急性肝衰竭的发展,不同衰竭器官的死亡细胞和细胞外基质的重塑,特别是在肝脏,都通过释放危险相关的分子模式来促进失代偿和炎症,最终可能是慢加急性肝衰竭发展的先决条件。
这种联系在乙肝病毒引起的肝硬化和/或慢加急性肝衰竭患者中尤其常见。慢性乙肝病毒的再激活可能导致肝损伤,从而释放危险相关的分子模式,进而导致器官衰竭和慢加急性肝衰竭。
在慢性肝病和肝硬化患者中,甲肝病毒和戊肝病毒重叠感染也可能诱发慢加急性肝衰竭。
对病原体相关分子模式的免疫反应导致器官功能障碍
另一方面,这种炎症的爆发是由微生物或其成分的转移引起的,也称为病原体相关分子模式。对病原体相关分子模式的免疫反应可能在免疫病理学过程中导致器官功能障碍,在这种过程中,免疫反应会导致感染造成损害。
炎症标志物水平升高
血浆中全身性炎症标志物(如IL-8或IL-6)水平升高,无论是否有明显的细菌感染,都与肝硬化和慢加急性肝衰竭的急性失代偿有关。新的数据强化了改变后的肠道微生物群和慢加急性肝衰竭之间的联系。
血浆代谢物特征
除了肠道菌群衍生代谢物与慢加急性肝衰竭发展之间的关联之外,血浆代谢物特征(可能也来自肠道菌群)也与全身炎症和慢加急性肝衰竭密切相关。
这些发现可能解释了为什么肠道微生物群的改变和细菌易位的增加可能为不同器官的免疫病理发展为器官衰竭,加重全身炎症和诱导ACLF的环境。
酒精性肝病
2019年研究表明,乙肝病毒相关ACLF患者的循环细菌DNA显著增加,并与炎症标记物(如CXCL10,一种已知的趋化因子)相关,在非乙肝病毒病因中也与ACLF相关,尤其是酒精性肝硬化。
另外,在急性酒精性肝炎(ACLF的一个亚型)中,研究表明,与没有这种特殊菌株的患者相比,具有一种产生细胞溶血素的肠球菌菌株的患者具有极高的死亡率(180天内的死亡率分别为89%和3.8%)。
我们知道,急性酒精性肝炎与微生物变化密切相关,这可能决定患者的临床特征及其结果。在几乎一半的急性酒精性肝炎患者中,失代偿和慢加急性肝衰竭都会发生,但没有任何可识别的促发事件,这表明这与内源性机制有关(例如,门静脉高压症或细菌易位)。
3. 门静脉高压症和酒精的作用
即使肝硬化的门静脉高压症得到有效治疗,例如通过放置经颈静脉肝内门体分流术(TIPS)支架,许多患者仍出现进一步失代偿和ACLF(2年内约47%),尤其是由于全身炎症和随后的器官衰竭。
此外,与肝静脉、右心房和外周静脉血相比,腹水的存在决定了门静脉循环微生物群的组成(腹水:一种失代偿的指标),以及与炎症标记物和ACLF的发生相关的特定循环微生物群。
然而,应该指出的是,TIPS支架本身可能会加重高动力循环,从而导致内毒素水平的增加。从长远来看,TIPS支架降低了失代偿率,可能主要是由于这些肝硬化患者腹水的发生率降低。
失代偿性肝硬化和ACLF先于酒精性肝硬化发生。这一发现可能很重要,不仅因为酒精是失代偿期肝硬化最常见的病因,而且可能是由于酒精本身对肠道微生物群和肠屏障功能的直接影响。
在健康个体和动物模型中,已经证明急性酗酒会增加循环中的内毒素和细菌DNA水平。
酒精显著改变肠道微生物群的组成,降低拟杆菌的相对丰度,增加变形菌。
它的代谢物,特别是乙醛,可以破坏肠道上皮细胞的紧密连接,导致肠道渗漏,促进细菌和真菌的易位,这两者都可能与肝硬化的进展有关。
在不同病因的肝硬化(例如,非酒精性脂肪性肝炎或乙型肝炎引起的肝硬化)中也观察到微生物群组成的改变以及肠道的渗漏。
4. 微生物代谢产物和转运
肝硬化发展过程中肠道微生物群的变化在很大程度上不仅归因于肠道微生物群的组成,还归因于其产物,这些产物可能具有致病作用。
一项研究表明,在肝硬化向失代偿和ACLF发展的过程中,血液代谢物特征明显改变。
针对903人的大规模研究为某些强预测代谢物模式的微生物起源带来了重要的见解,但很难对这些发现作出有力的陈述。
另一项对602名患者进行的研究表明,微生物群衍生代谢物与ACLF的存在有关。其他微生物成分,如次级胆汁酸、短链脂肪酸和色氨酸代谢物也在肝硬化中发生较大变化,与疾病的进展有关。尤其是,胆汁酸通过下调FXR受体来改变肠道屏障功能,这为临床FXR激动剂已经可用提供了新的治疗机会。
间接证据表明肠道微生物群可能会影响肝硬化的预后。
首先,研究表明,使用非选择性β受体阻滞剂(一种预防肝硬化失代偿的常用方法)治疗可改善肠道屏障,减少肠道转运时间,从而降低肝硬化患者细菌转移的可能性。
第二,在静脉曲张破裂出血期间或作为失代偿期肝硬化的长期预防措施,抗生素治疗是一种推荐的治疗方法,因为它可以改善结果,其机制可能与减少细菌移位有关。
尽管这一观点尚未得到确凿的证实,但我们知道,一种特定的微生物组表型(所谓的肠型)会导致肝功能的病理改变,并且考虑到微生物群中存在着广泛的成员,如真菌或病毒,微生物组标志物可能是非常有用的临床工具,以确定有失代偿和ACLF风险的患者。
肠道微生物群可以作为疾病进展、严重程度和治疗反应的生物标志物。
不同肝病的菌群特征
肝硬化:
瘤胃菌科、毛螺菌科与其他菌(包括肠杆菌科和拟杆菌科)进行比较,菌群比率失调。随着ACLF的发展,肝硬化菌群失调比率恶化。
该研究表明,肝硬化患者的菌群比率失调
对129名患者的研究显示,毛螺菌科减少,巴斯德氏菌科(Pasteurellaceae)的丰度可以预测死亡率。
其他研究也提供了证据,表明特定的微生物组群特征可以区分肝硬化和健康对照组,并且微生物组的变化可能能够监测病情的严重程度和进展情况。
一组45例肝移植受者中,肝移植改变了肠道菌群,使微生物多样性增加,原生细菌增加(如毛螺菌科),潜在致病菌减少(如肠杆菌科)。
该研究强调了患病的肝脏会影响肠道菌群。
肝硬化和慢加急性肝衰竭:
慢加急性肝衰竭和肝硬化的肠道微生物群特征


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
中国肝硬化患者宏基因组全关联研究(MWAS)显示,与健康个体相比,肝硬化肠道菌群组成有大于34个显著差异的菌群。肝硬化患者中韦荣球菌属和链球菌增多,而产丁酸共生菌包括Faecalibacterium prausnitzii 和Coprococcus comes减少。(下表)
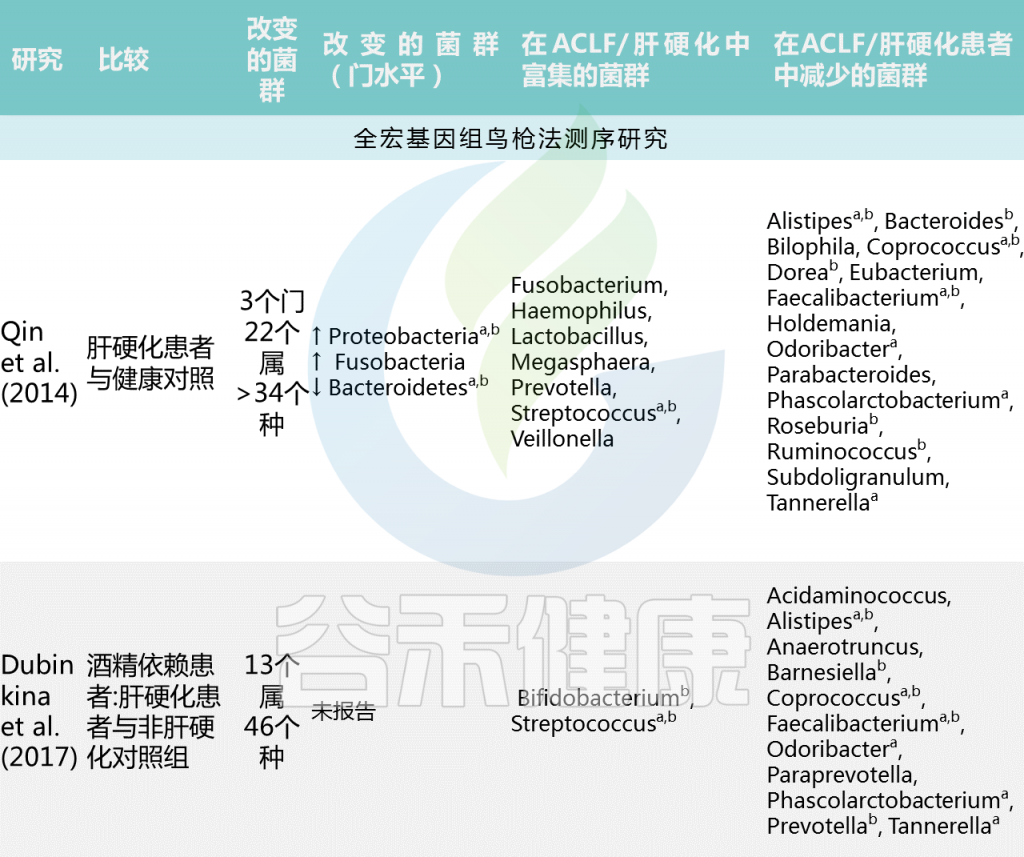

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝细胞癌(HCC)
持续的肝损伤和再生促进了肝细胞癌的发生,它是全球癌症死亡的第三大原因。
肝细胞癌HCC与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
在与非酒精性脂肪性肝病相关的HCC,一项来自意大利的研究注意到拟杆菌和瘤胃球菌科增加,双歧杆菌减少。
不同部位菌群功能
肠道菌群:
从门诊病人的角度来看,肠道菌群可以证明是预测入院,MHE和晚期纤维化患者的有用工具。
一项针对NAFLD肝硬化的研究发现,粪便微生物分析中的27种细菌特征以及年龄,性别和体重指数(BMI)可预测NAFLD肝硬化。
晚期纤维化是NAFLD死亡率的重要预测指标,可以从粪便菌群中推断出纤维化,以帮助识别高危人群。
鉴于失代偿性肝硬化中存在预测的失调模式,因此将CDR(肝硬化失调率-毛螺菌科+瘤胃菌科+韦荣氏菌科/肠杆菌科+拟杆菌科)视为预测失代偿风险的工具(适用于所有常见的CLD病因)较低的分数预示结果较差,并且具有较强的预测价值。
粪便菌群也可以用来预测谁会在90天内再次入院和急性肝性脑病复发,因为急性肝性脑病和其他失代偿的粪便菌群有所不同。
唾液菌群:
唾液菌群失调比率是一种简单实用的临床工具(Lachnospiraceae + Ruminococcaceae + Veillonellaceae/ Streptococcaceae),可以预测有和无肝性脑病的失代谢性肝硬化患者90天的入院情况。
其他部位菌群:
一些研究表明,粪便微生物群和结肠黏膜相关微生物群是不同的。事实上,回肠、空肠和十二指肠粘膜样本或抽吸物的微生物群是不同的,它们可能对肝硬化具有重要的预后能力,主要表现为肝性脑病。然而,这些样本并不容易获得,而且很难将其作为生物标志物进行常规的护理点采集。
微生物工具的潜力
需要进一步的研究才能使人信服结论:患者在不同的条件和疾病下,它们的肠道微生物群既表现出疾病特异性的变化,也表现出非特异性的共同反应。因此,在其作为生物标志物的潜力得以实现之前,确定强有力的疾病特异性肠道菌群特征至关重要。
生物标志物和基于微生物的工具的潜力

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
要更准确地估计疾病对肠道微生物群的影响程度,就需要从世界各地获得强有力的大规模纵向数据,同时考虑各种混杂因素。理解和解释其他相关的混杂因素将使我们更接近以微生物组为基础的肝硬化生物标志物。
微生物组的整体观点,包括微生物基因表达和微生物衍生的代谢物或蛋白质,可能导致更准确和全面的生物标志物,类似于整合宿主遗传学与基因表达和表观遗传学时的强大疾病关联。这种包含宿主-微生物全生物的整体观点也可能支持诊断、分层和治疗的个体化,并可能开创全生物群关联研究的新时代,扩大宏基因组全关联研究领域。
我们知道,即使在没有肝病的情况下,微生物组也在调节情绪和潜在的认知中发挥作用。慢性肝病患者的脑功能改变是肠-肝-脑轴的结果,甚至在肝硬化之前就可以影响病程。
酒精使用障碍(AUD)
一项关于酒精使用障碍(AUD)患者肠-肝-脑轴的重要研究发现,抑郁、焦虑和酒精渴求与肠通透性增加相关,即使在戒酒后,肠通透性高的患者仍然存在抑郁、焦虑和酗酒。
最近发表的一篇关于AUD中这一轴的操纵的文章显示,对于AUD患者,在粪菌移植后,这些渴望、消费和长期的与AUD相关的住院治疗可能会降低。
肝性脑病
肝硬化中普遍存在的认知功能障碍是一种记忆障碍型,称为轻度或隐性肝性脑病。这可以发展为明显的肝性脑病,表现为嗜睡,迷失方向,晕眩和昏迷。
肝性脑病是肠肝轴中与微生物组相关的经典并发症,是全身性内毒素血症和炎症的结果,最终加重了神经炎症,而神经炎症是支撑肝性脑病发病机理的重要因素。
多年来,氨被认为是肝性脑病发病的关键,但后来发现全身炎症对于氨发挥其神经毒性作用是必不可少的。越来越多地描述了特定微生物群在肝性脑病和全身性炎症(包括性别影响)进程中的作用。在小鼠中,发现肠道微生物组是肝性脑病所特有的全身性炎症和神经炎症所必需的。
轻度肝性脑病和PTSD
在临床上,轻度肝性脑病需要专门的认知测试,例如心理计量学肝性脑病评分(PHES),抑制性对照测试,脑卒中诊断等。但这些测试最好在专门的环境中进行,并且需要专业知识。
轻度肝性脑病(MHE)和创伤后应激障碍(PTSD)肠道菌群之间也存在协同作用,与其他人相比,PTSD患者的菌群失调更为严重。PTSD,酒精滥用和肝硬化常常并存。微生物变化可能有助于将MHE与PTSD区别开来,并且可以帮助我们定义较新的疗法。
老年肠道-肝-脑轴改变
利用肠脑轴的主要挑战是老年人群(慢性肝病患者)。老年人患者的致病菌往往更具致病性,随着合并症,住院和抗生素暴露于更大的革兰氏阴性病原体中,病情恶化。
与类似的老年非肝硬化对照组相比,年龄较大(> 65岁)的肝硬化患者往往会改变肠道-肝-脑轴,从而增加炎症并损害记忆的认知能力。在相关网络分析的研究中,更重要的是,在老年肝硬化和非肝硬化组中也发现了类似的模式,这表明老年患者已经具有潜在的肠脑轴改变。
这对肝移植具有重要意义,因为尽管进行了肝移植,但与年龄相关的肠脑轴变化仍可能持续。人口老龄化往往会导致多种其他合并症和精神疾病,需要额外的照顾以确保最佳的移植后效果。
针对肝硬化肠道微生物群的策略
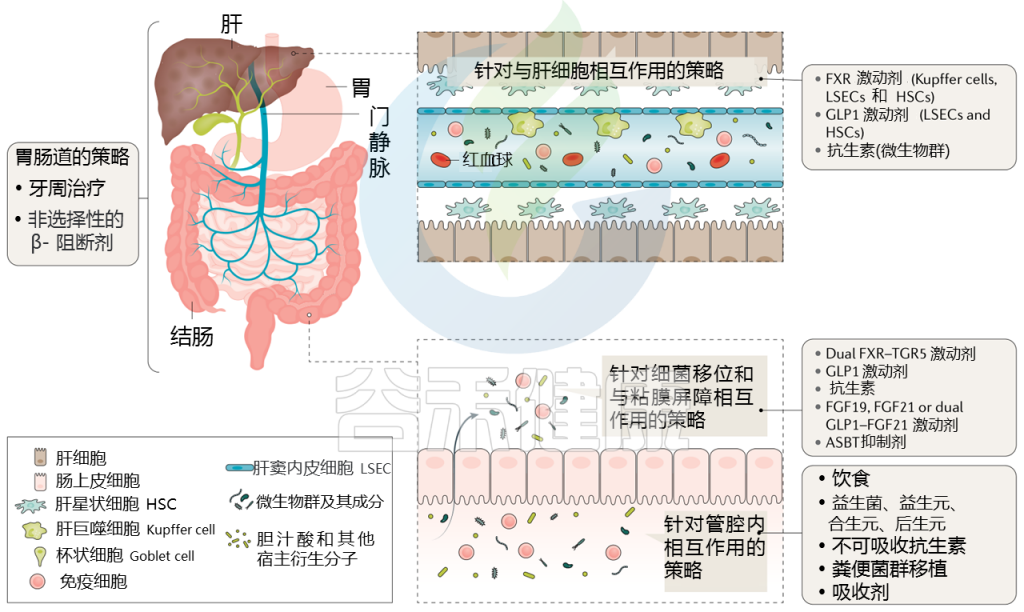

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
通过治疗(部分成立和部分试验)调节肠道微生物群可能改善肝硬化患者的预后,而微生物组生物标志物可能反映对这些治疗的反应。下表显示了不同的策略。
针对肠道微生物群的肝硬化干预措施

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
接下来主要介绍一些具体疗法:饮食、益生菌、抗生素、白蛋白、牙周、粪菌移植等,有些目前正在临床试验中。
饮 食
除其他因素外,饮食对肠道微生物群有重要影响,这一点已在各种疾病和条件下得到研究。一项针对国际肝硬化人群的研究报告称,咖啡、茶、蔬菜和酸奶的摄入都与微生物群落多样性的增加和住院率的降低有关,这为调节肠道微生物群落以促进肝脏健康提供了前景广阔的途径。(具体的饮食方面建议见文末附录部分)
益 生 菌
益生菌已经成为肝硬化临床研究的主题,特别是它们对脑功能的影响和肝性脑病的风险。
益生菌在肝硬化前可以改善NAFLD的组织学,在肝硬化中可以减少失调,对逆转OHE的二级预防有效,减少失代偿事件的住院率,但可能或不能改善认知能力(MHE)。
大多数制剂都含有乳酸菌,可产生短链脂肪酸,有利于结肠健康。一项短期(5天)口服两歧双歧杆菌和植物乳杆菌8PA3的小型试点研究表明,与单独标准治疗相比,口服两歧双歧杆菌和植物乳杆菌8PA3能恢复肠道菌群,并能更好地改善酒精性肝损伤。
以上是关于益生菌的前沿研究,如果想要尝试的话,最好是经过肠道菌群检测或者在医生的指导下服用更可靠。
抗 生 素
抗生素,也被用作失代偿期肝硬化的预防性治疗。
腹水患者发生自发性细菌性腹膜炎(SBP)的风险增加,接受抗生素预防来预防自发性细菌性腹膜炎的发展。这种SBP的一级预防已经被证明可以提高某些患者的生存率。
在一项多中心、随机对照试验中,对严重肝硬化患者使用抗生素,总体生存率没有任何益处,但是,同样,腹水中白蛋白浓度低的患者在接受抗生素治疗时,生存率得到了提高。
预防性抗生素治疗也同样有效建议用于其他临床情况,如静脉曲张破裂出血、既往SBP和复发性显性肝性脑病。然而,尽管对最脆弱的患者的短期效果可能是有益的,但在其他许多患者中,这些治疗不能阻止进一步的失代偿和ACLF。也许这种情况的部分原因是抗生素引起的微生物群落多样性减少。
因此,需要开发一种更具针对性的肠道微生物群来改善肝脏健康。
牙周卫生
也许你不知道,牙周卫生也会与肝硬化有关。已发表的人类MWAS表明,在肝硬化期间,肠道微生物组向口腔微生物组转变。
减少胃部充当天然屏障的酸性环境可能促成口腔微生物群转移到肠道,在肠道上皮屏障适应不同的微生物组分。如前所述,这些变化可能促进肠道微生物群通过肠道屏障的转移,进而导致并发症。因此,防止口腔微生物不必要的转移到肠道,可以成为未来肝硬化治疗的基础。
一项研究表明,与20名非肝硬化对照组相比,30名肝硬化患者的牙周卫生干预措施改变了肠道微生物群,改善了肝性脑病。
白蛋白作为潜在疗法
当肠道屏障被削弱时,它会双向泄漏,这也会导致重要的宿主分子从血液室泄漏到肠腔。例如,在酒精性肝病动物模型中,肠道通透性增加导致粪便白蛋白浓度升高。
随着肝硬化的进展,肝脏中的白蛋白合成受到损害:一方面,肝损伤导致肝细胞功能质量的丧失;
另一方面,肝脏僵硬程度的增加,白蛋白合成减少。不仅白蛋白减少,而且它能结合毒素和其他有害物质。这些观察结果将白蛋白水平定位为肝病严重程度的关键参数。
白蛋白还可通过前列腺素E2改善免疫B细胞功能,减少肝硬化患者的免疫反应,从而阻止与ACLF和死亡密切相关的全身炎症爆发。
长期白蛋白治疗肝损害和非自发性细菌性腹膜炎感染患者分别通过提高生存率和解决ACLF改善了临床结果。因此,白蛋白泄漏到肠腔可能会影响肠道微生物群并被其代谢,从而可能改变微生物组分,间接改变宿主。
粪菌移植(FMT)
失代偿期肝硬化中菌群移植的初步研究正在出现,其安全性也很高,为更大规模的研究铺平了道路。
菌群移植后变形菌减少,放线杆菌增多,肝脏疾病严重程度改善,严重酒精性肝炎患者3个月时的死亡率降低,1年生存率提高。
慢性乙型肝炎FMT组出现微生物改变,HBeAg降低。FMT减少了短期酒精渴求和消费,以及AUD相关的住院治疗。
一项包括20名复发性肝性脑病患者在内的开放性随机试验观察到,使用FMT灌肠剂减少了住院人数,改善了认知和菌群失调。
另一项研究也证明了这一点。使用口服胶囊制剂的FMT的新应用也显示出类似的安全性和对肝硬化和肝性脑病的治疗效果。然而,由于报告了一些由耐yao菌转移导致的FMT相关死亡病例,包括一些肝硬化患者,因此需要谨慎。因此,更好地理解和全面描述这些研究可能带来明确的微生物调节干预治疗失代偿期肝硬化。
加深菌群影响机制的理解
未来的研究应该探索和加深对肠道微生物组变化影响肝硬化进展和失代偿发展的动力学和机制的理解。
诊断、治疗
由于肝硬化表现为肠道微生物群与宿主的大量重要相互作用,微生物组诊断和治疗几乎是治疗疾病进展和失代偿发展的必经之路。需要进一步倡导基于微生物组检测和靶向疗法。
改善预后
针对不同水平微生物群与宿主相互作用的策略改善患者的预后。
产学研合作
使之更容易获得和更具成本效益,微生物检测需要更广泛地适应,因为它相对容易收集且信息量较大。可以帮助诊断,预测和潜在地个性化治疗。
多学科综合
多学科例如微生物学,宿主遗传学,基因组学,表观遗传学,代谢组学,营养学等相结合,更好地利用微生物帮助我们有效的进行慢病管理,预防为主,将指导落实到饮食、生活方式等具体应用上,用全新的视角帮助我们认识健康,保持健康。
饮 食 方 式
尽可能选择对肝脏友好的食物,帮你保护肝脏。以下是一些饮食技巧:
选择全麦谷物,面包和谷物。
多吃各种颜色的水果和蔬菜。
选择低脂乳制品。
选择瘦肉蛋白质。
选择植物油,例如橄榄油,而不是黄油。
零食坚果和种子食物。
减少钠摄入量。
每天喝8-10杯水。
避免含有反式脂肪的加工食品。
避免添加糖。
选择可以长期生活并遵循的饮食计划。
吃八分饱腹感
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
限 制 饮 酒 量
肝脏是负责代谢营养物质和其他摄入物质的主要器官。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
定期减少饮酒量很重要。医生甚至可能建议你完全戒酒。
增 加 运 动 量
运动的好处不仅限于减肥和控制体重,还可以帮助减少肝脏周围的脂肪。定期运动也可以改善你的情绪,助你维持在最佳的健康状态。
开始时要循序渐进,比如可以每周进行150分钟运动开始,尽量选择你喜欢的运动,例如,跑步和步行的组合,多人参与的活动增加趣味性(如各种球类运动),健身房的器械训练等。
睡 觉
充足的睡眠对于保持健康状态非常重要(包括慢性肝病治疗期间睡眠很重要)。如果你觉得入睡困难,开始慢慢尝试练习良好的睡眠习惯,例如:
每天都在同一时间上床睡觉和起床,作息规律。
避免咖啡因,烟草和其他刺激物。
尽量保持卧室环境清爽舒适。
运动尽量安排在清晨或午后,不要在睡前剧烈运动。
相关阅读:
膳食胆固醇通过调节肠道微生物群和代谢产物驱动脂肪肝相关的肝癌
参考文献:
Grat M, Wronka KM, Krasnodebski M, et al. Profile of Gut Microbiota Associated With the Presence of Hepatocellular Cancer in Patients With Liver Cirrhosis. Transplant Proc 2016;48:1687-91.
Jones R M, Neish A S. Gut Microbiota in Intestinal and Liver Disease[J]. Annual Review of Pathology:Mechanisms of Disease, 2020, 16.
Acharya Chathur,Bajaj Jasmohan S,Chronic Liver Diseases and the Microbiome: Translating Our Knowledge of Gut Microbiota to Management of Chronic Liver Disease.[J] .Gastroenterology, 2020
Bajaj JS, Sharma A, Dudeja PK. Targeting Gut Microbiome Interactions in Service-related Gastrointestinal and Liver Diseases of Veterans: Meeting Summary.Gastroenterology 2019.
Liu R, Kang JD, Sartor RB, et al. Neuroinflammation in Murine Cirrhosis Is Dependent on the Gut Microbiome and Is Attenuated by Fecal Transplant. Hepatology 2020;71:611-626
Ren Z, Li A, Jiang J, et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut 2019;68:1014-1023.
Trebicka Jonel,Bork Peer,Krag Aleksander et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure.[J] .Nat Rev Gastroenterol Hepatol, 2020
Lang S, Fairfied B, Gao B, et al. Changes in the fecal bacterial microbiota associated with disease severity in alcoholic hepatitis patients. Gut Microbes 2020;12:1785251.
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease. Hepatology 2019;69:107-120.
Gao B, Duan Y, Lang S, et al. Functional Microbiomics Reveals Alterations of the Gut Microbiome and Host Co-Metabolism in Patients With Alcoholic Hepatitis. Hepatol Commun 2020;4:1168-1182.
Duan, Y . et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505–51 1 (2019)