 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

血清素,5-羟色氨(5-HT)不仅充当体内系统的神经递质和激素,而且还是胃肠系统中的旁分泌信使。
5-HT神经元系统起源于中脑中缝核,下面示意图强调了血清素(5-HT)神经元与释放不同神经递质的其他神经元以及神经胶质细胞之间的解剖相互作用。
中枢神经系统几乎所有区域的神经末梢都会释放5-HT。换句话说,可能很难找到不受5-HT调节的神经元/细胞通信的单一参与者。血清素是一种抑制性神经递质,会抑制其它神经递质的分泌,比如(多巴胺,肾上腺素等)。所以它有时也被人们称为:“幸福激素”或“幸福神经递质”。
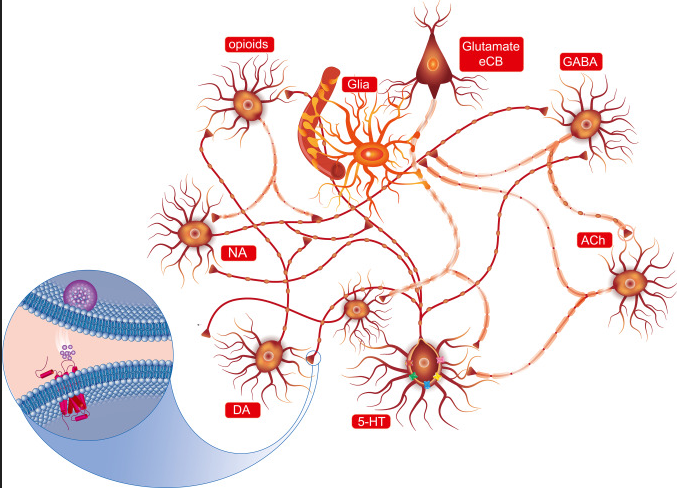
目前(血清素)5-HT系统是开发治疗中枢神经系统疾病药物的重要靶点。但是血清素仅有5%左右来自中枢神经产生,体内大约95%的血清素是由肠嗜铬(EC)细胞(胃肠道中最常见的神经内分泌细胞类型)通过感测来自肠腔和循环系统的信号合成和分泌的。肠道菌群及其代谢物、营养物质和激素是调节EC细胞分泌5-HT的主要因素。要注意,由于5-HT不能穿过血脑屏障,中枢和外周5-HT系统在解剖学和功能上是分开的。
循环血小板可以从胃肠道中隔离5-HT,并将其存储或需要时释放以促进止血并将其分布到身体各个部位。因此,肠道来源的5-HT调节多种功能,包括肠运动和分泌反射、血小板聚集、葡萄糖稳态、免疫反应和骨骼发育和心脏功能。
此外,血清素的生理作用受到多种蛋白质的调节,这些蛋白质调节其合成、储存、释放、再摄取和降解。血清素信号传导由至少14种不同的受体介导。
研究发现血清素传输的改变发生在许多中枢神经系统(CNS)疾病中,血清素过低或血清素使用障碍与精神分裂症、焦虑症、抑郁症、成瘾、癫痫、肥胖、强迫症、多发性硬化症、帕金森病和阿尔茨海默病的有关。因此,各种精神活性药物和药物的作用通常通过直接或间接机制涉及5-HT系统。
血清素产生和随后分解的速度之间的相对平衡是决定一个人拥有多少可用的“活性”血清素的主要因素之一。研究表明,一些补充剂能够增加血清素水平,如色氨酸,抗抑郁药物,维生素D、omega-3脂肪酸和某些益生菌,具有较强证据支持。此外,阳光照射,适当锻炼、积极思考、社交互动等也是增加血清素的重要手段。
与此同时,由于药物、补充剂或草药的组合导致也会血清素升高至不安全水平而引起血清素综合征。它可能导致意识混乱、发烧、呕心、不自主的肌肉痉挛、癫痫发作甚至死亡。任何食用改变血清素水平的产品的人都应该注意到这些症状。
然而,迄今为止,缺乏在体内相关探测这种难以捉摸的神经递质所需的有效工具。最近的技术进步,例如血清素 FSCV(”阶段性”测量)和 FSCAV(”环境”测量),刚刚开始揭示血清素活性对行为相关时间尺度的复杂性和影响。此外,血液高效液相色谱法也被用来测定血清素水平。
但是,血清素的变化受多方面因素的影响,其中大部分血清素是在肠道产生的。血清素与肠道菌群之间存在密切关系。因此利用肠道菌群的大数据库可以帮助我们从新的角度评估血清素,尤其是肠源性血清素的变化尺度和动态,可以反映个体整体的生理状态和代谢特点。
本文将探讨血清素的发现进化及其与光的作用,产生代谢,影响的生理功能和疾病,以及增加血清素水平的潜在自然方法。此外还有血清素综合征的定义,危害以及注意事项。希望本文的能够为5-HT在营养、临床医学和健康领域的应用提供一些见解。
血清素存在于身体的大部分器官中,例如皮肤、肠道、肺、肾、肝脏和睾丸中,以及地球上几乎所有生物体中,包括真菌、植物和动物中。血清素在系统发育上很古老,并且在植物和神经元出现之前就已进化。
根据文献,血清素的进化始于近三十亿年前单细胞生物中的前体色氨酸。色氨酸合成血清素需要氧气和光。保守的血清素生物合成途径始于蓝藻、绿藻和真菌的单细胞系统,并不断进化到目前在人脑中的位置。
▸ 阳光对血清素的合成以及水平有重要影响
血清素进化分析中出现的一个重要概念是它与光的关系。从色氨酸吲哚环的光吸收特性开始,随着系统发育的进一步发展,阳光对人类的血清素水平以及情绪、睡眠和自杀意念都有影响。与色氨酸结合并减轻与季节性情感障碍(SAD) 相关的抑郁症的最有效的光类型是蓝光。
色氨酸的光捕获特性归因于其吲哚结构。叶绿体中的色氨酸合成特别高,叶绿体吸收蓝光波会激发色氨酸的吲哚结构,使其失去吲哚环结构中的一个电子,从而被氧化。叶绿体细胞器含有色氨酸合成所需的基因和酶,类似于蓝细菌中的基因和酶。水果、蔬菜和坚果中的色氨酸含量要高得多。
拓展:除此之外,色氨酸产生烟酸及其所有前体。 NAD+和NADP+辅因子几乎参与细胞代谢的所有方面。从色氨酸从头合成NADH是这些辅酶比利用膳食烟酰胺或烟酸更重要的来源。在细胞核中,烟酸对于DNA修复很重要,并且色氨酸捕获光似乎是导致DNA光损伤的原因,该损伤与突变和缺乏修复的细胞死亡相关。
尽管光合作用具有营养价值,但对细胞来说却是一个主要风险。破坏光收集率和光利用率之间的平衡会扰乱光合作用,导致活性氧(ROS)的产生。如果不加以控制,活性氧会损害蛋白质功能和膜完整性,并对光合生物构成严重威胁。色氨酸产生荧光光产物,抑制培养的受精海胆卵和小鼠成纤维细胞的生长和分化。
因此,从细菌到哺乳动物的多种细胞都会受到光氧化色氨酸的损害。阳光对人体皮肤造成的损害很大程度上归因于色氨酸通过吡咯酶、犬尿氨酸和烟酸途径代谢的作用。
大约于1937年从纯化浓缩的牛血清中鉴定出一种具有吲哚核的血管收缩物质,并将其命名为“5-羟色胺”(5-HT)。5-HT后来被称为“血清素”,该术语源自其衍生物“血清”及其调节血管内张力的能力。
1960年,人们发现肠道是5-HT生物合成的主要枢纽;对大鼠进行全胃肠切除术导致尿液中5-HT和主要代谢物5-羟基吲哚乙酸(5-HIAA)大幅减少。这一发现以及大脑中完整的5-HT水平表明,神经元5-HT生物合成独立于其肠道来源。
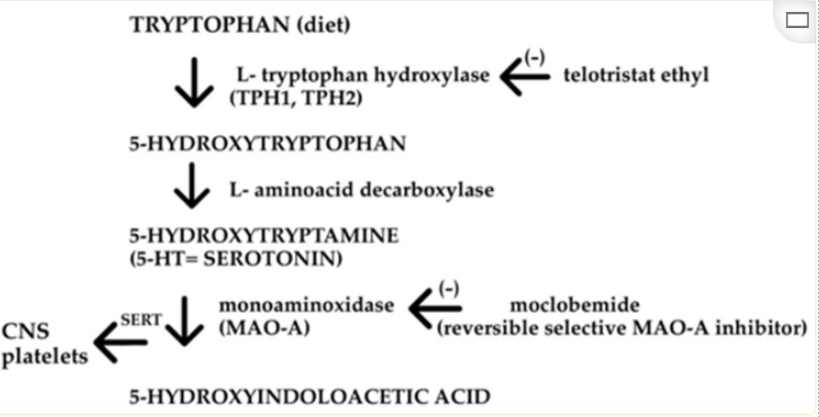
▸ 血清素(5-HT)合成
人体也是从色氨酸生物合成血清素。色氨酸被色氨酸羟化酶(TPH)分解,产生前体5-羟基色氨酸(5-HTP),然后被氨基酸脱羧酶(AADC)转化为5-HT。
TPH是5-HT合成中的特异性限速酶,它包含两种亚型,即TPH1和TPH2。TPH1负责外周5-HT的合成,主要在肠道肠嗜铬(EC)细胞中表达。TPH2主要表达于中枢神经系统(脑干裂齿核)和肠神经系统 。
色氨酸羟化酶(TPH)需要分子氧(O2)和四氢生物蝶呤(tetrahydrobiopterin,简写为BH4)作为共底物。该酶对亚铁(Fe2+)有绝对需求。
Guzel T and Mirowska-Guzel D.Molecules.2022
拓展:
四氢生物蝶呤(tetrahydrobiopterin)是一种天然存在的营养素,简写为BH4。是参与5-羟色胺、多巴胺、去甲肾上腺素、肾上腺素、褪黑素、一氧化氮生物合成的酶的重要辅助因子;
四氢生物蝶呤缺乏症是一种常染色体遗传性疾病,是迄今得以确认的5000~6000种人类的罕见病之一,四氢生物蝶呤缺乏症通过对新生儿进行疾病筛查,检出高苯丙氨酸血症(HPA)后可得到进一步确诊。BH4缺乏症主要会对人的神经系统造成损害,导致患儿出现智力低下、癫痫等症状。
♢色氨酸羟化酶活性影响血清素的水平
色氨酸羟化酶(TPH)是神经递质血清素 (5-HT) 生物合成中的限速酶。因此,TPH催化活性的增加或减少会导致神经元5-HT含量的相应变化。
TPH需要还原蝶啶辅助因子、分子氧和非血红素铁来羟基化其底物L-色氨酸。这四个因素中任何一个的组织含量的改变都可能改变TPH活性。TPH的翻译后修饰,包括磷酸化和半胱氨酸氧化,会导致其催化活性发生显著变化。
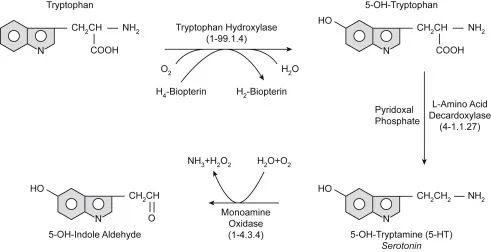
doi.org/10.1016/B978-0-444-64125-0.00001-3
上图显示了从色氨酸合成血清素的过程。色氨酸羟化酶和一般L-氨基酸脱羧酶的作用与必要的辅助因子一起显示。血清素代谢为5-OH-吲哚醛,与生长素(吲哚醛)类似,生成过氧化氢(H2O2 )。血清素也是脊椎动物合成褪黑激素的前体。
♢肠嗜铬细胞合成全身95%的血清素
除了在CNS(中枢神经系统)中合成外,胃肠粘膜内的肠嗜铬细胞(EC细胞)合成和分泌高达95%的全身血清素,也存在胰岛、乳腺和脂肪组织中。这些细胞对化学和机械刺激做出反应,但也收集来自肠道微生物群的信号以释放血清素。
肠嗜铬细胞(EC细胞)细胞激活将血清素释放到附近细胞的间隙中。 EC细胞感知胃肠道内的餐后变化,包括pH值、营养和毒素。
EC细胞产生高浓度的血清素,而调节系统从肠道间质空间去除高水平的血清素,该调节系统抑制血清素能传递并防止血清素中毒。血清素在肠细胞中循环或隔离以去除间质血清素。肠粘膜的肠细胞通过 SERT 吸收血清素,单胺氧化酶将其分解,然后粘膜下毛细血管将血清素转运到血液中。
▸ 血清素的吸收
我们现在知道,几乎血液中的所有5-HT都由血小板携带,血小板不会产生5-HT,而是在肠道循环时吸收它。因此,血清素在肠道中分泌并被血小板吸收后,就变成了“血清血清素”。
一旦5-HT被释放到固有层,它就会通过血清素再摄取转运蛋白(SERT)被上皮细胞吸收。接下来,5-HT 扩散到血流中,被血小板吸收并转运到外周靶组织。然而,血清素在体内可以通过多种方式被吸收和代谢,并且其吸收可以根据给药途径而变化。
一般来说,口服血清素不容易被吸收,因为它的活性形式很难穿过血脑屏障。中枢和外周血清素库在功能上彼此不同,因为它们分别控制大脑和外周区域的血清素依赖性行为。这就是为什么脑细胞必须从L-色氨酸或5-羟色氨酸(5-HTP)(L-色氨酸的副产品)产生自己的血清素。
注释:血清素再摄取过程,例如细胞X若是释放出了很多血清素,与其相靠近的细胞Y就会检测到周围血清素浓度的变化。信号发出后一段时间,细胞X会“回收”周围的血清素。这个过程叫神经递质的再摄取。再摄取不仅可以减少细胞X所需要生成的血清素,更能控制细胞之间信号的的传输。
▸ 血清素(5-HT)降解
过量的血清素以及大脑和肠道会通过几种不同的机制“失活”。例如,称为血清素转运蛋白的蛋白质可以有效地“清理”或“去除”(重新摄取)神经突触中的血清素,并将其带回神经元中以供重复使用,或者,释放到血液中的血清素要么被血小板吸收,要么在肝脏和肺部被单胺氧化酶(MAO-A)、乙醛和乙醇脱氢酶等酶分解(代谢)。
血清素主要被单胺氧化酶(MAO)分解代谢为5-羟基吲哚醛(5-HIA),然后被醛脱氢酶(ALDH)代谢为5-羟基吲哚乙酸(5-HIAA)。
单胺氧化酶有两种亚型:MAOA和MAOB。前者对5-HT的亲和力较高。5-HT也可以通过芳烷基胺N-乙酰基转移酶(AANAT)代谢为N-乙酰基血清素(NAS),随后通过羟基吲哚O-甲基转移酶(HIOMT)转化为褪黑激素。
此外,吲哚胺2,3-双加氧酶(IDO)对色氨酸、5-HTP、5-HT和褪黑激素等多种血清素通路成分的吲哚部分具有广泛的底物特异性。因此,5-HT也可以通过IDO进入犬尿氨酸途径。与抑郁症相关的血清素减少和犬尿氨酸增加与IDO活性有关。因此,除了Tph之外,犬尿氨酸途径对于调节血清素合成和可用性至关重要。
▸ 血清素周转和传递的复杂性
血清素(5-HT)在体内的周转速度非常快,尽管大脑中的5-HT含量只占体内总量的很小一部分(3%~5%),但在大脑中的循环速度却非常迅速。
♢血清素的周转速率非常快
研究表明,在健康的大鼠身上,5-HT的周转速率为15分钟到一个多小时。使用多室模型时,5-HT的合成、释放和降解可以被视为“后进先出”,这意味着这些过程发生得非常迅速,不到5分钟就会完成。
5-HTP是5-HT的前体,无需转运蛋白即可轻松穿过血脑屏障,并增加大脑5-HT水平,从而产生抗抑郁样作用。然而,5-HTP的快速药代动力学(在人体中的半衰期约为2小时)使其作为药物不切实际,神经药理学界将注意力转向更有效和安全的选择性血清再吸收抑制剂(SSRI)。
SSRIs可以通过阻断血清素转运蛋白(SERT)来提高大脑中细胞外5-HT水平,从而具有抗抑郁功能。根据临床反馈,目前SSRIs的药理潜力有限,只有三分之一的患者在治疗后情绪得到改善。因此,单独使用SSRIs抑制SERT活性可能不足以提高细胞外5-HT水平以引发大脑的抗抑郁反应,而用第二种协同药物治疗抑郁症则可以提高细胞外5-HT水平,从而超出其效果(这个不在本文讨论范围,下次有机会再讨论SSRIs与其他药物的协同互作)。
▸ 血清素(5-HT)受体
哺乳动物的受体存在巨大的多样性。有数百个血清素受体克隆,人脑至少有20个独立的5-HT受体神经元转录本。血清素与人脑中至少14种特定受体蛋白特异性结合,调节神经元中的离子通道、c-AMP 水平和激酶活性。
5-HT受体存在于身体的每个细胞中。为什么这么多,为什么分布这么大?可以推测,是由于动物体内制造和获取色氨酸的困难导致血清素利用率低。受体的功能是警告细胞环境中存在化学物质,而不去除或改变化学物质。
♢人体拥有众多的血清素受体
因此,如果化学物质供应短缺,受体分子的出现允许其作用传递到整个生物体。为了使其发挥最大效果,需要一种有效的血清素分配机制。动物的血液中含有特定的色氨酸和血清素结合蛋白,有助于将这些分子转运到特定的目标区域,例如大脑。
血脑屏障交界处的神经胶质细胞具有特殊的转运蛋白,用于浓缩色氨酸并将其递送至血清素神经元。血清素能神经元发育出长的无髓鞘轴突,可以吸收色氨酸并利用整个大脑和肠道合成血清素所需的酶。总之,色氨酸的丧失促进了高度分支、无髓鞘的神经网络和大量特定受体的形成,以最大限度地发挥血清素的作用。
迄今为止,已鉴定出14种血清素能受体,可以精确、快速地传递血清素的神经化学信息。此外,多种机制影响血清素再摄取,包括除SERT之外的其他单胺转运蛋白(例如多巴胺转运蛋白[DAT]、去甲肾上腺素转运蛋白[NET]和有机阳离子转运蛋白[OCT])对血清素的混杂再摄取。进一步强调该系统的复杂性,对血清素再摄取的显著控制是通过与SERT偶联的G蛋白的血清素自身受体实现的。
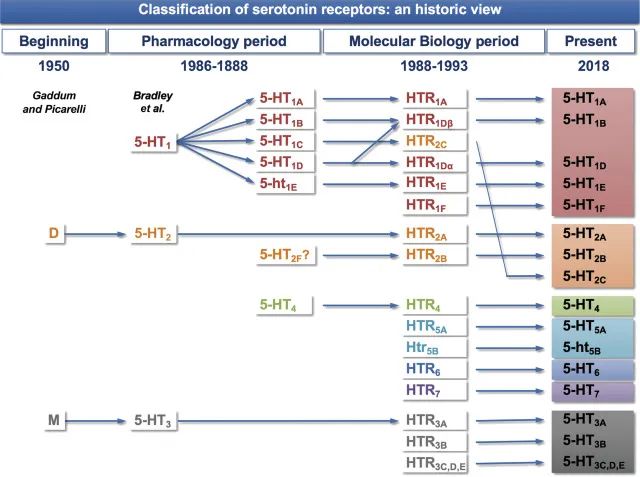
doi.org/10.1016/B978-0-444-64125-0.00005-0
过去了近10年。 5-HT受体的数量保持不变:14种受体亚型分为7个家族。
新发现与表达5-HT受体的细胞表型的鉴定及其与其他相关神经递质和神经递质受体的共定位有关,其中一些在神经元中,另一些在神经胶质细胞或星形胶质细胞中。免疫组织化学的应用增加了有关这种共定位的新信息。许多研究都集中在与偏头痛相关的大脑区域中5-HT受体的表达。
具有相似化学结构的血清素代谢物在细胞外的浓度可能比血清素本身高出近500倍,进一步阻碍测量,表明代谢过程很复杂。快速再摄取机制与快速代谢相结合,不仅减少了血清素可检测的时间,而且一些代谢物已被证明会显著降低微电极检测探针的完整性。总之,这些情况使体内血清素的测量和理解以及最终血清素活性与行为的对应关系变得复杂。
▸ 血清素(5-HT)反馈
血清素神经元在形态、连接性、电生理参数和基因表达方面表现出相当大的多样性。血清素神经元具有多种共递质,包括GABA或谷氨酸,以及许多不同的神经肽。
这些神经元能通过相同的神经递质语言进行交流,感知并相互调节血清素的释放,形成反馈回路。
反馈机制包括直接和间接的多突触途径,调节血清素系统的功能。不同区域的血清素神经元对反馈抑制的敏感性存在差异,与行为环境有关。
♢血清素的反馈机制可能影响人体系统功能
反馈机制可能不是维持血清素神经元稳态的主要作用,而是控制系统功能的重要机制。反馈的改变可能与多种与血清素相关的疾病有关,血清素选择性再摄取抑制剂可能通过重新平衡不同亚群间的相互作用发挥作用。
总而言之,血清素系统内的大量反馈机制在调节网络动态和塑造血清素神经传递的时间和空间方面发挥着关键作用。
▸ 肠道微生物与血清素合成,传递
肠道微生物群可以通过多种机制影响大脑中的血清素水平和神经传递,包括肠道中血清素的产生、SERT的调节、免疫系统相互作用、迷走神经通讯以及短链脂肪酸等代谢物的产生。
使用无菌小鼠或抗生素相关微生物群扰动进行的干预研究提供了令人信服的证据,研究使用无菌(GF)和抗生素治疗的小鼠,这些小鼠的外周5-HT水平显著降低,这种现象在正常肠道微生物定植后会逆转,表明5-HT和肠道微生物群之间的新型相互作用对于维持肠道稳态至关重要。
♢肠道微生物群对合成血清素有重要影响
越来越多的证据表明,外周5-HT是宿主与微生物群相互作用的关键介质,这对于维持肠道健康至关重要。膳食色氨酸(Trp)的很大一部分要么进入犬尿酸途径,要么被肠道微生物分解代谢为吲哚;只有一小部分用于外周5-HT合成。话虽如此,肠道微生物却是宿主5-HT合成的重要介质,这一过程主要由微生物代谢物驱动,向EC细胞发出信号并促使宿主机通过TPH1生成5-HT。
此外,宿主血清素能系统受到TLR2的严格调节。TLR2激活会降低5—羟色胺转运蛋白(SERT)表达和活性,而高水平的5-HT对TLR2表达产生负反馈效应。与此同时,TLR2 缺陷的小鼠表现出结肠5-HT水平和Tph1表达降低,非造血细胞(很可能是肠上皮细胞)中TLR2的激活负责肠道中5-HT的产生。这些发现与之前的观察结果一致,即Akkermansia muciniphila的外膜蛋白(Amuc 1100)通过TLR2信号传导促进5-HT生物合成。
此外,多形拟杆菌和齿双歧杆菌已被证明可以通过短链脂肪酸(例如乙酸盐和丙酸盐)的作用恢复EC细胞网络,从而促进5-HT合成,并增加肠道5-HT水平。
相反,胃内施用假长双歧杆菌可通过减少EC细胞数量来降低结肠5-HT水平,而鼠李糖乳杆菌GG上清液则上调结肠中的SERT表达。
此外,一些细菌菌株,如大肠杆菌、肺炎克雷伯菌和植物乳杆菌,可以直接转化色氨酸以从头合成5-HT ,而一些葡萄球菌则表达葡萄球菌AADC(sadA)基因负责转化5-HTP至5-HT。尽管已有证据,但这些细菌中5-HT的生理功能以及这种细菌来源的5-HT是否与宿主具有任何生物学相关性仍然难以捉摸。
虽然肠道产生的血清素不能穿过血脑屏障,它会影响血脑屏障的通透性,从而导致大脑炎症。此外,肠道微生物群对迷走神经的刺激可以改变动物和人类大脑中血清素、GABA 和谷氨酸的浓度,无菌雄性小鼠实验表现出类似焦虑的行为,并改变大脑中血清素的丰度。
♢使用精神药物产生的个体副作用差异可能与肠道菌群有关
其实抗抑郁和治疗精神障碍的药物包括SSRIs引起的副作用存在个体差异的事实可以用肠道微生物失调来解释。肠道血清素能神经元参与肠道蠕动的调节,这一事实可以很好解释恶心、便秘或腹泻等不良反应。
最近来自一项专门针对大鼠的氟西汀的小型临床前研究,其中体重增加伴随着某些细菌菌株(例如乳酸菌)的破坏,已知乳酸菌与体重调节有关。从临床试验和临床经验来看,一些患者似乎特别反应大,并且可能因使用SSRIs而体重显著增加 。这是否是由于个体的肠道微生物组成造成的,这也可能未来治疗领域需要关注的领域。
然而,在许多不同的精神疾病中也检测到其水平的改变。一些胃肠道功能障碍的症状可能是由于神经内分泌免疫刺激导致中枢神经系统活动失调、外周水平(肠)失调或两者(脑肠轴)的组合所致。此外,多项研究证明了5-HT在肝脏中的促纤维化作用,表明它与血小板衍生生长因子协同作用,刺激肝星状细胞增殖。
♢血清素是宿主与微生物群互作的关键介质
最近的一项研究指出大约50%的肠道来源5-HT受到肠道微生物群的调节,特别是以梭状芽孢杆菌科(Clostridiaceae)和苏黎世杆菌属(Turicibacteraceae)为主的孢子形成细菌,对宿主肠道蠕动、止血和骨化产生下游影响。
虽然大部分肠道5-HT由肠嗜铬细胞从基底外侧分泌到周围肠道组织中,但一些肠嗜铬细胞含有的5-HT则从顶部分泌到肠腔中,这表明肠道微生物暴露于宿主-衍生的5-HT。事实上,微生物对宿主肠嗜铬细胞的影响不仅调节肠道组织和血液中的5-HT水平,而且还调节肠腔和粪便中的5-HT水平。
一项新的研究表明,产孢肠道细菌(Turicibacter sanguinis)中的一种新型血清素传感器可能对宿主脂质和类固醇代谢很重要。这些发现支持了一个新兴概念,即双向信号通路可以影响细菌群落结构并对宿主生理产生影响。
为了解决粘膜血清素和肠道微生物组之间的串扰本质上是否是双向的,并可能导致细菌功能反应改变的问题,研究人员通过口服补充血清素或进行基因改造来限制血清素再摄取,他们发现粪便血清素水平的增加与肠道微生物群落结构的改变有关,特别是孢子形成细菌相对丰度的增加。生物信息学方法显示, Turicibacter属的孢子形成细菌表达蛋白质 CUW_0748,该蛋白质与哺乳动物血清素转运蛋白 (SERT) 具有序列和预测同源性,SERT 是一种膜转运蛋白,负责包括肠道在内的许多器官中血清素的再摄取和失活。
培养实验表明,细菌种Turicibacter sanguinis能够摄取血清素,而且这种作用可被选择性血清素再摄取抑制剂(SSRI) 氟西汀抑制。单独使用血清素或与氟西汀联合暴露时, T. sanguinis的转录组分析产生了基因表达的强烈变化,进一步支持了血清素介导的细菌反应作用。
总的来说,这些数据可能对抗抑郁药物的使用具有重要的临床意义。未来的研究将产生负责细菌对宿主血清素反应及其对宿主生理机能的后续影响的替代机制。
血清素有助于控制不同生物群体的新陈代谢。除了中枢神经系统和肠神经系统中发生的神经元交换之外,血清素还影响身体周围的组织。此外,血清素负责介导多种非神经元过程和功能,例如膀胱调节、止血、呼吸驱动、免疫反应、血管张力和肠道炎症。
血清素通过胃肠道中的5-HT受体在分泌、血管舒张、蠕动、疼痛感知和恶心中发挥关键作用。中枢血清素在调节情绪和行为以及通过降低食欲影响整体能量平衡方面发挥着至关重要的作用。
注:几种调节中枢血清素功能的药物(例如芬氟拉明、西布曲明和氯卡色林)最初被批准并用作抗肥胖治疗,但随后由于其不良心血管和致癌作用而被撤回。
在过去的十年中,人们利用特定血清素相关基因敲除的动物模型,对外周血清素在控制全身能量代谢中的作用进行了广泛的研究。以下是汇总的一些关键的相关的健康功能。
众所周知,脑干含有离散的含血清素(5-羟色胺,5-HT)神经元组,从尾髓质延伸到中脑头端。各种类型的血清素受体在整个大脑中分布不均匀,对目标部位的作用也不同。
血清素能神经元位于脑干中缝核,从那里它们投射到多个大脑区域并刺激多种血清素受体亚型。血清素能功能障碍与多种精神疾病有关,并且可能主要导致焦虑和抑郁等负面情绪。
血清素功能障碍会导致负面情绪和行为
突触内血清素的摄取受血清素转运蛋白(5-HTT)的功能和可用性的调节。血清素再摄取率的双重差异与5-HTT基因调节区域的功能多态性有关,并可能导致产生负面情绪状态的风险。
除了焦虑和抑郁等负面情绪状态外,血清素能功能障碍也可能有助于冲动行为、攻击性和过量饮酒的发病机制和维持。
脑干5-HTT可用性的增加与压力引起的血清素周转率下降相关。研究结果表明,产前和产后的压力暴露可以引起应激激素轴激活的长期改变,并可能影响血清素能神经传递。
血清素影响神经兴奋进而与一些精神疾病有关
5-HT在控制由神经网络振荡产生的节律性电活动方面至关重要,神经网络振荡是由反复兴奋和反馈以及前馈抑制的协调活动产生的兴奋和抑制平衡(E/I)之间的精确平衡决定的。血清素能功能的功能改变与多种疾病的缺陷有关,例如抑郁症、焦虑症、精神分裂症和明显的癫痫症。这些病理情况与5-HT的改变及其与不同神经递质系统的相互作用相关,例如GABA、多巴胺(DA)、大麻素(CB)等。导致E/I平衡改变并影响突触可塑性。
中枢神经系统中突触5-HT可用性的增加与情绪升高和焦虑减少相关,这构成了几类广泛使用的抗抑郁药的基础,这些抗抑郁药可通过以下方式防止5-HT从突触间隙中去除:阻断血清素转运蛋白(SERT)。
有一些证据表明血清素能系统在丛集性头痛(CH)病理生理学中的潜在作用。研究数据表明,丛集性头痛(CH)的特点是血浆血清素代谢升高,这表明中枢 5-羟色胺系统可能参与丛集性头痛的发生。
血清素的神经营养作用
在脊椎动物、线虫和果蝇等动物中,存在着一类称为星形胶质细胞的支持细胞,它们可能是最早出现的用于增强血清素营养作用的次级细胞。
1957年就有人提出血清素系统是一个”营养系统”。血清素可以通过受体介导的葡萄糖利用率和营养因子释放的变化。血清素纤维可以被认为是大脑的“滴灌系统”。只要轴突完好无损,血清素就能有效地释放到整个大脑中。而在老年和神经退行性疾病中,人脑中的血清素轴突会退化。
在哺乳动物中,血清素通过与神经胶质细胞的相互作用,形成了一种间接但重要的营养关系。高亲和力血清素受体已在星形胶质细胞、小胶质细胞、双极细胞和雪旺细胞等上发现。
血清素受体的激活可以促进神经胶质细胞的分化,诱导神经营养因子mRNA的表达,还可以刺激星形胶质细胞释放营养因子S100。
反过来,星形胶质细胞为血清素能神经元提供色氨酸,两者之间存在密切的营养相互作用,在海马体尤为明显。
季节性情感障碍和自杀
血清素的减少会对正常的大脑稳态(结构和功能)产生严重影响,并影响一个人继续生活的愿望。令人惊讶的是,阳光对人类大脑的血清素系统具有显著的作用。
几十年前就报道了情感障碍的季节性变化,并且从有记录的历史最早时期就已经注意到了。有些北半球文化制定了特殊的节日来纪念地球上的光的最低点,并举行庆祝活动来对抗冬季的阴暗(例如农神节和冬至)。
季节性情感障碍包括秋季/冬季复发性重度抑郁发作,春季/夏季缓解,可通过血清素药物和/或光疗法有效治疗。光疗法或抗抑郁药物治疗与心理社会功能和生活质量评估的显著改善相关。
光疗法对人体血清素参数有影响。研究表明,健康受试者和非季节性抑郁症患者在重复可见光照射后,血液血清素会增加。101 健康男性的颈静脉血样显示,冬季大脑中血清素的周转率最低,并且与明亮阳光的持续时间直接相关。
通过该程序测量的血清素的产生随着亮度的增加而迅速增加。无论一年中的什么时间,在明亮的日子里,血清素水平都较高,并且血清素的含量反映了特定一天暴露在阳光下的时间——前一天的条件没有影响。在一组有季节性情感障碍病史的患者中,测量到的血浆生物蝶呤和色氨酸水平显著降低,而光疗后则升高。
蓝光可有效增加叶绿体光合作用过程中色氨酸的吸收,并且这种光可有效治疗患有季节性情感障碍的患者。正如植物叶绿体系统所提到的,在人类研究中蓝光可能是最有效的。蓝光可以抑制褪黑激素水平并有助于昼夜节律相移。当使用窄带蓝光(468nm)时,光疗法可有效显著减少 HAMD21。
有人提议,应根据有关光的神经生物学效应的新知识重新评估家庭和工作场所的照明标准。这可能被认为是一个社会为实现有利于增强普通人群血清素功能的条件而采取的第一步,也是对血清素与阳光的特殊关系的承认,这种特殊关系在地球生命之初就开始出现。
外周血清素在调节肠道感觉、运动、肠腺分泌、维持肠道平衡等方面发挥着重要作用,健康状态下它不会穿过血脑屏障,影响中枢神经系统。
在人类肠道中,内皮细胞充当肠道内容物的传感器。在乙酰胆碱、腔内压力升高、低pH等一定刺激下, 肠嗜铬细胞(ECs)释放5-HT,激活肠壁内源性感觉神经元,引起肠内分泌反射和蠕动,而外源性神经元则也可被5-HT激活,引起疼痛、不适、恶心和呕吐。
血清素的分泌增加会导致肠道产生不适症状
当肠道受到刺激时,5-HT增加并与外源性初级传入神经末梢的5-HT 3受体结合,使肠神经系统(ENS)和内脏传入神经高度敏感,从而产生不适、腹痛、和腹泻。还有报道称,IBS-D 患者肠粘膜中的5-HT 和 5-HT 3受体显著高于健康对照者,表明 IBS 患者的 5-HT 系统受损。
在胃肠道中,血清素会引发恶心、肠道分泌和蠕动等反应,并且还与肠易激综合征等胃肠疾病有关。
例如,阿洛司琼(一种 5-HT 3拮抗剂)被证明可有效治疗伴有腹泻的IBS,而替加色罗(一种 5-HT 4激动剂)可有效治疗伴有便秘和慢性便秘的 IBS。5-HT 3拮抗剂阻断肠嗜铬细胞释放的 5-HT 对肌间神经丛固有初级传入神经元的影响,5-HT 4激动剂可引起蠕动反射。
这些作用机制可能涉及5-HT调节感觉神经传递和肠道反射运动。但这些药物的安全性存在问题,临床应用受限,需要进一步探索新的治疗靶标。此外,对肠嗜铬细胞5-HT作用的认识也需要重新审视。
5-羟色胺是一种肠神经系统生长因子
5-羟色胺(5-HT)不仅是肠神经系统(ENS)中的重要神经递质,也是ENS发育所需的关键生长因子。5-HT能够促进神经嵴源性前体细胞的分化和新神经元的生成,对ENS的出生后生长和维持至关重要。
缺乏神经元5-HT合成酶TPH2会导致ENS神经元数量显著降低,表明5-HT在ENS正常发育中的关键作用。此外,环境刺激可能通过改变5-HT能神经元的活动,从而对ENS的结构和功能产生持久影响,这为理解肠易激综合征等胃肠道功能障碍的发病机制提供了新线索。
血清素促进肠粘膜生长
肠神经元中的5-HT不仅影响肠粘膜的生长和维持,也影响ENS的生长和维持。缺乏5-HT再摄取转运蛋白SERT的小鼠,其肠粘膜生长和细胞增殖明显增强,因为SERT负责5-HT的失活。给予选择性5-HT再摄取抑制剂(SSRI)也会产生类似效果。这种作用主要是通过神经元5-HT而非肠嗜铬细胞5-HT介导的,因为删除TPH2(神经元5-HT合成酶)会减弱SERTKO小鼠的效果,而删除TPH1(肠嗜铬细胞5-HT合成酶)则不会。
5-HT 2A受体阻滞剂和乙酰胆碱拮抗剂都可以抑制SERTKO或SSRI增强肠粘膜生长的效果,表明这种作用是通过5-HT 2A受体介导的,而该受体主要表达在粘膜下胆碱能神经元上。这些神经元为上皮细胞提供神经支配,可能是促进粘膜干细胞/增殖细胞增殖的关键机制。
肠嗜铬细胞衍生的5-羟色胺与肠道炎症
缺失5-HT再摄取转运蛋白(SERT)会延长和增强粘膜中5-HT的作用,加重TNBS诱导的结肠炎和IL-10缺失相关的结肠炎。这是因为肠细胞通常表达SERT,缺失SERT会放大肠嗜铬细胞释放的5-HT的作用。
增强5-HT的作用会增强炎症,表明5-HT具有促炎作用。实验证实,这种促炎作用依赖于肠嗜铬细胞分泌的5-HT,因为缺失TPH1(肠嗜铬细胞5-HT合成酶)可以保护肠道免受炎症。
肠嗜铬细胞分泌的5-HT可以刺激树突状细胞上的5-HT 7受体,启动先天免疫反应,最终导致适应性免疫反应和肠道炎症。免疫系统的许多效应细胞也表达5-HT受体并对5-HT有反应。
相反,缺失TPH2(神经元5-HT合成酶)会增加炎症的严重程度,表明神经元5-HT具有抗炎作用,可能通过保护ENS免受炎症的神经毒性作用。
因此,5-HT在肠道中可以同时发挥”剑”(促炎)和”盾”(抗炎)的作用,其平衡对肠道健康非常关键。肠嗜铬细胞分泌的5-HT在肠道炎症发生和发展中起关键作用。
血清素受体及其在胃肠道中的功能
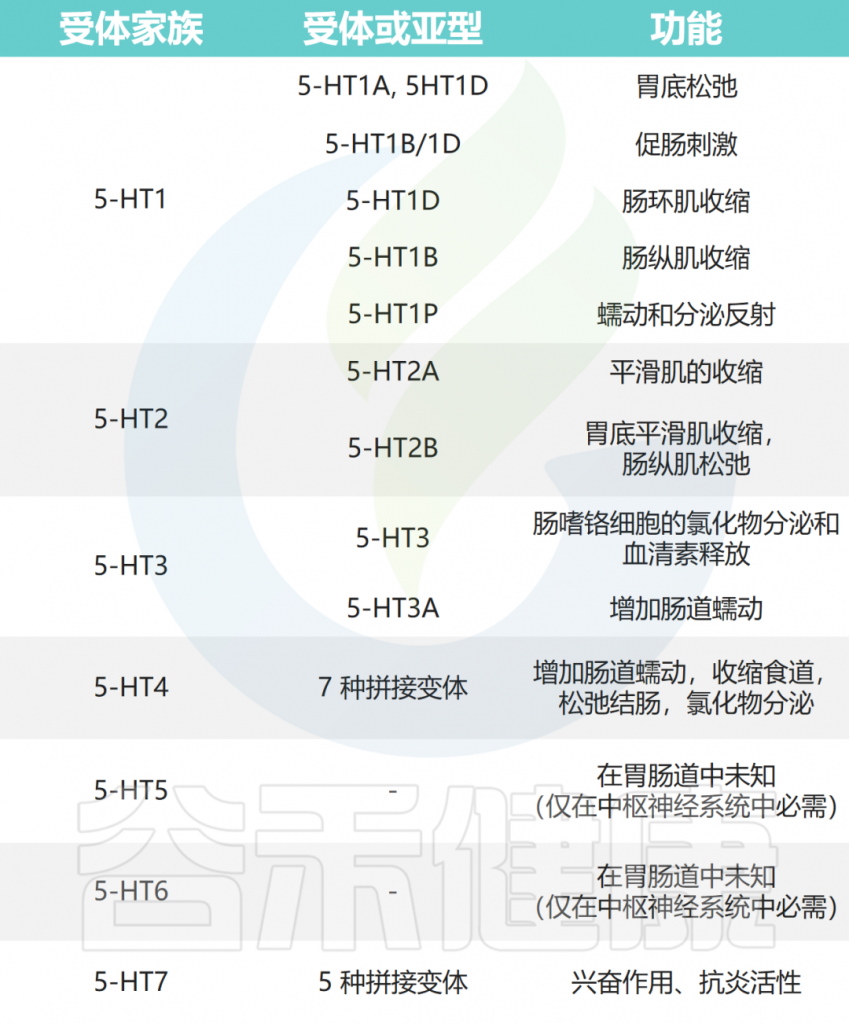
Guzel T and Mirowska-Guzel D.Molecules.2022
重点:血清素与肠脑轴
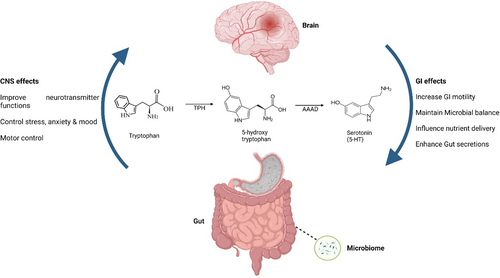
胃肠道和中枢神经系统通过称为脑肠轴的通讯途径连接。该路径允许信息双向流动。在这个网络的起点和终点,血清素作为神经递质发挥着关键作用
一项研究评估了Akkermansia muciniphila及其细胞外载体(EVs)对小鼠结肠和海马血清素能系统相关基因的影响,对Akkermansia muciniphila进行干预4周,观察结肠、海马和血清中的血清素水平通过ELISA测量小鼠以及人结肠癌细胞(Caco-2)的细胞活性。结果显示,通过肠-脑轴的血清素信号传导/代谢可能被考虑用于改善血清素相关疾病的新治疗策略。
在最近的一项研究中,衍生的齿双歧杆菌(B.dentium)已被用来调节哺乳动物的血清素能水平和肠脑轴,结果显示与齿状双歧杆菌相关的小鼠粪便中乙酸盐增加,研究结果表明齿状双歧杆菌和细菌代谢物乙酸盐是能够调节多个宿主组织中血清素能系统的关键组成部分,并与成人行为的功能变化相关。
下表显示了对益生菌补充剂通过肠-脑轴改善血清素信号传导的系统评价:

doi.org/10.1002/fsn3.3826
血清素被认为是一种重要的循环激素因子,它通过直接作用于心脏细胞或通过刺激心脏的化学敏感神经而与正常心血管功能有关。
类癌肿瘤患者血清素水平升高
类癌肿瘤(一种罕见的缓慢生长的癌症)患者心血管系统中的血清素活性水平升高,这与心律失常等某些症状有关,从而导致血流阻塞和瓣膜纤维增生。
类癌瘤又称类癌,是一组发生于胃肠道和其他器官嗜铬细胞的新生物,其临床、组织化学和生化特征可因其发生部位不同而异。此种肿瘤能分泌5-羟色胺(血清素)、激肽类、组织胺等生物学活性因子,引起血管运动障碍、胃肠症状、心脏和肺部病变等。
此外,据报道,暴露于显著升高的血清素水平(无论是由于高浓度的 5-HT 本身,还是用高水平的选择性血清素再摄取抑制剂 (SSRI) 处理)的小鼠胚胎在许多不同的部位都表现出异常生长。
血清素控制血管平滑肌的收缩
血清素被认为负责控制全身血管平滑肌细胞的收缩——这些肌肉细胞在整个循环系统中尤为突出,它们负责通过收缩或扩张血管来控制血流。据信,“S2”型血清素受体在这一功能中发挥着关键作用。
事实上,对血清素(5-HT)的一些最早的科学研究是由于它的血管收缩作用——通常直到后来它的其他生理和心理作用才变得明显。
例如,动物研究报告称,静脉注射血清素可以引起心血管系统的多种反应,导致血压升高或降低,具体取决于它在体内活跃的位置和时间。
血清素还可以通过其他“间接”机制来控制血压,例如通过放大其他血管活性物质(如NET、血管紧张素II和组胺)的反应。
血清素系统血清素(5-HT)是睡眠和清醒时大脑的关键调节剂/递质,中缝背侧(DR)和中缝(MR)是脑干的主要含5-HT核团,为前脑提供广泛的血清素能神经支配。这些中缝核涉及多种高阶功能,尤其是睡眠和意识。
血清素可用于调节睡眠和清醒
中缝背侧和中缝与脑干、下丘脑、视前区以及对清醒和睡眠至关重要的皮质结构具有相互联系。虽然血清素能DR/MR细胞的电生理学特性表明其在唤醒/觉醒中发挥作用,但血清素能传递的多样性(部分与5-HT受体的异质性相关)表明5-HT也可用于调节睡眠。
现在新出现的证据表明,5-HT DR 神经元是复杂神经回路的关键组成部分,其中(1)DR对前脑发挥兴奋作用,部分由来自外侧下丘脑的食欲素输入驱动;(2)DR在清醒时抑制腹外侧视前区(VLPO)的睡眠活跃神经元;(3)DR 与对睡眠压力做出反应的神经元相互作用,因此与腺苷一起,可以通过VLPO 神经元亚群的 5-HT 兴奋将生物体从清醒状态转变为NREM 状态;(4)DR/MR 在快速眼动(REM)睡眠中发挥着许可作用,因为它们在REM期间的虚拟沉默会抑制REM活跃神经元,从而触发REM睡眠状态。
血清素受体已在所有主要类型的骨细胞(成骨细胞、骨细胞和破骨细胞)中被发现。最近的数据表明,肠道来源的血清素可能介导低密度脂蛋白(LDL)受体相关蛋白的骨骼效应。
一些证据表明,使用SSRI(选择性血清素再摄取抑制剂)(可增加全身血清素水平)可能与骨量减少、骨质流失增加和骨折风险增加有关。
血清素过高会导致骨量减少、骨质流失增加
LRP5(LDL受体相关蛋白5)在成骨细胞和肠嗜铬细胞中表达,是Wnt信号的辅助受体。LRP5抑制肠嗜铬细胞中色氨酸羟化酶(TPH1)的表达,从而降低5-HT的分泌,导致血液和血小板中5-HT水平下降。
成骨细胞表达5-HT 1B受体,可直接响应循环中的5-HT,抑制成骨细胞增殖。因此,肠嗜铬细胞5-HT生物合成的降低,最终导致成骨细胞增殖增加,骨量增加。
而抑制肠道TPH1可增加骨量,说明使用不穿过血脑屏障的外周TPH抑制剂可能是一种治疗骨质疏松症的有效方法。
注:与外周5-HT的促骨作用不同,中枢5-HT通过抑制交感神经活动而抑制骨量增长。
总之,肠嗜铬细胞分泌的5-HT具有内分泌激素的作用,在调节骨代谢中发挥重要作用。这为开发新的治疗骨疾病的靶向药物提供了新思路。
除了对骨骼代谢的影响,肠嗜铬细胞分泌到血液中的5-HT还对肝脏再生产生作用。
在肝脏中,5-HT作为一种生长因子,可促进部分肝切除后的肝脏再生。肝脏再生的能力与血小板携带5-HT的数量直接相关。
血清素有助于推动肝脏再生
5-HT可激活肝细胞表面的5-HT2受体,从而促进肝细胞的增殖和DNA合成,推动肝脏再生。
缺乏色氨酸羟化酶1(TPH1)的小鼠,其肝脏再生能力受损,证实了肠嗜铬细胞来源的5-HT在这一过程中的关键作用。
总之,肠嗜铬细胞分泌的5-HT通过激活肝细胞上的受体,发挥了促进肝脏再生的内分泌功能。这为利用5-HT调节肝脏损伤后的再生提供了新的治疗思路。
禁食期间,内源性葡萄糖产生和脂肪分解增加,而葡萄糖摄取降低。这由激素(胰岛素、胰高血糖素等)和自主神经系统协调调节。
进食后,代谢转向合成代谢状态,胰岛素增加抑制内源性葡萄糖产生,促进肌肉和脂肪组织的葡萄糖摄取。
血清素可以提高胰岛素敏感性
下丘脑、脑干和皮质边缘区域参与葡萄糖感应,形成复杂的神经元网络,调节机体能量代谢。5-HT可通过中枢和外周机制影响葡萄糖代谢,包括调节胰岛素和胰高血糖素分泌。
5-HT1D和5-HT2A受体介导的作用可抑制胰高血糖素分泌,从而改善高血糖。5-HT可通过促进肌肉葡萄糖摄取和糖原合成来提高胰岛素敏感性。
此外,胰腺β细胞具有合成5-HT的机制,因为人类胰岛中存在编码关键酶色氨酸羟化酶(TPH)和芳香族氨基酸脱羧酶(AADC)的基因。
血清素会减少胰高血糖素分泌
5-HT1D和5-HT2A受体亚型也存在于胰腺α细胞中,表明5-HT在胰高血糖素分泌中发挥着额外作用。事实上,在人类胰岛中,研究表明5-HT会减少胰高血糖素分泌。
在体内,5-HT1D受体激动剂舒马普坦降低了人体胰高血糖素水平。从机制上讲,葡萄糖诱导邻近β细胞分泌5-HT,通过5-HT1F 受体降低α细胞中的环 AMP水平,并抑制胰高血糖素分泌。
与此一致,5-HT1F 受体的药理学激活减少了糖尿病小鼠的胰高血糖素分泌和血浆葡萄糖。据推测,α细胞的血清素控制受损可导致高胰高血糖素血症,从而导致高血糖。因此,5-HT1F 受体激动剂可能是治疗糖尿病等高血糖疾病的一种有前途的治疗方法。
5-羟色氨酸(5-HTP)被认为与主要饮食失调(例如厌食症)相关的许多心理和行为症状有关。由于这些原因,一些研究人员建议补充色氨酸可能有潜力治疗厌食症。
色氨酸是血清素的前体,也是一种只能在饮食中获得的必需氨基酸,因此,过度的饮食限制可能会导致大脑5-HT储存减少。血清素作用于多个大脑部位来调节进食行为,包括脑干中的多个核团、下丘脑亚区域(例如弓状核和室旁核)以及中皮质边缘多巴胺系统。
血清素调节饱腹感从而影响食欲
血清素和含下丘脑肽的细胞之间以及与缩胆囊素和其他肽之间存在重要的相互作用。血清素在行为水平上具有多种影响,其范围从调节短期饱腹感和饱足感以响应胃扩张和肠道营养素的存在,到调节奖赏和由条件线索引起的行为反应。
对血清素系统在控制食欲和摄食中的作用的大部分了解是从20世纪70年代到90年代初使用血清素释放剂和再摄取抑制剂芬氟拉明进行的研究中发展起来的,最初使用外消旋dl-芬氟拉明,后来使用更有效的异构体d-芬氟拉明。事实上,直到1997年,芬氟拉明因与瓣膜性心脏病相关而被撤回作为抗肥胖治疗药物,它一直是研究支持食物摄入和饱腹感的血清素机制的典型化合物。
d-芬氟拉明通过增加这些受体的5-HT可用性来间接减少食物消耗,而不是直接刺激突触后受体。然而,在大鼠中证明,d-芬氟拉明在服用一定剂量后仍然能够减少食物摄入量,并阻断 d-芬氟拉明增加下丘脑内侧区域 5-HT 传输的能力。这些发现清楚地表明d-芬氟拉明对5-HT受体有直接作用。
细胞外血清素水平升高通常会导致食物摄入量
减少,反之亦然
大脑中血清素能神经元的活动增强通常会导致食物摄入量减少和体重减轻,但也有其他研究报告了一些例外情况。据推测,大脑中5-HT容量传输通常会减少食物摄入量,因为一方面,5-HT水平升高会引起吞咽不足,另一方面,5-HT水平降低会导致食物摄入量增加,即食欲亢进。
事实上,通过脑血管内注射5,7-二羟色胺(血清素能神经元的神经毒素)或对氯苯丙氨酸(通过抑制5-羟色氨酸羟化酶减少5-HT合成)诱导的5-HT 水平降低,可诱导喂食大鼠的食欲亢进。
一些研究人员指出,某些神经元群释放到大脑中的血清素量似乎很大程度上取决于食物摄入量。这导致了这样的假设:血清素系统可能在食欲和饮食行为的调节中发挥着至关重要的作用——尽管这种潜在功能的确切性质尚不完全清楚。
在大脑中,自主神经和随意神经系统中的血清素能系统会导致饮食不足和过量。
doi.org/10.1016/B978-0-444-64125-0.00028-1
药理学和遗传学之间的合作关系:特定血清素受体有助于减少和增加食物摄入量
大量药理学研究,无论是否结合使用 5-HTR KO 小鼠,收集的证据表明5-HT容量传输通常有助于减少食物摄入通过大脑特定区域的特定 5-HTR,破译了饮食行为的一些细胞内基础。
一些初步证据表明,碳水化合物的摄入尤其可能会影响血清素——可能是通过与胰岛素分泌相关的机制发挥作用。其他大量营养素,例如蛋白质,似乎没有这种作用,这表明这种作用可能特定于某些类型的营养素或食物。
血清素调节外周其他激素进而影响能量代谢
现在越来越多的证据表明外周血清素作为一种能够调节外周代谢的激素具有明显的作用。与经典的禁食激素胰高血糖素类似,由于肠道Tph1表达上调,循环 5-HT 因禁食而显著升高。禁食期间,5-HT 有效促进脂肪细胞的脂解作用,从而为肝糖异生提供底物,而5-HT也显著上调这一过程。
另一方面,肠道来源的5-HT还可以通过降低敏感性激素的激活,抑制白色脂肪组织的褐变和棕色脂肪组织的产热过程,从而有效地减少能量消耗。并减少负责产热的解偶联蛋白1的表达。因此,肠道来源的 5-HT 通过增加短期能量可用性和促进长期能量保存,在驱动对营养缺乏的多种生理适应方面发挥着关键作用。
矛盾的是,在肥胖条件下,循环5-HT水平也会升高。肥胖人类和啮齿动物高脂肪饮食后,循环和肠道来源的5-HT水平会升高。外周 5-HT 调节胰岛中葡萄糖刺激的胰岛素分泌,高脂饮食导致外周5-HT水平增加,通过肝脏中脂肪储存的增加导致肝脂肪变性。
肠道5-HT的药理学或遗传减少可预防饮食引起的肥胖、肝脂肪变性和葡萄糖不耐受,说明肠道来源的5-HT升高在驱动代谢功能障碍中的致病作用。在人类肥胖中,EC细胞的密度和TPH1的表达都会增加 ,但驱动这种变化的机制仍然未知。
先前的文献表明,5-HT及其受体升高可能作为一种有效的营养物质、促有丝分裂和抗凋亡因子,然而还可能促进致癌进展。文献进一步证明5-HT受体在许多癌症类型中表达,包括结直肠癌(CRC)、胰腺癌、肝细胞癌(HCC)、乳腺癌、肺癌和前列腺癌,它们促进肿瘤细胞的生长和存活。
多种肿瘤中血清素水平较高
较高的全身5-HT水平存在于多种肿瘤中,并且与肿瘤复发和不良生存密切相关 。肿瘤细胞和正常细胞对5-HT刺激有不同的反应。 5-HT促进CRC细胞增殖,但不增加正常结肠隐窝细胞的有丝分裂率。正常结肠隐窝的增殖受到自主神经和内分泌调节,而结肠癌细胞的分裂仅需要内分泌信号传导。
在人胆管癌组织中,TPH1表达增加和MAOA表达减少促进5-HT的分泌。通过抑制5-HT1A、2A、2B、4和6或TPH1可以特异性逆转分泌。
血清素水平会影响肿瘤血管生长
5-HT也是肿瘤血管生成中有效的血管生成因子。低浓度的5-HT在体外可诱导内皮细胞增殖、迁移和管形成,体内血管生成通过5-羟色胺受体依赖于TR3/Nur77,而与血管内皮生长因子A(VEGF-A)无关。人体内大部分5-HT储存在血小板中。在肿瘤微环境中,血小板聚集导致5-HT大量释放,促进肿瘤微血管的形成。
此外,5-HT阳性细胞的存在与较高的微血管密度和VEGF表达相关。在肿瘤发生过程中,肿瘤微环境中 VEGF(一种血管生成介质)的释放促进了血管生长的增加和异常血管重塑。
在TPH缺陷小鼠的结肠癌同种异体移植物中,与野生型小鼠相比,微血管密度降低。TPH 缺陷小鼠中 VEGF 和 VEGFR2 的表达相似,但基质金属蛋白酶12 (MMP-12) 和血管抑制素的表达较高。
MMP-12可以将纤溶酶原裂解成血管抑制素,血管抑制素是一种内源性血管生成抑制剂。小鼠的肺癌和黑色素瘤的同种异体移植物也比野生型小鼠小,这可能是由于eNOS浓度降低(导致血管舒张)以及肿瘤生长的血液补充不足所致。然而,有研究报道5-HT作为血管收缩剂,可以通过选择性地收缩肿瘤小动脉来抑制结肠癌的生长。
近年来,5-HT与肿瘤浸润免疫细胞之间的关系也被揭示。例如,5-HT通过激活5-HTR来抑制TNF-α和IL-1β的释放。在单核细胞/巨噬细胞中,5-HT调节细胞因子的分泌并介导中性粒细胞募集和T细胞激活。
与身体和大脑中的其他生物活性物质一样,血清素水平需要精心平衡,以维持整体健康的最佳状态。
但是人们常常错误地认为“更多”总是“更好”,而事实并非如此!举例来说,血清素水平升高可能导致血清素综合症,这是一种可能致命的严重疾病。
此外,血清素水平升高有时会使其他已有疾病(例如强迫症)的症状恶化。
血清素综合症是由于药物、补充剂或草药的组合导致血清素升高至不安全水平而引起的。它可能导致意识混乱、发烧、不自主的肌肉痉挛、癫痫发作甚至死亡。虽然有点罕见,但血清素综合症是一种严重的疾病,任何食用改变血清素水平的产品的人都应该意识到这一病症。
▸ 什么是血清素综合症?
当人的系统中血清素过多时,就会出现血清素综合症——无论是由于过量服用一种药物,还是由于组合使用多种药物来增加血清素水平。这可能非常危险,并会导致许多严重的并发症,从轻度(意识模糊、腹泻、颤抖)到严重(谵妄、癫痫发作、昏迷)。
尽管有些人可能更容易患血清素综合症,并且严重程度可能有所不同,但任何血清素水平升高的人都会出现症状。即使服用一剂改变血清素的药物也可能导致血清素综合征。
警告:血清素综合症是一种潜在的致命疾病,需要紧急治疗。如果您使用过精神活性药物/草药/补充剂并注意到下述任何症状,请尽快寻求医疗帮助。
▸ 症状
由于血清素会激活全身的许多受体,因此血液中过量的血清素会产生广泛的影响。这些症状从轻微到危及生命不等。
大脑中血清素过多会导致:
困惑
搅动
对刺激的敏感性增加(高度警惕)
焦躁不安
焦虑
发烧
对心脏和血管的影响包括:
心率过快
血压飙升
通过作用于肠道,过量的血清素会导致 :
腹泻
恶心
呕吐
它还可能导致:
出汗过多
肌肉痉挛或肌张力增加
瞳孔扩张
发抖
震颤(有节奏的颤抖)
危及生命的症状包括:
谵妄
代谢性酸中毒
横纹肌溶解症(肌肉组织分解,释放有毒蛋白质)
体温极高(超过41°C)
昏迷
血清素综合征最明显的症状可能是重复的、不自主的肌肉收缩。
♢症状会持续多久?
症状通常在服用改变体内血清素水平的药物后6至8小时出现,并且症状非常严重。如果治疗得当,轻微症状通常会在24-72小时内消失,但可持续长达3天。更严重的病例需要住院治疗,并且可能需要更长的时间才能康复。
♢长期影响
血清素综合征症状的持续时间完全取决于违规药物在您的系统中停留的时间。一旦治疗得当,一般不会产生长期影响。然而,如果不及时治疗,严重的血清素综合征可能会导致死亡。康复后,重新评估所有当前药物以防止血清素综合征再次发生非常重要。
▸ 血清素综合症的原因
影响血清素水平的多种药物和补充剂之间的相互作用是导致血清素综合征的最常见原因。
♢非处方药和处方药
1) 抗抑郁药和抗焦虑药
选择性5-羟色胺再摄取抑制剂(SSRI)、5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI)和三环类抗抑郁药(TCA)是治疗抑郁和焦虑的常用药物。它们通过延长大脑中血清素的活性来发挥作用。
最常与血清素综合征相关的抗抑郁药和抗焦虑药包括:
西酞普兰(Celexa)
艾司西酞普兰(Lexapro)
氟西汀(百忧解)
帕罗西汀(Paxil、Pexeva)
舍曲林(左洛复)
维拉佐酮(Viibryd)
氟伏沙明(Luvox)
文拉法辛(Effexor)
氯米帕明(Anafranil)
丙咪嗪(托法尼)
沃替西汀(Trintellix,Brintellix)
2) 单胺氧化酶抑制剂
单胺氧化酶抑制剂(MAOIs)是用于帮助治疗各种情绪障碍和帕金森病的药物。它们通过阻断单胺氧化酶发挥作用,单胺氧化酶会分解大脑中发现的几种神经递质,包括血清素。这会产生更多的血清素来作用于大脑。
滥用 MAOIs 或与其他增加血清素的药物联合使用可能会导致血清素综合征。这些包括但不限于:
司来吉兰
联非美烷
吗氯贝胺
吡林多(吡拉齐多)
托洛沙酮(胡莫酰)
利奈唑胺(Zyvox)
3) 抗生素
利奈唑胺是一种抗生素,常用于治疗对其他抗生素(如链球菌、VRE 和 MRSA)耐药的细菌感染。利奈唑胺还可以稍微阻断血清素的分解(通过阻断 MAO)。
4) 偏头痛药物(曲普坦类药物)
曲坦类药物通常是医生为中度至重度偏头痛患者开出的第一种药物。曲普坦类药物还会激活大脑中的血清素受体,并存在发生血清素综合征的风险,特别是与阿片类药物或抗抑郁药联合使用时。
他们包括:
阿莫曲坦(Axert)
那拉曲坦(Amerge)
利扎曲普坦(Maxalt)
舒马曲坦(Imitrex)
佐米曲普坦(佐米格)
5)阿片类药物
目前用于缓解疼痛的阿片类药物处方和阿片类药物滥用呈上升趋势。一些阿片类药物可以延长血清素的作用(通过阻止再摄取),从而导致大脑中产生更多的血清素。阿片类药物可引起血清素综合征,尤其是与其他改变血清素的药物联合使用时。
阿片类药物包括但不限于:
曲马多
哌替啶
美沙酮
芬太尼
吗啡
他喷他多
6) 丁螺环酮 (Buspar)
丁螺环酮通常用于改善焦虑,并与其他抗抑郁药联合治疗情绪障碍。它激活血清素受体。过量单独使用或与其他抗抑郁药联合使用可能会导致血清素中毒。
7) 治恶心药物
甲氧氯普胺 (Reglan) 通常用于治疗胃部问题,如胃灼热、恶心、呕吐和消化不良。据报道,有两例患者因联合服用甲氧氯普胺和抗抑郁药而导致血清素综合征。
任何与血清素受体相互作用的恶心药物都会增加血清素综合征的风险。示例包括:
格拉司琼(Kytril,Sancuso)
昂丹司琼(Zofran)
8) 右美沙芬
右美沙芬是一种止咳药,存在于许多非处方药中,例如 Robitussin、Delsym、NyQuil 和 Dimetapp。右美沙芬可以延长大脑中血清素的作用(阻止再摄取)。
在一份病例报告中,一名 63 岁的抑郁女性在服用右美沙芬-异丙嗪止咳糖浆与抗抑郁药艾司西酞普兰 (Lexapro) 组合两周后出现了血清素综合征 。
9) 过敏药物
在一项案例研究中,一名患者服用曲马多治疗颈部疼痛并联合苯海拉明治疗季节性过敏后出现血清素综合征。
♢草药和补品
1) 圣约翰草
圣约翰草是一种草药,几个世纪以来一直被用来治疗抑郁症,其疗效已得到临床证明。然而,圣约翰草可以与许多药物(包括 SSRI)产生负面相互作用,这些组合可能会导致血清素综合征。
2) S-腺苷-L-蛋氨酸 (SAM-e)
在多项试验中, SAMe改善了抑郁症状,也改善了对传统SSRI药物无反应的患者的抑郁症状。SAM- e可以显著提高血清素的产生,因此理论上,如果大剂量服用或与其他药物联合使用,可能会带来患血清素综合征的风险。
3) 人参
临床试验表明,人参可以降低更年期女性的抑郁症。它会增加大脑中的血清素(尤其是海马体),但是当大量服用或与影响血清素水平的其他药物联合使用时,会带来患血清素综合征的风险。
4) L-色氨酸
L-色氨酸直接增加血清素的产生。如果服用剂量过高,或与另一种增加血清素水平的药物(例如单胺氧化酶抑制剂,MAOI)联合使用,则存在发生血清素综合征的潜在风险。
♢食品
由食物引起的血清素综合症的可能性极小,因为以标准量摄入时,这些食物中的活性化合物含量相对较低。然而,重要的是要了解哪些食物有可能增加血清素水平,尤其是与血清素药物结合使用。
1)姜黄(姜黄素)
姜黄含有高含量的姜黄素,在临床试验中已被用于改善人类患者的情绪。在小鼠中,姜黄素会增加血清素水平,在服用其他增加血清素的药物时应谨慎使用。
2) 藏红花
在多项临床试验中,与服用SSRIs类似,藏红花可以减轻患者的抑郁症。对大鼠的研究表明,藏红花与血清素系统相互作用,因此它可能会影响血清素综合症 。
3)富含色氨酸的食物
当有血清素综合症的风险时,应避免食用色氨酸含量高的食物,因为色氨酸会直接增加血清素的产生。这些包括火鸡、鸡肉、大豆、鸡蛋、南瓜子、花生和一些奶酪。
一些精神疾病——例如抑郁症,与大脑中异常的血清素活动有关。由于这些联系,研究人员非常关注研究针对血清素系统的不同方法(通常是为了提高血清素的水平或整体活性)。
最著名和最广泛使用的抑郁症治疗方法之一,选择性血清素再摄取抑制剂(SSRI)可显著增加整个大脑的血清素水平(具体来说,通过防止神经元突触“清除”血清素,从而使其对整体大脑活动产生更持久、更强的影响)。
然而,SSRIs仍然有几个相当大的缺点。其一,许多抑郁症患者对此没有成功的反应。其次,即使对这些药物治疗有反应的患者,SSRIs 也经常会引起许多明显的副作用,包括恶心、皮肤反应、体重增加、睡眠障碍和性功能障碍。此外,来自动物研究的一些初步证据表明,长期使用 SSRI 可能会加重潜在的血清素缺乏症。
由于这些原因,一些人不愿意依赖药物治疗,而更愿意尝试非化学治疗。
在下面的部分中,我们将讨论一些已提出的可能增加血清素水平或活动的各种生活方式、饮食和基于补充剂的方法。然而,请记住,这些背后的科学大多仍处于初步阶段,并且这些生活方式策略或补充剂均未获得正式批准用于治疗抑郁症或任何其他精神或医疗状况。
这些只是补充方法,这意味着虽然它们可能有助于支持和增强传统治疗的有效性,但仅靠它们可能还不够。与往常一样,在采取本文讨论的任何“补充”策略之前,请务必先与你的医生讨论任何重大的生活方式、饮食或其他变化!
▸ 生活方式和行为因素
已经确定了几种可能影响大脑中血清素系统的行为方法和其他生活方式因素。
1)锻炼
锻炼对生理和心理健康有多种显着益处,包括提高血清素水平和对整体情绪产生积极影响。
例如,一些人类研究报告称,从事有氧运动会导致大脑血清素水平增加,并且如果保持良好的运动习惯,这种增加可能会持久。
如果可能的话,户外锻炼可能会更有益。例如,阳光照射与血清素水平升高有关,这反过来又可能转化为整体情绪的改善。
2)积极情绪诱导
一些证据表明,像听积极的音乐这样简单的事情,或参与其他愉快的经历,如在大自然中散步,可能会对大脑的血清素水平产生影响。
一项针对20名健康受试者的研究报告称,听愉快的音乐可以短期提高他们的血清素水平,并改善他们的情绪。此外,参加自然散步、冥想和按摩等有趣的活动都可能对血清素水平和整体情绪产生潜在的有益影响。
然而,值得注意的是,这些“情绪诱导”效应也可能产生相反的效果:例如,据报道,听“消极”或“不愉快”的音乐和其他刺激会降低人的情绪。
3)社交互动
一些证据还表明,积极的社交互动也可能对血清素水平和情绪产生潜在的有益影响。
例如,据报道,一个人经历的积极的面对面社交互动的数量与血清素水平有很强的相关性。
4)健康的睡眠习惯
毫不奇怪,睡眠对于大脑和整体心理健康非常重要。据报道,拥有健康且均衡的睡眠时间表对于维持整个大脑的血清素平衡非常重要。据信,造成这种情况的至少部分原因是大脑在睡眠期间产生并释放大量的血清素。
相反,睡眠不足会使血清素受体“脱敏”。反过来,这可能会扰乱大脑血清素系统的整体活动——睡眠不足甚至与抑郁症可能性增加有关。
▸ 饮食因素和补充剂
除了上述一些与生活方式相关的和其他“基于行为”的技术之外,研究人员还确定了许多饮食因素和基于补充剂的方法,它们也可能对一个人的血清素总体水平产生影响。
然而,值得注意的是,这些补充剂的功效仍然“没有足够的证据”,并且需要在健康人群中进行更多的后续研究来证实它们的效果。与往常一样,请务必先与您的医生讨论任何饮食改变或新的补充剂,因为这是避免与其他生活方式或健康相关因素发生任何潜在负面相互作用的最佳方法。
考虑到所有这些要点,研究表明以下一些补充剂可能有助于增加血清素并支持情绪平衡。
1) L-色氨酸和5-HTP
在体内,血清素是由5-HTP制成的,而5-HTP是由L-色氨酸制成的。因此,从理论上讲,增加这些“组成部分”(代谢前体)中的任何一个的水平都可以导致血清素总体水平的增加。
有限的研究表明,服用 L-色氨酸可能会提高血浆血清素水平,并可能改善缺乏血清素的人的某些认知、运动或肠道问题。
2)益生菌
在消化道中,益生菌恢复肠道微生物组并影响肠脑轴。肠道细菌的重要性之一是因为它们产生大量的色氨酸,而色氨酸是用来制造血清素的。一些研究表明,帕金森病等神经系统疾病与肠道细菌多样性较低或较少有关。
根据一项研究,据报道,为期8周的益生菌疗法(2.0×10^9 CFU/g瑞士乳杆菌和2.0×10^9 CFU/g长双歧杆菌)可增加110名抑郁症患者的色氨酸水平。理论上,增加色氨酸可以增加血清素的产生。
同样,一项动物研究报告称,给予大鼠14天的益生菌(婴儿双歧杆菌)可提高血液色氨酸水平。
3)维生素D
维生素D有助于身体(包括大脑)制造、释放和使用血清素。然而,补充剂的益处尚不确定。
维生素D会激活一种酶,将色氨酸转化为血清素。因此,增加维生素D的摄入量可能会增加血清素水平,从而有可能支持心理健康。
4) Omega-3 脂肪酸
虽然维生素D有助于神经元产生血清素,但omega-3多不饱和脂肪酸 EPA(二十碳五烯酸)、DHA(二十二碳六烯酸)和ALA(α-亚麻酸)可能有助于神经元释放血清素,并提高其整体活性(例如例如通过增加血清素受体的敏感性)。
在一项针对大鼠的动物研究中,低水平的omega-3脂肪酸——特别是α-亚麻酸(ALA)——与较低的血清素活性有关。相关地,DHA缺乏与仔猪大脑血清素水平降低有关。
在另一项动物研究中,几组怀孕的老鼠被喂食缺乏或富含α-亚麻酸的饮食。研究发现,与富含ALA饮食的大鼠相比,缺乏ALA饮食的大鼠前额叶皮层中的血清素水平降低了 65%,这进一步表明 omega-3 脂肪酸与血清素水平及整体健康之间存在潜在联系。
5) B族维生素
身体需要维生素B6来从其前体(例如5-HTP)产生血清素(具体而言,维生素B充当酶辅因子)。此外,维生素B12和叶酸(维生素B9)都是叶酸循环所必需的,叶酸循环有助于将色氨酸转化为血清素。
几种不同的B族维生素(包括B6、B9和B12)被认为对于血清素的产生和释放至关重要。在一些初步研究中,维生素缺乏症与认知结果不佳有关,尽管补充这些维生素是否对健康人类使用者具有直接的心理健康益处尚未完全确定。
6) 锌
根据一些早期研究,一些科学家认为锌可能靶向并激活血清素受体。根据对17项观察性研究数据的一项荟萃分析,据报道,与非抑郁个体相比,抑郁个体的血锌水平较低,这可能暗示了血清素相关机制。
另一项针对37名重度抑郁症患者的研究显示,连续12周每天补充25毫克锌可减轻抑郁症状。除了直接补充外,膳食锌还可以通过红肉、牡蛎、螃蟹、全谷物等几种常见食物获得。
7) 镁
研究人员推测,镁补充剂可能会通过增加大脑中血清素的可用性(减少再摄取)来提高血清素水平。
例如,根据一项初步研究,60名被诊断为轻度至中度抑郁症的患者每天补充500毫克镁(氯化镁)8周,可显著改善抑郁症状。据报道,这种镁治疗对焦虑症状也有显著的效果。
8) 肌醇
来自细胞和动物研究的一些早期证据表明,“类维生素”化合物肌醇可能会增加血清素受体的敏感性 。
由于其与大脑血清素系统的相互作用,一些研究人员提出,肌醇的作用可能类似于常见的血清素靶向抗抑郁药物(例如选择性血清素再摄取抑制剂 SSRI)。
根据一项针对30名患有经前综合症相关情绪障碍症状的女性的研究,据报道,在六个月经周期(约6个月)内使用肌醇治疗可减轻情绪症状并改善整体情绪。
虽然其中一些早期发现很有希望,但仍需要更多的研究来证实这些对人类的影响。
中枢血清素功能障碍与多种临床疾病的焦虑感、威胁感和不安全感增加有关。患有重度抑郁症和酒精依赖的患者中,焦虑与血清素转运蛋白可用性降低直接相关。由于威胁感和不安全感与特定性别的行为模式和荷尔蒙调节相互作用,冲动攻击可能是血清素能功能障碍的次要相关因素。在强迫症中,血清素周转率的增加而不是减少可能会干扰丘脑“噪声过滤器”和逆转学习期间的眶额功能,从而导致额-纹状体-丘脑神经回路过度激活和行为不灵活。
血清素功能障碍可能是由发育早期的社会压力因素引起的,并且似乎可以调节青少年和成年人以及非人类灵长类动物对压力和镇静药物。第一项表观遗传学研究表明,DNA 甲基化的改变可能导致五羟色胺转运蛋白基因(5-HTT) mRNA 转录减少,从而减少中枢血清素转运蛋白的表达。血清素系统的药物遗传学还需要考虑各种基因,尤其是 5-HTT、色氨酸羟化酶 2(TPH2)和A 型单胺氧化酶(MAO-A) 的基因,所有这些基因证明了功能上重要的多态性,并且发现或可能影响血清素的突触活性。这些超出了本章的范围,尽管读者需要记住它们与此处描述的血清素受体药物遗传学相互作用的潜力。
注意,血清素只是神经递质“单胺”家族的一员,该家族还包括其他主要神经递质,如去甲肾上腺素和多巴胺。研究人员目前认为所有这些神经递质共同作用来影响和调节情绪和神经疾病。
身体的所有细胞和器官,尤其是大脑,都受到血清素系统的影响。阳光的作用可能是帮助维持身心平衡。这与血清素参与人类体内平衡的观点是一致的并有助于心智的出现。
通过总结发现5-HT和其他系统建立的串扰对于每个系统都是特定的。这意味着药物作用机制的精确确定是极其复杂的,但它也代表了一个令人难以置信的来源,可以从中汲取灵感,为中枢神经系统疾病开发新的治疗策略。
主要参考文献:
Müller, C. P., & Cunningham, K. A. (Eds.). (2020). Handbook of the Behavioral Neurobiology of Serotonin. Volume 31.
Liu N, Sun S, Wang P, Sun Y, Hu Q, Wang X. The Mechanism of Secretion and Metabolism of Gut-Derived 5-Hydroxytryptamine. Int J Mol Sci. 2021 Jul 25;22(15):7931.
Li H, Wang P, Zhou Y, Zhao F, Gao X, Wu C, Wu T, Jiang L, Zhang D. Correlation between intestinal microbiotal imbalance and 5-HT metabolism, immune inflammation in chronic unpredictable mild stress male rats. Genes Brain Behav. 2022 Jul;21(6):e12806.
Kwon YH, Wang H, Denou E, Ghia JE, Rossi L, Fontes ME, Bernier SP, Shajib MS, Banskota S, Collins SM, Surette MG, Khan WI. Modulation of Gut Microbiota Composition by Serotonin Signaling Influences Intestinal Immune Response and Susceptibility to Colitis. Cell Mol Gastroenterol Hepatol. 2019;7(4):709-728.
Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell. 2015 Apr 9;161(2):264-76.
Wu L, Ran L, Wu Y, Liang M, Zeng J, Ke F, Wang F, Yang J, Lao X, Liu L, Wang Q, Gao X. Oral Administration of 5-Hydroxytryptophan Restores Gut Microbiota Dysbiosis in a Mouse Model of Depression. Front Microbiol. 2022 Apr 28;13:864571.
Haq S, Wang H, Grondin J, Banskota S, Marshall JK, Khan II, Chauhan U, Cote F, Kwon YH, Philpott D, Brumell JH, Surette M, Steinberg GR, Khan WI. Disruption of autophagy by increased 5-HT alters gut microbiota and enhances susceptibility to experimental colitis and Crohn’s disease. Sci Adv. 2021 Nov 5;7(45):eabi6442.
Akram N, Faisal Z, Irfan R, Shah YA, Batool SA, Zahid T, Zulfiqar A, Fatima A, Jahan Q, Tariq H, Saeed F, Ahmed A, Asghar A, Ateeq H, Afzaal M, Khan MR. Exploring the serotonin-probiotics-gut health axis: A review of current evidence and potential mechanisms. Food Sci Nutr. 2023 Dec 7;12(2):694-706.
Guzel T and Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022 Mar 3;27(5):1680.
Kwon YH, Khan WI. Peripheral serotonin: cultivating companionship with gut microbiota in intestinal homeostasis. Am J Physiol Cell Physiol. 2022 Aug 1;323(2):C550-C555.

谷禾健康

癌症是重要的死亡原因之一,影响着全球至少数百万人。据世界卫生组织统计,发现全球范围内癌症负担正在迅速增加。
癌症的发展不仅仅是癌细胞的生长和增殖,其肿瘤微环境(TME)也与之共同进化,主要参与肿瘤的发生、发展、转移和治疗反应。
肿瘤微环境包含肿瘤细胞、肿瘤浸润免疫细胞、肿瘤相关其他细胞、细胞外基质、非细胞成分和非癌性宿主细胞,微生物群也是肿瘤微环境中的细胞成分之一,发挥着重要且不可替代的作用,因为微生物群落可以调节各种生物过程,包括细胞代谢、生理学和免疫反应等。
谷禾以前的文章曾多次讲述,肠道菌群与肿瘤尤其是胃肠道肿瘤的发生、发展密切相关。肠道微生物群可以通过调节细菌的特定生物活性代谢物来影响肠道微环境。例如短链脂肪酸(SCFA)作为肠道细菌发酵产生的典型代谢物,在肠道稳态和人体健康中发挥着关键作用。
短链脂肪酸可以调节能量代谢、增强肠道屏障并发挥抗炎作用。短链脂肪酸作为免疫功能的关键调节剂,可以调节T细胞、B细胞、巨噬细胞和其他免疫细胞。短链脂肪酸由于与G蛋白偶联受体(GPCRs)的结合或对组蛋白脱乙酰酶(HDACs)的抑制,可以影响免疫反应的信号转导途径,调节免疫相关炎症介质的释放,从而调节肿瘤免疫微环境。
近年来,短链脂肪酸对肿瘤微环境的影响被广泛研究。在结直肠癌和胰腺癌实验模型中,已证明丁酸盐可以增强CD8+ T细胞的抗肿瘤作用。此外,独特组成的微生物群可能还有助于诊断和定位恶性肿瘤,全面了解肠道微生物群及其代谢物与肿瘤微环境之间的相互作用有望成为诊断、治疗和预防肿瘤的新方法。
在本文中,我们(1)讲述了微生物群及其代谢物短链脂肪酸对肿瘤微环境和宿主免疫的影响;(2)短链脂肪酸在癌症发生、发展和治疗方面的相互作用;(3)介绍基于微生物群的癌症诊断和预后;(4)讨论了靶向微生物-短链脂肪酸轴调整肿瘤微环境以最大限度地提高癌症治疗效果的各种方法,包括粪便微生物移植、饮食调整和施用益生菌。这将为未来基于肠道菌群和肿瘤微环境的癌症靶向治疗奠定基础。
什么是肿瘤微环境?
肿瘤微环境(TME)是指肿瘤细胞及其周围的局部环境,包括周围的血管、免疫细胞、细胞外基质、细胞间信号分子等。
肿瘤细胞和肿瘤微环境之间永久的相互关系不仅为肿瘤细胞提供了生长和扩散所需的物质和信息,还显著影响肿瘤的发生、进展、转移和治疗反应。
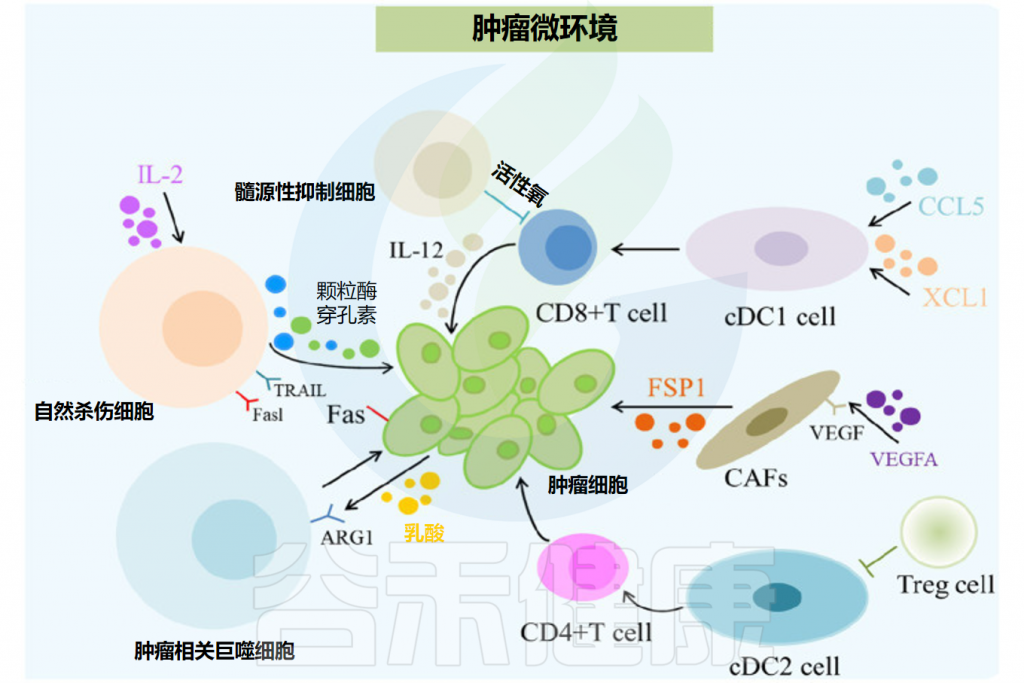
肿瘤微环境的组成部分
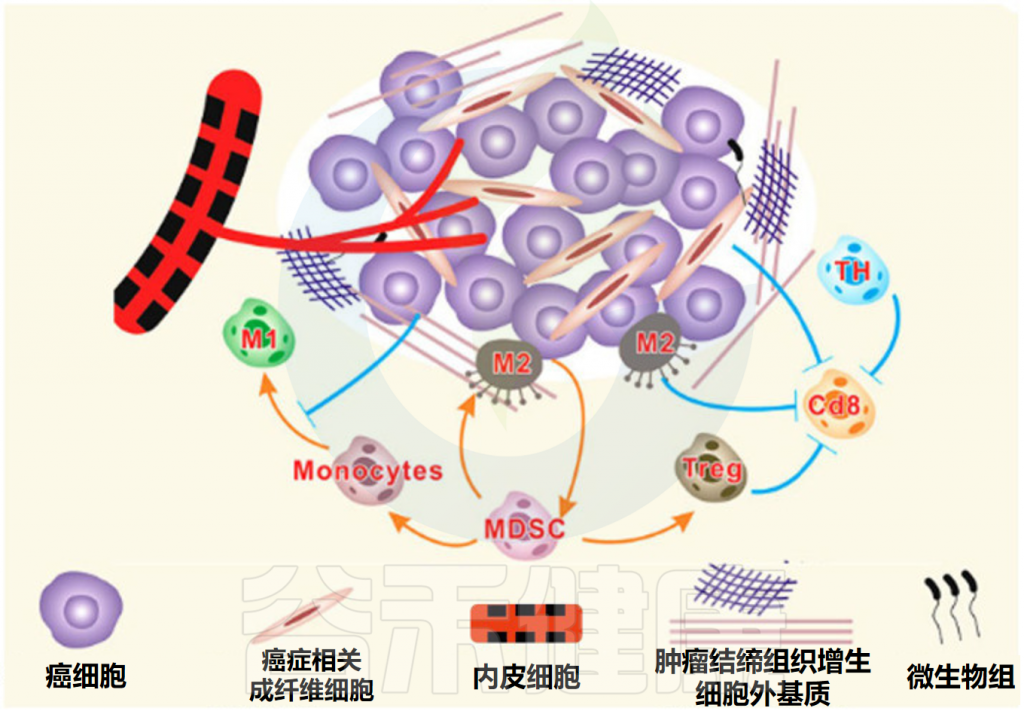
Feng P,et al.Front Microbiol.2024
▸ 前沿资料
最近,具有抗肿瘤能力的常规药物包括阿司匹林、塞来昔布、β-肾上腺素能拮抗剂、二甲双胍和他汀类药物,通过靶向肿瘤微环境成分显示出在联合治疗中的潜在用途。
★ 微生物群是肿瘤微环境的一个组成部分
肿瘤微环境是一个复杂的环境,其中微生物群被认为是一种新颖但必不可少的元素。微生物群在功能上减少肿瘤细胞代谢,例如炎症、基因毒素的产生以及具有各种特征的细菌代谢物的产生。
越来越多的证据表明,肿瘤微环境中微生物群及其代谢物之间的相互作用可以影响宿主免疫和肠上皮,最终驱动或抑制肿瘤生长。
研究报告称,肠道细菌可以调节人体免疫细胞的激活,使其迁移到肿瘤微环境来消除肿瘤细胞。此外,肠道微生物群和肿瘤微环境之间复杂的相互作用可能会使肿瘤细胞逃避免疫系统并增殖。了解这个系统将为癌症的预防、诊断和治疗带来希望。
肿瘤微环境在癌症免疫治疗中的作用
肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAM)和其他免疫抑制细胞的大量积累对癌症的进展和治疗效果有重要影响。
★ 肿瘤微环境的免疫细胞影响癌症进展和治疗效果
CD163是一种标志物,主要表达在巨噬细胞表面,尤其是在肿瘤相关巨噬细胞(TAM)上。CD163阳性的TAM在肿瘤微环境中的高表达与免疫抑制环境的形成有关,这种环境可以促进肿瘤的生长和扩散,并且与病人的不良临床结果相关。
当CD163+ TAM的消耗导致免疫抑制减少,意味着通过减少这些免疫抑制性的巨噬细胞,可以增强细胞毒性T细胞(CTLs)的浸润和活性,从而有助于控制肿瘤的发展。这是当前癌症免疫治疗研究的一个重要方向,即通过调节肿瘤微环境中的免疫细胞组成来增强机体对肿瘤的免疫反应。
简而言之,CD163阳性的表达通常与肿瘤微环境中的免疫抑制状态相关,通过靶向这些细胞,可以改善免疫系统对肿瘤的攻击能力,为癌症治疗提供新的策略。
Feng P,et al.Front Microbiol.2024
★ 非细胞成分也调节癌细胞的增殖和治疗效果
肿瘤微环境的非细胞成分对于癌症进展、侵袭性和化疗耐药性也至关重要。细胞外基质的硬度促进肿瘤细胞存活和增殖,同时上调整合素信号传导。
透明质酸是一种CD44受体,在各种癌症的肿瘤微环境中含量丰富。它们的相互作用激活促癌信号通路并诱导非编码RNA种类的上调,例如miR-10b/miR-302/miR-21和lncRNA。在胰腺癌中,间质与不同的透明质酸高度反应,导致间质液压力升高,从而导致血管塌陷和化疗效果不佳。
注:使用重组透明质酸酶靶向胰腺肿瘤中的酶已被证明可以降解透明质酸并通过减少转移和提高生存率来增强治疗效果。
此外,肠道菌群的分泌成分也与肿瘤微环境有关。例如,外膜囊泡(OMV)可以将肿瘤微环境重新编程为pro-TH1模式,而代谢物(如丁酸盐和烟酸)可以介导结肠上皮中IL-18的Gpr109a依赖性诱导,抑制结肠炎和结肠癌症。
肠道微生物群对肿瘤微环境的影响
肠道微生物群对于宿主免疫系统的发育、维持和生长至关重要。肠道生态系统可以通过影响骨髓的流入、免疫环境、淋巴细胞以及炎症和代谢模式来影响局部和远处的肿瘤。
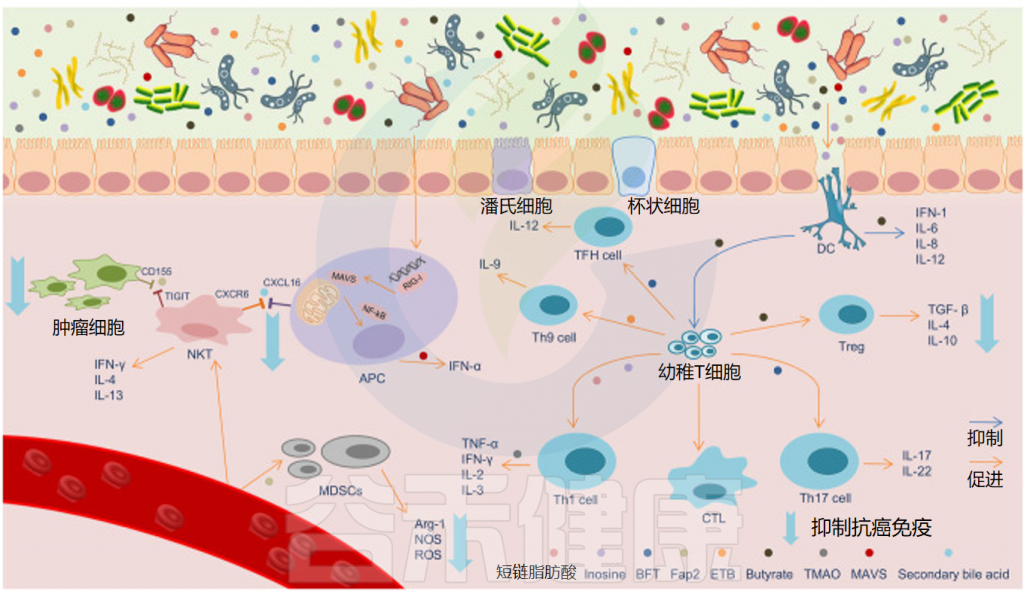
肠道微生物群参与多种细胞内信号通路的调节
Sun J,et al.ISME J.2023
★ 肠道微生物群是肿瘤微环境的重要调节剂
肠道微生物群正在成为结直肠癌、胃癌和肝癌等各种癌症中肿瘤微环境的关键调节剂。例如,之前的一项研究报告称,具核梭杆菌(Fusobacterium nucleatum)等细菌可以通过抑制人类免疫反应来增强肿瘤生长。
此外,乳腺癌和卵巢癌与微生物群中的特定生物特征有关,例如卷曲乳杆菌(Lactobacillus crispatus)的丰度,它与癌症的发生呈负相关。
★ 肠道微生物群的代谢物影响肿瘤治疗
先前的研究发现,肠道微生物群代谢活动的产物显著影响与肥胖、血脂和能量稳态相关的宿主代谢途径。因此,揭示肠道微生物群的代谢物和亚代谢物如何影响免疫细胞并重塑肿瘤微环境可以极大地促进肿瘤治疗的发展。
肠道微生物群的代谢物进入宿主细胞并与人体免疫反应相互作用,促进各种肿瘤抑制和免疫调节分子的产生。它们还通过维持上皮屏障和肠道的完整性来抑制炎症。
肠道微生物代谢物,如短链脂肪酸和肌苷,直接或间接与肿瘤微环境相互作用,重塑它,从而影响癌症过程。短链脂肪酸有助于维持肠道稳态和调节肠道屏障功能。
肠道微生物代谢物影响抗癌免疫
Sun J,et al.ISME J.2023
此外,一些脂肪酸和胆酸与炎症有关。丁酸盐等短链脂肪酸可由普拉梭菌(Faecalibacterium prausnitzii)产生,控制血管生成并减少促血管生成因子的表达。因此,增加丁酸盐浓度被认为可以减缓并阻止癌症的生长。
相反,脱氧胆酸和石胆酸可通过增加活性氧的产生而导致DNA损伤。最近的研究表明,肠道细菌假长双歧杆菌(B.pseudolongum)可以产生肌苷,在外源IFN-g存在的情况下驱动Th1细胞分化。
★ 影响免疫治疗的效果
此外,假长双歧杆菌(B.pseudolongum)通过与T细胞上的腺苷A2A受体相互作用,与免疫检查点治疗(例如抗CTLA-4和抗PD-L1)的反应相关。
CTLA-4和PD-L1是免疫检查点疗法的主要靶点,该疗法涉及膜结合分子,这些分子在初始刺激后会阻碍不受限制的T细胞反应。因此,癌细胞可以通过利用这种机制来逃避免疫监视。
然而,在重新激活低效T细胞的同时,免疫检查点抑制剂(ICIs)可以恢复对肿瘤抗原的反应。临床研究和临床前试验表明,肠道微生物群影响免疫检查点抑制剂的疗效,从而解释了患者对ICI反应的显著差异。因此,深入了解肠道微生物群、其代谢物和宿主免疫系统如何相互作用以重塑和调节肿瘤微环境,有望推动癌症免疫治疗的发展。
总体而言,肠道微生物群对肿瘤微环境的影响很复杂,目前尚未完全了解。然而研究表明,在控制肠道微生物以影响癌症治疗的有效性和改善患者预后方面具有潜在的应用前景。
近年来,微生物和微生物的代谢产物对宿主的影响越来越受到人们的关注。
短链脂肪酸由少于6个碳原子组成,是共生细菌通过膳食纤维在胃肠道中发酵产生的典型代谢产物,已被广泛研究。短链脂肪酸的产生是一个复杂的过程,由多种细菌在结肠中进行。在所有短链脂肪酸中,乙酸盐、丙酸盐和丁酸盐最具代表性。
短链脂肪酸对人体的基本作用
• 提供能量
当短链脂肪酸产生时,第一个功能是作为底物提供能量。大多数短链脂肪酸通过两种转运蛋白被结肠细胞吸收:单羧酸转运蛋白1(MCT-1)和钠偶联单羧酸转运蛋白1(SMCT-1)。
短链脂肪酸通过MCT-1以H+依赖性电中性方式转移,而短链脂肪酸阴离子通过SMCT-1运输。
• 调节生理反应
除了为结肠细胞提供能量外,短链脂肪酸还通过血液运输到全身的各个组织和器官,然后通过两种主要机制调节生物反应。
一方面,短链脂肪酸会降低组蛋白去乙酰化酶(HDAC)的活性或表达,从而导致组蛋白乙酰化增加。据报道,HDACs的异常激活存在于多种类型的癌症中。
另一方面,短链脂肪酸与G蛋白偶联受体(GPCR)结合,主要针对GPR41(更名为游离脂肪酸受体(FFAR)3)、GPR43(更名为FFAR2)和GPR109A,发挥相应的信号级联效应。一些研究表明GPCRs的异常表达或活性参与多种肿瘤进展。
短链脂肪酸调节炎症反应的机制
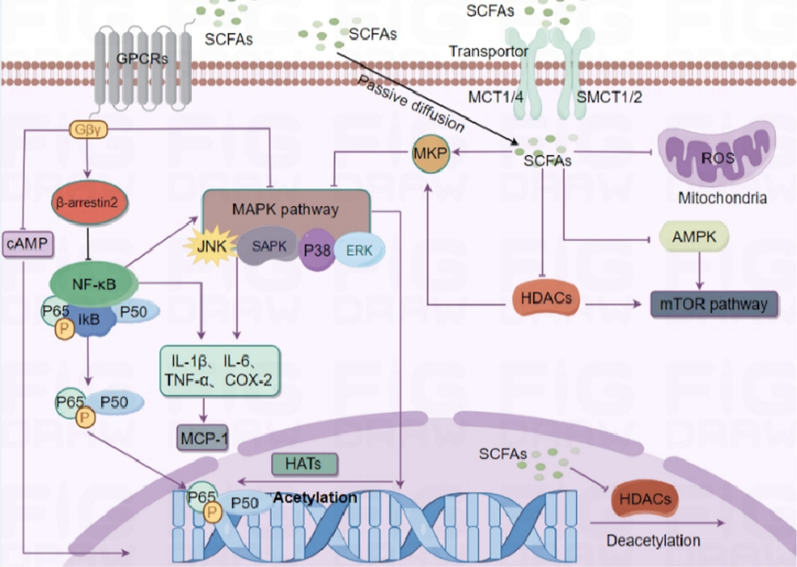
He M,et al.J Transl Med.2024
• 其他作用
既往研究总结了短链脂肪酸在调节能量代谢、保护肠道完整性、改善炎症反应等方面的作用,但短链脂肪酸对免疫系统的影响尚未引起足够的重视。一些作用罗列在下表中:


Dong Y,et al.Front Immunol.2023
短链脂肪酸对代谢稳态的影响
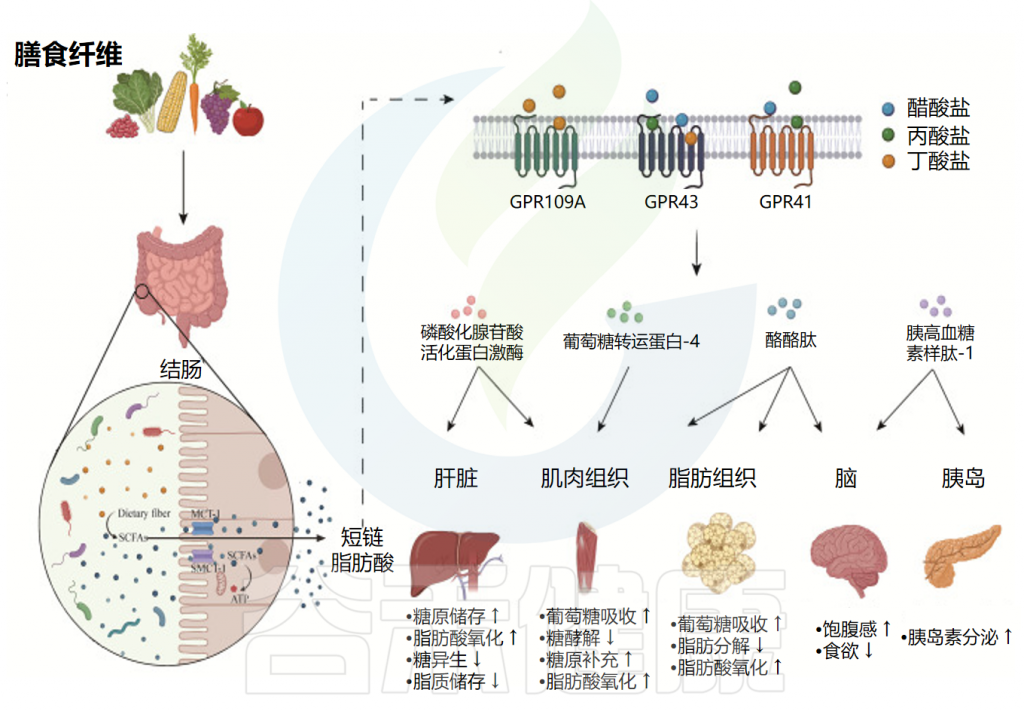
Dong Y,et al.Front Immunol.2023
在肿瘤免疫微环境中起重要作用
• 影响T细胞的分化
T细胞是肿瘤免疫微环境中的重要细胞,T细胞浸润减少或功能障碍会导致许多癌症治疗临床效果不佳。
由于幼稚T细胞在功能水平上表达时没有GPR41和GPR43,因此短链脂肪酸可以直接影响依赖于HDAC抑制剂活性的幼稚T细胞的分化。
通过这种方式,短链脂肪酸促进未成熟的CD4+ T细胞分化为不同的调节性T细胞和效应T细胞,这取决于不同的极化条件,比如细胞因子表型和免疫环境。
短链脂肪酸诱导mTOR-S6K和STAT3的激活,参与T细胞分化所需细胞因子的产生。无论极化条件如何,短链脂肪酸都会促进白细胞介素(IL)-10的表达,但只能在特定环境下促进IL-17或干扰素-γ (IFN-γ)的产生。
• 影响白细胞介素等细胞因子的含量
有趣的是,分化T细胞(例如辅助性T(Th)1细胞)中 IL-10的分泌取决于与GPR43的相互作用。此外,短链脂肪酸上调Blimp-1的表达,这与Th1细胞中IL-10的产生和T细胞功能的维持有关。
在高脂肪饮食治疗的小鼠中,IL-17和IFN-γ的水平升高,而转化生长因子-β(TGF-β)和IL-10的水平降低。这意味着T细胞向Th17和Th1细胞的分化程度较高,而向调节性T(Treg)细胞的分化程度较低,特别需要注意的是:短链脂肪酸可以扭转这种情况。
CD4+ T细胞和先天淋巴细胞中IL-22被发现可以通过短链脂肪酸进行调节。丁酸盐通过与GPR41结合增加转录因子HIF-1α和AhR的表达,同时伴随着STAT3和mTOR的激活。
同时,丁酸盐促进的HIF-1α与IL-22启动子的HRE结合涉及组蛋白乙酰化。CD4+ T细胞分化过程也受到表观遗传调控。不同的CD4+ T细胞亚群具有特定的转录因子,例如Th1细胞的T-bet、Th17细胞的RORγT和Treg细胞的FOXP3。丁酸盐通过乙酰化 H4K16增加分化的Th17细胞中RORγT的表达,但在Th17极化条件下对初始CD4+ T 细胞没有反应。
• 短链脂肪酸在抗肿瘤免疫中的其他作用
丁酸盐
低丁酸盐浓度以TGF-β1依赖性方式促进CD4+ T细胞向Foxp3+ Treg细胞分化,而高丁酸盐浓度无论在什么条件和亚群中都会诱导T-bet表达和IFN-γ释放。这似乎打破了我们对短链脂肪酸对粘膜免疫影响的传统认识。更重要的是,暴露于高浓度的短链脂肪酸,尤其是丁酸盐,可以抑制肠粘膜中CD4+ T细胞和其他CD4+ T细胞亚群的增殖和活化。这与组蛋白乙酰化和GPR43激活密切相关。
丁酸盐通过促进CD8+ T细胞作用参与抗肿瘤免疫。丁酸盐处理的细胞毒性T淋巴细胞(CTL)介导的抗肿瘤反应的促进作用依赖于一种称为ID2的转录调节因子,其水平在肿瘤微环境中的CD8+ T细胞中要高得多。丁酸通过抑制组蛋白脱乙酰酶(HDACs)的活性,诱导ID2表达并启动ID2-IL-12信号通路,从而提高奥沙利铂的化疗效果。
戊酸盐
戊酸通过抑制HDAC活性来增强CTL中IL-2、肿瘤坏死因子-α(TNF-α)、IFN-γ和其他效应分子的表达。
PVR/CD155 调节剂在恶性肿瘤中过度表达,并与具有Ig和ITIM结构域的T细胞免疫受体结合,介导免疫逃逸。
乙酸盐、丙酸盐
醋酸盐通过抑制PI3K/AKT通路抑制PVR/CD155水平,增强CD8+ T细胞的抗肿瘤能力。活化的γδ T细胞是IL-17的主要内源性来源。丙酸盐还通过抑制HDAC来抑制人γδ T细胞中IL-17、IL-22和其他细胞因子的分泌,从而防止癌症进展。
短链脂肪酸对肿瘤免疫微环境的影响
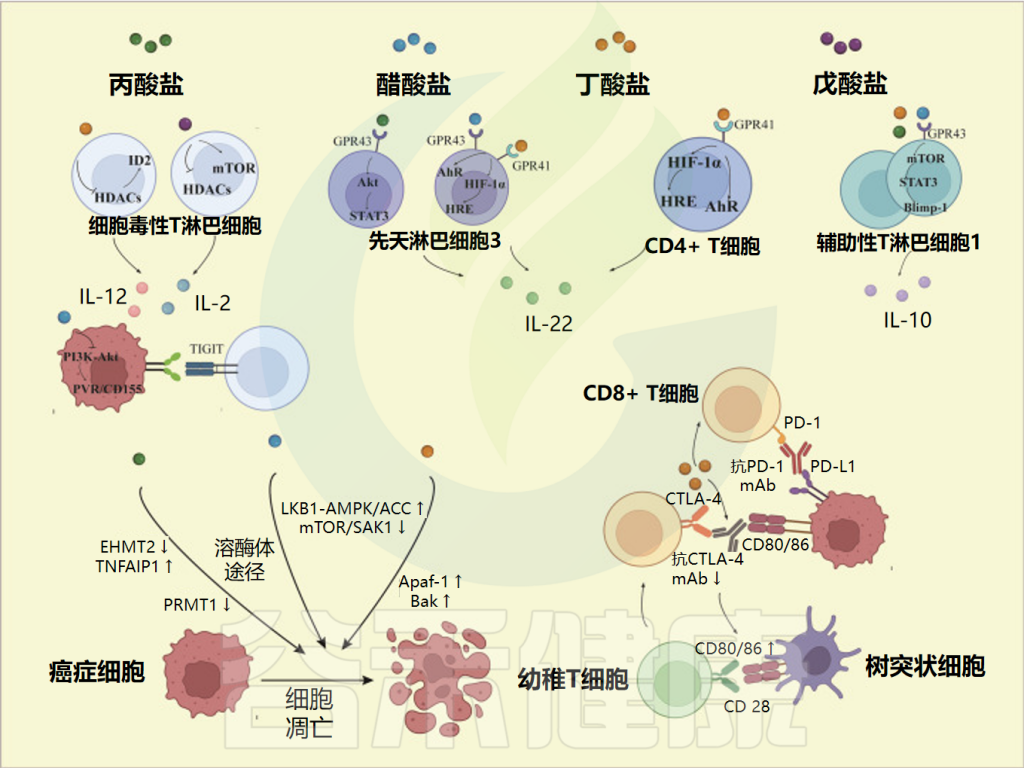
Dong Y,et al.Front Immunol.2023
密切相关的证据
实验研究和谷禾检测数据发现胃肠道肿瘤患者中短链脂肪酸和产生短链脂肪酸的细菌丰度明显较低,本节主要讲述短链脂肪酸可以通过多种机制影响胃肠道肿瘤的发展。而这也有助于未来将调节体内短链脂肪酸和肠道菌群的水平用作一种预防癌症或辅助治疗手段。
胃癌
• 短链脂肪酸可能用来评估胃癌的进展
在胃肠道化生或胃癌患者的血浆中检测到较低浓度的丙酸盐和丁酸盐。短链脂肪酸似乎可以用来评估胃癌的进展。
胃肠化生是指胃黏膜上皮转变为含有杯状细胞的肠黏膜上皮组织。肠上皮化生常见于慢性萎缩性胃炎,胃黏膜肠上皮化生属于胃的癌前病变。
此外,丁酸盐以剂量依赖性方式抑制KATO III细胞的增殖和迁移,这与其调节miRNA调控网络的作用有关。
• 影响胃癌治疗的效果
胃切除术后服用丁酸梭菌(C.butyricum)可以增加短链脂肪酸浓度,增强免疫力,减轻炎症,预防术后并发症。
体内实验证明,醋酸盐诱导胃癌细胞凋亡,随后体外实验证明氧化应激发挥了重要作用。大量摄入醋酸盐会增加胃癌细胞中活性氧的产生和MCT1的表达。
活性氧的过度表达上调了HCP1,两者均导致胃癌细胞对卟啉的摄入量增加。作为光动力疗法的光敏剂,卟啉的过度吸收增强了疗效。而作为HDAC抑制剂,丁酸盐修饰肿瘤抑制基因Per1和Per2并诱导它们在KATO III和NCI-N87中的表达。
与短链脂肪酸联合使用的传统疗法似乎具有更好的效果和更低的毒性。在裸鼠异种移植肿瘤模型中,丁酸盐-顺铂治疗抑制胃癌细胞的生长、迁移和侵袭,并依靠线粒体凋亡途径加速细胞凋亡。
此外,单独丁酸可以通过线粒体途径诱导胃癌细胞凋亡,这已在人细胞系BGC-823和SGC-7901中得到证实。
结直肠癌
先前的研究表明,结直肠癌高危人群中乙酸盐、丙酸盐和丁酸盐的浓度显著降低,并且短链脂肪酸水平较低的个体结直肠癌的发病率高于健康个体。各种短链脂肪酸均表现出抗癌行为。
注:与单独治疗相比,这些化合物具有叠加效应。
1
乙酸盐
•常规浓度下乙酸会增强癌细胞的凋亡并减少增殖
乙酸可以增强癌细胞的凋亡并减少增殖,已在不同的结直肠癌细胞系中得到证实,因此它已成为结直肠癌治疗的关键因素。
在结直肠癌患者中,短链脂肪酸减少,乙酸盐代谢转化为乙酰辅酶A。过去的研究表明,乙酸盐介导的细胞凋亡依赖于部分溶酶体膜透化触发的溶酶体途径。然而,溶酶体依赖性选择性死亡途径中随后释放的组织蛋白酶D降低了乙酸盐的敏感性。因此,组织蛋白酶D抑制剂与乙酸盐联合可能比单独使用乙酸盐效果更佳。
•注意:在缺乏氧气和葡萄糖的情况下乙酸盐可能导致癌细胞增加
然而,在没有氧气的情况下,乙酸盐会增加癌细胞的增殖,这依赖于ACSS2的上调和HIF-2的激活。
同时,在葡萄糖缺乏的情况下,乙酸盐通过激活 ACSS2/HIF-2 信号通路促进HCT-116(结肠癌细胞)和HT-29(结肠癌细胞)衍生肿瘤的生长。
因此,乙酸盐的抗癌作用可以根据环境和浓度的变化而改变。
此外,乙酸盐作为PI3K/AKT信号驱动的免疫检查点配体PVR/CD155的调节剂,可以增强肿瘤微环境中CD8+ T细胞的功能反应,促进IFN-γ的产生,有望成为促进肿瘤免疫的相关药物。基于上述讨论,免疫检查点抑制剂(ICIs)的功效可能受益于乙酸盐。
2
丙酸盐
研究发现结直肠癌组织中丙酸盐含量降低,并且向SW480细胞(人结肠腺癌细胞)中添加丙酸盐显著抑制癌细胞生长。
•丙酸盐调节免疫刺激来消灭癌细胞
短链脂肪酸调节免疫刺激和抑制配体,并参与免疫细胞介导的杀伤。丙酸盐诱导的NKG2D配体MICA/B的上调既不依赖于HDACs的抑制,也不依赖于GPR41/GPR43受体的组合,而是依赖于线粒体活性,而丁酸盐则取决于其HDACs抑制剂活性。丙酸盐的这种作用与介导肿瘤抑制蛋白p21表达的PEPCK-M酶和mTORC2/PDK1/AKT通路密切相关。
•丙酸盐通过调节表观遗传导致癌细胞凋亡
除了免疫调节之外,表观遗传调节也是短链脂肪酸发挥抗癌作用的一个有前景的靶点。丙酸盐通过阻止p70 S6激酶磷酸化导致PRMT1表达下调,从而导致结直肠癌细胞选择性死亡。
此外,丙酸盐诱导HECTD2上调,导致EHMT2降解,从而促进下游TNFAIP1的表达并最终促进癌细胞凋亡。
在丙酸盐介导的抗癌治疗中,表观遗传修饰是不可忽视的。然而,最新的孟德尔随机化分析发现,没有强有力的证据证明粪便中丙酸盐浓度与结直肠癌风险之间的相关性。可能有必要全面检测短链脂肪酸及其产生细菌。
3
丁酸盐
研究发现,丁酸盐抑制结直肠癌细胞的增殖,但滋养正常结肠细胞的生长。
•丁酸盐相比其他短链脂肪酸对癌细胞具有更强的抑制作用
与其他短链脂肪酸相比,丁酸盐对结直肠癌细胞系具有更强的抑制作用。
一方面,丁酸可以抑制促炎介质TNF-α、IL-1β、IL-6、IL-8,上调抗炎因子IL-10;另一方面,丁酸可以通过促进CD8+ T细胞发挥作用来促进抗肿瘤免疫。
此外,丁酸盐通过促进上皮细胞增殖、增加粘液层和改善紧密连接来维持肠道屏障的完整性。
在HCT 116细胞(人结肠癌细胞)中,丁酸介导的细胞凋亡与p300-Wnt信号传导密不可分。其中,致癌Wnt信号基因表达模式下的结肠癌细胞比受体介导的Wnt信号基因表达模式下对丁酸盐更敏感。
•丁酸盐影响结直肠癌细胞周期从而促进凋亡
结直肠癌中肠道微生物群的结构和稳定性发生显著改变,并与其进展密切相关。丁酸盐的施用改善了微生态紊乱,反映在病原体减少、厚壁菌门与拟杆菌门的比例减少以及益生菌丰度增加。
与乙酸盐和丙酸盐相比,丁酸盐对结直肠癌细胞周期至关重要的调节网络具有更强的影响。丁酸调节癌症相关miRNA的表达,其中miR-139和miR-542是众所周知的代表。具体来说,它们作为丁酸盐的协作对象来调节细胞周期中的EIF4G2和BIRC5基因。
丁酸盐调节c-Myc/p21通路,诱导细胞周期停滞在G2期,其中包含27个凋亡相关基因。此外,丁酸盐在G1期触发细胞周期阻滞,需要复杂的lncRNA-miRNA-mRNA调控网络。
补充丁酸盐可逆转CSE1L的过度表达,并似乎与p53表现出协同作用,最终将癌细胞抑制在G1和G2/M期。
同时,丁酸诱导的p21和γ-H2AX增加以及细胞周期蛋白B1减少导致细胞周期停滞在 G2/M 期。
•丁酸盐抑制癌细胞的迁移
不仅如此,丁酸盐还通过上调miR-200c并抑制其直接靶点BMI-1对癌细胞迁移产生抑制作用。
BMI-1是诱导依赖于AKT/GSK-3β/snail通路的上皮间质转化(EMT)驱动癌症转移的重要调节因子,丁酸盐阻止了BMI-1的作用。
丁酸盐处理还降低了结直肠癌细胞而非正常结肠细胞中Trx-1的表达。研究证明,Trx-1与S100P的相互作用通过AKT介导的S100A4上调促进EMT。通过施用丁酸盐,类器官证明细胞外基质-整合素/PI3K-Akt 轴参与结直肠癌细胞形态变化和细胞凋亡。
丁酸盐阻止结直肠癌细胞的迁移和侵袭,本质上是由于组蛋白脱乙酰酶(HDAC3)的抑制,从而阻断了AKT1和ERK1/2的激活。
•丁酸盐还改变表观遗传和代谢发挥抗癌特性
与其他短链脂肪酸不同,丁酸盐逆转前列腺素EP4受体的过度表达和环氧合酶2的产生,以减少从正常细胞到癌症的表型改变。
此外,丁酸盐通过激活LKB1-AMPK/ACC信号通路和降解β-catenin诱导结直肠癌细胞自噬。
丁酸盐致力于改变结直肠癌细胞的表观遗传学和代谢谱,发挥其抗癌特性。通过调节KEAP1的DNA甲基化,丁酸阻断NRF2-ARE信号传导,从而增强其抗癌潜力。
线粒体代谢和相关代谢物的变化参与了丁酸盐对表观遗传学的调节。丁酸激活三羧酸循环相关酶IDH1和PDH,从而下游产物α-KG水平升高。
作为一种信号分子,α-KG影响与细胞凋亡相关的MSH2和MLH1去甲基化。同时,α-KG减弱DNA和组蛋白H3K4me3的甲基化,导致结直肠癌中Wnt信号通路受到抑制。
丁酸盐通过促进PKM2的四聚化和去磷酸化来诱导有氧糖酵解的抑制,从而逆转癌细胞中的代谢优势。对于结直肠癌细胞,丁酸盐引起的代谢变化反映在促进氧化代谢而不是糖酵解。
此外,铁死亡是铁依赖性细胞程序性死亡的方式,丁酸盐通过CD44/SLC7A11信号通路诱导结直肠癌细胞中的铁死亡。
肝细胞癌
肝细胞癌是一种发生于肝脏的恶性肿瘤,它是全球范围内最常见的癌症类型之一。作为一个重要的危险因素,乙型肝炎病毒(HBV)会促进肝细胞癌(HCC)的进展。
• 丁酸盐促进肝癌细胞的凋亡和自噬
丁酸盐通过抑制SIRT-1从而促进p53乙酰化,显著抑制人肝癌细胞(Hep G2.2.15)的增殖和驻留乙型肝炎病毒的复制。
HBx是乙型肝炎病毒(HBV)编码的致癌蛋白,可能通过多种方式导致肝细胞癌的加速发生和发展。随着HBx相关途径的下调,短链脂肪酸导致肿瘤抑制因子DAB2的表达增加,从而延缓肝细胞癌的进展。
先前的研究表明,丁酸盐通过增加活性氧的产生来抑制AKT/mTOR通路,从而促进人肝癌细胞的凋亡和自噬。
• 短链脂肪酸延缓了肝癌进展
通过粪便罗伊氏乳杆菌(Lactobacillus reuteri)移植进行干预的肝细胞癌小鼠似乎也可以延缓癌症进展。相关机制是罗伊氏乳杆菌代谢产生的乙酸盐通过抑制HDAC和诱导Sox乙酰化,抑制先天淋巴细胞的效应分子IL-17A的产生。
另外,PD-1抑制剂与短链脂肪酸联合使用,在肝癌小鼠中显示出增强的抗肿瘤作用。Lachnospiracea具有减少肝纤维化的作用,部分原因是短链脂肪酸介导的。
已证明口服短链脂肪酸可以抑制万古霉素治疗的小鼠纤维化。
• 增强常规化疗药物的效果
此外,丙酸盐可以增强常规化疗药物在肝细胞癌中的化疗效果。研究表明,丙酸盐通过激活GPR41诱导TNF-α表达,并增加顺铂诱导的caspase-3激活,从而介导肝癌细胞凋亡。
肝细胞癌患者体内丁酸产生菌16s RNA表达降低,补充丁酸可促进肝癌细胞凋亡并抑制增殖。更重要的是,丁酸盐可以增强索拉非尼的治疗潜力,通过减少HK2对c-myc信号传导的依赖,丁酸盐可以抵抗糖酵解,从而增强索拉非尼的功效。
对于接受仑伐替尼治疗的肝细胞癌患者,无腹泻等不良反应的患者丁酸代谢相对丰富且活跃。最新研究表明,补充乙酸盐可以诱导人肝癌细胞中NAT2的水平,类似于葡萄糖和胰岛素,从而导致代谢相关基因的变化。
不仅如此,丁酸盐在胆管癌细胞中也表现出同样的抗癌作用。丁酸盐和HDAC6抑制剂在防止增殖、迁移和上皮间质转化方面具有协同作用。
• 短链脂肪酸改善一些癌前病变症状
酒精性脂肪肝病(AFLD)和非酒精性脂肪肝病(NAFLD)可进展为肝硬化,最终可能发展为肝癌。丁酸盐抑制gasdermin D 介导的细胞焦亡,改善肠道屏障破坏和内毒素血症,从而减轻AFLD中的肝脏脂肪变性和炎症。
此外,丁酸盐通过LKB1-AMPK-Insig信号通路的调节诱导肝脂质谱的改变并减轻肝脂肪变性来治疗 NAFLD 。
总而言之,短链脂肪酸限制了肝细胞癌前阶段的进展。
胰腺癌
研究发现,与对照组相比,胰腺癌患者的丙酸盐和丁酸盐水平降低,粪便微生物群的组成发生改变。
• 短链脂肪酸增强了对肿瘤细胞的杀伤能力
短链脂肪酸以肿瘤特异性免疫细胞为目标,无论单独使用还是与其他肿瘤疗法联合使用,都显示出强大的抗癌作用。
研究表明,与组蛋白脱乙酰酶(HDACs)抑制相关,丁酸和戊酸上调IL-2、CD25和mTOR的产生,这些物质参与T细胞激活的调节。通过触发增强的效应分子,丁酸盐和戊酸盐还增加了细胞毒性T淋巴细胞的肿瘤杀伤能力。
短链脂肪酸在过继性免疫治疗方面也显示出良好的前景。用丁酸盐或戊酸盐预处理的细胞在胰腺癌小鼠模型中显示出更好的治疗效果。
• 短链脂肪酸干扰胰腺癌的进展并减轻相关损伤
另一项研究表明,丁酸盐通过逆转胰腺腺癌患者的CD11b细胞的免疫抑制功能并增强CD8+ T细胞的免疫功能来延缓癌症的发展。
短链脂肪酸的影响不仅限于肿瘤微环境,还延伸至肿瘤相关基因。丁酸盐处理后,在AsPC-1细胞(人转移胰腺腺癌细胞)中可以观察到通过抑制组蛋白脱乙酰酶(HDACs)活性介导的p16INK4a、p14ARF和p15INK4b的上调。
在BxPC-3(人原位胰腺癌细胞)和PANC-1(胰腺癌细胞)细胞系中,丁酸盐单独或与吉西他滨联合使用可抑制增殖并诱导细胞凋亡。特别是联合用药减轻了吉西他滨引起的胃肠粘膜、肝、肾损伤。由于HDAC的抑制作用,丁酸盐还调节肿瘤微环境相关成分。
拓展:基于微生物群的癌症诊断和预后
癌症通常是在通过触诊或成像技术识别肿块后进行诊断,然后进行活检以确认细胞恶性肿瘤。断层扫描检测技术,包括PET-CT、MRI和CT,可以有效地识别体内的宏观病变。
基于微生物的癌症诊断
此外,研究已经证实,肠道微生物群动态可能有助于诊断和定位恶性肿瘤,例如根据胃肠道来源的解没食子链球菌菌血症。大多数基于微生物的癌症诊断侧重于对呼吸消化道内的肿瘤进行测序,包括结直肠癌、胰腺癌和肺癌。
有人提出,不同的癌症类型可能在呼吸消化道外具有独特组成的微生物群。一项研究了30多种癌症的瘤内微生物群,应用基于血液的诊断,并提供七种不同癌症中微生物瘤内空间分布和细胞内定位的视觉证据。
2017年的一项研究提出了结直肠癌粪便微生物组的宏基因组分析,以识别和验证不同种族群体中的细菌生物标志物。这项研究纳入了来自中国、丹麦、法国和奥地利的结直肠癌患者和对照样本,并强调了粪便宏基因组生物标志物在早期结直肠癌诊断中的潜力。
此后,更多的研究发现,粪便微生物DNA标记可以单独或与粪便免疫化学测试结合使用,作为新的测试来筛查无症状受试者的结直肠肿瘤。
此外,收集了41名肺癌患者和40名健康志愿者的粪便样本,并使用16S rRNA基因测序分析了肠道微生物群。他们发现, 肺癌患者中的放线菌属(Actinomyces)、韦荣球菌属(Veillonella)、巨球菌属(Megasphaera)、肠球菌属(Enterococcus)和梭菌属(Clostridioides)比健康个体更丰富。他们进一步证明肠道微生物及其相关代谢物是肺癌的潜在生物标志物和治疗靶点。
检查肠道微生物群的变化及其作为胰腺癌患者生物标志物的潜力。他们比较了患有癌前病变的胰腺癌患者、非酒精性脂肪肝患者和健康对照者的微生物群,发现了与胰腺癌相关的独特肠道微生物群特征。
主要特征是梭菌科、毛螺菌科的存在,瘤胃球菌科的缺乏,以及韦荣球菌科、阿克曼氏菌和Odoribacter的过度增加。
目前,已经开发了几种基于细菌的肿瘤检测策略,包括使用将肿瘤靶向细菌的特异性与生物标志物检测的敏感性相结合的工程细菌。使用远程诱导基因开关对减毒细菌进行工程改造,释放外源报告蛋白 ZsGreen。
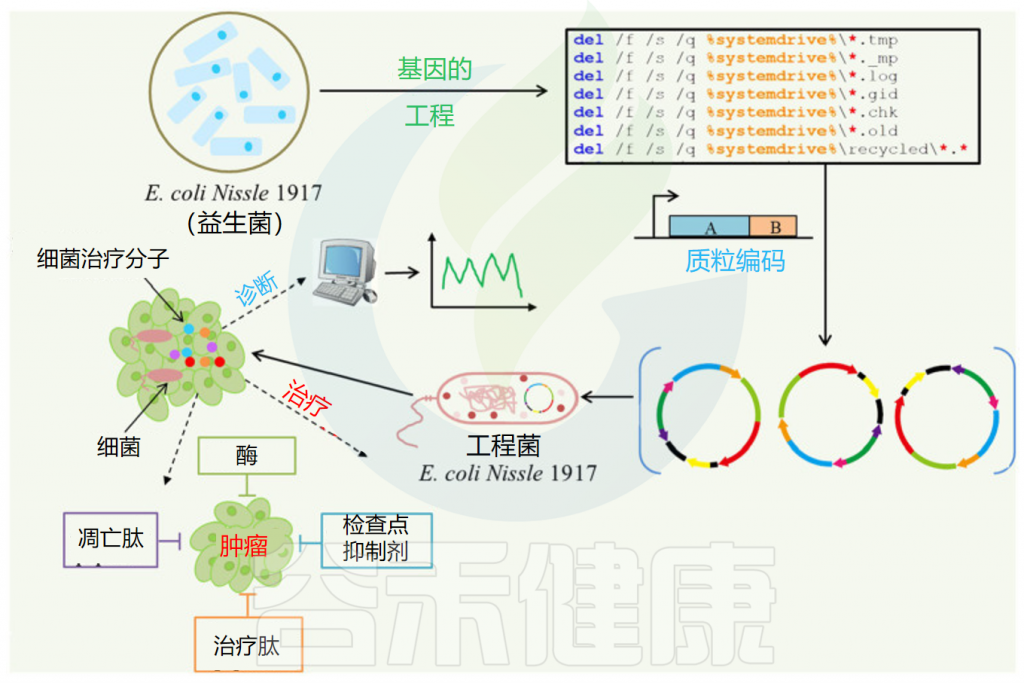
Feng P,et al.Front Microbiol.2024
体内和体外实验均表明,这些细菌可以通过对释放的ZsGreen的系统测量来识别肿瘤。尽管基于细菌的癌症诊断是一种有前景的策略,但它面临着一些挑战,例如相对于宿主的生物量较低以及试剂或环境污染物的干扰。因此,将基于肠道微生物群的方法与传统诊断技术(包括基因组测序、qPCR、免疫组织化学和电子显微镜)相结合,可以提供更准确、更有效的癌症诊断。
基于微生物的癌症诊断已成为一个新领域,专注于根据各种癌症或不同肿瘤阶段肠道微生物群的特定生物特征来设计或开发新策略。此外,深度学习和机器学习算法能够识别表明癌症的微生物特征,这是精准医学的基础。基于微生物的癌症诊断还具有改善癌症筛查和早期检测工作的潜力,有望为各种癌症开发更准确、更有效的诊断工具,并最终改善患者的治疗结果。
肠道微生物群作为潜在预后标志物
在预后方面,许多研究表明肠道微生物群可以作为癌症的潜在预后标志物。在一项结直肠癌患者预后模型的研究中,风险模型与结直肠癌患者的免疫状态和肠道微生物群相关,并且微生物组分析显示,高风险患者中拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)的相对丰度低于低风险患者。
具核梭杆菌作为结直肠癌患者的预后标志物
研究发现肠道中高水平的具核梭杆菌(Fusobacterium nucleatum)和脆弱拟杆菌(Bacteroides fragilis)与结直肠癌患者术后预后不良相关。具核梭杆菌作为结直肠癌患者预后标志物的作用已被多次证明。
例如,收集了100个结直肠癌组织和72个正常粘膜组织,并确定具核梭杆菌水平有助于预测结直肠癌患者的临床结果,发现IV期结直肠癌患者具有较高水平的具核梭杆菌。
此外,研究证明特定的肠道微生物群与接受nabuliumab治疗的肝细胞癌患者的预后相关。具体而言,普雷沃氏菌/拟杆菌比率可用作纳武单抗治疗肝细胞癌的预后预测因子;该比率越高,疗效越好。
纳武单抗(nabuliumab)是一种人类免疫球蛋白G4单克隆抗体。纳武利尤单抗主要治疗三种疾病,包括非小细胞肺癌、头颈部鳞状细胞癌、胃或胃食管连接部腺癌。
治疗胃肠道肿瘤
微生物与抗癌疗法的结合早在19世纪就开始了,当时首次尝试将灭活的链球菌注射到人体肿瘤组织中来治愈癌症。此前的研究表明,微生物制剂直接注射到肿瘤组织或口服给药,可以对肿瘤细胞产生直接的细胞毒性作用或刺激机体局部抗肿瘤免疫反应。
最近的研究发现,传统的放疗、化疗和免疫疗法可以改变患者的肠道微生物群,而菌群的组成可以深刻影响这些治疗的疗效和副作用,包括癌症复发、耐药性和对肠道菌群的附带损害。
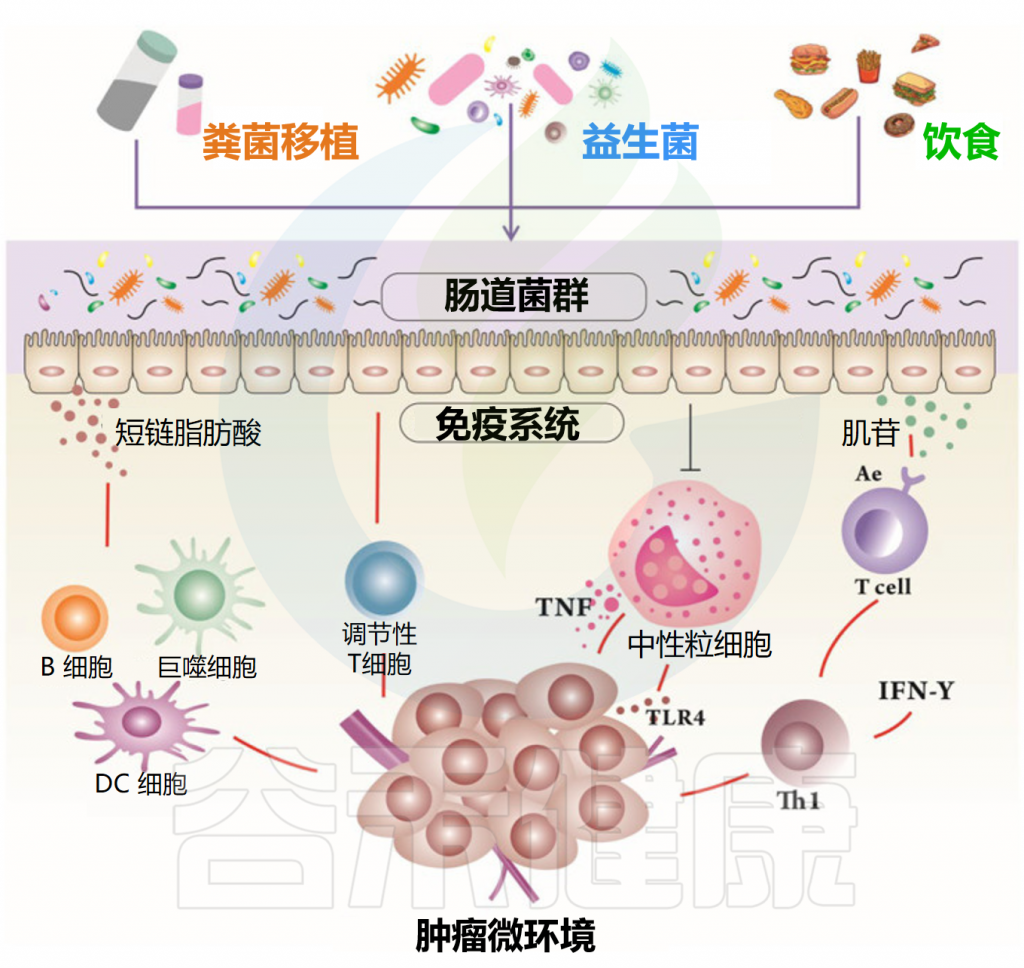
Feng P, et al.Front Microbiol.2024
施用益生菌
益生菌是一类存在于宿主体内并对宿主有益的细菌,给癌症患者服用益生菌的目的是重新激活患者受损的肠道微生物群,从而重建失败的共生微生物组的水平和功能。
益生菌在癌症辅助治疗中的作用


Sun J,et al.ISME J.2023
• 改善受损的肠道微生物群
益生菌还可以通过增加肠道微生物群的丰度、调节一些有助于产生致癌化合物的酶的活性以及改善肠道屏障来对抗胃肠道肿瘤。
23项随机对照试验表明,补充多种益生菌可改善结直肠癌患者的症状并提高生活质量,并减少传统治疗的不良反应。
• 增加短链脂肪酸的含量
增加短链脂肪酸的产量是一个关键途径。从人初乳中筛选出潜在益生菌唾液链球菌(Streptococcus salivarius),可抑制结直肠癌细胞增殖55%以上。唾液链球菌直接粘附并诱导癌细胞凋亡,促进短链脂肪酸的产生,并调节活化的B和T淋巴细胞。
丁酸梭菌(C.butyricum)依赖丁酸盐抑制胃肠道肿瘤的进展。C. butyricum调节Wnt/β-catenin的信号传导,减少高脂饮食诱导的结直肠癌,通过抑制NF-κB通路抑制结肠炎相关结肠癌,并增强免疫检查点抑制剂(ICIs)对肺癌的疗效。
一些产生短链脂肪酸的细菌有助于抗癌的例子
费氏丙酸杆菌(Propionibacterium freudenreichii)
通过产生作用于线粒体的丙酸和乙酸来诱导结直肠癌细胞的内在凋亡。
乳酸片球菌(Pediococcus acidilactici UAMS)是一种高产丁酸细菌,它能抑制人结肠癌细胞(HT29)和
SW480细胞(人结肠腺癌细胞)的增殖。
肠道Roseburia intestinalis、普拉梭菌(Faecalibacterium prausnitzii)、植物乳杆菌(Lactiplantibacillus plantarum)和Eubacterium callanderi也已被证明可增强结直肠癌中的抗癌免疫反应,同时产生丁酸盐。
用VSL#3益生菌治疗增加了丙酸盐和丁酸盐的水平,导致通过CCL20/CCR6轴募集Th17细胞,以减轻黑色素瘤的肺转移。鼠李糖乳杆菌GG ATCC 53103、罗伊氏乳杆菌DSM 17938、约氏乳杆菌LC1和其他益生菌不仅抑制结直肠癌细胞增殖,而且改善了化疗反应。
因此,补充益生菌可以在一定程度上增加短链脂肪酸,进而在癌症预防和治疗中发挥重要作用。
通过饮食成分改善
对于微生物群的组成和代谢功能,饮食可能是一种强大的调节剂。
• 摄入更多的膳食纤维可以降低结直肠癌等疾病的风险
膳食纤维作为短链脂肪酸的前体。研究证实,摄入更多膳食纤维可以降低患包括结直肠癌在内的多种疾病的风险。膳食纤维摄入量与患结直肠腺瘤和结直肠癌的几率之间存在统计学上显著且强烈的相关性。
作为代表性的膳食纤维,果胶显著增加了肠道微生物群的多样性,特别是产生丁酸的细菌,并促进肿瘤免疫微环境中的T细胞浸润,从而增强抗程序性死亡-1(抗PD-1)单克隆抗体(mAb)效果。
肥胖女性在一段时间内摄入富含菊粉和低聚果糖的混合物后,体内产生丁酸盐的细菌增多,还降低了餐后血糖水平。
• Omega-3等不饱和脂肪酸改善癌症治疗
Omega-3多不饱和脂肪酸(PUFA)人体不能合成,必须从食物中摄取,已被证明可以改善高脂血症、冠心病和动脉粥样硬化。每天服用更多的多不饱和脂肪酸时,可以观察到产生丁酸的细菌丰度增加。
与此同时,乳杆菌等益生菌增加,具核梭杆菌减少。研究表明,一些多不饱和脂肪酸可以辅助化疗药物5-氟尿嘧啶(5-FU)和奥沙利铂治疗结直肠癌并减少副作用。
• 益生元的摄入与结直肠癌呈负相关
益生元是不被宿主消化吸收、能选择性促进肠道内益生菌代谢和增殖的食物成分。常见的益生元包括菊粉、低聚果糖、半乳糖和一些藻类。益生元在癌症的发展中也发挥着重要作用。
最近进行的一项病例对照研究,包括1953名经组织学证实的结直肠癌患者和4154名对照者,发现结直肠癌风险与饮食中半乳糖摄入量呈负相关。
粪菌移植
除了补充益生菌、益生元外,粪菌移植也可能是增加短链脂肪酸、抵抗胃肠道肿瘤的一种选择。
• 粪菌移植有助于抗癌治疗的效果
在致癌物质诱导的常规小鼠或无菌小鼠中,来自结直肠癌患者的粪菌移植降低了肠道微生物群的丰富度并促进了胃肠道肿瘤的形成。
右旋糖酐硫酸钠或氧化偶氮甲烷的治疗可以在实验室小鼠中诱导结直肠癌,而从野生小鼠到实验小鼠的粪菌移植可以改善这一过程。
尽管没有临床证据表明粪菌移植可以直接治疗结直肠癌,但一项研究表明粪菌移植可以帮助提高化疗的疗效。将健康供体小鼠的粪便移植到FOLFOX治疗的小鼠体内,可以恢复FOLFOX治疗后破坏的肠道微生物群的组成,并减轻腹泻和肠粘膜炎症的严重程度。此外,粪菌移植通过增加微生物群多样性和调节免疫功能来增强抗PD-1治疗效果。
粪菌移植是塑造微生物组最直接的方式,通过粪菌移植直接增加产生短链脂肪酸的细菌,为胃肠道癌症的治疗提供了广阔的前景。
!
短链脂肪酸调节对化疗和免疫疗法的反应
短链脂肪酸还可以调节肿瘤对放化疗和免疫疗法的反应。临床研究发现,术前新辅助放化疗后,有反应的结直肠癌患者粪便中产生丁酸的细菌和短链脂肪酸水平比未接受治疗的患者更丰富。
• 丁酸盐协同增强抗癌作用
丁酸盐可作为奥沙利铂的增效剂,协同增强抗癌作用。丁酸盐通过调节CD8+ T细胞直接促进奥沙利铂的化疗疗效。
此外,与结直肠癌中无反应患者相比,有反应患者血清中的丁酸盐水平较高。与单独放疗相比,放疗-丁酸盐组合显著增强了抗癌效果。丁酸盐可以通过促进FOXO3A介导的转录来诱导细胞周期停滞,同时保护正常细胞免受辐射损伤。由于HDACs抑制剂已被证明可以增强放疗的敏感性,因此推测丁酸盐可能是因为抑制HDACs而增强了放疗的疗效。
丁酸盐还可以通过GPR109a-AKT信号通路增强5-氟尿嘧啶(5-FU)的功效。同时,短链脂肪酸降低了5-FU的促炎作用,并增加了粘膜中紧密连接蛋白的表达。
然而,产丁酸细菌的异常活性和患者体内过量的丁酸会导致对化疗药物的耐药性。结果表明,对丁酸盐具有抗性的结直肠癌细胞系表现出明显的化学抗性。
通过调节自身免疫细胞和免疫分子来靶向杀伤肿瘤细胞,同时减少对正常组织的损伤,已成为肿瘤免疫治疗的代表。
人类肠道微生物群在肿瘤生长、发展和治疗中发挥着关键作用。肠道菌群、宿主免疫系统和肿瘤之间的相互作用可以为调整肠道菌群以优化肿瘤微环境和增强癌症免疫治疗提供有价值的见解。
短链脂肪酸是肠道微生物群的重要产物,已被证明可以改变免疫细胞的分化和功能以及细胞因子的产生和释放,通过多种信号通路控制肿瘤的生长和转移并诱导细胞凋亡。此外,短链脂肪酸还有助于提高放疗和化疗的治疗效果,减少不良反应。
未来,个性化医疗可能会结合基于微生物组的诊断和治疗策略。以肿瘤免疫为目标,补充微生物源性 短链脂肪酸已成为诊断、治疗和预防肿瘤的新方法。可重点关注益生菌和粪便微生物移植以及合理的饮食,提高短链脂肪酸水平,调节胃肠道微生态,激活有效的抗癌作用。
主要参考文献
Feng P, Xue X, Bukhari I, Qiu C, Li Y, Zheng P, Mi Y. Gut microbiota and its therapeutic implications in tumor microenvironment interactions. Front Microbiol. 2024 Jan 23;15:1287077.
Dong Y, Zhang K, Wei J, Ding Y, Wang X, Hou H, Wu J, Liu T, Wang B, Cao H. Gut microbiota-derived short-chain fatty acids regulate gastrointestinal tumor immunity: a novel therapeutic strategy? Front Immunol. 2023 Apr 14;14:1158200.
Sun J, Chen F, Wu G. Potential effects of gut microbiota on host cancers: focus on immunity, DNA damage, cellular pathways, and anticancer therapy. ISME J. 2023 Oct;17(10):1535-1551.
He M, Wei W, Zhang Y, Xiang Z, Peng D, Kasimumali A, Rong S. Gut microbial metabolites SCFAs and chronic kidney disease. J Transl Med. 2024 Feb 18;22(1):172.
Hanus M, Parada-Venegas D, Landskron G, Wielandt AM, Hurtado C, Alvarez K, et al.. Immune system, microbiota, and microbial metabolites: The unresolved triad in colorectal cancer microenvironment. Front Immunol (2021) 12:612826.
Pansy K, Uhl B, Krstic J, Szmyra M, Fechter K, Santiso A, et al.. Immune regulatory processes of the tumor microenvironment under malignant conditions. Int J Mol Sci (2021) 22(24):13311.
Luu M, Riester Z, Baldrich A, Reichardt N, Yuille S, Busetti A, et al.. Microbial short-chain fatty acids modulate CD8(+) T cell responses and improve adoptive immunotherapy for cancer. Nat Commun (2021) 12(1):4077.
Kurokawa H, Ito H, Matano D, Terasaki M, Matsui H. Acetic acid enhances the effect of photodynamic therapy in gastric cancer cells via the production of reactive oxygen species. J Clin Biochem Nutr (2022) 71(3):206–11.
Marques C, Oliveira CS, Alves S, Chaves SR, Coutinho OP, Corte-Real M, et al.. Acetate-induced apoptosis in colorectal carcinoma cells involves lysosomal membrane permeabilization and cathepsin d release. Cell Death Dis (2013) 4:e507.

谷禾健康

一听到高脂饮食,很多人就会想到会增加患心脏病和其他慢性疾病的风险。然而,低碳水化合物、高脂肪的生酮饮食却在各个方面越来越受欢迎,从减肥到自身免疫疾病等。
生酮饮食的支持者认为,通过减少碳水化合物的摄入,可以帮助控制血糖和胰岛素水平,从而降低患糖尿病和肥胖的风险。甚至有人选择生酮饮食是为了提高生产力、精力和思维清晰度。
一些研究表明,生酮饮食可能会对肠道健康产生积极影响,如减少肠道炎症、改善肠道通透性和促进有益菌群的生长。然而,也有研究认为生酮饮食会减少肠道菌群多样性,可能引发代谢紊乱等情况,这是为什么呢?
这些研究之间是否相互矛盾?
许多人对这种饮食方法可能对肠道及肠道微生物组健康产生的影响有担忧。
有一种普遍的观念认为,唯一能为有益肠道微生物提供营养的物质是复合碳水化合物,如果我们没有膳食纤维,我们的肠道屏障也会受到影响。
但事实真的如此吗?
生酮饮食真的会给肠道带来很大危害吗?
生酮饮食对肠道菌群的影响是快速的吗?
生酮饮食中的高脂肪不会增加LPS吸收吗?
为什么说生酮饮食对一些疾病具有保护作用?
生酮饮食到底是促炎多还是抗炎多?
什么人群更适合生酮饮食呢?
……
在本文中,我们将深入探讨生酮饮食对肠道健康的影响,并对证据进行完整的讨论,包括目前知道什么和不知道什么,更全面地了解这种饮食方法,可以更好地选择适合自己的饮食方式。

我们与肠道微生物的关系是数千代共同进化的产物。数百万年来,进化不仅作用于我们 23,000 个人类基因,还作用于我们体内和体表的近 400 万个基因(包括人类和微生物)。之所以成为今天的我们,是因为我们是与微生物一起进化的。
什么是代谢灵活性?
我们进化的环境需要定期适应不断变化的条件。我们的祖先并不能总是稳定地获得食物,当食物匮乏时,他们会偶尔禁食。因此,当食物充足时,我们的身体有能力燃烧和使用碳水化合物,而当食物或碳水化合物稀缺时,我们的身体有能力将膳食脂肪或储存的身体脂肪转化为酮以获取能量。这种根据饮食摄入量变化而改变新陈代谢的能力称为代谢灵活性。
那么问题来了:为什么我们的身体具有代谢灵活性来应对食物供应的变化,而我们的肠道微生物群却没有同样的代谢灵活性?
当淀粉类碳水化合物变得稀缺时,我们的祖先真的会产生“患病”的微生物组吗?
不一定。
我们可以考虑一下因纽特人等传统文化。
因此,所谓“健康”微生物组,就是你个人健康时所拥有的微生物组,对你来说健康的东西可能对其他人来说并不健康。
打个比方,选择任意两个人,平均而言,他们只会分享大约三分之一的肠道微生物群。另外三分之二的肠道菌群将因遗传、地理位置、抗生素和药物使用史、出生方式、饮食以及其他未知的因素而存在显著差异。没有足够的信息来证明一个人的“三分之二”比另一个人的“三分之二”更好。
我们在肠道菌群检测的时候,并不能以单一的指标去武断地认为这个人就是不健康,而是要结合他自身其他指标来综合判断是否需要采取某些干预措施。
我们继续来看研究数据。
很多项研究表明,给动物喂养“高脂肪饮食”会导致严重的肠道菌群失调、肠道通透性增加和全身炎症,表明高脂肪饮食可能对人类肠道微生物群不利。
不过仔细观察会发现,大多数动物研究中使用的“高脂肪饮食”,更准确地说是富含精炼大豆油、猪油和精制糖且纤维含量极低的饮食。
加州大学戴维斯分校教授 Craig Warden 博士称其为“相当于小鼠吃猪皮、排骨、可乐”。换句话说,经典的动物“高脂肪饮食”比任何精心设计的生酮饮食更能反映标准美国饮食换句话说,典型的动物“高脂肪饮食”其实更多地反映了标准西方饮食,而不是精心设计的生酮饮食。
进化来说:人易适应高脂饮食,小鼠适应低脂
低碳饮食下,经过基因筛选的小鼠容易代谢紊乱
最常用于此类研究的小鼠品系 C57Bl/6 小鼠经过基因筛选,因其能够响应“高脂肪饮食”而增加体重和升高血糖。
Richard Feinman 等人写道:
“结果表明,肥胖的啮齿动物模型,在理解代谢机制如何以与人类效应不同的方式工作方面可能最有价值。”
因此,我们不能简单地将针对经过选择性育种、喂食高度精炼“高脂肪饮食”的小鼠的研究结果,直接应用到具有健康意识的人类身上,这是对基础科学的严重误解。
那么,我们来看看人类研究。
2014 年在《自然》杂志上发表了一项研究,研究人员让健康的人类志愿者短期接受植物性饮食或动物性饮食。他们发现独特的肠道微生物群在短短三天内就出现了。
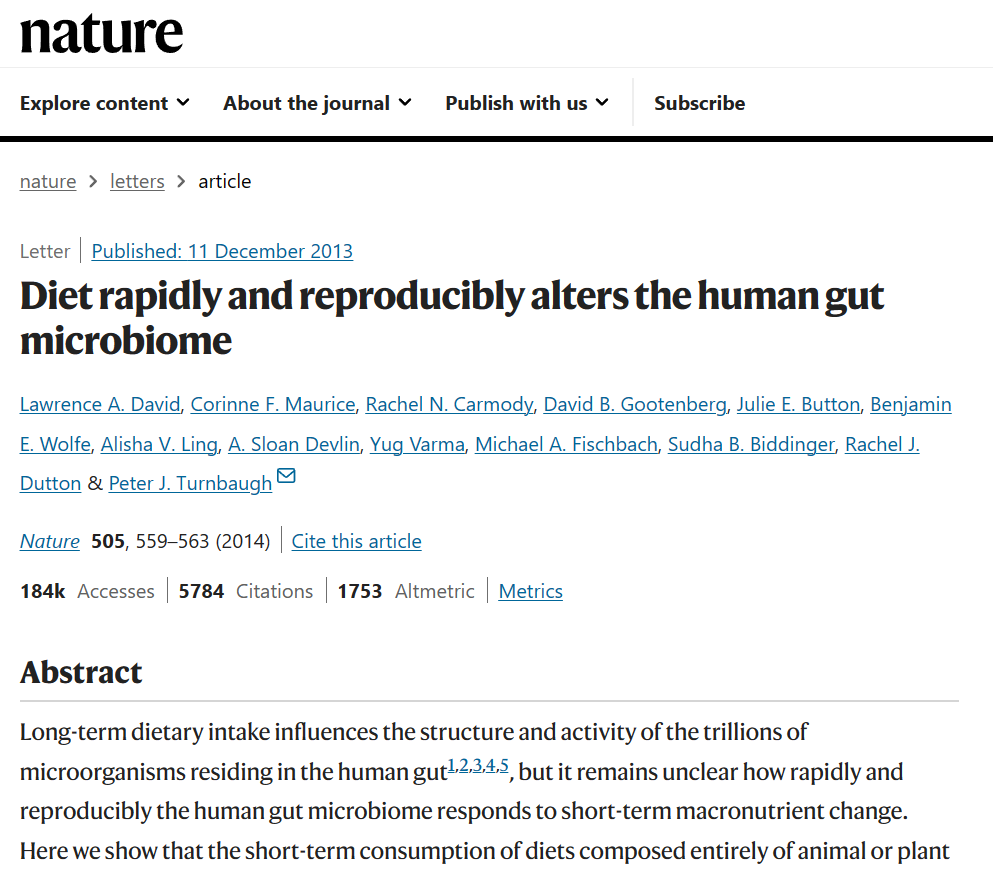
这是微生物组研究领域的一项开创性研究,自 2014 年以来已被引用超过 2700 次。其实这篇文章里面说的动物性饮食是生酮饮食。
– 植物性饮食每天包含 300 克来自谷物、蔬菜、大米、扁豆和水果的碳水化合物;
– 动物性饮食每天包含的碳水化合物少于 3 克,其中 30% 的热量来自蛋白质,70% 的热量来自蛋白质来自鸡蛋、肉和奶酪的脂肪。这种常量营养素比例与生酮饮食一致。研究人员甚至通过尿酮测量证实受试者在动物性饮食的第二天就处于酮症状态。
那么他们发现了什么?
动物性生酮饮食的参与者微生物α多样性没有变化。他们发现耐胆汁微生物相对丰度有所增加,如Bilophila、Alistipes、Bacteroides。已知代谢复杂膳食植物纤维的微生物的相对丰度减少,如Roseburia、Eubacterium rectale、 Ruminococcus bromii。
该文作者写道:
研究结果表明,人类肠道微生物组可以在草食性和肉食性功能特征之间快速切换,这可能反映了人类进化过程中过去的选择压力。
我们的祖先吃动物食品可能是不稳定的,依赖于季节和随机的觅食成功;
而现成的植物性食物提供了热量和营养的后备来源。微生物群落能够迅速、适当地改变其功能,以应对饮食变化,从而增强人类的饮食灵活性。
换句话说,我们的肠道微生物群只是在适应当前不同食物来源的可用性,它不一定会因饮食中碳水化合物或脂肪的数量而变得或多或少具有致病性。
注意:生酮饮食可能会加剧一些菌过度生长——稍后会详细介绍。
那么,更长期的研究呢?
2017 年《微生物学前沿》杂志上发表的一项研究检查了生酮饮食对 25 名多发性硬化症患者粪便微生物群的长期影响。
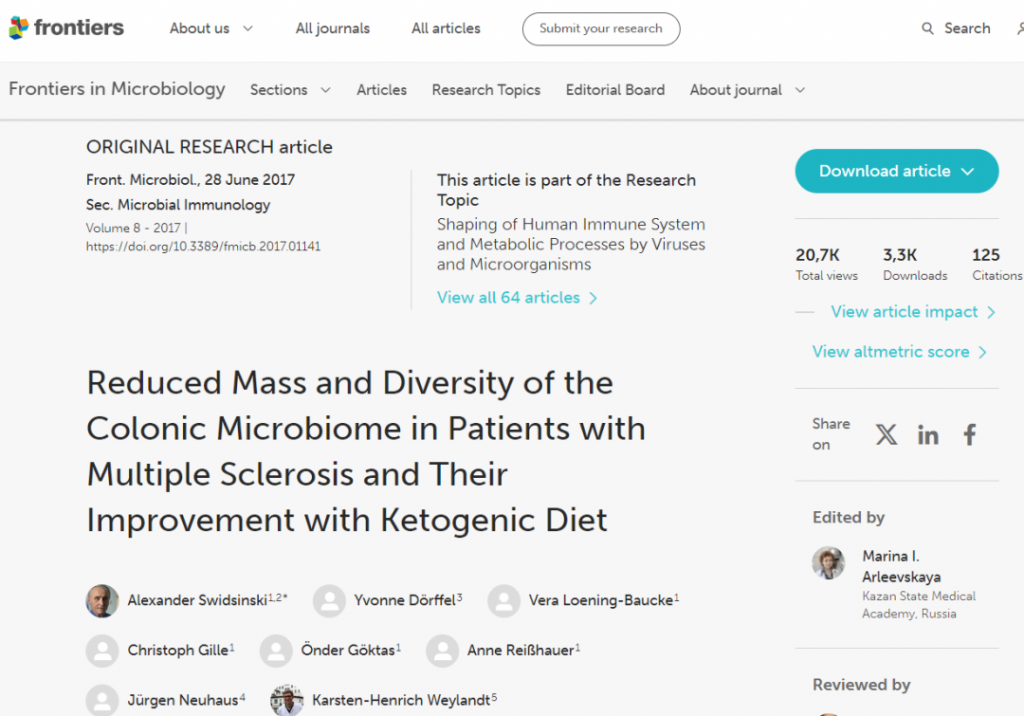
多发性硬化症 (MS) 是一种影响神经系统的自身免疫性疾病,与肠道病变有关。事实上,一些研究人员怀疑肠道菌群失调和肠道通透性可能先于自身免疫的发展。因此,如果生酮饮食可以显著改善多发性硬化症的症状,它可能不太会损害肠道,甚至可能改善肠道健康。
与健康个体相比,多发性硬化症患者在基线时的Roseburia、拟杆菌属和普拉梭菌属数量往往减少。然后他们进行了六个月的生酮饮食。
作者写道:
生酮饮食的影响是双向的。短期内,细菌浓度和多样性进一步降低。他们在第 12 周开始恢复,并在生酮饮食 23-24 周后显著超过基线值。
这表明,虽然短期饮食变化可以迅速改变肠道微生物群的组成,但我们可能需要关注长期饮食变化,并在多个时间点收集样本,以确定生酮饮食干预的真正效果。
最近发表的一项研究证实,生酮饮食可以改变肠道微生物群的结构和功能。

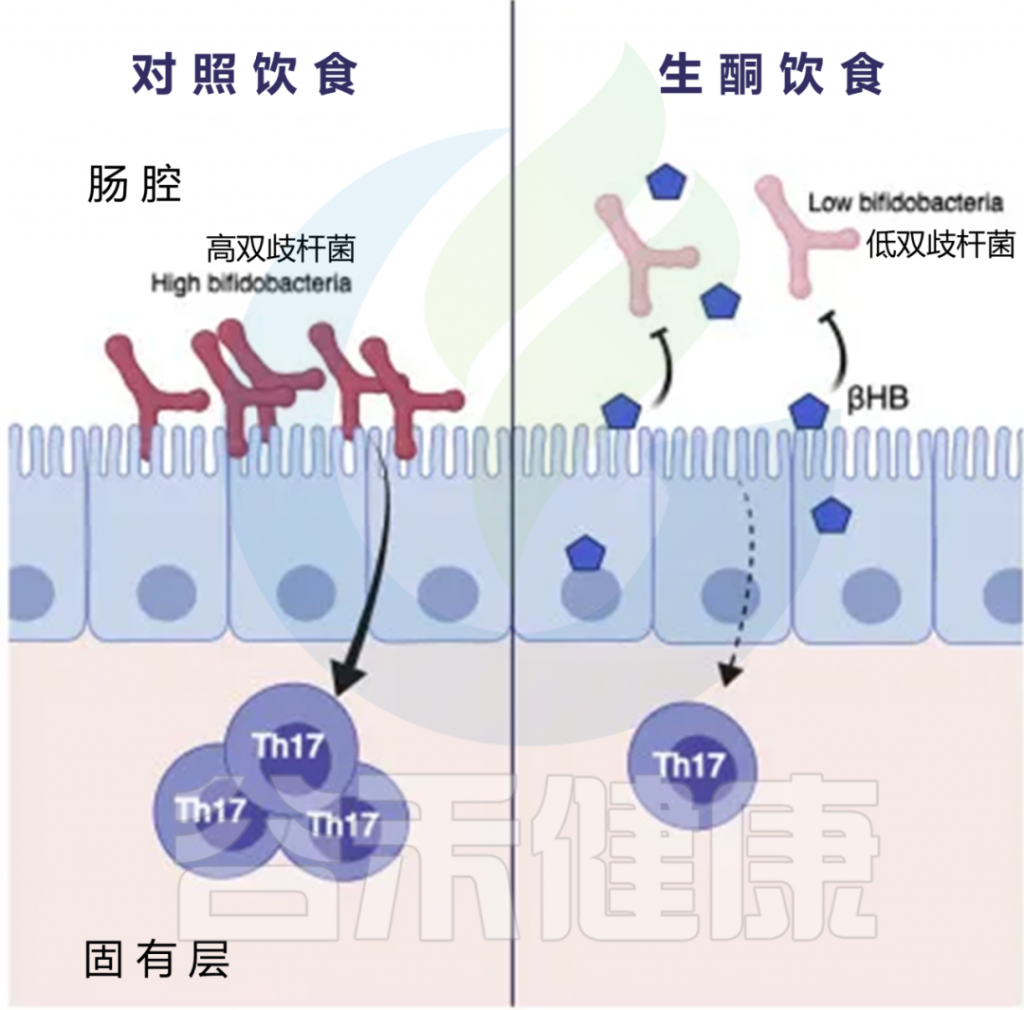
该小组招募了 17 名超重和肥胖男性参与研究的第一部分。让他们吃基线控制饮食四个星期,然后再吃四个星期规定的生酮饮食。生酮饮食最显着的变化是,几种双歧杆菌物种丰度的显著减少。
研究人员接下来对小鼠进行了控制喂养研究。相对于传统的高脂肪饮食,生酮小鼠饮食对肠道微生物组具有独特的影响,随着碳水化合物限制的增加,双歧杆菌的丰度减少。进一步的实验发现,生酮饮食或酮酯补充剂都会导致肠腔和结肠组织中β-羟基丁酸的增加。
酮体直接抑制双歧杆菌的生长
有趣的是,这与小肠 Th17 细胞的减少有关。Th17 细胞是T辅助细胞的一个亚群,可产生促炎细胞因子 IL-17,作为适应性免疫反应的一部分。这些细胞在维持肠粘膜屏障方面发挥着重要作用,并有助于清除粘膜表面的病原体。然而,Th17 细胞也与自身免疫和炎症性疾病有关,包括类风湿性关节炎、多发性硬化症和牛皮癣。
为了完善这个发现,他们将在基线饮食或生酮饮食期间收集的人类捐赠者的粪便,移植到无菌小鼠体内,以确定 Th17 细胞的变化是否依赖于酮诱导的微生物群变化。接受酮类微生物群的小鼠肠道 Th17 细胞显著降低。
doi.org/10.1016/j.cell.2020.04.027
有趣的是,与生酮饮食相比,基线饮食的总体胆汁酸池没有变化。
生酮饮食不会破坏肠道粘液层
之前的研究表明,喂食无纤维饮食的小鼠结肠粘液层有显著破坏。然而,在生酮饮食中却没有看到这一点。
作者写道:
尽管缺乏可发酵碳水化合物,生酮饮食仍能保持强健的粘液层。
这是一个关键发现。低碳水化合物者可以放心,如果处于酮症状态,肠道粘液层可能不会破坏。生酮饮食不仅维持了粘液宽度,还维持了肠道粘液主要成分 Muc2 的表达。
我们现在已经在人类身上看到了大量关于生酮饮食引起肠道微生物组变化的证据,并且看到了生酮饮食如何影响小鼠的肠道微生物群和粘液层。
让我们看看其他一些设计良好的动物研究。
生酮饮食经常用于治疗对药物治疗无反应的癫痫症。虽然生酮饮食非常有效,但几十年来,生酮饮食到底如何给大脑活动带来好处仍然难以捉摸。
然而,Elaine Hsiao 团队于 2018 年 5 月在《细胞》杂志上发表的一项研究表明,生酮饮食对癫痫的有益作用是通过肠道微生物组介导的。换句话说,如果生酮饮食不能改变微生物群,它就不能有效预防癫痫发作。
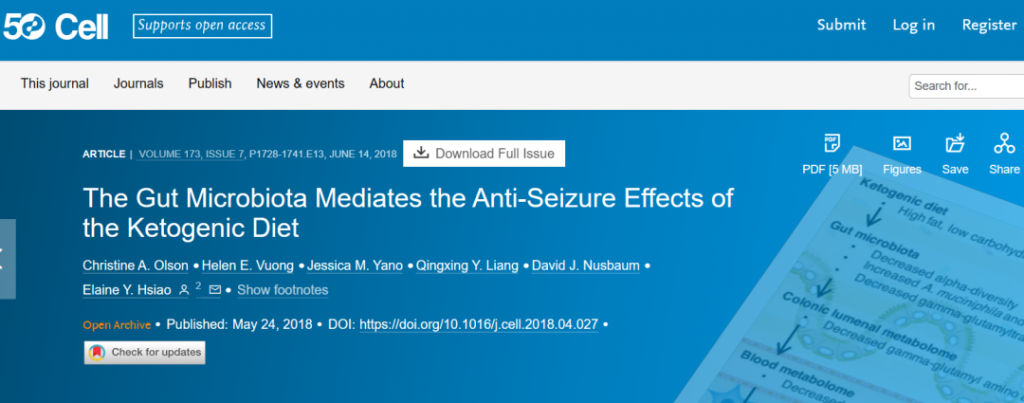
这项研究是在小鼠癫痫模型中进行的。与之前的研究一样,他们能够证明给小鼠喂食生酮饮食可以保护它们免受癫痫发作。
然而,他们进一步证明,用广谱抗生素治疗小鼠会消除对癫痫发作的保护作用。同样,在无菌培养箱中饲养且没有肠道微生物组的无菌小鼠,即使在食用生酮饮食时也无法预防癫痫发作。
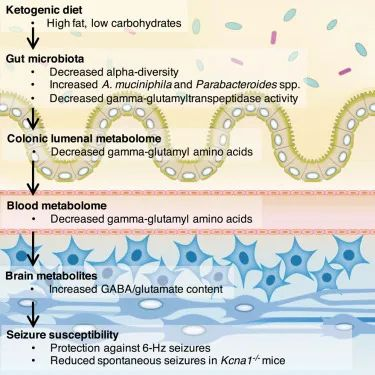
doi.org/10.1016/j.cell.2018.04.027
有趣的是,本研究中的生酮饮食降低了微生物多样性,但增加了Akkermansia muciniphila(简称AKK菌)和副拟杆菌(Parabacteroides)丰度。
扩展阅读:
研究人员想知道这两种微生物是否负责癫痫发作保护,并尝试用阿克曼氏菌和副杆菌来治疗喂食正常高碳水化合物食物的小鼠。令人惊讶的是,这可以防止癫痫发作。
进一步的机制实验发现了一条细菌途径,该途径提高了大脑中抑制性神经递质GABA与兴奋性神经递质谷氨酸的比例。GABA 可以镇静大脑的活动,因此这可以解释癫痫发作的减少,也可以解释为什么许多人发现生酮饮食有助于减少焦虑。
扩展阅读:
癫痫中的微生物群-肠-脑轴
Ding M,et al.Front Immunol.2021
基于相关的人类和动物实验数据,我们深入探讨生酮饮食引起的肠道生理学变化的一些机制。
你可能会问,如果没有任何可发酵碳水化合物,肠道如何生存?
我们知道肠道细菌代谢复杂的碳水化合物,产生短链脂肪酸(SCFA),如乙酸盐、丙酸盐和丁酸盐。丁酸盐在肠道中具有重要的信号传导功能,并且是肠上皮细胞的首选燃料来源。已发表的研究表明,丁酸盐提供了结肠上皮细胞约 70% 的能量需求。
丁酸盐对免疫功能的调节作用
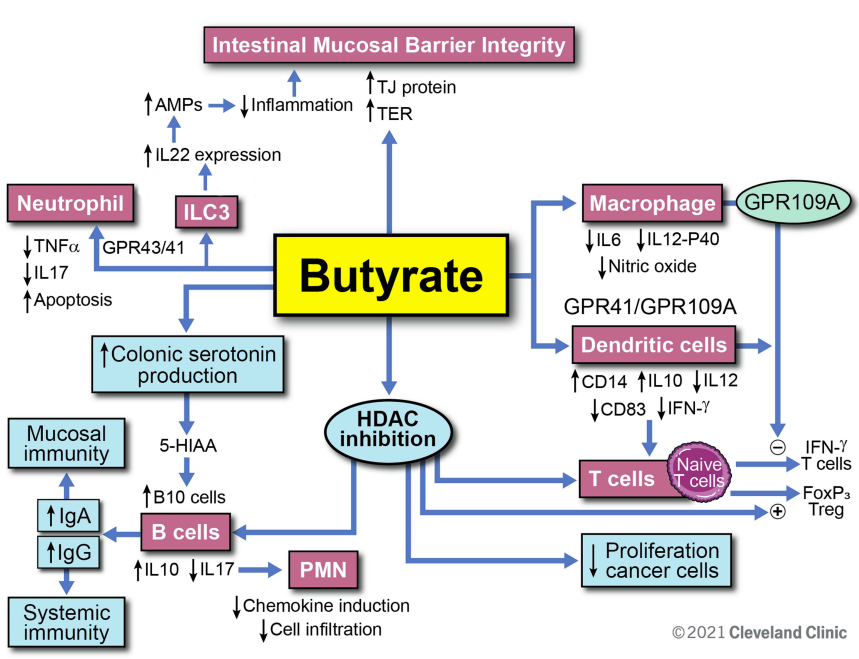
我们需要定期供应丁酸盐来维持肠道屏障功能吗?
不。事实证明,还有其他几种分子可以执行丁酸盐的许多信号传导功能,并作为肠上皮细胞的燃料来源。事实上,这种“首选”燃料来源的想法可能偏离了对食用大量碳水化合物的人(和啮齿动物)的研究。换句话说,生酮饮食中丁酸盐的产生可能会减少,但其他分子可以代替它来帮助维持肠道屏障功能。
扩展阅读:
有三种分子可以替代丁酸:异丁酸、乙酰乙酸、β-羟基丁酸。
异丁酸替代丁酸,刺激肠道受体
异丁酸是蛋白质发酵的代谢产物,其产生量通常低于丁酸。当丁酸较少时,异丁酸可以被肠上皮细胞从肠腔吸收并代谢为能量。前面提到的 2014 年研究发现,食用动物性生酮饮食的人类粪便异丁酸含量升高。
此外,异丁酸可以刺激肠道中与丁酸相同的受体(GPR41、GPR43和GPR109a),从而刺激粘液分泌、抗菌肽释放和免疫调节。
异丁酸浓度不足,效力来补
虽然中等高蛋白饮食中产生的异丁酸水平可能低于高碳水化合物饮食中产生的丁酸水平,但异丁酸已被证明是GPR41(FFAR3)的更强效刺激剂,这是丁酸的主要受体之一。换句话说,异丁酸在浓度上的不足,但在效力上可能弥补了这一不足。
乙酰乙酸 和 β-羟基丁酸 (βHB)
是肝脏产生的两种主要酮体。与丁酸盐一样,βHB 也可以刺激 GPR109a,减少肠道炎症。然而,最值得注意的是,βHB 和乙酰乙酸都是丁酸代谢途径中的中间体。
换句话说,当丁酸盐被肠道上皮细胞吸收时,它实际上首先转化为βHB,然后转化为乙酰乙酸,然后进一步分解为能量。参考下图:
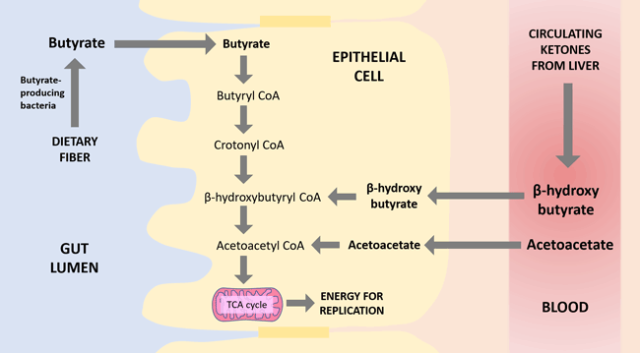
编辑
已知肠道上皮细胞在基底外侧表面(最靠近血流的细胞一侧)表达单羧酸转运蛋白 MCT1 。MCT1 可以转运酮,并且特别在使用酮体获取能量的细胞中表达。几篇论文表明,肠道上皮细胞确实能够利用血管床中的酮体。
酮体与丁酸盐在肠道健康中的角色
使用酮代替丁酸盐的能力可能看起来没有优势,但考虑到许多肠道发炎的人都存在粘膜损伤,丁酸盐的吸收受损。
那么这意味着什么呢?如果你有一个健康的微生物群和肠黏膜,丁酸可能足以应对你肠道的所有需求,不需要酮体。
但是,如果你:
尝试治疗性营养生酮来支持肠道上皮细胞代谢,至少在治疗潜在的肠道病理和治愈肠道粘膜之前是这样。
生酮饮食在治疗肠道疾病中的应用
可惜,很少有研究是针对克罗恩病、溃疡性结肠炎或肠易激综合症的生酮饮食。
一份病例报告发现,旧石器时代的生酮饮食使一名患有严重克罗恩病的小男孩完全缓解。
第二份病例报告发现,补充酮酯的低碳水化合物饮食可显著减少克罗恩病患者的炎症并提高生活质量。
另一项针对 13 名腹泻型肠易激综合征 (IBS-D) 患者的研究发现,10 名患者在 4 周生酮饮食期间症状得到缓解。

有趣的是,许多溃疡性结肠炎的患者发现生酮饮食可以缓解症状。
目前极少有研究评估酮或生酮饮食对肠道屏障功能的影响,在这方面可进一步研究。
鉴于生酮饮食相当严格,许多人开始使用酮酯或盐来实现酮症。其他人可能会在生酮饮食的基础上使用酮酯或盐来达到更深层次的酮症状态。
酮酯或酮盐对肠道微生物和丁酸盐水平的潜在影响
有趣的是,一些体外数据表明,至少在某些个体中,酮酯或酮盐可能会增加肠道丁酸盐水平。《科学报告》 2020 年发表的一项研究调查了体外发酵室中 12 种人类粪便微生物群样本的 β-羟基丁酸盐的动态。
编辑
在 7 个样本(βHB 利用者)中,超过 54% 的 βHB在发酵 30 小时后被代谢,这与已知的丁酸盐生产者粪球菌属丰度的增加有关,而粪球菌属又与丁酸盐产量的增加相关。
在其他五个粪便样本(βHB 非利用者)中,只有不到 19% 的 BHB 被代谢,并且粪便丁酸盐没有变化。
作者推测:
微生物正在将 βHB 转化为丁酸盐
这一观点得到了 2018 年发表在《细胞代谢》杂志上的一项研究的支持,该研究发现啮齿动物的间歇性禁食,导致与酮体合成和降解相关的微生物途径丰富。
另一种可能的机制是通过激活 PPAR-γ 并维持肠道低氧状态,这反过来又会支持肠道中的产丁酸菌。
一项由麻省理工学院的一组研究人员在2019年末发表在《细胞》杂志上的研究发现:
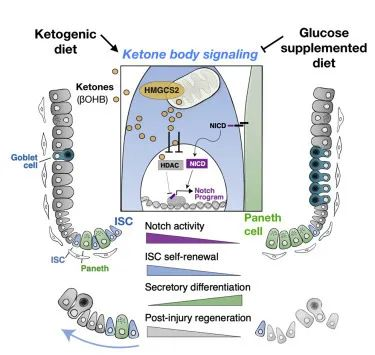
酮体信号调节了肠干细胞的正常功能及其对伤害的响应能力
肠道上皮广泛折叠,上皮表面有峰(绒毛)和谷(隐窝)。肠道干细胞(ISC)位于每个隐窝的底部,负责每隔几天更新整个肠道上皮或修复损伤。
肠道干细胞受到许多影响其发育的不同生长因子的严格控制。之前的研究表明,膳食营养素在决定肠道干细胞功能方面发挥着重要作用,但尚未有人研究酮体及其潜在作用。
Cheng C W et al., cell,2019
酮体生产酶HMGCS2对肠道健康的影响
研究小组首先发现,生成酮体的酶HMG-CoA合成酶2(HMGCS2)在小肠干细胞中富集。HMGCS2 存在于许多不同的组织中,已知可以限制酮的形成速率。
消除肠道中的Hmgcs2基因会降低隐窝中的 β-羟基丁酸水平,并损害干细胞功能以及后肠道上皮的再生。给予外源性(补充)βHB 可挽救干细胞功能并部分恢复肠道再生。
生酮饮食对肠道干细胞和上皮再生的影响
他们接下来研究了生酮饮食的影响,发现它增加了 HMGCS2 表达、ISC 数量、功能和损伤后再生。相比之下,补充葡萄糖的饮食抑制了肠道干细胞的生酮作用,并使干细胞向杯状细胞和潘氏细胞倾斜分化。
值得注意的是,一旦干细胞分化为成熟的上皮细胞并迁移出隐窝,它们就表达很少的 HMGCS2。这表明成熟的上皮细胞不具备通过经典生酮途径(通过两个乙酰辅酶A分子的缩合)产生大量酮的能力,尽管我们了解到它们确实有能力利用酮。
因此,如果我们在生酮饮食中看到成熟肠上皮细胞中存在高水平的酮,并且这些酮不是在成熟的上皮细胞中产生的,那么酮几乎肯定来自循环。
沿着这些思路,作者写道:
因为外源性酮在体外和体内都能纠正 Hmgcs2 的缺失,肝脏或其他非肠道来源的酮体可能会替代或补充肠道干细胞生成的酮体,在生酮饮食介导的再生过程中,其中循环酮水平高度升高。
避免高脂肪饮食的另一个常见论点是,它们会增加肠道对脂多糖 (LPS) 的吸收。LPS 是一种存在于革兰氏阴性细菌细胞壁中的分子。如果它进入循环,可能会引起低度的全身炎症。
要真正理解这一机制,我们需要了解一下:
脂肪是如何消化和吸收的?
当我们吃脂肪时,小肠中的特殊细胞会释放一种叫胆囊收缩素(CCK)的激素。胆囊收缩素刺激胆囊分泌胆汁进入小肠。在这里,胆汁酸包围脂肪分子,帮助它们变成水溶性的(就像洗洁精有助于乳化油一样)。
人体胆汁酸的肠肝循环
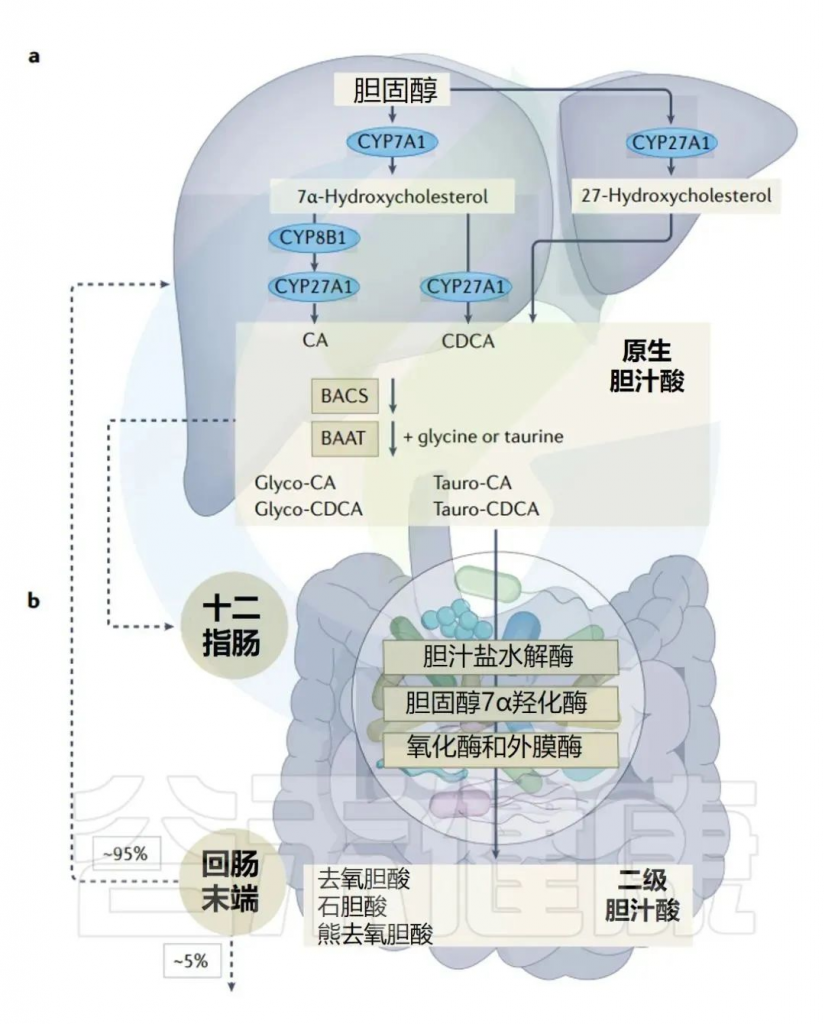
Collins SL,et al.Nat Rev Microbiol.2023
LPS的肠道吸收与运输
事实证明,LPS 对这些称为胶束的水溶性包裹具有很高的亲和力。胶束最终扩散到肠上皮,在那里它们的内容物(包括 LPS)被肠上皮细胞吸收。上皮细胞将脂质和脂多糖重新包装成乳糜微粒,然后乳糜微粒可以通过淋巴管(携带免疫系统淋巴的血管)输送到肝脏。
关于高脂饮食增加LPS吸收的思考
当我们摄入更多的长链脂肪酸时,我们的身体就会产生更多的乳糜微粒,因此更多的脂多糖可以以这种方式搭便车。事实上,富含脂肪的膳食已被证明可以适度增加小鼠和人类的血清 LPS 水平。
虽然这绝对是一个真实的现象并且值得考虑,但其实这个问题不大,原因如下:
LPS 吸收的增加可以减少肠道粘膜的炎症
首先,一些研究表明,乳糜微粒运输 LPS 可能具有优势,因为它有利于肝脏清除 LPS,从而降低 LPS 的毒性。此外,乳糜微粒还具有灭活 LPS 的先天能力。总而言之,LPS 吸收的增加可以减少肠道粘膜的炎症。
乳糜微粒诱导的 LPS 吸收与肠漏相比——小巫见大巫
这一点尤其重要,因为全身接触 LPS 的主要方式不是通过脂肪吸收,而是通过肠漏。当肠道具有渗透性时,大量脂多糖会渗漏到粘膜下层和血液中,引起局部肠道免疫反应和全身炎症。
换句话说,与完全的肠道通透性相比,乳糜微粒诱导的 LPS 吸收可能只是杯水车薪。事实上,对于那些患有严重肠道渗透性的人来说,乳糜微粒诱导的 LPS 解毒甚至可以减少炎症,足以促进肠道上皮的愈合。
生酮饮食的受试者全身炎症减轻
反过来说,如果脂肪诱导的 LPS 吸收是一个问题,那些食用高脂肪生酮饮食的人会出现全身炎症增加?
实际上相反,接受生酮饮食的受试者几乎普遍出现全身炎症减轻的情况。
不必担心高脂肪饮食缺乏丁酸盐或增加 LPS 的吸收。在下一节中,我们将了解胆汁酸如何促进肠道健康。
一些人还认为,高脂肪饮食可能对肠道微生物群和肠道屏障有害,因为它会刺激胆汁酸分泌增加。一般来说,吃的脂肪越多,释放到小肠的胆汁就越多。
事实上,一些研究表明,肠道屏障持续暴露于高浓度胆汁酸会导致肠道通透性增加。然而,生理剂量的胆汁酸已被证明可以支持屏障功能,诱导杯状细胞分泌粘液,促进上皮细胞迁移,并增强肠道先天免疫防御。
胆汁酸介导的肠道屏障功能调节
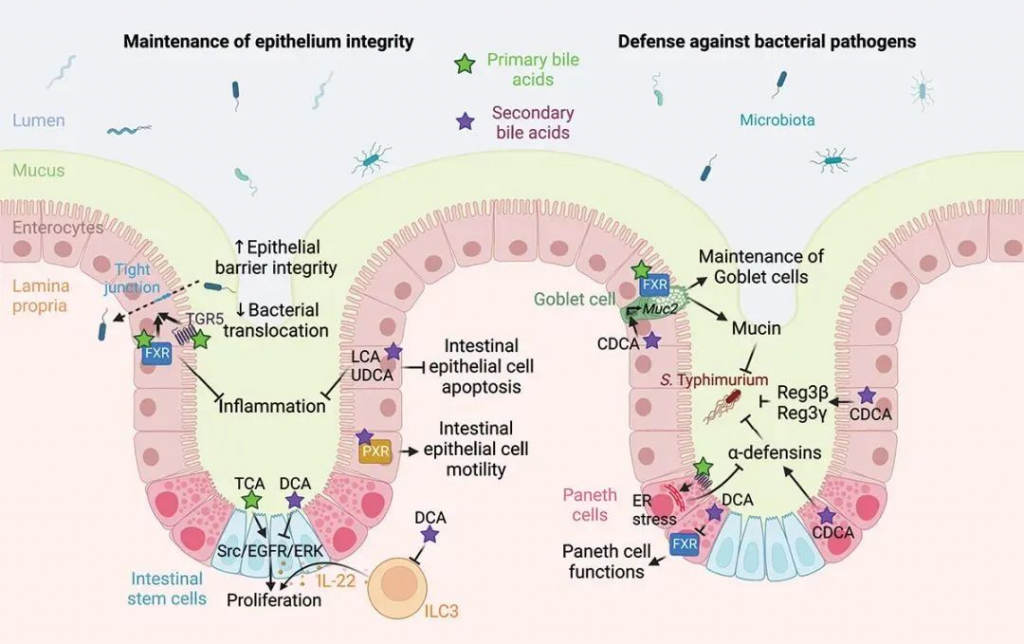
Larabi AB,et al.Gut Microbes.2023
胆汁酸还具有抗菌特性,有助于调节肠道微生物群,尤其可以防止小肠菌群失调。多项研究还表明,胆汁酸可激活肠内分泌细胞释放血清素,从而有助于促进肠道蠕动。
篇幅有限,每种类型的结合和解结合胆汁酸的来龙去脉就不详细阐述了,总的来说,没有足够的证据表明,生酮饮食中胆汁酸的生理增加对肠道微生物群或肠道屏障功能有害。
肉食动物饮食有时候被吹捧为治疗多种疾病的灵丹妙药。虽然全肉饮食作为短期治疗饮食可能是有益的,而且许多人的症状得到改善,但有关这种饮食方法的长期安全性的数据有限。
理论上,假设你从鼻子到尾巴吃遍动物的所有部分,从动物性饮食中获取所有营养素是可能的。有趣的是,上面提到的研究中的短期动物性饮食与维生素生物合成细菌基因表达的增加有关。作为低残渣饮食,肠道炎症的减少也可能在短期内改善营养状况。然而,我们对肉食动物饮食如何长期影响营养状况、激素、生育能力和甲状腺功能知之甚少。
此外,没有证据表明任何祖先只吃肉类或植物为生。即使是因纽特人和生活在极北纬度地区的其他人群,也会不遗余力地采集植物,或以其他方式提高他们的生育能力。
韦斯顿·普莱斯 (Weston A. Price) 在他的著作《营养与身体退化,原始与现代饮食及其影响的比较》中写道:
在北极圈附近驼鹿国家的印第安人中,六月份出生的孩子比例最高。
这是通过父母双方在雄性驼鹿从高山地区下来进入交配季节时,大量食用雄性驼鹿的甲状腺来实现的,此时喉咙下方携带甲状腺的大突起大大增大。
换句话说,这些文化有传统智慧,可以用其他动物的甲状腺进行自我用药,以弥补由于缺乏植物性食物而导致的生育能力下降。大多数现代“肉食动物”并没有这样做,许多人只吃肌肉。
话虽如此,相信在大多数情况下,治疗性生酮饮食可能同样有效,并且需要完全食肉来缓解症状,这是潜在肠道感染的一个迹象。一旦解决了这个问题,理想的饮食可能包括某种形式的植物性食物。
看到这里,希望你已经感觉到生酮饮食对于肠道健康来说一般没有什么可担心的。但这里确实有一个潜在的警告要聊,那就是硫化氢过度生长的个体。
硫化氢 (H2S) 是一种无色气体,通常在体内产生,在低浓度下可作为重要的信号分子。
哺乳动物细胞硫化氢的生物合成
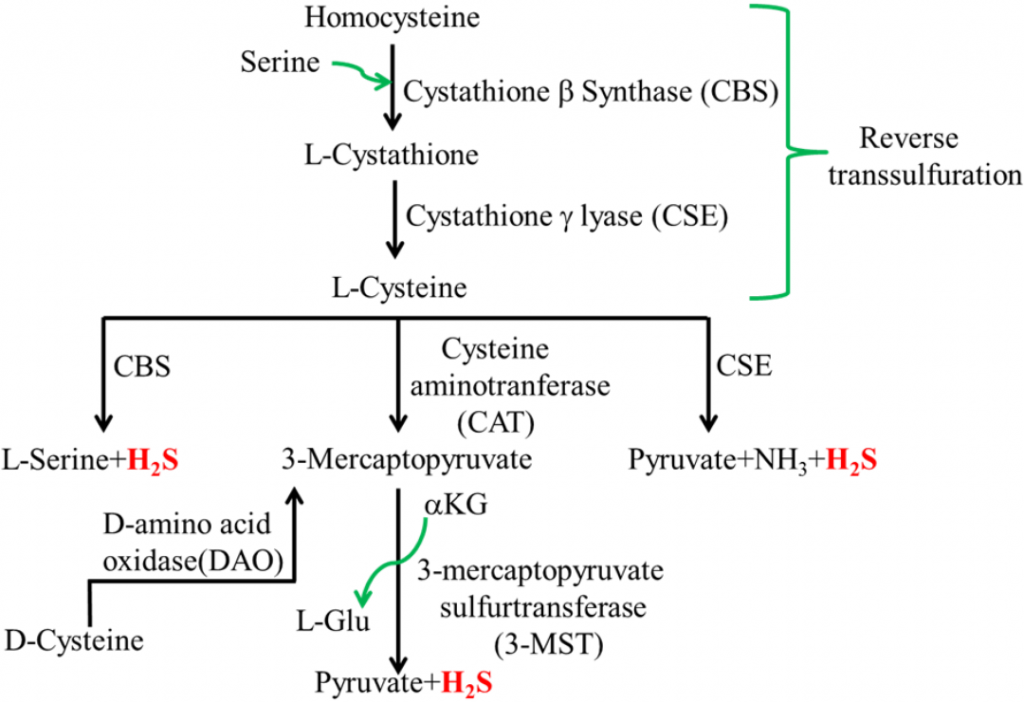
doi.org/10.3390/microorganisms3040866
然而,某些肠道细菌也会产生硫化氢,这些细菌的过度生长会导致硫化氢过量。H2S与腹泻、肠道过敏、IBS、IBD 和结直肠癌有关。
人类肠道中最常见的H2S产生者是Desulfovibrio、Bilophila wadsworthia和Fusobacter nucleatum。这些细菌往往在富含动物蛋白和脂肪的饮食中大量繁殖。
因此,如果有H2S过度生长,最好避免食用生酮饮食,解决了这个问题肠道重新平衡之后再尝试。
注:营养食品多酚(浆果提取物)可将H2S氧化为有效的抗氧化多硫化物,从而引发细胞保护作用。该机制表明,多酚会自动氧化为相应的半醌类物质,然后与H2S反应生成巯基,最终形成多硫化物和硫代硫酸盐。
那H2S过度生长的人适合什么饮食呢?一般来说,高纤维、以植物为主的地中海饮食实际上可能最适合。
扩展阅读:
总而言之, 没有明确的证据表明精心设计的高脂肪或生酮饮食对肠道微生物群或肠道屏障功能有害。事实上,生酮饮食带来的肠道微生物群和肠道屏障的变化甚至可能是我们从生酮饮食中看到如此多益处的原因。
此外,我们并不真正知道健康的肠道微生物群是由什么构成的,而酮和异丁酸酯可以取代丁酸。一些病例报告表明,生酮饮食可以减少 IBS 和 IBD 患者的炎症并改善生活质量。
这里强调的是,并不是说生酮饮食适合每个人。本文的目的并不是建议每个有肠道问题的人都去生酮饮食。只是对生酮饮食与肠道健康相关的证据进行更完整的讨论,让大家有个正确全面的认识。
就肠道健康而言,生酮饮食也有正确和错误的方法。下面两种饮食为肠道带来的治疗效果不同:
就此而言,以下是在食用高脂肪或生酮饮食时遵循肠道健康的一些建议:
1) 关注优质脂肪
如牛油果、牛油果油、橄榄油、多脂鱼、椰子油、放牧酥油、黄油、牛脂等。尽量摄入单不饱和脂肪、多不饱和脂肪和饱和脂肪的混合物。避免高度脂肪加工和精炼油,如菜籽油、玉米油和大豆油。

如果计划长期保持生酮饮食,建议在采用生酮饮食 1-2 个月后检查一下完整的心血管概况。一小部分人的低密度脂蛋白LDL数量会增加,可能需要调整脂肪摄入量或考虑改良生酮饮食,以确保他们不会增加心血管风险。
2)吃非淀粉类蔬菜
不一定需要丁酸盐并不意味着应该减少蔬菜的摄入量。尝试购买各种类型和颜色的生蔬菜和熟蔬菜。
3)多吃浆果
浆果是一种很好的低碳水化合物来源,提供益生元纤维,有助于促进有益细菌的生长。

4)喝咖啡,吃可可
多酚可促进有益细菌的生长,可以适量饮用咖啡和可可。具有严重肠漏或自身免疫性疾病的患者最初可能需要避免这些食物。
5)考虑营养密度,从头到尾吃
食用内脏、贝类、海鲜,并确保富含蛋氨酸的肌肉与富含甘氨酸的动物食品(如胶原蛋白和骨头汤)之间的平衡。
6)亲自实践找到最佳方案
了解生酮是否适合自己的最佳方法是尝试几周,看看感觉如何。特别注意自身能量、皮肤、情绪、生产力、消化、排便等方面。
7)灵活选择生酮饮食
没有必要无限期地处于生酮饮食状态。通过保持 20-120 克的碳水化合物摄入量(取决于自身活动水平),可以轻松地进入和退出生酮状态。实际上,这可能有助于肠道和微生物组保持最高的代谢灵活性。
全面的粪便测试是指除了标准粪便培养之外还可以提供有关肠道健康的更详细信息的任何测试。通常提供以下信息:
而肠道菌群检测使用更彻底的 DNA 测序来更细微地了解到菌属层面的肠道细菌的整体平衡。
谷禾肠道菌群检测还通过复杂的模型构建及大数据分析等方式解读人体健康状况,除了菌群详情之外,还包括疾病风险,营养构成,药物代谢等综合信息。
全面的粪便测试和肠道菌群检测都很有用,它们通常可以相互补充。
哪些人需要全面的粪便或肠道菌群检测?
如果感觉自己有以下症状或一些健康小问题,可能会需要肠道菌群检测:
消化问题、胃酸反流、胀气或腹胀、腹痛、便秘、腹泻、肠易激综合症、炎症性肠病、憩室炎、体重快速增加或减轻等。
患有肠道外其他症状的人也可以进行粪便和/或微生物组检测,例如:
食物不耐受、湿疹或荨麻疹、粉刺、情绪紊乱、抑郁或焦虑、疲劳、失眠、脑雾、关节疼痛、慢性鼻窦问题或过敏、哮喘、痛风等。
这些检测可以帮助自己了解肠道菌群的状况,为制定个性化的治疗方案提供重要参考。
主要参考文献
Singh SB, Lin HC. Hydrogen Sulfide in Physiology and Diseases of the Digestive Tract. Microorganisms. 2015 Nov 12;3(4):866-89.
Austin GL, Dalton CB, Hu Y, Morris CB, Hankins J, Weinland SR, Westman EC, Yancy WS Jr, Drossman DA. A very low-carbohydrate diet improves symptoms and quality of life in diarrhea-predominant irritable bowel syndrome. Clin Gastroenterol Hepatol. 2009 Jun;7(6):706-708.e1.
Cignarella F, Cantoni C, Ghezzi L, Salter A, Dorsett Y, Chen L, Phillips D, Weinstock GM, Fontana L, Cross AH, Zhou Y, Piccio L. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metab. 2018 Jun 5;27(6):1222-1235.e6.
Zambrano-Zaragoza JF, Romo-Martínez EJ, Durán-Avelar Mde J, García-Magallanes N, Vibanco-Pérez N. Th17 cells in autoimmune and infectious diseases. Int J Inflam. 2014;2014:651503.
Olson CA, Vuong HE, Yano JM, Liang QY, Nusbaum DJ, Hsiao EY. The Gut Microbiota Mediates the Anti-Seizure Effects of the Ketogenic Diet. Cell. 2018 Jun 14;173(7):1728-1741.e13.
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23;505(7484):559-63.
Jiang W, Chen J, Gong L, Liu F, Zhao H, Yan Z, Li Y, Zhang J, Xiao M, Mu J. Microbiota-derived short-chain fatty acids may participate in post-stroke depression by regulating host’s lipid metabolism. J Psychiatr Res. 2023 May;161:426-434.
Clemens Z, Kelemen A, Fogarasi A, Tóth C. Childhood absence epilepsy successfully treated with the paleolithic ketogenic diet. Neurol Ther. 2013 Sep 21;2(1-2):71-6.
Sasaki K, Sasaki D, Hannya A, Tsubota J, Kondo A. In vitro human colonic microbiota utilises D-β-hydroxybutyrate to increase butyrogenesis. Sci Rep. 2020 May 22;10(1):8516.

谷禾健康

随着社会的快速发展,环境污染物也逐渐增多(就像过年期间绚烂的烟花虽然让节日气氛更浓厚热闹,但在一定程度上也造成了污染)。这些污染物不仅对自然生态系统构成了威胁,也严重影响了人类的健康和生活质量。
环境毒物是指能够损害环境质量并对人类和其他动物产生不利影响的化学物质。接触这些污染物的主要途径是通过呼吸道、皮肤和口腔摄入。当通过口腔摄入时,它们会遇到生活在人体内的一个特殊的群体——肠道微生物群。
虽然污染物会破坏肠道微生物群平衡,但肠道微生物群在这些化合物的代谢和生物利用度中发挥着重要作用。在正常生理条件下,肠道微生物群用于代谢或排泄外源物质的策略包括还原和水解转化、裂合酶和官能团转移反应以及酶介导的功能转化。同时,宿主进行主要基于结合、氧化和水解反应的代谢过程。
肠道微生物群中存在多种细菌酶,化学物质以及次生代谢物,因此微生物转化被认为是人类和其他哺乳动物污染物代谢机制的关键组成部分。
在污染物中,近年来重金属的污染特备值得关注,因为其毒性,即使在非常低的浓度下也对人体有许多不利影响。下图列出了几种常见重金属对人器官的毒性以及被破坏的生理分子机制。
汞、铅、镉、砷的毒性

Balali-Mood M,et al.Front Pharmacol.2021
在本文中,将根据最新文献讨论污染物尤其重金属例如铅、砷、镉和汞与宿主生物体及其肠道微生物群之间的双向相互作用,以及肠道微生物群如何改变宿主生物体对有毒物质的敏感性,另外讨论针对微生物群的干预措施在多大程度上可以减轻重金属中毒造成的不良影响。
这些有可能是确定未来治疗方法中能够最小化金属毒性的有益物种的关键因素。
★ 每个人都拥有独特的肠道微生物群
肠道微生物群落在出生时就开始获得,个体通过阴道分娩出生或剖腹产出生呈现出不同的肠道微生物群成分。
此外,怀孕期间的许多其他因素也会影响新生儿肠道微生物群的组成,包括母亲预防性使用抗生素、压力和饮食类型。分娩地点和出生后母乳喂养也是影响新生儿肠道微生物群组成的关键因素。
出生后,肠道微生物群会在个体2或3岁时成熟,此时儿童呈现出与成人在多样性和丰度方面相似的肠道微生物群组成。在整个产后发育过程中,许多其他因素可以改变这种已经确定的肠道微生物群成分,例如饮食、药物尤其是抗生素的摄入、使用益生菌和益生元、接触异生素、体力活动、压力、衰老、睡眠剥夺以及粪菌移植等干预措施。
★ 肠道微生物与免疫紧密相关
根据研究推测,先天免疫系统和适应性免疫系统在整个出生后生命中都随着宿主和肠道微生物群成分一起进化。胃肠道中微生物的最佳平衡被称为生态平衡;其特征是微生物、其次级代谢产物和宿主之间的平衡。然而,这种稳定性的变化称为生态失调,其特征是微生物多样性丧失、潜在有害细菌物种过度生长或对宿主有益的物种丧失。
此外,生态失调状态通常伴随着肠上皮屏障功能和渗透性的变化,从而改变个体的免疫反应和炎症状态。这种反应是由肠上皮固有层中的免疫成分精心策划的,这些成分负责检测肠道中微生物成分的变化,从而激活局部免疫反应,最终导致炎症。
★ 肠道微生物的代谢产物对宿主免疫和代谢健康也具有重要影响
反过来,宿主免疫系统的调节可能通过肠道微生物在宿主摄入的食物消化和发酵过程中产生的次级化合物发生。
次级化合物的一个例子是短链脂肪酸,它是肠道微生物和肠上皮细胞的能量来源,也是影响宿主生理和免疫系统的重要调节分子,被认为是具有抗炎特性的代谢产物。短链脂肪酸对肠上皮具有保护作用,调节上皮紧密连接蛋白的表达,并抑制多形核细胞、淋巴细胞或吞噬细胞的炎症反应。
类似地,次级胆汁酸,由肠道微生物代谢产生的化合物,具有保护和代谢作用,起到抗菌化合物的作用;它们还负责激活宿主中的免疫反应。
健康的微生物群还会产生维生素等有机化合物,这些化合物主要作为生物体内重要反应的催化剂,如能量转换。当肠道微生物成分发生变化时,这些重要化合物的合成发生变化,宿主的代谢也发生变化。
这些变化还与微生物群和周围组织之间通讯轴稳态的改变有关,例如大脑、心脏、肝脏、肾脏和肺,这些器官之前被研究发现受肠道微生物调节。
因此,影响肠道微生物建立和发展的因素也可能对人体产生系统性影响。事实上,由肥胖、癌症、高血压、糖尿病、抑郁症以及克罗恩病和帕金森病、自身免疫性疾病和心血管疾病等引起的宿主健康变化与肠道微生物成分的变化以及对人类宿主免疫反应或代谢特征的影响有关。
“外源物质”一词是指对生物体来说是外来的化合物,由人类活动产生,例如工业化学品、药物、农用化学品、食品添加剂等。环境污染物则定义为进入环境、累积超出自然水平、降低环境质量并对各种生物体有毒的化合物。
扩展阅读:
肠道菌群对药物毒性,重金属,污染物,膳食化合物的代谢和健康效应及应用前景
✦ 现代环境污染物越来越多,会对人体产生各种不利影响
现代生活方式伴随着农业、工业和自我护理过程中大量化学物质的使用,这些化合物由于使用和处置不当,可能导致水、土壤和空气的环境污染,这被认为是全球性的问题。
最常用和研究的环境污染物是农药、邻苯二甲酸盐、对羟基苯甲酸酯、金属和药物残留。
越来越多的证据表明,这些环境污染物会对免疫反应的正常功能以及内分泌、生殖和呼吸生理机能产生负面影响。
✦ 肠道微生物可能改善摄入的环境污染物毒性
有趣的是,肠道微生物群一个非常重要的功能与其代谢宿主生物体摄入的物质的能力有关。肠道微生物群可以改变各种物质的活性、分布和半衰期,产生宿主生物体无法自行产生的次生代谢物。
为了代谢和消除摄入的外源性物质,宿主生物体通常会进行化学结合、氧化和水解反应,而肠道微生物群则通过还原和水解转化、裂合酶反应和酶介导的官能团转移来修饰这些化合物。肠道微生物群可能导致宿主胃肠道中化合物的失活、激活或再激活,这突显了肠道微生物群在环境污染物代谢中的重要性。
考虑到肠道微生物群与环境污染物之间的相互作用是双向途径,一方面,污染物可以改变肠道微生物群的组成,从而改变其所执行的功能,另一方面,肠道微生物群具有以下能力:改变化合物的毒性,从而改变其对暴露个体的不良健康影响,本文主要讲述第二种作用,尽管研究仍然很少。
肠道微生物与环境污染物之间的双向关系
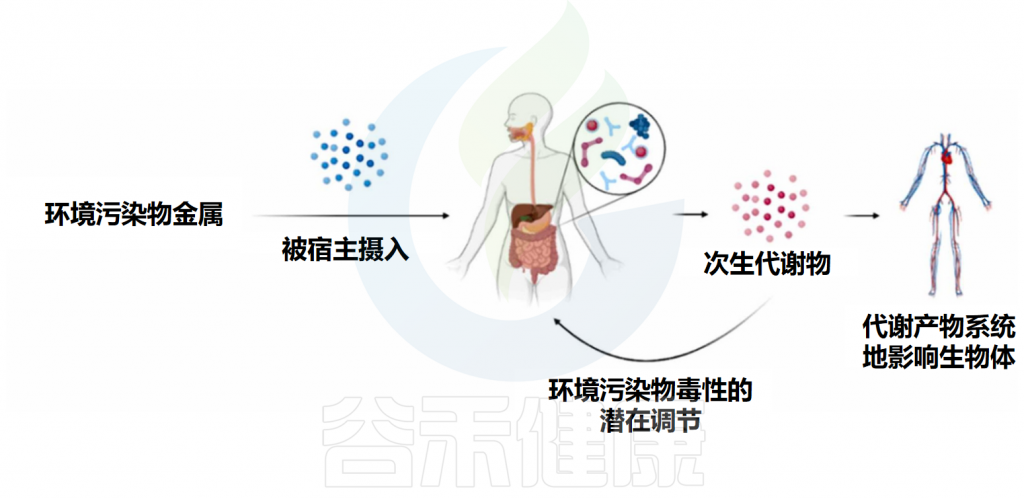
Santiago MSA,et al.Toxicology.2024
铅是一种耐蚀的重有色金属,常用于制造油漆、电池和电缆,并存在于一般环境中。一旦进入人体,铅就会对大脑和各种外周器官(肝脏、肾脏和骨骼)产生负面影响,并会在这些器官中累积多年。因此,铅可以影响重要的生物过程,包括内分泌、免疫、炎症和表观遗传反应。
根据美国毒物管理委员会(ATSDR),即使铅剂量非常低(≤5µg/dL),也可以观察到对健康的不利影响。
Santiago MSA,et al.Toxicology.2024
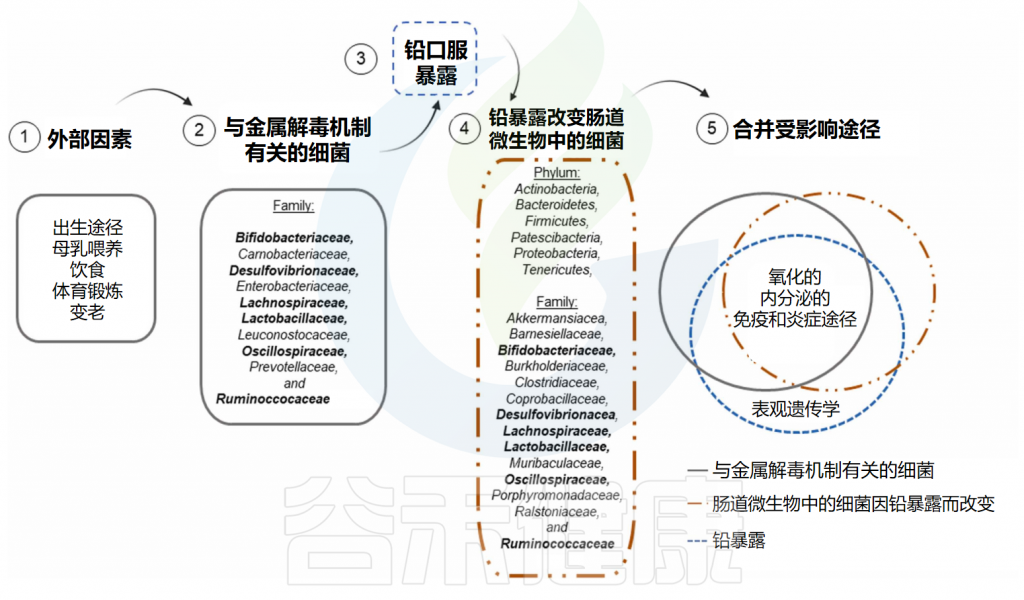
✦ 生态失调会加剧铅诱导的不良反应
影响人体和其他哺乳动物摄入铅的主要途径是摄入后胃肠道对铅的吸收和滞留,这取决于胃肠道内腔的微环境,特别是肠道微生物的特征。
动物暴露于不同剂量的铅(灌胃从20至1304毫克/公斤体重;饮用水中10微克/升至1.56克/升或100至 300ppm)以及治疗持续时间(从3天到28周)后,肠道微生物群的细菌特征发生变化。
与正常饮食(ND)喂养的动物相比,高脂肪饮食(HFD)喂养的动物因可能导致生态失调而出现加剧的铅诱导的不良反应,如组织中铅积累增加(结肠、肝脏、肾和胫骨)和组织学损伤(脂肪和肝组织),以及肠道微生物群组成的改变和许多其他结果。
✦ 铅浓度较高导致肠上皮渗透性增加
在临床环境中,中国电子垃圾回收区的土壤、水、空气、灰尘和植物中的铅浓度较高,发现生活在该区域的儿童肠上皮屏障渗透性增加 。
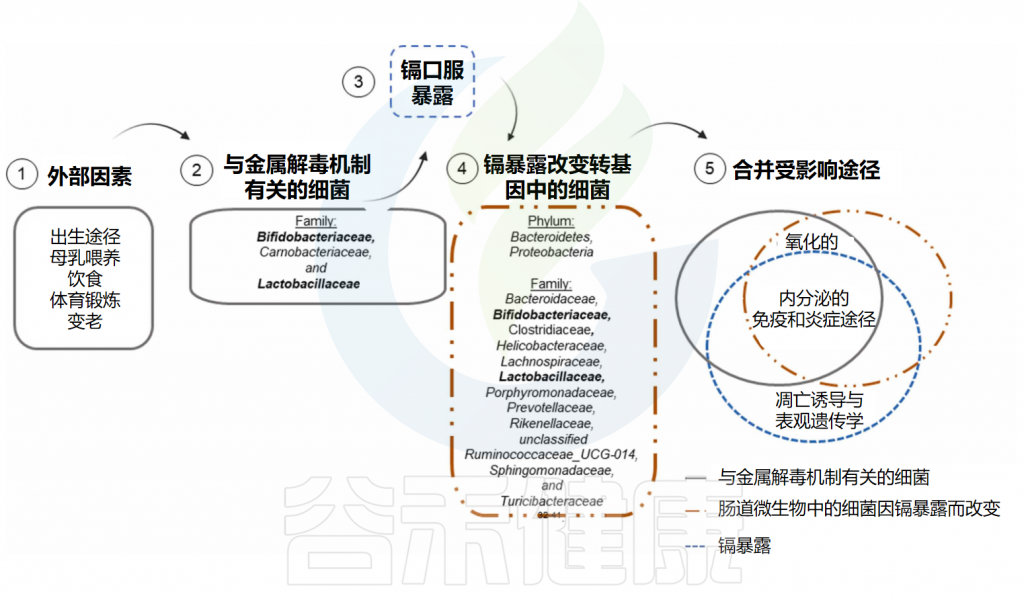
此外,暴露于铅正常饮食动物的肠道微生物群成分中,如脱硫弧菌属(Desulfovibrio)、罗氏菌属(Roseburia)和普雷沃氏菌(Prevotella)等细菌丰度增加,表明它们在调节铅毒性方面具有潜在相关性。
✦ 一些肠道细菌具有去除铅的能力对人体有益
最近,体外研究表明,99种乳酸菌菌株中至少有32种具有从培养基中去除铅(25ppm)的高能力。在这些微生物中,来自乳杆菌科(例如乳杆菌、魏斯氏菌和片球菌)或肉杆菌科(肉杆菌)的革兰氏阳性细菌被鉴定具有这种铅解毒的能力。
此外,来自双歧杆菌科(Bifidobacteriaceae)和肠杆菌科(Enterobacteriaceae)的细菌也表现出较高的铅去除能力,表明它们在暴露于铅的个体的肠道微生物中的多样性和丰度对于管理这种金属的毒性作用极其重要。
一些生物过程可能受到这些与铅解毒机制相关的细菌的影响,而铅暴露本身以及因暴露而改变的肠道微生物也可能影响相同的生物过程。
✦ 含有益生菌的膳食可减轻铅摄入的不利影响
临床前研究还表明,含有益生菌的膳食配方可减轻铅摄入引起的不利影响。在这些研究中,益生菌由单一革兰氏阳性菌组成,如鼠李糖乳杆菌、植物乳杆菌,或乳杆菌和双歧杆菌的组合、乳杆菌、双歧杆菌和链球菌、植物乳杆菌、罗伊氏乳杆菌或粪肠球菌,或与革兰氏阴性菌和Akkermansia muciniphila、Faecalibacter prausnitzii和Oscillibacter ruminantium,表明这些微生物在调节铅生物降解方面的潜在相关性。
大胆推测
这些结果提出了这样一个假设:口服某些类型的益生菌将有益于保护健康个体一生免受铅中毒的风险。其他类型的膳食补充剂,例如可溶性益生元低聚半乳糖、药用植物果实提取物溶液、源自蛹虫草的多糖以及高等植物中天然存在的绿原酸,也被建议用来减轻铅暴露对生物体的不利影响。
在膳食中添加益生元或益生菌来刺激已知调节铅解毒机制的细菌生长可能是对这些弱势群体的有益干预措施。这将是一个具有成本效益且无副作用的解决方案,也有助于缓解重要的公共卫生问题。
!
不足之处
迄今为止关于铅暴露和肠道微生物群成分的大多数研究都与铅如何影响肠道微生物群有关,而不是与肠道微生物如何影响和支持铅代谢有关。
有几点值得注意:除了表观遗传效应外,受铅暴露本身影响的生物过程与金属解毒机制相关的细菌以及受铅暴露改变的细菌调节的生物过程相同。因此,氧化、内分泌、免疫和炎症途径的损伤被认为在铅暴露个体中是重叠的,特别是在长期暴露中,这可能导致健康影响加剧,包括长期影响。
砷(As)是一种剧毒类金属,天然存在于水、土壤和沉积物中。砷中毒的主要来源是受污染的水和食物,无论是来自采矿和农业等人类活动还是自然保护区。
根据美国毒物管理委员会(ATSDR),砷的最低风险水平对于口服急性暴露(胃肠道结果)为0.005毫克/公斤/天, 对于口服慢性暴露(皮肤结果)为0.0003毫克/公斤/天。
✦砷暴露会导致人体肠道微生物组成改变、功能紊乱
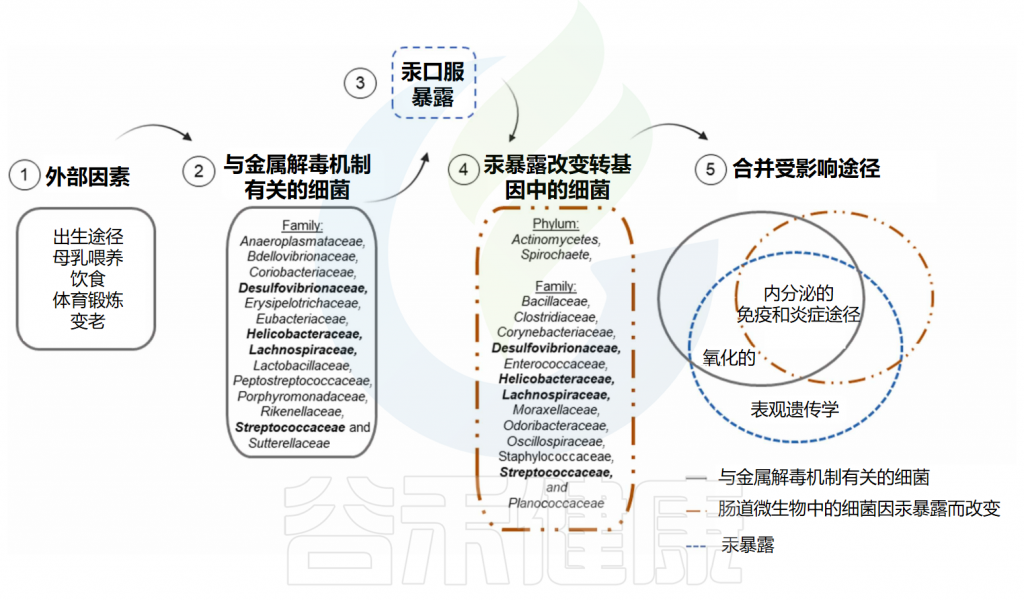
一些研究了砷暴露对肠道微生物群成分的影响以及对个人可能产生的后果。这些研究主要使用亚砷酸钠或无机砷,剂量范围为0.05至750mg/kg体重(灌胃、食物或皮下注射)、0.05ppm至100ppm(饮用水或灌胃)或0.05至80mg /L(饮用水)。观察到肠道微生物群组成的改变和代谢组的变化等。
在砷处理的动物中还观察到以下结果:肠道微生物群组成改变、肠道微生物群功能紊乱、短链脂肪酸水平改变等。在肠道微生物群耗尽的动物中更为突出,这表明肠道微生物在保护宿主暴露于砷中的重要性。
对动物进行腹腔注射砷治疗,证实肠道微生物群在砷代谢中发挥着重要作用。还观察到,诱发生态失调的动物在接触100ppm的亚砷酸钠10周后,肝脏和肾脏功能损伤增加,肝脏和肾脏中砷的积累增加。
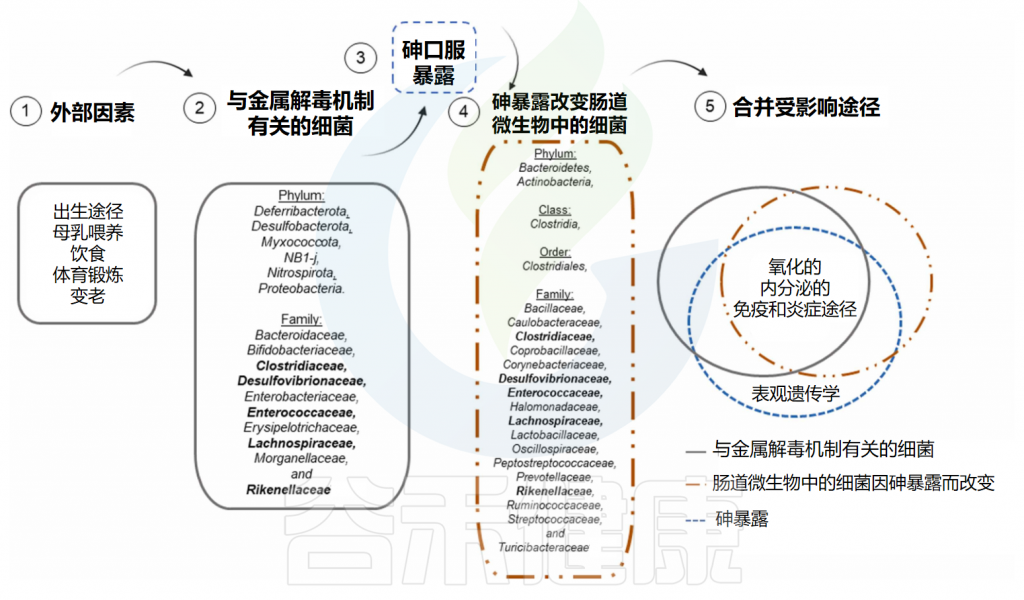
Santiago MSA,et al.Toxicology.2024
✦肠道微生物的生物转化可以减轻砷的危害
一些肠道微生物能够利用甲基化、去甲基化、氧化、还原和硫醇化反应来代谢和影响砷的生物转化。
将石墨烯给予暴露于砷的小鼠,通过改变肠道微生物群组成,从而改变了砷代谢。石墨烯减轻了砷引起的肠上皮结构改变、肠道和肝脏的氧化损伤以及其他不良反应,这表明石墨烯可能是砷暴露时的补充目标。
此外,暴露于亚砷酸盐的Beclin1+/-小鼠也表现出结果的减轻,例如肠道微生物群成分改变、脑组织学改变(神经元细胞形状异常、细胞核萎缩和断裂)、焦虑样行为等,表明抑制自噬也可能是预防砷引起的肠道微生物群干扰的一种方法。
✦ 影响砷代谢和转化的细菌
上图显示了肠道微生物群中一些特定的细菌物种在砷暴露后发生变化,这些细菌与重要的生物途径有关,这些途径与负责砷解毒机制的细菌和砷暴露本身调节的途径相同。 Alistipes、Bilophila和Clostridia是接触砷后发生变化的细菌,推测参与砷代谢和消除。
因此,这些细菌可能是干预策略的目标物种,例如在与砷暴露有关的地区中进行益生菌补充。乳酸杆菌和双歧杆菌是在体外具有生物转化砷能力的细菌,这表明它们也可能作为益生菌使用。
值得注意的是,除了表观遗传学外,砷暴露后受影响的所有其他过程(即氧化平衡、内分泌和免疫调节以及炎症反应)也受到参与砷解毒机制的细菌以及砷暴露后改变的细菌的调节。这些生物过程可能在砷暴露后受到长期影响,并产生长期影响,正如已经讨论过的铅一样。
镉(Cd)是一种毒性广泛的金属,导致人体生理发生许多变化。人类接触镉的主要来源是从受污染的土壤和水中摄入谷物和蔬菜。镉通过内分泌和免疫系统调节、炎症、先天、适应性和粘膜免疫反应的调节、DNA修复机制的损伤、氧化应激、细胞凋亡的诱导和表观遗传学的变化来发挥其毒性。
根据ATSDR(2024),口服中等暴露(肌肉结果)的镉最低风险水平为0.0005毫克/公斤/天 ,口服慢性暴露(肾脏结果)的最低风险水平为0.0001毫克/公斤/天。
✦ 镉暴露会导致肠上皮损伤、代谢紊乱
据描述,肠道微生物在摄入镉后的代谢中起着关键作用。在啮齿类动物的研究中,镉暴露与肠道微生物群成分的改变以及肠上皮屏障的损伤有关(通过Ocln、Cldn-1、Cldn-4、ZO-1的表达和 FITC-葡聚糖的血清水平的改变来证明),代谢谱(主要是氨基酸、多胺、长链脂肪酸、短链脂肪酸、核苷酸、糖、吲哚衍生物等)的紊乱和其他不良影响。
在这些研究中,氯化镉是所用镉的主要形式,剂量范围为0.25至85mg/kg(灌胃或腹腔注射),或150μg/L至100mg/L(饮用水),或50至100ppm(饮用水),暴露时间从5天到52周不等。
✦ 肠道微生物在镉代谢中发挥重要作用
暴露于镉的动物,与高脂肪饮食或阿尔茨海默症的遗传风险因素——这两个因素都已知会改变肠道微生物成分,对镉暴露的反应加剧。不良反应包括肠道微生物成分的改变、代谢途径的紊乱(通过改变KEGG直向同源物证明)以及肝脏和肾脏损伤。这些数据表明了健康微生物群在镉代谢方面的重要性。
关于补充益生菌,革兰氏阳性菌如植物乳杆菌CCFM8610、植物乳杆菌BGAN8、P. pentosaceus GS4、P. distasonis和革兰氏阴性A.muciniphila MucT、B. cepacia被证明可以减轻镉暴露对生理的影响。
细菌介导的镉消除具有菌株特异性
在一项225种细菌菌株混合物去除镉的体外研究中,细菌介导的镉去除被证明具有门、属和菌株特异性,其中革兰氏阳性菌为短双歧杆菌 FPL 19317、L.sakei DMS 20017、Carnobacters divergens V41、Pediococcus Acidilacici DSM 19927和Pediococcus claussenii DSM 14800表现出高镉 去除能力。
众所周知,外部因素可以改变肠道微生物中的一些细菌,从而影响宿主生物体的镉代谢、解毒和排泄能力。已知一些特定的细菌菌株在接触镉后会发生变化,这些细菌也与镉解毒有关,参与许多生物过程,如下图所示。
迄今为止的研究认为Pediococcus pentosaceus GS4 、植物乳杆菌CCFM8610和鼠李糖乳杆菌-发酵灵芝——是作为未来减轻镉毒理学有前途的物种。
Santiago MSA,et al.Toxicology.2024
除了细菌补充外,有证据表明还有其他方法可以减轻镉毒性,例如膳食补充低聚果糖、绿原酸和褪黑激素,可以间接促进肠道微生物群稳态。
汞(Hg)污染的主要来源是通过汞蒸气(污染物全球分布的主要途径)、通过受污染的土壤和水(使汞进入食物链)以及通过颜料等受汞污染的产品。
汞是毒性方面研究最多的金属之一,主要以无机汞(IHg)和甲基汞(MeHg)形式存在。有机汞在胃肠道中被吸收,然后分布到全身。
根据ATSDR(2024),口服急性暴露(肾脏结果)的IHg最低风险水平为2ug/kg/天,口服中间暴露(肾脏结果)的最低风险水平为0.01ug/kg/天,而MeHg的最低风险水平为0.1ug/kg/天口服慢性暴露(神经系统结果)。
✦ 汞影响人体的内分泌、免疫,扰乱代谢
许多研究已经报道汞影响生物体的重要途径,例如内分泌和免疫系统调节、炎症、氧化应激和表观遗传学,还提出了通过肠道微生物进行甲基汞代谢的间接途径,该途径主要增强肠道屏障功能,即肠道通透性,以防止甲基汞的再摄取。
从啮齿动物研究中可以推断,汞暴露会改变肠道微生物群组成,并扰乱代谢途径(与核苷酸、碳水化合物、氨基酸和脂质的代谢、肠道免疫系统和神经系统等相关)、肠道(细胞坏死、肠上皮改变、炎症细胞等)、肝脏(主要是炎症细胞浸润)和脑(具有小尺寸深染和浓缩细胞核的锥体细胞)的组织学变化。
✦ 通过改善肠道微生物有助于汞解毒
根据人类和动物研究,已知一些细菌种类在汞解毒中发挥重要作用。值得注意的是,外部因素可以改变肠道微生物中这些细菌的多样性和丰度,并且据报道这些细菌可以调节许多生物过程。
此外研究发现,在喂食补充低聚果糖的饮食后接触汞的小鼠,粪便中的汞含量增加,组织中的汞含量降低,这表明汞排泄有所改善。
研究还发现白藜芦醇治疗可以减轻汞引起的大鼠后果,例如肠道微生物成分的恢复、神经发育障碍、肠道和大脑组织学改变以及汞积累。
而使用抗生素治疗后暴露的汞(已知会导致生态失调)会降低粪便中的汞含量,并增加血液中的汞含量,这强化了肠道微生物在汞解毒机制和排泄中的重要作用。
Santiago MSA,et al.Toxicology.2024
合理建议
关于汞暴露后减轻不利影响的可能干预行动的研究很少。在这种情况下,可以假设螺旋杆菌科(Helicobacteraceae)、丹毒丝菌科(Erysipelotrichaceae)和消化链球菌科(Peptostreptococcaceae)可能是针对接触汞的个体进行补充的目标细菌家族,这些细菌被发现受到汞暴露的影响,并且也参与汞解毒机制。并开始采取一些举措来减轻汞对弱势群体的毒性影响,比如生活在淘金区的人,应定期进行医学检查,以早期发现和治疗汞中毒。
在本文提出的四种金属中,汞是关于汞暴露后潜在的益生元、益生菌或其他补充剂的研究较少的金属。因此,需要更多的研究来确定与汞暴露有关的潜在补充目标。
大多数研究都提到了金属可能对肠道微生物群造成的不利影响,然而肠道微生物细菌如何通过参与金属的代谢来影响金属毒性的研究却较少。
由于肠道微生物群可以改变摄入化合物的活性和反应性,因此肠道微生物群成为减轻异生物质(例如环境污染物)毒性的可能策略的重要研究目标。肠道微生物与环境污染物毒性调节之间关系的机制仍有待更好地阐明。
值得注意的是,除了肠道微生物生态失调之外,接触金属通常还与其他威胁有关,例如神经、内分泌、免疫和生殖损伤。除了已知的金属对这些目标系统的直接毒理学影响外,观察到的不利影响可能是由于直接和间接损害的重叠造成的,因为受影响的肠道微生物还可以通过以下方式调节这些目标系统的生理学:胃肠道和这些器官之间的通讯轴。这可能意味着暴露于重金属的个体生理方面会受到长期损害。
一些受金属接触影响的细菌与负责金属代谢的细菌可能存在重叠,并且容易因金属暴露而发生改变。因此长期暴露于金属污染的个体可能会逐渐变得更加脆弱。此外,深入了解肠道微生物对有毒金属的影响可以被认为是确定未来治疗方法中能够最小化金属毒性的有益物种的关键因素。需要进一步的研究来阐明可能涉及的新机制,以及可能的补充缓解策略,特别是在生活在污染地区的人群。
主要参考文献
Could the gut microbiota be capable of making individuals more or less susceptible to environmental toxicants?
Al Osman M, Yang F, Massey IY. Exposure routes and health effects of heavy metals on children. Biometals. 2019 Aug;32(4):563-573.
Balali-Mood M, Naseri K, Tahergorabi Z, Khazdair MR, Sadeghi M. Toxic Mechanisms of Five Heavy Metals: Mercury, Lead, Chromium, Cadmium, and Arsenic. Front Pharmacol. 2021 Apr 13;12:643972.
Dai Z, Liu J, Yao X, Wang A, Liu Y, Strappe P, Huang W, Zhou Z. Association of gut microbiota characteristics and metabolites reveals the regulation mechanisms under cadmium consumption circumstance. J Sci Food Agric. 2022 Nov;102(14):6737-6748.
Iljazovic A, Amend L, Galvez EJC, de Oliveira R, Strowig T. Modulation of inflammatory responses by gastrointestinal Prevotella spp. – From associations to functional studies. Int J Med Microbiol. 2021 Feb;311(2):151472.
Li D, Yang C, Xu X, Li S, Luo G, Zhang C, Wang Z, Sun D, Cheng J, Zhang Q. Low dosage fluorine ameliorates the bioaccumulation, hepatorenal dysfunction and oxidative stress, and gut microbiota perturbation of cadmium in rats. Environ Pollut. 2023 May 1;324:121375.
Ortigão R, Pimentel-Nunes P, Dinis-Ribeiro M, Libânio D. Gastrointestinal Microbiome – What We Need to Know in Clinical Practice. GE Port J Gastroenterol. 2020 Aug;27(5):336-351.

谷禾健康

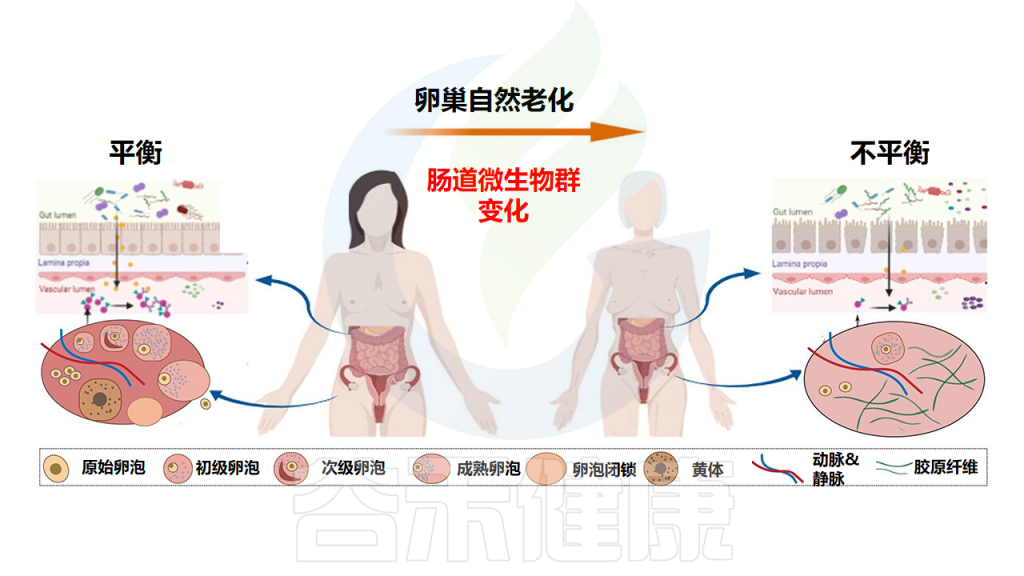
卵巢的衰老发生在其他器官系统的衰老之前,可以看作是多个器官衰老过程的“起搏器”。随着预期寿命的延长,预防卵巢衰老已成为促进女性延长生殖功能、改善与卵巢衰老相关的骨骼和泌尿生殖系统状况的重要目标。
卵巢衰老是指卵巢功能随着年龄的增长而逐渐衰退。其特点是卵母细胞数量和质量逐渐恶化,并伴有月经周期不规律、不孕,最后导致月经停止。
卵巢的寿命与其他器官不同。最近,多组学分析发现,女性在三十岁和五十岁左右的生物衰老显著加速,这与生育能力下降和更年期状态的时间点相一致。
随着全球预期寿命的延长,卵巢衰老将逐渐成为女性的主要健康问题。卵巢衰老是一个极其复杂的过程,包括,性激素的水平,促卵泡激素(FSH)、黄体生成素(LH)和抗缪勒管激素(AMH)等。此外,近年来越来越多的证据表明肠道微生物群与卵巢功能之间存在联系,肠道微生物群-卵巢轴有助于卵泡发育。肠道微生物群的组成和功能特征的改变对卵巢功能具有深远的影响。肠道微生物群和卵巢之间的相互作用是双向的。
本文带大家综合了解卵巢-微生物群串扰的不同方面,并提供有意义的结论。另外还尝试解释微生物群在一些抗衰老方法中的潜在作用。
在人类衰老以及与年龄相关的疾病中,优势微生物的特性、细菌多样性和功能特征发生了显著变化。最近的一项研究表明,体内存在多个“时钟”:器官/系统以不同的速度老化,并且特定器官或系统的老化速度与肠道微生物组的老化速度相关。因此,个体可能会表现出不同的健康或疾病状态。
肠道微生物特征可用于预测老年人的健康衰老或死亡率。有趣的是,小鼠实验表明,老年供体微生物群的移植会加速受体中与年龄相关的大脑退化的特定过程,相反,年轻供体微生物群的移植可以逆转这种情况。有人建议,肠道微生物群可以作为新的抗衰老干预措施的潜在治疗靶点。
更年期是卵巢自然衰老的标志事件。自然更年期多发生在49岁至52岁之间。随着卵巢卵泡的有限储备耗尽,剩余卵泡失去对促性腺激素的敏感性,卵泡停止发育和分泌卵巢激素雌激素和黄体酮。
雌二醇(E2)水平仅在围绝经期过渡过程相对较晚的情况下下降。然而,在最后一个月经周期期间,血浆E2水平急剧下降,绝经后卵巢停止合成E2。
√ 肠道微生物是循环雌激素的重要调节因子
肠道微生物 β-葡萄糖醛酸酶(gmGUS)可以将雌激素从失活形式转化为活性形式,并进一步影响宿主体内的雌激素水平。
肠道微生物群失调和微生物多样性降低会导致gmGUS减少和全身雌激素改变。反过来,肠道细菌也受到雌激素的影响。据报道,据报道,两个细菌类群的相对丰度,即γ-变形菌纲(Gammaproteobacteria)和Mixococcales目中的一个未知科,与雌二醇水平呈正相关,而普雷沃氏菌科(Prevotellaceae)的丰度与雌二醇水平呈负相关。
√ 雌激素也能发挥微生物调节作用
此外,雌激素或雌激素样化合物在患有代谢综合征的小鼠中发挥微生物组调节作用并维持肠道上皮屏障完整性。在绝经后妇女中,补充大豆异黄酮等类雌激素食物可增加双歧杆菌属(Bifidobacterium)和真杆菌属(Eubacterium )的丰度,同时抑制乳杆菌属 (Lactobacillus)和未分类的梭菌科细菌。
在某些病理条件下,肠道微生物群失调和gmGUS 活性升高可能通过参与内源性和外源性雌激素样化合物的循环或激活,导致雌激素驱动的疾病和更年期相关疾病的发生。
√ 更年期的变化影响女性肠道菌群及其代谢
众所周知,更年期状态会影响肠道微生物群。不同绝经状态的女性肠道微生物群的组成和功能特征的差异已经有报道,如下所述。
观察到绝经前(n=44)和绝经后(n=45)女性之间总共有90个差异丰富的分类群 ,与绝经后女性相比,绝经前女性与叶酸途径相关的嘧啶和碳库更加丰富。
罗氏菌属(Roseburia)被确定为区分绝经前群体(n=17)和绝经后群体(n=20)的显著的细菌分类群,并且观察到绝经前妇女的丙酸和丁酸代谢较高。
还有研究发现绝经后女性(n=24)的微生物组α多样性显著低于绝经前女性(n=24),厚壁菌门(Firmicutes)和罗氏菌属(Roseburia)丰度较低,而拟杆菌门(Bacteroidetes)和甲苯单胞菌属(Tolumonas)在绝经后妇女中被富集,绝经后妇女的同型半胱氨酸合成相关过程被激活。
在动物模型中,也描述了卵巢衰老引起的肠道微生物群的变化。4-乙烯基环己烯二环氧化物(VCD)是一种化学物质,可直接杀死卵巢的原始卵泡和初级卵泡,但对卵巢外组织没有毒性,可诱导卵巢衰老,类似于自然卵巢衰老。研究人员确定,VCD组和对照组小鼠在α多样性和β多样性上都存在显著差异。
VCD组占主导地位的微生物群中,包括幽门螺杆菌、Odoribacter和另枝菌属(Alistipes)水平较低,而梭菌XIVa群(Clostridium XIVa)、巴恩斯氏菌(Barnesiella)、拟杆菌属和Mucispirillum属的水平较高。
随着雌性的年龄增长,肠上皮恶化,导致微生物群负荷增高、屏障功能受损和寿命减短。
肠道微生物群在卵巢自然衰老过程中的生理演替
Huang F,et al.Gut Microbes.2024
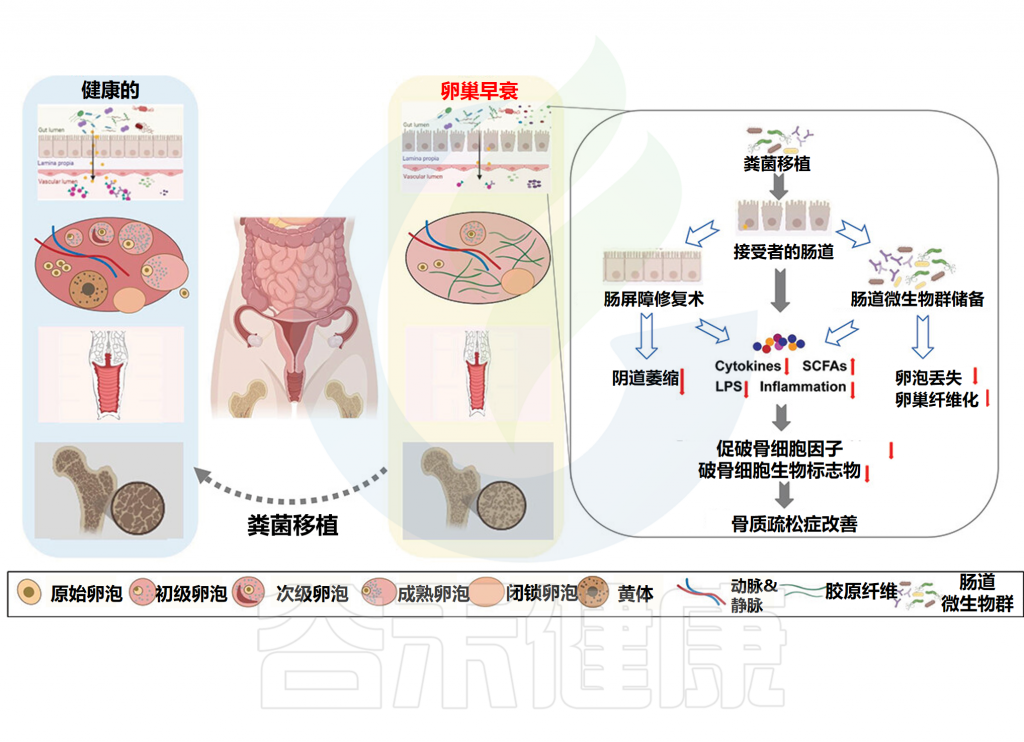
为了进一步探讨肠道微生物群与卵巢自然衰老之间更复杂、更深入的因果关系,将粪便微生物群移植(FMT)应用于自然衰老的小鼠。使用来自年轻供体 (5周龄)FMT治疗的老年小鼠(42周龄)肠道微生物组呈现出“年轻动物样表型”,卵泡闭锁和细胞凋亡减少,从而提高了老年小鼠的生育能力。
这些卵巢衰老延迟效应可能是通过改善炎症状态和免疫微环境来解释的。老年斑马鱼的大量证据也证明了年轻微生物群对生殖调节的影响。从年轻供体到老年斑马鱼的FMT可以抵消随后接触有毒污染物的不利影响,有效降低膜结合孕激素受体转录物的水平,促进卵子发生的进展,并降低有毒污染物引起的畸形率,及其后代表现出更强的运动能力并且游得更快。
总体而言,在卵巢衰老过程中维持“年轻”的肠道微生物群可能会限制卵巢衰老并提供额外的好处。
人群中的一些女性并非卵巢自然衰老,而是卵巢功能过早衰退,即卵巢早衰(POI)。POI 是一种临床综合征,定义为40岁以下患者正常卵巢活动衰竭,表现为月经失调(闭经或月经稀发),促性腺激素水平升高和雌二醇水平低。
据估计,全球患病率高达3.7%,而30岁以下女性和20岁以下女性中分别有0.1%和0.01%患有该病。卵巢早衰因其对生育能力的不利影响以及随之而来的负面健康影响而引起公众关注,例如心血管疾病风险增加、认知障碍、情绪和性功能障碍、骨质疏松症和预期寿命缩短。
卵巢早衰是一种高度异质性的病症,70%至90%的卵巢早衰病例除了已知的遗传、自身免疫、感染和医源性因素外,病因不明,即特发性卵巢早衰。最近,越来越多的证据表明肠道微生物群失调与卵巢早衰相关。在本节中,我们回顾当前肠道菌群与卵巢早衰之间联系的研究,重点关注特发性卵巢早衰、医源性卵巢早衰和卵巢早衰驱动的疾病。
√ 卵巢早衰患者β多样性减少
研究注意到,卵巢早衰患者的β多样性有所减少。在门层级,观察到卵巢早衰患者中拟杆菌门(Bacteroides)的丰度较高,而厚壁菌门(Firmicutes)的丰度较低。
而在属(genus)层级,与健康女性(n=18)相比,卵巢早衰患者(n=35)中的丁酸弧菌(Butyricimonas)、Dorea、Lachnobacterium和萨特氏菌(Sutterella)的丰度较高,而Bulleidia和普拉梭菌(Faecalibacterium)的丰度较低。
此外,与对照组(n=10)相比,在卵巢早衰(POI)患者(n=10)中,观察到埃格氏菌属(Eggerthella)和葡萄球菌属(Staphylococcus)的丰度降低,而Comamonas和巴恩斯氏菌(Barnesiella)的丰度增加。
这些微生物变化与卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和抗米勒管激素(AMH)的水平以及FSH/LH比值相关。
√ 健康的肠道微生物可能保护卵巢
激素替代疗法(HRT)是推荐用于卵巢早衰(POI)女性的治疗方法,既可用于症状管理也可用于疾病预防。与POI相关的β多样性变化、埃格特氏菌属(Eggerthella)相对丰度、血清代谢物以及雌二醇和孕酮激素水平,在实施HRT后显著逆转,这进一步验证了雌激素和肠道微生物之间的相互作用。
动物实验证实,E. lenta灌胃可诱导小鼠卵巢纤维化,而雌激素治疗可缓解卵巢纤维化。
综上所述,这些研究结果显示,肠道微生物群失调,如核心微生物群Lachnoclostridium和拟杆菌属扰动,短链脂肪酸产生菌Bacteroides和Faecalibacterium的减少,以及机会致病菌如埃格特氏菌属(Eggerthella)的增加,可能参与了原发性卵巢功能衰竭(POI)的病理生理过程。
肠道微生物群的逆转可能在一定程度上成为新的卵巢保护策略。尽管卵巢早衰与肠道微生物存在潜在关联,但这种关系的因果性仍需深入研究。
如上所述,大多数卵巢早衰病例是特发性的。但在少数已知原因的病例中,医源性因素占很大比例。许多医疗因素会损害肿瘤患者的卵巢功能,例如盆腔放疗、化疗和手术,这可能导致卵巢功能过早衰退甚至完全丧失。
√ 接受过卵巢手术的患者发生卵巢早衰概率较高
治疗剂量越高、照射面积越大、手术面积越大,对卵巢功能的影响就越大。接受过卵巢手术,尤其是腹腔镜手术的患者是医源性卵巢早衰的主要人群。由于医源性卵巢损伤,骨质流失和泌尿生殖系统萎缩是许多年轻癌症患者和术后妇女面临的两大挑战,严重影响了她们的整体生活质量。
一项研究对接受不同抗癌治疗的卵巢癌患者肠道微生物群的变化进行了分析,发现与手术后样本相比,拟杆菌门和厚壁菌门的丰度显著下降,变形菌门的丰度显著增加。然而,使用化疗呈现出了不一样的结果。与化疗前相比,化疗后的样本显示出拟杆菌门和厚壁菌门的丰度显著增加,变形杆菌门的丰度降低。
√ 肠道微生物群的变化与医源性卵巢早衰有关
根据卵巢切除(OVX)小鼠模型的许多研究显示,医源性绝经可能影响肠道微生物。在OVX组和假手术组的肠道微生物之间观察到β多样性和α多样性有显著差异。几项研究发现,OVX组在门水平上厚壁菌/拟杆菌比例更高,变形菌相对丰度更低。
双侧卵巢切除术是构建医源性更年期动物模型最成熟的方法,已广泛应用于更年期及绝经相关研究,如绝经期骨质疏松症、泌尿生殖系统萎缩等。
在属水平上,假手术组中优势属的丰度在OVX组中显著下降(87%VS29%)。相反,假手术组中丰度较低的属在OVX组中显著富集(<5%VS63%)。
在卵巢切除大鼠中确定了四个重要的关键属:Incertae Sedis、Anaerovorax、Anaerotruncus和Helicobacter。此外,卵巢切除组表现出明显的体重增加、肠屏障受损、骨丢失和阴道萎缩。
√ 补充益生菌有助于预防和治疗卵巢早衰
肠道微生物群对于卵巢切除诱导的破骨细胞分化是必不可少的。
厚壁菌门和拟杆菌门的比例对于破骨细胞分化至关重要,补充来自厚壁菌菌门的益生菌唾液乳杆菌(Lactobacillus salivarius LI01)可以预防卵巢切除诱导的骨质疏松症。
而来自卵巢完整小鼠的粪菌移植抑制了卵巢切除诱导的肠道微生物群变化和体重增加,抑制了促破骨细胞因子的释放,增加了粪便短链脂肪酸水平(主要是乙酸和丙酸),降低了肠道通透性,并最终防止了卵巢切除引导的骨丢失。
令人惊讶的是,来自卵巢完整的可育雌性的粪菌移植改变了卵巢切除小鼠的肠道微生物群,并显著缓解了阴道上皮萎缩。总的来说,粪菌移植可能是预防和治疗医源性卵巢早衰及相关后果的一个有前途的方案。
粪菌移植改变肠道微生物群并减缓卵巢衰老相关疾病
Huang F,et al.Gut Microbes.2024
迄今为止,还没有临床上可行的技术可以延迟或逆转与高龄相关的卵巢功能障碍。然而,过去几十年来,抗卵巢衰老领域取得了重要进展,出现了许多新兴的抗衰老药物,如辅酶Q10(CoQ10)、褪黑激素、烟酰胺单核苷酸(NMN)、白藜芦醇、雷帕霉素和N-乙酰基-L-半胱氨酸(NAC)已显示出延缓卵巢衰老的巨大潜力。
虽然没有研究直接探讨这些抗衰老药物、卵巢功能和肠道微生物群之间的关系,但一些间接证据表明这些药物的有益作用可能与肠道微生物有关。如图所示表格,这些药物可能通过肠道微生物发挥作用。

Huang F,et al.Gut Microbes.2024
1
辅酶Q10
辅酶Q10(CoQ10)是一种脂溶性的,类似维生素的苯醌化合物,在细胞能量生产中起关键作用,并且以还原形式起抗氧化剂的作用。
• 给予CoQ10改善卵巢反应
随着年龄的增加,CoQ10的合成似乎会下降,这与生育力和卵子质量下降的时间点一致。在生育治疗期间预先给予CoQ10可以改善卵巢储备减少的年轻患者的卵巢反应和胚胎质量。
在小鼠中,CoQ10治疗不仅保留了卵巢卵泡储备,还促进了能支持正常发育的配子的排卵。CoQ10的饮食补充对老年母鸡、高胎次妊娠母猪和红罗非鱼引用的生殖变量也有益效果。然而,在接受辅助生殖技术的不孕妇女中,CoQ10增加了临床妊娠率,但对活产率或流产率没有影响。
• CoQ10影响肠道微生物群组成,保护肠道屏障
CoQ10还影响肠道微生物及其产生的后续生物标志物。给予CoQ10 3周结果使瘤胃球菌(Ruminococcus)和Lachnospiraceae AC 2044群的相对丰度分别增加2.4倍和7.5倍,以及丁酸盐增加了1.26倍。
富含CoQ10的南瓜汁灌胃增加了小鼠肠道中乳酸菌和双歧杆菌的丰度,并通过减少变形菌门进一步保护了肠道屏障。
2
褪黑素
作为一种强大的抗氧化剂,褪黑素已被证明可以延缓雌性动物生育力的衰退。氧化应激被认为是卵巢老化的关键因素,它加速卵泡的损失和闭锁,同时也伴有显著的肠道微生物群失调。
• 褪黑素的抗氧化作用可以延缓卵巢老化
而褪黑素可以逆转氧化应激导致的表型,并改善肠道微生物群落。在小鼠身上,褪黑素治疗不仅显著增加了卵子的数量和质量,而且在体外受精后产生了更多的囊胚,产仔数也比对照组的更多。
褪黑素可能增加老年产蛋母鸡的雌二醇和黄体生成素水平,以及免疫球蛋白的水平和生长卵泡的数量。褪黑素预处理减少了厚壁菌门的丰度和厚壁菌门与拟杆菌门的比例,并在门的层面上增加了拟杆菌门的含量。
• 口服褪黑素可以逆转高脂饮食导致的菌群失调
此外,口服褪黑素补充剂显著逆转了高脂肪饮食诱导的肠道微生物群失调,包括肠道微生物群的α多样性降低,拟杆菌属和Alistipes属的相对丰度降低,以及乳杆菌目和乳杆菌属的相对丰富度增加。
褪黑素治疗小鼠粪菌移植后乙酸产生与拟杆菌属和Alistipes属的相对丰度之间的显著相关性表明,肠道微生物群重编程可能是褪黑素治疗的潜在机制。
扩展阅读:
3
烟酰胺单核苷酸
“NMN”是“烟酰胺单核苷酸”(Nicotinamide Mononucleotide)的缩写。它是细胞内 NAD+(烟酰胺腺嘌呤二核苷酸)的前体物质之一。
NAD+是一种重要的辅酶,存在于所有活细胞中,对于能量代谢、DNA修复、基因表达调控以及细胞信号传递等生命过程都至关重要。
随着年龄的增长,人体内NAD+的水平会逐渐下降,这与多种衰老相关的疾病有关。NMN作为一种补充剂,通过提高体内NAD+的水平,有望改善与衰老相关的各种生理功能下降,增强细胞的活力和代谢功能,因此被广泛研究作为抗衰老和提升健康寿命的潜在治疗方法。
• 延缓卵巢衰老,提高卵母细胞质量
NMN是另一种有前途的抗卵巢衰老药物。随着生殖衰老,卵母细胞质量的下降伴随着烟酰胺腺嘌呤二核苷酸(NAD+)水平的下降,作为NAD+生物合成的中间体,可以通过补充NMN来补偿,发挥延缓卵巢衰老的作用。
中年小鼠口服 NMN 20 周,改善发情周期状况,增加不同阶段卵泡数量以及黄体和血清FSH,与对照处理相比增强颗粒细胞(GCs)线粒体生物发生、自噬和蛋白酶活性。
在高脂饮食诱导的卵巢早衰小鼠中,给予 NMN 可以减少卵巢炎症和腹部脂肪组织的脂肪大小,并提高卵母细胞质量。NMN 处理增加了产生丁酸的细菌属的丰度,如Ruminococcae UCG-014, Prevotellaceae NK3B31 group 和 Akkermansia muciniphila,同时降低了几种有害细菌属的丰度,如Oscillibacter和嗜胆菌属(Bilophila)。NMN 还减少肠粘膜损伤并维持粘膜屏障完整性。
4
白藜芦醇
在谷禾菌群检测报告中,有很多菌的调节措施中给了白藜芦醇。白藜芦醇是一种天然多酚类化合物,可以延缓卵巢衰老并预防与年龄相关的不孕症,它还能够恢复微生物群的组成,并逆转肠道菌群失调。
• 白藜芦醇提高短链脂肪酸浓度并调节卵巢功能
一项研究揭示,白藜芦醇改善了氧化应激引起的产卵率下降和血清激素水平变化,以及肠道微生物群失调,并提高了产蛋母鸡体内主要短链脂肪酸的浓度。
这项研究直接证明了白藜芦醇通过肠道微生物调节卵巢功能。富集的微生物群,包括拟杆菌、Lachnospiraceae NK4A136群、Blautia、Lachnoclostridium,Parabacteroides和Ruminiclostridium 9(统称为白藜芦醇微生物群),显示出抗肥胖功能。
5
雷帕霉素
哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路在女性生殖细胞的卵泡发生中发挥着至关重要的作用。已有报告称,卵巢早衰患者激活了AKT/mTOR信号通路。
在高脂饮食诱导的卵巢早衰小鼠中抑制mTOR信号,逆转了卵泡丢失并延长了卵巢寿命。
• 雷帕霉素延长卵巢寿命,改善卵子质量
雷帕霉素是一种最初从细菌中分离出来的天然大环内酯化合物,作为TOR信号的抑制剂。雷帕霉素治疗增加了卵巢储备,并延长了卵巢寿命,特别是在老年小鼠中,改善了卵子质量。
在环磷酰胺诱导的卵巢早衰模型中,雷帕霉素防止了原始卵泡的损失,并保护了卵巢储备。在雷帕霉素处理的小鼠中观察到分段丝状细菌水平的显著增加。
然而,尽管雷帕霉素挽救了果蝇的肠道屏障功能障碍并增加了微生物负荷,但其抗衰老效果似乎与肠道微生物群无关。
6
乙酰氨基酚
乙酰氨基酚(NAC)有助于刺激谷胱甘肽的合成,发挥抗氧化作用。一项在小鼠身上进行的研究提出,NAC的给药可以改善植入前卵子的质量,并增加囊胚总细胞数和窝仔数,从而延缓生殖老化带来的生育能力下降。
NAC通过促进几种有益细菌的生长并影响肠道细菌的代谢途径,缓解了高脂饮食小鼠的肠道菌群失调。
总的来说,关于NAC治疗对生殖老化和肠道微生物群影响的证据是罕见的,需要进行与生育相关的研究来评估NAC给药的效果。
除了抗衰老药物之外,抗衰老饮食似乎是更受欢迎的选择,其中热量限制目前被认为是最可重复的策略。热量限制是指减少能量摄入,但不会导致营养不良或缺乏必需营养素。
作为抗衰老饮食的主导范式,其延长寿命的效果已被广泛认可。在过去的几十年里,人们关注了热量限制对生殖和肠道微生物群的影响(见下表)。
热量限制调节卵巢功能

Huang F,et al.Gut Microbes.2024
热量限制引起的肠道微生物群变化
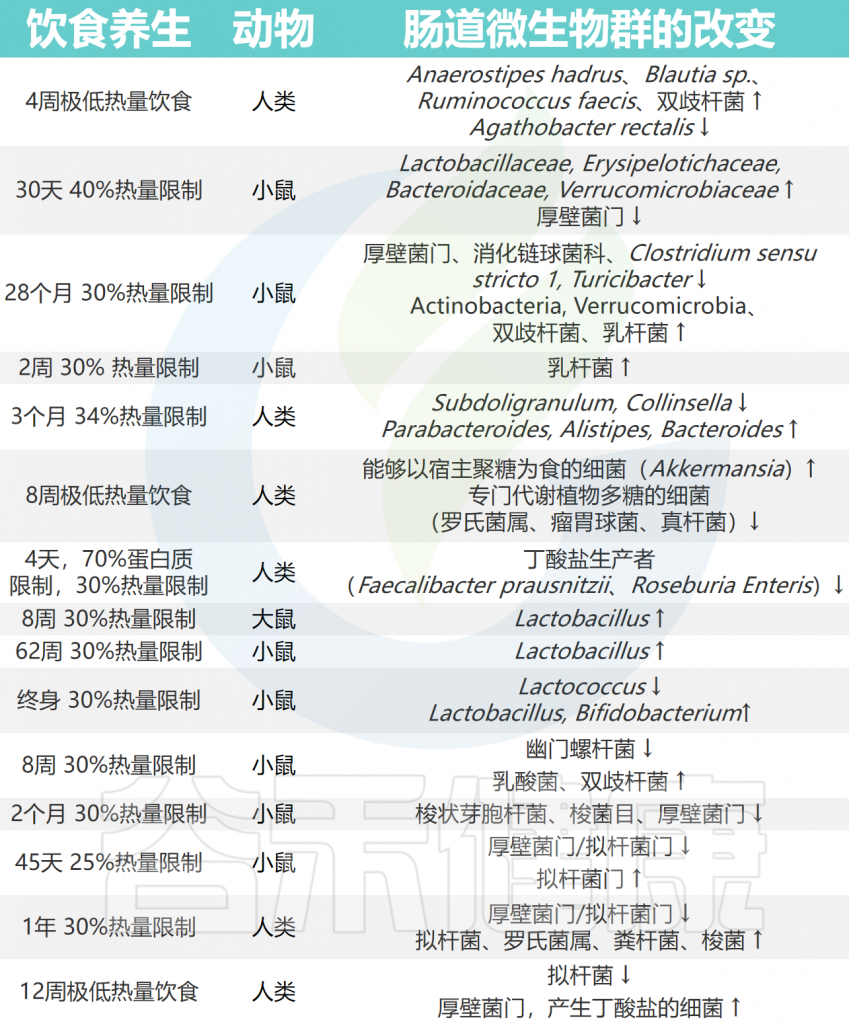
Huang F,et al.Gut Microbes.2024
• 抑制卵泡的丢失和保护卵泡库
肥胖、过多的体脂和胰岛素抵抗对卵巢卵泡的发育有不利影响,从而损害了雌性动物的生殖能力。
热量限制(CR)与体重减轻、腹部内脏脂肪积聚减少和胰岛素敏感性增加有关。因此,通过抑制卵泡丢失和保护卵泡库,实施了延缓卵巢老化的效果。
与对照组啮齿类动物不同,接受CR治疗的啮齿类动物显示出原始卵泡数量显著增加,并抑制了不同阶段卵泡的发育。
十周的热量限制喂食降低了血清黄体生成素、卵泡刺激素和雌激素水平。热量限制在高脂饮食诱导的卵巢早衰小鼠中产生了类似的效果。由CR引起的p53下调可能因其对细胞周期和凋亡的影响而抑制卵泡萎缩。
• 改善与年龄相关的菌群变化
热量限制还可以挽救老年雌性小鼠中观察到的与年龄相关的菌群变化。三个月34%的CR帮助实现了显著的体重减轻,并且腰围减小与五个细菌属(Subdoligranulum、Collinsella、Parabacteroides、Alistipes和Bacteroides)的变化相一致。
40%的热量限制喂食30天增加了 Lactobacillaceae, Erysipelotrichaceae,Bacteroidaceae 和 Verrucomicrobiaceae 丰度,并减少了厚壁菌门丰度。
• 改善葡萄糖代谢,降低脂多糖水平
热量限制还改善了葡萄糖代谢、脂肪棕化和耐寒能力,降低了脂多糖结合蛋白和循环脂多糖水平。
此外,严格的热量限制减少了体脂沉积,改善了葡萄糖耐受性。但富集了能够以宿主糖原为食的Akkermansia,并消耗了专门用于代谢植物多糖的Roseburia、Ruminococcus和Eubacterium,这些都是在人类肠道的核心菌。
• 热量限制可以减少炎症有助于防止卵巢衰老
慢性炎症是衰老以及卵巢衰老的另一种常见状况。炎症可能是导致生殖衰老的机制之一。卵巢内B细胞、CD4+ T细胞和巨噬细胞比例的增加与卵巢衰老的过程一致,并且在生殖衰老过程中观察到多种促炎细胞因子(包括IL-6、TNF-α和IL-1α/β)以及炎症小体基因NLRP3和ASC的年龄依赖性过表达。
抑制NLRP3炎症小体有助于防止卵巢衰老。肠道微生物群在调节炎症反应中起着至关重要的作用。热量限制可能通过塑造肠道微生物组来延迟免疫衰老。热量限制增加了受体的α多样性,并降低了梭状芽孢杆菌、Hungatella hathewayi和Alistipes obesi的丰度,这些CR相关的微生物群降低了肠道和肝脏效应记忆CD8+ T细胞、肠道记忆B细胞和肝脏效应记忆CD4+ T细胞的水平。
热量限制持续2周可显著减少肠道炎症,增加保护性肠道微生物群乳酸菌。终身热量限制诱导的双歧杆菌和乳酸菌增加与胆汁酸水平呈负相关,包括 ChDxCA 和次级胆汁酸(DxCA/TDxCA 和 ChDxCA 衍生物)。CR 促进的以乳杆菌群落降低了全身微生物抗原和炎症标志物的水平。
基于上述与热量限制相关的几种分子途径的发现,热量限制可能是改善炎症并可能促进肥胖相关不孕症和生殖寿命的一种可能策略。
!
不足之处
值得注意的是,上述这些抗衰老干预措施要么检查了对肠道微生物组或卵巢功能的影响,但很少有研究同时推测抗衰老药物、肠道微生物组和卵巢功能。
因此,目前涉及治疗机制影响卵巢功能的肠道微生物组的证据是支离破碎且分散的,这也是本综述的局限性。这些抗衰老干预措施在肠道微生物群和卵巢功能之间的相互作用方面仍然存在很大差距。因此,迫切需要更多的研究关注这些干预措施对肠道微生物组和卵巢功能的影响,以将这三个部分的相互作用联系起来。
肠道微生物群组成和功能的改变在生殖衰老的发病机制中发挥着重要作用。实验和临床研究揭示了肠道菌群失调与卵泡发育以及免疫反应紊乱之间的关系。粪菌移植研究结果为抗卵巢衰老提供了新的见解,即维持年轻的肠道菌群有助于保护卵巢功能并预防卵巢相关疾病。
基于微生物群的干预来延缓卵巢衰老是一种有吸引力的方法,并且可能为肠道微生物群调节提供新的治疗策略,以提高女性生育能力。
此外,抗衰老药物和限制热量等抗衰老干预措施的研究可能会改善肠道微生物失衡,促进更健康的肠道生态环境。然而,当前科学文献的证据无法提供有关这些措施的直接结论。大多数相关研究都是在动物模型中进行的,不能简单地适用于人类。因此,未来的研究应从简单的相关性分析转向大规模队列研究,重点关注潜在原因和潜在机制,以验证这些干预措施对卵巢衰老的有益作用。
鉴于肠道微生物群组成和功能在卵巢衰老过程中发生广泛变化,有人认为肠道微生物群可能适合破译女性预期和意外卵巢衰老的过程。肠道微生物群的失衡可能导致各种卵巢衰老相关疾病的进展。尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
特定菌株及其代谢物在卵泡发育中的作用和分子机制仍不确定,并且在很大程度上尚未得到探索。多项研究报告卵巢早衰样本中同时存在肠道和血清代谢紊乱,一些代谢物可能介导下丘脑-垂体-卵巢轴的功能。
发现短链脂肪酸与卵泡发育和卵泡液激素之间存在显著相关性。补充特定代谢物可能是调节卵巢功能的另一种选择。老年小鼠卵巢中多胺代谢物亚精胺水平降低,补充亚精胺可促进卵泡发育,恢复卵母细胞质量,提高老年小鼠的生育率。
发现支链氨基酸不足可能导致卵巢早衰,补充支链氨基酸可改善活性氧诱导的小鼠的卵巢功能障碍。
此外,卵泡闭锁是随着出生后GC细胞的凋亡而开始的。一项研究表明,肠道微生物群可能通过短链脂肪酸影响GC细胞凋亡来参与调节卵泡发育。其他某些代谢物对GC细胞凋亡的影响也值得探索。
大量研究还表明,使用三种略有不同的药物进行细菌疗法:益生菌、益生元和合生元,有望用于预防和治疗人类一般衰老和与年龄相关的疾病。
其中乳杆菌和双歧杆菌是最常用的,尽管不同研究的效果有所不同,具体取决于剂量、持续时间及其成分。研究表明,一些益生菌菌株对男性生殖功能障碍具有有益作用。补充乳酸菌和双歧杆菌可改善男性精子活力并降低DNA断裂率。然而,益生菌、益生元和合生元对卵巢衰老的影响尚不清楚,需要更多的研究来证明它们是否可以成为对抗卵巢衰老的有效策略。
尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
主要参考文献
Huang F, Cao Y, Liang J, Tang R, Wu S, Zhang P, Chen R. The influence of the gut microbiome on ovarian aging. Gut Microbes. 2024 Jan-Dec;16(1):2295394.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021 Jan;19(1):55-71.
Ling Z, Liu X, Cheng Y, Yan X, Wu S. Gut microbiota and aging. Crit Rev Food Sci Nutr. 2022;62(13):3509-3534.
谷禾健康
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。骨质疏松症会导致骨折风险增加,骨骼变性,身体功能受限等。因此,骨质疏松症的防治逐渐成为中老年人健康关注的焦点,减少和治疗骨质疏松症对于减轻医疗负担、缓解社会压力具有重要意义。
数据显示,全球大约每3秒就有一例骨质疏松性骨折发生,大约50%的女性和20%的男性在50岁后患有原发性骨质疏松性骨折。
骨质疏松症是一种慢性疾病,其特征是骨组织微结构恶化和骨量减少。研究表明,体内激素失衡和氧化炎症可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
我们日常的饮食中多酚类物质含量极其丰富,并且可以在自然界的多种植物中找到。多酚在化学上被鉴定为具有酚类结构特征的化合物。多酚的丰富来源包括水果、蔬菜和全谷物,以及其他类型的食物和饮料,如茶、巧克力和葡萄酒。
多酚可以通过影响骨形成和骨吸收而在骨重建中发挥作用。多酚作用于破骨细胞、成骨细胞和骨髓间充质干细胞,调节多个重要信号通路,在骨重塑中发挥重要作用。此外,多酚还通过抗炎、促进骨形成等机制抑制骨质疏松症。
此外,越来越多的研究表明,骨质疏松症患者及相关动物模型的肠道菌群与健康个体的肠道菌群有些不同,骨质流失的严重程度也与肠道菌群的改变有关。这也表明肠道微生物群可能成为预防和治疗骨质疏松症的潜在目标。
通过产生代谢物,肠道微生物影响和调节肠道屏障功能。正常的肠道屏障对于隔离有害物质、促进营养吸收和提供免疫保护非常重要。肠道屏障功能受损被认为是导致骨质疏松症的致病因素之一。
肠道微生物紊乱削弱了肠道屏障功能,导致有害物质进入体内,从而促进激活破骨细胞并导致骨吸收因子的产生,影响骨形成和骨吸收,最终导致骨质疏松。
而多酚等膳食成分还与肠道微生物群存在相互作用。肠道微生物群可以将多酚降解为更容易吸收的代谢物,从而提高其生物利用度。多酚可以塑造肠道微生物群并增加其丰度和活性,增强肠道屏障功能。在两者的协同作用下,可能对骨质疏松症的治疗效果最大化。
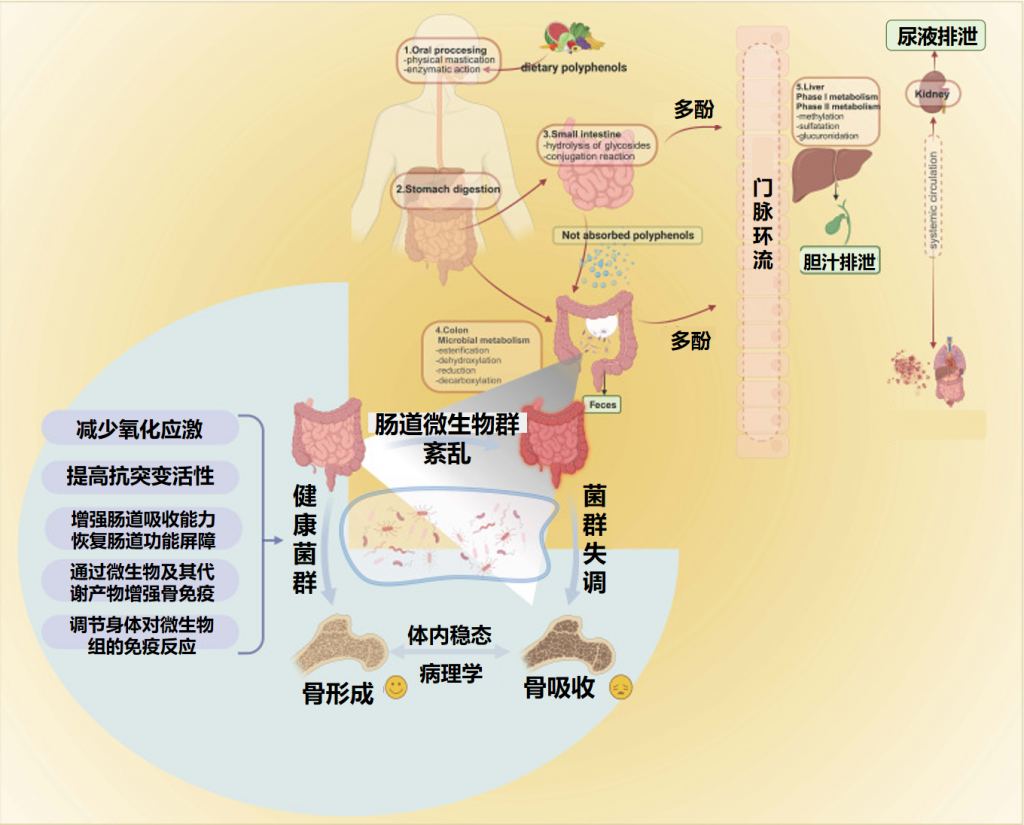
Wang K,et al.Front Immunol.2023
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。这种全身性骨骼疾病的特点是骨矿物质密度(BMD)低,骨组织微结构恶化和骨量减少。
世界卫生组织将骨质疏松症定义为骨密度T值低于相应年龄和种族的健康年轻人平均密度2.5或更多标准差。
骨质疏松症的特点是破骨细胞功能增加,随后骨吸收增加,骨形成相应减少。成骨细胞和破骨细胞失衡是骨密度低和骨愈合不良的标志。成骨细胞是骨骼生长和维持的重要细胞,它们形成骨组织。
★ 年龄增加和女性绝经是骨质疏松的最常见原因
骨质疏松症最常见的原因是绝经和年龄,因为骨重塑过程受到雌激素、甲状旁腺激素、炎症细胞因子和维生素D的调节。
因此,老年女性的患病率(30%)高于老年男性(16%)
研究表明,体内激素失衡和局部氧化炎症也可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
每年估计有890万起骨折是由于骨质疏松症而造成的。
由于骨骼是一种可塑性物质,它会根据生理和体外因素不断进行重塑,因此骨吸收增加以及随之而来的骨质流失,呈现出一种复杂的病理生理学,可能受到年龄、激素水平、遗传倾向,以及药物(如糖皮质激素)、生活方式和饮食的影响。
骨质疏松症分为原发性和继发性二大类。
✦ 原发性骨质疏松症
原发性骨质疏松症是指没有明显的诱因或疾病导致的骨质疏松症。它包括与年龄相关的骨质疏松症和绝经后骨质疏松症以及特发性骨质疏松(包括青少年型)。
老年性骨质疏松症:老年性骨质疏松症是一种与年龄相关的骨质疏松症,通常发生在50岁以上的男性和女性。它是由于骨骼的自然老化和骨形成减少而引起的。
老年性骨质疏松症患者的全身性骨质减少,尤其是脊椎、髋部和前臂骨。因此一些老人在不慎摔倒后特别容易出现髋部骨折。
绝经后骨质疏松症:绝经后骨质疏松症是绝经后女性最常见的骨质疏松症类型。在绝经后,女性体内雌激素水平下降,导致骨质流失加速。
绝经后骨质疏松症主要影响脊椎骨和髋部骨,增加骨折的风险。
特发性骨质疏松症:特发性骨质疏松症是指非目前所知的任何原因引起的骨质疏松。它包括特发性青少年骨质疏松和特发性成年骨质疏松,它们的病因和发病机制有很大不同。特发性青少年骨质疏松是一种比较罕见的病症,而特发性成年骨质疏松较常见。
特发性骨质疏松原因尚未明确,可能的原因是骨量的峰值下降造成骨量与同龄人比相对减少。骨量减少可能在早年就已经开始,并持续至成年。
✦ 继发性骨质疏松症
继发性骨质疏松症是由其他疾病、药物或疗法引起的骨质疏松症。它可以是由以下原因引起的:
激素失衡:某些激素失衡,如甲状腺功能亢进、垂体功能减退、库欣综合征(皮质醇增多症)等,都可能导致骨质疏松症。
药物:长期使用某些药物,如糖皮质激素、抗癫痫药物、抗抑郁药物等,也可能导致骨质疏松症。
慢性疾病:一些慢性疾病,如类风湿性关节炎、炎症性肠病、慢性肾病等,会增加骨质疏松的风险。
营养不良:缺乏足够的钙、维生素D和其他营养素,也可能导致骨质疏松症。
其他原因:骨质疏松症还可能与酗酒、吸烟、久坐不动、低体重指数等因素有关。
骨质疏松症是一种骨骼疾病,其主要特征是骨组织的密度和质量下降,导致骨骼变得脆弱和易碎。但骨质疏松症还可能带来以下其他危害:
✦ 骨折风险增加
骨质疏松症使骨骼变得脆弱,易于发生骨折。常见的骨折部位包括腕部、脊椎、髋部和股骨颈。即使是日常活动中的轻微压力或摔倒,也可能导致骨折,严重影响生活质量。
✦ 身体功能受限
骨质疏松症引起的骨折可能导致疼痛、残疾和功能受限。脊椎骨折可能导致身高减少、姿势异常和背部疼痛,严重影响日常活动和生活质量。
✦ 骨骼变形
骨质疏松症使骨骼弱化,容易发生骨骼变形,如驼背(脊柱前屈)和骨质疏松相关的骨折,这可能导致身体外观的改变和功能障碍。
✦ 慢性疼痛
骨质疏松症可能导致慢性骨痛,尤其是脊椎骨折引起的背部疼痛。这种疼痛可能会影响日常活动、睡眠和心理健康。
✦ 增加死亡风险
骨质疏松症相关的骨折,特别是髋部骨折,与较高的死亡风险相关。骨折还可能导致并发症,如感染、血栓形成和肺栓塞等,严重影响患者的生存率。
✦ 经济负担
骨质疏松症和相关骨折对个人、家庭和社会都带来了巨大的经济负担。治疗骨质疏松症和骨折的医疗费用、康复费用和长期护理费用都很高。
骨质疏松症有多种合适的治疗方法,目前的治疗建议包括锻炼、补充钙和维生素D,以及最终的双磷酸盐治疗。
正确的临床管理需要采取分阶段的方法,并仔细考虑具体干预措施的时机。
许多女性在绝经后会出现骨质减少,但尚未达到骨质疏松症的诊断标准;这可能是开始更保守治疗的理想时机,以防止骨质减少发展为骨质疏松症,并可能获得更好的长期疗效。
临床治疗可分为四个主要领域,其侵入性各不相同,分别为改变生活方式、补充营养、药物干预和手术治疗。
对于有骨质疏松症风险的患者,一致建议改变生活方式以防止骨质流失。充足的钙和维生素D、锻炼、戒烟、预防跌倒咨询和避免大量饮酒都是应注意的生活方式,特别是对于有骨质疏松症家族史的人来说。
高纤维饮食有助于预防骨质疏松症
饮食调整和运动是两种最有益和保守的治疗方法之一。对啮齿动物的研究表明,高纤维饮食以及由此增加肠道微生物群中短链脂肪酸的产量,特别是丁酸。
短链脂肪酸似乎可以防止小鼠绝经后和炎症性骨质流失、修复肠道屏障并预防骨质疏松症的发展。这些结果适用于人群,其中膳食纤维消耗增加与骨矿物质密度之间的关联已被证明。
避免使用促进骨质流失的药物
此外,处于骨质疏松症初始阶段或经历骨质减少的个体应避免使用促进骨质流失的药物,例如糖皮质激素。
在糖皮质激素引起骨质流失的情况下,发现饮食中添加山奈酚(一种在水果和蔬菜中发现的黄酮类化合物)可诱导成骨标志物的更高表达,并且在功能上似乎可以改善愈伤组织骨损伤部位形成并减少骨质流失,有效对抗糖皮质激素对骨骼健康的不利影响。
适度运动可以减少骨质疏松的发生
运动已显示出多种有益的健康效应,包括改善肌肉组织以预防跌倒和改善骨矿物质密度。
关于骨骼健康的运动训练,还发表了一篇有价值的文献,他们采用更多的细胞方法来考虑运动有益效果的机制。无论具体的获益机制如何,生活方式改变的证据表明,运动应该成为一线临床建议,以防止患者从骨质减少进展为骨质疏松症。
营养干预措施比较容易实现,而且相对便宜,应考虑将其作为骨质减少和骨质疏松症临床管理的措施。
增加钙与维生素D的摄入
增加钙摄入量并补充维生素D已被证明可以降低骨矿物质流失率,且不会损害肠道微生物群。膳食钙摄入不足的患者应在膳食中分次补充钙(通常为500至 1000毫克/天),将总钙摄入量提高到约1200毫克/天。
需要注意的是,钙的总摄入量(饮食加补充剂)通常不应超过2000毫克/天,因为钙摄入过高可能会出现不良反应,包括肾结石、心血管疾病、消化不良、铁和甲状腺激素失调以及便秘等。
关于维生素D的剂量存在争议。众所周知,维生素 D3(胆钙化醇)可促进小肠中钙的吸收;因此,确保足够的水平是必要的。
益生菌与益生元有助于钙代谢和骨骼健康
益生元和益生菌已被发现有助于治疗各种慢性炎症性疾病,并且越来越多的证据表明它们还有助于钙代谢和骨骼健康。
此外,向长期接受糖皮质激素治疗的小鼠添加益生菌、抗生素或粘液补充剂可预防糖皮质激素诱导的骨质疏松症的发生。

de Sire A,et al.Cells.2022
除了生活方式和其他保守的干预措施之外,骨折风险高或经历过脆性骨折的患者最有可能受益于药物辅助治疗。
双膦酸盐是一类抗骨吸收药物,自20世纪60年代首次用于治疗骨疾病以来,已被广泛使用。不过,渐进式新一线治疗方法越来越受欢迎,例如狄诺塞麦和合成代谢药物,包括甲状旁腺激素相关肽类似物和抗硬化素抗体。
具体药物需要根据患者的情况进行评估
值得注意的是,尽管有许多药物可以支持骨骼平衡和重塑,但它们的成功通常取决于患者对药物治疗的依从性。因此,最好根据患者的骨折风险设计治疗策略,并结合骨矿物质密度和临床风险因素进行评估。
此外,在开始药物治疗之前,所有患者的血钙和25-羟基维生素D水平应在范围内,如果食物摄入不足,应给予营养干预。骨质疏松症的药物治疗可分为抗吸收剂、合成代谢剂或激素调节剂。
重点来了
然而,还有其他方法可以治疗或预防骨质疏松症,这些方法可能更有效且副作用更少。本文接下来讲述的多酚等膳食成分与肠道菌群的协同作用可能就属于一种新型疗法。
多酚是存在蔬菜、谷物、水果、咖啡、茶等植物性食物中的次生代谢产物,具有潜在促进健康作用。
多酚按结构可分为黄酮类、酚酸类、木脂素类、芪类等。
流行病学研究表明,长期食用植物多酚可以预防心血管疾病、癌症、骨质疏松症、糖尿病和神经退行性疾病。
研究人员广泛研究了多酚类物质的有益作用,已知多酚可以增强骨形成并抑制骨吸收。
✦ 淫羊藿苷促进成骨细胞分化、抑制破骨细胞形成
淫羊藿苷(ICA)是8-异戊烯基黄酮苷。研究发现淫羊藿苷可以促进成骨细胞的分化,增加骨密度。骨形成主要通过成骨细胞的增殖和分化促进骨基质的合成和矿化,成骨细胞在骨形成和骨质疏松中发挥重要作用。
淫羊藿苷具有类似雌激素的药理活性,可以刺激成骨细胞的分化和矿化,调节破骨细胞的分化,并增加成骨细胞分化为成熟成骨细胞的数量。
淫羊藿苷抑制破骨细胞的形成,ICA抑制前破骨细胞向破骨细胞的分化。它还抑制参与破骨细胞形成和骨吸收的各种基因的表达。
研究表明,淫羊藿苷可以通过抑制NF-κB的激活,阻断MCF 7和MDA-MB-231诱导的破骨细胞形成。
✦ 芒柄花素增加骨量、减少骨吸收
芒柄花素(FO)是从黄芪中提取的主要异黄酮之一。研究表明,它可以刺激成骨细胞的形成,从而增加骨量,改善骨的微观结构。
芒柄花素还可以抑制破骨细胞的活化。研究表明,芒柄花素可抑制原代骨髓单核巨噬细胞向破骨细胞的增殖和分化,下调破骨细胞骨吸收功能相关蛋白和基因的表达。
✦ 葛根素对骨吸收也有调节作用
葛根原产于中国,历史悠久,是亚洲最常用的中药之一。由于异黄酮含量高,它已被广泛用作绝经后激素疗法的天然替代品。
研究表明,葛根素(PUE)对骨吸收也有调节作用。葛根素能够下调破骨细胞标志基因CTR、CATH-K、NFATc1和c-fos的mRNA水平,表明PUE抑制破骨细胞功能。
在体外,葛根素减弱骨吸收而不损害破骨细胞活力,并通过抑制骨吸收而不改变骨形成来显著防止骨丢失。此外,随着葛根素浓度的增加,葛根素会在体外抑制RANKL诱导的破骨细胞活化、骨吸收能力和F-肌动蛋白环形成。
白藜芦醇和淫羊藿苷控制成骨分化的分子机制
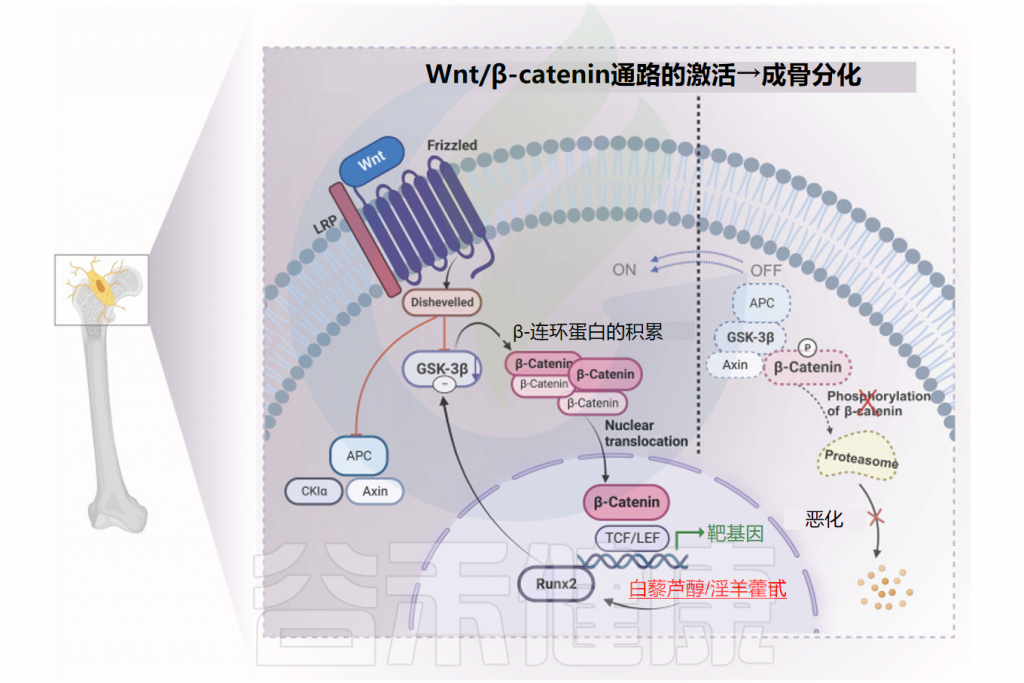
Wang K,et al.Front Immunol.2023
✦ 抗氧化应激
当活性氧的产生和消除不平衡时,就会发生氧化应激。过多的活性氧会导致细胞损伤和凋亡,影响细胞功能,引发疾病。
氧化应激可以影响骨髓间充质干细胞的功能,从而影响间充质干细胞的骨生长和成骨分化。因此,这可能导致成骨细胞功能受损并加速成骨细胞的形成和分化。
多酚化合物含有大量酚羟基,可作为抗氧化剂,防止活性氧引起的损伤。将单线态氧还原为活性较低的三线态氧,从而降低氧自由基产生的概率,终止自由基引发的链式反应。
有研究证据表明,摄入富含食源性多酚化合物的天然浆果,如蔓越莓和蓝莓,可以通过清除自由基来对抗氧化应激,预防和治疗骨质疏松症。
✦ 抗炎作用
多酚类化合物通过负调节炎症途径,特别是对关键的NF-κB转录因子的调节,发挥抗炎作用。雌激素受体能够参与与NF-κB的蛋白质相互作用,导致复合物的形成以及随后NF-κB与特定反应元件的结合。这些特异性反应元件以细胞类型特异性的方式调节NF-κB依赖性基因的转录,在调节炎症过程中至关重要。
例如,可以通过调节转录因子NF-κB并在HMC-1细胞中作为雌激素受体ERK来抑制脂质过氧化和对抗氧化应激。诱导型一氧化氮合酶表达受损会减少炎症因子TNF-1、IL-6、IL-8和NO的产生和释放。这一过程会产生抗炎作用,并有助于减轻骨丢失。
此外,多酚化合物已被证明通过下调受体激活的NF-κB配体(RANKL)来抑制骨吸收,并通过下调NFATc1和炎症介质来直接抑制成骨细胞的产生,从而降低成骨活性。
✦ 激活Wnt/β-Catenin信号通路
Wnt信号通路在骨骼发育和代谢稳态的维持中发挥着关键作用。Wnt相关蛋白或因子可以与卷曲基因受体(Fzd)结合并启动下游细胞内级联反应,从而调节β-Catenin、过氧化物酶体增殖物激活受体γ(PPARγ)和RUNX2等靶基因的转录或表达。然后调节成骨细胞形成、分化和成熟的生理过程。
Runx2是成骨细胞特异的转录因子,与成骨细胞的增殖和分化密切相关。
β-Catenin是通路中的关键因子,是Wnt/β-Catenin信号通路的中心调节因子。β-Catenin可以增强碱性磷酸酶(ALP)的活性,同时促进骨骼生长。
在一项研究中,发现淫羊藿苷对大鼠骨髓基质细胞的干预通过刺激β-连环蛋白的激活来增加总β-连环素和核转位。此外,Wnt信号传导成员(β-catenin、Lef1、TCF7、c-jun、c-myc和细胞周期蛋白D)的表达显著上调。
雌激素受体(ERα)的激活可增强成骨基因的表达,从而促进BMSCs的增殖和成骨分化。白藜芦醇是一种非黄酮类多酚有机化合物,具有雌激素样作用。一些研究人员通过白藜芦醇介导的Wnt/β-catenin途径得出结论。白藜芦醇通过刺激Runx2的表达,下调GSK38的表达水平,阻止β-连环蛋白降解复合物的有效形成,确保β-连环素在细胞质中的稳定积累和向细胞核的移位,从而激活Wnt/B-连环蛋白通路,促进成骨分化,提高骨密度,在预防和治疗骨质疏松症中发挥作用。
多酚调节骨形成或骨吸收的多种信号通路
Li Y,et al.Front Pharmacol.2022
✦ 抑制NF-κB通路
NF-κB信号通路在骨代谢中也具有重要作用,并且还可以与其他信号通路相互作用,影响骨质疏松症的进展。
应用芍药苷干预RAW 264.7细胞系分化的破骨细胞模型,观察芍药苷对破骨细胞信号通路的影响。结果表明,芍药苷减弱了p65 NF-κB的磷酸化水平,即抑制了NF-κB信号通路的激活。NF-κB途径是破骨细胞分化的主要生物学途径之一。已经证实,芍药苷通过抑制p65 NF-κB的激活,降低NF-κB信号通路的活性,降低破骨细胞的活性,减少骨吸收,并进一步维持骨稳态。
芍药和蛇籽都是中药,都含有多酚类物质。通过抑制NF-κB信号通路,抑制破骨细胞的产生,来达到骨质疏松的治疗效果。
Wang K,et al.Front Immunol.2023
许多研究还揭示了肠道微生物群与骨质疏松症之间的显著联系。肠道微生物群调节骨稳态,并可以通过多种机制影响骨质疏松症。
这些包括调节其代谢物、影响宿主代谢、改变药物代谢以及调节肠道屏障功能的完整性。一些研究还强调了肠道微生物对胶原蛋白特性的改变,这与骨骼脆弱性密切相关。
肠道微生物群组成的变化会导致肠道炎症并破坏免疫调节网络的平衡,许多研究表明这与骨质疏松症有关。
Seely KD,et al.Int J Mol Sci.2021
1.增加无机盐的溶解度,以改善其在肠壁的吸收
磷酸盐等无机盐的可用性对于成骨细胞的骨矿物质沉积和骨稳态至关重要。这种效应可能部分归因于微生物合成植酸酶将矿物质复合植酸代谢为无机磷酸盐和磷酸肌醇衍生物。
2.增强肠道矿物质吸收表面
通过促进肠上皮细胞和结肠细胞的增殖,介导肠道微生物群稳态,并支持肠道矿物质吸收。结肠细胞代谢的增加已被证明可以促进专性厌氧菌的产生,专性厌氧菌可以代谢纤维,从而增加短链脂肪酸,这对于骨稳态以及其他生理功能都至关重要。
3.恢复和维持肠道上皮屏障
肠道微生物群稳态有助于构建肠道上皮屏障,而健康的肠道上皮屏障可以防止因紧密连接受损而导致的通透性过高。通透性过高或“肠漏”会渗出异常高水平的炎症细胞因子,产生全身炎症并导致破骨细胞过度活跃和骨质退化。
4.通过微生物群代谢物增加骨密度
肠道微生物群产生的短链脂肪酸通过抑制活化B细胞的核因子kappa轻链增强子的活化来提供抗炎作用,从而减少自身免疫炎症。此外,短链脂肪酸,特别是丙酸和丁酸,通过下调TRAF6和NFATc1来抑制破骨细胞生成和骨吸收,从而有效增加骨密度,而不直接改变成骨细胞。
5.减少氧化应激
氧化应激被证明会导致过度的骨细胞凋亡,从而导致破骨细胞生成的失衡,导致骨重塑、周转和损失增加。特异性益生菌可以通过产生几种抗氧化分子(如谷胱甘肽、叶酸和胞外多糖)来缓解氧化应激。此外,几种肠道微生物群产生的短链脂肪酸还可以通过促进抗氧化分子的产生来帮助缓解氧化应激。
6.调节免疫反应
肠道微生物群通过影响与骨细胞密切相关的免疫系统,在维持骨骼健康方面发挥着至关重要的作用。在异常状态下,免疫系统对微生物群刺激的反应会通过T细胞的作用导致循环破骨细胞因子增加。它通过利用宿主完全发育的免疫系统来调节整个身体的反应来实现这一点,从而控制骨转换和密度。
7.增加抗诱变活性
尽管这种能力已在癌症领域得到广泛探索,但某些产乳酸微生物群可以有效的结合诱变剂,例如热解产物和杂环胺在肠道中降低这些化合物的诱变活性。减少DNA损伤可以减少炎症、保护肠壁、增加矿物质吸收并抑制骨质疏松症。
8.增加肠壁钙结合蛋白的表达
增加肠壁钙结合蛋白D9k基因的表达可以增加吸收钙的能力,通过抑制甲状旁腺激素的作用,有效抑制骨降解和促进骨沉积。此外,增强钙吸收以及抑制甲状旁腺激素活性和胰岛素样生长因子1的产生也可以改变破骨细胞和成骨细胞的发育。
9.调节生长因子和激素的分泌
肠道微生物群可以被视为基于大量分泌分子的内分泌器官。具体来说,肠道微生物群通过短链脂肪酸介导的途径促进胰岛素样生长因子1(IGF-1)的产生。已知IGF-1可刺激成骨细胞、破骨细胞和软骨细胞的分化。
肠道微生物群也可能通过皮质醇介导的相互作用增强骨降解。肠道微生物群还调节肠道血清素的产生,这是一种与骨细胞相互作用的分子,被认为可以充当骨量调节剂。
人类肠道微生物群和宿主相互作用,影响骨量的动态平衡,以及骨骼生长、骨骼老化和病理性骨质流失的过程,这催生了骨微生物学领域的兴起。
骨微生物学的最新研究将骨表型的变化与肠道菌群的变化联系起来。平衡、健康的微生物组似乎对于防止骨质流失是必要的,这一假设有证据支持,在小鼠的饮食中补充益生菌可逆转骨质疏松症的致病过程。
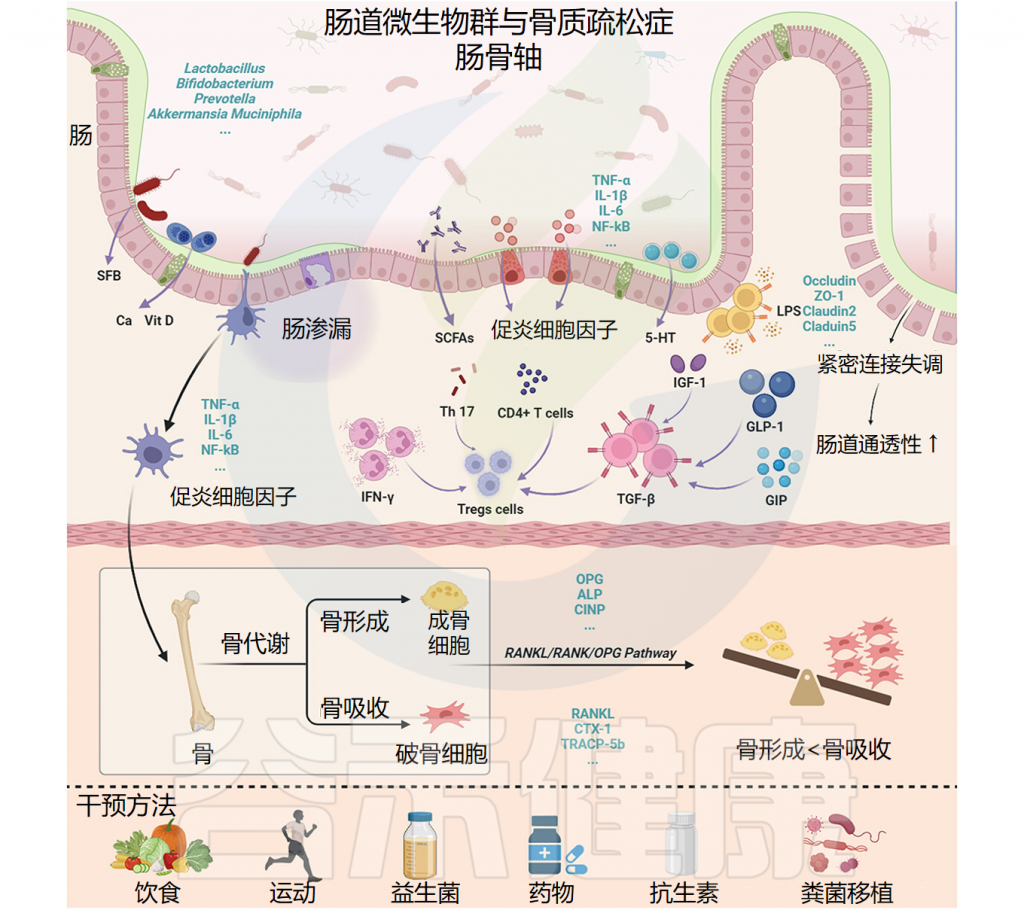
Zhang YW, et al.Gut Microbes.2024
✦ 骨质疏松症患者肠道菌群的多样性减少
评估骨质疏松症患者肠道内细菌种群数量和多样性的几项研究检查表明,骨质疏松症成年人的生物多样性似乎有所减少,某些物种如梭菌属(Fusobacterium),戴阿利斯特杆菌属 (Dialister),Faecalibacterium,甲苯单胞菌属(Tolumonas)以及拟杆菌属(Bacteroides)和罗氏菌属(Roseburia)减少。
注:上述这些基本都是肠道核心菌甚至是对人体健康非常重要的益生菌。
✦ 肠道菌群影响免疫细胞进而影响骨稳态
事实上,肠道微生物群与骨骼愈合和重塑之间的部分关联是由免疫细胞调节的。
免疫细胞成熟和功能所必需的许多细胞信号级联在一定程度上取决于肠道微生物群在整个生命过程中持续的最佳功能和体内平衡。尽管非常复杂,但近期文献中关于整体骨骼健康与肠道微生物组之间联系的主要假设以T细胞和Th17免疫细胞为中心 。在T细胞依赖性机制中,免疫系统对微生物群刺激的反应会增加循环的破骨细胞因子。
此外,虽然其作用尚不完全清楚,但Th17免疫细胞似乎是破骨细胞群的一个组成部分。因此,可以假设肠道微生物群的任何不平衡可能反过来影响骨稳态所需的关键免疫机制。
除了所提出的T细胞介导的相互作用之外,更广泛的免疫系统对微生物组的反应导致产生许多循环细胞因子和基于细胞的免疫效应物,这些效应物对骨细胞具有显著影响,这表明考虑肠道微生物群的健康可能会有益于骨愈合障碍。
✦ 肠道微生物影响微小RNA进而影响骨骼健康
尽管肠道微生物群对宿主免疫系统的影响有着相对较长的记录历史,但这并不是肠道微生物群影响骨骼健康的唯一潜在机制。类固醇激素、甲状旁腺激素和维生素D代谢物都可能受到微生物群的影响。
此外,细菌衍生的化合物(例如维生素)可能会进入血液并直接影响骨细胞活性。或者,肠道微生物群可能通过对宿主微小RNA (miRNA) 的影响来影响骨质疏松症的发展,宿主微小 RNA 是参与基因表达调节的非编码 RNA 分子。
一些 miRNA 可以影响与骨质疏松症中成骨细胞分化相关的转录物,例如 miRNA-33-5p、miRNA-194和miRNA-433-3p。尽管尚未完全了解,但在支持肠道微生物失调的反馈机制中,微生物群可能会影响宿主 miRNA,进而抑制成骨细胞发育,对骨质疏松修复构成障碍。
总的来说,肠道微生物群通过破骨细胞生成影响骨愈合和重塑有多种潜在途径。
益生菌是一类对宿主有益的活性微生物,定植于人体肠道和生殖系统等部位,能够产生精准的健康益处,改善微生态平衡,发挥有益作用。随着生命结构的不断改变,越来越多的益生菌被开发和利用,这与维持机体功能的稳定密不可分。
除了食品之外,益生菌的应用范围也越来越广,牙膏、啤酒等都在添加益生菌。益生菌对骨质疏松症的调节是一个新兴领域,研究益生菌如何改善骨代谢、预防或治疗骨质疏松症已成为研究热点,并已取得一定进展。
✦ 益生菌恢复肠道微生物平衡利于骨骼健康
目前的研究证据表明,补充益生菌以恢复肠道微生物群及其代谢产物的平衡对骨骼健康有益。
具体来说,被诊断患有炎症性肠病或相关疾病的个体由于肠道微环境的变化和随之而来的菌群失调而经常患有骨质疏松症,并研究了乳双歧杆菌BL-99可以作为有益的益生菌制剂来预防骨质疏松症。
最近的研究还表明,益生菌治疗可以通过抑制IL-6的分泌和肠道炎症反应来抑制卵巢切除术(OVX)诱导的小鼠破骨细胞的活性,从而增强骨量。
例如补充Bacteroides vulgatus ATCC 8482可以缓解骨质疏松小鼠肠道微生物群的失衡,下调脂多糖/TLR-4/p-NF-κB通路,改善腰椎的骨丢失和骨微结构破坏,这表明Bacteroides vulgatus ATCC 8482可能是一种具有改善绝经后骨丢失潜力的益生菌。
✦ 同时补充益生菌对改善绝经后女性的骨质疏松比单一常规药物更有效
目前益生菌防治骨质疏松的研究多集中于动物实验,临床试验报道较少。但一项基于人群的试验表明,在治疗绝经后骨质疏松症方面,施用Bifidobacterium animalis subsp. lactis Probio-M8与常规药物/补充剂的组合比单独使用常规药物/补充剂更有效。
在一项双盲、安慰剂对照研究中,75至80岁且骨矿物质密度较低的女性被随机分配每天口服10^10菌落形成单位的罗伊氏乳杆菌 ATCC PTA 6475或安慰剂,并且结果表明,补充罗伊氏乳杆菌 ATCC PTA 6475可能是预防骨质疏松症的新方法。
此外,在一项随机对照试验中,补充罗伊氏乳杆菌 ATCC PTA 6475有可能预防骨密度低的老年女性肠道微生物群恶化和炎症状态,这可能对骨代谢产生有益影响。
由此可见,越来越多的学者开始从补充益生菌的角度探讨调节肠道菌群及其代谢物的深层机制,益生菌也成为预防和治疗骨质疏松症的潜在候选者。
不同食物中营养素的组成和含量显著影响肠道微生物群的组成和丰度,进而影响骨代谢,调节骨质疏松。
因为一些微生物直接利用某些营养物质作为生长物质的来源,而大量摄入此类营养物质可能会导致细菌丰度增加并作用于骨代谢。例如,链球菌(Streptococcus), 芽孢杆菌(Bacillus),丙酸杆菌(Propionibacterium), 拟杆菌(Bacteroides)和梭菌属(Clostridium)等微生物可以利用蛋白质作为氮源,较高的膳食蛋白质摄入量也可以增加其丰度和多样性。
此外,人们还认识到,日常饮食摄入引起的生理环境的变化会影响微生物群落的选择。以膳食脂肪摄入为例,富含脂肪的膳食可能会促进胆汁分泌,以利于脂质的消化,而胆汁酸对细菌的细胞膜有不利影响,这使得胆汁酸对微生物产生强大的选择压力并导致这些肠道微生物群相关代谢物在骨质疏松症的代谢调节中发挥负面作用。
由于多酚抑制炎症因子并参与各种其他机制的能力,多酚已被确定为治疗骨质疏松症和慢性炎症的潜在药物,并且与肠道屏障的功能密切相关。
同时,多酚还可以充当肠道屏障-骨-免疫系统的调节介质和诱导剂。多酚可以通过两种方式影响肠道微生物群,即促进有益细菌的增殖和增加其丰度。
✦ 多酚可作为益生元增加有益菌的丰度
多酚具有益生元的属性并改变人类肠道微生物群组成。富含多酚的食物已被一致证明可以有效改变肠道微生物群。
大多数研究一致证明多酚可以引起肠道微生物群组成的有利改变。具体来说,当个体食用富含多酚的饮食时,人体肠道菌群会发生显著变化,乳杆菌、双歧杆菌、阿克曼氏菌、肠球菌和拟杆菌的数量增加,而梭菌和厚壁菌与拟杆菌的比例显著下降。
富含多酚的食物改变肠道微生物组成的证据
例如,富含多酚的红酒被发现可以刺激肠道微生物群中某些细菌的生长,例如拟杆菌和罗氏菌属。
发酵木瓜汁中发现的某些类型的多酚,例如没食子酸和咖啡酸,可以影响肠道微生物的组成。研究表明,这些多酚可以减少肠球菌、产气荚膜梭菌和艰难梭菌等有害细菌的数量,同时促进双歧杆菌等有益细菌的生长。
此外,某些多酚还可以促进肠道微生物群中真菌的生长。食用富含原花青素的葡萄籽可以增加肠道中乳酸杆菌、梭菌和瘤胃球菌的数量。
蔬菜与水果类似,富含多酚和益生元纤维。摄入胡萝卜中的膳食多酚可以增加拟杆菌和乳杆菌的数量,并减少产气荚膜梭菌、科氏梭菌、球状拟杆菌和肠杆菌。
利用16S rRNA和宏基因组测序分析研究了白藜芦醇对肠道生物屏障的影响。研究结果表明,白藜芦醇对肠道微生物群的多样性和结构具有积极影响。具体来说,它增加了益生菌的丰度并调节肠道微生物群的功能以对抗免疫抑制。


Wang K,et al.Front Immunol.2023
✦ 多酚衍生代谢物具有抗炎作用增强肠道健康
除了上述益生菌作用外,多酚衍生的代谢物可以增强肠道健康和表现出抗炎特性。例如,可可多酚的生物活性代谢物可以增强肠道健康,具有抗炎作用,对免疫系统有积极作用,并降低各种疾病的风险。
摄入多酚可以通过促进短链脂肪酸的产生、增强肠道免疫功能和其他生理过程来改善肠道微生物群的健康效应。
✦ 多酚减少有害细菌的水平
据观察,在含有人类粪便细菌的培养基中加入茶多酚,特别是儿茶素,可以减少有害细菌的水平,包括大肠杆菌、产气荚膜梭菌。
这一发现表明,在肠道环境中引入茶多酚可能对抗这些特定病原菌的增殖。强调了茶多酚对肠道微生物群平衡的积极影响。
还研究了茶多酚对肠道氧化还原状态的影响及其与肠道微生物群的相关性。研究发现螺旋体和拟杆菌属被确定为肠道氧化还原状态的生物标志物,并揭示了茶多酚的益处。
因此,多酚和肠道微生物群之间的协同作用成为治疗骨质疏松症的关键因素。
营养因素也对骨质疏松症有着至关重要的影响,低钙摄入、维生素D缺乏、高磷和钠饮食、过量饮酒以及碳酸饮料的摄入被普遍认为是骨质疏松症的危险因素,而充足的蛋白质摄入有利于骨骼健康。
膳食营养素通过作用于肠道微生物群及其代谢物对骨质疏松症产生影响:
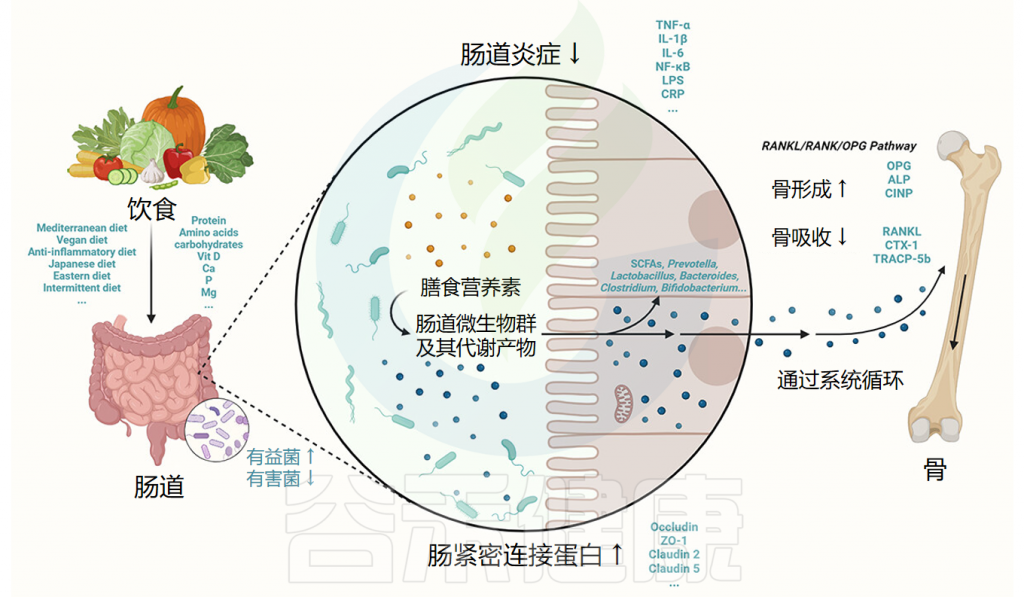
Zhang YW, et al.Gut Microbes.2024
人体的膳食蛋白质摄入可以通过细菌发酵、甲烷化、脱羧反应和硫还原来改变呼吸链中的电子受体,从而对转化为对健康具有不同影响的物质。
✦ 改变细菌生长环境,调整肠道菌群的组成
例如,含硫氨基酸如蛋氨酸和半胱氨酸可以在硫还原作用下生成硫化氢,而氨基酸和肽可以在厌氧菌的作用下通过脱羧反应产生胺类。这些代谢产物改变了细菌的生长微环境,并使细菌获得了一定的生长优势,从而改变了肠道菌群的组成和丰度。
同时,研究表明,高蛋白饮食者的肠道菌群中Bacteroides, Prevotella, Treponema, Fusobacterium, Clostridium perfringens和Bacillus的数量相对于传统饮食者增加,而厚壁菌门的数量减少。这种改变也已被证实与骨质疏松症的逆转一致。
✦ 蛋白质的代谢产物影响骨吸收和骨形成
研究人员揭示,肠道菌群发酵的蛋白质、氨基酸和肽的主要代谢产物是短链脂肪酸,如乙酸、丙酸和丁酸,而短链脂肪酸参与了骨形成和骨吸收的调节。
学者们还发现,肠道厌氧菌能够从甘氨酸、苏氨酸、谷氨酸、赖氨酸、鸟氨酸和天冬氨酸中合成乙酸,从苏氨酸、谷氨酸和赖氨酸中主要合成丙酸。
更重要的是,包括乙酸、丙酸和丁酸在内的短链脂肪酸的调节与骨质疏松症的发生和发展密切相关。与此同时,梭菌属可以利用支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成支链脂肪酸,而支链氨基酸和短链脂肪酸也是代谢性疾病如骨质疏松症、肥胖症、2型糖尿病等的潜在调节因素。
膳食脂肪是身体的有效能量来源。先前的研究已表明,膳食脂肪摄入的质量和数量可能会影响肠道微生物群的组成和丰度。
✦ 适量的不饱和脂肪酸可助肠道菌群有益改变
不饱和脂肪酸通过提高拟杆菌门与厚壁菌门的比例来改变肠道微生物群的组成和丰度。Omega-3脂肪酸可导致肠道微生物群的有益改变,包括增加双歧杆菌、乳酸杆菌、链球菌、脱硫弧菌和阿克曼菌。
✦ 高脂饮食会导致骨代谢紊乱和骨质疏松
但大量摄入饱和脂肪酸和反式脂肪酸会增加心血管和骨代谢相关疾病的风险,减少拟杆菌、普雷沃氏菌、乳杆菌和双歧杆菌的丰度,从而可能导致全身炎症、骨代谢紊乱和骨质疏松。
研究发现,长期高脂饮食会导致骨量下降、微生物群失调、肠漏和全身炎症,而低聚果糖或低聚半乳糖的施用可以显著增强肠道微生物群的生物多样性和短链脂肪酸浓度,逆转高肠道通透性和炎症细胞因子,最终预防高脂饮食诱导的骨质疏松症。
研究结果还表明,高脂饮食引起的骨质流失伴随着骨髓脂肪组织的扩张和骨形成的抑制。
高脂饮食对骨骼结构和健康具有至关重要的影响,肠道菌群失衡、肠道屏障恶化、炎症反应、氧化应激、脂肪因子改变和骨髓脂肪组织堆积被认为是潜在的机制。
研究还发现,运动可以预防高脂饮食对男性骨骼健康的多种负面影响,运动引起的肠道微生物群变化(降低厚壁菌门与拟杆菌门的比例)可能表现出一种新的机制,有助于运动诱导的骨骼健康益处。
可消化和不可消化的碳水化合物都可能影响肠道微生物群的组成和丰度,这两者都已被证实可以增加双歧杆菌的数量。各种水果中的可消化碳水化合物(例如葡萄糖、蔗糖和果糖)已被证明会降低拟杆菌和梭菌的丰度。
✦ 高膳食纤维的摄入有助于骨骼健康
难消化的碳水化合物也称为膳食纤维。近年来,随着肠骨轴研究的快速发展,膳食纤维发酵的短链脂肪酸已成为一种重要的介质,重点关注肠道微生物群与骨质疏松症之间的联系。
膳食纤维通过调节拟杆菌门与厚壁菌门的比例来改变肠道微生物群,并改变多种功能途径(包括氨基酸和脂质相关代谢),从而参与骨代谢的调节。研究人员分析了膳食纤维摄入不足的后果,观察到低纤维饮食显著降低了长达三代的微生物多样性,并且补充膳食纤维后微生物多样性无法恢复。
更重要的是,研究人员总结,摄入更多富含纤维的食物(包括粗粮、新鲜水果和蔬菜),再加上充足的运动、适当的饮水和规律的排便,可能有助于维持人体肠道和骨骼的健康,尤其是中老年人,以预防骨质疏松症。因此,食用多种食物中的膳食纤维对维持肠道健康和防止骨质流失至关重要。
肠道菌群在调节宿主健康中发挥着至关重要的作用,不同个体肠道菌群的组成存在显著差异,并受到饮食、环境等多种因素的影响,其中饮食是不可忽视的重要因素。
★ 饮食模式和膳食成分都会影响健康
不同的饮食模式对肠道微生物群的结构、代谢和功能有不同的影响,并参与各种生理活动,如食物消化、营养代谢吸收、能量供应、免疫调节和胃肠道稳态的维持,与骨质疏松症的发生发展密切相关。
此外,饮食不仅会影响肠道微生物群的结构和组成,还会影响其基因和功能。即使是同一属的细菌,在不同饮食模式的影响下,其功能和核心基因也存在显著差异。
纯素食和地中海饮食可以增强肠道微生物群的多样性,促进有益细菌的生长,如双歧杆菌、乳酸杆菌和普雷沃氏菌,而西方饮食可以减少肠道微生物群多样性,增加厚壁菌门与拟杆菌门的比例。
!
不同饮食对骨骼健康的影响
通过阅读相关文献,谷禾在这里为大家整理了不同饮食模式对肠道微生物群、代谢物和骨骼健康的影响,如下图:

Zhang YW, et al.Gut Microbes.2024
多元化的饮食更利于骨骼健康
不同的膳食成分可能以时间依赖性的方式塑造肠道细菌群落,并且不同的膳食成分对肠道微生物群的影响显著不同。
因此,合理的膳食结构、正确的膳食习惯和方法、适当的营养配比是保证人体健康的基础,而不合理的膳食结构则是高血压、糖尿病、骨质疏松等多种慢性病的罪魁祸首。在此基础上,还必须根据肠道菌群及其代谢产物对骨质疏松症的调节影响提出合理的饮食建议。
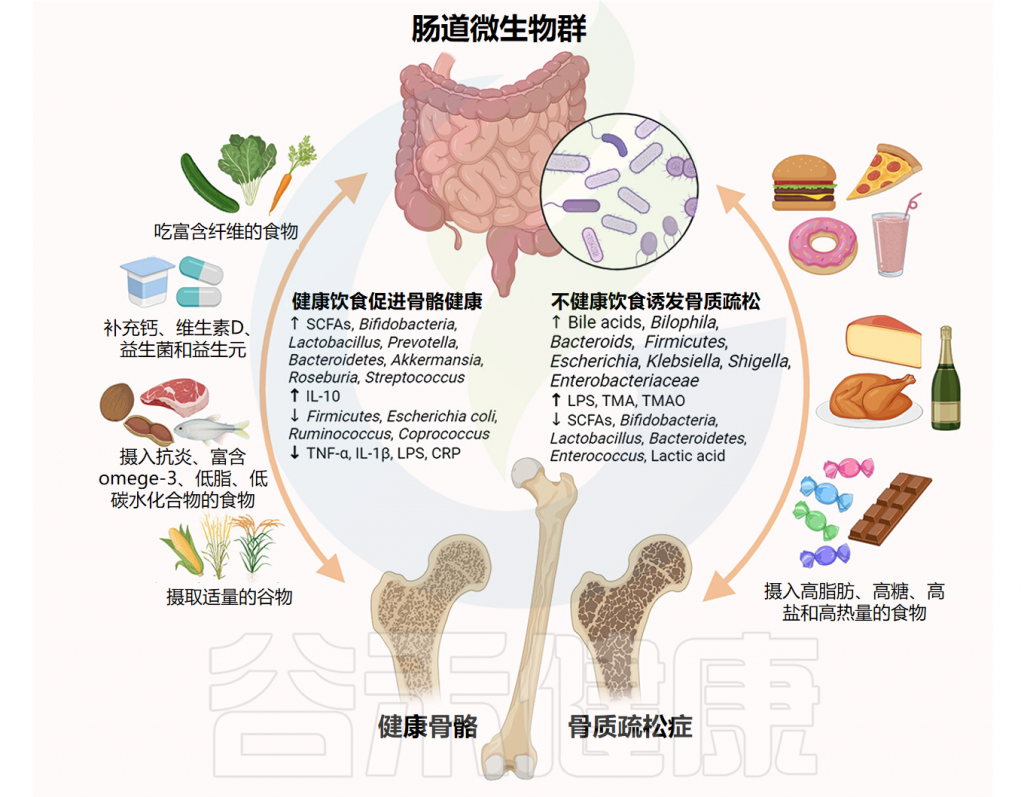
Zhang YW, et al.Gut Microbes.2024
合理的饮食模式融合了地中海饮食、抗炎饮食等健康饮食模式的特点,主要包括食物多样化、高纤维摄入、低糖摄入、低脂肪摄入、高谷物摄入。
合理的膳食结构主要以食物多样化为原则,建议多食用蔬菜、水果、豆类及其制品、鱼类、海鲜,同时少吃红肉和饱和脂肪酸,保证充足的摄入以植物性食物为主,适量动物性食物为主,从而获得种类齐全、数量充足、比例适当的膳食营养素,满足中老年人群维持骨骼健康、预防骨质疏松的生理需要。
合理的饮食模式也为塑造肠道稳态、有益菌繁殖、消除有害菌、维持肠道菌群多样性奠定了坚实的基础。
骨质疏松症作为一种中老年人常见的慢性疾病,在日常生活中如何更好地预防和改善非常重要。
除了常规的日常护理外,肠道微生物群与饮食也起着至关重要的作用。肠道微生物群可以将多酚等膳食成分分解为更容易吸收的有益代谢物,如短链脂肪酸,而多酚可以增加肠道中有益菌的丰度和活性,增强肠道屏障,从而促进骨健康。
两者协同作用下,更大程度地发挥各自的功能和作用,可能作为预防和治疗骨质疏松症的新方法。
主要参考文献:
Zhang YW, Song PR, Wang SC, Liu H, Shi ZM, Su JC. Diets intervene osteoporosis via gut-bone axis. Gut Microbes. 2024 Jan-Dec;16(1):2295432.
Wang K, Hu S. The synergistic effects of polyphenols and intestinal microbiota on osteoporosis. Front Immunol. 2023 Oct 23;14:1285621.
Seely KD, Kotelko CA, Douglas H, Bealer B, Brooks AE. The Human Gut Microbiota: A Key Mediator of Osteoporosis and Osteogenesis. Int J Mol Sci. 2021 Aug 31;22(17):9452.
Zhou RX, Zhang YW, Cao MM, Liu CH, Rui YF, Li YJ. Linking the relation between gut microbiota and glucocorticoid-induced osteoporosis. J Bone Miner Metab. 2023 Mar;41(2):145-162.
Cheung KCP, Jiao M, Xingxuan C, Wei J. Extracellular vesicles derived from host and gut microbiota as promising nanocarriers for targeted therapy in osteoporosis and osteoarthritis. Front Pharmacol. 2023 Jan 6;13:1051134.
de Sire A, de Sire R, Curci C, Castiglione F, Wahli W. Role of Dietary Supplements and Probiotics in Modulating Microbiota and Bone Health: The Gut-Bone Axis. Cells. 2022 Feb 21;11(4):743.
Martiniakova M, Babikova M, Mondockova V, Blahova J, Kovacova V, Omelka R. The Role of Macronutrients, Micronutrients and Flavonoid Polyphenols in the Prevention and Treatment of Osteoporosis. Nutrients. 2022 Jan 25;14(3):523.
Inchingolo AD, Inchingolo AM, Malcangi G, Avantario P, Azzollini D, Buongiorno S, Viapiano F, Campanelli M, Ciocia AM, De Leonardis N, de Ruvo E, Ferrara I, Garofoli G, Montenegro V, Netti A, Palmieri G, Mancini A, Patano A, Piras F, Marinelli G, Di Pede C, Laudadio C, Rapone B, Hazballa D, Corriero A, Fatone MC, Palermo A, Lorusso F, Scarano A, Bordea IR, Di Venere D, Inchingolo F, Dipalma G. Effects of Resveratrol, Curcumin and Quercetin Supplementation on Bone Metabolism-A Systematic Review. Nutrients. 2022 Aug 26;14(17):3519.
Li Y, Li L, Li X, Luo B, Ye Q, Wang H, Yang L, Zhu X, Han L, Zhang R, Tian H, Wang P. A mechanistic review of chinese medicine polyphenols on bone formation and resorption. Front Pharmacol. 2022 Oct 12;13:1017538.

谷禾健康

我们知道,微量营养素在人体健康中发挥着重要作用。然而,在全球范围内,约有3.4亿儿童患有多种微量营养素缺乏症,并伴有高致病性负担和耐多药细菌导致的死亡风险。
这些儿童经常用抗生素治疗营养不良相关疾病。可矛盾的是,由于潜在的微量营养素缺乏,他们的肠道微生物组可能已经为抗生素耐药性做好了准备…
通常,这些缺陷发生在生命早期前1000天,并可能带来即时和终身的健康缺陷。生命早期前1000 天是肠道微生物组成熟的关键时期,扰动会产生直接和长期的后果。
越来越多的研究让人认识到微生物与营养不良之间的密切关联。一些对单一微量营养素缺乏症的动物研究表明,诱导缺乏症后微生物特征发生了改变。例如,锌缺乏的雏鸡变形杆菌和厚壁菌门的丰度增加;妊娠、哺乳和断奶期间的维生素A缺乏症大鼠显示,其幼崽的微生物组成发生了显著变化,特别是厚壁菌门机会性病原体较高。
肠道环境中另一个容易被遗忘的元素是肠道抗性基因组(resistome),它是广泛表达于肠道微生物群栖息地内的共生菌和致病菌中的抗生素耐药基因(ARGs)和机制的完整集合。随着共生菌群的形成,抵抗基因组在婴儿期更加丰富,并在头几个月内高度动态变化。
抗生素耐药性可以是内在的,也可以是后天的。2019年的一份最新报告估计,5岁以下儿童中每5个死亡案例中就有1个是由于耐药细菌引起的。对营养不良微生物群组的理解仍然不完整,干预和治疗策略也可能被误导。
来自不列颠哥伦比亚大学的研究人员使用最近开发的小鼠模型,研究了多种微量营养素缺乏症,即维生素A、B12、叶酸、铁和锌,这是最常见的缺乏症,对成熟的肠道微生物组、结构和耐药性的影响。研究人员发现微量营养素缺乏会显著改变肠道菌群、真菌群、病毒组的组成,并且提供了以前未知的关于微量营养素如何塑造发育中的肠道抗性基因组的数据。

近日其研究成果发表在《Nature Microbiology》上,这为早期微量营养素缺乏症的长远后果提供了重要的见解。解决微量营养素缺乏问题,不仅仅是克服营养不良,也可能是抗击全球抗生素耐药性祸害的关键一步。我们一起来详细了解一下。
断奶C57BL/6N雄性小鼠接受等热量实验对照或多种微量营养素缺乏(即低锌、叶酸、铁、维生素A和B12)饮食28天。正如预期的那样,实验结束时,低微量营养素(LM)饮食的小鼠体重增加较少,发育迟缓和贫血。这里用鸟枪法宏基因组测序来表征饮食治疗前后的肠道微生物组。
第28天,在LM小鼠中观察到变形菌门、肠杆菌门和Tannerellaceae科的扩增,而CON组的厚壁菌门和丹毒科扩增。LM小鼠中,下列菌群的相对丰度较高:
而下列菌群丧失:
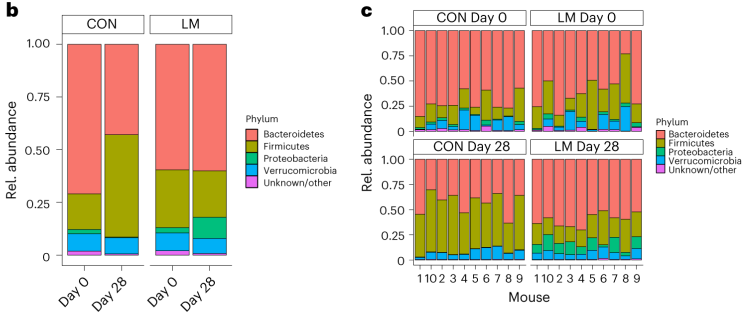
实验结束时,LM小鼠的α多样性较高(Shannon指数,P = 0.002);
PCA图显示,饮食处理后,两组之间存在明显的差异(p=0.001)
第28天,LM组中下列菌群增加:
下列菌群丰度降低:
LM小鼠中,下列噬菌体丰度更高:
对照小鼠中,下列菌群的丰度更高:
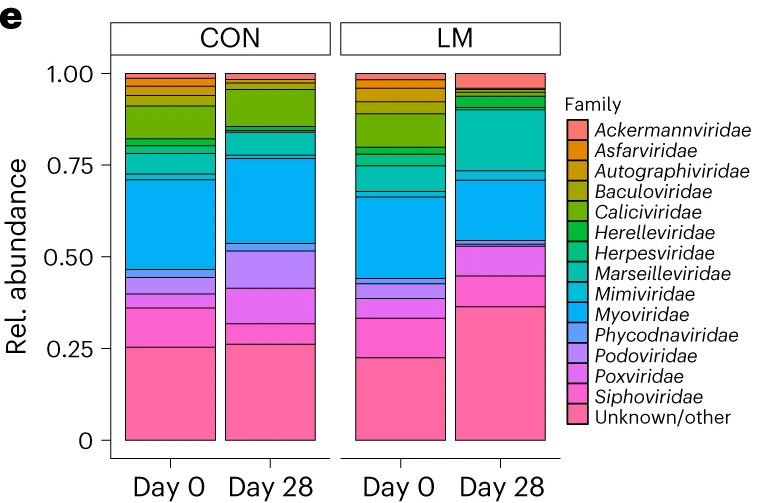
LM组的β多样性与对照在第28天有显著差异(Bray-Curtis,PERMANOVA,P < 0.01)
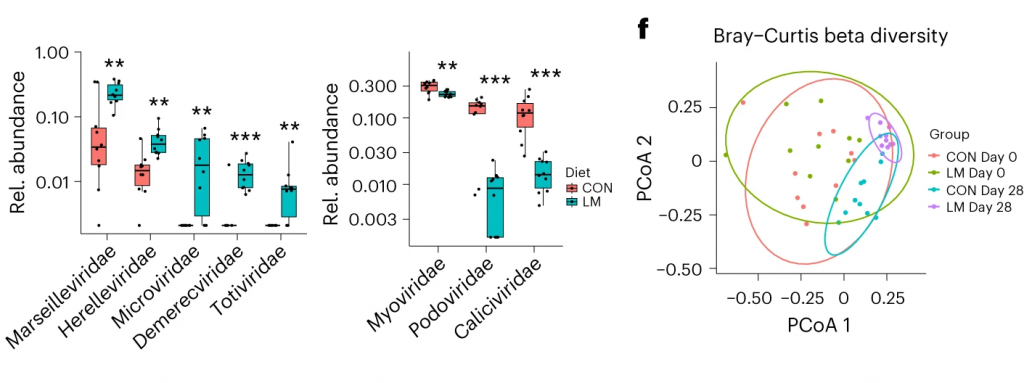
发现了14种指示细菌:
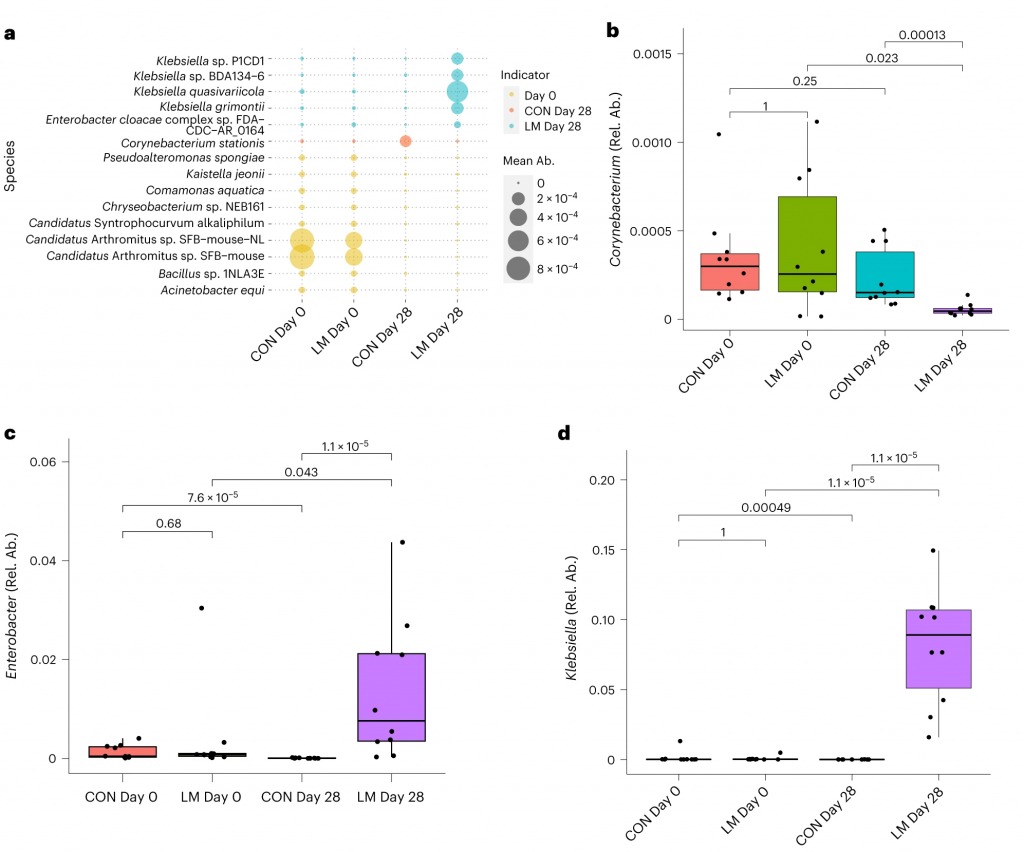
在真菌组和噬菌体组中,LM小鼠中下列相对丰度显著增加:
在营养不良的儿童中,机会性细菌的扩张(在不利情况下可能引发危害的微生物)是肠道的常见表型。因此,研究人员将模型中的机会性细菌与常见于营养不良儿童中的细菌进行表型比较。
第28天,LM小鼠中总机会性细菌的相对丰度总体增加(P < 0.0001)。11个分类单元中,有7个在第28天LM组的相对丰度显著增加:
有3个在LM组中丰度减少:
在LM的小鼠真菌群落中,观察到Candida dubliniensis 的相对丰度较高(P < 0.019)。
抗生素耐药性,无论是内在的还是后天的,都是由几个关键机制驱动的。
使用综合抗生素耐药性数据库(CARD)对肠道耐药性组进行分析显示,总ARGs的相对丰度增加(P = 1. × 10−5)。
随后的分析表明,抗生素外排和抗生素失活是改变的最常见的内在耐药性机制。
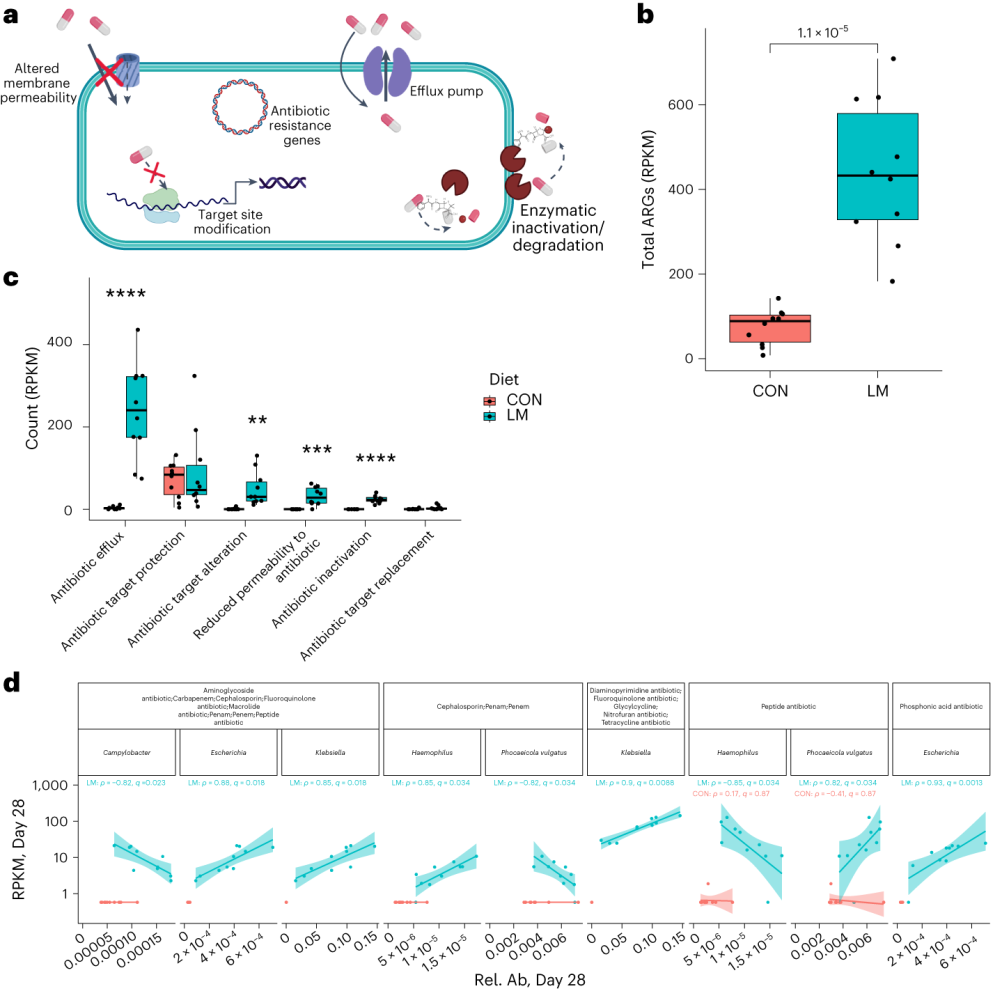
第28天LM组的ARG α多样性显著高于对照组(P = 0.0092)。
基于Bray–Curtis的相异性指标显示,低微量营养素饮食强烈影响了早期肠道抵抗。ARGs的计数显示,绝大多数(73%)ARGs仅在LM第28天组中流行≥30%。
将CARD数据库映射和药物分类分析显示,氟喹诺酮类/大环内酯类/青霉素类抗生素(Q < 0.0001)是LM处理小鼠中最常见的药物耐药机制改变,其次是磷酸酯类(即福氏霉素)(Q < 0.001),以及二氨基嘧啶类/氟喹诺酮类/甘氨环素类/硝呋环酮类/四环素类(Q < 0.001)。
▸ 接下来,研究人员提出是否有药物类别或耐药性机制与任何细菌门或机会性细菌相关?
事实上在LM小鼠中,克雷伯氏菌、嗜血杆菌、埃希氏菌、弯曲杆菌、Phocaeicola vulgatus和几种药物类别之间存在正相关(Q < 0.05)。不出所料,克雷伯菌和大肠杆菌与ARGs药物类别的相关性比其他机会细菌更强。
在个体机会性细菌中,克雷伯菌和弯曲杆菌与外排机制相关,克雷伯菌,志贺菌,弯曲杆菌和埃希氏菌与抗生素失活相关。
肠球菌与外排机制相关,但仅在对照组中。
环境压力源,如营养缺乏,已被证明会触发细菌的压力反应,从而诱导抗生素耐药性机制作为生存策略。矛盾的是,细菌也可以产生活性氧(ROS),在致命压力的存在下自毁。
研究人员研究了LM喂养的小鼠的应激反应机制是否发生了改变,以及它们是否与个体ARGs相关。
事实上,在LM小鼠中发现编码氧化应激和氧化应激反应的基因更丰富,总ARGs与氧化应激之间具有很强的相关性(P = 0.0098)。
具体来说,氧化应激反应与下列之间存在强烈的相关性:
在对照小鼠中,总体氧化应激与嗜血杆菌之间存在强烈的相关性(p<0.05)。
在LM小鼠中,氧化应激反应的调节与克雷伯杆菌、志贺氏菌、弯曲杆菌、大肠杆菌、肠杆菌科菌和变形菌门菌的增加相关。
微量营养素缺乏是一项重要的公共卫生危机,同时也是一个容易忽视的研究领域。该研究基于先前的动物研究,强调了这些微量营养素缺乏如何影响发育中的肠道微生物组。此外还探索了耐药基因组。
低微量营养素 & 肠道微生物组
在低微量营养素饮食28天的小鼠体内,细菌、真菌和病毒/噬菌体粪便种群发生了变化 。由于微量营养素不足的影响,变形菌门细菌和机会性细菌,如克雷伯菌、大肠杆菌、志贺菌、衣原体、肠球菌、弯曲杆菌、肠杆菌、Phocaeicola vulgatus富集。
研究表明,饮食扰动确实会破坏肠道中正在发育的真菌生物群落和病毒组/噬菌体。还观察到LM小鼠体内病毒/噬菌体的富集,这表明了一个不成熟(即婴儿)表型和发育延迟。这一特征可能对细菌适应能力和宿主免疫反应产生影响。
真菌组在早期生命发育阶段受到饮食和其他环境因素的影响,可能对短期和终身健康产生影响。两个实验组的真菌携带量随着群落成熟而增加。然而,在第28天,低微量营养素饮食组的小鼠体内明显增加了致病真菌念珠菌,这是一种常见的侵袭性物种。
这些发现与一个在马拉维队列中的研究结果一致。该研究报道了在无锌情况下给予多微量营养素粉剂(MNP)后,马拉维队列的肠道微生物组中原生动物和真菌群落的增加。埃希氏菌-志贺菌也在12个月大的婴儿中富集,这些婴儿接受了补充或不补充锌的MNP,强调了微量营养素在形成营养不良儿童肠道群落组成中的作用。
低微量营养素 & 抗生素耐药性
抗生素耐药性是一项迫切的全球公共卫生威胁,肠道微生物组是耐药基因(抗性基因组)的重要来源。
一项先前的研究发现,健康婴儿的耐药基因组中存在预测超过30类抗生素耐药性的400多个基因。其中,167个基因对多个抗生素表现出表型耐药性。有趣的是,婴儿的耐药基因组中还包括对婴儿之前未接触过的多种抗生素的耐药性。这进一步强调了内在耐药基因组作为当前和新兴抗生素耐药性的病原库的重要性。
在本次研究中,发现低微量营养素饮食的小鼠中富集了参与内在抗生素耐药性机制的基因,这些基因与机会性细菌的存在具有关联性。例如,与氟喹诺酮和膦酸(如磷霉素)耐药相关的基因得到了富集。这对于常见患有多药耐药细菌引起的菌血症的营养不良儿童来说,具有重要的临床意义。
本次研究提供了重要发现,并强调了微量营养素缺乏与肠道抗药基因组之间的重要联系。这些结果表明,我们对营养不良微生物组的认识还不完整,需要进一步研究成熟的抗药基因组。
低微量营养素 & 肠道微生物组 & 耐药性
此外,还展示了微量营养素缺乏引起了肠道微生物组成的显著变化。这导致了变形菌门的扩增、机会性细菌和真菌病原体的增加,进一步促进了多种内在耐药基因的表达。
尤其是发现了细菌氧化应激与抗药基因组之间的显著相关性。确定了微量营养素缺乏引起的细菌应激在营养不良宿主中显著促进内在抗生素耐药性的作用。因此,未来解决营养不良和抗生素耐药性问题的策略应将内在耐药基因组纳入考虑,并与可持续发展目标(良好健康和福祉)相一致,最大程度造福于相关儿童。
本研究的一个局限性是初步的微生物组特征分析中使用了雄性小鼠(基于先前的研究表明雄性对营养不良比雌性更加敏感),研究人员计划在未来探索雌性小鼠。
另一个潜在的局限性是使用了多种微量营养素;然而,这种设计增强了模型,反映了实际应用中与儿童相符的多种微量营养素的复杂协同作用。一个主要的优势是将测序和生物学评估相结合,用于微生物组和抗生素耐药性的特征化。进一步探索数据集可能揭示共存微量营养素缺乏的功能和微生物动态。
未来可以调查肠道生理学以及抗药基因组在致病感染易感性中的作用。进一步探索真菌耐药基因组和该模型中内在抗真菌性能。然而,抗真菌耐药性数据库(MARDy)是目前唯一经过策划的抗真菌耐药性数据库,但更新不够频繁,限制了它的应用。
目前可用的抗生素耐药性分析数据库往往存在高估基因关联性的倾向。数据库的选择取决于研究人员想要回答的问题类型。
CARD数据库的一个局限性是它基于已发表的基因组数据进行策划,可能对经过深入研究的生物体比对少研究的生物体有偏见。不过它的全面列表、专家的定期更新和机器学习算法支持使其成为该领域中的宝贵工具。
编辑
抗生素耐药性通常归因于抗生素的过度使用和误用,但本研究表明,微量营养素缺乏的“隐性饥饿”是一个重要因素。需要进一步加强对营养不良与抗生素耐药性之间关系的研究,增进我们对这一领域的理解。还需要制定和实施综合性的干预策略,以解决儿童营养不良及其对健康的连锁反应,以及抗生素耐药性的双重挑战。总的来说,该研究为减少抗生素耐药性提供新的视角,为这方面的研究带来新的思路,并在全球范围内推动健康和可持续发展目标的实现。
参考文献:
Littlejohn PT, Metcalfe-Roach A, Cardenas Poire E, Holani R, Bar-Yoseph H, Fan YM, Woodward SE, Finlay BB. Multiple micronutrient deficiencies in early life cause multi-kingdom alterations in the gut microbiome and intrinsic antibiotic resistance genes in mice. Nat Microbiol. 2023 Nov 16.
谷禾健康

“唉,昨晚又没睡好!”
失眠已经严重影响着一部分人们的生活。失眠后会引起烦躁、白天嗜睡、精力不足、内分泌系统紊乱、认知功能受损、免疫力下降甚至易得心脑血管疾病。
据中国睡眠研究会等机构统计,中国有超3亿人存在睡眠障碍。其中,19—25岁年轻人经常熬夜至零点以后;19—35岁青壮年是睡眠问题高发年龄段。 并且由于当代社会压力增加,失眠率还在不断攀升。


影响睡眠质量的因素有很多:包括人体的生物钟,环境因素如光照、噪音、温度,还有心理状况,饮食状况及疾病状况。而近年来的研究发现体内有一种物质与睡眠紧密相关——它就是褪黑素。
褪黑素于20世纪50年代首次被发现并表征,从那时起,广泛的研究揭示了它的生产、功能和潜在的治疗应用。
褪黑素作为改善睡眠质量和调节昼夜节律紊乱的补充剂已广受欢迎。除了在睡眠调节中的作用外,褪黑素还被发现具有抗氧化、抗炎、免疫调节和神经保护特性。它影响生殖过程、心血管健康、胃肠功能以及其他生理系统。
近年来,褪黑素和肠道微生物群之间的关系已成为一个令人着迷的研究领域。研究表明褪黑素和肠道微生物之间存在双向作用,强调了肠道微生物群对褪黑激素产生和代谢的潜在影响,以及褪黑激素对肠道微生物组成和功能的影响。
褪黑素(N-乙酰基-5-甲氧基色胺)最早于1958年在牛松果体中发现并分离出来,因其能够美白青蛙皮肤,研究人员一开始认为作为一种“美白因子”,并将其命名为“褪黑素”。
后续的研究才证明了其在调节生物节律和睡眠模式中的作用。
注:褪黑素是一种具有3-胺基和5-甲氧基的吲哚胺,因此具有两亲特性(同时具有亲水性和亲脂性)。
褪黑素的化学结构
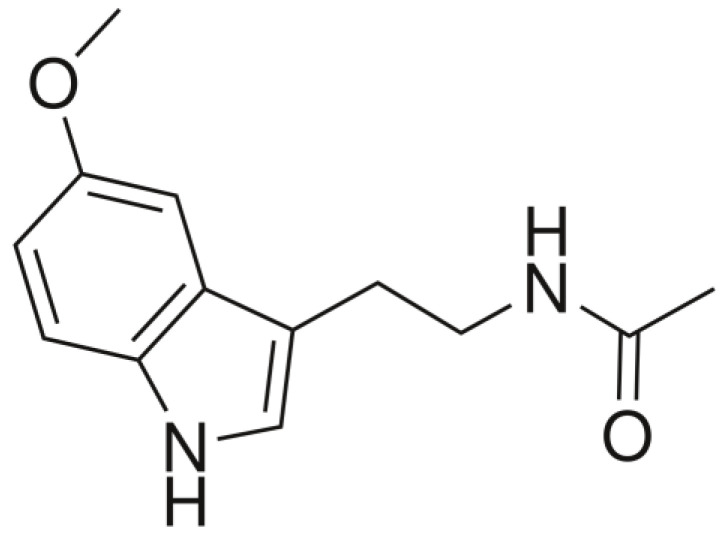
Minich DM,et al.Nutrients.2022
✦ 色氨酸是合成褪黑素的原料
松果体通常在黑暗环境中产生褪黑素,褪黑素生物合成从色氨酸开始,接着色氨酸转化为血清素(5-羟色胺)。5-羟色胺会经历两个酶促反应:首先,N-乙酰基转移酶进行N-乙酰化,产生N-乙酰-5-羟色胺。
然后,通过羟基吲哚-氧-甲基转移酶的作用,甲基从S-腺苷甲硫氨酸转移到N-乙酰血清素的5-羟基。N-乙酰基转移酶是褪黑素合成的限制步骤,它具有昼夜节律,夜间活动是日间活动的50到100倍。
褪黑素的生物合成途径

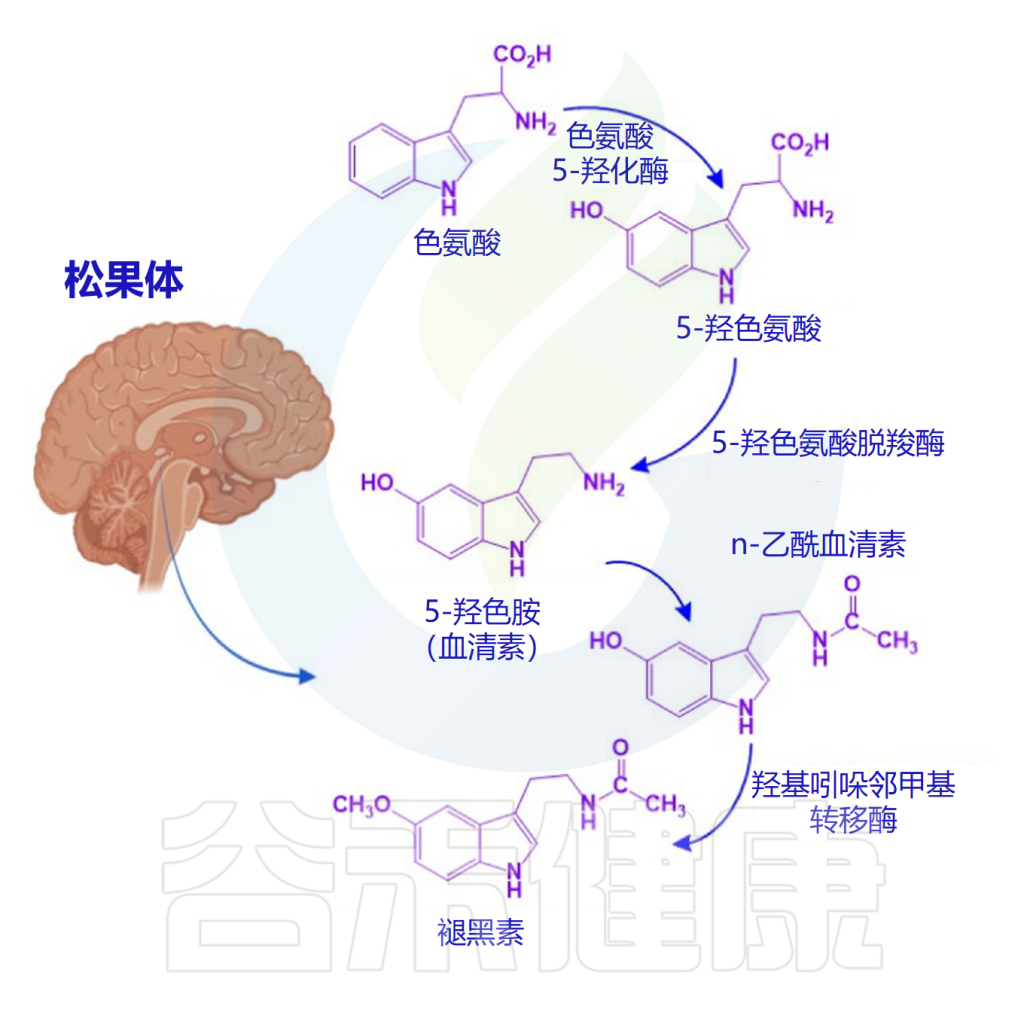
Miranda-Riestra A,et al.Molecules.2022
✦ 其他部位也可以产生褪黑素
值得注意的是,其他组织和器官也会产生褪黑激素,包括视网膜、胃肠道、皮肤和免疫细胞。其在胃肠道中的浓度比血清中的浓度高10至400倍。
注:胃肠道中的褪黑素主要由肠嗜铬细胞、某些类型的免疫细胞和肠道共生细胞产生。肝脏几乎会降解所有褪黑素,这表明胃肠道褪黑素仅限于肠-肝轴,而不是循环到其他器官,并且它在局部发挥作用。
在这些外周组织中,褪黑素的产生可能不会直接受光暗周期调节,但可能受到其他因素(例如饮食和局部信号)的影响。
褪黑素在体内的合成

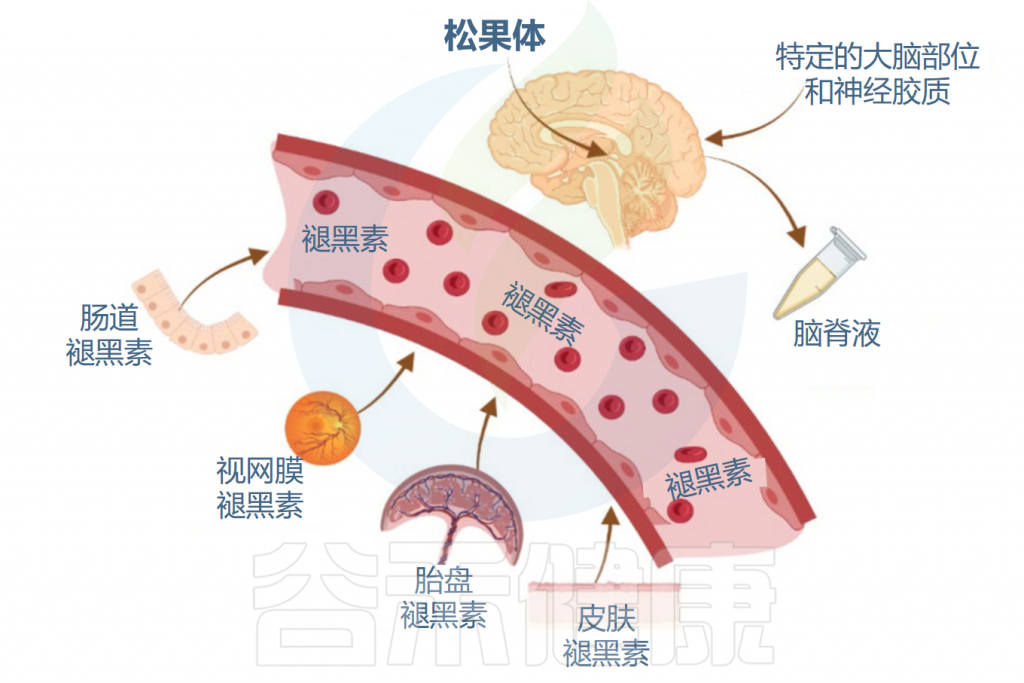
Miranda-Riestra A,et al.Molecules.2022
平均而言,松果体每天产生0.1至0.9毫克褪黑素。但一些因素会影响褪黑素的分泌。
✦光照
光照对于调节褪黑素的产生起着至关重要的作用。视网膜中称为本质光敏视网膜神经节细胞(ipRGC)的特殊细胞可检测光并向下丘脑视交叉上核 (SCN)发送信号。
当暴露于光,特别是蓝光时,这些细胞会抑制褪黑素的产生。这是因为光照会抑制血清素N-乙酰转移酶和N-乙酰血清素O-甲基转移酶的活性,这些酶参与褪黑素合成。

Repova K,et al.Int J Mol Sci.2022
在没有光的情况下,例如在夜间,褪黑素合成的抑制被消除。SCN向松果体发出信号,以增加褪黑素的产生。因此,褪黑素水平上升,促进困倦并帮助调节睡眠-觉醒周期。
✦生物钟
褪黑素的分泌与人体的生物钟密切相关。人体的生物钟是一种内在的生物节律,调节睡眠和其他生理过程。
褪黑素的分泌通常在晚上增加,帮助人们入睡。保持规律的作息时间和良好的睡眠习惯有助于维持正常的褪黑素分泌。

Minich DM,et al.Nutrients.2022
✦年龄
婴儿的褪黑素分泌和昼夜节律要到三个月左右才会发育。母乳喂养的婴儿可以从母乳中获得褪黑素。
从婴儿期到青春期,褪黑素的分泌水平随着年龄增长并达到稳定水平,然后从二十多岁开始随着年龄的增长而缓慢下降。儿童通常比成人产生更多的褪黑素。这也是为什么年长者常常会有睡眠质量下降的问题。

Minich DM,et al.Nutrients.2022
✦色氨酸可用性
色氨酸(褪黑素合成的前体)的可用性也会影响褪黑激素的产生。色氨酸是通过饮食来源获得的,并且可能受到饮食和新陈代谢等因素的影响。
充足的色氨酸对于合成血清素是必要的,血清素进一步转化为褪黑素。
✦药物和化学物质
某些药物和化学物质可能会影响褪黑素的分泌。例如,一些抗抑郁药物、抗高血压药物和咖啡因都可能抑制褪黑素的产生。
✦疾病和身体状况
一些疾病和身体状况也会影响褪黑素的分泌。例如,睡眠障碍、抑郁症、焦虑症和肾脏疾病等都可能干扰褪黑素的正常分泌。
值得注意的是,褪黑素产生的调节是复杂的,涉及多种因素之间的相互作用。昼夜节律紊乱,例如轮班工作、时差反应或夜间暴露在人造光下,可能会影响褪黑素的产生并扰乱睡眠模式。
总体而言,褪黑素的产生主要受到昼夜节律的调节,其中光照在抑制褪黑素合成中起着关键作用。黑暗和色氨酸的可用性促进褪黑激素的产生,有助于调节睡眠-觉醒周期并促进健康的睡眠模式。
褪黑素是一种多功能分子,在人体内具有多种生物学作用。在本节中,将介绍褪黑素对生理活动及人体健康的相关影响。

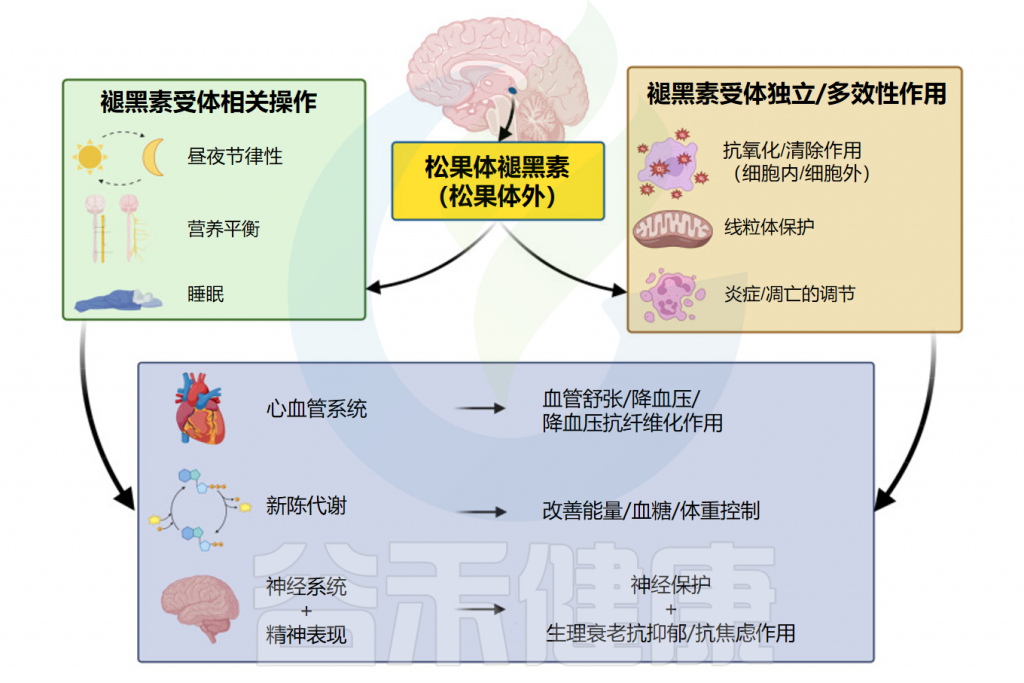
Repova K,et al.Int J Mol Sci.2022
▼
抗氧化、抗炎作用
许多研究已确定褪黑素是一种强大的自由基清除剂,甚至可能是迄今发现的最强的内源性自由基清除剂。体外和体内研究证明了褪黑素在抗氧化防御、减少氧化应激和抗炎过程中的作用。
• 褪黑素具有非常强的抗氧化作用
褪黑素是一种高效的抗氧化剂,因为一个褪黑素分子可以通过与其二级、三级甚至四级代谢物相关的级联机制清除多种活性氧和氮。
褪黑素的双重作用可以抑制促氧化酶(例如黄嘌呤氧化酶),同时还可以增强关键的抗氧化酶,例如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶,有助于人体的第一道免疫防御和代谢解毒。
• 褪黑素可以抑制促炎性细胞因子
此外,褪黑素可以阻断作用于环加氧酶(COX-2)的促炎过程,并抑制炎症介质如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)。
褪黑素还可以增强异常细胞的程序性细胞死亡(细胞凋亡),这在理论上使其成为一种理想的疾病治疗方法。
▼
调节昼夜节律,改善睡眠质量
人类的昼夜节律主要是由光照引起的,生活方式因素可能导致外在的昼夜节律障碍,如轮班工作或时差障碍,补充褪黑素可以通过提前或延迟来调节昼夜节律。
褪黑素对具有睡眠和昼夜节律紊乱人群的影响已得到充分证实。在失眠患者中,外源性褪黑素对一些睡眠参数有显著影响,如入睡潜伏期、总睡眠时间、早晨警觉性和睡眠质量。

• 缩短了入睡潜伏期
一项针对失眠患者的荟萃分析包含5项原始研究,结果表明睡前2小时服用褪黑素2mg显著缩短入睡潜伏期。
在其他一些目标群体中,也提供了褪黑素在纠正昼夜节律方面的证据。一项针对睡眠觉醒时相延迟障碍(DSWPD)患者的荟萃分析得出的结论是,外源性褪黑激素可提前内源性褪黑激素的发作并缩短入睡潜伏期。
在有时差症状的受试者、轮班工人和非24小时睡眠-觉醒节律障碍中也观察到褪黑素对睡眠参数的改善作用。
• 减少早醒时间,增加深度睡眠时间
最近的一项随机对照试验检查了97名中年失眠患者服用较高剂量的褪黑素(3毫克)4周对睡眠障碍的影响。研究显示褪黑素对睡眠参数有积极影响,例如减少早醒时间和增加深度睡眠百分比。
注:这些是睡眠的重要阶段,对于身体和大脑的恢复和健康至关重要。
▼
缓解焦虑
褪黑素除了对肠道炎症有一定的缓解作用外,多项研究表明,服用褪黑素还能发挥抗焦虑作用。
褪黑素的抗焦虑作用机制尚不完全清楚,可能与直接或间接作用有关。直接作用与大脑中褪黑素受体有关,间接作用与褪黑素调节各种神经体液系统(包括交感神经系统、糖皮质激素和神经递质)的能力有关,从而可能干扰应激反应和昼夜节律,并改变氧化和和炎症。
• 褪黑素用于预防术前和术后焦虑
在人类中,褪黑素已被测试为预防术前和术后焦虑的药物,作为麻醉药和止痛药辅助药物,以及用于预防术后谵妄。
临床研究表明,在接受腹部子宫切除术、静脉局部麻醉期间的手部手术或其他选择性手术的患者中,作为术前用药给予褪黑素可以减少术前焦虑,并且与苯二氮卓类药物的抗焦虑治疗同样有效。
在接受小型择期手术的儿童中,褪黑素与咪达唑仑一样,可以减轻术前分离焦虑和与引入麻醉面罩相关的焦虑。
• 褪黑素可能比一些精神药物更安全
此外,一些临床研究观察到褪黑素在降低术后兴奋、苏醒性谵妄和睡眠障碍发生率方面优于咪达唑仑。褪黑素还可以减轻结直肠手术和腹部子宫切除术患者的术后疼痛,同时减少吗啡用量。
值得注意的是,褪黑素可以有效抵消精神药物引起的代谢副作用。褪黑素可降低抗精神病药物治疗引起的血压、体重增加或胆固醇水平。
褪黑素似乎是苯二氮卓类药物的一种安全替代品,可以缓解儿童和成人与外科手术相关的焦虑,同时被认为是一种安全且耐受性良好的药物。苯二氮卓类药物会损害麻醉后的精神运动和认知功能,但褪黑激素却不会。
此外,褪黑素在人体内还有一些非常重要的功能:
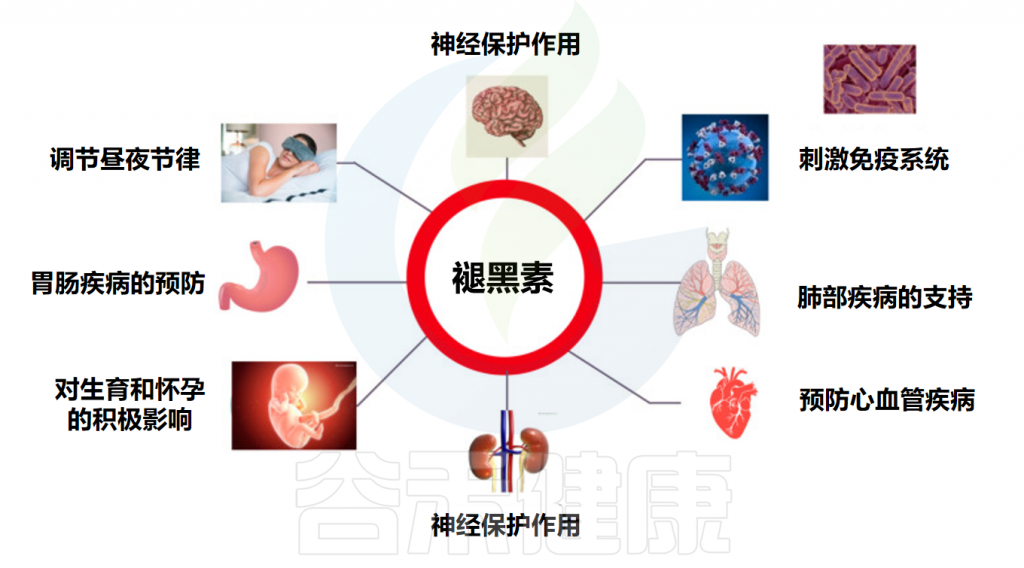

Markowska M,et al.Cells.2023
褪黑素对人体功能具有多种影响




Minich DM,et al.Nutrients.2022
▼
神经保护和神经再生作用
褪黑素的浓度变化与睡眠-觉醒周期紊乱、情绪紊乱、认知能力障碍、神经系统保护等有关。
• 对神经系统具有保护作用
由于其抗氧化特性,褪黑素可作为自由基的清除剂,在分子水平上调节多种反应,包括氧化应激、炎症和细胞凋亡。
它会影响神经营养素或神经递质的浓度。还有文献记载,褪黑素是钙蛋白酶的抑制剂,其活性在许多中枢神经系统疾病的发病机制中具有重要意义。
神经退行性疾病的发病机制与线粒体功能障碍有关。线粒体作为细胞能量来源,也是氧化损伤的目标。线粒体膜的敏感性会受到多种因素的损害,口服褪黑素可能会得到保护。线粒体膜选择性地吸收褪黑素,这是其他抗氧化剂不具备的功能。
初步研究还表明,它可能是淋巴液中的活性成分,有助于清除代谢废物,例如淀粉样蛋白的堆积。理论上,基于这一发现,从治疗角度来看,服用褪黑素可能是值得的,这样患有神经退行性疾病的老年人可以增加脑脊液和类淋巴液的水平。然而,这个概念仍处于起步阶段。
▼
免疫调节和加强监视
褪黑素另一个重要作用是其免疫调节和加强免疫监视的能力。它刺激参与体液免疫和细胞免疫的不同细胞系的产生,例如巨噬细胞、自然杀伤细胞和CD4+细胞,并影响多种细胞因子的合成。
• 褪黑素可以加强免疫调节和免疫监视
褪黑素的直接抗病毒和抗菌作用已被记录。在严重感染期间,服用褪黑激素已被发现具有免疫调节和细胞保护功能,可以降低病毒和细菌炎症的死亡率。
• 褪黑素还曾用于新冠期间的辅助治疗
考虑褪黑素在氧化应激、炎症过程以及免疫反应管理中的作用,对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的病毒感染患者进行了检查。
研究表明,使用褪黑素作为辅助治疗可能是有益的,在2019年新冠状病毒(COVID-19)期间也使用了褪黑激素。
▼
预防胃肠道疾病
消化系统中的褪黑素除了具有抗氧化作用和刺激免疫系统的能力外,还可以减少盐酸的分泌,增强上皮的再生,并增加微循环。
• 褪黑素有助于预防胃肠道疾病
所有这些功能使褪黑素成为预防不同胃肠道疾病的治疗选择之一,例如结直肠癌、溃疡性结肠炎、胃溃疡和肠易激综合症。
据记载,补充褪黑素可以使胃食管反流病完全缓解。它对影响食道和胃的急性和慢性刺激物具有保护作用。
一些研究还证实,褪黑素在预防非酒精性脂肪性肝炎方面对肝细胞具有很强的支持作用。
▼
改善血压、血糖
• 褪黑素可以降低胆固醇和改善血压
在30名患有代谢综合征的患者中,使用褪黑素(每天5毫克,睡前两小时)短短两个月后,低密度脂蛋白胆固醇和血压就得到了改善,而这些患者三个月的生活方式没有改变。
此外,褪黑素已被证明可以降低夜间高血压,改善收缩压和舒张压,降低颈内动脉搏动指数,减少血小板聚集,并降低血清儿茶酚胺水平。
香港中文大学研究人员最近进行的一项荟萃分析和系统评价得出结论,口服褪黑素补充剂可将睡眠收缩压降低3.57毫米汞柱。
其他研究表明,褪黑素可以改善心力衰竭患者的预后,并被认为是这些患者的预防和辅助治疗措施。
• 褪黑素可能有助于血糖控制
关于褪黑素是否有助于血糖控制的疾病(例如非胰岛素依赖型2型糖尿病)存在一些讨论。最近一项针对男性糖尿病患者的相对小型安慰剂对照研究表明,服用10毫克褪黑素三个月后,胰岛素敏感性降低了12%。
褪黑素对糖尿病人群口服葡萄糖耐量的影响差异可能与褪黑素受体1B基因(MTNR1B)中2型糖尿病相关G等位基因的多态性有关。
▼
对生育的影响
• 褪黑素有助于提高生育能力
已经在动物和人类群体中进行了褪黑素给药对生育影响的研究。研究发现,褪黑素可以提高生育能力、卵母细胞质量、成熟度和胚胎数量。
此外,还提出了在怀孕期间的积极作用。神经发生的保护、对胎盘的支持性影响以及氧化应激的减少是提高生育率和改善胚胎-胎儿发育的关键。
活性氧会在怀孕期间引起干扰,它们也是围产期并发症的罪魁祸首。褪黑素是自由基的清除剂,具有抗氧化和细胞保护能力,这可能对成功怀孕至关重要。
• 褪黑素影响新生儿的健康状况
褪黑素不仅在怀孕期间发挥着重要作用,而且在新生儿病理发生时也需要其支持。褪黑素是脱氧核糖核酸(DNA)甲基化和组蛋白改变过程中的监管者。这样可以避免基因表达的根本性变化。使胎儿受到保护,免受一些疾病的影响。
怀孕期间褪黑素浓度不足可能会在个体发育早期的遗传密码中留下内分泌紊乱,随后在儿童期发生。
▼
对骨骼健康的影响
根据细胞和临床前数据,有人认为褪黑素作用于骨代谢的合成代谢和分解代谢方面。
• 褪黑素增加了绝经后妇女的骨密度
一些临床试验证明了褪黑素在重新平衡围绝经期妇女骨重塑中的作用和增加绝经后骨质减少妇女的骨密度。
具体研究
在这些研究中,使用了多达3毫克的补充褪黑素。根据名为褪黑素微量营养素骨质减少治疗研究的为期一年的临床试验的结果,褪黑素(5毫克)、柠檬酸盐(450毫克)、维生素D3(2000IU/50微克) 的组合与安慰剂相比,能够对绝经后骨质疏松女性的骨标志物(例如骨矿物质密度)产生有利影响。
除了有益地改变骨标志物之外,干预措施还改善了情绪和睡眠质量等生活质量指标。当然,不能因此推断褪黑素是造成这些影响。
研究人员认为褪黑素是与年龄相关的骨骼肌疾病的关键化合物,因为它通过其抗氧化潜力参与线粒体功能。这方面的研究结果可能对恶病质或肌肉减少症患者有帮助。
除了上述的影响外,褪黑素与肠道微生物组之间的相互作用也很有趣。肠道中包含着大量的微生物,其与人体健康密切相关,褪黑素已被发现与肠道微生物存在复杂且多样的联系,并可能因此影响人体健康。让我们一起来了解下。
褪黑素主要由两种细胞产生:松果体细胞和肠嗜铬细胞。松果体细胞位于大脑内的松果体中。肠嗜铬细胞位于整个胃肠道的表面,在胃肠道的粘膜内层浓度很高。
与松果体细胞不同,肠嗜铬细胞不受光和暗的调节,但似乎受到食物摄入和消化的影响。
注:肠嗜铬细胞是神经内分泌免疫细胞,对肠道稳态至关重要。
★ 肠道中的褪黑素浓度比血清中高很多
据估计,肠道内的肠嗜铬细胞所含的褪黑素含量是松果体细胞产生的褪黑激素的400倍。肠道褪黑素水平可能比血清中褪黑激素水平高10至100倍。
肠嗜铬细胞中褪黑素的生物合成
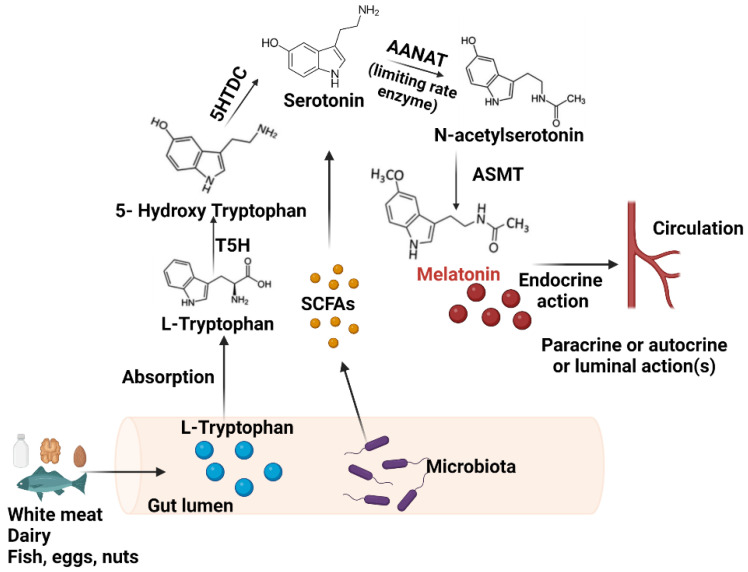
Iesanu MI,et al.Antioxidants (Basel).2022
肠道中褪黑素的释放以旁分泌方式发挥作用,增加胃粘膜的活动和循环,并增强胃肠道运动。此外,褪黑素在肠道中具有抗兴奋特性。它可以刺激上皮细胞的再生,并且还被证明对胃肠道内壁具有保护性抗氧化作用。
旁分泌——通过扩散而作用于邻近细胞的激素传递方式。

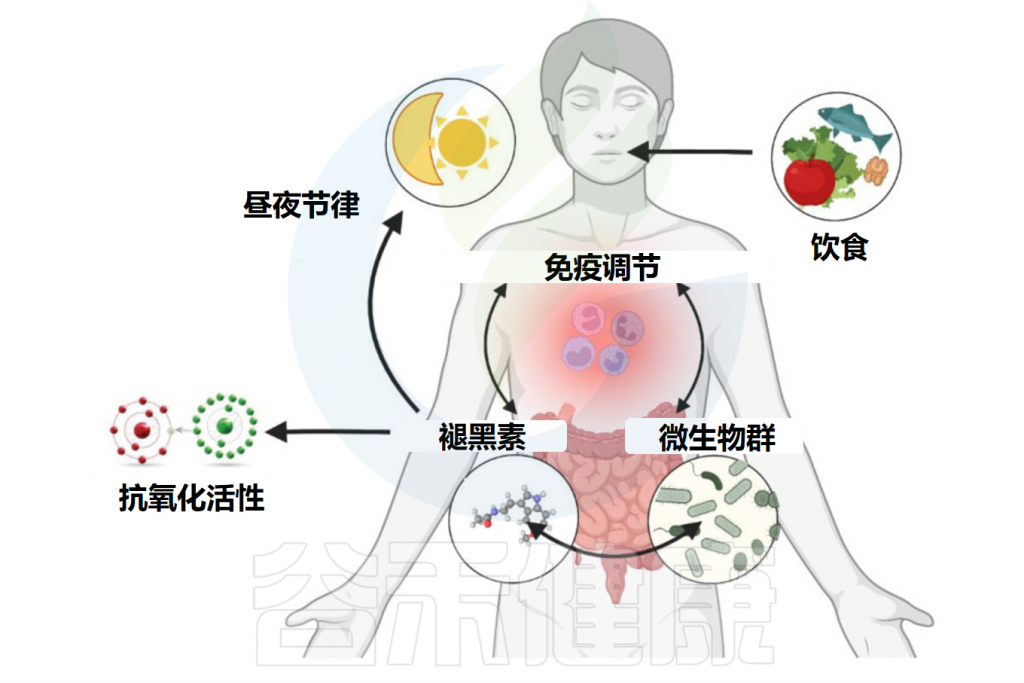
Iesanu MI,et al.Antioxidants (Basel).2022
值得注意的是,关于松果体产生的褪黑素和肠道来源的褪黑素如何相互关联,是否存在肠道-松果体轴串扰,以及不同的饮食模式甚至特定食物、禁食方案或进餐时间可能相互影响,仍然是推测性的。改变全身褪黑素水平与饮食和肠道产生的褪黑素这一领域还需要通过更多的研究来回答。
褪黑素和肠道细菌之间似乎具有复杂的相互关系。如下所述,微生物可以调节胃肠道中褪黑素的合成;相反,褪黑素与肠道微生物群的组成和动态有关。它们共同形成一个复杂的系统,在多个层面上发挥作用,以维持宿主的体内平衡。
• 肠道菌群影响褪黑素的前体进而影响其水平
肠道菌群可以通过调节其必需的前体色氨酸和5-羟色胺来影响褪黑素水平。色氨酸的可用性可以通过饮食改变或通过改变肠道微生物群组成来改变。
肠道中色氨酸代谢的三种途径都可以受到肠道细菌的调节。关于吲哚途径,微生物组特征决定了吲哚衍生物的类型。这些吲哚衍生物具有广泛的作用,从对肠粘膜和免疫系统的有益结果到肾毒性。
此外,炎症刺激激活的Toll样受体和肠道细菌释放的病原体相关分子模式分子会刺激犬尿氨酸途径。
肠腔中产生的短链脂肪酸刺激肠嗜铬细胞释放血清素并增强褪黑素的产生。内源性孢子形成细菌产生的其他代谢物可以激活肠嗜铬细胞并促进结肠中5-羟色胺的生物合成。
此外,抗生素引起的生态失调会增强吲哚途径,抑制犬尿氨酸途径,并降低动物模型中的结肠5-羟色胺。
• 病原菌感染后褪黑素的分泌减少
多种细菌对肠道合成褪黑素有影响。例如,胃粘膜幽门螺杆菌感染会下调褪黑激素生成酶的表达,并减少胃肠道中褪黑素的产生。感染清除后,褪黑素产量恢复到正常水平。
• 益生菌可能刺激褪黑素的产生
益生菌,对各种与菌群失调相关的疾病有效。研究还表明益生菌在刺激褪黑素产生方面发挥有益作用。
短期施用益生菌鼠李糖乳杆菌可以增加斑马鱼中褪黑素受体基因的丰度,与光周期转变为持续黑暗的结果相似。因此,益生菌似乎有可能影响褪黑素的产生,从而缓解各种疾病状态。
相反,生态失调和随后的肠道损伤可能会降低局部肠道和全身褪黑素水平。
越来越多的证据表明,褪黑素可以调节肠道微生物的组成和丰度,尤其是在各种病理状态下。
如下所述,褪黑素通过其作为抗氧化剂、免疫调节剂和昼夜节律调节剂的特性间接影响肠道微生物群,研究发现其还可能直接影响肠道微生物群。
• 褪黑素影响肠道微生物的昼夜节律
在人类中,褪黑素分泌主要以昼夜节律方式在夜间发生,血浆中最高水平出现在凌晨2至4点左右。
褪黑素的节律性释放由下丘脑前部的视交叉上核调节,代表中枢昼夜节律发生器。视交叉上核神经元的轴突投射到邻近的下丘脑核、丘脑和脑干,并使昼夜节律的一些组成部分同步,例如睡眠/觉醒节律、进食时间表和垂体/肾上腺轴的活动。
胃肠道和微生物群表现出与昼夜节律相关的变化,体外研究表明,多种肠道细菌受光暗循环影响,并与参与生物节律的分子密切相关。昼夜节律失调会引起并加剧炎症性肠病的炎症。
褪黑素含量高时,产气肠杆菌增殖的更快
产气肠杆菌(Enterobacter aerogenes)是人类肠道中普遍存在的细菌,具有昼夜节律,并对白天的褪黑素波动做出反应。
当褪黑素存在时,产气肠杆菌以剂量依赖性方式增殖得更快。此外,当暴露于色氨酸、5-羟色胺或N-乙酰血清素时,没有观察到相同的效果,这突显了褪黑素的重要性和敏感性。
产气肠杆菌主要生存于人类和动物的肠道,为人体内的正常菌群,在人体虚弱的特殊情况下才偶尔引起疾病。
此外,大肠杆菌和肺炎克雷伯菌对褪黑素的敏感性不同。另一项研究表明,高脂肪饮食会损害肠道细菌的日常波动,而褪黑素可以使这些波动正常化,这表明这种重新同步可能具有治疗意义 。
微生物代谢物(例如丁酸盐)的昼夜变化会影响宿主的生物钟。鉴于细菌代谢物的产生是周期性的,微生物功能与宿主的昼夜节律和代谢之间存在隐含的联系。
• 通过氧化还原平衡影响肠道微生物组成
褪黑素的抗氧化活性存在于多种功能中,直接作用是中和自由基,间接作用是通过增加抗氧化酶的水平来发挥作用。
健康的肠道微生物群也具有相当大的抗氧化作用。共生细菌直接参与活性氧的代谢,因为产生乳酸的细菌(例如乳杆菌属)具有乳酸氧化酶、超氧化物歧化酶和丙酮酸氧化酶,这些酶可以去除活性氧,减少氧化应激。
在较高浓度下,活性氧具有潜在毒性并导致生物分子损伤,例如蛋白质、脂质和DNA的氧化,这可能导致多种细胞功能障碍,包括细胞死亡。
结肠健康很大程度上受到肠道抑制过量活性氧产生的能力的影响。值得注意的是,肠道微生物群的组成根据氧化还原平衡而变化。在暴露于氧化应激的小鼠中,肠道微生物群经历了拟杆菌门的增加和厚壁菌门、梭菌目、瘤胃球菌属(Ruminococcus)和颤螺菌属(Oscillospira)的减少。
在衰老模型中,小鼠年龄越大,活性氧产生量越高,梭菌目数量减少,拟杆菌门丰度增加。当肠道损伤和生态失调时,胃肠道的抗氧化活性会受到抑制。例如,在炎症性肠病患者中,共生细菌多样性的减少和微生物群组成的变化与活性氧产生增加和肠粘膜防御系统受损有关。在这些情况下,褪黑素可以发挥其抗氧化活性并重建氧化还原平衡,从而改善肠道微生物群组成。
与其他器官类似,在肠道中,褪黑素不仅清除活性氧,还上调不同的抗氧化酶(GSH-Px、CAT、SOD)并下调促氧化酶。褪黑素可以通过与活性氧相互作用直接发挥其活性,或通过膜和核受体发挥其活性,膜和核受体作为其间接抗氧化作用的介质。
褪黑素激活该通路中的多个应激反应基因(例如AMPK、HIFa、Sirt),进而导致多种抗氧化酶的增加。
因此,通过所有这些褪黑素介导的途径减少肠道微生物群的氧化应激对肠道微环境具有显著影响。
越来越多的证据表明,褪黑素可以调节肠道特性和常驻微生物,以应对压力(例如睡眠障碍)。
当评估褪黑素、睡眠障碍和肠道微生物组之间的相互作用时,在有明显肠道损伤的临床前研究中,血浆和肠道褪黑素水平会降低。
总体而言,在睡眠障碍患者中补充褪黑素可以重建肠道微生物群平衡和肠道屏障的完整性,恢复了肠道微生物群的丰富性和多样性。

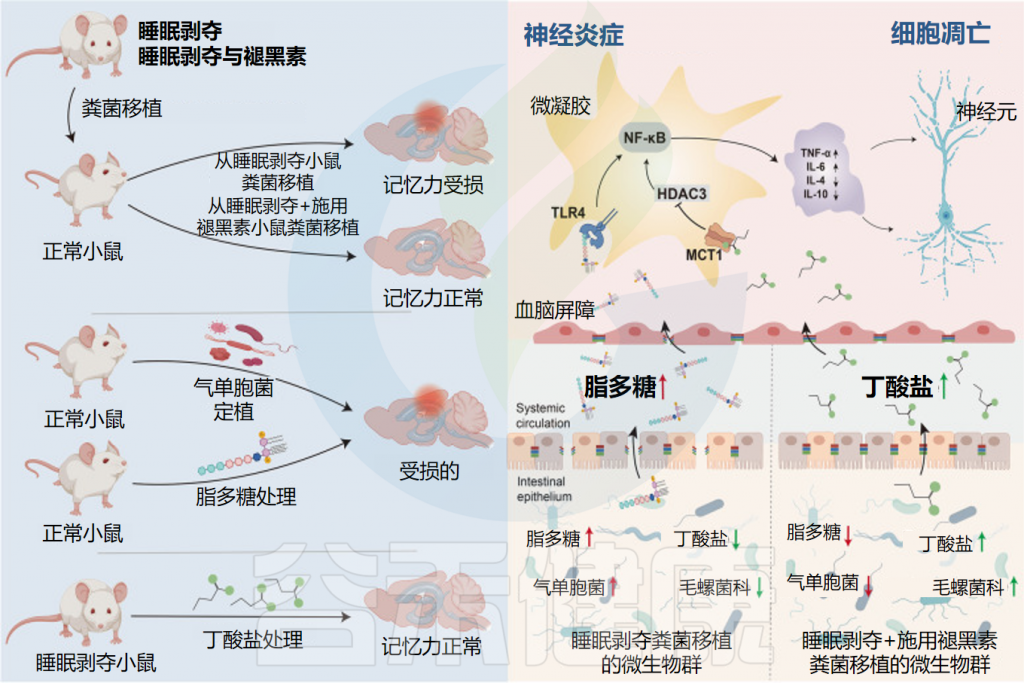
Wang X,et al.Microbiome.2023
• 增加了有益菌的丰度
在属水平上,补充褪黑素增加了阿克曼氏菌、乳杆菌、拟杆菌和粪杆菌(这些已知的有益细菌可以降低炎症),并减少了影响结肠炎的气单胞菌。
显著增加了阿克曼氏菌的丰度
褪黑素显著增加了阿克曼氏菌(Akkermansia muciniphila)的丰度,这种细菌以其在肠道中的有益作用而闻名(例如,增加粘蛋白产生,保持屏障完整性)。
提高了产丁酸盐细菌的丰度
此外,褪黑素通过增加拟杆菌属、乳杆菌属、阿克曼氏菌属和粪杆菌属的丰度,提高了丁酸盐的水平,丁酸盐是肠道微生物群的重要有益代谢物之一。
• 重建肠道屏障完整性
褪黑素还通过恢复因睡眠障碍受损的杯状细胞数量、粘液产生和肠上皮细胞增殖,增加紧密连接蛋白(claudin-1、occludin、ZO-1)和含有半胱天冬酶募集结构域的蛋白9(CARD9)的表达来重建肠道屏障的完整性。
• 降低促炎细胞因子,增加抗炎物质
睡眠障碍也会导致全身产生促炎症状态。褪黑素通过降低促炎细胞因子水平(IL-1β、IL-6、IL-17、TNF-α)同时增加抗炎标志物(IL-5、IL-10、IFN-α、IL-22)来抵消这种影响。
作为一种假定的机制,褪黑素还会下调睡眠剥夺小鼠的TLR4,从而降低长期炎症反应的可能性。
褪黑素在减轻粘膜损伤和生态失调方面发挥着至关重要的作用。这些发现表明,褪黑素可以作为益生元来治疗睡眠障碍相关的肠道损伤,并帮助保持肠道微生物群的平衡。
需要注意的是,褪黑素抑制可能是导致肠道损伤和生态失调的罪魁祸首,而不是睡眠障碍本身造成的应激。
总之,外源性给予褪黑素可恢复由睡眠障碍引起的全身和肠道微生物群改变,这意味着褪黑素在根据健康状况调节微生物群落方面发挥着作用。

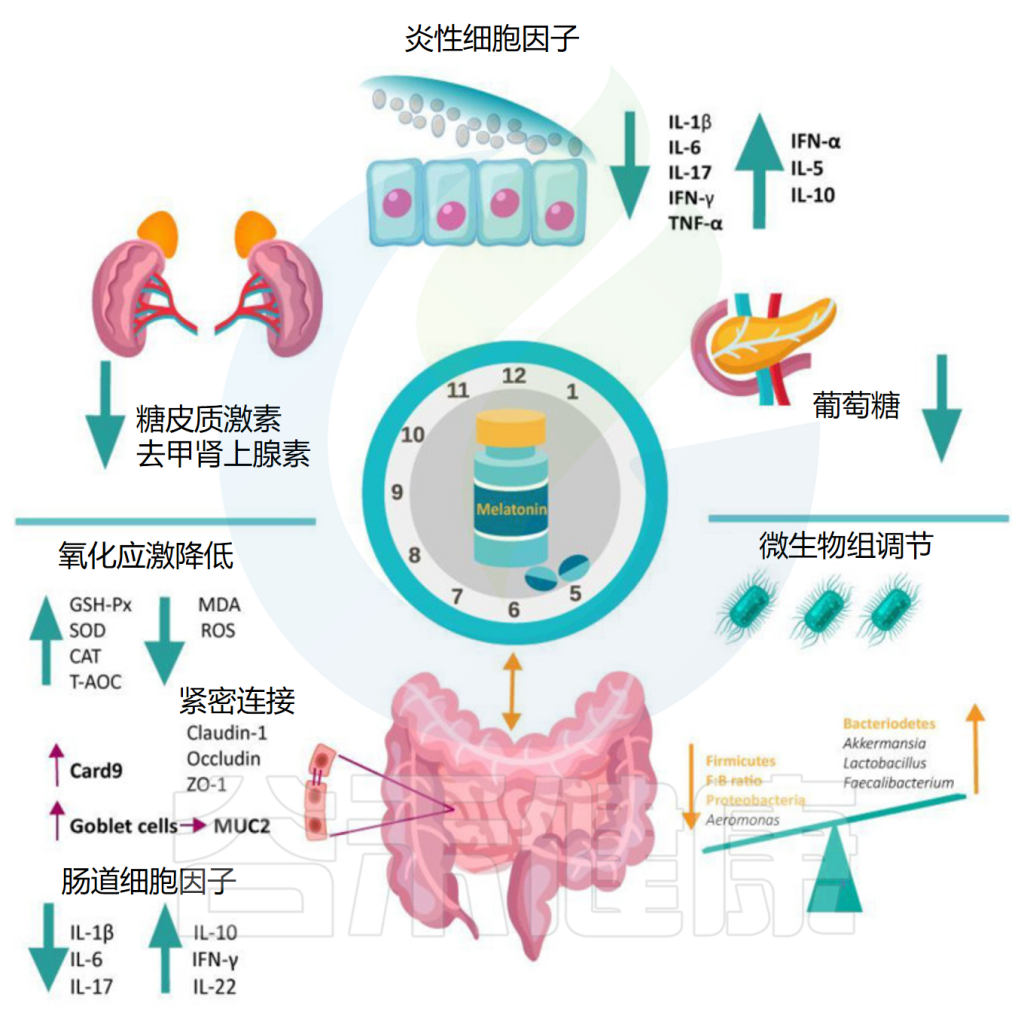
Iesanu MI,et al.Antioxidants (Basel).2022
褪黑素和肠道微生物群之间的相互作用对健康和疾病的各个方面都有潜在影响。大量临床和临床前研究证明了褪黑素对结肠炎的保护作用。
• 结肠炎患者体内褪黑素水平下降
测量了溃疡性结肠炎患者和健康对照的降结肠和乙状结肠中褪黑素的浓度。
与健康对照相比,溃疡性结肠炎患者的褪黑素水平急剧下降。值得注意的是,褪黑素浓度与组织学严重程度之间出现负相关。此外,溃疡性结肠炎患者中褪黑素生物合成途径中的关键酶AANAT和HIOMT的mRNA 水平显著低于健康对照。
这些数据表明溃疡性结肠炎患者的褪黑素水平下降,并且与疾病严重程度呈负相关,表明褪黑素可能参与溃疡性结肠炎的进展。
Zhao ZX,et al.Front Immunol.2022
(A)通过ELISA检测健康对照和溃疡性结肠炎患者中的褪黑素浓度;(B)结肠切片的代表性H&E染色(×20);(C)所有溃疡性结肠炎患者和健康对照的褪黑素浓度与组织学严重程度评分的相关性。
• 服用褪黑素可以减轻结肠炎
发现每日服用50毫克/公斤剂量的褪黑素治疗7天可显著改善恶唑酮诱发的小鼠结肠炎,体重减轻较少,结肠长度较长。
H&E染色显示,褪黑素治疗可预防肠道炎症,与对照组相比,褪黑素治疗导致CD11b+ Ly6G +中性粒细胞显著减少,并且炎症细胞因子的产生减少,例如TNF-α和Il-1β。
这些结果表明,褪黑素可以减轻恶唑酮诱发的结肠炎,炎症反应减少,肠道完整性提高。
• 服用褪黑素调节炎症性肠病的微生物组成
褪黑素改变微生物群组成的α和β多样性
Zhao ZX,et al.Front Immunol.2022
特定的变化与有益菌株的增加和有害菌株的减少有关。例如,褪黑素增加了瘤胃球菌科(Ruminococcaceae)和粪球菌属(Coprococcus)的水平,这两种细菌都是短链脂肪酸产生菌。
它还增加了双歧杆菌的含量,双歧杆菌作为益生菌在炎症性肠病中产生了积极的结果,以及乳杆菌的含量,乳杆菌是该疾病的另一种有前途的辅助疗法。
减少了条件性致病菌
相反,褪黑素给药后,肠道菌群显示出变形菌门显着减少,该门在炎症性肠病发病机制中发挥着重要作用。
链球菌属(Streptococcus)可能代表另一种被褪黑素下调的微生物并与疾病活动相关。另一项研究报告了脱硫弧菌、消化球菌科和毛螺菌科的减少。发现脱硫弧菌和溃疡性结肠炎之间存在明显关联。尽管消化球菌科在炎症性肠病中的研究较少,但在一些研究中与肠道炎症相关。
重要的是,所有这些细菌组成的变化都伴随着明显的临床症状增强——通过多种组织学方法和症状学评估进行量化。这可能表明至少在一定程度上通过微生物群调节来影响褪黑素的效果。
褪黑素在属水平上调节一些微生物群
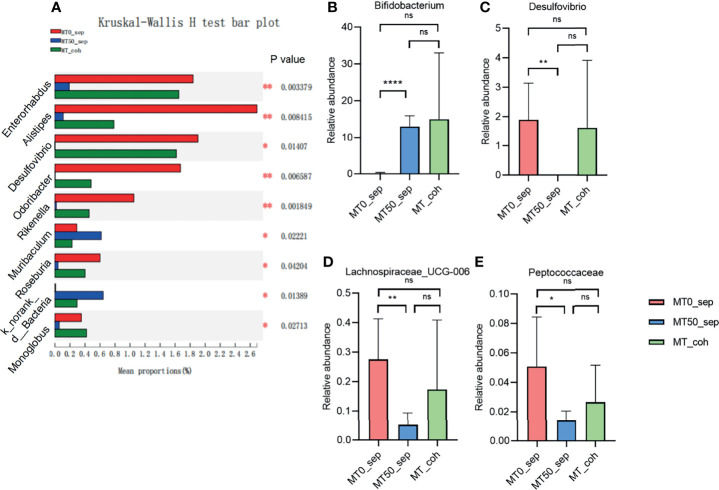
Zhao ZX,et al.Front Immunol.2022
• 褪黑素有利于肠道屏障完整性
总的来说,就肠道微生物群而言,褪黑素不仅具有改变细菌种类组成的能力,而且还能够减少肠道细菌移位。事实上,在结肠炎模型中,褪黑素诱导紧密连接蛋白和闭合蛋白的上调,这些蛋白是肠道屏障的关键组成部分。
细菌易位是一种有害过程,可导致内毒素血症,与炎症性肠病活动呈正相关。
褪黑素对肠道微生物群的调节可能对于缓解结肠炎至关重要。
除此之外,褪黑素还可以逆转高脂肪饮食产生的大多数代谢、形态和肠道微生物组成变化。
• 褪黑素恢复高脂饮食导致的微生物变化
首先,褪黑素成功恢复了因高脂饮食而减少的微生物群多样性,改变了肠道微生物结构,使其类似于正常饮食的小鼠。与对照组相比,褪黑素增加了细菌数量,但它阻止了高脂饮食引起的细菌突然过度生长。
有趣的是,与仅接受高脂饮食的小鼠相比,接受褪黑素的高脂饮食小鼠和对照组的不同类群每日振荡之间存在相似性,证明褪黑素也可以恢复细菌节律性。
它还刺激疣微菌门,包括阿克曼氏菌——一种治疗代谢紊乱的有效益生菌。脱硫弧菌科(产生内毒素的细菌)、Alistipes和Anaerotruncus中的表达下调,这些细菌与肥胖相关。
• 褪黑素改善代谢紊乱,降低脂肪比例
在影响这些微生物组相关的同时,褪黑素显著改善了高脂饮食啮齿动物的代谢紊乱。褪黑素还降低总体重和内脏脂肪比例,促进棕色脂肪组织的产生和产热作用。它还降低炎症、脂肪生成基因表达以及胆固醇和甘油三酯水平。
此外,它重建了时钟基因表达和血清甘油三酯的正常昼夜节律变化,而这些变化被高脂饮食破坏了。它还通过降低血糖和增强胰岛素敏感性来增强葡萄糖代谢。对于肝脏,它可以对抗脂肪变性并抑制 NF-κB信号,该通路与非酒精性脂肪肝病有关。
褪黑素缓解脂质代谢异常的一个特殊机制与抑制大肠杆菌有关。研究人员在时差小鼠模型中研究了与代谢综合征相关的变化,这些小鼠表现出体重增加、回肠脂质摄取增加以及血管生成素样4(脂质代谢调节剂)的减少。同时,观察到大肠杆菌和脂多糖产量增加。褪黑素逆转了所有这些修饰,并且通过下调大肠杆菌和脂多糖的合成,抑制了LPS/TLR4/STAT3等通路,使脂质摄取减少。
肠道微生物群在肥胖和代谢综合征的发展中起着关键作用。褪黑素恢复这种复杂结构正常组成和功能的能力证明了其作为药物治疗这些病症的合理性。
!
注意
需要进一步的研究来充分了解褪黑素–肠道微生物轴对健康和疾病的机制和影响。
然而,它强调了考虑肠道微生物群和褪黑素相互作用在维持肠道健康和整体健康方面的重要性。
褪黑素作为体内最重要的激素之一,过低或过高的含量都会对人体产生一些不利影响。
▸ 褪黑素过低
失眠:褪黑素是调节睡眠的重要激素,过低的褪黑素水平会导致失眠和睡眠质量下降。
生物钟紊乱:褪黑素水平过低可能导致生物钟紊乱,影响日常作息和生理节律。
免疫功能下降:褪黑素具有免疫调节作用,过低的褪黑素水平会导致免疫功能下降,增加感染和疾病的风险。
心理健康问题:褪黑素与神经系统密切相关,低褪黑素含量可能与焦虑、抑郁等心理健康问题有关。
其他健康问题:一些研究表明,褪黑素含量过低可能与肥胖、糖尿病、心血管疾病相关。
▸ 褪黑素过高
通常情况下,人体不会出现褪黑素过高。一般都是在补充了外源性褪黑素的情况下导致体内褪黑素水平过高。

一项研究对2130名患者进行了随机对照试验,发现过量服用褪黑素导致褪黑素水平过高引起的不良事件很少。其中最常报告的不良事件是日间嗜睡、头痛、头晕和体温过低。
除此之外,有一小部分研究发现过高的褪黑素水平可能对性欲和性功能产生负面影响。
由于褪黑素的代谢率较高,补充外源性褪黑素通常被认为是安全且耐受性良好的,大多数负面影响要么在几天内自然消退,要么在停药后立即消退。
褪黑素的分解代谢很快
循环中的褪黑素主要在肝脏和大脑中分解代谢。一般来说,褪黑素的半衰期(即分解一半所需的时间)约为30-50分钟。这意味着褪黑素在体内的浓度会在数小时内迅速降低。
在肝细胞中,褪黑素通过细胞色素P4501A2 (CYP1A2) 进行80%的羟基化;然后,在肾脏中,它被磺基结合(占总分解代谢的70%至80%)或与葡萄糖醛酸结合(占总分解代谢的5%)。
CYP1A2确保肝脏分解代谢。即使在肝脏水平,也存在脱乙酰化和脱甲基化途径。脱乙酰后,褪黑素转化为5-甲氧基色胺,氧化后转化为5-甲氧基吲哚乙酸。
褪黑素对人体如此重要,但经常会因一些外部环境、生活作息或疾病状态导致内源性褪黑素分泌不足,这个时候就需要一些外源性褪黑素来补充。
补充外源性褪黑素也有一些注意事项,包括可用的剂量、最佳服用时间、禁忌症。
除了人体自身会分泌褪黑素外,许多食物中也存在一些天然褪黑素,尤其是植物性食品。
✦ 许多植物性食品中含有褪黑素
自从20世纪90年代中期在植物中首次发现褪黑素(“植物褪黑素”)以来,各种食用植物和草药中的褪黑含量不断被提及。
然而,其浓度范围广泛且不一致,取决于许多因素,例如品种、生长条件、发芽、收获和加工(例如烘烤、干燥)等。
尽管褪黑素存在于大多数植物部位,但植物的生殖器官中的含量通常较高,尤其是种子,可能有助于确保植物的生存并抵御环境压力。
值得注意的是,褪黑素在植物中的众多作用之一是刺激促进健康的植物营养素(如芥子油苷和多酚)产生。
褪黑素已被记录在下列植物性食品和饮料中:


Minich DM,et al.Nutrients.2022
✦ 动物食品中的色氨酸有助于转化成褪黑素
虽然有几个变量需要考虑,但一般来说,动物性食品中的褪黑激素含量相对植物性食品中较少。根据已发表的文献,牛奶和乳制品、鸡蛋、鱼和肉类(牛肉、羊肉、猪肉)含有一定水平的褪黑素。
相反,动物食品往往是比植物食品更好的膳食色氨酸来源,因此可能需要考虑将这些食物最终转化为大量的褪黑素。
如前所述,虽然一些天然食物含有褪黑素,但其含量较低,因此很难获得足够的治疗剂量褪黑素。必须强调的是,几乎所有褪黑素产品都涉及工业加工,因此可能导致一些潜在毒性。
褪黑激素补充剂有多种形式,包括片剂、胶囊、舌下片和液体制剂。
• 褪黑素可能产生副作用和依赖性
在临床应用中,据记录,过多的褪黑素或各种缓释剂型会产生副作用,例如第二天健忘症或“褪黑素宿醉”,发现睡了三到四个小时就睡不好,醒来后无法再入睡。长期高剂量服用褪黑素随着时间的推移,个人可能会产生依赖性。
注:具有某些基因型的人,例如褪黑激素受体1B(MTNR1B)基因多态性,如果补充褪黑素,可能需要监测糖化血红蛋白。
• 补充高剂量的褪黑素会导致体温过低
一项关键研究中,比较了多个剂量:生理剂量(0.3mg)、药理剂量(3mg)和0.1mg的低生理剂量。
研究发现补充0.3毫克/天褪黑素的数据最佳客观。生理剂量(0.3 毫克)可恢复睡眠效率,并将血浆褪黑素水平提高至成年早期的正常水平。药理剂量(3毫克)也能改善睡眠;然而,它会导致体温过低,并导致血浆褪黑素在白天一直保持升高状态。
• 一般补充0.5-3毫克/天为宜
临床上补充褪黑素的剂量通常为每日0.5-3毫克;然而,发现剂量取决于产品类型,在某些情况下较低剂量也同样有效。
剂量参数可能会根据健康状况、睡眠问题类型或相关神经病理学等因素而有所不同,因此还需要根据每位患者提供适当的、个性化的剂量。
• 睡前一小时服用效果较好
从时间角度来看,许多与睡眠相关的研究都表明在睡前三十到六十分钟补充褪黑素效果较好;然而,一些研究表明,提前四个小时服用即可有效。
建议在黑暗环境或较弱光刺激下服用褪黑激素,从而模拟基于明暗模式的生理动力学和昼夜节律。
根据已发表的报告,口服褪黑素大多被认为是安全的,然而,在某些特定情况下可能需要进一步的临床监督。
• 一些药物会影响褪黑素的代谢
早期研究已发现,大部分褪黑素通过细胞色素CYP1A2代谢,小部分通过CYP1A1、CYP1B1和CYP2C19进行较少的代谢活动。
因此,影响这些酶途径的药物将影响褪黑素的代谢。褪黑素与一种或多种药物同时服用时应谨慎;否则,可能会导致不良副作用(如极度镇静)。
例如,最著名的相互作用之一是褪黑素与抗抑郁药物氟伏沙明的相互作用。该药物是一种已知的CYP1A2抑制剂,可通过减少褪黑素的降解来增强褪黑激素水平。同样,咖啡因也通过CYP1A2代谢,并可增加褪黑素水平。
总之,虽然还不全面,但褪黑素可以与具有血液稀释、降血糖、降血压、抗惊厥、镇静、抗抑郁或免疫抑制活性的药物、营养素或草药相互作用或受到影响。
褪黑素的代谢和活性可能会受到许多饮食、补充剂和药物的潜在影响,所有这些都说明了这样一个事实:每个人对褪黑素的个性化反应存在差异,具体取决于他们的饮食和医疗背景。
由于缺乏安全性数据,不建议怀孕或哺乳期的女性补充褪黑素。然而,有一些迹象表明褪黑素在这两个阶段可能都有好处。因此,让这些女性咨询了解患者个性化需求的健康专业人士是关键。同样,被诊断患有任何疾病的人应咨询其健康专业人员并接受医疗监督。
温馨提醒
调查发现,有的褪黑素产品月销已超过3万件,说明需要使用褪黑素来帮助改善睡眠的人已不在少数。需要注意的是,虽然补充外源性褪黑素可以在一定程度上改善睡眠质量、代谢健康或降低焦虑,但服用褪黑素存在的副作用使其不能成为长久的选择。
而且补充褪黑素主要是针对一些因工作昼夜颠倒导致的内源性褪黑素分泌不足造成的睡眠障碍,对于其他原因造成的失眠可能效果一般。我们额外补充的这些褪黑素,并不能促进身体去分泌更多的褪黑素。如果停用褪黑素,可能睡眠情况还会回到原样,并不会解决本质问题。
重点还是要从自身生活习惯出发,改善饮食,调节作息规律,增加体育锻炼并定期体检,及时了解自身健康状况。肠道菌群与很多影响睡眠的因素相关,例如压力、消化等,调节肠道菌群可以更全面地从根本上改善睡眠障碍。
改善内源性褪黑素的措施
除此之外,调节内源褪黑素的措施有以下几种:
•控制光照暴露,睡前半小时不玩手机
光线会影响褪黑素的分泌,晚上避免暴露于强烈的蓝光,尤其是来自电子设备的蓝光。蓝光会抑制褪黑素的分泌,影响睡眠质量。
•维持规律的睡眠时间
建立健康的睡眠习惯,如果不是因为工作导致的昼夜颠倒,尽量每天保持规律的睡眠时间,避免熬夜或睡眠不足。
•营造舒适的睡眠环境
保持安静、黑暗和凉爽的睡眠环境,可以使用遮光窗帘、耳塞或眼罩等辅助工具,有助于提高睡眠质量。
•避免过度应激
减少压力和焦虑,通过放松技巧如深呼吸、冥想和瑜伽等来缓解压力,有助于促进褪黑素的分泌。
•适度运动
进行适度的有氧运动,如散步、跑步或游泳等,可以提高睡眠质量和褪黑素的分泌。
•饮食调整
摄入富含色氨酸的食物,如禽肉、鱼类、坚果和豆类,色氨酸是合成褪黑素的必需物质。此外,可以适量摄入富含维生素B6、钙和镁的食物,这些营养素有助于褪黑素的合成和释放。
褪黑素在临床上有多种应用,以下是一些常见的褪黑素临床应用。
•睡眠障碍
褪黑素补充剂通常用于治疗睡眠障碍,如失眠、睡眠时相延迟综合征和非24小时睡眠觉醒障碍。它可以帮助调节睡眠-觉醒周期并提高睡眠质量。治疗睡眠障碍的剂量通常为0.3毫克至10毫克,睡前30分钟至2小时服用。
•时差反应
褪黑素可用于缓解时差反应症状,时差反应是因跨越多个时区旅行而导致的睡眠-觉醒周期暂时中断的症状。
在睡前适当的时间服用褪黑激素,可以帮助调整人体的生物钟,有利于更快地适应新的时区。
•轮班工作睡眠障碍
夜班或轮班工作的人经常会遇到睡眠困难和昼夜节律紊乱。褪黑素补充剂可用于帮助调节睡眠模式并改善白天的睡眠质量。
•神经退行性疾病
褪黑素已被研究其对阿尔茨海默病、帕金森病和亨廷顿舞蹈病等神经退行性疾病的潜在治疗作用。它具有抗氧化和抗炎的特性,可能有助于保护神经元并减轻神经退行性过程。然而,需要进一步研究以确定其功效和最佳剂量。
•情绪障碍
褪黑素补充剂在治疗重度抑郁症和季节性情感障碍等情绪障碍方面显示出良好的前景。它可能有助于调节昼夜节律、改善睡眠并缓解抑郁症状。
治疗情绪障碍的剂量可能会有所不同,咨询医疗保健专业人士很重要。
•癌症
褪黑素已被研究其潜在的抗癌特性。它具有抗氧化、抗炎和免疫调节作用,可能可以抑制肿瘤生长并增强癌症治疗的有效性。然而,需要更多的研究来确定其在癌症治疗中的功效和最佳用途。
关于褪黑素与肠道微生物群相互作用的新兴研究具有重要的临床意义,并为治疗干预带来了希望。
通过益生菌、益生元或粪菌移植调节肠道微生物群组成和功能可能与补充褪黑素在促进肠道健康和治疗炎症性肠病、肠易激综合征和代谢紊乱等疾病方面具有协同作用。
以下是有关褪黑素-肠道微生物轴未来前景的一些要点。
•时间生物学和个性化医疗
褪黑素和肠道微生物群之间的相互作用为个性化医疗增加了时间生物学的维度。考虑褪黑素产生的昼夜节律以及肠道微生物群组成和功能的昼夜变化,有助于优化针对褪黑激素-肠道微生物群轴的干预措施的时间和剂量。
•微生物代谢物和褪黑激素衍生物
肠道微生物群可以将褪黑素代谢成各种代谢物,其中一些可能具有不同的生物活性。探索这些褪黑激素代谢物的作用及其与肠道微生物群的相互作用可以发现新的治疗途径。
•营养干预
饮食在塑造肠道微生物群组成和功能方面起着至关重要的作用。未来的研究可以调查特定饮食成分,例如色氨酸(褪黑激素的前体)和多酚对褪黑激素-肠道微生物群轴的影响。
了解影响褪黑素产生和肠道微生物群的饮食因素可以为肠道健康的营养干预提供信息。

Iesanu MI,et al.Antioxidants (Basel).2022
•挑战和未来方向
尽管研究数量不断增加,但该领域仍存在一些挑战和未来方向。需要对肠道微生物群和褪黑素测量的研究方法进行标准化,以确保研究之间的一致性和可比性。
需要进行长期临床试验来评估针对褪黑激素-肠道微生物轴的干预措施的安全性、有效性和最佳剂量。
主要参考文献
Iesanu MI, Zahiu CDM, Dogaru IA, Chitimus DM, Pircalabioru GG, Voiculescu SE, Isac S, Galos F, Pavel B, O’Mahony SM, Zagrean AM. Melatonin-Microbiome Two-Sided Interaction in Dysbiosis-Associated Conditions. Antioxidants (Basel). 2022 Nov 14;11(11):2244.
Markowska M, Niemczyk S, Romejko K. Melatonin Treatment in Kidney Diseases. Cells. 2023 Mar 8;12(6):838.
Minich DM, Henning M, Darley C, Fahoum M, Schuler CB, Frame J. Is Melatonin the “Next Vitamin D”?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients. 2022 Sep 22;14(19):3934.
Repova K, Baka T, Krajcirovicova K, Stanko P, Aziriova S, Reiter RJ, Simko F. Melatonin as a Potential Approach to Anxiety Treatment. Int J Mol Sci. 2022 Dec 19;23(24):16187.
Moon E, Kim K, Partonen T, Linnaranta O. Role of Melatonin in the Management of Sleep and Circadian Disorders in the Context of Psychiatric Illness. Curr Psychiatry Rep. 2022 Nov;24(11):623-634.
Zhao ZX, Yuan X, Cui YY, Liu J, Shen J, Jin BY, Feng BC, Zhai YJ, Zheng MQ, Kou GJ, Zhou RC, Li LX, Zuo XL, Li SY, Li YQ. Melatonin Mitigates Oxazolone-Induced Colitis in Microbiota-Dependent Manner. Front Immunol. 2022 Jan 18;12:783806.
Wang X, Wang Z, Cao J, Dong Y, Chen Y. Gut microbiota-derived metabolites mediate the neuroprotective effect of melatonin in cognitive impairment induced by sleep deprivation. Microbiome. 2023 Jan 31;11(1):17.
Miranda-Riestra A, Estrada-Reyes R, Torres-Sanchez ED, Carreño-García S, Ortiz GG, Benítez-King G. Melatonin: A Neurotrophic Factor? Molecules. 2022 Nov 10;27(22):7742.
Zhang B, Chen T, Cao M, Yuan C, Reiter RJ, Zhao Z, Zhao Y, Chen L, Fan W, Wang X, Zhou X, Li C. Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer’s Disease and Obesity. Front Immunol. 2022 May 10;13:900132.

谷禾健康

辐射对人体的影响是一个长期以来备受关注的问题。长时间暴露在辐射环境下可能会导致细胞损伤、突变和癌症等健康问题。
辐射包括电离辐射(X光机、CT、伽马刀、钴60治疗机、碘-131)和非电离辐射(手机辐射、微波炉、电热毯、高压电塔、基地转播台等)。
电离辐射在核能发电、核医学诊疗、食品辐照灭菌、高分子材料改性以及环境治理等多个方面具有重要的应用。随着电离辐射在研究和技术中的广泛应用增加,其导致的代谢性疾病、急性造血综合征、胃肠综合征和免疫系统疾病也越来越多。
当核辐射暴露超过安全限度时,可能导致癌症、遗传损伤等健康问题。
其他电离辐射的主要来源包括医疗诊断、放射治疗等,长期暴露于电离辐射可能导致DNA损伤、细胞突变、组织损伤、患癌症、遗传疾病等健康问题的风险增加。
来自医疗暴露、放射性药物应用、切尔诺贝利灾难、环境辐射污染的研究证据表明,肠道菌群与电离辐射引起的损害之间存在着密切的关联。
电离辐射不仅仅对肠道产生直接影响,还对肠道菌群的组成和功能产生影响,如肠道菌群多样性下降、有益菌减少、有害菌如变形菌、梭菌属等富集。
临床上较常见的,放射性肠炎就是电离辐射对健康的不良影响之一,普雷沃氏菌属、巨单胞菌属等在放射性肠炎中显著富集,或成为放射性肠炎的特征菌属。某些重要菌属的缺失可能与较差的预后相关。
特别值得注意的是,《SCIENCE》研究发现,一些肠道菌群有辐射防护的潜力,如Lachnospiraceae和Enterococcaceae,这为临床上放射治疗或其他防辐射领域带来新的希望。
鉴于近期日本核污水的排放,及人们对辐射毒性威胁的关注不断增加,迫切需要了解关于核污水排放的一些小知识,基于此本文向大家介绍一些辐射对人体健康的影响,肠道菌群在其中发挥的防辐射作用,以及基于肠道菌群调节的辐射防护及其机制。充分了解这些信息,应用于临床辅助诊断中,可以帮助确定疾病的类型,指导相关治疗策略。
本文主要内容
01 核污水及辐射相关的小知识
什么是核污水?
核废水和核污水有什么区别?
核污水的主要成分及特点
核污水进入人体的主要途径
辐射有哪几种类型?
辐射对人体健康的影响
02 核辐射对人体健康的影响
03 电离辐射对肠道菌群的影响
电离辐射
电离辐射影响小鼠肠道菌群组成
放射性肠炎
“精英菌群”——电离辐射中保命?
电离辐射和肠道菌群有怎样的机制关联
(短链脂肪酸、芳香氨基酸、吲哚衍生物、胆汁酸等)
04 非电离辐射
紫外线辐射、红外线辐射、激光辐射、
微波辐射、极低频辐射等
05 基于肠道菌群调节的辐射防护及其机制
益生菌、益生元
粪菌移植
生活中抗辐射的食物
其他
(饮食模式、膳食成分、避免食物、运动、生活方式等)
从2011年3月11日海啸引发地震,日本福岛第一核电站发生爆炸。由于爆炸,核电站各种结构破损,辐射过于强大,人不能靠近,也无法清理,所以核电站爆炸至今,一直处理不了。
核燃料一直没有妥善处理,而其又必须不断地进行冷却,事发之后,福岛第一核电站的运营方东京电力公司需要持续注水为反应堆降温,所以,冷却水灌进去后,每天就会产生大概140吨的核污染水,现在装污水的罐子已经快容不下了…
这些冷却过核燃料的水就是我们说的核污水。
核废水只是核电站的冷却水,通过换热系统进行交叉循环,不会与发过电的铀燃料进行直接接触。核废水里的放射性物质,通常只有氢的同位素氚,而氚的半衰期是只有12.43年。
核污水因为经过融化堆芯,含有大量放射性核素,比如碳-14、碘-129、铯-137、锶-90、碘-131、钴-60、铀-238等。这些放射性核素会通过摄入或吸入进入人体,对人体组织产生辐射,增加患癌症和其他放射性疾病的风险。
碳-14的半衰期超过5000年,有些核素目前没有公认有效的净化技术,在国际上没有排放先例。

注:也有人认为,假如日方公布的数据属实,福岛的核污水虽然穿过了堆芯,但是会经过一系列的后续处理,过滤掉绝大多数放射性同位素,只有一种放射性同位素氚没法过滤,把“核污水”中的氚浓度降低至日本国内标准的四十分之一、世界卫生组织规定的饮用水标准七分之一后,才开始正式排放的,才能获得国际原子能机构的背书。基于此那么两者区别不大【这个结论有待商榷,此处不作详细探讨,本文所指的核污水只讨论含有大量放射性核素的核污水】。
放射性成分
核污水中含有放射性物质,包括碳14、碘131、铯137、锶90、钴60、氢3(也称为氚)等。这些放射性成分具有辐射活性,对环境和人体健康产生潜在的危害。
污染范围广泛
核污水的污染范围不仅局限于水体,还可能对大气、土壤和生物体产生影响。
核污水排放到海洋中会对环境产生广泛的影响。首先,核污水中的放射性物质会对海洋生态系统造成严重的影响。这些放射性物质会被水中生物摄取,并逐渐富集在食物链的不同层次中,进而传递给更高级的海洋生物,最终对整个生态系统产生影响。这不仅会破坏海洋生物多样性,还会导致生物畸形、生殖问题以及其他健康问题的出现。
其次,核污水排放到海洋中会对人类健康构成威胁。人类可通过食用海洋生物摄入核污水中的放射性物质,进而受到辐射的影响。这可能导致健康问题,如癌症、先天性缺陷等。此外,核污水中的放射性物质还会通过海洋风、波浪和潮汐等因素,扩散到沿海地区,进一步影响附近居民的健康和安全。
持久性
核污水中的放射性物质往往具有持久性,可能在环境中长时间存在。这意味着核污水的影响也是持久的,对周围环境和生物体造成的潜在危害可能长期存在,即使核污水排放停止,其带来的影响仍会持续存在。
饮用水
如果核污水进入水源并未经适当处理,人们可能通过饮用受污染的水源而摄入放射性物质。
食物链
食物链始于海洋浮游植物,与陆地植物一样进行光合作用的微型植物。这些生物体从周围的海水中吸收放射性污染物。由于浮游植物被食物链上较大的浮游动物、小鱼和较大的动物吃掉,一些污染物最终以粪便颗粒或其他碎屑颗粒的形式沉降到海底。这些颗粒积聚在沉积物中,其中包含的一些放射性同位素可能通过微生物和化学过程重新回到上覆水域。
呼吸道
如果核污水中的放射性物质以气溶胶的形式释放到空气中,人们可能通过呼吸受到污染。这种情况通常发生在核事故或核电站泄漏的情况下。
皮肤接触
如果人们接触到受核污水污染的土壤、水体或其他表面,放射性物质可能通过皮肤进入人体。
当谈到排放核污水时,不可避免地会涉及到辐射对人体的影响。我们先来了解一下辐射。
辐 射
辐射是指能量以电磁波或粒子的形式传播,它可以对人体产生不同程度的影响。
一般情况下,辐射分为电离辐射、非电离辐射。它们有什么区别呢?
电离辐射
波长短,频率高、能量强。使物质发生电离,对健康危害大,有致癌作用。
▸ 生活中可能接触到的比如:
X光机、CT、伽马刀、钴60治疗机、碘-131等。
非电离辐射
波长长,频率低,能量小。它对生物体和物质的穿透能力较弱,这些辐射不具备足够的能量来从原子或分子中剥离电子,因此不会引起电离作用。以热效应为主,没有明确致癌作用。
▸ 生活中比较常见的如:
手机辐射、微波炉、电热毯、高压电塔、基地转播台、近紫外光、可见光、热灯中使用的红外辐射等。
非电离辐射和电离辐射之间的分界线位于电磁波谱的紫外线部分
总的来说:
➩ 高剂量
在非常高的剂量下(超过一定阈值),辐射会损害组织和器官的功能,并产生急性影响,如恶心和呕吐、皮肤发红、脱发、急性辐射综合症、局部辐射损伤(也称为辐射烧伤),甚至死亡。

protein. cell., pwad044, doi.org/10.1093/procel/pwad044
▸ 头发
当暴露于高于 200 雷姆的辐射时,就会出现脱发。
▸ 心脏和大脑
强烈暴露于 1000 至 5000 雷姆的辐射下会影响心脏功能。辐射会杀死神经细胞和心脏小血管,可能导致立即死亡。如果辐射暴露超过 5000 雷姆,脑细胞就会受到影响。
▸ 甲状腺
当暴露于不同类型的辐射源时,某些身体部位会受到特别影响。暴露于放射性碘时,甲状腺可能会受到影响。如果暴露于大量放射性碘,整个或部分甲状腺可能会受到影响。
▸ 血液系统
如果一个人暴露于 100 雷姆,血液中存在的淋巴细胞数量将会减少。这可能会导致一些免疫问题。这被称为轻度放射病。根据长崎和广岛的报告,症状可能会在接触后十多年内出现。
▸ 生殖道
由于生殖道细胞分裂速度很快,即使暴露量不超过 200 雷姆,这些细胞也容易受到影响。
➩ 低剂量长期接触
低剂量电离辐射致癌相关的流行病学研究主要集中在辐射敏感部位发生的癌症,如白血病、甲状腺癌、乳腺癌、肺癌等。
致癌效应
非致癌效应
这里我们先了解一下电离辐射中的核辐射对人体健康的影响。
核辐射对人体健康的影响
美国心脏协会的《高血压》杂志上发表的一项针对俄罗斯核电站工人的研究表明,长期暴露在低剂量的电离辐射下会增加患高血压的风险。
对《英国医学杂志》发表的研究发现,接触低剂量电离辐射与心脏病风险适度增加有关。
……
我们来看一些案例。
在广岛和长崎爆炸事件后的两三年内:
白血病是首个与辐射暴露相关的癌症,从儿童到成年人都有。除了白血病外,乳腺癌、结肠癌和肺癌是报告中人数最多的其他癌症类型,但这些疾病在儿童中暴露的人数更多。
切尔诺贝利事件的长期后果:
研究人员普遍得出结论,由于儿童和青少年时期的辐射暴露而导致患甲状腺癌的风险增加,这是切尔诺贝利事故对健康的主要影响。
研究还证实,在暴露程度最高的人群中,存在以下情况的长期较高风险:
那些在 5 岁以下时暴露于高辐射水平的人最有可能遭受健康后果,包括生长发育不良、牙齿健康状况不佳、免疫紊乱、患甲状腺癌的风险等。
据切尔诺贝利儿童国际组织称,截至 2015 年,1986 年的事件继续影响着今天生活在辐射区的数百万人。超过一百万儿童生活在仍然受到污染的地区。该组织引用的健康风险和影响包括:
电离辐射可以引起造血系统,肠道系统,心脑血管神经系统的多器官损伤,这也意味着癌症放射治疗和意外暴露期间发生的大量未满足的医疗需求。研究人员已经做出大量努力来开发用于常规临床使用的治疗性放射防护剂,但辐射损伤仍然是一个长期存在且未解决的问题。
急性放射综合症或疾病(ARS)发生在部分或全身暴露于电离辐射后,死亡通常归因于造血恢复不良和/或胃肠道(GI)上皮细胞死亡。
胃肠道是更新最快的成人组织,因此对辐射高度敏感。
它还拥有由 10 至 100 万亿个微生物组成的多样化微生物群落,增加了肠道微生物群参与对辐射引起的损伤的反应的可能性。一些研究表明肠道微生物群与辐射引起的损伤之间存在关联。
电离辐射可以产生离子化的分子和自由基,对细胞和遗传物质造成损害,进而导致潜在的健康风险。
电离辐射可以是核辐射(如α、β、γ射线)或非核辐射(如X射线、紫外线)。当电离辐射与物质相互作用时,它可以剥离或激发原子或分子中的电子,导致化学和生物效应。不同射线穿透力不一样。
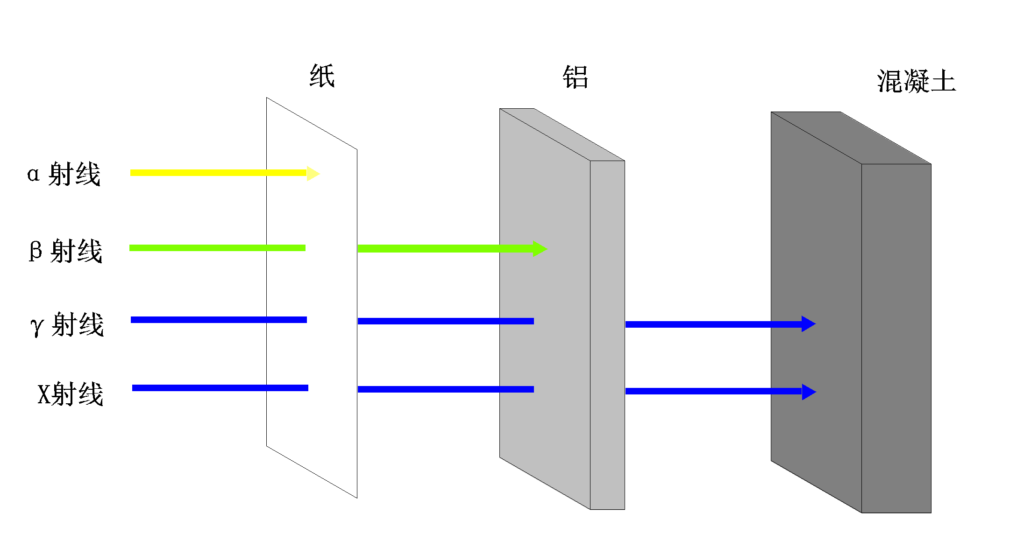
哪些情况可能暴露于电离辐射?
人们可能在不同的情况下暴露于电离辐射,在家里或在公共场所(公共暴露)、在工作场所(职业暴露)或在医疗环境(医疗暴露)。暴露于辐射可能通过内部或外部途径发生。
当放射性核素被吸入、摄入或以其他方式进入血流(例如,通过注射或通过伤口)时,就会发生电离辐射的内部暴露。当放射性核素自发地(例如通过排泄物)或由于治疗而从体内消除时,内照射就会停止。
当空气中的放射性物质(例如灰尘、液体或气溶胶)沉积在皮肤或衣服上时,可能会发生外部暴露。这种类型的放射性物质通常可以通过清洗从体内去除。电离辐射的暴露也可能是由外部来源的辐射引起的,例如 X 射线的医疗辐射暴露。当辐射源被屏蔽或人移出辐射场时,外部照射就会停止。
医学上辐射的应用占人类由人为源头产生的辐射总剂量的98%,也占总人口辐射暴露的20%。全球每年进行超过42亿次诊断放射学检查,进行4000万次核医学检查,进行850万次放射治疗。
电离辐射对身体的损害有哪些?
电离辐射对机体的损伤程度受辐射源、剂量率、暴露时间及机体敏感性等因素影响。
胃肠道系统对电离辐射具有高度的敏感性,辐射影响胃肠道的运动、吸收和分泌功能,常见的胃肠道反应为恶心呕吐、腹泻,病理检测可见小肠绒毛断裂、隐窝塌陷、黏膜上皮受损等。
长期低剂量辐射的影响较难衡量。电离辐射引起的DNA损伤可导致突变,导致癌症,尤其是在细胞分裂率高的组织中,如胃肠道、生殖细胞和骨髓。在生殖细胞中,电离辐射会损害遗传物质并导致代代相传的突变。
电离辐射可以破坏细胞内稳态,通过传输能量和引起细胞内水辐解和线粒体电子泄漏来激活促炎信号通路,释放自由基损伤DNA、蛋白质和脂质,从而导致机体组织损伤。
肠道菌群的特征与电离辐射引起的损伤严重程度有关。电离辐射对大脑、食管、心脏和肺部的损伤也与肠道菌群有关。
电离辐射对肠道菌群的影响
测量切尔诺贝利核灾所产生的人为放射性核素显示,暴露于环境放射性核素会显著影响脊椎动物的肠道菌群。
研究表明,电离辐射会降低小鼠肠道菌群的α和β多样性。
电离辐射会降低优势菌群的丰度,如:
增加某些菌群的丰度,如:
对于非人类灵长类动物,研究发现,电离辐射会使Actinobacillus、Bacteroides、Prevotella、Veillonella等属的丰度增加两倍以上,而Acinetobacter和Aerococcus等属的丰度减少十倍以上。
电离辐射诱导肠道微生物群失调
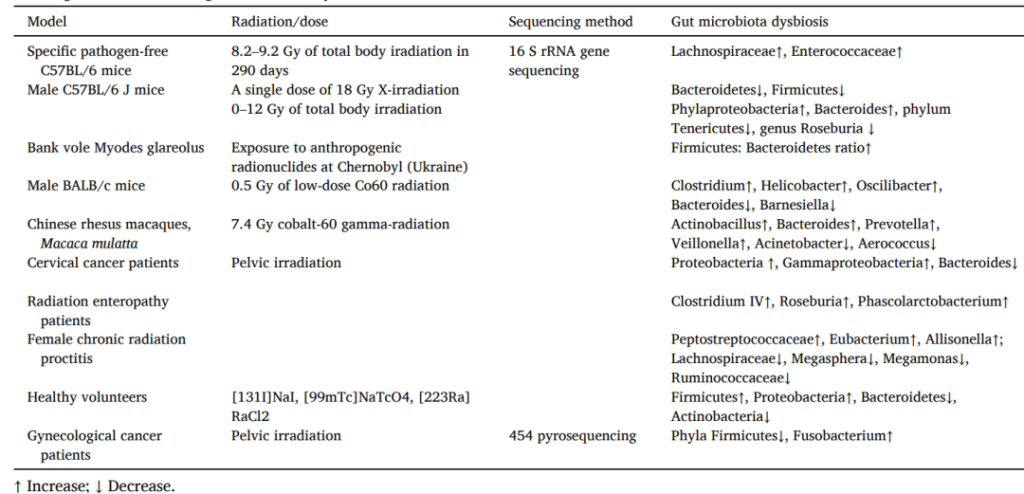
doi.org/10.1016/j.envres.2023.115947
电离辐射对人类肠道菌群也有着类似的影响,其中,放射性肠炎就是其中的影响之一。接下来,我们来了解一下放射性肠炎是如何发生的,肠道菌群在其中发挥怎样的作用。
放射治疗在临床上被广泛用于治疗多种肿瘤。放射治疗可诱导双链 DNA 断裂,导致肿瘤细胞凋亡。肿瘤细胞增殖迅速,对放射线敏感,修复速度比正常细胞慢,因此对多种类型的肿瘤有良好的治疗效果。
放射治疗的副作用
但是由于放射射线不仅可以杀死癌细胞,还会对周围的正常细胞和组织造成损伤。因此放疗经常会引起各种副作用,比如疲劳,恶心和腹泻等。由于放疗照射位置的不同,许多副作用也不同。胃肠细胞对电离辐射敏感,这限制了腹部和盆腔恶性肿瘤的放射治疗。
放射后的肠道损伤很常见
放射治疗造成的肠道损伤会在第一周或第二周导致胃肠道反应,少数发生在放射后几个小时。低剂量辐射引起的肠道损伤通常是可逆的。40%的患者在10~30 Gy的辐射剂量下可出现明显病变,而当剂量超过30 Gy时,这一数字将急剧增加至90%。
放射性肠炎的症状
急性放射性肠炎的临床表现为恶心、呕吐、腹痛、腹泻,大便次数增多,粪便呈粘液、脓血,严重者甚至死亡。
慢性放射性肠炎的临床表现包括慢性肠梗阻、肠穿孔、瘘管和脓肿等。
放射治疗对菌群的影响
辐射会导致肠道菌群失衡,包括有益菌的丰度降低和病原菌的丰度增加。当益生菌数量减少时,条件性致病菌会繁殖并占据生态位,从而抑制益生菌的生长并促进内毒素的释放。
在接受电离辐射和放射性药物治疗后,人类肠道菌群的组成发生改变。
下列菌群丰度减少:
健康肠道中优势菌群如厚壁菌门和拟杆菌门的丰度降低已被证明会削弱肠道对有害细菌的抵抗力,进而加重放射性肠炎的症状,激活促炎信号通路。
下列菌群丰度增加:
梭菌属(Clostridium IV)、Roseburia属和Phascolarctobacterium属的水平升高与放射性肠病相关。
2019 年发表的一项关于微生物群与急性/晚期放射性肠病相关性的临床研究,收集了134名受试者的粪便样本,基于16S rRNA 测序对放疗过程中肠道菌群的总体情况进行了分析。
结果表明,随着放疗进行,患者的肠道菌群多样性逐渐降低,并且表现出与晚期放射性肠病程度成正相关的特征。
放射性肠病患者的下列菌群相对丰度明显增加:
与微生物群调节和肠壁维持相关的稳态肠黏膜细胞因子(IL-7,IL-12/IL-23p40,IL-16,IL-15)明显减少,其中IL-15与罗氏菌属和丙酸杆菌属(Propionibacterium)的丰度呈负相关,表明肠道微生物可能与腹部或盆腔照射引发的急性和晚期放射性肠病有关。
反映放射性肠炎的特征菌属
另一项研究报道了盆腔放疗患者粪便中几种菌属的变化与放射性肠炎的发生密切相关,并可根据几种特定肠道菌属对患者放疗后可能发生肠炎的风险进行预测。
在该研究中,放射治疗导致粪便中菌群α多样性降低,β多样性增加。门水平上,放射性肠炎患者变形菌门相对丰度显著增加;属水平上,拟杆菌属相对丰度明显降低。
下列3种菌属在肠炎患者中显著富集,或可作为反映放射性肠炎的特征性菌属:
在放射性肠炎引起的腹泻中检测到革兰氏阴性杆菌的过度生长。
放疗前、放疗后立即和放疗后两周的微生物群比较表明,腹泻患者的放线菌门增加,梭状芽胞杆菌减少。放射后肠道蠕动受损是革兰氏阴性杆菌在胃肠道定植的主要致病因素。在细菌过度生长期间,肠道迁移运动复合体(MMC)的缺失与革兰氏阴性杆菌大规模定植的存在相关。因此,异常的肠道蠕动和革兰氏阴性杆菌的大量定植是严重晚期放射性肠病发生的重要因素。此外,放疗后对腹泻和其他细菌变化的易感性和保护作用也可能与不同的初始微生物群定植有关。
辐射诱导的肠道菌群失调助推放射性肠炎的发展
在放疗后发展为放射性肠炎的患者其照射前粪便样品中的粪球菌属(Copro⁃coccus)和脱硫弧菌属(Desulfovibrio)明显富集,这2种菌属或可作为特征性菌属对患者进行放射性肠炎发生风险的预测。
辐射导致部分菌属的丰度变化与促炎因子的表达量密切相关,可作为反映放射性肠炎发生发展的特征性菌属。
放射性肠炎患者粪菌液与上皮细胞共培养,诱导了上皮细胞的炎症和屏障功能障碍,使TNF-α和 IL-1β表达增加,进一步说明辐射诱导的肠道菌群失调可能助推放射性肠炎的发展进程。
辐射损害肠道完整性
辐射效应可以直接或间接影响细胞 DNA。DNA损伤导致细胞周期阻滞和细胞凋亡,同时激活炎症信号通路和释放促炎因子。绒毛细胞耗竭导致细胞死亡和肠道感染风险增加。此外,辐射还引发非靶向效应,导致染色体不稳定性。这些过程共同导致肠道屏障的破坏和菌群迁移。
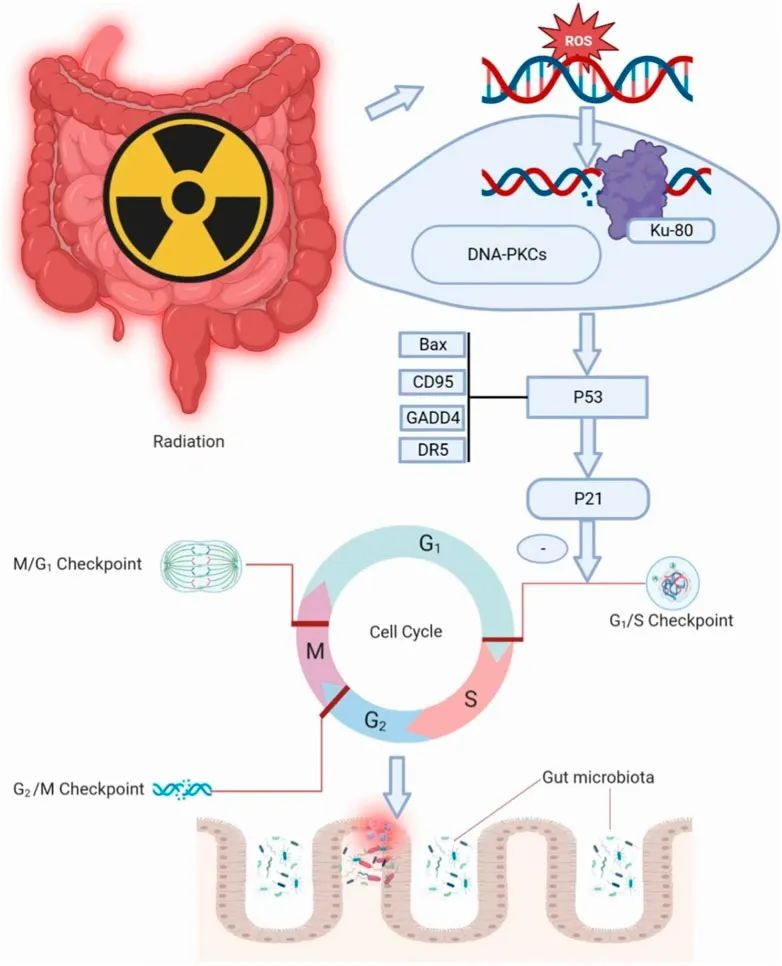
doi.org/10.3389/fphar.2023.1116558
文献中采用的辐射源、辐射方式和辐射剂量各不相同,辐射后菌群的变化特点也存在不一致的情况,一些显著变化的菌的功能及在机体损伤中发挥作用的机制阐述不够。相信这些复杂问题会在未来研究中逐渐解决。
以上是临床上放射性肠炎面临的一些困境以及关于肠道菌群中与放射性肠炎的相关特征菌属。
与此同时,研究人员也发现了一些好消息,肠道菌群并不是总是受害者,其中一些特殊的“精英肠道菌群”,似乎可以帮助我们抵抗辐射的伤害。
2020年,来自美国北卡罗拉纳大学教堂山分校的研究人员在《SCIENCE》上发表的一篇文章,揭示了肠道微生物群及其代谢产物在电离辐射中的保护作用。
该研究一群从高剂量辐射中恢复并过着正常寿命的小鼠。这些“精英幸存者”拥有独特的肠道微生物群,这些微生物群是在辐射后形成的,可以保护无菌和传统饲养的小鼠免受辐射引起的损伤和死亡。

在该研究中发现,毛螺菌科Lachnospiraceae和Enterococcaceae可以保护小鼠抵抗辐射引起的造血系统和肠道系统的损伤,从而在致死剂量的辐射后存活下来。
注:毛螺菌科一般参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强。
Lachnospiraceae 详见:肠道核心菌属——毛螺菌属(Lachnospira)
这些“有益菌”通过产生大量的短链脂肪酸和色氨酸代谢通路的代谢产物来促进造血发生以及肠道损伤修复,从而帮组机体抵抗辐射引起的损伤和死亡。
丙酸以及两种色氨酸途径代谢物 I3A 和 KYNA 在精英幸存者中升高,并提供长期的辐射保护。
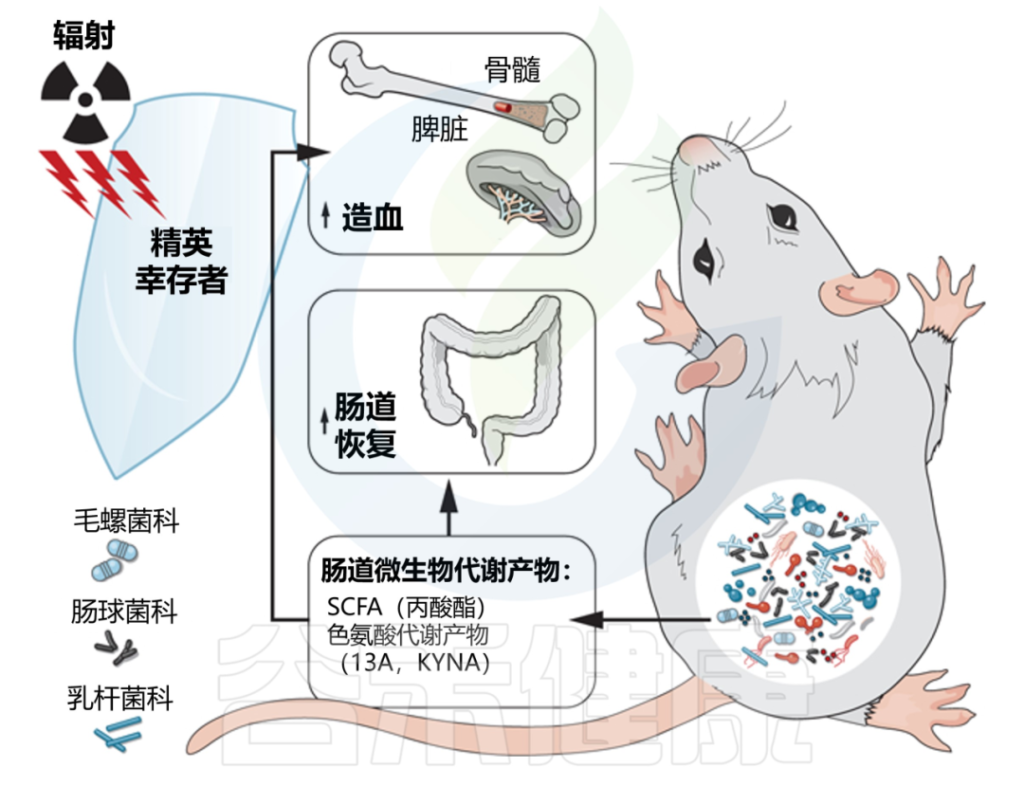
DOI: 10.1126/science.aay9097
这项研究还在白血病患者中进行了临床研究,在轻度腹泻病人中,Lachnospiraceae,Enterococcaceae以及Lactobacillaceae这三种在小鼠中可能的“有益菌”数量明显高于重度腹泻的病人。Lachnospiraceae的数量与病人腹泻时间存在显著地负相关性。
因此,作者推断在人体中,这些可能的“有益菌”也可以帮助病人降低放疗引起的副作用。这些发现为开发针对放射性肠炎的治疗策略提供了新的思路。
DNA双链断裂与NF-κB通路活性
辐射会破坏细胞的DNA结构,导致DNA链断裂,并触发多个蛋白激酶和信号通路的激活。这些激活过程会引发炎症反应。然而,肠道菌群和短链脂肪酸可以通过调节p53和NK-κB通路来减轻辐射损伤。
例如,丁酸可以抑制炎症反应的NF-κB通路。
异鼠李素是一种黄酮类物质,可以促进DNA修复并提高存活率。
肠道菌群代谢产物尿石素A(UroA)也可以抑制炎症反应并保护DNA免受损伤。
氧化应激和炎症效应
水是细胞的主要组成部分,也是高能光子辐射的主要目标。辐射会导致水的辐解,产生有害的ROS和RNS。内源性抗氧化途径可以减轻ROS的过度积累,但Nrf-2缺乏会加重辐射引起的病理变化和炎症反应。肠道菌群产生的代谢物可以缓解辐射的毒性作用。在接受放疗或化疗的患者中,缺乏抗炎菌群可能促进炎症事件的发生。
脂质损伤和铁死亡
辐射损伤DNA和其他细胞分子,引发铁死亡。辐射诱导肠损伤与铁死亡、NF-κB途径有关。激活Nrf-2途径可减轻铁死亡。辣椒素可保护免受铁死亡相关损伤。
辐射引起的旁观者效应
当细胞受到辐射和其他有害物质的影响时,它们会释放一种信号,影响到周围的细胞。周围的细胞可能会受到DNA损伤,增加患癌的风险。这种现象被称为辐射诱导的旁观者效应。
这个效应导致细胞的基因表达改变、DNA修复的激活以及细胞的增殖、凋亡和死亡。这种效应可能是通过氧化应激的影响来实现的。
肠道菌群代谢物功能及对电离辐射的影响
肠道菌群的改变往往伴随多种代谢产物的变化,大量的代谢物驱动着宿主和菌群之间的交流,从代谢层面更好地理解宿主与肠道菌群的相互作用可为基于肠道菌群的治疗干预提供启发。
目前,短链脂肪酸、芳香氨基酸、胆汁酸等已被发现作为菌群和宿主对话的信号分子,参与辐射条件下宿主生理功能的调节过程。
➢ 短链脂肪酸
短链脂肪酸通过与 G 蛋白偶联受体(GPCR)结 合 或 抑 制 组 蛋 白 去 乙 酰 酶(HDAC)调节下游信号通路发挥抗炎、免疫调节等作用。
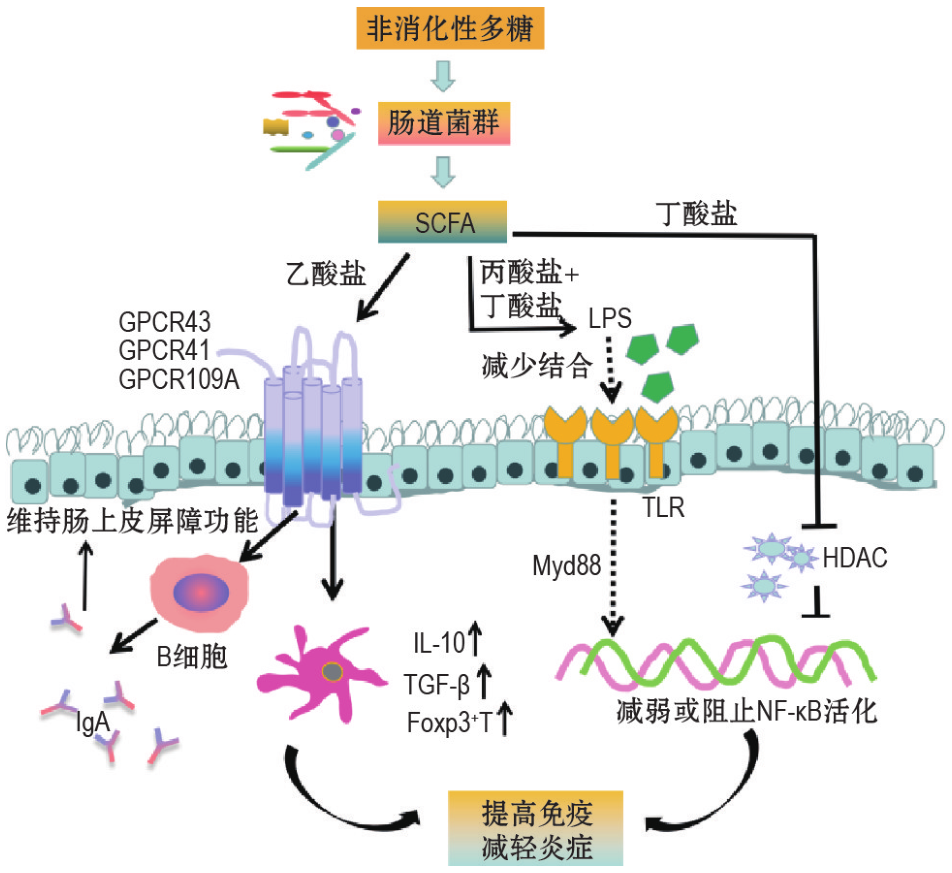
DOI:10.3867/j.issn.1000-3002.2020.07.009
最新研究表明,由肠道菌群代谢产生的戊酸灌胃后提高了辐照小鼠的生存率,保护造血器官损伤和胃肠道功能;高通量测序、同位素相对标记和绝对定量(iTRAQ)结果显示,戊酸可恢复小鼠肠道菌群的分类比例,重建小肠组织的蛋白表达谱。
➢ 芳香氨基酸
芳香氨基酸可由宿主本身和肠道菌群代谢产生。其中肠道菌群分解代谢产生的大量芳香氨基酸代谢物,可能作为宿主生理信号分子,在局部和远处调节宿主的免疫、代谢和神经元反应。大量文献报道了色氨酸吲哚类代谢物对肠道功能和远处器官的调节作用。
色氨酸在胃肠道中有3条主要的代谢途径:
① 饮食色氨酸可被肠道微生物群直接转化为芳香烃受体(AhR)的配体;
② 免疫细胞和上皮细胞中吲哚胺 2,3-双加氧酶(IDO)的犬尿酸通路;
③ 肠嗜铬细胞5-羟色胺(5-HT)合成途径。
AhR信号被认为是肠道屏障免疫反应的关键组成部分,对肠道内稳态至关重要。肠道菌群色氨酸代谢产生的吲哚类化合物可激活AhR,生成 IL-22,维持黏膜表面宿主微生物的稳态。在肠道中,一些吲哚类衍生物可通过AhR/IL-22轴调节上皮完整性和黏膜免疫应答。吲哚也可通过芳基烃受体激活上调固有层淋巴细胞的IL-22 分泌,加速肠干细胞(ISC)上皮细胞的增殖,从而保证组织的稳态。
电离辐射干扰小鼠肠道的微生物代谢。由于与色氨酸相关的吲哚化合物起源于肠道菌群,随后进入肝,因此吲哚化合物浓度的改变可作为辐射损伤的血浆标记。
分析不同辐射剂量的血浆差异性代谢物,证明了电离辐射对肠道微生物色氨酸代谢的抑制作用,表明或可根据辐照后特定时间内给定血液样本中吲哚类化合物浓度来推断可能的全身辐射剂量,这对于核事件后快速评估个人辐射剂量具有重要意义。
辐射对肠道菌群代谢产物的毒性调节
doi.org/10.1016/j.envres.2023.115947
➢ 吲哚衍生物
肠道菌群中色氨酸代谢产生的吲哚或吲哚衍生物可以限制辐射诱导的肠道炎症。
吲哚-3-羧醛(ICA)治疗可以通过1型干扰素(IFN)限制肠道上皮损伤,并且依赖刺激相关的1型IFN响应促进Lgr5+干细胞再生,减少肠上皮细胞间细菌转位和炎症因子的产生。
ICA治疗21天后,辐射小鼠的结肠中显示出减少的隐窝丧失和炎性细胞因子(TNF-α、IFN-γ和IL-6)以及趋化因子(CXCL1、CCL2和CCL3)的表达,从而降低了辐射引起的肠道炎症。
吲哚-3-丙酸(IPA)是Clostridium sporogenes的一个功能代谢产物,在全腹部照射(TAI)辐射小鼠中增加了肠道屏障功能和上皮完整性,提高了Glut1(Slc2a1)、Pgk1和MDR1的表达,同时降低了IL-6和TNF-α的表达。此外,IPA改变了辐射肠道菌群的结构。研究还发现,PXR/酰基辅酶A结合蛋白(ACBP)信号通路支持IPA对抗辐射的作用。
➢ 胆汁酸
辐射影响肠道内胆汁酸水平。大鼠盆腔照射可诱发胆汁酸吸收不良引发腹泻,主要原因是放射治疗影响大鼠胆汁酸稳态和顶膜钠依赖性胆汁酸转运体(Asbt),回肠 Asbt表达下调或Asbt功能降低导致胆汁酸吸收不良,肠道胆汁酸积累导致腹泻。
在溃疡性结肠炎患者体内,肠道菌群失调引发肠道次级胆汁酸水平降低,加重肠道炎症,而放射性肠炎及肠道菌群失调是腹盆腔肿瘤放射治疗的常见不良反应,通过调节菌群带来胆汁酸水平的变化或直接阻断胆汁酸受体可能对减轻辐射损伤有作用。
我们每天都会受到低水平的非电离辐射。
紫外线(UV)辐射是太阳辐射的自然组成部分,同时也会由黑光、日光浴床和电弧照明释放。正常的日常紫外线辐射水平对人体有益,并能产生维生素D。
过多的紫外线辐射可能导致皮肤灼伤、皮肤过早老化、眼睛损伤和皮肤癌。大多数皮肤癌都是由紫外线辐射引起的。
UVR 可通过光化学和热反应造成生物损伤。它具有高光子能谱,并且特别有害,因为通常不会立即出现过度暴露的迹象。 UV-A 和 UV-B 可能对皮肤和眼睛产生有害影响。90% 的早期皮肤老化症状是由紫外线接触造成的。
同样,眼睛的辐射暴露可能是由任何简单的原因引起的,例如水面反射阳光,甚至是相机的闪光灯。过度暴露于紫外线可能会导致严重的风险,包括白内障和黄斑变性。
红外线位于微波和可见光之间。它有一定的波长范围,最接近可见光的波长是近红外线,而“远红外线”则更接近微波区域。近红外波较短、不热且无法检测到,这使得它们对皮肤和眼睛等敏感组织特别有害。
皮肤对红外线照射的反应是以疼痛的形式发出警告信号。
生产环境中,加热金属、熔融玻璃及强发光体等可以成为红外线辐射源。炼钢工、轧钢工、铸造工、锻钢工、烧瓷工、焊接工等可受到红外线辐射。
激光不是天然存在的,是用人工激活某些活性物质,在特定条件下受激发光,在农业中可用于育种、杀虫,也可以用于焊接、打孔、切割等。
长期接触过量会导致白内障并损害视网膜。激光损伤的一个例子是导致中央凹盲点的视网膜损伤。
当存在大量光辐射时,皮肤可能会发生烧伤。
微波辐射(MW)属于波长在1毫米和1米之间(或等效频率范围从300千兆赫到300兆赫)的电磁频谱。它们被用于各种领域,从通信到广播,再到厨房食物的加热或除霜。频率范围从80到800用于电视和调频无线电广播天线。
微波通常由移动电话及其基站和微波链路产生。此外,它还来自无绳电话、蓝牙设备、无线局域网和许多其他应用。
中枢神经系统是一个脆弱的区域,当身体暴露在微波辐射下时,它会发生显著的变化。它会导致睡眠障碍和记忆障碍,一些研究表明,长时间接触移动电话设备(会发射微波)会增加患脑肿瘤风险。
通过无线电发射器和手机接触微波意味着它可以通过皮肤被人体吸收,从而损害组织。
微波可以通过足够高强度的加热来损伤组织。微波的传播深度取决于微波的频率以及受影响的组织的类型。这些影响不会立即显现,因为较低的频率会深入组织,并且身体较深处区域的神经末梢较少。
睾丸特别容易受到温度升高的影响,从而更容易受到微波辐射的影响。将怀孕大鼠暴露于 9.417 GHz 微波会导致其后代(雄性和雌性)表现出与焦虑相关的行为增加,更令人惊讶的是,雄性表现出记忆和学习受损。
流行病学研究表明,暴露于极低频率的电磁场会损害人类健康。这会导致在暴露于此类磁场的环境中生活或工作的人们患上某些形式的癌症、抑郁症和流产。多项研究报告称,身体多个组织暴露于极低频辐射会导致氧化应激。
身体免受极低频辐射暴露的保护措施包括服用维生素 E、MEL、FA等抗氧化剂,以避免暴露于极低频辐射可能产生的不利影响。
乳杆菌属
主要通过胃肠道与远离器官之间的免疫信号交流来调节免疫反应。
嗜酸乳杆菌Lactobacillus acidophilus(L. acidophilus)对受到有限辐射(≤15 Gy)损伤的小肠黏膜有缩短恢复时间的作用,但对超过20 Gy的辐射无效。Lactobacillus acidophilus通过改善肠道干细胞功能和细胞分化来增强肠道上皮功能,从而减轻辐射引起的肠道损伤。
植物乳杆菌Lactobacillus plantarum(L. plantarum)可以通过激活肠上皮细胞中的FXR-FGF15信号来缓解辐射引起的肠道损伤,从而防止小鼠死于辐射。
罗伊氏乳杆菌Lactobacillus reuteri 作为第二代益生菌,通过产生代谢物和释放IL-22来稳定Lgr+5肠道隐窝干细胞的数量和功能,并保护肠道微血管内皮细胞免受死亡的影响,从而直接抑制肠道病原菌的生长。
鼠李糖乳杆菌LGG提高小肠隐窝存活数量,减少上皮细胞凋亡。LGG能释放放射保护性的LTA(TLR2激动剂),通过触发涉及巨噬细胞和分泌PGE2的MSCs的多细胞适应性免疫信号级联来保护上皮干细胞。
Lactobacillus royale通过释放IL-22来预防和减轻辐射毒性。
Akkermansia muciniphila
作为被广泛认可的下一代益生菌,在代谢性疾病和肿瘤免疫治疗中发挥作用。它可以通过上调RORγt+ Treg细胞介导的免疫反应改善结肠炎,并通过减少CD8+细胞毒性T淋巴细胞、TNF-α和PD-1来减轻结肠炎相关结直肠癌。
给辐射小鼠投予Akkermansia muciniphila可以显著缓解肠道毒性,并在肠道毒性更严重的小鼠消化道中稳定定居。然而,在某些特定情况下,A. muciniphila及其相关成分可能加剧病原体感染和肠道炎症,尽管在正常情况下有益于宿主肠道稳态的维持。
普拉梭菌
Faecalibacterium prausnitzii (F. prausnitzii)具有抗炎作用,在治疗炎症性肠病(IBD)和结肠炎方面发挥重要作用。研究发现,与健康人相比,患有IBD的患者中F. prausnitzii的丰度减少。
在局部照射29 Gy后的3天内,在大鼠体内口服F. prausnitzii A2-165菌株可以减轻隐窝形态学变化的严重程度,保护干/祖细胞和增殖上皮隐窝细胞的数量,并增加结肠隐窝上皮细胞产生的IL-18的产量。
益生菌组合
VSL#3的益生菌组合是由八种益生菌混合而成的,广泛安全地用于治疗胃肠疾病。一项双盲安慰剂对照试验证实,与安慰剂组相比,补充VSL#3的患者较少出现放射性肠炎引起的腹泻(77/243,31.6% vs. 124/239,51.8%;P < 0.001),且较少出现3级或4级腹泻(1.4% vs. 55.4%;P < 0.001)。
Dixentil是一种益生元和益生菌的混合物(低聚半乳糖、乳酸杆菌和酸酸乳杆菌),在保护放射性肠炎患者方面显示出积极效果。
宫颈癌患者盆腔放疗前7 d和放疗期间每天口服活的嗜酸乳杆菌和双歧双歧杆菌降低了辐射引起的腹泻的发生率,可减少抗腹泻药物的使用,并能改善患者的大便状态。
复合益生菌,包括嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、长双歧杆菌和乳双歧杆菌,在小鼠模型的急性放射性肠道损伤中发挥积极作用。嗜酸乳杆菌加长双歧杆菌可以减少RE引起的2-3级腹泻,改善粪便稠度,尤其是在外束盆腔放疗后的盆腔癌患者中。此外,益生菌组的抗腹泻药物使用显著减少(P < 0.05)。
魔芋葡甘聚糖是一种天然大分子和可溶性膳食纤维,用于对抗电离辐射诱导的损伤。口服魔芋葡甘聚糖通过调节肠道微生物群和增加短链脂肪酸来预防电离辐射引起的损伤。魔芋葡甘聚糖作为一种益生元,可以增强肠道微生物群中益生菌数量和短链脂肪酸的产生,维持肠道稳态。魔芋葡甘聚糖还能抑制辐照后人肠上皮细胞的凋亡。
粪菌移植
粪菌移植(FMT)已被应用于难治性艰难梭菌感染的治疗,并在辐射损伤动物和放射性肠炎患者中显示出良好的效果。
研究表明,粪菌移植可以显著提高辐射小鼠的存活率,减轻体质量下降、脾脏萎缩和胃肠道功能异常等辐射损伤症状。粪菌移植还可以维持小鼠肠道菌群的组成,并对小肠中的基因表达谱产生性别特异性的影响。此外,粪菌移植对辐射引起的造血系统损伤也有一定的促进恢复作用。
在临床研究中,FMT被用于治疗常规治疗无效的慢性放射性肠炎患者。研究发现,在接受粪菌移植治疗的患者中,有部分患者的肠道不良反应减轻,卡氏评分降低,并且没有粪菌移植相关的死亡和感染并发症。这为粪菌移植作为治疗慢性放射性肠炎的可行性提供了证据。
此外,研究发现,FMT可以通过逆转肠道细菌分类比例和清除氧化应激来减少胸部局部辐射引起的肺损伤。因此,与抗生素相比,FMT更有效地增强胃肠功能和肠道上皮完整性。
由于缺乏长期随访证据,FMT的长期疗效尚不确定。对FMT前特定供体菌群特征的评估可能使其在治疗由辐射相关肠道菌群失衡引起的疾病时更安全、更有效。
★ 番茄红素
番茄红素在很多红色水果中都有,以番茄中的含量最高,番茄红素是迄今为止所发现的抗氧化能力最强的类胡萝卜素,它的抗氧化能力是维生素E的100倍,具有极强的清除自由基的能力,有抗辐射、预防心脑血管疾病、提高免疫力、延缓衰老等功效,有植物黄金之称。
代表:
番茄、西瓜等红色水果
★ 维生素E、维生素C
各种豆类、橄榄油、葵花籽油和十字花科蔬菜富含维生素E,而鲜枣、橘子、猕猴桃等水果富含维生素C,维生素E和维生素C都属于抗氧化维生素,具有抗氧化活性,可以减轻电脑辐射导致的过氧化反应,就像给我们的皮肤穿上了一层“防辐射衣”,从而减轻皮肤损害。
此外,新鲜的蔬果具有抗辐射作用,还在于它们可使血液呈碱性,溶解沉淀于细胞内的霉素,使之随尿液排泄掉。
代表:
各种豆类、橄榄油、葵花籽油、芥菜、卷心菜、萝卜等十字花科蔬菜;
鲜枣、橘子、猕猴桃等新鲜水果。
★ 维生素A、β胡萝卜素
此类食品富含维生素A和β胡萝卜素,能很好的保护眼睛。天然胡萝卜素是一种强有力的抗氧化剂,能有效保护人体细胞免受损害,从而避免细胞发生癌变。长期食用胡萝卜素,能使人体少受辐射和超量紫外线照射的损害,目前国外还将天然胡萝卜素用于化妆品中,发挥其防辐射,保护、滋润皮肤和抗衰老作用。
代表:
鱼肝油、动物肝脏、鸡肉、蛋黄、西兰花、胡萝卜、菠菜等。
★ 硒
微量元素硒具有抗氧化的作用,它是通过阻断身体过氧化反应而起到抗辐射、延缓衰老的作用,含硒丰富的食物首选芝麻、麦芽和黄芪。
代表:
芝麻、麦芽和黄芪;
酵母、蛋黄、啤酒、龙虾、金枪鱼等海产品;
大蒜、蘑菇等。
★ 脂多糖、维生素A原
如果不习惯喝绿茶,菊花茶也同样有效。现代医学研究证实,绿豆、绿茶中含脂多糖、维生素A原,能帮助排泄体内毒物、加速新陈代谢,可有效抵抗各种形式污染。
此外,茶叶中的茶多酚类化合物具有抗辐射作用,可以吸收90%的放射性同位素,并且加速代谢,减轻对人体的伤害。
代表:
绿茶、绿豆。
★ 胶原弹性物质
海带是放射性物质的克星,可减轻放射性核素、各种射线对机体免疫功能的损害,并抑制免疫细胞的凋亡而具有抗辐射作用。此外,海带还是人体内“清洁剂”,他是一种碱性食物,有利于保持身体处于弱碱性的环境。海带中含有的胶质、动物皮肤、脊髓中的胶原物质都有一种黏附作用,它可以把体内的腐蚀性物质黏附出来排出体外,而且其中动物皮肤所蕴含的弹性物质还具有修复受损肌肤的功能。
代表:
海带、紫菜;动物皮、骨髓。
选择可靠的食品来源
购买来自可靠供应商的食品,特别是海产品。选择经过严格检测和认证的产品,以确保其安全性。
查看食品标签上的信息,特别是有关产地和检测的信息。优先选择标明非受污染区域产地的食品。
饮食方式
保持饮食多样化,不要过度依赖某一种食品。通过摄入多种食物,可以减少单一食品对辐射的潜在影响。
含有ω-3多不饱和脂肪酸(n-3PUFAs)的饮食可以通过增加有益细菌(如乳酸菌、双歧杆菌和产丁酸细菌)来逆转肠道菌群失调。n-3PUFAs通过减少LPS合成和胃中粘液溶解菌的数量来减少炎症和氧化应激,预防和减轻辐射引起的损伤。
以下是一些可能含有较高辐射的食物:
海产品:如海藻、贝类和鱼类,可能吸收海水中的放射性物质,尤其是碘和铯。
野生蘑菇:野生蘑菇可能吸收土壤中的放射性物质,如铀和钍。
某些土壤栽培的农作物:某些农作物,特别是种植在放射性土壤中的农作物,可能含有较高的放射性物质。
食品添加剂中的聚山梨酸酯80和富含蛋氨酸的高蛋白饮食可以破坏肠道菌群的生态平衡,降低微生物多样性,并增加致炎细菌的丰度,这可能会加剧辐射引起的肠道损伤。
藻青蛋白(phyco⁃cyanin)可调节小鼠肠道微生物群组成,增加有益菌,减少有害细菌,进而降低 LPS 水平和抑制TLR4/Myd88/NF-κB通路的激活,下调炎性细胞因子的表达,使小鼠免受高剂量辐射损伤。
DIM是一种天然的小分子化合物,可减轻全腹部辐照引起的小鼠死亡或体质量减轻状况,提高辐照小鼠 Lgr5 +小肠干细胞的存活率及抗氧化酶 Nrf2 的表达,清除 ROS,缓解小肠内DNA损伤和细胞凋亡;DIM也可恢复辐射引起的肠道菌群失调现象,并表现出了通过调节菌群减轻辐射损伤的作用。
戊酸补充显著提高了辐照小鼠的存活率,保护了造血器官,改善了辐照小鼠的胃肠道功能和肠上皮完整性;戊酸对于肠炎的保护作用也不局限于放射性肠炎,还可用于DSS等化学物诱导的其他类型肠炎的保护。
中药复方凉血固元汤能有效调节 11 Gy 60Co-γ 全身照射引起的大鼠肠道菌群结构失调,改善大鼠生存质量。
黄芩素通过重新平衡肠道微生物群和抑制细胞凋亡来改善电离辐射引起的损伤。黄芩素改善了小鼠暴露于红外线后的肠道结构以及增殖和再生的能力,其中肠道微生物组成的重新平衡发挥了重要作用。黄芩素抑制p53的激活以及p53介导的肠道线粒体凋亡和死亡受体凋亡。黄芩素还改善电离辐射引起的造血系统损伤。
当归多糖对SD大鼠电离辐射诱发肠道屏障损伤具有一定的预防作用。当归多糖各组大鼠骨髓有核细胞计数,白细胞计数,Occludin蛋白高于模型组(P<0.05),Nrf2蛋白低于模型组(P<0.05),HE染色可见肠绒毛损伤轻于模型组(P<0.05),肠道菌群失调轻于模型组。
枸杞果实提取物(LBE)重建了辐射小鼠的肠道菌群,提高了潜在有益属的相对丰度,如Turicibacter和Akkermansia,并降低了潜在有害属的相对丰度,如Rikenellaceae。
槲皮素可以通过调节肠道菌群和降低炎症细胞因子水平来减少辐射性肠道疾病。
小球藻是一种单细胞绿藻,叶绿素含量非常高,已被证明可以中和体内的毒素,通常在汞中毒时使用。暴露于辐射时服用推荐剂量的小球藻是加速排毒的好方法。
水果中各种植物化学物质的辐射防护作用研究

编辑
Raghu SV, et al., Food Funct. 2023
低强度运动
与跑步相比,步行是一种更舒适、更可行的运动方式,对于接受放疗的虚弱患者来说可以接受。步行可减轻小鼠辐射引起的胃肠道损伤,受短期步行治疗的小鼠在属水平上表现出Dubosiella、拟杆菌属、A. muciniphila和乳杆菌属的优势,A. muciniphila可能是步行辐射防护的关键,增强步行治疗的辐射防护作用。
减少直接接触时长
避免在受污染区域长时间游泳、潜水、捕鱼等活动。如果必须在这些区域活动,应尽量缩短接触时间,减少潜水深度。
避免直接沾染雨水
放射性的粉尘和水蒸气在大气中随着气流传播,可传播到很远的地方,尤其是进入平流层,通过雨水落到地面。因此,在下雨天,尽量避免直接沾染雨水。
关注官方信息
密切关注官方相关机构发布的关于核污水排放的最新信息和指导方针。这些机构会提供有关食品安全和辐射风险的相关信息。
注意,以上信息是基于引用的研究论文,仅供参考。具体的治疗方案和应用建议应由专业医生或研究人员进行评估和制定。同时,日常生活中尽可能避免食用受污染区域产地的食品。
关于核污水排放:
核污水排放可能对环境和人类健康造成潜在风险。然而我们在担忧的同时,也不必为此陷入过度焦虑。听从中国海洋监测和质检部门的意见,相信他们会严密跟踪中国沿海水质的变化,一旦放射性物质超标,影响海产品的安全,他们会发出警告并采取相应的更为专业的措施。
相信国家监测部门的实时通报,关注相关的科学研究和专业意见,支持环境保护措施的加强。通过健康的饮食、良好的生活习惯和积极的心态来保护自己和家人。重要的是保持平衡,不让担忧阻碍我们享受生活的美好和追求自己的梦想。
关于辐射:
动物模型和临床试验已经用于探索辐射对肠道菌群的影响。辐射引起的菌群失调可以进一步促进宿主的辐射损伤和炎症。因此,肠道菌群的组成、多样性和丰度、有害菌富集等可以作为测量辐射暴露的生物剂量的新潜在生物标志物反应,并为后续辐射环境下的人体健康提供辅助评估和干预指导。
随着肠道菌群研究的深入,未来益生菌/益生元、菌群药物以及粪菌移植等产品及治疗方法,不仅能助健康人(或患者)建立良好的肠道微生态,也有可能达到减轻辐射损伤的目的。这些提示了未来以肠道菌群为基础的精准医疗的必要性。
相关阅读:
分享 | 肠道菌群和粪便菌群移植治疗炎症性肠病 – 罗马共识
主要参考文献
Azizova T, Briks K, Bannikova M, Grigoryeva E. Hypertension Incidence Risk in a Cohort of Russian Workers Exposed to Radiation at the Mayak Production Association Over Prolonged Periods. Hypertension. 2019 Jun;73(6):1174-1184.
Guo H, Chou WC, Lai Y, Liang K, Tam JW, Brickey WJ, Chen L, Montgomery ND, Li X, Bohannon LM, Sung AD, Chao NJ, Peled JU, Gomes ALC, van den Brink MRM, French MJ, Macintyre AN, Sempowski GD, Tan X, Sartor RB, Lu K, Ting JPY. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites. Science. 2020 Oct 30;370(6516):eaay9097.
Yu Y, Lin X, Feng F, Wei Y, Wei S, Gong Y, Guo C, Wang Q, Shuai P, Wang T, Qin H, Li G, Yi L. Gut microbiota and ionizing radiation-induced damage: Is there a link? Environ Res. 2023 Jul 15;229:115947.
Fernandes A, Oliveira A, Soares R, Barata P. The Effects of Ionizing Radiation on Gut Microbiota: What Can Animal Models Tell Us?-A Systematic Review. Curr Issues Mol Biol. 2023 May 2;45(5):3877-3910.
Liu D, Zhuang B, Wei M, Yuan T, Li J, Deng P, Du L, Yuan B, Jin Y. Oral konjac glucomannan for prevention of ionizing radiation-induced injury by regulating gut microbiota and increasing short chain fatty acids. Int J Biol Macromol. 2023 Jun 15;240:124402.
郑颖,殷祥昶,赵阳,等.电离辐射对肠道菌群的影响及基于菌群调节的辐射防护研究进展[J].中国药理学与毒理学杂志, 2020, 34(7):10.
Kamiya K, Ozasa K, Akiba S, Niwa O, Kodama K, Takamura N, Zaharieva EK, Kimura Y, Wakeford R. Long-term effects of radiation exposure on health. Lancet. 2015 Aug 1;386(9992):469-78.
Tonneau M, Elkrief A, Pasquier D, Paz Del Socorro T, Chamaillard M, Bahig H, Routy B. The role of the gut microbiome on radiation therapy efficacy and gastrointestinal complications: A systematic review. Radiother Oncol. 2021 Mar;156:1-9.
Raghu SV, Rao S, Kini V, Kudva AK, George T, Baliga MS. Fruits and their phytochemicals in mitigating the ill effects of ionizing radiation: review on the existing scientific evidence and way forward. Food Funct. 2023 Feb 6;14(3):1290-1319.

谷禾健康

微量营养素缺乏或称之为“隐性饥饿”,是目前一个严重的公共卫生问题,会对儿童发育及成人健康造成严重后果。
传统的治疗和预防方法,有些时候并是很有效,并且可能产生不良副作用(例如补铁引起的消化问题)。
★ 肠道细菌与微量营养素间存在重要的相互作用
许多研究发现肠道中的共生细菌可以增加特定微量营养素的生物利用度,特别是通过去除抗营养化合物(例如植酸盐和多酚),或通过合成维生素。
肠道黏膜是抵御病原体的第一道防线。肠黏膜微生物群有助于增强肠上皮的完整性并更好地吸收微量营养素。
细菌代谢还依赖于从肠道环境中获取的微量营养素,常驻细菌可能会竞争或协作以维持微量营养素稳态。因此,肠道微生物群的组成可以通过微量营养素的可用性来调节。

本文汇集了有关微量营养素和肠道微生物群之间双向关系的最新知识,重点关注铁、锌、维生素A和叶酸(维生素B9),因为这些缺乏症是全球范围内的比较严重的公共卫生问题。
目录
1.微量营养素缺乏
2.微量营养素与宿主健康
3.营养素与细菌的相互作用:以铁为例
4.细菌在锌生物利用中的作用
5.微生物群与宿主叶酸间的关联
6.微生物群与维生素A的相互作用
7.改善人体微量营养素的建议
8.结语
微量营养素,包括矿物质和维生素,是每天只需要少量的物质,但对人体代谢至关重要。
▼
微量营养素缺乏在全世界范围内非常普遍,最新估计表明,3.72亿学龄前儿童和1.20亿育龄非孕妇缺乏一种或多种微量营养素。
维生素和矿物质缺乏,也被称为“隐性饥饿”,是一个严重的公共卫生问题,世界各个国家都存在,特别是低收入和中等收入国家的弱势群体。
在全球范围内,三分之二的妇女和儿童(主要来自经济不发达家庭)的饮食中至少缺乏一种微量营养素。全球最普遍的微量营养素缺乏症包括铁、锌、维生素A和叶酸。
★ 微量营养素缺乏会导致不良健康结果
微量营养素缺乏与多种不良健康结果相关,例如儿童发病率和死亡率增加、贫血、发育迟缓和认知缺陷。
虽然存在多种改善个人或人群微量营养素状况的策略,其中主食强化被认为是改善人群微量营养素状况最具成本效益的干预措施。
然而,由于多种原因,应对微量营养素缺乏症的策略并不总是有效。包括可接受性差(例如,孕妇铁补充剂)、强化水平差和质量控制不足(例如,维生素A强化食用油),强化食品未能惠及最贫困人群。
★ 不同营养素的吸收具有差异
微量营养素的吸收主要发生在小肠中,根据微量营养素的不同,具有不同的机制。
例如,锌和铁主要通过特定的运输载体在十二指肠和空肠中吸收,这些运输载体针对每种矿物质及其形式而异,而叶酸不仅在小肠中被吸收,而且在结肠中也被吸收,因为在这两个部位都鉴定出了转运蛋白。
微量营养素的吸收差异很大,例如,铁充足的男性成年人吸收的铁摄入量不到5%,而正常条件下摄入的锌吸收量大于30%。
注:大部分摄入的微量营养素会到达结肠。
★ 微生物群与微量营养素之间存在相互作用
在消化道中,有一个复杂的微生物群落,其浓度和多样性从口腔到结肠不断增加。尽管含有其他微生物(病毒、真菌),但大多数研究都重点关注细菌,其中厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门是最重要的。
粪便细菌组成在个体之间存在很大差异,并且不仅取决于宿主的遗传学,还取决于包括饮食在内的许多环境因素。
注:大多数关于食物对肠道微生物群影响的研究都集中在大量营养素(脂肪、碳水化合物、蛋白质)上。
然而,细菌需要微量营养素才能生存。例如,细菌需要外部来源的铁,其中一些甚至开发出特定的机制,例如转铁蛋白来竞争铁源。
相比之下,许多细菌可以直接合成维生素,例如叶酸(维生素B9),因此不一定需要外部来源。
细菌影响微量营养素的生物利用度
常驻细菌可能对微量营养素产生直接作用,影响其对宿主的生物利用度,或者产生间接作用,例如通过产生能够改善上皮健康的代谢物,从而导致更好的吸收。
微量营养素影响肠道细菌的组成和功能
微量营养素的消耗反过来会影响肠道细菌的组成和功能。事实上,事实证明,补充铁可以导致潜在致病性肠杆菌科细菌的增加,以及被认为对健康具有积极影响的双歧杆菌科细菌和乳杆菌科细菌的减少。
微量营养素在控制人类健康的新陈代谢和组织功能维持中发挥着核心作用。
然而,尽管人们努力通过补充食品和饮食多样化来增加微量营养素的摄入量,全球微量营养素缺乏症的患病率仍然非常高,包括工业化国家。
推荐营养素摄入量和摄入上限
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
上表提出了男性和女性一些推荐营养素摄入量和可耐受的上限摄入水平。
由于维持生长和补偿损失(例如月经)的需求更高,儿童和妇女受到的影响更大。
★ 缺乏微量营养素的症状多样且大部分在晚期
单一微量营养素缺乏的临床症状多种多样,并且通常是具有微量营养素特异性的,但一般发生在缺乏的晚期阶段。例如缺铁性贫血是缺铁的最后阶段。
▼
缺铁被认为是最常见的微量营养素缺乏症,全世界估计有超过20亿人缺铁。它会导致贫血、免疫功能受损、工作能力下降以及内分泌功能受损。
导致铁缺乏的因素包括:
(1)血红素铁摄入量低,其生物利用度高于非血红素铁
(2)富含植酸酶或酚类化合物的饮食会降低生物利用度
(3)慢性炎症,导致铁调素水平升高,下调铁吸收
▼
据估计,全球有超过10亿人缺锌,它与儿童生长迟缓相关,但也会降低免疫能力,从而增加儿童对多种疾病的易感性,包括腹泻、肺炎,也许还有疟疾。
此外,锌缺乏似乎会导致其他微量营养素缺乏。
▼
据估计,低收入和中等收入国家超过20%的育龄妇女缺乏叶酸。
怀孕期间叶酸摄入不足与胚胎最初几周的神经发育缺陷有关。在普通人群中,叶酸缺乏还会导致巨幼红细胞性贫血和神经系统症状,这些症状与维生素B12缺乏症的症状部分重叠。
▼
维生素A缺乏不仅会导致干眼症和失明,还会影响免疫功能的许多方面,导致免疫能力下降以及皮肤和上皮完整性降低。
许多低收入和中等收入国家每半年向5岁以下儿童提供高剂量维生素A补充剂,以降低儿童死亡率,但这种干预措施的有效性受到质疑。
有关铁、细菌和宿主的相互作用,参考了最近的研究,下面总结了这种复杂关系的关键要素。
铁的吸收和稳态受到严格调节
由于人类无法主动排泄铁,因此铁的吸收在十二指肠中受到严格调节。
// 血红素铁
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
// 非血红素铁
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB) 将其还原为二价铁形式,然后再由二价金属转运蛋白 (DMT1) 转运到十二指肠刷膜上 。
注:二价金属转运蛋白的存在已被描述,铁也在回肠和结肠中被吸收,但这些吸收位点对宿主铁状态的贡献仍不清楚。
铁进入肠上皮细胞后,储存在铁蛋白中,或通过基底外侧铁转运蛋白输出到循环系统中。
铁稳态由激素铁调素调节,铁调素通过不同机制抑制铁释放到血浆中。
铁调素是由肝脏合成并分泌的富含半胱氨酸的抗菌多肽,在免疫过程中能够大量表达参与免疫反应;在机体内铁平衡的调节中起到负性调节的作用。
肠道微生物群在铁吸收中的作用示意图
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
细菌可以通过不同的机制获取铁
细菌可以通过不同的机制获取铁,例如使用称为铁载体的铁特异性螯合剂,铁载体是化学性质多样的次级代谢产物,对铁具有高亲和力。
由此产生的铁-铁载体复合物通过特定的外膜蛋白(上图中的细菌A)内化。细菌还可以通过产生具有不同配体结合位点的外膜受体来利用其他细菌产生的铁载体(上图中的细菌B)。
铁载体在细菌缺铁的情况下表达
铁载体在细菌缺铁的情况下表达,因此不在铁充足的环境中表达。在厌氧条件和低pH值下,铁主要以二价铁的形式存在,可以被细菌直接转运,主要通过专用转运系统Feo,由不同的蛋白质。
细菌可以利用宿主铁化合物
细菌还可以利用宿主铁化合物,例如血红素或转铁蛋白,它们通过特定受体转运或直接吸收。此外,尽管牛奶中存在的乳铁蛋白具有抑菌功能,但它也可以被具有特定受体的细菌利用。
铁吸收的调节对于细菌非常重要,因为铁在较高浓度下有毒。在许多细菌物种中,当铁浓度过高时,铁吸收调节蛋白 (Fur) 会抑制与铁吸收相关的基因转录。
研究细菌有助于揭示新的铁吸收途径
值得注意的是,大部分关于细菌铁吸收的知识来自对病原菌的研究。长期以来,人们一直认为一些有益菌,例如乳杆菌科的成员,不需要铁来生长。然而已经在植物乳杆菌(Lactiplantibacillus plantarum)和清酒乳杆菌(Latilactobacillus sakei)中鉴定出了特定的系统。
研究这些细菌可能会揭示新的铁吸收途径。在铁吸收的主要部位十二指肠中,大约有103 个细菌/克,低于空肠(104 个细菌/克),并且远低于结肠,结肠中的细菌数量高达1012 个细菌/克。
此外,乳杆菌科属的成员在铁吸收最多的小肠中数量众多,因此这些细菌对宿主铁吸收的作用应受到更多关注,以确定它们是否在铁的生物利用度中发挥作用。
▼
铁对于许多细菌来说是必需的,它们的生长需要铁。
据计算,结肠中的铁浓度很高,并且远远超过细菌生长的最低要求。但细菌对铁的生物利用度还取决于一系列因素(铁的形式、铁形态、pH值、氧气水平等)。
不同形式的铁可用于补充或强化,例如硫酸亚铁、富马酸亚铁或乙二胺四乙酸铁钠。由于铁补充剂中含有的铁明显多于人体可以吸收的铁,因此大量未吸收的铁会留在消化道内腔中。
•铁补充剂会导致潜在致病菌水平升高
多项人类研究表明,铁补充剂或强化铁会导致潜在致病菌水平升高,并导致通常被认为是有益细菌种类减少,例如乳杆菌科成员。
最近一项针对大鼠的研究还表明,出生后补充铁会导致肠道微生物群发生改变,这种改变会持续到成年期。此外,研究表明,抗生素治疗后服用铁剂会导致肠道细菌的组成和功能发生改变。
铁对于致病细菌至关重要,哺乳动物的免疫系统已经具备了通过表达铁结合蛋白(如脂质运载蛋白-2 或乳铁蛋白)来控制细菌对铁的可用性的能力,这种现象称为“营养免疫”。
研究了补充铁对肠道微生物群的作用,总的来说,根据所使用的模型(体外、动物或人类),结果似乎有很大不同。
事实上,在补充铁期间,乳杆菌科总是减少,这在体外、小鼠和婴儿中均观察到。所用铁的化学形式似乎对细菌组成有不同的影响。此外,出乎意料的是,补充铁的效果与缺铁的效果并不直接相反。
▼
对于细菌和人体来说,非血红素铁的生物利用度低于血红素铁的生物利用度,因为它受到食物基质的成分和管腔的物理化学成分的影响。
•肠道细菌有助于更好地吸收铁
事实上,许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而导致更好的铁吸收。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
扩展阅读:
▼
考虑到补铁的依从性低以及腹泻或便秘等副作用,很多研究已经测试和发现其他改善铁状态的策略。
它们包括使用益生菌、益生元和后生元等。
•使用益生菌改善铁状况
例如,将益生菌植物乳杆菌(Lactiplantibacillus plantarum 299v)与铁、抗坏血酸和叶酸一起食用,对健康、非贫血的瑞典孕妇的铁状况是安全的,可减少铁储备的损失并改善铁状况。
在另一项研究中,将果胶组装成铁纳米颗粒作为基质,用于植物乳杆菌(Lactiplantibacillus plantarum CIDCA 83114)的递送。益生菌没有毒性,生存能力没有减弱,这为用替代的铁输送策略对抗缺铁提供了新的视角。
•使用益生元帮助铁的吸收
在大鼠模型中,食用益生元寡糖通过调节肠道微生物群来增强铁吸收。摄入益生元后肠道pH值的降低可以帮助铁的吸收,此外还能以有益的方式改变肠道微生物组成。因此,益生元可以成为改善宿主铁状况的良好选择。
•食用乳铁蛋白增加铁的吸收
在肯尼亚婴儿中,研究表明,与单独服用硫酸亚铁相比,同时食用无铁乳铁蛋白(脱铁乳铁蛋白)和硫酸亚铁能够显著增加铁的吸收。
注:考虑到乳铁蛋白对肠道微生物群的影响,一些学者认为乳铁蛋白可能在婴儿铁配方中有用,因为它可以增加铁的吸收,同时可能减轻未吸收的铁对肠道微生物群的不利影响。
•使用富铁微生物
这些预防和治疗缺铁的新策略可能包括使用富铁微生物,除了从益生菌摄入中获益之外,它还可以为宿主提供大量矿物质。
在贫血小鼠中已显示,食用在铁存在下生长的酵母能够提高小鼠的血红蛋白浓度。在人类中只进行了一些尝试,其中含有富铁酵母的奶酪的吸收效率不如单独含有硫酸铁的奶酪。
注:还应该进行补充研究来评估富铁微生物在人类中的应用的全部潜力。
小结
从上面可以明显看出,肠道细菌在调节宿主铁的生物利用度方面发挥着重要作用。然而,宿主因素可以调节细菌对铁的吸收,例如,在炎症的情况下,脂质运载蛋白将与铁载体结合,从而对抗肠道细菌对铁的捕获。
最近,有人提出,共生细菌不仅使用不同的机制来释放和捕获铁,而且还在它们自己和它们的宿主之间共享铁。事实上,细菌扩散性铁载体生产的例子可以捕获铁,但不能保证这些铁将被生产细菌利用,这表明对可用铁的共同管理。
迄今为止,人类对锌、宿主和肠道微生物群之间相互作用的研究远少于铁。
★ 人体需要每日摄入锌
每日摄入锌补充剂,成人 40 毫克/天,通常被认为是安全的。
锌参与DNA合成、转录和翻译等重要过程。锌的吸收发生在十二指肠,涉及跨膜锌转运蛋白Zip4。然后,锌通过锌调节蛋白ZnT2-10转运至金属蛋白合成位点,或通过锌转运蛋白ZnT1输出至循环系统。
与铁相反,哺乳动物缺乏锌储存机制,每日摄入是必不可少的。如果过量,锌也可以主动排泄,锌通过基底外侧的 Zip5/Zip14 蛋白从循环分配到肠上皮细胞,并通过ZnT5从肠上皮细胞流出到管腔。
肠道微生物群在锌吸收中的作用示意图
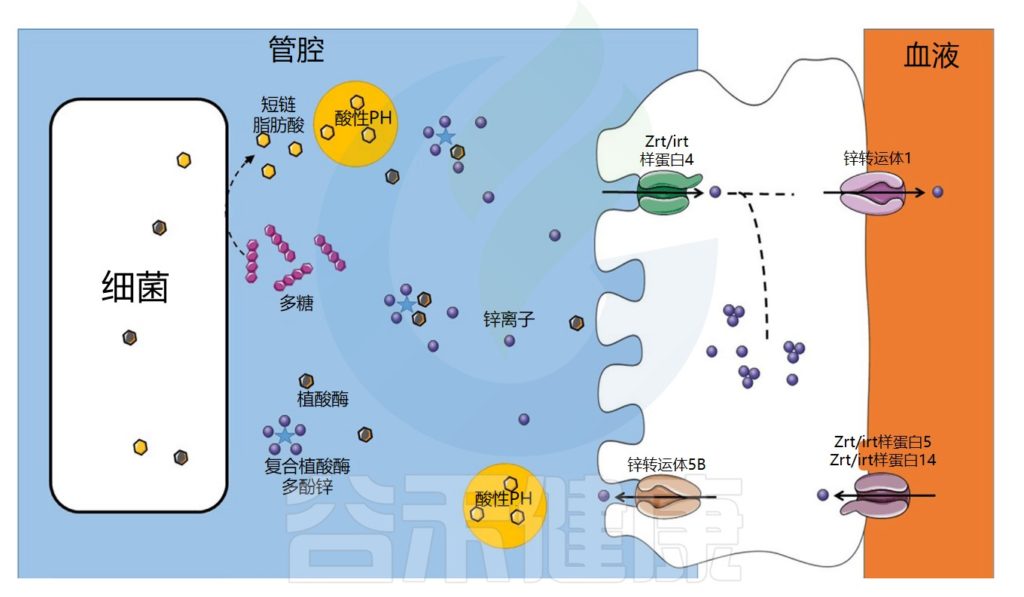
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
锌的转运与吸收过程
在食物中,锌可以与抗营养因子如植酸盐或多酚络合,从而减少其吸收。未被小肠吸收的锌会到达结肠,并可能被结肠细胞吸收,因为锌转运蛋白也在结肠中表达。
在细菌中,锌通过锌伴侣蛋白转运至金属蛋白合成位点。细菌对锌的吸收受锌吸收抑制因子Zur和锌流出抑制因子CzrA的调节。一些病原菌可以通过表达高亲和力转运蛋白(ZnuABC)来克服锌限制条件。
锌浓度过高可能对某些病原菌有毒。与铁的情况一样,宿主和病原微生物之间也存在竞争。事实上,宿主还利用营养免疫来通过产生钙卫蛋白来限制锌的生物利用度。
例如,钙卫蛋白在消化道中结合锌。
▼
锌缺乏与慢性腹泻相关。补锌对肠道微生物群的影响主要在动物模型中进行研究。它已在家禽和养猪业中以药物剂量用于减少胃肠道感染和腹泻。
√锌具有抗菌活性,能够减少腹泻
锌具有抗菌活性,不同的研究强调了高剂量的锌会引起肠道不同部位(从胃到结肠)细菌组成的变化。
在断奶仔猪中,使用低剂量的锌可以通过改善小肠形态和通透性、增强屏障功能,有效促进生长性能并减少腹泻。
此外,锌还能丰富肠道微生物群中的链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae),并减少芽孢杆菌和肠道疾病相关病原体,包括回肠腔中的梭状芽胞杆菌和克罗诺杆菌。
注:如果缺锌小鼠补充锌是有益的,那么过量的锌饮食摄入会改变肠道微生物群并降低对艰难梭菌感染的抵抗力。
√一些菌属可以预测锌的充足性
但研究结果并不一致。事实上,一项针对鸡的研究表明,瘤胃球菌属(Ruminococcus)可以预测宿主体内锌的充足性。但在一项针对小鼠的研究中,黑色素杆菌(Melainabacteria)和脱硫弧菌属(Desulfovibrio)被确定为锌状态的潜在标志物。
▼
尽管许多代谢过程都需要锌,但关于锌状态或补充剂对肠道微生物群影响的研究却很少。
√一些细菌可以作为锌缺乏的生物标志物
最近的研究表明,尽管缺锌和锌充足的学龄儿童之间的细菌多样性相似,但缺锌儿童的个体多样性更高。特别是,粪杆菌(Coprobacter)、醋酸弧菌(Acetivibrio)、副普雷沃氏菌(Paraprevotella)和梭状芽胞杆菌在缺锌组中更为丰富。它们可以用作进一步临床诊断锌缺乏的生物标志物,但需要更多的工作来推广这一结果。
锌的摄入量也会显著增加儿童粪便细菌。在同一项研究中还鉴定出了纳米颗粒抗性细菌的一些代表。
▼
由于补锌会改变肠道微生物群的组成和功能,因此许多研究已经研究了锌与益生菌一起服用的效果。
√锌与益生菌一起补充
例如,在大鼠中,施用在富锌培养基中生长的长双歧杆菌(Bifidobacterium longum CCFM1195)比单独补充锌更能有效地增加血浆锌浓度。
此外,一些细菌群(如乳杆菌科)的丰度随着富含锌的双歧杆菌的消耗而增加。使用富含硒和锌的植物乳杆菌对小鼠进行类似的设计,与对照组或补充硒锌的组相比,能够增加循环锌浓度。这种增加伴随着肠道细菌组成的改变,乳杆菌科(Lactobacillaceae)的比例增加。
√儿童单独补充锌可能更有效
最近总结了研究中获得的数据,对于24个月以下儿童的治疗,单独补充锌可能比益生菌更有效;在学龄前儿童中同时补充锌和植物乳杆菌并不比单独补充益生菌更有效。因此,锌和益生菌联合给药的有效性需要更多的人体研究。
使用益生元似乎效率较低,因为给猪施用锌和马铃薯纤维对大多数分析指标没有显示出任何交互作用。
注:锌源和纤维补充对微生物群生态的影响是独立的。
小结
与铁的情况一样,对锌状态和宿主微生物群的研究主要集中在致病条件上,而对细菌在正常情况下的作用知之甚少。
肠道细菌、锌和宿主之间的关系值得更深入地研究,尤其是在人类中。事实上,富锌益生菌等有前途的工具正在出现,它们代表了治疗锌缺乏症的替代方案。特别是大剂量、长期补锌可能会干扰铁和铜的吸收,导致铁和铜的缺乏。
叶酸,也可以称之为维生素B9,是一种水溶性维生素。叶酸在蛋白质合成及细胞分裂与生长过程中具有重要作用,对正常红细胞的形成有促进作用。
一些共生细菌已被证明可以合成某些维生素,细菌也可以成为宿主叶酸的来源,即使整体贡献的程度不清楚。同时,叶酸的摄入会影响肠道微生物群。
叶酸的转运与吸收过程
饮食中的叶酸以单谷氨酸盐和聚谷氨酸盐形式存在,它们被肠道结合物分解为单谷氨酸盐形式,然后通过特定的转运蛋白偶联叶酸转运蛋白(PCFT)在回肠中吸收。
在肠上皮细胞中,叶酸单谷氨酸转化为活性形式5-甲基四氢叶酸(5-MTHF),它可以被运输到循环系统。
注:细胞叶酸外排可能由多个耐药蛋白(MRPs)家族介导。在结肠中,已经发现了相同的一种受体。
肠道微生物群在叶酸吸收中的作用示意图
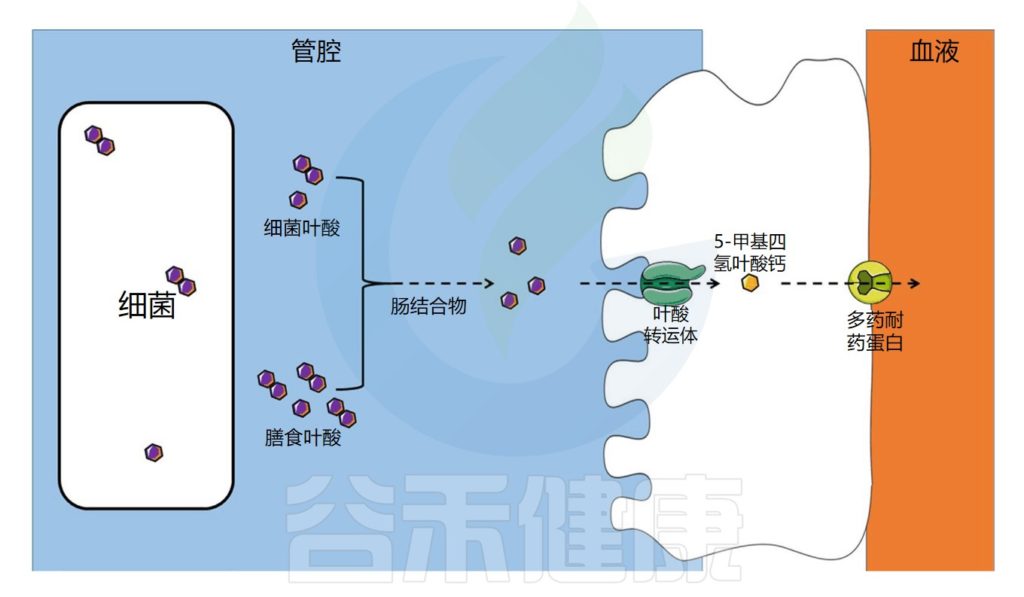
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
▼
细菌的生长需要叶酸,一些细菌是原养型细菌,可以从环境中存在的前体合成叶酸,而营养缺陷型细菌必须从环境中获取叶酸。
✦肠道细菌合成叶酸
大量文献支持细菌叶酸合成对宿主叶酸状态的重要贡献。早期研究报告称,人类粪便样本中的叶酸浓度为300-500µg/天,而饮食摄入量低于100µg/天,表明肠道细菌可以合成叶酸。
事实上,512个细菌基因组的叶酸生物合成能力预测表明,其中13%的细菌基因组包含所有叶酸生物合成相关基因,而39%的细菌基因组可以在外部来源提供额外的对氨基苯甲酸的情况下合成叶酸。
总而言之,这些数据表明肠道微生物群是叶酸的重要来源,并且饮食等不同因素导致的肠道微生物群组成的变化可能会影响叶酸的需求。
✦肠道细菌可以转化叶酸以便更好地利用
由于纤维消耗而改变肠道微生物群组成可能导致结肠内容物或循环中叶酸浓度增加。此外,尽管结肠中的叶酸吸收比小肠中的叶酸吸收慢100倍,但标记的叶酸被专门包裹在结肠中并在结肠中分解,并被纳入宿主组织。
肠道细菌不仅合成可供宿主使用的叶酸,还可以将叶酸转化为更好地被宿主吸收的维生素体,正如秀丽隐杆线虫(Caenorabditis Elegans)模型所证明的那样,其中细菌可以将叶酸转化为四氢叶酸。
✦微生物代谢叶酸的能力与宿主生理状况相关
肠道微生物群的代谢能力不仅取决于其组成,还取决于宿主的生理特征。例如,与成人相比,婴儿和幼儿肠道微生物群中更频繁地发现编码参与叶酸生物合成的酶的基因。
有趣的是,受营养不良影响的儿童的微生物组显示,参与B族维生素代谢的多个途径中的基因丰度显著降低。此外,在肥胖女性中观察到叶酸水平较低,同时产生B族维生素的细菌也减少。
▼
许多产生叶酸的细菌被鉴定并成功用于增加发酵食品的叶酸含量。其中一些细菌还能够改善缺乏叶酸饮食的啮齿动物的叶酸状况。
✦产生叶酸的益生菌改善叶酸状态并调节微生物组成
使用产生叶酸的益生菌可能是改善叶酸状态并调节肠道微生物群的一种方法。在体外发现了有希望的结果,其中产生叶酸的清酒乳杆菌(Latilactobacillus sakei)被证明可以增加短链脂肪酸并改变粪便细菌组成。
在大鼠中,食用使用产生叶酸的植物乳杆菌制备的发酵奶能够恢复正常的叶酸状态,同时广泛改变肠道细菌组成。
▼
叶酸摄入量对肠道细菌的影响并不一致。
✦叶酸缺乏可能影响部分动物的肠道细菌组成
在小鼠身上发现膳食叶酸缺乏不会影响肠道细菌组成,可能是一些细菌可以在缺乏时产生叶酸,叶酸摄入量的波动对肠道微生物群的影响较小。
然而,在其他动物模型中,叶酸摄入改变了肠道微生物群的组成,例如鸡和小猪。
✦叶酸缺乏影响微生物多样性
叶酸缺乏也会影响微生物多样性,因为在限生小鼠中发现,与微量营养素充足的饮食相比,叶酸缺乏的饮食在21天后增加了β多样性,但随后的14天全饮食治疗并没有改变这一趋势。
小结
宿主的叶酸状态、食物或肠道中的叶酸产生细菌之间存在多种关联。这种关联通常是矛盾的,但有利于宿主和细菌区室之间的密切相互作用,这表明需要进行大规模人类研究,以更好地了解与叶酸可用性和改善人群叶酸状态的策略相关的宿主-微生物群相互作用。
叶酸重要天然来源有:
花生(246微克/100克)、葵花籽(238微克/100克)、芦笋(149微克/100克)、生菜(136微克/100克)、一些绿叶蔬菜和柑橘类水果等。
扩展阅读:维生素B9(叶酸)
维生素A在免疫调节中发挥着至关重要的作用,包括调节细胞因子的产生和淋巴细胞归巢至粘膜表面。它通过调节肠上皮中免疫细胞的增殖和分化,直接有助于维持肠道屏障,并在抵抗肠道病原体入侵方面发挥着至关重要的作用。
膳食维生素A以视黄醇和类胡萝卜素的形式存在,分别存在于动物和蔬菜中。
肠道微生物群在维生素A吸收中的作用示意图
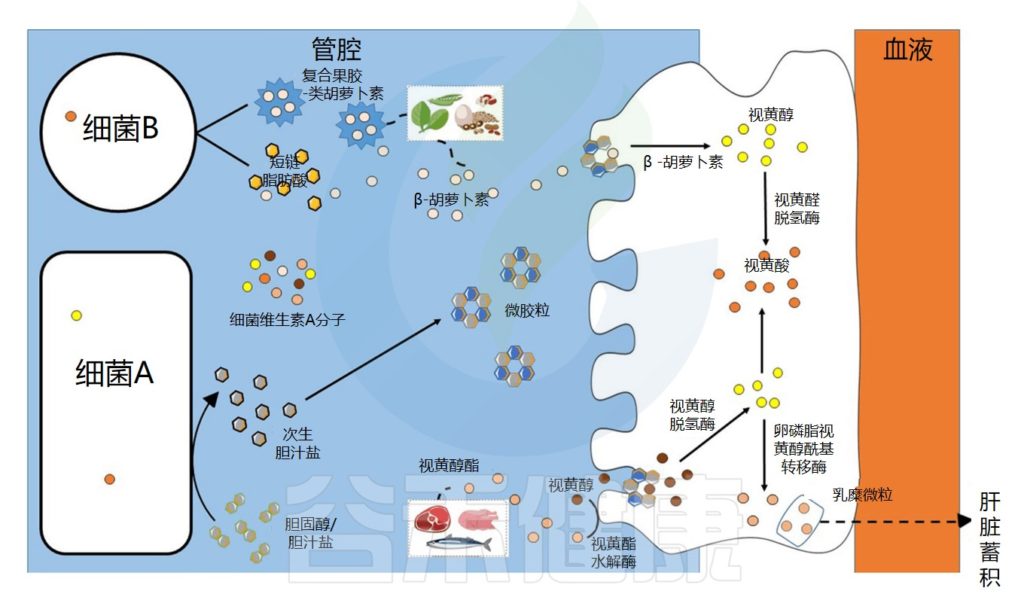
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
维生素A的吸收过程
视黄醇和类胡萝卜素是膳食脂溶性成分,在被肠上皮细胞吸收之前需要通过胶束溶解 。在胃和十二指肠中发生乳化成液滴的阶段,类胡萝卜素和视黄醇的摄取发生在小肠的上半部。
在肠上皮细胞中,类胡萝卜素通过胡萝卜素-15,15′-双加氧酶直接转化为全反式视黄醛。视黄醛可被视黄醛脱氢酶不可逆地转化为具有生物活性的视黄酸分子,或被转化为视黄醇酯,储存在肝脏中。
▼
肠道微生物群在维生素A代谢中的作用可能依赖于特定酶、脂多糖的产生,脂多糖可能有助于胶束形成或直接吸收,以及胆汁稳态。
•微生物通过调节胆汁酸有利于维生素A的溶解和吸收
一项以绵羊为模型的研究表明,宿主微生物群通过调节胆汁酸分泌对维生素A吸收产生影响。在该模型中,胆汁酸水平降低与维生素A吸收减少相关,并与瘤胃球菌科丰度密切相关。
由乳杆菌(Lactobacillaceae)、双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)或梭菌属等细菌产生的二级或三级胆汁盐的分泌可能有利于维生素A的溶解并改善其吸收,因为胆汁盐对于胶束化过程至关重要。
•肠道微生物可以直接和间接影响维生素A代谢
肠道细菌的基因组具有在动物和植物中发现的不同酶的类似物,这些酶允许乙酰辅酶A通过甲羟戊酸途径合成类胡萝卜素和类维生素A。
此外,来自拟杆菌(Bacteroides)、肠球菌(Enterococcus)和链球菌(Streptococcus)的细菌具有与宿主BCMO基因相似的brp/blh基因,可以将β-胡萝卜素转化为全反式视黄醇。
因此,肠道微生物组对维生素A代谢的影响既包括直接影响(如类胡萝卜素的合成),也包括间接影响(如调节其生物利用度)。
•肠道微生物合成相关蛋白有助于维生素A转运
类胡萝卜素的生物利用度会受到各种食物成分的影响,其中食物基质中蔬菜的细胞壁结构和组成形成物理屏障,从而限制消化酶的作用。
果胶和一些多酚(例如柚皮素)已被证明可以通过结合管腔中的胆固醇和胆汁盐来降低类胡萝卜素的体外生物利用度,从而抑制胶束的形成。
相反,果胶可以被许多共生细菌降解,并且肠道中的这种降解可能会增加类胡萝卜素的生物利用度。
此外,肠道微生物群合成酶或补体蛋白,例如细菌脂质运载蛋白,这可能有助于将类维生素A转运到肠上皮细胞中。
•肠道细菌调节宿主视黄醇的代谢
肠道微生物群可以消化膳食纤维,从而释放 β-胡萝卜素或其他结合态的微量营养素。
此外,肠道细菌群还可以调节宿主视黄醇的代谢,调节驱动免疫反应的视黄酸的产生。梭状芽胞杆菌类细菌可以通过抑制基因Rdh7的表达来调节肠道上皮中的视黄酸浓度,从而启动视黄醇向视黄酸的转化。
此外,这项研究表明,共生细菌群落降低了视黄酸的产生,视黄酸的产生通过肝脏储存形式的增加来平衡,并有利于视黄酯途径,而潜在致病菌则促进视黄酸的产生。
▼
肠道中维生素A的状态和类视黄醇的可用性可以调节肠道微生物的组成。
•维生素A调节免疫球蛋白的产生帮助保持细菌稳态
类胡萝卜素摄入、免疫功能和肠道细菌稳态之间相互作用的模型,表明维生素A可以通过调节IgA的产生来有助于保持细菌稳态。
在动物中,与未缺乏维生素A的小鼠相比,缺乏维生素A的小鼠的肠道微生物组成中,以下菌属的丰度较低:
另一项研究表明,拟杆菌在维生素A缺乏小鼠中的比例较低,维生素A缺乏组和维生素A充足组之间的几个细菌比例不同。在小鼠模型中,维生素A被证明可以调节分段丝状细菌(SFB)的丰度。
分段丝状细菌是一组能够诱导Th17细胞分化的细菌。
▼
•维生素A的摄入与微生物群多样性相关
类胡萝卜素的摄入量和状态与更大的微生物群多样性和有益细菌丰度的增加有关。
例如,在孕妇中,类胡萝卜素的摄入量和血浆浓度与肠道微生物群的α多样性呈正相关。
•维生素A影响免疫反应
维生素A对肠道微生物群组成的调节可能作为调节肠道免疫反应的间接途径。
例如,维生素A在体外和体内均被证明可以抑制诺如病毒(急性胃肠炎最常见的病毒因子)的复制,并且这种抑制似乎是通过微生物组变化直接或间接发生的,特别是肠道中的乳杆菌科。
•改善疾病患者的微生物组成
在溃疡性结肠炎患者中,摄入维生素A有益,可导致微生物群组成发生显著变化。
在自闭症儿童中,维生素A补充剂增加了拟杆菌目细菌的比例,并减少了双歧杆菌属的细菌比例。
有趣的是,一项针对306名孟加拉国新生儿的研究表明,与安慰剂相比,补充维生素A增加了男孩双歧杆菌的丰度,而这种差异在女孩中并未观察到。
对这些婴儿直至2岁的随访表明,女孩中放线菌相对丰度与血浆视黄醇呈浓度依赖性正相关,但男孩中则不然。
此外,阿克曼菌(一种与粘膜相关的细菌)的相对丰度也与女孩的血浆视黄醇呈正相关。
微生物群在肠道中参与了微量营养素的代谢和吸收,并且可以影响宿主的微量营养素状态。在这方面,给出以下一些建议:
➤ 1
摄入多样化的食物可以为肠道微生物提供更广泛的营养来源,从而促进微生物群的多样性和稳定性。
建议摄入富含膳食纤维的水果、发酵食物、蔬菜、全谷类食物以及富含微量营养素的食物,如坚果和海鲜等。
例如,香蕉钾含量高,还含有大量维生素 B6 和维生素 C。西兰花不仅富含维生素 C,还富含维生素 K、铁、钙和钾。
确保摄入足够的每种维生素和矿物质的一个简单方法就是“彩虹饮食”,彩虹饮食顾名思义就是色彩缤纷的蔬菜和水果,它们含有丰富的微量营养素,是一种健康趋势。每餐可以注意一下,是否有至少三到四种不同颜色的植物性食物,对于孩子,也可以鼓励他们去寻找不同的颜色。

下表列出了常见的维生素的食物来源,可供参考。

➤2
维生素D可以增加肠道对钙的吸收能力,并促进钙的转运到骨骼和其他组织中。
维生素 C 有助于改善植物中铁的吸收,这对于素食者来说尤其重要,可以在菠菜沙拉中添加柠檬汁。维生素C通过提高铁的溶解度或作为十二指肠细胞色素B将铁从铁还原为铁的辅助因子,有助于非血红素铁的生物利用度。
维生素B12和叶酸之间存在相互依赖的关系。维生素B12参与叶酸的代谢和激活,而叶酸则有助于维生素B12的合成和利用。
其他如,维生素E是一种脂溶性维生素,需要脂肪的存在来促进其吸收。摄入适量的脂肪可以提高维生素E的吸收率。
微量营养素之间的相互作用是复杂的,并且还受到其他因素的影响,最好的方式是通过均衡的饮食来获取各种微量营养素,因为食物中的微量营养素通常以复杂的组合形式存在,相互之间的相互作用更加协调和自然。
➤3
益生菌和益生元是一些有益的微生物和它们的营养物质,可以促进肠道的健康和微生物群的平衡。
建议摄入含有益生菌的酸奶、发酵食品、益生元的食物如洋葱、大蒜和麦麸等,以支持肠道微生物的生长和活动。
益生菌和益生元可能有助于微量营养素的最佳生物利用度,减少负面影响
例如,益生元低聚半乳糖减轻了补铁对婴儿肠道的不利影响,而罗伊氏乳杆菌与泻药氧化镁结合使用可以改善儿童的慢性便秘,而不会导致微生物组失衡。
益生元可以改变肠道微生物群,促进产短链脂肪酸的菌产生(如双歧杆菌、乳酸杆菌、真杆菌等),与钙吸收(在人类和动物模型中)、骨密度和强度(在动物模型中)增加相关。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
➤4
一般来说,在小谷物食品的自然发酵中,B族维生素的利用率可能会增加,并且可能会产生一些氨基酸,虽然说谷物含有一些维生素,但在小谷物食品发酵过程中添加乳酸菌或酵母可能会提高维生素水平。
例如,添加乳酸乳球菌N8 和布拉酵母菌Saccharomyces boulardii SAA655可将 idli 面糊中核黄素和叶酸的浓度提高 40-90%。
注:Idli 是印度的一种传统发酵面包,是一种由大米和脱壳黑豆原料的混合物,经过湿磨和传统发酵制成的糕点。
尽管小米主要用于制造面粉,但其加工(发芽和发酵)会增加谷物的铁含量。
➤5
抗生素的滥用可能破坏肠道微生物群的平衡,影响微量营养素的代谢和吸收。
抗生素还可能导致肠道黏膜的炎症反应,进一步干扰微量营养素的吸收和利用。
在使用抗生素时,建议按照医生的指导使用,并且在必要时采取预防措施,如同时摄入益生菌和益生元,以减少对肠道微生物的不良影响。
扩展阅读:
➤6
过度摄入糖或长期的压力和焦虑会对肠道微生物和宿主营养吸收产生不良后果。
深加工食品通常经过多道工序,其中许多有益的营养物质可能被去除或破坏。这些食品通常富含添加剂、防腐剂和高糖分,而这些成分可能会对微量营养素的吸收和利用产生负面影响。
通过减少摄入加工食品、管理压力等干预措施,可以帮助改善营养吸收和维持良好的微量营养素水平。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
➤7
运动可以改善血液循环,增加血液流向肠道和其他组织,从而提高微量营养素的输送和吸收。
运动还可以提高新陈代谢,提高能量消耗和细胞代谢的速度。这可能会导致对微量营养素的需求增加,从而促进其吸收和利用。
➤8
定期体检可以帮助发现潜在的营养和健康问题,及早采取措施。
定期进行体检是监测体内微量营养素的一种方法,但它可能无法提供详细的微量营养素水平信息。常规体检通常包括血液检查,可以检测一些关键的营养素水平,如铁、维生素B12、维生素D等。对于有些微量营养素,可能需要进行特殊的检测。
➤9
由于每个人的肠道微生物群和微量营养素状态可能存在差异,个体化的营养咨询和评估可以帮助确定针对个体需求的饮食和营养。
肠道菌群和微量营养素之间存在着紧密的关系和相互作用。肠道菌群中的某些菌种可以帮助合成和吸收微量营养素。这些菌种通过代谢和转化,将食物中的原始形式的微量营养素转化为人体可以吸收和利用的活性形式,提供给宿主机体所需。
同时,适当的微量营养素摄取也对肠道菌群的平衡和健康至关重要。一些微量营养素,如锌、铁等,不仅是肠道菌群的生长和代谢所必需,还能影响菌群的结构和功能。缺乏这些微量营养素可能导致菌群紊乱,而菌群紊乱又可能影响微量营养素的吸收和利用。
肠道细菌对宿主微量营养素状态的影响是一个急需关注的研究领域。同时对微量营养素代谢的研究应该扩大到包括一般肠道微生物组成,而不仅仅是病原菌。
相关阅读:
主要参考文献
Dje Kouadio DK, Wieringa F, Greffeuille V, Humblot C. Bacteria from the gut influence the host micronutrient status. Crit Rev Food Sci Nutr. 2023 Jun 27:1-16.
Amimo, J., H. Michael, J. Chepngeno, S. Raev, L. Saif, and A. Vlasova. 2022. Immune impairment associated with vitamin A deficiency: Insights from clinical studies and animal model research. Nutrients 14 (23):5038.
Baldi, A. J., L. M. Larson, and S.-R. Pasricha. 2020. Balancing safety and potential for impact in universal iron interventions. Global Landscape of Nutrition Challenges in Infants and Children 93:51–62.
Cuisiniere, T., A. Calve, G. Fragoso, M. Oliero, R. Hajjar, E. Gonzalez, and M. Santos. 2021. Oral iron supplementation after antibiotic exposure induces a deleterious recovery of the gut microbiota. BMC Microbiology 21 (1):1–15.
Kang, S., R. Li, H. Jin, H. Y ou, and G. Ji. 2020. Effects of selenium and zinc-enriched Lactobacillus plantarum SeZi on antioxidant capacities and gut microbiome in an ICR mouse model. Antioxidants 9 (10):1028.
Kramer, J., Ö. Özkaya, and R. Kümmerli. 2020. Bacterial siderophores in community and host interactions. Nature Reviews. Microbiology 18 (3):152–63.
McMillen, S., S. Thomas, E. Liang, E. Nonnecke, C. Slupsky, and B. Lonnerdal. 2022. Gut microbiome alterations following postnatal iron supplementation depend on iron form and persist into adulthood. Nutrients 14 (3):412.
Qin H, Wu H, Shen K, Liu Y, Li M, Wang H, Qiao Z, Mu Z. Fermented Minor Grain Foods: Classification, Functional Components, and Probiotic Potential. Foods. 2022 Oct 11;11(20):3155. doi: 10.3390/foods11203155. PMID: 37430904; PMCID: PMC9601907.