 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
衰老通常伴随着心血管、神经和免疫系统等一系列疾病的风险增加。
虽然在理解微生物组导致与衰老相关的个别疾病的细胞和分子机制方面取得了显著进展,我们在之前的文章也有这方面的阐述:
但微生物组对衰老过程的实际影响或操纵微生物组促进健康衰老的潜力仍不清楚。
这方面的研究因许多导致衰老和年龄相关表型的人口统计学因素而变得更加复杂。在世界各地几乎所有的人口中,女性的寿命都显著高于男性,世界卫生组织的大多数常见的与年龄相关的死亡原因都是性二型的,导致这些性二型表型的机制仍然知之甚少。
研究表明,人类微生物组在衰老个体中发生了改变,微生物组影响了模式生物的寿命。


本文重点介绍了最近在人类和模式生物中进行的研究,这些研究表明微生物组与多种年龄相关疾病有关,重点关注癌症、肥胖、2型糖尿病和帕金森氏病。同时解释了为什么性别是理解微生物组如何塑造衰老的关键差距。这些讨论共同强调了微生物组在整个生命周期中的广泛影响,以及在这一跨学科领域快速展开新发现的潜力。
通过微生物组预测年龄
人类微生物组与年龄之间的总体关联足够强,因此可以通过微生物组精确预测生物年龄。
在生命早期就证明了这一概念,在营养不良的情况下,在健康个体中建立的“微生物群成熟度指数”被推迟了。
最近,机器学习工具能够根据远端肠道宏基因组数据准确预测成年人的年龄,平均绝对误差为6至8岁。


其他部位菌群也与年龄相关
在其他身体部位发现的微生物群的组成也与年龄有关,包括皮肤和口腔在内。皮肤微生物群甚至在尸体解剖后被用于确定尸体的年龄,强调与人类微生物群的时间关系涵盖了整个生命周期以及生命周期结束后。
在法医学中有应用前景
这一领域的持续进展对法医学有着明确的影响,有助于采用新的方法来识别嫌疑人,甚至可能识别他们的年龄。微生物组特征也与老年人的生存有关,这进一步强调了了解微生物组如何在衰老中改变的重要性。
对百岁老人的研究促进健康衰老
对百岁老人(100岁以上的人)的研究为可能促进健康衰老的微生物组成分提供了有价值的见解。
健康的百岁老人和虚弱的老人
doi.org/10.1371/journal.pbio.3002087
百岁老人比年轻人表现出更高的细菌多样性,且Alistipes、Parabacteroides、Clostridium等丰度较高。
与这些分类变化一致的是,百岁老人体内也富含多种微生物代谢产物,包括肠道细菌产生的抗炎胆汁酸。
需要进行后续研究,测试特定细菌种类、基因和代谢产物在促进健康衰老中的因果作用;然而,这些数据清楚地表明,处于寿命极端的个体拥有独特的微生物类群和代谢最终产物。
虚弱老年人:肠道菌群多样性低,皮肤菌群中多种潜在的致病菌
虚弱也与人类肠道微生物组的个体间差异有关(图1)。经过年龄调整后,与不太虚弱的个体相比,虚弱的老年个体肠道细菌多样性降低。
对居住在社区和护理机构的老年人的纵向分析揭示了与虚弱相关的皮肤、口腔和肠道微生物群的差异。
在虚弱的老年人的皮肤上观察到多种潜在致病细菌,以及大量抗生素耐药性基因。与百岁老人一样,微生物群在导致虚弱中的因果作用仍有待确定,特别是考虑到许多可能解释人类微生物群中这些与虚弱相关的差异的混杂因素。
什么因素影响老年微生物组变化?
年龄与生活方式的多个方面和宿主生物学的变化有关,这些变化可以解释人类微生物群中观察到的许多或所有差异。
衰老伴随着宿主免疫受损,这可能导致以前被免疫系统控制的微生物的扩张,这可能解释了虚弱的老年人中潜在细菌病原体的富集。
饮食也是一个明显的混淆因素,因为疗养院居民更受限制的饮食可能是一些老年人肠道微生物群变化的关键驱动因素。
肠道运动通常也会随着年龄的增长而减慢,这可能会对肠道微生物群产生下游影响。
最后,老龄化健康的社会决定因素,如独居、住院护理的可能性增加、行动不便和人际关系的丧失,都可能影响微生物组。
考虑到可能起作用的众多因素,最近的一项研究采取了一种更为综合的方法,证明了肠道微生物组与整体生活史之间的联系,其中包括有关药物、体育活动、饮食和血液标志物的信息。因此,微生物组随年龄的变化似乎是由许多宿主和环境因素的净影响驱动的。
►▷
这些结果强调,人类微生物组是衰老过程中一个重要但研究不足的方面。鉴于这种微生物生态系统的复杂性,解开因果关系在人类中是难以解决的,这推动了我们在下一节中讨论的模式生物的新兴工作。
对无菌模式生物的研究,为微生物组在决定宿主寿命方面的因果作用提供了有力的支持,包括对蠕虫、苍蝇、鱼和小鼠的研究。
综合考虑,以下讨论的研究结果表明,人类微生物组在寿命中也起着因果作用;然而,将与衰老相关的人类微生物组的特定方面直接“反向翻译”为这些模式生物仍有待探索。
生命早期接触微生物组有利于延长寿命
跨多个模型系统的研究表明,在早期接触微生物组有利于延长寿命。这在斑马鱼中最为显著,由于表皮退化表型,可能是由于营养不足,斑马鱼在无菌条件下无法成熟。同样,胚胎发育过程中的细菌定植延长了黑腹果蝇的寿命。
然而,以上结果与来自无菌秀丽隐杆线虫、无菌小鼠和无菌大鼠的数据相冲突,这些动物的寿命都比传统饲养的对照动物更长。因此,微生物在生命早期定植的潜在好处可能会被生命后期的有害影响所抵消。
微生物组可能缩短老年动物的寿命
在秀丽隐杆线虫中,大肠杆菌的胃肠道积累会导致与年龄相关的死亡。将无菌条件下的无菌果蝇去除后,成年果蝇的寿命会缩短。
最近,人们用非洲绿松石溪鱼研究了微生物组对衰老动物的有害影响。使用抗生素治疗的中年鱼(9.5周龄)比未经治疗的鱼活得更长,这表明微生物群会损害老年鱼的寿命。
值得注意的是,6周大的溪鱼的胃肠道微生物群显著延长了中年溪鱼群体的寿命。
基于微生物组的干预措施延长寿命
这些发现也与哺乳动物有关。在2种早衰症小鼠模型中的研究,支持了基于微生物组的干预措施延长寿命的潜力。
早衰小鼠的肠道微生物群发生了改变,包括了LmnaG609G/G609G模型中的Akkermansia muciniphila的显著减少,该模型含有导致最常见的人类早衰综合征的核膜层粘连蛋白A/C点突变。
正如在鳉鱼中一样,野生型小鼠的粪便微生物群移植(FMT)显著增加了转基因过早衰老受体小鼠的寿命。
人类肠道微生物群的常见菌群疣微菌属(Verrucomicrobium) A.muciniphila足以延长小鼠的寿命。
这些结果为确定微生物群依赖性寿命变化的细胞和分子机制迈出了重要一步,也是将这些结果潜在地转化为人类的重要一步。
微生物增加膳食营养素的消化吸收
多种模式生物的研究结果支持的一种机制是,微生物组可能通过增加膳食营养素的可利用性来缩短寿命。因此,微生物组的差异可能会抵消甚至加剧热量限制的影响,从而延长多种物种的寿命。
简言之,微生物组对植物多糖的消化、脂质的吸收和氨基酸的吸收至关重要。关于肠道微生物组在营养中作用的我们也有多篇文章提及:
微生物定植激活多种被抑制途径,从而延长寿命
微生物定植还可以激活被热量限制抑制的多种途径(延长寿命),包括胰岛素样生长因子1和AMP活化蛋白激酶。值得注意的是,与传统饲养的对照动物小鼠相比,当热量受到限制时,无菌小鼠失去了寿命优势。
此外,最近对人类和小鼠模型的研究表明,热量限制会以促进减肥的方式扰乱人类肠道微生物组。大量数据也表明微生物组与营养不良有关。
►▷
需要做更多的工作来解开饮食和微生物组之间的这些复杂相互作用,以及它们对宿主健康和寿命的长期影响。
从前面了解的内容我们可以看到,微生物组可以通过影响疾病的风险和治疗来影响寿命。
最近的研究支持宿主年龄导致疾病相关微生物组和健康个体微生物组之间的差异。
鉴于涵盖多个疾病领域的大量文献,我们选择将以下部分重点放在3个年龄相关疾病领域:
这里讨论的研究强调了将机制和转化微生物组研究配对的潜力,以及这些方法对其他年龄相关疾病的可推广性。
研究人员认为,所有这些途径的净效应通过决定疾病的风险和治疗来决定寿命。
微生物组与3种不同的年龄相关疾病有关的一些机制

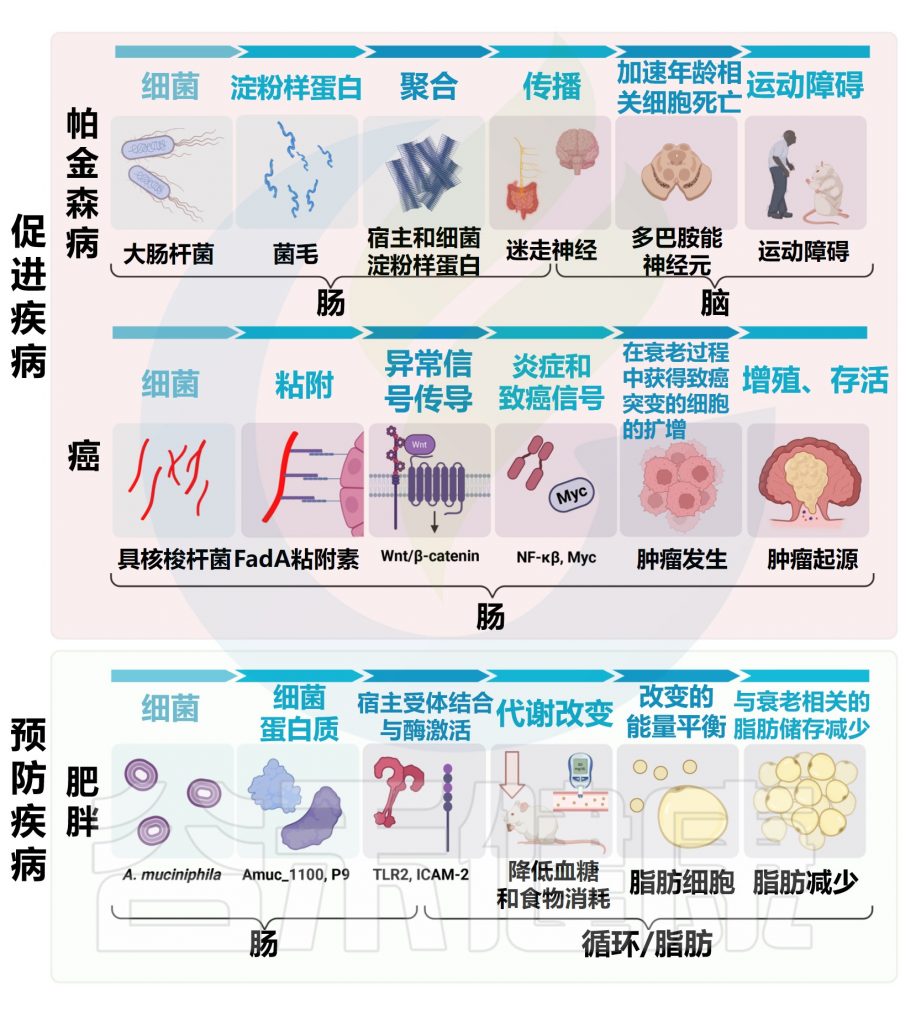
doi.org/10.1371/journal.pbio.3002087
癌症与年龄有关:
20岁以下:每10万人中有25例以下
45至49岁:每10万人为350例
60岁及以上:每10万人中有1000例以上
大多数癌症类型,包括乳腺癌、前列腺癌和结肠直肠癌,都遵循这一趋势。


单个物种的影响:具核梭杆菌
最近,将结直肠癌肿瘤与邻近的非恶性粘膜进行比较,发现具核梭杆菌(Fusobacterium nucleatum)显著富集。
具核梭杆菌在结肠癌中因果作用的证据来自小鼠,在小鼠中,这种细菌激活信号通路,促进髓样细胞浸润,并表达促炎和致癌基因。
整体微生物组:评估疾病状态
除了具核梭杆菌等单个物种外,整个微生物组都可以作为疾病状态的有价值的生物标志物。使用肠道微生物组数据作为筛查工具可将结直肠腺瘤预测成功率提高50倍以上。
肠道微生物组也与其他器官中发现的癌症有关,包括肝脏、前列腺和乳腺。
扩展阅读:
此外,全身发现的肿瘤通常含有可检测的微生物,包括细菌和真菌,这表明微生物组可能对肿瘤进展具有局部和全身影响。
改变免疫力
癌症化疗和免疫治疗工作强调了微生物组在塑造癌症治疗结果中的广泛作用。从对免疫疗法反应良好的黑色素瘤患者通过粪菌移植到其他患者之后,一部分受试者的肿瘤大小减小。这些研究强调了肠道微生物组的变化如何改变宿主免疫力,从而改变对免疫检查点阻断的反应性。
代谢抗癌药物
除了免疫相互作用外,微生物组还可以通过将抗癌药物代谢为下游代谢产物,使其活性增加或降低,从而直接影响抗癌药物。
选择性抑制重新激活抗癌药物伊立替康(β-葡萄糖醛酸酶)的细菌酶可以挽救胃肠道毒性,而细菌前TA操纵子的高水平表达会干扰卡培他滨(抗癌药物5-氟尿嘧啶的口服形式)的疗效。
►▷
在了解微生物组如何影响癌症风险、治疗和生存方面取得的持续进展,对解决这一影响全球人口老龄化的毁灭性疾病具有深远的意义。
代谢性疾病的常见医疗干预措施对肠道菌群有深远的影响
肥胖和2型糖尿病都与年龄有关,并且与微生物组有着广泛的联系。在人类中,由于糖尿病药物二甲双胍、胃旁路手术和减肥饮食的混杂影响,与这些疾病的一致微生物组相关性一直难以实现。
扩展阅读:
种族之间的差异也可能起到一定作用,例如,在美国的一个队列中,在东亚个体中没有检测到与肥胖相关的白人肠道微生物群差异。
总之,这些结果强调,旨在改善代谢性疾病的常见医疗干预措施对肠道微生物组有着深远的影响,而肠道微生物组也可能与衰老过程有关。此外,所涉及的特定微生物物种、基因和途径可能因个体和队列而异,这促使人们努力实现基于微生物组的精准营养和医学。
微生物组可以通过多种途径影响与肥胖和2型糖尿病相关的表型
如上所述,微生物组可以通过帮助消化饮食中其他无法获得的成分来促进热量摄入,这与最近在人类中的数据一致。该数据显示,抗生素万古霉素治疗后,饮食能量收获显著减少。
反过来,微生物组也会影响宿主的能量消耗,部分是通过改变宿主基因表达和酶活性。
最近,对A.muciniphila的研究已经鉴定出一种细菌蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。
额外的研究已经确定了一种单独的粘蛋白原蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。这些发现与来自人类的数据一致,这些数据支持灭菌的A. muciniphila的安全性和益处。
►▷
未来重要的是,要了解微生物组对衰老个体宿主能量学的影响是如何变化的,特别是考虑到饮食摄入和药物使用的伴随变化。
微生物组也可能在多种神经系统疾病的病因和治疗中发挥因果作用,这些疾病的风险和/或严重程度随着年龄的增长而增加,包括阿尔茨海默病、多发性硬化症和帕金森病。
扩展阅读:
在这里,我们重点关注帕金森病,因为最近在理解其与肠道微生物组的关系以及与衰老的明确联系方面取得了进展。
95%以上的帕金森病病例发生在50岁以上的人群中;然而,人口老龄化不足以解释帕金森病发病率的上升,这涉及到微生物组等因素。
胃肠道与帕金森症有关
便秘是一种早期症状;淀粉样蛋白α-突触核蛋白在到达中枢神经系统之前在迷走神经(连接大脑和肠道)中发现;迷走神经干切断术(切除胃食管交界处的迷走神经)可降低近50%的帕金森病风险。
然而,尽管胃肠道和帕金森氏症之间有许多联系,但微生物组的作用直到最近才成为焦点。
肠道菌群与大脑沟通影响帕金森病的发病机制
帕金森病小鼠模型中的微生物群发生了改变,其中α-突触核蛋白过表达(ASO模型)。与对照组相比,ASO-无菌小鼠以及帕金森病的替代小鼠模型与受影响小鼠或人类的肠道微生物群的定殖会加剧大脑病理和运动功能障碍。
细菌淀粉样蛋白也可能引发疾病,如大肠杆菌制造的细胞表面淀粉样curli蛋白。
最近研究表明,肠道细菌也会影响宿主淀粉样蛋白的产生,因为细菌硝酸盐的减少会刺激α-突触核蛋白的肠道聚集。
再加上来自帕金森病患者和健康个体的越来越多的宏基因组数据,表明多种不同的微生物组依赖性细胞和分子机制可能共同驱动帕金森病患者的疾病。
肠道菌群也可能导致帕金森病治疗结果的个体间差异
帕金森病的治疗通常从小分子药物左旋多巴(L-多巴)开始,左旋多巴在中枢神经系统中转化为多巴胺,从而缓解神经元多巴胺耗竭引起的帕金森病症状。
左旋多巴通常与卡比多巴(一种脱羟基酶抑制剂)配对使用,可降低药物的外周代谢。然而,卡比多巴不会抑制肠道细菌酶酪氨酸脱羧酶(TyrDC),该酶催化肠道细菌在胃肠道内将左旋多巴代谢为间酪胺的第一步。相反,化合物(S)-α-氟甲基酪氨酸可用于特异性抑制细菌TyrDC,导致小鼠血清L-多巴增加。
值得注意的是,帕金森病患者的TyrDC水平随着时间的推移而增加,并与多种帕金森病药物治疗的胃肠道不良反应有关。
TyrDC可能只是肠道细菌代谢的多种途径之一;产孢梭菌也可以使左旋多巴脱氨化。
►▷
需要更多研究来了解这些和其他途径在模型生物和帕金森病患者中的相对贡献,以及它们对药物疗效和不良反应的下游影响。
这一概念也可以更广泛地应用于其他用于治疗神经疾病的药物;例如,阿尔茨海默病药物加兰他敏和美金刚,在体外生长过程中被人体肠道细菌分离株耗尽。
扩展阅读:
衰老在男性和女性中有着根本的区别,在寿命、虚弱和与年龄相关的疾病方面有着广泛的差异。女性的虚弱贯穿一生,晚年达到残疾高峰。然而,在世界上几乎所有的人口中,女性的寿命都比男性长。即使根据社会经济地位、种族和教育程度进行调整,这些数据仍然有效。
多种分子机制导致衰老过程中的两性异形,包括内分泌和宿主遗传差异。例如,尽管存在相互矛盾的发现,报告存在更温和甚至相反的影响,但一些报告表明,在人类和小鼠中,卵巢切除术会降低健康寿命。
男性性腺和激素会对寿命产生负面影响
一些证据支持男性性腺和激素会对寿命产生负面影响,虽然也是一个争论的话题。例如,对太监的研究表明,阉割可以延长男性的寿命,对啮齿动物的研究表明某些外源性雄激素会缩短寿命。此外,在小鼠身上进行的性腺交换实验支持了卵巢(以及可能的激素)可以显著延长寿命的结论。
大多数与衰老相关的疾病也是性二型的,包括上面强调的3个疾病领域。
癌症:
女人和女孩的癌症发病率和生存率较高,许多非生产性癌症在发病率上具有强烈的性别偏见,尤其是内分泌癌(女性偏见)和卡波西肉瘤(男性偏见)。
代谢性疾病:
与男性相比,女性肥胖的风险增加,但患2型糖尿病的风险相当。
神经退行性疾病:
神经退行性疾病的严重程度和风险与性别有关:例如,男性患帕金森病的风险更高,但女性表现出更严重的疾病。
初步数据表明,性激素是这种关系的重要介质。在人类中,从青春期到更年期的平均年龄,性别与肠道微生物群的差异有关,这与性激素是差异的重要驱动因素的假设一致。反过来,微生物组也可能在控制性激素水平方面发挥重要作用。
相对于CONV-R动物,无菌小鼠的性激素水平发生了变化:无菌雄性的睾酮和β-雌二醇较低,而无菌雌性的孕酮和β-雄二醇较低。
肠道细菌β-葡糖苷酸酶可以重新激活雌激素葡糖苷酸,这与人类的数据一致,这些数据将抗生素与血清性激素浓度降低和性激素偶联物粪便排泄增加联系起来。此外,循环性激素水平与肠道微生物群的多样性和组成有关。
虽然关于性别、微生物组和衰老交叉的文献仍然很少,但一些初步观察结果突出了这一研究方向的价值。
对无菌小鼠的研究表明,雌性的长寿优势需要微生物群。
一项针对1型糖尿病非肥胖糖尿病模型的开创性研究表明,微生物组的性别差异会影响自身免疫性疾病。雄性CONV-R小鼠免受糖尿病的影响,但由于睾酮水平下降,无菌雄性小鼠的这种差异消失了。
值得注意的是,将雄性相关肠道微生物群移植到雌性受体中足以预防疾病。这些影响可能与睾酮有关:最近一项关于小鼠饮食诱导肥胖的研究表明,雌激素诱导的肠道微生物组差异可能会保护其免受代谢疾病的影响。
微生物组与衰老研究中生物性别的考虑


编辑
doi.org/10.1371/journal.pbio.3002087
►▷
今后,至关重要的是要确定性别改变微生物组的机制,以及年龄相关疾病和整体寿命的下游后果。在这样做的过程中,研究人员应该考虑重要因素,以了解生物性别如何影响微生物组对衰老表型的影响。
本文讨论了新出现的证据支持微生物组在衰老和年龄相关疾病中的作用。这些发现对生物医学和其他生物学领域具有广泛的意义。
从事微生物组的研究人员最好在研究中控制或考虑年龄、性别和其他人口统计变量。反过来,衰老和许多年龄相关疾病领域的研究人员应该考虑微生物组在研究中的潜在作用;例如,收集用于微生物组分析的探索性样本;控制与微生物组相关的变量,如饮食起居;或使用无菌模型。
通过合作,这一跨学科研究领域有望迅速发展,并可能解决长期存在的问题,即控制微生物群落结构和功能的因素,以及年龄相关疾病风险和治疗结果个体间差异的驱动因素。
当然,我们需要的并不是在微生物组和衰老领域大肆宣传,而是优先考虑旨在理解基本生物过程的严谨、机制性和实验可处理的工作,这一点至关重要。
虽然说长生不老这个目标可能还有很长的路要走,但也许这条结合微生物组的研究路线,可以帮助我们实现活得更长,生命质量更高。
主要参考文献:
Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol. 2023 Apr 5;21(4):e3002087. doi: 10.1371/journal.pbio.3002087. Epub ahead of print. PMID: 37018375.
Kim M, Benayoun BA. The microbiome: an emerging key player in aging and longevity. Transl Med Aging. 2020;4:103-116. Epub 2020 Jul 21. PMID: 32832742; PMCID: PMC7437988.
Glowacki RWP, Engelhart MJ, Ahern PP. Controlled Complexity: Optimized Systems to Study the Role of the Gut Microbiome in Host Physiology. Front Microbiol. 2021 Sep 27;12:735562. doi: 10.3389/fmicb.2021.735562. PMID: 34646255; PMCID: PMC8503645.
Chen Y, Wang H, Lu W, Wu T, Yuan W, Zhu J, Lee YK, Zhao J, Zhang H, Chen W. Human gut microbiome aging clocks based on taxonomic and functional signatures through multi-view learning. Gut Microbes. 2022 Jan-Dec;14(1):2025016. doi: 10.1080/19490976.2021.2025016. PMID: 35040752; PMCID: PMC8773134.
Baruch EN, Youngster I, Ben-Betzalel G, Ortenberg R, Lahat A, Katz L, Adler K, Dick-Necula D, Raskin S, Bloch N, Rotin D, Anafi L, Avivi C, Melnichenko J, Steinberg-Silman Y, Mamtani R, Harati H, Asher N, Shapira-Frommer R, Brosh-Nissimov T, Eshet Y, Ben-Simon S, Ziv O, Khan MAW, Amit M, Ajami NJ, Barshack I, Schachter J, Wargo JA, Koren O, Markel G, Boursi B. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science. 2021 Feb 5;371(6529):602-609. doi: 10.1126/science.abb5920. Epub 2020 Dec 10. PMID: 33303685.

谷禾健康

肠道微生物组与脂质代谢:超越关联
脂质在细胞信号转导中起着至关重要的作用,有助于细胞膜的结构完整性,并调节能量代谢。
肠道微生物组通过从头生物合成和对宿主和膳食底物的修饰产生了大量的小分子。
最近的研究表明,由肠道微生物组从头生物转化和生物合成的脂质具有重要的结构和信号功能,可通过代谢和免疫途径影响宿主细胞。肠道微生物群既可以转化和合成脂质,也可以分解膳食脂质,生成具有宿主调节特性的次级代谢产物。
微生物来源的脂质可以被宿主直接感知,从而调节先天性和适应性免疫途径,并调节代谢途径,所有这些都可以影响慢性炎症、自身免疫性疾病、心血管疾病和代谢综合征的进展。
本文基于对宿主和微生物组如何作为一个完整社区相互作用的思考,从更精细的层面介绍了肠道细菌衍生的脂质在生理学中的功能,特别强调免疫和新陈代谢。
▼ 脂质调节生物学功能
脂质是细胞膜的主要结构成分。作为能量储存分子,它们储存的能量几乎是从蛋白质或碳水化合物分解代谢中释放的能量的两倍。
脂质调节许多基本的生物学功能,包括细胞内信号传导过程。
例如,鞘脂 (SP),尤其是神经酰胺,在调节细胞信号和细胞凋亡中发挥作用。
其他脂质,例如甘油二酯 (DG),充当能量代谢的中间体和信号分子。
总的来说,脂质代谢在多个层面表现出空间和动态的复杂性。因此,脂质紊乱具有影响人类健康的重要生理后果也就不足为奇了 。
人体肠道中存在代谢活跃的微生物群,它们对脂质的吸收、消化、代谢和排泄具有深远影响,甚至会改变宿主的代谢状态。
▼ 肠道菌群和循环脂质密切相关
在人类中,肠道微生物组的多样性与 BMI 和血清甘油三酯 (TG) 呈负相关。妊娠期糖尿病合并症与特定的肠道微生物群组成和循环脂质组密切相关。其中Faecalibacterium和Prevotella的相对丰度显示与循环脂质有关,特别是与溶血磷脂酰乙醇胺和磷脂酰甘油有关。
膳食脂质和肠道菌群之间的相互作用会影响宿主生理
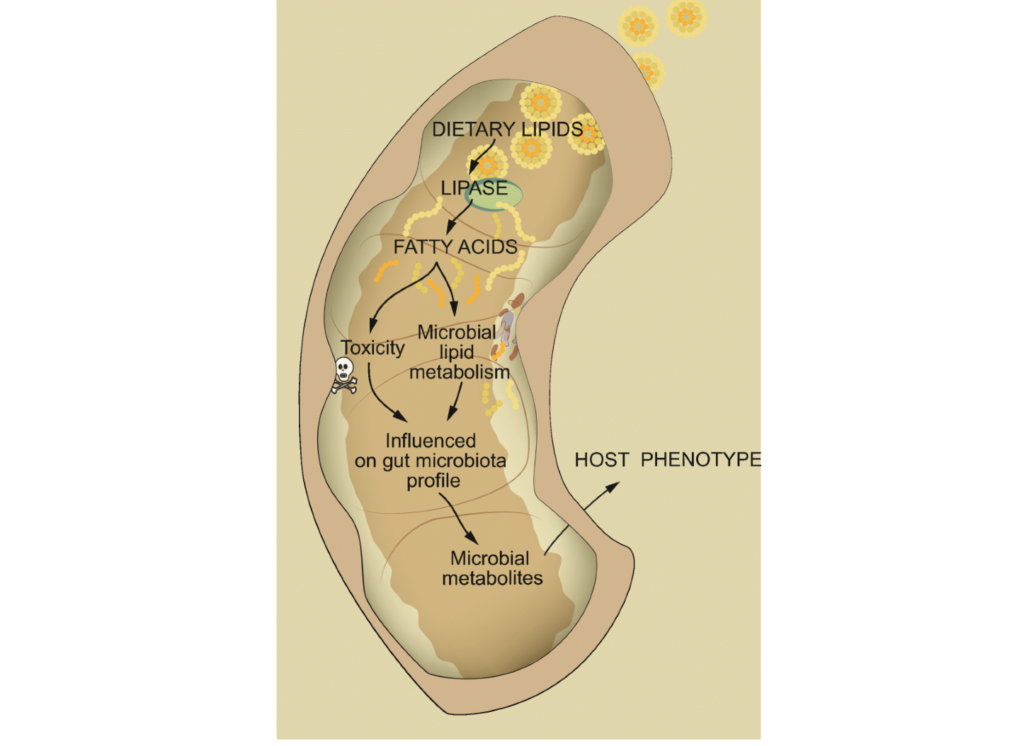
doi: 10.1007/s11154-019-09512-0.
▼ 饮食改变代谢状态,改变菌群
富含阿拉伯木聚糖的饮食改变了宿主的代谢状态,包括神经酰胺和胆碱水平,这随后影响了肠道中的普氏菌属和梭菌属。
▼ 肠道菌群可以调节宿主的脂质组
接受老年小鼠粪便细菌的小鼠表现出总单不饱和脂肪酸增加,以及大脑皮层中胆固醇和总多不饱和脂肪酸的相对量减少。
将微生物群从老年小鼠转移到年轻小鼠,会改变不同脂质类别的相对丰度和肝脏的脂肪酸含量。
在添加或不添加猪油或棕榈油的情况下,与棕榈油相比,猪油 + 富含含初级胆汁酸的饮食增加了定殖小鼠的脂肪量,但无菌小鼠的脂肪量没有增加。随后,这些影响与葡萄糖耐量受损和移居小鼠肝脏中甘油三酯、胆固醇酯和单不饱和脂肪酸升高有关。
长期以来,人们一直在研究细菌脂质在以下方面产生重要作用:
每种细菌的脂质特征都是独一无二的,反映了基因编码的生物合成机制和细菌的生活方式;然而,关于肠道细菌脂质生物合成的大部分知识都来自对大肠杆菌(Escherichia coli)的研究。
迄今为止,我们对细菌膜中发现的主要脂质类别的理解依赖于对少量模型细菌生物体的研究。
这些主要类别包括磷脂,例如:磷酸乙醇胺 (PE)、磷酸丝氨酸 (PS)、磷酸胆碱 (PC)、磷酸肌醇 (PI) 和磷酸甘油 (PG);甘油脂,例如甘油二酯(DAG)和甘油三酯(TAG);和心磷脂 (CL)。
还有糖脂,例如:脂多糖 (LPS),它们是连接有多种头基(例如糖)的大酰化脂质部分(例如脂质 A)。
其他脂质类别是特定细菌门或类群的特征。这些包括鞘脂,主要由共生拟杆菌菌株合成,如鞘氨醇、二氢神经酰胺 (DHCer)、神经酰胺磷酸乙醇胺 (CerPE)。
厌氧肠道微生物组的一个子集合成缩醛磷脂;然而,这些并不局限于特定的分类群,而是由拟杆菌门和厚壁菌门的不同成员产生的。
在一些肠道细菌中也发现了磺酸脂,包括拟杆菌属(Bacteroides)、Flavobacterium strains、Alistipes。每种脂质类别都有独特的结构,因此赋予细菌膜不同的结构特征和功能。
许多也是可以被宿主模式识别受体感知的信号分子,例如 Toll 样受体 (TLR)、NOD 样受体 (NLR)、C 型凝集素受体 (CLR) 和 G 蛋白偶联受体 (GPCR)。
细菌能够合成的脂质种类繁多。
最近人们才才刚刚开始意识到肠道微生物组的这种多样性,因为通过代谢组学技术在粪便中检测到的大部分脂质仍未注释且功能未知。
正在进行大量工作以生成培养的微生物组菌株的脂质组学概况,并将以前的结构数据与质谱相结合的脂质类别拼凑在一起。许多这些努力都围绕着宿主脂质注释,但最近已经开始解决细菌群落脂质组中的未知数。
在接下来的部分中,我们将讨论肠道微生物组中发现的主要脂质类别,并举例说明它们在宿主信号传导中的作用。
肠道微生物群生物合成的膜脂及其已知的宿主信号传导功能
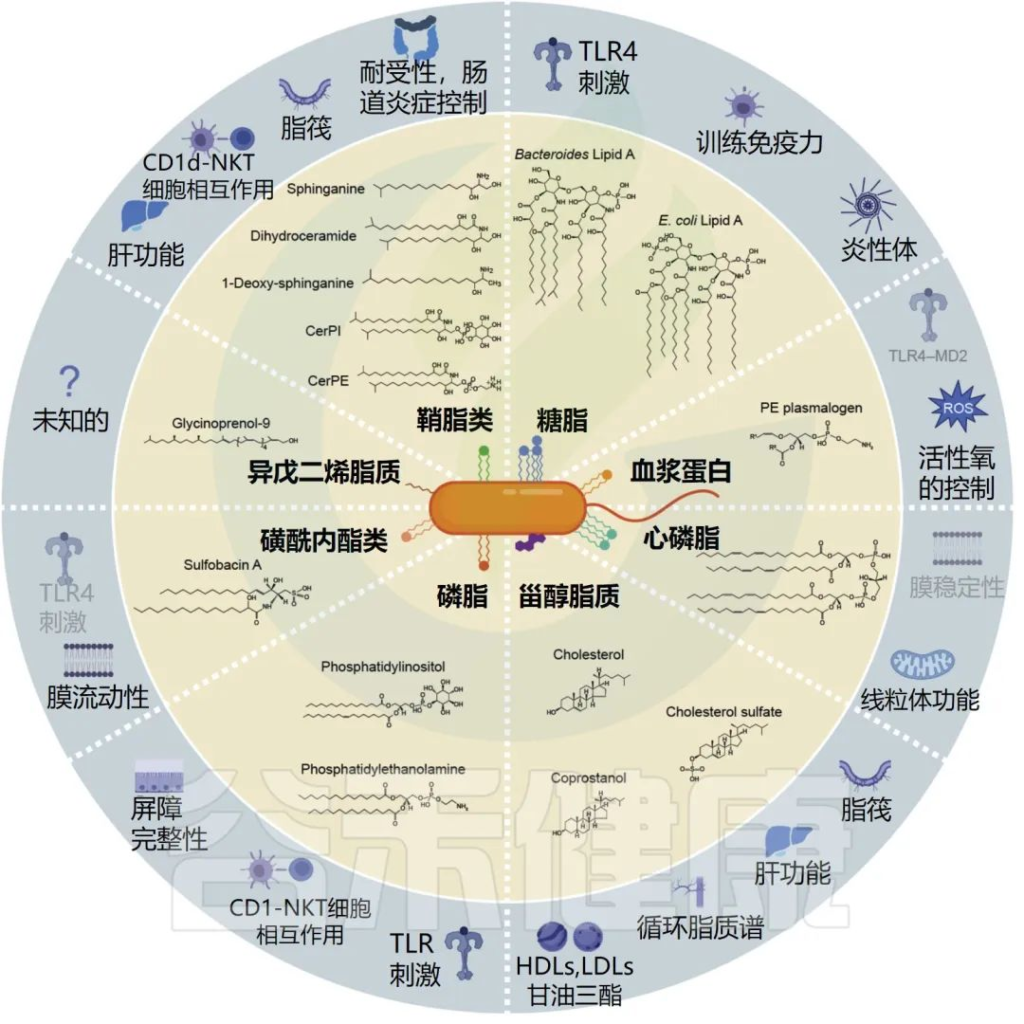
Brown et al.Cell Host Microbe, 2023.
细菌磷脂具有高度多样性,是从经过充分研究的细菌的细胞膜中回收的最丰富的脂质。它们的生物合成途径在模式生物大肠杆菌中已基本得到解决。
PE(磷酸乙醇胺) 是已知由肠道细菌广泛合成的主要膜磷脂。对宿主细胞微生物组代谢物的筛选尚未发现能够刺激细胞反应的多种磷脂。例如,大型 GPCR 筛选未能将微生物组磷脂识别为孤儿或已知受体的激动剂。
然而,最近的一项研究利用生物活性引导的分馏方法来筛选由常见肠道细菌Akkermansia muciniphila 产生的免疫调节分子,并鉴定出一种具有两条支链 (a15:0-i15:0 PE) 的二酰基磷脂酰乙醇胺,可激活模式识别由 TLR2-TLR1 组成受体 (PRR) 异二聚体。
与常见的 TLR2 激动剂相比,这种相互作用具有独特的信号特性,包括抑制人单核细胞中的促炎性 IL-12/IL-23 反应,这暗示了 Akkermansia 对人体生理学已知影响的分子机制。
▼ 细菌严格控制其膜磷脂的特性,使其广泛生长
细菌可以严格控制其膜磷脂的生化和生物物理特性,使它们能够在广泛的环境中茁壮成长。这包括改变酰基链长度和异构支化的能力,以及改变不饱和度和多样化头部基团的能力。这种响应肠道环境压力的修饰如何影响宿主免疫系统的信号传递能力尚不清楚。收集到的关于真核脂质的数据表明,异分支可以决定与蛋白质受体的结合强度。
对病原体的研究表明,微生物脂质的氧化、异构分支和饱和会影响宿主受体的识别。
▼ 肠道菌群影响细胞膜特性,膜磷脂变化导致肠道通透性增加
无菌小鼠宿主细胞中的磷脂水平与常规小鼠宿主细胞中的磷脂水平不同,这表明肠道微生物组也会影响哺乳动物细胞膜的特性。
膜磷脂化学的变化会导致肠道通透性增加,从而使细菌在宿主体内传播,从而产生许多病理后果。未来的研究需要解决微生物组合成的磷脂在肠道屏障功能中的潜在作用。
▼ 细菌磷脂可以调节免疫力,被自然杀伤 T 细胞识别
通过对病原体的研究中得出一些结论,即细菌磷脂会调节免疫力。结核分枝杆菌和李斯特菌磷脂,通常是 PG,被自然杀伤 T 细胞(NKT 细胞)识别,通过与呈递脂质抗原的非经典 MHC 分子 CD1d 结合。
共生磷脂是否在 CD1 信号转导或呈递给 T 细胞中具有相似的作用尚不清楚,微生物与宿主磷脂的 CD1 加载的生化决定因素也是如此。
▼ 肠道菌群可以合成磷酸肌醇
最近的研究已经确定肠道细菌可以合成 PI(磷酸肌醇),这是一种以前仅归因于真菌的能力。
鉴于 PI 在细菌和植物先天免疫之间的相互作用以及自噬中的肌醇信号传导中的作用,可以合理地假设这些脂质具有宿主特异性作用。作为真核细胞膜的一个小组成部分,肌醇信号对许多与细菌传感相关的重要生物信号通路有很大影响,包括 GPCR 信号。
糖脂是一种细菌糖脂,其中脂肪酸与糖骨架共价连接,以几何定义的方式定位酰基链。这些结构可以存在于膜双层中,并且在革兰氏阴性细菌中普遍存在,最典型的是 LPS(脂多糖)。
▼ 合成脂多糖 A 部分的生物合成机制可变
糖脂不是由真核生物产生的,因此被先天免疫系统识别为 MAMP(微生物相关分子模式)。在经典观点中,细菌 LPS 激活宿主细胞上的 PRR TLR4 以启动促炎反应。然而,激活取决于脂质 A 组分的酰基链结构,最近的研究表明,与深入研究的大肠杆菌LPS 相比,不同细菌的脂质 A 结构发生了变化。这种多样性源于用于合成脂多糖 A 部分的可变生物合成机制,并影响宿主感知代谢物的方式。
从拟杆菌属的微生物组菌株中分离出的 LPS可以通过 TLR2 和 TLR4 发出信号,并且由于其改变的脂质 A 酰基链而不会刺激有效的炎症反应。
普氏菌属和拟杆菌属 LPS 的免疫抑制也有报道。这些结构差异会影响生命早期的全身免疫启动、免疫发育和训练有素的免疫力。
▼ 糖脂(包括 LPS),通过CLR 发出信号
糖脂,包括 LPS,也可以通过哺乳动物细胞上的 C型凝集素受体发出信号。凝集素受体信号传导在调节肠道屏障功能和启动抗真菌或抗细菌免疫方面具有重要作用。通过许多 CLR 的信号也调节炎性体,介导 IL-1 家族细胞因子和警报素的释放。
注:CLR是免疫系统中重要的信号传导分子。
目前除 LPS 类似物外,没有证据表明微生物组中存在糖脂。有必要对来自微生物组菌株的不同 LPS 进行进一步的结构分析,并详细了解脂质糖对 C 型凝集素的参与。
想象鞘脂是细胞膜的“保护墙”,它可以由原核生物和真核生物从头合成。在真核生物中,膜鞘脂的存在无处不在,而只有少数细菌类群具有制造它们的酶促能力。
▼ 拟杆菌可从头合成鞘脂,缺乏鞘脂可能导致生长缺陷
拟杆菌在用spt酶催化的关键步骤从头合成鞘脂方面具有独特的能力,CerPI 是拟杆菌中最丰富的鞘脂之一,在赋予肠道细菌适应性方面具有重要作用。缺乏鞘脂的拟杆菌属虽然有活力,但表现出生长缺陷、膜结构改变和对氧化应激的易感性增加。
▼ 拟杆菌产生的α-GC,对免疫系统很重要
拟杆菌还能够产生一种类似于来自鞘氨醇单胞菌的 alpha-GC 的脂质,这对宿主的免疫系统可能具有重要作用,抗炎并减少结肠 NKT 细胞的数量。
鉴于 CD1d 限制性脂质特异性免疫细胞在各种炎症性疾病中的重要性,α-GC 是否是唯一能够与 CD1d 受体结合的鞘脂是一个需要解决的关键问题。
▼ 微生物群鞘脂影响宿主炎症和代谢途径
当无菌小鼠被鞘脂缺陷细菌定植时,导致肠道炎症和宿主神经酰胺库发生变化,提供了微生物群鞘脂影响宿主炎症和代谢途径的进一步证据。 拟杆菌外膜中鞘脂的存在有利于耐受性免疫反应。
OMV 中的鞘脂可作为巨噬细胞中 TLR2 信号的激动剂,并且在限制炎症信号方面很重要。
注:OMV 细菌细胞外膜的囊泡
在人类中,来自宿主的粪便鞘脂是炎症性肠病患者中最显着增加的代谢物类别,而微生物组鞘脂则显着减少。
微生物组鞘脂不仅发挥局部作用,而且通过运输到肠外器官和改变宿主鞘脂信号传导而发挥全身作用。
疾病关联、共同进化联系以及宿主和微生物鞘脂之间的直接生化串扰的结合,使其成为未来研究的一个值得探索的领域。
磺酸脂在结构上与磷酸化鞘脂(本质上是磷酸神经酰胺的硫类似物)相关,并且通常在拟杆菌门的成员中发现,例如Alistipes、Odoribacter、Flavobacterium、Chryseobacterium。
▼ 磺基脂类的生物合成
已知磺基脂类以类似于拟杆菌鞘脂类的方式进行生物合成,但最近的一项研究发现了它们合成的第一个酶促步骤:半胱氨酸酰基-酰基载体蛋白转移酶sulA。人们对它们的功能知之甚少。在Flavobacteria物种中,磺酸脂使细菌能够进行滑行运动。
已表征的主要磺脂是磺胺杆菌素,它与宿主唯一已知的相互作用是与 von Willebrand 因子受体结合。
▼ 磺脂对巨噬细胞和树突细胞有促炎作用
还有证据表明磺基杆菌素是一种与 MD-2 结合的 TLR4 激动剂,它与 TLR4 信号传导物理相关并增强 TLR4 信号传导,且来自金黄杆菌的磺脂对小鼠巨噬细胞具有强烈的促炎作用。具有聚糖头基的磺脂在人树突细胞中具有促炎作用。
▼ 产磺脂类的常见菌群——Alistipes
小鼠的膳食摄入对Alistipes的磺基脂类合成有很强的影响,高脂肪饮食喂养的小鼠显示出肠道硫杆菌素的丰度显着增加。
在人类中,Alistipes是已知可产生磺脂的最常见的人类肠道微生物组物种,并且在 IBD 患者的粪便中显着减少。
心磷脂和缩醛磷脂是脂质类别的其他例子,它们可以在相关途径中由原核生物和真核生物从头合成,再次表明趋同进化。
▼ 心磷脂的结构和功能
心磷脂是由甘油桥接的两个磷脂酰基组成的脂质二聚体。宿主心磷脂是仅在线粒体内膜中发现的标志性脂质,从进化的角度来看很有趣,因为它们被假设为细菌和真核生物的内共生融合体。
作为线粒体许多生理作用的关键脂质,例如高能 ATP 产生和线粒体蛋白质功能,心磷脂失调与许多疾病有关,包括衰老、代谢综合征、心力衰竭和癌症。
▼ 心磷脂调节免疫,稳定细胞膜
宿主心磷脂还可以调节免疫和细胞死亡途径,因为暴露于免疫系统会激活 NLRP3 炎性体和半胱天冬酶,并结合 CD1 分子呈递给 NKT 细胞,可能作为一种检测线粒体损伤的方法。
在细菌中,心磷脂似乎在稳定细胞膜方面发挥作用,因为心磷脂合酶的缺乏使细菌更容易受到渗透压的影响,并且它会积聚在细菌膜的两极。
▼ 细菌心磷脂信号
哪些微生物菌株含有心磷脂通常是未知的,有报道称它们在链球菌和大肠杆菌中富集。
人们对宿主免疫中的细菌心磷脂信号知之甚少。一项检查微生物组中 LPS 信号传导拮抗剂的研究发现,心磷脂是能够减少 LPS 与 TLR4 信号通路中 CD14 和 MD-2 结合的主要代谢物。
另一项研究发现了一种来自鲍曼不动杆菌(Acinetobacter baumannii)的脂质分子,该分子被认为是一种心磷脂,可通过 TLR2 介导的途径在哺乳动物细胞中诱导炎症和细胞死亡。
未来研究评估来自微生物组的心磷脂如何调节、改变或模拟宿主心磷脂通路将很重要。
▼ 缩醛磷脂:保护细胞免受氧化应激
缩醛磷脂是含有乙烯基醚键而不是酯键的甘油磷脂。缩醛磷脂具有许多重要功能,包括保护细胞免受氧化应激,并且在神经元和心血管细胞膜中的浓度最高。
▼ 缩醛磷脂:与神经系统疾病和炎症相关
虽然它们在人类中的全部功能尚不清楚,但缩醛磷脂合成和丰度的缺陷是许多神经系统疾病的基础,包括阿尔茨海默氏症。
缩醛磷脂也是活性氧的重要介质,因此被认为在引发或解决慢性炎症中发挥作用。
▼ 梭状芽孢杆菌:缩醛磷脂的生物合成酶
来自肠道微生物组的一部分细菌能够合成缩醛磷脂。最近,在梭状芽孢杆菌中发现了负责缩醛磷脂合成的酶,这些生物合成酶的同系物映射到许多不同的肠道微生物组物种。
膳食脂质的摄入对人类生命至关重要。从出生到幼年,人类的饮食由母乳组成,基于热量含量,母乳由约 55% 的脂质组成。
母乳甘油三酯中的脂质种类及其饱和度是影响婴儿健康发育的重要变量。
根据美国的最新数据,年龄较大的儿童和成人的饮食通常含有较少的脂肪热量,平均下降至 32%。
▼ 膳食脂质的来源
大多数脂质能够由真核细胞自身合成,因此提供了除饮食之外的第二来源。例外情况是 omega-3 和 omega-6 脂肪酸,哺乳动物不编码从头合成所需的酶,它们的前体必须来自饮食。
▼膳食脂质的健康益处
一般来说,膳食脂质为身体器官和细胞提供许多健康益处,例如,在细胞再生、蛋白质信号、能量平衡、膜稳定性和代谢途径的稳态维持方面。
▼ 肠道菌群类似肝脏,可以分解脂质
肠道菌群遇到摄入的所有膳食脂质,因此,肠道菌群中的酶就像第二个肝脏一样分解、转化和解毒膳食成分,这可能对宿主健康产生有益和有害的影响。由于肝酶具有分解膳食和外源性脂质的功能,因此微生物组酶在肠道中起着类似的作用。
微生物组酶对膳食脂质的生物转化
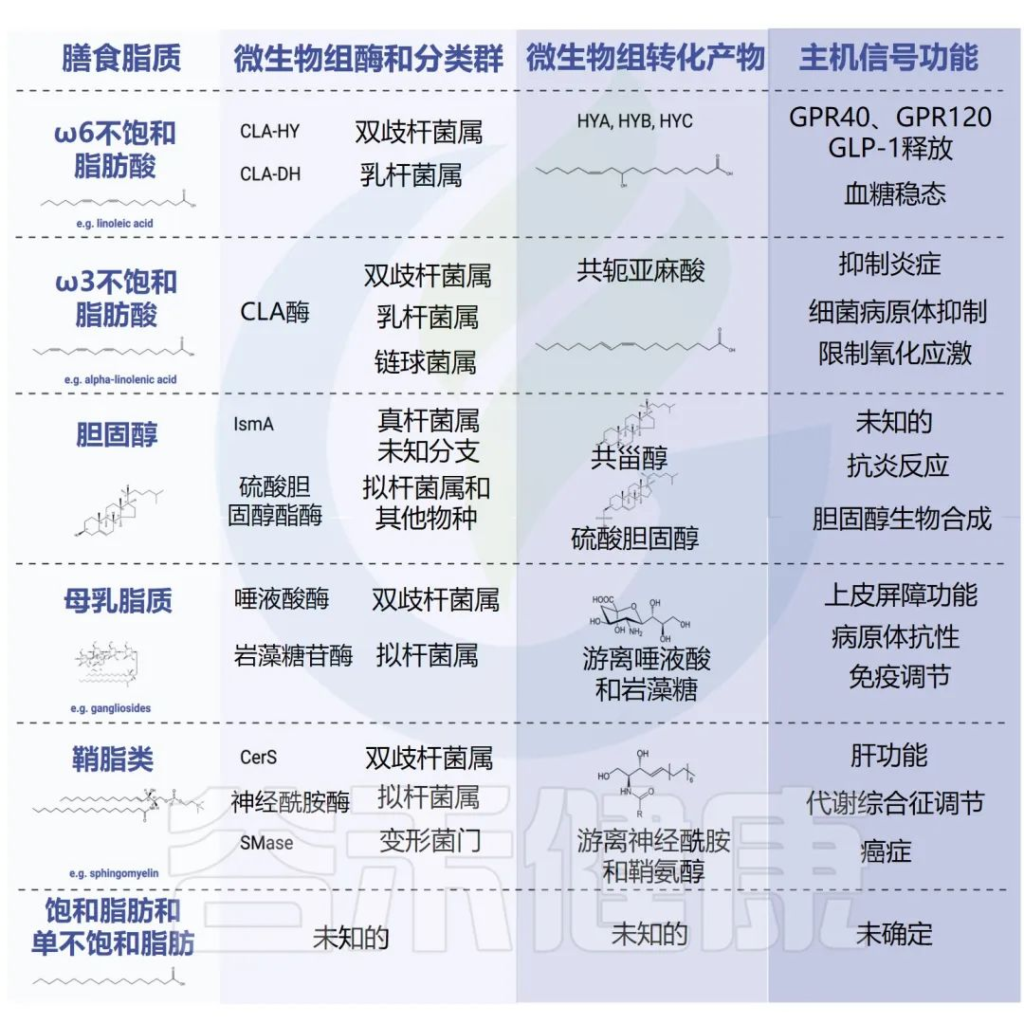
doi: 10.1016/j.chom.2023.01.009
注:由于我们的饮食中含有各种各样的脂质,因此上表并不代表所有生理上重要的膳食脂质清单。✔
从很小的时候起,人类就通过母乳接触饮食中的外源性鞘脂,随后食用乳制品、肉类、蛋和许多植物性食物。
摄入的常见类型的鞘脂包括神经酰胺、鞘磷脂、脑苷脂和神经节苷脂。
▼ 鞘脂的功能:尤其是大脑和神经生长很重要
鞘脂在整个胃肠道中被水解和吸收,它们在调节细胞生长、分化、免疫和新陈代谢方面起着重要作用。
鞘脂对大脑功能和神经生长很重要,神经节苷脂在脑细胞信号传导中起着重要作用,仅存在于动物脂肪中,因为植物缺乏合成这些脂质的酶。
▼ 拟杆菌:合成和转化鞘脂
在微生物组中,拟杆菌菌株不仅合成鞘脂,还通过从饮食中摄取简单的类鞘脂来生物转化膳食鞘脂。
它们还拥有许多聚糖降解酶,可以分解摄入的神经节苷脂。
这些包括唾液酸酶,它可以分解含唾液酸的代谢物(例如,神经节苷脂)并释放有助于免疫和预防感染的游离唾液酸。
神奇的是,不编码鞘脂合成所必需的酶的双歧杆菌菌株可以导入并利用鞘脂来产生 DHCer。
生命早期的宏基因组队列研究表明,双歧杆菌还编码预测分解复杂鞘脂的酶。目前的研究还很有限,但可以推测微生物组的酶活性与循环的鞘脂种类之间存在直接联系。
在肠道的局部水平上,增加复合鞘脂的摄入已被证明可以改善屏障功能并减少细菌毒素的伤害,这一过程可能受微生物组合成的酶功能影响的过程。
膳食鞘脂加工对哺乳动物生物学的影响才刚刚开始被发现。这些相互作用在富含鞘脂的母乳中尤为重要。鞘脂生物合成途径通常在早期微生物组中上调,这种上调是健康的预测指标。
拟杆菌和双歧杆菌是非常丰富的生命早期微生物组菌株,它们影响鞘脂代谢的能力可能会影响人类发育。
根据婴儿发育量表的评估,最近的一项研究发现婴儿肠道中肠道拟杆菌的存在与神经发育增强之间存在密切联系。随着肠道微生物群-脑轴正成为一个更被接受的范例,应进一步探索膳食和肠道来源的鞘脂在大脑发育中的作用。
胆固醇是真核细胞中类固醇激素和细胞膜的重要组成部分,哺乳动物无需膳食胆固醇即可合成胆固醇。这些甾醇脂质的信号传导和调节可以影响许多对人类健康和疾病很重要的免疫和代谢途径。
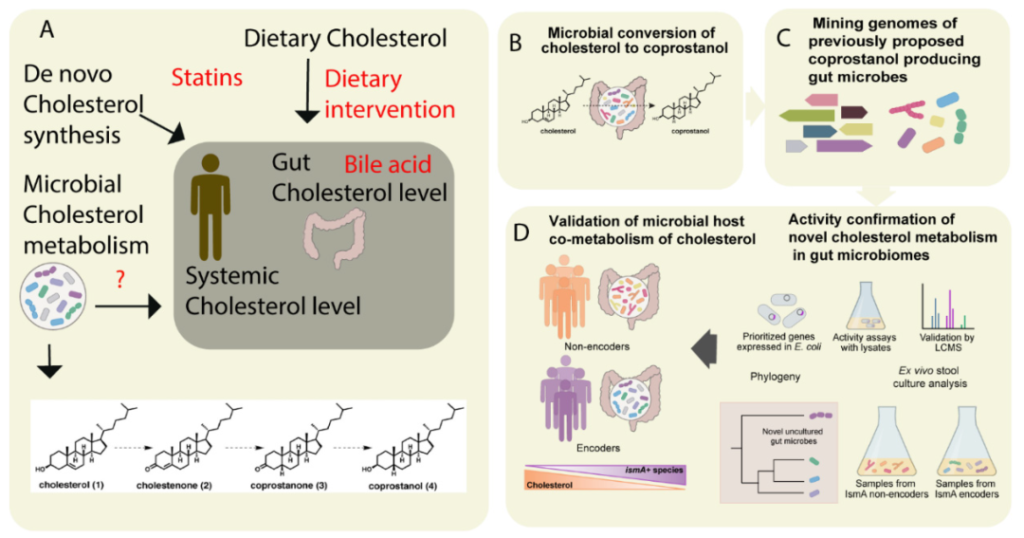
▼ 肠道微生物群胆固醇影响循环胆固醇
循环胆固醇被用作人类健康的重要生物标志物,可在肠道中吸收的游离胆固醇的量会影响循环中的胆固醇水平。
大约 100 年前提出了肠道微生物组胆固醇代谢影响血清胆固醇水平的观点,然而,直到最近的一份报告明确证实人类微生物组中的这种现象之前,研究这种联系的研究相对较少。
肠道微生物对胆固醇的代谢影响肠道和循环中的胆固醇浓度
doi.org/10.3390/metabo11010055
血液中的胆固醇水平可能会受到肝脏中合成的新胆固醇的影响,也可能来自于饮食等外源性来源。内源性胆固醇水平也可能受到他汀类药物或胆汁酸代谢改变的影响。肠道微生物对胆固醇的代谢也可作为维持胆固醇稳态的检查点。
▼ 厚壁菌中的微生物酶影响血清胆固醇
这项研究在以前未培养的肠道微生物群的厚壁菌门物种中发现了微生物酶 IsmA,该酶催化胆固醇转化为胆甾烯酮,并最终转化为粪前列腺素。
此外,这种酶在人体中的活性和存在会影响他们的总血清胆固醇水平。
这种酶的影响具有临床相关性,因为它影响血清胆固醇浓度的比值比相当于依折麦布( FDA 批准的肠道胆固醇转运蛋白小分子抑制剂,是经临床验证的降低血液胆固醇的方法)。这些表明肠道微生物调节胆固醇具有很大的潜力。
注:依折麦布是第一个,也是唯一个胆固醇吸收抑制剂,通过选择性抑制小肠胆固醇转运蛋白,有效减少肠道内胆固醇吸收,降低血浆胆固醇水平以及肝脏胆固醇储量。
▼ 拟杆菌磺化胆固醇
最近表明,肠道微生物组菌株对膳食胆固醇的生物转化比之前认为的更为普遍。
许多共生微生物,包括拟杆菌属,都能够磺化胆固醇。含有磺基转移酶的拟杆菌属基因簇会影响小鼠的血清胆固醇水平,为膳食胆固醇被吸收到循环中的能力增加了另一个变量。
该基因簇还可以硫酸化类固醇激素,如维生素 D3 类似物、异异石胆酸、粪前列腺素和其他膳食甾醇,如 ß-谷甾醇。
▼ 不同人群肠道菌群不同,代谢胆固醇的微生物酶分布不均
在 IBD 和肠道炎症中,基因簇显着减少,考虑到最近归因于 T 细胞中固醇信号的免疫功能,这很有意思。
代谢胆固醇的微生物酶在人群中分布不均;因此,受试者的肠道基因组可以解释胆固醇、胆固醇衍生物和血脂组的一些变异性。
▼ 未来研究:可能发现更多胆固醇衍生物由微生物群合成
尽管次级胆汁酸等硫酸化甾醇衍生物与健康衰老有关,来自微生物组的粪便甾烷醇和硫酸化胆固醇代谢物的生物学功能尚未完全阐明,关于其途径的未来研究充满无限想象。
由于有数百种可能的修饰可以添加到甾醇骨架中,因此可以想象许多其他胆固醇衍生物能够由微生物组通过膳食胆固醇合成。
循环甘油三酯结合高密度脂蛋白和低密度脂蛋白水平通常用作代谢健康的指标。然而循环胆固醇在多大程度上直接影响心血管疾病的发展是有争议的,未来的研究有必要评估治疗干预中的这些途径,可能作为联合疗法。
人类能够合成除亚油酸和α-亚麻酸以外的所有必需脂肪酸,这必须来自饮食。它们分别是 omega-6 和 omega-3 多不饱和脂肪酸 (PUFA) 的前体。
▼ Omega-3 和 omega-6与炎症
omega-6 和 omega-3 多不饱和脂肪酸的下游代谢产物对膜成分至关重要,对调节炎症也很重要。
Omega-3脂肪酸具有抗炎作用,而 omega-6 脂肪酸具有促炎作用。然而,每一种都可以很容易地被氧化,并通过脂质过氧化作用导致一般的氧化应激。
▼omega-6:omega-3 比例高与代谢综合征相关
血液中的 omega-6:omega-3 比例是心血管健康的重要标志,高 omega-6 读数可能是代谢综合征的征兆。
摄入 Omega-6 脂肪酸会增加胰岛素抵抗,这是代谢综合征的常见机制。
有证据支持维持 omega-6:omega-3 脂肪酸摄入量的平衡比例对于预防代谢综合征、心血管疾病和癌症的重要性。西方饮食中 omega-3 和 omega-6 脂肪酸的摄入不平衡,omega-6 脂肪酸含量是古代不含加工食品的饮食的 10 倍多。
人类脂肪组织和母乳中的亚油酸含量在过去 100 年中一直在稳步增加,这会对儿童发育产生负面影响。
▼ 肠道微生物组的酶对脂质生物转化
来自肠道微生物组的酶可以在这些脂质进入宿主代谢途径之前对其进行生物转化,从而调节它们对宿主-脂质代谢的影响。
双歧杆菌和乳杆菌含有 CLA-HY,这是一种将亚油酸转化为共轭亚油酸的酶,然后转化为可结合 GPR40 和 GPR120 的分子,从而产生抗炎信号并限制亚油酸转化为下游产物的量。
CLA 酶在人类微生物组中很常见,可能导致对代谢综合征和肥胖的易感性发生变化。
膳食多不饱和脂肪酸也可以被常见的肠道微生物酶饱和,从而限制双键的数量和氧化潜力。
▼ 肠道 omega-6高,促进炎症细菌生长
功能不同的微生物群可改变饮食中的多不饱和脂肪酸的炎症潜力。
一项研究发现,肠道中高浓度的 omega-6 可以杀死通常与健康相关的细菌,并促进与炎症性疾病相关的细菌(例如变形杆菌)的生长。
▼ 肠道菌群影响多不饱和脂肪酸代谢物水平
此外,常见的多不饱和脂肪酸代谢物在 IBD 患者的肠道微生物组中存在显着差异,从超高加工食品中摄取它们会增加 IBD 风险。
另一项研究发现,大豆油中亚油酸摄入量的增加会改变肝脏鞘脂代谢物的平衡,肠道微生物组的存在会影响肝脏鞘脂的变化及其饱和度水平。
▼ 多摄入omega-3可以抗炎
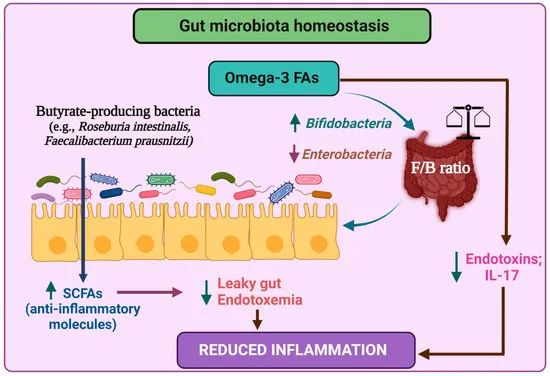
大量证据表明,在饮食中摄入更多的 omega-3 脂肪酸可以起到消炎和抗炎作用。随机、双盲研究表明,摄入鱼油和富含 omega-3 的食物可以改善关节炎等炎症性疾病患者的全身炎症。
膳食中的 omega-3 脂肪酸可以改变人类和小鼠体内的微生物组组成,这已被证明对宿主具有积极的抗炎作用。
Omega-3 脂肪酸及其与肠道菌群的相互作用
doi.org/10.3390/nu14091723
▼omega-3益处:通过肠道菌群产生共轭脂肪酸
omega-3多不饱和脂肪酸可能有益地影响宿主代谢的一种可能机制是,通过肠道微生物组产生共轭脂肪酸。据报道,α-亚麻酸的共轭异构体具有抗炎、抗癌和抗肥胖的特性。
体外研究表明,双歧杆菌、乳杆菌和丙酸杆菌菌株能够将 omega-3 脂肪酸、α-亚麻酸生物转化为共轭亚麻酸异构体。
此外,与无菌小鼠相比,常规小鼠结肠内容物中的共轭亚油酸异构体和非共轭代谢物有所增加,表明肠道微生物组有助于体内omega-3 脂肪酸代谢。
用源自肠道微生物组的 α-亚麻酸代谢物短期喂养小鼠会影响肠道免疫稳态。需要做更多的工作来确认肠道微生物组对这些代谢物的贡献及其对人类的有益作用。
最终,多不饱和脂肪酸的摄取和代谢不仅取决于饮食摄入,还取决于肠道中存在的微生物。肠道微生物组酶对膳食多不饱和脂肪酸的调节可能是易患炎症性疾病、代谢综合征和心血管疾病的重要因素。
▼酰基链饱和水平对脂肪的生化特性影响重要
哺乳动物消耗的植物和动物脂肪中的甘油三酯和磷脂通常根据酰基链的饱和水平进行分类,因为酰基链的饱和水平赋予脂肪重要的生化特性,比如氧化还原电位和进入炎症通路的能力。
▼ 饱和脂肪酸不一定有害
饱和脂肪酸,例如硬脂酸和棕榈酸(分别具有 18 个和 16 个碳骨架),在哺乳动物饮食中含量最丰富。尽管它们曾被认为是有害的并会导致心血管疾病,但有关饱和脂肪酸的最新数据并不支持这一观点。
摄入最多的单不饱和脂肪酸是 omega-9 脂肪酸,油酸,通常被认为是中性的或对人体健康有益。对能够生物转化或代谢饱和或单不饱和脂肪的肠道微生物菌株或酶的研究是有限的。一项研究表明,硬脂酸和油酸可以在体外选择性地改变某些细菌菌株的生长。
▼ 脂肪酸的饱和水平影响细胞功能和体内平衡
使用受控饮食的小鼠研究表明,膳食脂肪酸含量的饱和水平会对线粒体功能、肠道通透性、肠道运动和肠道微生物组组成产生重大影响,大豆油中的氧化脂多不饱和脂肪酸会导致肥胖增加。
细胞膜和线粒体中脂肪酸的饱和水平会影响细胞功能和体内平衡。
鉴于这些影响,了解肠道微生物菌株对膳食饱和和单不饱和脂肪酸以及与宿主途径相互作用的全面影响将很重要,因为它们在对饮食和炎症触发的个性化反应中发挥作用。
宿主微生物脂质代谢和炎症
慢性炎症是困扰全世界的众多疾病的基础,包括代谢综合征和自身免疫。与数十万年人类历史消耗的脂质相比,人类消耗的脂质的数量、平衡和类型在过去 50-100 年发生了巨大变化。
由于我们的基因适应这种快速变化的速度很慢,因此更加依赖共生微生物来进化以适应饮食变化。
▼微生物合成的脂质可以成为免疫的有效刺激物
人们普遍认为,膳食脂肪的数量和类型的改变会导致全身炎症增加。作为进一步的结果,由哺乳动物微生物组直接合成的脂质可以成为粘膜和全身免疫的有效刺激物,并且这种炎症的引发可以反馈改变脂质吸收和代谢。
绝大多数脂质在小肠中被吸收,小肠是肠道的一个区域,微生物衍生的脂质与免疫系统直接接触。
在肠上皮细胞中,消耗能量用于免疫与新陈代谢之间存在权衡,适应性 IgA 反应可防止微生物衍生的脂质过度刺激先天免疫系统,从而抑制脂质吸收。
▼脂质吸收促进微生物组介导的肠道炎症
脂质吸收还可以通过上皮细胞中促炎性膳食脂质的积累来促进微生物组介导的肠道炎症,这一过程由清道夫受体 CD36 促进并由 T 细胞信号传导调节。
在 T 细胞中,脂质谱和代谢维持调节细胞和表达 Th17 程序的倾向。来自微生物组的甾醇衍生物已被证明可以直接影响这些途径,影响在肠道炎症中被破坏的 T 细胞平衡。
最后,生命早期接触膳食和微生物衍生的脂质对于哺乳动物免疫系统的启动、训练和发育至关重要,并对以后的疾病易感性产生重要的影响。
总体而言:以下三方面之间的相互作用解释了脂质代谢变化引起的慢性炎症易感性的主要变化:
人类膳食脂质代谢的变化影响代谢综合征和自身免疫发展的风险
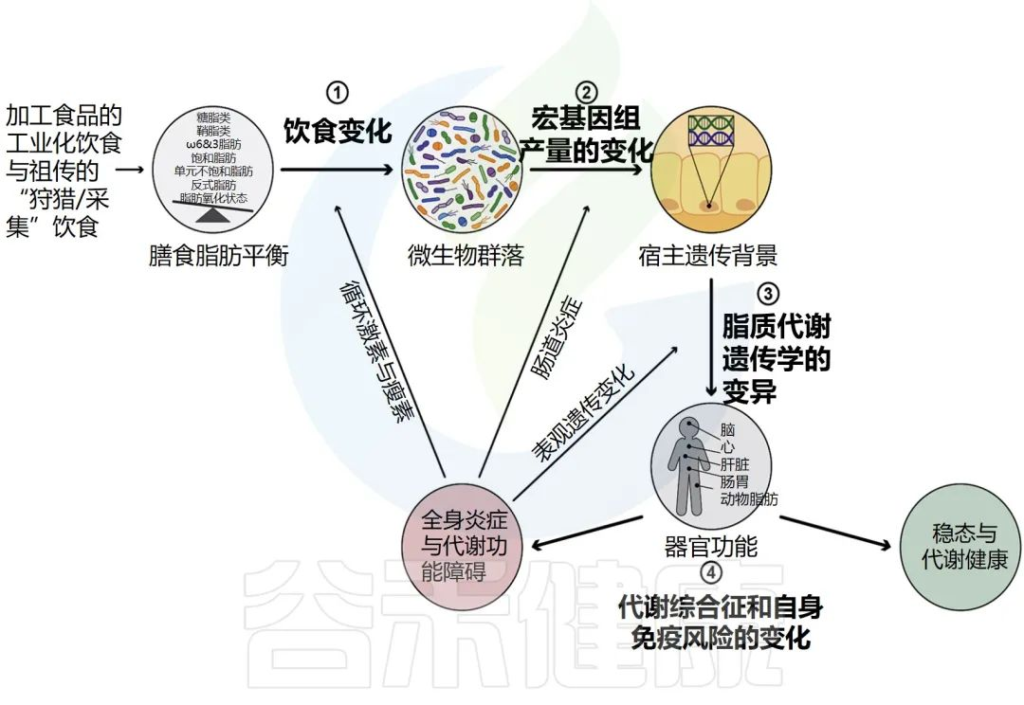
Brown et al., Cell Host Microbe.2023.
在上面三个变量中,微生物组酶产生的脂质产物及其对全身炎症和循环脂质信号传导的影响的特征最少。许多研究将基因和遗传多态性与人类的特定疾病和循环脂质谱联系起来;然而,人们对驱动临床结果的个体之间微生物组酶功能的变化知之甚少。
目前我们开始了解到,微生物来源的脂质及其对脂质代谢的影响在宿主许多器官的生物学功能中具有系统性作用。对健康人血清的深度代谢组学分析发现了数千种未知的细菌来源代谢物,其中许多被预测为脂质。
▼ 肠道菌群脂质代谢促炎或抗炎
随着时间的推移,这些脂质组谱中的每一个对于个体来说都是独一无二的,并且变化可以引发或解决炎症。例如,亚油酸和花生四烯酸代谢的副产物(类花生酸和消炎素)可能对哺乳动物炎症的发生或消退产生深远影响,而肠道中的微生物组酶可以控制它们的循环。
脂肪酸去饱和酶基因FADS1和FADS2的多态性,与许多炎性疾病的风险增加有关,也控制了循环类花生酸水平。
因此,必须考虑微生物组和宿主遗传学的结合,以应对由脂质代谢失调引起的炎症风险。在许多情况下,在 IBD 或风湿病等慢性炎症性疾病的发生过程中,环境因素的影响超过了宿主遗传易感性。
▼微生物组的脂质代谢响大脑中的慢性炎症
除了在肠道内,微生物组的脂质代谢可能会影响大脑中的慢性炎症,可能导致许多神经退行性疾病。大脑主要由脂质组成,微生物组脂质代谢是否影响脑脂质化学尚不清楚。将帕金森病等神经系统疾病视为始于肠道的疾病是该领域的一个想法。
大脑富含鞘脂和缩醛磷脂,已知这两种物质都是由微生物在肠道中产生的。NKT 细胞通过响应脂质抗原环境在维持大脑免疫耐受方面发挥重要作用。无菌小鼠表现出许多神经学特征,包括较低的焦虑和行为改变,其中许多可以在不同微生物的肠道定植后被诱导。未来的研究应该系统地评估哪些微生物来源的脂质影响肠脑轴。
肠道微生物组在脂质代谢(消耗和生成)中的作用正在成为人类健康和疾病的主要决定因素。未来的努力应该扩大我们在将各种脂质与生物功能联系起来方面取得的适度进展,并将我们的理解应用于人类疾病。
影响健康的微生物组酶可以被抑制或引入,具体取决于环境,并且可以使用代谢组学和遗传分析筛选受试者,以将代谢特征与个体微生物组分布联系起来。
我们可以使用这些数据对预防、诊断和治疗进行更明确的分析。一般地说,我们应该了解在我们体内循环的许多脂质都是微生物来源的知识,这些努力需要几个方面的努力。
➧ 首先是微生物组代谢物的大规模注释
➧ 其次是计算和机器学习提供脂质鉴定方法
计算和机器学习方法可以提供一种更具可扩展性的脂质鉴定方法,该方法可以从推定的理论结构中更好地预测脂质的功能和结构等。
➧ 最后将脂质与微生物和宿主-微生物相互作用联系起来
需要一个更完整的脂质组学目录,该目录来自与健康和疾病相关的组织相关微生物。此外,介导脂质代谢的微生物酶的遗传操作也很重要。
为了扩展对微生物组脂质与宿主相互作用的了解,优先对那些在对人类健康更重要的菌群进行基因敲除更适用,例如Akkermansia、双歧杆菌、毛螺菌科和梭菌目菌株。
总之,肠道微生物群及其衍生的脂质和宿主脂质代谢之间存在复杂的串扰。需考虑特定食物和营养素组合在塑造微生物特征方面的作用,饮食、肠道菌群结构和脂质代谢之间的关系需要在大量人群中进行研究,以制定治疗策略。鉴于肠道菌群组成的个体差异,这些策略很可能需要患者分层和个体化治疗。
主要参考文献:
Brown EM, Clardy J, Xavier RJ. Gut microbiome lipid metabolism and its impact on host physiology. Cell Host Microbe. 2023 Feb 8;31(2):173-186. doi: 10.1016/j.chom.2023.01.009. PMID: 36758518.
Yoon H, Shaw JL, Haigis MC, Greka A. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Mol Cell. 2021 Sep 16;81(18):3708-3730. doi: 10.1016/j.molcel.2021.08.027. PMID: 34547235; PMCID: PMC8620413.
Schoeler M, Caesar R. Dietary lipids, gut microbiota and lipid metabolism. Rev Endocr Metab Disord. 2019 Dec;20(4):461-472. doi: 10.1007/s11154-019-09512-0. PMID: 31707624; PMCID: PMC6938793.
Lamichhane S, Sen P, Alves MA, Ribeiro HC, Raunioniemi P, Hyötyläinen T, Orešič M. Linking Gut Microbiome and Lipid Metabolism: Moving beyond Associations. Metabolites. 2021 Jan 15;11(1):55. doi: 10.3390/metabo11010055. PMID: 33467644; PMCID: PMC7830997.
Ma J, Zheng Y, Tang W, Yan W, Nie H, Fang J, Liu G. Dietary polyphenols in lipid metabolism: A role of gut microbiome. Anim Nutr. 2020 Dec;6(4):404-409. doi: 10.1016/j.aninu.2020.08.002. Epub 2020 Oct 9. PMID: 33364456; PMCID: PMC7750795.

谷禾健康

在过去的几十年里,肥胖患病率的持续快速增长。成为了许多国家的主要医疗保健问题,尤其是在2019年新冠状病毒时代以来。
肥胖是包括心血管疾病在内的一系列疾病不断扩大的风险因素。2型糖尿病、慢性肾病、非酒精性脂肪肝病, 负重过大导致的关节炎,甚至许多癌症都与肥胖有关。
▸ 肥胖的定义
肥胖定义为身体脂肪过度积累到可能对健康产生不利影响的程度。
一般使用体重指数(BMI;体重(千克)除以身高(米)的平方)进行评估。
我国规定的BMI正常范围在18.5-23.9之间,24-27.9为超重,超过28则为肥胖。
肥胖不是单纯的体重增加,而是体内脂肪组织积蓄过剩的状态。肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。
主要原因是由于能量摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
▸ 引起肥胖的因素
肥胖是一个多因素问题,不仅限于饮食或缺乏运动的原因,还包括遗传、环境和心理社会因素,这些因素通过能量摄入和消耗的生理介质起作用。
肠道微生物组是这些环境因素之一;大约 20年前,在小鼠研究中已经确定了脂肪储存和肠道微生物组之间的联系。粪便微生物群移植研究提供了更切实的证据。
本文结合了最新的学术研究和谷禾健康数据库,涵盖了不同的角度,既关注单个细菌的作用,也特别强调整个微生物组的组成,以试图解开肠道微生物组与肥胖的关系。
让人们更好地了解肥胖以及其发病机制,在此基础上提出一些预防和治疗肥胖的建议,使人们拥有更健康的生活。
本文主要从以下几个方面讲述
●肠道微生物对肥胖发病机制的影响
●菌群代谢物对肥胖的影响
●健康与肥胖人群中的细菌比例
●肥胖与肠道微生物的研究分类
●微生物多样性与人体健康有关
●肥胖与肠道微生物的未来研究方向
●预防和治疗肥胖的一些建议
学术专业用词缩写
PRR—模式识别受体
NOD2—核苷酸结合寡聚化结构域2
FXR—法尼醇X受体
TLR5—TOLL样受体5重组蛋白CDI—复发性艰难梭菌感染
BSH—胆盐水解酶
GLP1—胰高血糖素样肽-1
GPR—G蛋白偶联受体
01
肠道微生物对肥胖发病机制的影响
研究肥胖的发病机制,有助于我们更好地了解肥胖,并以此制定相应的治疗方案。实验研究发现肠道微生物对肥胖的发病机制存在一定的影响。
许多研究已经确定了肠道微生物群与宿主免疫系统之间的关联。其中一个发现是肥胖与肠道微生物引起的慢性低度炎症有关。
肠道微生物群和肠道细胞之间的密切接触是由微生物相关分子模式介导的,这些分子模式可以与上皮细胞和免疫细胞中的模式识别受体 (PRR) 结合。
这些识别受体属于先天免疫系统,控制炎症和免疫反应。PRR还可以检测宿主细胞释放的损伤相关分子模式。
✦革兰氏阴性菌中的脂多糖易引起炎症
脂多糖 (LPS)是革兰氏阴性菌外膜的一种特有成分,由脂质和多糖构成,似乎会引起小鼠的低度炎症。
在这里列举了一些常见的革兰氏阴性菌:
大肠杆菌、变形杆菌、痢疾杆菌
肺炎杆菌、布氏杆菌
需要注意的是,大部分革兰氏阴性菌对人体都有害
在一项人体研究中进行了类似的观察,其中能量摄入与内毒素血症和伴随的炎症有关。
事实上,与健康对照组相比,在患有2型糖尿病的受试者中,革兰氏阴性菌的数量明显更多。
脂多糖通过脂多糖分化受体14(CD14)和辅助受体 toll样受体 (TLR4)引起炎症,这反过来又导致脂肪细胞产生的促炎细胞因子增加。
●饮食在脂多糖中起重要作用
果胶可抑制脂多糖诱导的单核细胞或树突状细胞中的TLR4活化,而果糖或高脂肪饮食导致含有脂多糖的变形菌增加,瘦素信号与饱腹感和能量平衡紊乱有关,因此失调。
在此列举了一些高果糖高脂食物:
1.蜂蜜和市面上一些甜的饮料果糖含量较高;
2.淀粉类:经油炸加工的馅饼、油条、葱油饼、油糕等食物中,含有大量脂肪与糖分;
2、肉类:用糖汁、糖煎、糖烧的方法进行烹调的红烧肉、炸鸡等,也为高糖高脂食物;
3、奶油制品食物:如奶油蛋糕、奶茶、泡芙等甜品,主要原材料为淀粉与黄油等物质,所以也有较高的糖分与脂肪。
同时还表明,分泌型脂蛋白脂肪酶(LPL)抑制剂血管生成素样蛋白4(一种禁食诱导的脂肪因子)可被微生物群抑制,进而导致分泌型脂蛋白脂肪酶活性增加和白色脂肪组织中的脂肪储存。
✦肽聚糖影响体内平衡
另一个例子是肽聚糖,它是细菌细胞壁的一种成分,对人体内平衡很重要。
核苷酸结合寡聚化结构域2 (NOD2) 是肽聚糖的产物,是一种位于上皮细胞和免疫细胞内的胞质 ,能够感知胞壁酰二肽。
这种胞质对于病原体入侵和几种炎症性疾病期间的免疫反应至关重要,从而调节粘膜细菌定植。
// 一些关于NOD2的研究案例
NOD2缺乏的小鼠在高脂饮食期间显示出脂肪组织、肝脏炎症和胰岛素抵抗增加。因此经常用于糖尿病研究。
在具有功能性NOD2受体的肥胖小鼠中,胞壁酰二肽识别显示可减少脂肪炎症和胰岛素抵抗,而不会减轻体重或改变肠道微生物群组成。
上述案例在一定程度上可以说明NOD2对于减轻肥胖和肠道微生物群稳定具有一定作用。
✦Toll样蛋白受体影响免疫
——Toll样受体5(TLR5)重组蛋白是免疫系统的关键成分,还是单体鞭毛蛋白的传感器,可以检测细菌感染并启动宿主抗菌的防卫反应。
肠道微生物群也通过位于上皮细胞上的TLR5与免疫系统相关联。
免疫系统通过TLR5感知肠道微生物群的组成和肠道微生物群的定位,以避免共生肠道微生物群传播到肠外器官、产毒成员的过度生长以及机会性病原体的过度生长和入侵。TLR5检测鞭毛蛋白会导致白细胞介素-22的产生,从而预防与肠道炎症相关的疾病。
// 关于TLR5影响免疫在小鼠中的研究
与野生型无菌小鼠相比,TLR5缺陷小鼠的胰岛素抵抗和肥胖水平增加。肠道微生物群从这些TLR5缺陷小鼠转移到野生型无菌小鼠也导致这些野生型小鼠代谢综合征的相似特征转移。
一项调查缺乏TLR5受体的小鼠的研究,观察到鞭毛蛋白特异性免疫球蛋白的丢失导致鞭毛细菌增加,包括许多变形杆菌,以及粘膜屏障破坏和炎症增加。
肠道微生物影响宿主免疫的推定机制
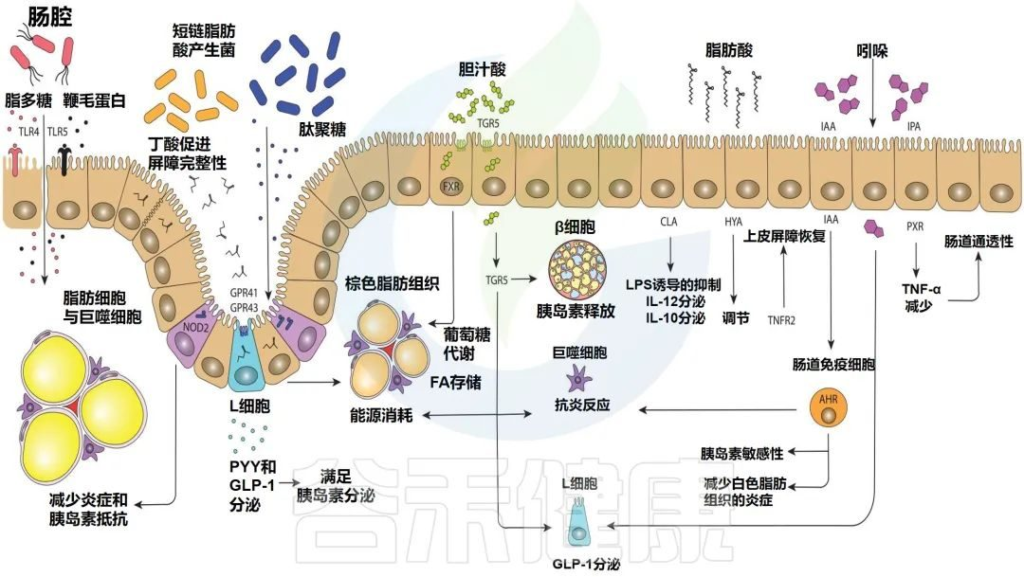
Levin E,et al.Therap Adv Gastroenterol.2022
部分肠道微生物群的鞭毛蛋白和脂多糖可以与toll样受体重组蛋白结合,而细胞内NOD2感知肽聚糖。几种短链脂肪酸的产生可以与GPR41和GPR43(2种特异性短链脂肪酸受体)结合,导致PYY(肽YY(一种新的胃肠道激素,具有抑制胃肠运动和胃酸分泌等作用))和GLP-1(胰高血糖素样肽-1)的表达增加。
胆汁酸激活TGR5和FXR(一种胆汁酸的受体)),影响脂质和葡萄糖代谢。脂肪酸,如HYA,调节TNFR2,参与上皮屏障恢复。吲哚通过GLP-1调节和AHR的激活以及与PXR 的结合影响宿主。
注意
事实上,与瘦的人相比,肥胖的人往往有的粪便鞭毛蛋白、更少的粪便抗鞭毛蛋白IgA和更高水平的慢性肠道炎症。
02
菌群代谢物对肥胖的影响
短链脂肪酸
短链脂肪酸(SCFA)主要是微生物厌氧发酵的衍生终产物,对宿主具有多种影响。它是一组少于六个碳的羧酸,包括乙酸盐、丙酸盐和丁酸盐。这些短链脂肪酸及其比例在几种不同的组织中具有多种有益的作用。
✦短链脂肪酸有利于肠道环境的稳态
短链脂肪酸被认为是人类宿主的能量来源和能量调节剂,但它们也有助于维持肠道环境的稳态。短链脂肪酸的细胞外活性主要由G蛋白偶联受体(GPRs)介导。
这些受体在多种细胞上表达,包括肠上皮细胞、脂肪细胞、肠内分泌L细胞、先天免疫细胞和体细胞感觉神经节的神经元。
✦短链脂肪酸会影响饱腹感
短链脂肪酸参与L细胞产生的肽YY和胰高血糖素样肽1(GLP1) 激素的调节。这两种激素都调节神经系统的饱腹感,GLP1在葡萄糖刺激的胰岛素敏感性和分泌中也起作用。
饱腹感也由丙酸盐通过激活脂肪细胞中的游离脂肪酸受体3(FFAR3)来控制,因为这些脂肪细胞会产生瘦素。微生物衍生的丁酸盐和丙酸盐都会诱导肠道糖异生,进而诱导对葡萄糖和能量稳态的有益影响。
✦短链脂肪酸促进能量消耗
研究显示丁酸盐通过游离脂肪酸受体2(FFAR2)的活化刺激棕色脂肪组织的活化,从而显著促进能量消耗。并且脂肪积累被丁酸盐诱导的白色脂肪组织中的游离脂肪酸受体2活化抑制。最后,丁酸盐通过降低肠屏障的通透性来减少上皮细胞中的细菌易位。
在肠道内,短链脂肪酸的产生通过各种中间体发生。不同的物种,在产生这些中间体和最终产物的每个步骤中使用不同的酶,都参与了这个过程。
●2型糖尿病中产丁酸盐菌丰度较低
在2型糖尿病中,许多研究看到的一个共同趋势是,糖尿病患者的丁酸盐生产者(如Roseburia和Faecalibacterium)的丰度低于对照组,这可能取决于饮食。
在肥胖症中也可能如此,短链脂肪酸的过量生产可能会导致更高的能量可用性和摄入量。
事实上,一项比较肥胖与瘦的受试者的研究表明,肥胖者的总短链脂肪酸水平较高,但必须指出,肥胖与丙酸盐水平特别相关。
胆汁酸
胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。 胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用。
许多研究报告了肠道微生物组、胆汁酸和肥胖或肥胖相关疾病之间存在联系。
初级胆汁酸通过两种途径在肝细胞中产生:
产生大部分胆汁酸的经典途径是由细胞色素P450中的胆固醇7α-羟化酶启动的。
替代途径由细胞色素P450中的27α-羟化酶启动。
注:细胞色素P450——一个很大的可自身氧化的亚铁血红素蛋白家族,属于单氧酶的一类,因其在450纳米有特异吸收峰而得名。它参与内源性物质和包括药物、环境化合物在内的外源性物质的代谢。
7α-羟化酶和27α-羟化酶都属于细胞色素P450中的成员。
经典途径中的一种中间体胆固醇7α-羟化酶与总血浆甘油三酯浓度相关,表明肝胆汁酸合成对于调节肥胖者的血浆甘油三酯水平很重要。
胆汁酸的作用途径
产生的初级胆汁酸是胆酸、鹅去氧胆酸和猪胆酸。这些初级胆汁酸与甘氨酸或牛磺酸结合。餐后,这些结合物被分泌到胆汁中并释放以促进膳食脂肪的溶解和吸收。
此后,肠道微生物群使用胆盐水解酶(BSHs)去结合初级胆汁酸。
Bifidobacterium spp., Lactobacillus spp., Enterococcus spp.和Methanobrevibacter spp.,这些细菌中都含有这些胆盐水解酶。
接下来,这些去结合的初级胆汁酸随后被转化为次级胆汁酸。
注:这是通过肠道微生物群的脱氨基作用和7α-羟化酶的脱羟基化来完成的。
在最后阶段,胆汁酸被回肠远端吸收,完成肠肝循环。产生的次级胆汁酸是脱氧胆酸和石胆酸。这些胆汁酸参与调节能量消耗,以及炎症和葡萄糖代谢和脂质代谢。
这表明这些胆汁酸在肥胖的病理生理学中非常重要,因为与肥胖相关的肠道微生物群的改变包括胆汁酸池大小和组成的变化。
✦不同胆汁酸具有不同的作用
不同的胆汁酸对各种肠道受体具有不同的亲和力,例如与膜结合的蛋白偶联受体(TGR)以及法尼醇X受体(FXR) 。
注:TGR5—是一种G蛋白偶联受体,不仅是胆汁酸的受体,也是多种选择性合成激动剂的受体。
法尼醇X受体(FXR):一种胆汁酸受体,被特定胆汁酸代谢物激活后发挥转录因子作用,参与调控胆汁酸的合成和肠肝循环,影响机体的糖脂代谢。
在小鼠中,已经表明肠道菌群通过FXR受体促进饮食诱导的肥胖。
在脂肪组织中,脂肪细胞分化受FXR通过促进过氧化物酶体增殖物激活受体γ活性,进而调节脂肪酸储存和葡萄糖代谢。
在棕色脂肪组织中,能量消耗因胆汁酸与TGR5结合而增加,随后产生的环磷酸腺苷会增加参与能量稳态的甲状腺激素活化。
在巨噬细胞中,胆汁酸激活TGR5会导致抗炎反应,因为抑制了NF-κb通路和NLRP3依赖性炎症小体活性。FXR和TGR5受体都存在于相似的细胞中,例如胰岛β细胞和肠内分泌L细胞。
在胰岛β细胞中,正向调节合成和葡萄糖诱导的胰岛素分泌。在肠内分泌L细胞中,观察到相反的效果。FXR的激活导致GLP-1分泌的抑制,而TGR5的激活诱导GLP-1的分泌。
✦饮食会影响胆汁酸的含量
几项研究已经将特定的肠道微生物群改变以及胆汁酸成分的改变与肥胖联系起来,同时考虑到饮食的类型。
与富含精制谷物的饮食相比,富含全谷物的饮食导致血浆胆汁酸含量显著增加,包括牛磺鹅去氧胆酸、甘胆酸和牛磺石胆酸。
这被假设为激活FXR和TGR5受体并影响葡萄糖稳态。事实上,高膳食纤维的纯素饮食与Prevotella丰度较高相关被证明可以增强法尼醇X受体的信号通路
与杂食动物相比,纯素食者的粪便胆汁酸含量也显著降低。当杂食动物的饮食中膳食纤维增加时,观察到粪便胆汁酸显著减少。
//研究证明高脂饮食胆汁酸水平升高
在小鼠中,高脂饮食引起的肥胖导致粪便中脱氧胆酸水平升高。此外,高脂肪饮食略微增加总胆汁酸池,特别是增加肝脏和血浆中的脱氧胆酸和牛磺脱氧胆酸水平。
这些变化与以下菌群的丰度增加相关:
Blautia ↑↑↑
Coprococcus ↑↑↑
Intestinimonas ↑↑↑
Lactococcus ↑↑↑
Roseburia ↑↑↑
Ruminococcus ↑↑↑
另一项小鼠研究调查了胆盐水解酶对法尼醇X受体胆汁酸拮抗剂牛磺-β-鼠胆酸的影响,因为法尼醇X受体抑制会导致对肥胖的抵抗。他们发现,乳酸杆菌水平降低与BSH水平降低相关,因此与牛磺酸-β-鼠胆酸水平升高相关。
事实上,从小鼠盲肠中分离出的L.johnsonii被发现表达产生胆盐水解酶的基因,这些基因专门针对牛磺-β-鼠胆酸,提供了肠道微生物群变化与调节法尼醇X受体和胆盐水解酶基因表达之间的机制联系。
然而,与其他产生类似胆盐水解酶的肠道微生物相比,乳酸杆菌对法尼醇X受体拮抗剂浓度的贡献仍不清楚。
一项调查肥胖受试者的人体研究发现了毛螺菌科的瘤胃球菌家族与甘氨脱氧胆酸的比例和血浆中次级胆汁酸与初级胆汁酸的比例呈正相关。
除此之外,Faecalibacterium prausnitzii与粪便中的异石胆酸水平呈负相关。
一项调查肥胖受试者的研究发现,该组的非12-OH胆汁酸比例降低。在同一项研究中,高脂饮食抗肥胖小鼠的这些非12-OH胆汁酸水平升高。
在高脂饮食易肥胖的小鼠中,这些胆汁酸减少并与肠道微生物群的改变有关。在这里,梭状芽孢杆菌减少的很明显,肥胖与肠道微生物群通过胆汁酸池的大小和组成有关,但在单个细菌、特定胆汁酸剖面和肥胖表型之间还没有明确的联系。
因此,还需要进行更多的研究,以将肥胖与胆汁酸谱和胆汁酸池大小与特定细菌组成谱联系起来。
脂肪酸
除了产生胆汁酸外,一些细菌,包括Lactobacilli和Bifidobacteria,还通过多不饱和脂肪酸的饱和代谢产生代谢物。这会产生中间脂肪酸,如羟基、氧代、共轭和部分饱和反式脂肪酸。
结果表明,与无菌小鼠相比,无特定病原体小鼠的羟基脂肪酸水平要高得多,这表明肠道微生物组的脂质代谢会影响宿主体内的脂肪酸组成,因此会影响宿主的健康。
✦增强抗炎能力,促进屏障恢复
此外,共轭脂肪酸组中的一些脂肪酸对健康有益。体外对树突状细胞的实验表明,共轭亚油酸的异构体抑制脂多糖诱导的白细胞介素12产生并增强抗炎细胞因子白细胞介素10的产生。
一个例子是10-hydroxy-cis-12-octadecenoic acid(HYA),因为它部分调节肿瘤坏死因子受体2 (TNFR2),从而促进上皮屏障恢复作用。
注:HYA是不饱和脂肪酸的代谢过程中,肠道微生物产生的中间体游离脂肪酸。HYA能够改善与一些细胞中成熟标志物表达相关的抗氧化/解毒防御能力。
✦保护宿主,减少肥胖
另一项研究展示了HYA如何通过G蛋白偶联受体40(GRP40)和G蛋白偶联受体120(GRP120)分泌胰高血糖素样肽-1来减轻高脂饮食诱导的小鼠肥胖。
此外,他们还证实了几种乳酸杆菌属,如
Lactobacillus salivarius和
Lactobacillus gasseri,能够产生相似水平的 HYA,保护宿主免受高脂饮食引起的肥胖。
吲哚
吲哚是吡咯与苯并联的化合物,细菌产生吲哚对人体健康具有重要意义。
✦饮食类型影响吲哚的产生
吲哚是通过降解肠中芳香族氨基酸如酪氨酸、苯丙氨酸和色氨酸的分解代谢产生的。因此,肠道吲哚水平取决于饮食类型。
富含蛋白质的饮食会促进吲哚的产生。然而,富含糖的饮食可能会降低吲哚合成,因为过度消耗糖可能会导致小肠饱和,从而导致更多剩余的糖进入大肠。
由于碳水化合物发酵优于蛋白水解活性,因此抑制色氨酸酶活性导致吲哚合成速率降低。吲哚通过以下途径影响宿主代谢L细胞对GLP-1分泌的调节,表明在2型糖尿病等代谢疾病中发挥作用。
吲哚丙酸(3-Indolepropionic acid)由Clostridium sporogenes产生,它与膳食纤维摄入量呈正相关。
•2型糖尿病会影响吲哚水平
事实上,一项研究发现较高的血浆吲哚丙酸水平与降低患2型糖尿病的风险之间存在关联。
另一项研究发现,与瘦对照相比,患有2型糖尿病的肥胖受试者的吲哚丙酸水平降低。吲哚丙酸显示通过与孕烷X受体结合并随后下调肿瘤坏死因子α来调节炎症。
✦吲哚具有抗肥胖等特性
研究显示吲哚丙酸可降低饮食诱导的肥胖小鼠的肠道通透性。吲哚丙酸也被证明在小鼠中具有抗肥胖活性。
在肠道中,色氨酸可以被肠道菌群用作底物来产生吲哚,但也可以被宿主代谢。在低度肠道炎症(肥胖的一种慢性症状)期间,巨噬细胞中的吲哚胺2,3-双加氧酶活性增加,导致犬尿氨酸的产生水平升高,从而将生产从微生物衍生的吲哚转移。
注:吲哚胺2,3-双加氧酶是人体内色氨酸代谢中的关键酶,可通过介导色氨酸耗竭及其代谢产物调节机体抗肿瘤免疫。
与正常饮食的小鼠相比,高脂肪饮食的小鼠显示出吲哚胺2,3-双加氧酶活性增加。然而,与高脂饮食的野生型小鼠相比,在这种酶被敲低的小鼠中观察到胰岛素耐受性有所改善。
微生物衍生的吲哚,如吲哚乙酸激活芳烃受体,但犬尿氨酸抑制其激活。微生物衍生的吲哚乙酸进一步限制了巨噬细胞中脂肪酸的积累和炎症标志物的产生。
谷氨酸
除了吲哚,谷氨酸也可以影响人体。
——谷氨酸是一种多功能氨基酸,谷氨酸在生物体内的蛋白质代谢过程中占重要地位。除此之外,谷氨酸也是人体兴奋神经递质,不仅参与消化系统和免疫系统,还是大脑健康密切相关。现在强有力的证据表明肠道微生物产生神经活性分子,如神经递质(即去甲肾上腺素、多巴胺、血清素、GABA 和谷氨酸)和代谢物(即,色氨酸代谢物,短链脂肪酸等)维持宿主和细菌之间跨界跨区域交流。谷氨酸代表了在这种跨界交流中活跃的众多神经活性分子之一。
根据对肥胖和瘦受试者的队列进行的全基因组关联分析显示,谷氨酸盐具有潜在危害。
通过进行途径分析,谷氨酰胺/谷氨酸转运系统在肥胖个体中高度富集。这与拟杆菌属(包括B.thetaiotaomicron)的物种呈负相关。事实上,与瘦受试者相比,肥胖者体内这种细菌的数量减少。因此谷氨酸与人体之间也存在一定联系。
•拟杆菌的在高脂饮食中的研究
对多形拟杆菌(B.thetaiotaomicron)在高脂饮食小鼠中的作用的研究表明,编码参与脂肪生成的蛋白质的基因表达较低,而编码参与脂肪酸氧化和脂肪分解的蛋白的基因表达较高。此外,炎症相关标志物的表达也降低。
关于发现与肥胖相关的B.thetaiotaomicron,其效应可能是由于与某些其他物种的相互作用,例如B. uniformis,已知其部分恢复了高脂肪饮食诱导的肥胖效应。
03
健康与肥胖人群中的细菌比例
有研究发现,健康人群和肥胖人群中的拟杆菌门和厚壁菌门比例存在不同。但是将健康受试者与肥胖受试者用拟杆菌与厚壁菌的比例区分开来的一个有争议的话题。
•支持的证据
一项研究调查了遗传易感肥胖小鼠及其接受相同多糖饮食的正常野生型同胞的盲肠微生物群之间的差异。
在肥胖小鼠中,拟杆菌数量减少,而厚壁菌的相对丰度较高。一年后,在比较肥胖和正常时发现了类似的结果。
•反对的证据
然而,同一组在比较正常人和肥胖人双胞胎时观察到了有争议的结果。然而,此处观察到拟杆菌显著减少,与厚壁菌没有关联。
除此之外,使用16s rRNA基因的类似管道和区域重新分析前面提到的文章的数据集和其他公开可用的数据也导致了与拟杆菌与厚壁菌比率相关的矛盾结果。
鉴于人类肠道中这两个门所代表的目、科、属的物种众多,这些门水平上相互矛盾的肠道微生物群结果并不令人惊讶。
另一方面,厚壁菌门是如此广泛,以至于说某个菌属于厚壁菌门,但是不同菌的功能差别很大。
此外,这些门中分类上不同的细菌具有截然不同的属性。拟杆菌门中最重要的例子是普氏杆菌属和拟杆菌属,它们往往相互排斥。当比较多个研究时,将每个门的细菌汇集在一起时,预计会出现相互矛盾的结果。
因此,目前还不鼓励使用拟杆菌与厚壁菌的比例来区分健康人群与肥胖人群。我们在检测实践中也发现部分肥胖人群拟杆菌比例较高。
Prevotella与Bacteroides的比例
在引入肠型后,在拟杆菌门内做出了更合适的区分,即Prevotella和Bacteroides的比率。
与Bacteroides相比,Prevotella个体在食用左旋肉碱时血浆氧化三甲胺浓度较高。
以Prevotella为主的肠道微生物群往往与素食主义或非工业化的富含膳食纤维的饮食有关。这些例子可以在非洲、南美洲或者东南亚狩猎采集者或农村人口进行的几项研究中找到。
✦Prevotella与Bacteroides更利于减肥
研究很好地说明了饮食和环境导致的从普氏杆菌向更为拟杆菌主导的肠道微生物群的转变,来自泰国农村的人移民到了美国。不出所料,这种转变也伴随着体重的增加。
关于减肥方案,这一比例很重要,因为普氏杆菌与拟杆菌比例较高的受试者在膳食纤维含量较高的情况下更容易减肥。
研究发现,给予辣椒素时,拟杆菌量较多的受试者体重减轻更多,在此强调了个性化营养的必要性。
04
肥胖与肠道微生物的研究分类
为了更好更有条理地研究肥胖与肠道微生物之间的关系,需要将微生物进行研究分类。
大多数关于肥胖与肠道微生物群之间关系的研究通常将个体分类群与病理生理途径联系起来,以建立与肥胖的联系。
影响微生物的因素
细菌并不存在于真空中,所以它们的生长速度以及它们能够进行的代谢活动取决于外部环境因素。
这些外部因素包括pH、胆汁酸和底物可用性。所有这些反过来又取决于微生物组分本身;这意味着一种细菌的功能受其周围所有其他细菌的影响。
更直接地说,各种细菌种类依赖于其他细菌种类为它们提供中间底物(其他细菌的废物),并且反过来,依赖于将消耗其自身废物(发酵产物)的其他细菌,以使其从中获得能量的生化转化在能量上有利。
同一物种的不同菌株可能存在很大差异
通常使用不同的分类水平(门/科/属/种)来归因特定的特征和关联,而物种的功能甚至在同一属内,甚至是目前被认为属于不同菌株的细菌。相同的物种,可以有很大的不同。
因此,旨在通过查看更高的分类级别来限制分类组数量的降维策略通常应该优选地限制在类属级别。
同一物种的不同菌株可能具有也可能不具有归因于它们的特定功能,正如在碳水化合物活性酶中观察到的那样。如果高度相似的基因存在于多种细菌中,则可能还会出现冲突模式。
越来越多的研究人员在过去几十年中得出结论,与肥胖相关的有益影响应归因于肠道微生物群中的多个参与者协同工作。而这种关联的紊乱可以被视为生态失调的一种形式。
微生物成员分组
——由于上述个体分类群分析的缺陷使得难以找到特定于健康结果的具有生物学意义的模式,因此创造了两个不同的术语来将个体微生物组成员分组。
▸ 微生物“聚类”
应用了“guild”这个术语,这在宏观生态学中已经众所周知。它包括“以类似方式利用同一类环境资源的一组物种”,后来成为“功能组”的同义词。
通过构建基于微生物丰度协变的共丰度组,给出了一个框架,以更生态有意义的方式解开肠道微生物组与人类健康之间的关系。这将克服目前对基于分类单元的分析和以基因为中心的分析存在问题的各种缺点。
▸ 营养网络
另一个术语称为“营养网络”,营养网络被定义为微生物种群形成代谢相互依赖的生物体的食物网,随着时间的推移以相关的方式稳定地建立。
小结
通过观察微生物聚类或特定的营养网络,可以实现对与健康和肥胖相关的肠道生态学的更有意义的解释。
此外,将数百个分类群聚集到有限数量的微生物聚类或营养网络中将有助于降低维度,从而有可能应用经典统计数据来限制与校正多重测试相关的问题。
尽管基于微生物聚类的方法似乎是一种有前途的方法,在了解肥胖儿童的体重调节方面观察到了附加价值,但与肥胖本身的相关性仍有待阐明。
05
微生物多样性与人体健康有关
α多样性与疾病状态有关
——在区分肥胖受试者和健康受试者时,一个常见的观察结果是他们平均较低的α-多样性。
在许多其他疾病中也观察到相同的情况,例如克罗恩病、肠易激综合征和结肠直肠癌。因此,微生物多样性的丧失通常与各种疾病状态有关。可以说,断奶后肠道α多样性降低是与各种人类状况相关的普遍特征。
在成年人中,较高丰度的细菌(如Akkermansia muciniphila和F. prausnitzii)通常与较高的α多样性相关。
丰富的A. muciniphila与BMI、炎症标志物、脂质合成和总脂肪组织重量呈负相关。
▸ α多样性是什么?
α多样性主要关注局域均匀生境下的物种数目,因此也被称为生境内的多样性。α-多样性是由扩散、局部多样化、环境选择和生态漂移共同形成的。
多样性本身不仅仅是健康的指标,因为多种高丰度的病原体持续存在一般不会让肠道感觉 “幸福”。
相反,更高的α多样性应该被视为存在发育良好和扩展的微生物营养网络,它们共同导致发酵能力的提高。
✦低α多样性下的肠道微生物
富含拟杆菌的微生物群倾向于具有较低的α-多样性值、较简单的营养网络,并且更容易下降。
这种低α-多样性组合物通常富含诸如肠杆菌科、梭杆菌属、链球菌属、瘤胃球菌属和各种拟杆菌属物种的物种。
这种益生菌组合物在肠型方面与拟杆菌2肠型最为相似,最终会是肥胖和2型糖尿病的危险因素。
营养网络被破坏导致α多样性减低
研究表明营养网络的彻底破坏以及由此导致的α-多样性、基因丰富度和肠道发酵能力的极大降低。
调查了(抗生素治疗)危重儿童的肠道微生物群、粪便短链脂肪酸和胆汁酸谱。由于缺乏代谢和发酵能力,这些儿童的初级胆汁酸与次级胆汁酸的比例较高,但短链脂肪酸的产量极低,而碳水化合物发酵的中间产物,如乳酸盐和琥珀酸盐与健康对照儿童相比含量增加。
后一项发现,加上剩余的未发酵糖组分、较高水平的未接触蛋白质和更松散的粪便,突出了肠道中剩余的发酵仍然处于糖分解阶段。
Christensenellaceae营养网络
——一个与高α-多样性和健康相关的特定营养网络
与肥胖受试者相比,体重指数正常的健康受试者的Christensenellaceae水平更高。
Christensenellaceae和寄主BMI之间的关联被认为是最稳健的关联之一。在无菌小鼠体内移植来自人类供体的富含菊苣科植物的粪便可减少肥胖。在富含瘤胃球菌科或厚壁菌的肠型的人中,Christensenellaceae通常很丰富。
如上所述,不应将Christensenellaceae视为一个独特的独立实体,因为它始终与其他细菌和古细菌形成营养网络。
✦Christensenellaceae与古细菌的关联
Christensenellaceae与一种古细菌——Methanobrevibacter smithii 的关联可能是这一营养网络最典型的部分。
M.smithii 从微小梭菌产生的氢气中产生甲烷。如果这种营养网络与低BMI之间存在因果关系,则仍然相当不确定。
除了M. smithii是这一营养网络的一部分外,一项比较意大利瘦弱和肥胖老年人的研究发现,Christensenellaceae、Rikenellaceae和Porphyromonadaceae之间存在相关性。
在日本的一个队列中,调查了不同地区健康成年人的粪便样本,Christensenellaceae与各种其他细菌也与BMI呈负相关。
注意
鉴于α-多样性、瘦弱性和Christensenellaceae细菌营养网络之间的紧密联系,未来将继续从机制上研究这种联系。还应注意的是,该营养网络对于短链脂肪酸生产的重要性尚未确定。
虽然Christensenellaceae和Methanobrevibacter可能仅占总微生物群的一小部分,但它们所代表的核心指示物种的营养网络在不同种族中绝不是一个小角色。这种营养网络,其中各种物种彼此之间非常密切相关,具有肠型定义潜力。
Prevotella stercorea营养网络
另一个营养网络,通常在工业化国家的人们中代表性不足,是Prevotella stercorea营养网络,它可以被视为Prevotella肠型组成中的一个重要因素。
这个营养网络的建立首先是通过观察冈比亚儿童正在发育的肠道微生物群来广泛描述的。P. stercorea与Succinivibrio dextinosolvens和Paraprevotella xylaniphila等形成一个大型营养网络,并且类似地与高α-多样性相关。
✦肠道Prevotella的特征
肠道普雷沃氏菌是一个完美的例子来展示微生物“聚类”和营养网络之间的区别。
在人群范围内的研究中,例如使用多民族队列研究的数据,被定义为肠型普氏杆菌的人通常具有非常高的P. stercorea水平和与P.stercorea营养网络相关的高水平物种。
当在分层聚集的热图中可视化时,P.copri和P.stercorea营养网络中的物种聚集在一起。然而,这种共同发生主要是由于粪便中的Prevotella(包括P.copri、P.stercorea和其他许多普氏杆菌属)和Bacteroides/Phocaeicola.之间的强烈拮抗作用。
P.copri和P.stercorea营养网络在同一环境中表现良好(Bacteroides贫乏),但P.copri的高丰度完全独立于P.stercorea营养网络发展,这可以通过跟踪儿童在前3个年的肠道微生物群成熟情况看出多年生活在一个每个人都会发展出富含Prevotella的肠道微生物群的环境中。
12个月后,P.copri成为优势种并保持优势,而与P.stercorea营养网络相关的物种丰度在生命的前30个月以相互依赖的方式缓慢增加,直到达到稳定水平。推测在P. stercorea的营养网络中存在着各种代谢产物的交换,值得进一步研究,特别是与Prevotella肠型生产短链脂肪酸的能力增加有关。
✦Prevotella与健康相关
与肥胖率上升最快的工业化国家相比,肠型拟杆菌相关的拟杆菌和种类在冈比亚并不多见。
肠道中的Prevotella本身也与较低的BMI相关,并且已观察到低密度脂蛋白胆固醇与肠道Prevotella呈负相关,这表明在非工业化国家,肠道Prevotella与健康有关。
06
肥胖与肠道微生物的未来研究方向
尽管使用大型队列的关联研究对于试图解开与肥胖相关的肠道微生物组的极端复杂性至关重要,但其他几种研究途径也具有潜力,其中一种是粪菌移植。
粪菌移植
▸ 定义
粪菌移植,是将粪便从瘦供体转移到受体。也称为“人类肠道微生物群转移”、“粪便移植”和“粪便细菌疗法”。
✦粪菌移植的作用
粪菌移植已被证明是比抗生素更有效的复发性艰难梭菌感染 (CDI) 治疗方法。然而,与肥胖不同,从病理学的角度来看,CDI是一种相对简单的疾病,其中肠道微生物群的因果关系是明确的。
在一项对患有胰岛素抵抗的肥胖受试者进行的粪菌移植试验中。受试者接受自己的粪便(自体)或瘦供者粪便(同种异体)。短期内在接受瘦供体粪菌移植的受试者中观察到对胰岛素敏感性的有益影响。
进一步研究表明基线肠道菌群有利于粪菌移植的成功。在这里,当接受同种异体粪菌移植时,在α-多样性降低的受试者中,粪菌移植成功率更高。
总的来说,与那些肠道微生物组组成尚未严重恶化的受试者相比,那些α-多样性较低的受试者有更大的改进空间。
✦其他影响粪菌移植的因素
一项研究,其中包括几个调查不同疾病的粪菌移植队列,显示生态变量(如低α-多样性)与临床变量(如抗生素治疗和灌洗)一起在植入成功中发挥作用。
他们进一步表明,通过合并供体样本来增加α-多样性预计不会增加供体菌株的植入,这表明合并供体样本在功能上并不等同于单个高α-多样性供体样本。
对队列进行的分析表明,P.copri对接受同种异体粪菌移植的受试者具有有益的影响。P.copri与BMI、C反应蛋白和空腹胰岛素水平进一步呈负相关。
此外,肠道微生物群的变化可能与特定血浆代谢物水平和血浆单核细胞中DNA甲基化的变化有关,为肠道微生物群影响肥胖相关疾病的机制提供了额外线索。
验证细菌植入的生物学工具
最近开发了几种工具来帮助解开粪菌移植中肠道微生物组与肥胖之间的关系。
为了验证来自瘦供体的菌株是否已移植到受体中,需要进行菌株跟踪分析。比较了七种不同的生物信息学工具,用于在数据集上进行应变跟踪。
减轻肥胖和相关疾病负担有前景的方法
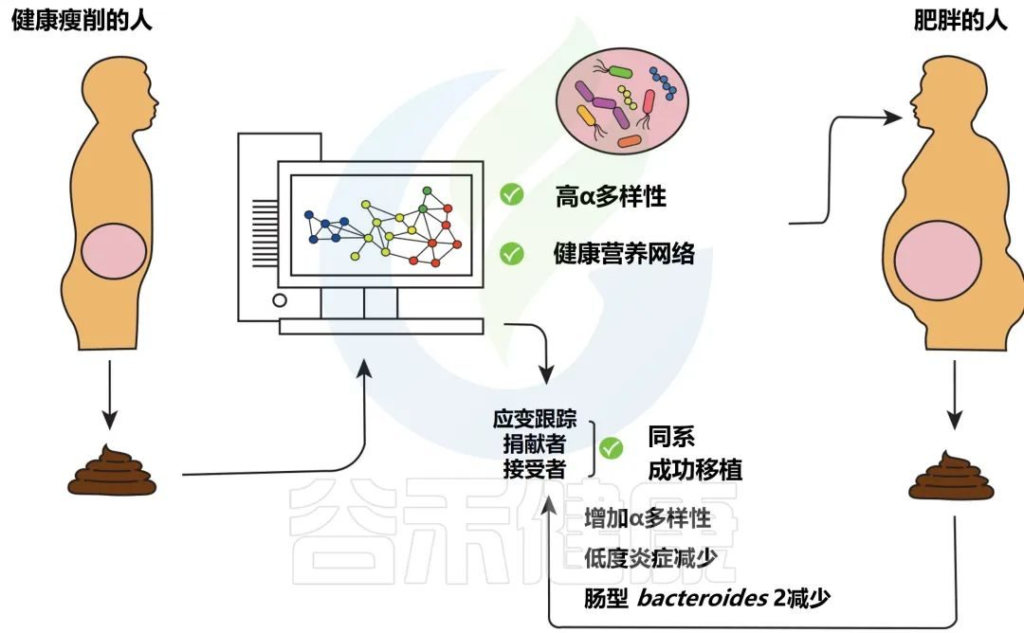
Levin E,et al.Therap Adv Gastroenterol.2022
分析健康瘦供体粪便的微生物组成,以选择具有高 α 多样性(以及其他)的供体,这可以被视为存在复杂的健康相关营养网络的标志。
如果合适,然后将高α多样性供体的粪便转移到肥胖的接受者身上,这可能会减轻低度炎症。在粪菌移植之后,使用菌株追踪在接受者的粪便中追踪肠道微生物群基因组中特定位置的特定SNP的供体菌株验证。
在这里,观察到概率工具在宏基因组测序数据上表现最好。然而,随着最近开发的两种新的应变跟踪工具,这一技术领域仍在快速发展。
其中一个工具是基于物种特异性标记基因中的单核苷酸变体跟踪菌株,另一个是先前发布和改进的进一步构建工具,应用应变跟踪方法。
在接受粪菌移植后调查了受体中的菌株植入,观察到供体和受体特异性菌株可以共存。与此同时,发现肥胖受试者的粪菌移植胶囊会导致微生物群落组成发生变化,从而导致受试者从一种肠型转变为另一种肠型。这随后改变了菌群的代谢潜力。微生物组向供体的转变与α多样性呈正相关。
此外,肠道微生物群组成的变化在治疗后持续26周。本研究结合了多个供体的粪便,并表明一些供体具有用于移植的高效微生物群,这意味着供体粪便的组成和整个营养网络的转移,而不是添加单个分类群的重要作用。
07
预防和治疗肥胖的建议
预防肥胖
——鉴于肥胖症如此普遍,并且考虑到治疗的难度,预防尤为重要。
为预防超重和肥胖,人们应该根据自己的营养需求进食和饮水,定期锻炼,定期检查体重。
•少吃高热量食物
就营养而言,他们应该少吃高能量密度的食物,多吃低能量密度的食物。由于水分或纤维含量高而能量密度低的食物,如全麦制品、水果和蔬菜,相对来说更能饱腹,能量含量也较低。地中海饮食有助于预防超重和肥胖。
还应减少酒精、快餐和含糖饮料的消费。快餐通常含有高比例的脂肪和糖,因此能量很高。不仅是加糖的饮料,还有果汁和果汁饮料,含糖量也很高。
•避免久坐或不活动
经常坐着看电视或上网和类似活动的不活跃生活方式会促进体重增加。在日常活动和休闲活动中进行锻炼具有预防作用。这个目标最好通过每周2小时以上的以耐力为重点的体育锻炼(使用大肌肉群)来实现。
肥胖的治疗方法
✦饮食疗法
为了减轻体重,目标应该是遵循减量饮食,这将产生约500kcal/天的热量缺口,或在个别情况下更多。
每天500至600kcal的能量缺口将使体重减轻,以约0.5kg/周的速度发生,持续12周最多24周。
低碳水化合物饮食在开始时会比其他饮食导致更剧烈的体重减轻,但一年后就看不到差异了。过去几年的几项大型研究表明,常量营养素组成(脂肪、碳水化合物和蛋白质的比例)与减肥无关。各种减脂饮食可在1至2年内减掉约4公斤。个人经验、知识和资源比营养关系更重要。
✦益生菌帮助减肥
已经证明几种益生菌,单独使用或以共生混合物的形式使用,能够通过物种和菌株特异性机制(例如,肠道微生物群调节、降低胰岛素抵抗、更强的饱腹感)来治疗肥胖。
更具体地说,乳酸杆菌和双歧杆菌物种由于其低致病性和低水平的抗生素耐药性而已成功用于成熟的肥胖动物模型。
益生菌对减肥作用的一些实验
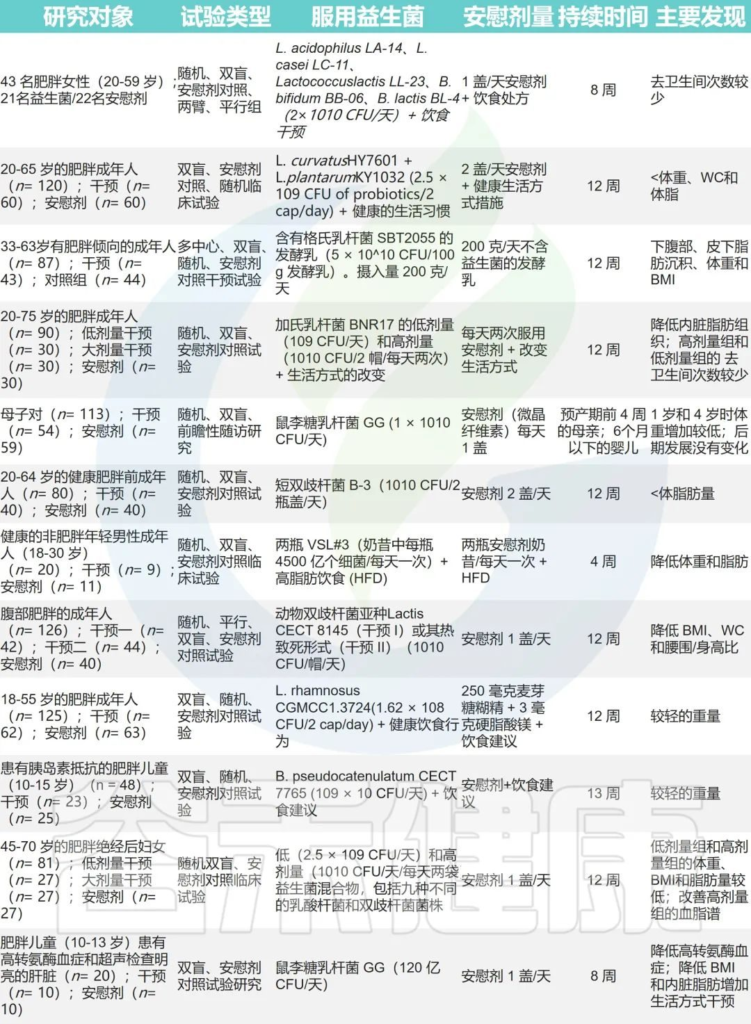
Abenavoli L, et al. Nutrients.2019
与安慰剂组相比,这些治疗导致不同程度的体重增加减少和脂肪累积减少。
所以在一些时候,我们可以利用例如乳酸杆菌等益生菌来帮助我们减肥。
✦增加运动
有效的减肥需要>150分钟/周的运动,能量消耗率为1200至1800kcal/周。单独的力量训练对于减轻体重作用不大。
运动中消耗的能量常常被高估。当使用大肌肉群,强度适中到高,运动时间长时,体重减轻是可以预期的。对照良好的研究和荟萃分析显示,在6至12个月内体重减轻了约2公斤,腹部脂肪减少了约6%.
应该向超重和肥胖的人解释运动的健康益处(代谢、心血管和社会心理),无论体重减轻如何,这些益处都会产生。即使在肥胖个体中,增加运动的健康价值也不仅仅体现在体重减轻上。
✦行为矫正干预
在团体或个人中,基于行为方法的干预应成为减重计划的一部分。
干预的主要目的是改变营养和运动方面的生活方式,并且可以由合格的非心理治疗师进行。如果伴随超重或肥胖的症状更严重,精神科医生或心理治疗师应参与患者管理,并应支持患者进行饮食治疗和锻炼。
08
结语
肥胖和肠道微生物群以多种方式交织在一起。饮食的类型及其数量会影响能量的可用性并因此影响肥胖,但也会强烈影响肠道微生物组,这反过来又可以放大饮食的致肥胖特性,或另一方面提供各种保护性益处。
许多微生物衍生的代谢物,包括短链脂肪酸、胆汁酸、吲哚和其他氨基酸,对健康同样至关重要。过量或缺乏这些,或者更具体地说,在任何这些方式中改变的整体组成,都可能是致肥胖的。
通过本文更好地了解肥胖以及其发病机制与微生物组之间的关系,有助于在日后的生活中更好地应对肥胖,使人人都有一个健康的身体。
主要参考文献
van der Vossen EWJ, de Goffau MC, Levin E, Nieuwdorp M. Recent insights into the role of microbiome in the pathogenesis of obesity. Therap Adv Gastroenterol. 2022 Aug 9;15:17562848221115320. doi: 10.1177/17562848221115320. PMID: 35967920; PMCID: PMC9373125.
Canfora, EE, Meex, RCR, Venema, K, et al. Gut microbial metabolites in obesity, NAFLD and T2DM. Nat Rev Endocrinol 2019; 15: 261–273.
Abenavoli L, Scarpellini E, Colica C, Boccuto L, Salehi B, Sharifi-Rad J, Aiello V, Romano B, De Lorenzo A, Izzo AA, Capasso R. Gut Microbiota and Obesity: A Role for Probiotics. Nutrients. 2019 Nov 7;11(11):2690. doi: 10.3390/nu11112690. PMID: 31703257; PMCID: PMC6893459.
GBD 2015 Obesity Collaborators . Health effects of overweight and obesity in 195 countries over 25 Years. N Engl J Med 2017; 377: 13–27.
Chauhan, S, Jena, KK, Mehto, S, et al. Innate immunity and inflammophagy: balancing the defence and immune homeostasis. FEBS J. Epub ahead of print 26 November 2021.
Beukema, M, Faas, MM, de Vos, P. The effects of different dietary fiber pectin structures on the gastrointestinal immune barrier: impact via gut microbiota and direct effects on immune cells. Exp Mol Med 2020; 52(9): 1364–1376.