 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

革兰氏阳性和阴性菌
在日常生活中,我们常常会看到药物或抗菌产品适应症会这样写到,对革兰氏阳性菌有效,对革兰氏阴性菌敏感,或者说对革兰氏阴性菌有效,对革兰氏阳性菌无效。可能很多人不是很清楚或搞不懂二者的区别。
本文主要介绍革兰氏阳性和阴性菌,它们的区别,代表性菌种以及针对用药等。
1884年,细菌学家Hans Christian Gram发明了革兰氏染色法来鉴别区分细菌。这种技术将细菌分成两大类,即革兰氏阳性菌(G+)和革兰氏阴性菌(G-)。区分主要是这两类细菌细胞壁成分不同,因而着色也不同所致。
这两类细菌的生理结构,疾病原因以及抗菌作用不一,因此,区分病原菌是革兰氏阳性菌,还是阴性菌,在临床确定感染和选择用药方面意义重大。
革兰氏阴性菌致病多由于患者有基础疾病或者体质比较差,肠道细菌感染引起的腹泻多是由肠道菌群中的革兰氏阴性菌所致,如大肠杆菌、沙门氏菌、志贺氏菌,布氏杆菌等,治疗这类细菌感染,一般使用三代头孢菌素以及喹诺酮类抗生素。注意大多数革兰氏阴性菌对青霉素耐药或不敏感。
大多数化脓性球菌都属于革兰氏阳性菌,它们能产生外毒素使人致病,常见的菌种有葡萄球菌、链球菌、肺炎双球菌、李斯特菌、炭疽杆菌、白喉杆菌、破伤风杆菌等。尤其在人体肠道内,革兰氏阳性致病菌致病几率更大。大多数由革兰氏阳性菌引起的感染可以用相当少量的抗生素治疗。青霉素、氯唑西林和红霉素足以覆盖 90% 的革兰氏阳性感染。
此外,某些广谱抗生素对革兰氏阳性菌和革兰氏阴性菌都有抗菌作用,如氨苄青霉素、庆大霉素、土霉素、磷霉素及环丙沙星等,但是作用效果可能不是最优。此外,磺胺类药物也属于广谱抑菌药物。
临床应用时,如果对细菌感染比较明确,尽量使用窄谱抗菌药物,如不太明确,可选用广谱抗菌药物。因此,临床治疗疾病时,首先要对药物的作用与用途要详细了解,然后再根据感染类型或诊断结果合理选择药物,这样才能取得最佳治疗效果。否则,药物选择不当,将会出现无效或越治越重的结果。
革兰氏阴性菌和革兰氏阳性菌之间的主要区别在于肽聚糖层的厚度和外部脂质膜的存在与否。
不同细菌的革兰氏染色
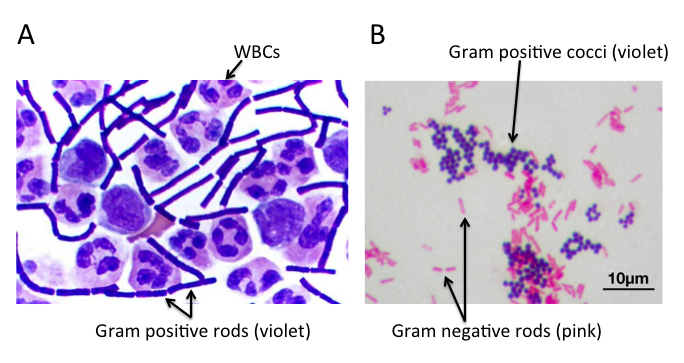
A) 脑脊液样本中的杆状革兰氏阳性炭疽杆菌(导致炭疽),也含有白细胞。B) 革兰氏阳性金黄色葡萄球菌(紫色或紫色)和革兰氏阴性杆菌大肠杆菌(粉红色)的革兰氏染色,它们是最常用的革兰氏染色参考细菌。参考来源:Wikipedia commons 和 tmedweb)
// 缺乏外膜,更容易受抗生素影响
革兰氏阳性菌的细胞壁含有肽聚糖、脂质、磷糖醛酸和磷壁酸。这种结构成分不同于由肽聚糖和外膜(由脂质、蛋白质和脂多糖组成)组成的革兰氏阴性细菌细胞壁。尽管革兰氏阳性菌具有较厚的肽聚糖层,但它们比革兰氏阴性菌更容易受到某些靶向细胞壁的抗生素的影响,因为它们缺乏外膜。
// 常见的致病菌
最常见的革兰氏阳性细菌包括葡萄球菌、链球菌、芽孢杆菌、梭状芽孢杆菌、李斯特菌、棒状杆菌等。这些革兰氏阳性菌的代表性物种是致病的,并可能引起多种疾病。
// 可用于治疗的抗生素
青霉素是影响革兰氏阳性菌的主要抗生素之一。
红霉素是另一种用于治疗革兰氏阳性细菌感染的强效抗生素。红霉素属于一类称为大环内酯类的抗生素,与阿奇霉素和克拉霉素同属一类。它通常用于对青霉素过敏的人。
甲氧苄啶/磺胺甲恶唑,克林霉素,克林霉素,强力霉素,万古霉素也可以用于特定的革兰氏阳性菌的感染。
// 层层抵抗更难杀死:细胞壁更硬,可改变外膜
革兰氏阴性菌有坚硬的保护外壳。它们的肽聚糖层比革兰氏阳性杆菌薄得多。
当它们的细胞壁受到干扰时,革兰氏阴性细菌会释放内毒素,症状更糟。同时,大多数抗生素为了接近它们的目标,必须通过外膜。例如,亲水性抗生素通过孔蛋白。革兰氏阴性菌可以通过改变它们的疏水特性或通过孔蛋白的突变来改变它们的外膜。这对这些细菌细胞产生了抵抗力。
// 暗藏玄机:比革兰氏阳性菌更危险
与革兰氏阳性菌相比,革兰氏阴性菌作为疾病生物体更危险,因为存在覆盖外膜的荚膜或粘液层。通过这种方式,微生物可以隐藏表面抗原,这个抗原可以触发人体免疫反应。
革兰氏阴性菌是一组臭名昭著的细菌,可导致多种疾病,包括肺炎、脑膜炎、淋病、细菌性痢疾、霍乱、胃炎等。在重症监护病房 (ICU)的患者,处于发病和死亡的高风险中,更容易遇见这类细菌,因此它们在医院具有重要的临床意义。
// 可用于治疗的抗生素
已经开发了许多不同种类的抗生素来杀死革兰氏阴性菌,例如头孢菌素、叶酸拮抗剂、哌拉西林-他唑巴坦、脲青霉素、内酰胺-β-内酰胺酶抑制剂、碳青霉烯类和喹诺酮类。它们是专门针对革兰氏阴性细菌而开发的,不过有时也对某些革兰氏阳性细菌有效。
革兰氏阳性菌与革兰氏阴性菌区别总结

参考来源:microbenotes
以上是革兰氏阳性菌和阴性菌的主要区别,接下来我们针对革兰氏阳/阴性菌,从细菌特征,形状表征,细胞结构等方面,进行更详细的介绍。
革兰氏阳性菌的定义是基于它们在革兰氏染色中用酒精短暂洗涤后保留结晶紫染料的能力。革兰氏阳性菌呈紫色。
这些细菌具有非常独特的特征,可以将其与其他类型的细菌区分开来。这些包括:
在革兰氏染色过程中,革兰氏阴性细菌在用酒精清洗后将失去结晶紫染料的颜色,并吸收反染物藏红花的粉红色/红色。
几乎在地球上的每个生活区域都可能发现革兰氏阴性细菌。
尽管大多数细菌是通过革兰氏染色染料进行区分的,但显微镜下的观察揭示了更多可用于定义和表征这些细菌的特征。
根据形状的定义,革兰氏阳性菌可分为两类:
革兰氏阳性细菌形成的其他特殊形状包括:
革兰氏阴性菌细胞的显微镜观察范围从杆状到芽孢杆菌,从球菌到螺旋状,螺旋状是最常见的形状。然而,有些表现出特殊的形状,如球杆菌、四分体、栅栏、毛状体等。例如:
革兰氏阳性菌的细胞壁含有肽聚糖、脂质、磷糖醛酸和磷壁酸。这种结构成分不同于由肽聚糖和外膜(由脂质、蛋白质和脂多糖组成)组成的革兰氏阴性细菌细胞壁。因此,革兰氏阳性菌的细胞壁很厚,并吸收了革兰氏染色的结晶紫染料。因此,显微镜下的革兰氏阳性菌呈紫色。
革兰氏阳性细菌细胞壁的结构特征
革兰氏阳性细菌具有由肽聚糖组成的厚的多层细胞壁(因为它含有肽和糖的混合物)。由于肽聚糖存在于大多数细菌中,但不存在于哺乳动物细胞中,因此它是抗菌药物的良好靶标(例如细胞壁合成抑制剂,包括青霉素、头孢菌素和万古霉素)。
这些抗生素会干扰转肽酶(也称为青霉素结合蛋白或PBP 的活性) 在细胞壁中催化相邻聚糖链之间的交联。
细胞壁还含有磷壁酸纤维,有助于细菌附着在宿主细胞膜(例如粘膜细胞)上,释放后会引起感染性休克,类似于革兰氏阴性菌释放的内毒素 (LPS) 产生的感染。
β-内酰胺酶(青霉素酶)是由细菌产生的酶家族,可水解 β-内酰胺抗生素(其中许多也是细菌来源)的四原子 β-内酯环,从而使其抗菌性能失活。
细菌细胞膜还可以包含ABC 外排泵这可能导致抗生素耐药性和对那些具有细胞内作用机制的药物(例如 DNA 促旋酶抑制剂或蛋白质合成抑制剂)的多药耐药性 (MDR)。
结晶紫染料附着在革兰氏阳性菌细胞壁的厚肽聚糖层上,在光学显微镜下观察时将它们染成紫色或紫色。
肽聚糖
它也被称为胞壁质(murein),占细菌细胞壁含量的 90%。
——维持形状,并保持细胞壁强度和弹性
它是一种优质聚合物,由两种相同的糖衍生物(N-乙酰氨基葡糖和 N-乙酰胞壁酸)以及 L-氨基酸链和蛋白质中很少发现的三种不同 D-氨基酸(即 D-谷氨酸、D-丙氨酸和内消旋二氨基庚二酸)组成,可保护细胞壁免受肽酶的攻击。
D-氨基酸和L-氨基酸连接到N-乙酰壁酸,L-氨基酸特别是赖氨酸可以取代中二氨基丙烯酸。
肽聚糖亚基的这种相互连接使肽聚糖具有很强的维持细菌形状和完整性的能力,并具有弹性和延展性。
肽聚糖也具有渗透性,允许分子进出细菌细胞。
——肽聚糖的生物合成
抑制细菌细胞壁肽聚糖层的合成是许多抗菌药物的分子靶点,包括 β-内酰胺类抗生素(青霉素、头孢菌素、碳青霉烯类和单环内酰胺类)和糖肽类抗生素(万古霉素和其他较新的类似物)。
这些药物的两个主要分子靶标是转肽酶,也称为青霉素结合蛋白 (PBP),因为它们与青霉素结合,而糖基转移酶 (GT) 可被万古霉素等糖肽抑制。
PBPs 有许多亚型,给定的细菌菌株可以表达多种 PBPs。这些 PBP 在其生理特性和与抗生素相互作用的敏感性方面可能有所不同。取决于 PBP 亚型,糖基转移酶可以作为单独的酶或作为与转肽酶相关的二聚体存在。
革兰氏阳性细胞壁生物合成
图片来源自(Wikipedia Commons 和 tmedweb)
细菌细胞壁由重复的 N-乙酰氨基葡萄糖 (NAG) 和 N-乙酰胞壁酸 (NAM) 亚基链组成。NAM 亚基附有短肽链。
肽链的组成因细菌而异,但近端的丙氨酸通常是 L-Ala,而远端的两个通常是 D-Ala。也与青霉素结合的细胞壁转肽酶(青霉素结合蛋白:PBPs)在肽侧链之间形成键,并从肽侧链之一排出末端 D-丙氨酸。
一旦形成交联,PBP 就会从壁上解离。用糖基转移酶 (GT)分离酶结构域NAM 和 NAG 残基之间的活性形成联系。一些高分子量 PBP(例如 PBP2)是含有转肽酶和糖基转移酶结构域的酶复合物。
磷壁酸纤维存在于革兰氏阳性菌的细胞壁中,由磷酸甘油或磷酸核糖醇的聚合物组成。它们参与细菌与黏膜细胞的附着,可诱发感染性休克,类似于革兰氏阴性菌释放的 LPS(内毒素)。
磷壁酸
这是由甘油共聚物组成的加固墙。
磷壁酸是水溶性的,占细菌细胞壁总干重的 50%。
它要么直接与肽聚糖共价连接,要么与细胞膜(脂磷壁酸)连接。通过 6-羟基 N-乙酰胞壁酸与肽聚糖直接相连。
带负电荷,延伸到肽聚糖表面,使细菌细胞壁带负电荷。
它还有助于维持细胞壁的结构。
它在革兰氏阴性菌中完全不存在。
脂质
它们在肽聚糖下方有一层薄薄的脂质,大约 2-5%,其作用是锚定细菌细胞壁。
细胞壁
——细胞壁非常复杂
结合细胞外膜的主要作用,加上一层肽聚糖,其功能特性复杂,这里是对细胞壁及其功能部分的描述。
革兰氏阴性细菌的细胞壁具有一层2-7nm的肽聚糖薄层和7-8nm厚的外膜。
——周质空间较大
显微镜下,细胞膜和细胞壁之间有一个空间,称为由周质组成的周质空间。在革兰氏阴性菌和革兰氏阳性菌中均能发现,但在革兰氏阴性菌中,周质空间较大。
革兰氏阴性细菌细胞壁
在结构上,革兰氏阴性细胞壁由细胞膜外部的两层组成:一层薄薄的肽聚糖(太薄而无法吸收大量甲基紫染色)和一层外膜(革兰氏阴性细菌独有),通常含有促进小(<700 Da)亲水分子(例如糖、氨基酸和维生素)扩散的孔蛋白。
许多抗生素(例如许多青霉素和头孢菌素)也可以通过孔蛋白扩散到达它们的作用部位。
然而,万古霉素 (1449 Da) 的质量太大,无法透过孔蛋白到达其作用部位,这使其对革兰氏阴性细菌无效。因此,外膜为革兰氏阴性菌提供了对某些抗生素的固有“内在抗性”,可以通过改变孔蛋白的表达水平或改变孔蛋白的孔特性以降低抗生素的渗透性来进一步修饰。
革兰氏阴性菌的外膜还含有脂多糖 (LPS)或内毒素,可被细菌排出,引起宿主强大的免疫反应。
周质空间
革兰氏阴性菌的周质空间由几种蛋白质组成,这些蛋白质有助于获取营养,例如攻击核酸和磷酸化分子的水解酶,以及积极协助将物质运输到细菌细胞中的结合蛋白。周质空间还具有合成肽聚糖和修饰可能对细胞造成伤害的有毒元素的酶。
肽聚糖
革兰氏阴性细菌细胞壁有一层薄的肽聚糖层,位于质膜上方,约占细胞干重的5%。厚度不超过4纳米,一些细菌如大肠杆菌只有2纳米厚的肽聚糖。
外膜和脂多糖
革兰氏阴性菌还有第二层脂质双层,位于肽聚糖层的外部。这种外膜通过布劳恩脂蛋白与肽聚糖相连。外膜和肽聚糖之间的紧密连接是维持外膜作为许多有毒分子和抗生素的不渗透屏障所必需的。
外膜上的粘附位点也加强了革兰氏阴性细胞壁,这些粘附位点在允许细胞接触和膜融合方面发挥作用。物质通过这些粘附位点进入细胞。
革兰氏阴性菌结构

图源:Jeff Dahl,wikipedia
外膜主要由脂多糖 (LPS)组成,脂多糖是由脂质和碳水化合物组成的大型复杂分子。脂多糖由3个单元组成:脂质A、核心多糖和O侧链。
脂质A由两种氨基葡萄糖糖衍生物组成,每个衍生物含有三种脂肪酸和焦磷酸盐,脂多糖的任何剩余部分都会伸出膜表面。
O侧链也称为O抗原,是从核心向外延伸的链。它由导致细菌菌株之间变异的糖组成。这些 O 抗原也负责细菌逃避抗体反应。
// 外膜及其脂多糖的作用
——脂多糖负责保护细胞壁免受外部攻击
LPS 带有负电荷,使电池表面带负电荷。因此,这稳定了膜结构。
脂质A是脂多糖的有毒成分,因此它起到内毒素的作用。
——防毒素进入,防成分丢失
外膜及其脂多糖有助于防止抗生素、胆汁盐和其他有毒元素进入并破坏细胞。
外膜由孔蛋白组成,使其具有渗透性,允许小分子(如葡萄糖)进入。维生素 B12 等较大的分子通过特定的载体运输穿过外膜。
外膜还有助于防止成分丢失,特别是来自周质空间。
下表描述了主要的革兰氏阳性致病菌,它们的基本形态特征以及它们在人类中引起的疾病。

已知革兰氏阴性菌是正常菌群,部分会导致严重的人类感染,从社区获得性感染到医院感染。
革兰氏阴性菌外膜的结构是其众多显着特征之一。脂多糖 (LPS) 存在于膜的外叶上,其脂质 A 部分用作内毒素。
// 革兰氏阴性菌感染:严重时可危及生命
如果由于某种原因,革兰氏阴性细菌能够到达动物的循环系统,脂多糖将激活免疫系统,并触发先天免疫反应,产生细胞因子和激素调节剂。这会引起炎症,并可能导致毒性反应,从而导致发烧、呼吸急促和低血压。这就是已知革兰氏阴性细菌会导致危及生命的休克的原因。
内毒素休克的一些症状:
发烧和发冷或体温下降、发炎、皮疹、呼吸急促、心率加快、低血压、多器官衰竭等。
下表给出了一些革兰氏阴性致病细菌的例子以及它们在人类宿主中引起疾病和感染时表现出的临床特征。

如上表所述,已知革兰氏阳性细菌会引起多种感染,如果不及时和适当地治疗和管理,可能对人类造成灾难性的影响。
革兰氏阳性杆菌感染用抗生素治疗。青霉素、氯唑西林和红霉素可治疗 90% 以上的革兰氏阳性菌。
常见的革兰氏阳性抗菌药物及作用机制

然而,抗生素耐药性正在成为革兰氏阳性感染的一个严重问题。研究人员正在开发新的药物来帮助解决这个问题。只有在绝对需要时才应使用抗生素。需要严格遵循感染控制标准,以防止抗生素耐药性感染的发展和传播。
由于它们的外膜,这些细菌对溶菌酶和青霉素具有抗性。这是因为存在保护内膜和细胞壁的外壁。
在周质空间(两个细胞膜之间的区域)中也发现了分解或改变抗生素的酶。用于治疗革兰氏阴性菌感染的治疗方法包括羧基、氨基和脲基青霉素。为了对抗可以消化这些药物的酶,有时将它们与β-内酰胺酶抑制剂结合使用。β-内酰胺酶是一种存在于周质中的酶。
针对细菌病原体的抗菌剂被称为抗生素。这些抗生素启动针对细菌细胞的阻断或抑制机制,以诱导细菌细胞增殖和复制。
用于对抗革兰氏阴性菌的抗生素示例

抗生素耐药性是现在世界上的一个主要临床问题。
耐多药细菌在人群中变得越来越普遍,如果不进行有效治疗,这种感染可能会导致肾功能衰竭、败血症,甚至死亡。
微生物以多种方式抑制临床治疗中使用的许多抗菌剂。这些包括改变药物结合位点的方法,改变药物构象的方法,改变膜通透性的方法,可以导致耐药机制失活。
例如革兰氏阴性菌中有两层膜,外膜和内膜。脂多糖被认为是一种非常强的免疫反应诱导剂,它具有三个重要成分:脂质 A、亲水性多糖、抗原 O 的疏水域。
疏水域在细胞膜的外部表达。它是疏水成分脂质a,它负责内毒素作用。LPS 在细菌中是可变的,并且由于遗传变异,一些细菌只产生一种不被 Toll 样受体识别的弱抗原。然而,有大量的革兰氏阴性菌团体可能会引起这样的反应。免疫系统也被一些 toll 样受体 4 (TLR4) 激活,这些受体存在于与免疫系统有关的众多细胞中,如巨噬细胞、单核细胞、中性粒细胞和树突状细胞。
由 LPS 和 TLR4 受体介导的先天免疫反应的激活导致反应增强,产生细胞因子、趋化因子和干扰素等。
免疫系统的反应取决于感染过程的严重程度以及侵袭性细菌中 LPS 的结构,这与菌的毒力有关。因此,虽然一些细菌(如大肠杆菌)可以诱导免疫系统,但其他细菌(如幽门螺杆菌)仅具有弱抗原性。
// 对付耐药性细菌新思路:根据电荷相互作用原理设计新药
2017 年,伊利诺伊大学化学教授和当前研究的合著者Paul Hergenrother(ACPP 负责人/MMG)在《自然》杂志上报告说 ,发现的一个关键是,如果向它们添加带正电荷的基团,例如胺,一些抗生素可以使用特定的膜孔穿透革兰氏阴性细菌的细胞膜。
这项工作表明,抗生素上带正电荷的胺基与细菌孔内的负电荷有良好的相互作用。这些吸引力使带有胺基的抗生素以一种更有利于能量的方式排列,因为它穿过收缩区的孔的最狭窄部分。不含胺的抗生素面临更高的能量屏障去通过孔隙。
这或许意味着未来可以设计新药(或修改旧药),以攻击和杀死对抗生素治疗具有耐药性的微生物。
问
革兰氏阳性细胞和革兰氏阴性细胞之间的三个区别是什么?
答
革兰氏阳性菌有一层厚的肽聚糖作为它们的细胞壁,而革兰氏阴性菌有一层薄薄的肽聚糖和外膜。
革兰氏阴性菌有脂多糖(LPS),而革兰氏阳性菌没有。
一些革兰氏阳性细菌含有霉菌酸,它会在细胞壁上形成一层蜡质层。
问
什么是革兰氏阳性感染?
答
由革兰氏阳性菌引起的感染,如耐甲氧西林金黄色葡萄球菌 (MRSA)、耐万古霉素肠球菌 (VRE) 和艰难梭菌是常见的多重耐药菌感染。
问
革兰氏阳性菌更容易治疗吗?
答
革兰氏阳性细菌,即那些具有肽聚糖外层的物种,更容易被杀死——它们的厚肽聚糖层很容易吸收抗生素和清洁产物。因此,某些容易杀死革兰氏阳性菌的洗涤剂不会破坏革兰氏阴性菌。
问
肠道内很多革兰氏阳性菌致病吗?
答
是的,人体肠胃道的大多数革兰氏阳性菌都是条件致病菌。包括微球菌、肠球菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、肺炎链球菌、草绿色链球菌、酿脓链球菌、无乳链球菌、破伤风梭菌、肉毒杆菌、产气荚膜梭菌、产气荚膜梭菌、艰难梭菌, 单核细胞增生李斯特菌等。
问
革兰氏阳性菌在哪里发现?
答
根据革兰氏阳性菌种,它们可以在人类的土壤、水生沉积物、灰尘、皮肤、口腔、肠道或生殖道中找到。
问
革兰氏阳性球菌危险吗?
答
革兰氏阳性菌可能是球菌或杆菌。这些称为常驻菌群的细菌通常不会引起疾病。革兰氏阳性杆菌引起某些感染,包括:炭疽。
问
革兰氏阳性菌对抗生素的抵抗力更强吗?
答
不是。与革兰氏阳性菌相比,革兰氏阴性菌对多种抗生素的耐药性更强。由于它们的外膜,它们对抗生素的抵抗力更强。
革兰氏阳性细菌更容易被杀死,因为它们的厚肽聚糖层很容易吸收抗生素和清洁剂。另一方面,革兰氏阴性细菌具有薄的肽聚糖层,不会吸收周围的任何异物。
问
革兰氏阳性菌有内毒素吗?
答
不会。内毒素与革兰氏阳性菌无关。这些细菌没有内毒素,因为它们没有外膜。另一方面,革兰氏阴性细菌会产生内毒素。
这些内毒素是革兰氏阴性细菌细胞外膜的一部分,只有当细胞裂解或细菌死亡时才会释放出来。内毒素是形成革兰氏阴性菌细胞壁结构的热稳定性脂多糖-蛋白质复合物。
问
为什么革兰氏阳性菌对抗生素更敏感?
答
尽管革兰氏阳性菌具有较厚的肽聚糖层,但它们比革兰氏阴性菌更容易受到某些靶向抗生素的细胞壁的影响,因为它们缺乏外膜。
大多数抗生素为了接近它们的目标,必须通过外膜。例如,亲水性抗生素通过孔蛋白。因此,革兰氏阴性菌可以通过改变它们的疏水特性或通过孔蛋白的突变来改变它们的外膜。这对这些细菌细胞产生了抵抗力。革兰氏阳性菌缺乏这一因素,因此革兰氏阴性菌对抗生素的抵抗力比它们强。
问
革兰氏阳性菌是否致病?
答
是的,大多数革兰氏阳性菌都是致病菌。致病性革兰氏阳性菌的实例包括微球菌、肠球菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、肺炎链球菌、草绿色链球菌、酿脓链球菌、无乳链球菌、破伤风梭菌、肉毒杆菌、产气荚膜梭菌、产气荚膜梭菌、艰难梭菌, 单核细胞增生李斯特菌等。
问
革兰氏阳性菌引起的常见感染有哪些?
答
炭疽、白喉、腹泻、脑膜炎、恶心、皮肤感染、尿路感染。
问
哪种抗生素对革兰氏阳性菌有效?
答
对革兰氏阳性菌有效的抗生素是青霉素、氯唑西林和红霉素,几乎覆盖了 90% 的革兰氏阳性菌感染。其他还有万古霉素、甲氧苄啶/磺胺甲恶唑,克林霉素,克林霉素等。
问
革兰氏阴性菌引起的人类常见疾病有哪些?
答
革兰氏阴性菌会在医疗机构中引起感染,包括肺炎、血流感染、伤口或手术部位感染以及脑膜炎。此外还有霍乱、鼠疫、伤寒、脑膜炎和尿路感染是人类常见的细菌性疾病。
问
为什么革兰氏阴性菌比革兰氏阳性菌更有害?
答
革兰氏阴性菌细胞壁坚硬,不易对抗生素敏感,在抗生素作用下会释放内毒素。
问
什么会杀死革兰氏阴性菌?
答
这些抗生素包括头孢菌素类(头孢曲松-头孢噻肟、头孢他啶等)、氟喹诺酮类药物(环丙沙星、左氧氟沙星)、氨基糖苷类(庆大霉素、阿米卡星)等
问
革兰氏阴性菌的分泌系统是什么?
答
革兰氏阴性菌具有广泛封闭的分泌系统,可以转移微小分子、DNA、氨基酸、蛋白质。
问
革兰氏阴性菌从哪来?
答
革兰氏阴性细菌随处可见,几乎遍布地球上所有支持生命的环境。革兰氏阴性菌包括模式生物大肠杆菌,以及许多致病菌,如铜绿假单胞菌、淋病奈瑟菌、沙眼衣原体和鼠疫耶尔森菌。
问
如何自然去除革兰氏阴性菌?
答
天然抗生素。一些天然抗生素是大蒜、蜂蜜、卷心菜、葡萄柚籽提取物、生苹果醋、特级初榨椰子油、发酵食品等。
免责声明:本公众号内容仅作交流参考,不作为诊断及医疗依据。主要参考文献:
Oliveira J, Reygaert WC. Gram Negative Bacteria. 2022 Mar 26. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 30855801.
Carroll K.C., & Hobden J.A., & Miller S, & Morse S.A., & Mietzner T.A., & Detrick B, & Mitchell T.G., & McKerrow J.H., & Sakanari J.A.(Eds.), (2019). Jawetz, Melnick, & Adelberg’s Medical Microbiology, 27e. McGraw Hill.
Acheson DWK (2015): Patient information: Food poisoning (foodborne illness) (Beyond the Basics). In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Apicella M (2015): Treatment and prevention of meningococcal infection. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Baum SG (2016): Mycoplasma pneumoniae infection in adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Crowe SE (2016): Bacteriology and epidemiology of Helicobacter pylori infection. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16.
Crowe SE (2016b): Treatment regimens for Helicobacter pylori. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16.
File TM (2016): Treatment of community-acquired pneumonia in adults in the outpatient setting. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Ghanem KG (2016): Clinical manifestations and diagnosis of Neisseria gonorrhoeae infection in adults and adolescents. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Hicks CB, Clement M (2016): Syphilis: Treatment and monitoring. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Kanafani ZA, Kanj SS (2014): Acinetobacter infection: Epidemiology, microbiology, pathogenesis, clinical features, and diagnosis. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/10/16
Kanafani ZA, Kanj SS (2016): Acinetobacter infection: Treatment and prevention. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/10/16
Kelly CP, Lamont JT (2015): Clostridium difficile in adults: Treatment. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Koulenti D et al (2009): Spectrum of practice in the diagnosis of nosocomial pneumonia in patients requiring mechanical ventilation in European intensive care units. Critical Care Med 37(9):2360-2369. doi: 10.1097/CCM.0b013e3181a037ac
Lamont JT (2016): Clostridium difficile in adults: Epidemiology, microbiology, and pathophysiology. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Li X-Z, Nikaido H (2004): Efflux-mediated drug resistance in bacteria. Drugs. 64(2):159–204.
Lowy FD (2016): Methicillin-resistant Staphylococcus aureus (MRSA) in adults: Treatment of skin and soft tissue infections. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Pegram PS, Stone SM (2016): Botulism. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Riley LW (2015): Natural history, microbiology, and pathogenesis of tuberculosis. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Sauvage E et al (2008): The penicillin-binding proteins: structure and role in peptidoglycan biosynthesis. FEMS Microbiol Rev 32:234–258. DOI:10.1111/j.1574-6976.2008.00105.x
Southwick F (2008): Infectious Diseases. A Clinical Short Course. McGraw Hill/Lange.
Sterling TR (2016): Treatment of pulmonary tuberculosis in HIV-uninfected adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Stevens DL, Bryant A (2015): Group A streptococcus: Virulence factors and pathogenic mechanisms. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Stevens DL (2016): Group A streptococcal (Streptococcus pyogenes) bacteremia in adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Swygard H et al (2016): Treatment of uncomplicated gonococcal infections. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Wanke CA (2015): Pathogenic Escherichia coli. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 7/28/16
Wanke CA (2015b): Travelers’ diarrhea: Clinical manifestations, diagnosis, and treatment. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Yeh S (2015): Microbiology, epidemiology and treatment of Haemophilus influenzae. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Sagar Aryal,Gram-Positive Vs Gram-Negative Bacteria- 31 Differences With Examples. Microbenotes.2022,January 9
Jawertz M., Alderbergs., Medical Microbiology 28th Edition.
Prescott M. L., Microbiology. 5th Edition
Lippincott Microbiology in review: 3rd edition
Faith Mokobi,Gram-Positive Bacteria- Cell Wall, Examples, Diseases, Antibiotics,2021, April 15
Faith Mokobi,Gram-Negative Bacteria- Cell Wall, Examples, Diseases, Antibiotics ,2021 ,April 15