 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
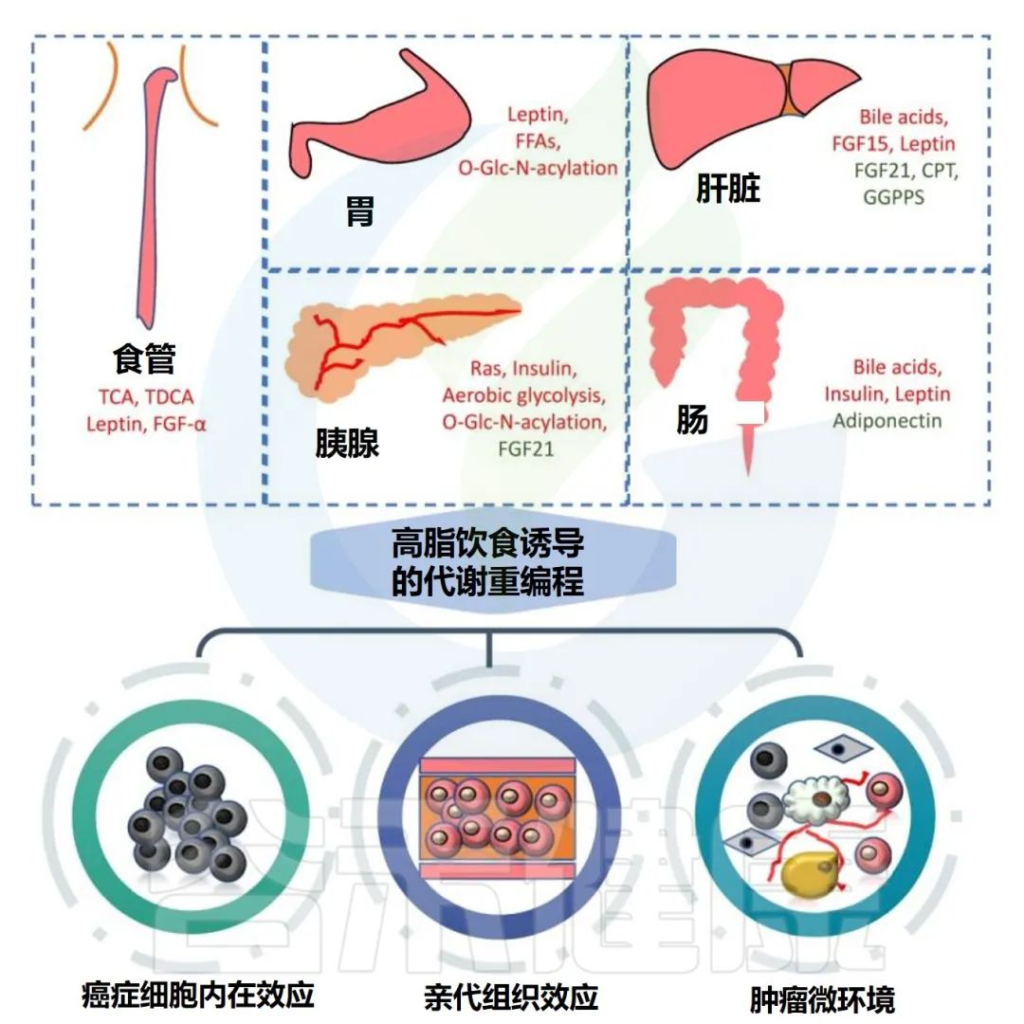
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
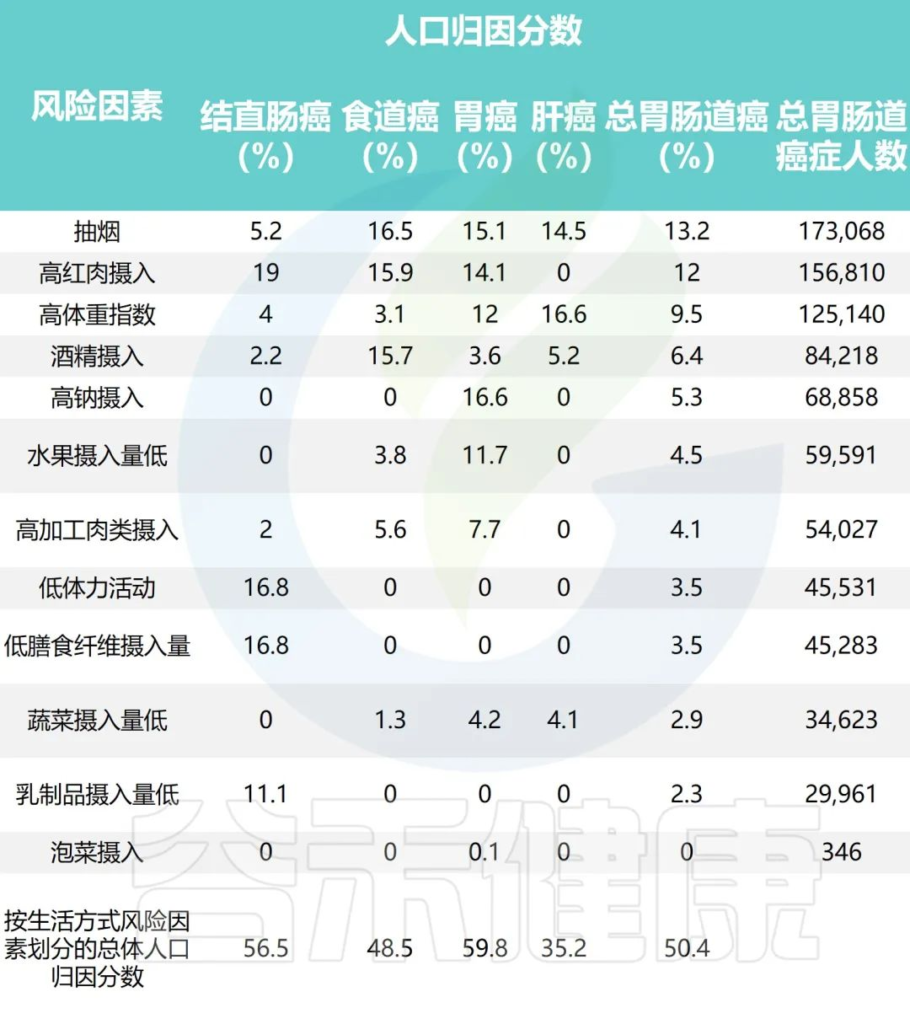
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
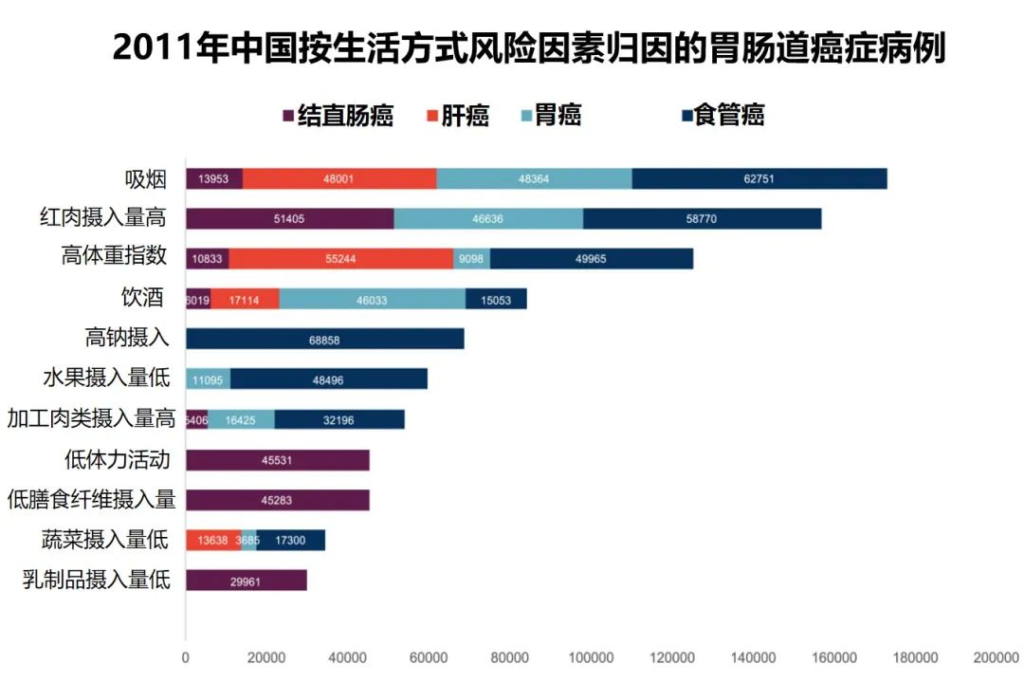
2011年中国不同生活方式危险因素的胃肠癌归因分数
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
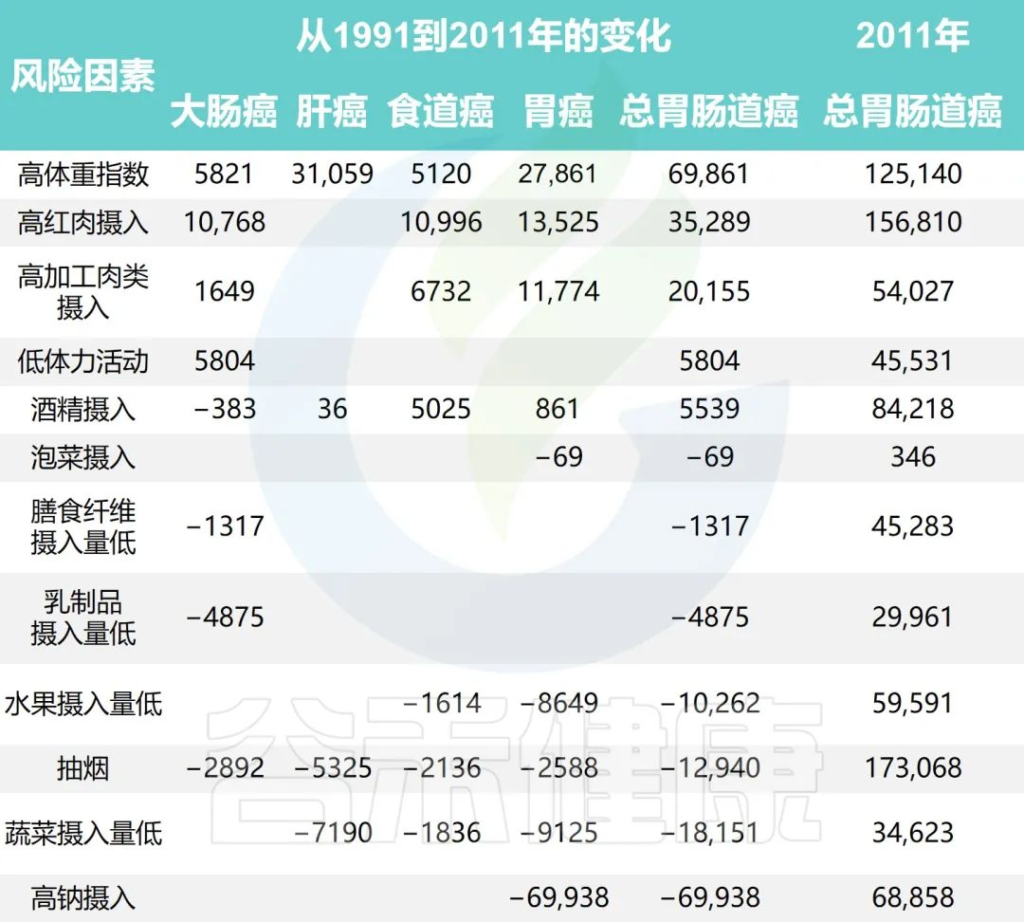
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
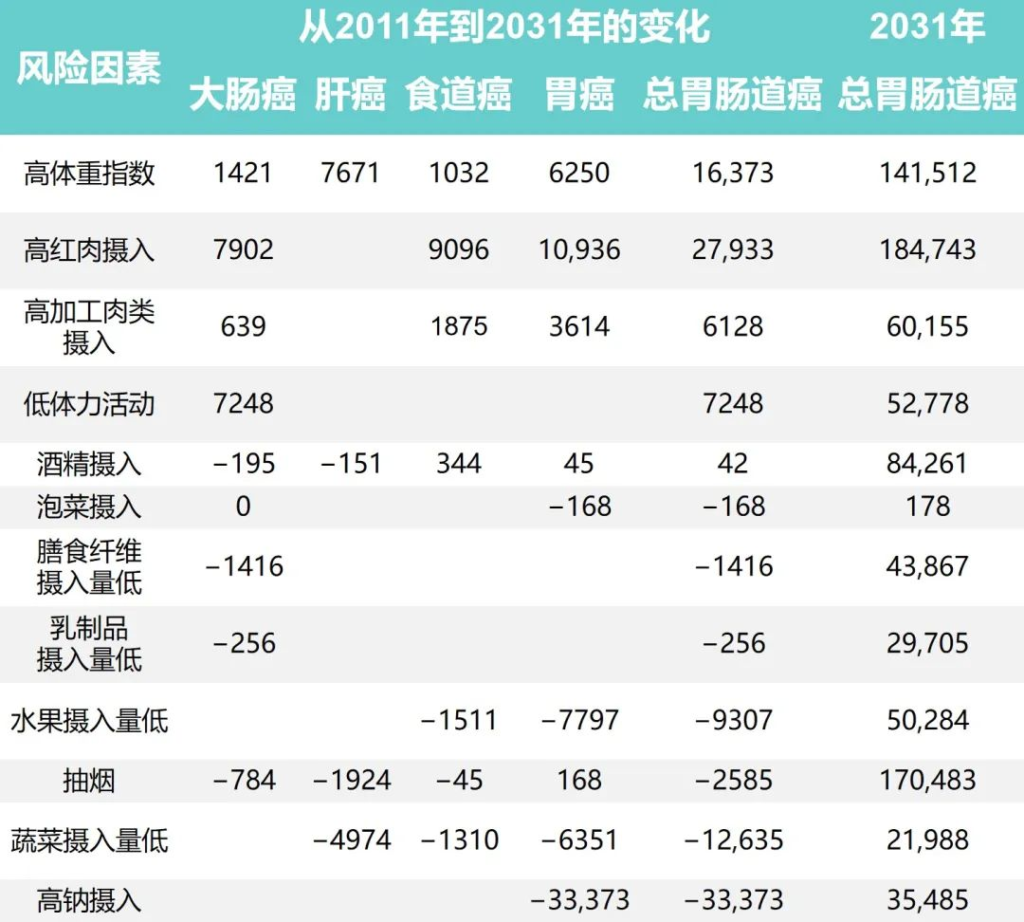
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
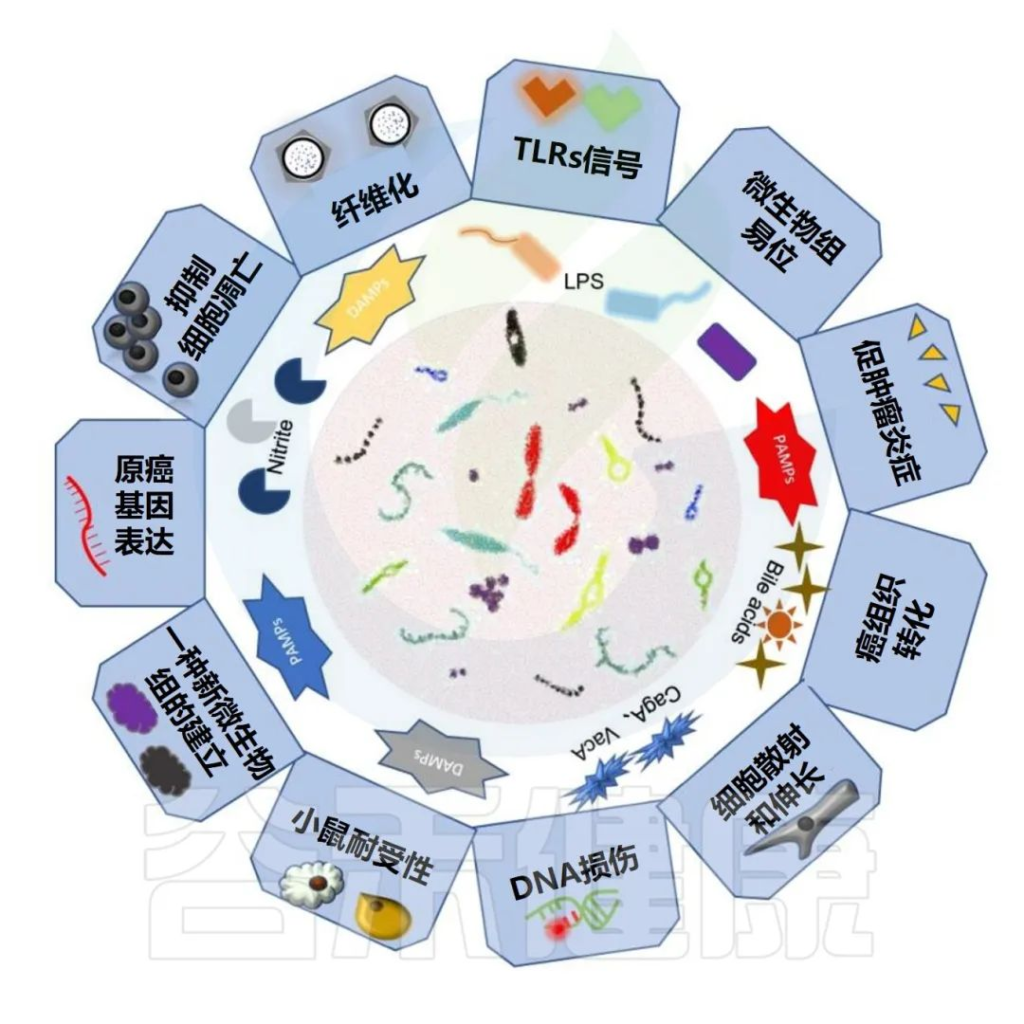
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
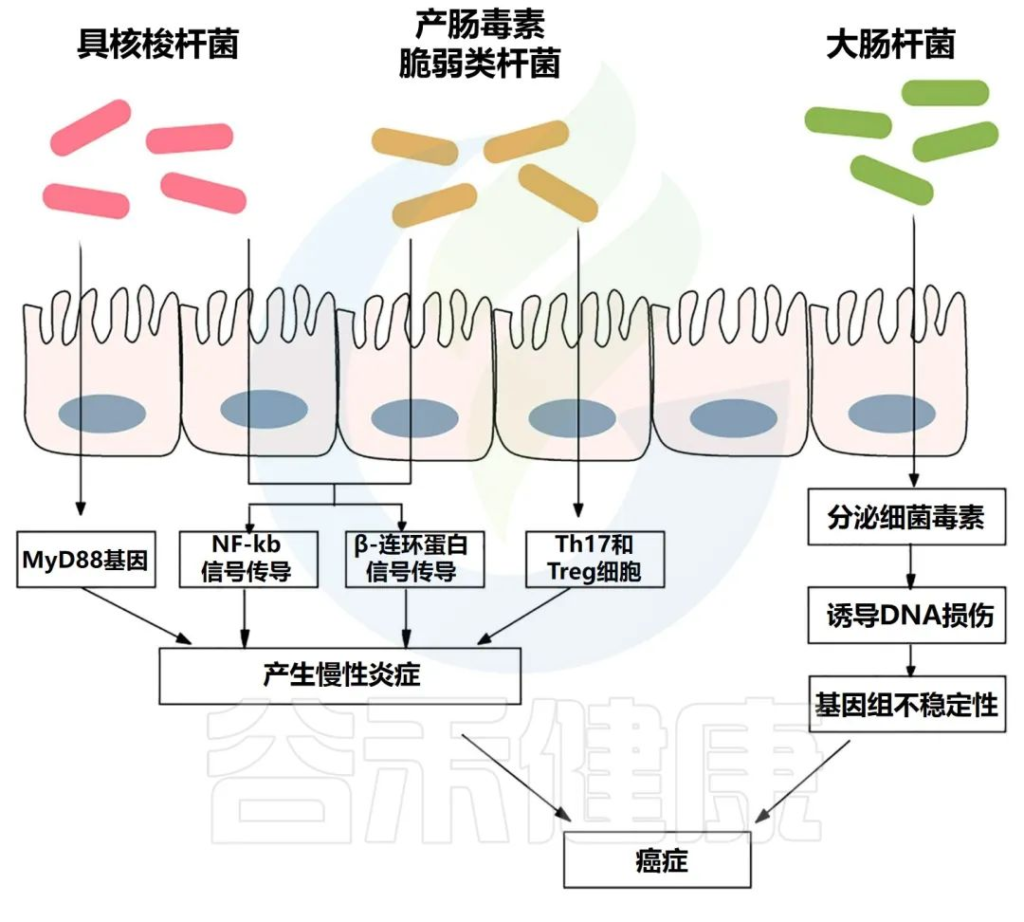
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640

谷禾健康
前面的文章中,我们已经了解到,在肝病的发生发展中肠道菌群的变化,详见:
深度解析 | 肠道菌群与慢性肝病,肝癌
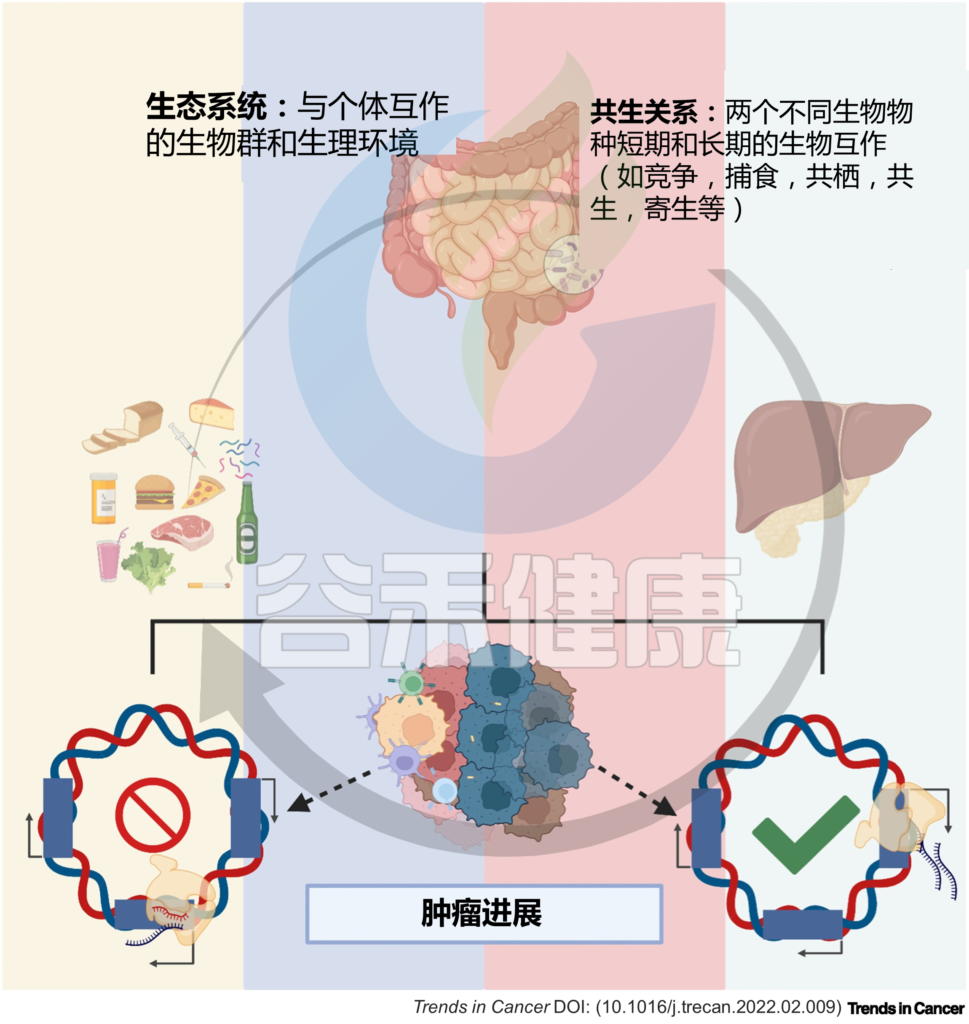
到目前为止,大多数研究都集中在细菌多样性及其代谢物与靶癌细胞表型的关联上,而没有考虑环境的微调。实际上生态系统中,个体在环境中与其他个体相互作用、相互影响和限制。
在肿瘤微环境中,特定的微生物会影响其他细胞(微生物或宿主细胞)并受其影响。
微生物群及其代谢物影响肠-肝轴的组织细胞。肠道微生物群以及肿瘤本身的细菌可以影响肿瘤微环境,包括通过调节癌症、基质和炎症/免疫细胞中的基因转录以及促进或抑制肿瘤进展。
同时,微生物群也受饮食、环境等因素影响,在环境扰动后会适应,从而影响宿主-微生物的相互作用。
本文主要阐述了微生物群在肝脏稳态中的作用,肠道菌群及其代谢物直接和间接地调节肝脏基因表达,导致肠-肝轴失衡,从而促使肝病的发生发展,甚至致癌,并对肿瘤微环境产生影响。
我们的健康和生存能力取决于共生微生物(微生物群)的存在,它们主要存在于上皮细胞界面上,在下消化道中特别丰富。
菌群维持肠道稳态
肠道微生物群中的平衡生态有助于食物加工和吸收,调节宿主新陈代谢,并通过防止病原体和病原菌的扩张或通过调节宿主免疫力和维持肠道上皮的完整性来防止感染。
肠道-肝脏-胰腺轴
在物理上,肝脏和胰腺通过胆管和胰管与肠道相通,而门静脉将肠道菌群产物输送到肝脏。因此,肠道菌群与肝脏和胰腺之间的串扰(肠道-肝脏-胰腺轴)可以将信号整合为一个相互关联的系统。
宿主与微生物群之间复杂而高度协调的相互作用代表了一个自然生态系统。共生相互作用,如互利共生、共栖、捕食、寄生和竞争,是微生物、微生物-宿主和宿主-宿主细胞之间相互作用的基础。
因此,肠-肝轴中的细胞处于稳态平衡,环境扰动会改变这种平衡,从而调节局部和全身的转录反应,并影响健康和疾病,例如癌症。
图1 微生物与宿主的相互作用调节体内平衡和疾病
关于微生物群在致癌中的作用的研究,最初集中在上皮屏障界面的肿瘤上,如胃癌和结肠癌,但胰腺导管腺癌 (PDAC) 为口腔和肠道微生物群以及癌症相关微生物群的作用提供了很多证据。
微生物群对致癌作用的影响,及细菌调节肿瘤微环境的一些机制如下:
胰腺癌研究解决了肠道菌群失调、瘤内细菌和癌症之间的联系
人类胰腺癌前体病变显示被产生 IL-17 的Th17 细胞浸润,加速了癌症的发生和进展。
几项研究表明,胰腺导管腺癌与口腔微生物组的组成、口腔病原体(如牙龈卟啉单胞菌Porphyromonas gingivalis、伴放线聚合杆菌Aggregatibacter actinomycetemcomitans)的丰度增加或口腔微生物抗体的存在有关。胰腺癌中出现了较低的α多样性,产生LPS的细菌增加,产丁酸盐菌减少。
基于与胰腺导管腺癌相关的口腔和肠道微生物群落的概况,已经提出了将胰腺导管腺癌患者与健康个体区分开来的无创诊断模型。
此外,胰腺导管腺癌研究已经确定,胰腺含有与组织相关的细菌和真菌,这些细菌和真菌在胰腺癌中比在正常胰腺组织中的含量更高。胰腺导管腺癌中的细菌主要存在于免疫细胞和癌细胞内。
在分析的每种肿瘤类型中,肿瘤内细菌的组成是不同的,可用于预测肿瘤与正常组织和肿瘤类型。
尽管在大约三分之二的胰腺导管腺癌中观察到细菌,并且数量高于大多数其他肿瘤类型,但与人类细胞相比,它们在肿瘤中的绝对数量仅为约 1/40 – 1/400。
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria较少。
胰腺导管腺癌相关微生物群的组成与十二指肠微生物群相似,这一事实表明细菌可能是通过胆胰管逆行迁移。
肿瘤相关微生物通过各种机制参与胰腺癌的发生或对治疗产生抵抗
例如,表达胞苷脱氨酶长同工型的细菌(如 Gammaproteobacteria)将吉西他滨代谢成无活性形式,导致胰腺导管腺癌出现耐药性。
瘤内细菌可能通过诱导 MDSCs 和抑制 M1 巨噬细胞分化和 CD4 +和 CD8 + T 细胞活化来重新编程肿瘤微环境;通过抗生素治疗进行的细菌消融可重新编程胰腺肿瘤免疫微环境,防止癌变并使免疫检查点抑制治疗产生反应。
然而,肿瘤内细菌也可能是有益的,并且 胰腺导管腺癌的长期幸存者在肿瘤相关微生物群中表现出更高的微生物 α 多样性和独特的特征(假黄单胞菌属Pseudoxanthomonas、链霉菌属Streptomyces、糖多孢菌属Saccharopolyspora),这可能诱导有效的免疫细胞浸润和抗肿瘤免疫。
最近有多项综述回顾了微生物调节在胰腺导管腺癌中的作用。这些研究支持胰腺导管腺癌患者的肿瘤外和肿瘤内微生物群与发育和临床进展的易感性之间的直接联系。
作为一个相互关联的系统,肠-肝轴中的微生物-宿主串扰有望成为肝癌发生的一个重要因素,就像在胰腺导管腺癌中一样。
细菌通过微生物-宿主和宿主-宿主相互作用参与致癌作用
幽门螺杆菌,已被正式确定为胃癌的明确人类致癌物。然而,新出现的证据表明,细菌,无论是存在于上皮屏障界面上还是存在于肿瘤中,都与局部或远处组织的癌变和肿瘤进展有关。
细菌在肿瘤微环境中产生选择性压力以促进肿瘤发生,部分原因是引发 ROS 的产生,影响对 pH 变化的反应,竞争有限的营养物质,增加 DNA 损伤和诱变,调节癌基因途径,影响化学疗法的代谢药物,或调节免疫。
携带产生大肠杆菌素的聚酮化合物-非核糖体肽合酶操纵子 (pks) 的大肠杆菌菌株在结直肠癌中诱导了明显的突变特征,这为细菌在基因组突变中的作用提供了证据。
微生物群对致癌基因诱导的肿瘤进展的影响得到以下观察结果的支持:
突变的p53仅在远端结肠中致癌,因为存在微生物产生的没食子酸,通过破坏 WNT 通路阻止突变的 p53 作为肿瘤抑制因子。相反,肿瘤会对局部组织细胞施加的竞争压力可能会影响肿瘤微环境、周围组织和肠道中的细菌。
宿主-宿主相邻细胞之间的肿瘤微环境竞争动态是生态系统模型的基础,在结肠和肝脏中均发现有致癌作用,并且可以为细菌调节肿瘤微环境提供底物。
恶性干细胞分泌促进邻近干细胞分化为含有促癌突变的克隆的因子。微生物群的改变可能代表另一个触发因素,结合宿主细胞串扰中涉及的其他多个信号,不仅影响癌症前体靶细胞,而且通过调整局部组织环境影响所有细胞。
此外,肿瘤相关细菌大多存在于癌细胞和免疫细胞的细胞内,可能影响癌细胞的信号传导,并在抗原呈递细胞表面以 MHC 限制性肽的形式呈递,从而刺激宿主免疫。
尽管在改进低生物量正常和肿瘤组织样本中稀有细菌的鉴定和分析技术方面取得了很大进展,但这些结果仍需谨慎解读。不过,这支持肿瘤微环境选择居住的微生物群并反过来受微生物群影响的新概念。
此外,肝脏和胰腺之间的生理联系提出了一个问题,即:最近在胰腺导管腺癌中建立的模型是否可以应用于肝细胞癌 (HCC)?
在此阐述了微生物群在维持肠-肝轴稳态中的作用,并关注环境扰动如何直接(通过诱导微生物相对丰度/多样性的变化)或间接(通过微生物代谢物的作用)触发与肝癌发生相关的基因反应。
微生物群的组成是在婴儿早期建立的,并在成年后保持相对稳定。然而,由于生活方式、饮食、疾病、感染和抗生素的使用,细菌种类的相对丰度可能会迅速改变。
微生物群与宿主之间的串扰对健康和疾病产生关键影响
微生物群通过其扩张/收缩、占据不同的解剖生态位以及遗传物质的突变和交换来适应环境变化并调节宿主反应。
微生物群在宿主从出生开始的先天性和适应性免疫系统发育中发挥着重要作用,免疫系统也塑造了宿主-微生物的相互作用。这个过程依赖于肠道黏膜表面的分隔、微生物群感应和信号传递以及免疫细胞启动,以产生特定的反应并维持体内平衡。
结合起来,上皮屏障、其微生物群落和局部免疫系统不仅可以耐受环境中的共生细菌,还可以使免疫系统对条件致病菌或微生物产物做出反应。
当这些防御机制失败时,例如由于肠道通透性增加(肠道渗漏)或生态失调(与疾病相关或与疾病有因果关系的微生物群组成的变化),就会出现细菌代谢物的涌入或先前被分隔,并且有害微生物可能通过肠道血管屏障(GVB)并通过门静脉循环延伸到肝脏。
微生物群在肝脏稳态中的关键作用
在肝脏中,环境扰动会触发肝脏免疫反应,这种反应依赖于常驻免疫细胞以及来自肠道微生物群的循环抗原和内毒素。由与肠道相关淋巴组织 (GALT) 相关的免疫监视形成,证实了微生物群作为一个相互关联的系统在肝脏稳态中的关键作用。
为什么肠道屏障的紊乱会改变肝脏的微环境?
小肠细菌过度生长(SIBO)也与肠漏和细菌流入肝脏有关。
细菌产物或微生物易位的增加会刺激与慢性肝病相关的促炎反应。相反,肝脏通过胆道在肠道中释放胆汁酸和其他生物活性介质,这些介质可能会被肠道微生物群进行生物转化,然后被吸收并释放到体循环中。
生理组织稳态的改变可能导致癌症等疾病。此外,通过将饮食模式与微生物组对免疫和代谢状态的影响和癌症治疗反应联系起来,这种关系揭示了微生物群和肝脏之间的联系,这是由局部环境扰动引发的一系列相互关联的反应。
总的来说,肠-肝轴生态系统可以触发局部和远处的反应,并勾勒出肠道微生物群与肝脏之间的直接和间接相互作用(图 2)。
图2 肠肝轴的双向关系调节体内平衡
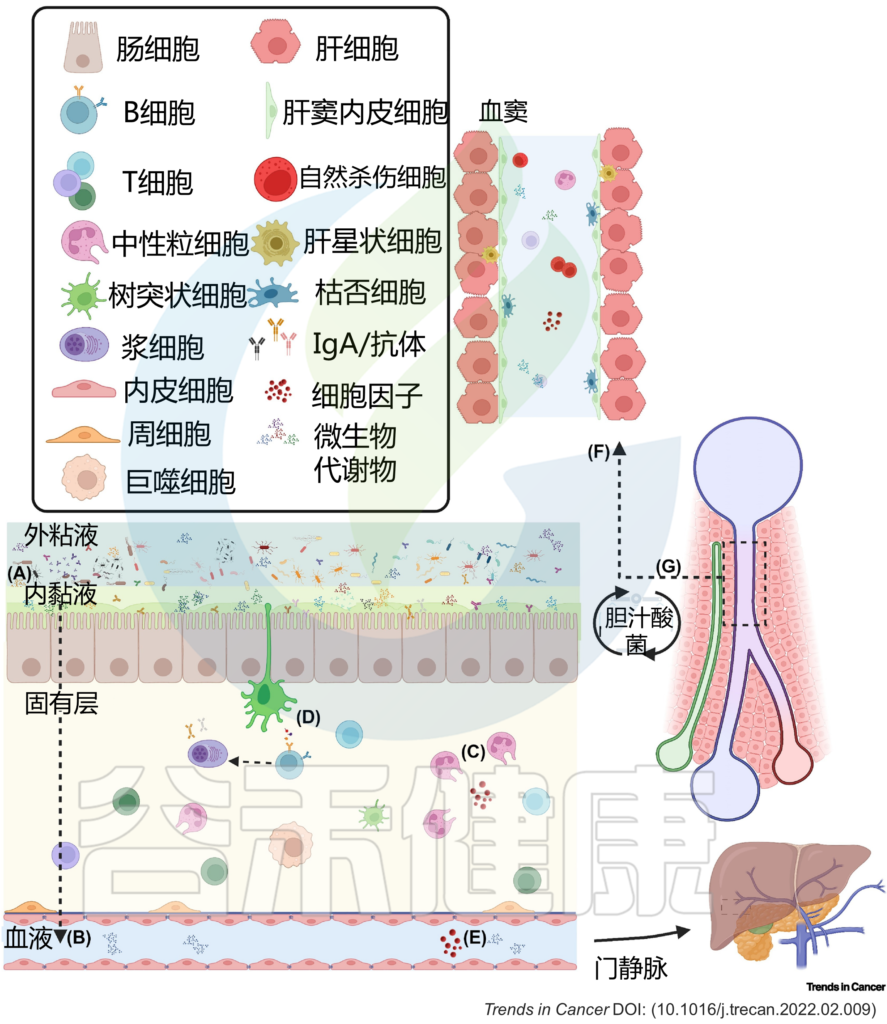
(A) 粘液从物理上将微生物群与上皮衬里分离,而抗菌肽使内部粘液几乎无菌。(B) 因此,微生物群与宿主之间的相互作用主要是间接的,并由代谢产物介导,这些代谢产物可能穿过粘液和上皮屏障,到达固有层中的免疫细胞和基质细胞,或通过淋巴和血管系统到达肝脏和体循环。(C) 免疫细胞通过产生生长因子和细胞因子来巡逻上皮细胞,并加强上皮和粘液屏障。这些产物对微生物产生选择性压力。(D) 树突状细胞感知环境并诱导T细胞和B细胞反应,从而产生IgA抗体,这些抗体转移到管腔,并通过调节微生物组成和多样性来促进粘膜免疫保护。代谢产物通过(E)肠血管屏障通过门静脉流入肝脏。(F) 在肝窦中,免疫细胞扫描异物。(G) 反过来,肝脏通过释放胆汁酸和其他生物活性介质进入胆道与小肠沟通;这些代谢物可被回肠和大肠末端丰富的微生物群生物转化,部分通过门静脉再循环到肝脏,从而可能影响局部和全身功能。
健康的肠道屏障对一些微生物代谢产物是可渗透的,但大多数完整的微生物却不能通过。
然而,饮食和其他环境因素的影响会迅速丰富或消耗特定的营养物质和细菌。这种效应会对微生物代谢物的产生和胆汁酸的转化产生影响,这有可能塑造局部微环境并与包括癌症在内的慢性肝病的发展相关。
例如,酒精会导致肠漏。与 SIBO 一起,它允许内毒素进入循环,导致肝脏疾病。SIBO 是肠道微生物菌群失调的一种表现,其特征是 α 多样性降低,在某些情况下,β 多样性增加,这可能导致全身性炎症。
增加的细菌易位会促进肝硬化进展(肝细胞癌的前体),包括:导致纤维化,通过增加肝细胞与微生物和细菌代谢物的接触,或通过在肝脏中创造转移前的小生境,改变环境以利于转移细胞的募集和增殖,从而促进肝硬化进展。
最后,在某些慢性肝病中,活细菌的易位可能导致 GALT 的免疫麻痹,表明微生物平衡的变化直接影响局部环境的机制。
下文将阐述肠道细菌如何通过扩散到肝脏、影响环境或改变其他细胞中的串扰直接影响肝癌发生。
饮食改变肠道微生物组,对免疫和新陈代谢状况、癌症风险和对癌症治疗的反应产生影响。因此,摄入食物的来源和类型在调节肠道微生物组中起着关键作用,并对宿主-微生物相互作用产生影响。
人类肠道中主要有三种类型(肠型)(拟杆菌属Bacteroides、普氏菌属Prevotella和瘤胃球菌属Ruminococcus)。
在工业化和非工业化人群中观察到的蛋白质和动物脂肪(拟杆菌属Bacteroides)与碳水化合物或植物性食物(普氏菌属Prevotella)的摄入比例不同。工业化与天然富含纤维食品的减少有关。
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
菊粉 是果糖聚合物的异质混合物。果糖摄入转化为乙酸盐,并通过微生物群衍生的乙酸盐经门静脉到达肝脏触发从头脂肪生成。在肠道中,菊粉对成年人微生物组组成的影响:
下列菌增加:
双歧杆菌Bifidobacterium
厌氧菌Anaerostipes
粪杆菌Faecalibacterium
乳杆菌属Lactobacillus
下列菌减少:
拟杆菌属Bacteroides
普氏菌Prevotella、密螺旋体Treponema、琥珀弧菌属Succinivibrio的丰度增加主要与蔬菜的纤维和碳水化合物发酵相关的饮食有关。
高纤维饮食增加了微生物组编码的聚糖降解碳水化合物活性酶,而不影响群落多样性。相比之下,高发酵食品饮食增加了微生物组的多样性并减少炎症。
从机制上讲,缺乏纤维的饮食可以使结肠粘液降解细菌增多,增强柠檬酸杆菌粘液层翻转和相关的结肠炎。这表明饮食模式可能影响肠-肝轴的多种机制。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
丁酸盐是一种短链脂肪酸,通过肠道内膳食纤维的微生物发酵产生。丁酸盐有助于黏膜稳态和肠道内壁的完整性,从而提供肠细胞的大部分能量需求,并通过与几种 G 蛋白偶联受体结合并作为组蛋白脱乙酰酶抑制剂发挥抗炎作用。在小鼠模型中,增加的膳食纤维以微生物群和丁酸盐依赖的方式防止结直肠肿瘤发生。
总的来说,这些研究强调了饮食对微生物群落的深远影响及其对宿主的影响,具体取决于摄入的食物来源。
先前的研究表明,地中海饮食与拟杆菌门Bacteroidetes和某些有益梭菌群Clostridium的富集以及变形杆菌门Proteobacteria和芽孢杆菌门Bacillota的减少有关,可以减少肝脏脂肪,被推荐用于预防非酒精性脂肪性肝病 (NAFLD)。
调节与饮食相关的微生物组是预防肝癌的潜在途径
长期食用可发酵的富含纤维的食物(如可溶性纤维菊粉或富含菊粉的高脂肪饮食)容易导致生态失调的小鼠出现炎症、胆汁淤积和肝细胞癌。总细菌负荷增加,多样性减少,变形杆菌和纤维发酵细菌(如梭菌属)的特定增加。消除这些产生丁酸盐的细菌成功地预防了富含菊粉的肝细胞癌,这表明调节与饮食相关的微生物组是预防肝癌的潜在途径。
由于肠道微生物群失调,高胆固醇/高脂肪饮食依次导致小鼠阶段进展为脂肪变性、脂肪性肝炎、纤维化,最终导致 NAFLD-肝细胞癌。
在每个阶段都富集了不同的微生物群组成,因为在肝细胞癌患者中:
Mucispirillum、Desulfovibrio、Anaerotruncus和 Desulfovibrionaceae依次增加,
而Bifidobacterium、Bacteroides被耗尽。
综合这些发现,饮食模式会通过富集与健康或疾病相关的特定细菌来影响肠道微生物组,从而对肝脏产生潜在影响。
许多微生物群代谢物是肝癌发展的危险因素。考虑到环境塑造和选择特定的微生物群,推测某些物种可能获得哪些竞争优势以及特定微生物群的富集如何影响肝癌的进展。
相似或不同的微生物群组成是否可能参与肝细胞癌和胆管癌 (CCA) 的发展?现在下结论还为时过早,在这部分讨论这两种类型的肝癌。
肝脏中肿瘤和非肿瘤区域之间菌群不同
最近有报道称,病毒和非病毒病因的肝细胞癌中的 16S rRNA 基因测序确定了肝脏中肿瘤和非肿瘤区域之间不同的微生物组成,其中拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形杆菌门Proteobacteria的物种占肿瘤相关菌群的主导地位。相关微生物群Ruminococcus gnavus被确定为感染肝炎病毒的 肝细胞癌患者的特征分类群。
肝硬化、肝细胞癌患者的肿瘤微生物群显示出更高丰度的嗜麦芽窄食单胞菌Stenotrophomonas maltophilia,这与肝星状细胞 (HSC) 中的衰老相关分泌表型 (SASP) 相关,证实了菌群失调与肝细胞调节之间的关联。
NAFLD肝硬化中,伴或不伴肝细胞癌的患者菌群不同
肝细胞癌患者的拟杆菌属Bacteroides和瘤胃球菌科Ruminococcaceae丰度增加,双歧杆菌Bifidobacterium丰度降低,这与粪便钙卫蛋白水平升高和全身炎症相关。同样,与肝硬化患者相比,早期肝细胞癌患者的肠道菌群中产生脂多糖 (LPS) 的菌群增加,而产生丁酸盐的菌群减少。
这些数据表明,在患有 NAFLD 和肝硬化的肝细胞癌患者中,肠道菌群组成与全身炎症相关,并可能促进肝癌的发生。
乙肝病毒感染进展的肝细胞癌的菌群特点
从乙型肝炎病毒 (HBV) 感染进展的肝细胞癌患者显示出丰富的抗炎细菌(例如,普氏菌Prevotella、乳酸杆菌Lactobacillus、双歧杆菌Bifidobacterium、粪杆菌Faecalibacterium)和减少的促炎细菌(例如,大肠杆菌-志贺氏菌Escherichia-Shigella、肠球菌Enterococcus),肠道微生物群可能与调节宿主免疫生物学途径的 HBV 感染有关的成分。
这些研究强调了在肝细胞癌中观察到的微生物多样性,这代表了已知风险因素与肝细胞癌发展之间的相关性。
作为饮食和其他环境因素影响微生物组的相互关联的系统,有必要在多个评估部位(肿瘤和非肿瘤)和组织中表征局部微生物群的组成和多样性,与单细胞分析相关并可能相关与环境因素。此外,突出特定细菌物种富集的潜在因果关系的功能分析是超越相关性的关键步骤。
胆管相关的微生物群
一些细菌科,如Dietziaceae、Pseudomonadaceae、Oxalobacteraceae主导了胆管相关微生物群,表明独特的微生物群落存在于这一解剖学定位中。
肝外胆管癌患者有大量肠球菌Enterococcus、链球菌Streptococcus、拟杆菌属Bacteroides、克雷伯氏菌属Klebsiella、锥体杆菌属Pyramidobacter。
此外,与胆总管结石患者相比,胆管癌患者的胆汁样本富含肠杆菌属Enterobacter、假单胞菌属Pseudomonas、窄食单胞菌属Stenotrophomonas。
最后,与肝细胞癌或肝硬化患者和健康个体相比,肝内胆管癌患者肠道菌群中的4个细菌属增加:
乳酸杆菌Lactobacillus、放线菌Actinomyces、消化链球菌Peptostreptococcus、异体卡多菌Alloscardovia。
肠道微生物群特征可以来区分胆管癌和胆石症
在胆管癌中富集的菌群:拟杆菌属Bacteroides、Muribaculaceae_unclassified、Muribaculum、Alistipes属的物种。
而不同的微生物物种在胆石症组中富集,这表明在从良性肝胆疾病到恶性肝胆疾病的演变过程中微生物关联发生了变化。
总的来说,这些过程可能解释了肠道细菌易位直接导致建立有利于肝癌发展和进展的发炎肝脏环境之间的联系。然而,很难根据与微生物相对丰度的相关性来唯一地假设因果关系,微生物相对丰度由于多种环境因素而迅速改变。
因此,全面的跨界网络分析比较肝细胞癌和胆管癌,并将局部肠道和组织微生物群的组成和多样性以及环境因素对代谢、免疫和转录改变的影响联系起来,对于剖析微生物群在肝癌的发生及其作用机制调节中的因果作用至关重要。
“
强调了微生物群变化对肝脏环境的间接影响(可能通过环境中其他细胞或微生物代谢物的串扰)及其与肝癌发生和进展的关系。
为了了解特定微生物群在肝肿瘤中的潜在影响,有必要将潜在机制以及微生物与其他细胞之间的串扰联系起来。
小鼠中肝细胞癌发展的演变
从这个意义上说,最近的一项研究描述了Mdr2 缺陷小鼠中肝细胞癌发展的时间演变,这些小鼠缺乏从肝脏将磷脂分泌到胆汁中的能力,从而经历胆汁淤积和肝细胞癌发展。
在这些代表炎症诱导肝细胞癌的有用模型的小鼠中,肠道菌群失调诱导肠道屏障功能障碍,先于 LPS 介导的肝脏转录改变,从而导致肝细胞癌发展。
此外,肝内炎症基因谱从肝损伤早期的促炎表型转变为肝细胞癌的免疫抑制表型。这种变化与通过微生物组功能从碳水化合物向氨基酸代谢的转变来重新调整能源利用有关。
菌群改变通过代谢和炎症影响肿瘤发生
微生物群的改变通过影响肝脏碳水化合物和脂质代谢调节炎症,从而导致 NAFLD 及其进展为非酒精性脂肪性肝炎 (NASH)。代谢和炎症的调节可能同样影响肝脏肿瘤发生。
肠道微生物组受饮食和其他环境因素的影响,微生物与营养物质的竞争是调节新陈代谢和免疫反应的关键步骤。例如,通过微生物群介导的膳食纤维发酵产生 SCFA 与胆汁淤积型肝细胞癌相关。
有人认为,细菌产物的易位可能会刺激炎症并释放 GALT 中的活性氧 (ROS),从而影响机械和分泌屏障以及局部微生物群。
这些研究强调需要继续进行系统和全球研究,将肠-肝轴中微生物物种的多样性和丰度作为一个生态系统进行表征,同时也需要开始剖析这些表型背后的机制。
最近有人提出,母亲在怀孕期间摄入丁酸盐和谷氨酰胺会影响新生小鼠的粪便微生物群和代谢物,这与拟杆菌和梭状芽胞杆菌的粪便特征有关。
此外,这些新生小鼠对肝脏免疫激活有抵抗力,导致胆管炎症和损伤。
从机制上讲,细菌代谢物在宿主细胞中触发基因反应的影响可能取决于环境中的转录改变。
对急性肝衰竭动物模型中不同的转录特征进行了检查,表明肠道微生物群和 Toll 样受体 (TLR) 信号激活肝星状细胞、枯否细胞和肝窦内皮细胞 (LSEC) 中的 MYC 依赖性转录程序,导致 Ly6C 阳性炎性单核细胞浸润和肝功能衰竭。
图3 微生物代谢产物和多样性是肝癌进展的触发因素


(A)一些细菌可能会穿透粘液屏障或参与其降解,在某些情况下导致上皮屏障的破坏或破坏,从而允许(B)微生物和微生物代谢物和免疫细胞之间的直接接触,诱导促炎细胞因子的产生和全身传播。粘液/上皮屏障的破坏也可能促进(C)细菌转移到肝脏(D),这为癌细胞的播散创造了一个有利的生态位。因此,先前划分的细菌和微生物产物的涌入影响了局部肝细胞的基因表达。例如:(E)肝细胞可能表达CXCR1并诱导CRCX2+多形核髓系衍生抑制细胞(PMN-MDSCs)的积累,创造免疫抑制环境促进胆管癌(CCA);(F)激活的肝星状细胞在肝细胞癌(HCC)和癌症转移中发挥多种功能,可能通过CXCL12-CXCR4相互作用破坏肝脏中自然杀伤细胞(NK)的功能,改变NK细胞介导的免疫,促进乳腺向肝脏转移;而(G)其他的肝脏免疫细胞可能通过脂多糖(LPS) – toll样受体4 (TLR4)或脱氧胆酸(DCA) -TLR2调节而被激活,并诱导促进肝细胞癌发生的炎症反应。相比之下,(H)被肠道菌群修饰后的肝脏产生的胆汁酸可能会激活肝脏自然杀伤T细胞(NKTs)在肝脏中的趋化因子依赖性积累,从而控制肿瘤的生长。
LPS调节影响肝细胞癌
循环水平的LPS通过TLR4 激活并诱导肝星状细胞分泌生长因子、调节肝脏慢性炎症状态和抑制细胞凋亡,这些过程与肝细胞癌促进有关。门静脉区域 LPS-TLR4 相互作用下游的转录调节因子 YAP1 的激活调节肝细胞的干性。
因为肝细胞周转的位点定位在激活基础稳态和再生的分子途径中很重要。推测 LPS 也可以通过调节局部微环境重编程来调节这些机制以影响肝细胞癌。
肠道微生物群调节肝细胞的基因表达程序,促进肝细胞癌和胆管癌
在胆管癌中,增加的肠道通透性诱导微生物 LPS 易位进入肝脏,通过 TLR4 依赖性机制诱导肝细胞中 CXCL1 的表达。这种表达反过来导致 CCR2 +多形核髓源性抑制细胞 (MDSCs) 的积累。
肝硬化肝细胞癌患者的瘤内S. maltophilia丰度更高。 通过激活 TLR4/NF-κB/NLRP3 通路诱导衰老肝星状细胞中衰老相关分泌表型SASP因子和促炎因子的表达,从而促进肝纤维化,随之而来的肝纤维化加重并发展为肝细胞癌。
肝星状细胞增殖是肝纤维化发展的关键事件。最后,胆汁酸通过激活表皮生长因子受体诱导肝星状细胞增殖。
饮食会迅速改变人体肠道微生物组。饮食衍生的微生物代谢物对甲酚硫酸盐、4-乙基苯基硫酸盐和 4-甲基儿茶酚会影响肝细胞癌亚型。
人类肠道微生物组编码的代谢途径通过众多生物活性分子不断与宿主基因产物相互作用。例如,营养过剩会增加 IL-17A,进而诱导白色脂肪组织中的中性粒细胞浸润和 NASH 诱导的肝细胞癌。
IL-17A 是一种促肿瘤细胞因子,通过调节Kupffer细胞和骨髓源性单核细胞的炎症反应和脂肪变性肝细胞的胆固醇合成,调节酒精诱导的肝脂肪变性、炎症、纤维化和肝细胞癌的进展。
地高辛,一种类视黄醇孤儿受体 γ t (RORγt) 拮抗剂,降低了 IL-17A 水平并稳定了体重。表明其在代谢紊乱中的关键作用。
此外,TNF和IL-17A 与骨髓来源细胞中NLRP3 炎性体激活诱导的肝脏炎症和纤维化的发展有关。
总的来说,这些研究表明饮食代谢物、细胞因子和肝癌疾病之间存在机制联系。
初级胆汁酸在肝细胞中合成,释放到十二指肠,大部分在小肠中重新吸收。一小部分初级胆汁酸逃逸到结肠,肠道共生细菌将其转化为次级胆汁酸,次级胆汁酸对新陈代谢和宿主先天免疫反应具有多种重要功能。
饮食和微生物胆汁酸代谢物均可调节 RORγt 阳性调节性 T 细胞(Treg) ,有助于维持宿主免疫稳态和改善肠道炎症。此外,胆汁酸代谢物可以通过调节 Th17 和 Treg 细胞的平衡来控制宿主免疫反应。
胆汁酸可以在高脂肪饮食中发挥积极作用
膳食胆固醇诱导肠道细菌代谢物改变,包括增加牛磺胆酸和减少 3-吲哚丙酸,从而在小鼠中驱动 NAFLD-肝细胞癌。因此,胆固醇抑制疗法和肠道菌群操作可能是预防 NAFLD-肝细胞癌的有效策略。
石胆酸 (LCA) 衍生物直接影响 CD4+ T 细胞(3-oxoLCA 和 isoalloLCA)
3-oxoLCA 通过直接结合转录因子 RORγt 抑制 Th17 细胞分化,而 isoalloLCA 增强 Treg 细胞分化,证实肠道微生物群可能控制宿主免疫反应。
对于肝内胆管癌,观察到甘熊去氧胆酸和牛磺脱氧胆酸血浆:粪便比率增加,血浆牛磺胆酸和 IL-4 呈正相关,表明肠道微生物群、代谢物、细胞因子和胆汁酸之间存在相互关系。
肥胖诱导的菌群失调促进肝癌发生
最近的一项综合组学研究揭示了一种胆汁酸代谢物升高、胆固醇代谢失调和与 BMI 增加相关的独特炎症反应的胆管癌亚型,这表明肥胖诱导的肠道微生物群失调促进肝癌发生的模型。
从机制上讲,胆汁酸/致癌轴涉及胆汁酸受体,例如法尼醇 X 受体 (FXR) 和 G 蛋白偶联胆汁酸受体 1,它们可能代表癌症的重要治疗靶点。胆汁酸如脱氧胆酸 (DCA) 被证明可阻断 FXR 的功能及其抑制肠癌干细胞增殖的能力,从而影响肠-肝轴稳态。
此外,胆汁酸传感器 FXR 或 G 蛋白偶联受体 TGR5 的激活通过抑制 NF-κB 依赖性信号通路和 NLRP3 依赖性炎症小体活性来抑制炎症信号传导。因此,饮食-肝脏-胆汁酸-微生物群的串扰在胃肠道炎症以及结直肠癌和肝癌的发生中起重要作用,可用于预防癌症的发生或进展。
菌群利用胆汁酸作为信使影响抗肿瘤免疫
肠道微生物组可以利用胆汁酸作为信使,来控制趋化因子依赖性肝脏自然杀伤 T 细胞 (NKT) 的积累,从而影响肝脏中的抗肿瘤免疫。这一过程是由共生肠道细菌的改变、初级和次级胆汁酸的平衡以及 LSEC 中的 CXCL16 表达介导的,LSEC 是最早暴露于肝脏中肠道衍生代谢物的细胞之一。
相反,NKTs 通过与肝细胞的相互作用与 CD8 T 细胞合作,促进 NASH 和 NASH相关的肝细胞癌。
NK 细胞和肝星状细胞之间的相互作用——癌症休眠和转移的主要开关
基质反应阻碍了 NK 细胞和干扰素 γ 介导的肿瘤细胞休眠的维持,并通过组织损伤和活化的肝星状细胞分泌 CXCL12 的过程诱导肝转移,CXCL12 通过 CXCR4 保留和使 NK 细胞静止,抑制免疫监视和促进转移性生长。
某些与肥胖相关的细菌具有增加次级胆汁酸脱氧胆酸的能力
脱氧胆酸的增加会导致肝星状细胞中的 DNA 损伤,从而诱导衰老相关分泌表型,导致炎症和肿瘤促进因子以及 COX2 诱导的免疫抑制性 PGE2 在肝脏中的产生,从而促进肝细胞癌的发展。
肥胖还与微生物群改变有关,导致 TLR2 激动剂脂磷壁酸 (LTA)这一革兰氏阳性菌的主要细胞壁成分的积累增加。脱氧胆酸增加肝星状细胞上 TLR2 的表达,并与 LTA 协同诱导衰老相关分泌表型因子和 COX2,后者通过 PGE2 诱导免疫抑制,并在化学致癌物暴露后促进肥胖相关的肝细胞癌。
总之,这些研究支持了一个模型,即平衡状态的改变会对环境中的连接细胞产生影响,证实微生物组及其代谢物是肠道和肝脏基因反应的关键影响因素,对肝癌发生具有影响。
本文主要介绍了影响肝细胞癌的微生物群的复杂相互作用,强调了微生物群多样性或肠-肝轴中微生物代谢物的改变触发局部细胞中的基因反应。
与肝细胞癌相比,微生物群和PDAC对患者预后的相关性已得到更彻底的研究,并已明确开始确定特定机制,通过这些机制,微生物群可以局部或系统地影响肿瘤微环境,以及肿瘤进展和对治疗的反应。因此,胰腺导管腺癌研究中使用的一些策略可以应用于肝细胞癌研究。
可以看到,目前的研究分析环境中局部细胞内微生物群介导的直接和间接变化,研究视角已逐渐从靶细胞转向微环境/生态系统。肠道微生物群以及肿瘤本身的细菌通过调节癌症、基质和炎症/免疫细胞中的基因转录程序以及促进或抑制肿瘤进展来影响肿瘤微环境。
癌症干细胞和免疫细胞之间的串扰在癌症进展中起着重要作用,那么癌症干细胞是否容易被微生物/代谢物的改变触发?这也是值得关注的问题。由于物理和生理上的联系,评估微生物群对癌症干细胞分化的影响以及作为一个综合系统对肠-肝轴生态系统的影响也非常重要。
主要参考文献:
Silveira MAD, Bilodeau S, Greten TF, Wang XW, Trinchieri G. The gut-liver axis: host microbiota interactions shape hepatocarcinogenesis. Trends Cancer. 2022 Mar 21:S2405-8033(22)00045-0. doi: 10.1016/j.trecan.2022.02.009. Epub ahead of print. PMID: 35331674.
Komiyama S, Yamada T, Takemura N, Kokudo N, Hase K, Kawamura YI. Profiling of tumour-associated microbiota in human hepatocellular carcinoma. Sci Rep. 2021 May 19;11(1):10589. doi: 10.1038/s41598-021-89963-1. PMID: 34012007; PMCID: PMC8134445.
Zhang T, Zhang S, Jin C, Lin Z, Deng T, Xie X, Deng L, Li X, Ma J, Ding X, Liu Y, Shan Y, Yu Z, Wang Y, Chen G, Li J. A Predictive Model Based on the Gut Microbiota Improves the Diagnostic Effect in Patients With Cholangiocarcinoma. Front Cell Infect Microbiol. 2021 Nov 23;11:751795. doi: 10.3389/fcimb.2021.751795. PMID: 34888258; PMCID: PMC8650695.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980. doi: 10.1126/science.aay9189. PMID: 32467386; PMCID: PMC7757858.
谷禾健康
胰腺癌是致命的癌症之一,其特点是:
难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌为什么难发现?这要从胰腺癌的位置说起。
胰腺位于人体后腹部深处,被胃、肝等层层围绕,且体积小,胰腺癌早期几乎没有不适。普通检查手段较难发现。
随着胰腺肿瘤的生长,出现的许多症状看起来与其他疾病的症状很像,比如:发冷和出汗、发热、腹胀、腹泻、恶心、疲劳、食欲不振、不明原因体重减轻、上背部或上腹部疼痛、手臂或腿部肿胀、黄疸迹象等。这就容易导致误诊。


胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
胰腺癌的诊断难,治愈也难,应对胰腺癌治疗这样的难题,科学界在不断努力中。
胰腺癌独特的免疫抑制微环境是免疫治疗面临的最大障碍,而微生物群的改变也被认为是塑造肿瘤局部微环境并影响免疫治疗的重要因素。
科学家发现微生物群在调节代谢和免疫反应中起着关键作用。通过维持相对健康的微生物群类型,提高胰腺癌化疗药物和免疫治疗的有效性,为胰腺癌患者带来新的希望。
接下来,本文详细列举口腔、肠道和胰腺微生物群在胰腺癌发展中的作用的关键信息,讨论不同类型的微生物群,它们在调节药物代谢、耐药性、免疫反应和胰腺癌治疗潜力中的潜在作用,以及相关预防措施。
图源:知易社
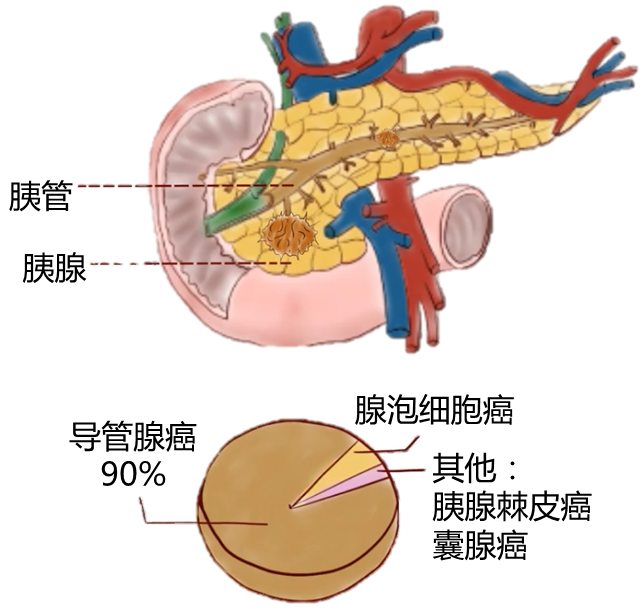
一般说的胰腺癌主要是指胰腺导管腺癌,简称PDAC,下同:
从临床和解剖学的角度来看,胰腺与肠道微生物群没有直接的物理联系,因此胰腺被认为是无菌组织。但微生物可以通过消化道中的胆管迁移到胰腺。
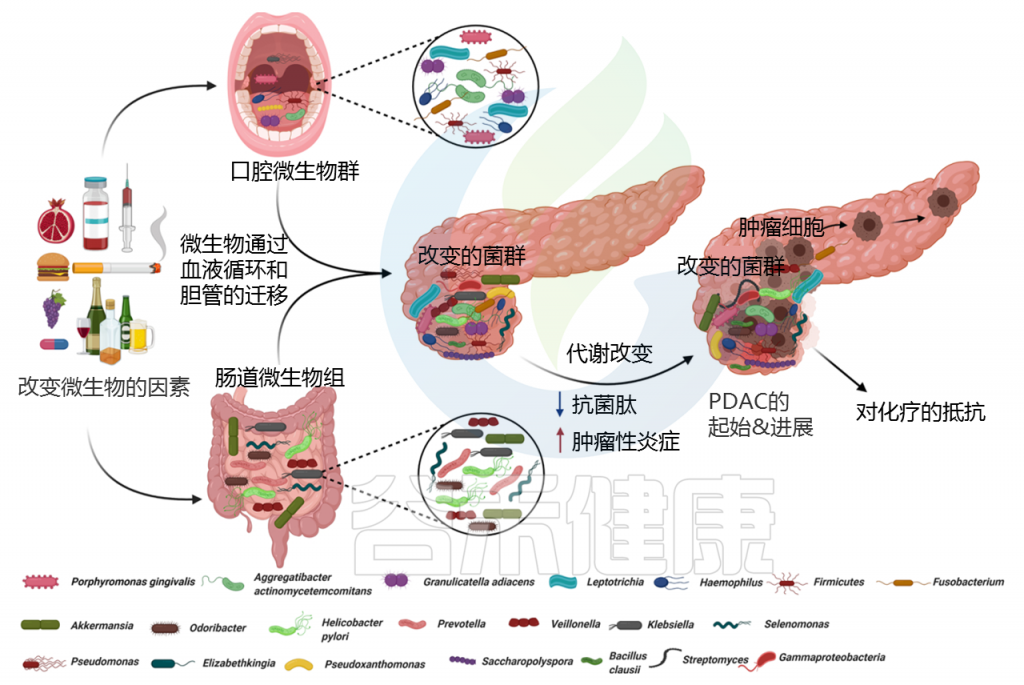

Pandya Gouri,et al., Semin Cancer Biol, 2021
许多研究表明,口腔、胃肠道、粪便和器官特异性(胰腺)微生物群的组成与PDAC高度相关。
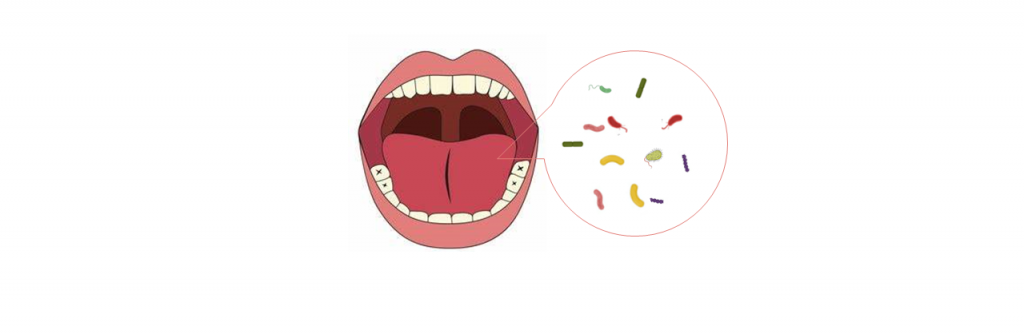

PDAC的口腔、唾液、舌苔微生物群
口腔和唾液微生物群组成的改变与PDAC的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
牙龈卟啉单胞菌(Porphyromonas gingivalis)、梭杆菌(Fusobacterium)、缓症链球菌(Streptococcus mitis )、长奈瑟氏球菌(Neisseria elongata ).
牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans 与胰腺癌高风险之间的相关性,表明口腔微生物群可能是导致PDAC肿瘤发生的危险因素。据推测,牙龈卟啉单胞菌可能分泌肽基精氨酸脱亚胺酶,通过引起KRAS和TP53基因突变来降解精氨酸代谢。
唾液微生物群
在胰腺癌患者的唾液样本中,与健康对照组相比,PDAC患者的长奈瑟氏球菌和缓症链球菌的水平明显降低,而Granulicatella adiacens的水平明显升高。
——作为预测胰腺癌的非侵入性生物标志物
在区分PDAC病患者和健康个体时,长奈瑟氏球菌和缓症链球菌的组合显示出96.4%的敏感性和82.1%的特异性。这项研究的结果表明,唾液微生物群可以作为预测胰腺癌的非侵入性生物标志物。
有研究对胰腺癌患者的唾液样本进行了微生物鉴定,发现纤毛菌Leptotrichia的丰度较高,而卟啉单胞菌和奈瑟氏球菌的比例相对较低。因此,唾液中纤毛菌Leptotrichia与卟啉单胞菌的显著高比率(L/P比率)可用作PDAC的预测标记。
口腔微生物组
PDAC和对照组在相关类群的平均相对比例上观察到差异。
PDAC患者 :高水平的厚壁菌门和相关类群,包括:乳杆菌科(Lactobacillales)、嗜热链球菌(Bacillli Streptococcus thermophilus)、链球菌科(Streptococcaceae)
对照组:具有相对较高水平的变形菌和相关分类群,包括:γ变形菌(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae)、副流感嗜血杆菌(Haemophilus parainfluenzae);β变形菌(Betaproteobacteria),奈瑟氏球菌(Neisseria),黄奈瑟氏球菌(Neisseria flaviscen)
舌苔微生物群
胰头癌患者优势菌群如下:梭杆菌属Fusobacterium, 纤毛菌属Leptotrichia, 放线菌属Actinomyces, 罗氏杆菌属Rothia, 奇异菌属Atopobium, 棒状杆菌Corynebacterium, 莫拉氏菌属Moraxella, 消化链球菌属Peptostreptococcus, 产线菌属Filifactor, Oribacterium,坦纳菌属Tannerella
对照组优势菌群如下:嗜血杆菌Haemophilus, 卟啉单胞菌属Porphyromonas,Paraprevotella
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌和纤毛杆菌、梭杆菌的富集量有显著差异。
类似地,在胰头癌患者中观察到链球菌和罗氏菌属相对较高的富集,而在肝癌患者中SR1的相对丰度较高。因此,SR1和链球菌可用于区分肝癌和胰头癌。
*SR1:SR1 genera incertae sedis
对PDAC与微生物群的变化在多样性和组成方面的关联研究非常有限。需要在一个大队列中进一步的调查证实这些发现,从而得出确切的结论。
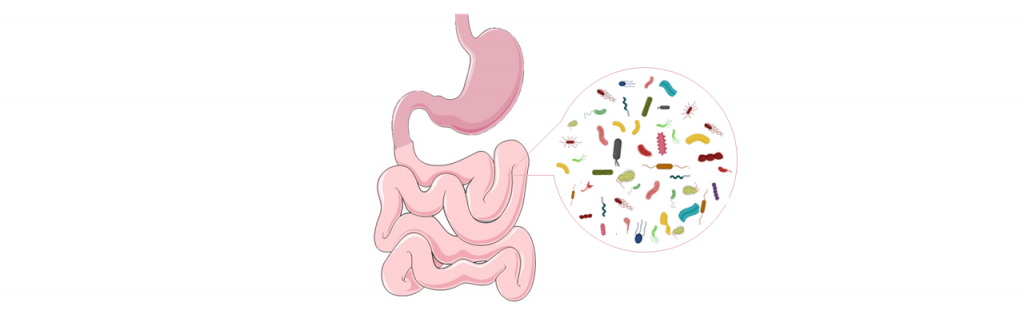

PDAC的胃肠道微生物群
——肠道微生物群可以直接影响胰腺微环境
给WT小鼠口服荧光标记的粪肠球菌Enterococcus faecalis,有趣的是,在这些小鼠的胰腺中观察到荧光,这表明细菌从肠道向胰腺迁移。
在另一项研究中,将抗生素混合物口服给药于PDAC、结肠癌和黑色素瘤的小鼠模型,观察到在所有受试模型中肠道微生物群的减少显著减弱了肿瘤的生长。
几个小组观察到,吸烟是胰腺癌的一个关键风险因素,可导致微生物群的显著变化,特别是在人类的肠道中。吸烟者肠道中厚壁菌门和放线菌门的减少,梭菌门、拟杆菌门、变形菌门的数量显著增加。
——胰腺癌患者和健康对照者粪便样本显著差异
微生物谱分析 (胰腺癌患者粪便样本,基于属水平的线性鉴别分析)
显著富集普雷沃菌属(Prevotella)、韦荣球菌属(Veillonella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、哈氏菌属(Hallella)、月形单胞菌属(Selenomonas)、Cronobacter spp.
显著减少双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Gemmiger)、梭状芽孢杆菌属(Clostridium IV)、Coprococcus、经黏液真杆菌属(Blautia)、Flavonifractor、丁酸球菌属(Butyricicoccus)、厌氧菌属(Anaerostipes)、Dorea spp.
这种粪便微生物群组成的显著差异表明,胰腺癌的胃肠道微生物是独一无二的。此外,本研究的数据表明,与脂多糖(LPS)生产、类异戊二烯和亮氨酸的生物合成相关的微生物有显著的富集/定殖,而已观察到产丁酸菌和益生菌的减少。
16S rRNA测序分析
分析PDAC患者和对照的粪便标本微生物群,观察到不同的优势菌:
PDAC患者:变形菌门(Proteobacteria),互养菌门(Synergistetes),广古菌门(Euryarchaeota),Akkermansia,韦荣氏菌科Veillonellaceae,Odoribacter
健康肠道:Clostridiacea,瘤胃球菌科,Ruminococcaceae,毛螺科Lachnospiraceae
除此之外,幽门螺杆菌感染和胰腺癌之间也呈正相关。在胃癌(69%)和胰腺癌(65%)患者的血液样本中,幽门螺杆菌感染率异常高。Meta分析和前瞻性队列研究表明,幽门螺杆菌感染的患者患胰腺癌的风险明显较高。然而,为了明确解决幽门螺杆菌在PDAC的影响,需要进行更多的人群和动物研究。
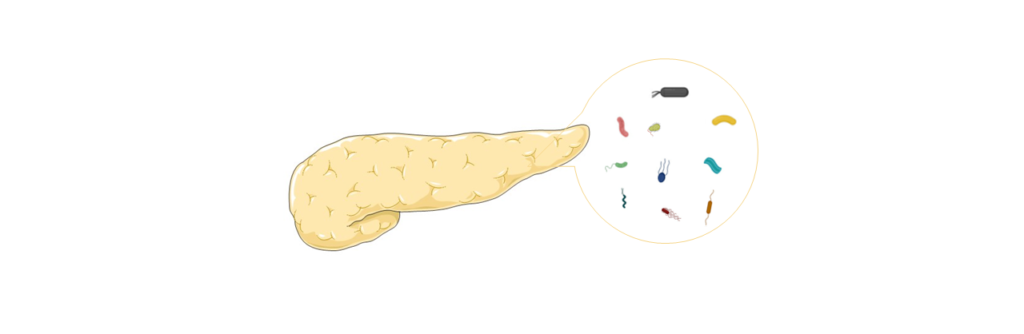
PDAC的胰腺微生物群
过去几十年科学家一直认为,在胰腺中存在蛋白酶,且胰腺环境是高碱性的,那么微生物无法生存。
胰腺中存在细菌,PDAC患者细菌更多
用16S rRNA基因特异性PCR对胰腺囊肿液体标本进行分析,发现优势菌:氨基酸球菌属Acidaminococcus, 埃希氏杆菌属Escherichia, 拟杆菌属Bacteroides, 志贺氏杆菌Shigella。这表明胰腺囊液可能是微生物群分析的良好来源。
最近,对PDAC样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,PDAC患者的胰腺组织中存在细菌(约为正常人的1000倍)。
PDAC的标本中的主要菌
对人类PDAC肿瘤标本进行16S rRNA测序,发现了13个不同的门。
PDAC患者:变形菌门 (45 %);拟杆菌门(31 %);厚壁菌门 (22 %);放线菌门 (1%);假长双歧杆菌Bifidobacterium;
·pseudolongum【Kras(G12D)介导的胰腺癌小鼠模型】;假单胞菌属 Pseudomonas;Elizabethkingia;梭杆菌 Fusobacterium
对照组:乳酸菌 Lactobacillus
梭杆菌——预后生物标志物
PDAC肿瘤内梭杆菌Fusobacterium的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
耐药患者的组织标本中 γ -变形菌定植
从耐受”吉西他滨”的PDAC中获得的组织标本中,γ-变形菌门Gammaproteobacteria定植,表明γ -变形菌可能干扰吉西他滨的代谢,并产生耐药性。
男女患者菌群差异
男性和女性患者之间微生物群组成的差异,各自的主导菌群如下:
男性患者:A. ebreus,Acinetobacter baumannii
女性患者:Geobacillus kaustophilus HTA426 ,Escherichia coli 55989
吸烟与非吸烟差距
此外,吸烟PDAC患者与非吸烟PDAC患者的对比,鲍曼不动杆菌A. baumannii 和M. hyopneumoniae高度富集,且与不良临床结果相关。这些微生物显示出富集的致癌信号和抑制肿瘤和免疫信号。
胰腺癌转移相关菌群
胰腺组织中微生物群的丰度与患者的转移和总生存率相关。M. hyopneumoniae、Sitophilus zeamais、宋内志贺菌Shigella sonnei、肠道沙门氏菌Salmonella enteric的高丰度与转移呈正相关。
更具体地说,Acidovorax ebreus与PDAC患者的转移和高肿瘤分级相关。
长期、短期生存的菌群不同
对长期和短期生存的PDAC患者的肿瘤标本进行了16S rRNA测序,肿瘤内微生物群:
PDAC长期生存者:多样性高;以下菌丰富:Pseudoxanthomonas, Saccharopolyspora, Bacillus clausii, Streptomyces
PDAC短期生存者:拟杆菌,梭状芽孢杆菌
上述数据表明,确定微生物群进入胰腺的机制以及这些微生物与胰腺癌的进展和转移之间的关系还有很大的研究空间。
宿主和微生物群形成共生关系。宿主可以通过其遗传、饮食摄入和生活方式影响微生物群的组成和生物量,而微生物群可以通过分泌微生物代谢物、代谢营养物、合成维生素和消化酶来影响宿主。
细菌成分及其代谢物可以渗透到宿主的体循环中,并被运输到发挥激素样作用的部位。这些生物活性代谢物调节宿主中的信号转导,以调节基因表达调节中涉及的各种途径。
代谢物对肿瘤的发生有促进和抑制作用
丁酸盐、乙酸盐和丙酸盐是主要的短链脂肪酸(SCFAs),由结肠中的粪肠球菌、双歧杆菌和梭状芽孢杆菌 等细菌产生,可发挥抗癌作用。
短链脂肪酸通过与游离脂肪酸受体(FFAR2/FFAR3)结合发挥作用,游离脂肪酸受体通常在癌细胞、基质细胞和肠细胞上表达,刺激G蛋白偶联受体,通过激活致癌途径(包括PDAC的AKT、ERK、mTOR和STAT3)促进肿瘤生长和转移。
对微生物代谢物在PDAC和胰腺中刺激FFAR2/3的作用的理解需要进一步详细研究。
改变的微生物群在PDAC免疫反应调节中的作用
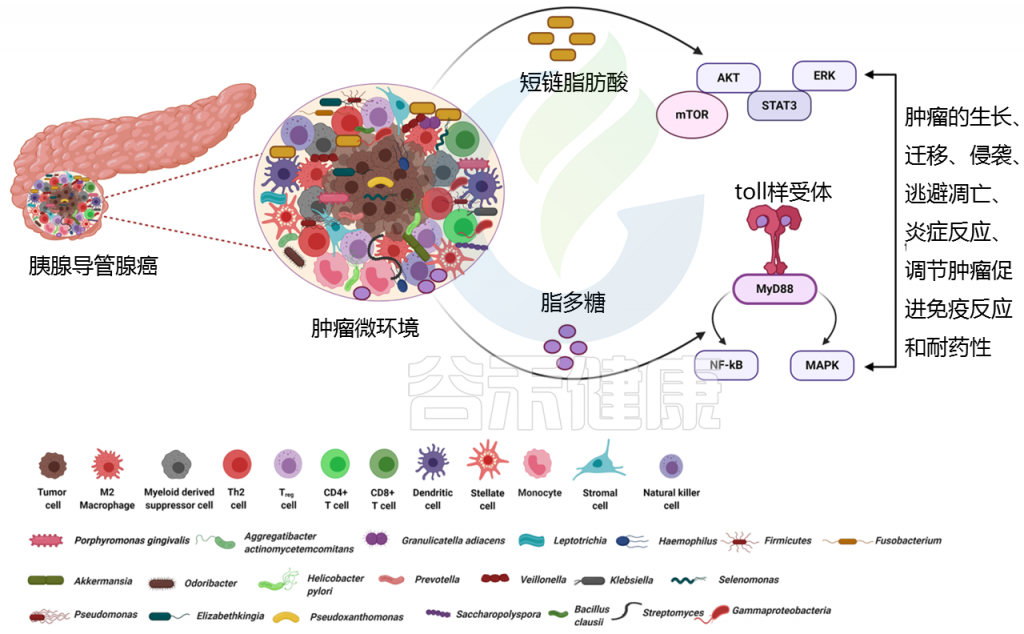

Pandya Gouri,et al., Semin Cancer Biol, 2021
体外研究表明,丁酸盐可以减少PDAC细胞的增殖,同时诱导它们向分泌表型分化。
此外,透明质酸与丁酸盐的共轭物显示出在PDAC细胞中诱导细胞抑制作用。据报道,丙戊酸(一种合成SCFA)结合5-FU对PDAC细胞有抑制细胞生长的作用。
PDAC患者多胺代谢失调
在PDAC患者中,益生菌和产丁酸的细菌被大量抑制。细菌可以合成多种多胺,如腐胺、精胺、亚精胺和尸胺。据报道,在PDAC患者中,多胺代谢严重失调。在小鼠模型和患者血清样本中,多胺均上调,并随着肿瘤的进展而进一步增多。
微生物代谢物可作为非侵入性生物标志物
罗伊乳酸杆菌Lactobacillus reuteri 在4个月大的KPC(K-rasLSL.G12D; p53R172 H/+; Pdx1-Cre)小鼠肿瘤标本(K-rasLSL)中定殖。罗伊乳酸杆菌参与多胺代谢。与2个月大的KPC鼠血清标本相比,4个月大的KPC鼠血清标本中多胺的浓度显著高。这些结果表明,微生物代谢物可被开发并用作潜在的非侵入性生物标志物,用于PDAC病的诊断,尤其是在肿瘤变得可见和明显之前的早期阶段。
脂多糖是与炎症、代谢性疾病和胰腺癌相关的关键因素
在PDAC患者中,脂多糖存在于高度富集的革兰氏阴性菌的细胞壁上。
脂多糖与线粒体的代谢重编程有关,从而有助于糖酵解、活性氧和炎症导致肿瘤发生。
脂多糖如何导致免疫抑制?
脂多糖可以有效地与免疫细胞上的toll样受体相互作用,并募集MyD88/TRIF分子来刺激NF-κB和MAPK信号产生炎性细胞因子,从而导致免疫抑制。
代谢产物——脱氧胆酸(DCA)
一些肠道相关细菌代谢原始胆汁并形成脱氧胆酸(DCA)。DCA通过与TGR5 (G蛋白偶联的细胞表面BA受体)结合发挥作用,TGR5反过来刺激PDAC细胞中的EGFR、MAPK和STAT3信号,并进一步导致细胞周期的进展。
代谢产物——熊去氧胆酸
与此相反,熊去氧胆酸通过抑制PDAC细胞系上皮细胞向间充质细胞的转化而显示出抗癌作用。
γ -变形菌科合成酶将化疗药代谢成不活跃形式
肿瘤内细菌属γ -变形菌科,能够合成胞苷脱氨酶(CDD),该酶能有效地将化疗药物吉西他滨代谢成2′,2′-difluorodeoxyuridine(不活跃的形式)。
说到化疗药物,为什么同样的药物治疗,有些人有效,有些人无效?这与微生物会有什么样的联系?
我们将在接下来的章节详细阐述。
肠道微生物群在改变癌症治疗中药物治疗的疗效方面发挥着既定的关键作用。当然,化疗药物也会使肠道微生物群失调。
二十多年来,吉西他滨单独和/或与化疗剂/药物联合用于治疗PDAC病患者。
引起化疗耐药性——猪支原体
人皮肤成纤维细胞中猪支原体(Mycoplasma hyorhinis)的存在,在体外和小鼠模型中导致了对吉西他滨的抗性,其中它被代谢为其非活性和脱氨代谢物,名为2’,2’-二氟脱氧尿苷。
引起化疗耐药性——γ – 变形菌
除此之外,γ – 变形菌能够通过表达胞苷脱氨酶(CDD)的长形式灭活吉西他滨。分析113个PDAC患者组织样本时,86个样本(76%)显示了γ – 变形菌的存在。
在结肠癌小鼠模型中,γ – 变形菌诱导的吉西他滨耐药可通过联合应用环丙沙星抗生素逆转。表明这种耐药是可逆的。
引起化疗耐药性——大肠杆菌
大肠杆菌可导致几种药物如克拉屈滨、吉西他滨、CB1954、氟达拉滨的原始化学结构发生改变。
在体外和体内小鼠模型中,非致病性大肠杆菌菌株引起了对吉西他滨治疗的化学抗性。
改变微生物群——更好的抗癌效果
最近,FOLFRNOX已被用于针对PDAC患者的多中心试验。结果报告了比吉西他滨更好的长期生存率。在这些试验中,患者腹泻和恶心的发生率很高。表明药物可以改变微生物群以产生更好的抗癌效果。
其他代谢疾病与胰腺癌的相关性
另一方面,肥胖、2型糖尿病和胰腺癌病例增加之间有很强的联系。
在KC小鼠中,高脂肪热量饮食(HFCD)显示完整腺泡的丧失和胰腺上皮内瘤形成的发展。此外,在小鼠模型中,高脂肪热量饮食显示出明显的微生物群组成变化,特别是梭状芽胞杆菌。
二甲双胍对这些小鼠的治疗与KC小鼠中PDAC的抑制相关,Akkermansia的定植显著增加,梭状芽胞杆菌的丰度显著减少。二甲双胍通过降低循环中脂多糖的水平来促使HFCD-KC小鼠模型的肠道菌群失调。这可以进一步抑制胰腺中M1巨噬细胞的脂多糖依赖性极化,从而抑制上皮内瘤的形成。
药物联合益生菌抗癌
吉西他滨与益生菌联合给药后,随着波形蛋白和Ki-67表达的抑制,上皮内瘤PanIN的形成明显减少。
鼠伤寒沙门氏菌与吉西他滨和贝伐单抗的组合在PDAC异种移植模型中产生了协同抗肿瘤作用。
肠道微生物群在调节化疗反应、将药物代谢成非活性形式,甚至对某些药物产生化学抗性方面起着不可避免的作用,越来越多的临床研究证明了微生物群对化疗的影响。这为癌症患者的治疗目的操控肠道菌群提供了基础。
免疫系统和微生物群之间的健康互动对于健康的生活方式和身体稳态至关重要。微生物群的失调会导致全身炎症和细菌代谢物介导的免疫反应,这可能进一步促进免疫调节,从而促使癌症发生和发展。
在胰腺癌的发展过程中,已经观察到胰腺组织内的微生物群和免疫细胞之间存在复杂的关系。癌症免疫可以通过微生物群的存在来改变。
菌群与胰腺癌发生的关系
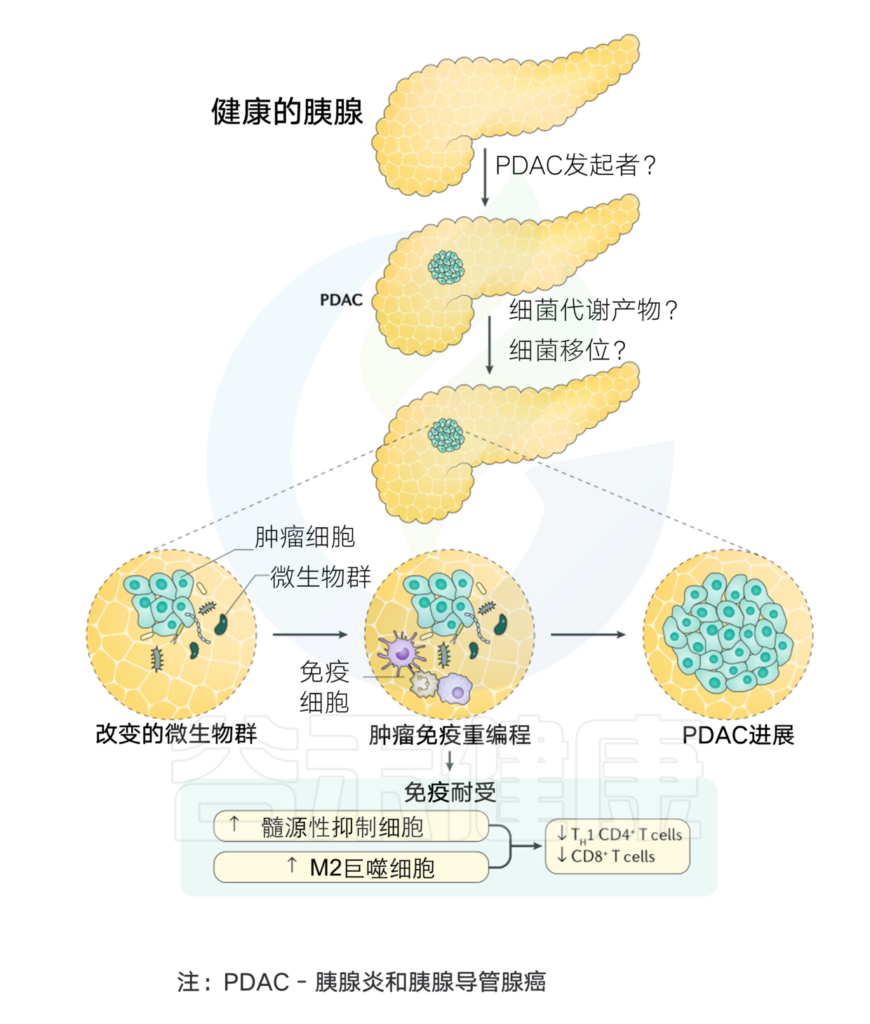
Thomas R M, et al.,Nature Reviews Gastroenterology & Hepatology, 2019
详见: 微生物,或许是下一个癌中之王(胰腺癌)诊断和干预治疗的新出路
微生物群对免疫系统的影响
当粘膜内层受到任何损伤时,微生物往往会进入肠道固有层,然后迁移到远处的淋巴器官,激活宿主免疫系统。PDAC肿瘤微环境基本上与免疫细胞交织在一起,其中免疫细胞与某些炎症因子一起负责促进肿瘤发生、免疫细胞浸润和疾病进展。
微生物衍生产物或代谢物,如脂蛋白、脂多糖、脂肽、单链或双链DNA,甚至CpG DNA可以有效地结合PPRs以激活TLRs,TLRs通过抑制胰腺癌的免疫反应在炎症和肿瘤发生过程中起关键作用。这与NF-κB和MAPK信号通路的激活有关,导致产生促进肿瘤的细胞因子和其他促炎分子,从而导致癌症的发展。
假长双歧杆菌促进肿瘤发生(TLRs)
假长双歧杆菌Bifidobacterium pseudolongum在肠道和肿瘤区域高度占优势,通过TLR介导的信号传导促进侵袭性肿瘤发生,TLR4和TLR7在PDAC的肿瘤微环境中特别强有力地表达。有研究显示,刺激TLRs会导致胰腺炎,并与K-ras协同促进胰腺癌在动物模型中的发展。
TLR7在人和鼠胰腺癌标本中有强有力的表达,并显示出刺激MAPK、NF-κB、STAT3和Notch信号以增强致癌作用。TLR7阻断可以通过阻止以上通路刺激,从而抑制胰腺癌。
肠道微生物群影响抗癌免疫治疗反应
肠道微生物群(脆弱双歧杆菌、双歧杆菌)的组成通过阻断CTLA-4和PD-1影响抗癌免疫治疗反应。
PDAC肿瘤微环境的产生在小鼠模型中具有免疫抑制作用,这归因于特定的肠道和胰腺内微生物。这也证明了随着免疫治疗抗性的增强,癌症进展的增强。
此外,微小核糖核酸与PDAC患者的生长、血管生成、化疗耐药性和转移增加有关。已知某些微生物如幽门螺杆菌和鼠伤寒沙门氏菌也能调节上述微小核糖核酸的表达,而这些微小核糖核酸又能调节宿主的免疫反应。
这表明肠道微生物群控制宿主免疫反应,从而提高免疫疗法的有效性,并在与PDAC相关的癌症领域具有巨大的意义。
微生物具有巨大的潜力,可用于设计不同的治疗方法,以对抗疾病的发展和进展。更具体地说,新出现的证据表明,微生物可能导致人类对恶性肿瘤的易感性,也可能影响对治疗的反应,还可能影响治疗相关的毒性。
用有益菌如拟杆菌和伯克霍尔德氏菌Burkholderiales恢复肠道提高了CTLA-4封闭的治疗效果。
双歧杆菌的存在增强了PDL-1阻断的抗癌潜力。
因此,微生物群的保护和恢复对改善治疗效果至关重要。
粪便微生物群移植(FMT)是一种直接有效的方法。肿瘤小鼠接受了来自短期生存期PDAC患者、长期生存期无疾病证据(LTS-NED)和健康对照组的粪便微生物群,发现肿瘤生长明显减少。这表明,在PDAC鼠模型中,来自长期存活者的FMT比来自短期存活者或没有PDAC的那些接受FMT的人对肿瘤有更好的保护作用。
此外,FMT在应对化疗的副作用方面显示出潜力,化疗会导致其他恶性肿瘤如转移性肾细胞癌的腹泻。这表明,用益生菌恢复肠道是一种可行的方法,可以与其他治疗方案一起使用,并且在治疗癌症方面可能非常有效。
目前这些研究探索了微生物群的多样性和组成,以及患者的菌群失调,与健康人的差异等,尽管还需要做深入研究,但这个方向的探索对于癌症治疗无疑是很有希望的。
虽然说没有完全避免胰腺癌的特定方法,但以下方法可以降低风险:
■ 戒烟
可避免的最重要的风险因素,戒烟有助于降低患胰腺癌风险
■ 维持正常体重
如果你现在正处于超重或肥胖阶段,减肥有助于降低胰腺癌风险;适当进行锻炼
■ 健康饮食
加工过的红肉和含糖饮料也可能增加患胰腺癌的风险。美国癌症协会建议遵循包括大量水果、蔬菜和全谷物在内的健康饮食模式,并限制或避免红肉和加工肉类、含糖饮料和高度加工食品
■ 不酗酒
大量饮酒与胰腺癌有关,也可能患上慢性胰腺炎,后期有发展成为胰腺癌的风险
■ 避免使用工作场所化学品
工作场所中的某些化学品会增加患胰腺癌和其他癌症的风险
■ 进行肠道菌群检测
维持一个相对健康的肠道菌群,监测健康状态,降低胰腺癌的风险
微生物组是一个新兴的前沿领域,它为胰腺癌的诊断、预后和转移的新生物标志物等提供了新的方向。
微生物治疗的个性化在于每个个体微生物群具有独特性,微生物群又与日常饮食,生活习惯,慢性病等息息相关,通过这些方式的改变使菌群维持或恢复到相对健康的状态,这对于胰腺癌及其他癌症的预防、治疗具有重大意义。
主要参考文献:
G.A. Vitiello, D.J. Cohen, G. Miller, Harnessing the microbiome for pancreatic cancer immunotherapy, Trends Cancer 5 (11) (2019) 670–676.
R. Mendez, K. Kesh, N. Arora, L. Di Martino, F. McAllister, N. Merchant, S. Banerjee, S. Banerjee, Microbial dysbiosis and polyamine metabolism as predictive markers for early detection of pancreatic cancer, Carcinogenesis 41 (5) (2020) 561–570.
R.M. Thomas, R.Z. Gharaibeh, J. Gauthier, M. Beveridge, J.L. Pope, M.V. Guijarro, Q. Yu, Z. He, C. Ohland, R. Newsome, J. Trevino, S.J. Hughes, M. Reinhard, K. Winglee, A.A. Fodor, M. Zajac-Kaye, C. Jobin, Intestinal microbiota enhances pancreatic carcinogenesis in preclinical models, Carcinogenesis 39 (8) (2018) 1068–1078.
Pandya Gouri,Kirtonia Anuradha,Singh Aishwarya et al. A comprehensive review of the multifaceted role of the microbiota in human pancreatic carcinoma.[J] .Semin Cancer Biol, 2021
B. Gupta, D. Sadaria, V.U. Warrier, A. Kirtonia, R. Kant, A. Awasthi, P. Baligar, J.K. Pal, E. Yuba, G.Sethi, M. Garg, R.K. Gupta, Plant lectins and their usage in preparing targeted nanovaccines for cancer immunotherapy, Semin. Cancer Biol.(2020).
J. Chakladar, S.Z. Kuo, G. Castaneda, W.T. Li, A. Gnanasekar, M.A. Yu, E.Y. Chang, X.Q. Wang, W.M. Ongkeko, The pancreatic microbiome is associated with carcinogenesis and worse prognosis in males and smokers, Cancers 12 (9) (2020).
J.S. Chang, C.R. Tsai, L.T. Chen, Y.S. Shan, Investigating the association between periodontal disease and risk of pancreatic Cancer, Pancreas 45 (1) (2016) 134–141.
H. Tilg, T.E. Adolph, Beyond digestion: the pancreas shapes intestinal microbiota and immunity, Cell Metab. 25 (3) (2017) 495–496.
Can Pancreatic Cancer Be Prevented? American Cancer Society. May 31, 2016.