 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肥胖和代谢综合征在全球范围内日益流行,是21世纪人类健康面临的重大威胁之一。据世界卫生组织(WHO)全球数据估计,目前全球约13%(即近65亿)成年人口受肥胖症影响。

肥胖和代谢综合征对健康的危害包括增加患心血管疾病、糖尿病和高血压的风险,影响身体的免疫系统和内分泌系统,还可能导致肝脏疾病等。
更令人担忧的是,模型预测到2030年,约五分之一的成年人将患有肥胖症,这些数字突显了寻求新疗法的迫切需要,这些新疗法将独特地利用肥胖和代谢综合征背后的复杂途径来促进体重减轻以及代谢和免疫系统的调节。
“肥胖”是指身体过度脂肪堆积,超过正常范围的体重。通常是由于摄入热量过多,消耗热量不足导致的。同时肥胖患者还伴有慢性低度炎症,以及肠内分泌和神经激素的失调。
体重通过激素、神经和代谢途径之间复杂的相互作用进行调节,并受到许多环境因素的影响。能量摄入和支出之间的不平衡可能是由于多种因素造成的,包括饮食行为的改变、异常的饱腹感或饥饿感以及低能量支出。
目前主要有两种新兴的治疗方式:通过肠道微生物群和膳食纤维。肠道微生物群通过涉及粘膜和全身免疫、激素和神经系统的多种机制,深刻影响能量稳态的各个方面。
膳食纤维对新陈代谢和肥胖的益处也已通过机制研究和临床试验得到证明,在本文,我们讨论了不同纤维的理化特性、纤维和肠道微生物群如何相互作用以调节体重稳态的最新发现,以及与使用膳食纤维作为补充策略。
了解膳食纤维沿胃肠道的生理效应,包括肠道微生物群的作用,将支持开发利用微生物群和临床特征来预测个体对纤维补充反应的精准医学方法,用于调节免疫、代谢和体重稳态。随着临床前和临床研究继续探索膳食纤维能够促进哪些与健康相关的微生物群和代谢物,对这种纤维-微生物群的相互作用将为开发基于纤维的精准营养提供框架,以实现更优化、个性化的肥胖和代谢综合征相关治疗。
为了更好地预防和改善肥胖,我们需要先了解关于肥胖的一些知识。
✦ 肥胖患者肠内分泌和神经激素会失调
肥胖不仅仅是体重过高,其实是一种复杂的慢性进行性疾病,其特征是体内脂肪堆积过多以及肠内分泌和神经激素信号通路失调,从而增加食欲和能量储存。
✦ 肥胖还伴有慢性低度炎症
肥胖也被描述为一种慢性低度全身炎症,循环促炎细胞因子水平升高,对中枢神经系统(CNS)以及参与能量和代谢稳态的所有器官产生负面影响。
肥胖个体下丘脑尺寸的增加被认为是由于下丘脑炎症所致,这将加剧能量稳态失调。内脏脂肪组织和胃肠道失调似乎是全身炎症的主要原因。来自肥胖动物模型的大量证据支持肠道微生物群衍生的脂多糖数量增加通过增强细胞旁运动或通过乳糜微粒运输的跨细胞途径进入体循环的作用,从而启动许多炎症途径,进一步导致体重增加。
尽管来自人类研究的证据不如来自动物模型的结果清楚地表明肠道来源的脂多糖与肥胖之间的关联,但人体中的一些研究结果已将全身性脂多糖增加与肥胖联系起来,特别是与肥胖相关的代谢疾病风险。
此外,一些人类研究的结果表明,高水平的餐后内毒素血症先于2型糖尿病的发生,这表明存在潜在的致病作用。
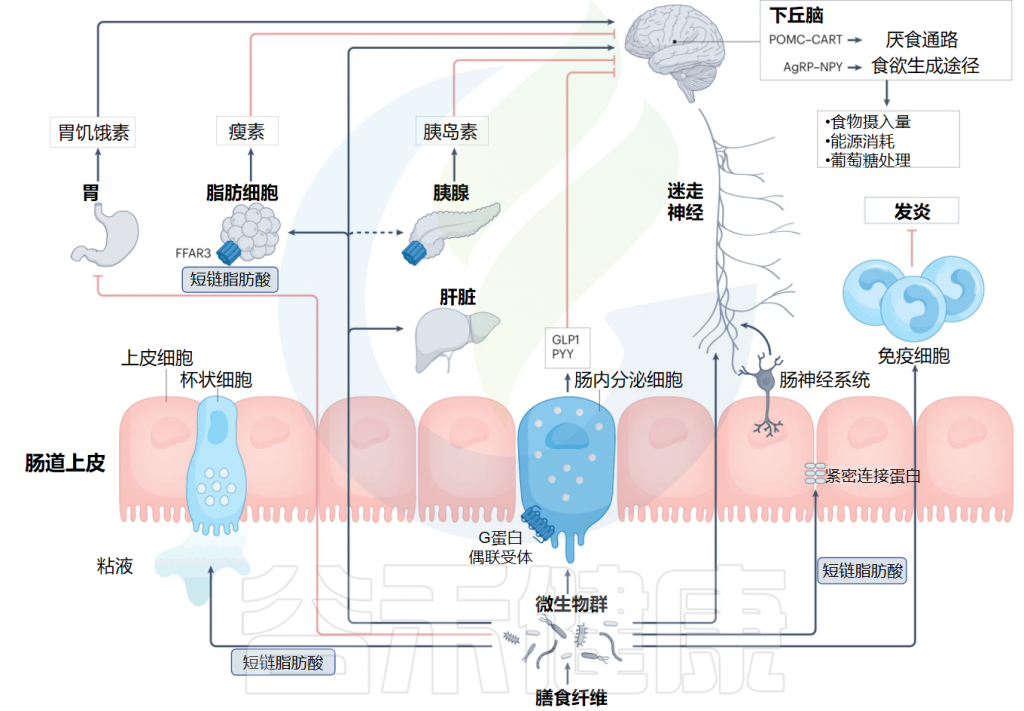
在正常生理条件下,能量稳态通过调节饮食行为和能量储存的肠内分泌和神经激素信号通路受到严格控制。除了胰腺产生胰岛素和胰高血糖素之外,胃肠道和脂肪组织也会产生主要整合在下丘脑内的信号,以调节食物摄入和能量消耗。
✦ 肠内分泌激素有促食欲和抑制食欲两种作用
肠内分泌激素,由整个胃肠道中专门的肠内分泌细胞(EEC)响应营养和其他信号而释放。这些激素在胃肠道和远处器官中发挥局部作用,协调能量稳态的维持,包括饥饿、饱腹感、肠道屏障完整性、肠道转运、血糖控制和整体能量平衡。
肠内分泌激素的功能可根据其促食欲(刺激食欲)和厌食(抑制食欲)特性大致分类。胆囊收缩素(CCK)、肽 YY(PYY)、胰高血糖素样肽1(GLP1)、葡萄糖依赖性促胰岛素多肽(GIP)和胃泌酸调节素是主要由小肠EEC产生并在餐后释放以诱导饱腹感和减少食物的摄入。
从胃中释放的生长激素释放肽和从结肠中的EEC释放的胰岛素样因子5(INSL5)充当促食欲信号。瘦素和脂联素从脂肪组织中释放,也有助于调节饮食行为和能量稳态。
主要肠道激素及其对能量稳态的影响


Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 进食速度和食物适口性也会影响能量摄入
然而,肠道源性食欲激素的水平并不一定与能量摄入相关;此外,一些研究表明,人类对急性饮食的激素反应并未表现出对常量营养素摄入量长期差异的实质性适应。这些发现表明,其他因素,例如食物能量密度和食物摄入速度以及食物的适口性,可能会增加人类的能量摄入。
✦ 中枢神经系统调节饥饿、饱腹感和能量储存
中枢神经系统是多种肠道源性激素的重要作用部位,也是通过整合涉及自主下丘脑回路、皮质执行回路和皮质边缘奖励通路的大脑网络来调节饥饿、饱腹感和能量储存的中枢调节器。
下丘脑的弓状核内有两个独立且相对的神经元群:促食欲NPY-AgRP神经元和促厌食POMC-CART神经元。
NPY-AgRP神经元被能量不足和信号(如生长激素释放肽)激活,以刺激食物摄入,并被胃肠道中营养物质的存在和饱足信号(如CCK和PYY)抑制。相比之下,瘦素等信号激活POMC-CART神经元会抑制进食,并由于释放与大脑黑皮质素受体结合的α-黑素细胞刺激激素而改变葡萄糖代谢。
✦ 肥胖患者的能量信号受损导致易暴饮暴食
有证据表明,肥胖成人中营养信号的受损会导致暴饮暴食和肥胖。在一项针对健康体重个体和肥胖个体的单盲、随机、对照交叉研究中,结果显示,肥胖个体在大脑对摄入营养素的反应中表现出整体和营养特异性受损。因此肠道和脂肪源性激素以及中枢神经系统共同是能量稳态治疗操纵的基本目标。
过去二十年的研究表明,肥胖代谢特征的特征是人类血清胆囊收缩素、胰岛淀粉样多肽、胃饥饿素、INSL5和胰岛素水平升高,同时瘦素、GLP1和PYY水平降低。
重要的是,这些血浆激素水平被发现随着减肥手术后肥胖的解决而恢复正常,从而强调了它们作为关键治疗靶点的作用。
✦ 激素药物的疗法会受到胃肠道耐受性的影响
针对肥胖的内源性神经分泌机制的药物是治疗肥胖和代谢综合征最有效的长期药物疗法。GLP1激动剂(索马鲁肽、利拉鲁肽和西他列汀)已被证明对持续减肥和改善心脏代谢功能具有良好功效。
使用作用于GIP、GLP1或胰高血糖素受体的双重和三重激素受体激动剂的临床试验已显示出在减肥和改善代谢参数方面的卓越功效。
然而,这些基于肠降血糖素的疗法的使用目前受到高成本、有限的医疗保健覆盖范围和胃肠道耐受性问题的限制。此外,人们还担心这些药物对肠道功能的长期影响。
✦ 基于饮食的疗法将是未来的趋势
由于这些限制,人们越来越有兴趣开发替代性肠促胰岛素靶向疗法,特别是基于饮食的方法,通过使肠促胰岛素激素(如GLP1和GIP)水平正常化来治疗肥胖并预防肥胖相关代谢功能障碍的发生。
在动物模型和人类中进行的大量研究表明膳食纤维摄入对宿主代谢和减肥有好处,因此增加膳食纤维摄入量作为一种基于饮食的肥胖疗法已引起广泛关注。
膳食纤维是碳水化合物的一种聚合物,主要存在于植物食物中,可抵抗哺乳动物基因组中编码的酶的消化;它们到达近端结肠,在其中经历肠道微生物群不同速率和程度的糖分解发酵。
✦ 目前大部分人群膳食纤维摄入不足
膳食纤维的生理益处多种多样,取决于其理化特性和摄入量,膳食纤维的推荐膳食摄入量为每1000kcal 14克(成年女性每天25克,成年男性每天38克)。然而,目前大部分人群通常每天摄入的纤维少于15克,即推荐量的一半左右。
✦ 肠道微生物在纤维代谢促进健康中起重要作用
几项大型前瞻性研究已经证明了纤维消耗与代谢健康之间的关联,目前的工作强调了肠道微生物群在将膳食纤维摄入与有益效果联系起来。
越来越多的证据表明,肠道微生物群通过涉及免疫、激素和神经系统影响的多种机制,深刻影响能量稳态的各个方面,并且肠道菌群失调或肠道微生物类群的异常组成可能会导致能量代谢紊乱并对脂肪组织、肌肉和肝脏造成影响。
肠道微生物群发酵纤维会释放出多种代谢物,包括短链脂肪酸、酚类和吲哚化合物、支链脂肪酸、乳酸、琥珀酸和各种气体(氢气、二氧化碳、甲烷、一氧化氮和含硫化合物)。
肠道微生物产生代谢物的途径和前体对饮食摄入具有高度适应性;因此,通过特定的饮食干预措施(例如膳食纤维)来针对微生物代谢是改善代谢功能障碍和肥胖的关键因素。
短链脂肪酸是通过微生物可接触的膳食纤维发酵产生的主要代谢物,人体肠腔中主要短链脂肪酸的相对比约为乙酸盐(60):丙酸盐(20):丁酸盐(20)。
短链脂肪酸可以通过与G蛋白偶联受体相互作用并抑制组蛋白脱乙酰化来介导多种局部和外周效应,从而导致基因表达的表观遗传调节变化。
丁酸盐在结肠中被结肠细胞用作能量来源,而丙酸盐和乙酸盐通过门静脉吸收到肝脏,其中丙酸盐主要用作糖异生和脂肪生成的底物;相反,乙酸盐以更高的量进入体循环。
✦ 短链脂肪酸影响激素分泌从而改善葡萄糖代谢
除了纤维对胃排空和抑制消化的影响已得到充分证明外,增加饮食中的纤维含量可能会通过产生短链脂肪酸来帮助减肥和葡萄糖代谢。
大量体外和小鼠研究表明,短链脂肪酸通过G蛋白偶联受体GPR41和GPR43(也称为FFAR3和FFAR2)直接刺激肠道肠内分泌细胞分泌胰高血糖素样肽-1(GLP-1)和肽YY(PYY)。
体内研究表明,急性直肠输注醋酸盐或短链脂肪酸混合物会增加PYY和GLP1的全身水平。此外,一项人体研究表明,与单独使用菊粉相比,在20名健康成年人中,急性口服菊粉丙酸盐会增加全身PYY和GLP1的水平,并减少食物摄入量,这表明丙酸盐水平增加在调节血糖新陈代谢方面发挥着作用。
✦ 短链脂肪酸影响神经系统抑制食欲和能量摄入
短链脂肪酸还可以直接与肠神经系统相互作用,从而允许肠道来源的短链脂肪酸向大脑直接发出信号。小鼠研究表明,短链脂肪酸给药可通过中枢神经系统相关机制抑制食欲和能量摄入。
此外,体外和小鼠研究表明,短链脂肪酸可以通过多种机制增强血脑屏障,包括减少氧化和促炎途径以及增加紧密连接蛋白。
在小鼠研究中,乙酸盐和丁酸盐已被证明可以穿过血脑屏障并刺激迷走神经和下丘脑,从而调节食物摄入量和饱腹感。使用功能性磁共振成像的人体研究表明,结肠丙酸盐输送减少了与食物渴望相关的大脑区域的活动,并减少了食物摄入量。
需要注意的是,尽管在人脑和脑脊液中发现了可测量浓度的短链脂肪酸,但人脑对循环短链脂肪酸的摄取似乎有限,这表明一些记录在案的循环短链脂肪酸对大脑活动的影响可能是这是由于短链脂肪酸诱导的与免疫和内分泌系统的相互作用,而不是大脑内的直接相互作用。
短链脂肪酸对能量稳态的作用机制
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 短链脂肪酸影响脂肪的分解和积累
在培养的小鼠和人类脂肪细胞中,乙酸盐和丙酸盐已被证明能够以G蛋白偶联受体依赖性方式促进脂肪分解并抑制脂肪生成,从而可能减少非脂肪组织和脂肪组织中的全身脂质循环和脂肪积累,同时还提高胰岛素敏感性。
在人类研究中,短链脂肪酸的直肠给药已证明可以促进全身脂肪分解,并且在体外培养的人类脂肪细胞中,短链脂肪酸也已被证明可以刺激瘦素分泌。短链脂肪酸还可以减少人类外植体脂肪组织的促炎细胞因子分泌,因此可能有助于减少与肥胖相关的全身低度炎症。
注意:仍然存在一些不确定性
然而,尽管大量工作支持短链脂肪酸在调节体重增加和宿主代谢方面具有潜在的有益作用,但该领域关于短链脂肪酸在肥胖中的作用仍然存在很大的不确定性,因为许多影响主要体现在小鼠模型无法在人类研究中复制。
事实上,据报道短链脂肪酸水平升高和降低都与肥胖有关。然而,大多数人类研究测量粪便样本中的 短链脂肪酸,这反映了生产、吸收和利用的净结果,并不一定反映可能更相关的全身水平。
为了支持这一观点,对160名BMI在19.2 kg/m2至41kg/m2且葡萄糖代谢正常或受损的参与者进行的横断面研究中证明,全身短链脂肪酸水平与空腹甘油呈负相关。三酰甘油和游离脂肪酸,与空腹GLP1呈正相关,而粪便水平与这些参数均无关联。此外还发现循环醋酸盐与胰岛素敏感性之间呈负相关,而丙酸盐与胰岛素敏感性呈正相关。
总体而言,研究短链脂肪酸对宿主代谢的生理影响的可用人体体内数据仍然有限。由于纤维、肠道微生物群和人体新陈代谢之间相互作用的复杂性,目前尚不清楚增加纤维摄入量的有益影响是由于微生物代谢和某些代谢物(例如短链脂肪酸)的产生或其他有据可查的影响而产生的纤维的变化,包括运输时间、营养吸收或粪便膨胀和结合的改变。
除了短链脂肪酸之外,肠道微生物群还在膳食纤维发酵过程中产生乳酸和琥珀酸,然而,这些代谢物通常被认为是微生物生产短链脂肪酸的中间体。
✦ 肥胖和代谢综合征患者乳酸和琥珀酸含量增加
乳酸和琥珀酸以低浓度存在于血液和组织中,与没有肥胖的人相比,在肥胖和代谢综合征患者中检测到的水平有所增加。乳酸是宿主衍生的葡萄糖代谢产物,当糖酵解通量超过线粒体氧化时,血液中的乳酸会增加。
✦ 乳酸可能作为活性信号分子减少促炎反应
因此,乳酸可以被认为是葡萄糖代谢受损的生物标志物。此外,体外和小鼠研究表明,乳酸可以作为活性信号分子,调节脂肪细胞功能和代谢,并通过GPR81依赖性和非GPR81依赖性来减少脂肪组织和免疫细胞功能中的促炎症反应。
由于这些有益的发现,有人建议通过增加纤维摄入量和由此产生的乳酸产量来靶向GPR81可能代表肥胖和代谢紊乱的新治疗靶点。
✦ 琥珀酸作为代谢稳态的一种信号分子
尽管琥珀酸传统上被认为是三羧酸循环的代谢物,但目前的研究已证明琥珀酸可作为参与应激和组织损伤的代谢信号。
肠腔中琥珀酸含量较低,但对小鼠的研究发现,细胞外琥珀酸的浓度随着纤维摄入量的增加而增加。琥珀酸可以通过与几种不同细胞类型(包括脂肪细胞和免疫细胞)上的琥珀酸受体1(SUCNR1;也称为GPR91)结合而充当信号分子。
在人类中,横断面研究报告称,血浆琥珀酸水平、肥胖和葡萄糖代谢损伤之间存在负相关。据报道,琥珀酸还可以充当生热激活剂和褐变剂,并且对脂肪分解具有影响。
一项使用脂肪细胞特异性Sucnr1敲除小鼠和从肥胖人群中分离出的人类脂肪细胞的研究发现,通过与SUCNR1相互作用调节脂肪细胞中的生物钟和瘦素表达,琥珀酸诱导的代谢效应具有新功能。
✦ 琥珀酸可能有助于解释代谢与炎症之间的联系
还有强有力的证据表明琥珀酸-SUCNR1信号传导可以充当代谢应激和炎症之间的联系。
利用人类原代巨噬细胞证明,细胞外琥珀酸可以诱导巨噬细胞产生抗炎作用。有趣的是,肥胖与全身琥珀酸水平高有关,但脂肪组织驻留巨噬细胞中琥珀酸受体的表达减少,这可能有助于解释为什么肥胖患者往往无法控制炎症。
在小鼠模型中,研究表明,肠道微生物群响应补充低聚果糖 的饮食而产生的琥珀酸增加,通过充当肠道糖异生的底物并随后减少肝脏葡萄糖的产生来改善血糖控制和能量代谢。
随着越来越多的研究检查琥珀酸诱导的生理效应,它可能有助于阐明细胞外琥珀酸的作用及其在调节宿主代谢中的局部和全身作用模式以及如何最好地针对这些途径。
✦ 微生物发酵膳食纤维产生的气体会导致一些胃肠道症状
膳食纤维经微生物发酵还会进一步产生H2、CO2和CH4等气体。然而,纤维发酵过程中气体产量的增加可能会引起不良症状,并且是个体不耐受高水平纤维的主要原因之一。
因此,还需要进行更多研究来增加肠道气体对宿主生理和代谢影响的了解,使用纤维和大量营养素的饮食控制来减轻患有与产气相关的胃肠道疾病的患者症状。
了解膳食纤维在胃肠道中的生理效应机制,包括其与肠道微生物群的作用,将有助于开发基于膳食纤维的补充策略,以调节免疫、代谢和体重稳态。
所有膳食纤维的共同特征是它们的低聚或多聚碳水化合物结构可抵抗小肠的消化,并且如果分离和合成,则对人类健康显示出生理益处。然而,纤维之间的化学和物理结构以及理化特性存在巨大的异质性。
常见分离和合成的商业膳食纤维
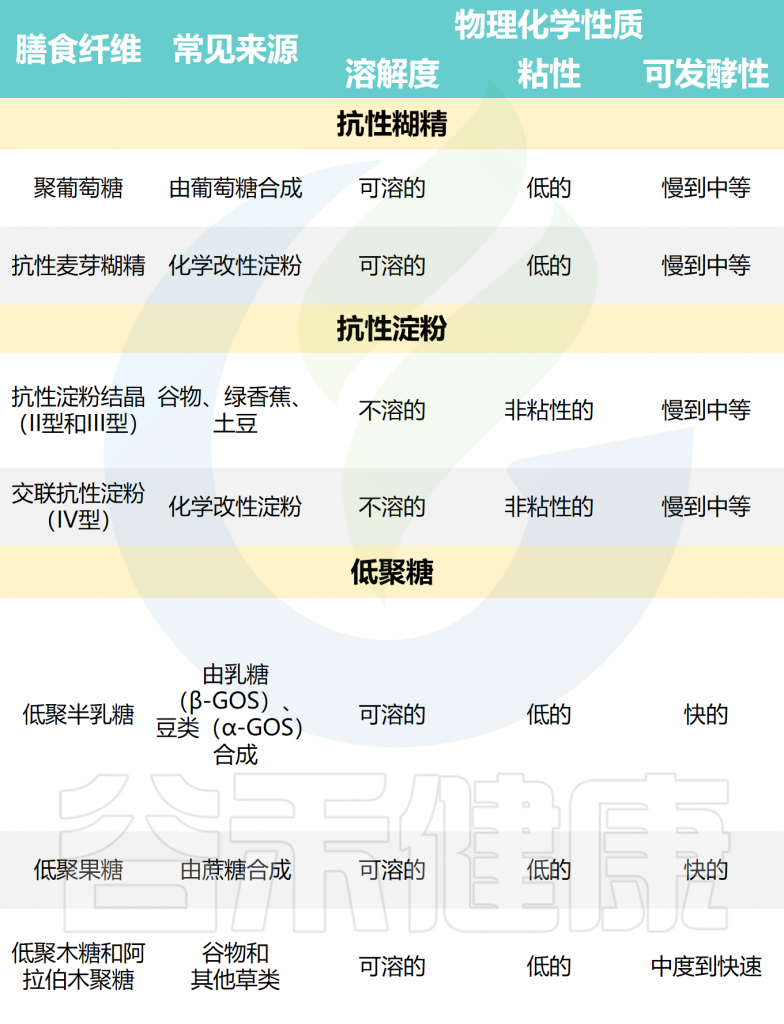

Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 膳食纤维的差异会影响其对人体的作用
具有较长、无支链的线性碳水化合物结构(如纤维素)通常不溶于水性溶剂,阻碍了人类肠道微生物群对其进行发酵,使较少的微生物能够接触到这种结构。
相比之下,具有混合连接或支链的低聚合物和聚合物通常可溶于水,更容易被肠道微生物接近。因此,随着聚合度的增加,可溶性纤维倾向于将水和其他化合物截留在聚合物内和聚合物之间,从而以浓度依赖性方式增加粘度。分子量也会影响微生物的发酵和短链脂肪酸生产速率;然而,分子量与发酵之间的关系取决于纤维结构,且不一定是线性的。
尽管纤维通常根据物理化学性质(例如溶解度、粘度、结合能力或发酵性)进行分类,但这种分类并不能反映离散纤维结构所表现出的全部性质。
例如,来自高粱或稻米等草类的阿拉伯木聚糖低聚物或简单结构的聚合物很容易发酵,而复杂结构的阿拉伯木聚糖要么在整个结肠中缓慢发酵,要么很难被人类肠道微生物群作用。
因此,了解纤维的结构和理化特性,尤其是分离或合成后的纤维,对于更精确地应用纤维来治疗肥胖至关重要。
膳食纤维的理化特性影响它们在胃肠道中的作用,从而决定它们对炎症、代谢和能量稳态的影响。
✦ 粘性纤维和较大纤维会增加饱腹感并减少摄入
从口腔开始,粘性纤维和大纤维颗粒(如谷类麸皮)可以通过获得更坚硬和耐嚼的食物基质来延长咀嚼和口腔感官暴露,从而改变内分泌相对饱腹感的反应并减少能量摄入。
当食品应用中热量密集的糖和脂肪减少时,菊粉、低聚果糖和微纤丝纤维等纤维也可以保持感官特性(如甜味和口感)。天然食品中的纤维基质进一步充当唾液淀粉酶等消化酶的屏障。咀嚼过程中这些三维植物细胞壁结构的维持影响细胞内成分(如淀粉)沿胃肠道的生物利用度。
增加食糜粘度的纤维,例如较高分子量的混合连接或支化聚合物和微纤丝纤维,可促进胃扩张并延迟胃排空。小肠腔内增加的食糜粘度通过限制营养物质向粘膜扩散和内源性消化酶的活性进一步延迟营养物质吸收,这通过触发回肠破裂进一步减慢近端胃肠传输。
✦ 纤维结构影响脂质的吸收和利用率
除了粘度之外,某些纤维结构还可以结合或捕获化合物,例如常量营养素和微量营养素、酚类和胆汁酸,从而延迟或阻止小肠吸收。胆汁酸与膳食纤维的结合会干扰胆汁酸的肠肝循环并阻碍胶束形成,从而减少脂质的吸收和利用率。
此外,增加纤维结合胆汁酸向大肠的输送可能会导致微生物胆汁盐水解酶和 7α-脱羟酶将初级胆汁酸转化为次级胆汁酸。对人类和小鼠的研究以及使用分离的人类胰岛和哺乳动物培养细胞的体外实验表明,这些次级胆汁酸通过多种膜和核受体(包括G蛋白偶联胆汁酸受体(TGR5)和法尼醇X受体,导致饱腹感增加、肝糖原合成、肝脏、棕色脂肪和肌肉组织中的胰岛素分泌和能量消耗。
一项针对肥胖和2型糖尿病患者(n=23)的研究证明,将结合胆汁酸输送到回结肠区域可降低餐后血糖和空腹胰岛素水平,并增加GLP1分泌,这支持了胆汁酸在葡萄糖代谢中的作用。
✦ 膳食纤维会影响小肠对营养的反应
尽管了解甚少,但膳食纤维可能会进一步改变驻留的小肠微生物群,在大鼠模型中显示这种相互作用会影响小肠营养感应,特别是低聚果糖诱导的脂质感应,从而促进肠内分泌细胞(EEC)释放GLP1以增加饱腹感。
在培养细胞、动物模型和人类中进行的大量工作也表明微生物代谢物与胃肠道味觉受体表达和活性的改变有关,从而导致味觉偏好和食物摄入的改变。
最后,所有膳食纤维,无论是天然存在的、分离的还是合成的,都可以通过简单地用不可消化的碳水化合物代替一部分可消化的化合物来减少能量摄入,这与能够在不改变感官特性的情况下在食物中实现更高水平的较低粘性纤维相关。
总体而言,小肠的营养吸收率受到结构依赖性的影响,增加了纤维消耗的阻碍。这有助于促进饱腹感,减弱餐后血糖、血脂和炎症反应,而这些反应通常在肥胖症中失调。
纤维摄入量的增加相当于未吸收的营养物质增加,这些营养物质到达近端结肠并可供人体肠道微生物群利用。
膳食纤维对胃肠道的生理影响
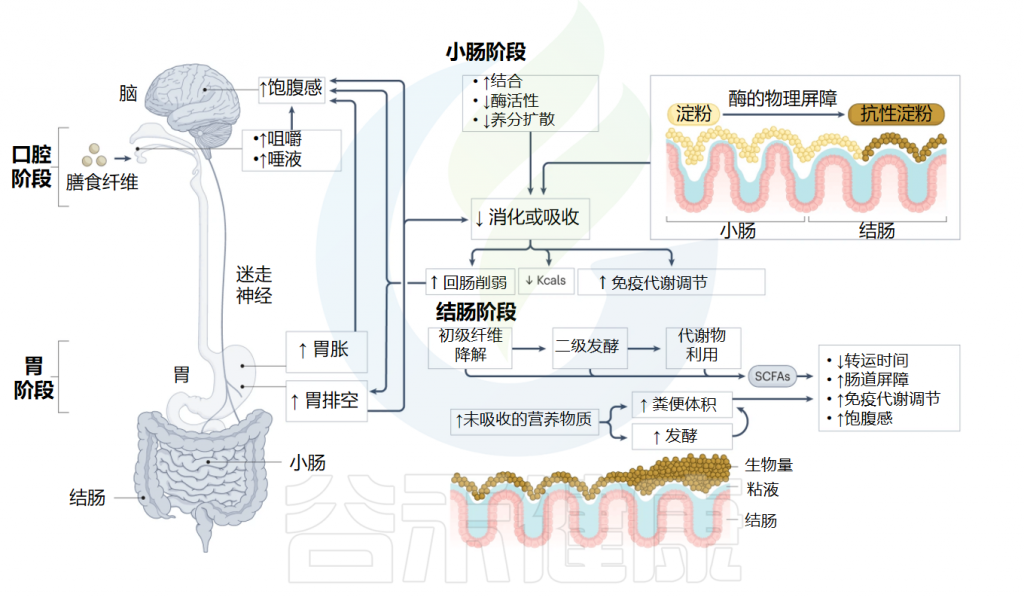
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 微生物对膳食纤维作用改善排便和减轻炎症
与小肠中的化合物结合的纤维进一步在结肠中被作用,使底物和其他生长因子接近利用它们的特定微生物。肠道微生物群对发酵缓慢或发酵不良的化学和物理结构,如大纤维颗粒、纤维素或车前草,通过刺激蠕动、粘膜分泌和抑制水的重吸收来提供其他胃肠道益处,这已被证明可以增加体积和软化人类粪便。
这些纤维通过抑制微生物发酵可能减少结肠转运时间,促进结合化合物的排泄并减轻全身炎症。尽管可发酵纤维还可以通过增加微生物生物量以及产生短链脂肪酸和气体来影响结肠转运时间,但纤维发酵的主要生理效应归因于假定有益微生物的结构特异性扩张以及随后结肠内短链脂肪酸和其他代谢物的产生。
✦ 富含膳食纤维的饮食使肠道微生物群更丰富
纤维到达结肠时会引发微生物群落内复杂的交互作用,这些群落共同获取、降解和利用代谢产物,最终丰富了成员多样性。
初级降解和次级发酵释放短链脂肪酸、气体和其他代谢产物,被代谢物利用者进一步转化,影响与结肠细胞的相互作用。
消耗可发酵纤维支持多种微生物群成员,解释了纤维结构多样的饮食与多样化微生物群的关联,这是健康肠道微生物组的特征。
结肠中成员的富集和代谢产物的促进取决于纤维结构、个体群落和生态因素,如结肠微环境。研究表明,特定饮食可增加能量利用,降低脂肪含量,并提高胰高血糖素样肽-1(GLP-1),而食物摄入量无显著变化。
✦ 复杂结构的膳食纤维增加结肠远端的短链脂肪酸产量对代谢有利
尽管纤维发酵过程中微生物群落产生的副产物主要发生在结肠近端,但通过消耗具有结晶或复杂结构的纤维可以减慢发酵速率,从而减轻肠道气体的产生并将短链脂肪酸输出转移到远端。
研究表明,增加短链脂肪酸远端产量可通过上调PYY和GLP1等肠内分泌激素,对人类的饱腹感、血糖和能量代谢产生有利影响。
事实上,在肥胖男性中,远端结肠中施用的醋酸盐增加了脂肪氧化和循环PYY;然而,当在近端结肠中施用醋酸盐时,没有看到效果。尽管向增加脂肪氧化和PYY产生的转变意味着有利的能量代谢,但仍需要进一步研究来确定是否可以通过增加远端结肠中纤维发酵和短链脂肪酸的产生来减少体重和肥胖。
✦ 远端结肠可能是未来治疗肥胖的靶点
糖分解发酵向远端结肠的扩展和延伸进一步减少了膳食和粘膜蛋白质的发酵。蛋白水解发酵的抑制部分是由于肠道微生物对碳水化合物而非氨基酸的普遍偏好,以及乳酸和纤维发酵过程中结肠pH值降低抑制蛋白水解酶。
人类蛋白水解发酵的减少可能会随后降低被认为有害和促炎的病原体(例如脱硫弧菌)和代谢物(例如氨或对甲酚)的水平。纤维和蛋白质发酵之间的平衡已在人类身上得到证实,因为增加抗性淀粉的剂量以及将饮食模式从高蛋白、低碳水化合物转变为体重维持饮食已被证明可以增加粪便中的短链脂肪酸并减少支链脂肪酸,支链氨基酸发酵产生的代谢物。
促进结肠中短链脂肪酸的产生可能会通过刺激粘液分泌、上调紧密连接蛋白、增加抗菌肽浓度和调节结肠上皮增殖来增强胃肠道屏障完整性,共同减轻细菌脂多糖的易位和随之而来的代谢性内毒素血症。总之,这些结果支持将远端结肠作为控制肥胖的治疗靶点。
除了膳食纤维结构之外,还有一些生态因素会影响纤维发酵过程中促进健康相关的微生物和代谢物的产生。
✦ 结肠转运时间影响微生物群和宿主代谢
结肠转运时间被认为是影响肠道微生物群和宿主代谢的关键因素,转运时间较慢与纤维发酵速率降低和短链脂肪酸减少、远端结肠pH值和蛋白水解发酵增加以及肠道对粪便能量的回收减少。
体外实验进一步表明,结肠pH值的降低可通过选择对酸敏感的微生物(如拟杆菌)来塑造参与纤维结构发酵的独特微生物群落。由于参与结肠纤维发酵的大多数共生微生物是专性厌氧菌,因此如在炎症中观察到的那样,结肠微环境中氧浓度的增加,也通过支持耐氧微生物(例如大肠杆菌)的大量繁殖来形成特殊菌群成员。
✦ 不同人群对补充膳食纤维会产生个性化反应
由于生态因素影响微生物对膳食纤维的个体化反应,因此在实施基于可发酵纤维的治疗策略来预防和治疗肥胖和代谢综合征时,需要从个人生态角度出发。
据报道,纤维引起的肠道微生物群变化仅限于少数主要反应类群,而其余成员和代谢副产物则发生更多个性化变化。
例如,数十年的人类研究证实,低聚果糖和低聚半乳糖等益生元寡糖可通过选择性促进经常用作益生菌的乳酸菌和双歧杆菌来增加乳酸和乙酸,从而为人类带来健康益处。
丁酸盐生产菌
体外研究还表明,厌氧丁酸菌、真杆菌、粪杆菌等丁酸盐生产菌可以通过乳酸和乙酸的交叉喂养或通过利用抗结晶淀粉、木聚糖和菊粉等底物来富集。
丙酸盐生产菌
另外,丙酸盐生产者,如拟杆菌属、副拟杆菌属、葡萄杆菌属和韦荣球菌属,可以通过交叉饲喂乳酸和琥珀酸盐或通过降解底物(如酯化抗性淀粉、果胶和木聚糖)来富集。
下一代益生菌
下一代益生菌有望改善患有肥胖和代谢综合征的成年人的代谢,其中包括Akkermansia muciniphila或Anaerobutyricum soehngenii ,这两种细菌已被证明可以通过补充纤维来丰富。
小结
因此,可发酵膳食纤维可用于选择性地扩大肠道微生物群内与健康相关的类群。然而,仍需要进行更多研究来阐明与肥胖和代谢功能障碍有因果关系的其他共生微生物和代谢物,并可通过选择膳食纤维来靶向。
肠脑轴连接肠道和中枢神经系统,促进双向通讯。这一过程牵涉到肠神经系统、迷走神经、内源性大麻素系统以及神经免疫和神经内分泌通路。
肠道代谢产物可直接调节神经系统活动,通过作用于肠神经元、迷走神经和交感神经末梢,或者经体循环传输至大脑。
★ 肠道微生物产生的多种神经递质会影响食欲
此外,肠道微生物还产生多种神经递质,如血清素、多巴胺、乙酰胆碱和GABA(γ-氨基丁酸),这些物质通过迷走神经在肠神经系统或中枢神经系统内发挥作用。一项小鼠研究指出,细菌肽聚糖片段与大脑下丘脑神经元上的NOD2相互作用,调节食物消耗和体温,进而影响食欲。
研究者还发现,从肥胖小鼠体内提取的微生物移植到瘦小鼠体内,可影响大脑奖励系统,与微生物代谢产物3-3′-羟苯基丙酸存在因果关系,影响多巴胺能和阿片类标记物,进而调节食欲行为和动机。进一步分析显示,嗜黏蛋白阿克曼菌(Akkermansia)、Muribaculum、普雷沃氏菌(Prevotellaceae)和副拟杆菌(Parabacteroides)的水平与3-3′-羟苯基丙酸血浆水平相关。
肥胖症中微生物群与肠道之间的相互作用
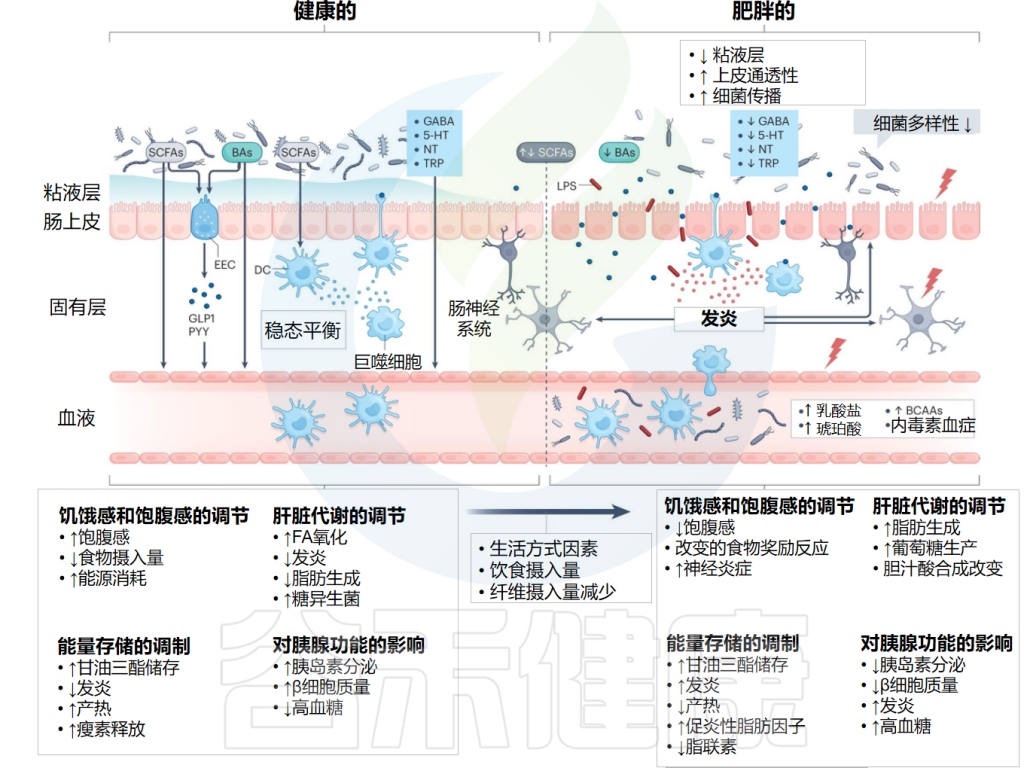
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
这些研究共同表明,肠道微生物群与宿主相互作用,通过不同的自主神经和体细胞神经内分泌途径改变新陈代谢,并且肥胖患者的这些相互作用发生了实质性改变。实际上,每个途径都代表了可以通过饮食干预(例如增加纤维摄入量)进行调节的潜在途径。
扩展阅读:
治疗肥胖症的精准医学方法是通过个性化的诊断和治疗方案来帮助患者减肥和改善健康状况。这种方法结合了先进的科学技术和专业知识,以确保每位患者都能得到最有效的治疗。
通过精准医学方法,医生可以根据患者的基因、生活方式、肠道微生物群和其他因素制定个性化的治疗计划,从而更好地管理和治疗肥胖。
对于减肥饮食干预的反应存在着高度的个体差异,这种差异可以归因于多种因素,包括遗传背景、微生物群组成以及生活方式因素(如进餐时间、睡眠、锻炼和昼夜节律)。为了实现减肥效果,需要确定影响个体对饮食干预反应的关键因素,并制定个性化的营养策略。
✦ 肠道微生物群是预测减肥效果的良好指标
研究表明,基线微生物宏基因组谱,尤其是与纤维降解相关的几个基因的存在,与随后的体重减轻密切相关。在一项为期6个月的减重研究中,研究人员发现,个体的肠道微生物群是预测体重减轻效果的一项重要指标。
特定的肠道细菌,如布劳特氏菌(Blautia wexlerae)和多氏拟杆菌(Bacteroides dorei),在含量丰富的个体往往能更好地预测体重减轻效果。
此外,体重减轻与活泼瘤胃球菌(Ruminococcus gnavus)、马赛拟杆菌(Bacteroides Massiliensis)和芬氏拟杆菌(Bacteroides Finegoldii)相关。
✦ 具有高发酵肠道微生物水平时增加纤维摄入有利于减肥
这些微生物群,如阿克曼氏菌和普雷沃氏菌,由于其处理植物来源复杂纤维的能力,与富含纤维的饮食密切相关。相比之下,食用低纤维饮食的个体通常具有更高水平的拟杆菌;而食用高纤维饮食的人群普雷沃氏菌更丰富。在人类减肥试验中,与普雷沃氏菌水平较高的个体相比,以拟杆菌为主的个体在摄入富含纤维的饮食时通常不太可能减肥或维持体重减轻效果。
这些发现表明,高水平发酵代谢的肠道微生物群(如普雷沃氏菌)可能更有利于减肥,尤其是在增加纤维摄入量时。
最后,试验(n=1002)的数据显示,肠道微生物群组成是餐后脂质和血糖反应,以及空腹心血管代谢标志物的良好预测因子。然而,必须指出的是,肠道微生物群组成仅解释了餐后甘油三酯、葡萄糖和C肽升高的5-7%变化,其他因素也在其中起作用。
将基于精准医学的方法应用于肥胖和代谢紊乱的另一种方法是根据个体的潜在病理生理学和行为特征使用针对表型的干预措施。
肥胖表型通常可分为四类:异常饱腹感、异常餐后饱腹感、情绪性进食和异常静息能量消耗。针对每种表型进行了可行性试验,比如通过使高纤维饱腹感异常的个体饮食,可以关闭大脑饥饿中枢并实现最大的胃扩张。支持这一概念的是,与接受标准治疗的参与者相比,接受表型定制生活方式干预的参与者减重更多,代谢和临床参数改善更显著。
✦ 根据不同表型采取饮食会有更好的效果
在一项为期12周的饮食干预试验中,患有肌肉胰岛素抵抗或肝脏胰岛素抵抗的人被随机分配到高单不饱和脂肪酸饮食或低脂肪、高蛋白和高纤维饮食。具有肌肉胰岛素抵抗的个体(n =149)在食用低脂肪、高蛋白和高纤维饮食时代谢参数有更多改善,而具有肝脏胰岛素抵抗的个体食用高单不饱和饮食时,肝脏胰岛素抵抗(n=93)有更大的改善。
需要注意的是,另一种基于代谢表型的方法根据CORDIOPREV-DIAB试验显示出相互矛盾的结果。可能是由于研究人群的差异或饮食干预措施的组成差异造成的,说明了基于某些表型设计精准饮食干预措施的还存在一些挑战。
通过营养干预进行个性化葡萄糖优化研究旨在测试这种通过根据组织特异性胰岛素抵抗表型调节膳食营养素含量来改善葡萄糖稳态参数和心脏代谢健康的方法。
尽管开发个性化营养干预措施存在相关的挑战,但这些原理验证研究总体上支持使用基于生物和表型因素开发个性化饮食干预措施的基本概念。
此外,了解肠道微生物及其基因途径如何与饮食成分相互作用可能有助于设计更有效的个性化疗法,并有可能提高饮食干预减肥的成功率。
膳食纤维的结构和理化多样性为开发基于纤维的策略提供了潜力,还能从一定程度上改善肥胖和代谢综合征药物和手术疗法。
富含纤维的天然食品,如全谷物、蔬菜、水果、豆类、坚果和种子,为以肥胖为中心的医学营养疗法提供了非淀粉多糖和抗性淀粉的混合来源,分离和合成的浓缩和均匀特征纤维为针对代谢综合征病理生理学的营养保健品开发提供了途径。
✦ 膳食纤维对于控制肥胖有重要作用
几种纯化的食品级膳食纤维已经作为食品成分或补充剂在市场上销售,其中许多可以被选定的微生物群落获取、降解和利用。
一项包含22项随机对照试验、总共1428名参与者的系统回顾和荟萃分析表明,使用分离的可溶性膳食纤维补充剂(菊粉、低聚果糖、抗性玉米糊精、瓜尔豆胶、亚麻籽粘液、海藻酸盐粉、葡甘露聚糖和黄原胶)的个体至少12周后, 与对照干预措施相比 ,体重减轻和代谢功能改善显著更高(可消化的碳水化合物),支持补充分离纤维在控制肥胖中的作用。
然而,体重的减少相对适度(平均差-1.25公斤),表明单独分离的可溶性纤维可能无法实现实质性的体重减轻。
!
补充膳食纤维需要和个体特征相匹配
使用基于膳食纤维的策略相关挑战在于需要什么剂量才能产生有益效果以及个人对这些剂量的反应如何?
通常,小鼠和大鼠模型中使用的剂量转化为人类每日摄入量>100 g ,这可能会导致严重的副作用。事实上,一项对18名参与者进行的纵向、随机交叉研究表明,补充30克菊粉会增加促炎细胞因子(如IL-6和TGFβ)以及肝酶的水平。
另一项结合使用人体组织样本、人体结肠活检离体培养和细胞培养模型的研究表明,饮食中的β-果聚糖可引发人体巨噬细胞和患有活动性肠道炎症的炎症性肠病患者的活检样本中的促炎症反应。研究人员推测,在缺乏发酵纤维(如β-果聚糖)所需的特定微生物类群(如罗氏菌属和普氏粪杆菌)的个体中,这些未发酵的纤维可能会在胃肠道中诱发炎症反应。
这些研究强调了基于将特定纤维混合物与宿主现有微生物功能特征相匹配的个性化饮食疗法的必要性。
了解膳食纤维如何沿着胃肠道表现并与人体肠道微生物群相互作用后,可以根据纤维独特的理化特性、对肠道微生物群的影响以及对饱腹感、血糖、血脂或炎症反应的影响来合理选择纤维。
✦ 根据对肠道微生物群的影响等选择合适的纤维
一个商业化的例子是PolyGlycopleX,它是海藻酸钠、魔芋胶和黄原胶的混合物,协同相互作用形成高粘性和凝胶形成的多糖复合物,先前已证明可以促进饱腹感并降低总胆固醇水平。
注:人们可以推测,将PolyGlycopleX与有利于丙酸产生的可发酵纤维混合物配对可能会增强临床反应,因为人类补充丙酸已被证明对饱腹感和胆固醇代谢有良好的影响。
39名患有高心脏代谢疾病风险的成年人服用含有七种可发酵纤维的专有混合物,可以改善葡萄糖和胆固醇代谢的替代标志物,并显著调节肠道微生物群的组成和功能特征。
快速(菊粉)和缓慢(抗性淀粉)发酵纤维的混合物,旨在将乙酸盐的产生扩展到远端结肠,也被证明可以在健康个体的餐后促进能量消耗并减弱血糖反应,但有趣的是,它并没有患有糖尿病前期的个体。
这些结果强调了微生物发酵能力的改变以及正常体重个体和肥胖或代谢功能障碍个体之间短链脂肪酸代谢的差异会影响对纤维补充剂的反应。
✦ 纤维引起的微生物变化会影响代谢、信号传导
虽然纤维混合物是一种新兴方法,可以部分克服对纤维补充的个性化反应,但仍需要精心设计的临床前和临床研究来开发和确定此类纤维混合物单独以及与治疗肥胖症和代谢综合征的护理标准相结合的功效。
对14名成年人进行的受控饮食研究中使用特定的纤维组合,证明不同的纤维组合在微生物功能基因表达和生长中引发了共同的和纤维特异性的反应。
例如,豌豆纤维和菊粉或豌豆纤维、菊粉、橙纤维和大麦麸的组合都促进了多种拟杆菌的生长,并增加了阿拉伯低聚糖和低聚木糖利用的途径。
此外,纤维诱导的特定微生物基因的变化可能与宿主葡萄糖代谢、钙调神经磷酸酶和AKT信号传导、细胞凋亡、激肽释放酶-激肽蛋白酶和免疫过程的变化相关。
尽管体外研究进一步证明了离散纤维结构能够操纵肠道微生物组的潜力,但仍需要在人体中进行额外的随机对照试验来确认纤维补充剂的生理效应。
膳食纤维和健康相关细菌基因组之间的联系表明,活体微生物的施用,无论是益生菌、活体生物治疗药物还是粪菌移植,都可能与选择性发酵的膳食纤维相互作用。
与将益生菌和益生元结合在一起的互补合生元不同,这种精确配对是协同合生元开发的基础,其中精确开发底物以供共同施用的活微生物选择性利用,从而为宿主带来健康益处。
✦ 膳食纤维协同合生元改善代谢和肥胖
一些早期的临床前和临床研究结果表明,协同合生元可能并不总是可预测地相互作用以促进健康。例如,根据三氯蔗糖与乳果糖的比率估计,在94名肥胖个体中补充益生元低聚半乳糖、益生菌青春双歧杆菌或协同合生元已被证明可以类似地增强肠道屏障完整性。
然而,根据系统评价和荟萃分析的报告,合生元补充剂,或益生元(或多种益生元)和益生菌(或多种益生菌)的一般配对,已显示出减轻体重和纠正肥胖代谢失调的希望。
一个例子是Pendulum Glucose Control,它是菊粉、低聚果糖、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、拜氏梭菌、丁酸梭菌和婴儿双歧杆菌专有混合物,已被证明可以改善2型糖尿病患者的葡萄糖代谢,这些患者单独通过饮食和运动治疗。
✦ 膳食纤维的摄入与粪菌移植的效果会相互影响
整个粪便微生物群落的管理可能会进一步受益于精确膳食纤维的共同管理,这些纤维支持群落内与健康相关的成员或调节防止微生物植入的环境限制。
在一项研究中,粪菌移植与不可获取的微晶纤维素 (n=17) 配对,但不是可发酵纤维混合物(n=17)(抗性麦芽糖糊精、IV型抗性淀粉和阿拉伯胶),改善了接受者中肥胖和代谢综合征患者的胰岛素敏感性。
微晶纤维素是一种食品添加剂,也常用作药物包衣材料。它是一种水溶性纤维素衍生物,具有优异的增稠、乳化、稳定等功能。在食品工业中,微晶纤维素常用于调制冰淇淋、奶油、果冻等产品;在药物制剂中,微晶纤维素常用作控释药物的包衣剂。
补充微晶纤维素有助于增加群落丰富度以及几种与健康相关的类群的植入或富集,例如Akkermansia、Christensenellaceae和Phascolarctobacter,这可能是通过将结肠环境转向更有利的条件,例如减少肠道炎症。
捐赠者在获得粪便之前的饮食会进一步影响粪菌移植的功效。例如,与遵循地中海减肥(n=16)或健康饮食指南(n=19)饮食后接受自体粪菌移植胶囊的个体相比,含有绿茶和较高膳食纤维的地中海饮食在粪菌移植后8个月可减弱体重增加。
总体而言,将益生菌、活生物治疗和粪菌移植疗法与具有离散结构的新型纯化的膳食纤维相结合,将有助于开发创新的营养保健品和药物疗法,通过平衡失调的肠道微生物群来针对代谢综合征的病理生理学。
主要参考文献
Deehan EC, Mocanu V, Madsen KL. Effects of dietary fibre on metabolic health and obesity. Nat Rev Gastroenterol Hepatol. 2024 Feb 7.
Lin D, Peters BA, Friedlander C, Freiman HJ, Goedert JJ, Sinha R, Miller G, Bernstein MA, Hayes RB, Ahn J. Association of dietary fibre intake and gut microbiota in adults. Br J Nutr. 2018 Nov;120(9):1014-1022.
Ricardo-Silgado ML, McRae A, Acosta A. Role of Enteroendocrine Hormones in Appetite and Glycemia. Obes Med. 2021 May;23:100332.
Crooks B, Stamataki NS, McLaughlin JT. Appetite, the enteroendocrine system, gastrointestinal disease and obesity. Proc Nutr Soc. 2021 Feb;80(1):50-58.
Brown SSG, Westwater ML, Seidlitz J, Ziauddeen H, Fletcher PC. Hypothalamic volume is associated with body mass index. Neuroimage Clin. 2023;39:103478.
She Y, Mangat R, Tsai S, Proctor SD, Richard C. Corrigendum: The interplay of obesity, dyslipidemia and immune dysfunction: a brief overview on pathophysiology, animal models, and nutritional modulation. Front Nutr. 2023 Oct 11;10:1304102.
Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021 Feb;18(2):101-116.
Mah E, Liska DJ, Goltz S, Chu Y. The effect of extracted and isolated fibers on appetite and energy intake: A comprehensive review of human intervention studies. Appetite. 2023 Jan 1;180:106340.

谷禾健康

随着一日三餐米面肉蛋菜等一些列食物的食用,数百种化学成分会进入我们的消化道。在那里,它们被肠道微生物组进一步代谢,这是数千种微生物物种的独特集合。
因此,肠道微生物组在决定营养如何影响健康方面发挥着重要作用。然而到目前为止,微生物组中的许多微生物的代谢能力仍然是未知的。这意味着我们不知道它们以什么物质为食,以及它们是如何处理这些物质的。
近期,来自普林斯顿大学的研究人员在《CELL》期刊上发表了最新的文章:
“Gut bacterial nutrient preferences quantified in vivo”,研究人员使用同位素追踪定量研究了小鼠肠道微生物群的输入和输出。
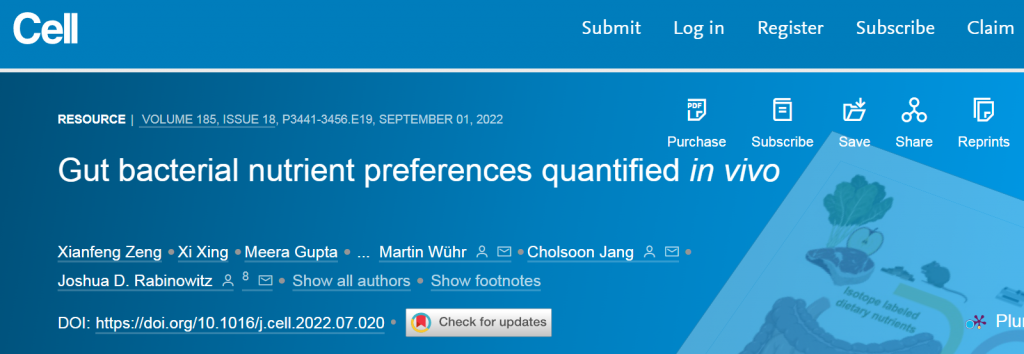

微生物碳水化合物发酵的主要输入是膳食纤维,支链脂肪酸和芳香代谢物的主要输入为膳食蛋白质。此外,循环宿主乳酸、3-羟基丁酸和尿素(但不是葡萄糖或氨基酸)为肠道微生物群提供食物。
肠道菌群拥有巨大的酶多样性,超过哺乳动物基因组的数量100多倍。这些酶的能力能使摄入的膳食营养物质加工成一些列微生物代谢物。
为了复制自身和释放代谢产物,肠道细菌需要营养输入。这些形式包括摄入的食物、宿主合成的肠道粘液和宿主循环代谢物。
//
在本文中,研究人员通过对肠道菌群及其进入宿主循环系统的代谢物进行了大规模的定量评估。
研究了膳食淀粉、纤维和蛋白质的贡献以及宿主粘液的贡献,也研究了大多数主要的循环宿主营养素,发现乳酸、3-羟基丁酸和尿素在从宿主传递到肠道微生物群中表现突出。基于对细菌特异性肽序列的测量,评估了不同细菌属的营养偏好,并表明这些偏好与响应改变饮食的微生物组分变化一致。
同位素追踪能够定量测量代谢物和生物量的输入。与质谱检测相结合的稳定同位素示踪剂,使得能够测量特定下游产物的标记。通过注入氮标记的苏氨酸来标记宿主粘液,研究人员能够比较饮食和粘液蛋白对肠道微生物群的贡献,并观察到喂食低蛋白饮食的小鼠中粘液贡献的变化。
从小鼠尾部静脉抽取血样;
使用注射器从小鼠膀胱采集尿液;
所有血清样品在没有抗凝剂的情况下置于冰上 15 分钟,并在 4°C 下以 16,000 x g 离心 15 分钟。
用预冷的Wollenberger钳在液氮中快速分离并快速冷冻(< 5秒)获得组织;夹紧前取出肠内容物;盲肠内容物取样时,先将小鼠盲肠取出并在表面切开,然后用镊子将盲肠内容物挤出。
取新鲜粪便,轻揉小鼠腹部诱导排便。将血清、组织和粪便样本保存在 -80 ºC 直至进一步分析。
为了测定血清和组织样本中的代谢物浓度,进行了同位素标配(isotope spike-in)或标准标配(standard spike-in )。
对于前者将已知浓度的同位素标记标准品加入血清或组织提取液中,通过标记与未标记代谢物的比值计算浓度。
当没有同位素标准品时,加入连续稀释的非标记标准品,测量的总离子计数与加入的标准品浓度之间产生线性拟合。然后通过拟合线的x截距确定内源代谢物的浓度;蛋白质氨基酸组成采用酸水解法测定。
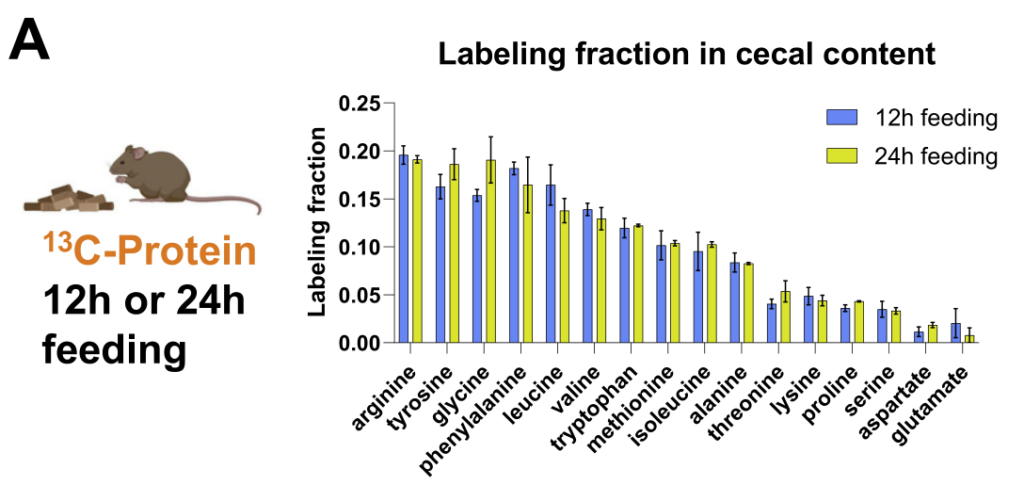
首先,使用13C同位素标记的不同营养物质,通过口服管饲法对小鼠进行灌胃采集小鼠的血清、组织和粪便样本。对粪便和肠内容物进行16S rRNA测序获得细菌分类。
首先使用代谢组学方法测定盲肠内容物中游离氨基酸13C-或15N标记。
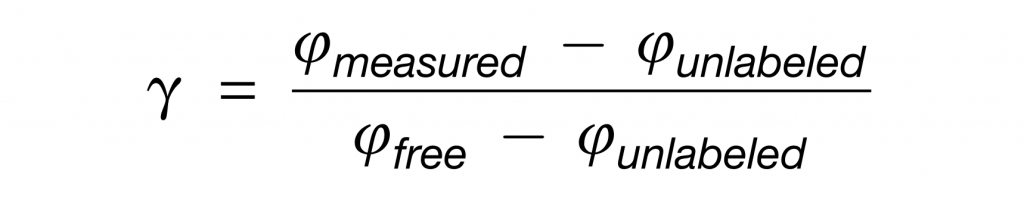
然后,对于每个肽,模拟了未标记(Iunlabeled)和由游离盲肠氨基酸(Ifree)合成的肽的同位素包膜模式。标量γ可以通过将测量的肽同位素分布(Imeasured)与Iunlabeled和Ifree的线性组合拟合来确定。
注意,当一个菌属使用的特定营养素超过该营养素对盲肠游离氨基酸的贡献时,γ将大于1。
具体来说,测量的每个肽的γ如下:

对于细菌属水平的原料贡献程度的测量,分析中只保留测量超过3个肽的属,多肽的中位数为γ-genus。
对于细菌科水平,仅分析在蛋白质组学中始终检测到的属,以及在 16S rRNA 基因扩增子测序中检测到 (> 0.5%) 的属的上一级科。
每种营养物质对菌属的贡献程度的定量公式如下:
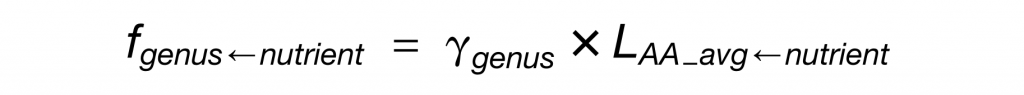

LAA_avg-nutrient为各营养物质对细菌蛋白质的贡献程度,其计算公式如下:
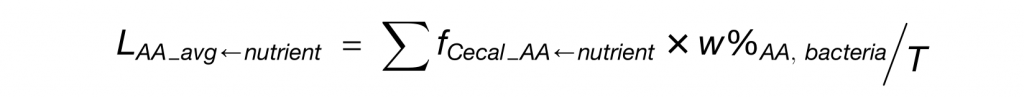

1 微生物组消耗较少的可消化膳食成分
微生物群影响宿主生理学的主要机制是通过分泌代谢产物。研究人员在门静脉和体循环以及盲肠内容物中测量了微生物衍生的50多种代谢产物的绝对浓度。
微生物群相关代谢物的绝对浓度和来源
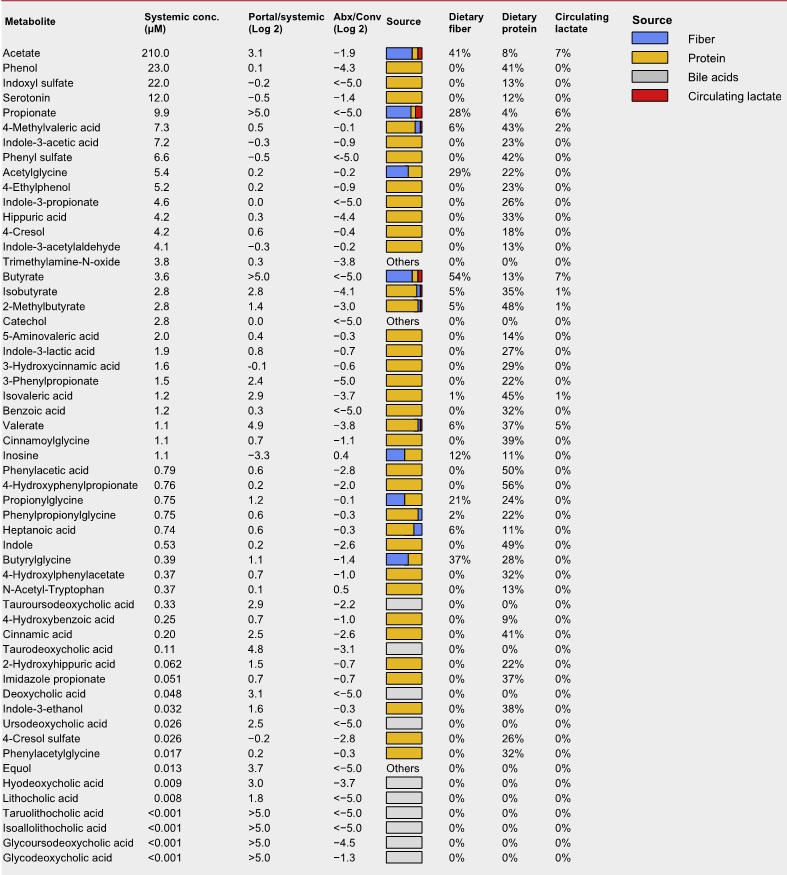
上表可以看到,与全身血液相比,大多数在门静脉循环中升高,除两种(肌苷和N-乙酰色氨酸主要来源于宿主)外,其余均被抗生素治疗耗尽。
门静脉血中主要排泄产物是短链脂肪酸。
其他相对丰富的微生物群产物是芳香族氨基酸发酵产物(苯酚、吲哚硫酸盐和3-苯丙酸盐)和支链脂肪酸(戊酸盐、异戊酸盐,4-甲基戊酸、异丁酸盐和2-甲基丁酸盐)。
探索肠道微生物产物的膳食输入:淀粉、菊粉
研究人员通过口服管饲法、淀粉(易消化葡萄糖聚合物)和菊粉(易消化果糖聚合物,即可溶性纤维)喂养小鼠:
13C淀粉灌胃后,标记的葡萄糖、乳酸和丙氨酸迅速出现在门脉循环中,并占大多数淀粉碳(约75%)。
13C菊粉和13C淀粉有什么不同?
13C菊粉灌胃后,没有观察到大量标记的果糖、葡萄糖、乳酸和丙氨酸,取而代之的是标记的门静脉代谢产物以短链脂肪酸的形式缓慢出现,约40%的菊粉碳成为短链脂肪酸,其余未消化并随粪便排出。
膳食菊粉,而不是淀粉,在盲肠内容物中广泛标记糖酵解和TCA中间体和氨基酸。
藻类蛋白大量标记了微生物群衍生的门静脉代谢物:短链脂肪酸、支链脂肪酸和芳烃(吲哚、吲哚-3-丙酸盐和3-苯丙酸盐)。
“难以消化的碳水化合物和蛋白质直接为微生物组提供营养,并通过微生物产物间接为宿主提供营养。”
研究中发现宿主循环系统中的乳酸,3-羟基丁酸以及尿素能为肠道细菌提供营养。
如图A,将同位素标记的营养物质通过静脉输注到小鼠的全身血液循环中。 2.5 小时后收集血清和粪便以量化每种营养物质对相应菌群代谢物的碳贡献。
图BCD表示了13C标记的各种营养物质在小鼠的血液和粪便中的含量,可见乳酸和 3-羟基丁酸有进入肠道菌群中,而其余大部分营养物质如柠檬酸盐、葡萄糖、氨基酸等都没有进入到肠道菌群中。
图F为15N标记的营养物质,可见尿素也同样被菌群大量利用。
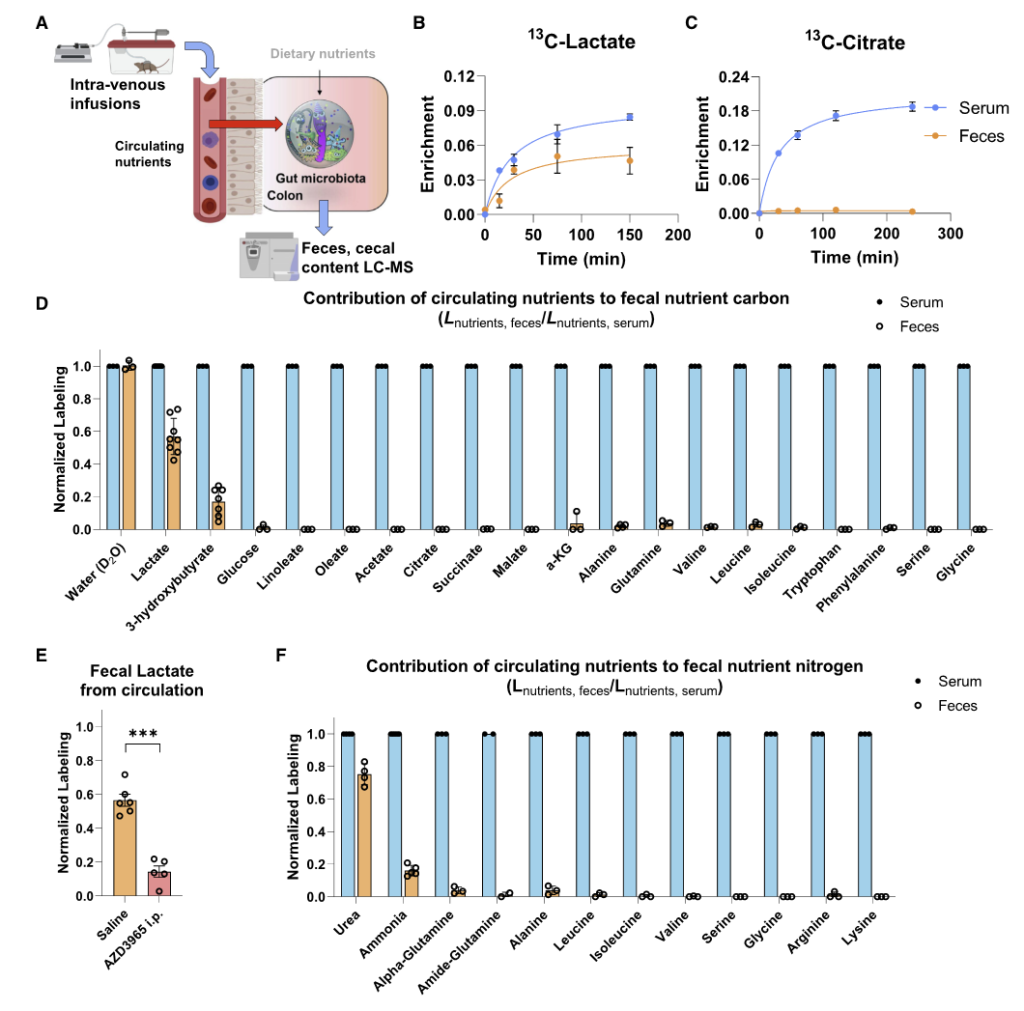
为了定量确定微生物代谢物的来源,研究人员给小鼠喂食部分纤维、脂肪或蛋白质13C标记的标准食物,盲肠标记在12小时内达到稳定状态。
为了说明循环营养输入,研究人员还注入了13C乳酸或3-羟基丁酸。
这些研究确定了大多数微生物群中心代谢物中的碳供给:
接下来,研究人员检查了微生物组游离氨基酸的输入,并用15N标记的膳食蛋白和注入的尿素进行追踪。
与哺乳动物不同,大多数肠道细菌具有合成所有20种蛋白质氨基酸的生物合成能力。
然而,研究人员观察到“必需氨基酸”主要来源于膳食蛋白质,哺乳动物无法制造,需要在细菌中表达广泛的生物合成途径。
“非必需氨基酸”主要在肠道微生物群中合成,使用膳食菊粉和循环乳酸作为碳源。
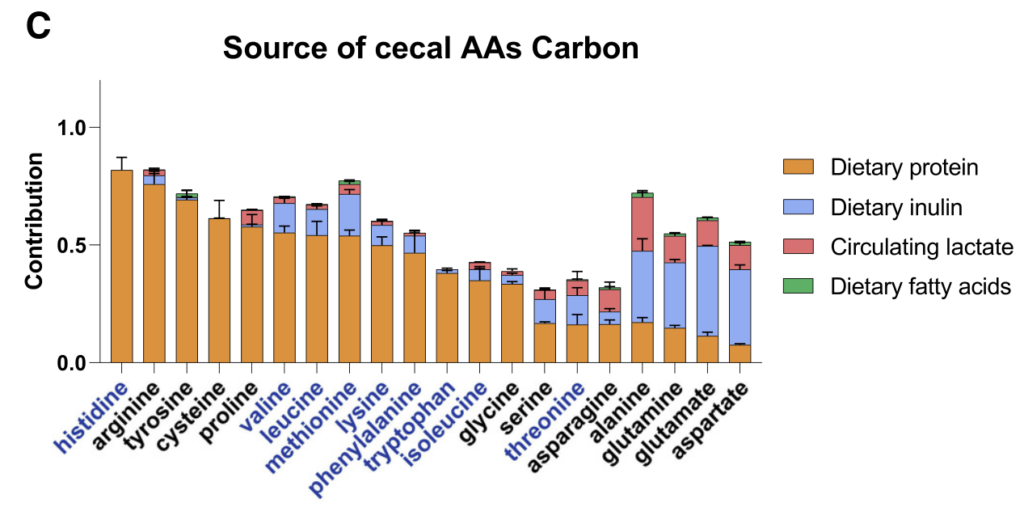
抗生素或无菌小鼠中的微生物群消耗有利于盲肠中氨基酸的积累(基于同位素追踪研究),这些氨基酸主要来自膳食蛋白质和微生物合成的氨基酸的消耗。
膳食蛋白质是必需氨基酸和非必需氨基酸的主要氮源,宿主尿素对非必需氨基酸也有很大贡献。
研究人员的发现如下:
【1】必需氨基酸,尽管能够由微生物群合成,但主要来自饮食,不经历任何碳重排;
【2】与TCA连接最紧密的非必需氨基酸基本上由微生物群合成,使用来自纤维的碳,通过中心代谢反应与其他碳争夺;
【3】转氨反应部分地将来自饮食衍生氨基酸的氮与来自宿主尿素的氮混合。
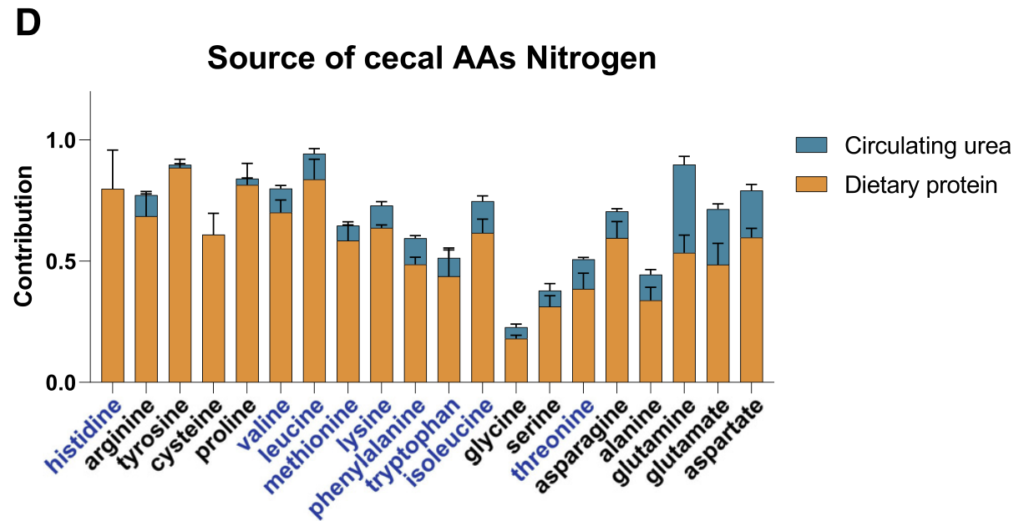
研究人员发现,许多微生物来源的代谢物来源于到达结肠的未吸收膳食蛋白。假设这些代谢物的循环水平将取决于膳食蛋白质到达结肠微生物群的程度。
为了控制这一点,研究人员给小鼠喂食的食物中,一部分蛋白质(酪蛋白,部分到达结肠微生物群)被游离氨基酸(基本上在小肠中完全吸收)取代。
2周后对全身血液进行代谢组学研究。含有较少完整蛋白质和更多游离氨基酸的饮食往往会增加循环氨基酸水平。
重要的是,蛋白质衍生的循环微生物代谢物(酚类、吲哚类和酰基甘氨酸)串联下降。
“微生物代谢物营养来源的知识可用于操纵其系统水平。”
研究人员通过结合13C营养标记和蛋白质组学来定量不同微生物的碳原料。
每种13C标记的营养素(膳食菊粉、膳食藻蛋白或循环乳酸)提供24小时,这足以在肠道细菌中实现稳态标记。
如同B-D,分别计算了在膳食中使用的菊粉和蛋白质以及乳酸在各细菌内的喜好程度,这个喜好程度也就是将在细菌特异性肽上被同位素标记的程度进行了量化。
结果可见:
拟杆菌属和梭状芽胞杆菌利用菊粉的程度是 Akkermansia、Muribaculum 或 Alistipes 的 4 倍多。
总体而言,厚壁菌门下的菌属比拟杆菌门的使用膳食中的蛋白质(厚壁菌0.237±0.052;拟杆菌0.175±0.031,p=0.02)。
Akkermansia通常被认为是一种促进健康的肠道微生物,使用的菊粉和蛋白质最少。相比之下,它使用了来自宿主的循环乳酸最多。
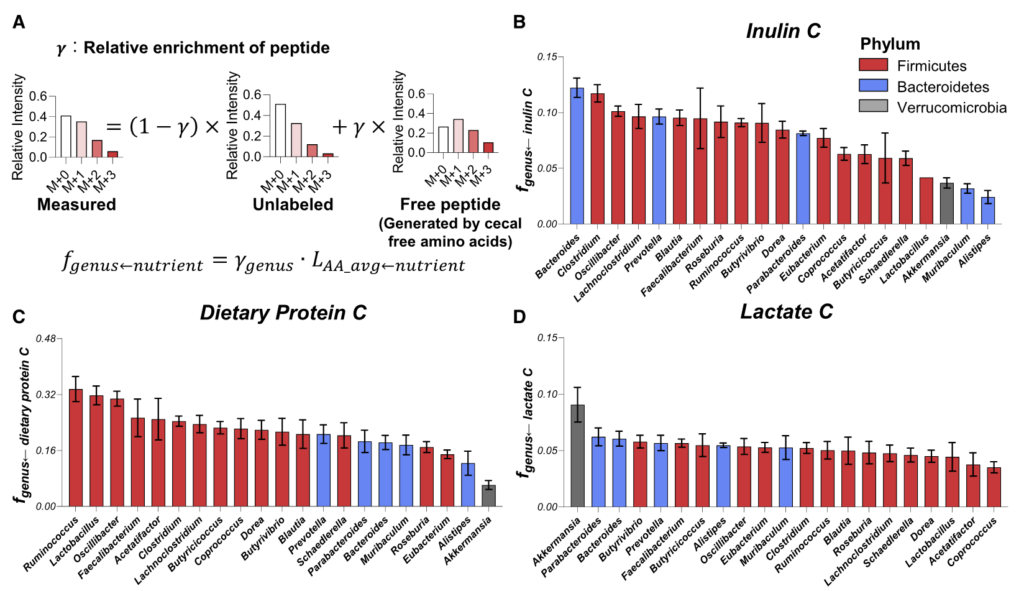
为了知晓这些细菌的营养偏好是否能预测饮食变化后的肠道菌群的组成变化。研究人员给小鼠喂食富含菊粉或藻类蛋白的饮食 2 天,并通过 16S rRNA 测序测量微生物组的组成。
结果如图F和I:
利用最多菊粉的拟杆菌属在高菊粉饮食后增加了4倍;
另一种利用较多菊粉的梭状芽胞杆菌也增加了2倍;
利用较少菊粉的菌属要么没有变化,要么略有下降;
富含藻类蛋白饮食的实验结果同理。
图G和J计算了这两种营养物与对其利用程度最高的前两名菌属相对丰度的相关性,p<0.05呈显著相关。
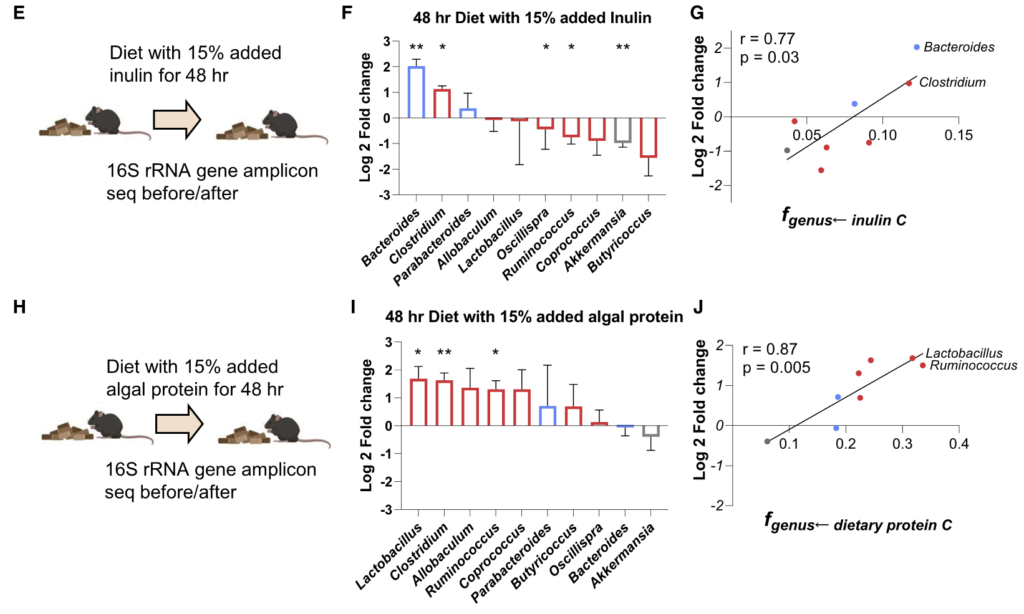
“不同肠道细菌的营养偏好有助于解释饮食操作后微生物组分的变化。”
最后,研究人员转向不同肠道细菌的氮源偏好,比较15N标记的膳食蛋白喂养和15N尿素输注。
高度利用膳食蛋白质中碳的细菌属也高度利用膳食蛋白中的氮,这与细菌蛋白质组中完整吸收的膳食蛋白质中的氨基酸一致。
厚壁菌喜欢从膳食蛋白质获取氮
在厚壁菌门成员中,偏好尿素氮的属往往是菊粉的疯狂使用者,即使用菊粉和尿素合成自己的氨基酸。这包括一些脲酶阴性菌属,它们可能通过交叉喂养获得尿素氮。
此外,在厚壁菌中也看到了一些属更喜欢从膳食蛋白质中获得氮,而其他属更喜欢循环尿素。
静脉注射尿素以提高循环尿素浓度后,偏好尿素的厚壁菌以及阿克曼菌的丰度大幅增加。
拟杆菌喜欢从宿主分泌的蛋白质中获取氮
与厚壁菌相比,拟杆菌对膳食蛋白质和循环尿素氮的利用率较低,这提出了一个关键问题:
拟杆菌如何获得氮?
肠道微生物群的一些成员(如拟杆菌和阿克曼菌)能够消化宿主分泌的蛋白质,如粘蛋白。
假设宿主分泌的蛋白质是拟杆菌氮的关键来源。为了探索这种可能性,研究人员进行了长期15N标记的赖氨酸和精氨酸输注(12、18和36小时),以标记结肠中的宿主蛋白。
尽管没有直接给微生物组喂食,但在36小时输注后,赖氨酸和精氨酸确实起作用,这与通过宿主蛋白进行的标记一致。这种标记优先发生在拟杆菌和阿克曼菌中。
膳食和分泌宿主蛋白的氮贡献呈负相关,与某些肠道细菌优先消耗膳食蛋白和其他宿主蛋白一致。
“膳食蛋白质和循环尿素是厚壁菌的主要氮原料,而分泌的宿主蛋白质为拟杆菌提供氮。”
研究人员开发了定量同位素追踪方法来测量肠道细菌的营养偏好。除了膳食纤维和分泌的宿主蛋白外,还将膳食蛋白和循环宿主乳酸、3-羟基丁酸和尿素确定为喂养肠道细菌的重要营养素。排除了其他循环宿主营养素(如葡萄糖和氨基酸)对结肠微生物群的直接贡献。
一项关键技术成就是能够从不同碳源和氮源追踪到细菌特异性肽,从而揭示复杂和竞争性肠腔环境中不同细菌的营养偏好。
厚壁菌门倾向于从膳食蛋白质获得氨基酸,而拟杆菌门更多地依赖宿主分泌蛋白。同样,一些厚壁菌门(如梭菌属)大量利用纤维(菊粉),而其他厚壁菌门则不利用纤维。
动物饮食干预实验发现,拟杆菌属和梭菌属是转化纤维最活跃的菌属。宿主循环代谢物水平也可能影响微生物组的营养获取和最终组成。
本文提供了关于哪些营养素喂养肠道微生物群以及哪些细菌更喜欢哪些营养素的基础知识。
文中所开发的方法具有广泛的应用前景,最终将有助于全面和定量地了解饮食-微生物-健康的关系。
参考文献:Zeng X, Xing X, Gupta M, Keber FC, Lopez JG, Lee YJ, Roichman A, Wang L, Neinast MD, Donia MS, Wühr M, Jang C, Rabinowitz JD. Gut bacterial nutrient preferences quantified in vivo. Cell. 2022 Sep 1;185(18):3441-3456.e19. doi: 10.1016/j.cell.2022.07.020. PMID: 36055202; PMCID: PMC9450212.

谷禾健康


写在前面
《基于肠道菌群思考饮食》
所谓“病从口入”,饮食是人类健康的核心。
有没有发现这样一种现象?我们的日常饮食正在向西式饮食过渡,与此同时,各类慢性病正日渐侵蚀。
近期在《CELL》子刊上接连发表了好几篇关于肠道菌群和健康饮食以及疾病的发生等循证科研研究和综述,谷禾长期的肠道菌群检测实践中也发现各种干预措施和用药治疗均需要考虑饮食营养的部分,结合肠道菌群的干预将起到更有效更长期的效果,例如炎症性肠病患者干预治疗期间,需要结合营养调整或补充来重塑肠道菌群和免疫平衡。
一系列严格的前瞻性队列研究和随机对照试验为健康饮食的特征提供了有力的验证:
蔬菜和水果、全谷物带来益处,加工食品带来有害影响。
然而,仍然存在许多争议,大家可能对“健康饮食”这个概念停留在模糊层面,依然存在许多困惑例如:


本文我们试着从微生物组科学的角度,讨论基于食物的饮食指南和健康饮食的各个方面,尽可能将我们已了解的科学知识融入其中,当然讨论仅限于针对普通人群的健康促进和疾病预防建议,这也是基于肠道菌群和食物营养的饮食推荐的目的。
以食物为基础的饮食指南提供了关于食物、食物组分和饮食模式的建议,以实现营养素的参考摄入量,预防慢性病,并维持普通人群的整体健康。
下表显示了过去10年中更新的国外基于食品的饮食指南的关键信息的非详尽概述,这些指南分为最常见和补充食品组:蔬菜和水果、谷物制品、乳制品、肉类和肉类替代品和加工食品。
非详尽的国家以食物为基础的膳食指南清单和一般成年人的食物组推荐摄入量



doi.org/10.1016/j.chom.2022.04.016
2022年4月26日,《中国居民膳食指南(2022)》发布,提出了平衡膳食八准则:
不同的饮食文化国家的指导原则,有很强的一致性,所有指南都在告诉我们:
建议限制或避免添加高糖、高盐和高饱和脂肪的食品,一些国家特别提到避免加工、超加工和/或包装食品。
一半以上的饮食应包括蔬菜、水果和谷物产品,全谷物优先于精制谷物。这些饮食需要补充少量的动物性蛋白质(鱼类、瘦肉、家禽、鸡蛋和乳制品)和/或植物性蛋白质(豆类、坚果)。
下面,我们在微生物组的背景下讨论饮食指南,重点是人类研究,尽管存在局限性(例如,大剂量给药和向人类转化),但动物模型在建立分子机制和因果关系方面存在优势。
在所有饮食指南中:
✔建议食用蔬菜、水果、全谷类、豆类和坚果等全植物食品
✖ 应限制摄入添加糖、盐或饱和脂肪的加工食品
膳食纤维
全植物食品是膳食纤维的唯一相关天然来源,膳食纤维是一种难以消化的碳水化合物聚合物,在化学成分、物理化学性质和生理效应方面有很大的不同。
与肠道微生物群特别相关的是可发酵纤维,也称为微生物群可获得碳水化合物(MAC),如果它们显示出与对微生物群的选择性影响相关的既定健康益处,则为益生元。
纤维为抑制粘液聚糖代谢的微生物提供生长基质,防止肠道粘液耗尽、细菌侵入粘液层、下游炎症和感染。
纤维发酵的主要最终产物是短链脂肪酸 (SCFA),即乙酸盐、丙酸盐和丁酸盐,它们会引起多种生理效应。
这些影响包括:
高纤维饮食可降低心脏病发作、中风和心血管疾病的风险。
近期,一项纵向、随机、交叉设计主要研究两种流行的纯化纤维,阿拉伯木聚糖 (AX) 和长链菊粉 (LCI),结果发表在《CELL Host & Microbe》.
该研究显示了单个纯化纤维对微生物组的影响,深入了解了纤维补充剂的影响以及纤维诱导的胆固醇降低背后的机制。
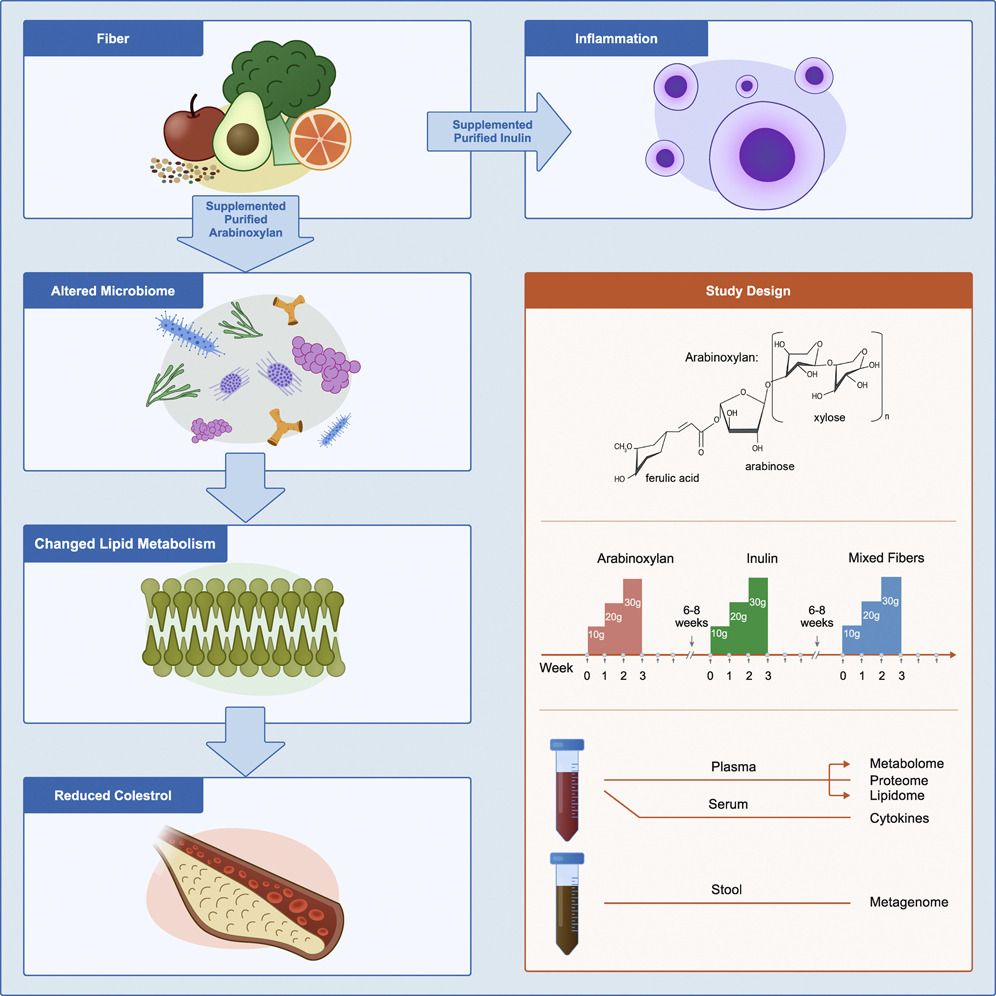
doi.org/10.1016/j.chom.2022.03.036
结果表明 ↓↓↓
阿拉伯木聚糖:
长链菊粉:
总的来说,每一种纤维都可引起个体化和纤维特异性的生化和微生物群反应,因此,膳食纤维对健康的益处因人而异,可能还取决于具体摄入的纤维类型和摄入剂量。
植物化学物质
全植物食品的另一个关键成分是植物化学物质,它们是非营养和生物活性化合物,通常与膳食纤维结合,赋予植物颜色、风味、气味和涩味。
大多数 (90%–95%) 的植物化学物质不会被小肠吸收,因此会与肠道微生物群进行双向相互作用。
肠道微生物负责通过去甲基化、开环和脱羟基等过程对植物化学物质进行生物转化,从而增加它们的生物利用度、吸收以及抗氧化和免疫调节作用。
全植物食品对肠道微生物群的影响及对宿主生理、免疫、代谢和疾病风险的影响
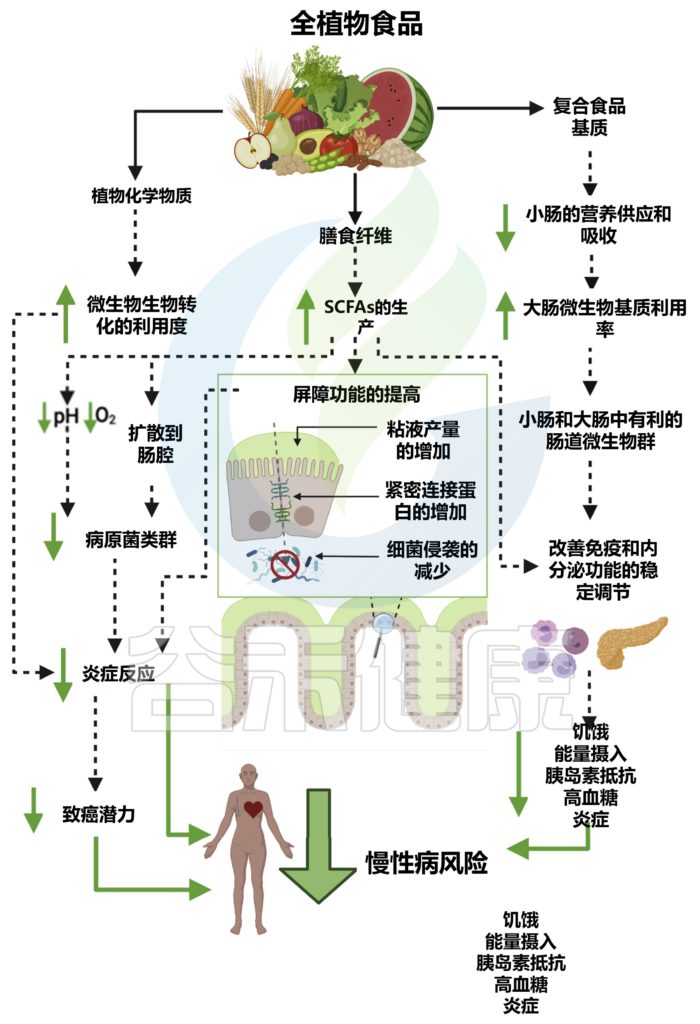
doi.org/10.1016/j.chom.2022.04.016
尽管全植物食品具有有益的效果,但工业化国家的全植物食品消费量始终低于建议的水平,而包装食品经过不同程度的加工。
根据NOVA食品分类工具,食品加工程度是饮食质量的主要驱动因素,加工程度最高的食品被归类为“超加工食品”。其有害影响(增加能量摄入和体重增加)已在严格控制喂养研究中得到实验验证。然而,超加工食品的定义或此类食品的示例几乎没有一致性,关于避免所有超加工食品而不考虑其个别营养属性的全面建议存在争议。
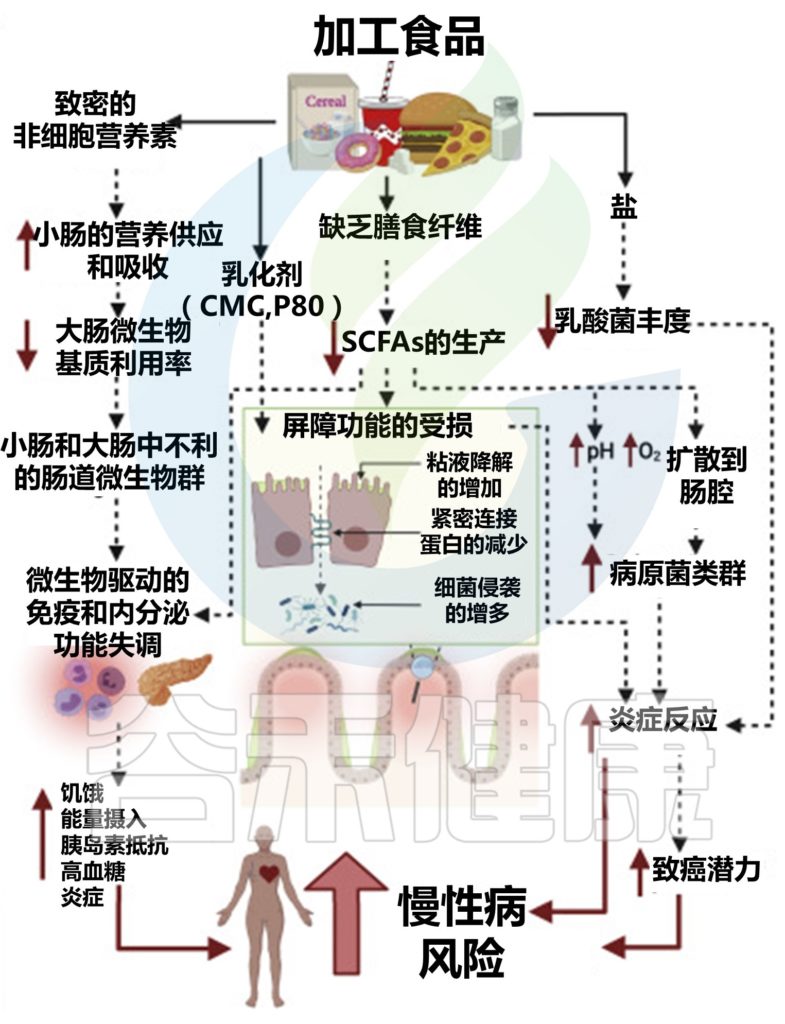
加工食品如何带来不利影响?
加工食品的功能特性与全植物食品有着根本的不同。加工食品通常具有较高的能量密度,并且缺乏植物细胞中存在的三维结构。因此,营养素主要是无细胞的(即不包含在细胞内),更容易被宿主消化,这增加了营养素吸收动力学。
这些容易发酵的营养素可能会促使小肠中的细菌过度生长,以及不利的微生物组成和代谢状况,从而对免疫和内分泌功能产生负面影响,而结肠微生物群无法获得这些营养素。
例如,高果糖玉米糖浆已被证明会导致小鼠脂肪肝和葡萄糖不耐受,其方式与肠道微生物群组成和功能变化有关。
加工食品:食品添加剂影响菌群
加工食品中的食品添加剂,可以进一步提高口感和保质期,但是会影响肠道微生物群。
合成乳化剂羧甲基纤维素(CMC)和聚山梨酯-80损害肠道屏障功能,导致微生物群侵占上皮,促进野生型小鼠的代谢异常和轻度炎症,以及遗传易感小鼠的结肠炎,其方式与肠道微生物群有因果关系。
在另一种乳化剂甘油单月桂酸盐的小鼠中也观察到类似的结果。人类短期食用CMC也会显著改变微生物群组成,降低粪便短链脂肪酸水平,并诱导细菌侵入粘液层。
加工食品中的高盐含量也可能改变微生物群。盐的摄入降低了乳酸菌的丰度,这与小鼠小肠固有层淋巴细胞和人类外周血淋巴细胞中辅助性T细胞17的数量增加以及血压升高有关。
另一项针对小鼠的研究报告了类似的结果,其中高盐饮食降低了乳酸菌的丰度,增加了促炎基因的表达,并加剧了两种不同疾病模型中的结肠炎。
因此,现有证据表明,加工食品和全植物食品对人类健康的对比效应部分是由肠道微生物组介导的。
加工食品对肠道微生物群的影响及对宿主生理、免疫、代谢和疾病风险的影响
doi.org/10.1016/j.chom.2022.04.016
更多关于食品添加剂与菌群详见之前的文章:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
根据饮食指南,健康饮食的最大组成部分应该是蔬菜和水果。目前关于蔬菜水果预防多种慢性病的能力的科学证据十分有力。
▸蔬菜水果富含膳食纤维
水果和蔬菜每份可提供高达 8g 的膳食纤维,并含有多种纤维,包括果胶、菊糖、纤维素、木聚糖、棉子糖和水苏糖。这些纤维引发微生物组独立(例如延迟的大量营养素吸收)和微生物组依赖(例如短链脂肪酸介导的胰岛素抵抗衰减)生理效应。
人类对照喂养实验发现,富含菊糖的蔬菜可提高双歧杆菌水平,促进饱腹感,并减轻体重。
在喂食高脂肪饮食的小鼠中,抗生素治疗降低了菊糖的代谢益处,比如降低这些益处:在小肠中诱导肠促胰岛素激素胰高血糖素样肽1和对代谢综合征的保护,这表明微生物群的因果作用。
▸蔬菜和水果也是植物化学物质的重要来源
包括多酚、硫代葡萄糖苷、萜类、植物甾醇和生物碱。
蔓越莓提取物是一种多酚类物质的丰富来源,在高脂高糖饮食的小鼠中诱导代谢改善(例如,减少内脏肥胖和改善胰岛素敏感性),这与 Akkermansia muciniphila的增加有关。
注:Akkermansia muciniphila菌在动物和人类中都显示出有益生理效应。关于该菌详见之前文章:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
Nature | AKK菌——下一代有益菌
从临床研究和临床前研究中,也有新的证据表明微生物组在西兰花的生理效应中发挥作用。后者为西兰花衍生的硫代葡萄糖苷生物活性转化为化学预防性异硫氰酸酯奠定了拟杆菌的遗传和生化基础。
总的来说,现有证据支持肠道微生物群在调解蔬菜和水果对健康的影响方面的作用。
食物对宿主-微生物相互作用的影响以及它们如何与膳食指南中的建议保持一致

doi.org/10.1016/j.chom.2022.04.016
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
大多数饮食指南建议食用全谷物而非精制谷物。全谷物的麸皮层被去除以生产精制谷物,含有植物化学物质(如阿魏酸、类黄酮)和膳食纤维。
▸ 全谷物含有独特纤维,抗炎作用与菌群相关
全谷物含有独特的半纤维素纤维,如木聚糖和β-(1→ 3,1 → 4)—除纤维素、抗性淀粉和低聚糖外,还有葡聚糖。全谷物能够降低慢性病风险的证据基础是令人信服的。人类干预试验表明,全谷物的抗炎作用与肠道微生物群的变化是并行的。
在健康成年人中,显示了对健康有益微生物的富集,如双歧杆菌和产丁酸菌(直肠真杆菌Eubacterium rectale、Roseburia faecis, Roseburia intestinalis),产短链脂肪酸菌Lachnospira增多,粪便乙酸盐和总短链脂肪酸增加,肠杆菌科减少。
虽然微生物组的变化为抗炎作用提供了潜在的解释,但这些研究之间并不一致;进一步的研究报告没有任何影响,也没有确定因果关系。
▸ 全谷物的部分代谢益处是由肠道菌群介导的
将人类研究与小鼠实验相结合的研究表明,微生物组对全谷物的健康影响具有因果关系。
食用大麦仁面包的人被分为“响应者”和“无响应者”,“响应者”的葡萄糖代谢因干预而得到改善。
响应者普氏菌/拟杆菌属比率和Prevotella copri丰度升高,以及编码复杂多糖降解的微生物基因在应答者中升高。
关于Prevotella copri菌详见:肠道重要基石菌属——普雷沃氏菌属 Prevotella
无菌小鼠灌胃普氏杆菌或含有P.copri的“应答者”人源性微生物群后,喂食标准食物后,葡萄糖耐量有所改善,这在机制上与肝糖原储存增加有关。
进一步的研究证实,在基线时含有高水平的普雷沃氏菌,会导致体重过重,且食用富含全谷物的饮食的个体的体重减轻。
一些饮食指南(加拿大的食品指南、巴西人口的饮食指南和英国的Eatwell指南)建议经常食用植物蛋白食品(如豆类、坚果),因为它们对人类健康有益。
豆类
豆类富含纤维,特别是纤维素、果胶、甘露聚糖、水苏糖、棉子糖和抗性淀粉。
豆科植物还含有黄酮醇等植物化学物质,黄酮醇是一种已知的抗炎类黄酮亚类,还含有酚酸,与谷物中的酚酸相比,豆类中酚酸的生物利用率更高。
新出现的证据表明,肠道微生物群在豆科植物的健康影响中发挥着作用。
例如,绿豆补充剂减少了喂食高脂肪饮食的小鼠的体重增加和脂肪积累,但没有减少喂食相同饮食的无菌小鼠的体重增加和脂肪积累。
坚果
坚果是不饱和脂肪酸、纤维和植物化学物质的来源,所有这些都可能影响宿主与微生物的相互作用。
在一项控制喂养研究中,每天补充核桃可增加粪杆菌属(Faecalibacterium)、罗氏菌属(Roseburia)、梭菌(Clostridium)和戴阿利斯特菌(Dialister)。
在一项杏仁对照喂养研究中观察到了类似的成分变化,显示罗氏菌属(Roseburia)、梭菌(Clostridium)、戴阿利斯特菌(Dialister)和毛螺菌属(Lachnospira)的相对丰度增加。
坚果对罗氏菌属丰度的影响也已在meta分析中得到证实。
主要产丁酸菌如Roseburia intestinalis能够将坚果中难以消化的聚糖β-甘露聚糖代谢为丁酸盐。
坚果中的omega-3脂肪酸也可能增强罗氏菌属,因为在人类中,补充核桃的饮食和不含核桃的具有相同脂肪酸组成的饮食都增加了罗氏菌属的相对丰度。
除了坚果中的纤维和不饱和脂肪酸外,肠道微生物还将植物化学物质鞣花单宁和鞣花酸代谢为尿石素,尿石素是一种生物活性抗炎化合物。
总之,增加坚果摄入量似乎在一定程度上通过影响微生物群的功能成分对宿主健康有益。
抗炎看到目前研究将植物性蛋白质食品的益处与微生物组联系起来,但该领域的研究仍处于初步阶段。
植物性蛋白质比动物性蛋白质更不易消化并因此为结肠微生物提供潜在的底物,这可能导致产生有益的生物活性代谢物,例如色氨酸代谢。然而,蛋白水解微生物发酵也可能有害(见下文讨论——红肉和加工肉)。目前尚不清楚植物蛋白微生物发酵产生的代谢结果是否不同于动物蛋白,需要进一步研究。
饮食指南一直鼓励把鱼类作为优质蛋白质来源和良好的脂肪酸组成。
多脂鱼类
多脂鱼类是长链ω-3脂肪酸二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的主要天然膳食来源之一。
观察研究和干预研究的有力证据表明,多脂鱼摄入量的增加具有心脏保护作用,肠道微生物群可能是这些健康影响的潜在中介。
鱼油
小鼠实验表明,与猪油(富含饱和脂肪)相比,鱼油降低了 Toll 样受体激活和白色脂肪组织炎症,这与改善胰岛素敏感性有关。
除了这两种脂肪对微生物群组成的不同影响(猪油增加Bilophila菌)之外,与传统猪油喂养的小鼠相比,喂食鱼油的无菌小鼠和喂食抗生素的小鼠的盲肠微生物群定植后,体重减轻,白色脂肪组织炎症减轻。
这项研究为肠道微生物群在饱和脂肪的炎症作用中的因果作用提供了证据。
尚未在人类身上做出因果推论,但在多脂鱼和其他饮食来源中发现的 omega-3 脂肪酸已被提议作为候选益生元,因为它们被特定的肠道微生物利用。
在一项随机对照试验中,鱼源性 omega-3 补充剂增加了Coprococcus的丰度,与富含甘油三酯的脂蛋白水平呈负相关。
因此,肠道微生物组可能是多不饱和脂肪酸心脏保护作用的介质。
以上各种饮食推荐都接近一种饮食模式,那就是地中海饮食,作为现在十分流行的饮食模式之一,
地中海饮食有什么独特之处?
对菌群有哪些影响?
接下来详细了解一下地中海饮食。
我们逐渐开始有这样一个认识,健康不止是受个别食物的影响,而是受其相互联系和协同效应的影响。因此,最近更新的几项饮食指南,如《中国饮食指南2022》、《2020-2025年美国人饮食指南》、《加拿大食品指南》等对饮食模式的关注发生了转变。
食物之间的相互作用也与它们对肠道微生物群的影响有关,人们对饮食模式,尤其是那些具有既定健康益处的饮食模式(如地中海饮食)如何通过微生物群组成和功能变化影响宿主健康感兴趣。
▸ 地中海饮食结合了许多对宿主微生物相互作用具有有利影响的食物组
地中海饮食推荐蔬菜、水果、全谷类、豆类、坚果和橄榄油作为主食,适度摄入鱼类、家禽、鸡蛋和乳制品,并限制摄入红色和加工肉类及加工食品。
在对体重超标的个体进行的一项随机对照试验中,与对照饮食相比,坚持地中海饮食可降低血浆胆固醇浓度,并增加了产丁酸菌普拉梭菌(F. prausnitzii)和罗氏菌属(Roseburia) 的丰度。F.prausnitzii和Roseburia也是通过随机森林模型确定的分类群,这些模型可以最好地预测饮食依从性得分。
▸ 地中海饮食改善老年人认知
在一项大型多中心随机对照试验中,该试验涉及了连续12个月食用地中海饮食的老年人。这些分类群与认知功能的改善呈正相关,与炎症标志物和虚弱呈负相关。
▸ 地中海饮食降低心肌梗死风险
在一项前瞻性队列研究中,长期坚持地中海饮食与F. prausnitzii, Eubacterium eligens, Bacteroides cellulosilyticus 呈正相关。这项研究进一步表明,与那些携带P.copri的人相比,P.copri丰度较低且坚持地中海饮食的人心肌梗死风险较低。
对地中海饮食的微生物组学研究强调了其在饮食建议中的重要性。最近部分国家更新的饮食指南推荐了类似地中海饮食的饮食模式,如阻止高血压的饮食方法(DASH)饮食,并对微生物组在调节其健康影响中的作用进行了研究。
虽然饮食指南已经演变为反映新的可用证据,并普遍同意其建议,但争议仍然存在。
在这里,我们讨论了宿主-微生物相互作用如何提供洞察力来帮助解决这些争议。
红肉含有必需的微量营养素,是重要的优质蛋白质来源。然而,大多数饮食指南建议只适度食用,同时建议避免食用加工肉类(盐腌、腌制和烟熏的肉类)(表1)。
▸ 红肉和加工肉类引争议?
在癌症预防方面,这些评估由国际癌症研究机构(IARC)和世界癌症研究基金会共同进行。尽管有这些一致的建议,但2019年的一系列系统性审查得出结论,成年人应该继续目前的红肉和加工肉摄入量,理由是它们与不良健康结果的联系的证据不足。这引发了营养领域的争议。
肠道菌群为这场争论提供了另一个视角
肠道微生物对红肉和加工肉类的蛋白水解发酵会导致产生潜在的有害代谢物,例如氨、对甲酚和硫化氢。
▸ 红肉和加工肉→产硫化物菌发酵→可能致癌
硫化氢是由脱硫弧菌等细菌发酵含硫氨基酸产生,并作为粘液溶解剂,可以增加小鼠肠道通透性。
这使得同样存在于红肉和加工肉类中的血红素能够增加肠道中的过度增殖和增生,抑制肿瘤抑制基因,并激活致癌基因,所有这些都是致癌的潜在原因。
抗生素给药抑制了小鼠的这些影响,表明肠道微生物群的因果作用。在人类中,产生硫化物的细菌和途径与晚期结直肠癌密切相关。
▸ 红肉和加工肉→TMAO→心血管疾病
肠道微生物将肉制品中大量存在的左旋肉碱和磷脂酰胆碱转化为三甲胺,三甲胺被含肝黄素的单加氧酶 (FMO) 氧化为三甲胺-N-氧化物 (TMAO)。
TMAO 在血浆中循环并由肾脏有效排泄,并在动物模型中与心血管疾病有因果关系。观察性研究报告了 TMAO 水平与心血管疾病风险之间的强正相关关系。然而,动物实验并不一致,而人类中的 TMAO 水平经常被混淆并可能由肾功能下降引起。
此外,TMAO 范式与将富含 TMAO 及其前体的脂肪鱼与有益的心脏代谢结果联系起来的流行病学发现不一致。
肉类以外的食物(即十字花科蔬菜)可以抑制 FMO3 的活性,使研究结果更加复杂。
为了阐明源自肉类产品的 TMAO 的因果贡献,需要在人类中进行足够持续时间的控制喂养试验,以评估经过验证的心血管疾病的替代标志物。
▸ 加工肉类含有瘦红肉中不存在的其他化合物,这些化合物可能会放大微生物介导的有害影响
大多数加工肉类富含饱和脂肪,可刺激小肠中的肝胆汁酸分泌。
一些初级胆汁酸逃脱肠肝再循环并进入大肠,在那里它们被微生物转化为次级胆汁酸。其中,脱氧胆酸和石胆酸可引起氧化应激和 DNA 损伤,并与结肠癌发生有关。
一项荟萃分析发现,在结直肠癌患者中,肠道微生物组功能特征的特征是次级胆汁酸的产生增加。而一项系统评价表明饱和脂肪会降低微生物的丰富度和多样性。
此外,加工肉类中使用的固化剂硝酸盐和亚硝酸盐构成微生物生物转化为N-亚硝基化合物的底物,它们会导致 DNA 烷基化损伤,因此具有致癌性。
▸ “适度食用瘦肉红肉和避免加工肉” 的科学依据
鉴于上述几点,红肉和加工肉类产生的肠道微生物代谢物的毒性与解释它们对健康的影响有关。
尽管有证据表明红肉是结肠癌的危险因素,但蛋白质发酵产生的代谢物(如硫化氢和氨)毒性较低,目前还没有归类为人类致癌物。
相比之下,仅来自加工肉类的微生物代谢产物(N-亚硝基化合物和次生胆汁酸)具有更高的毒性和致癌性。
考虑到可能的剂量-反应关系,毒理学考虑证明了IARC/世界卫生组织专家小组对红肉(2A组,可能致癌物)和加工肉(1组,致癌物)进行风险分类的合理性,以及当前的饮食指南:适度食用瘦肉红肉和避免加工肉。
▸ 长期存在争议:乳制品应在多大程度上纳入健康饮食?
大多数饮食指南建议使用脱脂和低脂(0%-2%)乳制品,并避免使用高脂乳制品(>25%,如某些奶酪、奶油制品和黄油)。然而,对于全脂乳制品还没有达成共识(∼3.5%),其有害影响受到质疑,一些饮食指南(表1)不鼓励使用。
▸ 乳脂肪和肠道微生物群之间的相互作用
一项开创性的研究表明,乳源性饱和脂肪诱导牛磺酸结合胆汁酸,促进产生硫化氢的致病菌Bilophila wadsworthia的爆发,从而引发遗传易感小鼠的结肠炎。
另一项针对小鼠的研究证实了这些发现,其中主要来源于乳脂的高脂肪饮食增加了B. wadsworthia的丰度和盲肠胆汁酸水平,从而导致肠道屏障功能障碍和代谢综合征。
这些动物模型强调了乳源性饱和脂肪对微生物群动态平衡的潜在有害影响,支持了建议限制高脂肪乳制品的饮食指南。
据我们所知,目前缺乏评估全脂乳制品中饱和脂肪水平是否影响微生物群的良好控制的人类干预试验,此类研究有必要,能为未来的饮食指南提供信息。
“低脂”、“低碳”,这对减肥人士来说,是非常熟悉的。
目前的膳食指南没有涉及到限制脂肪或碳水化合物摄入是否会支持最佳健康。
▸ 这些饮食如何影响微生物群代谢以及对健康的长期影响?
低脂饮食通常富含蔬菜、水果、全谷物和植物蛋白质,因此提供有益的饮食成分,改变微生物代谢。
相反,低碳水化合物饮食通常脂肪和/或蛋白质含量较高,因此纤维含量较低,这导致产生对结肠健康有害的代谢物。
这在一项随机对照试验中得到证实,在该试验中,高蛋白低碳水化合物饮食增加了N-亚硝基化合物的浓度,降低了丁酸盐和抗炎酚类化合物的水平。
在另一项研究中,高脂肪、低碳水化合物饮食导致健康年轻人的肠道微生物群、粪便代谢组学特征和血浆促炎介质发生不利变化。
这些发现引起了人们对低碳水化合物饮食的长期健康结果的担忧,并与前瞻性队列研究的荟萃分析一致,该研究显示,食用动物性低碳水化合物饮食的参与者死亡率最高。
因此,有必要通过针对微生物组的方法改善低碳水化合物饮食。
当代国家饮食指南高度一致,与研究人员对饮食如何影响与健康相关的微生物-宿主相互作用的理解一致。
这种一致性是显著的,证实饮食指南的观察性和干预性研究没有考虑微生物组。这表明肠道微生物群是饮食生理效应的关键中介,鉴于哺乳动物解剖学、生理学、免疫和代谢的中心方面在整个进化过程中都是由饮食-微生物-宿主相互作用形成的,这一功能可能在进化上根深蒂固。
虽然营养学和微生物组学学科之间的一致性在很大程度上验证了当前的饮食指南,但研究人员认为,更系统地结合营养素影响宿主-微生物相互作用的分子基础知识,有可能加强和创新人类营养。
下面概述了微生物组学观点可以推进营养策略的机会,然后提出了一个整合肠道微生物组学的研究框架,以进行实验验证。
对人类及其肠道微生物群共同进化的假设最有说服力的支持来自对母乳低聚糖(HMO)功能特征的解释。母乳构成了饮食、微生物组和人类健康之间进化关系重要性的范例。
现代饮食可能在进化上与人类生理不匹配,这可能是慢性病流行的重要驱动因素。
目前建议女性和男性每天摄入 25 克和 38 克纤维。一系列系统评价和荟萃分析支持了更高摄入量的论点,表明每天摄入超过25–29克的纤维将带来额外的益处。参与者每天从蔬菜、水果和坚果饮食中摄入100克以上的纤维,可以显著降低血清胆固醇水平,增加粪便中的短链脂肪酸。
在一项人体试验中,非裔美国人和南非农村人(分别习惯食用低纤维和高纤维饮食)交换了他们的饮食,导致非裔美国人的黏膜增殖率和结肠炎症(结肠癌风险的生物标志物)下降,而南非农村人在这些试验中经历了不利的变化。
饮食交换的效果与次级胆汁酸丰度和短链脂肪酸生成的相反变化相关。对饮食微生物群相互作用如何影响人类生理学的进化考虑,可以为饮食建议、有针对性的营养策略以及对抗慢性病风险的食品开发提供信息。进化的考虑也为微生物组的恢复策略奠定了基础。
工业化造成了非传染性慢性病的增加和微生物组的枯竭,其特征是微生物多样性减少,利用碳水化合物的酶的能力降低,发酵减少,以及黏液降解生物的富集。
尽管将微生物群恢复到祖先的状态可能是不现实的,也可能是不可取的,但人们对开发微生物群恢复策略、重建与健康相关的功能特征的兴趣越来越大。
全植物食物
这种策略得到了一项人类干预研究结果的支持,该研究测试了富含全植物食物(每天提供45克纤维)的饮食,这会提高短链脂肪酸的产量,并增加聚糖降解碳水化合物活性酶的相对丰度。
仅关注膳食纤维的微生物群落恢复方法不太可能补充丢失的微生物物种。已经提出了重新引入因工业化而丢失的菌群的建议。虽然从长远来看这是一种很有希望的方法,但许多消失物种的致病性未知,这使得它们转化为营养策略具有挑战性。
发酵食品
另一种方法是发酵食品,定义为通过理想的微生物生长和膳食成分的酶转化生产的食品,其结果通常具有增强的营养特性。
发酵食品的例子有开菲尔、酸奶、康普茶、豆豉、泡菜等。发酵食品在当前的饮食趋势中排名很靠前,在全球范围内广受欢迎。如果生吃,发酵食品通常含有大量的活微生物,这些微生物具有长期的安全食用历史。
▸ 关于发酵食品健康益处的研究
发酵食品的益处已通过一项定性系统综述进行了总结,该综述对观察性和实验性研究进行了评估,报告称酸奶、开菲尔和其他发酵牛奶与胃肠道健康、2型糖尿病和癌症风险以及体重管理的良好结果相关。
此外,一项针对120000多名参与者的大型观察性研究发现,体重增加与酸奶摄入量之间存在显著的负相关关系。然而,来自随机对照试验的证据非常稀少,发酵食品才刚刚开始被推荐到饮食指南中。
一项随机对照试验对每天包括6份发酵食品的饮食进行了试验,发现增加了微生物组的多样性,并减少了几种促炎细胞因子和趋化因子。
需要额外的设计良好的随机对照试验,并验证替代终点,以证明将发酵食品纳入饮食建议的合理性。此类研究应考虑到一些发酵食品(如发酵香肠、一些奶酪和加糖酸奶)的有害营养方面,如大量的盐、饱和脂肪、糖和固化剂,可能会超过活微生物的潜在益处。
益生菌、合生元
理论上,也可以通过饮食益生菌和合生元(益生菌和益生元的组合)来实现微生物群落的恢复策略。
有大量研究在许多临床环境中探索这些策略,并提出了不同的机制,例如其免疫调节作用。如果使用人体胃肠道固有的细菌菌株,益生菌可以成功地长时间定植。
这种策略可以使微生物群多样化,但据了解,这一点尚未得到系统的测试。
也有人提议探索每日摄入活微生物的饮食建议,以促进健康。为了使这一概念可行,需要进行流行病学研究和随机对照试验,以测试益生菌在预防慢性病方面的价值。
为了提高全人口的饮食质量,建议重新配方而不是取消加工食品。
这样的尝试将需要食品工程的创新,这将受益于饮食-微生物-宿主相互作用的考虑。例如,可以用不可消化的可发酵淀粉和其他纤维部分替代食品中的白面粉,从而改变加工食品的固有特性(如纤维含量、血糖生成指数和营养物质消化率),以抵消对肠道菌群和宿主代谢的有害影响。
在一项统计模型研究中,这一方法已具有广泛的影响,该研究预测,如果英国50%的加工食品的市场份额中添加约3克纤维,2型糖尿病和心血管疾病的风险将降低70%以上。
类似的方法可以应用于重新引入其他生物活性化合物,如植物化学物质,可能与膳食纤维联动。
与其依靠个人改变他们的饮食习惯改善健康,不如用更多的重新配方加工食品来改善饮食质量,而不显著改变饮食习惯。
确定“健康微生物群”
虽然很难定义什么是“健康”微生物群,但肠道微生物群的特定分类群和功能特征,特别是受饮食影响的分类群和功能特征(例如,与健康相关的SCFA和次生胆汁酸)与健康结果有关。
一旦确定了促进健康的分类群和微生物群特征,就可以用营养策略来针对它们。
例如,代谢有害的低碳水化合物或高肉类饮食,可通过补充可发酵纤维,以将微生物代谢从蛋白质转化为碳水化合物发酵,改善肠道屏障完整性,并通过短链脂肪酸诱导全身代谢益处。鉴于膳食纤维和低碳水化合物饮食的独立代谢效应,它们的结合可能产生协同效应。
扩展阅读:健康的人类微生物组
使用膳食纤维增强假定的健康菌群
通过这种方式促进菌群及其代谢产物。这种方法基本上符合益生元的概念,益生元被定义为宿主微生物选择性利用的底物,具有健康益处。
不幸的是,这一定义并没有就什么构成“选择性”效应、这种效应如何与健康益处因果关联以及如何区分益生元和膳食纤维提供明确的指导。这些担忧导致欧洲食品安全局规定,益生元不能标记为益生元,但必须标记为膳食纤维。
饮食指南中也没有提到食物来源的益生元,这很不幸,因为目标微生物组调节的总体概念很有希望。
▸ 用膳食纤维获得可预测的微生物群组成变化
研究人员提出了一个概念框架,利用该框架,可以使用含有离散结构的膳食纤维(定义为“一种独特的化学结构……与细菌基因组中编码的基因簇相一致”),来获得可预测的和理想的微生物群组成变化。
在人体试验中对该框架进行了实验测试,在该试验中,IV型抗性淀粉的细微结构差异将短链脂肪酸输出导向丙酸盐或丁酸盐,丙酸盐或丁酸盐具有不同的代谢和生理功能。
有针对性的营养微生物组调节对于饮食指南和治疗性食品都有巨大的前景,但关于微生物组的哪些方面应该有针对性的问题仍然存在,需要进行随机对照试验来证明这些策略是否能转化为改善健康的结果。
即使控制良好的饮食干预措施也会对个体产生不同的影响。这对目前在饮食指南中应用的“一刀切”方法提出了质疑。
精确营养(也称为“个性化营养”)的新兴领域旨在利用人类的个性,首先确定哪些特定的特征可以预测对饮食干预的反应,然后相应地调整营养,以实现不同人群的相同反应。
考虑到肠道微生物群对饮食的高度个性化反应,微生物群检测是针对慢性病预防和治疗的精准营养策略的关键组成部分,以及其他个人特定因素(例如,遗传学、基线代谢和体力活动)。
▸ 应用:同样的减肥方式,哪类人群更容易达到效果?——机器学习帮你预测
机器学习方法可以应用于大型参与者队列,以确定哪些特征可以预测健康结果。例如,机器学习算法利用参与者关于血液参数、饮食习惯、微生物组组成和其他因素的数据,准确预测标准化膳食的餐后血糖反应。
这类预测可以受益于微生物组和宿主遗传数据的结合,如一项研究所示,基线Prevotella/拟杆菌比率高,可以预测唾液淀粉酶基因拷贝数较低的受试者,在食用富含膳食纤维、全谷物、水果和蔬菜的饮食后体重减轻更大。
▸ 应用:微生物组结合手机用于饮食监测——机器学习为你提供高维数据,最终实现个性化建议
国家饮食指南目前没有考虑精确或个性化的方法,其实施将在人口规模上具有挑战性。然而,这样做的技术已经存在,并且可以利用微生物组测序和智能手机应用程序用于饮食监测的组合,最终为机器学习算法提供高维数据,以便将个性化营养建议反馈给用户。
▸ 精准营养可持续的条件
预测模型的多中心验证必须在不同人群(包括非西方国家和发展中国家)中进行,以确定其广泛适用性并鼓励进一步完善。精确营养方法将取决于营养和微生物学科之间的持续合作,其在全人口范围内的实施将需要监管机构、专业协会和决策者的大量额外投入。
有关饮食微生物组与宿主相互作用的信息有可能进一步验证、完善和创新饮食建议。
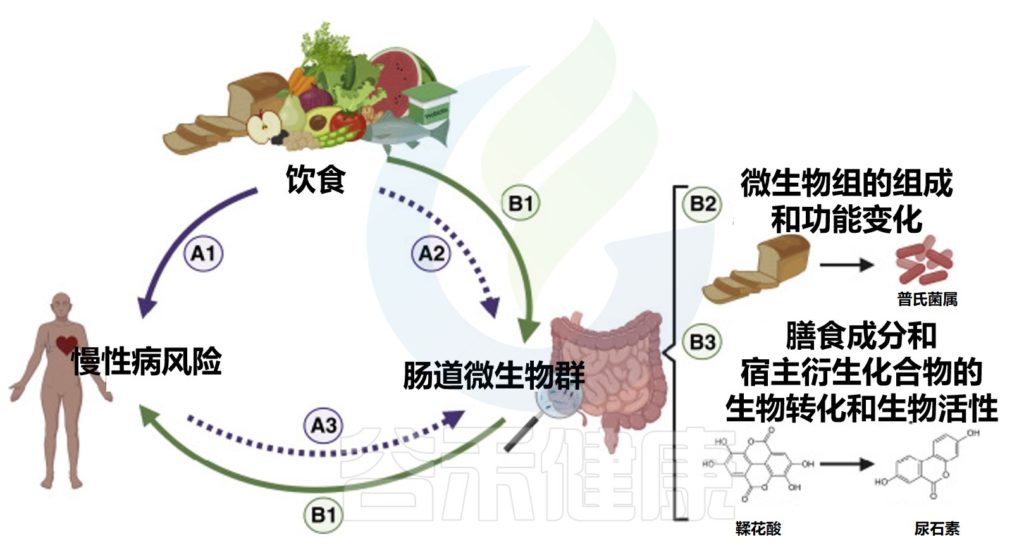
将肠道微生物组纳入饮食指导,需要有证据证明微生物组在饮食生理效应中的机制和因果作用。确定肠道微生物群在人类疾病易感性中的作用的因果关系仍然是一个挑战,这在营养学研究中更加复杂,因为饮食、肠道微生物群和人类健康之间的相互作用是复杂和多方向的。
饮食、肠道微生物群和人类健康之间复杂的、多向的因果关系
doi.org/10.1016/j.chom.2022.04.016
评估微生物组在营养中作用的人类研究因微生物组的复杂生态特征(个体间、地理和时间变异性)和营养研究的局限性(甚至适用于随机对照试验)而变得更加复杂(例如,难以评估饮食摄入和遵守研究方案、饮食成分的共线性和混杂因素)。
在设计未来的营养研究时,必须考虑这些复杂性,以阐明哪些因素(包括微生物组)介导了饮食对健康的影响。
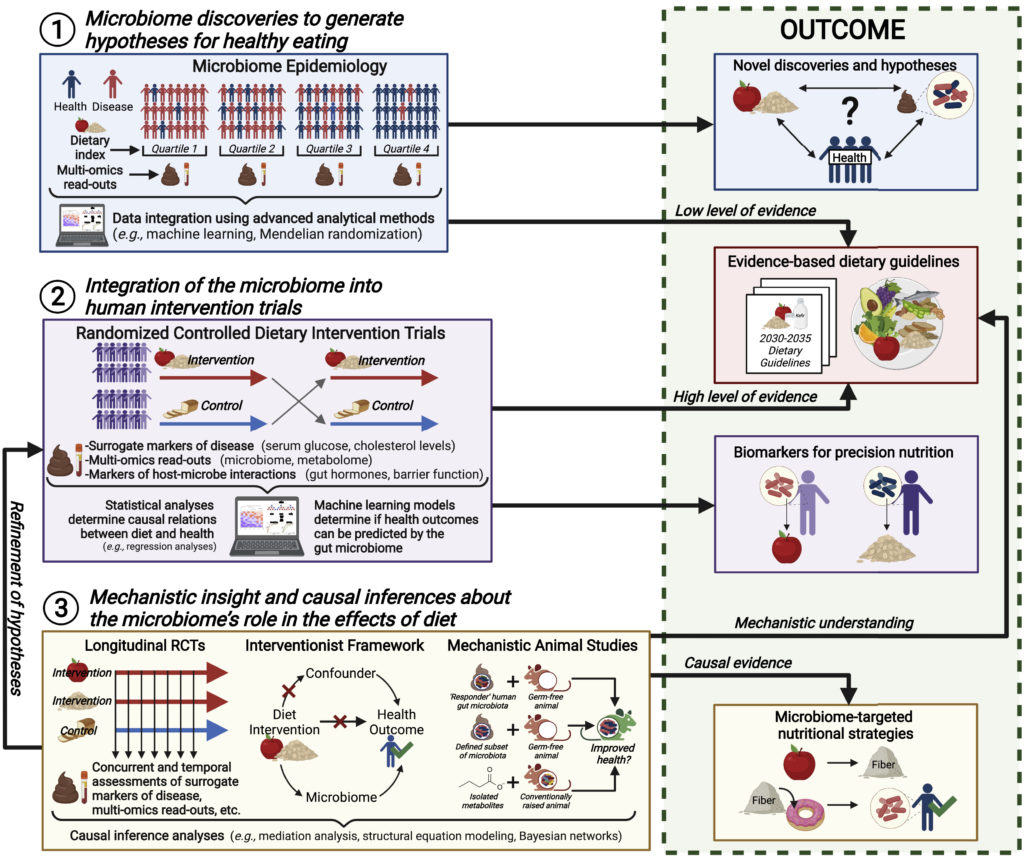
研究人员推荐概述饮食微生物组研究最佳实践指南的优秀评论,并通过使用三大支柱将肠道微生物组整合到营养研究的所有阶段的实验框架来扩展这些评论。
一、微生物群的发现为健康饮食提出假设
肠道微生物群可以在既定饮食策略验证之外为营养提供信息,并有助于确定微生物群特征作为未来的营养目标。
目前已经确定了肠道菌群与人类疾病状态之间的关联。多元组学技术(如宏基因组学、宏蛋白质组学、代谢组学)和先进分析方法的使用,已经建立了支撑生物途径的潜在机制和因果基础。高质量、大规模队列研究有助于为饮食指南提供证据基础。
最近的研究扩展了这一框架,并将微生物组学和营养流行病学结合起来,以阐明微生物组学在饮食诱导的生理效应中的作用。可以发现微生物组、健康和特定饮食或饮食成分之间的联系。
这些相互作用的潜在机制和生物学合理性及其作为营养靶点和诊断标记的价值可在实验系统中得到证实。
二、微生物组与人类干预试验的整合
▸随机对照试验:营养学金标准
▸交叉设计:允许消除个人特定因素的个体间差异
▸干预试验:确定因果关系,直接告知饮食指南
随机对照试验是建立人类因果关系的营养学金标准,如果它们表现良好,在证据层次结构上要高于观察性试验。这种层次结构也适用于微生物研究。营养随机对照试验可以使用微生物组流行病学中应用的相同多组学方法进行扩展,以整合肠道微生物组并有效测试特定饮食微生物组的相互作用。可以将有效预测疾病风险的替代标记物与微生物组终点(例如成分变化、功能和代谢物)和生物过程的分子标记物相结合,假设这些生物过程将肠道微生物组的代谢活动与宿主免疫代谢相联系(即肠道激素、细胞因子、TMAO和肠道屏障完整性标记物),以证实研究结果并提供假定的机制解释。
交叉设计对于以微生物组为终点的随机对照试验具有优势,因为参与者作为自己的对照,这允许消除个人特定因素的个体间差异(例如微生物组、遗传学、代谢物谱和基线临床测量)。研究应进一步控制其他混杂变量,如人口统计学(年龄和性别)和生活方式因素(习惯性饮食和药物使用)。在这种情况下,大便稠度和饮酒是意外的混杂因素。应使用分层随机化来平衡参与者根据年龄和性别等因素分配给治疗组的情况,并应收集有关混杂变量的详细信息,以便在统计分析中对其进行控制。通过对自由生活或定居的参与者进行充分的控制喂养研究,提供所有食物,包括足够的磨合期,可以消除习惯性饮食的实质性混杂因素。这样的研究进行起来困难且昂贵,但已经在微生物组领域成功应用。
干预试验可以确定饮食对健康影响的因果关系,从而直接告知饮食指南。如果微生物组被整合,随机对照试验也可以为微生物组在饮食健康影响中的作用提供假定的机制解释,并为精确营养策略提供基于诊断微生物组的生物标记。回归和相关分析可用于确定饮食诱导的微生物组分/功能变化与临床和机械终点之间的关联。此外,机器学习模型可以确定是否可以通过对微生物组或受微生物组影响的宿主生物过程的影响来预测饮食诱导的生理变化。然而,除非这些试验和分析采用特定的实验和统计方法进行扩展,否则它们无法确定肠道微生物群在饮食影响中的因果作用。
三、关于微生物组在饮食影响中作用的机制洞察和因果推断
▸收集纵向数据,使用数学方法,解开因果
▸通过动物模型扩展确定潜在机制
▸最常用和最复杂的建立菌群因果关系的模型
▸动物模型存在局限性,但对完善假设很宝贵
可以在随机对照试验中收集纵向数据,以便进行因果推断,因为必须使用中介分析等方法,在时间上先于效应。其他数学方法,如结构方程建模和贝叶斯网络,也可以解开饮食、微生物组和人类健康之间的因果关系。可以说,最有希望直接在人类身上进行因果推理的实验设计是“干预主义框架”,当针对假定原因的干预产生有利影响时,就可以推断因果关系。这种方法可适用于具有良好特征效果的饮食干预,以测试针对微生物组特征或给予微生物代谢物(假定原因)是否能产生预期效果。
人类研究可以通过动物模型扩展,以确定微生物组的因果作用,确定微生物组中的因果成分,并确定潜在机制。可以在无菌动物疾病模型中测试单独或作为群落的特定微生物(灵知动物)或与人类饮食干预生理效应相关的微生物代谢产物。灵长类动物允许去除或添加特定的微生物,以确定微生物群落中的致病成分,并且可以用模仿人类饮食的饲料进行挑战。
人类微生物相关(HMA)啮齿动物是最常用和最复杂的建立微生物组因果关系的模型,将人类粪便微生物群移植到啮齿类动物的疾病模型中。HMA动物可以非常有效地比较对饮食干预有或没有反应的人类微生物组,特别是如果假设差异是由特定微生物的存在或不存在引起的。然而,HMA动物在做出关于饮食诱导的人类微生物组组成变化的因果推断方面有很大的局限性。不提供活微生物的饮食不太可能从微生物群中添加或移除微生物物种,但只会改变群落中的相对比例。这种变化不太可能在受体动物身上复制,因为形成微生物群的生态和进化力量与供体中的不同。
尽管存在局限性,但动物模型,尤其是如果其微生物群得到良好控制并与多组学方法相结合,有能力补充人类研究,因为它们建立了饮食影响的机制基础。通过使用更好地模仿人类生理学的动物,如猪和灵长类动物,这些研究可以进一步改进。虽然不需要从机理和因果研究中获得见解,来确定和确认饮食成分的健康影响或基于微生物组的生物标记物的效用,但这对于完善假设非常宝贵,可以创新制定有针对性的营养策略,并为饮食建议提供额外的证据。
将肠道微生物组整合到营养学研究的所有阶段的实验框架,以促进对微生物组在健康饮食中的作用的理解:
doi.org/10.1016/j.chom.2022.04.016
饮食与疾病密切相关,而疾病又与微生物群相关。肠道微生物群可能是构成营养研究的“黑匣子”,饮食—微生物群的相互作用可能有助于建立饮食生理效应的机制基础。
这两个领域有很强的生物学和进化论理由来扩展已经活跃和正在进行的合作,以加深对如何通过饮食优化健康的理解。
应将以微生物组为中心的终点纳入营养科学的各个方面,以加强饮食指南的证据基础。营养微生物学研究有可能全面了解健康饮食的各个方面,从而有助于解决饮食相关疾病的预防和管理。
谷禾也将不断提供关于肠道微生物群如何影响和介导饮食化合物、特定食物和饮食模式的生理效应的机制的前沿研究进展,应用到肠道菌群健康检测,不断更新已有框架,为大众提供针对微生物群的营养策略。
主要参考文献:
Armet AM, Deehan EC, O’Sullivan AF, Mota JF, Field CJ, Prado CM, Lucey AJ, Walter J. Rethinking healthy eating in light of the gut microbiome. Cell Host Microbe. 2022 Jun 8;30(6):764-785. doi: 10.1016/j.chom.2022.04.016. PMID: 35679823.
Lancaster SM, Lee-McMullen B, Abbott CW, Quijada JV, Hornburg D, Park H, Perelman D, Peterson DJ, Tang M, Robinson A, Ahadi S, Contrepois K, Hung CJ, Ashland M, McLaughlin T, Boonyanit A, Horning A, Sonnenburg JL, Snyder MP. Global, distinctive, and personal changes in molecular and microbial profiles by specific fibers in humans. Cell Host Microbe. 2022 Jun 8;30(6):848-862.e7. doi: 10.1016/j.chom.2022.03.036. Epub 2022 Apr 27. PMID: 35483363; PMCID: PMC9187607.
Deehan EC, Walter J. The Fiber Gap and the Disappearing Gut Microbiome: Implications for Human Nutrition. Trends Endocrinol Metab. 2016 May;27(5):239-242. doi: 10.1016/j.tem.2016.03.001. Epub 2016 Apr 11. PMID: 27079516.
Guthrie L, Spencer SP, Perelman D, Van Treuren W, Han S, Yu FB, Sonnenburg ED, Fischbach MA, Meyer TW, Sonnenburg JL. Impact of a 7-day homogeneous diet on interpersonal variation in human gut microbiomes and metabolomes. Cell Host Microbe. 2022 Jun 8;30(6):863-874.e4. doi: 10.1016/j.chom.2022.05.003. Epub 2022 May 27. PMID: 35643079.

谷禾健康

现代化疗,放射疗法在摧毁癌细胞的同时,对健康细胞也造成了伤害,引发相关毒性,反应例如便秘,腹泻,疲劳,恶心,呕吐等。
癌症患者的营养状况可能是癌症治疗相关毒性的核心决定因素,也是癌症症状的指标。
一些临床前研究和初步临床试验表明,饮食干预可能会减轻某些癌症治疗相关的症状和毒性。可能机制包括影响炎症、氧化应激、肌肉质量、心脏健康和调节肠道菌群。
本篇涵盖了三大块内容,包括:
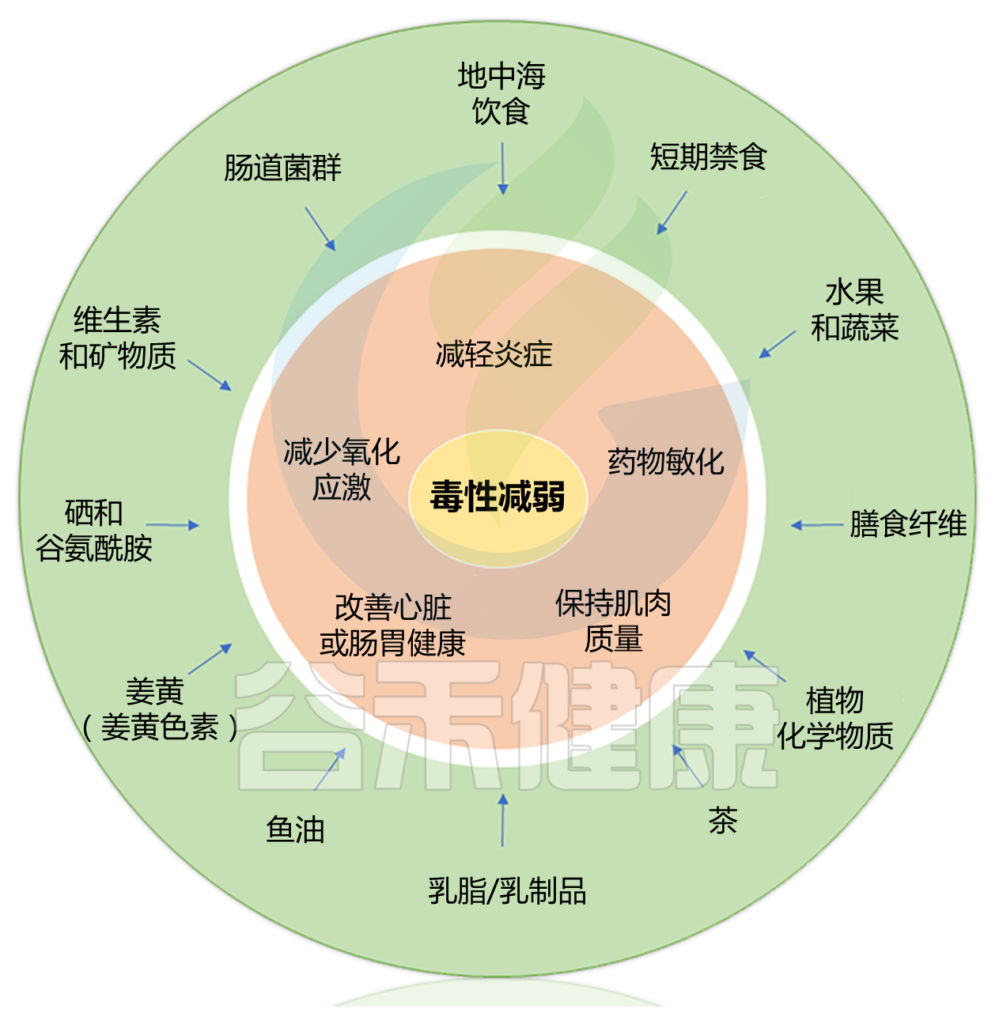
Alan J. Kim et al.,Cancer Treatment Reviews, 2022
地中海饮食模式,其特点是大量摄入水果、蔬菜、豆类、橄榄、全谷物、不饱和脂肪、坚果和鱼类;适度饮酒;减少红肉和加工肉类以及高脂肪乳制品的摄入,对减少炎症,改善心血管健康,抗肥胖,改善血脂以及对肠道菌群和免疫调节有积极作用。
↓↓ 降低心源性猝死
在一项大型前瞻性研究中,调查了激素替代疗法、钙和维生素D或饮食调整对健康绝经后妇女的影响,发现地中海饮食模式与降低心源性猝死的风险有关。
↓↓ 缓解癌症相关的疲劳
一项随机对照试验中,23名前列腺癌男性患者接受了至少3个月的雄激素剥夺治疗,被随机分成两组,一组接受12周常规治疗,另一组接受地中海饮食并同时接受六次个性化营养咨询,与常规治疗相比,坚持地中海饮食与缓解癌症相关的疲劳以及提高总体生活质量有关。
↓↓ 减轻妇科肿瘤患者症状
一项对22名接受铂类化疗的妇科肿瘤患者的观察研究表明,坚持地中海饮食的患者胃肠道毒性较小,恶心、胃痛、腹胀和干扰日常活动的频率和严重程度差异有统计学意义。
周期性禁食即在给定的时间内部分或完全不吃除水以外的食物和饮料。在动物模型和人类患者中,周期性禁食与降低癌症治疗中的毒性密切相关。
↓↓ 延缓肿瘤进展
例如,在一项临床前研究中证明,禁食条件增加了对化疗药物的敏感性,并延缓了肿瘤的进展。还有人发现,在荷尔蒙受体阳性乳腺癌的小鼠模型中,周期性禁食或类似禁食的饮食(FMD)可增强激素治疗的活性(如他莫昔芬和氟维司群),并通过降低循环中胰岛素、瘦素和IGF1的水平以及抑制AKT-mTOR信号传导来促进长期的肿瘤消退。
↓↓ 提升生活质量
在一项针对131名HER2阴性的II/III期乳腺癌患者的II期临床研究证实了4天FMD的潜在益处。在新辅助化疗前3天和新辅助化疗当天,接受了植物性、低氨基酸替代饮食(包括肉汤、汤、液体、维生素片和茶)的患者报告称,与对照组(常规饮食)相比,总体幸福感有所提高,情绪、身体、认知和社会功能都有所改善。
↓↓ 减少化疗相关毒性
在一项对照交叉初步研究中,调查了30名接受化疗的妇科癌症患者,结果表明,短期禁食的改良形式减少了化疗相关的毒性,包括口腔炎、头痛、虚弱和总体毒性。
据报道,FMD是安全可行的,可以减少脂肪量,降低循环中胰岛素生长因子1、胰岛素和瘦素的水平。禁食强烈影响新陈代谢和细胞途径,导致循环中类胰岛素一号生长因子(IGF-1)和葡萄糖水平下降。这些变化反过来影响几个癌基因,包括RAS和AKT信号通路,导致细胞生长和增殖的下调。
禁食和FMD(低卡路里、低蛋白质和低糖的饮食)可能与减少化疗副作用有关,即当营养素缺乏时,正常细胞,而不是肿瘤细胞,可以切换到抑制生长和增殖途径的保护模式,这一过程被称为差异应激抵抗。
↓↓ 增强免疫
此外,禁食和/或FMD已被证明可以增强免疫系统,减少炎症,减缓小鼠的骨密度损失,并减少HER2阴性的II期乳腺癌患者化疗引起的淋巴细胞DNA损伤。
生酮饮食的特点通常是碳水化合物消耗量低,占每日总热量摄入量的5%-10%,但其他产生能量的大量营养素,即脂肪和蛋白质的含量却不同。生酮比用来定义饮食的生酮能力,定义为脂肪克数与碳水化合物和蛋白质克数之和的比值。
在癌症中研究最多的生酮饮食包括经典生酮饮食(CKD),其特征是生酮比为4:1或3:1,每日87%-90%的热量来自脂肪)和中链甘油三酯生酮饮食[MCTKD,其中30%-60%的总热量来自中链脂肪酸,如己酸(C6)、辛酸(C8)、葵酸(C10)和月桂酸(C12)]。
↓↓ 血糖,体重更可控,生活质量高
在接受放化疗和辅助化疗的胶质母细胞瘤患者中,那些生酮饮食患者的血糖水平低于那些标准饮食的患者。有人研究发现,在接受放疗的非转移性乳腺癌患者中,以天然食物为基础的生酮饮食与未指定标准饮食相比,体重和脂肪减少得更多,生活质量水平更高。
↓↓ 降低癌症治疗相关毒性
生酮饮食降低癌症治疗相关毒性的机制可以用瓦氏效应(Warburg effect)来解释,在瓦氏效应中,癌细胞利用糖酵解而不是氧化磷酸化,能预防由活性氧引起的氧化损伤。
生酮饮食(通常是高脂肪低葡萄糖),可以利用这种代谢差异,要么让癌细胞挨饿,要么迫使它们转而利用氧化磷酸化。与正常细胞相比,癌细胞中氧化应激的增加可以使它们对化疗和放射更加敏感,从而减少治疗所需的剂量,降低与治疗相关的毒性。
↓↓ 注意高脂肪生酮饮食的副作用
有限的依据支持在临床实践中使用生酮饮食,而且,根据总含量和相对常量营养素组成,不同类型的生酮饮食可能对治疗相关的毒副作用产生不同的影响。例如,长期食用高脂肪生酮饮食可能会增加心血管或脑血管疾病的风险,特别是与特定的抗癌药物联合使用时。高脂生酮饮食还可能增加严重脂肪性肝炎的风险,促进肝纤维化的进展。此外,研究表明,高脂肪生酮饮食增加了酮体乙酰乙酯的循环水平,并促进了异种移植小鼠中表达BRAF-V600E致癌基因的人类黑色素瘤细胞的肿瘤生长潜力。
因此,根据目前对营养的理解,接受癌症治疗的患者的饮食应该包括所有的常量营养素,以降低营养不良的风险。
膳食纤维与多种肿瘤类型的胃肠道毒性和症状的预防有关。在一项随机对照试验中,在放疗期间服用高剂量膳食纤维(18克/天)的盆腔癌患者报告称辐射引起的胃肠道毒性发生率较低,证明了膳食纤维在预防放射治疗相关毒性方面存在潜在影响。
膳食纤维还可以促进健康的肠道菌群,从而降低毒性并增强治疗效果,例如纤维与促进免疫的普拉梭菌和短链脂肪酸丁酸盐的有关。有人发现在黑色素瘤患者中,膳食纤维会影响肠道菌群,并与免疫检查点阻断反应的增强有关。

Spencer CN, et al.,Science. 2021
tips
对于腹膜癌、肠癌进展或原发性胃肠癌的患者来说,可能需要低膳食纤维饮食,以降低肠梗阻的风险。
增加水果和蔬菜的摄入量与改善胃癌幸存者的身体和认知功能、减少疲劳和食欲不振有关。
水果和蔬菜含有过多的植物化学物质,并且已经检查了几种植物化学物质的影响,并在下表中进行了总结。

Alan J. Kim et al.,Cancer Treatment Reviews, 2022
例如,葡萄产品的抗氧化和抗炎作用归因于它们的植物化学物质,即芪类、花青素和原花青素,包括白藜芦醇。
其他几种水果,包括黑醋栗、李子、石榴和苹果,已经被证明具有抗癌和细胞毒性作用,这归因于植物化学物质,特别是多酚和黄酮类物质的抗氧化和抗炎作用。
tips
对于肠梗阻风险较高的患者,应避免过量摄入水果和蔬菜相关的膳食纤维。
据报道,在70多种植物中发现的一种植物化学物质白藜芦醇可以增加结直肠癌细胞系对化疗药物的敏感性,包括阿霉素、索拉非尼、5-氟尿嘧啶、依托泊苷、丝裂霉素、奥沙利铂和姜黄素。
关于白藜芦醇在该文有详细介绍:
注意:高剂量(每天>2.5克)会引起轻微的毒性(包括腹泻、胃肠道症状和前额头痛),即使在健康的人身上也是如此。
其他多酚也可能具有抗炎和抗氧化作用。
▸槲皮素是浆果中一种常见黄酮醇,它通过作用于炎症介质,包括白细胞介素6、白细胞介素8、干扰素γ、诱导型一氧化氮合酶、环氧合酶2和肿瘤坏死因子α来诱导抗炎作用,并在对促凋亡刺激敏感的癌细胞系中提供促凋亡作用。
▸非瑟素是一种存在于草莓、苹果和柿子中的类黄酮类化合物,在结构上与槲皮素相似,具有类似的抗炎和抗癌活性。
▸番茄红素是番茄和红色水果(包括木瓜和西瓜)中的一种植物化学物质,具有高抗氧化活性,并通过减少氧化应激以及染色体和膜的异常来减轻致癌损害。此外,番茄红素具有神经保护作用,并被认为可以通过减少氧化应激和神经炎症来预防神经毒性。
喝茶,尤其是绿茶,与抗癌作用、减轻药物引起的毒性以及对化疗药物的敏感性有关。
↓↓ 抑制继发性肿瘤
茶中存在的儿茶素在促进健康的作用中起着重要作用。表没食子儿茶素没食子酸酯在体外和体内乳腺癌模型中显示了抗氧化和抗炎活性(尤其是在他莫昔芬诱导的氧化应激情况下),能够抑制头颈部或盆腔癌症患者的放射性皮炎,并抑制继发性肿瘤的继发发展。
↓↓ 防止辐射带来的不良反应
据报道,表没食子儿茶素没食子酸酯还可用于预防暴露于γ辐射或以顺铂为基础的治疗后的唾液腺细胞功能障碍,防止辐射引起的不良血液学变化(如贫血、血小板减少),以及预防博莱霉素引起的肺纤维化。
↓↓ 减少药物引起的毒性
此外,表没食子儿茶素没食子酸酯可减少伊立替康治疗期间的胃肠紊乱、顺铂引起的肾毒性和耳毒性,以及阿霉素和柔红霉素治疗引起的心脏毒性。
在药物致敏方面,绿茶显示了许多与化疗的协同作用,其中一些包括与4-羟基他莫昔芬联合使用可以提高细胞毒性水平,通过降低大B细胞淋巴瘤(Bcl-xL)基因(编码抗凋亡蛋白)的表达使得MCF7细胞对5-氟尿嘧啶增敏,以及4只接种T1的Balb/c小鼠对紫杉醇的敏感性。这种致敏作用通过降低所需化学治疗药物的剂量有效地降低了药物引起的毒性的严重程度。
乳制品/奶制品与癌症治疗之间的关系一直存在争议。尽管据报道在Balb/c小鼠中,乳制品/乳脂可以增强紫杉醇治疗的有效性,并减少与该制剂相关的毒性,例如,器官损伤、腓肠肌丧失、附睾脂肪组织减少、红细胞和白细胞损失以及空肠形态、绒毛长度和肠 γ-谷氨酰转肽酶活性的破坏。
tips
有研究表明,在被诊断患有早期浸润性乳腺癌的女性中,高脂牛奶与乳腺癌、全因和非乳腺癌死亡率的增加有关,以及与绝经前妇女乳腺癌进展的风险增加有关。
鱼油富含omega-3脂肪酸,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),在减少癌症和癌症治疗相关症状和毒性方面的作用已被广泛研究。
↓↓ 减少化疗引起的毒性
一项随机临床试验表明,在宫颈癌患者(n=40)中,补充鱼油可以减少化疗引起的毒性,如厌食、恶心、口干和味觉障碍。一项对88例癌症患者补充精氨酸、谷氨酸和鱼油的研究表明,补充精氨酸、谷氨酸和鱼油可显著减少3-4级血液毒性,并提高两年总生存率。
↓↓ 增强抗肿瘤作用
一些体外和体内研究表明,与单纯化疗相比,化疗期间给予EPA和DHA可以增强抗肿瘤作用,减少化疗对正常组织的毒性,抑制全身炎症,改善癌症患者的营养状况。同样,在紫杉醇和顺铂/卡铂治疗期间,在等卡路里饮食中添加EPA与非小细胞肺癌患者的疲劳减轻、食欲改善和化疗引起的神经病变减少有关。
↓↓ omega-3脂肪酸减少化疗毒性
omega-3脂肪酸还可以减少癌症相关的恶病质,增加免疫调节作用,从而增强结直肠癌和食道癌患者的化疗与放疗,减少食道癌患者化疗引起的毒性(如口腔炎,3/4级腹泻,以及天冬氨酸转氨酶和丙氨酸转氨酶水平的升高)。
已经提出了多种机制来解释omega-3脂肪酸在降低癌症治疗相关毒性方面的作用。其中一种假设是细胞膜的组成,这表明不饱和脂肪酸掺入癌细胞膜中,导致细胞膜组成模式与正常细胞不同。考虑到细胞膜是细胞内信号传导和基因表达调控的中心,癌细胞和正常细胞之间细胞膜上脂肪酸分布的不同可能导致信号通路的不同激活(例如,PKC激活和NF-KB 通路)。
尽管omega-3脂肪酸在临床试验中显示出了益处,但在临床前模型中,omega-3脂肪酸十六碳-4,7,10,13-四烯酸已证明可以抑制铂化合物的肿瘤导向细胞毒性,这可能会对患者造成潜在的伤害。
因此,在建议临床食用鱼油之前,有必要进一步研究普通鱼油成分与纯化的EPA/DHA对特定化疗药物的细胞毒性的影响。
姜黄是一种开花植物,可从中提取姜黄素。它们与预防和治疗化疗和放疗相关的不良事件有关。姜黄/姜黄素对癌症的有益作用归因于它们的抗氧化和抗炎特性,以及它们在抑制细胞增殖和肿瘤干细胞发展方面的作用,以及它们对肠道菌群和免疫系统的积极作用。
↓↓ 姜黄油降低化疗4级毒性发生率
姜黄油具有保肝作用,并缓解刀豆蛋白A诱导的氧化应激和炎症,从而减少人类患者的多种症状和毒性。同样,与其他草本物质:发酵大豆提取物、绿茶提取物、樟芝菌丝体、螺旋藻和葡萄籽提取物相结合,可显著降低接受亚叶酸钙/5-氟尿嘧啶化疗患者的4级毒性发生率。
↓↓ 姜黄/姜黄素减轻粘膜炎严重程度
一项评估的结论是,局部应用姜黄和姜黄素可以控制接受化疗和/或放疗的癌症患者的口腔粘膜炎,而接受姜黄/姜黄素治疗的患者报告称疼痛较轻,红斑强度较低,溃疡区域较少。一项评估32名接受放射治疗的头颈部癌症患者的临床试验也得出结论,口服纳米胶束姜黄素显著减轻了放疗引起的粘膜炎的严重程度。
↓↓ 姜黄/姜黄素有助于控制癌症相关的疼痛
一项针对绝经后乳腺癌患者的多中心临床试验(n=45)显示,联合应用羟基酪醇(一种在橄榄油中发现的具有强大抗氧化作用的酚类植物化学物质)、omega-3脂肪酸和姜黄素可以减轻患者报告的疼痛,并降低炎症生物标志物的水平。
↓↓ 姜黄与常见化疗药物的协同 / 拮抗作用
姜黄素在I期临床试验中协同增强化疗药物FOLFOX(5-氟尿嘧啶、亚叶酸钙、奥沙利铂)和达沙替尼对经FOLFOX处理的HCT116和HT-29细胞有抗增殖作用。
尽管这些结果提示了有希望的进一步研究领域,但对人乳腺癌细胞株(即MCF-7、MDA-MB-231和BT-474)的体外实验表明,姜黄素与以伊立替康或环磷酰胺为基础的化疗之间存在拮抗作用,饮食补充姜黄素可能会抑制基于化疗的肿瘤消退。这些发现表明,需要更多的研究来确定乳腺癌患者是否应该在化疗期间避免补充姜黄素。
谷氨酰胺是巨噬细胞、淋巴细胞和肠细胞的主要燃料来源,具有多种有益作用,包括改善免疫系统、减少炎症和分解应激状态。
↓↓ 化疗配合谷氨酰胺补充,降低血液学毒性发生率
一项针对接受同步放化疗的癌症患者的随机研究表明,除了常规饮食外,还接受精氨酸、谷氨酰胺和鱼油营养补充剂的患者与未接受补充剂的患者相比,发生3级或4级血液学毒性的发生率较低。
↓↓ 补硒改善免疫系统
据报道,补硒在脂质过氧化方面具有抗氧化作用,刺激自然杀伤细胞的细胞毒活性,减少肿瘤内血管生成,并在体外改善免疫系统。硒与重金属的解毒作用有关。这些影响的产生可能是因为硒是硒蛋白和酶的重要组成部分,这些硒蛋白和酶有助于抗氧化防御、减少炎症、甲状腺激素产生、DNA合成。
一项对关于硒和放射治疗的文章进行了评估,得出的结论是,每天服用300-500微克的硒,持续10天到6个月,可以减少放疗的副作用,包括腹泻、唾液腺损伤和辐射伤口,不会产生不良影响。
tips
高剂量的硒(>400微克/天)会产生严重的副作用,像指甲变脆、脱发、胃肠功能障碍、皮疹、神经紊乱等。
维生素补充剂在减少癌症和癌症治疗相关症状和毒性方面的功效研究显示出相互矛盾的结果。
例如,尽管许多研究表明维生素C补充剂具有潜在的抗癌作用和降低毒性作用,但对接受化疗的癌症患者的维生素C进行的系统审查发现,没有明确的证据表明服用维生素C补充剂可以减少毒性或改善治疗的抗癌效果。
同样,尽管维生素D补充剂已被证明可以预防癌症治疗引起的骨质流失,并恢复许多早期乳腺癌患者经历的维生素D不足,但在各种研究中报告的维生素D的抗肿瘤效果仍然很差。
tips
由于维生素补充剂在癌症治疗期间的效果尚不清楚,强烈建议患者遵守饮食建议,通过水果和蔬菜等天然食物摄入维生素,而不是依赖膳食补充剂。
一个健康人体胃肠道中的各种复杂的微生物群已显示出显著的生理益处,如增强肠道功能和消化能力、抵御病原体和调节免疫力。
虽然“健康”肠道菌群的定义并不明确,但数据表明,具有高度功能冗余度的多样化和稳定的微生物群是健康状态的关键标志。
肠道菌群对癌症患者的治疗反应有显著影响。例如,白血病或淋巴瘤患者在造血干细胞移植后具有高水平的粘液真杆菌,其复发或肿瘤进展的可能性较低。
↓↓ 肠道菌群失调影响抗PD-L1治疗效果
人类、动物和体外研究表明,肠道菌群的免疫调节影响靶向免疫治疗的疗效,如细胞毒性T淋巴细胞相关4(CTLA-4)阻断和抗PD-L1治疗。与这些发现一致的是,一部分接受抗PD-L1治疗和广谱抗生素治疗的上皮性肿瘤患者经历了失败治疗,其原因可能是导致了微生物群的失调。
进一步支持这些发现的是,从应答者和无应答者患者向有免疫活性小鼠的粪便转移导致小鼠对抗PD-L1抗体产生了与相应粪便移植供体相同的反应,从而证明了肠道菌群对抗PD-L1治疗的效果。
↓↓ 肠道菌群调节化疗的疗效和毒性
化疗药物环磷酰胺和阿霉素能诱导革兰氏阳性菌(约氏乳杆菌、鼠乳杆菌和海氏肠球菌)转移到小鼠的次级淋巴器官中。一旦转移到淋巴器官,微生物就会刺激17型和1型T辅助细胞反应的积累,从而增强免疫反应。
临床前和临床证据都表明,抗生素会降低化疗的疗效。例如,长期使用抗生素已被证明会降低环磷酰胺治疗荷瘤小鼠P815肥大细胞瘤的疗效,支持了肠道细菌易位的重要性。
一项对C57BL/6(B6)和129SvEv(129)小鼠化疗所致周围神经病变的临床前研究表明,肠道细菌在确定紫杉醇诱导的疼痛敏感性中起主导作用;在对紫杉醇诱导的疼痛敏感和抵抗的小鼠之间,观察到肠道微生物群组成的显著差异。
↓↓ 肠道菌群与胃肠道不良反应的发生率有关
一项对接受放化疗的宫颈癌患者进行的临床研究(n=35)得出结论,肠道微生物多样性与胃肠道毒性的发生率呈负相关。
同样,一项针对儿童急性淋巴细胞性白血病患者(n=51)的临床研究确定,化疗期间肠道微生物群的变化与胃肠道不良反应的发生率有关,如全身炎症和肠道粘膜炎。Toll样受体(TLRs)和肠道微生物之间的免疫调节相互作用可能调节结肠的炎症和愈合,防止甲氨蝶呤化疗的毒性。
↓↓ 肠道菌群从根本上与粘膜炎的发病机制相关
粘膜炎是一种常见的胃肠道毒性,会导致腹泻、疼痛、体重减轻和剂量限制。例如,伊立替康是一种已知会引起严重腹泻的化疗剂。这种毒性的一种机制可能是某些细菌β-葡萄糖醛酸酶的作用,这些酶已被证明通过将伊立替康的活性代谢物SN-38释放到肠腔中来诱导腹泻。
与这一假设一致,通过喹诺酮类抗生素环丙沙星抑制此类酶可抑制伊立替康治疗小鼠的腹泻,从而证明肠道微生物群的调节可以降低伊立替康的毒性。
↓↓ 肠道菌群影响癌症治疗相关的心理神经症状
一项系统评价评估了肠道微生物群与化疗之间关系的研究,得出的结论是,肠道微生物群可能会影响癌症治疗相关的心理神经症状,例如疲劳、焦虑、抑郁和睡眠障碍。
因此,相对健康的肠道微生物群可以改善癌症患者的健康,通过增强治疗效果和减少免疫疗法和化学疗法的副作用以及通过免疫调节等方式。
饮食影响肠道微生物种类的组成和多样性。膳食纤维的高摄入量有利于膳食纤维消化细菌的增加。作用机制是消化膳食纤维的细菌产生丁酸等短链脂肪酸,滋养肠道上皮细胞,从而加强肠道黏膜屏障,增强黏膜和全身免疫。
↓↓ 食品补充剂调节微生物群驱动的化学治疗毒性
由于肠道屏障和微生物群稳态的潜在损害,化疗通常与肠道菌群的改变有关。因此,预防和治疗与化疗相关的肠道菌群改变可能有助于预防与化疗相关的胃肠道毒性。
▸从鱿鱼墨汁中提取的多糖在小鼠给药环磷酰胺后可富集双歧杆菌,并减少拟杆菌,从而改善肠道微生物群功能障碍。
▸人参化合物可以增强化疗药物5-氟尿嘧啶对结直肠癌细胞系的作用,特别是当这些化合物被肠道微生物群菌群代谢时。
▸鞣花酸,一种常见于草莓、葡萄和黑莓等蔬菜和水果中的多酚,被肠道菌群代谢释放尿石素,这对人类结肠癌具有抗增殖作用。
↓↓ 益生元和益生菌在癌症治疗中发挥作用
益生元(促进有益肠道微生物生长的难消化的食物成分,例如香蕉、芦笋和朝鲜蓟)和益生菌(引入体内以发挥有益作用的微生物,例如酸奶、克非尔、酸菜、豆豉,和泡菜)与肠道菌群的组成密切相关,这些物质在癌症治疗过程中的作用很关键。
许多动物和人类研究表明,益生元、益生菌在预防化疗期间的粘膜炎方面具有强大的作用。
对于接受同步放化疗的鼻咽癌患者,益生菌与放射治疗相结合,可以通过改变肠道菌群,显着增强宿主免疫力,缓解放化疗相关的口腔黏膜炎。
VSL #3(包括Streptococcus thermophiles, Bifidobacterium breve, B. longum, B. infantis, Lactobacillus paracasei, L. delbrueckii subsp. bulgaricus, L. acidophilus, L. plantarum),在伊立替康治疗期间,减少大鼠腹泻和体重减轻。
L. casei, L. rhamnosus, B. bifidum 通过抑制肿瘤坏死因子α、白细胞介素-1b和白细胞介素-6 mRNA的表达减少化疗诱导的小鼠腹泻。
鼠李糖乳杆菌GG补充可减少人类大肠癌患者在5-氟尿嘧啶化疗期间的严重腹泻和腹部不适。
在接受化疗的儿童中使用养乐多的短双歧杆菌菌株可预防发烧并减少静脉注射抗生素的频率。
膳食补充益生元低聚果糖和菊粉可放大药物对小鼠的作用(5-氟尿嘧啶、多柔比星、长春新碱、环磷酰胺、甲氨蝶呤、阿糖胞苷),从而证明了益生元与化疗之间的协同作用。
编辑
大量临床前数据以及有限的临床证据表明,饮食因素可能在预防和/或治疗癌症以及癌症治疗相关的症状和毒性方面发挥作用,寻求特定饮食干预措施的数据仍在不断涌现。
人们对肠道菌群的性质和对癌症治疗的影响也越来越感兴趣。期待更大样本量的随机对照试验,进一步研究饮食干预措施。
最好的饮食是患者愿意并且能够坚持的饮食,因此在将这些策略引入临床时可能需要一定程度的个性化。
如果能开发出,通过调节肠道菌群来改善治疗效果的药物,其潜力是巨大的。
主要参考文献
Spencer CN, McQuade JL, Gopalakrishnan V, McCulloch JA, Vetizou M, Cogdill AP, Khan MAW, Zhang X, White MG, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science. 2021 Dec 24;374(6575):1632-1640. doi: 10.1126/science.aaz7015. Epub 2021 Dec 23. PMID: 34941392; PMCID: PMC8970537.
Yu ZK, Xie RL, You R, et al. The role of the bacterial microbiome in the treatment of cancer. BMC Cancer. 2021;21(1):934. Published 2021 Aug 19. doi:10.1186/s12885-021-08664-0
Kim AJ, Hong DS, George GC. Dietary influences on symptomatic and non-symptomatic toxicities during cancer treatment: A narrative review. Cancer Treat Rev. 2022 May 13;108:102408. doi: 10.1016/j.ctrv.2022.102408. Epub ahead of print. PMID: 35623220.
Barrea L, Caprio M, Tuccinardi D, Moriconi E, Di Renzo L, Muscogiuri G, Colao A, Savastano S; Obesity Programs of nutrition, Education, Research and Assessment (OPERA) group. Could ketogenic diet “starve” cancer? Emerging evidence. Crit Rev Food Sci Nutr. 2022;62(7):1800-1821. doi: 10.1080/10408398.2020.1847030. Epub 2020 Dec 4. PMID: 33274644.
Baguley BJ, Skinner TL, Jenkins DG, Wright ORL. Mediterranean-style dietary pattern improves cancer-related fatigue and quality of life in men with prostate cancer treated with androgen deprivation therapy: A pilot randomised control trial. Clin Nutr. 2021 Jan;40(1):245-254. doi: 10.1016/j.clnu.2020.05.016. Epub 2020 May 25. PMID: 32534948.

谷禾健康
菌群多样性
✦
关于菌群多样性,小伙伴们常会问到:
菌群多样性是如何形成的?
菌群多样性越高越好吗?
它与健康的关系如何?
该怎么去改善呢?
……
✦
✦
本期推文就为大家统一解答这类问题。
本文要点
在了解前面问题之前。我们首先要明确,菌群多样性是什么?
首先,我们知道肠道微生物群代表了一个不断变化的生态系统。
为了便于理解,我们可以把肠道菌群比作一块草地,健康的肠道菌群包含多种菌群,它们之间相对平衡,就好比一块生长完好的草地,生长各种类型的草,整体和谐 ↓↓

一旦遇到疾病,药物等干扰之后,一些菌群被杀死,也就是说少了很多种类型的草,这块“草地”会逐渐变秃,甚至部分沦为荒漠 ↓↓


之后如果不加任何看管,没有很好得到恢复的话,部分菌群可能会野蛮生长,破坏了原有的平衡 ↓↓


以上,我们可以看到关于多样性的几个特点。
一个是种类:
成年人群中肠道菌群的种类参考范围在100~2000种,种类数量越多多样性越高。类比图1那样。
一个是均匀性:
即各个菌种的含量丰度较为均一,如果出现单一菌种占据绝大部分的情况,类比以上图3,那么多样性也不理想。
多样性的评估一般通过一个叫做香农-维纳多样性指数的指标来进行评估,计算公式为:
H=-∑(Pi)(log2Pi)
其中Pi为每个菌的占比例,值越大代表物种种类越多,均匀性也更好相应的多样性也越高。正常人群中香浓指数在2~9之间,一般大于3以上表明具有一定多样性。
肠道菌群多样性表现在:
微生态系统的稳定性,以及面对外界致病菌等入侵的抵御能力。
这要追溯到生命早期。
在胎儿发育和婴儿期,菌群多样性通常很低。
由于在生命的早期阶段,肠道含有氧气,此时肠道内的微生物大多是耐氧的。
随着不断发育,这些菌群开始逐渐被厌氧菌取代。肠道菌群的这种进化是迅速的。
研究表明,婴儿在出生后第一周,肠道内发现的病毒序列有56%,在第二周后就不存在了。
这种多样性在生命的前3个月继续迅速扩大,其中约95%的微生物随着时间的推移而保存下来。
婴儿的微生物群组成具有特征丰富的Akkermansia muciniphila、拟杆菌属、韦荣氏菌属、球状梭菌属和肉毒梭菌属等。肠道微生物多样性延迟与过敏、哮喘和营养不良有关。
肠道菌群变得稳定,微生物群落多样性随着年龄的增长而增加,直到它成为一个稳定的成年微生物群,主要由三个细菌门组成:
厚壁菌门
(Lachnospiraceae和ruminococaceae)
拟杆菌门
(拟杆菌科、Prevotellaceae和Rikenellaceae)
放线菌门
(双歧杆菌科和Coriobacteriaceae)
从出生到2.5岁的微生物群发育期可能非常关键,婴儿早期肠道微生物群的破坏可能会严重影响人类健康。
大约三岁时,儿童肠道微生物群的组成和多样性与成人最为相似。
在个体的整个生命过程中,它继续以更稳定、更慢的速度进化。

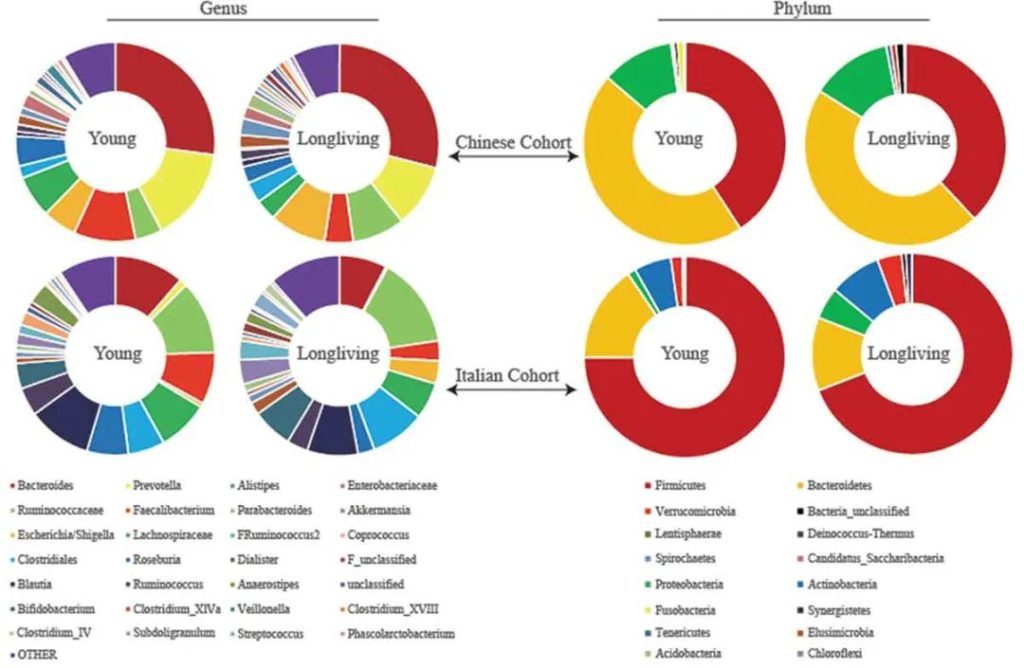
研究还发现,青春期之前儿童,肠道微生物群富含可能参与持续发育功能的菌群,如叶酸和维生素B12的合成方面也很丰富。
青少年微生物群,梭状芽胞杆菌属、双歧杆菌属的丰度显著高于成人。
健康成人肠道菌群以厚壁菌门和拟杆菌门为主,也包括较小比例的Verrucomicrobia、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)。
一般来说,老年微生物群的特点是微生物多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌门、梭状芽胞杆菌和真细菌Eubacteria增加,产生短链脂肪酸菌群减少。衰老显著影响老年人微生物群的组成和功能。
是不是所有老人的肠道菌群多样性都会降低?
不是,长寿老人的肠道菌群多样性水平高。
研究人员检测了一群健康的长寿老人的肠道微生物组,来自中国四川都江堰市的长寿老人,包括“90-99岁”和“≥100岁”两个年龄段。
他们发现长寿人群的肠道菌群比年轻成年人的肠道菌群更多样化,这与传统观点相矛盾。
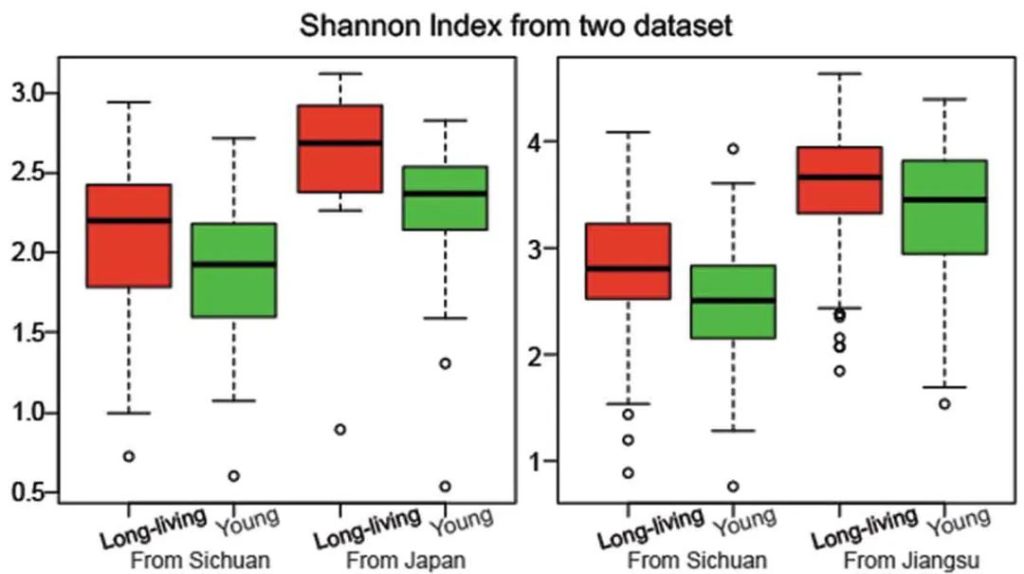
Kong F, et al., Gut Microbes, 2018
他们还发现了产短链脂肪酸菌在长寿老人中开始增加,例如梭状芽胞杆菌XIVa。
国内外研究结果一致
为了验证他们的发现,他们分析了来自一个意大利小组的独立数据集。
Kong F, et al., Gut Microbes, 2018
出现一致的结果:长寿的意大利人也比年轻的人群的肠道菌群多样化水平更高 。
庆幸的是,谷禾肠道菌群数据库中也有比较长寿的老人肠道菌群数据。
我们抽取其中一例相对较为健康的长寿老人的数据:
编号:083*****97 ,98岁(谷禾肠道菌群数据库)
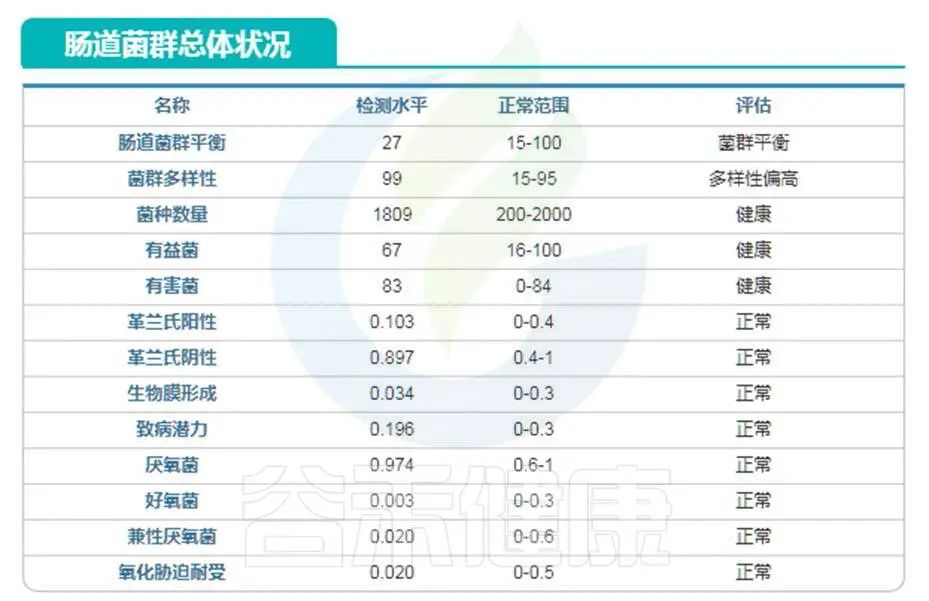
可以看到肠道菌群多样性水平也是明显增高,与文献报道相符。大部分指标都处于正常水平。
那么,菌群多样性是不是仅随年龄的变化而变化呢?
不是的,我们会发现同一年龄层人群的多样性还是有差别的。也就是说除了年龄这个因素之外,肠道菌群变化与某些其他因素也存在关联。
下一章节我们逐一展开了解一下其他相关因素。
前一章节,我们发现年龄会影响菌群多样性变化,其他也可能是由遗传、饮食习惯、生活方式、生理变化、地理位置、药物等因素共同决定的。
▼ 遗传(双胞胎菌群特征相似)
研究发现,分开生活多年的同卵双胞胎在微生物特征上表现出高度的相似性,而生活在相同环境和饮食习惯相似的配偶则没有。


厚壁菌门、放线菌门、Tenericutes、Euryarchaeota的遗传性更强,而拟杆菌门的遗传性很低。
以上这些发现有力地证明,遗传因素在塑造肠道微生物群方面提供了强大的力量。
其他也有研究证实了猪、人和小鼠之间的遗传分类群和候选基因的功能类别的高度相似性,这表明宿主基因对哺乳动物肠道微生物群的影响机制相似。
▼ 地理位置(一方水土养一方人)
肠道菌群中每一个门的比例随着地理位置的变化而变化。这些可能是受到各种不同生活方式有关的大气、基因、饮食或其他因素影响。
在非洲农村布吉纳法索村的儿童(高纤维饮食,脂肪和动物蛋白含量低),马拉维和委内瑞拉的儿童和成人中富含普雷沃特菌,他们吃的主要是玉米、木薯和其他植物源性多糖。


研究表明,普氏杆菌与碳水化合物和单糖有关(在农业社会普遍存在)。
在西方国家,拟杆菌门与厚壁菌门的比例更高。
拟杆菌与长期饮食中,富含动物蛋白、几种氨基酸和饱和脂肪有关(在美国和欧洲普遍存在);


西方国家,肠道菌群多样性的普遍减少,引发了人们的思考,更广泛人群中重要共生菌该如何维持?全球饮食趋势是否会导致有益菌群永久消失?

在发展中国家保持个体菌群(特别是在农业文化中),可能有助于保存人类微生物群中潜在的重要组成部分。
此外,特殊环境,如医院的ICU病房、更衣室等消毒严格的地方,也可能导致环境菌群多样性下降。
▼ 饮食 (调节菌群怎么离得开吃?)
都知道饮食对肠道微生物群的调节起着至关重要的作用,这其中可能起到有益的作用,也可能是有害的。
为什么要把婴儿单独拎出来讲呢?因为对他们来说,人生重要事儿就是吃吃睡睡,那么吃就占了很重要的一块。饮食可以说是塑造肠道菌群的关键驱动力。
婴儿早期,肠道微生物群富含与母乳中低聚糖消化有关的基因,后来,随着其他辅食的引入,富含与多糖和维生素代谢相关的基因。
母乳喂养的婴儿表现出放线菌的过度生长以及厚壁菌和变形菌的抑制。母乳中含有可被这些细菌有效代谢的低聚糖,导致短链脂肪酸增加,从而使免疫系统增加免疫球蛋白G的表达。
配方奶粉喂养的婴儿表现出梭菌、链球菌、拟杆菌和肠杆菌的增加。婴儿期后,肠道微生物群继续发展,饮食成为组织肠道微生物群结构、形状和多样性的主要关键。
日常强调的水果和蔬菜,在决定α多样性方面发挥了最重要的作用。研究发现α多样性或微生物丰富度与长期水果和蔬菜摄入呈正相关(p<0.05)。

膳食纤维的摄入对于保持肠道粘膜屏障功能的完整性至关重要。高纤维饮食可以改善2型糖尿病患者的血糖控制和促进更健康的代谢状况。
素食与健康、肠道菌群多样性的变化以及厚壁菌和拟杆菌的优势有关。
高蛋白质和高脂肪的饮食与大量耐胆汁的菌群有关,如拟杆菌、嗜胆汁菌和厚壁菌,以及对厚壁菌的抑制。不过需要注意的是,这种饮食习惯,可能会导致免疫力降低、感染易感性增加和代谢性疾病的发展。因此,减肥人士也需谨慎。
具体如何选择可见后面章节。
▼ 季节 (果蔬也有属于它们的生长季节)
食物供应的季节性变化的影响菌群多样性。
首先,初步研究将坦桑尼亚的哈扎狩猎采集人与城市化人进行了比较,结果与意大利城市居民相比,哈扎人的饮食富含复杂的多糖,并表现出更高水平的微生物多样性,表现为拟杆菌的比例较高。
后续宏基因组分析显示碳水化合物活性酶的富集,这与觅食、富含多糖的饮食一致。肠道微生物组保留的代谢复杂碳水化合物和蛋白质的功能潜力,可能是由于食物供应的季节性变化。
哈扎人肠道菌群在组成上,经历了与湿季和旱季同时发生的季节性循环,其中 Prevotellaceae 、 Spirochaetaceae 是 2 个最具季节性变化的菌群。Prevotellaceae 的比例在雨季下降,这与宏基因组中存在的碳水化合物活性酶显着减少有关,特别是植物碳水化合物。
另一项研究针对北达科他州的社区哈特派人群,他们的夏季饮食富含高纤维的新鲜水果和蔬菜。与冬季相比,北达科他州的夏季肠道微生物群与拟杆菌门的丰度显着增加相关,而放线菌和厚壁菌门的丰度相应减少。
当然,在城市化人群中并没有这种现象。
总的来说,研究城市化程度、地理位置和特定食物供应的全球饮食模式,有助于在宏观层面上形成全球肠道微生物群的巨大异质性。
▼ 生活方式 (除了吃还有什么能改变菌群?动!)
——运动锻炼
在人类研究中,运动增加了肠道菌群的多样性,与蛋白质摄入量和肌酸激酶水平呈正相关。
与非运动员相比,运动员的拟杆菌水平较低,厚壁菌数量较多。
对运动产生反应的细菌种类包括乳酸杆菌、双歧杆菌和阿克曼菌,而其他种类则有所减少,如变形杆菌、Turicibacter、Rikenellaceae.
此外,在运动的反应中,产短链脂肪酸菌(尤其产丁酸菌),如梭菌Clostridiales、罗斯氏菌Roseburia、毛螺菌科Lachnospiraceae、Erysipelotrichaceae增加,并在调节运动对宿主肠道菌群的影响中发挥重要作用。

运动增强丰富菌群的机制是什么?
涉及内部和外部因素。
【内】对耐力训练的内在适应,如血流量减少、组织缺氧和转运增加,会导致胃肠道的变化。
【外】运动型个体暴露于他们的环境生物圈中,遵循整体健康的生活方式,促进更丰富的微生物群。
与对照组相比,运动员表现出较低的炎症和改善的代谢标志物,并且运动与较低的慢性炎症导致的发病率降低有关。
有研究人员提出,运动可以作为一种治疗支持,可用于治疗与失调相关的疾病,如肥胖和其他一些胃肠道疾病。
关于运动详见:《运动如何影响肠道微生物群,如何正确运动》
《肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?》
——吸烟
在戒烟的健康个体的粪便微生物群中也观察到显著的变化,包括厚壁菌门和放线菌门相对丰度的增加,拟杆菌门和变形菌门的减少。
研究证实,吸烟者和非吸烟者的口腔菌群存在显著差异。特别是在吸烟者的口腔中,卟啉单胞菌和奈瑟菌的繁殖增加,Gemella减少。


▼ 药物
抗生素的使用是一把双刃剑:它摧毁致病菌的同时,可能也伤害了有益菌,导致肠道微生物群失调,多样性大幅下降,并且需要一段时间才能恢复。
广谱抗生素导致厚壁菌门和拟杆菌门之间的不平衡。在治疗过程中,菌群整体多样性降低,这些细菌的丰度也降低。
微生物组组成的改变取决于抗生素类别、剂量、暴露时间、药理作用和目标细菌等。例如,连续两年服用克林霉素会导致肠道微生物群发生变化,而拟杆菌种类不会恢复。
在幽门螺杆菌治疗中使用克拉霉素会导致放线菌数量减少,而环丙沙星会导致治疗半年后仍未恢复的瘤胃球菌数量减少。
研究表明,氨苄青霉素、万古霉素、甲硝唑和新霉素具有长期的负面影响,可引起肠道菌群多样性的不可逆变化,从而增加宿主疾病的风险。
关于抗生素对菌群的影响详见:
《抗生素对微生物组及对人体健康的影响》
《细菌感染和抗生素使用》
《细菌的天敌抗生素,如何用好这把救命的双刃剑?》
其他药物也会降低菌群多样性,如治疗胃溃疡和反酸的质子泵类药物也会导致菌群多样性降低。
以上是常见的菌群多样性的决定因素,那么菌群多样性是如何对身体产生影响的?下一章节我们探讨这部分内容。
微生物组的多样性和平衡在人类健康中发挥着重要作用。
▼ 消化系统疾病
以IBD为例。
在 IBD 患者中,肠道菌群的多样性减少,这主要是由于厚壁菌门的多样性减少。在厚壁菌中,梭菌减少,尤其是普拉梭菌,普拉梭菌是产丁酸盐的菌群之一。这些菌群少了,产出来的丁酸盐就少,丁酸有什么用呢?
它能对肠道防御机制具有多阶段调节作用,包括通过促进肠上皮中的紧密连接蛋白保护肠粘膜屏障,支持先天性和适应性免疫反应,刺激成熟的结肠细胞,抑制未分化的恶性细胞和干细胞,通过降低环氧合酶-2(COX-2)水平抑制氧化应激,并通过诱导过氧化氢酶,改善过氧化氢(H2O2)的解毒作用。
丁酸也能刺激芳香烃受体(AhR)、GPR41和GPR109A受体,并抑制不同细胞类型的HDAC,从而稳定肠道屏障功能并减少炎症过程。
丁酸少了,肠道屏障可能受损,炎症反应增加,就会出现IBD等肠道疾病。
在克罗恩病(CD)、肠易激综合征(IBS)等消化系统疾病中,无论是否伴有腹泻和结直肠癌,都会持续观察到多样性降低。
乳糜泻患者的十二指肠相关微生物群多样性也不太理想。
艰难梭菌结肠炎复发的危险因素之一就是多样性降低。
扩展阅读:
《深度解析 | 炎症,肠道菌群以及抗炎饮食》
《炎症性肠病中宿主与微生物群的相互作用》
▼ 神经系统疾病
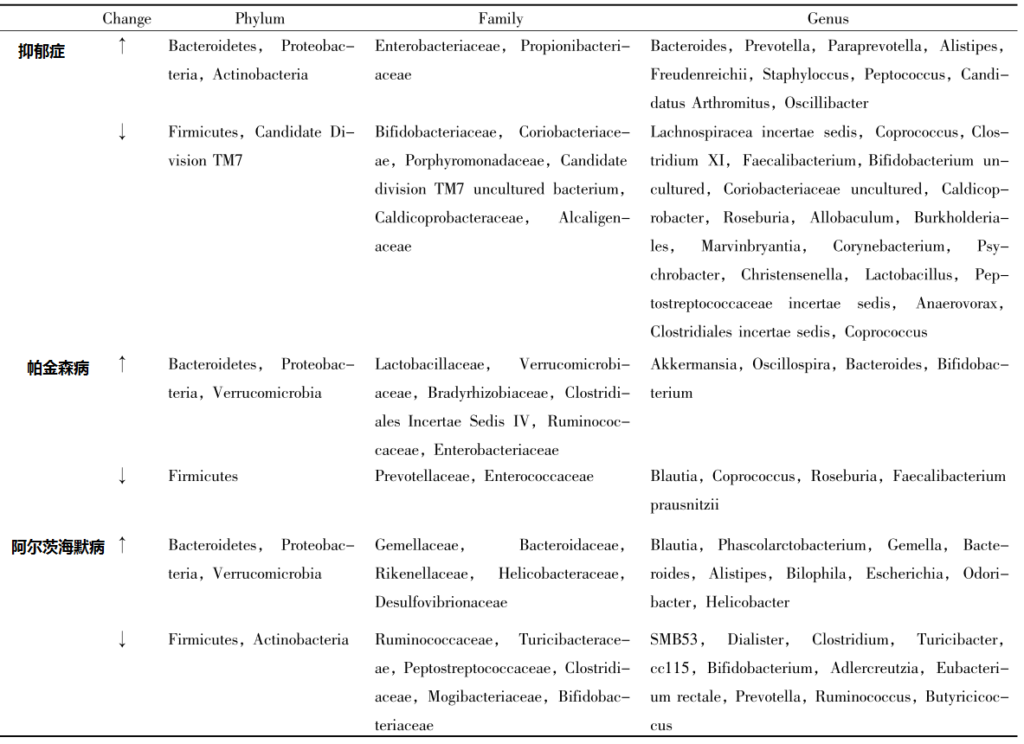
目前越来越多的研究表明,在抑郁症、帕金森病 、阿尔茨海默病等神经系统疾病中,肠道菌群多样性减少。
抑郁症、帕金森病和AD患者肠道菌群的变化
MU Xin et al., Chinese Pharmacological Bulletin 2019
扩展阅读:《肠道微生物组在人类神经系统疾病中的作用》
《最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用》
《深度解读 | 肠道菌群和中枢神经系统的关系》
▼ 癌症
以乳腺癌为例。
乳腺癌患者多样性减少。一项基于人群的病例对照试验研究中,调查了绝经后妇女的粪便微生物群与乳腺癌之间的关系。发现与对照组患者相比,病例患者的微生物群组成显着改变(β-多样性,P = 0.006)和较低的α-多样性(P = 0.004)。
肠道菌群失调可诱发慢性炎症,因此有可能影响乳腺癌的发展。
扩展阅读:《肠道微生物群与五种癌症的相互作用:致癌 -> 治疗 -> 预后》
《结直肠癌防治新策略——微生物群》
《“隐藏高手” 胰腺癌的新出路——微生物》
《肺癌最新研究进展,与肠肺微生物息息相关》
《深度解析 | 肠道菌群与慢性肝病,肝癌》
▼ 代谢类疾病
肥胖
一般来说,肥胖个体的微生物多样性低于瘦的个体。饮食干预可以改善微生物的丰富度和相关的临床表型,例如改善代谢和炎症状态。
扩展阅读:《体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)》
糖尿病
1 型糖尿病患者的肠道微生物群,高水平的拟杆菌,大量产生乳酸和丁酸的细菌以及细菌功能多样性降低。
2型糖尿病前期,菌群多样性就已经存在下降趋势。
扩展阅读:《2型糖尿病如何做到可防可控?肠道菌群发挥重要作用》
▼ 儿童发育
对来自孟加拉国的营养不良儿童和营养良好的健康儿童的肠道微生物群进行了横向比较研究,结果发现,营养不良儿童微生物群的多样性显著降低。
扩展阅读:《生命早期营养不良和微生物群影响大脑发育和行为》
《真实案例 | 儿童发育迟缓肠道菌群检测的应用》
《发育迟缓/营养不良不容忽视,问题很有可能在肠道》
▼ 心脑血管疾病
高血压个体的肠道微生物多样性减少,厚壁菌门/拟杆菌门比率增加。
扩展阅读:《认识肠道微生物及其与高血压的关系》
《饮食-肠道微生物群对心血管疾病的相互作用》
▼ 免疫系统疾病
以过敏为例。
在出生第一年甚至更早的时候,饮食多样性可能对预防过敏产生积极影响。早期接触多种食物抗原可能会促进免疫耐受的发展。
扩展阅读:《婴幼儿过敏有望改善,与肠道菌群密切相关》
《生命早期微生物接触和过敏风险:如何预防》
《微生物群对三大过敏性疾病发展的影响》
▼ 睡眠
人类肠道微生物群可以通过脑-肠道微生物群轴影响健康。
一项研究使用活动描记术量化睡眠测量,并结合肠道菌群采样,以确定肠道菌群与各种睡眠生理测量之间的相关性。测量了免疫系统生物标记物,并进行了神经行为评估,因为这些变量可能会改变睡眠和肠道菌群组成之间的关系。
总微生物组多样性与睡眠效率、总睡眠时间的增加呈正相关,睡眠越好,肠道菌群多样性越丰富,与睡眠开始后的觉醒呈负相关。
总微生物组多样性与IL-6之间存在正相关。微生物组分分析显示,拟杆菌和厚壁菌门内的丰富性与睡眠效率、IL-6浓度和抽象思维呈正相关。研究人员也发现了几个分类群(Lachnospiraceae, Corynebacterium, Blautia)与睡眠指标呈负相关。
肠道菌群多样性高有助于减轻压力,改善睡眠。
扩展阅读:
《肠道菌群与睡眠:双向调节》
《深度解析|睡眠健康与肠道健康之间的双向联系》
以上是菌群多样性与疾病的关联,了解这些我们可以有针对性地去改善菌群多样性。
我们在实际检测中会发现有这样一种情况:
多样性指标虽然很高,但是整体看起来健康总分并不理想。甚至还有很多慢性疾病风险,这是为什么呢?
这种情况可能是核心菌群丰度不够,核心菌群在代谢、免疫等方面都发挥重要作用,一旦核心菌群丰度下降,则可能造成外源物质侵入。感染、旅行等可能会出现这种情况。
如果发现肠道菌群检测报告中多样性很低,该如何判别具体情况,这要看以下几种情况:
✦
总的来说,在一定范围内,更高的多样性通常代表饮食更加丰富多样,同时也意味着更健康的身体状况。
✦
一个健康、有弹性的肠道微生物群依赖于高丰富性和生物多样性,也就是说,当你的肠道菌群多样性相对较高时,会更强大、更稳定。
就好比你拥有一支队伍,有很多不同类型的、不同专长的人可供你使用时,整体的能力就会很强大。


前面我们已经知道,菌群多样性的各种决定因素,例如,饮食、年龄、遗传、环境等。
多样性低不代表一定有疾病,但是更容易受到饮食,环境或疾病的影响,包括更易发生水土不服或更容易因饮食不洁导致腹泻等。菌群多样性低可能是肠道菌群不健康不稳定的一种表现形式。
当然,也不能过度追求菌群多样性高。
随着对饮食-微生物组-健康轴的理解逐渐加深,最近创造了个词叫“食品药学”,即“食品作为药物”的概念逐渐得到推广,基于个体微生物组特征的“食物疗法”的个性化得到越来越多的关注。
饮食干预引起的改变可能在几周甚至几天就会发生。对调节肠道菌群而言,饮食调节是一个非常重要且纯天然的方式。那到底该吃什么?如何吃?
我们可以从食物种类,饮食结构,饮食质量等多个角度去优化日常饮食,从而调节菌群。
✔ 食物种类:
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
食用膳食纤维时,各种菌群可以利用这些膳食纤维作为基质,扩大其种群,从而增加微生物组的总体多样性。
许多住在结肠和盲肠内的厌氧细菌,依赖于复杂碳水化合物的代谢来产生短链脂肪酸,短链脂肪酸是肠粘膜的重要能量来源,在宿主代谢、免疫功能和细胞增殖中发挥关键作用。
丁酸盐是肠道中一种丰富的短链脂肪酸,在结肠癌中起着复杂的作用,如最近的两项临床前研究所示,丁酸盐似乎是浓度和环境依赖性的。丁酸盐可以抑制肿瘤的发生,因为丁酸盐受体Grp109a缺乏的小鼠增加了炎症刺激或APC突变促进的肿瘤发生,并且通过Grp109a的信号传导抑制了这些刺激诱导的肿瘤发生。
▸ 富含膳食纤维的食物在哪里?
膳食纤维可以在各种水果、蔬菜、坚果、种子、豆类和谷类中找到。

吃洗过的生水果和蔬菜,这些水果和蔬菜含有环境微生物(如果难以消化生蔬菜,可以榨汁),包括益生元,以促进多样化的微生物群,不要只吃某一种蔬菜或水果。
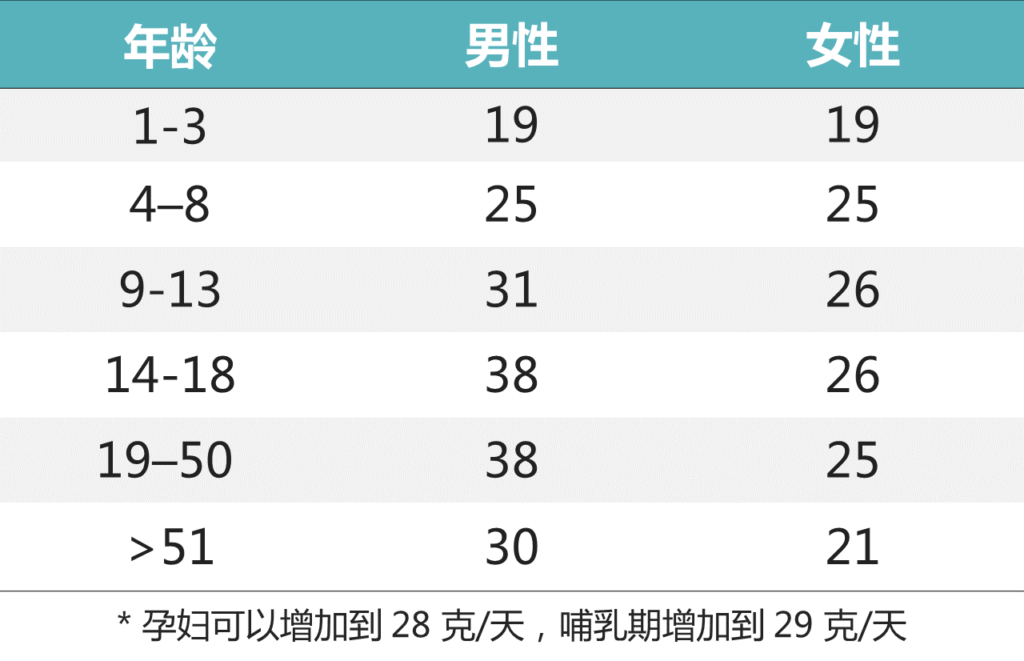
▸ 足量的膳食纤维该吃多少?
推荐的纤维摄入量(充足摄入 克/天)
▸ 具体哪些水果蔬菜中的富含膳食纤维?
各类水果蔬菜中每标准份量膳食纤维的含量及热量

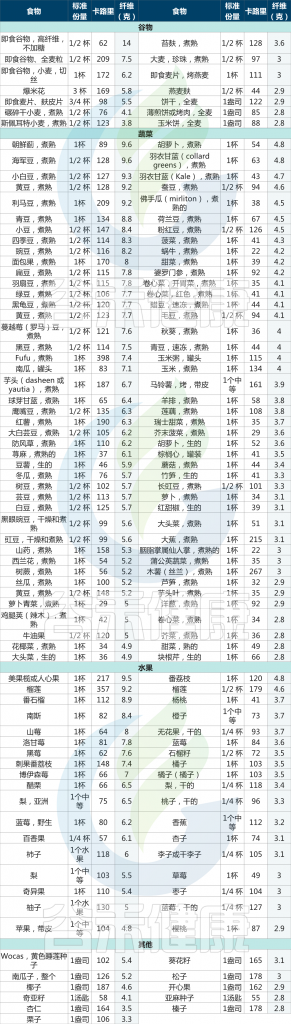
数据来源:U.S. Department of Agriculture, Agricultural Research Service. FoodData Central
同时,水果蔬菜里面一般富含多酚,多酚可以塑造肠道细菌的组成。
Vemana Gowd, et al.,Trends in Food Science & Technology, 2019
白藜芦醇
食用白藜芦醇可减轻结肠炎小鼠模型中的炎症状态并恢复微生物群多样性。
新的证据表明,红酒中的白藜芦醇能通过支持短链脂肪酸的产生来预防阿尔茨海默病 (AD),短链脂肪酸会干扰有毒的 β-淀粉样蛋白聚集体形成。在AD背景下,白藜芦醇的消耗与较高比例的有益菌有关,例如 F. prausnitzii、Akkermansia 物种和具有脑抗炎特性的产丁酸盐细菌。
姜黄素
姜黄素能够部分逆转多样性的变化 肠道微生物群,增加 F/B 比并降低 Anaerotruncus 和 Helicobacter 属的丰度。
已证明,姜黄素治疗降低了在癌症患者中发现的与癌症相关的菌群丰度(例如普氏菌属、冠状杆菌属和瘤胃球菌属)。
富含多酚的食物包括:


此外,饮食中添加全麦大麦、糙米或这两种的混合物会增加菌群多样性。
发酵食品是益生菌的另一个重要来源。
2021 年 7 月的《细胞》杂志上,健康成年人被分为两组,21人食用水果、全谷物、豆类、蔬菜、坚果和种子等高纤维食品,18人食用发酵食品。
在试验前的三周、指定饮食后的10周内,以及研究结束后的四周内,当参与者想吃什么就吃什么时,从受试者身上收集粪便样本。还采集了血液样本以测量炎症和免疫功能。
结果发现食用发酵食品的人,除了增加肠道微生物群的多样性外,同时对四种免疫细胞的激活程度较低,包括IL-6在内的几种炎症蛋白水平也降低。
然而,在大多数情况下,发酵食品对我们肠道微生物群的改变是暂时的,因此,持续摄入发酵食品更有利于对于维持高水平的有益菌。
▸ 发酵食物有哪些?
坚果(尤其是核桃)对健康有益,食用坚果可以降低血脂水平。核桃如何改变菌群?
在一项随机对照试验(交叉设计)中,96名健康参与者接受了为期8周的富含核桃的饮食,然后改用无坚果饮食。第二组98名参与者按相反顺序遵循饮食模式,收集粪便样本做16S rRNA测序分析。
在α多样性方面没有发现差异,但在β多样性方面,观察到核桃和对照组的明显聚集,也就是说,他们的菌群发生明显变化。
与对照饮食相比,核桃饮食仅解释了观察到的差异的5%左右。在核桃组,与对照组相比,瘤胃球菌Ruminococcaceae和双歧杆菌的丰度显著增加,同时梭状芽孢杆菌属簇XIVa物种的数量减少。
因此,摄入核桃可能会促进肠道微生物群向潜在的益生菌和产短链脂肪酸菌群的组成转变。核桃含有丰富的多酚和n-3 脂肪酸,这两种脂肪酸都具有益生元特性。
以上是各类食物对菌群多样性的影响。那么这些食物如何搭配在一起可以对菌群产生更好的影响?
这就涉及到日常饮食结构。
以现代地中海饮食金字塔为代表的高品质饮食,包括大量食用水果和蔬菜、豆类、坚果和全麦,适量橄榄油、鱼、家禽和酒,尽可能少吃红肉、糖果和加工肉类等食品。
坚持地中海饮食与降低疾病风险和改变微生物多样性有关。
地中海饮食评分与拟杆菌、普氏杆菌丰度较高呈正相关,与双歧杆菌/大肠杆菌的比例、粪便丙酸盐和丁酸盐浓度较高呈正相关。
地中海饮食中存在的典型食物成分与肠道微生物群中特定菌株的存在相关。
例如,全谷物与双歧杆菌、粪杆菌、 Tenericutes、Dorea的存在有关。橄榄油和红酒的食用量与Faecalibacterium的存在有关,蔬菜的食用量与Rikenellaceae, Dorea, Alistipes Ruminococcus存在有关,豆类与Coprococcus的存在有关。同一作者还观察到饮食中的多酚含量(通常在地中海饮食中较高)与特定梭菌(XIVa)和粪杆菌簇的存在之间存在相关性,这些梭菌簇能够合成丁酸,可能具有抗炎作用(如Akkermansia,也更多地与地中海饮食相关)。

doi: 10.3390/nu13010007
地中海饮食它没有指定份量大小或具体数量。由每个人根据自身情况设定每餐吃多少,大致比例参考以上金字塔。
目前认为的健康的饮食结构越来越偏向于,强调植物性食物和少吃红肉的饮食。
在地中海饮食结构中,我们可以看到,这类饮食结构的特点是:水果、蔬菜、高纤维食物类占比较多。
大多数研究表明,以植物为基础的饮食可以促进微生物的多样性。与杂食动物相比,纯素食者和素食者菌群具有显着更高的 α 多样性,也就是丰富度。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
一些研究表明,高纤维饮食可以降低体重增加的风险。高纤维饮食随后有助于形成高度多样的微生物群。
高纤维饮食的摄入会降低饮食的能量密度,从而导致体内的短链脂肪酸促进体内更高水平的糖异生。这会导致肠促胰岛素的形成,从而使人更快、更长时间地拥有饱腹感。
地中海饮食与肠道菌群生长之间的相关性
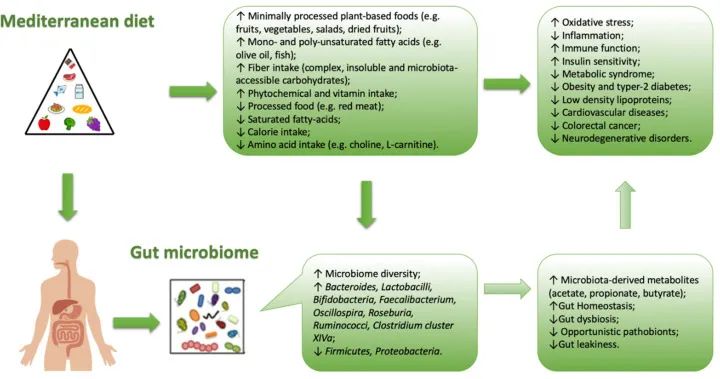
doi: 10.3390/nu13010007
此外,我们看到,地中海饮食结构中红肉类,加工肉类等是需要少吃,那么脂肪是否足够?能不能满足人体需求?
不必担心,地中海饮食中含有大量植物脂肪,这些脂肪来自橄榄油(主要是特级初榨橄榄油)和坚果,它们属于高脂肪能量密集型。
★ 地中海饮食中含有优质脂肪
榛子、 杏仁、夏威夷果、开心果、腰果等,都是单不饱和脂肪酸的重要来源。此外,核桃、碧根果和夏威夷果还富含植物性ω-3脂肪酸。核桃中的ω-3脂肪酸与ω-6脂肪酸的比例极好。
研究表明这些脂肪源与健康代谢状况直接相关,对改善大脑健康、消减炎症、降低各种原因的死亡风险和预防心脏病等有明显的作用,主要归因于它们的特定脂肪成分和生物活性分子含量。
ω-3脂肪酸,在肠道微生物群中的作用,可以调节炎症反应,改善结肠炎时的上皮屏障。
注:炎症反应是几种慢性非传染性退行性疾病的基础,如动脉粥样硬化、癌症、神经退行性疾病、慢性肾功能衰竭、糖尿病、男性肥胖、继发性性腺功能减退等。
地中海饮食中,除了坚果之外,鱼类、海鲜等食物都富含ω-3脂肪酸。显然优质的脂肪更有利于健康。
除了以上脂肪之外,地中海饮食中强调,“鱼和海鲜、鸡蛋、家禽类和高脂奶制品的摄入量每周几次;红肉每月只吃几次”,那么,蛋白质的量是否足够满足人体需求?
我们来看看地中海饮食中,蛋白质对菌群的影响。需要考虑多方面,比如蛋白质的数量、质量、加工方式和来源。
★ 高蛋白饮食可能不利于健康,地中海饮食中蛋白比例更合适
研究表明,与正常蛋白质饮食(20% 蛋白质,56% 碳水化合物)相比,喂给 Wistar 大鼠的高蛋白饮食(45% 蛋白质,30% 碳水化合物)对结肠微生物群有不利影响。
在高蛋白饮食中,链球菌、大肠杆菌/志贺菌和肠球菌分别增加了5.36倍、54.9倍和31.3倍,其丰度与与疾病发病相关的基因和代谢物(包括代谢物尸体)呈正相关,它来源于赖氨酸的脱羧作用,大量使用已被证明会引起氧化应激和DNA损伤。
有益菌在高蛋白饮食中大量减少,包括丁酸生产菌F.prausnitzii(减少3.5倍)、瘤胃球菌(减少8.04倍)和Akkermansia(在高蛋白饮食组中未检测到)。
慢性肾病下,长期低蛋白饮食更有利于改善健康。
研究表明,六个月的低蛋白饮食(0.6 g/kg/天)可以降低非透析慢性肾病患者的血清尿毒症毒素水平,包括对甲酚硫酸盐。低蛋白饮食也与肾功能改善、总胆固醇和低密度脂蛋白胆固醇降低有关。
★ 植物来源的蛋白比动物来源蛋白可能更有利于菌群和健康
在喂食大豆、猪肉、牛肉、鸡肉、鱼类和酪蛋白(后者作为对照)的大鼠中进行了为期14天的喂食试验,结果显示,到第2天,尤其是红肉(猪肉和牛肉)和白肉(鱼和鸡肉)之间的变化。主成分分析显示,在第7天和第14天有不同的微生物群,因此大豆蛋白组与肉类和对照组分开,也就说菌群特征显著变化。
在另一项类似的研究中,与喂食白肉、红肉或酪蛋白的大鼠相比,大豆蛋白与大鼠粪便短链脂肪酸增加有关。大豆组中拟杆菌和普氏杆菌的相对丰度也较高,它们是丙酸盐和其他短链脂肪酸的主要生产者。
另外研究发现,与接受牛奶分离蛋白的仓鼠相比,大豆喂养的仓鼠的血脂显著降低,至少部分原因是大豆蛋白引起的肠道微生物群变化。在高脂饮食制度下,大豆分离蛋白减少了高脂饮食诱导的小鼠体重增加和脂肪组织质量积累,并减轻了肝脏脂肪变性,而乳蛋白没有观察到这种情况。
荞麦蛋白抑制大肠杆菌的生长,促进乳酸杆菌、肠球菌和双歧杆菌的生长,后者与血脂密切相关。荞麦喂养的小鼠粪便中总胆汁酸和短链脂肪酸的排泄量显著增加。
绿豆蛋白在降低高脂饮食诱导的小鼠体重增加方面也优于酪蛋白。绿豆蛋白导致GLP-1分泌增加,盲肠和粪便胆汁酸池增加,次级和初级胆汁酸比率显著升高;在无菌小鼠中被消除的效应。就肠道微生物群而言,食用绿豆作为高脂肪饮食的一部分,导致了瘤胃菌科的扩张,并导致拟杆菌门分类群的增加和厚壁菌门丰度的减少。
乳清蛋白提取物和豌豆蛋白已被证明可以增加多样性、双歧杆菌和乳酸杆菌,其中,乳清蛋白提取物减少拟杆菌和梭菌。
以上这些研究清楚地表明,植物源性蛋白质在促进有益微生物群方面优于动物源性蛋白质,对宿主代谢具有积极影响。
蛋白质的加工(包括热加工)及其对蛋白质功能的影响(包括微生物组的调节)尚不完全清楚,需要进一步研究。
因此,在我们的饮食干预中,不能认为高蛋白饮食一定是健康的,还取决于其来源、加工方式等方面,对待“高蛋白饮食”需谨慎,尤其是在长期或反复饮食实践中。
我们可以看到,地中海饮食结构中,来源于动物蛋白只占金字塔上部(比例较小),无论是对慢病患者或者普通人群,都是一种更为安全、稳妥、健康的选择。
以上是地中海饮食结构对菌群多样性及健康的影响。那么知道吃什么,如何搭配之后,还需要注重什么?
✔ 饮食质量
同样是植物性饮食,有些高温下高油高盐等烹饪方式也会影响其营养。
为了防止破坏大量维生素、矿物质和纤维,加工烹饪的时候应尽量简化。天然食物的本味,对味蕾和身体是一种滋养。
在有条件的情况下,可以尽可能选用本地的、应季的新鲜蔬果作为食材。
高度加工的食物,富含脂肪、精制糖、盐等,与肠道微生物多样性降低有关,对宿主健康产生负面影响。
此外,各类添加剂比如,羧甲基纤维素 (CMC) 和聚山梨醇酯 80 (P80) 这两种乳化剂会降低肠道的微生物多样性并显着改变微生物群组成。
关于食品添加剂对菌群影响详见:《你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化》
服用含有益生元的食物,乳糖不耐症的症状减轻。
低聚半乳糖是益生元,通过刺激肠道中的有益细菌对人体有益。对于乳糖不耐症患者,当低聚半乳糖诱导的微生物群变化增加了双歧杆菌、粪杆菌、乳酸杆菌、Roseburia等乳糖发酵物种的丰度时,它们会起到有益作用。
一项研究观察到,通过向参与者喂食高纯度低聚半乳糖(>95%),乳糖不耐受相关症状得到改善。在有反应的受试者中,观察到微生物组的组成发生了显著变化,但是,双歧杆菌、乳酸杆菌和粪杆菌,所有乳糖发酵菌均出现增加,50%的原本腹痛的受试者报告在使用低聚半乳糖治疗结束时没有腹痛。在将乳制品重新引入饮食后,喂低聚半乳糖的受试者在治疗后,乳糖耐受性的可能性也增加了六倍。
总的来说,以上这些研究强调了饮食对肠道菌群及其对人体的深远影响,具体取决于摄入的食物种类、饮食结构、饮食质量等。除了饮食之外,其他方式也能对菌群产生影响,具体如下:
益生菌
益生菌通过多种机制发挥作用,对肠道菌群的多样性产生积极影响,并改变人体的免疫反应,与改善多种慢性疾病密切相关。
研究发现,益生菌会抑制肠杆菌科(志贺氏菌和埃希氏菌)的生长,同时促进厚壁菌门的大量增殖,尤其是厌氧菌属。益生菌具有帮助从抗生素治疗中恢复个体菌群的显著能力。
益生菌可以直接作用于肠黏膜层和下层上皮,影响肠屏障功能和黏膜免疫;也可以通过调节常驻微生物种群结构或酶活性对宿主产生间接影响。
益生元
益生元本质上是一种肠道菌群的肥料,可以滋养有益菌群。例如,菊粉等益生元支持双歧杆菌的平衡。
益生元通过多种方式与潜在病原体、免疫系统的直接相互作用,调节肠道环境,从而有利于人体健康。
关于益生菌、益生元这部分内容由于在前面的文章中多次提到,此处就不详述了,详见:
《如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍》
《益生菌的靶向递送:研究和商业化前景》
《益生菌的简单入门指南》
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
详见:《维生素D与肠道菌群的互作》
缺铁可能导致微生物群组成的显著重组,微生物多样性降低。
详见:《人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长》
如果从婴儿时期开始,住在农村或者养宠物,可能对儿童菌群多样性的建立比较有益。
另外,多去户外活动,亲近大自然。
一项研究对城市环境生物多样性进行人为干预试验,以检测其对儿童共生菌群和免疫调节的影响。在为期28天的生物多样性干预期间,对标准城市托儿所和自然托儿所的儿童进行对比分析,研究儿童皮肤和肠道微生物群以及血液免疫标记物的变化。
干预使环境和皮肤Gammaproteobacteria群落多样化,这反过来又与血浆TGF-β1水平和调节性T细胞比例的增加有关。
该研究发现,生物多样性干预增强了免疫调节途径,降低城市社会中免疫介导疾病的风险。
这可能为未来的预防方法提供了很大的参考价值。
写在最后
跟任何生态系统一样,我们的肠道菌群处于一种微妙的平衡。在不断变化的环境中,我们永远不知道自己会遇到什么新的威胁。
肠道菌群多样性高,能使整体菌群更有能力去抵抗外界的干扰,例如压力,抗生素药物等。
当然,对于“菌群多样性”这个指标,我们也应该理性看待,多样性出现异常高,如果是各类致病菌大量定植,核心菌群难以生存,那么也不利于健康…
肠道菌群检测报告可以帮助我们从更多角度去看待肠道菌群的整体状况,利用机器学习等最新技术,发现潜在的疾病风险,反映不同营养物质摄入比例,应该多吃什么、尽量少吃什么…
每个人对于要达到健康这个目的,可能有不同的路径,饮食需求不能一概而论,“个性化饮食建议”可以成为我们的健康指向标。我们可以利用好它,结合自身健康状态,有针对性地做出饮食或其他干预措施,从而达到更接近理想的健康状态。
主要参考文献:
Fatima Enam, Thomas J Mansell, Prebiotics: tools to manipulate the gut microbiome and metabolome, Journal of Industrial Microbiology and Biotechnology, Volume 46, Issue 9-10, 1 October 2019, Pages 1445–1459
Rinninella, Emanuele et al. “What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases.” Microorganisms vol. 7,1 14. 10 Jan. 2019, doi:10.3390/microorganisms7010014
Wu Y, Wan J, Choe U, Pham Q, Schoene NW, He Q, Li B, Yu L, Wang TTY. Interactions Between Food and Gut Microbiota: Impact on Human Health. Annu Rev Food Sci Technol. 2019 Mar 25;10:389-408. doi: 10.1146/annurev-food-032818-121303. PMID: 30908952.
Muralidharan J, Galiè S, Hernández-Alonso P, Bulló M, Salas-Salvadó J. Plant-Based Fat, Dietary Patterns Rich in Vegetable Fat and Gut Microbiota Modulation. Front Nutr. 2019;6:157. Published 2019 Oct 11. doi:10.3389/fnut.2019.00157
Fitzgerald E, Lambert K, Stanford J, Neale EP. The effect of nut consumption (tree nuts and peanuts) on the gut microbiota of humans: a systematic review. Br J Nutr. 2021 Mar 14;125(5):508-520. doi: 10.1017/S0007114520002925. Epub 2020 Jul 27. PMID: 32713355.
Azcarate-Peril MA, Ritter AJ, Savaiano D, Monteagudo-Mera A, Anderson C, Magness ST, Klaenhammer TR. Impact of short-chain galactooligosaccharides on the gut microbiome of lactose-intolerant individuals. Proc Natl Acad Sci U S A. 2017 Jan 17;114(3):E367-E375. doi: 10.1073/pnas.1606722113. Epub 2017 Jan 3. PMID: 28049818; PMCID: PMC5255593.
Smith RP, Easson C, Lyle SM, et al. Gut microbiome diversity is associated with sleep physiology in humans. PLoS One. 2019;14(10):e0222394. Published 2019 Oct 7. doi:10.1371/journal.pone.0222394
Spolidoro GCI, Azzolino D, Cesari M, Agostoni C. Diet Diversity Through the Life-Course as an Opportunity Toward Food Allergy Prevention. Front Allergy. 2021;2:711945. Published 2021 Sep 24. doi:10.3389/falgy.2021.711945
Ecklu-Mensah G, Gilbert J, Devkota S. Dietary Selection Pressures and Their Impact on the Gut Microbiome. Cell Mol Gastroenterol Hepatol. 2022;13(1):7-18. doi:10.1016/j.jcmgh.2021.07.009
Merra G, Noce A, Marrone G, et al. Influence of Mediterranean Diet on Human Gut Microbiota. Nutrients. 2020;13(1):7. Published 2020 Dec 22. doi:10.3390/nu13010007
Elena Mengheri, Diet Quality Is Associated with Microbial Diversity and Host Health, The Journal of Nutrition, Volume 149, Issue 9, September 2019, Pages 1489–1490
Wilson, Annette S et al. “Diet and the Human Gut Microbiome: An International Review.” Digestive diseases and sciences vol. 65,3 (2020): 723-740. doi:10.1007/s10620-020-06112-w
Huang C, Feng S, Huo F, Liu H. Effects of Four Antibiotics on the Diversity of the Intestinal Microbiota. Microbiol Spectr. 2022 Mar 21:e0190421. doi: 10.1128/spectrum.01904-21. Epub ahead of print. PMID: 35311555.
Shreiner AB, Kao JY, Young VB. The gut microbiome in health and in disease. Curr Opin Gastroenterol. 2015;31(1):69-75. doi:10.1097/MOG.0000000000000139
Sakkas H, Bozidis P, Touzios C, Kolios D, Athanasiou G, Athanasopoulou E, Gerou I, Gartzonika C. Nutritional Status and the Influence of the Vegan Diet on the Gut Microbiota and Human Health. Medicina (Kaunas). 2020 Feb 22;56(2):88. doi: 10.3390/medicina56020088. PMID: 32098430; PMCID: PMC7073751.
谷禾健康
现状
全球肥胖患病率的上升是一个主要的社会经济负担,肥胖与许多疾病的风险增加有关,包括糖尿病、心血管疾病和癌症。
尽管人们努力改善生活方式选择,提高对潜在病因的认识,但在预防和治疗肥胖方面的长期成功似乎有限,因为饮食诱导的体重减轻在5年随访后仅维持约25%。
近年来,在了解肠道微生物群作为宿主能量和底物代谢调节器参与肥胖和相关心脏代谢并发症方面取得了进展。因此,通过肠道微生物群靶向宿主代谢可能是饮食干预减轻体重的一项重要策略。
过去十年中,关于肠道微生物组对宿主代谢影响的研究数量呈指数增长,研究的数量和质量都在迅速发展,这些研究表明,基线微生物组成可以预测包括肥胖在内的代谢综合征。然而,研究同时表明微生物群组成的调节不可能会在所有条件下对人体代谢产生重要积极的影响,而这种影响取决于个体的特征,例如年龄、习惯性饮食、代谢表型和基线肠道微生物谱。
肠道微生物群的组成由可遗传、人口统计和环境因素决定,包括出生时的分娩方式、年龄、性别、胃肠道转运时间和药物使用。但是诸多因素中,饮食已成为塑造和定义肠道微生物组的关键因素。
饮食尤其是膳食纤维等引起的肠道微生物群组成和功能变化与肥胖和相关疾病的发展有关。这些研究结果发现肠道微生物群的个体间差异可以作为对抗肥胖代谢疾病的更精确饮食方法的基础。
本文将介绍有关饮食成分、肠道微生物组和宿主代谢之间相互作用的知识和研究成果,以及如何整合这些知识来制定基于精确的营养策略,以改善人类的体重控制和代谢健康。
厚壁菌/拟杆菌门
肠道微生物群影响免疫功能和上皮完整性、能量和底物代谢以及葡萄糖稳态。初步研究表明,与瘦个体相比,肥胖的人类和啮齿动物的厚壁菌门与拟杆菌门的比例增加,但也有个别研究未能观察到这种差异,甚至报告了比例下降。
多样性和微生物基因丰富度
在代谢健康与不健康个体的比较中,代谢不健康组的α多样性较低。而且重度肥胖症患者的低微生物基因丰富度比例高达75%,而瘦或超重/中度肥胖症患者的低微生物基因丰富度比例为23%-40%。
(小编推测可能是由于中重度肥胖人群其饮食比较丰富且量大,微生物不需要太多多余的基因就可以代谢获得生存繁殖的食物,而较瘦的个体食物不太丰富,那么菌需要更多的基因才获取生存的食物和繁殖生存)
具体菌属
具体而言,颤螺菌属(Oscillospira)和 红蝽菌科(Coriobacteriaceae)的细菌与良好的代谢健康相关。 在一项包含正常体重和超重/肥胖人群的研究人群中,特定菌属的丰度与代谢特征相关。 例如,产气柯林氏菌、Dorea formicigenans 和 Dorea longicatena 在超重/肥胖人群中的丰度更高。
Akkermansia属的细菌是最有说服力的证据,它与患肥胖症和代谢综合征的风险呈负相关。在超重/肥胖患者中,为期 3 个月的 Akkermansia muciniphila 补充剂可改善胰岛素敏感性并降低肝功能障碍和炎症的血液标志物。
基线菌属
另一项研究表明,在瘦肉型个体中,嗜粘菌A.muciniphila和Alistipes obesi显著富集,而在肥胖型个体中,Ruminococcus gnavus显著富集。该研究还确定,当在基线检查时高丰度存在的菌,如Blautia wexlerae 和 Bacteroides dorei 减肥前以高丰度存在时将有助于减肥。此外,基线普雷沃菌属 (Prevotella)普氏菌丰度可以预测肥胖人群在膳食纤维干预减肥中是否可以成功。
此外,与健康个体相比,II型糖尿病患者和代谢受损个体表现出微生物功能改变和发酵能力降低,尤其是产丁酸盐细菌丰度较低的个体。此外,胰岛素抵抗个体的肠道微生物组可能具有增加的生物合成潜力,并减少了支链氨基酸(BCAA,主要由Prevotella copri,B. vulgatus驱动)的吸收和分解代谢,这与有害代谢效果有关。
总之,代谢受损个体的微生物基因丰富度和多样性降低。肠道微生物群组成和功能的个体差异与饮食干预的反应变化有关。
在当前的西方世界,习惯性饮食结构已转向高能量密集型食物,包括相对较高的饱和脂肪和简单碳水化合物含量,以及较低的膳食纤维含量。尤其是膳食纤维的消耗,以及大量营养素的质量和消耗量都会强烈影响肠道微生物群的组成和功能。基于人群的宏基因组分析揭示了微生物组成和多样性与60多种饮食因素的习惯饮食之间的关联。这些因素包括能量和大量营养素的摄入,以及面包和软饮料等特定食品的消耗。这些数据证实了饮食对塑造肠道微生物群的重要性。
饮食塑造肠型
在一项纵向单卵双生子研究中,粪便微生物群分析表明,能量的习惯性摄入、不饱和脂肪酸(FA)的类型和可溶性纤维会影响微生物群的组成,尤其是拟杆菌属和双歧杆菌的丰度。微生物肠道类型与长期习惯性饮食密切相关,尤其是蛋白质和动物脂肪(拟杆菌属)与碳水化合物摄入(普雷沃氏菌属)相比。
与此一致,长期坚持地中海饮食与特定分类群以及肠道微生物谱的功能有关。肠道微生物组的组成是地中海饮食与心脏代谢疾病风险之间保护性关联的调节因素。当比较习惯性高脂肪饮食和高碳水化合物饮食时,高脂肪饮食的微生物多样性似乎较低。此外,与高(饱和)脂肪饮食和高碳水化合物/纤维饮食相比,微生物多样性似乎更低。这种饮食诱导的失调被认为是肥胖症代谢障碍的诱因。
饮食干预菌群变化较快,但是整齐菌群结构稳定
虽然主要在动物模型中得到证实,但数量有限的人体研究表明,饮食干预引起的微生物组成和功能改变可能已经在饮食摄入改变后的几周甚至几天内发生。在人类中,在严格转向完全以植物或动物为基础的饮食后,发现了适度的微生物变化。这些相当极端的饮食干预形式提供了对饮食-肠道微生物组相互作用的潜在机制的见解,并表明饮食干预引起的微生物变化可能会非常迅速地发生。
与此一致,一项小型控制喂养研究显示,在开始高脂肪/低纤维或低脂肪/高纤维饮食后 24 小时内微生物组组成发生了变化,尽管在整个为期 10 天的研究中肠型特征保持稳定。这些研究结果表明,成年人存在微生物复原力的趋势,这可能与长期习惯性饮食摄入有关。然而,由于缺乏对肠型动力学和复原力的理解,细菌肠型的概念受到了其他几项研究的质疑。
一项为期 1 年的干预研究比较了限制能量的地中海饮食和增加体力活动与等热量地中海饮食对超重/肥胖成年人的影响,结果显示两组之间肠道菌群组成的变化存在显著差异。尽管如此,两种饮食的微生物转移趋势是相同的。这表明饮食模式对于肠道微生物的整齐迁移起关键作用。
饮食与肠道和宿主代谢中的糖酵解和蛋白水解发酵之间的相互作用
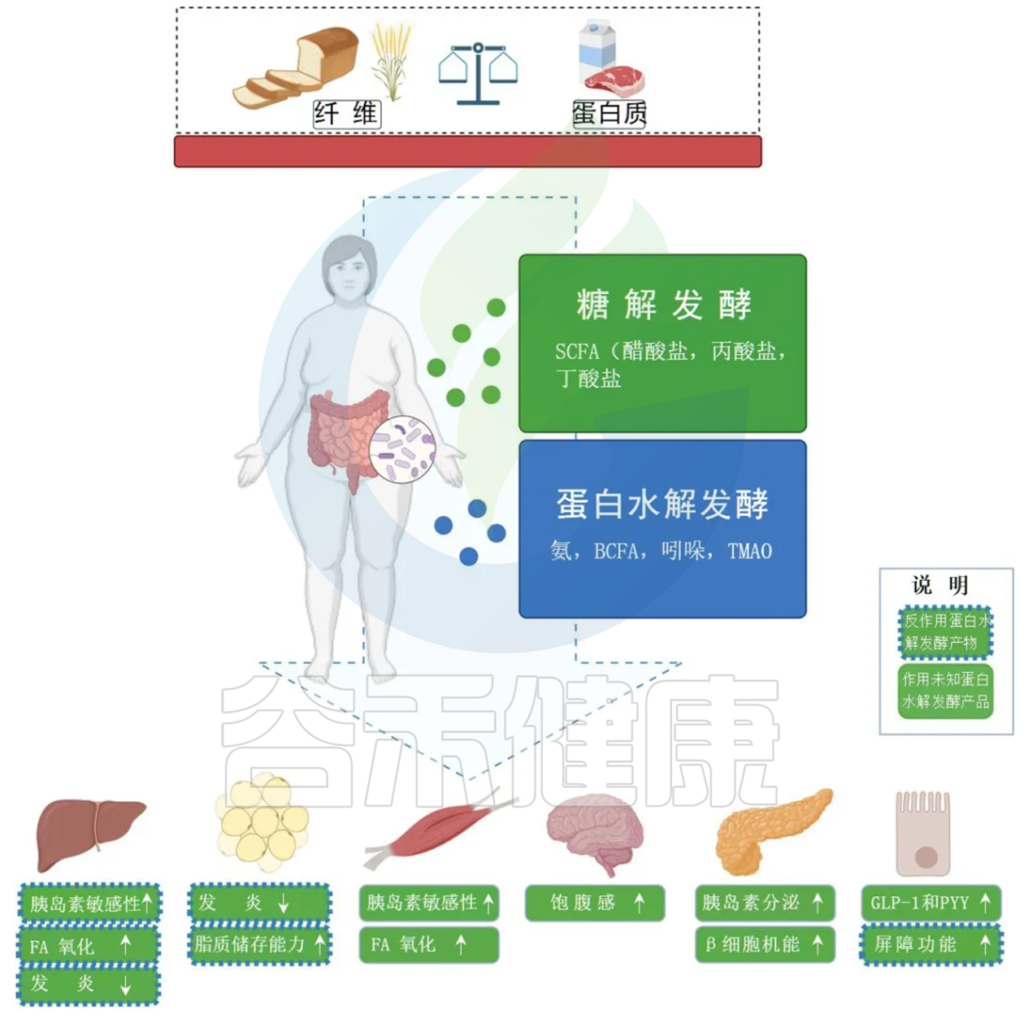
Jardon KM et al., Gut. 2022
膳食纤维的发酵主要发生在近端结肠并产生 SCFA,既可以用作肠细胞的燃料,也可以充当外周信号分子。SCFA 通过影响 GLP-1 和 PYY 的分泌,参与集中调节食物摄入和能量消耗。
蛋白质发酵主要发生在远端结肠并产生更多样化的代谢物,包括与肠道和代谢健康有害影响的 BCFA。
绿框表示 SCFAs 对周围器官代谢过程的影响。
蓝色边框表示蛋白水解发酵产物的相反方向位点方向(虚线)或未知方向(无线)的影响。
BCFA,支链脂肪酸;FA,脂肪酸;GLP-1,胰高血糖素样肽 1;PYY,肽YY;SCFA,短链脂肪酸;TMAO,三甲胺 N-氧化物。
成人肠道微生物组的塑造在生命早期就已经开始,这取决于诸如暴露于母体微生物组、分娩方式和早期暴露于膳食成分等因素。在所有生命阶段影响肠道微生物群组成和功能的众多因素中,饮食是调节特定细菌种类及其功能的丰度的关键。反之亦然,个人对某种饮食或饮食成分的反应可能在很大程度上受肠道微生物群特征的影响。
肠道微生物群能够发酵宿主无法获得的食物成分。小肠中不能被酶分解的膳食纤维和其他复杂碳水化合物可以(部分)被大肠中的细菌发酵,这一般是细菌作为首选能源,发酵后产生微生物产品,如短链脂肪酸(主要是乙酸盐、丙酸盐和丁酸盐)。
主要的产丁酸菌属于厚壁菌门,尤其是:
Faecalibacterium prausnitzii、Clostridium leptum、Eubacterium rectale 、Roseburia.
其他短链脂肪酸的产生由双歧杆菌等细菌介导,双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸。此外,A. muciniphila 物种同时产生丙酸盐和乙酸盐。
稳定同位素技术与13 C标记的短链脂肪酸可根据呼吸、尿液和血液分析对体内结肠产生的短链脂肪酸进行量化。短链脂肪酸主要在结肠中形成,其中约95%随后被吸收。
短链脂肪酸的作用
丁酸盐主要用作结肠细胞的主要能量来源,而丙酸盐和乙酸盐则通过门静脉进入肝脏。特别是,乙酸盐在进入体循环后也能到达外周组织,引起多种代谢和饱腹感相关效应。
短链脂肪酸可与G蛋白偶联受体(GPRs)结合。研究最好的受体包括GPR41、GPR43、GPR109a和GPR164,它们在大量细胞中表达,包括结肠上皮、胰腺β细胞、免疫细胞和周围组织,如脂肪组织。
短链脂肪酸对外周组织的影响包括脂肪生成、抑制脂肪组织脂肪分解(尤其是通过乙酸盐)和减轻脂肪细胞炎症、骨骼肌脂质氧化能力增加、胰腺胰岛素分泌和β细胞功能增加,肝脏的胰岛素敏感性和脂质氧化增加并改变肠-脑相互作用。但是注意这些数据主要来自体外和啮齿动物研究。
短链脂肪酸减脂(人类研究)
在人类研究中发现,长期结肠丙酸盐输送可防止体重增加,减少腹部肥胖和肝细胞内脂质含量,并防止超重成年人胰岛素敏感性的恶化。与这些发现一致,人体内数据表明,在超重或肥胖的成年人中,饮食诱导微生物短链脂肪酸产生变化或直接结肠短链脂肪酸输注后,空腹脂质氧化和静息能量消耗增加。
碳水化合物的消化是一个复杂的过程,涉及摄入的碳水化合物类型的特定酶。大多数可消化的膳食碳水化合物在小肠中被消化和吸收,而某些不可消化的碳水化合物,包括抗性淀粉和膳食纤维,很容易被结肠中含量最高的肠道微生物发酵。
膳食纤维对肠道菌群的有益影响
膳食纤维已被证明对与健康益处相关的肠道微生物群的组成和功能具有显著影响。这些因膳食纤维的结构、物理和化学特性可能会有所不同,例如水溶性、粘度、粘合和膨胀能力以及发酵性。高度可发酵的纤维,如 β-葡聚糖、菊粉和低聚半乳糖,在对微生物群组成和肠道代谢物产生的影响方面得到了很好的定义,而不溶性纤维虽然部分发酵,但大多数人都知道它们对粪便的有益作用一致性和结肠传输时间。

摄入高纤维饮食有益地影响宿主的健康,其中包括影响葡萄糖和脂质代谢。重要的机制包括调节营养吸收或产生短链脂肪酸,但有关膳食纤维对健康影响的数据存在争议。
对于膳食纤维研究中不一致发现的解释:
首先,在大多数人体研究中,只补充了一种特定的可发酵纤维,因此只刺激了一种或几种个体(潜在有益的)细菌属。后者的后果可能是其他必需细菌或核心菌属的丰度减少,这可能导致微生物生态系统的不平衡。因此,结合刺激多种不同细菌属的不同纤维可能对维持微生物丰富度以及对免疫状态和代谢健康产生更显著的(相加或协同)影响很重要,所以多样化膳食纤维和饮食摄入对于健康益处的微生物调节更有用。
有趣的是,一项研究表明,结肠中产生短链脂肪酸的部位可能是代谢健康的决定因素。急性远端结肠乙酸盐给药增加了超重男性的循环乙酸盐浓度,增加了脂肪氧化和刺激饱腹感激素 PYY,并降低了血浆肿瘤坏死因子-α。与远端输注相比,近端结肠中的乙酸盐给药不影响代谢特征。因此,通过结合不同的膳食纤维和/或更复杂的膳食纤维,针对远端结肠中微生物物种的膳食纤维可用性和短链脂肪酸形成,可能是改善免疫和代谢健康的有前景的策略。
TIPs
短链脂肪酸在一定范围内是越高越好,但是超过一定范围,也会产生害处。例如,高纤维饮食增加丁酸盐,诱导Stx受体球形三酰神经酰胺表达从而促进致病大肠杆菌定植。
此外,有益的短链脂肪酸一般需要通过结肠部位的菌群发酵产生,如果外源性的补充摄入,例如,丙酸盐有助于防止食物上霉菌,被广泛使用于烘焙食物、动物饲料和人造调味品中。如果长期摄入过量含有丙酸盐的食物,可能会增加人类患糖尿病和肥胖症的风险。
其次,到目前为止,大多数膳食纤维干预研究都没有考虑基线微生物组或代谢表型。基线肠道微生物组的特征可能与饮食干预结果密切相关。例如,已经表明肠道微生物群对膳食纤维(抗性淀粉与非淀粉多糖)的反应可以根据肥胖男性的基线微生物多样性来预测。高微生物多样性与微生物群的较低膳食反应性相关,这可能支持肠道微生物的更高多样性与微生物生态系统的稳定性有关的假设。
与此一致,与基因计数低的个体相比,基线时的高微生物基因计数与对减肥饮食的不太明显的反应有关。在低基因计数组中,基因丰富度和临床参数有所改善,尽管在基因丰富度低的个体中炎症标志物的变化不太明显。
一项针对肥胖个体的研究表明,不是基线微生物多样性而是厚壁菌门的基线丰度预测了个体微生物群的饮食反应。总之,这些发现表明微生物多样性并不总是饮食反应性的预测指标,这意味着需要进一步研究以更好地了解复杂的饮食-微生物组-宿主代谢相互作用。
作为对菊粉型果聚糖益生元的反应,具有高习惯性膳食纤维摄入量的健康个体的肠道菌群组成发生了更大的变化,而习惯性纤维摄入量低的人肠道菌群似乎更能适应变化。在II型糖尿病患者中进行的一项研究表明,膳食纤维促进了一组精选的产生短链脂肪酸的菌株,而许多其他微生物,包括蛋白水解发酵中的微生物,要么减少要么不变,表明微生物基因丰富度总体下降。粪便短链脂肪酸增加,尤其是丁酸盐,伴随着葡萄糖稳态的改善。因此,如几项人类纤维膳食干预研究所示,更高的微生物基因丰富度本身可能无益,但生理结果可能更依赖于微生物网络的功能。
在一项调查 6 周全麦饮食对体重变化影响的研究中,普雷沃氏菌属的高基线丰度与超重、健康成年人的体重减轻程度较高相关。这些发现表明,作为对特定饮食干预的反应,肠道微生物群的影响调节剂具有预测能力。
此外,发现超重、前驱糖尿病个体与瘦个体相比,对短期施用长链菊粉和抗性淀粉的微生物多样性和餐后胰岛素敏感性的变化的反应降低。与此一致,最近的研究表明,基线肠道微生物特征可以预测补充 3 个月长链菊粉后 BMI 的变化,这种效应在不同个体的粪便微生物群定植的小鼠中得到了复制。
有趣的是,可溶性菊粉纤维已被证明可以降低空腹血糖受损人群的胰岛素抵抗,但不能降低葡萄糖耐量受损的人群。鉴于空腹血糖受损与肝脏胰岛素抗性密切相关的发现,后一发现可能表明纤维 – 肠道微生物群 – 宿主代谢串扰中的组织特异性。
总体而言,益生元膳食纤维对代谢健康结果的有效性可能取决于几个参数,包括基线微生物组成以及微生物发酵的部位。
在低膳食纤维的西方饮食人群中,结肠远端的微生物群更擅长于利用剩余肽和蛋白质的发酵,因为首选的燃料,可发酵碳水化合物,已经在近端结肠中被人体大量使用。这种蛋白水解发酵过程的产物包括气体产物,如氢、甲烷、二氧化碳和硫化氢;BCFAs异丁酸酯、2-甲基丁酸酯和异戊酸酯(源自BCAAs发酵)、酚类和吲哚类化合物(源自芳香族氨基酸微生物发酵)以及较小的、未知的短链脂肪酸。
与糖解发酵产物相比,大多数蛋白水解发酵产物被认为对宿主肠道和代谢健康有害,尽管一些动物数据表明吲哚和硫化氢对肠道和外周组织功能有益。
例如,一些只能由肠道细菌(吲哚)或哺乳动物宿主(酪胺、色胺和短链脂肪酸)产生的氨基酸衍生化合物通过影响GLP-1和肠内分泌细胞血清素的分泌,直接影响哺乳动物的饱腹感和肠道运动。
然而,大多数这些化合物对宿主肠道和周围组织的生理作用仍不清楚。许多此类化合物的人类来源和细菌来源之间的区别尚未完全确定,需要进一步的体内研究来验证此类效应。
结肠中糖酵解和蛋白水解发酵之间的平衡,以及对宿主生理的假定有益和有害调节之间的平衡,可能对制定饮食干预策略很有意义。
一些研究表明,增加膳食纤维的摄入量,特别是缓慢发酵纤维的摄入量,会减少肠道微生物群仅产生有害的蛋白水解代谢物,使得整体发酵平衡向更有益的糖酵解发酵转变。
摄入的膳食蛋白质首先在小肠中被胰酶和来自肠细胞的肽酶消化。然后,大量的寡肽和氨基酸通过肠细胞转运蛋白被转运到门静脉血流中,在那里它们被用作蛋白质合成的氨基酸前体或被代谢为燃料或肠粘膜代谢物必需的前体。
由于远端小肠和近端结肠中的大多数细菌优先使用可发酵碳水化合物而不是蛋白质,因此大多数氨基酸作为能量来源的发酵发生在碳水化合物被耗尽的远端结肠。
摄入的蛋白质到达大肠的百分比也可能取决于蛋白质质量,估计约为 10%。由于植物的细胞壁不易消化,源自植物的蛋白质的消化率较低,而源自动物的蛋白质更容易在大肠中消化,这表明功能结果存在潜在差异。
酪蛋白是一种从动物产品中提取的相对缓慢消化的蛋白质,是防止高脂肪/高蛋白饮食小鼠体重增加和脂肪量增加的最有效蛋白质来源。
蛋白水解和糖酵解发酵之间的平衡可能决定对生活方式干预的反应情况,因此应在未来的研究中加以考虑。


流行病学研究还表明,摄入乳制品和素食蛋白质来源与预防肥胖有关,而大量摄入肉类(尤其是红肉)则预示着体重增加会更高。
尽管研究较少,但蛋白质摄入已被证明会影响微生物群的组成和功能。效果取决于蛋白质的氨基酸组成和消化率,而蛋白质的来源和摄入量会影响它们。
蛋白质摄入影响微生物组成
在大鼠研究中,高蛋白饮食与C. coccoides, C. leptum, F. prausnitzii 减少有关,而超重或肥胖雄性中Roseburia, E. rectale, C. aerofaciens, Bacteroides, Oscillibacter 减少。
值得注意的是,以等热量的方式比较高脂肪/高蛋白饮食与中等蛋白质或低蛋白质饮食会导致饮食之间碳水化合物或脂肪含量的差异。因此,对于所有的等热量膳食宏量营养素交换研究,很难确定导致肠道微生物群组成变化的主要膳食因素,这可能归因于一种(宏量)营养素的增加或另一种营养素的减少。
膳食脂肪已被广泛研究与饮食相关的代谢疾病(如肥胖)相关,但其对人类肠道微生物群的影响尚不明确,而且研究通常会得出相反的结果。
不同类型的脂肪酸(饱和、单不饱和、多不饱和脂肪酸)、碳链长度和饱和度可能对肠道微生物群组成有明显影响。
横断面研究表明,食用富含动物蛋白和脂肪的饮食与拟杆菌属肠型有关,而高纤维、水果和蔬菜的摄入与健康成年人的普氏菌肠型有关。

此外,主要饱和脂肪酸(SFA)的高摄入量与成人和婴儿肠道微生物丰富度和多样性的降低有关。在超重和肥胖人群中, 主要饱和脂肪酸与肠单胞菌属呈负相关,而主要饱和脂肪酸与Roseburia呈正相关,后者在体重正常的个体中也非常丰富。在这项研究中,根据 BMI,习惯性 主要饱和脂肪酸摄入量与产丁酸菌表现出相反的关联特征。
总体而言,应该注意的是,与膳食纤维相比,膳食脂肪-微生物组-宿主生理学相互作用的研究较少,而且其机理知识主要基于动物研究。根据人类生理学比较难解释这些发现,应进一步研究。
多酚主要作为酚类化合物存在于水果和蔬菜中,以其作为抗氧化、抗炎、心脏保护、癌症预防和神经保护剂的有益作用而闻名。
补充天然存在于茶中的表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate) 2个月,对肥胖小鼠胆汁酸代谢和疣微菌科Verrucomicrobiaceae丰度均有影响,促进了A. muciniphila丰度的增加。在其他研究中,后者与有益的代谢作用有关。
此外,虽然也在动物模型中,但 8 周的多酚补充剂可防止饮食引起的肥胖和肠道炎症,这与Akkermansia的丰度增加有关。在健康、超重或肥胖的个体中,12 周的白藜芦醇和表没食子儿茶素-3-没食子酸酯联合补充剂改善了男性的代谢参数并减少了拟杆菌门,但女性没有。
以上两项研究都表明存在性别特异性微生物反应,在评估干预反应时应考虑这一点。

总体而言,在饮食中添加膳食多酚似乎可以促进肠道和代谢健康,尽管仍然需要对人体研究的机制见解。
基于微生物组的精准营养预测代谢健康参数,如血糖反应和变异性,或用于抵消代谢紊乱,目前已受到很大关注。
该领域的一项具有里程碑意义的研究表明,尽管餐后血糖反应的人际差异很大,但在机器学习算法的帮助下创建的个性化饮食(基于习惯性饮食、身体活动和肠道微生物群)可能会成功降低血糖反应和不良代谢健康,还有助于减肥。
研究测试在对不同类型面包的血糖反应中发现了显著的人际差异,并且这种血糖反应可以通过基线微生物组特征来预测。值得注意的是,这些研究主要基于他们对急性膳食挑战和短期干预的反应,而不是长期干预反应。
肠道微生物组的预测能力正变得越来越明显,特别是在检查纤维和粪便微生物群移植效果的研究中。在长期的肠道菌群检测经验实践中也证实,基线微生物特征是对饮食干预(例如,膳食纤维或复合蛋白质)的反应性的有趣生物标志物,也是个性化健康管理的应该纳入的指标基础。
微生物组-宿主代谢轴可能对胰岛素抵抗患者的饮食干预存在抗性,这表明干预可能需要更长的时间,或者需要摄入的功能性膳食成分(如膳食纤维)来诱导有益的效果。特定功能微生物群的特点是对膳食成分的不同消化能力,导致微生物代谢物(如 短链脂肪酸)的不同产生,随后影响宿主代谢的调节。
总的来说,在评估饮食模式和常量营养素组成不同的饮食时,重要的是要同时考虑饮食成分的数量和质量,由于与宿主的微生物和代谢表型的不同相互作用,在整体饮食方法中要考虑到微量营养素和生物活性成分,如多酚。
对饮食干预的反应不仅取决于肠道微生物群的特征,还取决于饮食、生活方式和环境因素以及代谢表型等临床特征之间复杂的多因素相互作用。
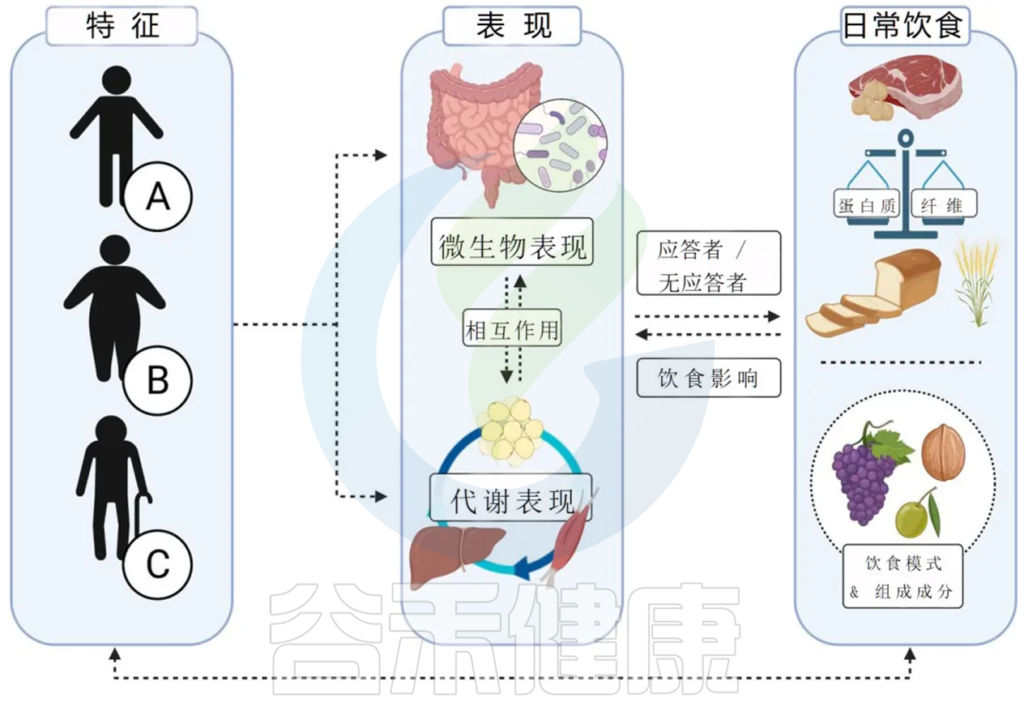
Jardon KM, et al., Gut. 2022
为了将基于精确的策略转化为医疗保健实践或指南,我们需要彻底了解为什么人们对饮食的反应不同,差异反应和相关表型是否长期保持,以及开发的算法在多大程度上是可重复的。
在饮食干预研究中通过最先进的方法进行详细的微生物和代谢表型分析至关重要。显然,鉴于复杂性,除了生活方式和环境因素的详细信息外,还需要详细的信息,包括出生方式、病史、药物使用情况(尤其是抗生素)、身体活动、心理压力和睡眠质量等。这也意味着需要先进的统计和建模方法来梳理不同因素的重要性。

主要参考文献:
Jardon KM, Canfora EE, Goossens GH, Blaak EE. Dietary macronutrients and the gut microbiome: a precision nutrition approach to improve cardiometabolic health. Gut. 2022 Feb 8:gutjnl-2020-323715. doi: 10.1136/gutjnl-2020-323715. Epub ahead of print. PMID: 35135841.
Agus A, Clément K, Sokol H. Gut microbiota-derived metabolites as central regulators in metabolic disorders. Gut. 2021 Jun;70(6):1174-1182. doi: 10.1136/gutjnl-2020-323071. Epub 2020 Dec 3. PMID: 33272977; PMCID: PMC8108286.
Jie Zhuye,Yu Xinlei,Liu Yinghua et al. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories.[J] .Gastroenterology, 2021
Jie Z, Yu X, Liu Y, Sun L, Chen P, Ding Q, Gao Y, Zhang X, Yu M, Liu Y, Zhang Y, Kristiansen K, Jia H, Brix S, Cai K. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories. Gastroenterology. 2021 May;160(6):2029-2042.e16. doi: 10.1053/j.gastro.2021.01.029. Epub 2021 Jan 20. PMID: 33482223.

谷禾健康

运动对心肺健康、肌肉力量、葡萄糖代谢、免疫系统和心理健康有影响。新的横断面研究证据表明,运动锻炼与肠道微生物群组成之间可能存在密切关联。

干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如饮食摄入,结肠运送时间,训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。

反过来,肠道微生物群对运动表现、恢复和疾病模式的各种指标都有间接影响,例如通过肌细胞因子,激素,神经肽和其他代谢物发出信号,调节下丘脑-垂体-肾上腺轴的激活,以及影响与表现相关的代谢途径。
了解肠道微生物群在运动表现中的各种作用,对于寻求改善锻炼结果以及减少训练恢复时间的普通人和运动员来说都非常重要。
本文就以下方面进行详细阐述:

最近的研究表明,运动对肠道微生物群有很多好处。它与有益微生物物种数量的增加和微生物多样性的丰富以及短链脂肪酸合成和碳水化合物代谢的增强有关。
适度运动的频率会导致厚壁菌门的多样性更大。包括Faecalibacterium prausnitzii(产生丁酸,抗炎共生菌),颤螺菌属(Oscillospira) ,有助于更健康肠道环境的Lachnospira和Coprococcus属的成员。
体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关
研究发现,锻炼与女性中具有促进健康功能的细菌的比例更高有关。包括以产生丁酸盐的能力而闻名的F. prausnitzii(普拉梭菌)和Roseburia hominis,以及运动员体内丰富的Akkermansia muciniphila,低水平与肥胖和糖尿病等代谢状况有关。
一项研究调查了 40 名国际职业橄榄球联盟球员的微生物组,并将其与 BMI 高或低的相似年龄的对照组进行比较。结果表明,运动员肠道微生物多样性显著著增加。
与对照组相比,许多其他参数也显示出显著改善的结果。其中包括短链脂肪酸 (SCFA),该研究发现与对照组相比,运动员体内的乙酸盐、丙酸盐、丁酸盐和戊酸盐水平明显更高。”
简而言之,运动已被证明可以显著改善与身体表现和健康相关的几个指标,特别是在有益细菌类型及其功能方面。
然而,这些观察性研究的结果只能确认训练状态和微生物群之间的关联,而不能确定因果关系。
运动与肠道微生物群组成之间的关联似乎是双向的。来自动物研究的越来越多的证据也表明肠道微生物群在宿主的身体机能中起着重要作用。肠道微生物群的组成和代谢活动可能有助于消化膳食化合物并改善运动期间的能量收集,这可以为运动员在高强度运动和恢复期间提供代谢益处。
观察性研究表明,与久坐的受试者相比,运动员微生物组中与氨基酸和碳水化合物代谢相关的代谢活动和途径增加。
在肠道中,细菌将不易消化的碳水化合物发酵成短链脂肪酸乙酸盐、丙酸盐和丁酸盐。训练和定期锻炼与人类粪便短链脂肪酸含量增加有关,并且在动物研究中,特定短链脂肪酸与改善身体机能有关。
大多数短链脂肪酸从肠道吸收并有助于宿主的能量代谢。
丁酸盐主要被结肠中的上皮细胞用作能量来源。
乙酸盐在肌肉组织中代谢,但也可以穿过血脑屏障。
丙酸盐可用作肝脏中葡萄糖合成的前体。
此外,短链脂肪酸可改善肠道屏障完整性,降低局部和全身炎症风险。临床前研究强烈表明短链脂肪酸可能是身体机能的关键调节剂。
值得注意的是,宿主可能不是唯一受益于运动期间与微生物群的共生关系的一方。
目前关于肠道微生物群与身体机能之间相互作用如下:
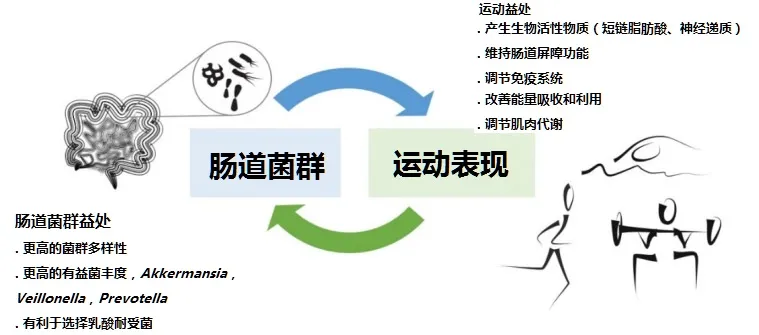
Maija Marttinen et al., Nutrients.2020

你可能想知道运动是否会改变微生物群,或者拥有健康的微生物群是否会让你更加活跃想运动。其实这用一句俗话讲就是“先有鸡还是先有蛋”的情景。
例如,肠道菌群失调会引起炎症,从而导致负面情绪,抑郁等症状,而抑郁不利于外出和积极运动锻炼。
多项研究表明,运动实际上可以改变你的肠道微生物群。
女性:运动与久坐女性菌群有差异
2017 年一项针对女性的研究表明,积极活动方式的女性和久坐女性之间肠道微生物群特征的差异。
积极参与者被选为在试验期间在 7 天内进行至少 10 小时运动的组。久坐组参加安静的活动,并从日常生活中不是经常运动的女性中挑选出来,每周进行 3 次不超过 30 分钟的适度运动。
11 个属(细菌的分类等级)在运动女性和久坐女性之间存在显著差异。重要的是,运动的女性群体拥有更丰富的促进健康的细菌,包括Faecalibacterium prausnitzii、Roseburia hominis和Akkermansia muciniphila.
他们还发现“体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关。”
换句话说就是,过着积极的生活方式更能取悦某些细菌,这是一种正向反馈。
橄榄球运动员比久坐者具有更高的α多样性
一项对爱尔兰男性职业橄榄球运动员的研究表明,与久坐的对照组相比,运动员肠道微生物群的 α 多样性(细菌丰富度,例如在粪便样本中鉴定了多少细菌种类)更高。
肠道微生物群多样性与蛋白质消耗和血浆肌酸激酶水平呈正相关,血浆肌酸激酶水平是运动引起的肌肉损伤的生物标志物。
与高 BMI 对照组的比例相比,在橄榄球运动员和低体重指数 (BMI) 对照组中检测到的Akkermansia细菌比例更高。与低 BMI 的对照组相比,运动员中拟杆菌属的含量显著减少。
从大人群水平上看,Akkermansia和拟杆菌属与肥胖呈负相关。
在微生物代谢水平上也检测到橄榄球运动员和久坐对照组之间的差异,在运动员中检测到的氨基酸和碳水化合物代谢途径活性增加。此外,与久坐的对照组相比,橄榄球运动员的粪便 SCFA(乙酸盐、丙酸盐和丁酸盐)水平更高。
竞技自行车运动员中:经常训练者普氏菌高
在竞技自行车运动员中,每周训练超过 11 小时的自行车手比那些不经常训练的人的普氏菌相对丰度更高。
此外,元转录组学分析表明,普氏菌的转录与微生物组中的支链氨基酸 (BCAA) 代谢途径呈正相关。支链氨基酸,尤其是亮氨酸,是促进肌肉蛋白质合成的必需氨基酸,可以促进运动后的恢复。(详见本文09章节——蛋白质小节)
与业余自行车手相比,在职业自行车手中发现了更多的粪便Methanobrevibacter smithii。该菌与上调的甲烷代谢相关,这与肠道微生物组中短链脂肪酸代谢途径的上调呈正相关。
遗憾的是,该研究没有饮食控制和非运动员对照组。与在骑自行车的人中观察到的结果一致,在一小群精英竞走者中,粪便微生物群被分为普氏菌或拟杆菌为主的肠型。
马拉松运动员:韦荣球菌增加
马拉松运动员中的韦荣球菌丰度在马拉松后显著增加。此外,同一研究小组使用来自超级马拉松运动员和奥运会级别赛艇运动员的粪便样本进行宏基因组分析,结果显示与运动前样本相比,运动后与乳酸和丙酸代谢相关的基因富集。
在小鼠中进行的一项后续研究表明,研究人员从跑步者的粪便中分离培养出Veillonella atypica菌株,给小鼠灌注,结果发现,小鼠开始跑得更多,在跑步机上的跑步时间增加了 13% 。
中强度锻炼的人:促进健康和抗炎细菌增加
除了由专业或竞技运动员进行的高强度训练外,根据世界卫生组织 (WHO) 每周进行 150 分钟中等强度运动的指导方针,以推荐的最低水平进行运动 ,似乎足以改变肠道微生物群的组成。
与久坐不动的女性相比,以低强度进行连续运动的绝经前女性的嗜粘蛋白阿克曼菌、普拉梭菌等的丰度增加。这些都是与促进健康和抗炎作用相关的细菌种类。
此外,运动组和久坐组之间不同的饮食模式可能影响了肠道微生物群的组成,与久坐的女性相比,运动女性的膳食纤维摄入量明显更高,久坐组加工肉类的摄入量比例明显更高。
长期运动的人:菌群多样性更高
在迄今为止最长的运动干预中,研究了在 6 个月内,具有相似运动能耗的不同强度和方式的定期有氧训练对肠道微生物群的影响。
总共 88 名久坐的超重/肥胖受试者被随机分为四个组,包括习惯性生活(对照组)、非机动自行车积极通勤、休闲时间中等强度的运动或剧烈运动。
与对照组相比,所有运动组的 β多样性(样本间差异)都发生了变化,剧烈运动组的参与者组内菌群差异度变小,换句话说就是构成趋向一致。
此外,与对照组相比,剧烈运动组在3个月时的 α多样性增加更多。这表明可能需要更剧烈的运动来诱导久坐、超重/肥胖受试者的肠道微生物群发生变化。
在一项关于剧烈运动的研究中,拟杆菌门增加,厚壁菌门/拟杆菌门比率下降。这一结果与运动员有关,因为拟杆菌的增加在复杂糖聚合物的代谢转化和蛋白质降解中起着至关重要的作用。
梭菌属和Blautia属也减少了。梭菌在全身免疫反应中起着重要作用,而Blautia会增加促炎细胞因子的释放。有趣的是,结肠葡萄糖浓度与拟杆菌呈正相关,并与厚壁菌门、厚壁菌门/拟杆菌门比率和Blautia属相反。此外,Blautia属的丰度较低与更好的全身胰岛素敏感性相关。
这些结果强调了肠道底物摄取对全身的重要性,尤其是葡萄糖和蛋白质摄取,可能对肠道微生物群产生积极影响。
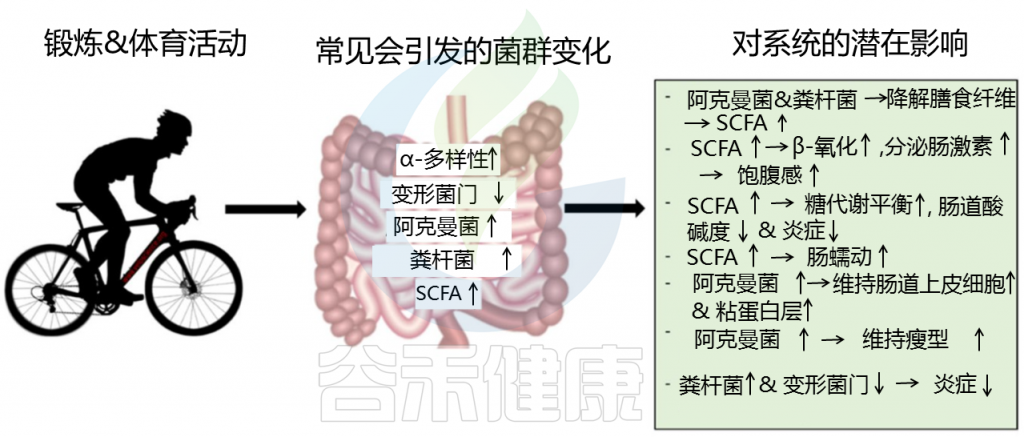

Lensu, S. et al., Metabolites, 2021
在儿童和老年人中也证明了身体活动水平与肠道微生物群组成之间的关联。
儿童:运动者菌群中梭菌目、毛螺菌科增加
来自美国肠道项目的 7-18 岁儿童研究队列中,在控制协变量(年龄、性别和使用抗生素和益生菌)。运动频率与富含厚壁菌门的肠道微生物群有关。此外,每天锻炼的儿童在梭菌目、毛螺菌科中的属增加了。
老年男性:与粪杆菌和Lachnospira菌有关
在老年男性中,根据步数和自我报告的活动测量的体力活动与微生物 α 多样性无关,但体力活动水平与粪杆菌属和Lachnospira属之间存在适度关联。
这些研究表明,运动员或经常运动人群与久坐人群之间的肠道微生物群组成存在差异。
运动者菌群特征可能与饮食有关
然而,运动员和身体活跃的人体内微生物群组成的一些特征可能是通过饮食来解释的,而不是运动的影响。
运动员经常遵循支持训练和表现的严格饮食,而极端运动通常与极端饮食有关。与正常人群相比,运动员的蛋白质摄入量可能要高得多。蛋白质补充剂通常用于满足训练者对蛋白质的更高需求,尽管蛋白质补充剂的流行也可能受到有关增加肌肉质量和改善性能和恢复的说法的影响。
摄入大量蛋白质后,未被吸收的蛋白质会进入结肠并促进特定细菌的生长和选择。
持续 10 周的蛋白质补充剂(乳清分离物和牛肉水解物)增加了跑步者拟杆菌的丰度,并减少了与健康相关的分类群,包括Roseburia spp、Blautia spp 和长双歧杆菌。然而,肠道微生物群组成的这种改变对宿主健康的长期影响仍不清楚。
动物研究:运动产生的变化与年龄、饮食、是否自愿、个体生理状态等因素都有关
很少有研究关注自愿运动对肠道微生物群的影响,迄今为止,除了七项实验研究外,所有研究都使用了小鼠模型。这些初步研究表明,运动会影响肠道微生物群的组成。
大鼠定期跑步运动与产丁酸菌的增加以及丁酸盐浓度的增加有关。其他动物研究表明,通过影响小鼠肠道微生物组成,每日轮式跑步运动可能会改善不健康状态的某些方面,例如饮食引起的肥胖、糖尿病和毒性。这些影响包括改变优势门厚壁菌门和拟杆菌门之间的比例。然而,这在研究之间并不总是相同。
在对动物进行的运动研究中,对于哪些种群受慢性运动的影响几乎没有达成一致。除了运动和乳酸杆菌之间的正相关关系之外,没有其他分类群在经常锻炼的小鼠或大鼠中相对丰度持续增加。
运动所产生的变化似乎取决于个人的生理状态。例如,无论是肥胖-高血压大鼠还是正常大鼠,有规律的强迫运动对微生物群的丰度都有不同的影响。高脂饮食的大鼠运动对微生物群的改变与正常饮食的大鼠不同,并且糖尿病小鼠产生的改变与其对照小鼠不同。
总的来说,这些发现表明,长期运动对微生物群的调节不仅取决于个体的生理状态,还取决于饮食。此外,动物强制运动与自愿运动之间的另一个显著差异是运动量。这在人类骑自行车的数据中得到了概括,需要在动物模型中进一步研究。
此外,年龄,性别也会呈现不同效果。据观察,与成年大鼠相比,运动对幼年大鼠的微生物群产生更有效的改变。在这些检查运动训练对肠道微生物群的影响的小鼠研究中,一个共同的发现是增加了α多样性。

在研究人类肠道微生物群时,很难分别研究运动和饮食。这种关系因饮食摄入变化而变得更加复杂(例如,抗阻力训练运动员的蛋白质摄入量增加或耐力运动员的碳水化合物摄入量增加,以及总体能量和营养摄入量的增加)。
为什么部分运动人群和久坐人群的菌群无显著差异?
高蛋白 + 膳食纤维少 = 运动改变菌群无效
韩国的一项研究表明,高蛋白/限制性膳食纤维与健康久坐人群之间的肠道微生物多样性或有益细菌没有显著差异。然而,当蛋白质或膳食纤维摄入量符合 KRDA(韩国推荐膳食允许量)时,肠道微生物多样性和有益细菌的相对丰度与健康久坐的受试者相比有显著差异。这些结果表明,运动对肠道微生物群的积极影响取决于蛋白质和膳食纤维的摄入量。结果还表明,在补充益生菌之前,应解决营养充足的问题。
研究人群之间膳食摄入量的差异,可能解释了不同研究结果之间观察到的一些不一致之处。
在韩国的一项临床研究中,总蛋白质摄入量与微生物多样性呈负相关 ,而爱尔兰职业橄榄球运动员的高蛋白质摄入量与微生物多样性增加有关。韩国运动员不符合膳食纤维摄入量的膳食建议(建议≥ 25 g/天;健美运动员的中位摄入量 19 g/天,耐力运动员 17 g/天),而爱尔兰橄榄球运动员的纤维摄入量处于推荐水平(中位摄入量 39 克/天)。
未消化的膳食纤维是肠道微生物群的重要能量和碳源,是短链脂肪酸合成的底物,是微生物多样性的关键贡献者。高蛋白饮食与低膳食纤维饮食相结合,可能对肠道微生物群组成有害,而不是单独摄入高蛋白。
营养补充剂介入运动和微生物关联
此外,主要来自动物研究的有限数据表明,流行的运动营养补充剂,如咖啡因、支链氨基酸、碳酸氢钠和肉碱,可以改变肠道微生物群的组成。大型研究队列的结果表明,运动与梭菌和毛螺菌科中的属增加有关。
其他小样本人群研究
尽管有几项研究调查了可能缺乏足够统计功效的小样本群,但有趣的是,通常诸如Akkermansia 和Prevotella等属在运动员和身体活跃的受试者中含量更高。然而,由于临床研究的数量仍然有限,参与者的人口统计学和膳食摄入量(特别是膳食纤维摄入量)差异很大,因此应谨慎得出结论。
运动前后营养变化不大,但是菌群有变化
运动对肠道菌群的影响需要考虑运动期间的饮食因素,那么运动前后对营养元素是否会显著变化?
一个研究小组表明,运动训练干预改变了久坐、未受过训练的芬兰女性的肠道微生物群组成,而饮食习惯、体重或身体成分没有改变。
作者证明,耐力运动改变了超重、久坐女性的肠道微生物群,这些女性参加了一项运动干预,包括每周 3 次、持续六周的自行车训练。研究表明,在训练干预后,总摄入量或常量营养素或膳食纤维的摄入量没有差异。
然而,耐力运动增加了Verrucomicrobia和Akkermansia相对丰度并减少肠道中与炎症相关的变形菌数量。此外,变形菌门和疣微菌门属对运动有反应,并且与年龄、体重、体脂百分比和食物摄入量无关。另一项研究为期 12 周的有氧运动训练计划显著增加了拟杆菌属的相对丰度,但是在年长、久坐的女性中,营养摄入没有变化。
下表总结了关于运动和/或运动饮食对肠道微生物群影响的研究



Mohr AE, et al., J Int Soc Sports Nutr. 2020

除了影响肠道微生物群,运动还会影响胃肠道生理机能。尽管运动通常是一种有益的或“刺激性”压力,但如果持续时间和强度的增加得不到足够的训练、休息、营养和抗氧化状态的支持,它就会变得有害。
运动后的生理效应
运动会激活自主神经系统,增加外周组织和胃肠道中皮质醇和儿茶酚胺、肾上腺素和去甲肾上腺素的循环浓度。这会导致流向胃肠道的血流量减少,导致缺氧、ATP 耗竭和氧化应激。这些作用会破坏肠道屏障,增加肠道通透性、内毒素血症、营养消耗和炎症。胃肠道通过释放与胃肠道紊乱相关的神经递质,如 γ-氨基丁酸 (GABA)、神经肽 Y 和多巴胺来应对压力激活。这些生理效应与运动的强度、持续时间和频率成正比。
长时间运动可能造成胃肠道紊乱
虽然低至中等强度的运动促进胃肠蠕动和转运时间,但剧烈的 [ >60%最大摄氧量(VO2max) ] 或长时间 (≥2 小时) 运动可能会产生相反的效果,并会造成急性胃肠道紊乱。定期运动可促进适应以维持肠道血流并减少炎症,当然恢复也必须足够。
为什么耐力运动员中常出现胃肠道问题?
胃肠道问题很常见,特别是在耐力运动员中,30-50% 的运动员出现胃肠道不适症状。这些症状可以通过生理,机械,心理,营养因子,包括血流量减少,增加的肠通透性引起的,产量增加应激激素和炎症细胞因子,胃排空不足。
然而,在耐力跑之外,很少评估胃肠道症状。例如,一项对参加 4 天严格越野滑雪行军的士兵的研究显示肠道通透性增加,但没有报告胃肠道症状,这使得对主观体验的影响和对运动表现的影响尚不清楚。
肠道上皮具有高周转率(3-5 天),需要大量的能量和营养。在没有足够燃料的情况下长时间高强度训练的运动员有可能出现肠道完整性和功能紊乱以及胃肠道症状。特别是,习惯性碳水化合物摄入量不足会增加对长时间、持续剧烈运动的促炎应激反应。

★
根据运动类型、强度、年龄和其他因素,20-50% 的运动员会出现胃肠道症状,并且随着运动强度的增加而增加。
高强度运动带来的负面影响
在对 29 名训练有素的男性铁人三项运动员的研究中,在比赛中,93% 的人报告消化功能紊乱,两名参与者因严重呕吐和腹泻而不得不放弃比赛。这些在运动员中很常见,因为在剧烈运动期间体温升高,血液从胃肠道流向周边肌肉和器官,如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。
在每周进行 4-10 小时耐力运动的健康年轻成年男性骑自行车者中,仅以 70% 的最大工作负荷进行 1 小时的运动就会产生内脏灌注不足,这会导致胃肠道循环减少、肠道通透性增加和小器官受损。
另一项研究表明,在 70% VO2max 下运动的人会导致内脏血流量减少 60-70%,当血流量减少 50% 时,运动引起的缺血会导致肠道通透性增加 。
加一句题外话,例如明星,网红为了美,限制碳水摄入,同时大量高强度锻炼来达到快速瘦身的效果,其实损害了肠道健康,可能会引起全身炎症反应,不要盲目效仿。
然而,研究主要集中在运动期间急性摄入(之前和期间)对胃肠道症状的影响,而不是习惯性饮食,尽管越来越多的运动员和研究人员关注避免食物的策略,例如低发酵低聚糖,二糖、单糖 、FODMAP 饮食或无麸质饮食。
剧烈运动 -> 胃肠道紊乱 -> 影响肠道微生物群
导致胃肠道症状的氧化应激增加和肠道屏障功能紊乱也会影响肠道微生物群。LPS(由肠道通透性增加引起的革兰氏阴性菌的成分)的易位会导致内毒素血症并触发促炎细胞因子分泌到胃肠道中,这可能会影响肠道微生物群并进一步加剧病情。
反过来:肠道微生物群失调 -> 胃肠道紊乱
相反,微生物代谢物丁酸盐和丙酸盐可作为结肠细胞的能量来源,减少粘膜降解、胃肠道通透性和炎性细胞因子。
肠道微生物群可作为生物标志物
由于微生物组成和多样性的改变与运动员胃肠道不适的流行有关,因此肠道微生物群组成可用作运动后代谢和全身压力的生物标志物。
例如,一项研究运动对血清和粪便代谢组以及肠道微生物群的急性影响的研究表明,一次运动上调骨骼肌底物利用和血清中碳水化合物代谢物的代谢途径,增加粪便氨和氨基酸代谢物,并增加梭菌的丰度。因此,微生物和代谢物谱的急剧变化可以提供有关运动对胃肠道和代谢影响的信息。
此外,考虑到运动对肠道微生物群的影响以及对以肠道为中心的饮食策略的需求,胃肠道症状评估可以补充有关肠道微生物群组成的信息。

一般运动员在运动训练中摄入大量单糖,以最大限度地储存糖原和维持血糖,同时尽量减少膳食纤维和抗性淀粉的摄入,以防止胃肠道紊乱。膳食纤维和抗性淀粉摄入不足可能会导致排便减少,从而导致肠道功能下降,也会降低肠道微生物群的多样性。
此外,运动员比非运动员消耗更多的动物蛋白来满足肌肉增生的需要。蛋白质摄入过多会导致肠道微生物中氮底物过量,产生腐败的发酵产物,如氨、硫化氢、胺、酚、硫醇和吲哚。随着食糜通过肠道,碳水化合物含量减少,腐烂的发酵变得更加有害。
实际上,蛋白质摄入过量,同时结肠中可发酵的膳食底物较低,会导致结肠黏膜DNA损伤。
高强度运动通过血液影响肠道微生物群
此外,高强度运动刺激血液从肠道器官重新分配到肌肉,同时它们积极进行细胞呼吸。血液的频繁重新分布可能会通过内脏低灌注和缺血以及随后的再灌注来扰乱肠道微生物群。因此,需要研究特定运动类型和运动员饮食对肠道微生物群的长期影响。
肠道微生物群在胃肠道功能、肠道免疫、内分泌以及调节氧化应激和水合水平等方面扮演多种角色,对肠道微生物群改善运动员肠道屏障功能的机制的研究也就越来越多。
微生物群产生的 SCFA 影响一系列宿主过程
在结肠和盲肠中,复杂的植物来源的多糖被消化,随后被肠道微生物(如乳杆菌、双歧杆菌、梭状芽孢杆菌、拟杆菌)发酵成短链脂肪酸和气体,这些气体也被专门的细菌(如还原性产乙酸菌)用作碳和能源、硫酸盐还原菌和产甲烷菌。肠道中乙酸盐、丙酸盐和丁酸盐在结肠和粪便中的摩尔比约为 60:20:20。肠道微生物群的组成,微生物群之间的代谢相互作用,及主要膳食宏量和微量营养素的数量和类型,决定了肠道微生物群产生的短链脂肪酸的类型和数量。
一个人吃的植物来源的多糖、寡糖、抗性淀粉和膳食纤维越多,这些细菌就越能将这些难以消化的食物来源发酵成有益的短链脂肪酸。微生物群产生的短链脂肪酸影响一系列宿主过程,包括控制结肠 pH 值,进而影响微生物群组成、肠道运动、肠道通透性和上皮细胞增殖。
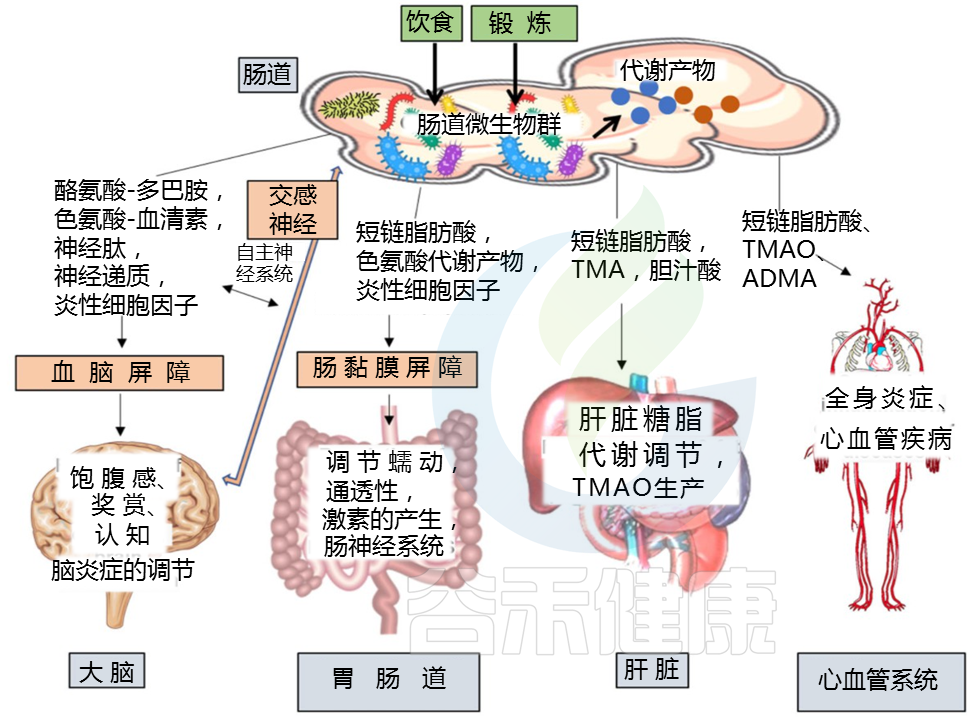
Lensu, S. et al., Metabolites, 2021

运动引起的压力会改变分解代谢激素、细胞因子和肠道微生物群,这可能会导致胃肠道紊乱、焦虑、抑郁和表现不佳。肠道微生物群在人类生物学的许多方面都具有基础性作用,包括新陈代谢、内分泌、神经元和免疫功能。
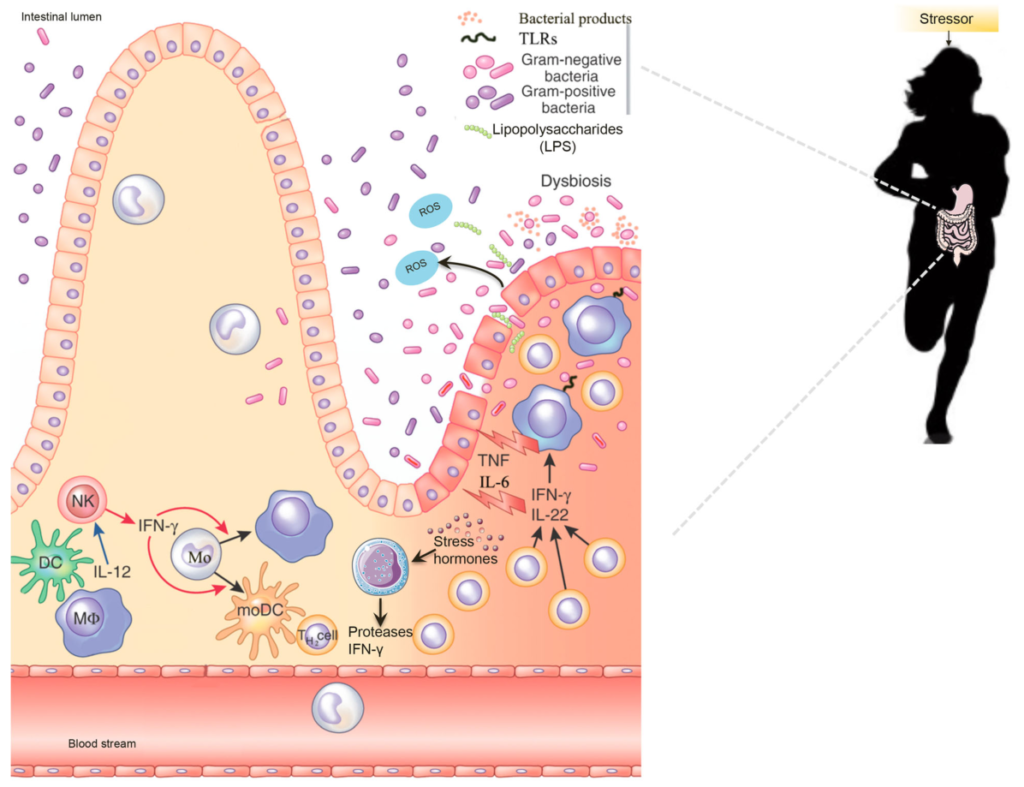
Allison Clark & Núria Mach,J Int Soc Sports Nutr. 2016
适当的肠道屏障功能对于维持健康和免疫力至关重要。但是训练和比赛数小时的精英运动员会经历身体和情绪压力,导致生理稳态发生变化,刺激SAM(交感神经-肾上腺髓质轴)和 HPA轴(下丘脑-垂体-肾上腺轴)高强度运动期间的胃肠道紊乱。
在剧烈运动期间,运动员的体温会升高,血液会在剧烈运动时从胃肠道流向周围肌肉和器官,例如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。长时间的剧烈运动会增加胃肠道中的应激激素和脂多糖 (LPS) 易位,从而引发免疫反应,这通常会导致促炎细胞因子和肠道通透性增加。
由于活性氧 (ROS) 的产生增加以及肠道微生物群组成和活性的改变(所谓的生态失调),肠道通透性可能会变得更糟。
胃肠道通过释放 GABA、神经肽 Y (NPY) 和多巴胺等激素来应对压力,这些激素会导致胃肠道紊乱、焦虑、抑郁、食物摄入减少和压力应对能力降低。相反,微生物群产生的丁酸盐和丙酸盐可以增加跨上皮抵抗,从而改善肠道屏障功能并减少炎症。
胃肠道通过释放 GABA、NPY和多巴胺等激素来应对压力
GABA,这是身体的主要抑制中枢神经系统的神经递质,调节血压和心率和在各种胃肠道功能中起着重要作用,如运动性,胃排空和瞬态下食道括约肌放松,以及焦虑、抑郁,疼痛感和免疫反应。
适度运动可以增加下丘脑中的 GABA 水平,从而降低静息血压、心率和交感神经张力。在 25 °C 水中强迫游泳时,发现大鼠海马 GABA 水平下降(基线的 70%)。
神经肽 Y(NPY)也会在胃肠道中响应各种压力刺激(例如剧烈运动)而释放,并在减弱 HPA 轴方面发挥作用。
注:神经肽Y是一种36个氨基酸的肽,位于整个肠脑轴,是大脑中最普遍的神经肽,在压力恢复和炎症过程中发挥作用。
检测了 12 名训练有素的赛艇运动员的神经肽 Y血清水平,发现运动后神经肽Y的浓度显著增加。虽然很少有研究研究了血清和海马 NPY 水平对运动的反应,但这些结果表明它在减少剧烈运动时的压力反应方面发挥作用。
多巴胺(去甲肾上腺素和肾上腺素的前体)也可以在胃肠道压力期间合成。
多巴胺的产生取决于几个因素:
整个肠道中有多种多巴胺受体,表明它在肠-脑轴中发挥作用。胃肠道、脾脏和胰腺会产生大量的多巴胺。在人胃上皮细胞中发现了多巴胺合成的限速酶酪氨酸羟化酶,表明其功能存在于大脑中的神经传递之外。每天大约 1-2 小时的习惯性运动已被证明会增加大脑中的多巴胺水平。
肠道微生物群如何与周围组织(如胃肠道粘膜层)的应激激素直接相互作用?
去甲肾上腺素(NE)已显示对肠道嗜水气单胞菌(Aeromonas hydrophila)、博德特氏菌属(Bordetella)、空肠弯曲杆菌(Campylobacter jejuni)、幽门螺杆菌(Helicobacter pylori)、李斯特菌(Listeria)和沙门氏菌(Salmonella enterica)有直接影响。
其中去甲肾上腺素促进致病细菌生长的一些方法是,通过增加其毒力因子 K99 菌毛粘附素的表达以及激活鼠伤寒沙门氏菌中毒力相关因子的表达来促进大肠杆菌粘附在肠壁上,然后使这些细菌更容易感染。
此外,去甲肾上腺素还会增加非致病性大肠杆菌和其他革兰氏阴性菌的水平。
微生物组如何调节运动引起的压力反应?
最近发表了一项研究,揭示了对胃肠道和全身健康很重要的,独特微生物群—宿主相互作用。
在结肠炎小鼠模型中,自愿跑步 6 周会减轻症状,而强制跑步机跑步会加剧肠道炎症和临床结果。粪便和盲肠水平与 6 周强制跑步机跑步组相比,与免疫功能和肠道疾病密切相关的在自愿跑步者中显著降低。
此外,与久坐组相比,强制组中的瘤胃球菌(Ruminococcus gnavus)在肠道粘液降解中具有明确的作用,以及增加了丁弧菌属、Oscillospira属和粪球菌属。
这项针对运动和压力动物的初步研究表明,运动可以改变微生物群的组成以及代谢功能,这可能根据运动强度和自愿性等对菌群产生积极或消极的影响。

由于营养、遗传和环境因素,在人类临床研究中剖析肠道微生物群对运动表现的确切作用可能很困难。无菌动物模型克服了其中的许多挑战,并已被用于证明肠道微生物群对身体表现结果所起的作用。
失去肠道微生物群的小鼠,运动表现下降
研究了无特定病原体 (SPF)、无菌 (GF) 和脆弱拟杆菌(Bacteroides fragilis)无菌小鼠的游泳能力。GF 小鼠从游泳到精疲力竭的时间最短,SPF小鼠最长,表明在没有肠道微生物群的情况下表现会下降。观察到与SPF小鼠相比,GF 小鼠表现降低的类似发现。
其他研究:失去肠道微生物群的小鼠运动表现无影响,但肌肉功能下降
与上述相反,另外的研究,GF 小鼠和 SPF 小鼠在运动至精疲力竭时的身体表现没有差异。然而,与 SPF 小鼠相比,GF 小鼠表现出肌肉质量减少、肌纤维减少和肌肉力量降低。GF 小鼠的肌肉萎缩与线粒体生物合成失调和氧化能力降低有关。SPF 小鼠肠道微生物群的移植恢复了 GF 小鼠的肌肉质量,与未治疗的 GF 小鼠相比,用短链脂肪酸混合治疗增加了 GF 小鼠的骨骼肌质量和肌肉力量。
抗生素治疗极大地改变了肠道微生物群的组成
研究证明肠道微生物群在光谱抗生素治疗后耗竭,同时减少了小鼠的耐力运行时间,通过重新接种微生物群恢复后,耐力能力恢复正常。耐力能力的变化与肌肉质量、肌纤维类型或线粒体功能的变化无关,但与肌糖原水平的变化有关,在重新接种后恢复。
多项研究报告了类似的发现,其中与未治疗的对照组相比,使用多种抗生素治疗的小鼠的跑步机运行时间更短。
SCFA 产生的影响及其对运动表现的作用
通过用具有不同底物可用性的纤维喂养小鼠,以在肠道中产生微生物 SCFA。与喂食高度可发酵纤维的小鼠相比,喂食可发酵纤维减少的小鼠的跑步时间显著缩短,这表明微生物群及其底物都与身体机能有关。
为了进一步探索 SCFAs 在表现能力中的假定作用,对抗生素治疗的小鼠进行皮下注射乙酸盐或丁酸盐。乙酸盐而非丁酸盐的输注改善了抗生素引起的剧烈运动带来的不良反应。
无菌动物当然是一种极端模型,可能无法解释在人类微生物群中观察到的更细微的差异。不过,无菌动物模型的研究已经建立了肠道微生物群与身体机能之间的因果关系。
总体而言,恢复肠道微生物群失调似乎可以有效恢复啮齿动物的运动能力和骨骼肌参数。
此外,肠道微生物群组成的差异或肠道微生物群的缺乏可以调节与肌肉结构、肌肉力量和/或能量利用相关的运动能力。
身体活动分为力量和耐力两大类,这取决于你的身体如何产生能量来维持你的运动表现。
无氧运动
力量运动通常高强度,如举重、短跑和拳击。这些运动通过锻炼细胞的无氧途径来增强肌肉质量。这就是说你的肌肉利用其有限的糖原储备来制造 ATP(肌肉的燃料),而无需使用氧气。
最近的一项研究表明,宿主骨骼肌在无氧运动期间产生的乳酸通过循环进入肠腔,为结肠中利用乳酸的物种提供了选择性优势。这项开创性工作的结果表明,在高强度运动期间,宿主以乳酸的形式为特定细菌提供燃料,这些细菌又会产生代谢物,例如丙酸盐,对运动宿主有益。
有氧运动
这与耐力运动不同,有氧运动允许身体以较低的强度进行运动,但运动时间要长得多,例如长跑、骑自行车和滑雪,此类运动肌肉使用氧气将脂肪和糖类转化为 ATP 作为燃料。
测量心血管健康最流行的方法是 V02最大值,它可以查看你的身体在剧烈运动期间可以使用的最大氧气量。用于评估耐力表现,并且可以通过高强度运动得到显著改善。
几项研究表明,微生物群组成与心肺健康之间的关系可以解释“分类丰富度”(微生物组中鉴定的细菌多样性)的 20% 以上的变化。注意到这些变化与其他因素无关,包括年龄、脂肪摄入量和碳水化合物摄入量。
有氧运动对微生物群及身体的益处
研究表明,有氧运动对你的微生物群有好处,包括有益菌和整体多样性丰度增加。
重复进行有氧运动可以增加健康个体和患有慢性便秘的中年患者的胃肠道转运时间。
有氧运动还会增加粪便 SCFA 浓度,从而降低结肠腔的 pH 值。
此外,作为运动副产物并在全身循环的代谢物(例如乳酸),可能会通过肠道过滤并作为某些细菌分类群(例如韦永氏菌)的能量来源。
有氧运动类型及建议
有氧运动是长期而稳定的,确保为你的肌肉提供氧气,以便它们可以产生燃料 (ATP)。这包括任何可以提高心率并长时间保持心率的运动。
比如:步行、慢跑、跳舞、慢骑自行车、椭圆机和健身房的划船机、登山、游泳等都是有氧运动。但是,锻炼的强度和持续时间还是根据身体的总体健康水平而异。
有氧运动是长期的。放轻松,坚持下去,你的身体会适应的。
NHS 已经发布了成人的运动建议:
至少150分钟中等的有氧运动,如骑自行车或快走
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
或者
每周进行中等强度和剧烈有氧运动的组合——例如,两次 30 分钟的跑步加上 30 分钟的快走相当于 150 分钟的中等有氧运动
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
适当的训练计划旨在平衡精英运动员所经历的全身压力因素以及个性化的饮食计划,以提高表现并减少运动引起的压力症状。
某种营养素对应激反应的调节程度取决于其持续时间、运动员的整体营养状况、运动的类型和强度、生理状况以及肠道微生物群的组成和功能。由于精英运动员的压力反应相当复杂(从肠漏到分解代谢和抑郁症),定义标准的饮食计划很困难。
一般来说,许多精英运动员被鼓励摄入大量的简单碳水化合物和蛋白质以及少量的脂肪和纤维,以提供快速的能量来源,同时避免潜在的消化问题,例如高纤维饮食有时会出现的胀气和腹胀。精英运动员的饮食计划也基于某些微量营养素的消耗,如铁、钙、氨基酸、必需脂肪酸和抗氧化剂。
饮食设计应考虑肠道微生物群
由于饮食强烈影响微生物群的组成和功能,通过营养治疗调节肠道微生物群可以改善运动员的压力反应并提高表现。可以假设,每个饮食计划可能都伴随着微生物群的同步调整。为运动员设计个性化饮食时的另一个重要考虑因素是了解微生物组如何随时间变化。
目前和未来运动员或经常的锻炼计划应根据其对肠道微生物群的潜在影响来考虑饮食策略,包括以运动为中心的饮食策略(例如,蛋白质补充剂、碳水化合物负荷)对肠道微生物群的影响以及以肠道为中心的饮食策略的影响。

对性能的饮食策略,除了摄入益生元、益生菌和合生元外,摄入足够的膳食纤维、多种蛋白质来源,并强调不饱和脂肪,尤其是 omega-3脂肪酸,在优化运动员的健康和表现。
蛋白质
蛋白质是骨骼肌的主要成分。然而,特定氨基酸在肝脏和骨骼肌的吸收和分解代谢以及它们调节肌肉蛋白质合成反应的能力方面有所不同。
必需氨基酸,尤其是支链氨基酸 (BCAA),对于肌肉蛋白质合成至关重要,并且比非必需氨基酸产生更大的肌肉蛋白质合成反应。因此,膳食蛋白质会影响蛋白质利用和骨骼肌对运动的合成代谢反应。
补充亮氨酸导致血浆亮氨酸和总支链氨基酸浓度显著增加,并改善耐力表现和上肢力量,影响血浆色氨酸:支链氨基酸比率。BCAA 的补充也被用于通过改变大脑神经递质的产生(如 5-HTP、多巴胺和去甲肾上腺素)来调节运动期间疲劳的影响。由于缺乏证据,无法对运动员应服用的 BCAA 类型或数量提出建议。
运动员可能需要的蛋白质是一般人群的两倍
用以维持蛋白质合成、能量产生、免疫功能和肠道完整性和运动引起的压力的结果。
这对于耐力和阻力训练的运动员来说比较重要。耐力运动员可能需要在运动后恢复期摄入更多的蛋白质,尤其是在禁食状态下进行耐力运动时,因为这可能会增加肌丝蛋白水解。
虽然根据饮食和生理因素而变化,例如消化率、氨基酸的数量和组成、食物基质以及其他营养素的存在,但约 10% 的蛋白质未被消化,可能会到达结肠被肠道细菌分泌的蛋白酶进行蛋白水解。
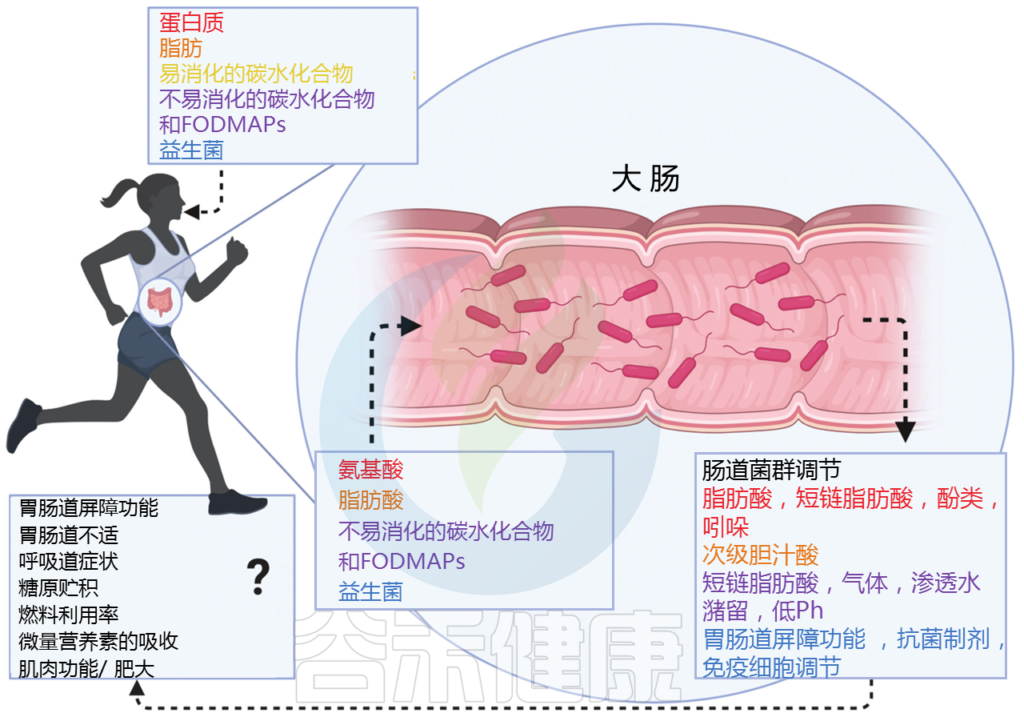
Hughes RL, et al., Adv Nutr. 2021
关于肠道微生物群代谢,氨基酸可以根据其发酵代谢产物进行分类:含硫氨基酸、芳香族氨基酸和色氨酸。
过量蛋白质摄入的不利影响
这些代谢物包括支链脂肪酸和短链脂肪酸、氨、硫化物、吲哚和酚类化合物。虽然其中一些代谢物(例如 SCFA 和吲哚)可能具有改善肠道完整性等有益效果,但其他代谢物(例如氨和对甲酚)会降低肠道上皮完整性。过量的蛋白质摄入可能会导致蛋白水解代谢物的产生水平超过宿主吸收、转化或解毒有害代谢物的能力,导致对肠道屏障功能、炎症和结肠健康的不利影响。
非蛋白质成分有助于运动后的蛋白质合成反应
另一个领域是全食物蛋白质与蛋白质补充剂的影响,因为全食物具有相同或更好的增效作用。例如,摄入全鸡蛋与蛋清相比,摄入全脂牛奶与脱脂牛奶相比,会导致更多的氨基酸摄入和运动后肌原蛋白合成,表明非蛋白质成分(例如,脂质、碳水化合物、微量营养素和其他生物活性化合物)有助于运动后的蛋白质合成反应。
过量蛋白质补充剂增加结直肠癌风险
蛋白质补充剂,包括添加到能量饮料中的支链氨基酸和牛磺酸,通常被运动员用来增强运动对骨骼肌的合成代谢和适应性作用,并促进恢复。过量的牛磺酸会导致牛磺胆酸(TCA)、脱氧胆酸(DCA) 和硫化氢 (H2S) 浓度升高,这与结直肠癌风险增加有关;然而,这些补充剂对运动肠道微生物群的影响尚不清楚。
谷氨酰胺
运动前几天食用高蛋白、低碳水化合物的饮食会导致运动后血浆谷氨酰胺浓度降低。然而,谷氨酰胺补充剂几乎没有得到对健康、营养良好的运动员的严格控制的科学研究的支持。此外,研究者指出谷氨酰胺补充剂应取决于症状(即血浆谷氨酰胺水平低、肠漏)。
酪氨酸
新的中央疲劳假说指出,当血清素水平升高而多巴胺水平降低时,疲劳就会开始,这可能是许多运动员服用酪氨酸补充剂以防止其消耗的原因,尽管尚未确定推荐的补充剂量。酪氨酸或 4-羟基苯丙氨酸可在体内由苯丙氨酸合成,存在于许多高蛋白食物中,如豆制品、鸡肉、火鸡、鱼、花生、杏仁、鳄梨、牛奶、奶酪、酸奶和芝麻。
肠道微生物群通过增加膳食蛋白质的生物利用度和吸收以及增加肌肉蛋白质合成影响肌肉功能
有证据表明,肠道微生物有助于蛋白质的吸收和利用。例如,益生菌补充剂(副干酪乳杆菌)增强了植物蛋白的生物利用度,将必需氨基酸和支链氨基酸的浓度提高到与动物蛋白相当的浓度。此外,当与蛋白质共同给药时,益生菌凝结芽孢杆菌(GBI-30,6086) 减少了上皮细胞炎症,改善了营养吸收,并产生了增加人类氨基酸吸收的蛋白酶。这些作用可以减少肌肉损伤并促进肌肉恢复,从而提高适应能力和表现。
需要注意的是,细菌虽发酵氨基酸,但它们代谢动物和植物蛋白的方式不同。每个饮食计划都伴随着微生物群组成和功能的同步调整。因此,纯素食者、素食者、杂食者和红肉摄入量高的饮食的微生物群组成差异很大。
多项研究表明在高蛋白饮食中添加抗性淀粉可以抵消高蛋白摄入的负面影响,进一步说明摄入足够的膳食纤维对肠道和整体健康的重要性。
碳水化合物
毫无疑问,充足的碳水化合物消耗对于繁重的训练计划和成功的运动表现至关重要。
碳水化合物怎么补充?
对于每天训练超过 2 小时的运动员,膳食碳水化合物的摄入量为每天 7 至 12 克/千克,脂肪摄入量通常小于每天体重的 1 克/千克(消耗总卡路里的 20%)。

碳水化合物在长时间的剧烈运动中恢复肌肉和肝脏糖原储存,减轻压力激素水平升高,如皮质醇,并可以限制与高强度运动相关的免疫抑制。高碳水化合物饮食(8.5 g/Kg/d;总能量摄入的 65%)和随意食用碳水化合物在高强度训练期间可以减少疲劳并改善身体机能和情绪。
运动前和运动中摄入大量简单碳水化合物
针对运动员的饮食建议在运动前摄入大量简单碳水化合物以维持葡萄糖稳态,并在运动前摄入低纤维以减少胃肠道不适,同时补充说,以植物为基础的高纤维饮食可能会降低能量供应。在运动前和运动期间摄入简单碳水化合物(例如,葡萄糖、果糖、蔗糖、右旋糖)可以减轻疲劳、提高运动表现、促进水重吸收和维持水分充足。
摄入等量的果糖和葡萄糖,优化果糖吸收减轻不适
然而,葡萄糖和果糖负荷以及果糖与葡萄糖的比例会影响肠道微生物发酵和胃肠道应激。葡萄糖和果糖的组合导致比摄入单一碳水化合物更高的碳水化合物氧化率,减少运动期间内源性能量储存的消耗。摄入等量的果糖和葡萄糖可优化果糖吸收,减少微生物发酵,从而减轻胃肠道不适症状。
乳糖提高运动表现和恢复能力
乳糖还可以作为运动前、运动中和运动后的良好燃料来源,以提高运动表现和恢复能力,同时还可能促进对肠道微生物群的有益影响,例如双歧杆菌和乳酸杆菌的增加。
注意:
高碳水化合物饮食不会改善免疫功能,也不会防止经过大量训练后血浆谷氨酰胺浓度降低。
富含简单和精制碳水化合物的饮食不会促进健康的肠道微生物群组成,也不会产生有益的短链脂肪酸。
需要更多的研究来了解微生物群从饮食中提取营养的能力,并包括宿主的代谢变化。
膳食纤维
一般每 1,000 卡路里摄入足够的纤维总量为 14 克,即成年女性为 25 克,成年男性为 38 克。
低膳食纤维供应与较低的微生物群多样性、较少的短链脂肪酸产生和较少的抗病原菌相关,所有这些都可能对宿主产生有害的长期后果。
运动员或运动锻炼期间可以通过增加植物性食物的摄入量(例如全谷类、豆类、蔬菜、水果和坚果),同时在恢复期和训练期减少来自高添加糖、精制碳水化合物和脂肪的加工食品的能量,从而获得足够的膳食纤维摄入量,因为在激烈的训练或比赛之前吃高纤维饮食可能会导致胃肠道不适,如腹胀、胀气。
腹胀详见:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
此外,膳食纤维和大量食用植物性食物似乎会抑制细菌从蛋白质中产生有害代谢物,这强调了摄入足够的复合碳水化合物以维持肠道微生物组碳水化合物发酵的重要性。
脂肪和多不饱和脂肪酸
运动员的脂肪消耗量往往很低,占膳食能量的 15-30% 。长时间运动期间脂肪代谢的增加(30-50% 的膳食能量)可能具有糖原节约作用,并可能改善耐力表现和健康。
高脂肠内营养可以减轻肠道灌注不足导致消化功能紊乱后的肠道炎症、细菌易位和肠道损伤。
高脂饮食的危害
另一方面,高脂饮食会导致类似焦虑的行为增加,选择性破坏探索性、认知性和刻板行为,神经炎症破坏肠道屏障功能的标志物,以及与高脂肪饮食的小鼠相比增加循环内毒素和淋巴细胞表达。
在人类中,与高碳水化合物饮食(65% 的饮食能量)相比,富含脂肪的饮食(62% 的饮食能量)可能对免疫功能有害。
这些作者比较了 10 名未经训练的年轻男性在每周 3-4 次持续 7 周的耐力训练期间食用富含碳水化合物的饮食,和10 名高脂饮食的受试者。高脂饮食的运动员的 NK 细胞活性较低。
注:NK 细胞溶解一定数量肿瘤靶细胞的能力
Omega-6 多不饱和脂肪酸
它可以改变细胞膜流动性并间接影响免疫功能,包括减少 IL-2 的产生和抑制有丝分裂原诱导的淋巴细胞增殖,从而在运动期间和运动后产生潜在的不良免疫功能。
omega-3 多不饱和脂肪酸
它的最佳剂量约为 1–2 g/d,二十碳五烯酸与二十二碳六烯酸的比例为 2:1,可能会减少运动过程中 ROS 的产生。

高脂饮食对运动的影响不明确
到目前为止,由于结果相互矛盾,很难就补充 omega-3 的数量和持续时间向运动员提出任何明确的建议。目前,高脂肪饮食对后续运动表现的影响是模棱两可的,并且缺乏关于压力个体的信息。
最重要的是,摄入高脂肪和卡路里的饮食与慢性“低度”全身炎症、肠道通透性和血浆LPS增加以及总细菌多样性降低以及拟杆菌和梭菌的相对比例增加有关。因此,似乎食用高脂肪饮食也可能导致肠道微生物群发生不利变化。
维生素和抗氧化剂
运动员通常不会补充维生素和其他抗氧化剂,但建议运动员应考虑增加抗氧化剂的摄入量,如维生素 C、E、β-胡萝卜素和多酚,以减少 ROS 的形成和脂质过氧化。

用蓝莓和绿茶提取物(作为布洛芬替代品)补充多酚并没有改变既定的炎症和氧化应激,但增加了肠道细菌多酚代谢特征的代谢物(例如马尿酸盐、4-羟基马尿酸、4-甲基儿茶酚硫酸盐)和跑步者在3天剧烈运动后恢复期间的生酮。
不推荐补充个别微量营养素或食用大剂量的简单抗氧化剂混合物
尽管没有任何负面影响的报道,但富含多酚提取物(蓝莓和绿茶)的运动员饮食并没有减轻剧烈运动带来的生理压力,也没有提高恢复速度。
摄入大剂量的个别维生素(在运动员中并不少见)可能弊大于利,因为大多数维生素在体内主要作为辅酶发挥作用。一旦这些酶系统饱和,游离形式的维生素就会产生毒性作用。因此,运动锻炼期间应该通过增加水果和蔬菜的摄入量来获得复杂的抗氧化化合物混合物。
益生菌
常规益生菌包括双歧杆菌属和乳酸杆菌,尽管在运动员中研究的其他细菌包括芽孢杆菌属、肠球菌属、链球菌属、韦永氏菌或酵母布拉氏酵母菌。
益生菌带来的健康益处及对运动效果的影响
益生菌可减少感染、炎症、肌肉酸痛和胃肠道通透性或不适。迄今为止,益生菌益处的最实质性证据是改善上呼吸道感染的发生率、持续时间和严重程度,这可能会间接提高运动成绩。
呼吸道症状改善的研究包括来自乳酸杆菌家族的有机体。L.salivarius也可能通过增加产生丁酸盐的类群Roseburia和Lachnospiraceae 来降低胃肠道通透性,并减少疣微菌。虽然有证据表明益生菌功能的共享机制,但益生菌的益处通常取决于益生菌的菌株和剂量。
益生菌可以通过改善肠道通透性和抗氧化状态以及减少炎症来减轻剧烈运动对运动员胃肠道不适和肌肉酸痛的影响。布拉氏酵母菌和嗜酸乳杆菌和双歧双歧杆菌的组合有助于预防旅行者腹泻。
益生菌还可以通过生物活性代谢物的产生(例如短链脂肪酸、神经递质)、肠道 pH 的调节和肠道的改变等机制改善营养吸收和利用、糖原储存、身体成分、能量收集、激素产生以及认知和情绪微生物群的活动。例如,植物乳杆菌增加了铁人三项运动员的耐力表现,同时增加了粪便短链脂肪酸。
一项对小鼠的研究表明,从一名奥林匹克举重运动员身上分离出的细菌菌株 [ L. salivarius亚种 salicinius (SA-03)] 通过增加肝脏和肌肉糖原并降低乳酸、血尿素氮、氨和肌酸激酶在运动后提高耐力表现和肌肉力量。
然而,更多的研究表明,多菌株益生菌比单菌株益生菌具有更强的增效作用,这表明多种菌株可能以互补的方式发挥作用以提供性能优势。
益生菌可能因此有利于通过直接和间接的机制,提高运动成绩,虽然增补效应的证据仍然稀少。
益生菌如何补充?
益生菌菌株和剂量的差异以及个人的基线饮食、免疫状态和微生物群组成可能会导致研究之间的结果存在差异,从而使比较和得出结论变得困难。
大多数针对运动员的益生菌补充研究并未评估肠道微生物群,因此很难确定疗效是否取决于基线或参与者肠道微生物群组成的变化。同时饮食摄入,尤其是纤维和益生元底物的摄入,也可能影响益生菌的作用,因此应在分析中加以考虑。因为消费者应该意识到,如果没有足够营养的饮食支持,单独补充益生菌可能不会产生预期的效果。
此外,针对运动的益生菌补充研究通常样本量较小(即 10 至 30 名参与者),并且通常仅包括或主要包括男性参与者,这是有问题的,因为存在可能是性别特定的影响。
发酵食品对运动的影响
人们越来越关注发酵食品中活培养物的影响 ,以及它们的影响或与肠道微生物群的关联。然而,很少有研究调查发酵食品(包括酸奶、开菲尔、酸菜)对运动的影响。
三项使用开菲尔或发酵乳的研究报告称,运动诱发的 CRP 或肌酸磷酸激酶和肌肉酸痛降低,表明这些发酵食品对减少炎症有积极作用。一项小鼠研究报告了开菲尔对力量和耐力的增效作用。因此,含有活微生物的发酵食品可能对炎症和运动表现有益。
合生元
合生元是“包含活微生物和宿主微生物选择性利用的底物的混合物,它赋予宿主健康益处”。合生元可能是益生菌和益生元的组合(互补合生元),尽管单个成分不一定需要满足益生菌和益生元的标准,只要它们在共同给药时协同作用(协同合生元)。因此,益生元成分可以增强益生菌(协同合生元)的功能,或者这两种成分在引入肠道及其常驻微生物(互补合生元)后可以提供独立的有益功能。
这种微生物和选择性利用底物的组合可能比单独补充益生元或益生菌具有不同的效果。然而,只有 1 项研究调查了这些成分对身体活跃的人类的协同和独立影响。合生元补充剂(副干酪乳杆菌431、动物双歧杆菌乳酸亚种BB-12、嗜酸乳杆菌LA-5、鼠李糖乳杆菌)与单独补充益生元(阿拉伯胶)相比,LGG、raftiline、raftilose、乳铁蛋白、免疫球蛋白、阿拉伯胶)与血清 IL-16 浓度的增加较小相关,但合生元补充剂和阿拉伯胶单独都不影响 SCFA 浓度、免疫或胃肠通透性。因此,与单独补充益生元或益生菌相比,合生元可能对运动员的健康和表现产生不同或额外的影响。
微量营养素
微量营养素有助于免疫功能、炎症、能量代谢和骨骼健康,影响运动表现。充足的铁、锌和维生素 A、E、C、B-6 和 B-12 的摄入量对于适当的免疫功能至关重要,在运动员的高强度训练和比赛条件下可能会受到影响。
此外,由于汗液和尿液的流失以及氧化应激的增加,运动员对某些微量营养素的饮食需求可能会增加。此外,女运动员或女性增加锻炼缺铁的风险更高,影响健康和表现。
微量营养素与肠道微生物群
缺乏抗氧化微量营养素(例如,维生素 C 和 E 以及硒)会减少共生肠道细菌的数量,同时促进大肠杆菌的增加。
在压力增加的动物中,维生素 C、维生素 E、多酚、硫辛酸和微生物抗氧化剂的抗氧化剂混合物可恢复肠道氧化还原状态,这与双歧杆菌和乳杆菌增加以及大肠杆菌减少有关。然而,过量摄入某些微量营养素也可能增加感染易感性。例如,婴儿过量补铁会增加病原微生物,包括大肠杆菌,并导致肠道炎症。
因此,在压力增加或微量营养素缺乏的情况下补充微量营养素可能对免疫和炎症具有微生物群介导的益处。
钙和维生素D
钙和维生素D支持骨骼健康。此外,维生素 D 可能通过调节钙依赖性收缩、蛋白质依赖性骨骼肌合成代谢、线粒体功能和胰岛素敏感性来影响骨骼肌质量和强度。纤维摄入后双歧杆菌、毛螺菌科和拟杆菌的增加与钙吸收的增加呈正相关。这可能是由于短链脂肪酸的产生,它通过降低结肠 pH 值或调节信号通路或基因表达来增加钙吸收。维生素 D 的摄入也会影响肠道微生物群,尽管结果的可变性排除了确定补充剂对特定分类群的影响的能力。摄入钙和维生素 D 与肠道微生物群之间的双向关系对所有年龄段运动员的骨骼健康都有重要意义,无论是生长还是维持骨密度,以降低骨折风险。
需避免的食物
胃肠道问题在运动员和长期运动锻炼人群中比较常见。为了缓解症状,运动员可能会避免或限制某些会引发症状的食物。运动员还可以采用营养策略来增加胃排空并改善水和营养物质的吸收,包括避免高 FODMAP食物和含麸质食物。
FODMAP 是不易消化的短链碳水化合物,可增加胃肠道内的渗透负荷。肠道微生物可以将这些膳食成分发酵形成气体,从而导致有些人出现腹胀和胃肠道不适。

最近一项调查耐力运动员 FODMAP 摄入量的研究报告称,高摄入量都会导致胃肠道症状。初步结果表明,低FODMAP饮食减轻了运动员胃肠道症状。然而,FODMAP也充当肠道微生物群的燃料,它们的限制可能会影响群落的组成和功能。
有一种推测,无麸质饮食之所以能改善胃肠道症状,并不是其本身,而是其中 FODMAP 食物的减少。
只有一项研究调查了无麸质饮食对非腹腔耐力运动员的影响,其中报告无麸质饮食对表现、胃肠道症状、健康、肠道损伤或炎症没有影响。

运动可能是改变肠道菌群组成和恢复肠道共生的重要干预措施
目前的研究支持运动作为一种重要的行为因素的作用,它可以影响肠道微生物组成和功能的定性和定量变化,并对宿主有益。运动可以丰富微生物群的多样性,刺激可以调节粘膜免疫、改善屏障功能的细菌的增殖,并刺激能够产生防止胃肠道疾病和提高性能的物质的细菌和功能通路。
尽管这些变化可能不会以类似的方式在个体间发生,也可能取决于微生物群和宿主的基线特征。
值得注意的是,某些菌群可能在运动员中富集,例如与瘦表型相关的A. muciniphila和产生丙酸盐的Veillonella(通过乳酸代谢)。精英运动员身上丰富多样的、有利于代谢的肠道微生物群,很可能是在整个青春期和成年期参加高水平运动期间,多年高营养摄入和高强度运动和训练的累积表现。
运动带来的益处涉及内在和外在因素的结合
常运动的人更有可能接触到他们的环境生物圈,并遵循整体健康的生活方式,因此拥有更健康的微生物群。
同时,耐力训练的内在适应性,例如血流量减少、组织缺氧以及转运和吸收能力增加,可导致胃肠道发生变化。胃肠道转运时间的变化又会影响结肠腔内的 pH 值,这可能导致肠道微生物群的组成发生变化。而较长的结肠转运时间与肠道微生物群多样性的减少有关,同时伴随着从近端结肠到远端结肠的转运过程中 pH 值的增加。
长时间过度运动对肠道功能产生不利影响
尽管运动通常有益健康,但如果持续时间和强度的增加,且得不到足够的休息、营养的支持,它就会变得有害。
剧烈运动将血液从内脏循环重新分配到活跃的呼吸组织。长时间的肠道低灌注会损害黏膜稳态并导致肠细胞损伤,可能会导致肠道缺血,特别是在脱水的情况下,表现为腹部绞痛、腹泻或偶尔血性腹泻,也会使肠道通透性增加,产生炎症。这种不利影响在耐力运动中尤其如此。
目前对人体肠道微生物群与运动之间相互作用的研究仍然缺乏
尤其是与控制饮食相结合的研究,这是一个重要的混杂因素。准确测量营养成分和饮食质量,将有助于把运动对肠道微生物群的影响与其他混杂因素区分开来。
研究还应记录液体摄入量或测量水合生物标志物(如和肽素),以确定水合状态是否影响肠道微生物群,反之亦然。
此外,饮食和运动对肠道微生物群的影响通常是短暂的,并且在干预完成后不会持续。这表明长期的生活习惯对于诱导肠道微生物群的稳定变化是必要的。在关键发育窗口期间的干预措施可能对肠道微生物群产生更持久的影响,当然这需要进一步研究。
未来与运动相关的肠道微生物群的研究领域

Mohr AE, et al., J Int Soc Sports Nutr. 2020
未来的研究应侧重于使用分层方法,使用人体临床试验来识别可能有益于运动表现的目标细菌,并使用动物和体外研究来确定因果关系和机制。
然后可以再次使用人体试验来确定是否补充已鉴定的细菌或实施饮食习惯(例如,益生元/不易消化的碳水化合物、ɷ-3 脂肪酸补充剂、蛋白质摄入量的类型/数量),以提高细菌丰度和/或功能有利于运动表现。
需要在控制饮食的情况下调查高蛋白饮食、全食物蛋白质来源和蛋白质补充剂的影响的临床研究,以确定这些饮食模式和成分对运动员肠道微生物群的影响。
此外,需要更多的研究来阐明膳食脂肪的数量和类型对肠道微生物群的影响以及随后微生物群介导的(例如,通过胆汁酸)对运动表现的影响。
总之,人们越来越意识到,微生物群的个体差异会导致运动反应和健康结果的差异性。
未来的研究还应该整合其他“组学”数据
整合其他“组学”数据,以确定可能导致、促成、介导或调节饮食和运动对肠道微生物群的影响的潜在代谢物、基因和表观遗传修饰。
“组学”数据的使用与机器学习方法相结合,有可能揭示肠道微生物群与其代谢物、饮食和运动表现之间的新关联,并预测对饮食策略的个性化反应。这些发现的影响包括提高运动员成绩和改善健康,尤其是胃肠道和呼吸系统健康的潜力。
此外,研究应对肠道微生物群、饮食和人类健康之间的相互作用有更深入的了解,这些相互作用可能具有超越运动人群的影响和应用,以造福所有人的健康。
声明:本账号发表的内容仅是用于信息的分享,仅供学习参考使用。在采取任何预防、治疗或治愈的措施之前,请先咨询临床医生。
主要参考文献:
Clark A, Mach N. Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes. J Int Soc Sports Nutr. 2016;13:43. Published 2016 Nov 24. doi:10.1186/s12970-016-0155-6
Lensu, S.; Pekkala, S. Gut Microbiota, Microbial Metabolites and Human Physical Performance. Metabolites 2021, 11, 716.
Mohr AE, Jäger R, Carpenter KC, et al. The athletic gut microbiota. J Int Soc Sports Nutr. 2020;17(1):24. Published 2020 May 12. doi:10.1186/s12970-020-00353-w
Jang LG, Choi G, Kim SW, Kim BY, Lee S, Park H. The combination of sport and sport-specific diet is associated with characteristics of gut microbiota: an observational study. J Int Soc Sports Nutr. 2019;16(1):21. Published 2019 May 3. doi:10.1186/s12970-019-0290-yHughes RL,
Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021;12(6):2190-2215. doi:10.1093/advances/nmab077
Jollet M, Nay K, Chopard A, et al. Does Physical Inactivity Induce Significant Changes in Human Gut Microbiota? New Answers Using the Dry Immersion Hypoactivity Model. Nutrients. 2021;13(11):3865. Published 2021 Oct 29. doi:10.3390/nu13113865
Marttinen M, Ala-Jaakkola R, Laitila A, Lehtinen MJ. Gut Microbiota, Probiotics and Physical Performance in Athletes and Physically Active Individuals. Nutrients. 2020;12(10):2936. Published 2020 Sep 25. doi:10.3390/nu12102936
Sohail MU, Yassine HM, Sohail A, Thani AAA. Impact of Physical Exercise on Gut Microbiome, Inflammation, and the Pathobiology of Metabolic Disorders. Rev Diabet Stud. 2019;15:35-48. doi:10.1900/RDS.2019.15.35
Monda V, Villano I, Messina A, et al. Exercise Modifies the Gut Microbiota with Positive Health Effects. Oxid Med Cell Longev. 2017;2017:3831972. doi:10.1155/2017/3831972
Clauss M, Gérard P, Mosca A, Leclerc M. Interplay Between Exercise and Gut Microbiome in the Context of Human Health and Performance. Front Nutr. 2021;8:637010. Published 2021 Jun 10. doi:10.3389/fnut.2021.637010
Okamoto T, Morino K, Ugi S, Nakagawa F, Lemecha M, Ida S, Ohashi N, Sato D, Fujita Y, Maegawa H. Microbiome potentiates endurance exercise through intestinal acetate production. Am J Physiol Endocrinol Metab. 2019 May 1;316(5):E956-E966. doi: 10.1152/ajpendo.00510.2018. Epub 2019 Mar 12. PMID: 30860879.
Ticinesi A, Nouvenne A, Cerundolo N, et al. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019;11(7):1633. Published 2019 Jul 17. doi:10.3390/nu11071633
Hughes RL, Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021 Dec 1;12(6):2190-2215. doi: 10.1093/advances/nmab077. PMID: 34229348; PMCID: PMC8634498.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154. doi: 10.2174/1389203719666180514145437. PMID: 29756574.

谷禾健康

我们知道肠道菌群代谢产生短链脂肪酸,丁酸是短链脂肪酸之一,它支持消化系统健康和疾病预防,地位不容小觑。
丁酸作为一种有效的调节因子,是宿主-微生物串扰的关键介体。本文整理了丁酸盐的特性,探讨其健康益处及改善健康的潜力。
肠道菌群消化膳食纤维,并将它们转化为多种有机化合物,这些化合物对人体健康有益,包括氨基酸、短链脂肪酸等。内源性丁酸主要是肠道内产丁酸细菌利用糖类发酵产生一类短链脂肪酸。
丁酸在体内可以通过脂肪酸氧化为机体供应能量,是肠道上皮细胞的主要供能物质。丁酸与机体健康密切相关,对调节肠道健康、抑制炎症及癌症等病症意义重大。在养殖业中常添加丁酸盐保护动物健康生长,如预防断奶仔猪腹泻、调节鸡肠道菌群并增强其免疫力等。
1、 为肠道细胞提供燃料
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。
与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
厚壁菌属的成员以产生丁酸盐而闻名,像Roseburia,Faecalibacterium prausnitzii,直肠真杆菌 E.rectale 等。
这种关系是相互的。丁酸盐为结肠细胞提供燃料,作为回报,这些细胞有助于提供一个无氧环境,有益的肠道微生物在其中茁壮成长。这可以控制炎症,保持肠道细胞健康,并使肠道细菌保持健康。
2、 促进肠道运动
丁酸盐还可以穿过上皮屏障,通过连接胃肠道、脾脏和肝脏的肝门静脉进入循环。肝脏似乎是内脏产生的SCFA的主要库,它们可能通过β-氧化代谢,用于合成酮体或转化为AcCoA。
最近的研究发现,外周血短链脂肪酸水平与膳食中溴的摄入量相关,这表明丁酸盐是通过循环运输的,其他器官可能会受到丁酸盐浓度变化的影响。
短链脂肪酸转运体的表达受到短链脂肪酸存在的调控,未在结肠中代谢的短链脂肪酸通过门静脉进入肝脏,作为肝细胞的能量底物,因此在体循环中只留下极少的丁酸。
实验室研究表明,丁酸盐通过作为SCFA受体的配体和激活剂,诱导肠道激素肽YY24或介导肠嗜铬细胞释放5-羟色胺来促进肠道运动。
★ 增强电解质吸收
丁酸盐通过上调Na+-H+交换器和诱导ATPase离子交换器基因来增强水和电解质的吸收。并且可能有益于预防某些类型的腹泻。
3、 激活AMPK
丁酸盐激活AMPK (AMP-activated protein kinase, AMPK)。AMPK的作用是促进细胞内的平衡。它在我们的新陈代谢功能中也扮演着重要的角色。一些科学家把减肥归功于AMPK的激活。
在有和没有NAFLD的小鼠中,当AMPK被激活时,肝脏中的脂肪水平下降,也就是说,新的脂肪产生减慢,现有的脂肪被代谢。此外,在喂食高脂肪食物的小鼠中当AMPK被激活时,小鼠的体重增加和肥胖缓解,肝脏炎症的迹象也更少。
AMPK对食欲调节至关重要。它在减肥方面也有重要作用。
刺激AMPK促进自噬。这个自然过程是细胞破坏和消耗老细胞。最后,肠道内的细胞变得更强壮。由于激活AMPK,丁酸盐帮助结肠细胞维持其4 – 5天的生命周期。有了健康细胞的存在,小肠的紧密连接变得更加强健。
反过来,来自器官的颗粒和毒素不会渗透导致肠漏的问题。因此,丁酸盐可以帮助修复肠道内壁。
4、 抗氧化能力
丁酸盐保护细胞免受有害物质的侵害,以维持肠道健康。
说起抗氧化,我们先了解一下自由基。它基本上是体内化学反应产生的废物。另一方面,抗氧化剂是身体抵御它们的防御措施。大量自由基会造成损害并压倒身体的修复系统。我们称之为氧化应激。氧化应激被认为是导致衰老和疾病的一个重要因素。
丁酸增加谷胱甘肽,可以中和自由基
结肠或大肠是身体产生的废物的储存容器。较高的丁酸盐水平已被证明会增加谷胱甘肽的水平,谷胱甘肽是一种在人体细胞中产生的抗氧化剂,可以中和肠道中的自由基(自由基与炎症和许多疾病有关)。
5、 防止肠漏
肠道内壁需要丁酸盐来保持健康和正常运作。
肠道内壁是肠道屏障。它促进绒毛的生长,微小的手指状挤压物排列在肠道内,并增加粘蛋白的产生,粘蛋白是一种覆盖肠道内部的凝胶状物质。它选择性地让维生素和矿物质等物质离开肠道,进入血液,并到达需要它们的地方。同样,它可以阻止毒素、病原体和食物化合物进入血液。
当屏障健康时,称为紧密连接的小孔会放松,让水和营养物质通过。
一些习惯,比如频繁吃零食,会阻止这些紧密连接在两餐之间的关闭,因此细菌和不需要的物质会进入血液,于是肠漏就发生了。
肠道微生物从膳食纤维中产生的丁酸盐提供了肠道内壁细胞所需的燃料。通过这样做,它可以保持肠道内壁的完整性,防止发生肠漏。
6、 抗炎、抗癌特性
丁酸盐对肠道具有抗炎和抗癌功能。
肠道内壁会保持低水平的炎症,以防与微生物群接触的粘膜表面发生任何变化。低水平的炎症受到严格控制,但如果它被破坏,会导致氧化损伤,并在很长一段时间内导致癌症。
丁酸盐会阻止体内的一些促炎物质发挥作用。丁酸盐的抗炎作用可减少氧化应激并控制自由基造成的损害。
丁酸盐的抗炎特性,部分原因是其抑制转录因子核因子-κB (NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
丁酸盐对免疫功能的调节作用
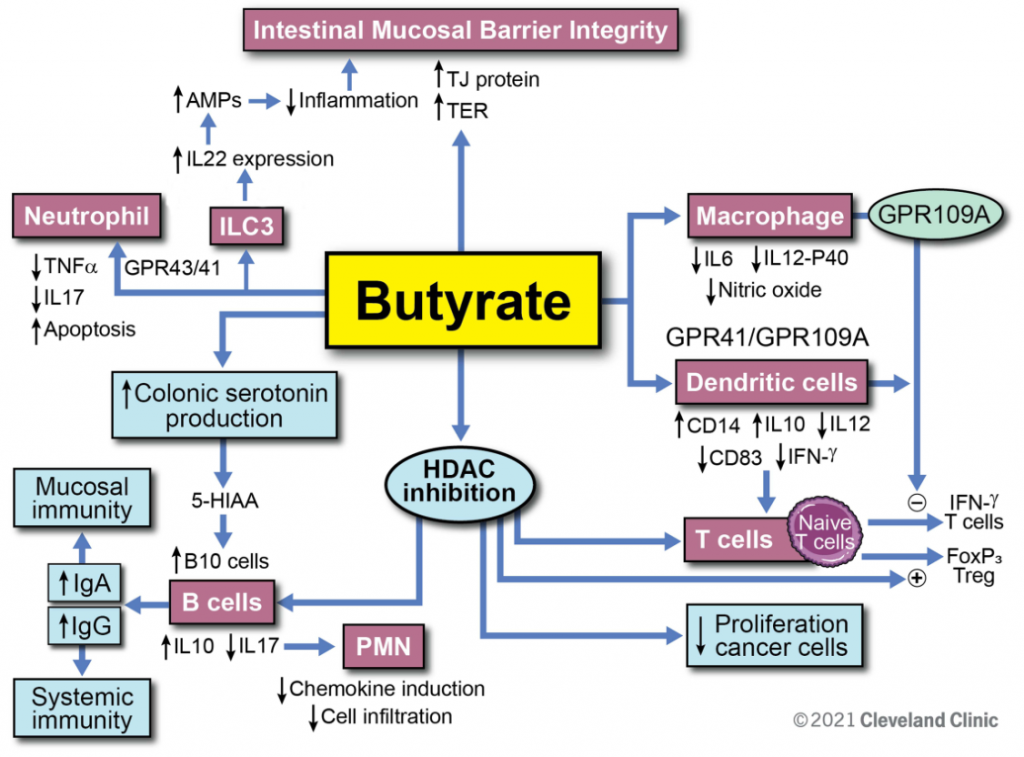

前面我们知道,丁酸盐通过直接诱导上皮中的紧密连接蛋白来增强肠粘膜屏障。此外,丁酸盐诱导ILC3细胞分泌IL-22进一步增强了这种作用。通过与GPCR 43和41的相互作用,丁酸抑制中性粒细胞的促炎细胞因子分泌。丁酸通过GPCR直接作用于巨噬细胞和树突状细胞,并通过增加Foxp3 T细胞调节T细胞功能,同时抑制产生IFN-ɣ的T细胞。丁酸增加5-羟色胺的产生,也是HDAC的抑制剂。它通过这些途径调节B细胞功能,增加抗炎细胞因子IL-10,同时降低IL-17。丁酸盐通过增加B细胞的IgA和IgG抗体反应,增强特异性免疫和抑制自身免疫。
抗炎 -> 抗癌
丁酸盐也是一种组蛋白脱乙酰酶(HDAC)抑制剂。组蛋白脱乙酰酶是大多数癌症中产生的酶。因为丁酸盐是一种抑制剂,它实际上会改变基因表达,抑制细胞增殖,诱导细胞分化或凋亡。因此,它可以阻止癌细胞的发展。
炎症性肠病
炎症性肠病(IBD)是一种慢性肠道炎症性疾病,有两种主要亚型:克罗恩病和溃疡性结肠炎。
虽然IBD的确切发病机制尚不完全清楚,但IBD涉及遗传、肠道微生物群和粘膜免疫等多种影响因素之间的复杂相互作用,包括先天性和适应性免疫反应。
据报道,在这两种IBD亚型中,产生丁酸的肠道微生物减少。丁酸对肠道防御机制具有多阶段调节作用,包括通过促进肠上皮中的紧密连接蛋白保护肠粘膜屏障,支持先天性和适应性免疫反应,以及通过降低环氧合酶-2(COX-2)水平抑制氧化应激,并通过诱导过氧化氢酶,改善过氧化氢(H2O2)的解毒作用。
肠粘膜溃疡是IBD的主要表现之一,丁酸对肠上皮细胞生长和细胞死亡过程的影响已被充分证明。
根据整体稳态条件,丁酸酯已被证明对人类结肠上皮细胞具有生长刺激或凋亡特性。此外,在人和大鼠来源的结肠细胞培养物中,丁酸已被证明能减少氧化应激引起的DNA损伤。
母乳通过丁酸保护宝宝的抗炎环境
据报道,母乳喂养等早期接触对IBD的发展和发病机制具有保护作用。母乳通过其代谢物丁酸诱导紧密连接蛋白和粘液产生基因的表达,从而诱导新生儿胃肠道的抗炎环境。
前面章节我们了解到,当肠道屏障完整时,炎性体具有保护作用,但一旦屏障被肠道失调破坏,炎性体的激活和免疫细胞的募集与粘膜炎症相关——这是IBD持续炎症的另一个主要病理生理机制。
在肠炎症的体外共培养模型中,丁酸已被证明可调节促炎症信号并抑制几种核苷酸结合寡聚化结构域样受体-3(NLRP3)炎症体标记物。
丁酸盐结合其他疗法
一项研究报告称,当IL-1β被其他IBD疗法(如5-ASA)抑制时,丁酸盐显著降低IL-8分泌,从而降低IL-8介导的趋化性,突出了单独丁酸盐不一致临床反应背后的机制,以及丁酸盐与IBD其他治疗方式相结合的可能性。
通过添加产丁酸菌改善屏障完整性
通过添加产丁酸菌(prausnitzii杆菌、白痢丁酸球菌和六种丁酸产生菌的混合物)来增加克罗恩病患者的微生物群中的产丁酸菌,从而改善体外上皮屏障完整性。
丁酸治疗潜力
由于丁酸治疗的反应不一致,可能在某种程度上由于剂量、持续时间和配方标准化的变化,目前丁酸在IBD中的适用性最多被视为补充治疗。
丁酸盐显示出更一致有效性的一个领域是转移性结肠炎,这是一种术后表现,当结肠的一部分失去连续性时,丁酸盐消耗被认为是导致炎症的主要因素。虽然手术治疗或结肠再连接或切除转移是一种更确切的治疗方法,但在考虑医疗管理时,丁酸灌肠已被证明具有治疗价值。
癌症
丁酸盐使肠道环境保持稳定,并且是膳食纤维对某些癌症的保护作用的一部分。
肠癌,是西方世界的主要健康负担,主要归咎于饮食。膳食纤维含量低的饮食会影响肠道中的细菌。结肠细胞需要丁酸盐作为能量,如果它们没有能量,就无法工作。
低膳食纤维 -> 丁酸盐↓ -> 肠癌
丁酸盐是由肠道细菌从植物性食物中的益生元纤维中产生的。如果肠道内的细胞无法工作,与肿瘤进展相关的细胞就会茁壮成长,接着会发出炎症信号并导致肿瘤发展。因此,低膳食纤维会使丁酸盐的产生减少,是肠癌的危险因素。
结直肠癌
据报道,结直肠癌患者包括丁酸盐在内的短链脂肪酸水平较低。
丁酸盐对肠上皮细胞的增殖具有双面作用,一方面支持健康细胞处于稳态,但另一方面抑制癌症诱导的过度增殖。丁酸钠已被证明以p-53非依赖性途径诱导人结肠癌细胞系凋亡。丁酸盐还可以防止氧化应激和DNA损伤。
据报道,丁酸盐还通过多种途径具有癌症保护作用,包括抑制神经纤毛蛋白-1(NRP-1)、抑制丝裂原活化蛋白激酶(MAPK)信号通路、差异调节Wnt-β-连环蛋白信号通路、上调microRNA miR-203和促进细胞凋亡,和促增殖miR-92a的抑制。
由于饮食模式在结直肠癌发病中的作用已得到充分证实,大多数人体试验研究了通过改变膳食纤维摄入量进行干预的方法,并报告了结直肠癌复发风险的降低。
代谢相关疾病
越来越多的证据表明饮食、肠道微生物群和代谢紊乱之间存在复杂的相互作用。
★ 肥胖
对人类的研究表明,肥胖和瘦人群的肠道细菌存在差异,微生物多样性的减少与胰岛素抵抗和血脂异常有关。
包括丁酸盐在内的SCFA可通过激活肠细胞内的FFAR来降低食欲和体重。这促进胰高血糖素样肽1(GLP-1)和肽YY(PYY)的释放,前者促进胰岛素分泌并抑制胰高血糖素分泌,后者降低食欲并减缓胃排空。
SCFA还能减少所谓的“饥饿激素”——ghrelin的分泌;FFAR2存在于ghrelin分泌细胞上,包括乙酸盐和丙酸盐在内的FFAR2激动剂可减少ghrelin分泌。
也有证据表明短链脂肪酸作用于交感神经系统,交感神经节中FFAR3的激活导致能量消耗增加。
然而,关于丁酸盐对食物摄入的影响,有相互矛盾的结果报道。
食物摄入量减少 -> 抗肥胖
有研究发现,丁酸盐在9天内使喂食HFD的小鼠的食物摄入量减少了22%。这与直接服用丁酸后GLP-1和PYY分泌增加有关。FFAR3基因敲除小鼠减少了丁酸刺激的GLP-1分泌,尽管丁酸减少了体重增加和食物摄入的程度与野生型小鼠相似,这表明FFAR3和GLP-1对于丁酸的抗肥胖作用不是必需的。
另一研究发现类似的结果,在HFD喂养的小鼠中,急性口服(而非静脉注射)丁酸盐在24小时内减少了21%的食物摄入量,而丁酸盐的慢性补充在9周内减少了相似量的摄入量。
在迷走神经切断术后,丁酸盐并没有改变小鼠的食物摄入量,因此作者认为丁酸盐通过肠-脑神经回路诱导饱腹感。这可能与GLP-1有关,因为GLP-1作用于迷走神经。
食物摄入量增加,体重不变 -> 抗肥胖
相反,有研究表明,在1-10周的四个测量时间点,补充丁酸盐可增加HFD喂养小鼠的食物摄入量。尽管增加了食物摄入量,但补充丁酸盐的小鼠体重并未显著增加,而对照组小鼠的平均体重增加了17克。相反,补充丁酸盐的小鼠在暴露于低温时,其能量消耗增加,产热增加,这一点可以从较高的体温中看出。
在小鼠中,丁酸增加棕色脂肪组织(UCP1)和骨骼肌(UCP2和UCP3)中解偶联蛋白、促进热量生成的线粒体蛋白的表达。在丁酸盐处理的小鼠骨骼肌中Ucp2和Ucp3基因的启动子处发现组蛋白乙酰化增加,这表明丁酸盐可能通过HDAC抑制增加解偶联蛋白表达来增加产热,从而增加能量消耗。
★ 糖尿病
研究发现,糖尿病患者和糖尿病前期受试者中丁酸盐水平降低。
丁酸盐通过多种途径影响糖代谢的调节
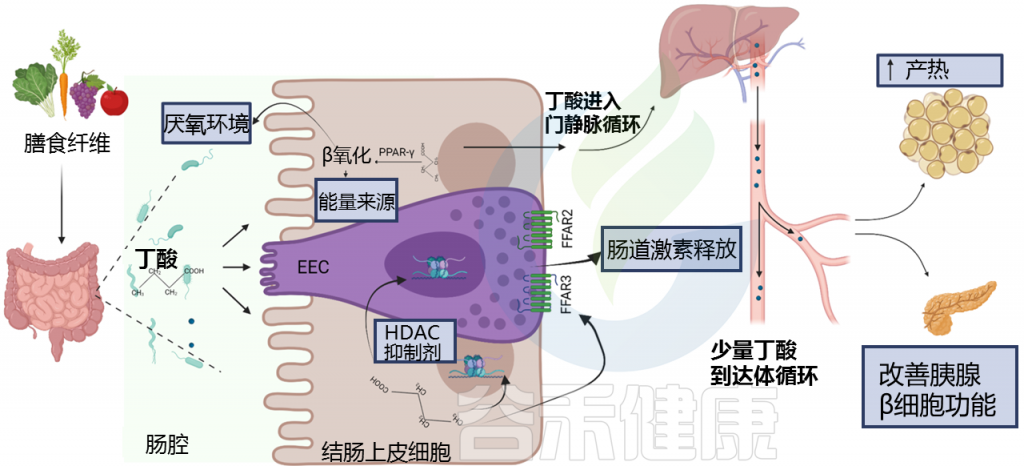

Arora T,et al., Front Endocrinol (Lausanne). 2021
膳食纤维经肠道菌群发酵产生短链脂肪酸,包括丁酸盐。丁酸盐介导的PPAR-γ的激活,诱导β-氧化和氧的消耗,从而促进厌氧条件的建立,这是几种厌氧肠道共生体生长和功能所需的条件。
丁酸在肠内分泌细胞(EEC)中与游离脂肪酸受体(FFAR) FFAR2和FFAR3结合,调节肠道激素释放,如胰高血糖素样肽 1 (GLP-1) 和肽 YY (PYY)。
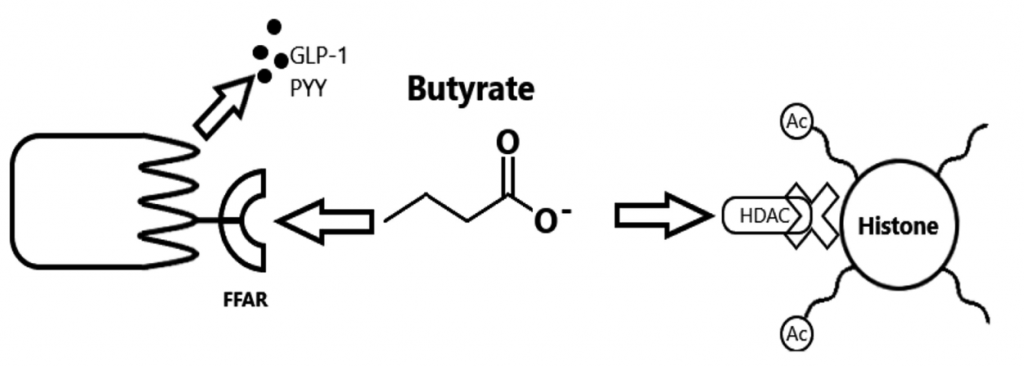

S.C. Bridgeman et al. Pharmacological Research,2020
GLP-1 增加胰岛素的产生并减少胰腺中胰高血糖素的产生。
PYY 会增加肌肉和脂肪组织对葡萄糖的吸收。
这些激素共同作用以保持血糖水平稳定。当血糖过高时,胰岛素会告诉身体的肌肉和脂肪细胞吸收多余的葡萄糖,所以说这些激素对肥胖和糖尿病很重要。丁酸盐增加这些肠道激素的释放,表明对控制血糖水平和防止体重增加有潜在的好处。
丁酸还可作为组蛋白去乙酰酶(HDAC)抑制剂,调节EEC和肠上皮细胞的基因表达。残余丁酸被结肠细胞吸收利用后,先排入门静脉循环,再排入外周体循环。在体循环中,丁酸可能调节棕色脂肪组织的产热和胰腺β细胞的功能。
增加丁酸水平的临床研究
一项随机临床研究中,对T2D患者补充混合膳食纤维可改善血糖参数,同时增加产生乙酸和丁酸的细菌丰度,并增加粪便中乙酸和丁酸水平。
在另一项研究中,将产丁酸菌(E.hallii,Clostridium beijerinckii,C.butyricum)与其他肠道细菌(A.muciniphila,婴儿双歧杆菌)和菊粉作为可发酵纤维混合,适度增加了T2D患者的丁酸水平,改善了口服葡萄糖耐量和糖化血红蛋白水平。
最后,添加菊粉和丁酸钠胶囊45天可改善T2D个体的空腹血糖和腰臀比。
这些研究清楚地表明,膳食纤维本身或与ngp或丁酸盐联合可以改善T2D的葡萄糖控制。
然而,维持患者依从性的策略和对这些补充剂的长期影响的调查仍然是值得的。此外,显然基线肠道菌群是饮食干预、益生菌注射和微生物移植成功的一个强有力的预测因素,基于微生物群对个体进行T2D分层可能有助于实现更好的代谢结果。
神经系统疾病
除了在肠道中的作用外,丁酸盐还具有支持大脑健康的巨大潜力。
由结肠中的细菌产生的丁酸盐具有一系列生物学功能。这些功能还与神经保护作用有关(有益于大脑和中枢神经系统)。
丁酸盐也是一种大脑助推器,因为它对大脑和中枢神经系统有保护作用。例如,它与许多与帕金森氏症、阿尔茨海默氏症甚至中风等疾病相关的通路有关。
丁酸盐对宿主生理和脑功能影响的示意图
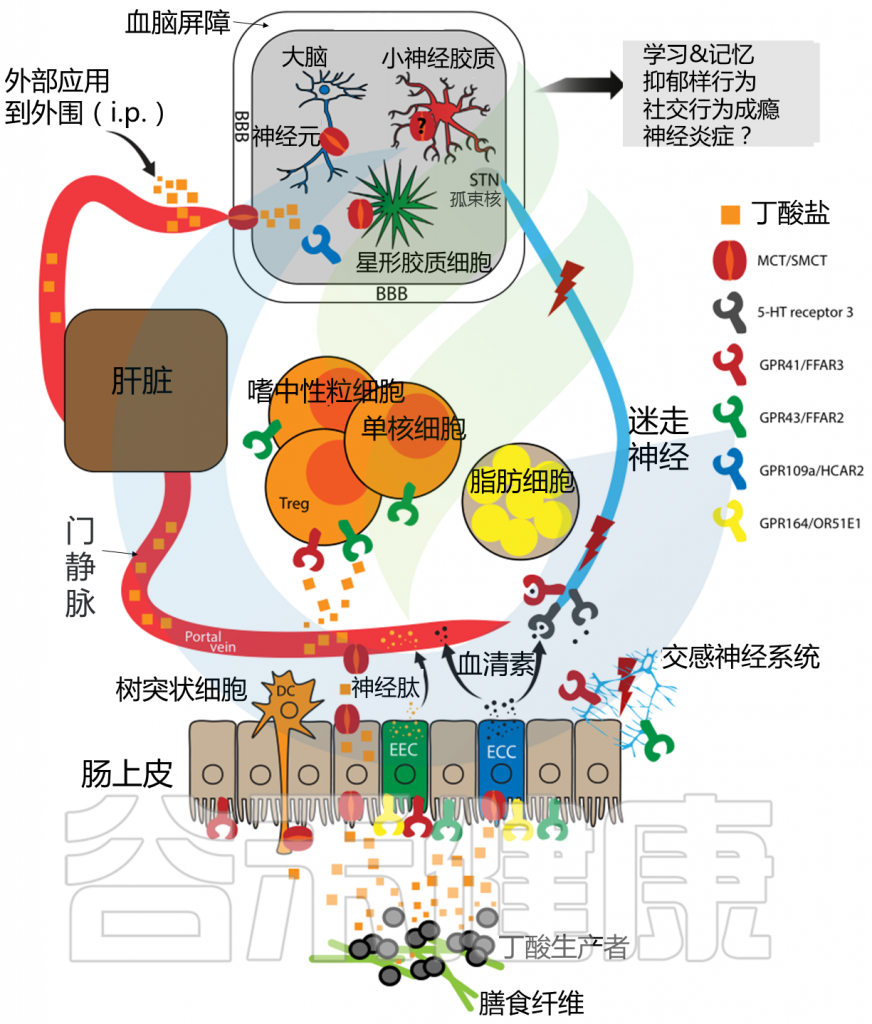

R.M. Stilling et al. / Neurochemistry International, 2016
由于抑郁症和其他神经精神疾病具有促炎症表型,反之亦然,丁酸盐在这些情况下也可能活跃。重要的是,丁酸盐的抗炎特性也对宿主(大脑)衰老具有根本意义,特别是考虑到许多组织(包括大脑)都会发生炎症衰老的慢性炎症状态。具体而言,丁酸盐通过减少NF-kB信号传导和诱导凋亡,从而促进神经保护,在脑内巨噬细胞(小胶质细胞)中显示出抗炎作用。
因此,丁酸盐会影响大脑健康,而饮食可能是改善疾病结果的一种简单方法。
压力、焦虑、抑郁等情绪都涉及肠道微生物群。
通过饮食提高丁酸盐的产量既简单又风险低。研究发现在加速老化的SAMP8小鼠模型中,长期喂养益生元纤维可改善认知能力下降,并具有抗炎、延缓衰老的作用。
未来有一天,它甚至可能成为脑部疾病的潜在治疗选择。


睡眠
新证据表明,肠道微生物群是促进睡眠信号的来源。细菌代谢产物和细菌细胞壁的成分可能在肠道共生菌群和大脑中的睡眠生成机制之间提供重要联系。
丁酸是一种短链脂肪酸,由肠道细菌通过不易消化的多糖发酵产生。研究人员验证了丁酸可能作为细菌源性促睡眠信号的假设。经口灌胃给予丁酸酯前药三丁酸甘油酯,在治疗后4小时内使小鼠非快速眼动睡眠(NREMS)增加近50%。
类似地,门脉内注射丁酸盐导致大鼠NREMS迅速而强劲地增加。在丁酸盐注射后6小时内,NREMS增加了70%。口服和门静脉注射丁酸盐都会导致体温显著下降。全身皮下或腹腔注射丁酸对睡眠或体温没有任何显著影响。
结果表明,丁酸盐的睡眠诱导作用是由位于肝脏和/或门静脉壁的感觉机制介导的。肝门丁酸盐敏感机制可能在肠道微生物群的睡眠调节中发挥作用。
扩展阅读:睡眠与肠道菌群
社交行为
微生物群可能会影响你的社交行为,虽然听起来可能有点夸张。
简而言之,丁酸盐很臭。
“butyrate”这个词实际上源自拉丁语butyrum,意思是黄油。你可能熟悉牛奶变质或变质黄油的气味,丁酸盐就是那个味儿。丁酸是哺乳动物最强烈的气味之一,人类可以通过嗅觉受体OR51E1检测到它的浓度约为亿分之240。


哺乳动物鼻子对丁酸酯气味敏感的一个合理原因是,丁酸酯是一种仅在厌氧条件下发生的细菌产物,如生物分解、腐败或发酵,也可能产生有害毒素。对丁酸盐高度敏感的另一种非互斥解释可能是其存在于体味中。
因此,它可以作为一种社会线索,携带有关微生物群组成和活动的信息,从而间接承载宿主免疫系统特征,类似于主要组织相容性复合体(MHC)中遗传变异性的公认社会信号功能。
存在于尿液和汗液中的MHC分子的肽配体被认为是携带遗传相关性和个体性信息的社会识别信号,并且可以被嗅觉上皮或犁鼻器官中的专门嗅觉受体神经元感知。
“气味相投”——可能是ta的气味在“撩”你
对包括人类在内的许多脊椎动物的研究表明,MHC基因座的变异影响社会行为,最显著的是配偶选择,但也影响社会群体的合作行为。也有人认为MHC依赖的嗅觉信号并不是携带个体和遗传变异信息的唯一线索,“嗅觉指纹”更为复杂。
化学通讯的发酵假说
一些科学家认为,它也是体味的一个组成部分。我们会使用丁酸盐等有气味的短链脂肪酸来(无意识地)相互交流。
事实上,这些微生物群是由产生挥发性脂肪酸、酯类、醇类和醛类的发酵厚壁菌门细菌主导的,这一事实促使作者提出了“化学通讯的发酵假说”,即共生细菌的变异驱动了物种、性别和个体特定气味的变化,从而促进了社会交流。
在雄性叉角羚(Antilocapra americana)的耳下气味中也发现了异戊酸和丁酸酯,用于标记其领地。此外,戊酸的潜意识气味已被证明能够引导社会偏好,例如降低人类受试者的面部受欢迎程度。
因此,丁酸盐和其他微生物发酵挥发性产物等短链脂肪酸似乎有可能不仅存在于专门的气味腺中,而且也存在于其他栖息地,如人类的腋窝,可能有助于化学交流,并传递有关微生物群组成的信息,从而也将遗传信息传递给感兴趣的接受者。
除食源性丁酸,动物体内丁酸主要是由盲肠和结肠的厌氧型细菌发酵产生,而由胃和小肠产生的丁酸含量极低。大肠产丁酸的菌种主要是梭菌属XIVa和IV族,以及真杆菌属和梭杆菌属。盲肠和结肠中丁酸的产生速度和数量主要取决于肠道微生物组成、日常膳食中可利用发酵成分组成等。
其中厚壁菌门的成员以其产生丁酸盐的能力而闻名。
在结肠中特别流行的产丁酸的细菌包括:
粪杆菌、直肠真杆菌E.rectale、Roseburia
双歧杆菌等常见益生菌配方中的微生物与丁酸盐生产者之间的交叉喂养相互作用已被证明是可以产丁酸盐的。
在消化道中发现的已知丁酸盐生产者中,大多数似乎属于毛螺菌科和瘤胃球菌科。
Faecalibacterium prausnitzii (FP) 是瘤胃球菌科的一部分,值得特别一提,因为它是消化道中最丰富的微生物之一,也是主要的丁酸盐生产者之一。FP 的特征包括通过丁酸盐产生和其他复杂途径的抗微生物活性和抗炎/免疫调节活性。
关于FP菌,详见:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
Anerostipes、Roseburia和 Coprococcus都是属于毛螺菌科,它们也是人类肠道中的主要丁酸盐生产者。
产生丁酸盐的细菌被认为在生命的第一年内定植于宿主,并且在成年时占总细菌群落的 20% 以上。
然而各种疾病状态都表明产生丁酸盐的肠道细菌相对缺乏。
有趣的是,现如今益生菌补充剂中常用的细菌菌株很多都不是丁酸盐生产者,因为丁酸盐生产者很多是高度厌氧的,这意味着它们在氧气存在的情况下会很快死亡,所以要补充产丁酸菌就比较具有挑战性。
或许我们可以转换个思路来考虑,既然不能直接补充菌,那是不是可以补充产菌的食物呢?
所以哪些食物可以喂养产丁酸菌?
饮食对人体微生物组有显著影响,通过饮食干预可显著改变细菌数量并增加微生物多样性。
富含纤维的饮食对丁酸盐的产生特别有益,因为它可以滋养产生丁酸盐的细菌。
网上还有很多关于如何增加肠道丁酸盐的建议,比如多吃黄油或服用丁酸盐补充剂。然而,补充丁酸盐不一定对肠道有益,因为如果摄入丁酸盐,它会被胃吸收,也就是说它不会到达肠道为其细胞提供燃料。
记住,丁酸盐是微生物群产生的代谢物。
益生元是直接滋养微生物群的食物,包括蔬菜、水果、豆类和全谷物。它们含有膳食纤维,可被肠道细菌发酵成丁酸盐等有机化合物。通过食物增强微生物群是促进消化系统健康和丁酸盐生成的有效且安全的方法。
肠道细菌以膳食纤维为食,而不是动物蛋白。因此,优化丁酸盐产量的最佳方法是通过高纤维饮食。
高蛋白、高脂肪、低碳水化合物的饮食已被证明会破坏微生物组中丁酸盐的产生。在一项研究中,研究人员分析了短期饮食限制碳水化合物摄入量的肥胖参与者的微生物组,从而限制了他们对植物性膳食纤维的消耗。
在低碳水化合物饮食(每天 24 克)和中等碳水化合物饮食(每天 164 克)4 周后,短链脂肪酸的浓度低于高碳水化合物饮食(每天 399 克)。具体来说,当碳水化合物摄入量减少时,丁酸盐浓度会降低。同一项研究还发现,厚壁菌门细菌种类 Roseburia 和 E. Rectale 的密度与丁酸盐浓度之间存在联系,两者都随着碳水化合物摄入量的减少而降低。
然而,以上所谓的“膳食纤维”并不能完全解决这个问题,为什么呢?
理解以下几点很重要:
1、即使是来自同一物种的细菌菌株,对不同底物的反应也非常不同,甚至是属于同一类碳水化合物的底物。
2、某些细菌能够消化果聚糖,有些则不能。而那些可以消化的里面又有不一样的情况,其中一些能够消化短链的果聚糖,但不能消化更长链菊糖的果聚糖。
3、以上只是细菌消化不同底物能力的一个例子。由于这种变化的存在,不能一概而论。
而我们最需要的,更应该是寻找特定类型的纤维。
一项研究表明,不同类型碳水化合物的SCFA产量(单位:kJ)如下所示:
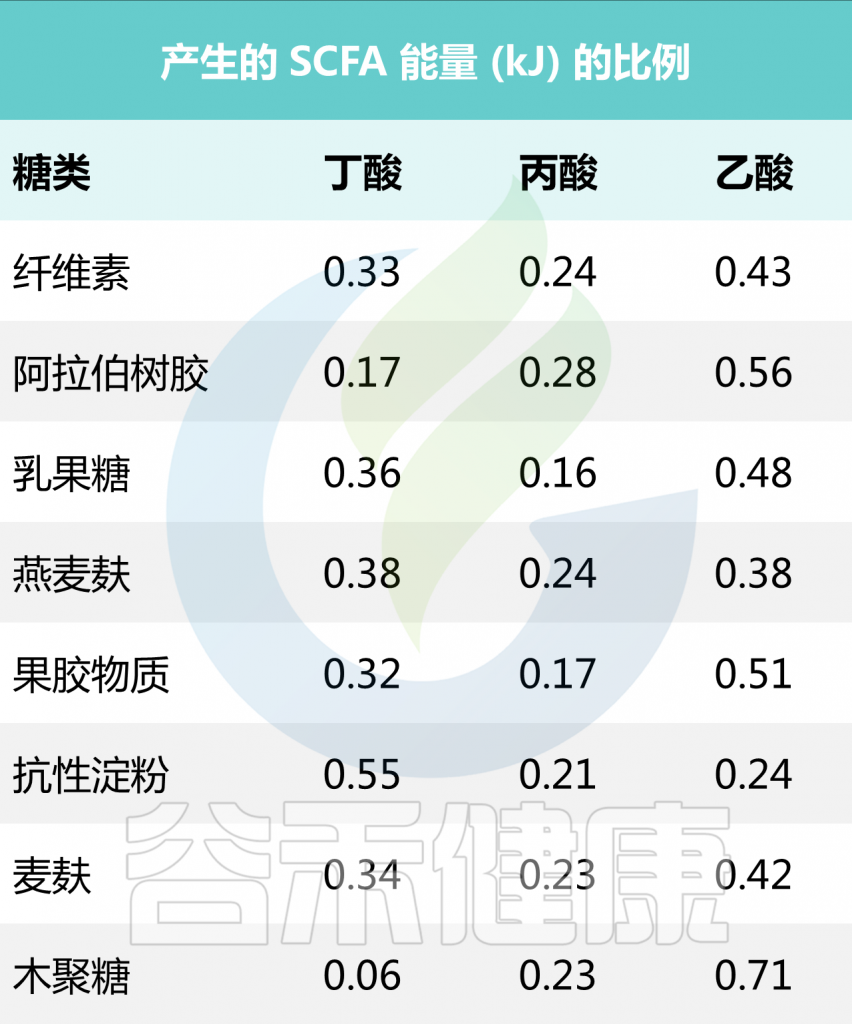

Bourassa MW, et al., Neurosci Lett. 2016
在该研究中,低聚果糖(FOS)的类型是洋葱、芦笋和香蕉等食物,而抗性淀粉(RS)则是全谷物和豆类。
另一项研究表明,补充特定猕猴桃中发现的低聚果糖可在4周内使F.prausnitzii菌增加100%。这是一项重大发现,因为目前有大量研究报告,F.prausnitzii 的相对缺乏与几种主要肠道疾病有关——最显著的是炎症性肠病、溃疡性结肠炎和克罗恩病。
抗性淀粉2型和3型,哪种更好?
这项研究表明,从生马铃薯和高直链淀粉玉米淀粉以及全谷物中发现的阿拉伯木聚糖中提取的2型抗性淀粉含量高的日粮中丁酸产量显著增加。
在174名健康年轻人的饮食中添加马铃薯抗性淀粉后,丁酸盐产量增加。玉米、菊苣和玉米中的抗性淀粉也进行了测试,但只有当食用土豆中的抗性淀粉时,粪便中的丁酸总量才会显著增加。
在该研究中,使用的是Bob’s Red Mill(品牌)未改性马铃薯淀粉。对于这种类型的抗性淀粉(RS2)是否对人类“有益”存在不同的观点,有多个来源表明RS3是一种更好的来源,因为RS2似乎可以喂养有害细菌,而RS3可以喂养有益细菌。
此外,鳄梨增加了能够产生短链脂肪酸的微生物数量,以及产生的总短链脂肪酸。
果聚糖(菊粉)
许多研究表明,菊粉可以增加短链脂肪酸的产量,包括丁酸盐。这可能解释了香蕉在溃疡性结肠炎和克罗恩病患者的饮食中如此有效的原因之一。然而,链长较短的果聚糖通常比链长的果聚糖(如菊粉)更容易喂养产丁酸菌。
补充菊粉虽然能够改变宿主的微生物群,但不会增加粪便丁酸水平。尽管这一结果似乎与谷物相反,但许多研究证明了补充菊粉在增加肠道短链脂肪酸生成方面的功效。


也就说,抗性淀粉和果聚糖(短链低聚果糖 和长链菊粉)在肠道中发酵时会产生丁酸盐。
对于抗性淀粉,似乎大多数研究都集中在 RS2 上。然而,在许多情况下,据报道 RS3 会产生更高水平的丁酸盐,对人类更健康。
抗性淀粉:
煮熟后冷却:土豆、红薯、米饭、意大利面、燕麦、豆类、豆类、全谷物。
原料:青香蕉、马铃薯、马铃薯淀粉、青香蕉粉。
果聚糖:
洋葱、菊苣、香蕉、朝鲜蓟、芦笋、大蒜、韭菜、西兰花、开心果和各种提取物。
由于人与人之间的常驻微生物存在显著差异,并且它们消化某些底物的能力不同,因此比较明智的选择是食用包含多种抗性淀粉和果聚糖的饮食。例如以马铃薯抗性淀粉、燕麦麸皮纤维或车前草种子或短链低聚半乳糖、长链低聚果糖和谷氨酰胺的混合物的形式短期补充,增加丁酸盐水平。
丁酸是不是越多越好?
丁酸并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。
胃肠道不同部位对丁酸的耐受阈值也存在一定差异,胃和小肠对丁酸的耐受阈值低,结肠和盲肠耐受阈值高。
添加普通丁酸钠制剂(主要在肠道前端被吸收利用),反而造成肠道炎症、菌群失调。
更有意思的是,轻微炎症或者轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,在严重溃疡肠道部位添加,不利于溃疡的恢复,甚至加剧整个溃疡。
有学者发现溃疡部位的粘膜组织对丁酸的代谢降低,甚至只有正常粘膜组织的一半,主要是由于其转运载体和氧化相关的酶活降低。
p.s. 进行干预之前需要了解现有肠道丁酸盐的水平状况,可以更好地进行干预治疗前后对比
Tips
如果你正在被一些肠道疾病困扰,需要注意其中几种食物的凝集素含量:土豆、燕麦、豆类、豆类和全谷物。如果你打算吃这些食物,建议先浸泡和加压烹饪,然后从很少量开始。也可以排除生食。
如果你患有自身免疫性疾病,不推荐豆类和大多数全谷物。
此外,许多患有肠道疾病和/或自身免疫性疾病的人难以食用果糖,这可能是果糖不耐受的迹象。症状包括胀气、腹胀等。
相关阅读:
肠道菌群健康检测报告——常见问题解析
主要参考文献:
Arora T, Tremaroli V. Therapeutic Potential of Butyrate for Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2021;12:761834. Published 2021 Oct 19. doi:10.3389/fendo.2021.761834
Siddiqui MT, Cresci GAM. The Immunomodulatory Functions of Butyrate. J Inflamm Res. 2021 Nov 18;14:6025-6041. doi: 10.2147/JIR.S300989. PMID: 34819742; PMCID: PMC8608412.
Bourassa MW, Alim I, Bultman SJ, Ratan RR. Butyrate, neuroepigenetics and the gut microbiome: Can a high fiber diet improve brain health?. Neurosci Lett. 2016;625:56-63. doi:10.1016/j.neulet.2016.02.009
Hu Liu, Ji Wang, Ting He, Sage Becker, Guolong Zhang, Defa Li, Xi Ma, Butyrate: A Double-Edged Sword for Health?, Advances in Nutrition, Volume 9, Issue 1, January 2018
Bridgeman SC, Northrop W, Melton PE, Ellison GC, Newsholme P, Mamotte CDS. Butyrate generated by gut microbiota and its therapeutic role in metabolic syndrome. Pharmacol Res. 2020 Oct;160:105174. doi: 10.1016/j.phrs.2020.105174. Epub 2020 Aug 27. PMID: 32860943.
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in microbiology, 7, 979.
LeBlanc JG, Chain F, Martín R, Bermúdez-Humarán LG, Courau S, Langella P. Beneficial effects on host energy metabolism of short-chain fatty acids and vitamins produced by commensal and probiotic bacteria. Microb Cell Fact. 2017 May 8;16(1):79. doi: 10.1186/s12934-017-0691-z. PMID: 28482838; PMCID: PMC5423028.
Stilling RM, van de Wouw M, Clarke G, Stanton C, Dinan TG, Cryan JF. The neuropharmacology of butyrate: The bread and butter of the microbiota-gut-brain axis? Neurochem Int. 2016 Oct;99:110-132. doi: 10.1016/j.neuint.2016.06.011. Epub 2016 Jun 23. PMID: 27346602.
Szentirmai É, Millican NS, Massie AR, Kapás L. Butyrate, a metabolite of intestinal bacteria, enhances sleep. Sci Rep. 2019 May 7;9(1):7035. doi: 10.1038/s41598-019-43502-1. PMID: 31065013; PMCID: PMC6504874.

谷禾健康
便秘的全球患病率为14%。慢性便秘会影响生活质量。健康人相比,便秘还会导致粪便重量降低,且与结直肠癌风险增加相关。
饮食调整是治疗便秘的主要方法之一。世界胃肠病学协会建议通过饮食建议或补充来增加纤维摄入量。在英国,健康专家指南建议食用水果,包括富含山梨醇的水果,例如杏子、桃子和李子,以及相应的果汁。然而,关于水果对肠道运动和便秘的作用机制的证据有限。
本文旨在探讨水果和水果制品对肠道微生物群、肠道运动和便秘的作用机制和有效性。
关于水果中的成分,离不开以下几大成分。
▌ 膳食纤维
水果是膳食纤维的极好来源。
纤维是什么?
纤维是指三个或三个以上单体单元的聚合物碳水化合物加上木质素在小肠中不被消化或吸收的总和。纤维不是一个分子,而是一系列在溶解度、粘度和发酵性方面不同的分子。
纤维会增加粪便体积和生物量
不可发酵纤维完好无损地到达下消化道,而粘性纤维具有较高的水结合能力,因此,这两种纤维都能有效地增加粪便体积。
粪便体积的增加进一步导致管腔扩张并触发蠕动。可发酵纤维增加肠道微生物群的丰度,从而增加粪便生物量,并增加短链脂肪酸的产生。
纤维使粪便变软
这导致结肠渗透负荷增加,从而增加粪便的含水量,从而导致粪便变软。研究发现,各种高纤维食物可以缩短整个肠道的转运时间。
▌ 山梨糖醇
山梨醇是一种在植物中发现的糖醇。山梨醇在小肠内不被消化或吸收,并且能够在其分子中保持水分,从而导致肠腔中水分的增加,从而软化粪便,从而缓解排便。
在一项随机对照试验(RCT)中,与安慰剂相比,每天40克山梨醇持续6天会导致粪便水和粪便重量显著增加。此外,未被吸收的山梨醇到达结肠,在结肠中被肠道微生物群发酵,增加短链脂肪酸的产生,并可能改变微生物群。
虽然这一假设尚未在人类身上得到验证,但与低聚果糖和对照组相比,大鼠体内的山梨醇增加了粪便、结肠和盲肠乳酸杆菌AD102和粪便罗氏乳酸杆菌,并且结肠和盲肠样本中的丁酸含量高于对照组。
▌ (多)酚类
多酚是植物性食品和饮料中的一大类化合物,包括水果、蔬菜、谷物、茶、咖啡和葡萄酒。它们的结构由一个或多个与芳香烃基团结合的羟基组成。
只有一小部分低分子量(聚)酚在小肠中被吸收,而那些高分子量的酚到达结肠时不受影响,在结肠中它们可被肠道微生物群发酵,从而将较大的(聚)酚分解成较小的可吸收分子,可能对多种健康有益。
此外,现有证据表明,(多)酚有可能通过增加有益细菌(如双歧杆菌和乳酸杆菌)来积极改变肠道微生物群,或者通过抑制潜在致病菌的生长。虽然有人假设,由于其抗炎能力(多聚)酚类可能有助于治疗炎症性肠病或肠易激综合征,但目前没有足够的数据显示其对便秘的直接影响。
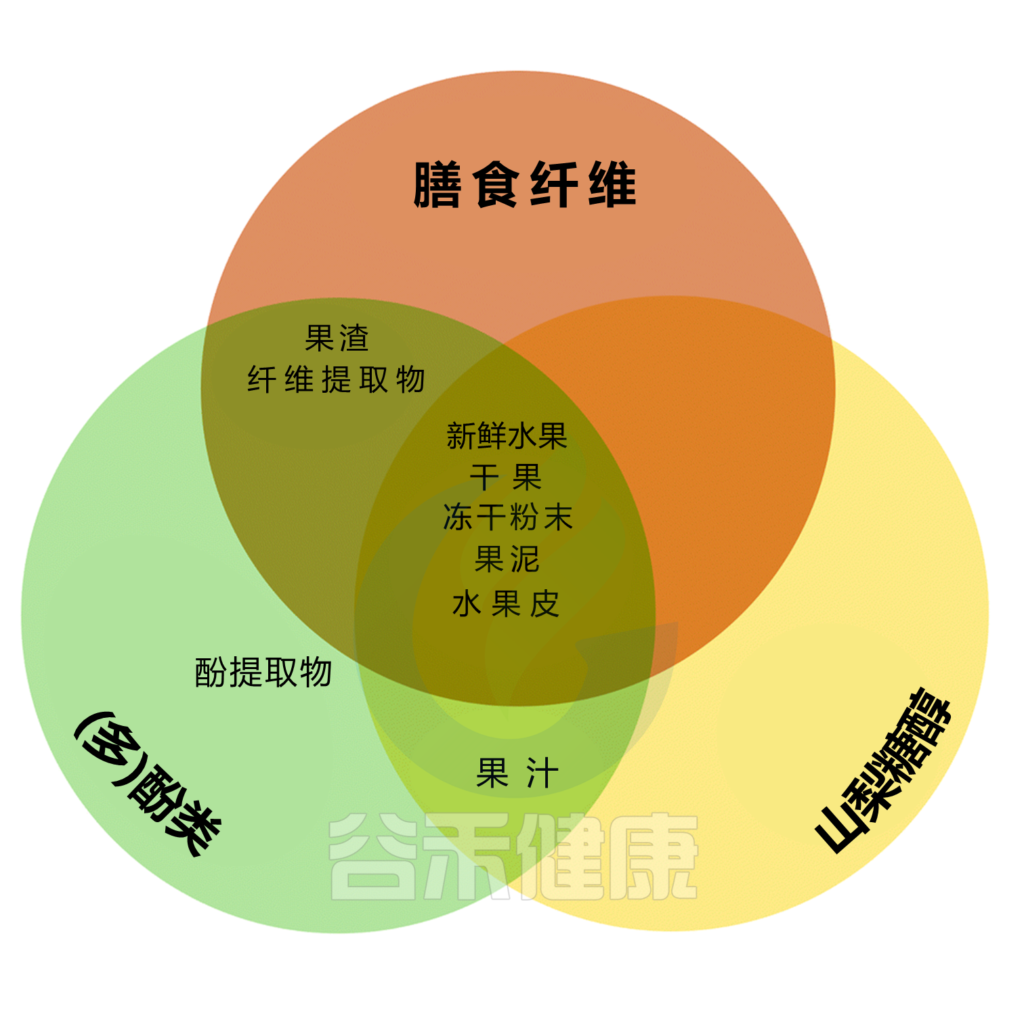
纤维、山梨醇和(多)酚是介导水果对肠道微生物群、肠道运动和肠道功能影响的主要成分,因此可能影响便秘。
不同的水果含有不同数量的纤维、山梨醇和(多)酚类物质,而水果的加工过程可能对这些物质产生重大影响。例如,新鲜或干果、果肉或全果冰沙(用新鲜、纯水果制成的饮料)可能含有大量的纤维、山梨醇和(多)酚,而浓缩果汁或浓缩果汁可能含有山梨醇和(多)酚,但纤维很少。