 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
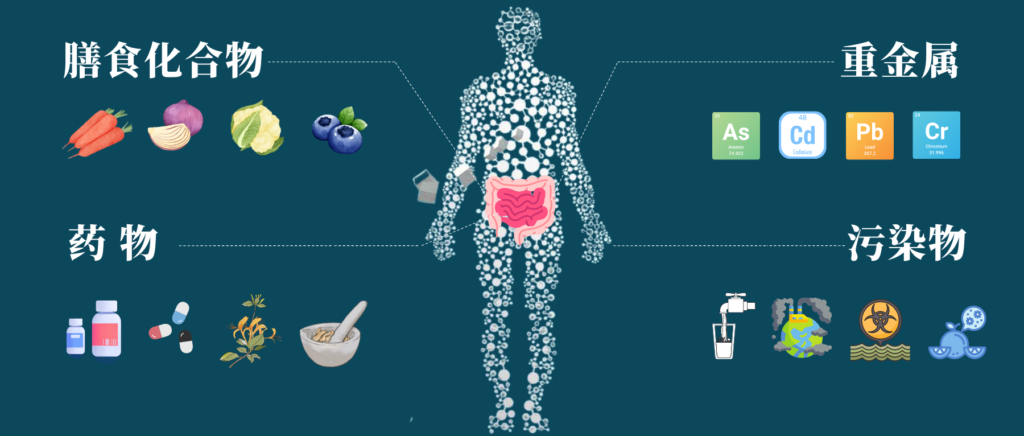
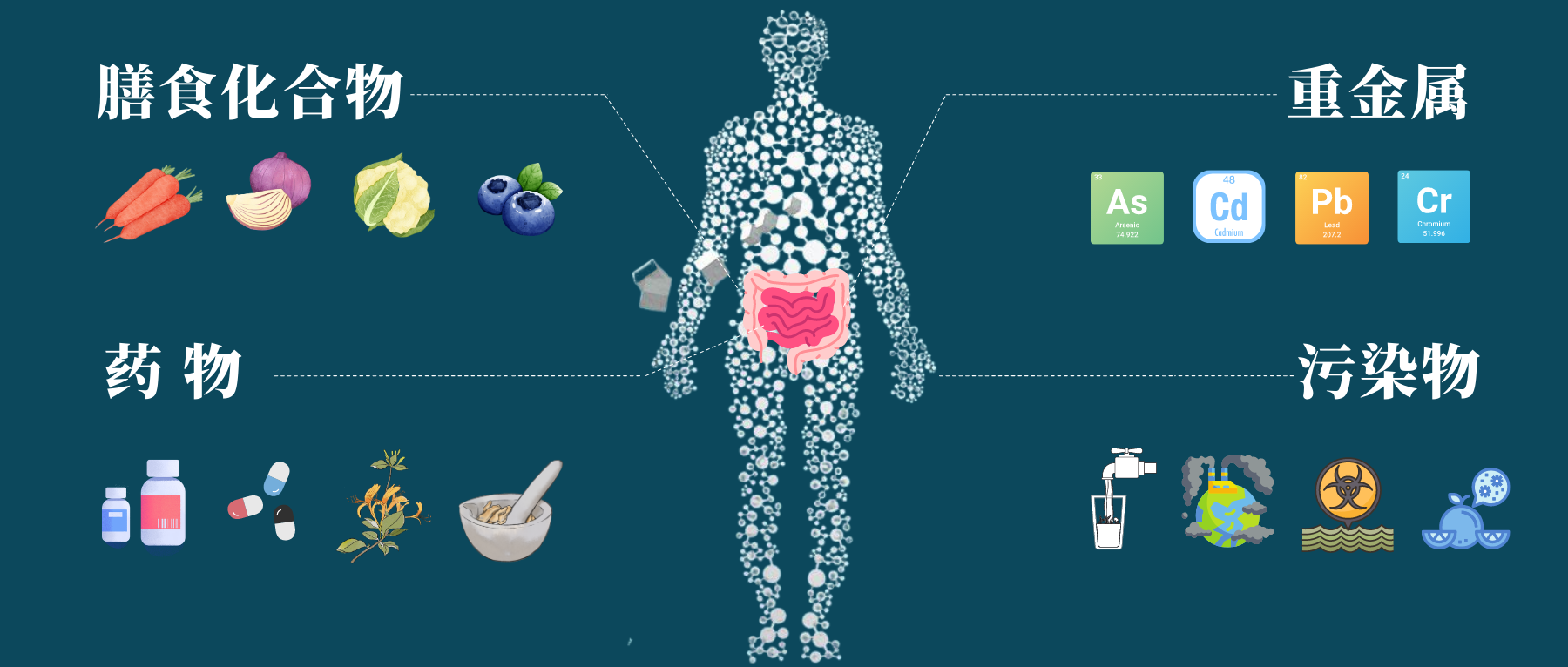
肠道菌群和人体健康息息相关,我们经常讲饮食、生活方式等都可以影响肠道菌群的组成,除了这些耳熟能详的因素之外,其他异源物如环境中的污染物,重金属,药物等都会影响肠道菌群,反过来,细菌也可以通过生物积累或化学修饰影响这些化合物。
通过皮肤接触、吸入或摄入等方式,我们每天都在和异生素接触,可能通过补充剂或药物自愿摄入异源物,或者通过受污染的食物和水被动摄入异源物。
肠道微生物群可以在吸收之前或之后与摄入的化合物相互作用。
了解肠道微生物群如何处理膳食成分的分子机制,是用“功能性食品”、益生菌和益生元治疗不同疾病的理论基础,有利于根据患者的代谢状况和肠道微生物群进行个性化营养定制。
与饮食类似,对肠道微生物群改变重金属、污染物、药物毒性进行研究,可以从肠道菌群代谢角度打开视野,进一步探讨从体内去除有害化合物并预防疾病的方法。
本文主要介绍了肠道微生物群对基本营养物质、重金属、污染物、药物、中草药等产生的代谢作用,并提供了基于肠道菌群的改善方式,以减轻这些有毒元素造成的损害。
什么是异源物?
异源物(xenobiotics),也就是说外源物质,来自希腊语,是指使人体从外界(包括肠道中的细菌作用产物)摄入体内的化学物质,例如药物、毒物、食品添加剂、环境污染物等。
人类肠道微生物群是一个多样而复杂的微生物群落,与宿主一起进化。肠道微生物群是宿主代谢过程的组成部分。
有时候会把肠道微生物群比作“器官”,可以干扰调节代谢的宿主基因。
人体肠道微生物群和异源物之间的大多数相互作用发生在胃肠道粘膜上。由于消化道的范围不同,不同的区域为微生物和代谢过程提供了不同的栖息地。
当我们说异源物的微生物代谢时,应该在宿主代谢过程的背景下进行。后者往往是同时发生的和相互竞争的。
▼ 异源物是怎么进入人体代谢的?
异源物经口服、吸收后在肠上皮细胞之间或通过肠上皮细胞传递,可被宿主酶处理或不被宿主酶处理。之后,它们可以通过门静脉输送到肝脏。
在肝脏中,异源物受到许多代谢酶的影响。因此,外源性代谢产物进入全身循环,从而使其分布到组织中并影响其他器官。
代谢产物可以与消化道的上皮细胞局部相互作用。当外源性药物通过静脉注射时,它们跳过了“第一道”代谢,立即进入全身循环。
而循环的外源性代谢产物进一步代谢并通过胆汁排泄排出,然后通过肠肝循环在小肠中重新吸收,或通过肾脏排出到尿液中。
▼ 异源物怎么和肠道菌群相遇?
可以通过多种途径与肠道微生物相遇。
小肠外源物中未被吸收或吸收不良的物质,继续进入大肠,被肠道微生物转化。
容易吸收或静脉注射的外源性物质最终可以通过胆汁排泄,到达肠道细菌。
▼ 肠道菌群影响异源物的生物转化
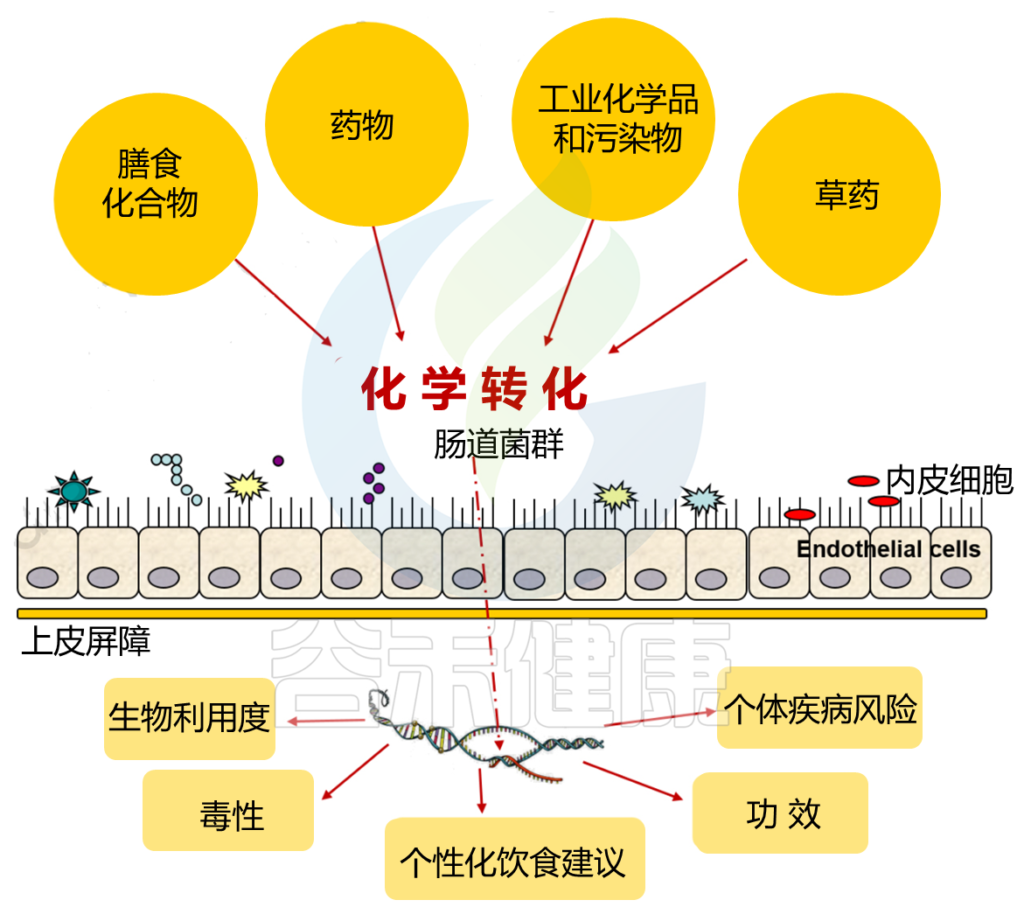
除了上面说的代谢过程外,肠道微生物群还可以影响异源物的生物转化,从而影响其功能和毒性。
同样,异源物可以诱导基因表达在人类肠道微生物群的直接参与异源物的代谢。结果表明,即使在短期暴露于异源物期间,这种表达也会上调。
异源物和微生物群之间的复杂相互作用
DOI: 10.2174/1389200221666200303113830
肠道微生物群对几种外源性物质的生物转化已通过体外和体内模型进行了广泛研究。然而,由于许多其他因素,例如在到达肠道细菌更普遍的肠道下部之前的有效吸收,或肝脏中的异源代谢,防止肠道微生物群遇到特定代谢产物,人类的异源物生物转化可能会发生很大变化。
同样,暴露于异源物质时,肠道菌群的结构和功能会发生特定变化。
摄入的外源物质的这些直接代谢导致了几种情况:
人类微生物群和异源物质相互作用是一个复杂的代谢网络,影响着双方。
饮食是人类健康的基石,目前已有许多研究将饮食模式与健康结果联系起来,这其中离不开肠道菌群的深度参与。在我们之前的多篇文章中也有相关阐述,这里我们简要回顾一下膳食化合物的代谢,重点关注重金属,污染物,药物代谢等异源物,逐一了解肠道菌群对异源物代谢过程,及其与健康之间的关联。
肠道菌群可以从多种膳食化合物中提取营养和能量,该过程的程度和类型在个体之间差异很大,主要是因为肠道微生物酶的存在和丰度不同,这里主要关注膳食蛋白质、脂类和多酚的转化。
膳食蛋白质可以用来做什么?
它可以体液平衡、细胞修复、血液凝固、激素、产生酶等。它也是肠道菌群的食物,主要作为氨基酸来源,可用于蛋白质合成和代谢能量的产生。
而肠道微生物群参与蛋白质代谢,它们在营养利用和宿主反应之间的相互作用中起着关键作用。
关于肠道微生物群参与蛋白质代谢详见:
小肠中的蛋白酶和许多肽酶对于将膳食蛋白质消化为氨基酸和寡肽是重要的。
肠道微生物群具有利用氨基酸的专门酶。
肠上皮细胞参与氨基酸分解代谢,并通过调节肠道屏障功能在先天免疫和适应性免疫中发挥重要作用。
肠道微生物生活在肠腔中,与粘蛋白密切相互作用,其任何变化都可能改变粘蛋白分泌。据推测,肠道微生物群利用必需和非必需的管腔氨基酸。
➤ 肠道菌群的组成及位置影响氨基酸代谢
肠道菌群的组成及其在肠道中的位置,对于确定膳食蛋白质的生产速率和氨基酸的代谢命运至关重要。
约氏乳杆菌(Lactobacillus johnsonii)
约氏乳杆菌是小肠中的常见居民,这种菌缺乏编码参与氨基酸生产的生物合成途径的基因。
约氏乳杆菌不利用氨,也不参与硫同化的代谢途径。但约氏乳杆菌产生一种胞外蛋白酶、3种寡肽转运蛋白、超过25种胞浆肽酶和20种氨基酸渗透酶型转运蛋白。这些有助于约氏乳杆菌吸收外源氨基酸或肽用于蛋白质合成。
➤不同菌群蛋白水解活性可能直接导致人类疾病
这里拿乳糜泻来举例,肠道微生物群与乳糜泻有关。乳糜泻是一种常见的自身免疫性疾病,其特征是对小麦基食物中的膳食面筋产生炎症反应。
这种富含脯氨酸的蛋白质避免了宿主蛋白酶的完全消化,从而产生了高分子量的免疫原性肽。肠道微生物群可能通过改变面筋蛋白水解来影响乳糜泻。
乳糜泻患者的肠道菌群是如何引发疾病的?
健康人和乳糜泻患者的粪便悬浮液,对面筋蛋白和免疫原性肽的处理方式不同。
一般健康人通过乳酸杆菌产生肽,而乳糜泻患者不一样,乳糜泻患者会多一些铜绿假单胞菌,这种铜绿假单胞菌产生的面筋衍生肽,更加易于穿过小鼠肠道易位,并引发增强的面筋特异性免疫应答。
所以说,鉴定负责肠道微生物面筋加工的特定蛋白酶,不仅可以更好地理解乳糜泻,还可以为该疾病的治疗干预提供信息,包括酶或益生菌治疗。
肠道微生物还可以将从膳食蛋白质中获得的氨基酸(包括l-苯丙氨酸、l-酪氨酸和l-色氨酸)代谢为一系列生物活性产物。例如,肠道细菌可以将l-色氨酸代谢为多种产物,包括抗氧化剂吲哚-3-丙酸、神经递质色胺和吲哚,后者可以通过肝脏酶进行羟基化和硫酸化,生成尿毒症毒素硫酸吲哚。
关于色氨酸代谢详见:
肠道微生物对脂质吸收很重要。
➤ 胆固醇的吸收
饮食胆固醇是西方饮食中与心血管疾病风险增加相关的主要成分。吃进去的胆固醇,被小肠吸收,随后经历胆汁排泄和肠肝循环。
➤ 肠道微生物群对胆固醇的影响
粪甾醇不能被重新吸收并被排出体外。通过肠道微生物的减少,胆固醇产生了不可吸收和排泄的粪甾醇。因此,这种转变有效地去除了循环中的胆固醇。
人类粪便中高达50%的类固醇是粪甾醇。高胆固醇降低患者和低胆固醇降低患者体内微生物群,分别定植的无菌小鼠,产生不同数量的粪甾醇。
还有研究表明,降低胆固醇的细菌可能会降低血清胆固醇。
➤ 降低胆固醇的细菌
对降低胆固醇的肠道细菌——产粪甾醇真细菌的研究表明,粪甾醇合成可能涉及氧化为5-胆甾-3-酮,然后烯烃异构化为4-胆甾-3-烯酮,共轭还原和酮还原。
确定负责这些修饰的酶并确定其在患者体内的丰度可能是关键,因为抑制胆固醇重吸收是降低胆固醇水平的有效方法。
关于脂质代谢,详见:
多酚是天然植物化合物,是人类饮食中最丰富的抗氧化剂,可以预防慢性退行性疾病。
多酚包括植物源性食物中存在的一类次级代谢产物,当它们作为纯化合物或富含多酚的提取物被纳入饮食中时,可以通过调节肠道微生物群的组成产生健康影响。当每天摄入高达2g时,多酚是重要的膳食生物活性成分。
它们的微生物调节是预期的,它们的化学结构,包括许多酚基团,表明了潜在的抗菌作用。
即使是不可吸收的聚合物化合物也会被肠道微生物群转化为可吸收的生物活性代谢物。
膳食多酚的生物利用度主要取决于肠道微生物群的组成:
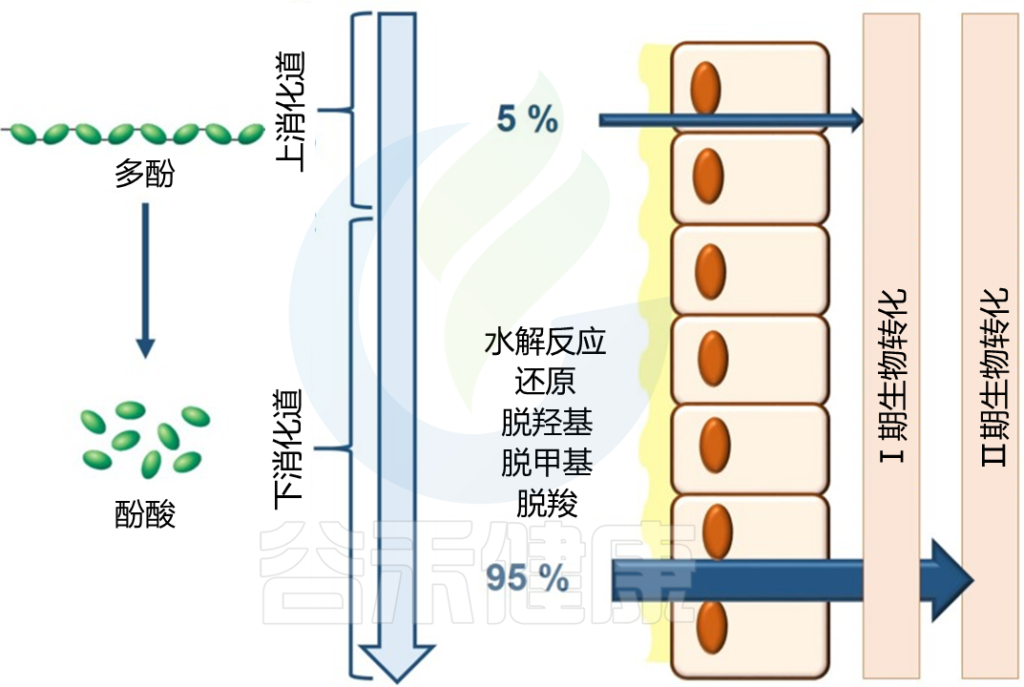
Westfall S, et al., Front Neurosci. 2019
肠道微生物群进行的三个主要分解代谢过程是水解、裂解和还原反应。在这些分解代谢反应之后,释放的苷元可能进行 II 期代谢并被肠道微生物群转化为简单的酚类衍生物,从而促进身体吸收。
关于肠道菌群代谢多酚详见:
近年来,人们越来越关注环境污染物对健康带来的影响。虽然说大多数污染物不直接针对肠道微生物群,但其中一些污染物可以通过不同途径进入人体,并与肠道微生物相互作用。
肠道菌群 ⇔ 污染物
肠道菌群活动可以改变这些化学品的毒性和生物利用度,并延长宿主接触有害化合物的时间。
暴露于环境污染物会改变肠道菌群的组成,导致能量代谢、免疫系统功能、营养吸收和/或产生其他毒性症状。
在评估这些物质的安全性时,必须考虑肠道微生物代谢的后果。这里讨论了几种与人类疾病风险有关的化学物质——重金属、持久性有机污染物和杀虫剂,有证据表明微生物代谢会影响其毒性。
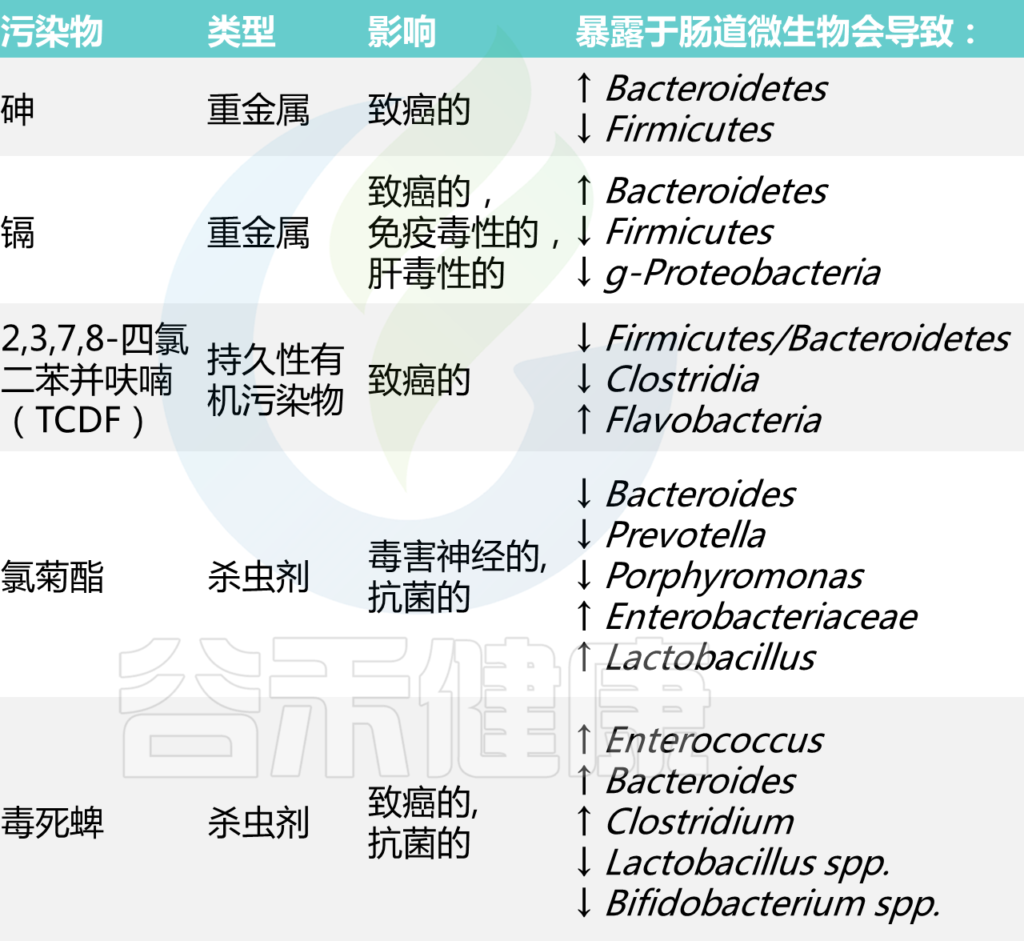
DOI: 10.2174/1389200221666200303113830
环境中的重金属与许多有害影响有关,包括致癌、氧化应激和对免疫系统的影响。几项研究表明,接触重金属也可能导致肠道微生物群失调。我们将以砷、镉、铅为例,展示重金属如何与肠道微生物相互作用,又会带来哪些健康后果。
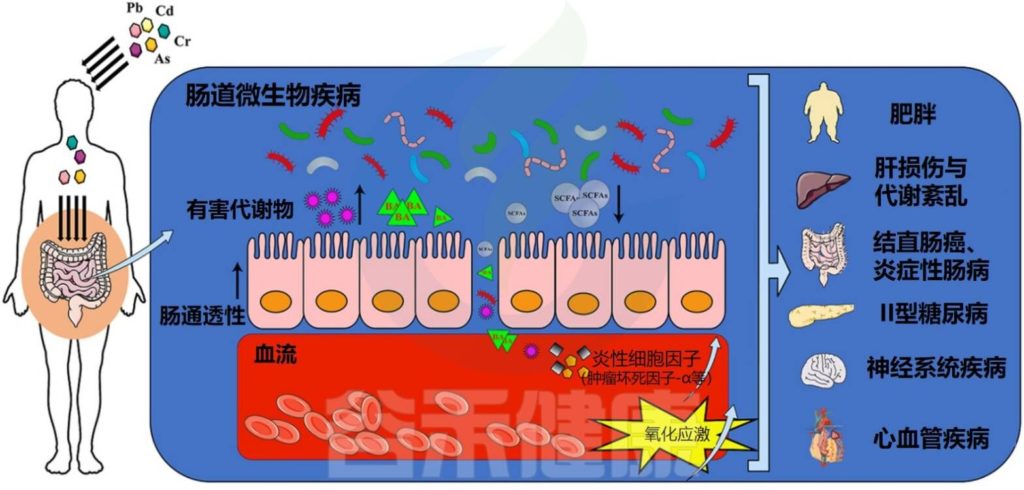
Liu X, et al.,Environ Pollut. 2023
砷(As)
砷(As)是最常见的有毒环境化合物之一。它具有已知的致癌作用。砷能够以砷酸盐[As(V)]的形式附着于固体表面。As(V)摄入并暴露于肠道微生物群后,会诱导硫化和甲基化。
研究发现,小鼠仅4周暴露于10mg/L的砷,就会显著干扰肠道微生物群的组成和代谢组学特征,拟杆菌门的丰度显著增加,而厚壁菌门的丰度则显著减少。这些变化与含吲哚的代谢产物、脂质代谢产物、异黄酮代谢产物和胆汁酸代谢产物有关。
➤砷暴露通过影响菌群及其代谢产物,损伤肝脏,从而影响健康
砷暴露会导致肠道微生物死亡,从而进一步损害肠道中的砷代谢。一旦砷不能代谢出体外,宿主的健康就会受到影响。砷暴露导致的肝脏损伤可能是由于肠道微生物代谢产物(如LPS)的变化所致。这种代谢产物是肝脏损伤的重要指标,并间接激活肠-肝轴。这表明肝脏是砷毒性的主要靶器官之一。
➤砷暴露影响脂质代谢,碳水化合物代谢
砷暴露极大地影响血清和肝脏的脂质稳态,主要影响脂质代谢,脂质代谢失衡与神经系统疾病有关,例如帕金森氏症、阿尔茨海默氏症和肌萎缩侧索硬化症;而肠道菌群在宿主脂质代谢中起着极其重要的作用,因为细菌产生的短链脂肪酸是宿主脂质合成、脂肪酸氧化和脂肪分解稳态的主要调节剂。
扩展阅读:
砷暴露还显着影响碳水化合物代谢途径。在砷暴露小鼠的肠道基因组中,参与淀粉利用系统的基因丰度显著增加。
➤食源性砷暴露不同于水源性砷暴露,会延长砷在胃肠道中的滞留时间
研究发现,小鼠粪便样本中接触30天砷,厚壁菌门和拟杆菌门的比例没有变化,该比率在暴露后 60 天显着降低,并且糖酵解、糖异生和肌醇磷酸代谢等碳水化合物代谢相关基因显著下调。
食源性砷暴露的影响是持久的。砷会导致参与丙酮酸代谢的几种酶水平下降,乙酸激酶和3-羟基丁基辅酶a脱氢酶水平下降,从而导致能量代谢异常。淀粉利用系统中susB、susC、susD和susR基因的增加,虽然缓解了这一情况,但碳水化合物代谢最终受到影响。
镉(Cd)
镉(Cd)用于电池、塑料、金属镀层和颜料的生产。镉以其致癌性、免疫毒性和肝毒性而闻名,它还诱导氧化应激。
研究人员发现雄性小鼠暴露于低剂量的镉(饮用水中为10mg/L)10周后,厚壁菌门和g-变形菌门的丰度降低,盲肠和粪便中拟杆菌门的丰度增加。肠道微生物组组成的这些变化与雄性小鼠血清中脂多糖(LPS)水平升高、肝脏炎症和能量代谢失调有关。
➤镉暴露影响脂肪代谢,引起“肠漏”,减少短链脂肪酸,引发炎症
镉暴露会引起代谢功能的显着变化,影响脂肪代谢并最终导致脂肪堆积。
镉暴露引起的肠道菌群失调会增加 FITC-葡聚糖,FITC-葡聚糖是肠道通透性的重要生物标志物,肠道通透性的增加会改变炎症和新陈代谢。
镉暴露会导致产短链脂肪酸菌数量急剧减少,并降低丁酸和丙酸的含量,短链脂肪酸减少会导致能量代谢受损,也会诱发炎症反应。
铅(Pb)
铅暴露没有明确的阈值。研究发现,血液中任何浓度的铅都会对成人和儿童产生毒性作用。铅中毒可直接影响中枢神经系统、肾脏和血压。
铅通过消化系统在体内蓄积,并对肠道微生物的组成产生显着影响,除了改变肠道多样性、菌群的组成之外,在一定程度上也改变代谢功能。铅对菌群影响主要是,厚壁菌门丰度减少,拟杆菌门丰度增加:
扩展阅读:
铅暴露还会导致某些代谢物和代谢途径发生变化。主要涉及胆汁酸、维生素、氮代谢、氧化应激、防御机制和能量代谢。而且,宿主释放有害代谢产物等变化可能会加剧铅造成的损害。
氮代谢的主要变化是UreE的激活;亚硝酸盐加速向一氧化氮生成,一氧化氮过量可能导致氧化应激、神经毒性、免疫抑制等问题。
注:UreE是一种激活尿素酶的共蛋白,导致尿素酶升高,最终导致肠道细菌中尿素的减少。
重金属暴露后肠道菌群紊乱引起的主要代谢变化
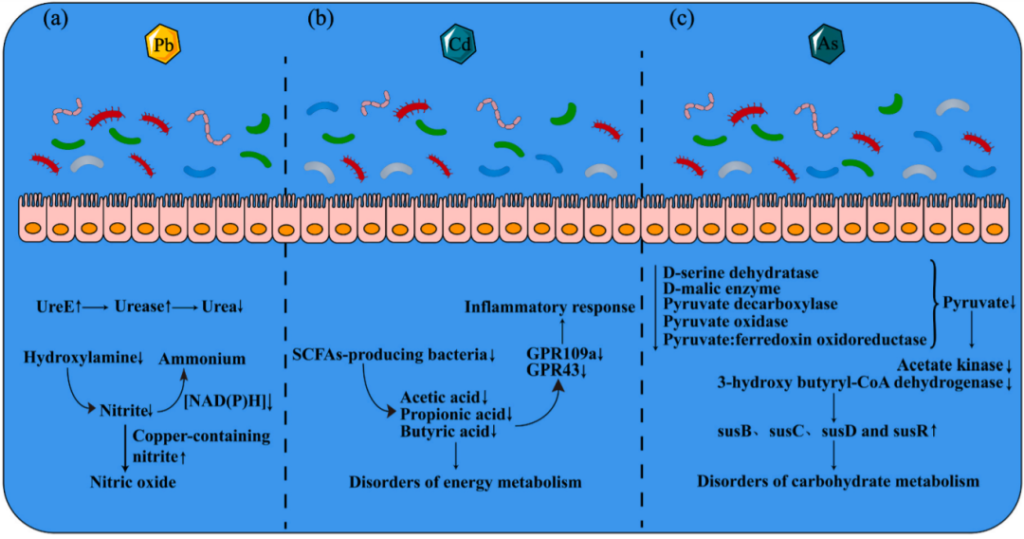
Liu X, et al.,Environ Pollut. 2023
肠道微生物群的研究为评估重金属毒性机制提供了一种新的途径。
持久性有机污染物(POP),包括有机氯农药、多氯联苯(PCB)、多溴二苯醚和多环芳烃(PAHs),是一种持久性和高毒性的合成化合物,可在生物组织中积累,可能与肥胖、糖尿病、自身免疫性疾病和某些发育障碍发病率上升相关。
扩展阅读:
通常,持久性有机污染物在摄入食物或水后会暴露于肠道微生物群,因此需要了解它们对肠道微生物的影响。
多氯联苯(PCB)
多氯联苯具有优异的介电财产和化学稳定性,因此用于制造冷却液、变压器、液压油和润滑剂。多氯联苯被认为是致癌物,可在小鼠暴露2天内显著改变肠道微生物群组成。肠中的产气荚膜梭菌Clostridium perfringens 和贝氏梭菌Clostridium beijerinckii可以降解多氯联苯,通过去除氯原子并打开苯环。
暴露于2,3,7,8-四氯二苯并呋喃(TCDF)(一种PCB)至少5天,可降低厚壁菌门/拟杆菌门的比例,降低梭状芽胞杆菌的水平,并增加盲肠内容物中的黄杆菌Flavobacteria水平。上述肠道微生物群的改变与胆汁酸代谢的变化有关。此外,TCDF还可以抑制法尼素X受体(FXR)信号通路,从而引发细菌发酵导致的宿主的严重炎症和代谢紊乱。
扩展阅读:环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
杀虫剂
在食品材料、水和土壤中检测到多种农药残留,这使得农药成为一个严重的环境问题。一些杀虫剂具有抗菌活性,因此能够改变肠道微生物组的组成。
氯氰菊酯(PEM)
氯氰菊酯(PEM)低剂量用于大鼠,结果降低了拟杆菌、普雷沃氏菌和卟啉单胞菌的丰度,增加了肠杆菌科和乳杆菌的丰度。这些菌群变化可能促进氯氰菊酯的神经毒性。
毒死蜱(CPF)
毒死蜱(CPF)是一种有机磷杀虫剂,通常用于水果、蔬菜和葡萄园。毒死蜱可以通过肝脏或肠道中的细胞色素P450酶代谢。毒死蜱增加了肠球菌、拟杆菌和梭菌的水平,但降低了大鼠肠道中乳酸杆菌和双歧杆菌的水平。
毒死蜱诱导的肠道失调导致粘膜屏障受损,细菌易位增加,并激活先天免疫系统。
以上是重金属等异源物对肠道菌群带来的影响,肠道菌群的变化也会给宿主健康造成影响。基于肠道菌群的层面进行干预,在一定程度上,可以帮助人体免受有害异源物积累带来的健康困扰,这些干预措施包括益生菌,饮食,运动等。
益生菌对重金属的作用
两种重金属解毒策略如下:
✔ 益生菌对重金属诱导的肠道细菌失调的保护
➦ 传统益生菌:
研究表明,鼠李糖乳杆菌(Lactobacillus rhamnosus sp.shermanii JS)和丙酸杆菌(Propionibacterium freudenreichii)能够在体内和体外成功解毒重金属。
有研究发现,含有鼠李糖乳杆菌GR-1 的益生菌降低了孕妇血液中砷和汞的含量。
以下菌株通过肠道重金属隔离和刺激肠道蠕动促进重金属的粪便排泄,从而减少重金属在肠道中的吸收,并逆转重金属引起的肠道菌群变化:
植物乳杆菌TW1-1
植物乳杆菌CCFM8610
乳酸片球菌(Pediococcus acidilactici strain BT36)
蜡样芽孢杆菌
植物乳杆菌CCFM8661
植物乳杆菌CCFM8610
扩展阅读:客观认识植物乳杆菌 (L. plantarum) 及其健康益处
罗伊氏乳杆菌P16
扩展阅读:认识罗伊氏乳杆菌(Lactobacillus reuteri)
短乳杆菌23017
➦ 下一代益生菌:
普拉梭菌Faecalibacterium prausnitzii 是一种可以生产短链脂肪酸能力的人类肠道共生菌,参与微生物的解毒作用。
扩展阅读:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
➦ 重组细菌:
由于一些天然益生菌的不足,重组菌成为重金属污染微生物解毒研究的热点。重组乳酸乳球菌pGSMT/MG1363,产生一种类似于谷胱甘肽 S-转移酶的融合蛋白,具有解毒功能。将重组乳酸乳球菌菌株喂给新生大鼠后,血铅水平显著降低。
Pb结合结构域(PbBD)是已证明具有吸附Pb2+能力的蛋白质之一。通过构建大肠杆菌PbBD并将其引入草鱼体内,结果表明,大肠杆菌PbBD可通过与Pb2+()结合,来减少组织中的Pb积累。
益生菌解毒重金属的机制
与细胞壁上的多糖的金属络合,以降低重金属浓度,通过转运蛋白的重金属离子,与细胞内金属螯合蛋白结合形成沉淀,以及通过酶反应转化为低毒形式等。
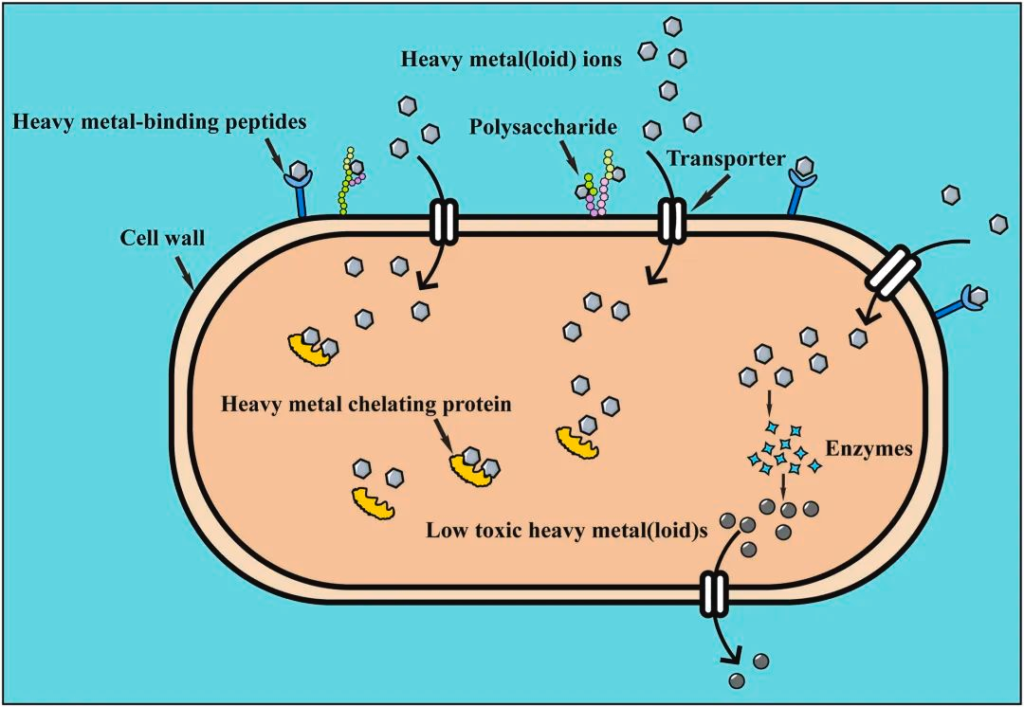
doi.org/10.1016/j.envpol.2022.120780
以上是第一种解毒策略,通过益生菌和重组细菌可以显著减少重金属对肠道微生物的影响,逐渐恢复健康的肠道菌群。接下来看第二张解毒策略:
✔ 肠道菌群防御反应的存在减少重金属的吸收
拮抗菌群的增加,可以减少宿主组织中镉的积累,从而降低发生一系列镉诱导疾病的风险。这种防御反应可能通过增加细胞外磷的浓度来增加铅的沉淀,从而降低肠道中的铅浓度。
——肠道微生物组可以直接影响砷代谢
在暴露于急性砷的小鼠肠道中,第一种反应被发现是一种防御机制,其特征是携带砷抗性基因或参与砷解毒机制的细菌数量增加。
动物研究也表明,肠道细菌通过将砷转化为粪便排泄,限制了砷在宿主体内的积累,降低了砷对宿主的影响。无机砷通过细胞膜上的磷转运蛋白或水通道蛋白进入生物体,并通过生物还原和生物甲基化进一步转化为各种其他形式的砷。
绝大多数无机砷的转化是由肠道菌群进行的,但肠道微生物对砷的处理在肠道的不同位置有所不同:
——肠道菌群抵抗铬吸收,有助于防止铬毒性
肠道微生物中的Cr(VI)耐受细菌,如副乳杆菌CL1107,在体外表现出Cr(VI)的减少,将Cr(IV)还原为Cr(III),其在中性或碱性条件下更难溶解。Cr(III)的低溶解度及其不能透过细胞,增加了粪便中铬的排泄量。
其他可能有用的措施
1、饮食
与排出重金属有关的食物包括:
螺旋藻、香菜、蓝莓等;
富含果胶的食物,如苹果、梨和柑橘类水果;
富含硫的食物,如西兰花、洋葱和大蒜等。
新鲜蔬菜榨汁:
绿叶蔬菜富含叶绿素,叶绿素在身体的解毒过程中非常重要,有助于清除血液中的重金属和毒素。同时,蔬果汁有利于增强肝功能,肝脏能够有效地处理和消除体内的毒素。
2、净化水源
例如:通过滤水器,帮助净化水中的重金属、有毒化学物质和污染物;或者饮用矿泉水等方式。
3、适量运动
出汗是一种自然的身体过程,可以帮助我们清除体内的毒素和废物。确保定期锻炼身体,让身体出汗排毒。
对于身体来说,药物是一种异源物质。身体可能会限制药物在胃肠道的吸收;加剧其在肠道和肝脏中的新陈代谢。
为什么不同人用药效果不一样?
药物明明是用于治病的,为什么可能带来所谓的副作用或者说毒性,甚至更严重后果?
肠道菌群是如何影响药物代谢,从而对身体带来不同影响?
用于神经系统疾病的药物,也与肠道菌群相关?
一个人服用多种药物,为什么会叠加健康风险?
本章节我们用常见的抗炎药,止泻药,癌症药物,神经系统药物,抗病毒药物来举例,从肠道菌群的角度来了解药物代谢的相关问题。
➤ 微生物对前药转化率不同,会影响患者疗效
抗炎药,尤其是针对胃肠道的抗炎药,由肠道细菌直接(化学修饰)或间接(通过微生物群和宿主细胞之间的相互作用)转化。此外,这些药物中的一些作为前药摄入,依赖微生物代谢将非活性前体转化为药物活性化合物。
肠道微生物将柳氮磺吡啶还原为磺胺吡啶后,柳氮磺嗪转化为活性抗炎剂5-ASA,然后进一步代谢为非活性N-乙酰基5-ASA。偶氮还原率和乙酰化率的差异,可以解释柳氮磺吡啶对患者的不同治疗效果。
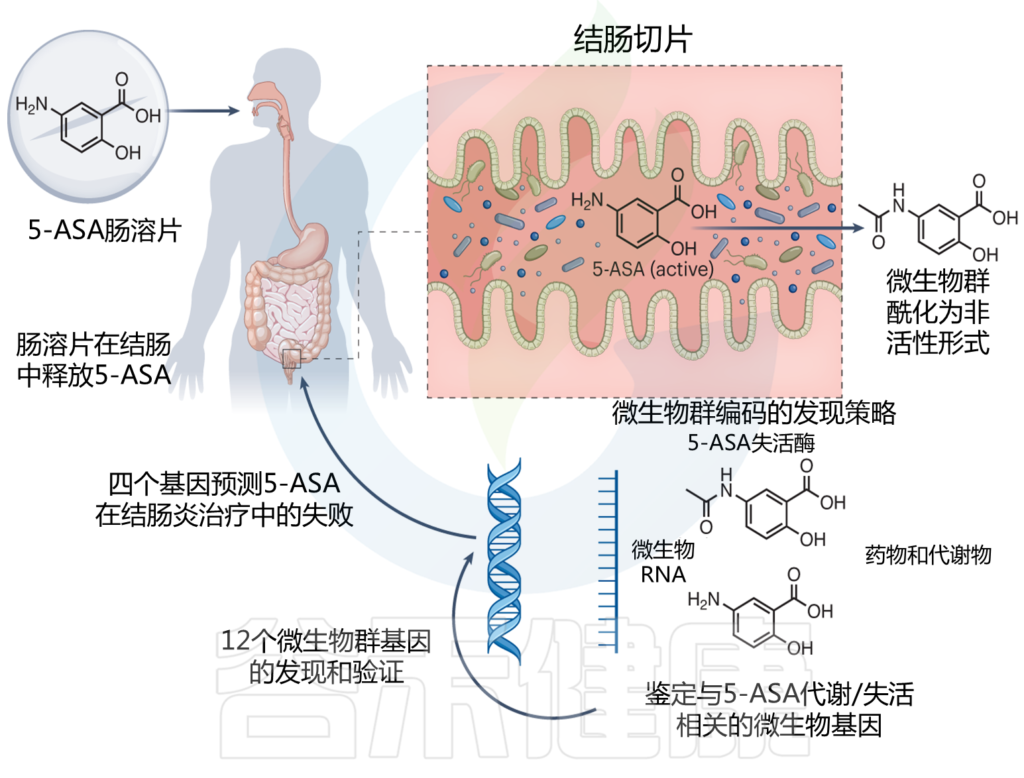
Macpherson AJ, et al., Nat Med. 2023
止泻药,洛哌丁胺的N-氧化物的减少也是肠道微生物活性激活前药的一个例子。
然而,对患者体内负责这些活动的特定生物和酶有更好的理解,有助于管理药物选择和给药等治疗。
个体之间对癌症化疗的治疗反应的一些差异,例如临床疗效和不良反应,也可能是由于肠道微生物群与药物相互作用的现象。肠道细菌可以直接改变化疗药物及其代谢产物的结构,从而改变与宿主细胞的相互作用。
➤ 癌症治疗:药物效果因人而异,可能与肠道菌群或肿瘤相关微生物对药物的结构改变有关
肠道菌群改变常用癌症药物的化学结构。在体外研究中,由于直接的化学修饰,大肠杆菌或魏氏李斯特菌(Listeria welshimeri)等细菌可以提高或降低30种抗癌药物的疗效。大肠杆菌也可以通过类似代谢活动来改变体内化疗的效果。
已知肠道微生物会降低化疗药物吉西他滨的活性浓度。大肠杆菌也可以阻止吉西他滨的疗效,因为它被微生物胞苷脱氨酶转化为其非活性代谢物。有意思的是,胞苷脱氨酶也作为嘧啶挽救途径的一部分存在于人类细胞中。因此,微生物酶在这种抗癌剂代谢中的真正影响仍然不确定。
➤ 神经药物作用于大脑,却也受控于肠道菌群
除了影响局部作用的药物外,肠道菌群代谢还会影响靶向远处器官系统的治疗效果。一些药物,如用于帕金森病治疗的口服左旋多巴,在穿过血脑屏障后,左旋多巴在大脑中被宿主酶局部代谢,以恢复多巴胺水平。然而,在到达大脑之前,药物在肠道中仍有广泛的代谢,导致浓度和患者反应发生显著变化。
一些短乳杆菌菌株,以及粪肠球菌、迟缓埃格特菌(Eggerthella lenta )能够在体外脱羧左旋多巴,但人类中大多数控制左旋多巴转化的肠道微生物和酶尚不清楚,需要更多的研究来揭示肠道菌群与各种神经药物之间的相互作用。
➤ 怎么看待同时服用不同种类药物,死亡风险升高?
拿抗病毒药物举例,如带状疱疹药物索罗夫定。据观察,服用索罗夫定的人,如果同时服用抗癌药物5-氟尿嘧啶,死亡风险会增加,这是为什么?
可能是因为索罗夫定溴戊酸脲的肠道微生物代谢产物减少,使二氢嘧啶脱氢酶失活,这反过来促进5-氟尿嘧啶的积累,导致更显著的毒性。
也可能与不同人群中酶的活性的显著差异有关。因此,同时服用这些药物带来药物不利影响的风险系数较高。
➤ 基于对肠道菌群药物代谢的了解,开发相应的方法提高疗效或减轻不良反应
地高辛主要用于治疗心力衰竭和心房颤动等心脏疾病,但是肠道菌群可以让它失活。地高辛具有狭窄的治疗窗口,用药过量会导致中毒反应,因此在临床上使用地高辛需要仔细监测以防止可能的心脏毒性。
当迟缓埃格特菌(Eggerthalla lenta)转化为没有治疗作用的代谢产物时,心力衰竭和心房颤动的治疗受到损害。
可能的机制与地高辛暴露时,迟缓埃格特菌中双基因细胞色素编码操纵子的上调有关。这种基因表达的蛋白质产物是Cgr1-Cgr2(心苷还原酶)复合物,它可以与地高辛结合并,将其还原为非活性代谢物。
既然我们了解到了这一点,那么有没有什么办法能阻止肠道菌群让地高辛失活?
研究人员认为,高蛋白饮食可以通过精氨酸防止肠道微生物群对地高辛的失活。也就是说饮食控制可以用来改变微生物的药物代谢,因为知道了细菌有独特的营养需求。不过随着对肠道细菌转化药物的机制了解的增加,也可以开发其他治疗方法来提高药物疗效或减轻不良反应。
所有这些研究都强调了揭示药物微生物转化的所有方面的重要性,可以从研究的药代动力学中明显地影响药物的作用。了解异源代谢过程是有必要的,这可能会影响药物的疗效、剂量和避免毒性。
草药在全世界范围内用于预防和治疗各种疾病已有数千年的历史。随着对天然药物的需求不断增长,中草药在世界范围内的重要性正日益增加。
肠道微生物群将中医药化学物质生物转化为代谢物,这些代谢物具有与其前体不同的生物利用度和生物活性/毒性。
接下来,我们从生物利用度和毒性这两方面,来详细了解,肠道菌群在中草药代谢中发挥什么样的作用,如何提高中草药的生物利用度,对毒性产生的正面或负面影响如何,用什么方法可以利用肠道菌群来降低中草药毒性等。
人在服用中草药后可分为两个阶段:
◗ 草药的生物利用度低,容易到达结肠与肠道菌群相遇
在草药中,许多成分的口服生物利用度非常低,因为它们是高极性化合物,亲脂性差。因此血流中的浓度水平有限。比如说,多酚的生物利用度通常低于 10%,人参皂苷的生物利用度可低至0.1%。
由于生物利用度低,这些化合物可以很容易地通过小肠并到达结肠。未被吸收的化合物就不可避免地与肠道菌群接触,并产生相互作用。
◗ 肠道菌群和中草药之间的相互作用是如何发生的?
首先,肠道微生物群与中草药之间的直接相互作用是双向的:
除了直接相互作用之外,中药与肠道菌群之间还会发生间接相互作用。在这类反应中,宿主的免疫和代谢系统起到了连接两端的桥梁作用。
免疫系统可以合成和释放一系列物质,如免疫球蛋白 A 和其他抗菌肽,可以调节肠道菌群组成。吸收的中草药可以调节胃肠道的免疫系统,最终导致肠道菌群发生变化。
比如说,一种中药化合物杜鹃花醇,可以改变牛乳腺上皮细胞中抗菌肽的表达,从而增强对金黄色葡萄球菌感染的防御能力。
◗ 在草药口服生物利用度低的问题中,肠道菌群能发挥作用吗?
出于患者方便和治疗依从性考虑,大多数药物是口服给药的。优化新药开发的主要特性之一是口服吸收度高。
糖苷,如三萜苷和黄酮苷,是许多草药含量中最常见的代表之一。由于氢键增加、糖部分的分子柔性和极性表面积,它们的肠道吸收有限。肠道微生物群可以将这些分子修饰成更亲脂性和极性更小的分子。
◗ 肠道菌群可以根据化合物的结构性质催化一系列代谢反应
草药中的糖苷首先在肠道中通过逐步水解(去糖基化和酯化)代谢。该过程产生的次生糖苷和/或苷元通常具有更好的肠道吸收和更好的生物利用度。它们通过骨架保留修饰(例如三萜苷)、骨架分裂(例如类黄酮苷)或骨架重排(例如环烯醚萜苷)进一步转化。
许多细菌门,其中拟杆菌门和厚壁菌门占优势,编码有丰富的糖苷水解酶基因,因此,它们用来进行糖苷水解。
◗ 不同肠道细菌可以合作处理单个化合物的代谢,单个细菌菌株也能够转化不同的化合物
梭杆菌K-60能使人肠道菌群中的槲皮苷去糖基化,而四种细菌菌株(Pedicoccus Q-5、链球菌S-3、拟杆菌JY-6、双歧杆菌B-9)参与了苷元(槲皮素)的进一步代谢。
丁酸梭菌通过各种反应机制,如脱糖基化、脱水、缩合、分子内环化和/或脱氢,能够转化属于不同结构类型的几种化合物,即紫草素、乌头碱和栀子苷。
然而说到中草药颇有争议,并不是所有人都认可,所谓“是药三分毒”,有人认为它会带来药物性肝损伤,这是一种常见的药物不良反应,可导致肝功能衰竭等问题。
近年来研究表明,中草药可以与肠道菌群相互作用,这种相互作用可以极大地影响其毒性和疗效。
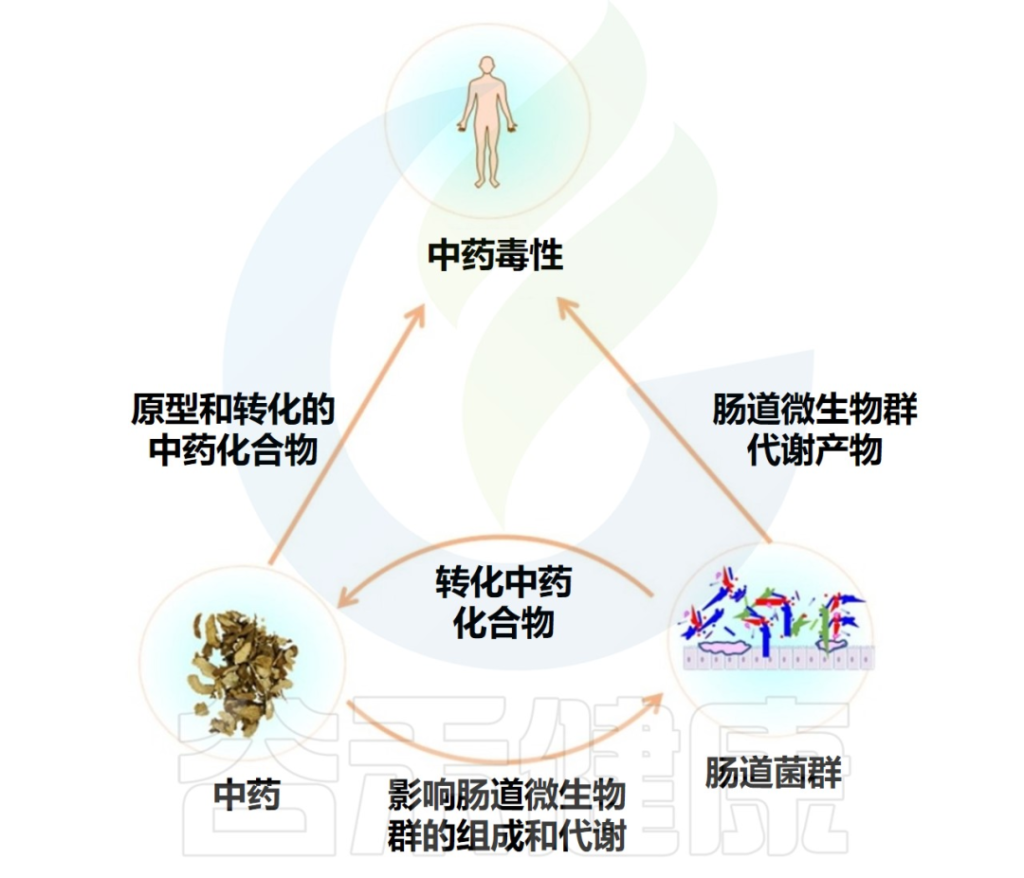
doi.org/10.1016/j.biopha.2020.111047
肠道菌群可以合成和释放一系列具有代谢异源物能力的酶,这些酶可以转化中药化合物,从而直接改变中药的毒性,这种改变包括增加毒性、减少毒性、解毒、激活毒性。
注:这些酶例如,β-葡萄糖醛酸酶、 β-葡萄糖苷酶、 β-半乳糖苷酶、α-鼠李糖苷酶等。
接下来从这四方面展开了解,肠道菌群对中药毒性的直接影响。
► 增加毒性
苦杏仁苷是一种在杏仁中发现的化合物,杏仁是一种用于治疗呼吸系统疾病如支气管炎、肺气肿的中药,但也可能有毒性,表现为恶心、呕吐、胸闷、头晕。
而肠道菌群可以水解苦杏仁苷的糖苷键,从而释放扁桃腈,扁桃腈是一种可以自发分解产生苯甲醛和有毒氢氰酸的化合物。因此,肠道菌群对苦杏仁苷毒性的修饰具有重要作用。
除了苦杏仁苷外,肠道菌群也可以代谢熊果苷、葛根素【与消化链球菌属 (Y-10)有关】、大豆苷【与双歧杆菌属 (K-111)有关】等其他中药成分,产生毒性更强的代谢物。
► 降低毒性
乌头(附子)的侧根是临床广泛用于治疗心力衰竭的中药,但常对神经和心血管系统产生毒性作用。
乌头生物碱是影响附子药理活性和毒性的主要化合物。在临床上有个办法来降低毒性,附子通常经过数小时的煮沸处理,然后再给患者开处方。
在胃肠道中,肠道菌群可以通过脱酰、酯化和去除甲基羟基以类似的方式转化乌头生物碱,参与的菌群与脆弱拟杆菌、肺炎克雷伯菌、丁酸梭菌有关。因此,肠道菌群降低了其毒性。注意肠道的这种减少的程度是有限的,口服大剂量依然会导致急性毒性。
除了乌头生物碱之外,肠道菌群还会对黄芩苷、对羟基苯甲酸丁酯转化为毒性较小的化合物。
► 解毒
这里的排毒,和前面章节的药物代谢机制类似,将活性中药化合物转化为非活性产物。
草酸盐是一种草药化合物,存在于许多中药中,能够诱发高草酸尿症、肾结石和心脏传导障碍。肠道菌群可以在甲酰辅酶 A转移酶和草酰辅酶 A脱羧酶的帮助下,解毒草酸盐。
► 激活毒性
这与前面解毒相反,激活是指肠道菌群将无毒化合物转化为有毒化合物。
苏铁甙是苏铁科植物中的一种偶氮糖苷,具有肝毒性和致癌能力。肠道菌群可以将苏铁甙转化为其苷元(甲氧基甲醇),苷元可以进一步转化为重氮甲烷,一种具有肝毒性和致癌作用的有毒化合物。
中药与肠道菌群的直接相互作用,不仅会导致中药化合物的转化,还会导致肠道菌群的组成和代谢发生变化,从而进一步影响中药的毒性。
以上我们可以看到,肠道菌群对毒性的影响并不是固定的,可能是增加毒性或者减小毒性。那么当发现某些肠道菌群可能会增加中草药毒性时,我们能做些什么尽可能阻止毒性增加呢?
由于肠道微生物群在调节中药毒性方面的重要作用,靶向肠道微生物群已成为控制中药毒性的新前沿。这里总结了靶向肠道菌群降低中药毒性的可能方法。
1、炮制减毒
许多中药在用于临床或制造中药之前要经过煮沸、漂、蒸等特殊处理,也就是“炮制”。
炮制的增效和降毒作用机制是中药现代化的重要问题。研究表明,煮沸等炮制可以将有毒化合物转化为无毒或毒性较小的化合物,从而改变中药的毒性,如前面说的乌头根。
近年来,研究人员证明炮制可以影响肠道微生物群,从而影响中药的药理作用。
甘遂是一种有毒的中药,用于治疗水肿、腹水和哮喘。由于其强烈的毒性,如肝脏和胃肠道毒性,通常用醋煎烤以降低毒性。最近的一项研究表明,醋制甘遂显著减少了甘遂中的10种有毒化合物,如甘遂素B、甘遂素C和甘遂素E。同时,醋制甘遂可以显著改变肠道微生物群的组成,显著提高了短链脂肪酸水平。
注:醋制是是中药炮制中重要的炮制方法。
考虑到肠道微生物群产生的短链脂肪酸具有抗炎和肠粘膜保护作用,可以推断醋制可以调节肠道微生物群的组成和代谢,从而降低甘遂的毒性。
2、中药组合
肠道微生物群释放的β-葡萄糖醛酸酶是一种重要的酶,可以将草药中的糖苷水解为苷元,这一过程可以增加草药化合物和药物的毒性。
非甾体抗炎药和β-葡萄糖醛酸酶抑制剂等化学药物的组合可以降低化学药物的毒性。
一些中药化合物(如黄芩苷)可以抑制细菌β-葡萄糖醛酸酶的活性,其与化学药物(如CPT-11)的组合可以降低CPT-11的毒性。
槲皮素的细菌代谢产物3,4-二羟基苯乙酸可以减少对乙酰氨基酚引起的肝损伤。因此,可以推断,具有抑制细菌酶的能力的中药可以与其他有毒中药或化学药物结合,以降低其毒性。
3、饮食
我们已经知道,饮食在调节肠道微生物群组成和功能中具有重要作用。同样,研究人员也想办法寻找饮食和药物之间的关联。上一章节我们已经了解到,高蛋白饮食可以抑制地高辛失活,并可用于降低某些患者(原本要更高剂量的患者)的地高辛毒性风险。
4、其他(FMT)
其他方法包括粪便微生物群移植(FMT)、益生元和益生菌的补充以及肠道微生物群的工程都有可能降低药物的毒性。
粪菌移植可以显著改善难治性免疫检查点抑制剂诱导的结肠炎,还可以显著改善FOLFOX(一种含有5-氟尿嘧啶、亚叶酸和草酸铂的方案)诱导的大肠癌癌症动物模型中的肠粘膜炎和腹泻。
预防性服用一种益生菌菌株干酪乳杆菌鼠李糖亚种,可显著降低FOLFOX诱导的结肠癌症动物模型中的肠道粘膜炎和腹泻,但不会改变FOLFOX的抗肿瘤作用。
TGF-β阻断剂和大肠杆菌Nisle 1917的组合增强了Galunisertib的肿瘤抑制作用。
肠道微生物群工程是直接治疗疾病和改善药物疗效的新兴前沿,如苯丙酮尿症和左旋多巴。尽管这些方法尚未用于控制中草药的毒性,但可以预见,这些方法将在不久的将来会引入,从而改善中草药毒性。
➭ 肠道微生物组、宿主因素和异源代谢的多方面相互作用是复杂的。微生物异源代谢可导致生物活化、解毒,通过加强肠粘膜屏障来防止吸收。肠道微生物的各种酶反应拓宽了我们对外来生物如何代谢的看法,代谢产物可以发挥新的活性。
➭ 破译异源物的肠道微生物转化,特别重要的是从患者处获取关于饮食或外源性暴露的广泛信息,有助于其与特定健康结果联系起来。
准确评估异源物质引起的肠道微生物群扰动,是将肠道微生物群失调与宿主健康状况联系起来和开发微生物群导向疗法的前提和基础。
➭ 重金属等环境污染物的暴露对肠道微生物群的扰动,会影响代谢和生理功能,部分导致代谢疾病的病因或进展。当然还需要更多深入、系统的研究,来确定重金属等污染物暴露对肠道微生物群的和时间效应。
➭ 了解肠道菌群对药物毒性和疗效的调节作用背后的分子机制,有助于改进药物开发和精准医学,更有效地评估风险,并开发个性化营养。
在不同的临床环境中为个体指导个性化营养膳食及肠道干预,或者制定相应益生菌补充方案,是提高中草药价值的重要研究方向。
将肠道微生物如何转化药物的知识整合到药物开发和实施的所有阶段,将有助于设计合适的治疗方案并改善患者对药物的临床反应。
主要参考文献
Liu X, Zhang J, Si J, Li P, Gao H, Li W, Chen Y. What happens to gut microorganisms and potential repair mechanisms when meet heavy metal(loid)s. Environ Pollut. 2023 Jan 15;317:120780. doi: 10.1016/j.envpol.2022.120780. Epub 2022 Nov 29. PMID: 36460187.
Mehta RS, Mayers JR, Zhang Y, Bhosle A, Glasser NR, Nguyen LH, Ma W, Bae S, Branck T, Song K, Sebastian L, Pacheco JA, Seo HS, Clish C, Dhe-Paganon S, Ananthakrishnan AN, Franzosa EA, Balskus EP, Chan AT, Huttenhower C. Gut microbial metabolism of 5-ASA diminishes its clinical efficacy in inflammatory bowel disease. Nat Med. 2023 Feb 23. doi: 10.1038/s41591-023-02217-7. Epub ahead of print. PMID: 36823301.
Koppel N, Maini Rekdal V, Balskus EP. Chemical transformation of xenobiotics by the human gut microbiota. Science. 2017 Jun 23;356(6344):eaag2770. doi: 10.1126/science.aag2770. PMID: 28642381; PMCID: PMC5534341.
Lindell AE, Zimmermann-Kogadeeva M, Patil KR. Multimodal interactions of drugs, natural compounds and pollutants with the gut microbiota. Nat Rev Microbiol. 2022 Jul;20(7):431-443. doi: 10.1038/s41579-022-00681-5. Epub 2022 Jan 31. PMID: 35102308.
Macpherson AJ, Sauer U. Secrets of microbiota drug metabolism. Nat Med. 2023 Feb 23. doi: 10.1038/s41591-023-02227-5. Epub ahead of print. PMID: 36823300.
Zhang Q, Bai Y, Wang W, Li J, Zhang L, Tang Y, Yue S. Role of herbal medicine and gut microbiota in the prevention and treatment of obesity. J Ethnopharmacol. 2023 Apr 6;305:116127. doi: 10.1016/j.jep.2022.116127. Epub 2023 Jan 2. PMID: 36603782.
Feng W, Liu J, Huang L, Tan Y, Peng C. Gut microbiota as a target to limit toxic effects of traditional Chinese medicine: Implications for therapy. Biomed Pharmacother. 2021 Jan;133:111047. doi: 10.1016/j.biopha.2020.111047. Epub 2020 Dec 4. PMID: 33378954.
Chen F, Wen Q, Jiang J, Li HL, Tan YF, Li YH, Zeng NK. Could the gut microbiota reconcile the oral bioavailability conundrum of traditional herbs? J Ethnopharmacol. 2016 Feb 17;179:253-64. doi: 10.1016/j.jep.2015.12.031. Epub 2015 Dec 23. PMID: 26723469.
Collins SL, Patterson AD. The gut microbiome: an orchestrator of xenobiotic metabolism. Acta Pharm Sin B. 2020 Jan;10(1):19-32. doi: 10.1016/j.apsb.2019.12.001. Epub 2019 Dec 10. PMID: 31998605; PMCID: PMC6984741.
Feng Y, Cao H, Hua J, Zhang F. Anti-Diabetic Intestinal Mechanisms: Foods, Herbs, and Western Medicines. Mol Nutr Food Res. 2022 Jul;66(13):e2200106. doi: 10.1002/mnfr.202200106. Epub 2022 May 11. PMID: 35481618.
Teschke R. Aluminum, Arsenic, Beryllium, Cadmium, Chromium, Cobalt, Copper, Iron, Lead, Mercury, Molybdenum, Nickel, Platinum, Thallium, Titanium, Vanadium, and Zinc: Molecular Aspects in Experimental Liver Injury. Int J Mol Sci. 2022 Oct 13;23(20):12213. doi: 10.3390/ijms232012213. PMID: 36293069; PMCID: PMC9602583.