 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
锌与肠道微生物
锌(Zn)是人体必需的微量元素,是人体中第二丰富的矿物质。锌在细胞和器官功能中起着关键的催化、调节和结构作用。
★ 膳食锌缺乏或过量均不健康
锌缺乏与发育不良、免疫功能低下、味觉丧失、不良妊娠结局、脱发、皮肤损伤和神经行为异常有关。
世界卫生组织估计,全球三分之一的人口面临锌缺乏症的风险,他们的饮食锌摄入量不足或食物中锌的生物利用度低。
不过需要注意不可在没有医嘱下擅自过量补充,导致锌的摄入量超过既定的营养需求。锌摄入过量也不利于健康,容易导致氧化应激增加、长期记忆受损、肠道吸收和分泌能力改变以及内脏脂肪增加。
近年来的几项体内研究表明,膳食锌摄入缺乏或过量会影响肠道菌群的组成和功能,进而对人体健康产生一定的影响。
本文主要讲述锌缺乏或锌超载情况下细菌类群的一些改变,短链脂肪酸生成变化,细菌金属抗性和抗生素抗性基因增加,以及锌相关转运蛋白的变化。
有助于进一步了解膳食锌对人体肠道微生物组的影响,并阐明利用肠道微生物组作为潜在锌状态生物标志物的适用性。帮助人们更好地控制锌的摄入量来塑造自身健康。
锌(Zinc)是一种化学元素,也是第四”常见”的金属。在现代工业中,锌是电池制造上不可替代、相当重要的金属。
锌还是人体必需的微量元素之一,起着极其重要的作用。
•维持正常食欲,利于生长发育
缺锌会导致味觉下降,锌会影响舌黏膜的正常功能,缺锌时味觉敏感度会比较差,可能还会因此而产生食欲不振或厌食等。长时间厌食会影响营养物质吸收,产生营养不良。
锌有助于生长发育、智力发育,缺乏锌会对我们的身体,特别是生长发育造成严重影响。所以,补充足够的锌是必须的。
•增强人体免疫力
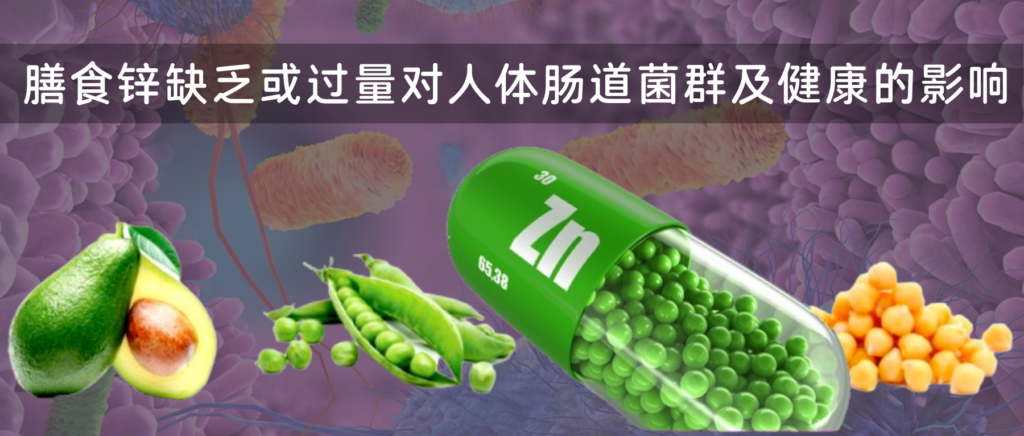
锌是免疫器官胸腺发育的营养素,只有锌充足才能有效保证胸腺发育,正常分化T淋巴细胞,促进细胞免疫功能。失调的锌稳态会损害整体免疫功能,从而增加对感染的易感性。
锌还以类似于钙的方式作为免疫反应的离子调节剂,通过作为细胞内信使参与信号通路。
锌在单核/巨噬细胞信号传导中的作用

Kim B,et al.Mol Cells.2021
•影响伤口恢复
锌作为许多转录因子和酶系统的辅助因子,包括锌依赖性基质金属蛋白酶,可在伤口修复过程中增强自体清创和角质形成细胞迁移。
缺锌易导致皮肤疾患,患口腔溃疡,受损伤口不易愈合,青春期痤疮等。
★ 锌对肠道微生物有重要影响
肠道微生物在宿主营养状况中发挥着重要作用,在免疫、与宿主细胞相互作用、代谢不可消化的营养素和合成必需维生素等方面发挥着关键作用。
锌结合蛋白占细菌蛋白质组的5%,突出了细菌定植胃肠道的主要锌。锌是一种重要的营养物质和抗菌剂,近年来的研究发现,膳食中锌含量的不同导致肠道微生物的组成和功能产生改变,进而对人体健康产生一系列影响。
膳食锌(锌缺乏或锌过量)对肠道菌群的影响
向上滑动阅览



Cheng J,et al.Crit Rev Food Sci Nutr.2023
接下来跟随谷禾了解一下膳食锌缺乏和过量情况下肠道微生物的具体改变
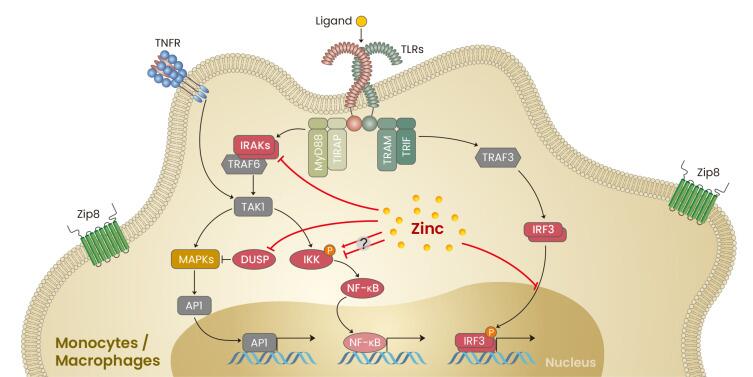
1. 在缺锌条件下,发现能够有效竞争锌的细菌(即肠杆菌科和瘤胃球菌科以及肠球菌属和脱硫弧菌属)增殖。
2. 与碳水化合物和糖代谢相关的微生物代谢途径的表达改变已被发现与锌缺乏相关,其中细菌可以将碳水化合物和糖代谢为短链脂肪酸。
3. 粘蛋白相关细菌丰度的改变(即粘嗜阿克曼氏菌和异源杆菌)也与锌缺乏有关。肠道粘蛋白由粘多糖和糖蛋白组成,细菌可以以这种粘蛋白为食并产生短链脂肪酸。
与锌缺乏相关的潜在结果包括细菌的定植和生长,这些细菌可以有效地竞争锌。
4. 此外,锌缺乏可能导致产生短链脂肪酸的细菌(即Blautia和Ruminococcus)的丰度降低。短链脂肪酸浓度与肠道pH值相关,由于短链脂肪酸含量降低导致的pH值升高会降低锌的溶解度,从而降低锌的生物利用度和吸收。
与锌缺乏相关的潜在宿主和肠道菌群
Cheng J,et al.Crit Rev Food Sci Nutr.2023
六项研究比较了锌缺乏相对于锌充足对肠道菌群的影响,其中五项研究通过膳食锌控制诱导锌缺乏。
与锌充足对照组相比,锌缺乏组血浆/血清、指甲、羽毛、肝脏、睾丸和粪便锌含量降低。
锌缺乏组的实验对象大部分生物多样性下降,尤其是粘蛋白相关细菌丰度降低,短链脂肪酸的产量也减少,微生物相关代谢也在一定程度上减弱。
以上实验研究主要是基于小鼠,大鼠,鸡和猪等动物实验,关于人类的临床实验还较少,但是动物的实验也可以为人类提供一定的参考价值。
锌缺乏影响微生物多样性
关于与锌缺乏相关的肠道菌群调节,所有六项研究都评估了α-多样性和β-多样性。
✦α多样性
关于缺锌对肠道菌群α-多样性的影响,六项研究尚无共识。总的来说,三项研究发现α-多样性的改变与缺锌相关,三项研究没有发现变化,其中大多数研究采用了不同的α-多样性测量方法。
缺锌对α多样性的影响具有差异
在锌缺乏的情况下,一项研究发现α-多样性以性别依赖的方式增加或减少(雄性小鼠增加,雌性小鼠减少)。
同样,在人类研究中,缺锌对α-多样性的影响也存在差异。在学龄儿童中,锌缺乏导致α-多样性增加,而在锌缺乏的母乳和配方奶喂养的婴儿中,α-多样性降低。
虽然每项研究中生物多样性变化的差异可能与不同的研究对象有关,但还需要在人类和动物模型中进一步研究锌缺乏对肠道微生物群改变的影响。
✦β多样性变化暂不明确
进行的六项研究中有五项发现了与锌缺乏相关的β多样性变化。
然而,在第六项研究中没有发现β-多样性的变化,该研究使用了θYC距离测量。β多样性的变化并不一定表明细菌类群的有益或消极变化。
●门水平
在门水平上,锌缺乏与变形菌门(Proteobacteria)和黑色素杆菌(Melainabacteria)的增加以及厚壁菌门(Firmicutes)的减少有关。
注:其中变形菌丰度的增加被认为是生态失调和疾病风险的潜在诊断标准,因为在健康的人类肠道中发现了低变形菌丰度。而厚壁菌门的许多成员都是有益菌
这或许可以从一部分角度解释锌缺乏对健康的不利影响
短期缺锌与长期缺锌菌群改变不同
短期缺锌会降低疣微菌门(Verrucomicrobia)的丰度(主要是Akkermansia muciniphila属),而长期缺锌则与疣微菌门丰度的增加有关。
菌群改变出现性别差异
发现与锌充足的野生型小鼠相比,通过ZnT7敲除诱导的锌缺乏导致了敲除(ZnT7-/-)和异质(ZnT7+/-)小鼠的红蝽菌科(Coriobacteriaceae)丰度和Allobaculum属丰度的增加,这种变化仅在雌性小鼠中发现。这表明锌的调节功能可能因性别而异。
注:因此锌对不同性别的人群影响可能不同
●属水平
在属水平上,研究发现双歧杆菌(Bifidobacterium)、希瓦式菌属(Shewanella)、Rheinheimera的减少与血浆锌水平相关。
除此之外还发现粪杆菌属(Faecalibaculum)增加,经黏液真杆菌属(Blautia)、乳杆菌(Lactobacillus)、Negativibacillus减少。
慢性缺锌的情况
在慢性锌缺乏的情况下,以下菌群丰度增加:
肠球菌(Enterococcus) ↑↑↑
肠杆菌(Enterobacteriaceae) ↑↑↑
瘤胃球菌科(Ruminococcaceae) ↑↑↑
而下列菌群丰度下降:
Clostridiales ↓↓↓
消化链球菌科(Peptostreptococcaceae) ↓↓↓
●物种水平
在物种水平上,Lachnospiraceae NK4A136和
真杆菌属(Eubacterium coprostanoligene)的丰度随着锌的缺乏而增加,而Ruminococcus gauvreauii的丰度随着锌的缺乏而降低。
此外还发现了一些菌群的增加和下降
增加的菌群:
吲哚梭菌(Clostridium indolis) ↑↑↑
未分类的某种拟杆菌 ↑↑↑,
减少的菌群:
酸奶瘤胃球菌(Ruminococcus lactaris) ↓↓↓
肠球菌(Enterococcus sp.) ↓↓↓
Clostridium lactatifermentans ↓↓↓
Clostridium clostridioformme ↓↓↓
// 注意
锌缺乏可能使得一些对人体有益的细菌丰度下降,而致病菌的丰度上升,从而对健康产生影响
虽然在上述研究中发现了从门到属水平的显著差异,但在一些学者的研究中,微生物群的相对丰度没有显著差异。
锌缺乏对菌群主要代谢产物——短链脂肪酸的影响
研究了锌缺乏与微生物代谢物(短链脂肪酸)生产和功能的变化。
✦锌缺乏影响短链脂肪酸的产量
锌缺乏时间不同对短链脂肪酸的影响不同
一项小鼠研究发现,短链脂肪酸产量在短期锌缺乏时增加,但在长期锌缺乏时减少。鸡的研究发现,相对于锌充足,锌缺乏会降低短链脂肪酸的产量。
具体而言,短期(4周)饮食锌不足会增加盲肠乙酸,并与各组短链脂肪酸产生细菌(Flavonifractor、Alistipes、Odoribacter、Anaerotruncus、 Alloprevotella、Bifidobacterium adolescentis、Paralactobacillus Leisner)呈正相关,表明在锌匮乏的条件下,肠道微生物群可以增加锌的利用率。
另一方面,长期锌不足(8周)与戊酸盐产量下降有关。发现与碳水化合物、氨基酸、萜类/聚酮、核苷酸代谢、聚糖生物合成和代谢以及异种生物降解和代谢相关的微生物代谢途径随着长期锌缺乏而降低。
✦短链脂肪酸浓度影响锌的利用与吸收
短链脂肪酸浓度与肠腔pH值相关,其中,由于短链脂肪酸含量增加而导致的pH值降低可增加锌的溶解度,从而增加锌的生物利用度和吸收。
说明锌与短链脂肪酸存在相互作用的关系
鉴于短链脂肪酸、宿主营养和肠上皮维持之间的联系,其中短链脂肪酸的产生与黏蛋白的产生有关,细菌发酵碳水化合物和抗性淀粉,短链脂肪酸被用作细菌能量来源。
一组研究人员发现锌缺乏导致乙酸盐产量下降,这可能是由于产生短链脂肪酸的细菌属,如梭状芽胞杆菌和瘤胃球菌的减少。
综上所述,锌缺乏情况下肠道菌群组成的改变及其相关代谢途径影响碳水化合物和糖基代谢、肠道黏蛋白降解,从而影响短链脂肪酸的产生。
锌缺乏与代谢通路变化
✦锌缺乏使微生物相关代谢减弱
在微生物代谢途径中,锌缺乏与碳水化合物代谢相关基因的表达降低有关、以及糖聚糖生物合成和代谢、核苷酸代谢、氨基酸代谢、抗生素耐药性、矿物质吸收、脂肪酸代谢、一级/二级胆汁酸合成和异种生物降解都有联系。
此外,发现与锌吸收、脂肪酸代谢和碳水化合物消化和发酵相关的KEGG途径表达减少,其中最后一种途径也可能导致短链脂肪酸产量减少,这与提高锌生物利用度有关,从而使锌缺乏状态持续存在。
注:基于人类疾病KEGG通路,分别在短期和长期锌缺乏症中发现了更多与物质依赖和心血管疾病相关的基因。
锌缺乏对肠道粘蛋白及相关菌的影响
额外的微生物类群改变与锌缺乏和肠粘蛋白丰富有关。由杯状细胞产生的黏液层由粘多糖和糖蛋白组成,并容纳有助于消化矿物质的肠道微生物群。
粘蛋白——黏蛋白关键特征是其形成凝胶的能力; 因此它们是大多数凝胶状分泌物的关键组成部分,提供润滑,细胞信号通路及化学屏障的功能。
✦锌缺乏影响粘蛋白相关细菌丰度
锌缺乏会影响与粘蛋白相关细菌丰度,例如嗜黏蛋白阿克曼菌的减少不利于肠道屏障的完整性,并在一定程度上影响乙酸和丙酸等短链脂肪酸的产生,从而对健康产生危害。下面是一些具体实验证据:
锌缺乏影响嗜黏蛋白阿克曼菌丰度
共生细菌以黏液蛋白为食并粘附在黏液蛋白上,与宿主相互作用并调节黏液蛋白基因的表达和分泌,与上皮细胞相互作用以维持黏液和上皮内稳态。
在短期锌缺乏的情况下,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在统计学上显著下降,这与之前的研究一致,这些研究表明嗜黏蛋白阿克曼菌相对丰度较低与锌缺乏相关。
嗜黏蛋白阿克曼菌(A.muciniphila)存在于大肠黏液层,调节肠道屏障的完整性,其丰度与代谢性疾病和炎症性肠病发病率呈负相关。此外,嗜黏蛋白阿克曼菌是一种粘蛋白降解物,可将粘蛋白转化为乙酸和丙酸以供能量使用。
锌缺乏与其他影响粘蛋白丰度的菌群相关
同样,在缺乏锌的情况下,发现经黏液真杆菌属(Blautia)和乳酸杆菌属,以及粪杆菌(Faecalibaculum)属的增加,这些都是可能影响粘蛋白丰度的类群。
乳酸菌的减少可能会减少肠道黏蛋白,因为某些乳酸菌会刺激黏液蛋白2 (MUC2)的产生,黏液蛋白2是杯状细胞表达的主要肠道黏蛋白。
经黏液真杆菌属(Blautia)含量降低,经黏液真杆菌属含有粘蛋白降解基因是一种短链脂肪酸(丁酸和乙酸)生产者,其丰度可能预测锌状态的差异。
异杆菌属丰度增加有利于结肠上皮健康
研究发现,与锌充足野生型(ZnT7+/+)相比,通过敲除ZnT7诱导的锌缺乏导致敲除(ZnT7-/-)小鼠和异质性(ZnT7+/-)小鼠的异杆菌属(Allobaculum)丰度在雌性小鼠中均有所增加。黏蛋白密度(酸性和中性黏蛋白减少,杯状细胞数量减少)与异杆菌属(Allobaculum)相对丰度呈负相关。
异杆菌属(Allobaculum)与发酵碳水化合物(即粘蛋白)有关,以产生短链脂肪酸(乳酸和丁酸),供异源菌群作为碳源利用,这表明异杆菌属(Allobaculum)丰度的增加可能与有利于结肠上皮健康的潜力有关。
小结
总的来说,锌缺乏通常会导致细菌生物多样性、从门到种水平的细菌丰度的降低、短链脂肪酸的产生减少以及与碳水化合物和糖基代谢相关的细菌代谢途径的减弱,锌相关蛋白基因表达也可能在一定程度上减弱。
注:这些变化影响了人体原本正常的代谢,可能导致一些疾病的产生。
注意
所有六项关于锌缺乏和肠道菌群改变影响的研究都使用了膳食锌作为锌源。对于α-多样性和短链脂肪酸产生的变化还缺乏共识,一个可能的解释可能是所使用的动物模型以及模型的生命阶段和性别的差异。
注:只有一项研究使用了大鼠模型,而所有其他研究都使用了小鼠模型。与其他研究相比,所使用的小鼠年龄最大,小鼠肠道菌群随着年龄的增长逐渐稳定。
三项研究仅使用男性受试者,一项研究仅使用女性受试者,两项研究同时使用女性和男性受试者,其中考虑到人类性别之间免疫功能的差异以及锌、免疫功能和肠道微生物组之间的联系,在设计阐明锌缺乏症对肠道微生物组组成和功能的影响的未来研究时,应考虑受试者的性别。
1.与高锌或锌过载相关的潜在结果包括具有高锌条件机制的细菌定殖和生长。
某些细菌具有通过有效的重金属排出系统来抵消高锌浓度的机制。在高锌条件下,发现了对增加金属锌暴露有进化适应的细菌(即梭状芽孢杆菌科、肠杆菌科和大肠杆菌)。
2.增加的细菌进化适应增加的金属暴露(金属抗性),已发现与抗生素耐药性相关的微生物基因表达增加有关。
此外,高锌条件可能会潜在地增加耐药肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐药现象。
与高锌或锌过载相关的潜在宿主和肠道菌
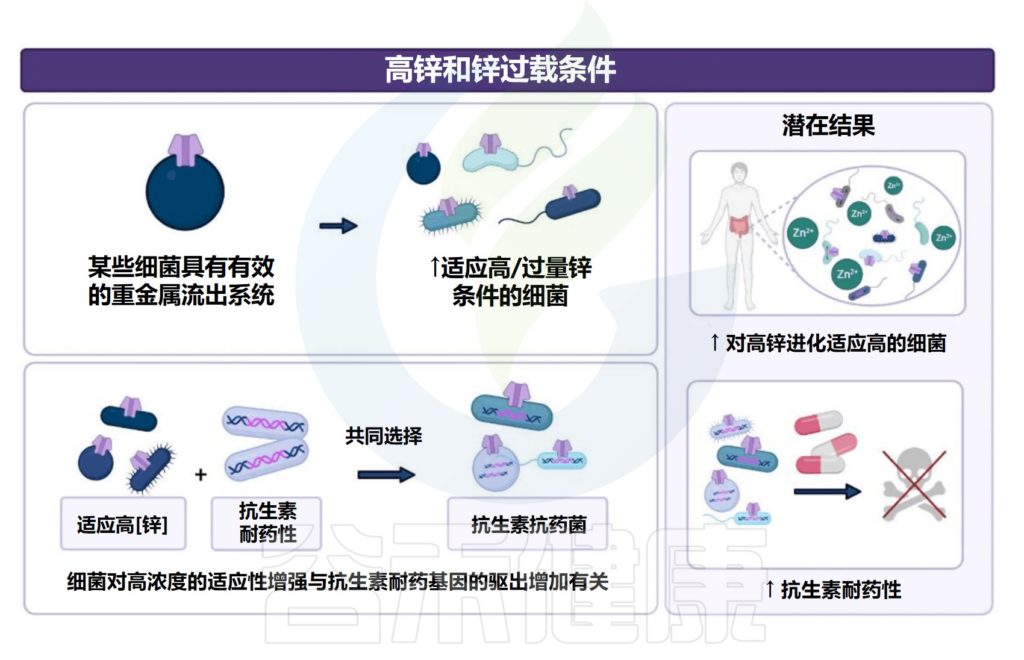
Cheng J,et al.Crit Rev Food Sci Nutr.2023
★锌过量的危害
1.一般情况下,补锌过量可能会导致机体出现锌中毒,大部分人群可能会出现胃肠道症状,如恶心、呕吐等。
2.抵抗力下降:过高的血锌会抑制白细胞的吞噬作用和杀菌作用,使人体的抵抗力下降,容易遭受致病菌侵袭。
3.记忆力下降:对于不缺锌的人,额外补充有可能造成体内锌过量,从而引发代谢紊乱,甚至会对大脑造成损害,可能损伤大脑神经元,导致记忆力下降。
4.贫血:有些家长误把锌制品当作营养品,给婴儿长期大量服用,殊不知补锌过量同样会带来危害,会使体内的维生素C和铁的含量减少,抑制铁的吸收、利用,容易引起、加重缺铁性贫血。
下面具体讲述一下锌过量状态下肠道微生物具体发生的变化
五项研究比较了高膳食锌或锌过载相对于锌充足对肠道菌群的影响。
锌过量与相关代谢基因
与锌充足对照相比,高锌或锌过载导致锌相关蛋白基因表达有所改变。
✦高锌摄入降低锌转运蛋白ZIP4基因表达
ZIP4是锌从肠腔进入肠上皮细胞的主要导入物,由饮食中的锌调节,随着锌摄入的增加,ZIP4的表达下调。
两项研究发现,高锌摄入量会降低ZIP4基因的表达。还发现,高锌摄入的小鼠ZnT2表达增加(仅回肠),MT1和MT2表达增加(回肠和结肠),而其他测试的ZnT(4-7,9)和ZIP(1,3,5-11,13,14)蛋白的基因表达没有变化。
✦脂质代谢基因表达降低
与短链脂肪酸产量降低一致,与脂质代谢相关的微生物基因表达也在高锌和过量锌饲粮中被发现降低。
✦抗性基因表达增强
在微生物代谢途径中,高锌和过量膳食锌与抗生素耐药性相关基因的表达增加有关、传染病和金属离子结合,以及与脂代谢、异种生物降解和酶活性(果胶酯酶、α-葡糖醛酸酶、α-l-阿拉伯糠醛苷酶)相关的基因表达降低。
抗生素耐药性增强
将抗生素抗性基因丰度的增加与肠杆菌的增加联系起来,其中高氧化锌饲粮已普遍用于猪,并导致促进抗生素耐药性。
具体而言,在猪肠道中发现耐多药大肠杆菌的患病率增加,这归因于高氧化锌饮食。
研究发现,饮食中锌过量会增加肠球菌,其中肠球菌具有质粒编码的耐药基因,本质上对许多常见抗菌剂不那么敏感。
尽管没有研究微生物代谢基因,但考虑到细菌类群对锌增加的适应性增加,考虑到金属耐药基因和抗生素耐药基因的共同共存,有可能存在抗生素耐药细菌基因的增加。
总的来说,高锌或锌过载似乎潜在地增加了耐抗生素的肠道微生物群,其中对高锌的进化适应以及抗生素和金属耐药基因的增选可能会由于水平基因转移而进一步延续这种耐抗生素现象,从而导致人体的抗生素和金属耐药性增强。
锌过量影响微生物多样性
评估了与高锌或锌过载相关的肠道菌群调节的多样性测量;4项研究评估了α-多样性,5项研究评估了β-多样性。
✦高锌下α多样性降低
利用Pielou的均匀度α-多样性测量发现,α-多样性随着高锌而降低。通过1/Simpson多样性测量也发现,α-多样性随着Zn过载而降低。
此外,短期(4周)高饲粮锌或锌过载被发现不会显著影响α-多样性,长期高锌被发现不会改变(观察物种)或降低α-多样性,长期(8周)锌过载也不会改变α-多样性。
注:这可能取决于所使用的评估方法
α多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌等增多,进而影响人体的的健康。
✦β多样性的变化未达成共识
关于高锌或锌过载对微生物组β-多样性的影响,在五项选定的研究中也没有共识,其中三项研究发现了与高锌或锌过量相关的β-多样性变化,并在其他两项研究中保持不变,尽管不同的研究使用了不同的距离测量。
疣微菌门的丰度与锌过载暴露时间有关
在小鼠中,高饲粮锌和锌过载在短期内增加了疣微菌门(Verrucomicrobia)丰度,但在长期暴露后会降低疣菌菌丰度,此前在仔猪中也有这种情况,其中长期高饲粮锌或锌过载会通过细菌金属间竞争、金属蛋白错金属、或与金属毒性和细菌金属稳态改变相关的氧化还原活性。
高锌显著增加了梭状芽孢杆菌科(Clostridiaceae)的丰度,其中梭状芽孢杆菌科被发现具有通过有效的重金属外排系统来抵消高锌浓度的机制,该系统可能是从携带重金属抗性基因的质粒转移而来的。
梭菌科更适应高锌的浓度
鉴于这些更强的抗锌机制,梭菌科可以适应高锌浓度,因此相对于其他细菌有更多的定殖。最后,在高膳食锌摄入量下,与金属离子结合和金属离子转运相关的微生物基因表达增加,支持了对高膳食锌环境具有特定进化适应的正向选择细菌类群的假设。
注:在所选研究中,在不同的分类水平上研究了肠道微生物群的组成和功能的变化。在这五项研究中都发现了细菌类群的显著变化,这些变化可以归因于微生物群对有效锌浓度增加的适应。
✦门水平
对于细菌类群的变化,在门水平上,两项研究发现高锌没有显著改变细菌丰度。
虽然在两项利用猪模型的研究中拟杆菌门(Bacteroidetes)丰度有所增加,但在门水平上的其他变化没有达成共识。
时间不同菌群丰度变化不同
研究发现短期(4周)高锌和锌过载会增加疣微菌门(Verrucomicrobia)的丰度,而长期暴露(8周)会降低疣微菌门(Verrucomicrobia)的丰度。
另一项研究发现,短期锌过载导致变形菌门丰度增加,长期锌过载导致放线菌门丰度增加。
✦科、属、种水平变化较小
与膳食锌含量过高或过量相关的科、属或种水平变化之间不明显。
在短期(4周)和长期(8周)暴露中,黑色素杆菌(Melainabacteria)与血清锌水平呈负相关,而Desulfovibrio sp. ABHU2SB与血清锌水平呈正相关。
✦锌过载时肠道菌群的具体变化
罗伊氏乳杆菌(L. reuteri)与短期锌过载呈负相关;然而,随着长期锌过载,该属与血清锌无显著相关性。
高锌显著增加了梭菌科(Clostridiaceae)丰度,降低了乳杆菌科(Lactobacillaceae)和肠杆菌科(Enterobacteraceae)丰度。
在利用猪模型的研究中发现, 普雷沃氏菌(Prevotella)和乳酸菌属增加,琥珀酸弧菌属(Succinivibrio) 减少。
另一组研究人员发现锌过载下列菌株丰度增加:
拟杆菌属(Bacteroides) ↑↑↑
副杆菌属(Parabacteroides) ↑↑↑
柯林斯菌属(Collinsella) ↑↑↑
醋弧菌属 (Acetivibrio) ↑↑↑
经黏液真杆菌属(Blautia) ↑↑↑
粪球菌属(Coprococcus) ↑↑↑
普拉梭菌(Faecalibacterium) ↑↑↑
霍尔德曼氏菌(Holdemania) ↑↑↑
Subdoligranulum ↑↑↑
Nestiinimonas ↑↑↑
Lachnoclostridium ↑↑↑
Pseudoflavonifractor ↑↑↑
而以下菌群减少:
巨型球菌属(Megasphaera) ↓↓↓
戴阿利斯特杆菌属 (Dialister) ↓↓↓
氨基酸球菌属(Acidaminococcus) ↓↓↓
瘤胃球菌(Ruminococcus) ↓↓↓
Treponema ↓↓↓
虽然生物多样性变化的差异可能与每项研究中不同的研究对象和不同的研究时间有关,但高膳食锌或锌过量对人类肠道微生物群的影响仍不确定,这突显了进一步研究的必要性。
锌过量对细菌主要代谢产物——短链脂肪酸的影响
✦高锌降低短链脂肪酸含量
长期(8周)高锌与对照组相比,短链脂肪酸总产量更低。具体而言,与锌充足相比,长期高饲粮锌导致盲肠戊酸、丁酸、乙酸、异戊酸、异丁酸和丙酸降低。
短链脂肪酸在管理炎症和促进肠上皮完整性方面发挥着重要作用,高锌除了抑制短链脂肪酸生成外,还发现导致结肠炎症增加。
锌过量与炎症及免疫
虽然锌通常被认为是安全的,因为它不具有氧化还原活性,但大量或过量的锌暴露与肠道功能的改变、免疫功能的改变和炎症有关,因此强调需要确定高剂量和锌过载剂量对肠道微生物组组成和功能的影响。
✦锌过量影响炎症疾病发病率
乳酸菌科的细菌与短链脂肪酸的产生有关,将碳水化合物发酵成乳酸。此外,乳酸菌,产生各种各样的胞外多糖,作为阳离子金属离子(如Zn2+)的结合位点,可以保护这些微生物免受金属毒性。
根据种类的不同,乳酸菌可以是促炎的,也可以是抗炎的。在一项研究中,来自乳酸菌科的细菌丰度增加(Lactobacillus spp.),但在两项研究中(罗伊氏乳杆菌)丰度下降,高膳食锌摄入量。人类罗伊氏乳杆菌丰度的降低与炎症疾病发病率的增加相关。
✦高浓度锌具有抗菌作用
此外,膳食中高浓度的锌在防御致病性大肠杆菌、单核细胞增生李斯特菌和链球菌方面发挥抗菌作用。
小结
总的来说,在大多数选定的研究中,高饲粮锌和锌过载状态与α-多样性降低或不变、短链脂肪酸产量降低以及金属和抗生素抗性基因增加有关。
这些因素都在一定程度上影响人体的健康,对其产生不利的影响。
不足之处
在每一项研究中,并没有量化短链脂肪酸和微生物代谢基因,这本可以更好地了解过量锌摄入相关的微生物群组成和功能。
饮食中高锌或锌过载对人类肠道菌群的影响研究较少。鉴于抗生素耐药性的潜在灾难性影响,未来的研究应了解微生物分类和多样性的变化,以及微生物代谢物产生的变化和驻留菌群的宏基因组潜力。
锌的每日推荐食用量
中国营养学会规定,婴幼儿(0-1岁)5毫克/天,儿童(1-10岁)10毫克/天。青春期男性15毫克/天,女性12毫克/天。
孕妇和哺乳期产妇因为母乳喂养,乳汁中的锌流失比较多,所以锌的摄入量也应多一点,每天20-25毫克。一般锌的摄入量不超过25毫克。
★ 含有锌的食物
海鲜类:如牡蛎、鱼、扇贝、虾仁等,不仅含有较多的锌元素,且含有较多的不饱和脂肪酸,有助于减少动脉硬化的发生风险,从而预防心血管疾病的发生,其中牡蛎的含锌量比较高;
肉禽类:如猪肝、瘦牛肉、猪肉、鸡肉等,通常会含有较多的蛋白质以及微量元素,如锌、铁、磷等,有助于补充锌元素以及预防缺铁性贫血的发生;
蛋类:如鸡蛋、鸭蛋中也含有一定的锌元素,还富含脂溶性维生素、磷脂等,有助于减少口唇干裂、皮炎等疾病的发生;
干果类:如花生、核桃、芝麻、蚕豆、黄豆、绿豆、板栗等,含有钙、锌等多种微量元素,以及胡萝卜素、核黄素等多种维生素和脂肪、碳水化合物,在补充锌元素的同时有助于能量的补充。
膳食锌缺乏与摄入过量都会影响肠道微生物组的组成和功能,进而影响人体正常代谢与健康。
缺锌时,肠道微生物组的改变包括α-多样性的改变、粘蛋白降解细菌丰度的下降、短链脂肪酸产生的减少以及影响碳水化合物和糖基代谢的代谢途径表达减弱。
过量摄入膳食锌的情况下,肠道微生物组变化包括α-多样性没有变化或减少,短链脂肪酸产量减少,细菌金属抗性和抗生素抗性基因的潜在增加。
未来期待更多关于锌等微量营养元素和肠道菌群互作以及影响机理的的人类试验,虽然人类膳食营养的研究中单一变量不太好控制,但是基于大人群的营养调查以及其他协变量控制情况下,去调查这些关键营养素与肠道菌群的扰动可以帮助进一步明确阐明营养在人体健康和疾病扮演的角色和作用机理,对于后续基于菌群或营养素的预防干预治疗有重要的指导价值。
主要参考文献:
Cheng J, Kolba N, Tako E. The effect of dietary zinc and zinc physiological status on the composition of the gut microbiome in vivo. Crit Rev Food Sci Nutr. 2023 Jan 23:1-20. doi: 10.1080/10408398.2023.2169857. Epub ahead of print. PMID: 36688291.
Kim B, Lee WW. Regulatory Role of Zinc in Immune Cell Signaling. Mol Cells. 2021 May 31;44(5):335-341. doi: 10.14348/molcells.2021.0061. PMID: 33986184; PMCID: PMC8175146.
Baholet D, Skalickova S, Batik A, Malyugina S, Skladanka J, Horky P. Importance of Zinc Nanoparticles for the Intestinal Microbiome of Weaned Piglets. Front Vet Sci. 2022 Jun 2;9:852085. doi: 10.3389/fvets.2022.852085. PMID: 35720843; PMCID: PMC9201420.
Chen, X., Y. Jiang, Z. Wang, Y. Chen, S. Tang, S. Wang, L. Su, X. Huang, D. Long, L. Wang, et al. 2022. Alteration in gut microbiotaassociated with zinc deffciency in school-age children. Nutrients 14 (14):2895.
Cheng, J., H. Bar, and E. Tako. 2021. Zinc status index (ZSI) for quantiffcation of zinc physiological status. Nutrients 13 (10):3399.
Chen, L., Z. Wang, P. Wang, X. Yu, H. Ding, Z. Wang, and J. Feng. 2021. Effect of long-term and short-term imbalanced Zn manipulation on gut microbiota and screening for microbial markers sensitive to zinc status. Microbiology spectrum 9 (3):e0048321.
Bombaywala, S., H. J. Purohit, and N. A. Dafale. 2021. Mobility of antibiotic resistance and its co-occurrence with metal resistance in pathogens under oxidative stress. Journal of Environmental Management 297:113315.