 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康 原创
导语:You are what you eat.
——饮食、肠道菌群与健康
肠道菌群对人体健康的影响和关联性已被广泛研究和认可,肠道菌群作为人体最重要的共生伙伴与我们的健康密切相关。影响肠道菌群的因素众多,饮食、年龄、发育、遗传、疾病、抗生素、用药、甚至激素水平和情绪压力都影响并塑造着每个人独特的肠道菌群,但是短期内,饮食内容以及饮食模式被认为是塑造肠道菌群最重要的驱动因素,长期来看,饮食也是调整和干预肠道菌群调整最有效和健康的选择方式。
肠道菌群是消化的关键组成部分,分解复杂的碳水化合物,蛋白质,并且在较小程度上分解到达下胃肠道的脂肪。该过程产生大量微生物代谢物,其可以局部和全身起作用(在被吸收到血流中之后)。这些途径都可以产生潜在有益和潜在毒性的代谢物。
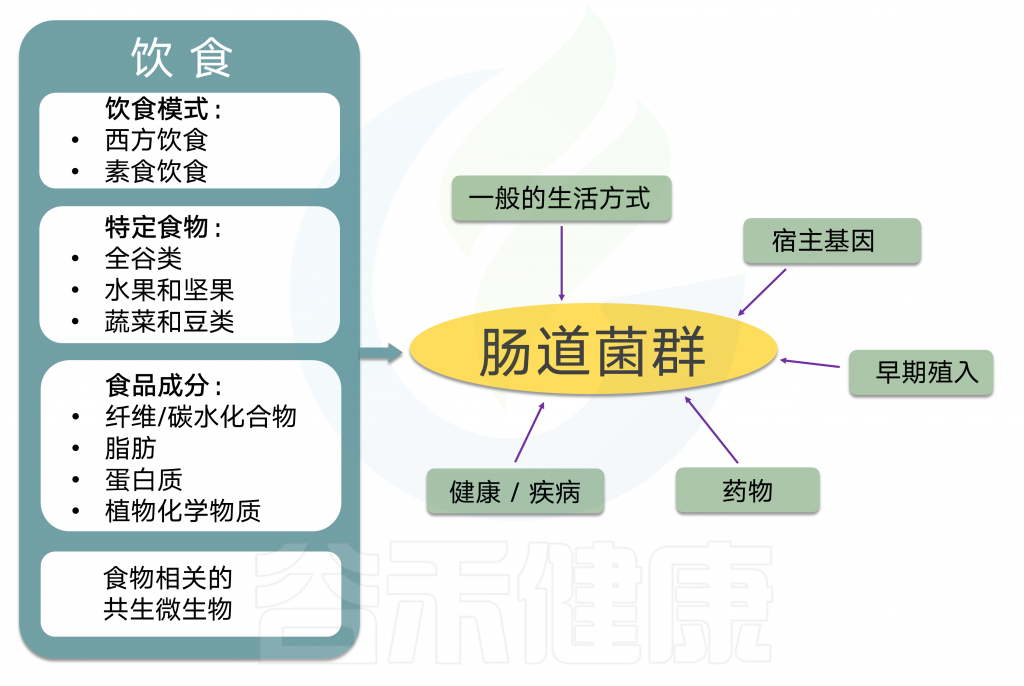
接下来,我们逐一解析各大营养物质和肠道菌群之间的关系,对人体健康会带来什么样的影响。
小贴士【全文导航】
各类营养成分
饮食模式—菌群
饮食量作为微生物调节剂
进食频率对菌群的影响
时间-饮食-菌群
饮食-菌群-健康互动的复杂性
普通膳食建议
膳食纤维
大部分食物经过小肠时吸收,但仍有一部分不能被消化吸收,主要是植物细胞壁多糖(包括纤维素,木聚糖,果胶)以及一些特定对体内水解酶无反应的多糖成分(如菊粉和寡糖),通常称为膳食纤维。膳食纤维在这里被定义为具有三个或更多个单体单元的碳水化合物聚合物。

膳食纤维对结肠屏障有重要作用,是结肠微生物的主要营养来源,经细菌酵解可以形成短链脂肪酸,对维持结肠系细胞的营养和功能完整时必需的,而且还具有排气,解毒,抗氧化,抗癌作用。
膳食纤维的发酵是盲肠和结肠微生物群的主要功能之一,也是短链脂肪酸的主要来源,短链脂肪酸是发酵的最终产物。
膳食纤维摄入增加时,胃肠运输速度增快,肠腔内细菌数量因营养物质增加而增多,从而使短链脂肪酸的含量明显增加,肠腔内PH值下降,影响肠腔内特定菌群的定植和生长。
膳食纤维主要有以下几类:
菊粉
一些研究表明菊粉通常与其他纤维结合从而对人体肠道微生物群组成产生影响。
菊粉或与减轻腹泻有关
一项研究调查了菊粉和部分水解瓜尔胶(i-phgg)或麦芽糊精混合物对60名便秘妇女肠道微生物群的影响。其中纤维组梭状芽孢杆菌(某些种类与腹泻有关)总数减少。
食用菊粉后双歧杆菌增加
在另一项研究中,从全球洋蓟(cynara scolymus)中提取的长链菊粉被给予健康志愿者。这项研究持续了3周,经过3周的缓冲期后,受试者又服用了3周的麦芽糊精(安慰剂)。总细菌水平不受干预影响。然而,与基线水平和麦芽糖糊精摄入后相比,食用菊粉后双歧杆菌数量显著增加。而且,食用菊粉后乳酸杆菌/肠球菌的数量更高,而食用麦芽糖糊精后则有所下降。另外,阿托波氏菌属的丰度增加,拟杆菌/普氏杆菌组的数量减少。SCFA浓度无差异。
此外,Lecerf等人还研究了菊粉和低聚木糖的影响。.在一项随机交叉研究中,60名健康受试者被给予木糖低聚糖、菊粉和木糖低聚糖以及小麦麦芽糖糊精的混合物4周。与麦芽糖糊精相比,仅木糖低聚糖就能提高双歧杆菌和丁酸盐的粪便浓度。此外,A-葡萄糖苷酶和B-葡萄糖醛酸酶活性较高,而乙酸和R-甲酚的粪便浓度较低。菊粉和低聚木糖的组合增加了粪便中的短链脂肪酸和丙酸盐,同时降低了血液中的脂多糖浓度。
抗性淀粉
淀粉可能逃过小肠的消化,到达结肠发酵。这种抗性淀粉通常被称为物理不可接近淀粉(RS1)、天然颗粒淀粉(RS2)、逆反应淀粉(RS3)或化学改性淀粉(RS4)

抗性淀粉促进布氏瘤胃球菌生长
一项随机交叉研究,包括14名超重男性,研究了在10周内服用RS3的效果。在特定饮食中,个体的细菌分布随时间的推移是恒定的。大多数研究对象在RS饮食中,布氏瘤胃球菌Ruminococcus bromii的丰度增加,该菌比例高达17%,而在含有麦麸的非淀粉多糖(NSP)饮食中为3.8%。未培养的颤杆菌克Oscillibacter和直肠真杆菌的水平也随着含有RS的饮食而增加。
在另一项关于RS的研究中,10名受试者被给予RS2、RS4或天然淀粉作为饼干,持续3周。RS4导致放线菌和类杆菌数量增加,而厚壁菌门数量降低。在种水平上,青春双歧杆菌Bifidobacterium adolescentis和迪氏副拟杆菌Parabacteroides distasonis的比例随RS4的增加而增加,而RS2则较RS4提高了布氏瘤胃球菌Ruminococcus bromii和直肠真杆菌的比例。个体差异较大,变化是可逆的,且与消耗的RS相关。
综上这两项研究的结果表明,食物中RS可能对布氏瘤胃球菌Ruminococcus bromii和直肠真杆菌有促进生长的作用,但这种作用可能取决于所使用的RS的类型。
低聚果糖和低聚半乳糖
无法在小肠中被酶解吸收,到达结肠后可产生SCFA,降低肠道pH值,具有促进双歧杆菌、乳杆菌等有益菌增殖,抑制肠杆菌、沙门菌等有害菌肠道内定植和繁殖的生理功能。
在一项前瞻性、双盲、随机、交叉试验中,健康志愿者每2周食用液体配方食品。一种配方食品含有由低聚果糖和豌豆纤维组成的膳食纤维,而另一种配方食品不含添加纤维。
在研究开始和两个干预期(6周)之间,志愿者们消耗他们的习惯性饮食。除双歧杆菌比例随纤维补充饮食增加而增加外,两个饮食期后所有靶向细菌种类均减少。
无论饮食的纤维含量如何,普氏栖粪杆菌Faecalibacterium prausnitzii和Roseburia intestinalis水平均降低,而拟杆菌的减少只发生在无纤维饮食。
无纤维饮食后,粪便短链脂肪酸(乙酸、丙酸和丁酸)浓度降低,而补充纤维饮食后,丁酸盐浓度也降低。
在一项双盲安慰剂对照交叉研究中,超重的成年人被喂食半乳糖(GOS)或麦芽糊精(安慰剂)混合物12周。在6周和12周后,含GOS的饮食增加了粪便中双歧杆菌的数量,而与安慰剂组相比,拟杆菌属(Bacteroides sp .)和梭菌(Clostridium histolitycum group)的数量同时减少。
聚葡萄糖
在持续21天的对照研究中,检测了聚葡萄糖(PDX)摄入对肠道微生物群的影响。每天志愿者食用三个小吃棒,提供PDX,可溶性玉米纤维或无纤维(对照)。与对照条相比,摄入PDX和可溶性玉米纤维导致梭菌科增多,优杆菌科减少。粪杆菌属Faecalibacterium,考拉杆菌属Phascolarctobacterium和戴阿利斯特杆菌属Dialister的水平较高,而对于乳杆菌,仅在可溶性玉米纤维消耗后才观察到这种效应。
普氏栖粪杆菌Faecalibacterium prausnitzii的数量也增多了。这种菌是丁酸盐生产者,以其抗炎特性而闻名。
处理前后,厚壁菌是最丰富的细菌群(93%),而纤维素消耗后,放线菌的丰度减少。
另一项对照研究,包括接受PDX治疗3周的健康人类受试者,结果显示,已知生产丁酸盐的菌Ruminococcus intestinalis的数量和Clostridium I,II和IV菌数量增加,而与接受麦芽糖糊精的安慰剂组相比,乳杆菌/肠球菌比例降低。肠道菌群变化持续了10周。
阿拉伯木聚糖

在一项前瞻性、双盲、随机、交叉试验中,健康志愿者每2周食用液体配方食品。一种配方食品含有由低聚果糖和豌豆纤维组成的膳食纤维,而另一种配方食品不含添加纤维。
在研究开始和两个干预期(6周)之间,志愿者们消耗他们的习惯性饮食。除双歧杆菌比例随纤维补充饮食增加而增加外,两个饮食期后所有靶向细菌种类均减少。
无论饮食的纤维含量如何,普氏栖粪杆菌Faecalibacterium prausnitzii和Roseburia intestinalis水平均降低,而拟杆菌的减少只发生在无纤维饮食。
无纤维饮食后,粪便短链脂肪酸(乙酸、丙酸和丁酸)浓度降低,而补充纤维饮食后,丁酸盐浓度也降低。
在一项双盲安慰剂对照交叉研究中,超重的成年人被喂食半乳糖(GOS)或麦芽糊精(安慰剂)混合物12周。在6周和12周后,含GOS的饮食增加了粪便中双歧杆菌的数量,而与安慰剂组相比,拟杆菌属(Bacteroides sp .)和梭菌(Clostridium histolitycum group)的数量同时减少。
聚葡萄糖
在持续21天的对照研究中,检测了聚葡萄糖(PDX)摄入对肠道微生物群的影响。每天志愿者食用三个小吃棒,提供PDX,可溶性玉米纤维或无纤维(对照)。与对照条相比,摄入PDX和可溶性玉米纤维导致梭菌科增多,优杆菌科减少。粪杆菌属Faecalibacterium,考拉杆菌属Phascolarctobacterium和戴阿利斯特杆菌属Dialister的水平较高,而对于乳杆菌,仅在可溶性玉米纤维消耗后才观察到这种效应。
普氏栖粪杆菌Faecalibacterium prausnitzii的数量也增多了。这种菌是丁酸盐生产者,以其抗炎特性而闻名。
处理前后,厚壁菌是最丰富的细菌群(93%),而纤维素消耗后,放线菌的丰度减少。
另一项对照研究,包括接受PDX治疗3周的健康人类受试者,结果显示,已知生产丁酸盐的菌Ruminococcus intestinalis的数量和Clostridium I,II和IV菌数量增加,而与接受麦芽糖糊精的安慰剂组相比,乳杆菌/肠球菌比例降低。肠道菌群变化持续了10周。
阿拉伯木聚糖
对健康成年人食用含有阿拉伯低聚糖(AXOS)的面包进行了对照研究。为了干预,将木聚糖内酯酶制剂加入到小麦/黑麦面包的面团中,得到平均聚合度为18。安慰剂面包含有阿拉伯木聚糖,平均聚合度为174。
安慰剂治疗后,拟杆菌/直肠真杆菌和 罗氏-真杆菌(Roseburia – Eubacterium) /普氏栖粪杆菌 比例更高。
食用添加AXOS的面包后,细菌总数和粪便丁酸盐含量增加,而分支链短链脂肪酸的浓度降低,同时,蛋白质发酵减少。
此外,一项随机的安慰剂对照的交叉研究检查了服用AXOS或麦芽糖糊精(安慰剂)的效果。与基线水平相比,摄入AXOS后(但3周后食用安慰剂后)双歧杆菌水平增加。细菌总数,乳酸杆菌,罗氏-直肠真杆菌或肠杆菌没有变化。在AXOS饮食后,尿液中的甲酚(一种细菌代谢物)含量较高。
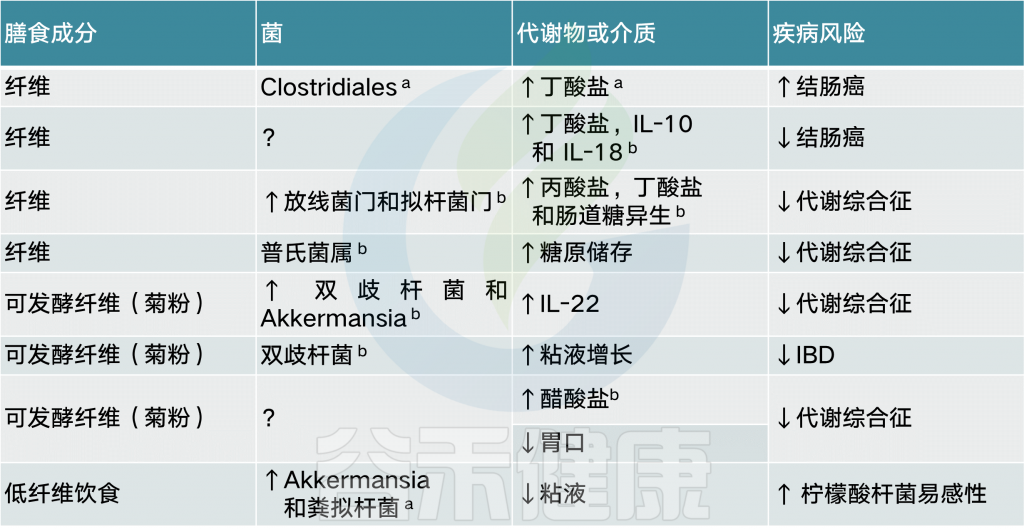

总的来说,具有不同化学成分的膳食纤维似乎能够刺激产丁酸盐菌的生长和活性,例如Roseburia、直肠真杆菌和普氏栖粪杆菌。此外,摄入纤维后,双歧杆菌和乳酸杆菌的数量增加,并经常出现拟杆菌向副拟杆菌的转变。肠道中较高浓度的丁酸盐可能有益于局部和全身健康。
综上,我们已经了解到膳食纤维对身体健康的益处,那么假设不吃膳食纤维,会发生什么后果呢?
一项研究构建了无菌小鼠,研究人员定制了3种食物:含有15%纤维的食物;富含可溶性纤维的食物(类似于膳食补充剂);不含有纤维的食物。他们以不同的食物喂养试验小鼠,并用大肠杆菌感染它们。
不吃膳食纤维,肠道菌群会吃你
结果发现:富含15%纤维的食物喂养的小鼠,它们肠道被感染的程度最轻。因为它们肠道黏液层较厚,可以防御细菌入侵。但是,如果小鼠摄取的是不含有纤维的食物,它们体内的肠道菌群会因为饥饿而“吃”黏液。一旦长期缺乏纤维,肠道菌群甚至于会“吃”肠壁。而且,使用富含可溶性纤维食物(类似膳食补充剂)的小鼠,它们体内的肠道菌群依然会呈现出“饥饿”状态。

碳水化合物
那些富含淀粉的食物,是我们平时摄入碳水化合物的主要来源,比如大米、小麦、玉米等谷物、土豆等薯类。

大肠中的细菌主要依赖于在上消化道中未消化的膳食底物以存活。糖分解细菌发酵通常产生有益的代谢产物,而如果碳水化合物含量有限,细菌转向替代能源,导致其他代谢产物的产生,这可能对人类健康更有害。膳食碳水化合物发酵后的关键细菌发酵产物是短链脂肪酸和气体。
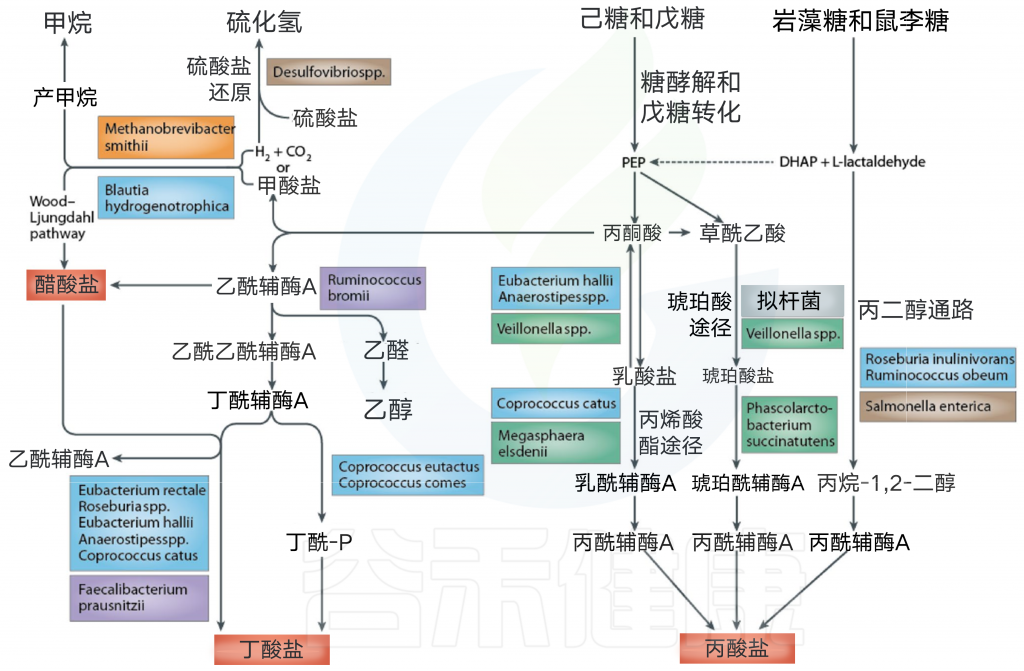
细菌发酵产物之一 短链脂肪酸
粪便中检测到的三种最丰富的SCFA是乙酸盐,丙酸盐和丁酸盐。
丁酸盐潜在的抗癌活性
丁酸盐可以说是最重要的。它能通过抑制组蛋白去乙酰化酶诱导结肠癌细胞凋亡及其调节基因表达的能力,形成人类结肠细胞的关键能量来源,并具有潜在的抗癌活性。还有证据表明丁酸盐可通过cAMP依赖性机制激活肠道糖异生(IGN),对葡萄糖和能量稳态有益。
丙酸盐与减肥有关
丙酸盐也是上皮细胞的能量来源,但也转移到肝脏,在肝脏中它也在糖原异生中起作用。由于与肠道受体(G蛋白偶联受体,GPR)GPR 41和GPR 43(也称为脂肪酸受体FFAR2和FFAR3)相互作用,它也越来越被认为是饱腹感信号中的重要分子。在肠道糖异生中丙酸转化为葡萄糖通过减少肝葡萄糖的产生直接促进能量稳态,从而减少肥胖。
细菌成长离不开乙酸盐
乙酸盐是最丰富的SCFA,是其他细菌生长的必需辅因子/代谢物。例如,在没有乙酸盐的情况下,普氏栖粪杆菌Faecalibacterium prausnitzii不会在纯培养物中生长。
细菌交叉喂养
细菌产生中间发酵产物,包括富马酸盐,琥珀酸盐和乳酸盐,但由于其它细菌广泛利用它们,这些产物通常在健康个体的粪便中被检测到低水平。例如,乳酸通常被其他细菌转化为丙酸盐或丁酸盐,因此在成年粪便中以可忽略的水平存在。
然而,在患有溃疡性结肠炎的患者中,乳酸可以被检测到显着更高的量,并且可能是疾病的指标。共培养交叉饲喂研究说明了细菌相互作用对最终短链脂肪酸检测的影响。由长双歧杆菌在纯培养物中生长的果寡糖(FOS)产生的乳酸盐在与Eubacterium hallii的共培养中完全消失,且单独的E. hallii不能在碳水化合物底物上生长,被显著的丁酸盐水平所取代。
乙酸盐刺激了Roseburia intestinalis的生长,并且与不同的长双歧杆菌菌株共培养,果寡糖上的Roseburia intestinalis生长推迟,直到由长双歧杆菌产生的足够的乙酸盐积累在生长培养基中。
脂肪
脂类在小肠消化吸收的比例较大,粪便中测得的脂肪酸只有7%左右。但有关高脂饮食-肠道菌群相关研究越来越引人注目。

高脂肪含量的食物富含磷脂酰胆碱和胆碱,肠道细菌能将其转化成三甲胺,氧化的三甲胺进入血液可导致动脉粥样硬化,从而引发心血管疾病。
高脂饮食引起的菌群失调可能与其促胆汁酸分泌有关
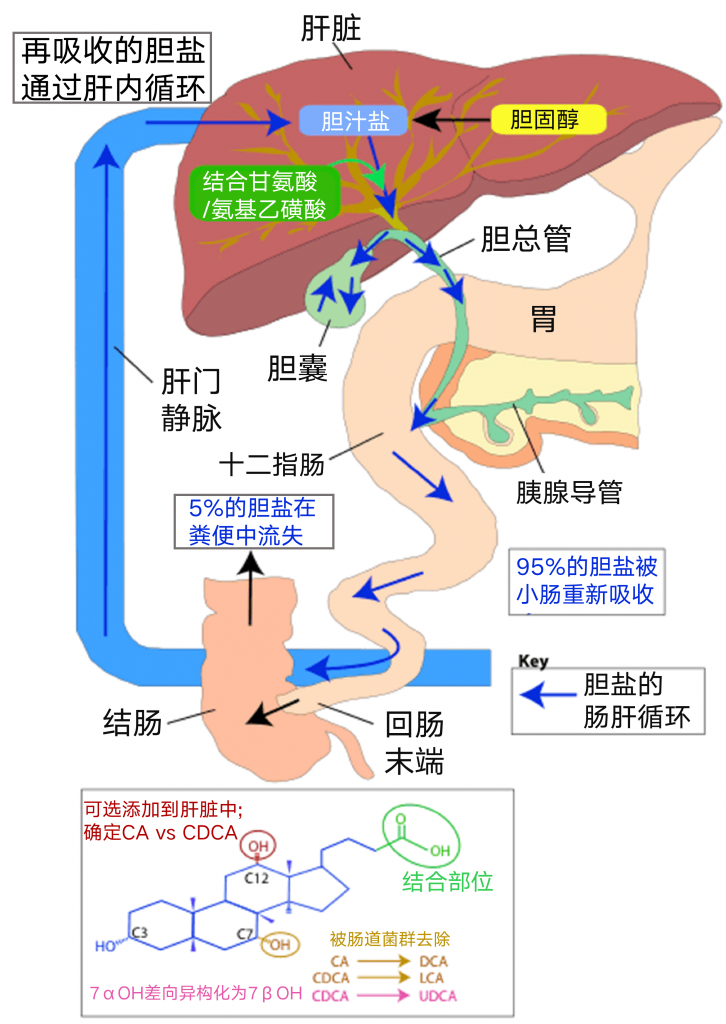
脂肪量和质量可能影响肠道微生物群组成。胆汁酸是膳食影响菌群构成的重要因素之一,在消化、吸收脂类,以及清除、排泄机体产生的诸多废物等发面发挥重要作用。
来自人类干预研究的初步数据表明,膳食脂肪通过其对胆汁酸分泌以及胆汁酸组成的影响间接调节肠道菌群的组成。
高脂肪摄入会刺激胆汁酸的分泌并增加粪便中二级胆汁酸的浓度,如脱氧胆酸(DCA)。由于它们具有选择性的抗菌活性,胆汁酸如DCA可以介导脂肪诱导的肠道菌群改变。
在最近的一项短期干预研究中,高脂肪,以动物为基础的饮食显着增加粪便DCA浓度并改变微生物群组成,导致耐胆汁酸细菌增加。
脂肪也有好坏之分
高饱和和反式脂肪饮食被认为会通过提高血液总胆固醇和低密度脂蛋白胆固醇来增加心血管疾病的风险。另一方面,促进健康的脂肪,如单不饱和脂肪和多不饱和脂肪,对减轻慢性疾病的风险至关重要。
为了你的身体正常运转,你需要在饱和和不饱和脂肪之间保持稳定和平衡的供应。
几项人体研究表明,高脂肪饮食会增加厌氧菌总数和拟杆菌计数。让受试者食用不同脂肪含量的饮食。研究者指出,与基线水平相比,低脂肪饮食的摄入导致拟杆菌丰度增加,同时空腹血糖和总胆固醇降低。另一方面,高饱和脂肪饮食增加了普氏栖粪杆菌Faecalibacterium prausnitzii的相对比例。
最后,摄入高单不饱和脂肪的受试者并没有经历任何细菌属相对丰度的变化,但总体上确实降低了总细菌负荷、血浆总胆固醇和低密度脂蛋白胆固醇。
对大鼠的研究表明,摄入高脂肪食物会导致肠道乳酸菌数量显著减少,而产丙酸盐和乙酸盐的菌(包括梭状芽孢杆菌、拟杆菌和肠杆菌)则不成比例地增多。此外,肠道乳酸杆菌的丰度与大鼠脂肪量和体重呈负相关。
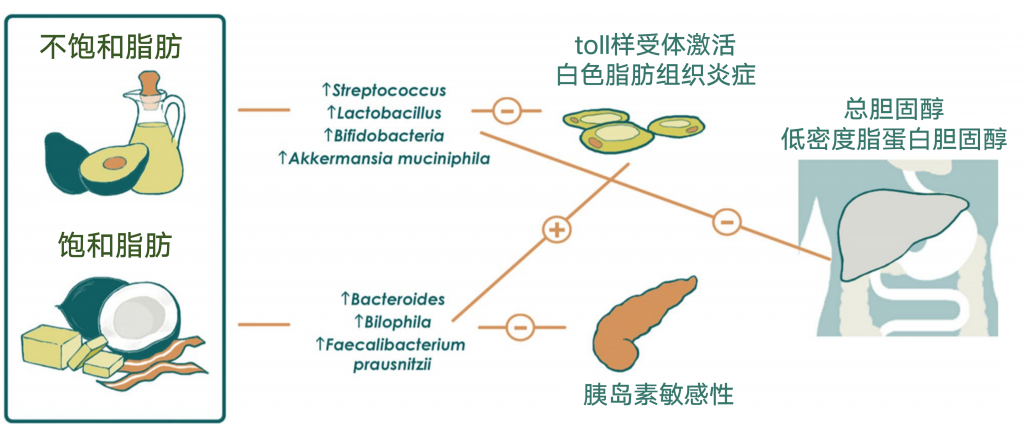
饱和脂肪促进代谢紊乱
猪油源性和鱼油源性脂质的比较显示,猪油喂养小鼠的拟杆菌和嗜胆菌属增多,用鱼油来源喂养的小鼠放线菌(双歧杆菌和Adlercreutzia)、乳酸菌(乳酸杆菌和链球菌)和Akkermansia muciniphila增加。
此外,与食用鱼油的小鼠相比,食用猪油的小鼠的全身TLR活化、白色脂肪组织炎症和胰岛素敏感性受损。作者证明,至少部分原因是由于两组间肠道菌群不同。结果表明,饮食中富含饱和脂肪的小鼠肠道菌群可能通过TLR信号在挑战时促进代谢紊乱。
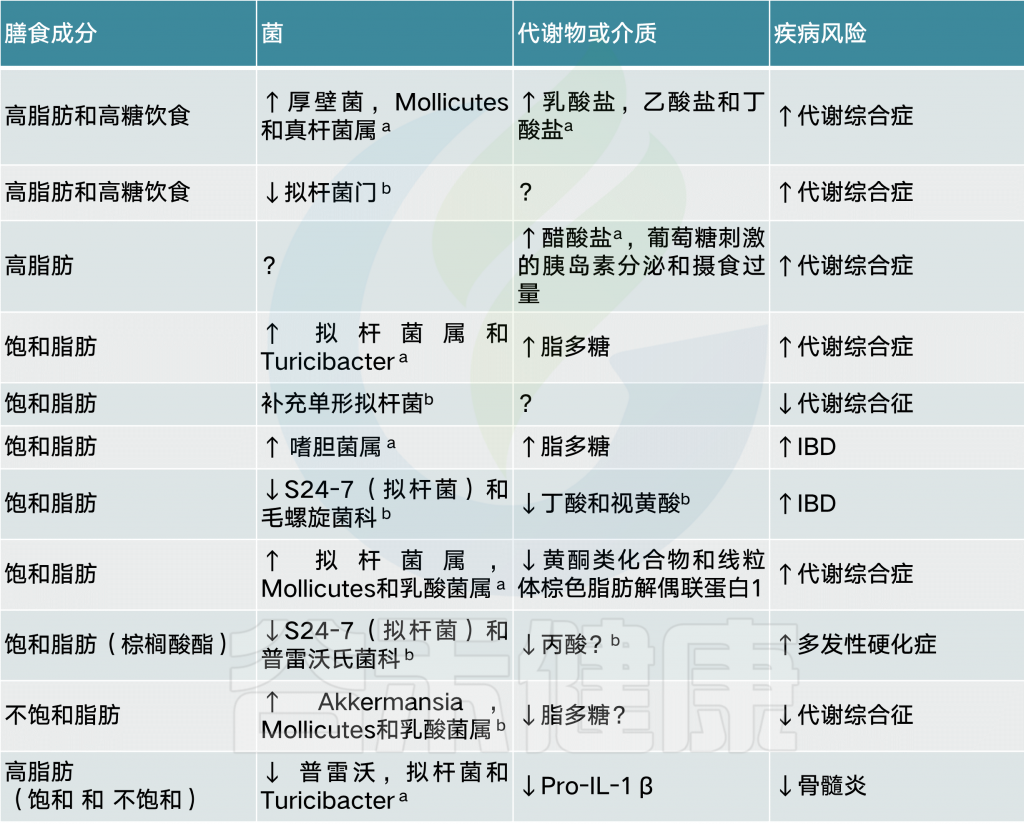
另外还有第三类脂肪包括氢化脂肪,这是一种人工处理后的脂肪,天然食物中并不存在,比如油炸的快餐食品和人造黄油等,通常是不健康的应该避免食用。
蛋白质
食物中的蛋白质的消化产物主要是氨基酸以及一些小肽,约有95%经过胃和小肠被消化吸收,未吸收的氨基酸以及未消化的蛋白质在大肠下部,经大肠杆菌的作用,即腐败作用,产生一系列产物。

大多数的研究指出,蛋白质消耗与总微生物多样性相关。例如,关于乳清和豌豆蛋白提取物,已报道可提高肠共生双歧杆菌和乳酸杆菌,而乳清另外降低了致病脆弱拟杆菌和产气荚膜梭菌 。豌豆蛋白也被观察到增加肠道短链脂肪酸(SCFA)水平,这被认为是抗炎的并且对维持粘膜屏障很重要。
一项研究给无菌小鼠肠道接种10种细菌,并给予不同组合的单糖(蔗糖)、多糖(玉米淀粉)、脂肪(玉米油)和蛋白质(酪蛋白),结果发现随着酪蛋白浓度增加,细菌总数增加,有7种细菌数量与酪蛋白呈正相关,3种细菌呈负相关。数量与酪蛋白浓度呈正相关的细菌多形拟杆菌、卵形拟杆菌、粪拟杆菌均属于拟杆菌属,占细菌总数绝大部分。
此外,摄入红肉促进的几种微生物也与三甲胺-N-氧化物(TMAO)水平升高有关,三甲胺-N-氧化物是一种致动脉粥样化合物,可增加心血管疾病的风险。
【 注:红肉是营养学上的概念,指的是在烹饪前呈现岀红色的肉,含有很高的饱和脂肪。如猪肉、牛肉、羊肉、鹿肉、兔肉等所有哺乳动物的的肌肉、内脏及其制品都是红肉。
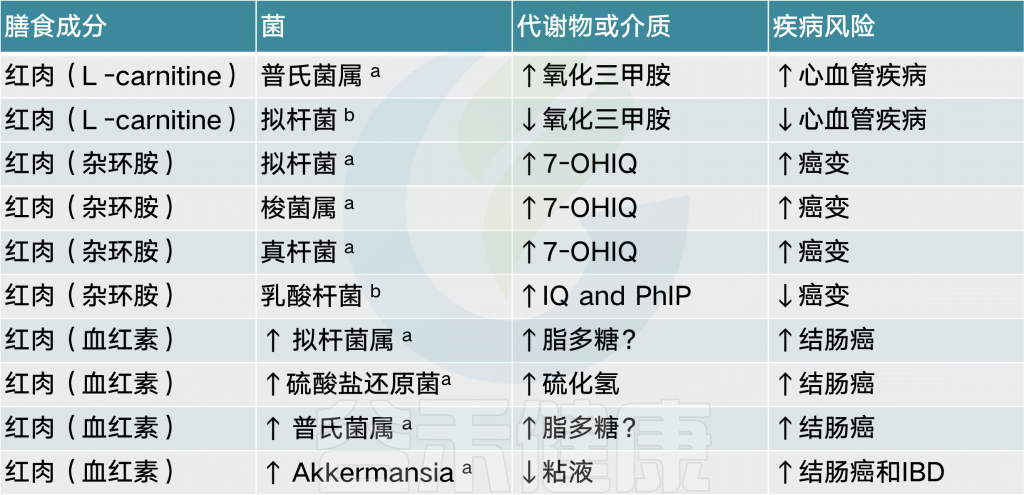
有证据表明,芳香族氨基酸(苯丙氨酸,酪氨酸和色氨酸)可以发酵成苯基丙醇代谢物,苯乙酸和4-羟基苯乙酸,它们在粪便中含量很高。所涉及的包括几种拟杆菌,Eubacterium hallii和Clostridium barlettii.
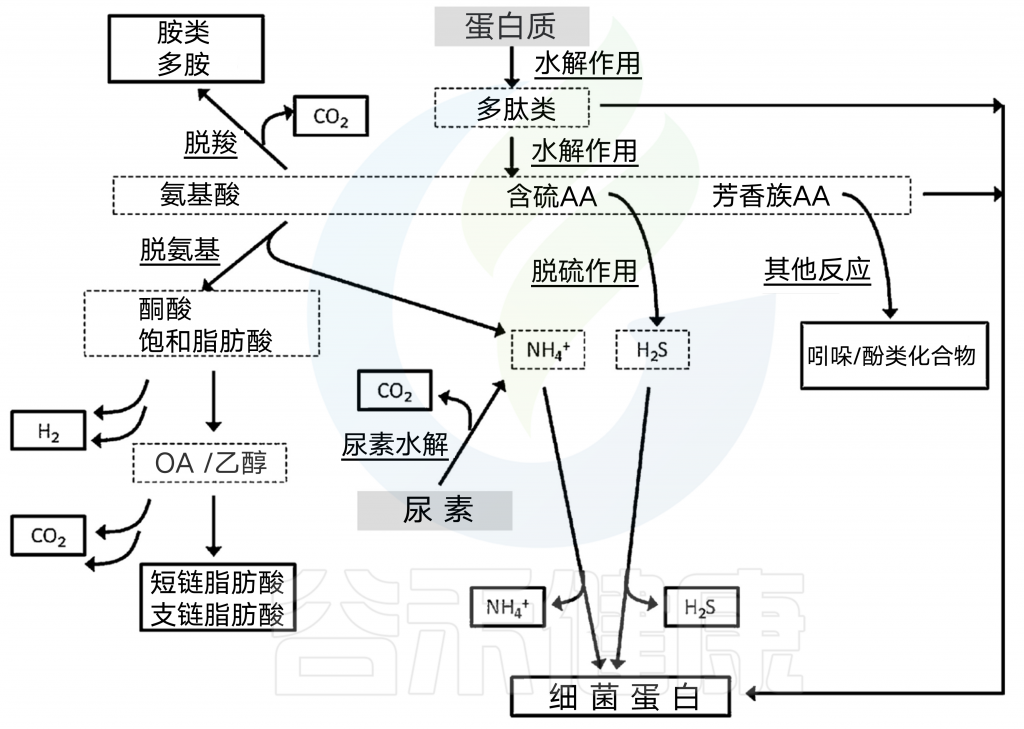
宿主对蛋白质的消化率比碳水化合物和脂肪的消化率变数更大,受先前提到的食品加工因素、大量营养素比率和转运时间的影响,这也导致不同氨基酸组成可以供肠道微生物群利用。
氨基酸发酵所需的额外的相互转化步骤产生了大量的代谢产物。对宿主有毒的化合物可由此过程产生,包括胺、酚/吲哚和含硫化合物。当然并非所有的氨基酸都会发酵成有毒的产品;事实上,最丰富的终产物是SCFAs.
氨基酸分解代谢两个步骤:要么脱氨生成羧酸加氨,要么脱羧生成胺加二氧化碳。脱氨基会产生高浓度的SCFAs.
接下来的步骤取决于氨基酸起始底物的种类,大多数最终会产生三羧酸循环中间体、丙酮酸盐或辅酶A-连接的SCFA前体。
人体肠道微生物群发酵氨基酸的主要产物

植物源生物活性营养素
植物,除了纤维,还为人类饮食提供了许多生物活性化合物。多酚是一大类不同的化合物,多存在于一些常见的植物性食物,如红酒、大豆、番茄、葡萄、绿茶等,其中一些有益于健康。
例如,给高脂饮食喂养的小鼠补充来自葡萄或蔓越莓的多酚,减少了炎症和饮食带来的致肥效果。这与
Akkermansia muciniphila菌的大量增加有关。

但由于对化合物的反应具有相当大的个体间差异,因此很难分析多酚对人类,特别是黄酮类化合物的健康影响,这可能源于肠道菌群的差异。
研究用高脂饮食喂养的小鼠,由于低膳食可用性和类黄酮降解共生物的增加,肠道中的黄酮类芹菜素和柚皮素水平显著减少。将高脂饮食喂养的小鼠转换为正常的多糖饮食使其代谢参数正常化,但不是它们的肠道菌群组成,其持续降解这些类黄酮,导致类黄酮水平低。由于成功节食的小鼠被重新喂养高脂饮食,低黄酮类水平充当“微生物群记忆”,通过影响棕色脂肪组织的热量产生进一步加剧高脂饮食喂养小鼠的代谢作用。用膳食芹菜素和柚皮素补充节食小鼠,可以通过补充其调节能量消耗的能力来防止加剧的体重恢复。

植物来源化合物如何与尿路结石风险增加有关?
通过肠道菌群改变为与健康有益的形式的其他植物化合物的实例包括羟基肉桂酸咖啡酸,香豆酸和阿魏酸,它们作为植物中的酯共轭物存在,并以其自由化学形式被认为是抗炎和抗氧化的。双歧杆菌,乳酸杆菌和埃希氏菌属的成员能够从共轭植物形态中释放出来,从而影响这些生物活性化合物的个体化水平。
与此同时,肠道菌群会降解其他有毒植物来源的化合物,如草酸盐,其中富含几种绿色,坚果,浆果和茶,并形成可能导致肾结石形成的草酸钙晶体。 在分解代谢草酸盐的细菌中,产甲酸草酸杆菌Oxalobacter formigenes是一个关键的参与者,该分类群的低丰度与尿草酸盐浓度升高和人类尿路结石风险增加有关。
各种食物中存在的膳食多酚类型
以及导致降解的微生物的类型

膳食多酚除了具有全身抗菌和代谢功能外,还具有抑制肠道细菌的作用。
维生素
维生素是人体健康必需的小分子物质,近年的研究发现这些小分子物质对肠道菌群的组成有一定的影响。

通过肠道菌群产生甲基萘醌,叶酸,钴胺素和核黄素,以满足其自身的能量和代谢需求。
维生素K在血液凝固,骨代谢以及可能的胰岛素敏感性中起关键作用。广泛的抗生素治疗降低肝脏维生素K2浓度,肠道菌群是维生素K的重要来源。
维生素B9是参与细胞分裂的必需维生素,这种维生素缺乏与癌症,贫血症的高风险相关和胚胎发育过程中的神经管缺陷。
维生素B12是一种代谢辅助因子,其缺陷导致老年人痴呆症和心血管疾病的风险增加。
维生素B2是辅因子黄素腺嘌呤二核苷酸(FAD)和黄素单核苷酸(FMN)的前体。其缺乏与神经肌肉和神经系统疾病,癌症和李斯特菌感染的易感性有关。
一项研究通过问卷形式计算非洲裔美国人和美国白人的饮食组成,结果显示非洲裔美国人杂环胺的摄入较高,维生素的摄入较少,并且与两个种族粪便微生物组成差异相关。维生素D摄入不足或缺乏可引起肠道菌群组成的改变。
另有研究表明,补充维生素D3可改变上消化道(胃体、胃窦和十二指肠)的肠道微生物群。γ-变形杆菌相对丰度降低,包括假单胞菌属和大肠杆菌/志贺氏杆菌属,细菌丰度增加。
食品添加剂
在过去的几十年里,人类饮食的主要变化之一是加工食品的增加,这些食品通常含有合成的或天然的添加剂,如防腐剂、甜味剂、乳化剂和强化剂。这些添加剂通常被食品监管机构认为是安全的,依据是批准时公布的科学证据。
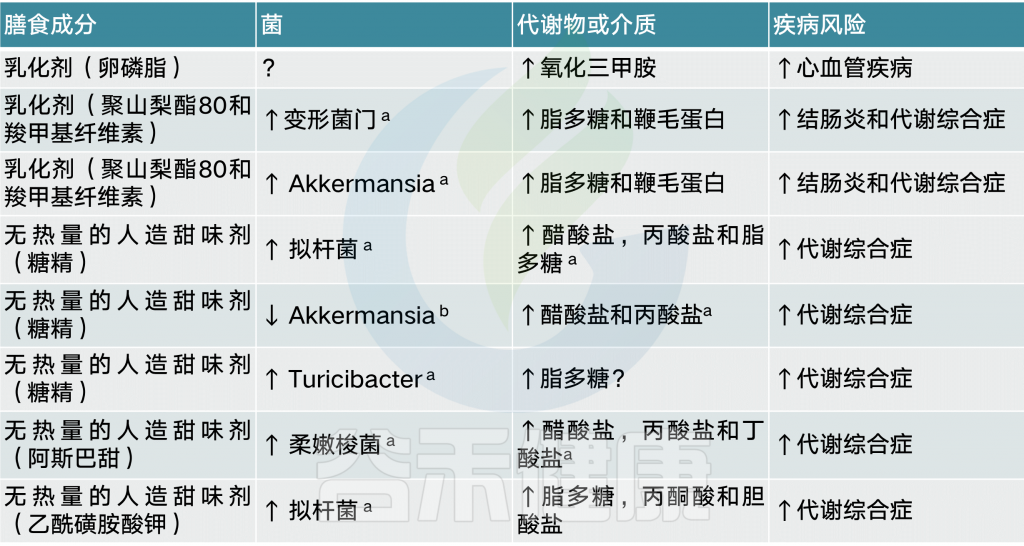
膳食乳化剂导致菌群失调引起炎症

许多食品(如工业生产的番茄酱)中都添加了膳食乳化剂,以保持油和水的乳剂。一项研究表明,低剂量的两种常见乳化剂,羧甲基纤维素和聚山梨酯-80,会使小鼠菌群失调,从而诱发低度炎症、代谢综合征和结肠炎。当对这些化合物的反应在人类肠道菌群培养中进行分析时,检测到了生物活性鞭毛蛋白水平的升高,其原因可能是菌群失调,也可能是细菌基因表达发生了改变。
另一种乳化剂是磷脂酰胆碱(一种卵磷脂)。与l-肉碱和其他胆碱分子一样,卵磷脂被肠道微生物群转化为TMA,从而增加TMAO水平和CVD1的风险
菌群决定无热量的人造甜味剂对人有益or有害

另一种常用的食品添加剂是无热量的人造甜味剂,它被推广为一种常见的减肥策略,通过将含有高热量糖的食物和饮料换成无热量的甜味替代品,来限制饮食中摄入的热量。
在人类的观察研究和啮齿类动物的干预中,对这种方法的疗效的研究显示出混合的和相互矛盾的结果:一些研究显示了无热量的人造甜味剂对减肥有益,而另一些研究报告了无热量的人造甜味剂促进增重和其他相关的代谢紊乱。

无热量的人造甜味剂与葡萄糖不耐受有关
有几项研究报告了啮齿动物在食用糖精、三氯蔗糖阿斯巴甜、甜蜜素、新甜和阿昔单胺钾等无热量的人造甜味剂时,其代谢平衡失调和菌群破坏。对改变的微生物组或其分泌的代谢物的基因含量进行的功能分析表明,人造甜味剂诱导的生态失调通向代谢表型,对于糖精,通过将引用糖精的小鼠菌群移植到GF幼鼠中,表现出同样葡萄糖不耐受。从而将无热量的人造甜味剂和葡萄糖不耐受建立直接联系。
无热量的人造甜味剂与提高能源收获能力有关
有趣的是,在两项针对不同无热量的人造甜味剂(糖精和阿斯巴甜)的啮齿类动物研究中,消耗量与醋酸和丙酸盐水平的增加有关,这表明无热量的人造甜味剂改变的肠道微生物群的能量收获能力增加。
在一项小规模的人体干预试验中,糖精摄入后葡萄糖稳态的破坏在一些参与者中很明显,但不是所有的参与者中都存在,这与他们接触糖精前和糖精诱导的菌群组成的改变有关(每天补充120mg糖精,6天,7人)
以上结果表明,无热量的人造甜味剂摄入对健康影响的相反结果源于参与者自身菌群的差异(通过鉴定菌群的敏感性特征)。由此,对于用无热量的人造甜味剂替代高热量甜味剂,我们可以区分哪些人可以从中获益,哪些人应该避免。
矿物质
大量补铁或有菌群失调风险
众所周知,补充铁是预防和治疗贫血的常用方法,尤其是婴儿。然而,细菌尤其是一些病原体是高效的铁清除剂。因此,补充铁可能导致菌群失调和病原体大量繁殖
类似的,在饮食中补充锰会增加心脏的细菌定植,增加小鼠金黄色葡萄球菌感染的致死率,这可能是由于细菌利用锰来保护机体免受活性氧和中性粒细胞的杀灭。
以上所有都是讨论食物中的某种营养成分,但我们日常生活中,每天吃很多种类的食物,多种食物的组合互相协同,我们可以探讨下不同的饮食模式和肠道菌群之间的关系,以及对健康的影响。
饮食模式-菌群
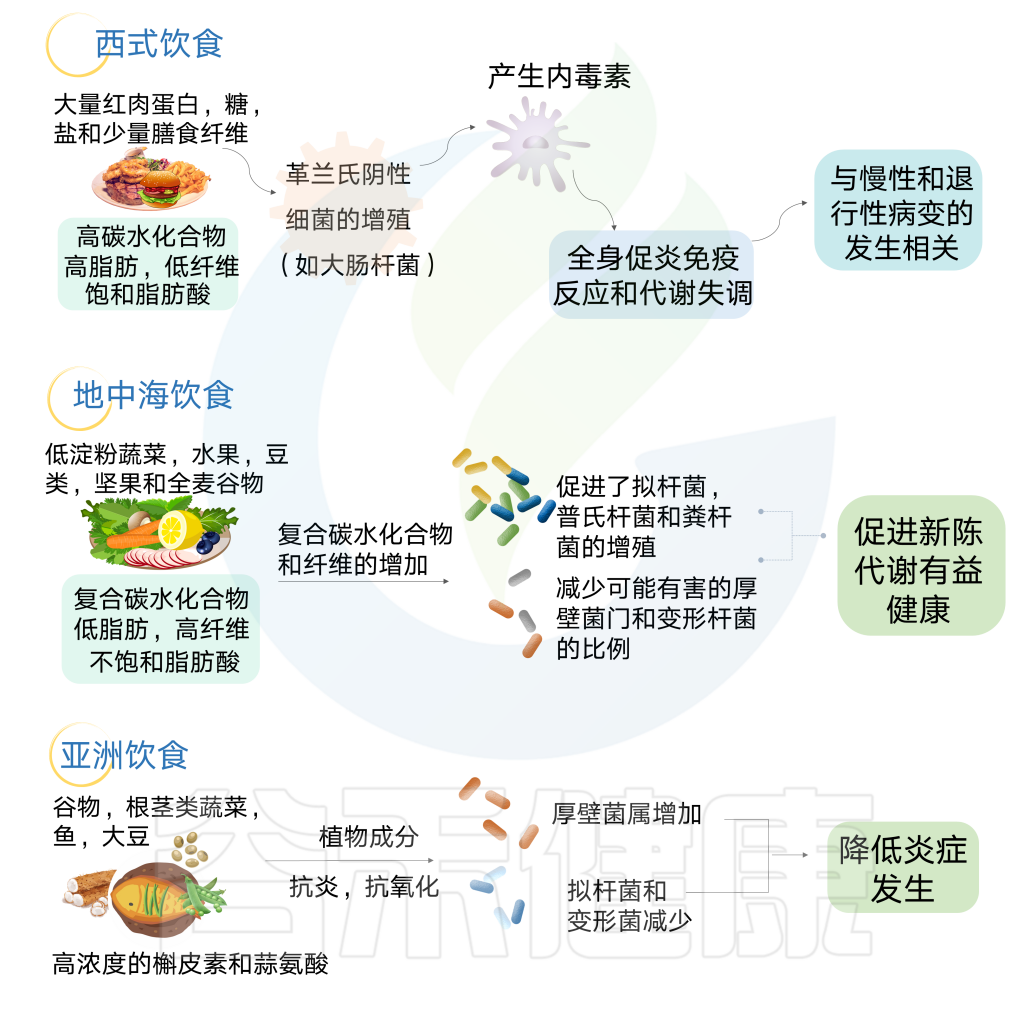
地中海饮食法
地中海饮食主要是植物性饮食。地中海饮食强调食用蔬菜、水果、蔬菜、坚果和橄榄油等“健康”脂肪。还有一个重点是利用香料和其他调味品来代替盐的使用。饮食的另一个重要组成部分是限制加工食品中的碳水化合物。
在一项小型研究中,与同样饮食的男性相比,女性在地中海饮食后的食欲和饥饿感下降幅度更大,这可能是由于该饮食中纤维含量增加所致。如果遵循正确的饮食习惯,这种饮食中的纤维含量高,动物源的脂肪含量低,加工食品中的碳水化合物含量低,盐含量低。
不同饮食特点的肠道菌群特征
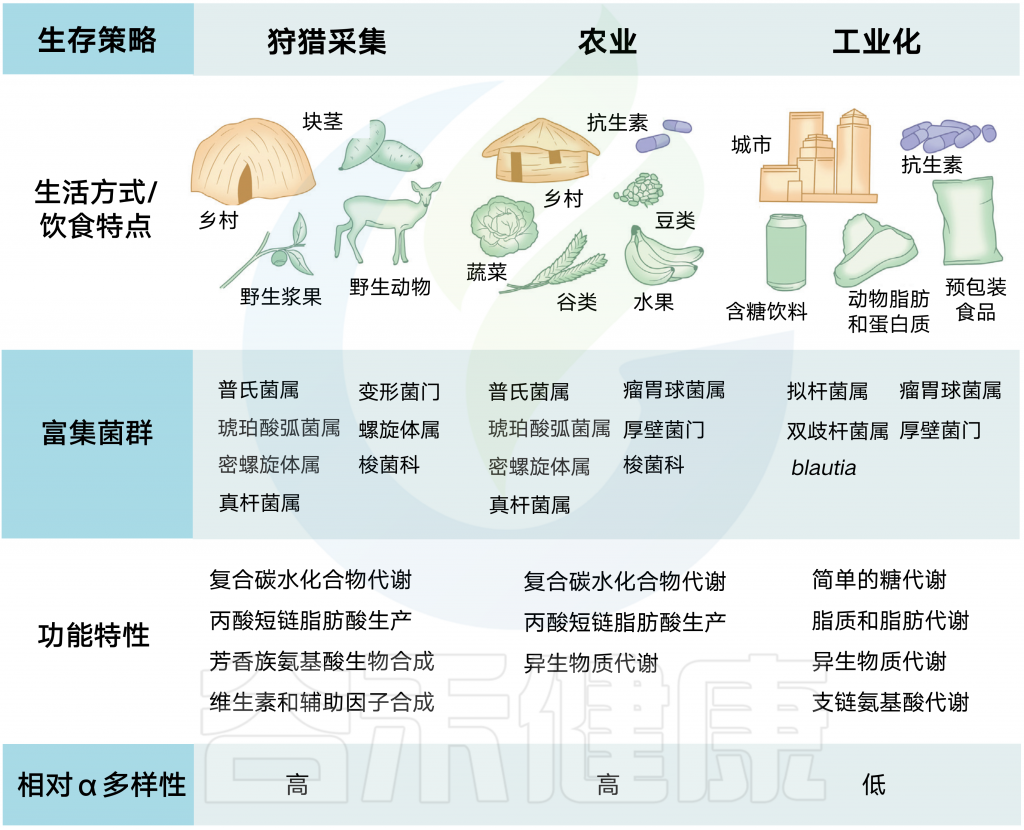
狩猎-采集人群依赖于觅食,很少接触治疗剂,在普氏菌和其他纤维降解菌群中高度富集。相反,西方化社会中发现的饮食特征和卫生基础设施与拟杆菌的优势相关,同时伴随着微生物多样性的减少。
动物饮食 vs 植物饮食
基于动物的饮食对肠道微生物群的影响比基于植物的饮食更大。
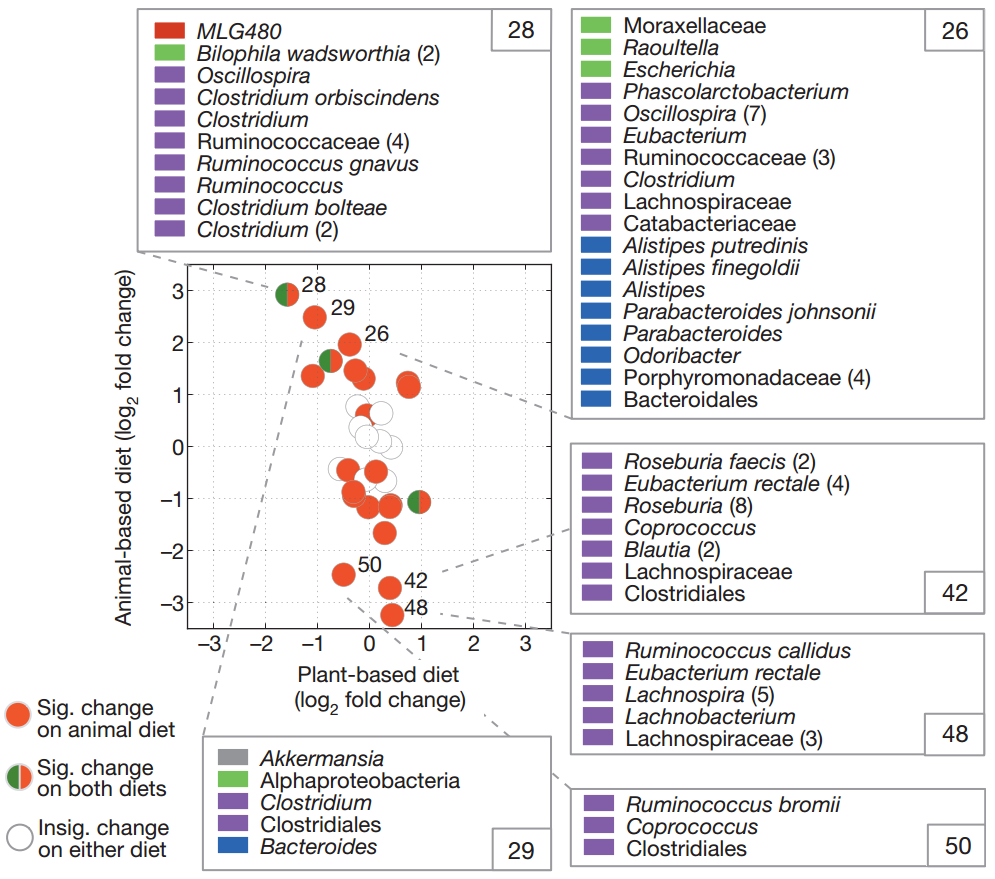
菌群对饮食的反应相对于所有受试者的基线样品计算每个饮食组上的簇log2倍数变化,并绘制为圆圈。
基于动物的饮食中具有显着倍数变化的群集以红色着色,并且基于植物和动物的饮食具有显着倍数变化的群集以红色和绿色着色。
未着色的簇在基于动物或植物的饮食中没有表现出显着的倍数变化(q <0.05,双侧Wilcoxon符号秩检验)。
在动物饮食中具有三个最大的正和负折叠变化的群集中的菌群成员也被显示并通过门着色:厚壁菌门(紫色),拟杆菌(蓝色),变形菌门(绿色),Tenericutes(红色)和Verrucomicrobia(灰色)。括号中会计入多个具有相同名称的OTU。
动物饮食增加了耐胆汁微生物(腐烂别样杆菌、嗜胆菌属和拟杆菌)的数量,并降低代谢膳食植物多糖的厚壁菌门的水平(罗氏菌属Roseburia、直肠真杆菌和布氏瘤胃球菌)。
该研究还显示:相对于植物性饮食和基线样本,动物性饮食显著降低了碳水化合物发酵产物的水平,提高了氨基酸发酵产物的浓度。
饮食量作为微生物调节剂
摄取的食物量会影响肠道微生物群。
在人类中,短期碳水化合物限制(每天24-164克,持续4周)导致产生丁酸盐的细菌减少,因此产生丁酸盐70,以及限制卡路里的方案(10%的能量摄入减少10%周)导致微生物组组成的改变,包括Blautia coccoides的减少和拟杆菌属的增加。
进食频率对菌群的影响
尽管对进食频率和健康状况进行了大量研究,但最近才开始研究进食频率对胃肠道微生物组的影响。
马的盲肠微生物群受饲养频率的影响,饲养频率越高,YRC22属相对丰度越高,普氏菌属、乳酸杆菌属、链球菌属、粪球菌属、和考拉杆菌属(Phascolarctobacterium)相对丰度越低。
为了确定饮食模式的改变是否影响与人类葡萄糖反应、脂质代谢和肥胖相关的类群,还需要进行更多的研究。
与进食频率无关,某些菌群与改善的葡萄糖稳态,脂质和肥胖有关。例如,粘蛋白降解肠细菌A. muciniphila与改善的葡萄糖稳态有关,与动物模型中的炎症反向相关。
在人类中,Akkermansia的增加与空腹血糖、腰臀比和皮下脂肪细胞直径呈负相关。
除以上膳食成分、饮食模式、饮食量、进食频率等对菌群产生影响外,还有昼夜节律变化也会影响菌群波动。
时间-饮食-菌群
饮食对微生物组分和功能的时间效应可以在多个时间尺度上发生,范围从饮食诱导每日微生物组波动到注意到长期变化后数天内观察到的营养相关效应。
在最高分辨率下,宿主每天昼夜节律的睡眠-清醒和进食-禁食周期伴随着显著的组成和功能性肠道微生物群变化,在三个主要门,拟杆菌门,厚壁菌门和变形杆菌门的成员中,以及粪便和循环中的细菌代谢产物的水平上,都能观察到绝对丰度振荡。
一生中饮食都会影响肠道细菌的结构和功能
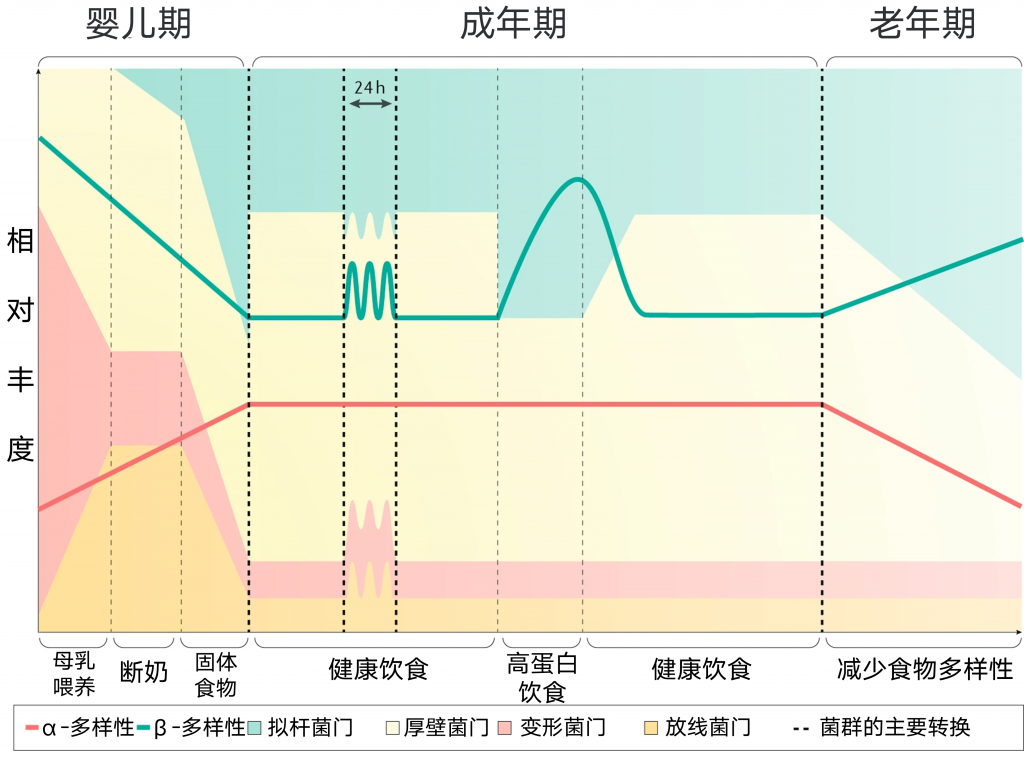
失调的昼夜节律和饮食对微生物群的影响
连续肠外营养的小鼠已被证明微生物群落结构发生了实质性变化,但微生物群并未完全丧失昼夜变化。但高脂肪饮食和昼夜节律紊乱的结合可能是导致小鼠微生物失调的原因。
有证据表明细菌含有时钟基因,并以昼夜节律的方式调节宿主的行为。例如,产气肠杆菌据称含有内源性生物钟基因,其通过分泌到胃肠道中的褪黑激素与人宿主同步。
在小鼠中,高脂肪饮食干预后出现的肝昼夜节律钟的重新编程被归因于微生物驱动的感应和转录因子PPARC的激活。
肝脏和肠道昼夜节律基因都受到未结合的胆汁酸(已知的微生物代谢产物)的影响。在无菌和抗生素诱导的小鼠模型中,微生物群的缺失已被证明会改变肠上皮细胞核受体的转录以及诸如Rev-erba、RORa、Bmal1、Cry1、Per1和Per2等时钟元件。
已发现在没有微生物的动物中,回肠和结肠上皮细胞内昼夜节律性被完全打乱了。研究人员推测,微生物相关的分子模式是以连续的方式从微生物群中释放出来的,相反,也有研究表明细菌组成的昼夜变化导致细菌代谢物浓度的相应变化,例如在禁食期间达到峰值的丁酸盐,以及在摄食期间达到峰值的硫化氢。已显示粪便丁酸盐在标准但不是高脂肪饮食的小鼠中循环,而硫化氢在高脂肪但非正常饮食的小鼠的盲肠中表现出周期性行为。先前已经在体外证明这些代谢物可以直接影响肝脏时钟基因Per2和Bmal1的循环。
总之,在昼夜节律破坏后观察到的负面后果可能与由肠屏障功能的改变,促炎细菌的丰度增加和昼夜节律紊乱相关疾病的病因引起的炎症过程有关。
饮食-菌群-健康互动的复杂性
大量营养素、微量营养素和食品添加剂与微生物群相互作用,改变特定属的丰度或微生物代谢产物环境,从而对宿主健康产生相当大的影响。在这个复杂的网络中,大多数食物成分和微生物是多面的,对宿主既有利又有害。
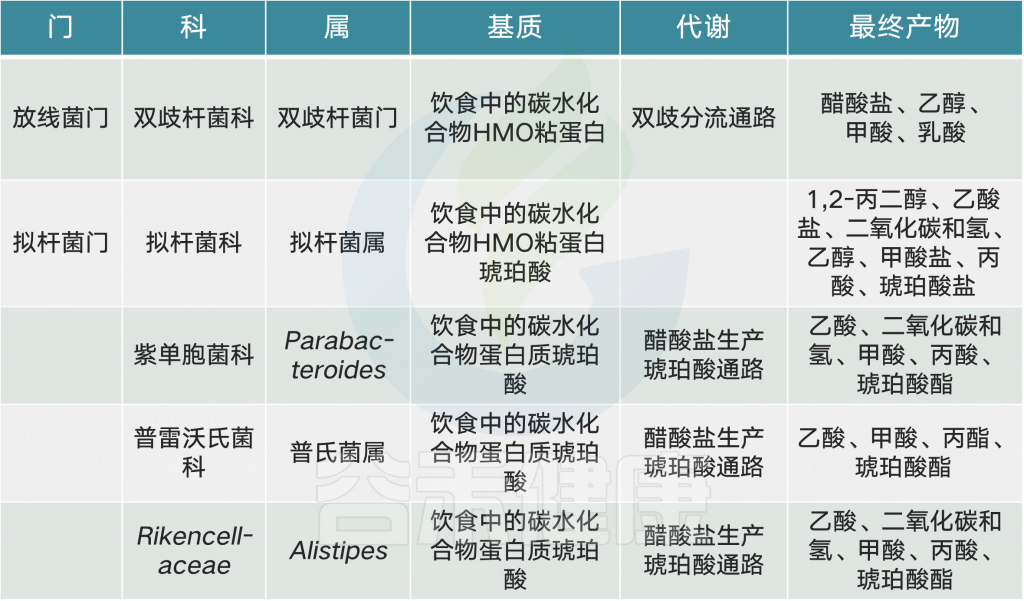
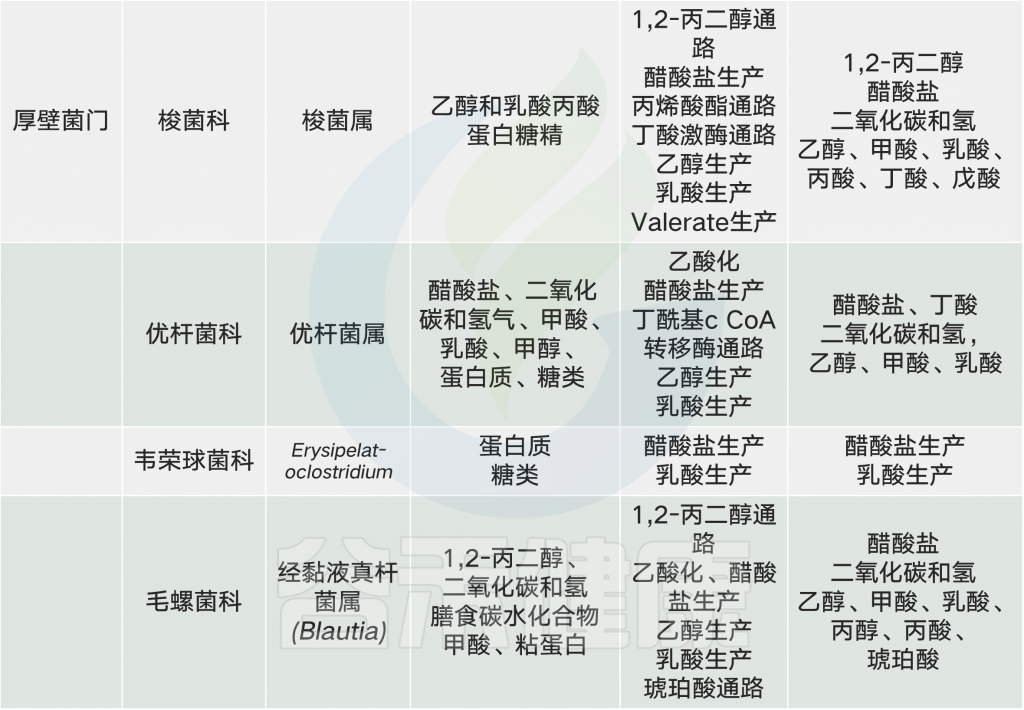
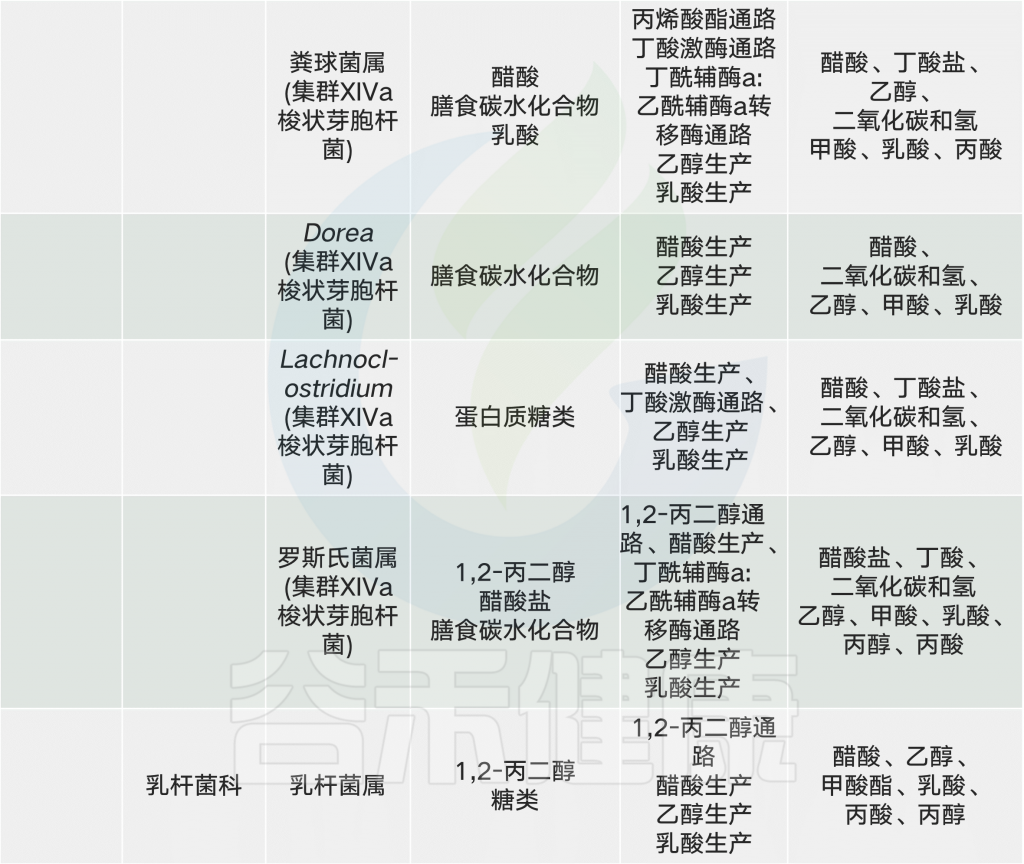

常见的膳食成分通过肠道微生物群代谢并产生调节宿主代谢(例如在动脉粥样硬化中)的代谢物【例如,膳食胆碱和三甲胺(TMA)】。同时,饮食改变了菌群组成并因此改变了微生物代谢产物,其中一些对宿主会产生有益或有害的影响【例如,脂肪,脂多糖(脂多糖)和内毒素血症)】。一些相互作用局限于肠道【例如,纤维,短链脂肪酸(SCFAs)和肠道糖异生】,而其他作用则有系统性效果【例如,脂肪,乙酸盐和抗胰岛素性(IR)】。
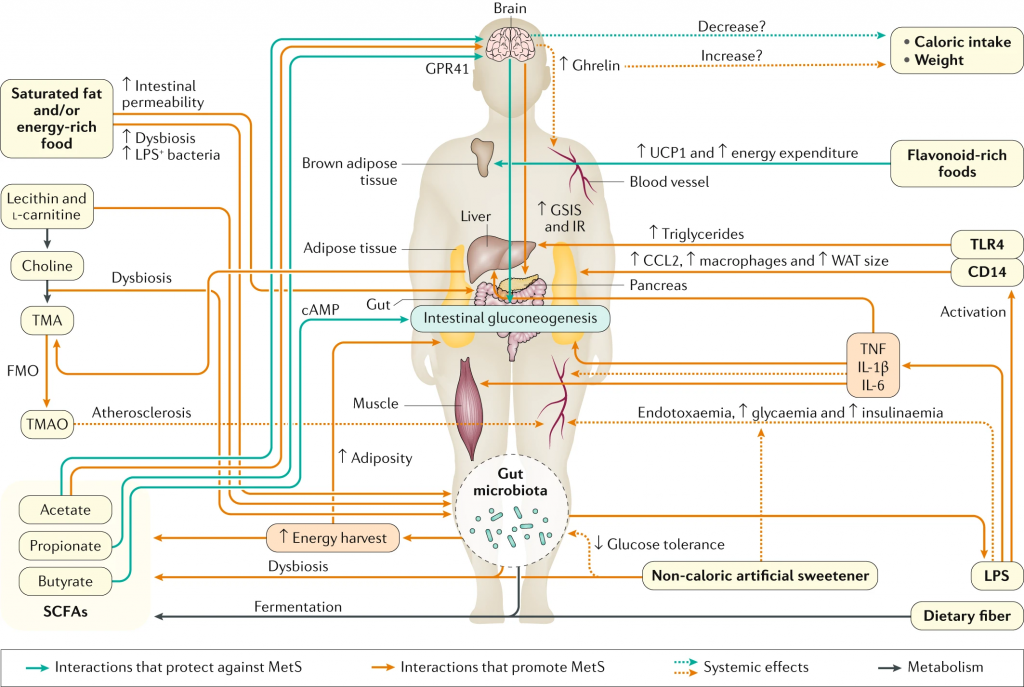
饮食模式可以通过营养物质对多种变量的影响影响影响代谢变化和炎症的发展,包括微生物组分、微生物产物的释放、胃肠道信号分子、以及神经递质。
由于细菌专门用于不同底物的发酵,复合饮食可以为特定的种系提供一系列促生长和生长抑制因子。
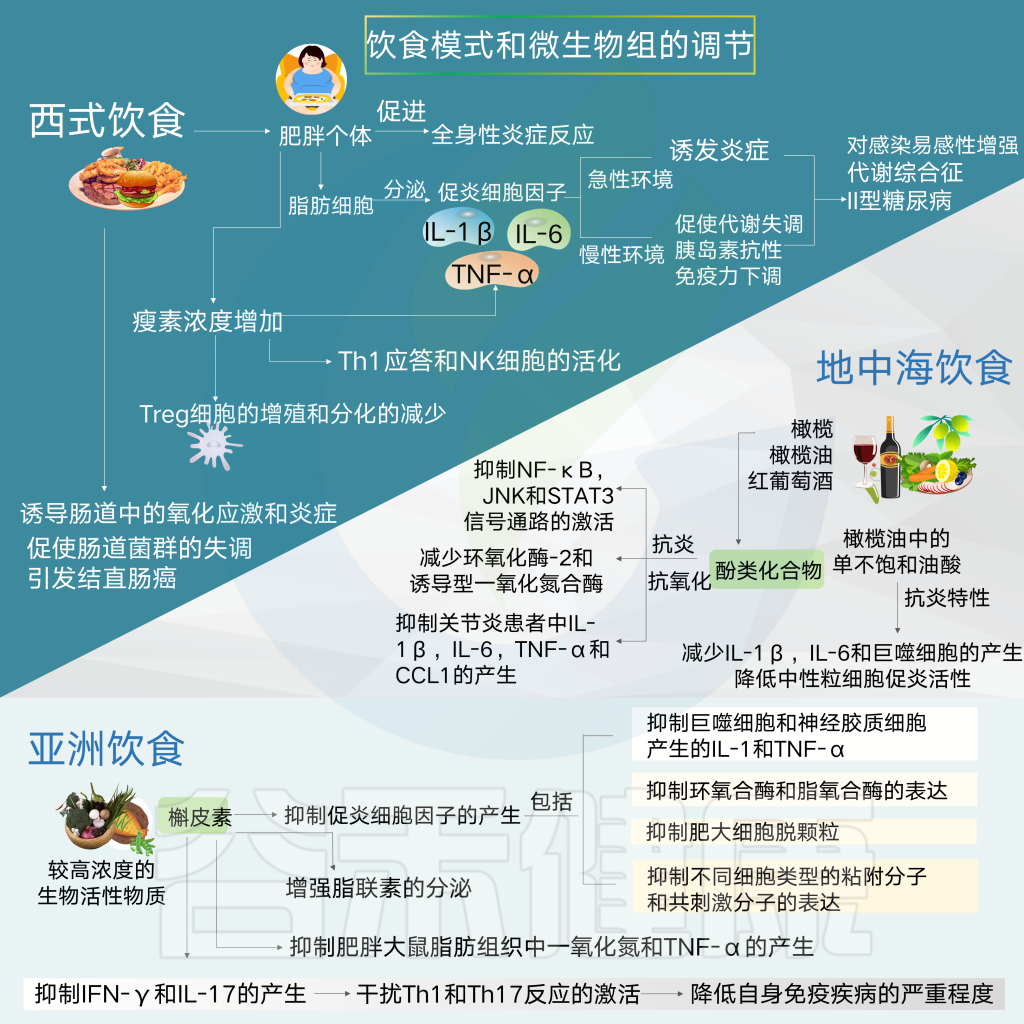
这些信号分子依次与免疫系统的调节有关,促进或抑制促炎细胞因子的产生和特异性白细胞亚群的扩大,如Th17和Treg细胞,它们与神经系统发育有关。
膳食代谢产物可通过不同的信号通路引起免疫应答
膳食代谢物来源于各种食物的消化
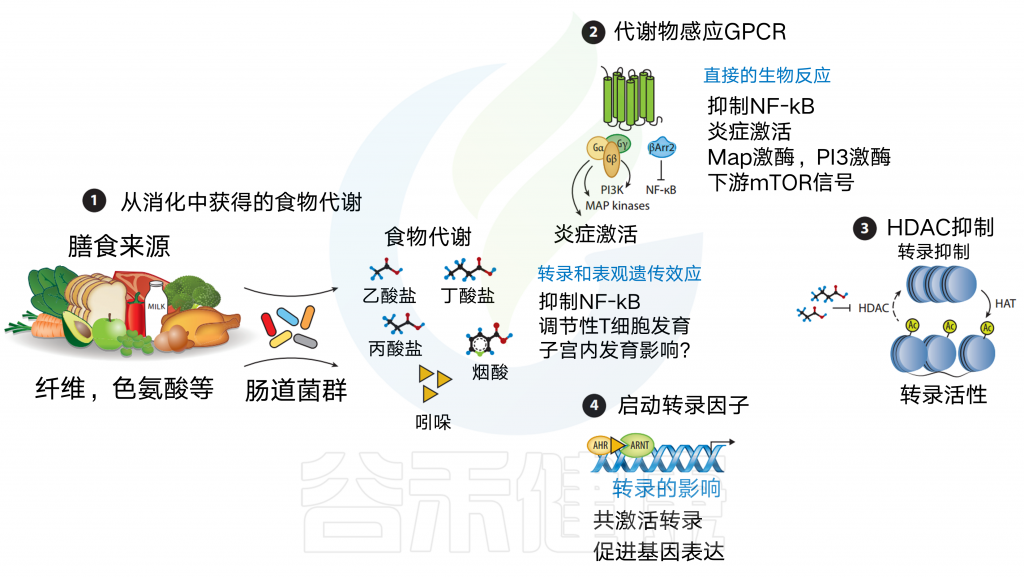
食物,如纤维、鱼和肉被消化,直接(例如,ω-3脂肪酸、烟酸)或间接产生代谢物【例如,短链脂肪酸(scfas)或吲哚-3-醛,分别通过细菌消化膳食纤维或色氨酸获得】
膳食代谢产物可以通过代谢传感GPCRs发出信号
这可以通过激活MAP激酶等途径的传统G蛋白信号传导,或通过β-抑制蛋白2来实现,一种与抗炎作用更密切相关的替代途径,包括抑制NF-κB功能或抑制炎症细胞因子的产生。
此外,在GPCR激活后,NLRP3炎症体激活响应Ca2+通量或K+射流。
某些代谢物作为组蛋白脱乙酰酶(HDAC)抑制剂
例如短链脂肪酸,尤其是丁酸盐和丙酸盐。
SCFAs抑制HDAC可使组蛋白内赖氨酸残基乙酰化,从而通过染色质松弛促进基因转录。
最后,膳食代谢物可以作为转录共激活因子
例如,吲哚-3-醛与芳烃受体(AHR)结合,允许其与AHR核转位蛋白(ARNT)相互作用以促进基因转录,包括肠内稳态细胞因子IL-22.
膳食代谢物信号的作用以及对免疫、代谢和神经系统的影响
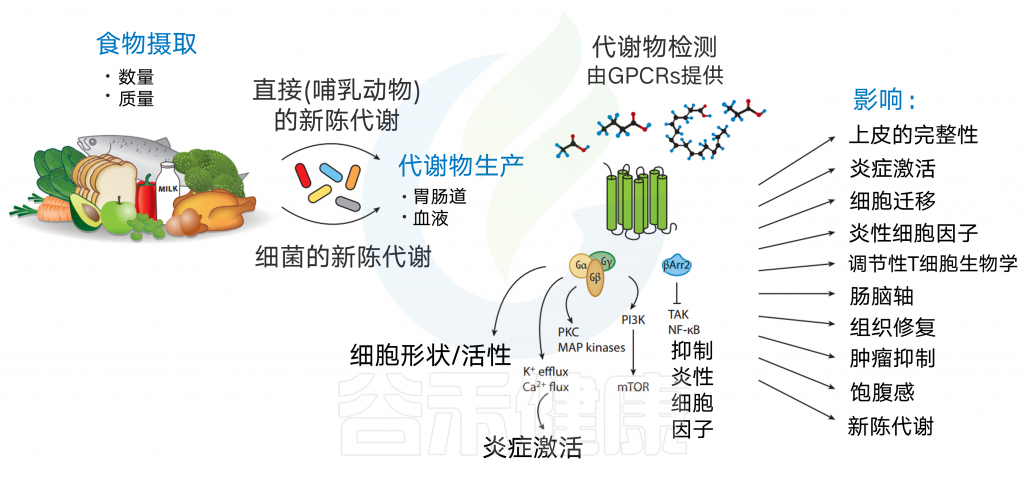
各种膳食代谢物的可用性取决于食物摄入量(数量和质量)以及宿主或肠道微生物群的新陈代谢。代谢产物分布到胃肠道,并以高浓度输送到门静脉。
这些代谢物可以引发广泛的生物学功能,主要是通过结合到它们的同源GPCRs。GPCR激活可诱导细胞形态和运动的改变,诱导Ca2+或K+流出,或诱导下游pi3k/map激酶途径。GPCRs也可以通过β-抑制蛋白来传递信号,β-抑制蛋白可以抑制NF-κB的激活和促炎细胞因子的产生。
随后,其同源GPCRs的饮食代谢物激活可影响细胞迁移、炎症体激活、上皮完整性、炎性细胞因子产生、Treg细胞生物学、肠-脑轴、组织修复、肿瘤抑制、饱腹感和代谢。
饮食和菌群相互作用影响胃肠功能和健康(从生态学、代谢学和免疫调节的角度)
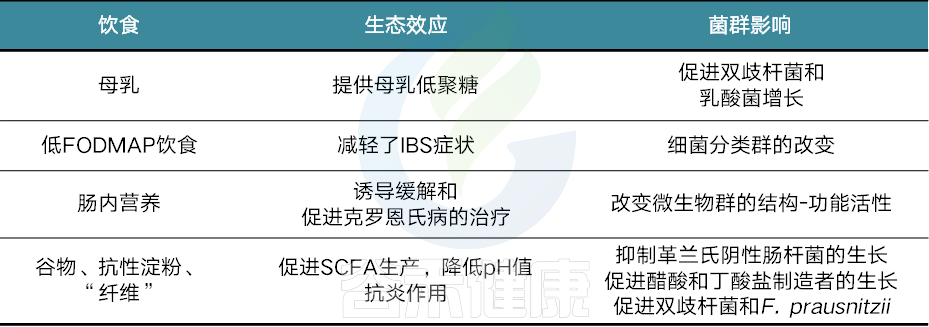
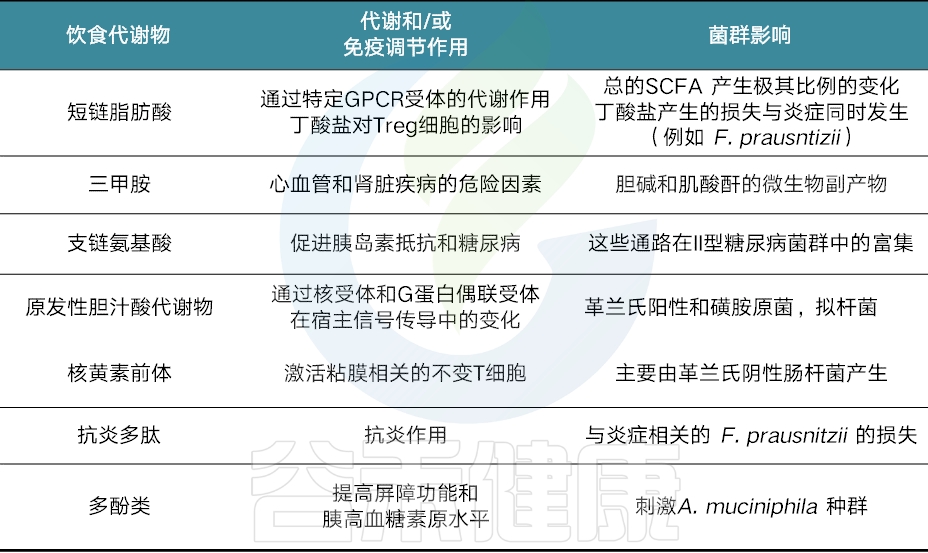
以上我们知道了饮食对塑造肠道菌群及健康的重要性
然而或许我们还有疑问:
肠道菌群对摄取食物的响应周期是多长时间?
肠道菌群的动态波动和稳定主要受什么因素影响?
下面看一篇权威的论文
该文章将每日宏基因组数据与日常饮食相结合,构建了响应饮食的肠道菌群变化模型来进行研究。
实验设计
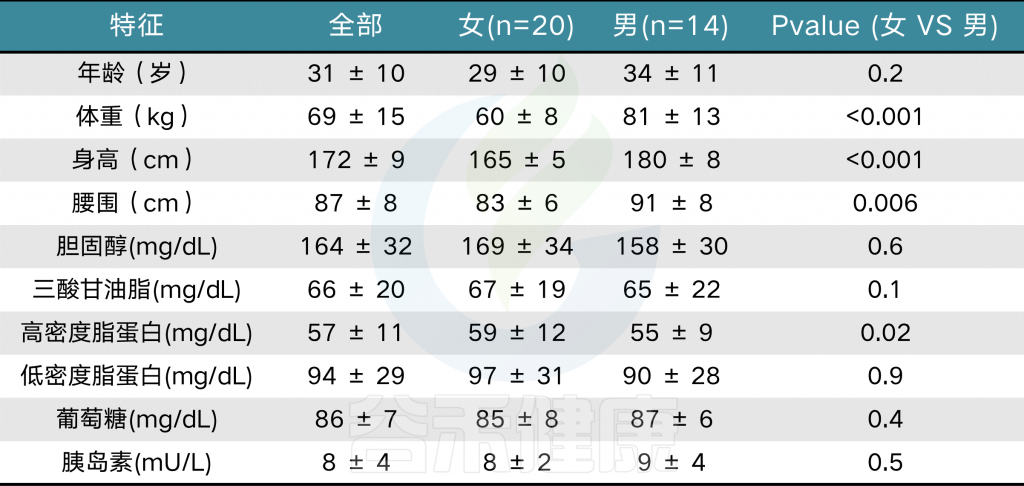
某研究连续17天收集来自34名受试者的膳食摄入数据和粪便样本。使用自动化自我管理的24小时(ASA24)饮食评估工具收集每日食物记录
表1 按性别分类的主体特征
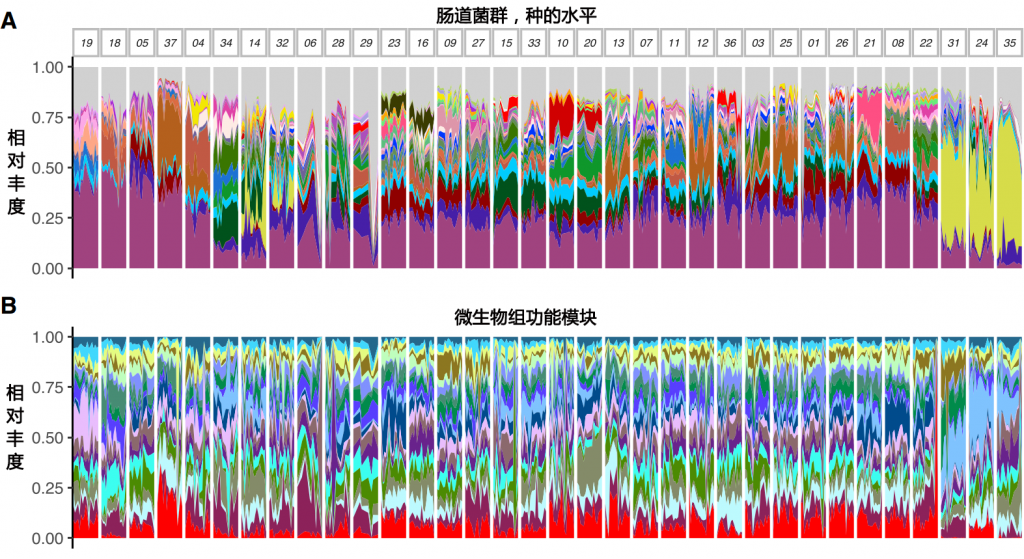
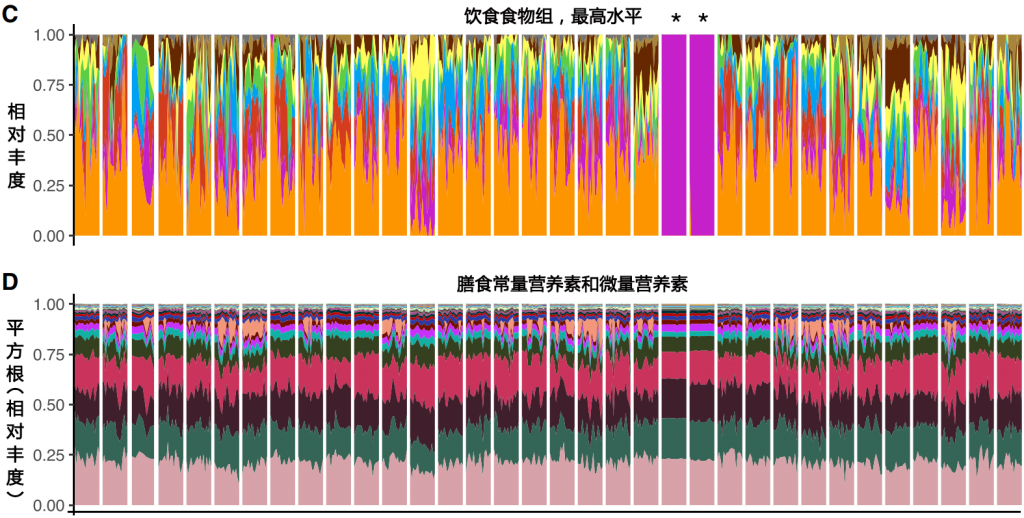

结果发现
同时我们也可以看出,以调节肠道菌群为目的的干预方案需要针对个体进行定制。
对上述所有饮食的比较揭示了一个中心主题:蔬菜、水果、瘦肉的消费量增加,加工食品的消费量减少,可带来积极的健康效益。大多数人选择食物的因素往往集中在食物的数量和容易获得和准备,而不是食物的内容和质量。由于优先考虑这些因素,食物首要为我们身体提供能源和保障健康越来越被我们忽视,取而代之的是快餐,高热量、低营养质量食品的大量进入我们生活,这直接导致了当下的许多慢病包括肥胖的流行。
普遍饮食建议
主要参考文献
Kaczmarek J L, Thompson S V, Holscher H D. Complex interactions of circadian rhythms, eating behaviors, and the gastrointestinal microbiota and their potential impact on health[J]. Nutrition reviews, 2017, 75(9): 673-682.
Johnson A J, Vangay P, Al-Ghalith G A, et al. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans[J]. Cell host & microbe, 2019, 25(6): 789-802. e5.
Oliphant K, Allen-Vercoe E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health[J]. Microbiome, 2019, 7(1): 91.
Zmora N, Suez J, Elinav E. You are what you eat: diet, health and the gut microbiota[J]. Nature Reviews Gastroenterology & Hepatology, 2018: 1.
Jandhyala S M, Talukdar R, Subramanyam C, et al. Role of the normal gut microbiota[J]. World journal of gastroenterology: WJG, 2015, 21(29): 8787.
David L A, Maurice C F, Carmody R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505(7484): 559.
Rowland I, Gibson G, Heinken A, et al. Gut microbiota functions: metabolism of nutrients and other food components[J]. European journal of nutrition, 2018, 57(1): 1-24.
Murtaza N, Cuív P Ó, Morrison M. Diet and the microbiome[J]. Gastroenterology Clinics, 2017, 46(1): 49-60.
Brewster R, Tamburini F B, Asiimwe E, et al. Surveying Gut Microbiome Research in Africans: Toward Improved Diversity and Representation[J]. Trends in microbiology, 2019.
Trepel F. Dietary fibre: more than a matter of dietetics. I. Compounds, properties, physiological effects[J]. Wiener klinische Wochenschrift, 2004, 116(14): 465-476.
Faith J J, McNulty N P, Rey F E, et al. Predicting a human gut microbiota’s response to diet in gnotobiotic mice[J]. Science, 2011, 333(6038): 101-104.
Mai V, McCrary Q M, Sinha R, et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers[J]. Nutrition journal, 2009, 8(1): 49.
Pace L A, Crowe S E. Complex relationships between food, diet, and the microbiome[J]. Gastroenterology Clinics, 2016, 45(2): 253-265.
Dietary reference intakes: the essential guide to nutrient requirements[M]. National Academies Press, 2006.
Hellwig JP, Otten JJ, Meyers LD. Dietary Reference Intakes∷ the Essential Guide to Nutrient Requirements. 2006
Katz DL, Meller S. Can we say what diet is best for health? Annu Rev Public Health. 2014;35:83–103. doi: 10.1146/annurev-publhealth-032013-182351.