 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

无论是什么社会阶层
无论以前的职业是什么
任何人都有可能患上阿尔兹海默症
这种疾病如同橡皮擦一般
逐渐抹掉一个人的记忆
…
在详细了解阿尔兹海默症之前,我们先来看一个动画短片(2020年奥斯卡最佳动画短片提名),该片讲述的是一位患有阿尔茨海默病的艺术家慢慢失去自己记忆的故事。
2020奥斯卡最佳动画短片提名——勿忘我(Mémorable)_腾讯视频
“ 他们彼此搂着对方在旋转中化作了记忆的露珠 ”
“你是我空白世界里最后一处的风景”
…
阿尔兹海默症正在呈指数级蔓延,目前却没有治愈的方法。
本文,我们在了解阿尔兹海默症的同时,也带来了关于阿尔兹海默症研究的新方向——结合肠道微生物群(“肠-脑轴”的阐述)来更深入了解该疾病。
阿尔茨海默氏病(AD)是一种神经退行性疾病,影响全世界超过5000万人,是最常见的痴呆症,临床表现为进行性认知功能减退和功能障碍。AD主要影响老年人(> 65岁),表明衰老是主要的危险因素之一,其中与衰老相关的AD进展被称为散发性AD
AD及其相关痴呆症的发病率在世界范围内呈上升趋势,以前,在高收入国家(西欧和北美),AD患病率最高。 然而,中低收入国家的痴呆症发病率开始增加,预计到2030年,所有病例中的63%发生在中低收入国家中,到2050年,占所有病例的71%。但其病因仍未解决,目前尚无有效的预防或改善治疗方法。
缩略词:

新的证据表明AD患者的肠道微生物群与认知正常的患者不同。肠道内的细菌强烈影响肠-脑轴,肠道微生物代谢物包括短链脂肪酸、促炎因子和神经递质也可能影响AD的发病机制和相关的认知能力下降。
饮食是肠道微生物群最强的调节剂之一,也强烈影响着大脑健康和AD病理学。例如,肥胖和2型糖尿病是AD的潜在危险因素,并且研究已将高脂饮食和高碳水化合物饮食与AD发生的风险联系在一起。 相反,地中海(MD)和生酮饮食与更健康的大脑衰老和较低的AD风险相关。 进一步证实了这一证据,在发展中国家,随着肥胖和糖尿病患者比例的增加,流行病学转变导致AD患病率增加。
因此,通过健康饮食来逆转肠道菌群异常可能有益于大脑并降低AD风险。
· 遗传
尽管尚不清楚AD的病理和影响因素,但仍存在一些遗传突变,例如淀粉样前体蛋白(APP)基因的额外拷贝和21号染色体三体等基因突变,这些突变增强了神经退行性β淀粉样蛋白(Aβ)的表达与家族性AD相关的蛋白质沉积。
· 病理
病理上,细胞外神经原纤维斑块和细胞内高磷酸化tau(pTau)缠结遍布AD大脑皮质实质,尤其是颞叶。深部脑萎缩也可能支持AD的诊断,这些明显的特征长期以来被认为是AD病理的主要因素。
新皮层中pTau的Aβ斑块和神经原纤维缠结的堆积会引起炎症,氧化应激和最终的神经退行性变。 这些症状也可以通过活性氧来介导,活性氧通常通过酶促抗氧化剂来控制。 然而,当抗氧化剂水平降低时,活性氧会引起氧化应激并导致神经退行性变。
大脑中的炎症也与AD患者常见的肠道渗漏有关,免疫系统因子如多形核中性粒细胞能够从肠壁漏出。来自肠道的持续炎症可开始降解血脑屏障,使这些炎症因子进入大脑并引起进一步的炎症。
用于AD诊断的生物标志物包括低Aβ-42和脑内高tau水平,PET上氟脱氧葡萄糖摄取减少,MRI上出现结构性脑萎缩。
AD的临床诊断因患者而异,很难用一系列规定的症状来描述。
需要关注的这10个方面
记忆退化/困难; 问题解决; 熟悉的任务完成; 时间/地点识别; 图像或空间关系的理解; 沟通; 追溯步骤; 判断/人际互动; 工作/社交活动; 情绪/认知
早期症状
记忆:丢钥匙,忘记朋友的名字或最近的一次谈话,在熟悉的地方迷路。
讲话:重复自己的话或努力跟上对话。
视觉:很难看到三维的东西和判断距离。
决策:难以做出决定、解决问题或完成多步骤任务,比如做饭。
方向:对自己的位置、时间和日期感到困惑。
情绪:感到焦虑、沮丧或易怒的。
晚期症状
错觉:
例如,毫无理由地相信有人在偷他们的东西
不寻常的行为:
表现出攻击性或躁动、喊叫或扰乱睡眠模式
行走和说话困难:
卧床不起或坐轮椅,需要24小时护理来帮助进食、饮水和上厕所
由于淀粉样蛋白级联假说的不可理解性,研究正在调查Aβ斑块和pTau作为一个系统的标志物,这个系统从许多末端被破坏。
研究假设β-淀粉样蛋白是一种抗菌肽,由于非有益微生物的大量携带,可能来自炎症导致的血脑屏障降解,因此可能会在AD大脑中积聚。这些淀粉样蛋白是由APP的裂解和toll样受体2激活的髓样分化主要反应途径形成的。
脑淀粉样变性外,肠道中还存在细菌淀粉样蛋白,其三级结构类似于中枢神经系统淀粉样蛋白,并可能在刺激大脑中的免疫系统中发挥作用,因为免疫系统学会了识别肠道中的淀粉样蛋白,然后 大脑中淀粉样蛋白的增强攻击,导致炎症。
饮食(例如高脂饮食)可进一步介导导致AD炎症和神经退行性变的肠道渗漏综合征。 因此,AD的可测量症状具有与肠道菌群相关的复杂原因。
Aβ 斑块和tau缠结假说是AD病理生理学的理想模型。然而,新的研究已经证实AD是系统性功能障碍的一个组成部分,至少部分由慢性、全身性和神经元炎症以及肠道微生物群介导。在这一点上,神经炎症假说建立在肠-脑轴上,它将肠道微生物群活动与神经元健康和功能障碍联系起来(下图)。
AD中肠道微生物群的作用是由微生物代谢物介导的,这些代谢物作用于肠道和周围组织中的局部神经元并向大脑发送信号,和/或从肠道吸收并通过循环到达大脑。例如:单胺类、短链脂肪酸(SCFA)、γ-氨基丁酸(GABA)、β-甲胺基-L-丙氨酸、脑源性神经营养因子、血清素和多巴胺。
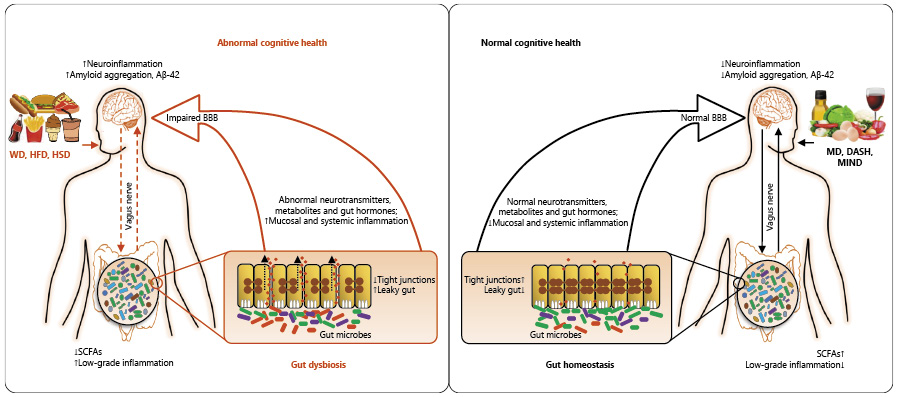
Kincaid HJ, et al., Ann Nutr Metab,2021
MCI和AD患者中饮食与微生物组相互作用与大脑和认知健康之间的假定联系的示意图。
AD患者和/或患有轻度认知障碍(MCI)的受试者存在明显的微生物群模式。
随着自然衰老相关的肠道营养不良开始发展并削弱肠道上皮,已经存在的微生物群营养不良会进一步影响大脑的衰老,从而导致肠道渗漏和炎症。
全身性炎症的加剧促使免疫功能受损,使大脑中的β-淀粉样蛋白堆积。这表明,患者通常要到老年时发展为AD,即使在生命早期就存在存在危险因素,如基因突变。
患有MCI和AD的患者在脑脊液中还显示出较高水平的肠道微生物来源的三甲胺N-氧化物(TMAO),这与AD生物标志物(包括pTau,总Tau和Aβ42)相关。
TMAO治疗可通过改善神经元衰老和线粒体功能障碍来降低小鼠的认知功能和衰老迹象。尽管TMAO在AD中的作用机制尚不清楚,但TMAO及其前体是炎症生物标志物,可能与AD相关的肠道渗漏有关。
西方饮食由低纤维、高脂肪和高蛋白食物组成,通常吃富含TMA和胆碱的高脂肪红肉和鸡蛋,从而增加TMAO的产生。这可能部分解释了西方国家AD发病率较高的原因。
此外,TMAO相关的脑损伤和认知缺陷可能由氧化应激增加介导。因为大脑消耗大量的氧气,而且神经元的新陈代谢率很高,所以一般人大脑中的神经元面临更高的氧化应激风险。然而,氧化应激可能是AD病理的原因和后果。
炎症引发氧化应激,从而导致β pTau的积累;然而,在一个破坏性的循环中,反之亦然也是可能的。
此外,氧化应激可导致线粒体功能障碍,肠道微生物源性代谢产物影响线粒体功能。饮食可以调节氧化应激,如高果蔬饮食可以提高认知能力,这与老年人氧化应激的降低有关;而西方饮食不富含水果和蔬菜,这也可能解释了在西方国家AD患病率较高的原因。
肠道微生物群对我们的新陈代谢、免疫和大脑健康至关重要。在健康的稳态条件下,肠道微生物群与宿主保持共生关系,对宿主营养和代谢、对病原体的定植抗性、肠道屏障完整性和免疫调节发挥重要作用。
肠道微生物群对脑部疾病有影响,包括抑郁症、焦虑症、高血压和帕金森病。最近的研究也将肠道微生物群与AD联系起来;然而,值得注意的是,这些研究大多是横断面调查,因此,需要更多的纵向干预研究来确定微生物群和AD病理学之间的偶然联系。
美国北卡罗来纳州科学团队最近报道了MCI患者拟杆菌丰度较低,厚壁菌和变形杆菌(肠杆菌科)丰度较高,此外在属水平上也存在一些差异。其他研究也报道了AD受试者的多样性较低,厚壁菌与拟杆菌比率较低,痴呆患者的拟杆菌比率较低,而与MCI患者和正常受试者相比,AD患者的多样性较低,厚壁菌和变形杆菌比率较高。
一项研究表明,丁酸盐产生菌参与认知功能。有趣的是,该团队还发现MD生酮饮食改善了AD生物标志物,即。MCI患者脑脊液中的淀粉样蛋白和tau蛋白,其中这些变化与肠丁酸盐增加有关。
已经研究了Aβ积累与微生物群的关系。 例如,APP-PS1小鼠是使用最广泛的AD模型,它以年龄依赖的方式展示了Aβ在大脑中的蓄积; 然而,它的微生物群不同于野生型小鼠。 此外,移植有AD微生物群的小鼠倾向于具有更高的Aβ积累。 此外,Aβ聚集可以被微生物群衍生的戊酸酯和丁酸酯抑制。
此外,细菌内毒素也可能与AD-淀粉样变性相关的炎症有关。 例如,脂多糖(LPS)是革兰氏阴性细菌的外细胞壁成分,具有高度促炎性,可以增强大脑中Aβ的积累并引起认知功能障碍。
AD患者的血浆LPS水平较高,新皮质和海马较高。 LPS还可能导致慢性神经发炎,内嗅皮质神经细胞死亡以及海马神经元的突触可塑性受损。 特定的细菌,例如大肠杆菌(Escherichia coli),枯草芽孢杆菌(Bacillus subtilis),鼠伤寒沙门氏菌(Salmonella typhimurium)和肠沙门氏菌 (Salmonella enterica)也可以产生淀粉样蛋白。 然而,这些并不是人类肠道微生物的典型且一致的’居民’。
此外,AD相关淀粉样变性与细菌淀粉样变性之间的关系仍不清楚。 尽管如此,细菌淀粉样蛋白可能会激活与AD发病机制有关的特定信号通路,这提示肠道菌群可能会加剧与淀粉样变性病相关的炎症。 这些研究通过微生物细胞外成分,促炎因子,毒素,SCFA,淀粉样蛋白和神经递质将微生物群与淀粉样蛋白的积累联系起来。 考虑到迅速兴起的研究,可以预见的是,AD预防和治疗将绕不开针对微生物群的影响。
鉴于AD患者与健康受试者之间微生物群差异的新数据,研究人员已经开始探索调节微生物群的方法,希望能够改善AD病理学。
尽管肠道微生物群可以通过多种方法进行调控,包括使用益生菌、益生元、合生元和抗生素或改变饮食,但饮食是肠道微生物群的最高级调节剂。
以不饱和脂肪、水果和蔬菜以及全谷类为重点的饮食调节可以给AD相关的认知健康带来好处(上图)。例如,MD通过增加血浆类胡萝卜素和降低C-反应蛋白水平,与AD关键区域的脑萎缩减少相关(表明对AD病理学有积极影响)。
此外,炎症减少也是AD的主要症状。食用富含二十二碳六烯酸(一种n-3多不饱和脂肪酸)的鱼制品与降低AD风险有关。富含维生素D3的鱼和富含维生素D的奶制品促进神经生长因子蛋白的分泌,这种蛋白可以防止大脑发炎和衰老。
由于MD对AD的这些改善作用,一项人体试验研究了MD-DASH干预对神经退行性延迟(MIND)饮食的影响,该饮食是MD与DASH饮食(阻止高血压的饮食方法)的结合,富含 水果,蔬菜,全谷类,低脂乳制品和瘦肉蛋白证明,MIND饮食比单独使用MD或DASH更为有效,尽管所有3种饮食均显示出降低AD病理学的益处。
除了某些饮食生活方式外,个别食物还可以带来抗AD病理学的益处。 例如,在小鼠模型中,饮用红酒可防止Aβ肽生成并降低AD风险。具体而言,据报道,适度饮酒可减少轴突末端的GABA能发芽,这可能是AD中神经退行性变的部分原因。 富含类黄酮的食物,例如黑加仑子,葡萄,柑橘和绿茶,已显示出抑制Aβ沉积并防止tau蛋白过度磷酸化的作用,同时改善了AD的其他生物标志物。
具体而言,据报道,适量饮酒可减少轴突终末的GABA能发芽,这可能是AD中发现的神经退行性变的部分原因。富含类黄酮的食物,如黑加仑、葡萄、柑橘和绿茶,已被证明能抑制β 沉积和阻止tau蛋白的过度磷酸化,同时改善AD的其他生物标志物。
虽然大多数研究都在研究健康饮食对改善AD病理的影响,几项研究探讨了直接针对AD肠道细菌的补充剂的使用。
一项随机双盲对照人体试验,研究了12周食用嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、双歧杆菌 (Bifidobacterium bifidum)和发酵乳杆菌(Lactobacillus fermentum),的益生菌组合的效果,据报道,对认知功能有显著的积极影响,但对氧化应激或炎症没有影响。
一项小鼠实验研究了生物素丁酸钠对早期AD小鼠Aβ水平和行为症状的影响,发现补充丁酸钠12周后Aβ水平显着降低,行为反应增加。
益生菌和益生元的组合合生元也显示出对AD的益处。一项人类研究观察到,AD患者食用开菲尔谷物发酵的牛奶(形成共生物质)90天后,精神能力得到改善,炎症和氧化应激减少。
综上所述,目前有关饮食和补充剂影响肠道微生物群和改善AD是有希望的,但更多的研究是也非常需要。
此外,研究已经通过测试Tramiprosate(一种GABA的类似物)来靶向GABA,并发现它有望增加AD模型和临床试验中Aβ抑制的长期增强作用。5-羟色胺激动剂和再摄取抑制剂曲唑酮(trazodone)也表明,与延缓AD患者认知障碍的相关性是非曲唑酮使用者的2.6倍。
AD在世界范围内迅速增长,但是迄今为止尚无治愈方法,这强调了需要有效的策略,例如饮食因素来调节AD相关的神经炎症并预防或减慢AD的进展。
目前的证据表明,饮食成分的促炎和抗炎能力都可能在AD管理中发挥作用。
富含单糖,饱和/反式脂肪,高级糖基化终产物和加工肉的饮食可能对AD患者的大脑产生促炎性影响,同时可能加速肥胖症,高血压,血脂异常,动脉粥样硬化和2型糖尿病。
相反,富含蔬菜,水果,沙拉,坚果,豆类,浆果,多不饱和脂肪酸,维生素,类黄酮,多酚,益生菌/益生元和全谷物的复杂饮食模式(例如,MD,DASH和MIND)可能有助于预防或减缓认知能力下降和AD进展。
研究表明,肠道菌群通过肠脑轴参与了AD病理。饮食会强烈调节和塑造肠道菌群,这可能是这些饮食模式改善肠道脑轴与AD相关的摄动的潜在机制之一。 对生活方式因素与AD相互作用的机械理解可以阐明生活方式模式的改变与AD患病率增加之间的联系,同时包括微生物群等对于宿主生活方式与健康之间的相互作用至关重要的因素。
对饮食,微生物群,生活方式和痴呆症之间的联系进行解码,将有助于揭示AD病理的潜在机制,同时有助于发现预防/治疗AD和相关痴呆及认知能力下降的新策略。
虽然该疾病目前无法得到根治,也无法逆转,但如果在早期就介入治疗,是可以有效延缓疾病的进程。
音乐
有观察表明,音乐疗法可以极大地帮助许多患有阿尔茨海默氏病的人,2019年3月发表在《神经科学前沿》上的一篇评论发现,音乐疗法可以改善行为,认知和社交功能-帮助缓解焦虑症和抑郁症。
对于许多患有阿尔茨海默氏症的人来说,正确的音乐疗法可以在恐惧和孤独的时候提供安慰、快乐。
“以某种方式、形式对音乐做出反应,无论是身体反应、情感反应、社会反应,还是认知反应”,来自伯克利音乐学院音乐治疗系主任乔伊认为,“我们知道痴呆患者的大脑受损,但对音乐作出反应的那部分似乎是最后消失的部分。”
音乐的镇静作用可以减少日常生活中产生焦虑的事件中的躁动,并使阿尔茨海默症患者及其护理者的过渡不那么令人焦虑。
精油
梅奥诊所称,当吸入精油时,它会刺激嗅觉感受器,嗅觉感受器通过中枢神经系统向边缘系统传递正(或负)信息。边缘系统是大脑控制情绪的部分。
梅奥诊所的从业者不会将精油涂抹在患者身上,而是用于供阿尔茨海默患者吸入。
当然吸入太多也不好。如果周围有太多的气味,就像用扩散器一样,使嗅觉系统饱和,甚至再也认不出这种气味了。所以不能过量使用。
几项小型研究表明,薰衣草精油可帮助改善痴呆症患者的行为并改善睡眠。柠檬香脂可以按摩到皮肤或吸入,在减轻压力和焦虑方面显示出优势。生姜精油缓解恶心症状。
但不推荐使用薄荷精油,较刺激,许多人会对它产生不良反应。
瑜伽
关于瑜伽及其对阿尔茨海默氏病的影响的研究在某种程度上是有限的,还远没有定论,但在阿尔茨海默氏症的护理中加入诸如瑜伽之类的补充方法,可能会有助于缓解该疾病的某些症状。
2018年2月发表在《神经生物学的压力》杂志上的一项研究综述指出,越来越多的证据表明,压力可能会对像阿尔茨海默氏症这样的神经退行性疾病的发展产生有害影响。
瑜伽具有潜在的好处,可以帮助减轻压力,平息躁动并改善整体情绪。
大多数针对阿兹海默症患者的瑜伽都是以缓慢,轻松的方式进行轻柔运动。上课时间通常比一般的瑜伽课短,一般持续10至30分钟。根据个人体能定制,老师从不强迫运动,并鼓励参与者做自己想做的事情。
一篇文章发表在2019年的《大脑可塑性》杂志上,发现瑜伽似乎对负责记忆和信息处理以及情绪调节的大脑关键区域具有积极作用。
游戏
大多数专家似乎都同意游戏本身并不能真正改变疾病的生物学或阻止阿尔茨海默氏症对大脑的破坏性作用。
但有研究人员认为,这使他们增加了进行更多社交互动的机会,这比游戏本身更重要,可以提高生活质量,并可能减少认知能力下降。
发表在2019年8月6日《神经病学》上的一项研究发现,精神刺激活动(例如使用计算机,玩游戏,制作手工艺品和参加社交活动)与年龄相关的记忆力丧失的风险较低或延迟有关。
研究发现,在中老年人参加社交活动,例如去看电影或与朋友外出,或玩填字游戏或纸牌游戏等游戏,发展轻度认知障碍的风险降低了20%。
当然也可能是因为有轻度认知障碍的人没有能力经常降低参加这些活动的机会,因此,需要进一步的研究来调查这些发现。
不同人喜欢玩不同游戏,同一款游戏多次重复也会无聊,以下多款游戏可供参考:
填字、拼图、数独、西蒙、Risk、Azul、Lumosity等。
肠道菌群检测
定期进行肠道菌群健康检测,可以了解该疾病风险,如果能在非常早期的时候及时发现,结合肠道菌群进行多种方式针对性干预(如饮食,益生菌,生活方式的调整等),可能会大大延缓病程。
主要参考文献
Kincaid HJ, Nagpal R, Yadav H. Diet-Microbiota-Brain Axis in Alzheimer’s Disease. Ann Nutr Metab. 2021 Apr 27:1-7. doi: 10.1159/000515700. Epub ahead of print. PMID: 33906194.
Prince M, Bryce R, Albanese E, Wimo A, Ribeiro W, Ferri CP. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers Dement. 2013 Jan;9(1):63–e2.
Alonso R, Pisa D, Fernández-Fernández AM, Carrasco L. Infection of fungi and bacteria in brain tissue from elderly persons and patients with Alzheimer’s disease. Front Aging Neurosci. 2018;10:159.
Szczechowiak K, Diniz BS, Leszek J. Diet and Alzheimer’s dementia: nutritional approach to modulate inflammation. Pharmacol Biochem Behav. 2019 Sep;184:172743.
Blum S, Aviram M, Ben-Amotz A, Levy Y. Effect of a mediterranean meal on postprandial carotenoids, paraoxonase activity and C-reactive protein levels. Ann Nutr Metab. 2006;50(1):20–4.
Mosconi L, Murray J, Tsui WH, Li Y, Davies M, Williams S, et al. Mediterranean diet and magnetic resonance imaging-assessed brain atrophy in cognitively normal individuals at risk for Alzheimer’s disease. J Prev Alzheimers Dis. 2014 Jun;1(1):23–32.
Morris MC, Tangney CC, Wang Y, Sacks FM, Bennett DA, Aggarwal NT. MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimers Dement. 2015 Sep;11(9):1007–14.
Nagpal R, Neth BJ, Wang S, Craft S, Yadav H. Modified mediterranean-ketogenic diet modulates gut microbiome and short-chain fatty acids in association with Alzheimer’s disease markers in subjects with mild cognitive impairment. EBioMedicine. 2019 Sep;47:529–42.
Bhattacharjee S, Lukiw WJ. Alzheimer’s disease and the microbiome. Front Cell Neurosci. 2013;7:153.