 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

嗜黏蛋白阿克曼菌(Akkermansia muciniphila, 简称A. muciniphila, Akk菌)的缺乏或减少与多种疾病(如肥胖、糖尿病、肝脂肪变性、炎症和对癌症免疫治疗的反应)有关。
关于AKK菌,我们之前的一篇文章也有详细介绍过,点击详见:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
谷禾肠道样本大数据库显示A. muciniphila缺乏或未检出情况在人群中很常见,尤其是那些有肠道问题的人。在健康个体中其约占肠道微生物群总数的0.5%–3%。
现如今,关于AKK菌的研究正在从动物模型转向人类验证试验,AKK菌与疾病之间的研究不仅仅停留在相关性,更是开始向因果性及具体产生作用的机制方面深入探讨。
– A. muciniphila –
本文我们将依次介绍A. muciniphila的起源,主要特性,以及它与不同疾病间的联系,并解释产生有益作用的主要机制。
一所在瓦格宁根(Wageningen)的微生物实验室的研究人员使用一种专门用于分离优势细菌的策略,即稀释到消亡(即基于连续稀释的分离),从一名健康成人身上分离出一株高度丰富的粘液降解菌株。
该菌株似乎是疣微菌门(Verrucomicrobiota)中一个新属的新种,被命名为嗜黏蛋白-阿克曼菌(Akkermansia muciniphila, A. muciniphila, Akk菌),并以典型菌株MucT为代表。
粘液主要由粘蛋白组成,粘蛋白是一种由粘多糖组成的保护肠道细胞的糖蛋白。
长期以来,粘液的降解被认为是一种可能导致宿主紊乱的不良特性。然而,对于结肠微生物群来说,粘蛋白在肠道中大量分泌,因此提供了持续的宿主产生的碳、能量和氮源。粘蛋白的代谢转换需要一组酶,如唾液酸酶和硫酸酯酶,这些酶参与顺序降解。
粘蛋白降解“专家”
A. muciniphila 是人类早期生命中存在的独特的粘蛋白降解“专家”。此外,对无菌小鼠的单体型关联研究表明,A. muciniphila MucT不会损害宿主,并在结肠中显示出特异性的代谢和免疫信号。其2.7Mb的基因组预测了粘蛋白降解的酶机制,比较生长分析表明,A. muciniphila是体外利用粘蛋白最有活性的菌株。
A. muciniphila MucT也可以利用人乳寡糖作为能量来源。值得注意的是,在纯培养中,只有少数其他底物被发现能刺激其生长,包括二甲双胍、甜菜碱和色氨酸。
由于A. muciniphila是人类肠道中疣微菌门的唯一代表,许多报道这一门的16S rRNA基因序列调查往往代表A. muciniphila 。最近的一项研究分析了2,000多个Akkermansia基因组,表明A. muciniphila是迄今为止具有高度相似(超过98%同一性)16S rRNA 序列的优势物种。
非工业化人群A. muciniphila下降
在这个大型宏基因组数据库中对四个已确定的A. muciniphila亚种的详细分析表明,它们的基因组通常存在于西方和中国人群中。对哈扎部落和其他非工业化人群的肠道微生物群与工业化世界个体的肠道微生物群进行分析比较,发现拟杆菌纲和疣微菌门微生物群的丰度减少。这些结果表明,非工业化种群的A. muciniphila丰度水平有所下降,但这一观察结果是否与粪便样本保存、DNA提取或测序深度的技术问题有关仍有待调查。
值得注意的是,A. muciniphila宏基因组已在非人类灵长类动物中发现,包括野生和圈养。类似地,与模式菌株MucT具有高度基因组同源性的A. muciniphila已从同样生活在野外的各种动物中分离出来。
部分A. muciniphila菌株产维生素B12
长期以来,A. muciniphila型菌株MucT是唯一可用的人类分离株然而,在过去的 5 年中,从不同的肠道环境中分离到了其他A. muciniphila菌株,包括野生哺乳动物和圈养哺乳动物,特别是人类。在临床前试验中报告了人类相关 A. muciniphila菌株之间的一些变异性,但尚不清楚观察到的差异的稳定性和可重复性如何。
迄今为止,观察到的菌株之间最显著的代谢差异是产生维生素B12的能力,而维生素B12是产生丙酸盐所必需的。大约三分之一的A. muciniphila分离株能产生类似于A. glycaniphila的维生素B12。多种结肠微生物可以产生可供A. muciniphila利用的维生素B12,正如霍氏真杆菌(Eubacterium hallii)(重命名为Anaerobutyricum soehn genii)所显示的那样,在共培养实验中,发现该细菌与菌株MucT形成微生物网络,导致从粘液中产生丙酸盐和丁酸盐。
代谢紊乱
由于观察到益生元补充剂(即低聚果糖)对肥胖发育的保护作用与啮齿动物疣微菌门的主要繁殖相吻合,因此引起了人们对A. muciniphila和代谢紊乱的兴趣。随后在人类和啮齿动物上进行的观察研究都表明,与瘦小的对应物相比,患有肥胖症的个体肠道中的A. muciniphila反复出现表达不足。代谢紊乱,包括肥胖、T2DM、非酒精性脂肪性肝病(NAFLD)和心血管疾病,都与Akkermansia spp.丰度减少有关。
研究发现,11名超重者和38名肥胖者体内A. muciniphila的丰度与更健康的代谢状态以及热量限制后较好的临床结果呈正相关。通过在小鼠和人类身上注射该模式菌株,研究了A. muciniphila在肥胖过程中的因果作用及其潜在的有益影响。首次证明,小鼠每天服用活的A. muciniphila MucT可以逆转高脂饮食引起的代谢紊乱,包括脂肪增加、代谢内毒素、脂肪组织炎症和胰岛素抵抗。
在合成培养基中生长的A. muciniphila MucT的巴氏杀菌增强了它减少小鼠脂肪团发育、胰岛素抵抗和血脂异常的能力。事实上,A. muciniphila MucT可以降低小鼠的胆固醇水平和血清甘油三酯水平。
代谢健康背景下黏质阿克曼菌的代谢效应及主要影响因素
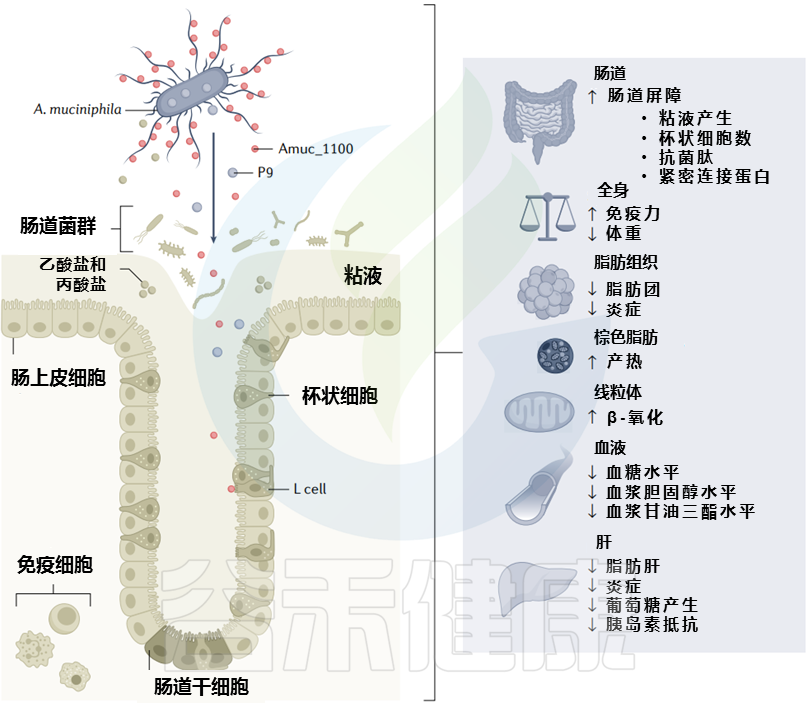
Cani PD, et al. Nat Rev Gastro Hepat. 2022
影响肝脏脂肪代谢
研究发现A. muciniphila MucT补充剂通过调节与脂肪合成有关的基因的表达(例如,降低肝脏中固醇调节元件结合蛋白的表达)和不同的炎症标志物(例如,降低IL-1β和IL-6的表达,ALT和髓过氧化物酶活性),可以积极地影响小鼠的肝脏脂肪代谢,预防非酒精性脂肪性肝病。
减轻动脉粥样硬化
在动脉粥样硬化发展的小鼠模型(载脂蛋白E缺陷(ApoE−/−)小鼠)中,A. muciniphila MucT的注射似乎减轻了动脉粥样硬化的损害。
降低糖尿病发病率
有趣的是,除了T2DM,在啮齿类动物和人类中,A. muciniphila通过降低肠道通透性、减少炎症和胰岛炎症的机制减少了T1DM的发病,从而有助于胰岛的保存。早期应用万古霉素可增加非肥胖型糖尿病小鼠(T1DM小鼠模型)的A. muciniphila丰度,降低糖尿病发病率。
神经退行性疾病
2016年至2020年间发表的几份报告表明,A. muciniphila在帕金森病和多发性硬化症中的作用,因为其相对丰度与受影响患者的疾病严重程度呈正相关。然而,尽管将患者的粪便微生物移植到无菌小鼠体内会导致疾病某些方面的发展,但这些研究都没有检测到受体小鼠粪便中的A. muciniphila,从而表明其他细菌可能参与了该病的发生表型。
多发性硬化症
对于多发性硬化症,在一项纳入62名复发缓解性疾病患者的研究中,作者发现脑脊液中的抗-Akkermansia IgG水平高于健康同行,并且局部脑脊髓特征与残疾评分呈正相关,而在同一个人的血液中检测到IgG水平没有明显的改变。
虽然在这些研究中观察到的抗-Akkermansia IgG水平的增加与肠道中嗜粘蛋白A. muciniphila丰度的改变无关,但另一项研究提供了支持 A. muciniphila在多发性硬化症中的积极和有益作用的机制解释。
这项研究表明,在多发性硬化症实验性自身免疫性脑脊髓炎小鼠模型的粪便和未治疗的多发性硬化症高峰期患者的粪便中发现的A. muciniphila的大量繁殖与miR-30d的富集有关。
有人发现,从这些小鼠或人类身上收集的粪便的转移导致A. muciniphila的丰度增加,并有利于调节性T (Treg)细胞的扩增,进而控制效应T细胞以抑制疾病症状。研究人员表明在患有多发性硬化症的小鼠中接种A. muciniphila可降低疾病评分、减少轴突损失的脱髓鞘和增加Treg细胞群。
相反,A. muciniphila衍生肽被确定为环境因素,与多发性硬化症(即HLA-DR15单倍体型)最强的遗传风险易感因素相结合,可以介导免疫调节介导的患者自身反应性T细胞的激活。
更具体地说,从患者体内分离出的 HLA-DR-SP反应性 CD4+ T细胞可以被某些外来因子(例如Epstein-Barr病毒和从A. muciniphila中分离出的一些肽)激活,然后对血液中的潜在致病多肽或自身抗原(如髓鞘碱性蛋白)产生反应,可能还会在脑脊液和/或脑中发生交叉反应,从而针对脑组织。
帕金森病
文献中关于阿尔茨海默病和A. muciniphila的发病机制存在差异,相关研究显示阿尔茨海默病患者的A. muciniphila含量较高,而干预研究清楚地报告了这种细菌在病理学中的有益作用。阿尔茨海默病是一种疾病,其最强的病理标志之一是淀粉样蛋白β肽42 (Aβ42)在老年斑中的积累。
由于肥胖和T2DM是痴呆的重要危险因素,一项机制研究探讨了在喂食高脂肪饮食的阿尔茨海默病小鼠模型中施用A. muciniphila的影响。除了抗肥胖作用外,无论饮食如何,接种都能显着减少大脑中的 Aβ并改善认知测试的表现。A. muciniphila给药还恢复了生命早期(生命3周时)暴露于高脂肪饮食的小鼠的认知能力下降和海马发育障碍。
癌症免疫治疗反应
免疫疗法是一种利用免疫系统对抗肿瘤形成细胞的癌症疗法,并已发展成为治疗各种癌症的成功方法。
肠道微生物组的相关性是增强对检查点抑制剂治疗的临床反应的标志物和辅助剂。
该疗法通过阻断程序性死亡受体1(PD1)等免疫检查点来恢复对抗癌细胞的活性。对100名对抗-PD1抗体反应良好的非小细胞肺癌和肾细胞癌患者的微生物组进行了详细的表征,结果显示A. muciniphila富集。此外,在疾病进展迅速的个体和后来死亡的个体中,A. muciniphila的患病率最低(34%)。
A. muciniphila菌株在用抗-PD1 药物治疗后,在移植无应答者粪便的无菌小鼠和预先暴露于抗生素的小鼠中改善了抗肿瘤活性。一项具有统计学意义的研究旨在专门评估338例非小细胞肺癌患者的A. muciniphila 基线检测与临床反应之间的关联。证实了A. muciniphila的存在与临床反应之间的密切关联。
在另一项研究中,42名主要使用抗-PD1药物治疗的转移性黑色素瘤患者的肠道微生物群也被证实富含多种分类群,包括Akkermansia。2020 年发表的一项研究确定肌苷是抗癌细胞活性的潜在因素,尽管这种核苷是由许多其他细菌产生的。
总之,这些研究表明,A. muciniphila是一种有望提高对检查点抑制剂免疫疗法的临床反应的候选菌。
肠道屏障和肠道炎症
最初发现A. muciniphila MucT 可以通过恢复小鼠的粘液层厚度以及抗微生物肽Reg3g的肠道表达来改善肠道屏障功能,这在肥胖和代谢紊乱期间都会发生改变。后来,在A. muciniphila MucT补充剂中观察到的粘液层厚度增加与小鼠粘液产生细胞数量的增加有关。
此外,来自A. muciniphila MucT (AmEVs)的细胞外囊泡,也显示通过调节小鼠的紧密连接来降低肠道通透性。
肠道炎症的情况下保护的肠道屏障
已有研究表明,与健康人相比,克罗恩病 (n = 26)和溃疡性结肠炎(n = 20和n = 15 ) 患者相比,A. muciniphila显著减少。这种相关性已在临床前模型中进行了因果研究。
改善结肠炎
已发现A. muciniphila MucT在结肠炎中的有益作用,AmEVs可保护葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎的进展。
随后,几项研究观察到A. muciniphila MucT细胞恢复肠道屏障功能并改善了:
改善衰老引起的变化
衰老是另一种肠道屏障减少和炎症增加的情况。各种人类研究报告称,与年轻成人(<50岁)和百岁老人相比,老年人(>65岁)的A. muciniphila丰度较低。
这一发现导致了旨在评估A. muciniphila MucT给药对不同衰老小鼠模型中几个年龄相关参数的影响的研究。
总之,这些研究表明,施用A. muciniphila MucT改善了一些与年龄相关的变化,包括炎症、屏障完整性和行为。
代谢综合征
在啮齿动物中,A. muciniphila被认为是健康的生物标记物。在啮齿类动物中,许多对A. muciniphila种群具有生长促进作用的膳食补充剂因其促进健康的作用而受到广泛关注。
在患有代谢综合征的人类中,给药被证实是可行的、安全的和有良好的耐受性。事实表明,与炎症、血液学、肾脏、肝脏和肌肉功能相关的任何标志物的变化,都可以用任何A. muciniphila MucT制剂来观察。这一结果是在不考虑所使用的形式以及短期(即2周)和长期(即3个月暴露)的情况下观察到的。
巴氏灭菌Akk菌比活菌效果好
以前的结果表明,高压灭菌灭活A. muciniphila可消除其对小鼠代谢综合征的保护作用。对植物乳杆菌或干酪乳杆菌菌株进行的研究表明,不剧烈的热诱导灭活,如巴氏杀菌,可以使细菌在稳定它们的同时保留部分有益的特性。
因此,有人在相同的饮食诱导肥胖小鼠模型上,通过比较活菌和巴氏灭菌菌的给药效果,检验A. muciniphila巴氏灭菌的效果。结果是,接受巴氏灭菌菌株的小鼠在体重、脂肪质量增加、血脂和胰岛素抵抗标志物方面的降幅甚至比接受活细菌的小鼠更大。除了提高A. muciniphila粘液的有效性,巴氏杀菌还具有提高菌稳定性和延长其保质期的好处,从而便于给人服用。
在未经治疗的患者中,给予巴氏灭菌A. muciniphila MucT成功地防止了与代谢综合征相关的参数的自然恶化。与补充安慰剂的志愿者相比,补充已过活的A. muciniphila MucT显著改善了胰岛素敏感性,降低了胰岛素血症和血浆总胆固醇水平。
为了进一步评估巴氏灭菌A. muciniphila MucT的安全性,对大鼠进行了一项强有力的毒理学长期评估。结果表明,口服90天,即使在测试的最高剂量(每公斤体重9.6×1010A. muciniphila MucT细胞,没有观察到不良反应的水平)下,也没有转化为亚慢性毒性,而体外遗传毒性试验显示阴性结果。
如前面所述,A. muciniphila可能有多种作用模式,所有这些都已用 MucT菌株进行了研究。当使用巴氏杀菌细菌时,可以观察到A. muciniphila MucT的几种有益效果和令人惊讶的功效增加。
产短链脂肪酸,作用于宿主代谢
最明显的答案是短链脂肪酸(如丙酸盐)的一般作用,因为A. muciniphila MucT在维生素B12存在下被称为丙酸盐生产者。虽然A. muciniphila对肠道中丙酸盐总水平的贡献可能相对于其他主要的丙酸盐生产者(例如拟杆菌)相对较低,尤其是在禁食条件下。但 Akkermansia似乎在动物和人类中都上调,并且可能对生产这种短链脂肪酸做出重大贡献。
在这种情况下,某些影响可能与肠道上皮细胞和肠道黏膜中存在的不同类型免疫细胞上表达的FFAR3和FFAR2受体(也分别称为GPR41和GPR43)有关。然而,值得注意的是,巴氏杀菌的 A. muciniphila MucT也可以作用于宿主代谢,不会改变丙酸盐的产生。
通过外膜上的蛋白质Amuc_1100发挥作用
2017年,有人确定了A. muciniphila MucT可以在宿主健康中发挥作用的特定和独特的分子机制。他们发现存在于A. muciniphila外膜中的一种特定蛋白质,称为Amuc_1100,概括了这种细菌的有益作用。A. muciniphila的所有有益作用是否都可归因于Amuc_1100目前尚不清楚,但其每个细胞的生产水平足以解释临床前模型中的作用。
重要的是,他们发现这种蛋白质在用于巴氏杀菌的温度下仍保持其活性构象,从而解释了为什么巴氏杀菌的A. muciniphila MucT在小鼠和人体实验中保持活性。
此外,发现Amuc_1100可激活Toll样受体2 (TLR2),单独给药可复制A. muciniphila MucT细胞的大部分有益作用,包括在肠道炎症和结肠癌的特定疾病模型中的作用。
这一发现表明,即使死亡(即巴氏杀菌后),A. muciniphila MucT仍然可以改善宿主健康,并反对需要潜在的分泌代谢物来观察细菌的有益作用。
外膜上的蛋白质 P9,刺激GLP1水平增加
2021年的一项研究确定了A. muciniphila MucT产生的另一种蛋白质。发现A. muciniphila处理的饮食诱导的肥胖小鼠在口服葡萄糖挑战期间表现出循环GLP1水平略有增加。
通过体外实验,作者鉴定了一种84kDa的蛋白质,命名为蛋白 9(P9;由早期鉴定的 Amuc_1831 基因编码),它负责体外刺激GLP1。
在体内,他们测试了 8周以非常高的剂量口服P9的效果,发现体重增加和脂肪量增加都有所减少,胰高血糖素前体(即GLP1的前体)的肠道表达增加。
这些影响怎么与较高的循环 GLP1 水平联系起来?
研究发现P9的药理作用激活 ICAM2,这些作用与可能的GLP1分泌有关,因为抗-ICAM2抗体在体外部分消除了P9对GLP1分泌的影响。
此外,A. muciniphila MucT增加了小鼠回肠中IL-6的表达。除了证实IL-6是一种促炎细胞因子外,这种细胞因子还在体外剂量依赖性地增加GLP1的分泌。
因此,有人假设A. muciniphila MucT也可以通过 IL-6-GLP1信号传导发挥作用。为了进一步支持他们的发现,研究人员使用了IL-6敲除小鼠,发现这些小鼠对P9诱导的GLP1分泌没有反应,而阻断GLP1受体也消除了P9对产热的影响。尽管这些发现是相关的,但应评估其他因素,例如P9的生理剂量和位置(可能被分泌)。
与Akkermansia或相关分子在疾病中的作用相关的主要机制
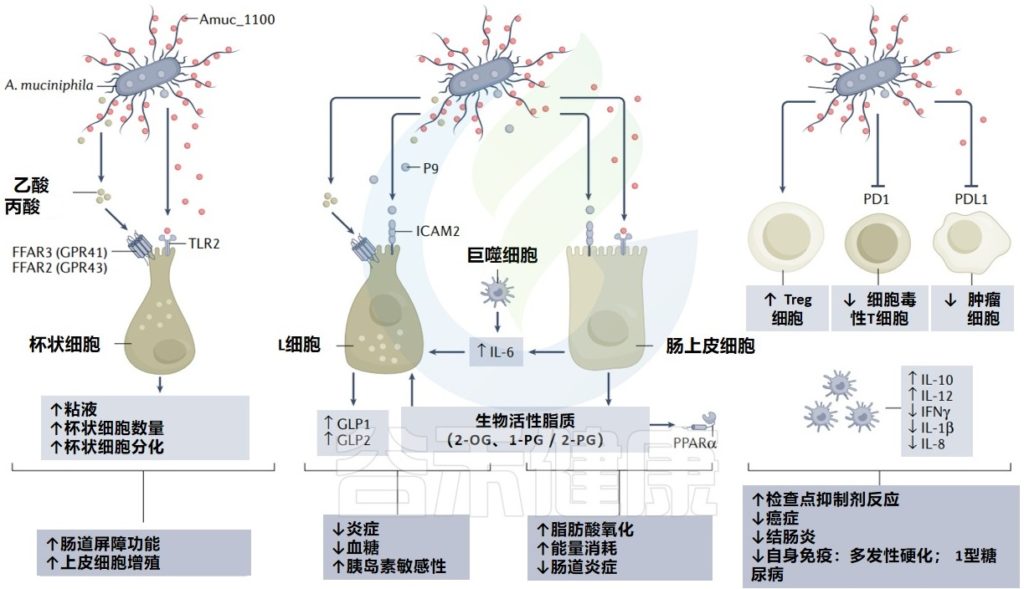
Cani PD, et al. Nat Rev Gastro Hepat. 2022
A. muciniphila MucT表达的酶潜在益处
一项研究证明天冬氨酸蛋白酶Amuc_1434*通过TRAIL介导的细胞凋亡途径抑制LS174T细胞活力。然而,没有进一步的位置、热稳定性或体内数据报告,因此尚无法评估这一发现的潜在和生理相关性。
第二项研究表明,A. muciniphila MucT表达的β-乙酰氨基己糖苷酶Amuc_2109*保护小鼠免受DSS诱导的结肠炎;然而,尚未报告热稳定性数据。
此外,已在人类身上表明,活的或巴氏杀菌的A. muciniphila MucT 改善了几种心脏代谢风险因素,包括胰岛素抵抗,而不增加 GLP1 的循环水平,也不影响 DPP4 活性,DPP4 是一种参与 GLP1 降解的酶。
有趣的是,无论使用何种形式的A. muciniphila MucT——活的或巴氏杀菌的,甚至是蛋白Amuc\U 1100,文献中的所有数据都通过作用于不同的关键标记物来强化肠道屏障。
事实上,所有的治疗都指向更高的粘液产量,紧密连接蛋白的恢复,抗菌因子的恢复,以及最终加强肠道屏障。
特异性调节
此外,一部分人通过对用活的或巴氏杀菌的 Akkermansia治疗的人体进行脂质组学和代谢组学分析。已经发现A. muciniphila MucT治疗诱导了不同生物活性脂质的特异性调节,这些被鉴定为 PPARα 激动剂(2-PG和1-PG)。
重要的是,在人类中使用非靶向代谢组学分析,他们已经能够重建一条指向通过β-氧化激活脂肪酸氧化的代谢途径,并且所有鉴定的代谢物都在PPARα的控制下趋向于增加线粒体活性,这些数据也在啮齿动物身上得到了证实。
除了对肠道屏障的影响,这可能涉及对几种疾病(即糖尿病、肥胖症、NAFLD和/或非酒精性脂肪性肝炎、炎症性肠道疾病、多发性硬化症)的保护作用,A. muciniphila对癌症的作用也是与依赖免疫系统的其他机制有关。
例如,使用检查点抑制剂(抗-PD1)的免疫疗法与动物数据中涉及 IL-12 依赖性效应的特定机制方面有关。此外,数据表明A. muciniphila菌株对抗-PD1反应的辅助作用增加了特定T细胞向肿瘤床的募集。
在炎症性肠病、T1DM或肠癌的小鼠模型中,A. muciniphila MucT或特定蛋白增加Treg细胞群的分化或降低结肠中浸润性巨噬细胞和CD8+细胞毒性T淋巴细胞的水平。
A. muciniphila MucT的代谢和抗炎作用是强大的,因为来自不同研究团队的许多结果已经证实了A. muciniphila菌株的各种健康特性。
A. muciniphila的生理和有益作用是多效性的(例如,能量、脂质、葡萄糖代谢、炎症、免疫、脑功能),重要的是要强调有许多汇聚的作用模式,可能是由于其特异性特性与其粘蛋白代谢的特化有关。
事实上,已经确定了几种常见的途径,都指向调节肠道屏障功能(即粘液产生和免疫系统)。肠道屏障的恢复,也有助于恢复几种改变的途径的正常功能,包括例如线粒体活性、肝脏代谢、脂肪组织和大脑活动。
最后,A. muciniphila MucT的有益作用已从临床前观察转化为代谢综合征背景下的人类干预。这种情况是独一无二的,是其他下一代微生物无法比拟的。
需要注意的是,虽然A. muciniphila具备各种有益特性,但是该菌丰度并不是越多越好,要保持在合适范围。谷禾肠道菌群检测结果中曾经有案例,发现该菌丰度过高,占比超50%。
该菌过量将过度消耗粘液蛋白而存活下来,这是大多数其他细菌所缺乏的生存优势,该菌增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、LPS 进入血液的增加、自身免疫性疾病有关。
该样本检测报告也显示菌群多样性低,肠炎和几项慢病注意风险:
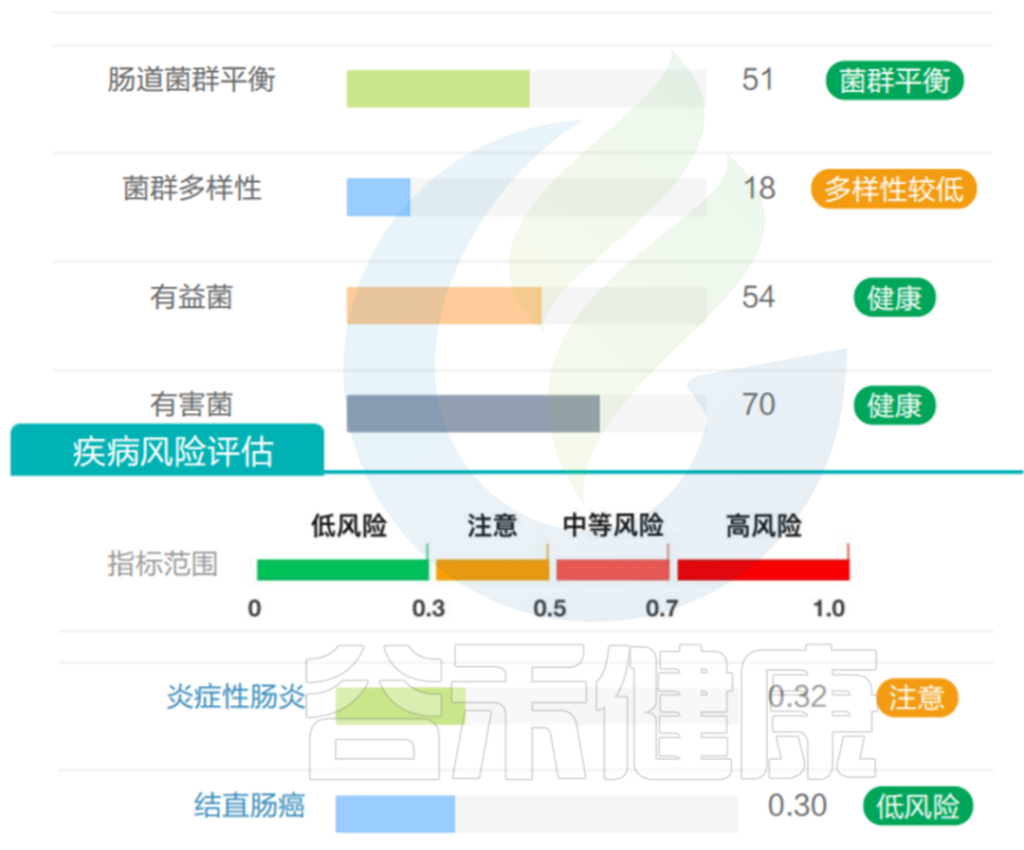
<来源:谷禾健康数据库>
总的来说,在合理范围内,A. muciniphila 带来有益影响。
当然也需要更多的研究来支持A. muciniphila的有益特性及临床治疗应用:
主要参考文献
Cani PD, Depommier C, Derrien M, Everard A, de Vos WM. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms. Nat Rev Gastroenterol Hepatol. 2022 May 31. doi: 10.1038/s41575-022-00631-9. Epub ahead of print. PMID: 35641786.
Kostopoulos I, Elzinga J, Ottman N, Klievink JT, Blijenberg B, Aalvink S, Boeren S, Mank M, Knol J, de Vos WM, Belzer C. Akkermansia muciniphila uses human milk oligosaccharides to thrive in the early life conditions in vitro. Sci Rep. 2020 Aug 31;10(1):14330. doi: 10.1038/s41598-020-71113-8. PMID: 32868839; PMCID: PMC7459334.
Yin J, Song Y, Hu Y, Wang Y, Zhang B, Wang J, Ji X, Wang S. Dose-Dependent Beneficial Effects of Tryptophan and Its Derived Metabolites on Akkermansia In Vitro: A Preliminary Prospective Study. Microorganisms. 2021 Jul 14;9(7):1511. doi: 10.3390/microorganisms9071511. PMID: 34361945; PMCID: PMC8305782.
Paone P, Cani PD. Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut. 2020 Dec;69(12):2232-2243. doi: 10.1136/gutjnl-2020-322260. Epub 2020 Sep 11. PMID: 32917747; PMCID: PMC7677487.

谷禾健康

维生素对人体健康至关重要;它们是无数酶的辅助因子,包括促进脂肪和碳水化合物代谢的酶,并具有直接和间接的抗氧化特性。
由于人类自身无法产生足够量的维生素(维生素 D 除外),因此要从食物中获取维生素。然而,许多维生素对温度敏感,在食品加工和储存过程中容易降解。因此,维生素缺乏症在某些人群(例如,素食主义者或老年人)中很常见。
例如口角炎,脚气病,腿部容易抽筋,皮肤容易红肿,容易烦躁和疲倦等,都有可能与缺乏B族维生素有关。
B族维生素从哪里来?
曾经有人认为B族维生素只从饮食中获得;然而并非如此,肠道微生物群也是维生素的重要来源。
B 族维生素包括哪些?
常见的有维生素 B1 (硫胺素)、B2(核黄素)、B3(烟酸/烟酰胺)、B5(泛酸)、B6(吡哆醇)、B7(生物素)、B9(叶酸)和B12 (钴胺素)等。

B族维生素的吸收情况
B族维生素主要通过结肠产生和吸收,大多数B族维生素的吸收情况类似:在低浓度时,主动运输系统促进吸收,而在较高浓度时,被动扩散主要发生在小肠。过量摄入B族维生素会使B族维生素到达大肠。

B族维生素是多种代谢途径中普遍必需的辅助因子的生物合成前体,对宿主和肠道微生物群都是不可或缺的,它们在维持免疫稳态中也发挥着重要作用。
本文来详细了解一下B族维生素(8类)和肠道微生物群之间有什么联系,它们在免疫代谢中有哪些作用,缺乏会导致什么症状,如何补充B族维生素。
维生素B1是维持神经、心脏及消化系统正常机能的重要生物活性物质。
维生素B1参与肠道粘膜免疫系统的免疫防御,调节免疫细胞在肠道内发挥作用。维生素B1对巨噬细胞有调控作用,能够介导巨噬细胞的生长及其细胞因子的分泌,间接促进免疫细胞的增殖和分化。
维生素 B1(硫胺素)是几种酶的辅助因子,包括丙酮酸脱氢酶和 α-酮戊二酸脱氢酶,它们都参与三羧酸 (TCA) 循环,从而为人体提供能量。
维生素B1在体内是如何参与代谢的?
前面我们已经知道,维生素B的两种来源:
摄入食物和细菌代谢生成。
膳食和细菌维生素B1在宿主中有不同的作用。因此我们从这两个方面分别了解其吸收转化过程。
膳食维生素B1
维生素 B1 在肉类(尤其是猪肉和鸡肉)、鸡蛋、谷芽、米糠、豆类中以高浓度的焦磷酸硫胺素 (TPP) 形式存在。
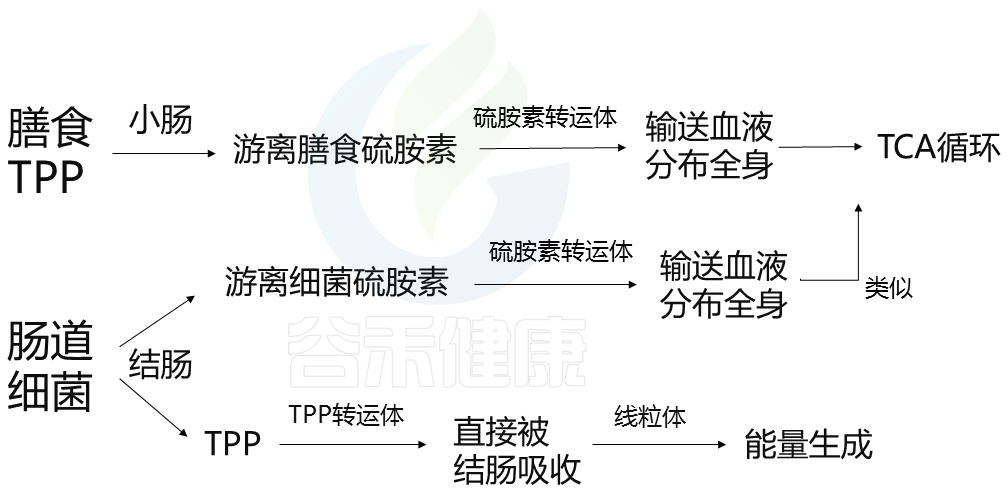
膳食TPP被碱性磷酸酶水解,并在小肠内转化为游离硫胺素。游离硫胺素通过硫胺素转运体(例如,THTR-1、THTR-2)被肠上皮吸收,并被输送到血液中以分布在全身。游离硫胺被转化回TPP,用于TCA循环中的能量代谢。
细菌维生素B1
结肠中各种类型的肠道细菌也会产生维生素B1作为游离硫胺素和TPP。在结肠中,游离细菌硫胺素主要被硫胺素转运体吸收,运输到血液中,并分布在全身;这一机制与小肠吸收游离膳食硫胺素的方式相似。
然而,肠道细菌产生的TPP不会转化为游离硫胺素,因为结肠中不会分泌碱性磷酸酶。相反,TPP通过在结肠顶膜上高度表达的TPP转运体(如TPPT-1)直接被结肠吸收。被吸收的TPP通过MTPP-1进入线粒体,MTPP-1是一种TPP转运体,在线粒体内膜中表达,用作ATP生成的辅助因子。这表明细菌TPP对结肠中的能量生成很重要。
这两者之间的区别在于:肠道细菌产生TPP这条途径,并不是通过游离硫氨酸,而是直接被结肠吸收。
哪些菌会产生维生素B1呢?
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃氏菌、艰难梭菌(Clostridium difficile)、一些乳杆菌属、Ruminococcus lactaris、双歧杆菌属、可变梭杆菌(Fusobacterium varium)是维生素B1的产生菌。

此外,比如干酪乳杆菌(Lactobacillus casei)在发酵乳饮料的生产过程中产生硫胺素,婴儿双歧杆菌和双歧双歧杆菌在培养上清液中产生硫胺素。
许多肠道细菌拥有完整的维生素B1合成途径,包括噻唑和嘧啶的合成途径。
维生素B1的结构由嘧啶环和噻唑环通过亚结合而成。
细菌从甘氨酸或酪氨酸和1-deoxy-d-xylulose-5-phosphate中获得噻唑部分;
嘧啶部分来自5-氨基咪唑核糖核苷酸,这是嘌呤途径的中间产物。
宿主和某些菌存在VB1竞争
在肠道微生物群中,并非所有细菌都产生 B 族维生素,一些细菌利用膳食 B 族维生素或其他肠道细菌产生的 B 族维生素来满足自己的需要;因此,宿主和肠道微生物群之间可能存在对 B 族维生素的竞争。
比如,粪杆菌属(Faecalibacterium)的生长虽然需要维生素B1,但它却缺乏维生素B1合成途径。因此,必须通过硫胺素转运体从其他细菌或宿主饮食中获得维生素B1,这表明宿主和某些肠道细菌之间存在维生素B1竞争。
建议摄入量
世界卫生组织 (WHO)/粮食及农业组织 (FAO) 建议成人每日维生素 B1 摄入量为 1.1-1.2 毫克。
缺乏导致
维生素 B1 缺乏会导致嗜睡,如果不及时治疗,可能会发展成脚气病,这是一种影响周围神经系统和心血管系统的疾病。
含量较高的食物
维生素B1 存在于全麦谷物、酵母、豆类、坚果和肉类(尤其是猪肉和鸡肉)等食物中。

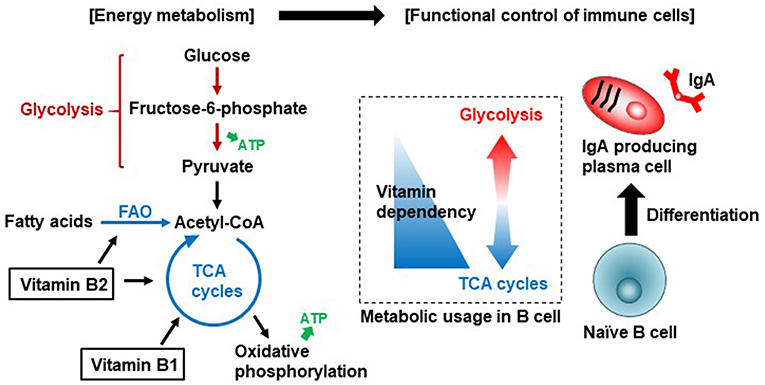
维生素 B2(核黄素)及其活性形式(黄素腺嘌呤二核苷酸 [FAD] 和黄素单核苷酸 [FMN])是 TCA 循环和脂肪酸氧化(也称为 β-氧化)中酶促反应的辅助因子。
维生素B2通过调节脂肪酸氧化来控制免疫细胞的分化和功能。
除了产生能量外,维生素B2通过启动NADPH氧化酶2与免疫细胞中活性氧(ROS)的产生有关,ROS是炎症和免疫过程中重要的效应分子和信号分子。
维生素B1和B2介导肠道B细胞分化的免疫代谢
Yoshii K, et al., Front Nutr. 2019
维生素B1是参与TCA循环的丙酮酸脱氢酶和α-酮戊二酸脱氢酶等酶的辅助因子。维生素B2是TCA循环中琥珀酸脱氢酶和脂肪酸氧化(FAO,也称为β-氧化)中酰基辅酶a脱氢酶等酶的辅助因子。初始B细胞优先使用TCA循环有效产生能量。一旦B细胞被激活,分化为产生IgA的浆细胞,它们就会利用糖酵解产生IgA抗体。
膳食维生素B2
膳食维生素 B2 以 FAD 或 FMN 形式存在,并在小肠中通过 FAD 焦磷酸酶和 FMN 磷酸酶转化为游离核黄素。游离核黄素通过小肠上皮上表达的核黄素转运蛋白被吸收,然后释放到血液中。在血液中,游离核黄素转化回 FAD 或 FMN 并分布在全身。
细菌维生素B2
细菌维生素B2是由三磷酸鸟苷(GTP)和5-磷酸核酮糖合成的。细菌维生素B2以游离核黄素的形式存在,可直接在大肠中吸收,转化为FAD或FMN,并如上所述分布在全身。
哪些菌会产生维生素B2呢?
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃特菌属;艰难梭菌(Clostridium difficile)、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(L. fermentum)、Ruminococcus lacttaris表达合成维生素B2所必需的因子,表明这些细菌是大肠中维生素B2的重要来源。
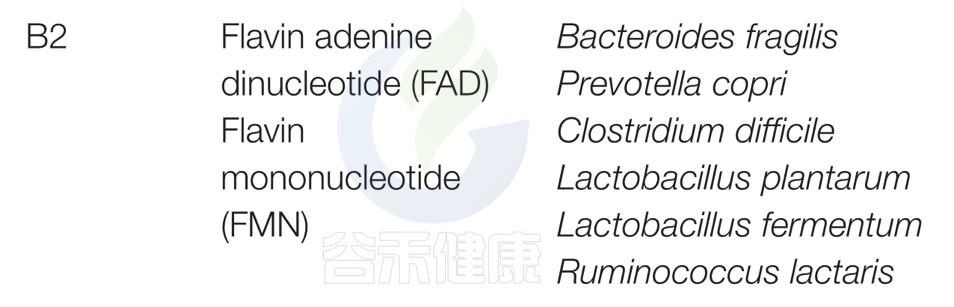
从酸面团中分离出的发酵乳杆菌可以在体外合成维生素B2。
双歧杆菌和Collinsella缺乏维生素B2途径。
在缺乏维生素B2的小鼠中,添加含有植物乳杆菌的发酵豆浆可以促进维生素B2的产生,防止维生素B2缺乏。
宿主和共生细菌之间对VB2的竞争
拟杆菌门中的某些物种比放线菌门和厚壁菌门产生更多的VB2。然而,放线菌和厚壁菌门仍然表达核黄素转运蛋白以及从游离核黄素生成 FAD 和 FMN 所必需的酶(即 FAD 合酶和黄素激酶),这表明所有细菌,包括那些不能合成维生素的细菌B2 本身需要 FAD 和 FMN 才能生长和生存。因此,与维生素 B1 一样,宿主和共生细菌之间可能存在对维生素 B2的竞争。
某些菌产生维生素B2中间体,有助于防御病原体
除了能够产生维生素 B2 之外,一些细菌(例如嗜酸乳杆菌等共生菌,结核分枝杆菌和鼠伤寒沙门氏菌等病原体)还产生维生素 B2 中间体(6-hydroxymethyl-8-d-ribityllumazine ),该中间体与抗原呈递细胞上的主要组织相容性复合物I类相关基因蛋白(MR1)结合;这会导致粘膜相关不变T细胞(MAIT)产生细胞因子,如干扰素γ和IL-17,这有助于宿主防御病原体(下图)。
来自维生素B2和B9的微生物代谢产物对MAIT细胞的调节
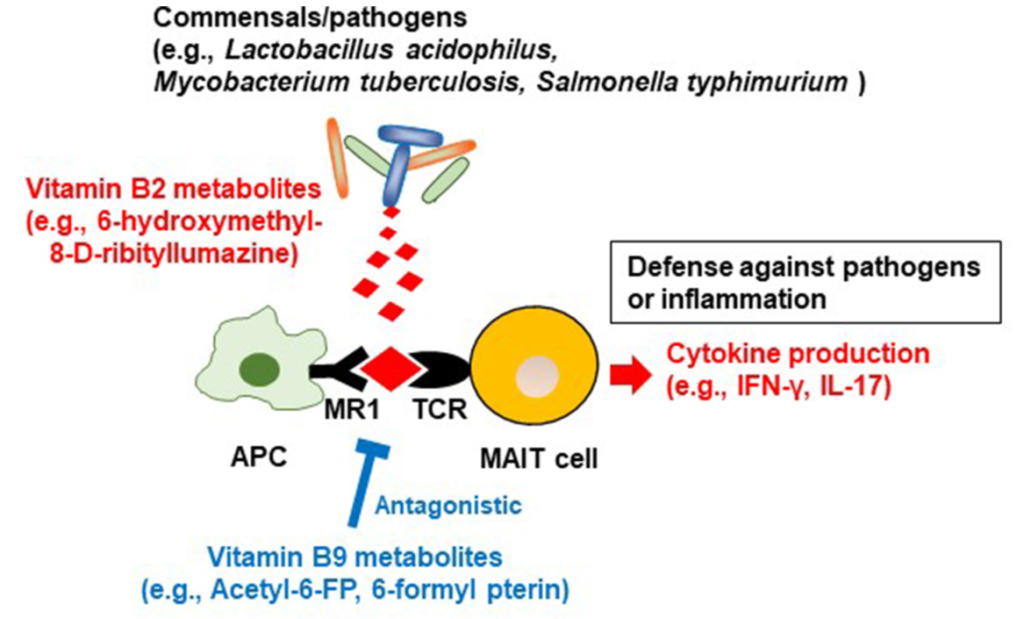
Yoshii K, et al., Front Nutr. 2019
有人认为,共生细菌的刺激有助于MAIT细胞的发育和激活,以便对病原体进行免疫监测。MAIT细胞还产生炎性细胞因子并具有组织归巢特性,表明这些细胞也参与自身免疫和炎症疾病的发展。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B2 摄入量为 1.0–1.3 毫克。
缺乏会导致
维生素 B2 缺乏会抑制参与脂肪酸氧化生成乙酰辅酶 A 的酰基辅酶 A 脱氢酶的活性,而乙酰辅酶 A 被线粒体用来通过 TCA 循环产生 ATP。
含量较高的食物
绿叶蔬菜、肝脏和鸡蛋中的维生素 B2 含量很高。

维生素 B3(烟酸)通常被称为烟酸和烟酰胺。这些化合物是烟酰胺腺嘌呤二核苷酸 (NAD) 的前体,NAD 是细胞氧化还原反应中的一种辅酶,在有氧呼吸中起核心作用。
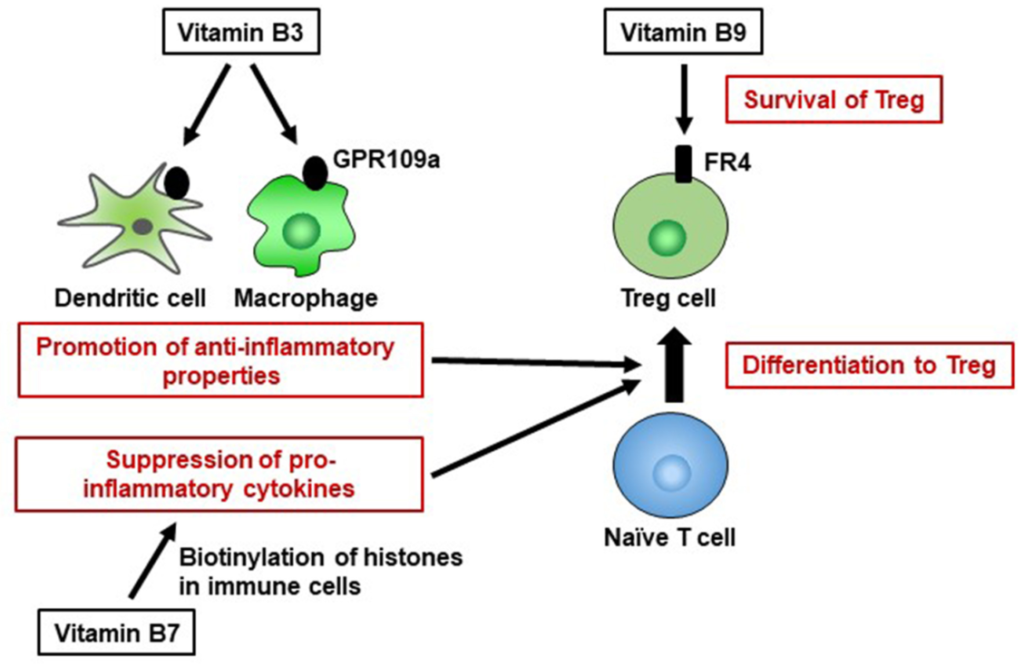
免疫功能:抗炎,抑制结肠炎
维生素 B3 也是 GPR109a 的配体,GPR109a 是一种 G 蛋白偶联受体,在包括免疫细胞在内的多种细胞上表达。维生素 B3-GPR109a 信号传导诱导调节性 T 细胞分化并以 GPR109a 依赖性方式抑制结肠炎。维生素 B3 还抑制巨噬细胞和单核细胞产生促炎细胞因子 IL-1、IL-6 和肿瘤坏死因子 α (TNF-α)。
Yoshii K, et al., Front Nutr. 2019
因此,维生素B3通过调节宿主免疫细胞而具有抗炎特性,并在维持免疫稳态中发挥重要作用。
与其他B族维生素不同,维生素B3可由哺乳动物通过色氨酸的内源性酶途径生成,并储存在肝脏中,也可从饮食中获得。
膳食维生素B3
动物性食品如鱼和肉含有维生素B3作为烟酰胺,而植物性食品如豆类含有维生素B3作为烟酸。烟酰胺和烟酸都通过小肠直接吸收,烟酸在小肠转化为烟酰胺。
哪些菌会产生维生素B3呢?

维生素B3也是由肠道细菌从色氨酸合成的。可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、乳瘤胃球菌、艰难梭菌、婴儿双歧杆菌、幽门螺杆菌、可变梭杆菌。
因此,来自不同属的许多肠道细菌可以产生维生素B3,这表明饮食和共生细菌来源的维生素B3对宿主免疫都很重要。
缺乏会导致
在人类中,维生素B3缺乏会导致糙皮病,这是一种以肠道炎症、腹泻、皮炎和痴呆为特征的疾病。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B3 摄入量为 11-12 毫克。
含量较高的食物
全麦制品、糙米、绿豆、芝麻、花生、香菇、紫菜、无花果、乳制品、蛋、鸡肉、肝、瘦肉、鱼等。

维生素B5(泛酸)是辅酶a(CoA)的前体,辅酶a是TCA循环和脂肪酸氧化的必要辅助因子。
与维生素B1和B2一样,维生素B5通过免疫细胞的能量生成参与宿主免疫的控制。
缺乏导致
维生素B5缺乏会导致皮炎等免疫疾病,以及疲劳和失眠等非免疫相关疾病。
维生素B5缺乏如何引起炎症?
在一项针对成年人的随机、双盲、安慰剂对照研究中,膳食中补充维生素B5可改善面部痤疮,表明上皮屏障功能通过促进角质形成细胞增殖和分化为成纤维细胞而改善。
为了在缺乏维生素B5的时候保持维生素B5水平,辅酶A通过泛碱转化回维生素B5或半胱胺。然而,半胱胺抑制过氧化物酶体增殖物激活受体γ(PPARγ)信号,导致炎症。在泛碱产生酶基因敲除小鼠中,结肠炎已得到改善。因此,维生素B5缺乏通过上皮屏障功能障碍和促炎分子的产生引起炎症。
维生素B5通过激活免疫反应来促进宿主防御
在免疫反应方面,维生素B5通过促进先天免疫和适应性免疫,增强抗结核分枝杆菌感染的保护活性。在小鼠中,补充维生素B5可激活巨噬细胞的吞噬作用和细胞因子(包括IL-6和TNF-α)的产生,并随后促进Th1和Th17反应,以清除肺结核分枝杆菌。因此,维生素B5通过激活免疫反应来促进宿主防御,表明这种维生素作为一种天然佐剂具有重要作用。
膳食维生素B5
维生素B5在肝脏、鸡蛋、鸡肉和发酵大豆中以辅酶A或磷酸泛酰巯基乙胺pantetheinase的形式存在,浓度很高。辅酶A和磷酸泛乙烯通过小肠内的内源性酶(如磷酸酶和泛乙烯酶)转化为游离泛酸。游离泛酸通过小肠上皮上表达的钠依赖性复合维生素转运体(SMVT)被吸收,然后释放到血液中。最后,游离泛酸被转化回辅酶A并分布在全身,尤其是肝脏和肾脏。
细菌维生素B5
细菌维生素B5由2-二氢泛酸盐和β-丙氨酸通过从头合成途径合成。细菌维生素B5以游离泛酸的形式存在,其在大肠中直接吸收,转化为辅酶A,并以与膳食维生素B5相同的方式分布。
哪些菌会产生维生素B5呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、一些瘤胃球菌属(乳链球菌和扭链球菌)、肠道沙门氏菌、幽门螺杆菌具有维生素B5生物合成途径,表明肠道共生菌可以产生维生素B5。
细菌与宿主竞争维生素B5
相比之下,大多数梭杆菌和双歧杆菌属、艰难梭菌、粪杆菌属和乳酸杆菌属(厚壁菌属)的一些菌株缺乏这种途径,尽管其中一些菌株确实表达泛酸转运体以利用维生素B5产生能量,表明这些细菌与宿主竞争维生素B5。
摄入量
世卫组织/粮农组织建议成年人每天摄入5.0毫克维生素B5。
含量较高的食物
蔬菜中的卷心菜类,例如西兰花羽衣甘蓝,以及鳄梨、全麦谷物、土豆、乳制品、内脏等食物。

维生素B6以多种形式存在,包括吡哆醇、吡哆醛和吡哆胺。这些形式的维生素B6是辅酶磷酸吡哆醛(PLP)和磷酸吡哆胺(PMP)的前体,参与多种细胞代谢过程,包括氨基酸、脂质和碳水化合物代谢。
维生素B6在肠道免疫监测中起着重要作用
维生素B6调节炎症的机制目前尚不清楚。维生素B6通过脂质介质1-磷酸鞘氨醇(S1P)的代谢促进肠道免疫调节。
S1P调节淋巴细胞进入肠道,尤其是大肠。淋巴细胞转运依赖于S1P的产生及其降解产生的S1P梯度。S1P降解由S1P裂解酶介导,该裂解酶需要维生素B6作为辅助因子。服用维生素B6拮抗剂会损害S1P裂解酶活性,并产生不适当的S1P梯度,导致淋巴细胞从淋巴组织迁移受损,并减少肠道中淋巴细胞的数量。位于肠道上皮细胞之间的淋巴细胞被称为上皮内细胞(IEL),参与抵抗病原体的保护。
膳食维生素B6
膳食维生素B6以PLP或PMP的形式存在;它通过内源性酶(如吡哆醛磷酸酶)转化为游离维生素B6,然后被小肠吸收。虽然已经证明维生素B6通过酸性pH依赖和载体介导的转运被吸收,但尚未在任何哺乳动物物种中鉴定出肠吡哆醇转运体。在吸收游离维生素B6后,它进入血液,并转化回PLP或PMP。
细菌维生素B6
细菌维生素B6是由脱氧基果糖5-磷酸和4-磷酸羟基-L-苏氨酸或甘油醛-3-磷酸和d-核酮糖5-磷酸合成的PLP。在大肠中,细菌衍生的PLP转化为游离维生素B6,通过被动运输被吸收,运输到血液中,并分布在全身。
哪些菌会产生维生素B6呢?

可能参与B6合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属、长双歧杆菌、产气柯林斯菌、幽门螺杆菌。
拟杆菌和变形杆菌可能从5-磷酸脱氧纤维素和4-磷酸羟基-l-苏氨酸开始产生维生素B6,而放线菌可能从甘油醛-3-磷酸和d-核酮糖5-磷酸开始产生。
相比之下,大多数厚壁菌属(韦荣球菌、瘤胃球菌、粪杆菌和乳杆菌属)都缺乏维生素B6生物合成途径,除了一些梭菌(C. bartlettii、C. leptum、C.methylpentosum和C. sporogenes)和乳杆菌(短乳杆菌和瘤胃乳酸杆菌)外。
摄入量
世卫组织/粮农组织建议成年人每天摄入1.3-1.7毫克维生素B6。青少年和怀孕或哺乳的女性每天需要更多的维生素 B6,大约 2 毫克。
缺乏导致
维生素B6缺乏与过敏和类风湿性关节炎等炎症性疾病的发展以及神经元功能障碍有关。维生素B6缺乏会破坏Th1-Th2平衡,导致过度的Th2反应,导致过敏。此外,在类风湿性关节炎患者中观察到血浆维生素B6水平较低,以及促炎细胞因子(如TNF-α和IL-6)水平升高。
其他还包括导致肌肉无力、抑郁、易怒、短期记忆丧失、紧张和注意力不集中等问题。
含量高的食物
鱼类、鸡肉、豆腐、红薯、鳄梨、扁豆、牛奶、三文鱼、虾、菠菜、葵花籽、金枪鱼、糙米等。

维生素B7(生物素)是葡萄糖、氨基酸和脂肪酸代谢所必需的几种羧化酶的辅助因子。例如,维生素B7是参与脂肪酸生物合成的乙酰辅酶A羧化酶和脂肪酸合成酶的必要辅助因子。因此,维生素B7可能会影响免疫代谢。
维生素B7的抗炎作用
维生素B7通过结合(生物素化)组蛋白抑制基因表达;这些基因包括编码NF-κB的基因,NF-κB是产生几种促炎细胞因子(例如,肿瘤坏死因子α、IL-1、IL-6、IL-8)的主要信号分子。NF-κB的核转录在维生素B7缺乏时被激活,表明组蛋白的生物素化抑制NF-κB信号中编码促炎细胞因子的基因的表达。
因此,维生素B7通过抑制NF-κB活化而具有抗炎作用,膳食维生素B7缺乏通过促进促炎细胞因子的分泌而引起炎症反应。
膳食维生素B7
膳食生物素以游离蛋白质结合形式或生物素形式存在。在小肠中,生物素酶从结合蛋白中释放游离生物素,游离生物素通过生物素转运体SMVT被吸收。
细菌维生素B7
维生素B7也是由肠道细菌产生的游离生物素,由丙二酰辅酶A或吡美乐酸通过吡美乐酰辅酶A合成。细菌游离生物素被结肠中表达的SMVT吸收。
哪些菌会产生维生素B7呢?

可能参与B7合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属可变梭杆菌、大肠弯曲杆菌(campylobacteric coli)。
维生素B7的产生似乎在不同的肠道细菌之间以合作的方式进行;肠道中的长双歧杆菌产生吡美拉酸,它是维生素B7的前体,可增强其他肠道细菌产生维生素B7。
细菌与宿主竞争维生素B7
相比之下,普雷沃氏菌属、双歧杆菌属、梭菌属、瘤胃球菌属、粪杆菌属和乳酸杆菌属缺乏这种途径;然而,它们确实表达游离生物素转运体,这表明这些细菌也利用饮食和细菌维生素B7,因此可能与宿主竞争。
因此,游离生物素可能会影响肠道微生物群的组成,因为生物素是微生物群生长和存活所必需的。
缺乏导致
生物素缺乏会导致肠道失调和鼠乳杆菌过度生长,从而导致脱发。
什么情况会缺乏?
生蛋清中含有大量的抗生物素,它与维生素B7紧密结合,阻止维生素B7在肠道中被吸收。因此,维生素B7缺乏症不仅可能由维生素B7摄入不足引起,还可能由过量摄入生蛋清引起。
摄入量
世卫组织/粮农组织建议成年人每天摄入30微克。
含量较高的食物
维生素B7在坚果、豆类和油籽等食物中含量丰富。

维生素B9(叶酸)以四氢叶酸的形式存在,是包括DNA和氨基酸合成在内的多种代谢反应的辅助因子。
缺乏导致
由于红细胞对维生素B9的高需求,维生素B9缺乏会导致巨幼细胞性贫血。维生素B9缺乏症还通过将细胞周期阻滞在S期并增加DNA损伤的频率,在体外抑制人类CD8+T细胞的增殖。
维生素B9有助于维持免疫稳态
调节性T细胞(Treg)表达高水平的维生素B9受体(叶酸受体4[FR4])。服用抗FR4抗体会导致Treg细胞群的特异性减少,这表明维持Treg细胞需要维生素B9–FR4轴。
在维生素B9减少的条件下体外培养Treg细胞会导致细胞存活受损,抗凋亡Bcl2分子的表达减少,尽管幼稚T细胞仍保留分化为Treg细胞的能力;这表明维生素B9是Treg细胞的生存因子。
与这些发现一致,膳食维生素B9缺乏导致小肠中Treg细胞数量减少。由于Treg细胞在预防过度免疫反应中起着重要作用,喂食缺乏维生素B9饮食的小鼠对肠道炎症的易感性增加。
膳食维生素B9
维生素B9以单谷氨酸和多谷氨酸叶酸的形式存在于饮食中。叶酸-聚谷氨酸酯与谷氨酸单酯脱结合,然后通过叶酸转运体(如质子耦合叶酸转运体(PCFT))在小肠吸收。在肠上皮中,叶酸单谷氨酸盐在被输送到血液之前转化为四氢叶酸(THF),四氢叶酸是一种活性形式和辅助因子。
细菌维生素B9
肠道细菌从GTP、4-磷酸红糖和磷酸烯醇式丙酮酸合成维生素B9作为THF。细菌性THF通过PCFT在结肠中直接吸收,并通过血液分布到全身。
哪些菌会产生维生素B9呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、艰难梭菌、植物乳杆菌、罗氏乳杆菌、德氏乳杆菌、保加利亚和嗜热链球菌、双歧杆菌属中的一些物种、可变梭杆菌、肠道沙门氏菌具有维生素B9生物合成途径。这表明几乎所有门中的所有物种都会产生叶酸。
膳食中添加双歧杆菌益生菌菌株(青春期双歧杆菌和假链双歧杆菌)可提高叶酸缺乏大鼠和无叶酸培养基大肠中叶酸的生成。此外,植物乳杆菌、德氏乳杆菌、保加利亚乳杆菌和罗氏乳杆菌可提高缺乏叶酸合成所需成分的细菌培养上清液中叶酸的生成。
维生素B9代谢物防止过敏和炎症
在共生细菌中,维生素B9代谢产物6-甲酰蝶呤(6-FP)是通过光降解产生的。与维生素B2代谢物6-羟甲基-8-d-三嗪一样,6-FP与MR1结合,但与B2代谢物不同,它不能激活MAIT细胞。6-FP的类似物乙酰-6-FP是MR1的拮抗剂,可抑制MAIT细胞活化。
如关于维生素B2的章节所述,6-羟甲基-8-d-三硝基脲嗪可激活MAIT细胞,从而抵御病原体,因此维生素B9代谢物可抑制过度的MAIT细胞反应,并防止过度过敏和炎症反应。
膳食维生素B2和B9与微生物群的组成及其代谢这些维生素的能力之间的定量平衡,可能是理解肠内MAIT细胞介导的稳态的关键。
摄入量
世卫组织/粮农组织建议成年人每天摄入400微克维生素B9。美国国立卫生研究院建议母乳喂养的母亲每天需要 500 微克,青少年和怀孕女性每天应该摄入 600 微克。
较高含量的食物
牛肉肝、深绿叶蔬菜、芦笋、抱子甘蓝、橙子、坚果、豆类等食物含有高水平的维生素B9。

维生素B12(钴胺素)是一种含钴的维生素,以甲钴胺素和腺苷钴胺素的活性形式催化甲硫氨酸的合成。
维生素B12促进免疫反应
在宿主免疫方面,膳食维生素B12缺乏会减少小鼠体内CD8+T细胞的数量,并抑制自然杀伤T细胞的活性;补充甲钴胺可以改善这些状况,这表明维生素B12通过CD8+T细胞和自然杀伤T细胞促进免疫反应。
膳食维生素B12
膳食维生素B12与膳食蛋白质复合存在,胃蛋白酶将其分解为游离维生素B12。游离维生素B12通过胃糖蛋白内源性因子(IF)被小肠上皮细胞吸收。在上皮细胞内,如果维生素B12复合物被溶酶体分解为游离维生素B12,然后释放到血液中,在血液中转化为活性形式并分布在全身。
细菌维生素B12
细菌维生素B12由前甲胎蛋白-2合成,产生腺苷钴胺素,直接被大肠吸收并分布在全身;这种吸收的机制目前尚不清楚。
哪些菌会产生维生素B12呢?

可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、艰难梭菌、粪杆菌和乳瘤胃球菌、动物双歧杆菌、婴儿双歧杆菌和长双歧杆菌、可变梭杆菌。
从发酵食品中分离出的植物乳杆菌和棒状乳杆菌产生维生素B12,而动物双歧杆菌在牛奶发酵过程中合成维生素B12。
摄入量
世卫组织/粮农组织建议成年人每天摄入2.4μg维生素B12。青少年和怀孕或哺乳的女性需要更多:每天 2.6 至 2.8 μg。
缺乏导致
与维生素B6和B9一起,维生素B12在红细胞形成和核酸合成中起着重要作用,尤其是在神经元中。因此,维生素B12缺乏会导致巨幼细胞性贫血和神经系统症状,如手脚麻木,刺痛。
其他还会导致包括贫血、失智、沮丧、难以保持平衡、疲劳、虚弱、体重减轻、肠道问题、肌肉无力、口腔或舌头酸痛等症状,缺乏也会损害神经系统,并可能导致记忆力差、情绪障碍、抑郁、精神错乱和痴呆。
什么情况会缺乏?
除了饮食摄入量不足的原因之外,维生素 B-12 缺乏还可能是由于恶性贫血(一种影响壁细胞和内因子释放的自身免疫性疾病,维生素 B-12 吸收所必需的)导致的生物利用度低或吸收受损;随着年龄的增长,药物(例如质子泵抑制剂)的使用,胃肠道疾病(例如炎症性肠病)或胃肠道感染(例如幽门螺杆菌、肠道蠕虫)的发生,萎缩性胃炎、吸收不良和恶性贫血的风险增加。
含量较高的食物
牛肝、双壳类、鱼类、鸡肉和鸡蛋含有高水平的维生素B12。

微生物群失调和维生素缺乏是相互关联的,这种关系可能直接影响宿主健康。
对哺乳期女性进行的一项关联研究发现,增加维生素 B2、B5、B6 和 B12 的摄入量与120个粪便样本中普氏菌的相对丰度增加和拟杆菌的相对丰度降低有关。
炎症性肠病(IBD)患者会出现血浆维生素B2浓度较低。肠道慢性炎症包括促炎细胞因子浓度升高,已被证明会导致上皮吸收功能的改变。肠上皮细胞暴露于促炎细胞因子肿瘤坏死因子-α中会显著抑制维生素B2的摄取,这可能解释了IBD患者中维生素B2浓度显著较低的原因。
维生素B2和B3浓度可能是疾病状态的标志物。
克罗恩病恶化与参与抗炎的维生素B2、B1、B9生物合成相关的微生物基因减少有关。
此外,患有 2 型糖尿病的受试者在与微生物介导的维生素代谢相关的基因丰度方面表现出显着变化。
营养不良儿童的微生物组显示参与B 族维生素代谢的多种途径显着减少,包括烟酸/NADP 生物合成。
所有这些观察结果表明,微量营养素的缺乏会改变肠道微生物群。
因此,在某些条件下,针对肠道微生物群的维生素补充剂(直接和间接)可能对健康有益。
越来越多的证据表明,当大量服用以逃避完全吸收或以结肠靶向递送系统 (CTDS) 的形式服用时,维生素可以直接调节肠道微生物组。此外,维生素似乎通过体循环的间接机制影响肠道微生物群,与人类健康直接相关。
结肠靶向维生素补充剂可能通过三种相互关联的途径影响宿主健康
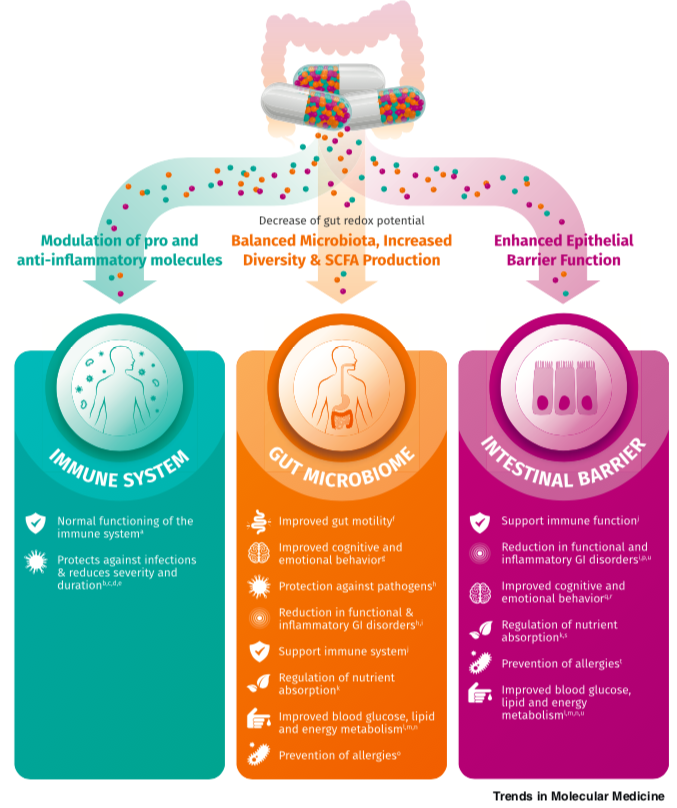
1) 对肠道免疫系统的直接影响(上左图)
2) 对肠道上皮屏障的直接影响(上右图)
3) 通过微生物代谢产物对肠道微生物群以及随后对肠道免疫和上皮屏障的影响(中)
在一个小型成人志愿者组中进行了一项试点研究,该组补充了过量的维生素B2(100 毫克),为期 14 天。他们发现,在补充过程中,每克粪便中的Faecalibacterium prausnitziip数量增加。作者还注意到厌氧罗氏菌属的增加和大肠杆菌减少。
关于维生素的结肠靶向性,最近的一项研究表明,通过缓释微囊结肠靶向补充烟碱酸有益于影响微生物组成和胰岛素敏感性。有趣的是,作者还观察到肥胖受试者群体中α多样性和拟杆菌丰度降低,并指出这种变化与膳食烟酸摄入量降低有关。
针对克罗恩病的研究发现发现,补充维生素 B2 可减少全身氧化应激、一些抗炎作用,降低 C 反应蛋白、红细胞沉降率、血小板和 IL-2,并减轻临床症状。粪便微生物群的荧光原位杂交分析显示 克罗恩病患者中粪便肠杆菌科细菌减少、粪便钙卫蛋白水平降低。
维生素可以调节微生物组、改变氧化还原电位,并且就维生素 B3而言,对全身胰岛素敏感性和代谢性炎症的生物标志物产生积极影响。虽然需要进行额外的临床研究以充分了解结肠靶向递送维生素的优势和潜在副作用,但在菌群失调的情况下,这种方法可能成为预防和治疗微生物组相关疾病的新的菌群调节途径。
该领域的研究很复杂,因为不仅肠道菌群的组成因人而异,饮食也会改变肠道菌群的组成和功能,维生素介导的免疫维持也因人而异。
补充结肠靶向维生素可能与基于个人健康状况和微生物组组成的个性化营养建议相关。
目前,对肠道微生物群的研究及其与多种 B族维生素的相互作用机制的理解正逐步深入,精准健康和营养新时代正在开启。
主要参考文献
Beane, K.E., Redding, M.C., Wang, X. et al. Effects of dietary fibers, micronutrients, and phytonutrients on gut microbiome: a review. Appl Biol Chem 64, 36 (2021). doi.org/10.1186/s13765-021-00605-6
Uebanso T, Shimohata T, Mawatari K, Takahashi A. Functional Roles of B-Vitamins in the Gut and Gut Microbiome. Mol Nutr Food Res. 2020 Sep;64(18):e2000426. doi: 10.1002/mnfr.202000426. Epub 2020 Aug 19. PMID: 32761878.
Yoshii K, Hosomi K, Sawane K, Kunisawa J. Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity. Front Nutr. 2019 Apr 17;6:48. doi: 10.3389/fnut.2019.00048. PMID: 31058161; PMCID: PMC6478888.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Heather M Guetterman, Samantha L Huey, Rob Knight, Allison M Fox, Saurabh Mehta, Julia L Finkelstein, Vitamin B-12 and the Gastrointestinal Microbiome: A Systematic Review, Advances in Nutrition, 2021;nmab123, doi.org/10.1093/advances/nmab123
Putnam EE, Goodman AL. B vitamin acquisition by gut commensal bacteria. PLoS Pathog. 2020 Jan 23;16(1):e1008208. doi: 10.1371/journal.ppat.1008208. PMID: 31971969; PMCID: PMC6977713.