 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

近年来,随着微生物群-肠-脑轴研究的深入,越来越多证据表明,微生物群-肠-脑轴在调节大脑功能方面发挥着关键作用,尤其是在情绪处理和行为方面。然而,肠道微生物群与长期封闭环境中的心理变化之间的相关性仍知之甚少。
近日,一项基于“月宫365”的多组学研究发表在《Microbiome》期刊,主要研究长期封闭环境下,肠道菌群与机组成员心理健康之间的关系。
研究发现,一些与长期封闭环境中的心理变化相关的肠道菌群改变,四种潜在的精神益生菌被识别出来,包括:
这些“益生菌”通过三种途径改善情绪:
通过对模拟慢性压力引起的抑郁和焦虑大鼠实验验证,功能机制获得了进一步支持。
本文我们来详细了解一下。
为什么要进行“月宫365”实验?该平台有哪些优势?
“月宫365”隔离了各种不可控的影响,是研究肠道菌群与情绪关系的理想实验平台。
具体来说,“月宫365”实验具有以下特点:
1)“月宫365”实验在北京航空航天大学月宫一号(LP1) 进行的持续370天,多人、封闭的实验。
注:月宫一号(LP1)是一个封闭的载人生物再生生命支持系统(BLSS)设施,性能优良,与外界几乎不进行物质交换。因此,可以在很大程度上避免微生物交换。
2) 系统中的微生物环境保持相对稳定
LP1 内的环境条件(如温度和适度)都处于恒定状态,LP1 内的微生物组(如空气、水和材料表面的微生物组)受到严格监测和控制。
3)作息、营养固定
在实验过程中,船员们按照固定的时间表工作、吃饭和睡觉,他们的食物来源是一样的,且膳食营养水平经过严格计算,基本保持不变。
4)船员在整个实验过程中保持身心健康
5)船员在同一环境中定期进行情绪测量测试和粪便样本检测,以尽量减少系统误差

“月宫365”实验是在LP1中进行的,它包括两个植物舱室和一个综合舱室。该实验共有8名机组成员,共收集了103份心理数据和相应的粪便样本,进行了多组学分析。
“月宫一号”的结构和实验流程
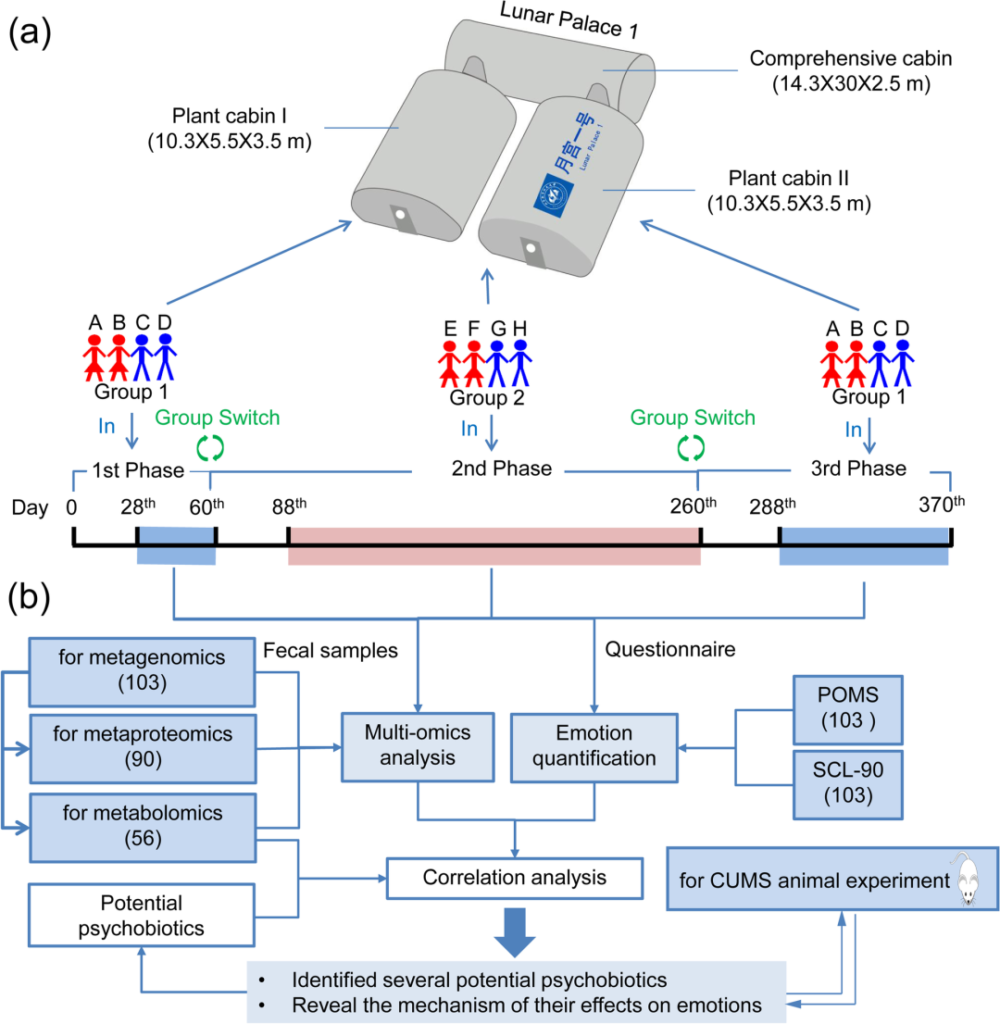
Hao Z, et al., Microbiome. 2023 Apr
在多组学分析中,分别对103份、90份和56份粪便样本进行了宏基因组、蛋白质组和代谢组学分析。
➯ 研究人员通过船员粪便宏基因组与心理变化之间的相关性分析,确定了几种潜在的精神益生菌。
➯ 在多组学分析的基础上,发现了这些潜在的精神益生菌改善情绪的机制。
➯ 用 CUMS 诱导的大鼠来分析和验证这些潜在的精神益生菌对情绪的机制和影响。
研究显示,肠道微生物群的组成和心理变化在个体和性别之间分别存在显著差异(P < 0.001)。
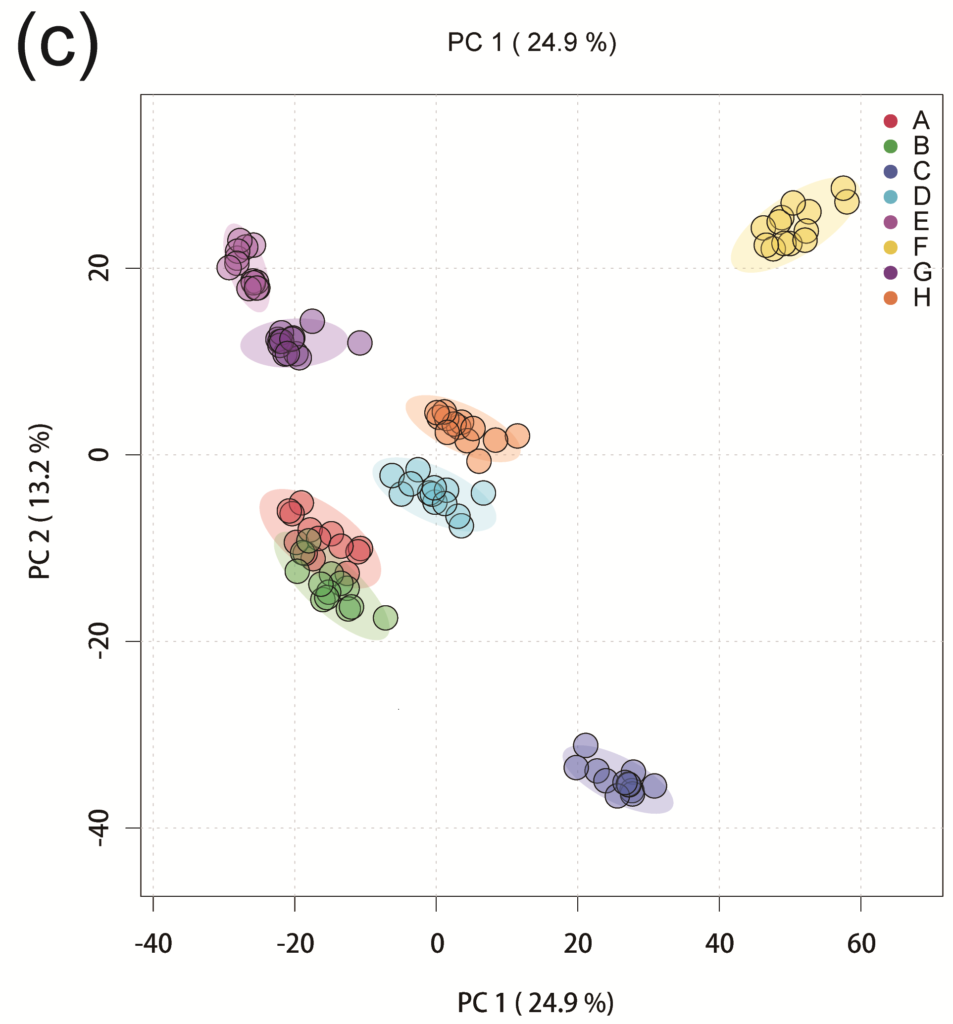
分别基于个体和性别差异下肠道微生物群的相对丰度
船员的心理变化随时间呈动态变化,每个船员的心理变化具有明显的个体差异和性别差异。
心理因素分数随时间变化的水平图

由以每个心理因素时间序列为中心的中位数构建的。
曲线被划分为色带,其宽度为中值绝对偏差。
较冷和较暖的区域分别表示某个因素超过和低于其中位数得分的日期范围。颜色越深,因子得分的绝对值越高。
结果表明下列菌群与积极情绪的变化呈显著正相关(P < 0.05),与消极情绪的演变呈负相关(P < 0.05):
因此,这些菌株被进一步分析为潜在的精神益生菌。
Spearman对潜在的心理生物学和心理因素得分的相关性热图
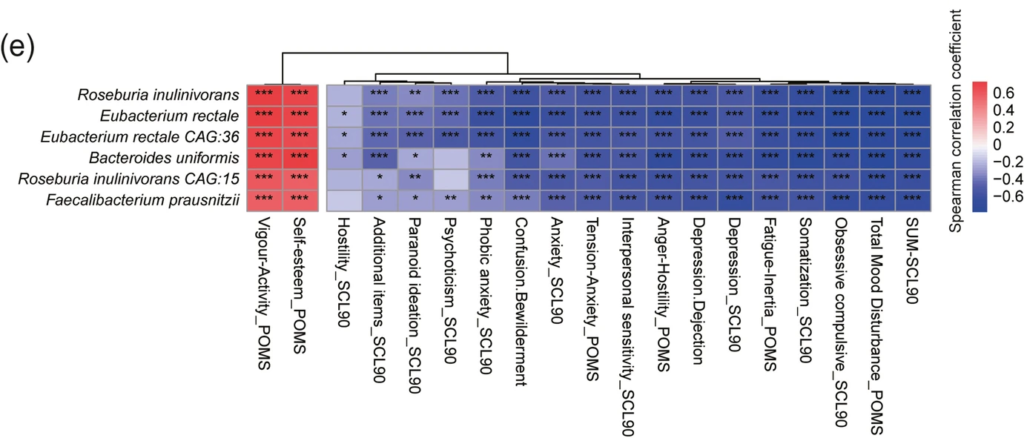
在50%以上的心理因素中,相关系数|R|≥0.5 (P < 0.001)的潜在心理生成物显示在这里。
相关系数的缩放用颜色深度表示——正相关用红色表示,负相关用蓝色表示。* p≤0.05,** p≤0.01,*** p≤0.001
研究人员还进行了ACF来测试潜在精神益生菌时间序列的自相关。结果表明,潜在精神益生菌随时间的变化也是一个静态随机过程。
也就是说,肠道微生物群和情绪随时间的变化无显著自相关。因此,研究肠道微生物群与心理变化之间的关系就足够了。
结果显示,船员肠道菌群的 KO 功能组成在个体和性别之间也存在显著差异(P < 0.001)。
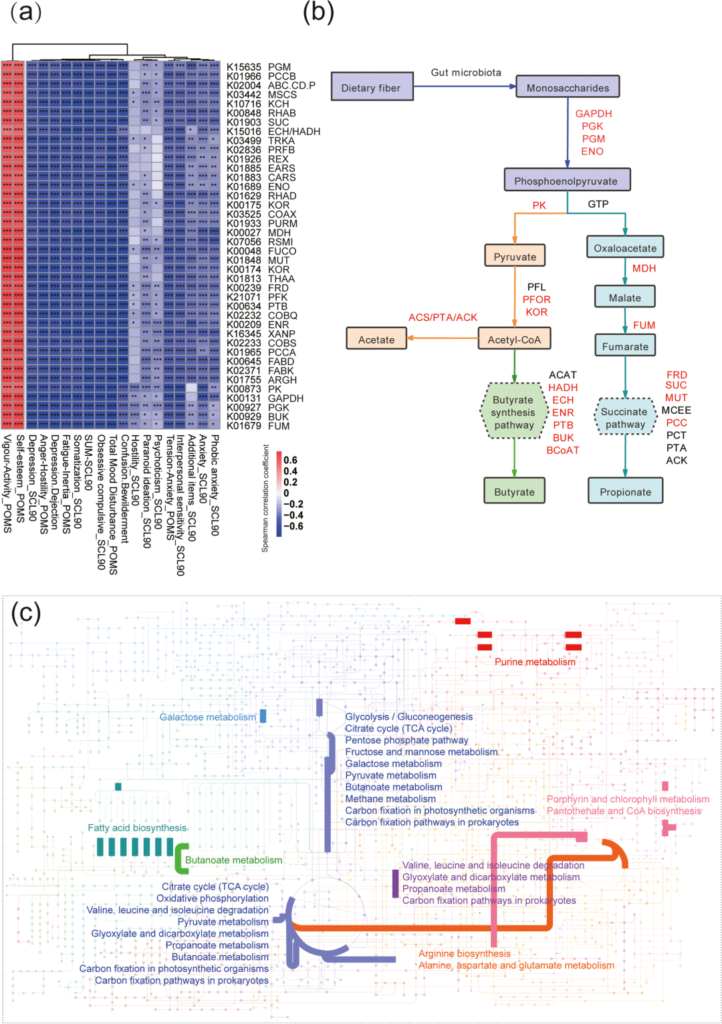
发现 40 个 KO 与积极情绪呈显著正相关(P < 0.05),与消极情绪呈显着负相关(P < 0.05)。
这40个KO涉及34种酶,其中18种酶参与微生物发酵产生
短链脂肪酸 。
这些 KO 涉及以下途径:
结果显示,研究对象的肠道微生物群的宏蛋白质组学特征,在个体和性别之间存在显著差异(P < 0.001)。
潜在精神益生菌的宏蛋白质组学功能分析
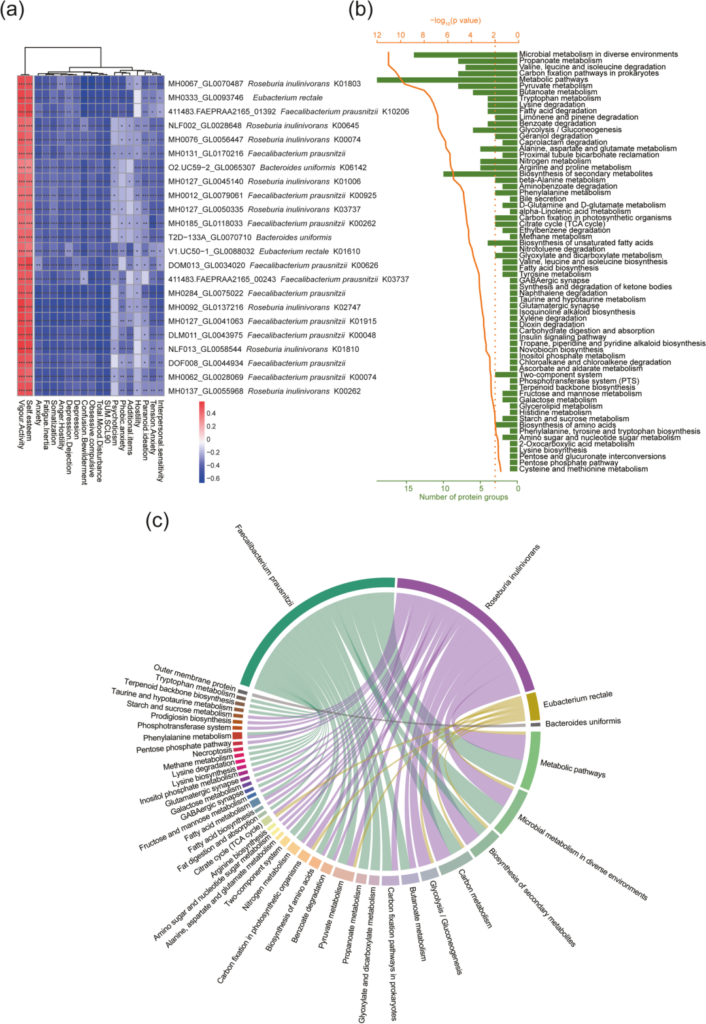
a)23个蛋白组与积极情绪呈显着正相关(P < 0.05),与消极情绪呈显着负相关(P < 0.05)。
b)这 23 个蛋白质组参与了 67 个KEGG通路。
c) 23 个蛋白质序列的 KO 注释和分类功能耦合分析。最终得到 18 个 KO,并且这些 KEGG 通路与相应的潜在精神益生菌相匹配。
结果显示,粪便代谢物的组成在个体和性别之间存在显著差异 (P < 0.001)。
通过文献分析,从这些关键代谢物中鉴定出 21种与神经系统相关的代谢物,用于 Spearman 相关性分析。
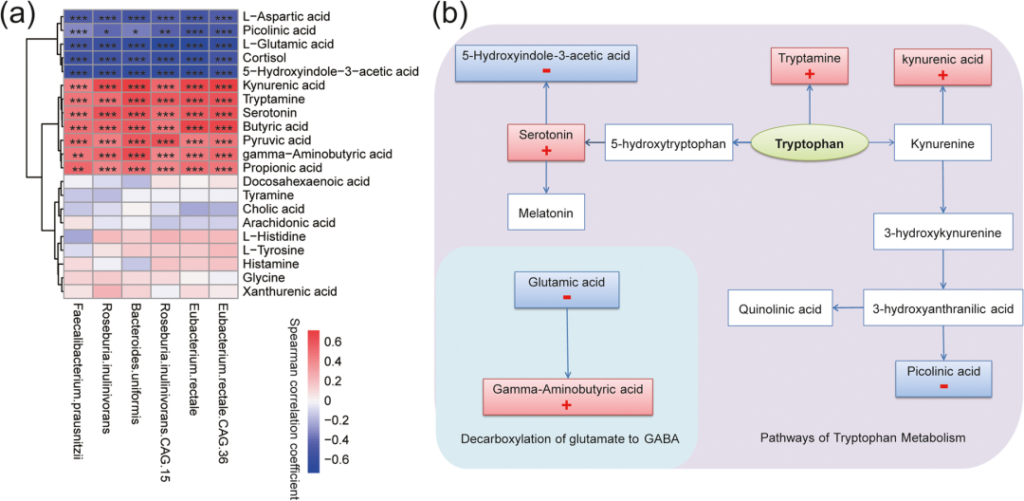
与潜在精神益生菌变化显著相关的代谢物(P < 0.05)主要参与葡萄糖脱羧生成γ-氨基丁酸(GABA)和色氨酸代谢途径。
此外,在色氨酸代谢途径中,色胺、血清素和犬尿酸(KYNA)与益生菌的相对丰度呈显著正相关;然而,5-羟基吲哚-3-乙酸 (5-HIAA) 和吡啶甲酸与益生菌的相对丰度呈显著负相关。
在谷氨酸脱羧生成GABA的途径中,GABA与益生菌相对丰度显著正相关,谷氨酸与益生菌相对丰度显著负相关。
B. uniformis和潜在的精神生物药物治疗显著降低了CUMS诱导的大鼠抑郁和焦虑样行为。
注:CUMS,慢性不可预知轻度应激
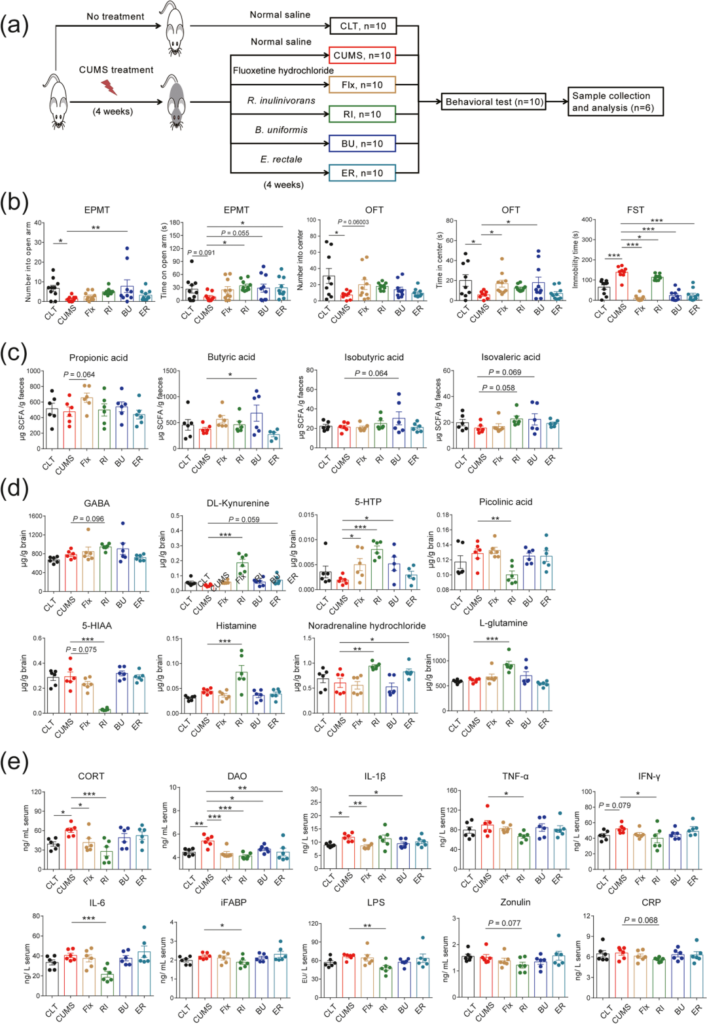
行为测试、 短链脂肪酸、神经递质、生化测定结果如下:
行为测试显示:
短链脂肪酸测定结果显示(与CUMS组相比):
神经递质测定结果显示(与 CUMS 组相比):
生化测定显示:
这里主要通过代谢、免疫、肠道屏障这几个方面,对本实验识别出来的4种精神益生菌对积极情绪的影响展开讨论,包括:
代 谢
在多组学分析的基础上,研究人员确定这些潜在的精神益生菌对情绪的作用机制是与神经系统功能相关的三个途径:
编辑
下面详细介绍这四种潜在精神益生菌在心理健康中发挥作用的三个代谢途径:
Roseburia,Eubacterium,Faecalibacterium是人类肠道微生物群中丰富的细菌,它们利用膳食和宿主来源的多糖影响人类健康,并产生促进健康的短链脂肪酸,作为发酵终产物。那么短链脂肪酸是如何参与调节情绪的呢?
短链脂肪酸积极参与微生物群-肠-脑轴的通讯,可以调节大脑功能。例如,它通过调节肠道激素(如 GLP-1)的分泌在肠脑轴中发挥作用,也可能直接激活迷走神经。 短链脂肪酸可以调节体循环中的免疫细胞功能,并具有直接的神经活性特性。因此,产短链脂肪酸的细菌的积极益处,使其成为精神益生菌的新来源。
在宏基因组和宏蛋白质组的KO功能分析的基础上,发现许多与多糖代谢和短链脂肪酸产生有关的途径,这些途径与潜在的精神益生菌的变化显著相关。
这些KO涉及:糖酵解/糖异生、原核生物中的碳固定途径、丙酮酸代谢、柠檬酸循环(TCA循环)、果糖和甘露糖代谢、戊糖-磷酸途径、丁酸代谢、丙酸代谢、脂肪酸生物合成和其他途径。
在宏基因组分析中鉴定了18种参与微生物发酵以产生短链脂肪酸的酶。在代谢组学分析中,丙酮酸、丙酸和丁酸与这些潜在的精神益生菌的相对丰度呈正相关。这表明这些潜在的精神益生菌可以代谢多糖(包括淀粉和膳食纤维)产生短链脂肪酸。
扩展阅读:你吃的膳食纤维对你有帮助吗?
在宏基因组功能分析的基础上,研究人员发现丙氨酸、天冬氨酸和谷氨酸代谢等氨基酸相关途径与积极情绪显著正相关。
宏蛋白质组学的分类单元功能耦合分析,研究人员发现氨基酸生物合成、丙氨酸、天冬氨酸和谷氨酸代谢途径均来自Faecalibacterium prausnitzii或Roseburia inulinivorans。
在代谢组学分析中,与天冬氨酸、谷氨酸和色氨酸代谢相关的神经递质,如L-谷氨酸、L-天冬氨酸,5-羟基吲哚-3-乙酸和吡啶酸的变化,与潜在的精神益生菌呈显著负相关,而GABA、色胺、5-羟色胺,KYNA与潜在的精神益生菌呈显著正相关。
氨基酸神经递质,包括GABA、甘氨酸、天冬氨酸和谷氨酸,在神经元之间的信号交换中发挥着显著作用。
天冬氨酸:可以调节大脑和神经的新陈代谢
谷氨酸:在精神疾病患者中过高,产生兴奋性神经毒性
谷氨酸存在于80%以上的神经元中,是一种主要的兴奋性突触神经递质,在调节神经可塑性、学习和记忆方面发挥关键作用。然而,假设谷氨酸的释放过量,在这种情况下,它会产生兴奋性神经毒性,这与许多中枢神经系统疾病有关,包括情绪障碍和严重抑郁症。大多数研究表明,精神疾病患者的谷氨酸水平显著高于健康对照组。因此,有人认为,减少谷氨酸的神经传递可能会改善精神疾病。
扩展阅读:兴奋神经递质——谷氨酸与大脑健康
GABA: 与潜在的精神益生菌之间存在显著的正相关
谷氨酸可以转化为GABA,GABA是一种主要的抑制性神经递质,在哺乳动物的焦虑和抑郁障碍中发挥着至关重要的作用。最近的研究表明,肠道微生物群可以通过产生GABA来调节肠-脑轴反应。在本研究的代谢组学分析中,GABA与潜在的精神益生菌之间存在显著的正相关,表明精神益生菌可能将谷氨酸转化为GABA以改善精神状态。
色氨酸:调节神经内分泌和肠道免疫反应
色氨酸是一种必需氨基酸,肠道菌群可以通过调节色氨酸代谢来调节神经内分泌和肠道免疫反应,从而产生血清素、犬尿烯酸、色胺、吲哚及其衍生物。其中,血清素是调节中枢神经传递和肠道生理功能的关键单胺类神经递质。
色氨酸的氧化通过犬氨酸途径(KP)产生犬氨酸。KP可以清除多余的色氨酸,影响色氨酸的可用性。犬尿喹啉酸Kynurenic acid(KYNA)不仅是一种炎症介质,而且可以穿过血脑屏障到达中枢神经系统;它在大脑和胃肠功能紊乱的各种生理和病理过程中发挥调节作用。值得注意的是,KYNA被认为是一种具有神经保护作用的N-甲基-D-天冬氨酸受体拮抗剂。
扩展阅读:色氨酸代谢与肠内外健康稳态
吡啶酸是由色氨酸通过KP的一个连续侧分支合成的。因此,与其他KP代谢产物类似,吡啶酸在中枢神经系统炎症疾病的发病机制中发挥作用。
5-HIAA是血清素的主要代谢产物。研究表明,血浆5-HIAA水平与抑郁症的严重程度呈正相关。
在多组学分析的基础上,研究人员推测潜在的精神生物可能通过调节色氨酸代谢来调节神经系统以改善情绪,例如增加色胺、血清素和KYNA的产生,减少5-HIAA和吡啶酸的产生。
在宏蛋白质组学分析的基础上发现,Faecalibacterium prausnitzii的牛磺酸和次牛磺酸代谢、谷氨酸能突触和GABA能突触与积极情绪显著正相关。
研究表明,牛磺酸是治疗焦虑相关疾病的一种很有前途的治疗工具,因为它可以与GABA能、甘氨酸能和谷氨酸能受体相互作用。
在代谢组学分析中,皮质醇与潜在的精神益生菌的变化呈负相关。最近的研究表明,肠道微生物群可以影响皮质醇的结构和水平,将皮质醇转化为雄激素,或通过影响下丘脑-垂体-肾上腺轴(HPA)的活动来调节血清中皮质醇和肾上腺素的水平。
因此,推测这些潜在的精神益生菌可能通过调节牛磺酸和皮质醇水平来改善宿主的情绪。
免 疫
除了以上三种途径之外,这些菌群还可以影响免疫系统,具有抗炎特性。
研究表明,Bacteroides uniformis是一种潜在的益生菌,最初是从健康的母乳喂养婴儿的粪便中分离出来的。动物实验中,B. uniformis CECT 7771 可在体外诱导抗炎细胞因子的产生,改善高脂饮食引起的肥胖小鼠的代谢和免疫功能障碍。B. uniformis 可降低IL-1β和DAO。
Roseburia、Eubacterium能够使用鞭毛调节宿主免疫力。
R. inulinivorans 可降低CORT、TNF-α、IFN-γ、IL-6、LPS、DAO、CRP;
E. rectale导致DAO降低。
Faecalibacterium prausnitzii分泌的代谢物能够阻断 NF-κB 的激活和 IL-8 的产生,从而对宿主产生抗炎作用,进而参与调节情绪。
在之前的一项研究中发现,F.prausnitzii会导致更高的细胞因子IL-10,阻止CUMS诱导的CORT、CRP和IL-6释放的影响。
肠道屏障
R. inulinivorans 可降低iFABP、LPS、DAO、zonulin; E. rectale导致DAO降低。
研究表明,血清中的DAO活性与小肠的肠道通透性呈负相关。
Zonulin是细胞间紧密连接的一种生理调节因子。Zonulin水平升高伴有肠屏障渗漏、生态失调和炎症。
iFABP位于成熟的肠上皮细胞中。当肠粘膜损伤发生时,iFABP会从肠上皮细胞泄漏到血液中。因此,iFABP已成为评估肠壁完整性损失和炎症的一种可能的非侵入性标志物。
扩展阅读:什么是肠漏综合征,它如何影响健康?
这些免疫因子和生物标志物的变化表明,潜在的精神益生菌可能会降低肠道通透性,减少炎症反应的增加,并通过影响肠道神经系统和中枢神经系统来改善情绪。
本研究分析了“月宫365”实验中8名机组人员粪便样本的多组学数据,鉴定出四种潜在的精神益生菌:
Bacteroides uniformis
Roseburia inulinivorans
Eubacterium rectale
Faecalibacterium prausnitzii
同时确定了这些潜在的精神益生菌对情绪的作用途径:
1
通过发酵膳食纤维,它们可能产生短链脂肪酸,如丁酸和丙酸;
2
它们可能调节天冬氨酸、谷氨酸和色氨酸等氨基酸代谢途径,如:
将谷氨酸转化为γ-氨基丁酸(GABA);
将色氨酸转化为5-羟色胺、犬尿酸或色胺
3
它们可能调节其他途径,如牛磺酸代谢、皮质醇代谢。
还发现了这些潜在的精神益生菌改善情绪的其他机制,例如:
产生其他小分子代谢物(例如,组胺、L-谷氨酰胺和盐酸去甲肾上腺素),并减少由 CUMS 引起的肠道通透性和炎症反应的增加。这通过影响肠神经系统和中枢神经系统来改善情绪。
★★★
该研究为未来开发基于肠道微生物群的缓解负面情绪对策提供了基础,可以在未来人类在月球或火星的长期太空探险中,减轻机组人员心理健康的风险。同时,也为心理生物学在神经精神治疗中的应用提供了重要的参考。也可以考虑如何在食品中添加这些“精神益生菌”,通过肠道菌群调节来调节情绪。
未来更深入的研究,可以通过模拟封闭环境下的压力,筛选和鉴定更多对机组成员心理健康有益的精神益生菌。也可以探讨如何将特定的精神益生菌与传统的心理治疗方法相结合,以提高调节情绪的效果。
参考文献:
Hao Z, Meng C, Li L, Feng S, Zhu Y, Yang J, Han L, Sun L, Lv W, Figeys D, Liu H. Positive mood-related gut microbiota in a long-term closed environment: a multiomics study based on the “Lunar Palace 365” experiment. Microbiome. 2023 Apr 24;11(1):88. doi: 10.1186/s40168-023-01506-0. PMID: 37095530; PMCID: PMC10124008.
Yao Y, Cai X, Fei W, Ye Y, Zhao M, Zheng C. The role of short-chain fatty acids in immunity, inflammation and metabolism. Crit Rev Food Sci Nutr. 2022;62(1):1-12. doi: 10.1080/10408398.2020.1854675. Epub 2020 Dec 1. PMID: 33261516.
Gao K, Mu CL, Farzi A, Zhu WY. Tryptophan Metabolism: A Link Between the Gut Microbiota and Brain. Adv Nutr. 2020 May 1;11(3):709-723. doi: 10.1093/advances/nmz127. PMID: 31825083; PMCID: PMC7231603.
Zhu C, Song K, Shen Z, Quan Y, Tan B, Luo W, Wu S, Tang K, Yang Z, Wang X. Roseburia intestinalis inhibits interleukin‑17 excretion and promotes regulatory T cells differentiation in colitis. Mol Med Rep. 2018 Jun;17(6):7567-7574. doi: 10.3892/mmr.2018.8833. Epub 2018 Mar 29. PMID: 29620246; PMCID: PMC5983956.

谷禾健康

粪球菌属(Coprococcus)
是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,菌种大部分从粪便中分离出来,积极发酵碳水化合物,是和Faecalibacterium prausnitzii 一样,丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。此外,该菌还与抑郁症,幼儿语言发育、便秘、睡眠以及慢性疲劳等相关。
细胞球状,直径0.8~1.5μm,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度37℃,多数物种分离于人的肠道和粪便,很少从人类临床标本中分离出来表明该菌主要定植于健康人的肠道。
需要注意的是,该菌需要与非常耐药且容易引起感染的肠球菌属(Enterococcus )区分开来,他们翻译的中文名虽然只差一个字,但是肠球菌能引发感染,以耐药性出名。
而粪球菌(Coprococcus)是厌氧球菌属,虽然它们都是人类粪便菌群的一部分。但是粪球菌积极发酵碳水化合物,产生丁酸和乙酸以及甲酸或丙酸和/或乳酸等。
在人类粪便中发现的最多产丁酸盐的细菌是属于梭菌簇 IV 和 XIVa 的对氧高度敏感的厌氧菌。其中包括许多以前未描述的与真杆菌属、罗斯氏菌属、普拉梭菌以及本文的粪球菌属。
该菌属主要至少包括以下物种:
Coprococcus catus (species)
Coprococcus comes (species)
Coprococcus eutactus (species)
Coprococcus sp. DJF_CR49 (species)
Coprococcus sp. L2-50
此属的模式种为(Coprococcus eutactus)
不同碳水化合物上的 Coprococcus 物种的生长不太一样,其中:
Coprococcus eutactus的丰度与肠道中更大的细菌基因丰富度有关,β-葡聚糖是与Coprococcus eutactus相关的人类肠道细菌的主要生长底物,其代谢产生丁酸盐和甲酸盐或乳酸。
此外,这两种菌可以利用广泛的碳水化合物底物:
Coprococcus. eutactus
Coprococcus sp. L2-50
但是,Coprococcus comes仅在葡萄糖上表现出良好的生长,而Coprococcus catus 仅在葡萄糖上表现出非常有限的生长,Coprococcus catus代谢产生丁酸盐和丙酸盐。
细菌互相作用或共同在一个生态位生存对整个菌群结构和宿主健康有很重要的影响,例如共现关系(例如,赋予抗生素耐药性)、共生关系(例如,交叉喂养其他成员产生的化合物)和协同作用。
研究报告Coprococcus和Roseburia之间的共现关系的支持,两者都属于Lachnospiraceae家族,表明系统发育密切相关的属也可能具有共现关系,而不是由于它们相似的栖息地偏好而总是相互竞争。然而,由于对人类肠道微生物群落的机理了解不足,因此应谨慎解释肠道细菌之间的生态联系。
此外还发现该菌属在生物化学上与瘤胃球菌密切相关。
值得注意的是,一项来自广东肠道微生物组计划的大规模队列数据,分析得出脱硫弧菌(DSV) 经常在人体肠道中发现,DSV的相对丰度与包括Oscillospira Coprococcus , Ruminococcus , Akkermansia,Roseburia , Faecalibacterium 和 Bacteroides呈正比。
人类肠道微生物群的物种组成对于弯曲杆菌感染的定植抗性很重要。相比于感染弯曲杆菌的人群,健康人群中Coprococcus丰度更好,表明高水平的Coprococcus有利于抵抗弯曲杆菌。
2019年比利时通过一项1070抑郁症病人的验证集小组发现,即使在控制了抗抑郁药的作用后,抑郁症患者的粪球菌属(Coprococcus)和小杆菌属(Dialister)细菌都已耗尽。
还发现Coprococcus具有与多巴胺相关的生物途径,多巴胺是一种会影响心理健康的神经递质。该研究的粪便宏基因组的肠脑模块分析确定,多巴胺代谢物 3,4-二羟基苯乙酸的微生物合成潜力与心理生活质量呈正相关,并表明微生物产生的γ-氨基丁酸在抑郁症中的潜在作用。
研究将重度抑郁症 (MDD) 患者的粪便微生物群移植 (FMT) 移植到大鼠体内,发现:相比较与移植健康粪便的大鼠, FMT-MDD大鼠瘤胃球菌科和毛螺菌属升高,而粪球菌属则被耗尽,从机理上表明粪球菌的缺乏会与抑郁症的关系。
另外一项对82 名抑郁的人随机分配接受多菌株益生菌加生物素治疗或生物素加安慰剂治疗 28 天。发现28天后,与接受安慰剂治疗的个体相比,精神症状的改善明显更高;同时粪便16s测试表明相比于安慰剂组,益生菌组的多样性高,Coprococcus 显著增加。
该研究的益生菌干预组为:包括九种菌株,双歧杆菌W23、乳酸双歧杆菌W51、乳酸双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24 和乳酸乳球菌W19。此外,益生菌产品中还添加了 125 毫克 D-生物素(维生素 B7)、30 毫克马尾草、30 毫克鱼胶原蛋白和 30 毫克角蛋白加基质。
帕金森病是一种神经退行性疾病,其特征是错误折叠的 α-突触核蛋白的细胞内聚集体沿脑轴聚集。一些研究报告了肠道菌群失调与帕金森病之间的关联,尽管因果关系仍有待确定。帕金森病组中最显著的变化突出了细菌类群的减少,特别是在毛螺菌科家庭和关键成员,例如丁酸弧菌属、粪球菌属(Coprococcus)和Blautia。
另外的研究发现帕金森病患者的结肠中有 α-突触核蛋白 (α-Syn) 聚集,并有结肠炎症的证据。PD患者的黏膜和粪便微生物群与对照组相比有显著差异,粪便样本比乙状结肠黏膜有更显著的差异。在属的分类水平上,来自 Blautia、Coprococcus和 Roseburia 属在对照组的粪便中明显多于 PD 患者。
此外,还有研究指出其他神经退行性疾病 (NDs)包括阿尔茨海默病 (AD)、多系统萎缩 (MSA)、多发性硬化症 (MS)、视神经脊髓炎(NMO) 和肌萎缩侧索硬化症 (ALS)中Faecalibacterium 、Coprococcus、Blautia 、 Prevotella减少。
一项针对136名3岁乌干达儿童粪便样本研究表明,产丁酸盐的肠道细菌Coprococcus eutactus可以作为乌干达农村三岁儿童语言发展的预测因子。
该研究模型指出3岁时语言发展高于平均水平的儿童,在其2岁时粪便中有相对较高水平的Coprococcus eutactus,语言发育低的儿童中Coprococcus 属平均丰度低,而且该研究表明早期获得产丁酸盐Coprococcus eutactus对语言发展的重要性,而在在语言发育受损的儿童中,耐氧物种的优势增加。
湿疹的严重程度一般与微生物群多样性和产生丁酸盐的细菌的丰度呈负相关,尤其产生丁酸盐的Coprococcus eutactus相关细菌的降低。我们数据库数据和案例也显示过敏和哮喘的儿童Coprococcus丰度很低或显著低于健康儿童。
自闭症谱系障碍 (ASD) 是世界范围内普遍存在的神经生物学疾病,原因复杂。多项研究表明自闭症儿童Coprococcus、Prevotella、Blautia 、Lachnospiraceae和Ruminococcaceae属的丰度较低。
睡眠在儿童的身心发展中发挥着重要作用。一项针对学龄前儿童(4.37 ±0.48 岁,n=143)的睡眠与肠道微生物群之间的关系研究表明拟杆菌中双歧杆菌的相对丰度较高,在睡眠效率较高和入睡后醒来时间较低(LDA 评分 >2)的儿童中较高。相比之下,包括 Blautia 和 Coprococcus 在内的一些毛螺菌科成员分别与较短的夜间睡眠时间和较低的效率相关。
慢性便秘是全球最常见的胃肠道疾病之一。然而,其发病机制在很大程度上仍不清楚。在便秘患者的肠道微生物组中,产生丁酸盐的 Roseburia、Coprococcus和 Faecalibacterium 属的丰度很低。不存在便秘状态的特定微生物生物标志物,整个肠道微生物群在都可能发挥作用。
此外,功能性便秘(FC)个体的肠道微生物群被证明缺乏属于拟杆菌属、罗斯氏菌属和 Coprococcus 的成员。与对照相比,FC 相对应的微生物组显示出高丰度的参与制氢、产甲烷和甘油降解的基因。
新出现的证据表明,肠道菌群失调与慢性肾脏病 (CKD) 的发病机制有关,其潜在机制涉及粘膜和/或系统免疫或代谢紊乱。
一项纳入1436 名慢性肾病的meta分析显示终末期肾病 (ESRD)患者中普氏菌属、粪球菌属、巨单胞菌属和粪杆菌属的丰度较低。
虚弱是一种常见的老年综合征,与不良健康后果的风险相关。从 176 名韩国老年人的粪便样本中获得的 16S rRNA 基因测序数据研究了虚弱测量与肠道微生物组的关联。发现在较虚弱的个体中,普氏菌和 Coprococcus eutactus的丰度减少。
先兆子痫是一种以高血压和多个器官功能障碍为特征的妊娠特异性疾病,与母体和胎儿并发症有关。
对 213 名孕妇的粪便样本进行 16S rRNA 基因扩增子测序,调查了妊娠 28 周时发生迟发性(>34 孕周)先兆子痫 (DPE) 的女性的肠道微生物群组成发现产丁酸的丰富粪球菌属在 DPE 中显著减少。产生丁酸盐的细菌特别是Coprococcus spp. 丰度的减少可能会增加孕妇患先兆子痫的风险。
此外,研究发现喹那普利在降低肠道菌群负荷较低的高血压大鼠的血压方面更有效。当他们分析肠道微生物群的组成时,Coprococcus 属成为一个重要的参与者。
早期乳腺癌 (BC) 患者和健康对照者的粪便微生物群分析对比表明早期 BC 的患者中微生物多样性的减少、Odoribacter、Butyricimonas和Coprococcus 的相对丰度降低的趋势。
慢性广泛性肌肉骨骼疼痛 (CWP) 是纤维肌痛的特征性症状,已被证明与肠道微生物组的改变有关。在 CWP 病例中,Coprococcus的物种显著减少 。
维生素 D 会增加瘤胃球菌科、阿克曼氏菌、粪杆菌和粪球菌的增加。
在整个人群中,Coprococcus 的变化与体重、总胆固醇和甘油三酯的变化呈正相关,与 HDL 胆固醇呈负相关。
银屑病是一种常见的慢性复发性皮炎。瘤胃球菌科、 Coprococcus_1属和Blautia属的丰度随着银屑病的改善而降低( p< 0.05),这已被证明在银屑病中显著增加。
但是也有研究指出观察到 Coprococcus属减少。这些研究队列都只有几十例,需要更大队列验证。
小檗碱和二甲双胍都是源自草药的成熟药剂,对包括糖尿病在内的多种疾病具有偶然的有益作用。使用二甲双胍或小檗碱干预 db/db 小鼠的肠道微生物群,增加产短链脂肪酸的细菌(例如,丁酸单胞菌属、粪球菌属、瘤胃球菌属)的数量。
补充维生素 D 对 26 种维生素 D 缺乏(25-羟基维生素 D (25(OH)D) ≤50 nmol/L)、超重或肥胖(BMI ≥25 kg/m 2) 其他健康的成年人。
一项研究是 2014 年至 2016 年间进行的基于社区的双盲随机临床试验的辅助研究。参与者在基线和 100,000 国际单位 (IU) 负荷剂量的胆钙化醇之后提供粪便样本,然后每天 4000 IU 或匹配安慰剂 16周。与25(OH)D <50 nmol/L的个体相比,25(OH)D >75 nmol/L 的个体的粪球菌属丰度增高。
关节和肠道炎症之间的密切关系早已为人所知。20 名受肠病性关节炎影响的患者,他们从未接受过生物药物治疗,在基线时和治疗 6 个月后接受了 TNFi 治疗。所有患者都遵循地中海饮食。治疗后6个月毛螺菌科和粪球菌属显著增加。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
紫薯中提取的抗性淀粉 (RS) 有利于增加Coprococcus的丰度。
胞外多糖 (EPS) 是合成并存在于双歧杆菌表面的碳水化合物聚合物。由于其在食品、生物技术、化妆品和医药等多个领域的潜在应用,双歧杆菌 EPS 促进了 Coprococcus 属的生长。与淀粉组相比,EPS 还增加了丙酸的产生。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
主要参考文献:
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S, Raes J. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol. 2019 Apr;4(4):623-632. doi: 10.1038/s41564-018-0337-x. Epub 2019 Feb 4. PMID: 30718848.
Vascellari S, Palmas V, Melis M, Pisanu S, Cusano R, Uva P, Perra D, Madau V, Sarchioto M, Oppo V, Simola N, Morelli M, Santoru ML, Atzori L, Melis M, Cossu G, Manzin A. Gut Microbiota and Metabolome Alterations Associated with Parkinson’s Disease. mSystems. 2020 Sep 15;5(5):e00561-20. doi: 10.1128/mSystems.00561-20. PMID: 32934117; PMCID: PMC7498685.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson’s disease. Mov Disord. 2015 Sep;30(10):1351-60. doi: 10.1002/mds.26307. Epub 2015 Jul 16. PMID: 26179554.
Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, Marmon S, Neimann A, Brusca S, Patel T, Manasson J, Pamer EG, Littman DR, Abramson SB. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015 Jan;67(1):128-39. doi: 10.1002/art.38892. PMID: 25319745; PMCID: PMC4280348.
Sun C, Chen L, Yang H, Sun H, Xie Z, Zhao B, Jiang X, Qin B, Shen Z. Involvement of Gut Microbiota in the Development of Psoriasis Vulgaris. Front Nutr. 2021 Nov 22;8:761978. doi: 10.3389/fnut.2021.761978. PMID: 34881280; PMCID: PMC8646027.
Andreo-Martínez P, García-Martínez N, Sánchez-Samper EP, Martínez-González AE. An approach to gut microbiota profile in children with autism spectrum disorder. Environ Microbiol Rep. 2020 Apr;12(2):115-135. doi: 10.1111/1758-2229.12810. Epub 2019 Nov 27. PMID: 31713352.
Mancabelli L, Milani C, Lugli GA, Turroni F, Mangifesta M, Viappiani A, Ticinesi A, Nouvenne A, Meschi T, van Sinderen D, Ventura M. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses. Sci Rep. 2017 Aug 29;7(1):9879. doi: 10.1038/s41598-017-10663-w. PMID: 28852182; PMCID: PMC5575163.
Yarullina DR, Shafigullin MU, Sakulin KA, Arzamastseva AA, Shaidullov IF, Markelova MI, Grigoryeva TV, Karpukhin OY, Sitdikova GF. Characterization of gut contractility and microbiota in patients with severe chronic constipation. PLoS One. 2020 Jul 17;15(7):e0235985. doi: 10.1371/journal.pone.0235985. PMID: 32678865; PMCID: PMC7367488.
Lim MY, Hong S, Kim JH, Nam YD. Association Between Gut Microbiome and Frailty in the Older Adult Population in Korea. J Gerontol A Biol Sci Med Sci. 2021 Jul 13;76(8):1362-1368. doi: 10.1093/gerona/glaa319. PMID: 33437992.

谷禾健康

Faecalibacterium prausnitzii(F. prausnitzii),普氏栖粪杆菌,又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的 5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
已经证实,患有慢性便秘、乳糜泻、肠易激综合征和炎症性肠病(包括克罗恩病和溃疡性结肠炎)的个体中这种微生物的数量减少。此外,在 2 型糖尿病、结直肠癌和银屑病患者中观察到较低水平的F. prausnitzii。
F. prausnitzii 数量的变化可能是人类肠道菌群失调的迹象,科学家们将其视为下一代益生菌的候选者。
Faecalibacterium prausnitzii,革兰氏阴性,对氧极度敏感,是柔嫩梭菌类群的优势菌,属于梭菌科,厚壁菌门。该物种属于Clostridium cluster IV分组的Clostridium leptum group柔嫩梭菌类群,是该类群的最优势菌种,占64%左右。一般中文翻译柔嫩梭菌指的就是这个类群,其代表物种就是普氏栖粪杆菌,又名普拉梭菌。
普拉梭菌的扫描电子显微镜图像
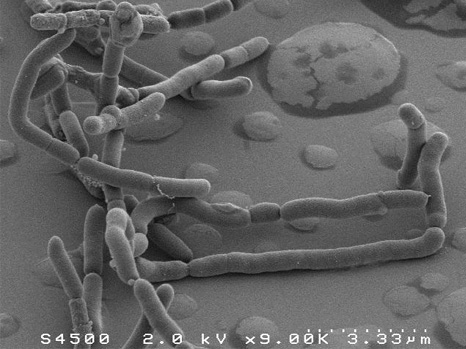
Plateforme MIMA 2, T. Meylheuc
直到 2000 年代中期,16S rRNA 文库的高通量测序和粪便 DNA 的宏基因组分析显示F. prausnitzii是人类肠道中最丰富的细菌之一,人们才完全意识到该物种对人类健康的重要性细菌总数的 5–15%。
在婴儿早期,Faecalibacterium prausnitzii 的数量非常低,并在原定殖细菌建立后增加。同时,在克罗恩病 (CD)和溃疡性结肠炎 (UC) 等各种炎症性肠病 (IBD) 以及结直肠癌 (CRC) 和 2 型糖尿病中观察到 F. prausnitzii 水平降低。
F. prausnitzii 生长繁殖肠道理化调节
F. prausnitzii 生长的最佳 pH 值范围在 5.7 和 6.7 之间,这是在结肠中发现的 pH 值范围。尽管在 5-5.7 的 pH 值范围内菌株之间的耐受性存在差异,但在 3.5 和 4.5 的 pH 值之间没有观察到生长。这表明 pH 值影响F. prausnitzii 沿肠道的分布。
该菌在健康受试者和肠道疾病患者的十二指肠(pH 范围 5.7-6.4)和回肠末端中也被检测到。据报道,溃疡性结肠炎和克罗恩病患者经常出现酸性大便,因此仍有待证明肠道局部 pH 值是否会调节F.prausnitzii 在肠道疾病(如 IBD)患者中的丰度和组成。
F. prausnitzii 对胆汁盐生理浓度的轻微增加也高度敏感,这为克罗恩病患者表现出的F. prausnitzii丰度减少提供了一个合理的解释,因为这些患者的胆红素浓度增加,尤其是那些有回肠疾病受累和接受过肠切除术的患者。
此外,据报道,分离株之间的耐受性存在差异,尤其是胆盐浓度为 0.1% (wt/vol) 时,表明胆汁盐浓度的变化可能决定F. prausnitzii亚型组成的变化。由于克罗恩病患者的胆盐成分也发生改变,需要进一步研究以确定F. prausnitzii是否对某些类型的胆盐成分具有更高的敏感性,并确定不同的胆汁盐谱是否会改变 F. prausnitzii 亚型组成。
F. prausnitzii对氧极为敏感,但它能够通过在黄素和半胱氨酸或谷胱甘肽存在的情况下使用细胞外电子转移来承受肠粘膜中发现的低水平氧气 。最近,已经证明,当与这些抗氧化剂和菊粉作为冷冻保护剂一起配制时,菌株 A2-165 可以在环境空气中保持活力 24 小时。因为氧气梯度在定义结肠中微生物的空间组织方面具有重要作用,确定F. prausnitzii亚型之间的氧耐受性是否存在差异,以及它是否与粘膜的发炎状态相关,将会很有趣。
F. prausnitzii的必需营养素的可用性和有效性可能会影响其在肠道中的分布。
F. prausnitzii的全局营养需求已经通过人工策划的代谢重建进行了调查,该重建确定了几种氨基酸和维生素作为生长因子。体外实验表明,F. prausnitzii可以通过代谢交叉喂养直接或间接地代谢纤维。乙酸盐消耗是F. prausnitzii生产丁酸盐的主要驱动力。当这两个物种在低聚果糖上一起生长时,青春双歧杆菌释放的醋酸盐的消耗已被证明会刺激F. prausnitzii。F. prausnitzii可以代谢来自宿主和饮食来源的底物,菌株之间存在一些差异。
F. prausnitzii分离株可以使用简单碳水化合物生长良好,但菌株之间在发酵更复杂碳水化合物的能力方面存在一些差异,例如那些来自宿主或饮食的碳水化合物,尽管大多数F. prausnitzii菌株都能够发酵菊粉,但研究结果表明,其中只有两种菌株可以在该基质上生长良好。这支持观察到该益生元在营养干预中对该物种的刺激,并表明只有F. prausnitzii种群的一些成员受到菊粉的选择性刺激。
该物种的菌株利用肠腔中发现的其他多糖的能力有限,例如阿拉伯半乳聚糖、木聚糖和可溶性淀粉。大多数分离株可以在苹果果胶上生长,并且能够使用一些果胶衍生物。体外研究表明,在生理条件下,F. prausnitzii可以在某些类型的果胶发酵中发挥关键作用,并且可以与其他肠道细菌成功竞争这种底物。
最近一项基于普拉梭菌 A2-165菌株功能代谢图的研究预测其无法合成氨基酸丙氨酸、半胱氨酸、蛋氨酸、丝氨酸和色氨酸。通过对其他F. prausnitzii菌株基因组的进一步分析,已经观察到维生素和辅助因子(例如:生物素、叶酸、烟酸、泛酸、吡哆醇和硫胺素)的营养缺陷型,并且菌株之间似乎存在与核黄素生产有关的一些差异,这可能是由于菌株间差异。
相比之下,该物种已被预测为钴胺素生产者。有证据表明,一些 IBD 患者易患钴胺素缺乏症,但尚未确定这种情况的原因。由于缺乏一致的临床数据表明 IBD 患者易患这种缺陷,因此确定它是否与肠道中钴胺素生产者的消耗有关会很有价值。
F. prausnitzii与肠道微生物群其他成员的关系
F. prausnitzii在肠道中与C. coccoides组和 Bacteroidetes 的几个成员共同发生。有人提出F. prausnitzii可能依赖其他物种(如拟杆菌)进行交叉饲养。在共培养实验中,观察到F. prausnitzii 的发酵活动过程中,多形拟杆菌(B. thetaiotaomicron)正在发酵果胶。表明后者产生的乙酸盐促进了F. prausnitzii 的生长。此外,B. thetaiotaomicron对果胶的初始发酵可以释放果胶衍生物,然后可以被F. prausnitzii使用。
最近对大鼠模型的研究表明,F.prausnitzii 需要预先存在后,B.thetaiotaomicron才能在肠道定植。已经反复观察到无法维持F. prausnitzii单相关动物模型 并且还描述了一种小鼠模型,其中F. prausnitzii植入胃肠道需要用大肠杆菌预先制备,表明F. prausnitzii和其他菌群存在密切关系。在 IBD 患者中发现了这两种物种之间的相关性,根据疾病位置观察到正相关或负相关。这表明一个种群对另一个种群的影响,尽管还不能排除宿主因素的影响。
F. prausnitzii 的分类学和系统发育
已经确定Faecalibacterium属与厚壁菌门、梭菌类和瘤胃球菌科中的梭菌群 IV的成员有关。目前,F. prausnitzii是唯一成功分离的粪杆菌属物种。
最近对分离株的系统发育表征确定该物种包括两个系统发育群,它们具有 97% 的 16S rRNA 基因序列相似性。其中分类群 I 的减少是肠道炎症的更敏感标志物。迄今为止,大部分可用的基因组和生理数据是使用分类群 II 菌株收集的。
F. prausnitzii基因组之间的平均核苷酸同一性水平非常低,而基因组的可塑性却很高。两个基因组可以根据功能基因互补的差异进行分离,尽管这种划分与基于保守基因系统发育的分离不完全一致,突出了水平基因转移在塑造F. prausnitzii 中的重要性基因组。两个基因组之间的差异主要在于与碳水化合物分解代谢相关的基因(例如分类群 I中预测的唾液酸酶基因)和氨基酸的互补,以及防御机制。
值得注意的是,最近对健康和患病肠道样本中物种多样性和丰度的研究表明,存在其他F. prausnitzii系统发育型,并且不能排除Faecalibacterium属内其他物种的存在。这些已经通过分析粪便样本中总体细菌群落的分子方法估计,代表大约 2% 的粪杆菌序列,并使用物种特异性引物。有趣的是,罕见的系统发育型主要是从患有肠道疾病的受试者身上发现的。
产生丁酸,维持肠道稳态
Faecalibacterium prausnitzii 一直被报道为肠道中发现的主要丁酸盐生产者之一。丁酸盐在肠道生理学和宿主健康中起着至关重要的作用。丁酸盐结肠细胞的主要能量来源之一,能够保持肠道内壁的完整性,防止病原体通过肠道进入人体。它刺激绒毛的生长 (肠道屏障上的微观挤压)并促进粘蛋白的产生,粘蛋白是一种覆盖肠道内壁的保护性凝胶。此外,丁酸盐通过增加紧密连接蛋白的合成和抗菌肽的产生来参与结肠屏障的增强。
肠道屏障依赖于 T 连接蛋白来防止肠道内容物泄漏到血液中。丁酸盐通过激活 AMP 活化蛋白激酶 (AMPK) 来促进紧密结合的 T 连接蛋白。
丁酸盐可以通过调节肠腔 pH 值来调节肠道微生物群,这对产生短链脂肪酸的细菌有益,丁酸盐可以保持上皮缺氧并限制硝酸盐呼吸依赖性细菌的过度生长以维持肠道稳态。
丁酸盐是由某些细菌在乳酸发酵过程中产生的。然而,乳酸也是硫酸盐还原菌的首选能源,硫酸盐还原菌会产生硫化物并抑制结肠细胞对丁酸的氧化。IBD 中产生丁酸盐的菌的消耗可能会削弱已经脆弱的肠上皮细胞,导致共生或低致病性细菌的入侵,随后激活免疫活性细胞。
产生丁酸,抗炎抗肿瘤
丁酸盐可以通过抑制 NF-κB 转录因子激活、上调 PPARγ和抑制干扰素γ来减轻肠黏膜炎症。
此外,F. prausnitzii已被证明可以产生许多具有抗炎特性的物质,包括一种 15 kDa 的蛋白质“微生物抗炎分子”(MAM),它能够抑制肠上皮中的 NF-κB 通路细胞和预防小鼠 IBD 模型中的结肠炎 。而且,丁酸盐可能通过抑制组蛋白脱乙酰酶活性来抑制炎症反应,导致组蛋白过度乙酰化和抑制 NF-κB 活性。
Faecalibacterium prausnitzii 上清液已被证明可以抑制促炎性 IL-8 免疫蛋白的产生。
F. prausnitzii 还通过激活产生 IL-10(一种抗炎蛋白)的 T 细胞来帮助对抗炎症。
F. prausnitzii 的抗炎机制
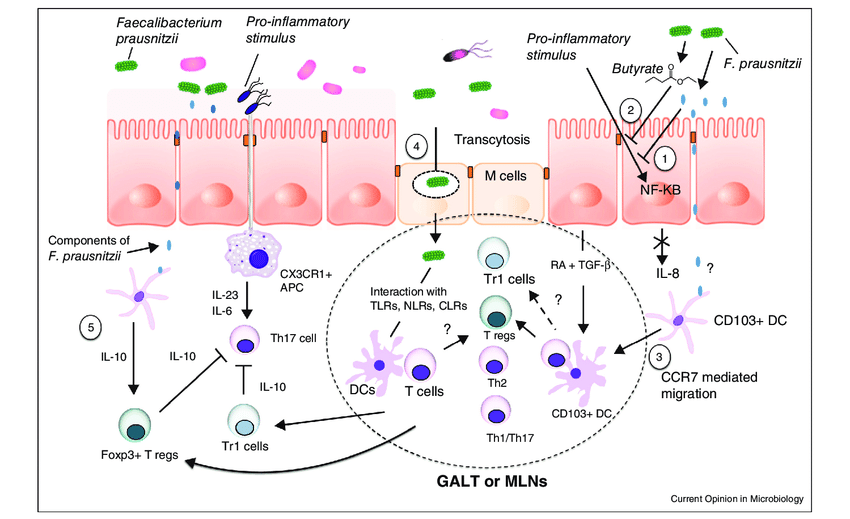
额外的抗炎特性归因于该菌还通过其诱导耐受性细胞因子谱的能力(促炎细胞因子如 IL-12 和 IFN-γ 的分泌非常低,而抗炎细胞因子 IL-10 的分泌增加)。这些抗炎作用部分与能够阻断 NF-κB 激活、IL-8 产生和调节性 T 细胞产生上调的分泌代谢物有关。
这些微生物可以产生莽草酸,一种常见于植物中的酸,能够防止脂多糖 (LPS) 引起的炎症。LPS 是一些细菌外膜上的毒素,可以激活免疫系统并引起炎症。F. prausnitzii 还可以制造水杨酸,这有助于防止细菌形成生物膜,这是一些引起感染的微生物的常见特征。
体外研究表明,丁酸盐还具有抗肿瘤作用,包括减少肠上皮细胞中肿瘤坏死因子 (TNF) 的分泌,并诱导肿瘤细胞的分化和凋亡,从而抑制肿瘤生长。
F. prausnitzii 及其代谢物对小鼠结肠炎发挥保护作用,改善了肠道菌群失调,增加了细菌多样性和产生短链脂肪酸菌的丰度,降低了血清 TNF-α 和Proteinbacteria,酸杆菌门和拟杆菌。这些发现将为F. prausnitzii 的抗炎抗肿瘤作用提供进一步的证据,其具有治疗 IBD 的潜力。

下一代益生菌特性
大多数商业益生菌不包括有益健康的优势肠道微生物菌株,这就是为什么这些益生菌菌株不会在人类肠道中定殖并且它们的作用仅在很短的时间内持续存在的原因。如今,人们对使用共生细菌作为潜在的益生菌剂越来越感兴趣。
使用厌氧细菌和 EOS(氧敏感) 细菌是成功分离可能影响肠道稳态的代表性菌株的先决条件。Faecalibacterium prausnitzii从健康志愿者分离株:F. prausnitzii作为新一代益生菌在使用中向前迈进了一步。
但是下一代共生益生菌必须满足与传统益生菌相同的标准。它们应该:
(i) 被隔离和充分表征
(ii) 达到安全要求,例如可接受的抗生素抗性或缺乏裂解和粘附能力
(iii) 作为益生菌考虑,在被隔离之前对宿主表现出有益的影响
关于F. prausnitzii,虽然对其安全性知之甚少,但该物种作为下一代益生菌具有明显的潜力。到目前为止,所有F. prausnitzii分离株具有一些特征,例如:
(i) 缺乏上皮细胞粘附、质粒、抗微生物和溶血活性
(ii) 存在 DNAse 活性。部分的F. prausnitzii菌株产生的 D-乳酸微弱,不会对宿主产生代谢有害影响,无法降解黏蛋白。
仅使用参考菌株F. prausnitzii A2-165在体外和体内分析了其有益的抗炎作用和生物膜形成菌株 HTF-F。由于益生菌特性通常是菌株特异性的,需要单独研究来评估其他F. prausnitzii分离菌株的抗炎特性。
人体微生物组中 F. prausnitzii 的丰度受其健康状况和结肠环境的影响。这一点尤其重要,因为在患有消化系统疾病的患者中发现了低于平均水平的F. prausnitzii。
克罗恩病和溃疡性结肠炎
肠道微生物群可能通过两种机制驱动致病性,即“促炎”菌群的扩张或微生物群保护性化合物的限制。
健康肠道和IBD患者中 F. prausnitzii
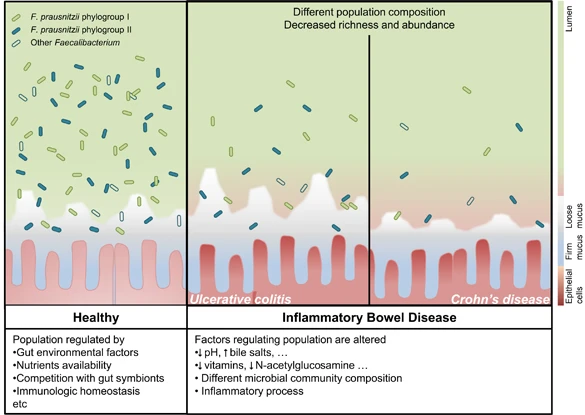
在IBD患者中,肠道环境的改变可能会影响F. prausnitzii 的种群组成和负荷。这些差异可以通过监测来鉴别IBD亚型。
在过去的十年的研究已发现,相当数量的降低的F. prausnitzii水平与某些形式的IBD相关。虽然F. prausnitzii水平与溃疡性结肠炎活动和隐窝炎之间的联系是有争议的,在克罗恩病中F. prausnitzii枯竭,尤其是在疾病发作和克罗恩病的回肠部位。
◥ 治疗后F. prausnitzii恢复
在粪便和活检样本中使用的各种证明方法表明,对克罗恩病患者有效的各种抗炎和抗菌治疗,包括大剂量皮质醇、英夫利昔单抗、干扰素-α2b 和利福昔明,都能够恢复正常水平的F. prausnitzii。
因此,有人提出F. prausnitzii的消耗不是克罗恩病的致病事件,而是产生过量活性氧 (ROS) 的粘膜炎症的结果。这导致粘膜相关和管腔 EOS 培养物显着减少,包括F. prausnitzii。
如何解释Faecalibacterium prausnitzii在溃疡性结肠炎和克罗恩病患者中减少?
◥ pH值
健康的肠道 pH 值 (5.7–6.7) 为 F. prausnitzii 的生长提供了最佳条件,而高酸性环境会抑制 Faecalibacterium prausnitzii 的生长。尤其是,溃疡性结肠炎和克罗恩病患者的大便呈酸性,这可能有助于解释为什么他们的微生物群中缺乏 F. prausnitzii .
◥ 胆汁
胆汁及其成分水平略微升高也会影响 F. prausnitzii 丰度。胆汁是肝脏分泌的一种物质,可在消化过程中分解脂肪。胆汁盐已被证明可以抑制 Faecalibacterium prausnitzii。
研究人员假设这种对胆汁的敏感性可以解释为什么这些微生物在克罗恩病患者中较少。患有这种炎症性疾病的人往往有较高水平的胆红素,胆红素是一种赋予胆汁颜色的色素,特别是如果他们已经切除了部分肠道。
溃疡性结肠炎中, F. prausnitzii有缺陷的肠道定植,这在缓解期短、既往有频繁复发史和结肠炎大范围扩展的患者中更为严重。此外,复发后,F. prausnitzii在维持缓解时逐渐恢复,1年后达到接近参考种群的值。
基于F. prausnitzii菌株特性的治疗探索
科学研究人员提出假设,即F. prausnitzii 的高定植可能会阻止溃疡性结肠炎中粘膜炎症过程的重新激活。这一假设应在未来的研究和增加肠道F. prausnitzii 的策略中得到证实需要在患有广泛疾病的患者中对人群进行验证。
F. prausnitzii菌株还可以利用N-乙酰氨基葡萄糖,一种在肠粘膜中发现的糖蛋白的成分。有趣的是,用这种化合物进行治疗可能会改善克罗恩病,因为它可以作为炎症、受损肠道软组织的愈合因子。因此,鉴于F. prausnitzii能够发酵这种碳水化合物,探索在接受这种治疗的克罗恩病患者中恢复这种有益肠道细菌的效果将是有意义的。
镇痛特性
慢性腹痛是肠易激综合征或炎症性肠病等肠道疾病患者的常见症状之一。研究人员表明,在炎症性肠病的患者中,肠道中的Faecalibacterium prausnitzii细菌的丰度降低。
这些研究人员已经证明,由于压力动物模型(产生绞痛起源的内脏超敏反应),F. prausnitzii丰度的减少与内脏超敏反应的出现有关。对于人类,这种超敏反应会导致肠道不适或腹痛。
科学家已经证明,通过给这些动物服用F. prausnitzii,它们恢复了正常的绞痛敏感性。
结直肠癌
丁酸盐的抗炎功能包括抗癌特性。这种短链脂肪酸是一种组蛋白脱乙酰酶 (HDAC) 抑制剂:它抑制癌细胞的活性和生命周期。这促使研究人员调查 Faecalibacterium prausnitzii 在结直肠癌中的作用。
结直肠癌患者产丁酸盐的细菌较少,包括Faecalibacterium prausnitzii。有人提出,由于丁酸盐产量较低,肠道内壁细胞可能更容易受到损伤,这可能会增加患癌症的风险。
扩展阅读:结直肠癌防治新策略——微生物群
乳腺癌
F.prausnitzii 通过抑制IL-6/STAT3通路抑制乳腺癌细胞的生长。菌群代谢物与菌群结合(如Faecalibacterium与磷胆碱结合)可能是乳腺癌的一种新的检测方法。
糖尿病
糖尿病是一种代谢性疾病,其中由于胰岛素功能受损,身体失去控制血糖的能力。升高的循环葡萄糖会损害血管并增加患心脏病的风险。
许多针对人类的研究已经确定了肠道微生物组的失衡(生态失调),这会削弱肠道内壁,并使不良分子进入体内,从而破坏其他器官。科学家们认为,生态失调先于并促进了糖尿病的发展。
糖尿病患者的厚壁菌门水平较低,包括 Faecalibacterium prausnitzii 和其他可强化肠道内壁的产丁酸盐细菌。
研究表明,脂多糖是在某些革兰氏阴性细菌上发现的促炎分子,当肠道屏障薄弱时,它会进入血液并损害胰腺中的B 细胞功能,产生胰岛素的细胞。
过敏反应
Faecalibacterium prausnitzii通过调节肠道微生物群和短链脂肪酸的产生来缓解屋尘螨引起的过敏性哮喘。
补充F. prausnitzii可阻断嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞的流入,减轻病理变化。此外,活的和死的F. prausnitzii给药都降低了白细胞介素 IL-4、IL-5、IL-13 和免疫球蛋白 G1 的水平,提高了调节性 T 细胞 (Treg) 的比例,改善了微生物生态失调并增强了短链脂肪酸生产。
Faecalibacterium prausnitzii部分通过肠道微生物群调节和短链脂肪酸产生发挥抗哮喘作用,表明其作为预防过敏性哮喘的益生菌剂的潜力。
肝病
研究人员研究了口服F. prausnitzii治疗对高脂肪喂养小鼠的影响。与高脂肪对照小鼠相比,F. prausnitzii处理的小鼠肝脏脂肪含量、天冬氨酸氨基转移酶和丙氨酸氨基转移酶较低,肝脏中脂肪酸氧化和脂联素信号传导增加。肝脏脂质组学分析显示,几种甘油三酯、磷脂和胆固醇酯的含量减少。内脏脂肪组织中的脂联素表达增加,皮下和内脏脂肪组织对胰岛素更敏感。
且F. prausnitzii治疗增加了肌肉质量,这可能与增强线粒体呼吸、改变肠道微生物群组成和改善肠道完整性有关。总的来说,F. prausnitzii治疗可改善肝脏健康,减少小鼠脂肪组织炎症,需要进一步研究以发现其治疗潜力。
其它
肠道菌群中F. prausnitzii的消耗与微生物失调有关,同时伴随着广泛的代谢和/或免疫介导的慢性疾病,包括银屑病、高血压、心脏和肾脏疾病。
在以下患者中已显示低水平的F. prausnitzii:
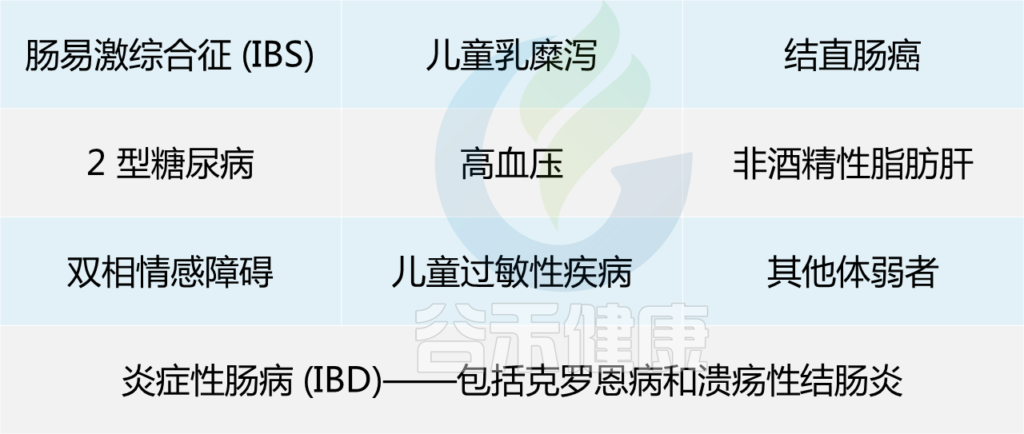
综上所述,F. prausnitzii 对人体肠道和健康非常重要,以至于它被称为肠道中的“关键物种”。现在问题来了:如何增加肠道中这种细菌的数量?
能否添加到酸奶中补充?
不能。
添加到酸奶中或作为补充剂的典型细菌在暴露于空气(氧气)时能够存活。然而,F. prausnitzii是“氧敏感的”,它们在暴露于空气后几分钟内就会死亡。研究人员将这种有益细菌视为“未来的益生菌”,目前正在进行研究以找出它可以轻松储存并暴露在空气中几个小时而不会死亡的方法。所以目前没有办法服用益生菌F. prausnitzii补充剂。
除此之外还能做什么呢?
饮食。
高动物肉、高动物脂肪、高糖、高度加工食品和低纤维饮食(典型的西化饮食)会降低F. prausnitzii 的数量,而高纤维、低肉的饮食会增加 F. prausnitzii 的数量。
——高纤维
我们可以做的第一个提高 F. prausnitzii 的数量的办法, 就是增加饮食中的纤维。增加膳食纤维会增加丁酸盐,丁酸盐与结肠健康有关,具有抗炎和抗癌作用。
高纤维是包括:全谷物、蔬菜、水果、坚果、种子和豆类。此外,还要主要吃多样化的植物性饮食,也就是说大量的植物性食物。多样性似乎很重要——不同类型的纤维喂养不同的细菌。
——益生元
菊粉型果聚糖和阿拉伯木聚糖等益生元可增加F. prausnitzii的数量。

一项研究表明,猕猴桃胶囊的摄入增加了功能性便秘患者的Faecalibacterium prausnitzii 丰度。
虽然F. prausnitzii可能是肠道中一种重要的有益细菌,但是它与其他有益细菌的关系,它们是交叉喂养的。研究表明青春双歧杆菌是利用菊粉主要物种并刺激Faecalibacterium prausnitzii的增加。
主要参考文献:
Heinken, A., Khan, M. T., Paglia, G., Rodionov, D. A., Harmsen, H. J. M., & Thiele, I. (2014). Functional Metabolic Map of Faecalibacterium prausnitzii, a Beneficial Human Gut Microbe. Journal of Bacteriology, 196(18), 3289–3302. doi:10.1128/jb.01780-14
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in Microbiology, 7. doi:10.3389/fmicb.2016.00979
Lopez-Siles, M., Duncan, S. H., Garcia-Gil, L. J., & Martinez-Medina, M. (2017). Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. The ISME Journal, 11(4), 841–852. doi:10.1038/ismej.2016.176
Moreno-Indias, I., Sánchez-Alcoholado, L., Pérez-Martínez, P., Andrés-Lacueva, C., Cardona, F., Tinahones, F., & Queipo-Ortuño, M. I. (2016). Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food & Function, 7(4), 1775–1787. doi:10.1039/c5fo00886g
Richardson, D. P., Ansell, J., & Drummond, L. N. (2018). The nutritional and health attributes of kiwifruit: a review. European Journal of Nutrition. doi:10.1007/s00394-018-1627-z
Blatchford, P., Stoklosinski, H., Eady, S., Wallace, A., Butts, C., Gearry, R., … Ansell, J. (2017). Consumption of kiwifruit capsules increases Faecalibacterium prausnitzii abundance in functionally constipated individuals: a randomized controlled human trial. Journal of Nutritional Science, 6. doi:10.1017/jns.2017.52
Lopez-Siles M, Duncan SH, Garcia-Gil LJ, Martinez-Medina M. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. ISME J. 2017 Apr;11(4):841-852. doi: 10.1038/ismej.2016.176. Epub 2017 Jan 3. PMID: 28045459; PMCID: PMC5364359.
Ramirez-Farias C, Slezak K, Fuller Z, Duncan A, Holtrop G, Louis P. Effect of inulin on the human gut microbiota: stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii. Br J Nutr. 2009 Feb;101(4):541-50. doi: 10.1017/S0007114508019880. Epub 2008 Jul 1. PMID: 18590586.
Varela E, Manichanh C, Gallart M, Torrejón A, Borruel N, Casellas F, Guarner F, Antolin M. Colonisation by Faecalibacterium prausnitzii and maintenance of clinical remission in patients with ulcerative colitis. Aliment Pharmacol Ther. 2013 Jul;38(2):151-61. doi: 10.1111/apt.12365. Epub 2013 Jun 3. PMID: 23725320.
Munukka, E., Rintala, A., Toivonen, R. et al. Faecalibacterium prausnitzii treatment improves hepatic health and reduces adipose tissue inflammation in high-fat fed mice. ISME J 11, 1667–1679 (2017). doi.org/10.1038/ismej.2017.24