 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

肠道微生物除了在肿瘤发生过程有重要作用,在抗癌治疗过程中也有着不可忽视的价值。
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。研究表明,肠道微生物群的调节不仅有助于增强机体免疫力,抑制肿瘤细胞的增殖和侵袭,还可以改善治疗的耐受性和减轻不良反应。
例如,研究发现化疗中伊立替康的毒性取决于肠道微生物群的组成;
毛螺菌科、肠球菌科通过产生短链脂肪酸减轻放疗毒性;
在晚期黑色素瘤患者中,双歧杆菌科、瘤胃球菌科、毛螺菌科等关键细菌与抗PD1治疗后的良好结果有关。
因此,如何通过将肠道微生物群结合现有的癌症治疗方式,更好地促进肿瘤患者的康复和疗效,值得深入挖掘和探讨。
本文我们就来详细了解一下,微生物群与各类癌症疗法,最主要是免疫疗法及其与免疫相关的不良反应。根据患者微生物群组成训练的机器学习方法,可以准确预测患者对免疫疗法的反应能力。
粪菌移植或饮食、益生元等干预可在临床上用于提高癌症患者免疫治疗的成功率,这里讨论了基于微生物群的癌症治疗的新策略。
理解肠道微生物群与肿瘤治疗之间的相互关系,可以为创新的治疗方法提供有力的支持,并为肿瘤治疗领域带来新的突破。
化疗是指使用药物来杀死或控制癌细胞的生长。这些药物可以通过静脉注射、口服或局部应用的方式给予患者。
缺点
由于化疗中使用的药物可能对癌症没有特异性,无法区分细胞好的坏的,会影响身体的其他健康组织,引起副作用,比如脱发、口腔溃疡、恶心、精疲力竭等。
肠道菌群影响化疗药代动力学、疗效和毒性
一个代表性的例子是:伊立替康的毒性取决于肠道微生物群的组成。
注:伊立替康用于治疗结直肠癌的拓扑异构酶 I 抑制剂。
肝脏中:
葡萄糖醛酸转移酶将活性形式的伊立替康 SN-38 解毒成无活性的 SN-38-G。
肠道中:
许多表达 β-葡萄糖醛酸酶的细菌将 SN-38-G 转化回 SN-38,从而引发腹泻。
这种毒性可以通过广谱抗生素或 β-葡萄糖醛酸酶抑制剂来预防。
肠道菌群可优化肿瘤治疗、增强免疫抗癌效果
肠道微生物群可以通过提供有利于药物对癌症细胞毒性作用的肿瘤微环境,并在药物诱导的免疫原性细胞死亡后维持抗癌适应性免疫,从而调节化疗效果。
奥沙利铂、顺铂
无菌或抗生素处理的小鼠中,铂基化合物奥沙利铂和顺铂显示出降低抗肿瘤功效。这些药物仍然可以在微生物群耗尽的小鼠的肿瘤中形成铂-DNA加合物,但没有观察到DNA损伤。肠道微生物群通过NOX2(NADPH氧化酶2)启动肿瘤中的髓细胞产生活性氧(ROS),这是铂治疗诱导的DNA损伤所需的。
肠道微生物发酵的膳食纤维产物——丁酸盐,可以通过 IL-12 信号传导调节 TME 中 CD8+ T 细胞的功能,从而增强奥沙利铂的抗癌作用。
烷化剂环磷酰胺(CTX)
同样,烷化剂环磷酰胺疗效也取决于肠道菌群。
注:烷化剂环磷酰胺既是一种化疗剂,也是一种免疫抑制剂。
CTX减少了小肠中厚壁菌门和螺旋体门,同时增加了其他细菌类群的丰度,其中一些细菌转移到肠系膜淋巴结。CTX诱导免疫原性肿瘤细胞死亡,这依赖于微生物群调节的致病性辅助T细胞17(TH17)和记忆性TH1细胞。
CTX治疗后, Enterococcus hirae移位至淋巴结和Barnesiella intestinihominis在结肠中的积聚促进了癌症免疫。
此外,接受化疗免疫治疗的癌症或卵巢癌患者的存活率与E. hirae和B. intestinihominis特异性TH1反应相关。
吉西他滨
吉西他滨是胰腺导管腺癌常用的化疗药物。肠道微生物参与化疗药物的药代动力学,吉西他滨治疗胰腺导管腺癌的疗效可能受到肠道微生物的影响。
γ-变形菌能够代谢吉西他滨并将其转化为无活性的2′,2′-二氟脱氧尿嘧啶。因此,未来有可能通过将抗γ-变形菌的抗生素与化疗相结合来提高吉西他滨的抗癌效果。
除了负面影响外,肠道微生物代谢产物丁酸盐,还可以通过诱导细胞凋亡来增强吉西他滨对抗癌症细胞的功效。
除了肠道微生物群,肿瘤内细菌促进肿瘤生长并干扰化疗效果,这表明:
肿瘤内微生物群可能是癌症治疗的靶向菌
肿瘤内微生物群已显示在人类乳腺癌、骨癌、胰腺癌、卵巢癌、肺癌、黑色素瘤、胶质母细胞瘤以及原发性和转移性结直肠癌中。肿瘤微生物群可能在肿瘤发生、肿瘤进展和治疗反应中发挥着重要作用。
肿瘤相关γ-变形菌表达细菌胞苷脱氨酶,该脱氨酶使细胞毒性药物吉西他滨失活;使用抗生素环丙沙星可以清除细菌,恢复对吉西他滨的敏感性。然而,吉西他滨治疗也通过增加变形杆菌的丰度来改变肠道微生物群。
↓↓↓
因此,抗生素治疗是否通过对肿瘤相关的γ-变形菌或其他与肠道或肿瘤相关的微生物成分的特异性影响来影响肿瘤生长,目前没有确切的证据。
*************************************************************************
小鼠乳腺癌模型:
通过循环肿瘤细胞携带的肿瘤内细菌,重组了细胞骨架,促进了宿主细胞的存活。通过肿瘤微生物群落中分离的菌株直接注入肿瘤,增强了转移形成。
在原发性人类结肠癌和远处转移中检测到:
——梭杆菌门(Fusobacteria)
使用甲硝唑抗生素治疗可以消除梭杆菌,并减小肿瘤生长速度。
肝癌和肝硬化患者:
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
↓↓↓
这些数据表明,抗生素有可能靶向肿瘤微生物群,但抗生素治疗的全身效应与肿瘤局部效应可能是拮抗的,特别是考虑到抗生素对免疫检查点阻断的有害影响。
*************************************************************************
细胞内细菌可能逃避RAB11介导的吞噬作用,并寄居于稳定的含有细菌的液泡中,使其对抗生素无效。
↓↓↓
因此,使用细胞穿透肽和核酸可能会最大限度地增强抗生素对肿瘤相关细菌的效力。
肠道微生物群调节癌症治疗,可以有针对性地提高治疗效果并预防不良反应
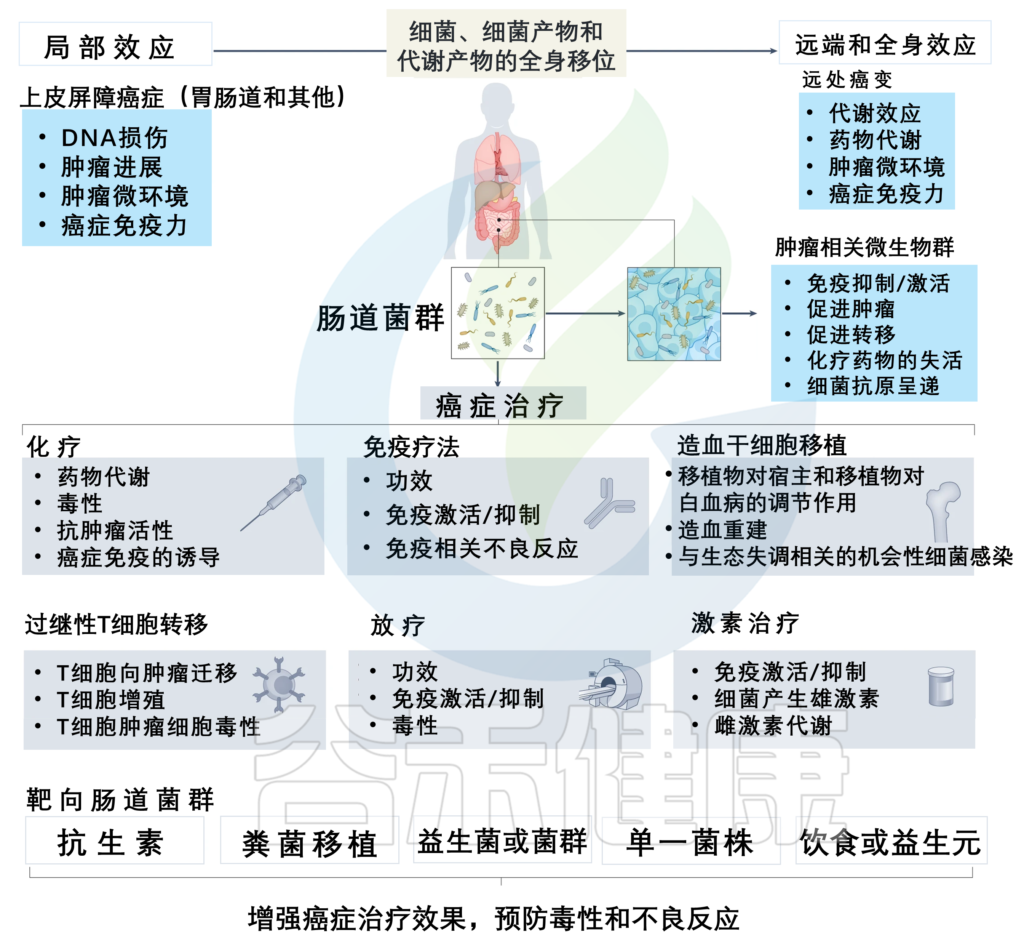
doi: 10.1038/s41568-022-00513-x
放射治疗在于缩小或破坏肿瘤,但过程不同。
辐射是一种高能不可见光波,可以针对癌细胞破坏其遗传物质,最终杀死它们。辐射波会损害癌细胞,癌细胞会随着时间的推移而死亡并被身体清除,从而导致肿瘤缩小。
与化疗不同,放疗通常是一种局部治疗,也就是说一般不会传播到全身。
缺点
如果附近的健康组织在治疗过程中受损,局部放射可能会产生副作用,比如恶心、口腔溃疡、喉咙问题导致进食困难、皮肤干燥、精疲力竭等。
不同癌症类型在毒性和敏感性方面存在差异,这是影响电离放射治疗安全性和有效性的主要障碍。
肠道微生物群的细菌和真菌成分都可能导致患者间的异质性
在实验动物中,对革兰氏阳性细菌有选择性的抗生素万古霉素通过消耗产短链脂肪酸的肠道细菌,提高RTX的有效性,并增强树突状细胞抗原呈递和癌症免疫。
向万古霉素处理的小鼠施用丁酸盐,部分通过抑制树突状细胞功能,包括它们产生IL-12的能力,消除了这种作用。
使用广谱抗生素治疗肠道微生物群会导致酵母菌类真菌肠道扩张,通过β-葡聚糖受体Dectin 1的信号传导抑制肿瘤免疫,从而降低RTX有效性。使用抗真菌药物治疗可提高未经治疗小鼠的RTX有效性,尤其在抗生素治疗的对RTX反应较差的小鼠中。
在乳腺癌患者中,肿瘤内髓细胞中Dectin1的表达与生存率呈负相关,这一观察结果表明真菌免疫抑制作用可能与临床相关。
短链脂肪酸在癌症治疗中的复杂功能:对抗毒性 与 免疫调节
传统饲养的小鼠比无菌小鼠更容易受到全身照射(TBI)毒性的影响,因为微生物群抑制ANGPTL4的表达。
注:ANGPTL4,血管生成素样4,也称为FIAF,是一种支持组织修复的脂蛋白脂肪酶抑制剂。
然而,产短链脂肪酸菌通过诱导ANGPTL4,来保护接受RTX治疗的患者免受结肠炎和粘膜炎的侵袭。
毛螺菌科、肠球菌科→产丙酸→减轻毒性
在全身照射存活的小鼠中,产生色氨酸代谢产物和短链脂肪酸(特别是丙酸盐)的细菌,毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)大量存在,并且可以将对TBI毒性的耐药性转移到其他小鼠。
在进行异基因造血干细胞移植(allo-HSCT)预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗(TBI)时出现的肠道毒性较轻。
这些发现可以解释为什么产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防TBI毒性。
总体而言,几项研究表明,不同的短链脂肪酸可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
因此,短链脂肪酸在放疗和其他癌症治疗中的功能似乎很复杂,需要进一步研究。
最新的癌症疗法利用宿主免疫系统来对抗癌症。免疫细胞通过识别和消灭癌细胞来抑制肿瘤的发生。
CTLA-4充当淋巴结中 T 细胞激活的“关闭”开关,而 PD-L1/PD-1降低肿瘤部位的晚期免疫反应。
免疫检查点抑制剂(ICI) 是一种单克隆阻断抗体,可以释放免疫系统的“刹车”,使免疫细胞能够更有效地识别和攻击癌细胞。
这种方法给一些难治癌症患者带来了显著的持久缓解,如晚期和转移性黑色素瘤、肾细胞癌、非小细胞肺癌等。目前用于超过25种不同的肿瘤类型。
缺点
免疫治疗(ICI)每年每个患者的费用超过10万元,成功率仅为20%-40%,同时许多患者会出现与免疫相关的不良事件。
因此,迅速发展的需求突显了将免疫疗法的有效性扩展到所有癌症患者的必要性。
微生物群维持对病原体的抵抗力和疾病耐受性,防止对无害抗原的过度炎症反应。
饮食、生活方式、抗生素和其他药物使用的变化可能会改变这种健康保护生态平衡。与对急性感染的抗原特异性耐药性不同,肿瘤通过劫持疾病耐受机制抑制癌症免疫。因此,肠道微生物群的改变,可能会影响患者对免疫疗法的反应和免疫相关不良事件(irAE)的程度。
过继性T细胞疗法(ACT):万古霉素增强ACT抗肿瘤,其他抗生素降低抗肿瘤
万古霉素的治疗增加了肠道中变形杆菌门的丰度,但耗尽了厚壁菌门和拟杆菌门的大多数物种,增强了ACT在小鼠中的抗肿瘤作用。
而其他抗生素,特别是新霉素和甲硝唑,分别消耗革兰氏阴性需氧菌和厌氧菌,降低了ACT的抗肿瘤作用。
万古霉素修饰的微生物群诱导产生刺激T细胞的IL-12,维持过继转移的细胞毒性T细胞。
Toll样受体激动剂:CpG-ODN、ICB疗法
革兰氏阴性菌与诱导坏死的CpG-ODN的有利先天反应,以及维持适应性CD8+T细胞介导的抗癌免疫的肿瘤微环境的重定向有关。
ICB 疗法增强的适应性免疫(如后面所讨论的)与几种革兰氏阳性细菌的存在相关,包括:
在这种情况下,革兰氏阴性菌与免疫抑制性局部和全身炎症状态有关。
在一项临床试验(NCT03618641)中,证明了 CpG-ODN和ICB组合的功效,抗PD1治疗下,初始CpG-ODN诱导的坏死和维持无复发生存,与革兰氏阴性细菌(变形菌门、拟杆菌门和革兰氏阴性Oscillospiraceae)的粪便丰度相关。
免疫检查点阻断
一般来说,只有20-40%的患者对ICB有反应,因此需要确定响应标志物并开发克服耐药性的治疗方法。
而肠道微生物群已成为预测ICB响应的肿瘤外部生物标志物。
CTLA4
➦ 无菌小鼠对抗CTLA4治疗反应不佳。
➥ 向微生物群耗尽的小鼠注射多形拟杆菌(Bacteroides thetaiotaomicron)或脆弱拟杆菌(Bacteroides fragilis),通过诱导肿瘤中的DC成熟和引流淋巴结中的TH1反应,恢复抗CTLA4反应。
PDL1
相反,小鼠对肿瘤生长的抵抗力和对抗PDL1的反应性与几种双歧杆菌的粪便丰度有关。
在晚期黑色素瘤患者中,放线菌门(双歧杆菌科和Coriobacteriaceae)和厚壁菌门(瘤胃球菌科和毛螺菌科)的关键细菌种类的粪便丰度与抗PD1治疗后的良好结果有关。
在肺癌、肾细胞癌或肝细胞癌患者中,粘蛋白降解的Akkermansia muciniphila在抗PD1治疗中发挥抗肿瘤作用。然而,在一些接受抗生素治疗的患者中,粪便中A. muciniphila的高丰度与抗PD1治疗的耐药性有关,这可能表明AKK菌在抗PD1疗法反应中具有双峰效应。
在抗PD1治疗无反应的患者粪便中,溶血性葡萄球菌和Corynebacterium aurimucosum的更高,在有反应的肾癌和肺癌患者中,E. hirae菌的粪便频率更高。
研究中发现的细菌种类的一致性有限,可能是由于ICB介导的免疫机制的变化。
TIM3
抗生素治疗对抗TIM3癌症治疗的损害,也表明了肠道微生物群在维持这种类型的ICB的疗效中的作用。
肠道菌群、血液相关菌群和肿瘤相关菌群的组成不同,对不同类型的癌症具有特异性,导致不同的细菌种类对免疫治疗的反应产生影响。
对相同类型肿瘤和相同ICB治疗的患者队列的研究,即使仍然受到队列内微生物群异质性的影响,也报告了更一致的结果。
事实上,复杂微生物群落中的未知变异阻碍了稳健的特征识别。未来的研究依赖于细菌亚种和菌株的新特征,并分析单个细菌基因或途径的关联,将更好地识别特定细菌与治疗反应的关联及其作用机制。
肠道菌群对抗PD1免疫检查点阻断反应的调节
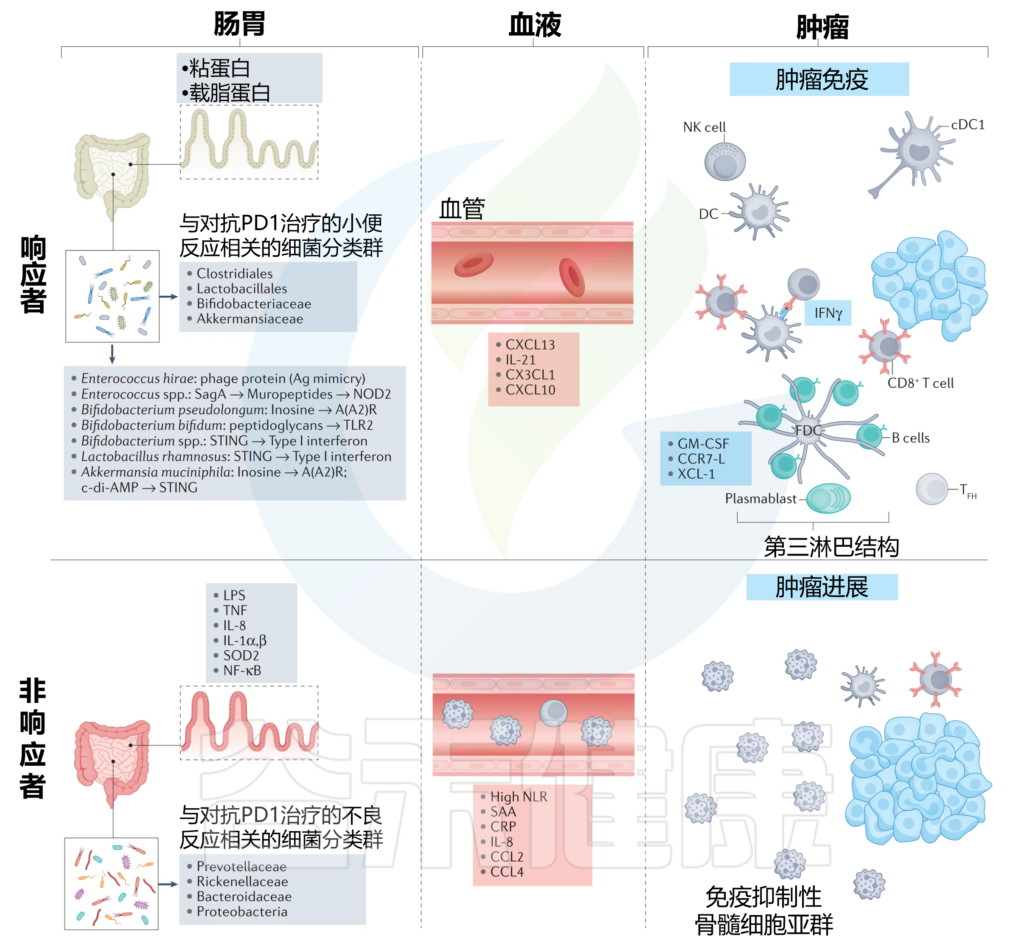
doi: 10.1038/s41568-022-00513-x
在大多数接受抗PD1治疗的癌症患者的研究和荟萃分析中,与有利或不利治疗反应普遍相关的细菌已得到一致定义。
在对抗PD1治疗有反应的患者中观察到一种健康、无炎症的肠粘膜,其特征是编码抗炎载脂蛋白和跨膜粘蛋白的转录物。在这些患者的血液中,参与T细胞和B细胞募集的细胞因子和趋化因子升高,这对抗肿瘤免疫很重要。左上角列出了与抗PD1治疗的有利反应相关的确定细菌种类及其在调节抗肿瘤免疫中的作用机制。
在对抗PD1治疗没有反应的患者中,观察到肠粘膜发炎和炎症细胞脱落,而在他们的血液中,通常存在全身炎症的生物标志物。所列的肠道革兰氏阴性菌群与抗PD1治疗的不良反应以及局部和全身炎症的生物标志物有关,可能反映了免疫抑制肿瘤微环境。
早期临床反应取决于肿瘤内在因素或宿主因素;而肠道菌群的调节作用在治疗开始约1年后更具影响力
一项针对黑色素瘤患者的抗PD1治疗研究报告称,较高的肠道微生物群α多样性与良好反应之间存在关联。但没有更多研究证实,α多样性用于区分健康个体和癌症患者,它不能预测对免疫疗法的反应性。
对已发表的接受抗PD1治疗的黑色素瘤患者队列的数据进行的荟萃分析显示,不仅在单个物种水平上,而且在更大的分类分支中,识别出的细菌之间存在共性。
大多数研究认为有利的微生物群特征,包括放线菌门的多个成员,以及在厚壁菌门中,瘤胃球菌科和Lachnospiraceae科。
而一个不利的特征包括拟杆菌门和变形菌门。
对黑色素瘤患者的免疫治疗反应进行的两项荟萃分析使用了大队列,研究发现,肠道微生物群的基线组成在3个月时进行放射学评估时,区分有反应的患者和没有反应的患者的能力有限,但它可以更好地区分在治疗开始后约1年有进展或没有进展的患者。此外,长期无进展生存期患者在开始抗PD1治疗后数年保持良好的微生物群。
为什么没有在队列中一致地识别出某些菌作为生物标志物?
一项研究的样本来自三个欧洲国家和一些公开的数据集,并包括用抗CTLA4、抗PD1或两者联合治疗的黑色素瘤患者。这里涉及到,地理和治疗类型的异质性。
即使同卵双胞胎,每个个体的肠道微生物组都是独特的,并且这种独特性的很大一部分是在单个菌株水平上编码的。需要分析方法更深入探索这种个体特异性的微生物多样性。
不同地理区域的肠道微生物类型不同,因为人类肠道微生物组受到种族和地理起源的影响。利用美国肠道项目的7000多个样本,对微生物类型进行了地理测绘,揭示了美国各地理区域的分布不均。
接受抗PD1治疗的黑色素瘤患者队列中的微生物类型代表性也不一样,并反映了他们的地理环境。此外,对抗PD1治疗有反应的概率与肠道微生物类型相关。
因此,通过微生物类型视角分析肠道微生物群与免疫疗法反应之间的关系,为先前研究的不一致性提供了可能的解释,并可作为纠正地理和临床中心特异性偏见的工具。
肠道菌群中的肽聚糖酶介导的抗癌
一些肠球菌在小鼠中维持ICB作用的能力是由一簇肽聚糖水解酶介导的,包括分泌抗原a(SagA),它产生NOD2激活的胞壁肽(muropeptides),增强抗PDL1诱导的肿瘤免疫。
当给予小鼠时,SagA转染的乳酸乳球菌抑制肿瘤生长并提高抗PD1反应性。某些与小鼠抗PD1和奥沙利铂癌症治疗协同作用的双歧双歧杆菌菌株富集了肽聚糖合成基因,通过TLR2刺激癌症免疫。
肠道菌群调控干扰素
肠道菌群维持I型干扰素表达,增强肿瘤免疫
在微生物群耗尽的小鼠中,肿瘤内先天免疫细胞中的干扰素信号减弱,改变巨噬细胞极化、树突状细胞分化和DC-自然杀伤(NK)细胞串扰,并使肿瘤微环境从抗肿瘤变为促肿瘤。
肠道微生物通过诱导免疫细胞产生干扰素,通过一系列的受体和信号通路来增强免疫应答。
注:一些列受体如TLR3、TLR4、TLR7、TLR9、Dectin 1、干扰素基因刺激因子(STING)、DDX41、RIG-I等。
微生物群诱导的细胞和基因表达特征激活了小鼠的STING-干扰素途径,并与黑色素瘤患者的良好ICB反应有关。
某些共生菌如AKK菌、双歧杆菌、鼠李糖乳杆菌,通过激活干扰素途径来抑制肿瘤进展,并增强免疫治疗的效果。
干扰素的作用也与肿瘤类型和治疗阶段有关
I型干扰素信号传导并不总是与抑制肿瘤生长有关。肝脏中持续的I型干扰素信号传导,分别通过诱导一氧化氮或改变尿素循环,诱导对抗PD1治疗的耐药性或抑制抗病毒T细胞反应。
不同刺激产生的干扰素还会对肿瘤生长和免疫反应产生不同的影响。在肿瘤治疗中,详细了解干扰素在不同时间点对不同细胞的作用,以及如何影响肿瘤环境和免疫治疗效果,还需深入研究。
肠道促炎:预测ICB疗效不佳
系统性炎症的许多外周血生物标志物,如高中性粒细胞与淋巴细胞比率(NLR)和C反应蛋白(CRP)、IL-8和血清淀粉样蛋白a(SAA)水平升高,是对ICB反应不佳的预测因素。
黑色素瘤患者粪便微生物群中,高NLR与革兰氏阴性拟杆菌门的丰度增加有关。人类粪便转录组分析显示,对抗PD1治疗没有反应的患者肠道中存在促炎特征,主要由脱落的中性粒细胞和其他髓细胞引起,这与LPS和NF-κB信号传导有关,导致产生促炎细胞因子,如TNF、IL-1和IL-8。
革兰氏阴性菌:阻碍ICB反应
总体而言,这些数据表明,肠道微生物群中的革兰氏阴性菌可能通过LPS产生和TLR4信号传导,诱导免疫抑制性局部肠道和全身炎症,从而阻碍ICB反应。
实验诱导的小鼠胆汁淤积诱导革兰氏阴性菌从肠道转移到肝脏,导致TLR4依赖性炎症反应,产生CXCL1,募集免疫抑制性中性粒细胞,抑制抗肿瘤免疫,导致胆管癌生长增强。此外,革兰氏阴性菌Fusobacterium nucleanum与原发性和转移性结直肠癌癌症的关联,通过吸引髓细胞而具有免疫抑制性。
自身抗原和微生物异种抗原之间交叉反应
自身抗原和微生物异种抗原之间的交叉反应在自身免疫性疾病中很常见,可能与癌症免疫有关。身体不仅对病原体产生免疫反应,而且对共生微生物产生免疫反应。尽管这种反应得到了很好的控制,但失调可能会引发免疫病理,并可能在接受ICB治疗的患者中被重新激活,导致免疫相关不良反应,并可能与肿瘤新抗原发生交叉反应。
ICB治疗的患者中鉴定的一些肿瘤新抗原,可能与微生物抗原具有交叉反应
在抗CTLA4处理的小鼠中,通过过继转移B.thetaiotaomin特异性或B.fragilis特异性T细胞导致其活化,进而抑制MCA-205肉瘤肿瘤生长,支持肿瘤和微生物抗原之间分子模拟的观点。
小鼠细菌共生体E.hirae与对环磷酰胺和ICB的有利反应相关的,E.hirae携带表达肽的原噬菌体,针对该肽引发主要组织相容性复合物(MHC)I类反应,并与癌症细胞中过表达的非突变蛋白酶体组分中的表位交叉反应。
在人类中,相同的原噬菌体在肠球菌属中表达。除毛滴虫外,其MHC限制性表位与甘油-3-磷酸脱氢酶1-样蛋白(GPD1L)中的表位发生交叉反应,后者也在肿瘤中过表达。
在人类黑色素瘤转移中,表达人类白细胞抗原(HLA)I类和II类限制性肽的细菌物种存在于造血细胞和肿瘤细胞中。当对表达肿瘤匹配HLA等位基因的EB病毒转化的B细胞进行脉冲时,其中一些肽能够特异性激活肿瘤浸润淋巴细胞。
因此可以推测,在患者中,这些肽通过传统抗原呈递细胞或黑色素瘤细胞的呈递,引发了可能影响抗癌免疫的T细胞免疫反应。
有望成为预测免疫疗法反应的生物标志物
前面第二章节有提到短链脂肪酸与放疗,这里我们主要看短链脂肪酸对接受 ICI 的癌症患者的预测作用。
在日本进行的一项研究中,52名接受抗PD-1抗体治疗的实体瘤患者的粪便短链脂肪酸与良好的临床结果相关。高浓度的粪便乙酸盐、丙酸盐、丁酸盐和戊酸盐以及血清异戊酸盐与PFS的延长有关。
相比之下,另有研究发现,高血清丁酸盐和丙酸盐水平与黑色素瘤患者对抗CTLA4抗体的耐药性和Treg细胞数量的增加有关。
鉴于临床前肿瘤模型也揭示了短链脂肪酸对抗CTLA4抗体或放射治疗的疗效的负面影响,在利用血液或粪便中的任何短链脂肪酸作为ICI疗效的生物标志物之前,需要进一步的研究来验证不同地理位置的大型队列中短链脂肪酸的预测价值。
不同的细菌种类,包括假长双歧杆菌、约氏乳杆菌和粘球菌,产生肌苷及其代谢产物次黄嘌呤。这些分子结合腺苷受体A2a(A2aR),激活抗肿瘤T细胞并提高小鼠的ICB效率,特别是抗CTLA4疗法。
肌苷增强抗PD1治疗效果
除了A2aR介导的T细胞活化外,肌苷是葡萄糖限制下CD8+T细胞的替代碳源,并增强了对不能利用肌苷作为能量来源的肿瘤的抗PD1治疗功效。表明肌苷活性增强了ICB疗效,并且像腺苷一样激活了A2aR,在临床癌症治疗的试验中,A2aR是一个免疫抑制的检查点,增强ICB效果。
肌苷也可能抑制自身免疫
罗伊氏乳杆菌(Lactobacillus reuteri)可以预防ICB诱导的结肠炎,但不会影响ICB在小鼠中的抗肿瘤功效,它通过增强作用于A2aR110的肌苷的产生,来抑制Treg细胞缺陷的Scurfy小鼠的自身免疫。
这些高度矛盾的结果可能可以通过肌苷对T细胞的直接刺激效应与上下文相关的事实来加以解释;在无菌动物中或在没有共生细菌提供的促炎启动的体外,肌苷需要在这些实验条件下分别由CpG-ODN或IFNγ提供的炎症刺激。由于缺乏这种炎症刺激,肌苷确实会抑制T细胞。
因此,在癌症免疫疗法中靶向肌苷依赖性途径需要更好地理解肌苷的这些对比效应,同时考虑到腺苷和肌苷通过A2aR的信号可能不相同,并且肌苷通过A2aR或A3R影响不同的全身炎症模型。
两项研究调查了接受ICIs的晚期癌症患者的犬尿氨酸与色氨酸(Kyn与Trp)比率的临床意义。
Kyn/Trp比率高,与总生存期缩短有关
第一项研究中,早期疾病进展患者(3个月内)的Kyn/Trp比率显著高于有反应者(P = 0.017)。
第二项研究中,在接受nivolumab治疗的黑色素瘤和肾细胞癌患者中,开始治疗4-6周后Kyn与Trp比率的增加(>50%)与中位总生存期的缩短密切相关(P ≤ 0.026)。
有争议的发现
鉴于代谢适应在癌症免疫疗法中的重要性,以及在黑素瘤患者中选择性IDO1抑制剂与ICI联合治疗的疗效不佳(在ECHO-301/KEYNOTE-252第三期试验中),这些发现不仅对未来试验中基于血清肾上腺素/色氨酸比率监测而进行患者分层的必要性提出了质疑,还对ICI治疗期间肠道菌群动态调节的分析提出了质疑。
事实上,色氨酸不仅由肿瘤和髓系细胞代谢,而且由肠道菌群中的不同种类代谢成吲哚和吲哚衍生物,包括吲哚乙酸、吲哚-3-醛(I3A)和吲哚丙酸等,这些物质能够与芳香烃受体结合。
可能支持富含色氨酸的饮食,或基于I3A或3-IAA 的益生元与ICI的组合
当罗伊氏乳杆菌与ICI联合给小鼠口服时,它可以从回肠转位到黑素瘤部位,释放I3A,激活CD8阳性T细胞的TCR信号通路,促进IFNγ的释放和抗肿瘤效应。
这些实验发现的临床意义已在一项涉及接受ICI治疗的黑素瘤患者的研究中得到证实,为基于色氨酸的饮食干预在癌症患者中的应用开辟了道路。
细胞内L-精氨酸浓度也直接影响T细胞的代谢适应度和存活率,从而影响它们在小鼠模型中介导有效抗肿瘤免疫反应的能力。
L-精氨酸水平升高诱导了整体代谢变化,包括活化T细胞从糖酵解向氧化磷酸化的转变,并促进了中枢记忆样T细胞的产生。
在发现组和验证组中,低血清L-精氨酸水平(<42 µM)与减少的临床获益率、无进展生存期和总生存期显著独立相关(P = 0.004)。此外,低血清L-精氨酸水平与髓系细胞中PD-L1的表达增加相关。因此,血浆L-精氨酸监测可能成为ICI疗效的适宜预测生物标志物。

doi: 10.1038/s41571-023-00785-8.
尽管广谱抗生素可能会导致真菌过度生长,从而降低放疗效率
万古霉素消耗产短链脂肪酸菌,提高放疗效果
一项正在进行的临床试验(NCT03546829),测试在接受立体定向身体放射治疗的非小细胞癌症(NSCLC)患者中,通过IFNγ的产生评估,万古霉素是否增加抗肿瘤免疫力。
万古霉素还通过增强自然杀伤T细胞(NKT)在肝脏中的迁移和IFNγ的产生,削弱小鼠原发性和转移性癌症的生长。
万古霉素耗尽革兰氏阳性菌,调控胆汁酸
万古霉素耗尽革兰氏阳性菌,特别是Clostridium scindens,它将初级胆汁酸转化为次级胆汁酸。微生物群衍生的胆汁酸影响炎症、免疫和致癌物的许多方面。初级胆汁酸,如鹅去氧胆酸,通过肝窦内皮细胞诱导趋化因子CXCL16的产生,该细胞通过CXCR6吸引NKT细胞,而次级胆汁酸,特别是ω-鼠胆酸,抑制CXCL16产生。
还计划进行临床试验(NCT03785210),测试万古霉素是否改善原发性肝癌或转移患者对抗PD1治疗的反应。然而,即使是特定的抗生素也会引起肠道微生物群组成的广泛变化,这可能会对癌症治疗产生相反的影响。
胆汁酸对免疫反应的调节也是复杂的
黑色素瘤患者FMT后,次级胆汁酸水平与抗PD1治疗的良好临床反应有关。
然而在小鼠中,拟杆菌属部分地将抑制TH17细胞的次级胆汁酸3-oxoLCA,转化为激活Treg细胞的isoalloLCA,从而限制自身免疫和癌症免疫。
万古霉素提高ADT疗效
去势抵抗性前列腺癌与促癌的肠道菌群变化有关,使用含有万古霉素的抗生素混合物来消耗小鼠体内产生雄激素的细菌,这种抗生素可以专门减少厚壁菌门的细菌,包括产生雄激素的梭菌属,从而提高ADT(雄激素剥夺疗法)的效果。因此,如果抗生素与ADT一起使用,它们的性质应该是选择性地消耗产生雄激素的细菌,而不是免疫刺激物种。
抗生素治疗仍有挑战,更特异性的方法有待探索
一般来说,在ICB期间或之前使用抗生素对临床反应产生不利影响,很可能是因为它们改变了肠道生态以及有利和不利细菌之间的平衡。尽管通过抗生素来靶向肠道菌群可能具有益处(如上面例子所述),但总体而言,这面临着大部分抗生素的广泛反应性以及可能诱导抗生素耐药性的挑战。
除了抗生素,其他更具特异性的方法,如噬菌体治疗以及更有效、更具特异性的噬菌体介导的CRISPR-Cas3抗微生物药物,可以在我们对直接影响抗肿瘤反应的细菌种类以及由其消除引起的生态变化的认识更加精确之后使用。
FMT可解决80-90%的抗生素耐药性艰难梭菌感染,其他包括各种机会性感染、炎症性肠病等也在研究中。
对免疫疗法后的结肠炎,FMT效果好
抗CTLA4治疗免疫相关不良反应中常见的有结肠炎,这类结肠炎可能比较严重,皮质类固醇或TNF拮抗剂的治疗难以治愈。
两名癌症患者在接受ICB治疗后出现结肠炎,经健康捐赠者FMT治疗后,病情迅速恢复。供体菌群确实发生了定植,厚壁菌门和变形菌门的丰度降低,拟杆菌门和Verrumicrobiae的丰度增加。随后的一份初步报告显示,在FMT治疗的15名癌症患者中,有11人从ICB诱导的结肠炎中恢复。
FMT:提高黑色素瘤患者的抗PD1治疗效果
两项临床试验证明,FMT可以靶向微生物群,以提高黑色素瘤患者的抗PD1治疗效果。由于预测微生物群组成尚不可行,这可能支持抗PD1治疗反应,以选择健康的粪便微生物群供体,两项试验都使用了黑色素瘤患者和对抗PD1疗法有持久反应的患者作为供体。
*****************************************************************************
第一项试验
10名进展中的黑色素瘤患者接受了抗生素治疗(其中6人之前对ICB有阳性反应),并通过结肠镜检查。这10个人做了FMT,供体是两名对抗PD1治疗有反应的捐赠者中的其中一人,随后重复胶囊形式的FMT和抗PD1疗法。
● 在从供体1接受移植的5名患者中,一个完全反应和两个部分反应;
● 在从供体2接受移植的五名患者没有反应。
两个供体的微生物群都包含有利于抗PD1治疗反应的菌群,供体1在梭菌属和放线菌属中更富集。FMT后,供体1受体的微生物组成变化比供体2受体更一致,人类粪便转录组中炎症和抗原呈递特征的表达增加。治疗后,三名有反应的患者表现出更显著的肿瘤排斥反应,其特征是I型干扰素反应和单核细胞、DC、NK细胞和T细胞浸润。
*****************************************
第二项试验
15名对抗PD1治疗原发性无反应的黑色素瘤患者在结肠清洗后(没有抗生素治疗),接受了来自6名抗PD1疗法有反应的供体中的1名,随后接受了持续的抗PD1治疗;1名患者完全缓解,2名患者部分缓解,3名患者病情稳定超过18个月。
这些反应良好的患者的菌群怎么样了?
在反应良好的患者中,FMT后的粪便微生物群变得更像供体,并且针对供体菌群的IgG抗体更显著诱导。有益菌的丰度增加,如毛螺菌科、瘤胃球菌科和双歧杆菌科,有害菌如拟杆菌属减少。
其他指标有什么变化?
在这些有反应的患者的血液中,IL-8水平下降,而CXCR13和IL-21水平上升,表明T卵泡辅助细胞(TFH)有反应。
初级和次级胆汁酸的水平以及苯甲酸盐降解的产物都增加了,苯甲酸盐是微生物群多样性,与抗PD1治疗反应相关的某些菌群的存在的标志。
******************************************************************************
尽管规模小且单臂试验,但这两项初步研究中的整体临床反应率为36%,高于其他联合治疗方案在难治性抗PD-1治疗患者中的反应率,且没有额外严重毒副作用。
FMT后菌群有效定植,干扰时长超1年
总的来说,即使没有抗生素调理,单次结肠镜进行FMT,也会干扰微生物群组成超过1年。宏基因组分析表明,大多数存在于供体而不在受体患者身上的菌属(和微生物基因),可以有效且持久地定植,除非受体接受了抗生素治疗。
供体菌株定植与治疗效果之间可能存在不一致?
事实上,FMT后的微生物群组成不仅反映了供体特异性菌群的定植情况,还反映了FMT引起的肠道生态变化,改变了来自供体或接受者的不同菌群的丰度。
对抗PD1治疗无效的黑色素瘤患者来说,FMT可能只有当患者存在针对肿瘤的免疫反应,但受到免疫抑制或微生物组成不利的影响,导致缺乏免疫促进的微环境时,才会产生对继续抗PD1治疗的反应。FMT可以纠正这种不利的微生物组成。
自体FMT,重建肠道微生物群
供体可以提供更健康、更多样的微生物群,能够重建受体微生物群的多样性。然而,将病原体或抗生素耐药性病原体转移到免疫抑制受体中存在风险,这也说明了患者自体微生物群的储存是合理的。
接受自体FMT的患者每种白细胞谱系的数量都更高,这表明FMT是有利的。Faecaliberium、Ruminococcus、Akkermansia与白细胞数量增加有因果关系的是通过自体FMT重建的。
癌症患者对抗PD1治疗产生抗药性的原因各不相同,可能导致FMT治疗失败
其中原因包括:
1)由于免疫抑制或肿瘤可能缺乏新抗原,无论微生物群组成如何,都无法对肿瘤做出反应
2)FMT供体可能缺乏对抗-PD4治疗做出反应所需的菌群
3)由于供体与受体微生物群的不相容性,FMT不能使微生物群扰动足够大
4)FMT模式的递送方法和频率可能不是最佳的
FMT在癌症免疫治疗中的未来发展
需要重点评估患者预处理和微生物群转移的最佳方案,确定最有可能受益于FMT的患者和合适的供体。
许多计划中以及正在进行的试验将通过评估FMT在不同肿瘤类型中的有效性,以及将FMT与其他方法(如益生菌、饮食和益生元)进行比较或结合,调节肠道微生物群的组成,来确定FMT是否成为治疗对ICB无反应患者的常规方法。
益生菌制剂含有具有抗炎和粘膜保护能力的菌群,如乳酸杆菌属和双歧杆菌属,用于预防化疗和放疗引起的毒性。
临床和小鼠研究,都确定了可能对特定机会性感染产生耐药性的细菌,以及可能纠正微生物群失衡的潜在益生菌。
乳杆菌属:抑制肿瘤生长,改善对ICIs的反应
鼠李糖乳杆菌、嗜酸乳杆菌和发酵乳杆菌对结肠癌发展的缓解作用已在小鼠模型中得到证实。
鼠李糖乳酸杆菌GG可通过cGAS/STING信号传导途径刺激I型干扰素,从而改善对ICIs的反应。
乳酸菌(LAB)可有效减少结直肠癌的发生,这可能归因于炎症因子的减少。此外,LAB还影响肠道微生物群落,其特征是拟杆菌丰度的降低。因此,LAB有利于抑制癌症的发生和发展。
罗伊氏乳杆菌能促进肠上皮的更新和修复,刺激宿主免疫。它能将上皮内CD4+T细胞转化为CD4+CD8αα双阳性上皮内淋巴细胞,从而缓解炎症性肠病,预防部分消化道癌症的发生。
罗伊氏乳杆菌抑制 ICI相关结肠炎的能力,与第 3 组先天淋巴细胞分布的减少有关。
罗伊氏乳杆菌通过产生三种色氨酸降解产物,抑制黑色素瘤、肝癌和结直肠癌的生长:
双歧杆菌属:增强抗PDL1疗效
对无特定病原体或微生物群耗尽的小鼠,给予与ICB反应相关的各种菌群可提高治疗反应。
为了验证双歧杆菌属支持小鼠抗PDL1治疗,施用含有四种双歧杆菌属菌株的非处方商业益生菌制剂可提高对抗PDL1疗法的反应。在对抗PD1治疗有反应的患者中,双歧杆菌也会增加。
只有一些双歧杆菌菌株能够在小鼠中与抗PD1治疗协同作用。这些协同菌株表达参与合成肽聚糖途径的基因,表明它们有助于产生免疫刺激分子。
Faecalibaculum rodentium: 抑制肿瘤生长
F.rodentium和Holdemanella biformis(人类同源物)在肿瘤发生过程中缺失或丢失,这两者都可以产生短链脂肪酸,通过抑制钙调神经磷酸酶和NFATc3激活来控制肿瘤细胞的增殖和蛋白质乙酰化。
当将F.rodentium应用于ApcMin/+小鼠时,80%以上的结直肠癌中会发生结肠腺瘤样息肉(APC)基因突变,或者用偶氮甲烷和右旋糖酐硫酸钠治疗可以减轻小鼠的肿瘤生长。同样,在ApcMin/+模型中,H.biformis在通过丁酸盐抑制肿瘤生长方面似乎与F.rodentium相似。因此,H.biformis可以应用于癌症治疗的设计。
嗜热链球菌:分泌β-半乳糖苷酶,释放叶酸
嗜热链球菌(Streptococcus thermophiles)是一种强大的益生菌,具有消化和免疫益处,通常在结直肠癌患者中被耗尽。更重要的是,嗜热链球菌对肿瘤发生有抑制作用。
具体而言,在结直肠癌小鼠中经口灌胃嗜热链球菌将显著减少肿瘤形成。嗜热链球菌分泌的β-半乳糖苷酶是抑制结直肠癌生长的活性成分;β-半乳糖苷酶可以增加另外两种益生菌乳酸杆菌和双歧杆菌的丰富性,这表明了协同作用。
嗜热链球菌通过释放叶酸来影响肿瘤生长。叶酸是一种主要的膳食元素,在细胞代谢和DNA复制、修复、甲基化和核苷酸合成中发挥重要作用。研究表明,叶酸缺乏在人类中相当普遍,嗜热链球菌释放的叶酸可能与肿瘤抑制有关。此外,嗜热链球菌对淋巴细胞特征、结肠炎的严重程度和调节性T细胞反应有影响。
大肠杆菌Nissle 1917: 减少并发症
大肠杆菌Nissle 1917 菌株可以调节肠道屏障上皮功能,缓解肠道菌群失调,最终减少伊立替康引起的肠道并发症。
丁酸梭菌588菌株:改善抗PD1治疗后患者生存率
相反,在一项回顾性分析中,一种单一的益生菌制剂,在日本和中国广泛用于治疗与胃肠道病理学相关的微生态失调的丁酸梭菌(CBM)588菌株,显著改善了接受抗PD1治疗的小细胞肺癌癌症患者的客观反应、PFS和总生存率。丁酸梭菌通过增加乳酸杆菌和双歧杆菌来改善微生态失调。
然而,一项对接受联合ICB治疗的肾细胞癌症患者的随机试验证实,接受丁酸梭菌治疗的患者临床反应有所改善,但未能检测到双歧杆菌的增加。
多种菌组合,效果 1+1>2
虽然单一益生菌菌株显示出前景,但细菌群落可能更好地维持肠道微生物群内的生态平衡。人类和小鼠种,某些种类的梭状芽孢杆菌与对结肠癌的耐药性有关。
小鼠口服下列四种梭菌菌株:
诱导了激活的CD8+T细胞在肿瘤内的积聚,并成功治疗了化学诱导的结肠癌和可移植结肠癌。
该联合体作为一种独立的治疗方法以及单个物种,在小鼠中比单独的抗PD1治疗更有效。所有四个菌株都产生短链脂肪酸,包括丁酸盐;然而,它们的免疫刺激作用独立于丁酸盐。
鉴定免疫激活细菌群落的另一种方法涉及鉴定罕见的人类共生菌株,该菌株可以激活小鼠肠道中产生IFNγ的CD8+T细胞。一个由11个物种组成的群落在无菌小鼠中对单核细胞增多性李斯特菌感染保持耐药性,并具有与抗PD1治疗相加的抗肿瘤作用。值得注意的是,7种本身没有抗癌活性的拟杆菌目物种确实对该群落的总活性有贡献,这支持了多物种细菌生态学在重建肠道微生物群中的重要性。因此,使用单一菌株和联合体的试验正在进行中。
免疫治疗期间,益生菌的服用也需谨慎
与不服用益生菌的患者相比,服用非处方益生菌的黑色素瘤患者对抗PD1治疗的反应并没有改善,反而有所下降。
这些结果,再加上商业益生菌的配方是异质的,缺乏严格的成分和生存能力质量标准,表明在免疫治疗期间使用这些产品时应谨慎。
饮食的变化会迅速改变肠道微生物群的组成,以及食物发酵衍生的细菌代谢产物的产生,从而产生代谢和免疫后果。
不同的饮食策略,包括热量限制、间歇性禁食、模拟禁食饮食、高纤维饮食、生酮饮食、发酵食物,都已在小鼠或患者中提出或测试,以改善癌症的治疗,至少在某些情况下,显示出通过改变肠道微生物群的组成来影响免疫力。
在T细胞过继转移模型中,小鼠的饮食热量限制促进了记忆性T细胞在骨髓中的积累,并增强了T细胞对细菌感染和肿瘤的免疫力。
发酵食品饮食持续增加了微生物组的多样性,并通过整体抗炎作用改变了其组成。
高纤维饮食对微生物组多样性和组成的影响更为温和,对免疫细胞的频率和细胞因子的表达没有显著影响,但对免疫细胞中的内源性信号传导产生了不同的影响,在一组具有高炎症指数的个体中,内源性信号传导增加,而在另外两组具有低炎症指数特征的个体中则减少炎症指数。
饮食可能通过改变菌群影响抗癌免疫
接受抗PD1治疗的黑色素瘤患者,在纤维充足的饮食超过20g/天时有更好的反应和存活率 ,每5 g纤维的增加相当于进展或死亡风险降低30%。
与另一项研究一致,不同纤维摄入量的人类肠道微生物群在组成或细菌丰富度方面没有显示出重大变化,但从小鼠食物中去除大部分纤维含量导致微生物群迅速变化,双歧杆菌属减少,AKK菌增加。低纤维饮食的小鼠对抗PD1癌症治疗反应较差,与临床结果相似。因此,在无菌小鼠中,高纤维和低纤维饮食不会影响对抗PD1治疗的反应,这表明该饮食可能通过改变微生物群影响抗癌免疫。
跨物种网络分析表明,小鼠的高纤维饮食通过扩大发酵纤维的瘤胃球菌属来维持有效的肿瘤免疫。瘤胃球菌属诱导T细胞的激活和肿瘤浸润,包括表达诱导型T细胞共刺激因子(ICOS)的CD8+和CD4+T细胞。
模拟禁食饮食(FMD)可降低癌症患者的毒性,并改善其对化疗的反应,但大多数关于这种饮食干预的研究尚未解决肠道微生物群改变的作用。
禁食对化疗的积极作用体现在四个方面:
二甲双胍、维生素 C、铂和曲美替尼与禁食联合使用可以增强化疗的效果。
对于三阴性乳腺癌,模拟禁食饮食激活癌细胞中的饥饿逃逸途径,并减少癌症干细胞的表面标志物,从而导致化疗药物的识别增加。
生酮饮食在小鼠中通过诱导由酮体3-羟基丁酸介导的T细胞癌症免疫,来增强抗PD1治疗的抗肿瘤作用。在小鼠和人类中,尽管在低碳水化合物饮食在增加Eisenbergiella massiliensis等细菌种类的丰度方面与抗癌效应相一致,但饮食对肿瘤免疫的影响是由3-羟基丁酸盐的增加介导的,并不依赖于肠道微生物群的改变。
菊粉和果胶是许多蔬菜和水果中天然存在的可溶性纤维,不能被胃肠道酶消化,但可以被细菌发酵。因此,它们通过改变肠道微生物群的组成、增强粘膜屏障、增强上皮完整性以及激活或抑制先天免疫细胞来发挥益生元的作用。
菊粉→产短链脂肪酸菌→增强抗PD1疗效
在小鼠中,菊粉凝胶的口服治疗增加了产短链脂肪酸菌的丰度,并增强了抗PD1疗法的抗肿瘤活性。
↘
果胶增强抗肿瘤免疫,有两种不同的机制。
果胶→产短链脂肪酸菌→增强抗PD1疗效
果胶喂养增强了移植有癌症患者粪便微生物群的小鼠对抗PD1治疗的反应能力,通过扩大纤维喂养和产生短链脂肪酸的Lachnospiraceae和Ruminococceae,通过丁酸盐激活肿瘤免疫。
果胶→AKK菌→激活STING→提高肿瘤免疫
果胶喂养也可以通过导致AKK菌的扩张来提高肿瘤免疫力,从而产生环状二磷酸腺苷(cyclic-di-AMP)并激活STING;由此产生的I型干扰素依赖性免疫肿瘤微环境特征,与小鼠和黑色素瘤患者的免疫介导的肿瘤抵抗相关。
卡姆果→增加多样性,有益菌→增强抗PD1疗效
小鼠研究中,从卡姆果(camu camu)中分离的多酚——栗木鞣花素(castalagin,一种可水解的单宁)的口服给药具有抗肿瘤作用,并通过增加肠道微生物群的多样性,增加有望对抗PD1治疗有益的菌(如瘤胃菌科,颤螺旋菌科Oscillospiraceae和AKK菌)来改变其组成,从而增强小鼠的抗PD1治疗效果。
栗木鞣花素通过影响肠道微生物群组成,重新编程肿瘤免疫微环境,并在一定程度上通过直接结合而不内化于共生细菌(如Ruminococcus bromii)来促进抗癌反应,这可能有助于扩大这种细菌和其他有益细菌的种类,促进抗PD1治疗反应。这表明,栗木鞣花素和其他传统食品添加剂或其成分可能是益生元的来源,通过靶向微生物群来提高免疫疗法的反应性。
人参多糖→增加戊酸→增强抗PD1疗效
人参多糖是一种来源于人参的益生元,可以通过降低犬尿氨酸/色氨酸的比例,增加微生物代谢产物戊酸来增强癌症对PD1抑制剂的反应,从而促进Teff细胞的诱导和调节T细胞的抑制。
肠道微生物群在癌症治疗中,可以通过多种机制影响肿瘤的发展和治疗效果。
研究表明,肠道微生物群可能成为多种癌症类型的预后和预测标记。肠道微生物群有望增强抗癌力,改善放疗化疗效果和增强免疫治疗效果,以降低死亡率和提高生活质量。初步临床试验表明,对抗PD1治疗有反应的患者的FMT可以克服对ICB治疗的原发性和获得性耐药性,这证明可以靶向微生物群增强治疗反应。
然而,在这些临床治疗研究的进展中存在许多障碍和局限性。个体生物学差异可能会阻碍微生物策略的应用。该领域的挑战包括需要在不同的癌症类型、分期、地理区域、年龄、遗传、性别、生活方式、伴随疾病、治疗和合并症中进行前瞻性验证。将小鼠的结果推广到人类也应该谨慎。
虽然存在挑战,但相应的解决方案也在不断研究中。目前应用机器学习方法分析,在考虑了不同群体和地理差异的患者肠道菌群的组成方面取得了进展,这可能很快使肠道菌群成为一个可靠的生物标志物,用于预测患者对治疗的反应,从而实现个性化选择最适合的治疗方法。
将肠道微生物群与独立调节 ICI 功效的其他生物标志物(例如 PD-L1、TMB、IL-8 或某些代谢物等)结合起来,预测免疫疗法效果的能力可能会提高。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症治疗具有积极和负面效应的因果关系,并了解其作用机制,因此需要进行更广泛的试验。
改进的细菌或许可以作为抗癌治疗药物,甚至可以被改造成指导性的“微型机器人”用于药物传递。
总的来说,这一领域的发展为癌症患者提供了新的治疗选择和希望,但同时也需要谨慎评估和监测,确保安全性和有效性。
肠道微生物群对于开发新的抗癌策略的重要性和潜力值得强调,并且有必要探索一种将微生物调节疗法纳入当前癌症管理的整体方法系统。未来我们有望实现更加精准和个性化的肠道菌群调节策略,为癌症治疗带来更大的突破和进展。
主要参考文献
Thomas AM, Fidelle M, Routy B, Kroemer G, Wargo JA, Segata N, Zitvogel L. Gut OncoMicrobiome Signatures (GOMS) as next-generation biomarkers for cancer immunotherapy. Nat Rev Clin Oncol. 2023 Sep;20(9):583-603.
Fernandes MR, Aggarwal P, Costa RGF, Cole AM, Trinchieri G. Targeting the gut microbiota for cancer therapy. Nat Rev Cancer. 2022 Dec;22(12):703-722.
Lee KA, Thomas AM, Bolte LA, Björk JR, de Ruijter LK, Armanini F, Asnicar F, Blanco-Miguez A, Board R, Segata N et al., Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma. Nat Med. 2022 Mar;28(3):535-544.
Zhao LY, Mei JX, Yu G, Lei L, Zhang WH, Liu K, Chen XL, Kołat D, Yang K, Hu JK. Role of the gut microbiota in anticancer therapy: from molecular mechanisms to clinical applications. Signal Transduct Target Ther. 2023 May 13;8(1):201.
Liu L, Shah K. The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm: A Review. JAMA Oncol. 2022 Jul 1;8(7):1059-1067.
McCulloch JA, Davar D, Rodrigues RR, Badger JH, Fang JR, Cole AM, Balaji AK, Vetizou M, Prescott SM, Fernandes MR, Costa RGF, Yuan W, Salcedo R, Bahadiroglu E, Roy S, DeBlasio RN, Morrison RM, Chauvin JM, Ding Q, Zidi B, Lowin A, Chakka S, Gao W, Pagliano O, Ernst SJ, Rose A, Newman NK, Morgun A, Zarour HM, Trinchieri G, Dzutsev AK. Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1. Nat Med. 2022 Mar;28(3):545-556.
Guillot N, Roméo B, Manesh SS, Milano G, Brest P, Zitvogel L, Hofman P, Mograbi B. Manipulating the gut and tumor microbiota for immune checkpoint inhibitor therapy: from dream to reality. Trends Mol Med. 2023 Nov;29(11):897-911.

谷禾健康

癌症是一种恶性肿瘤,它可以发生在人体的任何部位,包括肺、乳房、结肠、胃、肝、宫颈等。根据世界卫生组织的数据,全球每年有超过1800万人被诊断出患有癌症,其中约有1000万人死于癌症。癌症已成为全球范围内的主要健康问题之一。
癌症免疫疗法的概念在很早前就提出,但直到最近才被广泛接受为对抗癌症的新型选择。随着现代生物医学技术的发展,已经开发了各种类型的免疫治疗策略。
然而,癌症患者对免疫疗法的个体反应各不相同,并且经常观察到严重的副作用,这限制了这种新方法的进一步利用。
近年来的研究表明,肠道微生物群在免疫疗法的效果及副作用中的起到一定的介导作用,因为某些微生物物种或相关代谢物与癌症患者的反应密切相关。
已经对植物或动物天然产品的营养价值以及它们对肠道微生物群和肿瘤免疫疗法的调节进行了大量研究。膳食真菌因其丰富的营养价值和对人体的调节功能而成为近年来的研究热点。
本文将重点介绍天然产物中膳食真菌的摄入与肠道微生物群调节之间的关系,以及它们在癌症免疫治疗中的生物学作用和潜在机制。
本文出现的专业名词
CTLA-4(细胞毒性T淋巴细胞相关蛋白4),是一种蛋白受体,其作为免疫检查点起作用并下调免疫应答。
PD-1(程序性死亡受体1),是一种重要的免疫抑制分子。通过向下调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。
PDL1(细胞程序性死亡-配体1),是一种跨膜蛋白,细胞程序性死亡受体-1(PD-1)与细胞程序性死亡-配体1(PD-L1)结合,可以传导抑制性的信号,减低淋巴结CD8+ T细胞的增生与免疫系统的抑制有关。
CAR-T细胞:技术人员通过基因工程技术,将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
什么是癌症免疫疗法?
癌症免疫疗法是一种治疗癌症的新型方法,它利用人体自身的免疫系统来攻击癌细胞。传统的癌症治疗方法如化疗、放疗等是通过外源性方式杀死癌细胞来治疗癌症,但这些方法也会对正常细胞造成损伤。而免疫疗法则是通过激活或增强人体自身的免疫系统来攻击癌细胞,从而达到治疗癌症的目的。
癌症免疫疗法的优点是可以避免传统癌症治疗方法的副作用,同时可以提高患者的生存率和生活质量。然而,癌症免疫疗法仍然存在一些挑战和限制,如个体间治疗效果差异较大、治疗费用较高等问题,但其作为治疗癌症的新兴手段有着不错的前景。因此,目前仍需要进一步的研究和发展,以提高癌症免疫疗法的治疗效果和安全性。
免疫检查点阻断疗法(ICB)
免疫检查点阻断疗法(ICB)是一种新型的癌症免疫疗法,它通过阻断肿瘤细胞和免疫细胞之间的信号传导通路,从而激活免疫系统攻击癌细胞。
在正常情况下,免疫系统会通过检查点来控制和限制免疫细胞的活性,以避免对正常细胞的攻击。但是,癌细胞可以利用这种机制来逃避免疫系统的攻击,从而导致肿瘤的生长和扩散。 免疫检查点阻断疗法的主要作用是通过抑制免疫检查点分子的功能,从而激活免疫细胞攻击癌细胞。
免疫检查点阻断疗法(ICB)是基于“免疫监视”理论和在T细胞上发现免疫检查点分子(包括CTLA-4和PD-1等)的最具革命性的技术之一。
▸ 作用机理
CTLA-4与CD80/86细胞结合后转导的信号和PD-1与PD-L1结合后转导的信号抑制T细胞的“过度激活”,在预防慢性疾病的异常免疫反应中起重要作用。
阻断受体分子增强了肿瘤杀伤活性
然而,为了增强T细胞清除癌细胞的活性,需要取消这些信号。根据以往的研究,使用CTLA-4或PD-1/PD-L1单克隆抗体治疗的患者通过上调免疫活性产生了显著的抗肿瘤反应。
机理研究表明,CTLA-4或PD-1/PD-L1阻断显著增强了肿瘤特异性T细胞中的T细胞受体信号,从而导致更强的肿瘤杀伤活性,肿瘤微环境中T细胞的浸润和存活率也相应提高。
▸ 免疫检查点阻断适用于的癌症
目前,免疫检查点阻断已被批准用于各种类型的癌症,包括黑色素瘤、非小细胞肺癌、肾细胞癌、头颈部鳞状细胞癌、膀胱癌、肝细胞癌、霍奇金淋巴瘤,作为一线或二线治疗。
此外,许多其他靶向共刺激因子的激动性和拮抗性免疫检查点调节剂,如4-1BB、ICOS、GITR、OX-40、CD40等,目前正在研究中。
✦免疫检查点阻断疗法的局限性
随着临床实践的进展,免疫检查点阻断疗法仍有许多局限性。一个显著的问题是不同类型的癌症反应普遍较低。
•个体差异影响免疫检查点阻断疗法效果
虽然抗PD-1/PD-L1的有效性已经在黑色素瘤和非小细胞肺癌中得到明确证明,但来自其他类型癌症的结果不太明确,并且个体对免疫检查点阻断疗法的反应各不相同,这表明包括遗传、环境、行为甚至肠道微生物群在内的其他因素对免疫检查点阻断治疗效率的影响。
•会出现重度免疫相关毒副反应
免疫检查点阻断疗法的另一个限制是相关的副作用,称为重度免疫相关毒副反应(irAEs)。重度免疫相关毒副反应是免疫检查点阻断疗法诱导的过度炎症反应,可影响多个器官,在某些情况下甚至导致死亡。
据报道,免疫检查点阻断疗法总的重度免疫相关毒副反应发生率约为70-90%。irAEs最常见的症状涉及皮肤、胃肠道、肝脏、内分泌器官和肺,而它在不同类型的癌症和治疗中有所不同。
例如,结肠炎是胃肠道中最常见的irAEs类型,免疫检查点阻断治疗的10-20%的患者中发生。皮肤反应,包括皮疹、瘙痒和白癜风,也是免疫检查点抑制剂治疗中常见的副作用,其中大约50%的患者受到影响。
重度免疫相关毒副反应发生的确切机制仍在研究中,有人提出,过度激活的T细胞攻击正常组织,细胞因子不受控制的分泌,自身抗体的扩增,甚至免疫检查点抑制剂抗体与正常组织的结合(脱靶效应)是导致重度免疫相关毒副反应发生的原因。
肠道微生物影响ICB疗法
有趣的是,已经发现肠道微生物群可能影响免疫检查点阻断疗法的疗效以及相关重度免疫相关毒副反应的发生率。
•调节宿主免疫反应
粪便移植(FMT)已被证明可有效改善黑色素瘤或上皮肿瘤患者对PD-1治疗的总体反应,这表明肠道微生物群在PD-1治疗后调节宿主免疫反应中的重要作用。
•降低相关副作用发病率
另一方面,一项针对接受抗CTLA-4治疗的黑色素瘤患者的研究表明,拟杆菌(Bacteroidetes)的富集与结肠炎的发病率降低密切相关。
尽管有这些发现,但仍然迫切需要提高效率并消除免疫检查点阻断疗法的副作用,这依赖于对宿主与免疫检查点阻断反应的机制的深入理解,以及宿主免疫反应、免疫检查点阻断疗法和肠道微生物群之间相互作用。
嵌合抗原受体免疫疗法
嵌合抗原受体免疫疗法(CAR-T细胞疗法)是一种新型的癌症免疫疗法,它利用改造后的T细胞来攻击癌细胞。
CAR-T细胞疗法的基本原理是将患者的T细胞收集后,通过基因工程技术将其改造成能够识别并攻击癌细胞的CAR-T细胞,再将其注入患者体内。
▸ 作用机理
传统上,T细胞活化依赖于T细胞受体与细胞表面主要组织相容性复合体(MHC)呈递的特异性抗原(包括肿瘤细胞相关抗原)之间的相互作用,这种相互作用经常被肿瘤细胞下调。
为了克服这一问题,研究人员设计了一种嵌合抗原受体蛋白(由癌症抗原特异性B细胞的外结构域和T细胞的细胞内结构域组成),并在患者的正常T细胞中人工表达,以产生CAR-T细胞。
CAR-T细胞具有更强的杀伤性
与正常T细胞相比,CAR-T细胞在体外和体内对肿瘤细胞表现出更高的亲和力和更强的杀伤活性。CAR-T疗法最早用于治疗包括淋巴瘤和白血病在内的血癌,与传统疗法相比,CAR-T疗法表现出更好的效果。
✦嵌合抗原受体免疫疗法适用于的癌症
目前,CAR-T疗法已被批准用于治疗各种癌症,包括复发性或难治性多发性骨髓瘤、弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤、急性淋巴细胞白血病等。
此外,CAR-T疗法治疗其他类型癌症的潜力也在临床和临床前研究中进行了评估。
✦嵌合抗原受体免疫疗法的局限性
•产生耐药性、抗原逃逸
CAR-T疗法也有明显的缺点,最具挑战性的问题之一是肿瘤对单一抗原靶向CAR构建体的耐药性。
尽管施用CAR-T细胞最初产生高反应率,但相当比例的患者经历了靶抗原表达的部分或完全丧失,这被称为抗原逃逸。
据报道,70-90%的急性淋巴细胞白血病患者在初始阶段对CD19 CAR-T治疗表现出持久的反应;但复发后CD19抗原表达下调或丢失的比例为30-70%
在CAR-T治疗的多发性骨髓瘤患者中,也观察到包括B细胞成熟抗原(BCMA)在内的其他靶点的下调。
•全身细胞因子释放综合征
CAR-T治疗在临床上的另一个挑战是全身细胞因子释放综合征(CRS),其特征是低血压、心功能障碍、循环衰竭、呼吸衰竭、肾衰竭、多器官系统衰竭等,如果控制不好可能会危及生命。
注意:促炎性白细胞介素1和白细胞介素6被认为是CAR-T治疗中CRS的关键介质;因此,IL-6/IL-6R阻断被认为是消除CRS的潜在途径。
然而,即使使用tocilizumab,一种食品药品监督管理局批准的用于治疗严重全身细胞因子释放综合征的IL-6R单抗,症状仍然持续并最终导致患者死亡。
迄今为止,仍然缺乏对抗CAR-T疗法诱导的全身细胞因子释放综合征的有效策略。
此外,CAR-T治疗实体瘤的疗效因组织浸润能力低而降低,导致治疗结果较差。利用局部注射代替全身给药来促进CAR-T细胞的肿瘤浸润,而这仅适用于单个肿瘤病变/低转移疾病。
✦肠道微生物可能在CAR-T疗法起作用
最近发现了肠道微生物群和CAR-T疗法的反应/毒性之间的相关性。
根据一项队列研究,肠道微生物谱与B细胞恶性肿瘤患者接受抗CD19 CAR-T细胞治疗后的反应和毒性密切相关,这表现在接受/未接受抗生素治疗的患者中不同的细菌分类和代谢途径,以及暴露于抗生素的患者中观察到的较差存活率和增加的神经毒性。
最新发表的一项研究表明,在开始CAR-T治疗前,患者的基线肠道菌群特征可以预测之后对治疗的应答情况,但前提是这些患者没有预先使用广谱抗生素,因为这会破坏菌群与治疗反应间的关联。
然而,关于肠道微生物群在CAR-T治疗结果中的作用,仍然有很大程度的未知,并且仍然缺乏对其机理的认识,需要更多相关研究阐述其机制。
其他免疫疗法
除了上述的主流癌症免疫疗法,还有其他几种已经开发或正在研究的免疫疗法。
细胞因子疗法
白细胞介素-2(IL-2)是细胞因子疗法的典型例子,并于1992年被批准用于治疗转移性肾细胞癌,但包括毛细血管渗漏综合征和多器官功能障碍在内的严重毒性限制了白细胞介素-2的使用。
T细胞受体工程疗法
T细胞受体工程(TCR-T)疗法是一种类似CAR-T的过继细胞转移(ACT)疗法,其特点是通过植入肿瘤抗原特异性TCR分子对T细胞进行基因修饰。
TCR-T的优势已在临床前和临床研究中得到充分证明
除此之外,癌症疫苗和溶瘤病毒疗法也被认为是治疗癌症的有效策略。然而,肠道微生物群在调节癌症免疫疗法的效率或毒性方面的作用仍然需要解决。
肠道微生物群是生活在消化道中的复杂微生物群落,与身体的任何其他部分相比,其数量和种类最多。
众所周知,人类肠道中的微生物对宿主的健康起着重要作用。微生物群成分之间的相互作用以及它们与宿主免疫系统的关系以多种方式影响疾病的发展。
例如,它通过定居粘膜表面和分泌各种抗微生物物质来保护宿主免受病原体的侵害,这有助于增强免疫反应。
此外,肠道菌群在消化代谢、控制上皮细胞增殖分化、调节胰岛素抵抗、脑肠联系等方面发挥着重要作用。
★ 肠道菌群对癌症免疫治疗的效果和副作用有显著影响
关于癌症免疫疗法,来源于肠道微生物群的组成、生物活性和代谢产物显示出对治疗的效率和副作用有显著影响。
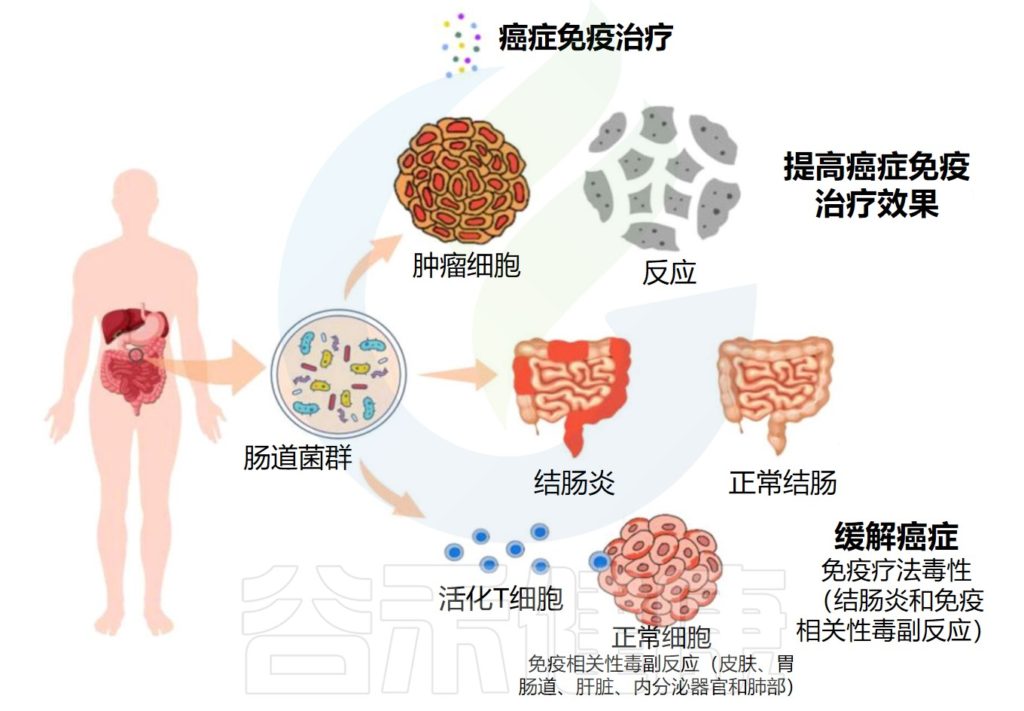
编辑
Wei Y,et al.Front. Oncol.2023
肠道菌群影响癌症免疫疗法效果
先前的一些研究已经揭示了黑色素瘤中肠道微生物群和抗PD-1功效之间的关系。
肠道菌群影响黑色素瘤细胞的生长
检查了在两个设施中饲养的遗传相似的小鼠中黑色素瘤的皮下生长。
他们发现,其中一组肿瘤生长更具侵略性,这与肿瘤内CD8+ T细胞积累显著降低有关,而这受肠道菌群组成的影响。
不同肠道微生物群接受癌症免疫治疗反应不同
一组研究人员检查了接受抗PD-1治疗的黑色素瘤患者的肠道微生物群,并观察到有反应者和无反应者之间肠道微生物群的多样性和组成有显著差异。
肠道微生物影响CAR-T治疗的患者生存率
此外,一项回顾性队列研究发现,在CAR-T治疗前四周暴露于抗生素可能会降低患者的生存率并增加神经毒性的发生率,这强调了肠道微生物群与CAR-T治疗效率之间的关联。
特定的肠道微生物在癌症免疫治疗中的参与也被发现。
✦双歧杆菌在免疫治疗中的抗肿瘤作用
在抗PD-1免疫治疗前从转移性黑色素瘤患者收集的粪便样本,发现长双歧杆菌(Bifidobacterium Longum)、产气柯林斯菌(Collinsella aerofaciens)以及屎肠球菌(Enterococcus faecium)在应答者中更丰富,这表明在PD-1免疫疗法的背景下双歧杆菌的抗肿瘤作用。
✦拟杆菌影响CTLA-4阻断剂的抗肿瘤作用
类似地,先前的研究表明CTLA-4阻断的抗肿瘤作用依赖于不同的拟杆菌物种,因为T细胞对多形拟杆菌(B.thetaiotaomicron)或脆弱拟杆菌(B.fragilis)
的特异性反应与CTLA-4阻断剂的疗效相关。
✦肠道菌群调节癌症免疫治疗效率
为了确定肠道菌群在调节患者对免疫检查点阻断治疗反应中的生物学作用,评估了粪菌移植(来自PD-1应答者)和抗PD-1给药联合治疗PD-1难治性黑色素瘤患者的疗效。
结果显示,应答者表现出先前被证明与抗PD-1反应相关的类群丰度增加,CD8+ T细胞激活增加,白细胞介素8表达髓系细胞频率降低。
应答者具有不同的蛋白质组和代谢组特征,跨域网络分析揭示了肠道微生物群在调节这些变化中的主导作用。这些结果证实了肠道微生物群在提高抗PD-1对黑色素瘤的效率方面的作用。
✦肠道微生物增强PD-1疗法对抗其他癌症
除此之外,还发现肠道微生物群在增强PD-1疗法对抗其他癌症类型。某些肠道微生物物种在调节癌症免疫疗法效率方面的生物学作用已经在以前的研究中得到了解决。
双歧杆菌(Bifidobacterium)在抗PD-1治疗过程中有利于促进抗肿瘤免疫应答。
脆弱拟杆菌(B.fragilis) 肠道定植与CTLA – 4阻断治疗之间的因果关系已通过粪便移植和脆弱拟杆菌植入得到很好的证明。
阿克曼菌提高了黑色素瘤患者PD-1的阻断效果
在一项类似的研究中,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在调节黑色素瘤患者对抗pd -1治疗的反应中的起作用。
在无应答者粪菌移植后口服嗜黏蛋白阿克曼菌(A.muciniphira),显著恢复了PD-1阻断的功效。
总之,这些发现强调了肠道菌群在提高癌症免疫治疗效率方面的重要性。
肠道微生物群改善癌症免疫疗法的毒性
关于癌症免疫治疗中肠道微生物群的另一个问题,是肠道微生物的组成或生物活性的改变如何影响免疫疗法相关毒性风险。
✦肠道菌群影响癌症免疫治疗后结肠炎的患病率
研究表明,肠道菌群的组成可以预测患者在接受阻断CTLA-4的单克隆抗体治疗后是否会发生结肠炎。
无结肠炎患者的拟杆菌门比例较高
16S rRNA基因测序/16S rDNA测序结果显示,在治疗前,结肠炎组和无结肠炎组的微生物组成相似,但治疗后仍无结肠炎的患者的拟杆菌门比例较高。
以下菌属在结肠炎耐药患者粪便中含量较高:
拟杆菌(Bacteroidaceae)、
巴恩斯氏菌科(Barnesiellaceae)
Rikenellaceae
注:上面三种细菌都是拟杆菌门下的生物
宏基因组测序分析进一步显示,与多胺转运和B族维生素生物合成相关的4个微生物模块在无结肠炎患者的微生物区系中更为丰富。
✦肠道微生物群缓解CAR-T疗法副作用
肠道微生物群也可用于预测抗PD-1/PD-L1疗法的副作用风险。
免疫相关毒副反应程度不同下的菌群丰度也不同
根据一项观察性研究,严重免疫相关毒副反应的患者以下菌属丰度较高:
链球菌(Streptococcus)
Paecalibacterium
Stenotrophomonas
轻度免疫相关毒副反应患者则富含Faecaliberium和毛螺菌(Lachnospiraceae)。
类似地,另一项临床研究显示,在经历临床显著性或不显著性irAEs的患者之间,肠道微生物群存在明显的组成差异。
拟杆菌丰度可能影响免疫治疗的相关副作用
在一项更全面的研究中,77名接受靶向PD-1和CTLA-4的联合免疫检查点阻断治疗的晚期黑色素瘤患者的血液、肿瘤和肠道微生物组被分析,在以结肠炎和黏膜白细胞介素1b上调为特征的毒性患者中发现肠拟杆菌丰度显著更高。
此外,如上所述,在接受CD19 CAR-T治疗的B细胞淋巴瘤和白血病患者中,抗生素暴露与神经毒性的高发相关。这间接证实了肠道菌群可以缓解CAR-T治疗的相关副作用。
肠道微生物治疗了免疫疗法引起的结肠炎
作为免疫检查点阻断疗法的另一个常见副作用,结肠炎通常用免疫抑制药物治疗,包括皮质类固醇或靶向肿瘤坏死因子-α (TNF-α)的药物,所有这些都具有明显的副作用。
显示结肠炎和炎症性肠病可以通过肠道微生物群操作成功治疗。
谷禾与浙一团队合作的研究,通过比较不同CAR-T治疗阶段的肠道菌群的多样性和组成,我们发现患者之间和治疗阶段之间的肠道菌群特征存在差异,并且可能反映复发/难治性多发性骨髓瘤(MM)、急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)患者对治疗的反应。

这项研究对于理解肠道菌群在CAR-T治疗血液恶性肿瘤患者的治疗反应性中的生物学作用具有重要意义,并可能指导治疗干预以增加疗效。MM、ALL和NHL的治疗反应以及多发性骨髓瘤中严重细胞因子释放综合征的发生与特定的肠道菌群变化相关。
小结
总的来说,肠道微生物群在调节癌症免疫疗法的疗效和副作用方面的生物学作用已被充分证明,这预示着未来促进癌症免疫疗法的新策略的发展。
随着对肠道菌群的深入了解,最近也对优化患者和健康人群肠道微生物的潜在方法进行了评估。
粪菌移植和单菌移植(益生菌给药)在改善患者健康方面取得了良好的效果,但对暴露于粪菌移植的异体菌株的患者可能是有害的,并使人们容易患上自身免疫性疾病等慢性疾病。
相反,饮食干预或益生元补充可能更适合普通人群,因为它被认为危害较小,更容易被接受。同时,有必要阐明饮食干预对肠道微生物群调节机制。
不同饮食对肠道菌群的影响
许多膳食补充剂被确定具有“微生物调节”活性。
✦大量摄入动物性食品导致菌群结构不健康
动物性食品是动物来源的食物,包括畜禽肉、蛋类、水产品、奶及其制品等。
总的来说,动物性食品中氨基酸发酵产物含量较高,碳水化合物发酵产物含量较低,而氨基酸发酵产物含量与耐胆汁的拟杆菌(Bacteroides)和梭状芽孢杆菌(Clostridia)等微生物数量呈正相关。
相比之下,有益细菌,如双歧杆菌(Bifidobacteria)与动物食品的消费呈负相关。
高脂肪和动物性饮食可以促进沃氏嗜胆菌生长(Bilophila wadsworthia)——产生硫化氢的细菌,这可能是胃肠道炎症的原因。然而,大量摄入多不饱和脂肪会促进瘤胃球菌(Ruminococcus)在肠道内的生长。
✦富含纤维的饮食有助于维持肠道菌群稳态
几项研究揭示了纤维在植物性饮食中的作用。例如,富含碳水化合物和纤维的饮食增加了肠道微生物的多样性和丰富性,其特征是拟杆菌门(Bacteroidetes)数量增加,厚壁菌门/拟杆菌门比例降低。
高纤维摄入还促进了厚壁菌(Firmicutes)和变形菌(Proteobacteria)的生长,而这两种细菌在食用高脂肪饮食的受试者中通常很低。而大量摄入单糖而非纤维导致拟杆菌(Bacteroides)大量生长。
素食不含任何肉类或鱼类,但富含碳水化合物和纤维。食用素食导致短链脂肪酸的产生增加,这有利于预防胃肠道炎症和维持肠道微生物菌群的稳态。
✦优质的蛋白可以增加肠道菌群多样性
研究发现蛋白质的摄入增加了肠道菌群的多样性;然而,影响取决于蛋白质的来源。
值得注意的是,乳清和豌豆蛋白的摄入增加了双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus)的水平,同时限制了脆弱拟杆菌(Bacteroides fragilis)和产气荚膜梭菌(Clostridium perfringens)的生长。
此外,豌豆蛋白增加了胃肠道中短链脂肪酸的水平。同时,动物蛋白饮食刺激耐胆汁厌氧菌。
植物化学物质对肠道菌群的调节
除了评估动物或植物性饮食对肠道微生物群的作用,还评估了植物化学物质以及益生元对肠道微生物群的调节活性。
包括多酚、类胡萝卜素、植物甾醇、木脂素、生物碱在内的植物化学物质已被证明对肠道微生物群的调节具有积极作用。
✦类胡萝卜素有助于维持肠道免疫稳态来提高抗肿瘤效率
补充类胡萝卜素如虾青素或视黄酸有助于通过诱导IgA产生来维持肠道免疫稳态。一项研究表明越橘花青素的消耗通过调节肠道微生物群的组成来促进免疫检查点阻断疗法的效率。
抗PD-L1抗体的抗肿瘤效率在口服越橘花青素后增强,同时在粪便中富集梭状芽孢杆菌(Clostridia)和约氏乳杆菌(Lactobacillus johnsonii)。
✦益生元通过调节共生微生物增强抗肿瘤效果
益生元,包括低聚果糖、低聚半乳糖、大豆低聚糖、菊粉等。通过增加共生菌如乳酸杆菌和双歧杆菌的数量,在调节肠道微生物群方面发挥作用。
一项研究报告称,口服菊粉凝胶可以通过调节共生微生物来增强α-PD-1治疗的抗肿瘤疗效,并通过激发记忆性CD8+T细胞反应来产生有效的长期抗肿瘤效果。
膳食真菌对肠道微生物群的影响
尽管在植物和动物的天然产物中发现了有趣的发现,但很少有研究研究来自膳食真菌的天然产物,这也可能对肠道微生物的组成和生物活性的调节有潜在影响。
1
香菇多糖调节了肠道微生物多样性
香菇是一种富含多种多糖的食用菌,研究表明,给予香菇多糖显著改变了小鼠小肠、盲肠、结肠和远端结肠(粪便)微生物群的多样性。具体而言,减少了拟杆菌(Bacteroidetes)与增加了变形菌(Proteobacteria)。
一项研究报道,香菇副产物(LESDF-3)可以促进拟杆菌(Bacteroides)的产生,表明香菇在调节肠道菌群方面的重要性。
与此同时,多项研究也证实了冬虫夏草多糖、黑木耳多糖、灵芝多糖、灰树花多糖、平菇多糖、猴头菌多糖、野生羊肚菌多糖在重塑肠道菌群、调节免疫等方面的生物学功能。
2
灵芝孢子油可以增强免疫活性,减少有害菌
灵芝长期以来被认为在药物治疗和饮食补充方面有价值。
根据最近的一项研究,灵芝孢子油具有很强的免疫增强活性,可导致几种有益细菌的丰度升高:
罗伊氏乳杆菌(Lactobacillus reuteri) ↑↑↑
肠乳酸杆菌(Lactobacillus intestinalis) ↑↑↑
Turicibacter ↑↑↑
Romboutsia ↑↑↑
并降低葡萄球菌(Staphylococcus)和幽门螺杆菌(Helicobacter)的丰度。
这些肠道菌群的改变进一步导致一系列关键代谢产物的分泌,如多巴胺、谷氨酰胺、蛋氨酸、L-苏氨酸、硬脂酰肉碱等,以增强巨噬细胞的吞噬能力和自然杀伤细胞的细胞毒性。
3
膳食真菌中的β-葡聚糖移植有害菌,上调
有益菌丰度
菊粉是一种存在于各种天然产品中的天然多糖,被认为是一种强有力的益生元,有趣的是,膳食真菌中的β-葡聚糖也表现出与菊粉相当的效果。
β-葡聚糖是由葡萄糖单位组成的多聚糖。它能够活化巨噬细胞、嗜中性白血球等,因此能提高白细胞素、细胞分裂素和特殊抗体的含量,全面刺激机体的免疫系统。
具体而言,β-葡聚糖可以通过抑制有害肠道微生物群的增殖,同时上调有益拟杆菌的丰度,从而调节肠道微生物群的结构和组成。
此外,β-葡聚糖和菊粉都能选择性地促进双歧杆菌(Bifidobacterium)的生长。来自蘑菇的D-葡聚糖对肠道菌群的调节也有类似的作用,因此可以认为是一种新型的益生元。
膳食真菌在调节肠道微生物群中的作用总结于下表:
膳食真菌中生物活性成分在调节肠道菌群中的作用

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的影响
先前的研究已经调查了来自膳食真菌的关键成分在癌症免疫调节中的作用。
✦真菌中β-葡聚糖增强抗肿瘤免疫反应
真菌细胞壁的主要成分是β-葡聚糖,据报道,β-葡聚糖可作为有效的免疫调节剂,通过调节单核细胞骨髓源抑制细胞(MDSCs)的分化和功能来增强抗肿瘤免疫反应。
骨髓源抑制性细胞——它含义是骨髓来源的一群抑制性细胞,是树突状细胞、巨噬细胞或粒细胞的前体,具有显著抑制免疫细胞应答的能力。
姬松茸多糖刺激MDSC从M2向M1型分化,通过toll样受体2介导抑制肿瘤免疫逃避。
后来发现,自然杀伤细胞、巨噬细胞和树突状细胞负责介导真菌产物引起的抗肿瘤免疫反应。
✦双孢菇多糖激活自然杀伤细胞对结肠癌细胞的治疗作用
一项研究表明,双孢蘑菇多糖MH751906通过激活肠道自然杀伤细胞对结肠癌产生免疫治疗作用,这些激活的自然杀伤细胞对人结肠癌细胞具有稳定的杀伤作用。
✦灵芝中的成分在抗肿瘤过程中起到重要作用
灵芝多糖可部分或完全拮抗B16F10黑素瘤细胞对腹腔巨噬细胞活力的抑制,提示其在癌症免疫治疗中的潜在作用。
后续研究发现灵芝的抗肿瘤作用来自于在体内刺激树突状细胞成熟和启动对Th1辅助细胞极化的适应性免疫应答。
两项研究均表明灵芝介导的免疫调节机制在抗肿瘤过程中起作用。
✦其他一些膳食真菌成分的抗肿瘤作用
一项研究报告称牛肝菌RNA也可以刺激自然杀伤细胞对抗骨髓性白血病。
另一项研究揭示了孤苓多孔菌多糖-蛋白复合物的免疫调节活性,通过激活巨噬细胞介导的宿主免疫应答发挥抗肿瘤作用。
此外,云芝多糖肽(PSP)可增强巨噬细胞的吞噬作用,增加细胞因子和趋化因子的表达,促进树突状细胞和T细胞向肿瘤的浸润,具有免疫治疗肿瘤的作用。
膳食真菌在癌症免疫治疗中的确切作用除了少数报道了相关作用的研究外,在很大程度上仍然是未知的。
✦膳食真菌可以增强免疫阻断疗法效果
一项研究发现蛹虫草多糖通过抑制肿瘤相关巨噬细胞和T淋巴细胞之间的PD-1/PD-L1轴,将免疫抑制巨噬细胞转化为M1表型并激活T淋巴细胞,这可能提高抗PD-1/PD-L1免疫治疗的有效性。
另一项研究表明,人参多糖改变了肠道菌群和犬尿氨酸/色氨酸的比例,增强了PD-1/PD-L1免疫治疗的抗肿瘤作用。阐明了真菌多糖通过肠道菌群增强免疫检查点阻断疗法抗肿瘤作用。
✦提高癌症疫苗疗效
除了增强免疫检查点阻断疗法的治疗效果外,服用真菌产物也有提高癌症疫苗疗效的报道。口服香菇菌丝体提取物可增强肽疫苗的抗肿瘤活性,表明香菇提取物在癌症免疫治疗中具有重要作用。
总的来说,全面了解膳食真菌在癌症免疫治疗中的作用及其分子机制是非常有前景的,肠道菌群在这一过程中的参与也需要进一步研究。
膳食真菌在调节针对癌症的宿主免疫反应中的作用总结于下图:
膳食真菌在治疗各种类型癌症中的生物学作用和机制

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的临床研究
迄今为止,已经进行了一些临床研究来评估真菌产物的抗肿瘤活性和潜在机制。
•灰树花抑制肺癌或乳腺癌转移
研究表明,灰树花能抑制肺癌或乳腺癌的转移,减小肿瘤的大小,这是通过增加自然杀伤细胞活性和促进Th1细胞反应实现的,而Th2细胞活性降低。
•灵芝多糖对晚期癌症的抗肿瘤作用
另一项研究表明,灵芝多糖对多种类型的晚期癌症具有抗肿瘤作用,这是通过刺激宿主免疫反应来实现的,包括白细胞介素2、白细胞介素6、人干扰素-g(IFN-g)的分泌增加,自然杀伤细胞活性增强,而白细胞介素-1b和肿瘤坏死因子的浓度较基线降低。
48名乳腺癌患者接受了灵芝孢子粉,并显示治疗后患者血清中肿瘤坏死因子的浓度显著降低,这伴随着肿瘤负荷的减轻。
•双孢蘑菇对前列腺癌具有一定抗肿瘤作用
此外,一项I期试验证明双孢蘑菇通过调节白细胞介素15水平和骨髓源抑制性细胞活性对前列腺癌具有抗肿瘤作用。
•平菇和羊角草也具有抗肿瘤活性
平菇,也被发现通过调节宿主免疫具有抗肿瘤作用。
通过临床试验研究了羊角草的抗肿瘤活性,发现血清中人干扰素-g和白细胞介素12水平随着自然杀伤细胞活性的升高而升高,提示Th1免疫应答参与了羊角草的靶向抗肿瘤活性。
临床上还评估了活性己糖相关化合物(AHCC,从担子菌蘑菇香菇中获得)对腺癌的抗肿瘤作用和免疫调节活性,治疗导致中性粒细胞增加,CD4+/CD8+、CD3+/CD16+/CD56+NK细胞的比例也相应增加,而淋巴细胞和单核细胞的数量减少。
总的来说,真菌产品的抗肿瘤作用以及分子机制已被很好地记录,然而,大多数结论仅基于小样本得出。
此外,尽管临床研究已经证实真菌产品可以增强化疗和放疗的抗肿瘤作用,但关于真菌产品在癌症免疫治疗中的有效性的临床证据仍然缺乏。因此,还需要额外的试验来研究真菌产品对癌症免疫治疗的临床效果。
膳食真菌在不同癌症中的作用总结下图:
膳食真菌治疗不同类型癌症的结果

Wei Y,et al.Front. Oncol.2023
近年来,随着高通量多组学技术(包括微生物扩增子、宏基因组、宏转录组、代谢组)的发展,肠道微生物群对人类健康的生物学相关性已得到充分认识。
肠道微生物在调节宿主免疫稳态方面具有多种功能,这有利于预防许多疾病,对改善癌症免疫治疗也有一定作用。
由于肠道微生物群与癌症患者在治疗时的临床特征密切相关,因此可通过评估其肠道微生物群来预测个体的情况。
食用真菌含有多种能被肠道微生物识别的营养物质,对肠道微生物群起到多种影响,并在癌症免疫治疗中起到作用。对膳食真菌和肠道微生物群的研究将为当前的免疫抗癌疗法提供非常有价值的帮助。
主要参考文献
Wei Y, Song D, Wang R, Li T, Wang H and Li X (2023) Dietary fungi in cancer immunotherapy: From the perspective of gut microbiota. Front. Oncol. 13:1038710. doi: 10.3389/fonc.2023.1038710.
Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nat Rev Immunol (2020) 20(11):651–68. doi: 10.1038/s41577-020-0306-5.
June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. Car T cell immunotherapy for human cancer. Science (2018) 359(6382):1361–5. doi: 10.1126/science.aar6711.
Zhao Q, Jiang Y, Xiang S, Kaboli PJ, Shen J, Zhao Y, et al. Engineered tcr-T cell immunotherapy in anticancer precision medicine: Pros and cons. Front Immunol (2021) 12:658753. doi: 10.3389/fimmu.2021.658753.
Tan S, Li D, Zhu X. Cancer immunotherapy: Pros, cons and beyond. BioMed Pharmacother (2020) 124:109821. doi: 10.1016/j.biopha.2020.109821.
Yan Z, Zhang H, Cao J, Zhang C, Liu H, Huang H, et al. Characteristics and risk factors of cytokine release syndrome in chimeric antigen receptor T cell treatment. Front Immunol (2021) 12. doi: 10.3389/fimmu.2021.611366.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol (2021) 19(1):55–71. doi: 10.1038/s41579-020-0433-9.