-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
谷禾健康2025年国庆收样及报告安排
尊敬的合作伙伴:
公司国庆放假时间为2025年10月1至2025年10月8日。期间实验室只接收样本但不开展实验,10月9号开始实验处理,节前已上机样本报告正常出具,请各位合作伙伴知悉。
杭州谷禾信息技术有限公司
2025年09月 18日

谷禾健康
早晨闹钟响起时那瞬间的动力、完成任务后的成就感、写完最后一道题的如释重负、品尝美食时的愉悦…这些日常体验背后都有同一个幕后功臣——多巴胺。
它并非简单的“快乐信使”,也是我们大脑里最强的“动力引擎”,驱使我们启动任务、保持专注并最终享受完成目标的喜悦。
多巴胺这个拥有5亿年历史的古老分子,其水平竟会受到我们肠道里微生物的影响。这意味着,我们吃的食物或许能直接帮助我们战胜拖延症,更有精力地投入到下一次学习和工作中。
本文探讨多巴胺的作用,过多或者过少对我们身体有什么影响,它与肠道微生物群的关联,哪些饮食或生活方式可能有助于优化多巴胺系统等。
关于多巴胺的总结:
1 多巴胺是古老的
多巴胺作为神经递质在蠕虫到人类的进化中保持不变,有5亿年历史。它是自然界中古老且功能一致的模块,在所有有神经系统的生物中都执行学习、动力和运动调控功能。
2 多巴胺神经元很长
多巴胺神经元是大脑中最大且连接最广的细胞,主要在中脑腹侧被盖区和黑质。大鼠的单个神经元可产生1米长的轴突分支,形成3万个突触,人类可达数十万。
3 多巴胺是神经递质
多巴胺很少单独起作用。每当多巴胺被释放到大脑中时,其他神经递质,如谷氨酸和 GABA,可能会被多巴胺神经元共同释放。
4 多巴胺传递很快
多巴胺传递速度不同:神经元爆发时传输快速;神经元也稳定放电,维持基线水平,突发可应对重要事件。
5 多巴胺奖励回路异常
生存恐慌与压力不耐受:对压力的反应更为敏感和剧烈。
病态食物摄入:通过暴饮暴食来寻求短暂的快感,以弥补多巴胺的不足。
脂肪合成与储存增加:身体更容易囤积脂肪,导致肥胖。
消化系统紊乱:进一步加剧肠道问题。
6 多巴胺功能障碍
多巴胺传递功能障碍是各种精神神经障碍的特征,包括抑郁症、帕金森氏症、ADHD 和物质使用障碍。
多巴胺过量:躁狂或轻躁狂,精神病,物质使用障碍,多动和冲动,抽搐和图雷特综合征,睡眠障碍,亨廷顿病、过度寻求奖励行为。
多巴胺不足: 帕金森氏病、抑郁症、注意力缺陷/多动障碍(ADHD)、药物成瘾和物质使用障碍、不宁腿综合征、精神分裂症和亨廷顿氏病。
7 多巴胺与肠道菌群关系密切
肠道菌群可以通过多种方式积极影响和参与这两个神经系统的交流和对话,例如分泌信使物质:例如单形拟杆菌、双歧杆菌、乳杆菌、肠球菌属、普雷沃氏菌与梭菌属通过直接或间接方式影响多巴胺能或多巴胺转运运蛋白等,进而直接激活肠道内的神经末梢,将信号通过迷走神经上传至大脑。多巴胺水平遵循昼夜节律,清醒时高,睡眠时低。
8 多巴胺药物干预
许多药物通过改变或刺激多巴胺受体活性、合成和再摄取来发挥作用。
9 多巴胺调节
必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。
有氧运动(跑步、骑自行车),力量训练以及瑜伽,听音乐等可以激活大脑的多巴胺并增强多巴胺奖励功能。
多巴胺的发现
多巴胺(化学名为 3,4-二羟基苯乙胺),于 1910 年由乔治·巴格和詹姆斯·尤恩斯在伦敦的惠康实验室首次合成。
但真正突破在近半个世纪后,1958 年,瑞典国家心脏研究所化学药理学实验室的阿维德·卡尔森和尼尔斯·希拉普才确定多巴胺是大脑中的一种神经递质。这一突破性的发现彻底改变了我们对大脑工作原理的认知,为现代神经科学的发展奠定了基础。卡尔森也因这项开创性贡献荣获了2000年诺贝尔生理学或医学奖。
多巴胺的关键证明:从实验室到临床的突破
在一项具有里程碑意义的实验中,研究人员阻断了兔子体内所有的多巴胺神经传递,使它们完全瘫痪,然后通过注射多巴胺前体左旋多巴(L-DOPA)完全恢复了它们的行为,证明多巴胺对自我启动的运动至关重要。
很快,奥列格·霍尼凯维奇和他的团队将这一发现应用到帕金森病患者身上,取得了同样惊人的效果。短短几年内,多巴胺从相对默默无闻一跃成为我们所知的生命的关键。
多巴胺的进化
多巴胺功能的惊人普适性
在鸟类身上,多巴胺展现出了惊人的精细调控能力。它不仅像哺乳动物一样处理基于奖励的学习信号,还能在鸟儿练习鸣唱时,通过”声音表现预测误差“来帮助它们完善歌声。
既关心有没有奖励,也关心这次唱得好不好。
这正是学习与动机功能的体现。
所有脊椎动物的基底神经节都保持着相似的基本架构,多巴胺在其中发挥着一致的作用:调控运动和学习。这种跨物种的功能稳定性表明,多巴胺系统的核心组件已经被进化完美保存了至少5亿年。
多巴胺功能在脊椎动物内部的家族相似性
DOI: 10.1016/j.cub.2022.06.060
多巴胺在不同生物中的类似功能
这种在不同物种中独立演化出相似结构和功能的现象,被称为“趋同演化”。
有力证明了多巴胺调控行为选择是一个极其高效的生物学解决方案。
多巴胺的演化之路清晰可见
多巴胺的化学结构
多巴胺的结构相对简单:一个带有两个羟基的苯环,连接着一条乙胺链。正是这种精巧的分子排列,让多巴胺能够与大脑中的各种受体和酶相互作用,进而影响我们的神经传导和行为表现。
作为大脑中的化学信使,多巴胺在神经元之间穿梭传递信息。但它的作用远不止于此,多巴胺深度参与调节我们的情绪状态、内在动机、奖赏感受、快乐体验、注意力集中、身体的运动控制。
从伸手拿杯水这样的简单动作,
到追求长远目标时的复杂决策,
多巴胺都在幕后发挥着关键作用
多巴胺合成和储存的复杂过程
▶ 多巴胺合成
从酪氨酸到神经递质是一个复杂的过程,涉及几个步骤和酶。
🧬 原材料:酪氨酸
多巴胺的前体是酪氨酸——一种我们可以从食物中获取,也可以在肝脏中由苯丙氨酸转化而来的氨基酸。当酪氨酸进入多巴胺神经元后,开始了它的转化之旅。
⚗️ 第一步:关键转化
第一步也是最关键的一步:酪氨酸羟化酶将酪氨酸转化为L-DOPA。这个步骤需要几种”助手”——四氢生物蝶呤、氧气和铁离子的协助。由于这一步控制着整个生产速度,因此受到严密监控。
⚡ 第二步:快速脱羧
接下来,芳香族氨基酸脱羧酶迅速将L-DOPA转化为多巴胺。这个反应很快完成,避免了L-DOPA的堆积,因为过多的L-DOPA可能会带来负面影响。
整个生物合成途径发生在神经元的细胞质中。
▶ 多巴胺储存
新鲜出炉的多巴胺并不会在神经元内四处游荡,而是被精心包装进一个叫”突触囊泡“的微型容器中。负责这项包装工作的是囊泡单胺转运蛋白(VMAT)。
这种包装有两大好处:
保护多巴胺不被细胞内的酶分解,
同时确保它能在需要时准确释放。
整个生产过程都有精密的调控机制。神经元会根据自身的活动状态和环境变化,灵活调节多巴胺的产量,确保大脑始终拥有合适的多巴胺供应。
多巴胺释放和再摄取的动力学
多巴胺从神经元的释放是由特定刺激触发的、高度调节的过程。
🌊 多巴胺的释放过程
当动作电位(电信号)到达多巴胺能神经元的轴突末端时,它会导致钙离子通过电压门控钙通道快速流入。细胞内钙离子浓度的突然增加触发了含有多巴胺的突触囊泡与细胞膜的融合,这一过程被称为胞吐作用。
🔄 突触间隙的扩散
当囊泡与膜融合时,它们将多巴胺释放到突触间隙中,突触间隙是突触前神经元和突触后细胞之间的狭窄空间。一旦进入突触间隙,多巴胺分子就会扩散到这个空间,可能与突触后神经元或附近细胞上的受体结合。
🎯 再摄取机制
多巴胺信号的持续时间和强度,通过一个称为再摄取的过程被仔细控制。
多巴胺细胞反应:神经生物学中的机制和意义在很大程度上取决于这种再摄取机制。
称为多巴胺转运蛋白(DAT)的特殊蛋白质负责这一过程。这些转运蛋白位于突触前神经元的膜上,积极地将多巴胺分子泵回释放它们的神经元。
再摄取过程有几个重要功能
多巴胺转运蛋白的活性可以受到各种因素的调节,包括其他神经递质和药物。例如,可卡因和安非他明通过干扰DAT的功能发挥其作用,导致突触中多巴胺浓度增加和多巴胺信号传导延长。
多巴胺受体和信号通路
多巴胺对靶细胞的作用是通过其与特定受体的相互作用来介导的。了解多巴胺受体的类型、功能和信号通路对于理解这种神经递质如何发挥其多种作用至关重要。
多巴胺受体有五种亚型,分为两个家族:
中脑多巴胺神经元的解剖连接
G蛋白偶联受体结构
所有多巴胺受体都属于G蛋白偶联受体(GPCR)超家族。这些受体跨越细胞膜七次,并与细胞内的G蛋白偶联。当多巴胺与这些受体结合时,它会引起构象变化,激活相关的G蛋白,引发细胞内信号级联事件。
不同受体的信号通路
D1
🔵 D1样受体通路(兴奋性)
偶联:与Gs蛋白偶联
效应:激活腺苷酸环化酶
结果:cAMP增加 → 激活PKA → 磷酸化细胞靶点
D2
🔵 D2样受体通路(抑制性)
偶联:与Gi蛋白偶联
效应:抑制腺苷酸环化酶
结果:cAMP降低
🧠 受体在大脑中的分布
多巴胺能受体:位置、功能和对脑化学的影响在不同的大脑区域各不相同,有助于多巴胺的不同作用。
纹状体:多巴胺作用的核心区域
在所有接收多巴胺信号的脑区中,纹状体(一个大型的皮层下区域,是基底神经节回路的核心)的神经支配最为密集。纹状体中高达95%的神经元是所谓的”纹状体投射神经元(SPNs)”,它们根据表达的多巴胺受体类型被清晰地分为两大类:
这种受体表达的差异意味着两类神经元对多巴胺信号的”聆听”方式截然不同,从而为多巴胺实现复杂的调控功能提供了基础。
多巴胺对神经回路和行为的影响
多巴胺的影响远远超出了单个神经元,塑造了整个神经回路的活动,从而影响了行为。
🎁 奖励与动机:大脑的激励系统
🧠 中脑边缘多巴胺通路
从腹侧被盖区投射到中脑背核,在奖赏加工和动机中起着至关重要的作用。
当我们经历一些有益的事情时,比如吃到美味的食物或受到表扬,这条通路上的多巴胺神经元就会被激活。这种多巴胺的释放加强了导致奖励的行为,增加了重复的可能性。这种机制是学习和习惯形成的基础。
重要提醒:
多巴胺不仅仅是一种”快乐化学物质”,
而是刺激的激励价值和显著性的信号。
🏃♂️ 运动控制:协调身体动作
🔗黑质纹状体多巴胺通路
连接黑质和纹状体的通路,对于启动和协调随意运动至关重要。
多巴胺调节基底神经节神经元的活动,基底神经节是一组参与运动控制的皮质下结构。这种调节有助于选择和启动适当的运动程序,同时抑制竞争性动作。
🧠 认知功能:思维与决策
除了奖励和运动,多巴胺还影响各种认知功能,包括注意力、工作记忆和决策。
📊 工作记忆
在前额叶皮层,多巴胺信号在维持和更新工作记忆中的信息方面起着至关重要的作用。
🎲 风险决策
多巴胺调节冒险行为和冲动,多巴胺水平较高通常与冒险和探索行为增加有关。
😊情绪调节:复杂的平衡艺术
多巴胺对情绪调节的影响是复杂的,并与其他神经递质系统相互作用。虽然多巴胺通常与积极的情绪状态有关,但它在情绪中的作用并不简单。
⚠️ 多巴胺信号过多和不足都可能导致情绪障碍。例如,精神分裂症的”多巴胺假说”表明,某些大脑区域的多巴胺活动过度可能导致精神病症状。
🕸️ 复杂的调控网络
多巴胺神经元的活动受到大脑内复杂网络的严密调控。它们接收来自局部及长距离投射的密集神经支配,其兴奋或抑制状态主要取决于两大类输入信号的动态平衡:
这种多层次、多维度的调控机制确保了多巴胺神经元能够精确响应机体内外环境的复杂变化,维持神经系统的动态平衡。
运动和动机
多巴胺在运动功能中的作用并非直接控制动作的精确性,而是作为一种“启动器”和“激励器”,负责激发和维持自主行为。
🚀 多巴胺是行为启动的关键
帕金森病就是个典型的例。患者虽然失去了自主行走的能力,但在外部刺激(如楼梯、音乐)的引导下,却能完成爬楼、跳舞等复杂的协调动作。
这表明多巴胺的核心作用在于:自我发起一个动作,而非执行动作本身。
⚡ 多巴胺调节行为活力与动机
现代研究发现,多巴胺的释放水平与动物执行动作的活力以及动机程度直接相关。
多巴胺越多,我们做事就越有劲头、越积极主动。
一个有影响力的假说认为,多巴胺的释放反映了某个特定行为的“价值”。也就是说多巴胺其实是在告诉我们某件事值不值得做。
当一个行为与重要结果相关联时,多巴胺会增强该行为,从而促进学习和激励。
比如你闻到了鸡腿香,大脑释放多巴胺让你更有动力去吃;当你发现不好了前方危险需要逃跑时,多巴胺也会激增,给你逃生的力量。
⏱️ 不同时间尺度的调控
多巴胺的这种激励作用体现在两个时间尺度上:
学 习
在过去的几十年里,科学家们发现,多巴胺除了是运动的启动器外,还在我们的大脑中扮演着一个更为深刻的角色——超级严格的学习教练。它不是简单地让你感到爽,而是通过一个精妙的机制,告诉我们什么值得学、什么需要改,从而塑造我们的行为。
学习的秘密:建立联系,预测未来
在神经科学看来,学习的本质就是建立关联。我们通过将一个中性线索与一个重要的结果联系起来,从而学会预测未来。也就是“条件反射”。
比如说:
这种能力让我们能提前预判,而不是被动挨打。
学习的核心动力:意外
什么时候我们学得最快?当现实和预期不一样的时候。举个生活中的例子:
🎉 意外惊喜时(正向误差):
😐 符合预期时(零误差):
😞 意外失望时(负向误差):
这个“现实与预期的差异”,在科学上被称为“奖励预测误差 (Reward Prediction Error, RPE)”。这正是学习发生的核心驱动力:
正向误差(Positive RPE): 现实 > 预期。
结果比想的要好,大脑发出“快学!”的信号,强化当前行为。
零误差(Zero RPE): 现实 = 预期。
一切尽在掌握,无需学习。
负向误差 (Negative RPE): 现实 < 预期。
结果比想的要糟,大脑发出“出错了,快改!”的信号,削弱当前行为。
经典例子:为什么”先入为主”这么难改?
一个经典的例子叫“阻断效应 (blocking)”。
如果狗已经学会了“铃声(A)=食物”,那么即便后来再给它“铃声+灯光(AB)=食物”的训练,它也学不会“灯光=食物”。因为食物的出现完全被铃声预测了,灯光的出现毫无意外可言,大脑就懒得学新东西了。
科学发现:多巴胺是意外探测器
神经科学家舒尔茨通过研究猴子发现:
从大脑到AI:跨界融合的典范
最神奇的是,科学家发现多巴胺的工作原理和人工智能的”强化学习“算法很像。
AI学习过程:
尝试一个动作 → 看结果如何 → 调整策略 → 再试再调整
大脑学习过程:
做一个行为 → 多巴胺评估意外程度 → 强化或削弱行为 → 下次做得更好
这就是为什么AI能学会下棋、打游戏的原理。
多巴胺是学习指导员:
它不会让你一直爽下去
它会根据”意外程度”给你反馈
它的目标是让你不断进步
该夸你时夸你,该推你时推你
让你变更聪明,更能适应这个世界
其他行为功能
前面我们说多巴胺是学习教练、动力开关,但其实它的功能远不止这些。多巴胺就像一个万能助手,在大脑不同区域有不同的工作职责。
🗺️ 多巴胺的工作岗位分布
– 腹侧纹状体
计算奖励预测误差,也就是评估这件事比我想的好还是差。
– 背侧纹状体
控制和协调身体运动, 指挥你的手脚如何动作。
– 纹状体后部
监测新鲜事物、重要信息、潜在危险。时刻警觉周围环境。
– 前额叶皮层
行为灵活性、工作记忆、控制冲动、区分不同刺激,也就是说负责规划和决策。
– 感觉皮层
帮助感知系统适应和改变,更好地适应环境。
– 海马体
帮助形成记忆,特别是新鲜事物的学习,专门负责把新信息存入大脑硬盘。
……
多巴胺参与了不同的行为过程,
它会根据所在位置和情况需要,
发挥不同的作用来帮助我们生存和适应。
科学家发现,肠道中的某些特定菌属,如普雷沃氏菌(Prevotella)、拟杆菌(Bacteroides)、乳杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、肠球菌属(Enterococcus)和梭菌属(Clostridium)等,可以直接或间接地遥控大脑中的多巴胺系统。它们能够影响多巴胺受体和转运蛋白的表达水平,从而或增强、或削弱多巴胺信号的传递。
普雷沃氏菌与拟杆菌:多巴胺系统的精细调节师
在肠道菌群中,普雷沃氏菌属和拟杆菌属同属拟杆菌门,通过截然相反的方式,精妙地影响着我们大脑中多巴胺的活性。
它们主要作用于一个关键目标:多巴胺转运体 (DAT)。
什么是DAT?
多巴胺在神经元之间传递完信号后,就好比完成了任务的信使。DAT是一个高效的回收器,负责将这些信使从工作岗位上(突触间隙)回收,以便下次再用。DAT的效率直接决定了多巴胺的停留时间和信号强度。
✦ 拟杆菌:提高回收效率
以普通拟杆菌 (Bacteroides uniformis) 为代表,它的存在能增强DAT的回收效率。
当普通拟杆菌增多时,大脑纹状体中的DAT回收器会变得更加活跃,与多巴胺的结合能力增强。这意味着多巴胺会被更快地从工作岗位上回收。这是一种维持多巴胺系统稳态和效率的重要机制。
✦ 普雷沃氏菌:降低回收效率
以Prevotella copri为代表,它的作用则完全相反:它会降低DAT的回收效率。
当Prevotella copri增多时,DAT回收器的工作效率会下降。这使得多巴胺能在工作岗位上停留更长时间,其信号强度和作用时间都会被放大。
普雷沃氏菌的另一条通路:通过饥饿素间接发力
普雷沃氏菌能增加我们体内“饥饿素”(Ghrelin)的水平。饥饿素不仅让我们感到饥饿,它还能直接作用于大脑的奖赏中枢(VTA),在这里激活多巴胺神经元,促进多巴胺的释放。
总结来说,普雷沃氏菌和拟杆菌就像多巴胺系统的两个调节阀:
这两类细菌的平衡,对于维持我们大脑正常的奖赏、动机和运动功能至关重要。它们的失衡,可能与多种神经精神疾病的发生密切相关。
肠道菌群对多巴胺能突触间隙和多巴胺代谢的影响
doi: 10.3390/biomedicines10020436
(1) 单形拟杆菌上调 DAT/多巴胺结合效率。普雷沃氏菌Prevotella copri下调 DAT 结合效率。
(2) 粪肠球菌和屎肠球菌显示酪氨酸羟化酶和芳香族 L-氨基酸脱羧酶活性。口服黄连素合成辅因子 BH4,增强酪氨酸向多巴胺的转化。
(3) 植物乳杆菌 PS128 增加 DAT 表达。
(4) 瘤胃球菌下调 D2 R 表达。
(5) 瘤胃球菌与酪氨酸羟化酶活性降低相关。
乳杆菌与双歧杆菌:多巴胺系统的全能守护神
乳杆菌属(Lactobacillus)和 双歧杆菌属(Bifidobacterium) 是两大初代的益生菌,通过多种机制,保护和调节多巴胺系统,对抗压力与神经损伤。
✦ 直接保护神经,对抗损伤
其中植物乳杆菌PS128(Lactobacillus plantarum PS128) 的表现尤为突出:
补充PS128能够显著减少多巴胺神经元的死亡,并阻止纹状体中多巴胺水平的下降。其作用机制是减轻由神经毒素引发的氧化应激和神经炎症,从根源上保护了神经细胞。
✦ 提升多巴胺回收效率
除了直接保护,还能微调多巴胺的代谢通路,提升多巴胺回收效率。研究发现,植物乳杆菌PS128还能增加多巴胺转运体 (DAT) 的表达。这能优化多巴胺的回收和再利用,提高整个系统的运转效率。
✦ 调节关键代谢酶
植物乳杆菌DR7 (Lactobacillus plantarum DR7):在压力状态下,它能下调“多巴胺β-羟化酶”和“酪氨酸羟化酶”的水平。这两种是多巴胺合成与转化的关键酶,通过调节它们,DR7能有效缓解压力反应。
鼠李糖乳杆菌 (Lactobacillus rhamnosus):能下调单胺氧化酶 (MAO)的活性。MAO是分解多巴胺的酶,抑制它就等于延长了多巴胺的作用时间。
同样的多巴胺发挥更长时间的作用。
✦ 缓解压力与行为异常
益生菌对多巴胺系统的调节,最终体现在对情绪和行为的改善上:
双歧杆菌:能有效减轻身体过度的应激反应(HPA轴反应),帮助身体更好地应对压力。
婴儿双歧杆菌 (Bifidobacterium infantis):在经历过早期压力的动物中,补充该菌逆转其行为缺陷,并使其大脑中失衡的去甲肾上腺素水平恢复正常。
总结来说,乳杆菌和双歧杆菌部分菌株通过减少炎症、保护神经元、调节关键代谢酶、优化多巴胺回收等多种途径,支持多巴胺系统的健康。
在对抗压力、焦虑、抑郁
以及神经退行性疾病方面,
展现出巨大的应用潜力。
肠道菌群对多巴胺代谢副产物的影响
doi: 10.3390/biomedicines10020436
(1) 粪球菌属Coprococcus comes和Coprococcus catus 与 DOPAC合成潜力密切相关。
(2) 破伤风梭菌对多巴胺具有降解作用,通过 DOPAC 中间体促进降解为 HVA。
(3) 鼠李糖乳杆菌下调 MAO。
(4) 植物乳杆菌 DR7 下调多巴胺β-羟化酶。
(5) 梭菌属物种显示下调多巴胺β-羟化酶。
(6) 植物乳杆菌 PS128 给药可改善多巴胺代谢并增加去甲肾上腺素水平。
梭菌属:多巴胺的破坏者 / 守护者
梭菌属是一个拥有超过180个成员的大家族,它们对多巴胺的影响,展现了双重性。
😫 魔鬼的一面:多巴胺的破坏者与搅局者
一些梭菌属的成员,比如破伤风梭菌(Clostridium tetani),直接降解多巴胺。
它们能将多巴胺分解成无活性、甚至有害的代谢产物,直接导致多巴胺水平下降。
还能扰乱代谢通路,它们产生的代谢物会堵塞多巴胺的正常转化路径。比如,它们会阻止多巴胺转化为另一种重要的神经递质——去甲肾上腺素。这会导致多巴胺在细胞内异常堆积,产生毒性,引发氧化应激,最终伤害甚至杀死宝贵的多巴胺神经元。
😇 天使的一面:保护和提升多巴胺
幸运的是,梭菌属中也有许多英雄成员,它们通过具体机制保护和提升多巴胺:
丁酸的生产菌 (Clostridium butyricum):丁酸梭菌也是生产丁酸的重要菌种。丁酸能穿过血脑屏障,直接进入大脑,通过减轻神经炎症来保护皮层神经元,并被证实能提升下丘脑的多巴胺浓度。
此外,Clostridium coccoides为代表的成员,拥有一种名为β-葡萄糖醛酸酶的特殊工具。在肠道中,许多多巴胺与其它分子结合而处于休眠状态。这些梭菌能利用这种酶,切断结合,将多巴胺激活成自由的、有生物活性的形式。
肠道里有很多多巴胺被锁住了,梭菌用β-葡萄糖醛酸酶切断锁链,增加了肠道中可用的多巴胺总量。
研究还发现,梭菌能将多巴胺与脂肪酸结合,创造出全新的信号分子——脂肪酸酰胺。这些新分子可以与细胞受体结合,调节身体的生理过程,展现了梭菌影响我们健康的另一条复杂途径。
梭菌属不能被简单地归为好或坏。它既有破坏神经的物种,也有通过生产丁酸、激活多巴胺来守护大脑的友谊菌种。理解这些菌株和它们精确的作用机制,是未来精准调控肠道菌群以维护大脑健康的关键。
肠球菌属:多巴胺生产者 / 消耗者 / 条件益生菌
在肠道菌群的世界里,肠球菌属(Enterococcus) 是一个充满矛盾的角色。它既是我们肠道的正常居民,又可能在特定情况下变成“机会主义病原体”。然而,它最引人注目的,是其作为“多巴胺生产者”的巨大潜力,以及一个可能耗尽多巴胺原料的“坏习惯”。
😇 潜力所在:一个移动的多巴胺工厂
肠球菌属的两个主要成员——粪肠球菌(Enterococcus faecalis) 和屎肠球菌 (Enterococcus faecium), 展现了惊人的多巴胺生产能力。
它们拥有将左旋多巴 (L-dopa)(帕金森病常用药)直接转化为多巴胺的酶。当把这些细菌移植到帕金森病小鼠体内,能显著提升其大脑中的多巴胺水平。
更关键的是,研究发现它们自身就携带酪氨酸羟化酶的活性。这是从最基础的原料——酪氨酸,开始合成多巴胺的第一步关键酶。这意味着它们具备了从头开始构建多巴胺的潜力。
服用小檗碱(黄连素主要成分)能进一步激活生产过程,让这个工厂开足马力运转
😫 坏习惯:浪费原料
尽管肠球菌有生产多巴胺的潜力,但它更喜欢走另一条岔路——优先生产酪胺。
肠球菌会优先使用其酪氨酸脱羧酶,将多巴胺的两种核心前体物质——酪氨酸和左旋多巴,都转化为酪胺 (Tyramine)。
这是个大问题,因为会大量消耗本应用于生产多巴胺的宝贵原料,
反而可能导致多巴胺水平下降。
肠球菌属是一个极具潜力的条件性益生菌。 它天生拥有成为多巴胺工厂的所有工具,但默认设置却是浪费原料。未来的应用前景在于,如果能找到方法比如联合使用特定药物引导它生产多巴胺,有望成为治疗帕金森病等神经系统疾病的强大生物工具。
瘤胃球菌属:可能引发炎症并干扰多巴胺信号
瘤胃球菌属 (Ruminococcus) 虽然能生产有益的短链脂肪酸,但却也可能降解黏液,引发炎症。
💥 引发炎症,破坏多巴胺能神经元
研究发现,在帕金森病动物模型中,瘤胃球菌属的数量会增加,这与大脑黑质区域酪氨酸羟化酶阳性细胞(即多巴胺能神经元)的死亡直接相关。
使用红参或进行运动可减少瘤胃球菌数量,
从而保护多巴胺神经元
临床研究进一步证实了瘤胃球菌的负面影响。例如,在患有抽动障碍的儿童中,发现其肠道内的产乳糖瘤胃球菌(Ruminococcus lactaris) 和 活泼瘤胃球菌(Ruminococcus gnavus) 数量显著高于健康儿童。抽动障碍本身也与多巴胺系统失调密切相关。
💥 干扰多巴胺信号接收
除了引发炎症,瘤胃球菌属还可能通过一种更隐蔽的方式干扰多巴胺系统,影响多巴胺受体的表达。
下调D2受体:在酒精诱导的动物模型中,发现包括瘤胃球菌科 (Ruminococcaceae) 在内的菌群增多,与大脑纹状体中多巴胺D2受体的基因表达水平下降有关。
D2受体是多巴胺发挥作用的关键接收器之一
它的数量减少,意味着即便多巴胺水平正常,
其信号也无法被有效接收,这与帕金森病
运动障碍(如运动迟缓)等症状密切相关
总结来说,瘤胃球菌属对多巴胺系统的负面影响是多方面的: 它通过降解肠道黏液来引发炎症,间接损害多巴胺神经元;同时,它还可能通过下调关键的D2受体,直接削弱多巴胺信号的传递。这使其成为一个在研究神经系统疾病时需要特别关注的菌属。
在多巴胺方面,瘤胃球菌属: 坏的影响 >> 好的影响
多巴胺对众多重要神经功能的广泛影响,几乎所有脑部疾病在某个阶段都可能涉及多巴胺功能障碍。在这里,我们将重点介绍以下几种疾病,最具体的特点是,多巴胺能异常和/或多巴胺能药物治疗。
帕金森病
在涉及中脑多巴胺系统的疾病中,研究最深入的或许就是帕金森病 (Parkinson’s disease, PD)。
帕金森病的核心病理改变,是黑质纹状体通路多巴胺神经元的选择性死亡,尤其是位于黑质外侧部的那些神经元。这些神经元就像大脑深处的多巴胺工厂,专门生产控制运动的关键化学物质,这些多巴胺被送到大脑的运动控制中心,充当运动启动器的角色。当这些工厂停产,身体就无法流畅地执行运动指令。
治疗突破
研究人员使用左旋多巴 (L-DOPA) 作为半成品原料,L-DOPA可以轻松进入大脑,然后被大脑里残存的神经元加工成多巴胺,治疗帕金森病患者能高效缓解其运动症状,这一发现彻底革新了我们对帕金森病的认知,并且该疗法至今仍用于临床实践。
帕金森患者的肠道菌群变化
帕金森病患者的肠道菌群组成发生显著改变,比如普雷沃氏菌减少,这是帕金森病患者最显著的肠道菌群改变。普雷沃氏菌能产生硫化氢,对多巴胺神经元具有保护作用。
厚壁菌门 / 拟杆菌门比例升高,特别是梭菌属和瘤胃球菌科增多。
其他具体变化如下表所示:
微生物在帕金森病中的作用
doi: 10.3390/biomedicines10020436
仍有部分研究结果存在矛盾,提示帕金森病的肠道菌群变化可能具有时间和个体差异性。
肠道症状:帕金森病的早期信号
帕金森病的胃肠道症状(如便秘、胃排空延迟)通常比运动症状更早出现,这为疾病的早期诊断提供了重要线索。
便秘:外周多巴胺水平降低 → 下肠道蠕动减少 → 便秘加重。
普雷沃氏菌减少导致硫化氢分泌不足,
进一步加剧了这一过程。
研究表明,与厚壁菌门肠型相比,普雷沃氏菌肠型的帕金森病患者,便秘严重程度明显降低。
谷禾肠道菌群检测报告中的肠型这个指标:其中有一种肠型就是普雷沃氏菌肠型。
<来源:谷禾肠道菌群检测数据库>
如果帕金森患者的普雷沃氏菌少,后面有可能会出现便秘症状。
研究指出,将乳杆菌属和双歧杆菌属作为益生菌引入后,帕金森病患者的排便频率得到改善,平均肠道转运时间从135小时缩短至77小时。
注意力缺陷/多动障碍症
注意力缺陷/多动障碍(ADHD)是儿童期最普遍的行为和多因素精神障碍之一,具有复杂的病因和强大的遗传基础。全世界约 5%的儿童和 2.5%的成人患有 ADHD。在约 80%被诊断患有该疾病的儿童中,ADHD 的一些症状持续到青春期和成年期。
多动症的特征是注意力不集中、冲动、过度运动和多动症;情绪失调,表现为易怒加剧、耐受挫折能力低和情绪波动。
注意力像蝴蝶一样飞来飞去,很难专注,身体像装了小马达,停不下来,做事很冲动,想到什么就做什么。
🧠 多巴胺系统罢工了
还记得我们前面说多巴胺是学习教练和动力开关吗?在ADHD患者大脑里,这套系统出了故障:
“多巴胺假说”认为,ADHD的症状源于大脑中多巴胺系统的功能失调。就像城市交通系统瘫痪:
🚗 正常大脑: 多巴胺像交通警察,指挥着注意力和行为有序进行
🚧 ADHD大脑: 交通警察生病了,到处都是堵车和乱象
🔬 科学发现:关键零件有问题
在一项人类研究中,描述了特定基因显示出与 ADHD 的重要关联,并且这些基因与多巴胺系统的组分相关,例如:
在 ADHD 患者的脑中也检测到异常水平的 DAT,并且 DAT 是抗多动症药物如安非他明的靶标。
多巴胺系统的失调,特别是 D4 和 D5 受体功能的异常,会破坏奖赏处理和动机系统,这是 ADHD 核心症状的重要神经生物学基础。
D4 受体主要存在于与 ADHD 病因密切相关的关键脑区,特别是额叶区域。额叶区域在执行功能、注意力控制和行为调节中发挥核心作用,而这些正是 ADHD 患者表现出功能障碍的主要认知领域。
ADHD的发育、遗传和环境因素
doi: 10.12865/CHSJ.51.01.02
虽然ADHD可能有独特的风险基因,但相当一部分风险变异在昼夜节律和多巴胺系统中有作用。
注:在与环境因素的相互作用中,受基因驱动的多巴胺和昼夜节律病理机制会增加 ADHD 患者发展共病疾病的风险,即物质滥用障碍、抑郁症和肥胖症。
多巴胺不是唯一因素
多巴胺至关重要,但ADHD是一种复杂的神经发育障碍。去甲肾上腺素系统同样扮演着极其重要的角色(尤其在注意力和警觉性方面),且与多巴胺系统相互作用紧密。其他神经递质(如血清素、谷氨酸、GABA)和环境因素(如早产、低出生体重、铅暴露等)也可能参与其中。
精神分裂症
精神分裂症是一种相对常见(发病率约1%)、致残率极高的精神疾病,其症状繁多,包括幻觉、思维障碍、情感淡漠,以及学习和工作记忆的缺陷。精神分裂症患者的失业率很高(80-90%),且其平均预期寿命会缩短10-20年,这在很大程度上是由于自杀风险的增加。
多巴胺在精神分裂症中的作用
多巴胺的神经传递在精神分裂症的临床发展和症状表现中扮演着关键角色。关于精神分裂症的“多巴胺假说”是在20世纪60年代提出的。
根据修订的多巴胺假说,精神分裂症患者在大脑的两个关键区域——中脑边缘系统(这是负责情绪和奖励的部分)和前额叶(帮助思考和决策的部分)的多巴胺水平异常。
具体来说,在大脑的一个叫纹状体的区域,多巴胺释放得太多,这和阳性症状(如相信不真实的事)有关。研究发现,患者在联想纹状体(一种帮助连接想法的脑区)的前突触(神经信号传递的起点)多巴胺活动增加,这可能引发妄想和幻觉。
例如,像安非他明这样的药物能刺激多巴胺大量释放,会让健康人出现类似精神分裂的症状,这支持了多巴胺过度活跃的观点。
另一方面,前额叶的多巴胺太少,可能解释了阴性症状(如情绪麻木、没动力)和认知问题(如注意力不集中)。
治疗与其他影响因素
早期的抗精神病药物,如氟哌啶醇和氯丙嗪,都是强效的多巴胺D2受体(D2R)拮抗剂。
像氯丙嗪这样的第一代抗精神病药物,主要通过阻挡多巴胺的D2受体(多巴胺的“接收器”)来缓解阳性症状。但这些药有时会让阴性症状更糟,因为它们没针对多巴胺不足的地方。第二代药物,比如利培酮,不仅调控多巴胺,还调整血清素(另一种影响心情的化学物质)。
当然,多巴胺问题不是精神分裂症的唯一原因,它还会和其他大脑化学物质(如谷氨酸,GABA)相互影响。基因因素,比如COMT基因的变化,会影响多巴胺的分解过程,从而提高患病风险。
物质使用障碍
物质使用障碍(亦称药物成瘾)是一种慢性疾病,其特征在于强迫性地、或难以控制地寻求和使用药物,不顾其会带来有害后果。
明知有害后果,但无法控制
成瘾性物质共同特征——都能引起多巴胺释放的急剧增加
关于成瘾起源的经典理论认为,药物扮演了一种异常强大的原发性奖赏 ,它会强化与药物使用相关的行为,同时又绕开自然奖赏(如食物和水)消耗的饱足感过程,这被认为是促进(药量)逐步增加和强迫性使用的原因。
经典多巴胺理论:大脑被欺骗的过程
招数一:模拟超级奖赏
正常情况:
吃美食 → 适度多巴胺释放 → 感觉愉悦
完成目标 → 适度多巴胺释放 → 获得满足感
物质成瘾:
使用某类物质 → 超量多巴胺释放 → 极度愉悦感
问题: 这种奖赏比任何自然奖赏都强烈
招数二:打破饱足机制
自然奖赏有刹车:
物质成瘾没有刹车:
理论的局限性
它无法完全解释成瘾带来的长期认知损伤,也无法解释为何一些非药物的奖励性行为疗法同样有效。然而,无论存在何种争议,一个不可动摇的结论是:多巴胺系统功能紊乱,是药物成瘾发生和发展的关键生物学基础。
考虑到多巴胺功能的复杂性及其与几种疾病的发展的关系,有各种药物旨在通过直接或间接靶向多巴胺受体来治疗这些疾病也就不足为奇了。
传统药物
有广泛的选择性或非选择性多巴胺激动剂和拮抗剂,其已在临床上用于改善疾病的症状,例如:帕金森病、勃起功能障碍、高泌乳素血症、精神分裂症、双相抑郁症、恶心等。
一些实例是阿扑吗啡、伊潘立酮、多潘立酮、溴必利、氯氮平、鲁拉西酮、奥氮平。
共同特点:瞄准D2受体
这些药物中的大多数以 D2 受体为主要靶点,尽管也有化合物可作用于 D1 和 D3。 D2受体是多巴胺系统的主控开关。D4受体至今没有临床药物。
新一代药物
▪ 布雷哌唑,多功能
最近,美国食品药品监督管理局批准了一种新的药物,它是多巴胺 D2 受体部分激动剂,对 5-HT1A 受体也具有激动剂活性,对 5-HT2A 和α-肾上腺素能受体也具有拮抗剂活性:布雷哌唑。
治疗范围:
✅已获批准: 精神分裂症、重度抑郁症(辅助治疗)
🔬 研发中: 阿尔茨海默病相关、创伤后应激障碍
▪ 阿立哌唑,智能调节
另一种有趣的非典型抗精神病药物是 D2 受体的部分激动剂,是阿立哌唑。
浓度决定作用
高浓度的阿立哌唑降低多巴胺能神经元的放电,而低浓度的阿立哌唑增加放电,表明该药物作用于 cAMP/PKA 和 Akt/GSK 3 途径。
治疗应用:
新策略
策略一:绕过受体,直击信号通路
最近,有一种新的方法来开发作用于多巴胺能途径的药物,其中药物靶向受体后信号传导途径,而不是受体。
传统方法: 直接作用于多巴胺受体
新方法: 绕过受体,直接调节受体后的信号传导
策略二:变构调节剂- 侧门入口
这些药物可以通过结合到与内源性配体结合的位点在地形上不同的位点来潜在地减少不良副作用,并且它们还可以双向影响下游途径。已经提出,使用变构调节剂可以增加对 GPCR 亚基的选择性并改善治疗效果,而不破坏生理调节的基质。
不在多巴胺结合位点起作用
在受体的侧门位置结合
改变受体的形状和功能
策略三:偏向性配体- 选择性激活
另一类专注于多巴胺受体后受体信号传导的药物正在开发中,它们是偏向性配体(也称为功能性选择性配体)。这些化合物被设计为选择性地接合受体下游的一个信号传导途径,该受体响应其内源性配体调节多个途径。
传统药物激活所有通路
偏向性配体只激活特定有益通路
未来前景
非编码RNA疗法
未来多巴胺能信号药物发现的其他可能靶点可能是非编码 RNA,因为它们在维持神经元稳态及其在神经系统疾病中的失调中起作用。重新建立非编码 RNA 功能的药物的开发可以更新突触传递。
干细胞疗法
正在开发使用干细胞衍生的多巴胺神经元的疗法,特别是用于治疗帕金森病。
基于肠道菌群的疗法
前面我们了解到,肠道菌群能够直接影响多巴胺的合成、代谢和受体表达,为治疗策略提供了全新思路。
特定菌群超标或不足的干预
例如,肠球菌属(如粪肠球菌和屎肠球菌)具备将酪氨酸转化为多巴胺的完整酶系统,配合小檗碱等天然化合物可增强其多巴胺合成能力。
在肠道菌群检测报告中,如果看到这类菌群偏低,可以配合小檗碱补充进行相关干预。
肠道菌群检测报告相关指标
在谷禾肠道菌群检测报告中,也有多巴胺这个指标,这个指标并非直接检测多巴胺浓度,而是基于谷禾自有的“菌群-代谢-神经递质预测算法”得到的评估。
<来源:谷禾肠道菌群检测数据库>
如果测出来过多或者过少,谷禾肠道菌群检测报告也会给出相关的说明及建议,可以根据该指标结合自身症状进行干预。
值得注意的是,谷禾肠道菌群检测报告中除了多巴胺的指标外,也有血清素、GABA、谷氨酸、DOPAC等多种神经递质相关指标,有些症状可以结合多个指标一起分析来获得更全面的评估。例如,焦虑情绪可能不仅与GABA水平相关,还可能与血清素代谢异常有关。
比如说,DOPAC是多巴胺的代谢产物,参与神经递质的代谢循环。作为代谢产物,间接反映了多巴胺代谢的活动水平。
DOPAC这个指标低可能意味着多巴胺代谢减少或代谢过程受到抑制。这种情况可能出现在多巴胺能神经元活动降低时,比如在帕金森病患者中,由于多巴胺能神经元的退化,多巴胺及其代谢产物DOPAC的水平都会降低。DOPAC水平异常也可能与某些精神疾病如抑郁症相关,这反映了中枢神经系统中多巴胺能系统功能的改变。
在谷禾肠道菌群检测报告中一次检测列出众多指标,也可以结合分析,比如说,当多巴胺合成能力高但DOPAC水平低时,提示多巴胺降解酶活性不足,可能导致多巴胺积累;相反,如果多巴胺指标正常但DOPAC过高,则可能存在多巴胺过度代谢的问题。
大脑中的多巴胺水平受到多种因素的影响,包括日常习惯和医疗干预。这些因素会显著影响情绪、动机和认知功能。
营养和生活方式
饮食对多巴胺水平有很大影响。富含蛋白质食物中的必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。苯丙氨酸和酪氨酸广泛存在于多种食物中,包括肉类、乳制品、豆类、蔬菜(如蘑菇)、水果(如猕猴桃、红树莓)等。
摄入美味食物(尤其是高糖、高脂肪的食物)会激活大脑的奖赏回路,促进多巴胺的释放,从而增强食物的愉悦感和进食行为。然而长期摄入高糖或高脂肪食物可能导致多巴胺系统的适应性变化,例如多巴胺反应的习惯化或敏感性改变。
益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。某些研究表明,健康的肠道微生物组对包括多巴胺在内的神经递质水平有积极影响。
益 生 菌
益生菌和益生元改善宿主的健康。这是通过引入活微生物及其生长基质,影响肠道微生物生态,并积极改变宿主的生理学来实现的。一些研究表明益生菌作为治疗工具的潜力,对免疫系统甚至 中枢神经系统有益。
关于影响中枢神经系统的益生菌:
已经表明,鼠李糖乳杆菌 JB-1、 长双歧杆菌 NCC 3001 和瑞士乳杆菌 R 0052 和 长双歧杆菌 R 0175 可减少大鼠的焦虑样行为。
双歧杆菌和鼠李糖乳杆菌JB-1进行干预会影响 HPA 轴,降低皮质酮水平。
向无菌小鼠施用植物乳杆菌 PS128 可以减少焦虑样行为和过度运动。此外,这些变化伴随着 DA 和 HVA 的增加,以及纹状体中 5-HT 的增加。
特定的益生菌菌株能够:
降低应激激素:如假小链双歧杆菌 CECT 7765 能降低应激模型小鼠的皮质酮(CORT)水平。
调节神经递质:瑞士乳杆菌 NS 8 能恢复海马体中的去甲肾上腺素(NA)、5-HT水平,但另一些研究显示对下丘脑的神经递质无影响,表明其作用具有区域特异性。
改善情绪与行为:多种益生菌(如双歧杆菌、乳杆菌)显示出能够减少动物的焦虑和抑郁样行为,并改善认知功能。
支持大脑健康:能恢复神经营养因子(如BDNF)的水平,这对神经元的健康至关重要。
对人类有潜在益处:初步研究表明,益生菌可以降低健康女性大脑对情绪任务的反应,改善自闭症儿童的行为症状,并可能减少儿童患ADHD的风险。
然而,研究也强调了两个关键的复杂性:
菌株特异性:效果并非普适,不同的益生菌菌株(甚至是同一种类下的不同菌株)效果迥异。
并非绝对有益:一项研究指出,某种干酪乳杆菌反而增加了健康动物的焦虑样行为,提醒我们益生菌的作用是复杂的,并非多多益善。
益生菌并非万能药,其效果不仅取决于菌株,也取决于个体的身体状况。在健康状态下,不当补充某些益生菌甚至可能产生负面效果。
补充剂
一些补充剂被认为可以增强多巴胺功能:
注:刺毛黧豆也叫天鹅绒豆,是一种天然植物,其种子中富含左旋多巴(L-DOPA),这是多巴胺的前体物质,种子的提取物用于许多健美运动补剂。
将肠道健康视为心理健康的一部分。通过饮食(如发酵乳制品、高纤维食物)和生活方式来维护健康的肠道菌群,可能对情绪稳定和压力管理有积极作用。
睡眠和锻炼
有规律的身体活动已被证明可以提高多巴胺水平并增强受体敏感性。 这可以促进改善情绪,注意力和运动技能。
可能增加多巴胺的运动类型包括:
睡眠质量和持续时间也会影响多巴胺的功能。睡眠-觉醒周期的中断可以改变多巴胺信号,可能影响注意力,学习和压力管理。
建立健康的睡眠习惯可以支持最佳的多巴胺水平:
了解多巴胺,就是了解我们行动的底层逻辑。希望这份科普能给你带来启发,学会如何与自己的多巴胺系统合作,我们可以更好地管理自己的能量和动力,让工作变得更轻松高效,也让生活中的小确幸更加触手可及。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Hamamah S, Aghazarian A, Nazaryan A, Hajnal A, Covasa M. Role of Microbiota-Gut-Brain Axis in Regulating Dopaminergic Signaling. Biomedicines. 2022 Feb 13;10(2):436.
Grigore M, Ionică MV, Pătru L, Gheorman V, Wagner AP. Recent Advances in the Etiology and Neural Pathways Underlying Attention-Deficit and Hyperactivity Disorder. Curr Health Sci J. 2025 Jan-Mar;51(1):14-25.
Kollins SH, Adcock RA. ADHD, altered dopamine neurotransmission, and disrupted reinforcement processes: implications for smoking and nicotine dependence. Prog Neuropsychopharmacol Biol Psychiatry. 2014 Jul 3;52:70-8.
Loh JS, Mak WQ, Tan LKS, Ng CX, Chan HH, Yeow SH, Foo JB, Ong YS, How CW, Khaw KY. Microbiota-gut-brain axis and its therapeutic applications in neurodegenerative diseases. Signal Transduct Target Ther. 2024 Feb 16;9(1):37.
Beaulieu, J. M., & Gainetdinov, R. R. (2011). The physiology, signaling, and pharmacology of dopamine receptors. Pharmacological Reviews, 63(1), 182-217.
Wise, R. A. (2004). Dopamine, learning and motivation. Nature Reviews Neuroscience, 5(6), 483-494.
Grace, A. A. (2016). Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nature Reviews Neuroscience, 17(8), 524-532.
Volkow, N. D., Wise, R. A., & Baler, R. (2017). The dopamine motive system: implications for drug and food addiction. Nature Reviews Neuroscience, 18(12), 741-752.
Tritsch, N. X., & Sabatini, B. L. (2012). Dopaminergic modulation of synaptic transmission in cortex and striatum. Neuron, 76(1), 33-50.
Berke, J. D. (2018). What does dopamine mean? Nature Neuroscience, 21(6), 787-793.
Sulzer, D., Cragg, S. J., & Rice, M. E. (2016). Striatal dopamine neurotransmission: regulation of release and uptake. Basal Ganglia, 6(3), 123-148.
González-Arancibia C, Urrutia-Piñones J, Illanes-González J, Martinez-Pinto J, Sotomayor-Zárate R, Julio-Pieper M, Bravo JA. Do your gut microbes affect your brain dopamine? Psychopharmacology (Berl). 2019 May;236(5):1611-1622.
Abela AR, Duan Y, Chudasama Y (2015) Hippocampal interplay with the nucleus accumbens is critical for decisions about time. Eur J Neurosci 42:2224–2233.
Arentsen T et al (2017) The bacterial peptidoglycan-sensing molecule Pglyrp2 modulates brain development and behavior. Mol Psychiatry 22:257–266.
Speranza L, di Porzio U, Viggiano D, de Donato A, Volpicelli F. Dopamine: The Neuromodulator of Long-Term Synaptic Plasticity, Reward and Movement Control. Cells. 2021 Mar 26;10(4):735.
谷禾健康
随着现代医学的不断进步,人类对于肠道微生态的研究正逐渐深入,粪菌移植(FMT)作为一种新兴的、生物学意义深远的治疗手段,在临床实践中展现出了革命性潜力。FMT广泛用于治疗艰难梭菌感染等复杂疾病,并逐渐延伸至免疫功能调节、代谢紊乱等领域,尤其是在儿童人群中的应用引发了广泛关注。
然而,在这项技术日益普及的同时,其在特殊人群中的安全性问题始终是临床医生和产业从业者关注的焦点。大多数关于FMT安全性的研究主要集中在成人人群中,而对儿科人群的了解较少,目前所有儿科FMT数据均来自小型病例系列和病例报告。
近日,一项来自上海儿童医院的大规模单中心回顾性研究,揭示了FMT在儿童人群中的长期安全性数据。这项跨越十年(2013-2023年)、涵盖813名儿童患者的研究,不仅是目前样本量最大的儿科FMT安全性评估,更是首次系统性地呈现了中国儿童接受FMT后的长期随访结果。

研究发现,FMT在儿科人群中总体表现安全,短期不良事件(AE)发生率仅为5.8%,且大多为轻微自限性症状;在长达122个月的随访期内未观察到长期不良事件。
这些珍贵的临床数据将为技术优化、产品研发和临床应用提供重要参考,并为拓展儿科FMT市场提供有力支撑。
本文我们来详细了解一下这项研究。

该研究回顾性分析了2013年12月~2023年12月在上海儿童医院接受 FMT 治疗的儿科患者,例如复发性艰难梭菌感染、抗生素腹泻、乙肝、慢性顽固性腹泻、炎症性、慢性肠假性梗阻、自闭症、多动症、神经性厌食症等,详见下表。
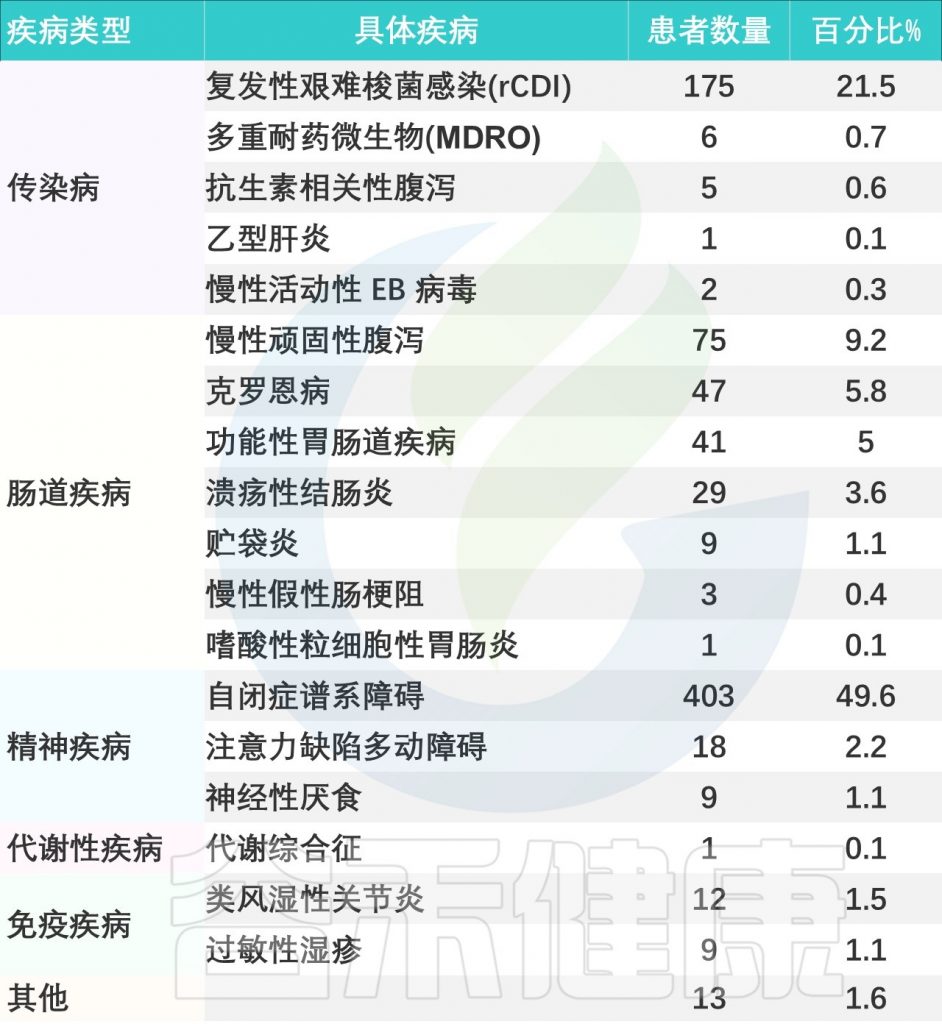
doi.org/10.1186/s12866-025-03858-z
患者特征详细分析
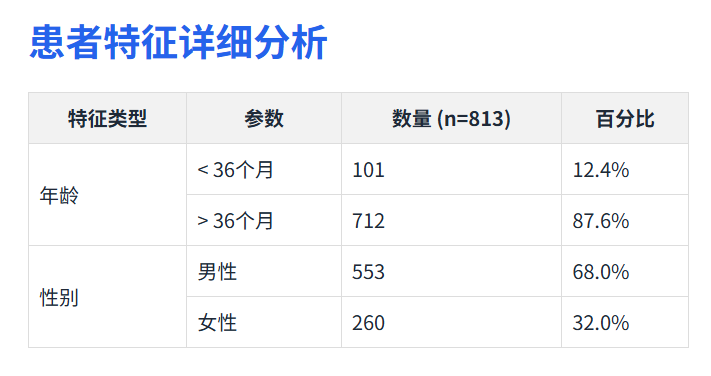

1. FMT相关不良事件
短期不良事件总发生率为5.8%(47/813例)
最常见的短期不良反应包括:
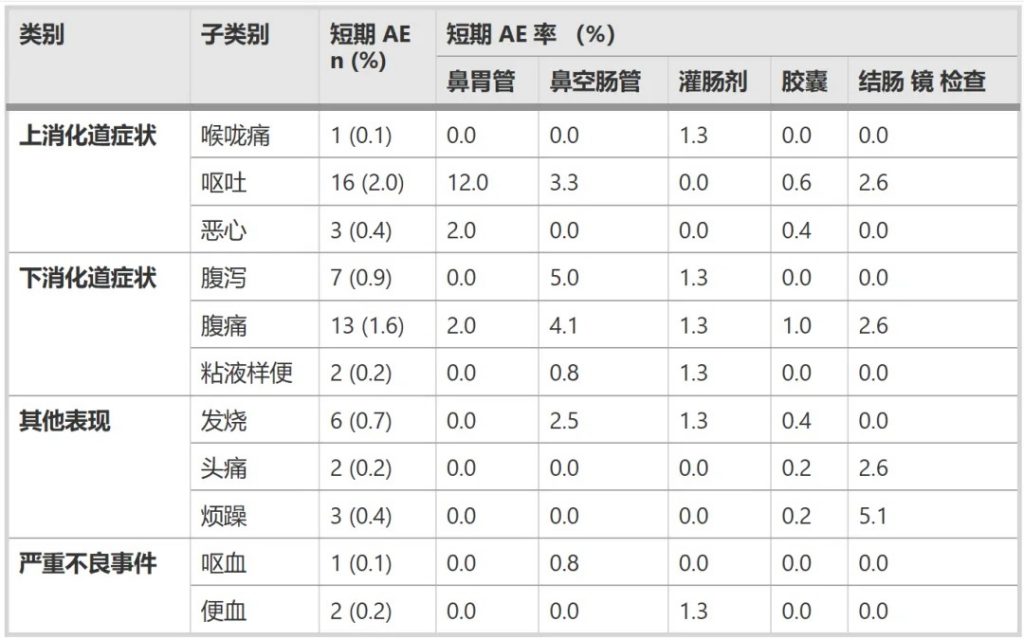
doi.org/10.1186/s12866-025-03858-z
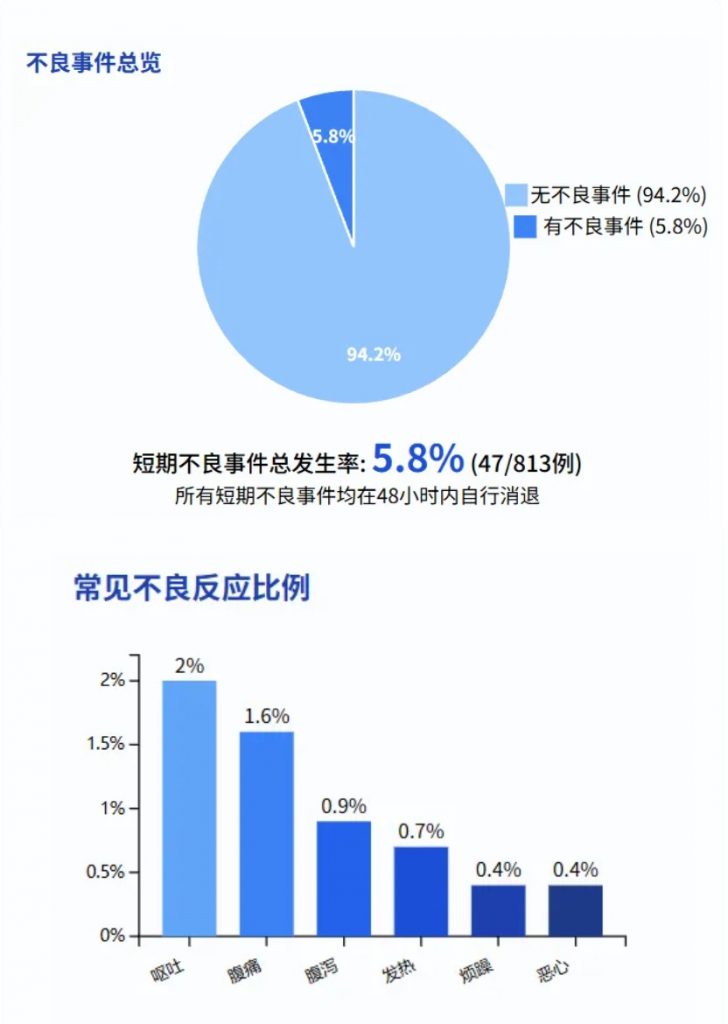
2. 给药途径与不良事件关联
FMT 的给药途径在短期不良事件的发生中起着重要作用。
给药选择包括上消化道(UGI),例如使用鼻胃管或鼻空肠管、内窥镜检查、胶囊,以及下消化道途径(LGI),如保留灌肠、乙状结肠镜检查或结肠镜检查。
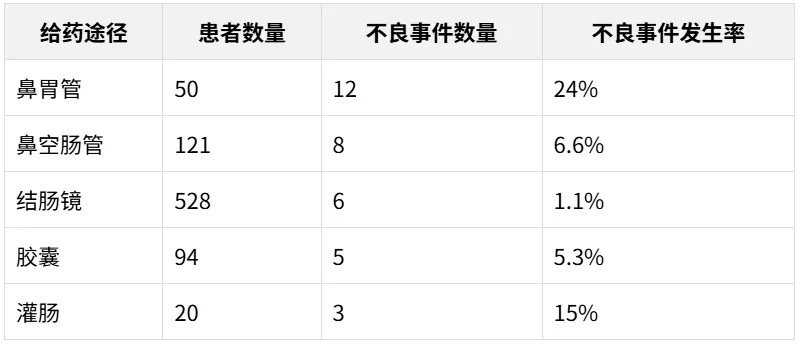
与其他途径相比,胶囊的短期不良事件发生率较低;鼻胃管(16.0%,8/50) 和鼻空肠管(14.0%,17/121) 的短期不良事件发生率更高。
FMT不同给药方式下的短期不良事件发生率(%)
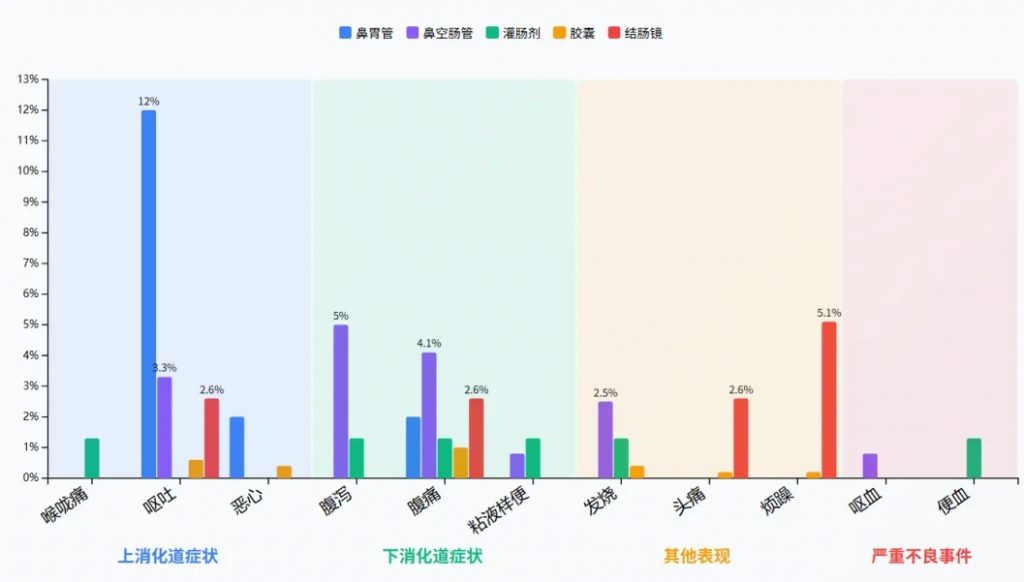
鼻胃管给药方式下,呕吐的发生率最高(12.0%),是所有给药方式中单一不良事件最高的发生率。
鼻空肠管给药方式下,腹痛(4.1%)和腹泻(5.0%)的发生率较高。
严重不良事件(呕血、便血)总体发生率极低(0.1%-0.2%)。

胶囊形式安全也更易于标准化生产、储存和运输,有利于FMT治疗的普及和推广。
3. 疾病类型与不良事件关联
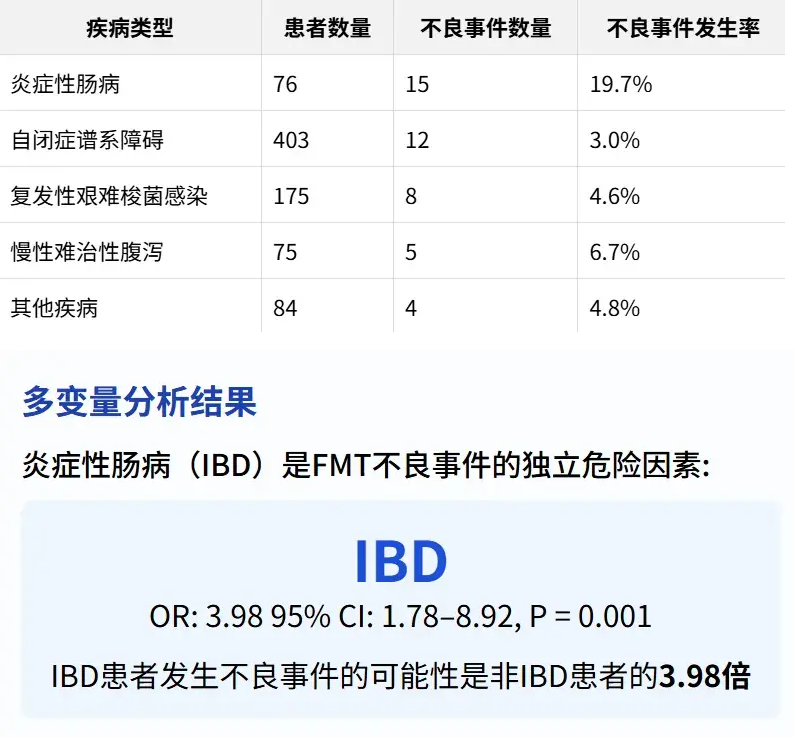
提示在产品开发中需针对IBD患者群体设计更安全的给药方案。
4. 长期随访结果
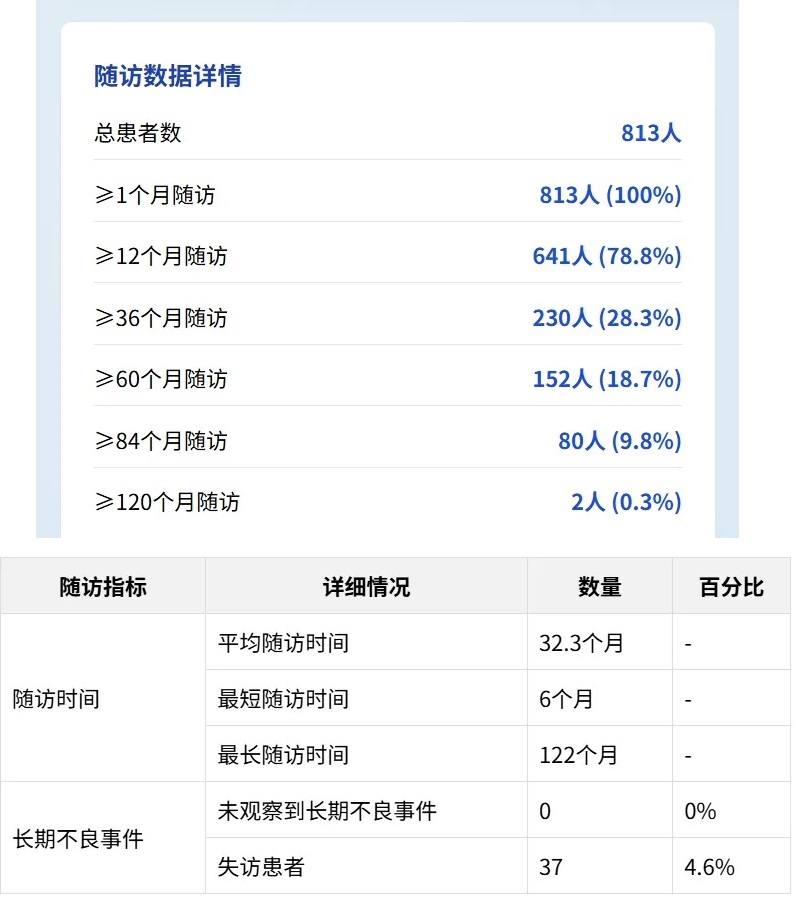
研究纳入813名患者,平均随访时间达32.3个月,最长随访期达122个月,形成了一个极具代表性的儿科FMT安全性数据库。
该研究作为迄今为止中国儿科领域样本量最大、随访时间最长的粪菌移植(FMT)安全性评估,具有较大的科学价值和临床指导意义。
这种大样本、长随访的队列设计克服了以往研究样本量小、随访时间短的局限性,为FMT安全性评估提供了更为可靠的证据。
且该研究覆盖了多种疾病类型和给药途径,包括感染性疾病、肠道疾病、精神疾病、代谢性疾病等多种适应症,以及鼻胃管、鼻空肠管、灌肠剂、胶囊和结肠镜等多种给药方式,能够指导不同疾病和不同情况下FMT的应用策略。
该研究提供的长期安全性数据将增强医患对FMT的接受度,促进其临床应用的规范化,也为微生物组治疗领域的产业化发展奠定了基础。未来,FMT产业有望通过以下方向发展:
未来需要加强微生物组移植后的菌群定植与功能研究,深入探索宿主-菌群互作机制,开发更加精准的微生物组干预策略。
随着高通量测序技术和人工智能技术的发展,FMT治疗前后的连续性菌群数据采集成为可能。这种基于海量微生物组动态变化数据的安全性评估,将远超传统的症状观察方法,能够在潜在安全问题出现前就发出预警,大幅提升FMT的安全性保障水平

谷禾健康

目前可获得的有关人类不同人群微生物组成的大量数据显示,总体而言,人类肠道中最丰富的细菌属于两个门,即厚壁菌门和拟杆菌门。而在拟杆菌门的成员中,有两个属占主导地位——拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)。
在任何生态系统中,某些生物体往往扮演着更为重要的角色。类似于在人类社会中,科学家和发明家对人类发展做出了重大贡献,肠道菌群社区中也存在一些关键物种,它们在菌群的定植、聚集、生存和保护方面发挥着重要作用。这些关键物种包括拟杆菌属的某些物种、普雷沃氏菌属的某些物种,以及其他一些共生菌。它们在维持肠道生态平衡和促进健康方面具有重要贡献。
普雷沃氏菌和拟杆菌是两类重要的肠道细菌,它们来自同一个祖先,但在进化过程中选择了不同的生存环境:
◆ 拟杆菌
拟杆菌是肠道中的“先驱开拓者”,从婴儿时期就开始在肠道定居。它们能够很好地适应肠道环境,主要有两个原因:
一是因为婴儿的饮食相对简单,主要是一些简单的糖类,而拟杆菌恰好擅长分解这些糖类,把它们转化为更简单的糖分,不仅自己获得营养,还能为其他细菌提供食物来源。
二是它们能够很好地利用肠道粘液层中的粘蛋白。这些粘蛋白就像”停靠站”,帮助细菌在肠道中定居。
此外,细菌居民获取营养物质可能需要:
1)细胞外多糖水解酶
2)细菌细胞表面的受体蛋白
3)适当的糖转运系统
4)细胞质碳水化合物降解酶
拟杆菌属成员的多糖利用位点(PUL)刚好包括:
分泌的糖苷酶
细胞表面聚糖结合蛋白的补体
TonB依赖性外膜寡糖受体/转运蛋白
细胞质膜中的摄取转运蛋白
细胞质碳水化合物代谢酶
然后它们通过多糖利用位点来获取和利用营养,这使其能在竞争激烈的肠道环境中占据优势的同时,还能影响其他菌的生存。
例如Bacteroides thetaiotaomicron VPI-5482菌株具有88个多糖利用位点,可用于降解各种聚糖,包括饮食衍生和宿主聚糖。还具有灵活的聚糖捕食能力,当膳食多糖变得稀缺时,它可以轻松切换到宿主多糖。在营养缺乏期间,这为肠道细菌组的生态系统提供了整体稳定性。
◆ 普雷沃氏菌
普雷沃氏菌属以微生物学家AR Prevot的先驱之名命名。普氏菌属包含50多个已鉴定的物种,除了存在于肠道,在人体的口腔和阴道丰度也较高。
虽然都是拟杆菌门下的革兰氏阴性厌氧菌,但普雷沃氏菌属的糖利用和分解能力弱于拟杆菌,并且缺乏参与戊糖磷酸途径的酶,如葡萄糖6磷酸脱氢酶、6磷酸葡萄糖酸脱氢酶,这使它们与拟杆菌属不同。
普雷沃氏菌属是肠道中的膳食纤维发酵剂,与地中海饮食呈正相关,特别是与高碳水化合物以及水果和蔬菜摄入量有关。
一项研究利用小鼠研究了拟杆菌和普雷沃氏菌在无菌小鼠体内的相互作用。实验结果显示,当两种细菌同时定植时,拟杆菌的数量超过普雷沃氏菌,但两者的数量都低于它们单独定植时的水平。这表明两种细菌之间可能存在拮抗作用。
通过进行 PubMed、Web of Science 核心合集和 Google Scholar 电子搜索确定了研究。我们发现85篇出版物报告了饮食模式对肠道微生物群落的影响,特别是普雷沃氏菌与拟杆菌(P/B)比率。但单一饮食成分对普雷沃氏菌的影响并不容易预测。
在一项随机对照试验,80名超重参与者被随机分配到不同的干预组或对照组,以比较不同干预措施的效果。发现在普雷沃氏菌与拟杆菌比率(P/B)高的个体比P/B比率低的个体多减重和减脂3.8kg。
高纤维摄入(>30g/10MJ)时:
P/B比率高组减重8.3kg
P/B比率低组减重3.2kg
两组差异达5.1kg
相关性分析:
P/B比率高组:纤维摄入与体重变化强相关(r=0.90)
P/B比率低组:相关性较弱(r=0.25)
这项研究表明,肠道菌群中P/B比率可能是预测减重效果的重要指标,特别是在高纤维饮食干预中。
图片来源:Laura Marshall/NPG
2011年,科学家首次提出了“肠型”的概念,试图将人类肠道中的微生物群落分类。这就像是给我们的肠道细菌”划分阵营”,帮助我们更好地理解肠道微生物的分布特点。
最初科学家认为有三种主要的肠型,但随着研究深入,实际上主要确定了两种显著的类型:
以拟杆菌属(Bacteroides)为主导的类型
以普雷沃氏菌属(Prevotella)为主导的类型
第三个与瘤胃球菌有关,但不够明显,因为瘤胃球菌分布在其他两类中。
■ 饮食习惯与肠型的关系
研究发现,不同地区、不同饮食习惯的人群往往具有不同的肠型特征:
西方饮食人群(如欧美人群)
特点:高蛋白、高脂肪、低纤维
主导菌:拟杆菌较多
传统饮食人群(如非洲农村):
特点:高纤维、低蛋白、多植物性食物
主导菌:普雷沃氏菌较多
■ 有趣的研究发现
儿童研究
意大利儿童(西式饮食,低纤维,更多的动物蛋白、脂肪和糖,母乳喂养1年):拟杆菌占优势
非洲儿童(传统饮食,富含蔬菜和纤维,母乳喂养到两岁):普雷沃氏菌占优势
母乳喂养的婴儿:双歧杆菌较多
跨文化比较
美国人vs非洲人:饮食习惯不同导致肠道菌群差异明显
城市vs农村:生活方式的差异也会影响肠道菌群构成
总体而言,采用西方饮食的美国人和欧洲人的肠道微生物群往往以拟杆菌属和梭菌目为主,而高纤维、低蛋白饮食的农村人口往往以普雷沃氏菌为主。
■ “肠型”概念的局限性
想象一下,我们在试图给不同人的肠道细菌”画像”。科学家们发现,虽然”肠型”这个词很常用,但可能过于简化了实际情况。这就像把人分类成”高个子”和”矮个子”,忽略了身高其实是连续的,中等身高的人可能更多。
两种主要细菌的重要性
拟杆菌和普雷沃氏菌是最常见的两种主要细菌
它们通常占据肠道细菌总量的40%以上
有趣的是,当一种细菌数量多时,另一种就会很少
常规研究方法的特点
科学家们通常用特殊的方法(PCoA和NMDS)来分析样本。这些方法就像在地图上标注位置:相似的样本会被画在一起,不同的样本会被画得远一些。因为这两种主要细菌的变化最大,所以它们在分析中的影响最明显。
研究的挑战
当研究的细菌种类太多,而样本数量较少时,可能会得出不准确的结论。目前的证据表明,把人的肠道细菌简单地分成几种固定的”肠型”可能不够准确。
从谷禾的角度以及部分科学家的建议还是不要简单地用”肠型”来给人分类,改用”具体的菌群结构以及指标或生物标注物”这个概念。这些标志物可以更好地反映一个人的生活环境和健康状况。
因为肠道菌群比我们想象的要复杂得多,不同的生活方式和饮食习惯会影响肠道菌群,需要更细致的方法来研究和理解肠道健康。
这就像是从”给人贴标签”转变为”理解每个人的独特性”,这种方式更科学,也更有助于我们理解如何维护肠道健康。
① 拟杆菌:肠道中的”适应高手”
拟杆菌就像是肠道中的“生存专家”,它们有着令人惊叹的适应能力。让我们来看看它们是如何在肠道中生存和繁荣的:
•超强的环境适应能力:氧气适应
虽然拟杆菌通常不喜欢氧气,但它们能在极少量氧气存在的环境中生存,这种能力帮助它们在人体组织中更好地定居。例如,脆弱拟杆菌可以在低O2条件下生长,这可能有利于它在含氧宿主组织中建立初始感染。
•灵活的饮食习惯
婴儿时期:能利用母乳中的营养物质
断奶后:可以转而消化植物纤维
它就像一个”美食家”,几乎能消化各种碳水化合物,例如B.thetaiotaomicron会根据宿主的情况调整其食物来源,在哺乳期优先使用宿主衍生的多糖以及来自母乳的单糖和寡糖,然后在断奶后扩大其新陈代谢以使用植物多糖。
•竞争策略
拥有类似”微型武器系统”的机制,能够抑制其他细菌的生长,确保自己的生存空间。拟杆菌进一步在胃肠道中立足,利用类似于 VI 型分泌系统的系统将物质转移到胃肠道中的受体微生物,输出抗菌效应物并拮抗其他胃肠道细菌。
•基因的”魔法”
拟杆菌最神奇的地方在于它的基因特性:
基因的灵活性
能够根据需要“开启”或”关闭”特定基因
就像随身携带的”百宝箱”,需要什么就拿出什么
在对174个脆弱拟杆菌组临床分离株的研究中,至少有10个编码孔蛋白的不同基因序列和8个青霉素结合蛋白的不同序列,这可能影响生物体的抗菌敏感性。
•基因的学习能力
能从其他细菌那里”学习”新的基因(称为水平基因转移),这种能力让它们能获得新的特性,比如抗药性。
多样的基因版本:同一个功能的基因可能有多个不同版本,能根据环境选择最合适的版本使用。
肠道微生物群中拟杆菌门的数量较多,水平基因转移率较高,这对拟杆菌门与其他细菌之间的微生物组基因转移产生了重大影响,导致整个细菌群落发生重要的遗传变化。
由于拟杆菌的这些特性,它们可能帮助传播抗生素耐药性,这提醒我们要谨慎使用抗生素。
② 拟杆菌:肠道中的多面手
拟杆菌是肠道中最稳定和重要的细菌之一,它们具有非常丰富的代谢能力,能够影响人体的多个生理功能。
•智能适应系统
拟杆菌有一个特殊的”感应系统”,能够检测环境中的营养物质,根据需要,它可以快速开启或关闭相应的基因,产生不同的消化酶。这种能力让它能够适应各种不同的食物来源。
拟杆菌属凭借其多功能的多糖利用机制可以降解复杂的植物多糖,如淀粉、纤维素、木聚糖和果胶,使它们成为微生物群中最稳定的成员,并能够作为关键物种影响微生物组。
•强大的消化能力
能分解复杂的植物纤维,如淀粉、纤维素等,当简单糖类已经被人体吸收后,它仍能利用其他复杂的营养物质,这种能力使它成为肠道中的“常驻居民”。
•产生多种有益代谢物
能产生有益物质,如短链脂肪酸(SCFA),包括:琥珀酸、乙酸、丙酸、丁酸。
丁酸盐被用作结肠上皮细胞的主要能量来源,而丙酸盐和乙酸盐是肝脏中脂肪生成和糖异生所必需的。
除此之外,拟杆菌属还能产生神经递质类化合物,如GABA。在一项对人类肠道拟杆菌分离株的研究中,几乎所有分离株都产生 GABA,浓度范围很宽(取决于前体可用性和浓度)。有强有力的临床前和临床证据表明微生物群影响神经系统的发育和功能,并可能影响大脑功能和心理健康。
③ 拟杆菌:肠道的守护者
拟杆菌不仅参与消化,还能保护我们的肠道健康,特别是在抵抗有害细菌入侵方面发挥重要作用。
•对抗感染
几种拟杆菌属会产生胆汁盐水解酶,这些酶可解离逃逸肠肝再循环的胆汁酸,这是将初级胆汁酸转变为次级胆汁酸的两步过程的第一步。这种转化过程能够抑制艰难梭菌(一种导致严重腹泻的细菌)的生长。在粪便菌群移植治疗中,这种机制帮助患者预防艰难梭菌感染的复发。研究发现拟杆菌含量越高,艰难梭菌感染的风险越低。
•维持肠道屏障,调节微生物平衡
拟杆菌帮助维持肠道壁的完整性,减少炎症反应,保护肠道健康。同时促进有益菌群的生长,增加肠道微生物的多样性。
•其他健康影响
拟杆菌还可以帮助调节血糖水平,参与脂肪代谢可能与预防肥胖和糖尿病有关。研究表明拟杆菌数量减少可能与肥胖有关;一些研究发现它与2型糖尿病呈负相关;某些拟杆菌种类可能有助于改善胰岛素敏感性。
④ 拟杆菌:平衡中的潜在病原体
虽然大多数研究表明拟杆菌对健康有益,但也存在一些复杂性。它们通常是共生生物,但一些拟杆菌属。可能是机会致病菌。
一些情况,包括胃肠道疾病、创伤、癌症和胃肠道手术,可能会使拟杆菌逃离胃肠道中的生态位,侵入其他解剖位置并引起感染。
促进这种入侵的脆弱拟杆菌的毒力因素包括其产生的脆弱拟杆菌毒素(增加通透性并诱导活性氧形成)、裂解粘蛋白多糖的神经氨酸酶和促进脓肿形成的荚膜多糖。
拟杆菌最常与腹内感染相关,通常是因为肠壁完整性受到损害而发生。如果不及时治疗,这些感染可能会发展为菌血症。
触发条件:
-肠道疾病
-外伤
-癌症
-手术创伤
这些情况可能导致拟杆菌”越界”,从肠道进入身体其他部位。
致病机制:
-产生特殊毒素(BFT),可能损害组织
-分泌能分解粘液的酶
-形成保护性外壳,有助于细菌存活
-可能引发的健康问题
常见感染:
-腹腔感染(最常见)
-血液感染
-皮肤和软组织感染
-肺部感染
-脑部感染
危险信号:
-当肠道屏障受损时,感染风险最高
-如果不及时治疗,可能会扩散到血液中
治疗方法:
甲硝唑是首选药物,其次还有一些抗生素包括:哌拉西林-他唑巴坦、亚胺培南、美罗培南。
治疗注意事项:
-通常需要联合用药,因为感染往往涉及多种细菌
-医院感染可能需要额外的抗生素覆盖
未来随着拟杆菌对抗生素的耐药性增加,需要开发新的治疗策略,预防感染变得越来越重要。
因此,保持肠道健康,避免不必要的抗生素使用,手术时注意预防感染,及时治疗肠道疾病。
⑤ 拟杆菌:在抗癌中的双重角色
拟杆菌是一类在肠道中常见的细菌,它在癌症发展和抑制中的作用是一个颇具研究价值的话题。
•保护与免疫调节
拟杆菌产生代谢副产物,如丁酸盐,对肠道健康具有保护作用。
在一项动物研究中,使用携带肠癌的小鼠模型,发现移植脆弱拟杆菌有助于减少体重减轻并抑制肿瘤生长。
•与免疫疗法的协同作用
在接受抗癌药物ipilimumab治疗的小鼠中,脆弱拟杆菌似乎增强了药物效果,并减轻了药物引发的肠道不良反应。
•拟杆菌的促癌潜力
携带特定毒素的脆弱拟杆菌可能在特定情况下增加结肠癌风险。有研究指出,结肠癌患者肠道中脆弱拟杆菌毒素基因的数量较多。
一些动物研究也表明,当拟杆菌定殖在肠道时,可以促进肿瘤发生。
未来识别哪些具体的拟杆菌种类最有利于预防癌症,了解哪些种类可能促进癌症发展是重要的研究方向。
⑥ 拟杆菌:抗炎作用
普通拟杆菌(FTJS7K1)在脂多糖诱导的急性肠道损伤小鼠模型中显示出对急性炎症的显著保护作用,包括恢复因急性损伤而受到干扰的肠道微生物群。
移植物抗宿主病(GVHD)是一种促炎性疾病,由同种异体造血细胞移植后供体T细胞发展而来。在一项临床前小鼠GVHD模型研究中,给予脆弱拟杆菌增强了小鼠肠道的多样性,减少了急性GVHD的发生,并预防了慢性GVHD。
金氏副拟杆菌(P. goldsteinii)已被证明有助于免疫系统的成熟和发展。具体而言,P.goldsteinii促进了 CD4+效应T细胞亚型的发育,调节肠粘膜的适应性免疫,从而在肠粘膜的稳态和炎症中发挥重要作用。
β-己糖胺酶是拟杆菌门中的一种保守酶,有助于预防小鼠结肠炎模型中的炎症。
普雷沃氏菌属(Prevotella)是人类体内、特别是在肠道和口腔中常见的细菌群之一,具有多种重要的菌群特性。
① 生态位与环境适应
普雷沃氏菌主要存在于人类的口腔和肠道中。在健康的口腔微生物群中,普雷沃氏菌是一种普遍存在的菌种,且在肠道微生物群中占据重要位置。它们通常作为共生菌存在,但在特定条件下可能转变为机会性病原体。
•主要栖息地
口腔环境:在牙菌斑、牙周袋等部位常见
消化道:主要分布在结肠和直肠
女性生殖道:在阴道微生物群中也有发现
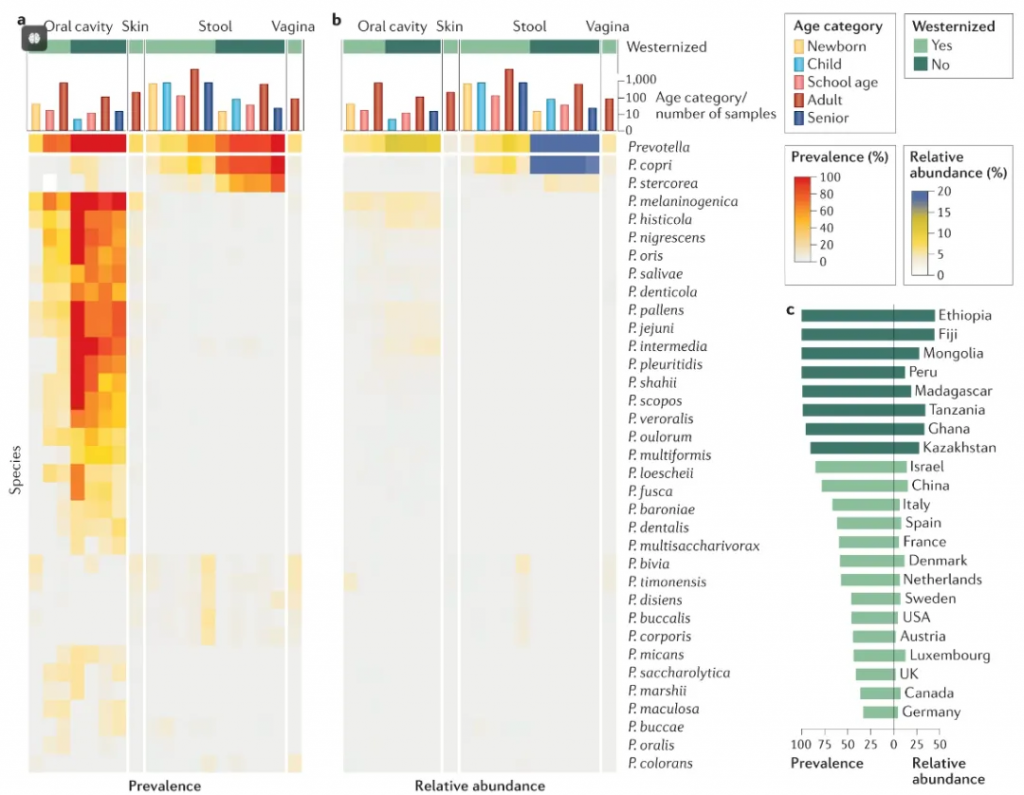
•环境适应特征
普雷沃氏菌是一类严格厌氧的细菌,能够在缺氧环境中生存,这是它们适应宿主微环境的关键特性。它们对宿主的免疫环境具有一定的适应能力,能够调节宿主免疫反应,促进其自身的生存和繁殖。
氧气耐受性:严格厌氧,需要低氧或无氧环境生存
pH适应性:最适pH在6.5-7.0之间
温度要求:37℃为最适生长温度
营养需求:需要特定生长因子,如维生素K和血红素
② 代谢特征与营养方式
普雷沃氏菌在代谢方面表现出高度的灵活性,能够利用各种碳源,包括植物性纤维和淀粉。它们能够生成短链脂肪酸,如丙酸和丁酸,这些代谢产物对于宿主的肠道健康具有重要意义。
此外,普雷沃氏菌还与宿主的营养状态和代谢健康密切相关,可能在一些代谢疾病中扮演角色。
•碳水化合物代谢
主要底物:
-复杂多糖(如木聚糖、果胶)
-植物性纤维
-粘蛋白
代谢产物:
-短链脂肪酸(如丙酸、丁酸)
-琥珀酸
-乳酸
•特殊代谢能力
多糖降解酶系统:
-β-木糖苷酶
-α-葡萄糖苷酶
-纤维素酶
蛋白质降解能力:
-产生蛋白酶
-肽酶系统完整
③ 基因组特征
普雷沃氏菌拥有丰富的基因组多样性,其中某些种类如P.copri表现出显著的遗传多样性。研究表明,这些细菌的不同亚种可能对维持宿主健康或诱发疾病具有不同的功能特性。
它们的基因组常包含与代谢能力、毒力因子及抵抗药物相关的基因,这使得普雷沃氏菌在健康与疾病之间的界限变得模糊。
•基因组结构
基因组大小:2.5-3.5 Mb
GC含量:约40-48%
基因密度:每kb约0.9个基因
•功能基因特征
碳水化合物代谢相关基因:
-多糖降解酶基因簇
-糖转运体基因
耐药基因:
-β-内酰胺酶基因
-外排泵基因
毒力因子基因:
-粘附素
-溶血素
④ 肠道分布特点与生态学意义
•群落分布特征
-某些人群中可达20%以上
地理分布差异:
-东亚人群中部分人含量较高
-非洲农村人群中含量较高
-西方发达国家人群中含量较低
•菌株代谢能力差异
研究表明,西方人群中的普雷沃氏菌(特别是P.copri)往往缺乏有效代谢碳水化合物的能力。这一现象与西方饮食结构有关,通常富含高脂肪和低纤维,这使得某些普雷沃氏菌在这样的环境中生存和增殖的能力受到限制。
而东亚人群的普雷沃氏菌则表现出较强的代谢碳水化合物的能力,尤其在以碳水化合物为主的饮食中,普雷沃氏菌能显著占据主要菌群的组成。
•生态适应性
东亚地区人群中的普雷沃氏菌群体在饮食多样性与微生物生态位的适应性上表现出更高的灵活性,这可能与他们的饮食模式(例如更多的全谷物和蔬菜)密切相关。相对地,西方人群由于饮食结构的变化,导致普雷沃氏菌的生态位和多样性出现了很大的变化,从而影响了肠道微生物组的平衡。
⑤ 健康相关性
•有益作用
-维持肠道屏障功能
-产生有益代谢物:短链脂肪酸、维生素B族
-调节免疫系统:促进Th17细胞分化、调节炎症反应
•潜在风险
-与某些疾病相关:牙周炎、类风湿性关节炎、炎症性肠病
-机会性感染:在免疫力低下时可能致病、可能参与混合感染
⑥ 致病机制和触发因素
1.环境因素
普雷沃氏菌的致病性与特定的环境因素密切相关,包括:
-pH值改变:口腔或肠道的pH值显著变化,会促进普雷沃氏菌的生长,特别是在细菌性阴道病或口腔感染中。
-氧化还原电位改变:微环境中的氧气水平异常,过度的厌氧环境可能会促使厌氧细菌大量繁殖。
-营养物质改变:特定营养物质的过度丰富(例如糖类)可能会导致普雷沃氏菌的快速增殖。
2.宿主因素
宿主的状态也是普雷沃氏菌引发感染的重要因素,包括:
-免疫功能低下:免疫抑制治疗、HIV感染或器官移植后的免疫抑制可能使宿主更易受到普雷沃氏菌的感染。
-局部屏障受损:例如粘膜损伤、手术创伤或放化疗后的局部损伤,会使普雷沃氏菌更容易入侵。
3.微生态失衡
-优势菌群改变:抗生素的使用可能导致菌群失调,抑制保护性菌群的生长,使得普雷沃氏菌过度增殖。
-菌群多样性下降:多样性的减少往往会导致生物膜的形成和感染风险的增加。
普雷沃氏菌的致病机制包括以下几种:
1.直接致病作用
普雷沃氏菌通过产生毒素直接致病:包括内毒素和外毒素,这些毒素能够导致组织损伤和炎症。
普雷沃氏菌产生的毒力因子

组织侵袭:普雷沃氏菌还可能释放组织降解酶,破坏周围组织和细胞间连接。
2.免疫介导损伤
-炎症反应激活:普雷沃氏菌的感染可刺激宿主免疫系统,促进炎症因子的释放和趋化因子的产生,导致局部或全身的免疫反应。
免疫失调:T细胞应答的异常可能导致自身免疫反应,使得宿主的免疫反应对自身组织造成损伤。
3.代谢紊乱
普雷沃氏菌在代谢方面的失调可能导致:
-营养物质竞争:普雷沃氏菌可能与宿主或其他细菌竞争营养物质,从而影响宿主的营养吸收。
-有害代谢产物积累:某些代谢产物可能对宿主造成毒性,进一步加重疾病。
⑦ 感染的信号和治疗
•临床表现
普雷沃氏菌感染的临床表现通常包括:
-口腔症状:如牙龈出血、口臭加重和牙周疼痛。
-消化道症状:如腹痛、腹泻和消化不良。
-全身症状:可表现为发热、乏力和体重下降。
•实验室指标
-炎症标志物的升高:例如C反应蛋白(CRP)和红细胞沉降率(ESR)。
-微生物学检查:可以通过检测普雷沃氏菌的丰度来判断感染情况。
•治疗方案
1.抗生素治疗
对于普雷沃氏菌感染,通常采用以下抗生素:
首选药物:包括β-内酰胺类、克林霉素和甲硝唑。
用药原则:根据药敏结果选择合适药物,确保足量和足疗程,多考虑联合用药。
2.微生态调节
益生菌补充:可以使用乳酸杆菌和双歧杆菌,有助于帮助恢复健康的肠道微生物群。
益生元应用:如低聚糖和膳食纤维可促进益生菌的生长。
3.免疫调节
免疫功能评估和支持:可使用免疫调节剂和提供必要的营养支持。
•治疗注意事项
1.用药监测
定期评估疗效和不良反应,关注药物耐药性的发展。
2.预防措施
维持良好的口腔卫生和调整饮食结构以避免菌群失调。
3.长期管理
定期复查和生活方式指导用以防止复发。
⑧ 肠道普雷沃氏菌—饮食与健康
普雷沃氏菌属,尤其是P.copri复合群,通常与非西方饮食模式以及富含碳水化合物、抗性淀粉和纤维的饮食习惯相关。
在西方饮食中,梭状芽孢杆菌属(包括瘤胃球菌科和毛螺菌科)通常负责降解膳食纤维。尽管如此,通过增加富含纤维的食物来进行营养干预时,往往会导致普雷沃氏菌数量的增加。
•膳食纤维与普雷沃氏菌和拟杆菌丰度密切相关
膳食纤维不仅能改善糖代谢,还与普雷沃氏菌和拟杆菌的相对比例关联密切。研究显示,普雷沃氏菌对葡萄糖稳态和整体代谢有潜在的益处。然而,也有研究指出,P. copri与胰岛素抵抗相关,而其在基线时的较低水平则与超重个体在地中海饮食干预后改善胰岛素抵抗的效果相关。
普雷沃氏菌能有效分解膳食中的复杂多糖。这一点与人类的代谢密切相关,因为人类基因组中编码的酶只能降解有限类型的碳水化合物,比如蔗糖、乳糖和淀粉。因此,肠道微生物能够发酵多糖,促进人类营养吸收是至关重要的。
此外,普雷沃氏菌能够分解植物来源的多糖和某些宿主来源的粘蛋白,但不具备分解动物来源多糖的能力。这就解释了为何工业化西方人群的普雷沃氏菌多样性下降,因为他们很少摄入多种类的植物性食物。
研究也表明,普雷沃氏菌的多样性越高,其在消化多糖和维持肠道稳态方面的能力就越强。在这些发现基础上,研究人员正在努力揭示普雷沃氏菌对于饮食变化和健康状况的具体影响机制,尽管目前对其角色的理解仍存在一定的争议。
共存关系的形成
1.进化适应
普雷沃氏菌和拟杆菌都经过长期进化,形成了与人类肠道共生的关系。它们在进化过程中获得了特殊的代谢能力:
-可以分解复杂的膳食纤维
-与人体免疫系统相适应的表面分子结构
-能够在肠道厌氧环境中生存的代谢系统
2.生态位分配
这两类菌群在肠道中形成了独特的生态位分配:
拟杆菌主要分布在结肠前端,更适应中性偏酸性环境;
而普雷沃氏菌则在结肠后段较为丰富,能够适应更广范围的pH值。
3.不用降解能力
此外它们对不同类型的膳食纤维具有互补性的降解能力。
拟杆菌主导型:
-适应高蛋白、高脂肪的西式饮食
-产生更多支链氨基酸和饱和脂肪酸
-倾向于形成较高的胆汁酸代谢活性
普雷沃氏菌主导型:
-适应高纤维、植物性为主的饮食
-产生更多短链脂肪酸
-有利于维持肠道屏障功能
拟杆菌代谢特点:
-善于降解动物性蛋白质
-产生较多的乙酸盐和丙酸盐
-影响胆固醇代谢
普雷沃氏菌代谢特点:
-擅长发酵复杂碳水化合物
-产生琥珀酸等代谢物
-影响葡萄糖代谢
相互制约机制
1.营养物质竞争
两类菌群之间存在竞争关系
对碳源的竞争:不同种类的膳食纤维
对氮源的竞争:蛋白质和氨基酸
对微量元素的竞争:铁、锌等
2.代谢产物影响
拟杆菌主要通过产生短链脂肪酸(SCFAs)来抑制普雷沃氏菌的生长。乙酸盐是拟杆菌产生的主要SCFAs之一,在酸性环境下可抑制普雷沃氏菌的生长,研究表明高浓度乙酸盐会降低普雷沃氏菌的增殖速率。
拟杆菌还通过琥珀酸途径产生丙酸盐,可降低环境pH值,不利于普雷沃氏菌生长,对普雷沃氏菌的生物膜形成有抑制作用。
普雷沃氏菌发酵碳水化合物产生琥珀酸,高浓度琥珀酸可抑制拟杆菌的生长,影响拟杆菌的代谢通路。
占比此消彼长的原因
1.饮食因素
拟杆菌属通常被认为是能够有效降解多种膳食纤维的细菌,尤其是在高纤维饮食环境中表现良好。这种菌群能够利用复杂的碳水化合物(如植物多糖)作为其主要能量来源,同时能促进短链脂肪酸的生成。
而普雷沃氏菌特别是P. copri复合群,通常与丰富的碳水化合物、抗性淀粉和膳食纤维的饮食模式相关。这类菌群能较好地利用膳食纤维,尤其是对于那些以植物性为主的饮食表现出强大的代谢能力。特定的普雷沃氏菌在研究中显示出较强的能力来降解阿拉伯木聚糖和低聚果糖,这些物质常见于富含纤维的饮食中。
2.环境因素
pH值变化会影响两种菌群的相对丰度
肠道氧化还原电位的改变会影响菌群平衡
肠道蠕动速度会影响营养物质的可及性
普雷沃氏菌的健康影响机制
普雷沃氏菌(Prevotella)在不同健康状况下的影响机制涉及多个领域,特别是在与炎症、代谢和免疫反应相关的疾病中。
炎症反应
普雷沃氏菌与类风湿性关节炎(RA)等免疫介导疾病的发病机制相关。
一些研究指出,普雷沃氏菌可引发促炎性T细胞(如Th17细胞)的反应。这些细胞分泌多种细胞因子(如IL-17),加剧局部和全身性炎症,从而可能导致关节和组织的损伤。
研究发现,普雷沃氏菌的数量增加与粪便样本中的炎症因子水平升高相关。此外,普雷沃氏菌在类风湿性关节炎患者的滑液中也存在,表明其可能通过免疫激活机制参与疾病的发生。
代谢影响
普雷沃氏菌与葡萄糖代谢的关系相对复杂。
一些研究显示,P. copri 可能与胰岛素抵抗相关,但其作用依赖于饮食和个体差异。在高纤维饮食下,普雷沃氏菌的富集通常有助于改善葡萄糖稳态。
其主要机制可能与普雷沃氏菌对抗性淀粉和其他膳食纤维的高效发酵能力相关,这使得它们能够生成短链脂肪酸,为宿主提供代谢能量,有助于改善代谢综合症。
微生物群失调
普雷沃氏菌的丰度在不同人的微生物组中表现出差异。在细菌性阴道病(BV)或HIV感染相关的肠道菌群失调情况下,普雷沃氏菌的增加与炎症因子的释放、局部免疫反应的增强有关,可能导致更易患其他感染。
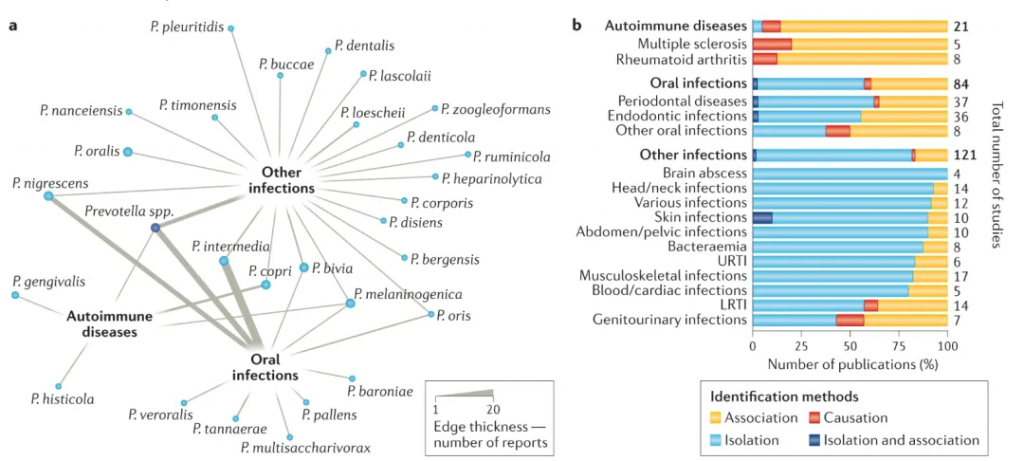
doi.org/10.1038/s41579-021-00559-y
网络分析显示每种普雷沃氏菌与一种或多种疾病(分为三大类:自身免疫性疾病、口腔感染或其他感染)的关联,基于总共226项研究。边的厚度与报告普雷沃氏菌与疾病关系的文章数量成正比。
❤ 编者总结
这两个菌属是中国人群肠道菌群最主要的两个属,两个菌属代表了不同的饮食习惯,展现了肠道菌群令人惊叹的适应能力和复杂的相互作用。它们不仅在进化过程中形成了独特的生态位分配,还通过各自的代谢特长参与营养物质的消化和吸收,还能通过产生多种代谢物来调节人体免疫系统,影响我们的整体健康状况。
主要参考文献
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14.
Hitch TCA, Bisdorf K, Afrizal A, Riedel T, Overmann J, Strowig T, Clavel T. A taxonomic note on the genus Prevotella: Description of four novel genera and emended description of the genera Hallella and Xylanibacter. Syst Appl Microbiol. 2022 Nov;45(6):126354.
Shah HN, Collins DM. Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus Bacteroides. Int J Syst Bacteriol. 1990 Apr;40(2):205-8.
De Filippis F, Pasolli E, Tett A, Tarallo S, Naccarati A, De Angelis M, Neviani E, Cocolin L, Gobbetti M, Segata N, Ercolini D. Distinct Genetic and Functional Traits of Human Intestinal Prevotella copri Strains Are Associated with Different Habitual Diets. Cell Host Microbe. 2019 Mar 13;25(3):444-453.e3.
De Filippis F, Pellegrini N, Laghi L, Gobbetti M, Ercolini D. Unusual sub-genus associations of faecal Prevotella and Bacteroides with specific dietary patterns. Microbiome. 2016 Oct 21;4(1):57.
Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology. 2017 Aug;151(4):363-374.
Tett A, Huang KD, Asnicar F, Fehlner-Peach H, Pasolli E, Karcher N, Armanini F, Manghi P, Bonham K, Zolfo M, De Filippis F, Magnabosco C, Bonneau R, Lusingu J, Amuasi J, Reinhard K, Rattei T, Boulund F, Engstrand L, Zink A, Collado MC, Littman DR, Eibach D, Ercolini D, Rota-Stabelli O, Huttenhower C, Maixner F, Segata N. The Prevotella copri Complex Comprises Four Distinct Clades Underrepresented in Westernized Populations. Cell Host Microbe. 2019 Nov 13;26(5):666-679.e7.
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Gellman RH, Olm MR, Terrapon N, Enam F, Higginbottom SK, Sonnenburg JL, Sonnenburg ED. Hadza Prevotella Require Diet-derived Microbiota Accessible Carbohydrates to Persist in Mice. bioRxiv [Preprint]. 2023 Mar 9:2023.03.08.531063.
Yeoh YK, Sun Y, Ip LYT, Wang L, Chan FKL, Miao Y, Ng SC. Prevotella species in the human gut is primarily comprised of Prevotella copri, Prevotella stercorea and related lineages. Sci Rep. 2022 May 31;12(1):9055.
Iljazovic A, Roy U, Gálvez EJC, Lesker TR, Zhao B, Gronow A, Amend L, Will SE, Hofmann JD, Pils MC, Schmidt-Hohagen K, Neumann-Schaal M, Strowig T. Perturbation of the gut microbiome by Prevotella spp. enhances host susceptibility to mucosal inflammation. Mucosal Immunol. 2021 Jan;14(1):113-124.
Tett, A., Pasolli, E., Masetti, G. et al. Prevotella diversity, niches and interactions with the human host. Nat Rev Microbiol 19, 585–599 (2021).
谷禾健康
革兰氏阴性菌,非运动性、杆状、可在厌氧条件下生长。普雷沃氏菌包括50多个不同的物种,大多数可以从口腔和肠道中分离出来。还可以通过结合或附着在上皮细胞以外的其他细菌上定植,在以前感染的区域产生更大的感染。
普雷沃氏菌有助于分解蛋白质和碳水化合物食物,普雷沃氏菌通常被认为是一种与健康的植物性饮食相关的菌。普雷沃氏菌擅长从阿拉伯木聚糖和低聚果糖中提取短链脂肪酸丙酸。
肠道中普雷沃氏菌较低与以下疾病有关:自闭症、过敏、多发性硬化症。普雷沃氏菌丰度的增加也与局部和全身性疾病有联系,包括肠易激综合征 (IBS)、牙周炎、细菌性阴道病、高血压、类风湿性关节炎、代谢紊乱和低级别全身性炎症。以及一些神经系统疾病中普雷沃氏菌的丰度也较高:例如精神分裂症、脑瘫。痛风/高尿酸血症中普雷沃氏菌也偏高。阴道粘膜普雷沃氏菌增多与细菌性阴道病有关。这种细菌会破坏阴道的酸度,更容易受到感染。
低脂高纤维饮食可以提升普雷沃氏菌的丰度。
革兰氏阳性菌,厌氧,呈球状,不产生孢子。瘤胃球菌通过分解宿主消化系统的纤维素来获取营养,也能够发酵葡萄糖和木糖以及抗性淀粉。
瘤胃球菌在婴儿过敏、脑瘫、溃疡性结肠炎展现出一定的健康益处。
然而,瘤胃球菌也与一些疾病相关,包括肠道疾病(IBS,IBD,克罗恩等)、免疫性疾病(过敏、湿疹、哮喘等)、神经系统疾病(自闭症,抑郁症、肌萎缩性脊髓侧索硬化症等)、代谢疾病(II型糖尿病、肥胖(超重))和一些肝病中瘤胃球菌的丰度过高。
瘤胃球菌属包括有益菌和有害菌。当长期食用水果和蔬菜时,瘤胃球菌属能够发酵复合糖类,产生乙酸酯、丙酸盐以及具有抗炎效益的丁酸盐。而过量食用肉类会增加有害的瘤胃球菌。益生菌如嗜酸乳杆菌和长双歧杆菌显著促进瘤胃球菌生长。
革兰氏阴性、不形成孢子、厌氧和杆状细菌,是人类常驻菌群。拟杆菌参与人体结肠中许多重要的代谢活动,包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。
拟杆菌作为对人类有益的菌,具有消化膳食纤维多糖和宿主聚糖的能力,通过产生乙酸盐和丙酸盐对维持肠道内稳态很重要。是维生素K的主要合成菌,它可以通过增加骨矿物质密度来预防或治疗骨质疏松症。拟杆菌属含量高的婴儿认知和语言方面发育更好,而缺乏拟杆菌与抑郁症、冠状动脉疾病、炎症性肠病相关。
但当拟杆菌能够逃到肠道以外的身体其他部位时,它们就会充当致病菌,导致脓肿和其他感染。脆弱拟杆菌丰度较高与结直肠癌的发病率增加有关,而多形拟杆菌与自身免疫性疾病存在关联。
增加肠道中拟杆菌数量的最好方法是增加纤维和抗性淀粉的摄入量——所以多吃含低聚果糖的多叶蔬菜、豆类、种子、坚果等。
又名普拉梭菌,革兰氏阴性,对氧极度敏感。是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。通过产生丁酸,由助于保持肠道内壁的完整性,丁酸盐可以通过抑制 NF-κB 转录因子激活、上调 PPARγ和抑制干扰素γ来减轻肠黏膜炎症,对维持肠道稳态非常重要。
患有慢性便秘、乳糜泻、肠易激综合征和炎症性肠病(包括克罗恩病和溃疡性结肠炎)的个体中这种微生物的数量减少。此外,在2型糖尿病、结直肠癌和银屑病患者中观察到较低水平的F. prausnitzii。
高肉、高脂肪、高糖、高度加工食品和低纤维饮食会降低F. prausnitzii 的数量,而高纤维、低肉的饮食会增加 F. prausnitzii 的数量。除此之外,菊粉型果聚糖和阿拉伯木聚糖等益生元可增加F. prausnitzii的数量。
革兰氏阳性细菌,杆状,不形成孢子。它们可以是能动的或不能动的,如果能动,它们就有鞭毛。该细菌从碳水化合物或蛋白质中产生有机酸混合物,其可能包括大量的丁酸、乙酸和甲酸。
真杆菌通过产生丁酸,促进肠道完整性,抑制促炎细胞因子,上调抗炎细胞因子,预防肠道炎症、有助于肠道健康。然而少数菌种可与其它兼性厌氧菌造成混合感染,引起人心内膜炎,盆腔炎等疾病。真杆菌属还通过胆汁酸代谢促进肠道和肝脏健康。真杆菌可以改善自闭症儿童症状和肠道问题、以及有助于避免患上痴呆症,重度抑郁症的真杆菌水平较低。
Eubacterium的减少或缺乏与很多疾病相关,比如抑郁或疲劳、肥胖、炎症性肠病、II型糖尿病、心脑血管、结直肠癌、自闭症、老年肌少症、肠道健康以及肿瘤预后良好和肠道稳态状态等。
真杆菌属会随着饮食中蛋白质/脂肪百分比的增加而减少,地中海饮食可以增加肠道中真杆菌属(Eubacterium)的数量。
属于革兰氏阳性菌,专性厌氧、形成孢子、能动。Lachnoclostridium属包括来自Lachnospiraceae科和几个梭菌簇的生物,例如梭菌XIVa。这类细菌能够发酵多糖类物质产生短链脂肪酸,如丁酸和乙酸等。这些物质对肠道上皮细胞的生长和肠道屏障功能的增强具有积极作用,同时也具有抗炎作用。
Lachnoclostridium属的相对丰度在一些疾病中有所变化,如:在肠炎病变和肠道肿瘤中相对丰度增加,在肝脏脂肪变性和代谢性疾病中相对丰度增加;
在自身免疫性疾病以及肌肉减少症、桥本甲状腺中相对丰度降低。Lachnoclostridium的丰度降低与蛋白质处理和营养物质转运等功能通路的下调有关。
一些天然化合物有助于增加Lachnoclostridium的丰度:包括甜菜碱、蓝莓和蔓越莓花青素提取物、西藏茶多糖、白藜芦醇、红曲米、黄芩素、人参皂苷 Rg1;增加水果和蔬菜的摄入量、地中海饮食、高粗粮饮食、低热量饮食也有助于增加Lachnoclostridium的丰度。
革兰氏阳性、严格厌氧,通常为球形或椭圆形、不能运动。所有Blautia菌株都可以利用葡萄糖,但不同菌株对蔗糖、果糖、乳糖、麦芽糖、鼠李糖和棉子糖的利用能力不同。Blautia发酵葡萄糖的最终产物是乙酸、琥珀酸、乳酸和乙醇,乙酸盐可以抑制病原菌,有抗炎作用。
Blautia属目前根据公布的有效名称物种共计20个,包括:B. Hydrogenotrophica、B. coccoides、B. wexlerae、B. hansenii、B. producta。
Blautia 与宿主生理功能障碍具有显著相关性,例如肥胖、糖尿病、癌症和各种炎症性疾病。Blautia与内脏脂肪面积负相关,研究还确定了Blautia luti 和Blautia wexlerae 的减少与肥胖个体的胰岛素抵抗有关。Blautia菌通过产生细菌素来防止病原体的定植,并通过上调调节性 T 细胞和 SCFA 的产生而表现出抗炎特性和维持葡萄糖稳态作用。
该属中的物种水平在老年患者中经常减少,在结直肠癌患者的黏膜样本中水平降低,在肠易激综合征 (IBS) 患者中水平升高。
可以通过食物(富含 Omega-3 的食物、糙米、大麦、迷迭香、黄酮类、高谷物饮食)或者益生元(二甲双胍、黄连素、小檗碱、红花油、丁酸钠、抗性淀粉(II、IV型)、橙子(果胶/黄烷酮)、葡萄籽多酚/酒、亚麻籽、维生素 D3)来增加,而抗生素(氟喹诺酮和克林霉素)、高胆汁酸、饮酒、缺乏乳酸菌会导致减少Blautia。
是小的、厌氧或微需氧的革兰氏阴性球状或杆状菌,因次也被翻译成小杆菌属。大部分菌种不形成孢子、不运动。属于厚壁菌门,韦荣氏球菌科,代谢碳水化合物,产生琥珀酸和乙酸,丙酸,丁酸,产生组胺,过氧化氢酶。
该菌属物种被发现出现在人体全身各个部位,包括骨骼和血液,但是主要从人体粪便,口腔以及上呼吸道,阴道等部位分离或发现,属于人体肠道核心菌。当在肠道中检出“Dialister invisus”与疾病无关,但是当在尿液中发现时,可能与尿路感染有关;当在口腔中检出“Dialister invisus”,它通常与冠周炎、边缘和根尖周炎、龋齿、口臭和牙髓感染有关。特别是“Dialister pneumosintes”被认为是一种新的牙周病病原体。
抑郁症、自闭症患者缺乏Dialister,关节炎患者Dialister丰度较高,Dialister 属的丰度与强直性脊柱炎疾病活动评分呈正相关。除此之外Dialister还与情绪控制、口腔疾病、减肥、不同组织部位的感染,肾病等相关。
酸奶、胡桃、芽孢杆菌补充、双歧杆菌补充、菊粉以及运动可增加肠道Dialister 属的丰度。
属于专性革兰氏阳性厌氧菌, 轻微弯曲,杆状,并通过多个亚末端鞭毛运动。罗氏菌属代谢膳食成分,刺激其增殖和代谢活动。产生短链脂肪酸(乙酸,丙酸,丁酸),从可发酵的膳食碳水化合物中产生了大量的丁酸盐。影响结肠运动,具抗炎特性。
罗氏菌属可以分泌各种分子,与宿主和消化道的其他细菌相互作用。罗氏菌属可以改善肠道生物多样性,提高葡萄糖耐受性,帮助减肥,使结肠细胞恢复活力。Roseburia也可以作为症状性病理(如胆石形成)的生物标志物,或作为益生菌修复有益菌群。
罗氏菌属的失调(过少)可能影响多种代谢途径,并与多种疾病相关。在溃疡性结肠炎、慢性便秘患者、结直肠癌患者中,发现患者罗氏菌属丰度较低;肥胖、2型糖尿病、动脉粥样硬化、高血压患者中罗氏菌属丰度也过低;一些神经系统疾病如帕金森病、肌痛性脑脊髓炎/慢性疲劳综合征中的罗氏菌属比例也较低;罗氏菌属较少可能还与慢性风湿病、幼年特发性关节炎、食物过敏、白塞氏综合征有关。
植物性食物(例如水果和蔬菜)、全谷物、豆类和坚果可以促进罗氏菌属的增加,β-葡聚糖(蘑菇、燕麦)、几丁质、青香蕉粉、菊粉、膳食多酚等益生元也被证明可以增加罗氏菌属的丰度。
是一种专性厌氧、革兰氏阴性、能动的细菌,细胞呈现棒状形,可形成圆形菌落。鞭毛排列单质的,在35到39℃、PH为7的生长最佳。能够从苦杏仁苷、l-阿拉伯糖、熊果苷、纤维二糖、纤维二糖苷、d-果糖、α-半乳糖苷、龙胆二糖、d葡萄糖,糖原,菊粉,麦芽糖,鼠李糖和蔗糖获取营养,主要发酵产物为丁酸盐、乙酸盐、氢气和乳酸盐。
患有睡眠障碍的自闭症儿童表现出粪便细菌和直肠真杆菌的丰度下降;粪链球菌和直肠真杆菌的丰度可能会影响ASD儿童睡眠障碍和自闭症核心症状的严重程度。Agathobacter菌、半胱氨酸甘氨酸和焦磷酸盐具有显著相关性,从而调节谷胱甘肽代谢和氧化磷酸化的代谢水平,并参与消化性溃疡的进展。
革兰氏阴性菌,这些细菌发酵各种糖类以产生甲酸、丁酸和乳酸。似乎有两组Gemmiger,一种主要产生乳酸,另一种产生甲酸盐作为主要发酵代谢物。维生素的单一缺失(来自确定的维生素混合物)表明泛酸、核黄素和硫胺素在含有瘤胃液和胰蛋白酶作为维生素来源的培养基中高度刺激生物体的生长。
吉米菌属(Gemmiger)在多种精神疾病中显著减少;Gemmiger与女性样本中的雌性脂肪比率呈正相关,而在男性样本中呈负相关。肠道中的 Gemmiger 和瘤胃球菌越多,便秘症状越轻,相反,这两种菌越少,便秘症状也越重,所以,这两种菌可能具有保护作用。
炎症性疾病中Gemmiger的丰度显著较低,Gemmiger和粪球菌被确定为克罗恩病和健康人分类的重要特征。研究表明Lachnospira可能对炎症有保护作用。
菌体呈梭状,又称梭状芽孢杆菌属或厌氧芽孢杆菌属,芽孢常比菌体大,是一类能产生内生孢子的厌氧性革兰氏阳性菌。除了产气荚膜梭菌无鞭毛外,大多有鞭毛,专性厌氧。大部分的梭菌属可以水解糖、蛋白质,又可产生外毒素,成为一些疾病的原因。
多数为非致病菌,少数为致病菌。常见致病厌氧芽孢梭菌主要有破伤风梭菌、产气荚膜梭菌、肉毒梭菌和艰难梭菌等。破伤风梭菌是破伤风的病原菌;产气荚膜梭菌广泛存在于自然界及人和动物的肠道中,引起气性坏疽和食物中毒的主要病原菌。肉毒梭菌在在厌氧条件下产生肉毒毒素,人体的胃肠道很适于肉毒杆菌居住,而肉毒毒素对酸的抵抗力特别强,胃酸溶液24小时内不能将其破坏,食入和吸收这种毒素后发生食物中毒,神经系统将遭到破坏,出现恶心、呕吐、头晕、呼吸困难和肌肉乏力等症状,死亡率极高。
该属的模式种为丁酸梭菌,丁酸梭菌(Clostridium butyricum)是人类胃肠道的天然居民。它是肠道中发酵膳食纤维并产生有益的短链脂肪酸丁酸盐的众多细菌之一。丁酸盐作为结肠上皮细胞的能量来源,有助于维持肠道屏障,具有抗炎作用,并可预防结肠癌。
革兰氏阴性、专性厌氧、不形成孢子、不活动、呈杆状,中等大小的细菌,已经鉴定分离出20多个物种。一些报道证实P.distasonis拥有N-聚糖的代谢途径,并在体外粪便发酵中具有木葡聚糖降解能力。P. distasonis的发酵可以产生甲烷。副拟杆菌属有助于消化我们无法以其他方式处理的高纤维饮食,并且在抗性淀粉饮食中丰度增加。
副拟杆菌具有致病性和益生作用的双重潜力,在炎症性肠病中的二分作用,既出现了抗炎特性也出现了促炎特性;P.distasonis被证实对结直肠癌有益。粪便中P. distasonis的水平与肠道肿瘤的存在呈负相关。还被证明对肥胖的改善作用,患有肥胖和代谢综合征的儿童的肠道微生物组中P.distasonis的丰度降低。人类多发性硬化症患者中P.distasonis的水平较低,副拟杆菌被证明促进多发性硬化症中的T细胞分化。
P. distasonis也可能对许多其他类型的疾病具有调节或保护作用:在强直性脊柱炎(AS)患者的粪便样本中,P.distasonis的丰度显著增加;在银屑病患者中,P.distasonis的存在显著减少;斑秃患者的肠道微生物组中P.distasonis的丰度更高;P. distasonis的水平升高与宫颈癌的进展呈正相关;两种副拟杆菌属物种都被显示出能促进生酮饮食的有益抗癫痫效应
属于拟杆菌门的一种革兰氏阴性细菌,专性厌氧,呈直或略微弯曲的棒状,末端为圆形。不会形成孢子。细胞通常单独或成对出现,偶尔以较长的细丝出现。不运动,可将色氨酸水解为吲哚。葡萄糖代谢终产物是琥珀酸和少量的乙酸,丙酸。
Alistipes可能对包括肝纤维化、癌症免疫治疗和心血管疾病有保护作用。相比之下,其他研究表明Alistipes在结直肠癌中具有致病性,并且与抑郁症有关。
肝纤维化中Alistipes减少,在NASH 和 NAFLD 等其他纤维化疾病中也可以看到肝纤维化患者的Alistipes丰度降低。心房颤动患者Alistipes减少,Alistipes和链球菌之间存在潜在的拮抗作用。高血压中Alistipes有助于炎症和上皮细胞的改变。已发现Alistipes作为潜在的病原体可能会诱发结直肠癌。
然而Alistipes的增加也与一些疾病有关,抑郁患者中Alistipes增加,Aistipes丰度的增加还可能与GABA增加有关。
该菌可以在高脂肪饮食中茁壮成长,并且在肥胖患者的肠道微生物群中生长得特别好,表明与肥胖相关。
革兰氏阳性,严格厌氧,呈直的或略微弯曲的棒状细胞,有的可能呈螺旋状。存在于大多数健康人的肠道里,可能是一种潜在的有益菌,参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶的能力很强。
发酵果胶、聚半乳糖醛酸、果糖和纤维二糖等。乙酸盐、甲酸盐、乙醇和CO2是聚半乳糖醛酸和果胶发酵的主要最终产物。也可能产生少量的H2 。果胶发酵时也会产生甲醇,不产生琥珀酸盐、丁酸盐和丙酸盐。
毛螺菌属过多可能影响睡眠、在一些肝病(非酒精性脂肪肝)中发现毛螺菌属的富集。而毛螺菌科过少可能与哮喘、抑郁症、自闭症、阿尔兹海默症、慢性肾病、食管鳞状细胞癌、系统性红斑狼疮、慢性自发性荨麻疹、2 型糖尿病、白塞病等疾病相关。
增加的方法:食用富含纤维的植物性饮食,摄入果胶、β-胡萝卜素、维生素 E、洋车前子、茶多糖等植物性化学物质。而食用油炸食品、吸烟会使毛螺菌属减少。
革兰氏阴性专性厌氧菌,多形棒状杆菌,不运动、不形成孢子。可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关。随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。早期肝癌患者中考拉杆菌属明显减少,而在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高度富集。
考拉杆菌属(Phascolarctobacterium)还有助于阻止艰难梭菌定植、帮助减肥和有助于肺癌的免疫治疗。
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。此外,小檗碱和二甲双胍可以显著增加这种菌。
革兰氏阴性,专性厌氧,嗜中温,亲糖,杆状,不产芽孢,不运动。发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。属内成员有三个种:Megamonas hypermegas(趋巨巨单胞菌)、Megamonas funiformis(单形巨单胞菌)、Megamonas rupellensis。
巨单胞菌作为肠道核心种,可能是亚洲人种的特征。与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、自闭症谱系障碍(ASD)、肥胖等疾病密切相关。炎症性肠病、结直肠息肉患者巨单胞菌属度显著降低,巨单胞菌属在强制性脊柱炎(AS)、自闭症谱系障碍(ASD)、注意缺陷/多动障碍 (ADHD)、肥胖、急性缺血性脑卒中(AIS)、抑郁患者中丰度较高。
而巨单胞菌属减少与一些疾病也相关(证据不充分),包括老年人虚弱、白塞病,肝病等。
动物脂肪摄入过多会导致巨单胞菌属丰度降低,而玉米,马铃薯等富含抗性淀粉的食物以及燕麦阿拉伯木聚糖、桑叶粉可以增加巨单胞菌的丰度。
细胞呈球状,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度约为37℃。
丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌还有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。
在抑郁、帕金森病(PD)、幼儿语言发育障碍,认知、自闭症、睡眠、便秘、慢性肾病、早期乳腺癌、慢性广泛性肌肉骨骼疼痛、慢性疲劳等疾病中粪球菌属(Coprococcus)的丰度较低。
而在体重,胆固醇过高和银屑病患者中粪球菌属(Coprococcus)丰度过高。
使用小檗碱、二甲双胍、甘草甜素,以及补充维生素D、抗性淀粉可以使粪球菌属丰度增高。
严格厌氧的革兰氏阳性多形性杆状细菌,不运动、过氧化氢酶阴性、不形成孢子。末端常常分叉,故名双歧杆菌。该属比较典型的特征是单糖的分解代谢(即所谓的果糖 6-磷酸途径),主要发酵葡萄糖产生乳酸和乙酸和少量乙醇。
双歧杆菌产生硫胺素(维生素B1)、核黄素(维生素B2)、维生素 B6和维生素 K。可能还具有合成叶酸、烟酸(维生素B3)和吡哆醇(维生素B6)的能力。双歧杆菌代谢产物还包括γ-氨基丁酸(GABA)和生物素。
肥胖、糖尿病和过敏等各种疾病都与生命各个阶段的双歧杆菌数量减少有关。双歧杆菌有助于改善消化问题,抗菌和病毒、抗炎、改善血糖控制,降低血脂水平,提高免疫力,表现出抗氧化活性,有助于预防湿疹,缓解压力和过敏。在肝病、过敏性疾病、精神性疾病、代谢性疾病中具有一定的有益作用。然而双歧杆菌侵入其他组织可能造成感染或败血症。
导致减少的因素包括:年龄(年龄增加)、饮食(精制碳水化合物,加工食品等,缺镁铁饮食、高脂肪饮食)、疾病(肠病,炎症,代谢性疾病)、生活方式(缺乏运动、过度使用抗生素、酗酒等)、其他因素(比如感染,菌群失衡)
增加双歧杆菌的因素包括:补充益生菌、吃发酵食品、增加特定膳食补充剂,比如低聚果糖,抗性淀粉,白藜芦醇、镁、绿茶、水苏糖,杏仁/杏仁皮、岩藻多糖、大麦、菊芋、阿拉伯木聚糖、菊粉等;多样性饮食;合理运动和良好睡眠,清洁的水源等。
革兰氏阳性兼性厌氧或微需氧的棒状细菌,呈细长的杆状,但无分枝,无芽孢,不具有鞭毛或纤毛,能够在无氧或微氧条件下进行发酵,主要产生乳酸作为碳水化合物发酵的主要代谢终产物。乳杆菌属的成员已有超过200种,主要有德氏乳杆菌保加利亚亚种(保加利亚乳杆菌)、嗜酸乳杆菌、干酪乳杆菌、罗伊氏乳杆菌、惰性乳杆菌等。
乳杆菌是一种益生菌,对人体健康有着重要的作用:包括维护肠道菌群平衡,改善消化功能,提高免疫力,缓解过敏反应,降低胆固醇,改善口腔健康。乳杆菌对于肠道健康尤为重要,乳杆菌通过促进粘液分泌增强胃肠道屏障,诱导抗菌肽表达,通过产生短链脂肪酸刺激紧密连接的形成,细菌素抑制或杀死其他细菌,竞争结合位点抵抗病原体。
乳杆菌属不仅在人体肠道健康中起着重要作用,在女性阴道健康与相关疾病中的作用也不容忽视。健康阴道中主要乳杆菌的相对丰度决定了细菌群落群的类型,乳杆菌的丰度与阴道健康有关,乳杆菌种类显著减少或消失可能导致细菌性阴道病。除此之外乳杆菌的丰度还会影响月经周期、妊娠健康。
乳杆菌在其他疾病中也有一定作用,包括在特应性皮炎、牙周疾病、呼吸系统疾病、系统性红斑狼疮中具有一定保护作用。
然而,乳杆菌可能也是一种机会病原体,可引起脓肿、菌血症、心内膜炎、肺部感染和新生儿脑膜炎等多种感染。
饮食中富含益生元的食物,如蔬菜、水果、全麦面包等,以及食用发酵食品和一些天然生物活性成分包括绿茶与异麦芽低聚糖、姜黄素、白藜芦醇、葡萄多酚可以促进乳杆菌的生长。
相反,高脂肪、高糖、高盐等不健康的饮食习惯会抑制乳杆菌的生长。长期使用抗生素、非甾体抗炎药等药物会破坏肠道菌群平衡,抑制乳杆菌的生长。 缺乏运动、长期处于压力状态等生活方式也会抑制乳杆菌的生长。
是一种厌氧(但具有一定的耐氧性)、革兰氏阴性、无运动、没有内生孢子的卵圆形肠道细菌,其最适生长温度是37℃,最适生长pH为6.5。该菌的生长繁殖需要蛋白质,可降解黏蛋白和粘液层。能够使用粘蛋白作为碳、氮和能量的唯一来源,并发酵产生乙酸盐、丙酸盐和乙醇。也可以利用人乳寡糖作为能量来源。
阿克曼菌属具有促进肠道屏障完整性、调节免疫反应、抑制炎症、防止体重增加、降低某些心脏病风险,如胰岛素抵抗、总血胆固醇和脂肪组织储存等健康特性;有助于改善糖尿病和肥胖个体的代谢功能。缺乏或减少与多种疾病(如肥胖、糖尿病、肝脂肪变性、神经退行性疾病、炎症和对癌症免疫治疗的反应)有关。
然而Akkermansia 增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、脂多糖进入血液的增加、自身免疫性疾病,神经退行性疾病等有关。
含有高水平多酚和鱼油的食物是提高A. muciniphila菌最好的食物。例如红酒中的白藜芦醇、辣椒中的辣椒素、百里香中的百里酚、肉桂中的肉桂酸、迷迭香中的迷迭香酸。其他常见的高多酚食物包括葡萄、橄榄、菠菜、李子和桃子等。一般来说,颜色越深越好。此外,补充补充膳食纤维,选择有机产品,避免高脂肪饮食和酒精都有助于 提升阿克曼菌属的丰度。
革兰氏阴性细菌,适生长温度约为37°C,大多数为好氧生物,埃希氏菌属细菌既能够利用氧气进行呼吸代谢,产生能量。也可以进行发酵代谢,利用糖类等有机物产生能量。它可以与厌氧菌共生,分解单糖、二糖和复杂多糖,为肠道提供能量和营养物质。
它的存在和代谢活动间接影响短链脂肪酸的生成,大肠杆菌可以产生多种神经递质,如去甲肾上腺素、多巴胺、5-羟色胺和乙酰胆碱。这些神经递质可以通过影响神经元活动和调节情绪、压力反应等方式,对神经系统功能产生影响。
大肠杆菌在正常情况下对人体无害,但某些菌株也可能引起感染和疾病。例如,某些产生肠毒素的毒力菌株的大肠杆菌可引起食物中毒,导致胃肠道症状,如腹泻、呕吐和腹痛。还会破坏肠道屏障完整性,激活肠道黏膜免疫。炎症性肠病(IBD)和结直肠癌中大肠杆菌的数量显著上升。
此外,大肠杆菌也可能引起泌尿系统感染和其他感染性疾病。动脉粥样硬化患者中,埃希氏菌属的丰度明显增加;糖尿病患者的埃希氏菌属相对丰度较高;非酒精性脂肪肝病 (NAFLD)和多动症(ADHD)中埃希氏菌属也较高。
埃希氏菌属的增加与二甲双胍的副作用有关,二甲双胍的使用会导致埃希氏菌属的丰度增加,埃希氏菌属的增加还可能与肠道炎症和代谢紊乱有关。肉桂皮油、抗性淀粉(III型)、
甘草酸、维生素D、石榴、大蒜(大蒜素)、黄芪属、蔓越莓低聚糖、乳铁蛋白、黄芩汤、苍耳精油等饮食或补充剂有助于减少埃希氏菌属过度生长。
链球菌属(Streptococcus)是革兰氏阳性菌,呈球形或卵形,通常成链排列或成对排列,广泛存在于人类粪便和鼻咽中。大多数不致病。医学上重要的链球菌主要有化脓性链球菌、草绿色链球菌、肺炎链球菌、无乳链球菌等。
Streptococcus LJ-22表达β-葡萄糖醛酸酶将甘草酸代谢为18β-甘草次酸-3-O-β-D-葡萄糖醛酸(GAMG)。GAMG对脂多糖诱导的RAW264.7细胞具有抗过敏活性。SGG可能通过消除单宁酸对肿瘤细胞的毒性来促进结直肠癌的发展。S.thermophilus GIM 1.321很高的β-葡萄糖苷酶生产能力,可以降低血压并发挥抗氧化作用。
肺炎链球菌是引起人类疾病的重要病原菌,肺炎链球菌通过胞外酶系统获得大量的碳和氮,胞外酶系统允许多糖和己糖胺的代谢,并对宿主组织造成损害并使其定植。
血链球菌是口腔生物膜发育的开拓者和关键角色。除了在口腔中作为主要定居者的作用外,血链球菌还被广泛认为是感染性心内膜炎,心脏瓣膜或心内膜感染的病因。在一般条件下血链球菌定植于牙菌斑中,对人体无害,但当其通过口腔内的微小创口进入血液循环引起菌血症,就有可能引发感染性心内膜炎。
一种厌氧或微需氧的、耐胆汁、降解糖 、非运动性且不形成孢子和球杆菌形的短杆状革兰氏阴性球杆菌。肠道Sutterella中主要分为两大类,分别为华德萨特菌(Sutterella wadsworthensis)和粪链球菌(Sutterella stercoricanis)。
Sutterella通常与人类疾病有关,例如自闭症、唐氏综合症和炎症性肠病 (IBD),但这些细菌对健康的影响仍不清楚。 Sutterella 属的成员是肠道重要的共生菌,在健康成人的十二指肠中含量丰富,朝向结肠的梯度逐渐减小。在人类胃肠道中具有轻度促炎能力,Sutterella会过分泌IgA蛋白酶,降解IgA,从而降低肠粘膜中IgA的浓度,损害肠道抗菌免疫反应功能。
Sutterella属与抗生素性腹泻的病情呈正相关,被诊断患有自闭症和胃肠道紊乱的儿童中,超过一半的肠道活检组织中存在 Sutterella菌,而通常发育中的胃肠道紊乱儿童的活检组织中没有 Sutterella。唐氏综合症与大量的Sutterella显著相关。
体重和脂肪量的增加与Sutterella 呈负相关,而高效有氧健身锻炼与Sutterella丰度增加和物种多样性呈正相关。
补充低聚半乳糖(GOS)以及低聚果糖(FOS)和维生素D有助于增加Sutterella的丰度,而岩藻多糖具有降低Sutterella丰度的作用;此外,Sutterella显示对甲硝唑的耐药性。
也被称为硫酸盐还原菌,非发酵性、厌氧性、革兰氏阴性杆菌,在25至40摄氏度之间的温度下生长速率理想。已有12个属40多个种,一般具有产生乙酸,消耗乳酸特征中的一种或多种。四种脱硫弧菌种均与人类感染有关(主要是腹部):Desulfovibrio. fairfieldensis、 Desulfovibrio. desulfuricans、 Desulfovibrio. Piger、 Desulfovibrio. Vulgaris。
一些脱硫弧菌物种的存在与慢性牙周炎、细胞死亡和炎症性肠病如溃疡性结肠炎和克罗恩病有关,或者至少增加复发的风险。Desulfovibrio的相对丰度与体重指数、腰围、甘油三酯水平和尿酸水平呈负相关。肥胖和超重儿童Desulfovibrio显著低于正常体重儿童。脱硫弧菌物种的浓度与帕金森的严重程度相关,此外在系统性硬化症、关节炎 、结直肠癌、妊娠期糖尿病中脱硫弧菌的丰度增加。
革兰氏阴性、不形成孢子的厌氧菌,球状、多形性小球(坏死梭杆菌)到杆状的一系列细胞形态。梭杆菌细胞通过发酵碳水化合物和蛋白获得能量。这种发酵产生丁酸盐,在某些情况下产生乙酸作为主要的代谢副产物。其中具核梭杆菌是少数利用氨基酸分解代谢来提供能量的非产孢厌氧物种之一,能使用谷氨酸、组氨酸和天冬氨酸。
F. nucleatum在有助于牙周健康和疾病的生物膜中发挥不可或缺的有益作用。在牙菌斑生物膜中,具核梭菌作为桥梁生物在结构上起到支持作用,将主要定植菌(如链球菌属)与主要厌氧的次级定植菌连接起来,梭杆菌细菌素可以通过去除特定的口腔或肠道微生物来促进其他微生物的生长。
梭杆菌作为主要病原体侵入人类宿主的能力很强,其中具核梭杆菌和坏死梭杆菌是可怕的厌氧病原体之一,最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、口腔癌、溃疡性结肠炎、克罗恩病和结直肠癌有关。 结直肠癌患者粪便样本中,具核梭杆菌高,此外在肿瘤复发患者中肠菌具核梭杆菌含量明显升高。
此外,痛风患者中梭杆菌丰度增加,胰腺导管腺癌中梭杆菌fusobacteria 较少。
梭杆菌属对粘菌素和卡那霉素敏感,一些菌株产生β-内酰胺酶并对青霉素耐药。
一组呈黄色、杆状的革兰氏阴性菌。是兼性厌氧菌,氧化酶阴性。非包膜、非孢子形成的活动杆菌,具有周毛鞭毛。可以利用 D-木糖、D-核糖、麦芽糖、D-半乳糖、D-甘露糖、D-果糖、海藻糖和 D-甘露醇作为能量代谢的碳源。
泛菌属有 20 多个物种,其中90%以上的感染与2个物种有关:Pantoea agglomerans、Pantoea dispersa。这种细菌会导致新生儿 ICU 中的机会性血流感染。Pantoea 可作为社区获得性感染(包括职业接触)或医院获得性感染引起人类感染。Pantoea引起的感染的临床结果包括感染骨骼、关节、滑膜引起化脓性关节炎、骨髓炎或滑膜炎,包括但不限于心内膜炎、眼内炎和皮肤感染。
成团泛菌已表现出对多种抗生素的耐药性,包括早代青霉素、早代头孢菌素、广谱头孢菌素和抗假单胞菌青霉素、氟喹诺酮类、氨基糖苷类、TMP-SMX和四环素。许多泛菌菌株显示出惊人的环境多功能性和适应性,并具有多种生物合成和生物降解能力,可用于农业、环境和临床环境中的潜在有用应用。
为肠杆菌科中一类有荚膜的革兰氏阴性杆菌,不运动,兼性厌氧,氧化酶为阴性,并从乳糖产生酸和气体。是一种机会性病原体,本属中肺炎克雷伯氏菌与人类关系密切。肺炎克雷伯菌可以自然存在于健康个体的肠道和呼吸道中,具有健康免疫系统的人很少发生感染疾病。
但当细菌直接进入人体内时,通常会发生克雷伯菌感染。这种细菌都与脑膜炎,腹膜炎,败血病和肺炎有关。肺炎克雷伯菌是引起肺炎的人类呼吸系统的主要病原体之一。甚至还会导致鼻部、眼部、尿道感染。
K. ozaenae被认为是萎缩性鼻炎的病因;K. rhinoscleromatis可导致缓慢进展的疾病,称为鼻硬化症;K.oxytoca与新生儿菌血症有关。
克雷伯菌感染通常发生在由于年龄,酒精滥用或糖尿病等导致免疫功能低下人群,并且通常以医院感染的形式出现。此外,易感因素包括营养不良,接触程度,不卫生的环境和遗传易感性等。
一般可用阿扎坦(aztreonam);喹诺酮类;第三或第四代头孢菌素,例如罗芬(头孢曲松);碳青霉烯类,例如Primaxin(亚胺培南/西司他丁);青霉素,例如佐辛(哌拉西林-他唑巴坦)等抗生素进行治疗。
该属的典型菌种是Eggerthella lenta(迟缓埃格特菌)。Eggerthella lenta是一种正常的人类微生物菌群,它是厌氧的、不产生孢子的、革兰氏阳性的。然而,Eggerthella lenta(迟缓埃格特菌)可引起血流感染,被认为是一种机会性人类病原体。越来越多的研究表明,它也可能是人类的重要病原体,甚至在某些条件下引起危及生命的感染。Eggerthella lenta已从血液、脓肿、伤口、皮肤溃疡、产科和泌尿生殖道感染以及腹腔内感染中分离出来。
危险因素包括免疫功能受损状态(类固醇使用、近期化疗、终末期肾病和糖尿病)、恶性肿瘤和胃肠道疾病,如溃疡性结肠炎和克罗恩病。Eggerthella lenta菌血症最常见的潜在健康状况是实体癌或血液器官癌、糖尿病和心血管疾病。而所有这些患者的主要感染源是胃肠道、皮肤和软组织和脓肿。在所有首发症状中,阑尾炎所占比例最高,远高于第二大的结肠炎。阑尾炎常伴有穿孔甚至腹膜炎。Eggerthella lenta通常定植于胃肠道,更容易侵入血液。因此,肿瘤、糖尿病、阑尾炎患者更应关注迟缓埃格特菌的血行感染。
多项研究表明在抑郁,情感障碍以及精神分裂患者中Eggerthella丰度富集。还证明eggerthella有可能成为与慢性失眠相关的独特属种。在重度抑郁症中,eggerthella的增加和sutterella的减少也得到证实。此外,埃格特氏菌 (eggerthella)与甘油三酯增加和高密度胆固醇减少存在相关性。
用药:对抗迟缓肠球菌感染最有效的抗菌药物是甲硝唑、阿莫西林克拉维酸和碳青霉烯类;它对头孢曲松具有耐药性。头孢唑肟,也显示出良好的疗效,健康饮食分数越高,该菌的丰度相对更低。
Flavonifractor(解黄酮菌属)属于厚壁菌门,梭菌目的,通常为革兰氏阳性,大多数物种形成椭圆形/球形内孢子,通常为过氧化氢酶阴性,大多数物种是专性厌氧的,尽管对氧气的耐受性差异很大。肠道微生物群中 Flavonifractor 丰度升高与较高的情感障碍相关,吸烟和女性是造成这种关联的原因之一,可能导致氧化应激增强,以及儿茶酚途径和低度炎症有关。此外,肠癌或息肉病人该菌富集。
Flavonifractor是肠道健康的重要菌群,其含量与肥胖呈负相关,Flavonifractor plautii改善动脉硬化程度。Flavonifractor属的种类增加和抑郁症相关。Flavonifractor(参与微生物儿茶素代谢并影响宿主免疫,它的增加可能与葡萄粉中儿茶素的含量有关)。Flavonifractor 还在慢性肾病、终末期肾病中显著增加。
该菌的典型菌种是 Flavonifractor plautii ,是人类肠道微生物中一种常见的专性厌氧菌,通常黏附在肠壁上,在粪便中可提取得到。 Flavonifractor plautii 及其主要效应物顺乌头酸可以通过改善动脉功能和减少炎症来防止动脉僵硬。这个细菌还有一个超能力,它可以「吃掉」红细胞的 A 抗原。
Flavonifractor plautii可以通过裂解类黄酮分子的 C 环来降解类黄酮。黄酮类化合物是人类饮食的重要成分,主要由具有广谱药理活性的多酚类次级代谢产物组成。从流行病学、临床前和临床研究中积累的证据支持这些多酚在预防癌症、心血管疾病、2 型糖尿病和认知功能障碍方面的作用。
几种常见的食物,如茶、咖啡、苹果、番石榴、榄仁树皮、葫芦巴籽、芥菜籽、肉桂、红辣椒粉、丁香、姜黄和豆类,都含有大量的类黄酮。因此为了最大限度发挥类黄酮在结直肠癌中的潜在有益作用和生物利用度,需要控制Flavonifractor plautii其丰度。
但是,个别研究报道口服 Flavonifractor plautii(一种在绿茶摄入量中增加的肠道细菌)可通过抑制 IL-17 信号传导促进小鼠急性结肠炎的恢复。 口服 Flavonifractor plautii 可有效抑制小鼠的 Th2 免疫反应,可能有助于减轻抗原诱导的 Th2 免疫反应。
Oscillibacter革兰氏染色阳性,酰基类型是乙酰基。主要的细胞壁糖是半乳糖,属于厚壁菌门,主要的菌种有Oscillibacter ruminantium、Oscillibacter valericigenes。
Oscillibacter属代谢和降解胆固醇。对心脑血管疾病有影响,中风和短暂性脑缺血发作患者增多,在各种研究中被指出与神经发育和抑郁症的关系。此外,Oscillibacter属在各种研究中被指出与神经发育和抑郁症的关系。Oscillibacter属与抑郁症显著相关,抑郁症患者中的丰度较高,并且与抑郁行为和神经递质紊乱相关。
Holdemania是一种厌氧细菌属,主要存在于人类肠道中。Holdemania属于芽胞细菌,可形成芽胞以抵御不利环境,细胞呈棒状或杆状,大小约0.5-1.2μm × 1.5-6μm,厌氧生长,需要无氧环境。是丹毒菌科的一员,其丰度与脂质代谢紊乱的严重程度呈显着正相关。之前的报告还表明,肠道中高丰度的霍尔德曼尼亚有助于诱导炎症反应。
Holdemania通常被认为是人体肠道正常菌群的一部分,在维持肠道微生态平衡中起一定作用,大多数情况下,Holdemania属菌不会引起疾病,是人体共生的细菌。但在某些情况下,如免疫功能下降等,Holdemania可能会导致机会性感染,如腹泻等。
有研究显示Holdemanella属与脂质和葡萄糖代谢受损有关,其在II型糖尿病和肥胖等代谢性疾病中具有潜在危害作用。此外研究发现妊娠晚期母体肠道微生物群中霍尔德曼菌的丰度较高,与婴儿食物过敏的发生率较低有关。另外中国帕金森病患者的粪便中富含霍尔德曼菌。鸭肉、羊肉、乳制品和藻类蔬菜等饮食因素会增加Holdemanella属的相对丰度。锌过载时Holdemania的丰度也会增加。
弯曲杆菌属,是革兰氏阴性螺旋,杆状或弯曲细菌,是引起肠道感染的细菌,是引起全世界腹泻病最常见的细菌原因之一。其可以急性肠炎(腹泻、恶心、呕吐、腹痛、发热等),肠外感染,严重会导致并发症,包括格林-巴利综合征。
弯曲杆菌可以使未煮熟的鸡肉、蔬菜水果、各类熟食品、牛奶、海鲜类等受到污染,还可以感染宠物,通过动物粪便对水源的污染或人和动物的接触传播,从而引起腹泻或者中毒。
任何人都可能感染,婴儿和儿童感染弯曲杆菌的几率比成人高,大多数弯曲杆菌感染是自限性的,也就是说大多数弯曲杆菌病无需任何其他治疗即可痊愈,严重时需抗生素如阿奇霉素治疗。
预防弯曲杆菌感染需注意饮食卫生,加强食品加工过程的卫生控制,避免生食易感染动物产品等。
谷禾健康

“唉,昨晚又没睡好!”
失眠已经严重影响着一部分人们的生活。失眠后会引起烦躁、白天嗜睡、精力不足、内分泌系统紊乱、认知功能受损、免疫力下降甚至易得心脑血管疾病。
据中国睡眠研究会等机构统计,中国有超3亿人存在睡眠障碍。其中,19—25岁年轻人经常熬夜至零点以后;19—35岁青壮年是睡眠问题高发年龄段。 并且由于当代社会压力增加,失眠率还在不断攀升。

影响睡眠质量的因素有很多:包括人体的生物钟,环境因素如光照、噪音、温度,还有心理状况,饮食状况及疾病状况。而近年来的研究发现体内有一种物质与睡眠紧密相关——它就是褪黑素。
褪黑素于20世纪50年代首次被发现并表征,从那时起,广泛的研究揭示了它的生产、功能和潜在的治疗应用。
褪黑素作为改善睡眠质量和调节昼夜节律紊乱的补充剂已广受欢迎。除了在睡眠调节中的作用外,褪黑素还被发现具有抗氧化、抗炎、免疫调节和神经保护特性。它影响生殖过程、心血管健康、胃肠功能以及其他生理系统。
近年来,褪黑素和肠道微生物群之间的关系已成为一个令人着迷的研究领域。研究表明褪黑素和肠道微生物之间存在双向作用,强调了肠道微生物群对褪黑激素产生和代谢的潜在影响,以及褪黑激素对肠道微生物组成和功能的影响。
褪黑素(N-乙酰基-5-甲氧基色胺)最早于1958年在牛松果体中发现并分离出来,因其能够美白青蛙皮肤,研究人员一开始认为作为一种“美白因子”,并将其命名为“褪黑素”。
后续的研究才证明了其在调节生物节律和睡眠模式中的作用。
注:褪黑素是一种具有3-胺基和5-甲氧基的吲哚胺,因此具有两亲特性(同时具有亲水性和亲脂性)。
褪黑素的化学结构
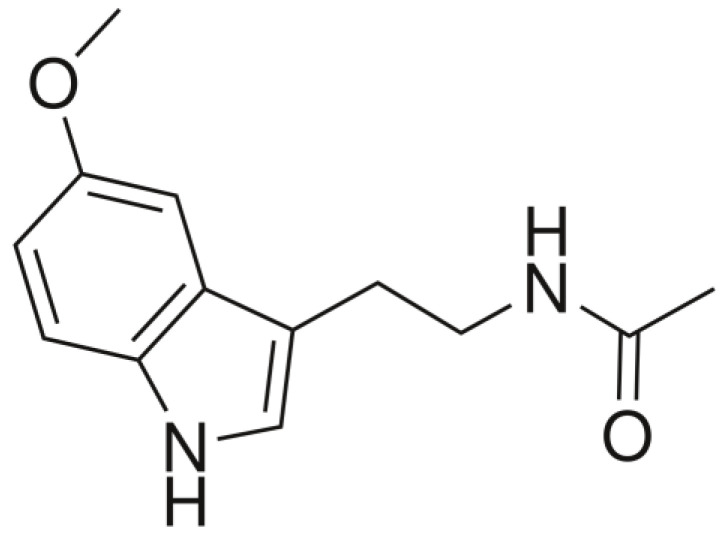
Minich DM,et al.Nutrients.2022
✦ 色氨酸是合成褪黑素的原料
松果体通常在黑暗环境中产生褪黑素,褪黑素生物合成从色氨酸开始,接着色氨酸转化为血清素(5-羟色胺)。5-羟色胺会经历两个酶促反应:首先,N-乙酰基转移酶进行N-乙酰化,产生N-乙酰-5-羟色胺。
然后,通过羟基吲哚-氧-甲基转移酶的作用,甲基从S-腺苷甲硫氨酸转移到N-乙酰血清素的5-羟基。N-乙酰基转移酶是褪黑素合成的限制步骤,它具有昼夜节律,夜间活动是日间活动的50到100倍。
褪黑素的生物合成途径

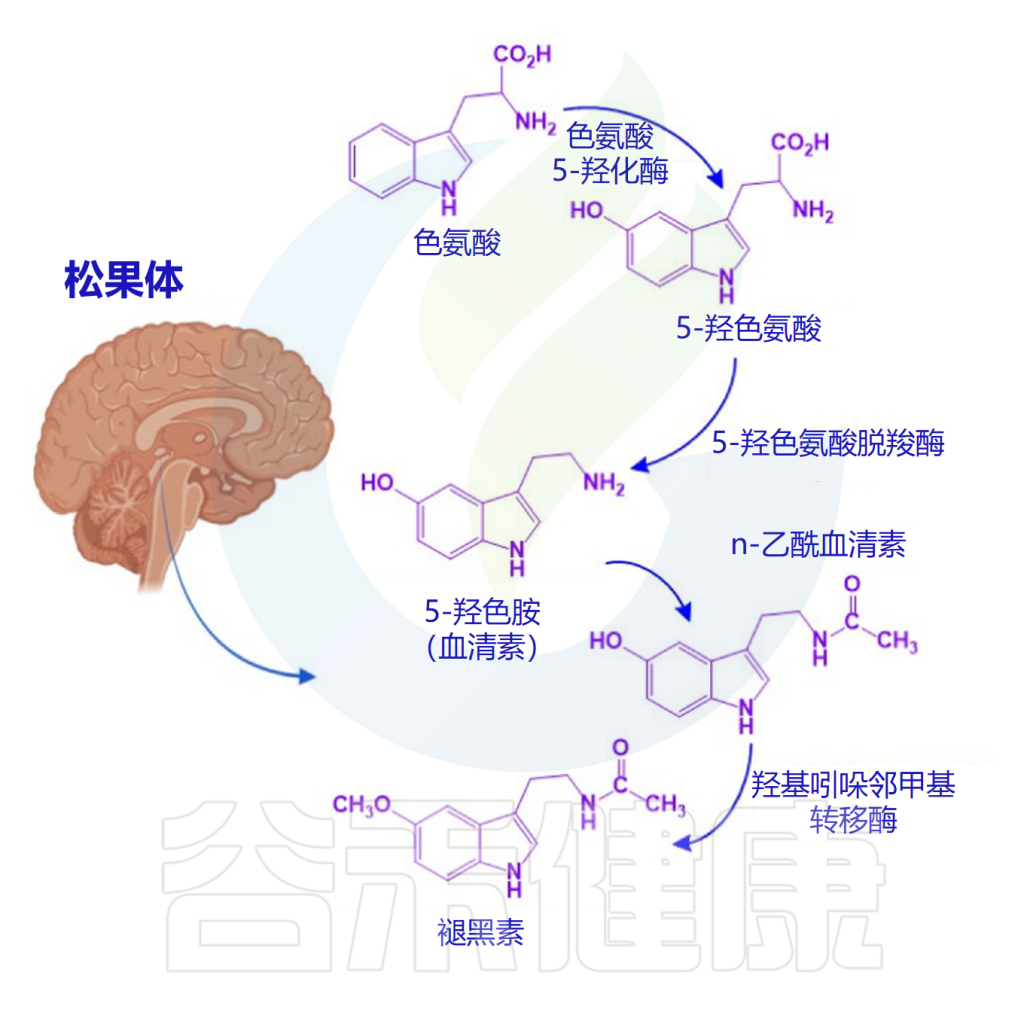
Miranda-Riestra A,et al.Molecules.2022
✦ 其他部位也可以产生褪黑素
值得注意的是,其他组织和器官也会产生褪黑激素,包括视网膜、胃肠道、皮肤和免疫细胞。其在胃肠道中的浓度比血清中的浓度高10至400倍。
注:胃肠道中的褪黑素主要由肠嗜铬细胞、某些类型的免疫细胞和肠道共生细胞产生。肝脏几乎会降解所有褪黑素,这表明胃肠道褪黑素仅限于肠-肝轴,而不是循环到其他器官,并且它在局部发挥作用。
在这些外周组织中,褪黑素的产生可能不会直接受光暗周期调节,但可能受到其他因素(例如饮食和局部信号)的影响。
褪黑素在体内的合成

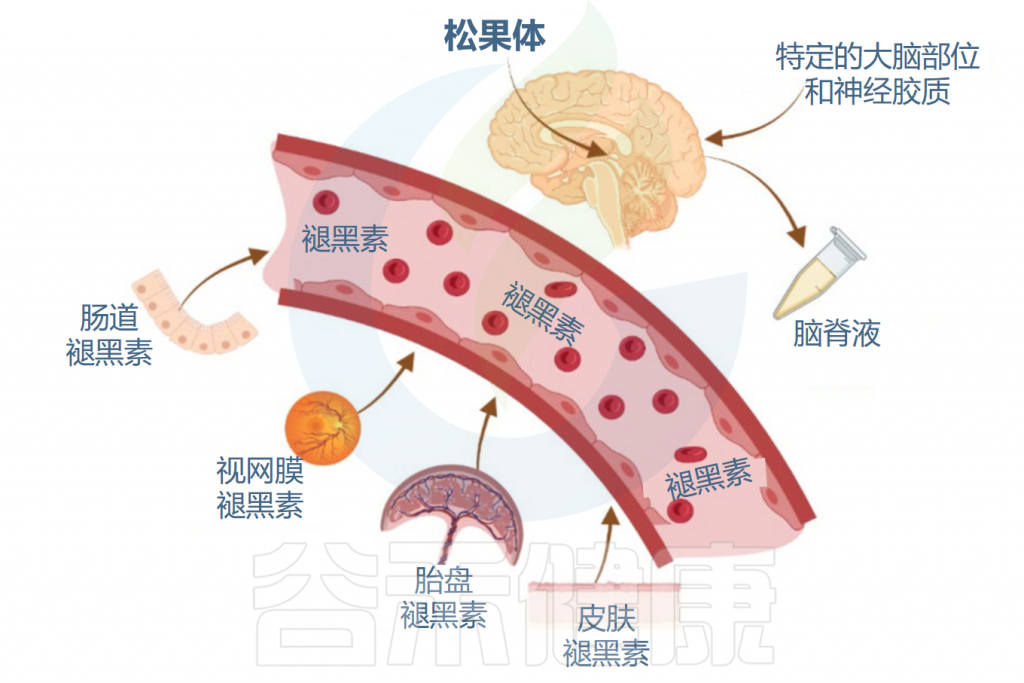
Miranda-Riestra A,et al.Molecules.2022
平均而言,松果体每天产生0.1至0.9毫克褪黑素。但一些因素会影响褪黑素的分泌。
✦光照
光照对于调节褪黑素的产生起着至关重要的作用。视网膜中称为本质光敏视网膜神经节细胞(ipRGC)的特殊细胞可检测光并向下丘脑视交叉上核 (SCN)发送信号。
当暴露于光,特别是蓝光时,这些细胞会抑制褪黑素的产生。这是因为光照会抑制血清素N-乙酰转移酶和N-乙酰血清素O-甲基转移酶的活性,这些酶参与褪黑素合成。

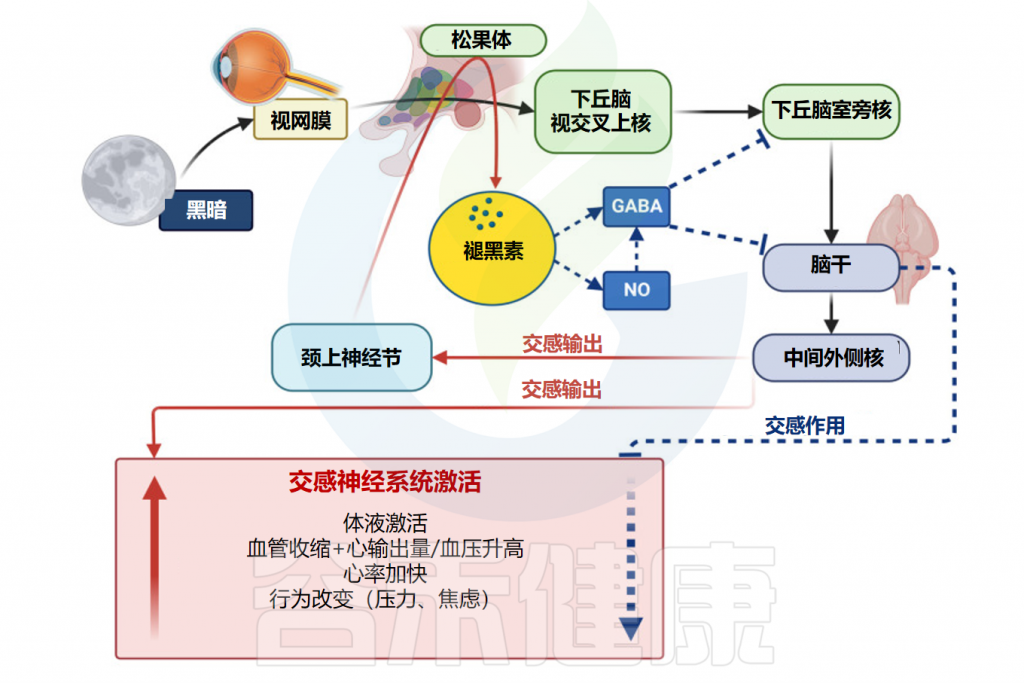
Repova K,et al.Int J Mol Sci.2022
在没有光的情况下,例如在夜间,褪黑素合成的抑制被消除。SCN向松果体发出信号,以增加褪黑素的产生。因此,褪黑素水平上升,促进困倦并帮助调节睡眠-觉醒周期。
✦生物钟
褪黑素的分泌与人体的生物钟密切相关。人体的生物钟是一种内在的生物节律,调节睡眠和其他生理过程。
褪黑素的分泌通常在晚上增加,帮助人们入睡。保持规律的作息时间和良好的睡眠习惯有助于维持正常的褪黑素分泌。

Minich DM,et al.Nutrients.2022
✦年龄
婴儿的褪黑素分泌和昼夜节律要到三个月左右才会发育。母乳喂养的婴儿可以从母乳中获得褪黑素。
从婴儿期到青春期,褪黑素的分泌水平随着年龄增长并达到稳定水平,然后从二十多岁开始随着年龄的增长而缓慢下降。儿童通常比成人产生更多的褪黑素。这也是为什么年长者常常会有睡眠质量下降的问题。

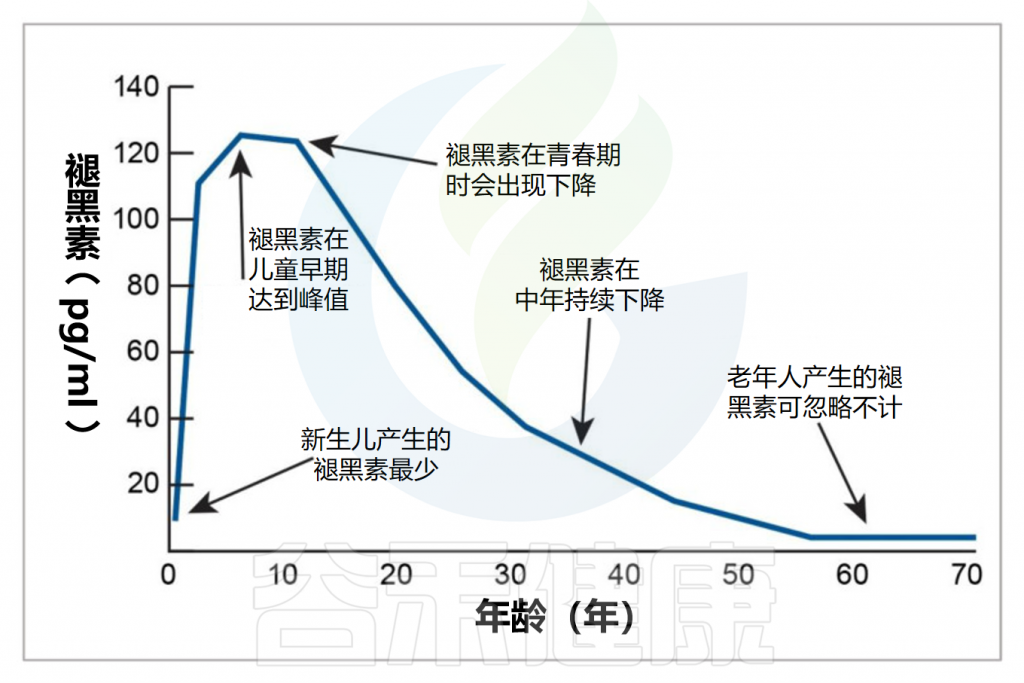
Minich DM,et al.Nutrients.2022
✦色氨酸可用性
色氨酸(褪黑素合成的前体)的可用性也会影响褪黑激素的产生。色氨酸是通过饮食来源获得的,并且可能受到饮食和新陈代谢等因素的影响。
充足的色氨酸对于合成血清素是必要的,血清素进一步转化为褪黑素。
✦药物和化学物质
某些药物和化学物质可能会影响褪黑素的分泌。例如,一些抗抑郁药物、抗高血压药物和咖啡因都可能抑制褪黑素的产生。
✦疾病和身体状况
一些疾病和身体状况也会影响褪黑素的分泌。例如,睡眠障碍、抑郁症、焦虑症和肾脏疾病等都可能干扰褪黑素的正常分泌。
值得注意的是,褪黑素产生的调节是复杂的,涉及多种因素之间的相互作用。昼夜节律紊乱,例如轮班工作、时差反应或夜间暴露在人造光下,可能会影响褪黑素的产生并扰乱睡眠模式。
总体而言,褪黑素的产生主要受到昼夜节律的调节,其中光照在抑制褪黑素合成中起着关键作用。黑暗和色氨酸的可用性促进褪黑激素的产生,有助于调节睡眠-觉醒周期并促进健康的睡眠模式。
褪黑素是一种多功能分子,在人体内具有多种生物学作用。在本节中,将介绍褪黑素对生理活动及人体健康的相关影响。

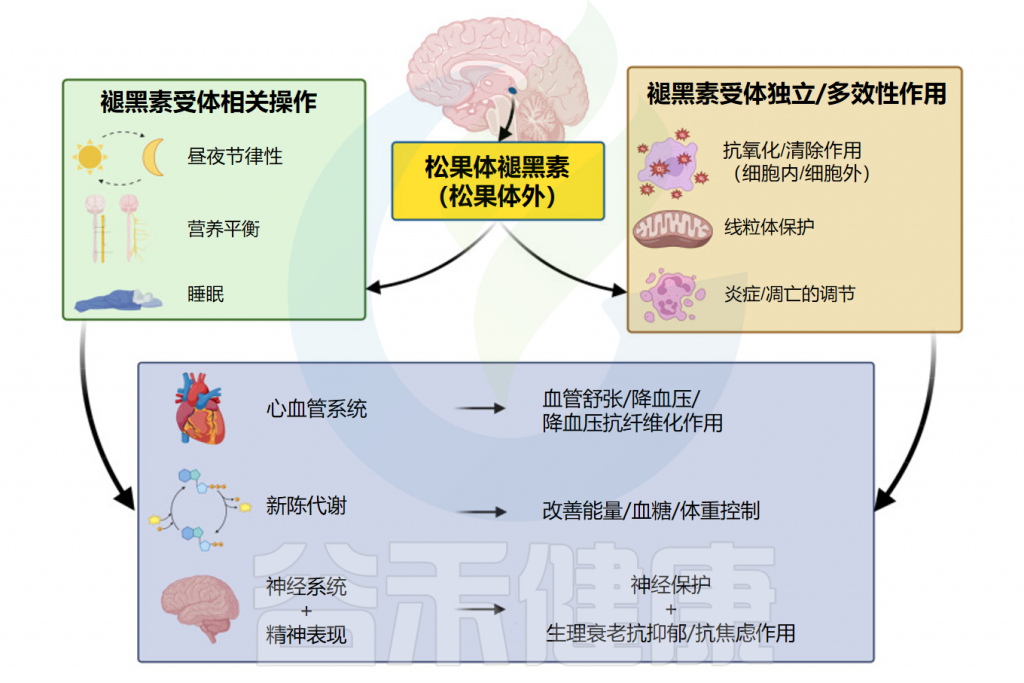
Repova K,et al.Int J Mol Sci.2022
▼
抗氧化、抗炎作用
许多研究已确定褪黑素是一种强大的自由基清除剂,甚至可能是迄今发现的最强的内源性自由基清除剂。体外和体内研究证明了褪黑素在抗氧化防御、减少氧化应激和抗炎过程中的作用。
• 褪黑素具有非常强的抗氧化作用
褪黑素是一种高效的抗氧化剂,因为一个褪黑素分子可以通过与其二级、三级甚至四级代谢物相关的级联机制清除多种活性氧和氮。
褪黑素的双重作用可以抑制促氧化酶(例如黄嘌呤氧化酶),同时还可以增强关键的抗氧化酶,例如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶,有助于人体的第一道免疫防御和代谢解毒。
• 褪黑素可以抑制促炎性细胞因子
此外,褪黑素可以阻断作用于环加氧酶(COX-2)的促炎过程,并抑制炎症介质如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)。
褪黑素还可以增强异常细胞的程序性细胞死亡(细胞凋亡),这在理论上使其成为一种理想的疾病治疗方法。
▼
调节昼夜节律,改善睡眠质量
人类的昼夜节律主要是由光照引起的,生活方式因素可能导致外在的昼夜节律障碍,如轮班工作或时差障碍,补充褪黑素可以通过提前或延迟来调节昼夜节律。
褪黑素对具有睡眠和昼夜节律紊乱人群的影响已得到充分证实。在失眠患者中,外源性褪黑素对一些睡眠参数有显著影响,如入睡潜伏期、总睡眠时间、早晨警觉性和睡眠质量。

• 缩短了入睡潜伏期
一项针对失眠患者的荟萃分析包含5项原始研究,结果表明睡前2小时服用褪黑素2mg显著缩短入睡潜伏期。
在其他一些目标群体中,也提供了褪黑素在纠正昼夜节律方面的证据。一项针对睡眠觉醒时相延迟障碍(DSWPD)患者的荟萃分析得出的结论是,外源性褪黑激素可提前内源性褪黑激素的发作并缩短入睡潜伏期。
在有时差症状的受试者、轮班工人和非24小时睡眠-觉醒节律障碍中也观察到褪黑素对睡眠参数的改善作用。
• 减少早醒时间,增加深度睡眠时间
最近的一项随机对照试验检查了97名中年失眠患者服用较高剂量的褪黑素(3毫克)4周对睡眠障碍的影响。研究显示褪黑素对睡眠参数有积极影响,例如减少早醒时间和增加深度睡眠百分比。
注:这些是睡眠的重要阶段,对于身体和大脑的恢复和健康至关重要。
▼
缓解焦虑
褪黑素除了对肠道炎症有一定的缓解作用外,多项研究表明,服用褪黑素还能发挥抗焦虑作用。
褪黑素的抗焦虑作用机制尚不完全清楚,可能与直接或间接作用有关。直接作用与大脑中褪黑素受体有关,间接作用与褪黑素调节各种神经体液系统(包括交感神经系统、糖皮质激素和神经递质)的能力有关,从而可能干扰应激反应和昼夜节律,并改变氧化和和炎症。
• 褪黑素用于预防术前和术后焦虑
在人类中,褪黑素已被测试为预防术前和术后焦虑的药物,作为麻醉药和止痛药辅助药物,以及用于预防术后谵妄。
临床研究表明,在接受腹部子宫切除术、静脉局部麻醉期间的手部手术或其他选择性手术的患者中,作为术前用药给予褪黑素可以减少术前焦虑,并且与苯二氮卓类药物的抗焦虑治疗同样有效。
在接受小型择期手术的儿童中,褪黑素与咪达唑仑一样,可以减轻术前分离焦虑和与引入麻醉面罩相关的焦虑。
• 褪黑素可能比一些精神药物更安全
此外,一些临床研究观察到褪黑素在降低术后兴奋、苏醒性谵妄和睡眠障碍发生率方面优于咪达唑仑。褪黑素还可以减轻结直肠手术和腹部子宫切除术患者的术后疼痛,同时减少吗啡用量。
值得注意的是,褪黑素可以有效抵消精神药物引起的代谢副作用。褪黑素可降低抗精神病药物治疗引起的血压、体重增加或胆固醇水平。
褪黑素似乎是苯二氮卓类药物的一种安全替代品,可以缓解儿童和成人与外科手术相关的焦虑,同时被认为是一种安全且耐受性良好的药物。苯二氮卓类药物会损害麻醉后的精神运动和认知功能,但褪黑激素却不会。
此外,褪黑素在人体内还有一些非常重要的功能:
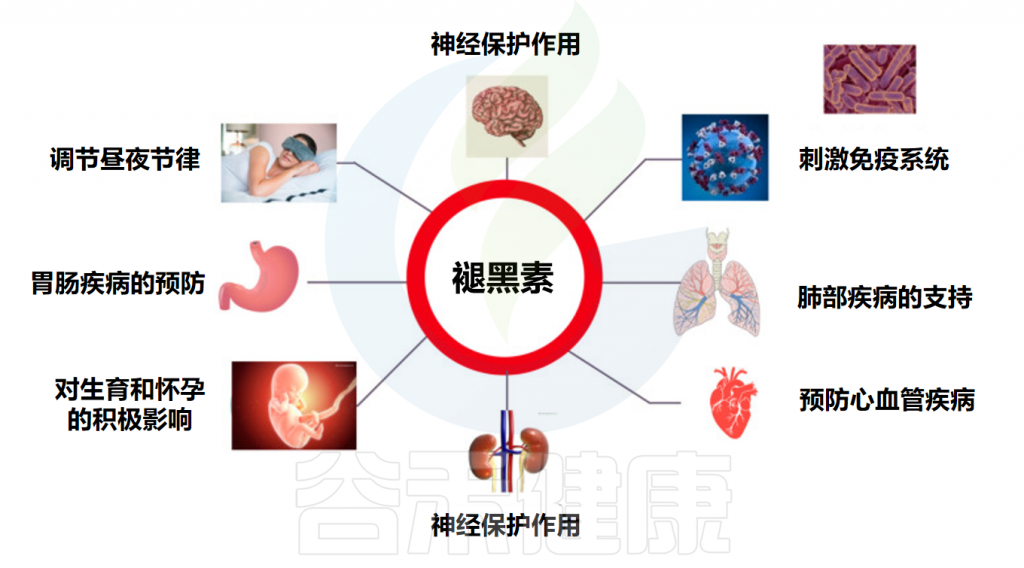

Markowska M,et al.Cells.2023
褪黑素对人体功能具有多种影响




Minich DM,et al.Nutrients.2022
▼
神经保护和神经再生作用
褪黑素的浓度变化与睡眠-觉醒周期紊乱、情绪紊乱、认知能力障碍、神经系统保护等有关。
• 对神经系统具有保护作用
由于其抗氧化特性,褪黑素可作为自由基的清除剂,在分子水平上调节多种反应,包括氧化应激、炎症和细胞凋亡。
它会影响神经营养素或神经递质的浓度。还有文献记载,褪黑素是钙蛋白酶的抑制剂,其活性在许多中枢神经系统疾病的发病机制中具有重要意义。
神经退行性疾病的发病机制与线粒体功能障碍有关。线粒体作为细胞能量来源,也是氧化损伤的目标。线粒体膜的敏感性会受到多种因素的损害,口服褪黑素可能会得到保护。线粒体膜选择性地吸收褪黑素,这是其他抗氧化剂不具备的功能。
初步研究还表明,它可能是淋巴液中的活性成分,有助于清除代谢废物,例如淀粉样蛋白的堆积。理论上,基于这一发现,从治疗角度来看,服用褪黑素可能是值得的,这样患有神经退行性疾病的老年人可以增加脑脊液和类淋巴液的水平。然而,这个概念仍处于起步阶段。
▼
免疫调节和加强监视
褪黑素另一个重要作用是其免疫调节和加强免疫监视的能力。它刺激参与体液免疫和细胞免疫的不同细胞系的产生,例如巨噬细胞、自然杀伤细胞和CD4+细胞,并影响多种细胞因子的合成。
• 褪黑素可以加强免疫调节和免疫监视
褪黑素的直接抗病毒和抗菌作用已被记录。在严重感染期间,服用褪黑激素已被发现具有免疫调节和细胞保护功能,可以降低病毒和细菌炎症的死亡率。
• 褪黑素还曾用于新冠期间的辅助治疗
考虑褪黑素在氧化应激、炎症过程以及免疫反应管理中的作用,对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的病毒感染患者进行了检查。
研究表明,使用褪黑素作为辅助治疗可能是有益的,在2019年新冠状病毒(COVID-19)期间也使用了褪黑激素。
▼
预防胃肠道疾病
消化系统中的褪黑素除了具有抗氧化作用和刺激免疫系统的能力外,还可以减少盐酸的分泌,增强上皮的再生,并增加微循环。
• 褪黑素有助于预防胃肠道疾病
所有这些功能使褪黑素成为预防不同胃肠道疾病的治疗选择之一,例如结直肠癌、溃疡性结肠炎、胃溃疡和肠易激综合症。
据记载,补充褪黑素可以使胃食管反流病完全缓解。它对影响食道和胃的急性和慢性刺激物具有保护作用。
一些研究还证实,褪黑素在预防非酒精性脂肪性肝炎方面对肝细胞具有很强的支持作用。
▼
改善血压、血糖
• 褪黑素可以降低胆固醇和改善血压
在30名患有代谢综合征的患者中,使用褪黑素(每天5毫克,睡前两小时)短短两个月后,低密度脂蛋白胆固醇和血压就得到了改善,而这些患者三个月的生活方式没有改变。
此外,褪黑素已被证明可以降低夜间高血压,改善收缩压和舒张压,降低颈内动脉搏动指数,减少血小板聚集,并降低血清儿茶酚胺水平。
香港中文大学研究人员最近进行的一项荟萃分析和系统评价得出结论,口服褪黑素补充剂可将睡眠收缩压降低3.57毫米汞柱。
其他研究表明,褪黑素可以改善心力衰竭患者的预后,并被认为是这些患者的预防和辅助治疗措施。
• 褪黑素可能有助于血糖控制
关于褪黑素是否有助于血糖控制的疾病(例如非胰岛素依赖型2型糖尿病)存在一些讨论。最近一项针对男性糖尿病患者的相对小型安慰剂对照研究表明,服用10毫克褪黑素三个月后,胰岛素敏感性降低了12%。
褪黑素对糖尿病人群口服葡萄糖耐量的影响差异可能与褪黑素受体1B基因(MTNR1B)中2型糖尿病相关G等位基因的多态性有关。
▼
对生育的影响
• 褪黑素有助于提高生育能力
已经在动物和人类群体中进行了褪黑素给药对生育影响的研究。研究发现,褪黑素可以提高生育能力、卵母细胞质量、成熟度和胚胎数量。
此外,还提出了在怀孕期间的积极作用。神经发生的保护、对胎盘的支持性影响以及氧化应激的减少是提高生育率和改善胚胎-胎儿发育的关键。
活性氧会在怀孕期间引起干扰,它们也是围产期并发症的罪魁祸首。褪黑素是自由基的清除剂,具有抗氧化和细胞保护能力,这可能对成功怀孕至关重要。
• 褪黑素影响新生儿的健康状况
褪黑素不仅在怀孕期间发挥着重要作用,而且在新生儿病理发生时也需要其支持。褪黑素是脱氧核糖核酸(DNA)甲基化和组蛋白改变过程中的监管者。这样可以避免基因表达的根本性变化。使胎儿受到保护,免受一些疾病的影响。
怀孕期间褪黑素浓度不足可能会在个体发育早期的遗传密码中留下内分泌紊乱,随后在儿童期发生。
▼
对骨骼健康的影响
根据细胞和临床前数据,有人认为褪黑素作用于骨代谢的合成代谢和分解代谢方面。
• 褪黑素增加了绝经后妇女的骨密度
一些临床试验证明了褪黑素在重新平衡围绝经期妇女骨重塑中的作用和增加绝经后骨质减少妇女的骨密度。
具体研究
在这些研究中,使用了多达3毫克的补充褪黑素。根据名为褪黑素微量营养素骨质减少治疗研究的为期一年的临床试验的结果,褪黑素(5毫克)、柠檬酸盐(450毫克)、维生素D3(2000IU/50微克) 的组合与安慰剂相比,能够对绝经后骨质疏松女性的骨标志物(例如骨矿物质密度)产生有利影响。
除了有益地改变骨标志物之外,干预措施还改善了情绪和睡眠质量等生活质量指标。当然,不能因此推断褪黑素是造成这些影响。
研究人员认为褪黑素是与年龄相关的骨骼肌疾病的关键化合物,因为它通过其抗氧化潜力参与线粒体功能。这方面的研究结果可能对恶病质或肌肉减少症患者有帮助。
除了上述的影响外,褪黑素与肠道微生物组之间的相互作用也很有趣。肠道中包含着大量的微生物,其与人体健康密切相关,褪黑素已被发现与肠道微生物存在复杂且多样的联系,并可能因此影响人体健康。让我们一起来了解下。
褪黑素主要由两种细胞产生:松果体细胞和肠嗜铬细胞。松果体细胞位于大脑内的松果体中。肠嗜铬细胞位于整个胃肠道的表面,在胃肠道的粘膜内层浓度很高。
与松果体细胞不同,肠嗜铬细胞不受光和暗的调节,但似乎受到食物摄入和消化的影响。
注:肠嗜铬细胞是神经内分泌免疫细胞,对肠道稳态至关重要。
★ 肠道中的褪黑素浓度比血清中高很多
据估计,肠道内的肠嗜铬细胞所含的褪黑素含量是松果体细胞产生的褪黑激素的400倍。肠道褪黑素水平可能比血清中褪黑激素水平高10至100倍。
肠嗜铬细胞中褪黑素的生物合成
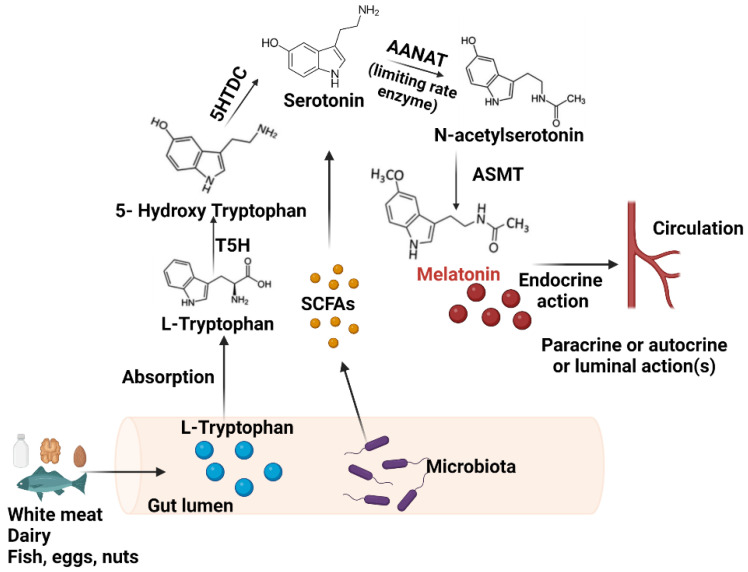
Iesanu MI,et al.Antioxidants (Basel).2022
肠道中褪黑素的释放以旁分泌方式发挥作用,增加胃粘膜的活动和循环,并增强胃肠道运动。此外,褪黑素在肠道中具有抗兴奋特性。它可以刺激上皮细胞的再生,并且还被证明对胃肠道内壁具有保护性抗氧化作用。
旁分泌——通过扩散而作用于邻近细胞的激素传递方式。

Iesanu MI,et al.Antioxidants (Basel).2022
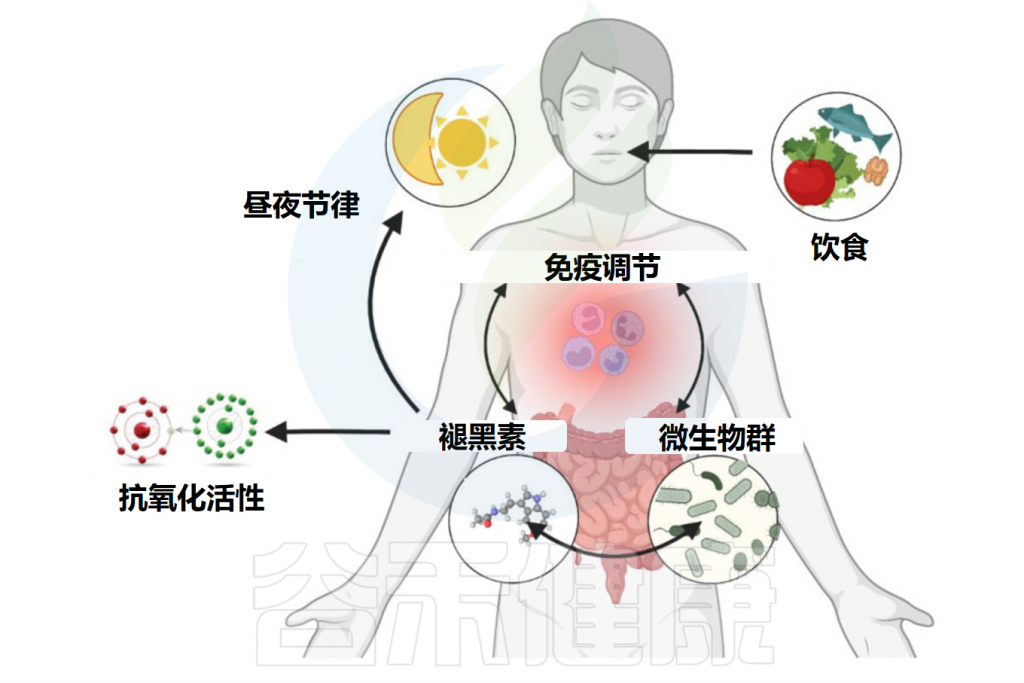
值得注意的是,关于松果体产生的褪黑素和肠道来源的褪黑素如何相互关联,是否存在肠道-松果体轴串扰,以及不同的饮食模式甚至特定食物、禁食方案或进餐时间可能相互影响,仍然是推测性的。改变全身褪黑素水平与饮食和肠道产生的褪黑素这一领域还需要通过更多的研究来回答。
褪黑素和肠道细菌之间似乎具有复杂的相互关系。如下所述,微生物可以调节胃肠道中褪黑素的合成;相反,褪黑素与肠道微生物群的组成和动态有关。它们共同形成一个复杂的系统,在多个层面上发挥作用,以维持宿主的体内平衡。
• 肠道菌群影响褪黑素的前体进而影响其水平
肠道菌群可以通过调节其必需的前体色氨酸和5-羟色胺来影响褪黑素水平。色氨酸的可用性可以通过饮食改变或通过改变肠道微生物群组成来改变。
肠道中色氨酸代谢的三种途径都可以受到肠道细菌的调节。关于吲哚途径,微生物组特征决定了吲哚衍生物的类型。这些吲哚衍生物具有广泛的作用,从对肠粘膜和免疫系统的有益结果到肾毒性。
此外,炎症刺激激活的Toll样受体和肠道细菌释放的病原体相关分子模式分子会刺激犬尿氨酸途径。
肠腔中产生的短链脂肪酸刺激肠嗜铬细胞释放血清素并增强褪黑素的产生。内源性孢子形成细菌产生的其他代谢物可以激活肠嗜铬细胞并促进结肠中5-羟色胺的生物合成。
此外,抗生素引起的生态失调会增强吲哚途径,抑制犬尿氨酸途径,并降低动物模型中的结肠5-羟色胺。
• 病原菌感染后褪黑素的分泌减少
多种细菌对肠道合成褪黑素有影响。例如,胃粘膜幽门螺杆菌感染会下调褪黑激素生成酶的表达,并减少胃肠道中褪黑素的产生。感染清除后,褪黑素产量恢复到正常水平。
• 益生菌可能刺激褪黑素的产生
益生菌,对各种与菌群失调相关的疾病有效。研究还表明益生菌在刺激褪黑素产生方面发挥有益作用。
短期施用益生菌鼠李糖乳杆菌可以增加斑马鱼中褪黑素受体基因的丰度,与光周期转变为持续黑暗的结果相似。因此,益生菌似乎有可能影响褪黑素的产生,从而缓解各种疾病状态。
相反,生态失调和随后的肠道损伤可能会降低局部肠道和全身褪黑素水平。
越来越多的证据表明,褪黑素可以调节肠道微生物的组成和丰度,尤其是在各种病理状态下。
如下所述,褪黑素通过其作为抗氧化剂、免疫调节剂和昼夜节律调节剂的特性间接影响肠道微生物群,研究发现其还可能直接影响肠道微生物群。
• 褪黑素影响肠道微生物的昼夜节律
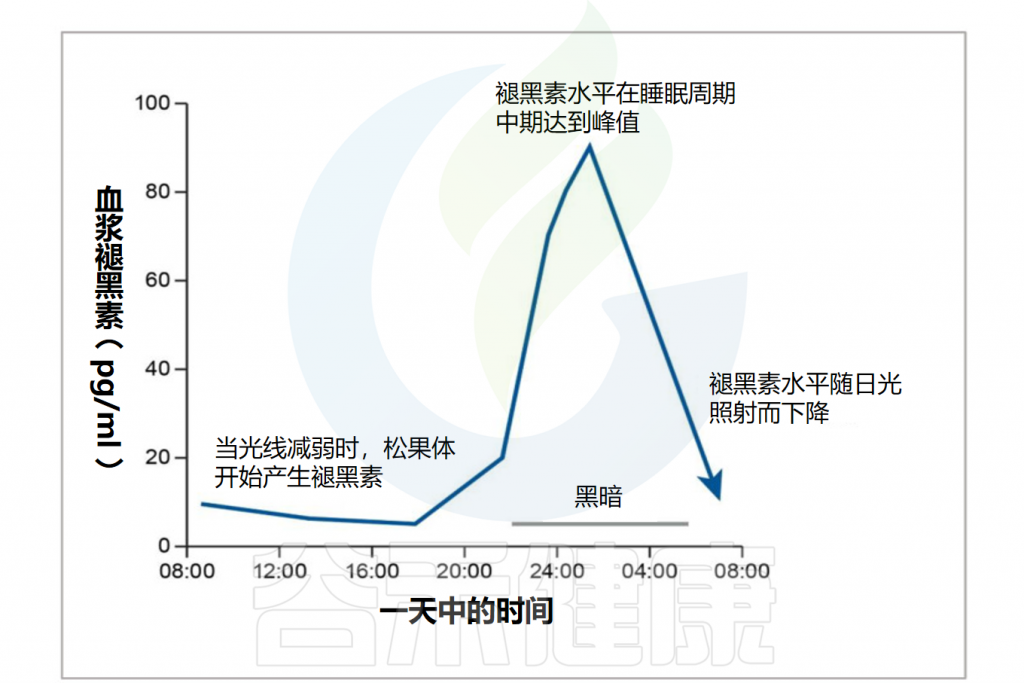
在人类中,褪黑素分泌主要以昼夜节律方式在夜间发生,血浆中最高水平出现在凌晨2至4点左右。
褪黑素的节律性释放由下丘脑前部的视交叉上核调节,代表中枢昼夜节律发生器。视交叉上核神经元的轴突投射到邻近的下丘脑核、丘脑和脑干,并使昼夜节律的一些组成部分同步,例如睡眠/觉醒节律、进食时间表和垂体/肾上腺轴的活动。
胃肠道和微生物群表现出与昼夜节律相关的变化,体外研究表明,多种肠道细菌受光暗循环影响,并与参与生物节律的分子密切相关。昼夜节律失调会引起并加剧炎症性肠病的炎症。
褪黑素含量高时,产气肠杆菌增殖的更快
产气肠杆菌(Enterobacter aerogenes)是人类肠道中普遍存在的细菌,具有昼夜节律,并对白天的褪黑素波动做出反应。
当褪黑素存在时,产气肠杆菌以剂量依赖性方式增殖得更快。此外,当暴露于色氨酸、5-羟色胺或N-乙酰血清素时,没有观察到相同的效果,这突显了褪黑素的重要性和敏感性。
产气肠杆菌主要生存于人类和动物的肠道,为人体内的正常菌群,在人体虚弱的特殊情况下才偶尔引起疾病。
此外,大肠杆菌和肺炎克雷伯菌对褪黑素的敏感性不同。另一项研究表明,高脂肪饮食会损害肠道细菌的日常波动,而褪黑素可以使这些波动正常化,这表明这种重新同步可能具有治疗意义 。
微生物代谢物(例如丁酸盐)的昼夜变化会影响宿主的生物钟。鉴于细菌代谢物的产生是周期性的,微生物功能与宿主的昼夜节律和代谢之间存在隐含的联系。
• 通过氧化还原平衡影响肠道微生物组成
褪黑素的抗氧化活性存在于多种功能中,直接作用是中和自由基,间接作用是通过增加抗氧化酶的水平来发挥作用。
健康的肠道微生物群也具有相当大的抗氧化作用。共生细菌直接参与活性氧的代谢,因为产生乳酸的细菌(例如乳杆菌属)具有乳酸氧化酶、超氧化物歧化酶和丙酮酸氧化酶,这些酶可以去除活性氧,减少氧化应激。
在较高浓度下,活性氧具有潜在毒性并导致生物分子损伤,例如蛋白质、脂质和DNA的氧化,这可能导致多种细胞功能障碍,包括细胞死亡。
结肠健康很大程度上受到肠道抑制过量活性氧产生的能力的影响。值得注意的是,肠道微生物群的组成根据氧化还原平衡而变化。在暴露于氧化应激的小鼠中,肠道微生物群经历了拟杆菌门的增加和厚壁菌门、梭菌目、瘤胃球菌属(Ruminococcus)和颤螺菌属(Oscillospira)的减少。
在衰老模型中,小鼠年龄越大,活性氧产生量越高,梭菌目数量减少,拟杆菌门丰度增加。当肠道损伤和生态失调时,胃肠道的抗氧化活性会受到抑制。例如,在炎症性肠病患者中,共生细菌多样性的减少和微生物群组成的变化与活性氧产生增加和肠粘膜防御系统受损有关。在这些情况下,褪黑素可以发挥其抗氧化活性并重建氧化还原平衡,从而改善肠道微生物群组成。
与其他器官类似,在肠道中,褪黑素不仅清除活性氧,还上调不同的抗氧化酶(GSH-Px、CAT、SOD)并下调促氧化酶。褪黑素可以通过与活性氧相互作用直接发挥其活性,或通过膜和核受体发挥其活性,膜和核受体作为其间接抗氧化作用的介质。
褪黑素激活该通路中的多个应激反应基因(例如AMPK、HIFa、Sirt),进而导致多种抗氧化酶的增加。
因此,通过所有这些褪黑素介导的途径减少肠道微生物群的氧化应激对肠道微环境具有显著影响。
越来越多的证据表明,褪黑素可以调节肠道特性和常驻微生物,以应对压力(例如睡眠障碍)。
当评估褪黑素、睡眠障碍和肠道微生物组之间的相互作用时,在有明显肠道损伤的临床前研究中,血浆和肠道褪黑素水平会降低。
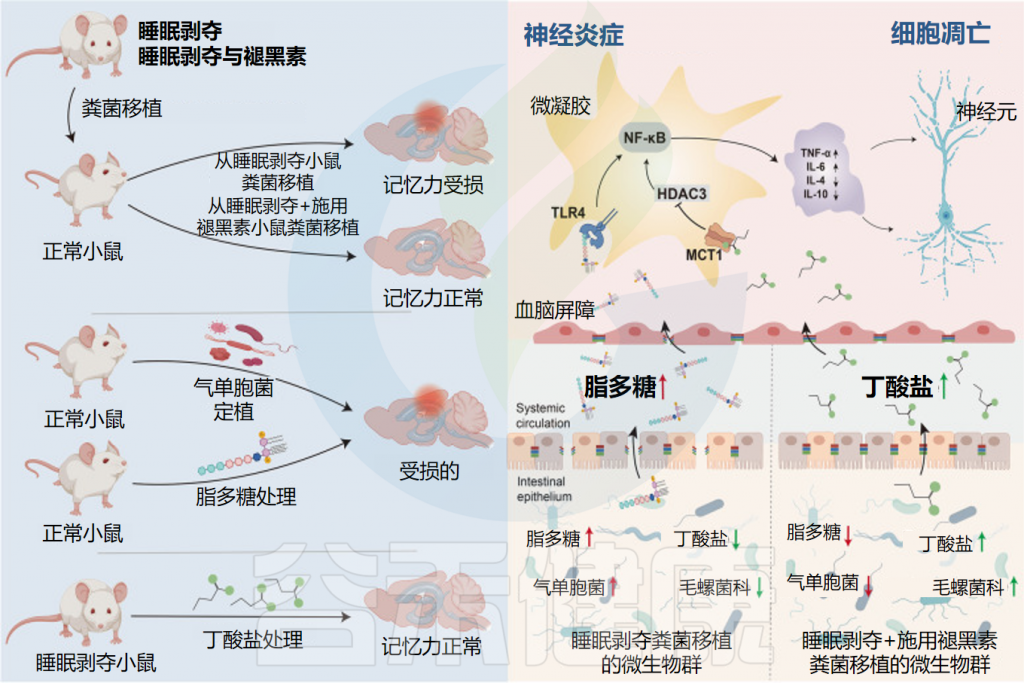
总体而言,在睡眠障碍患者中补充褪黑素可以重建肠道微生物群平衡和肠道屏障的完整性,恢复了肠道微生物群的丰富性和多样性。

Wang X,et al.Microbiome.2023
• 增加了有益菌的丰度
在属水平上,补充褪黑素增加了阿克曼氏菌、乳杆菌、拟杆菌和粪杆菌(这些已知的有益细菌可以降低炎症),并减少了影响结肠炎的气单胞菌。
显著增加了阿克曼氏菌的丰度
褪黑素显著增加了阿克曼氏菌(Akkermansia muciniphila)的丰度,这种细菌以其在肠道中的有益作用而闻名(例如,增加粘蛋白产生,保持屏障完整性)。
提高了产丁酸盐细菌的丰度
此外,褪黑素通过增加拟杆菌属、乳杆菌属、阿克曼氏菌属和粪杆菌属的丰度,提高了丁酸盐的水平,丁酸盐是肠道微生物群的重要有益代谢物之一。
• 重建肠道屏障完整性
褪黑素还通过恢复因睡眠障碍受损的杯状细胞数量、粘液产生和肠上皮细胞增殖,增加紧密连接蛋白(claudin-1、occludin、ZO-1)和含有半胱天冬酶募集结构域的蛋白9(CARD9)的表达来重建肠道屏障的完整性。
• 降低促炎细胞因子,增加抗炎物质
睡眠障碍也会导致全身产生促炎症状态。褪黑素通过降低促炎细胞因子水平(IL-1β、IL-6、IL-17、TNF-α)同时增加抗炎标志物(IL-5、IL-10、IFN-α、IL-22)来抵消这种影响。
作为一种假定的机制,褪黑素还会下调睡眠剥夺小鼠的TLR4,从而降低长期炎症反应的可能性。
褪黑素在减轻粘膜损伤和生态失调方面发挥着至关重要的作用。这些发现表明,褪黑素可以作为益生元来治疗睡眠障碍相关的肠道损伤,并帮助保持肠道微生物群的平衡。
需要注意的是,褪黑素抑制可能是导致肠道损伤和生态失调的罪魁祸首,而不是睡眠障碍本身造成的应激。
总之,外源性给予褪黑素可恢复由睡眠障碍引起的全身和肠道微生物群改变,这意味着褪黑素在根据健康状况调节微生物群落方面发挥着作用。

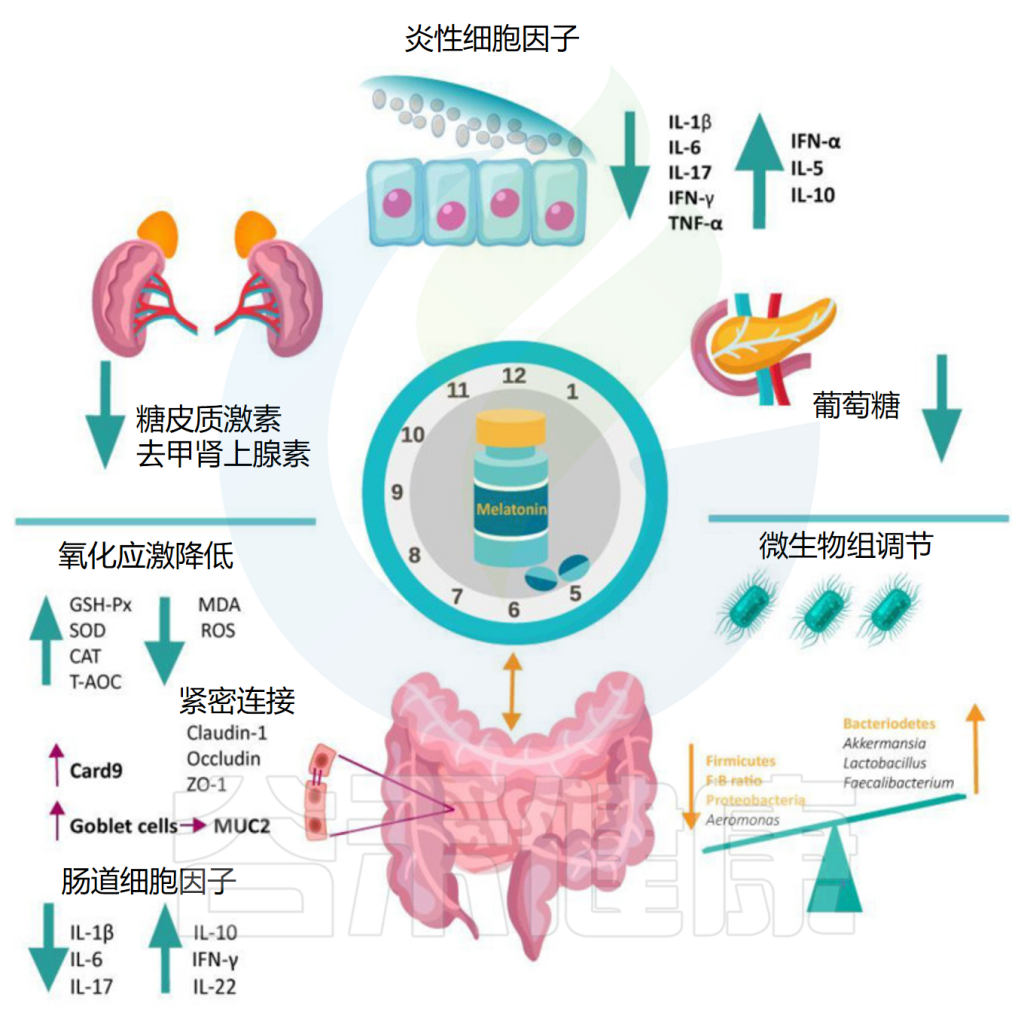
Iesanu MI,et al.Antioxidants (Basel).2022
褪黑素和肠道微生物群之间的相互作用对健康和疾病的各个方面都有潜在影响。大量临床和临床前研究证明了褪黑素对结肠炎的保护作用。
• 结肠炎患者体内褪黑素水平下降
测量了溃疡性结肠炎患者和健康对照的降结肠和乙状结肠中褪黑素的浓度。
与健康对照相比,溃疡性结肠炎患者的褪黑素水平急剧下降。值得注意的是,褪黑素浓度与组织学严重程度之间出现负相关。此外,溃疡性结肠炎患者中褪黑素生物合成途径中的关键酶AANAT和HIOMT的mRNA 水平显著低于健康对照。
这些数据表明溃疡性结肠炎患者的褪黑素水平下降,并且与疾病严重程度呈负相关,表明褪黑素可能参与溃疡性结肠炎的进展。
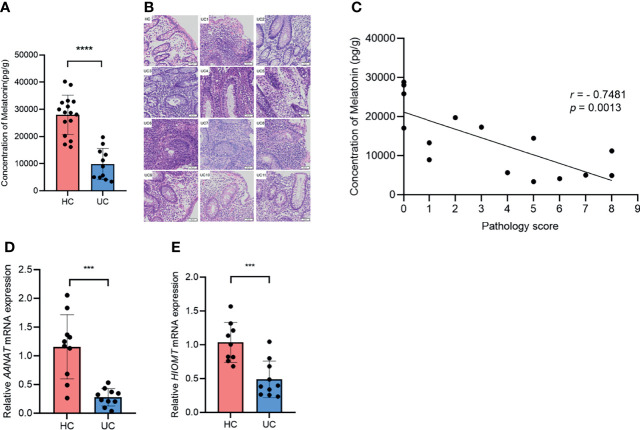
Zhao ZX,et al.Front Immunol.2022
(A)通过ELISA检测健康对照和溃疡性结肠炎患者中的褪黑素浓度;(B)结肠切片的代表性H&E染色(×20);(C)所有溃疡性结肠炎患者和健康对照的褪黑素浓度与组织学严重程度评分的相关性。
• 服用褪黑素可以减轻结肠炎
发现每日服用50毫克/公斤剂量的褪黑素治疗7天可显著改善恶唑酮诱发的小鼠结肠炎,体重减轻较少,结肠长度较长。
H&E染色显示,褪黑素治疗可预防肠道炎症,与对照组相比,褪黑素治疗导致CD11b+ Ly6G +中性粒细胞显著减少,并且炎症细胞因子的产生减少,例如TNF-α和Il-1β。
这些结果表明,褪黑素可以减轻恶唑酮诱发的结肠炎,炎症反应减少,肠道完整性提高。
• 服用褪黑素调节炎症性肠病的微生物组成
褪黑素改变微生物群组成的α和β多样性
Zhao ZX,et al.Front Immunol.2022
特定的变化与有益菌株的增加和有害菌株的减少有关。例如,褪黑素增加了瘤胃球菌科(Ruminococcaceae)和粪球菌属(Coprococcus)的水平,这两种细菌都是短链脂肪酸产生菌。
它还增加了双歧杆菌的含量,双歧杆菌作为益生菌在炎症性肠病中产生了积极的结果,以及乳杆菌的含量,乳杆菌是该疾病的另一种有前途的辅助疗法。
减少了条件性致病菌
相反,褪黑素给药后,肠道菌群显示出变形菌门显着减少,该门在炎症性肠病发病机制中发挥着重要作用。
链球菌属(Streptococcus)可能代表另一种被褪黑素下调的微生物并与疾病活动相关。另一项研究报告了脱硫弧菌、消化球菌科和毛螺菌科的减少。发现脱硫弧菌和溃疡性结肠炎之间存在明显关联。尽管消化球菌科在炎症性肠病中的研究较少,但在一些研究中与肠道炎症相关。
重要的是,所有这些细菌组成的变化都伴随着明显的临床症状增强——通过多种组织学方法和症状学评估进行量化。这可能表明至少在一定程度上通过微生物群调节来影响褪黑素的效果。
褪黑素在属水平上调节一些微生物群
Zhao ZX,et al.Front Immunol.2022
• 褪黑素有利于肠道屏障完整性
总的来说,就肠道微生物群而言,褪黑素不仅具有改变细菌种类组成的能力,而且还能够减少肠道细菌移位。事实上,在结肠炎模型中,褪黑素诱导紧密连接蛋白和闭合蛋白的上调,这些蛋白是肠道屏障的关键组成部分。
细菌易位是一种有害过程,可导致内毒素血症,与炎症性肠病活动呈正相关。
褪黑素对肠道微生物群的调节可能对于缓解结肠炎至关重要。
除此之外,褪黑素还可以逆转高脂肪饮食产生的大多数代谢、形态和肠道微生物组成变化。
• 褪黑素恢复高脂饮食导致的微生物变化
首先,褪黑素成功恢复了因高脂饮食而减少的微生物群多样性,改变了肠道微生物结构,使其类似于正常饮食的小鼠。与对照组相比,褪黑素增加了细菌数量,但它阻止了高脂饮食引起的细菌突然过度生长。
有趣的是,与仅接受高脂饮食的小鼠相比,接受褪黑素的高脂饮食小鼠和对照组的不同类群每日振荡之间存在相似性,证明褪黑素也可以恢复细菌节律性。
它还刺激疣微菌门,包括阿克曼氏菌——一种治疗代谢紊乱的有效益生菌。脱硫弧菌科(产生内毒素的细菌)、Alistipes和Anaerotruncus中的表达下调,这些细菌与肥胖相关。
• 褪黑素改善代谢紊乱,降低脂肪比例
在影响这些微生物组相关的同时,褪黑素显著改善了高脂饮食啮齿动物的代谢紊乱。褪黑素还降低总体重和内脏脂肪比例,促进棕色脂肪组织的产生和产热作用。它还降低炎症、脂肪生成基因表达以及胆固醇和甘油三酯水平。
此外,它重建了时钟基因表达和血清甘油三酯的正常昼夜节律变化,而这些变化被高脂饮食破坏了。它还通过降低血糖和增强胰岛素敏感性来增强葡萄糖代谢。对于肝脏,它可以对抗脂肪变性并抑制 NF-κB信号,该通路与非酒精性脂肪肝病有关。
褪黑素缓解脂质代谢异常的一个特殊机制与抑制大肠杆菌有关。研究人员在时差小鼠模型中研究了与代谢综合征相关的变化,这些小鼠表现出体重增加、回肠脂质摄取增加以及血管生成素样4(脂质代谢调节剂)的减少。同时,观察到大肠杆菌和脂多糖产量增加。褪黑素逆转了所有这些修饰,并且通过下调大肠杆菌和脂多糖的合成,抑制了LPS/TLR4/STAT3等通路,使脂质摄取减少。
肠道微生物群在肥胖和代谢综合征的发展中起着关键作用。褪黑素恢复这种复杂结构正常组成和功能的能力证明了其作为药物治疗这些病症的合理性。
!
注意
需要进一步的研究来充分了解褪黑素–肠道微生物轴对健康和疾病的机制和影响。
然而,它强调了考虑肠道微生物群和褪黑素相互作用在维持肠道健康和整体健康方面的重要性。
褪黑素作为体内最重要的激素之一,过低或过高的含量都会对人体产生一些不利影响。
▸ 褪黑素过低
失眠:褪黑素是调节睡眠的重要激素,过低的褪黑素水平会导致失眠和睡眠质量下降。
生物钟紊乱:褪黑素水平过低可能导致生物钟紊乱,影响日常作息和生理节律。
免疫功能下降:褪黑素具有免疫调节作用,过低的褪黑素水平会导致免疫功能下降,增加感染和疾病的风险。
心理健康问题:褪黑素与神经系统密切相关,低褪黑素含量可能与焦虑、抑郁等心理健康问题有关。
其他健康问题:一些研究表明,褪黑素含量过低可能与肥胖、糖尿病、心血管疾病相关。
▸ 褪黑素过高
通常情况下,人体不会出现褪黑素过高。一般都是在补充了外源性褪黑素的情况下导致体内褪黑素水平过高。

一项研究对2130名患者进行了随机对照试验,发现过量服用褪黑素导致褪黑素水平过高引起的不良事件很少。其中最常报告的不良事件是日间嗜睡、头痛、头晕和体温过低。
除此之外,有一小部分研究发现过高的褪黑素水平可能对性欲和性功能产生负面影响。
由于褪黑素的代谢率较高,补充外源性褪黑素通常被认为是安全且耐受性良好的,大多数负面影响要么在几天内自然消退,要么在停药后立即消退。
褪黑素的分解代谢很快
循环中的褪黑素主要在肝脏和大脑中分解代谢。一般来说,褪黑素的半衰期(即分解一半所需的时间)约为30-50分钟。这意味着褪黑素在体内的浓度会在数小时内迅速降低。
在肝细胞中,褪黑素通过细胞色素P4501A2 (CYP1A2) 进行80%的羟基化;然后,在肾脏中,它被磺基结合(占总分解代谢的70%至80%)或与葡萄糖醛酸结合(占总分解代谢的5%)。
CYP1A2确保肝脏分解代谢。即使在肝脏水平,也存在脱乙酰化和脱甲基化途径。脱乙酰后,褪黑素转化为5-甲氧基色胺,氧化后转化为5-甲氧基吲哚乙酸。
褪黑素对人体如此重要,但经常会因一些外部环境、生活作息或疾病状态导致内源性褪黑素分泌不足,这个时候就需要一些外源性褪黑素来补充。
补充外源性褪黑素也有一些注意事项,包括可用的剂量、最佳服用时间、禁忌症。
除了人体自身会分泌褪黑素外,许多食物中也存在一些天然褪黑素,尤其是植物性食品。
✦ 许多植物性食品中含有褪黑素
自从20世纪90年代中期在植物中首次发现褪黑素(“植物褪黑素”)以来,各种食用植物和草药中的褪黑含量不断被提及。
然而,其浓度范围广泛且不一致,取决于许多因素,例如品种、生长条件、发芽、收获和加工(例如烘烤、干燥)等。
尽管褪黑素存在于大多数植物部位,但植物的生殖器官中的含量通常较高,尤其是种子,可能有助于确保植物的生存并抵御环境压力。
值得注意的是,褪黑素在植物中的众多作用之一是刺激促进健康的植物营养素(如芥子油苷和多酚)产生。
褪黑素已被记录在下列植物性食品和饮料中:


Minich DM,et al.Nutrients.2022
✦ 动物食品中的色氨酸有助于转化成褪黑素
虽然有几个变量需要考虑,但一般来说,动物性食品中的褪黑激素含量相对植物性食品中较少。根据已发表的文献,牛奶和乳制品、鸡蛋、鱼和肉类(牛肉、羊肉、猪肉)含有一定水平的褪黑素。
相反,动物食品往往是比植物食品更好的膳食色氨酸来源,因此可能需要考虑将这些食物最终转化为大量的褪黑素。
如前所述,虽然一些天然食物含有褪黑素,但其含量较低,因此很难获得足够的治疗剂量褪黑素。必须强调的是,几乎所有褪黑素产品都涉及工业加工,因此可能导致一些潜在毒性。
褪黑激素补充剂有多种形式,包括片剂、胶囊、舌下片和液体制剂。
• 褪黑素可能产生副作用和依赖性
在临床应用中,据记录,过多的褪黑素或各种缓释剂型会产生副作用,例如第二天健忘症或“褪黑素宿醉”,发现睡了三到四个小时就睡不好,醒来后无法再入睡。长期高剂量服用褪黑素随着时间的推移,个人可能会产生依赖性。
注:具有某些基因型的人,例如褪黑激素受体1B(MTNR1B)基因多态性,如果补充褪黑素,可能需要监测糖化血红蛋白。
• 补充高剂量的褪黑素会导致体温过低
一项关键研究中,比较了多个剂量:生理剂量(0.3mg)、药理剂量(3mg)和0.1mg的低生理剂量。
研究发现补充0.3毫克/天褪黑素的数据最佳客观。生理剂量(0.3 毫克)可恢复睡眠效率,并将血浆褪黑素水平提高至成年早期的正常水平。药理剂量(3毫克)也能改善睡眠;然而,它会导致体温过低,并导致血浆褪黑素在白天一直保持升高状态。
• 一般补充0.5-3毫克/天为宜
临床上补充褪黑素的剂量通常为每日0.5-3毫克;然而,发现剂量取决于产品类型,在某些情况下较低剂量也同样有效。
剂量参数可能会根据健康状况、睡眠问题类型或相关神经病理学等因素而有所不同,因此还需要根据每位患者提供适当的、个性化的剂量。
• 睡前一小时服用效果较好
从时间角度来看,许多与睡眠相关的研究都表明在睡前三十到六十分钟补充褪黑素效果较好;然而,一些研究表明,提前四个小时服用即可有效。
建议在黑暗环境或较弱光刺激下服用褪黑激素,从而模拟基于明暗模式的生理动力学和昼夜节律。
根据已发表的报告,口服褪黑素大多被认为是安全的,然而,在某些特定情况下可能需要进一步的临床监督。
• 一些药物会影响褪黑素的代谢
早期研究已发现,大部分褪黑素通过细胞色素CYP1A2代谢,小部分通过CYP1A1、CYP1B1和CYP2C19进行较少的代谢活动。
因此,影响这些酶途径的药物将影响褪黑素的代谢。褪黑素与一种或多种药物同时服用时应谨慎;否则,可能会导致不良副作用(如极度镇静)。
例如,最著名的相互作用之一是褪黑素与抗抑郁药物氟伏沙明的相互作用。该药物是一种已知的CYP1A2抑制剂,可通过减少褪黑素的降解来增强褪黑激素水平。同样,咖啡因也通过CYP1A2代谢,并可增加褪黑素水平。
总之,虽然还不全面,但褪黑素可以与具有血液稀释、降血糖、降血压、抗惊厥、镇静、抗抑郁或免疫抑制活性的药物、营养素或草药相互作用或受到影响。
褪黑素的代谢和活性可能会受到许多饮食、补充剂和药物的潜在影响,所有这些都说明了这样一个事实:每个人对褪黑素的个性化反应存在差异,具体取决于他们的饮食和医疗背景。
由于缺乏安全性数据,不建议怀孕或哺乳期的女性补充褪黑素。然而,有一些迹象表明褪黑素在这两个阶段可能都有好处。因此,让这些女性咨询了解患者个性化需求的健康专业人士是关键。同样,被诊断患有任何疾病的人应咨询其健康专业人员并接受医疗监督。
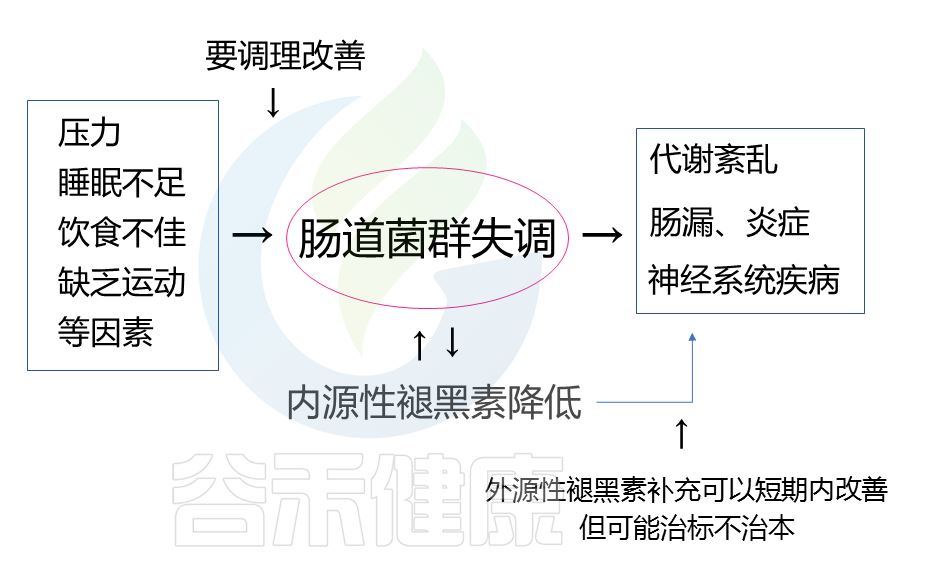
温馨提醒
调查发现,有的褪黑素产品月销已超过3万件,说明需要使用褪黑素来帮助改善睡眠的人已不在少数。需要注意的是,虽然补充外源性褪黑素可以在一定程度上改善睡眠质量、代谢健康或降低焦虑,但服用褪黑素存在的副作用使其不能成为长久的选择。
而且补充褪黑素主要是针对一些因工作昼夜颠倒导致的内源性褪黑素分泌不足造成的睡眠障碍,对于其他原因造成的失眠可能效果一般。我们额外补充的这些褪黑素,并不能促进身体去分泌更多的褪黑素。如果停用褪黑素,可能睡眠情况还会回到原样,并不会解决本质问题。
重点还是要从自身生活习惯出发,改善饮食,调节作息规律,增加体育锻炼并定期体检,及时了解自身健康状况。肠道菌群与很多影响睡眠的因素相关,例如压力、消化等,调节肠道菌群可以更全面地从根本上改善睡眠障碍。
改善内源性褪黑素的措施
除此之外,调节内源褪黑素的措施有以下几种:
•控制光照暴露,睡前半小时不玩手机
光线会影响褪黑素的分泌,晚上避免暴露于强烈的蓝光,尤其是来自电子设备的蓝光。蓝光会抑制褪黑素的分泌,影响睡眠质量。
•维持规律的睡眠时间
建立健康的睡眠习惯,如果不是因为工作导致的昼夜颠倒,尽量每天保持规律的睡眠时间,避免熬夜或睡眠不足。
•营造舒适的睡眠环境
保持安静、黑暗和凉爽的睡眠环境,可以使用遮光窗帘、耳塞或眼罩等辅助工具,有助于提高睡眠质量。
•避免过度应激
减少压力和焦虑,通过放松技巧如深呼吸、冥想和瑜伽等来缓解压力,有助于促进褪黑素的分泌。
•适度运动
进行适度的有氧运动,如散步、跑步或游泳等,可以提高睡眠质量和褪黑素的分泌。
•饮食调整
摄入富含色氨酸的食物,如禽肉、鱼类、坚果和豆类,色氨酸是合成褪黑素的必需物质。此外,可以适量摄入富含维生素B6、钙和镁的食物,这些营养素有助于褪黑素的合成和释放。
褪黑素在临床上有多种应用,以下是一些常见的褪黑素临床应用。
•睡眠障碍
褪黑素补充剂通常用于治疗睡眠障碍,如失眠、睡眠时相延迟综合征和非24小时睡眠觉醒障碍。它可以帮助调节睡眠-觉醒周期并提高睡眠质量。治疗睡眠障碍的剂量通常为0.3毫克至10毫克,睡前30分钟至2小时服用。
•时差反应
褪黑素可用于缓解时差反应症状,时差反应是因跨越多个时区旅行而导致的睡眠-觉醒周期暂时中断的症状。
在睡前适当的时间服用褪黑激素,可以帮助调整人体的生物钟,有利于更快地适应新的时区。
•轮班工作睡眠障碍
夜班或轮班工作的人经常会遇到睡眠困难和昼夜节律紊乱。褪黑素补充剂可用于帮助调节睡眠模式并改善白天的睡眠质量。
•神经退行性疾病
褪黑素已被研究其对阿尔茨海默病、帕金森病和亨廷顿舞蹈病等神经退行性疾病的潜在治疗作用。它具有抗氧化和抗炎的特性,可能有助于保护神经元并减轻神经退行性过程。然而,需要进一步研究以确定其功效和最佳剂量。
•情绪障碍
褪黑素补充剂在治疗重度抑郁症和季节性情感障碍等情绪障碍方面显示出良好的前景。它可能有助于调节昼夜节律、改善睡眠并缓解抑郁症状。
治疗情绪障碍的剂量可能会有所不同,咨询医疗保健专业人士很重要。
•癌症
褪黑素已被研究其潜在的抗癌特性。它具有抗氧化、抗炎和免疫调节作用,可能可以抑制肿瘤生长并增强癌症治疗的有效性。然而,需要更多的研究来确定其在癌症治疗中的功效和最佳用途。
关于褪黑素与肠道微生物群相互作用的新兴研究具有重要的临床意义,并为治疗干预带来了希望。
通过益生菌、益生元或粪菌移植调节肠道微生物群组成和功能可能与补充褪黑素在促进肠道健康和治疗炎症性肠病、肠易激综合征和代谢紊乱等疾病方面具有协同作用。
以下是有关褪黑素-肠道微生物轴未来前景的一些要点。
•时间生物学和个性化医疗
褪黑素和肠道微生物群之间的相互作用为个性化医疗增加了时间生物学的维度。考虑褪黑素产生的昼夜节律以及肠道微生物群组成和功能的昼夜变化,有助于优化针对褪黑激素-肠道微生物群轴的干预措施的时间和剂量。
•微生物代谢物和褪黑激素衍生物
肠道微生物群可以将褪黑素代谢成各种代谢物,其中一些可能具有不同的生物活性。探索这些褪黑激素代谢物的作用及其与肠道微生物群的相互作用可以发现新的治疗途径。
•营养干预
饮食在塑造肠道微生物群组成和功能方面起着至关重要的作用。未来的研究可以调查特定饮食成分,例如色氨酸(褪黑激素的前体)和多酚对褪黑激素-肠道微生物群轴的影响。
了解影响褪黑素产生和肠道微生物群的饮食因素可以为肠道健康的营养干预提供信息。
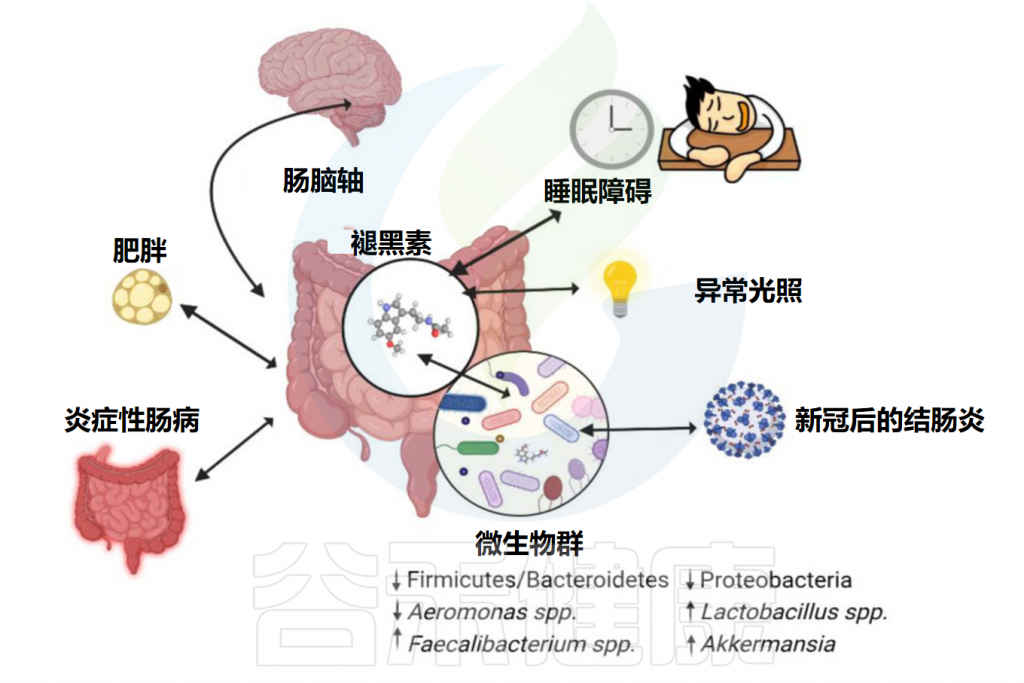

Iesanu MI,et al.Antioxidants (Basel).2022
•挑战和未来方向
尽管研究数量不断增加,但该领域仍存在一些挑战和未来方向。需要对肠道微生物群和褪黑素测量的研究方法进行标准化,以确保研究之间的一致性和可比性。
需要进行长期临床试验来评估针对褪黑激素-肠道微生物轴的干预措施的安全性、有效性和最佳剂量。
主要参考文献
Iesanu MI, Zahiu CDM, Dogaru IA, Chitimus DM, Pircalabioru GG, Voiculescu SE, Isac S, Galos F, Pavel B, O’Mahony SM, Zagrean AM. Melatonin-Microbiome Two-Sided Interaction in Dysbiosis-Associated Conditions. Antioxidants (Basel). 2022 Nov 14;11(11):2244.
Markowska M, Niemczyk S, Romejko K. Melatonin Treatment in Kidney Diseases. Cells. 2023 Mar 8;12(6):838.
Minich DM, Henning M, Darley C, Fahoum M, Schuler CB, Frame J. Is Melatonin the “Next Vitamin D”?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients. 2022 Sep 22;14(19):3934.
Repova K, Baka T, Krajcirovicova K, Stanko P, Aziriova S, Reiter RJ, Simko F. Melatonin as a Potential Approach to Anxiety Treatment. Int J Mol Sci. 2022 Dec 19;23(24):16187.
Moon E, Kim K, Partonen T, Linnaranta O. Role of Melatonin in the Management of Sleep and Circadian Disorders in the Context of Psychiatric Illness. Curr Psychiatry Rep. 2022 Nov;24(11):623-634.
Zhao ZX, Yuan X, Cui YY, Liu J, Shen J, Jin BY, Feng BC, Zhai YJ, Zheng MQ, Kou GJ, Zhou RC, Li LX, Zuo XL, Li SY, Li YQ. Melatonin Mitigates Oxazolone-Induced Colitis in Microbiota-Dependent Manner. Front Immunol. 2022 Jan 18;12:783806.
Wang X, Wang Z, Cao J, Dong Y, Chen Y. Gut microbiota-derived metabolites mediate the neuroprotective effect of melatonin in cognitive impairment induced by sleep deprivation. Microbiome. 2023 Jan 31;11(1):17.
Miranda-Riestra A, Estrada-Reyes R, Torres-Sanchez ED, Carreño-García S, Ortiz GG, Benítez-King G. Melatonin: A Neurotrophic Factor? Molecules. 2022 Nov 10;27(22):7742.
Zhang B, Chen T, Cao M, Yuan C, Reiter RJ, Zhao Z, Zhao Y, Chen L, Fan W, Wang X, Zhou X, Li C. Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer’s Disease and Obesity. Front Immunol. 2022 May 10;13:900132.

谷禾健康
不知道大家有没有这样的体验:紧张时会想上厕所,伤心时会食欲不振。任何情绪变化,好像都会反映在消化系统。
与此同时,你相不相信一个人的肠道微生物可以影响其认知、性格、气质、社交情况、甚至是责任心。
有大量证据表明神经系统与肠道微生物的组成和功能有关。目前,已经描述了各种肠-脑串扰途径,包括通过迷走神经途径的免疫、内分泌和神经回路。此外,中枢神经系统控制肠道菌群的失衡,构成双向通讯系统。
肠道菌群失衡,也许是导致精神问题的潜在原因。一些研究发现,肠道菌群改变(生态失调)与阿尔茨海默病、自闭症和帕金森病等神经精神疾病以及焦虑、抑郁和认知功能障碍等其他心理疾病有关。
肠道菌群可以分泌神经递质,例如乙酰胆碱、γ-氨基丁酸(GABA)和色氨酸;此外肠道中有数百万个神经元,可以通过神经递质向大脑发送信号。
肠脑轴功能障碍被认为是精神障碍的病理生理学;因此,恢复受干扰的微生物生态系统为管理或预防这些神经系统疾病提供了一种新颖且有前途的方法。
本文对人类肠道微生物群失调与几种精神和心理疾病之间联系进行了概述。此外,还展示了一些使用精神药物与调节肠道微生物相结合的方式以改善精神疾病或心理障碍的干预措施。肠道微生物群在未来可能成为缓解压力与治疗精神疾病的新工具。
人类肠道含有多样化的微生物群落,据估计,肠道中的微生物数量可以达到数万亿个。微生物群的密度在肠道不同部位也有所不同,结肠和直肠的微生物密度较高,而小肠的微生物密度较低。
肠道微生物由多种微生物类群组成,包括细菌、病毒、真菌、古细菌和原生动物,其中最主要的是细菌。
•古细菌
在健康的人类肠道中,古细菌的数量很少,其中史密斯产甲烷短杆菌(Methanobrevibactersmithii)是最常见的物种。
•真菌
肠道中最常检测到的真核微生物是真菌,例如念珠菌(Candida)和酵母菌(Saccharomyces)。这些真菌维持生态和免疫肠道微生物组的平衡。
•病毒
人体病毒组主要由噬菌体组成,它们在肠道中的作用是作为细菌组的调节剂。
•原生生物
一些原生动物,例如芽囊原虫属(Blastocystis),已在人类肠道微生物群中检测到,它们的存在通常与胃肠道疾病有关。
✦细菌是人类肠道中最常见的微生物
细菌是人体肠道中最常见的微生物,一般属于以下8个门:放线菌门 (Actinobacteria)、芽孢杆菌门 (Bacillota)(又名厚壁菌门)、拟杆菌门 (Bacteroidetes)、弯曲菌门 (Campylobacterota)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、热脱硫杆菌门(Thermodesulfobacteriota)和疣微菌门(Verrucomicrobia)。
下图显示了健康人肠道微生物群中主要的门、科和属。
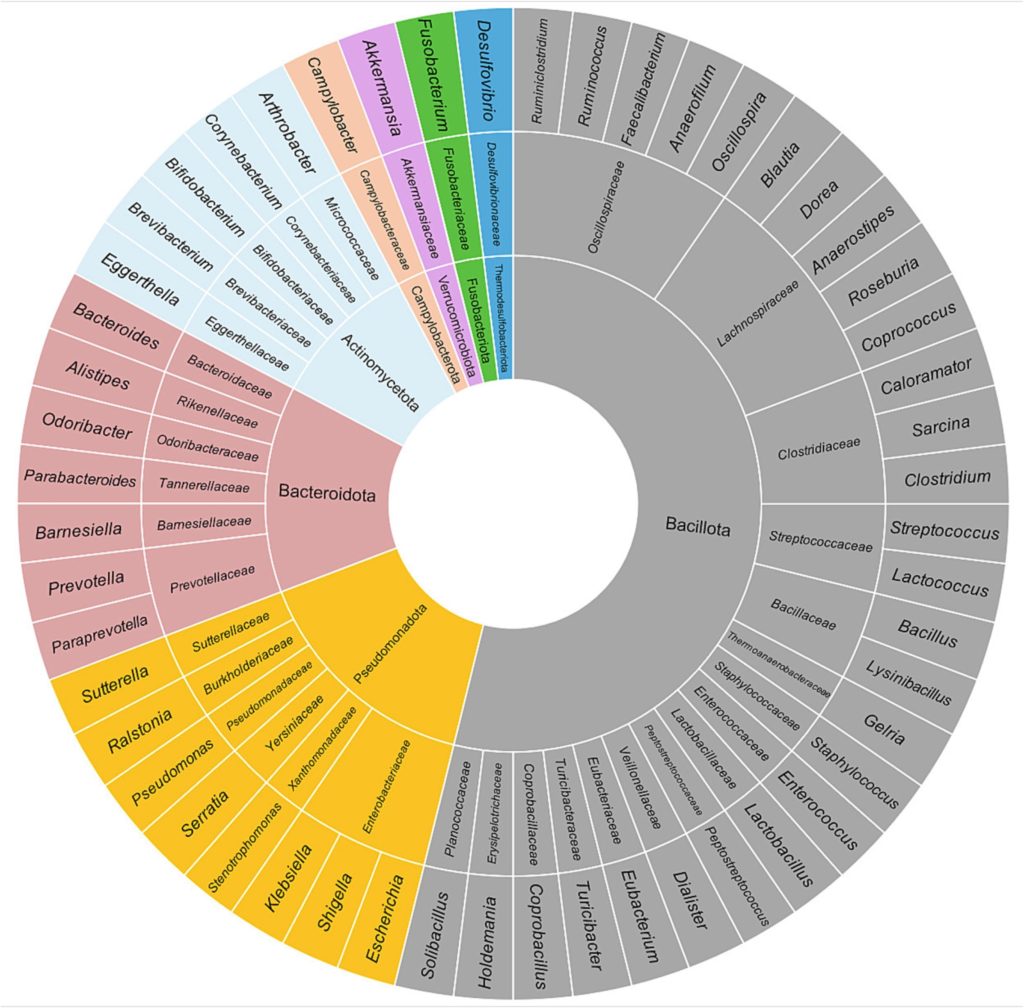
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
✦肠道不同部位的微生物群组成具有差异
肠道区室中的微生物有特定的空间分布。上消化道中最主要的是孪生球菌属(Gemella)、韦荣氏球菌属(Veillonella)、奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、链球菌属(Streptococcus)、普雷沃氏菌属(Prevotella)、假单胞菌属(Pseudomonas)和放线菌属(Actinomyces)。
而在下消化道中则有粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)和瘤胃球菌属(Ruminococcus)。
十二指肠
研究发现人类十二指肠粘膜富含芽孢杆菌(Bacillus)、Solibacillus、赖氨酸芽孢杆菌(Lysinibacillus)、微小杆菌属(Exiguobacterium)、海洋芽胞杆菌属(Oceanobacillus)和类芽孢杆菌(Paenibacillus)。
空肠
在空肠中,变形菌门和厚壁菌门是最常见的门,而埃希氏菌属、乳杆菌属和肠球菌属是空肠中最常见的属。
回肠
链球菌属(Streptococcus spp.)、大肠杆菌(Escherichia coli)和梭菌属(Clostridium spp.),是回肠中最常见的物种。
结肠
结肠是一个厌氧环境,以拟杆菌门、放线菌门和厚壁菌门以及毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)、拟杆菌科(Bacteroidaceae)和理研菌科(Rikenellaceae)为主,以及已鉴定的主要细菌属乳杆菌属、双歧杆菌属和粪杆菌属。
研究了不同结肠区域的细菌属优势,他们发现乙状结肠中存在拟杆菌属、肠球菌属。近端结肠和远端结肠为粪杆菌和大肠杆菌。
阑尾中微生物多样性较高,以放线菌门、梭杆菌门、变形菌门、拟杆菌门和厚壁菌门为主;以及毛螺菌科、肠杆菌科、拟杆菌科、梭杆菌科和双歧杆菌科。
尽管人类肠道微生物群的组成因年龄、营养和抗生素使用等因素而在分类学和功能上存在差异,但人类肠道微生物群主要是由乳杆菌属、芽孢杆菌属、梭菌属、肠球菌属、瘤胃球菌属、粪杆菌属、罗氏菌属(Roseburia)、经黏液真杆菌属(Blautia)、Dorea属、拟杆菌属、普雷沃氏菌属、双歧杆菌属和埃希氏菌属。
✦肠道微生物对于消化非常重要
肠道微生物群为人类宿主提供了多种积极影响,包括免疫和代谢功能。肠道微生物是消化的关键调节者,通过营养物质的吸收以及多种代谢物的合成,包括脂质、氨基酸、维生素和短链脂肪酸。
✦肠道微生物有助于预防病原体感染
此外,肠道微生物群通过多种竞争过程在预防病原菌感染方面发挥着关键作用,并且还有助于维持肠上皮的完整性。
✦肠道微生物产生的化合物可作为信号分子
肠道微生物群从未消化的食物中产生多种分泌化合物。其中一些可以作为细菌间通讯的信号分子,影响细菌调节、稳态、生长、毒力和生物膜形成等。
色氨酸代谢物
细菌还可能分泌其他生物活性化合物,包括色氨酸分解代谢物、短链脂肪酸、多胺和组胺。色氨酸的代谢产物[5-羟色胺(血清素)、犬尿氨酸和吲哚]与生理和神经元活动有关。
吲哚
吲哚调节肠促胰岛素的分泌,调节肠道屏障通透性,并且可以作为微生物和宿主细胞之间细胞间通讯的信号分子。此外,吲哚及其衍生物被描述为神经炎症的抑制化合物。
短链脂肪酸
最重要的定量代谢物是由微生物降解不可消化的膳食纤维、蛋白质和糖蛋白产生的短链脂肪酸。如丁酸盐、乙酸盐和丙酸盐,可以作为信号分子,局部调节从十二指肠到结肠的肠道功能,并且通过肠内分泌细胞,它们还可以控制肝脏、肌肉和大脑的代谢,影响肠道功能及宿主能量稳态。
此外,短链脂肪酸通过诱导神经炎症反应呈现神经活性特性。短链脂肪酸是强大的表观遗传调节剂,控制DNA甲基化遗传物质的可及性并抑制组蛋白脱乙酰化。
该机制依赖于10-11易位 (TET) 蛋白,该蛋白催化胞嘧啶残基羟基化为5-羟甲基胞嘧啶,介导主动DNA去甲基化。确定丁酸盐诱导前额皮质中许多行为相关基因的变化,特别是影响涉及神经元兴奋或抑制的基因。几种兴奋性神经递质和神经元激活标记基因的减少,以及抑制性神经递质基因的增加表明丁酸盐促进抑制途径转录物的转录。
✦细菌代谢产物会影响神经发育
最近的研究表明,细菌代谢产物会影响神经发育。一些研究人员还报道了短链脂肪酸影响神经发生基因的表达。
使用无微生物的斑马鱼模型,观察到无微生物培养的胚胎中神经基因表达显著下降,并通过添加斑马鱼代谢物重新建立了该模型,识别出超过300个下调的基因。
基因分析表明,这些基因参与重要的神经发育途径,包括转录调控和Wnt信号传导。事实上,Wnt信号通路在发育和疾病中发挥着重要作用,可以推测其调控与多细胞真核生物的细菌定植共同进化。
下图展示了肠道微生物群合成的一些关键神经递质及其与心理和精神疾病的关联。这些神经活性化合物通过内在或外在传入神经通路将信息从肠腔传输到肠神经系统、肠神经胶质细胞和中枢神经系统。
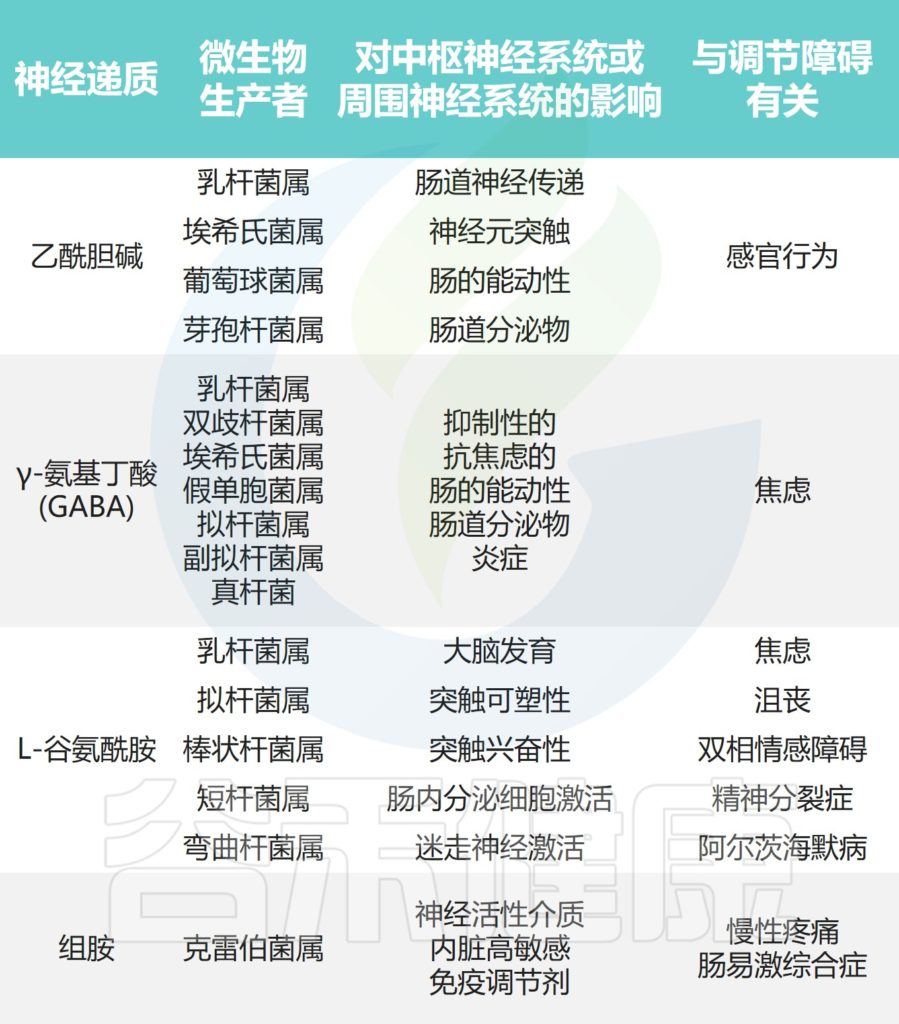

Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
阿尔茨海默病(AD)是一种慢性神经退行性疾病,其中记忆和执行功能进行性丧失,与突触损伤和神经损失有关,主要发生在海马体和大脑皮层。
多项研究已明确β-淀粉样肽(Aβ)在阿尔茨海默病中的作用。最近的研究表明,细菌来源的淀粉样蛋白,例如curli、Csg A、tau、TasA、FapC和酚溶性调节蛋白,在Aβ寡聚体的聚集和促进错误折叠中发挥作用。
细菌淀粉样蛋白通过与Toll样受体2相互作用激活宿主免疫系统,诱导促炎介质刺激大脑中神经元淀粉样蛋白的产生。
•肠道微生物失调与阿尔兹海默病存在关联
其他证据表明肠道微生物群失调与阿尔茨海默病的早期阶段有关,导致细胞因子分泌增强、免疫衰老、神经炎症和氧化应激。
此外,肠道微生物失调会诱导脂多糖的分泌,从而破坏胃肠道通透性和血脑屏障,调节炎症途径,促进神经炎症和认知能力下降,并导致阿尔茨海默病中的神经元死亡。
在大鼠中,腹膜脂多糖给药导致炎症因子(例如IL-1、IL-6和TNF-α)水平升高,表明微生物组在阿尔茨海默病先天免疫反应的启动中发挥作用。
•阿尔兹海默病中短链脂肪酸水平降低
研究表明,阿尔茨海默病小鼠的微生物群组成和多样性受到干扰,短链脂肪酸水平降低,这预示着30多种代谢途径的改变,这可能与淀粉样蛋白沉积有关。
肠道菌群失调可能会增加氧化三甲胺(TMAO)浓度,这与不同的功能有关,例如β-淀粉样蛋白的形成、外周免疫反应的激活和氧化应激。此外,还与肠粘膜屏障功能障碍、血脑屏障通透性以及胆汁酸和胆固醇进入大脑的通道增加有关。
•阿尔茨海默病患者体内促炎菌群比例增加
研究发现阿尔茨海默病患者中大肠杆菌/志贺氏菌等促炎菌群的比例增加,而直肠真杆菌(eubacterium rectale)、霍氏大肠杆菌(E.hallii)、普拉梭菌(F. prausnitzii)和脆弱拟杆菌等产生丁酸的细菌则减少。
这些细菌与外周炎症状态有关,这是轻度认知障碍(MCI)和脑淀粉样变性患者的典型症状。
注:淀粉样脑血管病主要是由淀粉样物质在软脑膜以及大脑皮质小动脉中层沉积所导致的疾病,多见于80岁以上的老年人,可能会导致血管壁受损。
•阿尔茨海默病患者肠道微生物多样性较低
据报道阿尔茨海默病患者肠道菌群的微生物多样性较低,厚壁菌门和双歧杆菌种类减少。
此外,发现门水平上拟杆菌门细菌成员增加,放线菌门减少,以及科水平上瘤胃球菌科、肠球菌科和乳杆菌科增加,毛螺菌科、拟杆菌科和韦荣氏菌减少。
促炎细菌类群增加,同时产生丁酸盐的细菌减少,例如丁酸弧菌(B.proteoclasticus和B.Hungatei)、梭菌属、真杆菌属(E.Hallii、E.rectal和E.eligens)、普拉梭菌和罗斯拜瑞氏菌 (R.hominis)。
几种精神障碍疾病中的肠道菌群失调
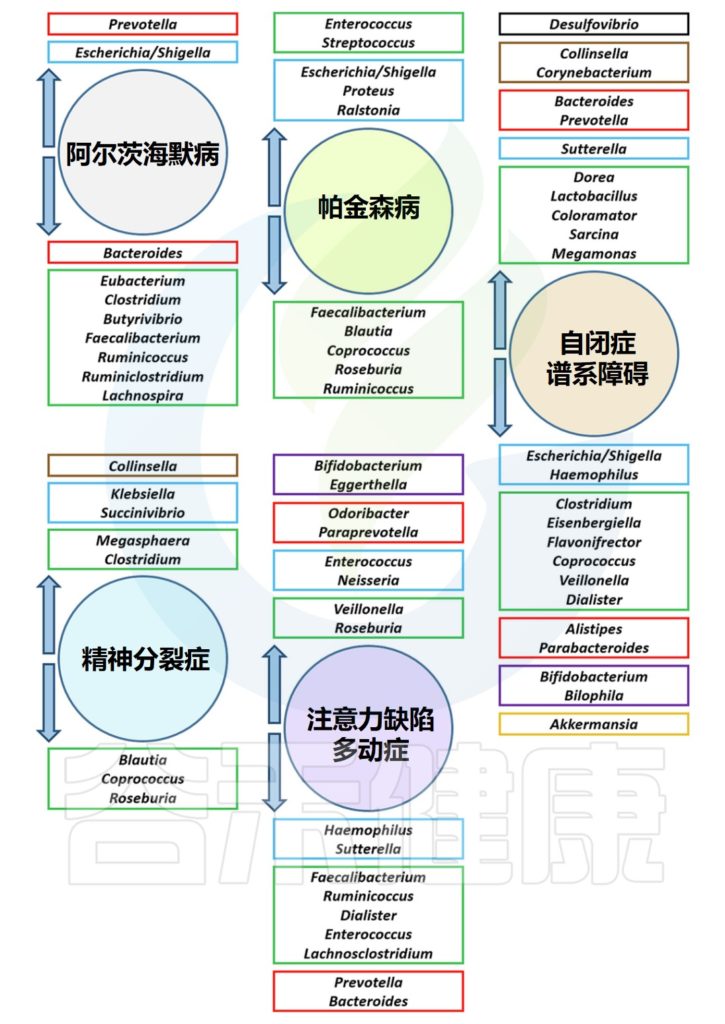
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
自闭症谱系障碍(ASD)是一种大脑发育障碍,其特征是刻板行为以及沟通和社交互动缺陷。
注:儿童自闭症是儿童精神类疾病当中最为严重的一种。
自闭症谱系障碍的确切病理学和病因很难确定,研究重点是调查遗传原因、免疫系统失调、环境毒物暴露以及肠道微生物群的改变。
•自闭症儿童的肠道微生物多样性较高
据报道自闭症儿童的肠道微生物多样性较高。自闭症谱系障碍样本中最常见的属如下:
拟杆菌属(Bacteroides),
脱硫弧菌属(Desulfovibrio),
柯林斯氏菌属(collinsella),
棒状杆菌属 (Corynebacterium),
乳杆菌属(Lactobacillus),
普雷沃氏菌属(Prevotella),
萨特氏菌属(Sutterella),
八叠球菌(Sarcina),
罗氏菌属(Roseburia),
粪杆菌属(Faecalibacterium),
巨单胞菌(Megamonas),
Caloramator,
Dorea;
此外以下属的存在减少:
双歧杆菌(Bifidobacterium) ↓↓↓
另枝菌属(Alistipes) ↓↓↓
嗜胆菌属(Bilophila) ↓↓↓
韦荣氏球菌属(Veillonella) ↓↓↓
阿克曼菌(Akkermansia) ↓↓↓
粪球菌属(Coprococcus) ↓↓↓
埃希氏杆菌属-志贺氏杆菌 ↓↓↓
梭菌属(Clostridium) ↓↓↓
艾森伯格氏菌(Eisenbergiella) ↓↓↓
嗜血杆菌属(Haemophilus)↓↓↓
Dialister ↓↓↓
Parabacteroides ↓↓↓
Flavonifractor ↓↓↓
这些发现强烈表明肠道微生物群失调与自闭症行为表现之间存在联系。
•有害菌会产生神经毒素影响自闭症
在自闭症行为表现患者中发现双歧杆菌丰度较低,而双歧杆菌是产生GABA神经递质的关键,双歧杆菌丰度过低会导致焦虑、认知缺陷和行为障碍。
产生神经毒素的艰难梭菌和溶组织梭菌的积累与自闭症谱系障碍症状相关。这些释放的有毒分子会影响血清素信号传导,可能导致自闭症谱系障碍行为模式,例如社交能力下降、对疼痛的反应减弱、语言异常以及自虐或重复行为。
受自闭症行为表现影响的个体表现出其他潜在有毒化合物水平的改变,例如抑制多巴胺-β-羟化酶的对甲酚和对甲酚硫酸盐。此外,在受自闭症谱系障碍影响的个体中检测到梭菌衍生的代谢物3-(3-羟基苯基)-3-羟基丙酸增加,这可能反映了儿茶酚胺代谢的改变。
•短链脂肪酸对自闭症的作用存在矛盾结果
短链脂肪酸在自闭症谱系障碍中的作用存在矛盾的结果。丙酸盐会诱导小胶质细胞激活、神经毒性细胞因子产生、基因表达改变、海马组织学异常和神经行为异常,例如重复动作和社交互动受损。
然而,丁酸盐对一种自闭症谱系障碍样小鼠模型的社交和重复行为具有有益影响。丁酸盐改善血脑屏障的不渗透性可能是丁酸盐可以恢复丙酸盐诱发的自闭症样疾病异常的另一种机制。
帕金森病(PD)是老年人中常见的一种痴呆症,其主要疾病症状包括神经炎症、中脑多巴胺能神经元丧失以及伴有非运动症状的异常运动。
•微生物失调引起的炎症可能导致帕金森病发展
一些研究人员认为,微生物群失调引起的炎症反应可能会导致帕金森病病理学的发展或恶化。这些反应可以促进脂多糖和α-突触核蛋白在肠道和大脑中的积累,并且由于促炎细菌活性导致氧化应激增加,从而促进α-突触核蛋白病理学通过迷走神经从头侧向尾侧区域扩散。
•帕金森病患者体内短链脂肪酸显著减少
另一方面,微生物短链脂肪酸可以防止肠粘膜通透性增加,从而减少细菌移位。帕金森病中短链脂肪酸显著减少。
短链脂肪酸在帕金森病病理学中的作用尚未完全阐明,报道短链脂肪酸的消耗导致肠神经系统中路易体的形成;相反,有研究表明短链脂肪酸能够降低血脑屏障的通透性。
注:路易体主要是以帕金森病为代表的脑门特征性标志物,患者常常会出现功能障碍。
考虑到短链脂肪酸缺乏与神经炎症和小胶质细胞激活以及便秘、肠漏和结肠炎症等胃肠道特征有关,这些研究结果支持了这样的假设:短链脂肪酸缺乏可能是帕金森病的病因。
•帕金森病患者有抗炎作用的菌群减少
帕金森病患者经常出现属于乳杆菌科、巴氏杆菌科和肠球菌科的某些细菌种类水平升高。
此外发现,帕金森病患者粪便和粘膜中产生抗炎丁酸的细菌水平显著降低(普雷沃氏菌、布氏菌、粪球菌属和罗氏菌属),以及粪杆菌属的水平显著降低。
此外,像罗尔斯通氏菌(Ralstonia)这样的促炎细菌在帕金森病患者的肠粘膜中更为丰富。
拓展
基于肠杆菌科细菌滴度与帕金森病症状严重程度之间的正相关性,这些作者认为肠道微生物群可能与帕金森病表型有关。
相关分析显示疾病严重程度和帕金森病持续时间与纤维素降解剂呈负相关,但与致病生物呈正相关,可能导致短链脂肪酸产生减少以及神经毒素和内毒素增加,可能与帕金森病病理学的发展有关。
此外,普雷沃菌科丰度的降低和乳杆菌科丰度的增加与胃饥饿素浓度的降低有关,胃饥饿素是一种与维持正常多巴胺功能有关的肠道激素,帕金森病患者的胃饥饿素分泌发生了改变。
精神分裂症是一种复杂的精神障碍,患者对现实的理解异常,经常出现焦虑和严重抑郁症状。
这种疾病的起源是有争议的,表明是遗传起源。然而,值得注意的是,通过表观遗传学机制,如神经传递基因甲基化、核苷酸修饰或非编码RNA的作用,一些环境因素可能在其易感性和疾病的发展中发挥作用。
•肠道菌群代谢物影响精神分裂症风险
短链脂肪酸、色氨酸分解代谢物和神经递质(GABA、谷氨酸)的差异被称为精神分裂症相关的肠脑模块。
微生物产生的多巴胺与精神分裂症有关,而与精神分裂症相关的胃肠道炎症增加强烈表明肠道微生物群可能在患精神分裂症或其表现的风险中发挥作用。
•精神分裂症患者肠道微生物群显著改变
研究表明抗生素治疗引起的肠道微生物群失调与精神分裂症的发病率之间存在直接关系。精神分裂症患者中巨球型菌属、琥珀酸弧菌属、梭菌属、柯林斯氏菌属、甲烷短杆菌属和克雷伯菌属的丰度显著增加,而与健康人相比,精神分裂症患者中经黏液真杆菌属、粪球菌属和罗氏菌属的滴度下降。
•抗精神病药物治疗后肠道微生物群发生改变
几项研究已经确定抗精神病药物治疗与肠道微生物群之间的联系。精神分裂症患者在接受抗精神病药物治疗后发现微生物群丰度发生了显著变化。
在其他研究中,接受抗精神病药物治疗的患者的厚壁菌门与拟杆菌门的比例逐渐增加,与体重指数的上升相关。此外,接受治疗的个体的肠道微生物群富含短链脂肪酸和血清素代谢的基因。
注意缺陷与多动障碍(ADHD)是一种神经发育障碍,其特征是高度多动冲动和注意力问题。尽管可能涉及环境和遗传因素,一些证据表明注意缺陷与多动障碍的发展或症状可能与饮食成分对肠道微生物组的调节有关。
•ADHD儿童体内有害菌丰度较高,有益菌较少
最近发现,食用加工饮食的注意缺陷与多动障碍儿童体内有害细菌(如肠杆菌、大肠杆菌和梭菌菌株)的丰度明显较高,而有益细菌(如双歧杆菌和瘤胃球菌菌株)的丰度明显较低。
食用加工食品的注意缺陷与多动障碍患者的肠道微生物群α多样性和短链脂肪酸水平显著低于对照组,研究人员认为不平衡的饮食会扰乱结肠微生物平衡,并可能成为多动症患病的潜在风险因素。
•患者肠道菌群失衡影响激素和神经递质水平
宿主-微生物组的相互作用对激素和神经递质水平产生影响,被认为与注意缺陷与多动障碍的病理生理学有关。肠道菌群失调加上持续接触微生物病原体引起的免疫功能障碍可能会导致受影响的多动症患者出现过度活跃的行为。
肠道菌群提供多巴胺和去甲肾上腺素的前体
注意缺陷与多动障碍与预测的多巴胺和去甲肾上腺素合成异常有关,其前体由肠道细菌(主要是双歧杆菌)提供。
压力被定义为由困难情况或环境压力源引起的非特定情绪或身体反应。这种反应与心理和生物因素有关,例如性激素、高情绪反应性、被动应对技巧、糖皮质激素抵抗以及中枢和外周免疫激活。
✦压力会影响肠道微生物组成与活动
不同类型的心理和社会压力源已被证明可以通过神经元、免疫细胞和结肠嗜铬细胞释放信号分子、激素或神经递质来调节肠道微生物群的组成和活动。
压力对肠道微生物群的影响可能直接通过宿主肠道微生物群信号传导介导,也可能间接通过肠道生态系统的变化介导,并涉及炎症反应、微生物栖息地的改变、肠道运动和粘蛋白分泌。
✦产生短链脂肪酸的细菌减少可能是导致焦虑的关键
暴露于压力会导致肠道微生物群组成的实质性变化,肠杆菌科细菌的增加,而乳杆菌属的细菌减少。拟杆菌属减少,梭菌属增加。以及大肠杆菌和假单胞菌属的增加。
某些微生物群可能参与应激性焦虑和一般性焦虑症,其特征是社交和职业功能下降。研究人员报道,在一般性焦虑症患者中,粪杆菌(Faecalibacterium)、直肠真杆菌(E.rectale)、毛螺菌属(Lachnospira)、丁酸球菌(Butyricicoccus)和萨特氏菌(Sutterella)较低。这些都是短链脂肪酸的重要生产者。
应激性焦虑是指在强烈的精神或躯体应激事件的刺激下,产生的过度焦虑、恐惧等情绪。患者可出现紧张、坐立不安、心慌、呼吸急促等症状,还可伴有睡眠障碍、食欲改变等表现。
大胆猜想
短链脂肪酸产生菌的减少是焦虑和抑郁单胺类假说的关键。
单胺假说——指科学家在抗抑郁药领域提出的假说,即抑郁患者神经突触间隙可有效利用的单胺类神经递质浓度明显下降,而升高突触间隙单胺递质浓度(主要是血清素)能发挥抗抑郁作用。
抑郁症是一种与压力相关的情绪障碍,涉及神经免疫-神经内分泌失调,与促炎细胞因子水平升高相关。
促炎细胞因子与高水平的皮质醇有关,通过抑制四氢生物蝶呤酶发挥重要作用,四氢生物蝶呤对于合成多巴胺、血清素和去甲肾上腺素至关重要。
多巴胺、血清素和去甲肾上腺素是人体内重要的神经递质,它们在神经系统中发挥着重要的作用。
✦肠道微生物的多样性与抑郁严重程度负相关
几项研究报告称,不同抑郁症患者的肠道微生物群组成差异较大,粪便微生物多样性的增加与抑郁症症状的严重程度呈负相关。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania和Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialiste)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,以及副拟杆菌属(Parabacteroides)、普雷沃氏菌属(Prevotella)和放线菌属(Actinobacteria)的增加与抑郁个体相关。
✦短链脂肪酸有助于释放神经递质和调节血脑屏障
几项研究表明,重度抑郁症患者的丁酸盐、乙酸盐和丙酸盐减少,表明短链脂肪酸可能通过直接刺激神经通路或通过神经内分泌和免疫激活的间接中枢效应改变行为。
短链脂肪酸也有助于结肠嗜铬细胞合成和释放外周神经递质(血清素和乙酰胆碱),并有助于交感神经元合成和释放去甲肾上腺素。
除了局部作用外,短链脂肪酸还可以直接作用于血脑屏障的中心受体。此外,体外研究表明,丙酸盐和丁酸盐,而不是乙酸盐,都可以调节血脑屏障的通透性,防止脂多糖引起的通透性增加。
强迫症是一种慢性且持久的疾病,会被迫出现侵入性、自我张力障碍的想法或冲动或重复行为。
尽管只有少数研究涉及肠道微生物群与强迫症的关系,但压力和抗生素治疗都会影响微生物群组成,已被认为是与强迫症症状同时发生的因素。
✦强迫症患者肠道微生物丰富度较低
据报道,患有强迫症的个体肠道微生物群的物种丰富度较低,产生丁酸盐的属(颤旋菌属、Odoribacter和Anaerostipes)的相对丰度较低。
最近还报道强迫症患者粪便样本显示文肯菌科(Rikenellaceae)(另枝菌属)丰度增加,而普雷沃氏菌和毛螺菌科(Lachnospiraceae)丰度降低。
几种心理障碍中的肠道菌群失调
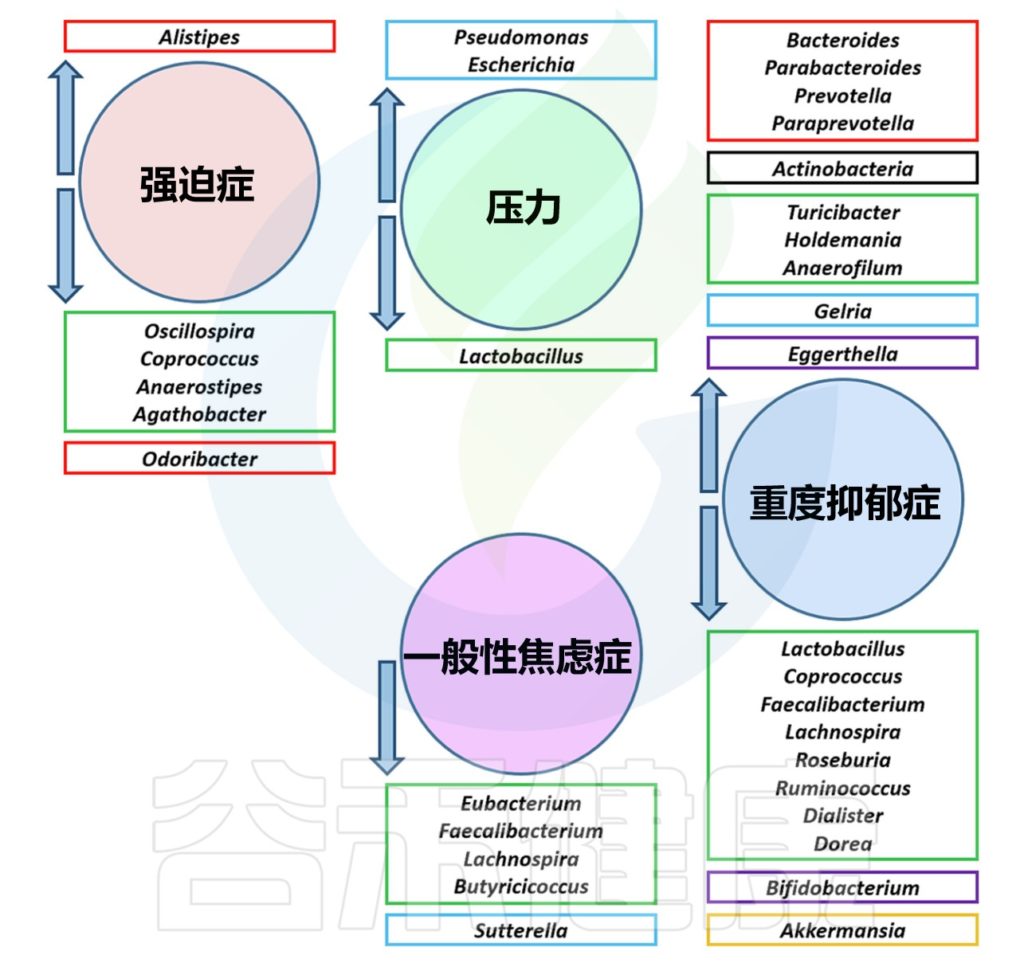
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
杏仁核在与压力相关的情绪、行为反应和情绪调节中发挥着关键作用,它显著受到肠道微生物群的影响。
杏仁核,又名杏仁体,呈杏仁状,是边缘系统的一部分。
√肠道微生物的变化可以调节认知功能
在动物模型中,有一些证据支持肠道微生物群组成的变化可以影响调节认知功能,尽管只有少数研究关注人类认知。
拟杆菌水平较高的人群拥有较好的认知表现
最近,根据粪杆菌(Faecalibacterium)、拟杆菌(Bacteroides)和瘤胃球菌科(Ruminococcaceae)的丰度建立了三组受试者,并得出结论,较好的认知表现与较高水平的拟杆菌相对应。
使用抗生素会影响认知功能,故不可滥用
用抗生素治疗剥夺或破坏肠道微生物群也会影响认知功能,包括语言学习能力以及工作和空间记忆。
√肠道微生物会影响一个人的气质和性格
由于人格特征和行为模式以及生理和心理健康结果之间存在很强的关联,一些研究已经证明肠道微生物群与气质和性格之间存在关联,这些特征甚至可以通过粪菌移植在受试者之间传播。
研究了肠道微生物的组成与儿童气质之间的关系,发现更大的暴躁/外向和恐惧与系统发育多样性呈正相关,包括戴阿利斯特杆菌属 (Dialister)、文肯菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)和约氏副拟杆菌(Parabacteroides)的丰度变化。
产丁酸细菌更丰富的人可能有更高的责任心
发现高度神经质和低外向性与γ-变形菌纲丰度增加有关。低责任性与变形菌丰度增加和毛螺菌科丰度减少有关,而开放程度高的人与更大的系统发育多样性和丰富度相关。
另一方面,高度的责任心与产生丁酸的细菌滴度的增加有关,这些细菌主要属于毛螺菌科。
√多样化的肠道微生物有助于社交和好心情
最近有研究表明,特定细菌属的丰度与人格特征显著相关。对肠道微生物组多样性的分析表明,具有较高社交网络的个体呈现出多样化的肠道微生物组,而焦虑和压力与肠道微生物组的组成改变和多样性降低有关。
研究还发现某些细菌属,包括阿克曼氏菌、脱硫弧菌、乳球菌、颤螺菌和萨特氏菌可能与行为密切相关。
已经使用了几种方法来确定肠道微生物群对中枢神经系统功能的作用,包括抗生素治疗、无菌动物模型和粪菌移植。
此外,精神抗生素和益生元已被用作精神和心理疾病的辅助治疗。精神抗生素的类别可以定义为“一种活的有机体,通过与共生肠道细菌相互作用,为患有精神疾病的患者带来心理健康益处”。这些药物通过调节和改善肠道微生物群发挥作用。
为了让大家有更清晰的认识,谷禾在下表整理了使用益生菌或益生元治疗对心理或精神疾病的影响。





Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
•基因集富集分析展示下肠道菌群与精神疾病的关联
使用基因集富集分析 (GSEA) 能够检测肠道微生物群与精神疾病之间的以下显著关联:注意力缺陷与多动障碍常伴有脱硫弧菌和梭状芽孢杆菌富集;自闭症谱系障碍与拟杆菌属和脱硫弧菌有关;对于重度抑郁障碍,观察到脱硫弧菌、梭状芽孢杆菌目、钩端螺旋菌科和拟杆菌类的关联。
最近报道了普雷沃氏菌与自闭症谱系障碍以及放线菌属与精神分裂症之间的特定关联。还有一组研究人员提出了放线菌和假单胞菌与重度抑郁障碍之间的关系。
肠道微生物群和中枢神经系统通过两条途径进行交流:
(1)通过迷走神经途径的神经免疫和代谢回路;
(2)通过微生物群合成的代谢产物、肠道激素和内分泌肽。
先前的研究表明,肠道微生物群的失调是几种精神疾病的病理生理学。因此,恢复受干扰的微生物生态平衡可能为管理或预防神经系统疾病提供一种新的、有前景的方法。
另一方面,心理干预已证明在治疗功能性胃肠道疾病如肠易激综合征方面是有效的;然而还需要进一步的研究来确定心理干预对肠道微生物群变化的具体影响。
通过粪菌移植、健康的饮食和生活方式或使用心理生物药物等干预措施重建失调的肠道微生物群,可能在未来调节微生物群肠脑轴功能和促进心理精神健康方面具有重大潜力。
特别是,心理干预可能对某些神经系统疾病具有潜在的治疗作用。然而,这些干预措施的有效性并不相同,取决于给药方法、干预时间、使用的微生物菌株的数量和具体类型以及宿主的生理状况等因素。
在未来,单独或与抗精神病药物联合的个性化精神微生物干预可能成为临床患者的一种新的治疗策略。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Abuaish S, Al-Otaibi NM, Abujamel TS, Alzahrani SA, Alotaibi SM, AlShawakir YA, Aabed K, El-Ansary A. Fecal Transplant and Bifidobacterium Treatments Modulate Gut Clostridium Bacteria and Rescue Social Impairment and Hippocampal BDNF Expression in a Rodent Model of Autism. Brain Sci. 2021 Aug 5;11(8):1038.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Ansari F, Pourjafar H, Tabrizi A, Homayouni A. The Effects of Probiotics and Prebiotics on Mental Disorders: A Review on Depression, Anxiety, Alzheimer, and Autism Spectrum Disorders. Curr Pharm Biotechnol. 2020;21(7):555-565.
Bharwani A, Mian MF, Foster JA, Surette MG, Bienenstock J, Forsythe P. Structural & functional consequences of chronic psychosocial stress on the microbiome & host. Psychoneuroendocrinology. 2016 Jan;63:217-27.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.

谷禾健康
抑郁症·肠道菌群
当一个人面临抑郁症时,一切看似平常的事都会变得很有挑战性。上班、与朋友社交,甚至只是起床都感觉很困难。
抑郁症是如今已是世界上最普遍的精神障碍之一,一直是心理学和医学领域的研究热点。抑郁症是一种需要预防和治疗的疾病——它并不是软弱或失败的表现。
抑郁症影响着数百万计的人们,造成抑郁症的因素有很多,包括创伤、生活压力事件、遗传基因、环境因素、药物滥用和其他心理健康问题。
虽然我们目前仍然不完全了解导致抑郁症的原因,一个新的研究领域涉及微生物群-肠-脑轴,证明可以控制认知功能。微生物组通过内分泌、免疫和神经活性途径影响肠脑通讯。后者包括微生物源性神经递质(例如,γ-氨基丁酸、血清素)和代谢物(短链脂肪酸和胆汁酸),以及脑源性神经营养因子。

本文我们主要来了解一下关于抑郁症与肠道菌群之间的关系,它们之间的相互作用机制可能涉及肠脑轴、免疫调节、代谢途径、肠漏、神经炎症、HPA轴等多种途径,同时也列举了较多关于抑郁症的干预措施,希望为抑郁症的治疗和预防提供新的视角和方法。

-正文-
抑郁症是一种复杂的疾病,有许多影响因素,包括多种生活方式、饮食、遗传和环境因素。
据估计,全世界有超过3亿人至少经历过一次重度抑郁症。18-25 岁人群中重度抑郁发作的患病率最高。
一开始,抑郁发作的症状可能只是感觉忧郁、疲劳或“陷入困境”。因此,学习如何辨别平常的低落一天或只是感到忧郁和抑郁对于知道何时寻求帮助非常重要。
要符合抑郁发作的症状,个人必须在两周内几乎每天、全天经历抑郁情绪或兴趣丧失,以及同时经历其他四到五种症状。
▼
某些类型的抑郁症还可能出现以下症状:
▼
抑郁症的主要诊断标准包括:
然而,请注意,并非所有症状都必须出现才能被诊断为抑郁症:大多数患者仅具有完整“核心”症状的一部分。
▼
包括情绪低落或失去兴趣的症状,大多数情况持续至少两周,影响日常活动。
也称为心境恶劣或心境恶劣障碍,是指持续时间较长(通常至少 2 年)的不太严重的抑郁症状。
指怀孕期间或怀孕后发生的抑郁症。在怀孕期间开始的抑郁症是产前抑郁症,在婴儿出生后开始的抑郁症是产后抑郁症。
是一种随季节变化而出现和消失的抑郁症,症状通常在秋末冬初开始,在春季和夏季消失。
是抑郁症的一种严重形式,患者会出现精神病症状,例如妄想(令人不安的、错误的固定信念)或幻觉(听到或看到别人没有听到或看到的东西)。
其他还有:
以前称为躁狂抑郁症或躁狂抑郁症患者,也会经历抑郁发作,在此期间他们感到悲伤、冷漠或绝望,并且活动水平非常低。但双相情感障碍患者也会经历躁狂(或不太严重的轻躁狂)发作,或情绪异常升高,他们可能会感到非常高兴、烦躁或“兴奋”,活动水平显着增加。
▼
一些可能增加一个人患抑郁症风险的已知因素包括:
▼
神经递质是神经元用来将信号从一个细胞传递到另一个细胞的化学物质。神经递质有 100 多种不同类型,其中最著名的包括血清素、多巴胺和去甲肾上腺素等。
大多数最常见或广泛使用的抗抑郁药物(例如西酞普兰和许多其他药物)通常通过增加大脑中可用的神经递质血清素和去甲肾上腺素的量来发挥作用(即选择性血清素再摄取抑制剂或血清素-去甲肾上腺素再摄取抑制剂,或分别为“SSRI”和“SNRI”)。
注:西酞普兰是一种抗抑郁药,属于选择性血清素再摄取抑制剂(SSRI)类药物。是一种流行且用途广泛的处方药,用于治疗许多精神健康状况,包括抑郁、焦虑和创伤后应激障碍 (PTSD)。它于 2002 年获得 FDA 批准用于治疗抑郁症(成人和青少年)和广泛性焦虑症(成人)。
然而,其他一些抗抑郁药——例如安非他酮(Wellbutrin)——主要作用于多巴胺和去甲肾上腺素(即去甲肾上腺素-多巴胺再摄取抑制剂,或“NDRIs”)。
尽管如此,低水平的血清素或去甲肾上腺素是否直接导致抑郁症仍然是一个悬而未决的问题。许多科学尝试证实抑郁症患者实际上具有异常低水平的这些神经递质,但有时未能完全验证其中的联系。
我们理解的抑郁症的另一个主要方法学局限性是,尽管抗抑郁药已经建立了生化机制(例如抑制单胺氧化酶(MAO),或抑制特定神经递质的再摄取),但抑郁症的诊断和治疗很大程度上基于主观报告症状,而不是特定生化标志物或其他“客观”生物指标的任何离散测量。
换句话说,这并不是通过测量一个人这些化合物的水平,然后得出他们是否“患有”抑郁症那么简单。此外,虽然大多数 SSRI 会立即增加大脑中的血清素水平和活动,但许多患者在服用药物数周或数月后才报告情绪有显著改善。
诸如此类的发现表明血清素水平可能只是与抑郁症共同相关的更为复杂的机制和生物变化链中的一个部分。
虽然抑郁症的“血清素缺乏”假说仍然存在争议,并且并非 100% 被所有研究人员普遍接受,但目前根据迄今为止可获得的总体证据和数据,它通常被认为是最佳的工作假说。也就是说与调节情绪、思维和行为的大脑回路故障有关,大脑化学物质对于健康的神经细胞连接非常重要。
▼
正如识别抑郁症特定生化“标记”的尝试都失败了一样,许多识别导致抑郁症的特定基因或基因突变的尝试也只取得了有限的成功——可能是因为不同的抑郁症病例可能是由许多不同基因的突变以及独特的环境因素综合的。
几项综合研究(包括全基因组关联研究以及家族和双胞胎研究)报告的证据表明,对于某些情况或类型的抑郁症来说,大量个体基因之间的相互作用,以及这些基因与某些环境因素的复杂相互作用,可能只是部分原因。
例如,一项系统性全基因组关联研究(GWAS)报告称,许多与免疫系统功能和炎症相关的基因可能是影响一个人患抑郁症风险的可能遗传因素之一。
据报道,另一项全面的 GWAS 研究确定了许多与血清素功能、昼夜节律和其他神经递质相关的基因可能是抑郁症的遗传风险因素,如下表:
doi.org/10.1016/j.neuron.2014.01.027
对复发性/单相型重度抑郁症(“MDD-RU”)的家庭研究报告称,抑郁症诊断患者的一级亲属可能面临特别高的风险。
血清素转运蛋白基因( SLC6A4 ) 也与重度抑郁症相关。SLC6A4和其他参与大脑血清素能系统的基因现在被认为是抑郁症易感性的“候选基因”,这也符合许多最常见的抗抑郁药物被认为主要作用于该系统的事实。
其他五个与抑郁症风险相关的“候选基因”包括:
▼
肠道菌群与抑郁症之间存在一定的关联。肠道菌群是指人体消化道中的微生物群落,包括细菌、真菌、病毒等。它们与人体的健康和免疫系统密切相关。
微生物群-肠-脑轴
肠道和大脑之间存在着肠脑轴,通过神经、免疫和内分泌系统的相互作用进行沟通。肠道菌群可以通过产生代谢产物、神经递质和炎症因子等影响大脑功能和情绪调节。
炎症反应
肠道菌群失衡可能导致肠道黏膜的炎症反应,释放炎症因子进入血液循环,进而影响大脑功能。慢性炎症反应与抑郁症的发生和发展有关。
神经递质
肠道菌群可以影响神经递质的合成和代谢,如血清素、多巴胺和γ-氨基丁酸等,这些神经递质与情绪调节密切相关。
营养吸收
肠道菌群参与食物的消化和营养的吸收,它们可以合成维生素和其他有益物质,这些物质对大脑和情绪调节有影响。
而肠道菌群又受到多种因素的影响,比如:饮食、抗生素使用、生活方式、环境因素等。接下来章节,我们就肠道菌群与抑郁症展开了解它们之间密不可分的关联。
▼
一些研究发现,中度和重度抑郁症患者的肠道菌群特征是拟杆菌门富集,而重度患者中瘤胃球菌和真杆菌则减少。
抑郁症个体与健康对照组相比,微生物群变化的总结如下:
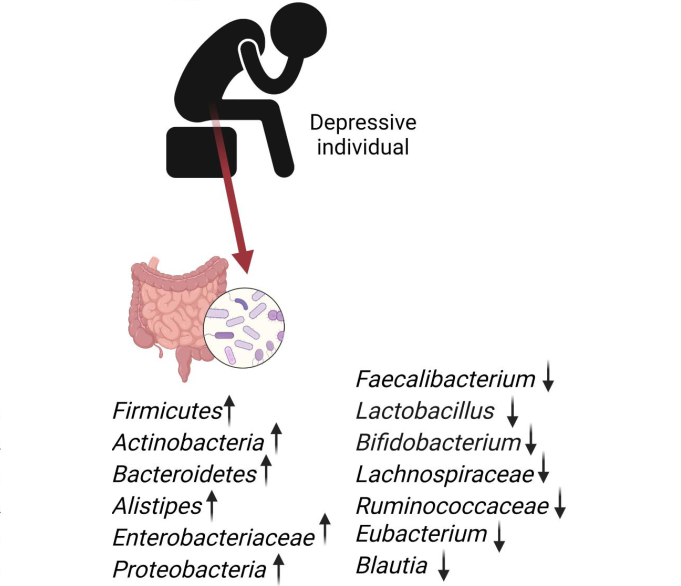
Basiji K, et al., Metab Brain Dis. 2023
▼
根据一项早期的动物研究,在没有肠道细菌的情况下生长的啮齿动物(无菌大鼠和小鼠)缺乏成熟的肠内分泌系统(胃肠道的激素产生系统)。
与具有更典型肠道细菌水平的对应物相比,它们的几种不同主要神经递质的水平和活性也有所不同。
一项初步的动物研究称,没有肠道细菌的小鼠可能会表现出自发运动的增加,该研究的作者将其解释为表明更加焦虑。他们进一步假设,这些行为差异可能是由于某些神经递质,包括血清素、多巴胺和去甲肾上腺素(去甲肾上腺素),在整个大脑中合成和代谢方式的差异造成的。
另一项研究着眼于肠道微生物与早期生活压力之间的潜在关系。在这项研究中,由于早年与母亲分离而经历压力和抑郁样症状的新生大鼠,当在其饮食中添加特定种类的细菌(双歧杆菌)时,其中一些症状会减轻。尽管抑郁相关行为的减少程度小于传统抗抑郁药物西酞普兰造成的减少,但这一初步发现仍然表明,理论上可以通过改变肠道微生物群的组成来“治疗”抑郁症。
其他一些来自动物研究的早期但有趣的证据表明,即使是复杂的行为也可以通过“粪菌移植”从一组小鼠“复制”到另一组小鼠。
一项动物研究报告称,抗生素(通过杀死肠道微生物组中的一些细菌种类来改变肠道微生物组)可能会影响小鼠表现出的“探索行为”的数量,甚至可能会改变大脑中某些重要化合物的水平,如脑源性神经营养因子(BDNF)。
▼
您以前可能听说过“益生菌”——这是指将特定菌株(菌种)引入胃肠道的食品或膳食补充剂。
一些初步证据表明,使用益生菌“修改”人类肠道微生物组可能会产生一些心理影响。例如,据报道,某些益生菌补充剂可以降低健康非老年个体以及诊断为重度抑郁症(MDD)的非老年患者的抑郁症状严重程度评分。
同样,另一项早期研究报告称,定期服用含有瑞士乳杆菌和长双歧杆菌菌株的益生菌可能有助于减少健康志愿者的抑郁症。
最后,另一项初步研究报告称,嗜酸乳杆菌、干酪乳杆菌和两歧双歧杆菌的组合可能有助于部分减轻抑郁症状。
虽然这些作用背后的潜在机制尚不清楚或不明白,但一些研究人员指出,这些“益生菌治疗”可能会导致胰岛素水平降低、胰岛素抵抗和 hs- CRP水平降低,以及谷胱甘肽(一种主要天然物质)水平升高。抗氧化化合物用于重度抑郁症患者。
总的来说,虽然这项早期研究充满希望且令人兴奋,但还需要更多的研究来充分证实这些效应,并找出哪些机制可能导致这些有趣的效应。
▼
“肠-脑轴”是指肠道微生物群与大脑之间假设的“双向”连接。
肠-脑轴可能包括许多不同的潜在机制,包括在许多不同的器官系统和所涉及的单个细菌物种之间产生的各种神经、化学、体液和免疫信号。
虽然许多不同的疾病和健康状况可能受到肠-脑轴的影响,但一些研究人员特别关注肠-脑相互作用在抑郁症发展中可能发挥的作用。
微生物群-肠-脑异常导致抑郁症
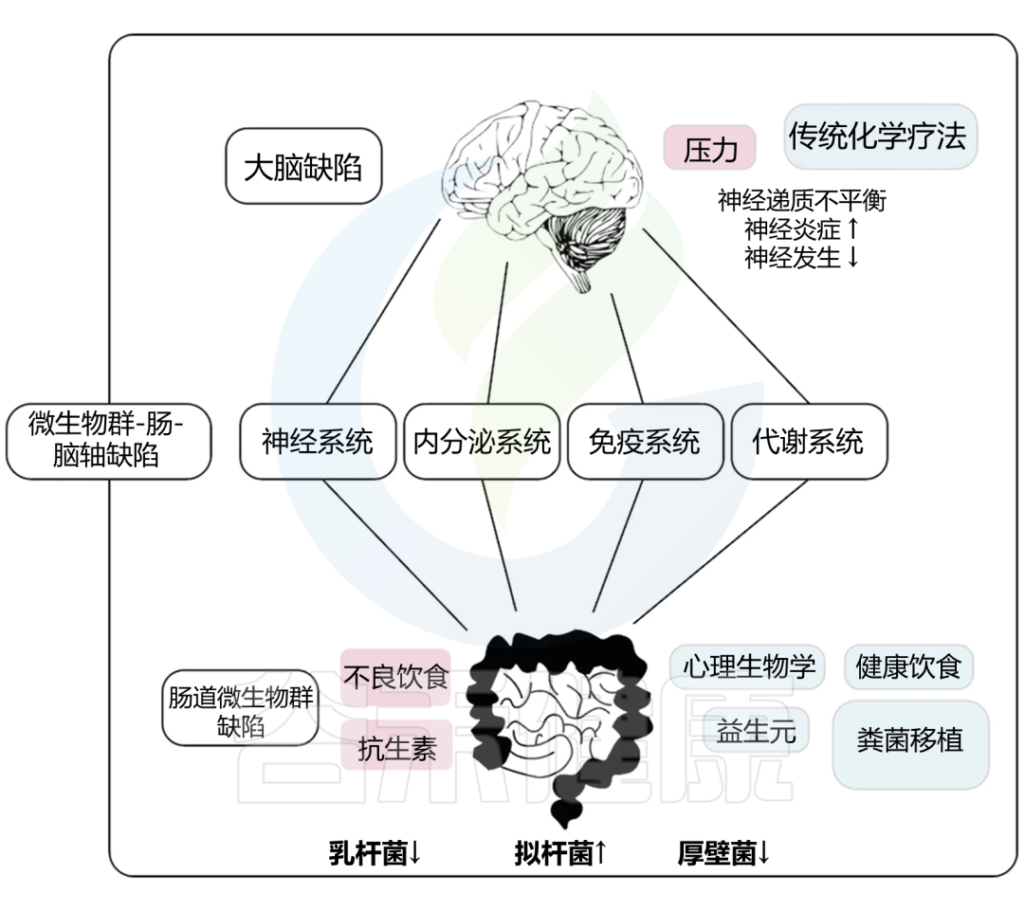
DOI: 10.1007/978-981-19-7376-5_10
▼
微生物群-肠道-免疫-神经胶质轴
微生物群对小胶质细胞稳态的重大贡献,无菌小鼠表现出小胶质细胞的整体缺陷,细胞比例改变和不成熟的表型,导致先天免疫特性受损。
值得注意的是,复杂微生物群的重新定殖,部分恢复了小胶质细胞的特征,而微生物群衍生的短链脂肪酸调节了小胶质细胞的稳态。
神经胶质细胞,包括小胶质细胞、星形胶质细胞、少突胶质细胞和室管膜细胞,与神经元相互作用,影响大脑健康和疾病(如抑郁症)。
神经胶质功能可能由肠道微生物群通过神经和化学信号途径驱动。肠道微生物群对小胶质细胞从促炎到抗炎的激活状态具有重要意义,小胶质细胞功能障碍可以触发抑郁症中神经炎症的信号级联反应。
脑功能、脑小胶质细胞(Iba1)和外周炎症细胞因子的改变(如TNF-α、IL− 1β 、IFN-γ,IL-12)。通过肠-脑轴调节小胶质细胞激活状态(M1、M2)可能是治疗抑郁症的一种有前途的治疗方法。
脑神经炎症中脑-肠-微生物轴(Th17/Treg)
许多临床前和临床研究表明,Th17 和 Treg 细胞对抑郁症有显著影响。
注:
TH17细胞是一种产生促炎细胞因子的T细胞亚群,TH17细胞的异常活化和功能异常与多种炎症性和自身免疫疾病的发生和发展有关,Treg细胞主要通过产生抑制性细胞因子和细胞接触来抑制免疫反应。
TH17细胞和Treg细胞之间的平衡是免疫系统正常功能的重要组成部分。当TH17细胞过度活化或Treg细胞功能受损时,可能导致免疫系统失衡,从而引发炎症性和自身免疫疾病。
肠道 Th17 和 Treg 细胞受到肠道微生物群的调节,而大脑相关的 Th17 和 Treg 细胞则维持免疫稳态,以控制怀孕期间的神经炎症、小胶质细胞激活、星形胶质细胞激活和大脑发育。
值得注意的是,Th17 和 Treg 细胞之间的不平衡,或 Th17/Treg 细胞的比例异常,在抑郁症中发挥着关键作用。
Th17/Treg 细胞是脑神经炎症中脑-肠-微生物轴调节所特别需要的。受肠道微生物群调节的 Th17 和 Treg 细胞之间的不平衡可能会赋予机体抵抗力和对压力的敏感性。
特定的肠道微生物群,如分节丝状菌、梭状芽胞杆菌、脆弱拟杆菌、罗伊氏乳杆菌和双歧杆菌,及其代谢产物如短链脂肪酸和ATP,也参与 Th17/Treg 活性,从而形成 Th17 和 Treg 细胞之间的不平衡。
除了脑神经炎症之外,炎症还可以发生在身体其他部位和系统,比如周围炎症,胃肠道炎症等。
▼
抑郁症和炎症的相互作用就像一个互相助长的恶性循环。炎症是抑郁症发展的主导力量之一。长期的神经炎症会影响大脑功能,这可能会决定个人的情绪和行为。
抑郁症的细胞因子假说来自于观察,即抑郁症的几种症状类似于“疾病行为”,例如嗜睡、发烧、食欲下降、对探索行为或性活动的兴趣下降等。
一些研究人员提出,从进化的角度来看,疾病行为可能是有意义的,因为其中许多行为可能有助于治愈或减少疾病的传播。例如,隔离病人可能会降低他们传播感染的几率。
抑郁症相关炎症因子变化
周围炎症与抑郁症密切相关。抑郁症患者的炎症标志物包括:
血清 IL-6、IL-1β、C反应蛋白升高。
肠道炎症性疾病患者抑郁行为的并发率很高
根据一些报告,患有胃肠道炎症等健康问题的人抑郁和焦虑症状的发生率在统计上有所增加。一些研究人员估计,高达 50-90% 的 IBS患者还同时患有某种精神疾病。
根据最近的《自然》杂志评论,尽管存在明显的异质性,但 IBD 抑郁症状(包括克罗恩病和溃疡性结肠炎)的总体患病率超过 20%。随着时间的推移,抑郁症状加剧与活动性IBD的几率增加有关。
前扣带皮层(ACC)可能是大脑中的一个交叉点,它会感知肠道炎症和不适当的反应,从而增加患抑郁症的风险。
用促炎细胞因子引发炎症的同时诱发抑郁
对人类或动物施用促炎细胞因子进行治疗会诱发抑郁症状。虽然 SSRIs(选择性血清素再摄取抑制剂)通常不会直接减轻“疾病行为”,但据报道,它们可以减少促炎细胞因子,并增加抗炎细胞因子,这一机制也与抑郁症的细胞因子假说一致。
给予脂多糖 LPS 会增加细胞因子的血浆浓度,同时诱发抑郁症状。
然而,抑郁症的正式诊断标准(由 DSM 定义)和“疾病行为”本身之间存在一些细微差别,并且关于炎症是否真的导致抑郁症的证据是相互矛盾的。
并非所有炎症患者都患有抑郁症,也并非所有抑郁症患者都具有高炎症标志物,炎症(可能与血清素缺乏相似)可能只是抑郁症的一个诱因,而不是唯一的直接原因。换句话说,炎症细胞因子的异常调节可能只是一个更加复杂的谜题的一部分,并且需要更多的研究来充分探索这些潜在联系所涉及的机制。
▼
肠粘膜屏障和粘膜免疫系统是帮助防止肠腔内的肠道微生物直接与肠道免疫系统相互作用的两个主要机制。如果这些屏障受到损害,细菌可能会易位,激活免疫系统,从而引发炎症。
注:这些屏障受到损害的情况有时非正式地被称为“肠漏”。
一项动物研究报告称,肠道屏障受损的小鼠表现出与焦虑相关的行为增加,并且一旦肠道屏障恢复或引入益生菌后,这些行为就会消退。
根据一项针对人类的初步研究的作者,IgA 和IgM等血清抗体通常会被激活以对抗有害的肠道细菌。因此,这些抗体的存在是肠道屏障受损的一种潜在生物指标,一项研究甚至报告称,这些抗体水平升高可用于识别抑郁症患者,准确率高达 90%。
尽管这种现象背后的机,但一些研究人员认为“坏”肠道细菌可能通过 TLR4 受体引发炎症。
诱发炎症
LPS 与 TLR4 结合激活免疫细胞,激活NF-κB(一种细胞内信号分子),进而促进促炎细胞因子的产生,包括 TNF-α 和 IL-1 以及环加氧酶-2。
加剧炎症
相同的过程还诱导氧化和亚硝化应激途径,通过进一步激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶来增加诱导型一氧化氮的表达和活性氧 (ROS) 的产生。ROS 超载不仅会激活 NF-κB,还会导致 DNA 损伤和细胞死亡,这两个过程都会加剧炎症状态。
促炎循环——抑郁症
包括干扰素-α、IL-6、IL-1β 和 TNF-α 在内的细胞因子以及氧化和亚硝化应激途径可能会导致紧密连接屏障松动,从而在肠道通透性过高和宿主免疫反应之间形成促炎循环。
这个循环至少部分解释了抑郁症患者慢性低度但持续的炎症状态。
总的来说,这些机制及其影响复杂,值得更多的研究来验证这些初步发现。
▼
激素影响我们身体功能的许多方面,包括新陈代谢、生长、性健康和生殖系统功能。我们的心理健康受到激素的强烈影响,因为激素在情绪的调节中发挥着重要作用。这里我们来了解几种常见的和抑郁症相关的激素。
皮质醇
皮质醇是一种压力激素,由肾上腺分泌。这种激素负责通过选择使用哪种底物以及应消耗多少底物来调节能量。如果皮质醇水平过高或过低,可能会开始出现抑郁症。皮质醇水平低与过度疲劳、难以处理压力情况、不可预测和不稳定的情绪以及性欲下降有关。
雌激素
雌激素在大脑中扮演着重要的角色,它们参与调节神经递质的活动,如血清素、多巴胺和去甲肾上腺素等。这些神经递质与情绪调节密切相关,因此,雌激素的变化可能会对情绪产生影响。
女性患抑郁症的风险要高于男性,这与雌激素和孕激素变化有关。在月经周期、孕期和更年期等生理状态的激素波动可能影响情绪和抑郁症发病风险。
使用雌激素治疗抑郁症的疗效和安全性仍存在争议,因此,使用雌激素治疗抑郁症需要谨慎。
黄体酮
黄体酮有助于平衡体内雌激素水平。它还有助于改善睡眠模式,使人感到更平静。如果黄体酮水平不平衡,可能会变得烦躁或晚上无法入睡,这可能影响抑郁症。
▼
// 短 链 脂 肪 酸
短链脂肪酸在肠腔中具有多种功能,如氧化还原平衡、维持肠屏障完整性、肠道激素产生和表观遗传调节。然而研究表明,短链脂肪酸与抑郁症等精神疾病有关。
短链脂肪酸由肠道微生物群合成,主要由AKK菌、双歧杆菌、粪杆菌、毛螺菌科、乳酸杆菌和瘤胃球菌等物种合成。
短链脂肪酸与抑郁症的关联
已知短链脂肪酸调节神经反应的不同途径,如:
短链脂肪酸诱导肠道神经肽的释放,例如YY肽(YYP)和胰高血糖素样肽2(GLP-2)肽,以及参与维持肠道屏障、细胞代谢和饱腹感的激素。
戊酸与抑郁症有关,主要由Oscillibacter产生。缬草酸的结构与GABA,并可与其受体结合,这可能在严重抑郁障碍中发挥重要作用。
在抑郁症患者的粪便中发现了更高量的异戊酸,这表明微生物群和异戊酸与抑郁症有关。
在一项针对有抑郁症状患者的研究中,粪便中的乙酸盐水平与这些患者呈正相关,而丁酸盐和丙酸盐水平则呈负相关。
在一项针对患有抑郁症的波兰妇女的类似研究中,与非抑郁症患者相比,抑郁症患者粪便中的乙酸盐和丙酸盐水平降低,而异己酸含量增加。这些发现表明,为了保持心理健康,特定的短链脂肪酸水平和微生物群之间必须保持平衡。
// 胆 汁 酸
胆汁中的一种重要成分——胆汁酸,是由肝脏中的胆固醇产生的,它们与肠道菌群协同调节胆固醇代谢,帮助脂质消化和吸收。胆固醇通过肝细胞代谢为原代胆汁酸;之后被输送到胆囊,最终在十二指肠中被释放。到达肠道后,肠道细菌从初级胆汁酸中产生次级胆汁酸(脱氧胆酸和石胆酸)。只有一些细菌,主要是梭菌和真细菌,负责次级胆汁酸的合成。
胆汁酸改变了神经递质受体的功能,如M2和M3毒蕈碱乙酰胆碱、GABA和N-甲基-D-天冬氨酸(NMDA)受体。在对培养的下丘脑神经元的体外研究中,鹅去氧胆酸抑制GABA和NMDA受体。
胆汁酸与抑郁症的关联
中国的一项研究表明,与健康对照组相比,重度抑郁症患者的2,3-脱氧胆酸水平较高,而牛磺酸(TLCA)、甘胆酸(GLCA)和3-硫酸胆酸水平较低,这与汉密尔顿抑郁量表(HAM-D)评分呈负相关。
同样在这项研究中,这些菌Turicibacteraceae、Turicibacteriales和Turicibacter与TLCA和GLCA水平呈正相关。
在美国的另一项研究中,与不太严重的抑郁症患者相比,严重抑郁症患者的原发胆汁酸鹅去氧胆酸水平降低。因此,肠道菌群可以通过胆汁酸改变诱导中枢神经系统疾病,如重度抑郁症。
次级胆汁酸合成的减少会导致微生态失调,并改变肠道屏障的通透性,诱导促炎性基调,从而导致抑郁症的发病机制。
▼
肠道细菌是血液中化学物质(代谢物)的主要调节剂。其中一些是在大脑中制造神经递质的“成分”或“构件”(代谢前体)。
换句话说,这意味着肠道细菌可能能够对某些神经递质的水平和活动产生一些影响,这反过来又可能使它们能够影响大脑活动和行为(尽管是间接的)。
肠道细菌可以通过多种方式调节神经递质的产生
首先,肠道细菌可以合成和分解多种神经递质,如γ-氨基丁酸(GABA)、多巴胺、血清素等。这些神经递质可以通过门脉循环影响迷走神经的传入通路,它们在大脑中起到调节情绪、认知和行为的重要作用。
GABA是大脑中的主要抑制性神经递质。
谷氨酸是大脑中最丰富的兴奋性神经递质,负责在神经细胞之间发送信号,其在大脑中的合成取决于神经元和星形胶质细胞之间的合作,肠道中的肠内分泌细胞亚群能够合成谷氨酸,并利用它通过迷走神经将快速信号传输到大脑。关于谷氨酸详见我们之前的文章:
去甲肾上腺素在中枢神经系统内发挥作用,同时充当应激激素。它有助于“战斗或逃跑”反应,并与唤醒、注意力和聚焦机制相关。
多巴胺参与奖励处理和动机以及运动控制。
肠道微生物群对多巴胺代谢副产物的影响
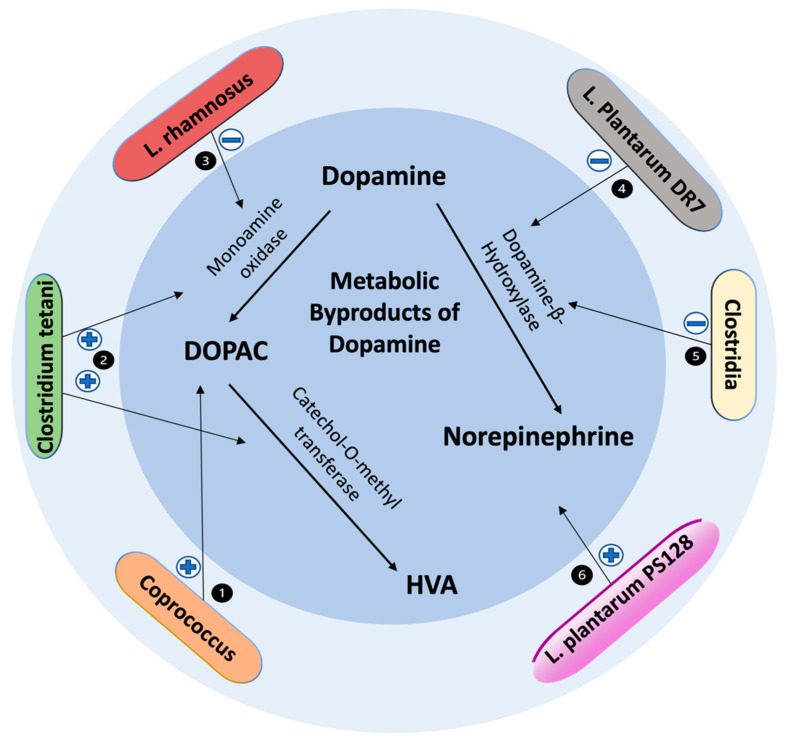
doi: 10.3390/biomedicines10020436
1) 粪球菌属Coprococcus comes和Coprococcus catus与多巴胺合成潜力密切相关
2) 破伤风梭菌对多巴胺具有降解作用,通过多巴胺中间体促进降解为高香草酸
3) 鼠李糖乳杆菌下调MAO
4) 植物乳杆菌DR7下调多巴胺β-羟化酶
5) 梭状芽孢杆菌显示下调多巴胺β-羟化酶
6) 植物乳杆菌PS128给药改善多巴胺代谢并增加去甲肾上腺素水平
血清素,也称为 5-羟色胺 (5-HT),参与调节情绪、食欲、睡眠和其他身体功能。
其次,肠道细菌可以影响神经递质的合成和代谢途径。例如,某些细菌可以产生短链脂肪酸,如丙酸、丁酸和乙酸,这些短链脂肪酸可以促进神经递质的合成和释放。
肠道细菌还可以通过与肠道上皮细胞和免疫系统的相互作用,间接影响神经递质的产生。肠道细菌可以调节免疫系统的活性,影响免疫细胞的分泌和反应,从而影响神经递质的合成和释放。
▼
氨基酸色氨酸是大脑用来产生神经递质血清素的主要“构件”(代谢前体)之一。虽然色氨酸消耗并不总是导致抑郁症,但一些研究人员认为,血清色氨酸偏低有时可能会导致易感人群抑郁症。根据前面,我们可以看出高血清脯氨酸和低血清色氨酸与抑郁症的发展有一定关系。
一些研究表明,某些促炎细胞因子(例如 IFN-α、IFN-γ和TNF-α)水平的增加可能会刺激吲哚胺-2,3-双加氧酶( IDO )的活性,从而在转刺激色氨酸转化为神经毒性化合物,包括犬尿氨酸和喹啉酸。
基于此,一些研究人员认为,可能是这些神经毒性物质,而不是色氨酸消耗本身,可能导致抑郁症的发生。
肠道细菌和炎症可能会影响血清素代谢:
色氨酸代谢途径的犬尿氨酸
DOI: 10.1038/sj.mp.4001600
扩展阅读:
▼
重度抑郁症患者表现出应激反应系统(例如HPA 轴)过度活跃。它主要表现为腺体反应性增加、激素分泌破坏和负反馈失调。这些疾病可能进一步导致肠道炎症、神经元损伤和皮质醇过度产生,所有这些都与抑郁症相关。
此外,HPA 轴功能障碍的解决与抑郁症的缓解(“治愈”)密切相关,表明它们之间存在某种相互联系。
早期生活压力—肠道菌群—应激反应形成
一项针对大鼠的动物研究报告称,将新生儿从母亲身边带走所产生的压力(母亲分离压力)可能会导致后代肠道微生物组发生巨大的长期变化。母亲分离是早期生活压力的一种模式,它通过改变 HPA 轴、免疫系统和氨基酸代谢以及影响微生物群组成来诱发焦虑和抑郁。
早期生活压力可能使人以后对压力更加敏感。
doi.org/10.3389/fneur.2022.1015175
▼
虽然迷走神经无法到达管腔内容物,但它可以通过与肠内分泌细胞的通信间接感知肠道信息。
迷走神经传入将信号从肠道菌群传递到中枢神经系统
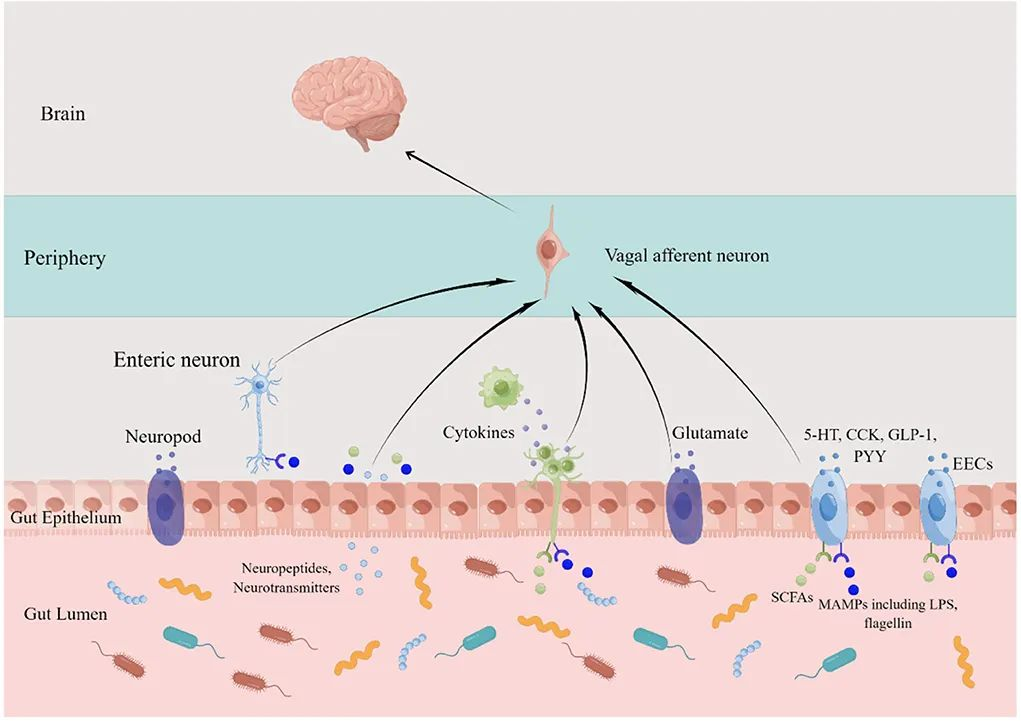
doi.org/10.3389/fneur.2022.1015175
▼
肠道微生物组可能用来与中枢神经系统沟通的其他机制之一是通过肠嗜铬细胞(ECC)和迷走神经。
例如,一些研究人员目前认为肠嗜铬细胞和迷走神经可能参与肠道细菌和大脑之间的通讯,尽管我们仍然不完全了解如何进行。
肠嗜铬细胞感知肠道细菌并分泌血清素
肠嗜铬细胞(ECC) 遍布整个消化道
▼
HPA轴是指下丘脑-垂体-肾上腺轴。HPA轴的功能紊乱可能导致患者出现情绪失调和应激反应的异常。
肠道菌群如何影响 HPA 轴?
肠道菌群失调与炎症之间存在密切关系。这些细胞因子也是 HPA 轴非常有效的激活剂。促炎细胞因子可以干扰皮质醇循环的负反馈,刺激HPA轴的活性。
肠道菌群还可以通过其他能够穿过血脑屏障的介质(例如微生物抗原和前列腺素)刺激 HPA 轴。
除了依赖这些介质之外,细菌还可以直接参与干预过程。例如,LPS和肽聚糖可以通过激活先天免疫系统来激活HPA轴,最终诱发抑郁症)。
还有证据表明,肠道菌群可以直接调节肠道和肾上腺中的类固醇生成,从而增强 HPA 轴反应。
肠道菌群衍生的代谢物也通过体液途径参与调节 HPA 轴。例如,慢性吲哚(拟杆菌属、乳杆菌属和梭菌属)可诱导肾上腺髓质 Pnmt 基因过度表达。它可以与去甲肾上腺素一起增加肾上腺素能系统中儿茶酚胺的生物合成途径。这样,吲哚可以增加小鼠在慢性轻度应激下的脆弱性,最终导致抑郁行为。
除此之外,肠道菌群还可以通过调节 HPA 轴在抑郁症中发挥积极作用。例如,其下游代谢物短链脂肪酸可以降低HPA轴中一些编码蛋白的基因表达,从而减弱HPA轴的应激反应。
最后,肠道菌群还可以影响膈下迷走神经的信号输入。孤束核通过去甲肾上腺素能神经元激活 HPA 轴。
据报道,单胺再摄取抑制剂(MAO-Is) 可以降低糖皮质激素受体抵抗,从而减少 HPA 轴功能障碍。这使得一些研究人员提出,针对大脑 HPA 轴的药物可能是治疗重度抑郁症的潜在有效方法。
▼
如果发现抑郁症的迹象,请及时进行身体检查,帮助确定症状是否可能与抑郁有关,并寻求专业医疗帮助进行抑郁症的诊断和治疗干预。
诊断抑郁症是一个多步骤的过程,通常当有人注意到自己感觉不太像自己时就开始了。在某些情况下,一个人的朋友和家人可能会首先注意到抑郁症的微妙迹象。相关判别方式有:
// 量表
医疗和心理健康专业人员使用既定的、研究支持的指南、筛查工具、检查表和其他标准来帮助他们诊断抑郁症。
DSM-5
心理健康专家可能使用美国精神病学协会出版的《精神障碍诊断与统计手册》(DSM-5) 中列出的抑郁症诊断标准。
注:《精神疾病诊断和统计手册》(DSM)是一本为诊断精神疾病的临床医生提供指南的手册。对每种情况进行分类,并给出一套明确的标准,必须满足这些标准才能做出诊断。
DSM-5 包含了评估自杀风险的新量表:一种针对成人,另一种针对青少年。
要诊断为重度抑郁症,一个人的症状必须符合 DSM-5 中概述的标准。悲伤、情绪低落和对日常活动失去兴趣的感觉必定标志着一个人以前的状态发生了变化,并且持续了至少两周。
这些感觉还必须伴有至少五种其他常见的抑郁症状,包括:
这些症状必定会导致个体出现临床上显著的痛苦或社交、职业或其他重要功能领域的损害。
这些症状不能归因于药物或物质滥用,也不能是由其他身体疾病引起的。
除了DSM-5,还有一些常用的抑郁症量表,用于评估抑郁症的严重程度和症状表现。常见的抑郁症量表包括:
用于评估抑郁症状的程度。
临床评估工具,用于评估抑郁症状的严重程度。
用于评估双相情感障碍,包括抑郁症和躁狂症。
这些量表可以帮助医生更全面地评估抑郁症的症状和严重程度,以指导治疗计划的制定。
抑郁症的诊断主要是基于临床评估和心理评估,其他也包括一些实验室测试来辅助判别。
// 实验室测试
用于识别生物标志物并应用于诊断重度抑郁症的基因组、蛋白质组和代谢分析仍处于起步阶段。
炎症标志物
严重抑郁症与细胞因子或其可溶性受体升高有关,包括:白细胞介素IL-2、可溶性 IL-2 受体 (sIL-2R)、IL-1b、IL-1 受体拮抗剂 (IL-1Ra)、IL -6、可溶性 IL-6 受体 (sIL-6R) 和 γ-干扰素。
一项病例对照研究发现,血清抵抗素(一种细胞因子和代谢标志物)水平与非典型抑郁症症状相关,抑郁症受试者的脂联素水平低于对照组。
BDNF(脑源性神经营养因子)
与对照组相比,抑郁症受试者的血清水平通常较低,并且血清BDNF水平在抗抑郁治疗后升高。血清BDNF可以作为区分单极性和双极性抑郁症的生物标志物。
皮质醇
HPA轴功能障碍已在抑郁症的病因中得到观察。抑郁症患者的高皮质醇血症表现为24小时平均血清皮质醇浓度升高和24小时尿液皮质醇排泄增加。
新型血液测试
一种新的血液测试被描述用于重度抑郁症的诊断。该测试由9种生物标志物组成,包括α-1抗胰蛋白酶、载脂蛋白CIII、BDNF、皮质醇、表皮生长因子、髓过氧化物酶、催乳素、抵抗素、可溶性肿瘤坏死因子αII型,均通过标准免疫测定进行测量。
促甲状腺激素
促甲状腺激素(TSH)被纳入并单独报道,用于评估抑郁症的总体评估中的甲状腺功能减退或甲状腺功能亢进。内源性抑郁症患者的基础血清TSH水平通常较低,从基线到峰值的TSH变化也较低。抑郁症可能与亚临床甲状腺功能减退或轻度甲状腺功能衰竭有关。
肠道菌群健康检测
某些菌群的异常与抑郁症之间可能存在相关性。肠道菌群检测可以在抑郁症的早期进行风险提示,当临床症状不明显或存在疑难病例时,结合肠道菌群检测结果,可以提供更加全面的信息,辅助医生进行准确的诊断。
▼
有时候,我们口头说的“抑郁症”很多情况是短暂的抑郁情绪,还不是重度抑郁症,可以趁抑郁症在早期阶段,通过改变生活方式对其进行干预和管理。
// 饮 食
饮食选择显著影响其他身体系统,例如内分泌、免疫和胃肠道系统。
避免不健康饮食
限制摄入食品添加剂、糖、饱和脂肪酸和精制碳水化合物等。
近年来,研究表明,西方饮食中富含加工或油炸食品、糖、精制谷物和酒精,与抑郁和焦虑症状呈正相关。2020 年的一项研究发现,食用加工食品会引发体内炎症,并对免疫系统产生连锁反应,可能会增加出现抑郁症状的风险。
富含脂肪的饮食可能促进焦虑和抑郁的发展或持续。高脂肪摄入不仅会导致肥胖,还会引起身体系统广泛的炎症。肠道微生物组可能会改变高脂肪饮食的有害影响,改善情绪和行为。
通过避免受污染的食物,改善饮食质量,增强身体的免疫力,并有助于抑郁症的治疗和康复。环境重金属污染的食物可能会含有铅、汞、镉等有害物质,海鲜也是需要格外关注的食物类型,因为海产品往往容易受到汞等重金属的污染。抑郁症患者需要特别留意,避免摄入这些污染物。
高脯氨酸食物与抑郁症相关
来自西班牙巴塞罗那赫罗纳生物医学研究所 (IDIBGI) 和庞培法布拉大学 (UPF) 的研究人员发现,较高的脯氨酸摄入量与抑郁症的发展有关。这项研究的结果发表在《细胞代谢》杂志上。
为了更多地了解饮食是否会导致抑郁症的发生,IDIBGI 研究人员将大约 100 名受试者分为三类:非抑郁症、轻度抑郁症和重度抑郁症。从那里,他们分析了抑郁症诊断与肠道微生物组组成之间是否存在关系。
通过对氨基酸的代谢物分析,研究人员能够将体内脯氨酸与抑郁症评分最紧密地联系起来。
为了了解这种脯氨酸从何而来,研究人员依靠包含参与者饮食信息的调查问卷。脯氨酸再次成为对抑郁症影响最大的饮食因素。
在健康的受试者中,脯氨酸的摄入量是与抑郁评分最相关的项目。在进一步确定小鼠体内脯氨酸/抑郁症的联系后,研究人员试图通过将人类受试者的肠道细菌移植到小鼠体内来证实他们的发现。接受脯氨酸含量最高的细菌的小鼠表现出更多的抑郁症状。
什么是脯氨酸?
我们体内的蛋白质由 20 种特定氨基酸的各种组合组成,其中 9 种被认为是“必需的”。身体无法自行制造这九种氨基酸,我们需要通过饮食摄入它们。
脯氨酸是一种非必需氨基酸,这意味着我们的身体在生命的大多数阶段都可以产生足够的量。然而,在压力、康复或成长时期,这种氨基酸变得至关重要,因为我们的需求量超过了我们身体的制造量。
富含脯氨酸的食物
脯氨酸主要存在于许多动物源食品中。“脯氨酸最重要的来源是明胶和动物皮,这些食物富含胶原蛋白,是这种氨基酸的天然来源。
事实上,脯氨酸约占胶原蛋白总氨基酸的 10%。因此,含有胶原蛋白的食物,如骨头汤、鸡翅(带皮)、猪皮和明胶,是这种氨基酸的丰富来源。
大多数肉类、鱼类和乳制品也含有脯氨酸。
需要避免脯氨酸来降低抑郁风险吗?
根据这些结果,看起来有必要从饮食中去除任何含有脯氨酸的食物,以降低患抑郁症的风险。
根据研究作者和我们经验还是不要那么绝对。毕竟许多富含脯氨酸的食物,包括肉类、鱼类和奶制品,都富含对正常生长、发育和免疫支持至关重要的营养素。
在建议减少饮食中这部分食物之前,我们认为需要进行更多的研究。
当然,关于抑郁症的饮食干预不只是避免某些食物的摄入,而是要建立一个全面健康的饮食习惯。
健康饮食
2019 年的一项研究发现,富含水果、蔬菜、鱼类和瘦肉的健康饮食有助于降低抑郁症的临床水平。
有研究发现西班牙护理学生坚持地中海饮食与心理健康问题之间存在很强的相关性。坚持地中海饮食的参与者比没有坚持的人的焦虑和抑郁分数要低得多。
地中海饮食(主要是纤维、鱼和全谷物),已被证明可以通过增加产短链脂肪酸菌丰度来调节肠道菌群组成,从而减少抑郁症的发作。
也有研究发现强有力的证据表明,适度限制热量的健康饮食有助于改善抑郁症状。
多酚还被证明可以通过抑制参与氧化应激和炎症的丝裂原激活蛋白激酶途径来改善抑郁症状。多酚还作为益生元为微生物提供营养,两者相辅相成。
一项干预性随机临床试验表明,富含类黄酮的橙汁可以通过增加BDNF和毛癣菌科Trichophyton来缓解抑郁症。
总的来说,富含 omega-3 多不饱和脂肪酸 (PUFA) 的食物,大量摄入蔬菜、水果、鱼、橄榄油、大豆、全谷物的健康饮食模式可能与降低抑郁风险相关。
相关阅读:
// 动起来
缺乏身体活动是抑郁和焦虑的常见危险因素。在治疗重度抑郁症方面有大量研究表明,体育锻炼已被证明有助于预防、缓解和治疗症状。
定期锻炼对身体有好处,有助于增强力量和健康,而且对大脑和神经系统也有帮助。在剧烈运动期间,身体会释放内啡肽和多巴胺等神经递质,这有助于增加愉悦感和幸福感。
// 注重睡眠质量
睡眠质量是幸福感的重要指标。80% 的抑郁症患者自我报告存在睡眠障碍。晚上适当的休息(不要太多或太少)是控制抑郁症和保持精力充沛的好方法。为了达到最佳健康状态,建议七到八小时。
除了适当的休息之外,充足的睡眠还有助于注意力、认知、记忆形成和情绪调节。
如果有睡眠问题,请持续保持良好的睡眠习惯。比如收起电子产品,睡前写日记,并制定一个轻松的睡前习惯来放松身心。
如果睡眠无法改善,请寻求医生的帮助。
// 冥想正念
当您处于抑郁状态时,很容易陷入消极的想法和情绪中。正念、冥想和呼吸练习可以成为抵御压力和焦虑、让你的大脑专注于当下的一种方法。还可以将正念应用于创造性追求,其中可能涉及日记、绘画、唱歌、玩耍、跳舞等活动。
从生物学角度来看,冥想对某些生理功能具有积极、显著的影响。练习冥想可以影响大脑结构、大脑网络,保持自主神经系统的稳态,甚至影响我们基因的运作方式。
练习正念也可以导致知觉转变。你的想法和情绪不再被视为压倒性的事件,而是一个有助于洞察和平静的时刻。
// 走出去,感受新鲜空气
抑郁症的症状之一是很难起床,完成基本任务可能需要付出巨大的努力。如果忽视户外活动而更多地待在室内,可能会扰乱睡眠和昼夜节律,并导致维生素D 不足。
维生素D 水平下降与抑郁症之间可能存在关联。尽管研究仍然很少,但越来越多的研究表明维生素D 可以在缓解抑郁症方面发挥治疗作用。然而,它在促进免疫功能健康、细胞生长和维持骨骼健康方面的益处是众所周知的。
为了摆脱抑郁症,充足的自然阳光照射有助于满足每日维生素D。拥抱自然疗法,感受皮肤上的阳光,并在街区周围散步以改变环境。
// 依靠爱的人
当你感到沮丧时,你很容易孤立并拒绝与人交往的尝试。或者你可能在人群中却仍然感到孤独。然而,人类天生就是社会性动物。如果你的社会支持质量下降,它可能会加剧抑郁症状,并产生更多的孤独、内疚、羞耻和疏远感。
建议适当社交,是提高自尊、适应力、爱的途径——所有这些都有助于产生积极的心理健康结果。数十年的研究证明,与社区的较高社会关系质量与降低压力水平和抑郁症状有关。
哈佛大学成人发展研究对幸福进行了一项长期研究,发现人际关系可以产生精神和情感刺激(情绪助推器),并有助于抵消孤立感。哈佛大学的研究人员指出,人际关系是幸福和生活满意度的有力预测因素。
// 尽可能寻找感激之情和欢笑
有可靠的科学证据表明,感恩可以改善认知和情感健康。研究的一项感恩干预措施是使用感恩情,在其中列出几周内每天让你感激的三到五件事。感恩练习有助于增加积极情绪、主观幸福感、生活满意度,并减少抑郁症状。
研究发现幽默可以成为对抗抑郁症状和焦虑的重要应对机制。当你沮丧时,很难从任何事情中找到乐趣。即便如此,寻找令人愉快的活动仍然是件好事,比如观看搞笑的单口喜剧、拥抱宠物、沉迷于一部让人感觉良好的电影、听音乐、犒赏自己一个热水澡,或者点你最喜欢的饭菜。做任何你喜欢做的事都可以带来快乐。
// 尝试摆脱情绪低落的小技巧
-简化生活,管理时间
列出日常任务清单,使用提醒便签,或者使用计划表有助于保持生活有条不紊。尽可能减少责任,为自己设定合理的目标。当感觉情绪低落时,允许自己少做一些事情。当感到沮丧时避免做出重大决定。
-写日记
作为治疗的一部分,可以通过表达痛苦、愤怒、恐惧或其他情绪来改善心情。
-阅读
阅读知名的自助书籍和网站。医生或治疗师会推荐书籍或网站以供阅读。
-战胜拖延
抑郁症的症状,例如疲劳和注意力不集中,很容易拖延。拖延事情会加剧抑郁。它会导致增加内疚、担忧和压力。制定短期目标并努力首先完成最重要的事情。成功完成的每一项任务都会帮你打破拖延的习惯。
-尝试社交或找到有用的团体
尝试参加社交活动,定期与家人或朋友聚会。许多组织支持联盟,提供教育、互助组、咨询和其他资源来帮助治疗抑郁症。参加各种心理小组也可以为心理健康问题提供帮助。抑郁症患者互助组可以与其他面临类似问题的患者建立联系并分享经验。
-避免酗酒
酒精似乎可以减轻抑郁症状,但从长远来看,它们通常会加重症状,使抑郁更难治疗。
▼
可以通过肠道菌群检测,了解整体菌群结构和异常指标,进行个性化干预。
如果发现核心菌属丰度低,有害菌丰度高,菌群结构紊乱,那么可以配合使用抗生素或益生元等抑制过多有害菌,加以改善。
或者通过粪菌移植的方式适当改变菌群结构,从而有效改善。
发现异常菌群,可以针对缺乏菌群,通过补充益生菌,功能性补充剂等方式加以改善。
// 益生菌 & 益生元
益生菌
最近的荟萃分析和系统综述证实了益生菌在临床研究中的抗抑郁功效。相关动物研究也表明,这种作用与肠道菌群结构的调节有关。
研究人员使用罗伊氏乳杆菌(Lactobacillus reuteri )干预CUMS小鼠,发现只有恢复乳杆菌水平才足以改善与应激相关的代谢变化和行为异常。
在另一项研究中,热灭菌的短双歧杆菌可以调节肠道菌群成分,从而预防慢性社交失败压力引起的抑郁症状。这种具有功能性食物成分的菌株可以用作新的疗法。


编辑
doi: 10.7759/cureus.40293
益生元
每天 5 克的低聚半乳糖和 1 克或以下的二十碳五烯酸可以有效缓解抑郁症状。虽然 EGCG 具有潜在的抗抑郁特性,但可能需要 3 克/天的较高剂量才能产生显着效果。
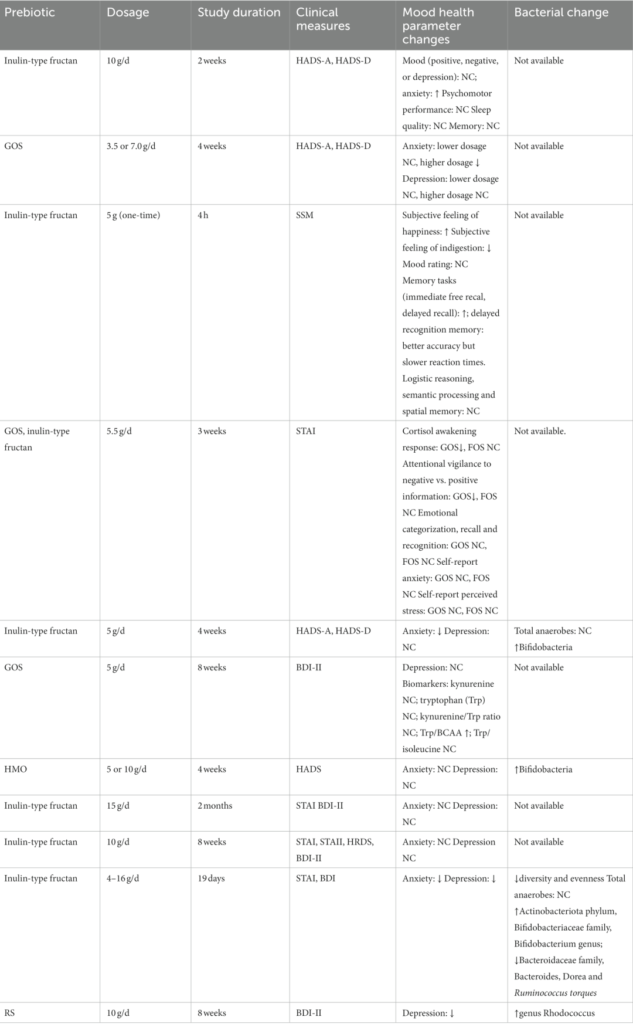
doi.org/10.3389/fnut.2023.1206468
益生菌和益生元联合给药
研究表明,益生菌和益生元的联合给药可以达到更大的抗抑郁效果。益生元的显著营养作用可能会提高益生菌的存活率,从而增强益生菌的抗抑郁能力。
没有相关研究报告益生菌引起的戒断反应和副作用等问题,这似乎是一种很有前途的抑郁症干预措施。益生菌菌株、剂量和方法的最佳组合尚不精确。为了解决这些问题,还需要更多的随机、双盲、安慰剂对照试验来解开这个谜题。
// 粪菌移植
一种直接干扰肠道菌群的方法是粪便微生物群移植(FMT)。它在抑郁症和微生物结构紊乱方面的优异表现使我们看到了新的治疗方向。
在一项动物研究中,NLRP3 KO菌群移植显著改善了受体小鼠的抑郁样行为。在他们的研究中,FMT机制主要依赖于抑制抑郁小鼠中circHIPK2的表达。
在人类受试者中,FMT也显示出类似的效果。在一份FMT作为抑郁症辅助治疗的病例报告中,入选的患者表现出抑郁症状的改善、肠道菌群多样性的增加以及胃肠道症状的缓解。
然而,这种影响并不持久,他们推测FMT的疗效与供体和受体的微生物相似性有关。FMT面临的主要挑战是提高成功率、最佳交付途径、捐赠者选择和其他需要探索的问题。
▼
// 药物
N-乙酰半胱氨酸(NAC)
NAC 通过其抗氧化、抗炎和谷氨酸调节活性,可能在多种精神疾病的治疗中发挥作用。
身体使用N-乙酰半胱氨酸(NAC)来制造自身的抗氧化剂。医学上,NAC用于治疗对乙酰氨基酚中毒;只要在服药过量后的前 8 小时内服用,几乎 100% 有效。
根据对多项单独研究数据(包括 574 名抑郁症患者和健康参与者的数据)的一项审查,据报道,NAC 在使用 3-6 个月内有可能改善抑郁症状和整体日常功能。此外,据报道,抑郁症患者的情绪在 3-4 个月后得到改善。
NAC 还可以通过减少大脑的氧化应激来平衡情绪。例如,一项针对 76 名抑郁症患者的研究报告称,服用 NAC 的患者大脑抗氧化水平较高。
以上益处仅得到有限的小规模临床研究的支持。在 NAC 推荐临床之前需要进行更长时间、更有力度的研究。
选择性血清素再摄取抑制剂(SSRI)
医生通常会先开一种 SSRI 药物。通常认为这些药物更安全,所产生的不适副作用一般少于其他类型的抗抑郁药。SSRI 药物包括西酞普兰(Celexa)、艾司西酞普兰(Lexapro)、氟西汀(Prozac)、帕罗西汀(Paxil、Pexeva)、舍曲林(Zoloft)、维拉佐酮(Viibryd)
血清素-去甲肾上腺素再摄取抑制剂(SNRI)
SNRI 药物包括度洛西汀(Cymbalta)、文拉法辛(Effexor XR)、地文拉法辛(Pristiq、Khedezla)和左米那普仑(Fetzima)
非典型抗抑郁药
这些药物不太适合归入其他任何抗抑郁药类别。这些药物包括安非他酮(Wellbutrin XL、Wellbutrin SR、Aplenzin、Forfivo XL)、米氮平(Remeron)、奈法唑酮、曲唑酮和伏硫西汀(Trintellix)。
三环类抗抑郁药
例如丙米嗪(Tofranil)、去甲替林(Pamelor)、阿米替林、多塞平、曲米帕明(Surmontil)、地昔帕明(Norpramin)和普罗替林(Vivactil)等这些药物可能都很有效,但是副作用往往比新型的抗抑郁药更严重。因此通常不会开三环类药物,除非您已经用过 SSRI,却没有起色。
单胺氧化酶抑制剂(MAOI)
反苯环丙胺(Parnate)、苯乙肼(Nardil)和异卡波肼(Marplan)等 MAOI 药物会产生严重的副作用,因此,一般在其他药物没有疗效的情况下才会开这些药物。使用 MAOI 时需要严格控制饮食,因为这类药物会和某些奶酪、泡菜、葡萄酒等食物以及某些药物和草本补充剂发生相互作用,危险甚至致命。司来吉兰(Emsam)是一种新型 MAOI,可以作为垫片贴在皮肤上,副作用少于其他 MAOI 药物。这类药物不能和 SSRI 药物联合使用。
鼻内艾氯胺酮
新药物,例如鼻内艾氯胺酮,可以快速发挥抗抑郁作用,特别是对于难治性抑郁症患者。以鼻喷雾剂的形式提供,通常在几个小时内迅速起效,缓解抑郁症状。使用艾氯胺酮的人通常会继续服用口服抗抑郁药以维持症状的改善。
多种药物
有时候可能需要尝试几种药物或联合用药,然后才能找到有效的药物。这需要耐心,因为对有些药物而言,完全起效及其副作用随着身体调整而缓解,需要数周或更长时间。
突然停药的风险
抗抑郁药需要一段时间(通常需要 4-8 周)才能发挥作用,睡眠、食欲和注意力问题通常会在情绪好转之前得到改善。
咨询医生前,请不要停止服用抗抑郁药。抗抑郁药一般不会上瘾,但有时会产生身体依赖性(这与上瘾不同)。突然停止治疗或多次漏服药物可能导致类似戒断的症状,突然放弃治疗可能导致抑郁症恶化。配合医生,逐渐安全减小剂量。
// 中药类
早在中国汉代,张仲景就记载了治疗抑郁症的经典方剂,但其具体药理机制尚不清楚。在最近的研究中,一些中药的抗抑郁作用已被证明与肠道菌群相关。
例如,舒肝颗粒可以显著改善慢性约束应激小鼠的异常行为和海马炎症。后续的机制研究表明,其给药丰富了小鼠肠道中的丁酸单胞菌和节疣念珠菌,降低了拟杆菌的丰度,并与PI3K/Akt/mTOR途径密切相关。
五味子可以通过抑制TLR4/NF-κB信号通路来减轻抑郁小鼠的肠道微生态失调。
除了调节炎症,中药还在调节神经递质水平方面发挥作用。
莲心碱治疗可以缩短抑郁小鼠的不动时间,增加海马中的DA、5-HT和NE等神经递质。同时,小鼠结肠中乳酸杆菌的相对丰度也有所增加。
在另一项研究中,特异性抗抑郁药中药的靶点可以集中在嘌呤代谢的调节上。与中药相关的动物研究,如肉苁蓉和藏红花酸,表明它们的抗抑郁作用与肠道菌群的调节密切相关。
除了动物研究,临床研究也提供了相应的证据。对患有抑郁症的癌症患者使用中药复方小柴胡汤进行干预。给药后,受试者的抑郁症状减轻,肠道微生态失调得到部分逆转(特别是减少了副拟杆菌、Blautia和瘤胃球菌科细菌的丰度)。有趣的是,这种抗抑郁的草药也表现出一些抗肿瘤作用,其潜在机制涉及TLR4/MyD88/NF-κB信号传导。
值得注意的是,这些途径在涉及微生物群的抑郁症发病机制中也发挥着重要作用。最近的系统综述和荟萃分析也表明,与抗抑郁药相比,中药可以减少不良事件。鉴于目前的研究数量有限,准确总结中药治疗抑郁症的益处和风险还为时过早。
// 专业治疗
一旦注意到抑郁症的迹象或症状,与心理健康专家交谈将是至关重要的一步。值得信赖的治疗师可以识别模式,帮助情绪调节。
心理治疗
几种类型的心理治疗(也称为谈话疗法或咨询),可以通过教抑郁症患者新的思维和行为方式以及如何改变导致抑郁的习惯来帮助他们。
治疗抑郁症的循证方法包括:
一种谈话疗法,旨在帮助改变任何可能导致或恶化抑郁症的消极思想或行为模式。这种疗法通常也是短期的,重点是解决当前的问题并学习新的应对技巧。
治疗师通过帮助个体识别和处理与人际关系有关的困难,以及改善与他人的交流方式,来促进情绪上的积极变化。 解决几个常见的人际问题,包括失去、冲突、角色变化和人际孤立感。个体可以增强情感的稳定性和归属感,提高应对人际问题的能力。
心理健康服务远程医疗的发展提供了面对面治疗的替代方案,在某些情况下使人们更容易、更方便地获得帮助。对于过去可能对寻求心理健康护理犹豫不决的人来说,远程心理健康服务可能是比传统心理健康服务更容易的第一步。
脑刺激疗法
如果药物或心理治疗不能减轻抑郁症状,脑刺激疗法可能是一种值得探索的选择。
拥有最多证据的脑刺激疗法包括:
ECT 和 rTMS 是使用最广泛的脑刺激疗法,其中 ECT 的使用历史最长。
替代疗法
每日晨光疗法是季节性情感障碍患者的常见治疗选择。光疗设备比普通室内照明明亮得多,被认为是安全的,但患有某些眼病或服用增加对阳光敏感性的药物的人不建议。
抑郁症不仅仅是一种精神疾病,还具有生理和解剖学改变,本文我们了解了抑郁症相关的基本知识,以及肠道菌群在抑郁症发展和症状表现中的重要性。深入了解抑郁症和肠道菌群之间的相互影响将有助于未来开发更有效的治疗策略,并提高患者的生活质量。
我们应该全面认识抑郁症,意识到其不仅仅是一种心理问题,而是一个涉及多个身体系统的综合性障碍。除了对心理状态的影响外,抑郁症还可以引起神经系统、免疫系统、心血管系统以及睡眠障碍等多方面的变化。
目前对于微生物组在口腔-肠道-脑轴中的作用已经有了一定的认识,这是一个重要的研究方向,从病理生理学到调节肠道微生物组对精神疾病产生影响。关于口腔微生物群与精神疾病的关联详见本次推文第二篇:
这些身体系统的紊乱可能进一步加剧抑郁症的症状,并对患者的整体健康状况产生负面影响。
在临床实践中,针对抑郁症的治疗需要不同科室的医生共同合作。未来更多需要整合心理治疗、药物治疗、营养治疗和包括菌群检测在内的综合性健康管理等多个领域的专业知识与技术,实施多学科联合治疗,为抑郁症的治疗提供全新的视角,并为未来研究和改进抑郁症治疗策略提供宝贵的经验。
吾日三省吾身:
每天给予自己足够的关怀和爱吗?
对自己的身心健康变化是否警觉并感兴趣?
是否意识到自己的情绪,并且能够充分处理和接纳它们?
…
希望大家都能健康快乐,远离抑郁。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
主要参考文献:
Basiji K, Sendani AA, Ghavami SB, Farmani M, Kazemifard N, Sadeghi A, Lotfali E, Aghdaei HA. The critical role of gut-brain axis microbiome in mental disorders. Metab Brain Dis. 2023 Jul 12. doi: 10.1007/s11011-023-01248-w. Epub ahead of print. PMID: 37436588.
Chang L, Wei Y, Hashimoto K. Brain-gut-microbiota axis in depression: A historical overview and future directions. Brain Res Bull. 2022 May;182:44-56. doi: 10.1016/j.brainresbull.2022.02.004. Epub 2022 Feb 11. PMID: 35151796.
Bradlow RCJ, Berk M, Kalivas PW, Back SE, Kanaan RA. The Potential of N-Acetyl-L-Cysteine (NAC) in the Treatment of Psychiatric Disorders. CNS Drugs. 2022 May;36(5):451-482.
Chen Y, Xu J, Chen Y. Regulation of Neurotransmitters by the Gut Microbiota and Effects on Cognition in Neurological Disorders. Nutrients. 2021 Jun 19;13(6):2099. doi: 10.3390/nu13062099. PMID: 34205336; PMCID: PMC8234057.
Smith KM, Renshaw PF, Bilello J. The diagnosis of depression: current and emerging methods. Compr Psychiatry. 2013 Jan;54(1):1-6. doi: 10.1016/j.comppsych.2012.06.006. Epub 2012 Aug 15. PMID: 22901834; PMCID: PMC5502713.
Joe Cohen, BS. How Depression May Be Linked To Gut Microbes. 2022.12.selfhacked.
Major Depressive Disorder Working Group of the Psychiatric GWAS Consortium; Ripke S, Wray NR, Lewis CM, Hamilton SP, Weissman MM, et al., A mega-analysis of genome-wide association studies for major depressive disorder. Mol Psychiatry. 2013 Apr;18(4):497-511.
Zeng Y, Navarro P, Xia C, Amador C, Fernandez-Pujals AM, Thomson PA, Campbell A, Nagy R, Clarke TK, Hafferty JD, Smith BH, Hocking LJ, Padmanabhan S, Hayward C, MacIntyre DJ, Porteous DJ, Haley CS, McIntosh AM. Shared Genetics and Couple-Associated Environment Are Major Contributors to the Risk of Both Clinical and Self-Declared Depression. EBioMedicine. 2016 Dec;14:161-167.
Sharma A. Systems Genomics Support for Immune and Inflammation Hypothesis of Depression. Curr Neuropharmacol. 2016;14(7):749-58.
Flint J, Kendler KS. The genetics of major depression. Neuron. 2014 Feb 5;81(3):484-503. doi: 10.1016/j.neuron.2014.01.027. Erratum in: Neuron. 2014 Mar 5;81(5):1214.
Brundin L, Sellgren CM, Lim CK, Grit J, Pålsson E, Landén M, Samuelsson M, Lundgren K, Brundin P, Fuchs D, Postolache TT, Traskman-Bendz L, Guillemin GJ, Erhardt S. An enzyme in the kynurenine pathway that governs vulnerability to suicidal behavior by regulating excitotoxicity and neuroinflammation. Transl Psychiatry. 2016 Aug 2;6(8):e865.
Lohoff FW. Overview of the genetics of major depressive disorder. Curr Psychiatry Rep. 2010 Dec;12(6):539-46.
González-Arancibia C, Urrutia-Piñones J, Illanes-González J, Martinez-Pinto J, Sotomayor-Zárate R, Julio-Pieper M, Bravo JA. Do your gut microbes affect your brain dopamine? Psychopharmacology (Berl). 2019 May;236(5):1611-1622. doi: 10.1007/s00213-019-05265-5. Epub 2019 May 17. PMID: 31098656.
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li J, Xu J, Li S, Li D, Cao J, Wang B, Liang H, Zheng H, Xie Y, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu H, Yu C, Li S, Jian M, Zhou Y, Li Y, Zhang X, Li S, Qin N, Yang H, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J; MetaHIT Consortium; Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010 Mar 4;464(7285):59-65.
Bercik P, Collins SM, Verdu EF. Microbes and the gut-brain axis. Neurogastroenterol Motil. 2012 May;24(5):405-13.
Mayneris-Perxachs J, Castells-Nobau A, Arnoriaga-Rodríguez M, Martin M, de la Vega-Correa L, Zapata C, Burokas A, Blasco G, Coll C, Escrichs A, Biarnés C, Moreno-Navarrete JM, Puig J, Garre-Olmo J, Ramos R, Pedraza S, Brugada R, Vilanova JC, Serena J, Gich J, Ramió-Torrentà L, Pérez-Brocal V, Moya A, Pamplona R, Sol J, Jové M, Ricart W, Portero-Otin M, Deco G, Maldonado R, Fernández-Real JM. Microbiota alterations in proline metabolism impact depression. Cell Metab. 2022 May 3;34(5):681-701.e10.
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23;505(7484):559-63.
Bailey MT, Dowd SE, Galley JD, Hufnagle AR, Allen RG, Lyte M. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation. Brain Behav Immun. 2011 Mar;25(3):397-407.
Diaz Heijtz R, Wang S, Anuar F, Qian Y, Björkholm B, Samuelsson A, Hibberd ML, Forssberg H, Pettersson S. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A. 2011 Feb 15;108(7):3047-52.
Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 170: 1179-1188
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng Y, Blennerhassett P, Macri J, McCoy KD, Verdu EF, Collins SM. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011 Aug;141(2):599-609, 609.e1-3.
Huang R, Wang K, Hu J. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2016 Aug 6;8(8):483.
Akkasheh G, Kashani-Poor Z, Tajabadi-Ebrahimi M, Jafari P, Akbari H, Taghizadeh M, Memarzadeh MR, Asemi Z, Esmaillzadeh A. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition. 2016 Mar;32(3):315-20.
Macpherson AJ, Harris NL.. Interactions between commensal intestinal bacteria and the immune system. Nat Rev Immunol 4: 478-485
Bailey MT. Influence of stressor-induced nervous system activation on the intestinal microbiota and the importance for immunomodulation. Adv Exp Med Biol. 2014;817:255-76.
García Bueno B, Caso JR, Madrigal JL, Leza JC. Innate immune receptor Toll-like receptor 4 signalling in neuropsychiatric diseases. Neurosci Biobehav Rev. 2016 May;64:134-47.
Nugent NR, Tyrka AR, Carpenter LL, Price LH. Gene-environment interactions: early life stress and risk for depressive and anxiety disorders. Psychopharmacology (Berl). 2011 Mar;214(1):175-96.
Ait-Belgnaoui A, Durand H, Cartier C, Chaumaz G, Eutamene H, Ferrier L, Houdeau E, Fioramonti J, Bueno L, Theodorou V. Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats. Psychoneuroendocrinology. 2012 Nov;37(11):1885-95.
Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012 Oct;13(10):701-12.
Bercik P, Verdu EF, Foster JA, Macri J, Potter M, Huang X, Malinowski P, Jackson W, Blennerhassett P, Neufeld KA, Lu J, Khan WI, Corthesy-Theulaz I, Cherbut C, Bergonzelli GE, Collins SM. Chronic gastrointestinal inflammation induces anxiety-like behavior and alters central nervous system biochemistry in mice. Gastroenterology. 2010 Dec;139(6):2102-2112.e1.
Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, Bienenstock J, Cryan JF. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A. 2011 Sep 20;108(38):16050-5. doi: 10.1073/pnas.1102999108.
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng Y, Blennerhassett P, Macri J, McCoy KD, Verdu EF, Collins SM. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011 Aug;141(2):599-609, 609.e1-3.
Mayneris-Perxachs J, Castells-Nobau A, Arnoriaga-Rodríguez M, Martin M, de la Vega-Correa L, Zapata C, Burokas A, Blasco G, Coll C, Escrichs A, Biarnés C, Moreno-Navarrete JM, Puig J, Garre-Olmo J, Ramos R, Pedraza S, Brugada R, Vilanova JC, Serena J, Gich J, Ramió-Torrentà L, Pérez-Brocal V, Moya A, Pamplona R, Sol J, Jové M, Ricart W, Portero-Otin M, Deco G, Maldonado R, Fernández-Real JM. Microbiota alterations in proline metabolism impact depression. Cell Metab. 2022 May 3;34(5):681-701.e10.
Lopez MJ, Mohiuddin SS. Biochemistry, Essential Amino Acids. 2023 Mar 13. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–.
Mokhtari V, Afsharian P, Shahhoseini M, Kalantar SM, Moini A. A Review on Various Uses of N-Acetyl Cysteine. Cell J. 2017 Apr-Jun;19(1):11-17.
Ershad M, Naji A, Vearrier D. N-Acetylcysteine. [Updated 2023 Feb 19]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-.
Fernandes BS, Dean OM, Dodd S, Malhi GS, Berk M. N-Acetylcysteine in depressive symptoms and functionality: a systematic review and meta-analysis. J Clin Psychiatry. 2016 Apr;77(4):e457-66.
Berk M, Dean OM, Cotton SM, Jeavons S, Tanious M, Kohlmann K, Hewitt K, Moss K, Allwang C, Schapkaitz I, Robbins J, Cobb H, Ng F, Dodd S, Bush AI, Malhi GS. The efficacy of adjunctive N-acetylcysteine in major depressive disorder: a double-blind, randomized, placebo-controlled trial. J Clin Psychiatry. 2014 Jun;75(6):628-36.
Fernandes BS, Dean OM, Dodd S, Malhi GS, Berk M. N-Acetylcysteine in depressive symptoms and functionality: a systematic review and meta-analysis. J Clin Psychiatry. 2016 Apr;77(4):e457-66.
Hasebe K, Gray L, Bortolasci C, Panizzutti B, Mohebbi M, Kidnapillai S, Spolding B, Walder K, Berk M, Malhi G, Dodd S, Dean OM. Adjunctive N-acetylcysteine in depression: exploration of interleukin-6, C-reactive protein and brain-derived neurotrophic factor. Acta Neuropsychiatr. 2017 Dec;29(6):337-346.
Das P, Tanious M, Fritz K, Dodd S, Dean OM, Berk M, Malhi GS. Metabolite profiles in the anterior cingulate cortex of depressed patients differentiate those taking N-acetyl-cysteine versus placebo. Aust N Z J Psychiatry. 2013 Apr;47(4):347-54.
Fekadu A, Demissie M, Birhane R, Medhin G, Bitew T, Hailemariam M, Minaye A, Habtamu K, Milkias B, Petersen I, Patel V, Cleare AJ, Mayston R, Thornicroft G, Alem A, Hanlon C, Prince M. Under detection of depression in primary care settings in low and middle-income countries: a systematic review and meta-analysis. Syst Rev. 2022 Feb 5;11(1):21.
Wickham SR, Amarasekara NA, Bartonicek A, Conner TS. The Big Three Health Behaviors and Mental Health and Well-Being Among Young Adults: A Cross-Sectional Investigation of Sleep, Exercise, and Diet. Front Psychol. 2020 Dec 10;11:579205.
Yates BE, DeLetter MC, Parrish EM. Prescribed exercise for the treatment of depression in a college population: An interprofessional approach. Perspect Psychiatr Care. 2020 Oct;56(4):894-899.
Belvederi Murri M, Ekkekakis P, Magagnoli M, Zampogna D, Cattedra S, Capobianco L, Serafini G, Calcagno P, Zanetidou S, Amore M. Physical Exercise in Major Depression: Reducing the Mortality Gap While Improving Clinical Outcomes. Front Psychiatry. 2019 Jan 10;9:762.
Peirce JM, Alviña K. The role of inflammation and the gut microbiome in depression and anxiety. J Neurosci Res. 2019 Oct;97(10):1223-1241. doi: 10.1002/jnr.24476. Epub 2019 May 29. PMID: 31144383.
Basso JC, Suzuki WA. The Effects of Acute Exercise on Mood, Cognition, Neurophysiology, and Neurochemical Pathways: A Review. Brain Plast. 2017 Mar 28;2(2):127-152.
Worley SL. The Extraordinary Importance of Sleep: The Detrimental Effects of Inadequate Sleep on Health and Public Safety Drive an Explosion of Sleep Research. P T. 2018 Dec;43(12):758-763.
Shen H, Chen M, Cui D. Biological mechanism study of meditation and its application in mental disorders. Gen Psychiatr. 2020 Jul 13;33(4):e100214.
Hölzel BK, Carmody J, Vangel M, Congleton C, Yerramsetti SM, Gard T, Lazar SW. Mindfulness practice leads to increases in regional brain gray matter density. Psychiatry Res. 2011 Jan 30;191(1):36-43.
Ljungberg T, Bondza E, Lethin C. Evidence of the Importance of Dietary Habits Regarding Depressive Symptoms and Depression. Int J Environ Res Public Health. 2020 Mar 2;17(5):1616.
Francis HM, Stevenson RJ, Chambers JR, Gupta D, Newey B, Lim CK. A brief diet intervention can reduce symptoms of depression in young adults – A randomised controlled trial. PLoS One. 2019 Oct 9;14(10):e0222768.
Wong SK, Chin KY, Ima-Nirwana S. Vitamin D and Depression: The Evidence from an Indirect Clue to Treatment Strategy. Curr Drug Targets. 2018;19(8):888-897.
Kaveladze B, Diamond Altman A, Niederhausen M, Loftis JM, Teo AR. Social relationship quality, depression and inflammation: A cross-cultural longitudinal study in the United States and Tokyo, Japan. Int J Soc Psychiatry. 2022 Mar;68(2):253-263.
Matthew Solan.The secret to happiness? Here’s some advice from the longest-running study on happiness.Harvard Health.
Cunha LF, Pellanda LC, Reppold CT. Positive Psychology and Gratitude Interventions: A Randomized Clinical Trial. Front Psychol. 2019 Mar 21;10:584.
Menéndez-Aller Á, Postigo Á, Montes-Álvarez P, González-Primo FJ, García-Cueto E. Humor as a protective factor against anxiety and depression. Int J Clin Health Psychol. 2020 Jan-Apr;20(1):38-45.
Reyes-Martínez S, Segura-Real L, Gómez-García AP, Tesoro-Cruz E, Constantino-Jonapa LA, Amedei A, Aguirre-García MM. Neuroinflammation, Microbiota-Gut-Brain Axis, and Depression: The Vicious Circle. J Integr Neurosci. 2023 May 8;22(3):65. doi: 10.31083/j.jin2203065. PMID: 37258450.

谷禾健康
花青素-肠道微生物群-健康轴
经常听到一些专家在介绍食品或保健品时说富含花青素,那么究竟什么是花青素?对我们的健康又有何益处?
花青素是在植物组织中发现的天然水溶性色素,水果、蔬菜、花卉中的呈色物质大部分与之有关,是类黄酮的一个亚类,迄今为止已鉴定出700多种结构不同的花青素。
花青素是一种重要的营养素,具有多种生物活性和保健作用,如抗氧化、抗炎、抗癌、降血压、降血糖、保护视力及心血管健康。
花青素在消化过程中还会影响肠道中的细菌代谢。花青素及其衍生物还通过调节肠道屏障功能和有益细菌的定植来促进肠道健康,从而更好地抵御病原体,改善营养代谢和整体免疫反应。
在本文中,谷禾简要介绍了不同类型的花青素,它们常见的饮食来源和通过胃肠道(包括胃、小肠和结肠)的吸收和代谢。
本文还总结了膳食花青素对健康的直接影响,以及肠道微生物群作为“媒介”时的影响。花青素-微生物的相互作用可能成为肥胖、2型糖尿病、心血管疾病、神经退行性疾病、炎症性肠病、癌症、慢性肾脏病和骨关节炎等疾病的治疗新途径。
目录
1.常见的花青素及膳食来源
2.膳食花青素在人体内的吸收和代谢
3.花青素对肠道微生物群的影响
4.花青素-微生物群对肥胖的改善作用
5.花青素-肠道菌群对糖尿病的影响
6.花青素改善心血管疾病
7.花青素降低神经退行性疾病风险
8.花青素对其他疾病的影响
9.日常补充膳食花青素的一些建议
花青素又称花色素,是自然界一类广泛存在于植物中的水溶性天然色素,是花色苷水解而得的有颜色的苷元。
水果、蔬菜、花卉中的主要呈色物质大部分与之有关。在植物细胞液泡不同的PH值条件下,花青素使花瓣呈现五彩缤纷的颜色。
▼
已知现有的花青素多达几百种,食物中重要的有6种,即天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素。
花青素具有2-苯基苯并吡喃结构,具有完全不饱和的C环和3位的羟基。
植物性食物中主要花青素的结构

Liang A,et al.Crit Rev Food Sci Nutr.2023
(A)花青素中的2-苯基苯并吡喃骨架 (B)附着在糖基化花青素上的常见糖部分 (C)植物性食物中常见的花青素 (D)酰化花青素 (E)吡喃花青素
▼
植物性食品中花青素的浓度和组成高度依赖于植物品种、生长区域、植物部位、加工方法和测量方法。
花青素在各种红色、紫色和蓝色水果(如浆果、石榴、血橙和红梅)中含量丰富,这些水果代表了人类饮食中花青素的主要摄入。
常见水果中的花青素

Liang A,et al.Crit Rev Food Sci Nutr.2023
•花青素在不同酸碱度下颜色不同
花青素在水果中根据pH条件,它会显示红色(pH<3)、紫色(pH=7-8)及蓝色(pH>11)。
例如飞燕草色素通常存在于花朵和葡萄中,它们提供蓝紫色,而天竺葵色素为许多浆果和水果提供橙色和红色,包括树莓、草莓和石榴。
•酰化花青素具有更强的耐热性和耐光性
酰化花青素是通过糖基和有机酸的乙酰化酯键得到的,进一步扩大了食品中花青素的多样性。常见的酰化酸包括脂肪酸(乙酸、丙二酸、苹果酸、草酸和琥珀酸)和环状酸(对香豆酸、咖啡酸、芥子酸、没食子酸和阿魏酸)。
在葡萄中鉴定出酰化花青素,在黑胡萝卜、红薯和红甘蓝中发现了肉桂酸酰化的花青素。在红萝卜中发现了多达12种酰化花青素。
酰化花青素在加工过程中表现出更强的耐热性和耐光性,因此被广泛用作食品工业中的着色剂。
•吡喃花青素具有更强的抗氧化能力
吡喃花青素是另一组具有额外吡喃环的花青素,主要在红酒的酒精发酵和陈酿过程中产生。少量吡喃花青素天然存在于血橙、草莓和黑加仑等水果中。
吡喃花青素的主要类别包括A型和B型视黄素、甲基吡喃花青素、羟基苯基吡喃花青素和黄烷基吡喃花青素。
相较于单体花青素,吡喃花青素,在更大范围的pH条件下保持其颜色,这是因为额外的吡喃环可以防止亲核攻击和无色甲醇碱的形成。
吡喃花青素在二氧化硫漂白和热降解过程中也具有更大的稳定性,并且相对于单体花青素具有更强的抗氧化能力。
由于这些原因,吡喃花青素作为颜料和生物活性剂广泛用于食品加工。
膳食花青素是指可以通过饮食摄入的一类花青素,广泛存在于深红色、紫色或蓝色蔬菜水果中,如葡萄、蓝莓、紫甘蓝、紫薯、黑枸杞等。
膳食花青素的代谢和治疗活性取决于其生物可及性(可从食物基质中获得的量)和生物利用度(在人体肠道中的吸收)。这受到许多因素的影响,包括化学结构、与食物基质的相互作用、其他膳食化合物的存在以及个体遗传学和生理学差异。
★ 不同结构的花青素消化率存在差异
例如,具有双糖部分的糖基化花青素相对于单葡萄糖苷和苷元更耐消化。酰化花青素的消化率低于非酰化化合物,主要是因为极性降低和酰基的阻碍。吡喃花青素和聚合物花青素在刺激消化过程中更稳定。
花青素及其衍生物在人体内的消化吸收发生在胃、小肠和大肠中。
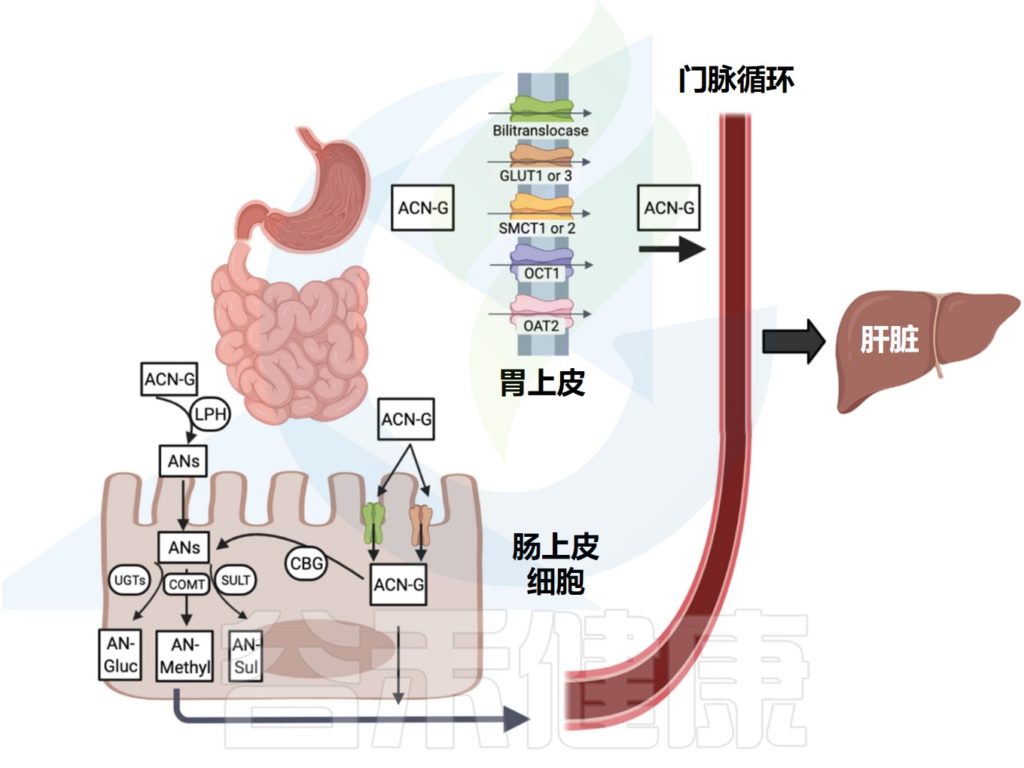
Liang A,et al.Crit Rev Food Sci Nutr.2023
▼
食用食物后第一个吸收花青素的部位是胃,在胃中,一小部分花青素穿过胃细胞屏障(大部分以完整的糖基化形式),并在血浆中检测到。
在胃内,花青素保持相对稳定,在大鼠胃肠道研究期间,从流出物中可回收总摄入花青素的75-79%,在体外研究期间可回收75-88%。
✦胃吸收效率受膳食成分影响
胃吸收效率也受到膳食成分的影响,在高葡萄糖 (>40mM)存在的情况下,花青素通过胃细胞屏障的摄取速率显著降低。
✦参与胃中花青素代谢的蛋白
胃胆转位酶是一种膜蛋白载体,可将完整的花青素转运穿过胃屏障。花青素的糖苷部分优先满足双转位酶提供的结构规格,因此无需去糖基化即可被吸收。
后来,葡萄糖转运蛋白GLUT1和GLUT3也参与了胃对花青素的摄取。花青素中的A环和C环以及葡萄糖部分在与人类GLUT1和GLUT3载体的跨膜结合中起重要作用。
其他参与花青素在胃中吸收的转运蛋白包括单羧酸转运蛋白(SMCT1和SMCT2)和有机阳离子/阴离子转运蛋白(OCT1和OAT2)。
胃以前被认为是花青素吸收而非代谢的部位,直到最近在胃上皮细胞中发现结合酶活性才证实了胃的代谢功能。
此外,红酒中花青素在体外消化(使用胃MKN-28和肠道Caco-2细胞)过程中代谢物malvidin-3-O-葡糖苷酸的存在提供了花青素在胃内代谢的证据。
▼
空肠(小肠中部)是花青素吸收的主要部位。花青素在小肠内的吸收通过膜转运蛋白促进的被动扩散或主动转运发生。
✦花青素的主动转运吸收
与胃吸收类似,完整的糖基化花青素被肠上皮细胞内的转位酶和葡萄糖转运蛋白(SGLT1和GLUT2)吸收。
SGLT1转运蛋白是一种在肠细胞顶端表面发现的钠-葡萄糖共转运蛋白1,而GLUT2转运蛋白是主要在上皮细胞基底外侧膜上发现的促进载体。这两种转运蛋白都与花青素的葡萄糖部分相互作用,并负责基于葡萄糖的花青素的肠道吸收。
除了己糖转运(糖、葡萄糖、果糖等简单碳水化合物的转运系统)外,最近发现有机阴离子转运多肽转运体(OATP)也参与了大鼠空肠上皮对完整β型酰化花青素的吸收,但其吸收率很低,仅为0.2%~2.2%。
✦花青素的被动扩散吸收
另一方面,当花青素被乳糖酶-根皮苷水解酶、β-葡萄糖苷酶、α-鼠李糖苷酶和β-葡萄糖醛酸酶等水解为其苷元形式时,花青素通过肠上皮的被动扩散吸收。
✦花青素的转运速率
最近使用Caco-2细胞(人类结直肠腺癌细胞)作为人类肠道屏障功能的模型,可以评估花青素的运输,并表明运输效率取决于附着在花青素骨架上的苷元或糖的类型,以及花青素是否为聚合物。
Caco-2细胞模型还估计,达到系统循环的花青素比例约为总膳食摄入量的1%。
✦肠道内花青素的代谢
在肠道内吸收的花青素经历第一阶段代谢,包括氧化、还原和水解,但它们发生的频率较低,在多酚代谢中也不太重要。
第二阶段的生物转化更加密集和快速,它们首先发生在小肠,然后发生在肝脏和肾脏。一旦被肠细胞吸收,花青素及其分解代谢物就会发生结合反应。
包括分别由UDP葡萄糖醛酸基转移酶(UGTs)、硫转移酶(SULT)和邻苯二酚-O甲基转移酶(COMT)催化的葡萄糖醛酸化、硫酸化和甲基化。
这些生物转化产生葡萄糖醛酸、硫酸盐和甲基化代谢产物,这些代谢产物由活性ATP结合盒蛋白转运,因为它们过于亲水,无法被动扩散到细胞中。
活性ATP结合盒蛋白——一个膜内在蛋白质超家族。将ATP水解释出的能量提供给各种分子进行穿膜转运。
花青素进入血液后,通过门静脉分布到肝组织,进行进一步的偶联反应,增加其在水中的溶解度,并最终促进其在尿液中的排泄。
▼
膳食中花青素的低生物利用度以及粪便和尿液样本中花青素的低回收率表明,花青素在结肠中会被降解。
例如,食用覆盆子后,总膳食花青素的40%从回肠液中回收。这些来自小肠的未被吸收的花青素通过细菌或化学降解进行生物转化,潜在地提高了它们的生物利用度,并允许通过结肠上皮壁吸收。
花青素的微生物降解需要多种细菌,如拟杆菌、Enterococcus casseliflavus、优/真杆菌属(Eubacterium)和梭状芽胞杆菌(Clostridium)等,它们产生各种酶,如β-葡萄糖苷酶、α-半乳糖苷酶和α-鼠李糖苷酶,用于微生物分解代谢。
✦原儿茶酸是最丰富的代谢物
由于这些相互作用,通过肠道微生物降解产生了各种代谢产物。代谢物原儿茶酸占花青素摄入量的73%,是花青素消耗后最丰富的人体代谢物。
桑椹的矢车菊素-3-O-葡萄糖苷和矢车菊苷-3-O-芸香糖苷的体外粪便发酵产生了原儿茶酸、对香豆酸和间苯三酚醛,而飞燕草素-3-O-芸香糖苷的发酵产生了没食子酸、丁香酸和间苯三酚醛。
✦其他花青素的代谢产物
桑椹的矢车菊素-3-O-葡萄糖苷和矢车菊苷-3-O-芸香糖苷的体外粪便发酵产生了原儿茶酸、对香豆酸和间苯三酚醛,而飞燕草素-3-O-芸香糖苷的发酵产生了没食子酸、丁香酸和间苯三酚醛。
在与结肠细菌孵育24小时后,Malvidin-3-O-葡萄糖苷会完全代谢为丁香酸。
如体内人体研究和体外研究所示,天竺葵素-3-O-葡糖苷被代谢为4-羟基苯甲酸。
六种主要花青素及其结肠代谢物


Liang A,et al.Crit Rev Food Sci Nutr.2023
★ 花青素的主要代谢物对人体健康有益
原儿茶酸
原儿茶酸是一种水溶性酚酸成分,并且是很多中药中的活性物质,其不仅具有抗血小板凝集、降低心肌耗氧量、提高心肌耐氧能力、减慢心率、抑菌、镇痛等药理活性,还具有抗氧化、抗肿瘤和神经保护作用。
没食子酸
没食子酸具有抗炎、抗突变、抗氧化、抗自由基等多种生物学活性;同时没食子酸具有抗肿瘤作用,可以抑制肥大细胞瘤的转移, 从而延长生存期;对肝脏具有保护作用。
丁香酸
丁香酸可以抑制炎症反应,减轻炎症症状;同时丁香酸具有抗菌作用,可以抑制多种细菌和真菌的生长;丁香酸还能够降血糖、降血脂。
✦肠道微生物在花青素的去酰化起重要作用
此外,人体肠道微生物组在花青素的去酰化过程中发挥重要作用,释放出具有更高生物利用度的酚酸。
花青素衍生的代谢物可能比母体花青素表现出更强的稳定性和生物活性,并可能调节人体肠道微生物组成。
肠道微生物群受年龄、体重、饮食模式、抗生素治疗和宿主遗传的影响,并且个体之间(以及个体内部)存在差异。这种变化可能会影响膳食花青素的生物利用度和代谢。
花青素及其结肠代谢物通过其生物活性直接改善健康,并通过重塑肠道微生物组的组成和操纵短链脂肪酸的产生间接改善健康。
在宿主的一生中,肠道微生物组的组成随着时间的推移而变化,以响应内部和外部刺激。因此,肠道微生物组成的动态平衡和多样性是正常肠道功能所必需的,包括维生素和短链脂肪酸的产生、脂质代谢、免疫防御和肠-脑轴相互作用等。
▼
花青素及其代谢物目前被认为是改变肠道微生物群的调节剂,主要是通过促进有益菌的增殖和抑制有害菌的生长,许多不同模型的研究都观察到这一点。
✦促进了有益菌的增殖
研究发现黑米中分离的矢车菊素-3-葡萄糖苷在体外发酵条件下对青春双歧杆菌(B. adolescentis)、婴儿双歧杆菌(B. infantis)、双歧双歧杆菌(B.bifidum)和嗜酸乳酸杆菌(L.acidophilus)的增殖具有促进作用。
培养48小时后还观察到生长培养基pH值的降低,这归因于由酚酸和短链脂肪酸组成的有机酸的产生。双歧杆菌和乳杆菌的数量增加。它们通过竞争底物和粘附位点以及降低结肠腔内pH值来对病原体产生抗菌作用。
研究发现,降低结肠内pH值可抑制肠杆菌科(Enterobacteriaceae)和梭状芽胞杆菌(Clostridia)等pH敏感有害菌群的过度增殖,并通过抑制前致癌物的形成来降低结直肠癌的风险。
✦抑制有害菌的生长
与上述发现一致,紫甘薯中提取的花青素增加了最知名的益生菌之一双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)的种群数量,但减少了溶组织梭状芽胞杆菌(C. histolyticum)和拟杆菌/普雷沃氏菌的种群数量。
溶组织梭状芽胞杆菌是与感染和炎症性肠病相关的最常见致病性物种之一。
▼
虽然许多研究表明花青素及其代谢产物促进有益菌群生长,抑制有害菌群生长,但对结肠细菌的促进作用存在差异。
对微生物群的不同影响可能是由于源自花青素的代谢物的差异。
花青素(单独和混合物)和没食子酸的孵育被证明可以增加双歧杆菌和乳酸杆菌的数量。而混合花青素和没食子酸显著诱导奇异菌属(Atopobium)的生长,并减少了潜在致病性溶组织梭菌。
没食子酸似乎是本研究中的关键代谢物,可抑制溶组织梭菌增殖。
在其他研究中,研究了没食子酸对梭菌、大肠杆菌和金黄色葡萄球菌等有害微生物的抗菌活性。
花青素对肠道菌群的调节作用



Liang A,et al.Crit Rev Food Sci Nutr.2023
▼
花青素的发酵有助于短链脂肪酸的产生,主要是乳酸、乙酸、丙酸和丁酸。短链脂肪酸通过调节细菌毒力基因表达和降低结肠中管腔pH值来抑制肠道病原体如沙门氏菌(Salmonella spp.)、大肠杆菌(E. coli)和李斯特菌(Listeria spp.)的入侵。
此外,短链脂肪酸在肠道生理事件中发挥着重要作用,如获取能量、调节pH、参与肠脑轴和保护肠道屏障功能。
花青素与肠道菌群作用的研究证据
花青素与肠道微生物的相互作用已经通过动物模型得到了广泛的研究。用黑甜樱桃对小鼠进行饮食干预发现,除了双歧杆菌和乳杆菌外,樱桃花青素的补充还促进了结肠中阿克曼氏菌(Akkermansia)的增殖。
阿克曼氏菌的丰富度被认为可以刺激粘液分泌,改善肠道屏障功能,从而降低炎症风险和免疫介导的疾病,如乳糜泻。
促进Coriobacteriaceae有助于健康
对小鼠进行为期六周的多种浆果饮食干预,结果发现放线菌(Actinobacteria)数量有所改善,这与补充蓝莓的研究结果一致。
放线菌门下的一些科,如双歧杆菌和Coriobacteriaceae,已被证明对健康有益。特别是,有人认为,在高脂肪饮食存在的情况下, Coriobacteriaceae在降低肥胖和肝脏相关疾病的风险方面发挥作用。
双歧杆菌和乳酸杆菌的丰度增加
与体内试验的结果一致,在参加为期六周的25克蓝莓能量饮料的健康男性中发现双歧杆菌和乳酸杆菌的丰度增加。
花青素、其代谢物和肠道微生物群间的相互作用
Liang A,et al.Crit Rev Food Sci Nutr.2023
小结
体外、动物和人体研究一致认为,花青素及其代谢物能够调节肠道微生物群。花青素会促进益生菌的生长,特别是双歧杆菌、乳杆菌和阿克曼氏菌,它们通过产生短链脂肪酸或通过竞争底物和定植位点来对抗有害和致病性菌株,从而有利于宿主健康。
然而,花青素对肠道微生物群的调节也可能依赖于其他相关的化学物质,如葡萄糖,因为与那些喂食高葡萄糖对照饮食的大鼠相比,在蓝莓补充后,在肠道中发现了较低水平的乳酸杆菌。
此外,不同的动物模型和志愿者群体在微生物组成方面存在较大差异,这是这些研究的另一个挑战。
因此,未来的临床研究重点应放在不同年龄和生理阶段的男性和女性不同亚类人群上,这可能会更深入地了解花青素在微生物群调节中的作用及其对特定人群的健康益处。
前面讲述了花青素对肠道菌群的调节作用,下面谷禾来具体讲讲花青素和肠道微生物群相互作用下对一些疾病的影响
肥胖和超重被定义为对健康构成威胁的脂肪组织的过度积累。脂肪组织中的代谢紊乱,如炎症、脂肪因子释放失调和脂肪生成增加,是肥胖和其他肥胖相关疾病的一些常见潜在特征。
有证据表明,与肥胖相关的疾病可能部分由肠道生态失调引起,包括微生物组成及其代谢物的变化。
最近,花青素与肠道微生物的相互作用被证明具有改善肥胖的作用。主要通过调节脂肪生成和脂肪分解,炎症反应的介导以及通过肠脑通讯控制食欲。
1
肠道微生物组影响脂质代谢,肠道菌群失调与血脂异常和肥胖等有关。
最近的一项体内研究显示,对高脂喂养的小鼠补充了200毫克/公斤体重的紫甘薯花青素(花青素和芍药苷酰基糖苷),改善了高脂饮食引起的体重增加和肝脏总脂肪积累。
√调节AMPK通路减少脂肪积累
他们认为,花青素抑制脂肪堆积的作用需要激活小鼠肝脏细胞AMPK通路。此外,在摄入花青素后,AMPK途径下游靶点乙酰辅酶a羧化酶、脂肪酸合成酶、甾醇调节元件结合蛋白也被下调,以减少小鼠肝细胞中的脂肪积累。
已知AMPK通路的上调在抑制脂肪生成中发挥重要作用,例如抑制脂蛋白脂肪酶 (LPL),这是一种可受肠道微生物群调节的酶。肠道菌群通过影响抑制脂蛋白脂肪酶,以相反的方式促进脂肪细胞中甘油三酯的储存。而活化的AMPK及其下游信号通路至少部分抵消了肠道微生物群促进的能量储存。
√操纵法尼醇X受体信号减轻代谢受损
此外,已知肠道菌群产生的次生胆汁酸通过胆汁酸受体法尼醇X受体(FXR)改变肝脏脂质代谢。胆汁酸-结肠微生物群相互作用的破坏可能导致肥胖易感性。
花青素被证明可以操纵肠道微生物群/法尼醇X受体信号,从而减轻高脂肪诱导的肝脏脂肪积累和脂质代谢受损。
黑米花青素(0.48g/kg)喂养12周使血清乳酸脱氢酶(LDH)、丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)含量正常化,这些指标是肝脏脂肪过度积累影响肝损伤的指标。
这些发现表明,膳食花青素可能通过改变肠道菌群来减轻高脂饮食引起的脂质代谢紊乱。
2
肠道微生物群参与调节炎症,在肥胖患者的脂肪组织中通常观察到系统性的低级别炎症并发症。
√经常摄入花青素的肥胖患者炎症标志物含量下降
在一项研究中,代谢综合征患者每天食用400克新鲜越桔,持续12周后,血清脂多糖、IL-6、IL-12和高敏C反应蛋白(hsCPR)浓度下降。
hsCPR是一种与肥胖相关的炎症标志物。
另一项动物研究显示,花青素的干预通过抑制21天大的小鼠白色脂肪组织中TLR4介导的NF-κB信号通路,降低了高脂肪诱导的促炎标志物IL-6和肿瘤坏死因子的表达。
此外,高脂肪喂养诱导下的粪便双歧杆菌减少,在妊娠期和哺乳期用花青素处理后恢复。
3
肠道微生物在调节涉及能量稳态的神经激素活动中发挥作用。由微生物群产生的花青素和短链脂肪酸会影响促食欲激素和厌食激素的释放。
√刺激肠促胰岛素激素分泌减少食物摄入量
飞燕草素3-芸香糖苷被证明可刺激释放胰高血糖素样肽-1,这是一种肠促胰岛素激素,可促进胰岛素分泌和饱腹感,从而减少食物摄入量。
√减轻肥胖引起的神经激素紊乱
肥胖会通过表观遗传修饰相关基因表达导致参与能量平衡的神经激素活动紊乱。食用花青素可能会恢复肥胖引起的这些不利影响。
在肥胖大鼠中,连续8周食用额外的樱桃和桑葚花青素可以减少体重增加,降低血清瘦素水平,增加脂联素。
与先前的研究一致,肥胖患者在食用富含花青素的水果6周后,发现瘦素受体表达增加,这表明补充花青素后瘦素敏感性有所改善。
此外,高脂饮食诱导的肥胖大鼠大脑皮层和海马体中的γ-氨基丁酸(GABA)水平下降。研究报道,与对照组相比,40天摄入黑大豆花青素减少了成年大鼠的体重增加。高剂量花青素可降低促氧神经肽Y (NPY)的表达,提高下丘脑GABA受体B (GABAB1R)的表达。
GABA是中枢神经系统中的一种抑制性神经递质,通过控制神经元的兴奋性、可塑性和额叶皮质的同步性,在摄食反应中起关键作用。
综上所述,花青素似乎通过多种方式与肠道微生物群相互作用,包括调节脂质代谢、炎症反应和参与能量平衡的神经激素活动,从而具有改善肥胖的作用。
注:关于健康和肥胖个体肠道中花青素代谢的差异,人们的理解有限。因此,未来的研究重点应放在花青素结肠代谢物及其对健康和肥胖受试者的健康影响上。
2型糖尿病是一种以高血糖为特征的代谢性疾病,由胰岛素抵抗逐渐发展而来。
许多研究已经报道了花青素及其代谢物的抗糖尿病潜力,这可能归因于以下单一或同时的作用,包括增强胰岛素敏感性,改善β细胞功能和延迟餐后血糖反应。
1
花青素可以通过自身或其微生物代谢物改善胰岛素敏感性。
脂肪组织能够分泌脂联素等脂肪细胞因子来调节葡萄糖稳态。
√花青素可以诱导脂肪细胞摄取葡萄糖
花青素及其微生物代谢物原儿茶酸已被证明可以通过上调葡萄糖转运蛋白4来增加人类脂肪细胞去除血浆葡萄糖的能力。
PPARγ的敲除消除了花青素的胰岛素增敏特性,这表明PPARγ可能在增加花青素诱导的脂肪细胞葡萄糖摄取中发挥作用。
PPARγ是一种参与葡萄糖处理和葡萄糖转运蛋白调节的核转录因子
√花青素还可以介导骨骼肌中的葡萄糖摄取
除了脂肪细胞外,骨骼肌中的葡萄糖摄取也可由花青素介导。
糖尿病小鼠口服紫玉米花青素提取物8周后,骨骼肌对葡萄糖的摄取增加,因为在肌肉细胞中发现葡萄糖转运蛋白4表达增加,并伴随AMPK通路的激活。增加AMPK活性是刺激葡萄糖转运蛋白4从细胞内囊泡转移到细胞膜的重要途径,从而促进葡萄糖流入细胞。
此外,在摄入原儿茶酸后大鼠肝脏中发现胰岛素受体底物1/磷脂酰肌醇3-激酶/蛋白激酶B-2 (IRS1/PI3K/AKT2) 信号通路的活性增加,表明肝脏胰岛素敏感性得到改善。
证据表明,花青素及其降解产物改善了脂肪细胞和肌肉细胞的胰岛素敏感性。
2
花青素还可以通过消除高血糖引起的氧化应激来保护胰腺β细胞的功能。
√改善高糖影响下的胰岛β细胞损伤
发现富含花青素的提取物可减轻高糖诱导的β细胞损伤,保护其分泌功能,并导致血清胰岛素水平升高。
一项体外研究(对与桑椹花青素孵育的高糖培养的β细胞)发现,花青素能够通过抑制β细胞中的凋亡相关蛋白,包括丝裂原活化蛋白激酶、细胞色素c和Bcl-2家族蛋白,消除高糖诱导的细胞内活性氧水平升高,并将β细胞活力恢复到84%。
除了完整的花青素外,丁香酸是花青素的主要微生物代谢产物之一,口服30天可改善四氧嘧啶诱导的糖尿病大鼠的胰岛素释放功能异常、血糖和糖蛋白水平升高。
丁香酸的抗糖尿病作用可能与保持β细胞的活力和功能有关。
3
在人体试验中也观察到了膳食花青素和微生物代谢物在调节餐前和餐后血糖中的作用,从而降低了患2型糖尿病的风险。
众所周知,血糖水平是动态的,全天都在变化。空腹和餐后血糖水平是诊断糖尿病的两个重要指标。空腹血糖值代表身体在一夜禁食后如何管理血浆葡萄糖,而餐后血糖则代表餐后的血糖反应。
√多摄入花青素表现出延迟的血糖反应
与未补充花青素的人相比,额外摄入150克混合浆果泥的参与者表现出延迟的血糖反应。
研究人员解释:餐后血糖降低至少部分是由于花青素对α-葡萄糖苷酶的抑制作用,α-葡萄糖苷酶是一种释放α-葡萄糖的酶。
该研究结果支持以下机制:花青素通过抑制胰腺α-淀粉酶和α-葡萄糖苷酶的活性,以及干扰葡萄糖转运蛋白(SGLT1和GLUT2),因为这些转运蛋白存在竞争关系,从而降低餐后血糖。
√降低了空腹血糖浓度
血清马尿酸是一种花青素的结肠代谢产物,在成年人食用越橘8周(200克/天)后显著增加。8周越桔 干预也降低了空腹血糖浓度。
然而,没有观察到血浆马尿酸与餐后血糖浓度之间存在任何相关性。
花青素可能通过抑制α-淀粉酶和α-葡萄糖苷酶活性以及与葡萄糖载体相互作用来调节餐后血糖,而花青素代谢产物马尿酸则由于微生物降解物的延迟出现而与改善空腹血糖控制有关。
小结
花青素及其代谢物的抗糖尿病作用已经在体外和体内研究中得到阐明。主要通过调节葡萄糖转运蛋白表达和易位来改善胰岛素抵抗,对胰岛β细胞及其分泌功能的保护作用,以及调节空腹和餐后血糖水平。
因此,由富含花青素的食物或补充剂组成的饮食干预可能是更好地控制患有2型糖尿病高风险个体和糖尿病患者血糖的替代途径。
心血管疾病是一类影响心脏和血管的疾病,最常见的形式包括动脉粥样硬化、冠心病、心律失常、心力衰竭和中风。
流行病学研究表明,高花青素摄入量与心血管疾病风险降低有关。花青素及其代谢物发挥保护作用,主要归因于抑制血小板过度活跃,缓解内皮功能障碍,改善脂质谱和逆转胆固醇转运。
1
花青素和原儿茶酸已被证明稳定血小板活性,从而防止血栓形成。
√摄入花青素抑制了血小板的过度聚集
一项研究发现,100μM和500μM没食子酸可以减少刺激物(二磷酸腺苷和血栓素A2激动剂U46619)诱导的血小板聚集、血小板-白细胞聚集和P-选择素表达。
P-选择素(一种参与细胞表面粘附的糖蛋白)的表达减少,表明血小板稳定性提高,血栓形成风险降低。
没食子酸抗血小板聚集的潜在机制是通过降低细胞内钙水平和下调蛋白激酶c-α(PKCα)/p38丝裂原活化蛋白激酶(p38MAPK)和Akt/糖原合成酶激酶3β (GSK3β)通路的活性。
另一项临床试验也支持了这种抗血栓作用,该试验发现,在健康志愿者中,200mL富含花青素和芸香苷的李子汁干预28天,可有效抑制人工刺激的血小板聚集,并降低P-选择素的表达。
此外,补充花青素28天后还观察到氧化应激生物标志物丙二醛水平降低,这表明血小板的抗机能亢进至少部分归因于花青素及其代谢物的抗氧化能力。
2
花青素及其代谢物具有血管内皮保护作用,内皮功能障碍被认为是动脉粥样硬化发展的早期指标。内皮功能受损可破坏血管收缩和血管舒张的止血作用,引发一系列生理事件,如促炎因子分泌、白细胞粘附等,从而引发动脉粥样硬化。
√减缓动脉粥样硬化
研究了花青素代谢物原儿茶酸对载脂蛋白e缺乏小鼠的内皮保护作用。原儿茶酸(0.03g/kg)喂养20周小鼠,动脉粥样硬化形成延迟,血管细胞粘附分子1 (VCAM-1)和细胞间粘附分子1(ICAM-1)表达显著降低。
这些粘附分子的减少可以减少单核细胞对血管内皮的附着,从而减缓动脉粥样硬化的早期发展。
√改善血管舒张情况
蓝莓花青素的血管保护特性已在临床试验中得到证实。健康志愿者在摄入蓝莓花青素(766-1791毫克)1至2小时和6小时后,内皮依赖性血管舒张得到改善。
3
许多研究也报道了富含花青素的饮食对血脂的有益影响。
√直接补充花青素缓解高脂血症
在高脂饮食诱导的肥胖小鼠中,每天补充150 mg/kg黑加仑花青素12周后,高脂血症得到缓解,相应的血清总胆固醇、甘油三酯和低密度脂蛋白水平降低。
另一项研究报告,50mg/kg原儿茶酸干预10周后,降低了先前由脂肪和果糖丰富的饮食引起的高脂血症雄性大鼠的血清甘油三酯、总胆固醇和低密度脂蛋白水平。
三项新指标,即血浆动脉粥样硬化指数(AIP)、动脉粥样硬化指数(AI)和冠状动脉危险指数(CRI),在50mg/kg原儿茶酸治疗后分别显著降低33%、52%和36%。
√通过调节菌群降低血脂
此外,花青素干预后观察到嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和狄氏副拟杆菌(Parabacteroides distasonis)的富集,其与循环甘油三酯和低密度脂蛋白水平呈负相关。已知阿克曼菌可以积极调节肠道屏障完整性,防止脂多糖易位诱导炎症。
低密度脂蛋白(LDL)及其氧化修饰(oxLDL)通过刺激泡沫细胞的形成与动脉粥样硬化的发病机制有关。
最近发现狄氏副拟杆菌(Parabacteroides distasonis)通过产生琥珀酸和次生胆汁酸,如石胆酸和熊去氧胆酸,具有降血脂作用。
综上所述,花青素及其代谢物可能通过改善血脂来预防动脉粥样硬化和冠状动脉疾病。
小结
综上所述,花青素及其代谢物通过维持血小板稳定、保护血管内皮功能、改善血脂等发挥心血管保护作用。
然而,关于花青素心血管保护作用的人类和动物研究之间存在差距。因为动物中使用的浓度可能无法在人体中达到生理水平。
此外,临床研究的实验持续时间通常在4至12周之间,这可能无法捕捉到长期补充的影响。因此,未来可能需要进行长达一年的长期饮食干预研究。
帕金森病、阿尔茨海默病和肌萎缩侧索硬化症等神经退行性疾病是发生在神经系统中的疾病,导致日常活动协调困难、认知障碍和记忆丧失。
这些疾病的病因可能多种多样,但它们有一系列共同的潜在因素。这些因素包括但不限于长时间的氧化应激、中枢神经系统炎症、神经元钙信号失调和兴奋性毒性(即神经毒性)。
有证据表明,一些花青素代谢物,如原儿茶酸、香草酸、没食子酸和其他简单的酚酸,可以通过血脑屏障进入中枢神经系统,这表明这些物质可能直接在发生神经系统疾病的中枢神经系统中发挥作用。
1
花青素肠道代谢物与防止神经毒性和维持Ca2+体内平衡有关。
√没食子酸可以减轻谷氨酸诱导的神经毒性
谷氨酸是一种兴奋性神经递质,有助于大脑正常功能,而谷氨酸水平异常升高可引起谷氨酸兴奋性毒性。谷氨酸兴奋性毒性被认为是神经退行性疾病的主要原因之一。
没食子酸是能够穿透血脑屏障的代谢物之一。报道,25和50μg/ml 没食子酸预处理2小时可导致大鼠皮层神经元细胞中N-乙酰天冬氨酸(NAA)水平和微管相关蛋白2(MAP-2)表达增加,表明没食子酸处理减轻了谷氨酸诱导的大鼠神经元神经毒性。
在缺乏没食子酸的细胞中观察到的NAA和MAP-2的下调被认为是神经元损伤和丧失的直接指标。
此外,在没食子酸处理的细胞中也观察到钙结合蛋白(一种能够缓冲Ca2+内流的钙结合蛋白)的上调,表明没食子酸在保护神经元免受谷氨酸引发的钙失衡方面的作用。
√天竺葵素代谢物减轻神经兴奋性毒性
观察到4-羟基苯甲酸(HBA)是一种天竺葵素的代谢物,可在体外保护大鼠小脑颗粒神经元免受谷氨酸兴奋性毒性。当仅用谷氨酸处理的大鼠小脑颗粒神经元导致近50%的细胞损失时,4-羟基苯甲酸处理保留了细胞并且只有13%的细胞死亡得到证实,揭示了4-羟基苯甲酸在谷氨酸兴奋性毒性缓解中的作用。
注:原儿茶酸和4-羟基苯甲酸似乎发挥互补作用,表明它们的共同治疗可能比单一代谢物更有效。然而,本研究并未提供原儿茶酸和4-羟基苯甲酸的联合治疗,因此其最佳效果的混合比例值得进一步研究。
2
花青素及其代谢物的神经保护作用与它们在防止蛋白质聚集和促进自噬中的潜在作用有关。
蛋白质聚集被认为刺激神经元变性,与许多神经退行性疾病有关。例如,由聚集的淀粉样蛋白(Aβ)形成的斑块和由tau蛋白形成的神经原纤维缠结是阿尔茨海默病的标志。导致路易体形成的α-突触核蛋白(αS)的异常组装与帕金森病有关。
√原儿茶酸防止蛋白质异常聚集
48小时原儿茶酸处理(10至100 μM)对Aβ和αS原纤维聚集的抑制率分别为30–79%和70–80%。原儿茶酸治疗6天(100μM)也使预先形成的Aβ原纤维和αS原纤维不稳定65%和80%。
这些结果表明,原儿茶酸不仅能抑制Aβ和αS纤颤,还能逆转预先形成的纤颤,它们共同调节蛋白质相互作用,防止蛋白质异常聚集导致的细胞死亡
√香草酸的干预有助于治疗阿尔兹海默病
香草酸是黑芝麻色素释放的主要代谢物,它显示出对β-淀粉样蛋白的抑制活性。在用6μM香草酸处理24小时后发现一半(50%)的抑制,在50μM香草酸孵育时达到90%的抑制。
此外,较高浓度的香草酸(60μM)可使β-分泌酶活性降低60%。β-分泌酶是一种在神经元中催化淀粉样前体蛋白合成淀粉样肽的第一步酶,促进蛋白质聚集。抑制β-分泌酶活性被认为是治疗阿尔茨海默病的另一种方法。
3
花青素微生物降解产物的有益作用已通过调节神经元细胞凋亡信号通路被发现。诱导细胞死亡是神经退行性疾病的最终病理活动。
√花青素代谢物调控细胞凋亡信号
原儿茶酸在最近的动物研究中显示出抗凋亡能力。原儿茶酸通过上调大脑皮层中参与抗氧化活性的基因,如Sod2、Cat、Gpx1和Gsr,来阻止镉诱导的细胞凋亡。
原儿茶酸处理可以减轻镉引起的促炎生物标志物肿瘤坏死因子和IL-1β的表达增加,这表明原儿茶酸通过介导促凋亡蛋白和抗凋亡蛋白,增强抗氧化防御系统和减少炎症细胞因子的产生来保护皮质组织免受镉损伤。
总之,这些发现表明花青素代谢物不仅可以减轻导致神经元死亡的各种诱导剂,还可以调节凋亡信号,从而在多个层面上降低神经退行性病变的风险。
√花青素介导的肠道菌群变化减少了神经退行性疾病的风险
除了花青素及其代谢物有助于神经保护作用外,花青素介导的肠道微生物群变化间接减少了神经退行性疾病的发生。
研究表明,由于脂多糖诱导的神经炎症反应、血脑屏障渗漏增加和β-淀粉样蛋白错误折叠的发生率,肠道生态失调可能增加神经退行性疾病的易感性。
在高脂喂养大鼠中补充黑莓花青素(25mg/kg)17天可以抵消高脂饮食引起的部分生态失调,例如孢杆菌属(sporobacter)数量增加和瘤胃球菌(Rumminococcus)数量减少。
花青素相关的肠道菌群调节通过犬尿氨酸途径改变色氨酸代谢,从而与抗神经炎症活性相关。这种改变被证明可以增加犬尿氨酸的产生,犬尿酸是一种抗兴奋毒性分子,可以减轻神经退行性病变。
尽管花青素介导的色氨酸代谢对神经保护的证据有限,但肠道微生物群对色氨酸代谢的操纵很可能会影响肠-脑轴。
建议
花青素及其微生物代谢产物可能是治疗神经退行性疾病的有效分子。然而,由于大多数研究结果都是基于体外或动物模型,因此在未来的研究中需要进行大量的临床前和临床研究。
由于衰老是神经退行性变的主要危险因素,因此有必要以老年人为重点补充花青素,以探索其在认知改善中的作用和肠道微生物群。
▼
•花青素抑制了炎性细胞因子的产生
花青素可以通过调节微生物群来预防肠道疾病。在葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠中,用枸杞中的花青素提取物(200 mg/kg/天)喂养持续至少一周,恢复了紧密连接蛋白的表达,抑制炎症细胞因子(如TNF-α,IL-6)的产生。
同样,食用富含花青素的马铃薯持续9周喂养结肠炎小鼠,缓解了结肠长度的缩短,降低了髓过氧化物酶(炎性粘膜标志物)水平和炎性细胞因子。
•微生物群是花青素调节炎症性肠病的介质
然而,这种作用在抗生素治疗的小鼠身上消失了,强烈表明微生物群作为花青素对炎症性肠病介质的作用。
▼
摄入花青素可通过多种潜在机制降低患非酒精性脂肪性肝病的风险,例如其固有的抗炎作用、脂质代谢和葡萄糖代谢的管理以及改变微生物群特性。
•改变了脂肪肝小鼠体内的微生物群
其他研究也证明了花青素改变微生物群的作用,但花青素来源的多样性可能导致不同的微生物种群发生改变。在高脂饮食诱导的非酒精性脂肪肝变性小鼠中,摄入桑树水提取物(0.2-0.6%)可减少促炎的Turicibacteres,并提高拟杆菌(Bacteroidales)与梭菌(Clostridiales)的比例。
总的来说,花青素的摄入可能会改变肠道微生物群的组成,从而改善肠道屏障功能和能量消耗,降低肥胖、炎症、胰岛素抵抗,并最终降低非酒精性脂肪性肝病及其代谢并发症的风险。
▼
先前的动物研究已经证明了花青素通过微生物群调节途径抑制肿瘤生长和癌症进展的潜力。
•花青素治疗后肿瘤计数显著降低
在结直肠癌小鼠模型中,用覆盆子花青素治疗可显著削弱结肠癌的发生,每只动物的肿瘤计数减少约90%,肿瘤发病率降低(从100%降至72%左右)。
肠道生态失调可能与结直肠癌的增加有关,而花青素似乎可以恢复这种平衡,并通过促进乳酸菌的生长、抑制肠球菌和脱硫弧菌来调节微生物群。
此外,口服越桔花青素可能通过微生物群加速免疫检查点抑制剂(即程序性死亡配体1,可以限制T免疫细胞反应激活的蛋白质)的肿瘤抑制特性。
研究人员提出,补充花青素可改善肠道物种多样性,诱导梭状芽孢杆菌、约氏乳杆菌和毛螺菌科的丰度增加。
▼
花青素有可能降低慢性肾脏疾病的风险。慢性肾脏疾病的特点是肠道生态失调和由此产生的尿毒症毒素。
在一项研究中,花青素显示出通过AMPK磷酸化减轻培养细胞中糖尿病肾病的能力,并在腺嘌呤诱导的慢性肾病小鼠模型中减轻症状。
▼
花青素和富含花青素的食品的抗炎作用也与减缓骨关节炎和骨修复的进展有关,主要是通过抑制MAPK信号通路和NF-kB信号通路。
认识了花青素对人体健康的重要性,那么我们在日常生活中应该如何去补充呢,谷禾在这里列出了一些建议。
水果:存在于葡萄、蓝莓、桑葚、血橙、草莓、樱桃、红心火龙果、山楂等水果中,与水果色泽有一定的关系,在外观上有所体现,水果是补充花青素的较好选择;
蔬菜:如紫甘蓝、紫薯、紫玉米、紫土豆、黑枸杞、茄子、紫苏、甜菜、萝卜、紫洋葱等蔬菜中,也含有较多的花青素;
谷物:大麦、高粱、黑米,以及豆类如绿豆、红豆、黑豆、黄豆、赤小豆等,其中也含有较多的花青素。
花青素易受热、光、氧等因素的影响而降解,因此建议选择新鲜的食物食用,以保证花青素的含量。
花青素在高温下易被破坏,因此建议采用轻微加热的烹饪方式,如蒸、煮、炖等,以尽可能保留花青素的含量。
花青素与其他营养素的搭配可以增强其吸收和利用效果。例如,与维生素C搭配可以增强花青素的抗氧化作用。
如果日常饮食中花青素的摄入量不足,可以考虑适当补充花青素保健品。但是,需要注意选择正规品牌和适量摄入。
虽然花青素对人体健康具有多种保护作用,但过量摄入也可能对健康造成负面影响。
因此,建议适量摄入花青素,不要过度依赖花青素保健品等补充剂。
总之,通过日常饮食摄入富含花青素的食物,可以有效补充花青素,发挥其保健作用。同时,需要注意花青素的摄入量和搭配方式,以充分发挥其保健作用。
总的来说,花青素的健康益处已被广泛研究,它们被认为可以有效减轻或预防一些疾病。
通过与肠道微生物相互作用了解花青素及其健康益处是很重要的。肠道菌群在花青素降解过程中发挥重要作用,并介导多种生理活动。
花青素也会改变肠道微生物组成,维持微生态平衡,操纵短链脂肪酸的产生、脂肪代谢、肠道上皮功能、与中枢神经系统的联系和免疫反应。
因此,花青素的潜在益处可能间接归因于其对肠道微生物群的调节作用及其随之而来的生理影响。由于这些原因,研究花青素和肠道微生物群的相互作用在慢性疾病预防和治疗中是很重要的。
主要参考文献
Liang A, Leonard W, Beasley JT, Fang Z, Zhang P, Ranadheera CS. Anthocyanins-gut microbiota-health axis: A review. Crit Rev Food Sci Nutr. 2023 Mar 17:1-26.
Akbari, G. 2020. Molecular mechanisms underlying gallic acid effects against cardiovascular diseases: An update review. Avicenna Journal of Phytomedicine 10 (1):11–23.
Agustí, A., M. P. García-Pardo, I. López-Almela, I. Campillo, M. Maes, M. Romaní-Pérez, and Y. Sanz. 2018. Interplay between the gut-brain axis, obesity and cognitive function. Frontiers in Neuroscience 12:155.
Cortés‐Martín, A., C. E. Iglesias‐Aguirre, A. Meoro, M. V. Selma, and J. C. Espín. 2021. Pharmacological therapy determines the gut microbiota modulation by a pomegranate extract nutraceutical in metabolic syndrome: A randomized clinical trial. Molecular Nutrition & Food Research 65 (6):2001048. 2001048.
Drago, L. 2019. Probiotics and colon cancer. Microorganisms 7 (3):66.
Foley, M. H., S. O’Flaherty, R. Barrangou, and C. M. Theriot. 2019. Bile salt hydrolases: Gatekeepers of bile acid metabolism and host-microbiome crosstalk in the gastrointestinal tract. PLOS Pathogens 15 (3):e1007581.
Hampel, H., R. Vassar, B. De Strooper, J. Hardy, M. Willem, N. Singh, … A. De Vos. 2020. The β-secretase BACE1 in Alzheimer’s disease. Biological Psychiatry 89 (8):745–756.