-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

霍尔德曼氏菌属(Holdemania)是一种棒状或杆状的革兰氏阳性细菌,属于厚壁菌门下的丹毒丝菌科。严格厌氧,不形成芽孢。
其表现出对糖类的代谢能力,能够发酵葡萄糖和其他糖类如阿拉伯糖、纤维二糖、赤藓糖醇等。并产生乙酸,乳酸和琥珀酸,有时还会产生少量甲酸。还发现Holdemania与色氨酸代谢呈正相关,这可能是其影响神经系统疾病的一个机制。
Holdemania通常被认为是人体肠道正常菌群的一部分,在谷禾健康人群检出率为29.33%,在维持肠道微生态平衡中起一定作用,大多数情况下,Holdemania属菌不会引起疾病,是人体共生的细菌。但研究发现其丰度过高与脂质代谢紊乱的严重程度相关。之前的报告还表明,肠道中高丰度的霍尔德曼氏菌会诱导炎症反应。
谷禾查找并整理了相关文献资料,发现霍尔德曼氏菌属(Holdemania)与脂质和葡萄糖代谢受损有关,其在II型糖尿病和肥胖等代谢性疾病中具有潜在危害作用。
此外研究发现在肝炎、抑郁症、肠易激综合征、肺动脉高压、心房颤动、痛风、过敏性哮喘和非酒精性脂肪肝等病症中,Holdemania的相对丰度明显增加。而在胰腺炎、肾结石中Holdemania的丰度减少。此外,一些研究表明霍尔德曼氏菌属可能对巴雷特食管和癌症治疗具有一定的积极作用。
鸭肉、羊肉、乳制品和藻类蔬菜等饮食因素以及利福昔明和伊匹单抗+纳武单抗等药物会增加Holdemanella属的相对丰度。锌过载时Holdemania的丰度也会增加。而使用二陈汤、夏桑菊、针刺疗法等有助于减少Holdemania的丰度。
关于霍尔德曼氏菌属(Holdemania)的研究资料相对有限,本文将根据该菌相关的研究结果以及检测实践数据来综合分享该菌的相关信息和健康特性及其干预措施。
1
细胞形态
霍尔德曼氏菌属(Holdemania)是一种棒状或杆状的革兰氏阳性细菌,最早于1997年被发现,大小约0.5-1.2μm×1.5-6μm,更长的细胞有中央到末端的肿胀。无鞭毛,成对或短链出现,不产生孢子。
该菌的细胞壁含有B组胞壁质类型(B1δ(L-Ala)-D-Glu-L-Asp-L-Lys),这种类型在任何其他细菌物种中均未观察到。
在琼脂上生长的菌落直径为1.0毫米。它们是圆形、完整的、半透明的,具有颗粒状外观。通过葡萄糖肉汤培养浑浊并含有白色沉淀物。
2
生长条件
该菌属通常在37°C下生长最佳,但也能在25°C至45°C的温度范围内生长。它们是专性厌氧菌,不能在有氧条件下生长。适宜生长的pH范围是6.5-7.5,最佳pH是7.0。人体大肠的环境非常适宜其生长。
3
代谢特征
Holdemania有严格的无氧代谢,通常表现出对糖类的代谢能力,而不是蛋白质分解。能够发酵葡萄糖和其他糖类。例如阿拉伯糖、纤维二糖、赤藓糖醇、甘露糖、麦芽糖、甘露糖、棉子糖、鼠李糖、核糖、山梨醇、淀粉、海藻糖或木糖等。
通过代谢葡萄糖的最终产物是乙酸,乳酸和琥珀酸,有时还会产生少量甲酸。不产生过氧化氢酶和吲哚。
此外还发现Holdemania与色氨酸代谢呈正相关,与异丁酸呈负相关。
4
抗生素敏感性
霍尔德曼氏菌属(Holdemania)对万古霉素具有耐药性,但对特定的抗生素敏感,如在一些研究中观察到的对青霉素类和大环内酯类抗生素的敏感性。
5
霍尔德曼氏菌属下的物种
Holdemania filiformis是该菌属的模式种,此外还可以对其他物种进行细分。
Holdemania filiformis
–Holdemania filiformis DSM 12042
Holdemania massiliensis
–Holdemania massiliensis AP2
未分类的 Holdemania
–Holdemania sp.
–Holdemania sp. 1001095H_141210_F2
–Holdemania sp. 1001302B_160321_E10
–Holdemania sp. cp07.24
–Holdemania sp. Marseille-P2844
–Holdemania sp. P15wH7
–Holdemania sp. P23wH1
具有致病性的物种:
Holdemania filiformis
Holdemania sp AP2
6
基因组结构
霍尔德曼氏菌属(Holdemania)的DNA G+C 含量(mol%):38
霍尔德曼氏菌属的模式菌种Holdemania filiformis有一条环状染色体,由3932923个碱基对组成,该基因组采用宏基因组测序法进行测序,已识别出4223个假定的蛋白质编码区。
7
人群中的分布特征
研究表明,霍尔德曼氏菌属(Holdemania)在不同人群中的分布特征存在差异。
儿童和老年人群中Holdemania的丰度较低,而成年人群中丰度较高。这可能与年龄相关的生理变化和免疫系统成熟度有关。性别方面,目前的数据并不充分,但初步研究指出Holdemania在女性中的丰度较高,而在男性中的丰度较低。
Holdemania属的分布特征与地理区域密切相关。不同地区的环境条件、饮食习惯及生活方式等因素都可能对其在人群中的存在产生影响。一项针对亚洲和西方国家的微生物群落研究显示,Holdemania属 在亚洲人群中更为常见。
8
与其他菌群的互作
Holdemania与其他微生物之间存在复杂的互作关系。这些互作可以是共生的、促进的或拮抗的,具体取决于环境条件和微生物群的组成。以下是一些可能的互作方式。
能够增强下列菌属的生长:
•Bacteroidales
•Bacteroides
•Odoribacter
•Peptococcaceae
能够抑制下列菌属的生长:
•Bifidobacterium
•Coriobacteriales
•Adlercreutzia
•Collinsella
•Porphyromonas
•Prevotella
•Clostridium
•Clostridiales incertae sedis
•Clostridiales Family XIII. Incertae Sedis
•Blautia
•Coprococcus
•Dorea
•Lachnospiraceae
•Ruminococcaceae
•Ruminococcus
•Dialister
•Campylobacteraceae
•Erysipelotrichaceae
谷禾查找并整理了相关文献资料,发现霍尔德曼氏菌属(Holdemania)的丰度变化与健康状态或一些疾病存在关联。
研究显示,在肝炎、抑郁症、肠易激综合征、肺动脉高压、心房颤动、痛风、过敏性哮喘和非酒精性脂肪肝等病症中,Holdemania的相对丰度明显增加。
Part 1
Holdemania高丰度相关
前列腺炎、肝炎

霍尔德曼氏菌属(Holdemania)属于丹毒丝菌科,是一个相对不典型的属。它存在于各种环境中,包括动物的胃肠道。一些观察性研究表明,在患有肝炎、肺炎和神经炎症等各种炎症性疾病的患者肠道中,Holdemania的丰度显著增加。
推测其丰度的变化可能影响肠道屏障的完整性,促进微生物产物易位到血液中,诱导IL-8的产生,这被认为是一种潜在的促炎机制,从而引发炎症反应。此外发现Holdemania数量增加还会带来前列腺炎风险,可能与前列腺炎风险呈正相关。
抑郁症

研究发现,抑郁症患者的肠道菌群发生改变,其中Butyricicoccus、Coprococcus、Faecalibacterium、Fusicatenibacter、Romboutsia的含量持续下降,而Eggerthella、Enterococcus、Flavonifractor、Holdemania 和 Streptococcus的含量增加。
这些肠道菌群可能通过影响色氨酸代谢来调节大脑功能。一些编码色氨酸合酶基因的细菌,如肠球菌、乳杆菌和Oscillibacter,被发现在研究中增加。Trp和5-HTP(5-HT的前体)可以通过血脑屏障(BBB),成为脑内5-HT的前体。
同时在患有沮丧的个体中观察到Holdemania的增多,这表明这种细菌与抑郁症状之间可能存在联系。

抑郁症性高血压(DEP-HTN)患者肠道细菌主要富集的菌落包括Eubacterium siraeum、Alistipes obesi、Holdemania filiformis、Lachnospiraceae bacterium 1.1.57FAA和Streptococcus salivariu,这5种细菌的丰度较高。
肠易激综合征

在属水平上,霍尔德曼氏菌属(Holdemania)在肠易激综合征(IBS)患者中显著高于对照组。IBS 粪便样本中有9个属显著丰富,包括Akkermansia、Blautia、Coprococcus、Granulicatella、Holdemania、Oribacterium、Oscillospira、Parabacteroides和Sutterella。
食物蛋白诱导的小肠结肠炎综合征(FPIES)患儿的粪便菌群失调,表现为:青春双歧杆菌显著减少,拟杆菌属(尤其是脆弱拟杆菌)、Holdemania、Lachnobacterium、鲁氏不动杆菌等菌增加,而双歧杆菌利用寡糖产生短链脂肪酸的代谢通路显著减少。
主观记忆障碍

来自大型前瞻性队列的老年女性的研究中,报告有2个或更多主观记忆障碍(SMC)的女性与报告仅有1个或没有的女性相比,霍尔德曼氏菌属(Holdemania)和脱硫弧菌科的相对丰度更高。
与主观记忆障碍(SMC)少于2个的女性相比,SMC 有2个以上女性的Holdemania和脱硫弧菌科的相对丰度分别高2.09倍和2.10倍。
肺动脉高压
肺动脉高压(PAH)患者可能导致丁酸球菌 (Butyricicoccus)和Holdemania的水平升高,同时降低无害梭菌(Clostridium innocuum)、Defluviitaleaceae UCG011、Eisenbergiella和Ruminiclostridium 5的水平 。
心房颤动
Holdemania与心房颤动(AF)风险相关,霍尔德曼氏菌属(Holdemania)与BMI显著相关,而霍尔德曼氏菌属通过BMI对心房颤动风险的中介作用比例为12.01%。
口腔溃疡

三种肠道微生物群与口腔溃疡呈正相关:Holdemania(比值比 [OR] = 1.005,95% 置信区间 [CI]:1.001-1.009,P = .019)、草酸杆菌(OR = 1.004,95% CI:1.000-1.007,P = .032)和瘤胃球菌科 UCG011(OR = 1.006,95% CI:1.001-1.011,P = .029)。
其他疾病
痛风
基于细菌 16sRNA 的测序结果表明,拟杆菌、Holdemania、Anaerotruncus 和其他几种细菌与痛风病呈正相关。
非酒精性脂肪肝
非酒精性脂肪肝(NAFLD)会导致Holdemania和瘤胃球菌丰度增加。
过敏性哮喘
霍尔德曼氏菌属(Holdemania)(P=0.046)与过敏性哮喘(AA)存在正相关关系。
慢性自发性荨麻疹
慢性自发性荨麻疹(CSU)和对照组肠道菌群Holdemania菌属相对丰度分别为0.04%、0.01%,两组间差异有统计学意义(P = 0.025)。
创伤性脊髓损伤
还分析了23名创伤性脊髓损伤(SCI)患者与23名健康对照,并报道了在创伤性脊髓损伤(SCI)患者中Parabacteroides、aliistipes、Phascolarctobacterium、Christensenella、Barnesiella、Holdemania、Eggerthella、nestiinimonas、Gordonibacter、Bilophila和Coprobacillus的丰度高于健康个体。
乙型肝炎肝硬化
研究发现,乙型肝炎肝硬化无腹水(HBLC-WOA)患者中:阿克曼菌属(Akkermansia)、另枝菌属(Alistipes)、肠杆菌属(Enterobacter)、霍尔德曼菌属(Holdemania)的丰度明显升高。
重症肌无力
此外,瘤胃球菌科UCG005属、 Holdemania、 Lachnoclostridium和真细菌属(反刍动物)与重症肌无力(MG)发生概率较大相关。
Part 2
Holdemania低丰度相关
霍尔德曼氏菌属(Holdemania)在一些疾病中的丰度较高,与此同时,某些疾病中霍尔德曼氏菌属(Holdemania)的丰度可能会降低。
胰腺炎

已确定七种微生物群与胰腺炎的发展显著相关。宿主基因驱动的拟杆菌目和拟杆菌纲与胰腺炎风险增加有关。粪球菌属和裂解真杆菌组(Eubacterium fissicatena)也对胰腺炎的发展表现出促进作用。同时,急性胰腺炎与变形菌门和毛螺菌属呈正相关,与Holdemania属呈负相关。
认知障碍

一项对西班牙裔为主的认知障碍(CI)和不认知障碍(NC)个体中口腔和肠道微生物群的测序研究发现:认知障碍(CI)个体表现出一些肠道菌属的丰度下降,包括Shuttleworthia、Holdemania和Subdoligranulum。
肾结石
肾结石患者中显著降低的菌群:霍氏真杆菌、多尔氏菌属、啮齿杆菌、厌氧棒菌属、Ruminiclostridium_5、霍尔德曼氏菌属(Holdemania)、Fusicatenibacter、罕见小球菌属(Subdoligranulum)、戴阿利斯特菌属、Parasutterella、嗜胆菌属。
Part 3
可能存在的益处
尽管霍尔德曼氏菌属(Holdemania)被发现在一些疾病中存在丰度的变化,但是也有一小部分研究发现霍尔德曼氏菌属(Holdemania)可能对一些疾病存在保护作用。
对巴雷特食管可能具有保护作用

研究发现,Alistipes、Lactobacillus、Prevotella 7和Ruminococcaceae UCG004是Barrett食管(BE)的危险因素,而Flavonifractor和Ruminococcaceae UCG004是食管腺癌(EAC)的危险因素。
另一方面,某些肠道微生物群似乎对BE和EAC都有保护作用。这些菌群包括Eubacterium、 Holdemania、Lactococcus和Actinomyces。
预防3-4期子宫内膜异位症

研究了肠道菌群与子宫内膜异位症不同阶段之间的因果关系。霍尔德曼氏菌属(Holdemania)和瘤胃球菌科UCG002可能在子宫内膜异位症的发展中起着至关重要的作用。
Holdemania和瘤胃球菌科UCG002参与肠道丁酸的产生。值得注意的是,瘤胃球菌科UCG002与调节性T细胞(Treg)呈正相关,其丰度与促炎细胞因子水平密切相关。
目前推测霍尔德曼氏菌属(Holdemania)是预防3-4期子宫内膜异位症的保护因素。相反,较高水平的瘤胃球菌科UCG002会增加1-2期子宫内膜异位症的风险。
在肿瘤治疗中的积极作用
霍尔德曼氏菌属(Holdemania)、多形拟杆菌和普鲁士尼茨菌在对肿瘤免疫治疗响应的患者中显著富集。
此外,肝细胞癌(HCC)恢复正常的群体有几个微生物属相对于延迟恢复(DR)患者显著富集,包括双歧杆菌、丹毒菌科、霍尔德曼氏菌属(Holdemania)。
某些食物和药物的摄入可能对Holdemania的丰度产生影响,导致其水平升高或降低。这种影响取决于食物的种类、药物的成分以及个体的具体健康状况。通过调整饮食和药物使用,可以间接调节Holdemania的丰度。
✦ 果胶
果胶的添加富集了厚壁菌门的微生物成员,包括梭菌纲下的Mogibacteriaceae科、Lachnospiraceae(毛螺菌科)以及产芽胞菌科。
其中,毛螺菌科的Butyrivibrio(丁酸弧菌属)、Coprococcus(粪球菌属)、Moryella、Holdemania(霍尔德曼氏菌属)和Bulleidia属对果胶表现出显著的特异性。
✦ 纳米硒
代谢组学和微生物组学分析结果表明,纳米硒SeNPs能够参与调节机体脂质代谢途径,提高霍尔德曼氏菌的丰度及其代谢产物短链脂肪酸(乙酸、丙酸)的含量。
✦ 利福昔明
利福昔明干预后丰度升高的菌属包括粪杆菌属(Faecalibacterium)、嗜胆菌属(Bilophila)、副萨特氏菌属(Parasutterella)、粪芽孢菌属(Coprobacillus)、霍尔德曼菌(Holdemania)、双歧杆菌属、真杆菌属(Eubacterium)。
✦ 伊匹单抗+纳武单抗
使用伊匹单抗结合纳武单抗治疗的患者肠道内厚壁菌门的Faecalibacterium prausnitzii和Holdemania filiformis菌以及拟杆菌门的Bacteroides thetaiotamicron增多。
✦ 针刺疗法
2型糖尿病患者,通过针刺疗法,在细菌属、种水平上,针刺组的埃希菌属(Escherichia)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、霍尔德曼氏菌属(Holdemania)、罗氏菌属(Rothia)、普雷沃氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、弯曲杆菌属(Campylobacter)、厌氧棍状菌属(Anaerotruncus)、厌氧消化链球菌(Peptostreptococcus anaerobius)和Shuttleworthia satelles的丰度下降。
✦ 低FODMAP黑麦面包
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者破坏菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella 和克雷伯菌的丰度。
✦ 夏桑菊

夏桑菊是一种上市药物和膳食补充剂,用于治疗具有炎症的代谢疾病。夏桑菊可以引起肠道菌群组成的变化,颤杆菌丰度增加,胆菌属、Candidatus Stoquefichus、Holdemania、Parasutterella和Rothia减少。
✦ 二陈汤
二陈汤(ECD):使用二陈汤主要减少了Prevotella、Blautia和Holdemania菌属的含量,这些菌属及丙酸水平与宿主肥胖表型(特别是脂质代谢紊乱)存在正相关关系。
✦ 开菲尔
使用开菲尔干预后Holdemania属的显著减少可能通过炎症产生了积极的微生物群组成变化。
主要参考文献
Liu H, Li J, Guan C, Gao W, Li Y, Wang J, Yang Y, Du Y. Endometriosis is a disease of immune dysfunction, which could be linked to microbiota. Front Genet. 2024 Jun 21;15:1386411.
Gao M, Wang J, Liu P, Tu H, Zhang R, Zhang Y, Sun N, Zhang K. Gut microbiota composition in depressive disorder: a systematic review, meta-analysis, and meta-regression. Transl Psychiatry. 2023 Dec 8;13(1):379.
Wu F, Davey S, Clendenen TV, Koenig KL, Afanasyeva Y, Zhou B, Bedi S, Li H, Zeleniuch-Jacquotte A, Chen Y. Gut Microbiota and Subjective Memory Complaints in Older Women. J Alzheimers Dis. 2022;88(1):251-262.
Zhou F, Liu Y, Shi Y, Wu N, Xie Y, Zhou X. Association between gut microbiota and acute pancreatitis: a bidirectional Mendelian randomization study. J Gastroenterol Hepatol. 2024 Jun 18.
Wadop YN, Vasquez EL, Mathews JJ, Muhammad JAS, Mavarez RP, Satizabal C, Gonzales MM, Tanner J, Maestre G, Fonteh AN, Seshadri S, Kautz TF, Fongang B. Differential Patterns of Gut and Oral Microbiomes in Hispanic Individuals with Cognitive Impairment. bioRxiv [Preprint]. 2024 Jul 29:2024.07.27.605455.
Mishra AK, Lagier JC, Pfleiderer A, Nguyen TT, Caputo A, Raoult D, Fournier PE. Non-contiguous finished genome sequence and description of Holdemania massiliensis sp. nov. Stand Genomic Sci. 2013 Dec 15;9(2):395-409.
Zhang M, Fang J, Zheng C, Lin Q, Zhang J. Gut microbiota and autoimmune neurologic disorders: a two-sample bidirectional Mendelian randomization study. Front Microbiol. 2024 Apr 24;15:1337632.

谷禾健康
不知道大家有没有这样的体验:紧张时会想上厕所,伤心时会食欲不振。任何情绪变化,好像都会反映在消化系统。
与此同时,你相不相信一个人的肠道微生物可以影响其认知、性格、气质、社交情况、甚至是责任心。
有大量证据表明神经系统与肠道微生物的组成和功能有关。目前,已经描述了各种肠-脑串扰途径,包括通过迷走神经途径的免疫、内分泌和神经回路。此外,中枢神经系统控制肠道菌群的失衡,构成双向通讯系统。
肠道菌群失衡,也许是导致精神问题的潜在原因。一些研究发现,肠道菌群改变(生态失调)与阿尔茨海默病、自闭症和帕金森病等神经精神疾病以及焦虑、抑郁和认知功能障碍等其他心理疾病有关。
肠道菌群可以分泌神经递质,例如乙酰胆碱、γ-氨基丁酸(GABA)和色氨酸;此外肠道中有数百万个神经元,可以通过神经递质向大脑发送信号。
肠脑轴功能障碍被认为是精神障碍的病理生理学;因此,恢复受干扰的微生物生态系统为管理或预防这些神经系统疾病提供了一种新颖且有前途的方法。
本文对人类肠道微生物群失调与几种精神和心理疾病之间联系进行了概述。此外,还展示了一些使用精神药物与调节肠道微生物相结合的方式以改善精神疾病或心理障碍的干预措施。肠道微生物群在未来可能成为缓解压力与治疗精神疾病的新工具。
人类肠道含有多样化的微生物群落,据估计,肠道中的微生物数量可以达到数万亿个。微生物群的密度在肠道不同部位也有所不同,结肠和直肠的微生物密度较高,而小肠的微生物密度较低。
肠道微生物由多种微生物类群组成,包括细菌、病毒、真菌、古细菌和原生动物,其中最主要的是细菌。
•古细菌
在健康的人类肠道中,古细菌的数量很少,其中史密斯产甲烷短杆菌(Methanobrevibactersmithii)是最常见的物种。
•真菌
肠道中最常检测到的真核微生物是真菌,例如念珠菌(Candida)和酵母菌(Saccharomyces)。这些真菌维持生态和免疫肠道微生物组的平衡。
•病毒
人体病毒组主要由噬菌体组成,它们在肠道中的作用是作为细菌组的调节剂。
•原生生物
一些原生动物,例如芽囊原虫属(Blastocystis),已在人类肠道微生物群中检测到,它们的存在通常与胃肠道疾病有关。
✦细菌是人类肠道中最常见的微生物
细菌是人体肠道中最常见的微生物,一般属于以下8个门:放线菌门 (Actinobacteria)、芽孢杆菌门 (Bacillota)(又名厚壁菌门)、拟杆菌门 (Bacteroidetes)、弯曲菌门 (Campylobacterota)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、热脱硫杆菌门(Thermodesulfobacteriota)和疣微菌门(Verrucomicrobia)。
下图显示了健康人肠道微生物群中主要的门、科和属。
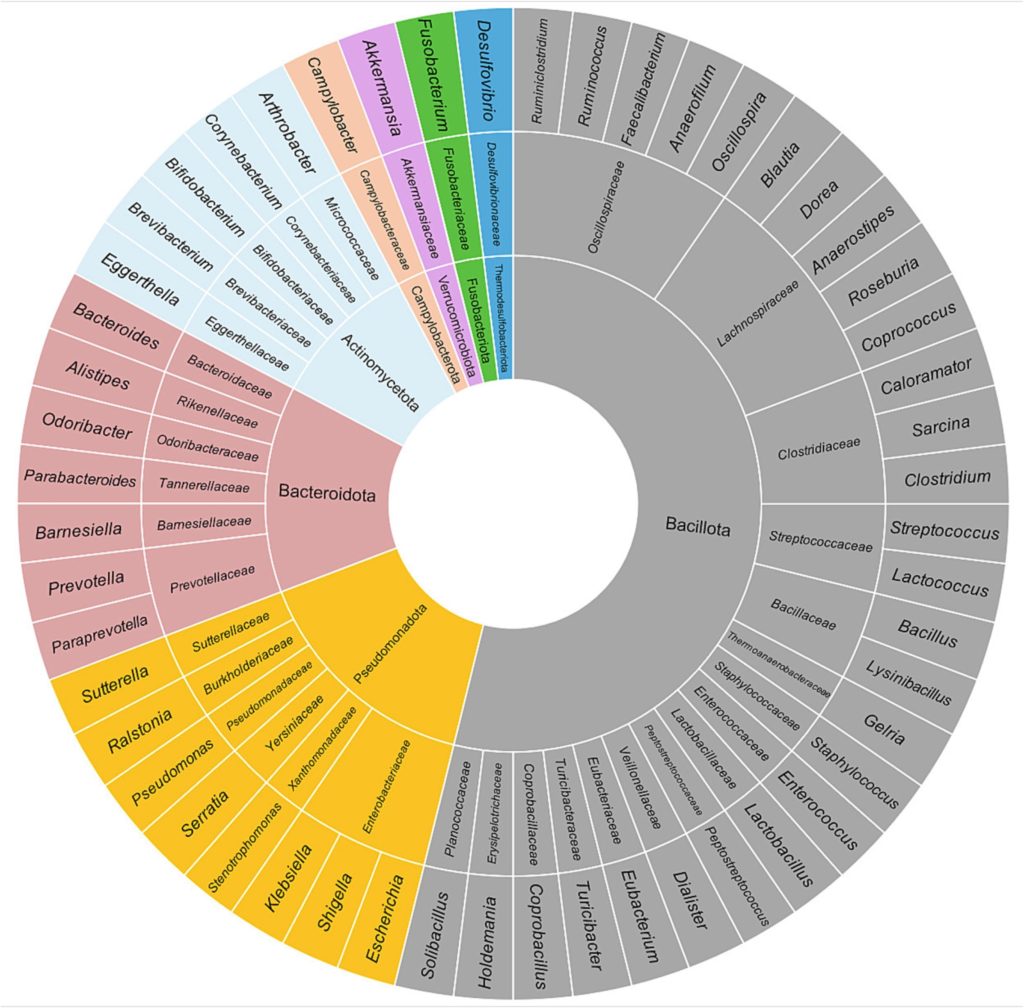
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
✦肠道不同部位的微生物群组成具有差异
肠道区室中的微生物有特定的空间分布。上消化道中最主要的是孪生球菌属(Gemella)、韦荣氏球菌属(Veillonella)、奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、链球菌属(Streptococcus)、普雷沃氏菌属(Prevotella)、假单胞菌属(Pseudomonas)和放线菌属(Actinomyces)。
而在下消化道中则有粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)和瘤胃球菌属(Ruminococcus)。
十二指肠
研究发现人类十二指肠粘膜富含芽孢杆菌(Bacillus)、Solibacillus、赖氨酸芽孢杆菌(Lysinibacillus)、微小杆菌属(Exiguobacterium)、海洋芽胞杆菌属(Oceanobacillus)和类芽孢杆菌(Paenibacillus)。
空肠
在空肠中,变形菌门和厚壁菌门是最常见的门,而埃希氏菌属、乳杆菌属和肠球菌属是空肠中最常见的属。
回肠
链球菌属(Streptococcus spp.)、大肠杆菌(Escherichia coli)和梭菌属(Clostridium spp.),是回肠中最常见的物种。
结肠
结肠是一个厌氧环境,以拟杆菌门、放线菌门和厚壁菌门以及毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)、拟杆菌科(Bacteroidaceae)和理研菌科(Rikenellaceae)为主,以及已鉴定的主要细菌属乳杆菌属、双歧杆菌属和粪杆菌属。
研究了不同结肠区域的细菌属优势,他们发现乙状结肠中存在拟杆菌属、肠球菌属。近端结肠和远端结肠为粪杆菌和大肠杆菌。
阑尾中微生物多样性较高,以放线菌门、梭杆菌门、变形菌门、拟杆菌门和厚壁菌门为主;以及毛螺菌科、肠杆菌科、拟杆菌科、梭杆菌科和双歧杆菌科。
尽管人类肠道微生物群的组成因年龄、营养和抗生素使用等因素而在分类学和功能上存在差异,但人类肠道微生物群主要是由乳杆菌属、芽孢杆菌属、梭菌属、肠球菌属、瘤胃球菌属、粪杆菌属、罗氏菌属(Roseburia)、经黏液真杆菌属(Blautia)、Dorea属、拟杆菌属、普雷沃氏菌属、双歧杆菌属和埃希氏菌属。
✦肠道微生物对于消化非常重要
肠道微生物群为人类宿主提供了多种积极影响,包括免疫和代谢功能。肠道微生物是消化的关键调节者,通过营养物质的吸收以及多种代谢物的合成,包括脂质、氨基酸、维生素和短链脂肪酸。
✦肠道微生物有助于预防病原体感染
此外,肠道微生物群通过多种竞争过程在预防病原菌感染方面发挥着关键作用,并且还有助于维持肠上皮的完整性。
✦肠道微生物产生的化合物可作为信号分子
肠道微生物群从未消化的食物中产生多种分泌化合物。其中一些可以作为细菌间通讯的信号分子,影响细菌调节、稳态、生长、毒力和生物膜形成等。
色氨酸代谢物
细菌还可能分泌其他生物活性化合物,包括色氨酸分解代谢物、短链脂肪酸、多胺和组胺。色氨酸的代谢产物[5-羟色胺(血清素)、犬尿氨酸和吲哚]与生理和神经元活动有关。
吲哚
吲哚调节肠促胰岛素的分泌,调节肠道屏障通透性,并且可以作为微生物和宿主细胞之间细胞间通讯的信号分子。此外,吲哚及其衍生物被描述为神经炎症的抑制化合物。
短链脂肪酸
最重要的定量代谢物是由微生物降解不可消化的膳食纤维、蛋白质和糖蛋白产生的短链脂肪酸。如丁酸盐、乙酸盐和丙酸盐,可以作为信号分子,局部调节从十二指肠到结肠的肠道功能,并且通过肠内分泌细胞,它们还可以控制肝脏、肌肉和大脑的代谢,影响肠道功能及宿主能量稳态。
此外,短链脂肪酸通过诱导神经炎症反应呈现神经活性特性。短链脂肪酸是强大的表观遗传调节剂,控制DNA甲基化遗传物质的可及性并抑制组蛋白脱乙酰化。
该机制依赖于10-11易位 (TET) 蛋白,该蛋白催化胞嘧啶残基羟基化为5-羟甲基胞嘧啶,介导主动DNA去甲基化。确定丁酸盐诱导前额皮质中许多行为相关基因的变化,特别是影响涉及神经元兴奋或抑制的基因。几种兴奋性神经递质和神经元激活标记基因的减少,以及抑制性神经递质基因的增加表明丁酸盐促进抑制途径转录物的转录。
✦细菌代谢产物会影响神经发育
最近的研究表明,细菌代谢产物会影响神经发育。一些研究人员还报道了短链脂肪酸影响神经发生基因的表达。
使用无微生物的斑马鱼模型,观察到无微生物培养的胚胎中神经基因表达显著下降,并通过添加斑马鱼代谢物重新建立了该模型,识别出超过300个下调的基因。
基因分析表明,这些基因参与重要的神经发育途径,包括转录调控和Wnt信号传导。事实上,Wnt信号通路在发育和疾病中发挥着重要作用,可以推测其调控与多细胞真核生物的细菌定植共同进化。
下图展示了肠道微生物群合成的一些关键神经递质及其与心理和精神疾病的关联。这些神经活性化合物通过内在或外在传入神经通路将信息从肠腔传输到肠神经系统、肠神经胶质细胞和中枢神经系统。
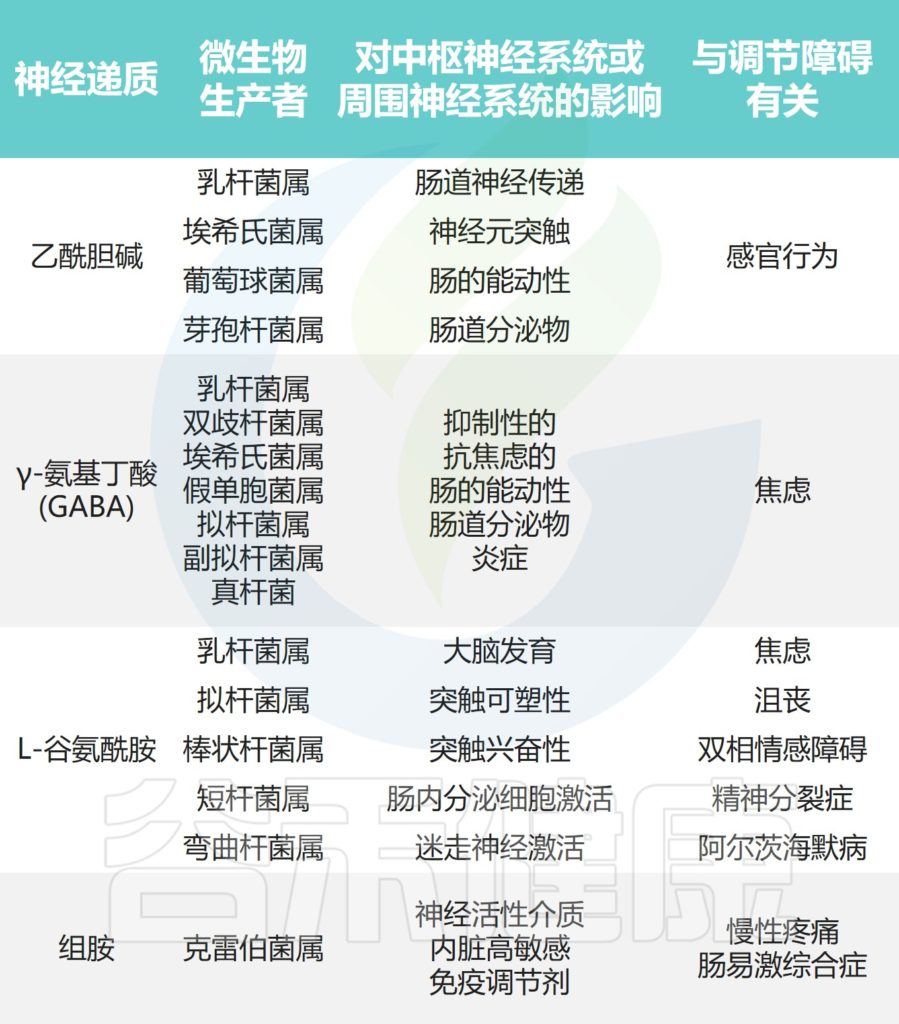

Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
阿尔茨海默病(AD)是一种慢性神经退行性疾病,其中记忆和执行功能进行性丧失,与突触损伤和神经损失有关,主要发生在海马体和大脑皮层。
多项研究已明确β-淀粉样肽(Aβ)在阿尔茨海默病中的作用。最近的研究表明,细菌来源的淀粉样蛋白,例如curli、Csg A、tau、TasA、FapC和酚溶性调节蛋白,在Aβ寡聚体的聚集和促进错误折叠中发挥作用。
细菌淀粉样蛋白通过与Toll样受体2相互作用激活宿主免疫系统,诱导促炎介质刺激大脑中神经元淀粉样蛋白的产生。
•肠道微生物失调与阿尔兹海默病存在关联
其他证据表明肠道微生物群失调与阿尔茨海默病的早期阶段有关,导致细胞因子分泌增强、免疫衰老、神经炎症和氧化应激。
此外,肠道微生物失调会诱导脂多糖的分泌,从而破坏胃肠道通透性和血脑屏障,调节炎症途径,促进神经炎症和认知能力下降,并导致阿尔茨海默病中的神经元死亡。
在大鼠中,腹膜脂多糖给药导致炎症因子(例如IL-1、IL-6和TNF-α)水平升高,表明微生物组在阿尔茨海默病先天免疫反应的启动中发挥作用。
•阿尔兹海默病中短链脂肪酸水平降低
研究表明,阿尔茨海默病小鼠的微生物群组成和多样性受到干扰,短链脂肪酸水平降低,这预示着30多种代谢途径的改变,这可能与淀粉样蛋白沉积有关。
肠道菌群失调可能会增加氧化三甲胺(TMAO)浓度,这与不同的功能有关,例如β-淀粉样蛋白的形成、外周免疫反应的激活和氧化应激。此外,还与肠粘膜屏障功能障碍、血脑屏障通透性以及胆汁酸和胆固醇进入大脑的通道增加有关。
•阿尔茨海默病患者体内促炎菌群比例增加
研究发现阿尔茨海默病患者中大肠杆菌/志贺氏菌等促炎菌群的比例增加,而直肠真杆菌(eubacterium rectale)、霍氏大肠杆菌(E.hallii)、普拉梭菌(F. prausnitzii)和脆弱拟杆菌等产生丁酸的细菌则减少。
这些细菌与外周炎症状态有关,这是轻度认知障碍(MCI)和脑淀粉样变性患者的典型症状。
注:淀粉样脑血管病主要是由淀粉样物质在软脑膜以及大脑皮质小动脉中层沉积所导致的疾病,多见于80岁以上的老年人,可能会导致血管壁受损。
•阿尔茨海默病患者肠道微生物多样性较低
据报道阿尔茨海默病患者肠道菌群的微生物多样性较低,厚壁菌门和双歧杆菌种类减少。
此外,发现门水平上拟杆菌门细菌成员增加,放线菌门减少,以及科水平上瘤胃球菌科、肠球菌科和乳杆菌科增加,毛螺菌科、拟杆菌科和韦荣氏菌减少。
促炎细菌类群增加,同时产生丁酸盐的细菌减少,例如丁酸弧菌(B.proteoclasticus和B.Hungatei)、梭菌属、真杆菌属(E.Hallii、E.rectal和E.eligens)、普拉梭菌和罗斯拜瑞氏菌 (R.hominis)。
几种精神障碍疾病中的肠道菌群失调
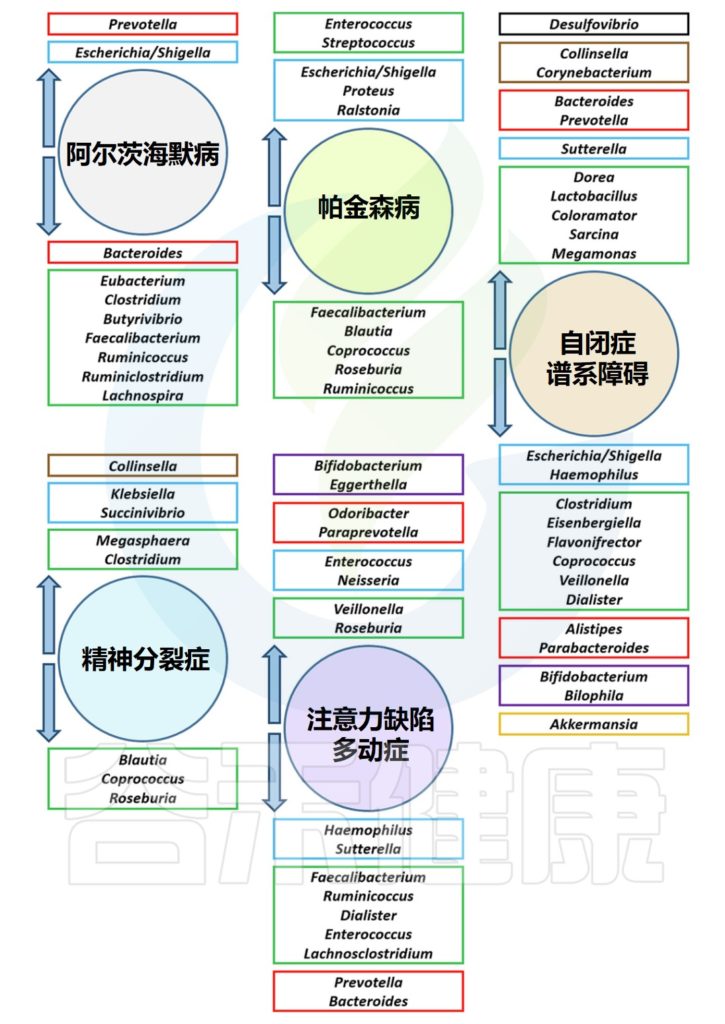
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
自闭症谱系障碍(ASD)是一种大脑发育障碍,其特征是刻板行为以及沟通和社交互动缺陷。
注:儿童自闭症是儿童精神类疾病当中最为严重的一种。
自闭症谱系障碍的确切病理学和病因很难确定,研究重点是调查遗传原因、免疫系统失调、环境毒物暴露以及肠道微生物群的改变。
•自闭症儿童的肠道微生物多样性较高
据报道自闭症儿童的肠道微生物多样性较高。自闭症谱系障碍样本中最常见的属如下:
拟杆菌属(Bacteroides),
脱硫弧菌属(Desulfovibrio),
柯林斯氏菌属(collinsella),
棒状杆菌属 (Corynebacterium),
乳杆菌属(Lactobacillus),
普雷沃氏菌属(Prevotella),
萨特氏菌属(Sutterella),
八叠球菌(Sarcina),
罗氏菌属(Roseburia),
粪杆菌属(Faecalibacterium),
巨单胞菌(Megamonas),
Caloramator,
Dorea;
此外以下属的存在减少:
双歧杆菌(Bifidobacterium) ↓↓↓
另枝菌属(Alistipes) ↓↓↓
嗜胆菌属(Bilophila) ↓↓↓
韦荣氏球菌属(Veillonella) ↓↓↓
阿克曼菌(Akkermansia) ↓↓↓
粪球菌属(Coprococcus) ↓↓↓
埃希氏杆菌属-志贺氏杆菌 ↓↓↓
梭菌属(Clostridium) ↓↓↓
艾森伯格氏菌(Eisenbergiella) ↓↓↓
嗜血杆菌属(Haemophilus)↓↓↓
Dialister ↓↓↓
Parabacteroides ↓↓↓
Flavonifractor ↓↓↓
这些发现强烈表明肠道微生物群失调与自闭症行为表现之间存在联系。
•有害菌会产生神经毒素影响自闭症
在自闭症行为表现患者中发现双歧杆菌丰度较低,而双歧杆菌是产生GABA神经递质的关键,双歧杆菌丰度过低会导致焦虑、认知缺陷和行为障碍。
产生神经毒素的艰难梭菌和溶组织梭菌的积累与自闭症谱系障碍症状相关。这些释放的有毒分子会影响血清素信号传导,可能导致自闭症谱系障碍行为模式,例如社交能力下降、对疼痛的反应减弱、语言异常以及自虐或重复行为。
受自闭症行为表现影响的个体表现出其他潜在有毒化合物水平的改变,例如抑制多巴胺-β-羟化酶的对甲酚和对甲酚硫酸盐。此外,在受自闭症谱系障碍影响的个体中检测到梭菌衍生的代谢物3-(3-羟基苯基)-3-羟基丙酸增加,这可能反映了儿茶酚胺代谢的改变。
•短链脂肪酸对自闭症的作用存在矛盾结果
短链脂肪酸在自闭症谱系障碍中的作用存在矛盾的结果。丙酸盐会诱导小胶质细胞激活、神经毒性细胞因子产生、基因表达改变、海马组织学异常和神经行为异常,例如重复动作和社交互动受损。
然而,丁酸盐对一种自闭症谱系障碍样小鼠模型的社交和重复行为具有有益影响。丁酸盐改善血脑屏障的不渗透性可能是丁酸盐可以恢复丙酸盐诱发的自闭症样疾病异常的另一种机制。
帕金森病(PD)是老年人中常见的一种痴呆症,其主要疾病症状包括神经炎症、中脑多巴胺能神经元丧失以及伴有非运动症状的异常运动。
•微生物失调引起的炎症可能导致帕金森病发展
一些研究人员认为,微生物群失调引起的炎症反应可能会导致帕金森病病理学的发展或恶化。这些反应可以促进脂多糖和α-突触核蛋白在肠道和大脑中的积累,并且由于促炎细菌活性导致氧化应激增加,从而促进α-突触核蛋白病理学通过迷走神经从头侧向尾侧区域扩散。
•帕金森病患者体内短链脂肪酸显著减少
另一方面,微生物短链脂肪酸可以防止肠粘膜通透性增加,从而减少细菌移位。帕金森病中短链脂肪酸显著减少。
短链脂肪酸在帕金森病病理学中的作用尚未完全阐明,报道短链脂肪酸的消耗导致肠神经系统中路易体的形成;相反,有研究表明短链脂肪酸能够降低血脑屏障的通透性。
注:路易体主要是以帕金森病为代表的脑门特征性标志物,患者常常会出现功能障碍。
考虑到短链脂肪酸缺乏与神经炎症和小胶质细胞激活以及便秘、肠漏和结肠炎症等胃肠道特征有关,这些研究结果支持了这样的假设:短链脂肪酸缺乏可能是帕金森病的病因。
•帕金森病患者有抗炎作用的菌群减少
帕金森病患者经常出现属于乳杆菌科、巴氏杆菌科和肠球菌科的某些细菌种类水平升高。
此外发现,帕金森病患者粪便和粘膜中产生抗炎丁酸的细菌水平显著降低(普雷沃氏菌、布氏菌、粪球菌属和罗氏菌属),以及粪杆菌属的水平显著降低。
此外,像罗尔斯通氏菌(Ralstonia)这样的促炎细菌在帕金森病患者的肠粘膜中更为丰富。
拓展
基于肠杆菌科细菌滴度与帕金森病症状严重程度之间的正相关性,这些作者认为肠道微生物群可能与帕金森病表型有关。
相关分析显示疾病严重程度和帕金森病持续时间与纤维素降解剂呈负相关,但与致病生物呈正相关,可能导致短链脂肪酸产生减少以及神经毒素和内毒素增加,可能与帕金森病病理学的发展有关。
此外,普雷沃菌科丰度的降低和乳杆菌科丰度的增加与胃饥饿素浓度的降低有关,胃饥饿素是一种与维持正常多巴胺功能有关的肠道激素,帕金森病患者的胃饥饿素分泌发生了改变。
精神分裂症是一种复杂的精神障碍,患者对现实的理解异常,经常出现焦虑和严重抑郁症状。
这种疾病的起源是有争议的,表明是遗传起源。然而,值得注意的是,通过表观遗传学机制,如神经传递基因甲基化、核苷酸修饰或非编码RNA的作用,一些环境因素可能在其易感性和疾病的发展中发挥作用。
•肠道菌群代谢物影响精神分裂症风险
短链脂肪酸、色氨酸分解代谢物和神经递质(GABA、谷氨酸)的差异被称为精神分裂症相关的肠脑模块。
微生物产生的多巴胺与精神分裂症有关,而与精神分裂症相关的胃肠道炎症增加强烈表明肠道微生物群可能在患精神分裂症或其表现的风险中发挥作用。
•精神分裂症患者肠道微生物群显著改变
研究表明抗生素治疗引起的肠道微生物群失调与精神分裂症的发病率之间存在直接关系。精神分裂症患者中巨球型菌属、琥珀酸弧菌属、梭菌属、柯林斯氏菌属、甲烷短杆菌属和克雷伯菌属的丰度显著增加,而与健康人相比,精神分裂症患者中经黏液真杆菌属、粪球菌属和罗氏菌属的滴度下降。
•抗精神病药物治疗后肠道微生物群发生改变
几项研究已经确定抗精神病药物治疗与肠道微生物群之间的联系。精神分裂症患者在接受抗精神病药物治疗后发现微生物群丰度发生了显著变化。
在其他研究中,接受抗精神病药物治疗的患者的厚壁菌门与拟杆菌门的比例逐渐增加,与体重指数的上升相关。此外,接受治疗的个体的肠道微生物群富含短链脂肪酸和血清素代谢的基因。
注意缺陷与多动障碍(ADHD)是一种神经发育障碍,其特征是高度多动冲动和注意力问题。尽管可能涉及环境和遗传因素,一些证据表明注意缺陷与多动障碍的发展或症状可能与饮食成分对肠道微生物组的调节有关。
•ADHD儿童体内有害菌丰度较高,有益菌较少
最近发现,食用加工饮食的注意缺陷与多动障碍儿童体内有害细菌(如肠杆菌、大肠杆菌和梭菌菌株)的丰度明显较高,而有益细菌(如双歧杆菌和瘤胃球菌菌株)的丰度明显较低。
食用加工食品的注意缺陷与多动障碍患者的肠道微生物群α多样性和短链脂肪酸水平显著低于对照组,研究人员认为不平衡的饮食会扰乱结肠微生物平衡,并可能成为多动症患病的潜在风险因素。
•患者肠道菌群失衡影响激素和神经递质水平
宿主-微生物组的相互作用对激素和神经递质水平产生影响,被认为与注意缺陷与多动障碍的病理生理学有关。肠道菌群失调加上持续接触微生物病原体引起的免疫功能障碍可能会导致受影响的多动症患者出现过度活跃的行为。
肠道菌群提供多巴胺和去甲肾上腺素的前体
注意缺陷与多动障碍与预测的多巴胺和去甲肾上腺素合成异常有关,其前体由肠道细菌(主要是双歧杆菌)提供。
压力被定义为由困难情况或环境压力源引起的非特定情绪或身体反应。这种反应与心理和生物因素有关,例如性激素、高情绪反应性、被动应对技巧、糖皮质激素抵抗以及中枢和外周免疫激活。
✦压力会影响肠道微生物组成与活动
不同类型的心理和社会压力源已被证明可以通过神经元、免疫细胞和结肠嗜铬细胞释放信号分子、激素或神经递质来调节肠道微生物群的组成和活动。
压力对肠道微生物群的影响可能直接通过宿主肠道微生物群信号传导介导,也可能间接通过肠道生态系统的变化介导,并涉及炎症反应、微生物栖息地的改变、肠道运动和粘蛋白分泌。
✦产生短链脂肪酸的细菌减少可能是导致焦虑的关键
暴露于压力会导致肠道微生物群组成的实质性变化,肠杆菌科细菌的增加,而乳杆菌属的细菌减少。拟杆菌属减少,梭菌属增加。以及大肠杆菌和假单胞菌属的增加。
某些微生物群可能参与应激性焦虑和一般性焦虑症,其特征是社交和职业功能下降。研究人员报道,在一般性焦虑症患者中,粪杆菌(Faecalibacterium)、直肠真杆菌(E.rectale)、毛螺菌属(Lachnospira)、丁酸球菌(Butyricicoccus)和萨特氏菌(Sutterella)较低。这些都是短链脂肪酸的重要生产者。
应激性焦虑是指在强烈的精神或躯体应激事件的刺激下,产生的过度焦虑、恐惧等情绪。患者可出现紧张、坐立不安、心慌、呼吸急促等症状,还可伴有睡眠障碍、食欲改变等表现。
大胆猜想
短链脂肪酸产生菌的减少是焦虑和抑郁单胺类假说的关键。
单胺假说——指科学家在抗抑郁药领域提出的假说,即抑郁患者神经突触间隙可有效利用的单胺类神经递质浓度明显下降,而升高突触间隙单胺递质浓度(主要是血清素)能发挥抗抑郁作用。
抑郁症是一种与压力相关的情绪障碍,涉及神经免疫-神经内分泌失调,与促炎细胞因子水平升高相关。
促炎细胞因子与高水平的皮质醇有关,通过抑制四氢生物蝶呤酶发挥重要作用,四氢生物蝶呤对于合成多巴胺、血清素和去甲肾上腺素至关重要。
多巴胺、血清素和去甲肾上腺素是人体内重要的神经递质,它们在神经系统中发挥着重要的作用。
✦肠道微生物的多样性与抑郁严重程度负相关
几项研究报告称,不同抑郁症患者的肠道微生物群组成差异较大,粪便微生物多样性的增加与抑郁症症状的严重程度呈负相关。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania和Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialiste)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,以及副拟杆菌属(Parabacteroides)、普雷沃氏菌属(Prevotella)和放线菌属(Actinobacteria)的增加与抑郁个体相关。
✦短链脂肪酸有助于释放神经递质和调节血脑屏障
几项研究表明,重度抑郁症患者的丁酸盐、乙酸盐和丙酸盐减少,表明短链脂肪酸可能通过直接刺激神经通路或通过神经内分泌和免疫激活的间接中枢效应改变行为。
短链脂肪酸也有助于结肠嗜铬细胞合成和释放外周神经递质(血清素和乙酰胆碱),并有助于交感神经元合成和释放去甲肾上腺素。
除了局部作用外,短链脂肪酸还可以直接作用于血脑屏障的中心受体。此外,体外研究表明,丙酸盐和丁酸盐,而不是乙酸盐,都可以调节血脑屏障的通透性,防止脂多糖引起的通透性增加。
强迫症是一种慢性且持久的疾病,会被迫出现侵入性、自我张力障碍的想法或冲动或重复行为。
尽管只有少数研究涉及肠道微生物群与强迫症的关系,但压力和抗生素治疗都会影响微生物群组成,已被认为是与强迫症症状同时发生的因素。
✦强迫症患者肠道微生物丰富度较低
据报道,患有强迫症的个体肠道微生物群的物种丰富度较低,产生丁酸盐的属(颤旋菌属、Odoribacter和Anaerostipes)的相对丰度较低。
最近还报道强迫症患者粪便样本显示文肯菌科(Rikenellaceae)(另枝菌属)丰度增加,而普雷沃氏菌和毛螺菌科(Lachnospiraceae)丰度降低。
几种心理障碍中的肠道菌群失调
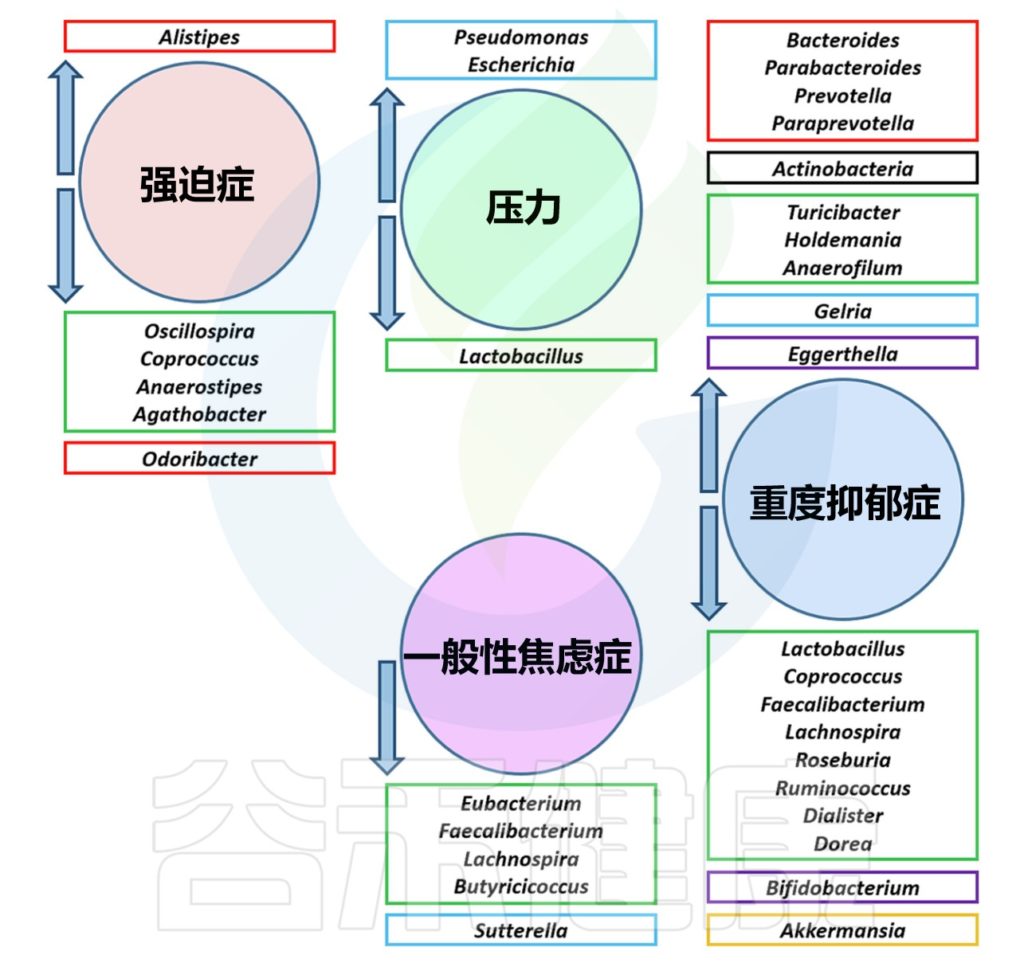
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
杏仁核在与压力相关的情绪、行为反应和情绪调节中发挥着关键作用,它显著受到肠道微生物群的影响。
杏仁核,又名杏仁体,呈杏仁状,是边缘系统的一部分。
√肠道微生物的变化可以调节认知功能
在动物模型中,有一些证据支持肠道微生物群组成的变化可以影响调节认知功能,尽管只有少数研究关注人类认知。
拟杆菌水平较高的人群拥有较好的认知表现
最近,根据粪杆菌(Faecalibacterium)、拟杆菌(Bacteroides)和瘤胃球菌科(Ruminococcaceae)的丰度建立了三组受试者,并得出结论,较好的认知表现与较高水平的拟杆菌相对应。
使用抗生素会影响认知功能,故不可滥用
用抗生素治疗剥夺或破坏肠道微生物群也会影响认知功能,包括语言学习能力以及工作和空间记忆。
√肠道微生物会影响一个人的气质和性格
由于人格特征和行为模式以及生理和心理健康结果之间存在很强的关联,一些研究已经证明肠道微生物群与气质和性格之间存在关联,这些特征甚至可以通过粪菌移植在受试者之间传播。
研究了肠道微生物的组成与儿童气质之间的关系,发现更大的暴躁/外向和恐惧与系统发育多样性呈正相关,包括戴阿利斯特杆菌属 (Dialister)、文肯菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)和约氏副拟杆菌(Parabacteroides)的丰度变化。
产丁酸细菌更丰富的人可能有更高的责任心
发现高度神经质和低外向性与γ-变形菌纲丰度增加有关。低责任性与变形菌丰度增加和毛螺菌科丰度减少有关,而开放程度高的人与更大的系统发育多样性和丰富度相关。
另一方面,高度的责任心与产生丁酸的细菌滴度的增加有关,这些细菌主要属于毛螺菌科。
√多样化的肠道微生物有助于社交和好心情
最近有研究表明,特定细菌属的丰度与人格特征显著相关。对肠道微生物组多样性的分析表明,具有较高社交网络的个体呈现出多样化的肠道微生物组,而焦虑和压力与肠道微生物组的组成改变和多样性降低有关。
研究还发现某些细菌属,包括阿克曼氏菌、脱硫弧菌、乳球菌、颤螺菌和萨特氏菌可能与行为密切相关。
已经使用了几种方法来确定肠道微生物群对中枢神经系统功能的作用,包括抗生素治疗、无菌动物模型和粪菌移植。
此外,精神抗生素和益生元已被用作精神和心理疾病的辅助治疗。精神抗生素的类别可以定义为“一种活的有机体,通过与共生肠道细菌相互作用,为患有精神疾病的患者带来心理健康益处”。这些药物通过调节和改善肠道微生物群发挥作用。
为了让大家有更清晰的认识,谷禾在下表整理了使用益生菌或益生元治疗对心理或精神疾病的影响。





Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
•基因集富集分析展示下肠道菌群与精神疾病的关联
使用基因集富集分析 (GSEA) 能够检测肠道微生物群与精神疾病之间的以下显著关联:注意力缺陷与多动障碍常伴有脱硫弧菌和梭状芽孢杆菌富集;自闭症谱系障碍与拟杆菌属和脱硫弧菌有关;对于重度抑郁障碍,观察到脱硫弧菌、梭状芽孢杆菌目、钩端螺旋菌科和拟杆菌类的关联。
最近报道了普雷沃氏菌与自闭症谱系障碍以及放线菌属与精神分裂症之间的特定关联。还有一组研究人员提出了放线菌和假单胞菌与重度抑郁障碍之间的关系。
肠道微生物群和中枢神经系统通过两条途径进行交流:
(1)通过迷走神经途径的神经免疫和代谢回路;
(2)通过微生物群合成的代谢产物、肠道激素和内分泌肽。
先前的研究表明,肠道微生物群的失调是几种精神疾病的病理生理学。因此,恢复受干扰的微生物生态平衡可能为管理或预防神经系统疾病提供一种新的、有前景的方法。
另一方面,心理干预已证明在治疗功能性胃肠道疾病如肠易激综合征方面是有效的;然而还需要进一步的研究来确定心理干预对肠道微生物群变化的具体影响。
通过粪菌移植、健康的饮食和生活方式或使用心理生物药物等干预措施重建失调的肠道微生物群,可能在未来调节微生物群肠脑轴功能和促进心理精神健康方面具有重大潜力。
特别是,心理干预可能对某些神经系统疾病具有潜在的治疗作用。然而,这些干预措施的有效性并不相同,取决于给药方法、干预时间、使用的微生物菌株的数量和具体类型以及宿主的生理状况等因素。
在未来,单独或与抗精神病药物联合的个性化精神微生物干预可能成为临床患者的一种新的治疗策略。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Abuaish S, Al-Otaibi NM, Abujamel TS, Alzahrani SA, Alotaibi SM, AlShawakir YA, Aabed K, El-Ansary A. Fecal Transplant and Bifidobacterium Treatments Modulate Gut Clostridium Bacteria and Rescue Social Impairment and Hippocampal BDNF Expression in a Rodent Model of Autism. Brain Sci. 2021 Aug 5;11(8):1038.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Ansari F, Pourjafar H, Tabrizi A, Homayouni A. The Effects of Probiotics and Prebiotics on Mental Disorders: A Review on Depression, Anxiety, Alzheimer, and Autism Spectrum Disorders. Curr Pharm Biotechnol. 2020;21(7):555-565.
Bharwani A, Mian MF, Foster JA, Surette MG, Bienenstock J, Forsythe P. Structural & functional consequences of chronic psychosocial stress on the microbiome & host. Psychoneuroendocrinology. 2016 Jan;63:217-27.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.

谷禾健康

色氨酸(Tryptophan,简称 Try)是人体必需氨基酸,也是唯一含有吲哚结构的氨基酸,由食物尤其膳食蛋白质提供,是正常细胞稳态所必需的,是维持细胞生长和协调机体对环境和饮食线索的反应(其中色氨酸代谢物充当神经递质和信号分子)。
不同组织内的色氨酸代谢与许多生理功能有关:
在哺乳动物中,色氨酸是代谢物的生化前体,显著影响哺乳动物的生理机能,包括胃肠道功能、免疫力、新陈代谢和神经系统。色氨酸及其代谢物水平的失衡与广泛的人类病理学相关,包括抑郁症、精神分裂症、自身免疫、神经退化和癌症。同时它也是自身免疫、癌症、神经退行性或肠道疾病的一个非常有吸引力的治疗靶点。
本文将总结和讨论色氨酸及色氨酸代谢的生理和病理学作用,肠道中色氨酸代谢物的产生和调控、肠道菌群衍生的色氨酸代谢物在全身健康稳态中的作用、以及基于色氨酸代谢药物开发的巨大机遇和挑战。
/
/
▼
色氨酸是一种必需氨基酸,是体内许多重要分子的前体。
如果您读过我们很多文章,可能读到比较多是短链脂肪酸。短链脂肪酸(SCFA),尤其是丁酸盐,通常会在肠道菌群失调和慢性疾病的状态下耗尽。
但短链脂肪酸只是肠道代谢物的一大类之一。其他两类——色氨酸代谢物和胆汁酸,在维持肠道健康方面发挥着同样重要的作用。所以我们也将逐步关注和分享它们。
● 什么是色氨酸?
色氨酸是一种氨基酸——我们体内蛋白质的众多组成部分之一。
色氨酸是一种必需的芳香族氨基酸,由连接到吲哚基团 3 位的 β 碳组成。在 20 种常见的经典氨基酸中,色氨酸的分子量最大。
虽然色氨酸是蛋白质和细胞中含量最少的氨基酸,但它是大量微生物的生物合成前体和宿主代谢物。
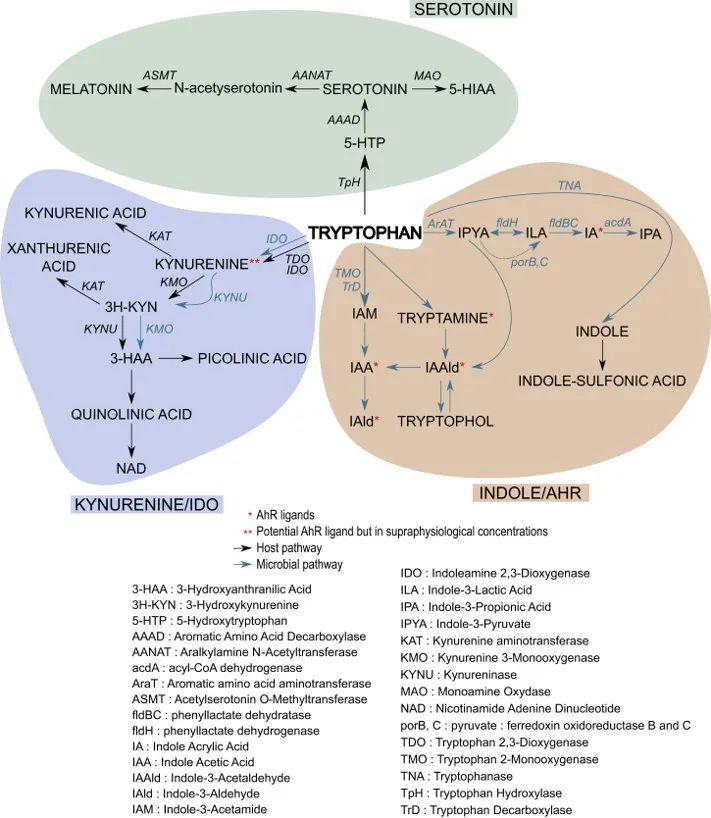
大多数游离色氨酸通过犬尿氨酸 (Kyn) 途径 (KP) 或血清素途径降解为具有生物活性的化合物。
色氨酸分解代谢途径
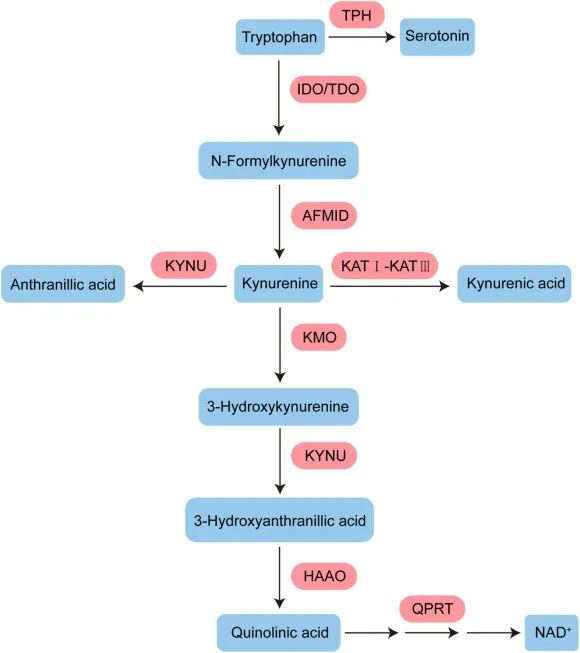
血清素途径产生血清素,可进一步转化为 N-乙酰血清素 (NAS) 和褪黑激素,后者对于昼夜节律调节和抗衰老至关重要。
肠道菌群对色氨酸的吸收很重要,限制和调节宿主细胞的使用。在此过程中生成吲哚衍生物,扩大了色氨酸分解代谢在不同组织器官中中的通讯作用。
色氨酸是体内许多其他化合物的重要前体,包括:
● 色氨酸 / 起源与生产
色氨酸是人体无法产生的必需氨基酸,必须通过饮食获取,主要来自动物或植物性蛋白质来源。
起源:酪蛋白分离
色氨酸是在 1900 年代初期从酪蛋白(一种在牛奶中发现的蛋白质)中分离出来后被发现的。几年后确定了它的分子结构。
释放:进入血液循环
小肠中膳食蛋白质的消化导致色氨酸的释放,色氨酸可以通过肠上皮细胞吸收并进入血液。色氨酸在血液中循环,主要与白蛋白结合,而在血液循环中只有 10-20% 的色氨酸是游离态。被吸收的色氨酸以其游离形式循环或与外周血流中的白蛋白结合。
据报道,健康献血者的总色氨酸平均血清水平为 73 ± 14.9 μmol/l 。
游离色氨酸的一个重要生理功能是对宿主蛋白质合成的贡献。
除了作为蛋白质合成的成分外,色氨酸还是生产多种重要生物活性物质的必需底物。例如,色氨酸是血清素合成(情绪相关)以及褪黑激素(睡眠相关)合成的底物。
全身和细胞色氨酸水平由食物摄入量、生物转化以及降解色氨酸的途径酶活性共同决定。
● 色氨酸的常见天然食物来源
乳制品、燕麦、香蕉、豆类、黑芝麻、李子干、金枪鱼、奶酪、面包、家禽、花生、黑巧克力、鱼肉、三文鱼、杏仁、南瓜和南瓜子等。
世界卫生组织将推荐的色氨酸摄入量设定为 4 毫克/千克/天,迄今为止,没有关于饮食中色氨酸过量的不良影响的报道。
注:含有色氨酸的食物对于制造激素血清素至关重要。但不应高估其影响。
一般来说,动物蛋白中的色氨酸含量往往高于植物蛋白。虽然色氨酸可以补充形式服用,但最好将其作为全食物中完整蛋白质的一部分。
● 为什么需要色氨酸?
色氨酸在体内的浓度是所有氨基酸中最低的,然而,色氨酸摄入量低与抑郁、焦虑、情绪低落、睡眠质量差、视觉认知能力下降以及学习和记忆受损有关。它还可能改变肠道微生物组并削弱肠道免疫力。
另一方面人们普遍认为色氨酸过量会导致困倦。比如在美国的感恩节食用大量火鸡,火鸡中的色氨酸含量很高,进食大餐会刺激胰岛素的产生,而胰岛素会清除血液中除色氨酸以外的所有氨基酸,会导致困倦。
/
/
▼
大量的数据表明色氨酸代谢的调节对环境条件很敏感,并且会影响生理和行为过程。
它因物种、细胞类型、诱导剂而异,并且可以通过组织之间的相互作用进行调节。
● 宿主色氨酸代谢
这里我们对色氨酸代谢先有个整体的认识:
色氨酸分解代谢主要两条通路:
▸犬尿氨酸通路占整体色氨酸降解的约95%
色氨酸 (TRP) 通过犬尿氨酸 (KYN) 通路 (KP) 的分解代谢,该通路占整体色氨酸降解的约 95%,形成主要最终产物 NAD+。
注:犬尿氨酸通路是炎症和免疫反应的重要参与者。
首先,色氨酸被转化为N-甲酰基-L-犬尿氨酸
该反应由三种限速酶之一催化:
注:这三种酶都是血红蛋白,并使用分子 O2作为共底物,这也使它们能够利用活性氧 (ROS) 并调节细胞内的氧化还原平衡。
IDO 和 TDO 酶在不同的组织中表达,暴露于不同的刺激物时被诱导,表明它们在健康和疾病中具有不同的功能。
TDO 在基础条件下催化色氨酸分解,而在免疫调节中具有关键作用的 IDO-1 受到多种刺激物的诱导和调节,例如炎症信号 。
进一步的,N-甲酰基-犬尿氨酸形式酰胺酶将 N-甲酰基-L-犬尿氨酸水解为 L-犬尿氨酸
成为三种具有不同氧化应激和器官毒性特性的替代代谢物:
最终在3-羟基邻氨基苯甲酸3,4-双加氧酶(3-HAAO)的催化下,进一步分解为喹啉酸、烟酰胺腺嘌呤二核苷酸(NAD+).
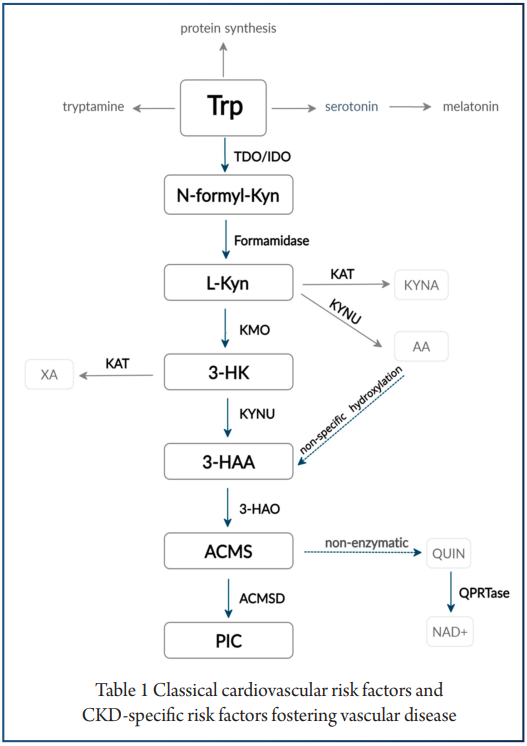
肝外色氨酸犬尿氨酸通路不提供所有必需的酶;因此,其中间代谢物及其特性在这些病症的发病机制和调节中变得至关重要(下图)。
注:在生理条件下,肝外通路仅占整体色氨酸降解的 5-10%.
编辑
B 族维生素作为辅因子起着至关重要作用
KP 对B族维生素浓度的变化很敏感。维生素 B6(5′-磷酸吡哆醛,PLP)的活性形式影响犬尿氨酸酶 (KYNU) 和犬尿氨酸氨基转移酶 (KAT)。
维生素B6缺乏后,会影响色氨酸代谢。
▸ 大约不到5%的色氨酸会转化为5-羟色胺
通过色氨酸羟化酶(TPH)催化生成5-羟色胺(5-HT),也就是血清素。
doi.org/10.3389/fendo.2019.00158
以上是色氨酸代谢的两种主要途径。感染、压力和肠道菌群的变化都可以将色氨酸代谢从 5-HT的产生分流到犬尿氨酸途径,因此如抑郁症之类的病理变化,与人类的营养因素、压力和免疫功能有关。
简化的人类色氨酸的主要代谢途径
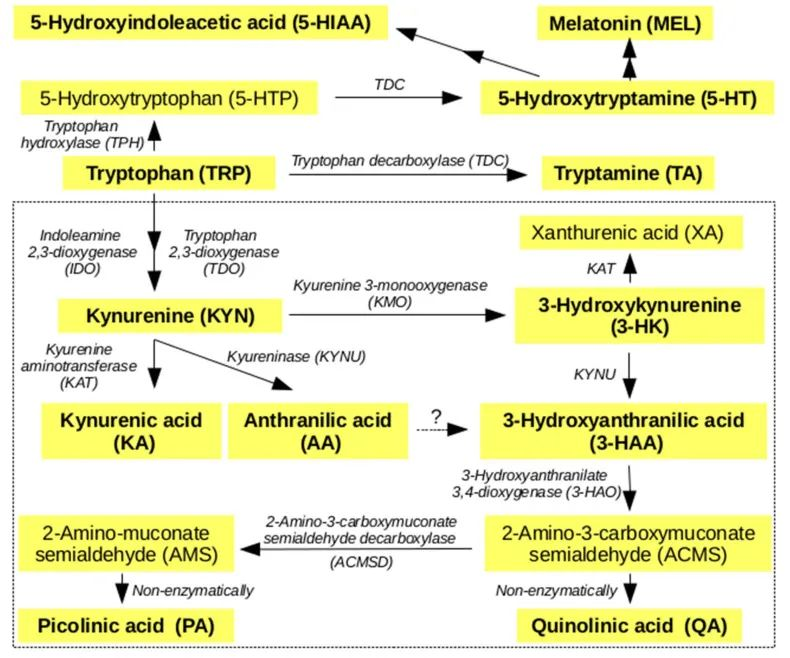
doi: 10.3390/metabo10050208.
● 色氨酸微生物代谢
肠道微生物将未吸收的 L-色氨酸 代谢成几个分子,如吲哚衍生物 [indole-3-aldehyde (IAld)、indole-3-acetic acid (IAA)、indole-3-propionic acid (IPA)、indole-3-acetaldehyde (IAAld)、吲哚-3-乳酸 (ILA) 和吲哚丙烯酸],还有色胺和粪臭素。
最近表明,其中一些分子不仅由微生物群合成,而且还通过 L-氨基酸氧化酶 (IL-4I1) 的作用由肿瘤细胞合成,代谢 L -色氨酸 转化为吲哚-3-丙酮酸,随后转化为 IAA、IAld 和 ILA,从而以 AhR 依赖性方式逃避免疫系统、存活和肿瘤运动。
AhR 信号是免疫反应屏障位点的重要组成部分。它通过作用于上皮更新、屏障完整性和许多免疫细胞类型(如上皮内淋巴细胞、T 辅助 (Th)17 细胞、先天性淋巴样细胞、巨噬细胞树突状细胞和中。
肠道环境的细菌色氨酸代谢
由于不同的微生物拥有不同的催化酶,需要两种以上的细菌相互合作才能从色氨酸中产生一种代谢物。与动物内源性色氨酸代谢相对简单的背景不同,人类肠道环境在细菌色氨酸代谢方面相对复杂。
肠道菌群通过各种代谢途径产生多种色氨酸代谢产物,例如:
肠道中微生物群相关的色氨酸代谢
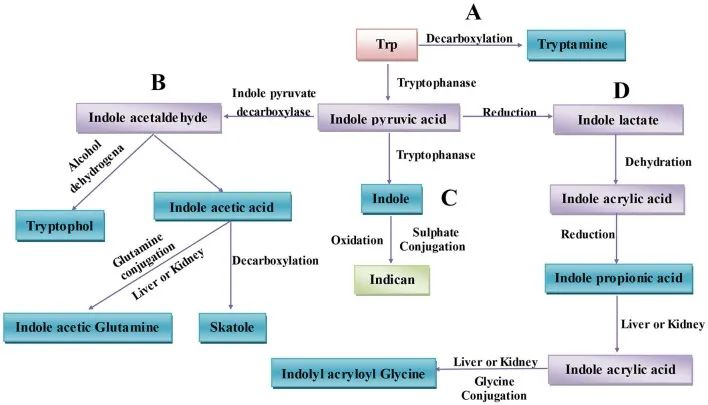
不同菌种可能存在相同代谢能力
比如:消化链球菌属的相同代谢功能可能是基于这些菌种拥有苯乳酸脱水酶基因簇,在下列菌群中也发现与它们产生IPA能力一致的同源基因簇:
不同菌种之间也存在一定代谢能力差异
比如:几种拟杆菌属和梭菌(Clostridium bartlettii)可以产生ILA和吲哚乙酸(IAA),而双歧杆菌属(Bifidobacterium spp.) 产生ILA 。
通过 5-HT、Kyn 和吲哚/AhR 途径的色氨酸代谢途径
doi.org/10.1016/j.chom.2018.05.003
吲哚也是一种种间信号分子,能够控制细菌生理学的各个方面,例如抗生素抗性、孢子形成和生物膜形成。
在不产生吲哚的细菌中,吲哚及其衍生物显着抑制群体感应并调节毒力因子。然而,这些复杂现象在肠道生态系统中的重要性尚未得到具体解决。
微生物代谢的作用在肠道 AhR 活性中占主导地位。事实上,无菌或失调小鼠的肠道内容物缺乏 AhR 激动剂。只有少数共生物种能够产生 AhR 配体,例如Peptostreptococcus russellii罗氏消化链球菌和乳杆菌属已被表征,许多可能仍有待发现。
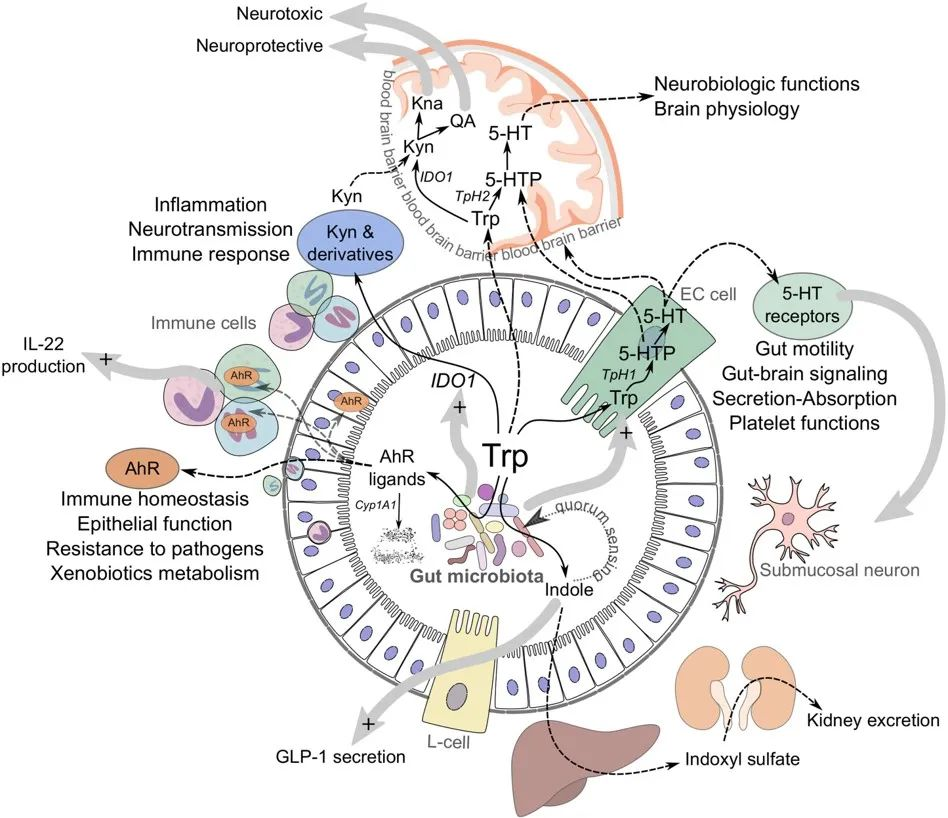
● 肠道色氨酸代谢平衡
虽然大部分色氨酸被小肠吸收,但其中一些会继续进入大肠,在那里它可以被微生物和宿主细胞作用。从上一小节的阐述,我们可以看到色氨酸在肠道内的三个主要归宿:
1) 吲哚/AhR 通路
肠道细菌直接将色氨酸转化为吲哚和相关分子。就像锁和钥匙一样,其中一些吲哚分子与整个肠道和其他器官细胞表面的芳烃受体 (AhR)结合。这会引发广泛的反应,促进肠道稳态。该途径的活性取决于饮食和微生物群的组成。
2) 犬尿氨酸(KP)通路
一些色氨酸被肠道上皮细胞和免疫细胞吸收,在那里它被 IDO1 酶转化为犬尿氨酸。犬尿氨酸可以进一步代谢为其他分子,例如具有神经毒性作用的喹啉酸。应激、炎症或感染会增加该通路的活性。
3) 血清素途径
色氨酸也被吸收到肠道肠内分泌细胞中,然后通过酶 TpH1转化为神经递质血清素。肠道中的血清素调节肠道运动、分泌和吸收,并在肠-脑信号传导中发挥作用。该通路的活性受禁食、饮食、肠道感染和某些微生物的影响。
当然,关键是平衡。在健康的肠道中,这三种途径是平衡的,从而产生最佳的肠道屏障功能、动力、免疫力和神经功能。
宿主生理学中肠道菌群控制下的综合色氨酸代谢
doi.org/10.1016/j.chom.2018.05.003
▼
在慢性疾病中,上述三种途径的平衡似乎出现了偏差,导致肠道功能受损和系统性影响。
/
/
▼
色氨酸及其代谢物水平的失衡与广泛的人类病理学相关,包括肠道疾病、抑郁症、精神分裂症、自身免疫、神经退化、癌症、心血管疾病、过敏、代谢综合征、肥胖、衰老等。
本章节我们对这些疾病中的色氨酸代谢先做个大致了解,后面章节会对各类疾病一一展开阐述。
由于许多 KP 代谢物具有神经活性,因此通常由炎症损伤引起的 KP 酶功能障碍可引发或促进中枢神经系统 (CNS) 疾病。
对于中枢神经系统疾病,人们越来越关注通过靶向特定 KP 酶来纠正 KP 代谢物变阻器的变化以实现净神经保护作用,以及色氨酸及其代谢物在调节肠道微生物组和大脑之间的相互作用中的作用。
肠道微生物组对膳食色氨酸吸收和代谢的影响也越来越受到关注,并且与中枢神经系统疾病以及肠易激综合征、胰腺炎和糖尿病具有潜在相关性。
降低维生素 B2 浓度会导致依赖于黄素腺嘌呤二核苷酸的犬尿氨酸 3-单加氧酶 (KMO) 的活性降低。B 族维生素,包括核黄素 (RBF) 和吡哆醇 ,在预防中风和中风后恢复中发挥作用。据报道,异常 KP 与神经系统疾病、癌症、心血管疾病和中风有关。
色氨酸分解代谢——涉及的关键器官
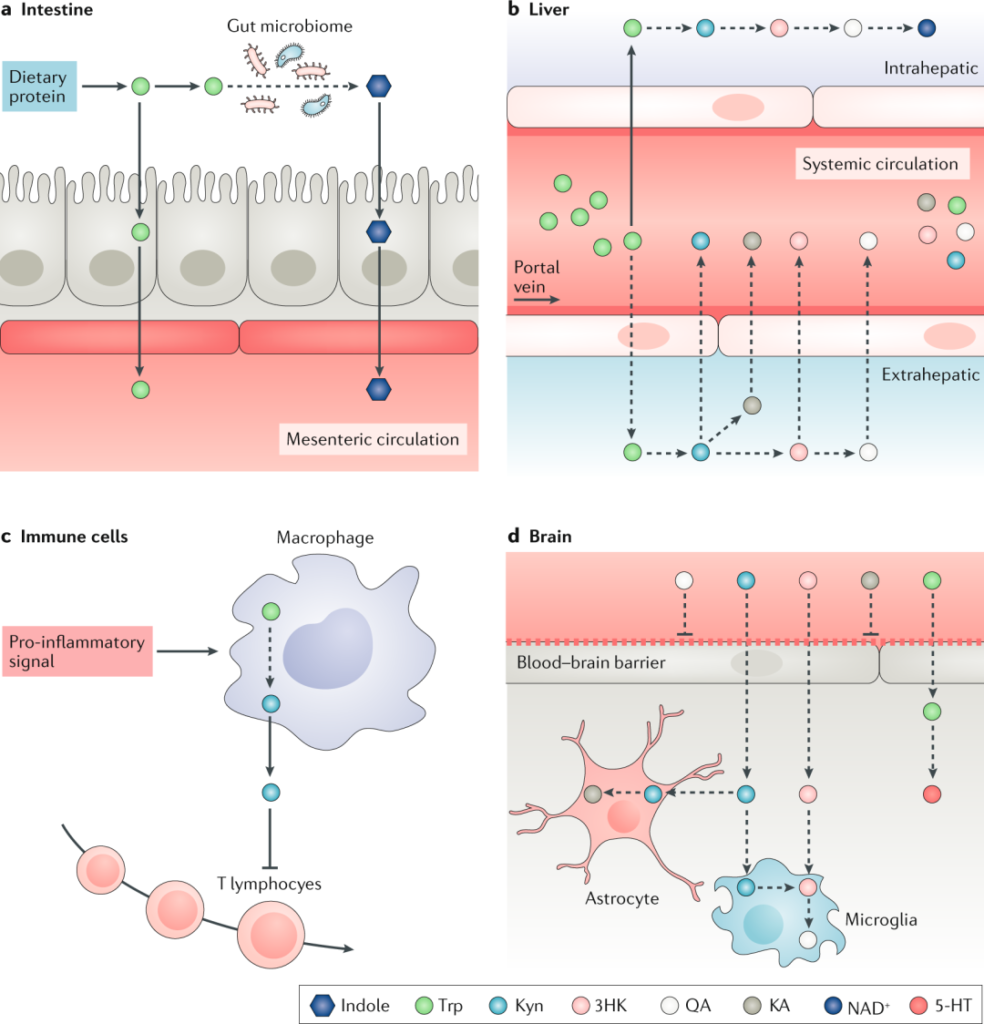
doi.org/10.1038/s41573-019-0016-5
a | 摄入膳食蛋白质后,肠上皮细胞将L-色氨酸转运穿过顶膜进入间质和肠系膜循环。或者,肠道微生物群合成色氨酸并将其代谢为吲哚并将其释放到体循环中。
b | 然后色氨进入肝脏,其中大部分被氧化为乙酰乙酰辅酶 A 并用于合成 NAD+。沿着犬尿氨酸 (Kyn) 途径 (KP) 代谢色氨酸 的肝外器官,包括肾脏、脾脏和免疫细胞,对 Kyn 和 KP 代谢物的循环水平贡献最大。
c | 在促炎性刺激后由骨髓细胞释放的 KP 代谢物抑制 T 细胞反应。
d | 色氨酸、Kyn 和 3-羟基犬尿氨酸 (3HK) 被转运穿过血脑屏障并被星形胶质细胞、小胶质细胞和神经元吸收。星形胶质细胞主要产生具有神经保护作用的犬尿酸 (KA),而小胶质细胞产生具有神经毒性的 KP 代谢物,例如喹啉酸 (QA)。
大约 5% 的色氨酸被代谢为血清素 (5-HT)、5-羟基吲哚乙酸 (5-HIAA)、褪黑激素 (MEL) 和色胺 (TA)。最近研究表明,5-HT除了在神经传递、血管收缩或血管舒张、止血控制和血小板功能中的作用外,还参与调节人体的能量平衡、食欲、肠道蠕动、免疫力、肝脏修复以及心血管和肺部生理学。
疾病中色氨酸代谢的扰动
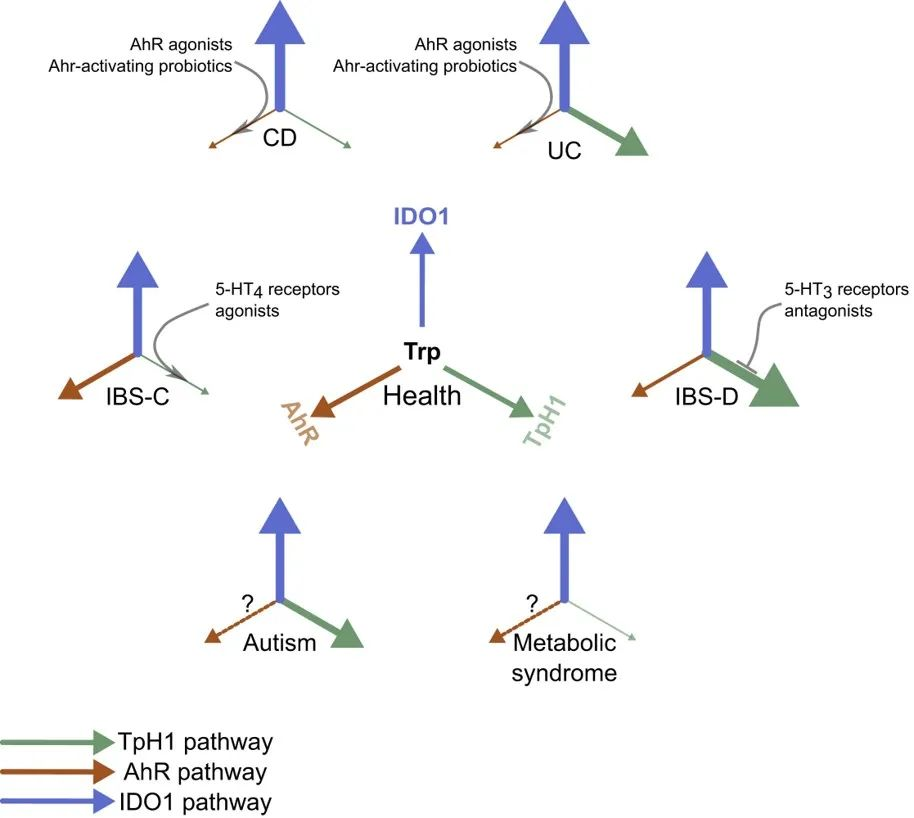
doi.org/10.1016/j.chom.2018.05.003
使用免疫组织化学监测 KP 代谢物的抗体的最新发展使得能够确定组织中 KP 代谢物的积累。
这些工具表明,犬尿氨酸通路在 IDO1 阳性癌症中积累,兴奋性毒性代谢物喹啉酸在脑肿瘤和神经退行性疾病的神经元中积累,而黄嘌呤酸 (XA) 是谷氨酸能突触传递的调节剂,定位于躯体和健康大脑中神经元的树突。
色氨酸代谢物与一系列疾病的联系导致人们在治疗上调节 KP 方面付出了巨大努力,特别是通过抑制所涉及的关键酶,包括 IDO1、TDO 和 KMO。
在癌症中,IDO1 和 TDO 的异常激活导致抗肿瘤免疫抑制。近年来 IDO1 抑制剂在癌症免疫治疗中得到了深入研究。
临床试验中有多种化合物,通常与免疫检查点抑制剂等其他药物联合使用。人们普遍预计领先的 IDO1 抑制剂将接近监管批准,但最近的 III 期试验终止引发了对该方法可行性的质疑,并强调需要更深入地了解 KP。
/
/
▼
● 神经退行性疾病中的色氨酸代谢
色氨酸代谢与多种神经退行性疾病有关,包括亨廷顿病 (HD)、阿尔茨海默病(AD)、肌萎缩侧索硬化 (ALS) 和帕金森病 (PD)。
尽管病理生理触发因素各不相同,但所有这些疾病的共同点是容易聚集的蛋白质引起神经元退化,从而导致细胞应激和有害的先天免疫反应。
基于人群的研究表明,就这些病理学特征而言,衰老和神经退行性疾病之间存在相当大的重叠,个体间差异很大。
虽然遗传和环境对色氨酸代谢的影响尚不完全清楚,但据信色氨酸代谢会导致衰老和神经退行性变,并且所涉及的机制即使不完全相同。这一观察得到了小鼠研究的支持,其中 TDO 的缺失已被证明会导致海马体和脑室下区的神经发生增强,可能抵消神经变性。
尽管生物标志物研究表明色氨酸代谢在神经退行性疾病患者中的活性不同,目前尚不清楚这是原发性倾向的结果还是神经变性或附带的先天免疫激活的结果。流行病学研究表明,KP 的激活与痴呆症风险增加有关。
然而,很难与生理老化明确区分。KP 对感染性和炎症性损伤的敏感性明显损害了其作为神经变性标志物的稳健性。另一方面,炎症对 KP 的激活可能在多发性硬化症等疾病中的神经炎症和神经变性之间建立联系。
由色氨酸代谢介导的神经变性的潜在机制包括:
➤ 阿尔茨海默氏病
色氨酸代谢物、肠道微生物和相关的神经炎症变化对阿尔茨海默病的病理生理学有显着影响。
阿尔茨海默患者的肠道微生物分类有显着差异,厚壁菌门和放线菌门减少,拟杆菌门增加。CSF 生物标志物升高与某些属的丰度相关,尤其是拟杆菌属和Blautia。
一项研究中,发现阿尔茨海默患者的循环色氨酸显著减少,犬尿氨酸/色氨酸比率升高,这反过来又与认知能力较差和促炎细胞因子升高相关。
几项临床前研究表明,在阿尔茨海默动物模型中具有保护作用。色氨酸代谢产物以芳基烃受体依赖的方式调节小胶质细胞和星形胶质细胞的活化。
此外,延缓阿尔茨海默进展的药物治疗的研究表明,肠道微生物和色氨酸代谢产物在阿尔茨海默的发展中可能发挥作用。
研究人员提供了犬尿氨酸代谢物在阿尔茨海默中的潜在毒性作用的间接证据,因为持续向小鼠腔内灌注犬尿氨酸会导致小鼠后代的学习和记忆缺陷。
吲哚途径代谢产物也可能介导阿尔茨海默病的发病。吲哚途径代谢物IPA在体外可抑制淀粉样蛋白-β诱导的神经毒性,并已被开发为治疗阿尔茨海默的神经保护剂。
➤ 帕金森病
帕金森病是一种进行性神经退行性疾病,其中α-突触核蛋白的聚集导致黑质神经毒性,导致多巴胺能神经传递不足。
大量数据表明肠道微生物组通过诱导炎性神经毒性参与帕金森发病机制。这些患者肠道拟杆菌属的丰度与运动症状严重程度和促炎性TNFα和IFNγ水平相关。尤其是疣微菌门(Verrucomicrobia)与循环中较高水平的IFNγ相关,说明了与IDO和色氨酸代谢产物的可能相互作用。
最近的研究还表明,帕金森病患者的色氨酸代谢紊乱,是潜在的治疗目标。帕金森患者血浆中3-HK显著升高,3-HANA降低。在这些患者中,犬尿酸显著降低,喹啉酸水平与疾病严重程度相关,表明色氨酸代谢产物在加重兴奋性毒性损伤中的潜在致病作用,尽管因果作用仍有待确定。
帕金森患者脑脊液和血浆中的犬尿氨酸/色氨酸比率升高,犬尿氨酸转氨酶活性降低。因此,犬尿酸合成类似物已成为治疗帕金森、亨廷顿病和阿尔茨海默病的神经保护药物。
➤ 其他神经退行性疾病
已知 NMDA 受体过度激活和随之而来的神经元兴奋性毒性在几种神经退行性疾病的发病机制中发挥作用。
——肌萎缩侧索硬化症
犬尿酸可能作为一种内源性神经保护剂发挥其拮抗 NMDA 受体过度激活的作用。临床数据表明了潜在的作用。晚期和延髓起病的肌萎缩侧索硬化症患者的 CSF 中 KA 水平显着升高。
——亨廷顿病
在亨廷顿病患者中,产生自由基的 3-HK 在早发性疾病中高度升高,同时纹状体和皮质喹啉酸也升高。然而,对于更晚期的疾病,这些浓度会降低。
虽然亨廷顿病患者的 CSF 中犬尿酸水平升高,对亨廷顿病大脑的尸检分析显示,与对照组相比,犬尿酸浓度降低,血清犬尿氨酸/色氨酸 比率升高。有趣的是,谷氨酰胺重复次数和疾病严重程度与循环色氨酸水平呈负相关。
亨廷顿病大鼠模型表明 3-HK 增强了神经兴奋性毒性,而自由基清除剂抑制了这种作用。
犬尿酸的合成类似物在原位产生神经保护和抗癫痫作用。鉴于IPA的抗氧化作用,研究人员还提出使用这种吲哚衍生物对亨廷顿病患者进行神经保护。
➤ 多发性硬化症
多发性硬化症是一种慢性、进行性和复发性中枢神经系统炎性脱髓鞘疾病。许多证据表明,这主要是由B和T细胞驱动的过程。最近,许多靶向B细胞和T细胞活化的药物被证明在预防复发方面具有临床疗效。
多发性硬化患者肠道菌群变化
多发性硬化患者粪便样本的微生物组分析显示,与对照组相比,多发性硬化患者中的Methanobrevibacter和Akkermansia增加,Butyricimonas 减少。
肠道微生物代谢产物参与多发性硬化发病
色氨酸代谢产物和I型IFN信号已显示在多发性硬化的实验性变态反应性脑脊髓炎(EAE)模型中激活星形胶质细胞AHR,从而抑制中枢神经系统炎症。
评估这种疾病中的犬尿氨酸途径的研究取得了有趣的结果。复发患者犬尿酸水平升高,而尸检样本显示犬尿氨酸转氨酶活性降低。
此外,喹啉酸可能诱导少突胶质细胞凋亡,导致脱髓鞘损伤。在其他EAE模型中,数据显示了有毒的犬尿氨酸代谢产物的集中聚集。
在这些模型中,肠道微生物也会影响中枢免疫,因为继发于微生物变化的免疫过度激活会加剧炎症损伤。
● 神经精神疾病中的色氨酸代谢
KP 的不平衡导致具有特定神经活性特性的代谢物过多,被认为是导致多种神经精神疾病的原因。
➤ 焦虑和抑郁
色氨酸代谢产物,尤其是血清素,与焦虑和抑郁的发病机制密切相关。
促进中枢5-羟色胺可用性的药物,特别是选择性5-羟色胺再摄取抑制剂(SSRIs)、MAO抑制剂(MAOIs)和三环类抗抑郁药(TCAs)已经彻底改变了这些疾病的治疗。
重度抑郁症、自杀倾向与喹啉酸水平升高相关
例如,重度抑郁症与 KP 的 3-羟基犬尿氨酸 (3HK) 分支下的新陈代谢增加有因果关系,导致大脑神经毒性喹啉酸水平高于神经保护性 KA。
同样,与 KA 和吡啶甲酸相比,喹啉酸水平升高也与自杀倾向相关。社会心理压力、感染或细胞因子治疗引起的免疫激活会导致抑郁症状。
系统性 IDO1 激活与抑郁症中 3HK 分支的激活有关
小鼠中的 IDO1 抑制或敲除可减轻抑郁样行为,细胞因子诱导的抑郁症易感性与 IDO1 基因的多态性有关。因此,系统性 IDO1 激活被认为与抑郁症中 3HK 分支的激活有关,但目前尚不清楚为什么 KA 和喹啉酸在对 IDO1 诱导的反应中没有同样上调。
随着对不同疾病过程中肠道微生物组组成的理解的增加,很明显,肠道微生物可能在这些疾病的起源和临床表型中发挥关键作用。
无菌小鼠表现出比常规饲养小鼠更焦虑的行为,这种行为在宿主断奶后不易随着微生物的重新繁殖而逆转,这表明肠道微生物组可能支持心理发育的关键时期。
一些益生菌在动物模型和人类中显示出减少焦虑和抑郁的功效。
补充色氨酸减少焦虑?仍然存在争议
瑞士乳杆菌R0052和长双歧杆菌R0175等物种的益生菌分别降低了小鼠和人类的焦虑、增强了情绪幸福感和抑郁症状。
患有抑郁症患者粪便微生物移植的小鼠表现出更严重的焦虑,这与更高的循环犬尿氨酸和犬尿氨酸/色氨酸比率有关。
有趣的是,已知慢性应激会增加循环色氨酸和皮质醇,由于糖皮质激素诱导的TDO表达增强,导致5-羟色胺代谢向犬尿氨酸及其代谢产物分流。
小鼠应激诱导的结果表明,外源性丁酸盐调节应激诱导的抑郁行为,降低海马血清素,增加海马脑源性神经营养因子(BDNF)。
肠道微生物群被抗生素耗尽的小鼠表现出类似焦虑的行为,循环的犬尿氨酸升高。在喂食高脂肪饮食的肥胖大鼠中,花青素可以防止神经炎症,并且循环色氨酸降低,犬尿酸增加。
➤ 精神分裂症
色氨酸向血清素的转换可能在精神分裂症的发病机制中受损,因为某些TPH1多态性增加了对精神分裂症和自杀的易感性。
精神分裂症患者 KA 的水平升高,与认知缺陷相关
精神分裂症和精神病似乎是由 NMDA 受体拮抗剂 KA 的形成增加引起的。在精神分裂症患者的死后大脑和脑脊髓液中测量到 KA 水平升高。KA 水平升高与在精神分裂症中观察到的认知缺陷相关、而KA 形成减少与认知功能改善相关。
同样,特别是在发育中的大脑中的神经炎症与精神分裂症的认知缺陷特征有关。KMO中的单核苷酸多态性基因与精神分裂症和双相情感障碍相关,这表明 KP 3HK分支下的流量减少可能使 Kyn 转向 KA 形成,KA 的积累与这些疾病有关。
脑脊液中低5-HIAA水平与自杀和攻击行为相关
由于精神分裂症患者皮质犬尿酸水平升高,犬尿氨酸代谢产物也可能起到致病作用。动物模型研究表明,色氨酸抑制攻击性行为,可能与增加中枢血清素的可用性有关。
小胶质细胞突触修剪过度激活
Sekar及其同事发表了一项具有里程碑意义的全基因组关联研究,该研究确定了与精神分裂症发病机制有关的基因位点,这涉及补体C4介导的小胶质细胞突触修剪过度激活。
肠道失调与免疫失调联系起来
鉴于肠道微生物组在介导中枢免疫中的既定作用,以及病例对照研究在精神分裂症患者中的优势,研究人员试图将肠道失调与免疫失调联系起来,导致大脑发育关键时期突触修剪过度活跃。
流行病学研究也支持这样的假设,即全身感染诱导的母体免疫激活是后代患精神分裂症的独立危险因素。
最近的一项研究表明,产前免疫暴露导致额叶皮质C4活性上调。母体微生物组向后代的垂直转移也可能导致持续的免疫功能障碍,增加突触过度修剪的风险。
需要进一步的机制研究来了解肠道微生物、色氨酸代谢产物和宿主免疫在精神分裂症和其他神经发育障碍发病机制中的相互作用。
➤ 自闭症
根据循环色氨酸的临床研究和排泄的犬尿氨酸代谢产物的检查,自闭症谱系障碍患者可能缺乏色氨酸。
自闭症患者来源的淋巴母细胞的代谢组学分析显示,当色氨酸是唯一可用的能量来源时,NADH生成减少,表明这些患者的喹啉酸降解途径可能受损。
某些微生物物种可能参与了自闭症的发病机制
几项评估自闭症患者肠道微生物丰度差异的研究将自闭症症状与Prevotella、Coprococcus、Veillonellaceae丰度较低联系起来。
脆弱拟杆菌(一种胰蛋白酶合成细菌),可能会降低自闭症患者的色氨酸可用性。非色氨酸衍生的微生物代谢产物也可能起到因果作用,一项观察自闭症小鼠母体免疫激活(MIA)模型中肠道微生物代谢产物的研究显示,微生物代谢产物4-乙基苯基硫酸盐增加了46倍,如果小鼠被脆弱拟杆菌定殖,则其正常化。
色氨酸代谢在肠道菌群-脑轴中的潜在作用
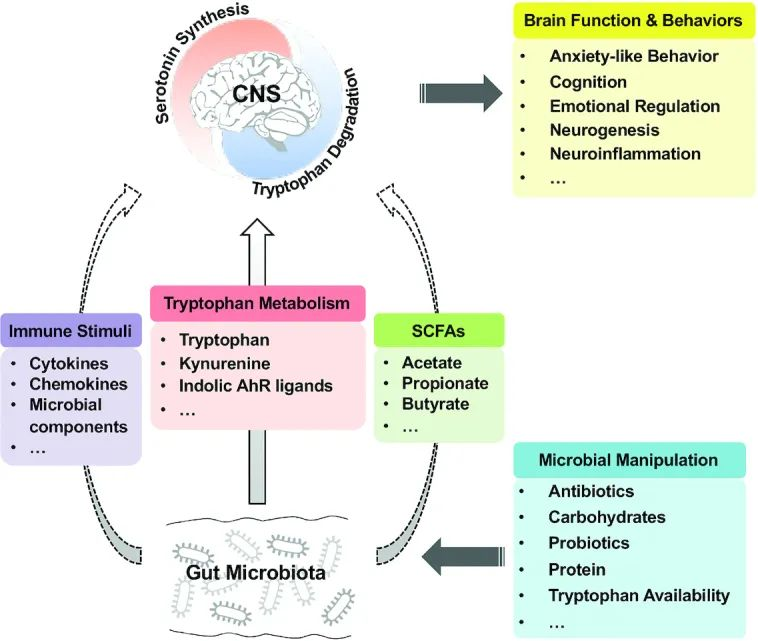
doi: 10.1093/advances/nmz127
通过各种方式(例如,抗生素和益生菌)对肠道微生物群组成和代谢的调控有助于在 5-羟色胺合成和色氨酸降解途径之间改变中枢色氨酸代谢,从而影响大脑功能和行为。
● 中枢神经系统疾病中靶向 KP 酶
尽管临床试验的重点(部分仍然是)补充或剥夺色氨酸或其代谢物以治疗神经精神疾病,但目前神经退行性和神经精神疾病药物开发的临床前工作主要集中在通过改变神经活性 KP 代谢物的变阻器抑制参与 喹啉酸或 KA 形成的酶。
从概念上讲,所有 KP 酶都代表潜在的治疗靶点,并且有几项研究调查了药理学抑制的影响。
例如,IDO1 抑制剂黄连碱已被证明可以减缓阿尔茨海默小鼠模型的认知障碍,尽管其对 IDO1 的特异性尚不清楚。
有趣的是,环氧合酶抑制通过抑制海马 TDO 表达,来防止类似阿尔茨海默模型中的行为下降。当使用 TDO 的药理学抑制剂时,观察到类似的神经保护作用。这些研究连同阿尔茨海默病和亨廷顿病患者中 KP 激活的证据, 表明抑制色氨酸降解中限速的第一个酶促步骤是一种潜在可行的治疗方法,可以抵消由淀粉样蛋白形成蛋白的积累引起的神经毒性。
尽管 IDO1 和 TDO 的抑制剂阻止了 KP 代谢物的产生,但这不会直接影响 KA/喹啉酸 喹啉酸变阻器,但会阻止两者的产生。这种治疗方法是可行的,因为它可以防止色氨酸的消耗,这可以减少在临床前模型中观察到的蛋白质毒性。
KAT 在辅助因子 pyridoxal-5-phosphate (PLP) 的帮助下催化 Kyn 转化为 KA。KATII 是哺乳动物大脑中最普遍的 KAT,并且正在寻求作为精神分裂症和认知障碍疾病的药物靶点。由于最近显示 KATII 也能催化 3HK 105形成 XA ,因此之前归因于 KA 的基于抑制 KATII 的效应也可能涉及 XA。
▸ KATII 抑制剂
KATII 的可逆抑制剂已经开发出来,包括 Kyn 类似物 (S)-4-(ethylsulfonyl)benzoylalalanine ( S -ESBA) ,它被证明可以降低大鼠大脑中的 KA 水平。
高效和选择性脑渗透不可逆抑制剂 PF-04859989 也报道了相同的抑制模式。然而,这些化合物都没有进入临床研究,这可能是由于它们与 KAT 同工酶和所有其他 PLP 依赖性酶所需的 PLP 辅因子发生不可逆相互作用而引起的毒性。
将 KATII 抑制剂推进临床试验的主要挑战包括由脑 KA 水平降低引起的潜在毒性、获得足够的效力和选择性以及 KATII 抑制剂效力的种间差异的发生。
▸ KMO 抑制剂
为了抑制 KP 的 喹啉酸分支和增加拮抗 KA 水平,KMO 抑制剂正在积极开发中。有关 KMO 晶体结构的信息有助于生成特异性更高的 KMO 抑制剂。众所周知的 KMO 抑制剂 Ro 61-8048已用于大量临床前研究,证明其作用范围从改善神经变性到减少大麻素滥用。
另一种广泛使用的工具化合物,UPF-648, 是一种不含氨基的 Kyn 类似物,在构象上受到环丙基环的限制。这种化合物,以及高效的恶唑烷酮 GSK180(在胰腺炎的背景下研究),是所谓的 I 型 KMO 抑制剂,它模仿 Kyn 并刺激有害的过氧化氢产生。
在一项基于结构的药物化学合作研究中,开发并评估了一种新的芳基嘧啶先导化合物 CHDI-340246,用于治疗 HD。然而,这种选择性 KMO 抑制剂的长期治疗并未显着改变 HD 小鼠模型的行为表型或自然进展,尽管它恢复了电生理学改变。
结构研究最近破译了 I 型和 II 型KMO抑制剂112、121之间的区别。II 型 KMO 抑制剂 GSK065 和 GSK366 显示出比 I 型 KMO 抑制剂更好的类药特性,因为它们具有皮摩尔亲和力、增加的停留时间和不产生过氧化物。
GSK065以GSK3335065(NCT03245619)的名称进入治疗胰腺炎的I期临床试验。有趣的是,KMO 抑制剂的外周给药足以影响 CNS KP 。然而,KMO 抑制剂是否需要穿透血脑屏障才能发挥作用,这仍然是一个有争议的问题。
最后,抑制初始限速 KP 酶 IDO1 和 TDO,它们分别在炎症条件或慢性社会心理压力下诱导,在神经退行性疾病和精神疾病中也可能值得探索。由于这些酶的抑制剂目前正在开发用于癌症治疗,因此可以使用多种化合物在临床环境中测试这些方法。
/
/
▼
● 感染中的色氨酸代谢
几条证据最近揭示了色氨酸代谢作为宿主-病原体相互作用和塑造宿主微生物群中免疫反应的重要调节因子的关键作用。
通过特定的色氨酸代谢酶,色氨酸代谢在细菌、病毒、真菌和寄生虫感染部位增加。通常以低基础水平表达,在抗原呈递细胞 (APC)中观察到 IDO1 增加,例如树突细胞 (DC) 和巨噬细胞,以响应多种微生物刺激,包括 Toll 样受体 (TLR) 配体(例如,脂多糖 (LPS) , CpG 寡核苷酸和聚肌胞苷酸 。
炎症刺激物诱导IDO1,IDO1 会耗尽色氨酸
此外,据报道,I 型和 II 型干扰素 、肿瘤坏死因子 (TNF)、前列腺素 和膜结合分子 等炎症刺激物可在特定APC类型中诱导IDO1。
在传染病中,IDO1 活性具有多效性,是一把双刃剑。实际上,IDO1 会耗尽色氨酸以饿死和重新编程营养缺陷型入侵者,同时有助于对在急性感染期间未清除的微生物产生 Kyn 依赖性免疫抑制状态或那些已经能够重新激活色氨酸生物合成的。
因此,已经表明色氨酸营养缺陷型病原体对 CD4 + T 细胞激活的巨噬细胞高度敏感。 在特定的环境条件下,色氨酸的微生物营养缺陷型可能会消失。
特定条件微生物重新获得合成必须氨基酸的能力
某些微生物可以在特定的胁迫条件下重新获得合成这种必需氨基酸的能力。此外,天然能够合成色氨酸的微生物群菌株可以在特定感染期间扩大,从而在色氨酸缺乏的条件下提供额外的这种必需氨基酸供应。
最近的研究结果表明,结核分枝杆菌等特定病原体可以在压力条件下重新获得合成色氨酸的能力,从而抵消 IDO1 饥饿驱动的抗菌作用。
此外,衣原体在由局部色氨酸剥夺引起的应激条件下进入非复制的持久状态。同样,IDO1 依赖性持久性已被记录在其他细菌物种中,包括肺炎积瘤。
除了调节病原体负荷外,通过 IDO1 活性进行的色氨酸代谢对于抑制最终阻止病原体根除的免疫病理也至关重要。
在这方面,最近对肠道微生物群的研究发现:
色氨酸代谢与通过充当特定 AHR 配体的微生物或细菌毒力因子在粘膜屏障表达的 AHR 激活之间存在重要联系。
值得注意的是,AHR +由于产生色氨酸代谢物(即吲哚 3 醛)的乳酸杆菌的选择性扩增,即使在 IDO1 缺乏的情况下,也会诱导产生IL-22 的第 3 组先天淋巴样细胞 (ILC3s)能够激活 AHR,从而在真菌感染模型中诱导保护性耐受状态。
TDO 在感染过程中的潜在作用
用 LPS 攻击的小鼠肝脏中 TDO 表达增加,而 TDO 缺陷小鼠更容易受到内毒素攻击。因此,在对弓形虫和金黄色葡萄球菌感染进行的体外研究中,已经报道了 TDO 依赖性抗菌和免疫调节作用。此外,代谢组分析揭示了原发性登革热感染患者 TDO 激活的变化。
因此,在宿主细胞中的三种不同色氨酸分解代谢酶中,IDO1 的影响已在几种临床前感染模型中得到解决。具体而言,据报道,IDO1 在体内抑制某些细胞内寄生虫和细菌的复制,例如弓形虫、衣原体和杜氏利什曼原虫。另一方面,弱 IDO1 抑制剂 1-甲基- L – Trp (L-1-MT) 增强了沙眼衣原体抗生素清除的功效,尽管可能涉及额外的 IDO1 独立机制。
IDO1活性还可以在体外抑制特定病毒的复制
例如人巨细胞病毒 (CMV)、2 型单纯疱疹病毒和痘苗病毒。然而,体内情况可能有所不同,因为病毒感染可能会诱导 IDO1 和 KP 逃避宿主免疫反应。
由于它们具有诱导 Treg细胞的能力 ,因此 IDO1 消耗色氨酸并产生 Kyn 是抑制抗菌 TH17 和 TH1 驱动的炎症的重要手段。
因此,病原体可能会劫持 IDO1 的免疫抑制作用,并利用它们来促进自身的生命周期。在这方面,尿道致病性大肠杆菌(UPEC) 在泌尿道的上皮细胞中诱导 IDO1 ,并且色氨酸分解代谢的免疫反应减弱使得 UPEC 能够成功定植。
HIV-1 等病毒利用 IDO1 的免疫抑制活性建立 HIV 慢性感染
KP 活性的增加也与丙型肝炎病毒感染患者的进行性肝硬化有关。
同样,小鼠感染甲型流感/PR/8/34 (PR8) 会刺激肺部和肺引流纵隔淋巴结中 IDO1 活性的快速升高,导致发病率增加、恢复减慢和肺部效应 T 细胞反应降低,尽管在原发性甲型流感病毒感染期间,IDO1 诱导不会影响病毒清除。在其他情况下,例如在真菌感染中,IDO1 可用作建立共生或慢性感染的逃避机制。
● 在传染病中靶向 KP 酶
在选定的微生物物种中调节特定的色氨酸生物合成途径并靶向宿主细胞中的 IDO1-AHR-微生物群轴可能代表了抗生素开发或补充抗病毒疗法的新颖有吸引力的策略。有必要更全面地了解特定感染期间色氨酸分解代谢酶或下游酶的作用,以便了解旨在调节色氨酸分解代谢以根除病原体同时保持与微生物群平衡的疗法的效用。
基于以上总结的证据,可以假设特定的 IDO1 阻断剂可能会发现潜在的应用作为辅助疗法来提高抗病毒药物的疗效,但可能证明对真菌感染有害,其中色氨酸分解代谢主要通过 IDO1 作用于维持免疫稳态和保护性耐受。
然而,这种作用可能构成使用 IDO1 抑制剂作为抗肿瘤药物的潜在缺点(下面讲)。实际上,在使用 IDO1 通路调节剂 1-甲基-D -Trp (D-1-MT)对转移性实体瘤患者进行的 I 期试验中,感染是最常见的不良事件。
有趣的是,最近的一项研究表明,KYNU 的靶向抑制会影响铜绿假单胞菌基因表达和群体感应,这表明一种新的潜在抗毒策略。具体而言,与 Kyn 具有结构相似性的S-苯基-L-半胱氨酸亚砜可抑制对铜绿假单胞菌毒力至关重要的邻氨基苯甲酸盐的产生。
/
/
▼
● 自身免疫中的色氨酸代谢
自身免疫是未能发展出对自身的中枢(胸腺)耐受性和外周耐受性维持不足的结果。免疫区室中的色氨酸代谢主要由 IDO1 启动,它代表主要促炎刺激的靶基因。
在这方面,IDO1 介导的色氨酸降解可被视为调节过度活跃的免疫反应的关键反馈机制,这是自身免疫性疾病的标志。
IDO1 在发炎组织中转录激活抑制适应性免疫反应的作用已经从最初在胎盘中观察到的维持胎儿耐受性扩展到多种自身免疫性疾病。
尽管 IDO1 缺陷不会导致与 Treg细胞重要检查点缺陷相关的整体自身免疫表型,但它与更微妙的炎症表型相关。这种关联可能部分是由于与其他双加氧酶共享的酶功能冗余。越来越多的证据表明,人类自身免疫性疾病是由免疫和/或基质细胞未能上调 IDO1 以响应炎症刺激驱动的。
然而,与自身免疫相关的上调 IDO 的结构性缺陷的潜在原因尚未阐明。连锁分析将IDO1和IDO2基因的多态性分别与克罗恩病的严重程度和风险相关联。需要进一步的研究来确定上调组织中色氨酸代谢的本构或诱导缺陷是否会导致组织特异性自身免疫。
许多针对多发性硬化症、类风湿性关节炎、狼疮和自身免疫性糖尿病的自身免疫性疾病小鼠模型的研究已经证明色氨酸代谢在调节疾病活动中的相关性。
综上所述,这些研究表明 IDO1 在组织驻留的骨髓细胞中表达,并限制对自身抗原和炎症病理学的先天性和适应性免疫。
然而,自相矛盾的是,在自发性类风湿性关节炎的动物模型中,使用 D/L-1-MT 对 IDO1 的药理学抑制减轻了疾病的严重程度,这可能是自身反应性 B 细胞活化减少的结果。
这一发现说明了 IDO1 在自身免疫中的复杂免疫调节功能,这取决于细胞区室。例如,B 细胞中免疫抑制细胞因子 IL-10 的表达依赖于 IDO1,这表明 IDO1 不仅会触发免疫抑制机制,还会协调对炎症的复杂免疫调节反应。
重要的是,转录激活和蛋白质表达不一定转化为人类 B 细胞中描述的酶活性。 在这方面,需要更多的研究来阐明 IDO1 的非酶功能。
此外,需要谨慎看待使用 D-1-MT 得出关于 IDO1 功能的关键结论的研究,因为 D-1-MT 不会抑制 IDO1 并显示出相当大的脱靶效应,从而导致 p38 MAPK 通路的激活。
对自身免疫性疾病模型的研究表明,与 IDO1 相比,IDO2 充当自身免疫的促进者,特别是由于体液免疫反应的调节。由于致病性自身抗体和抗体分泌细胞的减少,IDO2 缺陷小鼠表现出关节炎症减少。尽管与人类疾病的相关性仍不清楚, 这些研究突出了双加氧酶对色氨酸代谢的复杂和高度分隔的调节。
尽管 IDO1 介导的免疫调节的主要作用被认为是由组织炎症的局部微环境中的活动驱动的,但在患有自身免疫性疾病的患者中观察到色氨酸代谢的全身激活。在干燥综合征患者中,血清中色氨酸的降解增加,并与循环 Treg细胞频率增加有关。
相比之下,在多发性硬化症中,血清中的 IDO1 活性与健康对照相比没有显着差异,但抗炎治疗降低了 IDO1 活性。由于全身性 IDO1 活性会受到大量非特异性和难以控制的刺激的影响,包括感染、压力和营养,尝试通过循环色氨酸代谢物监测组织特异性自身免疫将具有挑战性。然而,对血清中 KP 代谢组的更详细分析不仅揭示了 KP 在多发性硬化症患者中的激活,而且还将 KP 活性的程度与疾病严重程度相关联。因此,KP 活性可以作为能够指导多发性硬化症治疗的预测性生物标志物。
● 靶向自身免疫性疾病中的色氨酸代谢
在治疗上针对色氨酸代谢的努力主要集中在开发具有 Kyn 样特性的药物上。
曲尼司特
曲尼司特是一种具有 AHR 激动特性的 AA 衍生物,能够在多发性硬化症和类风湿性关节炎的临床前模型中诱导免疫耐受和改善疾病活动。然而,一项针对类风湿性关节炎患者的 II 期临床试验(NCT00882024)因肝毒性而终止。
拉喹莫德
拉喹莫德是一种喹啉甲酰胺,在开发治疗多发性硬化症时显示出与 KA 的结构相似性,它以 AHR 依赖性方式抑制多发性硬化症临床前模型中的自身反应性 T 细胞免疫和疾病活动。
在针对复发和进行性多发性硬化症患者的一系列 II/III 期临床试验中,拉喹莫德未达到预先指定的主要终点,包括减少复发率和残疾进展,因此被终止 (NCT01707992)。
AHR 配体改善自身免疫神经炎症
AHR 的特定内源性配体足够稳定,可以在临床前疾病模型中进行肠胃外给药。2-(1’H-indole-3′-carbonyl)-thiazole-4-carboxylic acid methyl ester (ITE) 通过以 AHR 依赖性方式诱导致耐受性 DC,在实验性自身免疫性脑脊髓炎 (EAE) 模型中诱导 Treg细胞并改善自身免疫性神经炎症。
AHR 激活配体也可以与自身抗原偶联,从而导致 APC 的特异性靶向,然后耐受性抑制自身反应性 T 细胞反应,从而抑制系统性自身免疫。
从概念上讲,色氨酸代谢也可以通过全身给药色氨酸来增强,色氨酸在口服灌胃后会迅速代谢成 Kyn。尽管这种方法导致 TH17 免疫力的不同抑制,但这并不转化为实验性自身免疫性神经炎症的改善。
阻断IDO1降解,维持外周耐受性
认识到蛋白酶体降解是调节自身免疫中色氨酸代谢的免疫抑制活性的重要机制后,另一种治疗途径是阻断IDO1降解,从而维持外周耐受性。
硼替佐米是一种批准用于治疗多发性骨髓瘤的蛋白酶体抑制剂,可防止 IDO1 降解并以 IDO1 依赖性方式在临床前动物模型中改善自身免疫性糖尿病。
基于 IDO1 感受态细胞的疗法
尽管间充质干细胞的过继转移已被证明可以独立于IDO抑制自身免疫性神经炎症的临床疾病活动,但 IDO1 已被证明在其他自身免疫性体内疾病模型中与间充质干细胞的免疫抑制特性密切相关。
增强或诱导宿主 IDO 表达的另一种方法是通过局部基因治疗。例如,腺病毒将 IDO1 递送至移植器官可诱导免疫耐受并防止大鼠发生移植排斥反应。
IDO2 直到最近才成为潜在的治疗靶点
迄今为止,还没有对 IDO2 具有足够特异性的小分子。在自身免疫性关节炎的临床前模型中,一种通过内化靶向 IDO2 的抗体通过抑制自身反应性 T 细胞和 B 细胞减轻了疾病。
新开发的 IDO2 特异性测定系统和基于计算结构的研究可能有助于开发对 IDO1 没有交叉反应的 IDO2 抑制剂。
/
/
▼
● 肠 病
最近研究强调了肠道色氨酸代谢的改变与肠道微生物的潜在联系。发现 IBD 患者微生物群产生的 AhR 配体减少,这是受遗传因素的影响。与健康受试者相比, 肠道组织中 AhR 的表达降低。
IBD还与宿主和肠道细菌色氨酸代谢物的改变有关。IBD 患者的犬尿氨酸和 KA 血浆水平升高,血浆色氨酸浓度降低。
几种特定的肠道细菌色氨酸代谢物也参与 IBD 的病理生理学
在患有 IBD 的狗中,被认为在肠道中具有抗炎功能的细菌色氨酸代谢物(吲哚乙酸盐和吲哚丙酸盐)显着减少。在 IBD 患者中,粪便中 IAA(肠道抗炎功能)水平降低,表明细菌色氨酸代谢减少可能是 IBD 的病因。
此外,在 IBD 患者中,可利用 α-L-岩藻糖苷酶从肠粘蛋白中切割末端岩藻糖残基的细菌数量显着减少,这与来自色氨酸的吲哚丙烯酸和吲哚-3-丙酸产量减少有关。
IBD 患者的 IDO1 活性更高
据报道,IBD 患者外周血和结肠细胞中的 IDO1 活性增加。在 IBD 中,增加的促炎细胞因子,包括 IFN-γ、IL-1 和 IL-6,已被建议诱导色氨酸分解代谢途径以降低血浆色氨酸水平,并增加色氨酸分解代谢物水平。
此外,UC 患者血清中的 IPA 降低。在肠道局部观察到 IDO1 的过度激活和免疫系统过渡激活。与非活动性 IBD 患者相比,活动性 IBD 患者的 IDO1 活性更高,并且色氨酸和 C 反应蛋白血清水平呈负相关,这一假设得到了支持,C 反应蛋白是一种常用的生物标志物,对炎症反应增加。
IBD 中 5-HT 通路激活的状态存在争议。限速酶TpH1的表达增加在克罗恩病中已报道。
小鼠研究表明AhR 缺乏会增加实验性结肠炎的严重程度
这种结肠炎是由 T 细胞转移或通过施用葡聚糖硫酸钠 (DSS) 以化学方式驱动的。在这些模型中,AhR 缺陷部分通过改变白细胞介素 (IL)-22 的产生来驱动结肠炎,白细胞介素 (IL)-22 是一种对肠道稳态具有众所周知影响的细胞因子。
缺乏 caspase 募集域 9 (Card9)(一种 IBD 易感基因)的小鼠的肠道菌群失调无法将色氨酸催化成 AhR 配体,导致 IL-22 释放减少并最终导致Card9的易感性更高-/-小鼠对 DSS 诱导的结肠炎 。
在人类中也发现了一些功能相关性,因为 AhR 的药理学激活减少了促炎细胞因子干扰素 (IFN) γ 的产生,并增加了 IBD 患者固有层单核细胞中 IL-22 的产生。
此外,正如在患有 UC 的人类中观察到的那样,IPA 和吲哚在 DSS 诱导的结肠炎小鼠血清中减少,另外的证据表明口服 IPA 在该模型系统中具有保护特性。
KP 的改变也可能在机制上参与 IBD 发病机制
IDO1 -/-小鼠更易患结肠炎,表明 IDO1 是肠道炎症的负调节剂。与 IDO1 缺乏相关的病理损伤部分是由于促炎细胞因子的激活和结肠中 CD4+ Foxp3+ 调节性 T 细胞数量的减少。然而,所涉及的确切机制和代谢产物仍然未知。
众所周知,Kyn 是一种 AhR 激动剂,但在肝癌细胞系中引发报告基因 AhR 活性所需的浓度让人怀疑它在生理条件下作为 AhR 激活剂的相关性,可能涉及导致抗炎代谢物(如 Kna)缺乏的下游代谢途径的改变,但这仍有待证明。在 IBD 的背景下,来自失调微生物群的异常信号可能是 KP 的驱动因素。
5-HT 加重肠道炎症
化学诱导的结肠炎的严重程度在TpH1 −/−小鼠和用 5-HT 合成抑制剂对氯苯丙氨酸处理的小鼠中减弱,表明 5-HT 加重肠道炎症。此外,删除 SERT 会导致 5-HT 可用性增加,从而导致实验性结肠炎恶化。
这些促炎作用可能部分是由DC上 5-HT 7受体的激活驱动的。然而,新的线索表明 5-HT 还通过作用于 5-HT 4 发挥抗炎作用对肠上皮细胞屏障功能产生积极影响。
总之,这些数据表明在 IBD 中观察到的色氨酸代谢改变可能在疾病发病机制中发挥积极作用。就这些微生物产生 AhR 激动剂的能力受损而言,微生物群的参与是显而易见的,但也可能解释了在生理条件下微生物群的直接影响下发生的 IDO 和 TpH1 的局部激活加剧。
● 肠易激综合症
IBS 的病因在很大程度上是未知的,但可能与色氨酸代谢受损有关。IBS 患者血清中 Kyn 升高,外周 IDO1 活性与 IBS 严重程度呈正相关。
IBS 与通过 KP 增加的色氨酸代谢有关
犬尿氨酸:色氨酸比率与 IBS 症状严重程度呈正相关,IFN-γ 激活和随后的色氨酸 IDO1 氧化可能是 IBS 的致病机制。
此外,血清素能系统的功能障碍与 IBS 的病理生理学有关。与急性色氨酸耗竭治疗相比,IBS 患者通过急性色氨酸增加治疗进行的 5-羟色胺能调节导致更严重的胃肠道症状。
肠道运动的改变是 IBS 的关键特征之一,与 5-HT 代谢障碍有关
与健康对照组相比,IBS 患者的直肠活检组织中发现 TpH1 和 SERT 表达水平降低。
此外,5-HT 结肠内容物在便秘型和腹泻型 IBS 中分别减少和增加。5-HT 的多效性与其受体的多样性有关,这些受体能够触发特定器官的特定功能。
在胃肠道中表达最多的5-HT 3和 5-HT 4亚型将 5-HT 与内脏伤害感受和运动障碍联系起来。5-HT 的作用已经被开发为治疗靶点,使用 5-HT 3受体拮抗剂和 5-HT 4受体激动剂分别显示出对腹泻和便秘为主的 IBS 的一些疗效。
然而,受肠道微生物群调节的中枢血清素作用紊乱也可能参与 IBS 发病机制。肠道菌群对 5-HT 产生和肠道运动的影响已在小鼠身上得到证实,并表明 IBS 发病机制部分与微生物群对 5-HT 产生的功能失调控制有关。
● 与年龄有关的胃肠功能障碍
高龄增加了个体对胃肠道功能障碍的易感性,这归因于与年龄相关的神经元丢失。
5-HT4 激动剂刺激发育中的肠道中的神经突生长和网络形成,也已被证明可以防止神经元凋亡和炎症诱导的轴突变性和自噬。
此外,5-HT4 受体激动作用可促进成人肠道神经发生。相应地,其他方面健康的高龄个体表现出循环色氨酸减少,可能会限制血清素的可用性。
/
/
▼
● 衰 老
衰老与肠道微生物群的变化有关,这通常与胃肠道的生理变化有关,同时免疫系统功能下降可能导致感染、营养不良和其他功能缺陷的风险增加。
老年人菌群特征
老年人的肠道微生物群通常以细菌多样性降低、优势菌种改变、有益微生物减少和兼性厌氧菌增加为特征,所有这些都表明与衰老相关的微生物变化具有潜在的不利影响。微生物群组成的变化与老年人的免疫衰老和炎症有关。
色氨酸代谢受衰老影响
色氨酸在诱导免疫耐受和维持肠道菌群方面起着至关重要的作用。
对老年人和年轻人肠道核心微生物组直系同源基因的分析表明,丰度增加的年龄相关基因参与了色氨酸代谢途径 (ko00380),这与在百岁老人血清中发现的与年龄相关的色氨酸浓度降低一致。研究表明,肠道微生物群对色氨酸消耗的潜在增加可能会影响宿主对色氨酸的生物利用度。
最近的一项研究报告了血清色氨酸水平降低与免疫激活增加之间的关系。还推测微生物群依赖性色氨酸减少会增强百岁老人的炎症。
食物传感信号通路调节寿命,与色氨酸关联
几种食物传感信号通路,包括胰岛素/胰岛素样生长因子 (IIS) 通路和哺乳动物雷帕霉素靶标 (mTOR) 通路,已被证明可以调节模式生物的寿命,并且已经提出了类似的关联对于KP途径。
在人类中,表示该通路活性的 Kyn:色氨酸 比率随着年龄的增长而增加。这种增加与 65 岁以上人群的虚弱有关,并预示着 90 多岁人群的死亡率。
KP 的活性与衰老之间存在因果关系
此外,对成人个体外周血中年龄相关基因表达变化的荟萃分析将 KYNU 酶(犬尿氨酸酶,色氨酸降解途径关键酶)鉴定为表达差异最大的基因之一。在对秀丽隐杆线虫的后续研究中,通过 RNA 干扰 (RNAi) 敲低 KYNU 比敲低任何其他差异表达基因所达到的寿命更长,这表明 KYNU 对衰老有重要贡献。
连同独立发现,线虫和黑腹果蝇中 TDO 活性的遗传减少, 导致 Trp:Kyn 比率显着增加,延长寿命,这些研究表明 KP 的活性与衰老之间存在因果关系。
Kyn/Trp 分流在炎症中的后果
色氨酸代谢向肝外 Kyn 产生的炎症相关分流,可能影响衰老过程中一系列器官中色氨酸代谢物的功能。
编辑
doi.org/10.3389/fimmu.2019.02565
与年龄相关的组织稳态下降会导致生理上的低度慢性炎症表型,称为炎症。我们假设色氨酸向Kyn途径代谢,以控制与年龄相关的炎症。色氨酸和Kyn代谢产物的相应紊乱可能与年龄相关疾病和寿命缩短有关。
色氨酸参与调节寿命机制
KP 调节衰老的机制尚不清楚。已经针对不同的无脊椎动物和脊椎动物模型描述了氨基酸(包括色氨酸)在调节寿命方面的作用。在大多数情况下,色氨酸可用性的降低或细胞摄取的阻断可延长寿命。然而,这种机制与 TDO 抑制(增加色氨酸)延长寿命的发现相悖,除非这与细胞摄取减少有关。
此外,用 Kyn 喂养果蝇会缩短寿命,这表明该通路下游的代谢物水平也可能参与寿命的调节。TDO 耗尽对秀丽隐杆线虫延长寿命的影响取决于 FOXO 转录因子 DAF-16,它是寿命调节通路的介质,例如驱动细胞防御通路表达的 IIS 通路,表明它具有保护细胞免受细胞侵害的作用伤害。
有趣的是,防止与年龄相关的蛋白质毒性(这也是由秀丽隐杆线虫中的 TDO 耗尽引起的)不依赖于 DAF-16,并且独立于 KP 63中的下游酶。这一观察结果表明,延长寿命的效果要么是这种保护的结果,要么是由一种独立的机制引起的。
由于 NAD +正在成为一种潜在的延长寿命分子,KP 的改变可能通过 NAD +产生延长寿命的效果。然而,无脊椎动物的寿命更长是 KP 活性降低的结果,而通过外部供应其他 NAD +前体来延长寿命则表明 KP 活性的增加也是有益的。
需要更多的研究来理解这些看似矛盾的发现。由于 IDO1 或 TDO 的敲除小鼠是可行的,这些模型对于进一步研究 KP 中的寿命调节机制和潜在治疗靶点可能很有价值。KP 调节的寿命延长效应可能源于一般健康益处,而不是疾病特异性效应。
● 代谢综合征和肥胖
在患有代谢综合征的人类患者中,据报道 IDO1 过度激活会导致血清 Kyn 水平升高以及 Kyn/Trp 比率与肥胖、代谢综合征、BMI 和血液甘油三酯之间的相关性。
肥胖患者IDO1 的局部激活
IDO1和 KP 下游酶(如犬尿氨酸酶 (KYNU)、犬尿氨酸氨基转移酶 (KAT) 和犬尿氨酸 3-单加氧酶 (KMO))的基因表达增加已在肥胖患者的脂肪组织中观察到,表明 IDO1 的局部激活。
然而,循环 5-HT 水平在代谢综合征中降低,并且与 BMI 和体脂呈负相关。
色氨酸转化产物吲哚衍生物起作用
微生物群通过色氨酸转化产生的几种吲哚衍生物可能在代谢综合征的发病机制中起作用。
吲哚本身已被证明可以刺激肠内分泌 L 细胞产生胰高血糖素样肽-1 (GLP-1),这是一种刺激胰腺 β 细胞分泌胰岛素的肠降血糖素。这种机制涉及快速抑制刺激 GLP-1 分泌的电压门控 K+ 通道,但受 ATP 合成抑制的长期影响控制,减少 GLP-1 分泌。
硫酸吲哚酚促炎和氧化作用,与心血管和肾病等相关
吲哚也在肝脏中被吸收并代谢为硫酸吲哚酚。在肾衰竭期间,这种代谢物会积累,其促炎和氧化作用与动脉粥样硬化、动脉硬化、充血性心力衰竭和其他心血管并发症的发病机制有关,这些并发症在慢性肾衰竭患者中尤为突出。
硫酸吲哚酚在肾功能正常的受试者中的作用仍有待确定。KP 也与动脉粥样硬化有关。在小鼠模型中,IDO1 缺乏症通过 IL-10 产生失调减少了动脉粥样硬化病变的发展,这是一种通过施用 Kna 逆转的表型。在人类中,高 Kna 水平与不稳定的斑块表型相关。
低度慢性炎症可能有助于 IDO1 激活
KP 的过度激活也可能参与低度炎症情况下胰岛素抵抗的发生,例如肥胖、抑郁、丙型肝炎病毒感染和心血管疾病。人体和实验数据表明,黄嘌呤酸和 KP 的其他产物对胰岛素的产生和释放以及对靶组织的影响具有有害影响。
大脑中产生的血清素会引起饱腹感,但在微生物群的直接影响下产生的肠道来源的 5-HT 不会穿过血脑屏障。然而,色氨酸和直接 5-HT 前体 5-HTP 确实可以穿过血脑屏障,从而间接调节中枢 5-HT 的产生和功能。
外周 5-HT 独立于任何中枢效应影响宿主代谢
肠道来源的 5-HT 能够诱导食欲减退和饱腹感,其水平在禁食期间增加并刺激脂肪组织中的脂肪分解和肝细胞中的糖异生,有利于血糖控制。随后,通过一种涉及产热棕色脂肪组织消耗更多能量的机制,给予高脂肪饮食的 TpH1 基因或化学消融小鼠可免于肥胖、胰岛素抵抗和非酒精性脂肪肝疾病 (NAFLD)。
然而,这些结果可能不适用于棕色脂肪组织含量低且随年龄增长而减少的成年人。此外,人类肥胖与外周 5-HT 减少有关,表明其在发病机制中的复杂作用。
已经使用小鼠模型研究了 AhR 在代谢综合征中的作用,但尚未得出明确的结论。这可能与 AhR 的多重作用有关,AhR 在参与代谢综合征发病机制的各种细胞类型(肠细胞、肝细胞和免疫细胞)中表达。
/
/
▼
● 癌症中的色氨酸代谢
多项证据表明色氨酸代谢在癌症中具有重要作用,通过抑制抗肿瘤免疫反应和增加癌细胞的恶性特性来促进肿瘤进展。
首先,色氨酸降解酶在多种癌症中表达
IDO1 在大约 58% 的人类肿瘤中表达,其表达与多种癌症的不良临床结果相关,包括黑色素瘤、妇科癌症、结肠癌和血液系统恶性肿瘤。
IDO1 表达要么作为一种反调节机制被诱导,以响应从肿瘤浸润性免疫细胞释放的细胞因子,要么它的表达通过肿瘤固有的致癌信号传导维持。
TDO 催化与 IDO1 相同的反应,在神经胶质瘤、黑色素瘤、卵巢癌、肝癌、乳腺癌、非小细胞肺癌、肾细胞癌和膀胱癌中表达,并已被证明可促进肿瘤进展。
其次,各类癌症患者中全身色氨酸水平降低
已在成人 T 细胞白血病、结直肠癌 、妇科癌症、恶性黑色素瘤、肺癌和恶性神经胶质瘤患者中测量到全身色氨酸水平降低。在患有这些癌症的患者的血液中很少观察到 KP 代谢物浓度升高,这可能表明肿瘤微环境中 Kyn 和下游代谢物的局部变化受到更多限制。
第三,色氨酸降解在调节 Treg细胞和癌症中的免疫细胞浸润中发挥作用
FOXP3 + T reg细胞与宫颈癌引流淋巴结中表达 IDO1 的 DC 直接接触,IDO1 表达与转移性胰腺导管腺癌患者CD4 + CD25 + FOXP3 + T reg细胞增加有关,急性髓性白血病 (AML) 33和非霍奇金淋巴瘤。
此外,IDO1 表达与 CD3 + T 细胞、CD8的低肿瘤浸润相关+ T 细胞和 CD3 +和 CD8 + T 细胞以及 CD57 +自然杀伤细胞分别存在于结直肠癌、卵巢癌和子宫内膜癌患者中。
最近的一项研究表明,肿瘤再生细胞将 Kyn 转移到 CD8 + T 细胞,这反过来又以 AHR 依赖性方式上调程序性细胞死亡蛋白 1 (PD-1)。总而言之,这些观察结果为色氨酸代谢在肿瘤细胞免疫逃逸中的作用提供了机制解释。
第四,色氨酸代谢物可以有效促进癌细胞的运动和转移
例如,体外研究表明,TDO 在胶质母细胞瘤或乳腺癌细胞中的表达可促进肿瘤细胞迁移和侵袭。类似地,IDO1 的过表达增强了肺癌细胞的运动性,而敲除则降低了运动性。
这种促迁移表型也反映在临床前模型中由色氨酸降解引起的转移形成促进。药理学 TDO 抑制减少了肺癌小鼠模型肺部肿瘤结节的数量。
植入小鼠体内的人肺癌细胞中的 IDO1 过表达增加了大脑、肝脏和骨骼中的转移形成,而 IDO1 缺乏减少了转移负担并提高了乳腺癌衍生肺转移小鼠模型的存活率。
此外,TDO-AHR 信号轴促进了对贴壁依赖性细胞从周围细胞外基质分离时发生的程序性细胞死亡的抵抗,这是转移的关键步骤。最后,肿瘤内 IDO1 表达已被证明与结直肠癌肝转移、肝细胞癌远处转移和子宫内膜癌淋巴结转移的频率相关。
第五,NAD+ 在癌症生物学中通过色氨酸 de novo 途径产生的作用
在小鼠中,色氨酸代谢受损导致肝脏中从头合成 NAD+ 受到抑制,从而通过 DNA 损伤促进肝肿瘤发生。
在人类神经胶质瘤中,从色氨酸重新产生的 NAD+ 赋予对放化疗诱导的氧化应激的抗性。有趣的是,胶质瘤细胞和小胶质细胞合作产生 NAD+。
此外,在人类癌细胞中,IDO1 与通过产生 NAD +改善 DNA 修复和介导对治疗的抗性有关,例如 PARP 抑制剂奥拉帕尼、γ-辐射和化疗剂顺铂。因此,抑制色氨安代谢也可能通过从头形成 NAD +来防止治疗耐药性;然而,根据 NAD +合成所必需的 KP 酶的表达,这种效应可能是组织特异性或细胞特异性的,因此需要进一步研究。
● 靶向癌症中的 IDO1 和 TDO
基于 IDO1 和 TDO 的肿瘤促进功能,已经研究了这些酶的小分子抑制剂用于癌症治疗。临床阶段 IDO1 抑制剂 epacadostat (INCB024360)、navoximod (NLG-919/GDC919)等化学结构已被公开。未公开结构的化合物KHK2455、LY3381916和MK-7162也作为IDO1抑制剂进入临床评估。
TDO 抑制剂(最初被开发为抗抑郁药以提高全身色氨酸水平,从而提高大脑血清素浓度)也正在探索用于癌症治疗,但尚未进入临床试验阶段。
此外,indoximod 正在临床试验中进行研究,但与 L-1-MT 237不同,它们不是 IDO1抑制剂及其作用机制,尽管它似乎与 IDO1 表达有关,但仍存在争议。
然而,IDO1 抑制的最大治疗潜力预计是它与其他疗法的联合使用,这一直是大多数 II 期和 III 期研究的重点。
● 与免疫检查点抑制剂联合
IDO1 抑制剂的临床评估最先进的是它们与针对免疫系统检查点的单克隆抗体的组合,例如细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA4)、PD-1 或其配体 (PD-L1),其中一些已被批准用于近年来治疗多种癌症的基础上部分患者出现前所未有的反应。
然而,由于相当大比例的患者无法从检查点抑制剂中获益,因此人们非常有兴趣确定缺乏治疗反应和治疗耐药性的分子基础,因为这些知识可能表明潜在的联合疗法可以改善反应。
有趣的是,在使用 PD-1 受体阻断剂 pembrolizumab 治疗期间,肉瘤患者的 Kyn:Trp 血浆比率增加,表明 IDO1 可能由免疫检查点封锁诱导。最有可能的是,这种 IDO1 的诱导,预计会抵消免疫检查点抑制的免疫刺激作用,是通过活化的 T 细胞产生的 IFNγ 介导的。
一项临床前研究表明,抑制 IDO1 会略微增强抗 CTLA4、抗 PD-1–PD-L1 和抗 GITR(糖皮质激素诱导的 TNFR 相关蛋白)疗法的疗效。
这些发现虽然不大,但引发了对 IDO1 抑制剂与免疫检查点抑制剂联合治疗的广泛临床研究。在 epacadostat 与 pembrolizumab 联合治疗的 I/II 期单臂试验获得令人鼓舞的数据后,在无法切除或转移性黑色素瘤患者中进行了 III 期试验。
尽管 ECHO-301 试验的阴性结果明显代表了 IDO1 抑制剂在癌症免疫治疗中的开发受挫,但它也激励人们利用临床试验来更多地了解 IDO1 抑制剂在癌症中的作用机制,以开发更复杂的生物标志物用于患者选择和治疗监测,并利用该途径中的新靶点,例如 AhR。
● 与免疫检查点抑制剂联合
目前已经计划在验证试验中继续研究 IDO1 抑制剂在联合免疫疗法中的潜力,包括不同于与 PD-1 和 PD-L1 拮抗剂组合的策略。
几项测试 IDO1 抑制剂 epacadostat 与抗肿瘤疫苗联合应用的临床试验正在进行中,可能会显示阻断 IDO1 是否会提高抗肿瘤疫苗接种的功效。这背后的基本原理是干扰素信号对 IDO1 的上调涉及多种免疫相关途径。例如,TLR 的激活通过干扰素诱导 IDO1 表达。
抑制抗肿瘤免疫反应的其他几种途径也与驱动色氨酸降解酶的肿瘤表达有关,包括 AhR 信号、TGFβ 信号和信号转导和转录激活因子 3 (STAT3)。
因此可以设想两种情况:
• 如果这些途径的抑制剂非常有效并且同时完全消除了色氨酸降解酶的表达,那么它们可能会使 IDO1 或 TDO 抑制剂在这种情况下变得可有可无。
• 相反,如果这些药物不能完全减轻 IDO1 和/或 TDO 的表达,它们可能与色氨酸代谢抑制剂协同作用。相比之下,其他治疗方法可能会诱导 IDO1 作为一种不良影响,这表明这些疗法与 IDO1 抑制剂的组合可能是有益的。
/
/
▼
前面概述了色氨酸及其在肠道中的三种命运。在这里主要谈论吲哚/AhR 通路,将深入探讨 AhR 信号的好处、为什么大多数人都缺乏这种途径、增加肠道中 AhR 活性的潜在策略,以及 AhR 可能被过度刺激的一些例外情况。
● 什么是AhR?
芳烃受体 (AhR)是一种转录因子——一种调节基因表达的蛋白质。结合并激活受体的分子称为激动剂。
AhR 的激动剂(即激活剂)主要分为三类分子:
AhR 最初因其在对二恶英和其他芳基碳氢化合物等环境毒素作出反应中的作用而被发现。这些污染物是 AhR 的非常强的激活剂。它们的结合增加了有助于促进其解毒的酶的表达。
肠道细菌,包括各种梭菌属、拟杆菌属、真杆菌属、乳杆菌属和双歧杆菌属,可以直接将色氨酸转化为称为吲哚的化合物,其中许多结合并激活 AhR。
近年来,膳食化合物也被证明可以激活 AhR。Indole-3-carbinol (I3C) 是一种源自十字花科蔬菜分解的化合物,可以结合并激活 AhR。
虽然环境污染物对 AhR 的慢性激活可能对健康产生负面影响,但肠道代谢物和膳食化合物对 AhR 的瞬时激活具有许多积极的下游影响。
● 肠道 AhR 激活的诸多好处
规律的、短暂的 AhR 信号在肠道和整体健康中起着许多重要作用。
1) 维持肠道屏障功能
AhR 刺激肠道中的先天免疫细胞产生细胞因子 IL-22,这是一种促进粘液产生和抗菌肽分泌的信号分子。在称为隐窝的肠道屏障口袋中,AhR 还支持干细胞增殖,这对于正常的肠道更新和修复至关重要。
2) 调节肠道菌群的组成
缺乏 AhR 刺激会导致促炎性肠杆菌科的扩张和产丁酸梭菌的减少,这是肠道菌群失调的常见特征。
3) 维持肠道免疫细胞群并减少炎症
AhR 支持肠道上皮细胞内足够数量的淋巴细胞。它还在将调节性 T 细胞引导至肠道并支持其抑制炎症的能力方面发挥关键作用。
4) 调节肠神经系统和肠蠕动
AhR 已被证明在调节蠕动方面发挥作用,蠕动是沿着胃肠道移动食物的肌肉收缩。AhR 也可能与损伤后肠神经的再生有关。
5) 防止念珠菌和其他肠道感染
AhR 激活通过支持 IL-22 信号传导在维持对酵母白色念珠菌和细菌病原体的定植抗性方面发挥重要作用。
6) 支持肺部的免疫防御
肠道 AhR 在防止其他粘膜表面(如肺)感染方面也起着重要作用。2019 年的一项研究发现,抗生素治疗后提高肠道中的 AhR 活性可显着减少肺部致病菌数量。
7) 促进健康的皮肤屏障功能
肠道 AhR 对于维持皮肤屏障的完整性至关重要。2016 年的一项研究发现,从饮食中去除 AhR 配体会损害皮肤屏障功能,而重新添加 AhR 激活剂吲哚-3-甲醇可挽救屏障缺陷,即使在老年小鼠中也是如此。
8) 激活解毒途径
AhR 在许多物质的解毒中发挥作用,包括多环芳烃、霉菌毒素、重金属和雌激素,激活整个身体的 解毒途径。
9) 保护肝肾功能
来自肠道色氨酸代谢的 AhR 信号也被证明可以预防非酒精性脂肪肝、酒精性肝损伤和肾纤维化。
10) 支持神经系统健康
星形胶质细胞中通过 AhR 发出的膳食色氨酸代谢物信号已被证明可以限制中枢神经系统的炎症。肠道 AhR 活性还促进成人神经发生,即新神经元的形成。
AhR 信号减少:许多慢性病的一个特征
在多种慢性疾病中观察到肠道 AhR 活性降低,包括炎症性肠病、肠易激综合征、结直肠癌、肥胖、代谢综合征、高血压、动脉粥样硬化、抑郁症、炎症性皮肤病、乳糜泻和多发性硬化症等疾病。
● 是什么导致 AhR 信号减少?
影响因素很多,包括:
改变的肠道微生物群组成通常无法产生已知可激活 AhR 的化合物,包括色氨酸衍生的吲哚和短链脂肪酸丁酸盐。
色氨酸(细菌吲哚形成的底物)的摄入量减少和/或植物性食物中 AhR 激动剂的摄入量减少都会减少 AhR 激动剂的总量。人造甜味剂的消费也被证明会减少 AhR 信号。
压力、炎症和某些类型的感染可以将色氨酸代谢从 AhR 转移到其他途径(后面我们会持续分享)。
解决这些根本原因始终是恢复 AhR 活动的第一步。
● 增加 AhR 活性的其他策略
以下是已知会暂时增加 AhR 活性的其他干预措施的总结。但是需要注意 AhR 激动剂具有物种特异性和组织特异性作用。它们的效果还取决于浓度,在存在多种化合物的情况下,它们甚至可能相互竞争——因此虽然这里列出了很多可能性,但“厨房水槽”方法并不一定是理想的。
希望在接下来的几年里,我们将看到更多的人体临床试验,以阐明这些疗法中的哪些可能对以 AhR 缺陷为特征的疾病状态最有帮助。以下信息不能视为医疗建议。
▸Indole-3-carbinol (I3C)
这种化合物由球芽甘蓝、卷心菜、西兰花、花椰菜和芥菜等十字花科蔬菜中的葡糖甘蓝素分解产生,是一种有效的 AhR 激活剂。
在动物模型中,I3C 已被证明可以诱导调节性 T 细胞的形成、抑制 Th17、保护粘液层、增加丁酸盐的产生、上调 PPAR-γ 并防止结肠炎。还对其潜在的抗癌和抗氧化作用进行了研究。虽然 I3C 或其衍生物二吲哚基甲烷 (DIM) 以补充剂形式提供,但较高剂量可能存在风险且人体研究有限,因此最好以整个食物形式食用 I3C。
注意:为了最大限度地提高膳食 I3C 的生物利用度,食用酸菜等生发酵形式的十字花科蔬菜,或在烹饪后加入芥末籽粉(含有黑芥子酶)。
▸丁酸盐
一种短链脂肪酸,是人肠上皮细胞中 AhR 的直接激活剂。在健康的肠道中,丁酸盐是由膳食纤维的发酵产生的,在较小程度上是蛋白质的发酵。它也以补充形式提供。一定情况下对结肠需要更有针对性。
▸尿石素 A
这种化合物由石榴、覆盆子和黑莓中的鞣花单宁分解产生,已被证明可以通过 AhR 增强肠道屏障功能。然而,估计只有 30-40% 的人拥有可以进行这种转化的细菌。尿石素 A也可以作为补充剂服用,并且作为食品成分已获得 FDA 公认的安全状态。
▸阳光照射
2019 年的一项研究发现,在小鼠身上,仅 15 分钟的 UV-B 照射就会诱导 AhR 靶基因在血液和外周组织(包括肠道)中的表达。
▸婴儿双歧杆菌(Bifidobacterium infantis)
该菌株在人乳低聚糖上生长后产生吲哚-3-乳酸,一种 AhR 的激活剂。它已在婴儿中得到充分研究,可用作婴儿益生菌。该菌株尚未在成人中进行研究。该配方确实含有大量的乳糖和残留量的大豆。
▸鼠李糖乳杆菌
某些乳杆菌菌株已被证明在色氨酸丰富时自然产生 AhR 激动剂。发现唯一已知可增加 AhR 活性且可商购的菌株是鼠李糖乳杆菌GG。
但是注意,不建议在使用抗生素期间或之后立即使用基于乳酸杆菌的益生菌,也不建议患有组胺不耐受/肥大细胞活化综合症的人服用。
▸Akkermansia muciniphila
至少在一项动物研究中,这种细菌或其外膜上的一种蛋白质增加了循环中的吲哚化合物并上调了 AhR 靶基因。
▸美沙拉嗪 (5-氨基水杨酸,5-ASA)
该药物是炎症性肠病 (IBD) 的一线治疗药物。这种药物上调 PPARgamma 和促细胞凋亡和抗增殖作用的能力。有趣的是,美沙拉嗪似乎也能激活 AhR。
▸咖啡
咖啡提取物,尤其是过滤较少的咖啡,如土耳其咖啡,已被证明可诱导肠上皮细胞中的 AhR 表达,并在啮齿动物模型中预防结肠炎。
▸萝卜硫素
虽然这种化合物的作用通常归因于 Nrf2 通路,但 AhR 似乎介导了它的许多保护作用。在喂食西方饮食的小鼠中,萝卜硫素增加了肠道中吲哚乙酸的产生,从而上调了 AhR 活性。
▸多酚
槲皮素、白藜芦醇和姜黄素都可以通过抑制控制 AhR 激动剂分解的 CYP1A1 酶来间接激活 AhR。其中,槲皮素在增强 AhR 信号传导方面最有效。
▸血清素
这种神经递质及其副产物 (5-HIAA) 也可以通过部分抑制 AhR 配体的清除来间接激活 AhR。这种效果取决于功能正常的血清素运输。
关于反馈调节而不是长期过度刺激 AhR 的重要性的说明:
这里不能忽略AhR 过度刺激的问题。虽然大多数慢性炎症性疾病都以 AhR 缺陷为特征,但在少数情况下,AhR 可能会过度激活,从而产生负面后果。这通常是由于污染物或霉菌暴露、严重病毒感染、或慢性肾病等引起的显着环境毒性。
这些条件的特点是持续的 AhR 激活,其对基因表达的影响与短暂的 AhR 激活截然不同。相反,由于某些解毒酶的上调,结合 AhR 的天然化合物在结合 AhR 时会被有效代谢。这种负反馈回路确保 AhR 信号是短暂的。
拥有足够的维生素,尤其B12 和叶酸可以防止慢性 AhR 过度刺激。尽管如此,在某些极端毒性或感染的情况下,短暂的 AhR 刺激是不提倡的。
/
/
▼
● 益 生 菌
益生菌,如属于乳杆菌属和双歧杆菌属的细菌,对色氨酸代谢产生有益影响。
益生菌促进血清素合成
一方面,益生菌,如乳杆菌和双歧杆菌中的物种,可以直接将色氨酸转化为血清素。
另一方面,一些益生菌乳杆菌菌株,如干酪乳杆菌327,可以通过增加TPH1表达间接促进结肠血清素合成。
益生菌与犬尿氨酸途径的调节密切相关
与血清5-羟色胺水平升高一致,大鼠口服约氏乳杆菌(Lactobacillus johnsonii) 无细胞上清液,也会导致血清中的犬尿氨酸水平降低,同时肠道IDO活性降低。口服约氏乳杆菌8周后,观察到人血清犬尿氨酸水平下降,色氨酸含量增加的明显趋势。
此前的一项研究还表明,大鼠服用益生菌婴儿双歧杆菌( Bifidobacteria infantis)会导致色氨酸水平升高,血液循环中的犬尿氨酸与色氨酸比率降低。
这些研究表明,一些属于乳杆菌和双歧杆菌的益生菌物种可能通过抑制犬尿氨酸途径改变宿主色氨酸代谢。
益生菌将色氨酸降解为吲哚化合物
此外,据报道,一些属于乳杆菌的细菌能够将色氨酸降解为吲哚化合物,如IAld、ILA和IAA。
向结肠炎易感小鼠口服3种色氨酸代谢乳杆菌菌株可促进微生物色氨酸新陈代谢芳基烃受体(Ah)依赖性信号传导,从而影响外周色氨酸的有效性。
尽管操纵肠道微生物群影响色氨酸代谢途径的机制尚未完全了解,但以肠道微生物群为靶点可能是调节色氨酸新陈代谢的一种有前途的方法。
● 抗 生 素
口服抗生素能够重塑肠道微生物群的组成和代谢。口服广谱抗生素会导致肠道微生物群耗竭,降低结肠血清素水平,进而延缓小鼠结肠运动。
正如结肠中关键合酶TPH1的下调所证明的,这项研究指出了共生微生物群在调节肠道血清素合成中的可能作用。
据报道,抗生素的微生物操纵会影响犬尿氨酸途径,因为抗生素诱导的微生物群耗竭会导致小鼠和猪的循环色氨酸可用性增加,并降低沿犬尿氨素途径的代谢。
此外,一些研究表明,抗生素诱导的肠道微生物改变也有利于猪体内的微生物色氨酸降解途径。随着循环色氨酸水平的增加,口服抗生素降低了空肠中色氨酸的可用性,并降低了猪大肠中的微生物色氨酸脱羧活性。
此外,口服抗生素会增加猪大肠中吲哚和吲哚化合物的含量。
有趣的是,最近的一项研究表明,回肠末端输注专门针对大肠微生物群的广谱抗生素会导致血液循环中的色氨酸水平降低,并增强微生物色氨酸降解,从而增加大肠中的吲哚水平。与之前的研究结果相反,该研究的发现表明,肠道微生物群在响应抗生素操作而调节色氨酸代谢方面发挥了独特的作用。
● 饮 食
饮食被认为是影响微生物色氨酸代谢的重要因素。
高脂肪饮食:抑制微生物从色氨酸向吲哚代谢物的转化,从而影响免疫调节
例如,最近的一项研究表明,高脂肪饮食会耗尽小鼠盲肠中的微生物代谢产物IAA和色胺,这表明在高脂肪饮食下,微生物色氨酸降解途径可以减弱。
高脂肪饮食增加了Alistipes和Bacteroides的丰度,同时减少了 Faecalibacterium。高脂肪饮食增加了致病菌属Alistipes,同时减少了有益菌 Parabacteroides distasonis ,导致小鼠肠道屏障功能受损。
高脂饮食显著增加小鼠肠道的IDO活性,促进色氨酸分解代谢为犬尿氨酸。
在暴露于高脂饮食的情况下,肠道微环境受到影响,随后抑制微生物从色氨酸向吲哚代谢物的转化,特别是吲哚-3-丙酸、吲哚-3-乳酸和吲哚乙酸盐。这些代谢物被认为是 AhR 激动剂,在免疫调节中起着关键作用。
配方奶:影响新生猪色氨酸代谢
母乳不仅是早期营养的唯一来源,而且有助于宿主肠道微生物群的成熟。有趣的是,之前的一项研究发现,配方奶引起的肠道微生物群的改变使新生猪结肠中的色氨酸代谢从血清素转变为色胺。
碳水化合物:影响色氨酸代谢速率
微生物色氨酸代谢的速率可能会受到管腔内营养物质(如碳水化合物)可用性变化的影响。
正如先前的体外研究所证明的,从仔猪粪便中分离出的一株利用色氨酸的细菌使用色氨酸进行细菌蛋白质合成,以可消化碳水化合物(葡萄糖)为底物,而不可消化碳水化合物(低聚果糖)是吲哚产生的底物。
此外,通过添加不可消化的碳水化合物,如低聚果糖和抗性淀粉,增加碳水化合物的可用性,促进碳水化合物代谢,从而增加短链脂肪酸的产量,同时减少色氨酸降解和仔猪大肠中的吲哚化合物。
事实证明,通过盲肠淀粉输注增加大肠碳水化合物的可用性可以抑制微生物色氨酸降解,从而导致大肠和血清中色氨酸水平的增加。
这些研究表明,增加碳水化合物的可用性抑制了肠道中的微生物色氨酸降解,这将进一步影响循环色氨酸库。
相比之下,增加碳水化合物的可用性促进了肠道血清素的合成,这与增加胃肠道传输有关,正如先前在口服多糖的小鼠中进行的一项研究所报告的那样。微生物短链脂肪酸的产生增强可以参与这一过程,因为它们已经被证明可以刺激结肠EC中的血清素释放。
腔内色氨酸可用性是影响微生物色氨酸代谢的另一个直接因素
IDO激活或饮食限制导致的宿主色氨酸耗竭可减少微生物增殖,尤其是乳酸杆菌中的细菌,据报道,其中一些细菌是利用色氨酸的细菌。通过饮食喂养选择性地恢复色氨酸水平导致乳杆菌的扩张,这进一步导致微生物色氨酸代谢的增强,IAld增加。
鉴于色氨酸也会被宿主直接吸收,肠道微生物群、管腔色氨酸可用性和宿主色氨酸代谢之间的复杂串扰需要进一步研究。
富含麦麸的饮食在调节色氨酸代谢物的合成和生物转化中的作用
富含麦麸的饮食有效地抑制了色氨酸向犬尿氨酸途径代谢物的转化,同时增加了褪黑激素和微生物分解代谢物,即吲哚-3-丙酸、吲哚-3-乙醛和 5-羟基-吲哚-3-乙酸。
麦麸增加了促进健康的细菌(例如,Akkermansia和Lactobacillus),它们与色氨酸衍生的吲哚类代谢物显著相关。
富含麦麸的饮食可有效调节与免疫功能相关的微生物转化和色氨酸合成(即增加 AhR 和 IL-22 的结肠表达),同时改善葡萄糖和脂质稳态,以及增加肠道健康促进菌的丰度。
/
/
色氨酸代谢调节炎症、肠道稳态和大脑功能等。色氨酸可用性和代谢的微生物调节对许多肠脑轴疾病具有重要意义,包括伴有精神疾病的胃肠道疾病,如IBS 、IBD,其他具有胃肠道功能障碍的中枢神经系统疾病,如自闭症等。
由于宿主色氨酸代谢直接或间接受肠道菌群调节,许多因素会影响肠道微生物群的组成和代谢,包括饮食、抗生素、益生菌等可以调节肠道微生物群,调节色氨酸的可用性,因此靶向肠道菌群干预是治疗肠脑轴疾病的有前途的方法。
色氨酸代谢可以作为与年龄相关的病理和寿命的调节剂。犬尿氨酸通路及其代谢产物可能成为预测衰老相关疾病的潜在风险标记物。
色氨酸主要经犬尿氨酸代谢,既促进肿瘤细胞固有的恶性特性,又限制肿瘤免疫,因此它是癌症免疫治疗的重要药物开发靶点。肿瘤中色氨酸代谢的改变常伴随色氨酸相关酶基因表达的异常,基于此,IDO抑制剂、TDO抑制剂及联合治疗被应用于大量的临床试验中。
随着这方面研究的不断深入,我们会持续关注和更新色氨酸代谢和全身健康稳态以及药物进展等。
主要参考文献
Le Floc’h N, Otten W, Merlot E. Tryptophan metabolism, from nutrition to potential therapeutic applications. Amino Acids. 2011 Nov;41(5):1195-205. doi: 10.1007/s00726-010-0752-7. Epub 2010 Sep 25. PMID: 20872026.
Gao K, Mu CL, Farzi A, Zhu WY. Tryptophan Metabolism: A Link Between the Gut Microbiota and Brain. Adv Nutr. 2020 May 1;11(3):709-723. doi: 10.1093/advances/nmz127. PMID: 31825083; PMCID: PMC7231603.
Sorgdrager FJH, Naudé PJW, Kema IP, Nollen EA, Deyn PP. Tryptophan Metabolism in Inflammaging: From Biomarker to Therapeutic Target. Front Immunol. 2019 Oct 30;10:2565. doi: 10.3389/fimmu.2019.02565. PMID: 31736978; PMCID: PMC6833926.
Richard DM, Dawes MA, Mathias CW, Acheson A, Hill-Kapturczak N, Dougherty DM. L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications. Int J Tryptophan Res. 2009 Mar 23;2:45-60. doi: 10.4137/ijtr.s2129. PMID: 20651948; PMCID: PMC2908021.
Platten M, Nollen EAA, Röhrig UF, Fallarino F, Opitz CA. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond. Nat Rev Drug Discov. 2019 May;18(5):379-401. doi: 10.1038/s41573-019-0016-5. PMID: 30760888.
Chen G, Zhou S, Chen Q, Liu M, Dong M, Hou J, Zhou B. Tryptophan-5-HT pathway disorder was uncovered in the olfactory bulb of a depression mice model by metabolomic analysis. Front Mol Neurosci. 2022 Oct 10;15:965697. doi: 10.3389/fnmol.2022.965697. PMID: 36299862; PMCID: PMC9589483.
Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan Metabolism and Gut-Brain Homeostasis. Int J Mol Sci. 2021 Mar 15;22(6):2973. doi: 10.3390/ijms22062973. PMID: 33804088; PMCID: PMC8000752.
van der Goot AT, Nollen EA. Tryptophan metabolism: entering the field of aging and age-related pathologies. Trends Mol Med. 2013 Jun;19(6):336-44. doi: 10.1016/j.molmed.2013.02.007. Epub 2013 Apr 2. PMID: 23562344.
Yao K, Fang J, Yin YL, Feng ZM, Tang ZR, Wu G. Tryptophan metabolism in animals: important roles in nutrition and health. Front Biosci (Schol Ed). 2011 Jan 1;3(1):286-97. doi: 10.2741/s152. PMID: 21196377.
Höglund E, Øverli Ø, Winberg S. Tryptophan Metabolic Pathways and Brain Serotonergic Activity: A Comparative Review. Front Endocrinol (Lausanne). 2019 Apr 8;10:158. doi: 10.3389/fendo.2019.00158. PMID: 31024440; PMCID: PMC6463810.
Gibson EL. Tryptophan supplementation and serotonin function: genetic variations in behavioural effects. Proc Nutr Soc. 2018 May;77(2):174-188. doi: 10.1017/S0029665117004451. Epub 2018 Jan 25. PMID: 29368666.
Gostner JM, Becker K, Kofler H, Strasser B, Fuchs D. Tryptophan Metabolism in Allergic Disorders. Int Arch Allergy Immunol. 2016;169(4):203-15. doi: 10.1159/000445500. Epub 2016 May 4. PMID: 27161289; PMCID: PMC5433561.
Liu XH, Zhai XY. Role of tryptophan metabolism in cancers and therapeutic implications. Biochimie. 2021 Mar;182:131-139. doi: 10.1016/j.biochi.2021.01.005. Epub 2021 Jan 16. PMID: 33460767.
Yan T, Shi L, Liu T, Zhang X, Yang M, Peng W, Sun X, Yan L, Dai X, Yang X. Diet-rich in wheat bran modulates tryptophan metabolism and AhR/IL-22 signalling mediated metabolic health and gut dysbacteriosis: A novel prebiotic-like activity of wheat bran. Food Res Int. 2023 Jan;163:112179. doi: 10.1016/j.foodres.2022.112179. Epub 2022 Nov 19. PMID: 36596122.