-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

我们知道,SARS-CoV-2感染引起的新型冠状病毒肺炎COVID-19,最常见的症状是发烧和呼吸道不适。也有胃肠道感染的报道,症状包括腹泻、恶心、呕吐、腹痛和食欲不振等。
胃肠道感染SARS-CoV-2或其他病毒后,部分患者可能发生胃肠道微生物群改变。此外,部分新冠肺炎患者可能会接受抗生素治疗,这也可能会扰乱胃肠道稳态。
本文就以下问题,对COVID-19,胃肠道疾病,程度菌群,营养干预之间的联系进行探讨。

腹泻患者粪便样本中病毒RNA阳性率更高?
COVID-19和胃肠道疾病有什么联系?
肠-肺轴在COVID-19的发展中发挥作用?
肠道菌群在其中扮演什么角色?
针对COVID-19不同严重程度的措施?
营养干预是否有效?如何干预?
……
SARS-CoV-2在鼻咽清除后仍能在粪便中呈阳性,并可能继续具有传染性。
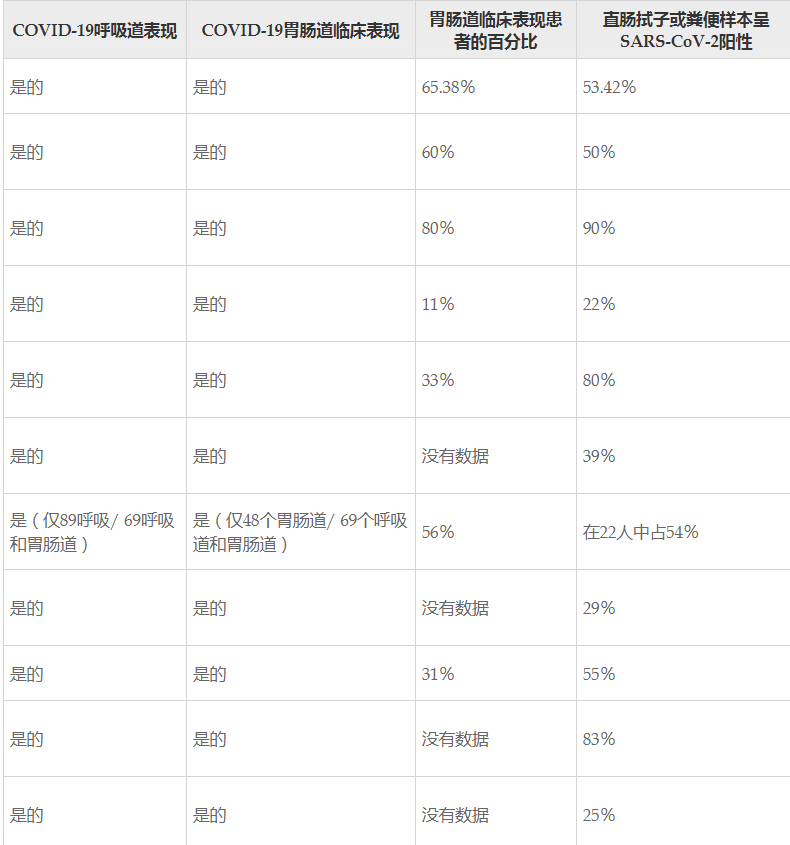
Alberca GGFet al., World J Gastroenterol. 2021
COVID-19最常见的胃肠道症状是腹泻、恶心、腹痛和食欲不振。
在病毒性胃肠道感染后,一些患者可能会出现胃肠道微生物群的改变,如变形菌增加、拟杆菌减少。
最近的一份报告确定了COVID-19住院患者肠道微生物群的改变,有益共生细菌减少,条件致病菌增加。
肠道组织和粪便也可能是一个贮存器。最近研究表明,即使鼻咽和口咽拭子检测SARS-CoV-2RNA呈阴性,患者粪便样本中仍然有可能含有SARS-CoV-2RNA.
另有研究指出,腹泻患者的COVID-19症状持续时间延长,而腹泻患者的粪便样本中病毒RNA的阳性率更高。
目前的假设是可能涉及肠道组织上的直接病毒感染和对该病毒的局部免疫反应。实际上,在粪便COVID-19患者中检测到SARS-CoV-2 RNA可能表明粪-口传播。
除了SARS-CoV-2对肠道免疫反应的影响外,COVID-19患者还可能发生细菌共感染和继发感染,也就是说必须使用抗生素。即使COVID-19患者没有细菌共感染,对其抗生素的使用也是在临床上常见的做法。这也可能会破坏胃肠道微生物组。
微生物群受环境因素,食物,药物和感染的影响。根据人体的部位不同,每个微生物群具有独特的特性。许多因素会影响微生物组的组成,例如局部pH值,温度和养分。
微生物几乎可以在人体的每个小生境中发现,但胃肠道是宿主与人体中微生物之间最大的界面。大约有1013-1014胃肠道中的微生物,其基因组含量比人类基因组中更大。
微生物与人类有共生关系。共生微生物对于人类健康,调节许多生理功能,物质降解,代谢产物的产生和免疫反应至关重要。
微生物能激活和刺激T辅助细胞(Th)1、Th2、Th17和T调节细胞(Treg)的分化,从而调节免疫应答。肠道菌群多样性低会增加对局部和肺部疾病的易感性。
微生物组的环境处于不断调节中,受到外部微生物和其他非细菌化合物(例如肠道菌群中的食物和病毒)的调节。微生物群的突然变化会导致共生细菌的失衡和/或条件致病菌增加,增加对疾病的敏感性。
微生物群对于人类免疫系统的发展至关重要,并且可以影响局部和非局部免疫反应,例如肠-肺轴。肠道菌群的改变可以调节呼吸系统疾病的发展。在患有肠道功能障碍的患者,例如已确诊的肠道炎性疾病的患者或肥胖患者中,肠道菌群可能是发生严重COVID-19的次要危险因素。
此外,患有COVID-19的患者可能会出现胃肠道菌群失调,且产短链脂肪酸的细菌减少。
肠道菌群的破坏可以触发与代谢功能障碍,肥胖症,癌症,和神经障碍相关的炎症事件。某些微生物的增加或减少可以增加对先天性免疫受体的刺激,例如核苷酸结合寡聚化域样受体和Toll样受体。该受体的刺激触发几个促炎症信号和细胞因子和趋化因子的产生,它们调节适应性免疫系统,影响局部和全身免疫反应。
微生物群激活免疫细胞上的Toll样受体可在宿主体内产生低度全身性炎症,这与代谢和免疫反应的改变有关。微生物组的改变与疾病的发展有关,例如肥胖,炎症性肠病和癌症。
因此,SARS-CoV-2胃肠道感染和肠道稳态的改变可能与疾病的发展有关,并影响对口服疫苗和药物的免疫应答以及病原体的免疫应答。
一些研究强调了营养物质在调节对SARS-CoV-2或直接抗病毒和/或抗SARS-CoV-2特性的免疫应答中的潜在作用。
营养方面如肥胖,营养不良,和微量营养素缺乏已经假定作为严重COVID-19的危险因素。然而,人类微生物群的组成受到许多因素的影响,包括饮食成分。一些细菌可以发酵不可消化的碳水化合物(益生元),例如可溶性纤维,以产生短链脂肪酸(SCFA)。
短链脂肪酸
短链脂肪酸可以刺激共生细菌的生长和/或活性,并与健康有关。短链脂肪酸可以诱导肠屏障的调节,降低氧化应激,控制腹泻,并调节肠能动性,并且还诱导局部和全身抗炎作用。
短链脂肪酸可诱导抗炎细胞因子的释放,如IL-10,促进Th细胞和炎症性疾病的调节,包括炎症性肠病。
短链脂肪酸分为乙酸,丙酸和丁酸。所有短链脂肪酸都具有潜在的抗炎作用,降低前列腺素E2和炎症因子。
乙酸盐能抑制含有3个炎症小体的NLR家族pyrin结构域的激活;
丙酸盐能抑制组蛋白脱乙酰酶,减轻脂多糖引起的炎症。
丁酸盐具有抗癌和减少肺部炎症的作用。
总的来说,研究表明短链脂肪酸有直接抗炎作用或调节微生物群在局部(肠道)和非局部炎症中具有潜在的抗炎作用。
益生菌
对于胃肠微生物的调节,另一个干预是通过益生菌。益生菌是可以被摄入并与宿主产生有益相互作用的细菌。
一些研究调查对肠道菌群益生菌的作用,但有关它们移植物于共生微生物群的能力的结果相互矛盾。
然而,益生菌产生代谢物可影响共生微生物群,肠屏障,免疫系统。益生菌还可以帮助预防或治疗细菌和病毒感染。益生菌的使用可以提高感染流感病毒的小鼠的存活率。除流感病毒外,研究还显示出对呼吸道合胞病毒感染的有益保护作用。
益生菌在呼吸道病毒感染中的健康益处是由于细胞因子的产生和氧化应激的调节; 因此,它们可能是严重COVID-19期间促炎性细胞因子,趋化因子和氧化应激异常释放的辅助治疗。
最常用的益生菌是乳杆菌,双歧杆菌和肠球菌。尽管有大量研究表明它们具有健康益处,但目前在益生菌菌株之间涉及理想剂量和菌株之间比较的知识尚存在差距。
高纤维饮食
高纤维饮食可以诱导有益菌的繁殖,比如乳酸杆菌属和双歧杆菌属在胃肠道。实际上,高纤维饮食可能增加免疫球蛋白A的生产和调节干扰素-γ和白细胞介素(IL)-10的分泌,这有助控制胃肠道感染。
益生元
益生元可以通过一种称为交叉喂养的机制改变微生物群的组成,当益生元的发酵产物可以被另一种微生物作为底物使用。
益生元可以改变微生物群的另一种机制是通过改变pH值。
发酵产物主要是酸,这可能会导致肠道pH降低,抑制酸敏感细菌(如拟杆菌)的生长并促进产生丁酸的细菌生长。
病毒感染可以改变胃肠道微生物群。一份报告确认了COVID-19患者粪便样本中乳酸杆菌和双歧杆菌的减少。同样,必要或不必要使用抗生素会干扰COVID-19患者的微生物组。
肠道微生物组的改变包括在SARS-CoV-2清除后的30天内,柔嫩梭菌群Faecalibacterium prausnitzii、Eubacterium rectale和双歧杆菌的减少。
COVID-19中的微生物群失调可能与炎症反应有关,并且可能是COVID-19解决后的一个持久性问题,这表明营养干预可能在抑制炎症反应和重建COVID-19患者胃肠道稳态方面发挥作用。
低纤维饮食增加胃肠道感染的易感性
饮食和营养干预可以调节免疫反应,增加或抑制抗病毒反应。西式饮食(低纤维含量)可增加拟杆菌和减少厚壁菌,并与肥胖的发展有关,后者是严重COVID-19的危险因素。
虽然有报告指出肥胖者粪便样本中的短链脂肪酸增加,但短链脂肪酸与控制食欲和增加能量消耗有关。
此外,非常低纤维的饮食可以降低肠粘液的产生,增加胃肠道感染的易感性。
饮食的改变可以改变微生物群的组成。微生物群落处于不断变化之中,并且还受到食物消耗的季节性影响。事实上,减少纤维的消耗可以在短短的1天内改变微生物群,减少短链脂肪酸的产生。
高纤维饮食减少肺部炎症,促进抗炎反应
相反,高纤维饮食增加了肠道微生物群中的厚壁菌和放线菌,并增加了短链脂肪酸的产生,这有助于通过肠-肺轴减少肺部炎症,并通过IL-10的产生和Treg细胞促进局部和全身的抗炎反应。
益生菌治疗减少呼吸机相关肺炎
摄入益生菌可能会稳定或改变胃肠道微生物组,特别是在微生物组受到干扰后,如抗生素使用后或胃肠道感染。
使用枯草芽孢杆菌Bacillus subtilis和粪肠球菌Enterococcus faecalis的益生菌治疗已被证明可减少呼吸机相关肺炎。
鼠李糖乳杆菌Lactobacillus rhamnosus治疗可减少机械通气患者的呼吸机相关性肺炎和艰难梭菌相关性腹泻,使其成为重症监护病房辅助机械通气患者治疗的可能补充。
使用乳酸杆菌治疗可能特别重要,因为呼吸道感染可能导致乳酸菌减少,肠杆菌科增加和肠道IL-17炎症。
调节免疫应答
靶向IL-17被认为是治疗COVID-19的一种方法,因为与中度COVID-19患者相比,重度COVID-19患者的IL-17增加。
IL-17和产生IL-17的辅助性T细胞(Th17)、三型固有淋巴细胞、不变的自然杀伤细胞和γδT细胞参与了COVID-19的免疫应答。IL-17受体表达于许多不同细胞的表面,如中性粒细胞、嗜酸性粒细胞、上皮细胞、角质形成细胞和成纤维细胞。此外,IL-17可直接影响ACE2、SARS-CoV-2入口受体的表达。
IL-17阻断剂的使用,如针对IL-17A和/或IL-17受体A的单克隆抗体,可能代表了COVID-19的一种可能的治疗选择。尽管如此,IL-17在对抗肺炎链球菌Pseudomonas aeruginosa和铜绿假单胞菌Pseudomonas aeruginosa(呼吸道和肠道感染中常见的病原体)的免疫反应中是一种重要的细胞因子。
继发性细菌感染可发生在SARS-CoV-2感染后的呼吸系统,尤其是有创机械通气患者。IL-17对肠道内稳态尤其重要。因此,抗IL-17治疗应考虑呼吸道和肠道细菌感染易感性增加的可能风险。
增加短链脂肪酸辅助治疗
COVID-19患者也可能出现细胞因子风暴综合征,这可能导致多器官衰竭,并导致死亡或长期后果。在这种情况下,益生菌或益生元治疗通过增加短链脂肪酸在呼吸道感染中的抗炎作用已经被证实。
摄入高发酵纤维饮食、益生菌、口服三丁酸甘油酯(丁酸的前药)或直接服用短链脂肪酸等药物均可增加短链脂肪酸的生产和健康效益。
在这种情况下,摄入益生元和/或益生菌可代表COVID-19患者的显著预防性干预和/或康复。
显然,SARS-CoV-2可以感染胃肠道并影响肠道免疫反应和肠道微生物组。但胃肠道的SARS-CoV-2感染以及COVID-19在胃肠道稳态中的长期后果仍需进一步研究。
目前,尚无针对COVID-19的特异性治疗方法,但已对通过调节免疫应答或通过肠道微生物群进行营养干预的影响进行了研究,这可能是对COVID-19的重要干预和/或恢复的手段。
相关阅读:
参考文献
Zuo T, Liu Q, Zhang F, et al., Depicting SARS-CoV-2 faecal viral activity in association with gut microbiota composition in patients with COVID-19. Gut. 2021;70:276-284.
Yeoh YK, Zuo T,et al., Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut . 2021
Alberca GGF, Solis-Castro RL, Solis-Castro ME, Alberca RW. Coronavirus disease–2019 and the intestinal tract: An overview. World J Gastroenterol 2021; 27(13): 1255-1266
Vieira RS, Castoldi A, Basso PJ, et al., Butyrate Attenuates Lung Inflammation by Negatively Modulating Th9 Cells. Front Immunol. 2019;10.
Zhang N, Gong Y, Meng F et al., Comparative study on virus shedding patterns in nasopharyngeal and fecal specimens of COVID-19 patients. Sci China Life Sci. 2020

谷禾健康
感觉疲惫?沮丧?容易出汗?经常感冒?免疫力下降?骨痛?脱发?…
这些都可能与维生素D缺乏有关。
维生素D对人体健康很重要。然而流行病学研究表明,全世界近十亿人口受维生素D缺乏症的影响。
一项针对北京和上海50-70岁人群调查显示:

注:VD水平缺乏(低于20ng/ml);VD水平不足(低于30ng/ml)
首先我们来看下维生素D在人体中扮演怎样的角色。
维生素D
· 维生素D是脂溶性维生素
· 参与钙和磷的吸收,骨骼健康以及肌肉的生长和发育(生理过程)
· 刺激肌肉细胞的增殖和分化(影响肌肉系统)
· 其充足的供应可预防呼吸道感染,间接参与具有抗生素特性的化合物的生产(免疫系统)
· 其最佳含量对皮肤的状况和健康以及男性和女性生殖过程的调节都有积极的作用(皮肤)
为什么会有这么多人出现维生素D缺乏?
1. 饮食摄入和/或吸收减少
某些吸收不良综合症,如腹腔疾病,短肠综合症,胃搭桥,炎性肠病,慢性胰腺功能不全和囊性纤维化,可能导致维生素D缺乏。老年人中口服维生素D摄入量较低的情况更为普遍。
2. 减少阳光照射
大约50%-90%的维生素D通过阳光通过皮肤吸收,其余的来自饮食。为了防止维生素D缺乏,每天需要20分钟的阳光照射,皮肤暴露在40%以上。维生素D的皮肤合成随着年龄的增长而下降。黑皮肤的人皮肤维生素D的合成较少。在住院或长期住院的患者中减少的日光照射也会导致维生素D缺乏。持续使用防晒霜的人的有效日晒量降低。
3.内源性合成减少
患有慢性肝病(例如肝硬化)的个体可能具有缺陷的25-羟化作用,导致活性维生素D缺乏。1-α25-羟化作用的缺陷可见于甲状旁腺功能亢进,肾衰竭和1-α羟化酶缺乏症。
4.肝分解代谢增加
某些yao物会诱导肝p450酶,从而激活维生素D的降解。
5.维生素D 抵抗
在遗传性抗维生素D佝偻病中可以看到维生素D受体抵抗。
维生素D缺乏症的大多数患者无症状。
轻度的慢性维生素D缺乏症,也可能会导致慢性低钙血症和甲状旁腺功能亢进,特别是在老年人群中,可能导致骨质疏松,跌倒和骨折的风险。
长期严重维生素D缺乏症患者会出现与继发性甲状旁腺功能亢进有关的症状,包括骨痛,关节痛,肌痛,疲劳,肌肉抽搐(束缚)和无力。脆性骨折可能是由于长期缺乏维生素D导致骨质疏松所致。
在儿童中可能产生的症状:烦躁,嗜睡,发育迟缓,骨骼变化或骨折等。
其他一些症状可能会被忽视,其实也与维生素D缺乏有关,例如:
感到疲惫,免疫力下降,反复感染,容易出汗,脱发,伤口愈合慢,头晕,心脏问题,超重或肥胖,情绪低落,认知功能障碍等。
25(OH)D是血中维生素D的主要存在形式, 而且血清或血浆中25(OH)D受机体调节的影响较小, 可以在较长时间内维持稳定,可以体现膳食摄入维生素D和阳光维生素D的总量,这是评估维生素D水平是否正常的首选临床措施。
临床上,血清25(OH)D水平标准如下:
足够: 大于20–30 ng/ml 或50–75 nmol/L
安全上限: 不超过60 ng / ml 或 150 nmol/L
有毒: 高于150 ng/mL 或 375 nmol/L
毒 副 作 用
高维生素D水平是由于过量摄入而不是由于过度日光照射引起的。
急性中毒可导致急性高钙血症,可引起混乱,厌食,呕吐,多尿,多饮和肌肉无力。
慢性中毒可导致肾钙化和骨痛。
维生素D缺乏与许多非传染性疾病的发生有关,如结肠癌,乳腺癌,卵巢癌,肾癌,胰腺癌,精神分裂症,阿尔茨海默,多发性硬化,骨软化症,佝偻病,骨质疏松,糖尿病等。
4.1 呼吸道疾病
一些研究表明,维生素D补充剂可以增强免疫反应并预防呼吸道感染。
一项来自14个国家/地区的11,321人的研究表明,补充维生素D可以使维生素D缺乏和适当水平的人降低急性呼吸道感染(ARI)的风险。
来自三项随机对照试验的Meta分析研究中,发现补充维生素D可以降低维生素D水平低于25 nmol / L的患者慢性阻塞性肺疾病恶化率。
4.2 新 冠 肺 炎
与呼吸道疾病相关的,例如COVID-19。
最近的一项研究表明,血液中25(OH)D的浓度至少为30 ng / mL有助于住院的COVID-19患者减少临床预后不良和死亡的可能性。
研究分析了235例COVID-19患者的住院资料。与维生素D缺乏症患者相比,在40岁以上的患者中,维生素D含量适当的患者发生不良后果(包括失去知觉,缺氧和死亡)的可能性降低51.5%。
在疫情期间,我们可能常听到这样的词:“细胞因子风暴”。而维生素D缺乏会增强细胞因子风暴的过程。
注:细胞因子是蛋白质,是免疫系统不可或缺的一部分。它们可以同时具有促炎和抗炎作用,并发挥重要作用,有助于预防感染和疾病。但是,在某些情况下,细胞因子也会引起组织损伤。
细胞因子风暴是指响应感染或其他因素而发生的促炎性细胞因子的失控释放。细胞因子的这种失调和过度释放会导致严重的组织损伤,并增强疾病的进展和严重程度。
细胞因子风暴是导致多器官功能衰竭和急性呼吸窘迫综合征(ARDS)的主要原因,也是导致COVID-19进程和严重程度的重要因素。例如,已显示严重病例COVID-19的患者释放大量细胞因子,尤其是IL-1和IL-6。
维生素D缺乏与免疫功能降低有关,并可能增强细胞因子风暴。当然该领域还在研究中。
需要特别注意,单独服用补充维生素D并不能让你免受COVID-19的侵害。不过,缺乏维生素D可能会损害免疫功能,从而增加感染风险和对疾病的敏感性。
4.3 自 闭 症
自闭症是遗传和环境因素共同作用导致的神经发育异常,自闭症人群中维生素D的缺乏较常见,而维生素D能够促进儿童的大脑神经发育,因此可能在自闭症的病因学上起着重要作用。
采用随机双盲对照临床试验(RCT)设计,纳入109名自闭症儿童(85名男孩和24名女孩;年龄为3-10岁)。将自闭症患儿随机分组,分别接受维生素D3或安慰剂治疗4个月。结果发现,自闭症儿童可很好地耐受高剂量的维生素D3,且临床疗效较好。
这项研究是第一个证明维生素D3补充剂有益于自闭症患者的随机双盲对照试验,但是仍需更大规模的随机对照试验来严格验证维生素D对自闭症患者的疗效。
4.4 癌 症
对包括57,000多名受试者的18项随机对照试验(RCT)进行的荟萃分析发现,每天摄入维生素D补充剂可降低总死亡率。补充钙和维生素D降低了罹患总癌症,乳腺癌和结直肠癌的风险。
一项RCT显示,钙和维生素D可以大大降低绝经后妇女的所有癌症风险。
近几年来的人群研究还发现,机体维生素D水平与肠道菌群之间也存在密切联系。
生命早期生长发育与维生素D有关
我们知道,婴儿在出生6 个月内身体生长发育迅速,所以需要充足的营养。维生素D 缺乏是婴儿早期营养不足的主要原因之一,维生素D 补充不足会严重影响婴儿的骨骼发育。
有研究显示,婴儿体重与维生素D 缺乏具有明显关联性。婴幼儿缺乏维生素D 也会影响肠道菌群的定植能力和数量平衡,导致消化系统功能失调造成吸收功能障碍。

婴儿期肠道菌群数量的改变受多种因素影响。研究显示,维生素D可通过信号传导来增强肠道结构屏障的完整性和提高肠道免疫反应能力,进而稳定菌群在肠道的定植和数量平衡。
婴儿在1 岁以内是肠道内菌群定植、演替和达到平衡的主要阶段,特别是肠道内双歧杆菌、大肠杆菌、乳杆菌等主要菌体在婴儿出生半年内完成定植、演替和数量的平衡,对增强机体免疫力和促进消化吸收起到了重要作用。
在最近对3-6 个月大的婴儿肠道微生物群的研究中,研究人员发现脐带血维生素D 水平与乳球菌减少有关。

正常成年人补充维生素D 后,普氏菌属(Prevotella)的丰度随维生素D 的摄入量增加而增加,嗜血杆菌(Haemophilus)和韦荣氏球菌(Veillonella)的丰度随维生素D 的摄入量增加而降低,粪球菌属(Coprococcus)和双歧杆菌属(Bifdobacterium)的丰度与血清25-OH-D 水平呈负相关。
上述资料表明从婴儿期到成人期,维生素D 对肠道菌群的组成具有调节作用。
维生素D减少与肥胖有关
有研究显示,饮食中类固醇类物质的缺乏会影响肠道菌群的定植和平衡状态,使菌群数量明显增加,可能与肥胖的发生均有一定关系,但仍需进一步研究证实。
维生素D 还可促进脂肪细胞内Ca2 + 的吸收,使脂肪酸合成酶的活性增强进而减少脂肪的分解,增强脂肪细胞的储脂能力。所以体内维生素D 含量减少时,体内脂质代谢会明显增强和细胞内储脂能力降低,导致肥胖发生。
国内学者发现,超重和肥胖患者血清中维生素D 水平明显低于正常水平,且维生素D 与BMI 和腰围指标呈独立负相关性。
维生素D 缺乏的婴儿体重和BMI 指标明显高于维生素补充充足的婴儿。肠道菌群数量的增加与肥胖具有密切联系,特别是乳酸杆菌和双歧杆菌以及肠球菌能增加体重和引起肥胖。
该研究发现,观察组婴儿补充维生素D 后乳酸杆菌、双歧杆菌、肠球菌含量明显低于对照组。
活性维生素D代谢产物
多项研究表明,肠道菌群会改变肠道维生素D的代谢,而益生菌补充剂会影响循环中的维生素D水平。维生素D缺乏会降低防御素的生成,防御素是一种对于维持健康肠道菌群非常重要的抗菌分子。正如研究人员期待的那样,口服合成防御素分子能够恢复肠道菌群平衡,降低血糖水平,并改善脂肪肝症状。

最近Nature Communications上发表的一项横断面研究,对567名老年男性的血清维生素D代谢产物及粪便菌群进行深入分析后发现,8种特定肠道细菌分类群与维生素D活性形式——1,25(OH)2D的水平相关,而更高的1,25(OH)2D水平与更健康的肠道菌群(更多的丁酸盐产生菌)相关。同时,1,25(OH)2D水平较高的男性具有更大的多样性。
这些结果提供了强有力的证据,表明宿主维生素D信号和老年人肠道菌群健康之间存在重要的相互作用。肠道中CYP27B1-和CYP24A1-24-羟化酶的共定位表达可能会被存在的微生物群增强或抑制。
无论是通过饮食干预和/或在临床上给合适的人群补充维生素D,发现与更有利的肠道微生物多样性相关的活性维生素D代谢产物(包括已知的丁酸盐生产者的特定微生物)可能会为临床提供潜在的干预目标。
自闭症儿童维生素D水平较低现象
大量研究证实,自闭症儿童的维生素D 水平低于同龄健康人群,并且足量、规范地补充维生素D 可改善其自闭症核心症。
动物实验研究表明,发育早期维生素D 缺乏会导致永久性的大脑发育异常,如神经生长因子(NGF)表达减少、侧脑室增大、神经结构或神经递质相关基因(如MAP2, NF-L,GABA-Aa4)表达降低、脑组织氨酰胺水平普遍降低、去甲肾上腺素和丝氨酸水平升高、多巴胺水平升高、5-HT 水平下降等。
维生素D——神经保护剂
而维生素 D的存在,可以改善由于脑部炎症和神经毒性引起的脑损伤,促进NGF表达,延缓神经元细胞死亡。因此,维生素D 可以作为一种神经保护剂保护大脑皮层神经元避免兴奋性毒性。
自闭症儿童肠道患病率更高
自闭症儿童存在免疫系统功能紊乱,胃肠道紊乱患病率高于正常发育儿童。一项超过14,000 例自闭症患者的多中心研究显示,自闭症患者炎症性肠道疾病患病率为0.83%,而全院患者患病率为0.54%;自闭症患者其他胃肠道紊乱疾病患病率为11.74%,而全院患者患病率为4.5%,表明自闭症肠道患病率更高。
Wang L 等研究发现,在自闭症患者和正常人群中发现鲍氏梭状芽孢杆菌存在明显差异。自闭症患者肠道中的脱硫菌属比正常人群明显增多,且普通拟杆菌属含量丰富,自闭症患者与对照组正常人群肠道中的放线菌及变形菌属含量也有差异。
还有研究观察到自闭症患者肠道中有更高水平的萨特菌和瘤胃球菌属。国外通过自闭症小鼠模型肠道菌群宏基因组的研究发现,其脆弱拟杆菌属、梭菌属比例较对照组明显异常,口服脆弱拟杆菌可改善自闭症样行为症状。
维生素D通过影响Th17/Treg细胞平衡改善菌群紊乱
维生素D 可调节Th 细胞以及Treg 细胞功能,可抑制Th17 细胞,并促进Treg 细胞的增殖。Th17/Treg细胞平衡可能是维持正常的机体整体免疫功能和肠道免疫屏障功能中关键的因素。
维生素D 通过影响Th17/Treg细胞平衡调节自闭症肠道的菌群紊乱,进而通过脑肠轴作用改善神经系统的发育。
这些研究提示,自闭症存在肠道微生物生态失衡,肠道微生物失衡的改善很有可能作为自闭症治疗新的发展方向。
VD与肠道菌群相互影响,从而影响肠道疾病
结直肠癌
2009 年Volker Mai 团队研究了非裔美国人结直肠癌高于白种美国人,研究发现非裔美国人饮食中的环杂胺明显增高,维生素D 摄入量明显减少,两组人群的粪便微生物群组成也存在差异,推测环杂胺、维生素D 与肠道菌群的组成有相互影响,从而影响肠道环境促进结直肠癌的发生。
克罗恩病
维生素D 缺乏与克罗恩病(Crohn’s disease,CD)的发病有关,研究表明补充维生素D3 会改变CD 患者肠道细菌组成,参与者口服维生素D3,从第1 天至第3天每天服用20000 IU,然后每隔一天服用一次,共4 周,CD 患者口服一周后,Alistipes 菌、Barnesiella 菌、紫单胞菌科(Porphyromonadaceae)、Roseburia 菌、Anaerotruncus 菌、Subdoligranulum 菌和Ruminococaceae(均为厚壁菌门)的丰度显著增加。
炎症性肠病
1,25-OH2-D3 治疗还可在炎症性肠病中改变肠道菌群的组成,从而对小鼠有保护作用。
在肠道性疾病中肠道细菌组成多发生改变,补充维生素D 则可调节已经发生改变的肠道菌群组成。通过补充维生素D可以改变肠道内不同菌种的含量,调节肠道菌群的组成,增加双歧杆菌,拟杆菌,降低大肠杆菌和肠球菌的含量和比例。
肠炎
此外,益生菌治疗沙门氏菌肠炎的研究显示益生菌在维生素D 受体(VDR)缺陷小鼠中没有显示出保护作用,而在野生型小鼠中可抑制沙门氏菌诱导的炎症和损伤。
VDR基因消融降低肠道中DEFA5和MMP7表达,肠道通透性增加,肠道内环境紊乱,维生素D参与ß-防御素-2的表达,通过ß-防御素-2的表达与肠道菌群相互作用,改善肠道环境以及影响肠道炎症,并且存在剂量关系。溃疡性结肠炎急性期用维生素D能够缓解急性期症状,改善肠道粘膜和肠道菌群。此外,推测益生菌对个体起效可能依赖于VDR 基因。
以上,我们看到在各种肠道疾病的条件下,补充维生素D在一定程度上能改善肠道菌群。那么在缺乏维生素D的健康个体中,补充维生素D对肠道菌群是否有益?
近日,一项研究对80位健康维生素D缺乏的女性进行补充维生素D的治疗。

该研究主要是解决两个问题。
1. 补充维生素D对受试者的肠道菌群的影响
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
2. 评估受试者菌群是否与他们的无反应状态有关。
注:无反应状态指一部分人群口服高剂量的维生素D也无效。
已有研究表明,Bacteroides acidifaciens可以预防肥胖和提高胰岛素敏感性,也是大肠中促进IgA抗体产生的主要共生菌之一。在该研究中,无反应者中较低的Bacteroides acidifaciens以及补充维生素D后的额外消耗表明,这种细菌可能与补充维生素D的反应有关。
因此,研究人员有这样一个设想,维生素D的补充促进有益菌生长,以维持免疫微生物的体内平衡。当然,需要开展更大队列的实验研究,以充分代表有反应者/无反应者,来证实该研究的发现。
6.1 鱼 类
鲑鱼
鲑鱼是一种受欢迎的脂肪鱼,也是维生素D的重要来源。

根据USDA食物成分数据库显示,一份3.5盎司(100克)大西洋鲑鱼每份含526 IU维生素D。
一些研究发现野生鲑鱼的含量更高,每份高达1300 IU。而鲑鱼养殖平均含量为250 IU。
鲱鱼
鲱鱼也是维生素D的最佳来源之一。每100克新鲜大西洋鲱鱼可提供216 IU,如果不是新鲜的鱼,腌鲱鱼也是维生素D的良好来源,每100克提供112 IU。

其他鱼类包括沙丁鱼,大比目鱼和鲭鱼等,都是维生素D的良好来源。
金枪鱼罐头
每包100克可含多达268 IU的维生素D,然而金枪鱼罐头中一般含有甲基汞(甲基汞是许多鱼类中发现的一种毒素)。可以选择淡金枪鱼(通常比白金枪鱼更好),每周不超过170克,可以防止甲基汞过多。

鱼肝油
鱼肝油每匙(4.9毫升)含维生素D约448 IU。同时也富含维生素A,omega-3脂肪酸等,但是不要服用过量。
6.2 蛋 黄
不吃鱼的人应该知道,海鲜不是维生素D的唯一来源。全蛋是另一种良好的来源,也是一种营养丰富的食品。
鸡蛋中的蛋白质大多在蛋清中,而脂肪、维生素和矿物质主要在蛋黄中。一颗标准的蛋黄含有37 IU的维生素D。

蛋黄中的维生素D含量取决于阳光照射和鸡饲料中维生素D的含量。当使用相同的饲料时,在阳光下漫游的牧场饲养的鸡所产卵的水平要高3-4倍。
从饲养的鸡中选择鸡蛋,或者从市场上购买富含维生素D的鸡蛋,可以满足日常需求。
6.3 蘑 菇
蘑菇是维生素D的唯一良好植物来源。蘑菇有点像人类,蘑菇在暴露于紫外线时也可以合成维生素D。不同的是,蘑菇产生维生素D2,而动物产生维生素D3。
某些野生蘑菇每100克包装含维生素D高达2300 IU。总的来说,只有野生蘑菇或经紫外线照射的蘑菇才是维生素D的良好来源。

6.4 强化食品
注:强化食品指向食品中添加一定量的食品营养强化剂,以提高其营养价值。
牛奶
有些牛奶中富含维生素D。每杯牛奶(237毫升)通常含有115-130 IU。
豆浆
通常会含维生素D以及牛奶中常见的其他维生素和矿物质。一杯(237毫升)通常含有107-117 IU的维生素D。
橙汁
一杯(237毫升)强化橙汁,包括高达100 IU的维生素D,当作早餐开启一天的活力。

燕麦片
半杯(78克)可提供维生素D量为54–136 IU。
注意以上食物中维生素D计算是强化食品中的含量。
最后,要提醒大家的是,“过犹不及”。维生素D虽然好,但不能补充过量。一旦维生素D过量,就会对身体带来伤害。
大剂量的维生素D服用一开始没有症状,但过几个月或几年就开始显现了,严重的情况下甚至可能导致肾脏衰竭和动脉钙化。
每天摄入1000-4000IU(25-100微克)的维生素D应该足以确保大多数人的最佳血液水平。
附 录 : 特殊人群维生素D补充剂量
维生素D缺乏引起的骨软化需要起始每日使用3000-40000IU的维生素D,随后使用每日400IU的维持剂量。
肠道吸收不良或肝脏疾病引起的维生素D缺乏通常需要每日使用40000IU(成人)治疗,每日10000-25000IU(儿童)。
甲状旁腺功能减退引起的低钙血症需要使用每日最多100000IU维生素D
——参考自:《DK家庭用药指南》
相关阅读:
参考文献:
Sizar O, Khare S, Goyal A, et al. Vitamin D Deficiency. [Updated 2020 Jul 21]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan
Nair R, Maseeh A. Vitamin D: The “sunshine” vitamin. J Pharmacol Pharmacother. 2012 Apr;3(2):118-26.
Holick MF. Vitamin D: important for prevention of osteoporosis, cardiovascular heart disease, type 1 diabetes, autoimmune diseases, and some cancers. South Med J. 2005 Oct;98(10):1024-7.
Czernichow S, Fan T, Nocea G, Sen SS. Calcium and vitamin D intake by postmenopausal women with osteoporosis in France. Curr Med Res Opin. 2010 Jul;26(7):1667-74. [PubMed] 4.
Naeem Z. Vitamin d deficiency- an ignored epidemic. Int J Health Sci (Qassim). 2010 Jan;4(1):V-VI.
Singh Parul,Rawat Arun,Alwakeel Mariam et al. The potential role of vitamin D supplementation as a gut microbiota modifier in healthy individuals.[J] .Sci Rep, 2020, 10: 21641.
Thomas MK, Lloyd-Jones DM, Thadhani RI, Shaw AC, Deraska DJ, Kitch BT, Vamvakas EC, Dick IM, Prince RL, Finkelstein JS. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998 Mar 19;338(12):777-83.
Gröber U, Kisters K. Influence of drugs on vitamin D and calcium metabolism. Dermatoendocrinol. 2012 Apr 01;4(2):158-66.
Pereira-Santos M, Costa PR, Assis AM, Santos CA, Santos DB. Obesity and vitamin D deficiency: a systematic review and meta-analysis. Obes Rev. 2015 Apr;16(4):341-9.
Elliott ME, Binkley NC, Carnes M, Zimmerman DR, Petersen K, Knapp K, Behlke JM, Ahmann N, Kieser MA. Fracture risks for women in long-term care: high prevalence of calcaneal osteoporosis and hypovitaminosis D. Pharmacotherapy. 2003 Jun;23(6):702-10.
Kennel KA, Drake MT, Hurley DL. Vitamin D deficiency in adults: when to test and how to treat. Mayo Clin Proc. 2010 Aug;85(8):752-7
Palacios C, Gonzalez L. Is vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol. 2014 Oct;144 Pt A:138-45.
Zadka K, Pałkowska-Goździk E, Rosołowska-Huszcz D. The State of Knowledge about Nutrition Sources of Vitamin D, Its Role in the Human Body, and Necessity of Supplementation among Parents in Central Poland. Int J Environ Res Public Health. 2018;15(7):1489. Published 2018 Jul 14.
Sordillo JE, Zhou Y, McGeachie MJ, et al. Factors influencing the infant gut microbiome at age 3-6 months: Findings from the ethnically diverse Vitamin D Antenatal Asthma Reduction Trial (VDAART) [J]. J Allergy Clin Immunol, 2017, 139(2):482-491.
Luthold RV, Fernandes GR, Franco-de-Moraes AC, et al. Gut microbiota interactions with the immunomodulatory role of vitamin D in normal individuals[J]. Metabolism, 2017,69:76-86.
Mai V , Mccrary Q M , Sinha R , et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers[J]. Nutrition Journal, 2009, 8(1):49.
White JH. Vitamin D deficiency and the pathogenesis of Crohn’s disease[J]. Steroid Biochem Mol Biol, 2018,175:23-28.
Schäffler H, Herlemann DP, Klinitzke P, et al. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn’s Disease patients, but not in healthy controls[J]. Journal of Digestive Diseases, 2018, 19(4): 225- 234.
Ooi JH, Li Y, Rogers CJ, et al. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis[J]. J Nutr, 2013,143(10):1679-1686.
Shang M, Sun J. Vitamin D/VDR, Probiotics, and Gastrointestinal Diseases[J]. Curr Med Chem, 2017,24(9):876-887.
李子傲. 母乳喂养对肠道菌群的影响[J]. 营养与健康,2016, 10( 8) : 97-99.
汪英,袁莉,李广利,等. 肥胖与血清维生素D 水平的关系研究[J]. 中华内分泌代谢杂志,2011,27 ( 7) :589-590.
祝海波,周苗苗,王海,张晓宇.婴儿早期维生素D补充水平对生长发育和肠道菌群的影响[J].中国食物与营养,2018,24(12):87-89.
李苹,昌雪莲,尚煜,刘雅静,陈晓宇,梁爱民,齐可民.婴儿早期维生素D补充对生长发育及肠道菌群的影响[J].公共卫生与预防医学,2018,29(01):12-16.
杜琳. 维生素D介导的Th17/Treg细胞稳态调节对孤独症大鼠肠道菌群失调作用的研究[D].吉林大学,2019.