-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
炎症,慢病
炎症,作为一种保护机制,其本身是有益的。因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是由心理因素还是器质性因素(如抗原或损伤)引起的,持续或反复激活免疫系统都会导致长期的炎症反应,从而引发低度慢性炎症。
失调的炎症作为影响最常见慢性病的驱动因素,它不分青红皂白地影响着整个人体。
人体,作为一个综合系统,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且过程还与反馈相关。人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症不仅是身体系统的“表达语言”,也是解决多种慢性疾病的指标或目标。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现,即一个人身上“多种不同疾病”的个例,实际上是由炎症这一共同线索串联起来的。
因此,识别具体的炎症来源、标志物,并综合这些指标来判别定位这些影响的靶器官或组织,是预防和管理慢性病的重要思路。
未来的预防医学需要无创、便捷且准确的方法来判别炎症源和炎症反应影响的靶器官或组织。例如,识别促炎细胞因子如IL-1、IL-6、IL-12、IL-18、TNF-α、IFN-α,组织代谢物如尿酸盐晶体和肝素结合蛋白的变化以及是否高负荷状态,是未来医学的重要一环。
随着大数据和多组学技术的发展,目前还可以通过分析体温、血压、心率等生理指标的变化,同时结合微生物组学、基因组学、蛋白组学数据,识别出与炎症水平相关的身体标志物,将有助于为个体综合治疗管理提供更加全面的依据。
本文将回顾了促炎和抗炎调节的局部免疫级联以及与神经和心理通路相互关联的反馈回路。
共同探讨和尝试了解身体这个精细调节的系统,如果遭受持续不断的“超负荷”将导致全身性炎症,从而导致慢性疾病的出现。描述了几种常见疾病的途径,以及这些详细理解对临床医学、预防和卫生系统等的启思。

■ 免疫系统的主要目标:
清除体内外来或非自身细胞物质,如细菌、病毒、真菌、寄生虫和受损细胞。
■ 免疫系统由两个分支组成:
先天免疫系统是基本的首道防线,负责启动炎症反应。
适应性免疫系统进化得更高级,能够在生物体一生中接触抗原时“学习”并形成“记忆”。

免疫系统的两个分支虽然功能各异,但都致力于保护身体的健康。它们的主要任务是协同工作,并有效清除体内的有害物质(非自身细胞物质)。这两个分支都负责监测整个身体的抗原存在情况;但每个分支的启动方式却不同。
简而言之,这两个分支就像是身体的两支特种部队,各有所长,但通力合作,共同守护健康。
■ 初级淋巴器官
包括骨髓和胸腺,淋巴细胞在此生成和/或分化。例如,T 细胞在胸腺中分化并经历正向和负向选择,使 T 细胞进入血液,只有当识别具有主要组织相容性复合体 (MHC) 标记的细胞并呈递抗原时,T 细胞才会被激活。
■ 次级淋巴器官
包括淋巴结和脾脏,它们是幼稚免疫细胞的储存器。淋巴结过滤淋巴系统并提供抗原激活白细胞与 B 细胞和 T 细胞之间的相互作用。
幼稚白细胞监测血液和组织中的外来抗原和/或被免疫信使(如细胞因子)招募到炎症部位并被激活。一旦被激活,白细胞就会清除受影响区域的外来抗原、受感染、受伤或死亡的细胞,并协助修复。
免疫细胞利用细胞因子作为自分泌、旁分泌或内分泌信使,在彼此之间以及与其他生物系统之间进行交流,从而产生协同、拮抗或多重效应。
注:自分泌(Autocrine)信使:
自分泌信使是指细胞释放的化学物质作用于同一细胞自身。这种信号传递方式使细胞可以调节自身的功能和活动。例如,一种细胞产生某种激素或生长因子后,会通过自分泌方式使自身的生理活动发生变化。
旁分泌(Paracrine)信使:
旁分泌信使是指细胞释放的化学物质作用于邻近的细胞。这种类型的信号传递对于局部细胞间的通讯至关重要。例如,在伤口愈合过程中,某些细胞释放的生长因子可以影响周围细胞的增殖和修复能力。
内分泌(Endocrine)信使:
内分泌信使是指细胞或腺体释放的激素通过血液循环到达远离其来源的靶细胞,通常这种信号传递作用于身体内的多个系统。例如,胰腺分泌的胰岛素通过血液传播,调节各个组织的糖代谢。
细胞因子环境可以调节适应性免疫反应。例如, IL-2(白细胞介素 2) 和 IFN-γ(干扰素-γ) 的产生支持细胞毒性 T 淋巴细胞的激活,是抵抗细菌和病毒所必需的。然而,高水平的IL-4和IL-6支持B淋巴细胞的激活和增殖,有利于抗体的产生。
先天免疫系统不仅涉及细胞防御,还涉及物理和化学屏障。
物理屏障包括皮肤和呼吸系统及胃肠道系统的粘膜。化学屏障是胃的酸性 pH 值。
尽管先天免疫系统比较简单,但它是造成即时非特异性炎症的原因,例如皮肤割伤引起的发热、发红、疼痛、肿胀。
利用识别细菌常见膜配体的模式识别受体 (PRR),先天免疫系统可以检测多种微生物抗原并引发炎症反应。
注:模式识别受体(Pattern Recognition Receptors,PRR)是存在于宿主细胞表面或细胞内的一类受体,主要负责识别和应对病原体(如细菌、病毒、真菌和寄生虫)以及其他有害物质(如损伤相关分子模式,DAMPs)。这些受体在先天免疫系统中发挥关键作用,帮助机体快速识别并响应感染和损伤。
此外,血液中还存在可溶性模式识别受体,包括补体系统。补体是一系列蛋白质,可导致微生物膜上“穿孔”,并有助于招募炎症细胞。
积极参与先天免疫反应的免疫细胞包括巨噬细胞(活化单核细胞)、中性粒细胞、自然杀伤 (NK) 细胞和树突状细胞 (DC)。
利用吞噬作用清除抗原或微生物,并产生活性氧来杀死微生物。
裂解病毒感染的细胞。一旦被激活,NK 细胞就会继续通过细胞因子招募新的免疫细胞。
也称为抗原呈递细胞 (APC),会迁移到淋巴结以引发适应性免疫系统的激活。
对先天免疫系统有效性至关重要的细胞因子包括 IL-1、IL-6、TNF-α、IFN-α。这些免疫信使会引发发烧、疼痛和疲劳(临床上称为疾病行为),并激活下丘脑-垂体-肾上腺轴 (HPA轴)。
■ IL-1(白细胞介素-1):
IL-1是一种主要的促炎细胞因子,由巨噬细胞、单核细胞和其他免疫细胞产生。
它有两种主要形式:IL-1α 和 IL-1β。
主要功能包括促进炎症反应、刺激T细胞和B细胞的增殖、诱导发热,并参与机体对感染和损伤的反应。IL-1还可以促进其他细胞因子的产生,增强免疫反应。
■ IL-6(白细胞介素-6):
IL-6是一种多功能细胞因子,由多种细胞产生,包括巨噬细胞、内皮细胞和肌肉细胞。
它在急性炎症、免疫反应和细胞增殖中发挥重要作用。IL-6可以刺激B细胞分化为抗体产生细胞,促进T细胞增殖,并参与急性期反应,增加急性期蛋白的产生。
■ TNF-α(肿瘤坏死因子-α):
TNF-α是一种主要的促炎细胞因子,由巨噬细胞、T细胞和其他细胞产生。
它在免疫反应和炎症中发挥关键作用,能够诱导细胞凋亡、促进炎症反应、增强免疫细胞的活性,并参与各种疾病的病理过程,如自身免疫病和感染。
■ IFN-α(干扰素-α):
IFN-α是干扰素家族中的一种,主要由病毒感染的细胞、T细胞和树突状细胞产生。
它在抗病毒免疫中发挥重要作用,能够增强细胞的抗病毒能力,抑制病毒复制,并刺激邻近细胞产生其他抗病毒蛋白。IFN-α还可以增强白细胞的活性,促进适应性免疫反应。
这些细胞因子在免疫反应、炎症以及与多种疾病(如感染、癌症和自身免疫疾病)的发展中扮演着重要的角色,它们的相互作用和调控对于维持机体的免疫平衡和健康至关重要。
更进化的适应性免疫系统仅存在于脊椎动物中,负责增加抗原清除的强度和特异性,以及发展记忆,以便在二次接触时更快地清除抗原。

在人类中,适应性反应需要10-14 天才能产生原发性抗原特异性反应。
T 细胞有两种主要类型:辅助性T (TH) 细胞 (CD4+) 和细胞毒性T (TC) 细胞 (CD8+),它们在血液和淋巴系统中循环,并驻留在次级淋巴器官中。
一旦 T 细胞通过 APC 呈现抗原,它们就会分化为记忆细胞和效应细胞。TC效应细胞是细胞毒性 T 淋巴细胞 (CTL),可裂解携带抗原的细胞。
APC(抗原呈递细胞,Antigen-Presenting Cell)
是免疫系统中的一种特殊细胞,负责捕获、处理和呈递抗原(如病原体、毒素和其他外源性物质)以激活T细胞,从而启动适应性免疫反应。APC在免疫反应中的作用至关重要。
■ 常见的APC包括:
树突状细胞:最有效的抗原呈递细胞,负责捕获外来物质并在淋巴结中激活T细胞。
巨噬细胞:具有吞噬和消化病原体的能力,也能呈递抗原。
B细胞:虽然主要功能是产生抗体,但也能作为APC呈递抗原。
■ 抗原呈递的过程
抗原呈递涉及以下步骤:
捕获抗原:APC通过吞噬或内吞作用捕获外源性抗原,通常是在感染的部位或周围组织。
处理抗原:APC内的酶会将捕获的抗原分解成小肽片段。
呈递抗原:这些小肽片段与主要组织相容性复合体(MHC)分子结合,然后被转运到APC的细胞表面。

编辑
■ MHC分子分为两类:
MHC I类:呈递内源性抗原,通常由所有有核细胞表达,主要激活CD8+细胞毒性T细胞。
MHC II类:呈递外源性抗原,通常由APC(如树突状细胞和巨噬细胞)表达,主要激活CD4+辅助T细胞。
■ T细胞激活与免疫应答
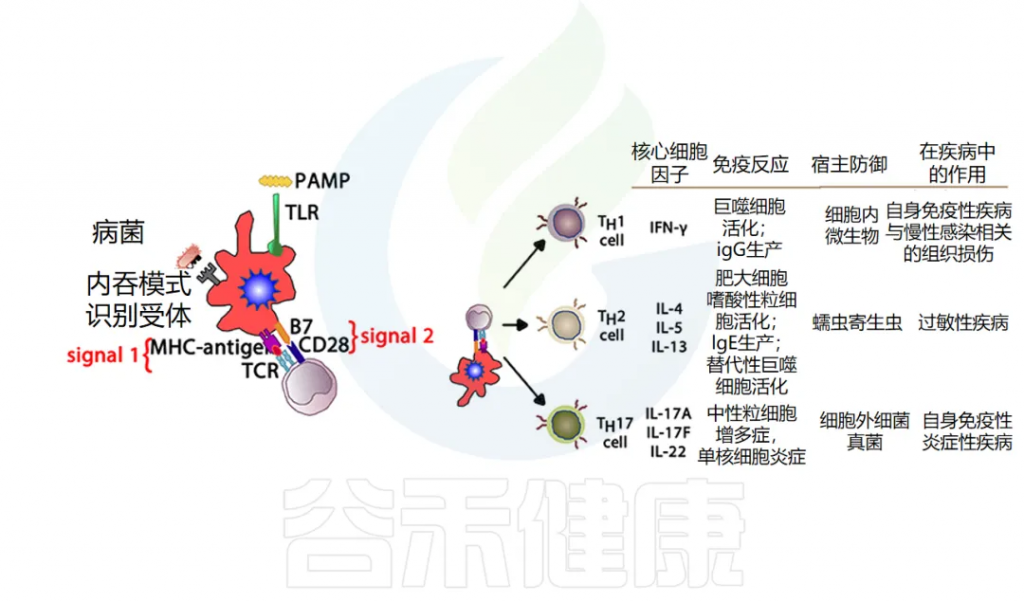
T细胞激活:当T细胞的T细胞受体(TCR)识别并结合APC表面的抗原-MHC复合物时,它们被激活。激活后的T细胞会增殖,分化为效应T细胞,参与免疫应答。
TH效应细胞功能:负责产生细胞因子并指导 B 细胞发育或动员。先天免疫细胞产生的当前细胞因子环境会影响 TH细胞的发育,进而影响免疫反应的进程,使其倾向于两个主要方向之一。
TH1 细胞产生细胞因子 IL-2、IFN-γ 和 TNF-α,这些细胞因子可驱动 CTL 活化并支持细胞免疫。这种细胞介导的免疫反应对于针对细胞内细菌和病毒产生有效反应至关重要。
注:CTL是适应性免疫系统中的主要效应细胞,负责识别和消灭被病毒感染的细胞以及肿瘤细胞。其主要功能是通过释放细胞毒性因子来诱导靶细胞凋亡,从而发挥抗感染和抗肿瘤的作用。
另一方面,TH2 细胞产生IL-4和IL-5,进而支持B细胞活化和分化,也称为体液免疫。
TH和TC记忆细胞通过血液和淋巴系统监测身体是否反复接触抗原。这两种细胞类型对于快速、有效地对抗原产生二次反应都至关重要。
其他T细胞亚群的作用
其他T细胞亚群也被定义为在宿主防御中发挥关键作用,并且更多 T 细胞亚群的重要性日益得到认可:T 调节细胞(Treg)和 TH17 细胞。
Treg细胞在调节其他免疫反应中起着核心作用,它们释放 TGF-β 和 IL-10 来下调 TH1 和 TH2 细胞的过度活化,如果不加以控制,这些细胞分别可能导致自身免疫或过敏性疾病。
TH17 会释放 IL-17,在涉及中性粒细胞募集(尤其是对粘膜)的抗菌防御中起重要作用,在防御某些特定病原体(如念珠菌)方面发挥着特别重要的作用。
■ 体液免疫的重要性
体液免疫反应,在对抗细胞外微生物和在对抗原的原发性和继发性反应期间产生抗体反应方面非常重要。
未成熟 B 细胞遍布全身,在淋巴结中浓度较高。活化的 B 细胞成为效应浆细胞,并制造抗原特异性抗体,以中和游离抗原或标记受感染细胞以进行破坏。
记忆 B 细胞是长效细胞,通过为吞噬或溶解免疫细胞创造更大的攻击目标(如在原发性反应中)来支持在第二次接触期间更快地清除。
例如,NK 细胞和巨噬细胞检测抗体复合物,从而导致抗体中和抗原或受感染细胞的吞噬。此外,抗体可以激活或延续补体级联。
当身体感受到感染、创伤、缺血、物理、化学或其他形式的“危险”时,就会引发炎症。
暴露于病原体相关分子模式 (PAMP) 和损伤相关分子模式 (DAMP) 会导致单核细胞-巨噬细胞谱系细胞激活,从而表达促炎基因并抑制抗炎基因。
■ 病原体相关分子模式 (PAMP)
定义:PAMP是指广泛存在于病原体(如细菌、病毒、真菌和寄生虫)中的特征分子,相较于宿主细胞而言,这些分子是特异性地存在于病原体中。
常见的PAMP示例包括:
特点:
PAMP通常是高度保守的分子结构,使得宿主的免疫系统能够快速识别和应对多种病原体。
功能:
PAMP通过与宿主细胞的模式识别受体(PRR,如Toll样受体等)结合,激活免疫反应,包括炎症反应、白细胞的招募和抗体的产生。它们在启动先天免疫反应中起到关键作用。
■ 损伤相关分子模式 (DAMP)
定义:DAMP是指宿主细胞在受到损伤、死亡或应激时释放的内源性分子。这些分子可以被免疫系统识别,从而触发免疫反应。
常见的DAMP示例包括:
特点:DAMP并不是特定于病原体的,而是在细胞受到损伤或应激时由宿主自身细胞释放的。
功能:DAMP通过与模式识别受体相互作用,促进免疫细胞的活化,诱导炎症反应,帮助机体清理损伤细胞并启动修复过程。
细胞因子和趋化因子在炎症中的作用
细胞因子、趋化因子和其他化学物质的产生会介导非特异性细胞募集和体液介导的血管变化。这些细胞过程由各种细胞内信号传导和核转录途径介导。
促炎反应:NF-κB 和 AP-1
NF-κB 和 AP-1 这两种转录因子在促炎反应中扮演关键角色,它们能够驱动促炎细胞因子(如TNF-α 和 IL-1)、趋化因子(如 CCL2 和 CXCL8)以及内皮粘附分子的表达,从而影响炎症反应的进程。
干扰素反应因子 IRF3 和 IRF7
另一方面,干扰素反应因子 IRF3 和 IRF7 则主要负责促进 I 型干扰素(如 IFN-α 和 β)的产生,这些干扰素在对抗病毒防御中具有重要作用。
然而,炎症反应并不仅仅由这些分子机制所限定。实际上,除了病原体引起的免疫激活外,非抗原性刺激也能触发炎症过程。
非抗原刺激引发的炎症反应
非抗原刺激可能被视为“危险”并引发炎症反应;这些影响包括创伤,如辐射、缺血、毒素暴露,甚至心理压力。
这些因素可能通过各种机制诱发炎症,包括激活神经内分泌通路(如情绪压力所见,见抑郁症部分),或通过上调刺激炎症信号传导的“应激”通路,如缺血性中风中的小胶质细胞激活。
环境毒素和化学物质的影响
如农药残留、添加剂、防腐剂等,也可能通过激活细胞色素 P450 通路、诱导活性氧或代谢为具有免疫毒性作用的反应中间体和新抗原,来诱发炎症活动。也就是说,我们日常接触的化学物质可能正悄悄影响着我们的免疫系统。
芳烃受体 AhR 在炎症中的角色
在探讨了化学物质如何诱发炎症之后,我们进一步了解到芳烃受体AhR在其中扮演的角色。芳烃受体AhR激活可以介导对一系列内源性和外源性配体的炎症反应,在粘膜免疫和正常屏障功能中发挥关键作用,同时也是各种致癌因素途径,如二恶英的致病。强调了环境因素与炎症性疾病之间的复杂联系。
临床上,炎症的典型表现是疼痛、发热、发红、肿胀和功能丧失。组织损伤会导致组胺释放,刺激毛细血管扩张,导致血管淤滞,使吞噬细胞迁移和血浆渗漏(发红、发热和肿胀)。
缓激肽的释放会增加含有神经末梢的组织的疼痛敏感性。功能丧失被认为是对疼痛的神经反射。
吞噬活性可清除病原体,炎症级联的下调可导致愈合。
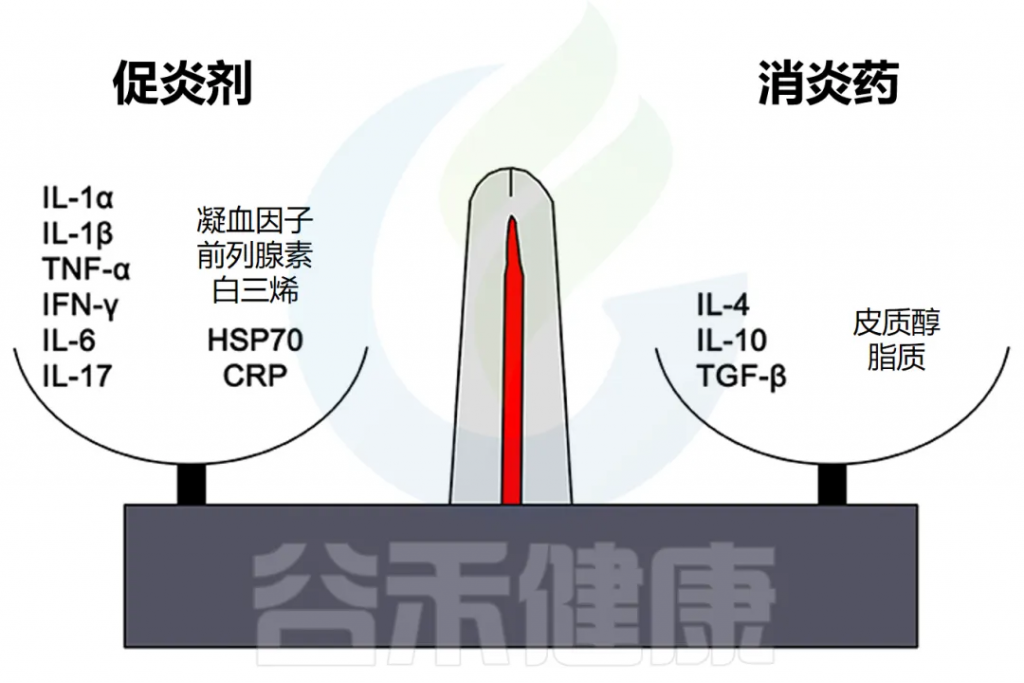
细胞因子在炎症中的双重作用
IL-1、IL-6 和 TNF-α 等因子有利于炎症,而 IL-10 和 TGF-β 等细胞因子可抑制炎症。
然而,这些区别并不是绝对的,有些因素起着双重作用。例如,IL-4 会干扰某些肿瘤的炎症,但有利于过敏症中的抗体产生。
慢性炎症中IL-6的作用
在慢性炎症的背景下,IL-6 通常被认为是促炎的,然而,也有 IL-6 具有抗炎作用的例子,也可能表明其他自然的持续过程,如组织修复。因此,在检查炎症水平时,结合背景至关重要,才得出正确的结论。
doi.org/10.3389/fmed.2018.00316
此外,炎症平衡的非细胞因子介质包括促炎化学物质,如 CXCL8 趋化因子和某些金属蛋白酶,以及抗炎剂,包括抗菌肽、TIMP(金属蛋白酶组织抑制剂)和趋化因子 CCL2 。
这些“宏观”炎症变化受免疫调节途径控制。然而,免疫反应释放的免疫介质和细胞因子会触发神经元反应,从而放大局部炎症反应,并触发全身神经内分泌和神经反应,最终导致炎症过程消退并恢复正常的稳态。
这些正常的反馈回路可能会因中枢神经系统长时间或不适当的激活而中断,从而导致激素抑制不足导致过度炎症,或因过度或长时间的抗炎反应导致不受控制的感染。
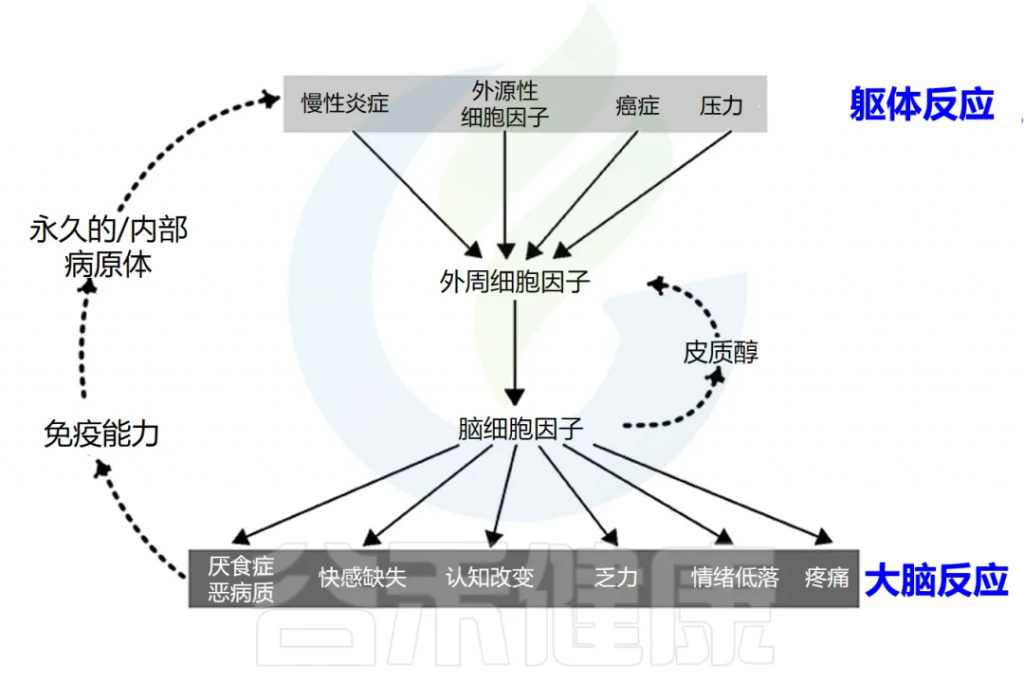
炎症会导致全身不适反应
可能会出现发烧、恶心、食欲不振、疲倦,睡眠质量差、易怒、情绪低落、注意力不集中、健忘、社交退缩等。
这些症状是由促炎细胞因子引发的,包括 IL-1α、IL-1β、TNF-α、IFN-γ、 IL-6等。虽然它们是对感染的局部反应,但它们会刺激大脑细胞因子系统,导致出现疾病症状,促使人们减少活动,多休息更好地应对感染。
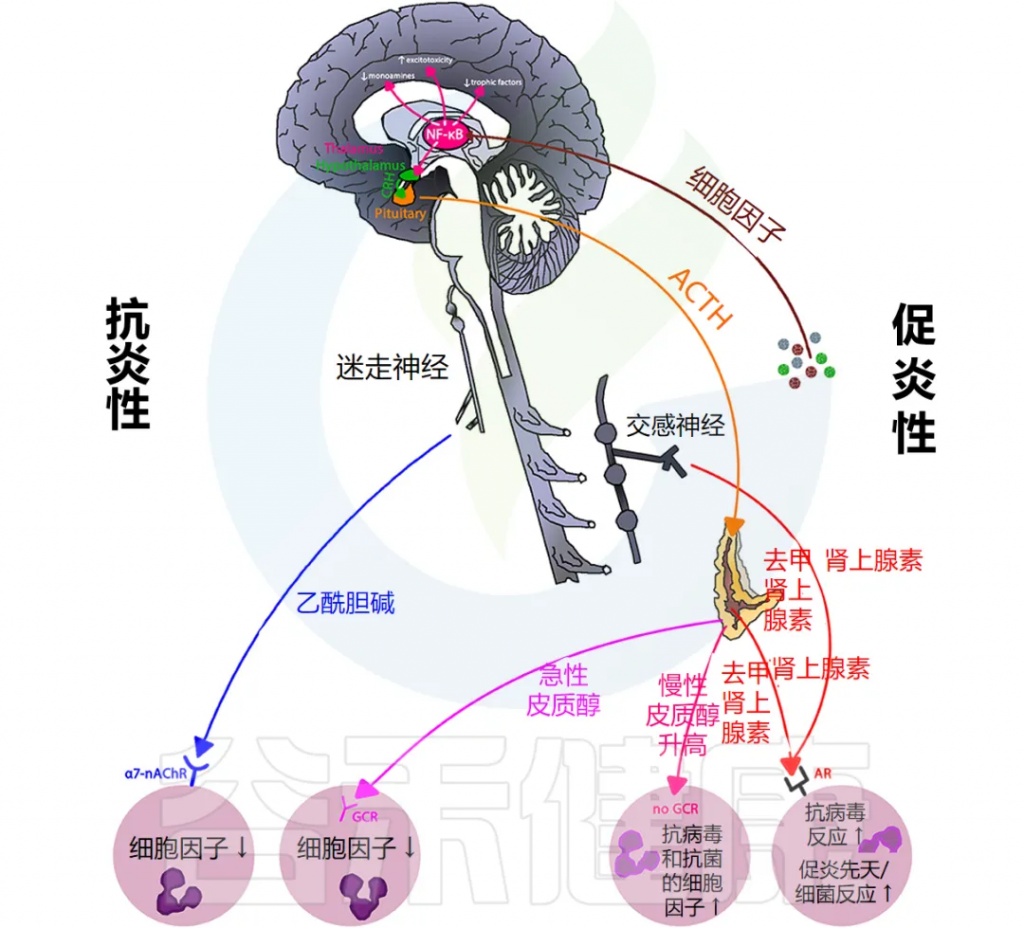
炎症通过激活许多不同的反馈回路触发全身反应。中枢神经系统 (CNS) 对环境刺激反应迅速,导致神经递质和神经肽与免疫介质刺激的相同信号通路结合。
炎症部位释放的免疫调节剂与疼痛通路的神经递质受体相互作用,反过来,局部神经肽可以释放组胺等促炎介质来增强局部炎症反应。
神经对炎症的反应很快,但会随时间而变化,并且可能对炎症过程产生放大或抑制作用,因此临床上观察到的疾病行为会随时间而变化。
总体而言,这些神经反应模式旨在维持正常的生理稳态,以响应免疫系统刺激和正常组织功能的恢复。
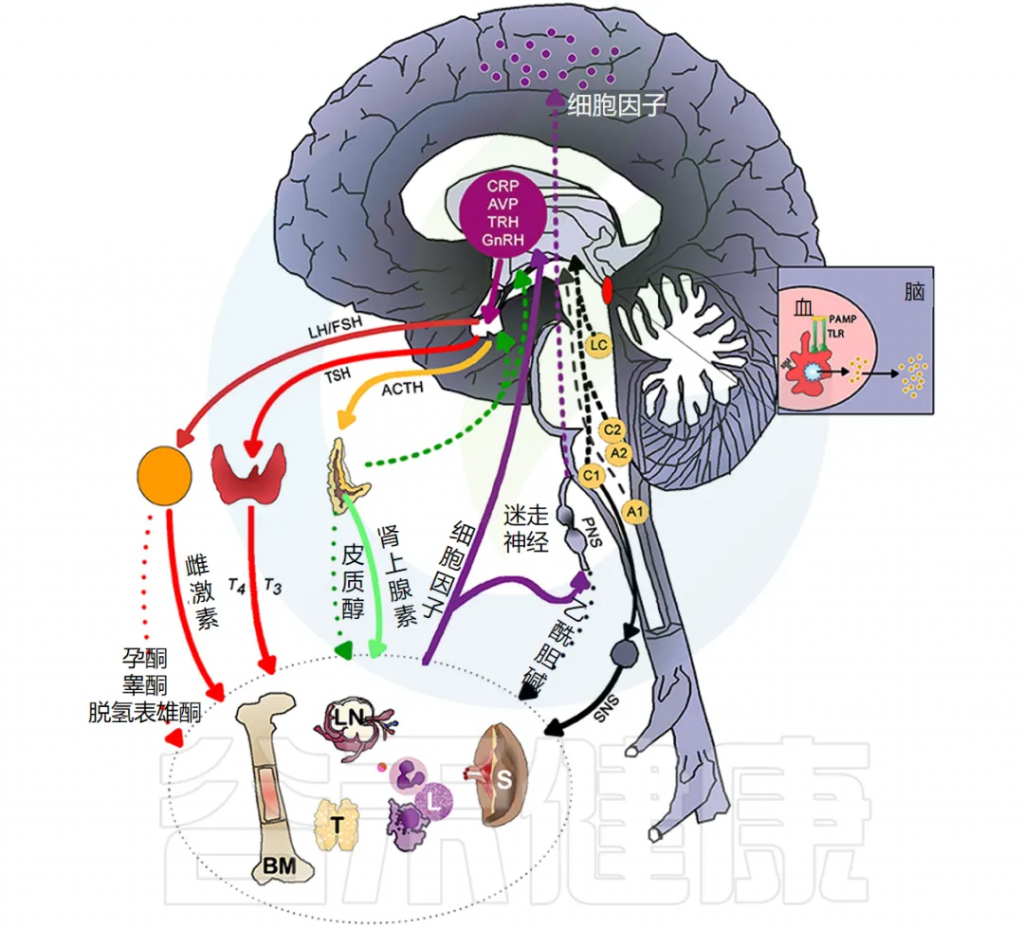
下图说明大脑免疫系统的主要通路和反馈回路。
doi.org/10.3389/fmed.2018.00316
交感神经系统 (SNS) 激活促进免疫细胞活动和全身免疫反应,而副交感神经系统 (PNS) 和下丘脑-垂体-肾上腺 (HPA) 轴通常会抑制炎症反应。然而,慢性应激反应系统的激活会导致免疫细胞过度活跃并促进全身炎症(详情将在下一节讨论)。
大脑中有小胶质细胞、巨噬细胞和树突状细胞等免疫细胞,它们在受到炎症刺激时会产生细胞因子和前列腺素,刺激神经和非神经脑细胞受体,从而影响大脑功能。
小胶质细胞和神经元可以对外周细胞因子的产生作出反应。此外,小胶质细胞是免疫系统中的常驻神经细胞,对细菌脂多糖 (LPS) 敏感,由于 Toll 样受体 (TLR) 的表达,它可直接引发中枢神经系统炎症,而无需外周细胞因子的参与。
无论是与实际年龄还是慢性疾病状态相关的衰老大脑,都有更多反应性小胶质细胞,它们对刺激有过度的细胞因子反应,并破坏神经可塑性以及行为和认知功能。
doi.org/10.3389/fmed.2018.00316
大脑对外周免疫反应的监测
大脑还通过传入神经刺激、体液途径、跨血脑屏障的细胞因子交换以及血管周围巨噬细胞和脑小静脉内皮细胞上的 IL-1 受体激活来监测外周免疫反应。
抗炎细胞因子的调节作用
大脑中的抗炎细胞因子 IL-10 和 TGF-rβ 可改善疾病体验。在健康状态下,大脑中的促炎和抗炎细胞因子保持平衡。由于衰老与先天免疫系统活动增加有关,因此大脑会产生大量的促炎细胞因子,但抗炎细胞因子的产生会减少,从而导致更明显的疾病行为。
皮质醇的基本功能
皮质醇是一种糖皮质激素,影响身体的日常功能,如能量利用/储存、记忆形成、呼吸、心率、胃肠功能和情绪。它有稳定的昼夜节律,但也会因内部(如过度免疫活动)和外部(如感知到的威胁)压力源而释放。皮质醇是下丘脑-垂体-肾上腺 (HPA) 轴的终产物。
HPA轴与皮质醇的调控
下丘脑的促肾上腺皮质激素释放激素 (CRH) 会启动垂体前叶释放促肾上腺皮质激素 (ACTH)。ACTH 通过血流传播并刺激肾上腺皮质产生皮质醇。
通过对海马中的糖皮质激素受体进行负反馈,皮质醇会阻止 CRH 和 ACTH 的进一步释放。其他各种激素,包括雄激素、雌激素、垂体后叶激素、加压素和催产素,都可以调节HPA轴。
皮质醇与免疫系统的相互作用
在调节良好的系统中,免疫细胞会表达糖皮质激素受体,从而使皮质醇抑制免疫细胞活化和促炎细胞因子释放。
然而,慢性压力可能会长时间升高皮质醇水平,导致糖皮质激素受体表达下调。因此,不受调节的免疫细胞会产生过量的促炎细胞因子。
“
皮质醇作为HPA轴的终产物,在调节身体对压力的响应、维持生理平衡以及抑制免疫反应中发挥着关键作用。理解皮质醇的生理作用及其调控机制,对于我们认识压力如何影响健康具有重要意义。同时,慢性压力下皮质醇水平的变化及其对免疫系统的潜在影响,也提示我们在面对长期压力时需要采取适当的应对策略,维护身心健康。
自主神经系统直接连接大脑和周围器官和组织。其两个独立分支发出相反的信息,即交感神经兴奋和副交感神经放松。
■ 交 感 神 经 系 统
交感神经支配将大脑直接与肾上腺髓质联系起来,让身体做好“战斗或逃跑”的准备。
交感神经激活后,肾上腺髓质会释放儿茶酚胺、肾上腺素和去甲肾上腺素,这些物质会导致心率、血压和呼吸频率增加,并将血液从非重要器官转移到主要肌肉群和大脑。
尽管儿茶酚胺的半衰期较短且在血液中代谢迅速,但交感神经系统 (SNS) 也直接支配作为免疫细胞储存器的次级淋巴结构。因此,慢性交感神经激活和去甲肾上腺素释放可导致免疫失调。例如,去甲肾上腺素促进核因子 κB (NF-κB) 活化,这会增加几种促炎介质的基因表达,进而增强炎症。
此外,肾上腺素在应激期间会增加 IL-6 和 TNF-α 的产生。因此,肾上腺素和去甲肾上腺素可以诱导促炎细胞因子的产生并增强全身炎症。
■ 副 交 感 神 经 系 统
副交感神经与交感神经的平衡
副交感神经系统 (PNS) 通过多种方式对抗交感神经系统,例如减慢心率、降低呼吸频率、促进消化和平静情绪。迷走神经具有传入和传出神经纤维,用于大脑和周围神经之间的双向通讯。
副交感神经的免疫调节作用
副交感神经激活会导致乙酰胆碱释放。乙酰胆碱可以与免疫细胞表面的 α7 烟碱型乙酰胆碱受体 (nAChR) 结合。α7 nAChR 刺激可抑制 NF-κB 改变炎症表达,从而导致细胞因子产生减少和抗炎作用。
PNS在压力管理中的角色
在静息期间,PNS控制着器官和身体功能。长期压力下,如果交感神经占主导地位,PNS对免疫功能的调节作用可能会受到抑制。
维持平衡的自主神经系统
即休息时迷走神经占主导地位,以及 PNS 的动态、可变激活,与情绪反应和压力脆弱性有关。Porges 的多重迷走神经理论利用进化和发展的方法,将 PNS 活动和社会沟通与支持对宁静、潜在危险和危及生命的环境做出适应性反应的电路层次联系起来。
神经内脏整合模型,以描述压力源(无论来源如何)如何从外周感觉汇聚到大脑,这些信息如何整合,以及 PNS 反应的灵活性,对于理解个体生理如何受到调节至关重要。
心率变异性的评估与意义
无论使用哪种视角,心率变异性 (HRV) 都可以评估 PNS 对 SNS 的影响,PNS 激活的变异性越大(即身体越平衡、越灵活),HRV 就越高。
因此,与 HRV 较低的人相比,HRV 较高的人功能更好,幸福感更强(例如,社交、情感、心理、生理),包括炎症更低。对于初级保健临床医生和为弱势群体服务的医疗工作者来说,HRV 可以作为个人功能状况的良好估计,包括免疫功能的间接替代指标。
炎症消退的其他途径
虽然本文主要关注神经内分泌系统和免疫系统之间的交集,但我们认识到还有其他途径可以消退炎症。例如,脂质介质(如消退素、保护素和马来素)在关闭和清除急性炎症反应方面起着关键作用。此外,这些生物活性脂质似乎可以阻断 NF-κB 活化,这与皮质醇和乙酰胆碱的作用相似。
Tips
因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是心理上还是器质性(即抗原、损伤)相关的,持续或重复激活免疫系统都会导致长期暴露,从而导致低度炎症。
这种慢性炎症会破坏多个系统,因为它会影响神经系统,并通过细胞因子受体在多个身体组织中表达而局部破坏多个系统。
作为一个综合系统,人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症受促炎和抗炎细胞因子的产生所调节。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现。在综合系统中,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且总是与反馈相关,以调节“致病变量”的行为。
例如,外部因素和内部因素可导致相同的表型结果;社会经济地位低和脂肪组织过多都与慢性炎症有关。这种炎症加剧会导致大脑细胞因子信号增加,损害学习和记忆,并导致抑郁症状或病态行为;
这种反馈导致负面或不健康的系统性循环进一步传播。因此,不受控制或失调的炎症将慢性身心疾病的表现结合在一起,这些疾病通常普遍存在于高压力、脆弱的人群中(例如少数民族、社会经济地位较低等)。
目前,大多数疾病的病因都是由外部致病因素和/或内部生物医学变化导致疾病的宏观和/或微观表现所致。然而,一个显而易见但很少被提出的问题是:这些疾病是如何促成的?
大多数疾病(无论是急性还是慢性)都是由炎症引起的。
神经内分泌—免疫平衡失调,无论是受到“压力”和侵入性病原体等外部因素刺激,还是受到糖尿病或肾衰竭等代谢紊乱等内部因素刺激,都会导致免疫细胞活动失控。抗炎机制的同步丧失导致细胞因子负荷升高,进而激活 NF-κB和基因转录调控。
此外,许多疾病都是触发了“相关”疾病共病,如心脏病和糖尿病。疾病分类只提供了表型分类或命名,而不考虑潜在的病因和生理网络相互作用。
这些见解挑战了当前对“多重患病”的方法,一个人的表型疾病集合是精细调节的相互关联的生理网络反应的出现结果。
这里我们看到了,体内促炎与抗炎活动的微妙平衡,为我们提供了一种有效且高效的机制,以应对所有可能威胁生物体生存的内外干扰。这种平衡确保了我们能够迅速而恰当地响应各种挑战。
接下来我们将详细(但也不全面)地概述许多常见慢性疾病背后的一些重要炎症机制。特别是强调了,通过刺激下丘脑-垂体-肾上腺 (HPA) 轴而激活的炎症与慢性交感神经激活对疾病的促进之间的关联。
过去 30 年来,过敏性呼吸道疾病(过敏性气道疾病、哮喘和过敏性鼻炎)的患病率不断上升;哮喘影响约 8% 的人口,过敏性鼻炎影响 15% 至 20% 的人口。
过敏原的类型
过敏是指对环境中普遍存在且本质上相对无害的病原体产生的不适当的破坏性反应。
常年诱因包括:
屋尘螨、动物皮屑、霉菌、蟑螂蛋白。
季节性诱因包括:草、树、杂草的花粉。
更多过敏原及过敏的预防措施详见:
过敏的机制
过敏症,即在TH2 型 T 细胞的驱动下,对普遍存在的抗原产生过量 IgE 抗体。过敏症是由过敏原特异性 IgE 反应引起的,可通过表皮皮肤测试(下图)或血液过敏原特异性 IgE 测量来证实。
此类测试可揭示致敏的存在,但只有一小部分人会发展出临床上明显的过敏性疾病:过敏性皮炎(湿疹)、过敏性鼻炎、哮喘、食物过敏和其他过敏反应等。
特应性具有很强的遗传决定性
如果父母一方患有特应性,则患过敏性疾病的可能性约为 50%,而如果父母双方都患有特应性,则患过敏性疾病的可能性为 70%。
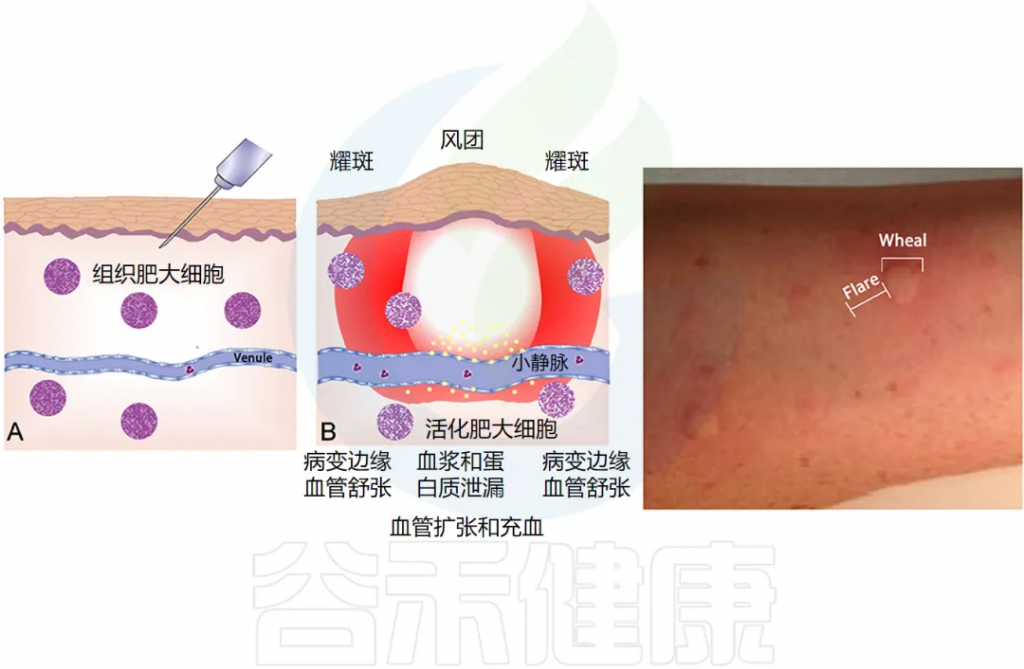
doi.org/10.3389/fmed.2018.00316
哮喘
哮喘是一种疾病,表现为反复发作的呼吸道受阻。特征包括时好时坏的气道堵塞、慢性的支气管炎症和对刺激表现出极强的敏感性。
过敏性哮喘的成因
这些问题主要是由于气道对某些过敏物质的强烈反应引起的,尤其是由一些特定化学物质(如白三烯)引发的过敏反应。
不过,对于约30%没有明确过敏原的哮喘患者,这种病可能是因为对多种刺激(如感染、药物、寒冷、胃酸倒流和运动)过度反应引起的。
非过敏性哮喘的成因
在所谓的“非过敏性”哮喘患者中,包含许多不同的亚群。其中一些亚群表现与典型过敏反应相似,但不产生过敏抗体,而另一些亚群则表现出不同的免疫特征。
过敏性呼吸道疾病的免疫机制
对于过敏性呼吸道疾病,免疫系统的某些细胞会将入侵体内的外来物(称作抗原)处理和呈递给免疫细胞,导致过敏反应的发生。这一过程需要多种信号进行协调,类似打响并引导免疫反应。
如果在抗原呈递过程中,有些特定信号分子(如IL-4)成为主导,会导致免疫细胞趋向于“过敏反应”,这时体内如哮喘的表现就可能加重。
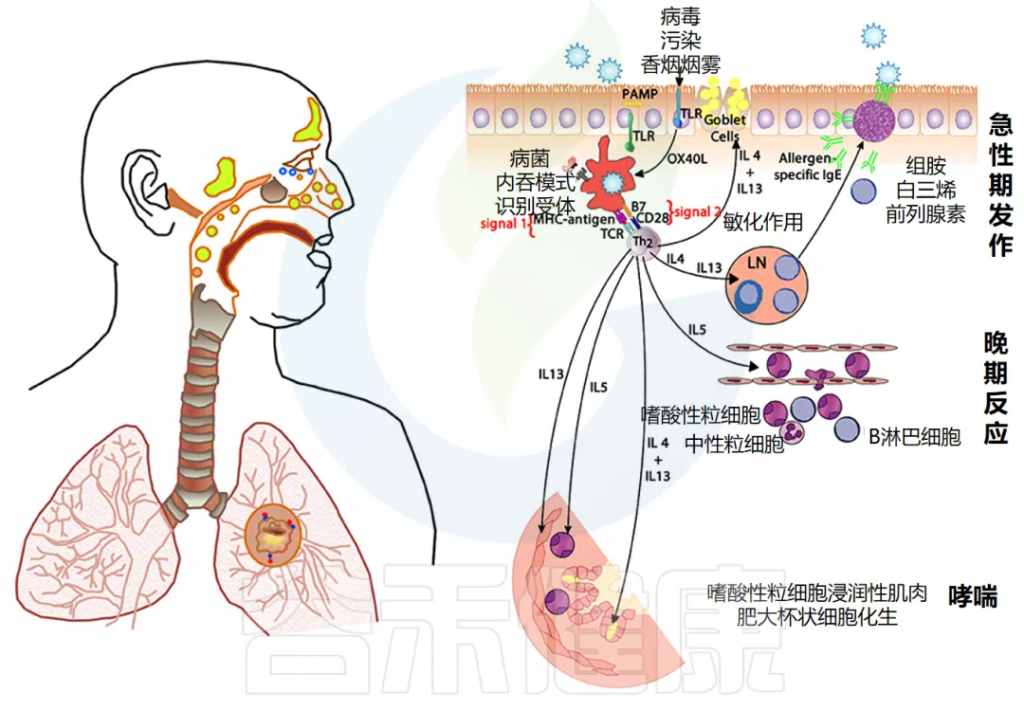
doi.org/10.3389/fmed.2018.00316
自身免疫性疾病影响大约 5% 的人口 ,并表现为一系列全身性疾病(如狼疮、硬皮病)和器官特异性性疾病(如慢性荨麻疹、甲状腺炎)。
自身免疫性疾病的成因
自身免疫性疾病是当身体的免疫系统错误地攻击自身组织时发生的。这种情况通常是因为身体的“中枢”和“外周”耐受机制失效了。
有些人可能携带自身抗体或免疫细胞,但这并不意味着他们一定会得自身免疫性疾病。这些抗体和细胞在某些情况下可能有助于清除体内的损伤产物。
自身免疫性疾病的诊断
在怀疑患有自身免疫性疾病的个体血清中检测抗体,在许多情况下都具有很大的诊断帮助作用。
例如,在系统性红斑狼疮 (SLE) 中检测 ANA,在类风湿性关节炎中检测抗环瓜氨酸肽 (anti-CCP),在乳糜泻中检测组织转谷氨酰胺酶 (tTG) 抗体。
然而,重要的是不要根据这些抗体的存在推断它们具有致病性。事实上,大多数可以识别抗体的自身免疫性疾病实际上主要由 T 细胞介导的病理学介导,抗体只不过是诊断上有用的附带现象。这些细胞介导的疾病的例子通常由相对较新定义的 TH17(IL-17 分泌)途径的过度活动主导,并涉及淋巴细胞和/或中性粒细胞浸润和炎症组织破坏,包括 1 型糖尿病、牛皮癣、桥本甲状腺炎、多发性硬化症、类风湿关节炎、克罗恩病。
自身免疫性疾病的风险因素
这些疾病的发生受遗传和环境多方面因素的影响,比如遗传缺陷、自身抗原的异常暴露或环境因素(如感染)都会增加风险。基因尤其在6号染色体上的影响较大,这与免疫系统在识别和耐受自体组织时发挥的作用有关。
doi.org/10.3389/fmed.2018.00316
心血管疾病是世界范围内慢性发病和死亡的最大原因,主要涉及冠状动脉和脑动脉。其基础是动脉粥样硬化,这是一种血管慢性炎症性疾病。
动脉粥样硬化的病理过程
动脉粥样硬化斑块的关键部位是其肩部区域,该区域被活化的 T 细胞、巨噬细胞和肥大细胞浸润,这些细胞会产生促炎介质和酶。斑块破裂会引发血小板聚集和血栓形成,导致急性缺血、临床症状和潜在的远端细胞死亡。
巨噬细胞在动脉粥样硬化中的作用
巨噬细胞是动脉粥样硬化病变的标志。
泡沫细胞的形成:它们通过清道夫和 Toll 样受体 (TLR) 摄入氧化低密度脂蛋白 (oxLDL)。胆固醇在细胞质中酯化,将巨噬细胞转化为泡沫细胞。
泡沫细胞的炎症作用:氧化脂蛋白向斑块周围的细胞发出信号,尤其是向内皮细胞和泡沫细胞发出信号,增加粘附分子的表达,进而吸引更多的单核细胞和淋巴细胞进入局部活化的内皮细胞。
泡沫细胞和活化的内皮细胞产生促炎细胞因子——IL-1、IL-6、IL-12、IL-18、IFN-γ、TNF-α,这会加剧炎症反应。
动脉粥样硬化病变的组成与免疫反应
动脉粥样硬化病变包含巨噬细胞、T细胞、树突状细胞、蛋白聚糖和平滑肌细胞以及从血液中渗出的胆固醇。氧化胆固醇会触发先天性和适应性免疫反应,导致 T 细胞活化和抗体产生。
TH2 细胞产生 IFN-γ,具有促炎作用,并通过激活巨噬细胞进一步驱动炎症活动,而 TH2 细胞产生 IL-4 和 IL-5。
TH1 和 TH2 活性是自我调节的:
在斑块内,TH1活性占主导地位,但被巨噬细胞和 TH2 细胞产生的 IL-10 所平衡(下图)。
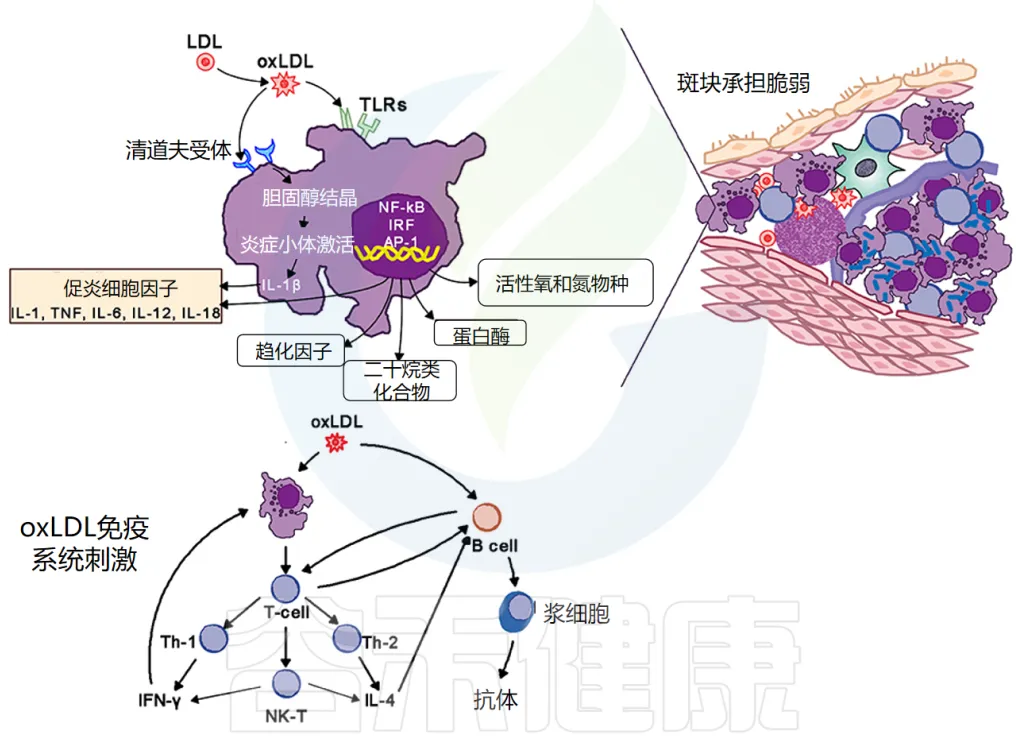
doi.org/10.3389/fmed.2018.00316
动脉粥样硬化的免疫调节和治疗策略
不同免疫细胞之间的相互作用有可能显著影响斑块炎症的结果。
实验研究表明,输注 IFN-γ、IL-12 或 IL-18 均会增加动脉粥样硬化,而输注 CD50L 和 oxLDL 抗体则会减少动脉粥样硬化。
抗炎治疗的潜力
TGF-β 被发现具有抗炎作用,一方面限制白细胞的募集,另一方面促进胶原蛋白的合成,从而稳定斑块。
此外,衣原体等生物体可能会激活 TLR 并促进动脉粥样硬化的炎症过程 。
他汀类药物的治疗作用
在治疗上,他汀类药物可抑制 Rho/ROCK 通路并阻断 IL-1β 的促炎作用。
扩展阅读:
心脏自主神经调节异常(心脏自主神经重塑,交感神经活动增加而副交感神经活动减少)会增加恶性心律失常和心源性猝死的风险,尤其是在患有心血管疾病的患者中。
如前提到的,交感神经激活具有促炎作用,而副交感神经调节具有抗炎作用,炎症可能在心律失常的发生中起着核心作用。
炎症生物标志物与猝死风险
事实上,炎症生物标志物水平升高与心源性猝死风险增加有关。在一项 17 年的随访期内,无论老年人是否患有心脏病(心力衰竭或心肌梗死),IL-6 或 C反应蛋白 (CRP) 水平升高都与心脏猝死风险增加有关。即使在调整基线风险因素后,IL-6 仍存在心脏猝死风险,但 CRP 则不存在。
炎症与心房颤动的关联
促炎途径也可能在心房颤动 (AF) 中发挥重要作用。研究证实,炎症过程会损害心房并促进电紊乱,最终导致 AF。具体来说,他们在孤立性心房颤动患者的心房活检中发现淋巴单核细胞浸润,但在对照受试者(Wolf-Parkinson’s-White 综合征患者)中从未发现过。
随后,许多临床研究证实了炎症生物标志物(CRP、IL-2、IL-6、IL-8、TNF-α;单核细胞趋化蛋白-1)与持续性和阵发性心房颤动之间存在密切关联。
抗炎治疗在心律失常治疗中的潜力
炎症与心房颤动(心律不齐的一种)和心源性猝死(心脏突然停止导致的死亡)有密切关系。因此,针对炎症的治疗可能成为治疗心律失常的新方法。
抗炎药物,如非甾体抗炎药(NSAID)和皮质类固醇,已经被证明可以降低手术期间心房颤动的风险。然而,在其他患者中,这些药物反而可能增加心房颤动的发生率。此外,这些药物对室性心律失常(心室的心律不齐)和猝死的影响还不清楚,需要进一步研究。
炎症正在成为衰老的最重要机制(称为炎症衰老),并在大多数解释模型中发挥着不可或缺的作用。
衰老是细胞损伤不断积累的结果,而这种损伤与无法清除损伤相关分子模式 (DAMP) 有关——坏死细胞的分解产物、细胞外 ATP、尿酸、淀粉样蛋白原纤维、游离胆固醇晶体。
注:关于损伤相关分子模式 (DAMP),我们在文章前面介绍过。
组织先天免疫细胞对DAMP的响应
组织先天免疫细胞包括巨噬细胞、脑中的小胶质细胞、肝脏中的库普弗细胞、骨中的破骨细胞和肾脏中的系膜细胞可以检测 DAMP。
慢性炎症与衰老
DAMP 负荷的增加导致炎症小体复合物的持续激活,从而释放促炎细胞因子(IL-6 和 IL-18),引起持续的低度慢性炎症。
慢性炎症的特征是血清或受影响器官组织内和周围促炎标志物持续低水平升高,临床上与神经退行性疾病、代谢紊乱、癌症、肌肉骨骼疾病、心血管疾病和虚弱有关。
衰老过程中炎症标志物的变化
与年轻人相比,50 岁以上的人群中促炎标志物(如 IL-6、IL-18、TNF-α 和 CRP)和血清淀粉样蛋白 A 升高 2-4 倍。值得注意的是,即使在没有特定疾病的情况下,多个器官的慢性低度炎症也会导致功能衰竭。
IL-6与衰老相关性
特别是,IL-6 水平较高与虚弱和残疾程度增加有关,临床上与步行速度慢、肌肉力量弱、小腿功能差和贫血有关。在老年患者中,体质虚弱的患者促炎标志物水平较高,而抗炎标志物水平较低,如皮质醇、IL-10。
扩展阅读:
免疫衰老
免疫衰老是指随着年龄增长,适应性免疫系统功能衰退,先天免疫系统过度活跃。
虽然绝对淋巴细胞计数保持不变,但 B 细胞、T 辅助细胞 (CD4+) 和 T 细胞毒性细胞 (CD8+) 的绝对数量减少,而 NK 细胞数量增加。
幼稚 T 细胞也会减少,导致对新抗原的反应减弱,T 细胞和 B 细胞克隆扩增,尤其是针对 CMV、EBV 和 VZV 等疱疹病毒的细胞。
因此,衰老的身体对新抗原呈递的反应能力下降,对已知抗原的记忆反应下降,使老年人更容易患上传染病 。此外,终生接触抗原会导致先天免疫细胞逐渐激活,进一步增加促炎细胞因子释放和慢性低度炎症 (下图)。

doi.org/10.3389/fmed.2018.00316
已经提出了两种炎症衰老机制:
脂肪在免疫功能中起着重要作用,因为白细胞浸润水平高——网膜脂肪占基础循环 IL-6 的 10-35%。
因此,随着年龄相关体重的增加,低度炎症会持续存在,这尤其会增加动脉粥样硬化中患糖尿病的风险。促炎细胞因子通过血脑屏障的被动扩散最初会由于 HPA 轴激活而引发主动的抗炎反应,从而导致肾上腺排出皮质醇。然而,过度的促炎负荷可激活 CRP 释放细胞,从而进一步激活 HPA 轴,最终导致皮质醇水平长期升高,进而导致糖皮质激素不敏感,进一步加剧促炎状态。
较高的外周炎性细胞因子负荷会影响衰老的小胶质细胞,从而触发脑内细胞因子的加速产生。高脑细胞因子负荷会影响神经元功能,导致与年龄相关的心理功能特征。
炎症与虚弱症
虚弱症本来就是由于高促炎负荷导致的炎症所致,而尿路感染或肺炎等感染导致的促炎负荷过度增加则极易导致虚弱症。
IL-1β对大脑功能的影响
IL-1β 的增加会触发影响大脑不同部位的适应不良疾病行为;谵妄会导致工作记忆受损和冷漠(海马体)、焦虑加剧和长期严重的活动减退(杏仁核)、HPA 轴激活(室旁核)以及无热感染和过度低体温(内侧视前核)。
如今,肥胖已成为最可预防的发病和过早死亡原因。肥胖可以通过体重指数 (BMI) 来评估,BMI在30-39 表示肥胖;40 或更高则被认为是病态肥胖。
脂肪组织的功能与影响
脂肪组织,特别是位于中心的脂肪组织,其行为方式很像内分泌腺,可以调节其他组织的活动,并受同位神经系统和免疫系统的影响。
巨噬细胞位于脂肪组织中。无论是肥胖发病机制中的一个关键因素,还是由于携带过量脂肪组织的身体压力所致,肥胖都与循环中促炎细胞因子的增加有关。
因此,肥胖个体会经历一种似乎与剂量相关的慢性炎症状态,并且无论不良健康行为和疾病状况如何都会存在。
压力会加剧肥胖个体的促炎状态
例如,肥胖女性对急性应激源表现出比非肥胖女性更强烈的炎症应激反应。脂肪组织产生的促炎细胞因子(如 IL-1、IL-6 和 TNF-α )或应激反应可激活下丘脑-垂体-肾上腺 (HPA) 轴;因此,肥胖、全身炎症和应激反应之间的关系本质上是周期性的。在中断此周期之前,临床医生和其他健康倡导者必须首先意识到它的存在。
减肥可降低炎症
包括 CRP、TNF-α、IL-6 和 IL-18,单独控制饮食或结合身体活动干预后,这种效果可持续维持长达 2 年。通常,联合干预(饮食和身体活动)最有效,因为可以减少脂肪质量组成;然而,由于脂肪减少和身体活动增加之间的内在联系,很难确定哪个因素推动了炎症的减少。
例如,与身体活动较少相比,身体活动较多可降低慢性炎症,但当考虑 BMI 和瘦素水平时,这种关系不再存在。
在一项纵向研究中,低度炎症的增加与肥胖有关,但与身体健康无关。
总之,尽管身体活动和锻炼与降低炎症有关,但由于个人脂肪量的管理与全身炎症升高密切相关,因此似乎是整体健康的更关键因素。
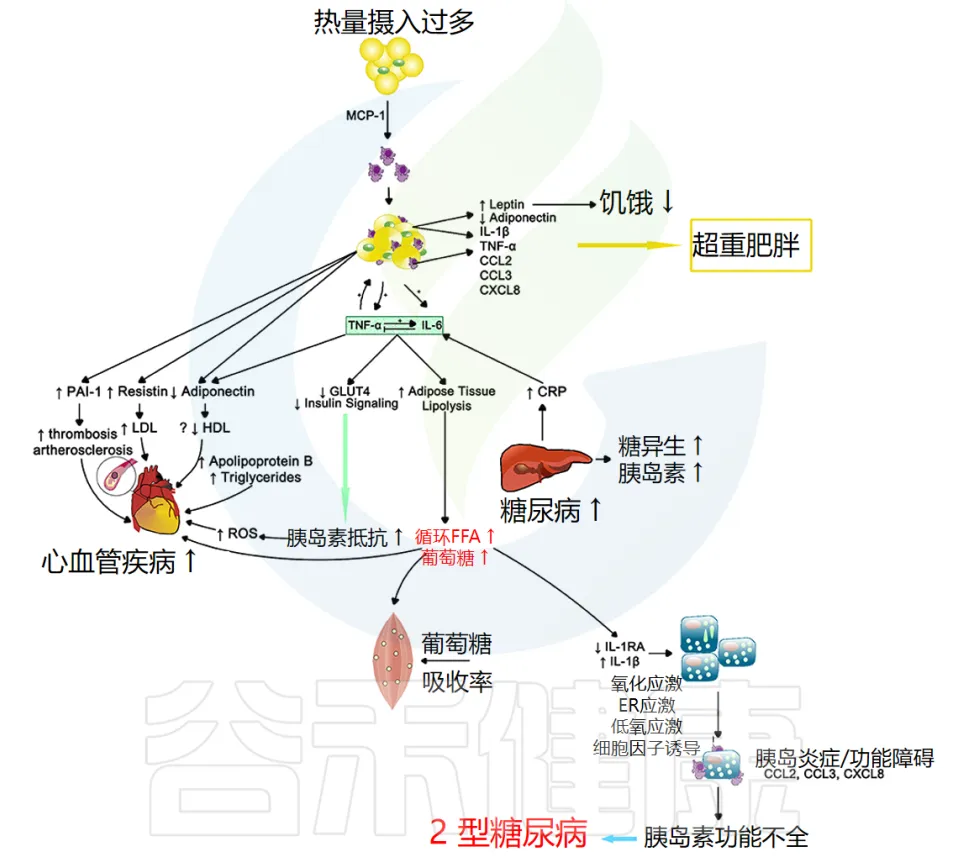
当个体细胞对胰岛素吸收血液中葡萄糖的信息不敏感时,就会发生胰岛素抵抗。
这种不敏感性导致胰腺产生更多的胰岛素;从而引发一个永无止境的负面循环,这通常会导致 β 细胞疲劳或凋亡,并引发 2 型糖尿病等代谢疾病。全身性炎症似乎在这两种代谢异常中都起着关键作用(下图)。
doi.org/10.3389/fmed.2018.00316
注:CRP指的是C反应蛋白(C-reactive protein)。C反应蛋白是一种由肝脏产生的蛋白质,其水平在体内炎症或感染时会升高。CRP常被用作炎症的生物标志物。
炎症与胰岛素抵抗的关系
较高的 CRP 水平与胰岛素抵抗有关,这表明炎症加剧可能导致 2 型糖尿病进展。事实上,在控制了 BMI 和 2 型糖尿病家族史后,女性健康研究中的 CRP 和 IL-6 升高 在 4 年期间独立预测了 2 型糖尿病的发展。因此,全身性炎症本身就可以促进胰岛素抵抗,但肥胖似乎会使情况更加复杂。
肥胖与炎症的相互作用
如肥胖部分所述,BMI 增加或肥胖与全身炎症(例如 CRP、IL-6 和 TNF-α 水平)增加有关。肥胖引起的炎症也与胰岛素抵抗的形成有关,即使控制 BMI 也是如此,这表明胰岛素抵抗带来的额外身体压力除了脂肪量外,还会增加慢性炎症。
此外,胰岛素抵抗会加剧炎症相关疾病,如丙型肝炎感染 ,而类风湿性关节炎患者服用 TNF-α 抑制剂会增加他们的胰岛素敏感性。
扩展阅读:
胎球蛋白 A 在胰岛素抵抗中的作用
有充分证据表明炎症与胰岛素抵抗和/或 2 型糖尿病之间存在关联。胎球蛋白 A 是一种肝脏急性期蛋白,可能提供关键机制。胎球蛋白 A 水平升高与胰岛素抵抗和/或 2 型糖尿病的横断面发生和纵向发展相关 。
胎球蛋白 A 有两种内源性效应支持这些数据:
治疗 2 型糖尿病的行为和药物干预可减轻炎症
与通过生活方式管理降低 BMI 可减轻炎症类似,减肥干预可降低血浆 IL-18 并增加胰岛素敏感性;这表明降低 BMI 和/或脂肪组织的努力可以改善对胰岛素的敏感性。二甲双胍和罗格列酮等血糖控制药物可同时减轻炎症并增加胰岛素敏感性;然而,炎症改善的确切机制仍不清楚。
IL-18(白细胞介素-18):
IL-18(白细胞介素-18)是一种由免疫系统细胞产生的细胞因子,属于白细胞介素家族。它在免疫反应中发挥重要作用,特别是在促进炎症和调节免疫细胞活性方面。
IL-18的主要功能和作用包括:
精神和身体疲劳是抑郁症的主要症状,包括注意力不集中、动力不足或没有动力、对以前喜欢的活动缺乏兴趣、睡眠和食欲紊乱、易怒、无望和社会孤立。
几十年来, HPA 轴失调一直与抑郁症有关;然而,抑郁症与炎症之间的关系最近才有所发展。
抑郁症与炎症的新认识
抑郁症常常与炎症相关疾病如心血管疾病和癌症并发 ;这表明慢性炎症可能与抑郁症有关。事实上,社区成年人的重度抑郁症和抑郁症状与慢性炎症有关,其严重程度呈现剂量依赖性模式。
由于长期和过度的应激激活导致免疫细胞不受控制或失调,可能会导致这种观察到的关系(下图)。
doi.org/10.3389/fmed.2018.00316
与非抑郁个体的免疫细胞相比,抑郁症患者的免疫细胞由于皮质醇敏感性降低而具有更高的 NF-κB 活性,从而创造了一种有利于持续产生促炎细胞因子的细胞内环境。
抑郁和炎症之间的关系是双向的
例如,在健康志愿者中,接触促炎细胞因子可产生病态行为或抑郁样症状,包括消极情绪、疲劳和精神运动迟缓。
细胞因子会影响血清素和多巴胺等神经递质的产生和代谢,而这些神经递质在情绪中起着至关重要的作用。
抗炎药物在抑郁症治疗中的作用
与同时服用抗抑郁药和安慰剂的患者相比,在临床抑郁症患者中,当同时服用非甾体抗炎药(如 COX-2 抑制剂或阿司匹林)时,血清素和去甲肾上腺素再摄取抑制剂的抗抑郁作用会增强。
抑郁症的周期性与炎症
抑郁症,尤其是重度抑郁症,具有周期性,因此增加确定其起源的困难:全身炎症增加还是抑郁症状增加。炎症对心理健康有影响吗?鉴于抑郁症与炎症之间存在显著联系,答案是肯定的。
炎症与其他精神疾病的关联
精神分裂症、躁郁症和创伤后应激障碍等其他精神疾病也与炎症加剧有关。因此,临床医生在治疗患有慢性炎症性疾病或抑郁症和其他潜在神经精神疾病的患者时,需要敏锐地意识到这种心理-生理关系。慢性炎症,无论是精神障碍的驱动因素还是结果,都开始模糊我们对身体和心理健康状况的理解,提示我们需要将它们视为相互关联的整体体验。
扩展阅读:
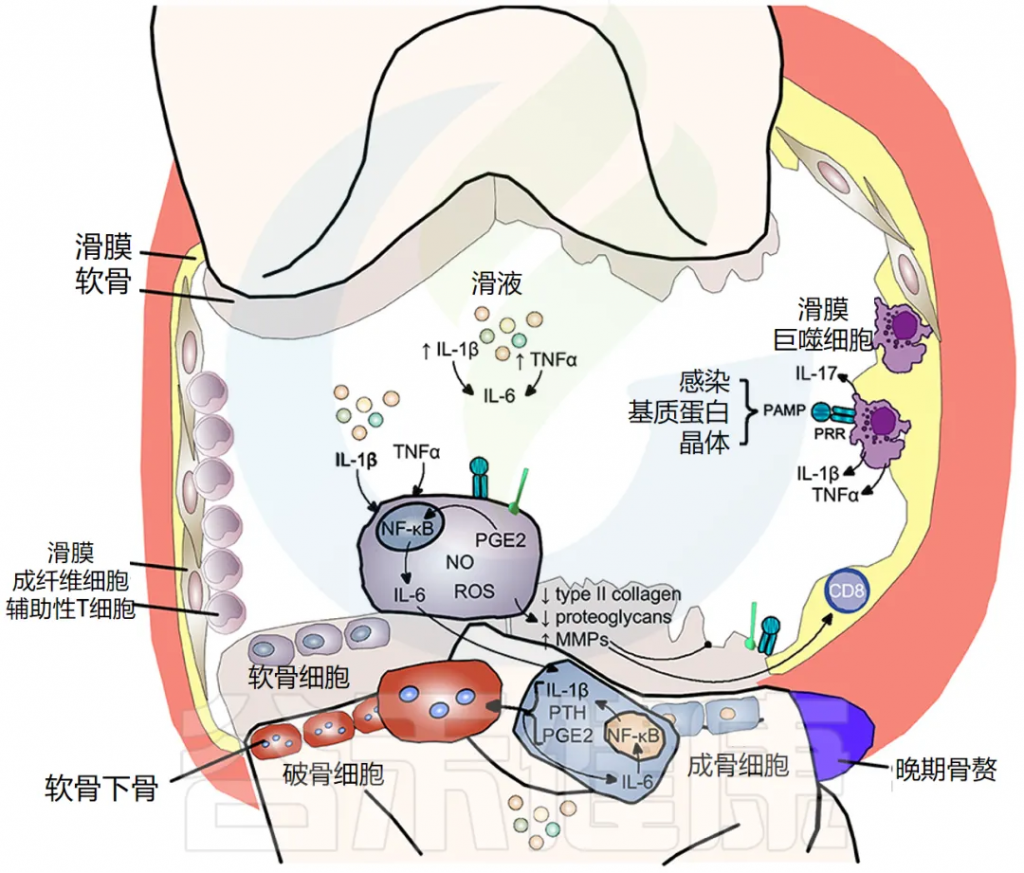
软骨破坏、软骨下骨重塑和滑膜炎症是骨关节炎的典型特征。最初,骨关节炎被认为是一种导致软骨损失的“磨损”疾病,这是临床上的主要特征;然而,现在显然滑膜炎是该疾病的主要驱动因素。流行病学研究表明,骨关节炎的进展与滑液中促炎细胞因子的数量相关,特别是 IL-1β、TNF-α 和 IL-6。
滑膜炎症是骨关节炎的一个重要的早期特征
其特征是滑膜内膜增生、巨噬细胞和淋巴细胞浸润、新血管生成和纤维化。滑膜炎导致滑液、滑膜、软骨下骨和软骨中的促炎细胞因子 IL-1β 和 TNF-α 增加。滑膜炎的程度在临床上与疼痛和功能丧失、骨赘形成和软骨损失的进展相关。
炎症的引发因素与机制
炎症可由感染性和非感染性刺激物引发,如透明质酸、滑液中的蛋白质和晶体,导致模式识别受体 (PRR) 和 Toll 样受体 (TLR) 激活,从而增加滑液中炎性细胞因子,如 IL-1β 和 IL-17。
炎症——软骨破坏
IL-1β 和 TNF-α 以及 PRR 和 TLR 的刺激,使软骨细胞内原本严格控制的合成/分解软骨稳态转向分解代谢程度更高的状态。一氧化二氮、自由基氧和前列腺素 E2 的产生增加,增加了基质金属蛋白酶 (MMP) 的释放,并抑制了软骨细胞中 II 型胶原蛋白和蛋白聚糖的表达,导致软骨破坏。
骨关节炎中的骨重塑
IL-1β 和 TNF-α 也显著上调软骨细胞释放 IL-6,激活成骨细胞释放 IL-1β、PTH 和 PGE2,进而激活破骨细胞活性,导致软骨下骨吸收。同时,这些介质刺激细胞间 IL-6 产生,维持破骨细胞活性。骨赘反映新骨形成,仅在疾病晚期出现(下图)。
doi.org/10.3389/fmed.2018.00316
现在人们认识到骨关节炎是一种由低度炎症驱动的全身性疾病和衰老,与智力衰退、脑血管病和心血管疾病等常见衰老情况有关。肥胖,特别是内脏脂肪,会导致促炎细胞因子产生显著增加,而脂肪因子、血糖水平升高和ox-LDL都会加剧低度炎症活动。特别是脂肪因子与直接扰乱软骨稳态有关;减肥的好处更可能来自于炎症负荷的减少,而不是关节机械负荷的减少。
随着对健康和疾病理解的深入,我们认识到19世纪的生物医学模型已不足以应对21世纪的慢性疾病挑战。现代研究显示,疾病是一个相互关联的复杂网络构成,而非孤立事件。炎症作为连接宏观疾病与个体体验的桥梁,强调了疾病发生的多因素性质。
面对这一现实,临床医学需要超越传统的生物医学方法,采用更全面的生物心理社会模型,关注患者的生活环境和心理状态。
监测炎症标志物如CRP、IL-6等,对于评估和控制疾病至关重要,尽管这些指标的解读需要考虑多种影响因素。
成功控制炎症疾病状态需要三个简单的步骤:
预防等于减少促炎活性
鉴于炎症在疾病发病机制和/或预后中的作用,我们需要改变疾病和疾病预防的方法。由于炎症活动会导致患病并产生可定义的疾病,因此成功的预防计划需要针对个人及其社会环境中促进促炎刺激的那些领域。
个体层面的抗炎预防
个人层面的预防策略应该从孕期就开始着手,目的是增强并维持母亲的适应能力,这一过程应该持续终身。
为了提高身体的适应力,我们应该采取以下措施:
“你吃什么,你就是什么”,这句老话在近年来得到了新的科学支持。随着理论和技术的发展,我们的饮食与健康之间的联系变得更加清晰。一个低饱和脂肪和精制糖、高复合碳水化合物、高纤维、富含鱼类蛋白质、坚果中的健康多不饱和脂肪酸(PUFA)、新鲜水果和蔬菜的饮食模式,一直被认为是健康的黄金标准。
肠道微生物研究为我们提供了更深入的理解
肠道微生物不仅帮助我们消化食物,还影响我们的免疫系统、肠壁的完整性,甚至影响大脑功能和行为。脑-肠轴理论认为,这些细菌及其消化副产物能够调节炎症、神经递质、神经递质前体的产生,以及肠神经系统的功能。
现在,我们已经能够测肠道微生物组的组成,并且可以实时观察食物变化对肠道微生物组的影响。复合碳水化合物和不饱和脂肪有助于支持抗炎细菌的生长,而简单碳水化合物(如精制糖)和不健康的脂肪(如过多的omega-6脂肪酸)则支持促炎细菌。肠道炎症的加剧与身心健康的损害密切相关。因此,关注肠道健康,选择加工程度较低的食物,或采取慢食的生活方式,是预防和干预炎症的关键步骤。
➣
总的来说,对疾病的理解应转向综合征概念,这有助于我们更好地识别和治疗如纤维肌痛等复杂疾病(例如,多达50%的纤维肌痛患者有抑郁症史)。未来的医学实践需要整合跨学科的知识,以更全面地理解炎症的作用,更有效地管理慢性疾病,并推动医学向更精准的方向发展。
主要参考文献:
Wang Y, Ma H, Zhang X, Xiao X, Yang Z. The Increasing Diagnostic Role of Exosomes in Inflammatory Diseases to Leverage the Therapeutic Biomarkers. J Inflamm Res. 2024 Jul 25;17:5005-5024.
Bennett JM, Reeves G, Billman GE, Sturmberg JP. Inflammation-Nature’s Way to Efficiently Respond to All Types of Challenges: Implications for Understanding and Managing “the Epidemic” of Chronic Diseases. Front Med (Lausanne). 2018 Nov 27;5:316.
Giacca M. SARS-CoV-2 infection boosts inflammation in atherosclerotic plaques. Nat Cardiovasc Res. 2023 Nov;2(11):966-967.
Matter MA, Tschaikowsky T, Stähli BE, Matter CM. Acute-on-chronic inflammation in acute myocardial infarction. Curr Opin Cardiol. 2024 Aug 20.

谷禾健康

日常生活中大部分人都可能碰到过食用了不卫生或过期变质食物以及水源后,出现过恶心、腹痛,并伴有腹泻、食欲不振、呕吐等症状?如果有就要当心,这可能是病原体感染引起的胃肠道炎症。
但是,即使食用了同样食物水源,不同人表现不一样。有的人表现无严重症状,有的人却症状严重,那么是什么因素导致病原体进入肠道后定植或无法定植,什么因素影响其进一步的感染?

胃肠道感染,也称作胃肠炎,是指病毒、细菌或其他病原微生物侵入消化道,引起的一系列消化系统症状的疾病。
这些微生物主要是通过食物或水进入人体后,在胃肠内繁殖并产生毒素,导致黏膜损伤和免疫细胞浸润,进而引发一系列病理生理变化。胃肠道感染的症状包括腹泻、腹痛、恶心呕吐以及食欲减退等。严重时还可能出现脱水、电解质紊乱甚至死亡。
有人可能会问:我们胃肠道中有那么多的微生物,为什么稍微一点外来的微生物就会让我们生病呢?的确,人体肠道内栖息着大量微生物,包括数万亿细菌,统称为肠道微生物群。微生物群的各种细菌成员在多个复杂层面上参与合作和竞争的生理网络。在过去10年中,测序技术领域的进步极大地增进了我们对共生微生物群影响的各种生理和病理过程的理解。
越来越多的人类疾病,如炎症性肠病、2型糖尿病、肥胖、心血管疾病、过敏和结直肠癌等被发现与微生物群组成的改变有关。此外,关于健康个体中人类微生物群的组成、其随时间和不同人之间的差异以及环境因素(即饮食)和遗传背景如何塑造微生物群的也正在变得更加清晰。
正常、健康的肠道微生物群可以在肠道中产生不利于肠道病原体定植的条件,这被称为定植抗性。肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
当微生物群稳态受到干扰时,定植抗性可能会暂时受到破坏,病原体就有机会生长到高水平。这种破坏可能是由接触抗生素、饮食变化、益生菌和药物的应用以及各种疾病引起的。定植抗性的减弱会促进内在病原体的定植或增加对感染的易感性。
病原体扩张的后果之一是引发宿主炎症反应和病原体介导的疾病。同时在肠道炎症患者中,通常会观察到微生物群组成异常,称为“生态失调”。这通常的特征是兼性厌氧细菌(例如肠杆菌科、芽孢杆菌)的相对丰度增加,同时,拟杆菌属等专性厌氧细菌的减少。不过到目前为止,尚不清楚生态失调是肠道炎症的原因还是结果,但我们有充分的理由证明两者之间存在显著的相关性。
除了肠道微生物外,宿主营养通过影响宿主免疫系统和病原体资源的可用性,进而影响感染结果。从宿主角度看,维持活跃的免疫反应需耗费大量精力。营养状况的降低可能削弱宿主抵抗感染的能力,并在其他条件不变的情况下增加病原体的危害。
另一方面,从病原体角度看,宿主营养的数量(食物量)和质量(特定营养成分)的变化可能影响感染期间病原体生长资源的可用性和类型。在此情况下,生长较快的病原体或更高的病原体适应性/负载量可能导致更大的毒力。
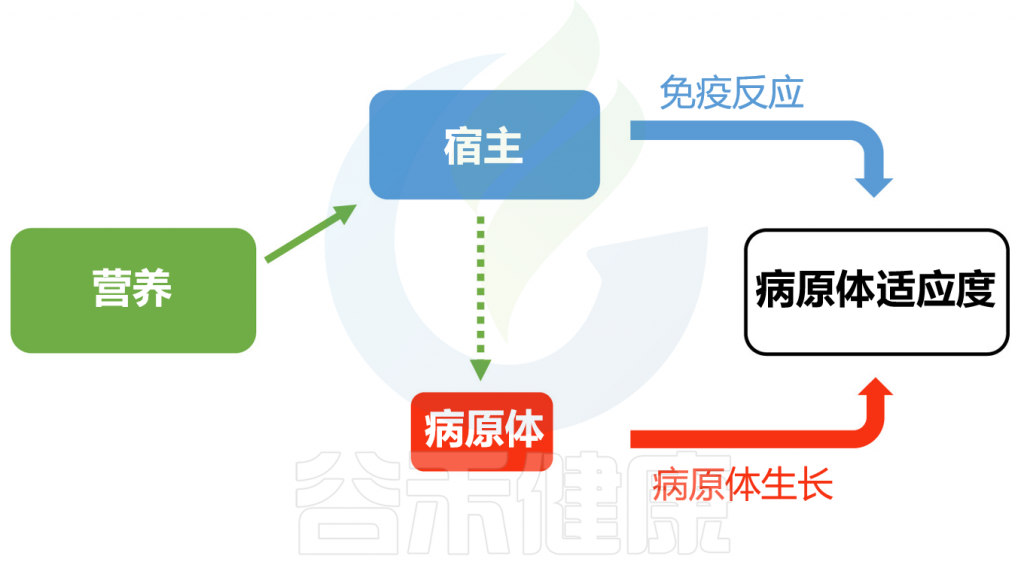
Pike VL,et al.Proc Biol Sci.2019
在本文中,我们将讲述健康人体肠道微生物的抗感染作用;讨论了营养与感染的关联。此外,本文重点关注肠道感染中炎症与微生物群的双向作用、发炎肠道中肠道病原体和肠道微生物群的竞争,以及最后提出了通过营养与微生物作用有助于预防和治疗感染的方法。
▸ 如何区分病原菌和共生菌
在感染医学中,共生菌和致病菌之间的区分仍然是一个重要标准,有益的共生现象和对立的致病性代表了细菌行为范围的两个极端,尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力。
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
扩展阅读:
在这篇文章中,我们将常规引起感染的外来细菌称为病原体,而不常引起感染的细菌称为共生菌,越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ 稳定的肠道共生菌对健康至关重要
而健康的肠道内有一个稳定的微生物群落,可以抵抗外来细菌和病原体的侵袭,这就是所谓的“定植抵抗”,这个概念至少从上世纪50年代就被认识到了。
不成熟的微生物群落(比如婴儿的微生物群落)或者受到抗生素或者饮食破坏的微生物群落可能会失去这种保护作用。
在健康个体中,共生稳定的肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
肠道微生物介导的定植抵抗机制
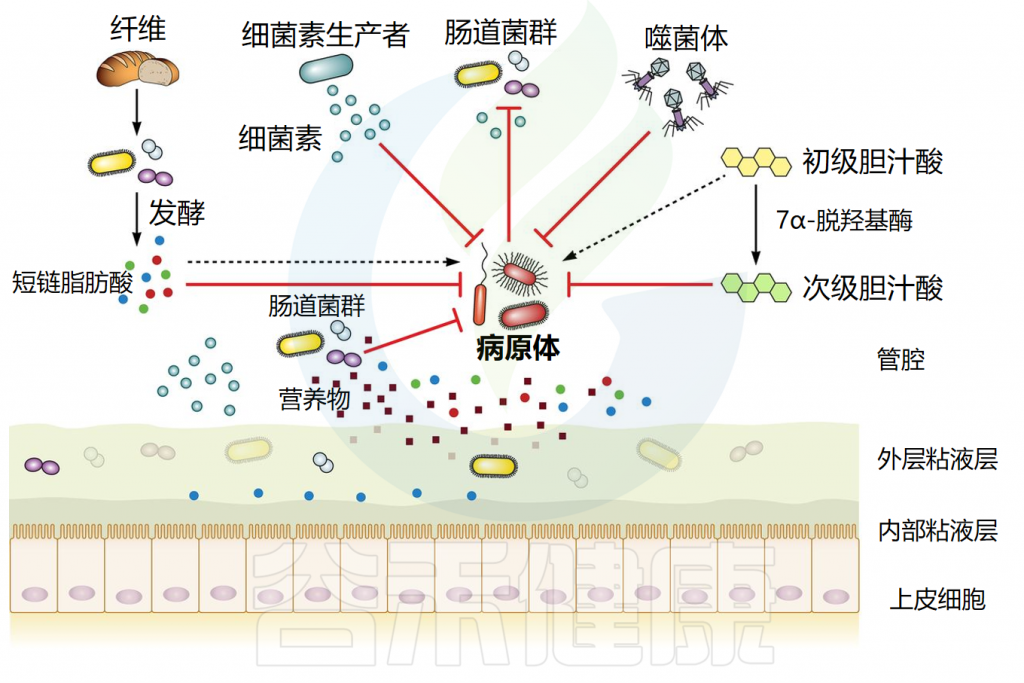
Ducarmon QR,et al.Microbiol Mol Biol Rev.2019
肠道微生物群能产生各种具有抗菌作用的产物,包括短链脂肪酸、次级胆汁酸和细菌素。每一种都以特的方式抵抗外源微生物的定植。它们的作用机制如下所述。
// 短链脂肪酸影响细胞内pH值和代谢功能来抑制细菌生长
短链脂肪酸(SCFA)主要由细菌通过不易消化的碳水化合物发酵产生。三种主要的SCFA是乙酸盐、丙酸盐和丁酸盐,占总量的90%至95%。在稳态条件下,丁酸盐是肠上皮细胞的主要营养物质,并通过β-氧化进行代谢,可以维持肠道内的厌氧环境。
短链脂肪酸通过影响细胞内pH值和代谢功能来抑制细菌生长。研究表明,SCFA浓度与肠道不同区域的pH值呈负相关。在较低pH值下,短链脂肪酸以其非离子形式更为普遍,这些非离子酸可以穿过细菌膜,扩散到细胞质中。在细胞质内,它们解离,导致阴离子和质子积聚,从而降低细胞内pH值。
短链脂肪酸已被确认为抑制鼠伤寒沙门氏菌(Salmonella typhimurium)生长的关键因素,并且对致病性大肠杆菌和艰难梭菌具有抑制作用。这些SCFA主要由拟杆菌和梭菌等厌氧共生细菌产生,这些细菌是成年哺乳动物微生物群中的重要成员。
短链脂肪酸还可以影响病原体的毒力:例如,丙酸和丁酸可以抑制鼠伤寒沙门氏菌的毒力因子。短链脂肪酸还可以作用于宿主,降低氧气浓度,为病原体生长创造一个不利环境。
// 胆汁酸具有抗菌作用,减少病原体定植
胆汁酸是分泌到小肠中的两亲性胆固醇衍生分子。它们的主要功能是乳化脂肪和脂溶性维生素以供吸收,但它们也具有抗菌特性。
大部分结合的初级胆汁酸(50%至90%)在远端回肠中被重吸收,而其余部分可以在结肠中进行细菌代谢。一些细菌(主要是梭状芽胞杆菌)通过复杂的生化途径进行 7α-脱羟基作用,将解离的初级胆汁酸转化为两种主要的次级胆汁酸:脱氧胆酸和石胆酸。
一些胆汁酸对许多细菌具有杀菌作用,包括金黄色葡萄球菌、多形拟杆菌、艰难梭菌等。证据如下:
-其中一种细菌,C. scindens ,通过产生次级胆汁酸与对艰难梭菌的定植抗性相关。C.scindens能够保护小鼠免受艰难梭菌的侵害,并恢复次级胆汁酸水平。
-使用HT-29细胞系,石胆酸已被证明可以增强肠上皮中抗菌肽LL-37的转录。
-此外,初级胆汁酸鹅去氧胆酸通过激活小肠FXR受体,间接启动先天防御机制,具有保护作用。
// 细菌素通过多种机制发挥其抗菌作用
细菌素是由特定细菌物种产生的短有毒肽,能够抑制其他物种的定殖和生长。细菌素通过多种机制发挥其抗菌作用,主要方式包括直接杀死目标细菌或抑制其生长。这些机制具体如下:
-细胞膜破坏:许多细菌素可以通过插入到细菌的细胞膜中,形成孔洞。这些孔洞破坏了细胞膜的完整性,导致细胞内容物的泄漏,最终引起细菌细胞的死亡。
-干扰细胞壁合成:某些细菌素能够干扰细菌细胞壁的合成。例如,它们可能会抑制细胞壁的主要构建块(如肽聚糖)的形成,从而阻止细胞壁的正常建造和修复,导致细菌无法在分裂或生长过程中维持其结构的完整性。
-抑制核酸合成:直接或间接影响DNA和RNA的合成或功能。例如,它们可能会阻止核酸的复制或转录,或者干扰核酸的修复过程,从而抑制细菌的生长和繁殖。
-蛋白质合成抑制:细菌素还可能通过抑制蛋白质的合成来发挥作用。这通常是通过与细菌的核糖体结合,阻断蛋白质合成的关键步骤来实现的。
-代谢途径干扰:此外,一些细菌素可能会干扰细菌的代谢途径,如阻断能量产生的关键酶的活性,从而削弱细菌的生存能力。
细菌会在肠道中竞争营养物质,这对于同一物种的不同菌株尤为重要,因为它们通常需要相同的营养物。多项研究使用不同的大肠杆菌菌株已经证明了营养竞争在细菌定植抵抗中的重要性。以下是一些研究证据:
// 利用相同营养物的菌株竞争有助于抑制病原菌
本土大肠杆菌菌株与致病性大肠杆菌O157:H7 竞争氨基酸脯氨酸。在粪便悬浮液中,高脯氨酸利用率的菌株通过耗尽脯氨酸池抑制致病菌的生长,而添加脯氨酸可逆转此抑制效果,证实了菌株间的营养竞争。
除氨基酸外,不同的大肠杆菌菌株还利用肠粘液中的不同糖类。当小鼠肠道中存在两种大肠杆菌菌株共同利用与O157:H7相同的糖时,O157:H7无法在小鼠中定植。但若只有一种共生菌株存在,O157:H7则能成功定植,显示这两种共生体能共同耗尽所有致病菌所需的糖。
营养竞争还涉及微量营养素,如铁。已知鼠伤寒菌在感染过程中从发炎的肠道吸收大量铁。益生菌大肠杆菌Nissle能高效清除铁,单次给药可显著降低鼠伤寒菌的水平。对铁的竞争可能是大肠杆菌Nissle 能够减少鼠伤寒沙门氏菌在小鼠体内定植的另一种解释。
总之,这些研究表明,通过营养竞争吸收病原体所需的关键营养物质,可以有效地抵抗病原体定植。因此,未来的策略可能会集中在培养能在特定营养素上胜过病原体的益生菌菌株,这在肠道微生物群紊乱时尤为重要,如抗生素治疗期间及其后,因为这是外源细菌最易定植的时期。
// 对粘附位点的空间竞争可以预防感染
除了基于营养的功能性生态位外,细菌还必须竞争物理空间。有些物种更喜欢以内腔或外粘液层的食物为生,或更罕见的是上皮表面的食物。
与上皮细胞的密切身体接触是某些病原体生活方式的重要组成部分(例如弯曲杆菌、某些致病性大肠杆菌、鼠伤寒沙门氏菌),因此对粘附位点(通常是聚糖结构)的物理竞争有助于预防感染或病理。
定植抵抗的直接和间接机制
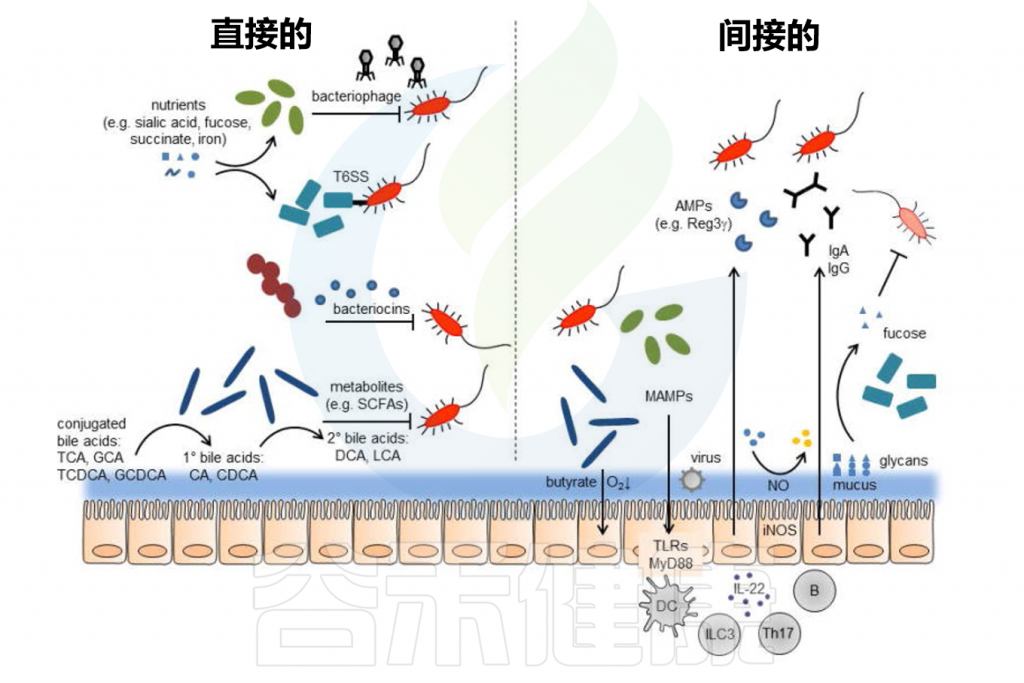
Pickard JM,et al.Immunol Rev.2017
肠道屏障由内外粘液层、上皮屏障及其相关的免疫屏障组成。内部粘液层不可穿透且牢固地附着在上皮层上,形成了一道防止细菌直接接触上皮层并引发潜在炎症的物理屏障。
// 缺乏可利用营养物质时粘液降解细菌会消耗外粘液层
共生肠道微生物居住在非附着的外粘液层中并代谢营养物。粘液层变薄会增加对病原体定植的敏感性,这可能由于西式饮食中缺乏微生物可利用的碳水化合物(MAC)引起。
当MAC稀缺时,粘液降解细菌如Akkermansia muciniphila和Bacteroides caccae会消耗外粘液层,使细菌更接近上皮层。宿主通过增加粘蛋白(MUC2)的表达来适应,但这种适应往往不足。
然而,内粘液层的损伤可以通过施用长双歧杆菌逆转,这可能因其刺激粘液生成。
// 肠道微生物对于维持粘液屏障的完整性非常重要
一方面,有益的微生物如乳酸菌和双歧杆菌可以通过产生短链脂肪酸等代谢产物来增强粘液层的保护作用,这些代谢产物能刺激粘液的产生和分泌,从而增强屏障功能。
另一方面,某些条件下如不健康的饮食习惯导致有益微生物减少,而粘液降解细菌的比例增加,可能会导致粘液层被过度消耗,粘液屏障变薄,从而使肠道更容易受到病原体的侵袭。
总之,粘液层是抵御外源微生物定植的首要屏障。研究已证明饮食是维持屏障正常功能的重要因素,这表明通过饮食干预或特定的益生元和益生菌可能成为未来的治疗选择。
目前,肠道微生物影响全身免疫反应的最佳机制可能是其对适应性免疫系统T细胞的影响。
// 肠道微生物影响T细胞的分化、影响炎症反应
研究表明,胃肠道微生物群可以影响T细胞群分化为辅助性T(Th)Th1、Th2和Th17细胞或具有调节表型的T细胞。具体来说,丁酸盐作为短链脂肪酸促进外周诱导的调节性T细胞的分化,并以这种方式能够抑制全身炎症的发展。
SCFA还能够重新编程细胞的代谢活动,从而诱导调节性B细胞并通过戊酸抑制Th17细胞的生成,这可能与炎症性肠病和自身免疫性疾病有关。
此外,微生物来源的ATP可以诱导Th17细胞的扩增,色氨酸分解产物可以导致上皮内CD4+ CD8αα+ T细胞的增加,细菌来源的多糖可以启动调节性T细胞。通过其诱导调节群体的能力,微生物组可以支持抑制炎症反应。
噬菌体是地球上最丰富的微生物,也在人类肠道中大量存在。噬菌体已被提议作为抗生素的潜在替代品,因其高度特异性,仅针对单一或少数细菌菌株,从而极大地减少对微生物群共生成员的影响。
// 使用噬菌体有效减少了霍乱弧菌感染
在实验中,使用小鼠和兔子的预防性噬菌体混合物可以有效控制霍乱弧菌感染。这种预防性混合物在体外能够杀死霍乱弧菌,减少其在小鼠肠道中的定植,并预防兔子的霍乱样腹泻。
研究表明,肠道中噬菌体的浓度是预防感染成功的关键因素,噬菌体的给药时间与霍乱弧菌接种的时间间隔与治疗效果密切相关。空肠弯曲杆菌在鸡体内的定植也通过噬菌体混合物显著降低。
// 噬菌体为肠道共生细菌提供竞争优势
噬菌体还可以提供共生体竞争优势。例如,粪肠球菌V583含有能够感染并杀死其他粪肠球菌菌株的噬菌体,为粪肠球菌V583创造了竞争优势。
噬菌体在排除特定肠道细菌方面发挥重要作用,对肠道健康具有潜在贡献。噬菌体的人类治疗应用尚未广泛进行,主要是因为缺乏足够的安全性和有效性证据。然而,最近的病例报告显示,噬菌体治疗在对抗多重耐药细菌方面展现出明显的潜力。
VI 型分泌系统(T6SS)是在一些革兰氏阴性细菌中发现的蛋白质易位复合物,其与一些噬菌体蛋白质具有相似的机制,具有注射毒素到邻近细胞的能力,这一功能使其在微生物间的竞争以及宿主与病原体间的相互作用中发挥关键作用。
T6SS的结构类似于细菌噬菌体的尾部,能够将效应蛋白直接转运到靶细胞中,这些效应蛋白能够破坏靶细胞的细胞结构或功能,从而抑制或杀死竞争对手。
T6SS 示意图
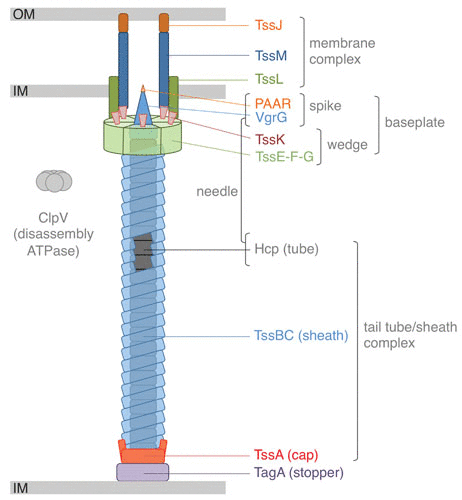
Cherrak Y,et al.Microbiol Spectr.2019
// T6SS通过注射毒素杀死或抑制病原细菌
在抵抗病原体感染方面,T6SS可以被视为一种防御机制。一些非病原性或共生细菌利用T6SS对抗侵入的病原细菌,通过直接向病原体注射毒素来抑制其生长或直接杀死这些病原体。
注:这种机制不仅限于细菌间的相互作用,也可能影响更高级生物的细胞,如真核宿主细胞,进而影响病原体的感染能力和宿主的免疫反应。
最近,在拟杆菌门成员中发现了一个新的T6SS蛋白家族,该门与厚壁菌门一起在哺乳动物肠道中占主导地位。多项研究表明,T6SS及其相关效应子和免疫蛋白的存在在小鼠肠道内拟杆菌属物种之间的竞争中发挥着重要作用。重要的是,T6SS 介导的竞争是接触依赖性的,可以涉及效应子和免疫蛋白的多种组合,并且可以具有比其他杀伤机制更广泛的目标范围。
// T6SS能够调节宿主的免疫系统
此外,T6SS还能够调节宿主的免疫系统。一些研究表明,T6SS可以通过调控炎症反应和影响免疫细胞的活性来影响宿主的免疫环境。例如,T6SS可以影响巨噬细胞的吞噬作用和炎症因子的释放,从而调节宿主的免疫反应。
因此,T6SS不仅是细菌间相互作用的武器,也是细菌与宿主互作的重要因素,对于维持微生物群落的平衡、抵抗病原体侵袭以及调节宿主免疫反应具有重要作用。
通过进一步研究T6SS的具体机制和作用,可以为开发新的抗感染策略提供理论基础和潜在靶点。
营养与感染之间存在密切的相互关系。首先,营养直接影响人体免疫系统的发展。此外,营养状况还会影响感染的发生,包括胃肠道感染、食物中毒、肠道疾病以及其他全身性传染病。
营养与感染的关系可分为以下几种:
(1)营养对人体免疫系统发育的影响;
(2)营养对感染(如胃肠道感染)、食物中毒、肠道疾病(如微生物性腹泻)和全身感染性疾病(如布鲁氏菌病、伤寒)发生的影响;
(3)营养不良与感染的关系;
(4)严重联合免疫缺陷患者的营养;
(5)暴饮暴食与感染的关系。
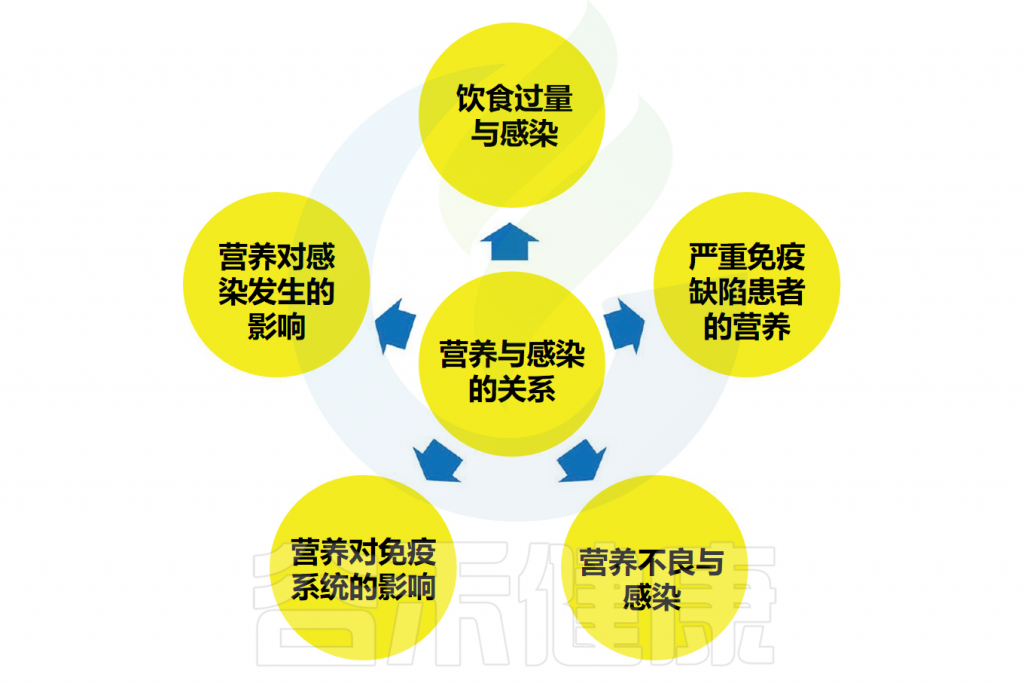
// 营养对免疫系统的发育至关重要
营养从胚胎阶段起就对人体免疫系统的发育产生影响。怀孕期间,尤其是前三个月,如果母亲摄入足够的蛋白质、维生素和矿物质,胚胎组织将得到良好的发育。胎儿营养不良会对免疫系统的正常发育造成不利影响,如果免疫系统在这一关键时期未能有效发展,将来对抗病原体的能力会受到影响。
// 营养不良抵抗病原体的能力会受到影响
母乳喂养是建立强健免疫系统的关键步骤。未经母乳喂养的营养不良婴儿,容易因缺乏蛋白质和维生素而易感染疾病,并且对疫苗的反应也不佳。因此,良好的营养是提高人体对环境病原体防御能力的基石。
广泛的研究已经证实了营养在增强抵抗感染能力方面的重要作用。例如,研究显示,相比仅接种结核疫苗的儿童,饮食充足的儿童患结核病的风险更低。同时保证营养健康和接种疫苗的人,患结核病的风险显著减少。
进行了一项研究来显示儿童感染与营养不良之间的关系。结果显示,营养不良的儿童经常出现腹泻。这些儿童的腹泻发生率和严重程度较高。结果表明,营养不良程度与腹泻风险之间存在直接关系。另一项研究评估了婴儿从出生到24个月大期间腹泻的影响。结果显示,腹泻发生率每增加 5%,生长障碍就会增加(约16%)。
营养不良和菌血症风险之间存在可变关系,营养不良儿童更有可能患革兰氏阴性菌血症。在坦桑尼亚进行的一项血培养研究结果表明,假单胞菌属、肠杆菌属和金黄色葡萄球菌的患病率很高。
溶组织内阿米巴寄生虫引起的阿米巴病与营养不良儿童腹泻的发生率和严重程度增加之间存在密切关系。据观察,溶组织内阿米巴感染可导致发展中国家儿童腹泻的发生率为2%–10%。全球每年由阿米巴病引起的死亡率和感染率估计分别约为100000例和5000万例。分泌性抗体(免疫球蛋白A)可促进针对溶组织阿米巴腹泻的免疫保护。营养不良儿童中IgA分泌细胞的减少会增加溶组织内阿米巴感染的发生率。
// 受污染的食物和水会导致人体发生感染
食物是人体的主要能量来源,但如果受到微生物污染,可能会引发消化系统疾病和食物中毒等问题。在不同季节,人们可能会遭遇不同程度的食物中毒。尤其在炎热天气中,肠道疾病的发生率较高。
// 受霍乱弧菌污染的食物会使人感染霍乱
其中霍乱是最危险的一种,霍乱是由一种叫做霍乱弧菌(Vibrio cholerae)的细菌引起的急性肠道传染病。这种病主要通过饮用或食用被霍乱弧菌污染的水和食物传播。人们在卫生条件差、饮用水处理不当或个人卫生习惯不佳的环境中更容易感染霍乱。
// 布鲁氏菌病
此外,通过水和食物传播的微生物污染可能导致儿童严重腹泻和传染病。布鲁氏菌病是通过摄入受布鲁氏菌(Brucella)污染的食物和水引起的传染病,这是人类和动物之间的常见疾病。
布鲁氏菌可感染绵羊、山羊、牛、猪和狗,人类则可能通过食用未经高温消毒的牛奶或未煮透的感染动物肉类而感染。密切接触受感染动物的分泌物也可能将病菌传播给人类。
// 其他可能通过食物导致人体的感染
阿米巴原虫病主要通过摄入受污染的水和食物引起,而弓形虫病则是通过食用生或未煮熟的肉类传播。当寄生虫包囊进入人体胃部,胃酸作用下释放,通过肠粘膜传入肝脏和淋巴结。
蛲虫感染是一种通过食物传播的寄生虫病,在全球范围内普遍存在,儿童的感染率高于成人。其他如带虫病和钩虫感染也常由不良营养引起。
注:由于病原体可能具有抗生素耐药性,这给治疗带来了挑战。
1968年,世界卫生组织报告就指出,感染可能会加剧人类营养不良,这种现象被称为协同作用。感染通常会对人的营养状态产生负面影响,从而导致营养不良,反过来又可能加重感染。
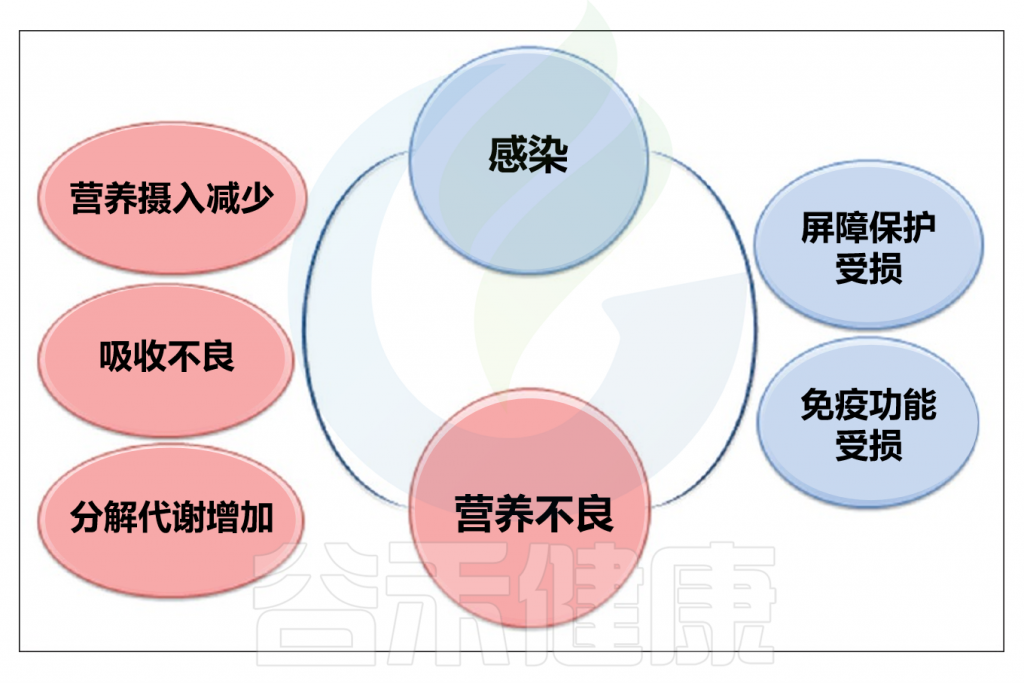
// 感染期间代谢和吸收功能会被削弱
多种因素可能削弱人体对抗感染的能力并引发营养不良。例如,厌食可能导致营养不良,从而削弱免疫系统。某些传统行为也会加剧营养不良和感染问题,如在一些文化中,发烧或腹泻的人被禁止进食。肠道感染可能导致肠道吸收功能降低,蛋白质、碳水化合物和脂肪的吸收量可能分别减少43%、42%和72%,具体数值取决于感染类型。
感染期间,如蛋白质丢失等代谢损伤会增加膳食蛋白质的需求。脂质和碳水化合物的代谢紊乱(如脂肪酸自身代谢紊乱、酮体和甘油三酯的变化)在各种感染中可见。此外,感染期间,通过糖异生途径,氨基酸可转化为葡萄糖。在呼吸道感染期间,血液中的维生素A浓度可能降低,肝炎、急性扁桃体炎、类风湿性关节炎等疾病也会降低血清维生素A浓度。
// 感染时体内许多营养素过低
感染时,血液中维生素C浓度降低,而尿液中维生素C浓度增加,即使是接种过麻疹和天花疫苗的人也会出现。感染后,体内维生素B2(核黄素)含量会减少,这种减少具有统计学意义。
铁是感染期间体内减少的另一种营养素,铁的有效利用有助于降低病原体活性并治疗感染。锌和铜是感染时浓度可能降低的其他元素,研究显示感染中铜和锌的平衡呈负值,尽管血液中铜浓度可能增加,但感染者体内铜水平可能显著降低。
有人说,营养不良会增加感染的风险,那我尽量多吃行不行,其实这也是不可取的。
// 暴饮暴食会降低抗感染能力
暴饮暴食可能会对人体的免疫系统造成负面影响,从而降低抗感染的能力。当人体摄入过量的食物,尤其是高脂肪、高糖的食物时,可能会导致炎症反应增强,肠道微生物失衡,这些都可能削弱身体的免疫功能。
因此,暴饮暴食不仅对健康有害,还可能增加感染的风险,包括消化系统的感染如胃肠炎等。合理的饮食习惯和适量的食物摄入对维护免疫系统和预防感染至关重要。
此外,肥胖的人有患糖尿病的潜力,所有糖尿病人都对感染敏感。一些研究还表明,超重的人患呼吸道感染的风险更大。
炎症和感染之间存在密切的关系,炎症通常是身体对感染的一种防御反应。当病原体如细菌、病毒或寄生虫侵入人体时,免疫系统会激活,产生炎症反应以抵抗感染。这种反应包括血液中的白细胞和其他免疫分子到达感染部位,以消灭病原体。
人类肠道微生物群的组成表现出很大的个体差异。而感染和肠道炎症可导致肠道微生物群组成发生改变,称为生态失调。
关于微生物群如何参与肠道炎症发病机制,人们提出了不同的理论:
(1)导致粘膜屏障功能缺陷(例如粘液层、先天杀伤、抗菌肽)的突变涉及共生细菌的过度易位和促炎信号的触发;
(2)宿主免疫调节异常会引起针对内在共生菌的过度免疫反应;
(3)不明病原体的存在会导致疾病的诱发;
(4)失调的微生物群,其特征是“有益”和“潜在有害”共生细菌之间的不平衡,是疾病的触发因素或驱动因素。
慢性结肠炎或肠道病原体感染过程中的炎症可能会破坏正常的微生物群组成,诱发生态失调,并有利于病原体和共生菌的过度生长,并增加毒力潜力。因此,菌群失调不仅被认为是肠道炎症的原因,而且也是肠道炎症的结果。
炎症相关的菌群失调有哪些特点?越来越多的证据表明,感染病原体导致肠道微生物群落的扰动可能会助长丰度较低的有害细菌大量繁殖,从而进一步加剧肠道炎症。
这些研究使用分子、独立于培养的技术,如16S rRNA 基因测序和宏基因组学。
事实上,远端肠道的生态失调通常以特定专性厌氧革兰氏阳性菌(如瘤胃球菌科、毛螺菌科)的丰度降低,同时兼性厌氧菌(如肠球菌和链球菌)以及革兰氏阴性变形菌(特别是肠杆菌科成员)也随之增加。
已提出将人类肠道中丰富的丁酸盐生产菌——普氏栖粪杆菌(F. prausnitzii)的减少作为活动性疾病的微生物标志物。
// 肠杆菌的大量增加可能是肠道炎症的一个重要标志物
肠杆菌科(Enterobacteriaceae)是革兰氏阴性兼性厌氧菌的一个大家族,由于它们对从上皮屏障扩散的氧气具有相对较高的耐受性,因此通常位于靠近肠道上皮的位置。事实上,肠杆菌科仅占远端肠道微生物群落的一小部分,大约为0.1%。然而,它们在各种肠道炎症环境中过度生长,例如炎症性肠病、乳糜泻和结肠癌。
肠道炎症是由病原体感染后产生的,炎症引起的环境和营养变化可能赋予肠杆菌科细菌生长优势。例如在克罗恩病(CD)和溃疡性结肠炎(UC)(炎症性肠病的两种主要形式)患者中观察到肠杆菌科细菌(包括粘附性侵袭性大肠杆菌)的患病率增加。
// 许多肠道病原体利用炎症环境来促进自身生长
许多肠道病原体能够利用炎症反应来谋取自身利益。在健康的肠道中,复杂的厌氧微生物群有效地阻止主要人类肠道病原体的定植和感染。这种“定植抵抗”在肠道炎症存在时会减弱,从而使病原体过度生长。
一个典型的例子是啮齿类柠檬酸杆菌(Citrobacter rodentium),一种引起鼠类传染性结肠增生的病原体;空肠弯曲杆菌;以及引起人类小肠结肠炎的鼠伤寒沙门菌(S. Typhimurium)。
许多研究已经表明,其他病原体如肺炎克雷伯菌、奇异变形杆菌、霍乱弧菌、艰难梭菌和肠球菌属也可能从肠道炎症环境中获益。因此,肠道中的炎症环境能够改变肠道病原体及其相关共生物种的存活、附着或生长情况。
细菌转录组的分析揭示了炎症对微生物功能及其在炎症环境中生存能力的影响。
// 病原菌粘附能力的增强使之持续存在并诱导肠道炎症
粘附性侵袭性大肠杆菌(AIEC)能够通过常见的1型菌毛粘附素FimH粘附到回肠肠上皮细胞,并识别在克罗恩病(CD)回肠上皮细胞上异常表达的癌胚抗原相关细胞粘附分子6(CEACAM6)。
最近的DNA序列分析表明,AIEC菌株主要表达带有新近氨基酸突变的FimH。这些新突变显著增强了AIEC对表达CEACAM的肠上皮细胞的粘附能力,使其能在遗传易感宿主中持续存在并诱导肠道炎症。
// 在不同炎症条件下表达特定的蛋白来促进生存
在另一项研究中,分析了从IBD和非IBD儿科患者中分离的粘膜相关大肠杆菌菌株的FimH基因突变模式,发现了每种大肠杆菌特征(即状态、门群和粘附类别)的不同FimH突变模式。溃疡性结肠炎(UC)患者的大肠杆菌菌株显示出突变数量增加,而克罗恩病(CD)患者的分离株显示出突变率增加,但出现了不同的FimH突变。
这些结果表明,在特定的选择压力下,FimH蛋白会发生选择性氨基酸突变以维持细菌的生存,并暗示大肠杆菌在不同炎症条件下(如CD和UC)采用独特的生存策略。
因此,可以想象,炎症环境可能会选择表达特定的微生物蛋白,从而促进细菌存活并进一步维持炎症。
许多文献已经提出了导致发炎肠道中一些有害细菌大量繁殖的机制,包括营养变化、粘蛋白利用、抗菌剂的产生、无氧/有氧呼吸和金属利用。我们这里主要以肠道炎症中的标志物种肠杆菌(Enterobacteriaceae)为例来介绍。
// 炎症下的营养变化使病原菌更具竞争优势
居住在远端肠道的微生物群落竞争有限的食源性碳水化合物或宿主粘液源性聚糖。因此,饮食对肠道微生物群的组成起着关键作用,饮食的变化可能导致肠道微生物群落结构的扰动。
在健康肠道中,专性厌氧梭菌和拟杆菌仍然保持对兼性厌氧肠杆菌科的主导地位。在正常情况下,梭状芽胞杆菌和拟杆菌利用糖苷水解酶分解复杂的碳水化合物,并通过结合蛋白质增加其表面的碳水化合物浓度,最终通过主动转运系统将碳水化合物转运穿过梭状芽胞杆菌的细胞质膜和拟杆菌的外膜。相比之下,肠杆菌科因缺乏糖苷水解酶,其分解复杂碳水化合物的能力较差,只能通过外膜扩散通道被动运输寡糖。
因此,在健康状态下肠杆菌科细菌在与专性厌氧菌竞争高能营养物质时处于劣势,这种竞争性生长劣势解释了健康远端肠道中梭状芽胞杆菌和拟杆菌对肠杆菌科细菌的优势。
而在炎症过程中,肠上皮损伤导致死亡上皮细胞脱落增加,增强了上皮细胞膜衍生磷脂(如磷脂酰胆碱和磷脂酰乙醇胺)的可用性。特别是,乙醇胺可被变形菌门中的某些细菌及病原菌(如沙门氏菌和假单胞菌)作为唯一的碳或氮源利用。这种利用乙醇胺的能力有助于这些细菌在肠道中成功定植并维持其致病机制。
// 粘蛋白的分解促进发炎肠道中病原菌的定植
肠杆菌科细菌在发炎肠道中扩张的另一个机制是利用粘蛋白。粘液层覆盖肠上皮,分为两层;外层可移动,被细菌定殖,通常限制共生菌的定殖,而内层牢固地附着在上皮上,基本上无细菌。
分泌的凝胶形成粘蛋白MUC2是人结肠粘液的主要成分。值得注意的是,MUC2缺陷小鼠表现出细菌对表面上皮的粘附增强、肠道通透性增加以及发生自发性或DSS诱导的结肠炎和结直肠癌的易感性增加。
最近的一篇论文强调了粘蛋白衍生的唾液酸在DSS治疗诱导小鼠肠道炎症期间促进肠杆菌科细菌扩张的作用。唾液酸是粘蛋白中的主要碳水化合物之一,可以被无法从头合成这些糖的细菌(如大肠杆菌)摄取,并掺入细菌荚膜和脂寡糖中。
此外,鼠伤寒沙门氏菌和艰难梭菌在肠道内扩张期间,采用了一种常见策略来分解代谢微生物群释放的粘膜糖,如岩藻糖和唾液酸。这些观察结果表明,唾液酸的分解代谢可能为发炎肠道中肠杆菌科细菌的生长提供优势。
// 肠杆菌产生大肠杆菌素来抑制其他细菌
肠杆菌科细菌还可以通过产生抗菌分子来战胜其他细菌,更利于自身在肠道中的繁殖。例如,大肠杆菌素是由某些大肠杆菌菌株产生的细菌素,对系统发育上的近亲致命。在发炎肠道中,大肠杆菌素Ib(col1B)的产生赋予鼠伤寒沙门氏菌相对于敏感大肠杆菌菌株的竞争优势。
col1B的表达受到低铁可用性和SOS反应的正向调节,这两种情况通常由中性粒细胞募集和氧化应激诱导的DNA损伤在发炎肠道中引发。
因此,肠道中的炎症环境似乎创造了一种有利的条件,可以增强大肠杆菌素的作用,大肠杆菌素作为适应因素,为肠杆菌科细菌的大量繁殖提供竞争性生长优势。
// 肠杆菌科的呼吸灵活性使其在炎症条件下更好地生长
导致肠杆菌科细菌在发炎的远端肠道中扩张的进一步机制是宿主在这种基本上厌氧的环境中诱导的生长条件的变化。
炎症期间血流量和血红蛋白升高而产生的高水平氧气,可以为兼性厌氧菌(如肠杆菌科)提供比专性厌氧菌(如梭菌属和拟杆菌属)更有利的生长优势。肠道炎症期间产生的新呼吸电子受体可能通过无氧呼吸(包括硝酸盐呼吸)支持细菌生长。
已经证明硝酸盐是作为宿主炎症反应的副产物而产生的。这种源自宿主的硝酸盐的富集可以为肠杆菌科(例如大肠杆菌和鼠伤寒沙门氏菌)带来适应性优势,因为编码硝酸还原酶的基因存在于大多数肠杆菌科细菌中,但在属于梭菌属和拟杆菌属的专性厌氧菌中基本上不存在。
由宿主炎症反应产生的活性氧(ROS)可以与内源性硫化合物(即硫代硫酸盐)反应,产生一种新的呼吸电子受体,称为四硫酸盐。这种新产生的电子受体为伤寒沙门氏菌提供了选择性生长优势,而不是发炎肠道中竞争的发酵肠道微生物。这些观察结果表明,病原体可以利用宿主反应来超越肠道微生物群。
肠杆菌科的呼吸灵活性使它们能够对肠道内不同的氧气供应量做出反应。例如,在没有氧气的情况下,大肠杆菌可以使用硝酸盐、亚硝酸盐、三甲胺-N-氧化物(TMAO)、二甲基亚砜(DMSO)和富马酸盐作为电子受体,而在氧气存在下,大肠杆菌表达使用氧作为电子受体的末端氧化酶。
此外,链霉素治疗导致小鼠体内产生丁酸的共生梭状芽孢杆菌的耗竭,导致丁酸水平降低,上皮氧合升高,伤寒沙门氏菌有氧繁殖。鼠类柠檬酸杆菌(C.rodentium)使用III型分泌系统(T3SS)促进小鼠结肠隐窝增生,这反过来增加了表面上皮的氧化,并促进了C.rodentim在结肠中的有氧扩张。
鼠类柠檬酸杆菌(C.rodentium)感染是常用的模型之一。
// 许多病原体进化出了高亲和力的金属摄取机制
肠杆菌科细菌在肠道炎症中大量繁殖的另一机制是金属获取。铁是宿主和病原菌重要的营养物质,大部分储存在细胞内,使得病原体难以获取。
然而,为了克服这种铁限制,许多病原体已进化出高亲和力的铁摄取机制,与宿主的限制性铁环境竞争。这些机制包括释放铁螯合铁载体、血红素获取系统和转铁蛋白/乳铁蛋白受体。
例如,大肠杆菌能产生肠杆菌素,一种儿茶酚铁载体,有效抑制中性粒细胞的杀菌髓过氧化物酶,使大肠杆菌在发炎肠道中具有明显的生存优势。因此,大肠杆菌释放的铁载体既能获取铁,也能抵御宿主源性氧化应激。
此外,粘附性侵袭性大肠杆菌(AIEC)生长依赖铁,chuA(血红素铁获取)的存在与其在巨噬细胞内持续存在的能力相关。这些结果支持铁载体需氧菌素增强巨噬细胞内存活及AIEC NRG857c (O83:H1)在小鼠肠道中的定植,该菌株是从CD患者回肠分离的AIEC临床菌株。
总体来看,这些研究突显了铁获取在促进发炎肠道中毒性更强的肠杆菌科细菌扩张的关键作用。肠杆菌科细菌也进化出了获取其他金属(如锌和锰)的策略,以利于它们在发炎肠道中的生长。
!
注意
肠道炎症通常会促进毒性更强的肠杆菌科细菌的出现,这些细菌已进化出多种策略来逃避宿主免疫反应、战胜共生细菌,并在发炎的肠道中茁壮成长。
众所周知,营养对肠道微生物群和免疫系统具有显著影响,在健康与疾病的发展中扮演着关键角色。例如,西方饮食通过诱导骨髓祖细胞的表观遗传和转录重编程,与炎症反应的增强有关,这直接影响了多种疾病的发展。
增强对肠道微生物群、宿主反应及其他微生物间关系的理解,为通过营养调节这三者之间的互动提供了可能,帮助维护肠道稳态和抵抗感染。
应考虑到不同的饮食成分,如矿物质、碳水化合物、维生素、脂质和蛋白质,它们具有特定的功能特性,能够以直接或通过微生物组间接的方式影响宿主与病原体的相互作用。在这些营养素之间建立机制联系为影响健康提供了多种可能。
因此,饮食干预应视为一种调节感染风险、预防病原微生物入侵、减轻感染严重程度及支持感染治疗的重要手段。尽管已知多种营养化合物对宿主微生物组和免疫系统有影响,但膳食纤维、益生元和益生菌仍然是研究的热点。
益生元是不易消化的食物成分,通过选择性刺激结肠中一种或有限数量的细菌的生长或活性,对宿主产生有益影响。典型的益生元是人乳低聚糖、菊粉、低聚果糖和低聚半乳糖。
膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物促进肠道中有益细菌的生长,同时通过生态位排除抑制病原体的生长。
// 益生元与膳食纤维的代谢产物具有抗菌活性有助于预防胃肠道感染
主要发酵产物是短链脂肪酸,如上所述,它对免疫系统具有重大影响,因此可以抑制感染的发展。除短链脂肪酸外,益生元和膳食纤维还可以通过排除和抗菌活性直接预防胃肠道感染。
// 与免疫细胞作用预防感染、并减轻感染后的炎症
此外,益生元和膳食纤维与上皮细胞和免疫细胞的直接相互作用也有助于预防感染。β-葡聚糖和阿拉伯木聚糖等膳食纤维已被证明可以激活CLR dectin-1,这是一种参与诱导训练免疫的重要受体,可增强针对继发感染的免疫反应。
人乳低聚糖、阿拉伯木聚糖和果胶还与Toll 样受体 (TLR)相互作用,从而提高树突状细胞(DC)的功效,通过肠上皮细胞诱导耐受性DC,并保护胃肠道免受过度的TLR信号传导影响,而且还支持解决胃肠道感染后的炎症。
饮食改变与肠道炎症相关的肠道微生物群
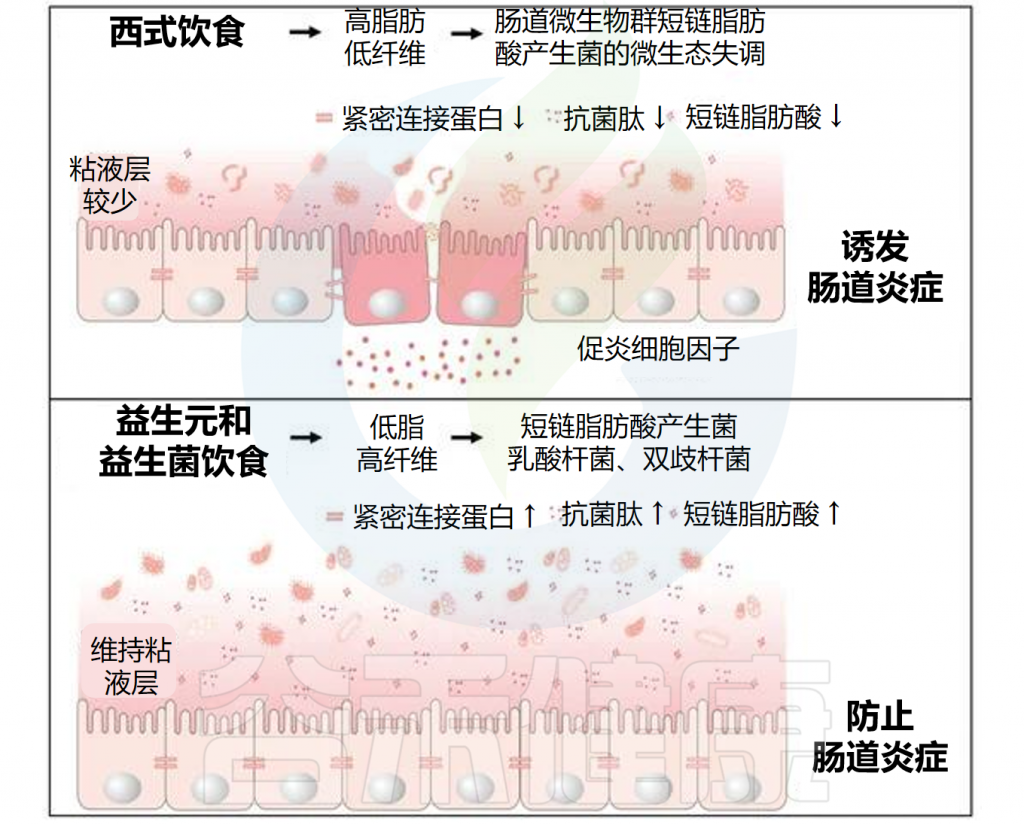
Lobionda S,et al.Microorganisms.2019
益生菌是活细菌,当摄入足够量时,可为宿主提供健康益处。使用益生菌的基本原理主要是基于它们改变肠道微生物群的能力,支持共生菌的生长而不是致病菌的生长。它们能够通过提供短链脂肪酸、维生素和其他通过粘蛋白降解产生的食物来源等代谢物来刺激常驻细菌的生长。
在一项关于益生菌治疗急性腹泻功效的研究中,益生菌通过缩短急性感染性腹泻的持续时间和减少平均排便次数具有明显的积极作用。
许多研究探讨了益生菌在预防和治疗感染方面的潜在作用,包括以下几种机制:
// 竞争性抑制
益生菌可以与病原菌竞争肠道黏膜的结合位点。通过占据这些位点,益生菌阻止病原菌的附着和进一步的入侵。此外,益生菌还能竞争肠道内的营养资源,限制病原菌的生长和繁殖。
// 产生抗菌物质,营造病原菌生存不利的环境
许多益生菌能产生抗菌物质,如细菌素、过氧化氢等。这些物质能直接杀死或抑制病原菌的生长,帮助清除肠道中的感染。
乳酸菌(LAB)可以通过产生抗菌肽(例如细菌素)来防止病原体入侵,抗菌肽可以通过在细菌细胞壁上形成孔并抑制细胞壁合成来消灭病原菌。此外,益生菌通过产生乳酸和乙酸来降低pH值,创造酸性环境,具有抗菌作用,不利于细菌病原体的生长。
// 增强肠道屏障功能
肠道完整性的损害可以解释胃肠道感染的发展。因此,益生菌增强肠道屏障的能力可能会对感染提供一些保护。
据报道,乳酸杆菌通过调节参与紧密连接信号传导的基因表达来改善肠道屏障功能。VSL3(益生元和益生菌的混合物)治疗可促进MUC2的表达和粘液分泌,有助于增强肠道屏障。这种屏障的增强有助于减少病原体的侵袭和内毒素的吸收,从而减轻感染的严重程度。
乳杆菌(尤其是L.reuteri)和动物双歧杆菌亚群,通过乳酸产生促进粘液粘附的蛋白质,称为粘液结合蛋白(MUBs),增强益生菌与宿主之间的相互作用。
// 调节免疫系统
宿主免疫系统和细胞因子谱的调节可能是益生菌有益的主要机制之一。益生菌和宿主免疫系统之间的相互作用在微生物相关分子模式中可见,包括细胞壁成分,如多糖、肽聚糖、脂蛋白和脂磷壁酸,这些成分可被上皮或宿主免疫细胞中表达的模式识别受体 (PRR) 识别。
Toll样受体2(TLR2)是一种跨膜受体,可在多种细胞类型(包括小胶质细胞、单核细胞、巨噬细胞和树突状细胞)中表达,在先天免疫反应中起着重要作用
益生菌还可以刺激肠道免疫系统产生特定的抗体(如IgA),这些抗体能够中和病原体,减少其感染性。
// 调节炎症反应
益生菌能够调节宿主的炎症反应,减少由过度免疫反应引起的组织损伤。它们通过产生抗炎细胞因子(如IL-10)和降低促炎细胞因子(如TNF-α)的水平来实现这一点。
除了单独使用益生元和益生菌外,还有将益生元和益生菌组合成合生元混合物的营养概念。考虑到上述临床研究的局限性,合生元已显示出临床成功,因此有望成为未来的治疗选择。
!
通过营养治疗感染需要注意的
与药物化合物的靶向作用相比,饮食治疗可能更加多因素。个体对营养化合物的反应受到个体遗传特征的影响。例如,炎症基因(如IL-1B、IL-6和TNF-α)中的单核苷酸多态性(SNP)会导致不同的炎症反应,这可以部分解释观察到的对营养化合物反应性的差异。
此外,越来越多的证据表明,每个人的肠道微生物群都是独一无二的,这种多样性使得个体对营养和治疗感染的反应存在显著差异。
研究显示,肠道微生物的组成可以影响营养物质的吸收和代谢,同时也会影响宿主的免疫系统功能。因此,了解个体的肠道微生物组成对于制定个性化的营养和治疗策略至关重要。
通过针对特定肠道微生物群优化的营养干预,可以更有效地预防和治疗各种感染,提高治疗的精准性和效果。这一新兴领域的研究不仅有助于推动精准医疗的发展,同时也为临床实践提供了新的视角和方法。
肠道感染仍然在全世界范围内造成沉重的疾病和经济负担。如何更好的预防和治疗胃肠道感染成了许多百姓和临床工作者关心的问题。
大量研究表明营养不良与感染之间存在双向作用。总体而言,营养影响人体免疫系统发育,而某些因素会导致营养不良并削弱人体抵抗感染的能力。包括厌食、肠道吸收减少、代谢损伤、脂质和碳水化合物代谢紊乱、维生素、铁、锌、铜减少。需要注意的是暴饮暴食可能也会增加感染风险。
与此同时,肠道微生物群在抵抗肠道病原体定植、生长和促进宿主免疫系统成熟以及影响宿主代谢方面发挥着不可或缺的作用。一些人类疾病被确定与特定微生物群的改变具有相关性或因果关系。
越来越多的人类疾病被确定与特定微生物群的改变具有相关性或因果关系。肠道中的炎症免疫反应(炎症性肠病和病原体诱导的)也可以直接塑造微生物群的组成并引发菌群失调。这一发现具有深远的影响。它从根本上改变了我们对人类肠道炎症发病机制的理解。
肠道微生物群在帮助宿主应对全身感染方面可能还有许多其他功能尚未被发现。越来越多的证据表明肠道菌群失调与慢性肠道炎症相关疾病的表现有关,尤其是炎症性肠病。抑制肠道炎症、利用益生菌或调整营养变化(如益生元和金属)可能是未来限制肠杆菌等致病细菌大量繁殖的潜在方法。
主要参考文献
Stecher B. The Roles of Inflammation, Nutrient Availability and the Commensal Microbiota in Enteric Pathogen Infection. Microbiol Spectr. 2015 Jun;3(3).
Pike VL, Lythgoe KA, King KC. On the diverse and opposing effects of nutrition on pathogen virulence. Proc Biol Sci. 2019 Jul 10;286(1906):20191220.
Cristofori F, Dargenio VN, Dargenio C, Miniello VL, Barone M, Francavilla R. Anti-Inflammatory and Immunomodulatory Effects of Probiotics in Gut Inflammation: A Door to the Body. Front Immunol. 2021 Feb 26;12:578386.
Ducarmon QR, Zwittink RD, Hornung BVH, van Schaik W, Young VB, Kuijper EJ. Gut Microbiota and Colonization Resistance against Bacterial Enteric Infection. Microbiol Mol Biol Rev. 2019 Jun 5;83(3):e00007-19.
Wiertsema SP, van Bergenhenegouwen J, Garssen J, Knippels LMJ. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients. 2021 Mar 9;13(3):886.
Lobionda S, Sittipo P, Kwon HY, Lee YK. The Role of Gut Microbiota in Intestinal Inflammation with Respect to Diet and Extrinsic Stressors. Microorganisms. 2019 Aug 19;7(8):271.
Farhadi, Sedigheh1; Ovchinnikov, Roman S.2,. The Relationship between Nutrition and Infectious Diseases: A Review. Biomedical and Biotechnology Research Journal (BBRJ) 2(3):p 168-172, Jul–Sep 2018.
Cherrak Y, Flaugnatti N, Durand E, Journet L, Cascales E. Structure and Activity of the Type VI Secretion System. Microbiol Spectr. 2019 Jul;7(4).
Pickard JM, Zeng MY, Caruso R, Núñez G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev. 2017 Sep;279(1):70-89.

谷禾健康

就在前不久,世界卫生组织将阿斯巴甜列为可能致癌物,引发了人们不小的热议。阿斯巴甜作为人工甜味剂的一种,不提供任何卡路里,就可以提供蔗糖几百倍的甜度。
人工甜味剂几乎不提供热量,或只提供极少的热量,所以深受健身人士及减肥人群的喜爱。人工甜味剂相关产业发展迅速,许多无糖饮料、无糖冰淇淋、巧克力等食品中都有其身影。
除了人工甜味剂外,乳化剂、着色剂、防腐剂等食品添加剂也是现代食品产业的重要组成部分,用于维持或提高食品的口味、安全性、新鲜度和外观。
但随着食品中的添加剂越来越多,其对健康的影响正引起人们的担忧。在此背景下,食品添加剂对微生物群的影响受到广泛研究。
事实上许多国家允许的食品添加剂并不会直接对人产生有害影响,但是会改变肠道微生物及其代谢。近年来出现的证据表明食品添加剂和微生物群之间存在相互作用,这可能会间接影响宿主健康。
例如盐是用于食品保鲜的最常见天然添加剂之一。高盐摄入会改变肠道微生物群组成和粪便短链脂肪酸的产生,通过调节辅助T细胞17影响肠道免疫轴并促进局部和全身组织炎症,可能导致高血压和肥胖。
此外,人工甜味剂有可能引起糖代谢障碍。随着人工甜味剂摄入量的增加,患心血管疾病的风险上升,尤其是阿斯巴甜与脑血管疾病,安赛蜜和三氯蔗糖与冠动脉性心脏病的风险有关。
本文主要总结了食品添加剂中的人工甜味剂、多元醇、乳化剂、色素、防腐剂对人体肠道微生物的影响,并间接导致了一些宿主代谢的变化,已有研究发现过量摄入食品添加剂与肠道炎症之间存在关联。在最后,我们提出了一些有助于减轻食品添加剂对身体的损害的小建议。
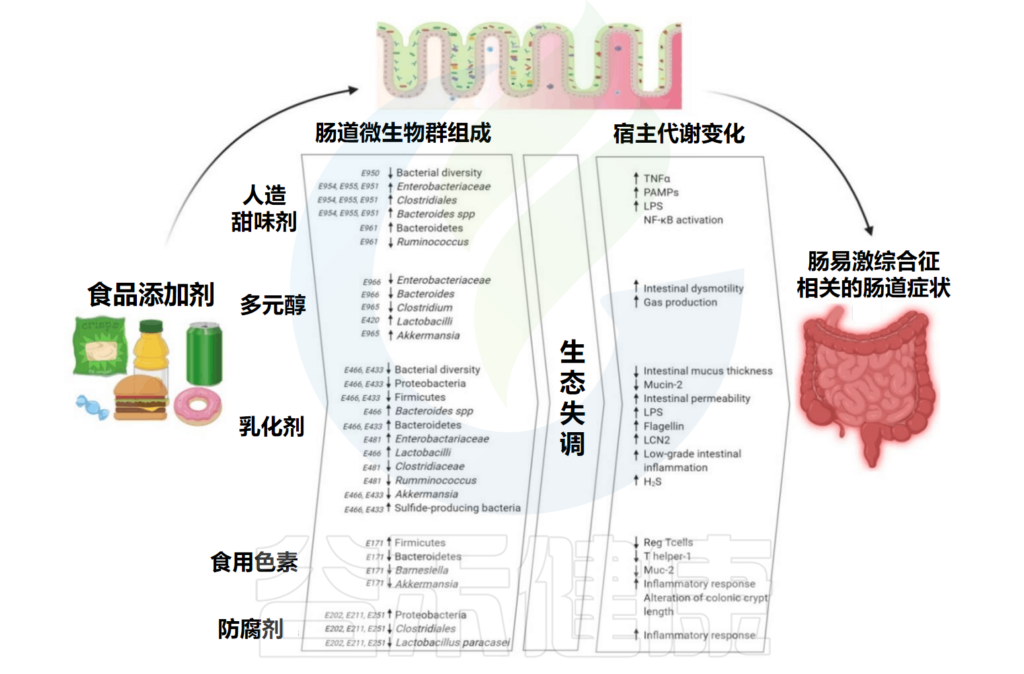
Rinninella E,et al.Int J Environ Res Public Health.2020
甜味剂与食品风味和人体健康密切相关,由于现在许多人们重视对身材的管理,无热量人工甜味剂逐渐兴起,其是蔗糖的替代品,特点是能够在不增加热量摄入的情况下具有更高的甜味强度,不会增加热量或引发血糖反应。
其中包括阿斯巴甜、安赛蜜、三氯蔗糖、糖精、纽甜和相应的化合物,主要存在于无糖饮料、无糖糖果和乳制品中。目前的研究已观察到人工甜味剂引起的肠道微生物群和代谢物的改变。
阿斯巴甜是一种低热量、强效的人造甜味剂。
•阿斯巴甜会改变人体肠道微生物的多样性
在人类中,阿斯巴甜可能不会改变粪便微生物群的丰度,但会改变其多样性。产生短链脂肪酸的细菌(例如双歧杆菌和另一项研究中检测到Blautia coccoides和拟杆菌/普雷沃氏菌比例下降。
•阿斯巴甜会影响短链脂肪酸浓度
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌 (Parasutterella)的丰度较低。
注:厚壁菌门和柔嫩梭菌都是重要的产丁酸菌属。
而在另一项人体研究中,随着阿斯巴甜的摄入,血清、粪便和盲肠内容物中的短链脂肪酸(包括丙酸和丁酸)浓度有所增加。
鉴于阿斯巴甜在不同动物和体外研究中存在一定的差异,阿斯巴甜对人体短链脂肪酸的影响还需要更多的实验研究,但目前可以确定的是,阿斯巴甜的摄入对人体短链脂肪酸的含量有影响。
阿斯巴甜存在一定的安全隐患!
需要注意的是,苯丙酮尿症患者苯丙氨酸代谢困难,应控制阿斯巴甜的摄入量。并且在此之前,美国一项研究发现,阿斯巴甜还会导致小鼠产生焦虑行为,这种影响还会跨代遗传。
阿斯巴甜对革兰氏阴性菌N-酰基高丝氨酸内酯(AHL)具有显著的抑制作用,通过群体感应抑制影响肠道微生物群落的平衡,从而促进消化系统疾病的进展。
此外,法国一项大规模前瞻性队列研究的结果表明,较高的人工甜味剂消耗量(尤其是阿斯巴甜)与心血管疾病风险增加之间存在潜在的直接关联。

安赛蜜,又称AK糖,是一种常用的人造甜味剂,也适合1-3岁儿童用于特殊医疗项目。
安赛蜜的可接受每日摄入量为9毫克/公斤体重
•安赛蜜在改变肠道微生物时具有性别特异性
在一项研究中,安赛蜜的摄入量在改变肠道微生物及其代谢物方面表现出高度的性别特异性。
在女性中,观察到乳杆菌属(Lactobacillus)和梭菌属(Clostridium)的丰度较低,Mucispirillum的丰度较高;而在男性中,拟杆菌属、萨特氏菌(Sutterella)、Anaerostipes有所增加。
•过量的安赛蜜会引起肠道炎症
在怀孕和哺乳期间将小鼠暴露于三氯蔗糖和安赛蜜会改变其后代肠道微生物群的α和β多样性,厚壁菌门增加和潜在抗炎细菌Akkermansia muciniphila的极度减少。
抗生素治疗后施用安赛蜜还会诱导硫酸盐还原菌脱硫弧菌的扩增以及结肠中促炎细胞因子的较高表达。
在炎症性肠病患者的粪便样本中,安赛蜜治疗后抗炎细菌减少,并伴有一些细菌功能改变,如脂多糖和胆汁酸合成。这表明安赛蜜诱导的肠道微生物组和代谢物扰动可能是破坏肠道稳态的因素,这可能会增加炎症性肠病的风险。
此外,安赛蜜可能会通过菌群失调引起吲哚美辛诱导的肠道损伤。
三氯蔗糖又名三氯半乳蔗糖,其甜度是蔗糖的600-650倍。
•长期摄入三氯蔗糖会改变肠道菌群并影响胰岛素水平
在人类研究中,摄入三氯蔗糖并不会在短期中影响肠道微生物,而年轻人摄入十周可能会导致Blautia coccoides增加和嗜酸乳杆菌减少,并改变肠道菌群和血清中的胰岛素和葡萄糖水平。
注:B. coccoides是一种参与促炎途径的细菌。
•三氯蔗糖的摄入导致体内多种代谢物改变
三氯蔗糖的摄入导致了多种代谢物的改变。酪氨酸水平升高,而对羟基苯乙酸和肉桂酸水平降低。这些化合物可以抑制参与色氨酸代谢的活性氧的产生。
此外,胆汁酸含量受损,盲肠内容物中胆酸浓度较高,胆酸/鹅去氧胆酸比率较高。研究人员认为这些代谢物的变化将导致引发和维持肝脏炎症。
▷大胆推测:三氯蔗糖会增加结肠炎的易感性
根据现有证据,我们认为三氯蔗糖对结肠炎有害,会增加促炎细菌的丰度。
三氯蔗糖会增加2,4,6,三硝基苯磺酸诱发的结肠炎易感性,并导致拟杆菌门和变形菌门的水平升高,厚壁菌门和放线菌门的数量减少。
最近的一项调查还发现,三氯蔗糖可能会增加患结肠炎相关结直肠癌的风险。
邻苯甲酰磺酰亚胺,俗称糖精。是一种热量为0的甜味剂,其甜度为蔗糖的300~500倍,但吃起来会有轻微的苦味和金属味。大部分糖精会被吸收并最终通过尿液排出,而未被吸收的糖精则通过粪便排出体外。
•糖精的消耗导致黏膜炎症细胞富集并改变肠道通透性
最近的一项研究发现,糖精的消耗会导致粘膜炎症细胞的富集并改变小鼠的肠道通透性。
此外,用抗生素预处理的糖精暴露小鼠可诱导较低水平的粘膜炎症和肠道屏障功能障碍。这些发现表明肠道菌群失调被认为是介导这些异常的原因。
•大量食用糖精会导致菌群失调
盲肠内容物中糖精的高含量与需氧菌群的增加有关。糖精暴露会导致严重的菌群失调,从而导致葡萄糖不耐受。许多增加的类群属于拟杆菌门和梭菌目,但厚壁菌门和蓝藻门减少了。
在无菌小鼠中无法诱导代谢变化,但在移植肠道微生物群后却发生了代谢变化。糖精还会导致肝脏炎症,导致阿克曼氏菌、棒状杆菌(Corynebacterium)和Turicibacter增加,并减少Anaerostipes、瘤胃球菌(Ruminococcus)和Dorea。
纽甜的味道比蔗糖甜7000-13000倍。纽甜的摄入降低了粪便微生物组的α多样性并改变了β多样性。
观察到厚壁菌门数量急剧下降。拟杆菌门,尤其是拟杆菌属的丰度增加。值得注意的是,毛螺菌科和瘤胃球菌科的多种成分显著减少,包括Blautia、Dorea、Oscillospira和瘤胃球菌属。
•纽甜的摄入改变了丁酸等物质的代谢
纽甜的摄入还改变了肠道微生物组的两种丁酸发酵途径。其中一条途径包括编码t4-羟基丁酰辅酶A脱水酶、丁酰辅酶A脱氢酶和乙酸辅酶A转移酶的三个基因的减少。这些基因参与了琥珀酸发酵为丁酸的过程。
另一方面,有关丙酮酸发酵丁酸的上游基因也被下调。此外,氨基酸代谢、脂多糖生物合成和抗生素生物合成增强,而脂肪酸和碳水化合物代谢途径减少。
为了方便大家观看,谷禾将一些食品添加剂与肠道微生物群之间的相互作用整理在了下表:




Liu C,et al.Nutrients.2022
人工甜味剂对肠道功能和代谢的影响
多项研究探讨了人工甜味剂对肠道微生物群和宿主生理功能的影响。他们证明人工甜味剂消耗与胰岛素抵抗和葡萄糖耐受不良增加之间的关联。
•富含人工甜味剂的饮食可能导致病态肥胖
研究表明,与对照小鼠相比,食用糖精的小鼠的聚糖降解显著增加。鉴于肠道细菌将聚糖发酵成短链脂肪酸,接触糖精可能会减少短链脂肪酸的产生。
丁酸盐通过肠-脑神经回路降低食欲和激活棕色脂肪组织而具有关键的抗肥胖作用。因此富含人工甜味剂的饮食可能与成年人的病态肥胖有关。
这些结果强调了一些人工甜味剂对聚糖发酵和短链脂肪酸产生的潜在不利影响,从而导致代谢紊乱。
•长期食用人工甜味剂会诱导炎症反应
此外,分析了给予糖精6个月后的小鼠肝脏,报告显示,与对照组相比,糖精处理的小鼠肝脏出现明显的肝脏炎症,且TNF-α基因表达升高。
注:TNF-α是炎症中的关键细胞因子,TNF-α的表达可以激活NFκB通路并诱导细胞损伤和炎症反应。
如前所述,在动物模型中,人工甜味剂的摄入可能会增加拟杆菌和肠杆菌科。肠杆菌科,如大肠杆菌、克雷伯菌属和变形杆菌属,位于粘膜上皮附近。
病原体感染、化学诱导的结肠炎或宿主免疫力不足可能导致肠道炎症,并刺激肠杆菌科的生长。因此,人工甜味剂似乎与肠道微生态失调、肠道炎症以及肠易激综合征相关的症状有关。
谷禾在下图中汇总了各种食品添加剂对肠道代谢产物的影响:



Liu C,et al.Nutrients.2022
多元醇,也叫糖醇,是一种有机物。主要种类有赤藓糖醇、异麦芽酮糖醇、山梨糖醇和木糖醇。它们天然存在于一些水果、蔬菜和蘑菇中。
其热量约为白糖的一半,并且只会导致血糖轻微变化。它们中的大多数在宿主中不能被很好地吸收或代谢,并且一部分会被结肠中的微生物群发酵。
糖醇对肠道微生物和代谢物的影响
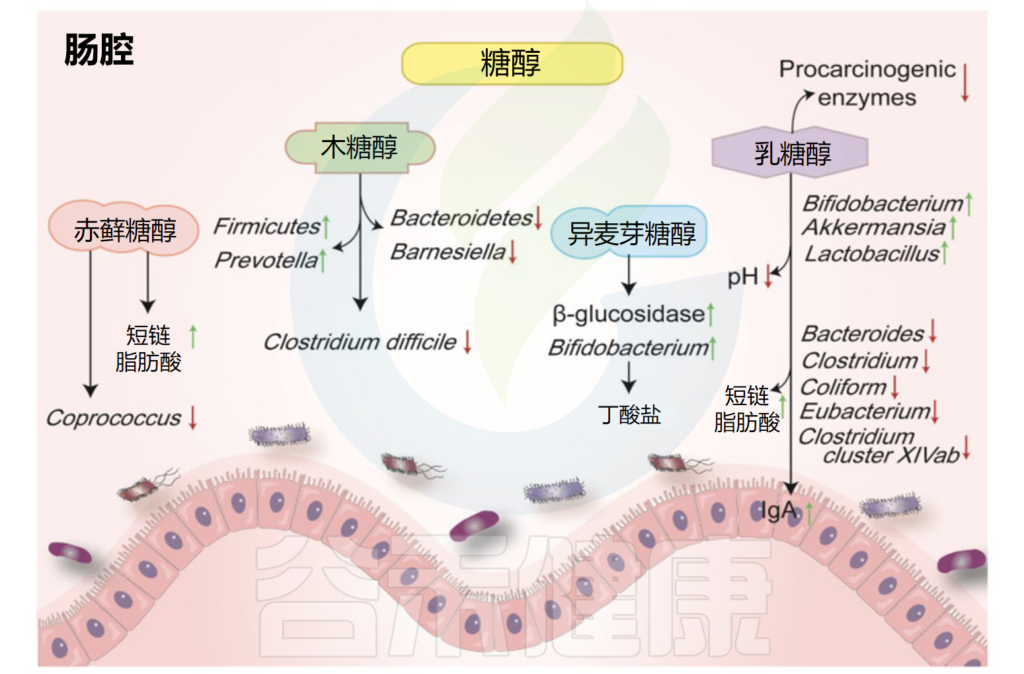
Liu C,et al.Nutrients.2022
赤藓糖醇在自然界中广泛存在,葡萄、梨、蘑菇、地衣中都有赤藓糖醇。摄入赤藓糖醇后,约90%可被小肠吸收,但代谢率很低,并主要以原形通过尿液排出体外。
•摄入赤藓糖醇增加了体内短链脂肪酸含量
在结肠中,肠道菌群可以代谢未吸收的部分。研究证明,摄入赤藓糖醇会导致丁酸和戊酸增加。考虑到到达大肠的赤藓糖醇数量有限,该化合物仅对肠道微生物群的组成产生轻微影响。
然而,赤藓糖醇会增强肠道微生物群以产生短链脂肪酸,从而减轻肠道炎症。赤藓糖醇被发现可以改善高脂肪饮食中的小肠炎症,并诱导粪球菌属丰度降低。
注:研究发现摄入赤藓糖醇后血清、粪便和白色脂肪组织中短链脂肪酸的浓度明显升高。
▷目前认为赤藓糖醇是一种对肠道稳定有利的物质
尽管缺乏赤藓糖醇对炎症性肠病的直接证据,但它被认为是一种对细菌友好的多元醇,可以稳定肠道微环境,并且可以降解为对炎症性肠病友好的代谢物。
异麦芽酮糖醇长期以来一直在食品和制药工业中用作甜味剂。微生物可以很容易地降解结肠中未吸收的异麦芽酮糖醇。
•异麦芽酮糖醇提高双歧杆菌的丰度
最近的研究认为它是一种益生元。在人类肠道中发酵的异麦芽酮糖醇可提高双歧杆菌的丰度并抑制致病菌,此外还降低了细菌β-葡萄糖苷酶的活性。
粪便中的短链脂肪酸、乳酸、胆汁酸、中性甾醇、苯酚和对甲酚也发生了变化。一些双歧杆菌菌株可以在体外发酵异麦芽,产生更高含量的丁酸盐。然而,暴露于异麦芽后没有发现不同的基因表达。
尽管很少有临床试验探讨异麦芽酮糖醇对肠道炎症的影响,但异麦芽酮糖醇可能被认为是一种双歧多元醇,是肠道稳态和微环境的“亲密朋友”。
木糖醇是是从白桦树、橡树、玉米芯、甘蔗渣等植物原料中提取出来的一种天然甜味剂。木糖醇被认为是一种非致龋性甜味剂,常被应用于口香糖中。
•木糖醇有一定的抗炎作用并能抑制变型链球菌
据报道,木糖醇会影响肠道菌群,并对脂多糖诱导的炎症细胞因子表达具有抑制作用。在一项人体研究中,摄入包括木糖醇在内的低消化性碳水化合物会导致Anaerostipes spp和粪便中的丁酸盐显著升高。
木糖醇降低了粪便拟杆菌(Bacteroidetes)和Barnesiella属的水平,而厚壁菌门和普雷沃氏菌(Prevotella)的丰度增加。较低的木糖醇浓度还可以抑制有害的变形链球菌。
注:变型链球菌是口腔天然菌群中占比例最大的链球菌属中的一种,是龋病的主要致病菌。
因此,我们认为木糖醇可能有利于肠道菌群的生长和代谢,而不会对肠道产生低有害刺激。
其他食品添加剂对肠道菌群及其功能的影响

编辑
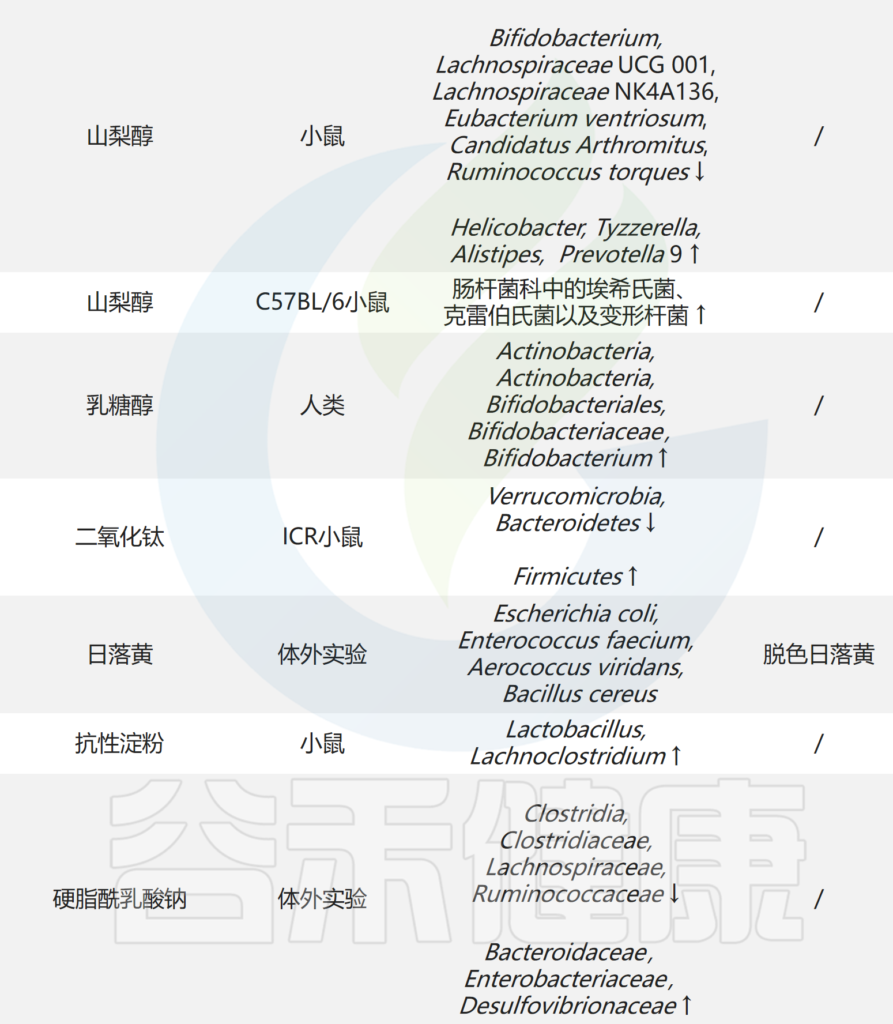
Zhou X,et al.Molecules.2023
多元醇引起的菌群变化对肠道健康有益
多元醇属于所谓的“FODMAP”(可发酵低聚糖、二糖和单糖以及多元醇)饮食类别。近年来,FODMAP饮食已成为肠易激综合征患者的宝贵治疗选择,对其限制将改善肠易激综合征治疗的结果。
“FODMAP”一词于2004年创建,用于定义高度可发酵的碳水化合物和多元醇。
乳化剂在日常生活中被广泛应用,因为它们能够稳定乳液并通过防止储存期间分离来延长保质期。它们还可以通过食品中的脂肪分子充当胶凝剂和表面活性剂。
常见的乳化剂包括羧甲基纤维素、聚山梨酯、卡拉胶等。它们存在于各种加工食品中,如酱汁、布丁、人造黄油和冰淇淋,在西方饮食中非常普遍。研究发现乳化剂会通过肠道微生物影响人体健康。
乳化剂通过肠道微生物诱发结肠炎的机制
编辑
Liu C,et al.Nutrients.2022
羧甲基纤维素(CMC)和聚山梨酯80(P80)常见于食用油、冰淇淋、蛋糕粉、糖霜和巧克力糖浆中。然而,接触乳化剂CMC和P80会对肠道微生物群产生负面影响。
•可能通过微生物群驱动肠道炎症
有益菌如短链脂肪酸的生产菌减少
聚山梨酯80的施用引起了与炎症性肠病类似的人类肠道微生物群的改变,导致有益的双歧杆菌属、重要的短链脂肪酸生产者如粪杆菌属和罕见小球菌属 (Subdoligranulum)以及Clostridium leptum的减少。
炎症性肠病相关病原菌增长显著
在小鼠中,摄入P80会加剧吲哚美辛诱发的回肠炎,从而降低肠道微生物群的α多样性。包括肠杆菌科在内的硫化物生产者的生长和炎症性肠病相关物种奇异变形杆菌的群集行为得到显著促进。
群集是一种鞭毛介导的运动,需要营养细胞分化成一种称为群集细胞的特殊细胞类型。奇异变形杆菌的群集能力与其在炎症性肠病中的发病机制高度相关。
增加病原菌的入侵
研究发现长期摄入羧甲基纤维素或聚山梨酯80会诱发低度肠道炎症,并促进易患这种疾病的小鼠出现严重结肠炎,最终导致细菌入侵增加。
卡拉胶,又名角叉菜胶,是从麒麟菜、石花菜、鹿角菜等红藻类海草中提炼出来的亲水性胶体。它们常见于调味牛奶、冰咖啡、乳制品冰淇淋和冷冻甜点中。
卡拉胶的代谢主要由宿主肠道微生物群进行。因此,肠道微生物直接与卡拉胶相互作用,影响肠道稳态。有趣的是,不同种类和分子量的卡拉胶对宿主有不同的影响。
卡拉胶可分为低分子量或高分子量、降解或未降解卡拉胶。
•低分子量的卡拉胶会增加肠道通透性并与结肠炎相关
低分子量卡拉胶已被证明可以增加肠道通透性并与结肠炎的发生有关。据报道,角叉菜胶会诱发和加重肠道炎症,改变肠道微生物群组成。
卡拉胶的摄入导致变形菌门和脱铁杆菌门(Deferribacteres)的增加,以及厚壁菌门、放线菌门和拟杆菌门的减少。
卡拉胶的不同异构体均被认为会对肠道生态产生有害影响。对于人类肠道微生物群,每种异构体都会诱导α-多样性的变化并增加微生物群的促炎潜力。
κ-卡拉胶和λ-卡拉胶显著富集了拟杆菌,而ι-卡拉胶减少了Faecaliberium,处理后鞭毛蛋白含量更高。κ-卡拉胶在高脂饮食模型中诱导了结肠炎,显著增加了志贺菌并减少了双歧杆菌。两种炎症相关细菌Alistipes finegoldii和Bacteroides acidifaciens的丰度也显著增加。
然而,高分子量卡拉胶可能具有良好的抗肿瘤和抗氧化活性。此外,之前的研究认为,肠道微生物组的改变仅在饮用水中添加卡拉胶时观察到,而在补充卡拉胶的饮食中则未观察到,这表明与蛋白质等其他食物成分的结合可能改变其构象并消除其对某些细菌的生物利用度。
▷推测:食用卡拉胶不利于肠道炎症患者恢复
在一项研究中,两种协同菌株:Bacteroides xylanisolvens 38F6A4和E. coli 38F6C1是从健康人的粪便中获得的,并给予无菌小鼠,与卡拉胶一起食用时会加剧肠道炎症。
对于缓解期的溃疡性结肠炎患者,在含卡拉胶的饮食治疗后复发率较高。鉴于卡拉胶对炎症性肠病患者和肠道菌群的直接有害作用,我们推测卡拉胶可能由于肠道菌群和肠道稳态紊乱而对炎症性肠病患者产生有害影响。
!
乳化剂可能通过肠道微生物影响宿主心理
研究结果表明,膳食乳化剂也可能对肠脑轴产生影响,并通过微生物群依赖机制诱导暴露者的心理/行为障碍。
肠道微生物群中聚山梨酯80和羧甲基纤维素依赖性的变化也是小鼠性别特异性行为和神经改变的原因。特别是,雌性获得了反社会行为,而雄性表现出更高的焦虑水平。
这两种变化都与微生物群特征和α-黑素细胞刺激素水平的明显变化相关,这两个神经肽参与调节焦虑相关行为、食欲和能量。
小结
乳化剂中羧甲基纤维素和聚山梨酯80过量食用会导致生态失调,粘液降解细菌过度生长,以及白细胞介素10或Toll样受体5进一步缺乏。
乳化剂可能还会增加肠上皮屏障中病原微生物的易位,引起肠道炎症,从而导致炎症性肠病发病率增加。
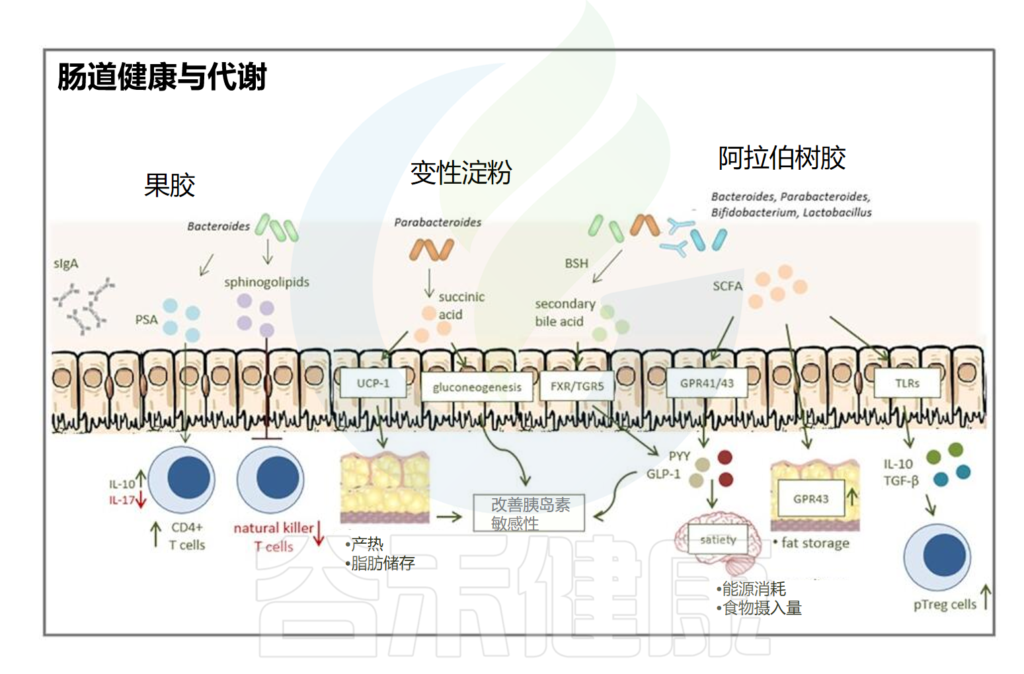
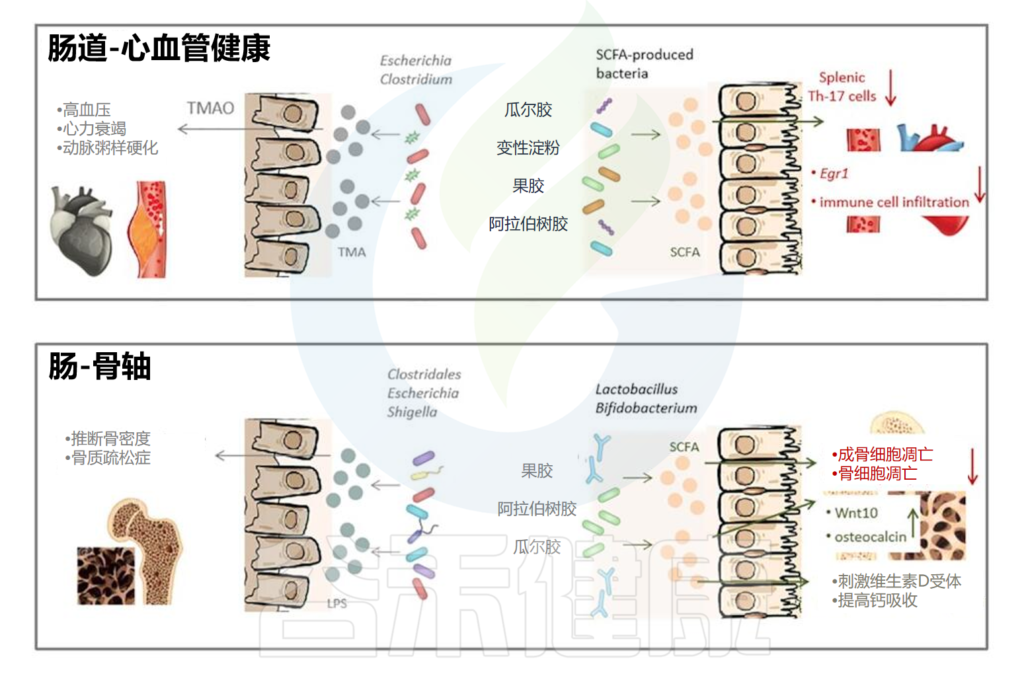
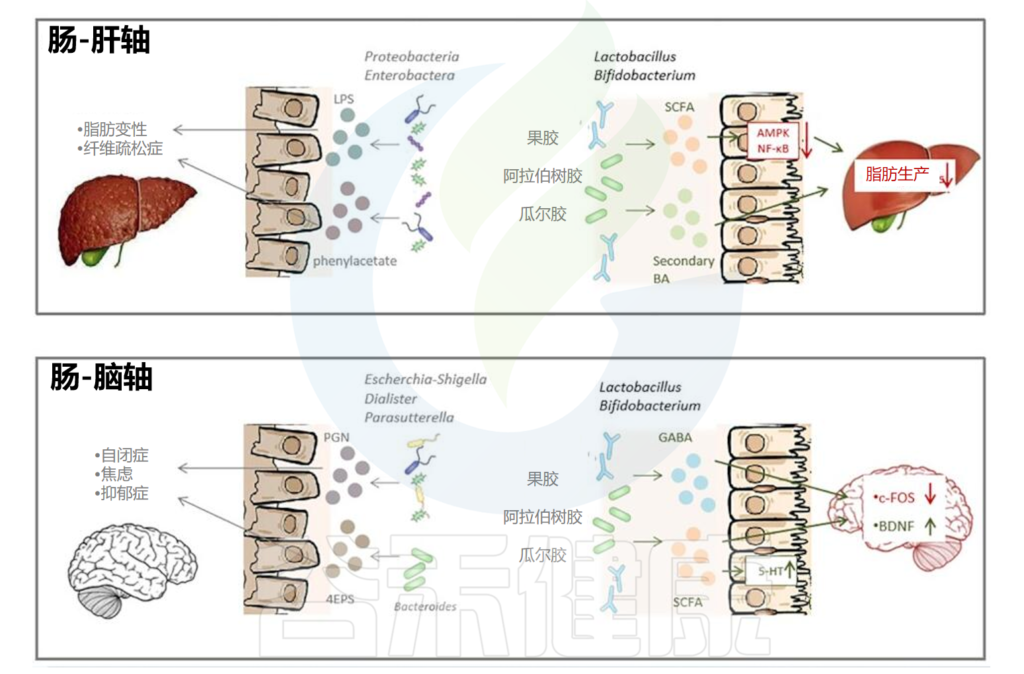
除此之外,乳化剂等胶体还会通过肠脑轴、肠肝轴、肠道与骨骼、心血管之间的联系进一步影响人体代谢和健康。
其他乳化剂在体内的生理影响



Tan H,Nie S.FEMS Microbiol Rev.2021
乳化剂和相关微生物代谢对人体的影响
编辑
Tan H,Nie S.FEMS Microbiol Rev.2021
食品着色剂又称食品色素,是以食品着色为主要目的,赋予食品色泽和改善食品色泽的物质。
食品着色剂主要添加到奶酪、酱汁、冰淇淋、糕点、糖果、巧克力和口香糖中。
二氧化钛(TiO2)是我国常用的食品着色剂,通常用作食品中的增白剂或增亮剂。
•二氧化钛影响肠道保护细菌的丰度
近年来,各种研究试图确定口服二氧化钛对小鼠和人类肠道微生物群组成的影响。在用二氧化钛处理的小鼠中,与对照组相比,观察到厚壁菌门显著增加,拟杆菌门减少。特别是,巴恩斯氏菌(Barnesiella),一种关键的保护性肠道细菌,其丰度受到二氧化钛暴露(160mg/kg/天,持续28天)的显著影响。
巴恩斯氏菌(Barnesiella)可以清除肠道中的有害细菌。消除对万古霉素耐药的肠球菌的定植,并抑制抗生素耐药细菌的传播。它还可以改善环磷酰胺等抗癌化合物的性能。
巴恩斯氏菌(Barnesiella)的减少可能与炎症性肠病的发病机制有关。此外,它们导致结肠中的炎症浸润和线粒体异常,粪便中Turicibacter属和格氏乳杆菌(Lactobacillus gasseri)和Lactobacillus NK4A136_group的增加。
•高剂量的二氧化钛会诱导肠道炎症加剧
在人类中,添加二氧化钛会导致肠道微生物群多样性适度下降,并导致卵形拟杆菌(Bacteroides ovatus)和Clostridium cocleatum减少。
卵形拟杆菌(Bacteroides ovatus)被誉为新一代益生菌,在肠道免疫、肿瘤治疗、膳食纤维代谢方面发挥重要作用。
剂量反应实验表明,单独使用微量二氧化钛对两组巨噬细胞的吞噬作用没有影响。然而,高剂量的二氧化钛与细菌抗原协同作用,可促进巨噬细胞产生 IL-8、肿瘤坏死因子-α和IL-10,并损害其转化生长因子-β分泌/吞噬细胞活性。
据报道,喂食富含二氧化钛饮食的小鼠肠道炎症加剧。特别是,微生物群组成发生了显著变化,活性氧释放增强,NLRP3炎症小体激活。
!
食品着色剂会影响肠道稳态
二氧化钛等食品着色剂可能会影响肠道稳态。事实上,各种研究已经证明了二氧化钛暴露与对肠道微生物群功能性不利影响之间的潜在关联。
炎症反应加剧
在口服二氧化钛一周(10mg/kg体重/天)的大鼠中,在派尔贴片的免疫细胞和参与炎症反应的调节性T细胞中检测到二氧化钛。具体而言,在二氧化钛暴露后,从Peyer贴片中分离的免疫细胞的刺激显示辅助性T细胞减少,IFN-γ分泌增加,Th1/Th17炎症反应增加。
注:更进一步研究表明二氧化钛暴露与啮齿动物肠道疾病和结直肠癌的发展之间可能存在关联。
短链脂肪酸水平降低
研究了小鼠体内不同剂量的二氧化钛(2、10、50 mg/kg体重/天),并报告了高剂量暴露后短链脂肪酸水平的降低、粘液相关基因表达的降低、炎症反应的增加和结肠隐窝长度的改变。
不同食品着色剂对粘膜屏障和肠道微生态的影响
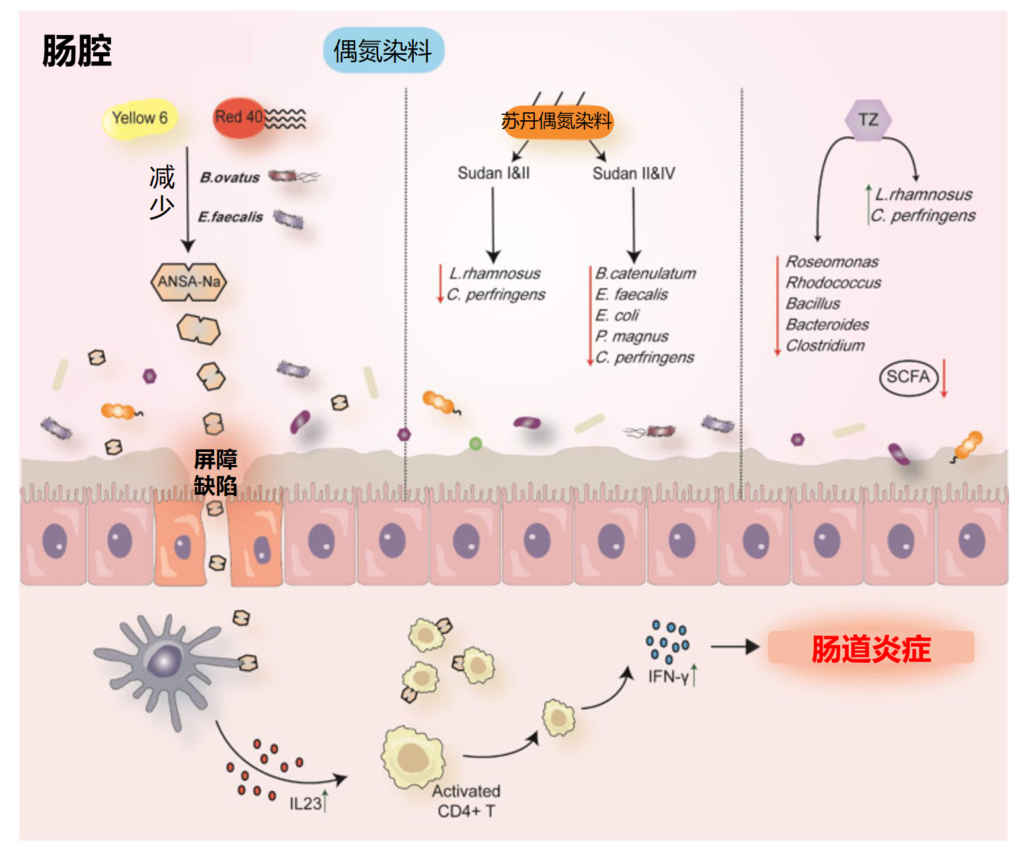
Liu C,et al.Nutrients.2022
所有这些发现表明,由于暴露于二氧化钛等食品着色剂而导致的菌群失调可能导致微生物群失调,其中特定科和属细菌的变异可能参与炎症性肠病的发病机制。
食品防腐剂可以延缓食品的降解,延长食品的保质期,限制微生物的生长,抑制食品的氧化。
防腐剂的益处和安全性存在争议,许多常见的防腐剂,如苯甲酸、山梨酸钾、亚硝酸钠和亚硫酸钠以及银纳米颗粒被报道可以诱导肠道微生物群的改变。
美国儿科学会警告说,防腐剂可能与恶化的多动行为或致癌风险有关。
苯甲酸和苯甲酸钠均可作为食品防腐剂,因为它们能够限制病原微生物的生长。所有吸收的苯甲酸均可完全降解为马尿酸。
•适量的苯甲酸会提高有益微生物的水平
最近的研究发现苯甲酸和苯甲酸钠通过调节氧化状态和免疫状态对肠道屏障功能和肠道微生物群的有益影响。
苯甲酸处理增强了回肠微生物群的生物多样性,以剂量依赖性方式降低了总需氧细菌的丰度。它还会减少十二指肠中革兰氏阴性菌的丰富度。在小猪中,苯甲酸处理增加了肠绒毛的高度,提高了有益微生物(例如双歧杆菌和乳杆菌)的水平,并减少了有害微生物的数量。
•过量摄入可能会破坏肠道屏障
然而,过量摄入苯甲酸可能会通过氧化还原状态破坏肠道屏障。
最近的研究报告称,苯甲酸增加了小鼠中诱导变形菌失调的易感性。值得注意的是,变形菌的增殖被认为是生态失调的潜在诊断标志物,并且与炎症性肠病等疾病的风险相关。
虽然现有的研究对苯甲酸表现出相互矛盾的观点,仍需要更多的研究来阐明其对肠道菌群和肠道炎症的影响。
山梨酸钾是一种低毒防腐剂,能强烈抑制腐败细菌和霉菌,其对感官特性影响轻微。
•山梨酸钾会降低肠道微生物多样性
先前的研究报道,山梨酸钾通过改变宿主免疫来抑制肠道微生物群的生存能力。暴露于山梨酸钾显著降低了斑马鱼肠道中IgG、IL-1β和TNF-α的含量,并激活了免疫系统。
在属水平上,有益菌粪杆菌(Faecalibacterium)以及病原菌气单胞菌(Aeromonas)和甲基杆菌(Methylobacterium)的含量呈现显著下降趋势。在体外,施用山梨酸钾后,普氏粪杆菌的生长也显著下降。
•革兰氏阳性菌可能阻碍山梨酸钾的传递
值得注意的是,山梨酸钾的亲脂性在调节不同类型的肠道微生物群中发挥着重要作用。革兰氏阴性细菌细胞壁中含有大量脂质,从而抑制转录和碳水化合物代谢途径。然而,革兰氏阳性菌含有较高的肽聚糖含量,可能会阻碍山梨酸钾的传递。大肠杆菌已被证明通过其外排泵机制对山梨酸钾具有抗性。
亚硫酸钠是常见的食品防腐剂之一。
•亚硫酸钠对人体有一定的危害
它强烈抑制普拉梭菌(Faecalibacterium prausnitzii)的生长。干酪乳杆菌、鼠李糖乳杆菌和植物乳杆菌因具有产生乳酸的能力而被认为是有益的肠道细菌,但它们也减少了。
在另一项研究中,亚硫酸钠持续降低奇异变形杆菌、Escherichia fergusonii、摩氏摩根菌(Morganellamorganii)的活力。亚硫酸钠对肠道有益菌较强的抗菌能力,可能诱发肠道疾病。
•具有抗炎特性的细菌可能对防腐剂更敏感
在一项体外研究中,发现人类肠道微生物对亚硝酸钠、苯甲酸钠和山梨酸钾高度敏感,尤其是酪丁酸梭菌(Clostridium tyrobutyricum)或副干酪乳杆菌(Lactobacillus paracasei),具有已知的抗炎特性,与具有促炎或致大肠杆菌特性的粪肠球菌或多形拟杆菌相比,对这三种防腐剂更敏感。
减轻食品添加剂对身体损害的一些建议
•选择天然食物:尽量选择天然食物,例如新鲜水果、蔬菜、全谷物和未经加工的肉类。这些食物通常不含添加剂。
•阅读食品标签:在购买加工食品时,仔细阅读食品标签。避免购买添加剂含量较高的食品,特别是那些含有大量人工色素和防腐剂的食品。
•自制食物:尽量选择自制食物,这样可以控制所使用的成分和添加剂的量。自制食物可以使用新鲜的食材,并尝试使用天然的调味料来增添风味。
•限制加工食品摄入量:减少加工食品的摄入量,特别是那些高度加工和包装的食品。这些食品通常含有更多的添加剂。
•多样化饮食:保持饮食的多样性,摄入各种不同类型的食物。这样可以减少对某一种食品及其潜在添加剂的过度依赖。
需要注意的是,并非所有的食品添加剂都对每个人都会产生负面影响。食品添加剂经过严格的监管和安全评估,以确保在合理摄入量下的安全性。
然而,对于敏感人群来说,或在过量摄入的情况下,某些食品添加剂可能会引起问题。因此,适度和平衡地摄入食品添加剂是很重要的。
越来越多的研究调查肠道微生物群与食品添加剂之间的相互作用,在总结当前研究中收集的信息后,我们得出结论:食品添加剂对肠道微生物群和肠道稳态产生多种影响,这可能与肠道炎症的发病和进展有关。
食品添加剂显著介导细菌功能的改变。总而言之,安赛蜜、三氯蔗糖和糖精等甜味剂可能通过提高细菌炎症潜力而诱发或加剧结肠炎。
羧甲基纤维素和聚山梨酯80等乳化剂被认为会改变肠道微生物群的多样性并增加细菌的侵入,从而对肠道健康有害。
食品着色剂的安全性应重新评估,因为其会引发肠道紊乱和菌群失调;然而,多元醇似乎通过改善肠道微生物的结构和功能而对肠道微生物群有益。
根据目前的证据和法规,必须谨慎考虑对炎症性肠病患者不利的食品添加剂,例如食品着色剂和乳化剂,包括羧甲基纤维素和聚山梨酯80。
尽管研究显示食品添加剂对肠道微生物组和肠道炎症有不同的影响,但将体外或动物模型中获得的相同结果归因于人类是不可行的。因此,未来的研究应该基于生物相关模型来复制人类的生理条件。
总之,需要更多的研究来阐明食品添加剂、肠道微生物群和人体健康之间的关系,并了解后代由于当代人的消费习惯而可能面临的炎症性肠病风险。
相关阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
主要参考文献
Zhou X, Qiao K, Wu H, Zhang Y. The Impact of Food Additives on the Abundance and Composition of Gut Microbiota. Molecules. 2023 Jan 7;28(2):631.
Rinninella E, Cintoni M, Raoul P, Gasbarrini A, Mele MC. Food Additives, Gut Microbiota, and Irritable Bowel Syndrome: A Hidden Track. Int J Environ Res Public Health. 2020 Nov 27;17(23):8816.
Tan H, Nie S. Functional hydrocolloids, gut microbiota and health: picking food additives for personalized nutrition. FEMS Microbiol Rev. 2021 Aug 17;45(4):fuaa065.
Liu C, Zhan S, Tian Z, Li N, Li T, Wu D, Zeng Z, Zhuang X. Food Additives Associated with Gut Microbiota Alterations in Inflammatory Bowel Disease: Friends or Enemies? Nutrients. 2022 Jul 25;14(15):3049.
Del Pozo S, Gómez-Martínez S, Díaz LE, Nova E, Urrialde R, Marcos A. Potential Effects of Sucralose and Saccharin on Gut Microbiota: A Review. Nutrients. 2022 Apr 18;14(8):1682.
Ravash N, Peighambardoust SH, Soltanzadeh M, Pateiro M, Lorenzo JM. Impact of high-pressure treatment on casein micelles, whey proteins, fat globules and enzymes activity in dairy products: a review. Crit Rev Food Sci Nutr. 2022;62(11):2888-2908.
Laudisi F, Stolfi C, Monteleone G. Impact of Food Additives on Gut Homeostasis. Nutrients. 2019 Oct 1;11(10):2334.
Abiega-Franyutti P, Freyre-Fonseca V. Chronic consumption of food-additives lead to changes via microbiota gut-brain axis. Toxicology. 2021 Dec;464:153001.

谷禾健康

维生素C是一种广泛存在于自然界中的水溶性维生素。维生素C在人体新陈代谢中具有多种重要功能,包括抗氧化、参与胶原蛋白合成、增强铁的吸收等。由于其众多生理益处,维生素C被广泛地应用于修复伤口、治疗感冒、癌症等多种疾病。
人体无法自行合成维生素C,需要从膳食来源(如水果、蔬菜)中获取。维生素C的代谢过程涉及多个酶和转运蛋白。肠道微生物群可能通过影响这些酶和蛋白的活性或表达,来影响维生素C的代谢吸收过程。
维生素C也可以直接调节肠道微生物群,或通过修复肠道屏障、改变氧化还原电位等方式间接对肠道微生物群的平衡起到调节作用。
个体之间的差异、饮食习惯和生活方式等因素各不相同,这些都可能对维生素C与肠道菌群的相互作用产生影响。
本文将从维生素C的结构、功能、吸收和代谢、与肠道菌群的关联等多角度,全面探讨维生素C的作用及其对人体健康的影响,同时介绍了一些维生素C的食物来源、人体需要的剂量、如何补充、注意事项等。
▼
本文主要内容:

编辑
维生素C,也称为抗坏血酸,是一种水溶性维生素,对人体健康非常重要。它在许多身体功能中起着关键作用,包括增强免疫力、抗氧化、胶原蛋白的合成等。
▼
维生素C的化学名称是L-抗坏血酸,它是一种有机化合物。无臭,味酸,易溶于水,微溶于乙醇,不溶于乙醚。
维生素C结构简单,化学式为C6H8O6:
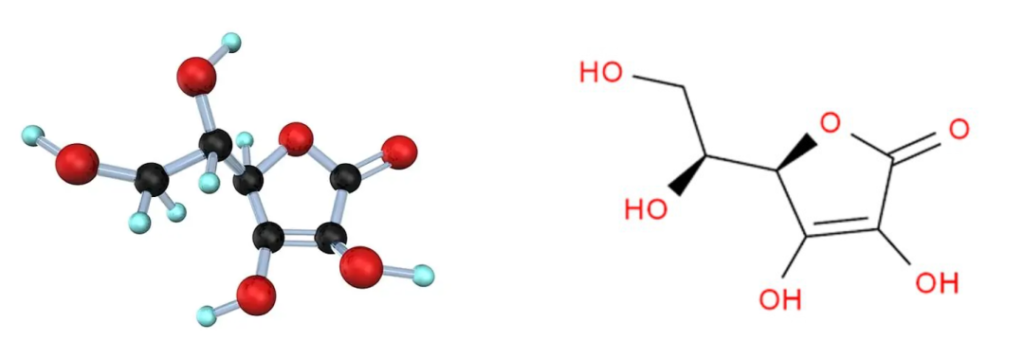
这种结构使维生素C具有抗氧化性质,能够捕捉自由基,并保护细胞免受氧化损伤。
注:体内的分子暴露于环境污染物、吸烟和慢性炎症等情况时,它们会变成自由基。自由基是不稳定的分子,会破坏细胞并导致疾病,维生素C可以通过中和自由基来减缓或预防某些健康问题。
由于其与葡萄糖的结构相似,维生素C可以在许多化学反应中取代葡萄糖,并且可以防止蛋白质的非酶糖基化。
▼
维生素C参与胶原蛋白、激素、肉碱的合成,促进铁离子的吸收,此外,它在免疫系统的功能和调节中发挥着重要作用,对维持内部环境的平衡和中枢神经系统的正常功能极为重要。
维生素C的大部分功能是由于其作为抗氧化剂和辅助因子的能力。由于人类缺乏L-gulono-1, 4-lactone氧化酶,无法自行合成维生素C,因此完全依赖于维生素C的饮食摄入。
▼
从食物中获取营养总是最好的。大约90%的日常需求来自蔬菜和水果,它们是这种维生素的极好来源,例如奇异果、橙子、芒果、草莓、红椒、青椒等。
一些维生素C含量较高的食物

注:单位“杯”是一个常见的非正式计量单位,美规和英规略有区别,大约是237毫升-250毫升左右,涉及到果蔬的份量时,一杯通常是指将果蔬切碎后填满一杯容器的量。
▼
维生素 C 对大脑健康非常重要。大脑在长期缺乏维生素 C 的情况下以牺牲其他组织为代价来保留维生素 C,并且可以维持比其他器官(例如肝脏和肾脏)高很多倍的浓度,如下图。
维生素C的分布在身体各器官之间差异很大
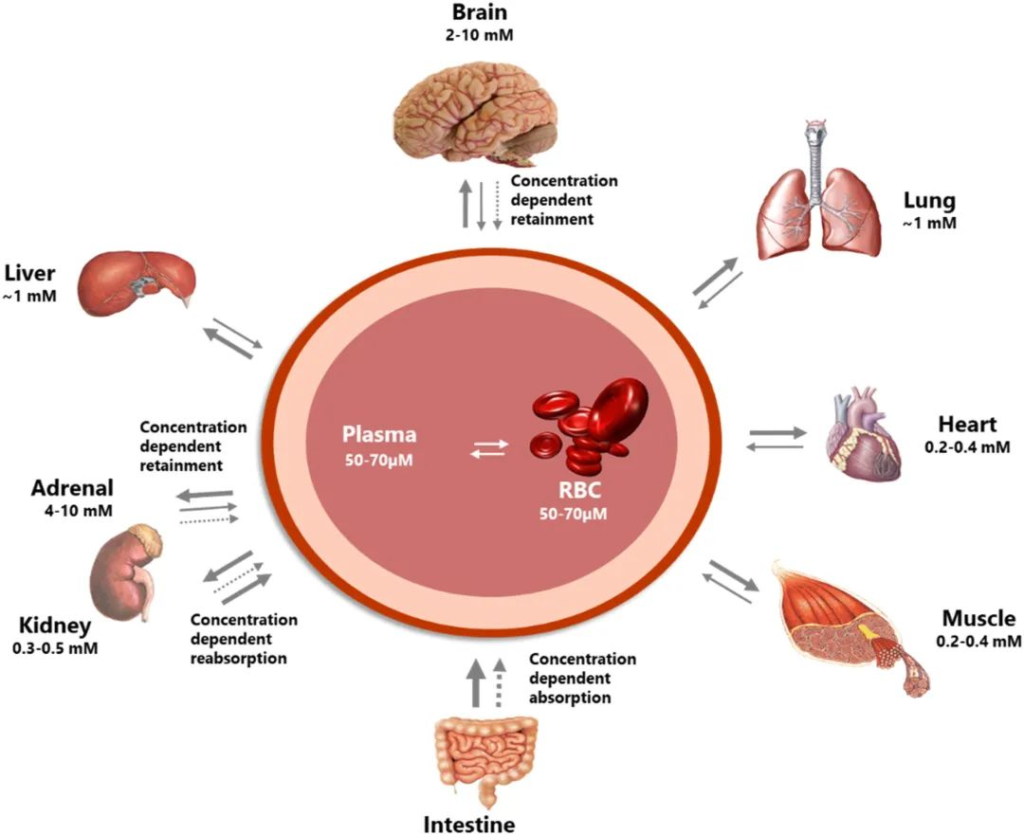
doi.org/10.1016/j.redox.2020.101532
维生素C供应不足时,首先保证大脑里的浓度,那么维生素C对于大脑而言有什么作用?
▼
维生素 C 对胶原蛋白的稳定作用对于形成整个身体的结缔组织框架至关重要;包括皮肤、骨骼、软骨、肌腱、韧带、血管等。
胶原蛋白生产的最后步骤取决于维生素 C,维生素 C 在前胶原脯氨酰和赖氨酰残基的羟基化中充当电子供体。
▼
维生素 C 可增强其他营养素的生物利用度,例如维生素 E 和非血红素铁,这可能会增强含维生素 C 的食物的健康效果。
维生素C经常添加到含铁的口服制剂中,以增加铁的吸收。
▼
维生素 C 是否可以预防或减轻包括普通感冒在内的感染的严重程度是一个有争议的话题。大多数证据都支持其好处。
▼
维生素C对正常骨骼发育至关重要。维生素C水平与骨骼健康之间存在正相关关系,如骨密度、骨折概率、骨转换标志物等。
▼
维生素 C 有助于维持健康的皮肤。
▼
肺部的维生素C水平是血液中的30倍。
维生素C在抵御氧化剂的同时也会被消耗,这表明即使是单剂量的维生素C,也能有效抵御肺部氧化应激的急性增加。
▼
根据现有证据,摄入足够的维生素 C 可能有助于保持健康的情绪。
焦虑
抑郁
▼
人类慢性低维生素 C 状态与神经退行性疾病有关。但是,尚未确定因果关系。
▼
维生素 C 可以通过抑制炎性细胞因子来减轻炎症。
▼
除上述主要的功能之外,在部分小型研究中提到的关于维生素C的功能如下:
助孕育:
助减肥:
降血压、防中风:
降血糖:
助排毒:
助抗癌:
牙周健康:
水溶性维生素在人体内储存较少,从肠道吸收后进入人体的多余的水溶性维生素大多从尿中排出。因此,摄入较多的水溶性维生素一般不会引起中毒现象,但是若摄入量过少,则会很快出现缺乏症状。
▼
刚缺乏的时候症状不明显,饮食中缺乏VC需要大约一个月的时间才会出现症状。
体内维生素C总含量低于300-400mg会出现明显症状。
维生素C的缺乏会出现什么症状?
由于维生素C功能的复杂性及其被不同还原剂的部分替代性,维生素C与坏血病症状的直接联系不容易确定。
如果发展为坏血病,典型症状是:
肌肉无力、牙龈肿胀和出血、牙齿脱落、瘀点出血、自发性瘀斑、贫血、愈合障碍、角化过度、虚弱、肌痛、关节痛和体重减轻(也可能因肿胀而出现矛盾的体重增加),而早期表现包括嗜睡、倦怠、易激惹,甚至呼吸困难等。
在生化上,维生素C血浆水平低于11μM被认为与坏血病的临床症状一致。
在专业医疗人员的指导下,补充维生素C可以轻松有效地逆转坏血病。许多症状可以在几周内轻松解决。富含维生素C的饮食将防止坏血病的发展。
什么人群更容易发生维生素C缺乏?
▼
NIH 认为,成人可耐受的上限是每天 2000 毫克,仅仅靠含有维生素 C 的食物几乎不可能达到这一上限,所以食物可以放心吃。服用补充剂则需注意剂量,可能存在过量的风险。
更高的剂量更有可能导致副作用。
维生素C过量可能会出现什么症状?
单次口服5-10克维生素C会产生短暂的渗透性腹泻和/或腹胀伴疼痛,不建议这样做。
随食物一起摄入可减少这些不良反应。
每天超过 2000 毫克的剂量可能会增加腹泻和肾结石的风险。如果有肾结石病史,每天摄入超过 1000 毫克可能会增加患结石的几率。
那么到底应该怎么补充?每日摄取多少维生素C 合适呢?
▼
科学界对维生素C的最佳剂量方案(摄入量和频率)最健康存在持续争论。
对于大多数健康人来说,通过食物可以获得足量的维生素 C。
维生素C摄入量标准在不同地区有所不同:
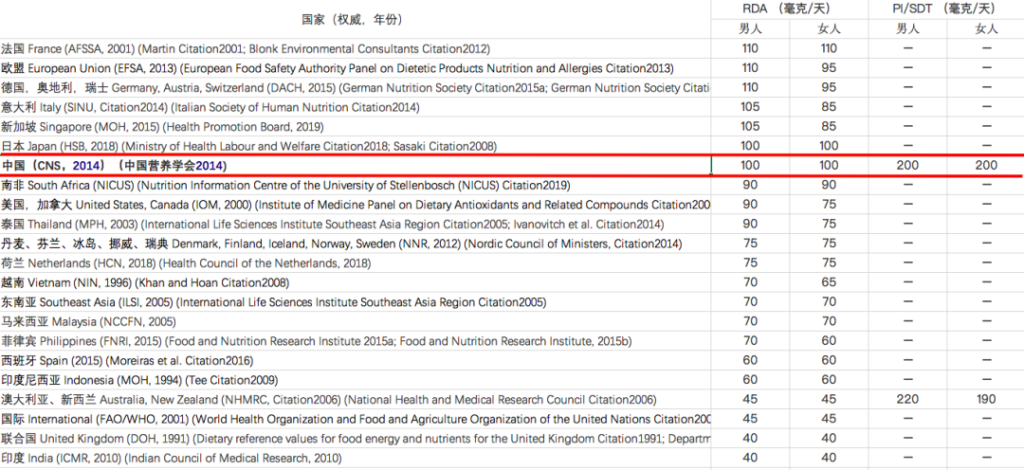
注:RDA – 推荐膳食摄入量,
PI – 建议摄入量,SDT – 建议膳食目标
在中国营养学会编著的《中国居民膳食指南》2022版中对维生素C的推荐摄入量:
中国居民膳食指南2022版
为什么不同地区的标准不一样呢?
这主要是由于RDA标准的基本前提从预防坏血病(~45 mg/d)至健康优化(~200 mg/d)。许多权威机构建议使用最低量的维生素C,但这可能无法满足不同亚群的健康需求。
例如,吸烟者和肥胖者比普通人群有更高的要求。一些国家的吸烟率继续上升,有证据表明,吸烟者每天至少摄入200 mg的维生素C。
随着全球肥胖率的增加,以及与肥胖相关的合并症,如代谢综合征、糖尿病和心血管疾病,需要更多地考虑适当的建议,以优化快速增加的亚健康人群中的维生素C状态。
以上是维生素C的摄入量标准,具体该如何补充,应该注意什么?详见下一章节。
▼
食物:如何才能最大程度地保留其维生素C?
——烹饪方式
长时间烹饪,特别是用大量水煮沸会导致维生素C浸出到水中,显著降低食物中的维生素C含量。
在少量水中蒸或煮,且持续时间较短,是保存维生素C的更温和的方法。
即使将所有外部因素消除到最低限度,也会发生损失,因为由于抗坏血酸氧化酶的存在,材料内部会发生氧化反应。因此,理想的加工方法是用最少量的水快速热灭活酶,然后快速冷却。
——长期保存条件
温度对储存稳定性也有很大影响。随着温度的升高,会出现更显著的损失。然而,在长期储存期间,即使维持短期储存期间仅发生少量损失的条件,维生素C的量也会显著减少。
损失主要是由于酶催化的氧化反应,其程度尤其取决于pH、材料完整性和温度。
总之,为了使水果和蔬菜的维生素C含量保持更长时间,最温和的方法是深度冷冻。
补充剂:一天中分几次服用
食物和许多补充剂中的维生素 C 是一种抗坏血酸的形式。
当肠道面临较低水平的抗坏血酸(即低于约 400 毫克)时,主动运输系统会吸收维生素 C(即,将营养物质通过肠道并进入血液,到身体需要的地方)。
一旦这些主动运输变得不堪重负,被动扩散就会接管吸收其余的维生素 C(这是一个相当低效的过程)。吸收并不像听起来那么容易,事实上抗坏血酸有吸收上限。
身体一次可以处理大约 300 – 400 毫克的纯抗坏血酸形式的维生素 C,更多量一下子难吸收。
所以如果能记得的话,一天中分几次服用比较合适。
▼
维生素C补充剂并非适合所有人。如果遇到以下任何情况,请首先与医生联系:
也不要认为维生素C服用越多越好,每天服用 1000 毫克或更多,实际上会使吸收率降低约 50%。
▼
维生素C可以增加某些药物的吸收,例如:
服用维生素C可以增加含铝药物(如磷酸盐粘合剂)对铝的吸收。这可能对有肾脏问题的人有害。抗酸剂中含铝:不要同时服用维生素C和抗酸剂。服用维生素C后至少等待两个小时,然后再服用抗酸剂。服用抗酸剂后等待四个小时服用维生素C。
维生素C可能会增加左旋甲状腺素的吸收。
补充维生素C会降低一些药物的疗效:
口服维生素C可能会降低这些抗病毒药物的作用。
当与维生素C一起服用时,烟酸和他汀类药物的影响可能会降低,这可能有益于高胆固醇的人。
高剂量的维生素C可能会降低人体对这种抗凝剂的反应。
其他还包括:
维生素C增加或减少药物副作用的风险
如果服用雌激素或基于雌激素的避孕药,维生素C可能会增加激素副作用的风险。这是因为维生素C可能会减缓雌激素离开身体的速度。
一些早期的研究认为, 维生素C可能有助于预防阿司匹林和非甾体抗炎药引起的胃部不适。
▼
维生素 C 和益生菌对肠道健康和免疫力有不同的好处,它们可以很好地互补,这意味着它们可以安全地一起服用。
一项针对学龄前儿童的双盲、随机、安慰剂对照初步研究中,发现益生菌与维生素 C 联合预防呼吸道感染的功效(URTI;33%,P =0.002)。
Lab4 益生菌和维生素 C 组合补充 6 个月的儿童显示,上呼吸道感染症状的发生率和持续时间有所减少,降低感染的严重程度。
注:Lab4 益生菌包含:嗜酸乳杆菌CUL21(NCIMB 30156)和CUL60(NCIMM 30157),双歧杆菌CUL20(NCIMB 30153)和动物双歧杆菌乳亚种CUL34(NCIMM 30172)。
注意:根据说明书剂量服用或遵医嘱。
以上并不是维生素C可能发生的相互作用的完整列表。在开始补充维生素C或调整摄入量之前,请与医生或药剂师沟通,让医生知道你正在服用的所有药物,包括处方药和非处方药、其他维生素或微量营养素、草药补充剂等。
▼
静脉注射和口服给药,这两者可能具有不同的药代动力学特征。
药理学模型显示,口服维生素C,即使是在非常大和频繁的剂量下,也只能适度地增加血浆浓度,从0.07 mM增加到最大0.22 mM。
而静脉注射剂量预计会导致血浆维生素C峰值水平比口服剂量高60倍以上,尿液浓度比口服剂量低140倍。
分子的实际生物利用度由许多因素控制,包括肠道和其他组织的吸收、肾脏的吸收和排泄以及其他患者特异性因素。
除了通过静脉给药和口服给药的浓度差异外,口服给药将维生素C直接输送到肠道微生物组,而不是通过血液;因此,它对肠道微生物的影响可能与动力学和浓度有关,这与影响血浆水平的动力学和浓度完全不同。
静脉注射维生素C常用于临床医疗环境中,用于治疗某些疾病或特殊情况下的高剂量补充,如感染、外伤、手术恢复等。专业医生会给予相应的建议。
口服给药适用于一般的日常维生素C补充,维持正常的维生素C水平。
有几种方法可以评估人体中的维生素C状态。这些包括测量血浆、尿液、组织、粪便中维生素 C 的浓度。
▼
检测血浆维生素C,血浆样品中维生素C的定量测定常见的有两种方法:酶法和色谱法。
酶促维生素C测定
有几种基于维生素C的酶促转化的商业试剂盒,产生可以用光光谱法检测的信号。通常,抗坏血酸氧化酶用于这种类型的测定。这些测定的常见方法是酶联免疫吸附测定(ELISA),它非常适合分批处理样品,但不太方便立即测定少数样品中的值。
根据欧洲外部质量评估计划(Instand EQAS)中报告的方法,基于酶的分析方法在医院中并不常规使用。如果临床对立即测定维生素C的需求增加,由于其直接的技术性质,这些基于酶的测定可用于护理点或集中平台。
色谱法测定维生素C
抗坏血酸和DHA的定量测量目前是通过高效液相色谱(HPLC)方法进行的。如果必须分析具有相似性质的多种化合物,或者如果存在许多可能干扰感兴趣化合物定量的物质,则HPLC方法是优越的。
将酸化样品注射到HPLC仪器中后,通过通过基于化合物的物理性质不同地保留化合物的柱来分离化合物。结果,在分离柱的末端,可以选择性地检测抗坏血酸和DHA,而不受其他化合物的干扰。
目前有两种方法可以检测分离后的抗坏血酸和DHA,一种是电化学检测,另一种是紫外线检测。这两种检测方法给出的结果相同,但由于相对技术简单,紫外线检测更广泛地用于日常检测。
其他检测技术,如荧光检测,需要在柱前对抗坏血酸和DHA进行化学改性,但使用较少。比色/荧光法可能会产生更高的DHA浓度,因为该方法缺乏特异性。
▼
可以查看近期体内维生素状况。
肠道菌群可以影响食物中的营养物质的吸收和利用。肠道菌群的失调可能会影响维生素C吸收,从而出现维生素C缺乏,引发一系列健康问题。因此,检测肠道菌群的状况,可以帮助我们更好地了解维生素C的吸收和利用情况。
与抽血检测不同,肠道菌群的评估更加反映一段时间 ( 一般2周左右 ) 的长期状态,如部分维生素无法在体内留存,需要每日补充,血液检测波动较大。
肠道菌群与维生素C的水平之间存在怎样的关联?
为什么肠道菌群检测报告可以了解维生素情况?
我们来看下一章节。
我们在日常生活会看到,同样吃食物,有些人的维生素吸收状况比较好,有些人就容易缺乏,这是为什么呢?
为什么大剂量补充对一些人的身体有益,而少数人因为过量出现了肾结石呢?
这其实都与肠道微生物群相关。
这里我们分为两个方面来讨论:
一个是肠道微生物群对维生素C的影响,
一个是维生素C的补充对肠道微生物群的影响。
维生素C在人体代谢过程中的吸收和利用,与肠道微生物群相关。了解肠道微生物群对维生素C的吸收和利用的影响,可以帮助我们更好地理解其与人体健康之间的关系。
▼
微量营养素使用各种特定的吸收途径和机制,既可以是被动的,也可以是主动的。
膳食维生素 C 很容易通过钠依赖性维生素 C 转运蛋白(SVCT1 和 SVCT2)在肠道中吸收,其他比如维生素A 、维生素D 的吸收通过小肠中的被动扩散发生。
肠道微生物群是人体肠道中的有效生物反应器,可将各种化合物转化为有益或有害的代谢物,因此对其生物利用度起着至关重要的作用。
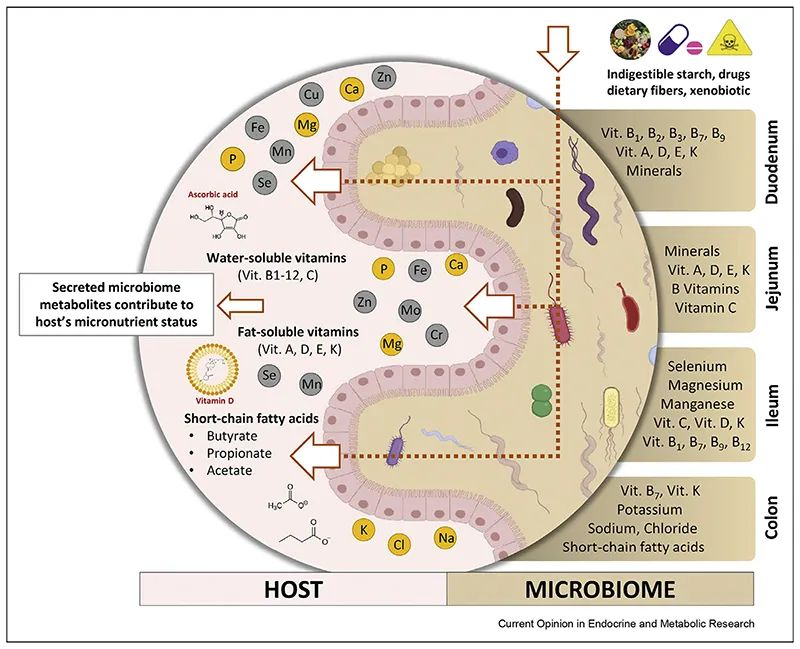
doi: 10.1016/j.coemr.2021.100285
胃肠道各部分理化特性的差异,以及位点特异性受体的存在,使得不同的维生素和矿物质能够沿胃肠道吸收。不同微生物在每个不同部分的定殖会影响当地环境,从而对微量营养素的生物利用度产生积极或消极的影响。
微生物可以干扰维生素C的吸收
微生物可以通过干预生物合成过程和调节吸收,来调节微量营养素的水平,包括维生素C。
来自革兰氏阴性菌的脂多糖降低SVCT-1的表达,进而降低SVCT-1-介导的维生素C的摄取。
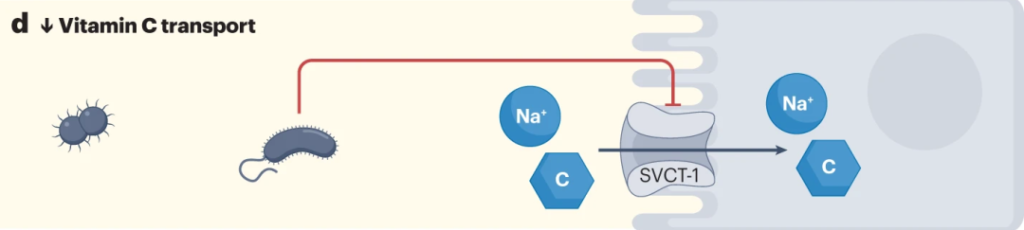
Chmiel JA, et al.,Nat Rev Urol. 2023
大肠杆菌可以通过释放脂多糖来减少宿主对抗坏血酸的摄取,从而增加NF-κB依赖性TNF的产生,其进而通过抑制SLC23A1和SLC23A2启动子(分别编码SVCT1和SVCT2),来降低钠依赖性维生素C转运蛋白SVCT1与SVCT2的表达。从而对维生素C的吸收率产生负面影响。
细菌可以与宿主竞争维生素C
大肠杆菌抗坏血酸转运蛋白对抗坏血酸的亲和力高于哺乳动物SVCT1,这表明细菌可以与宿主竞争维生素C。
因此,肠道菌群中大肠杆菌等革兰氏阴性菌占比较多的情况,可能不利于维生素C的吸收,这在谷禾肠道菌群检测报告中也是可以反映的。
▼
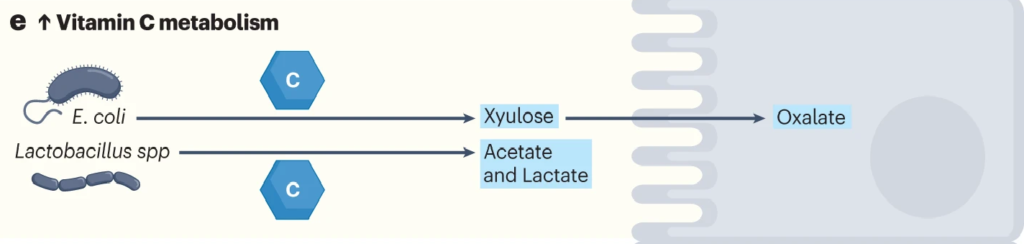
肠道细菌如大肠杆菌和乳酸杆菌代谢维生素C。
利用ula基因簇,大肠杆菌等细菌可以将抗坏血酸代谢为D-木酮糖,宿主细胞可以进一步加工木酮糖以产生草酸盐。
在肺炎链球菌、沙门氏菌、福氏志贺菌、粪肠球菌、肺炎克雷伯菌等病原菌中,也发现了相同的ula基因簇。
带ula的致病菌与草酸盐:携手制造结石
结石形成者(比如肾结石患者)微生物群更常见地富含携带ula基因簇的致病菌,并且这些患者在接受口服维生素C时,草酸盐增加的水平比非结石者增加得更多。高草酸盐水平增加了结石的风险。
因此,如果在肠道菌群检测报告中发现以上提到的致病菌占比较多,则有可能在代谢维生素C的时候产生的草酸盐过多,增加了结石的风险。
Chmiel JA, et al.,Nat Rev Urol. 2023
“
以上通过微生物群代谢维生素的机制,有助于我们更好地理解结石形成的机制。
既然有促进结石的细菌,自然也有降解的细菌:
一些乳酸杆菌可以将维生素C转化为乙酸盐和乳酸盐,这是一种无毒的代谢产物,通过生物能量途径增加微生物组的功能,并可能促进这些草酸降解细菌的定植。
Oxalobacter formigenes是一种革兰氏阴性厌氧细菌,可降解肠道草酸盐并促进原发性高草酸条件下肠道草酸盐的分泌。该菌在肠道定植可降低尿液或血浆中的草酸盐浓度。
Barone M, et al., Biofactors. 2022
我们看到生活中有人认为不能吃生菠菜,会得肾结石,但有些人每天吃生菠菜也没事…其实可能是因为人家的肠道菌群中致病菌较少,而降解草酸的菌群又在拼命干活…
因此,健康的肠道菌群结构非常重要,菌群在该干活的时候各司其职,井井有条,那么你的身体抵抗疾病的能力也随之提升。
以上是肠道菌群对维生素代谢吸收的影响,反过来,维生素C的补充也可以影响肠道菌群的组成。
二、
补充维生素C可以直接调节肠道微生物群,也可以通过改变氧化还原电位、修复肠道屏障,改善肠道条件,支持部分有益菌生长,防止有害菌泄漏到身体其他部位。
▼
维生素C直接调节肠道菌群
与安慰剂组相比,补充维生素C已被证明可以显着增加微生物生态系统的多样性,以及Collinsella的相对丰度和粪便水平的短链脂肪酸,特别是丁酸盐和丙酸盐。
在健康受试者中,每日高剂量维生素C补充(1000 mg/天):
下列菌群的相对丰度升高
下列菌群的相对丰度下降
一项观察性研究探讨了微量营养素维生素C对肠道微生物组组成和多样性的影响。结果表明,维生素C增加了肠道中双歧杆菌属的丰度,在科水平上,毛螺菌科和双歧杆菌科显著增加。
双歧杆菌属的成员是有益菌,例如增加ATP生成、调节免疫系统、黏膜屏障完整性、短链脂肪酸的产生,对健康有益,维生素C通过增加肠道有益菌促进健康。
研究发现,囊性纤维化患者维生素C摄入量的增加与厚壁菌门的丰度呈正相关,与拟杆菌门的丰度呈负相关。
▼
改变氧化还原电位
调节微生物组的机制类似于维生素B2:通过改变氧化还原电位,改善消化道中的厌氧/耐氧平衡,从而选择性地支持微生物生长,改善肠道条件。
与安慰剂相比,维生素C组粪便样本中的粪便pH值和氧化还原平衡降低。
▼
修复肠道屏障
我们知道,肠道屏障受损,细菌和有害物质有可能会穿过屏障进入血液循环,对人体产生各种负面影响,导致诸如过敏、炎症、自身免疫疾病等多种反应。
关于肠漏可以详见我们之前的文章:
而维生素 C 具有维持肠粘膜屏障完整性和修复粘膜屏障的作用。
这里介绍两种修复肠屏障机制。
——通过激活Notch 信号
Notch 信号影响细胞正常形态发生的多个过程,与许多人类疾病有关,包括IBD,因此被认为是癌症治疗的潜在靶点。Notch 信号通路的激活会改变紧密连接蛋白的表达并影响其分布的连续性,从而降低细胞屏障通透性。
豚鼠结肠组织相关基因检测表明,低剂量的维生素C可强烈激活Notch/Hes-1信号通路,对DSS诱导的结肠炎豚鼠的肠粘膜具有一定的保护作用。肠上皮受损时,Notch-1表达增加可促进上皮细胞增殖,有利于损伤部位的修复和重建。
——通过增加肠道胶原蛋白合成
增加维生素 C 摄入量的另一个潜在好处是肠道胶原蛋白合成增加,从而改善屏障功能。这一提出的机制与抗坏血酸的辅酶功能一致,即羟基化脯氨酸和赖氨酸以交联胶原蛋白。
例如,对具有吲哚美辛诱导的屏障功能障碍的 T84 人隐窝样上皮细胞系的研究表明,细菌通过跨细胞途径穿过上皮细胞,维生素 C 治疗可消除该途径。因此,肠道中抗坏血酸状态不佳可能会加剧屏障功能障碍,从而增加 LPS 衍生的革兰氏阴性菌的易位,从而加剧炎症。
维生素C修复肠道屏障后,肠道屏障可以正常发挥吸收、分解和转换营养物质等功能,同时可以帮助促进健康微生物群栖息和生长,从而促进整体健康。
以上我们了解到,维生素C可以通过多种方式影响肠道菌群,从而促进整体健康。那么当我们看到肠道菌群报告中菌群多样性较低,部分菌群失调,尤其是上面提到的毛螺菌科、肠球菌属、Collinsella、Gemmiger formicilis等,可以考虑通过补充维生素C来调节。
我们首先可以考虑通过食物补充,如卡姆果、针叶樱桃等维生素C含量很高的食物,或者一些常见的蔬菜水果例如:猕猴桃、番石榴(芭乐)、青椒、羽衣甘蓝等。也可以考虑通过维生素C补充剂调节。
人体维生素研究面临着许多挑战,维生素通常是通过食物摄入的,而食物中同时存在多种营养素,这使得难以研究单一维生素的作用;某些高剂量维生素的使用可能存在潜在的风险,进行研究时涉及到人体试验和干预,需要遵循伦理准则,并确保研究的安全性;不同人对维生素的需求和代谢能力存在个体差异,基因、环境和生活方式等因素都可能影响维生素的吸收、利用和代谢。
肠道菌群研究可以揭示不同个体之间菌群组成的差异,这有助于理解个体差异对维生素代谢和利用的影响。可以通过检测肠道菌群的组成和丰度,了解维生素的代谢情况,从而辅助评估维生素水平。
综合运用多种研究方法和技术,结合肠道菌群检测,可以考虑多个因素对维生素代谢和利用的综合影响,进一步理解维生素的作用机制,对人体健康具有重要意义。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314.
Chmiel JA, Stuivenberg GA, Al KF, Akouris PP, Razvi H, Burton JP, Bjazevic J. Vitamins as regulators of calcium-containing kidney stones – new perspectives on the role of the gut microbiome. Nat Rev Urol. 2023 May 9:1–23.
Pham VT, Dold S, Rehman A, Bird JK, Steinert RE. Vitamins, the gut microbiome and gastrointestinal health in humans. Nutr Res. 2021 Nov;95:35-53.
Li XY, Meng L, Shen L, Ji HF. Regulation of gut microbiota by vitamin C, vitamin E and β-carotene. Food Res Int. 2023 Jul;169:112749.
Yang Q, Liang Q, Balakrishnan B, Belobrajdic DP, Feng QJ, Zhang W. Role of Dietary Nutrients in the Modulation of Gut Microbiota: A Narrative Review. Nutrients. 2020 Jan 31;12(2):381.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140.
Gomes-Neto JC, Round JL. Gut microbiota: a new way to take your vitamins. Nat Rev Gastroenterol Hepatol. 2018 Sep;15(9):521-522.
Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, Tuohy K. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018 Feb;57(1):1-24. doi: 10.1007/s00394-017-1445-8. Epub 2017 Apr 9. PMID: 28393285; PMCID: PMC5847071.
Traber MG, Buettner GR, Bruno RS. The relationship between vitamin C status, the gut-liver axis, and metabolic syndrome. Redox Biol. 2019 Feb;21:101091.
Rozemeijer S, Spoelstra-de Man AME, Coenen S, Smit B, Elbers PWG, de Grooth HJ, Girbes ARJ, Oudemans-van Straaten HM. Estimating Vitamin C Status in Critically Ill Patients with a Novel Point-of-Care Oxidation-Reduction Potential Measurement. Nutrients. 2019 May 8;11(5):1031.
Otten AT, Bourgonje AR, Peters V, Alizadeh BZ, Dijkstra G, Harmsen HJM. Vitamin C Supplementation in Healthy Individuals Leads to Shifts of Bacterial Populations in the Gut-A Pilot Study. Antioxidants (Basel). 2021 Aug 12;10(8):1278.

谷禾健康
酒精与健康

饮酒作为一种特殊的文化形式,在我们国家有其独特的地位,在几千年的发展中,酒几乎渗透到日常生活、社会经济、文化活动之中。
据2018年发表的《中国饮酒人群适量饮酒状况》白皮书数据显示,中国饮酒人群高达6亿。酒精暴露是一种环境刺激,可显著改变许多生理、心理以及周围和中枢神经系统过程。从心脏和肝功能,到对肠道微生物组和内分泌途径的影响,酒精对全身和大脑都有广泛的影响。
众多的研究表明酒精本身可以产生双重效果,当然,这取决于饮酒量和酒的生产方式。
▸ 低-中剂量
低度至中度酒精对肠道微生物组、肠道代谢物和免疫相关疾病甚至一些癌症似乎起保护和有益作用。
▸ 高剂量
高剂量酒精或长期酗酒对胃肠道、肠道微生物组、免疫细胞和营养物质起破坏和损害作用。
目前的证据还表明,不同剂量的酒精在体内不同组织部位发挥不同的作用。
总体来说,过度饮酒,尤其在青少年和部分职业人群中占比越来越高,带来的伤害和健康风险不容忽视。过度饮酒会导致许多不良的病理健康影响和沉重的医疗保健负担。
根据世界卫生组织最新的通报指出,全球每年大约有超过300万人因过量饮酒而被夺去生命,其死亡人数已经超过爱滋病、暴力和交通事故死亡人数的总和。在饮酒所造成的直接或间接的死亡事件中,男性饮酒带来的风险尤为突出。

酒精引起的胃肠道功能以及微生物群组成和代谢的变化,内毒素血症的肠道通透性与全身性炎症和组织损伤/器官病变相关。
在过去的十年中,肠道,特别是肠道微生物群与酒精性肝病之间的关联引起了研究人员的关注。酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝和其它器官损伤。
而且,酒精引起的微生物组改变和肠道屏障完整性下降会对中枢神经系统产生深远影响,导致抑郁、焦虑和对酒精的渴望增加,从而增加酗酒行为,造成恶心循环。
目前,酒精的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。然而,这些干预措施都存在着一定的局限性,例如药物治疗可能会产生副作用,心理治疗需要长时间的治疗过程,社会支持需要家庭、朋友等的积极配合。
因此,寻找一种更加有效、安全、方便的治疗方法成为了当前治疗酒精成瘾和酒精使用障碍的研究重点。近年来,越来越多的研究表明,肠道菌群可能成为新的治疗酒精成瘾和酒精使用障碍的途径。新兴研究表明,通过调节肠道菌群可以减轻酒精成瘾的症状,例如减少饮酒量、降低戒断症状等。
本文将介绍酒精摄入或饮酒与肠道菌群及其代谢,肠内外健康的关系。
↘
本文目录
01 饮酒如何影响健康
酒精进入人体过程
酒精和肠道
酒精带来的有害影响
适量酒精带来的益处
02 轻中剂量酒精对自身免疫性疾病的保护作用
短链脂肪酸
多不饱和脂肪酸
自身免疫性糖尿病
自身免疫性甲状腺疾病
系统性红斑狼疮
类风湿关节炎
多发性硬化症
03 高剂量酒精对肠道菌群及其代谢物和营养物质的促炎作用
高剂量酒精对肠道菌群组成的影响
高剂量酒精对肠道屏障功能的影响
高剂量酒精对肠道微生物代谢物的影响
长期饮酒对营养状况的影响
高剂量酒精对肠道炎症和黏膜免疫的影响
04 酒精对相关疾病的影响
酒精与肠-肝轴和肝病
-酒精代谢
-酒精相关性脂肪变性
-酒精性脂肪性肝炎
-酒精引起的纤维化和肝硬化
-肝癌
酒精与胃肠道疾病
酒精和营养不良&肥胖
-营养不良
-肥胖
酒精和心血管疾病
-血脂概括
-高血压
05 酒精与肠脑轴和酒精成瘾
06 干预措施
酒精(乙醇)是一种水溶性小分子,通过胃和近端小肠进入血流,然后分布到全身。它首先进入门静脉,门静脉直接排入肝脏,这是接触酒精最多的地方。肝脏消除了大部分酒精 (90%),而 2–5% 以原形通过尿液、汗液和呼吸排出。
身体第一个直接接触酒精的器官系统是消化系统;因此,从口腔到直肠,几乎消化系统的每个部分都会受到酒精的影响。
酒精对消化系统的病理影响部分取决于肠-肝轴。这种由肠肝循环促进的双向关系涉及消化和细菌产物从肠道到肝脏的运输,以及胆汁、抗体和细胞因子返回肠道。
过量酒精摄入已被证明会通过破坏肠道微生物组成、代谢组和肠道上皮屏障来改变这一轴。这些干扰最终会对营养吸收产生连锁反应。
酒精对肠道的影响
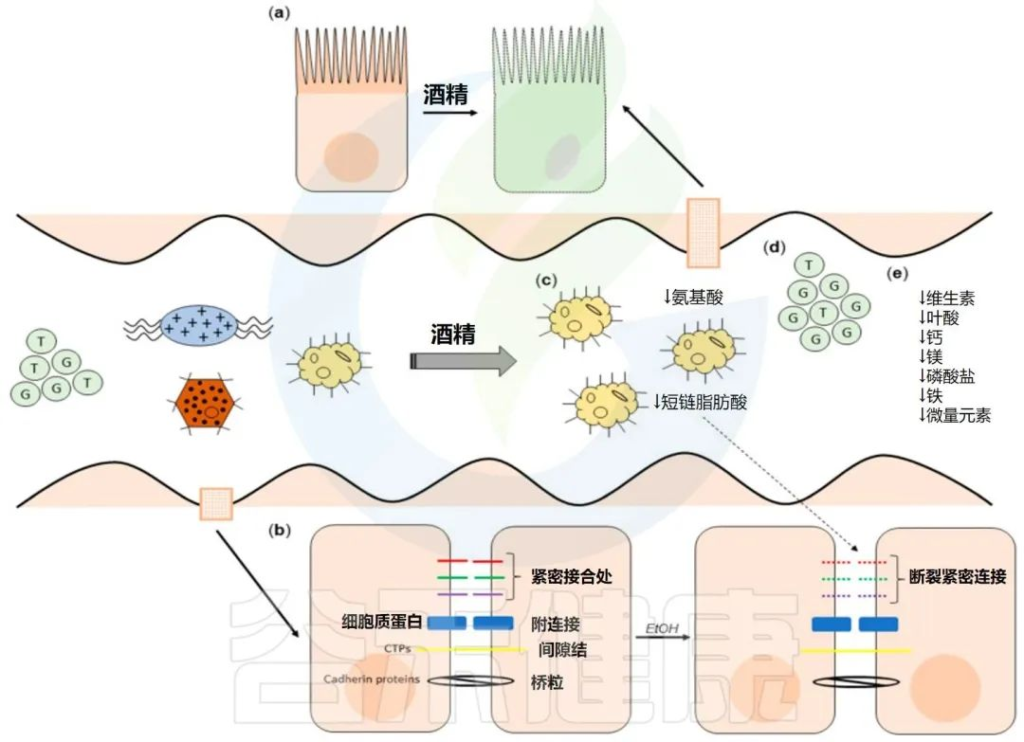
Pohl K et al. Nutrients. 2021,13(9):3170.
CTP:连接蛋白跨膜蛋白;JAM:连接粘附分子;EtOH:酒精。
( a ) 酒精对肠粘膜的组织学影响(细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失)。
( b ) 酒精引起的紧密连接破坏,因管腔短链脂肪酸浓度降低而加剧。
( c ) 酒精引起的生态失调导致短链脂肪酸和氨基酸浓度降低。
( d ) 次级胆汁酸浓度增加,与甘氨酸结合的比例增加。
( e ) ( a – d ) 导致的营养缺乏。
酒精对人体的影响是双重的,既有正面的作用,也有负面的作用。
▼
过量饮酒对人体各部位可能引起的有害影响
– 嘴
饮酒会刺激口腔和喉咙,这会增加患口腔癌的风险。
– 食管
酒精从口腔进入胃部时会引起刺激,从而增加患食道癌的风险。
– 胃
酒精会引起胃壁刺激和随后的炎症,这种情况也称为胃炎。胃壁过度刺激或发炎会导致受影响区域出血和溃疡。
此外,饮酒会导致营养吸收不良,从而使个人患上一系列其他疾病的风险更高。
– 大/小肠
饮酒会抑制大肠和小肠内的营养吸收。肠道蠕动也会受到影响并导致腹泻。
– 胰腺
酒精会导致胰腺发炎,也称为胰腺炎。酒精还会影响胰腺产生胰岛素的方式,如果不停止饮酒,最终会导致个体患上糖尿病。
– 肝脏
酒精是通过 ADH 和 CYP2E1 代谢的,这两种酶都是肝脏的重要功能酶。
通过干扰这些酶的正常功能并产生有害的副产物,对肝脏的影响可能包括肝脏炎症或肝炎、肝硬化、黄疸。
饮酒过多的人可能的直接有害影响
长期酗酒的危害
长期饮酒是全世界最常见的死亡原因之一。根据世界卫生组织的数据,全世界有 23 亿人饮酒,其中约 7500 万人被归类为患有酒精障碍。
酒精滥用会对多个终末器官造成损害,主要是肝脏、肠道和大脑,从而引发多系统损伤。
酒精中毒对全球发病率和死亡率有显著影响,每年约有 5.3% 的死亡是由有害饮酒造成的(世卫组织,2018 年)。一项针对印度南部农村 167,343 名成年受试者的研究发现,每天饮酒 30 年或更长时间会增加癌症相关死亡率的总体水平。
大量饮酒通常与患癌症的风险增加有关;然而,具体的剂量反应关系因癌症部位而异。
——饮酒量越多,肝癌风险越高
最近对涉及 19 组肝癌(即肝细胞癌)受试者的 16 篇文章进行的荟萃分析发现,与不饮酒者相比,饮酒量与肝癌风险之间存在线性关系。
因此,每天饮用 3 杯酒精饮料与风险增加相关,而每天饮用约 7 杯酒精饮料则风险增加高达 66%。
——不同种类乳腺癌,饮酒风险不同
乳腺癌风险也存在类似的线性关系。虽然饮酒总体上与女性患乳腺癌的风险较高有关,但这种关联并不适用于所有类型的乳腺癌。
在参加妇女健康倡议的女性中,饮酒者患雌激素阳性乳腺癌的风险增加。
而与从未饮酒的女性相比,饮酒者患三阴性乳腺癌的风险降低。
注:三阴性乳腺癌,孕激素、雌激素受体以及Her-2即表皮上皮生长因子,都是阴性,叫三阴性乳腺癌。
总之,饮酒和滥用酒精与多种癌症有关,并且这些关联的数量还在不断增加。与此同时,现在越来越清楚的是,酒精对某些慢病和癌症具有预防作用。此外,尽管酒精在预防某些癌症方面具有潜在的有益作用,但重要的是要记住,不能忽视长期酗酒的有害影响。
可能会增加以下疾病的易感性:
酒精引起的肠道菌群和代谢功能的变化可能导致
虽然酒精的新陈代谢看起来相当简单,但酒精的有害影响最常与新陈代谢过程相关,而新陈代谢过程通常会导致烟酰胺腺嘌呤二核苷酸加氢 (NADH) 的过量产生。
大量的 NADH 会导致乳酸,从而导致体内酸中毒,以及葡萄糖合成不足,从而导致低血糖。
▼
虽然大多时候我们都认为饮酒会带来许多有害影响,但过去几年进行的几项临床研究表明,适度饮酒实际上可以促进许多健康益处,例如:可能有助于降低患心脏病和死亡、缺血性中风、糖尿病的风险。这些益处的前提是要适度饮酒,那么什么是适度饮酒?
根据疾病预防控制中心的说法:
轻度饮酒:每周喝三杯或更少的酒精饮料。
适度饮酒:女性每天喝一杯酒精饮料,男性每天喝两杯。
大量饮酒:女性每天喝四杯或更多酒,男性每天喝五杯或更多酒。
注:这个定义在不同的研究中存在差异。由于参与者的主观记忆和准确的报告,准确的人类消费量很难量化。
适度饮酒具体是如何带来益处的?
适量的酒精已被证明可以提高高密度脂蛋白 (HDL) 的水平,这是一种“好”胆固醇,实际上这已经从你的身体中去除了有害的胆固醇。
当一个人的 HDL 水平较高时,它们就能更好地保护自己免受心脏病的侵害。
适度摄入不含酒精的啤酒,可以通过补充生物活性多酚和酚酸,以及通过有益菌丰富肠道微生物群多样性,对人体健康产生积极影响。
——适量饮酒与血癌发病率较低相关
有趣的是,饮酒还与几种血癌的发病率较低有关,包括非霍奇金淋巴瘤 (NHL) 和多发性骨髓瘤。对与瑞典癌症登记处相关的 420489 名被诊断患有酒精使用障碍 (AUD) 的人进行的分析还发现,他们患白血病、多发性骨髓瘤和霍奇金病的风险较低。
最近的另一项研究还表明,饮酒与白血病风险增加无关,事实上,少量饮酒(每天少于或等于一杯)与白血病发病率降低 10% 有关。
——适量饮酒与甲状腺癌和肾细胞癌风险降低有关
在肾细胞癌的案例中,男性和女性的饮酒量低至每天 1 杯,风险也会降低,而更高的酒精摄入量并没有带来进一步的好处。
——适度饮酒与直肠腺癌呈负相关
一项针对结肠和直肠腺癌的回顾性观察性研究表明,适度饮酒(每天少于 14 克)与直肠癌的发病率呈负相关。研究人员还发现,适度摄入啤酒,尤其是葡萄酒与远端结直肠癌呈负相关。
酒精在体内具有多效性
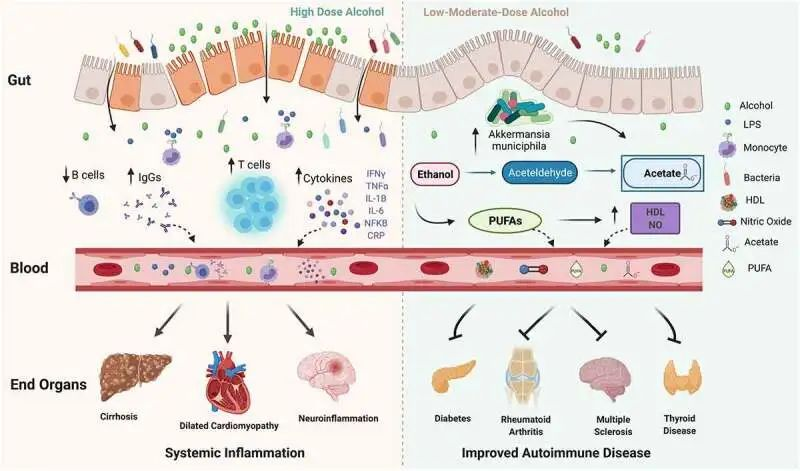
10.1080/19490976.2021.1916278
在高剂量下,酒精会破坏肠道屏障的稳定性,并可能导致肠道微生态失调、细菌壁产物、脂多糖 (LPS) 增加,后者会刺激免疫细胞上的 Toll 样受体 (TLR),并导致单核细胞、T 细胞、细胞因子和免疫球蛋白 (IgG) 水平以及 B 细胞减少。反过来,循环的炎性细胞因子、IgG 和免疫细胞会导致终末器官损伤。
在中低剂量下,酒精已被证明可以改善自身免疫性疾病的风险和进展。
低剂量酒精可能通过增加Akkermansia muciniphila对炎症产生积极影响和其他保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸 (PUFA)、高密度脂蛋白 (HDL) 和一氧化氮 (NO)。
接下来展开讨论低-中剂量酒精对自身免疫性疾病的保护作用,以及高剂量酒精带来的健康危害,包括免疫系统、肠道菌群及其代谢产物、营养物质等多方面。
酒精可能对自身免疫性炎症产生有益影响的一个重要方式是通过其对肠道中脂肪酸代谢的影响。
众所周知,高剂量酒精会导致脂肪酸失调和发展为脂肪肝疾病,而在低剂量时,酒精可能有助于产生肠道衍生的抗炎脂肪酸,例如短链脂肪酸(SCFAs) 和多不饱和脂肪酸 (PUFAs)。
短链脂肪酸
低度至中度饮酒可以通过两种方式调节短链脂肪酸的产生:
1、通过改变肠道中产短链脂肪酸菌
低度至中度酒精会改变肠道中产生短链脂肪酸的微生物群,例如Akkermansia muciniphila。
短期饮酒(5 天 0.8 g/kg 胃内)会升高小鼠的Akkermansia muciniphila水平,而在消耗同等酒精强度的发酵米酒 (FRL) 的组中未观察到升高。
2、通过乙酸盐产生
酒精本身会代谢成短链脂肪酸、乙酸盐,并且喂食 Lieber-DeCarli 饮食 8 周的动物与对照组相比显示乙酸水平升高。
Lieber-DeCarli 饮食
Lieber-DeCarli 饮食是一种常用于动物实验中的饮食方案。它是由两位科学家 Lieber 和 DeCarli 在 1980 年代开发的,旨在为动物提供一种高度可控的饮食,也就是说可以根据实验需要增加或减少某种营养素的含量,以便研究不同营养素对健康和疾病的影响。
Lieber-DeCarli 饮食的特点是含有高浓度的葡萄糖和脂肪,而蛋白质含量相对较低。这种饮食的能量密度非常高,因此可以使动物快速增重。
Lieber-DeCarli 饮食在动物实验中应用广泛,特别是在研究肝脏疾病、肿瘤、代谢疾病等方面。由于该饮食的成分非常可控,可以帮助研究人员更准确地评估不同营养素对健康的影响,因此被广泛应用于基础医学和临床研究中。
需要注意的是,Lieber-DeCarli 饮食虽然在动物实验中应用广泛,但并不适合人类长期食用。这是因为该饮食的成分并不符合人类的膳食建议,长期食用可能会导致营养不良和健康问题。
多不饱和脂肪酸
低度至中度酒精保护自身免疫性疾病的另一个潜在机制,可能依赖于酒精在必需多不饱和脂肪酸代谢中的重要作用,如二十二碳六烯酸 (DHA) 和二十碳五烯酸 (EPA)。这些多不饱和脂肪酸(PUFA)可以减少活性氧的形成并充当抗炎分子。
低至中等剂量的酒精已被证明会增加多不饱和脂肪酸的产生,而在高剂量酒精下,由于脂肪酸分解代谢增加,多不饱和脂肪酸浓度会降低。
值得注意的是,多不饱和脂肪酸和多不饱和脂肪酸衍生物,如分解素、脂氧素和与自身免疫性疾病的缓解有关。
此外,多项研究还表明,多不饱和脂肪酸的增加具有心脏保护作用。由于心血管健康正在成为自身免疫性疾病结果的一个重要因素,这可能是另一种由低度至中度酒精介导的保护机制。
鉴于促炎特性,饮酒可能会导致自身免疫性疾病的风险增加或恶化。事实上,在某些炎症性疾病中,例如肠易激综合征 (IBS) 和常年性过敏,大量饮酒与疾病发作之间存在直接相关性。然而,适度饮酒似乎可以降低疾病风险、严重程度和进展。
这里介绍几种酒精相关的自身免疫性疾病,包括自身免疫性糖尿病、自身免疫性甲状腺疾病、系统性红斑狼疮、类风湿关节炎、多发性硬化症等,适度饮酒可降低其风险。
自身免疫性糖尿病
适度饮酒的有益作用已在成人非自身免疫性2 型糖尿病和自身免疫性 1 型糖尿病 (LADA) 中得到证实。
每天摄入 2–7 g 的患者风险降低了 60%
在一项自身免疫性 1 型糖尿病研究中,与每天摄入 0.01–2 g 的患者相比,每天摄入 2–7 g 的患者风险降低了 60%。这项研究还指出,与饮酒者相比,戒酒者的抗谷氨酸脱羧酶抗体 (GAD Ab) 水平更高,C 肽水平更低,对男性的影响更为明显。
注:抗谷氨酸脱羧酶抗体 (GAD-Ab) 在1型糖尿病发病前期和发病时多为阳性,而在正常人群及2型糖尿病患者中多为阴性。
葡萄酒的效果显著,可能与葡萄酒中的多酚类抗氧化物质相关
在另一项自身免疫性 1 型糖尿病研究中,发现摄入量超过 25 克/天的男性和女性的风险降低了 46%。这种效果似乎在抗 GAD 抗体水平低的患者中最强,并且与啤酒或白酒消费者相比仅限于葡萄酒饮用者。作者推测,抗 GAD 抗体水平较低的患者可能与 2 型糖尿病患者最相似,可能是葡萄酒中的多酚和羟基二苯乙烯类物质促进了酒精在自身免疫中的抗氧化或抗炎作用。
自身免疫性甲状腺疾病
与糖尿病类似,适度饮酒已被证明对自身免疫性甲状腺功能减退症和甲状腺功能亢进症均有保护作用。
例如,与对照组相比,适度饮酒与甲状腺功能减退症和格雷夫氏病的风险降低呈剂量依赖关系,无论性别或饮酒类型如何。
几项研究还发现,适度饮酒 >10 单位/周或每天至少饮酒 35 克,与自身免疫性甲状腺疾病和甲状腺过氧化物酶抗体阳性的发生概率较低有关。
系统性红斑狼疮(SLE)
多个病例对照、队列和横断面研究已经确定适度饮酒与系统性红斑狼疮风险之间存在显著的剂量依赖性关联。
在一项荟萃分析中,适度饮酒的保护作用与系统性红斑狼疮的持续时间有关,与治疗少于 5 年的患者相比,治疗少于 10 年的患者具有显著性。
另一项研究得出结论,适度饮酒可能会降低 ANA 阳性患者进展为系统性红斑狼疮的概率。
注:系统性红斑狼疮(SLE)是临床上最为常见的自身免疫性疾病之一。SLE的实验室检查包括多种项目,抗核抗体(ANA)是其中较为经常检测的项目之一。ANA阳性尤其是ANA核型为核均质性的结果往往与SLE具有较高的相关性,故临床上往往以此结果联合其他检查并结合患者症状作为诊断SLE的依据。
类风湿关节炎
与甲状腺疾病、糖尿病和系统性红斑狼疮类似,多项流行病学研究和几项机制研究支持轻度至中度酒精以 J 型或 U型剂量依赖方式在类风湿关节炎中发挥保护作用。
适度饮酒女性:较低的风险,较高的生活质量
在一项荟萃分析研究中,男性和女性的类风湿关节炎风险在10年内均有所降低,其中女性的风险降低幅度最大。
在其他研究中,与男性相比,适度饮酒的女性报告了较低的疾病活动和较高的生活质量。
然而,也有文献记载:酒精可能会阻止男性的放射学进展,并增加女性的放射学进展。与不饮酒的患者相比,中度饮酒的类风湿关节炎患者的改良健康评估问卷得分(提示功能状态改善)也显著降低。这种影响在HLA-DRB1共享表位阳性的患者中更强。
因此,类风湿关节炎患者的酒精、性别和基因构成之间可能存在有益但复杂的关系。
在类风湿关节炎中,适度饮酒与CRP 水平、IL-6水平的关联
在类风湿关节炎(RA)中,已注意到 CRP 水平呈 J 型关联:每周饮用 1-7 杯酒的患者 CRP 水平最低。
51 名适度饮酒的类风湿关节炎患者在症状出现前与 IL-6 水平呈 U 型关联,饮酒与可溶性肿瘤坏死因子受体 2 (TNFR2) 水平呈负相关。
适度饮酒:ACPA阳性患者类风湿关节炎风险降低
由于酒精会导致肝损伤,一项评估饮酒与肝脏炎症之间关系的研究报告称,每周饮酒量大于 21 单位与转氨酶相关,而每周饮酒量小于 14 单位则没有。适度饮酒还与抗瓜氨酸化蛋白抗体 (ACPA) 阳性患者的类风湿关节炎风险降低 50% 相关,并且与 ACPA 阴性类风湿关节炎患者的疾病风险降低 30% 呈反比剂量反应关系。
在类风湿关节炎小鼠模型中也注意到酒精对免疫系统的剂量依赖性影响。
适度饮酒:胶原性关节炎发病率下降
在胶原性关节炎 (CIA) 模型中,与非酒精对照组相比,适度饮酒的小鼠的 CIA 发病率降低了 40%,放射疾病严重程度降低了 50% 以上。
饮酒小鼠的 IL-21 和 IL-17A、中性粒细胞、单核细胞、浆 B 细胞和 IgG 水平也较低。酒精和乙酸盐都会影响体外和体内T 滤泡辅助 (TFH ) 细胞的功能状态,从而抑制 IL-21 的分泌。
这些发现很有趣,因为 TFH细胞通常存在于类风湿关节炎患者的滑膜关节中,也是肠道免疫的重要介质,表明肠道免疫过程与类风湿关节炎之间可能存在联系。
在另一项 CIA 研究中,适度饮酒(10% 乙醇水溶液)通过增加内源性睾酮、抑制核因子 B 活化和下调白细胞迁移来延缓 CIA 的发作并改善其进展。
多发性硬化症(MS)
同样,在多发性硬化症中,也有证据表明,适度饮酒在降低疾病风险和/或疾病进展方面具有保护作用。几项大型人口研究表明:
酒精与男女多发性硬化症风险之间存在剂量依赖性负相关
适度饮用红酒似乎与较低的扩展残疾状态量表评分相关,这表明功能有所改善,尽管适度饮酒的患者在脑部 MRI 上表现出 T2 病变体积增加。
相反,大量饮酒可能会增加患多发性硬化症的风险,尤其是男性。
也有研究认为剂量和多发性硬化症风险之间没有关联,性别可能是一个变量
一些研究指出,不同剂量的酒精与患多发性硬化症的风险之间没有关联。在这些研究中,性别可能是一个变量,可以解释酒精对多发性硬化症的影响。
例如,在一项女性护士健康研究(NHS)I和II中,不同类型的酒精与多发性麻痹症的风险没有关联。尽管这是一项针对英国国家医疗服务体系两项研究中超过90000名女性的大型研究,但258例多发性硬化症患者的队列相对较小,与男性相比,女性可能没有经历到酒精的保护作用。
例如,在多发性硬化症的动物模型,即实验性自身免疫性脑脊髓炎(EAE)中,最近的研究表明,主要是雄性小鼠在适度饮酒后疾病评分有所改善。
以上是低-中剂量酒精带来的健康益处,“凡事皆有度,过犹不及”。接下来章节来看过量饮酒可能带来哪些不利影响。
酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝损伤。在某些人中,长期酗酒会导致肝病从脂肪肝发展为肝硬化和肝细胞癌。
持续酗酒会改变肠腔pH 值,促进病原体过度生长,并且还与肠道微生物群功能的改变有关,因为它会改变与肠屏障功能障碍有关的特定代谢物分泌物。酒精使用障碍患者通常表现出血浆细胞因子水平升高,例如 TNF-α、IL-10 和 CRP,这表明慢性、低度、全身性炎症。
几项研究调查了饮酒对动物和人体模型的影响,并一致表明过量饮酒与肠道微生态失调的发展有关。
简而言之,酒精已被证明可以增加变形杆菌、肠杆菌和链球菌的相对丰度,并降低拟杆菌、阿克曼氏菌和粪杆菌的丰度。其他还包括抗炎细菌(如Faecalibacterium prausnitzii和双歧杆菌等)水平下降。
在人类酒精使用障碍 (AUD) 研究中,生态失调的特征是:
扩展阅读:
肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
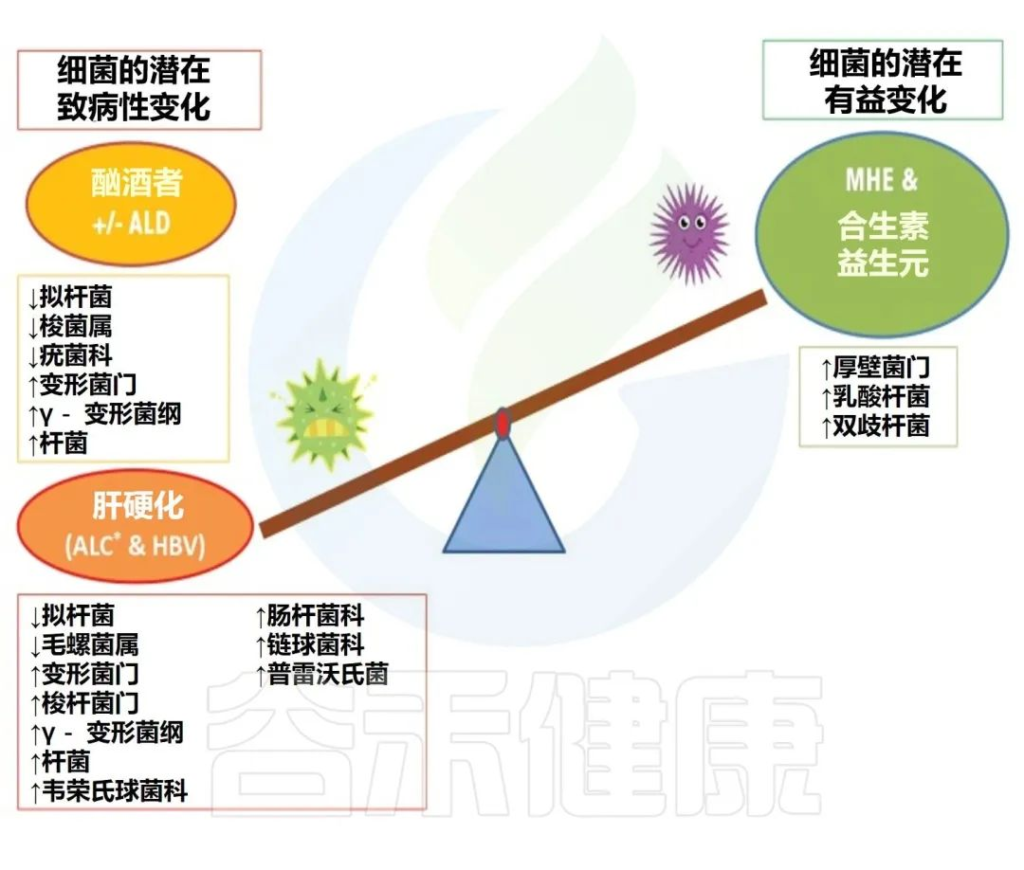
然而,并非所有研究都注意到厚壁菌门对高剂量酒精的反应有所减少。例如,在猕猴中自愿自我给予慢性高剂量酒精会导致拟杆菌减少、厚壁菌门升高,并且在饮酒期间完全没有Akkermansia muciniphila,而戒酒则恢复了基线细菌种类。
肠道微生物群稳态的破坏与这些疾病有关
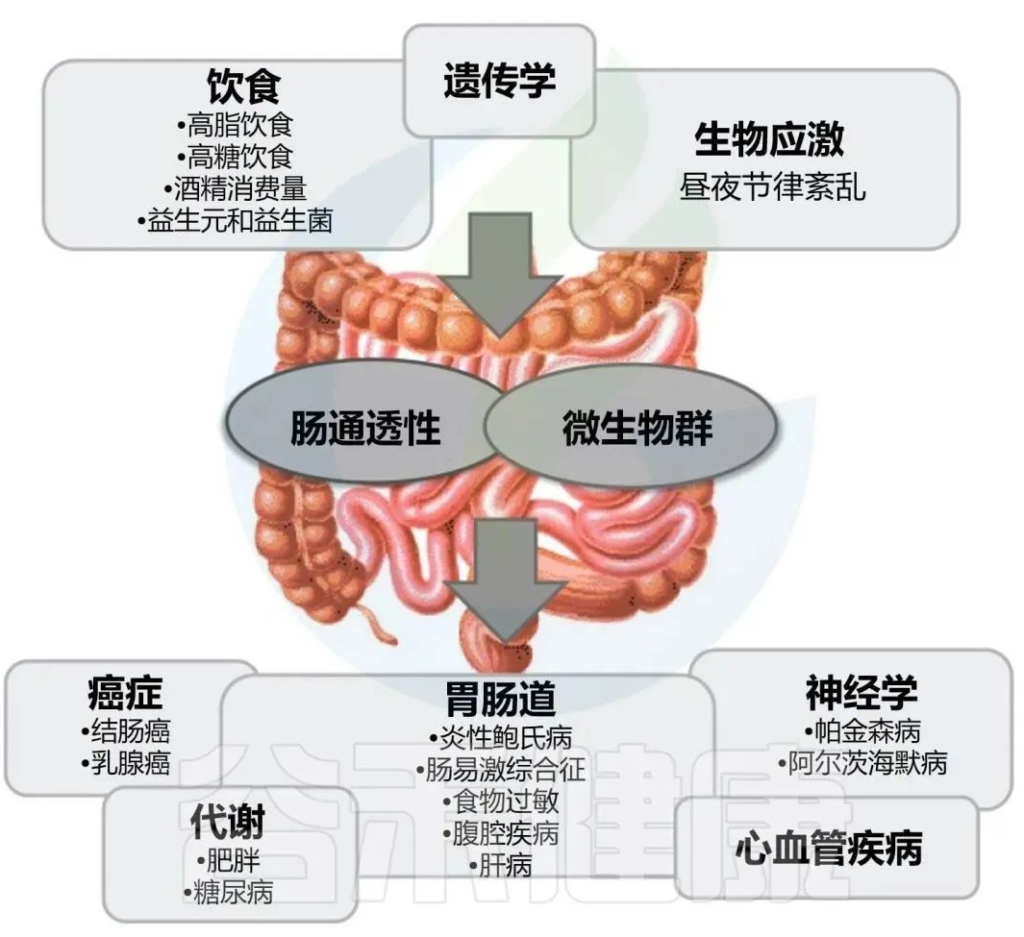
Engen PA et al., Alcohol Res. 2015;37(2):223-36.
此外,生态失调可能是由西方社会常见的环境因素引起的,包括饮食、遗传、昼夜节律紊乱和酒精饮料消费。
在酒精成瘾者中,饮酒会破坏肠道屏障功能,也称为肠漏症。肠道屏障由肠细胞、杯状细胞和影响粘液层内肠道微生物组的抗菌物质以及固有层中的众多免疫细胞组成。
酒精引起的生态失调通过其对肠道完整性的病理影响促进急性(例如,酒精性肝炎)和慢性(例如,酒精相关性肝硬化)肝病的发展。
肠粘液屏障在肠道的免疫功能中起着至关重要的作用,它的破坏会导致这些疾病状态。在这个屏障中,相邻的肠细胞被顶端“紧密连接”蛋白 claudins、occludin 和 zona occludens 结合在一起,防止病原体相关分子颗粒 (PAMP) 和细菌内毒素等管腔内容物意外转移到门脉循环中。
饮酒引起的生态失调与这些紧密连接的破坏有关。因此,随后的免疫功能障碍和循环促炎细胞因子(如肿瘤坏死因子 (TNF)-α 和IL-1β)的增加进一步破坏了肠道屏障。
扩展阅读:什么是肠漏综合征,它如何影响健康?
酒精相关的微生态失调不可避免地会影响肠道代谢,包括短链脂肪酸 (SCFA)、氨基酸和胆汁酸的显著变化。
短链脂肪酸
短链脂肪酸在维持紧密连接方面的作用越来越明显。短链脂肪酸是肠道菌群对难消化膳食纤维进行厌氧发酵的产物。
对酒精使用障碍患者的粪便代谢组分析显示,短链脂肪酸减少,这可能部分是由于生态失调对粪杆菌等产短链脂肪酸菌产生负面影响。一些小鼠模型表明,以高纤维饮食、益生菌或饮食调整形式补充短链脂肪酸,可增强肠道上皮完整性,并减少酒精模型中的肝损伤。
氨基酸
从饮食中获得的必需氨基酸(例如赖氨酸)和非必需氨基酸(例如谷氨酸)都会受到酒精影响。据推测,这是由于生态失调导致微生物-宿主共同代谢紊乱的结果。
虽然管腔氨基酸浓度会随着饮酒而下降,但一些氨基酸(如酪氨酸和苯丙氨酸)的血清水平会升高,这表明失调微生物组的代谢和吸收特征发生了改变。这种代谢失衡可能在活性氧 (ROS) 和有毒中间体水平升高的过程中发挥作用。
胆汁酸
胆汁酸已被证明在人类和大鼠饮酒后的血清和管腔内容物中都会发生变化。初级(由肝脏合成)和次级(来自细菌代谢)胆汁酸主要在小肠中发挥多种功能,并通过其类固醇结构在脂质吸收、胆固醇稳态以及激素作用中发挥关键作用。
在健康的肠肝循环中,初级胆汁酸与牛磺酸或甘氨酸结合形成分泌到肠腔中的胆汁盐。然后肠道微生物群将这些代谢为次级胆汁酸,在将它们循环回肝脏之前去除牛磺酸/甘氨酸基团。饮酒通过增加次级胆汁酸的比例和胆汁酸的总浓度,以及增加与甘氨酸而非牛磺酸结合的比例来破坏这一点。
这是由于生态失调降低了牛磺酸的生物利用度和肠肝循环率增加所致。这种破坏的后果尚不完全清楚;然而,在饮酒过程中更普遍的甘氨酸结合酸可能毒性相对更大,尽管管腔浓度高但胆汁酸的合成增加导致肝脂肪变性。
长期饮酒会减少营养吸收并导致营养不良。肠道通透性、胆汁酸概况和微生物组的改变都促成了这一点,此外,酒精代谢过程中释放的有毒代谢物和 ROS 会对肠道造成结构损伤。
特别是,长期饮酒已被证明会导致细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失。其后果是维生素 A、B1(硫胺素)、B2(核黄素)、B6(吡哆醇)、C、D、E 和 K 以及叶酸、钙、镁、磷酸盐、铁和微量元素锌和硒的不同程度的缺乏。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
所有患有慢性酒精使用障碍的患者都要接受全面的营养评估,因为这些缺乏症因人而异,例如铁可能缺乏或过量。
除了上述机制外,重度饮酒者每天从营养不良的酒精饮料中获取高达 50% 的热量摄入 。此外,应该注意的是,除了慢性酒精滥用的症状影响(例如,呕吐、厌食和腹痛)之外,该群体中的社会因素(例如贫困和获得营养“完整”的饮食)也可能导致营养不良。
微生物组从高剂量酒精喂养的小鼠,转移到未接触酒精的无菌小鼠,已被证明会在受体小鼠中诱发肠道炎症。
酒精通过影响肠粘膜免疫诱发炎症
肠道炎症是由免疫系统对酒精及其代谢物产生的炎症反应引起的。酒精通过多种机制影响肠粘膜免疫。特别是,它可能首先降低粘膜中的先天免疫反应,导致对肠道病原体的易感性增加。
随后,正如在细胞培养研究中发现的那样,酒精可能会触发免疫系统反应和促进炎症反应的分子上调,包括释放炎症免疫细胞,例如白细胞和肥大细胞。
研究还表明,酒精可以直接调节先天免疫和适应性免疫,进一步促进肠道和肠道源性炎症。例如,一项针对小鼠的研究发现酒精会抑制肠道清除有害细菌的免疫反应,而其他研究发现酒精会抑制肠道粘膜免疫细胞的活性。
酒精通过引起肠道菌群失调诱发炎症
酒精相关的细菌过度生长和生态失调可能导致肠道内毒素产生增加,内毒素可与肠粘膜上的细胞结合,引起局部炎症,并易位至肠外部位,引起全身炎症。
微生物群失调可导致肠道通透性受损,并通过肠道细菌内毒素、LPS 的系统易位、免疫细胞上 TLR 和NF-kB 的激活以及炎症 iNOS 的诱导促进炎症。
酒精通过肝毒性诱发炎症
肝毒性会干扰肝脏解毒物质的能力,从而导致酒精的有毒代谢物乙醛在全身蓄积。此外,LPS 介导的肝脏驻留巨噬细胞 Kupffer 细胞的激活进一步促进了促炎细胞因子的释放和全身炎症的传播。
其他研究发现酒精影响粘膜免疫的多种方式,包括:
酒精对先天免疫系统和适应性免疫系统的影响具有剂量依赖性。
酒精对小胶质细胞(中枢神经系统的先天免疫细胞)具有显著的剂量依赖性影响
在急性酒精滥用的小鼠模型中:
酒精还以剂量依赖的方式调节适应性免疫系统
长期适度饮酒会导致 T 细胞和 B 细胞活化和增殖,而长期大量饮酒则与 T 细胞和 B 细胞耗竭和凋亡以及免疫球蛋白增加有关。
此外,长期酗酒会改变 T 细胞表型,导致幼稚 T 淋巴细胞百分比下降和记忆 T 细胞百分比升高。相反,适度饮酒与滤泡辅助性 T (T FH )细胞的调节有关。
细胞因子和炎症标志物也以剂量依赖的方式受到酒精的影响。例如,C 反应蛋白 (CRP) 和白细胞介素 6 (IL-6) 在人类重度饮酒者中升高,但与不饮酒者相比,在适度饮酒者中相对降低。
CRP 效应也可能是性别二态的,一些研究表明酒精引起的 CRP 降低是女性特有的,也有其他研究表明适度饮酒会以 U 形模式降低 CRP,而与性别无关。
以上是高剂量酒精对肠道屏障、肠道菌群及其代谢产物、营养状况、免疫系统等方面的影响。接下来章节我们具体来了解一下酒精相关疾病,包括肝病、胃肠道疾病、营养不良、肥胖、心血管疾病等。
►►►
酒精代谢
肝肠微生物轴在营养吸收和肝毒性中起着重要作用,其中肝脏是营养物质、毒素和肠道血液供应的细菌代谢产物的第一道过滤器。
酒精性肝病 (ALD) 是一种由过量饮酒引起的疾病,是全球医疗保健的负担。酒精性肝病涵盖范围广泛的肝损伤,包括无症状脂肪变性、酒精性脂肪性肝炎 (ASH)、纤维化、肝硬化和肝细胞癌 (HCC)。
酗酒患者发展为酒精性肝病的易感性是高度可变的,并且其向更晚期的进展受若干因素(即酒精滥用的量和持续时间)的强烈影响。
其中,肠道微生物群及其代谢物最近被确定为酒精性肝病病理生理学中最重要的。
酒精滥用会引发肠道菌群分类组成、粘膜炎症和肠道屏障紊乱的定性和定量改变。肠道通透性过高导致活致病菌、革兰氏阴性微生物产物和促炎性内腔代谢物转移到血液中,进一步证实了酒精引起的肝损伤。
酒精在肝脏中的代谢
酒精在肝脏中的代谢是了解其在酒精相关肝病发病机制中的作用的关键。酒精在肝细胞中主要通过乙醇脱氢酶代谢为乙醛,然后通过乙醛脱氢酶代谢为乙酸。
乙醛是一种高反应性蛋白质,会导致肝损伤。它与脂质、蛋白质和 DNA 结合形成潜在的免疫原性加合物。这些加合物可产生适应性免疫反应,导致肝细胞损伤和炎症。
线粒体结构改变可导致功能障碍,包括 ATP 生成减少、ROS 生成和乙醛脱氢酶活性降低。乙醛也是肝纤维化进程中的关键代谢物。它可以促进肝星状细胞 (hepatic stellate cells, HSCs) 中胶原 I 的合成,乙醛加合物刺激炎性细胞因子和趋化因子的释放。
乙醇脱氢酶途径可有效代谢少量酒精,但在长期接触酒精时,该途径会变得饱和,并且会显著诱导 CYP2E1。向 CYP 途径的转变导致 ROS 的产生,从而导致氧化应激。
ROS 与蛋白质结合,改变它们的结构和功能特性,并可能充当新抗原。ROS 还可以直接与 DNA 结合,造成损伤,或导致脂质过氧化产物,如 4-羟基壬烯醛 (4-HNE) 和丙二醛 (MDA),从而产生高度致癌的 DNA 加合物。
此外,在慢性重度酒精摄入中,由于乙醛介导的谷胱甘肽减少,肝脏的抗氧化清除系统受损。氧化应激的结果是诱导肝细胞凋亡和坏死。
酒精性肝损伤
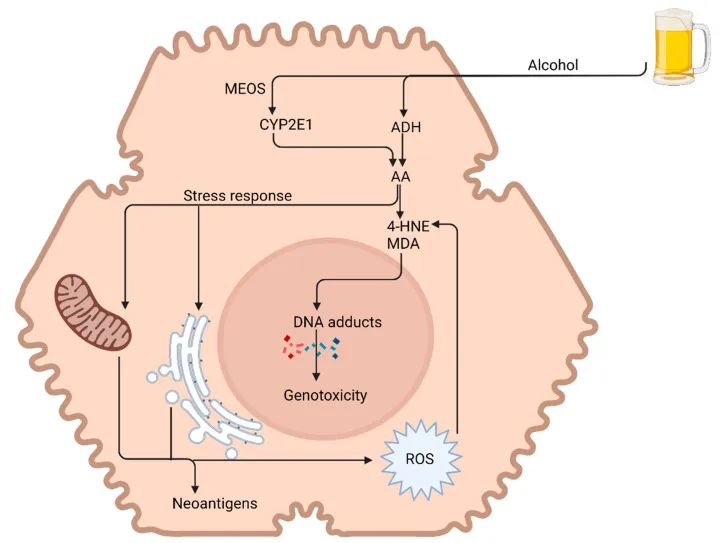
编辑
图源:biorender
乙醛 (AA) 是造成酒精对肝脏的大部分毒性作用的原因。乙醛极度亲脂,导致形成乙醛加合物——丙二醛 (MDA) 和 4-羟基壬烯醛 (4-HNE)。这与活性氧 (ROS) 一起导致 DNA 损伤和遗传毒性。
乙醛还会诱导各种细胞器(例如线粒体和内质网)的功能和结构改变。
MEOS:线粒体酶氧化系统;ADH:乙醇脱氢酶。
酒精相关性脂肪变性
脂肪变性的特征是肝细胞中脂肪(甘油三酯、磷脂和胆固醇酯)的积累,是肝脏对长期饮酒的最早反应,几乎普遍存在于慢性重度饮酒者中。
虽然它在减少饮酒后是完全可逆的,但它的存在与酒精相关肝病的进展有关,最近的一项荟萃分析发现肝硬化的年进展率为 3%。 肝脂肪变性可能通过更大的脂质过氧化和氧化应激增加肝脏炎症(脂肪性肝炎)、纤维化和肝硬化的风险。
然而,进展不仅受饮酒量的影响,还受其他因素的影响,包括性别、共存的肝病、吸烟和遗传。
慢性酒精摄入通过增加肝脂肪生成和减少肝脂肪分解导致肝脂肪变性
酒精通过多种机制诱导肝脂肪变性
图源:biorender
↑:增加;↓:减少;HSC:肝星状细胞。
酒精性脂肪性肝炎
肝脏炎症强烈影响纤维化、肝硬化和最终肝细胞癌的发展
酒精引起的肠漏症导致病原体相关分子模式(PAMP) 输送到肝脏。PAMP 与受损细胞释放的损伤相关分子模式一起激活单核细胞、巨噬细胞、枯否细胞和肝实质细胞上的先天受体【Toll 样受体 (TLR) 和 NOD 样受体 (NLR)】。
通过这些受体发出的信号导致包括 NF-κB 在内的促炎转录因子的转录增加以及促炎趋化因子和细胞因子的产生。
净效应是单核细胞、中性粒细胞和 T 细胞的流入,导致细胞死亡和肝星状细胞 (HSC) 激活的可溶性介质的释放。
除了对酒精激活的促炎性免疫反应外,酒精性肝炎患者还有免疫功能障碍的证据。肠道来源的 PAMP 对单核细胞的激活导致 T 细胞耗竭,同时产生抗炎 IL-10 的 T 细胞数量减少,单核细胞和中性粒细胞功能受损 。
酒精引起的炎症
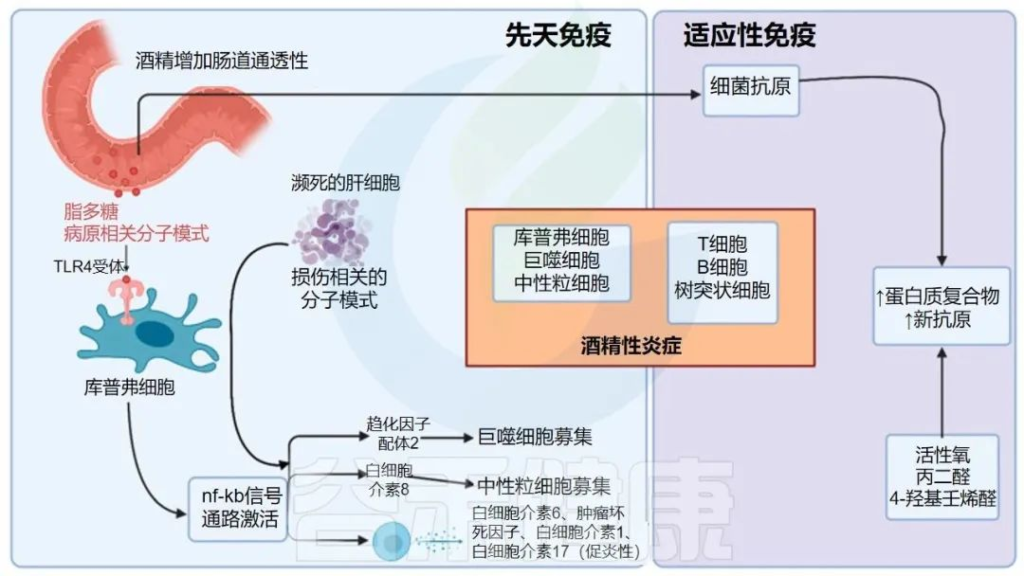
酒精对先天免疫和适应性免疫均有影响。酒精不仅会诱发肠道菌群失调,还会增加肠道通透性。病原体相关分子模式 (PAMP) 如脂多糖与 Kupffer 细胞上的 TLR4 受体相互作用,并通过 NF-κB 途径产生促炎细胞因子和趋化因子,导致肝脏炎症。
乙醛诱导各种蛋白质的结构变化并产生新抗原,从而引发适应性免疫反应并导致肝脏炎症。
CCL2:CC基序趋化因子配体2;DAMPs:损伤相关分子模式;4-HNE:4-羟基壬烯醛;IL:白细胞介素;MDA:丙二醛;NF-κB:核因子 kappa B;ROS:活性氧;TLR4:toll 样受体 4;TNFα:肿瘤坏死因子α;↑: 增加; ↓:减少。
肝细胞死亡通过多种机制发生
包括细胞凋亡、细胞焦亡、坏死和坏死性凋亡。
细胞凋亡是由直接酒精介导的肝毒性、氧化应激的诱导、存活基因 ( C-met ) 的抑制和促细胞凋亡信号分子(TNF-α 和 Fas 配体)的诱导引起的。
坏死、细胞肿胀和膜破裂也可以通过称为坏死性凋亡的程序化途径发生。
而细胞焦亡是一种依赖于 caspase-1 的程序性细胞死亡。
细胞死亡的模式可能受疾病状态的影响,早期酒精相关肝病中细胞凋亡占主导地位,但酒精性肝炎中炎性体激活驱动细胞焦亡和肝损伤扩散。
长期饮酒通过多种机制影响肝脏
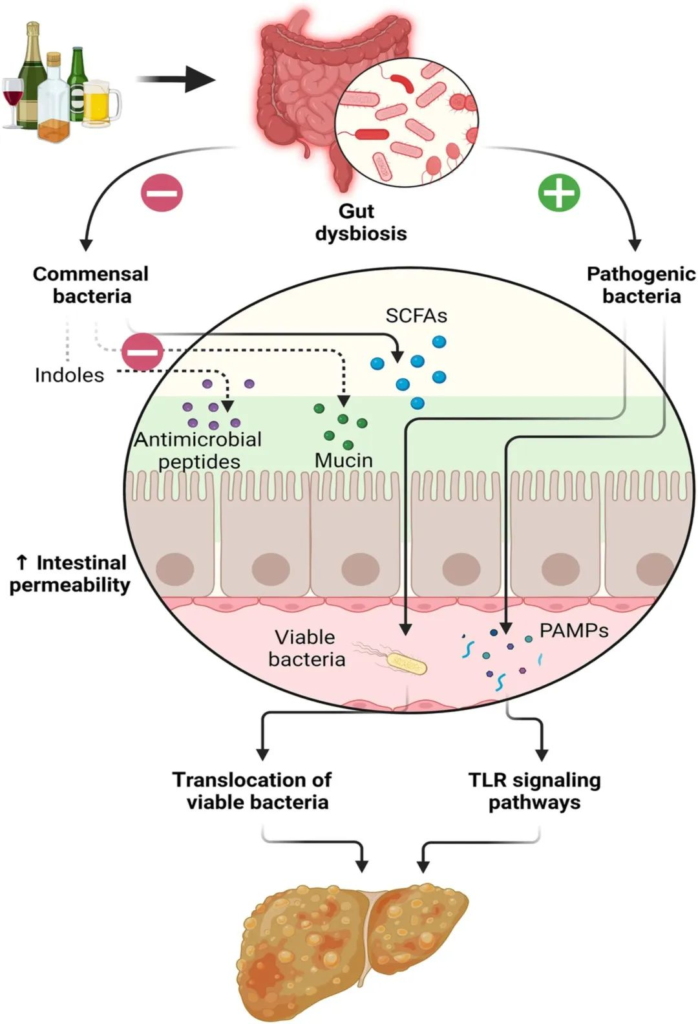
doi.org/10.1111/jgh.16199
长期饮酒会导致肠道生态失调,从而导致肠道通透性增加、肠道细菌易位和病原体相关分子模式 (PAMP),并通过 Toll 样受体 (TLR) 信号通路增加肝脏炎症和纤维化。
为什么有些人不喝酒也有可能得脂肪肝?
脂肪肝的发生与多种因素有关,包括肥胖、高血压、高血脂、糖尿病等,也与外源性酒精和内源性酒精相关。这些因素会影响肝脏的代谢功能,导致脂肪在肝脏内积累,从而引起脂肪肝。
我们一般认为的酒精摄入是指外源性酒精,是通过饮酒等途径摄入的酒精。而内源性酒精则是由人体自身产生的一种酒精,主要产生于肠道中的细菌代谢过程中。这两种酒精对人体的影响有所不同。
内源性酒精对人体的影响相对较小,因为它的产生量较少。但是,如果肠道细菌失衡,导致内源性酒精产生过多,就可能会对人体健康产生负面影响,如肝脏疾病、代谢紊乱等。
酒精引起的纤维化和肝硬化
纤维化是肝脏对破坏性刺激的伤口愈合反应,在去除刺激后可逆。在长期大量饮酒的情况下,会发生慢性炎症和纤维化,导致宽频带纤维组织沉积,扭曲肝脏结构并改变肝脏血流,导致门脉高压及其相关并发症。
当肝纤维化发展到扭曲肝脏结构并形成结节时,患者会发展为肝硬化。
活化的星形细胞 (HSC) 引起的细胞外基质沉积是肝纤维化发生和发展的关键事件。其他细胞(门静脉成纤维细胞和肌成纤维细胞)的贡献较小。HSC 被炎性细胞因子和直接被酒精及其代谢物和 ROS 激活。活化的 HSC 通过分泌趋化因子和表达粘附分子来吸引和刺激循环免疫细胞,从而使炎症反应持续存在,进而激活静止的 HSC。
肝癌
肝硬化是一种癌前状态,会增加原发性肝癌的风险,最常见的是肝细胞癌(HCC)。在全球范围内,大约 30% 的肝细胞癌是由酒精引起的。
酒精本身是一种致癌物,在肝细胞癌的背景下,通过 ROS 诱导的损伤、炎症机制及其反应性代谢物乙醛,酒精在其发展中起着特定的作用。
在大量饮酒者中,CYP 通路活性增加会产生 ROS,导致 DNA 损伤,导致细胞周期停滞和细胞凋亡并破坏基因功能,从而增加癌发生。
酒精相关性肝病患者炎症通路的激活与癌症风险增加相关
尽管机制尚未完全阐明,但可能涉及促炎细胞因子促进 ROS 积累(关于ROS平衡与健康我们准备专门搞一个主题讲下)。细胞因子的产生也与血管生成和转移发展的上调有关。此外,酒精会抑制 CD8+ T 细胞的抗肿瘤反应。
乙醛具有高反应性,并与 DNA 和蛋白质形成加合物,导致线粒体损伤和 DNA 修复机制的破坏。在具有遗传变异的人群中发现的乙醛水平升高会导致酒精脱氢酶和乙醛脱氢酶的活性改变,这与重度饮酒者患肝细胞癌的风险较高有关。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
►►►
胃肠道 (GI) 是与摄入体内任何物质的第一道接触线,特别容易受到毒素的损害。越来越多的研究表明,胃肠道健康状况不佳对身体的整体健康起着重要作用。任何可能导致胃肠道损伤的事情,其后果可能远远超出肠道。事实上,研究人员已经开始发现酒精,特别是如果长期大量饮酒,会引发肠道内启动的过程,从而促进全身炎症。
酒精使用障碍患者肠道通透性增加
对人类的研究表明,一部分酒精使用障碍 (AUD) 患者的肠道通透性实际上有所增加,这是使用称为 Cr-EDTA 的方法测量的,该方法检查口服铬的排泄。此外,那些患有酒精使用障碍且通透性增加的人更容易患肝病,表明肠道通透性可能是某些酒精使用障碍患者器官损伤的介质。
另一项研究表明,患有酒精使用障碍的人不仅肠道通透性增加,而且增加到足以让大分子通过肠道屏障。内毒素 – 也称为脂多糖 (LPS),是大分子,同一项研究发现血浆内毒素水平随着肠道通透性的增加而增加。
酒精是如何诱导肠道通透性的呢?
简短的回答是通过破坏上皮细胞本身(跨上皮通透性)和破坏上皮细胞之间的空间(细胞旁通透性),它由紧密连接、细胞骨架和一些相关蛋白组成。
跨上皮渗透性是由直接细胞损伤引起的。例如:
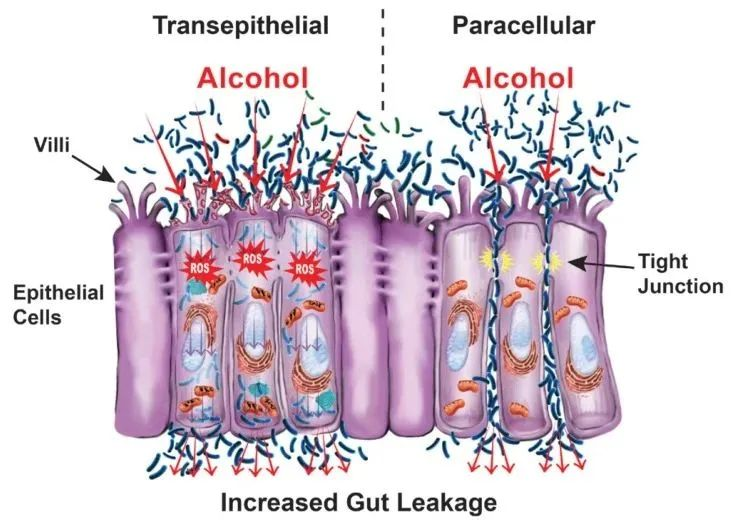
肠道屏障调节肠道内部(食物和饮料流经的地方)和肠道内部上皮细胞层另一侧的细胞和血管之间的物质通道,包括微生物产物。
破坏肠道屏障有两种方式:
肠道屏障通透性增加,使细菌及其产生的毒素离开肠道,并通过血液渗入其他器官。
酒精及代谢物如何通过触发以上两种机制?
— 酒精及其代谢物通过直接破坏细胞和通过活性氧 (ROS) 引起的氧化应激等多种机制削弱细胞膜来触发跨上皮机制。
酒精会导致细胞死亡,从而导致肠道发生变化,包括粘膜溃疡、糜烂和主要位于绒毛尖端的上皮细胞丢失;乙醛形成导致直接细胞损伤的 DNA 加合物;和酒精代谢过程中释放的活性氧 (ROS) 通过氧化应激导致直接细胞损伤。
— 酒精的代谢物通过破坏产生连接细胞和稳定细胞骨架的蛋白质的紧密连接的蛋白质,来触发细胞旁路机制。
酒精及其代谢物通过作用于将两个相邻细胞融合在一起的紧密连接复合物而引起细胞旁通透性。例如,乙醛通过重新分配蛋白质来破坏紧密连接的稳定性;酒精及其代谢物改变紧密连接蛋白的表达;和酒精的非氧化代谢物导致紧密连接再分布,破坏其屏障功能。
此外,研究表明酒精会破坏细胞的细胞骨架,即赋予它们结构的细胞边界。还有越来越多的证据表明,酒精会导致 microRNA (miRNA) 的过度表达,这些小片段的非编码 RNA 会沉默基因表达。具体而言,酒精会导致 miRNA 过度表达,从而影响与肠道屏障完整性相关的基因。
酒精和胃肠道癌症
长期饮酒会增加患主要胃肠道癌症的风险,包括食道癌、胃癌和结肠癌(结直肠癌)。这种风险通常随着饮酒量的增加以及与其他生活方式相关因素(如吸烟或代谢综合征)的增加而增加。虽然酒精最初被认为是一种直接致癌物,但研究表明酒精引起的肠道炎症可能是罪魁祸首。
代谢综合征和肥胖中出现的全身性炎症会增加多种上皮癌的风险,包括胃肠道癌,这表明酒精引起的肠道炎症造成的全身性炎症状态,也可能导致酒精引起的胃肠道和其他器官癌症发生。这个过程像滚雪球,因为随着细胞转变为癌变状态,ADH 活性会增加,而 ALDH 活性可能会降低 。
这导致氧化速率增加和清除酒精代谢物的能力降低,这反过来又可以通过对 DNA、氧化应激和肠道炎症的直接影响进一步促进癌变。
►►►
营养不良
酒精的能量价值及其对营养状况的影响
酒精是唯一提供能量 (7.1 kcal/g) 的精神药物。然而,它的卡路里被认为是“空的”,因为酒精摄入不能提供维生素和矿物质,并且它的过量摄入会导致营养状况的改变。
由于酒精的高能量值,人们普遍认为,过量饮酒会增加体重和肥胖的风险。尽管酒精密度高,但与不饮酒者相比,饮酒者的体重似乎并未增加。
当酒精摄入热量占总热量摄入的 50% 或更多时,由于微粒体乙醇氧化系统 (MEOS) 的激活,身体系统可能无法有效利用乙醇摄入提供的能量。以能量浪费为代价,MEOS 是乙醇氧化的主要肝脏途径。其诱导在戒酒后是可逆的。
饮酒与体重的关系及戒酒对营养状况的改善
在对 181 名每天消耗超过 80 克乙醇的住院男性进行观察性研究期间观察到,63.1% 的人患有厌食症,58.7% 的人体重减轻,17.8% 的人的 BMI 低于 20 kg/m2。经过三个月的戒酒期后,酗酒者的热量使用正常化,体重指数 (BMI) 和腰臀比 (WHP) 也有所增加。
作者认为,戒酒期间营养状况的改善可能是由于 MEOS 活性较低,从而减少了热量的浪费。
少量或中等程度饮酒的女性肥胖风险较低
酗酒患者因饮酒而出现代谢和营养障碍,并表现出在静息状态下大量使用能量,优先使用脂质作为能量来源,并且与对照组相比,脂肪组织比健康对照减少了 19%。
队列研究表明,与戒酒的女性相比,少量或中等程度饮酒(最多 30 克/天)的女性体重增加和肥胖的风险较低,而其他研究已经达到无论受试者的性别如何,都得出相同的结论。
研究评估了酗酒者脂肪和肌肉组织长期变化的预后价值以及戒酒对这些变化的影响。结果表明,在第一次评估后的头六个月内,原来体重较轻与较差的预后相关,无论患者是否在同一时期戒酒。然而,不禁欲与瘦体重的减少相关性更大。
低剂量饮酒是热量的重要来源
身体对酒精热量的利用可能与酒精的用量有关。酒精消耗量低于每日卡路里的 25-35% 可用作能量来源;然而,在更高的消耗量下,利用可能不完整。
在人类中,热量营养不良是世界各地数以百万计死于饥饿的人所面临的现实,并且由于价格低廉且可用性高,乙醇被摄入以代替食物。一些研究创建动物模型是为了阐明当营养不良的生物体暴露于乙醇时会发生什么。然而,结果并不是人们所期望的。
事实上,低剂量饮酒是热量的重要来源,可减轻营养不良的影响。动物研究表明,摄入低至中等剂量的酒精(最多占总热量摄入的 20%)会导致营养不良的大鼠体重增加,这表明有效利用了酒精的能量含量。然而,当酒精中的能量含量占总卡路里摄入量的 10% 或更多时,富营养化大鼠的体重就会减轻。
肥胖
个人的营养状况可能会影响酒精饮料中能量的利用。在人类中,瘦个体对酒精卡路里的利用效率可能较低,而在肥胖个体中,卡路里有助于增加体重。
酒精对体重的影响仍然是一个有争议的话题
一项长达10年的前瞻性研究表明,饮酒者的体重比不饮酒者更稳定,这表明饮酒不是肥胖的危险因素。每月长期适度饮用啤酒不会改变成年人的体重或身体成分。
一些研究表明,身体和腹部脂肪的增加与适度和频繁饮酒有关。还有证据表明,不同的饮酒方式会导致体重增加。每天摄入 ≥ 30 克酒精可能会改变能量稳态的平衡,促使食欲增加,从而导致体重增加和肥胖,无论摄入哪种类型的酒精。
为什么有可能增加肥胖的风险?
在短期内,饮酒被认为是一种食欲兴奋剂,影响用于控制食欲的神经化学和外周系统,如瘦素抑制、胰高血糖素样肽-1 和血清素,并增强γ-氨基丁酸的作用,内源性阿片类药物和神经肽 Y。因此,在没有依赖性的情况下大量饮酒以及酗酒可能会增加肥胖的风险。
饮酒与体重变化及发展为肥胖的关联因性别而异
男性将酒精添加到日常摄入的卡路里中,而女性则倾向于使用酒精替代其他能源,例如减少碳水化合物的消耗而不会增加总卡路里摄取。在考虑能量平衡时必须包括这些差异,因为它们可能会产生关于体重的不同结果。
多种肥胖风险因素与饮酒有关
例如腹部脂肪增加 、脂质氧化能力下降、高热量饮食消耗和皮质醇分泌增加。有人可能会说,与酗酒者和饮食富含脂肪的人相比,超重或肥胖的人和非日常适度饮酒者更多地利用酒精中的卡路里。
女性、饮酒者、大学生的身体、腹部和外周脂肪值也较高,表明 AUDIT 问卷中较高的分数与 BMI、体脂百分比、腰围、三头肌皮褶,手臂周长呈正相关。
喝得量少,频率高 ⇒ BMI 较低
喝得量多,频率低 ⇒ BMI 较高
一项基于 1997 – 2001 年全国健康采访调查数据的研究表明,与 BMI 相关的饮酒量和频率之间存在强烈的相反影响。喝得频率更高但喝得少(即每天喝一杯)的人 BMI 较低。另一方面,饮酒频率较低但饮酒量较大(暴饮暴食)的个体 BMI 较高。那些每天摄入 ≥ 50 g 的人的腹部肥胖风险因素增加。
与这一发现一致的是,在对英国人进行的一项研究中,有人指出,摄入 30 克或更多的酒精会增高 BMI 和体重增加的风险。
肥胖风险:当前适度饮酒者<戒酒者<酗酒者
同样,在对第三次全国健康和营养检查数据进行研究后提供的结果显示,与戒酒者相比,当前饮酒者肥胖的可能性较低,而酗酒者(一天四剂或更多剂饮酒者)肥胖的可能性更大。在报告经常饮酒但每周饮酒量少于 5 剂的人群中,肥胖风险因素显著降低。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
►►►
血脂概况
每周饮酒三到四天与患心肌梗塞的风险较低有关
据估计,酒精的心脏保护作用可能归因于 50% 的 HDL 升高。适量饮酒(30 克乙醇/天)可使 HDL-c 浓度增加约 4 mg/dL,apoA-I 浓度增加 8.82 mg/dL,心脏病风险估计降低 24.7%。
不管饮用的饮料(葡萄酒、烈酒或啤酒)的数量或类型如何,这种改变都可能发生。此外,酒精促进 HDL (好胆固醇)的较少降解和 LDL(坏胆固醇)的更大肝脏代谢。
重度饮酒者中风风险较高
尽管饮酒会改变血脂水平并减少心血管事件,但已证明重度饮酒者中脑出血和蛛网膜下腔出血等中风的发生率高于不饮酒者 。此外,由于大量饮酒,如糖尿病、高血压性心脏病、缺血性心脏病、缺血性和出血性中风等疾病逐渐增加。
酒精的风险和益处之间的差异因人而异,科学家呼吁不应将其用作保护心血管的工具作为一项公共卫生措施加以鼓励。
在一项荟萃分析研究中描述了酒精对预防冠心病的益处的减少,其中节制和轻度和中度饮酒者显示出相同的冠心病死亡风险。
发现每天饮酒 10 克的人甘油三酯水平较高。摄入量大于 50 克/天可显著降低发生低水平 HDL-c 的风险,但会增加发生高水平胆固醇的风险。
在餐后时期,酒精会导致甘油三酯升高,并抑制游离脂肪酸 (FFA) 的氧化 。重要的是要强调,对于患有冠心病的个体,餐后高甘油三酯血症更大、持续时间更长。高甘油三酯血症或 FFA 增加与正常个体和胰岛素抵抗者的内皮血管舒张减少有关。
扩展阅读:
高血压
酒精摄入会以剂量依赖性反应升高动脉压
每天摄入超过两次的剂量是最常见的可逆性高血压原因之一 。肾素-血管紧张素系统可能参与了酒精诱发高血压的机制。
一项研究表明,急性酒精中毒改变了肾素-醛固酮系统,使人体具有正常的氢和钠平衡。血浆肾素的增加可能是由于乙醇利尿或乙醇对醛固酮分泌的抑制作用引起的脱水。渗透压、动脉压和心脏频率没有发现显著变化。后来,证实适度饮酒时肾素活性会急剧增加,从而引起液体和电解质平衡以及动脉血压的变化。
少量和适度饮酒的影响可能因性别而异
文献对这个问题的描述并不一致。在一项由女性健康研究对 28,848 名女性开展的前瞻性研究和由医生健康研究开展的另一项对 13,455 名女性开展的前瞻性研究中,少量和适度饮酒降低了女性患高血压的风险,并增加了男性患高血压的风险。
酒精成为高血压危险因素的阈值在女性中等于或大于每天 4 剂,而男性的中等水平等于或大于每天 1 剂。 然而,一些研究在考虑男性和女性的动脉血压对酒精的敏感性是否不同时存在争议。
饮酒推荐量因体重而异
由于习惯性饮酒不同,动脉血压升高在低体重个体中比在高体重个体中更为显著。因此,低体重女性预防高血压的推荐饮酒限度必须低于高体重女性。
对于重度饮酒者而言,少喝可以预防治疗高血压
在没有其他心血管疾病的健康男性和女性中调查了饮酒和当前饮酒标准与高血压风险之间的关联。与节制的人相比,那些饮酒且饮酒量很大的人患高血压的风险更高。
重度饮酒者酒精摄入量的减少显著降低了动脉收缩压和舒张压。因此,必须推荐减少饮酒作为生活方式调整措施,以预防和治疗重度饮酒者的高血压。
扩展阅读:认识肠道微生物及其与高血压的关系
以上是酒精对相关疾病的影响。长期大量饮酒后,人体对酒精容易产生依赖性,出现无法自主控制饮酒行为,也就是戒不掉、戒断症状等现象,我们通常说酒精成瘾。他们需要往往更多的酒精来获得同样的愉悦感。接下来章节,我们来看一下酒精成瘾的相关因素。
肠道和大脑是两个器官,它们在解剖学上相距甚远,但在其他方面却如此接近。我们过去的文章写过,肠道微生物组和大脑之间的代谢和神经串扰对大脑功能、情绪和行为具有重要意义。
详见:
在过去十年中,多项研究表明,全身性炎症与精神疾病(包括抑郁症和自闭症)之间存在关联。然而,全身炎症与酒精成瘾、抑郁症和自闭症等精神疾病之间相互作用的机制尚不完全清楚,肠道菌群可能是一个很好的研究目标。
全身性炎症和酒精成瘾的一个可能机制是肠道细菌产物激活外周血单核细胞,诱导细胞因子进入血流,在酒精依赖者中引起低度全身性炎症 。
肠道炎症还可以将内毒素和细胞因子传播到血液中,在那里它们可以进入中枢神经系统 (CNS),引起神经炎症。
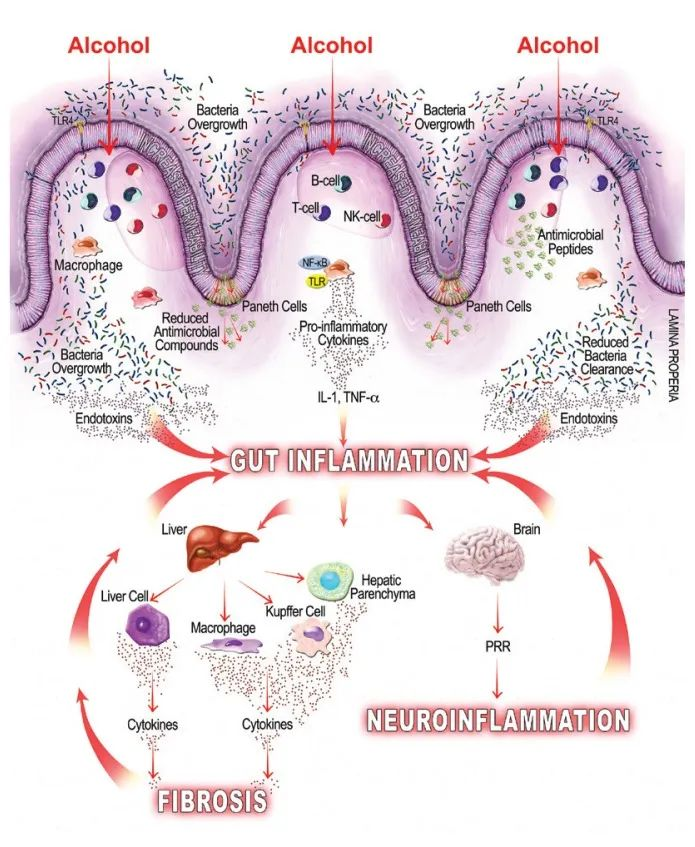
酒精成瘾与十二指肠的吸收障碍有关,导致营养不良和硫胺素的肝脏储存受损。
酒精成瘾与其他精神疾病高度相关,包括重度抑郁症、双相情感障碍以及焦虑症。重度抑郁症等情绪障碍通常先于酒瘾发作;例如,有人使用酒精来应对情绪低落。
酒精成瘾的严重程度与其渴望、认知功能障碍、焦虑和抑郁症状的强度相关
正如我们上面提到的,全身炎症可能在酒精成瘾的发展中起重要作用;肠道和肝脏的肠屏障功能障碍和炎症可能导致外周炎症并引起脑部炎症,从而诱发小胶质细胞或星形胶质细胞等脑细胞的炎症。
疾病行为理论可能将全身性炎症与酒精成瘾和情绪障碍联系起来。该理论支持外周炎症,如肠漏症,激活免疫系统并产生可到达大脑的细胞因子,导致发烧、疲劳、疲倦、无法集中注意力和退出社交;当上述行为持续存在时,可能会出现抑郁症状。
越来越多的研究将肠道微生物组的组成和功能与物质使用障碍 (SUD) 联系起来。
肠脑轴和物质使用障碍(SUD)
SUD 的特征是:尽管知道会对精神、身体和社会造成负面影响,但仍对某种物质(例如,酒精、阿片类药物和/或其他药物)长期依赖。
它们具有社会经济、生物化学、遗传以及越来越多的微生物学基础。众所周知,大脑是调节成瘾参数的重要器官,然而,通过微生物角度研究成瘾提供了一种思考:与身体相关的其他因素如何与大脑携手合作,以调解获得滥用药物的动机的新方法。
肠道和大脑通过双向、生化和神经高速公路(肠-脑轴)进行交流。肠上皮细胞下方的神经末梢接收来自肠道微生物群的代谢信号,这可能会影响行为,例如压力或焦虑。
除了与中枢神经系统发育和大脑功能有关的其他代谢物,如短链脂肪酸,肠道微生物还有助于产生一系列与情绪、认知和奖赏相关的神经递质(例如血清素和多巴胺)。
肠脑轴
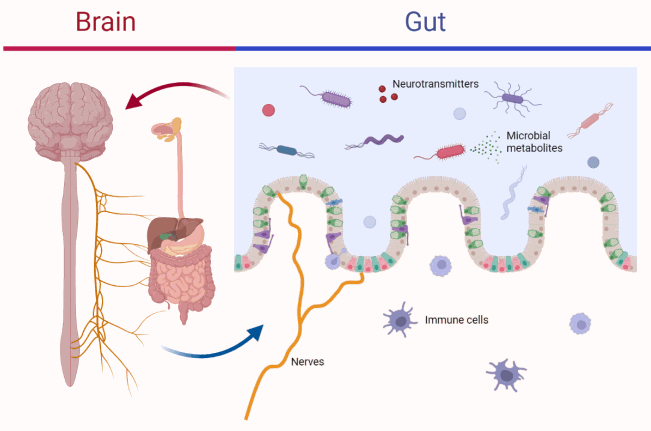
图源:BioRender
这些神经递质在 SUD 的情况下特别相关;许多滥用物质通过触发大量多巴胺进入奖励途径来劫持大脑的奖励系统。这种多巴胺泛滥带来的愉悦感最终会减弱,个人可能会反复服用该物质以再次体验这些感觉。研究表明,肠道微生物参与自然(例如食物)和人工奖励(包括药物)的奖励感知,这表明 SUD 的发展/进展与肠道微生物组组成之间存在联系。
事实上,滥用酒精或药物与微生物组组成的变化有关。尽管这些改变的具体情况因物质而异,但与“健康”相关的微生物通常会减少,而具有促炎作用的微生物会增加,例如变形杆菌。这些变化伴随着关键微生物代谢物(如短链脂肪酸)的减少,具有各种全身和局部效应(例如,肠道屏障完整性的破坏)。
通常,SUD 的特征是肠道炎症增加,部分原因是这种渗漏的肠道屏障允许微生物及其产物与底层免疫细胞相互作用。激活后,这些免疫细胞会产生细胞因子,这些细胞因子不仅会引发局部炎症,还会进入循环并穿过血脑屏障。由此产生的神经炎症会改变神经元活动,包括在大脑的奖励通路内,并可能影响对物质本身的反应和耐受性。
管理物质使用障碍——肠道微生物
治疗 SUD 的策略因人和物质而异,但可能涉及药物(如阿片类拮抗剂)、咨询和行为护理。然而,这些策略可能并不总是奏效,并且可能会复发。目前药物成瘾治疗干预的成功率很低,大约40-60% 接受治疗的人最终会复发并重新使用滥用药物。
鉴于肠道微生物群和 SUD 之间出现的交叉点,发现用某些细菌补充肠道微生物群,它们的发酵产物(如短链脂肪酸)可能会减少滥用物质的影响。
例如,一项研究发现富含双歧杆菌的益生菌和Lactobacillaeae 可逆转小鼠对吗啡的耐受性。
粪便微生物群移植 (FMT) 也可能是一种选择,或许未来可以用于干预酒精成瘾或使用障碍。一项 1 期临床试验表明,与安慰剂组相比,接受富含毛螺菌科和瘤胃球菌科 FMT 的酒精使用障碍患者在 15 天后 对酒精的渴望有所减少(分别减少 90% 和 30%)。在吗啡依赖小鼠中,FMT减轻了戒断症状由阿片拮抗剂触发。由于阿片类药物耐受性容易导致剂量增加和用药过量,这些发现表明微生物可以延长药物的疗效。
以上表明肠道微生物组的未来及其对健康和福祉的影响有很大的应用,尤其是与 SUD 相关的情况。这是一个有前景的领域。
目前,酒精摄入过量的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。以下是一些应对过度饮酒的可行性计划:
这里再介绍一些关于过量饮酒的饮食干预。
1. 豆腐
豆腐中所含的半脱氨酸是一种氨基酸,其重要性在于能解除乙醇的毒性,食用后能促进酒中乙醇的排出,从而达到解酒的目的。
2. 香蕉
香蕉还有解酒作用,因为香蕉中含有丰富的果糖,进入人体后可以稀释酒精,所以可以解酒。

3. 糖水
适量白糖和开水混合,甜度视醉度而定,稍凉片刻即可饮用。糖分进入人体后,会增加体内血糖浓度,降低血液中酒精浓度,加速体内酒精的排出,从而达到醒酒的目的。
4. 蜂蜜水
其实酒后喝点蜂蜜水可以有效减轻酒后头痛的症状,蜂蜜可以促进人体对酒精的吸收从而减轻酒后头痛的症状,此外,蜂蜜还有镇静催眠的作用. 多吃蜂蜜对皮肤和胃都有好处。

5.葛根水
葛根泡水喝,不管是喝前还是喝后,都有很好的效果。饮酒前先喝葛根水,可预防酒精对肝脏的损害。酒后饮用可起到醒酒作用。
6.番茄
番茄中的果糖、葡萄糖和维生素对肝脏和心脏都有保健作用,而且果糖还是解酒醒酒的好味道。酒后吃几个西红柿,可使头晕逐渐消失。
7.红薯
将生红薯磨碎,加入适量白糖,搅拌均匀后服用。
8.绿豆
绿豆适量,用温水冲净,捣烂,用沸水冲净或熬汤食用。
9.甘蔗
1 根甘蔗,去皮并榨汁。
10.盐水
在开水中加少许盐,喝下醒酒。
11.柑橘皮(陈皮)
将陈皮烘熟,研末,加食盐1.5克煮汤。
12.白萝卜
白萝卜1公斤,捣成泥取汁,分次服用。也可以在白萝卜汁中加入适量的红糖饮用,也可以生吃萝卜。

编辑
这些用食物解酒的方法虽然看似简单,但是却能够起到解酒作用。如果你也喜欢喝酒,经常喝醉,那么学习一些有效的解酒方法就显得非常重要了。对于喜欢喝酒的朋友而言,为了整体健康,请根据自身情况适度饮酒,尽可能避免过量饮酒。
总的来说,适量酒精可能给人体带来好处,尤其对自身免疫性疾病具有保护作用。低剂量酒精可能通过增加Akk菌等保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸等,间接产生积极影响。
而高剂量酒精则可能带来不利影响,破坏肠道屏障的稳定性,增加肠道通透性,导致微生物成分进入循环系统,引发肝脏和其他器官的炎症反应;并可能导致肠道微生态失调、肠道菌群产物、脂多糖增加;导致单核细胞、T 细胞、细胞因子、IgG 水平以及 B 细胞减少;进而影响酒精性肝病、肥胖、胃肠道疾病、心血管疾病等发生和发展。
此外,饮酒还会影响肠道微生物组影响社交行为和精神障碍。因此,保持健康的肠道微生物组对于预防和治疗与饮酒相关的疾病具有重要意义。
未来的研究应该进一步探讨肠道菌群与酒精代谢和酒精成瘾之间的因果关系,肠道菌群的调节可能成为预防和治疗酒精成瘾的新靶点。
主要参考文献:
Jew MH, Hsu CL. Alcohol, the gut microbiome, and liver disease. J Gastroenterol Hepatol. 2023 Apr 25. doi: 10.1111/jgh.16199. Epub ahead of print. PMID: 37096652.
Meroni M, Longo M, Dongiovanni P. Alcohol or Gut Microbiota: Who Is the Guilty? Int J Mol Sci. 2019 Sep 14;20(18):4568.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.
Zugravu CA, Medar C, Manolescu LSC, Constantin C. Beer and Microbiota: Pathways for a Positive and Healthy Interaction. Nutrients. 2023 Feb 7;15(4):844.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772
Crews FT, Sarkar DK, Qin L, Zou J, Boyadjieva N, Vetreno RP. Neuroimmune Function and the Consequences of Alcohol Exposure. Alcohol Res. 2015;37(2):331-41, 344-51.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772.
Hernández-Quiroz F, Nirmalkar K, Villalobos-Flores LE, Murugesan S, Cruz-Narváez Y, Rico-Arzate E, Hoyo-Vadillo C, Chavez-Carbajal A, Pizano-Zárate ML, García-Mena J. Influence of moderate beer consumption on human gut microbiota and its impact on fasting glucose and β-cell function. Alcohol. 2020 Jun;85:77-94.
Doremus-Fitzwater TL, Deak T. Adolescent neuroimmune function and its interaction with alcohol. Int Rev Neurobiol. 2022;161:167-208.
Tirado-Kulieva VA, Hernández-Martínez E, Minchán-Velayarce HH, Pasapera-Campos SE, Luque-Vilca OM. A comprehensive review of the benefits of drinking craft beer: Role of phenolic content in health and possible potential of the alcoholic fraction. Curr Res Food Sci. 2023 Mar 4;6:100477.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.
谷禾健康

心力衰竭 Heart Failure(HF)
心力衰竭是一种严重的心血管疾病,其特点是较高的发病率和死亡率,同时也会带来高昂的医疗成本。
一般都认为心力衰竭是老年人的疾病,但其实心力衰竭已经呈现年轻化趋势。


以上症状都有可能与早期心力衰竭相关。发生心力衰竭时,血液通常会回流并导致液体在肺部积聚,从而引发气短。
长期熬夜睡眠不足,不健康饮食,吸烟酗酒,压力大,过度劳累等各种因素日积月累都有可能导致心律失常,诱发突发性心衰。
越来越多的证据表明,心力衰竭与肠道微生物群变化相关。
肠道微生物群失调会导致肠道屏障功能受损,从而使肠道中的有害物质和细菌进入血液循环系统,引发炎症反应。这些炎症因子会进一步损害心脏功能,导致心力衰竭的发生和发展。
肠道微生物群还可以通过产生代谢产物,如短链脂肪酸、TMAO等,影响心血管系统的功能。
本文主要介绍有关肠道微生物群及其代谢物对心力衰竭的影响,以便更好地理解这种多层次的复杂关系。
更深入地了解人体肠道微生物组、心力衰竭和相关风险因素之间的相互作用,对于优化基于微生物群调节的治疗策略和提供个体化治疗非常重要。
本文主要内容:
01 了解心力衰竭
心力衰竭的类型
心力衰竭的症状
心力衰竭的形成
心力衰竭的发病率
心力衰竭的风险因素
02心力衰竭&肠道屏障功能受损和炎症
03心力衰竭的肠道菌群变化
04心力衰竭的风险因素和肠道菌群
西方饮食
肥胖
2型糖尿病
高血压
05与心力衰竭相关的肠道菌群代谢产物
苯丙氨酸
TMAO
短链脂肪酸
胆汁酸
06 肠道菌群与心血管药物的相互作用
强心甙类药物
血液稀释剂
β-阻断剂、ACEi和ARBs
他汀类药物
07 基于肠道菌群的干预措施
饮食方式
特定食物
益生菌
益生元
抗生素
粪菌移植
生活方式
08 结语
心力衰竭是一种心脏疾病,指心脏无法泵出足够的血液来满足身体需要,导致身体器官缺氧和水肿等症状。
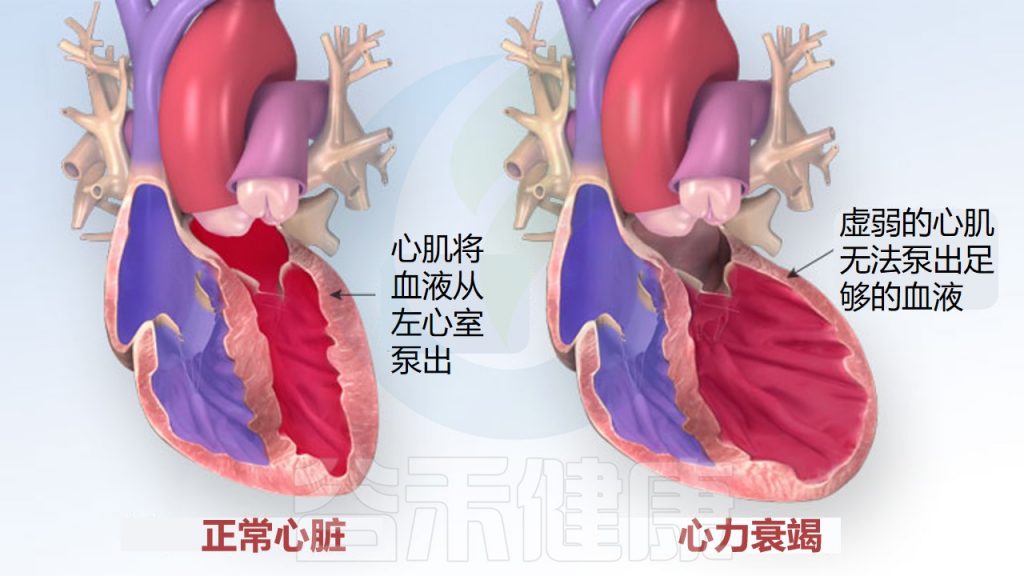

图源:American Heart Association / watchlearnlive.heart
根据急缓程度区分:
两者可以互相转变。
根据部位区分:
左侧和右侧心力衰竭不同,左侧心力衰竭比右侧心力衰竭更常见。
左侧心力衰竭可能出现的症状有:
呼吸困难;咳嗽;疲劳(即使休息后也极度疲倦);手指和嘴唇呈蓝色;嗜睡;注意力不集中;平躺无法入睡。
右侧心力衰竭可能出现的症状有:
恶心(胃部不适)和食欲不振、腹部疼痛(胃周围区域);脚踝、脚、腿、腹部和颈部静脉肿胀;需要经常小便;体重增加。
根据射血分数区分:
注:射血分数是心脏强度的指标。在临床常用于判断心功能的基本情况以及心力衰竭的诊断,射血分数越低,心脏的泵血功能就越弱。
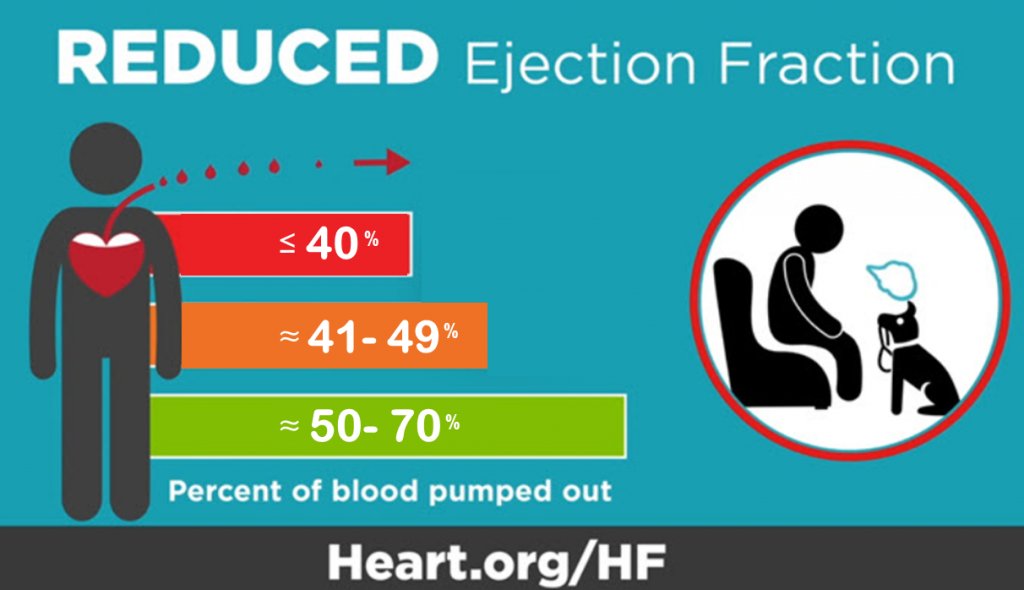

收缩性心力衰竭:心脏无法将足够的血液泵出,导致心脏收缩功能下降。
舒张性心力衰竭:心脏在舒张时无法完全放松和扩张,导致心脏无法充分填充血液,从而降低了心脏泵血的效率。
大多数情况下,心力衰竭是由另一种损害心脏的疾病引起的,比如冠心病、心脏炎症、高血压、心肌病、心律不齐等。
我们知道,心力衰竭是心肌无法泵出足够的血液来满足身体的需求,那么在心力衰竭的初始阶段,心脏会通过一些方式来弥补:
身体还会通过其他方式进行补偿:
以上是身体的补偿机制,这就可以解释为什么有些人在心脏开始衰退多年后才意识到自己的病情。
根据 Framingham 心脏研究的数据,心力衰竭的患病率随着年龄的增长而增加,该研究估计:
50 – 59 岁:
心力衰竭患病率为 8 / 1000;
80 – 89岁:
男性为66/1000,女性患病率为79/1000。
发病率随着年龄的增长而急剧增加:
在 65 岁后,男性心力衰竭的发病率每增加10岁就会翻一倍,而在同年龄段的女性中,发病率会翻三倍。
所有年龄段的血压和BMI越高,终身风险越高。
以下人群更容易患心力衰竭:
心力衰竭中的“肠道假说”表明,肠道微生物群、其代谢物与心力衰竭发病机制之间存在密切关系。
这种细菌易位出现在心力衰竭中,是导致胃肠道结构和功能改变的各种机制的结果,从内脏充血到宿主的免疫防御系统。
心力衰竭的肠-心轴
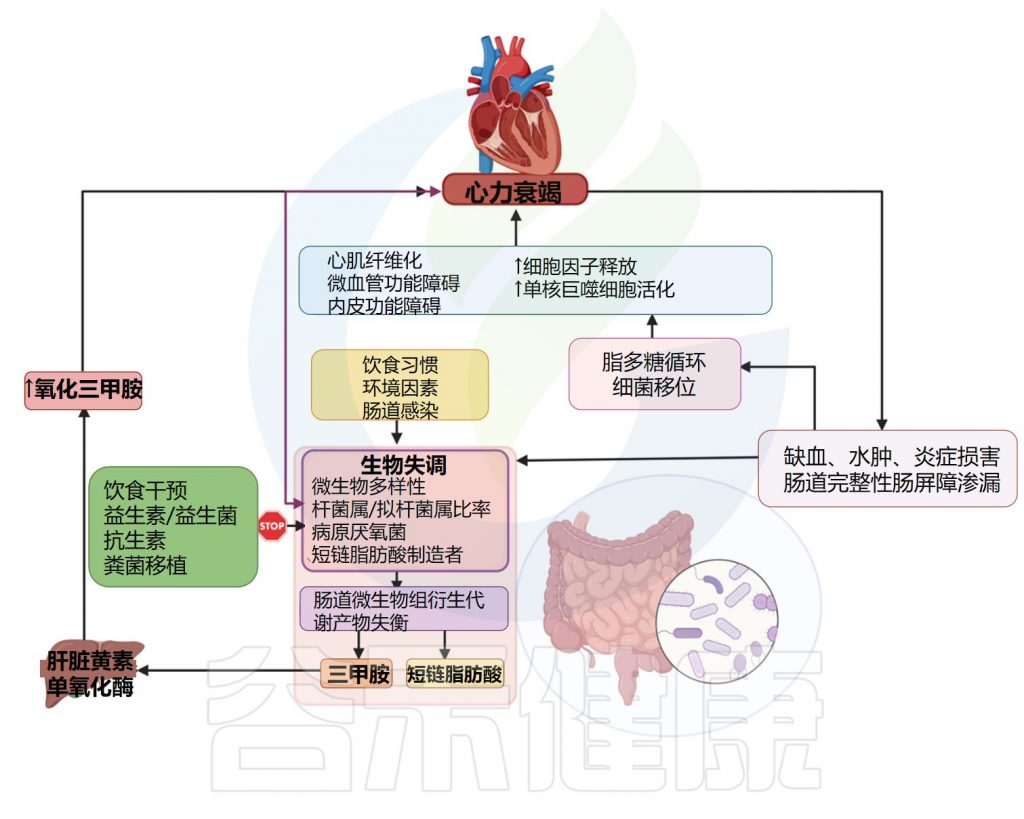

doi.org/10.3390/cells12081158
心力衰竭患者 ⇒ 肠道屏障功能受损
肠道结构和功能的改变是心力衰竭患者微循环紊乱的结果。在这些患者中,尤其是在疾病失代偿的形式中,肠道微生物群落的正常组成被打破,这是由于肠道灌注不足导致的,从而导致局部pH和肠腔缺氧。
肠壁水肿
有证据表明,与心力衰竭相关的肠道上皮功能受损:这种改变似乎是肠道灌注减少和缺血的结果。心输出量降低导致全身循环向多个终末器官的适应性再分配。因此,肠壁水肿增加,肠壁增厚与肠道通透性标志物、血液白细胞和循环C-反应蛋白水平的增加呈正相关。
肠道吸收能力降低,上皮通透性增加
除了肠壁水肿外,心力衰竭还表现为肠道吸收能力降低和上皮通透性增加,促进了多种肠道细菌和/或内毒素(如脂多糖)的通过,从肠道进入全身循环。
脂多糖黏膜屏障功能恶化
脂多糖是革兰氏阴性菌壁的生物活性成分,具有潜在的免疫刺激活性,通过使用Toll样受体4(TLR4)模式识别受体。
在心力衰竭患者中,在肝静脉中发现高浓度的脂多糖,支持肠道菌群的肠道易位过程的假设。此外,据推测,脂多糖本身可以加剧黏膜屏障功能恶化,导致心力衰竭进展。
心力衰竭患者 ⇒ 炎症
内毒素易位导致炎症因子水平升高
内毒素肠吸收刺激系统炎症因子水平的增加。根据目前的数据,心力衰竭与慢性炎症状态相关,这种微生物易位可以诱导或加速炎症,间接影响心肌细胞的正常功能。
循环细胞因子水平升高,心力衰竭患者预后不良,与脂多糖相关
循环细胞因子水平的升高对应于心力衰竭患者生存中更严重的临床症状和更差的预后。心力衰竭患者的血清TNF-α、IL-1和IL-6水平直接受到现有脂多糖数量的影响,目前认为脂多糖是高炎症性疾病的主要因素。
而在失代偿的心力衰竭患者中,脂多糖水平似乎与全身炎症标志物直接相关,并且在心力衰竭代偿后降低。治疗后血浆细胞因子水平并不一定会下降,这表明随着疾病的进展,其影响是持续的。根据两项大型随机安慰剂对照试验,使用TNF- α拮抗剂均不能降低心力衰竭患者的住院或死亡风险。
所有的心力衰竭患者炎症水平上升
另一项针对心力衰竭伴射血分数降低(HFrEF)患者的研究,该患者具有不同的疾病严重程度,或采用了先进的干预措施,如心脏移植(HT)或左心室辅助装置(LVAD),评估了他们的血液和粪便标本。从纽约心脏协会(NYHA)的I级到IV级的所有受试者,炎症标志物水平都有所增加。
治疗后水平下降,但未到正常,脂多糖仍处高位
在左心室辅助装置和心脏移植治疗后,他们的水平下降,但未能达到正常值。然而,所有NYHA级别的脂多糖水平均有所增加,并且在心脏移植和左心室辅助装置干预的患者中仍保持升高。
与脂多糖类似,血清中IL-6、IL-1β和TNF-α水平的升高也诱导肠通透性,促进炎症细胞因子增加和内毒素易位的恶性前馈循环。
肠道微生物群已被证明对心力衰竭有很大影响。心力衰竭患者有更多的致病菌和更少的有益菌。
心力衰竭肠道菌群变化
在心力衰竭中,由于射血分数降低,肠道血流量减少,氧气输送减少。这使肠道容易滋生致病性厌氧菌。
综合目前的研究来看,与对照相比,心力衰竭患者肠道菌群主要变化如下:
下列菌群丰度增加:
↑↑ Escherichia Shigella
↑↑ Streptococcus 链球菌
↑↑ Pseudomonadota 假单胞菌门
↑↑ Klebsiella 克雷伯菌
↑↑ Candida 念珠菌
↑↑ Enterococcus 肠球菌属
下列菌群丰度减少:
↓↓ Faecalibacterium 粪杆菌属
↓↓ Faecalibacterium prausnitzii 普拉梭菌
↓↓ SMB53
↓↓ Dorea longicatena
↓↓ Roseburia intestinalis
↓↓ Collinsella 柯林斯氏菌
α多样性随着疾病严重程度的增加而降低
尽管接受了LVAD或HT等治疗,但仍保持较低水平,这可能是由于持续的炎症。随着心力衰竭发展到晚期,内毒素血症和全身炎症水平增加,细菌群落的肠道多样性降低。
几项关于急性失代偿或稳定型HFrEF患者肠道细菌谱的研究报告称,与健康个体相比,心力衰竭患者的α和β多样性显著降低。
心力衰竭相关的肠道菌群失调因患者年龄而异
与已知患有心力衰竭的年轻患者相比,老年患者表现出拟杆菌门水平下降,变形菌门、假单胞菌门数量增加。
在所有已知的心力衰竭患者中,毛螺菌科的Dorea longicatena和Eubacterium rectale的数量都有所减少,而与年轻患者相比,Clostridium clostridioforme和普拉梭菌(Faecalibacterium prausnitzii)在老年心力衰竭患者中的数量更少。
下表中总结了关于心力衰竭患者肠道微生物群的研究。
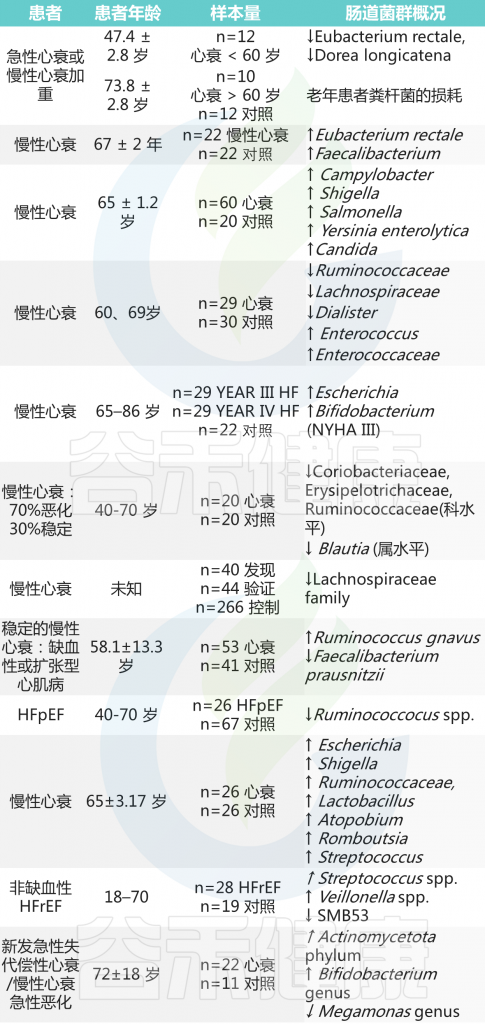

doi.org/10.3390/cells12081158
患有心力衰竭的人有各种危险因素,但他们中的大多数人患有高血压、肥胖、血脂异常、糖尿病、遗传易患心力衰竭、吸烟、久坐不动的生活方式或不健康的饮食。新证据表明,肠道微生物群及其代谢物也可能对心力衰竭危险因素产生影响。
西方饮食的特点是摄入高糖和精制碳水化合物,血糖指数高;抑制一氧化氮合酶的含量,导致心肌氧化功能障碍、心肌肥大和心肌细胞重塑,所有这些都是心力衰竭的诱发因素。
西方饮食:通过菌群代谢增加TMAO,胆固醇积累,动脉粥样硬化,心力衰竭风险增加
这种饮食富含快餐食品会导致微生态失调,其菌群特征是假单胞菌(Pseudomonadota)和Bacillota水平升高,从而增加TMAO和神经酰胺的水平,促进巨噬细胞中的胆固醇积累,并加剧动脉粥样硬化的发展。
西方饮食诱发心力衰竭
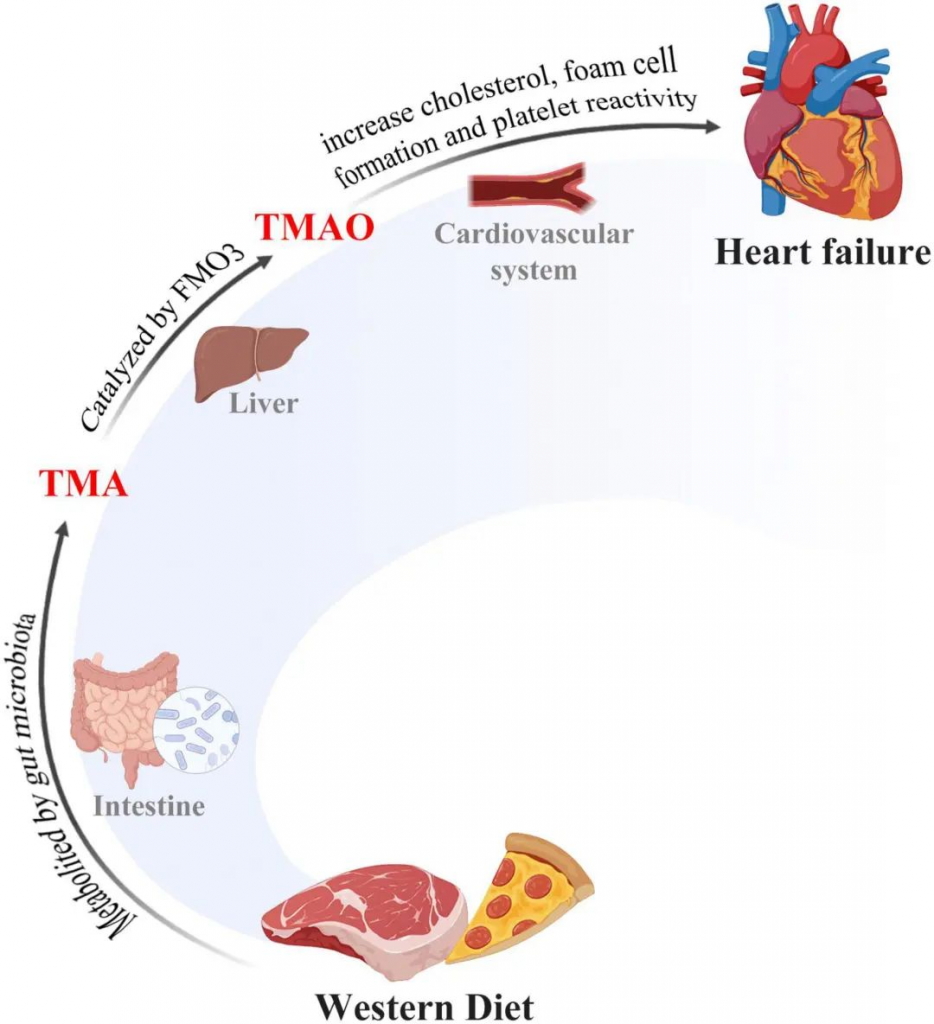

doi.org/10.3389/fmicb.2022.956516
西方饮食通过肠道微生物群代谢为 TMA,然后 TMA 在肝组织中转化为 TMAO。TMAO 积累在许多病理过程中触发胆固醇,包括运输和泡沫细胞形成,从而诱发心力衰竭。
西方饮食还会导致心肌中的脂质积聚、慢性炎症和肥胖。快餐食品加工中使用的盐和食品添加剂(包括亚硝酸盐和磷酸盐)水平的增加与心力衰竭风险的增加有关。它们改变了厚壁菌与拟杆菌的比例。
西方饮食:构建肠道屏障菌群减少,屏障破坏
西方饮食还改变了肠道屏障的通透性,其特征是拟杆菌属、双歧杆菌属、梭状芽孢杆菌属、乳酸杆菌属和Akkermansia muciniphila以及所有促进肠道屏障细菌的水平降低。此外,肠壁完整性似乎被脱硫弧菌属和Oscillibacter的增加所破坏。
扩展阅读:AKK菌——下一代有益菌
研究表明,肥胖及其相关的代谢障碍,包括高脂血症、高血糖和胰岛素抵抗,与心力衰竭密切相关。
肥胖 ⇒ 促炎
肥胖及其相关的心脏代谢因子(胰岛素抵抗、血脂异常和腹部肥胖)加剧促炎环境,也就是促炎细胞因子水平升高。
肥胖 ⇒ 血容量改变
内皮功能障碍和一氧化氮不可用,可能导致HFpEF的左心室肥大以及收缩和舒张功能障碍。此外,肥胖会导致血管系统和血容量的改变,这与氧气消耗的增加有关,导致心室肥大、平均肺动脉压增加和左心室舒张压升高。
肥胖 ⇌ 肠道菌群变化
在动物和人类研究中,在大多数研究中,肥胖似乎与厚壁菌门和拟杆菌门之间的比例改变有关,拟杆菌门减少,厚壁菌增加。肠道拟杆菌数量与肥胖有关。
限制热量饮食并减肥的肥胖者肠道微生物群中拟杆菌类的比例似乎较高。具体而言,所有产短链脂肪酸菌Clostridium bartlettii、Akkermansia muciniphila和双歧杆菌都与高脂肪饮食诱导的肥胖及其代谢并发症呈负相关。
扩展阅读:肠道菌群与肥胖
2型糖尿病是心力衰竭和其他心血管疾病的强相关危险因素。
已知2型糖尿病患者粪杆菌、双歧杆菌、Akkermansia、拟杆菌和Roseburia降低。Roseburia、拟杆菌和Akkermansia具有抗炎作用。拟杆菌和Akkermansia水平下降导致紧密连接基因表达不足,“肠漏”加剧,从而导致内毒素血症。
扩展阅读:肠道重要基石菌属——罗氏菌属(Roseburia)
此外,产丁酸菌普拉梭菌和Roseburia nestiinalis的丰度降低,会导致脂肪酸代谢失调,导致氧化应激及其相关的心脏代谢不良表现。
另一方面,2型糖尿病与梭杆菌属、瘤胃球菌属和厚壁菌门的细菌呈正相关,这些细菌都具有促炎活性。
与血压正常的对照组相比,持续升高的血压患者的厚壁菌与拟杆菌比例更高(高达5倍)。此外,高血压时,肠道菌群以产乳酸菌属(如Turicibacter、Streptococcus)为主,而产短链脂肪酸菌属(如Clostridiaceae、Bacteroides、Akkermansia)似乎减少。其中一些相关的肠道菌群稳态扰动部分与心力衰竭发病有关,并增加心衰进展的风险。
扩展阅读:认识肠道微生物及其与高血压的关系
经典的心力衰竭的生物标志物:利钠肽(NP)、脑型钠尿肽(BNP)、BNP的N-末端原激素和肌钙蛋白测量,已被欧洲心脏病学会和美国心脏协会纳入心力衰竭的诊断和治疗指南。
肠道微生物衍生的代谢物也可以在心力衰竭的发病机制中发挥重要作用。通过产生包括短链脂肪酸、三甲胺(TMA) / 三甲胺 N-氧化物 (TMAO) 和胆汁酸在内的活性生物代谢物,肠道微生物群会影响宿主生理。
影响心力衰竭的微生物代谢产物及相关治疗策略
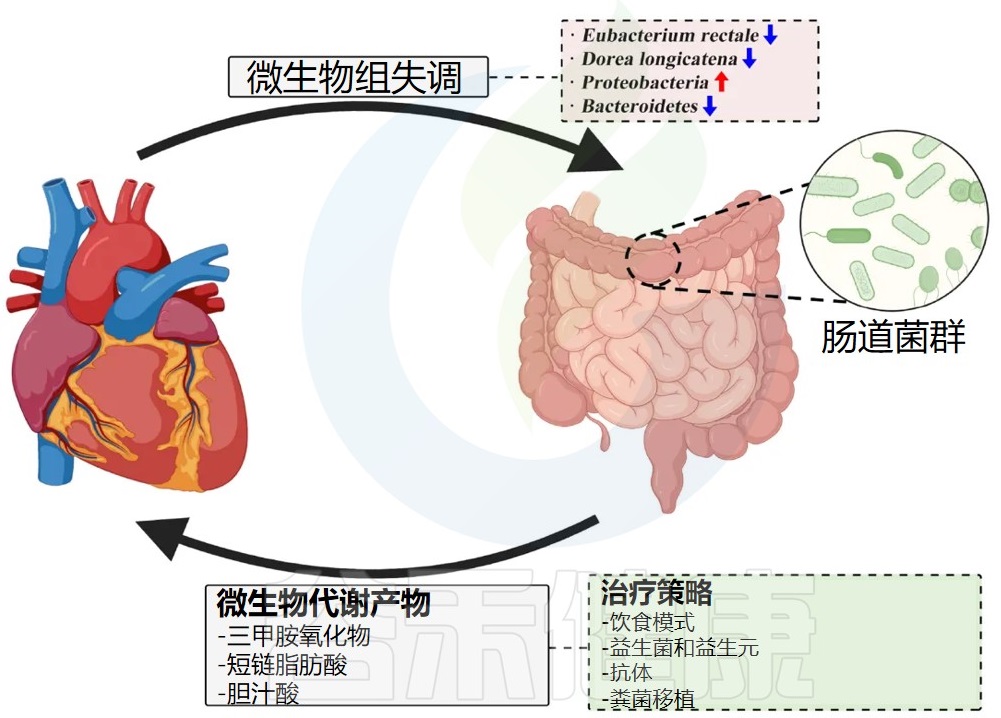

doi.org/10.3389/fmicb.2022.956516
苯丙氨酸:与炎症细胞因子呈正相关,是心力衰竭的独立预测因子
这些代谢物可被视为肠道微生态失调的生物标志物,并且可以预测已知患有心力衰竭的患者的炎症。血浆苯丙氨酸水平升高的患者表现出炎症细胞因子(IL-8、IL-10)、C反应蛋白 (CRP) 水平升高,并伴有更高的死亡率。而甘氨酸表现出抗炎作用,似乎提供保护细胞和心脏。对从 FINRISK 和 PROSPER 队列收集的数据进行的分析中,苯丙氨酸是心力衰竭的独立预测因子。
升高的TMAO水平与心力衰竭的风险相关
TMAO 是一种由包括厚壁菌和假单胞菌属在内的肠道细菌产生的代谢产物,从胆碱、磷脂酰胆碱和左旋肉碱发酵中获得。
高饱和脂肪和高糖饮食导致的 TMAO 水平升高,可导致纤维化、心肌炎症和舒张功能受损。瘤胃球菌、普雷沃氏菌和梭状芽孢杆菌属和毛螺菌科丰度增加,以及拟杆菌门水平降低,表明其血浆中的 TMAO 水平较高。
心力衰竭相关生态失调的特点是循环中高水平的TMAO,能够通过促进心肌纤维化和促炎作用来刺激心脏重塑。现有证据表明,TMAO 水平升高会刺激具有促炎作用的细胞因子(包括 IL-1β 和 TNF-α)的过度表达,以及 IL-10 和其他具有抗炎特性的细胞因子的减弱。
TMAO水平升高可作为急性和慢性心力衰竭的预后生物标志物
与健康人相比,心力衰竭患者的血浆TMAO水平升高。TMAO水平升高可作为急性和慢性心力衰竭的预后生物标志物,独立于B型钠尿肽(BNP)和传统风险因素,因为TMAO水平可预测这些患者的死亡率。
TMAO血浆值升高对应于左心室舒张功能障碍的晚期。TMAO也可被视为HFeEF的预后预测因子和这一特定类别患者的风险分层标志物。
对于住院的心力衰竭急性失代偿患者,TMAO水平升高与肾功能下降相关,可作为心力衰竭恶化死亡或再次入院风险升高的预测指标。
TMAO水平还与血红蛋白、肌酐、BUN和NT-proBNP相关。
肉碱相关代谢产物与不良预后有关
特别是L-肉碱和乙酰-L-肉碱与短期预后(急性事件后30天)有关,而TMAO与长期预后(急性事件后1年)有关。
短链脂肪酸属于胃肠道中肠道微生物产生的代谢产物。短链脂肪酸对心力衰竭具有保护作用,并在维持肠道屏障的完整性方面发挥主要作用:在粘液产生中,它们在抗炎保护中具有活性。
肠道菌群产生的短链脂肪酸对心血管系统的下游影响
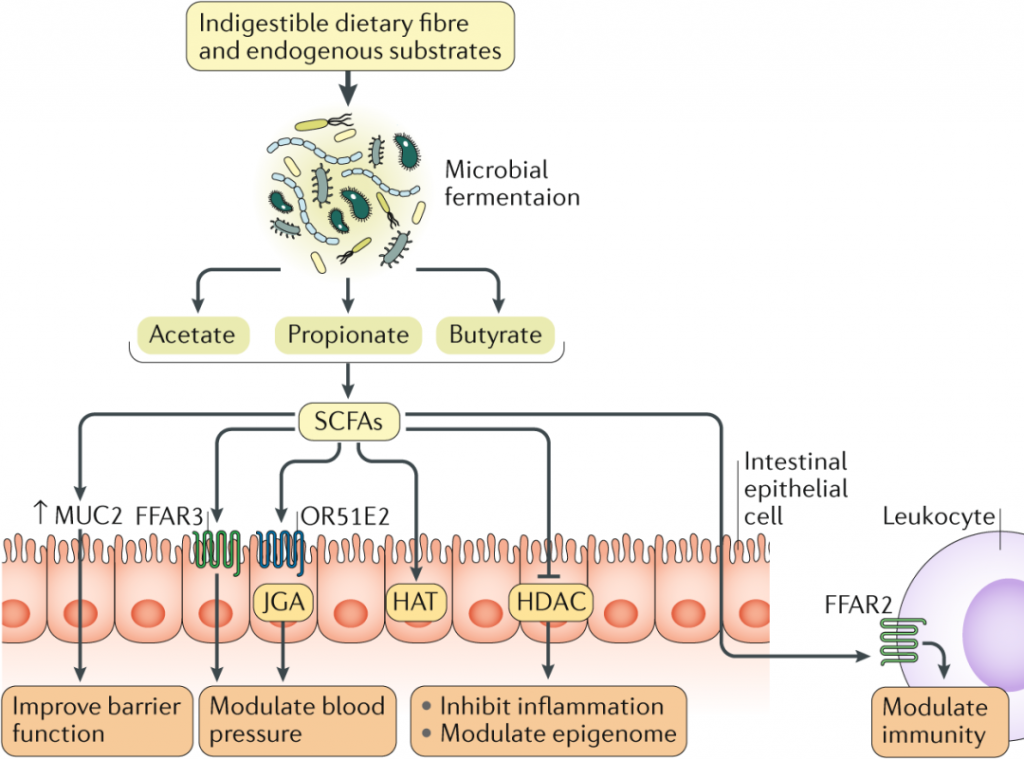

doi: 10.1038/s41569-018-0108-7.
肠道微生物群产生的短链脂肪酸通过以下方式发挥其心血管作用:
胆汁酸(BA)是由肠道微生物合成的胆汁代谢物,在脂质代谢中起着关键作用。饮食习惯、禁食和昼夜节律对胆汁酸的产生和重吸收有影响。
胆汁酸信号传导的受体,如法尼醇-X受体(FXR),在几乎所有的心血管细胞中表达,与心脏组织中的电传导和细胞力学密切相关。因此,胆汁酸信号在调节宿主的生理过程和许多心脏疾病方面非常重要。
一项前瞻性队列研究评估了慢性心力衰竭患者的原发性和继发性胆汁酸水平,然后显示原发性胆汁酸水平显着降低,继发性胆汁酸水平增加。研究人员这些发现归因于微生物群的功能,因为微生物代谢对胆汁酸合成的影响很大,尤其是次级胆汁酸。
这项工作揭示了胆汁酸和肠道菌群在调节心肌功能方面的密切相关性,但潜在的机制仍然未知。法尼类 X 受体(FXR)和 G 蛋白偶联受体 5 (TGR5)是 胆汁酸信号通路中的两个重要分子。
FXR是心力衰竭患者的潜在治疗靶点,因为FXR可以通过增加脂联素来改善心功能障碍并促进心肌重塑。此外,FXR的敲除通过抑制心脏病细胞的凋亡和纤维化促进了衰竭心脏的恢复。
年龄、性别、营养状况、疾病状态以及遗传和环境暴露是可以解释个体对药物治疗反应的因素。我们知道,微生物群参与药物代谢和药理作用,同时也存在双向交流,药物也会影响微生物群的组成。
药物吸收是一个复杂的过程,取决于许多因素,如它们在胃肠液中的溶解度和稳定性、pH值、胃肠道转运期、通过上皮膜的渗透性以及药物与宿主和微生物酶的相互作用。
人类肠道微生物群能够产生参与口服药物代谢的酶,促进其在肠道和血液中的吸收。肠道细菌群落的失调可以进一步改变药物的药代动力学;前药的激活可能加剧产生不需要的毒性代谢产物和药物的失活。
由于肠道细菌种类的个体间差异,“健康”肠道中也可能存在药物反应的变化。
心力衰竭患者粪便样本的宏基因组测序显示,他汀类药物、β受体阻滞剂、血管紧张素转换酶抑制剂、血小板聚集抑制剂等几种药物的使用对肠道微生物组成有重要影响。下表列出了微生物生物转化的例子。
肠道菌群可能影响心血管药物疗效的已知和提出的机制


doi.org/10.3390/cells12081158
地高辛,一种经常被推荐用于心力衰竭的药物,是微生物群影响药物生物利用度的一个很好的例子。
一些迟缓埃格特菌(Eggerthella lenta)菌株负责将地高辛转化为一种无活性的微生物代谢产物,限制了10%的患者吸收到系统血流中的活性药物的数量。
最近的研究证明,地高辛与抗生素或富含精氨酸的饮食共同给药,都会导致全身地高辛水平升高和药物水平的临床相关波动。
阿司匹林是一种非甾体抗炎药,通常用于降低脑血管和心血管疾病的风险。
阿司匹林破坏肠道微生物群的组成
与未使用或未使用其他类型非甾体抗炎药的患者相比,使用阿司匹林的患者的瘤胃球菌科、普雷沃氏菌、Barnesiella和拟杆菌的细菌水平存在差异。
肠道菌群的组成对阿司匹林的代谢产生影响
口服抗生素可以通过减缓肠道微生物群的降解、提高其生物利用度和延长其抗血栓作用来降低其代谢活性。
含有短双歧杆菌Bif195的益生菌可以预防阿司匹林摄入的不良反应,如肠壁损伤和阿司匹林诱导的胃溃疡。
抗生素通过改变肠道菌群影响华法林的药效
华法林是一种常用的抗凝剂,通过抑制维生素K依赖性的凝血因子II、VII、IX和X的激活来表达其作用。当与抗生素一起服用时,与华法林使用相关的出血事件增加。
两种机制:抗生素可以通过抑制或诱导CYP酶来干扰华法林的使用;还可以改变肠道细菌组成,消除产生维生素K的细菌,如拟杆菌属。
抗高血压药物的作用已经在动物和人类研究中进行了多次研究。
β受体阻滞剂、血管紧张素受体阻滞剂(ARBs)和血管紧张素转换酶抑制剂(ACE抑制剂)的使用之间的关联可以改变肠道微生物群的组成。
一项大型宏基因组学研究报告了,钙通道阻滞剂、ACE抑制剂和肠道细菌组成之间的正相关。对高血压大鼠研究发现,包括卡托普利在内的血管紧张素转换酶抑制剂带来的有益作用,是通过减轻肠道微生态失调、改善肠壁通透性和增加绒毛长度来实现。
他汀类药物是用于降低低密度脂蛋白-C(LDL-C)和胆固醇水平的药物。
他汀类药物治疗反应的存在个体间差异,与特定的他汀类药物或剂量无关。
他汀类药物在调节肠道菌群方面的作用
接受阿托伐他汀治疗的个体表现出抗炎肠道细菌水平的增加,如普拉梭菌(Faecalibacterium prausnitzii)和AKK菌(Akkermansia muciniphila)
已知患有高胆固醇血症的未经治疗的患者表现出具有促炎作用的细菌种类的增加,例如柯林斯氏菌(collinsella)和链球菌。
与LDL-C水平相关的菌群
LDL-C水平似乎与厚壁菌门和梭杆菌门呈负相关,而黏胶球形菌(Lentisphaerae)和蓝细菌门与LDL-C呈正相关。现有证据表明,LDL-C对他汀类药物治疗的反应可能受到含有胆汁盐水解酶(bsh)的细菌的影响。路氏乳杆菌是一种bsh活性升高的肠道细菌,给药后LDL-C水平显著降低。
同一项研究报告称,低密度脂蛋白胆固醇水平的个体变化与循环胆汁酸呈负相关。以前与LDL-C水平呈负相关的厚壁菌门也与bsh活性有关。几种动物模型维持了他汀类药物治疗对肠道微生物群落的有益作用。
使用瑞舒伐他汀有一种罕见的副作用
由于瑞舒伐他汀中含有一种叔胺,在肝脏水平上与TMA竞争代谢,血清TMA水平及其在尿液中的排泄量增加,导致鱼腥味综合征。
考虑到微生态失调是心力衰竭发病机制和疾病进展的关键因素,靶向破坏的肠道微生物群是一个有效的治疗目标。
表征每个患者的肠道微生物群及其与疾病相关的肠道微生态失调的可能性,需要个性化的、有针对性的治疗计划。
有各种方法可以管理和调节失调的肠道微生物群,如饮食干预(也包括使用益生元、后生元)和粪便移植,但现有文献中的几份研究将饮食调节和使用益生菌作为调节微生物群的主要干预措施。
●
饮食方式
饮食一直被认为是塑造肠道相关微生物群结构和功能的关键因素。
地中海饮食
医学文献中经常引用的地中海饮食包括高水平的多不饱和脂肪酸、膳食纤维、多酚和少量红肉。
在其对人类健康的益处中,地中海饮食提供了更丰富的益生菌、更大的生物多样性、增加的短链脂肪酸和减少的TMAO。坚持地中海饮食与心力衰竭发病率下降相关,最高可达74%。
此外,地中海饮食的高依从性似乎与心力衰竭呈负相关,并改善了HFpEF患者的长期预后,因为这是10年随访的结果。地中海饮食可能具有抗炎作用,因为有益作用与CRP水平相关。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
得舒饮食(DASH饮食)
控制高血压的饮食方法(DASH饮食)饮食计划代表了一种摄入多不饱和脂肪、富含全谷物营养、蔬菜、水果和低脂乳制品的饮食,在降低心力衰竭发病率方面具有重要潜力。
饱和脂肪和胆固醇会导致其他心血管问题,请避免使用黄油、起酥油和人造黄油,避免奶酪、熏肉等,并食用有限量的橄榄油、亚麻籽油、山茶油等。
高纤维饮食
最近,在高血压诱导的心力衰竭实验模型中,高纤维饮食被证明可以改善肠道微生态失调(厚壁菌和拟杆菌的比例)、降低血压、改善心脏功能和使心脏肥大正常化。此外,纤维的发酵会增加短链脂肪酸的产量,对人类健康具有有益作用。
避免高钠饮食
通常建议心力衰竭患者限制饮食中的钠含量。美国心脏协会建议个人将钠摄入量限制在每天 2300 毫克以下。
管理液体量
心脏无法将血液泵送到身体其他部位时,体液就会积聚,喝太多液体可能会导致肿胀、体重增加和呼吸急促。
因此要控制饮水量,其他液体也要限制一定的量,比如说咖啡、果汁、牛奶、茶、苏打水等,还有酸奶、布丁、冰淇淋、果汁,少喝汤。


总体而言,饮食中尽可能将各种新鲜水果和蔬菜比例调大,适量食用全谷物、去皮家禽、鱼、坚果和豆类以及非热带植物油。
尽量少吃饱和脂肪、反式脂肪、胆固醇、钠、红肉、糖果、油腻甜点、含糖饮料等。
山楂
山楂有助于将心率和血压水平提高到正常水平。它还含有抗氧化剂,可以保护心脏免受自由基的侵害,山楂是心脏营养的绝佳来源,因为它含有生物类黄酮、单宁、维生素A、B族维生素、维生素C,以及铁、钙和钾等必需矿物质。
大蒜
大蒜可以降低心脏病的风险因素,包括高血压和胆固醇。它还降低了冠心病(CAD)心力衰竭患者的心率和心脏收缩力(心脏泵血的强度),冠心病是心力衰竭最常见的原因。


银杏叶
与安慰剂相比,银杏叶通过增加摄氧量、产生能量以及改善局部左心室功能,对心力衰竭有帮助。它还可以预防肾损伤。
人参
人参长期以来一直被用于中医治疗心脏病和心血管疾病。可以帮助降低血压,并降低因压力而导致的体内皮质醇水平。人参可以通过改善动脉和静脉的血液流动、增加心肌的氧合和防止动脉硬化来改善心脏功能。
生姜
生姜含有有益心脏健康的营养物质,如抗氧化剂和抗炎剂。它可以通过预防心脏病发作或心肌损伤、降低胆固醇水平和调节血压来帮助治疗心力衰竭。
水飞蓟补充剂
水飞蓟补充剂已被用于心力衰竭患者,水飞蓟含有一组黄酮类抗氧化剂水飞蓟素,可减少心力衰竭时的氧化应激。
辣椒
辣椒能增加血液循环,这意味着心力衰竭患者可以从中受益匪浅。此外,辣椒中含有辣椒素,辣椒素可以使心脏动脉放松和扩张,从而减少心脏病发作。它还可以防止血栓形成或扩大。

大多数关于益生菌治疗心力衰竭疗效的研究都是在动物模型中进行的。
大鼠模型中:益生菌促进产短链脂肪酸
口服植物乳杆菌299v和鼠李糖乳杆菌GR-1可产生有益的心脏作用。补充乳杆菌属似乎可以促进产短链脂肪酸菌,如真细菌、罗氏菌属(Roseburia)和瘤胃球菌,以促进膳食纤维发酵的副产物短链脂肪酸,在维持健康的心血管活动中发挥关键作用。
临床改善:益生菌改善心脏收缩功能
在一项针对心力衰竭患者(NYHA II级或III级,LVEF<50%)的小型双盲、安慰剂对照试点研究中,随机接受益生菌治疗,接受布拉酵母菌(Saccharomyces boulardii)(每天1000mg,持续3个月)或安慰剂。与安慰剂组相比,接受益生菌治疗的心力衰竭患者总胆固醇水平和尿酸水平降低,心脏收缩功能改善。
在人类中,一项初步研究报告称,在慢性心力衰竭患者中使用益生菌布拉酵母菌进行干预后,不仅减少了全身炎症,而且改善了左心室射血分数。不过参与者人数较少(n = 20),应谨慎解释结果。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
最近的一项研究报告称,益生元低聚果糖可减少大鼠炎症细胞的浸润。益生元可以促进有益细菌的发生长,包括双歧杆菌和乳杆菌,减轻体重和炎症,改善葡萄糖和胰岛素耐受,所有这些都与更好的心力衰竭结果有关。
关于肠道微生物群对有害代谢产物产生的调节,临床前研究报告了DMB给药,饮食中TMAO的去除,胆碱TMA裂解酶抑制剂碘甲基胆碱的给药在降低血清TMAO水平、改善心脏重塑和减少促炎细胞因子表达方面的有益作用。
白藜芦醇还可以通过重建肠道菌群来刺激肠道中有益细菌的生长,从而减少TMAO的产生。
扩展阅读:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
与抗生素在心力衰竭患者肠道微生物群调节中的应用有关,研究结果存在争议。
万古霉素
在动物模型中,与未经治疗的大鼠相比,口服万古霉素可诱导较小的左心室梗死面积,并改善缺血/再灌注实验后的心功能恢复。
利福昔明
利福昔明除了具有杀菌和抑菌作用外,还具有减少细菌移位和毒性的能力,具有抗炎作用,可以积极调节肠道微生物群的组成,促进乳酸杆菌和双歧杆菌的生长。至于人体临床试验,结果是矛盾的。
妥布霉素和多粘菌素B
在心力衰竭患者中使用妥布[拉]霉素和多粘菌素B的混合物,使肠道革兰氏阴性杆菌水平正常化,显著降低促炎细胞因子,血流介导的舒张改善:内皮功能障碍的证据。然而,结果仅限于给药治疗期间。
此外,在开具抗生素治疗处方时,必须考虑副作用,如多粘菌素B毒性和大环内酯类药物增加心肌梗死风险。
最近一项评估共生给药对慢性心衰患者左心室肥大的影响及其对血压和hsCRP作为炎症生物标志物的影响的研究报告称,与安慰剂组相比,共生给药10周后,作为左心室肥大标志物的NT-proBNP水平显著下降。hsCRP水平或血压值没有显著差异。
最近的一项研究报告称,在饮食诱导的HFpEF前啮齿动物模型中,FMT和三丁酸治疗改善了早期心脏功能障碍,并增加了支链氨基酸的分解代谢。
在人类受试者中,FMT使患有代谢综合征的肥胖个体的胰岛素敏感性正常化,但其影响是短期的。目前,还没有可用的临床研究来评估心力衰竭患者的FMT结果,但FMT具有巨大的治疗潜力,并代表了未来研究的一个有希望的方向。
戒烟
烟草烟雾中的尼古丁会暂时增加心率和血压,吸烟还会导致血管结块或粘稠。戒烟的人更有可能改善心力衰竭症状。
适当运动,维持体重稳定
体重突然增加或减少可能是正在发展为心力衰竭的迹象。适当运动,维持体重,高强度间歇训练 (HIIT)、低强度有氧运动或阻力训练等运动训练方法均能有效改善心肌功能。研究表明,高强度间歇训练在提高患者的活动水平和心脏性能方面最为有效。
注意:具体合适的运动量请根据个人情况咨询医生。
限制饮酒
如果需要饮酒,请适度。男性每天不要超过一到两杯,女性每天不超过一杯。
管理压力
每天花 15 到 20 分钟静静地坐着,深呼吸,想象一个宁静的场景,或者尝试瑜伽或冥想等方式。
涉及深横膈膜呼吸的呼吸练习,可以帮助心力衰竭患者缓解焦虑、增加血液中的氧气水平和降低压力水平,从而改善心脏功能。
充分休息
为了改善晚上的睡眠,请使用枕头支撑头部。避免睡前小睡和大餐。试着在午饭后打个盹,或者每隔几个小时把脚抬起来几分钟。
选择合适的衣服
避免穿紧身袜或袜子,例如大腿或膝盖高的袜子,它们会减慢腿部的血液流动并导致血栓。也尽可能避免极端温度。分层穿着,以便根据需要添加或脱掉衣服。
肠道相关微生物群的组成和功能及其在人类健康中的病理生理作用一直是活跃的研究领域。现代技术的不断进步进一步推动了心力衰竭研究的前沿,探索了心力衰竭的新方面。
本文总结了有关肠道菌群及其代谢产物对心力衰竭及其相关风险因素的影响。心力衰竭与肠道微生态失调、细菌多样性低、肠道潜在致病菌过度生长和产短链脂肪酸菌减少有关。肠道通透性增加,允许微生物移位和细菌衍生的代谢产物进入血液,这与心力衰竭的进展有关。
靶向被破坏的肠道微生物群可以被认为是一个有效的治疗目标。有许多方法可以用来调节失调的肠道微生物群,如饮食干预(包括益生元、益生菌)、生活方式调整、补充剂、粪菌移植等。
然而这些方式带来的效果可能各不相同,因为这在很大程度上取决于每个个体的肠道菌群特征,也包括遗传背景、肠道屏障功能等。因此,通过肠道菌群健康检测,以及基于菌群特征开发个性化的微生物组疗法,或为心力衰竭临床治疗带来新的途径。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Tang WHW, Li DY, Hazen SL. Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol. 2019 Mar;16(3):137-154. doi: 10.1038/s41569-018-0108-7. PMID: 30410105; PMCID: PMC6377322.
Lu X, Liu J, Zhou B, Wang S, Liu Z, Mei F, Luo J, Cui Y. Microbial metabolites and heart failure: Friends or enemies? Front Microbiol. 2022 Aug 15;13:956516. doi: 10.3389/fmicb.2022.956516. PMID: 36046023; PMCID: PMC9420987.
Desai D, Desai A, Jamil A, Csendes D, Gutlapalli SD, Prakash K, Swarnakari KM, Bai M, Manoharan MP, Raja R, Khan S. Re-defining the Gut Heart Axis: A Systematic Review of the Literature on the Role of Gut Microbial Dysbiosis in Patients With Heart Failure. Cureus. 2023 Feb 12;15(2):e34902. doi: 10.7759/cureus.34902. PMID: 36938237; PMCID: PMC10014482.
Malik A, Brito D, Vaqar S, Chhabra L. Congestive Heart Failure. 2022 Nov 7. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28613623.
Lupu, V.V.; Adam Raileanu, A.; Mihai, C.M.; Morariu, I.D.; Lupu, A.; Starcea, I.M.; Frasinariu, O.E.; Mocanu, A.; Dragan, F.; Fotea, S. The Implication of the Gut Microbiome in Heart Failure. Cells 2023, 12, 1158.
Gallo A, Macerola N, Favuzzi AM, Nicolazzi MA, Gasbarrini A, Montalto M. The Gut in Heart Failure: Current Knowledge and Novel Frontiers. Med Princ Pract. 2022;31(3):203-214. doi: 10.1159/000522284. Epub 2022 Jan 28. PMID: 35093952; PMCID: PMC9275003.
Branchereau M, Burcelin R, Heymes C. The gut microbiome and heart failure: A better gut for a better heart. Rev Endocr Metab Disord. 2019 Dec;20(4):407-414. doi: 10.1007/s11154-019-09519-7. PMID: 31705258.
Chen X, Li HY, Hu XM, Zhang Y, Zhang SY. Current understanding of gut microbiota alterations and related therapeutic intervention strategies in heart failure. Chin Med J (Engl). 2019 Aug 5;132(15):1843-1855. doi: 10.1097/CM9.0000000000000330. PMID: 31306229; PMCID: PMC6759126.
Trøseid M, Andersen GØ, Broch K, Hov JR. The gut microbiome in coronary artery disease and heart failure: Current knowledge and future directions. EBioMedicine. 2020 Feb;52:102649. doi: 10.1016/j.ebiom.2020.102649. Epub 2020 Feb 12. PMID: 32062353; PMCID: PMC7016372.

谷禾健康

人类肠道微生物组是一个多样化的生态系统,我们已经知道,它在多个器官系统健康中发挥着重要作用,肠道微生态失调可能导致各种常见疾病,如糖尿病、神经精神疾病、癌症等。
新的研究表明,肠道微生物组的改变与眼部疾病相关。
基于小鼠实验,已经开始对人类微生物组及其与眼部病理学的关系进行临床研究。
葡萄膜炎、年龄相关性黄斑变性、青光眼、干眼综合征和霰粒肿等病理学正在探索中,对微生物组的深入研究可能扩展这些疾病的治疗方案。

本文总结目前检查肠-眼轴的临床研究,尤其是改变微生物组来缓解眼部疾病的潜在治疗方法。
研究发现,10% 的炎症性肠病患者会出现眼部疾病(巩膜外层炎、葡萄膜炎、结膜炎等)。肠道和与之相对较远的眼睛之间有什么关联?我们从以下几个方面来看:
▼
视网膜是眼睛后部的一层,里面装满了神经细胞,可以捕获图像并将其发送到大脑。
在所有的眼组织中,从免疫的角度来看,视网膜被认为是一种特权组织。它有三层保护(内部的血液-视网膜屏障;外层血视网膜屏障;以及血水屏障),以及通过“抵抗”和“容忍”策略,来保护它免受来自内部和外部环境的伤害。
这些血液视网膜屏障的变化可能通过募集炎症细胞和随后的眼内炎症导致视网膜疾病的发展,例如葡萄膜炎。
此外,它还受到自身防御系统的保护,如小胶质细胞和补体系统,以维持视网膜稳态。
视网膜由于更新和修复能力差而非常脆弱,因此即使是轻微的损伤也会产生毁灭性的后果。
年龄相关性黄斑变性是一种全身免疫性疾病,局部表现为眼部免疫环境下调所致。免疫反应改变的迹象表现为先在视网膜色素上皮中逐渐积累,后在玻璃膜疣中逐渐积累的沉积物,构成有利于免疫系统显著激活的抗原刺激。
在衰老过程中,所有防御系统的效率都会降低,与年龄相关的形态功能和免疫变化伴随着慢性低水平炎症。“炎症”过程也会导致与年龄相关的视网膜疾病。
▼
眼睛的物理变化被认为是由于肠道内壁的炎症与肠道通透性增加有关。肠道通透性/肠漏综合征的变化允许细菌、毒素或免疫化合物穿过粘膜肠道屏障并传播到不同位置,包括眼睛表面。这些化合物直接影响眼睛或可能通过分子模拟引发眼睛的免疫反应。分子模拟是一种可能引发自身免疫性炎症的机制,因为保护屏障受损以及细菌或毒素的长期存在。
扩展阅读:
▼
在许多层面上,肠道微生物群和免疫化合物与眼睛的视网膜相互作用。不健康、失调的肠道微生物群和活化的免疫细胞会在眼睛中引发炎症,并影响视网膜、眼睛微生物组和眼睛润滑,从而导致眼部相关疾病。
肠道微生物组及其代谢物,尤其是短链脂肪酸,都可以通过直接或间接修改不同细胞类型的表观基因组来调节免疫细胞的关键功能。
损害眼睛的危及视力的免疫反应是眼内炎症性疾病的典型特征。葡萄膜炎、年龄相关性黄斑变性、与干眼症相关的干燥综合征、糖尿病视网膜病变、青光眼和感染性角膜炎与肠道微生物组异常有关。
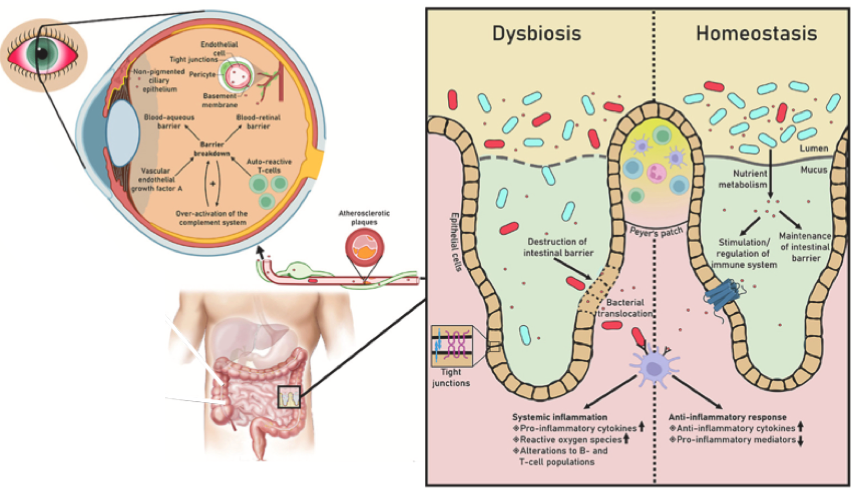
doi.org/10.1016/j.preteyeres.2022.101117
接下来,我们来看一下具体哪些肠道菌群与眼部相关疾病有关。
▼
在糖尿病视网膜病变中,与健康对照组相比,主要的分类门,包括拟杆菌门、放线菌门、粪杆菌门和梭菌门被耗尽。
在两项评估糖尿病视网膜病变队列中微生物组多样性的研究中,发现多样性下降,这与临床前小鼠模型一致。
▼
与对照小鼠相比,Bacteroides caecimuris在患病小鼠中显着增高。受影响的小鼠缺少健康肠道微生物组典型的菌群,如Rikenella,Muribaculaceae, Prevotellaceae UCG-001, Bacilli 等。
肠道微生物组变化与眼部疾病之间的联系可以通过多种机制来解释。肠道生态失调可以有利于增加肠道通透性,允许微生物及其代谢物诱导眼细胞炎症。微生物失衡也可能是血液视网膜屏障破裂和中枢神经系统氧化应激增加的原因。所有这些假设也可以解释视网膜色素变性小鼠模型中的神经炎症,氧化应激和细胞死亡。
▼
年龄相关性黄斑变性( ARMD )是一种多因素疾病,由遗传和环境因素的复杂组合引起。
与改变的肠道微生物群相关的肠道通透性增加,允许肠道代谢物和产物的更高易位,可能调节视网膜特异性免疫细胞。有趣的是,LPS 引起的慢性炎症会加速营养不良 P23H 大鼠的神经变性,导致营养不良视网膜的形态和生理紊乱恶化。
宏基因组测序评估了 ARMD 患者和对照组,研究人员发现 ARMD 患者中以下菌群含量较高 :
而以下菌群在对照组中含量较高:
研究人员推测可能与谷氨酸降解和精氨酸生物合成途径增加有关。谷氨酸是一种众所周知的视网膜兴奋性神经递质,因此其减少可能导致视网膜神经传递不足。
关于谷氨酸代谢详见:兴奋神经递质——谷氨酸与大脑健康
此外,患者也缺乏负责脂肪酸延伸途径的细菌。在这方面,长链多不饱和脂肪酸可能对视网膜生理学产生关键影响,并可能促进ARMD发展。
相比之下,对照组中Bacteroides eggerthii 的丰度可能对该疾病具有保护作用,因为它能够产生短链脂肪酸。这些代谢产物可能通过改变淋巴细胞从肠道向眼睛的迁移来调节眼内炎症。
▼
一项针对12名新生血管性年龄相关性黄斑变性(nAMD)患者的试验发现,与对照组相比,nAMD患者存在“微生态失调”。值得注意的是,研究人员发现了Anaerotruncus的增加,这也与小鼠模型中炎症信号的增加有关,这表明肠道微生物变化和nAMD进展相关的可能作用机制。
▼
在青光眼患者中,研究人员发现肠易激综合征是一种与微生物群失调相关的疾病,会显著增加患青光眼的几率(OR=5.84)。
除了发现青光眼患者与对照组的细菌谱存在差异外,还注意到视觉效果与巨单胞菌和Blautia属的丰度呈负相关。
扩展阅读:
肠道核心菌属——巨单胞菌属(Megamonas),不同人群差异大
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
▼
一项视网膜研究了一组特发性颅内高压患者,再次发现与对照组相比微生物群存在差异。
有趣的是,使用乙酰唑胺治疗的患者发现乳酸杆菌增加,这被认为对肠道微生物健康有益。
总的来说,在眼部病理中,菌群可能发生改变或破坏,见下表:
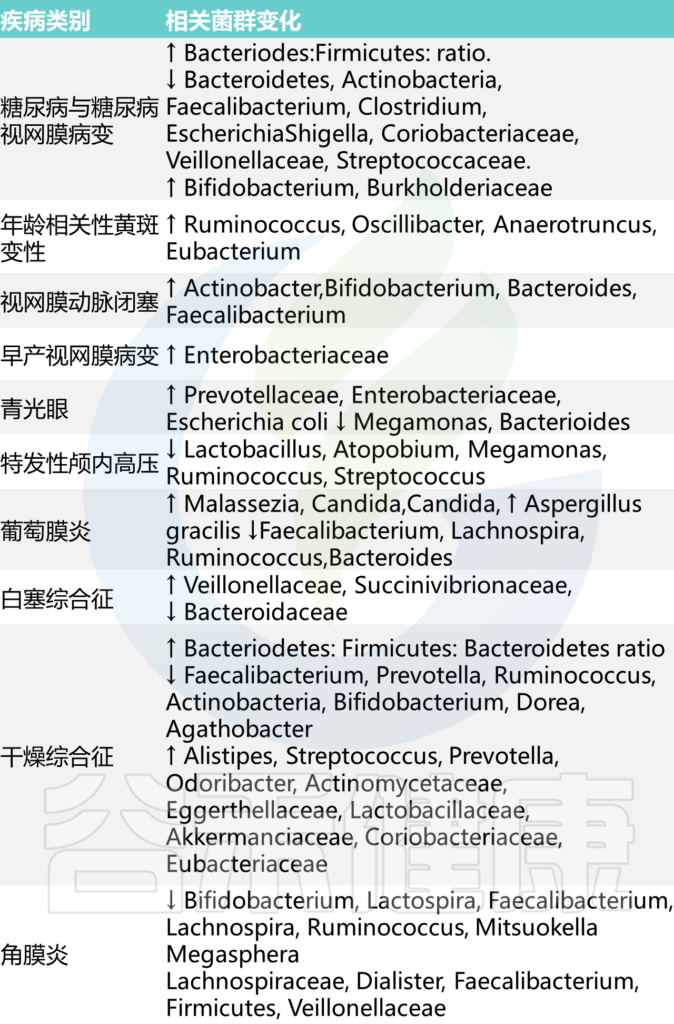
Russell MW, et al., Eye (Lond). 2023
肠道微生物组可以调节炎症信号的变化。因此,如果肠道组织受到影响,导致全身促炎状态,那么眼部后果可能是继发于或平行于肠道炎症轴的,或者可能在主要过程中有所不同。
▼
在葡萄膜炎的情况下检查了肠道失调,发现各种抗炎微生物群减少。但也有研究人员注意到葡萄膜炎的肠道失调,病例和对照组之间的没有显著差异,研究人员认为细菌可能与这种病理状态无关。
进一步探讨这种可能性,有研究人员发现,与对照患者相比,致病性念珠菌属和曲霉菌属增加了。另一项研究发现与对照患者相比,角膜炎患者的肠道失调,这两项研究都发现了标记的细菌群落变化。这些研究也检测了真菌的变化,注意到致病性曲霉、念珠菌和马拉色菌增加的趋势,这些真菌已被证明表现出抗真菌耐药性并参与其他疾病过程。
两项试验检测了白塞病葡萄膜炎患者的微生物群差异,发现病例和对照组之间存在显著差异。白塞病患者的微生物群多样性也显著降低。上述数据表明肠道健康和眼部病理之间可能存在联系。
然而,目前尚不清楚真菌和细菌是否直接介导眼部病理,是否与免疫系统有关,或者是否有其他未发现的途径在起作用。
扩展阅读:膳食真菌在癌症免疫治疗中的作用: 从肠道微生物群的角度
▼
研究人员发现,视网膜动脉阻塞(RAO)患者与健康对照相比,不同分类属的细菌有所增加。这项研究还发现RAO患者的三甲胺-N-氧化物(TMAO)显著增加,TMAO是一种微生物群衍生的代谢产物,已被发现是心血管不良事件、死亡率和血栓形成的独立风险因素。
在这项研究中,TMAO和阿克曼菌Akkermansia丰度呈正相关,表明微生物群和RAO之间存在潜在的机制联系。然而,必须注意的是,在其他研究中,Akkermansia被发现与TMAO浓度呈负相关,这表明TMAO可能不是病因,或者,TMAO本身可以在眼部病理学中发挥中介或主要作用。如上所述,这项研究并不是为了证明一种联系,也不是为了简单地假设一种联系的存在。
肠道微生态失调的眼部临床研究

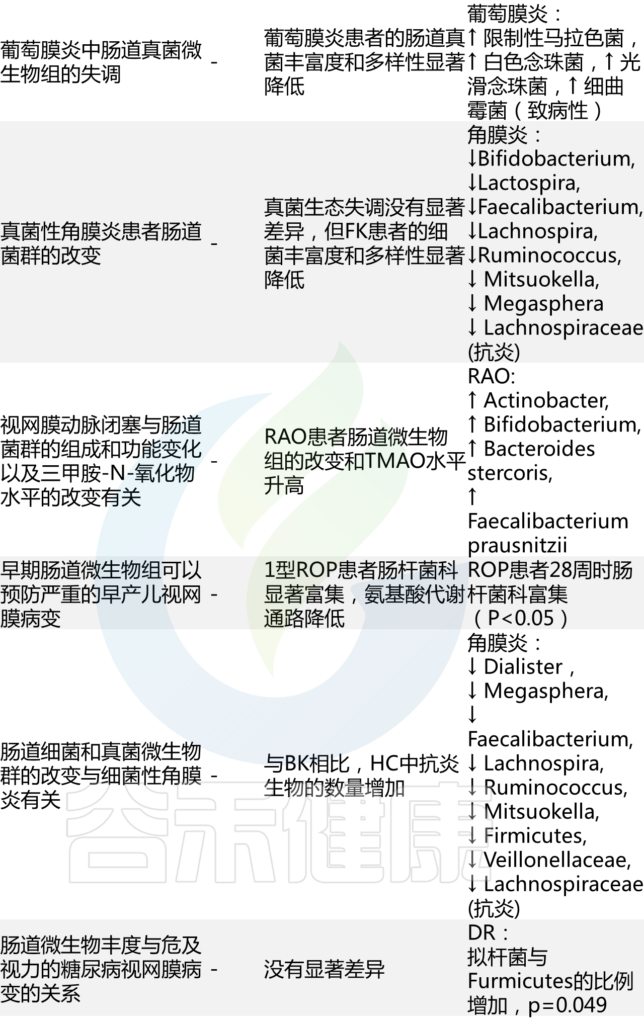
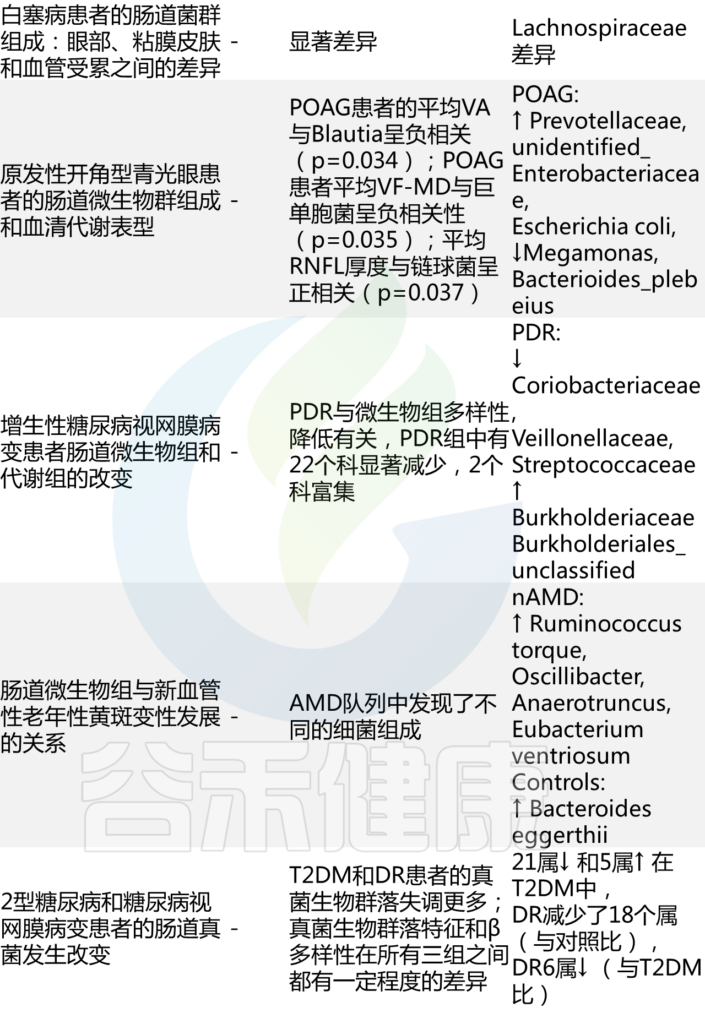
Russell MW, et al., Eye (Lond). 2023
有四项临床研究(≤23名患者)通过粪菌移植(FMT)或益生菌补充靶向肠道微生物群,来治疗眼部疾病。
▼
Watane等人于2021年对10例干燥综合征并发干眼症的患者进行了粪菌移植。粪菌移植后三个月,没有副作用报告,患者自我报告的干眼症症状在一半的队列中减轻了。
▼
Filippelli等人于2021和2022年对10名成人和13名儿童患者的益生菌补充剂及其治疗霰粒肿的疗效进行了研究。在这两项研究中,均使用了含有嗜热链球菌、乳酸乳球菌和德氏乳杆菌的益生菌。所有接受益生菌制剂治疗的成年患者霰粒肿消退时间显著缩短,而这种影响对于只有小于2.0mm的小霰粒肿的儿童来说也是如此。
Napolitano等人于2021报道了一例有三年前葡萄膜炎病史的患者的病例。患者服用了含有乳酸双歧杆菌、两歧双歧杆菌和短双歧杆菌的益生菌补充剂。两个月后,该患者的视觉功能增加,葡萄膜炎的临床症状减少。益生菌配方并不包括患者微生物组中不存在的物种。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
除了以上的临床研究外,其他可能的干预措施:
▼
高纤维饮食会促进某些细菌在肠道中占据优势地位,这些细菌会产生短链脂肪酸,促进调节性 T 细胞分化,并降低发生眼部炎症的倾向。一些实验正在直接使用短链脂肪酸来测试它作为肠外自身免疫性疾病的治疗干预,已有研究人员发现,在小鼠身上,它对自身免疫性葡萄膜炎有保护作用。
▼
一项涉及衰老小鼠的研究中,高血糖饮食导致光感受器退化和视网膜色素上皮细胞萎缩,这在喂食正常饮食的小鼠中是看不到的。恢复到低血糖饮食可以逆转疾病的特征,并改变肠道中 AMD 保护因子(包括血清素)的水平。
▼
高脂饮食会导致肠道渗透性增加,从而使细菌产物如脂多糖和其他病原体相关分子模式的分子易位增加,它们通过先天免疫系统的模式识别受体 ( 特别是Toll样受体和Nod样受体)影响促炎信号转导,引起低度全身性炎症,加剧脉络膜新生血管形成,最终加重病理性血管生成。
在一项研究中,在4周龄的C57BL/6小鼠中研究了高脂肪饮食对泪腺功能的影响。结果显示,高脂饮食的小鼠表现出病理变化,包括眼泪分泌水平降低、炎症性CD4+T细胞增加 ,细胞浸润、TNF-α和IL-1β等促炎因子增加以及腺泡和肌上皮细胞凋亡增加。将标准饮食引入之前高脂肪饮食的小鼠后,泪腺的病理变化部分逆转,包括炎症细胞和促炎因子的减少以及抗炎胞质分裂素的上调。
▼
在啮齿动物模型中,在开始隔日禁食方案后的 1 周内,间歇性禁食已被证明可以降低血压和心率,这两者都是 糖尿病性视网膜病变等眼部血管疾病的已知危险因素。
另一项早期限时喂养(从早上 8 点到下午 2 点随意喂养,剩下的 18 小时禁食)被证明可以降低餐后胰岛素、血压、氧化应激和夜间食欲同时增加人类受试者的胰岛素敏感性和 β 细胞功能。这项研究和其他研究进一步支持间歇性禁食的有益作用,并表明它可能通过降低血压和胰岛素敏感性来治疗眼部血管疾病。
连续 7 个月的隔日禁食,增加了产生肠粘液的杯状细胞的数量,并降低了血浆 PGN 的浓度,表明肠血管屏障完整性得到改善。
▼
动物研究表明,锌通过减少氧化应激来改善视网膜的抗氧化过程。特别是,肠道菌群竞争锌的供应,锌对共生代谢途径和细菌毒力因子都很有用。然而,锌缺乏及其过量的存在都会改变微生物组的组成。
▼
膳食补充类胡萝卜素和锌可以预防或延缓眼部疾病的进展,可能是通过它们的抗氧化和抗炎特性。叶黄素和玉米黄质两种叶黄素,它们天然集中在人眼的黄斑中。它们充当蓝光的光学滤光片,并作为常驻抗氧化剂和自由基清除剂,以减少氧化应激引起的损伤。
由于人类无法合成类胡萝卜素,因此供应取决于含类胡萝卜素的食物,例如绿叶蔬菜、西兰花、豌豆、玉米和蛋黄。
▼
大量摄入 omega-3 长链多不饱和脂肪酸 (LCPUFA) 与年龄相关黄斑变性风险降低有关。而大量摄入 omega-6 LCPUFA 与风险增加有关。LCPUFAs高度集中在眼睛中,对视网膜的视觉功能至关重要。此外,它们是对氧化应激的促炎和抗炎免疫反应的重要调节剂。ω-3和ω-6 LCPUF之间的比例似乎对预防慢性低度炎症很重要。可以通过某些富含脂肪的鱼,亚麻籽和藻类等补充。
▼
膳食多酚可减少氧化应激,在视网膜色素上皮细胞中具有抗炎作用,并与各种白细胞介素和信号通路的调节有关。在丁香、浆果、红酒或绿茶中富含。
其他对眼部健康至关重要的营养物质包括:
维生素 A、番茄红素、硫辛酸、维生素 C、姜黄素、白藜芦醇、槲皮素、葡萄籽提取物、绿茶提取物等。
微生物组的复杂性对研究微生物变化有挑战,因为微生态失调可能归因于多种菌群的同时过度生长或损失。目前的文献并没有直接分析出因果关系。
除了目前的试验涉及的非特异性干预之外,其他干预措施也可能有效果。一项对36名患者进行的17周的随机前瞻性研究表明,通过逐步引入发酵食品等相对不那么激烈的措施,可以对免疫功能产生类似的影响。
关于发酵食品详见:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
也有研究人员认为,应该谨慎采用通过改变微生物组来改善系统健康的干预措施。30名患者使用益生菌增加微生物多样性,然而却因这种补充而患上了小肠细菌过度生长和D-乳酸酸中毒。开始抗生素治疗后,患者症状减轻(P=0.005)。
由于许多原因,选择与疾病相关的正确益生菌并不容易。同一属和种的不同菌株可能对宿主产生完全不同的影响。应充分了解特定细菌菌株的特定特性和特征以及对宿主健康的影响。
因此,需要更大规模的前瞻性临床试验研究益生菌补充剂对各种眼部疾病的影响,对于进一步阐明这些干预措施的疗效至关重要。有必要研究在剂量和配方方面选择更合适的益生菌方案。
为了建立肠道菌群与眼部病变缓解之间的因果治疗关系,未来的研究可能考虑将微生物组-免疫-眼部效应与纯粹的微生物组-眼部效应分离开来。
临床试验检查了肠道微生物群和眼部病理之间的联系,显示了这两个系统之间的联系。
通过饮食、益生元和益生菌以及粪菌移植等方式调节肠道微生物群,可能都会成为预防和/或治疗眼部疾病的有效方案。
充分结合肠道菌群检测全面评估患者的菌群健康状况,可以考虑采用更有针对性的干预措施,而不仅仅是粪菌移植和益生菌补充剂。
大规模的随机对照临床试验可能会进一步证明这种联系,并阐明新的靶点治疗机制。
主要参考文献:
Zysset-Burri DC, Morandi S, Herzog EL, Berger LE, Zinkernagel MS. The role of the gut microbiome in eye diseases. Prog Retin Eye Res. 2023 Jan;92:101117. doi: 10.1016/j.preteyeres.2022.101117. Epub 2022 Sep 6. PMID: 36075807.
Napolitano P, Filippelli M, Davinelli S, Bartollino S, dell’Omo R, Costagliola C. Influence of gut microbiota on eye diseases: an overview. Ann Med. 2021 Dec;53(1):750-761. doi: 10.1080/07853890.2021.1925150. PMID: 34042554; PMCID: PMC8168766.
Russell MW, Muste JC, Kuo BL, Wu AK, Singh RP. Clinical trials targeting the gut-microbiome to effect ocular health: a systematic review. Eye (Lond). 2023 Mar 14. doi: 10.1038/s41433-023-02462-7. Epub ahead of print. PMID: 36918627.
Shivaji S. A systematic review of gut microbiome and ocular inflammatory diseases: Are they associated? Indian J Ophthalmol. 2021 Mar;69(3):535-542. doi: 10.4103/ijo.IJO_1362_20. PMID: 33595467; PMCID: PMC7942081.
Bai X, Xu Q, Zhang W, Wang C. The Gut-Eye Axis: Correlation Between the Gut Microbiota and Autoimmune Dry Eye in Individuals With Sjögren Syndrome. Eye Contact Lens. 2023 Jan 1;49(1):1-7. doi: 10.1097/ICL.0000000000000953. Epub 2022 Nov 11. PMID: 36544282.
Scuderi G, Troiani E, Minnella AM. Gut Microbiome in Retina Health: The Crucial Role of the Gut-Retina Axis. Front Microbiol. 2022 Jan 14;12:726792. doi: 10.3389/fmicb.2021.726792. PMID: 35095780; PMCID: PMC8795667.
谷禾健康
✦ ✦ ✦
炎症:就是平时人们所说的“发炎”,是机体对于刺激的一种防御反应。炎症,可以是感染引起的感染性炎症,也可以不是由于感染引起的非感染性炎症。
炎症在在各种症状中起重要作用,如脑雾、焦虑和抑郁、腹胀、各种身体疼痛和低血糖水平。为了更好地理解这是如何工作的,需要了解身体的炎症回路。

谷禾在本文中介绍了炎症的一些症状与原因,炎症回路如何影响人体的健康,并有研究发现肠道微生物在炎症回路中起重要作用,这有助于人们更好地认识炎症以及在炎症时做出正确的应对。
✦ ✦ ✦
从本质上讲,炎症是身体对任何类型的压力做出反应的结果。这意味着这可能是由于身体或心理性质的压力。
举例来说,身体压力的一个例子可能是你跌倒摔断了腿,或者你患上了流感。另一方面,心理压力是你情绪的结果,如你在上班路上与路人发生激烈的争吵。
★ 炎症的症状
炎症是身体一系列变化的结果。这些是在分子和细胞水平上产生的信号,可以改变你的正常生理反应。炎症一般有四个症状:
Dolor – pain (疼痛、悲伤)
引起炎症局部疼痛的因素与多种因素有关。局部炎症病灶内钾离子、氢离子的积聚,尤其是炎症介质诸如前列腺素、5-羟色胺、缓激肽等的刺激是引起疼痛的主要原因。
炎症病灶内渗出物造成组织肿胀,张力增高,压迫神经末梢可引起疼痛,故疏松组织发炎时疼痛相对较轻,而牙髓和骨膜的炎症往往引起剧痛;此外,发炎的器官肿大,使富含感觉神经末梢的被膜张力增加,神经末梢受牵拉而引起疼痛。
Rubor – redness (发红)
由于炎症病灶内充血所致,炎症初期由于动脉性充血,局部氧合血红蛋白增多,故呈鲜红色。随着炎症的发展,血流缓慢、淤血和停滞,局部组织含还原血红蛋白增多,故呈暗红色。
Calor – heat (灼热、发热)
热是由于动脉性充血及代谢增强所致,白细胞产生的白细胞介素Ⅰ(IL-1)、肿瘤坏死因子(TNF)及前列腺素E(PGE)等均可引起发热。
Tumor (肿胀、肿瘤)
主要是由于渗出物,特别是炎性水肿所致。慢性炎症时,组织和细胞的增生也可引起局部肿胀。
•身体对抗病原体产生炎症
当涉及到身体自我修复时,炎症是极其重要的,因为炎症过程允许身体对抗和摆脱任何造成伤害的东西。我们感觉到的症状——发红、肿胀、疼痛和发热——是这个过程的副作用。
当我们的身体开始保护自己免受侵入我们身体的毒素和病原体或身体开始愈合时,炎症就开始了。
•炎症影响内分泌
在这个过程中,毛细血管扩张,而血管壁变得更加多孔。这允许白细胞穿过血管壁,从而到达因感染而造成损害的区域。
这些区域的肿胀和相关疼痛是由于液体积聚,进而对这些区域的神经施加压力,从而导致我们感到疼痛和不适。
分子介质(即抗炎分子)也会引发疼痛,增加您的不适感。在炎症过程中感受到的热量是由于流向身体特定区域的血流量增加所致。
// 小结
一般来说,炎症回路会对您体内的任何情况做出反应,以保持自身健康并以最佳状态工作。这是一种自然的生物反应。然而,当炎症不受控制时,就会出现问题。如果您身体的自然炎症反应没有得到抑制和控制,可能是慢性炎症。
•炎症具有防御作用
在炎症过程中,以血管系统为中心的一系列局部反应限制并消除损伤因子,同时也促进受损组织的愈合。液体的渗出可稀释毒素,吞噬搬运坏死组织以利于再生和修复,使致病因子局限在炎症部位而不蔓延全身。
因此,炎症是以防御为主的天然的局部反应,一般而论,是对机体有利的。可以设想,如果没有炎症反应,细菌感染就无法控制,损伤永远也不能愈合,对机体可以造成严重的危害。
•一些情况下炎症是有害的
但是在有些情况下,炎症又是潜在有害的。炎症反应是一些疾病的发病基础,如严重的超敏反应炎症过于剧烈时可以威胁病人的生命。
此外,特殊部位或器官所发生的炎症可造成严重后果,如脑或脑的炎症可压迫生命中枢,声带炎症阻塞喉部导致窒息,严重的心肌炎可以影响心脏功能,此时,应使用抗炎症药物抑制炎症反应。
如上所述,炎症是身体或心理压力的结果。然而,由心理压力引起的炎症通常比由身体(生理)压力引发的炎症影响要小。炎症是对身体所经历的任何威胁的自动反应。
炎症通常可依病程经过分为两大类:急性炎症和慢性炎症。急性炎症起病急骤,持续时间短,仅几天到一个月,以渗出病变为其特征,炎症细胞浸润以粒细胞为主。
慢性炎症持续时间较长,常数月到数年,常以增生病变为主,其炎症细胞浸润则以巨噬细胞和淋巴细胞为主。
✦急性炎症较容易控制
健康人的急性炎症很容易控制。健康身体在感知到威胁时被激活,然后它与感染作斗争并开始修复任何损坏。然而,一旦威胁过去,身体也会恢复正常,让身体再次正常运作。肾上腺分泌的皮质醇激素控制炎症“关闭”过程。
注:皮质醇也是身体的减压激素。
✦慢性炎症易反复发作,治疗较困难
虽然炎症的典型迹象很容易识别(发热、发红、疼痛和肿胀),但慢性炎症的迹象并不那么容易看到。其中包括:腹胀、食物敏感、焦虑、抑郁、肠漏(肠易激)、头晕等等。
多数可以由急性炎症治疗不及时、不彻底,或治疗效果不佳,造成疾病逐渐发展导致,一般持续时间比较长,多数在6周以上,甚至长达数月或数年。并且慢性炎症的治疗比较困难,而且容易反复发作。
✦持续炎症具有负面影响
通常身体对急性炎症的反应相关的短期疼痛是具有长期益处的。然而,当涉及到低度、持续的炎症时,情况并非如此,这种炎症通常是对心理压力和慢性感染的反应,就像莱姆病或EB病毒一样。
这种情况,身体会经历持续的压力状态,导致炎症回路超时工作,结果是一种不平衡的状态,使你的身体更容易感染不同的疾病,并对与衰老过程相关的影响产生负面影响。
莱姆病是一种以蜱为媒介的螺旋体感染性疾病,是由伯氏疏螺旋体所致的自然疫源性疾病。
EB病毒(Epstein-Barr virus,EBV)是疱疹病毒科嗜淋巴细胞病毒属的成员,基因组为DNA。EB病毒具有在体内外专一性地感染人类及某些灵长类B细胞的生物学特性。人是EB病毒感染的宿主,主要通过唾液传播。无症状感染多发生在幼儿,3~5岁幼儿90%以上曾感染EB病毒,90%以上的成人都有病毒抗体。
这种炎症虽然不明显,但在实际表现出来之前已经存在多年。这种炎症状态存在的时间长度不仅直接影响诊断疾病的严重程度,还直接影响预后。在许多情况下,你身体的炎症回路对某些疾病的反应是某些慢性疾病的原因。
注意
尽管炎症不舒服,但也是必要的,身体的设计方式既可以让我们既可以忍受它又可以控制它。研究表明,即使没有身体迹象,慢性低水平压力也会在体内停留一段时间,并对生理和心理健康产生负面影响。
✦许多疾病都伴有炎症
与特定慢性病相关的炎症是局部的。例如:心脏病患者的动脉有局部炎症,糖尿病患者的胰腺有炎症,阿尔茨海默氏症患者的大脑有炎症。
炎症也可能是环境或我们吃的食物中存在或身体代谢出来某些毒素的结果。在这种情况下,这些毒素会影响身体的不同部位,包括局部和全身。
★ 与炎症相关的疾病
有许多疾病和健康问题都包括炎症的一个方面。其中包括:纤维肌痛、狼疮、哮喘、中风、乳糜泻、自闭症、酸回流、对某些感染(病毒、细菌、真菌)的易感性、癌症、关节炎、皮肤问题,以及糖尿病、慢性疼痛、支气管炎、骨质疏松症等
任何能够引起组织损伤的因素都可成为炎症的原因,即致炎因子。可归纳为以下几类:
生物性因子
细菌、病毒、立克次体、支原体、真菌、螺旋体和寄生虫等为炎症最常见的原因。由生物病原体引起的炎症又称感染。
物理性因子
高温、低温、放射性物质及紫外线等和机械损伤。
化学性因子
外源性化学物质如强酸、强碱及松节油、芥子气等。内源性毒性物质如坏死组织的分解产物及在某些病理条件下堆积于体内的代谢产物如尿素等。
坏死组织
缺血缺氧等原因引起的组织坏死是潜在的致炎因子。
免疫反应
免疫反应所造成的组织损伤最常见于各种类型的超敏反应:I型变态反应如过敏性鼻炎、荨麻疹,II型变态反应如抗基底膜性肾小球肾炎,III型变态反应如免疫复合物沉着所致的肾小球肾炎,IV型变态反应如结核、伤寒等;另外,还有许多自身免疫性疾病如淋巴细胞性甲状腺炎、溃疡性结肠炎等。
✦慢性炎症的原因
慢性炎症的原因相较于急性炎症有所不同,主要是炎症回路变得不平衡。其中包括:
•肠道菌群失调
•环境毒素
•生活方式和饮食不健康
•某些药物,例如导致肠道菌群失调的抗生素
✦慢性压力对炎症有重要影响
慢性压力,无论是心理上的还是生理上的,都会导致肾上腺皮质醇的过量产生,从而导致炎症
注:肾上腺疲劳通常被忽视为炎症回路不平衡的原因。
✦炎症回路会及时对压力做出反应
当身体受到任何类型的“压力”时,炎症回路是关键的反应器之一。当对压力做出反应时,炎症反应与其他身体系统和器官协同工作。最直接影响炎症回路的身体系统包括:免疫系统、肠道(胃肠道)以及微生物组。
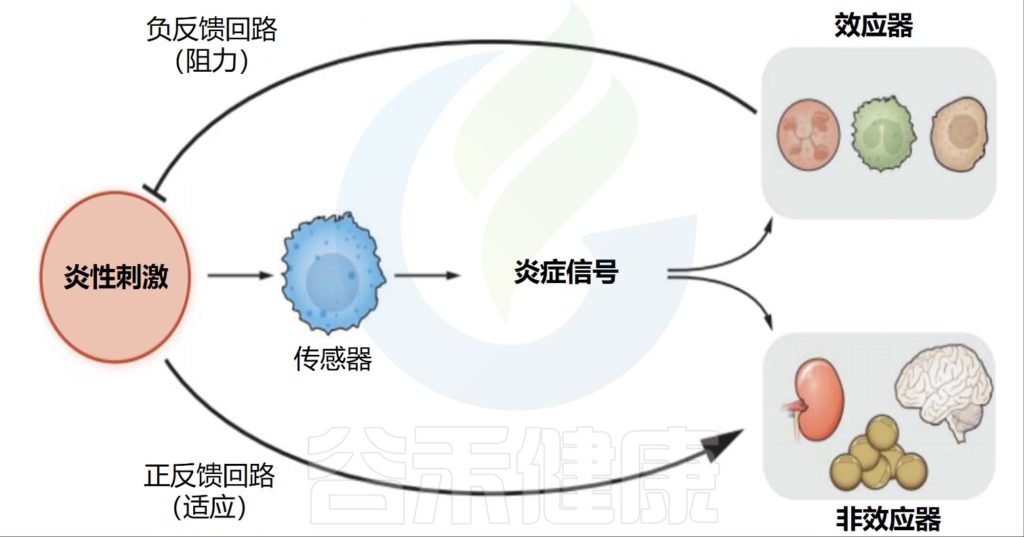
Medzhitov R.Science.2021
所有炎症反应都包括四个部分。这些信号包括触发反应的炎性刺激、检测它们的传感器、传感器产生的炎症信号以及炎症信号的各种目标。
•负反馈回路直接消除病原体
炎症信号有两种类型的靶点:第一种是效应靶点,它们直接参与了炎症病原体的消除。炎症信号诱导效应细胞的激活、招募和分化。炎症回路的这一部分以负反馈的方式运作。
•正反馈回路调节信号
第二种靶点是不直接参与病原体消除的组织和器官。根据问题是什么(调节、功能或结构的缺失),炎症信号会以与稳态信号相同的“方向”改变这些功能,或者对抗稳态信号。
✦面对病原体激活炎性小体
2023 © Cell Signaling Technology
先天性免疫系统是防止病原微生物和宿主源性细胞窘迫信号的第一道防线。这些“危险”信号诱发炎症的一种方式是通过激活炎性体,炎性体是在暴露在病原体相关分子模式 (PAMP) 或危险相关分子模式 (DAMP) 下之后在胞质中组装的多蛋白复合体,并且会激活caspase-1以及后续裂解活化促炎性细胞因子白细胞介素1β和白细胞介素18。
炎性复合体
炎性复合体通常含有胞质模式识别受体(PRR;一种核苷酸结合结构域和亮氨酸富集重复序列 [NLR] 或 AIM2 样受体 [ALR] 家族成员)、接头蛋白 (ASC) 和 pro-caspase-1。
现已检测到许多不同的炎性体复合体,每个复合体有独特的PRR和激活触发物。特征最明显的是NLRP3复合体,它含有 NLRP3、ASC、pro-caspase-1和丝氨酸-苏氨酸激酶NEK7。NLRP3炎性体在2个步骤的过程中被激活。
首先,PAMP或DAMP介导的TLR4或TNFR 激活会诱导 NF-kB 信号转导,导致NLRP3、pro-IL-1β和pro-IL-18表达升高(引导步骤,信号1)。
接下来,大量信号(全病原体、PAMP/DAMP、钾外流、溶酶体损坏的环境因子 [尿酸、硅和明矾]、内源性因子 [淀粉样蛋白 β、胆固醇结晶] 和线粒体损害)会间接激活NLRP3,导致复合体组装和 caspase-1激活(信号2)。
蛋白组分之间的结构域相互作用会形成复合体炎性体结构。其他炎性体通过更直接的方式被激活:双链DNA激活AIM2复合体,炭疽霉素激活NLRP1,细菌flagelllin激活NLRC4。激活的caspase-1会诱导促炎性细胞因子IL-1β和-18的分泌,而且调控代谢酶表达、吞噬体成熟、血管舒张和细胞焦亡(一种炎性程序性细胞死亡)。
炎性体信号转导会导致许多疾病的发作,包括动脉粥样硬化、II型糖尿病、阿尔茨海默病和自身免疫性疾病。
✦抗炎信号调节炎症器官
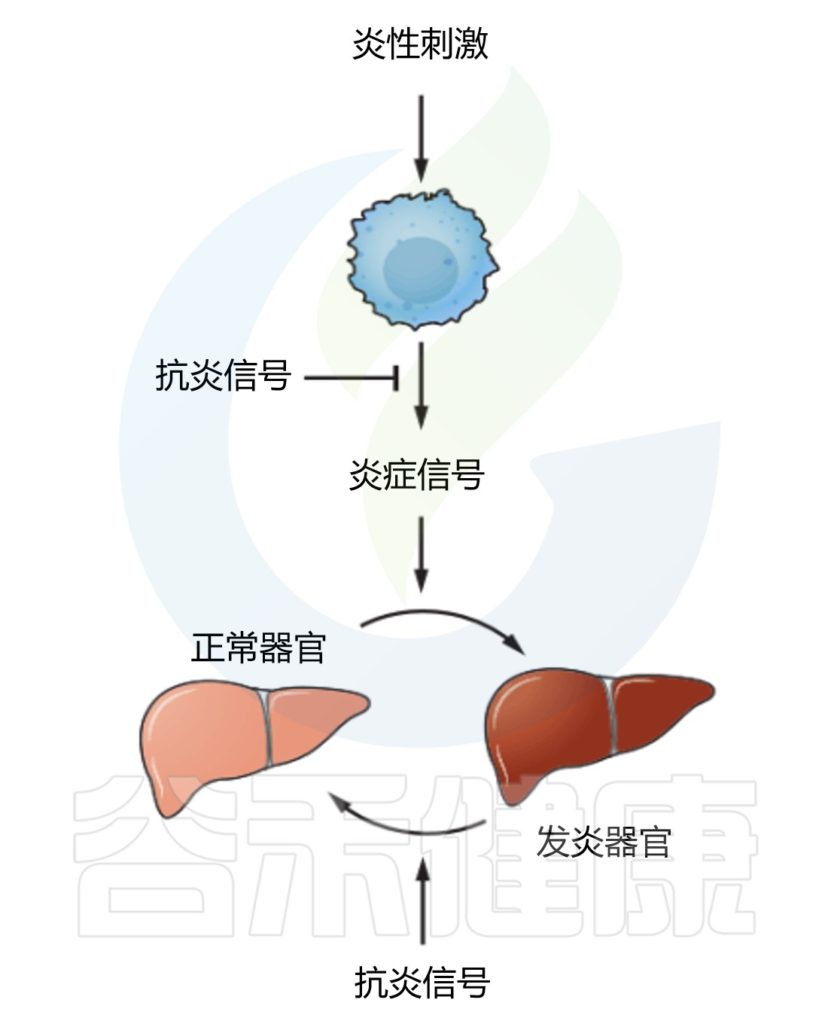
Medzhitov R.Science.2021
消除病原体本身并不足以控制炎症,在没有负调节因子的情况下,炎症反应总是极端过渡到病理状态。
控制炎症程度的抗炎信号(Anti-inflammatory signals)包括IL-10、TGF-β和糖皮质激素等。如何抑制由炎症反应引起的附带损伤也很重要,一种机制有可能是通过靶组织对炎症信号的反应性不同,使最容易受到炎症损伤的重要组织和器官对炎症信号的反应性较低。
另一种可能机制是通过“反炎信号(counter-inflammatory signals)”将组织的炎症状态恢复到原来的“稳态”状态。控制靶组织的反应程度,将炎症反应成本降到最低。
这些稳态信号很可能纠正机体偏离正常时的炎症状态,例如肾上腺素对支气管平滑肌的影响:组胺和白三烯在炎症反应中诱导支气管收缩,而肾上腺素通过诱导支气管松弛恢复到稳态来抵消这种作用。
目前发现的“反炎信号”(counter-inflammatory signals)有调节性T细胞(Tregs,不仅控制炎症的大小,而且还控制组织稳态)和参与分解的信号分子(脂质素和分解素)。
需要注意的是,抗炎和反炎作用可能由相同的信号来实现。例如,腺苷和TGF-β可能同时具有抗炎(即作用于传感器细胞和效应细胞)和反炎(即作用于所有其他靶组织)来调节炎症的模式。
不足之处
虽然现有的抗炎药物提供了一定的治疗效果,但它们增加了对感染的易感性。激活抗炎途径应该在不损害防御功能的同时,有助于恢复组织和器官的稳态。
抗炎途径的研究未来将是新型治疗方法开发的重要方向,更多抗炎信号的研究可能有助产生炎症领域的有效新药。
✦大部分炎症性疾病始于胃肠道
大多数不同的炎症性疾病始于身体的肠道(或胃肠道)。从那里扩散到身体的不同部位。肠道内壁是可渗透的,这意味着它允许某些物质通过并进入血液。
•炎性物质可能会扩散到其他器官
然而,当这种渗透性增加时,不需要的物质也会通过,从而触发身体的免疫系统来对抗它。这可能不仅会导致炎症,还会导致过敏和疾病。在某些情况下,这些毒素会进入您的大脑,不仅会导致抑郁症,还会导致某些神经系统问题。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
✦炎症小体与肠道稳态相关
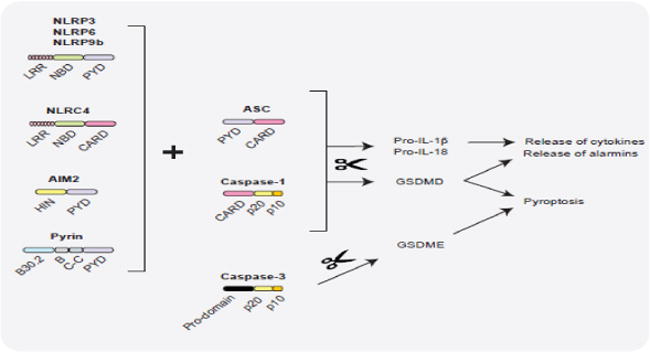
Rathinam VAK,et al.Trends Mol Med.2018
宿主和微生物来源的各种信号被不同的炎性体受体感知,导致ASC-CASPASE-1复合物的组装和 CASPASE-1的成熟。在酶促作用下,活性 CASPASE-1通过蛋白水解加工激活pro-IL-1β、pro-IL-18和gasdermin D (GSDMD)。GSDMD通过质膜穿孔执行裂解性细胞死亡,还促进IL-1β、IL-18和警报素释放。
•炎性体影响肠道上皮细胞
炎性体激活的所有这些结果都会在不同程度上影响肠上皮细胞和固有层免疫细胞的功能,从而以依赖于环境的方式协调肠道稳态。
此外,细胞凋亡半胱天冬酶CASPASE-3可以裂解GSDME以响应化疗,从而引发癌细胞焦亡。然而,尚不清楚GSDME诱导的细胞焦亡是否参与肠道稳态。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
下面让我们来看看可能由发炎的胃肠系统引起的一些症状。
食物敏感性和炎症回路
目前面临比较突出的问题越来越多的人正在增加对某些食物的敏感性,尤其是麸质。食物敏感性经常长时间未被诊断的原因是因为这些症状与其他肠道疾病和病症的症状非常相似。他们通常被误认为是另一种疾病。
为什么对麸质敏感的人数增加了这么多?
小麦经过各种加工使其变得更易溶于水,以便与其他成分混合。这意味着我们实际上消耗的小麦数量比我们的祖先曾经做过的要多得多。
食用后,由于酶的作用,麸质会分解成麦醇溶蛋白和麦谷蛋白。一旦它们到达您的肠道相关淋巴组织 (GALT),系统就会对其进行评估,以确定它们是否对您的身体有害。
•酶的攻击使肠道受损
如果您碰巧对麸质敏感,GALT会通过抗体攻击蛋白质。在患有乳糜泻的人中,分解麸质的蛋白质和酶都会受到GALT产生的抗体的攻击。
这种酶的另一个功能是帮助吸收营养。这是通过将肠道的微绒毛保持在一起来实现的。微绒毛是在肠壁中发现的毛发状结构。对这种酶的任何攻击都会导致微绒毛受损——进而对肠壁产生负面影响,使其更容易被毒素渗透,并导致称为漏肠的状况。抗体还可能攻击你自身的器官和组织,例如皮肤和大脑,结果就是发生自身免疫性疾病。
然而,引起炎症的不仅仅是麸质。其他来源是乳制品、含有亚油酸的油,例如花生油、向日葵油、红花油和玉米油,以及海鲜和特定调味品。
可以通过识别和消除敏感的食物来治愈肠道并平息您的炎症回路。慢性炎症与肾上腺疲劳综合征 (AFS) 和神经内代谢 (NEM) 应激反应密切相关。通过调整饮食,您可以帮助自己从肾上腺疲劳中恢复过来,同时降低患胃肠道疾病的风险。
便秘与炎症回路
什么是便秘?
便秘是一种排便不规律的情况,导致排便困难,过程伴随痛苦的。偶尔便秘被认为是正常的,经常便秘可能会导致肠道疾病,从而影响炎症回路。
你可能会问“正常到什么程度才正常?” 它因人而异,但在大多数情况下,每天排便一次或两次在被认为是正常的范围内。超过三天没有排便会导致便秘,因为随着时间的推移大便会变干,使排便变得更加困难和痛苦。
✦便秘会引起其他问题
便秘时上厕所不仅不舒服,而且用力也会引起一系列问题,例如痔疮或憩室病。
✦便秘的原因
便秘的原因有很多。其中包括:纤维含量低的饮食、喝水过少、乳制品含量高的饮食、结肠癌、肠易激综合征、长时间不活动、结肠肌肉或神经问题引起的问题、压力、某些类型的药物、甲状腺功能减退和怀孕。
便秘通常是肾上腺疲劳后期出现的并发症,因为您的身体能量水平降低,难以排便以保存能量。你的消化速度减慢,导致废物留在结肠中。这会增加毒性并导致炎症。
✦便秘的危害
如果不理会,随着肾上腺疲劳的加剧,随着时间的推移,情况可能会变得更糟。体内积聚的毒素压倒了炎症回路,可能导致炎症,进而导致肌肉骨骼系统的崩溃。这还包括内部器官的胶原蛋白结构。随着时间的推移,胃肠道会受到损害,从而导致便秘和消化问题恶化的循环效应。
•便秘容易加重一系列疾病
由于胃不能产生足够的酸来分解食物以吸收营养,这会耗尽细胞,结果是一个循环导致整个系统减速以节省能量。然而,它可能导致以体重大幅减轻为特征的分解代谢状态。
在大多数情况下,甲状腺也会受到损害,会减慢速度以降低新陈代谢率以节省能量。这进一步加剧了疲劳并增加了便秘问题。由于废物堆积,毒素开始影响肝脏和肾脏功能。
•改善肠道菌群有助于调节便秘
如果便秘严重或持续存在,则可能需要干预。这其中包括改善肠道菌群组成,帮助调节肠道运动,有助于改善便秘及相关症状。
腹泻和炎症回路
腹泻会导致脱水并失去电解质。如果持续存在,可能表明存在更严重的问题。
注:如果发现大便中有血或粘液,并且发烧、疼痛或体重减轻,您可能需要尽快咨询医生或就医,因为这些是潜在的、更深层次的问题的迹象。
✦腹泻的病因
腹泻有多种常见原因。这些包括细菌,吃你过敏或敏感的食物,或病毒。其他原因可能包括克罗恩氏病、肠易激综合征 (IBS)、糖尿病、某些癌症、甲状腺机能亢进和吸收不良等。
然而,在大多数情况下,腹泻与这些疾病中的任何一种都无关,而且问题通常可以通过药店买治疗腹泻的药就可以缓解。在大多数情况下,清淡的食物、充足的休息和保持水分会很有帮助。
注意
患有肾上腺疲劳综合症 (AFS) 的人通常更容易患便秘而不是腹泻。另一方面,肾上腺衰竭晚期的人往往会出现非常严重的腹泻。
肠易激综合征和炎症回路
肠道最重要的目的之一是防止毒素、微生物、未消化的食物和外来物质进入血液。健康时,肠道黏膜细胞的连接很紧密,只允许身体所需的营养物质通过。当你的肠道渗漏时,这些连接处就不那么紧密了,毒素和其他颗粒会被允许通过。这些被免疫系统视为外来入侵者。然后你的炎症回路会攻击它们,导致炎症。
✦症状
肠易激综合征 (IBS) 的症状包括:恶心、背疼、尿频、焦虑、疲劳、腹胀、肚子痛、便秘/腹泻、口臭、关节痛、头痛。
当实验室测试排除具有类似症状的其他情况时,通常通过排除过程来诊断肠易激综合征。它本质上是对胃肠道的刺激。
✦病因
许多因素会导致肠易激综合征,例如使用某些药物,抗生素,焦虑,抑郁,荷尔蒙失衡和各种其他因素。压力起着重要作用。
患有肠易激综合征的后期阶段新陈代谢减慢以节省能量。在这个过程中,肠道运动也会减慢。因此,食物以慢得多的速度穿过身体。结果通常是便秘,尽管有时也会出现腹泻。当然,这会增加肠道刺激并恶化与肠易激综合征相关的症状。
建议
某些补充剂,如omega-3脂肪酸、谷氨酰胺、植物甾醇、槲皮素和益生菌益生元,改善饮食等都可能有助于预防肠易激综合征的发生。某些类型的纤维甚至有助于帮助微生物组和加强炎症回路。
微生物组(microbiome )可以描述为体内特定环境中所有不同微生物的所有遗传物质。这是炎症回路的第二部分。
注:不应将术语微生物群与仅指特定环境中的微生物(microbiota),即仅指胃肠道中的微生物这一术语混淆。
据估计,人体中大约90%的细胞都不是人类的。在大多数情况下,它们本质上是原核生物。原核生物是单细胞的,没有线粒体,细胞核没有膜。这些原核细胞是来自1,800多个不同属的 4 万多种不同菌株的结果。而肠道中拥有最丰富的微生物群。
当我们年轻的时候,肠道的微生物组在我们免疫系统的形成中起着极其重要的作用。在免疫系统仍在发育的儿童早期尤其如此。
✦免疫系统影响炎症的产生
小时候,我们的身体免疫系统接触并习惯于抗原,并对它们产生耐受性。一旦达到稳态(平衡)状态,外来微生物和抗原将无法在体内引起炎症反应。
只有当我们的免疫系统较弱或发育不全时,接触外来过敏原才会触发炎症回路中的反应,导致自身免疫性疾病、过敏以及对化学品和某些食物的敏感性问题。
一个很好的例子是老鼠一生都被关在无菌环境中。虽然他们很健康,但他们的免疫系统还没有完全发育。一旦接触到外来微生物,它们往往会发展为自身免疫性疾病和其他健康问题。
✦微生物群对健康有重要影响
研究表明,婴儿的第一个肠道微生物组对他们的健康有着深远的影响。
身体某些部位的不同微生物具有相同的功能。一个例子是,两个人的舌头上有不同的微生物,但在分解糖分时,他们的工作完全相同。就我们所吃的食物而言,微生物需要一个稳定的栖息地。反过来,当它们分解某些被肠道消化的成分时,我们会从释放的热能中受益。
这意味着我们的身体和我们的微生物宿主之间存在明确的、有益的相互作用,并且身体中的某些功能依赖于这些微生物才能保持健康。当由于某种原因,我们的微生物群落失衡时,我们就处于生态失调状态。
•肠道菌群影响炎症回路
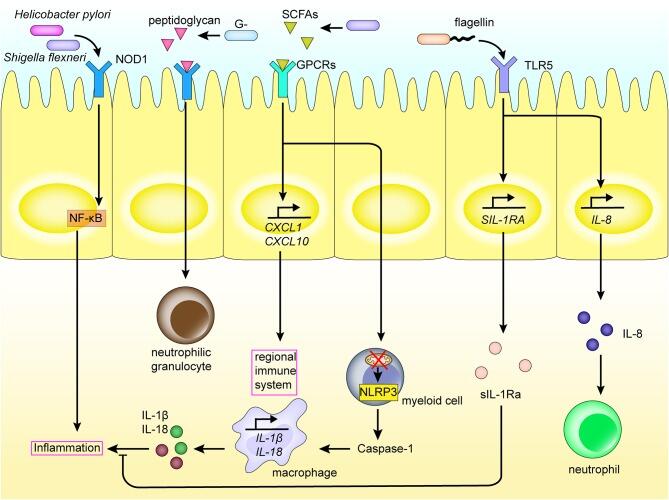
Zhou B,et al.Front Immunol.2020
肠道菌群和代谢物与肠道中的区域免疫系统相互作用。PRRs如NOD1、表达于肠粘膜上皮细胞的Toll样受体,识别肠道菌群的PAMPs和短链脂肪酸,从而激活炎症通路和炎症细胞因子的产生。
这会诱导骨髓细胞的分化、巨噬细胞和中性粒细胞的募集等,引发炎症反应,并激活局部免疫系统。这种相互作用还促进炎症因子的表达。
炎症通常是生态失调的结果。它在许多健康问题中发挥作用,包括糖尿病、肥胖症、哮喘、自闭症和心脏问题等。它还与某些与肠道有关的问题有关,例如克罗恩病。它也可能在大脑中发挥作用,被认为是肠易激综合征 (IBS) 的触发因素之一。这些情况都与肠道生态失调有关。
生态失调的一个常见原因是抗生素。它们会破坏保持系统平衡所需的“好”细菌。当“好”微生物组受到负面影响时,免疫系统也会受到负面影响。
✦肠道菌群失调引起炎症
肠道菌群失调可能引起炎症,进而导致粘膜损伤。当不同黏膜细胞之间的连接受损时,免疫系统会做出相应的反应。
蛋白质、细菌和毒素很容易通过受损的肠壁进入血液,导致所谓的肠漏。与这种情况相关的症状包括:脑雾、抑郁、失眠和疲劳,以及许多其他症状。
健康的肠道细菌与多样化的微生物组相结合,可以形成健康的肠道来支持炎症回路。肠道健康的人通常更健康,感染或复发性疾病的可能性更低,因为他们的身体防御系统更强。
微生物组和神经系统疾病
肠道菌群失调与许多神经系统疾病有关。其中包括自闭症谱系、多发性硬化症 (MS) 和帕金森氏症。帕金森病患者的最初症状通常是便秘,随后是嗅觉和味觉丧失。其他症状,如震颤和摇晃,仅在胃肠道紊乱出现后很久才会出现。
有许多环境因素会影响神经系统状况和炎症回路。其中之一是大脑中没有正确使用蛋白质,导致许多神经退行性疾病。这可能是肠道炎症触发大脑中某些炎症反应的结果,导致蛋白质使用不足和大脑神经细胞退化。
炎症和肠道失衡也可能与某些自身免疫性疾病有关。西方国家的人群有相似的饮食和相应的更高的多发性硬化症发病率。随后的饮食可能会导致炎症,从而破坏肠道中存在的微生物的正常功能。
•压力与饮食通过肠道进而影响炎症回路
帕金森氏症和多发性硬化症患者的肠壁通透性增加,导致针对多种抗原的抗体增加。有证据表明,持续的压力以及其他各种原因是炎症回路失调的原因。
阿尔茨海默氏症和认知功能下降的特点是氧化应激、免疫问题和大脑本身的变化。实验表明,这些都是由于饮食及其对肠道生物群落的影响。神经营养因子是一种保护和促进健康神经元的蛋白质,它依赖于健康的肠道生物群落。阿尔茨海默病患者在这方面表现出明显下降。
微生物组对精神疾病的影响
有证据表明肠道和大脑健康之间存在很强的相关性。这意味着某些心理问题,例如抑郁症,可能是炎症的结果,肠道是最初的煽动者。对动物的研究表明,当某些微生物从抑郁的小鼠身上移植时,健康小鼠的心理会显著下降。
•肠道微生物有助于神经与身体恢复
与肾上腺疲劳综合症相关的两个最常见的症状是焦虑和抑郁。因此,有证据表明,有问题的人必须确保健康的肠道微生物组。它不仅有助于恢复他们的神经处理,还有助于身体恢复。
▸ 小肠细菌过度生长造成危害
当小肠中细菌的生长超出健康限度时,这种情况被称为小肠细菌过度生长 (SIBO)。这些细菌通常存在于结肠中。患有小肠细菌过度生长的人与患有肠易激综合征的人有非常相似的症状,许多人同时患有这两种情况。与该病症相关的症状包括腹痛、便秘、腹胀、胀气和腹泻。
•原因
这种情况发展的原因有很多。最常见的原因包括:
•高糖饮食、富含精制碳水化合物的饮食、酒精过多;
•克罗恩病导致的疤痕会聚集细菌;
•憩室病,其中小肠壁形成袋并收集细菌;
•某些药物,例如对肠道菌群具有破坏性影响的抗生素;
•由于念珠菌、莱姆病和人类疱疹病毒等感染导致炎症回路减弱
•危害
如果小肠细菌过度生长未经治疗,它会对健康产生不利影响,导致慢性腹泻,导致身体所需营养物质吸收不足,最终导致营养不良。
•抵抗外界病原体会触发炎症
炎症是免疫系统的重要组成部分。慢性炎症通常是感染、对自身身体物质的自身免疫反应或来自环境的抗原等的结果。
在慢性炎症的情况下,介质是单核细胞和巨噬细胞,它们是免疫系统的组成部分。也称为白细胞,白细胞在遇到问题时会释放化学试剂,靶向导致炎症回路反应的化学试剂。
•修复自身组织也会触发炎症
然而,问题是这些细胞不仅针对入侵者,还针对您自己的组织,从而造成损害。这些受损组织需要不断修复。慢性感染也是导致您的身体不断发展新血管的原因。
完成的修复工作通常会引起刺激,从而导致炎症过程被重新触发。如果由于某种原因,这变成了一个循环,你的身体就会一直处于炎症状态,从长远来看,它会产生衰弱的影响。
注:现代医学并没有为问题提供长期的解决方案。有时,会开具某些抑制免疫力的类固醇。然而,这些药物通常只能提供短期的症状缓解,并不能解决问题的根本原因。
当处于压力之下时,免疫系统会发现并保护我们免受病原体的侵害,从而引发炎症反应来解决问题。免疫系统因此攻击并清除任何潜在的危险病原体。一个按预期发挥作用的免疫系统可以迅速摆脱某些慢性病原体和感染带来的危险。
✦免疫系统过强和减弱都会导致疾病
尽管免疫系统减弱通常是导致反复感染,甚至是那些难以摆脱的感染的原因,但这不一定是疾病的原因——免疫系统过度活跃也可能是原因。
在“正常”条件下,免疫系统会识别并瞄准敌人的病原体,而将那些被认为是有益的病原体留在一边。然而,有时情况并非如此,炎症回路变得过激,甚至对正常细胞和条件产生免疫反应。
由于强大的免疫系统,炎症回路不一定能正常工作,免疫系统会在过度活跃时导致自身免疫问题。
当这种情况发生时,某些抗体会混淆它们所看到的正常细胞和被认为是病原体的细胞。然后它不分青红皂白地攻击。结果,当这种情况发生时,炎症回路随后会出现与某些自身免疫状况一致的突然发作。
✦导致免疫过度的原因
考虑以下情况,身体可能会将自己的细胞识别为外来细胞并产生自身免疫类型的反应:
•食物敏感性
吃我们敏感的食物会引起炎症,并导致我们的免疫细胞将我们的组织视为异物。免疫反应被激活以摆脱这些不受欢迎的客人。
•微生物组失衡
我们的肠道本身就是一个完整的生态系统。当这个系统失去平衡时,如患有小肠细菌过度生长、胃反流、幽门螺杆菌、肠易激、炎症性肠病、分解代谢状态或肾上腺疲劳晚期胃部减慢的人,可能意味着好的有益细菌被外来的非有益细菌所取代。
外来机会性细菌和隐形病毒从休眠状态转变为活跃状态。这会导致免疫系统超速运转,从而导致慢性炎症。
在这个过程中,免疫系统,特别是在过度活跃的状态下,很容易混淆谁是真正的敌人。外来机会性细菌及其自身同时受到攻击,导致各种自身免疫性疾病。
•HPA轴不平衡
HPA轴又叫下丘脑-垂体-肾上腺轴,是身体的主要压力调节激素轴。皮质醇是主要的抗应激激素。在肾上腺疲劳的晚期阶段,产生的皮质醇不足会导致猖獗的全身炎症,进而导致或引发自身免疫症状。
•肠漏或肠道通透性增加
当食物颗粒穿过胃肠黏膜时,就会引发炎症。未消化的食物应该在胃肠道内。当它进入肝循环和身体其他部位时,免疫系统将其识别为异物,并尽一切努力尝试攻击和中和这些异物。
免疫系统的持续激活会导致免疫细胞与正常细胞发生交叉反应,从而引发自身免疫性疾病
•重金属毒性和化学敏感性
环境毒素无处不在。如果一个人生活在城市世界中,就不可能逃脱。我们体内积累的过多毒素会触发我们的免疫系统在过度活跃的状态下工作,以清除我们身体中这些不需要的物质。那些不能自然而适当地发挥这种功能的人可能会出现自身免疫性疾病的症状。
•慢性和隐形感染
生活中,让我们接触到不断涌现的病毒、真菌、细菌和原生动物等。一些病原体往往会长期伴随我们,处于休眠状态。当我们的免疫系统较弱时,它们会被激活并爆发。这些生物包括伯氏疏螺旋体、小巴贝虫、白色念珠菌、孢疹病毒等。这些病原体引起的疾病会导致免疫系统过度活跃。
与体内正常组织的交叉反应并不少见。这些传染病中的许多都具有自身免疫性疾病的症状,例如肿胀、关节痛、牛皮癣、疲劳和食物过敏。自身免疫实验室标志物可能在血液测试中会升高。
•身体或情绪压力过大
情绪压力持续可能会降低病原体入侵的障碍,触发我们的免疫系统进入超速状态。换句话说,压力会使任何先前存在的临床或亚临床自身免疫性疾病恶化。
注意
由于现有的微生物群失衡、胃肠道刺激或反应性代谢物超负荷而导致身体发炎,很难完全确定是否存在真正的自身免疫性疾病(如原发性桥本氏甲状腺炎或狼疮),或者只是出现类似于自身免疫性疾病的症状。
抗体等测试也可能会混淆。但是注意在这些情况下,它们可能是正常的或临界高,而不是像真正的原发性自身免疫状态那样高。
不幸的是,目前临床医生较少对这种依赖于详细病史进行正确评估的区分保持警惕。当正常或临界高实验室检查伴有疲劳、关节痛、牛皮癣、胃部不适、体重增加、血管炎和肌肉酸痛时,医生的下意识反应是跳到自身免疫性疾病的临床诊断。没有对身体进行全面的整体观察,很难对过度活跃的免疫状态找寻到其根本原因。
因为临床表现相似,所以很少努力将症状追溯到根本原因——无论是主要由病原体驱动、过度活跃的免疫状态驱动,还是两者兼而有之。患者经常服用类固醇和自身免疫药物。短期益处很常见,因为过度活跃的免疫状态会因皮质类固醇的抗炎特性而平静下来。
然而长期服用类固醇可能是有问题的,因为它会降低我们的整体免疫反应,并掩盖在过度活跃的免疫状态是真正原因的情况下代谢产物过多的潜在问题。随着时间的推移,炎症回路会随着时间的推移而缓慢但逐渐恶化,因为它变得功能失调。一个典型的例子是桥本甲状腺炎。
自身免疫性甲状腺炎
✦炎症回路过度运转导致甲状腺出现问题
当身体的炎症回路超速运转时,甲状腺系统通常是最容易因过度活跃的免疫状态而导致功能障碍的器官之一。
甲状腺控制着整体的新陈代谢率,并负责我们的体温调节。甲状腺功能的轻微变化会导致疲劳、体重增加和甲状腺功能减退侧感觉寒冷以及焦虑和心悸。
在过度活跃的免疫状态下,靶向一种或多种甲状腺成分的抗甲状腺自身抗体(也称为抗甲状腺抗体)可能会被激活。最重要的一种是抗TPO抗体。它存在于大约90%的桥本甲状腺炎、10%至20%的结节性甲状腺肿或甲状腺癌以及75%的格雷夫斯病中。
注:TPO抗体是人体针对甲状腺的自身抗体,如果甲状腺相关抗体增高,容易导致甲状腺素分泌增高,引起甲亢或甲状腺炎等疾病。tpo抗体全称是甲状腺过氧化物酶抗体,它是甲状腺自身免疫抗体之一,正常人一般为阴性,如果该抗体升高一般提示可能存在桥本氏甲状腺炎。
甲状腺炎的诊断
临床医生通常根据在疲劳和低能量的临床环境中显示抗TPO抗体的实验室测试来诊断桥本氏甲状腺炎。
此外,应该注意的是,10%到15%的正常个体可以具有更高水平的抗TPO抗体滴度。他们没有像上面提到的那些原发性自身免疫性疾病。当我们的炎症回路处于超速状态时,高滴度可能继发于过度活跃的免疫系统。这些患者可能被错误地诊断为患有临床或亚临床原发性桥本甲状腺炎。通常开始甲状腺替代治疗。很少考虑其他原因,例如炎症回路过载。
根据实验室测试和症状,甲状腺减慢症状被视为自身免疫问题,而实际上,有些时候它代表了处于炎症回路问题的身体。在这种情况下,甲状腺替代疗法只是掩盖了症状。应采用整体方法,以充分理解根本原因并影响全面的长期恢复计划。
炎症回路是人体为克服压力而部署的神经内代谢应激反应的一部分。过度和失调的炎症反应会破坏人类的身体,导致一系列疾病和不良症状。
传统医学解决这个问题的方法是抑制症状。随着时间的推移,这可能会使情况恶化。自身免疫性疾病和过度活跃的免疫状态是常见的后果。由于当身体过度发炎时系统范围内的统一,因此需要从整体的角度了解身体以更好控制炎症。肠道菌群在其中扮演着重要作用,有更多值得被研究和发现的价值。
主要参考资料:
Michael Lam, MPH; Justin Lam, Carrie Lam,
Inflammation Circuit Dysfunction.Drlamcoaching.
Zhou B, Yuan Y, Zhang S, Guo C, Li X, Li G, Xiong W, Zeng Z. Intestinal Flora and Disease Mutually Shape the Regional Immune System in the Intestinal Tract. Front Immunol. 2020 Apr 3;11:575. doi: 10.3389/fimmu.2020.00575. PMID: 32318067; PMCID: PMC7147503.
Ruiz F, Vigne S, Pot C. Resolution of inflammation during multiple sclerosis. Semin Immunopathol. 2019 Nov;41(6):711-726. doi: 10.1007/s00281-019-00765-0. Epub 2019 Nov 15. PMID: 31732775; PMCID: PMC6881249.
Rathinam VAK, Chan FK. Inflammasome, Inflammation, and Tissue Homeostasis. Trends Mol Med. 2018 Mar;24(3):304-318. doi: 10.1016/j.molmed.2018.01.004. Epub 2018 Feb 9. PMID: 29433944; PMCID: PMC6456255.
Amoroso C, Perillo F, Strati F, Fantini MC, Caprioli F, Facciotti F. The Role of Gut Microbiota Biomodulators on Mucosal Immunity and Intestinal Inflammation. Cells. 2020 May 16;9(5):1234. doi: 10.3390/cells9051234. PMID: 32429359; PMCID: PMC7291275.
Hess JM, Stephensen CB, Kratz M, Bolling BW. Exploring the Links between Diet and Inflammation: Dairy Foods as Case Studies. Adv Nutr. 2021 Oct 11;12(Suppl 1):1S-13S. doi: 10.1093/advances/nmab108. PMID: 34632478; PMCID: PMC8502778.
Brennan CA, Garrett WS. Gut Microbiota, Inflammation, and Colorectal Cancer. Annu Rev Microbiol. 2016 Sep 8;70:395-411. doi: 10.1146/annurev-micro-102215-095513. PMID: 27607555; PMCID: PMC5541233.

谷禾健康

日常感觉疲劳,精力不好,稍微不注意就容易腹泻便秘,一不小心就感冒,更可怕的是,无论使尽各种方法依然减不下去的体重……
有以上状况的小伙伴注意,可能是慢性炎症在体内作怪。炎症是我们免疫系统的自然反应,也就是说身体和病原体斗争,试图自愈的过程。
根据时间和病理特征,炎症可以是急性和慢性的。
急性炎症来势汹汹,通常持续时间很短(几分钟到几天),包括淋巴细胞/嗜中性粒细胞和巨噬细胞迁移到炎症部位,刺激促炎细胞因子的释放【如:肿瘤坏死因子-α(TNF-α)、白细胞介素6 (IL-6)、高运动性蛋白B1(HMGB-1)】,以及细胞聚集,酶分解等。
NOD样受体(NLRs)(如NLRP3、NLRP1和NLRC4)的激活导致高度调节的蛋白复合物(称为炎症小体)的募集,其激活启动下游炎症细胞因子的产生,主要是白细胞介素1β(IL-1β)和白细胞介素18 (IL-18)对细胞应激的反应。
其他中介包括趋化因子、脂质介质、急性期蛋白如C-反应蛋白(CRP)、转录因子包括核因子κB(NF-κB)和主要免疫细胞类型。
然而,急性炎症如果不受控制,则可能发展为永久性疾病,导致组织损伤、血流动力学改变和器官衰竭。
慢性炎症就像温水煮青蛙,带来的损害缓慢,但是持久。事实上,慢性炎症与肥胖等非传染性疾病和相关的共病的发生有关。在这方面,肥胖导致脂肪细胞中的异常脂肪积累、免疫细胞浸润和促炎环境,从而破坏胰岛素信号级联诱导胰岛素抵抗。
炎症和氧化应激相互作用对于理解肥胖症的生理病理学至关重要,包括内质网功能受损、脂肪组织缺氧、线粒体改变和活性氧过度产生。
肠道微生物群与肥胖相关的低度炎症的发展有关,包括脂多糖易位和toll样受体4(TLR-4)结合,从而引发血液内毒素血症。
由此产生的未解决的免疫激活不仅影响局部组织,还影响全身生理学,即所谓的代谢性炎症。
本文讨论了不同营养因素对炎症的影响和最终调节,包括特定营养素(碳水化合物类型、蛋白质来源、结构脂肪酸、矿物质、微量元素)和生物活性化合物(多酚);饮食模式(即西方、地中海和北欧饮食);治疗性饮食(DASH饮食);常见烹饪原料(调味品和草药)等。
与人类炎症结果相关的营养因素

了解日常饮食中的营养物质对炎症的影响和调节,可以帮助我们在日常饮食中有意识地进行相应调整,从而更好地改善健康状况。
纵向和观察性研究表明,膳食维生素摄入量与炎症特征之间存在一些关联。
例如,维生素C和E或胡萝卜素的摄入与血清CRP浓度的概率成反比 > 美国成年人服用3 mg/L。
在横断面KORA研究中,剂量-反应分析显示,经常摄入超过78毫克维生素E/天的参与者的血清CRP水平比未接触任何额外维生素E来源的受试者低22%。
摄入含有维生素E和C以及B族复合维生素(B1、B2、B3、B5、B6、B9和B12)的膳食补充剂与女性血CRP水平降低相关。
饮食维生素K1(叶喹酮)摄入量变化的上三分位受试者(随访1年后)的IL-6和TNF-α血浆浓度比最低三分位组的受试者下降更大。
健康韩国成年人的膳食维生素B5摄入量与血清CRP浓度呈负相关。
消费 > 健康成人每天摄入310毫克的膳食胆碱(通常归入复合维生素B组),血液中CRP、IL-6和TNF-α浓度较低。
系统总结了探索维生素对炎症状态影响的临床试验结果(下表)。一些研究发现,补充维生素后有助于降低炎症。
表 临床试验:维生素和生物活性化合物抗炎作用
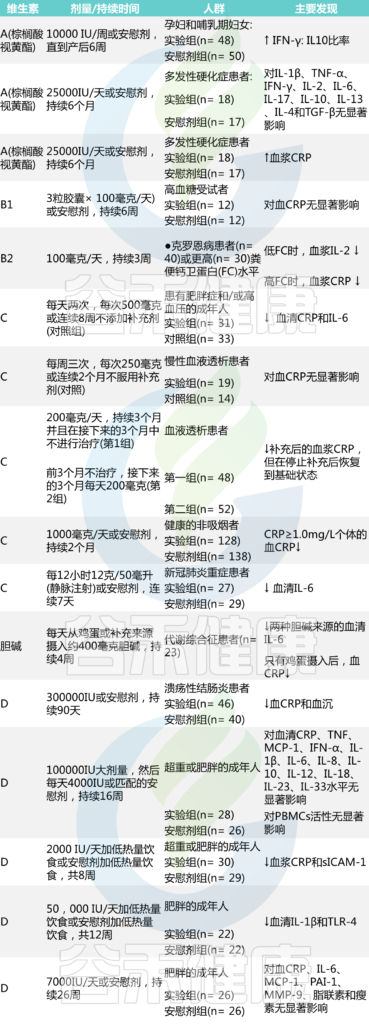

doi: 10.1007/s13679-022-00490-0
矿物质和微量元素对人体的结构、免疫和代谢功能至关重要。
高镁摄入与绝经后妇女体内潜在炎症标志物(CRP、sTNF-R2和IL-6)的血浆浓度降低有关。
在护士健康研究队列中,发现饮食来源的镁摄入量与血浆IL-6呈负相关。
一项嵌套病例对照研究报告,绝经后妇女的饮食锰与血清促炎细胞因子循环水平存在相反的关联。
据报道,淋巴细胞增殖和IL-2R表达的变化是健康男性轻度缺锌的早期标志。
膳食铜摄入量与成人血液CRP浓度直接相关。
反过来,肥胖相关炎症对肠道铁吸收的影响可能会加剧铁缺乏。
还显示了补充某些矿物质对人体抗炎作用的主要结果(下表)。
表 分析某些矿物质抗炎作用的临床试验



doi: 10.1007/s13679-022-00490-0
膳食碳水化合物对健康的影响取决于数量和质量特征。有趣的是,低碳水化合物饮食(总能量的20%)显著改善了糖尿病患者的亚临床炎症状态(血清IL-1Ra和IL-6水平较低)。
值得注意的是,坚持低碳水化合物饮食(占总能量的35%)可以降低肥胖女性的炎症标记物水平。
此外,低碳水化合物饮食的总体效果良好(≤ 30克/天)。此外,如其他地方报道的那样,与低脂饮食(总能量的24%)相比,极低碳水化合物饮食(占总能量的12%)可减少炎症反应。
血糖指数(GI)旨在根据对餐后血糖浓度的影响,从生理学上评估不同食物的碳水化合物质量。
有趣的是,高GI饮食(基于煮熟的意大利面,GI = 35)显著增加了瘦健康受试者单核细胞中NF-κB的激活率。
事实上,在糖尿病患者中,高GI饮食(GI > 70)诱导的负面代谢和炎症反应被低GI饮食(GI < 55)抵消。
此外,DIOGenes试验的结果表明,超重或肥胖受试者在减肥后,低GI碳水化合物(高GI碳水化合物的差异为15分)可以减少通过减肥饮食维持的低度炎症。
膳食纤维可能对健康有益,涉及一些免疫机制。因此,在糖尿病患者中,纤维摄入量等于或大于15 g/1000 kcal与血液CRP水平降低相关。
一项随机干预试验表明,从天然富含纤维的饮食或从补充剂中摄取纤维(30 g/天)可以显著降低瘦削正常血压参与者的循环CRP水平。
此外,中年成人膳食纤维摄入量(平均16.8克/天)和CRP血清浓度之间存在显著的负线性关系。
扩展阅读:肠道菌群与蛋白质代谢
膳食脂肪在生物体内引发许多基本功能;然而,过度消耗脂肪可能导致肥胖和相关的低度炎症过程。
事实上,临床证据表明,高脂饮食(即接近总能量的75%)会导致循环游离脂肪酸的过度生产和全身炎症。
一直以来,低脂饮食(占能量需求的25%)与糖尿病患者血浆IL-6水平降低相关。
越来越多的证据表明,膳食饱和脂肪酸(SFA)在肥胖和炎症之间起着重要的联系。
有趣的是,与摄入正常饱和脂肪的受试者相比,摄入超过10%能量作为饱和膳食脂肪的受试验者血清CRP水平升高(< 7%的热量摄入)。
同样,摄入膳食饱和脂肪酸(100毫升饱和脂肪含量为70%的乳脂)导致女性血浆CRP的脂质诱导升高,与肥胖状况无关。
单不饱和脂肪酸(MUFAs)被认为是一种健康的脂肪,油酸(OA)是日常营养中最常见的MUFA。
在这种情况下,一项针对日本人群的横断面流行病学研究报告,油酸摄入量(平均占总能量的6.94%)与血清CRP浓度之间存在显著的负相关。
对于不同剂量的MUFA治疗炎症特征的进一步对照试验是有保证的。
在过去的几年里,大量证据支持多不饱和脂肪酸(PUFAs)在预防心血管疾病和其他炎症性慢性疾病方面的有益作用。
在这种情况下,健康人n-3 PUFA二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的摄入量与血浆中可溶性TNF受体1和2的水平呈负相关。
此外,总膳食n-3 PUFA与女性CRP和IL-6的血水平呈负相关。
此外,一些临床试验评估了高PUFA饮食处方或通过补充PUFA对炎症结果的影响。例如,鱼油补充(38.2克/天EPA + 90天内的DHA)降低了高血压患者血液中促炎症标记物的水平。
健康的年轻人服用n-3 PUFA(2.5 g/天,2085 mg EPA和348 mg DHA)12周后,血清IL-6水平下降了14%。
在超重成人中,低(1.25 g/天)或高(2.5 g/天)剂量的n-3 PUFA补充4个月可以减少炎症反应(特别是血清IL-6和TNF-α浓度)。
反式脂肪酸(TFA)主要由植物油氢化或反刍动物衍生食品(包括乳制品和肉类)在工业上形成。
反式脂肪酸摄入量与女性血浆炎症生物标志物(包括CRP、VCAM-1、E-selectin)呈正相关。
在同一人群中,反式脂肪酸的摄入与可溶性TNF受体1和2的血浆水平呈正相关,主要是在体重指数较高的女性中。
男性服用TFA(占总脂肪的8%)后血清CRP浓度升高。
胆固醇过高可能会对健康产生有害影响,包括一些影响炎症状态的过程。
例如,在伊朗成年人中,血清CRP浓度的最高四分位数(5.9 mg/L)与饮食胆固醇的摄入量较高(189 mg/天)有关。
在大量具有代表性的中东人群中,发现饮食胆固醇和血浆CRP水平之间存在正相关。
膳食蛋白质的数量和质量是营养价值和身体/内分泌稳态的主要决定因素。
在Framingham心脏研究后代队列的参与者中,膳食蛋白质摄入量(尤其是植物来源的蛋白质)与血清炎症标记物(如IL-6和CRP)呈负相关。
此外,摄入高(总能量的30%)或低(总能量10%)蛋白质饮食会导致病态肥胖个体的血液CRP浓度降低。
关于蛋白质来源,以较高动物蛋白质摄入量(高脂肪和加工肉类水平)为特征的饮食与某些血液促炎标记物(如CRP、IL-6、TNF-a、IL-8、血清淀粉样蛋白a和糖蛋白乙酰化)呈正相关。
此外,RESMENA膳食研究的结果(30%的能量来自蛋白质)表明,动物和肉类蛋白质摄入量与炎症之间存在正相关,而蔬菜或鱼类来源的蛋白质对炎症状态没有显著影响。
扩展阅读:肠道菌群与蛋白质代谢
多酚是一大类生物活性分子,广泛存在于植物性食品中,具有强大的抗氧化和抗炎特性。在这种情况下,据报道,美国成年人的总黄酮摄入量与血清CRP浓度呈负相关。
在多种族队列中,黄烷酮消耗量与血液IL-6浓度呈负相关。同样,异黄酮摄入量较高(最高四分位数 = 1.61–78.8 mg/天)与健康绝经前妇女血浆CRP降低有关。
此外,在黄酮、黄烷酮和总黄酮摄入量较高的女性中,发现血清IL-8水平较低(五分位数最高 = 分别为264 ng/L、273 ng/L和276 ng/L)。
此外,台湾人群总黄酮摄入量和茶叶摄入量的增加与CRP水平呈负相关。
值得注意的是,许多随机临床试验已经测试了几种多酚的抗炎潜力,其结果总结如下:
表 分析某些多酚抗炎作用的临床试验

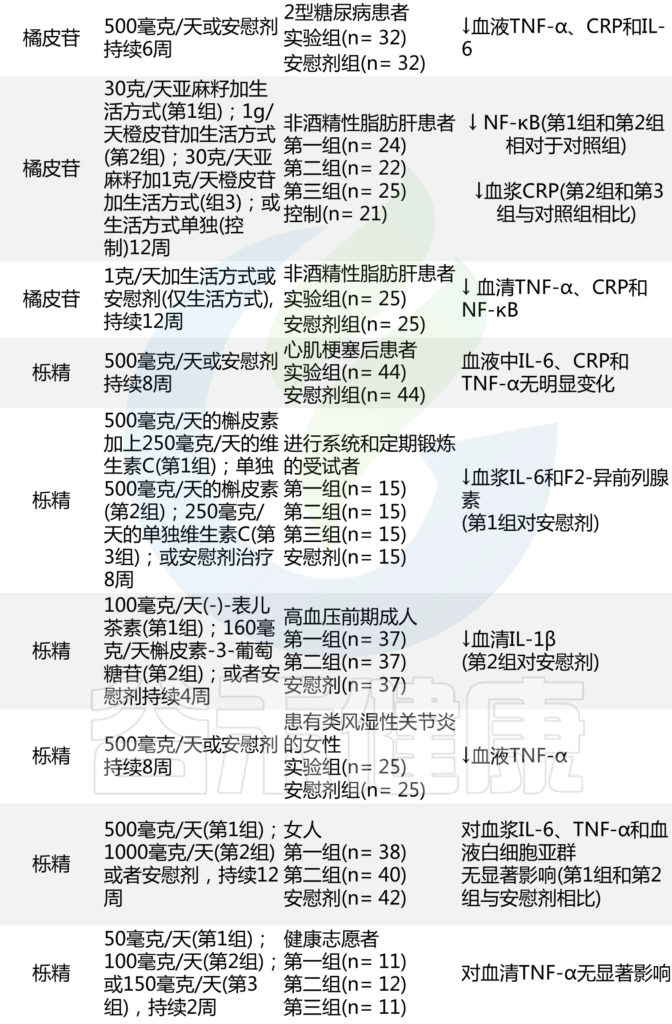

doi: 10.1007/s13679-022-00490-0
扩展阅读:
关于对炎症的影响,总摄入(中位数54 g/天)、未加工(中位数47 g/天)。
在多民族队列研究中,红肉和加工肉消费与血清CRP水平呈正相关。
在英国成年人中,食用加工肉与血清CRP水平增加有关(每天摄入50克以上,差异为38%)。
在调整后的模型中,在大量美国样本中,红肉消耗量与血液CRP显著相关。
在一项针对巴西人的横断面研究中,增加酸奶摄入量(中位数为10克/天)似乎会产生抗炎作用,而奶酪摄入量的增加(中位数10.7克/日)可能会加剧促炎状态。
在体重正常的青少年中,总乳制品和牛奶摄入量与血清IL-6浓度呈负相关。
ATTICA研究的结果显示,每周食用11-14份乳制品的人的CRP、IL-6和TNF-α血水平低于每周食用8份以下的人。
ATTICA研究结果显示,习惯性鱼类消费之间存在独立关联(> 每周食用300克鱼),并降低健康成年人的炎症标记物水平,包括CRP、IL-6、TNF-a、血清淀粉样蛋白a和白细胞计数降低。
在6年的随访中,食用鱼(约100克/周)可降低健康成人的内皮功能障碍和轻度炎症。
在表面上健康的日本人群中,高频率摄入鱼类与较低的外周血白细胞计数(慢性炎症标志物)相关。
事实上,随着每周摄入鱼的频率(0天、1-2天、3-4天或5-7天)的增加,全身炎症的标志显著降低(全身炎症的标志:中性粒细胞/淋巴细胞比率)。
近年来,食用昆虫被公认为具有抗炎和抗氧化特性的高价值食品。
例如,在健康成年人中,蟋蟀摄入量(25克/天)与通过微生物群调节减少全身炎症相关。
然而,需要对人类进行更多的研究来证实这些发现,以便推荐习惯性食用食用昆虫作为消炎疗法。
伊朗女性的水果和蔬菜摄入量与血清CRP水平呈负相关。
中国女性食用大量十字花科蔬菜(最高五分之一 > 140.6 g/天)显示循环中TNF-α、IL-1β和IL-6水平降低。
在一项随机交叉试验中,14天内食用十字花科蔬菜(14 g/kg体重)持续降低健康年轻人的循环IL-6.
在动脉粥样硬化的多种族研究中,经常食用坚果和种子(尤其是每周五次或五次以上)与较低水平的炎症标记物相关,包括IL-6和CRP。
在两个大的美国人队列中,与从未或几乎从未的频率类别的个体相比,每周坚果摄入五次或更多次的受试者的CRP和IL-6血浓度显著降低。
对随机对照试验的系统回顾和荟萃分析显示,摄入亚麻籽和相关营养衍生物系统地降低了肥胖受试者的循环CRP水平。使用同样的方法,急性高油酸花生摄入系统性地导致超重/肥胖男性餐后TNF-α浓度的下调。
研究表明,在健康饮食中添加杏仁(4周内每天56克)可以改善中国糖尿病患者的炎症和氧化应激。
一项随机试验还发现,在健康成年人中,食用杏仁(用杏仁替代对照饮食10–20%等量摄入4周)可以降低血清CRP水平。
事实上,在青少年和青年人中,杏仁喂养(每天56克,持续90天)后,血浆TNF-α和IL-6水平下降。
据报道,每天服用50毫升特级初榨橄榄油(EVOO),为期两周,可降低稳定型冠心病患者的血浆IL-6和CRP水平。
EVOO(50 mL)对正常血压的健康受试者具有急性餐后抗炎和抗氧化作用。
有趣的是,在糖尿病妇女中,谷类纤维的摄入与较低的CRP和TNF-R2血液水平呈负相关。
超重和肥胖受试者食用全麦小麦(8周内每天70克)后,血清TNF-α水平下降,血浆IL-10水平升高。
GRANDIOOS研究的结果表明,食用全麦小麦(每天98克,持续12周)可能会促进超重/肥胖和轻度高胆固醇血症患者的肝脏和炎症恢复力。
在中国中年女性中,食用大豆食品与炎症标志物(如IL-6、TNFα和可溶性TNF受体1和2)的循环水平呈负相关。
与习惯性饮食相比,一项为期6周的富含豆类的饮食营养试验(在所有干预阶段共摄入24包65克)显著降低了糖尿病患者的CRP浓度。
基于豆类的低热量饮食(每天160–235克,持续8周)持续降低超重/肥胖受试者的促炎状态并改善代谢特征。
在肥胖女性中,8周内补充绿茶提取物(450 mg/天)改善了氧化应激生物标记物,降低了IL-6循环水平。
3个月内饮用绿茶(379 mg/天)可降低肥胖、高血压患者的血清CRP和TNF-α浓度。
高咖啡消耗量(每天8杯)对习惯性咖啡饮用者的亚临床炎症产生了有益影响。
一直以来,在健康和糖尿病女性中,饮用咖啡与炎症标记物和内皮功能障碍呈负相关。
在年龄较大的非西班牙裔白人中,大量饮用咖啡(等于或超过2.5杯/天)的人全身炎症较低。
另一方面,来自ATTICA研究的分析报告称,中度至重度咖啡摄入后,炎症标记物(包括IL-6、TNF-α和CRP)增加(> 200毫升咖啡/天),强调剂量对结果的重要性。
补充蜂胶和限制热量饮食8周可以显著改善非酒精性脂肪性肝病患者的血糖稳态、肝纤维化评分和肝功能。
一项双盲安慰剂对照随机临床试验,44名非酒精性脂肪性肝病患者,用蜂胶和热量限制饮食(500千卡/天)干预,发现炎症因子降低,包括肿瘤坏死因子-α (TNF-α)、toll样受体-4 (TLR-4)和单核细胞趋化蛋白-1 (MCP-1)的血清水平以及肝酶和脂肪肝的严重程度显著降低。
现有证据表明,定期食用黑巧克力可能会减少炎症,尤其是对于每3天食用一份(20克)黑巧克力的消费者而言。
在一项随机平行临床试验中,与仅遵循一般生活方式指南的受试者相比,服用黑巧克力(8周内服用30克84%的黑巧克力)并保持健康生活方式的糖尿病患者的炎症标记物(CRP、TNF-α和IL-6)水平较低。
事实上,急性黑巧克力摄入(50克)通过增加IL-10的表达和减弱细胞内促炎性应激反应而引发抗炎症结果。
健康女性在摄入黑巧克力(一周内每天100克)后,CRP的血液水平较低,这在男性中没有发现。
在过去几十年里,几项调查已经确定了香料和草药在预防和治疗各种慢性病方面的有效作用。这些烹饪成分的多种健康特性归因于具有潜在抗炎特性的生物活性成分,如含硫分子、单宁、生物碱和酚类二萜。下表总结了探索香料对炎症状态影响的临床试验结果。
表 分析某些香料和烹饪成分抗炎作用的临床试验
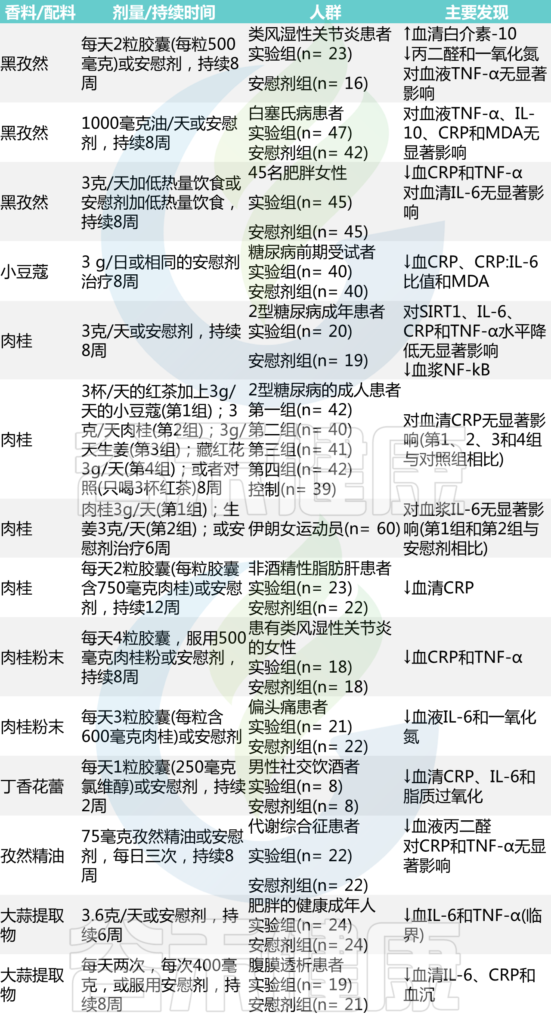

doi: 10.1007/s13679-022-00490-0
益生菌、益生元和合生元是有益的微生物、底物(多糖和寡糖)或最终也可能缓解炎症症状的组合。
对于糖尿病患者,建议补充益生菌和合生元,通过持续降低循环中CRP和TNF-α的水平来减少炎症表现。
关于肠道疾病,最近有报道称,使用益生菌(基于乳酸杆菌和双歧杆菌)和合生元可以促进抗炎反应并平衡肠道内稳态。
短链脂肪酸(称为后生元的非活性细菌产物)的抗炎作用是通过抑制肠上皮细胞中的NF-κB通路、Treg细胞分化和促炎细胞因子阻断来介导的。例如,干酪乳杆菌DG和衍生后生物抑制肠易激综合征患者结肠粘膜中IL-8、IL-1α、IL-6和TLR-4的表达水平。
关于益生菌,益生元在此就不详述了,在前面的文章已有介绍,详见:
总的来说,植物性饮食已经证明可以改善肥胖相关的炎症状态。
值得注意的是,在北美,素食对血液CRP和IL-6水平的有益影响是由BMI介导的。此外,一项系统回顾和荟萃分析显示,素食饮食模式也降低了免疫生物标志物,如纤维蛋白原和白细胞总浓度。
对观察性和干预性试验的系统审查表明,北欧饮食(以北欧国家的主食为基础)对低度炎症缓解有积极影响。潜在机制包括代谢综合征患者的促炎症基因下调,尤其是TNFRSF1A和RELA。
南欧大西洋饮食(SEAD)是葡萄牙北部和西班牙加利西亚的传统饮食,其特点是摄入更多的鱼、牛奶、土豆、水果、蔬菜和橄榄油以及红酒。总体而言,SEAD依从性与炎症标记物(主要是CRP)的血浆浓度降低和心脏代谢风险降低相关。
就亚洲地区而言,健康的日本饮食模式(富含蘑菇、海藻、大豆制品和土豆、蔬菜、鱼类/贝类和水果)似乎可以发挥抗炎作用,改善当地消费者的心理健康。
一些中药已经显示出抑制促炎途径和控制炎症相关疾病。
墨西哥传统饮食(TMexD)已证明可以降低墨西哥裔女性的全身炎症和胰岛素抵抗风险。TMexD的特定食物包括玉米、豆类、辣椒、南瓜、番茄、仙人掌和洋葱,它们富含纤维、维生素、矿物质和辣椒素,具有潜在的抗炎和抗氧化特性。
在一项综合横断面研究中,旧石器时代饮食(基于蔬菜和水果、瘦肉、鱼类、坚果和钙来源的多样性消费)与人类较低水平的全身炎症和氧化应激相关。
在6周内,DASH饮食模式(以水果和蔬菜、低脂乳制品和复合碳水化合物的大量摄入为特征)降低了代谢综合征青少年的CRP循环水平。在女性成年人中,DASH饮食与伊朗人血清CRP水平较低有关,但与IL-17A浓度无关。定量评估显示,随访4周后,DASH饮食使CRP降低了13%。
PREDIMED试验的结果表明,地中海饮食(富含蔬菜和水果、纤维和维生素C和E)具有抗炎作用,因为它下调了动脉粥样硬化形成过程中涉及的细胞和循环炎症生物标记物。
在这个队列中,地中海饮食降低了血清CRP和IL-6水平,以及内皮和单核细胞粘附分子和促炎性趋化因子。此外,在随访1年后,Med饮食(包括EVOO和蔬菜)降低了心血管高危患者的血浆TNFR60浓度。长期(3年),PREDIMED试验通过与对照低脂饮食相比降低IL-1β、IL-6、IL-8和TNF-α水平,证实了Med饮食的抗炎作用。
总的来说,西式饮食(WTD)含有大量不健康的脂肪、精制谷物、糖和盐,会引发慢性代谢性炎症。在这方面,在护士健康研究I队列中,西式饮食与炎症和内皮功能障碍标志物呈正相关。此外,伊朗女性的西式饮食评分与CRP和IL-6促炎标记物呈正相关。
有趣的是,巴西妇女食用含有大量游离糖、总脂肪、膳食饱和脂肪酸、反式脂肪酸和钠的超加工食品(UPF)与血清CRP水平之间存在正相关。同样,超加工食品中上三分之一的巴西青少年(≥ 总能量的30%)与第1三分位青少年相比,循环IL-8浓度增加(≤ 15.9%的总能量)。
此外,瑞典类风湿关节炎患者的不良饮食质量(考虑到习惯性随意饮食,如糖果、蛋糕、软饮料和油炸土豆)与炎症增加有关,如血浆CRP和红细胞沉降率。
生物节律和营养分析(称为“时间营养”)的最新进展表明,一天中进食的时间可能会影响代谢稳态和免疫功能。
在这种情况下,在饮食质量较差的成年人中,不吃早餐与血清CRP浓度升高之间存在显著关联。在一项随机对照交叉试验中,不吃早餐会导致人类外周血单核细胞和单核细胞中NLRP3炎性体的更高活化。
间歇性禁食(IF),即个体连续或隔天禁食,改善了肥胖男性的全身炎症。然而,在超重或肥胖的女性中发现了间歇性禁食后,脂肪组织中巨噬细胞浸润(CD40+)和骨骼肌(CD163 +)的生物标志物短暂升高。
现有证据表明,限时饮食(TRE)是一种基于一天活动期总热量摄入巩固的替代时间营养方法,可能会调节多种代谢疾病风险因素,包括炎症。事实上,已经假设TRE作为定期营养计划的一部分,可能有助于减少炎症,并对免疫系统的某些组成部分产生保护作用。
有趣的是,代谢综合征患者在隔日禁食(ADF)后,血液CRP水平显著下降,ADF包括“禁食日”,热量摄入有限,而“喂食日”则是随意进食。此外,隔日禁食降低了健康非肥胖受试者血浆中sICAM-1(年龄相关炎症标记物)的水平。
此外,据报道,晚吃是指推迟用餐时间(通常是一天的主食或晚餐),可能会增加患心脏代谢疾病的风险。事实上,晚吃与腹部肥胖、炎症生物标志物(如IL-6和CRP)以及儿童的昼夜节律紊乱有关。
对精确变量(年龄、性别、身体表型、习惯性饮食摄入、体力活动水平和生活方式)以及个性化问题(遗传背景、表观遗传特征、微生物群组成、基因表达谱和代谢指纹)的综合分析可能有助于制定更个性化的治疗方案,以改善炎症的营养和药物管理。
例如,有证据表明,遗传变异可能通过与环境因素(如饮食)的相互作用,调节个体对与炎症相关的慢性和急性疾病的易感性,从而易诱发炎症状态。
表观遗传标记(包括DNA甲基化、miRNA表达和组蛋白修饰)在炎症基因转录中起着基础作用。
值得注意的是,基于微生物群的回归模型已经能够预测人类肥胖相关炎症状态,这可能是精确管理炎症性的有用工具。
具有促炎和抗炎作用的基因表达最终决定炎症的结果。
代谢组学是一种综合方法,可用于剖析炎症的局部和全身代谢后果,为炎症疾病的调节提供新的见解。
这些应用有助于阐明独特和特异的炎症代谢类型,扩大了我们对人类代谢复杂性和多样性的理解。
总的来说,这些新颖的科学见解正带来精确药物/营养战略,以预防和控制具有炎症背景的流行性慢性病。
营养物质对生命和健康至关重要,不仅有助于疾病预防、健康维护和疾病管理,而且可以抵御内源性和外源性有害因素,包括炎症/氧化应激或免疫系统功能障碍。
促炎
促炎营养因素包括大量食用富含简单碳水化合物、膳食饱和脂肪酸、TFA、胆固醇和动物蛋白的食物,以及习惯性不吃早餐和晚吃暴食。
抗炎
潜在的抗炎化合物包括MUFA、PUFA、抗氧化维生素和矿物质、生物活性分子(多酚)、特定食品(乳制品、全谷物、鱼类、油籽、水果和蔬菜、食用昆虫、豆类、绿茶和咖啡),烹饪香料(肉桂、姜、小茴香、大蒜和姜黄)和一些饮食习惯,包括间歇性禁食和限时进食。
由于研究之间存在不一致和差异,考虑到异质性的关键方面,包括人群类型(祖先)、最低和最高水平以及不利影响、烹饪方法、生理病理状态和干预时间,仍需在该领域进行进一步研究。
目前的证据有助于理解营养与代谢性炎症之间的关系,为慢病的控制和管理提供了新的见解和潜在目标。
主要参考文献:
Ramos-Lopez O, Martinez-Urbistondo D, Vargas-Nuñez JA, Martinez JA. The Role of Nutrition on Meta-inflammation: Insights and Potential Targets in Communicable and Chronic Disease Management. Curr Obes Rep. 2022 Oct 18. doi: 10.1007/s13679-022-00490-0. Epub ahead of print. PMID: 36258149.
Li C, Xu MM, Wang K, Adler AJ, Vella AT, Zhou B. Macrophage polarization and meta-inflammation. Transl Res. 2018 Jan;191:29-44. doi: 10.1016/j.trsl.2017.10.004. Epub 2017 Nov 3. PMID: 29154757; PMCID: PMC5776711.
Nikbaf-Shandiz M, Tutunchi H, Khoshbaten M, Nazari Bonab H, Ebrahimi-Mameghani M. Propolis supplementation in obese patients with non-alcoholic fatty liver disease: effects on glucose homeostasis, lipid profile, liver function, anthropometric indices and meta-inflammation. Food Funct. 2022 Oct 20. doi: 10.1039/d2fo01280d. Epub ahead of print. PMID: 36263703.
Rossi JF, Lu ZY, Massart C, Levon K. Dynamic Immune/Inflammation Precision Medicine: The Good and the Bad Inflammation in Infection and Cancer. Front Immunol. 2021 Feb 23;12:595722. doi: 10.3389/fimmu.2021.595722. PMID: 33708198; PMCID: PMC7940508.

谷禾健康

嗜胆菌属
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科的一种厌氧、革兰氏阴性、耐胆汁、过氧化氢酶阳性杆菌。目前通过数据库发现在越来越多的人群,尤其男性,甚至低龄儿童中检出了高丰度的该菌。
该菌被认为是“喜欢动物脂肪喜欢胆汁”的微生物——在以动物为基础的饮食,尤其富含肉类和乳制品脂肪时,其肠道中Bilophila丰度会增加和积累。
目前为止,该属下研究最多和证据充分的菌种是沃氏嗜胆菌(Bilophila wadsworthii, B.wadsworthii),它是从穿孔和坏疽性阑尾炎患者的临床材料中回收的第三大最常见的厌氧菌。
Bilophila是机会致病菌,其丰度的增加的负面影响对肠道炎症的影响已经得到证实,B. wadsworthia与高脂肪饮食协同促进更高炎症反应、肠屏障功能障碍和胆汁酸代谢异常,导致更高的葡萄糖代谢异常和肝脂肪发生。
2021年《Cell》子刊最新研究发现生酮饮食会加剧间歇性缺氧引起的认知障碍,并认为这是由肠道菌群介导的。在生酮饮食和间歇性缺氧的双重条件下,Bilophila大量繁殖富集,进而对海马体功能造成损伤,增加认知障碍风险。
此外,证据显示Bilophila 在便秘,白赛病,重症感染,脑脓肿,帕金森,结直肠癌,卵巢癌患者中增加。
但是Bilophila属中的一些物种是有用的共生细菌,促进宿主新陈代谢并有利地塑造免疫反应。来自mSystems上发表的一项最新研究,发现Bilophila的基因组中存在遗传密码扩张现象,使三甲胺(TMA)甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生氧化三甲胺(TMAO)。该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险,但是这一结论需要更多的样本支持和验证。
Bilophila 作为正常菌群存在于人类粪便中,偶尔也存在于唾液和阴道中。来自人类的分离物通常是β-内酰胺酶阳性,因此该菌对某些β-内酰胺抗生素具有抗药性。部分的菌株也对克林霉素有抗药性。
本文基于文献调查和谷禾数据库讨论和介绍肠道重要菌属——嗜胆菌属 (Bilophila)。
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科除了脱硫弧菌属(Desulfovibrio) 的第二类重要菌属。一种革兰氏阴性厌氧菌,包括 B. wadsworthia,可引起腹腔内和其他感染。
Bilophila 属下代表物种是:Bilophila wadsworthia。该菌最初从坏疽和穿孔性阑尾炎患者的感染中分离出来。后来在包括来自阴囊脓肿、下颌骨髓炎和腋窝化脓性汗腺炎的胸水、关节液、血液和脓液的临床组织样本中也逐渐发现。
Bilophila wadsworthia 是一种革兰氏阴性、专性厌氧、过氧化氢酶阳性、耐胆汁和解酶杆菌。单独或成对出现;偶尔观察到长丝。没有观察到孢子形成。菌落宽度约为 0.7 μm,长 1.0-10.0 μm,细胞呈多形性,细胞壁不规则,约 75% 的菌株为脲酶阳性。DNA G + C 含量约为59.2。
已鉴定菌种:
Bilophila wadsworthia
Bilophila sp. 4_1_30
基于核糖体 RNA 的系统发育研究表明 Bilophila与 脱硫弧菌科另外一个成员 脱硫弧菌属(Desulfovibrio)物种关系最密切。
基于数据库和文献Bilophila和其他肠道菌属的关系如下图:

编辑
▸ 代谢牛磺酸,嗜好胆汁
该菌具有呼吸型新陈代谢,化学有机异养和非发酵。代谢蛋白底物,但不代谢碳水化合物。蛋白底物的主要产物是乙酸,含有少量至痕量的琥珀酸。能将硝酸盐还原为亚硝酸盐。
硫化物由含硫氨基酸和亚硫酸盐产生,有时由硫代硫酸盐产生,但Bilophila不会还原硫。过氧化氢酶强阳性。在甲酸盐存在的情况下,B. wadsworthia利用牛磺酸作为电子受体产生乙酸盐并将磺酸盐硫还原为硫化物。
Bilophila是机会致病菌,培养实验等得出硫,蛋白胨,L-牛磺酸,丙酮酸以及胆汁酸是B. wadsworthia扩张的基础。其代谢产物主要为硫化物,硫化氢,乙酸盐,琥珀酸等。
胆汁酸是胆固醇在肝脏分解以及肠肝循环中的一组代谢产物。在肝脏中,牛磺酸与甘氨酸一起用于结合胆汁酸以产生初级胆汁酸。胆汁酸经历肠肝循环,并被微生物群转化为次级胆汁酸。饱和动物源性脂肪先前已被证明可促进牛磺酸结合胆汁酸的产生。至少在高脂环境中,已经提出增加牛磺酸结合胆汁酸的产量是B. wadsworthia扩张的基础。
所有高脂肪喂养小鼠脂多糖(LPS)生物合成和牛磺酸代谢途径的活化显着提高,而涉及氨基酸、糖、淀粉和氮代谢的许多途径显着减少。
B. wadsworthia进一步加剧了高脂饮食情况下的胆汁酸失调,也表明该菌可能加强了高脂饮食诱导的代谢障碍和宿主功能障碍,特别是炎症和屏障功能障碍的一种机制。
▸ 喜欢动物脂肪和乳脂
小鼠和人类实验表明以动物脂肪和乳源性饱和脂肪为基础的饮食可以增加耐胆汁菌Bilophila wadsworthia.
研究人员称并没有刻意去衡量Bilophila的丰度,但当比较哪种细菌含量增加最快时,Bilophila排在首位。
不同的饮食可以快速且可重复地改变肠道微生物群的组成和功能。
《Nature》杂志的一项研究发现,当人们从素食转变为以肉类和奶酪为主的饮食结构上时,他们肠道里的细菌Bilophila几乎立即增加,但植物性为主的饮食结构可以降低该菌群的数量。一项人群研究实验,在清肠后 5 至 7 天收集素食者和杂食者的粪便样本。发现Bilophila和Lachnoclostridium与膳食动物蛋白呈正相关,与膳食植物蛋白来源呈负相关。
《Cell Metabolism》发表了一项研究,发现经常伴随红肉的饱和脂肪,还可能让人变肥胖,脂肪还会出现炎症。与之相反,以鱼肉为代表的白肉所包含的不饱和脂肪则健康很多。线性判别分析(LDA)表明,拟杆菌, Turicibacter和嗜胆菌(Bilophila)属细菌在猪油组小鼠肠道中显著增多,而在鱼油组小鼠中,主要是双歧杆菌和另一种菌 (Bifidobacterium,Adlercreutzia),乳酸菌(lactic acid)等增加。
当前西方化饮食(低纤维、高糖、高脂肪和高动物蛋白)饮食持续增加粪便中Bilophila丰度,所以在越来越多的人群水平中发现Bilophila的富集。研究表明Bilophila可以将亚硫酸盐还原为硫化氢(H2S气体),诱发炎症以及免疫和代谢障碍。这对那些尝试许多流行的“品牌”饮食(例如生酮、旧石器时代、食肉动物等)的个体具有临床意义。
▸ 产生硫化氢
硫代喹诺酮糖是葡萄糖的磺酸衍生物,在菠菜和生菜等所有绿色蔬菜中都能找到。专门的细菌配合利用磺基糖产生硫化氢(H2S)。
这种气体以臭鸡蛋味著称,也对人类健康有不同的影响:在低量的情况下,硫化氢可以对肠黏膜产生抗炎消炎作用。另一方面,肠道微生物产生的硫化氢增多,与慢性炎症性疾病和甚至癌症有关。
研究表明,与葡萄糖等喂养肠道内大量微生物不同,硫代喹诺酮糖刺激肠道微生物组中非常特定的关键微生物的生长。这些关键生物包括Eubacterium rectale物种的细菌,它是健康人常见的肠道微生物之一。E.rectale细菌通过发酵硫代喹诺酮糖,产生一种硫化合物,即二羟基丙烷磺酸盐,而这种硫化合物又是其他肠道细菌如Bilophila wadsworthia的能量来源。
Bilophila wadsworthia最终会通过一种新陈代谢途径从二羟基丙烷磺酸盐中产生硫化氢,这种途径也是最近才发现的。
以往认为主要是由于富含肉类或脂肪的饮食导致肠道中的硫酸盐和牛磺酸含量增加,已知它们是微生物的硫化氢来源。目前发现来自菠菜和藻类等绿色食物的硫代奎诺糖也有助于肠道内气体的产生,这让人感到意外。
病原菌,与肠道炎症有关
B. wadsworthia具有固有的促炎特性。然而,尚不清楚这种B. wadsworthia特征在多大程度上在宿主代谢障碍的发展中发挥作用。炎症是代谢综合征的一个重要特征;因此,尚不清楚与B. wadsworthia相关的代谢障碍是否仅继发于B. wadsworthia-驱动炎症。
为了解决这些问题,研究用广泛使用的免疫抑制剂环孢素抑制了喂食高脂饮食(HFD)的小鼠的炎症。
发现环孢素 (Ci) 有效地消除了高脂饮食喂养小鼠的炎症反应,无论它们是否含有低密度或高密度的B. wadsworthia,因此,可以清楚地推断出B. wadsworthia 的直接代谢作用。
高脂饮食 —— B. wadsworthia过度积累
为了更好地确定更高密度的B. wadsworthia是否会影响代谢功能,特意通过灌胃将B. wadsworthia给予小鼠。
结果强调高脂饮食不是B. wadsworthia在宿主肠道中茁壮成长所必需,但却是B. wadsworthia 的持续增长必不可少的。这个结果比较有意义,表明B. wadsworthia的过度积累离不开高脂饮食的喂养。
B. wadsworthia 诱发的全身炎症相关疾病
B. wadsworthia增加了高脂饮食诱导的代谢综合征,这是一种通常与低程度全身炎症相关的疾病。同时,B. wadsworthia已被证明会加剧遗传易感小鼠的肠道炎症并在野生型动物中诱发全身炎症。较高的炎症状态的特征是消瘦和体重减轻,而代谢综合征的特征是低度炎症和较高的体重指数。
因此,一个关键问题是:
B. wadworthia 如何影响两种相反的病理?
通过药理学抑制炎症,揭示了B. wadsworthia直接诱导对宿主代谢功能的负面影响的能力。
具体来说,不同的代谢障碍,即葡萄糖清除率降低和脂肪肝表型,受B. wadworthia的影响,它们并不完全依赖于其促炎特性。
尽管如此,B. wadworthia驱动的炎症仍然是一个重要因素,它进一步使平衡向更强的代谢功能障碍倾斜。因此,这可以解释为什么B. wadworthia能够在两种截然不同的环境中发挥病态作用。
B. wadsworthia通过恶化高脂饮食诱导的肠道炎症、抑制参与代谢稳态的途径、有利于增加 LPS 的产生和易位,以及减少微生物群的丁酸盐产生来作用于宿主和微生物群。这些与B. wadsworthia相关的改变中的大多数被鼠李糖乳杆菌CNCM I-3690 给药完全或部分逆转。
导致认知障碍
2021年cell最新研究,喂食生酮饮食并间歇性缺氧的小鼠的肠道微生物群中,嗜胆菌属(Bilophila)的细菌浓度急剧增加。他们还发现,沃氏嗜胆菌(Bilophila wadsworthia)沃氏嗜胆菌损害海马体,导致小鼠的认知能力下降。
减轻心血管疾病
目前导致心血管疾病(CVD)发生的心血管风险因素并没有减少,反而在增加。因此,想要防止这种疾病发生,仅靠控制传统风险因素是不够的。虽然许多二级预防患者的传统风险因素控制较好,但仍会出现新的心血管事件。
已证实肠道菌群导致胆汁酸功能性改变,决定了其与法尼酯X受体或G蛋白偶联胆汁酸受体(TGR5)等潜在受体的结合。
动物性饮食是三甲胺(TMA)的主要来源,肠道菌群代谢TMA产生的氧化三甲胺(TMAO)与心血管疾病风险的增加密切相关。
来自mSystems上发表的一项最新研究,发现嗜胆菌属(Bilophila)的基因组中存在遗传密码扩张现象,使TMA甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生TMAO。
该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险。这个结果让临床看到了机会,后续这一机制希望能尽快完成临床实验验证。
扩展阅读:
饮食-肠道微生物群对心血管疾病的相互作用
结直肠癌
结直肠癌是最常见的恶性肿瘤之一,与年龄和生活习惯密切相关,饮食风险因素包括红肉、加工肉类以及酒精,另一个风险因素是炎症性肠病,包括克罗恩病和溃疡性结肠炎。
根据已有报道发现结直肠癌患者中生成硫化物的细菌增加:
美国黑人的结肠直肠癌发病率显著高于非西裔白人,研究假设:硫酸盐还原菌在结肠粘膜中的丰度可能是导致美国黑人结肠直肠癌发病风险较高的环境因素。
无论是结肠直肠癌患者还是健康人,美国黑人的结肠硫酸盐还原菌丰度均高于非西裔白人;沃氏嗜胆菌(Bilophila wadsworthia)特异性dsrA在美国黑人结肠直肠癌患者中高于健康美国黑人;美国黑人日常摄入的脂肪及蛋白质显著高于非西裔白人,多种饮食组分与硫酸盐还原菌的丰度较高相关。
扩展阅读:
结直肠癌防治新策略——微生物群
白塞病(BD)
贝塞特氏病(Behctet,白塞病,BD)是一是一种顽固的多系统性炎症性疾病,可导致不可逆转的失明。
微生物因子被认为是造成这种疾病的原因,但其潜在机制仍不清楚。来自活动性BD患者的粪便样品富含Bilophila spp,一种硫酸盐还原细菌(SRB)和一些机会病原体。活跃的BD患者的荚膜多糖转运系统,氧化还原过程,III型和IV型分泌系统也有所增加。
网络分析表明,富含BD的硫酸盐还原细菌和机会性病原体彼此呈正相关。动物实验表明,粪便微生物群与BD患者粪便的移植增加了包括IL-17和IFN-γ在内的炎性细胞因子的产生。
帕金森病进展
对比分析了帕金森患者与对照的菌群组成及代谢功能差异,发现帕金森相关的特定菌群组成变化与疾病严重程度相关,特定的菌群代谢功能也与疾病表型相关,例如:Hoehn-Yahr分级与Paraprevotella菌属呈负相关,与嗜胆菌属(Bilophila)呈正相关;
帕金森相关菌群变化与甲硫氨酸等9种菌群代谢产物的变化相关,菌群产生泛酸的能力与帕金森患者的特定非运动症状相关。
扩展阅读:
肠道微生物与帕金森以及相关影响因素
重症病人
许多重症医学科室住院患者有严重感染。这部分是由于危重患者经常接受各种各样的药物治疗,这些药物影响肠道菌群多样性,部分是由于患者病情不稳定,可导致缺氧病变、炎症、上皮完整性破坏、运动障碍、腔内pH值变化或肠道免疫功能受损。在一项多中心研究中,ICU患者的菌群显示与炎症密切相关的微生物丰度增加,如拟杆菌属、梭菌属和嗜Bilophila菌属。
脑脓肿:病例报告
研究报道了一例20 年慢性中耳炎病史的患者并发胆脂瘤和脑脓肿的病例。使用对比材料的 CT 扫描显示右小脑半球有三个脓肿腔。
胆脂瘤标本的培养物和脑脓肿的脓液中分离出了大量的 Bilophila wadsworthia、Bacteroides fragilis 和 Prevotella oris。不存在需氧菌。患者接受了开颅手术,最大的脓肿与胶囊一起被切除。抗菌治疗包括青霉素加甲硝唑和后来的增效素。治疗的结果是患者完全治愈并完全康复。这是在慢性中耳炎和脑脓肿中分离出 B. wadsworthia 的一个典型案例。
衰老相关
Cell 子刊一项研究分析了251位18-80岁个体十二指肠菌群多样性,发现多样性受年龄、伴随疾病和用药情况多因素影响,与衰老过程呈负相关;
十二指肠核心菌群随衰老进程变化,变形菌门相对丰度增加,大肠杆菌和克雷伯菌增加,拟杆菌进行性降低;该研究显示克雷伯氏菌属增加仅与药物服用相关,梭菌属和嗜胆菌属增加则与伴随疾病相关。
症状性手骨关节炎
我国湘雅医院2021年纳入1388名平均年龄为61.3岁的受试者分析研究症状性手骨关节炎患者的肠道菌群变化,发现粪便菌群的β-多样性(而非α-多样性)与手骨关节炎显著相关;手骨关节粪便菌群中有更高的嗜胆菌属(Bilophila)与脱硫弧菌属、更低的罗斯氏菌属。
功能分析显示,手骨关节炎患者的粪便菌群中,与氨基酸、碳水化合物及脂质代谢相关的通路发生显著变化。
“
降 低
鼠李糖乳杆菌CNCM I-3690 (Lr) 的每日口服管饲导致粪便 B. wadsworthia 丰度显着降低。同样,鼠李糖乳杆菌CNCM I-3690 能够进一步减少盲肠和小肠中的 B. wadsworthia 扩张。表明除了通过阻止其在体内扩张来抑制与 B. wadsworthia 相关的代谢功能障碍外,它还通过其调节胰岛素水平的固有能力来改善代谢功能。
菊苣根纤维(低聚果糖和菊粉)是益生元营养素,可滋养有益的肠道微生物,尤其是双歧杆菌。众多人体临床研究表明,这些益生元增加了肠道内的有益双歧杆菌,同时可以减少Bilophila菌。
大枣与巴豆霜合用可减缓巴豆霜的快速利尿作用。研究发现大枣合用高剂量巴豆霜后Bilophila水平降低。巴豆霜为大戟科植物巴豆Croton tiglium L.(CT)的干燥成熟果实经去皮制霜后制得的炮制品,具有峻下冷积、逐水退肿、豁痰利咽、蚀疮的功效。因其有大毒,临床应用受到一定限制。
酵母 β-葡聚糖 (Y-BG) 是一种以其免疫调节作用而闻名的膳食补充剂,在健康小鼠中进行了为期 4 周的膳食补充剂,发现 2% 的 Y-BG 颗粒物诱导强大的肠道微生物群落变化,包括粪便Bilophila丰度的显着减少。
水果和蔬菜富含纤维、维生素 B、维生素 C、β-胡萝卜素、钾和生物活性化合物,如番茄红素和白藜芦醇。食用水果可以在维持肠道菌群平衡和改善肠道生态方面发挥作用。健康成年人食用十字花科蔬菜(西兰花、花椰菜)显示出拟杆菌门与厚壁菌门的比例呈正变化,硫酸盐还原菌(SRB) ,包括嗜胆菌和脱硫弧菌丰度下降。
扩展阅读:
常见水果对肠道菌群、肠道蠕动和便秘的影响
在患有轻度便秘的健康成年人中,食用菊粉可能会导致厌氧菌、嗜胆菌和双歧杆菌的相对丰度发生变化。特别是,食用菊粉后Bilophila丰度的下降与较软的粪便和便秘特异性生活质量指标的有利变化有关。
扩展阅读:
排便困难?便秘反复?不要忽视肠道菌群
“
增 强
主要参考文献
Natividad JM, Lamas B, Pham HP, Michel ML, Rainteau D, Bridonneau C, da Costa G, van Hylckama Vlieg J, Sovran B, Chamignon C, Planchais J, Richard ML, Langella P, Veiga P, Sokol H. Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice. Nat Commun. 2018 Jul 18;9(1):2802. doi: 10.1038/s41467-018-05249-7. PMID: 30022049; PMCID: PMC6052103.
Kivenson V, Giovannoni SJ. An Expanded Genetic Code Enables Trimethylamine Metabolism in Human Gut Bacteria. mSystems. 2020 Oct 27;5(5):e00413-20. doi: 10.1128/mSystems.00413-20. PMID: 33109749; PMCID: PMC7593587.
Yazici C, Wolf PG, Kim H, Cross TL, Vermillion K, Carroll T, Augustus GJ, Mutlu E, Tussing-Humphreys L, Braunschweig C, Xicola RM, Jung B, Llor X, Ellis NA, Gaskins HR. Race-dependent association of sulfidogenic bacteria with colorectal cancer. Gut. 2017 Nov;66(11):1983-1994. doi: 10.1136/gutjnl-2016-313321. Epub 2017 Feb 2. PMID: 28153960; PMCID: PMC5575988.
Sun Y, Ma Y, Lin P, Tang YW, Yang L, Shen Y, Zhang R, Liu L, Cheng J, Shao J, Qi T, Tang Y, Cai R, Guan L, Luo B, Sun M, Li B, Pei Z, Lu H. Fecal bacterial microbiome diversity in chronic HIV-infected patients in China. Emerg Microbes Infect. 2016 Apr 6;5(4):e31. doi: 10.1038/emi.2016.25. PMID: 27048741; PMCID: PMC4855070.
Baron EJ. Bilophila wadsworthia: a unique Gram-negative anaerobic rod. Anaerobe. 1997 Apr-Jun;3(2-3):83-6. doi: 10.1006/anae.1997.0075. PMID: 16887567.
Baldini F, Hertel J, Sandt E, Thinnes CC, Neuberger-Castillo L, Pavelka L, Betsou F, Krüger R, Thiele I; NCER-PD Consortium. Parkinson’s disease-associated alterations of the gut microbiome predict disease-relevant changes in metabolic functions. BMC Biol. 2020 Jun 9;18(1):62. doi: 10.1186/s12915-020-00775-7. PMID: 32517799; PMCID: PMC7285525.
Wei J, Zhang C, Zhang Y, Zhang W, Doherty M, Yang T, Zhai G, Obotiba AD, Lyu H, Zeng C, Lei G. Association Between Gut Microbiota and Symptomatic Hand Osteoarthritis: Data From the Xiangya Osteoarthritis Study. Arthritis Rheumatol. 2021 Sep;73(9):1656-1662. doi: 10.1002/art.41729. Epub 2021 Aug 6. PMID: 33760399; PMCID: PMC8457181.
Leite G, Pimentel M, Barlow GM, Chang C, Hosseini A, Wang J, Parodi G, Sedighi R, Rezaie A, Mathur R. Age and the aging process significantly alter the small bowel microbiome. Cell Rep. 2021 Sep 28;36(13):109765. doi: 10.1016/j.celrep.2021.109765. PMID: 34592155.
Marina M, Ivanova K, Ficheva M, Fichev G. Bilophila wadsworthiain brain abscess: case report. Anaerobe. 1997 Apr-Jun;3(2-3):107-9. doi: 10.1006/anae.1997.0084. PMID: 16887572.
Chen Y, Zhang S, Zeng B, Zhao J, Yang M, Zhang M, Li Y, Ni Q, Wu D, Li Y. Transplant of microbiota from long-living people to mice reduces aging-related indices and transfers beneficial bacteria. Aging (Albany NY). 2020 Mar 16;12(6):4778-4793. doi: 10.18632/aging.102872. Epub 2020 Mar 16. PMID: 32176868; PMCID: PMC7138539.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.
So SY, Wu Q, Leung KS, Kundi ZM, Savidge TC, El-Nezami H. Yeast β-glucan reduces obesity-associated Bilophila abundance and modulates bile acid metabolism in healthy and high-fat diet mouse models. Am J Physiol Gastrointest Liver Physiol. 2021 Dec 1;321(6):G639-G655. doi: 10.1152/ajpgi.00226.2021. Epub 2021 Oct 13. PMID: 34643089.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.