-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com



病原微生物和/或有害微生物成功入侵、繁殖并定居于宿主的体内或体内,从而导致健康障碍,称为感染。简单地说,它可以定义为由微生物引起的疾病。感染也被称为传染病或传染病或传染性疾病。
感染每年导致 1300多万 人死亡;2019 年死亡人数为 1370万人(新英格兰医学,2022年统计)。在这 1370 万人死亡中,有 770 万人与细菌感染有关。由于抗菌素耐药性的迅速出现和蔓延,与传染病相关的病例严重程度和死亡率也在增加。
感染和疾病是两个经常互换使用的术语,但它们的含义截然不同。了解两者之间的区别对于有效预防、诊断和治疗至关重要。
感染是指有害微生物(如细菌、病毒或真菌)侵入人体。这些病原体可以通过各种途径进入人体,如呼吸系统、消化系统或皮肤等。感染可以是局部的,也可以是全身性的,程度可轻可重。
疾病是指由于感染或其他原因而出现的症状或异常的表现。感染是原因,而疾病是结果。简而言之,感染是体内存在病原体,而疾病是感染导致的症状的表现。感染可能只是局部的轻微症状,而疾病则是影响身体正常功能的更严重的情况。在某些情况下,如果免疫系统无法控制微生物的传播,感染可能会发展成疾病。
在诊断时,区分感染和疾病非常重要。一个人可能感染了病原微生物,但没有表现出任何疾病症状。另一方面,一个人可能患病但没有活动性感染。在这种情况下,疾病可能是由感染以外的因素引起的,例如遗传易感性或环境诱因。
虽然预防策略主要侧重于避免感染,但防止感染发展为疾病也同样重要。及早发现和适当治疗感染有助于防止发展为严重疾病。比如,长期的呼吸道或肠道感染被认为是相关肿瘤发生的高风险因素之一。
因此,早期识别感染、诊断、治疗和预防是控制感染和疾病的重要组成部分。感染可以用抗生素或抗病毒药物等药物治疗,而疾病可能需要更专业的治疗方案。准确诊断潜在病因对于有效治疗至关重要。
疾病的定义,原因,诊断
// 定义
疾病是一种以身体或精神功能异常为特征的医疗状况。它通常由感染或受伤等外部因素引起,但也可能是由内部失衡或遗传倾向造成的。疾病的严重程度各不相同,会影响身体的不同器官或系统。
// 原因
疾病有多种原因,包括:
// 症状
疾病可表现出各种症状,包括疼痛、疲劳、发烧和身体功能异常,以及癌症。疾病的症状会因具体情况而有很大差异。
常见症状包括发烧、疲劳、疼痛、炎症和身体功能变化。某些疾病还可能导致与受影响器官或系统相关的特定症状,例如呼吸系统疾病的咳嗽或胃肠道疾病的消化问题。
疾病的形成方式多种多样。有些疾病,例如由遗传性疾病引起的疾病,是天生的。其他疾病可能是通过接触有害物质或环境因素而获得的。感染也会导致疾病的发展。当病原体侵入人体并造成伤害时,免疫反应可能会引发炎症、组织损伤和其他导致疾病的变化。
// 诊断和预防
诊断疾病通常需要结合病史、体格检查、实验室检查和影像学检查等。
预防疾病对于保持整体健康至关重要。这可以通过各种方式实现,例如保持良好卫生习惯、接种疫苗、保持健康的生活方式以及避免危险因素。早期发现和治疗感染也有助于防止其发展成更严重的疾病。
疾病的治疗包括药物治疗、手术治疗、其他疗法或这些方法的组合。
总之,疾病涉及身体或精神的异常功能,可能由感染、受伤、遗传因素或失衡引起。识别症状、诊断和了解疾病的原因对于有效预防和治疗疾病至关重要。
感染的定义,原因,诊断
// 原因
感染是一个术语,用于描述有害微生物在体内的入侵和繁殖。这些微生物被称为病原体,包括细菌、病毒、真菌和寄生虫。当这些病原体进入人体时,它们会引起感染。
感染的原因多种多样,包括细菌、病毒、真菌和寄生虫。这些微生物可以通过各种途径进入人体,例如吸入、摄入或通过皮肤破损。
// 症状
虽然感染的严重程度各不相同,但它们通常具有共同的症状。这些症状包括发烧、疲劳、咳嗽、打喷嚏、喉咙痛和炎症。在某些情况下,感染还可能导致更具体的症状,具体取决于所涉及的病原体类型。
感染可能是局部的,即传染源仅感染特定的器官或组织,或者可能是全身性的,即传染源通过血液或淋巴到达身体的不同部位,从而感染不同的器官和组织。
感染可能不会导致疾病等特定症状,因为大多数感染往往是亚临床的。相反,其他感染可能导致严重的症状和并发症。
虽然有些感染可能不被宿主的免疫系统察觉并自行消退,但其他感染可能会引起症状并发展为疾病。
// 预防与治疗
预防是控制感染的一个重要方面。这可以通过保持良好的卫生习惯来实现,例如经常洗手和避免与受感染者密切接触。疫苗接种也可以通过提供针对特定病原体的免疫力来帮助预防某些感染。
预防在降低感染和疾病风险方面发挥着重要作用。保持良好的卫生习惯、接种疫苗和避免与受感染者接触等措施有助于防止感染传播。此外,保持健康的生活方式和增强免疫系统可以降低感染发展为疾病的可能性。
一旦感染,治疗可能涉及使用抗生素、抗病毒药物、抗真菌药物或抗寄生虫药物,具体取决于引起感染的具体微生物。在某些情况下,支持性护理(如休息、补液和缓解症状的药物)可能足以恢复。
// 原因与传播
感染的原因可能因所涉及的微生物类型而异。例如,细菌可通过直接接触受污染的表面、咳嗽或打喷嚏时产生的飞沫,或通过食用受污染的食物或水引起感染。另一方面,病毒通常通过呼吸道飞沫、与受感染者的直接接触或通过受污染的表面传播。
总之,了解感染的原因和传播方式对于预防、诊断和治疗感染至关重要。通过保持良好的卫生习惯、采取适当的预防措施并及时就医,个人可以降低感染风险并最大程度地减少相关疾病的影响。
感染的诊断是基于通过不同的诊断过程对传染源的识别。
某些感染可能会表现出可用于症状诊断的症状,但通常需要进一步确认。感染直接取决于传染源以及宿主对该传染源的免疫反应。
现在我们认为手术是理所当然的,但不久前,即使是最小的手术,如果感染进入体内,也可能是致命的。消毒为我们提供了一种预防手术感染和确保手术安全的方法。
消毒法是使用化学物质(称为防腐剂)来消灭引起感染的细菌的方法。它是由英国外科医生约瑟夫·李斯特发明的。
约瑟夫·李斯特找到了一种预防手术期间和手术后伤口感染的方法。他是第一个将细菌理论的科学应用于外科手术的人。李斯特消毒系统是现代感染控制的基础。
感染和疾病的区别在于症状的严重程度以及对个人整体健康的影响。
感染的定义是细菌、病毒和真菌等微生物在体内的入侵和生长。
感染可能由多种因素引起,包括接触病原体、卫生条件差、免疫系统受损以及食物或水受污染。感染的症状因感染类型和部位而异,但通常包括发烧、疼痛、炎症和疲劳。
疾病是指影响身体或精神功能的特定状况。
疾病可能是由感染引起的,但也可能是由其他因素引起的,例如遗传异常、环境毒素、生活方式选择或自身免疫反应。疾病的症状范围从轻微到严重,并且可能持续很短时间或变成慢性病。
感染的诊断通常涉及检测体液或组织样本以确定病原体的存在。另一方面,疾病的诊断通常需要结合病史、体格检查、实验室检查和影像学检查。
在治疗方面,感染通常使用抗生素、抗病毒药物或抗真菌药物治疗。治疗的目的是消除入侵的微生物并缓解症状。另一方面,疾病可能需要更全面的方法,包括药物治疗、手术、改变生活方式和支持疗法。
大致的区别总结如下:

总之,虽然感染和疾病相关,但它们的定义、原因、症状和治疗方法不同。了解两者的区别可以帮助医护人员和个人采取适当的措施来预防和控制疾病。
感染常见类型
细菌感染是由有害细菌进入人体引起的。它们会影响身体的不同部位,例如呼吸系统、泌尿道或皮肤。常见症状包括发烧、疼痛、肿胀和发红。细菌感染通常用抗生素治疗。
病毒感染是由病毒引起的。它们可导致各种疾病,例如普通感冒、流感或 COVID-19。症状从轻微到严重不等,可能包括发烧、咳嗽、喉咙痛和疲劳。病毒感染通常会自行痊愈,但有些可能需要抗病毒药物。
真菌感染是由真菌引起的,例如酵母菌或霉菌。它们会影响皮肤、指甲或内脏器官。常见的真菌感染包括足癣、酵母菌感染和癣。症状可能包括瘙痒、发红和不适。真菌感染的治疗方法包括抗真菌药物和外用药膏。
寄生虫感染是由寄生在人体内或体表的寄生虫引起的。寄生虫感染的例子包括疟疾、虱子感染和贾第虫病。症状可能因寄生虫类型而异,但可能包括发烧、瘙痒、腹泻和疼痛。寄生虫感染的治疗可能涉及抗寄生虫药物。
性传播感染是通过性接触传播的感染。常见的性传播感染包括衣原体感染、淋病和疱疹。症状范围从轻微到严重,可能包括生殖器分泌物、疼痛和溃疡。性传播感染通常通过检测诊断,可以用抗生素或抗病毒药物治疗。
通过了解不同类型的感染、其症状、原因和治疗方法,个人可以采取预防措施来降低感染风险并在需要时寻求适当的医疗护理。
说到疾病和健康,有各种各样的疾病会影响人体。以下是一些常见的疾病类型:
– 传染性疾病
传染病是由细菌、病毒、真菌和寄生虫等微生物引起的。它们可以通过各种方式在人与人之间传播,包括直接接触、呼吸道飞沫和受污染的食物或水。传染病的例子包括普通感冒、流感、肺结核和艾滋病毒/艾滋病。症状和治疗方法因具体感染而异。
– 慢性疾病
慢性病是一种长期疾病,通常会随着时间的推移而发展,并且没有已知的治疗方法。这些疾病通常有多种原因,并可能受到遗传、生活方式选择和环境因素的影响。慢性病的例子包括心脏病、糖尿病、癌症和慢性阻塞性肺病 (COPD)。治疗通常侧重于控制症状和预防并发症。
其他常见疾病类型
– 自身免疫性疾病
当免疫系统错误地攻击健康细胞和组织时,就会发生此类疾病,从而导致炎症和组织损伤。例如类风湿性关节炎、狼疮和多发性硬化症。
– 心血管疾病
影响心脏和血管。包括冠状动脉疾病、心力衰竭和中风等。
– 呼吸系统疾病
这些疾病会影响肺部和呼吸。一些常见的呼吸系统疾病包括哮喘、慢性支气管炎和肺炎。
– 精神健康障碍
这些障碍会影响一个人的情绪、心理和社会健康。例如抑郁症、焦虑症和精神分裂症。
– 遗传性疾病
这些疾病是由遗传异常基因或突变引起的。这些疾病包括囊性纤维化、镰状细胞病和亨廷顿氏病等。
这些疾病的诊断、治疗和预防策略因具体情况而异。
预防感染
预防是感染和疾病管理的一个重要方面。虽然治疗和诊断很重要,但采取措施预防感染可以大大降低疾病的发病率。
预防感染的一个关键因素是了解病因和传播方式。感染可通过与感染者直接接触、受污染的表面或空气中的颗粒传播。通过了解传播途径,个人可以采取必要的预防措施,将感染风险降至最低。
定期洗手是预防感染最有效的措施之一。用肥皂和水洗手至少 20 秒或使用含酒精的洗手液有助于消除有害微生物。
此外,例如咳嗽或打喷嚏时捂住口鼻,有助于防止呼吸道感染的传播。
接种疫苗是预防感染的另一个重要方面。疫苗刺激免疫系统产生对抗特定病原体的抗体,从而提供免疫力。通过接种疫苗,个人可以保护自己并为社区免疫做出贡献,从而降低传染病的总体流行率。
教育和意识在预防感染方面也发挥着重要作用。了解常见感染的体征和症状可以及早发现并及时治疗,防止进一步的并发症。此外,提倡卫生习惯并提供有关适当预防措施的教育可以使个人能够做出明智的决定并保护自己和他人。
总之,预防是对抗感染和疾病的关键。通过采取积极措施,例如保持良好的卫生习惯、接种疫苗和提高认识,个人可以大大降低感染风险,并为整个社区的健康做出贡献。
预防疾病
预防在减轻疾病负担方面起着至关重要的作用。了解各种感染和疾病的原因、症状和诊断有助于制定有效的预防策略。
预防疾病不仅仅是避免感染。它涉及采取健康的生活方式并做出明智的选择以降低患病风险。这包括保持均衡饮食,定期进行体育锻炼,避免吸烟和过量饮酒等行为,这些行为会增加患某些疾病的风险。
定期筛查和检查对于疾病的早期发现和治疗也很重要。通过早期发现疾病,医护人员可以及时治疗,改善治疗效果并减轻疾病的总体负担。
感染和疾病预防还涉及教育公众预防的重要性,并提供必要的资源和服务。
总之,预防在减少疾病的发生和影响方面起着至关重要的作用。通过了解感染和疾病的原因、症状和诊断,实施预防措施并促进健康行为。
感染治疗
在治疗感染时,了解这些疾病的病因、预防和诊断非常重要。
治疗感染的关键因素之一是防止其传播。
感染的诊断对于有效治疗至关重要。医生可以使用多种方法,包括体检、实验室检查和成像技术来确定感染的原因并确定最合适的治疗方案。
感染的治疗方法取决于感染的类型和严重程度。细菌感染通常用抗生素治疗,而病毒感染则使用抗病毒药物。真菌感染使用抗真菌药物,寄生虫感染则使用抗寄生虫药物。
症状管理
除了针对感染的根本原因外,症状管理也是治疗的一个重要方面。这可能涉及使用非处方药来缓解疼痛、发烧和充血等症状。
治疗持续时间
感染的治疗时间各不相同。有些感染可能需要短期用药,而有些感染可能需要更长时间的治疗。即使症状有所改善,也必须完成处方药物的全部疗程,以确保感染完全根除。
总之,感染的治疗涉及多方面的方法,包括解决根本原因、症状管理和防止感染扩散。通过了解感染的原因、预防和诊断,医疗保健专业人员可以为患者提供最有效的治疗。
疾病治疗
疾病的治疗取决于具体症状和致病因素。
在感染病例中,治疗通常侧重于消除引起感染的生物体。这可能涉及使用抗生素、抗病毒药物或抗真菌药物,具体取决于感染的具体类型。在某些情况下,可以预防性地使用抗病毒或抗真菌药物,以防止感染传播给他人。
另一方面,疾病的治疗不仅仅是治疗感染本身。当疾病被诊断出来后,治疗的目的是缓解症状、控制并发症,并改善整体健康和福祉。
疾病的治疗可能涉及药物治疗、生活方式改变和支持疗法的结合。对于糖尿病或高血压等慢性疾病,主要重点通常是通过药物治疗和生活方式改变(包括定期锻炼和健康饮食)来控制病情。
在某些情况下,可能需要手术干预来治疗疾病。这可能涉及切除受感染或患病的组织、修复受损器官,或在受伤或退化的情况下恢复功能。
预防也是疾病治疗的一个重要方面。通过解决风险因素并实施预防措施,例如接种疫苗、定期健康检查和改变生活方式,可以减少疾病的发生和严重程度。
诊断在确定疾病的最适当治疗方法方面起着至关重要的作用。准确及时的诊断使医疗保健提供者能够根据每位患者的个人需求量身定制治疗计划。
总之,治疗疾病需要综合考虑具体症状、潜在病因和个体因素。通过了解感染和疾病之间的区别,医护人员可以就治疗方案做出明智的决定,并改善患者的治疗效果。
▼
与心血管系统相关的感染,包括血液,即心脏、血管和血液的感染,也称为血流感染或血液循环系统感染。与心血管系统相关的一些常见感染包括:

▼
消化系统是参与食物消化的身体系统。它包括胃肠道 (GI 道) 和相关消化器官。胃肠道两端开放,是外来、可能受污染的物质(包括食物和饮料)的停靠点。这使得消化系统极易受到感染。
幽门螺杆菌感染
消化系统感染包括胃肠道任何部位(从口腔到肛门)和任何消化器官(如肝脏、胰腺和胆囊)的感染。消化系统感染主要包括细菌、病毒、原生动物和寄生虫,真菌病原体感染较少。


▼
呼吸道感染 (RTI) 是指呼吸系统任何器官的感染。它是人类最常见的感染类型。根据感染呼吸道的部位,RTI 可分为上呼吸道感染 (URTI)(即鼻、鼻窦、咽和喉感染)和下呼吸道感染 (LRTI)(即气管、支气管、细支气管和肺感染)。

▼
神经系统感染是指大脑、脊髓和/或人体神经的任何形式的感染。此类神经系统感染可能危及生命。它们是由不同的微生物引起的,主要是病毒和细菌。
▼
泌尿系统包括尿道、膀胱、输尿管和肾脏。这些器官中的任何一个感染都称为尿路感染 (UTI)。UTI 主要由细菌引起,但也有真菌和病毒感染的报道,但这种情况很少见。由于女性尿道较短,因此女性比男性更容易患上 UTI。

▼
生殖系统包括所有参与生殖过程的器官。它在人类中与泌尿系统非常接近。许多引起尿路感染的微生物是造成生殖系统感染的原因。生殖系统感染分为三种类型:

▼
淋巴系统是淋巴管、淋巴结和淋巴器官的网络,淋巴液在其中流动。它是免疫系统的一部分,也是循环系统的一部分。淋巴感染并不常见,但有报道称存在多种细菌和寄生虫感染。

▼
外皮系统包括身体的所有外部覆盖物。它包括皮肤、头发和指甲。外皮系统是我们身体的第一层防御。它是数百万微生物作为正常菌群的家园。病原体在侵入身体之前首先与外皮接触。

▼
肌肉系统包括我们身体的所有肌肉。肌肉感染通常是血源性或传染性传播,但通常很严重,需要立即治疗。

骨骼:
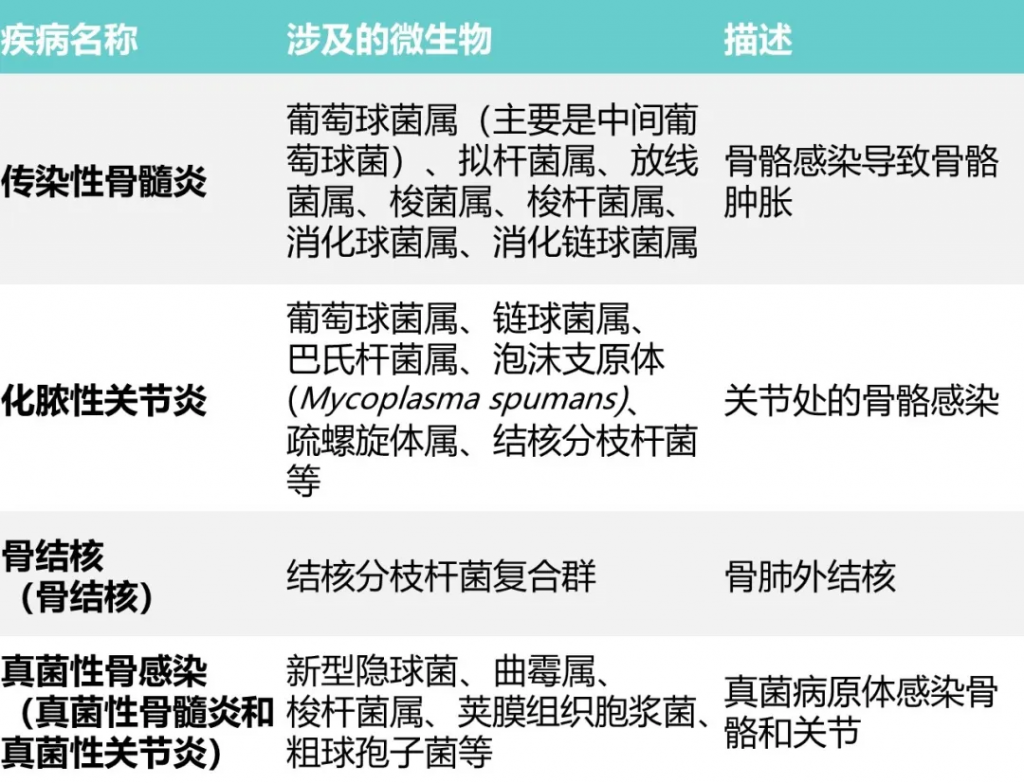
▼
内分泌系统由内分泌腺组成,内分泌腺感染主要是通过血源性播散感染或进行性全身感染而引起。
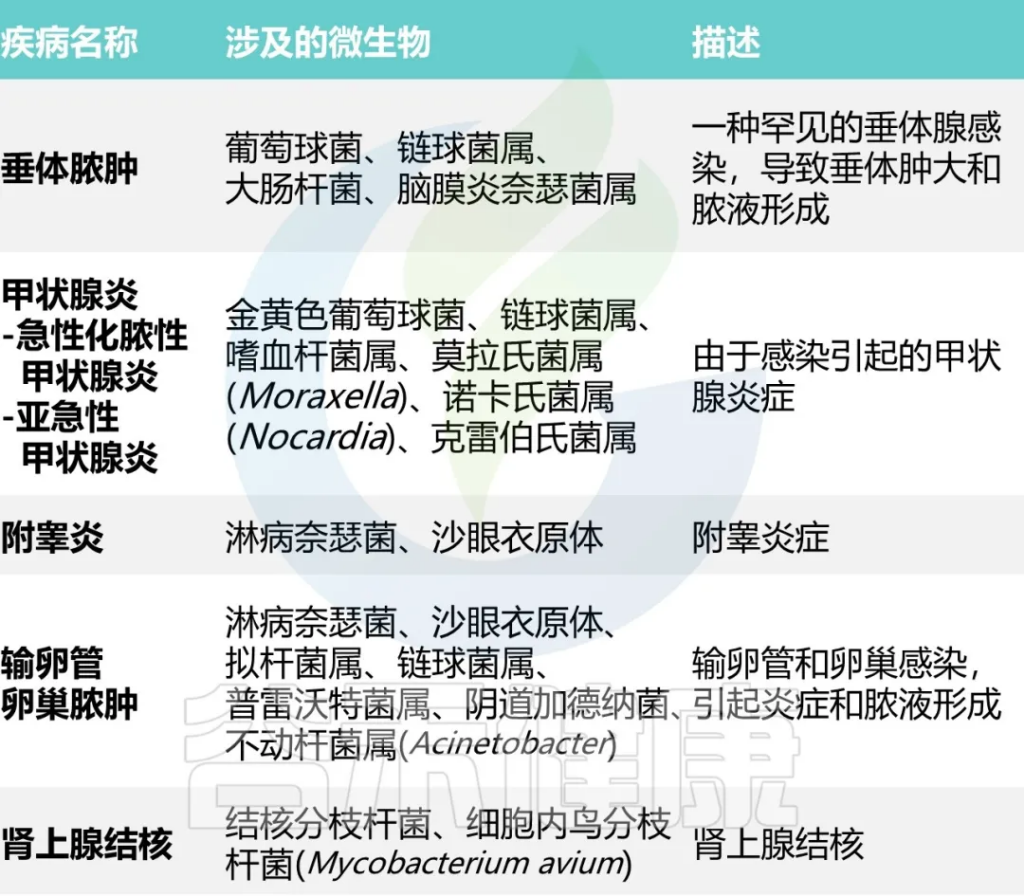
在当今世界,传染病始终是一个威胁,了解感染的各个阶段对于有效诊断和治疗至关重要。从感染到康复的过程可以粗分为四个不同的阶段,每个阶段都有各自的症状和结果。
了解感染的四个阶段对于确定适当的行动方案至关重要,从预防和早期发现到治疗和康复。识别前驱期及其独特症状有助于早期干预,降低传播率并预防并发症。下面详细了解一下每个时期不同的特征及相关干预。
▼
潜伏期
感染的第一阶段称为潜伏期,在此期间,患者接触到病原体,但可能不会出现任何症状。潜伏期的长短取决于具体感染源,可能为几小时至数周不等。
最初接触病原体的方式多种多样,例如接触受污染的表面、空气中的颗粒物,或直接接触受感染者。在此期间,患者可能并未意识到自己已经接触到病原体。
潜伏期内可能出现前驱期
此阶段的特点是出现轻微症状,这些症状通常不具特异性,容易被忽视或归因于其他因素。前驱期的症状可能包括疲劳、头痛、轻微发烧和全身不适。
值得注意的是,并非所有感染都会经历前驱期。有些感染可能直接从潜伏期进入急性期,这取决于具体病原体和个人的免疫反应。
▼
潜伏期过后,感染进入第二阶段,即入侵和复制。在此阶段,病毒或细菌已成功侵入宿主体内,并开始快速繁殖。这导致体内病原体的浓度较高,从而导致症状的出现。
前驱期是侵袭和复制阶段的一部分,其特点是出现初始症状。这些症状可能是一般性的和非特异性的,例如疲劳、发烧、头痛和肌肉疼痛。前驱期是感染正在发展的警告信号,可让免疫系统为即将到来的战斗做好准备。
随着感染的进展,它会进入急性期,症状会变得更加严重,并且针对特定病原体。人体的免疫系统在各种防御机制的帮助下,试图对抗入侵的病原体。然而,在这个阶段,战斗仍在继续,结果尚不确定。
在慢性期,一些感染可以在体内持续很长一段时间。此阶段的特点是症状较轻,甚至完全没有症状。然而,病原体继续复制并慢慢损害身体组织。如果不及时治疗,慢性感染会导致长期并发症和后遗症。
在某些情况下,随着人体免疫系统成功消灭病原体,感染会自然消退。这会导致康复,症状逐渐消退,患者恢复正常健康状态。然而,在其他情况下,可能会出现并发症,如继发感染或器官损伤,这会延长康复过程,并可能需要额外的医疗干预。
值得注意的是,感染过程的各个阶段可能因具体病原体、个人免疫反应和医疗条件而异。
▼
经过潜伏期和症状出现后,感染者进入前驱期,预示着疾病急性期的开始。
在前驱期,症状逐渐恶化,变得更加明显。感染者可能会出现疲劳、不适和发烧等一般症状,以及特定感染特有的特定症状。
此阶段至关重要,因为它通常表明免疫系统正在积极对抗感染。然而,需要注意的是,并非所有感染都有明确的前驱期。有些人可能会直接从潜伏期进入急性期,而不会出现任何前驱症状。
可能出现并发症
如果不及时治疗或免疫系统无法有效控制感染,前驱期可能会导致进一步的并发症。这些并发症的严重程度可能因感染类型和个人的整体健康状况而异。
前驱期可能出现的一些并发症包括继发感染、器官损伤或感染扩散至身体其他部位。这些并发症会延长病程,增加重症甚至死亡的风险。
前驱期的恢复
对于大多数感染来说,前驱期标志着急性期的开始,在此期间症状达到顶峰。急性期过后,身体逐渐恢复并进入缓解期,症状开始消退,患者开始感觉好些。
从前驱期和随后的急性期恢复可能需要一些时间,因此遵循处方治疗并根据需要休息很重要。在某些情况下,即使感染痊愈后,也可能出现复发或出现长期后遗症,如慢性疲劳或器官损伤。
总体而言,了解前驱期的进展和症状对于有效管理和治疗感染至关重要。认识到这一阶段的开始可以帮助个人寻求适当的医疗护理并采取措施预防进一步的并发症。
▼
潜伏期结束后,感染者进入感染的急性期。在这个阶段,症状会完全显现,感染也会达到高峰。
前驱期是急性期的初始阶段,其特点是出现发烧、疲劳、头痛和肌肉疼痛等症状。在此阶段,感染者还可能感到全身不适。
严重感染的急性期通常持续数天至数周。此阶段的严重程度和持续时间可能因具体病原体和个人的免疫反应而异。
并发症和后遗症
在某些情况下,感染的急性期会导致并发症。这些并发症可能是由于病原体对身体的直接影响或身体对感染的免疫反应而引起的。常见的并发症包括肺炎、器官衰竭和继发感染。
一旦成功控制了急性期,感染者就会进入恢复期。在此阶段,身体会逐渐消除感染,症状开始改善。根据感染的严重程度,恢复可能需要几天到几周的时间。
在某些情况下,感染可能会发展为慢性阶段。当身体无法完全消除病原体时,就会发生这种情况,并且感染会持续很长时间。慢性感染可能导致长期健康问题,可能需要持续治疗。
值得注意的是,并非所有感染都会经历所有阶段,并且进展和症状可能因具体病原体和个体因素而异。
常见症状
在感染的这个阶段,可能会出现常见症状,这些症状可能因具体病原体和个人的免疫反应而异。值得注意的是,并不是所有人都会出现相同的症状,有些人的表现可能比其他人更严重。
在急性期,患者可能会出现发烧、疲劳、身体疼痛和头痛等症状。这些症状通常表明身体对感染产生了免疫反应,可能会持续数天。
急性期过后,患者可能会进入慢性感染期。在此阶段,症状可能会持续很长时间,有时持续数月甚至数年。常见的慢性症状包括持续疲劳、关节疼痛、肌肉无力和认知困难。
有些感染还可能产生后遗症,即感染导致的长期后果或并发症。这些后遗症的严重程度可轻可重,可能影响身体的各个器官或系统。后遗症的例子包括器官损伤、神经系统疾病和免疫功能受损。
复发是另一种可能的结果,尤其是某些病原体引起的感染。经过一段时间的明显缓解后,症状可能会再次出现,表明感染复发。这可能是由于各种因素造成的,例如病原体根除不彻底或休眠感染重新激活。
▼
在感染的呼吸道症状阶段,病毒已到达呼吸系统并开始影响肺部和呼吸道。此阶段通常是在前驱期结束后,发烧和疲劳等一般症状开始消退。
呼吸道症状的严重程度因个人和引起感染的特定病毒而异。常见症状包括咳嗽、呼吸急促、胸痛或不适以及喘息。这些症状通常表明呼吸系统发炎和充血。
在某些情况下,呼吸道症状可能导致肺炎、支气管炎或呼吸衰竭等并发症。这些并发症可能需要额外的医疗干预,并可能延长整体康复过程。如果呼吸道症状恶化或没有随着时间的推移而改善,请务必就医。
一旦呼吸道症状开始改善,患者即被认为处于康复阶段。在此阶段,身体继续抵抗感染,免疫系统努力清除呼吸系统中的病毒。康复阶段的持续时间可能因个人和感染严重程度而异。
在极少数情况下,有些人可能会出现与呼吸道症状相关的后遗症或长期影响。这些可能包括慢性肺损伤、肺功能下降或感染痊愈后仍持续存在的呼吸道疾病。同样,有些人可能会出现呼吸道症状复发,即症状在改善一段时间后再次出现。
为了帮助康复和预防并发症,休息、保持水分充足并遵照处方治疗或药物非常重要。健康的生活方式(包括均衡饮食和定期锻炼)也可以支持免疫系统并促进整体呼吸系统健康。
▼
在感染的第七阶段,即胃肠道阶段,患者可能会出现一系列与消化系统相关的症状。这些症状的严重程度和持续时间可能有所不同,
可能包括:
这些胃肠道症状可能是感染扩散至肠道或人体对感染的免疫反应所致。在某些情况下,这些症状可能会随着时间和休息而自行缓解。但是,可能会出现脱水等并发症,需要医疗干预。
对于处于此阶段的人来说,控制症状并在必要时寻求适当的医疗护理非常重要。根据症状的严重程度,医疗保健专业人员可能会建议休息、补充水分和改变饮食。在某些情况下,可能会开药来缓解症状或治疗并发症。
还要注意的是,虽然有些人可能在此阶段后症状完全消失,但其他人可能会继续经历其他阶段,例如复发或出现后遗症。
▼
神经系统症状可发生在感染的急性期,也可发生在恢复期、复发期和并发症期。这些症状可能是病毒直接入侵的结果,也可能是病毒对神经系统的继发影响。
在感染的急性期,部分患者可能会出现头痛、头晕和精神错乱等神经症状。这些症状通常较轻且短暂,可在数天或数周内缓解。
但在某些情况下,神经系统症状可能会在恢复阶段持续存在。这些症状可能包括持续性头痛、注意力不集中和记忆力问题。
在复发阶段,神经系统症状可能会再次出现或恶化。这可能是病毒重新激活或对神经系统造成进一步损害的结果。
此阶段还可能出现并发症,导致更严重的神经系统症状。这些并发症可能包括脑炎、脑膜炎和中风。
经过适当的医疗护理和治疗,大多数人可以从这些神经症状中恢复过来。然而,有些人可能会出现长期的神经后遗症,如认知障碍或运动功能障碍。
值得注意的是,感染潜伏期也可能出现神经症状。这是接触病毒和出现症状之间的阶段。此阶段的神经症状很少见,但可能包括嗅觉或味觉丧失。
在慢性感染病例中,神经系统症状可能会持续很长一段时间。这些症状可能是间歇性的,严重程度也各不相同。
如果您在感染的任何阶段出现任何神经系统症状,请务必重视。
▼
在感染的急性期,个人通常会出现皮肤症状。皮肤症状是指影响皮肤的任何症状。这些症状的范围从轻微到严重,并可能以各种方式表现出来,具体取决于感染的类型。
在潜伏期,个人可能不会出现任何皮肤症状。然而,随着感染进展到慢性阶段,皮肤症状可能开始出现。这些症状可能包括皮疹、水泡、病变或皮肤变色。这些症状的严重程度因人而异,有些人只会出现轻微症状,而另一些人可能会出现影响日常活动的严重症状。
在某些情况下,皮肤症状可能导致并发症。当感染扩散到身体其他部位或免疫系统对感染反应强烈时,就会出现并发症。这些并发症可能导致更严重的皮肤症状,甚至可能导致其他健康问题。
感染急性期过后,患者可能会出现感染的后遗症或长期影响。这些后遗症可能包括持续的皮肤症状,如疤痕或色素沉着变化。这些长期影响因人而异,取决于感染的严重程度和个人的免疫反应等因素。
在某些情况下,即使感染痊愈,患者也可能会出现皮肤症状复发。如果感染未从体内完全清除,或者免疫系统受损,则可能会出现这种情况。如果患者出现皮肤症状复发,请务必就医,因为这可能表明感染复发或其他潜在健康问题。
总之,皮肤症状可发生在感染的各个阶段,从急性期到慢性期,甚至感染消退后。这些症状可从轻微到严重,并可能对皮肤产生长期影响。个人必须注意这些症状,并在必要时寻求医疗帮助,以确保正确的诊断和治疗。
▼
血液学症状通常出现在感染的恢复期。此阶段发生在急性期之后,急性期的特点是出现症状并出现并发症。
在此阶段,人体的血液系统开始稳定并恢复正常。前驱症状(即感染前出现的一般症状)开始消退。人体开始产生更多的白细胞,负责抵抗感染。
在某些情况下,血液学症状可能会复发。如果感染在急性期没有完全解决,就会出现这种情况。复发可能是由于病毒重新激活或出现新的细菌菌株引起的。
常见的血液学症状:
潜伏期(即从接触感染到症状首次出现之间的时间)也会出现血液学症状。然而,此阶段的症状通常较轻微,可能不明显。
如果血液学症状在恢复期持续存在或恶化,则可能表明出现并发症或发展为慢性感染。在这种情况下,可能需要额外的医疗干预。
在感染的不同阶段密切监测血液学症状对于确保正确的诊断和治疗非常重要。可以定期进行血液检查以跟踪血液系统的变化并指导治疗计划。
▼
在感染的肌肉骨骼症状阶段,患者可能会出现肌肉、关节和骨骼的急性疼痛、僵硬和肿胀。这些症状通常发生在前驱期之后,可能是身体对感染的免疫反应的结果。
肌肉骨骼症状的强度和持续时间会有所不同,具体取决于个人和引起感染的具体病原体。有些人可能只会感到轻微不适,而另一些人则可能会感到剧烈疼痛和活动受限。
在某些情况下,肌肉骨骼症状可能是感染的后遗症,这意味着即使感染已经消退,这些症状仍会持续存在。这在某些病毒感染中更为常见,例如寨卡病毒或基孔肯雅病毒。
注:寨卡病毒属黄病毒科,黄病毒属,单股正链RNA病毒,直径20nm,是一种通过蚊虫进行传播的虫媒病毒,宿主不明确,主要在野生灵长类动物和栖息在树上的蚊子。
基孔肯雅病是由伊蚊传染的一种急性传染病,其临床症状为突然发烧、头疼、呕吐、关节痛及腰下部疼痛等,而最有效的应对途径是采取预防措施,减少蚊虫的滋生。
肌肉骨骼症状的恢复通常包括休息、疼痛管理和物理治疗,以改善力量和活动能力。如果症状严重或持续,可能需要更密集的治疗。
值得注意的是,肌肉骨骼症状也可能是感染的并发症,可能需要额外的医疗干预。并发症可能包括关节炎症、骨骼或软骨损伤或周围组织感染。
在极少数情况下,患者在经过一段时间的缓解或恢复后可能会出现肌肉骨骼症状复发。这可能是由于引起最初感染的病毒或细菌重新激活,或被同一病原体再次感染。
总体而言,感染过程中的肌肉骨骼症状会极大地影响个人的生活质量。如果您出现任何这些症状,建议处理以便获得准确的诊断和适当的治疗。
▼
泌尿生殖系统症状可作为某些传染病发展的一部分出现。这些症状可能表明感染已到达泌尿生殖道,包括生殖系统和泌尿系统的器官。并非所有感染都会发展到这个阶段,并且出现泌尿生殖系统症状并不总是表明感染严重或晚期。
泌尿生殖道阶段通常发生在感染的初期阶段之后,例如急性期和前驱期。在此阶段,病毒或细菌可能已经通过血液或其他身体系统到达泌尿生殖道。
出现泌尿生殖系统症状的患者可能会注意到泌尿系统的变化,例如排尿频率或尿急增加、排尿疼痛、尿液浑浊或带血,或难以完全排空膀胱。影响生殖系统的感染也会导致阴道分泌物、异常出血、盆腔疼痛或男性睾丸疼痛等症状。
在某些情况下,泌尿生殖系统症状可能伴有并发症。这些并发症可能包括肾脏感染、尿路感染、盆腔炎或性传播感染。如果出现这些症状或怀疑有感染,请务必就医。
泌尿生殖系统阶段的持续时间可能因具体感染和个人因素而异。在某些情况下,症状可能会通过适当的休息、补水和对症治疗自行缓解。但是,如果感染未得到适当治疗或存在潜在健康问题,感染可能会发展为慢性阶段或导致复发。
值得注意的是,某些感染会对泌尿生殖系统产生长期影响或后遗症。这些后遗症可能包括不孕症、慢性疼痛、疤痕或其他可能需要持续医疗管理的并发症。
常见的泌尿生殖系统症状:
▼
在感染过程中,个人可能会经历多个阶段。这些阶段包括潜伏期、复发、并发症、缓解,甚至慢性和急性后遗症。然而,一个经常被忽视的阶段是心理症状阶段。
心理症状可发生在感染的任何阶段,程度从轻微到严重不等。这些症状通常表现为情绪、行为和认知的变化。常见的心理症状包括焦虑、抑郁、易怒、困惑和注意力难以集中。
心理症状的存在会对个人的整体幸福感和生活质量产生重大影响。这些症状会影响一个人进行日常活动、维持人际关系甚至工作或上学的能力。为了提供适当的支持和治疗,识别和解决这些症状非常重要。
病原微生物检测在感染管理中的重要性不容忽视。通过病原微生物检测可以有效地控制和预防医院内感染,并加速患者的恢复过程。
随着分子生物学技术的发展,现代医学微生物学检验技术已经取得了显著进步,正在成为指导临床感染辅助诊断和治疗的重要依据。
多种检测手段应用于病原体检测,例如:
在感染的临床管理中,除了传统的病原体检测方法外,肠道菌群检测也是一个重要的发展方向。肠道菌群有助于消化、吸收营养物质,同时还调节人体免疫系统的功能,对人体健康起着至关重要的作用,肠道菌群失衡与多种疾病的发生发展密切相关。
肠道菌群与宿主之间的相互作用对维持内稳态很重要,但这种相互作用一旦受到干扰,就会成为许多慢性疾病的核心驱动因素。
在肠道、相关微生物群和各种器官之间的双向或多向通信连接(轴)
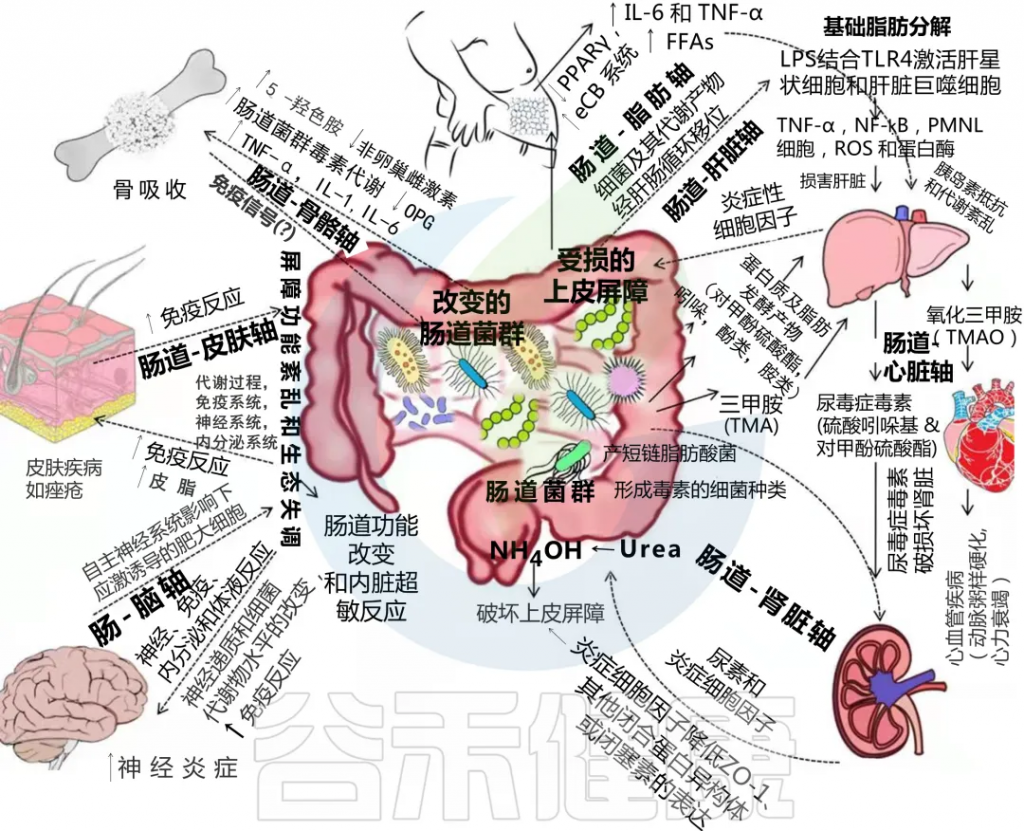
Ahlawat S,et al.,Lett Appl Microbiol. 2021
关于这方面可详见我们之前的文章:
肠道菌群报告中会有致病菌超标等明确指示,此外我们还可以判断整个肠道微生态的健康状况。肠道微生物群的失调可能导致肠道易感性增加,使得易感性疾病如艰难梭菌感染更容易发生。
通过分析肠道微生物组的变化,可以帮助我们更好地理解感染过程,评估治疗效果,并为个性化干预提供依据。
感染,作为全球健康的主要威胁,其影响甚至超过个体的病痛,它触及社会的每一个层面。本文在了解各种感染阶段、症状的同时,也强调了病原体检测在感染管理中的重要性,病原体相关检测手段让我们能够及时识别感染类型,评估其严重程度,并预测可能的并发症。
面对不断演变的病原体和日益严峻的抗生素耐药性问题,我们在推动科研创新的同时,也需提高公众对感染性疾病的认识,强化预防措施,如感染源的识别、个人卫生习惯等,对于控制感染的传播同样至关重要。
在治疗方面,针对病原体的特异性治疗是帮助患者恢复健康的关键。这需要医疗相关专业人员根据相关诊断结果,选择最合适的治疗方案,包括抗生素、抗病毒、抗真菌等。同时,症状管理和支持性护理也是治疗过程中不可或缺的组成部分。
随着科技的进步和医疗知识的积累,整合病原体相关检测,加强跨学科的研究,以及普及健康教育,有望不断提升治疗效果,为患者带来更好的康复和生存机会。
免责声明:本文仅供参考,不构成医疗建议。请务必咨询医疗保健专业人员,以正确诊断和治疗任何感染。
主要参考文献:
Murray, P. R., Rosenthal, K. S., & Pfaller, M. A. (2013). Medical microbiology. Philadelphia: Elsevier/Saunders
Parija S.C. (2012). Textbook of Microbiology & Immunology.(2 ed.). India: Elsevier India.
Sastry A.S. & Bhat S.K. (2016). Essentials of Medical Microbiology. New Delhi : Jaypee Brothers Medical Publishers.
Joseph Lister’s antisepsis system,2018,Science Museum
sciencedirect.com/topics/immunology-and-microbiology/germ-theory-of-disease
biologydictionary.net/germ-theory/
infectioncycle.com/articles/infection-stages-understanding-the-progression-of-infectious-diseases-and-their-impact-on-health
germ theory,Adam Augustyn,2024, 5
National Research Council (US) Committee to Update Science, Medicine, and Animals. Science, Medicine, and Animals. Washington (DC): National Academies Press (US); 2004.
Murray, P.R., Rosenthal, K.S., & Pfaller, M.A. (2015). Medical microbiology (8th ed.). Elsevier.
Fauci, A.S., Braunwald, E., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2008). Harrison’s principles of internal medicine (17th ed.). McGraw-Hill Medical
Mandell, G. L., Bennett, J. E., & Dolin, R. (2010). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases (7th ed.). Churchill Livingstone.
Brook, I. (2013). Microbiology and management of respiratory tract infections. CRC Press.
Control of Communicable Diseases Manual by David Heymann.
G. Authia, S. Fablina, 2022. Global and regional sepsis and infectious syndrome mortality in 2019: a systematic analysis. Published by Elsevier Ltd. Published:March, 2022
Loretta J. Bubenik (2005). Infections of the Skeletal System. , 35(5), 0–1109. doi:10.1016/j.cvsm.2005.05.001
Morrison WB, Kransdorf MJ. Infection. 2021 Apr 13. In: Hodler J, Kubik-Huch RA, von Schulthess GK, editors. Musculoskeletal Diseases 2021-2024: Diagnostic Imaging [Internet]. Cham (CH): Springer; 2021.
Megran DW. Enterococcal endocarditis. Clin Infect Dis. 1992 Jul;15(1):63-71. doi: 10.1093/clinids/15.1.63. PMID: 1617074.
Roberts RB, Krieger AG, Schiller NL, Gross KC. Viridans streptococcal endocarditis: the role of various species, including pyridoxal-dependent streptococci. Rev Infect Dis. 1979 Nov-Dec;1(6):955-66. doi: 10.1093/clinids/1.6.955. PMID: 551516.
Infective endocarditis: A contemporary update. Ronak Rajani, John L Klein. Clinical Medicine Jan 2020, 20 (1) 31-35; DOI: 10.7861/clinmed.cme.20.1.1
Lamas, C. C., & Eykyn, S. J. (2003). Blood culture negative endocarditis: Analysis of 63 cases presenting over 25 years. Heart, 89(3), 258-262.
Smith DA, Nehring SM. Bacteremia. [Updated 2022 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-.
Britannica, The Editors of Encyclopaedia. “septicemia”. Encyclopedia Britannica, 23 Jun. 2022
Martinez RM, Wolk DM. Bloodstream Infections. Microbiol Spectr. 2016 Aug;4(4).
Akhondi H, Simonsen KA. Bacterial Diarrhea. 2022 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 31869107.
Bacterial gastroenteritis: Causes, treatment, and prevention (medicalnewstoday.com)
Typhoid (who.int)
Imam Z, Simons-Linares CR, Chahal P. Infectious causes of acute pancreatitis: A systematic review. Pancreatology. 2020 Oct;20(7):1312-1322.
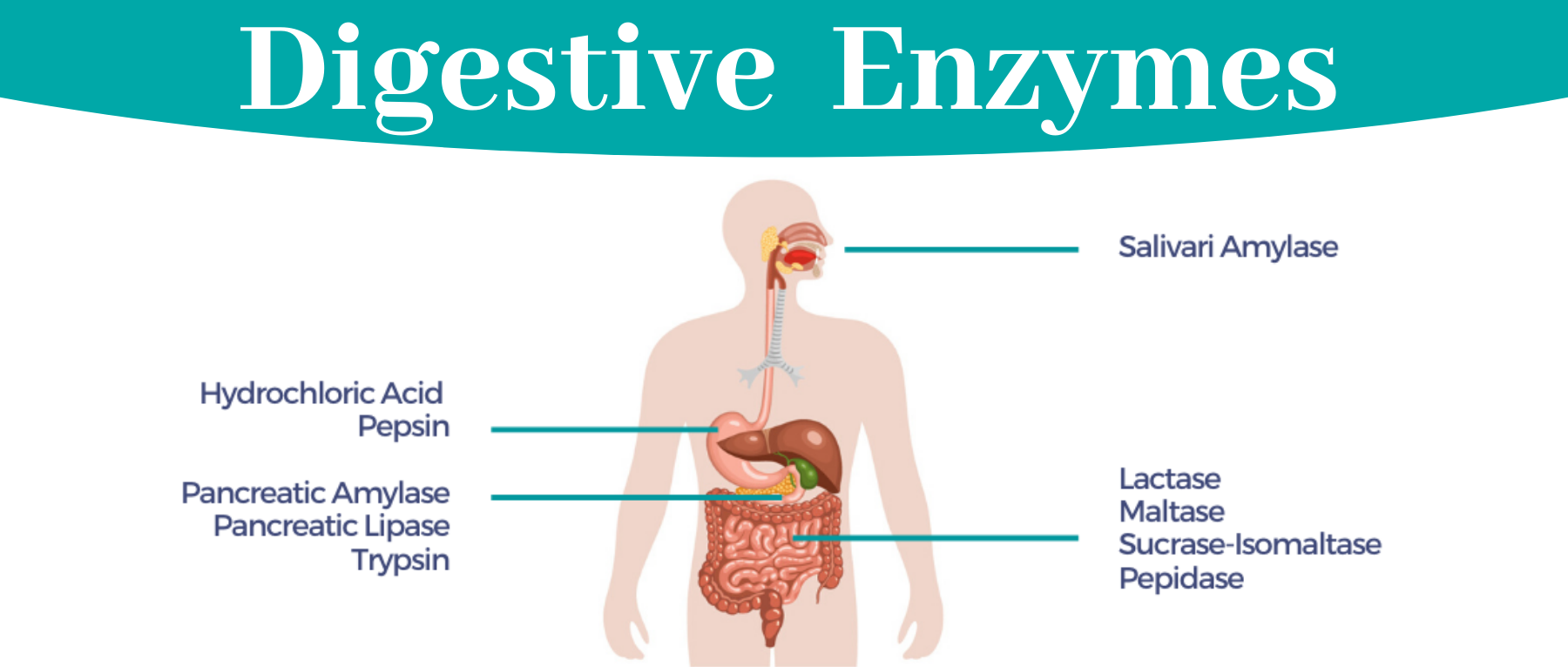
谷禾健康
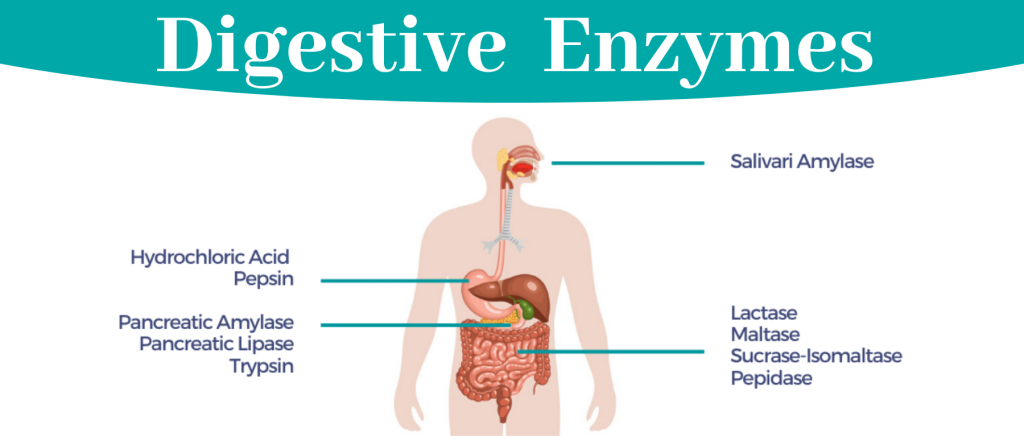
消化酶分解脂肪、蛋白质和碳水化合物,便于身体吸收营养。大部分消化酶由胰腺产生,其次是小肠、胃和口腔。
本文主要介绍不同酶的工作原理、酶水平背后的遗传因素和消化系统疾病以及自然促进消化的方法。
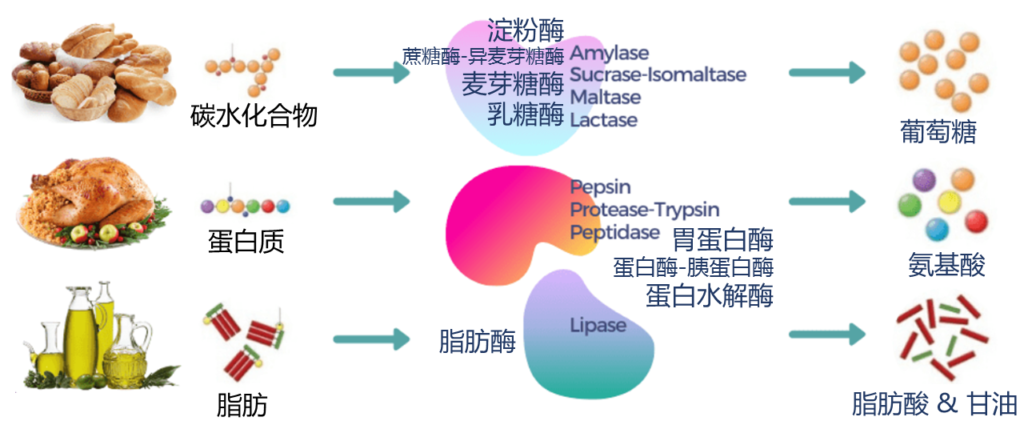
消化酶是一组广泛的酶,可将脂肪、蛋白质和碳水化合物等大营养素分解成更容易被身体吸收的较小营养素。人体在胰腺中自然产生大部分酶,而胃、小肠和口腔中产生少量酶。
以下酶可以帮助人体从特定的食物中吸收营养:
▪ 蛋白酶把蛋白质分解成氨基酸
▪ 脂肪酶把脂肪分解成脂肪酸
▪ 淀粉酶将碳水化合物分解成单糖,如葡萄糖
它们的主要作用是帮助消化,这些酶在你体内的数量和活性取决于一系列复杂的因素。初步研究表明,消化酶可能有助于缓解各种消化疾病、减轻炎症、肠道感染等。
消化酶水平低表明胰腺不能正常工作,难以产生重要的消化化合物。
在严重的时候,这种情况被称为外分泌胰腺功能不全(EPI)。这时,胰腺中产生消化酶的细胞会随着时间的推移而被破坏。
当然,EPI不是唯一的原因,各种因素都会导致消化酶水平降低:

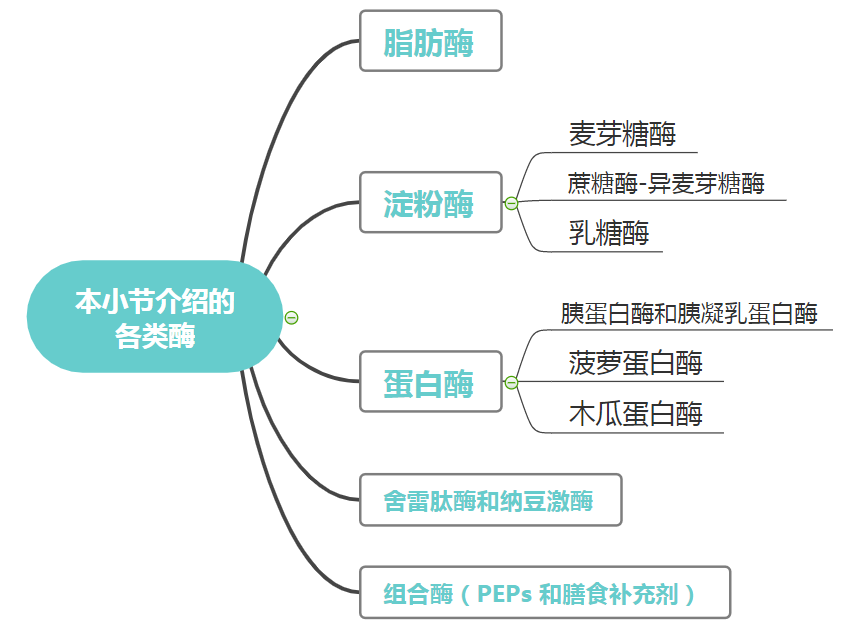
消化酶主要分三大类:脂肪酶、淀粉酶、蛋白酶
脂肪酶
脂肪酶是分解脂肪的酶,帮助维持胆囊功能正常。它们在胰腺中产生,但也可以从植物、动物和真菌中提取,并且足够稳定。
各种类型的脂肪酶参与不同的过程,例如脂肪代谢、运输、细胞信号传导、炎症等。

✓ 用于肠易激综合征(IBS)患者
含有脂肪酶和其他胰酶的补充剂可以帮助减少餐后的腹胀、胀气和饱腹感,尤其是脂肪含量高的食物。这些症状通常与消化问题有关,如肠易激综合征(IBS)。研究还表明,一些肠易激综合征患者可能存在胰腺外分泌功能不全,即由于胰腺产生的消化酶缺乏而无法正确消化食物。
谷禾健康
自身免疫性疾病,包括炎症性肠病、多发性硬化和类风湿性关节炎,具有不同的临床表现,但肠道微生物群紊乱和肠道屏障功能障碍的潜在模式相同。但宿主因素的个体差异使得统一的方法不太可能。
我们往往会有这样的错觉:“自然”的东西一定是对健康有益的。我们是不是只要吃最原始的食物就能恢复健康?
事实上,优化人类健康的途径并不像照搬我们祖先的饮食或增加我们对微生物的接触那样简单。归根结底,过去和现在的环境是根本不同的,也许是不可逆转的。
因此,针对微生物群的饮食干预的目标不应是回到祖先的状态,而是操纵微生物群,优化宿主健康,直接适应日益工业化的世界。
本文介绍了关于饮食-局部炎症中的微生物群相互作用、肠道微生物群失衡和宿主免疫失调的知识。通过了解并结合个别饮食成分对微生物代谢输出和宿主生理的影响,研究了基于饮食的自身免疫性疾病预防和治疗的潜力。讨论了针对肠道微生物群的工具,如粪便微生物群移植、益生菌和正交小生境工程等。这些方法强调了在自身免疫性疾病不断增加的情况下,利用饮食精确操纵肠道微生物组的途径。
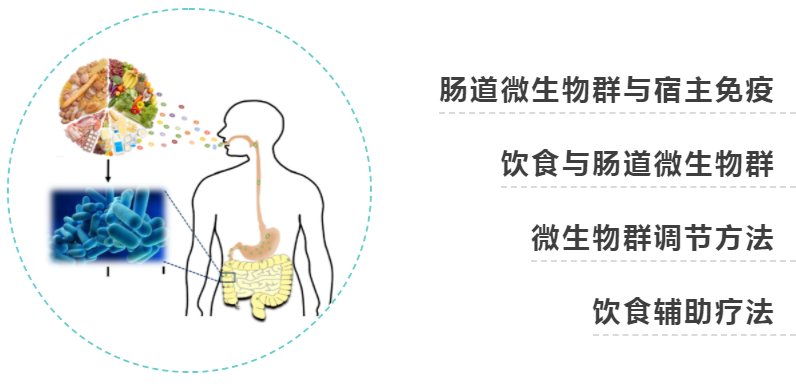
在肠道中,对微生物威胁作出适当反应的免疫平衡行为,对共生微生物和自身抗原的耐受,在生命早期尤其重要,这是定植微生物群和宿主免疫系统相互作用的窗口,引发促炎或抗炎倾向,可能对终身健康产生影响。
★ 婴儿期影响菌群的因素
看过我们文章的都知道,早期生活因素,如剖腹产、配方奶粉喂养和抗生素的使用,可能会干扰微生物群生长过程。
婴儿期母乳中的人乳低聚糖有助于双歧杆菌的定植,双歧杆菌在早期肠道微生物群中占主导地位,产生岩藻糖、乙酸盐、丙酮酸盐和1,2-丙二醇,通过交叉喂养支持微生物群的扩增,有助于对共生细菌的免疫耐受。
人类通常在6个月大时开始转变为固体食物饮食,自此菌群显著扩大,产生更多数量和种类的代谢物(例如,丁酸盐,它促进结肠粘液屏障的成熟,并阻止具有高致病潜力的细菌的生长)。
★ 抗性淀粉缓解系统性红斑狼疮
在一项涉及149名健康志愿者的研究中,脂多糖通过诱导TLR4耐受来抑制先天免疫过程。微生物抗原对TLR的不当刺激也可能影响自身免疫疾病的进展,并为其修复提供线索,如系统性红斑狼疮过度表达TLR7的小鼠模型中,通过添加抗性淀粉来改变微生物代谢产物和分类组成,狼疮进展得到缓解。
★ 微生物变化引起的免疫反应
在自身免疫性疾病患者中也发现了由微生物引起的适应性免疫反应失调。哺乳动物肠道中的共生微生物群,尤其是梭菌群IV和XIVa,它们将膳食纤维代谢成丁酸盐以诱导Treg细胞发育,与小鼠模型中的结肠炎严重程度呈负相关。
通常,自身免疫性疾病患者表现出产生耐受性IL-10的CD25 FOXP3 T细胞的丰度降低,自身反应性效应性T细胞亚群(如TH1细胞和TH17细胞)的丰度增加,从而使Treg细胞与效应性T细胞的比率偏离稳态水平。这些改变可能通过过度产生促炎细胞因子(如TNF和IL-17)进一步促进肠道通透性的增加,这些促炎细胞因子可调节紧密连接蛋白的表达。
自身免疫疾病共同的潜在驱动因素鼓励通过饮食干预或微生物群调节策略(下文讨论)来进行肠道微生物群工程,以将肠道微生物群转变为功能多样的“健康”状态。
饮食可直接影响肠道微生物群,调节其组成或代谢输出,从而可能促进疾病或形成稳态。

谷禾健康


看过往期文章的小伙伴都知道,人体微生物群维持体内的共生关系,促进新陈代谢功能,抵御病原体,训练和发展免疫系统,直接或间接影响我们的大部分生理功能。
每个人都拥有属于自己的独特的微生物组,人与人之间这种显著的个体差异性是疾病易感性差异的潜在来源。
基因是从出生开始确定了,很大程度上伴随着人的一生,微生物组是否也是遗传决定的呢?
2018年的研究显示,家庭中的遗传血统或单个多态性变体在肠道微生物组组成中的作用很小(<2%),而微生物组多样性中超过20%的变异可以从共享的环境因素中推断出来,例如与饮食和生活方式。可见环境是影响微生物组的重要因素。
那么:
影响微生物组环境因素包括哪些?
环境如何对人类微生物组产生影响?
环境如何通过微生物组影响人的健康?
环境对人类微生物组的影响研究会有哪些挑战?
这对理解非传染性疾病的微生物基础带来哪些启示?
本文我们来详细阐述以上问题。
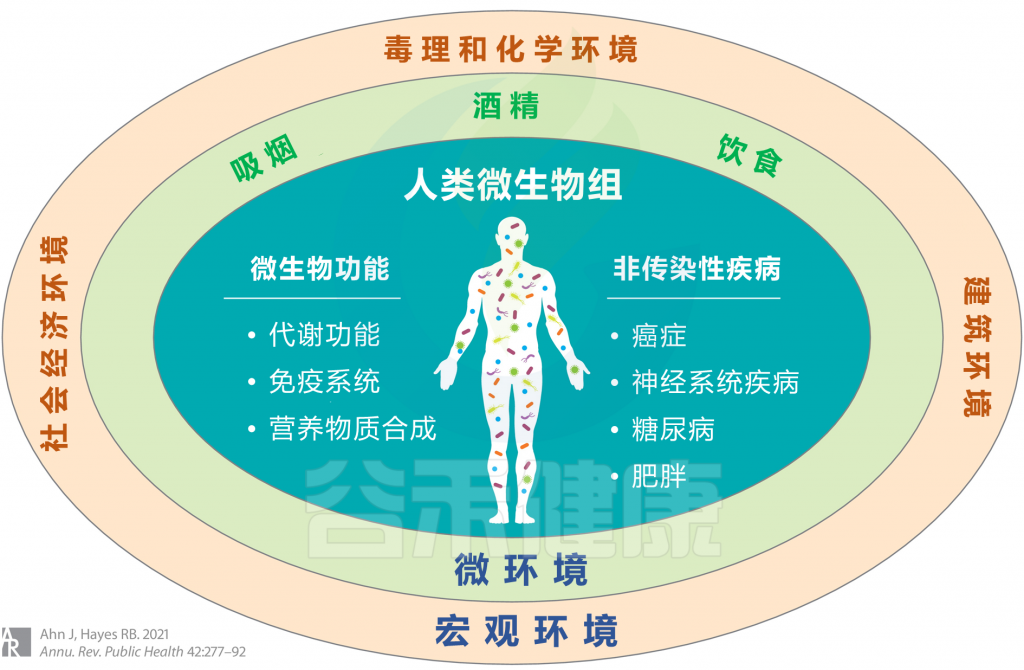
<从广义上考虑环境,涉及宏观环境和微环境,并考虑个人行为,包括吸烟,饮酒和饮食摄入等>

口腔消化道癌症
微生物诱发了至少60%的人类口腔消化道癌症,这表明控制微生物相关过程在预防和治疗口腔消化道癌症方面具有巨大的潜力。
流行病学研究一致报告口腔疾病与口腔消化道癌症(包括头颈部、食道癌、胃癌和胰腺癌)风险之间的联系。由于口腔疾病具有重要的微生物基础,这些观察导致了口腔微生物组与口消化癌的发生有关的假设。
基于大量人群的队列研究中的病例对照研究发现,用漱口水样本评估的诊断前口腔微生物组与随后发生的头颈部、食道和胰腺消化道癌症的相关。一些研究也明确指出了肠道微生物组梭菌属Fusobacterium和其他菌群与结肠癌之间的联系,以及肠道微生物组与炎症性肠病和结直肠腺瘤之间的联系。
微生物来源的信号通过不同的机制调节癌症的许多特征。一般来说,细菌不能直接诱发癌症;这一过程通常伴随着慢性炎症,并需要致癌信号通路的独立突变。
进一步的研究表明,微生物组与宿主之间的交互作用通过调节肿瘤微环境中的先天和适应性免疫功能,对口腔消化道肿瘤发生至关重要。
细菌-癌症模型提出,革兰氏阴性细菌促进致癌作用,因为脂多糖细菌外膜通过Toll样模式识别受体为先天免疫系统反应提供免疫原性刺激,导致由核转录因子NF-κB原瘤细胞因子释放、免疫细胞募集和活性氧释放引起的基因突变。
因此,微生物在形成肿瘤免疫微环境中的作用在癌症的发病机制中具有重要的潜在意义,特别是在口腔消化道。
神经系统疾病
肠道和中枢神经系统通过肠-脑轴相互作用,调节中枢神经系统功能,包括情感行为、认知表现、疲劳和睡眠。
研究表明,肠道微生物组通过影响肠-脑轴,可能在某些神经精神和神经发育障碍中发挥作用,改变行为,并可能影响神经系统障碍的发作和/或严重程度。
无菌小鼠和用抗生素治疗的小鼠表现出大量的神经免疫功能障碍和行为缺陷。主要在临床前模型中,肠道微生物组与大脑障碍有关,包括焦虑、抑郁、癫痫以及自闭症谱系障碍。
在人类中,胃肠道病理和神经精神疾病之间相互作用的证据已经在焦虑、抑郁和自闭症等情况中报告;然而,因果关系仍未得到证实。
揭示微生物组介导肠-脑连接的机制可能为靶向治疗肠道提供新的机会,以预防和治疗神经疾病。
糖尿病
大量的文献已经为肠道菌群在糖尿病前期和2型糖尿病病因学中的作用提供了证据。一份2020年的综述总结了40多项已发表的人类研究。
例如,在糖尿病前期研究中发现,基于肠道微生物群、炎症和免疫标志物的分子特征预测了2型糖尿病的发病。
两项开创性研究发现,2型糖尿病患者和非糖尿病对照组的肠道微生物组不同。
随后一项研究表明,2型糖尿病患者的肠道微生物群介导了用于控制糖尿病的二甲双胍的治疗效果。

还有研究人员开发了个性化饮食以优化2型糖尿病患者的血糖水平,同时考虑了个性化饮食习惯、体育活动和肠道微生物群。研究人员随后在一项盲法随机对照饮食干预试验中表明,应用这种算法可以改善餐后血糖反应。
目前面临的挑战是搞清楚,具体精确到哪些肠道微生物组组成部分,能驱动异质性、多因素、多器官疾病。
肥 胖
肥胖在全球范围内日益流行,导致过早死亡和许多慢性非传染性疾病。虽然肥胖的根本原因是能量摄入和输出之间的不平衡,但肠道微生物组成是导致体重增加的公认因素,当然还有其他机制,如遗传变异和表观遗传调节。


从野生型小鼠、肥胖小鼠或肥胖人类转移到无菌小鼠的肠道菌群实验表明,在该试验系统中,肠道菌群在体重增加和肥胖中起着关键作用,与肥胖表型的建立有关。这些实验结果引出了这样一个问题:
肠道的微生物组成是否会影响人类体重增加(无论是基因决定的还是饮食诱导的)?
一份早期的小规模人类样本报告与小鼠的研究结果一致,即肥胖状态与厚壁菌门(Firmicutes)的相对丰度增加和拟杆菌门(Bacteroidetes)的相对丰度减少有关。
然而,对人类的研究并没有证实这一特定模式:一些研究发现拟杆菌门(Bacteroidetes)的减少(但没有发现厚壁菌门(Firmicutes)的增加)与肥胖有关,而另一些研究则发现相反或未发现这两种门水平与体重指数(BMI)有关。
此外,研究已经确定了与BMI或肥胖相关的不同属和种水平的分类群。
点击此处查看 体重增长:目前为止我们所知道的一切
未来在动物模型和人类中的下游实验可以确定这些候选菌群是否在肥胖的病因学中起作用,如果是,建议干预肥胖的预防和治疗。
目前也有通过各种治疗方法(如益生菌、益生元、抗生素)改变菌群的潜力,微生物组是预防和治疗肥胖的一个不错的方式。


宏观环境
——毒理和化学环境
在人体中,消化道和呼吸系统是环境毒物进入和加工的主要途径。在这些器官系统中,人类微生物组丰富的代谢系统具有强大的转化外来生物化学物质的能力,有时与宿主的生物转化模式相反。
宿主代谢酶的典型特征是氧化和结合排泄,而微生物的酶反应主要是还原、水解和去甲基化,生成碳源进一步生长和分裂。
环境砷形态与心血管疾病和其他健康影响有关;证据表明,口腔消化道微生物组的甲基化能力可能会影响这些毒性。
肠道乳酸菌Lactobacillus对金属(如镉和铅)的固定化可能会影响金属毒性,降低重金属积累。
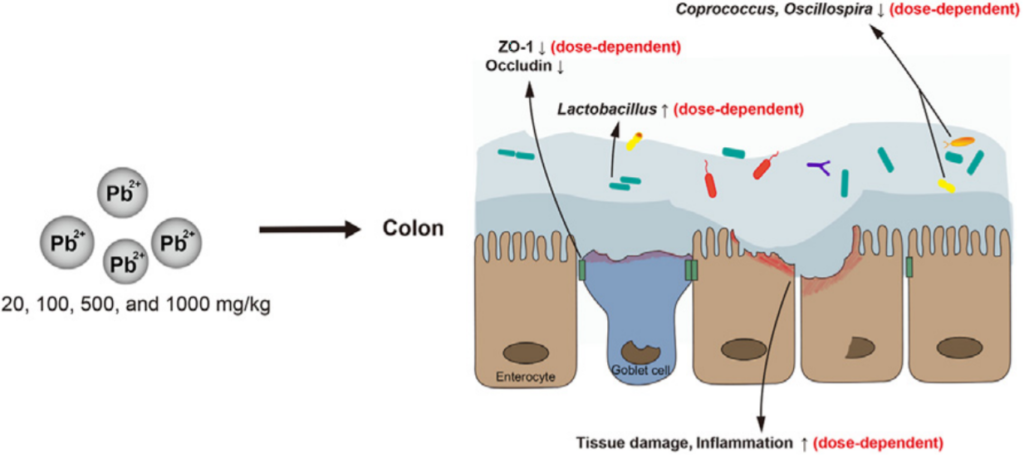
Yu.Let al., chemosphere2020
某些肠道细菌表达偶氮还原酶来代谢潜在致突变的偶氮化合物。个人护理产品中对环境具有持久性的化学物质,如三氯卡班(TCC)和三氯生(TCS)普遍存在,并与啮齿类动物微生物群的潜在变化有关。
肠道微生物群对化学物质(包括内分泌干扰物)的代谢会伴随微生物的失调:改变微生物群落结构,诱导特定细菌基因,改变微生物分子转化。此外,内分泌干扰物可以被吸收并运输到肝脏,然后被结合并通过胆汁分泌排泄回肠道,进一步进行微生物代谢。
酶如偶氮还原酶、酯酶、甲基酶、硫代还原酶、脂肪酶、硝基还原酶、β-葡萄糖醛酸苷酶、硫酸盐酶和β-裂解酶也参与环境化学物质的微生物代谢。
——建筑环境与新兴假说
建筑环境包括人类建造的所有建筑,包括家、工作场所、学校、车辆等。研究人员认识到许多微生物病原体可能存在于建筑环境中。
例如,细菌病原体,如结核分枝杆菌;真菌病原体,如烟曲霉菌Aspergillus fumigatus;致病性病毒,如鼻病毒和流感病毒,以及SARS-CoV-2冠状病毒等,均可通过在建筑环境中直接吸入传播。其他病原体,如艰难梭菌和粪肠球菌,以及诺如病毒和流感病毒,可通过皮肤或黏液接触传播给人,原因是病菌从表面传播。
除了直接的微生物传播,建筑环境中的微生物代谢产物也可能涉及人类健康,包括细菌和真菌毒素、细胞壁的致敏成分和微生物衍生的挥发性有机化合物。
室内空气和表面与灰尘和微生物化学产物有关。环境中相对湿度的增加导致灰尘和表面微生物代谢物的增加。室内潮湿和发霉条件(例如,可见的霉菌和霉菌气味)与许多不同的疾病状态有关,但建筑环境中微生物及其代谢产物的组成和浓度与疾病之间的联系仍然难以捉摸。

通过靶向细菌16S rRNA测序和宏基因组测序的应用,研究人员对建筑环境微生物生态的复杂性有了更全面的认识,包括可培养和非培养因子的多样性。认识到环境样品中微生物DNA序列的组成可能是由大量的不可活残留物组成的,环境微生物相关DNA表现出丰富的复杂性,反映了人类微生物来源,室内建造环境和人类来源的微生物来源之间的关系特别强。
卫生假说认为,卫生条件的改善可能与自身免疫性疾病的增多有关,这一概念也适用于有益菌暴露的概念。
研究人员研究了人类微生物组和建筑环境微生物组之间的相关关系,重点关注家庭环境,并绘制居住者和他们的家庭之间的细菌共享。这项调查表明,与表面有关的大多数细菌有很大的可能来自该住宅的居住者。暴露于室内灰尘中的复杂微生物群与患哮喘的可能性呈负相关。在另一项研究中,与没有接触到农业环境的儿童相比,接触到农场附近家庭灰尘并在农场积极参与工作的儿童患哮喘的风险有统计学上显著降低。

总之,越来越多的证据表明,建筑环境、微生物群和健康之间存在相互关系,但要了解建筑环境中微生物的生态和进化与人类健康之间的关系,还需要做大量的工作。
其他与建筑环境有关的著名假说也出现了。其中一个在文献中越来越流行的假说是野化假说,该假说认为,改变城市绿地使其恢复到更自然的状态,有可能改变环境中的微生物群,进而改变人类微生物群。对人和动物的研究表明,野化可能会影响微生物组和宿主的免疫反应。
除其他环境因素外,2018年的研究表明,吸入颗粒物空气污染会改变肠道微生物组的组成。
此外,日光暴露可以调节家庭灰尘细菌群落,这也可能表明阳光和紫外线辐射影响人体微生物群落组成,例如皮肤上的细菌群落。
微生物在皮肤老化中的作用模式
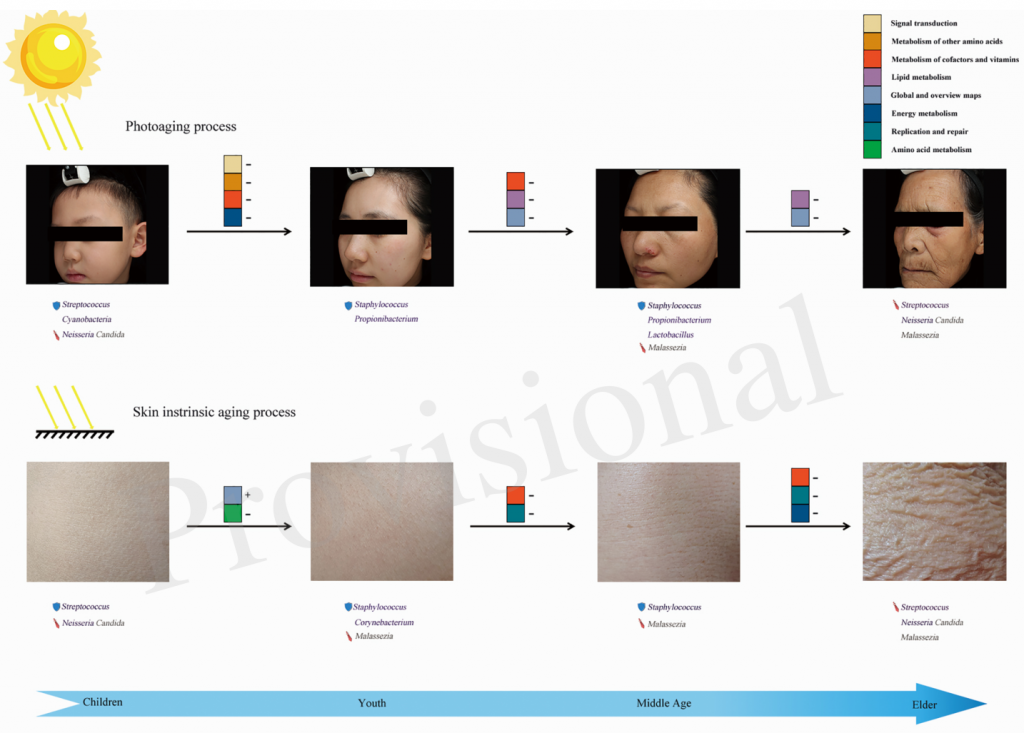

Li Zichao,et al., Front Microbiol, 2020
气候变化和极端高温也可能引发生理变化,可能有利于周围环境、食物或体内的某些微生物群。
此外,在应对将大量微生物菌群与无数已建立和新出现的暴露物结合起来的挑战时,将细菌宏基因组与环境暴露物结合起来的无针对性评估和发现可能是前瞻性研究议程的一部分。
——社会经济环境
较低的社会经济地位与多种与健康有关的行为有关,如获得医疗和牙科护理的机会减少,增加参与不健康行为(如吸烟和酒精依赖),减少对积极健康行为(如健康饮食和锻炼)的参与。低社会经济地位与较高的发病率和死亡率以及其他一些健康状况如肥胖、糖尿病和癌症的高发病率相关。
微生物群在调节社会经济地位和健康之间关系中的作用正在研究中。许多与低社会经济地位社区和生活方式相关的特征(例如,加工食品、久坐的生活方式、社会心理压力、暴露于污染物和内分泌干扰物)也与肠道微生物多样性减少有关。


研究已经检验了高社会经济地位和低社会经济地位群体之间微生物组成的差异。在美国,较高的社会经济地位与肠道微生物群中特定微生物的α多样性和种群丰度相关。
更好地理解微生物组在社会经济地位相关疾病易感性中的中介关系需要综合研究,包括调查社区和个人水平的暴露。建筑环境是考虑的一个部分。
微环境
——吸烟
香烟烟雾是大量有毒物质的来源,直接接触口腔和上呼吸道的细菌;这些毒物可以通过抗生素作用、缺氧或其他潜在机制扰乱微生物生态。由于吸烟而失去有益的口腔菌群可导致病原体定植并最终导致疾病;吸烟在微生物依赖性牙周炎的发病和发展过程中所起的既定作用有力地支持了这一论点。

实验室调查发现,与从不吸烟的人(变形菌门11.7%)相比,吸烟人群口腔微生物组的总体多样性降低,变形菌门的相对丰度降低(4.6%) (FDR q = 5.2×10−7)。
当前吸烟者体内三羧酸(TCA)循环和氧化磷酸化等微生物有氧代谢途径相关基因的丰度降低,糖酵解等非氧碳水化合物代谢途径的丰度增加。
当前吸烟者所消耗的其他途径包括与甲苯、一硝基甲苯、苯乙烯、氯环己烷和氯苯降解有关的某些外来生物降解途径以及细胞色素P450的外来生物代谢。相反,多环芳烃(PAH)和二甲苯降解在当前吸烟者中富集。这些化学物质是香烟烟雾的组成部分,因此口腔菌群降解这些物质的能力的改变可能会对宿主产生毒性后果。
除了创造一个厌氧、酸性和/或选择性有毒的环境,吸烟还被认为对人体免疫有显著的影响,这反过来可以影响宿主阻止病原体殖民的能力。
总之,越来越多的证据表明:
吸烟影响口腔微生物群的整体组成和许多种群丰度;吸烟可促进厌氧口腔环境和具有减少的异种生物降解能力的菌群。
观察性和介入性研究也提示吸烟者肠道微生物组的多样性降低,总的来说,变形菌门、拟杆菌门和梭菌属、拟杆菌属、普雷沃氏菌属呈上升趋势,放线菌门、厚壁菌门和双歧杆菌属、乳球菌属呈下降趋势。
可能解释吸烟对肠道微生物组影响的机制包括氧化应激增强、肠道紧密连接和肠道粘蛋白组成的改变以及酸碱平衡的改变。一些吸烟引起的肠道微生物组改变类似于炎症性肠病和肥胖等情况下的改变。应该进行进一步的研究来研究这种联系。吸烟会影响肠道微生物群,建议改变其组成。吸烟和肠道微生物组之间的相互作用可能有助于肠道和全身疾病的发展。
——酒精
酒精摄入可能通过几种方式影响人体口腔微生物群:
首先,口腔细菌和真菌将酒精和膳食糖代谢成致癌的乙醛,与香烟烟雾冷凝液相互作用,产生致癌的亚硝胺,并在实验上促进口腔癌变。无论是在体内还是体外,在吸烟者中,口腔微生物群有更强大的能力从乙醇中产生乙醛。
体外和动物实验也指出了口腔微生物群参与口腔癌变的可能机制,包括抑制细胞凋亡,激活细胞增殖,促进细胞侵袭,诱导慢性炎症,以及口腔多菌群中细菌和真菌的合作。
第二,酒精可能对细菌产生直接的细胞毒性作用。动物研究表明,摄入20%的酒精会增加变形链球菌Streptococcus mutans的定植,并显著减少大鼠口腔生物膜中可检测到的细菌种类。

在人类研究,饮用红酒与物种丰度降低以及龈下和龈上菌斑中某些厌氧菌的减少有关,而过量同时使用烟草和酒精与物种丰富度降低以及口腔粘膜生物膜中奈瑟菌Neisseria、Aggregatibacter和梭杆菌Fusobacteria丰度降低有关。
酒精除了直接作用外,还可能通过干扰宿主防御系统间接影响口腔微生物群,从而导致宿主介导的牙周炎。
大量以人群为基础的研究表明,每天至少喝一杯标准饮料会增加牙周炎15-27%的风险,并与糟糕的口腔健康有关。有证据表明,口腔微生物群与口腔健康状况密切相关。
酒精和肠道微生物组的研究主要是在大量饮酒的背景下进行的,酒精可能改变肠道屏障功能,导致肠道渗漏,产生促炎病原微生物产物,并扰乱肝脏代谢途径。
大量饮酒和肝硬化患者的研究表明,拟杆菌门细菌的相对丰度随着变形菌门的增加而降低,肝硬化患者中梭杆菌门的独特增加。
大量饮酒与肠道失调有关,而红酒作为膳食多酚的丰富来源,如果适量饮用,可能有利于改变胃肠道微生物群的组成。红酒多酚能显著增加变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的丰度,而杜松子酒则能显著减少这些细菌门。
——饮食
西方饮食的特点是高脂肪,高糖,大量食用红肉和加工肉类,大量食用精制谷物,而纤维摄入量较低。
许多研究表明,西方饮食与炎症、糖尿病、心血管疾病、肥胖、代谢综合征和癌症有关。而西方饮食有着广泛的生理影响,影响许多不同的细胞类型,如脂肪细胞,免疫细胞和内分泌细胞。
这个饮食习惯也与肠道菌群的变化密切相关,其特征是微生物多样性和物种丰富度降低,厚壁菌门增加,拟杆菌门减少。在属水平上,西方饮食显示双歧杆菌和乳酸菌减少,而肠杆菌增加。
纤维摄入量,是一个诱人的可改变的饮食因素,因为其假定有益的生物效应。一些研究表明,纤维可以预防2型糖尿病、心血管疾病、结肠癌和肥胖等疾病。纤维加速结肠运输,并可能减少结肠上皮细胞暴露于摄入的致癌物质。


此外,纤维经过微生物群发酵,产生短链脂肪酸如丁酸,对结肠能量代谢和上皮细胞增殖至关重要,在小鼠模型中,通过抑制组蛋白去乙酰化酶,显示出肿瘤抑制活性。因此,人们越来越关注膳食纤维对肠道微生物组成的影响,这可能最终影响一个人患癌症和其他疾病的风险。
高纤维饮食与更高的胃肠道微生物丰富度和多样性有关,特别是与普氏菌Prevotella和密螺旋体Treponema的丰富度有关,还与炎症信号的减少有关,对肥胖的保护,以及可能减少结肠直肠癌的存在。尽管短期饮食干预试验已经证明,不同数量的纤维摄入量可以在几周内显著改变肠道微生物群的组成,但很少有研究在人类中评估长期摄入纤维的饮食习惯对肠道微生物群的影响。
点此查看 你吃的膳食纤维对你有帮助吗
人类微生物组、健康、环境科学的这三个要素每一个都是复杂的,整合具有挑战。环境因素往往是复杂的;要考虑的环境因素众多,更不用说对微生物组的不断深入了解,难以全面把握外部环境如何在疾病发生率和死亡率中起因果作用。在现实生活中,这些因素通常相互影响,随着时间的推移是动态变化的。
化学毒物经常在混合物中出现,例如,与化妆品和内分泌干扰物的混合物。此外,在整个生命过程中暴露的风险可能随年龄而变化,即易感性窗口。由于这种复杂性,确定直接或间接影响人类健康和疾病的微生物特征仍然具有极大的挑战性。
需要新的方法来充分评价可能影响微生物组和人类健康的现有和尚未确定的因素。前瞻性队列研究是环境和人类健康研究的支柱,特别是因为这项研究设计在建立因果关系的自然时间序列方面很重要,而这在横断面或回顾性研究中往往很难理清。
对粪便样本和人体其他部位样本进行前瞻性收集,以及连续的纵向样本收集也只是在最近才达到一定规模。需要以大量人群为基础的队列,包括不同社会经济地位和地理群体等。

此外,环境和微生物组对健康状况的多维影响,加强了整合其他组学的需要,包括代谢组学、转录组学、基因组学和免疫组学。需要开发相关的数据集成工具和流程。
结语
以上强调了环境中通过影响人类微生物群与非传染性疾病相关的许多因素。必须考虑复杂的相互作用、上游因果因素和多种因果路径。以大数据驱动的技术正为微生物组研究和临床运用带来许多便捷。
随着深入研究,不久的将来我们会对环境,微生物组,健康三者之间的关系有进一步认识,结合公共政策领域,有效地从多方面去实现健康的改善。
相关阅读:
主要参考文献:
Li Zichao,Bai Xiaozhi,Peng Tingwei et al. New Insights Into the Skin Microbial Communities and Skin Aging [J]. Front Microbiol, 2020, 11: 565-549.
Ahn Jiyoung,Hayes Richard B,Environmental Influences on the Human Microbiome and Implications for Noncommunicable Disease [J] .Annu Rev Public Health, 2021, 42: 277-292.
Yu L, Yu Y, Yin R, Duan H, Qu D, Tian F, Narbad A, Chen W, Zhai Q. Dose-dependent effects of lead induced gut injuries: An in vitro and in vivo study. Chemosphere. 2021 Mar, 266: 129-130.
Hayes RB, Ahn J, Fan X, Peters BA, Ma Y, et al. 2018. Association of oral microbiome with risk for incident head and neck squamous cell cancer. JAMA Oncol. 4:358–65
Sampson TR, Mazmanian SK. 2015. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 17:565–76
Daisley BA, Monachese M, Trinder M, Bisanz JE, Chmiel JA, et al. 2019. Immobilization of cadmium and lead by Lactobacillus rhamnosus GR-1 mitigates apical-to-basolateral heavy metal translocation in a Caco-2 model of the intestinal epithelium. Gut Microbes 10:321–33
Gilbert JA, Stephens B. 2018. Microbiology of the built environment. Nat. Rev. Microbiol. 16:661–70
Rook GAW, Raison CL, Lowry CA. 2014. Microbial ‘old friends’, immunoregulation and socioeconomic status. Clin. Exp. Immunol. 177:1–12