-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

细菌耐药性
抗生素耐药性细菌感染的发生率正在上升,而新抗生素的开发由于种种原因在制药行业受重视程度下降。
最新在《柳叶刀-微生物》(The Lancet Microbe)上,科学家提出了基于细菌适应性、竞争和传播的生态原则的跨学科研究方法,可能开辟新途径来对抗抗生素耐药性感染。
许多兼性细菌病原体使用人类粘膜表面作为其主要储藏库,并在微生物组和宿主的某些病理状态下诱发传染病,以帮助其横向传播到新的宿主生物体。
有益的细菌共生体可以战胜特定的病原体,从而降低病原体传播和引起严重感染的能力。然而,尽管具有临床相关性,但对其自然栖息地中的共生-病原体相互作用的了解仍然很少。
本文将在人类微生物组和宿主生物学背景下讨论细菌病原体和共生体之间相互作用的研究最新内容,为预防和治疗传染病提供一些新视角。
The Gut Microbiome
对人类微生物组完整性作为健康需求的日益认可,正在极大地改变人们对细菌微生物组成员及其相互作用的评价,无论是微生物之间的互动还是与宿主的互动。这种理解的变化使得微生物生态学的原则成为了预防和治疗主要人类疾病的创新方法的核心。
从海量数据中分析推断出的微生物组特征正被考虑作为不同疾病诊断中的生物标志物,这些疾病包括各种类型的癌症,如结肠癌或乳腺癌,以及自身免疫性疾病,如类风湿性关节炎或银屑病。
粪便微生物移植在治疗艰难梭菌感染方面已被有效使用,而补充微生物组成员(例如AKK菌)或微生物组产品(例如短链脂肪酸),已显示出在改善代谢紊乱和癌症的健康结果方面的潜力。
然而,环境与人类相关的微生物生态系统之间存在根本性差异。许多环境微生物组代表了广阔、不受限制的生态系统,通常具有无限的生命周期,对微生物扩散几乎没有障碍。相比之下,与宿主相关的微生物组,如人类肠道中的微生物组,是受限的生态系统,具有较短的生命周期。
与宿主相关的微生物组需要特定的细菌机制来在个体和世代之间传播,并在其首选的生活条件之外暂时持续存在。
此外,宿主将微生物定殖者暴露于环境栖息地以外的压力源中,特别是通过其粘膜免疫系统。
Microbial Symbiosis and Pathogenicity
▸ 过去,对共生体和病原体的理解不全面
从历史上看,对与宿主相关的微生物生态系统的研究,曾局限于不同研究团队分别对中性或共生的细菌共生体和有害病原体进行的独立调查。因此,对这些不同组的与宿主相关细菌的当前理解高度不对称,且存在对病原体的强烈偏见,这阻碍了对人类微生物组生态的全面理解。
虽然这些细菌组在自然栖息地中有广泛的相互作用,但关于共生菌和病原体相互作用的实验研究却很少。例如,典型的病原体可以被发现几乎是人类微生物组的驯化成员,而共生菌则可以与病原体勾结,这会像多重微生物感染中那样。
▸ 共生菌和致病菌的区分较复杂
尽管在感染医学中,共生菌和致病菌之间的传统区分仍然是一个重要标准,但在生态学上下文中,这两组微生物固有的属性重叠使得这种区分变得不够充分。
有益的共生现象和对立的致病性代表了细菌行为范围的两个极端(下图),尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力,这进一步使区别变得复杂。
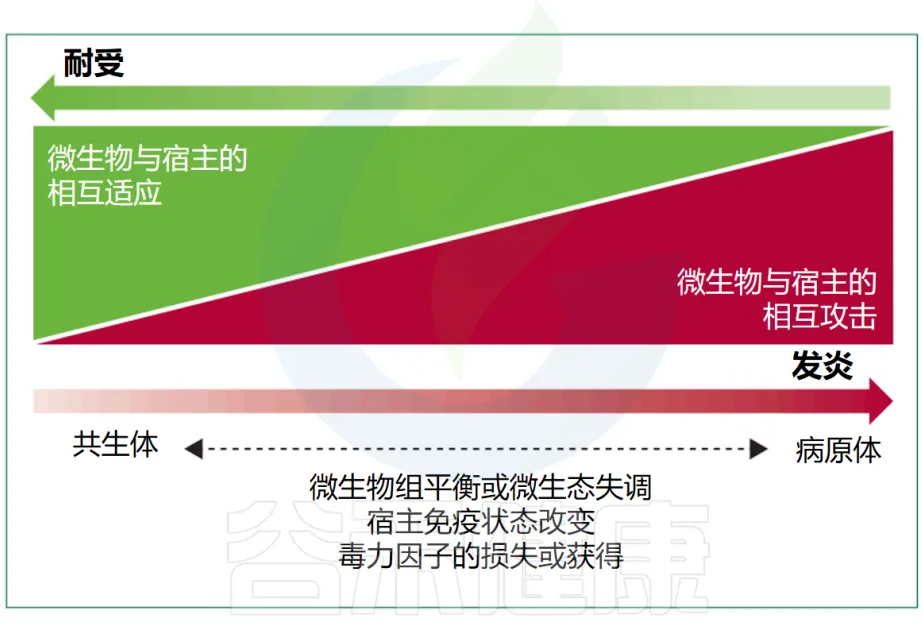
Maier L, et al. Lancet Microbe. 2024
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
Redefining “Infection”
条件性细菌病原体之间的共生与致病性的动态变化,这挑战了当前对“感染”一词的使用,这种使用往往不一致。
《柳叶刀-微生物》全体作者建议仅将“感染”这个术语,保留用于由特定器官组织中出现的细菌菌株引起的病理状态。例如下列情况:
因此,在这篇个人观点文章中,我们也建议将常规引起感染的细菌称为病原体,而不常引起感染的细菌称为共生菌,尽管这些术语有其局限性,并不能适当描述所有类型的微生物与宿主之间的对抗关系。
目前病原体与共生菌之间的界限模糊,也挑战了科赫的假说,该假说提出了特定微生物与相应疾病之间的单一因果关系。然而,实际上,有些疾病是由多种细菌种类的间接效应引起的,当微生物群落失衡而不仅仅是这些种类的存在,导致了一种特定的病理状态,而这种状态目前并不被视为典型的感染。
Understanding of Bacterial Pathogens and Symbiotic Bacteria
微生物组科学,尤其测序技术的快速进展以及新技术的出现,为微生物学开启了一个新阶段,这一阶段的研究将细菌病原体和共生菌整合在一起,超越了简化的研究方法。
为了探究环境变化如何影响细菌微生物组成员的动态行为变化,来自不同背景的微生物学家应当合作,并结合系统生物学、天然产物化学、粘膜免疫学和临床传染病等互补学科的专业知识。这些新方法可能有助于回答一些最相关和明显的问题:
Future Research on Commensal Bacteria
由于其高度的临床相关性以及培养和操控相对容易,像S. flexneri(志贺氏菌)、S. aureus(金黄色葡萄球菌)和 S. pneumoniae(肺炎链球菌)这样的主要细菌病原体已经被研究了几十年,远超过典型的宿主相关共生菌。相比之下,主要的人类相关共生菌,例如来自属如拟杆菌属、梭菌属(Clostridium)、Cutibacterium,仅被少数实验室研究。
实际上,大多数人类微生物组成员仍然难以培养,并且在遗传上不易处理。在特定情况下可以成为偶发性病原体的一些共生菌,如医院获得性大肠杆菌、粪肠球菌(E.faecium)或表皮葡萄球菌(Staphylococcus epidermidis),已经在一定程度上被研究。但为什么这些特定的细菌比其他更无害的共生菌更频繁地引起侵袭性感染,这一点仍然不清楚(如下表)。


Maier L, et al. Lancet Microbe. 2024
The Important Role of Symbiotic Bacteria in Human Health
越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ Blautia producta 抑制粪肠球菌
例如,Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium),而Staphylococcus lugdunensis的共生菌则可以抑制并排除金黄色葡萄球菌。
▸ 枯草芽孢杆菌阻止金黄色葡萄球菌
肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阻止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
一些共生菌还能产生对宿主有直接益处的化合物,例如促进肿瘤疗法的成功。病原体的研究可以帮助理解这些有益共生菌的生物学特性,并利用它们来对抗细菌感染。
共生菌的许多重要特性在不同菌株间可能会有所不同,这取决于例如获得或丢失移动遗传元素,如编码抗性或适应性特征的基因岛。用于病原体菌株特异性分类的现有方法,如序列分型方案,也可以应用于共生菌。这些方法可以帮助提升当前的诊断策略,达到个性化感染医学的新水平,不仅监测特定有害病原体的存在,还监测如那些保护免受潜在病原体定植的特定有益共生菌的缺失。
bacterial pathogens and symbiotes
▸ 共生菌的宿主特异性适应
与许多主要的细菌病原体一样,很多共生菌也特定于特定的宿主物种。这种适应过程导致宿主特异性,可能作为一种策略来增加细菌在与其他适应性较差的微生物竞争中的生存能力。这些基础机制对于病原体来说理解得很少,对于非致病性共生菌来说则基本上是不清楚的。
▸ 共生菌的粘附与持续定殖机制
特定宿主的持续定殖往往依赖于有效地粘附到上皮细胞的结合基序,如表面蛋白、蛋白多糖或糖脂。尽管在许多主要病原体中已经在一定程度上研究了相应的细菌粘附素,但现在才开始探索共生微生物中的这些机制。
▸ 共生菌与宿主免疫系统的相互作用
细菌在上皮表面的生存受到粘膜宿主防御机制的限制,这些机制包括IgA、抗菌肽和脂质以及活性氧和氮化合物的产生。先天和适应性免疫机制,通过感知与微生物相关的分子模式分子或通过粘膜白细胞检测微生物抗原来启动,有助于粘膜免疫过程,导致促炎或抗炎信号和效应分子的释放。
宿主的持续定殖依赖于细菌耐受抗菌免疫效应分子的能力或通过诱导免疫耐受来减少它们的表达。具有对抗菌宿主效应分子增强耐受性的细菌甚至可以诱导和利用抗菌宿主反应来消除更易感的竞争者。
根据宿主免疫反应,与微生物群其他成员的拮抗干扰已在表皮葡萄球菌和鼠伤寒沙门氏菌中得到记录。广泛的研究揭示了主要病原体的免疫逃避机制,但共生菌是否使用类似或不同的策略仍然未知。
▸ 共生菌免疫调节的复杂性及其潜在影响
例如,一些肠道共生菌通过产生非炎症性鞭毛蛋白来钝化先天免疫反应,这些蛋白抑制人类的Toll样受体5,或产生可以在粘膜表面诱导调节性T细胞的短链脂肪酸,以促进免疫耐受。然而,这些潜在的控制机制可能会被干扰,并可能在宿主无法启动耐受并以炎症反应的情况下导致疾病,例如当口腔共生菌异位定殖在肠道时。
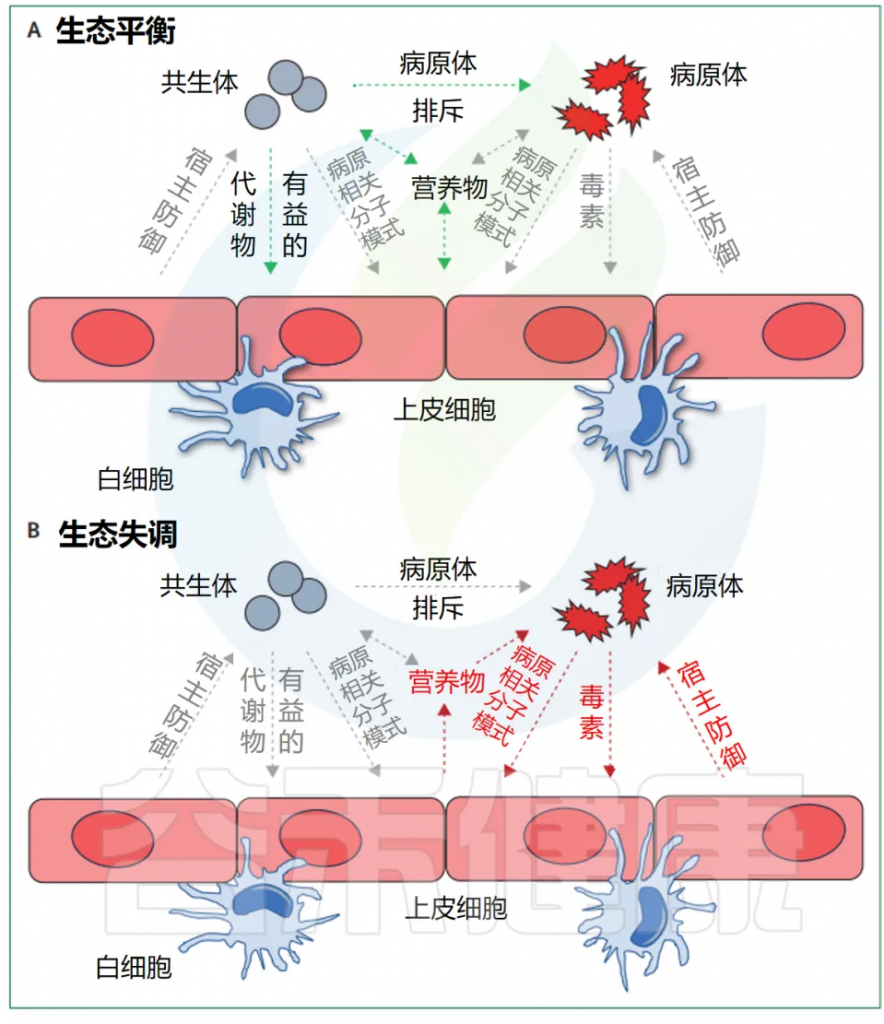
doi.org/10.1016/S2666-5247(24)00049-1
总的来说,宿主相关生态系统中的细菌间的相互作用很大程度上依赖于分泌的因子,这些因子可以通过专门的分泌系统以单独的可溶性分子的形式释放出来,或者作为膜囊泡的组成部分释放出来(上图)。
因此,细菌病原体的分泌毒力因子已经被广泛研究。相比之下,共生菌分泌的初级或次级代谢产物或蛋白质介质如何调节与病原体和宿主的相互作用的研究较少。这些研究显示,例如一些共生菌可以释放杀菌素等分子,消灭金黄色葡萄球菌等病原体,或产生营养物促进艰难梭菌等病原体的扩展,由此凸显了宿主相关微生物生态系统中的一个新的复杂层面。
Fitness mechanisms of facultative human pathogens
许多主要的人类细菌病原体不是专性病原体,而是作为常见微生物组成员定植于人类或动物体表面,但不会引起疾病(下表)。

doi.org/10.1016/S2666-5247(24)00049-1
事实上,在大多数兼性病原体的共生生活方式中,急性感染是罕见的。然而,研究主要集中在S.flexneri、金黄色葡萄球菌、肺炎链球菌等病原体的毒力机制上,而在共生行为期间引导这些生物体与其他微生物组成员竞争的适应性的机制仍然被忽视。
从微生物的角度来看,感染是否以及哪些类型确实对细菌有利,或者应该被视为偶然事件,而不利于它们在几代宿主中的长期进化成功,目前尚不清楚。
Importance of a Deep Understanding of Bacterial Infections
现在比以往任何时候都更需要深入理解细菌感染,因为全球抗菌药物抗性和细菌感染的负担日益增加。目前对细菌感染的了解主要限于少数模型病原体,如金黄色葡萄球菌和肺炎链球菌。相比之下,一些臭名昭著的抗生素抗性细菌种类,根据以下病原体种属的首字母被命名为ESKAPE病原体,包括粪肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、假单胞菌和肠杆菌,这些病原体的研究细节远不够充分。
▸ ESKAPE病原体的持久抗性与适应性进化
抗生素抗性机制在某些情况下可能会给细菌带来适应性的负担,即抗性可能会影响细菌的其他生存能力,但在没有抗生素的环境中,这种抗性通常会消失。然而,一些被称为ESKAPE病原体的细菌已经进化出了一种能力,使它们能够在医疗环境之外保持这种抗性特征。补偿性突变可以帮助这些细菌克服由于抗性而带来的适应性负担,从而促进抗性菌的成功和抗性的传播。
▸ 社区相关的抗性细菌扩散
这就是为什么社区相关的甲氧西林抗性金黄色葡萄球菌(MRSA)和万古霉素抗性屎肠球菌(VRE)等细菌,能够如此有效地在社区中扩散和扩张,甚至以牺牲它们对抗生素敏感的同类为代价,这一现象仍然是科学界未解之谜。这表明这些细菌可能已经发展出了一些未知的机制来维持和增强其抗性,即使在抗生素使用减少的环境中也是如此。这种现象需要进一步的研究来解明其背后的具体机制和因素。
The Relationship Between Bacterial and Ecological Success
生态学概念在普通微生物学和环境微生物学领域很常见,但尚未广泛应用于对病原菌的理解。
细菌在与其他微生物组成员的竞争中的成功依赖于多种机制,包括利用生长限制性营养物质的能力,从其他细菌那里获取促进生长的共同物质如聚合物水解酶或微量金属捕获剂,抵抗由微生物群体成员释放的抗菌分子,或者附着在少数上皮细胞附着点上。
一个细菌种类或菌株的长期生态成功来自于该种类在特定宿主体内的增殖和向新宿主体传播的综合效应。为了研究一个种类在特定宿主体内的增殖,应采用一系列研究策略,从共生菌的研究到对主要专业和偶发病原体的调查。
细菌有两种主要的传播方式:垂直传播和横向传播。
每个人体内都有大量细菌,它们组成了独特的微生物组。这些细菌有的倾向于垂直传播,有的倾向于横向传播,不同细菌的传播方式和速度是不一样的。
2022年的一项研究就发现,微生物组中的细菌在这两种传播方式的偏好上有所不同。我们已经对一些常见的致病细菌的横向传播有了较多了解,比如幽门螺杆菌、肺炎链球菌、金黄色葡萄球菌等。它们能在人群中快速传播,传播过程也被很好地监测和记录。但目前对这些细菌是如何在人体外存活,又是如何进入新的人体的,还不太清楚。
The association between the epidemic spread of pathogens
主要病原体的流行扩散很可能与它们引起的感染类型和严重程度有关(下图)。
▸ 感染类型
疾病特性对细菌传播的贡献在引起腹泻的病原体(如志贺氏菌)中最为明显,这类病原体通过污染的污水传播而获益。
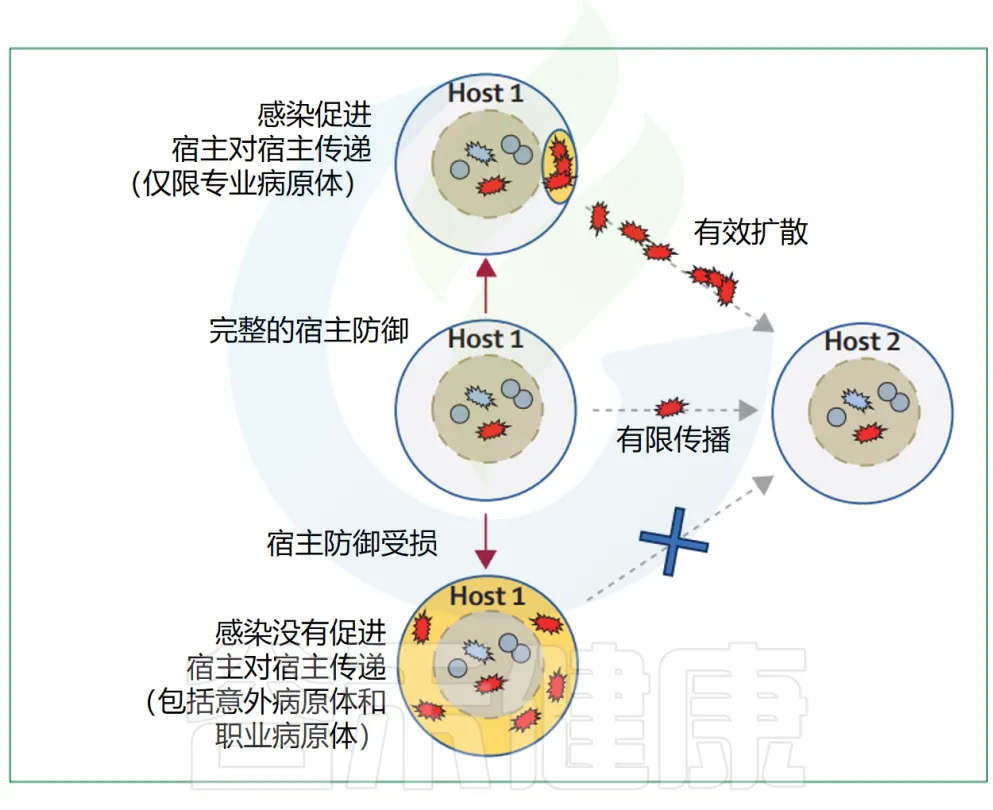
其他常见的感染表现可能也具有类似的作用。例如,金黄色葡萄球菌引起的典型感染——化脓性皮肤和伤口感染,会导致大量的S.aureus细胞在体表出现,从而支持通过皮肤接触的宿主间传播。
类似的机制也可以使尿生殖道病原体,如淋病奈瑟菌Neisseria gonorrhoeae在宿主间迅速传播。引起呼吸道感染的病原体,如百日咳博德特氏菌Bordetella pertussis、化脓性链球菌Streptococcus pyogenes或肺炎链球菌S pneumoniae则通过咳嗽或打喷嚏的个体释放的气溶胶传播。
▸ 严重程度
关于疾病的严重程度如何通过支持传播来增强病原体的适应性已有讨论,例如在SARS-CoV-2的背景下,但尚未对细菌病原体进行系统性评估。值得注意的是,大多数专业化的细菌病原体并非人类微生物组的核心成员,它们只是暂时性地定植在人类体内(见表1),这就需要它们具备有效的横向传播机制。
专业人类病原体(如志贺氏菌和淋病奈瑟菌N.gonorrhoeae)的持续定植在人群中较为罕见,或仅在人群的一小部分(如金黄色葡萄球菌)或特定年龄组(如化脓性链球菌或肺炎链球菌)中发现,这表明维持广泛的致病力涉及与其他微生物组成员竞争时的重大适应性负担。
诸如粪肠球菌(E.faecium)和表皮葡萄球菌( S.epidermidis )等偶然病原体表达的因子有助于其免疫逃避能力,但几乎不表达任何侵袭性毒素,这可能导致这些病原体在人类微生物组中比大多数专业病原体具有更高的患病率和持久性。
由于偶发性病原体主要在免疫力低下的个体中引起感染,它们也常被称为机会性病原体。然而,这一术语也经常用于诸如金黄色葡萄球菌和肺炎链球菌等专业病原体,这些病原体在免疫力低下的个体中引起的感染类型不同且更为严重(通常是血流感染),而在免疫力正常的个体中则不然。因此,专业病原体有时也可能引起偶发性感染,这种感染并不促进病原体的传播。偶发性人类感染也可以由适应于非人类宿主的病原体如军团菌(Legionella pneumophila)或霍乱弧菌引起,这些病原体只在特定的环境条件下感染人类。
The association between the epidemic spread of pathogens
在自然环境中同时研究共生菌和病原体,可以帮助我们更好地控制微生物,对抗感染以及其他与微生物组相关的疾病。
共生细菌对传染病的影响远比先前假设的要复杂得多。一些共生菌种采用主动防御策略,如释放抗菌肽或通过依赖接触的V型、VI型或VII型分泌系统消除其他细菌,这些系统在针对特定目标物种的特异性上可能有很大差异。此外,共生菌还可以使用更微妙的抑制策略来增加其在抗击病原体定植方面的生态成功,这基于代谢干扰。
共生细菌群落可以以依赖于群落多样性及其与病原体的代谢重叠的协作方式,阻止诸如克雷伯肺炎菌和鼠伤寒沙门氏菌等病原体获取营养物。
病原体的排除可能是由于共生菌释放的金属载体螯合必需的微量金属,或产生抑制性代谢产物而产生的。例如,一些肠道共生菌可以将原生胆酸转化为抑制肠道病原体艰难梭菌C difficile孢子生长的次生胆酸代谢产物。
Challenges in Fecal Microbiome Transplantation Treatment
粪便微生物组移植(FMT)是治疗艰难梭菌感染的一种有效策略。粪便微生物组移植成功至少部分是由于恢复了有益细菌群及其代谢产物,这些代谢产物能抑制艰难梭菌的生长。然而,粪便微生物组移植难以标准化,其对抗其他病原体的效果仍不明确。
目前,临床前和临床试验正在评估使用基于共生菌的生命治疗产品来预防处于风险中的个体被抗生素耐药病原体定植。然而,那些防止病原体定植的共生菌往往比目标病原体更易受抗生素影响,这可能会消除共生菌的有益效果,并在抗生素治疗期间加剧与菌群失调相关的疾病。
因此,研究人员需要平衡使用共生菌治疗产品的风险和好处。深入了解不同共生菌菌株对抗生素的敏感性,以及这些菌株如何与目标病原体相互作用。只有通过深入的研究和严格的监测,才能确保共生菌的治疗潜力得到充分发挥,同时避免不良后果的发生。
系统评估关键共生菌群的抗生素敏感性,并将这些知识纳入个性化的、基于微生物组的抗生素管理方案中,对于最小化广谱抗生素对微生物组的附带伤害至关重要。
除了我们通常使用的抗生素之外,许多针对人类的其他药物也可能意外地影响到人体肠道中的有益细菌。这种药物的副作用在未来的医疗实践中需要被特别注意,特别是对于那些需要同时使用多种药物治疗多种疾病的患者。此外,人体内的微生物群体本身可能是一种新型抗菌剂的重要来源。通过系统地研究和描述这些微生物产生的创新化合物,我们可能会发现新的药物,这些药物有望用于预防或消除病原体在人体内的定植。
Antibiotic Resistance Issues in Treatment
在现代医疗中,我们常用的广谱抗生素不仅攻击病原体(引起病症的微生物),还会影响到人体内的有益共生细菌。这种广泛的攻击会导致细菌之间的抗药性基因传递,特别是通过一些可以在不同细菌间转移的元素,如质粒和噬菌体。这种基因的传递可能导致抗生素更难以消灭病原体。
由于这种抗药性基因的传递,需要更好地监控不仅是病原体的抗药性发展,也要监控那些可能是抗药性传播者的共生菌。这样可以更有效地控制病原体的传播和抗药性的发展。
此外,通过理解这些微生物之间的生态关系,可以更好地发现病原体的弱点,从而开发出新的治疗方法。
这些方法不仅限于传统的抗生素,还包括能够利用有益共生菌或宿主防御机制的新型药物。这些新药物的开发需要在模拟真实生态环境的实验模型中进行,比如使用人类挑战模型,这种模型允许我们在受控的环境中测试病原体和治疗方法。
总之,通过更好地理解微生物之间的相互作用和生态平衡,可以开发出更有效的策略来对抗病原体,同时减少对有益共生菌的损害。这种方法有助于限制病原体的传播和疾病的爆发。
主要参考文献:
Maier L, Stein-Thoeringer C, Ley RE, Brötz-Oesterhelt H, Link H, Ziemert N, Wagner S, Peschel A. Integrating research on bacterial pathogens and commensals to fight infections-an ecological perspective. Lancet Microbe. 2024 Apr 9:S2666-5247(24)00049-1. doi: 10.1016/S2666-5247(24)00049-1. Epub ahead of print. PMID: 38608681.

谷禾健康


↑出现以上症状,可能是身体缺乏蛋白质的信号。
★ 蛋白质有多重要?
蛋白质不仅是构建人体组织的主要原料,而且对新陈代谢至关重要。膳食蛋白质及其代谢产物氨基酸是人类的必需营养素。
蛋白质提供能量,调节代谢;我们的皮肤、骨骼、毛发都有它的参与;当然免疫系统也少不了它。
★ 肠道菌群参与蛋白质代谢
肠道微生物群介导蛋白质代谢和宿主免疫反应之间的相互作用,在代谢过程中发挥重要作用。
小肠细菌能代谢部分氨基酸,进而影响宿主整体氨基酸的代谢。大肠拥有更丰富的菌群和更长的蠕动时间。
一方面,进入大肠的氮营养素会影响大肠菌群的代谢和群落结构;另一方面,大肠菌群也能广泛参与氮营养素的代谢与利用,生成许多代谢产物,进而影响人体健康。
因此,本文详细讨论蛋白质对人体的影响,肠道菌群与蛋白质的相互作用,肠道微生物群代谢产物的影响,文末有人体对蛋白质的需求量及相关食物补充说明。
我们先来看一下蛋白质的消化分解过程。
蛋白质的消化分解
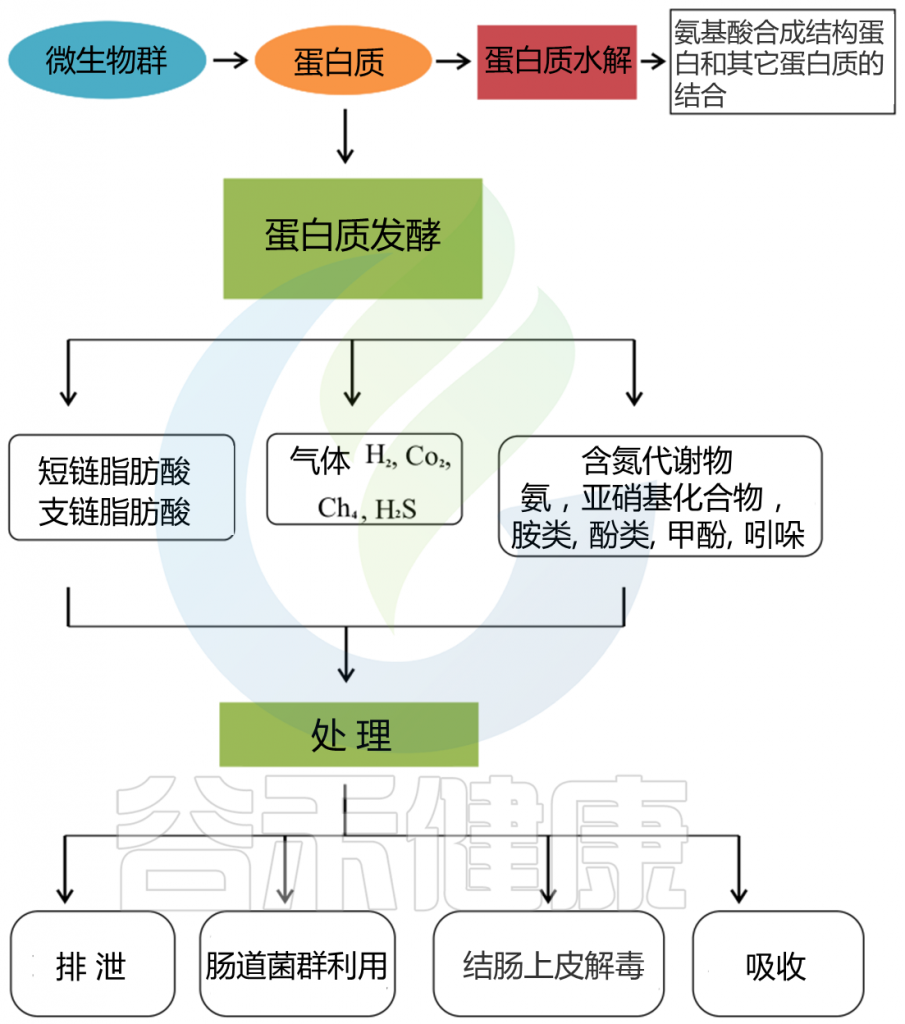
小肠上皮细胞消化膳食蛋白质,然后吸收氨基酸和肽是一个高效的过程。高可消化的蛋白质可能部分逃脱小肠的消化,大量的含氮物质可能从小肠转移到大肠。未消化的蛋白质和多肽通过肠道微生物和残留的胰腺蛋白酶进行蛋白水解,产生大量的微生物代谢物。
胃肠道中的蛋白质分解代谢物
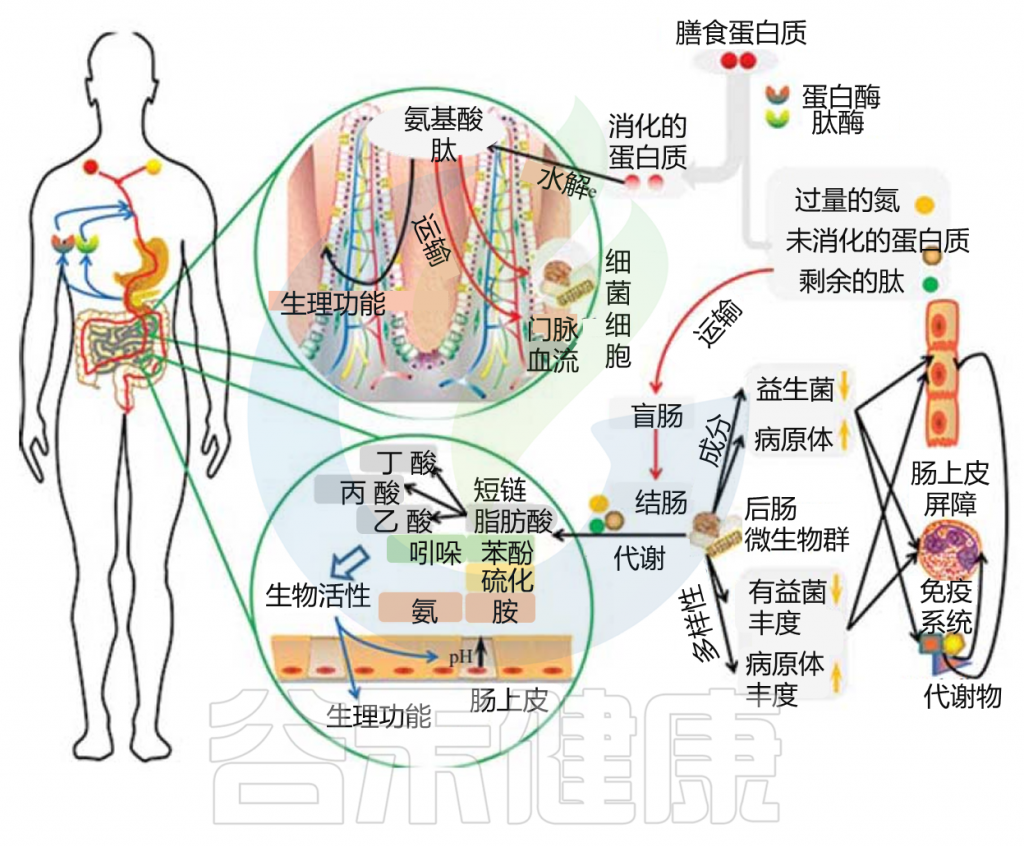

Zhao J, et al., Curr Protein Pept Sci. 2019
这些微生物代谢物中有些是中间产物,有些是最终产物。大量的最终产物主要是短链脂肪酸、氨、多胺、硫化氢、酚类和吲哚类化合物。
这些细菌代谢物中的一些可以被运输到结肠细胞,并根据其在腔内的浓度对这些上皮细胞产生有益或有害的影响。一些细菌代谢产物被输送到门脉血,对肝脏和周围器官组织产生各种生理作用(这些代谢物在健康中发挥的作用详见本文后面章节)。
肠道微生物群在膳食蛋白质分解代谢中作用
宿主饮食对肠道微生物群的分布和活性有很大影响。膳食蛋白质或氨基酸调节可作为调节发酵细菌的一种方法。
在研究不同动物蛋白质来源(牛肉、鸡肉和鱼类)对人类粪便微生物群的影响的研究中,与牛肉蛋白孵育2天后,产气荚膜梭菌的数量显著增加,双歧杆菌的数量显著减少。
微生物分泌的酶直接降解分解蛋白
肠道微生物群在促进氨基酸调节以及氨基酸消化和吸收过程中的分泌方面起着至关重要的作用。
蛋白质的转换主要发生在肠道中,结肠细菌降解内源性或外源性蛋白质的效率较高。
拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。
粪便微生物群与结肠微生物群具有不同的蛋白水解活性。粪便微生物的活性仅在球状蛋白质的蛋白质水解方面较高。
发酵过程中,复杂蛋白质首先被各种细菌肽酶、蛋白酶和内肽酶切割,释放出游离氨基酸和短肽。氨基酸和短肽然后进行发酵。蛋白质发酵产生支链脂肪酸(2-甲基丁酸酯、异丁酸酯、异戊酸酯)、有机酸、气体(H2和CO2)以及微量酚、胺、吲哚和氨。
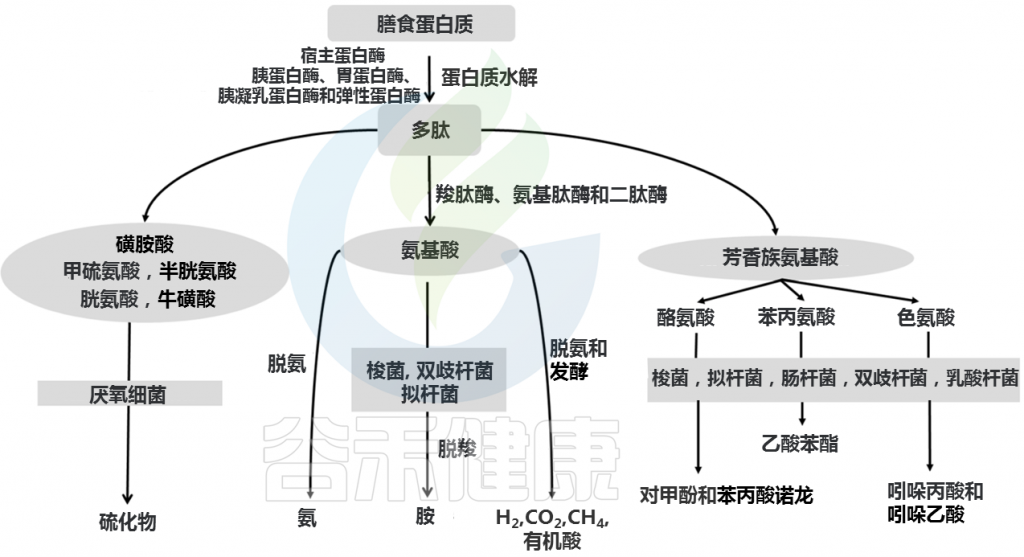

Yadav M, et al., Arch Microbiol. 2018
肠道微生物参与氨基酸代谢
一些菌群可能在肠道中的氨基酸代谢中发挥重要作用,例如梭杆菌属、拟杆菌属和韦荣球菌,Megasphaera elsdenii, Selenomonas ruminantium.
肠道内的梭菌属细菌(赖氨酸或脯氨酸利用的基础细菌)是氨基酸发酵的关键驱动因素,而消化链球菌属细菌是谷氨酸或色氨酸利用的关键驱动因素。
其他例如瘤胃细菌,Selenomonas ruminantium, Megasphaera elsdenii, Prevotella ruminicola, Misuokella multiacidas, Butyrivibrio fibrisolvens, Streptococcus bovis等含有极为活跃的二肽基肽酶和二肽酶。
微生物从头合成氨基酸
肠道微生物群在产生氨基酸方面也起着关键作用,这包括从头生物合成。
例如,一些体外研究项目表明,瘤胃细菌种类,如Streptococcus bovis,Selenomonas ruminantium, Prevotella bryantii,在生理肽浓度存在的情况下参与氨基酸的从头合成。

Lin R, et al., Amino Acids. 2017
体内研究还表明,微生物衍生的赖氨酸(一种必需氨基酸)被吸收并并入宿主蛋白质。在无菌和常规化大鼠体内,将15NH4CL中的15N并入赖氨酸的比较表明,检测到的所有15N赖氨酸均来自微生物来源。在后续研究中,这些研究人员确定约75%的微生物15N标记的赖氨酸被小肠吸收。
此外,其他体内研究项目表明,微生物衍生的赖氨酸被吸收并整合到宿主蛋白质中。与动物研究相一致,六名健康男性的样本以15NH4Cl的形式口服15N与标记肠道微生物来源的微生物蛋白和苏氨酸有关,这些微生物来源存在于活体门静脉血流中。
对18岁以上的人样本进行了检查,这些人被提供了氮充足的饮食,并发现微生物衍生的赖氨酸和苏氨酸对游离血浆赖氨酸和苏氨酸库有显著贡献。
此外,Gill等人报告说,大肠中微生物群的富集是通过与必需氨基酸(EAA)生物合成相关的基因进行的,该生物合成基于人血浆池产生的前体。
蛋白质或氨基酸摄入对肠道微生物的影响
膳食蛋白质是均衡饮食的重要组成部分。人类无法合成多种氨基酸,因此这些氨基酸必须从食物中获取以维持健康。胃肠道微生物群组成和功能的差异可能是由于膳食蛋白质的变化。
进入结肠的蛋白质量和尿液中检测到的发酵代谢物量取决于蛋白质的消化率,蛋白质消化由蛋白质水平和来源的共同作用决定。
当进展到结肠的远端部分时,碳水化合物被消耗,pH值增加,蛋白质发酵变得更加有效。在消化过程中,蛋白质摄入量的增加总是与消化率的相对降低有关,通常会导致更多可发酵的大量营养物质进入结肠。
不同形式蛋白对肠道微生物群影响不同
蛋白质来源主要来自植物或动物来源,每种类型都具有独特的消化率和不同的降解模式,具体取决于所涉及的微生物。结肠中的细菌属参与蛋白质代谢,主要包括可能致病的拟杆菌属、大肠杆菌属和梭菌属。抑制这些潜在病原体通常与通过减少肠毒素和有害微生物代谢物的释放来恢复微生态系统平衡有关。
考虑到蛋白质来源在消化中的作用,动物来源的蛋白质,如乳品和动物蛋白的消化率普遍高于植物蛋白。然而,酪蛋白的热分解显著降低了蛋白质的消化率,增加了蛋白质的发酵程度。下面就详细来看蛋白质来源如何调节肠道微生物群。
植物蛋白
与动物蛋白相比,植物蛋白通常具有较低的蛋白质消化率,因为植物细胞壁不能消化。大豆和花生蛋白都在调节肠道有益细菌组成方面有积极的作用。
添加20%花生蛋白的饲粮改变了大鼠肠道菌群多样性,增加了双歧杆菌,降低了肠杆菌和产气荚膜梭菌的数量。增加的双歧杆菌有助于产生更多的微生物代谢物,包括乙酸和乳酸,导致肠道pH值降低,抑制有毒代谢物,如胺和苯并吡咯。
大豆已被广泛应用于人类和动物,它可以改变肠道微生物的组成,增加了埃希氏杆菌属和丙酸杆菌。系统发育分析显示,埃希氏杆菌属与志贺菌的同源性最高,两者都能在不损害肠道黏膜的情况下调节盐和水的代谢。但大豆中含有的抗营养因子会对生产性能产生负面影响,限制了其在非反刍动物中的应用。
植物蛋白被用于动物饲料行业,因为它的价格普遍低于动物蛋白,并且在食品安全方面具有一些优势。
动物蛋白
与植物蛋白相比,动物蛋白对于牲畜来说是高度易消化的。酪蛋白、脱脂奶粉和鱼粉通常用作猪的饲料,它们可以被消化成丰富的蛋白质底物并在到达大肠之前被吸收。这些动物蛋白的代谢特性有利于宿主健康,特别是,对环境应激导致仔猪断奶后腹泻的预防作用及一些植物蛋白中的抗营养因子。
酪蛋白可以被近端肠道中的宿主酶消化,从而减少大肠中细菌的降解。具体而言,酪蛋白可以增加乳杆菌和双歧杆菌,并减少粪便中葡萄球菌、大肠菌群和链球菌的数量。此外,酪蛋白可以调节直肠真杆菌和Marvinbryantia formatexigens的减少。
补充脱脂干牛奶可以增加总厌氧菌和需氧菌,而膳食鱼粉可以减少需氧菌,包括大肠菌群,并增加厌氧菌的数量,如乳酸杆菌属。
此外,动物蛋白的特点是 短链脂肪酸减少,肠道 pH 值和氨浓度增加。
显然,蛋白质来源对肠道微生物群的影响并不一致,需要更多的研究来评估不同蛋白质类型对蛋白质消化率和代谢以及肠道微生物群组成的影响。
蛋白质摄入量与肠道菌群
膳食蛋白质的浓度是影响蛋白质发酵和肠道微生物组成的主要因素。
更高的水平和未消化的蛋白质会导致致病微生物的增加,从而增加代谢疾病的风险。
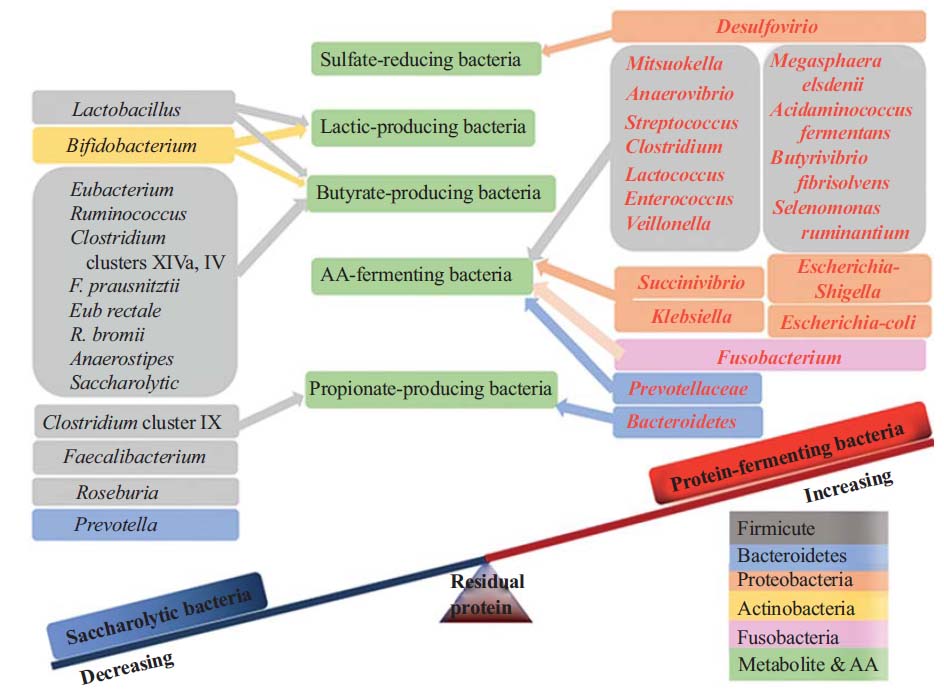

Zhao J, et al., Curr Protein Pept Sci. 2019
未被小肠吸收的残留含氮化合物将被转移到远端肠道,并被该位置微生物代谢。微生物代谢物的数量和种类均受膳食蛋白质摄入量的影响。
有些微生物代谢物是有毒的,例如硫化氢、氨和吲哚化合物,并可能对宿主健康产生负面影响。有些代谢物是参与宿主各种生理过程的生物活性分子。
此外,由于肠道微生态系统的稳态破坏和有益菌的减少,高浓度的蛋白质补充会导致潜在病原体数量增加。膳食蛋白质改变的肠道微生物群,通过调节肠道屏障功能、肠道运动和免疫系统来影响宿主代谢。
结肠中过量蛋白质发酵影响肠道微生物群变化
未消化蛋白质的增加与蛋白质摄入水平高、蛋白质消化率相对降低和氨基酸组成不平衡有关。结肠中多余蛋白质的降解始于细菌蛋白酶和肽酶将蛋白质水解成较小的肽和氨基酸。这些含氮化合物会影响肠道微生物群,尤其是结肠。
-3.png)
稍低蛋白浓度有助于减少大肠杆菌,但蛋白浓度过低会增加潜在致病菌
相对低浓度的膳食蛋白质会减少致病菌增殖的底物量。例如,人类饮食中低浓度的蛋白质导致粘膜表面的大肠杆菌群落减少。在较低蛋白质条件下肠道微生物的变化会产生毒性较小的含氮细菌代谢物,例如多胺。
然而,当饮食中蛋白质的浓度过低而不能满足宿主的基本需要时,就会增加潜在病原体的丰度,减少有益菌的数量。
具体来看一项关于蛋白浓度变化对肠道菌群影响的研究。
断奶动物
蛋白水平适量:
当断奶动物饲喂100-200g/kg的膳食蛋白质时,粪便中需氧菌和厌氧菌的数量会增加,这些蛋白质水平会导致肠道中乳酸杆菌的增加以及大肠菌群和葡萄球菌的减少。
蛋白水平过高:
然而,当膳食蛋白质水平大于 200 g/kg 时,致病菌数量会增加,例如大肠菌群、链球菌和芽孢杆菌。
蛋白水平过低:
低浓度的膳食蛋白质会减少产丁酸菌(这些菌群是抗癌和其他肠道疾病的抗炎剂),包括乳酸杆菌、双歧杆菌、saccharolytic(糖酵解菌)。
成年动物
成年动物中,在蛋白质水平的微小变化下,肠道微生物群相对稳健。例如,当成年动物分别用 190 g/kg 和 150 g/kg 蛋白质喂养时,粪便样本中的细菌数量几乎没有差异。
在成年动物中,只有当蛋白质水平发生重大变化时,才能观察到微生物群的变化。
低蛋白饮食还与低浓度的氨、血浆尿素氮和回肠食糜中的短链脂肪酸含量有关。肠道中的氨不是来自宿主脲酶活性,而是来自蛋白水解和微生物活动。因此,回肠食糜中低浓度的氨可能表明蛋白质代谢降低。
蛋白质发酵产物对肠道微生物的影响
大部分膳食蛋白质在小肠中消化,但蛋白质摄入过多会导致结肠输入量增加。结肠中多余蛋白质的降解始于蛋白质被细菌蛋白酶和肽酶水解成更小的肽和AA,这些蛋白酶和肽酶在中性至碱性pH下更为活跃。这些残余蛋白质不仅提高了肠道pH值,而且还可供结肠微生物进一步代谢。
然而,碱性pH有利于病原体增殖,对肠道健康不利。此外,由于向肠道微生物群过量供应膳食蛋白质而导致的蛋白质发酵也被视为肠道疾病发展的一个因素。
虽然有报道称结肠蛋白输注过多会产生有害影响,仍有一些争议,但似乎较低量的蛋白到达远端肠道可能会降低腹泻的发生率,并抑制病原菌的增殖,特别是在应激情况下,如感染高压。
蛋白质的发酵通常与蛋白质发酵细菌以及潜在致病菌的生长有关。通过培养基分析,至少拟杆菌属和丙酸杆菌以及各种杆菌被鉴定为蛋白水解细菌,其中一些细菌的基因组中携带丝氨酸和其他蛋白酶的基因。
氨基酸为细菌提供代谢底物
饮食和内源性来源的蛋白质和氨基酸对于肠道微生物群的生长和存活是必要。
蛋白质水解后,释放的肽和氨基酸被宿主和胃肠道中的细菌用于各种代谢活动,虽然一些细菌缺乏使用细胞外氨基酸的特定转运体。
胃肠道中许多细菌的理想氮源是氨基酸和NH3,可能是因为它们缺乏必要的肽转运蛋白。然而,如瘤胃前置杆菌等细菌利用肽作为氮的唯一来源。这些肽最初被输送到瘤胃前置杆菌的细胞中,然后直接使用或水解成FAAs。通常,肽、氨基酸和NH3可用于细菌细胞成分的生产或通过各种途径分解代谢。这些过程可能对身体产生有利或不利的影响。
蛋白质摄入与肠道屏障
肠道是一个具有高度蛋白水解活性的部位,主要由微生物群介导。这些蛋白水解代谢物以及肠道微生物(可通过蛋白质水平改变)通过调节紧密连接蛋白和Zonulin在调节肠粘膜屏障中发挥重要作用。
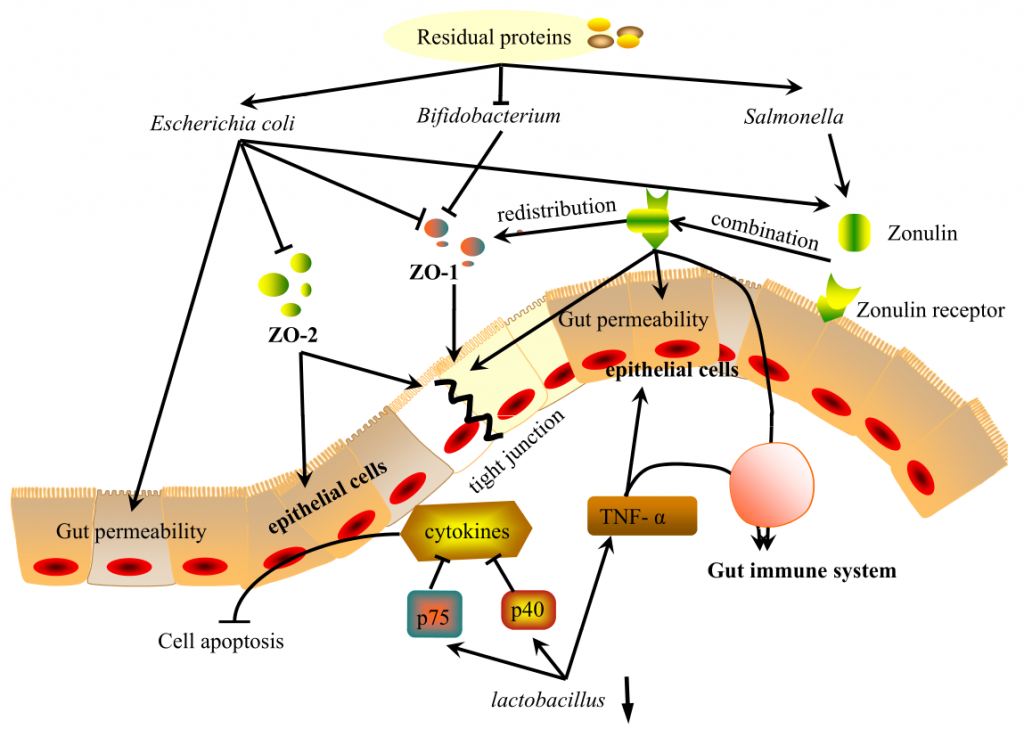

Ma N, et al., Curr Protein Pept Sci. 2017
肠道微生物通过调节紧密连接蛋白ZO-1和ZO-2的表达来影响肠道上皮屏障。研究表明,在高蛋白饮食(HPD)中增加双歧杆菌可有效缓解结肠上皮细胞膜屈曲,上调ZO-1表达,有利于紧密连接修复。
相反,低蛋白饮食(low-protein diet, LPD)或正常蛋白饲粮(normalprotein diet, NPD)通过降低肠上皮通透性,降低大肠杆菌水平,从而上调ZO-1的表达。抑制大肠杆菌生长也可上调ZO-2的表达,从而保护肠上皮细胞,修复上皮屏障。
连蛋白Zonulin是唯一已知的细胞间紧密连接的生理调节剂,可能是微生物群和紧密连接蛋白之间的一种可能的调节剂。
Zonulin可逆且快速地调节肠道通透性,其在遗传易感个体中的上调可能导致免疫介导的疾病。其释放将由细菌数量的变化触发。
在上皮细胞中结合其受体后,该复合物导致紧密连接的开放并增加肠道通透性。
研究人员选择了4种细菌菌株作为兴奋剂,包括3种大肠杆菌菌株和1种沙门氏菌菌株,它们都是病原体,HPD增加。它们都释放了Zonulin并改变了细胞旁通透性。同时,观察到ZO-1从紧密连接复合物重新分布到细胞单层。
此外,不同的细菌会导致不同水平的Zonulin分泌,这会在不同程度上改变肠道屏障功能,反映微生物和肠道之间的急性调节。
氨基酸不均衡会诱发肠道问题
膳食蛋白质中的氨基酸可通过调节肠道微生物群组成间接影响肠道形态。此前有研究报道,低赖氨酸玉米蛋白会导致肠道绒毛高度降低,隐窝深度加深,提示肠道黏膜的损伤是由于饲粮中氨基酸比例失衡所致。
小肠上皮细胞可将氨基酸和其他营养物质吸收到血液和器官中,营养不良对肠道微生物群的干扰和影响可能导致肠道形态受损。
断奶时观察到的腹泻可以通过低蛋白质水平和平衡氨基酸组成来缓解。然而,饮食中氨基酸的不平衡可能损害肠道形态,增加腹泻风险。因此,饮食中氨基酸失衡会抑制蛋白质吸收,导致肠上皮增生。
注意蛋白过敏或不耐受诱发的肠道问题
大豆中的粗蛋白质相对较高,约为40%,主要由球蛋白组成,球蛋白由伴大豆球蛋白和大豆球蛋白组成。这些球蛋白具有免疫原性和热稳定性。
大豆蛋白补充剂中抗原复合物的形成,如大豆球蛋白、β-伴大豆球蛋白和免疫球蛋白抗体,可能是刺激过敏反应和腹泻的原因。大部分膳食蛋白质在消化后降解为肽和氨基酸。
然而,还有一种可能性是,其他分子如一种抗营养因子,可以通过肠上皮细胞进入血液和淋巴。大豆中具有抗原活性的抗营养因子可刺激宿主的免疫应答。
免疫反应由具有IgE分泌的T淋巴细胞介导,其对肠道形态具有负面影响,导致绒毛损伤和隐窝细胞增殖。
此外,上皮细胞中消化酶活性的降低可能与吸收功能失调和肠道微生物群组成多样性减少有关。
由于其抗原性,膳食大豆蛋白可能有利于病原体增殖,这些抗原也可能是对粪便微生物群一致性产生不利影响的因素。
对大豆蛋白的超敏反应可能导致对病原体过度生长的更高易感性,主要包括蛋白质代谢细菌以及肠致病性大肠杆菌。
大豆蛋白和其他植物蛋白通常含有抗营养因子,包括可溶性非淀粉多糖含量升高,可能增加断奶仔猪腹泻的发生率。
在大豆蛋白质代谢过程中,会产生各种毒素,如组胺、尸碱和腐胺,这些毒素会破坏肠壁,增加肠上皮细胞的通透性。当病原体在管腔内定植时,可能发生肠道微生态失调。
大豆蛋白被认为是一种相对健康的蛋白质来源。大豆经加工处理后,抗原活性有所降低,抗营养因子显著降低。Pepsin-hydrolysate conglycinin (PTC)是一种治疗后从球蛋白中提取的小肽,具有降低高血压、抗氧化和免疫刺激等药理和生理活性。
伴大豆球蛋白是大豆贮藏蛋白的组分之一,经消化和酶处理后以PTC的形式发挥作用。PTC可以抑制病理性大肠杆菌的生长,无时间依赖性,并且在 大肠杆菌E. coli O138激发后也被激活以预防疾病。
伴胰球蛋白-胃蛋白酶水解物参与调节肠道微生物群落平衡和维持肠道完整性。当肠道微生态系统的稳态受到干扰时,生物活性肽可在预防与肠道疾病相关的疾病中发挥重要作用。PTC还通过产生胃蛋白酶介导的双歧杆菌生长刺激肽促进双歧杆菌的生长。然而,PTC对E. coli O138的抑制作用的潜在机制尚不清楚,需要进一步的研究来阐明。
酪蛋白与肠道微生物群
酪蛋白具有特殊的氨基酸组成,可以诱导肠道氨基酸转运蛋白基因的转录水平。肠道微生物群的组成和功能也受到氨基酸平衡改变的影响。
CAT1
阳离子氨基酸转运蛋白(CAT1)参与赖氨酸和精氨酸的转运。研究表明,对十二指肠和回肠中的CAT1没有显著影响。相反,与空肠中的膳食玉米醇溶蛋白相比,补充酪蛋白的CAT1表达水平更高。
因此,可以合理地得出结论,酪蛋白可促进赖氨酸和精氨酸的积累,这与补充酪蛋白的赖氨酸含量高于膳食玉米醇溶蛋白的报告一致。
肠道中赖氨酸和精氨酸的变化可能有助于酪蛋白对肠道微生物群的影响。CAT1的表达随着饮食中赖氨酸水平的增加而上调。
EAAC1
兴奋性氨基酸载体1(EAAC1)参与天冬氨酸和谷氨酸的转运,其作用类似于CAT1。EAAC1在十二指肠中的表达水平被膳食玉米醇溶蛋白下调,而在空肠和回肠中,补充酪蛋白的EAAC1表达水平高于玉米醇溶蛋白或大豆蛋白。
PePT1
此外,肽转运蛋白1(PePT1)的表达也受到不同蛋白质来源的调控。与植物蛋白相比,膳食酪蛋白在所有肠段都有更高的PepT1表达。
因此,具有平衡氨基酸组成的膳食酪蛋白可以促进氨基酸和肽转运蛋白的表达。这种表达可以加速功能性氨基酸在肠道环境中的运输。
赖氨酸、天冬氨酸和谷氨酸在管腔中的浓度受不同蛋白质来源的不同处理的影响。这些变化可以影响特定代谢物的衍生和转化途径,改变生理功能,改变肠道内的微生态平衡。
氨基酸还通过合成细菌蛋白质以及与肠道微生物群的相互作用对微生物组成起重要作用。
菌群发酵蛋白质主要副产物
短链脂肪酸
短链脂肪酸(SCFA)是细菌在大肠内代谢的最终产物,主要成分为乙酸、丁酸和丙酸。短链脂肪酸的基质主要来自膳食纤维和抗性淀粉。
然而,未消化的蛋白质也是短链脂肪酸产物的底物。膳食蛋白质在大肠中释放的几种氨基酸是短链脂肪酸合成的前体。肠道微生物可以从甘氨酸、丙氨酸、苏氨酸、谷氨酸、赖氨酸和天冬氨酸中产生乙酸盐。
谷氨酸和赖氨酸可以合成丁酸,丙氨酸和苏氨酸可以合成丙酸。
短链脂肪酸产物的数量和形态主要取决于营养物质的底物可得性、肠道菌群组成和肠道传递时间。短链脂肪酸是已知的氧化和使用作为燃料的结肠上皮。
此外,SCFA可以靶向游离脂肪酸受体(FFAR)配体转运到结肠肠细胞,FFAR代谢感知的激活在调节肠道脂肪沉积和营养物质吸收中发挥重要作用。
短链脂肪酸与肠道血流相互作用,促进5-羟色胺的释放,这可能受到肠道-脑内分泌轴的调节。这有助于增加肠道运动和离子转运,从而改变肠道菌群组成和免疫防御。
SCFA参与多种生理过程,在维持肠道完整性、葡萄糖稳态和食欲调节中发挥重要作用。除了为结肠细胞提供能量外,丁酸盐也是SLC5A8的底物。该蛋白编码基因抑制组蛋白去乙酰化酶的活性,而组蛋白去乙酰化酶是一种表观遗传调节因子,在多种肿瘤中诱导细胞凋亡。丁酸可以通过上调宿主防御肽的表达来刺激中性粒细胞群体,有利于破坏病原体,增强抗病能力。
氨
氨在大肠中以毫摩尔浓度存在。与远端结肠相比,近端结肠的特点是pH值低,碳水化合物含量高。因此,从升结肠到降结肠,氨浓度升高,这与远端结肠的蛋白质代谢率高于近端结肠是一致的。
大肠中的氨浓度主要是与氨基酸脱氨和尿素水解有关的微生物代谢物。肠道菌群可利用氨,氨可被上皮细胞吸收。尿素在肠道内的水解是通过细菌脲酶活性进行的。
虽然幽门螺杆菌的脲酶活性已经得到了充分的研究,但关于其他大肠微生物的脲酶活性的信息却很少。最近的一项研究报道,部分氨被谷氨酰胺合成酶的活性与l -谷氨酸缩合,使谷氨酰胺合成。这是一种可能的机制,以控制氨细胞内浓度在结肠细胞。
硫化氢 (H2S)
硫化氢(H2S)是蛋氨酸、半胱氨酸等含硫氨基酸发酵产生的一种微生物代谢物。H2S也来源于无机硫酸盐和亚硫酸盐添加剂的还原,以及肠道磺胺类物质的分解代谢。
肠道微生物能够通过脱硫酶从半胱氨酸碳链中获得能量。甲硫氨酸可转化为α-酮丁酸酯、氨和甲硫醇。这些代谢物归因于一个特定的分类组的细菌,包括大肠杆菌、肠沙门氏菌、梭菌和产气肠杆菌,通常在大肠中发现。
肠杆菌、肠球菌、肠链球菌、梭杆菌和真细菌能够发酵含硫氨基酸。
多胺
多胺是由精氨酸、鸟氨酸和蛋氨酸等氨基酸前体的结肠细胞产生的聚阳离子分子。从结肠癌中分离出来的结肠上皮具有高的多胺合成能力,这可能是由于肿瘤细胞持续有丝分裂需要高的多胺。
肠道微生物可从鸟氨酸、精氨酸、赖氨酸、酪氨酸和组氨酸等氨基酸前体产生腐胺、胍胺、尸胺、酪胺和组胺等多种多胺。
多胺参与细菌细胞的生长、增殖、分泌和运输活动。大肠生态系统中能够产生多胺的大肠细菌有多种,包括拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、Veillonella、双歧杆菌属(Bifidobacterium)和梭状芽胞杆菌属(Clostridium)。因此,肠道菌群组成是影响结肠多胺分布和分配的因素之一。
苯酚和吲哚
结肠中苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸可被特定的肠道微生物代谢为酚类和吲哚类化合物。
然而,芳香氨基酸的代谢与结肠微生物群的特定组分之间的相互作用还没有充分的研究。一些代谢产物如酚和吲哚,被怀疑为共致癌物和结肠癌促进剂。
已知发酵芳香氨基酸的厌氧菌包括大肠中的拟杆菌、乳酸菌、双歧杆菌、梭状芽胞杆菌和胃链球菌。与结肠中的其他氨基酸相比,芳香氨基酸在细菌中代谢缓慢。它们可以生产一系列的酚类和吲哚类化合物作为最终产品,如对甲酚、吲哚、酚和粪臭酚。
据报道,酪氨酸可产生苯酚和对甲酚,而苯乙酸和色氨酸在人体浆发酵过程中分解为吲哚乙酸盐和吲哚。
在一项研究中,远端结肠中的酚类化合物浓度增加,表明大肠远端区域的氨基酸代谢较高。吲哚和酚类代谢物的浓度取决于细菌产生率和结肠吸收率之间的平衡。酚类化合物似乎大部分被结肠内容物吸收。它们在从管腔转移到血液和肝脏的过程中部分代谢,最后通过尿液排出。
对无菌和常规小鼠血浆代谢物的对比分析表明,无菌小鼠的色氨酸和酪氨酸水平至少增加了1.5倍。涉及这些芳香族氨基酸的细菌代谢产物包括硫酸吲哚氧基、硫酸苯酯、硫酸对甲酚和苯丙酰甘氨酸,仅在常规小鼠中发现。
关于酚类和吲哚类化合物对结肠上皮细胞的影响知之甚少。体外实验表明,苯酚会降低屏障功能的完整性。需要注意的是,当苯酚浓度高于1.25 mM时,它会损害结肠上皮细胞。
如果蛋白质摄入过量,或者肠道里消化蛋白质的菌群构成不理想,那么蛋白质发酵发生的胺,硫化氢,苯酚等肠道毒素过量积累,会诱发肠道炎症,便秘,腹胀等问题,因此正确摄入适量优质蛋白对于维持肠道菌群和身体健康很重要。
蛋白质摄入要因人而异
实际上,我们摄入的一些蛋白质可以转化为葡萄糖,特别是当蛋白质的消化速度快且人体糖原储存量低时,有些蛋白质可以被微生物群发酵,特别是当蛋白质的消化速度慢时。
每个人对蛋白质的需求量各不相同,比如经常运动人群和久坐人群对蛋白质的需求量不一样,孕妇、老人、儿童、肥胖等群体都有各自不同的需求。当然,每个人的不同状态对蛋白质的需求量也都不同,比如爬山的一天,和在家刷剧的一天,也是不一样的。
因此,我们说最佳每日蛋白质摄入量取决于你的身高体重、健康状况、目标、身体活动水平。
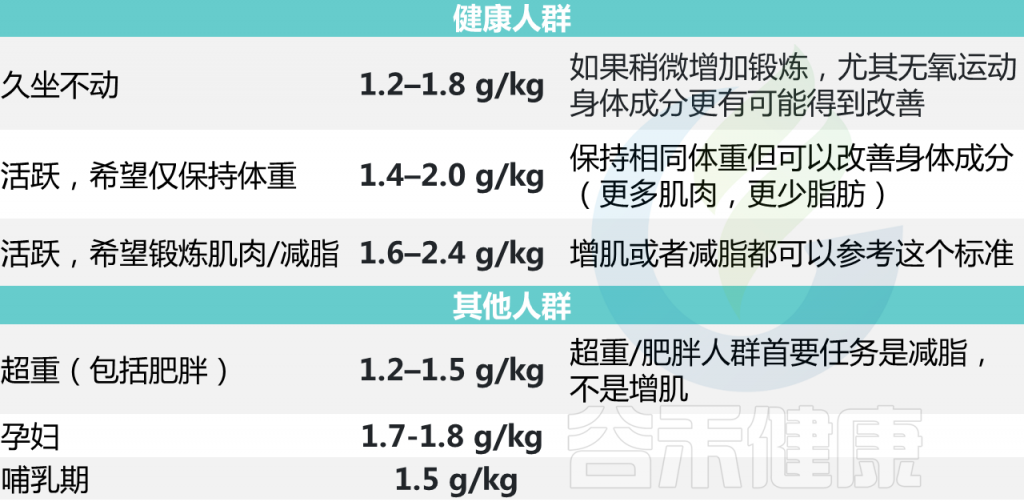

素食主义者对蛋白质的需求较高,因为植物蛋白在生物利用度上通常不如动物蛋白。植物蛋白消化率为 60-80%,而动物蛋白消化率超过90%.
注意植物蛋白的较难消化吸收
因为植物含有抑制蛋白质消化和吸收的抗营养物质,如胰蛋白酶抑制剂、植酸盐和单宁。虽然烧熟后确实降低了抗营养物质的浓度,但并不能完全消除它们。
另外,植物性蛋白质也含有限制性氨基酸,这些氨基酸是必须氨基酸但数量太少,以至于不够蛋白质的合成所需。
注:限制性氨基酸是指食物所含必需氨基酸的量与动物所需的蛋白质必需氨基酸的量相比,比值偏低的氨基酸。比如说一种食物里特别缺少某一种氨基酸,即使其它的氨基酸含量很高,因为这个氨基酸导致它的各个氨基酸比例不平衡。人体对这种食物的吸收依然不理想,这种氨基酸就叫限制性氨基酸。
结合不同的植物性蛋白质可以帮助弥补它们各自的不足。
摄入蛋白注意其氨基酸构成
比如说,赖氨酸是最常见的限制性氨基酸,特别是在谷类中,如小麦和水稻。坚果往往也含有赖氨酸作为限制性氨基酸。另一方面,豆类含有足够的赖氨酸,可以弥补,但缺乏硫氨基酸,如蛋氨酸和半胱氨酸。
蛋白质能否被人体吸收利用,还应该考虑蛋白质的氨基酸组成。
因此,了解一下评估蛋白质的另一个标准:氨基酸的组成。
氨基酸组成
蛋白质由氨基酸组成,身体可以合成其中一些氨基酸,而另一些则不能。
需要但不能合成、需要从食物中摄取的九种氨基酸被称为必需氨基酸(EAA)。
氨基酸:成人的需求和不同食物的含量
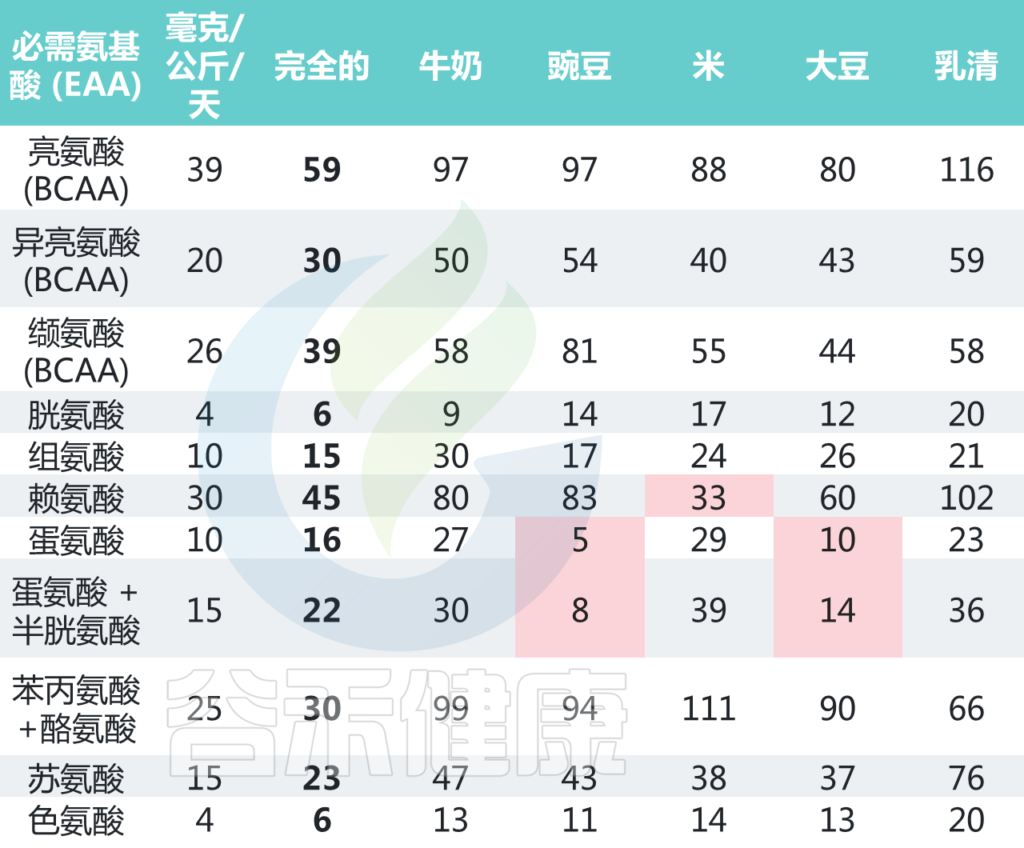
World Health Organization. Protein and Amino Acid Requirements in Human Nutrition
人群范围蛋白质摄入量如何?
使用谷禾检测人群,基于肠道菌群分析营养膳食摄入构成,图中给出了蛋白质占总能量摄入的占比,正常比例在10~20%范围。可以看出0~3岁蛋白质占比较高,3~15岁蛋白质占比较低,80~100岁比例又进一步下降。
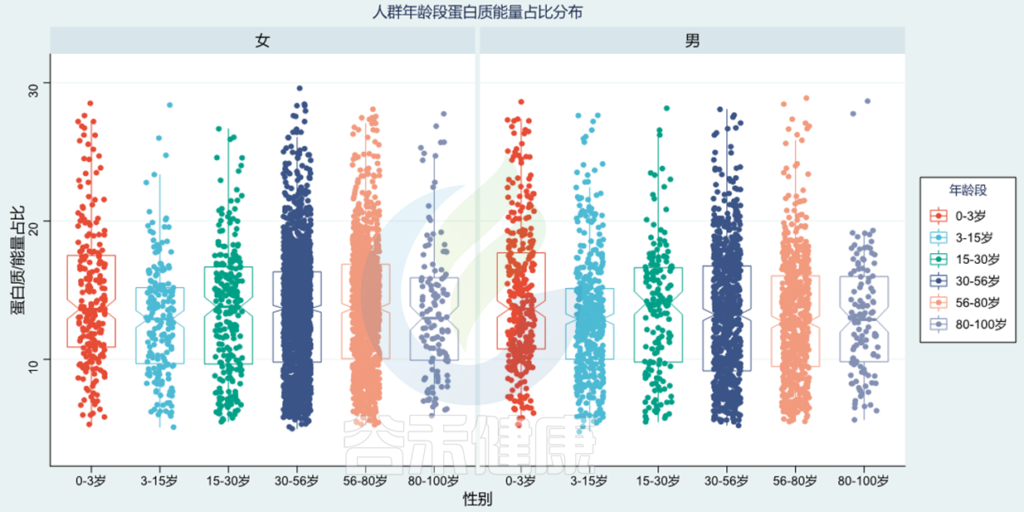
<谷禾健康肠道菌群检测数据库>
结 语
蛋白质代谢与肠道菌群密切相关。膳食蛋白质在小肠中被蛋白酶和众多肽酶代谢,膳食蛋白质释放的氨基酸可用于肠道微生物合成蛋白质。这反过来又促进了饮食、微生物群和宿主之间的氮循环和利用。
不同的细菌有不同的代谢能力,依靠我们摄入的营养物质繁殖生存,其中拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。通过肠道菌群检测评估的蛋白质摄入水平显示不同人蛋白质摄入及营养占比差异很大,过高或者过低均伴随肠道菌群问题,包括过低导致潜在病原体数量增加,有益菌减少,同时导致部分氨基酸缺乏,过高又导致例如大肠菌群、链球菌和芽孢杆菌增殖,蛋白质发酵产生的副产物如,腐胺,苯酚,硫化氢等增诱发便秘,腹痛等健康问题。
除了蛋白质的摄入量,不同的蛋白形式,如植物蛋白,乳蛋白、动物蛋白以及蛋白质与其他营养摄入的相对比例构成,如膳食纤维、抗性淀粉、脂肪、微量元素等的比例都会影响肠道菌群进而反过来影响其消化降解,改变氨基酸的合成和代谢,最终影响宿主营养代谢健康。
总之,我们提倡膳食平衡,没有特殊情况不建议盲目补充蛋白粉等,建议从膳食结构调整保证营养均衡,从而使各种营养都能达到生长发育和身体健康的生理需要量,这同时要关注肠道菌群状况,因为他们是相辅相生。
常见食物中氨基酸含量见附录。
附录
供人类食用的植物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸) mg/g
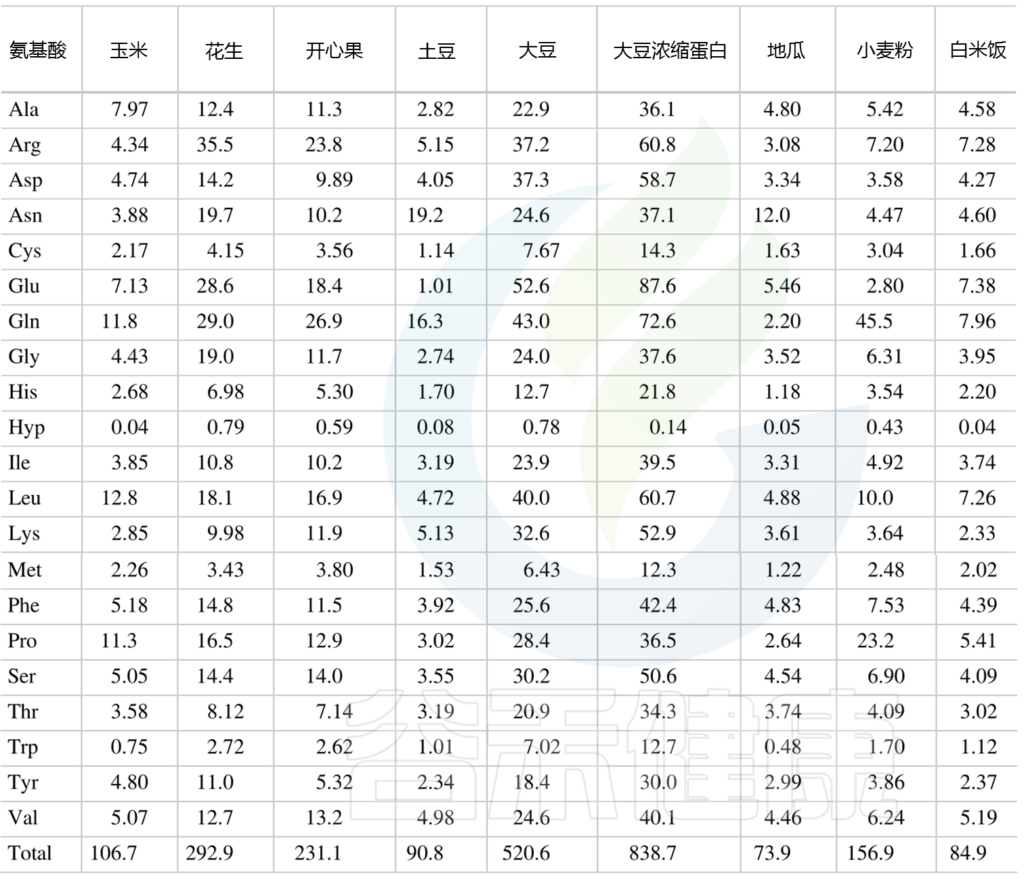
Amino Acids in Nutrition and Health, 2021
人类动物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸)mg/g
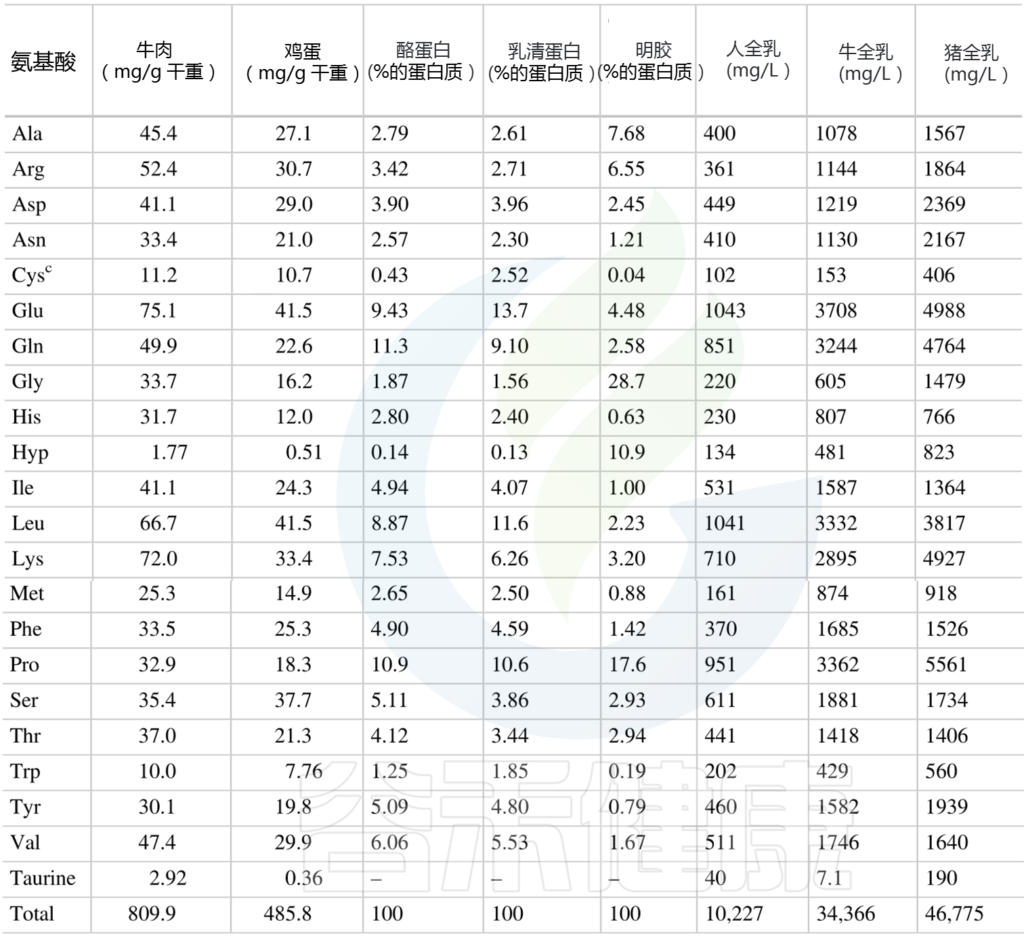
Amino Acids in Nutrition and Health, 2021
主要参考文献:
向上滑动阅览
Abdallah A, Elemba E, Zhong Q, Sun Z. Gastrointestinal Interaction between Dietary Amino Acids and Gut Microbiota: With Special Emphasis on Host Nutrition. Curr Protein Pept Sci. 2020;21(8):785-798.
doi: 10.2174/1389203721666200212095503. PMID: 32048965.
Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808.
Yadav M, Verma MK, Chauhan NS. A review of metabolic potential of human gut microbiome in human nutrition. Arch Microbiol. 2018 Mar;200(2):203-217. doi: 10.1007/s00203-017-1459-x. Epub 2017 Nov 29. PMID: 29188341.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154.
Lin R, Liu W, Piao M, Zhu H. A review of the relationship between the gut microbiota and amino acid metabolism. Amino Acids. 2017 Dec;49(12):2083-2090. doi: 10.1007/s00726-017-2493-3. Epub 2017 Sep 20. PMID: 28932911.

谷禾健康
一个多世纪前,埃利·梅奇尼科夫提出了人类健康和预期寿命可以通过操纵肠道菌群来改善的概念。
现在,科学家们已经将目光投向了如何利用微生物来促进人类健康。
来自美国国立卫生研究院国家过敏症和传染病研究所的Stacy及其同事的最新研究表明,有感染史的肠道菌群能够为宿主提供更强的抗感染力。也就是说急性感染后,共生微生物群也可以被“训练”以增强对异源感染的定植抗性。
定植抗性:微生物群阻碍病原体入侵肠道生态系统,这种现象称为定植抗性。定植抗性是肠道微生物群的原始功能之一,为宿主提供了明显的益处。
训练免疫:感染或免疫可以重新编程先天免疫细胞,产生对后续感染具有广泛保护作用的记忆反应,这一过程被称为“训练免疫”。
肠道微生物群是宿主防御网络的基础。除了塑造免疫系统的发展和维护,共生微生物通过战胜病原体获得必需的营养物质和分泌抗生素来确保宿主(和它们自己)的生存,这些因素共同使肠道成为入侵的病原菌不可生存的环境。
肠道微生物群的训练总览
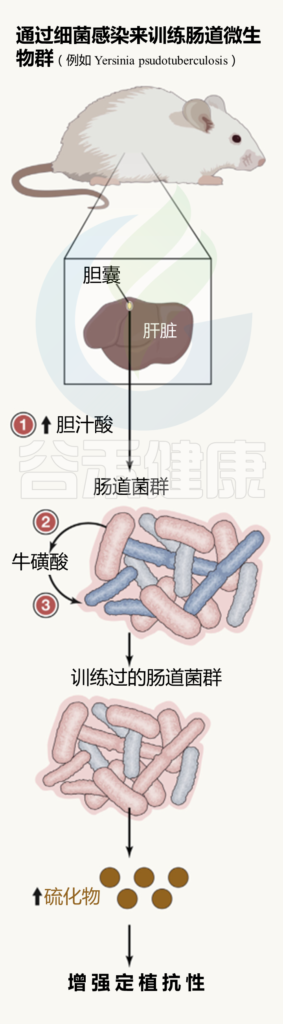
最初的肠道感染后:
( 如Y. pseudotuberculosis )
(1) 肝脏中与牛磺酸结合的胆汁酸产生增加,储存在胆囊,并释放到肠道;
(2) 在肠道中,胆汁酸被特定的微生物群化学解共轭;
(3)牛磺酸变得可利用,导致产生硫化氢的细菌大量繁殖,从而阻止肠道病原体的有氧生长。
下面我们来看Stacy等人是如何一步步进行的实验探究过程。
Stacy等人在研究中发现,与实验室特有的无病原体(SPF)微生物群的小鼠相比,拥有野生小鼠(即WildR)微生物群的自交系小鼠表现出对致命病毒感染的增强保护。
在这里,作者还发现野生小鼠比SPF小鼠对肠道肺炎克雷伯菌感染更具抵抗力。考虑到WildR小鼠的未知感染史,作者用肺炎克雷伯菌对以前感染过急性Yersinia pseudotuberculosis ( post-△yopM) 的SPF小鼠进行了挑战。
值得注意的是,post-△yopM 的小鼠在初次感染后的至少15周内对肺炎克雷伯菌感染的抵抗力也更强。与SPF重建的对照组相比,用post-△yopM小鼠的粪便重建无菌小鼠也增强了对肺炎克雷伯菌感染的保护,这证实了微生物群在抗性中的作用。
这些结果表明,感染史可以改变肠道微生物群,从而诱导定植抗性,因此称为“微生物群训练”。
Stacy等人使用代谢组学方法记录了清除了假结核杆菌Y. pseudotuberculosis△yopM的小鼠肠道中胆汁酸水平的升高。微生物群对初级胆汁酸的解偶联释放了偶联组分,如牛磺酸。
注:牛磺酸在胰腺中合成,对肌肉和大脑发育至关重要,是哺乳动物中最丰富的游离氨基酸。最近发现牛磺酸可以激活杯状细胞中的NLRP6炎症小体,并通过肠道上皮细胞调节稳定状态的抗微生物肽的产生。
在短暂的假结核杆菌感染后牛磺酸水平升高。之前的研究表明,牛磺酸支持解决肠道炎症和清除肠道病原体的柠檬酸杆菌感染。
他们发现,补充牛磺酸会损害柠檬酸杆菌C. rodentium和肺炎克雷伯菌的肠道定植。而当补充给无菌小鼠时,牛磺酸对肠道感染没有影响,这表明它通过调节共栖群落而不是直接影响病原体。
从机制上讲,牛磺酸可增强微生物群中硫化物的产生,硫化物是细胞呼吸的抑制剂,这是宿主被多种病原体入侵的关键。
Stacy等人用16S rDNA和宏基因组测序来解决这个问题。肠道炎症通常与肠杆菌科(Enterobacteriaceae)的大量繁殖有关。
参与对抗感染菌– δ 变形菌 Deltaproteobacteria
他们发现,与对照组小鼠相比,清除假结核杆菌△yopM感染的小鼠微生物群中变形菌门增加,特别是δ 变形菌纲(Deltaproteobacteria)。
宏基因组学揭示,δ 变形菌纲的这种繁殖导致感染小鼠的硫代谢途径增加。虽然在感染后的微生物群中没有发现代谢硫的菌(δ 变形菌纲Bilophila wadsworthia),但当补充到无菌小鼠中时,足以提高对肺炎克雷伯菌的定殖抗性。
牛磺酸的施用同样影响了微生物群;然而,这些变化与post-Yersinia状态相当不一致,包括梭状芽孢杆菌而不是δ变形菌的增殖。这些不一致的分类变化表明,仅补充牛磺酸并不能完全重现共生微生物群的感染后状态,多种因素和微生物群可能能够增强对继发感染的定殖抗性。
Stacy等人通过宏基因组学检测牛磺酸处理过的小鼠微生物组,发现与post-Yersinia菌感染后的微生物组相似,编码异化亚硫酸盐还原酶(dsr)的基因得到了富集。这种蛋白质参与牛磺酸酶转化为硫化物的最后一步。
当牛磺酸调节的微生物群在体外培养中暴露于牛磺酸时,会产生更多的硫化氢,这与肠道中牛磺酸水平较高支持能将这种代谢物转化为硫化物的物种生长的观点一致。
重要的是,硫化氢通过抑制细胞色素氧化酶来限制有氧呼吸,而细胞色素氧化酶是病原体在不可发酵的底物上进行有氧呼吸和生长的常用物质。因此,牛磺酸依赖的硫化氢的产生可能通过阻断有氧呼吸来提高定植抗性。
原发感染后牛磺酸代谢菌群的扩张增强了对继发感染的定植抗性
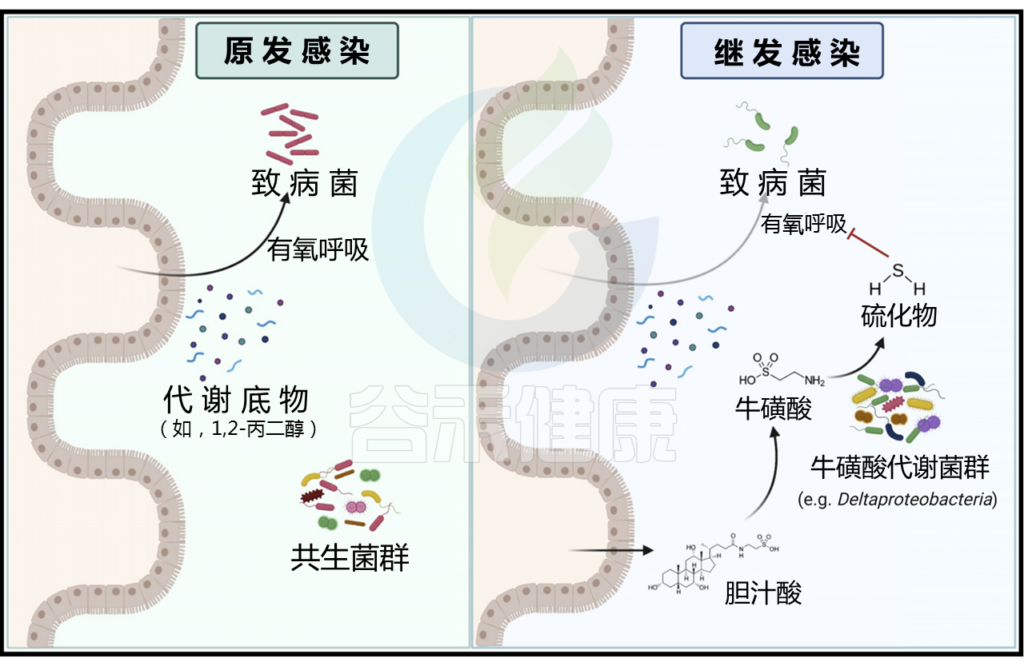
在原发感染(左)期间,病原体通过有氧发酵利用代谢底物,如1,2-丙二醇。清除感染后,宿主产生的胆汁酸水平增加,可以通过共生微生物群与牛磺酸解偶联。牛磺酸反过来被代谢成硫化物,抑制有氧呼吸,从而增强对继发感染的定植抗性(右)。
Stacy等人用两种方法验证:
(1) 使病原体不能在不可发酵的物质上生长
Stacy等人对肺炎克雷伯菌进行了高通量转座子测序。他们让12000个转座子突变体通过小鼠,然后测序,以确定与输入库相比丢失的突变体。
在未感染的小鼠中,导致细菌适应的因素包括与1,2-丙二醇利用有关的基因以及与细胞色素氧化酶bd-II同源的假定氧化酶。因此,肺炎克雷伯菌在低氧环境下对1,2丙二醇作用最为有利,低氧环境受硫化物抑制。
此外,缺乏在1,2-丙二醇或细胞色素氧化酶II上生长能力的肺炎克雷伯菌突变体在体内被它们的野生型对应物所取代,但当牛磺酸被补充到肠道生态系统中时却没有这种情况,表明牛磺酸破坏了病原体在1,2-丙二醇上的呼吸和生长能力。
(2) 隔离硫化氢
Stacy等人使用铋来隔离硫化物。铋对小鼠的处理阻止了微生物群产生硫化氢,导致了具有有氧呼吸功能的细菌数量的增加。
重要的是,铋处理还增加了对肺炎克雷伯菌感染的易感性,突出了硫化物隔离对定植抗性的影响。
这种对继发感染的增强抗性似乎是高度非特异性的,因为弱毒假结核分枝杆菌的初次感染可以防止肺炎克雷伯氏菌或柠檬酸杆菌的继发感染。
事实上,Stacy等人使用“wildR”小鼠的微生物群发现了相同的效果,这些小鼠是无菌小鼠,与野生小鼠的微生物群一起定居,野生小鼠可能有许多肠道感染的历史。
野生小鼠的肠道也显示出δ变形菌纲的扩张,但牛磺酸的水平降低而不是升高,这表明感染后牛磺酸可能会随着时间的推移而消耗,或者是不同的机制导致了这些小鼠中δ变形菌纲的大量繁殖。
Stacy等人没有用相同的病原体进行原发性和继发性感染,因此尚不清楚保护机制是否也适用于这种情况,以及增强定殖抗性的进化目的论是否是为了避免用相同的病原体进行二次感染。同样,确定感染后微生物群是否对不依赖硫化物敏感有氧呼吸的病原体无效也很重要。
Stacy等人的发现也存在一些问题。
首先,为什么在成功清除感染后胆汁酸分泌持续升高?
作者在post–Yersinia感染后的小鼠中发现了增大的胆囊,但这可能不是主要原因。
二、这种增强的殖民抵抗的状态持续多久?
Stacy等人在post-Yersinia感染后15天观察到,接受来自小鼠体内微生物群的无菌小鼠的定殖减少,但尚不清楚肠道牛磺酸水平是否表现相似,以及保护作用是否在超过15天的时间内减弱。
同样,确定多轮感染是否会进一步增强最终的定植抗性能力也很有意思。
Stacy等人的工作使用了生物化学、微生物学和生物信息学方法等,不仅形成了一个关于感染史如何导致肠道-肝脏保护轴的新概念框架,使“微生物群记忆”的概念得到推广,还提供了对宿主及其微生物群之间存在的互利途径的新见解。
这可能是通过精确调节微生物群来提高抗病原体入侵能力的重要一步。
相关阅读:
主要参考文献:
Stacy, A., Andrade-Oliveira, V., McCulloch, J.A.,Hild, B., Oh, J.H., Perez-Chaparro, P.J., Sim, C.K., Lim, A.I., Link, V.M., Enamorado, M., et al. (2021). Infection trains the host for microbiota-enhanced resistance to pathogens. Cell 184, this issue, 615–627.e18
Wong Andrea C, Levy Maayan,Microbial memories.[J] .Immunity, 2021, 54: 201-204.
King Irah L,Divangahi Maziar,Training the metaorganism: the microbial counterpart.[J] .Cell, 2021, 184: 574-576.
Rosshart, S.P., Vassallo, B.G., Angeletti, D.,Hutchinson, D.S., Morgan, A.P., Takeda, K., Hickman, H.D., McCulloch, J.A., Badger, J.H., Ajami, N.J., et al. (2017). Wild Mouse Gut Microbiota Promotes Host Fitness and Improves Disease Resistance. Cell 171, 1015–1028.

谷禾健康
“ 在人类适应中整合宿主-微生物群的相互作用可以提供新的方法来提高我们对人类健康和进化的理解。”

面对快速的环境变化,生物如何适应新环境是进化生物学中的一个核心问题。
刚刚,来自德国马克斯·普朗克研究所研究人员在science发表了最新文章:

回顾了人类适应新环境的例子,这些例子表明宿主基因和微生物群之间的相互作用。提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。寻找微生物群与人类遗传适应性有关的其他例子。
当人类在基因上适应新环境时,他们的微生物群也可能参与这个过程。微生物可以比宿主进化得更快,这使它们能够对环境变化做出快速反应。微生物群还过滤宿主的环境,从而改变宿主的选择性压力。
图1 人类及其微生物的局部适应

举例说明适应性宿主等位基因和适应性微生物群功能之间的相互作用。
选择压力的差异,包括饮食、气候和病原体暴露,导致了人类群体在性状上的差异,与消化、生理和免疫相关。这些差异是由跨多代发生的局部遗传适应造成的,与宿主一生中免疫系统的适应或生理适应是有区别的。
在许多情况下,主要的遗传变异体被确定为如下:
乳糖消化所需的乳糖酶:(由基因区域LCT编码)突变和截短
缺氧诱导因子2α:(由PAS1编码)在高原适应中产生作用
β-珠蛋白基因单倍型或镰状细胞性状:(由血红蛋白编码)在疟疾抗性中产生作用
此外,人类微生物群的组成和功能变化已被广泛描述。Amato等人最近回顾了可能影响人类本地适应性的微生物群的有益功能,例如微生物群增强营养和预防传染病。然而,在人类局部适应过程中,宿主适应性等位基因和适应性微生物群功能之间的特定相互作用仍有待研究。
接下来的两小节,作者详细研究了LCT–双歧杆菌和AMY1–瘤胃球菌之间的相互作用。在这些例子中,适应性宿主等位基因和适应性微生物功能是相联系的。
婴儿的主要能量来源于乳糖。在上消化道(GIT,下同),宿主酶乳糖酶将乳糖分解成葡萄糖和半乳糖。饮食中没有牛奶,乳糖酶的生产就会停止。乳糖酶非持续性LNP(乳糖不耐受)是祖先的条件。
注:由于乳糖酶活性的不同,人群中存在三种基因型,即纯合乳糖酶持续性(LP)、纯合乳糖酶非持续性(LNP)和杂合子(heterozygotes)。LNP是人群中最常见的表型。因乳糖酶的相对或绝对缺乏而导致的以腹泻为主的相关消化道症状的现象称之为乳糖不耐受。LNP是原发性乳糖不耐受的生理基础。
不同大陆的动物驯化(2500年到10000年前)和对非人类牛奶的反复消费导致了强烈的选择压力,使乳糖酶的生产持续到成年,即乳糖酶持久性LP(乳糖耐受)。LP是突变,在有长期放牧和挤奶历史的人群中常见。
宿主和微生物共争乳糖
许多肠道微生物群中常见的微生物可以使用β-半乳糖苷酶来裂解乳糖,然后发酵,乳糖可能被乳酸菌隔离。不管如何加工,微生物利用乳糖的副产物给宿主产生的能量更少。这意味着宿主和微生物在争夺乳糖,宿主有强烈的动机去战胜微生物。
乳糖耐受——宿主赢
乳糖耐受宿主胜过微生物,因为乳糖酶在微生物生物量较低的上层消化道中具有活性。
乳糖不耐受——微生物赢
相比之下,乳糖不耐受宿主主要在较低的消化道中获取微生物乳糖代谢的低能量密度产物。
因此,未消化的乳糖进入结肠可以被认为是一种需要微生物酶来处理的纤维形式。
就像结肠中的纤维降解一样,来自发酵的微生物,和它们的发酵产物[短链脂肪酸(SCFAs)]组成,虽然微生物群吸收了乳糖的一部分能量,但乳糖不耐受宿主的另一种选择是完全失去能量来源。
LCT位点的相同变异与肠道微生物群中双歧杆菌的相对丰度有关。
这种关联是迄今为止微生物组全基因组关联研究最一致的信号,该关联取决于牛奶消费量。
乳糖耐受基因型和双歧杆菌相对丰度之间的反比关系支持了哺乳动物乳糖酶和细菌β-半乳糖苷酶直接竞争乳糖的观点。
双歧杆菌是重要的乳糖降解菌,可能在产奶动物驯化后和选择乳糖耐受等位基因前帮助成年宿主从牛奶中提取能量。在畜牧业兴起后,乳糖代谢细菌可能在缺乏乳糖耐受等位基因的情况下对宿主的适应性产生积极影响。后来,有益的宿主等位基因出现并取代了微生物群的功能,在一些人群中变得几乎固定。
双歧杆菌(或功能过剩的微生物)产生的β-半乳糖苷酶也可能通过降低LCT基因型之间的适应度差异而减轻了对乳糖耐受等位基因的选择压力。
此外,如果微生物摄入乳糖能最大限度地减少与乳糖消化不良相关的疾病后果,并促进牛奶摄入,从而带来额外的益处,则微生物群可能会减轻能量权衡并维持人类群体中的乳糖酶多态性。
乳糖的例子表明,由微生物组和宿主基因组编码的活性可能特别容易受到宿主和微生物组之间竞争的影响。
与乳糖相反,人类饮食中的各种淀粉为宿主提供了一种机会,在较高的消化道中获得一种带有淀粉酶的淀粉,而在较低的消化道中为微生物群消化留下抗性淀粉。
事实上,淀粉有许多不同的形式,包括难以被宿主淀粉酶降解的结构,淀粉酶将淀粉分解成葡萄糖亚基。宿主和微生物群分配淀粉底物的程度可能取决于宿主基因型。
由AMY1基因编码的唾液淀粉酶在口腔中开始淀粉分解为葡萄糖的过程。唾液淀粉酶活性的个体差异与AMY1基因的拷贝数呈正相关,通常在2到15之间。
与AMY1 拷贝数含量低的个体相比,AMY1 拷贝数含量高的个体在食物到达较低的消化道及其微生物群之前,更彻底地消耗了给定饮食中对淀粉酶敏感的淀粉(图2,C和 D)。
图2 宿主基因型和微生物群之间联系的例子
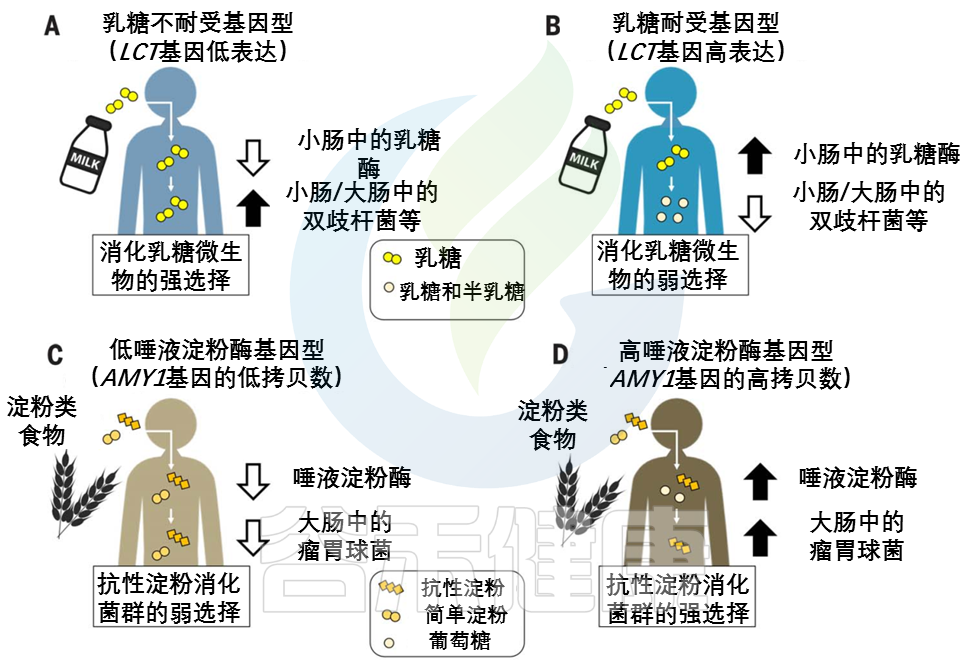
在(A) 乳糖不耐受宿主和(B) 乳糖耐受宿主中,乳糖酶基因型与双歧杆菌相对丰度呈负相关关系。
AMY1基因拷贝数(CN)和瘤胃球菌相对丰度之间的正相关性被描述为(C)低AMY1 拷贝数宿主和(D)高AMY1 拷贝数宿主。
不同类型的糖分以不同的形状和颜色显示。
AMY1 拷贝数为2是祖先的情况:AMY1 拷贝数在人类中的扩展可能是由从低淀粉饮食到高淀粉饮食的饮食转变所驱动的。
随着农业的发展,唾液淀粉酶水平的提高可能会促进高淀粉饮食人群的健康。与乳糖耐受的进化相似,宿主淀粉酶通过其比微生物发酵产物更大的能量产量而具有适应性优势。
具有AMY1高拷贝数的宿主还能从结肠微生物对抗性淀粉的强化降解中获益。
抗性淀粉发酵中的重要属——Ruminococcus
与AMY1低拷贝数个体的肠道微生物群相比,高AMY1拷贝数宿主的肠道微生物群富含瘤胃球菌属(Ruminococcus)。
在AMY1 低拷贝数宿主中,肠道细菌优先发酵淀粉酶敏感型淀粉,宿主不能使用这些淀粉,因为它们的唾液淀粉酶水平较低。
乳球菌,或功能冗余的微生物,可能通过放大AMY1高拷贝数和低拷贝数个体之间的相对适应度差异,增强了对AMY1 拷贝数扩增的选择压力,并可能增强了宿主基因-微生物的关联(图2,C和D)。因此,这种动态可能导致基于宿主基因型的微生物补充。
以上,作者提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。接下来的章节,作者寻找微生物群与人类遗传适应性有关的其他例子,其中适应性的遗传基础得到了很好的描述。
有新的证据表明,微生物参与了其他几种人类遗传适应(图3),之前在这些适应中,微生物的作用没有得到充分认识。
图3 人类的局部适应性与微生物群有关
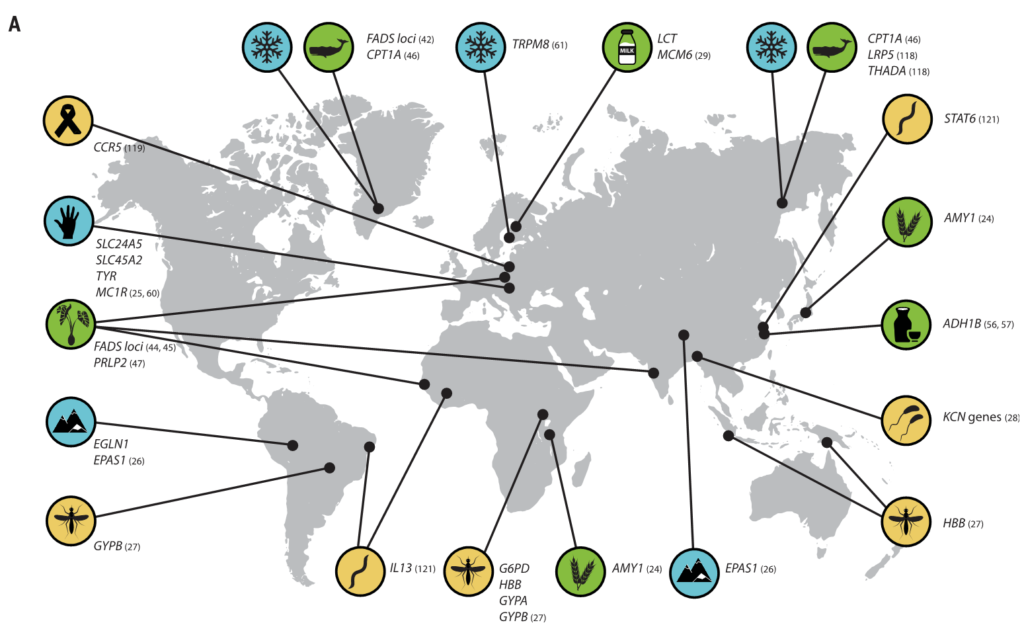
(A) 与适应性性状相关的人类基因位点的全球分布。这些符号对应于(B)中的选择因子和/或特征。
向上和向下的箭头分别表示微生物类群相对丰度与阳性或阴性相关的趋势。
微生物群的研究群体与宿主基因位点的研究群体不匹配.
星号和黑体字表示正向选择下与宿主基因位点相关的微生物类群: LCT和双歧杆菌,AMY1和Ruminococcus,PLD1和Akkermansia
乳糖和淀粉消耗可能是第一个已知的与饮食相关的基因-微生物相互作用的例子,可以进一步研究其在人类适应中的作用,但其他例子可能会出现。例如,长链多不饱和脂肪酸(LC-PUFAs)是关键的营养物质,可以直接从动物性饮食中获得,或者使用宿主衍生的酶从植物衍生的前体中合成。
脂肪酸代谢相关基因【包括脂肪酸去饱和酶(FADS)、肉碱棕榈酰转移酶1A (CPT1A) 和胰脂肪酶相关蛋白2 (PLRP2)】的正向选择证据与多种人群的饮食适应有关。
FADS基因区域的祖先等位基因与食用植物性食物的人群相关,衍生等位基因与当前和历史上偏爱高脂肪食物的人群相关。属于至少10个门的细菌似乎能合成长链多不饱和脂肪酸。
在人类肠道微生物中,植物乳杆菌和其他细菌已被证明能代谢植物来源的前体,并影响多不饱和脂肪酸来源的代谢物在体外和体内的生物利用度。分别通过植物性饮食或动物性饮食富集的人类肠道微生物 。
类似地,酒精脱氢酶1B (ADH1B)位点在人类中显示出正向选择的证据,并与脱脂摄入有关,人们认为这是伴随着农业的发展而产生的。
人和细菌的酶可以将乙醇转化为乙醛;肠道微生物群的变异与饮酒和相关疾病有关。
这些观察表明:
我们已经适应了自己所在地的气候。生活在高纬度地区的人面临冷胁迫,与温度感应(TRPM8)和能量收获(如FADS和CPT1A)相关的基因与气候相关的适应有关。
气候是参与常见代谢紊乱基因的重要选择压力
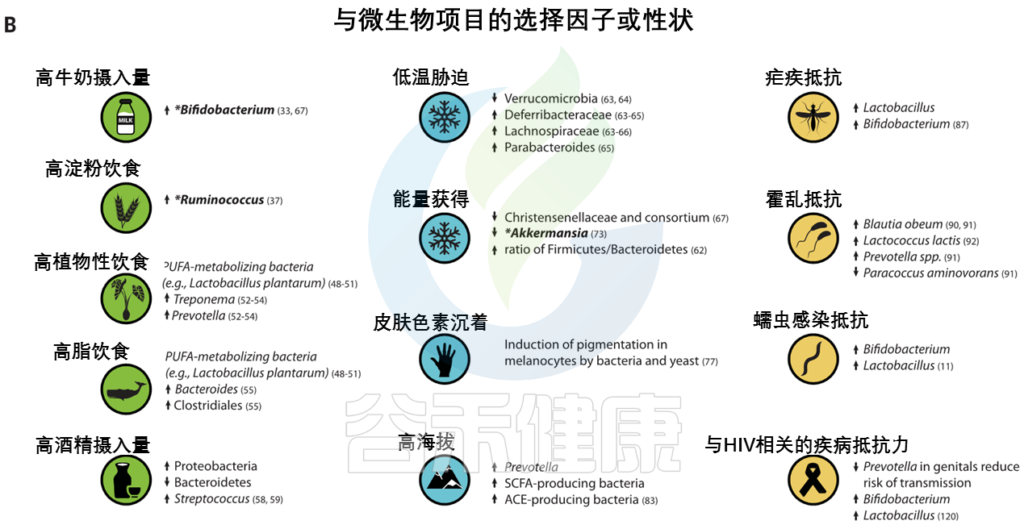
人类微生物群也因纬度而异,并可能通过提高从饮食中提取能量和随后储存脂肪的效率来促进与气候相关的适应。微生物群中的一些变异与环境温度和宿主体型有关。对小鼠的实验研究表明,仅环境温度的变化就能引起肠道菌群的变化。
低温
低温暴露宿主的微生物表现出更高的吸收能力和能量收获能力,以及棕色脂肪组织产生的热量增加。然而,微生物介导的产热和TRPM8多态性在人类中是否相关仍有待确定。
· Christensenellaceae
人类肠道中最紧密和高度可遗传的分类单元,细菌家族christensenellaceae,它与较低的体重指数(BMI) 和代谢紊乱有关。甲烷菌科、脱水杆菌科 和Tenericutes在多个人类群体中也表现出遗传性,并与Christensenellaceae共存。
最近的证据表明,这些菌群之间的代谢相互作用可能会影响宿主对代谢物的利用。
GWASs没有发现显著的宿主遗传变异。这表明,一些明显可遗传的分类群可能具有多基因性质,其中许多基因的影响很小。
· Akkermansia
Akkermansia是一种微生物降解菌,也与体重指数有关,在多项研究中显示为一个可遗传的分类群。Akkermansia的相对丰度与PLD1 中的宿主遗传变异有关,PLD1是之前与BMI相关的基因。PLD1显示了非洲人群中正向选择的证据,但选择剂尚不清楚。
太阳辐射
生活在低纬度地区的人群面临高水平的太阳辐射,与皮肤色素沉着相关的基因是人类本地适应的典型例子(图3)。
皮肤中的黑色素保护皮肤免受紫外线辐射,其抗菌特性被认为是皮肤色素沉着纬度梯度的替代假设。因此,人类黑素细胞中皮肤色素沉着的增加可以通过暴露于微生物产物如脂多糖来诱导。
Guéniche等人报道了乳酸菌对皮肤的保护作用,紫外线照射后的全身免疫反应。鉴于肠道微生物群在调节皮肤内环境稳定中的新兴作用,进一步的研究可能有助于确定色素沉着基因与皮肤和肠道微生物之间的潜在相互作用。
高海拔环境
高海拔环境也带来了许多生理挑战,包括缺氧应激,这也可能被微生物群改变。在高海拔环境中,已经鉴定出与氧呼吸和血液循环相关的多种适应性特征和基因,这些特征和基因通常涉及血压的调节(图3)。
最近,肠道微生物群被证明通过产生短链脂肪酸来调节血压,短链脂肪酸有可能在高海拔环境中帮助调节血压。
包括丁酸盐在内的短链脂肪酸的产生影响小鼠缺氧诱导因子的活性,这也是多个人类群体中参与高海拔适应的关键途径。作用于肾素-血管紧张素系统的细菌血管紧张素转换酶(ACEs)的产生也可能改变高海拔环境中的血压。细菌ACEs已被证明能在体外转化哺乳动物血管紧张素。
病原体被认为是人类适应性进化的主要驱动力之一(图3),微生物群与病原体防御和免疫之间的界面已被广泛研究。
人类本地适应的一个典型例子是疟疾抗性的遗传基础,由疟原虫属的几种寄生原生动物引起。皮肤和肠道微生物可能影响疟疾的不同阶段。
相同细胞因子相关基因的遗传变异,包括IL10、IL12、肿瘤坏死因子、干扰素α和干扰素γ,与疟疾严重程度和微生物群组成的变异有关。
Ippolito等人总结了微生物群在疟疾抗性中可能扮演的多重角色的几种假说:
1 皮肤细菌产生可改变蚊子媒介吸引力的挥发性化合物
2 由肠道微生物诱导的抗原表达,该抗原表达诱导针对疟原虫传播的保护性抗体
3 影响血液阶段疟原虫感染严重性的微生物群的差异
其他可能受到微生物群和宿主遗传变异组合影响的感染包括霍乱、艾滋病毒和蠕虫感染。
霍 乱
霍乱毒素针对几个带有显示选择信号的基因的离子通道。已经在人群中鉴定出与霍乱易感性和从霍乱中恢复相关的肠道微生物分类群。实验研究已经确定了提供定殖抗性和抑制霍乱弧菌毒性的细菌分类群。
鉴于在胃肠疾病中离子通道的表达和功能经常被改变,探索微生物群和离子通道基因之间的联系对于治疗或预防腹泻疾病可能是有价值的。
艾滋病毒和蠕虫感染
阴道微生物群在艾滋病毒的获得和传播中起作用,
肠道微生物群与蠕虫相互作用并改变疾病结果。
对研究充分的宿主适应性等位基因和新兴有益微生物群功能之间的相互作用的进一步研究可能会揭示以前未知的抗病机制。
这里提到的所有宿主基因-微生物例子(图3)仍处于研究的早期阶段。但是在每一种情况下,微生物群都有可能通过改变适应性景观来影响宿主的进化。这些微生物可能改变了宿主的环境,导致宿主表型选择压力的改变。
在未来关于适应性宿主基因型和适应性微生物群功能之间关系的研究中,GWASs、候选基因方法或使用基因敲除模型的移植实验可以帮助确定维持有益微生物群功能的宿主遗传机制,并测试微生物群的替代和补充是否是适应性的一般特征。
基因研究已经将越来越多的群体纳入考虑范围,微生物群的特征研究也是如此。但到目前为止,包括宿主遗传学和微生物群的研究,除了少数例外,主要是在西方人群中进行的。
需要将人类基因研究的范围扩大到更广泛的人群和地点,其中包括微生物组成分。这些类型的研究结果将测试当前发现的普遍性,并描述更多微生物介导的适应情况。
还可以进一步研究特定分类群的遗传力,以更好地表征潜在的遗传多态性。遗传性既适用于分类群,也适用于微生物功能,因此通过宏基因组学将与人类遗传变异相关的性状从分类群扩展到功能群,将有助于进一步阐明微生物群在人类适应中的作用。
在这里关注的是宿主(主要是人类)的进化,但是微生物也在快速进化以适应它们的宿主环境。在适应性进化的背景下,对宿主基因组和微生物群之间相互作用的更好理解将阐明人类和其他动物及其微生物群是如何适应不断变化的世界的。
参考文献:
Suzuki Taichi A,Ley Ruth E,The role of the microbiota in human genetic adaptation.[J] .Science, 2020, 370
Bayless Theodore M,Brown Elizabeth,Paige David M,Lactase Non-persistence and Lactose Intolerance.[J] .Curr Gastroenterol Rep, 2017, 19: 23.
S. Fan, M. E. B. Hansen, Y. Lo, S. A. Tishkoff, Going global by adapting local: A review of recent human adaptation. Science 354, 5 4–59 (2016). doi: 10.1126/science.aaf5098; pmid: 27846491
M. Fumagalli et al., Greenlandic Inuit show genetic signatures of diet and climate adaptation. Science 349, 1343–1347 (2015). doi: 10.1126/science.aab2319; pmid: 26383953
T. A. Suzuki, F. M. Martins, M. W. Nachman, Altitudinal variation of the gut microbiota in wild house mice. Mol. Ecol. 28, 2378–2390 (2019). doi: 10.1111/mec.14905; pmid: 30346069