-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
真菌感染
真菌病原体正迅速崛起为全球公共卫生体系中最具挑战性的威胁之一,其引发的抗真菌耐药性问题日益严峻。每年,真菌感染影响数亿人,并导致约160万例死亡,其致病范围从浅表皮肤感染到危及生命的侵袭性疾病,尤以免疫功能低下患者为重。其中白色念珠菌(Candida albicans)、新型隐球菌(Cryptococcus neoformans)和烟曲霉(Aspergillus fumigatus)已被世界卫生组织列入重点优先监测病原体名单。
目前临床上可用的抗真菌药物主要局限于唑类、多烯类和棘白菌素类这三大类别,这一有限的药物谱系难以满足日益复杂的临床需求。并且耐药株的持续出现和积累,使传统药物的疗效显著下降,部分病例甚至对联合治疗方案也产生抵抗。
此外,真菌生物膜的形成进一步加剧了治疗难度。真菌生物膜是一种由真菌细胞附着在宿主组织或医疗器械表面形成的结构,外包裹复杂的细胞外基质(ECM),为真菌提供了物理与化学双重屏障。研究显示,生物膜中的真菌对抗真菌药物的耐受性可提高多达一千倍,导致感染顽固复发,并显著增加了住院时间和医疗成本。
面对这一挑战,科研界正积极探索创新治疗策略,包括靶向生物膜结构的药物、旧药新用及天然产物疗法。这些新兴方法展示出克服耐药性、破坏生物膜完整性与提升抗真菌疗效的潜力。深入理解真菌病原体的耐药机制,并结合多样化的干预手段,有望为未来开发更为高效、低毒的抗真菌疗法奠定基础,从而开辟对抗真菌生物膜相关感染的新局面。
真菌感染已成为全球重要的公共卫生问题,其中白色念珠菌(C.albicans)、新型隐球菌(C.neoformans)和烟曲霉(A.fumigatus)是最主要的病原体。
白色念珠菌普遍存在于人体黏膜,当宿主免疫功能下降时可引起侵袭性感染,其毒力源于形态转换和生物膜形成;新型隐球菌则以多药耐药性和持久生物膜为特征,已导致多起医院暴发;烟曲霉是免疫受损患者中侵袭性曲霉病的主要致病菌,能够形成致密菌丝生物膜并产生耐药突变。
生物与非生物上的真菌感染
Elgammal Y,et al.Crit Rev Microbiol.2025
生物膜可以在生物或非生物表面形成。生物感染发生在人体组织和器官上(例如脑,引起隐球菌性脑膜炎;口腔,引起口腔念珠菌病;肺部,引起肺曲霉菌病;皮肤,导致持续性皮肤感染;血液,引起侵袭性念珠菌病;非生物感染发生在植入式医疗器械(例如起搏器、导管等)上。 心脏装置)、假肢(例如人工关节或植入物)和气管插管。
白色念珠菌及治疗方法
白色念珠菌是一种常见于人体粘膜表面的真菌。但在免疫功能低下者中可过度生长并转变为致命的机会性病原体,导致侵袭性念珠菌病。
它是医院感染的主要原因,造成约15%的败血症病例和40%的血流感染。其毒力与酵母形态和菌丝形态之间的可逆转换密切相关,菌丝形式中更高含量的几丁质可提供额外的结构强度与环境保护。
• 生物膜促进真菌黏附并提高其抗性
生物膜的形成由细胞壁黏附素介导,使真菌黏附于宿主组织和医疗器械表面。发育成熟的生物膜以丝状菌为主,形成坚固的三维结构并大量产生胞外基质(ECM)。β‑1,3‑葡聚糖是其中的关键成分,可隔绝抗真菌药物并抑制中性粒细胞活化,从而增强真菌对先天免疫的抵抗力。随着生物膜相关感染和非白念珠菌种在医院中的增加,评估和改进现有治疗策略至关重要。尤其是耳念珠菌(C.auris),已成为全球多药耐药院内感染的重要来源。
真菌生物膜形成阶段
Elgammal Y,et al.Crit Rev Microbiol.2025
上图说明了三种医学上重要的真菌:白色念珠菌、新型隐球菌和烟曲霉的生物膜形成过程,经历了四个不同的阶段:
(1) 酵母/丝状细胞粘附到表面;
(2) 真菌细胞生长成薄层细胞并发育成微菌落,烟曲霉细胞发芽形成菌丝网络;
(3) 通过发育成熟具有细胞外基质的生物膜结构;
(4) 真菌细胞从生物膜中分散,促进其他位点的定植。
• 部分念珠菌已具有耐药性,急需开发新疗法
目前的主要抗真菌药物包括唑类、多烯类和棘白菌素类。
多烯类(如两性霉素B)通过与麦角甾醇结合并形成细胞膜孔道发挥广谱杀真菌作用,但在生物膜条件下效力显著下降,且其肾毒性限制了临床使用。
唑类药物以阻断麦角甾醇生物合成为作用机制,毒性较低,但白念珠菌近年来对其耐药性逐渐增强。
棘白菌素通过抑制细胞壁β‑葡聚糖合成,对生物膜更具靶向性,其良好的疗效和安全性使其成为念珠菌感染治疗的一线药物。然而,FKS基因突变已导致部分菌株对棘白菌素耐药。
部分临床分离的念珠菌已表现出泛耐药性,对目前三大类抗真菌药物均无效,并能形成持久的生物膜,进一步强化其耐药性。这凸显出研发新型抗真菌药物和改进现有疗法的迫切需求。
注:尽管移除受感染植入物仍是治疗生物膜感染的常用手段,但该方法风险高、成本大,进一步强调了开发更安全有效疗法以应对白色念珠菌生物膜感染的紧迫性。
生物膜相关真菌病原体的关键耐药机制
Elgammal Y,et al.Crit Rev Microbiol.2025
这些机制主要包括:
(1) 细胞外基质充当物理屏障,阻碍抗真菌药物渗透至生物膜内部;
(2) 外排泵转运蛋白在生物膜形成早期上调,主动排出药物,降低细胞内浓度并促进耐药性;
(3) 持久细胞处于代谢休眠状态,对药物高度耐受,使生物膜在治疗中存活并可在压力解除后再生;
(4) 其他机制如应激反应、细胞密度、化学环境和靶点蛋白过度表达等,也进一步增强了生物膜的耐药性。
新型隐球菌及治疗方法
新型隐球菌(C.neoformans)又名溶组织酵母菌,是土壤,鸽类,牛乳、水果等的腐生菌,也可侵犯人体。新型隐球菌是导致免疫功能低下个体脑膜脑炎的主要原因之一。
• 新型隐球菌可形成脑部生物膜样结构
其毒力主要源于由葡糖醛酸甘露聚糖(GXM)组成的多糖荚膜。GXM不仅调节宿主免疫反应,也是生物膜形成的关键成分,对生物膜结构的建立起重要作用。新型隐球菌可形成脑部生物膜样结构,使感染更具持续性和治疗难度。耐药机制的出现进一步削弱了现有疗法的效果,凸显出开发新型抗真菌策略以针对其生物膜的必要性。
• 当前治疗方法对生物膜感染效果有限
当前推荐的治疗方案为脂质体两性霉素B联合5-氟胞嘧啶诱导治疗,之后以氟康唑维持,用于肺隐球菌病及隐球菌性脑膜炎。该方案对浮游状态的新型隐球菌有效,但对生物膜内菌株疗效显著下降。
此外,氟康唑相关耐药病例中发现ERG11基因突变,该基因编码唑类药物靶标酶14α-脱甲基酶,导致药物敏感性降低。这些问题凸显了迫切需要新型疗法以有效靶向并控制新型隐球菌生物膜感染。
烟曲霉及治疗方法
烟曲霉是一种机会致病真菌,是侵袭性曲霉病的主要致病因子,尤其危害免疫功能低下者。其致病机制与形成致密交织的菌丝型生物膜能力密切相关,该生物膜经历多阶段发育过程。
烟曲霉广泛分布于环境中,因其强适应性、高效空气传播及能抵达远端气道而成为重要病原体。此外,它可形成由菌丝团构成的局部感染——曲霉瘤,进一步促进生物膜相关感染,可通过曲霉病患者的支气管肺泡灌洗液检测到。
• 目前主要以三唑类药物治疗,但也出现耐药性
目前,烟曲霉感染的主要治疗药物为三唑类(如伏立康唑、伊曲康唑、泊沙康唑和艾沙康唑)及两性霉素B。虽然这些药物对敏感菌株疗效良好,但多地已报告三唑类耐药菌株的出现,严重影响疗效并带来公共卫生风险。
耐药机制主要包括cyp51A基因突变(改变唑类靶点)及外排泵过度表达(降低药物浓度)。当出现唑类耐药时,两性霉素B常作为一线替代药物使用,其脂质体制剂因毒性较低正日益应用于临床。
针对耐药菌株的联合治疗显示出潜在疗效,例如棘白菌素与泊沙康唑或艾沙康唑联合使用可能产生协同作用,但相关临床证据仍有限。与唑类和多烯类不同,棘白菌素作用于真菌细胞壁,特异性高,且有助于减少交叉耐药性。然而,日益增加的耐药性与治疗选择受限依然是临床难题。应通过加强抗真菌药物管理、常规监测耐药性,并开发新型或改良制剂以提升治疗安全性和有效性。
新型抗真菌药物的研发对于应对系统性和生物膜相关真菌感染具有关键意义,因为现有治疗手段在面对耐药性和生物膜屏障时往往效果有限。通过开发能够有效穿透或破坏真菌生物膜的新型药物,可以显著增强抗真菌治疗的渗透性和杀菌效率,从而改善患者预后并降低感染复发风险。
这些新兴疗法的研究重点在于结合药理活性与生物膜干预机制,以突破传统药物难以到达感染核心区域的限制。在此背景下,我们系统评估这些潜在药物在临床重要真菌所致生物膜感染及系统性疾病治疗中的应用前景,深入探索其作用机制、疗效表现及潜在的临床转化价值,为未来抗真菌治疗策略的优化提供科学依据。
白色念珠菌的新型疗法
由于白色念珠菌在医院感染中的高发病率,针对其生物膜的抗真菌药物成为重点研究方向。
• Rezafungin(雷扎芬净)药效时间长
Rezafungin是FDA批准的第二代棘白菌素,具有改良的药代动力学特性。其半衰期高达130小时,可实现每周一次给药而非每日给药。Rezafungin能破坏白色念珠菌生物膜形成,降低成熟生物膜的代谢活性和厚度,并抑制菌丝生成,活性优于氟康唑。
• Ibrexafungerp药效更明显,且可减少耐药
Ibrexafungerp是一种源自恩夫曼芬的半合成三萜类药物,是首个具有高组织分布和优良口服生物利用度的葡聚糖合酶抑制剂。它对包括白色念珠菌在内的多种致病真菌具有广谱活性,已获FDA批准用于治疗外阴阴道念珠菌病。尽管其作用机制与棘白菌素相似,但因结合位点部分不同,可避免交叉耐药。体外研究表明,Ibrexafungerp在0.25 µg/mL即可使生物膜代谢活性降低50%,而氟康唑需超过256 µg/mL才能达到相同效果。
• Fosmanogepix削弱白色念珠菌的毒力因子
Fosmanogepix是一种由前体药物转化而来的新型抗真菌剂,经碱性磷酸酶激活为Manogepix。目前其治疗念珠菌血症和侵袭性念珠菌病的III期临床试验正在进行中。该药通过抑制肌醇乙酰转移酶Gwt1干扰真菌细胞壁合成,从而削弱白色念珠菌的黏附、菌丝化和生物膜形成等毒力因子。其>90%的口服生物利用度和广谱抗真菌活性显示出作为新型系统感染治疗药物的潜力。
• Turbinmicin降低生物膜代谢活性
从海鞘微生物组中发现的Turbinmicin能靶向Sec14蛋白,对白色念珠菌生物膜表现出优异活性。Sec14在生物膜基质的囊泡递送中起关键作用。Turbinmicin通过抑制囊泡输出破坏基质形成,并在极低浓度下显著降低生物膜代谢活性。
动物实验显示,其在2.5 µg/mL时即可减少生物膜衍生菌落约2 log₁₀,在10 µg/mL时可完全清除感染导管,展现出在医疗器械相关感染中的高应用潜力。
针对不同细胞途径的新型抗真菌药物的作用机制
Elgammal Y,et al.Crit Rev Microbiol.2025
• 四唑类新药有更高的选择性并降低对宿主毒性
此外,四唑类新药如VT‑1161(奥替瑟唑)和VT‑1598代表第四代唑类抗真菌药,具有对真菌CYP51酶更高的选择性(约2000倍)并显著降低宿主毒性。
VT‑1161已获FDA批准用于治疗复发性外阴阴道念珠菌病,VT‑1598则在白色念珠菌、耳念珠菌及隐球菌感染模型中均表现出良好疗效。
多重耐药白色念珠菌,尤其是形成生物膜的菌株,给临床治疗带来严峻挑战。新型抗真菌药物的出现为现有疗法提供了有效替代方案,不仅展现出更强的抗真菌活性,还能靶向生物膜特异性机制,克服传统治疗的局限。
未来需继续通过系统研究和临床试验验证其有效性与安全性,以期改善侵袭性念珠菌感染的治疗效果。
隐球菌的的新型疗法
虽然新型隐球菌整体耐药率较低,但近年对氟康唑的耐药性日益引起关注,约有10–30%的临床分离株表现出敏感性下降。同时,其对氟胞嘧啶的耐药性也不断增加,这正是临床常将其与两性霉素B联合使用的主要原因之一。
氟胞嘧啶耐药主要源于fcy1、fcy2和fur1基因突变,这些基因分别编码胞嘧啶脱氨酶、胞嘧啶通透酶和尿嘧啶磷酸核糖基转移酶。突变会阻碍药物的摄取与代谢,阻断5‑氟胞嘧啶向其活性形式5‑氟尿嘧啶的转化,从而削弱抗真菌效果。相比之下,对两性霉素B的耐药性较低。
值得注意的是,这些耐药性评估多基于浮游状态的菌体,未充分考虑隐球菌生物膜对药物的天然抗性。此外,真菌对唑类药物的固有耐药性进一步强调了开发新型靶向疗法的必要性,以减少对传统两性霉素B与氟胞嘧啶方案的依赖。
• Fosmanogepix也对新型隐球菌表现出显著抗菌作用
除对白色念珠菌的活性外,Fosmanogepix也通过抑制真菌细胞壁合成对隐球菌表现出显著抗真菌作用。其Gwt1抑制剂衍生物的MIC低至0.004 µg/mL。在隐球菌性脑膜炎小鼠模型中,Fosmanogepix显著降低了肺部和脑部真菌负荷,尤其在与氟康唑联合应用时效果更佳,显示出增强疗效和克服耐药的潜力。
新型隐球菌耐药性的上升表明开发新一代抗真菌药物迫在眉睫,尤其针对生物膜相关感染。隐球菌自身致密且富含多糖的基质,加之血脑屏障的限制,使脑部感染极难清除,需要长疗程治疗,而复发仍更为常见。Fosmanogepix等新兴疗法为此类顽固感染提供了新的希望。
未来,需通过系统的体内实验与严格的临床试验,全面评估并优化这些新型药物的疗效,以期为隐球菌性脑膜炎带来更有效的治疗方案。
烟曲霉的新型疗法
尽管抗真菌治疗取得显著进展,但烟曲霉仍是重要且难治的致病真菌,尤其危及免疫功能低下患者。其对现有抗真菌药物的耐药性及复杂的生物膜结构,凸显了对新型治疗手段的迫切需求。目前,多种新型抗曲霉药物正处于不同临床开发阶段,具有多样的作用机制和制剂形式,为临床治疗提供了新的可能。
• Olorofim抑制早期生物膜形成
Olorofim(F901318)是一种处于III期临床试验的抗真菌药,对包括烟曲霉在内的多种难治真菌感染有效。它抑制早期生物膜形成(4小时内减少约66.4%),虽对成熟生物膜作用有限,但强调了早期干预的重要性。
Olorofim通过抑制真菌二氢乳清酸脱氢酶(DHODH)阻断嘧啶合成,具有极低脱靶风险。其对唑类和两性霉素B耐药菌仍具活性,在大量临床分离株中未发现固有耐药。药物口服吸收良好,半衰期20–30小时,可穿越血脑屏障并分布于肺、肝、肾组织,每日一次服用耐受性佳,仅有轻度胃肠不适。
但需注意其与唑类药物可能存在拮抗作用。此外,对具有相似作用机制的农业杀真菌剂异氟醚喹的耐药性,可能促进其临床耐药风险。
• Opelconazole专门针对肺部烟曲霉感染
Opelconazole(PC945)是一种吸入型三唑类抗真菌药,专为肺部烟曲霉感染设计。其强亲脂性使药物可在肺内蓄积,即使停药后仍保持活性,表现出持久局部效应与低系统暴露。
该特性为高风险人群(如肺移植受者)提供了潜在的预防性治疗选择,但其对烟曲霉生物膜活性的研究仍不充分,尚需进一步验证。
• Ibrexafungerp对曲霉也有广谱抗性
Ibrexafungerp除对白色念珠菌有效外,对曲霉也具广谱活性。在侵袭性肺曲霉病实验模型中,与艾沙康唑联用表现出协同作用,提高生存率并降低肺组织损伤。在一项针对难治性或不耐受真菌感染(包括侵袭性肺曲霉病)的III期研究中,其成功率为46.2%,并涵盖生物膜相关病例,显示出临床应用潜力。
在这里总结了这些新兴药物的药代动力学、剂量与安全特征。
Elgammal Y,et al.Crit Rev Microbiol.2025
新型药物也存在一些限制
尽管这些化合物极大拓宽了抗真菌药物储备,但从实验室到临床的转化仍面临挑战。由于真菌与人体在主要代谢通路上的高度保守性,一些有效抑制真菌生长的药物也可能对宿主细胞产生毒性,加之药物相互作用风险,使得复杂用药患者群体(如免疫低下者)更易受不良反应影响。
此外,许多新药受限于药代动力学和药效学特征,如口服吸收差、组织渗透性不足或中枢神经系统分布有限,削弱了其在系统性或侵袭性真菌感染中的应用潜力。高昂的研发成本与严格的审批流程亦增加了临床转化难度,尤其对结构复杂的天然产物而言更为显著。因此,在药物开发早期整合药理学、临床与经济学考量,并采用创新研究设计,将是推动抗真菌新药成功转化的关键。
• 根据生物膜阶段选择合适的药物
为进一步理解这些药物对生物膜的作用机制,可根据其干预生物膜生命周期的阶段(如粘附、萌发或成熟)进行分类。
阻断早期粘附或代谢活动的药物可防止生物膜形成,如唑类和四唑类(氟康唑、奥替康唑、VT‑1598)通过抑制麦角固醇合成削弱膜功能、减少表面定植。
而针对已形成的生物膜,则需药物具备穿透或破坏胞外基质(ECM)的能力。两性霉素B与棘白菌素在此阶段仍具一定效力,但作用有限。新型葡聚糖合酶抑制剂及Turbinmicin等则能直接靶向基质运输与ECM结构,对成熟真菌生物膜展现出更强活性。
药物再利用,是指将原本用于治疗其他疾病、已获批准或正在研发的药物,重新用于治疗真菌感染的一种策略。它的核心理念是:“旧药新用”——基于已有的药物安全性、药代动力学以及临床数据,探索其潜在的抗真菌活性,从而发现新的治疗方案。
药物再利用为发现新的抗真菌疗法提供了有前景的途径,尤其针对由白色念珠菌、新型隐球菌和烟曲霉等引起的生物膜相关感染。该策略具有高性价比优势,且大多数已用于人体的药物其毒性特征明确,安全性可控。通过高通量筛选及现有药物协同效应的研究,科研人员能够加速抗真菌治疗的创新与开发。
再利用的药物治疗白色念珠菌
白色念珠菌的生物膜相关感染常与导管使用有关,对传统抗真菌治疗具有显著耐受性。药物再利用被视为克服这一挑战的有前景策略。
• 依布硒啉有效抑制白色念珠菌生物膜形成
依布硒啉(Ebselen)是一种合成有机硒化合物,原用于治疗听力损失、美尼尔病及SARS‑CoV‑2感染,具有显著的抗真菌潜力。其通过模拟谷胱甘肽过氧化物酶活性,保护细胞免受活性氧伤害,并以中和自由基发挥神经保护作用。在8.96 µg/mL浓度下,依布硒啉即可有效抑制白色念珠菌生物膜形成,对多重耐药的耳念珠菌亦有类似活性。
• 环孢菌素A、匹伐他汀等也表现出对念珠菌生物膜的抑制作用
环孢菌素A作为抑制IL‑2合成的免疫抑制剂,能恢复氟康唑的疗效并增强对白色念珠菌生物膜的抑制。降胆固醇药物匹伐他汀通过抑制HMG‑CoA还原酶,与氟康唑联合表现出明显的抗生物膜协同作用,提示其主要影响生物膜形成过程。
此外,5‑羟色胺再摄取抑制剂如舍曲林和氟西汀也表现出抗生物膜活性,无论单用或与氟康唑联用均能增强抗真菌效果。这些研究强调了药物再利用作为一种实用、经济的策略,可拓展对白色念珠菌及其生物膜相关感染的治疗手段。
• 动物研究已验证部分再利用药物的疗效
部分再利用药物已在动物模型中验证疗效。例如,用于治疗类风湿性关节炎的含金抗炎药金诺芬在小鼠导管感染模型中,于3 µg/mL和10 µg/mL时均显著减少白色念珠菌生物膜。与抗原生动物药喷他脒联合使用时,金诺芬对成熟生物膜表现出协同效应。
高通量筛选还发现多种具有抗生物膜活性的药物,包括阿维菌素、苯溴马隆、盐酸育亨宾、佐替平和双羟萘酸吡咯烷铵,均对白色念珠菌具有抑制作用。
此外,真菌线粒体复合物I组分NDU1被确定为新的抗真菌靶点。FDA批准的抗蠕虫药氯硝柳胺在2 µg/mL时即可抑制NDU1并破坏成熟生物膜。将其制成纳米颗粒后,在小鼠口咽和外阴阴道念珠菌感染模型中显著降低了舌部与阴道的真菌负荷。这类NDU1抑制剂突出显示了通过靶向线粒体功能和破坏生物膜保护性基质来突破真菌防御的潜力。
再利用的药物治疗新型隐球菌
新型隐球菌生物膜因对标准抗真菌治疗的高度耐药性,仍是治疗中的主要难题。药物再利用揭示了多种非抗真菌药物对其具有显著活性,为治疗提供了新的方向。
• 联合使用时可能具有更强的抗生物膜作用
其中,抗结核药物如异烟肼和乙硫异烟胺可使隐球菌生物膜代谢活性降低约50%。当二者与氟康唑或伊曲康唑联合使用时,产生明显协同效应,对成熟生物膜的作用优于单独使用唑类药物。
甲苯咪唑是一种抗寄生虫药,也表现出强效的抗隐球菌活性,在0.0156µM浓度下可显著减少隐球菌生物膜形成并根除成熟生物膜。此外,甲苯咪唑与阿替霉素B联合使用时,两种化合物在较低MIC下均表现出抗隐球菌活性。
• 精神药物氟哌啶醇也减少隐球菌生物膜形成
抗精神病药物对新型隐球菌具有抗真菌活性。特别是氟哌啶醇,主要用于治疗精神分裂症和图雷特综合征,具有抗真菌活性。特别是氟哌啶醇衍生物化合物B10在2µg/mL时可有效减少隐球菌生物膜形成≥80%,并与氟康唑协同作用,显著降低小鼠脑真菌负荷。
这些发现凸显了药物再利用作为对抗新型隐球菌生物膜的有效策略的潜力,为以更短的研发时间和更低的成本扩大现有抗真菌药物库提供了一条有前景的途径。
再利用的药物治疗烟曲霉
三唑类耐药烟曲霉株的流行率持续上升,尤其是能形成坚固生物膜的菌株,凸显出开发替代疗法的紧迫性。
• 新鱼腥草素钠可减少生物膜并使其变薄
源自鱼腥草素的新鱼腥草素钠(SNH)传统上因抗菌特性在亚洲广泛使用。SNH通过干扰烟曲霉类固醇合成途径,抑制麦角固醇生成。XTT还原实验显示,SNH在1×MIC时可使成熟生物膜减少约20%,在4×MIC时减少约80%。显微镜观察发现,其显著缩短菌丝并使生物膜变薄。此外,经SNH治疗的曲霉感染小鼠其真菌负荷、组织损伤及促炎因子水平均显著下降。
• 双胍类化合物等也能够抑制真菌增殖
双胍类化合物Alexidine dihydrochloride(AXD)对白色念珠菌、新型隐球菌及烟曲霉均具抗真菌活性。在1.5–6 μg/mL浓度范围内,AXD能通过抑制真菌的丝状化与增殖,完全破坏成熟烟曲霉生物膜。
同时,抗利什曼病药物米替福新(Miltefosine)也表现出抑菌作用,其通过干扰鞘脂生物合成并对唑类耐药株依然有效。转录组学结果表明,米替福新通过SmiA转录因子调控鞘脂途径相关基因,而鞘脂分析进一步证实处理突变株的鞘脂水平显著降低。
另有研究发现螺吖啶衍生物,原以抗利什曼病与抗肿瘤作用闻名,可作为几丁质酶抑制剂,显示其作为生物膜靶向抗真菌候选物的潜力。
小结
药物再利用为开发更高效、低毒且经济的抗生物膜策略提供了新思路。这些化合物与现有抗真菌药联合应用可能产生协同效应。对其抗真菌活性及联合疗法的持续研究,加之优化给药方式,有望改善生物膜相关感染的治疗并有效应对日益严峻的耐药挑战。
除了药物治疗外,天然产物在应对真菌生物膜方面同样扮演着重要角色。长期以来,天然产物一直是抗真菌药物发现的重要宝库,凭借其天然来源的丰富化学结构和独特活性,提供了与合成化合物截然不同的多样性和创新性。相比人工合成的药物,天然化合物往往具有更复杂的分子骨架和多重作用机制,这使其在破坏真菌生物膜结构、抑制其形成及干扰信号传导等方面展现出独特优势。
随着真菌对现有抗真菌药物耐药性的持续上升,传统治疗手段的有效性逐渐下降,促使科学界重新关注天然产物这一重要资源。近年来,来自植物、微生物乃至海洋生物等多种天然来源的化合物被系统研究,显示出显著的抗真菌和抗生物膜活性。一些研究揭示,这些天然化合物不仅能够影响真菌细胞壁组成和代谢通路,还可能作为潜在的药物先导物,为新型抗真菌治疗策略的开发提供了坚实基础。
具有抗真菌生物膜活性的天然产物
Elgammal Y,et al.Crit Rev Microbiol.2025
1
维生素可减少白色念珠菌生物膜
维生素已成为易于获取的抗生物膜剂。维生素D3在60微克/毫升的浓度下可将白色念珠菌生物膜的形成减少高达88%,其半抑制浓度(IC50)为7.5微克/毫升,通过干扰核糖体生物发生和代谢途径来发挥作用。
它不仅在0.4至0.8毫克/毫升的浓度下降低新型隐球菌生物膜的代谢活性,还能防止粘附,从而限制生物膜的形成。此外,维生素C或抗坏血酸也表现出抗生物膜作用,但其机制与维生素D不同。
2
精油具有抗真菌生物膜的作用
精油对白色念珠菌和新型隐球菌的生物膜具有显著的抗真菌作用。百里香和牛至油中的主要成分百里香酚与香芹酚可有效降低生物膜的粘附性与代谢活性。将精油与抗真菌药物联合使用能增强后者的疗效。
例如,桉树油成分桉树醇可与两性霉素B、制霉菌素及伊曲康唑产生协同作用,通过降低这些药物对白色念珠菌生物膜的MIC提升抗真菌效能。其他精油,如椰子油、茶树油和菜籽油,也表现出抑制白色念珠菌生物膜的潜力。
3
中草药活性成分同样具有抗真菌作用
中草药也被广泛应用于对白色念珠菌和新型隐球菌生物膜的治疗。其中,青蒿素作为FDA批准的抗疟药,可通过调控白色念珠菌生物膜相关基因,抑制菌丝形成。
丹皮酚源自牡丹根皮,具有抗炎及多靶点抗真菌活性。在4和8 mg/mL浓度下,丹皮酚能抑制白色念珠菌菌丝生长,破坏新型隐球菌成熟生物膜,并削弱其荚膜和黑色素的生成,显示出多重抗毒性机制。
此外,多种植物来源化合物如姜黄素、胡椒碱和生姜也表现出对白色念珠菌生物膜的抑制作用。然而,由于其药代动力学性质较差,体内血浆浓度低且半衰期短,难以达到有效水平。其他天然产物如大蒜、肉桂、石榴和蔓越莓提取物同样展现出一定的抗真菌活性,为开发新的抗生物膜策略提供了潜在方向。
4
抗真菌肽和靶向热休克蛋白抑制剂
抗真菌肽已成为治疗真菌感染(包括新型隐球菌)的有效药物。源自酿酒酵母的SP1抗真菌肽在16 µM浓度下可使新型隐球菌生物膜生物量减少86.4%,代谢活性降低96.9%,并在64 µM时使成熟生物膜代谢活性下降73.6%。同样,来源于家蝇的AMP-17肽在64 µg/mL下可分别降低生物膜生物量和代谢活性78%与86%。这些结果显示出新型抗隐球菌生物膜肽的巨大潜力。
根霉酚是一种从镰刀菌属(Fusarium)中提取的天然Hsp90抑制剂,对新型隐球菌的MIC为1–2 µg/mL。尽管单独使用时对生物膜活性有限,但与氟康唑或伊曲康唑联合后表现出协同作用,可显著抑制成熟生物膜的形成。这表明Hsp90抑制剂作为佐剂,具备增强现有抗隐球菌疗法效果的潜在价值。
注:靶向热休克蛋白(Hsp),尤其是Hsp90作为毒力因子,能增强新型隐球菌的抗药性与致病性,并参与多糖荚膜的分泌,对生物膜形成至关重要。
5
其他具有抑制烟曲霉能力的物质
Plakortide F酸(PFA)是一种来源于海洋的聚酮内过氧化物,可通过破坏细胞钙稳态诱导细胞死亡,对烟曲霉具有显著抑制作用。研究还发现,PFA能激活钙调神经磷酸酶依赖的反应元件,表明其干扰了酵母关键的钙信号传导通路。
顺式-9-十六烯醛是一种具备抗烟曲霉生物膜活性的植物来源化合物,在0.078 mg/mL时可抑制真菌生长,在0.156 mg/mL时表现出显著的抗生物膜效应。扫描电子显微镜观察显示,其可导致烟曲霉生物膜大面积破坏,表现为胞外基质缺失及菌丝受损,效果优于烟曲霉素B。细胞毒性实验表明,该化合物对白色肺上皮细胞(L‑132)毒性较低,安全性良好。
天然产物作为自然界中丰富且复杂的化学资源,依然是一片尚未被充分开发的潜力领域,在抗真菌感染的研究与治疗中展现出广阔前景。这些来源于植物、微生物或海洋生物的化合物往往具有多样的生物活性和独特的作用机制,能够干扰真菌的生长、粘附及生物膜形成。
通过与现有药物协同作用,提高药物的生物利用度或降低真菌的耐药性,从而显著增强整体治疗效果。同时,其免疫调节特性有助于激发或强化宿主自身的防御机制,为机体提供额外的保护屏障。正因如此,天然产物不仅为抗真菌研究提供了新的思路,也为防治真菌生物膜相关感染开辟了更具前景的治疗途径。
针对真菌生物膜的治疗手段并不仅仅局限于传统的抗真菌药物或天然产物,还探索了多种具有潜力的替代疗法。这些新兴策略旨在弥补现有治疗的局限性,为真菌生物膜相关感染提供更多元化和更有效的干预途径,从而拓展抗真菌治疗的整体思路与应用前景。
1
光动力疗法
光动力疗法使用一种光敏剂,其被特定波长的光激活,目的是产生活性氧(ROS),这导致微生物细胞损伤和死亡。(维生素B2)和金丝桃素,它们是在贯叶连翘中发现的蒽醌衍生物。核黄素和金丝桃素被蓝色和黄橙色光激活,并且已经证明了在降低真菌生物膜形成的活力方面的显著功效。然而,由于ROS具有潜在毒性,该技术仍需进一步研究与优化。
2
防止医疗器械表明真菌定植
改变医疗器械的表面是防止真菌定植的关键。例如,在不锈钢医疗器械上进行银亚胺处理可抑制白色念珠菌生物膜的定植约82%,无哺乳动物毒性。钛植入物上的石墨烯涂层也被证明可以显著减少真菌粘附。
其他防止医疗器械上真菌生物膜形成的涂层包括之前提到的聚氨酯静脉导管上的壳聚糖和咪唑鎓盐共轭聚(L-丙交酯)。
3
使用疫苗防止真菌感染
疫苗为防治真菌生物膜提供了一种替代策略,可靶向生物膜形成相关抗原或诱导针对真菌细胞壁的广泛免疫应答。新型疫苗NDV‑3A(处于Ⅱ期临床试验阶段)能够诱导产生抗rAls3p抗体,从而抑制白色念珠菌与内皮细胞的粘附和侵入,并在导管小鼠模型中有效防止中心静脉生物膜形成。
此外,真菌细胞壁碳水化合物也是极具潜力的免疫治疗靶点。糖缀合疫苗和针对β‑葡聚糖及甘露聚糖的单克隆抗体在临床前研究中均展现出保护效果,并筛选出多种有望开发的候选抗体。尽管目前尚无疫苗获批用于预防真菌感染或生物膜形成,但研究仍在积极推进中,目标是开发出能够有效防控真菌感染的新型疫苗。
4
结合疗法效果更好
真菌生物膜的预防可通过将抗真菌药物、新型小分子或肽与材料表面修饰相结合来实现。例如,与单独的钛相比,卡泊芬净涂层钛片可完全抑制真菌附着;β‑环糊精与咪康唑联合应用于医疗器械后,白色念珠菌生物膜减少约90%。
鉴于真菌对常规抗真菌剂的高耐药性,小分子和肽类物质被广泛用于防止生物膜形成。其中,白色念珠菌在生物活性玻璃(耳蜗植入体)、牙科树脂(义齿)和硅胶(导管)上的粘附分别减少99%、77%和60%。
真菌生物膜感染依然是临床医学中最复杂且最具挑战性的问题之一。现有抗真菌药物虽然仍是治疗的核心手段,但其疗效受到多重限制——包括毒性高、药物渗透性不足以及抗药性风险增加。尤其在生物膜相关感染中,由于细胞外基质的屏障作用与多重耐药机制的存在,传统药物的效果大幅削弱。这不仅凸显了研发新型抗真菌药物的迫切性,也强调了探索能够有效干预生物膜形成与维持机制的创新策略的重要意义。
近年来,新一代抗真菌药物的研发、旧药再利用及天然产物的研究展现出显著潜力。药物再利用提供了一种低成本、低风险且可直接进入临床应用的途径,而天然化合物作为药物或辅助剂,能在防止生物膜形成和抑制其生长方面发挥重要作用。这些新策略的出现,为应对真菌系统性感染与生物膜相关感染提供了新的可能性。
除传统药理学方法外,多种跨学科创新技术正加速推进抗真菌治疗的革新。例如,光动力疗法、表面功能化与抗黏附涂层、以及基于纳米技术的药物递送系统,为从病灶源头预防和根除真菌生物膜提供了全新思路。这些手段不仅能增强药物靶向性与局部浓度,同时降低宿主毒性。值得注意的是,这些新兴疗法在白色念珠菌、新型隐球菌及烟曲霉等医学关键病原体中均展现出广谱抗真菌活性。
未来,抗真菌领域正迎来转变。通过整合分子靶向药物、天然产物、智能材料与纳米技术,有望实现对真菌生物膜的精准破坏与再感染预防。同时,应以患者安全与疗效为核心导向,构建兼顾个体化与精准治疗的综合策略,以延缓甚至防止真菌耐药性的进一步扩散。随着多学科融合与临床应用的推进,这些新一代疗法有潜力显著改善抗真菌治疗的临床结局,并最终在保障患者安全的同时,重塑真菌感染防治的新格局。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Elgammal Y, Garcia Martinez RI, Requejo A, Martinez LR. Current and emerging therapies for fungal biofilms and systemic infections. Crit Rev Microbiol. 2025 Oct 10:1-20.
Agbadamashi DJ, Price CL. Novel Strategies for Preventing Fungal Infections-Outline. Pathogens. 2025 Feb 1;14(2):126.
Buil JB, Oliver JD, Law D, Baltussen T, Zoll J, Hokken MWJ, Tehupeiory-Kooreman M, Melchers WJG, Birch M, Verweij PE. Resistance profiling of Aspergillus fumigatus to olorofim indicates absence of intrinsic resistance and unveils the molecular mechanisms of acquired olorofim resistance. Emerg Microbes Infect. 2022 Dec;11(1):703-714.
Kirchhoff L, Dittmer S, Furnica DT, Buer J, Steinmann E, Rath PM, Steinmann J. Inhibition of azole-resistant Aspergillus fumigatus biofilm at various formation stages by antifungal drugs, including olorofim. J Antimicrob Chemother. 2022 May 29;77(6):1645-1654.
Sutar Y, Nabeela S, Singh S, Alqarihi A, Solis N, Ghebremariam T, Filler S, Ibrahim AS, Date A, Uppuluri P. Niclosamide-loaded nanoparticles disrupt Candida biofilms and protect mice from mucosal candidiasis. PLoS Biol. 2022 Aug 17;20(8):e3001762.
Vassiliou E, Awoleye O, Davis A, Mishra S. Anti-Inflammatory and Antimicrobial Properties of Thyme Oil and Its Main Constituents. Int J Mol Sci. 2023 Apr 8;24(8):6936.
Yang L, Tian Z, Zhou L, Zhu L, Sun C, Huang M, Peng J, Guo G. In vitro Antifungal Activity of a Novel Antimicrobial Peptide AMP-17 Against Planktonic Cells and Biofilms of Cryptococcus neoformans. Infect Drug Resist. 2022 Jan 25;15:233-248.
Liu Y, Zhang Y, Zhao X, Lu W, Zhong Y, Fu YV. Antifungal Peptide SP1 Damages Polysaccharide Capsule of Cryptococcus neoformans and Enhances Phagocytosis of Macrophages. Microbiol Spectr. 2023 Mar 14;11(2):e0456222.
谷禾健康
在广阔的微生物世界中,细菌和真菌无疑是与人类健康关系最密切的两大类生物。它们都能够作为我们身体的“共生居民”,也都能摇身一变成为导致疾病的“入侵者”。细菌是简单的原核生物,而真菌则是相对复杂的真核生物。
然而,在临床医学的视角下,这两种微生物是截然不同的。一场细菌性肺炎和一场真菌性肺炎,尽管症状相似,其背后的病理机制、发展速度和治疗策略却有很多区别。这种差异的根源,并非在于它们的外在表现,而在于它们生命蓝图的最深处——细胞结构和生命活动的基本法则。
本文将聚焦于细菌与真菌在生物学上的核心差异,并深入探讨这些差异如何直接转化为它们在人类疾病中的不同角色、致病方式,以及治疗策略。理解这些差异,不仅是理解感染性疾病的关键,也是洞悉现代抗菌药物为何如此设计的根本所在。
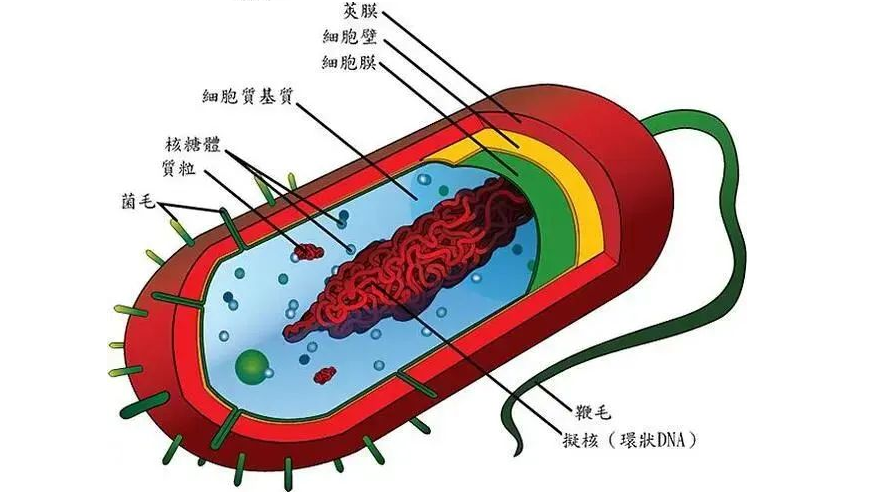
细菌是单细胞微生物,其最显著的特征是缺乏一个由核膜包裹的、真正意义上的细胞核,属于原核生物。 作为地球上最古老的生命形式之一,细菌的历史可以追溯到约35亿年前。它们的结构相对简单,但适应能力极强,遍布于土壤、水、空气乃至极端环境(如深海热泉)和生物体内。
细胞结构
细菌细胞缺乏膜结合的细胞器,如线粒体、内质网等。其遗传物质(通常为单个环状DNA分子)集中在细胞质中一个被称为拟核 (Nucleoid) 的区域,没有核膜包裹。细胞质中含有大量的70S核糖体,负责蛋白质合成。
细胞壁
绝大多数细菌的细胞膜外都有一层坚韧的细胞壁,其主要成分是肽聚糖(Peptidoglycan)。这层结构不仅维持了细菌的形态,提供了保护,也是区分不同细菌(如革兰氏阳性菌和革兰氏阴性菌)以及抗生素作用的重要靶点。
图源:pediaa
形态与大小
细菌形态各异,主要有三种基本形状:
它们的尺寸微小,通常在0.5~5微米(µm)之间。
繁殖与遗传
细菌主要通过二分裂的方式进行无性繁殖,在适宜条件下增殖速度极快,细胞周期可短至20-60分钟。此外,它们还能通过接合、转化和转导等方式进行基因水平转移,从而获得新的性状,如抗药性。
营养与代谢
细菌的营养方式多种多样。部分细菌是自养生物(如光合细菌和化能自养细菌),能自己制造养分;但大多数是异养生物,需从外界环境(如糖、蛋白质、脂肪等有机物)获取能量和营养。它们的代谢方式也涵盖了需氧呼吸、厌氧呼吸和发酵等多种类型。
典型代表
大肠杆菌 (Escherichia coli)
作为一种典型的革兰氏阴性杆菌,大肠杆菌是科学研究中的模式生物。它广泛存在于人体或其他恒温动物的肠道中,大多数菌株是无害的,甚至能帮助合成维生素K和维生素B12。然而,某些致病性菌株可引起从轻微腹泻到严重肠道感染的多种疾病。
伤寒沙门氏菌 (Salmonella Typhi)
这是一种致病性革兰氏阴性杆菌,是引起伤寒病的元凶。它通过污染的食物或水源进入人体,感染肠道和血液,可导致从发热到危及生命的败血性休克等严重后果。
真菌是具有由几丁质构成的细胞壁的真核生物。 它们构成了一个独立的生物界——真菌界。与细菌不同,真菌的细胞结构更为复杂,与动植物细胞更为相似。真菌的种类繁多,从微观的酵母菌、霉菌到宏观的蘑菇,形态各异。
细胞结构
真菌细胞拥有一个由核膜包裹的真核,遗传物质(线性染色体)位于其中。细胞质内含有多种膜结合细胞器,如线粒体(能量工厂)、内质网、高尔基体等。其核糖体为80S核糖体。
细胞壁
真菌细胞壁的主要成分是几丁质 (Chitin),这是一种多糖,也存在于昆虫的外骨骼中。这种独特的成分是区别真菌与植物(细胞壁主要为纤维素)的关键特征之一。
形态与大小
真菌可以是单细胞(如酵母菌),也可以是多细胞。多细胞真菌通常由被称为菌丝(Hyphae) 的线状结构组成,大量菌丝交织在一起形成菌丝体 (Mycelium)。真菌的大小范围很广,从几微米的酵母到巨大的蘑菇不等。
繁殖
真菌的繁殖方式多样,可进行无性繁殖(如出芽、断裂、产生无性孢子)和有性繁殖(通过有性孢子)。孢子是真菌繁殖和传播的主要单位。
营养方式
所有真菌都是异养生物。它们通常通过分泌消化酶到环境中,将复杂的有机物分解成小分子,然后再吸收这些养分。因此,它们在生态系统中扮演着至关重要的分解者角色,也被称为腐生菌。部分真菌也可以寄生或与其他生物共生。
典型代表
酵母菌 (Yeast)
这是一类单细胞真菌的统称。其中,酿酒酵母(Saccharomyces cerevisiae) 因其在烘焙和酿酒中的关键作用而广为人知。然而,某些酵母菌也具有致病性,如白色念珠菌 (Candida albicans),是引起人类常见机会性感染的病原体。
对于绝大多数健康人而言,它只是口腔、肠道和阴道黏膜上一个安静的共生成员。
而一旦身体的微生态平衡因为免疫力下降、长期使用抗生素、不健康的饮食习惯或激素水平变化等因素被打破,这个潜伏的伙伴就会迅速转变为危险的病原体。
它不仅是引起鹅口疮和外阴阴道念珠菌病等常见浅表感染的元凶,在严重情况下,它还能突破黏膜屏障进入血液,引发死亡率极高的侵袭性念珠菌病,对免疫力低下的人群构成致命威胁。关于白色念珠菌,详见谷禾之前的文章:
蘑菇(Mushroom)
蘑菇本质上是大型真菌为了繁衍后代而长出的子实体,负责产生和散播孢子。许多蘑菇如双孢蘑菇(Agaricus bisporus) 是营养丰富的食物,富含维生素D。但也有一些蘑菇含有剧毒,误食可致命。
细菌和真菌在生命演化的道路上分道扬镳,形成了本质上的区别。这些差异体现在细胞的每一个角落,从最基本的分类到具体的生化反应。下表详细列出了两者之间的关键区别:
细菌和真菌与人类的关系是复杂且双面的。它们既是导致疾病的元凶,也是维持健康和提供宝贵资源的益友。
致 病 性:感染与疾病
当病原性细菌或真菌侵入人体并成功定植、繁殖时,就会引发感染。由于它们的生物学特性不同,所引起的疾病类型和感染途径也大相径庭。
► 细菌性感染
菌血症是指血液中出现细菌。这可能是暂时的(如刷牙或咀嚼食物时),也可能是持续的。当身体的免疫系统无法清除这些细菌,并出现发烧、寒战等全身性感染症状时,就发展为败血症,这是一种可能危及生命的严重状况。
– 常见致病菌
根据临床资料,最常见的革兰氏阳性致病菌包括:金黄色葡萄球菌和肺炎链球菌。
最常见的革兰氏阴性致病菌则有大肠杆菌、克雷伯氏菌属(Klebsiella spp.) 和铜绿假单胞菌 (Pseudomonas aeruginosa).
– 常见疾病
细菌可引起多种疾病,包括:
呼吸道感染: 肺炎、结核病。
消化道感染: 霍乱、伤寒、食物中毒。
全身性感染: 破伤风、麻风病、败血症。
其他: 链球菌性咽炎、皮肤感染等。
► 真菌性感染
真菌血症 (Fungemia) 是指血液中存在真菌,同样是严重的临床状况。真菌感染可分为表皮感染、皮下感染和深部(全身性)感染。对于免疫功能低下的人群(如艾滋病患者、器官移植者、化疗患者),真菌感染尤其危险。
– 常见致病真菌
临床上最常见的致病真菌是念珠菌属 (Candida),尤其是白色念珠菌,以及新型隐球菌 (Cryptococcus neoformans)。
– 常见疾病
皮肤感染: 脚癣(足癣)、体癣等。
黏膜感染: 鹅口疮、阴道酵母菌感染。
全身性感染: 曲霉病、组织胞浆菌病、隐球菌性脑膜炎。
菌 血 症
菌血症是指血液中存在细菌。细菌可通过三种途径进入血液:从共生菌群区域、从已存在的感染病灶,或通过创伤将污染物质直接注入血管系统。
根据血液中细菌存在的持续时间,菌血症分为:
短暂性菌血症
可能自发发生,也可能伴随刷牙或咀嚼食物等轻微事件发生。在操作受感染的组织、污染表面的器械和在非无菌部位进行手术时,细菌可能会短暂出现。这些细菌通常在几分钟内被免疫细胞从血液中清除。尽管如此,如果免疫系统不堪重负或被逃避,这些生物体可能会在血液中持续存在,导致菌血症的症状和体征。
持续性菌血症
在感染性休克、细菌性心内膜炎和其他血管内感染期间,细菌会源源不断地进入血液。在伤寒、布鲁氏菌病和钩端螺旋体病等感染的早期阶段,也会出现持续的菌血症。
间歇性菌血症
未引流脓肿患者的血液中可间歇性检出细菌。肺炎、脑膜炎、化脓性关节炎和骨髓炎等疾病的病原菌常在早期阶段从血液中被检出。
败血症
尽管败血症(字面意思是血液败血症)在实践中意味着比菌血症更严重的临床状况,但许多临床医生和微生物学家可以互换使用该术语。
注:传统上,菌血症一词是指患者血液中细菌在没有症状的情况下暂时存在;细菌的起源通常来自共生菌的定殖地。败血症是指血液中存在细菌,具有感染的临床症状和体征。在新的医学文献和出版物中,这种差异在很大程度上被忽视了。
有 益 作 用:共生与应用
尽管病原体臭名昭著,但绝大多数细菌和真菌对人类和自然界都是有益的。
► 维持人体微生态平衡
人体肠道、皮肤和黏膜表面栖息着数以万亿计的微生物,构成了复杂的微生物组。这些共生菌群(主要是细菌)有助于消化食物、合成必需维生素(如维生素K和B12)、训练免疫系统,并抵御外来病原体的入侵。
► 食品工业
细菌: 乳酸菌被用于制造酸奶、奶酪和泡菜等发酵食品。
真菌: 酵母菌是面包和酒精饮料(啤酒、葡萄酒)生产的核心。一些蘑菇和霉菌(如用于制作蓝纹奶酪的青霉)也是重要的食材。
► 医药工业
抗生素生产: 许多最重要的抗生素最初都来源于微生物。例如,链霉菌(一类细菌)是链霉素等多种抗生素的来源。著名的青霉素则是由青霉菌(一种真菌)产生的,开启了现代医学的抗生素时代。
药物研发: 一些真菌(如蘑菇)正在被研究用于提取具有抗癌、免疫调节等药用价值的多糖、糖蛋白等活性物质。
► 生态系统功能
微生物是地球上主要的分解者,它们分解死亡的有机物质,将营养物质释放回土壤,完成了物质循环的关键一环。
细菌:数量庞大、适应性强,能够快速分解易降解的有机物(如糖类、蛋白质),在土壤和水体中是最常见的分解者。
真菌:能够分泌多种胞外酶,特别擅长分解纤维素、半纤维素和木质素等复杂的高分子物质,在分解木材和其他难降解有机物方面起关键作用。
在精准对抗病原体之前,首要任务是准确地识别它们。临床上,对细菌和真菌感染的诊断依赖于一套从传统到现代的多样化技术,它们各有侧重,共同构成了病原体检测的完整体系。
传统微生物学方法
显微镜检
通过对样本(如痰液、血液、分泌物)进行涂片和染色(如革兰氏染色),可以直接观察微生物的形态、大小、排列方式及染色特性,快速地区分出是细菌还是真菌,并对细菌做出初步分类。
微生物培养
将样本接种到适宜的培养基上,让病原体生长繁殖形成肉眼可见的菌落。不仅能证实病原体的存在,还能进行后续的药敏试验,指导临床用药。
免疫学与生物标志物检测
通过捕捉血液等体液中的病原体“标志物”(抗原)或人体产生的抗体来实现的快速诊断,无需等待耗时的培养。
该方法在真菌和细菌诊断中的地位截然不同。
对于生长极其缓慢的真菌,这是早期诊断的核心武器。血液中的G试验(广谱筛查)、GM试验(针对曲霉菌)和隐球菌抗原检测,是医生在培养结果出来前判断病情、决定用药的关键依据,为抢救重症患者生命赢得了宝贵时间。
而对于大多数培养较快的细菌,该方法更像是一个辅助侦察兵,仅用于特定场景(如肺炎链球菌和军团菌的尿抗原检测)为社区获得性肺炎提供快速的初步线索。
注:免疫学检测对细菌是辅助,对真菌则是主力,这种策略差异的根源在于两者截然不同的生长速度。
现代分子诊断技术
随着技术发展,分子诊断方法因其高灵敏度、高特异性和速度,在病原体检测中占据了越来越重要的地位。它们通过识别病原体独特的遗传物质(DNA/RNA),为快速、精准诊断提供了强有力的工具。
聚合酶链式反应 (PCR) 及其衍生技术
等温扩增技术
这类技术(如重组酶聚合酶扩增,RPA)无需传统PCR所需的高温变性步骤,可以在恒定温度下快速扩增DNA。这使得检测流程极大简化,反应时间缩短至5-20分钟,非常适合开发成可在现场或资源匮乏地区使用的快速检测工具 (Tan et al.; Liu et al.)。结合CRISPR等技术,其灵敏度和特异性能得到进一步提升。
高通量测序 (NGS)
靶向扩增子测序
这是一种寻找策略,它不测序整个基因组,而是只聚焦于特定物种的身份证基因。
这种方法成本相对较低,分析简单,对于研究特定菌群(如肠道菌群、口腔菌群)的构成非常有效。但它的局限性是看不到真菌和病毒。
宏基因组测序
这是一种破案策略,采取的是“无偏倚”的鸟枪法(Shotgun)。它不对目标进行任何预设,而是将样本中所有的遗传物质(包括细菌、真菌、病毒和来自宿主的)全部打碎,进行无差别的大规模测序。这种方法更全面。
人体的自然防御与免疫清除能力
自然防御机制:物理屏障
我们身体的某些部分具有自身的防御机制来抵抗细菌感染。例如,呼吸道有纤毛,这些像微小毛发一样的结构以同步波动的形式移动,清除细菌并防止它们定植。
体内的免疫系统:主动防御
我们的身体免疫系统旨在对抗感染并清除有害细菌。当它检测到细菌入侵时,会激活各种防御机制,例如产生抗体和免疫细胞,以摧毁病原体。在许多情况下,免疫系统能够自行清除感染。
轻微或局部感染:感染的自限性与自愈过程
一些细菌感染只影响身体的较小区域或引起轻微症状。在这种情况下,免疫系统可能能够清除感染,而无需使用抗生素或其他医疗干预。
微生物定植与感染
在临床实践中,区分微生物的定植与活动性感染是一个长期存在且至关重要的挑战。
定植指微生物(细菌、真菌等)存在于人体特定部位(如呼吸道、胃肠道、皮肤黏膜),但不引发宿主的免疫反应或相关的临床感染症状。此时,该微生物被称为定植菌。
感染是指当宿主与微生物之间的平衡被打破时,定植菌可转变为致病菌。
这种转化通常由两个因素触发:
摒弃单一指标,强调临床整合
目前的共识是,需要进行综合分析,将微生物学证据与患者的临床信息进行整合判断。
➦ 判断依据
辅助检查结果
对菌群检测结果的解读,需要脱离“检出/超标即为感染”的简单逻辑。
➦ 临床决策逻辑
倾向于感染: 当微生物学证据与临床表现、辅助检查结果三者相符时,应高度怀疑为感染,并启动相应的抗感染治疗。
倾向于定植:若仅有微生物学培养/肠道菌群检测阳性结果,而患者无任何相关的临床表现和辅助检查异常,则应首先考虑为定植。
病原体与标本部位的特异性
同一病原体在不同标本部位的临床意义截然不同,这是鉴别诊断中的核心考量点。
– 以肺炎克雷伯氏菌为例
粪便标本: 在肠道中通常为定植菌,检出率高(谷禾健康数据库显示28.2%的人群丰度>1%),这并不代表肠道感染。
但是当肺炎克雷伯菌进入血液并感染时,通常会发生细菌血症。症状可能包括发冷,发烧,发抖,肌肉酸痛,疲劳和嗜睡。
当肺炎克雷伯菌感染肝脏时,会引起脓性病变,也被称为化脓性肝脓肿。这种类型的感染更常见于患有糖尿病一段时间或已经服用抗生素多年的人。
– 以大肠埃希氏菌为例
血培养阳性时需考虑血流感染,怀疑致病性大肠埃希菌感染肠道时需特殊培养或者血清学、PCR,16s测序检测等。
因普通大肠埃希菌可寄居在肠道中,粪便普通培养有大肠埃希菌生长并不能直接考虑大肠埃希菌肠道感染。
– 以念珠菌为例
痰/尿标本: 可能为定植,需结合临床综合判断。
血液标本: 血培养阳性(念珠菌血症)是危重信号,需警惕,可能是严重感染。
对微生物检测结果的解读,需要将其置于完整的临床背景下,结合标本质量、采集部位、患者病史、临床体征和多源化的检测数据进行综合研判。
药物干预
传统抗生素和抗真菌药物仍是主流。
➤ 抗生素与抗真菌药物
针对细菌感染,首选抗生素。当患者感染金黄色葡萄球菌引起的肺炎时,可根据细菌的耐药情况选择合适的抗生素 。如果是耐甲氧西林金黄色葡萄球菌(MRSA)感染,通常会选用万古霉素等抗生素进行治疗 。这是因为万古霉素能够抑制 MRSA 细胞壁的合成,从而有效地杀灭细菌。
对于真菌感染,如白色念珠菌引起的阴道炎,常用唑类抗真菌药物进行治疗。氟康唑等唑类药物能够抑制白色念珠菌细胞膜麦角固醇的合成,破坏细胞膜的完整性,达到治疗目的。
如果真菌感染有渗液,可能并发了细菌感染。需要用抗生素治疗。涂敷抗生素霜剂或口服抗生素。稀释醋酸铝溶液或怀特菲尔德软膏也可用来使渗液的皮肤干燥。
现代抗菌药物设计的核心原则是选择性毒性,即药物能够特异性地攻击或抑制病原体,而对宿主(人体)细胞的损害尽可能小。细菌和真菌与人体细胞在结构和生化上的差异,为实现这一目标提供了绝佳的靶点。
★ 抗生素(靶向细菌)的设计
由于细菌是原核生物,而人体细胞是真核生物,两者之间存在大量独特的靶点,使得抗生素的开发相对容易。
靶点一:细胞壁合成
细菌细胞壁的肽聚糖是其独有的结构,人体细胞没有。因此,抑制肽聚糖合成的药物(如青霉素类和头孢菌素类抗生素)可以有效破坏细菌细胞壁,导致细菌裂解死亡,而对人体细胞完全无害。这是最经典、成功的抗生素作用机制之一。
靶点二:蛋白质合成
细菌的70S核糖体与人体的80S核糖体在结构上有显著差异。许多抗生素(如四环素类、大环内酯类)可以特异性地与70S核糖体结合,干扰或阻断细菌的蛋白质合成过程,从而抑制其生长和繁殖。
靶点三:核酸合成
某些抗生素(如喹诺酮类)可以抑制细菌特有的DNA旋转酶,从而阻断DNA的复制和修复。另一些(如利福平)则抑制细菌的RNA聚合酶。
靶点四:叶酸代谢
人体直接从食物中获取叶酸,而许多细菌必须自己合成。磺胺类药物通过抑制细菌合成叶酸所需的关键酶,达到抑菌效果,而对不合成叶酸的人体细胞无影响。
★ 抗真菌药物(靶向真菌)的设计
开发抗真菌药物的挑战远大于抗生素,因为真菌和人体细胞同为真核生物,许多生化途径和细胞结构非常相似,可供选择的特异性靶点较少。
靶点一:细胞膜的麦角固醇
这是抗真菌药物最重要的靶点。真菌细胞膜的主要固醇是麦角固醇(Ergosterol),而人体细胞膜是胆固醇 (Cholesterol)。
多烯类药物(如两性霉素B)能与麦角固醇结合,在细胞膜上形成孔道,导致细胞内容物泄露而死亡。
唑类药物(如氟康唑)则通过抑制合成麦角固醇的关键酶来发挥作用。
由于靶点的差异,这些药物对真菌细胞膜的亲和力远高于对人体细胞膜的亲和力。
靶点二:细胞壁合成
真菌细胞壁的几丁质和葡聚糖是人体细胞所没有的。棘白菌素类药物(如卡泊芬净)通过抑制β-(1,3)-D-葡聚糖的合成来破坏真菌细胞壁的完整性,对多种念珠菌和曲霉菌有良好效果。
靶点三:核酸合成
氟胞嘧啶是一种抗真菌药物,它在真菌细胞内被特异性酶转化为一种抗代谢物,从而干扰DNA和RNA的合成。由于人体细胞缺乏这种转化酶,该药物表现出较好的选择性。
➤ 药物再利用
部分已获批的非抗菌药物(如降脂药、抗炎药等)被发现对多重耐药细菌和真菌有效,可缩短研发周期并降低成本。
➤ 药物联合与新剂型
抗真菌药物联合应用可增强疗效、降低毒性,纳米载体等新型制剂有助于提升药物靶向性和生物利用度。
微生态干预
益生菌:通过调节肠道菌群、抑制病原菌/真菌定植、增强黏膜免疫,辅助预防和治疗真菌感染。例如下表:
益生元:膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物促进肠道中有益细菌的生长,同时通过生态位排除抑制病原体的生长。
粪菌移植(FMT)
粪菌移植是最早应用于临床的微生物群干预手段,尤其在复发性艰难梭菌感染治疗中疗效显著,已有多项指南推荐。
日常注意
➤ 饮食
富含水果、蔬菜、豆类和全谷物的纤维饮食与多样且强大的微生物群相关。这种多样性对肠道健康至关重要,因为它增强了对抗病原体细菌的抵抗力,支持免疫系统,并产生丁酸、丙酸和乙酸等短链脂肪酸。
西兰花芽中的萝卜硫素、卷心菜、菜花、甘蓝等能抑制细菌生长;发酵乳制品、蔓越莓可创造不利于其定植的环境;浆果(蔓越莓、蓝莓、覆盆子、草莓等)等能有效阻止有害菌粘附。
大蒜具有天然的抗菌特性,可以帮助抵抗某些类型的细菌。食用生大蒜或服用大蒜补充剂可能有助于减少体内细菌的生长。
薰衣草油、牛至油因其抗菌特性而常被使用。
绿茶、乳铁蛋白、蜂胶等补充剂也显示出抑菌和抗炎的效果。
姜黄具有天然的抗菌特性,可以帮助抵抗感染。它可以作为调味品用于烹饪,或与温牛奶和蜂蜜混合制成舒缓饮品。
将这些食物融入日常饮食,虽不能替代药物,但却能从多个维度辅助治疗。
饮食改变与肠道炎症相关的肠道微生物群
Lobionda S,et al.Microorganisms.2019
一项大规模全球宏基因组学研究,通过分析超过12,000份人类肠道样本发现:
肠道中的细菌可以分为两大阵营:
肠杆菌科能否在肠道内站稳脚跟,很大程度上取决于这两大阵营的势力平衡。
这种平衡可以直接受到我们饮食的影响。例如,高纤维饮食(富含蔬菜、豆类)会喂养像粪杆菌属(Faecalibacterium)这样的关键“共排斥菌”。这些有益菌在分解纤维时,会产生大量短链脂肪酸。这些酸性物质会降低肠道环境的pH值,创造一个不利于肠杆菌科生长的酸性“土壤”,从而有效地抑制其过度繁殖。这就像通过施肥来帮助益草生长,从而挤压杂草的生存空间。
反之,饮食也可能为有害菌提供可乘之机。研究指出,争夺铁是共排斥菌抑制肠杆菌科的另一重要手段。
➤ 应该避免哪些饮食?
乳制品
生的蛋白质食物
未洗的水果和蔬菜
茶水
➤ 如何在厨房尽可能避免细菌?
➤ 应该遵循哪些食品购物指南?
➤ 其他注意事项
注意卫生:日常生活中注意饮食卫生,家庭居所最好日常进行消毒、灭菌,防止带入外界环境的致病菌。
体育锻炼:适当从事体育锻炼可以提高免疫力,可根据自身情况选择打太极拳、健身、跑步、郊游等,劳逸结合。
增加维生素摄入:维生素C、维生素D和锌等在支持免疫系统方面起着至关重要的作用。将富含这些维生素的食物纳入你的饮食中,或者考虑服用补充剂。
避免吸烟和过度饮酒: 吸烟会损害呼吸系统,使细菌更容易进入你的身体。过度饮酒也会损害免疫功能。
远离传染源:有传染性疾病的人群应做好隔离措施,其他人群也应做好防护措施,避免与其接触,避免到细菌感染流行病区。
细菌和真菌,作为人体内共存的微生物,共同构成了复杂而精妙的微生态系统。它们既有细胞结构和繁殖方式上的根本区别,又在人体内扮演着双重角色——既是维持健康不可或缺的伙伴,也可能是引发疾病的潜在威胁。
肠道菌群检测等先进技术为我们提供了一个窗口,去窥探这个“看不见的器官”的健康状况。帮助我们评估疾病风险的同时,开启了个性化健康管理的全新可能。
通过精准调节肠道菌群,例如开发新型益生菌、定制营养饮食干预方案等,我们有望开发出更具针对性的疾病预防和治疗策略。这预示着一个从“治疗疾病”到“经营健康”的医学新时代即将到来,而这一切的核心,就蕴藏于我们体内的微小生命之中。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考资料
Wu Y, Hu S, Wu C, Gu F, Yang Y. Probiotics: Potential Novel Therapeutics Against Fungal Infections. Front Cell Infect Microbiol. 2022 Jan 21;11:793419.
Li X, Wang Q, Hu X, Liu W. Current Status of Probiotics as Supplements in the Prevention and Treatment of Infectious Diseases. Front Cell Infect Microbiol. 2022 Mar 14;12:789063.
Moura IB, Buckley AM. Using nutrition to help recovery from infections. Curr Opin Gastroenterol. 2025 Jan 1;41(1):54-58.
Mo Y, Tan WC, Cooper BS. Antibiotic duration for common bacterial infections-a systematic review. JAC Antimicrob Resist. 2025 Jan 29;7(1):dlae215.
Vinh DC. Human immunity to fungal infections. J Exp Med. 2025 Jun 2;222(6):e20241215.
Bacteria vs Fungi- Definition, 21 Major Differences, Examples. January 13, 2022 by Anupama Sapkota
Common Cause of Bacteremia and Sepsis,Written by Acharya Tankeshwar in Bacteriology.
Yin, Q., da Silva, A.C., Zorrilla, F. et al. Ecological dynamics of Enterobacteriaceae in the human gut microbiome across global populations. Nat Microbiol 10, 541–553 (2025).
Almeida C, Cerqueira L. Editorial: Molecular diagnostic methods for bacteria and fungi detection. Front Cell Infect Microbiol. 2024 Jun 4;14:1430630.
Wawrzeńczyk, A.; Czarnowska, M.; Darwish, S.; Ćwirko-Godycka, A.; Lis, K.; Szota, M.; Treichel, P.; Wojtkiewicz, A.; Napiórkowska-Baran, K. Methane, Bacteria, Fungi, and Fermentation: Pathophysiology, Diagnosis and Treatment Strategies for Small Intestinal Bacterial Overgrowth, Intestinal Methanogen Overgrowth and Small Intestinal Fungal Overgrowth. Curr. Issues Mol. Biol. 2025, 47, 713.
谷禾健康
通常认为人类体内微生物群存在于与外部环境接触的体腔和器官中,例如胃肠道、皮肤、口腔、上呼吸道(尤其是鼻咽)和泌尿生殖道。然而在过去十年中,越来越多的研究确定了肿瘤内存在着低生物量而独特的微生物群落(瘤内微生物群)。
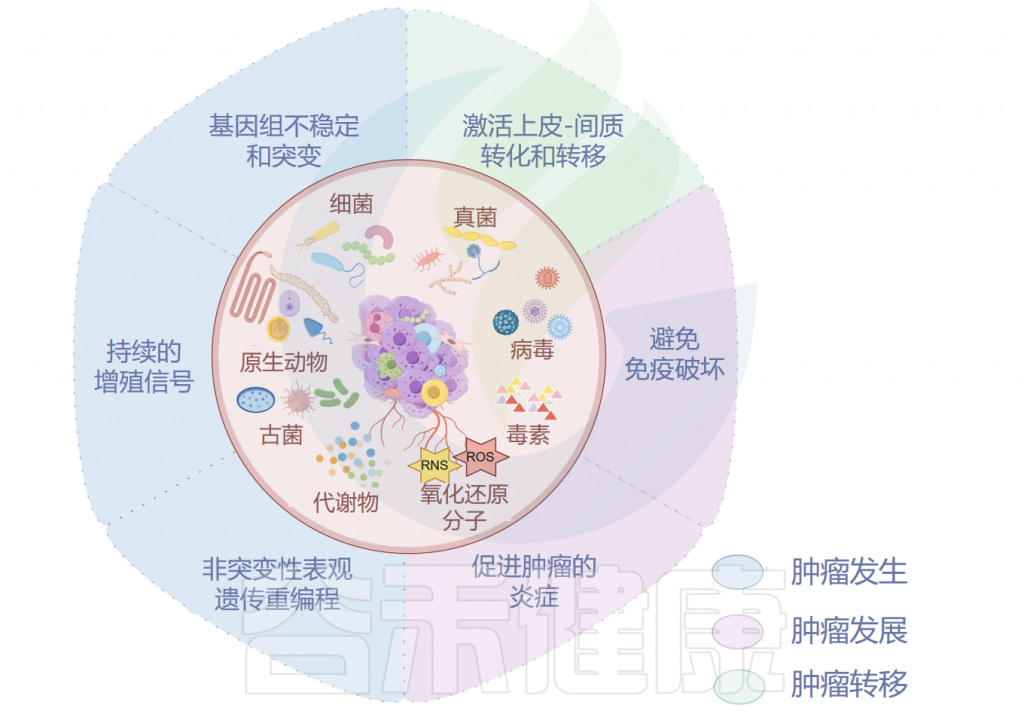
在肿瘤内,细菌、真菌、病毒和古菌等微生物形成了肿瘤微生物群,主要存在于肿瘤细胞、免疫细胞和细胞间基质中。这些微生物群落构成了肿瘤微环境(TME)的一部分,影响免疫调节、炎症和代谢控制等过程,这些过程与肿瘤的发生和进展密切相关。迄今为止报道的证据表明,肿瘤微生物组存在于33种主要癌症类型中。
大量证据表明,多达20%的癌症与微生物感染有着错综复杂的联系。最初在伯基特淋巴瘤中发现了EB 病毒(EBV)。从那时起,病毒感染就被认为是导致人类癌症的重要因素,包括确定人乳头瘤病毒(HPV)是导致宫颈癌的原因,乙型肝炎病毒(HBV)是导致肝癌的原因,以及人T细胞嗜淋巴细胞病毒是导致白血病和淋巴瘤的主要原因。
伯基特淋巴瘤(Burkitt淋巴瘤)是儿童恶性淋巴瘤中最常见的类型,起病急,进展快,侵袭强和恶性度高。1964年首先从非洲儿童Burkitt淋巴组织中分离出EB病毒。
1982年,就在胃中发现幽门螺杆菌(Helicobacter pylori)证实了其作为消化性溃疡和胃癌病原体的作用。2020年,对来自七种常见实体瘤(包括乳腺癌、肺癌、卵巢癌、胰腺癌、黑色素瘤、骨癌和脑肿瘤)的超过1526个样本进行了分析,发现大多数实体瘤含有细菌,其中许多是存活在癌细胞内的细胞内细菌。随后,在各种人类癌症标本中也发现了真菌,包括胰腺癌、肺腺癌和结直肠癌。
本文介绍了肿瘤微生物组的相关概念、来源和特征及检测方法。然后,我们描述了常见肿瘤中肿瘤微生物组的组成及其在塑造肿瘤微环境中的作用。肿瘤微生物组和免疫系统之间的相互作用可以调节宿主的抗肿瘤免疫,影响肿瘤治疗的疗效。理解肿瘤微生物组与肿瘤之间的相互关系,有助于为肿瘤的早期诊断和治疗带来新的突破。
▸ 肿瘤微生物的定义
“肿瘤微生物”,其定义为在肿瘤组织中发现的可影响癌症易感性和治疗反应的微生物。国际癌症登记协会(IARC)将11种微生物归类为人类致癌物。
其中包括7种病毒,即乙型肝炎病毒(HBV)、丙型肝炎病毒、人类嗜T细胞病毒、人乳头瘤病毒(HPV)、EB病毒、卡波西肉瘤相关疱疹病毒(KSHV)和默克尔细胞多瘤病毒(MCV);三种寄生虫,即华支睾吸虫、埃及血吸虫和Clonorchis mukusicus;和一种细菌,幽门螺杆菌(Helicobacter pylori)。
术语“瘤内微生物群 ”和 “瘤内微生物组 ”经常被人们混用。在本文中,我们将前者定义为肿瘤组织内所有微生物(包括细菌、病毒、真菌、原生动物和古细菌)的集合,而后者包括肿瘤组织内所有微生物的基因组和产物,包括所有分泌毒素(如来自脆弱拟杆菌和具核梭杆菌的毒素)、代谢物(如短链脂肪酸)和氧化还原活性小分子(活性氧、活性氮)。
并且在本文的术语中,“肿瘤”主要是指癌症(恶性肿瘤)。尽管良性肿瘤(如子宫肌瘤)也含有微生物群,但关于良性肿瘤的微生物群和微生物组的研究较少。此外,良性肿瘤不具有转移特性,限制了对微生物组在转移中作用的探索。
▸ 肿瘤微生物的来源
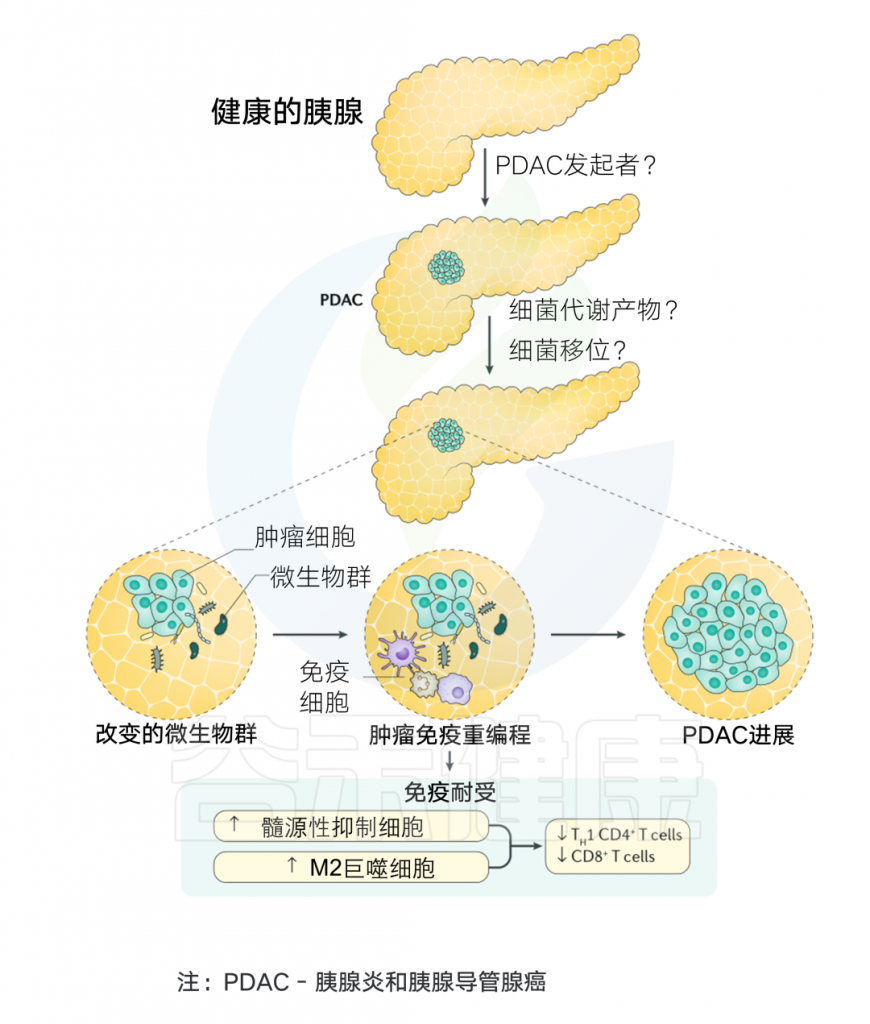
肿瘤微生物群的来源可分为两类。第一类是“常驻”生物,它们栖息在人类生态位中,在正常情况下通常不会引起疾病。然而,在微生物组的整体扰动导致生态失衡(生态失调)之后,共生微生物群的比例被破坏,导致共生微生物易位,从而诱导肿瘤形成。
第二类由“外来入侵者”组成,例如致癌微生物和其他病原微生物。入侵的肿瘤微生物群可以根据入侵途径进一步分为三种类型。
(一)微生物通过粘膜屏障侵入
微生物群落栖息在人体的各种粘膜表面,形成不同的微生物组生态位。在健康状态下,微生物群保持动态平衡,调节免疫系统以抵抗外部病原体的定植,并抑制内源性微生物的致病潜力。
然而,微生物组成的破坏或这些群落的位移会导致生态位间微生物串扰,从而可能影响癌症进展。在肿瘤发生过程中,粘膜屏障的损伤(无论是由细菌还是其他因素引起)可能使粘膜微生物有机会侵入肿瘤组织,从而导致结直肠癌、胰腺癌、肺癌和宫颈癌等癌症的发展。
(二)源自邻近健康组织的微生物
一些研究发现,肿瘤组织的微生物群组成与邻近正常组织的组成非常相似。胰腺癌患者肿瘤组织和十二指肠组织之间的细菌DNA谱相似性表明胰腺组织中的细菌可能起源于十二指肠。
起源于口腔的具核梭杆菌(Fusobacterium nucleatum)可进入肠道并在结直肠癌内增殖,从而在肿瘤微环境(TME)内诱导免疫细胞激活。小鼠模型显示,具核梭杆菌通过将其粘附素Fap2与结直肠癌细胞上表达的糖分子Gal-GalNAc结合来定植结直肠癌组织,而Fap2缺陷细菌在这些小鼠中的定植受损。
同样,发现口服荧光标记的粪肠球菌(Enterococcus faecalis)从肠道转移到肿瘤外围,改变了肿瘤微生物组的基因组特征并调节免疫功能。
此外,与正常组织相比,肿瘤微环境(TME)的特点是免疫抑制和缺氧,这些条件更有利于微生物定植,因此假设肿瘤微生物群可能起源于正常组织。
(三)微生物通过血液迁移到肿瘤
血液是肿瘤微生物组的另一个潜在来源。由于肿瘤组织的丰富血管化,它们为微生物的生存和传播提供了合适的环境。红细胞在细菌易位中起着至关重要的作用,有助于免疫逃避。使用 16S rDNA 定量聚合酶链反应测定和 MiSeq 测序(16S 靶向宏基因组测序)证实了健康人血液中存在细菌,并且在红细胞中检测到的细菌 DNA 浓度高于血浆。
活细菌,如肺炎链球菌和金黄色葡萄球菌,已被证明存在于红细胞中。
源自口腔、肠道、呼吸道和其他区域的微生物可以通过血流运输到肿瘤部位,通过受损的血管浸润肿瘤。坏死肿瘤细胞碎片的趋化梯度可能引导从身体不同部位进入血液的微生物迁移到肿瘤。
例如,金黄色葡萄球菌(Staphylococcus aureus) 的肺部感染已被证明会影响乳腺癌转移。结肠中的大肠杆菌(Escherichia coli)在结直肠癌期间破坏肠道血管屏障,进入血液,随后定植于肝脏,诱导转移前生态位的形成并促进肝转移。
★ 不同类型的癌症微生物群组成不同
许多研究已经确定了肿瘤组织内微生物组的存在,并强调了癌症微生物群的异质性。癌症微生物群是多种多样的,癌症微生物群的组成在不同类型的癌症之间,甚至在同一癌症的不同病理亚型之间也不同。
例如厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是结直肠癌中最丰富的物种,而变形菌门(Proteobacteria)在胰腺癌的微生物群中占主导地位。肝细胞癌富含变形菌门、拟杆菌门和Patescibacteria。
不同的癌症类型承载着不同的微环境,具有不同的氧分压、血管生成能力和周围组织的微生物群,这会影响肿瘤微生物群的组成并产生肿瘤类型的异质性。
不同肿瘤类型中微生物群的组成



Ma Y,et al.Microb Pathog.2024
★ 癌症不同阶段的微生物群也存在变化
除了类型异质性外,癌症微生物群还表现出位点异质性和分期异质性。前者是指肿瘤组织和非肿瘤组织之间微生物群组成的差异,主要包括特定个体微生物的存在或生态失调。肿瘤组织中的微生物群多样性通常低于非肿瘤组织,这可能与肿瘤微环境中特定微生物的选择性扩增有关。
后者是指癌症发展不同阶段肿瘤微生物群的变化。在口腔鳞状细胞癌的进化过程中,癌前阶段(癌前病变)显示链球菌(Streptococcus)和罗氏菌(Rothia)的高富集。而在晚期癌症中,Capnocytophaga在肿瘤组织中富集。
★ 癌症微生物组与宿主之间存在双向作用
肿瘤微生物组和宿主之间的相互作用是双向的。
这种影响主要体现在两个方面:
首先,细胞内和细胞外肿瘤环境之间的生化和生物差异与细胞内和细胞外肿瘤微生物组之间的功能变化有关。例如,某些细菌可以在癌细胞侵袭过程中调节RhoA-GTP酶-Rock-肌动蛋白细胞骨架重塑途径,从而促进携带细菌的癌细胞远处转移——这是细胞内肿瘤微生物组特有的作用。
其次,肿瘤微环境对肿瘤微生物组产生选择性影响。不同微环境中血管生成、氧水平、微生物来源、内吞作用和胞饮作用活性的变化导致肿瘤内的微生物组成不同。
让我们一起来看下不同癌症中的肿瘤微生物组与宿主之间可能存在的相互作用。
结直肠癌(CRC)是全球最常见的肿瘤之一,也是与肿瘤微生物组密切相关的肿瘤之一。
菌群失调可能是结直肠癌的诱因之一
动态平衡的微生物群对人类健康有益,但菌群失调可能导致结直肠炎症、炎症性肠病,甚至结直肠癌。
一项对423名I-IV期结直肠癌患者的肿瘤组织和正常粘膜进行 16S rRNA 测序的研究发现,与正常肠粘膜相比,结直肠癌组织的α多样性降低,β多样性增加。
变形菌门、梭菌门、弯曲杆菌门在肿瘤组织中的含量增加,而拟杆菌门、厚壁菌门、疣微菌门、放线菌门和古细菌减少。
有益菌和有害菌在结直肠癌环境中的作用
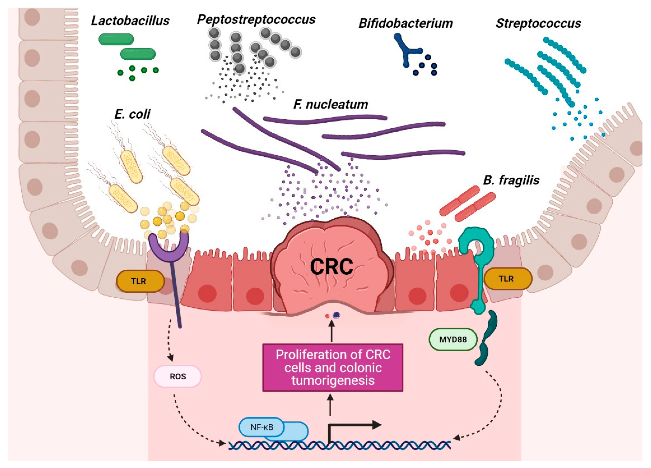
Torres-Maravilla,et al.Microorganisms.2021
产生毒素的特定细菌诱导肿瘤的进展
结直肠癌患者富含特定菌群,包括产生肠毒素的脆弱拟杆菌(B.fragilis)、肝螺杆菌(Helicobacter hepaticus)、败血梭菌(Clostridium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)、大肠杆菌、无乳链球菌和幽门螺杆菌。
这些细菌可通过释放破坏宿主细胞基因组的毒素,激活STAT3、NF-κB、Wnt和SREBP-2途径、诱导COX-2表达、与TRL2和TRL4相互作用、刺激促炎细胞因子(IL-1β、IL-6、IL-8、IL-17、TNF-α和IFN-γ)产生、调节NLRP3炎症体活性,通过氧化应激活性氧(ROS)和活性氮(RNS)DNA损伤来促进肿瘤中炎性微环境的形成并导致免疫逃逸来影响肿瘤的发展。
由于肿瘤粘膜微生态中的病原体网络与肿瘤突变和代谢特征相关,我们预计肿瘤微生物群组成的分析可以预测接受切除的结直肠癌患者的预后。
肺癌是常见的恶性肿瘤之一,肺癌的发生与下呼吸道以及口腔、鼻腔、胃肠道的微生物群密切相关。
肺癌患者中Gemmiger、Blautia等菌增加
普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)常见于口腔中,在肺癌中的含量增加。
并且与良性肺病患者相比,肺癌患者发现的菌群之间存在高度差异,Capnocytophaga、Sediminibacterium、吉米菌(Gemmiger)、Blautia和颤螺菌属(Oscillospira)这几个细菌相对丰富。
与肺癌可能相关的微生物
从全球角度来看,假单胞菌、链球菌、葡萄球菌、韦荣球菌属和莫拉克斯氏菌属经常被报道为与肺癌最相关的微生物群。

Liu NN,et al.NPJ Precis Oncol.2020
通过qPCR确定,二氧化碳嗜纤维菌(capnocytophaga)和韦荣氏球菌在肺癌患者的唾液样本中含量更高,而奈瑟菌属的丰度相对较低,它们有可能用作肺癌早期检测的生物标志物和微生物组治疗的靶标。
对30项相关研究的荟萃分析发现,肺部感染结核分枝杆菌、非结核分枝杆菌和其他病原体会增加患肺癌的风险。
胰腺癌是一种主要起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,起病隐匿,早期诊断困难,进展迅速,生存时间短,是预后最差的恶性肿瘤之一,被称为“癌中之王”。
胰腺中存在细菌,胰腺癌患者细菌更多
胰腺以前被认为是一个完全无菌的器官。然而,在2017年,在人胰腺癌组织中发现了γ-变形杆菌。随后,其他研究通过 16S rRNA 测序、NGS 和免疫荧光鉴定了胰腺癌中的肠杆菌科、假单胞菌属和变形杆菌科等细菌。
用16S rRNA基因特异性PCR对胰腺囊肿标本进行分析,发现优势菌:氨基酸球菌属(Acidaminococcus),埃希氏菌属(Escherichia),拟杆菌属(Bacteroides),志贺氏菌(Shigella)。
最近,对胰腺癌样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,胰腺癌患者中存在的细菌约为正常人的1000倍。
肿瘤微生物可引发炎症,促进胰腺癌变
此外,胰腺组织中的真菌组相比正常组织富集度增加了3000倍,主要成分为马拉色菌(Malassezia)。研究表明,马拉色菌属激活并结合甘露糖结合凝集素(MBL)蛋白,触发诱导胰腺癌的补体级联反应。
此外,肿瘤微生物组中的代谢物可以引发炎症和免疫抑制反应,并产生有利于肿瘤进展的免疫抑制微环境,促进胰腺癌变。
微生物组与胰腺癌发生的关系
Thomas R M, et al.Nature Reviews Gastroenterology & Hepatology.2019
乳腺癌是常见的癌症之一,也是全球女性癌症相关死亡的主要原因。
乳腺癌组织中的微生物稳态受到破坏
与正常乳腺组织相比,乳腺癌组织中的细菌 DNA 总水平较低,并且这些水平随着癌症的进展而持续下降,这表明癌症可能会破坏微生物组稳态。此外,已经确定肠道微生物群中预先存在的干扰增加了乳腺癌细胞转移,但还需要更多的研究来确定这些发现在临床环境中的相关性。
进一步表征乳腺组织中的正常微生物群和乳腺癌组织中的群落结构变化,可能会确定乳腺癌预防和诊断的新靶点。
阴道微生物组影响卵巢癌、子宫内膜癌和宫颈癌的发生和进展。研究表明,阴道细菌多样性的增加和乳杆菌丰度的降低可能导致持续的HPV感染。
阴道微生物组与HPV感染、宫颈上皮内瘤变相关
评估了250名女性的阴道菌群,证明了阴道微生物组、HPV感染与宫颈上皮内瘤变之间存在联系。阴道微生物群以阴道加德纳菌为主,其次是 Lactobacillus iners、Lactobacillus crispatus、Lactobacillus taiwanensis。
与健康女性相比,子宫肌瘤(UF)患者的宫颈和阴道微生物群相互作用和相对微生物丰度发生了改变。Erysipelatoclostridium、Mucispirillum、Finegoldia相对丰富,而Finegoldia的丰度降低,这表明子宫肌瘤患者可能存在宫颈和阴道微生物群的生态失调。
促炎微生物群与前列腺癌有关
前列腺癌是男性人群中常见的癌症,前列腺癌和非前列腺癌患者的尿液测序显示,促炎微生物群与泌尿生殖系统感染和前列腺癌有关。
研究报告了前列腺癌中促炎拟杆菌和链球菌丰度的显著差异,叶酸和精氨酸途径显著改变。对前列腺肿瘤微环境的分析显示,与非肿瘤组织相比,肿瘤/肿瘤周围组织中的葡萄球菌(Staphylococcus)明显更多,而丙酸菌属(Propionibacterium)在所有测试的肿瘤/肿瘤周围和非肿瘤组织中最为丰富。
病例对照研究还发现,良性对照受试者和前列腺癌男性的肠道微生物组的组成有很大不同,这可能适应前列腺癌的发病机制和对其危险因素的进一步研究。特别是,与对照组相比,前列腺癌病例中Bacteroides massiliensis的相对丰度较高,而对照组中普氏栖粪杆菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectalie)的相对丰度较高。
超过700种不同的微生物定植于人类口腔,健康人的口腔微生物群保持相对稳定。而口腔癌患者的口腔微生物群发生了变化。
口腔癌患者丰度和多样性比正常人群更高
对121例患者的分析显示,与健康个体相比,口腔癌患者的戴阿利斯特杆菌属(Dialister)含量显著增加,放线菌属、乳酸菌属和链球菌属丰度显著降低。牙龈卟啉单胞菌和核镰刀菌等主要牙周病原菌的慢性感染可增强IL-6-STAT3 轴信号传导并诱导口腔鳞状细胞癌。
使用16S rDNA测序来表征口腔鳞状细胞癌(OSCC)组织的微生物群,肿瘤部位细菌的丰度和多样性显著高于来自同一患者的正常组织样本。在OSCC样本中检测到梭杆菌属、卟啉单胞菌属、消化链球菌科、Flavobacteriaceae、Prevotellaceae和Campylobacteraceae,可能是诊断标志物和治疗靶点。
肿瘤微生物组与肿瘤发生、发展和转移密切相关,研究人员认为可以将多态性微生物组列为肿瘤的标志。接下来,我们将讲述肿瘤微生物组与肿瘤之间关系的代表性机制。
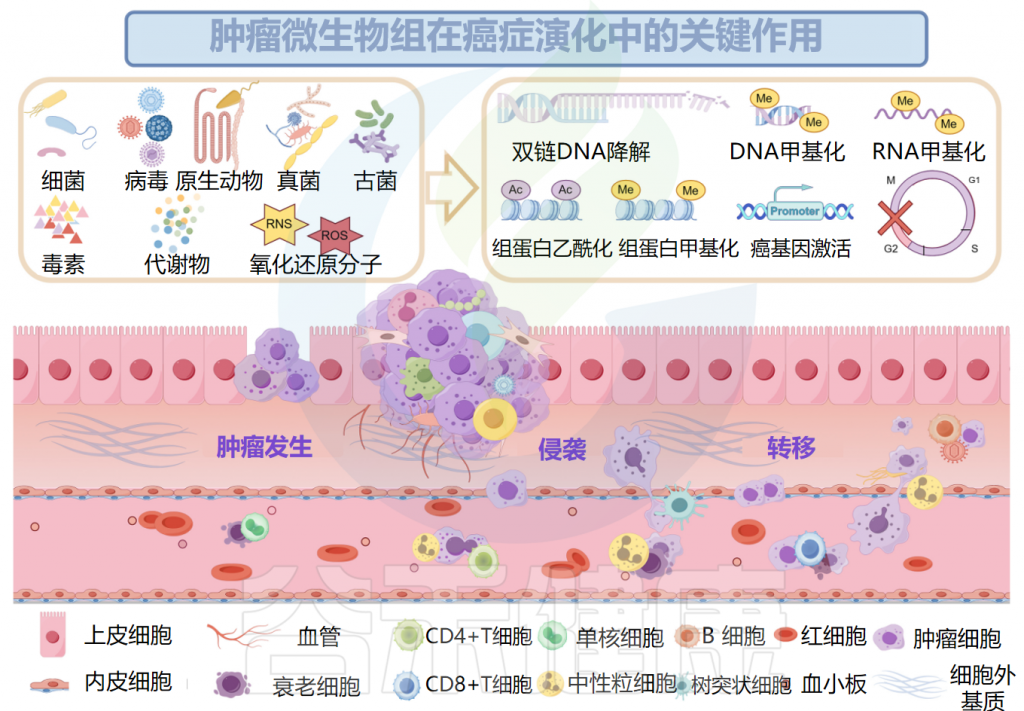
肿瘤微生物组与肿瘤密切相关
Ma Y,et al.Microb Pathog.2024
▸ 与肿瘤发生之间的关系
已被证明有助于肿瘤发生的肿瘤微生物组成分包括毒素、代谢物、酶和触发氧化应激的反应性小分子。这些物质可通过诱导基因组不稳定、表观遗传修饰和刺激宿主细胞的持续增殖而导致癌症。
细菌产生的毒素破坏基因稳定性并导致氧化应激
例如,由聚酮合酶阳性(pks+)大肠杆菌产生的大肠杆菌素和空肠弯曲菌分泌的细胞致死性膨胀毒素(Cdt)具有DNA酶活性,可以直接降解双链DNA,也可以导致DNA烷基化,从而在表观遗传水平上破坏基因组的稳定。
毒素介导的对DNA结构的间接损伤也可能是由反应性小分子的失衡引起的,例如脆弱拟杆菌毒素(BFT),它通过增加活性氧(ROS)的水平来诱导宿主细胞中的氧化应激。
此外,许多研究证实了肿瘤发生与癌微生物群产生的代谢物之间的联系。黄曲霉毒素B1(AFB1)是黄曲霉的代谢产物,可与DNA中的鸟嘌呤残基形成DNA加合物并诱导DNA损伤,最终致癌。在肝脏中,细胞色素P450酶参与AFB的代谢,它经历环氧化并转化为具有遗传毒性的8,9-环氧化物。8,9-环氧化物随后形成DNA加合物并促进突变,导致肝细胞癌的发展。
丁酸表达异常可能导致上皮细胞过度增殖
丁酸盐是一种短链脂肪酸,由结肠中的细菌发酵可溶性纤维衍生而来,是首选的宿主能量底物,可抑制结肠癌的发展。
丁酸抑制组蛋白脱乙酰酶(HDACs)和 DNA 修复蛋白的表达,在表观遗传水平上调节细胞增殖和凋亡,并减轻淋巴瘤。然而,在错配修复缺陷(dMMR)小鼠模型中,丁酸与结肠上皮细胞的过度增殖有关。
除了遗传起源外,表观遗传,包括由DNA甲基化、组蛋白甲基化和组蛋白乙酰化驱动的表观遗传,可以驱动宿主细胞恶性转化为癌细胞。
致癌微生物会驱动肿瘤的发生
EB病毒(EBV),也称为人类疱疹病毒4型(HHV-4),是一种致癌病毒,可诱导表观遗传变化以驱动肿瘤发生。溶原性EBV可诱导基因组不稳定并改变免疫逃逸,而潜伏的EBV有助于肿瘤细胞获得干性。
注:肿瘤干性被认为是肿瘤发展的关键组成部分
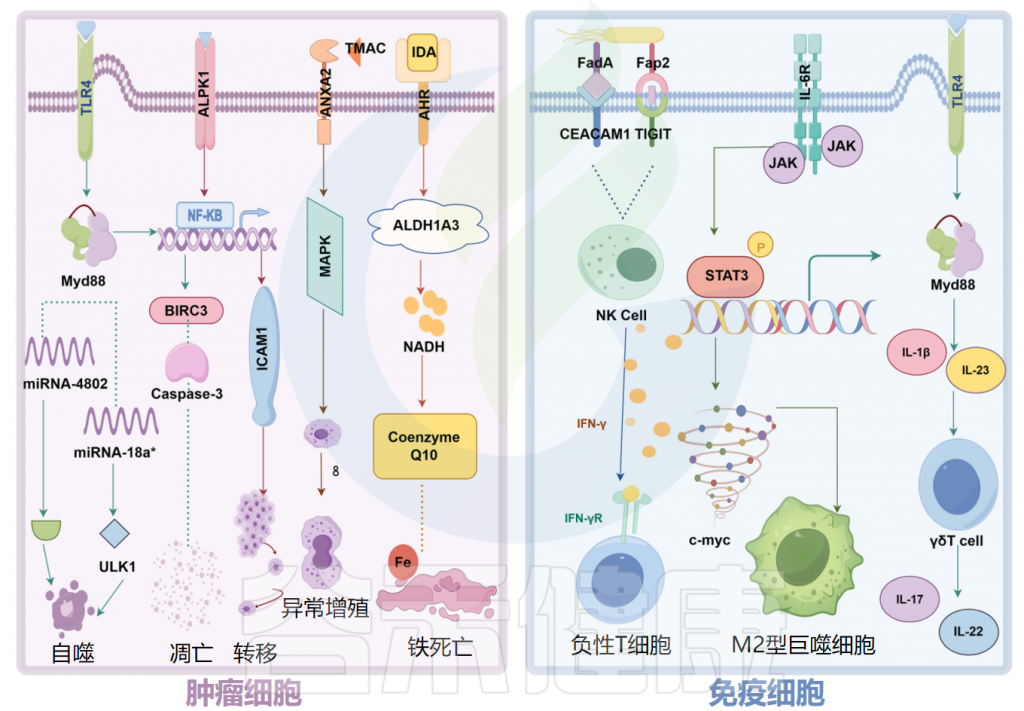
具核梭杆菌(F.nucleatum)通过钙黏附蛋白(E-cadherin)和粘附A蛋白(FadA)与癌细胞或免疫细胞结合,并激活β-catenin和Wnt信号通路以促进癌细胞增殖。
微生物组产生的炎症反应会增加对肿瘤的易感性
肿瘤微生物组产生炎症反应,以增加宿主对肿瘤的易感性。肿瘤微生物群的抗原表位被肿瘤微环境(TME)中的模式识别受体(如Toll样受体)识别,并导致活性氧、细胞因子和趋化因子等炎症介质的诱导,触发促进血管生成、癌细胞增殖以及肿瘤生长和进展的信号级联反应。
口腔牙龈卟啉单胞菌在癌症和胰腺导管腺癌中定植,促进CXCR2介导的中性粒细胞浸润,增强中性粒细胞弹性蛋白酶分泌,重塑肿瘤的炎症微环境,从而导致癌症进展。结直肠癌中,牙龈卟啉单胞菌激活造血NLRP3炎症小体,招募髓细胞,创造促炎微环境,与结直肠癌的发展和不良预后相关。
Ma Y,et al.Microb Pathog.2024
!
代谢物可能促癌也可能抑制癌症
重要的是要注意,代谢物的活性取决于肿瘤类型。色氨酸是变形杆菌和放线菌的能量来源,其代谢衍生物吲哚-3-醛激活肿瘤相关巨噬细胞中的芳烃受体(AHR),改变炎症基因的表达,随后可能诱发结直肠癌。
相反,在黑色素瘤中,罗伊氏乳杆菌代谢产生的吲哚-3-醛通过IFN-γ激活CD8+T 细胞中的AHR并增强免疫检查点抑制剂的疗效,从而促进肿瘤治疗。
▸ 与肿瘤发展之间的关系
肿瘤微生物群及其结构成分调节宿主代谢和免疫力,从而影响肿瘤的发展。
抑制自然杀伤细胞并促进肿瘤发展
除了激活长链非编码RNA ENO1-IT1的转录并影响组蛋白修饰外,具核梭杆菌(F.nucleatum)还调节结直肠癌细胞中的糖酵解途径,抑制自然杀伤细胞的活性并促进肿瘤发展。
肿瘤微生物的作用在不同肿瘤中可能有所不同,而不同生物体也可能在肿瘤中产生相同的生理效应。
例如,食管癌中的具核梭杆菌(F.nucleatum)以趋化因子(CCL20)依赖性方式促进Treg淋巴细胞浸润到肿瘤中,从而增强了肿瘤的侵袭性。在结直肠癌中,具核梭杆菌通过CCL20诱导巨噬细胞M2型极化参与肿瘤转移。
口腔鳞状细胞癌(OSCC)是一种起源于口腔粘膜复杂鳞状上皮的恶性肿瘤。具核梭杆菌激活自噬途径可促进体内癌细胞的迁移和侵袭。
同样,产气荚膜梭菌肠毒素诱导紧密连接蛋白Claudin 4(CLDN4)的核转位,增强OSCC细胞的增殖、迁移和侵袭,抑制YAP1磷酸化,促进YAP1表达以驱动肿瘤进展。
▸ 与肿瘤转移之间的关系
癌症转移是指肿瘤从原发部位迁移到远端器官的复杂过程,形成继发性肿瘤,是恶性肿瘤的一个重要标志。在发现癌微生物组作为肿瘤成分后,多项研究表征了癌微生物组在肿瘤转移中的作用。
调节上皮-间充质转化的激活
上皮-间充质转化(EMT)是将上皮细胞转化为间充质细胞的过程,其特征是细胞间极性和粘附丧失,运动和迁移增加。EMT的激活是肿瘤适应恶劣环境以促进侵袭和转移的关键策略,也可以由肿瘤微生物组调节。
在口腔癌小鼠模型中,具核梭杆菌(F.nucleatum)分泌的外膜囊泡调节EMT相关蛋白的表达,上调波形蛋白和神经钙网蛋白(N-cadherin)的表达,下调E-钙网蛋白(E-cadherin)的表达,从而促进口腔癌转移。
白色念珠菌是口腔癌菌群的主要组成部分,分泌蛋白酶诱导上皮细胞整合素的变化,增加E-钙粘蛋白表达,增强口腔癌的EMT表型,并促进侵袭和转移。
定植于乳腺导管腺癌的产肠毒素脆弱拟杆菌(ETBF)分泌的毒素可影响 Slug 和 Twist(EMT 标志物)的表达,并激活 β-catenin 和 Notch1 信号通路,促进肿瘤转移。
驱动细胞因子产生刺激癌细胞增殖和迁移
在胰腺癌中,具核梭杆菌(F.nucleatum)通过Fap-2依赖性途径靶向胰腺癌细胞紧密连接。这种相互作用驱动细胞因子的产生,这些细胞因子刺激癌细胞增殖并促进通过自分泌和旁分泌途径的迁移,最终驱动恶性肿瘤进展。
此外,紧密连接的破坏会激活YAP信号转导,从而抑制FOXD3的表达,从而降低m6A甲基转移酶甲基转移酶样3(METTL3)的表达。这随后降低了m6A甲基化,并促进了靶驱动蛋白家族成员26B的表达,从而驱动结直肠癌转移。
分泌细胞外囊泡,促进胰腺癌转移
最后,胰腺肿瘤微生物群可以分泌小的细胞外囊泡(sEVs),这些囊泡重塑细胞外基质,促进血管生成,并形成转移前生态位,促进胰腺癌转移。
与转移相关的肿瘤微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
对肿瘤微生物组及其异质性的研究发现了其在肿瘤诊断、预防和治疗方面的重要作用。
★ 有助于作为早期癌症的诊断标志物
迄今为止的研究表明,肿瘤微生物组可用作早期癌症诊断的标志物。幽门螺杆菌、梭杆菌、肠球菌属、沙门氏菌属、假单胞菌属和双歧杆菌属在特定的肿瘤部位富集,它们的检出可能用于诊断。
例如在原发性人类结肠癌和远处转移中检测到梭杆菌门(Fusobacteria),而使用甲硝唑抗生素治疗可以消除梭杆菌,并减缓肿瘤生长速度。
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
微生物组对肿瘤细胞和免疫细胞的特异性机制
Ma Y,et al.Microb Pathog.2024
测序技术的广泛使用大大提高了我们研究肿瘤微生物组的能力。这些测序技术包括16S rRNA测序、DNA测序、下一代测序技术(NGS)、表观遗传学测序(例如染色质免疫沉淀测序和DNA/RNA甲基化测序)和三维(3D)基因组技术。
肿瘤内微生物的生物量相对较低,这导致了多路复用16S rRNA 测序方案的开发,以最大限度地减少污染并准确表征癌微生物组。
例如,利用qPCR和16S测序技术从肿瘤组织获取测序数据,并构建了一个表征肿瘤微生物组的数据库,实现了检测灵敏度103-104每克组织对应的细菌数。
宏基因组是一种针对样本中所有DNA的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。最近的研究表明,宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
代谢组学,特别是质谱法,可以检测和表征人类微生物群产生的小分子,并了解这些微生物代谢物的功能作用。这提高了我们研究肿瘤微生物群的能力,并可能开发出非侵入性的诊断性肿瘤生物标志物。
微生物产生的多种细胞毒性代谢物在肿瘤发生和发展中起着至关重要的作用。单一的实验技术可能不足以完全解释肿瘤和微生物之间的复杂相互作用,需要基因组学、转录组学、蛋白质组学和代谢组学的组合来了解各种代谢物在调节肿瘤发生和发展中的作用。
肿瘤微生物组检测技术

Ma Y,et al.Microb Pathog.2024
▸ 微生物组在癌症治疗中的作用
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。
靶向肿瘤微生物组的治疗方法可能通过增强宿主抗肿瘤免疫、诱导肿瘤细胞焦亡、促进CD8+ T 细胞活性以及避免干扰健康组织及其相关微生物群来改善肿瘤的治疗。
肿瘤微生物组在肿瘤治疗中的应用
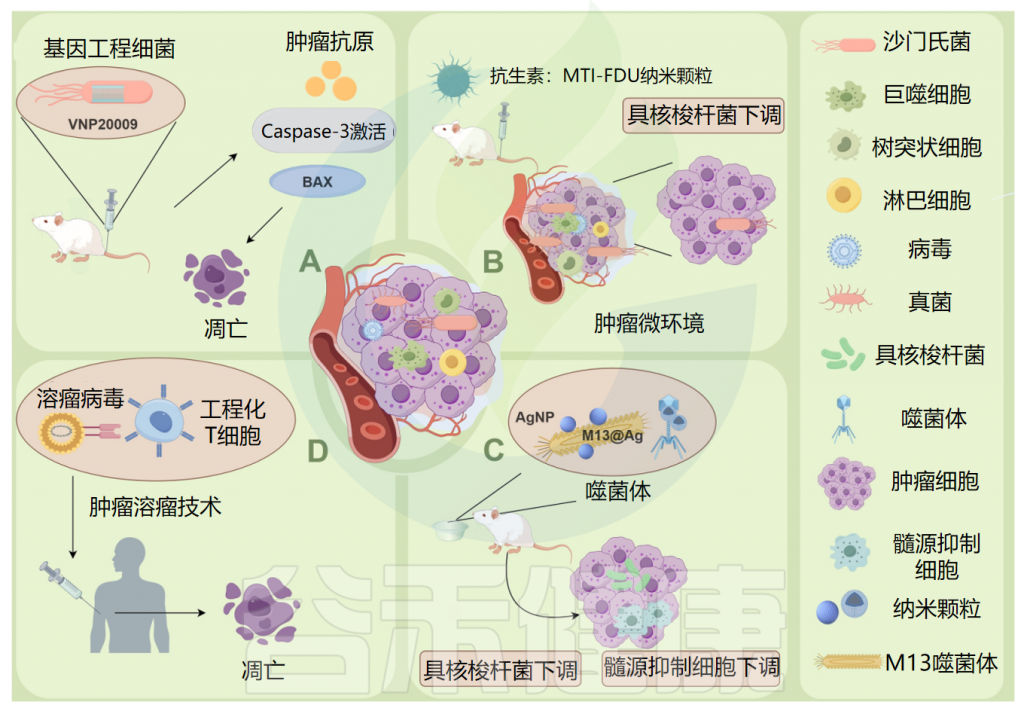
Ma Y,et al.Microb Pathog.2024
例如:(A)将基因工程减毒细菌菌株VNP20009直接递送到肿瘤发生部位,以及caspase-3凋亡酶活性的增加和促凋亡蛋白 Bax 的表达,显著诱导小鼠胰腺肿瘤细胞坏死,可作为杀死胰腺肿瘤的有效药物。
(B)甲硝唑-氟尿嘧啶利用增强的渗透性和保留作用,靶向肿瘤中的微生物群和肿瘤细胞,可以有效地从结直肠癌癌症组织中去除具核梭杆菌(F.nucleatum),具有低毒性和副作用。
(C)ONCOTECH(溶瘤病毒T细胞嵌合体)递送技术不仅增强了溶酶体病毒的靶向递送,而且改善了肿瘤微环境,能够在肿瘤中诱导长期免疫记忆。
(D)M13噬菌体特异性结合具核梭杆菌,在其表面外壳蛋白上静电组装银纳米粒子(AgNP)(M13@Ag),从肿瘤中去除具核梭杆菌,导致肿瘤部位髓系衍生抑制细胞(MDSC)减少。
除此之外,许多研究和谷禾的检测数据发现肠道微生物群可以调节癌症治疗,针对性地提高治疗效果并预防不良反应。
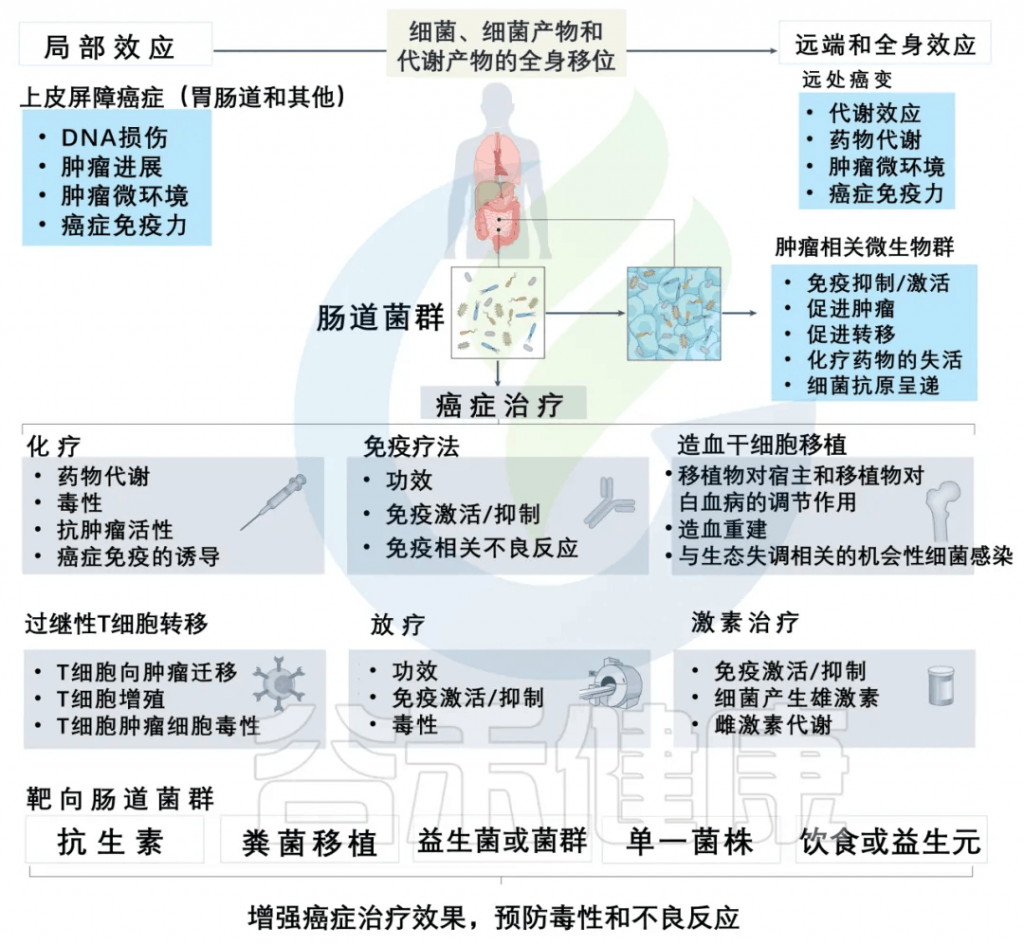
减轻化疗副作用,提高治疗效果
一些证据清楚地表明,调节肠道菌群可以减轻化疗药物的副作用,提高治疗效果。

减轻放疗毒性
在进行异基因造血干细胞移植预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗时出现的肠道毒性较轻。
几项研究表明,产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防全身放疗治疗毒性。可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
影响免疫疗法的效果
当前的癌症免疫疗法集中于利用特异性抗体来自我调节癌症免疫周期,这确保了应答的传播而没有生物中断。
微生态的改变会中断和削弱化学信号,导致致病状态,包括与炎症相关的疾病和癌症。
肠道微生物群对抗癌免疫反应的调节活性也与通过微生物群影响PD-L1和CTLA-4抑制剂的疗效有关。当与双歧杆菌的口服给药相结合时,PD-L1特异性抗体疗法的给药可以显著调节肿瘤的发展,在小鼠模型中肿瘤的生长几乎被消除。
我们预计肿瘤微生物组的研究将继续引起关注。然而,肿瘤微生物组在肿瘤预防和诊断中的应用,还存在着一些挑战。包括以下几点:
(一)人类微生物组在健康人群中的差异
同一个体在不同年龄的微生物组组成是可变的,更不用说不同个体中的微生物组成差异。部分原因是微生物组受饮食习惯、生活环境、药物暴露、生活方式和其他因素的影响。
因此,一个重大的挑战是根据微生物组的变化来确定个体的健康状况和癌症风险。未来,研究应探索肿瘤微生物组与环境、饮食和个人因素之间的相互作用。
(二)肿瘤微生物组的内容非常多样化
迄今为止已发表的大多数研究主要集中在细菌组上,而分析真菌组或病毒组的研究较少。此外,缺乏关于微生物组在非粘膜器官来源的肿瘤发展中的作用的数据。对肿瘤微生物组中微生物之间的关系也了解有限。例如,目前尚不清楚肿瘤微生物组中不同种类的细菌和真菌以及不同的病毒家族是相互独立的、协同的还是拮抗的。
(三)缺乏微生物代谢物等机制细节
尽管一些研究已经阐明了微生物改变肿瘤发生和发展的机制,但大多数仅具有相关性,缺乏与肿瘤发生因果关系的直接证据。特别是,其中许多研究无法确定微生物在肿瘤中定植的时间点。并且缺乏机制细节,主要集中在微生物种类的检测上,而忽略了分泌的毒素、代谢物和其他产物的功能。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症早期诊断和治疗的因果关系,并了解其作用机制,因此需要进行更广泛的试验。改进的细菌可能作为抗癌药物,甚至可被改造成“微型机器人”用于药物传递。
总体而言,这一领域的发展为癌症患者提供了新的治疗选择和希望,但也需谨慎评估和监测以确保安全性和有效性。
微生物群在开发癌症诊断和抗癌策略中的重要性和潜力值得强调,将微生物调节疗法纳入癌症管理的整体方法很有必要。未来,我们有望实现更精准和个性化的菌群调节策略,为癌症治疗带来更大突破。
主要参考文献
Ma Y, Chen T, Sun T, Dilimulati D, Xiao Y. The oncomicrobiome: New insights into microorganisms in cancer. Microb Pathog. 2024 Oct 29;197:107091.
Azevedo MM, Pina-Vaz C, Baltazar F. Microbes and Cancer: Friends or Faux? Int J Mol Sci. 2020 Apr 28;21(9):3115.
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2021 May;12(5):426-435.
Gagliani N, Hu B, Huber S, Elinav E, Flavell RA. The fire within: microbes inflame tumors. Cell. 2014 May 8;157(4):776-83.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, Weiser R, Mallel G, Gigi E, Meltser A, Douglas GM, Kamer I, Gopalakrishnan V, Dadosh T, Levin-Zaidman S, Avnet S, Atlan T, Cooper ZA, Arora R, Cogdill AP, Khan MAW, Ologun G, Bussi Y, Weinberger A, Lotan-Pompan M, Golani O, Perry G, Rokah M, Bahar-Shany K, Rozeman EA, Blank CU, Ronai A, Shaoul R, Amit A, Dorfman T, Kremer R, Cohen ZR, Harnof S, Siegal T, Yehuda-Shnaidman E, Gal-Yam EN, Shapira H, Baldini N, Langille MGI, Ben-Nun A, Kaufman B, Nissan A, Golan T, Dadiani M, Levanon K, Bar J, Yust-Katz S, Barshack I, Peeper DS, Raz DJ, Segal E, Wargo JA, Sandbank J, Shental N, Straussman R. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980.
Poore GD, Kopylova E, Zhu Q, Carpenter C, Fraraccio S, Wandro S, Kosciolek T, Janssen S, Metcalf J, Song SJ, Kanbar J, Miller-Montgomery S, Heaton R, Mckay R, Patel SP, Swafford AD, Knight R. Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature. 2020 Mar;579(7800):567-574.
Narunsky-Haziza L, Sepich-Poore GD, Livyatan I, Asraf O, Martino C, Nejman D, Gavert N, Stajich JE, Amit G, González A, Wandro S, Perry G, Ariel R, Meltser A, Shaffer JP, Zhu Q, Balint-Lahat N, Barshack I, Dadiani M, Gal-Yam EN, Patel SP, Bashan A, Swafford AD, Pilpel Y, Knight R, Straussman R. Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions. Cell. 2022 Sep 29;185(20):3789-3806.e17.
El Tekle G, Garrett WS. Bacteria in cancer initiation, promotion and progression. Nat Rev Cancer. 2023 Sep;23(9):600-618.

谷禾健康
谷禾以往在科研领域深耕十余年,积累了丰富的科研项目经验和数据分析能力,几年前,谷禾成功实现了从科研到大健康应用的技术转化,推出了谷禾宏基因组精准检测。
对于一些特定需要深度检测的应用场景,如健康管理机构的差异化服务需求,或者临床应用需求,宏基因组精准健康检测提供了另一种专业的技术选择。
宏基因组数据库的物种涵盖范围和菌株构成,直接影响着宏基因组物种鉴定分类的准确性和分类精度。
针对宏基因组数据库不完善的问题,谷禾整合了最新的NCBI refseq数据库,涵盖细菌、病毒、真菌和寄生虫,结合自研多元统计模型和机器学习算法,极大提升了物种鉴定和功能注释的准确性。
物种精准鉴定
分辨率更加精细,可达“种”和“菌株”水平,并对复杂的多菌种感染进行精细化解构。
肠道功能评估
肠道基础功能:包括蛋白质发酵能⼒、消化吸收效率、肠道产气情况、肠道屏障完整性、肠道炎症状态等,在菌群整体评估指标中也增加了包括菌群恢复力、革兰氏阴性菌、好氧菌等指标。
功能基因分析
– 全面评估菌群的基因功能潜力
如次生代谢产物合成通路、维生素合成能力、碳水化合物利用能力等,为个性化营养和精准干预提供科学证据。
耐药基因
– 分析耐药基因
不局限于已知靶点,可鉴定出各种已知和新型耐药基因,全面评估耐药基因的种类和数量,例如,在人体肠道宏基因组中发现了大量β-内酰胺酶等耐药基因。
– 追踪耐药基因的传播途径
通过比较不同环境(如土壤、水体、动物和人体)中耐药基因的分布情况,可推测耐药基因的来源和传播途径。
– 辅助指导耐药风险评估和防控策略
宏基因组学评估环境和宿主中耐药基因的分布特点,识别高风险区域和人群,为制定针对性监测和干预措施提供依据。
毒力基因
宏基因组检测技术在病原微生物毒力基因研究中具有独特优势,可在基因组水平系统分析其毒力基因组成及调控网络,加深对致病机理的理解。
免疫炎症分析
肠道菌群通过调控免疫平衡维持健康,⽽炎症标志物则作为评估机体炎症程度的关键指标。
宏基因组测序对测序深度要求较高,当数据量不足时,一些低丰度的真菌、寄生虫等病原体可能覆盖不到;然而,若要获得足够的测序深度来确保全面覆盖,则会显著增加测序成本,同时对分析能力和计算资源提出更高要求。
因此,宏基因组检测看似”简单粗暴”,只要更多数据量,实则真正的挑战在于,如何在成本与深度之间找到最优平衡。
谷禾持续迭代升级自有数据库
整合最新的NCBI refseq数据库
并结合十余年积累的临床样本数据
让相对较小的测序量
也能获得高精度的物种鉴定结果
同时,谷禾致力于深入挖掘
数据背后的生物学意义
通过专业团队的生物信息学分析
从宏基因组数据中构建
炎症状态、消化功能异常等关键健康指标
通过机器学习算法将海量基因信息
转化为实用的健康评估结果
通过这种”数据挖掘+算法迭代“
尽可能为大家控制成本的同时提供
媲美高深度测序的检测精度
极力追求技术创新与商业价值的完美结合
宏基因组报告中的解读更详细,还整理了一些评估指标,检测指标的总结等。
其他谷禾肠道菌群检测专业版的内容,宏基因组报告里面也都涵盖了,包括慢病风险、菌群代谢物及神经递质代谢、个性化营养等板块。
…
…
个性化饮食板块也在谷禾16S版本的基础上进行了迭代升级。
…
宏基因组检测并不常用于常规检测,其高昂的成本和复杂的数据分析决定了它更适用于关键时刻。
特定菌群感染的判别
对于一些复杂的多菌种感染,宏基因组能够更精细化鉴定感染菌群的构成,为临床辅助诊疗提供依据。
真菌与病毒感染的深度判别
相比传统培养,宏基因组学诊断真菌感染的敏感性和特异性更高,适用于一些真菌感染疾病。也可能鉴定出可疑的新病原体,为后续的病原学研究、药物和疫苗开发奠定基础。

<来源:谷禾宏基因组精准检测报告>
缺点:
总的来说,宏基因组测序仍存在技术瓶颈和生物学解释的局限性。然而,针对某些特殊情况研究需要,宏基因组测序也是一种有用的微生物组学研究工具。
特殊应用场景
对于一些复杂的多菌种感染,宏基因组能够更精细化鉴定感染菌群的构成,为临床辅助诊疗提供依据。
与传统方法相比,宏基因组学诊断真菌感染的敏感性和特异性更高,适用于一些真菌感染疾病。也可能鉴定出可疑的新病原体,为后续的病原学研究、药物和疫苗开发奠定基础。
以上是谷禾宏基因组精准检测报告的一些节选,其全面、精准、个性化分析肠道菌群的组成和功能,可帮助评估菌群失衡的风险和预后,为个性化诊疗和健康管理提供科学依据。
注:报告仅用于菌群科学研究和辅助参考,不直接用于临床诊断 。

谷禾健康

我们知道,微量营养素在人体健康中发挥着重要作用。然而,在全球范围内,约有3.4亿儿童患有多种微量营养素缺乏症,并伴有高致病性负担和耐多药细菌导致的死亡风险。
这些儿童经常用抗生素治疗营养不良相关疾病。可矛盾的是,由于潜在的微量营养素缺乏,他们的肠道微生物组可能已经为抗生素耐药性做好了准备…
通常,这些缺陷发生在生命早期前1000天,并可能带来即时和终身的健康缺陷。生命早期前1000 天是肠道微生物组成熟的关键时期,扰动会产生直接和长期的后果。
越来越多的研究让人认识到微生物与营养不良之间的密切关联。一些对单一微量营养素缺乏症的动物研究表明,诱导缺乏症后微生物特征发生了改变。例如,锌缺乏的雏鸡变形杆菌和厚壁菌门的丰度增加;妊娠、哺乳和断奶期间的维生素A缺乏症大鼠显示,其幼崽的微生物组成发生了显著变化,特别是厚壁菌门机会性病原体较高。
肠道环境中另一个容易被遗忘的元素是肠道抗性基因组(resistome),它是广泛表达于肠道微生物群栖息地内的共生菌和致病菌中的抗生素耐药基因(ARGs)和机制的完整集合。随着共生菌群的形成,抵抗基因组在婴儿期更加丰富,并在头几个月内高度动态变化。
抗生素耐药性可以是内在的,也可以是后天的。2019年的一份最新报告估计,5岁以下儿童中每5个死亡案例中就有1个是由于耐药细菌引起的。对营养不良微生物群组的理解仍然不完整,干预和治疗策略也可能被误导。
来自不列颠哥伦比亚大学的研究人员使用最近开发的小鼠模型,研究了多种微量营养素缺乏症,即维生素A、B12、叶酸、铁和锌,这是最常见的缺乏症,对成熟的肠道微生物组、结构和耐药性的影响。研究人员发现微量营养素缺乏会显著改变肠道菌群、真菌群、病毒组的组成,并且提供了以前未知的关于微量营养素如何塑造发育中的肠道抗性基因组的数据。

近日其研究成果发表在《Nature Microbiology》上,这为早期微量营养素缺乏症的长远后果提供了重要的见解。解决微量营养素缺乏问题,不仅仅是克服营养不良,也可能是抗击全球抗生素耐药性祸害的关键一步。我们一起来详细了解一下。
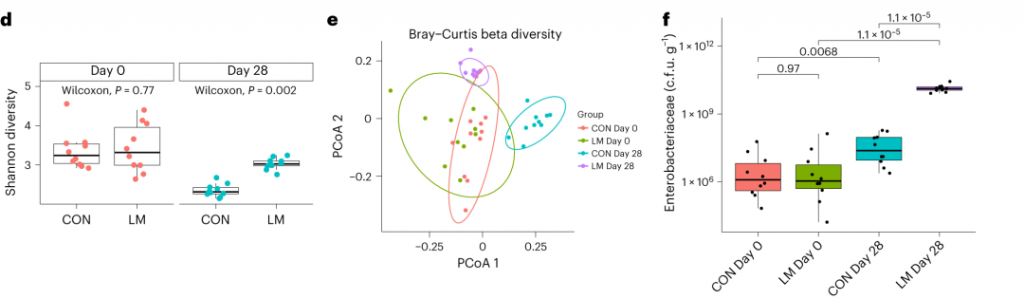
断奶C57BL/6N雄性小鼠接受等热量实验对照或多种微量营养素缺乏(即低锌、叶酸、铁、维生素A和B12)饮食28天。正如预期的那样,实验结束时,低微量营养素(LM)饮食的小鼠体重增加较少,发育迟缓和贫血。这里用鸟枪法宏基因组测序来表征饮食治疗前后的肠道微生物组。
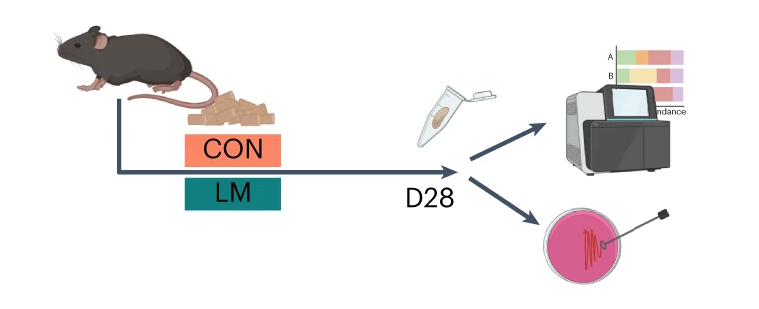
第28天,在LM小鼠中观察到变形菌门、肠杆菌门和Tannerellaceae科的扩增,而CON组的厚壁菌门和丹毒科扩增。LM小鼠中,下列菌群的相对丰度较高:
而下列菌群丧失:
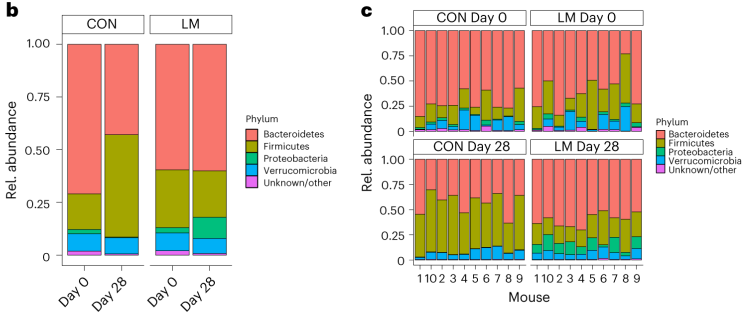
实验结束时,LM小鼠的α多样性较高(Shannon指数,P = 0.002);
PCA图显示,饮食处理后,两组之间存在明显的差异(p=0.001)
第28天,LM组中下列菌群增加:
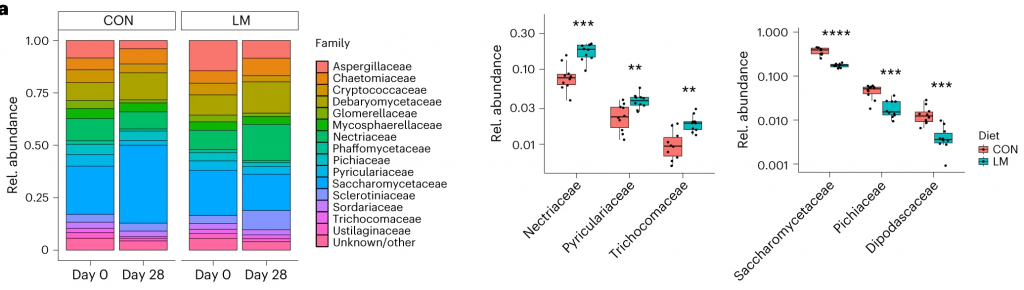
下列菌群丰度降低:
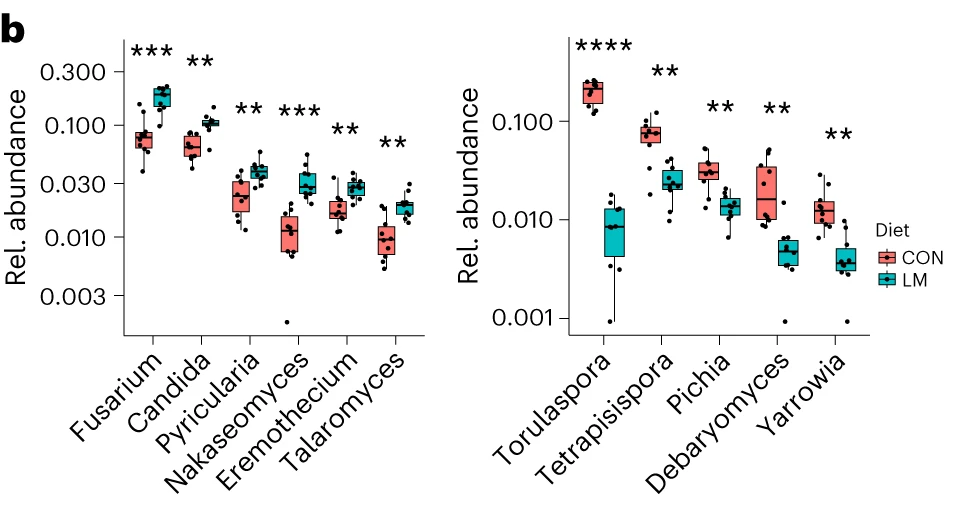
LM小鼠中,下列噬菌体丰度更高:
对照小鼠中,下列菌群的丰度更高:
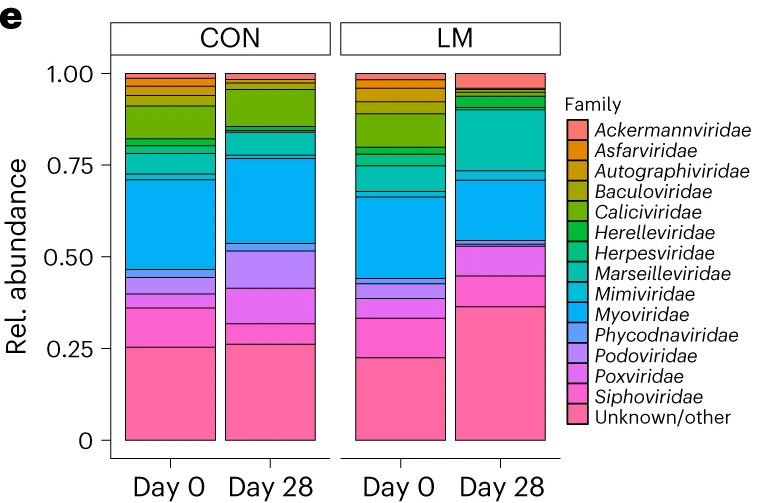
LM组的β多样性与对照在第28天有显著差异(Bray-Curtis,PERMANOVA,P < 0.01)
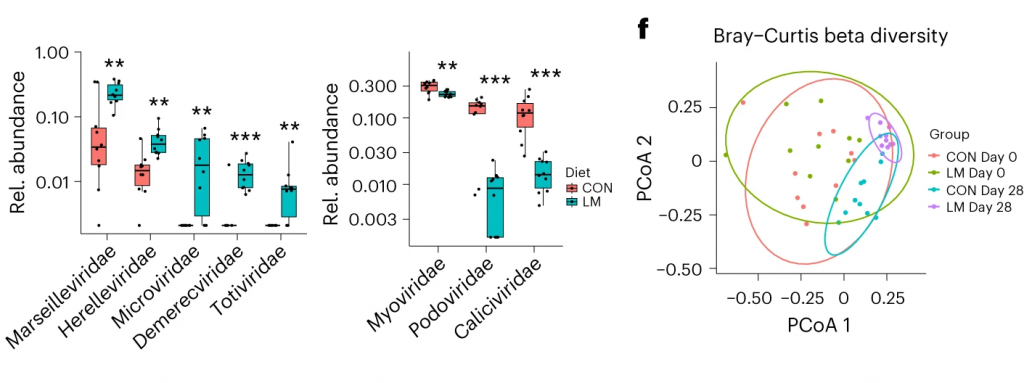
发现了14种指示细菌:
在真菌组和噬菌体组中,LM小鼠中下列相对丰度显著增加:
在营养不良的儿童中,机会性细菌的扩张(在不利情况下可能引发危害的微生物)是肠道的常见表型。因此,研究人员将模型中的机会性细菌与常见于营养不良儿童中的细菌进行表型比较。
第28天,LM小鼠中总机会性细菌的相对丰度总体增加(P < 0.0001)。11个分类单元中,有7个在第28天LM组的相对丰度显著增加:
有3个在LM组中丰度减少:
在LM的小鼠真菌群落中,观察到Candida dubliniensis 的相对丰度较高(P < 0.019)。
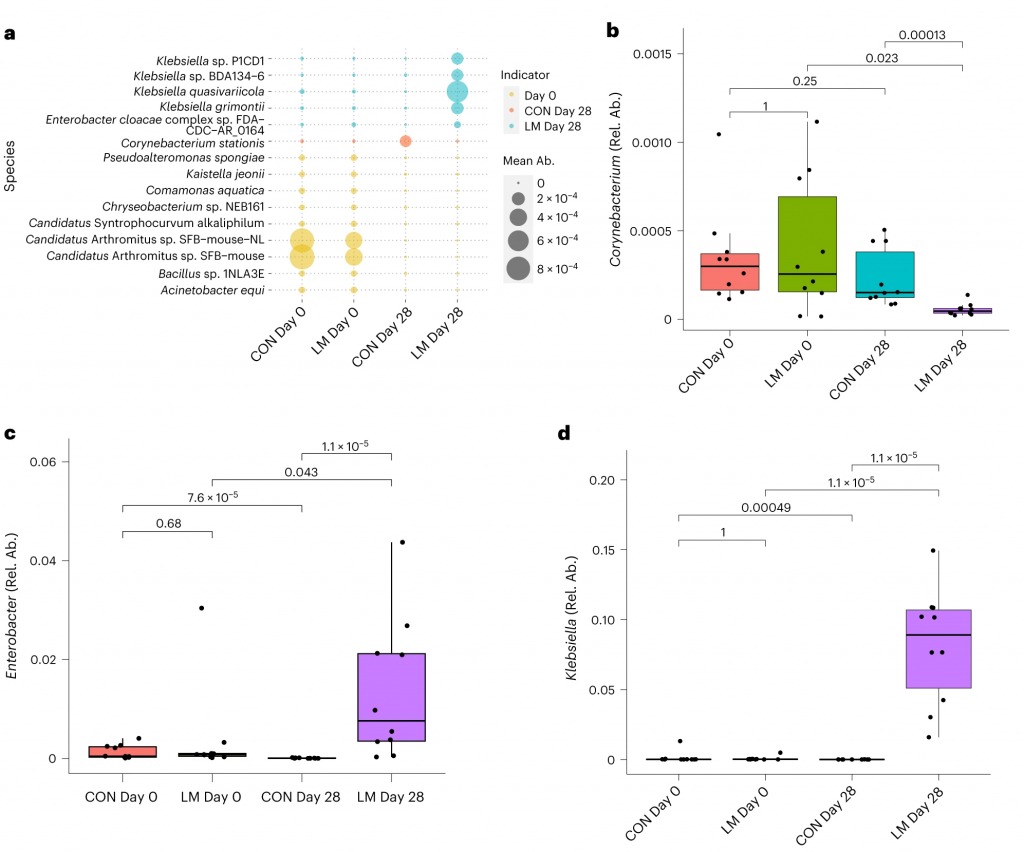
抗生素耐药性,无论是内在的还是后天的,都是由几个关键机制驱动的。
使用综合抗生素耐药性数据库(CARD)对肠道耐药性组进行分析显示,总ARGs的相对丰度增加(P = 1. × 10−5)。
随后的分析表明,抗生素外排和抗生素失活是改变的最常见的内在耐药性机制。
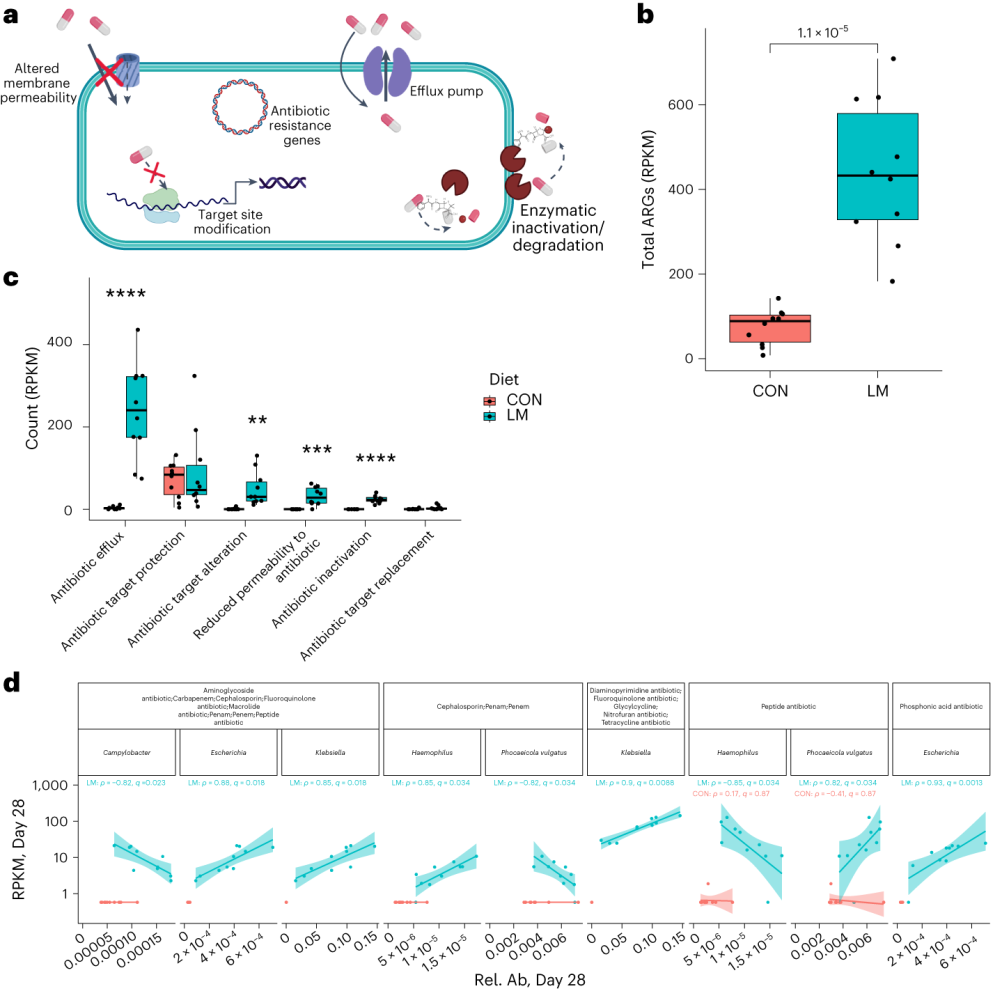
第28天LM组的ARG α多样性显著高于对照组(P = 0.0092)。
基于Bray–Curtis的相异性指标显示,低微量营养素饮食强烈影响了早期肠道抵抗。ARGs的计数显示,绝大多数(73%)ARGs仅在LM第28天组中流行≥30%。
将CARD数据库映射和药物分类分析显示,氟喹诺酮类/大环内酯类/青霉素类抗生素(Q < 0.0001)是LM处理小鼠中最常见的药物耐药机制改变,其次是磷酸酯类(即福氏霉素)(Q < 0.001),以及二氨基嘧啶类/氟喹诺酮类/甘氨环素类/硝呋环酮类/四环素类(Q < 0.001)。
▸ 接下来,研究人员提出是否有药物类别或耐药性机制与任何细菌门或机会性细菌相关?
事实上在LM小鼠中,克雷伯氏菌、嗜血杆菌、埃希氏菌、弯曲杆菌、Phocaeicola vulgatus和几种药物类别之间存在正相关(Q < 0.05)。不出所料,克雷伯菌和大肠杆菌与ARGs药物类别的相关性比其他机会细菌更强。
在个体机会性细菌中,克雷伯菌和弯曲杆菌与外排机制相关,克雷伯菌,志贺菌,弯曲杆菌和埃希氏菌与抗生素失活相关。
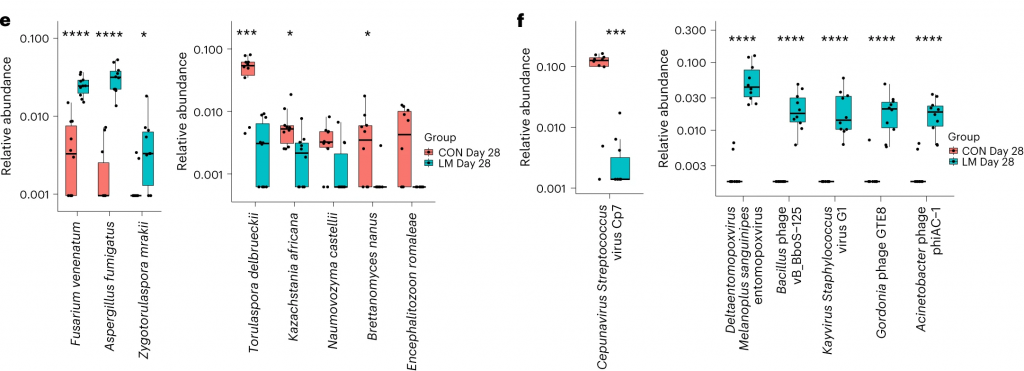
肠球菌与外排机制相关,但仅在对照组中。
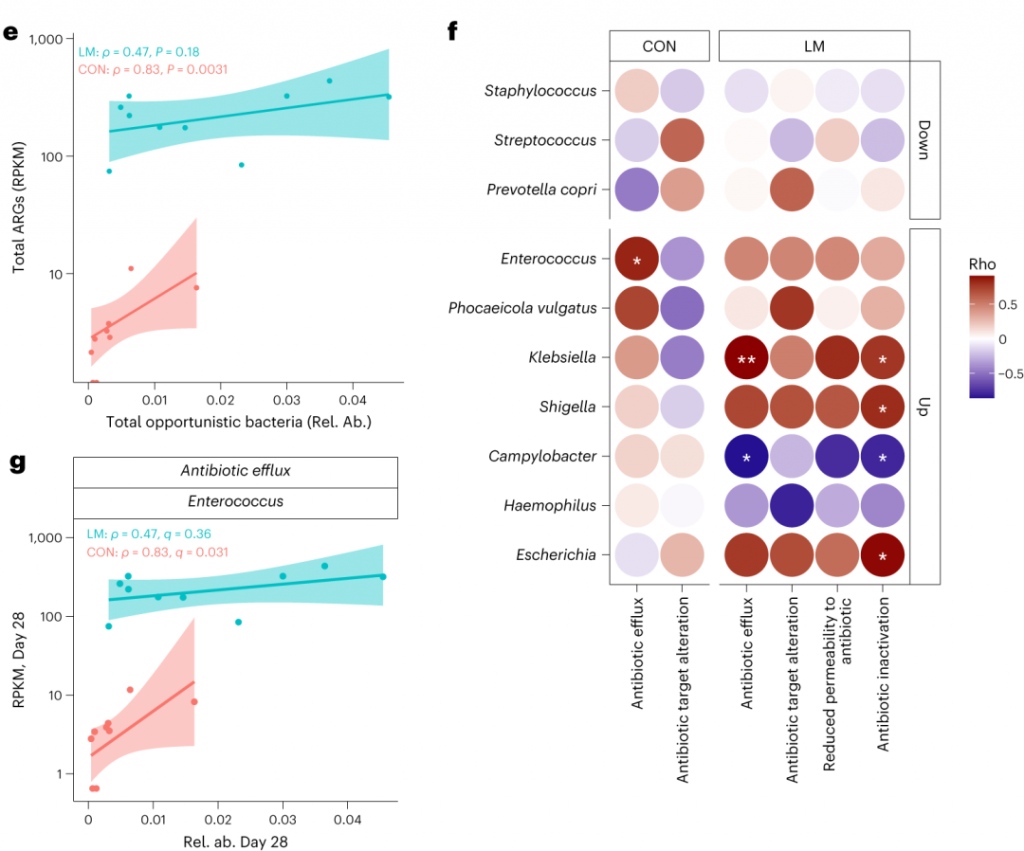
环境压力源,如营养缺乏,已被证明会触发细菌的压力反应,从而诱导抗生素耐药性机制作为生存策略。矛盾的是,细菌也可以产生活性氧(ROS),在致命压力的存在下自毁。
研究人员研究了LM喂养的小鼠的应激反应机制是否发生了改变,以及它们是否与个体ARGs相关。
事实上,在LM小鼠中发现编码氧化应激和氧化应激反应的基因更丰富,总ARGs与氧化应激之间具有很强的相关性(P = 0.0098)。
具体来说,氧化应激反应与下列之间存在强烈的相关性:
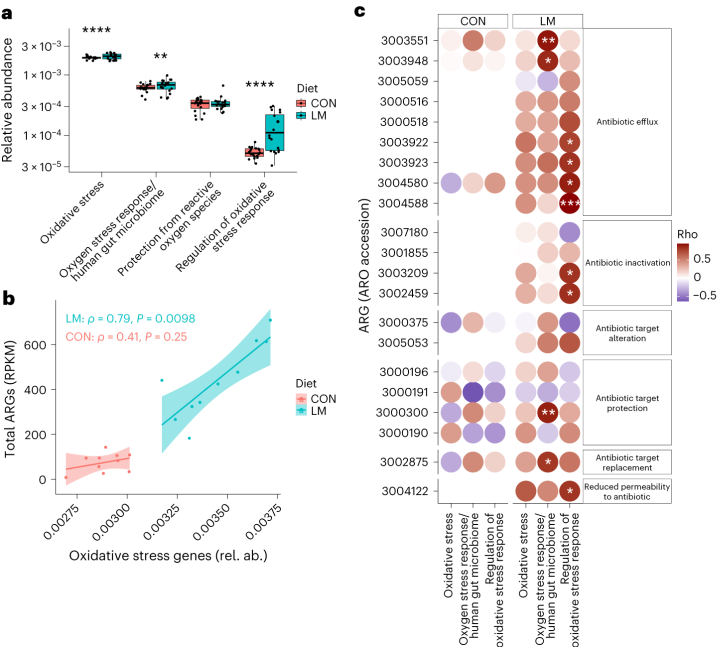
在对照小鼠中,总体氧化应激与嗜血杆菌之间存在强烈的相关性(p<0.05)。
在LM小鼠中,氧化应激反应的调节与克雷伯杆菌、志贺氏菌、弯曲杆菌、大肠杆菌、肠杆菌科菌和变形菌门菌的增加相关。
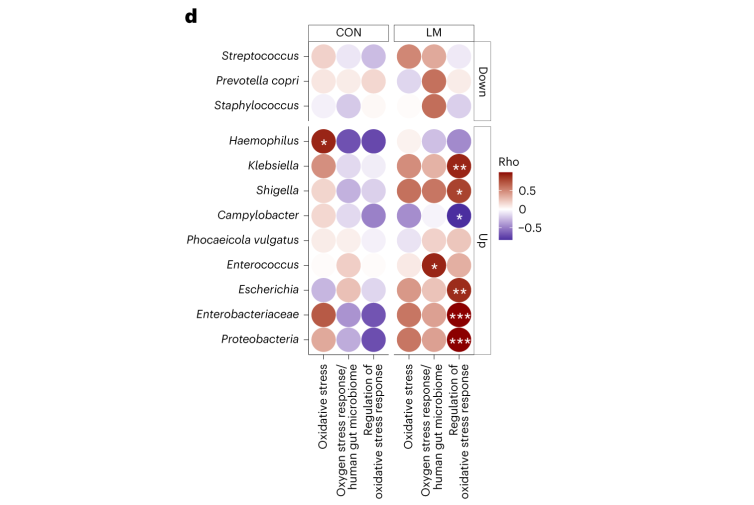
微量营养素缺乏是一项重要的公共卫生危机,同时也是一个容易忽视的研究领域。该研究基于先前的动物研究,强调了这些微量营养素缺乏如何影响发育中的肠道微生物组。此外还探索了耐药基因组。
低微量营养素 & 肠道微生物组
在低微量营养素饮食28天的小鼠体内,细菌、真菌和病毒/噬菌体粪便种群发生了变化 。由于微量营养素不足的影响,变形菌门细菌和机会性细菌,如克雷伯菌、大肠杆菌、志贺菌、衣原体、肠球菌、弯曲杆菌、肠杆菌、Phocaeicola vulgatus富集。
研究表明,饮食扰动确实会破坏肠道中正在发育的真菌生物群落和病毒组/噬菌体。还观察到LM小鼠体内病毒/噬菌体的富集,这表明了一个不成熟(即婴儿)表型和发育延迟。这一特征可能对细菌适应能力和宿主免疫反应产生影响。
真菌组在早期生命发育阶段受到饮食和其他环境因素的影响,可能对短期和终身健康产生影响。两个实验组的真菌携带量随着群落成熟而增加。然而,在第28天,低微量营养素饮食组的小鼠体内明显增加了致病真菌念珠菌,这是一种常见的侵袭性物种。
这些发现与一个在马拉维队列中的研究结果一致。该研究报道了在无锌情况下给予多微量营养素粉剂(MNP)后,马拉维队列的肠道微生物组中原生动物和真菌群落的增加。埃希氏菌-志贺菌也在12个月大的婴儿中富集,这些婴儿接受了补充或不补充锌的MNP,强调了微量营养素在形成营养不良儿童肠道群落组成中的作用。
低微量营养素 & 抗生素耐药性
抗生素耐药性是一项迫切的全球公共卫生威胁,肠道微生物组是耐药基因(抗性基因组)的重要来源。
一项先前的研究发现,健康婴儿的耐药基因组中存在预测超过30类抗生素耐药性的400多个基因。其中,167个基因对多个抗生素表现出表型耐药性。有趣的是,婴儿的耐药基因组中还包括对婴儿之前未接触过的多种抗生素的耐药性。这进一步强调了内在耐药基因组作为当前和新兴抗生素耐药性的病原库的重要性。
在本次研究中,发现低微量营养素饮食的小鼠中富集了参与内在抗生素耐药性机制的基因,这些基因与机会性细菌的存在具有关联性。例如,与氟喹诺酮和膦酸(如磷霉素)耐药相关的基因得到了富集。这对于常见患有多药耐药细菌引起的菌血症的营养不良儿童来说,具有重要的临床意义。
本次研究提供了重要发现,并强调了微量营养素缺乏与肠道抗药基因组之间的重要联系。这些结果表明,我们对营养不良微生物组的认识还不完整,需要进一步研究成熟的抗药基因组。
低微量营养素 & 肠道微生物组 & 耐药性
此外,还展示了微量营养素缺乏引起了肠道微生物组成的显著变化。这导致了变形菌门的扩增、机会性细菌和真菌病原体的增加,进一步促进了多种内在耐药基因的表达。
尤其是发现了细菌氧化应激与抗药基因组之间的显著相关性。确定了微量营养素缺乏引起的细菌应激在营养不良宿主中显著促进内在抗生素耐药性的作用。因此,未来解决营养不良和抗生素耐药性问题的策略应将内在耐药基因组纳入考虑,并与可持续发展目标(良好健康和福祉)相一致,最大程度造福于相关儿童。
本研究的一个局限性是初步的微生物组特征分析中使用了雄性小鼠(基于先前的研究表明雄性对营养不良比雌性更加敏感),研究人员计划在未来探索雌性小鼠。
另一个潜在的局限性是使用了多种微量营养素;然而,这种设计增强了模型,反映了实际应用中与儿童相符的多种微量营养素的复杂协同作用。一个主要的优势是将测序和生物学评估相结合,用于微生物组和抗生素耐药性的特征化。进一步探索数据集可能揭示共存微量营养素缺乏的功能和微生物动态。
未来可以调查肠道生理学以及抗药基因组在致病感染易感性中的作用。进一步探索真菌耐药基因组和该模型中内在抗真菌性能。然而,抗真菌耐药性数据库(MARDy)是目前唯一经过策划的抗真菌耐药性数据库,但更新不够频繁,限制了它的应用。
目前可用的抗生素耐药性分析数据库往往存在高估基因关联性的倾向。数据库的选择取决于研究人员想要回答的问题类型。
CARD数据库的一个局限性是它基于已发表的基因组数据进行策划,可能对经过深入研究的生物体比对少研究的生物体有偏见。不过它的全面列表、专家的定期更新和机器学习算法支持使其成为该领域中的宝贵工具。
编辑
抗生素耐药性通常归因于抗生素的过度使用和误用,但本研究表明,微量营养素缺乏的“隐性饥饿”是一个重要因素。需要进一步加强对营养不良与抗生素耐药性之间关系的研究,增进我们对这一领域的理解。还需要制定和实施综合性的干预策略,以解决儿童营养不良及其对健康的连锁反应,以及抗生素耐药性的双重挑战。总的来说,该研究为减少抗生素耐药性提供新的视角,为这方面的研究带来新的思路,并在全球范围内推动健康和可持续发展目标的实现。
参考文献:
Littlejohn PT, Metcalfe-Roach A, Cardenas Poire E, Holani R, Bar-Yoseph H, Fan YM, Woodward SE, Finlay BB. Multiple micronutrient deficiencies in early life cause multi-kingdom alterations in the gut microbiome and intrinsic antibiotic resistance genes in mice. Nat Microbiol. 2023 Nov 16.

谷禾健康

在我们日常的护肤和美容过程中,我们经常听到关于皮肤的各种话题,从保湿到抗衰老,从痘痘到过敏…
随着科学的不断进步和技术的发展,人们开始逐渐发现,皮肤上隐藏着一个神秘的世界——皮肤微生物群。它在维护我们的皮肤健康方面扮演着举足轻重的角色。
皮肤微生物群由各种细菌、真菌等微生物组成,它们聚集在毛囊、汗腺、皮脂腺等地方,形成一个庞大的生态系统。它们在皮肤表面形成了一道坚固的屏障,阻止了有害菌的入侵。除了提供保护作用外,皮肤微生物群还参与调节角质层的代谢,协助皮肤的水分平衡,并对免疫系统起到了重要的调节作用。
皮肤微生物群的平衡易受到许多因素的干扰。个人的生活方式(过度清洁)、饮食习惯(高糖高脂的饮食)等可能直接影响皮肤微生物的结构和组成,进而引发皮肤问题。外界环境中的污染物、紫外线辐射、气候变化等也会对皮肤微生物群产生影响,从而引发皮肤干燥、过敏、炎症等问题。肠道微生物群的失衡可能导致身体免疫系统的异常反应,进而影响皮肤的健康。
了解皮肤微生物群的特征及其与其他因素的相互关系,对于制定精确的治疗和护肤策略具有重要意义。

图源:Getty Images
本文我们来了解一下整个生命中皮肤微生物组,探讨皮肤微生物群的功能,包括保护屏障、免疫调节等,阐述了皮肤微生物与宿主的相互关系,微生物群在皮肤病中的影响,同时也介绍一些基于微生物群的保持皮肤健康的方法,以及皮肤微生物群在不同领域的应用前景和潜力。
-本文主要内容如下-
编辑
-正文-
皮肤是暴露于外界环境的重要器官,它可以调节体温、防止感染、保护内脏器官等。
皮肤表面是一个酸性、富含盐分、干燥、有氧的环境,而形成毛囊皮脂腺单位的内陷则相对厌氧,甚至富含脂质。
▼
皮肤是身体最大的器官。一个成年人的皮肤平均面积约为1.5-2.0平方米。皮肤除了作为外界与生物体之间的物理和化学屏障的功能外,还作为许多微生物的栖息地。通常,一个人的皮肤上有大约 1000 种细菌。
皮肤微生物组由多种微生物组成,包括细菌、真菌、病毒、螨虫等。
皮肤微生物群通过参与皮肤中发生的基本生理过程,对于维持皮肤屏障、抵御病原体入侵、增强免疫系统、分解天然产物等方面发挥着重要作用。
皮肤和微生物群的结构

编辑
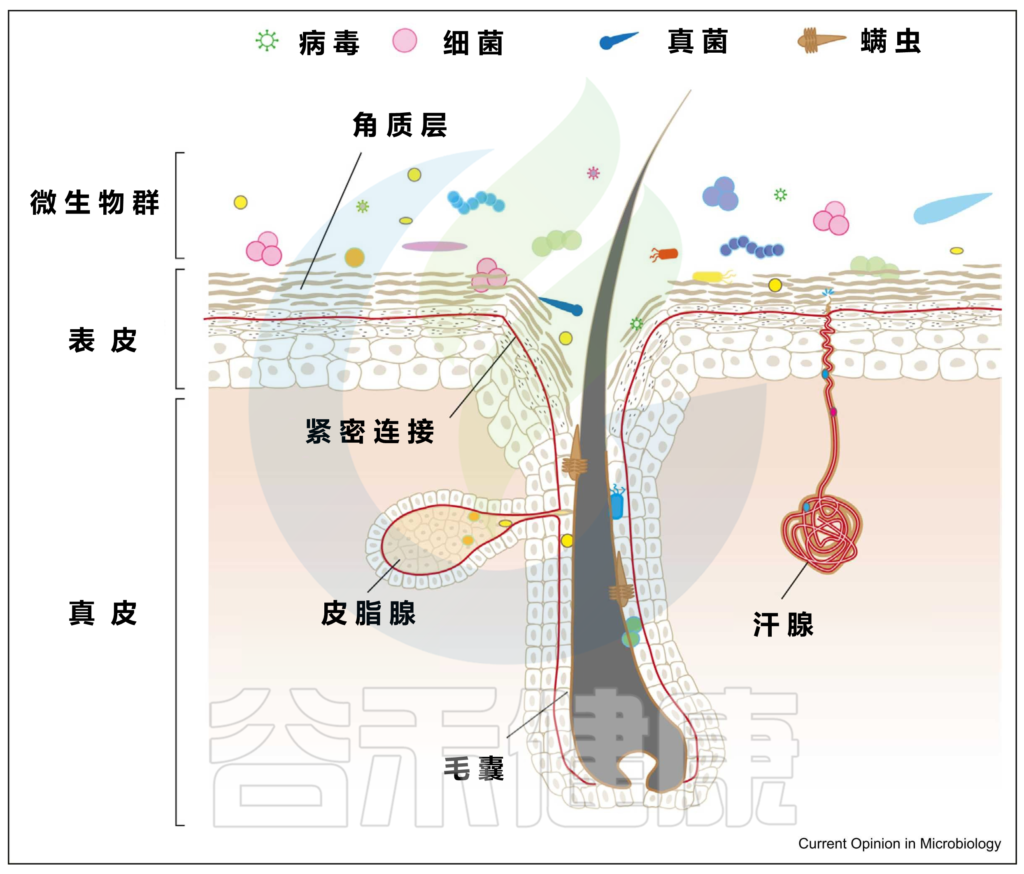
上图可以看到,皮肤由两层组成,即真皮和表皮,具有不同的、专门的生态位或微环境。
▼
皮肤微生物成员和功能可能因皮肤的各种特殊生态位或微环境而异:
具有高密度的毛囊和皮脂腺,例如面部(额头、鼻翼、耳后)、胸部和背部。通常呈高酸性,其特点是细菌可以消耗脂质,需要或可以在厌氧条件下生存,例如:
Corynebacterium minutissimum(微小棒状杆菌)
Cutibacterium
肘部,膝盖,生殖器,肚脐,腹股沟等部位。温和的酸性环境,温度和湿度较高,导致体味的细菌喜欢在这样的环境生活,例如:
Corynebacterium (棒状杆菌)
Staphylococcus (葡萄球菌)
例如手掌等部位。生物量最低,但细菌多样性却最高。
最不稳定的是足部微生物群。足部皮肤上细菌的平均数量从足背表面的103CFU/cm2到第四趾裂处的107CFU/cm2不等。
脚跟底部的真菌居多, 例如:
Malassezia(马拉色菌属)
Aspergillus (曲霉属)
Cryptococcus (隐球菌属)
Rhodotorula (红酵母属)
Epicoccum (附球菌属)
▼
在一生中,随着个人皮肤免疫系统的成熟和激素驱动汗液和皮脂腺的发育,皮肤的生理机能会发生变化。这些变化与突出的皮肤微生物群的相对丰度的变化和整体微生物群落多样性的变化有关。
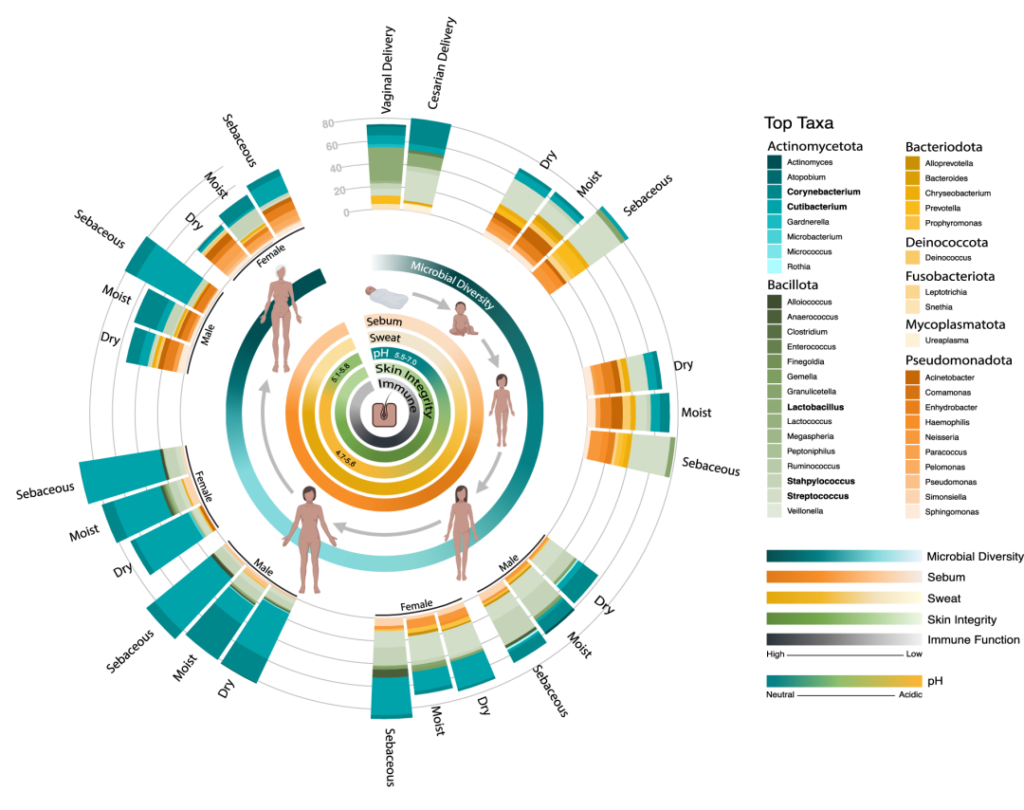
作为与环境的直接接触面,皮肤也不断地与我们周围的地方和人分享微生物。下图总结了人类一生中皮肤微生物组的变化,并强调了在与年龄相关的关键阶段皮肤微生物组的破坏会影响疾病发展的风险。
皮肤及其微生物组在整个生命周期中的动态平衡
doi.org/10.1042/BST20220216
内圈代表相对微生物多样性、皮脂生成、汗液生成、表面pH值、皮肤完整性和终身免疫功能。微生物组16s测序数据显示了每组前 10 个微生物类群的平均相对丰度。
出生
皮肤微生物组在出生时就已开始定植,并受到多种因素的影响,如:分娩方式、母亲微生物群、抗生素治疗、卫生条件、营养缺乏、住房、动物/宠物接触和环境暴露等。
阴道分娩新生儿的皮肤微生物组以阴道相关菌群为主,主要是乳杆菌,普雷沃氏菌,白色念珠菌。
剖宫产新生儿的微生物群中含有母体皮肤相关微生物,包括葡萄球菌、链球菌、棒状杆菌,Cutibacterium等。
这些初始群落是短暂的,不过物种定殖的顺序和时间会影响菌株后面的相互作用。这些优先效应可以塑造未来的菌群结构,并对皮肤、微生物组和整体健康产生长期影响。
doi: 10.3390/microorganisms9030543
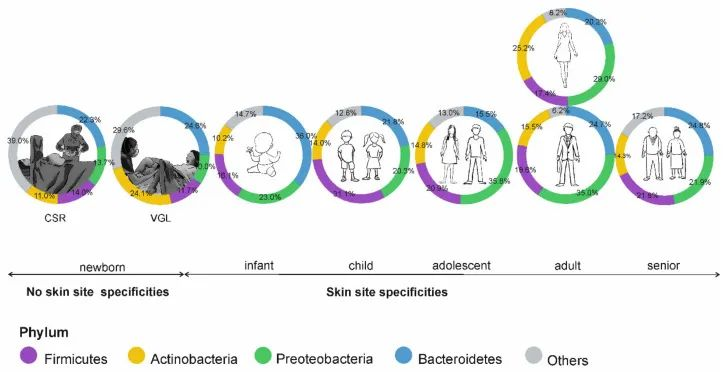
皮肤微生物组的年龄依赖性特异性;CSR剖宫产,VGL阴道分娩。
婴儿期和儿童期
婴儿期,最初接触微生物会促进免疫发育,并通过促进角质形成细胞的适当分化和表皮修复来加强皮肤屏障。
新生儿和婴儿皮肤含水量更高,pH值更高,皮脂生成受到抑制,表皮更新更快,抗菌性能更强。在3-6个月内,微生物分类群与皮肤代谢功能(如脂质生成和pH)之间的联系建立起来。
早期皮脂生成减少与棒状杆菌、Cutibacterium、马拉色菌丰度降低,葡萄球菌、链球菌增加以及以念珠菌为主的真菌生物群落有关。
随着儿童年龄的增长,皮肤进一步酸化并产生更多的皮脂脂质,这促使了酸敏感链球菌(acid-sensitive streptococci)的逐渐减少和整体群落多样性的增加。
在整个儿童时期,皮肤会继续携带来自照顾者的不同微生物群。然而随着年龄的增长,年龄较大的孩子具有更高的皮肤微生物多样性,以及更多来自农村或城市环境的微生物,母婴微生物组之间的相似性逐渐下降。
一旦这种平衡破坏,则可能与更大的炎症有关,并可能增加儿童患特应性皮炎和过敏的风险。
青春发育期
青春期标志着皮肤微生物群的下一个重大转变。驱动身体和性发育的激素也直接促进皮肤的结构和功能变化,如皮脂和顶泌汗液的产生,导致了随后微生物组成的变化。
横断面和纵向研究都表明,Tanner阶段的皮肤微生物组组成发生了明显变化。与V期的年轻人相比,I期的儿童链球菌、拟杆菌和假单胞菌的相对丰度更高,细菌和真菌的多样性也更高。
在年轻成人的皮肤微生物组中主要存在亲脂菌群,如棒状杆菌、痤疮角质杆菌和马拉色菌。与皮脂生成和痤疮相关。
青春期早期和晚期皮肤、微生物组和体味产生的差异
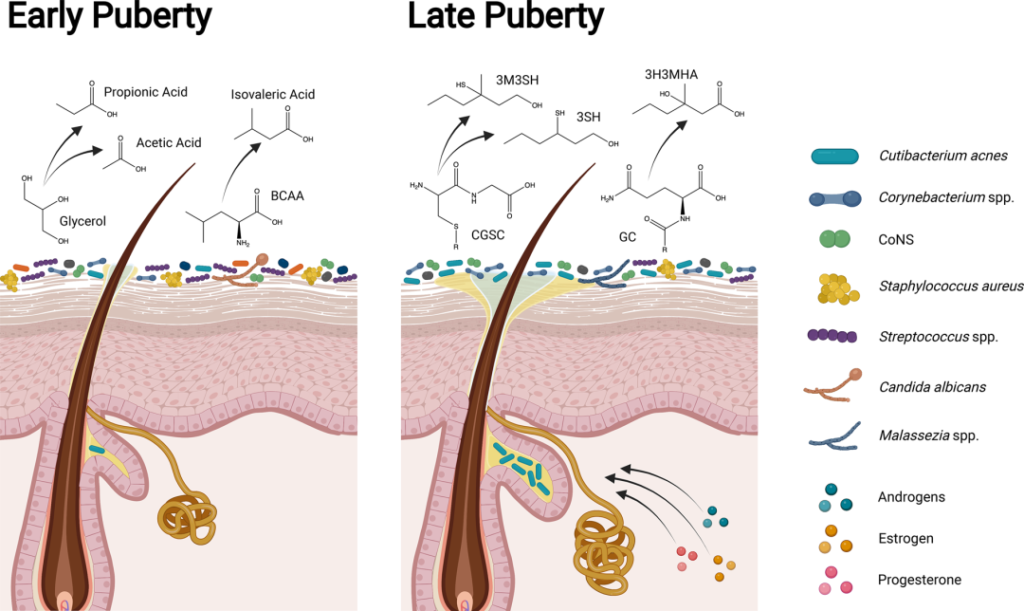
doi.org/10.1042/BST20220216
在儿童期和青春期早期(Tanner阶段I至II),皮肤微生物组高度多样化,体味与凝固酶阴性葡萄球菌属(如表皮葡萄球菌和人型葡萄球菌)产生挥发性脂肪酸(如丙酸、乙酸和异戊酸;酸味)和硫(臭鸡蛋味)有关。随着青春期的发展,类固醇激素促进皮脂腺和顶泌汗腺的发育,改变皮脂中的脂质类型,增强皮肤屏障。
在青春期后期(Tanner IV至V期),脂质生成增加和脂质含量改变与亲脂性类群主导的皮肤微生物组有关。虽然汗液和皮脂成分仍会分解为挥发性脂肪酸,但年轻人的体味与棒状杆菌属更为相关。皮脂和汗液成分代谢为硫烷基烷醇(如3-硫烷基己醇和3-甲基-3-磺基己醇;洋葱味)和挥发性有机化合物(如3-羟基-3-甲基己酸;类孜然味)。
成年期
成年皮肤微生物组在几年内是稳定的。微生物-微生物相互作用网络、持久的成人皮肤生理学和有弹性的皮肤免疫力维持了平衡的成人皮肤微生物群。
成年皮肤微生物群以角质杆菌、棒状杆菌、葡萄球菌、马拉色菌为主。
一旦成年后,成熟和持久的皮肤生理机能,会促进皮脂的产生、汗液成分和表面pH值的一致性,这些共同提供了稳定的身体部位微环境和营养库。免疫系统那时候也成熟了,这些内在特征使皮肤上的大部分微生物群能够在日常环境变化的情况下持续存在。
年龄增长
随着年龄的增长,皮肤会发生明显的变化,包括胶原蛋白合成下降、细胞外基质断裂和皮肤细胞再生减少,皮肤皱纹也就出现了。
随着皮肤屏障的变化,它可能会失去保持水分的能力,导致天然保湿因子(NFM)产生的补偿性增加。NMFs既能吸收水分,又能促进细菌增殖和粘附在皮肤上。随后,NMFs的增加与许多分类群的更丰富有关,如棒状杆菌、微球菌、链球菌、厌氧球菌,同时角质杆菌的减少。皮肤微生物多样性也广泛增加。
女性更年期后皮脂细胞面积和皮脂生成的减少,与角质杆菌的减少以及棒状杆菌、链球菌、不动杆菌和棒状杆菌丰度的增加有关。
在男性中,皮脂分泌下降的速度明显较慢,因此随着年龄的增长,它们保持着更丰富的角质杆菌。
随着年龄增长,免疫系统功能也会慢慢下降。老年人维持低度炎症状态,免疫防御受损和潜在致病菌(如β-溶血性链球菌)增加,皮肤感染的风险大幅增加,难以清除感染。
衰老会改变皮肤结构、功能和微生物定植
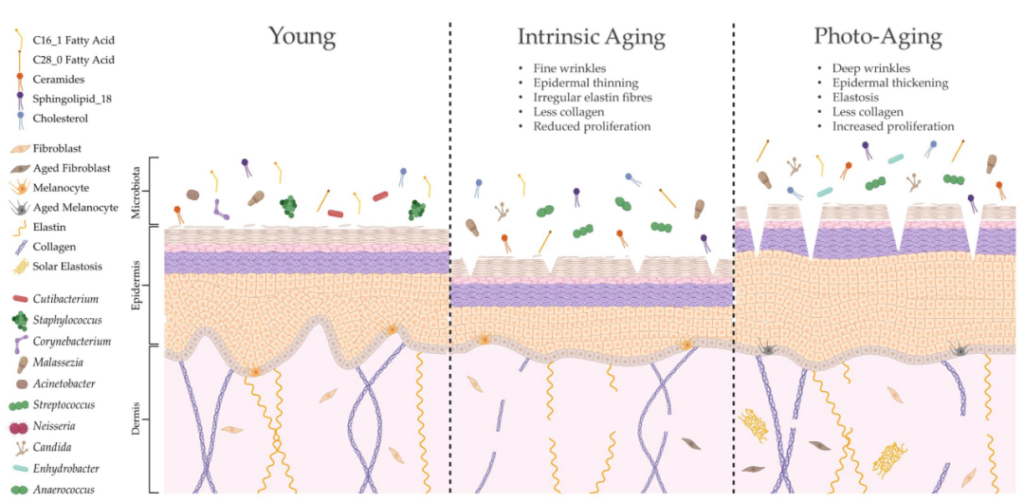
doi.org/10.3390/ijms24043950
内在衰老和光老化会导致皮肤结构和生理的不同变化,导致微生物组成的显著变化。这种改变的皮肤微生物组可能是由脂质成分的特定修饰形成的,这可能进一步导致与年龄相关的皮肤异常。
以上是皮肤微生物组在整个生命周期中的变化情况,那么皮肤微生物组是稳定的吗?它有可能受到哪些因素的影响?我们来看下一章节。
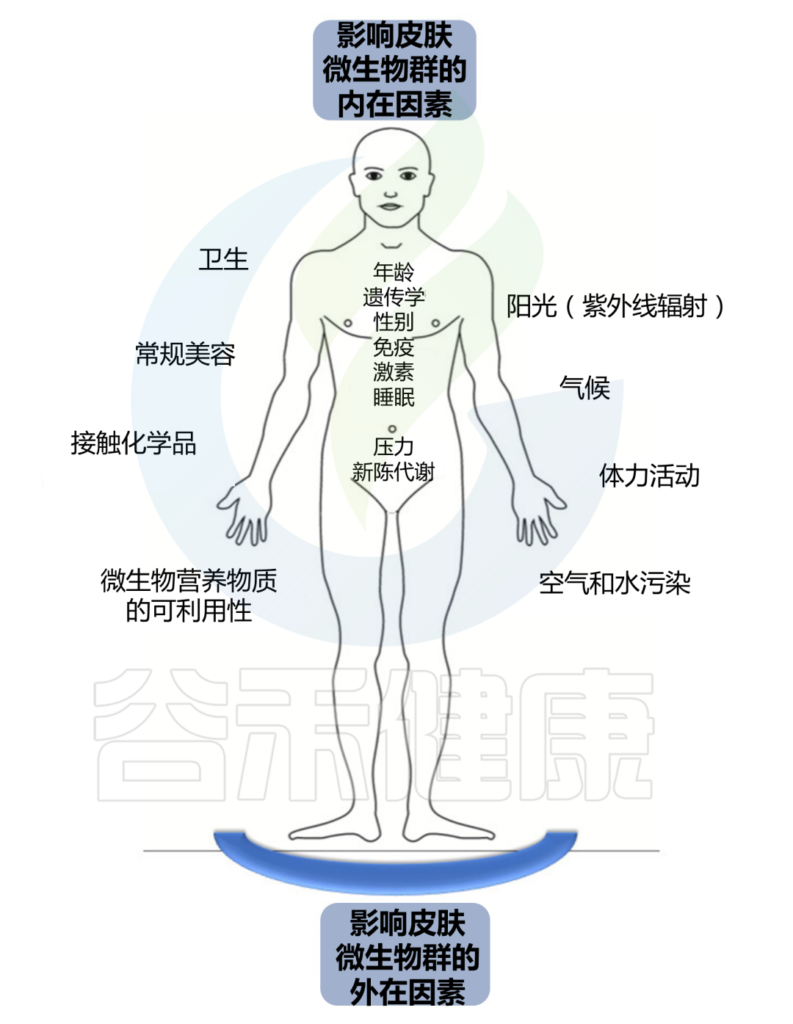
持续暴露于各种外在和内在因素会影响这个皮肤生态系统的平衡。
皮肤结构决定了皮肤微生物组的组成,个体特征取决于宿主的年龄、性别和健康状况等。个人生活方式和所处环境也会影响皮肤上微生物的数量和组成。微生物组的组成可能会随着宿主健康状况的恶化、衰老、甚至居住或职业的改变而改变。皮肤的物理和化学特性影响特定微生物群的优势、它们的比例以及它们之间的相互关系。
Skowron K, et al., Microorganisms. 2021
我们分为外在因素和内在因素两大块。
外 在 因 素
▼
紫外线辐射,对皮肤细胞有破坏和抗菌作用。大多数与年龄相关的皮肤病是由光老化引起的。皮肤光老化表现为:皱纹、局部色素沉着、毛细血管扩张、干燥和粗糙。这些与表皮和真皮中各种细胞和组织的病理生理变化有关。
皱纹作为光老化最明显的临床特征,主要是由于真皮成纤维细胞减少,以及胶原蛋白和弹性蛋白合成速度减慢但分解速度加快所致。皮肤光老化不仅影响美观,还会损害正常的皮肤屏障功能,增加皮肤炎症性疾病甚至恶性肿瘤的风险。
紫外线:破坏作用
皮肤强烈暴露于紫外线辐射可能会增加其感染的易感性,并加剧相关症状,例如单纯疱疹病毒。
紫外线辐射也可能影响皮肤微生物群的遗传变异,扰乱健康的微生物组结构。
皮肤暴露在紫外线下导致蓝藻菌数量总体增加,乳酸杆菌科和假单胞菌科数量减少。
紫外线:抗菌作用
阳光和紫外线也有效抑制了金黄色葡萄球菌和痤疮丙酸杆菌的生长。痤疮丙酸杆菌数量的减少与卟啉的产生减少有关。
微生物也可以抗紫外线辐射
皮肤微生物组对太阳辐射和紫外线辐射的抵抗力各不相同。一些细菌可以保护皮肤免受紫外线辐射的破坏。皮肤表面的蓝细菌和乳酸杆菌降低了色素沉着的强度和光老化相关损伤的发生。
共生马拉色菌对紫外线辐射表现出高度敏感性,尽管它们有能力合成类似紫外线过滤器的物质——pityriacitrin。
关于紫外线辐射对皮肤微生物群的影响详见谷禾之前的文章:
▼
化学空气污染物,包括 O3、颗粒物(PM 2.5:≤2.5 μm;PM 10:≤10 μm)、挥发性有机化合物和二氧化氮(NO2)等温室气体,是已知的外部暴露组的组成部分,增加过敏性疾病发生和恶化的风险。
空气污染物N2O干扰共生微生物,在对头葡萄球菌和结核棒状杆菌的负面影响大于对金黄色葡萄球菌的负面影响的情况下,有可能发生微生态失调。
烧烤烟雾中较多的成分——多环芳烃,在推动皮肤微生物群分化成不同类型中的作用
多环芳烃来源可以分为自然源和人为源:自然源指火山爆发、森林火灾等自然现象释放到环境介质中的;人为源则是由于人类生产生活活动中化石燃料(煤、油等)不充分燃烧造成的。
我们生活中例如室内外烧烤烟雾中存在较多,在烧烤的过程中,燃料的不完全燃烧或肉类食品脂肪的高温热解均可以产生大量多环芳烃类化合物。
一项研究揭示了多环芳烃暴露与皮肤微生物组分化成不同皮肤类型之间的关联。
皮肤微生物组分化为两种细胞类型(cutotype 1 和 cutotype2)。Cutotype 2与45岁以下受试者的皮肤干燥和色素沉着过度有关。多环芳烃暴露量高与皮肤干燥和cutotype 2有关,cutotype 2富含具有潜在生物降解功能的物种,相关网络结构完整性降低。
cutotype 1中精氨酸生物合成途径中的优势类群、关键功能基因和代谢产物之间的正相关性表明,来自细菌的精氨酸有助于合成聚丝蛋白衍生的天然保湿因子(NMFs),为皮肤提供水合作用,并可解释正常皮肤表型。
这项研究揭示了多环芳烃在推动皮肤微生物群分化成不同类型中的作用,这些类型在分类学和代谢功能上存在广泛的差异,并可能随后导致皮肤与微生物之间的相互作用变化,从而影响人体皮肤的健康。
也就是说:暴露于空气污染后皮肤微生物组组成的变化,可能导致皮肤干燥和炎症的恶化。
▼
全球变暖和极端天气事件等气候变化相关因素,会影响皮肤维持体内平衡的能力,在许多皮肤疾病的发病机制中发挥作用。
全球变暖可能破坏皮肤微生物组
温度和湿度的升高与皮肤上细菌的总体生长有关。
较高的气温和金黄色葡萄球菌的生长之间可能存在关联:
在一项以人群为基础的每月皮肤和软组织感染(SSTI)发病率研究中,SSTI 的时间变化与平均温度和比湿度显着相关。在美国 SSTI 的回顾性分析中(n = 616,375),在气温较高的南部地区,社区获得性耐甲氧西林金黄色葡萄球菌的感染率较高。
温度每升高1˚C,皮脂的产生就会增加10%,这反过来可能会增加微生物的生长,包括角质杆菌和马拉色菌。
极端天气可能引发皮肤病
气候变化导致极端天气事件发生的频率不断增加,包括热浪、干旱、野火、暴雨、洪水和飓风。
例如,洪水的最初影响阶段,经常有创伤与继发性伤口感染的相关风险,包括:嗜水气单胞菌( Aeromonas hydrophila)、创伤弧菌、副溶血性弧菌、Burkholderia pseudomallei等感染。
除了对皮肤病的直接影响外,极端天气事件的额外影响还包括冲突加剧、被迫迁移、心理健康恶化以及传染病的更大传播,所有这些都进一步增加了皮肤病的风险。
▼
农村和城市居民皮肤微生物组的差异,可能与不同程度地接触农业或畜牧业中的土壤、水和生物质中的微生物有关。即使皮肤与土壤和植物材料的短期接触,也会导致手部微生物组的变化以及酸杆菌Acidobacteria和拟杆菌的丰度增加。
在芬兰进行的一项研究结果表明,城市和乡村环境对 1-4 岁儿童的皮肤微生物群有显著影响。这种效应在青少年(14岁)中消失,这直接归因于该年龄段的户外活动时间有限。然而,在其他国家获得的研究结果并未证实这种趋势,表明其他因素(文化差异)也影响皮肤微生物组。
角质杆菌属在农村成年人的背部皮肤上更常见,而Trabulsiella属细菌在城市居民的手和前臂上更丰富。
农村环境的特点是微生物多样性很高
棒状杆菌和角质杆菌属数量的减少,以及假单胞菌和不动杆菌数量的增加,主要发生在与各种农场动物接触的农场工人身上。
封闭空间环境中的微生物有城市和工业区的特点
随着室内城市化的发展,与人类皮肤相关的真菌和细菌的相对丰度也在增加。此外,潜在致病真菌的数量也在增加,包括曲霉菌、马拉色菌、念珠菌等。
由于卫生习惯和西方生活方式,皮肤的细菌多样性降低。许多皮肤共生菌(如表皮葡萄球菌、乳酸杆菌、伯克霍尔德菌Burkholderis、痤疮梭菌)消失,取而代之的是葡萄球菌、棒状杆菌、角质杆菌(Cutibacterium)和微球菌Micrococcus。
▼
不同的动物物种含有独特的微生物群,与动物的持续接触会影响健康人皮肤细菌群落的组成和多样性。例如家养狗和家庭主人共享微生物群。菌群结构受季节的影响,但不受狗的性别、年龄、品种或皮毛类型的影响。
宠物肠道菌群与主人的肠道菌群也会产生关联,详见:
▼
皮肤与衣服的长时间接触也很重要,这会导致微生物的传播,并形成所谓的纺织品和挥发性微生物组。反过来,织物微生物组的组成会受到洗涤和干燥的影响。附着在纤维上的微生物可以利用污垢或皮脂化合物作为基质,并产生挥发性物质作为副产品,从而产生难闻的气味。
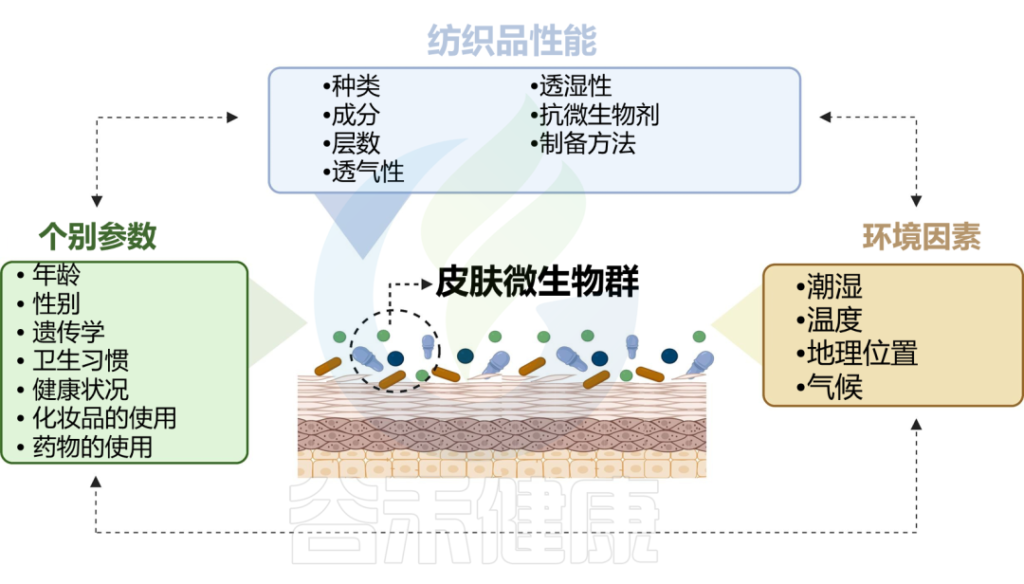
doi.org/10.1016/j.ejpb.2023.05.004
纺织纤维的性质可以直接影响微生物的附着、生长和定植
葡萄球菌属在几乎所有纺织纤维中显示出显着的固定性。Staphylococcus hominis对棉花的亲和力较高,在粘胶纤维和羊毛中不生长。
羊毛促进了许多菌群生长,包括表皮葡萄球菌、Enhydrobacter、角质杆菌、微球菌属。
聚酯为角质杆菌、Enhydrbecter、微球菌属提供了最大的生长环境。
棒状杆菌属无法在棉花、丙烯酸、羊毛、粘胶、尼龙、羊毛和聚酯上进行竞争,这解释了只有少量棒状杆菌属才能从破旧的衣服中分离出来。
合成纤维由于其疏水性和较差的吸附能力,通常抵抗微生物定植。
天然纤维更容易受到微生物定植的影响,因为它们具有高保湿性能,并且它们的聚合物键更容易被微生物酶获取。天然纤维可以以碳水化合物或蛋白质的形式为微生物提供营养和能量来源,支持微生物生长和定植。
与棉花相比,亚麻纺织品对金黄色葡萄球菌和表皮葡萄球菌表现出强烈的抑制作用,同时对角质形成细胞产生细胞毒性。
▼
化妆品旨在改善皮肤,减缓衰老过程。这些产品可能有助于皮肤微生物组的多样化,尤其是当定期或长期使用时。
化妆品中含有的活性成分可能有利于或抑制某些微生物的生长
N-乙酰氨基葡萄糖是刺激皮肤微生物群的化合物之一,它是透明质酸的前体,常见于护肤品中。
保湿产品可以降低皮肤水分流失的强度,并可以增加皮肤微生物群多样性(α多样性高是健康皮肤微生物群的标志),同时减少皮肤细胞剥落。它们的脂质化合物促进亲脂性细菌的生长,如葡萄球菌和角质杆菌。另一方面,皮肤水合水平的提高会降低皮脂含量,并可能减少角质杆菌数量。
化妆品成分的作用持续数周,个体的反应可能差异很大。不合适的化妆品或不合适的应用会减少皮肤微生物组的多样性,从而对其产生负面影响,导致生态失调。洗发水或面霜等化妆品也可能会导致感染,有时会导致严重的健康后果,尤其是在儿童或免疫力下降的人群中使用。
内 在 因 素
▼
皮肤表面呈微酸性(pH值5.6左右)且干燥,但温度比体内低。
表皮细胞自身脱落机制影响菌群组成
表皮外层不断释放角质化皮肤细胞,导致皮肤每四个星期自我更新一次。每小时有 500-3000 个细胞从1cm2的皮肤脱落,这意味着一个成年人每小时释放 600,000-100 万个或更多细胞。由于约 10% 的脱落细胞含有细菌,这种机制可能会显着影响微生物组的组成。
皮肤的厚度、表面褶皱的深度和位置,毛囊和腺体的密度都是影响宿主微生物群的关键因素。腺体释放的分泌物以不同的方式影响微生物,创造刺激或抑制微生物发育的条件。
皮脂腺:确保专性和兼性厌氧菌的最佳环境。这些腺体分泌的皮脂在皮肤上形成保湿、疏水的保护层,并且是微生物使用的脂质的来源。这些脂质水解产生的游离脂肪酸有利于细菌粘附到腺体表面并降低皮肤pH值,抑制金黄色葡萄球菌和化脓性链球菌等病原体的生长。
水分含量:潮湿的区域为许多微生物创造了有利的条件,如棒状杆菌属、葡萄球菌属等。相对干燥且温度波动较大的皮肤部位主要含有变形菌、拟杆菌、放线菌等。微生物的数量随着深层皮肤层中营养物质和水分含量的增加而增加。
▼
男性和女性微生物群之间物种组成的差异是由皮肤的性别特异性特性造成的,即皮肤厚度、毛发、汗液和皮脂腺的数量。女性多样性高于男性。更薄的皮肤、更低的 pH 值和更少的出汗量会导致更多的多样性。
对手部表面的微生物进行的一项研究表明,女性的物种多样性高于男性。在女性手上,肠杆菌和乳杆菌科的数量显著较高(300-400%),而在男性中,观察到更高浓度的角质杆菌和棒状杆菌。
关于不同年龄皮肤菌群构成不同,在前面第一章节已经详细阐述。
▼
在形成皮肤微生物组的遗传因素中,种族是次要的,但也有一定影响。最主要的是不同生活方式的差异。非洲和拉丁美洲男性头皮和腋下的Cutibacterium数量低于其他种族(高加索、非洲裔、东亚和南亚)。中国人皮肤微生物组与其他人群存在差异,比如Enhydrobacter在中国人的皮肤上较为常见。
▼
抑制细菌和减少炎症病变
口服米诺环素(用于治疗痤疮)降低了Cutibacterium、棒状杆菌、普雷沃氏菌、乳酸杆菌和卟啉单胞菌的丰度。
多西环素显著减少痤疮梭菌的数量(治疗6周后为1.96倍)。Snodgrassella alvi的数量也减少了(3.85倍)。另一方面,观察到Cutibacterium granulosum的数量显著增加(4.46倍)。
大环内酯类、四环素类和克林霉素用于治疗痤疮。用利美环素进行的脸颊皮肤治疗减少了角质杆菌的存在,并增加了链球菌、葡萄球菌、微球菌和棒状杆菌的数量。反过来,二甲胺四环素导致微生物组紊乱。
虽然氟喹诺酮类药物(培氟沙星)和大环内酯类药物(红霉素)显著减少了痤疮梭菌的数量,但只有纳氟沙星对凝固酶阴性葡萄球菌表现出抑制活性。
导致出现抗生素耐药性物种
例如痤疮梭菌和表皮葡萄球菌。大环内酯类药物的长期治疗痤疮,增加了痤疮梭菌分离株的数量,但对大环内酯的影响的敏感性降低。
据估计,红霉素和阿奇霉素耐药菌株的比例可能分别达到50%,甚至100%。从感染皮肤分离的G+细菌中,77.5%对青霉素耐药,28%对甲氧西林耐药。在所有测试的菌株中,31.9%对三种以上的抗生素不敏感。
儿童皮肤分析结果显示,36.4%的从皮肤表面分离的金黄色葡萄球菌菌株对甲氧西林有耐药性。此外,耐甲氧西林葡萄球菌(MRSA)是医院感染最常见的原因之一。
▼
肠道内表面和皮肤表面有一些有趣的相似之处:两者都被上皮细胞覆盖,上皮细胞维持着体内与外部环境之间的重要联系,充当第一道防线,在抵御外部病原体、调节免疫反应和抑制分解代谢物方面发挥着重要作用。
肠道和皮肤组织是宿主原核和真核共生微生物的两个主要生态位,因为它们的高细胞周转率决定了定植微生物组的低粘附和感染。
皮肤健康与肠道屏障的完整性有关。一些饮食代谢物可以直接吸收到皮肤中,其他通过肠道微生物代谢来做到这一点,这两者都可能有助于皮肤健康。
由于肠道通透性增加,肠道菌群或其代谢产物可能从肠道迁移到循环系统中并在皮肤中积聚,这可能会损害皮肤屏障并使其容易发炎。
肠道微生物群的变化还可能引发系统性炎症和异常免疫反应,从而破坏皮肤健康。
皮肤或肠道微生物群失调与免疫应答改变密切相关,与多种皮肤病相关,包括特应性皮炎、牛皮癣、寻常痤疮、甚至皮肤癌等,这在下一章节会详细讲述。
饮食强烈影响肠道微生物组的组成,影响代谢和免疫功能,间接影响皮肤健康。关于如何通过饮食调整在最后章节会讲到。
以上是影响皮肤微生物群的外在和内在因素,那么皮肤微生物群会如何影响人体健康呢?我们来看下一章节。
这里我们分为两个部分来阐述:
皮肤微生物群直接影响皮肤健康
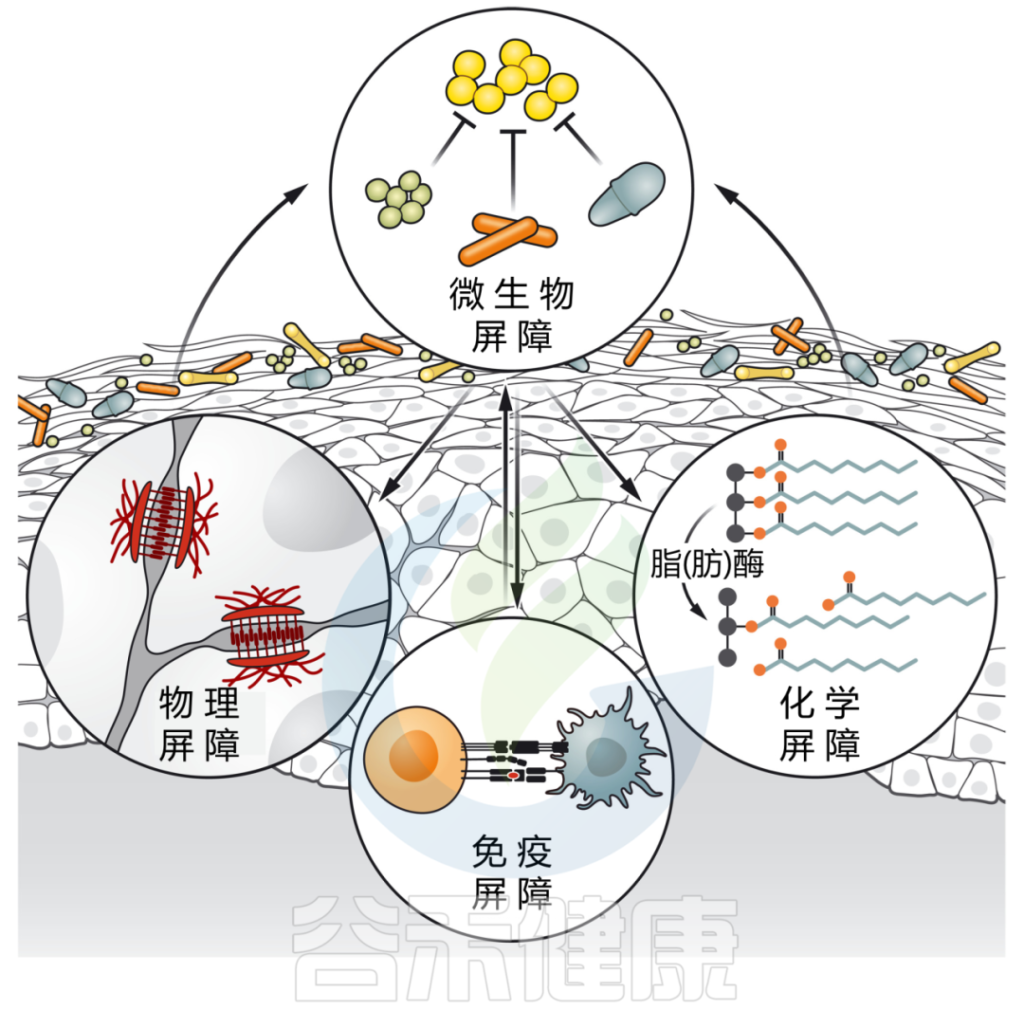
我们知道,皮肤是由角质形成细胞的分层角质化上皮组成,这些上皮经历终末分化。这些物理结构通过增强屏障的化学和免疫学特征得到进一步强化。
皮肤微生物群影响皮肤屏障的各个方面,同时也直接与表面遇到的共生微生物和病原微生物相互作用。
皮肤微生物群介导多种屏障功能
DOI: 10.1126/science.abo0693
微生物群强化皮肤屏障的多个方面:
皮肤微生物通过各种定殖抗性机制,包括资源排斥、直接抑制和/或干扰,形成对抗环境的第一道屏障。
皮肤微生物群也有助于物理皮肤屏障的分化和上皮化。微生物通过产生脂肪酶来增强皮肤的化学屏障,脂肪酶将皮脂甘油三酯消化为游离脂肪酸,从而增强皮肤的酸性,并限制瞬时和致病物种的定植。
最后,微生物刺激先天和适应性免疫防御,如抗菌肽的释放、新生儿耐受性的诱导和保护性免疫的发展。
接下来我们讨论微生物群到底如何与皮肤屏障的微生物、化学以及先天和适应性免疫成分相互作用。
▼
皮肤微生物群本身是抵御外来微生物和病原微生物入侵、定植和感染的屏障。
——直接竞争关系
皮肤微生物争夺资源,并进化出直接对抗对手的机制。
多种CoNS物种(凝固酶阴性葡萄球菌),如人葡萄球菌,产生具有独特化学性质的抗生素,并抑制皮肤病原体金黄色葡萄球菌。
其他物种,如头葡萄球菌,通过干扰金黄色葡萄球菌毒力所需的辅助基因调节因子(agr)群体感应途径来拮抗金黄色葡萄菌。
——拮抗机制与宿主抗菌反应协同作用
人型葡萄球菌和表皮葡萄球菌,可以产生共生衍生的AMPs,其发挥选择性抗菌活性,并与宿主衍生的AMPs协同作用,以抑制皮肤病原体的存活。
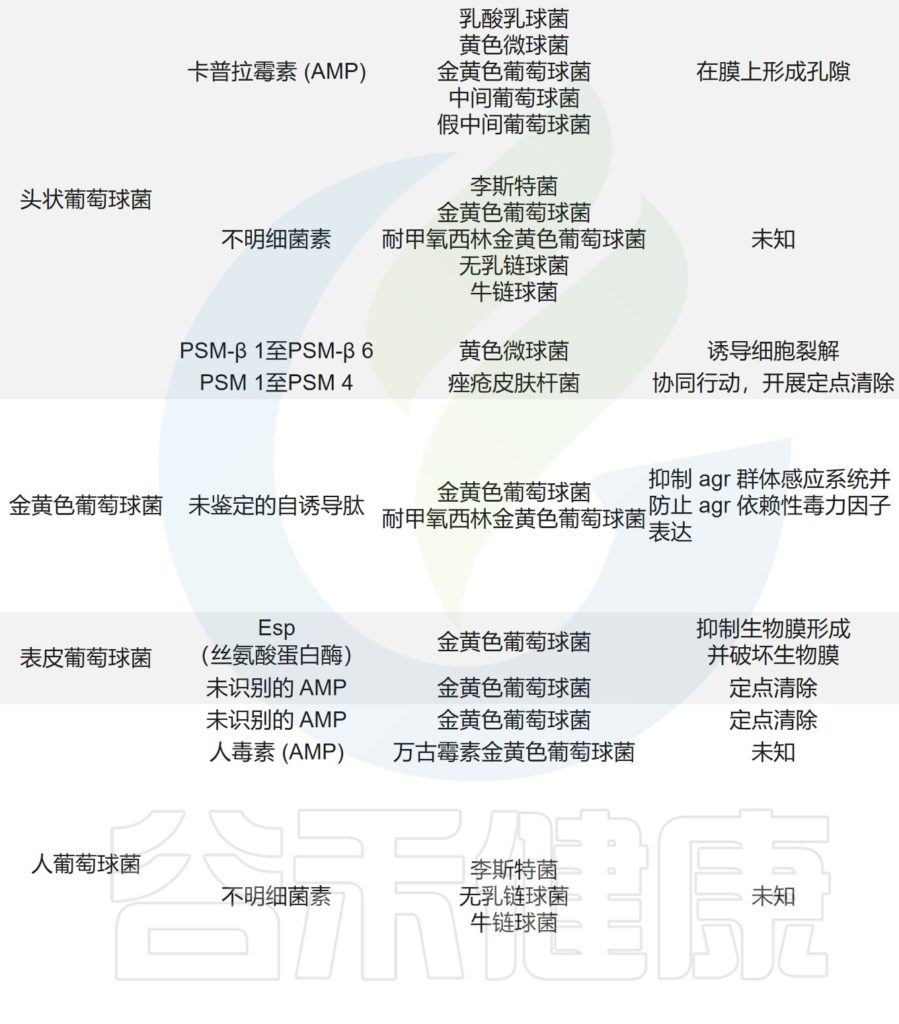
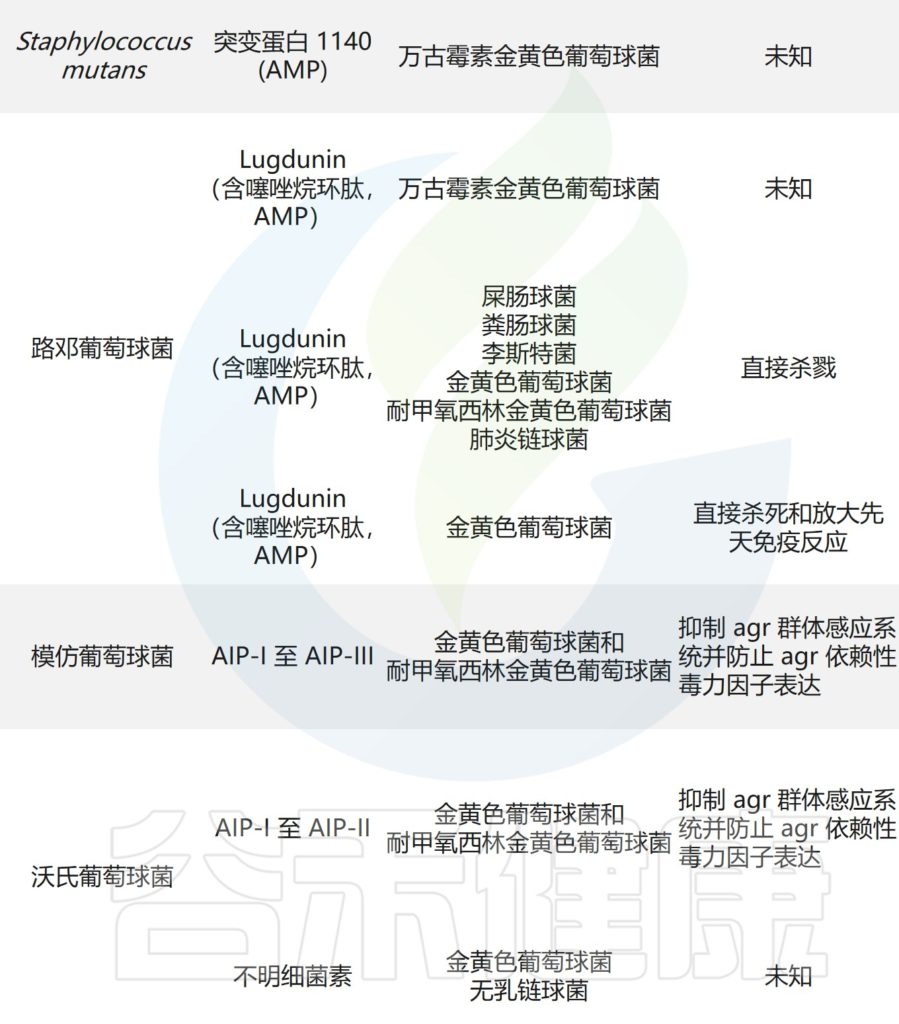
痤疮角质杆菌与产生硫肽抗生素角质霉素的特定菌株竞争,以维持其在人类毛皮脂腺单元中的生态位,从而限制金黄色葡萄球菌的定植。
皮肤微生物组内微生物之间的相互作用,可以驱动整体微生物群结构。
主要皮肤菌群产生的抑制其他微生物群,和/或潜在病原体的突出和最近鉴定的抗菌分子汇总在下表,分子作用机制也包括在内。
皮肤上关键的微生物与微生物相互作用

doi.org/10.1042/BST20220216
▼
角质细胞经历严格调控的终末分化程序,形成角质层,该过程由微生物群介导。微生物群通过角质形成细胞芳香烃受体(AHR)的信号传导促进分化和上皮完整性;还分泌鞘磷脂酶,将层状脂质加工成神经酰胺,神经酰胺是角质层的关键成分。
▼
酸性皮肤表面还产生了限制细菌定植的化学环境。痤疮角质杆菌和棒状杆菌都分泌脂肪酶,水解皮脂中甘油三酯中的游离脂肪酸。游离脂肪酸通过直接抑制细菌和刺激人β-防御素2(hBD-2)的表达,进一步增强皮肤免疫力。痤疮角质杆菌也直接与游离脂肪酸结合,这表明游离脂肪酸的存在促进了痤疮角质杆菌的定植。
▼
微生物可以刺激多种与先天免疫反应有关的反应,通常取决于代谢和炎症环境。例如,念珠菌的菌丝和酵母形式在皮肤中刺激不同的免疫反应。S. epidermidis在皮肤中引起的T细胞反应,需要菌体表面特定糖蛋白与宿主先天免疫细胞上的C型凝集素相互作用。
氧气的可用性也会影响皮肤表面宿主与微生物的相互作用。微氧耐性细菌痤疮角质杆菌生成短链脂肪酸,抑制组蛋白去乙酰化酶,后者可作为免疫系统的表观遗传调节因子,从而刺激炎症。
注:在皮肤中,短链脂肪酸具有促炎作用,这点和肠道中不同。SCFAs通过抑制HDAC8和HDAC9以及通过TLR信号通路刺激炎症。
皮肤微生物还通过刺激宿主产生抗菌肽和蛋白来增强皮肤免疫力,这些抗菌肽和蛋白起到天然抗生素的作用。
皮肤微生物群落还在创伤修复过程中协调先天免疫反应。在皮肤中的共生微生物群落会引发I型干扰素(IFN)反应。作为对微生物信号的反应,中性粒细胞会表达CXCL10,吸引活化浆细胞样树突状细胞(pDC)到损伤部位。pDC会产生I型干扰素,通过刺激成纤维细胞和巨噬细胞增长因子反应来加速创伤修复。
实际上,抗原呈递细胞向皮肤的募集是微生物群依赖性的。微生物通过需要IL-1R-MYD88信号传导的过程,在伤口修复和毛囊新生中增强皮肤再生。
▼
皮肤是各种适应性免疫细胞的家园,其中包括大量的常驻记忆T细胞,随时准备对各种环境刺激做出反应,包括致病微生物和共生微生物。
在婴儿早期,暴露于皮肤共生表皮葡萄球菌介导调节性T细胞(Tregs)流入皮肤。这种Treg迁移波与毛囊发育同时发生,需要毛囊角质形成细胞产生趋化因子。Tregs,以及皮肤中的许多其他免疫细胞亚群,最终位于毛囊附近,对在这个发育窗口期间检测到的微生物抗原具有特异性。
在一个平行的过程中,粘膜相关不变T细胞(MAIT)是在婴儿期在类似的时间限制的发育窗口中获得的。MAIT细胞在无菌小鼠中是不存在的,它们的发育需要维生素B2代谢产物,而这些代谢产物仅由细菌和真菌产生,而不是哺乳动物细胞。
在胸腺中,暴露于5-(2-oxopropylideneamino)-6-d-ribitylaminouracil(一种维生素B2的细菌代谢产物,从粘膜部位运输到胸腺),介导MAIT细胞扩增并靶向皮肤和粘膜部位。
微生物细胞表面分子也可以作为宿主的信号。大多数棒状杆菌的细胞膜中含有霉菌酸。棒状杆菌属霉菌酸在稳定状态下可以以IL-23依赖的方式促进γδT细胞的积累。然而,这种相互作用取决于环境,因为高脂肪饮食反而会促进皮肤炎症。因此,微生物暴露时存在的炎症环境影响皮肤内的免疫反应。
这些发现突出了微生物在皮肤免疫细胞的募集和刺激中发挥的关键作用。
以上是皮肤微生物群从物理、化学、免疫等多角度与皮肤之间的关联,如果说上述对局部组织微环境的相互作用,那么接下来我们从更系统的角度来看,皮肤微生物群通过与其他器官的交流,对全身健康产生的影响。
皮肤微生物群通过影响其他器官间接影响
越来越多的证据表明,皮肤损伤和致敏会影响其他屏障部位,如肠道、肺部等。
▼
皮肤和肠道之间存在双向沟通。
为什么浅表皮肤损伤会引起肠道炎症?
浅表皮肤损伤会导致角质形成细胞全身释放 IL-33。IL-33 与 IL-25 协同作用,触发肠道内 ILC2 的激活,产生 IL-4。这反过来又刺激肠道中肥大细胞的扩张,在那里它们准备对食物过敏原做出反应并介导过敏反应。
在模拟炎症性肠病的小鼠模型中,皮肤受伤还会加剧肠道炎症。
皮肤和肠道之间的相互作用取决于损伤期间真皮中产生的透明质酸片段的产生,这些片段刺激肠道成纤维细胞,通过反应性脂肪生成的过程分化为促炎脂肪细胞。这些反应性脂肪细胞通过产生 AMP 和其他炎症介质来传播肠道炎症。
肠道微生物群变化也会影响皮肤炎症
在这两种情况下,肠道免疫网络的激活都会影响皮肤中炎症信号的振幅。
因此,肠道微生物组的改变可能会影响皮肤免疫力。
研究表明,饮食对肠道微生物组的影响,尤其是膳食纤维,对系统免疫有重要影响。皮肤先天免疫反应也与肠道有关,肠道中保护细菌性皮肤感染的AMPs的充分表达,取决于饮食中的维生素A。这些发现加强了我们对饮食在宿主免疫发展中重要性的分子理解。
▼
流行病学证据表明,许多患者经历了“特应性进军”,首先出现特异性皮炎,随后发展为过敏性鼻炎、食物过敏、哮喘。它们的先后出现意味着存在什么样的关联?
皮肤微生物群失调和金黄色葡萄球菌定植增加,与特应性皮炎的发作有关。
表皮暴露于金黄色葡萄球菌刺激角质形成细胞产生IL-36,从而提高血清IgE水平。
而缺乏IL-36受体的小鼠对金黄色葡萄球菌的反应不会产生升高的IgE,并且也可以免受过敏原特异性肺部炎症的影响。这些发现支持了皮肤暴露于微生物病原体作为全身炎症的起始。
微生物组的变化与哮喘、过敏性鼻炎、特应性皮炎和食物过敏的风险有关
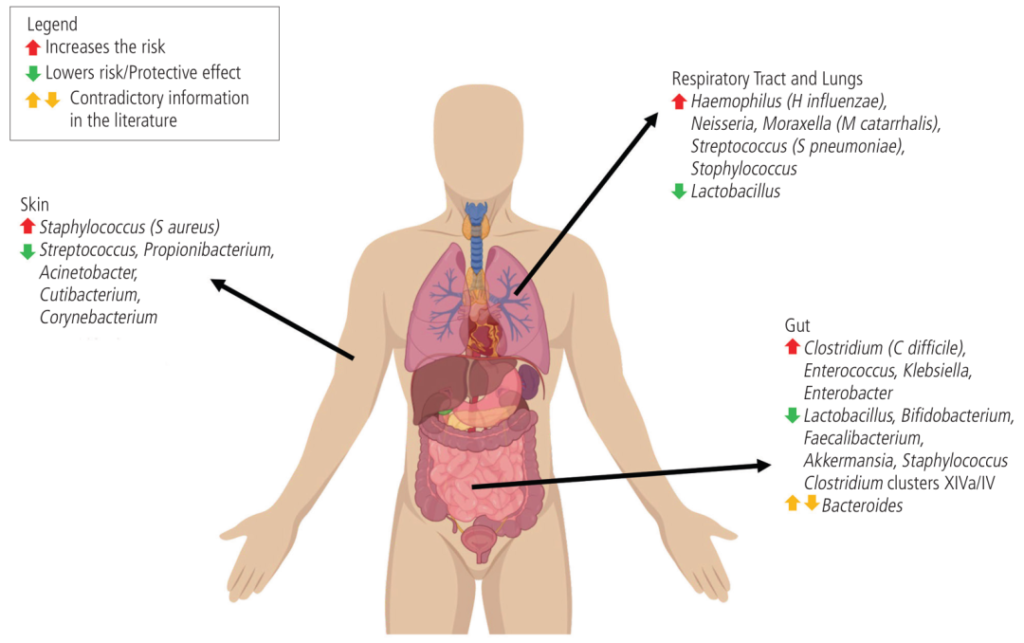
doi: 10.18176/jiaci.0852
在气道中,卡他莫拉克菌(Moraxella catarrhalis)、流感嗜血杆菌(Haemophilus influenzae)和肺炎链球菌水平较高与婴儿哮喘有关。
肠道艰难梭菌的比例高于双歧杆菌,这与更高的食物过敏率有关。
▼
神经免疫相互作用中的皮肤病原体
细菌可以直接激活皮肤中的感觉神经元,并通过产生造孔毒素引起疼痛。菌株水平的变化驱动着可变的反应,这取决于特定毒素和群体感应系统的存在。
关于群体感应,详见:
真菌(白色念珠菌)也可以直接激活皮肤中的感觉神经元。γδT细胞免疫需要刺激才能通过释放神经肽CGRP来控制皮肤念珠菌感染。
相反,引起坏死性筋膜炎的病原体化脓性链球菌,通过分泌链球菌溶血素S直接激活伤害感受器神经元,进而促进神经肽CGRP的释放并抑制化脓性链球菌的杀伤。在这种情况下,CGRP拮抗作用可防止坏死性感染。
皮肤与其他器官系统的交互作用是由微生物群介导的
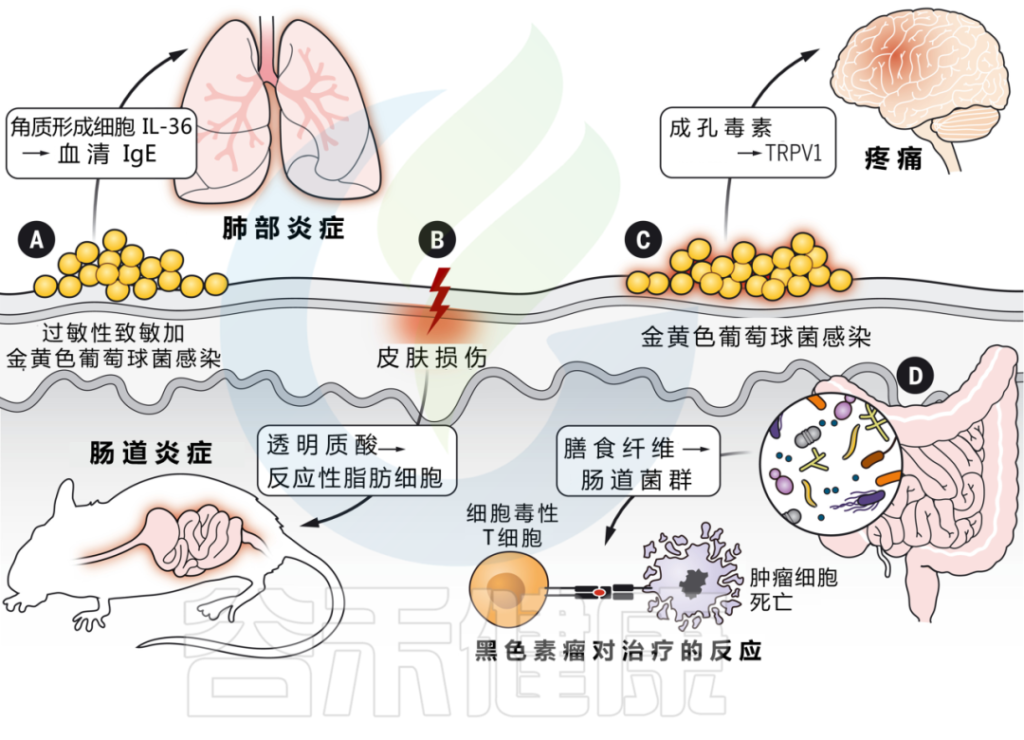
DOI: 10.1126/science.abo0693
微生物与宿主相互作用和皮肤疾病
doi.org/10.1002/mlf2.12064
▼
痤疮患者,特别是那些症状严重的患者,表现出α多样性增加,四种革兰氏阴性细菌(即粪杆菌属、克雷伯氏菌属、臭杆菌属和拟杆菌属)的比例更高。
痤疮角质杆菌(C. acnes)的过度生长与痤疮发病机制有着长期的关联。宏基因组分析表明,痤疮患者中痤疮丙酸杆菌的菌株结构与健康个体不同,IV 型和 V 型菌株在受痤疮影响的皮肤中特别普遍。
痤疮丙酸杆菌通过多种不同方式参与痤疮发病机制的调节,它参与:
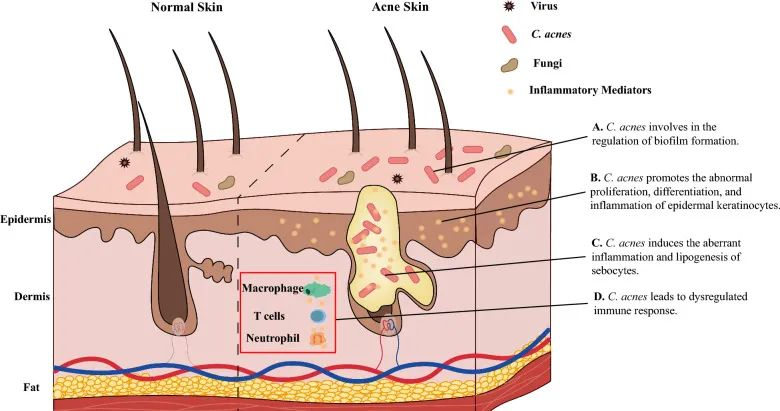
doi: 10.1186/s13578-023-01072-w
痤疮丙酸杆菌和表皮葡萄球菌在痤疮以及炎症后色素沉着过度中具有病理生理作用。
肠道微生物群在皮肤炎症和情绪之间起着中介作用
痤疮和胃肠道功能障碍之间的联系可能起源于大脑。支持这一假设的是压力引起的痤疮加重。实验动物和人类研究表明,压力会损害正常的肠道菌群,尤其是乳酸杆菌和双歧杆菌。心理应激源导致肠道微生物群产生神经递质(即乙酰胆碱、血清素、去甲肾上腺素),这些神经递质穿过肠粘膜进入血流,导致全身炎症。
痤疮中肠-脑-皮肤轴的拟议模型
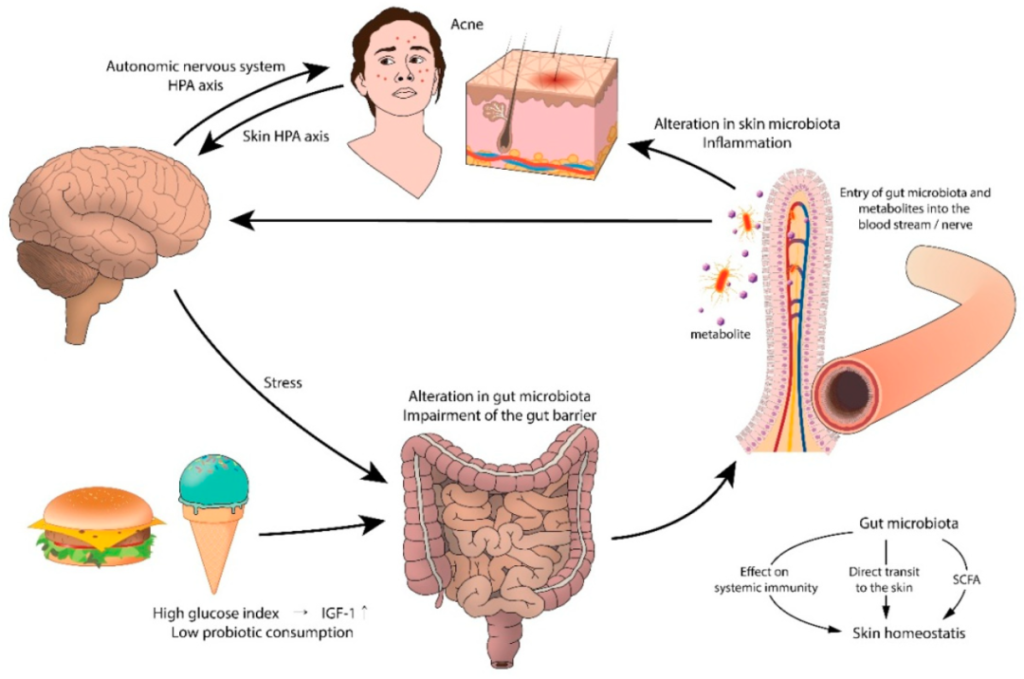
doi.org/10.3390/jcm8070987
西方饮食包括乳制品、精制碳水化合物、巧克力、饱和脂肪等,这些物质可能通过激活营养来源的代谢信号来加重痤疮。高脂肪饮食会降低肠道菌群水平,增加脂多糖的浓度,通过损害结肠上皮完整性和屏障功能、降低粘液层厚度和增加促炎细胞因子的分泌来引起全身炎症。
扩展阅读:
▼
皮肤干燥、斑块发痒和反复出现的湿疹是特异性皮炎的标志。
特异性皮炎引起的皮肤耀斑通常与更多的金黄色葡萄球菌丰度有关,金黄色葡萄球菌定殖的增加与CoNS数量的减少相关,CoNS本来会产生抗菌蛋白,它在特异性皮炎患者中数量少。
金黄色葡萄球菌在病变的真皮中更为普遍,这表明在剥皮过程中更容易接触到更深的皮肤层。
是什么引起金黄色葡萄球菌定植增加呢?
表皮葡萄球菌、痤疮杆菌和棒状杆菌属的丰度降低,它们通常对金黄色葡萄菌的入侵起作用。
特异性皮炎的菌群多样性低。共生细菌数量减少而导致的共生产生的AMPs的缺失,抵御病原体如金黄色葡萄球菌的能力下降,金黄色葡萄球菌定植增加。
与特异性皮炎相关的皮肤屏障缺陷会损害层状膜的完整性,改变皮肤的微生物群,并可能使金黄色葡萄球菌等有害细菌滋生。厌氧微生物的缺乏可能会降低关键的皮肤屏障活性,并促进潜在的感染。
金黄色葡萄球菌分泌毒力因子
金黄色葡萄球菌分泌几种毒力因子,包括纤连蛋白结合蛋白1(FBP1),α-和δ-溶血素,酚溶性调节素(psm)的蛋白家族等,所有这些毒素都会导致更高的炎症反应和更严重的症状。
皮肤稳态取决于复杂的宿主-微生物相互作用,包括金黄色葡萄球菌和特异性皮炎宿主细胞之间的相互作用,微生态失调会导致疾病的发展。
特异性皮炎的其他微生物群变化包括痤疮角质杆菌、棒状杆菌、Dermacoccus、微球菌、CoNS减少,链球菌和一些马拉色菌属增加。这些微生物变化似乎是暂时的,在特异性皮炎发作之前和期间,群落多样性丧失,金黄色葡萄球菌优势更大,在炎症消退后逐渐恢复到基线。
潜在益生菌治疗和预防AD的临床试验

doi.org/10.1016/j.phymed.2023.154824
▼
一般来说,皮肤破裂会导致炎症级联活动;然而,这种免疫反应在糖尿病皮肤中被破坏,也就是无法有效引起免疫反应。微生物组的改变可能会加剧疾病的严重程度。
糖尿病皮肤的菌群特征
糖尿病早期患者的皮肤细菌微生物群与健康人的非常相似。随着疾病的恶化,物种多样性和丰度发生动态变化。总的来说,糖尿病足的皮肤细菌微生物群的多样性低于健康足。因此,不太常见的微生物种类的变化,其中大多数只在健康的足部皮肤中发现,可以用来预测是否患有糖尿病。
糖尿病足皮肤中葡萄球菌的含量通常较低,金黄色葡萄球菌的比例较高。金黄色葡萄球菌的大量存在破坏皮肤微生物群平衡,可能会导致炎症变化,并增加皮肤感染的风险。
慢性溃疡相关菌群
铜绿假单胞菌和厌氧菌通常与深部慢性溃疡有关,但金黄色葡萄球菌通常与急性浅部溃疡有关。比较有慢性感染和没有慢性感染的糖尿病患者的微生物组的研究可以提供有关诊断标志物的信息,这些标志物可以用作发展为慢性损伤的可能性的指标。
▼
牛皮癣患者由于慢性炎症性皮肤病而出现中度至持续性皮肤斑块。许多遗传和环境变量之间的复杂组合导致皮肤过度活跃的炎症反应是病因。
牛皮癣皮肤菌群特征
牛皮癣患者皮肤样本在α、β多样性明显低于正常皮肤。下列菌群相对丰度和分类性能显著下降:
棒状杆菌在牛皮癣的发病机制中发挥重要作用
大量的研究表明,棒状杆菌属丰度上升,棒状杆菌有可能干扰干扰素信号系统,这可能导致皮肤微生物组的微生态失调。
乳制品和糖类的摄入是牛皮癣最常见的诱因之一,而肉类和鸡蛋则被列为次要的常见诱因之一。
关于牛皮癣与肠道菌群之间也存在很多相关性,此处不展开阐述,详见:
▼
皮肤黑色素瘤
黑色素瘤和正常皮肤样本之间的微生物组成和多样性存在显著差异。黑色素瘤样本中的梭杆菌和Trueperella水平较高。
棒状杆菌属与疾病严重程度相关,棒状杆菌水平与IL-17之间存在关系,IL-17可以通过增加IL-6和信号转导器和STAT-3来促进黑色素瘤细胞增殖。
相反,痤疮角质杆菌的细菌上清液增加了黑色素细胞的凋亡。
角质细胞皮肤癌
以皮肤微生物群为代表的生物屏障通过分泌抗微生物肽(AMP)(如组织蛋白酶LL-37和人β-防御素)来抑制病理生物和病原体入侵,从而与角质形成细胞和免疫细胞产生串扰。
研究人员认为金黄色葡萄球菌和鳞状细胞癌之间的联系不是偶然的,皮肤溃疡是有利于外源性搪塞/感染的致病过程的结果。金黄色葡萄球菌也可能参与鳞状细胞癌的发病机制,引起慢性局部炎症,涉及不同的致瘤阶段,包括促进生存、增殖、细胞转化、侵袭、血管生成、转移。
葡萄球菌毒素-α决定了参与炎症过程的局部细胞的分泌,进而导致活化B细胞的NF-Kβ的激活,从而增加不同细胞因子和趋化因子的表达,包括IL-1β、IL-6和IL-12。
其他因素如紫外线辐射(尤其是UVB)也是皮肤癌发生的主要危险因素之一。紫外线照射会改变皮肤微生物群,导致大量形成活性氧、细胞凋亡和炎症,与皮肤癌相关。
总的来说,许多常见的皮肤病,如痤疮、特异性皮炎、牛皮癣、皮肤癌等,都与皮肤微生物群的变化有关。
皮肤病中的关键微生物发现如下:

编辑
doi.org/10.1002/mlf2.12064
●
饮食对肠道微生物群的影响较大,皮肤和肠道微生物群是内在相关的,由宿主免疫系统介导。因此,肠道和皮肤可以通过饮食、微生物代谢产物、神经内分泌途径和中枢神经系统等途径相互作用,也就是说,饮食对皮肤也会产生较大影响。
饮食结构
西方饮食已被证明会破坏微生物组并导致皮肤病,从而对皮肤健康产生负面影响。相反,植物性饮食与更健康的皮肤有关。
以植物为基础的饮食是一种由多种蔬菜、水果、豆类、扁豆、豆类、坚果、种子、真菌和全谷物组成的饮食模式,并且限制或不摄入动物产品、加工食品或糖果。
这种饮食的饱和脂肪、反式脂肪和花生四烯酸含量较低,而抗氧化剂和 omega-3 脂肪酸含量较高,再加上其直接治疗作用,可减少炎症和皮肤症状。
植物性饮食与皮肤健康/疾病之间的关联
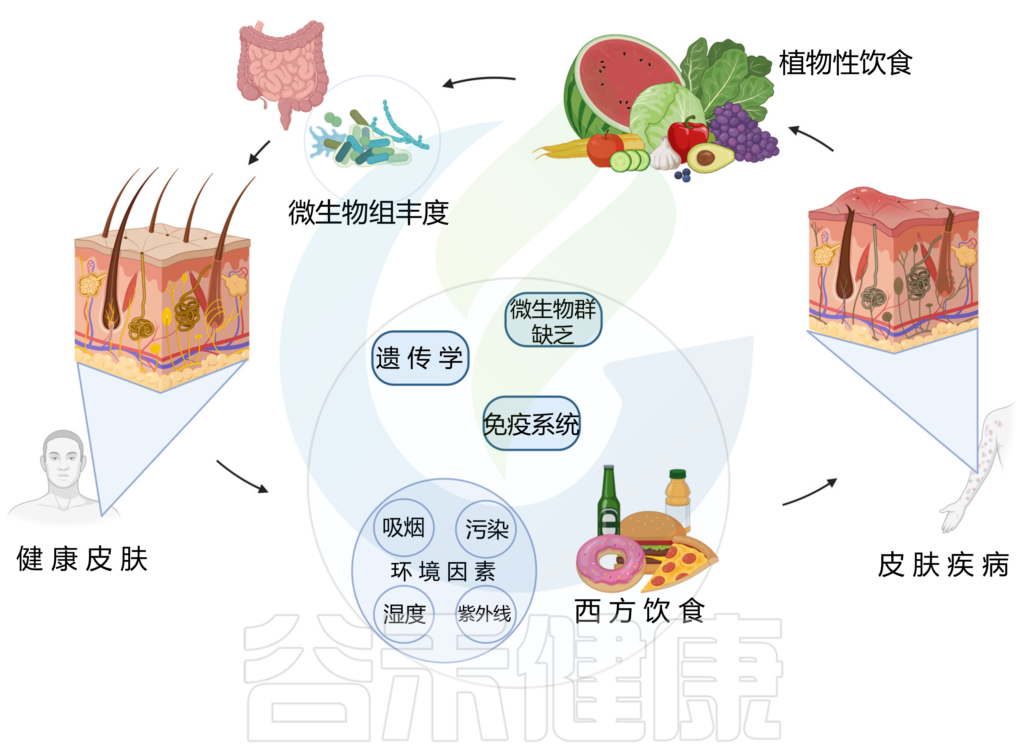
doi.org/10.3390/nu15132842
多项研究发现,植物性饮食对缓解牛皮癣、特异性皮炎、痤疮等皮肤问题有益。


doi.org/10.3390/nu15132842
食 物
植物性功能性食品增强皮肤健康,减少皮肤老化迹象,并改善整体外观。下图是芒果、杏仁、牛油果及其对皮肤健康的积极影响。
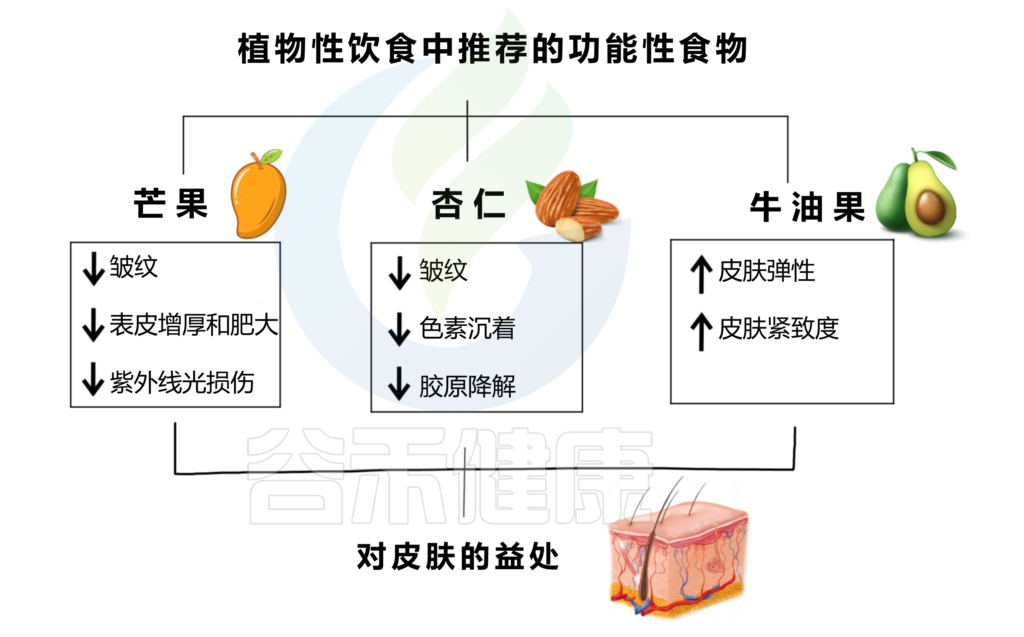
编辑
doi.org/10.3390/nu15132842
芒果能够减少皱纹、表皮变薄和肥厚,防止 UVB 损伤。无论是果肉还是果汁,芒果酚酸的抗氧化特性和生物利用度都会得到保留,而果汁的呈现可能会增强其特性。从芒果干中提取的芒果提取物也可以减少UVB辐射引起的皱纹的形成。
杏仁富含α-生育酚(或维生素E)、脂肪酸、多酚,因此是一种具有抗氧化特性的食物,可以减少皱纹、色素沉着和胶原蛋白降解。
牛油果含有类胡萝卜素、单不饱和脂肪酸、酚类化合物,某些基因的表达,如胶原蛋白和弹性蛋白基因,在进行饮食调整后被诱导,因此可以促进皮肤弹性和紧致度的增加。
限制饮酒和甜食
酒精会使你的身体和皮肤脱水,这可能会使皮肤看起来更加干燥或有皱纹,许多含有酒精的混合饮料也富含糖,这都不利于皮肤健康。糖可能使胶原蛋白变硬,从而使皮肤老化,也可能带来炎症。
喝 水
对于每日饮水量较低的人(即那些本来就脱水的人)来说,增加饮水量对皮肤外观有积极影响,有助于维持皮肤水合水平。同时,尝试在食物中多加入黄瓜、芹菜、西葫芦、西瓜、草莓和花椰菜等,也可以适当补水。
●
适当的清洁和保湿可用于维持皮肤的生理pH值。据报道,早在1995年,与使用 pH8 的普通肥皂相比,使用酸性合成皂(pH 5.5-5.6)可显著减少非炎症和炎症病变。
从那时起,pH 值的变化通过皮肤屏障的完整性与痤疮的发病机制联系起来,建议使用 pH 值约为 5.5 的皮肤清洁剂。
为什么洗脸很重要?
脸每天面对风吹、紫外线、化妆/护肤品、屏幕等刺激,会积聚污垢、油脂和其他碎屑,如果不及时清除,可能会导致刺激和其他皮肤问题。
合适的洗脸方式
注意:
应该多久洗一次脸?
没有既定的指导方针,一般来说,最好每天洗两次脸。
如果皮肤干燥或敏感,可以在晚上用清洁去除污垢,然后在早上用温水冲洗脸。
即使当天不化妆或者不出门,污垢、油脂和其他不需要的碎屑仍然会在一天中积聚在皮肤上,因此最好在睡觉之前洗脸。
如果刚在健身房、参加高温瑜伽课或在户外徒步旅行,并且出汗较多,最好马上洗脸。
如果存在敏感问题或其他特殊的皮肤状况,请与医生沟通。
●
痤疮是一种慢性炎症性皮肤病,对于痤疮,护肤品有多种作用机制,包括:
1) 保护和改善皮肤屏障
2) 保护皮肤微生物组
3) 维持健康的皮肤 pH 值
4) 抵御紫外线伤害
保护皮肤屏障是皮肤化妆品改善痤疮管理的重要机制,临床上,屏障功能障碍表现为皮肤干燥、刺痛/烧灼/刺痛、紧绷、疼痛或刺激性皮炎等形式。这些被认为与经表皮失水 (TEWL) 有关,并且可以通过使用保湿剂至少部分缓解。
特别适用于痤疮的成分包括烟酰胺、视黄醇衍生物、水杨酸、神经酰胺、甘油、温泉水、泛醇等。
护肤品中可能存在的活性成分及其针对性作用
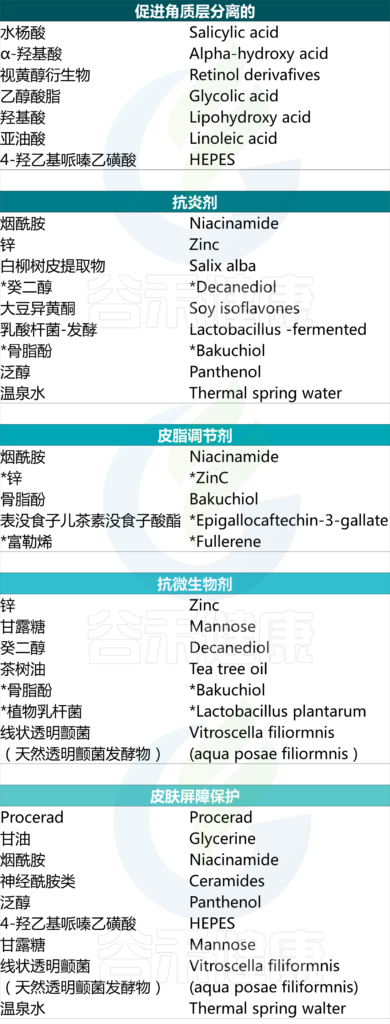
Kurokawa I, et al., Dermatol Ther (Heidelb). 2023
而皮肤微生物组的核心作用与表皮屏障功能一起,为优化护肤提供了强有力的支持。可以通过尝试恢复微生物组的多样性并通过下调先天免疫来抑制炎症。
总的来说,现有文献结果的总体趋势表明,护肤品可以改善整体皮肤健康,减少痤疮皮损,在处方治疗后维持痤疮清除,并且可能对减少表面皮肤油腻具有有益作用。
然而需要进一步研究才能更好地理解这一作用。在此情况下可能有益的成分包括但不限于:乙醇酸、LHA、亚油酸、烟酰胺、锌、吡罗克酮乙醇胺、procerad、Vitroscella filiformis.
注意:
痤疮的治疗管理需谨慎,一些基于类维生素A的治疗方案,可能会加剧皮肤干燥和刺激,这不仅可能导致屏障功能改变,而且还会增加深色皮肤患者继发性妊娠高血压综合征的可能性。
●
温泉水已被证明对膜流动性、皮肤屏障修复、抗自由基、抗氧化、抗炎和免疫调节特性以及增殖活性和衰老和保湿过程的调节有影响。
温泉水的水微生物群中的生物活性化合物可以改善特应性皮炎或红斑痤疮等皮肤病,并改善瘙痒和干燥症;还能增加对紫外线的防护,强化屏障功能,维持皮肤防御良好的稳态,修复受损皮肤,促进伤口愈合,改善皮肤状况,减少皮肤色素不均匀,防止皮肤老化。
未来,护肤品研发人员、水文学家、温泉中心之间的合作,将推动该行业更好地了解温泉水的水生生物群落对皮肤病的作用,并考虑将这种水生生物群落的衍生物纳入皮肤病配方(以发酵罐、裂解物、提取物等形式)。
●
某些益生菌菌株及其代谢物可能带来许多益处,如:改善皮肤屏障功能、减少炎症、改善易长粉刺或易湿疹的皮肤、抗皮肤光老化等。因此,近年来益生菌已成为护肤品中的流行成分。
益生菌分为口服和外涂。
口服益生菌
肠道微生物群的变化可能会引发全身炎症和异常免疫反应,从而破坏皮肤健康。口服益生菌直接作用于肠道微生物群,帮助恢复肠道微生物群的稳态,这在皮肤稳态中发挥着至关重要的作用。
益生菌在皮肤光老化中的作用
含有约氏乳杆菌和营养类胡萝卜素的膳食补充剂的摄入对紫外线暴露的长期和反复影响有益处,并且对光老化更有针对性。
含有长双歧杆菌和低聚半乳糖的膳食补充剂由于其抗炎和抗氧化特性,保护皮肤免受UVB诱导的光老化。它们也提高了血清中短链脂肪酸和乙酸盐的水平,可以增加和激活依赖于组蛋白乙酰化的皮肤固有Treg。
口服植物乳杆菌HY7714通过抑制JNK/AP-1信号通路的激活,降低了UVB损伤细胞中过量的MMP-13转录水平和MMP-2和MMP-9的活性。
口服清酒乳杆菌可以通过阻断MAPK信号通路来抑制AP-1的表达,以增加真皮成纤维细胞中的胶原蛋白并延缓皮肤光老化。
益生菌通过多种途径对抗皮肤光老化的作用
编辑
doi: 10.2147/CCID.S388954
局部益生菌(外涂)
局部益生菌于1912年首次被提出作为皮肤疾病的治疗方法。
在特定条件下,益生菌可以持续存在并成功定殖皮肤:
虽然益生菌对皮肤健康有一定益处,但益生菌使用的安全性可能存在一些限制,主要针对免疫系统较弱的人群,如婴儿、孕妇、老年人等。需要进一步的研究来证明益生菌作为皮肤病治疗和护肤品的功效,作用机制以及主要是局部使用益生菌的安全性。
●
过氧化苯甲酰 (BPO) 治疗可以调节痤疮患者的皮肤微生物群,治疗后细菌种类的数量和多样性均减少,接近健康组。也有研究人员认为,BPO治疗虽然降低了GAGS评分并降低了微生物多样性,但它也损害了痤疮的表皮屏障,这可以被认为是一种副作用。
抗生素
针对痤疮丙酸杆菌的抗生素一直是痤疮治疗的支柱。其中,大环内酯类、克林霉素和四环素类药物的处方最为广泛。
红霉素、罗红霉素、克拉霉素和阿奇霉素是大环内酯类药物。常用于痤疮的四环素类药物是多西环素、四环素和米诺环素。
异维甲酸是一种全反式维甲酸原药,是严重顽固性痤疮患者的最终选择,它抑制皮脂生成,它可以使痤疮患者的C.acnes/TLR-2介导的先天免疫反应正常化,也就是说,异维甲酸会间接影响皮肤微生物。
其他,比如抗生素治疗会降低皮肤伤口中的细菌密度并改变细菌组成,其次是RegIIIγ表达的降低,这可能有助于延迟伤口修复。
●
几项研究表明,互惠共生对维持微生物物种之间的新陈代谢很重要。我们不仅需要关注微生物组的转移,还需要关注潜在的交叉喂养和共同居住。
有研究表明,整个原始皮肤微生物组从一个皮肤部位移植到另一个部位。研究人员将能够在腋下产生气味的细菌转移到受试者的前臂,前臂上培养的双菌群样本产生强烈的气味,这表明引起气味的细菌可以从腋下传播到前臂。
这项研究表明,通过皮肤微生物组移植重塑人类气味,降低对传染病媒介的吸引力,从而阻断病毒传播,为传染病预防和控制提供了一条新的途径。
●
尽可能选择天然纤维材料,如棉、亚麻或丝绸等,这些材料通常具有良好的透气性和吸湿性,可以帮助皮肤保持干爽。同时,天然纤维材料也更加温和,减少与皮肤的摩擦和刺激。
避免合成纤维材料:尽量减少使用合成纤维材料,如尼龙或涤纶等。
保持衣物的清洁和卫生非常重要。定期清洗和消毒衣物,避免细菌、真菌和其他有害微生物的滋生。
●
吸烟会使皮肤最外层的微小血管变窄,从而减少血液流动并使皮肤更苍白。这也耗尽了皮肤对皮肤健康很重要的氧气和营养物质。吸烟还会损害胶原蛋白,也可能会增加患鳞状细胞皮肤癌的风险。
压力会通过肠-脑-皮肤轴影响皮肤健康,皮肤细胞的代谢和分泌作用可能发生变化,导致皮肤微生物群失去原本的平衡状态,皮肤更加敏感,并引发痤疮爆发和其他皮肤问题。
长期的压力会导致免疫系统的紊乱,使皮肤更容易受到各种外界因素的侵害,从而引发炎症、过敏等症状。
睡眠可以促进皮肤细胞的修复和再生,有助于提升肤色的均匀度。同时,在深度睡眠状态下,身体会产生更多的生长激素,促进皮肤中胶原蛋白和弹力纤维的生成,有助于减少皱纹的产生。因此,保证充足的睡眠对皮肤健康也相当重要。
适度的身体运动可以促进血液循环和新陈代谢,有助于清除毒素和废物,使皮肤更加健康。选择适合自己的运动方式,如散步、跑步、瑜伽等,坚持每周进行几次。
随着年龄的增长,我们的皮肤微生物群组成发生了很大变化且可预测。未来的研究将继续阐明动态皮肤微生物组在整个生命周期中的积极作用。
皮肤微生物群扮演着重要角色,它不仅是阻止致病菌进入皮肤的屏障,还可以通过调节免疫系统减少炎症等方式对皮肤疾病起到积极作用。肠道微生物组的研究为我们探索皮肤微生物群在其他生理系统中的作用提供了途径。确定哪些微生物及其代谢产物对维持人类健康和疾病至关重要。
了解皮肤微生物群和肠道微生物群之间的相互关系可以帮助我们更好地理解肠-皮肤轴的作用机制。
未来的研究需要更深入地了解皮肤微生物组的分子基础,包括微生物-微生物相互作用、微生物-宿主-微生物相互作用、环境因素-微生物相互作用以及不同细菌菌株之间的互动对宿主健康的影响,为调控皮肤微生物群的紊乱提供更专业的治疗方法。
微生物群研究的相关应用领域
护肤品可以改变皮肤上的分子和菌群多样性及微生物在皮肤上的动力学和结构。微生物群在护肤中的应用是一种先进、前沿的方法。
服装和皮肤之间的关系已成为探索纺织品如何通过调节皮肤微生物群,来治疗或缓解皮肤疾病的新领域。
考虑到生物活性纺织品的广泛应用,需要寻找创新技术和产品。对于抗菌纺织品,根据其对纺织材料和人体皮肤微生物群的主要影响,可以在下述生物医学研究方向中找到有价值的用途:
这些应用使得生物活性纺织品更加绿色环保、安全、高性能,能够提供更多的功能性和舒适性,满足人们对健康和舒适的需求。
通过利用皮肤微生物穿透皮肤屏障的能力,或许可以开发微生物活化免疫细胞来传递细胞因子、小分子化学物质或疫苗。
微生物在皮肤上引发免疫反应,并与皮肤免疫细胞进行相互作用,调节免疫应答和免疫耐受。这为开发新的免疫调节治疗策略提供了新的思路。
通过调节肠道微生物组来靶向皮肤健康是一种很有前景的替代疗法。对于一些慢性皮肤病患者来说,肠道微生物群的紊乱可能是病情加重或难以治愈的原因之一,而通过调整饮食、生活习惯、环境等因素,同时加入益生菌或其他补充剂等,调节肠道微生物群的平衡,增强皮肤对各种病原体的抵抗力;同时通过肠道菌群调节影响自身免疫反应,改善皮肤疾病的症状。
通过皮肤、肠道微生物群联合检测可以探索和评估微生物之间的相互关系,并在皮肤问题的中提供更全面有效、个性化的治疗方案。
主要参考文献:
Townsend EC, Kalan LR. The dynamic balance of the skin microbiome across the lifespan. Biochem Soc Trans. 2023 Feb 27;51(1):71-86.
Kurokawa I, Kobayashi M, Nomura Y, Abe M, Kerob D, Dreno B. The Role and Benefits of Dermocosmetics in Acne Management in Japan. Dermatol Ther (Heidelb). 2023 Jul;13(7):1423-1433.
Harris-Tryon TA, Grice EA. Microbiota and maintenance of skin barrier function. Science. 2022 May 27;376(6596):940-945.
Belzer A, Parker ER. Climate Change, Skin Health, and Dermatologic Disease: A Guide for the Dermatologist. Am J Clin Dermatol. 2023 Jul;24(4):577-593.
Patra V, Bordag N, Clement Y, Köfeler H, Nicolas JF, Vocanson M, Ayciriex S, Wolf P. Ultraviolet exposure regulates skin metabolome based on the microbiome. Sci Rep. 2023 May 3;13(1):7207.
Skowron K, Bauza-Kaszewska J, Kraszewska Z, Wiktorczyk-Kapischke N, Grudlewska-Buda K, Kwiecińska-Piróg J, Wałecka-Zacharska E, Radtke L, Gospodarek-Komkowska E. Human Skin Microbiome: Impact of Intrinsic and Extrinsic Factors on Skin Microbiota. Microorganisms. 2021 Mar 5;9(3):543.
Trompette A, Ubags ND. Skin barrier immunology from early life to adulthood. Mucosal Immunol. 2023 Apr;16(2):194-207.
Alashkar Alhamwe B, López JF, Zhernov Y, von Strandmann EP, Karaulov A, Kolahian S, Geßner R, Renz H. Impact of local human microbiota on the allergic diseases: Organ-organ interaction. Pediatr Allergy Immunol. 2023 Jun;34(6):e13976.
Xu H, Li H. Acne, the Skin Microbiome, and Antibiotic Treatment. Am J Clin Dermatol. 2019 Jun;20(3):335-344.
Zubeldia-Varela E, Barker-Tejeda TC, Obeso D, Villaseñor A, Barber D, Pérez-Gordo M. Microbiome and Allergy: New Insights and Perspectives. J Investig Allergol Clin Immunol. 2022 Oct;32(5):327-344.
De Almeida, C.V.; Antiga, E.; Lulli, M. Oral and Topical Probiotics and Postbiotics in Skincare and Dermatological Therapy: A Concise Review. Microorganisms 2023, 11, 1420.
Flores-Balderas, X.; Peña-Peña, M.; Rada, K.M.; Alvarez-Alvarez, Y.Q.; Guzmán-Martín, C.A.; Sánchez-Gloria, J.L.; Huang, F.; Ruiz-Ojeda, D.; Morán-Ramos, S.; Springall, R.; et al. Beneficial Effects of Plant-Based Diets on Skin Health and Inflammatory Skin Diseases. Nutrients 2023, 15, 2842.
Suellen Ferro de Oliveira C, Kekhasharú Tavaria F. The impact of bioactive textiles on human skin microbiota. Eur J Pharm Biopharm. 2023 Jul;188:66-77.
Santiago-Rodriguez, T.M.; Le François, B.; Macklaim, J.M.; Doukhanine, E.; Hollister, E.B. The Skin Microbiome: Current Techniques, Challenges, and Future Directions. Microorganisms 2023, 11, 1222.
Fernandes A, Rodrigues PM, Pintado M, Tavaria FK. A systematic review of natural products for skin applications: Targeting inflammation, wound healing, and photo-aging. Phytomedicine. 2023 Jul;115:154824.
Lee, H.-J.; Kim, M. Skin Barrier Function and the Microbiome. Int. J. Mol. Sci. 2022, 23, 13071.
Ito Y, Amagai M. Dissecting skin microbiota and microenvironment for the development of therapeutic strategies. Curr Opin Microbiol. 2023 Apr 3;74:102311.
Mourelle, M.L.; Gómez, C.P.; Legido, J.L. Hydrobiome of Thermal Waters: Potential Use in Dermocosmetics. Cosmetics 2023, 10, 94
Azzimonti, B.; Ballacchino, C.; Zanetta, P.; Cucci, M.A.; Monge, C.; Grattarola, M.; Dianzani, C.; Barrera, G.; Pizzimenti, S. Microbiota, Oxidative Stress, and Skin Cancer: An Unexpected Triangle. Antioxidants 2023, 12, 546
Leung MHY, Tong X, Shen Z, Du S, Bastien P, Appenzeller BMR, Betts RJ, Mezzache S, Bourokba N, Cavusoglu N, Aguilar L, Misra N, Clavaud C, Lee PKH. Skin microbiome differentiates into distinct cutotypes with unique metabolic functions upon exposure to polycyclic aromatic hydrocarbons. Microbiome. 2023 Jun 1;11(1):124.
Kengmo Tchoupa A, Kretschmer D, Schittek B, Peschel A. The epidermal lipid barrier in microbiome-skin interaction. Trends Microbiol. 2023 Jul;31(7):723-734.

谷禾健康

与人类密切相关的微生物
我们的世界大到浩瀚宇宙,小到微观下的生物分子。我们总说漫天繁星,其实身边微生物数量可能更多。动物、植物、真菌、细菌、病毒等,共同构成了丰富多彩的生命世界。
细菌、真菌、病毒是其中的三个大类,虽然它们都体型微小,但是相互之间可以说是天差地别。并且它们与我们的生活以及健康息息相关,有对人体有益的益生菌,也有对人体危害极大的病毒。

谷禾在本文中介绍了细菌、真菌、病毒的一些特征,它们的分类及繁殖方式,以及有致病性的微生物和感染后的一些症状与免疫过程。
在最后,针对一些病原体的感染。我们提出了一些预防的方法,以及目前技术条件下的治疗手段。微生物检测技术能够帮助人们更好地了解就在我们体内或身边的微生物,有助于塑造更健康的身体及生活。
本文主要从以下几个方面讲述
●什么是细菌、真菌、病毒?
●细菌、真菌、病毒的分类与繁殖方式
●细菌、真菌、病毒的致病性与感染症状
●细菌、真菌、病毒在体内的免疫反应
●病原体感染的预防及治疗方法
细菌
细菌(Bacteria)是生物的主要类群之一,属于细菌域。广义的细菌即为原核生物, 是指一大类细胞核无核膜包裹,只存在拟核区(或拟核)的裸露DNA的原始单细胞生物,包括真细菌(eubacteria)和古细菌(archaea)两大类群。
注:其中除少数属古细菌外,多数的原核生物都是真细菌。
✦结构简单、个体小
图片来源:百度
细菌为原核微生物的一类,是一类形状细短,结构简单,多以二分裂方式进行繁殖的原核生物。细菌一般是单细胞,主要由细胞壁、细胞膜、细胞质、核质体等部分构成,有的细菌还有荚膜、鞭毛、菌毛等特殊结构, 缺乏细胞核、细胞骨架以及膜状胞器,例如粒线体和叶绿体。
细菌的个体非常小,绝大多数细菌的直径大小在0.5~5μm之间。目前已知最小的细菌只有0.2微米长,因此大多情况只能在显微镜下看到它们。但处于有利环境中时,细菌可以形成肉眼可见的集合体,例如菌簇。
✦数量众多、分布广泛
细菌是所有生物中数量最多的一类,据估计,其总数约有5×10的三十次方个。
细菌广泛分布于土壤和水中,或者与其他生物共生。人体是大量细菌的栖息地;可以在皮肤表面、肠道、口腔、鼻子和其他身体部位找到。据估计,人体内及表皮上的细菌细胞总数约是人体细胞总数的十倍。
此外,也有部分种类分布在极端的环境中,例如温泉,甚至是放射性废弃物中,它们被归类为嗜极生物,其中最著名的种类之一是海栖热袍菌(Thermotoga maritima),科学家是在意大利的一座海底火山中发现这种细菌的。
★ 常见的细菌
大肠埃希氏菌(Escherichia coli)
大肠杆菌是短杆菌,两端呈钝圆形,属革兰氏阴性菌,于1885年首次被发现。
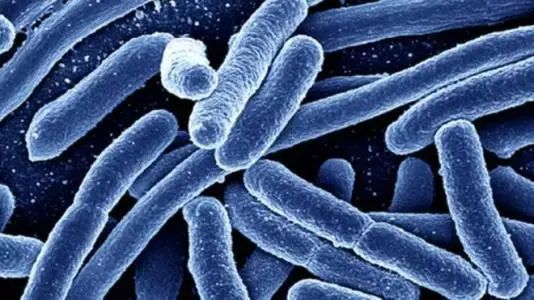
图片来源:百度百科
大肠杆菌是条件致病菌,在一定条件下可以引起多种疾病,如腹泻,肠炎,尿路感染,呼吸道感染、菌血症和其他临床感染(如新生儿脑膜炎)。
金黄色葡萄球菌(Staphylococcus aureus)
金黄色葡萄球菌也称“金葡菌”,隶属于葡萄球菌属,是革兰氏阳性菌代表,为一种常见的食源性致病微生物。
图片来源:百度
该菌最适宜生长温度为37℃,pH为7.4,耐高盐,可在盐浓度接近10%的环境中生长。金黄色葡萄球菌常寄生于人和动物的皮肤、鼻腔、咽喉、肠胃、痈、化脓疮口中,空气、污水等环境中也无处不在。
金黄色葡萄球菌是最臭名昭著、分布最广的细菌病原体之一。这种病原体可引起多种疾病,从中度严重的皮肤感染到致命的肺炎和败血症。
每年在全球范围内造成难以估计数量的无并发症皮肤感染,并可能导致数十万至数百万更严重的侵入性感染。
双歧杆菌属(Bifidobacterium)
双歧杆菌是一种革兰氏阳性、不运动、细胞呈杆状、一端有时呈分叉状、严格厌氧的细菌属,广泛存在于人和动物的消化道、阴道和口腔等生境中。双歧杆菌属的细菌是人和动物肠道菌群的重要组成成员之一。
双歧杆菌是一种重要的肠道有益微生物。双歧杆菌作为一种生理性有益菌,对人体健康具有生物屏障、营养作用、抗肿瘤作用、免疫增强作用、改善胃肠道功能、抗衰老等多种重要的生理功能。
★ 细菌对人类有利有弊
细菌也对人类活动有很大的影响。一方面,细菌是许多疾病的病原体,可以通过各种方式,如接触、消化道、呼吸道、昆虫叮咬等在正常人体间传播疾病,具有较强的传染性,对社会危害极大。
另一方面,人类也时常利用细菌,例如乳酪及酸奶和酒酿的制作、部分抗生素的制造、废水的处理等,都与细菌有关。在生物科技领域中,细菌也有着广泛的运用。
真菌
真菌(Fungus)是一种真核生物。在生物学分类上属于藻菌植物中真菌超纲。微生物中只有真菌具有真正的细胞核和完整的细胞器,故又称真核细胞型微生物。
最常见的真菌是各类蕈类,另外真菌也包括霉菌和酵母。现在已经发现了七万多种真菌,估计只是所有存在的一小半。大多真菌原先被分入动物或植物,现在成为自己的界,分为四门。
✦结构
菌体由菌丝组成,无根、茎、叶的分化,无叶绿素,不能自己制造养料,以寄生或腐生方式生活的低等生物。
真菌菌丝呈管状,多数菌丝有隔膜,此类菌丝为多细胞,隔膜中央有小孔,使细胞质、细胞核得以通过。有些真菌的菌丝无隔膜,为多核细胞。
✦分布
真菌广泛分布于全球各带的土壤、水体、动植物及其残骸和空气中,营腐生、寄生和共生生活。
★ 常见的真菌
蘑菇(Agaricus campestris)

图片来源:百度
蘑菇属于腐生真菌中的一种,其体内并没有叶绿素的存在,因此不能直接在光照下进行光合作用。蘑菇生长过程中,主要是将培养料中的各类营养物质作为营养来源,从而实现生长发育。
酵母(Saccharomyces)
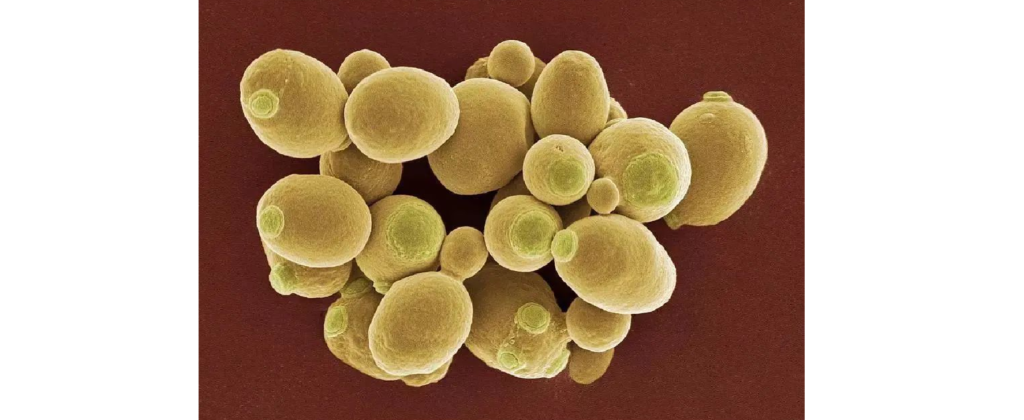
图片来源:百度
酵母菌是单细胞微生物。它属于高等微生物的真菌类。有细胞核、细胞膜、细胞壁、线粒体、相同的酶和代谢途径。酵母无害,容易生长,空气中、土壤中、水中、动物体内都存在酵母。有氧气或者无氧气都能生存。
酵母菌的作用
1、在面包、蛋糕、饼干和烤饼等这种一般的粮食制品掺入酵母菌可以提高食品的营养价值,酵母菌还在婴儿食品以及健康食品中作为食品营养的强化剂。
2、利用酵母菌可以将糖类发酵成酒精,在白酒、啤酒、果酒、黄酒等的酿造过程中都会加入酵母菌。
3、此外,大量的酵母菌还能令酒免受外界杂菌的侵害,在酵母菌发酵完成之后有澄清酒体的作用。
4、酵母菌还有入药价值,入药后的酵母菌不仅在治疗克山病和大骨节病起到辅助作用,还可以具有一定的防衰老作用。
酵母菌的危害
1、个别的酵母菌会危害生物或家庭用具,例如红酵母菌会生长在浴帘或者一些潮湿的家具上,会慢慢地腐蚀这些家具。
2、酵母菌种类中的白色假丝酵母菌,也就是俗称的白色念珠菌,主要出现在口腔、肠道、尿道和阴道等部位的粘膜上,会引起鹅口疮或尿道炎等感染疾病。
病毒
病毒(virus)是一种可以利用宿主细胞系统进行复制的微小, 无完整细胞结构的亚显微粒子。病毒不具细胞结构,无法独立生长和复制, 但病毒可以感染所有的具有细胞的生命体, 具有遗传、复制等生命特征。
✦无细胞结构
病毒主要由核酸和蛋白质外壳组成。有些病毒有囊膜和刺突,如流感病毒。病毒基因同其他生物的基因一样,也可以发生突变和重组,因此也是可以演化的。
对于病毒到底是一种生命形式,还是仅仅是一种能够与生物体作用的有机结构,人们的观点各不相同。
病毒有高度的寄生性,完全依赖宿主细胞的能量和代谢系统,获取生命活动所需的物质和能量,离开宿主细胞,它只是一个大化学分子,停止活动,可制成蛋白质结晶,为一个非生命体,遇到宿主细胞它会通过吸附,进入、复制、装配、释放子代病毒而显示典型的生命体特征,所以病毒是介于生物与非生物之间的, 一种处于“生命边缘的生物体”。
★ 常见的病毒
狂犬病毒(Rabies virus)
图片来源:百度
狂犬病病毒为弹状病毒,其头部为半球形,末端常为平端,形态呈典型的子弹状,长约130-240nm,直径65~80nm,内含有单链RNA。
狂犬病病毒是引起狂犬病的病原体。狂犬病毒具有两种主要抗原:一种是病毒外膜上的糖蛋白抗原,能与乙酰胆碱受体结合使病毒具有神经毒性,并使体内产生中和抗体及血凝抑制抗体,中和抗体具有保护作用;另一种为内层的核蛋白抗原,可使体内产生补体结合抗体和沉淀素,无保护作用。
冠状病毒
图片来源:百度
冠状病毒属的病毒是具囊膜、基因组为线性单股正链的RNA病毒,是自然界广泛存在的一大类病毒。
冠状病毒直径约80~120nm,基因组全长约27-32kb,是已知RNA病毒中基因组最大的病毒。
冠状病毒是成人普通感冒的主要病原之一,在儿童可以引起上呼吸道感染,一般很少波及下呼吸道。
冠状病毒还可以引起婴儿、新生儿急性肠胃炎,主要症状是水样大便、发热、呕吐,每天10余次,严重者可以出现血水样便。
2019新型冠状病毒(2019-nCoV ,引发新型冠状病毒肺炎COVID-19)是已知的第7种可以感染人的冠状病毒。
注:第一个已知的病毒是烟草花叶病毒,由马丁乌斯·贝杰林克于1899年发现并命名,如今已有超过5000种类型的病毒得到鉴定。研究病毒的科学被称为病毒学,是微生物学的一个分支。
细菌和真菌的名称中均有一个“菌”字,同属微生物,但两者在生物类型、结构、大小、增殖方式上却有着诸多不同。比较如下:
✦生物类型不同
一是就有无成形的细胞核来看:细菌没有核膜包围形成的细胞核,属于原核生物;真菌有核膜包围形成的细胞核,属于真核生物。
二是就组成生物的细胞数目来看:细菌全部是由单个细胞构成,为单细胞型生物;真菌既有由单个细胞构成的单细胞型生物(如酵母菌),也有由多个细胞构成的多细胞型生物(如食用菌、霉菌等)。
✦细胞结构不同
细菌和真菌都具有细胞结构,属于细胞型生物,在它们的细胞结构中都具有细胞壁、细胞膜、细胞质,但却存在诸多不同,具体表现在:一是细胞壁的成分不同:细菌细胞壁的主要成分是肽聚糖,而真菌细胞壁的主要成分是几丁质。
二是细胞质中的细胞器组成不同:细菌只有核糖体一种细胞器;而真菌除具有核糖体外,还有内质网、高尔基体、线粒体、中心体等多种细胞器。
三是细菌没有成形的细胞核,只有拟核;真菌具有。细菌没有染色体,其DNA分子单独存在;真菌细胞核中的DNA与蛋白质结合在一起形成染色体。
✦细胞大小差异
细胞大小:原核细胞一般较小,直径一般为1μm-10μm;真核细胞较大,直径一般为10μm-100μm。
✦增殖方式不同
细菌是原核生物,为单细胞型生物,通过细胞分裂而增殖,具有原核生物增殖的特有方式(二分裂);真菌为真核生物,细胞的增殖主要通过有丝分裂进行,因真菌种类的不同其个体增殖方式主要有出芽生殖(如酵母菌)和孢子生殖(食用菌)等方式。
注:尽管在细菌和真菌的名称中都有一个菌字,但细菌的名称中一般含有:球、杆、弧、螺旋等描述细菌形态的字眼,只有乳酸菌例外(实为乳酸杆菌);而真菌名称中则不含有。
✦体积差异大
细菌和病毒同属于微生物,只有在显微镜下才能看到。但两者是截然不同的东西。
细菌和病毒均属于微生物。在一定的环境条件下,细菌和病毒都可以在人体中增殖,并可能导致疾病发生。细菌较大,用普通光学显微镜就可看到,它们的生长条件也不高。病毒则较小,一般要用放大倍数超过万倍的电子显微镜才能看到。
注意:有一点值得指出的是,在人们身体的许多部位都有细菌的增殖。医学上称之为正常菌群,它们与我们和平相处,互惠互利。而在任何情况下从机体中发现病毒都非正常状况。因为只有侵入我们的活组织细胞中这些病毒才能存活。
✦结构不同
细菌是和植物一样,有细胞壁,而人的细胞是没有细胞壁的,这就是很多抗生素杀菌的原理。比如破坏它的细胞壁或者阻止合成细胞壁,细菌就死掉了,而人没有这个结构,所以对人无影响。
病毒与细菌不同之处是,病毒没有细胞结构,可以说是最低等的生物,但是它的能耐可不小,人类的疾病从小的感冒到大的癌症都和它有关系。
病毒构造很简单,外面是一层蛋白质,称为病毒外壳。蛋白质外壳内部包裹着病毒的遗传物质,可以是DNA,也可以是RNA。病毒自己不能完成新陈代谢,也不能完成繁殖,需要寄生在其它细胞内完成。
病毒没有自己的生长代谢系统,它的生存靠寄生在宿主(如人)和细胞中依赖他人的代谢系统。也是因为如此,目前抗病毒的特殊药物不多。
✦按形状分类
细菌具有不同的形状,并可根据形状分为三类,即:球菌、杆菌和螺旋菌(包括弧菌、螺菌、螺杆菌)。
✦不同生存条件
按细菌的生活方式来分类,分为两大类:自养菌和异养菌,其中异养菌包括腐生菌和寄生菌。
按细菌对氧气的需求来分类,可分为需氧(完全需氧和微需氧)和厌氧(不完全厌氧、有氧耐受和完全厌氧)细菌。
按细菌生存温度分类,可分为喜冷、常温和喜高温三类。
✦按细胞壁组成分类
细菌的结构十分简单,原核生物,没有成形的细胞核,没有膜结构的细胞器例如线粒体和叶绿体,但是有细胞壁,有的细菌还有鞭毛和荚膜,根据细胞壁的组成成分,细菌分为革兰氏阳性菌和革兰氏阴性菌。
“革兰氏”来源于丹麦细菌学家革兰,他发明了革兰氏染色。
革兰氏阳性菌具有较厚的肽聚糖细胞壁结构,在革兰氏染色试验中呈紫色/蓝色;
革兰氏阴性菌的细胞壁较薄,在革兰氏染色试验中呈红色至粉红色。
革兰氏阳性菌特征
革兰氏阳性细菌的主要特征是它们的结构。一般有以下特点:
●没有外膜。革兰氏阳性细菌没有外膜,但革兰氏阴性细菌有。
●复杂的细胞壁。包围细胞质膜的细胞壁由肽聚糖、多糖、磷壁和蛋白质组成。它很容易吸收外来物质。
●厚的肽聚糖层。在革兰氏阳性细菌中,肽聚糖有40到80层厚。
●某些表面附属物。革兰氏阳性细菌可能有鞭毛,可以帮助它们移动。它们很少有被称为菌毛的毛发状结构。
革兰氏阴性菌特征
革兰氏阳性菌和革兰氏阴性菌具有不同的结构。通常,革兰氏阴性菌具有以下特征:
●外脂质膜
●肽聚糖薄层(2-3纳米)
●通常不含磷壁酸
●可以有鞭毛或毛
小结
主要的区别是外脂膜。它很难渗透,这给了革兰氏阴性细菌额外的保护。革兰氏阳性细菌没有这种特征。
由于这种差异,革兰氏阴性细菌更难杀死。这意味着革兰氏阳性菌和革兰氏阴性菌需要不同的处理方法。
真菌较高层级的分类系统仍有很大争议,新理论不断被提出,各个分类阶层的名称均常有变动。且同一种真菌还可能在生活史的不同阶段,例如无性与有性世代拥有数种不同的学名,使真菌分类更加复杂。目前将真菌界分为4门和1类。
✦壶菌门
壶菌门(Chytridiomycota)壶菌门是游动细胞具有“9+2”结构的鞭毛,并能在水中游动的一类真菌,游动孢子具有一根后生尾鞭式鞭毛。
壶菌多水生,大多腐生在动植物残体上或寄生于水生植物、藻类、小动物和其他真菌上,少数寄生于高等种子植物上。大多数种类能分解纤维素和几丁质。
✦接合菌门
接合菌门(Zygomycota)是由低等的水生真菌发展到陆生种类,由游动的带鞭毛的孢囊孢子发展为不游动的孢囊孢子——静孢子或单孢孢子囊的分生孢子。
接合菌门菌物共同特征是有性生殖产生接合孢子。接合菌营养体为单倍体,大多是很发达的无隔菌丝体,少数菌丝体不发达,较高等的种类菌丝体有隔膜。有的种类菌丝体可以分化形成假根和匍匐丝。细胞壁的主要成分为几丁质。
✦子囊菌门
子囊菌门(Ascomycota)是真菌中最大的类群,与担子菌被称为高等真菌,生殖菌丝细胞出现较短双核阶段,其区别于其他真菌的一个特征是产生子囊。
子囊菌大都陆生,营养方式有腐生、寄生和共生。腐生的子囊菌可以引起木材、食品、布匹和皮革的霉烂以及动植物残体的分解。
✦担子菌门
担子菌门(Basidiomycota)是一类高等真菌,构成双核亚界,包含2万多种,包括蘑菇、木耳等主要食用菌。
担子菌门包括以下组:蘑菇,马勃,鬼笔科,和人体致病酵母隐球菌属等等。
担子菌门的真菌基本全为陆生品种,主要特征是由多细胞,有横隔膜的菌丝体组成,菌丝分为两种,初生菌丝体的细胞只有一个细胞核,次生菌丝体的细胞有两个核,两个核的次生菌丝体可以形成一种子实体,称为担子果,经过有性繁殖过程,在担子上生成担孢子;也可以经过无性繁殖过程生成无性孢子或出芽繁殖。
✦半知菌类
半知菌类(Deuteromycota)是一种已废止的生物分类,指在子囊菌、担子菌的同伴之中,还未发现有性繁殖阶段而在分类学上位置不明的一种临时分类。
只进行无性繁殖的菌类被称作不完全型,这一阶段被称为无性阶段。进行有性繁殖的被称为完全型,该阶段被称作有性阶段,通常有性阶段的菌类也是同时进行无性生殖的。
从遗传物质分类:DNA病毒、RNA病毒、蛋白质病毒(如:朊病毒)
RNA病毒和DNA病毒在结构、成分、复制能力和致病力等方面都不同。RNA病毒就是遗传物质是RNA的一种病毒。DNA病毒也称为脱氧核苷酸病毒,是一种生物病毒,属于原发病毒。
✦DNA病毒和RNA病毒的区别
1、结构:RNA病毒是单链病毒,比较容易发生变异。DNA病毒是双链结构的病毒,不容易发生变异,更稳定。
2、组成成分:RNA病毒是由核糖和磷酸组成,一般只有数百个或者数千个核苷酸。DNA病毒是由去氧核糖和磷酸组成,通常有上百万个核苷酸单位。
3、复制能力:RNA病毒感染人体后,在人体细胞中复制非常活跃,而复制过程中发生变异后也不修复,而是继续复制下去。这样就使RNA病毒变异非常快,不容易被攻破。比如甲型流感H1N1病毒和SARS病毒以及新冠病毒等,都是RNA病毒。
4、致病力:DNA病毒相对不容易变异,致病比较单一。由于RNA病毒相对比较容易变异,因此较容易致病。
从病毒结构分类:真病毒(Euvirus,简称病毒)和亚病毒(Subvirus,包括类病毒、拟病毒、朊病毒)
从寄主类型分类:噬菌体(细菌病毒)、植物病毒(如烟草花叶病毒)、动物病毒(如禽流感病毒、天花病毒、HIV等)
从性质来分:温和病毒(例如HIV)、烈性病毒(例如狂犬病毒)。
✦无性二分裂方式
细菌主要以无性二分裂方式繁殖,即细菌生长到一定时期,在细胞中间逐渐形成横隔,由一个母细胞分裂为两个大小相等的子细胞。
细胞分裂是连续的过程,分裂中的两个子细胞形成的同时,在子细胞的中间又形成横隔,开始细菌的第二次分裂。有些细菌分裂后的子细胞分开,形成单个的菌体,有的则不分开,形成一定的排列方式,如链球菌、链杆菌等。
分裂过程
采用电子显微镜研究细菌的分裂过程表明:细菌细胞分裂大致可经过核物质与细胞质分裂、横隔壁形成和子细胞分离等过程。
细菌细胞分裂时,核质DNA与中介体或细胞膜相连,首先DNA复制并向细胞两端移动,与此同时,细菌细胞膜向内凹陷并形成一垂直于细胞长轴的细胞质隔膜,使细胞质和核质均匀分配到两个子细胞中。
其次细胞形成横隔壁,在细胞膜不断内陷,形成子细胞各自的细胞质膜同时,母细胞的细胞壁也从四周向中心逐渐延伸。最后,逐渐形成子细胞各自完整的细胞壁。接着,子细胞分裂,形成两个大小基本相等的子细胞。
✦繁殖速度快
细菌繁殖速度快,一般细菌约20-30min便分裂一次,即为一代。接种子肉汤培养中的细菌在适宜的温度下迅速生长繁殖,肉汤很快即可变浑浊,表明有细菌的大量生长。不过也有些细菌,如结核分枝杆菌(M.tuberculosis)的繁殖速度较慢,需要15-18小时才能繁殖一代。
真菌的繁殖方式分为无性繁殖和有性繁殖两种。
✦无性繁殖
无性繁殖是指营养体不经过核配和减数分裂产生后代个体的繁殖。它的基本特征是营养繁殖通常直接由菌丝分化产生无性孢子。
常见的无性孢子有三种类型:
(1)游动孢子:形成于游动孢子囊内。游动孢子囊由菌丝或孢囊梗顶端膨大而成。游动孢子无细胞壁,具1-2根鞭毛,释放后能在水中游动。
(2)孢囊孢子:形成于孢囊孢子囊内。孢子囊由孢囊梗的顶端膨大而成。孢囊孢子有细胞壁,水生型有鞭毛,释放后可随风飞散。
(3)分生孢子(conidium)产生于由菌丝分化而形成的分生孢子梗(conidiophore)上,顶生、侧生或串生,形状、大小多种多样,单胞或多胞,无色或有色,成熟后从孢子梗上脱落。有些真菌的分生孢子和分生孢子梗还着生在分生孢子果内。孢子果主要有两种类型,即近球形的具孔口的分生孢子器(pycnidium)和杯状或盘状的分生孢子盘(acervulus)。
✦有性繁殖
真菌生长发育到一定时期(一般到后期)就进行有性生殖。有性生殖是经过两个性细胞结合后细胞核产生减数分裂产生孢子的繁殖方式。
多数真菌由菌丝分化产生性器官即配子囊,通过雌、雄配子囊结合形成有性孢子。其整个过程可分为质配、核配和减数分裂三个阶段。
第一阶段:质配阶段
即经过两个性细胞的融合,两者的细胞质和细胞核(N)合并在同一细胞中,形成双核期(N+N)。
第二阶段:核配阶段
核配阶段,就是在融合的细胞内两个单倍体的细胞核结合成一个双倍体的核(2N)。
第三阶段:减数分裂阶段
双倍体细胞核经过两次连续的分裂,形成四个单倍体的核(N),从而回到原来的单倍体阶段。
经过有性生殖,真菌可产生四种类型的有性孢子。
(1)卵孢子(oospore):卵菌的有性孢子。是由两个异型配子囊——雄器和藏卵器接触后,雄器的细胞质和细胞核经授精管进入藏卵器,与卵球核配,最后受精的卵球发育成厚壁的、双倍体的卵孢子。
(2)接合孢子(zygospore):接合菌的有性孢子。是由两个配子囊以配子囊结合的方式融合成1个细胞,并在这个细胞中进行质配和核配后形成的厚壁孢子。
(3)子囊孢子(ascospore):子囊菌的有性孢子。通常是由两个异型配子囊——雄器和产囊体相结合,经质配、核配和减数分裂而形成的单倍体孢子。子囊孢子着生在无色透明、棒状或卵圆形的囊状结构即子囊内。
每个子囊中一般形成8个子囊孢子。子囊通常产生在具包被的子囊果内。子囊果一般有四种类型,即球状而无孔口的闭囊壳,瓶状或球状且有真正壳壁和固定孔口的子囊壳,由于座溶解而成的、无真正壳壁和固定孔口的子囊腔,以及盘状或杯状的子囊盘。
(4)担孢子(basidiospore):担子菌的有性孢子。通常是直接由“+”、“-”菌丝结合形成双核菌丝,以后双核菌丝的顶端细胞膨大成棒状的担子。在担子内的双核经过核配和减数分裂,最后在担子上产生4个外生的单倍体的担孢子。
此外,有些低等真菌如根肿菌和壶菌产生的有性孢子是一种由游动配子结合成合子,再由合子发育而成的厚壁的休眠孢子(restingspore)。
✦自我复制
病毒繁殖借助宿主细胞为其提供的原料、能量和酶等必要条件,以自我复制的方式进行增殖,利用宿主细胞的核苷酸和氨基酸来自主地合成自身的一些组件,装配下一代个体。
流感病毒自我复制过程
1.病毒体附着到宿主细胞表面并通过胞吞进入细胞;2.衣壳分解后,病毒核糖核蛋白转运入核;3a.病毒基因组转录;3b.病毒基因组复制;4.新合成的病毒mRNA出核并完成翻译;5a.合成的核蛋白入核与新复制的核酸结合;5b.合成的病毒表面蛋白进入高尔基体完成翻译后修饰并转运上膜;6.新形成的核衣壳进入细胞质并与插有病毒表面蛋白的细胞膜结合;7.新生成的病毒体通过出泡方式离开宿主细胞。
✦细菌因素
主要与病原菌的毒力和数量有关。毒力强或数量多的致病菌进入机体,引起败血症的可能性较大。
注:败血症是指各种致病菌侵入血液循环,并在血中生长繁殖,产生毒素而发生的急性全身性感染。
✦人体因素
细菌侵入人体后是否引起感染,与人的防御、免疫功能有关。
•皮肤和黏膜是抵御细菌的有效武器
完整的皮肤和粘膜是防止细菌侵入人体的天然屏障,破损后细菌易于从此处侵入体内,挤压皮肤炎症部位或脓肿时细菌侵入的可能性更大。
严重烧伤时,创面为细菌敞开门户,皮肤坏死、血浆渗出又为细菌繁殖提供了良好环境,故极易发生感染。尿路、胆道、胃肠道、呼吸道粘膜受破坏后,若同时有内容物积滞、压力增高,细菌更易进入血中。保留导尿管、静脉等血管内留置导管、人工辅助呼吸时插管等,也使细菌易于侵入。
•免疫细胞能清除细菌
人体免疫功能正常时,进入血中的细菌迅速被血中免疫细胞如单核细胞、嗜中性粒细胞等所清除,而患肝硬变、糖尿病、血液病、结缔组织病等慢性病者,可因代谢紊乱、体液免疫及细胞免疫功能减低,易导致细菌感染发生;各种免疫抑制药物的使用、放射治疗亦是导致细菌感染发病率高的原因。
注:广谱抗菌药物使用后,对药物敏感的细菌虽被抑制或杀灭,而一些耐药菌乘机繁殖,亦可酿成细菌感染。
★细菌病
由细菌引起的疾病有许多,如:伤寒和副伤寒、细菌性食物中毒、 细菌感染性腹泻、霍乱、弯曲菌感染(弯曲菌肠炎、幽门螺杆菌感染) 细菌性痢疾、鼠疫、炭疽、白喉、百日咳、猩红热、流行性脑脊髓膜炎、结核病、人感染猪链球菌病、破伤风、败血症等。
✦症状
原发炎症:各种病原菌所引起的原发炎症与其在人体的分布部位有关。原发炎症的特点是局部的红、肿、热、痛和功能障碍。
皮疹:见于部分患者,以瘀点最为多见,多分布于躯干、四肢、眼结膜、口腔粘膜等处,为数不多。
关节症状:可出现大关节红、肿、热、痛和活动受限,甚至并发关节腔积液、积脓,多见于革兰阳性球菌、脑膜炎球菌、产碱杆菌等败血症的病程中。
感染性休克:约见于1/5~1/3败血症患者,表现为烦燥不安,脉搏细速,四肢厥冷,皮肤花斑,尿量减少及血压下降等,是严重败血症所致。
除外伤性、手术后、挤压疮疖后发生的败血症有较明显的潜伏期外,大多发病急骤。
注意
由于新生儿及老年患者具有不同的生理特点,其败血症亦各有特征。
•新生儿免疫力弱,发病率高
新生儿的皮肤粘膜屏障功能、淋巴及单核吞噬细胞系统功能尚不健全,补体尚缺乏,体液免疫水平低,细胞免疫也未完善;脐带残端为细菌入侵创造了有利条件,孕母泌尿生殖道感染或全身感染等均可使新生儿败血症发病率高、表现复杂、并发症多。
•老年人发病往往比较严重
老年人败血症的发病率有增高的趋势,由于机体反应性差,早期临床表现较隐蔽,热型往往不规则;又因免疫功能低下,病情常较严重,进展迅速且不易控制;老年人脏器功能多有减退或原有慢性病,败血症极易诱发脏器功能衰竭。
故新生儿及老年败血症预后差、死亡率亦高。及时发现新生儿和老年败血症,主要依据年龄特点和提高警惕。
真菌感染性疾病根据真菌侵犯人体的部位分为4类:浅表真菌病、皮肤真菌病、皮下组织真菌病和系统性真菌病;前二者合称为浅部真菌病,后二者又称为深部真菌病。
真菌感染多为继发性感染,由机会致病性真菌引起,特别是深部真菌感染多是由于各种诱因使机体免疫功能显著下降所致。
某些真菌如白假丝酵母菌、烟曲霉中可产生高分子强毒素或低分子毒素,这些毒素也会在治病中起到一定作用。另外,真菌的黏附能力,对免疫系统功能的抑制及胞壁中的酶类也与致病性有关。
诱发因素:发烧、创伤、肿瘤、严重其他微生物感染等。
✦浅部真菌感染
主要是由于人体接触所致,如皮肤廯菌、角层癣菌等皮肤感染真菌,多具有嗜角质性,可分解细胞的角蛋白和脂质,还可通过机械刺激和代谢产物作用,引起局部病变。
✦深部真菌感染
多发生于人体抵抗力下降或菌群失调时,为继发性感染,常见菌属有白色念珠菌、新生隐球菌、肺孢子菌、曲霉及毛菌等,因患者抵抗力较差,治疗效果往往不佳。
✦系统性真菌感染
在机体抵抗力低下时致病,如患有白血病、淋巴瘤、糖尿病等疾病或有长期大量广谱抗生素、激素使用史时,许多条件致病菌、如念珠菌、曲霉、毛霉等感染后在体内发展繁殖,从而引起系统性真菌感染。
✦症状
•浅表真菌病
感染仅仅局限于皮肤角质层的最外层,极少甚至完全没有组织反应,感染毛发时也只累及毛发表面,很少损伤毛发。
主要包括:花斑癣、掌黑癣和毛结节菌病。
•皮肤真菌病
感染累及皮肤角质层和皮肤附属器,如毛发、甲板等,能广泛破坏这些组织的结构并伴有不同程度的宿主免疫反应;这类真菌感染中最常见的是皮肤癣菌病,其他真菌引起的感染还包括皮肤念珠菌病等。
皮肤癣菌病根据不同的发病部位可以分为足癣(俗称”脚气”)、手癣、体癣、股癣、甲癣以及头癣等各类癣病;在世界范围内广泛发生,是最常见的真菌性疾病,发病率高。
•皮下真菌病
感染皮肤、皮下组织,包括肌肉和结缔组织,一般不会经血液流向重要脏器播散;但有些感染可以由病灶向周围组织缓慢扩散蔓延,如足菌肿等;也有些则沿淋巴管扩散,如孢子丝菌病、着色芽生菌病。免疫受损患者的皮下真菌具有潜在的播散全身的危险。
•系统性真菌病
除侵犯皮肤和皮下组织外,还累及组织和器官,甚至引起播散性感染,又称为侵袭性真菌感染。
近年来,随着高效广谱抗生素、免疫抑制剂、抗恶性肿瘤药物的广泛应用,器官移植、导管技术以及外科其他介入性治疗的深入开展,条件致病性真菌引起的系统性真菌病日益增多,新的致病菌不断出现,病情也日趋严重。
主要包括念珠菌病、曲霉病、隐球菌病、接合菌病和马内菲青霉病等。
病毒通过多种途径侵入机体,并在易感的宿主细胞中增殖。
✦水平传播
水平传播是指病毒在人群中不同个体之间的传播,包括病毒从动物到人的传播。常见的水平传播方式有以下几种。
(1)经呼吸道传播:病毒经空气、飞沫等吸入感染,如流感病毒、风疹病毒等。
(2)经消化道传播:病毒污染了食物和水源,经口食入而感染。如甲型肝炎病毒、脊髓灰质炎病毒等。
(3)经泌尿生殖道传播:由直接性接触而感染,如人类免疫缺陷病毒、单纯疱疹病毒等。
(4)经皮肤伤口传播:经昆虫媒介的叮咬、动物咬伤或皮肤伤口直接接触病毒而感染。如流行性乙型脑炎病毒、狂犬病病毒等。
(5)经血液传播:经输血或血液制品,包括经注射、器官移植等途径引起的感染,如乙型肝炎病毒、人类免疫缺陷病毒等。
✦垂直传播
病毒经胎盘、产道、哺乳由母亲传给胎儿或新生儿的方式,称为垂直传播。可经垂直传播的病毒有风疹病毒、人类免疫缺陷病毒、乙型肝炎病毒等。
✦症状
机体感染病毒后,可表现出不同的临床类型。依据有无症状,可分为显性感染和隐性感染;依据病毒滞留时间及症状持续时间长短,又可分为急性感染和持续性感染。
•隐性感染
由于侵入机体的病毒数量较少、毒力较弱或机体的抵抗力较强,病毒在宿主细胞内增殖,但机体不出现明显的临床症状,称为隐性感染。
隐性感染可使机体获得对该病毒的特异性免疫,保护机体免受该病毒的再次感染。隐性感染虽不出现临床症状,但病毒仍在体内增殖并向外界传播病毒,成为重要的传染源。
•显性感染
由于侵入机体的病毒数量较多、毒力较强或是机体的抵抗力较弱,病毒在宿主细胞内大量增殖,出现明显的临床症状,称为显性感染。显性感染根据感染持续时间长短。分为急性感染和持续性感染。
急性感染:病毒侵入机体后,其潜伏期短、发病急、病程数日至数周,病后常可获得特异性免疫力,机体可通过自身的免疫机制把病毒完全清除出体外,如甲型肝炎病毒。
持续性感染:病毒侵入机体后,在体内持续存在数月、数年,甚至数十年,机体可出现临床症状,也可不出现临床症状而长期带有病毒,成为重要的传染源。持续感染按病程、致病机制的不同,可分为三种。
①慢性感染:病毒侵入机体后,长期存在于血液或组织中,机体可出现症状,也可不出现症状。在整个病程病毒均可被查出,如乙型肝炎病毒引起的慢性肝炎。
②潜伏感染:原发感染后,病毒基因潜伏在机体一定的组织或细胞中,但不复制增殖出具有感染性的病毒,此时机体既没有临床症状,也不会向体外排出病毒。在某些条件下病毒可被激活而急性发作,并可检测出病毒,如单纯疱疹病毒。
③慢发病毒感染:经显性或隐性感染后,病毒长时间潜伏在机体内,潜伏期可长达数月至数年,此时机体一般无症状,一般也检测不出病毒。一旦发病,则呈亚急性进行性加重直至死亡,如人类免疫缺陷病毒的感染。
抗细菌感染的免疫是指机体抵御细菌感染的能力,是由机体的非特异性免疫和特异性免疫共同协调来完成的。
先天具有的非特异性免疫包括机体的屏障结构,吞噬细胞的吞噬功能和正常组织及体液中的抗菌物质;后天获得的特异性免疫包括以抗体作用为中心的体液免疫和致敏淋巴细胞及其产生的淋巴因子为中心的细胞免疫。
病原菌侵入机体后,由于其生物学特性的不同,致病物质的不同。机体对它们的免疫反应也各有差别。
✦宿主体表的防御功能
(一)机械的阻挡和排除作用
健康和完整的皮肤与粘膜能有效地阻挡细菌的侵入。
呼吸道粘膜上皮细胞的纤毛向上颤动,可将细菌咳出或咽下;随粪便每日约排菌1012个;小便可清除尿道上皮的细菌。
(二)分泌液中化学物质的局部抗菌作用
汗腺分泌的乳酸,皮脂腺分泌的脂肪酸均有一定的抗菌作用。
胃酸能杀死寒杆菌、痢疾杆菌和霍乱弧菌。阴道分泌物中的酸类亦有抗菌作用。前列腺分泌的精素是正常精液中存在的对革兰氏阳性细菌有效的抑制物。泪液、唾液、乳汗和呼吸道分泌物中广泛分布的溶菌酶能溶解革兰氏阳性细菌。
(三)正常菌群的拮抗作用
人体表以及与外界相通腔道中的正常菌群,可以通过它们的代谢产物对抗病原菌入侵。
例如皮肤上的痤疮丙酸菌(Propionibacterium acnes)能产生抗菌性脂类、抑制金黄色葡萄球菌和化脓性链球菌在皮肤上生长;肠道中的某些厌氧菌能产生脂肪酸阻止沙门氏菌在局部生存;肠道中大肠杆菌产生的大肠菌毒和酸性产物能抑制痢疾杆菌、金黄色葡萄球菌;咽部的草绿色链球菌(Viridans Streptococci)似能阻止肺炎球菌在局部生长;鼻腔的表皮葡萄球菌和类白喉杆菌能妨碍金黄色葡萄球菌定居等。当这种拮抗作用受影响时,则可发生菌群失调症。
✦机体抗毒性免疫
抗毒性免疫是一种以体液抗体为主的免疫应答。许多以外毒素致病的病原菌造成的感染,如白喉、破伤风、气性坏疽及内毒中毒等,机体的免疫应答,主要表现为抗毒素(lgG)中和毒素的作用。
由抗毒素与外毒素特异结合形成的复合物,可被吞噬细胞吞噬,并将其降解消除。抗毒素与毒素结合,可以通过空间阻碍使毒素不能吸附到敏感的宿主细胞(受体)上,或者使毒素生物学活性部位(酶)被封闭,从而使毒素不能发生毒性作用。
注意:抗毒素不能对已与组织结合的毒素起中和作用。
// 建议
根据外毒素的免疫特点,可应用类毒素进行预防接种,应用抗毒素血清进行早期治疗与紧急预防,使用时要保证“早期足量”。
✦机体的抗菌性免疫
病原侵入机体后,由于其生物学特征的不同,可分为胞外菌感染和胞内菌感染两类,机体对这两类感染的免疫反应是有差别的。
(一)胞外寄生菌的抗感染免疫
1.抗体对细菌繁殖的抑制作用:抗体与细菌结合,可以出现凝集和鞭毛制动现象,但一般而言,对细菌的活力只有微弱的影响,甚至没有影响。如果抗体的结合能抑制细菌的重要酶系统或代谢途径,则可能抑制细菌的生长。
例如,某些细菌(例如败血巴氏杆菌)从血清转铁蛋白摄取铁的能力可被特异性抗体封闭,从而导致细菌生长受抑制。
2.抗体对细菌吸附作用的抑制:病原菌吸附到粘膜上皮细胞是造成感染的先决条件。粘膜表面的抗体,在防止病原菌对粘膜的侵犯中具有更重要的作用。
在粘膜表面起这种作用的抗体主要是SlgA它是局部免疫的主要因素。SlgA抗细菌感染可有以下几种方式:在补体和溶菌酶的参与下溶解某些细菌;在肠道局部增强吞噬作用;防止细菌对粘膜上皮细胞的吸附。
例如SlgA能阻止链球菌、致病性大肠杆菌、霍乱弧菌、淋球菌、百日咳杆菌等对粘膜表面的吸附。
3.抗体和补体对细菌的溶解作用:在许多感染中,机体能产生相应抗体(lgG、lgM、lgA),当细菌表面抗原和lgG、lgM结合的免疫复合物一旦通过经典途径使补体活化或由分泌型 lgA或聚合的血清lgA通过替代途径活化补体,即可引起细胞膜的损伤,最终发生溶菌。
实验证明补体的溶菌作用仅对革兰氏阴性菌,其中包括霍乱弧菌、大肠杆菌、痢疾杆菌、伤寒杆菌等发挥作用。但这种作用往往并不彻底,仅使杆菌菌体膨大或变为球形,不引起溶解。但若于试验中系统中加入适量的溶菌酶,则可出现溶菌现象。
4.抗体和补体对吞噬作用的调理:抗体和补体单独能适当的靶细胞起调理吞噬作用,若两者联合作用效应更加强大。中性粒细胞和单核吞噬细胞表面具有lgG的Fc受体。当lgG通过其特异性抗原结合部位(Fab)与细菌表面相应抗原结合后,其Fc段可与吞噬细胞表面相应Fc受体结合,即可在细菌与吞噬细胞间形成抗体“桥梁”,这不仅能促进吞噬细胞对细菌的吞噬,而且有助于强化细胞内的杀菌作用。
注:中性粒细胞和单核细胞表面还有C3b 受体。因此,细菌与所有能结合补体的抗体(lgg 、lgM )形成的复合物,均可激活补体形成活化产物C3B,从而发挥调理吞噬作用。尤以lgM 的作用更强,此作用在感染的早期特别重要,因为此时lgM抗体占优势。
(二)胞内寄生菌的细胞免疫
凡侵入人体后大部分时间停留在宿主细胞内并繁殖的病原菌称胞内寄生菌。例如结核杆菌、麻风杆菌、布氏杆菌等均属此类。
由于抗体不能进入细胞内,所以体液免疫对这类细菌感染的作用受到限制,对胞内感染的防御功能主要靠细胞免疫。例如机体初次感染结核杆菌,由于细胞免疫尚未建立,吞噬细胞虽可将它们吞噬,但不能有效地消化杀灭,因此病原菌容易随吞噬细胞在体内扩散,蔓延,而造成全身感染。
但在传染过程中,机体在病原菌的刺激下逐渐形成细胞免疫,通过致敏淋巴细胞释放的各种淋巴因子,激活吞噬细胞,可增强其吞噬消化能力,抑制病原菌在吞噬细胞内生存,从而获得防御同种病种原菌再感染的免疫力。
✦非特异性免疫
人类对真菌感染有天然免疫力。包括皮肤分泌短链脂肪酸和乳酸的抗真菌作用,血液中转铁蛋白扩散至皮肤角质层的抑真菌作用;中性粒细胞和单核巨噬细胞的吞噬作用,以及正常菌群的拮抗作用。
注意:许多真菌病受生理状态影响,如婴儿对念珠菌病易感,学龄前儿童易患头癣。
✦特异性免疫
•细胞免疫排菌杀菌
真菌感染中细胞免疫是机体排菌杀菌及复原的关键,T细胞分泌的淋巴因子对加速表皮角化和皮屑形成,随皮屑脱落,将真菌排除;以T细胞为主导的迟发型变态反应引起免疫病理损伤能局限和消灭真菌,以终止感染。
一般反应强度与体内菌量呈反比,如阴性则菌量增加,病情严重,而经治疗又转阳性,说明治疗见效,预后良好。
•体液免疫具有保护作用
体液免疫对部分真菌感染有一定保护作用,如特异性抗体可阻止真菌转为菌丝相以提高吞噬细胞的吞噬率;抗白色念珠菌抗体与菌表面甘露醇蛋白质复合物结合,阻止本菌粘附宿主细胞;全身性白色念珠菌感染,尽管其迟发型变态反应阳性,或通过被动转移致敏淋巴细胞,还必须同时输入特异抗体才起保护作用。
注意:而DTH反应阴性者即使有抗体,不能引起保护作用,表明抗体须在具有良好的细胞免疫基础的机体内才发生保护作用。
DTH指的是迟发型超敏反应,主要是T细胞与相应抗原作用后,引起单个核细胞浸润以及组织细胞损伤为主的炎症反应。
✦先天性免疫
人体抵御病毒的第一道防线是先天性免疫系统。这一免疫系统由能够抵御非特异性病毒感染的细胞和其他机制组成,即以一种通用方式来对入侵的病原体做出识别和反应,但不同于获得性免疫系统,这一免疫系统并不产生持久的或保护性的免疫。
RNA干扰是对抗病毒的一种重要的先天性防御机制。
✦体液免疫
当人体的获得性免疫系统探测到病毒时,会产生特异性的抗体来与病毒结合并使其失去感染性,这种作用被称为体液免疫。
其中,有两类抗体非常重要。第一类被称为IgM(免疫球蛋白M),它能高效地使病毒去活,但免疫系统的细胞产生IgM的时间只有几个星期。第二类被称为IgG(免疫球蛋白G),它能够被免疫系统不停地制造出来。
IgM存在于宿主的血液中是用于急性感染的情况,而IgG的存在则表明过去曾经受到某种感染(用于防御以后的同类感染)。进行免疫性测试时,通常是对体内的IgG型抗体进行测量。
✦细胞免疫
人体对抗病毒的另一道防线是细胞免疫,包括了被称为T细胞的免疫细胞。人体中的细胞不断地将其内部蛋白质的片断展示在细胞表面(抗原呈递)供T细胞来进行检查,一旦T细胞识别出可能的病毒片断,那么对应的细胞就会被病毒特异性T细胞扩增所消灭。
诸如巨噬细胞在内的一些细胞专门负责抗原呈递。制造干扰素是一种重要的宿主防御机制。干扰素是病毒感染之后由机体所产生的一种激素,它在免疫中的作用较为复杂,可以确定的是它能够通过杀死受感染细胞及其邻近细胞来逐步阻止病毒的复制。
注:并非所有的病毒感染都会引起保护性免疫反应。例如,艾滋病毒可以通过不断地变换其病毒体表面蛋白的氨基酸序列来逃避免疫系统的打击。这些顽固的病毒采用多种方式来逃脱免疫系统的控制,如隔离、阻断抗原呈递、产生细胞因子抗性、逃避自然杀伤细胞的作用、逃脱细胞凋亡以及抗原转移。其他一些病毒,如向神经病毒,可以通过神经来传播,而在神经系统中免疫系统可能无法接触到它们。
✦预防
细菌感染的预防需要重点关注防止感染,对于具有传播性质的疾病,应从传染源、传播途径和易感人群三个基本环节中进行防控。
1、注意卫生:日常生活中注意饮食卫生,家庭居所最好日常进行消毒、灭菌,防止带入外界环境的致病菌。
2、接种疫苗:接种疫苗后可使机体产生免疫应答,产生特异性抗体,使机体获得针对病原疫苗的免疫力,应及时接种相关疫苗提高自身抗细菌感染能力。
3、体育锻炼:适当从事体育锻炼可以提高免疫力,可根据自身情况选择打太极拳、健身、跑步、郊游等,劳逸结合。
4、远离传染源:有传染性疾病的人群应做好隔离措施,其他人群也应做好防护措施,避免与其接触,避免到细菌感染流行病区。
小结
经常保持皮肤和粘膜的清洁和完整,避免创伤,控制慢性病,合理使用免疫抑制剂和抗生素类药物,烧伤病房应严格消毒等措施,均可预防细菌感染。
一切明显的或隐匿的化脓性病灶如能及早予以清除,感染的发生就可以减少。小儿时常见的传染病如麻疹、流行性感冒、百日咳等每易继发较重的呼吸道细菌感染,从而发生细菌感染。对这类病儿,必须加强保护。对不论多么细小的皮肤创伤必须予以重视,早作适当处理。
✦治疗
一般治疗:卧床休息,加强营养,补充适量维生素。维持水、电解质及酸碱平衡。必要时给予输血、血浆、白蛋白和丙种球蛋白。高热时可给予物理降温,烦躁者给予镇静剂等。
病原治疗:及时选用适当的抗菌药物是治疗的关键。应注意早期、足量并以杀菌剂为主;一般两种抗菌药物联合应用,多自静脉给药;首次剂量宜偏大,注意药物的半衰期,分次给药;疗程不宜过短,一般三周以上,或热退后7~10天方可酌情停药。
局部病灶的处理:化脓性病灶不论原发性或迁徙性,均应在使用适当、足量抗生素的基础上及时行穿刺或切开引流。化脓性胸膜炎、关节脓肿等可在穿刺引流后局部注入抗菌药物。胆道及泌尿道感染有梗阻时应考虑手术治疗。
建议
关键在于及时选用适当的抗菌药物,并予以休息及适量的营养。诊断基本肯定后应尽早治疗,在培养未获阳性结果前可根据细菌入侵途径及临床表现推测致病菌的种类给药,若获阳性培养而治疗效果欠佳时,则可按药物敏感试验选用适宜抗菌药物。
革兰氏阳性球菌感染者可选用青霉素、红霉素、头孢菌素等;革兰氏阴性杆菌感染则选用庆大霉素、丁胺卡那霉素、头孢菌素及半合成广谱青霉素;厌氧菌感染则首选甲硝唑,也可选用青霉素、氯霉素、氯洁霉素等;败血症确为真菌所致则应选用二性霉素。
此外,正确处理局部病灶及各阶段的突出矛盾(如感染性休克、弥漫性血管内凝血、心肾功能不全)亦很重要。
✦预防
1.保持皮肤干燥和清洁。
2.穿着宽松的衣服。
3.避免共用发刷,梳子和毛巾,因为它们可能含有与皮肤真菌菌落片段。
4.为避免脚气,应该使用备用鞋,每2、3天换洗。
5.尽量选择天然纤维制品的衣服,如棉花、蚕丝,使皮肤呼吸。
6.糖尿病患者应控制血糖水平。疾病有可能会导致免疫功能低下,增加了真菌感染的概率。
✦治疗
•大多真菌感染症状较轻微
除头癣和甲癣外,大多数真菌感染症状都较轻微,常用抗真菌霜剂治疗。一般不用抗真菌粉剂。抗真菌药物的活性成分有咪康唑、克霉唑、益康唑和酮康唑等。
一般霜剂每天涂敷两次,治疗持续到皮损消退后7~10天。如果霜剂停用太快,感染并未消除,皮疹又会复发。
抗真菌霜剂要在使用几天后才显效,其间可用皮质类固醇霜剂缓解瘙痒和疼痛。严重的或顽固性感染,可用灰黄霉素治疗几个月,有时同时用抗真菌霜剂。
•部分口服药物会引起副作用
口服灰黄霉素很有效,但可引起副作用,如头痛、胃肠道功能紊乱、光敏、水肿和白细胞减少等。停用灰黄霉素后,感染可能复发。皮肤真菌感染也可用酮康唑治疗。与灰黄霉素一样,口服酮康唑也有严重的副作用,包括肝脏损害。
保持感染部位清洁、干燥有助于抑制真菌繁殖,促进皮肤愈合。感染处应经常用肥皂和水清洗,擦干后扑撒滑石粉。避免使用含玉米粉的粉剂,因为它容易促进真菌生长。
注意
如果真菌感染有渗液,可能并发了细菌感染。需要用抗生素治疗。涂敷抗生素霜剂或口服抗生素。稀释醋酸铝溶液或怀特菲尔德软膏也可用来使渗液的皮肤干燥。
由于病毒使用了宿主细胞来进行复制并且寄居其内,因此很难用不破坏细胞的方法来杀灭病毒。现在最积极的对付病毒疾病的方法是疫苗接种来预防病毒感染或者使用抗病毒药物来降低病毒的活性以达到治疗的目的。
部分病毒感染以对症支持治疗为主,如普通感冒,甲型肝炎、病毒性胃肠炎等,可通过补液维持体内水分、电解质和酸碱平衡。
✦疫苗接种预防感染
疫苗接种是一种廉价而又有效的防止病毒感染的方法。早在病毒被发现之前,疫苗就已经为人们用于预防病毒感染。随着疫苗接种的普及,病毒感染相关的一些疾病(如小儿麻痹、痳疹、腮腺炎和风疹)的发病率和死亡率都大幅度下降,而曾经是致命疾病的天花已经绝迹。
目前各类疫苗可以预防超过30种对人体的病毒感染,而有更多的疫苗被用于防止动物受到的病毒感染。
疫苗的成分可以是活性降低或死亡的病毒,也可以是病毒蛋白质(抗原)。活疫苗包含了活性减弱的可致病的病毒,这样的病毒被称为“减毒”病毒。
注意
虽然活性减弱,但活疫苗对于那些免疫力较弱或免疫缺陷的人可能是危险的,对他们注射活疫苗可能反而会导致疾病。
生物技术和基因工程被用于改造病毒疫苗,改造后的疫苗(即亚单位疫苗)只含有病毒的衣壳蛋白,如乙肝疫苗。由于不含有病毒核酸,因此亚单位疫苗对于免疫缺陷的病人是安全的。
对于活疫苗的安全性也有一些例外,如黄热病毒疫苗,虽然是一种减毒病毒株(被称为17D),却可能是目前所有疫苗中最安全和最有效的。
✦治疗
•抗病毒药物
在过去的二十年间,抗病毒药物的发展非常迅速。艾滋病的不断蔓延推动了对抗病毒药物的需求。抗病毒药物常是核苷类似物,当病毒复制时如果将这些类似物当作核苷用于合成其基因组就会产生没有活性的病毒基因组(因为这些类似物缺少与磷相连能够相互连接形成DNA“骨架”的羟基,会造成DNA的链终止),从而抑制病毒的增殖。
核苷类似物作为抗病毒药物的例子包括阿昔洛韦,可用于抑制单纯疱疹病毒感染,和拉米夫定,可用于治疗艾滋病和乙型肝炎。阿昔洛韦是最早出现也是最经常被指定使用的抗病毒药物。其他使用中的抗病毒药物是针对病毒生活周期的不同阶段。艾滋病毒需要依赖一种被称为HIV-1蛋白酶的作用来获得完整的感染能力;而通过使用大量的蛋白酶抑制剂类的药物可以使这种酶失活。
•“吃病毒”生物
近日,美国的研究人员称,他所在的研究团队于近日首次发现了有生物会把“病毒”作为“食物”。他们研究后发现,两种浮游生物——“Halteria”和“Paramecium”可以主动食用病毒并茁壮成长。
研究发现,“Halteria”在两天内就有明显成长的迹象,纤毛的种群在两天内增长了约15倍,而氯病毒含量则下降了100倍以上。而在没有氯病毒的对照样本中,“Halteria”与初始状态相差无几。“Paramecium”也有类似表现,同样把氯病毒作为营养来源。并且,标记在氯病毒DNA的荧光绿移动痕迹证实病毒被“吃掉”了。
从科学上讲,这是人类第一次改变看待病毒的方式:病毒不仅是导致机体发生病变的“病原体”,还可以是自然界食物链中的一环。这可能对未来治疗病毒相关疾病具有重要作用。
细菌、真菌、病毒等生物共同构成了我们生活的世界。它们基本上无处不在,也时刻影响着我们的生命活动。而人体内的肠道菌群是其中数量最庞大的一类,其对人们的影响巨大。
微生物检测技术可以较为清晰地发现生活中的一些细菌和其他微生物,有助于我们判断健康状况,并根据此来做出一些调整。
随着测序技术和其他体外诊断技术的快速发展,新标志物的发现等新技术的发展将能更快更精准的区分和诊断感染病原,甚至大大提高用药的针对性和减少无效用药和耐药性,将有利于人类和微生物更好的共存。
主要参考文献:
Kwiecinski JM, Horswill AR. Staphylococcus aureus bloodstream infections: pathogenesis and regulatory mechanisms. Curr Opin Microbiol. 2020 Feb;53:51-60. doi: 10.1016/j.mib.2020.02.005. Epub 2020 Mar 12. PMID: 32172183; PMCID: PMC7244392.
Fisher CR, Streicker DG, Schnell MJ. The spread and evolution of rabies virus: conquering new frontiers. Nat Rev Microbiol. 2018 Apr;16(4):241-255. doi: 10.1038/nrmicro.2018.11. Epub 2018 Feb 26. PMID: 29479072; PMCID: PMC6899062.
Riley LW. Distinguishing Pathovars from Nonpathovars: Escherichia coli. Microbiol Spectr. 2020 Dec;8(4). doi: 10.1128/microbiolspec.AME-0014-2020. PMID: 33385193.
Cheung GYC, Bae JS, Otto M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 2021 Dec;12(1):547-569. doi:
10.1080/21505594.2021.1878688. PMID: 33522395; PMCID: PMC7872022.
Liu N, Pang X, Zhang H, Ji P. The cGAS-STING Pathway in Bacterial Infection and Bacterial Immunity. Front Immunol. 2022 Jan 13;12:814709. doi: 10.3389/fimmu.2021.814709. PMID: 35095914; PMCID: PMC8793285.
Klein EY, Monteforte B, Gupta A, Jiang W, May L, Hsieh YH, Dugas A. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. Influenza Other Respir Viruses. 2016 Sep;10(5):394-403. doi: 10.1111/irv.12398. Epub 2016 Jun 24. PMID: 27232677; PMCID: PMC4947938.
Piepenbring M, Maciá-Vicente JG, Codjia JEI, Glatthorn C, Kirk P, Meswaet Y, Minter D, Olou BA, Reschke K, Schmidt M, Yorou NS. Mapping mycological ignorance – checklists and diversity patterns of fungi known for West Africa. IMA Fungus. 2020 Jul 7;11:13. doi: 10.1186/s43008-020-00034-y. PMID: 32699745; PMCID: PMC7341642.
Wu HY, Chang PH, Huang YS, Tsai CS, Chen KY, Lin IF, Hsih WH, Tsai WL, Chen JA, Yang TL, Lee CY, Ho TS, Wang HW, Huang SF, Wu AY, Chen HJ, Chen YC, Chen WC, Tseng CH, Lin PC, Yang CH, Hong PL, Lee SS, Chen YS, Liu YC, Wang FD; Infectious Disease Society of Taiwan; Medical Foundation in Memory of Dr. Deh-Lin Cheng; Foundation of Professor Wei-Chuan Hsieh for Infectious Diseases Research and Education; CY Lee’s Research Foundation for Pediatric Infectious Diseases and Vaccines,; 7th Guidelines Recommendations for Evidence-based Antimicrobial agents use in Taiwan (GREAT) working group; Members of the expert panel and board members of the IDST are listed in alphabetical order. Recommendations and guidelines for the diagnosis and management of Coronavirus Disease-19 (COVID-19) associated bacterial and fungal infections in Taiwan. J Microbiol Immunol Infect. 2022 Dec 21:S1684-1182(22)00284-5. doi: 10.1016/j.jmii.2022.12.003. Epub ahead of print. PMID: 36586743; PMCID: PMC9767873.
Dickson RP, Singer BH, Newstead MW, Falkowski NR, Erb-Downward JR, Standiford TJ, Huffnagle GB. Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol. 2016 Jul 18;1(10):16113. doi: 10.1038/nmicrobiol.2016.113. PMID: 27670109; PMCID: PMC5076472.
de Wilde AH, Snijder EJ, Kikkert M, van Hemert MJ. Host Factors in Coronavirus Replication. Curr Top Microbiol Immunol. 2018;419:1-42. doi: 10.1007/82_2017_25. PMID: 28643204; PMCID: PMC7119980.
谷禾健康
健康是人生命活动的根本,而肠道健康更是其中的重要部分。随着现代生活方式改变,炎症性肠病发病率增加。
炎症性肠病是一种严重影响患者生活质量的疾病。在全球范围内影响数百万人,发病率高,给卫生保健系统带来了沉重负担。
●炎症性肠病的病因
炎症性肠病的病因尚不明确,可能与肠道免疫反应异常有关。但与其他炎症性疾病一样,炎症性肠病的病因是多因素的,涉及遗传和环境因素的参与。这些病因大多影响肠道菌群组成,说明微生物群在炎症性肠病发展中发挥重要作用。
肠道微生物群在维持宿主生理和免疫稳态方面发挥着关键作用。维持健康的肠道菌群对免疫平衡至关重要,多项研究证明,肠道菌群失调(菌群组成改变)与炎症性肠病有关。
●炎症性肠病引起的其他疾病
慢性结肠炎不及时治疗有可能引起肠穿孔、肠狭窄、大量便血、中毒性肠扩张甚至结肠癌等疾病,不过结肠癌的可能性是比较小的。
慢性结肠炎引起的并发症也是比较多的,有可能引起关节炎、肝功能障碍、皮肤病变等一系列并发症。
近年来,在健康和疾病中肠道微生物组成,以及通过使用益生菌调节肠道微生物群方面取得了实质性进展。通过益生菌或粪菌移植调节肠道菌群后,患者的炎症性肠病缓解,为肠道炎症疾病的治疗开辟了新的前景。
了解并关注肠道健康非常重要。本文带大家了解慢性肠道炎症的病因和机制,重点关注肠道失调在这一复杂疾病的免疫病理学中的作用。
同时还介绍了目前可用的肠道菌群导向治疗炎症性肠病的方法,并讨论了其对炎症性肠病长期缓解的作用。希望大家拥有更健康的肠道。
本文主要从以下几个方面讲述
●炎症性肠病的症状和病因
●炎症性肠病中的免疫
●炎症性肠病患者体内的菌群
●肠道微生物群失调与免疫失调
●慢性肠道炎症的治疗
炎症性肠病是肠道的一种慢性炎症状态,也可能影响其他器官,如果不治疗,会导致高发病率和死亡率。炎症性肠病可通过不同的临床表现发生,其主要亚型为克罗恩病和溃疡性结肠炎。
✦临床症状
克罗恩病和溃疡性结肠炎表现出明显的临床特征。
克罗恩病
在克罗恩病中,炎症病变是跨壁的(可能涉及肠壁的所有层),也不连续,正常的肠区与受影响的肠区交替出现。
虽然在大多数克罗恩病例中,病变发生在回肠或结肠的第一部分,但也可能位于胃肠道的其他区域(从口腔到肛门)。
溃疡性结肠炎
溃疡性结肠炎的炎症病变是连续的,通常累及直肠和近端结肠。与克罗恩病相反,溃疡性结肠炎只影响肠道上皮层。
两种炎症性肠病症状相似,包括腹泻、腹痛和直肠出血,通常伴有体重减轻、疲劳和发烧。
然而,在克罗恩病中,肉芽肿更常见于炎症区域,也可能出现脓肿,阻塞肠道狭窄和不同肠道区域之间以及皮肤和其他器官之间的瘘管(炎症连接)。
溃疡性结肠炎患者通常在诊断时表现为中度症状,但炎症病变的范围与疾病严重程度相关,而胰腺炎与更严重的疾病相关。
•肠道外的一些表现症状
肠外表现在克罗恩病和溃疡性结肠炎中都很常见,25%–40%的炎症性肠病患者都有肠外表现。
虽然这些表现可能出现在几乎所有的器官和系统中,但主要影响眼睛、皮肤、肝脏和关节。肺、胰腺和血管系统不太常见。
一些肠外表现与疾病活动有关,并通过治疗得到改善,如少关节炎和口腔溃疡。其他则是非依赖治疗的,如葡萄膜炎和强直性脊柱炎。
✦治疗方法
大多数溃疡性结肠炎患者只需要医疗,其中20%-30%需要手术治疗。克罗恩病通常是进行性的,约50%的患者在确诊后10年内需要手术治疗。
克罗恩病患者的死亡率是健康人群的1.3-1.5倍,不受影响区域的影响,主要由结直肠癌、低血容量、营养不良、贫血引起。
由于目前尚无完全治愈方法,炎症性肠病的治疗旨在改善症状和缓解疾病。
不同疾病类型和严重程度抗炎药的使用
溃疡性结肠炎的治疗
在活动期溃疡性结肠炎中,首先口服类固醇,然后是氨基水杨酸盐(ASA)。对于左侧结肠炎,通常使用外用制剂(栓剂或灌肠剂),而对于横向和上行结肠炎,口服制剂有时结合外用给药是有效的。
对于这种治疗无效的溃疡性结肠炎患者,考虑使用单克隆抗体,通常是英夫利西单抗(IFX)阻断炎症细胞因子肿瘤坏死因子α。为了保持病情缓解,ASA是首选药物。然而,对于ASA不能维持缓解的患者,也可以使用硫唑嘌呤(AZA)或IFX。
克罗恩病的治疗
对活动性克罗恩病的治疗可能遵循“自上而下”或“加速”策略。在自上而下的治疗中,治疗从高剂量免疫调节剂或生物制剂开始,剂量随症状改善而调整。
在强化治疗中,先用低剂量的低效药物,如果无效,则调整治疗以达到缓解,方法是使用未定义的更有效药物。
类固醇、氨基水杨酸盐和抗生素可以联合使用以达到缓解。如果出现肠梗阻、脓肿或瘘管等并发症,也可进行手术。
硫唑嘌呤通常用于维持治疗,有时与甲氨蝶呤联合使用。对这些方案无效的克罗恩病患者,需要进行生物治疗,单独使用英夫利西单抗或与之前的药物联合使用。
炎症性肠病被描述为一种多因素疾病,可能是由遗传物质和环境特征等不同易感因素造成的,这些因素反过来可能影响基因调控的表观遗传机制。
炎症性肠病的病因
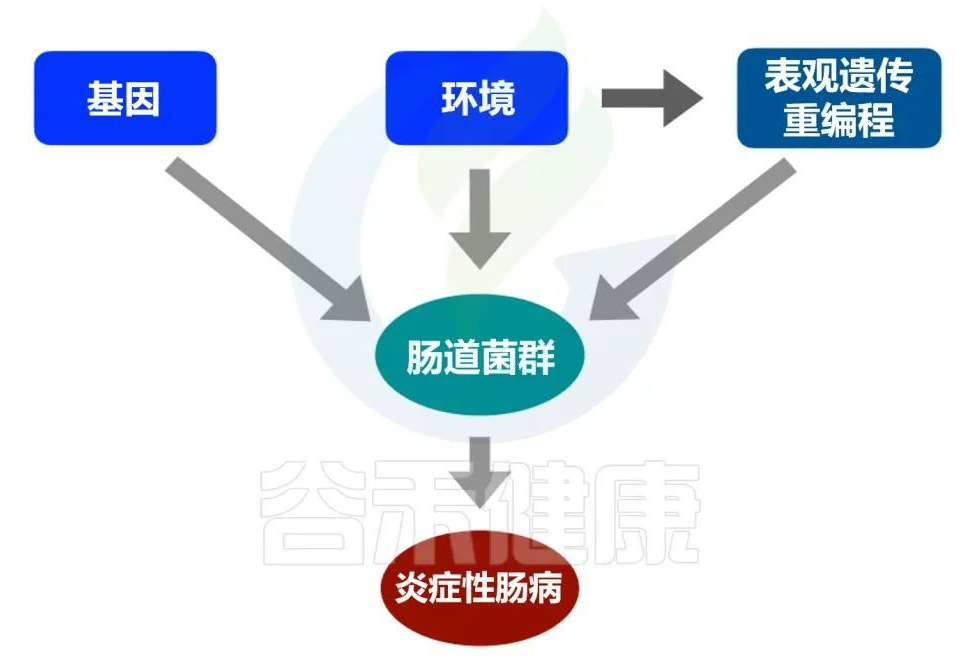
编辑
Amelia S,et al.Elsevier.2022
基因和环境(在表观遗传调控的参与下)都可能影响微生物群的组成,进而可能触发炎症性肠病。
✦遗传因素影响炎症性肠病
遗传因素对炎症性肠病的重要性早已被提出。事实上,多达12%的患者有炎症性肠病家族史。在亲属中,炎症性肠病患病率明显高于普通人群,在兄弟姐妹中发现克罗恩病的易感性风险最高(30%-35%)。
注:全基因组关联研究有助于剖析炎症性肠病的遗传背景,迄今已确定240多个易感位点。克罗恩病和溃疡性结肠炎以及其他炎症性疾病共享大多数基因座。然而,除了非常早发病的炎症性肠病外,这些易感基因座仅占炎症性肠病估计遗传风险的一小部分(约20%)。
许多风险相关基因座参与了早期免疫应答期间宿主和微生物之间的相互作用,表明宿主-微生物相互作用和先天免疫在炎症性肠病的发展中起着核心作用。
影响炎症性肠病的基因
1996年确定的第一个与炎症性肠病(IBD)相关的遗传位点被指定为IBD-1。后来,在IBD-1位点发现了一个基因,该基因参与细胞内对细菌细胞壁成分胞壁二肽的传感。该基因被命名为“核苷酸结合寡聚化域-2”或“半胱氨酸天冬氨酸蛋白酶募集域15”(NOD-2/CARD-15)。
在NOD-2基因中发现了三种易感变异体,它们都导致核因子kB(NF-kB)激活功能丧失,这是一种参与促炎细胞因子表达的转录因子,对细胞内细菌的免疫发展很重要。尽管迄今为止,NOD-2风险变体在高加索人群中与回肠克罗恩病的相关性最强,但只有少数回肠疾病患者具有风险变体,而亚洲克罗恩病患者几乎没有这些变体。
影响先天免疫应答的其他遗传风险变体的例子包括ATG16L1(“自噬相关16样-1”)、LRRK2(“富含亮氨酸重复激酶-2”)和IRGM(“免疫相关GTPase M00”)基因,这些基因在自噬中起作用。
✦表观遗传(性状)与炎症性肠病有关
基因表达的表观遗传修饰也与炎症性肠病有关。影响基因表达的三个主要表观遗传过程是DNA甲基化、组蛋白修饰和非编码RNA。
DNA甲基化是指在胞嘧啶核苷酸中添加甲基(主要是CpG基序)。
其中,DNA甲基化和非编码RNA的作用在炎症性肠病中得到了最广泛的研究。这个过程影响基因的转录活性和表达水平。与健康对照受试者相比,炎症性肠病患者的基因甲基化程度增加。微RNA(miRNA)在转录和转录后水平介导RNA沉默和基因表达。
这些过程可能会干扰T细胞分化、Th17信号传导和自噬。与健康对照组相比,炎症性肠病患者以及活动性与非活动性疾病患者的miRNAs表达不同。
注意:在其他炎症性疾病中,如系统性红斑狼疮和类风湿性关节炎中发现了一些重叠的miRNA特征。环境因素强烈影响表观遗传调控,因此表明表观遗传是环境暴露和基因表达之间的联系。
✦环境因素
已确定炎症性肠病风险的不同环境决定因素,如吸烟、城市与农村生活、空气污染和饮食。
// 工业化与吸烟增加了风险
欧洲和北美的炎症性肠病发病率最高,但自21世纪初以来似乎趋于稳定。相反,在非洲、亚洲和南美洲的新兴工业化国家,随着这些国家进入更加西化的生活方式,炎症性肠病的发病率仍在增加。
吸烟似乎会增加炎症性肠病(尤其是克罗恩病)的风险,并与肠道通透性丧失有关。
// 饮食会影响炎症性肠病的风险
一些基于多中心欧洲前瞻性队列研究的研究试图将饮食习惯与炎症性肠病风险联系起来。
最近的一项文献荟萃分析也确定了炎症性肠病的其他环境风险因素:阑尾切除术或扁桃体切除术(CD)、软饮料消费(UC)、抗生素暴露、口服避孕药使用、维生素D缺乏和肠肝螺杆菌(enterohepatic Helicobacter)(IBD)。
// 微生物可能导致发病或炎症
环境因素也可能直接或间接影响肠道微生物群的组成。
长期以来,人们认为微生物在炎症性肠病发病中起着重要作用。并对炎症性肠病中特定致病生物的定植和肠道菌群组成进行了广泛研究。
禽分枝杆菌(Mycobacterium avium)的定植,副结核分枝杆菌(Mycobacterium tuberculosisycobactins)或带有大肠杆菌粘附侵袭性变体的副结核分枝杆菌似乎会促进易感宿主的慢性炎症,可能导致炎症性肠病的发展(尤其是克罗恩病)。
此外,肠道微生物群组成的改变(失调)可能使代谢失衡,导致炎症反应缺乏调节。
除环境因素外,宿主遗传也影响微生物群落组成。事实上,单卵双胞胎比双卵双胞胎显示出更相似的微生物群。炎症性肠病风险等位基因与肠道微生物群组成的关联研究表明,炎症性肠病的高遗传风险与罗氏菌属(Roseburia)的丰度较低相关,而肠杆菌科(Enterobacteriaceae)的丰度较高。
固有免疫是机体在种系发育和进化过程中形成的天然免疫防御功能,即出生后就已具备的非特异性防御功能,也称为非特异性免疫。
✦上皮细胞
上皮层和相关的抗菌机制对于限制肠道微生物群进入肠粘膜至关重要。当第一道防线受损时,就会发生微生物移位,并建立炎症机制。
覆盖肠上皮的粘液层在保持肠道微生物和上皮细胞之间的低接触方面起着重要作用。它由凝胶形成粘蛋白聚合而成,主要由特殊上皮细胞(即杯状细胞)分泌。
这些粘蛋白聚合物由于能够结合水而在肠腔中膨胀,形成肠粘液。小肠粘液由一层薄而不连续的粘液层组成,结肠粘液由两层密度不同的粘液组成:外层更疏松,细菌更易渗透,内层更坚固,通常无菌。
●粘蛋白缺少会增加结肠炎风险
小鼠粘蛋白2敲除被证明会发展为结肠炎并增加结直肠癌的风险。在这些小鼠中,发现许多细菌与上皮细胞直接接触。研究发现,克罗恩病患者的结肠中,黏蛋白表达减少,炎症区域MUC1表达减少,非炎症区域MUC3、MUC4和MUC5B表达降低。
黏蛋白(MUC)是一类主要由黏多糖组成的糖蛋白
最近,一项荟萃分析证实克罗恩病患者肠道中粘蛋白表达降低。黏液蛋白表达受损可能导致肠道微生物群与上皮衬里之间的接触增加,从而导致炎症。
•肠上皮细胞有助于维持稳态
肠道上皮细胞分泌抗菌肽(AMPs),在限制肠道病原体感染方面发挥重要作用,并有助于维持肠道内稳态,保持共生细菌和上皮细胞之间的低接触。
抗菌肽(AMPs)的例子包括再生蛋白、免疫球蛋白(Ig)A和防御素。在人类中,已经确定了十种防御素,分为两类:a-防御素(HD),主要由小肠的潘氏细胞、中性粒细胞和某些巨噬细胞群分泌;b-防御素(HBD),由上皮细胞分泌,以响应细胞因子或模式识别受体(PRR)的微生物识别。
克罗恩病中描述了防御素生产的失调。事实上,携带NOD2移码敏感变异体的回肠克罗恩病患者HD5和HD6的潘氏细胞表达降低。这可能导致微生物与上皮层接触增加,部分解释了克罗恩病敏感性增加的原因。相反,据报道,HBD2在结肠克罗恩病和溃疡性结肠炎的炎症区域表达增加,这可能是通过炎症刺激调节HBD2表达。
✦微生物分子的识别
通过上皮层里易位的微生物进入下层肠粘膜,被吞噬细胞(主要是单核细胞、巨噬细胞和树突状细胞)吞噬,并在吞噬小体中被进一步清除。这些细胞通过属于不同膜或细胞溶质蛋白家族的模式识别受体识别病原体相关分子模式(PAMP)。
PAMP是进化保守的微生物抗原
一旦识别,信号转导途径就会发生,导致转录因子的核移位和炎症细胞因子的产生。Toll样受体是一类广泛的模式识别受体,是肠道微生物群的关键免疫传感器,是通过PAMP识别的免疫系统的哨兵。它们在吞噬细胞的细胞质或内体膜以及肠上皮细胞和基质细胞中表达,激活后二聚并导致下游信号级联,导致NF-kB激活,推动参与树突状细胞成熟和T淋巴细胞增殖和激活的关键细胞因子的产生。
●炎症性肠病患者识别功能受到影响
炎症性肠病患者TLR信号似乎受到影响。与健康对照组相比,在活动期溃疡性结肠炎患者中,TLR2、TLR4、TLR5、TLR8和TLR9表达上调,而在静止期溃疡性结肠炎患者中,TLR5表达下调。
在结肠炎小鼠模型中,TLR2/6的抑制减缓了疾病进展,表明其与病理有关。据报道,在炎症性肠病患者的肠道中TLR6过度表达,可能会加剧T辅助因子Th1和Th17反应。
由于TLR3、TLR5和TLR7的多态性与更高的溃疡性结肠炎严重程度相关,其他TLR受体的失调似乎也会导致炎症性肠病。TLR下游信号传导导致细胞因子分泌,这可能对肠道内稳态有利或有害。
TLR诱导的细胞因子有助于肠道内稳态的例子包括IFN-a和b(后者诱导溃疡性结肠炎缓解、白细胞介素-15(通过调节性T细胞诱导控制肠道炎症和白细胞介素11(其刺激对溃疡性结肠炎有益)。
另一方面,TLR信号也可诱导促炎细胞因子,如IL-1b、IL-6、IL-8、TNF-a和IL-18(抑制杯状细胞成熟,促进溃疡性结肠炎病理。
✦炎性小体
——也称炎症小体,是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是天然免疫系统的重要组成部分。
炎症小体激活异常也与炎症性肠病的发展有关。NLRP3炎性小体是细胞质模式识别受体的NLR家族成员,是肠内稳态的重要调节器。
NLRP3可在各种细胞类型中表达,如粒细胞、抗原呈递细胞(APC)、T和B淋巴细胞,其激活可在识别外源微生物抗原或内源性危险信号时触发。一旦触发,NLRP3介导炎症小体复合体的组装。
作用机制
在这个复合物中,caspase-1被激活,将白介素1β前体和白介素18前体分别裂解为分泌的IL-1b和IL-18。激活的半胱氨酸天冬氨酸蛋白酶1与半胱氨酸蛋白酶11一起裂解胃泌素D,使其发生聚合,从而导致细胞质膜孔的形成并导致细胞溶解,这是一种称为细胞凋亡的细胞死亡过程。
细胞溶解后,细胞内成分的释放诱导炎症细胞的募集,促进炎症。炎症激活分为两个步骤:在第一启动步骤中,NF-kB被激活,导致NLRP3和白介素1β前体合成的转录诱导;由微生物或危险信号触发的第二个激活步骤导致NLRP3炎性小体复合体的组装。
●炎症小体缺乏可能导致炎症恶化
NLRP3表达和炎症小体激活对维持肠道内稳态至关重要,因为据报道,NRLP3和炎症小体表达缺陷的小鼠对右旋糖酐硫酸钠(DSS)诱导的结肠炎的敏感性增强,病情恶化,死亡率更高。
然而,炎症小体激活的持续上调也可能导致白细胞介素1β和白细胞介素-18的过度生成,以及细胞凋亡的增加,从而导致炎症性肠病中观察到的炎症恶化。
事实上,60%的克罗恩病患者检测到NLRP3炎性体激活,并与长期溃疡性结肠炎疾病相关。据报道,克罗恩病患者中白细胞介素-18分泌增加,白细胞介素1β水平升高与炎症性肠病严重程度增加相关。此外,在携带TLR2风险等位基因的炎症性肠病患者中,共生肠道微生物诱导了细胞凋亡,使病情恶化。
注意
尽管有这些发现,NLRP3炎症组在炎症性肠病发病机制中的作用仍然存在争议,因为其他小鼠和人类研究也表明过度活跃的炎症组具有保护作用。
✦自噬
自噬是一种细胞更新过程,其中起源于内质网的小泡包围老化的细胞器和蛋白质,通过溶酶体融合促进其降解。
自噬机制影响其他细胞过程,如肽分泌和细胞内病原体降解。
●自噬损伤会使炎症失控
自噬相关克罗恩病易感性等位基因的存在导致自噬损伤。患有自噬相关风险变异体的克罗恩病患者的潘氏细胞表现出颗粒异常,可能影响其抗菌肽分泌途径,导致微生物增殖增加和炎症失控。自噬缺陷的巨噬细胞和树突状细胞清除细胞内病原体的能力较低,并可能通过炎症小体激活促进炎症。
✦固有淋巴细胞
固有淋巴细胞(ILC)是指不表达任何T、B或髓细胞标记物,但同时表达白细胞介素2和白细胞介素7受体的淋巴细胞。
它们在抵御微生物病原体方面起着核心作用,并且在组织内稳态方面很重要。固有淋巴细胞作用于先天免疫和适应性免疫之间的串扰,并对多种细胞类型分泌的细胞因子作出反应。
由于固有淋巴细胞作用于第一道防线,因此它们战略性地位于外部因素和传染源暴露程度较高的位置,如肠粘膜、皮肤和肺部。
固有淋巴细胞的三个主要亚组
ILC1细胞(Th1样细胞)表达转录因子T-bet,能够分泌IFN-g和TNF-a,并对抗细胞内病原体——这一亚群还包括NK(“自然杀伤”)细胞。
ILC2(Th2样细胞)表达GATA-3(“谷氨酰胺基tRNA转氨酶结合蛋白-3”)转录因子,分泌IL-4、IL-5、IL-9和IL-13,在抵御蠕虫方面很重要,也在过敏反应中起作用。
ILC3(Th17样细胞)表达转录因子RORgt,分泌IL-17、IL-22、GM-CSF(“粒细胞-巨噬细胞集落刺激因子”)和TNF-a,对细胞外病原体侵入粘膜部位具有重要作用。
然而,这些不同的表型保留了相当大的可塑性。粘膜ILC3细胞的主要功能是维持屏障完整性。
●固有淋巴细胞对调节稳态至关重要
如上所述,肠道粘膜巨噬细胞和树突状细胞对微生物的TLR感应导致下游释放促炎细胞因子,如白细胞介素1β和白细胞介素23。黏膜ILC3细胞通过分泌IL-22、GM-CSF和IL-17对这些介质作出反应。IL-22也由Th17和Th22细胞分泌,在体内稳态控制中发挥重要作用。
事实上,IL-22作用于上皮细胞,改善屏障完整性,从而防止细菌移位。该细胞因子还促进抗菌肽(如b-防御素)的产生和分泌,影响小鼠的微生物群组成,并增加宿主对病原微生物的耐药性。
除了产生白细胞介素22,ILC3细胞还能够通过直接接触和抗原递呈调节其他免疫细胞(如CD4+T细胞)的活性,因为这些细胞表达II类主要组织相容性复合物分子(MHC-II)。
克罗恩病中描述了ILC1和ILC3的肠道过度积累,在溃疡性结肠炎中观察到固有淋巴细胞活性增加。在小鼠中,由抗原呈递细胞分泌的白细胞介素1b和白细胞介素23诱导的ILC3刺激导致肠内累积的白细胞介素17和IFN-g分泌增加。缺乏ILC3细胞的小鼠未发生右旋糖酐硫酸钠诱导的结肠
这种免疫只针对一种病原体。它是人体经后天感染(病愈或无症状的感染)或人工预防接种(菌苗、疫苗、类毒素、免疫球蛋白等)而使机体获得的抵抗感染能力。
✦作用机制
巨噬细胞和树突状细胞消化吞噬微生物的抗原,并将其与MHC1类或2类分子结合,呈现给效应T细胞。
细胞膜标记物CD11b、CD11c和CD103的表达定义了树突状细胞的独立亚群,从而影响随后的T细胞反应。
T细胞是适应性免疫反应的关键参与者,根据周围组织环境的细胞因子特征,可以分化为效应器或调节亚型。抗原呈递细胞与T细胞相互作用的性质和调节促使Th细胞分化为不同的亚群,每个亚群都发挥着特定的作用:
Th1是产生IFN-g的细胞,对细胞内细菌和某些原生动物的免疫很重要;Th2是产生IL4、Il-5和Il-13的细胞,参与对蠕虫和寄生虫的免疫;Th17是IL-17A、IL-17F、IL-21和IL-22的产生者,参与中性粒细胞反应;Th1/Th17细胞同时产生IFNg和IL-17A,具有Th1和Th17细胞的特征。
虽然暴露于肿瘤生长因子-b(TGF-b)可促进调节性T细胞分化,但Th1细胞主要由IL-12和IFN-g诱导,而IL-4在IL-6存在的情况下可促进Th2细胞和TGF-b的分化,从而促进Th17细胞的分化。
✦炎症性肠病患者适应性免疫出现异常
在克罗恩病患者中,检测到巨噬细胞产生较高的白细胞介素12,以及白细胞介素12和白细胞介素18诱导的异常Th1免疫应答。此外,在炎症性肠病患者的肠道固有层中检测到Th17和Th1细胞群的丰度增加。
•促炎细胞因子增加
体外培养的克罗恩病和溃疡性结肠炎患者的活检均分泌了相当数量的IFN-g。这种细胞因子促进肠细胞凋亡和巨噬细胞活化,增加巨噬细胞产生肿瘤坏死因子,进一步加剧炎症。
炎症性肠病患者炎症粘膜的体外培养也报告了白细胞介素17A转录水平的升高和白细胞介素17A分泌的增加。白细胞介素17A诱导中性粒细胞向炎症部位募集,并介导炎症分子的上调,如诱导型一氧化氮合酶和白细胞介素1β。此外,白细胞介素17A诱导巨噬细胞产生促炎细胞因子。
注意
患有活动性疾病的炎症性肠病患者血液中的调节性T细胞减少,而肠粘膜中的调节性T细胞增加,功能正常。然而,肠固有层T细胞在炎症性肠病中对调节性T细胞功能无反应,这可以说明Th细胞缺乏调节。
胃肠道内微生物种群的建立是一个复杂的过程,涉及微生物和宿主的相互作用,最终形成稠密和稳定的种群。
✦肠道微生物与宿主互惠互利
肠道微生物群落或肠道内的微生物群落与宿主建立了共生关系,在健康环境中互惠互利。宿主提供了一个稳定且营养丰富的栖息地,而微生物群给宿主带来了重要的益处,例如未消化的饮食成分和肠粘膜产生的内源性粘液的发酵,以及短链脂肪酸、氨基酸和维生素的产生。
此外,微生物群通过防止外来生物入侵,例如通过产生代谢物和细菌素,抵抗病原体定植,并影响肠上皮和免疫系统的发育和内稳态。
肠道微生物群的组成受宿主因素的影响,如年龄、遗传、分泌产物(如胃酸和胆汁)、蠕动和肠道转运时间。另一方面,环境因素(如饮食)在生命周期内对宿主产生影响,不断调节微生物群落。
尽管肠道中的大多数微生物都存在于肠腔内,但与粘膜相关的微生物群对宿主来说非常重要,因为它对上皮和粘膜功能的影响比肠腔细菌更大,对炎症性肠病的发病机制的影响更大。
注意:由于采样限制,大多数人体肠道微生物群研究,包括炎症性肠病患者的研究,都分析粪便样本。尽管粪便样本可能不能准确反映整个胃肠道的微生物群落组成,但大多数微生物都是通过粪便途径离开的。因此,粪便微生物群组成的变化反映了胃肠相关效应。
健康成年人大肠粘膜微生物群的组成是一致的,但与同一个人的粪便微生物群不同。因此,对炎症性肠病患者粘膜相关微生物群的研究证实,远端胃肠道不同解剖部位的微生物组成没有显著差异。另一方面,比较炎症性肠病患者粪便微生物群相关粘膜的研究报告了不同的结果。
✦炎症性肠病患者肠道菌群多样性较低
与健康对照组相比,克罗恩病和溃疡性结肠炎患者的肠道菌群多样性较低。与健康个体相比,这种变化伴随着物种丰富度的降低(一种群落中物种总数的测量方法),在克罗恩病患者中尤为明显。
对大多数炎症性肠病患者的报告了厚壁菌门(Phylum Firmicutes)、拟杆菌门(Bacteroidetes)和变形杆菌门(Proteus)内特定细菌类群的丰度变化,随着被认为具有攻击性的菌群(如变形杆菌(Proteus)、梭杆菌属(Fusobacterium)和瘤胃球菌(Ruminococcus)的扩大,同时具有保护性的菌群(例如Faecalibacterium、罗氏菌属(Roseburia) 、毛螺菌科(Lachnospiraceae)和双歧杆菌属(Bifidobacterium spp.))的减少。
在厚壁菌门和梭状芽孢杆菌类中,属于Faecalibacterium、罗氏菌属(Roseburia) 、颤螺菌属(Oscillibacter)和粪球菌属(Coprococcus)的丁酸盐产生菌在炎症性肠病患者中普遍减少。
丁酸是一种短链脂肪酸,可被肠粘膜吸收,是结肠细胞的主要能量来源,提供高达70%的需求量。此外,丁酸具有抗炎作用,并积极调节肠道内稳态。
✦梭状芽孢杆菌缺乏可能引起肠道炎症
梭状芽孢杆菌(Clostridia)类成员的缺乏可能会使某些个体易于继发肠道炎症。相比之下,炎性多糖的产生菌——瘤胃球菌(Ruminococcus)(也属于梭状芽孢杆菌类)在炎症性肠病患者中富集。
✦肠道炎症患者拟杆菌、疣微菌等丰度减少
在拟杆菌门(Bacteroidaceae)中,克罗恩病和溃疡性结肠炎患者的拟杆菌丰度低于健康人。拟杆菌在活动性克罗恩病和溃疡性结肠炎患者中的减少比缓解期更明显。
在变性菌门变形菌门(Proteobacteria)内,肠道微生物群中的γ-变形菌纲(Gammaproteobacteria)、肠杆菌科( Enterobacteriaceae )成员的富集与炎症性肠病密切相关。
另一方面,在疣微菌门(Verrucomicrobia)内,炎症性肠病患者粪便样本中的嗜黏蛋白阿克曼菌(Akkermansia muciniphila)减少。在含有人类肠道微生物群的动物模型中,嗜黏蛋白阿克曼菌的存在降低了结肠组织学损伤和促炎介质的组织mRNA表达。
尽管一些研究表明炎症性肠病患者存在肠道微生物群失衡,但与克罗恩病和溃疡性结肠炎相关的失调似乎是特定疾病。
据报道,克罗恩病、溃疡性结肠炎和非炎症性肠病患者之间存在明显的微生物特征,无论炎症性肠病患者体内粘膜相关微生物群的稳定性如何。
炎症性肠病患者的粪便和粘膜真菌群均不平衡。与健康个体类似,炎症性肠病患者的真菌群主要由担子菌门(Basidiomycota)和子囊菌门(Ascomycota)两个门以及伞菌纲(Agaricomycetes)和酵母菌纲(Saccharomyces)两个类别组成。
✦克罗恩病中念珠菌占主导地位
主要差异在于较低的分类学水平。特别是对于克罗恩病, 念珠菌(Candidaspp)的丰度普遍增加,尽管研究中的优势种有所不同。
Candida tropicalis和Candida glabrata在克罗恩病患者中占主导地位,而 Leptosphaeria减少。
与健康受试者相比,克罗恩病中炎症和非炎症粘膜中的总真菌负荷显著增加。
Filobasidium uniguttulatum和Saccharomyces cerevisiae均与克罗恩病患者的非炎症粘膜相关,而Xylariales(子囊菌门)与炎症粘膜相关。
患有炎症性肠病的儿科患者有机会帮助研究疾病发病机制的生物学成分,尤其是在诊断过程中获得的样本。
–1 炎症性肠病中微生物群总体减少
一项研究分析了最近诊断为炎症性肠病的儿科患者粘膜相关菌群的主要细菌组成,报告了一些潜在有害细菌群的优势,或有益细菌种类的减少。
肠易激综合征患儿的粘膜与更多的需氧和兼性厌氧菌相关,而克罗恩病和溃疡性结肠炎中属于正常厌氧肠道微生物群的物种或组的总体减少,尤其是普通拟杆菌。
随后,通过细菌16S rRNA基因和真菌小亚单位核糖体区域的焦测序分析了治疗初期克罗恩病儿童的粘膜。虽然与对照组相比,罗氏菌属(Roseburia) 、Eubacterium和 Subdoligranulum、梭状芽孢杆菌类成员在克罗恩病中的丰度较低,但萨特氏菌(Sutterella)的丰度明显较高。
–2 特定细菌的丰富程度与疾病状态呈正相关
大型儿科新发克罗恩病队列研究,包括代表各种疾病表型的受试者,在开始治疗之前,调查了多个胃肠道位置的粪便和粘膜相关微生物群。
微生物群分析表明,粘膜相关生物并不局限于任何肠道位置,总体微生物组成主要通过样品类型和微生物多样性与对照组进行区分。疾病表型不足以区分患者。
在炎症性克罗恩病条件下,粘膜相关微生物群与物种多样性的总体下降和几个分类群丰度的变化密切相关。
E.coli、Pasteurellaceae、Veillonella parvula、Eikenella corredens和Fusobacteriaum nucleatum中特定细菌种类的丰富程度与治疗前新诊断的克罗恩病儿童的疾病状态呈正相关,该研究支持以上菌群为炎症性肠病进展驱动因素。
与克罗恩病呈负相关的菌群常见于:
长双歧杆菌(Bifidobacterium Longum) ↓↓↓
青春双歧杆菌(Bifidobacterium adolescentis) ↓↓↓
普拉梭菌(Faecalibacterium prausnitzii) ↓↓↓
罗氏菌属(Roseburia) ↓↓↓
直肠真杆菌(Eubacterium rectale) ↓↓↓
普通拟杆菌( Bacteroides vulgatus) ↓↓↓
Bacteroides caccae ↓↓↓
巴氏杆菌科(Pasteurellaceae)和奈瑟氏菌科(Neisseriaceae)在10岁以下患者中的丰度较高,但随着年龄的增长而减少。在诊断时收集的粪便中仅微弱地反映出新发的粘膜相关失调,这表明粘膜失调可能先于临床疾病,并独立于长期炎症发展。
–3 环境因素影响微生物的反应
一项关于儿童克罗恩病的前瞻性研究分析了患者在开始治疗之前和之后的粪便样本,首先使用抗生素,然后在8个月期间使用规定的配方食品或抗肿瘤坏死因子抗体。
在诊断时,肠道微生物群表现出特定细菌和真菌的变化,即埃希氏菌属(Escherichia)和韦荣氏球菌属(Veillonella)增加,阿克曼菌属( Akkermansia)、罗氏菌属(Roseburia) 、普雷沃氏菌(Prevotella)和真菌(包括念珠菌属)减少。
降低了肠道炎症反应中的失调。炎症、抗生素暴露和饮食独立影响肠道微生物群落的不同分类群。例如,真菌负荷随着疾病和抗生素的使用而增加,但随着饮食治疗而减少。
因此,虽然肠道内的失调在克罗恩病中很常见,但微生物的反应取决于环境因素。
✦开始治疗前的微生物群特征
在开始治疗之前,新诊断的溃疡性结肠炎儿科患者的粘膜微生物群也有特征。除了溃疡性结肠炎患者中疣微菌门(Verrucomicrobia)显著减少外,其他细菌种类的丰富程度与健康儿童相似。此外,在属水平上,溃疡性结肠炎患者中罗氏菌属(Roseburia)的相对丰度显著降低,而嗜血杆菌(Haemophilus)的相对丰量增加。
●疾病活动与部位影响肠菌群的组成和功能
肠菌群组成和功能的改变似乎与炎症性肠病患者的疾病活动、疾病行为和病变部位有关。尽管在研究之间或与疾病活动相关的研究中,微生物群组成的确切差异没有得到一致复制。
但已经观察到,在所有形式的克罗恩病中,下列菌群持续减少:
而下列菌群增加:
✦儿童患者的肠道菌群特征与成人患者相似
新发炎症性肠病儿童和成人常见的肠道菌群主要偏差
Amelia S,et al.Elsevier.2022
炎症性肠病患儿的肠道菌群特征与成人患者相似。因此,成人型炎症性肠病患者的生态失调可能在儿童期就已确立。
●肠道微生物失调反应炎症的严重程度
对儿科患者(包括治疗前新诊断的儿童)的研究得出结论,肠道生物失调反映了炎症的存在和严重程度。然而,虽然肠道微生物群的变化可能在炎症性肠病早期发生,并可能导致疾病的发生,但随着时间的推移,环境因素,包括炎症本身,可能通过改变肠道的代谢条件,进一步导致失调。
人类肠道微生物群失调是真正的致病因素还是仅仅是肠病炎症的后果,这个问题尚不清楚。但是肠道微生物被证明是炎症性肠病相关肠道炎症的重要因素。
在健康状态下,宿主对肠道微生物群的免疫反应仅局限于粘膜表面。据报道,炎症性肠病患者的粘膜相关微生物密度较高,在促进肠道炎症方面,被认为比粪便微生物群发挥更大的作用。
注意:比较炎症性肠病患者结肠粘膜炎症和非炎症区域的微生物群组成的研究试图阐明居民肠道微生物群对炎症免疫反应的可能影响,但结果相互矛盾。
一项研究发现,炎症性肠病患者体内粘膜炎症和非炎症区域的微生物群落组成没有显著差异。不过该项研究未根据炎症性肠病类型进行区分。
其他研究分析了克罗恩病和溃疡性结肠炎患者炎症和非炎症粘膜活检中的微生物群,发现同一个体内的微生物特征相似,但个体间差异很大。
✦克罗恩病患者中变形菌丰富
与溃疡性结肠炎患者或健康受试者相比,克罗恩病患者的变形菌门(Proteobacteria)显著增加。还报告说,在炎症克罗恩病组织中,埃希氏菌(Escherichia)和志贺氏菌(Shigella)更为丰富,而在非炎症克罗恩病组织里,Pseudomonas更为广泛。大肠杆菌和梭杆菌能够粘附粘膜,侵入肠上皮细胞,并可能加剧炎症。
拟杆菌和梭杆菌更常见
具核梭杆菌通过破坏上皮屏障和诱发异常炎症而加重结肠炎。相对于炎症性溃疡性结肠炎,拟杆菌门(Bacteroidetes)在克罗恩病炎症粘膜中更常见。克罗恩病粘膜活检中最常见的是普通拟杆菌(Bacteroides vulgatus),克罗恩病患者中脆弱拟杆菌(Bacteroides fragilis)的数量明显高于溃疡性结肠炎患者或健康受试者。脆弱拟杆菌与产生白细胞介素10的调节性T细胞的增加有关,这限制了促炎机制,从而有助于减少炎症。
除了拟杆菌外,梭杆菌门(Fusobacteria)在克罗恩病患者的炎症粘膜中比溃疡性结肠炎患者的炎症黏膜中更常见。相反,在发炎的溃疡性结肠炎粘膜中更频繁地检测到厚壁菌门(Phylum Firmicutes)和变形菌门(Proteobacteria)。与大肠杆菌类似,梭杆菌能够粘附粘膜,侵入肠上皮细胞,并可能加剧炎症。尤其是具核梭杆菌刺激结肠上皮细胞中肿瘤坏死因子的表达。
总的来说,这些研究结果表明,由于同一参与者的微生物群分布几乎没有变化,无论炎症状况或取样位置如何,因此粘膜相关微生物群没有发生明显的局部变化。
此外,根据引用的研究,粘膜微生物组成更依赖于个体间的变异,而不是疾病类型。
事实上,肠道微生物群组成的变化导致微生物代谢物的改变,这可能在炎症性肠病发病机制中起作用。
✦短链脂肪酸
短链脂肪酸是肠道微生物群通过发酵未消化的饮食成分和肠粘膜产生的内源性粘液而产生的。
短链脂肪酸影响肠上皮细胞生物能量学、微生物增殖、屏障和炎症功能。
短链脂肪酸影响受体激活与信号传导
短链脂肪酸被吸收到血液循环中,在那里它们可能与白细胞上的G蛋白偶联受体GPR43结合,阻碍其激活。GPR43信号传导抑制炎症反应,包括粘附分子和炎症介质的表达,以及白细胞趋化性。
缺乏GPR43的小鼠炎症反应加剧,外源性给予野生型小鼠短链脂肪酸对临床有益。短链脂肪酸还抑制NF-kB信号传导,在相对高浓度下,丁酸抑制I类组蛋白脱乙酰酶,后者是免疫和炎症的重要调节因子。
微生物群影响免疫细胞的激活
颤螺菌属 (Oscillospira)被认为是一种利用宿主衍生聚糖或从富含糖蛋白的饮食中获得的聚糖的丁酸生产菌。
在炎症性疾病中,尤其是克罗恩病中,颤螺菌的含量减少。微生物群似乎控制先天性和适应性免疫细胞激活的系统阈值。因此,持续接触常驻细菌发酵产物和代谢物对外周免疫系统的正确功能至关重要。
然而,不能排除常驻微生物在控制局部免疫中的直接作用,因为在其他研究中,粘膜炎症状态与局部粘膜相关微生物群的扰动有关,即同一炎症性肠病患者体内炎症粘膜和非炎症粘膜的微生物群组成差异。
✦色氨酸代谢物
对宿主的免疫反应至关重要的另一类代谢物是色氨酸代谢物。
色氨酸又称β-吲哚基丙氨酸,是人体的必须氨基酸之一。
缺乏色氨酸会导致结肠炎
使用小鼠进行的营养研究表明,饮食中缺乏色氨酸会导致结肠炎,并补充色氨酸以防止发炎。将失调的微生物组从喂食色氨酸缺乏饮食的小鼠转移到喂食正常饮食的无菌受体,足以引起结肠炎。
在小鼠中,色氨酸代谢菌株罗伊氏乳杆菌(Lactobacillus reuteri)可预防结肠炎。当它将色氨酸代谢成吲哚丙烯酸时,它是通过增强上皮屏障功能和减少炎症反应而起作用的芳烃受体的配体。
色氨酸影响上皮免疫
膳食色氨酸还可以通过增加调节微生物组组成并防止机会病原体感染的抗菌肽的产生来影响上皮免疫性。与炎症性肠病相反,在多发性硬化的鼠模型中,缺乏饮食色氨酸可防止中枢神经系统自身免疫,这是由于致脑病的T细胞反应受损和微生物组发生了深远的变化。
值得注意的是,饮食中色氨酸限制的保护作用在无菌小鼠中被取消,并且与色氨酸代谢物的原型传感器无关,这表明这些保护作用可以通过微生物组的代谢功能来介导。
✦结肠炎患者炎症部位细菌减少
研究表明,尽管溃疡性结肠炎和克罗恩病患者的成对活检样本之间的微生物群落组成具有高度的个体间变异性,但在每个疾病队列中,结肠发炎区域的细菌负荷通常低于非发炎区域。
克罗恩病和溃疡性结肠炎患者的炎症部位和非炎症部位所含的厚壁菌(以及相应的更多拟杆菌)均比非炎症性肠病对照样品少,但仅溃疡性结肠炎患者显著减少。
另一方面,在研究中包括的克罗恩病患者的大多数成对活检样本中检测到肠杆菌科成员,与溃疡性结肠炎和非炎症性肠病样本相比,肠杆菌属成员占克罗恩病总微生物群的比例增加了10倍。
肠杆菌科相对丰度的增加与NOD2风险等位基因计数呈正相关。NOD2基因内的多态性损害了这种细胞内受体作为细菌细胞壁成分的传感器在先天免疫中的作用,增加了克罗恩病的发病风险。
由于先天免疫受体(如NOD2和TLR4)的遗传多态性被认为是炎症性肠病发展的主要风险因素,宿主自身常驻微生物群的异常免疫反应被认为在促进炎症疾病进展方面起着关键作用。
✦白细胞介素放大炎症过程
与正常组织相比,在活动性炎症的溃疡性结肠炎组织中,厚壁菌门的数量较少,这主要是由于粪杆菌属(梭状芽孢杆菌目)的减少。事实上,白细胞介素22、白细胞介素17细胞(Th22细胞)和Th1细胞与厚壁菌门正相关。
白细胞介素17细胞渗入炎症性肠病患者的炎症肠道,在那里产生白细胞介素17A和其他细胞因子,触发并放大炎症过程。虽然Th17细胞因子在炎症性肠病发病机制中可能很重要,但Th17细胞也可能具有组织保护作用,主要取决于其通过产生白细胞介素22增强上皮屏障功能和反调节机制的能力。
✦结肠炎期间宿主-肠道微生物氧交换加强
事实上,众所周知,粪便细菌通过炎症细胞因子调节或刺激白细胞介素10的产生而表现出保护作用。相比之下,由于不动杆菌属的差异,蛋白杆菌门在炎症粘膜中更为丰富,这与Th22细胞和Th1细胞的数量呈负相关。
因此,在活动性炎症的溃疡性结肠炎患者的活检组织中,严格需氧不动杆菌属也扩大了,这表明结肠炎期间粘膜上皮的损伤可能会增加宿主-肠道微生物群的氧交换。
事实上,活动性炎症期间的生物失调状况可能与肠道内存在的径向氧梯度有关,这种氧梯度从较需氧粘膜界面延伸到大部分厌氧肠腔。宿主的氧合影响肠腔氧合,氧从宿主组织扩散到肠腔。在宿主组织恢复常氧后,腔氧浓度也降低,这表明氧气正被靠近粘膜界面的肠道微生物群消耗。粘膜较高的耐氧性和过氧化氢酶表达可能有利于肠道生态系统中的微生物竞争,因此,粘膜可能有利于耐气细菌群落的定植,尤其是来自蛋白质杆菌门的细菌。
与粪便微生物群相比,溃疡性结肠炎患者活检样本中富集的一些细菌类群在无胃肠道症状的研究对象的粘膜中也较高。
因此,在结肠炎活动性炎症期间扩张的细菌很可能在健康人的肠道菌群中正常存在,数量较少。例如,梭状芽孢杆菌和瘤胃球菌科在肠腔菌群中更为丰富,但与活动性结肠炎的样本相比,这些分类群在正常非炎症组织中也更为丰富。
✦炎症和肠道菌群失衡直接可能存在联系
内源性或外源性因素(如饮食、压力或感染)或它们的组合可能会引发亚临床肠道粘膜炎症,这取决于个体的遗传易感性,可能有利于特定促疾病肠道细菌的生长。
这些机会性微生物随后加剧了形态学和功能变化,导致病理后果,导致宿主的慢性炎症和临床症状。这些结果可能支持这样的假设,即炎症性肠病患者中观察到的整体生物失调在某种程度上可能是肠道环境紊乱的结果,而不是疾病的直接原因。
例如,作为炎症反应副产物生成的电子受体促进兼性厌氧菌(如肠杆菌科)的生长。因此,慢性炎症可能形成肠道微生物群,并进一步导致失调。
急性胃肠道粘膜感染的特点是与微生物群的显著变化相关的失调,以及具有增强的侵袭性和炎症特性的细菌的优势,这些特性可以直接加剧炎症和组织损伤,如γ-变形菌。
✦通过肠道菌群判断炎症状态
已有研究显示不同的肠道菌群可以通过免疫反应、影响肠道屏障以及通过胆汁酸转化等代谢途径影响免疫细胞相互作用,从而影响免疫调节。
借助这些方面的研究和临床数据,我们可以通过肠道菌群从几个方面来反映和了解免疫系统及自身的炎症状态。
病原菌的存在很大程度上会激发免疫系统的炎症,因此首先评估肠道菌群中是否存在异常的病原菌超标情况。
来自谷禾健康肠炎临床患者肠道菌群检测报告,结果显示血液链球菌(Streptococcus)及衣氏放线菌(Actinomyces israelii)超标,如下:
<来源:谷禾健康数据库>
类似的病原菌超标在没有严重导致感染症状的情况下也会诱发或刺激免疫系统炎症,如果免疫力低下就可能导致病原菌感染,如果持续存在超标也可能导致慢性炎症。
真菌微生物群在肠道炎症中的作用日益被认识。炎症性肠病患者和健康人之间的菌群组成不同,真菌菌群也不同,炎症粘膜中的真菌群与非炎症区域的真菌群是可以区分的。
✦炎症区域和非炎症区域真菌差异很大
白色念珠菌(C. albicans)和热带念珠菌(C.tropicalis)在炎症区域特别丰富,而在非炎症粘膜中则不存在。相比之下,S. cerevisiae和Saccharomyces castellii在炎症粘膜中较少出现。
光滑念珠菌(C.glabrata)也在克罗恩病粘膜中富集。光滑念珠菌是最重要的真菌机会性病原体之一,通过适应和免疫逃避策略促进炎症反应,这表明它可能在肠道炎症中起作用。
白色念珠菌也与炎症性肠病患者的粪便真菌有关。白色念珠菌可能是炎症性肠病中观察到的炎症过程的发起者,通过几种途径与酵母菌的主要成分和先天免疫反应的主要受体相结合。
此外,炭角菌目在炎症粘膜上更为丰富,而酿酒酵母在非炎症粘膜中更为丰富。炭角菌目的许多物种产生具有抗菌特性的化合物,可对抗人类病原体,如结核分枝杆菌、耶尔森菌、李斯特菌和沙门氏菌,以及具有细胞毒性和抗氧化活性的代谢物。因此,炭角菌目成员的存在可能反映了对炎症环境的适应。
✦真菌影响受体与免疫,导致炎症
真菌细胞壁成分与宿主免疫反应相关。与病原菌平行,真菌可以穿透被破坏的粘膜屏障,并通过其细胞壁成分激活TLR受体、Dectin-1(C型凝集素受体)、清道夫受体家族成员和固有层的补体系统。
这些受体的感应导致信号事件,依赖于白细胞介素17、白细胞介素22、CARD9(Caspase募集域家族成员-9)、ITAM(免疫受体酪氨酸基激活基序)、NFAT(活化T细胞的核因子)和NF-kB,导致严重的炎症表型。
由于文化传统、农业做法、社会经济地位和生活方式的改变,饮食本身在世界各地都在发生变化。炎症性肠病发病率的快速增加与工业化和暴露于环境因素,特别是饮食改变有关。营养和饮食模式影响免疫系统稳态,并可能通过不同的机制导致肠道炎症,包括肠道微生物群的调节。
饮食对肠道菌群组成有很大影响。目前关于饮食策略作为炎症性肠病主要治疗方法的证据越来越多。过去几年,针对炎症性肠病的潜在治疗效果,提出了几种饮食干预措施,即特定碳水化合物饮食、无麸质饮食、抗炎饮食。
然而,这些饮食要么不耐受,要么限制性很强,要么缺乏证据证明其对炎症性肠病的疗效。炎症性肠病的饮食干预研究最多的是独家肠内营养,这在儿科克罗恩病中常用,但饮食发挥其作用的确切机制尚不清楚。
独家肠内营养包括使用营养全面的液体饮食,而不是通常的固体和液体,通常长达8周,这是非常严格的,特别是在长期使用期间,可接受性有限。
✦抗炎饮食
你吃的食物在控制慢性炎症方面可能起到积极和消极的作用。
▸ 什么是抗炎饮食?
国际食品信息理事会基金会(International Food Information Council Foundation)营养传播副主任将其描述为一种饮食,重点关注高营养的食物,任何“营养密集”,“天然来源的维生素,矿物质和色素很多”的食物都是这种饮食的理想成分。
尤其是抗氧化剂, “它的主要参与者是水果,蔬菜,豆类,健康脂肪等食物,例如橄榄油和牛油果,包括鱼类,坚果和浆果等。
但是,抗炎饮食不仅是您的饮食,而且与食物的烹饪方式有关。应限制或避免高盐,饱和脂肪,糖和精制碳水化合物的食物。
在这里列举了一些抗炎食物和促炎食物,可以帮助更好地进行抗炎饮食。
•抗炎食物
很多种食物均具有抗炎特性,其中包括抗氧化剂和多酚含量高的食物。
1 浆果
浆果是小果实,富含纤维,维生素和矿物质
2 深海鱼
深海鱼是蛋白质和长链omega-3脂肪酸EPA和DHA的重要来源。
3 西兰花
西兰花是萝卜硫烷的最佳来源之一,萝卜硫烷是一种具有强大抗炎作用的抗氧化剂,可通过减少引起炎症的细胞因子和NF-kB的水平来对抗炎症。
4 牛油果
牛油果可能是少数值得冠以的超级食品之一,提供各种有益的化合物,可防止发炎并降低癌症风险。
5 辣椒
甜椒和辣椒中富含维生素C和抗氧化剂,具有强大的消炎作用。
6 蘑菇
蘑菇的热量非常低,并且富含硒,铜和所有B族维生素。它们还包含提供抗炎保护的酚和其他抗氧化剂。
7 葡萄
葡萄含有花青素,可减少炎症。此外,它们还可以降低多种疾病的风险,包括心脏病,糖尿病,肥胖症,阿尔茨海默氏病和眼疾。
8 姜黄
姜黄素是一种强大的抗炎营养素,因此受到了广泛的关注。姜黄可减轻与关节炎,糖尿病和其他疾病相关的炎症。
9 特级初榨橄榄油
特级初榨橄榄油是可以吃的最健康的脂肪之一。
它富含单不饱和脂肪,是地中海饮食中的主要食物,具有许多健康益处。
•促炎食物
在受伤或感染期间,身体会释放化学物质以帮助保护它并抵抗任何有害生物。但是,食用过多的促炎食物可能会导致慢性低度发炎。
1 糖和精制碳水化合物
摄入过多的糖和精制的碳水化合物与体内炎症增加以及胰岛素抵抗和体重增加有关。
2 人造反式脂肪
人造反式脂肪可能是您可以食用的最不健康的脂肪。它们是通过将氢添加到液态不饱和脂肪中而产生的,以使其具有更固态的脂肪的稳定性。
3 过量饮酒
虽然适度饮酒可带来一些健康益处。但是,较高的用量会导致严重的问题。大量饮酒可能会加剧炎症并导致“漏泄的肠道”,从而在整个身体内引发炎症。
4 植物油和种子油
概要一些研究表明,大量食用植物油中的omega-6脂肪酸含量可能会促进炎症。但是,证据不一致,需要更多的研究。
6 加工肉
加工肉富含AGEs等炎性化合物,其与结肠癌的强烈关联可能部分归因于炎症反应。食用加工肉会增加患心脏病,糖尿病,胃癌和结肠癌的风险。
✦FODMAP饮食
前不久提出了一种更有前景的直接针对肠道微生物群的营养方法,包括低可发酵低聚糖、双糖、单糖和(FODMAP)的饮食。
FODMAP是极易发酵但吸收不足的物质,分子量小,高渗效应导致肠道通透性增加。这些特性增强了肠道微生物群的发酵作用。
•FODMAP饮食的负面作用
富含FODMAP的饮食相关的症状是产气、腹痛、腹胀、抽筋、腹胀和腹泻。另一方面,近端结肠中FODMAP的快速发酵导致内腔中短链脂肪酸和乳酸的大量生成,进而影响粘膜屏障。
// 容易营养缺乏
尽管静止性炎症性肠病患者的胃肠道症状有潜在改善,但低FODMAP饮食与负面影响相关。由于饮食限制,营养缺乏的风险很高。
// 对肠道微生物有负面影响
另一方面,低FODMAP饮食意味着限制食品中天然存在的益生元,如果聚糖和低聚半乳糖,通过减少糖化细菌,特别是双歧杆菌,对肠道微生物群组成产生负面影响。
// 菌群数量减少
观察到,在静止期炎症性肠病患者中,低FODMAP饮食后,长双歧杆菌、青春期双歧杆菌和普氏双歧杆菌的数量减少。
由于双歧杆菌优先发酵果聚糖和低聚半乳糖,而普拉斯尼茨革兰阴性杆菌通过交叉喂养间接利用它们,因此,这种减少可能是由于到达肠道的可发酵底物数量的变化造成的。
在静止期克罗恩病患者中,低FODMAP饮食导致产生丁酸盐的梭状芽孢杆菌簇和嗜粘杆菌数量减少,这对粘膜相关微生物群的健康很重要,并且黏液溶解度瘤胃球菌扭矩的相对丰度增加,通常在克罗恩病患者中减少。
注意
长期服用低FODMAP饮食引起了一些担忧。除了评估饮食对炎症标记物或疾病活动的影响外,还需要对炎症性肠病患者低FODMAP饮食的充分性和安全性进行更多研究。
此外,关于低FODMAP饮食影响的少数研究样本量小,饮食应用的设计和时间不同,可能会影响结果的显著性。
营养干预可能在炎症性肠病症状管理和延长病情缓解方面发挥重要作用。然而,需要进一步的研究来更好地描述饮食、肠道微生物群和炎症性肠病之间的关系。
小结
饮食干预可能是挽救生命和降低医疗费用的可持续且具有成本效益的方式。但是,这些饮食干预措施的长期成功因人而异。成功与否取决于每个人的饮食建议是否可行,以及这些措施是否确实产生了预期的生理变化。
益生菌被定义为当摄入足够量时对宿主健康有益的活微生物。
益生菌作为操纵肠道微生物群内物种组成和代谢活动的一种手段,已被大量研究,以促进健康,预防或管理肠道疾病。
益生菌的作用可以是直接的,也可以是间接的,通过调节居民的微生物群或免疫系统。它们可以增强上皮屏障功能,增加对肠粘膜的粘附力,同时抑制病原体,促进对病原菌的竞争性排斥,产生抗微生物物质,并调节宿主的免疫系统。
例如,在感染或炎症状态下,益生菌可能会增加肠上皮细胞之间紧密连接的完整性,并防止肠细胞凋亡。此外,益生菌会产生短链脂肪酸和乳酸,降低肠上皮细胞的促炎反应,抑制潜在致病微生物的生长。
✦益生菌在炎症性肠病的作用
因此,使用益生菌调节肠道菌群,以对症和明确管理炎症性肠病具有巨大的治疗潜力。益生菌应从人类的肠道菌群中选择,不应对抗生素产生固有的耐药性。乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)的成员通常被认为是安全的,是功能性食品和补充剂中使用最多的益生菌,因为它们被证明对健康有益。
•益生菌对克罗恩病的作用暂不明确
使用益生菌治疗克罗恩病产生了相互矛盾的结果。一些研究已经成功地用益生菌治疗克罗恩病,如大肠杆菌(Escherichia coli)、鼠李糖乳杆菌( Lactobacillus rhamnosus)和布拉迪酵母菌(Saccharomyces cerevisiae boulardii)。
相反,也有报道称,鼠李糖乳杆菌未能维持克罗恩病的缓解。由于该研究领域缺乏精心设计的随机对照试验,目前关于益生菌诱导克罗恩病缓解的疗效和安全性的证据的确定性较低。
然而,最近公布的克罗恩病患者报告称,定期服用含有乳酸菌菌株组合(戊糖乳杆菌、短乳杆菌、植物乳杆菌、发酵乳杆菌、凯氏乳杆菌和林德纳乳杆菌)的产品导致其粪便中凯氏乳球菌丰度更高,症状的减轻和生活质量的提高。
L. kefiri具有很强的调节肠道微生物群组成的能力,导致与炎症反应和胃肠道疾病发病直接相关的几个细菌属显著减少。
✦益生元与合生元在炎症性肠病中的作用
益生元被定义为“通过选择性刺激结肠中一种或有限数量细菌的生长或活性,从而对宿主产生有益影响的非消化性食品成分,从而改善宿主的健康”。
益生元与短链脂肪酸(主要是醋酸盐、丙酸盐和丁酸盐)的生成增加有关,这可能有助于维持结肠内稳态。合生元是益生菌与益生元的结合,可能有利于活性克罗恩病患者,是治疗该疾病的潜在疗法。长期研究表明,服用合生元对活性克罗恩病有很好的疗效。
对最初接受氨基水杨酸盐和泼尼松龙治疗方案但未能缓解的患者进行合生疗法试验。合生元包括高剂量的益生菌短双歧杆菌、长双歧杆菌和干酪乳杆菌,以及作为益生元的木薯。
// 一定程度上改善克罗恩病症状
大多数患者的临床症状有所改善。车前草已被证明有助于腹泻患者,改善粪便粘稠度和黏度。其他随机对照试验评估了克罗恩病患者服用含有长双歧杆菌与商业益生元组合的合生元后,临床症状和组织学评分得到了有效改善,肠粘膜中的长双歧杆菌和其他种类的双歧杆菌定植增加。
此外,在3个月时,治疗组对粘膜白细胞介素18、干扰素(INF-g)和白细胞介素1b的影响不大,而TNF-a的表达在6个月时显著降低。粘膜中双歧杆菌物种的更高丰度可促进与参与调节促炎细胞因子途径的致病物种的竞争,从而刺激更具免疫调节性和耐受性的免疫反应。
// 缓解溃疡性结肠炎
大肠杆菌Nissle 1917是一种非致病性大肠杆菌菌株,可防止和对抗病原菌的定植。它减少结肠粘膜损伤,降低上皮通透性,有效维持溃疡性结肠炎缓解。
混合益生菌VSL#3由8株细菌组成,包括嗜酸乳杆菌、保加利亚乳杆菌、植物乳杆菌、干酪乳杆菌、嗜热链球菌、短双歧杆菌、婴儿双歧杆菌和长双歧杆菌。它下调宿主免疫反应,改善上皮屏障功能,增加粘液生成。
综合分析显示,VSL#3与安慰剂相比,在诱导缓解方面有显著益处的趋势,而与美沙拉秦相比,大肠杆菌Nissle 1917在维持缓解方面表现出非劣效性。
一种类似的合生元被证明在溃疡性结肠炎治疗中有用。肿瘤坏死因子、白细胞介素1a是驱动炎症和诱导防御素表达的炎症细胞因子,治疗后也显著降低。试验组的活检减少了上皮组织的炎症和再生。肿瘤坏死因子在活动性溃疡性结肠炎的发病机制中起着关键作用。因此,抑制炎症溃疡性结肠炎粘膜中肿瘤坏死因子的分泌是治疗疾病和预防复发的主要目标。
小结
虽然益生菌或合生元的使用对溃疡性结肠炎的治疗和维持有积极作用,但在克罗恩病中,只有合生元显示出明显的效果。
益生菌疗法可以通过与促进结肠中益生菌生长的益生元结合而潜在地得到改善。使用合生元的另一个优点是,益生元成分可以促进肠道内具有益生菌特性的本地生物体的生长。使用益生菌调节肠道细菌组成,并可能减少炎症或激活先天免疫,可用于治疗策略中,以恢复宿主肠道微生物群。
益生菌可能通过操纵微生物群来增加有益微生物的数量,减少可能有害的细菌,从而减少炎症触发因素,从而增加肠道生物多样性,改善炎症性肠病患者的症状。不过,不同微生物菌株和临床环境的益生菌效果不同。因此,对于大多数炎症性肠病患者来说,很难实现一般益生菌配方。
目前用于炎症性肠病的治疗策略会严重抑制免疫系统,从而导致严重感染和恶性肿瘤等风险。最近开发了一种基于微生物的免疫疗法,利用正常肠道微生物群的固有免疫调节特性,通过恢复免疫功能来治疗免疫相关疾病。
这种新的方法涉及位点特异性免疫调节剂,它是一种复杂的生物制剂,旨在以靶向、器官特异性的方式激活先天免疫应答。
▸ QBECO治疗
QBECO是一种来源于临床肠致病性大肠杆菌灭活分离物的试验性位点特异性免疫调节剂。
QBECO针对激活的巨噬细胞向胃肠道募集,大肠杆菌菌株通常会导致感染。免疫调节剂包含来自单个灭活微生物物种的成分,免疫系统将其识别为特定器官或组织中感染的常见原因,刺激新一波激活的固有免疫细胞的募集,并清除非生产性炎症的慢性来源。
因此,QBECO治疗不是抑制免疫功能,而是通过新免疫细胞的产生和动员,优化异常免疫反应,重建正常屏障功能和粘膜稳态,从而克服胃肠道免疫失调。
✦QBEOO减轻了炎症性肠病的病理
QBECO已经在诱导性结肠炎和炎症性肠病患者的实验模型中进行了测试。服用QBECO后,小鼠结肠炎的严重程度总体降低。该疗法减弱了肠道病理,改善了粘膜完整性,从而减少了胃肠粘膜的免疫细胞浸润,尤其是中性粒细胞的数量。
// 溃疡性结肠炎患者症状改善
在同一研究中,大多数接受QBECO治疗的UC患者在接受16周治疗后,其疾病在临床、内镜和组织学方面均有改善,粘膜完整性也有所改善。此外,治疗后1周内直肠出血明显减少。QBECO治疗还降低了结肠粘膜UC患者中中性粒细胞的数量,正如在诱导性结肠炎小鼠中观察到的那样。
// 克罗恩病患者症状也有改善
接受微生物QBECO治疗的克罗恩病患者也报告症状改善。在第一种临床方法中,十分之七的患者在至少三个月的治疗期间症状完全缓解。三名患者在停止药物治疗和QBECO治疗后持续出现临床病情缓解。此外,研究期间未报告严重不良事件。
最近对68名中重度克罗恩病患者进行的随机对照试验(RCT)评估了QBECO的安全性、疗效和耐受性。接受QBECO治疗的患者对治疗有良好的耐受性。
与安慰剂相比,到第8周时,疾病活动显著减少。之前接受肿瘤坏死因子抑制剂治疗的患者在第8周对QBECO反应的可能性较小,但随着治疗持续到第16周,症状有所改善,这表明可能需要更长的疗程才能在这些受试者中取得最佳结果。
此外,在随机对照试验期间QBECO治疗改善的克罗恩病患者产生IL-18,血清IFNg、IL-12p70和IL-17A水平较高,证实了对细菌刺激的有效免疫反应。
小结
利用基于微生物的免疫疗法,如QBECO,其功能是有效激活而不是抑制粘膜免疫功能,这是一种新的炎症性肠病治疗思路。然而,还需要进一步研究来评估这种新型免疫治疗方法在溃疡性结肠炎和克罗恩病治疗中的安全性和疗效。
用捐赠的粪便或纯化的粪便培养物进行粪便微生物群移植是目前治疗复发性艰难梭菌感染的常规方法。越来越多的人认识到微生物群失调在炎症性肠病发病机制中的作用,促使人们研究粪便移植作为一种潜在的炎症性肠病新疗法。
粪便移植改善炎症性肠病的证据进展迅速,前景看好。然而,关于这种治疗的疗效,有报道称结果相互矛盾。
注意:结果的多样性可能与不同的实验设计和方法学问题有关,包括供体选择、粪便类型、分娩方法、移植前准备、供体粪便处理方法、供体样本汇集以及给药频率和时间。
例如,粪便捐赠者样本的厌氧处理可保存可存活的厌氧菌用于移植,并可能影响临床结果。
最近的一项短期随机对照试验得出结论,使用经厌氧处理的供者样本进行粪便移植,与使用自体样本相比,8周后病情缓解的可能性更高,并且与本研究中观察到的治疗反应呈正相关的所有生物体都是厌氧菌(主要是专性厌氧菌)。Anaerofilum pentosovorans和粪拟杆菌物种的增加与治疗后疾病的改善密切相关。然而,从基线检查到第4周,微生物的数量发生了显著变化,在第8周之前保持稳定,但在12个月后发生了变化。
✦粪菌移植在溃疡性结肠炎中的作用
// 胃肠道症状改善,微生物群与健康者相似
一项前瞻性研究调查了溃疡性结肠炎患者粪便微生物群移植的临床疗效,结果表明,治疗后胃肠道症状改善,健康肠道微生物群重新繁殖。移植后,微生物群逐渐与健康献血者相似。克雷伯菌属和链球菌属的相对丰度下降,普氏菌属的相对丰度增加,表明这些属的变异可能是导致溃疡性结肠炎发病的重要因素。
// 微生物多样性显著增加
另一项研究表明,多次给药6周的多捐赠者密集剂量粪便微生物群移植是活动性溃疡性结肠炎患者的有效治疗方法。移植与微生物多样性显著增加相关,持续至治疗结束后8周。
此外,特定分类群与粪便微生物群移植结果相关。虽然梭状芽孢杆菌和Blautia属与治疗益处相关,但其他属(包括梭杆菌属和Sutterella属)的结果一直为阴性,这些属被认为与溃疡性结肠炎的发病机制有关。
粪便移植后病情缓解的溃疡性结肠炎患者粪便中的霍氏真杆菌(Eubacterium hallii)和inulivorans Roseburia富集,粪便样本中的短链脂肪酸水平升高。此外,未获得缓解的患者 Fusobacterium gonidiaformans、Sutterella wadsworthensis和埃希氏杆菌的富集。
建议
需要进一步研究来评估炎症性肠病患者粪便微生物群移植的长期缓解维持和安全性。
根据个体特征,使用各种特定肠道保护微生物菌株或其代谢物组合,可能比整个粪便微生物群移植更有效、更安全。
肠道微生物群失调似乎在炎症性肠病的发展中起着重要作用。发现可能导致慢性炎症的肠道微生物特征至关重要。
近年来,在鉴定不同微生物类群之间的健康平衡方面取得了重大进展。厚壁菌门和拟杆菌门中包含的某些微生物类群的丰富程度与健康肠道相关,有益或有害微生物之间的平衡强烈影响宿主健康。
影响宿主微生物群的遗传和环境因素需要进一步研究。为了开发个人定向治疗,还迫切需要更广泛地鉴定促进健康的微生物类群。
未来的另一个主要目标是选择个性化的益生菌或合生元疗法(或微生物特异性粪便移植)来治疗单个炎症性肠病患者,为实现长期缓解甚至完全治愈炎症性肠病做出巨大贡献。
主要参考文献:
Adamji, M., Day, A.S., 2019. An overview of the role of exclusive enteral nutrition for complicated Crohn’s disease. Int. Res. 17, 171–176.
Borisova, M.A., Achasova, K.M., Morozova, K.N., et al., 2020. Mucin-2 knockout is a model of intercellular junction defects, mitochondrial damage and ATP depletion in the intestinal epithelium. Sci. Rep. 10, 21135.
Buisson, A., Douadi, C., Ouchchane, L., et al., 2019. Macrophages inability to mediate adherent-invasive E. coli replication is linked to autophagy in Crohn’s disease patients. Cells 8, 1394.
Caldeira, L. de F., Borba, H.H., Tonin, F.S., et al., 2020. Fecal microbiota transplantation in inflammatory bowel disease patients: a systematic review and meta-analysis. PLoS One 15, e0238910.
Cox, S.R., Lindsay, J.O., Fromentin, S., et al., 2020. Effects of low FODMAP diet on symptoms, fecal microbiome, and markers of inflammation in patients with quiescent inflammatory bowel disease in a randomized trial. Gastroenterology 158, 176–188.e7.

谷禾健康
大部分人都遭受过头皮屑的困扰。头皮屑虽然看起来不是严重的疾病,但有时候足以令人头疼和尴尬,影响整体生活质量。

头皮屑是一种非常常见的皮肤病,无论年龄,性别等,任何人都可能会有。
头皮屑通常看起来像油腻的皮肤片,如果飘落在深色衣服上更加明显。在头皮上,它也可能表现为皮肤的鳞片状斑点,有时伴有发红、发痒或发炎。
头皮表面为微生物提供了独特的微环境,主要来自宿主的生理条件,包括皮脂含量,水分,pH值等。
头皮屑与多种可能的原因有关,包括卫生差,压力大和饮食不当,当然头皮屑的产生也离不开微生物群。
微生物包括真菌和细菌。
真菌
少量脱落实际上是正常的,因为皮肤细胞会死亡,以便形成新的皮肤。然而,在某些情况下,由于一种或多种潜在的问题可能会使头皮真菌的过量生长,导致剥落异常大量。
头皮表面发现的最多的真菌是马拉色菌(malassezia)。这种真菌生活在头皮上,以皮肤油脂为食。
马拉色菌里有限制性马拉色菌、球形马拉色菌等,不同种类的马拉色菌的致病性不同,并适应人体皮肤的不同部位,这主要归因于宿主的生理条件(皮脂,免疫反应,汗液等),环境(温度,湿度,紫外线暴露)以及其他微生物的存在。
其中限制性马拉色菌与球形马拉色菌的比例较低与健康的头皮有关。
当球形马拉色菌利用脂肪酶代谢其消耗的油脂时,会产生一种副产物——油酸,该副产物渗透到头皮并引起头皮屑。
功能分析表明,真菌菌群主要通过与头皮屑头皮细胞-宿主粘附有关的途径富集。马拉色菌的粘附与头皮角质层屏障功能受损有关,可能进一步有助于头皮屑区马拉色菌的发育。
与健康头皮相比,头皮屑头皮中还发现了大量与一般功能和遗传信息处理相关的通路(硫中继系统、蛋白酶体通路、酵母细胞周期和减数分裂等),且与限制性马拉色菌呈显著正相关。
“酵母细胞周期”和“减数分裂”是参与真菌细胞周期和增殖的重要通路,这两通路在头皮屑头皮上的较高数量表明,它们在头皮屑头皮上的马拉色菌的增殖中起作用。
“蛋白酶体通路”与包膜的形成有关,包膜是真菌的主要致病决定因素。

细菌
头皮表面发现的最丰富的两个细菌属是Cutibacterium菌(健康头皮)和葡萄球菌(头皮屑头皮)。
研究表明,与健康人群相比,头皮屑患者的限制性马拉色菌和葡萄球菌的丰度较高(p <0.05)。
不同的葡萄球菌丰度变化也不同。
与健康人群相比,头皮屑患者头皮上表皮葡萄球菌的丰度减少,而同时头状葡萄球菌的丰度显著增加。头状葡萄球菌丰度的增加足以驱动头皮屑损伤部位葡萄球菌绝对物种丰度的总体增加。
细菌菌群的功能分析显示出,健康头皮与以下代谢相关通路明显高于头皮屑头皮:
氨基酸:丙氨酸、天冬氨酸、谷氨酸、精氨酸、脯氨酸、赖氨酸、组氨酸、半胱氨酸、蛋氨酸代谢;
维生素:维生素B6,B7
其他辅助因子:卟啉,叶绿素,烟酸和烟酰胺代谢,泛醌和其他萜醌的生物合成。
这些头皮微生物群合成的维生素、生物素、氨基酸等被头皮角质形成细胞吸收,为头皮提供营养,在保持头发和头皮健康以及控制头皮屑方面起着有益的作用。
可能引起头皮屑的一些潜在潜在问题包括:
•皮肤状况-例如脂溢性皮炎,湿疹和牛皮癣,会增加头皮屑的风险。
•神经系统疾病-发现患有帕金森氏症等神经系统疾病的人更容易患头皮屑。
•洗护用品的刺激-购买的洗护品含有许多化学物质,可能会刺激头皮并导致发炎,发痒和脱落。
•不良的饮食习惯-摄入含锌和B族维生素的食物不足,可能会导致头皮屑。
•年龄-虽然说任何年龄的任何人都可能患有头皮屑,但往往在年轻人和中年人中更为普遍。
•气候-冬季的寒冷天气可能促进头皮中酵母样真菌的生长。
•激素-体内激素的变化可能会影响头皮的天然皮脂分泌。激素失调的人更容易有头皮屑。

为了想要尽快清除头皮屑,有人会选择含药的洗发水。但是,药用洗发水真的可以治愈头皮问题吗?
首先,含药的洗发香波只有在您持续使用时才有效-它们不能彻底治愈头皮屑。这就意味着,必须要每周使用几次这种洗发水才能看到效果,一旦停止使用,头皮屑很可能卷土重来。

这些洗发剂大多数都含有抗真菌成分,例如酮康唑。虽然可以有效控制头皮屑,但连续使用会刺激头皮,并使头发变得蓬松干燥。
其他药用去屑洗发水也可能含有煤焦油,煤焦油是通过延迟皮肤细胞再生的过程来控制头皮屑。但是,煤焦油是已知的致癌物质,因此最好避免含有这种成分的洗发水。
皮肤会吸收施加的任何物质,自然疗法是最佳选择。
盐
快速去除头皮屑且不使用任何有害化学物质的最安全方法之一是:用盐来去除片状头皮屑。
在洗澡之前,将盐轻轻按摩到干头皮上,使头发在漂洗时更容易去除。
椰子油
椰子油可以帮助改善水合作用,减少刺激感,并防止真菌在头皮上生长。恢复头皮的水分有助于止痒。

根据一项临床试验的结果,在117名1-13岁的儿童中,将纯净的椰子油涂在皮肤上可使特应性皮炎症状减少68.23%。当然也需要进行更多研究,以评估椰子油在治疗头皮屑中的作用。
椰子油的保湿和抗菌特性,使其成为抵抗干燥的绝佳自然选择。
茶树油
使用茶树油治疗头皮屑也是比较快速简便的。有研究人员认为茶树油中的化合物可以有效控制表皮葡萄球菌。

只需在头皮上按摩几滴茶树油,可减少瘙痒和多余油脂的产生。也可以在洗发水中混合几滴茶树油。
芦荟凝胶
芦荟是一种多汁植物,以其愈合特性而闻名。叶片中的凝胶含有几种生物活性化合物,例如氨基酸和抗氧化剂,可减少头皮屑。
2019年一项研究检查了23项涉及芦荟的临床试验。这些研究的结果表明,芦荟凝胶可以改善皮肤中的水分保留并促进伤口愈合。芦荟还可以减轻炎症,这可以帮助有头皮屑症状的人减轻症状,例如发痒。
2015年的研究表明,芦荟的抗菌性能可预防头皮屑。

饮 食
头皮屑通常与不良饮食有关,首先请开始调整饮食习惯。
Omega-3脂肪酸
Omega-3脂肪酸可以降低血压,增加“良好的” HDL胆固醇水平,并支持心脏和大脑健康。这种脂肪酸的缺乏会导致不良症状,例如头皮屑,指甲变脆和皮肤干燥。
锌
锌是支持人体免疫系统并促进细胞生长的矿物质。可以从动物蛋白,坚果等获取锌。

根据NIH研究表明,严重的锌缺乏与脱发、腹泻、皮肤损伤等有关。
2016年的一研究将缺锌列为脂溢性皮炎和头皮屑的潜在诱因。
减少糖和谷物
应该减少糖和谷物的摄入,因为已知这些会促进酵母或真菌的过度生长。
水果
水果和蔬菜含有许多必需的维生素,矿物质和抗氧化剂,可以帮助减轻炎症。

一项涉及4379人的观察性研究称,多吃水果的人患脂溢性皮炎的可能性较小。
研究结果还表明,典型的西方饮食可能会增加女性脂溢性皮炎的风险。
生物素
2018年的一项审查显示,生物素缺乏症可能导致几种皮肤疾病,包括脂溢性皮炎。生物素,也称为维生素B7,在支持健康的头发,指甲和皮肤方面发挥作用。富含生物素的食物包括:肝、蛋黄、坚果、三文鱼等。

晒太阳
还有一种非常简单的方法是:经常晒晒太阳。阳光可以防止真菌在头皮上繁衍。同时可以增加维生素D的含量,从而有助于改善皮肤状况。

解 压
此外,压力是头皮屑的最常见诱因之一。学习如何正确处理压力也很重要。适当培养一些兴趣爱好,定期放松解压,尽可能远离压力源。

其 他
最后,要保持良好的个人卫生习惯,避免过多抓挠,发痒最初是由头皮屑引起的刺激引起的,抓挠会增加刺激性并导致恶性循环。
避免使用过多的护发产品,防止头皮发炎。
摆脱头皮屑需要时间,精力和耐心,才能获得持久的效果。
Q & A
如何区分头皮屑和虱子?
如果白色颗粒在吹动或梳理头发时掉落,痒的程度相对较轻,则很可能是头皮屑。头虱在头皮部叮咬吸血,主要症状头皮部剧烈瘙痒,斑点粘在发干上,则可能是虱子或虱子空卵。
头皮屑可以治愈吗?
没有永久治愈的方法,但合理的方式可以控制住头皮屑。一些自然疗法包括茶树油、椰子油等。
头皮屑会导致脱发吗?
头皮屑本身不会直接导致脱发。然而,因为头皮屑抓挠发痒的头皮,久而久之可能会导致发丝脱落。
相关阅读:
主要参考文献:
Grimshaw SG, Smith AM, Arnold DS, Xu E, Hoptroff M, Murphy B. The diversity and abundance of fungi and bacteria on the healthy and dandruff affected human scalp. PLoS One. 2019;14(12):e0225796. Published 2019 Dec 18.
Saxena R, Mittal P, Clavaud C, et al. Comparison of Healthy and Dandruff Scalp Microbiome Reveals the Role of Commensals in Scalp Health. Front Cell Infect Microbiol. 2018;8:346. Published 2018 Oct 4.
National Health Service, Dandruff
Lorch JMP J.M.; Vanderwolf K.J.; Schmidt K.Z.; Verant M.L.; Weller T.J.; Blehert D.S. Malassezia vespertilionis sp. nov.: a new cold-tolerant species of yeast isolated from bats. Persoonia. 2018; 41:56–70. 10.3767/persoonia.2018.41.04
Symptom Find, Dandruff
Lin Qingbin,Panchamukhi Ananth,Li Pan et al. Malassezia and Staphylococcus dominate scalp microbiome for seborrheic dermatitis.[J] .Bioprocess Biosyst Eng, 2020
Zinc, Fact Sheet for Health Professionals
Borda, L. J., & Wikramanayake, T. C. (2016). Seborrheic dermatitis and dandruff: A comprehensive review.
Hekmatpou, D., et al. (2019). The effect of aloe vera clinical trials on prevention and healing of skin wound: A systematic review.
Kim, S., et al. (2017). Enhanced barrier functions and anti-inflammatory effect of cultured coconut extract on human skin.
Omega-3 fatty acids fact sheet for consumers. (2018).
Sanders, M. G. H., et al. (2019). Association between diet and seborrheic dermatitis: A cross-sectional study.
Varma, S. R., et al. (2019). In vitro anti-inflammatory and skin protective properties of virgin coconut oil.