-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

“唉,昨晚又没睡好!”
失眠已经严重影响着一部分人们的生活。失眠后会引起烦躁、白天嗜睡、精力不足、内分泌系统紊乱、认知功能受损、免疫力下降甚至易得心脑血管疾病。
据中国睡眠研究会等机构统计,中国有超3亿人存在睡眠障碍。其中,19—25岁年轻人经常熬夜至零点以后;19—35岁青壮年是睡眠问题高发年龄段。 并且由于当代社会压力增加,失眠率还在不断攀升。

影响睡眠质量的因素有很多:包括人体的生物钟,环境因素如光照、噪音、温度,还有心理状况,饮食状况及疾病状况。而近年来的研究发现体内有一种物质与睡眠紧密相关——它就是褪黑素。
褪黑素于20世纪50年代首次被发现并表征,从那时起,广泛的研究揭示了它的生产、功能和潜在的治疗应用。
褪黑素作为改善睡眠质量和调节昼夜节律紊乱的补充剂已广受欢迎。除了在睡眠调节中的作用外,褪黑素还被发现具有抗氧化、抗炎、免疫调节和神经保护特性。它影响生殖过程、心血管健康、胃肠功能以及其他生理系统。
近年来,褪黑素和肠道微生物群之间的关系已成为一个令人着迷的研究领域。研究表明褪黑素和肠道微生物之间存在双向作用,强调了肠道微生物群对褪黑激素产生和代谢的潜在影响,以及褪黑激素对肠道微生物组成和功能的影响。
褪黑素(N-乙酰基-5-甲氧基色胺)最早于1958年在牛松果体中发现并分离出来,因其能够美白青蛙皮肤,研究人员一开始认为作为一种“美白因子”,并将其命名为“褪黑素”。
后续的研究才证明了其在调节生物节律和睡眠模式中的作用。
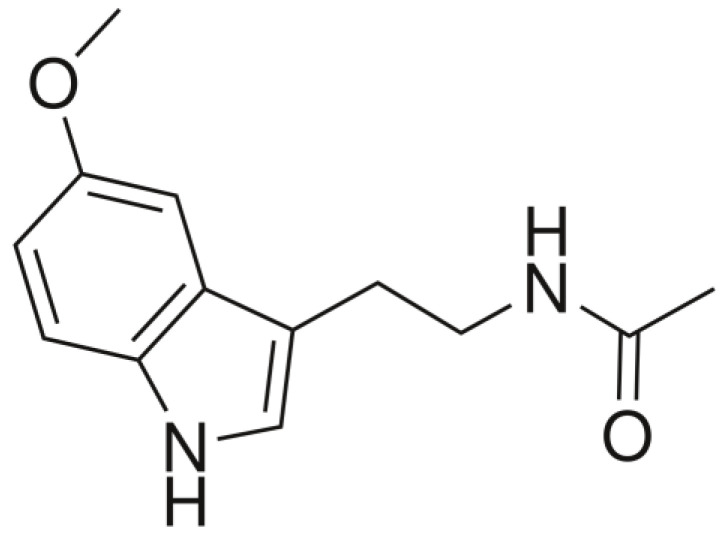
注:褪黑素是一种具有3-胺基和5-甲氧基的吲哚胺,因此具有两亲特性(同时具有亲水性和亲脂性)。
褪黑素的化学结构
Minich DM,et al.Nutrients.2022
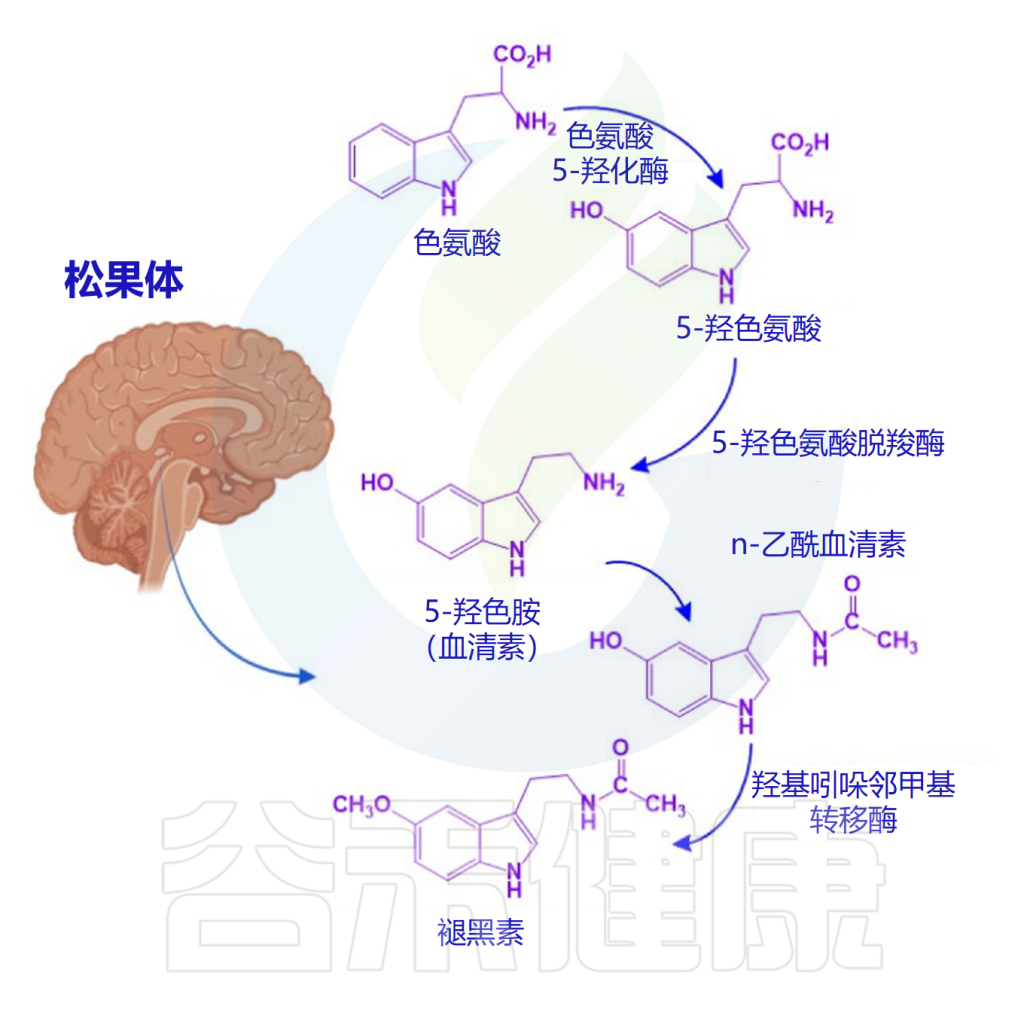
✦ 色氨酸是合成褪黑素的原料
松果体通常在黑暗环境中产生褪黑素,褪黑素生物合成从色氨酸开始,接着色氨酸转化为血清素(5-羟色胺)。5-羟色胺会经历两个酶促反应:首先,N-乙酰基转移酶进行N-乙酰化,产生N-乙酰-5-羟色胺。
然后,通过羟基吲哚-氧-甲基转移酶的作用,甲基从S-腺苷甲硫氨酸转移到N-乙酰血清素的5-羟基。N-乙酰基转移酶是褪黑素合成的限制步骤,它具有昼夜节律,夜间活动是日间活动的50到100倍。
褪黑素的生物合成途径

Miranda-Riestra A,et al.Molecules.2022
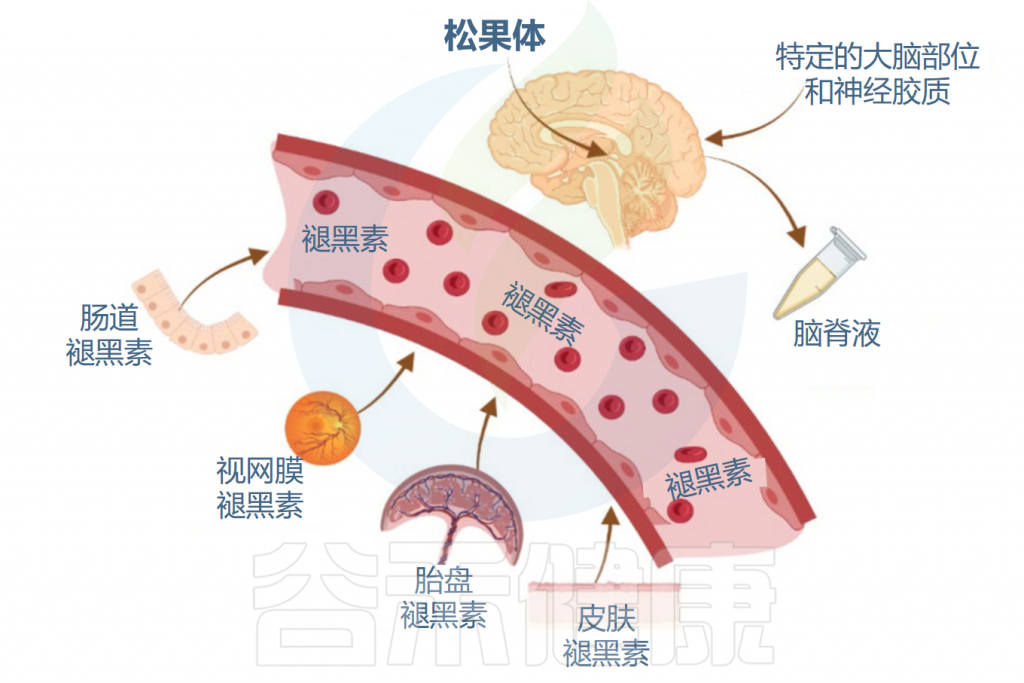
✦ 其他部位也可以产生褪黑素
值得注意的是,其他组织和器官也会产生褪黑激素,包括视网膜、胃肠道、皮肤和免疫细胞。其在胃肠道中的浓度比血清中的浓度高10至400倍。
注:胃肠道中的褪黑素主要由肠嗜铬细胞、某些类型的免疫细胞和肠道共生细胞产生。肝脏几乎会降解所有褪黑素,这表明胃肠道褪黑素仅限于肠-肝轴,而不是循环到其他器官,并且它在局部发挥作用。
在这些外周组织中,褪黑素的产生可能不会直接受光暗周期调节,但可能受到其他因素(例如饮食和局部信号)的影响。
褪黑素在体内的合成

Miranda-Riestra A,et al.Molecules.2022
平均而言,松果体每天产生0.1至0.9毫克褪黑素。但一些因素会影响褪黑素的分泌。
✦光照
光照对于调节褪黑素的产生起着至关重要的作用。视网膜中称为本质光敏视网膜神经节细胞(ipRGC)的特殊细胞可检测光并向下丘脑视交叉上核 (SCN)发送信号。
当暴露于光,特别是蓝光时,这些细胞会抑制褪黑素的产生。这是因为光照会抑制血清素N-乙酰转移酶和N-乙酰血清素O-甲基转移酶的活性,这些酶参与褪黑素合成。

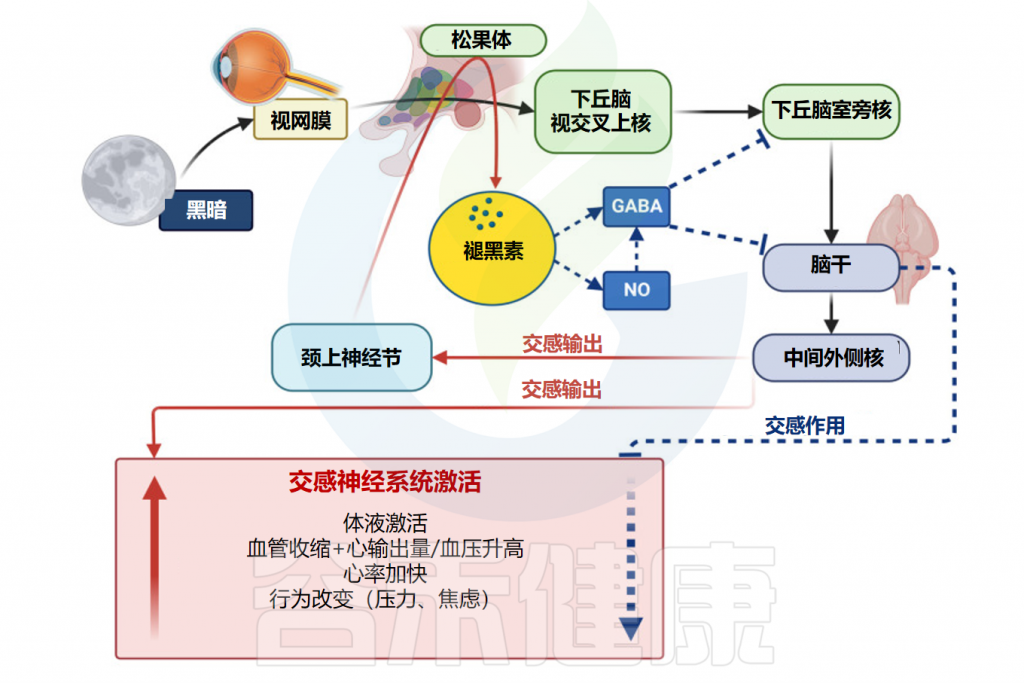
Repova K,et al.Int J Mol Sci.2022
在没有光的情况下,例如在夜间,褪黑素合成的抑制被消除。SCN向松果体发出信号,以增加褪黑素的产生。因此,褪黑素水平上升,促进困倦并帮助调节睡眠-觉醒周期。
✦生物钟
褪黑素的分泌与人体的生物钟密切相关。人体的生物钟是一种内在的生物节律,调节睡眠和其他生理过程。
褪黑素的分泌通常在晚上增加,帮助人们入睡。保持规律的作息时间和良好的睡眠习惯有助于维持正常的褪黑素分泌。

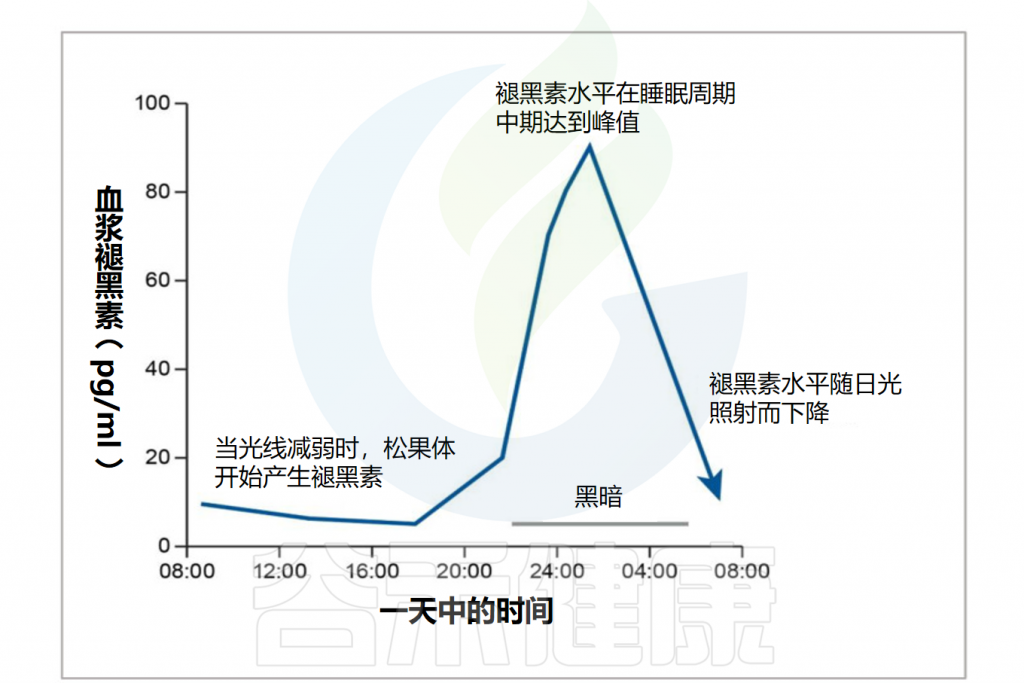
Minich DM,et al.Nutrients.2022
✦年龄
婴儿的褪黑素分泌和昼夜节律要到三个月左右才会发育。母乳喂养的婴儿可以从母乳中获得褪黑素。
从婴儿期到青春期,褪黑素的分泌水平随着年龄增长并达到稳定水平,然后从二十多岁开始随着年龄的增长而缓慢下降。儿童通常比成人产生更多的褪黑素。这也是为什么年长者常常会有睡眠质量下降的问题。

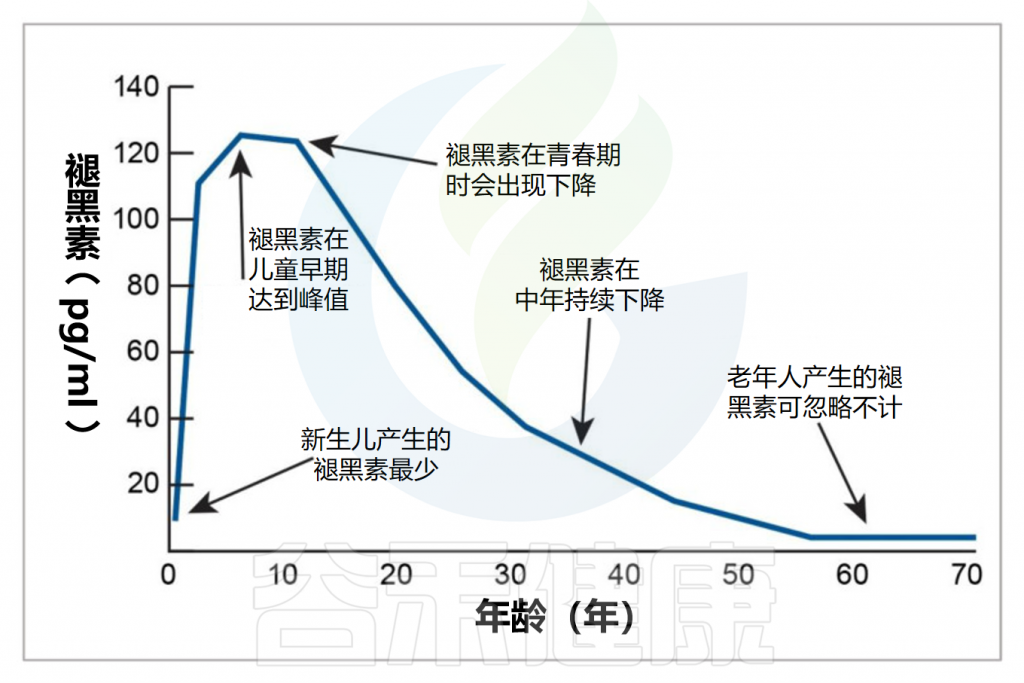
Minich DM,et al.Nutrients.2022
✦色氨酸可用性
色氨酸(褪黑素合成的前体)的可用性也会影响褪黑激素的产生。色氨酸是通过饮食来源获得的,并且可能受到饮食和新陈代谢等因素的影响。
充足的色氨酸对于合成血清素是必要的,血清素进一步转化为褪黑素。
✦药物和化学物质
某些药物和化学物质可能会影响褪黑素的分泌。例如,一些抗抑郁药物、抗高血压药物和咖啡因都可能抑制褪黑素的产生。
✦疾病和身体状况
一些疾病和身体状况也会影响褪黑素的分泌。例如,睡眠障碍、抑郁症、焦虑症和肾脏疾病等都可能干扰褪黑素的正常分泌。
值得注意的是,褪黑素产生的调节是复杂的,涉及多种因素之间的相互作用。昼夜节律紊乱,例如轮班工作、时差反应或夜间暴露在人造光下,可能会影响褪黑素的产生并扰乱睡眠模式。
总体而言,褪黑素的产生主要受到昼夜节律的调节,其中光照在抑制褪黑素合成中起着关键作用。黑暗和色氨酸的可用性促进褪黑激素的产生,有助于调节睡眠-觉醒周期并促进健康的睡眠模式。
褪黑素是一种多功能分子,在人体内具有多种生物学作用。在本节中,将介绍褪黑素对生理活动及人体健康的相关影响。

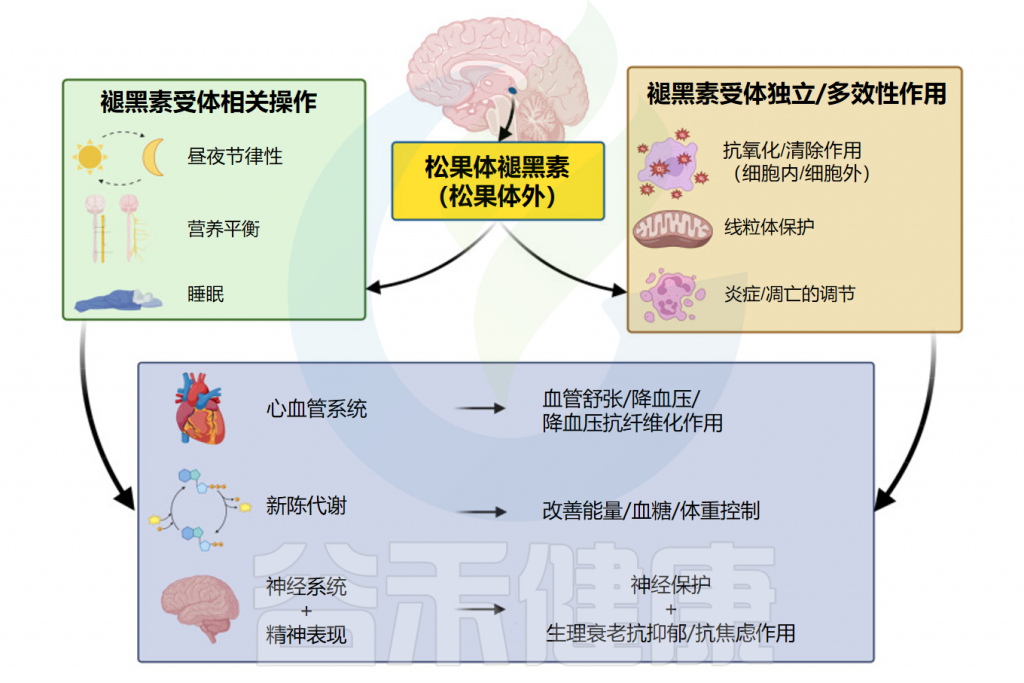
Repova K,et al.Int J Mol Sci.2022
▼
抗氧化、抗炎作用
许多研究已确定褪黑素是一种强大的自由基清除剂,甚至可能是迄今发现的最强的内源性自由基清除剂。体外和体内研究证明了褪黑素在抗氧化防御、减少氧化应激和抗炎过程中的作用。
• 褪黑素具有非常强的抗氧化作用
褪黑素是一种高效的抗氧化剂,因为一个褪黑素分子可以通过与其二级、三级甚至四级代谢物相关的级联机制清除多种活性氧和氮。
褪黑素的双重作用可以抑制促氧化酶(例如黄嘌呤氧化酶),同时还可以增强关键的抗氧化酶,例如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶,有助于人体的第一道免疫防御和代谢解毒。
• 褪黑素可以抑制促炎性细胞因子
此外,褪黑素可以阻断作用于环加氧酶(COX-2)的促炎过程,并抑制炎症介质如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)。
褪黑素还可以增强异常细胞的程序性细胞死亡(细胞凋亡),这在理论上使其成为一种理想的疾病治疗方法。
▼
调节昼夜节律,改善睡眠质量
人类的昼夜节律主要是由光照引起的,生活方式因素可能导致外在的昼夜节律障碍,如轮班工作或时差障碍,补充褪黑素可以通过提前或延迟来调节昼夜节律。
褪黑素对具有睡眠和昼夜节律紊乱人群的影响已得到充分证实。在失眠患者中,外源性褪黑素对一些睡眠参数有显著影响,如入睡潜伏期、总睡眠时间、早晨警觉性和睡眠质量。

• 缩短了入睡潜伏期
一项针对失眠患者的荟萃分析包含5项原始研究,结果表明睡前2小时服用褪黑素2mg显著缩短入睡潜伏期。
在其他一些目标群体中,也提供了褪黑素在纠正昼夜节律方面的证据。一项针对睡眠觉醒时相延迟障碍(DSWPD)患者的荟萃分析得出的结论是,外源性褪黑激素可提前内源性褪黑激素的发作并缩短入睡潜伏期。
在有时差症状的受试者、轮班工人和非24小时睡眠-觉醒节律障碍中也观察到褪黑素对睡眠参数的改善作用。
• 减少早醒时间,增加深度睡眠时间
最近的一项随机对照试验检查了97名中年失眠患者服用较高剂量的褪黑素(3毫克)4周对睡眠障碍的影响。研究显示褪黑素对睡眠参数有积极影响,例如减少早醒时间和增加深度睡眠百分比。
注:这些是睡眠的重要阶段,对于身体和大脑的恢复和健康至关重要。
▼
缓解焦虑
褪黑素除了对肠道炎症有一定的缓解作用外,多项研究表明,服用褪黑素还能发挥抗焦虑作用。
褪黑素的抗焦虑作用机制尚不完全清楚,可能与直接或间接作用有关。直接作用与大脑中褪黑素受体有关,间接作用与褪黑素调节各种神经体液系统(包括交感神经系统、糖皮质激素和神经递质)的能力有关,从而可能干扰应激反应和昼夜节律,并改变氧化和和炎症。
• 褪黑素用于预防术前和术后焦虑
在人类中,褪黑素已被测试为预防术前和术后焦虑的药物,作为麻醉药和止痛药辅助药物,以及用于预防术后谵妄。
临床研究表明,在接受腹部子宫切除术、静脉局部麻醉期间的手部手术或其他选择性手术的患者中,作为术前用药给予褪黑素可以减少术前焦虑,并且与苯二氮卓类药物的抗焦虑治疗同样有效。
在接受小型择期手术的儿童中,褪黑素与咪达唑仑一样,可以减轻术前分离焦虑和与引入麻醉面罩相关的焦虑。
• 褪黑素可能比一些精神药物更安全
此外,一些临床研究观察到褪黑素在降低术后兴奋、苏醒性谵妄和睡眠障碍发生率方面优于咪达唑仑。褪黑素还可以减轻结直肠手术和腹部子宫切除术患者的术后疼痛,同时减少吗啡用量。
值得注意的是,褪黑素可以有效抵消精神药物引起的代谢副作用。褪黑素可降低抗精神病药物治疗引起的血压、体重增加或胆固醇水平。
褪黑素似乎是苯二氮卓类药物的一种安全替代品,可以缓解儿童和成人与外科手术相关的焦虑,同时被认为是一种安全且耐受性良好的药物。苯二氮卓类药物会损害麻醉后的精神运动和认知功能,但褪黑激素却不会。
此外,褪黑素在人体内还有一些非常重要的功能:
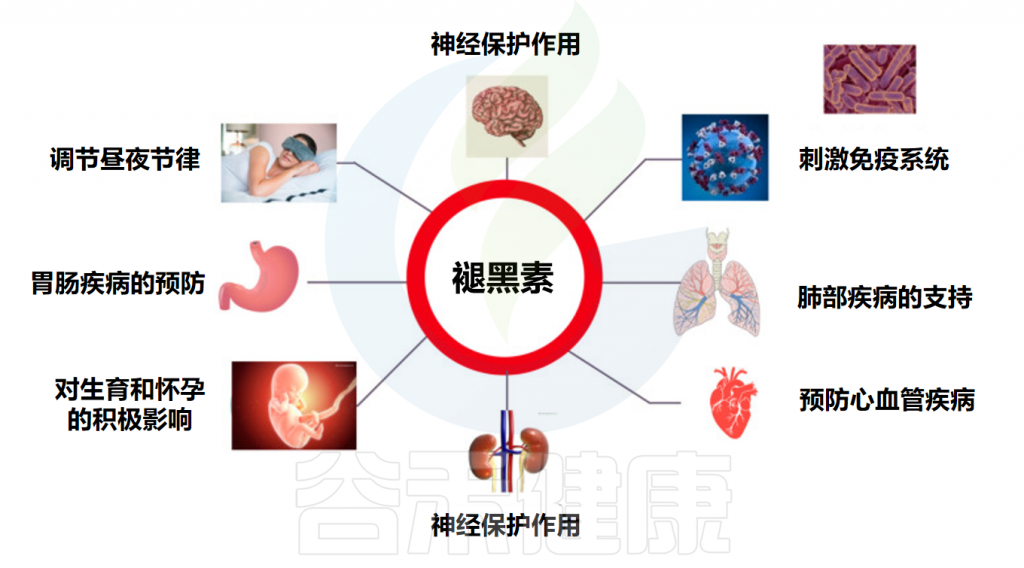

Markowska M,et al.Cells.2023
褪黑素对人体功能具有多种影响




Minich DM,et al.Nutrients.2022
▼
神经保护和神经再生作用
褪黑素的浓度变化与睡眠-觉醒周期紊乱、情绪紊乱、认知能力障碍、神经系统保护等有关。
• 对神经系统具有保护作用
由于其抗氧化特性,褪黑素可作为自由基的清除剂,在分子水平上调节多种反应,包括氧化应激、炎症和细胞凋亡。
它会影响神经营养素或神经递质的浓度。还有文献记载,褪黑素是钙蛋白酶的抑制剂,其活性在许多中枢神经系统疾病的发病机制中具有重要意义。
神经退行性疾病的发病机制与线粒体功能障碍有关。线粒体作为细胞能量来源,也是氧化损伤的目标。线粒体膜的敏感性会受到多种因素的损害,口服褪黑素可能会得到保护。线粒体膜选择性地吸收褪黑素,这是其他抗氧化剂不具备的功能。
初步研究还表明,它可能是淋巴液中的活性成分,有助于清除代谢废物,例如淀粉样蛋白的堆积。理论上,基于这一发现,从治疗角度来看,服用褪黑素可能是值得的,这样患有神经退行性疾病的老年人可以增加脑脊液和类淋巴液的水平。然而,这个概念仍处于起步阶段。
▼
免疫调节和加强监视
褪黑素另一个重要作用是其免疫调节和加强免疫监视的能力。它刺激参与体液免疫和细胞免疫的不同细胞系的产生,例如巨噬细胞、自然杀伤细胞和CD4+细胞,并影响多种细胞因子的合成。
• 褪黑素可以加强免疫调节和免疫监视
褪黑素的直接抗病毒和抗菌作用已被记录。在严重感染期间,服用褪黑激素已被发现具有免疫调节和细胞保护功能,可以降低病毒和细菌炎症的死亡率。
• 褪黑素还曾用于新冠期间的辅助治疗
考虑褪黑素在氧化应激、炎症过程以及免疫反应管理中的作用,对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的病毒感染患者进行了检查。
研究表明,使用褪黑素作为辅助治疗可能是有益的,在2019年新冠状病毒(COVID-19)期间也使用了褪黑激素。
▼
预防胃肠道疾病
消化系统中的褪黑素除了具有抗氧化作用和刺激免疫系统的能力外,还可以减少盐酸的分泌,增强上皮的再生,并增加微循环。
• 褪黑素有助于预防胃肠道疾病
所有这些功能使褪黑素成为预防不同胃肠道疾病的治疗选择之一,例如结直肠癌、溃疡性结肠炎、胃溃疡和肠易激综合症。
据记载,补充褪黑素可以使胃食管反流病完全缓解。它对影响食道和胃的急性和慢性刺激物具有保护作用。
一些研究还证实,褪黑素在预防非酒精性脂肪性肝炎方面对肝细胞具有很强的支持作用。
▼
改善血压、血糖
• 褪黑素可以降低胆固醇和改善血压
在30名患有代谢综合征的患者中,使用褪黑素(每天5毫克,睡前两小时)短短两个月后,低密度脂蛋白胆固醇和血压就得到了改善,而这些患者三个月的生活方式没有改变。
此外,褪黑素已被证明可以降低夜间高血压,改善收缩压和舒张压,降低颈内动脉搏动指数,减少血小板聚集,并降低血清儿茶酚胺水平。
香港中文大学研究人员最近进行的一项荟萃分析和系统评价得出结论,口服褪黑素补充剂可将睡眠收缩压降低3.57毫米汞柱。
其他研究表明,褪黑素可以改善心力衰竭患者的预后,并被认为是这些患者的预防和辅助治疗措施。
• 褪黑素可能有助于血糖控制
关于褪黑素是否有助于血糖控制的疾病(例如非胰岛素依赖型2型糖尿病)存在一些讨论。最近一项针对男性糖尿病患者的相对小型安慰剂对照研究表明,服用10毫克褪黑素三个月后,胰岛素敏感性降低了12%。
褪黑素对糖尿病人群口服葡萄糖耐量的影响差异可能与褪黑素受体1B基因(MTNR1B)中2型糖尿病相关G等位基因的多态性有关。
▼
对生育的影响
• 褪黑素有助于提高生育能力
已经在动物和人类群体中进行了褪黑素给药对生育影响的研究。研究发现,褪黑素可以提高生育能力、卵母细胞质量、成熟度和胚胎数量。
此外,还提出了在怀孕期间的积极作用。神经发生的保护、对胎盘的支持性影响以及氧化应激的减少是提高生育率和改善胚胎-胎儿发育的关键。
活性氧会在怀孕期间引起干扰,它们也是围产期并发症的罪魁祸首。褪黑素是自由基的清除剂,具有抗氧化和细胞保护能力,这可能对成功怀孕至关重要。
• 褪黑素影响新生儿的健康状况
褪黑素不仅在怀孕期间发挥着重要作用,而且在新生儿病理发生时也需要其支持。褪黑素是脱氧核糖核酸(DNA)甲基化和组蛋白改变过程中的监管者。这样可以避免基因表达的根本性变化。使胎儿受到保护,免受一些疾病的影响。
怀孕期间褪黑素浓度不足可能会在个体发育早期的遗传密码中留下内分泌紊乱,随后在儿童期发生。
▼
对骨骼健康的影响
根据细胞和临床前数据,有人认为褪黑素作用于骨代谢的合成代谢和分解代谢方面。
• 褪黑素增加了绝经后妇女的骨密度
一些临床试验证明了褪黑素在重新平衡围绝经期妇女骨重塑中的作用和增加绝经后骨质减少妇女的骨密度。
具体研究
在这些研究中,使用了多达3毫克的补充褪黑素。根据名为褪黑素微量营养素骨质减少治疗研究的为期一年的临床试验的结果,褪黑素(5毫克)、柠檬酸盐(450毫克)、维生素D3(2000IU/50微克) 的组合与安慰剂相比,能够对绝经后骨质疏松女性的骨标志物(例如骨矿物质密度)产生有利影响。
除了有益地改变骨标志物之外,干预措施还改善了情绪和睡眠质量等生活质量指标。当然,不能因此推断褪黑素是造成这些影响。
研究人员认为褪黑素是与年龄相关的骨骼肌疾病的关键化合物,因为它通过其抗氧化潜力参与线粒体功能。这方面的研究结果可能对恶病质或肌肉减少症患者有帮助。
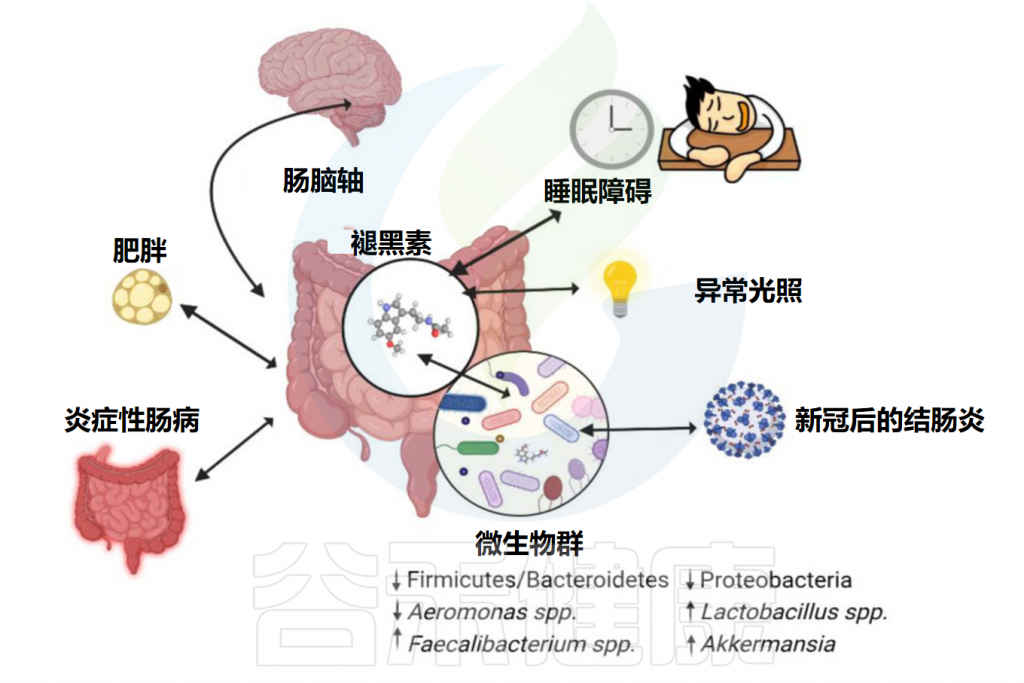
除了上述的影响外,褪黑素与肠道微生物组之间的相互作用也很有趣。肠道中包含着大量的微生物,其与人体健康密切相关,褪黑素已被发现与肠道微生物存在复杂且多样的联系,并可能因此影响人体健康。让我们一起来了解下。
褪黑素主要由两种细胞产生:松果体细胞和肠嗜铬细胞。松果体细胞位于大脑内的松果体中。肠嗜铬细胞位于整个胃肠道的表面,在胃肠道的粘膜内层浓度很高。
与松果体细胞不同,肠嗜铬细胞不受光和暗的调节,但似乎受到食物摄入和消化的影响。
注:肠嗜铬细胞是神经内分泌免疫细胞,对肠道稳态至关重要。
★ 肠道中的褪黑素浓度比血清中高很多
据估计,肠道内的肠嗜铬细胞所含的褪黑素含量是松果体细胞产生的褪黑激素的400倍。肠道褪黑素水平可能比血清中褪黑激素水平高10至100倍。
肠嗜铬细胞中褪黑素的生物合成
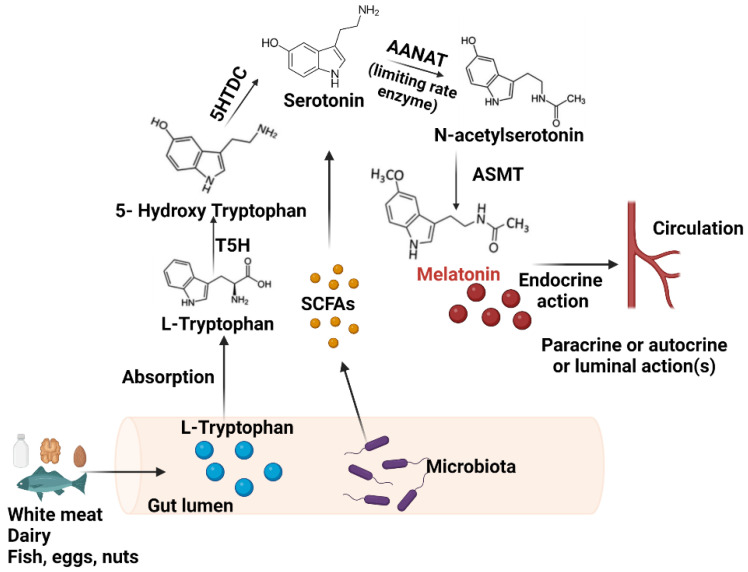
Iesanu MI,et al.Antioxidants (Basel).2022
肠道中褪黑素的释放以旁分泌方式发挥作用,增加胃粘膜的活动和循环,并增强胃肠道运动。此外,褪黑素在肠道中具有抗兴奋特性。它可以刺激上皮细胞的再生,并且还被证明对胃肠道内壁具有保护性抗氧化作用。
旁分泌——通过扩散而作用于邻近细胞的激素传递方式。

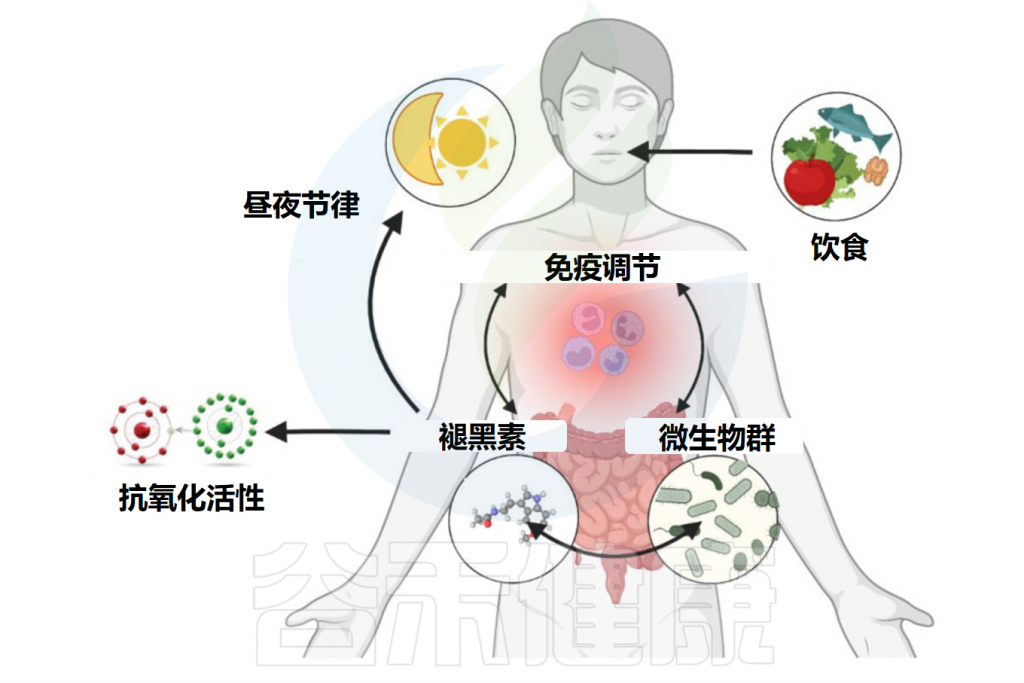
Iesanu MI,et al.Antioxidants (Basel).2022
值得注意的是,关于松果体产生的褪黑素和肠道来源的褪黑素如何相互关联,是否存在肠道-松果体轴串扰,以及不同的饮食模式甚至特定食物、禁食方案或进餐时间可能相互影响,仍然是推测性的。改变全身褪黑素水平与饮食和肠道产生的褪黑素这一领域还需要通过更多的研究来回答。
褪黑素和肠道细菌之间似乎具有复杂的相互关系。如下所述,微生物可以调节胃肠道中褪黑素的合成;相反,褪黑素与肠道微生物群的组成和动态有关。它们共同形成一个复杂的系统,在多个层面上发挥作用,以维持宿主的体内平衡。
• 肠道菌群影响褪黑素的前体进而影响其水平
肠道菌群可以通过调节其必需的前体色氨酸和5-羟色胺来影响褪黑素水平。色氨酸的可用性可以通过饮食改变或通过改变肠道微生物群组成来改变。
肠道中色氨酸代谢的三种途径都可以受到肠道细菌的调节。关于吲哚途径,微生物组特征决定了吲哚衍生物的类型。这些吲哚衍生物具有广泛的作用,从对肠粘膜和免疫系统的有益结果到肾毒性。
此外,炎症刺激激活的Toll样受体和肠道细菌释放的病原体相关分子模式分子会刺激犬尿氨酸途径。
肠腔中产生的短链脂肪酸刺激肠嗜铬细胞释放血清素并增强褪黑素的产生。内源性孢子形成细菌产生的其他代谢物可以激活肠嗜铬细胞并促进结肠中5-羟色胺的生物合成。
此外,抗生素引起的生态失调会增强吲哚途径,抑制犬尿氨酸途径,并降低动物模型中的结肠5-羟色胺。
• 病原菌感染后褪黑素的分泌减少
多种细菌对肠道合成褪黑素有影响。例如,胃粘膜幽门螺杆菌感染会下调褪黑激素生成酶的表达,并减少胃肠道中褪黑素的产生。感染清除后,褪黑素产量恢复到正常水平。
• 益生菌可能刺激褪黑素的产生
益生菌,对各种与菌群失调相关的疾病有效。研究还表明益生菌在刺激褪黑素产生方面发挥有益作用。
短期施用益生菌鼠李糖乳杆菌可以增加斑马鱼中褪黑素受体基因的丰度,与光周期转变为持续黑暗的结果相似。因此,益生菌似乎有可能影响褪黑素的产生,从而缓解各种疾病状态。
相反,生态失调和随后的肠道损伤可能会降低局部肠道和全身褪黑素水平。
越来越多的证据表明,褪黑素可以调节肠道微生物的组成和丰度,尤其是在各种病理状态下。
如下所述,褪黑素通过其作为抗氧化剂、免疫调节剂和昼夜节律调节剂的特性间接影响肠道微生物群,研究发现其还可能直接影响肠道微生物群。
• 褪黑素影响肠道微生物的昼夜节律
在人类中,褪黑素分泌主要以昼夜节律方式在夜间发生,血浆中最高水平出现在凌晨2至4点左右。
褪黑素的节律性释放由下丘脑前部的视交叉上核调节,代表中枢昼夜节律发生器。视交叉上核神经元的轴突投射到邻近的下丘脑核、丘脑和脑干,并使昼夜节律的一些组成部分同步,例如睡眠/觉醒节律、进食时间表和垂体/肾上腺轴的活动。
胃肠道和微生物群表现出与昼夜节律相关的变化,体外研究表明,多种肠道细菌受光暗循环影响,并与参与生物节律的分子密切相关。昼夜节律失调会引起并加剧炎症性肠病的炎症。
褪黑素含量高时,产气肠杆菌增殖的更快
产气肠杆菌(Enterobacter aerogenes)是人类肠道中普遍存在的细菌,具有昼夜节律,并对白天的褪黑素波动做出反应。
当褪黑素存在时,产气肠杆菌以剂量依赖性方式增殖得更快。此外,当暴露于色氨酸、5-羟色胺或N-乙酰血清素时,没有观察到相同的效果,这突显了褪黑素的重要性和敏感性。
产气肠杆菌主要生存于人类和动物的肠道,为人体内的正常菌群,在人体虚弱的特殊情况下才偶尔引起疾病。
此外,大肠杆菌和肺炎克雷伯菌对褪黑素的敏感性不同。另一项研究表明,高脂肪饮食会损害肠道细菌的日常波动,而褪黑素可以使这些波动正常化,这表明这种重新同步可能具有治疗意义 。
微生物代谢物(例如丁酸盐)的昼夜变化会影响宿主的生物钟。鉴于细菌代谢物的产生是周期性的,微生物功能与宿主的昼夜节律和代谢之间存在隐含的联系。
• 通过氧化还原平衡影响肠道微生物组成
褪黑素的抗氧化活性存在于多种功能中,直接作用是中和自由基,间接作用是通过增加抗氧化酶的水平来发挥作用。
健康的肠道微生物群也具有相当大的抗氧化作用。共生细菌直接参与活性氧的代谢,因为产生乳酸的细菌(例如乳杆菌属)具有乳酸氧化酶、超氧化物歧化酶和丙酮酸氧化酶,这些酶可以去除活性氧,减少氧化应激。
在较高浓度下,活性氧具有潜在毒性并导致生物分子损伤,例如蛋白质、脂质和DNA的氧化,这可能导致多种细胞功能障碍,包括细胞死亡。
结肠健康很大程度上受到肠道抑制过量活性氧产生的能力的影响。值得注意的是,肠道微生物群的组成根据氧化还原平衡而变化。在暴露于氧化应激的小鼠中,肠道微生物群经历了拟杆菌门的增加和厚壁菌门、梭菌目、瘤胃球菌属(Ruminococcus)和颤螺菌属(Oscillospira)的减少。
在衰老模型中,小鼠年龄越大,活性氧产生量越高,梭菌目数量减少,拟杆菌门丰度增加。当肠道损伤和生态失调时,胃肠道的抗氧化活性会受到抑制。例如,在炎症性肠病患者中,共生细菌多样性的减少和微生物群组成的变化与活性氧产生增加和肠粘膜防御系统受损有关。在这些情况下,褪黑素可以发挥其抗氧化活性并重建氧化还原平衡,从而改善肠道微生物群组成。
与其他器官类似,在肠道中,褪黑素不仅清除活性氧,还上调不同的抗氧化酶(GSH-Px、CAT、SOD)并下调促氧化酶。褪黑素可以通过与活性氧相互作用直接发挥其活性,或通过膜和核受体发挥其活性,膜和核受体作为其间接抗氧化作用的介质。
褪黑素激活该通路中的多个应激反应基因(例如AMPK、HIFa、Sirt),进而导致多种抗氧化酶的增加。
因此,通过所有这些褪黑素介导的途径减少肠道微生物群的氧化应激对肠道微环境具有显著影响。
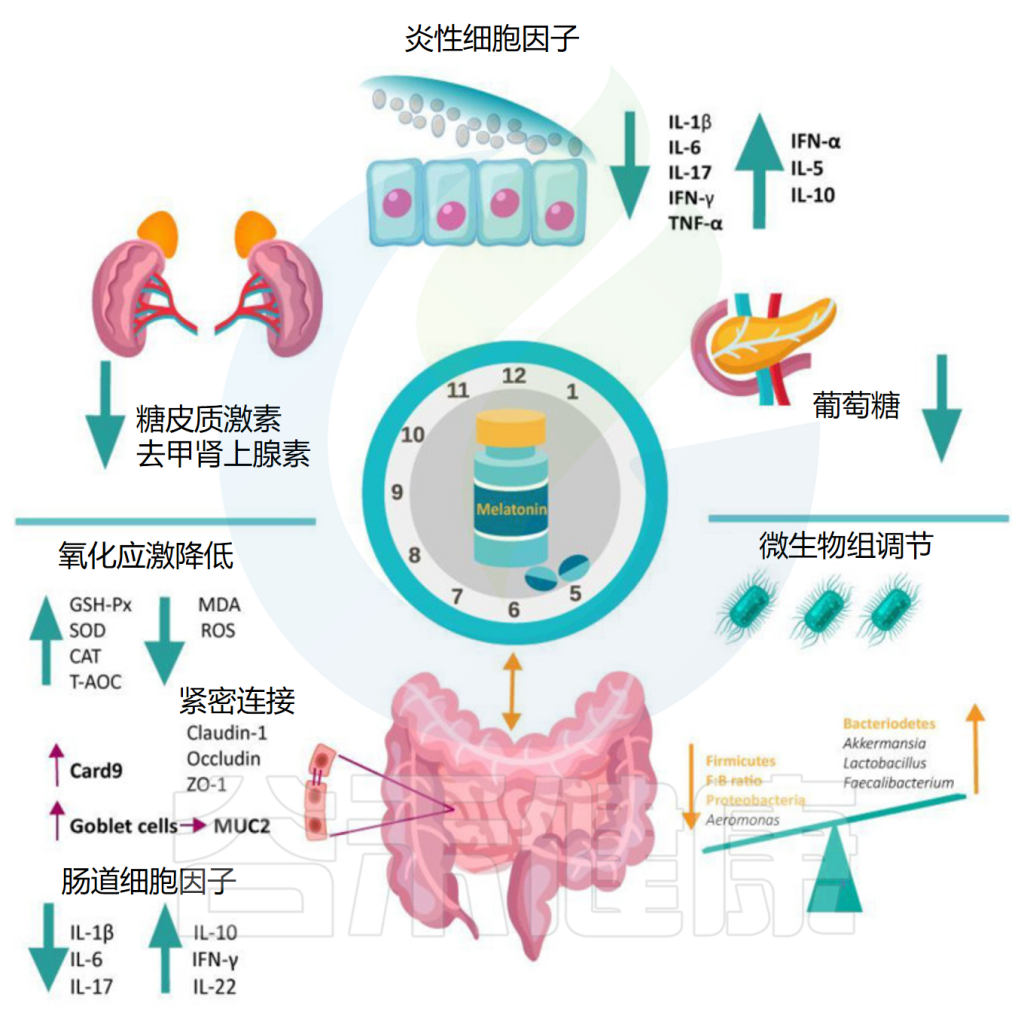
越来越多的证据表明,褪黑素可以调节肠道特性和常驻微生物,以应对压力(例如睡眠障碍)。
当评估褪黑素、睡眠障碍和肠道微生物组之间的相互作用时,在有明显肠道损伤的临床前研究中,血浆和肠道褪黑素水平会降低。
总体而言,在睡眠障碍患者中补充褪黑素可以重建肠道微生物群平衡和肠道屏障的完整性,恢复了肠道微生物群的丰富性和多样性。

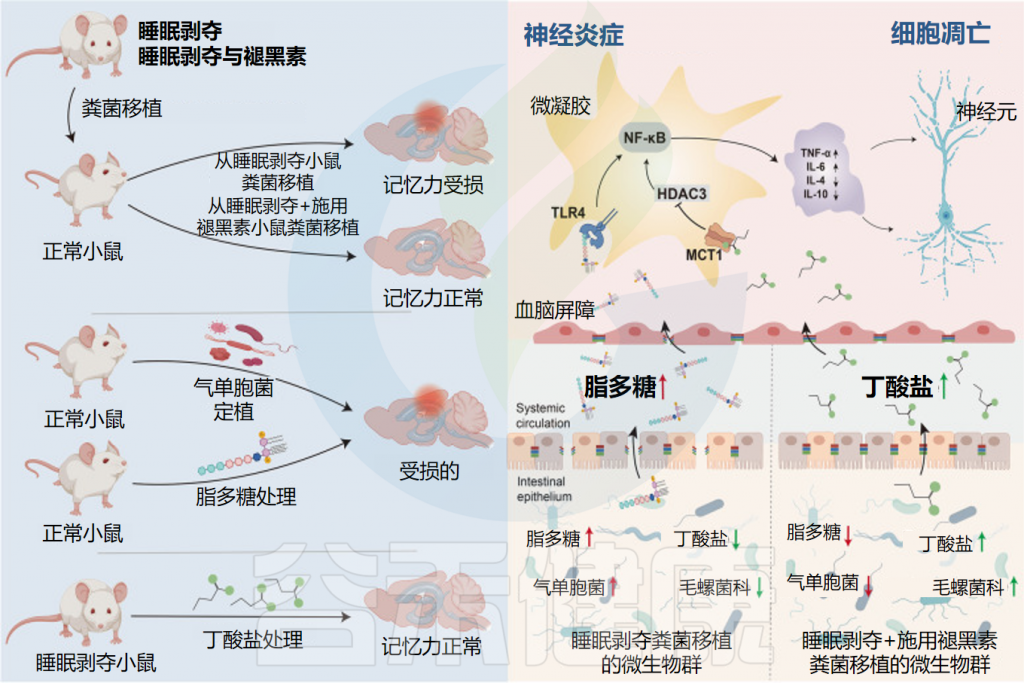
Wang X,et al.Microbiome.2023
• 增加了有益菌的丰度
在属水平上,补充褪黑素增加了阿克曼氏菌、乳杆菌、拟杆菌和粪杆菌(这些已知的有益细菌可以降低炎症),并减少了影响结肠炎的气单胞菌。
显著增加了阿克曼氏菌的丰度
褪黑素显著增加了阿克曼氏菌(Akkermansia muciniphila)的丰度,这种细菌以其在肠道中的有益作用而闻名(例如,增加粘蛋白产生,保持屏障完整性)。
提高了产丁酸盐细菌的丰度
此外,褪黑素通过增加拟杆菌属、乳杆菌属、阿克曼氏菌属和粪杆菌属的丰度,提高了丁酸盐的水平,丁酸盐是肠道微生物群的重要有益代谢物之一。
• 重建肠道屏障完整性
褪黑素还通过恢复因睡眠障碍受损的杯状细胞数量、粘液产生和肠上皮细胞增殖,增加紧密连接蛋白(claudin-1、occludin、ZO-1)和含有半胱天冬酶募集结构域的蛋白9(CARD9)的表达来重建肠道屏障的完整性。
• 降低促炎细胞因子,增加抗炎物质
睡眠障碍也会导致全身产生促炎症状态。褪黑素通过降低促炎细胞因子水平(IL-1β、IL-6、IL-17、TNF-α)同时增加抗炎标志物(IL-5、IL-10、IFN-α、IL-22)来抵消这种影响。
作为一种假定的机制,褪黑素还会下调睡眠剥夺小鼠的TLR4,从而降低长期炎症反应的可能性。
褪黑素在减轻粘膜损伤和生态失调方面发挥着至关重要的作用。这些发现表明,褪黑素可以作为益生元来治疗睡眠障碍相关的肠道损伤,并帮助保持肠道微生物群的平衡。
需要注意的是,褪黑素抑制可能是导致肠道损伤和生态失调的罪魁祸首,而不是睡眠障碍本身造成的应激。
总之,外源性给予褪黑素可恢复由睡眠障碍引起的全身和肠道微生物群改变,这意味着褪黑素在根据健康状况调节微生物群落方面发挥着作用。

Iesanu MI,et al.Antioxidants (Basel).2022
褪黑素和肠道微生物群之间的相互作用对健康和疾病的各个方面都有潜在影响。大量临床和临床前研究证明了褪黑素对结肠炎的保护作用。
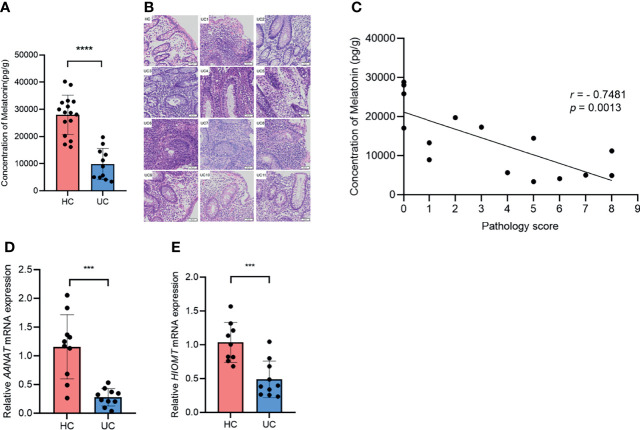
• 结肠炎患者体内褪黑素水平下降
测量了溃疡性结肠炎患者和健康对照的降结肠和乙状结肠中褪黑素的浓度。
与健康对照相比,溃疡性结肠炎患者的褪黑素水平急剧下降。值得注意的是,褪黑素浓度与组织学严重程度之间出现负相关。此外,溃疡性结肠炎患者中褪黑素生物合成途径中的关键酶AANAT和HIOMT的mRNA 水平显著低于健康对照。
这些数据表明溃疡性结肠炎患者的褪黑素水平下降,并且与疾病严重程度呈负相关,表明褪黑素可能参与溃疡性结肠炎的进展。
Zhao ZX,et al.Front Immunol.2022
(A)通过ELISA检测健康对照和溃疡性结肠炎患者中的褪黑素浓度;(B)结肠切片的代表性H&E染色(×20);(C)所有溃疡性结肠炎患者和健康对照的褪黑素浓度与组织学严重程度评分的相关性。
• 服用褪黑素可以减轻结肠炎
发现每日服用50毫克/公斤剂量的褪黑素治疗7天可显著改善恶唑酮诱发的小鼠结肠炎,体重减轻较少,结肠长度较长。
H&E染色显示,褪黑素治疗可预防肠道炎症,与对照组相比,褪黑素治疗导致CD11b+ Ly6G +中性粒细胞显著减少,并且炎症细胞因子的产生减少,例如TNF-α和Il-1β。
这些结果表明,褪黑素可以减轻恶唑酮诱发的结肠炎,炎症反应减少,肠道完整性提高。
• 服用褪黑素调节炎症性肠病的微生物组成
褪黑素改变微生物群组成的α和β多样性
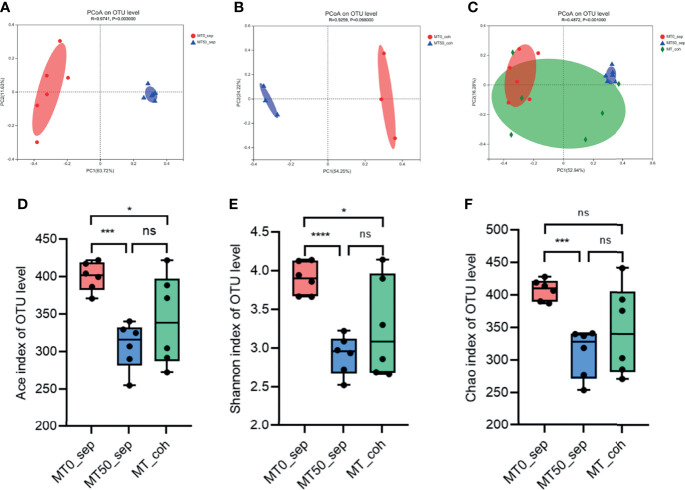
Zhao ZX,et al.Front Immunol.2022
特定的变化与有益菌株的增加和有害菌株的减少有关。例如,褪黑素增加了瘤胃球菌科(Ruminococcaceae)和粪球菌属(Coprococcus)的水平,这两种细菌都是短链脂肪酸产生菌。
它还增加了双歧杆菌的含量,双歧杆菌作为益生菌在炎症性肠病中产生了积极的结果,以及乳杆菌的含量,乳杆菌是该疾病的另一种有前途的辅助疗法。
减少了条件性致病菌
相反,褪黑素给药后,肠道菌群显示出变形菌门显着减少,该门在炎症性肠病发病机制中发挥着重要作用。
链球菌属(Streptococcus)可能代表另一种被褪黑素下调的微生物并与疾病活动相关。另一项研究报告了脱硫弧菌、消化球菌科和毛螺菌科的减少。发现脱硫弧菌和溃疡性结肠炎之间存在明显关联。尽管消化球菌科在炎症性肠病中的研究较少,但在一些研究中与肠道炎症相关。
重要的是,所有这些细菌组成的变化都伴随着明显的临床症状增强——通过多种组织学方法和症状学评估进行量化。这可能表明至少在一定程度上通过微生物群调节来影响褪黑素的效果。
褪黑素在属水平上调节一些微生物群
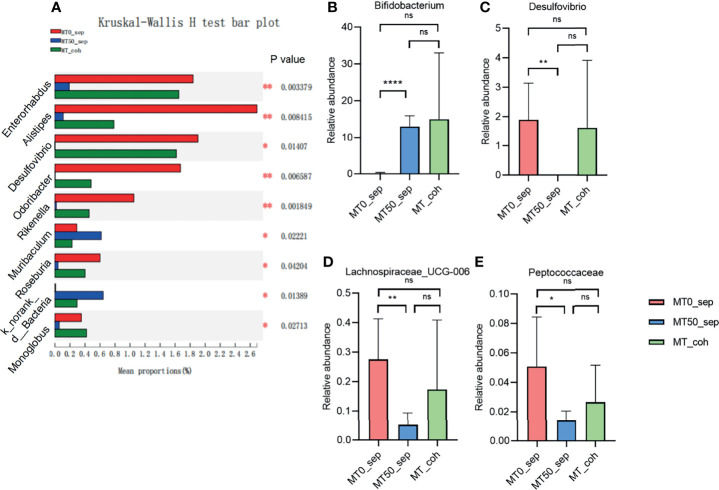
Zhao ZX,et al.Front Immunol.2022
• 褪黑素有利于肠道屏障完整性
总的来说,就肠道微生物群而言,褪黑素不仅具有改变细菌种类组成的能力,而且还能够减少肠道细菌移位。事实上,在结肠炎模型中,褪黑素诱导紧密连接蛋白和闭合蛋白的上调,这些蛋白是肠道屏障的关键组成部分。
细菌易位是一种有害过程,可导致内毒素血症,与炎症性肠病活动呈正相关。
褪黑素对肠道微生物群的调节可能对于缓解结肠炎至关重要。
除此之外,褪黑素还可以逆转高脂肪饮食产生的大多数代谢、形态和肠道微生物组成变化。
• 褪黑素恢复高脂饮食导致的微生物变化
首先,褪黑素成功恢复了因高脂饮食而减少的微生物群多样性,改变了肠道微生物结构,使其类似于正常饮食的小鼠。与对照组相比,褪黑素增加了细菌数量,但它阻止了高脂饮食引起的细菌突然过度生长。
有趣的是,与仅接受高脂饮食的小鼠相比,接受褪黑素的高脂饮食小鼠和对照组的不同类群每日振荡之间存在相似性,证明褪黑素也可以恢复细菌节律性。
它还刺激疣微菌门,包括阿克曼氏菌——一种治疗代谢紊乱的有效益生菌。脱硫弧菌科(产生内毒素的细菌)、Alistipes和Anaerotruncus中的表达下调,这些细菌与肥胖相关。
• 褪黑素改善代谢紊乱,降低脂肪比例
在影响这些微生物组相关的同时,褪黑素显著改善了高脂饮食啮齿动物的代谢紊乱。褪黑素还降低总体重和内脏脂肪比例,促进棕色脂肪组织的产生和产热作用。它还降低炎症、脂肪生成基因表达以及胆固醇和甘油三酯水平。
此外,它重建了时钟基因表达和血清甘油三酯的正常昼夜节律变化,而这些变化被高脂饮食破坏了。它还通过降低血糖和增强胰岛素敏感性来增强葡萄糖代谢。对于肝脏,它可以对抗脂肪变性并抑制 NF-κB信号,该通路与非酒精性脂肪肝病有关。
褪黑素缓解脂质代谢异常的一个特殊机制与抑制大肠杆菌有关。研究人员在时差小鼠模型中研究了与代谢综合征相关的变化,这些小鼠表现出体重增加、回肠脂质摄取增加以及血管生成素样4(脂质代谢调节剂)的减少。同时,观察到大肠杆菌和脂多糖产量增加。褪黑素逆转了所有这些修饰,并且通过下调大肠杆菌和脂多糖的合成,抑制了LPS/TLR4/STAT3等通路,使脂质摄取减少。
肠道微生物群在肥胖和代谢综合征的发展中起着关键作用。褪黑素恢复这种复杂结构正常组成和功能的能力证明了其作为药物治疗这些病症的合理性。
!
注意
需要进一步的研究来充分了解褪黑素–肠道微生物轴对健康和疾病的机制和影响。
然而,它强调了考虑肠道微生物群和褪黑素相互作用在维持肠道健康和整体健康方面的重要性。
褪黑素作为体内最重要的激素之一,过低或过高的含量都会对人体产生一些不利影响。
▸ 褪黑素过低
失眠:褪黑素是调节睡眠的重要激素,过低的褪黑素水平会导致失眠和睡眠质量下降。
生物钟紊乱:褪黑素水平过低可能导致生物钟紊乱,影响日常作息和生理节律。
免疫功能下降:褪黑素具有免疫调节作用,过低的褪黑素水平会导致免疫功能下降,增加感染和疾病的风险。
心理健康问题:褪黑素与神经系统密切相关,低褪黑素含量可能与焦虑、抑郁等心理健康问题有关。
其他健康问题:一些研究表明,褪黑素含量过低可能与肥胖、糖尿病、心血管疾病相关。
▸ 褪黑素过高
通常情况下,人体不会出现褪黑素过高。一般都是在补充了外源性褪黑素的情况下导致体内褪黑素水平过高。

一项研究对2130名患者进行了随机对照试验,发现过量服用褪黑素导致褪黑素水平过高引起的不良事件很少。其中最常报告的不良事件是日间嗜睡、头痛、头晕和体温过低。
除此之外,有一小部分研究发现过高的褪黑素水平可能对性欲和性功能产生负面影响。
由于褪黑素的代谢率较高,补充外源性褪黑素通常被认为是安全且耐受性良好的,大多数负面影响要么在几天内自然消退,要么在停药后立即消退。
褪黑素的分解代谢很快
循环中的褪黑素主要在肝脏和大脑中分解代谢。一般来说,褪黑素的半衰期(即分解一半所需的时间)约为30-50分钟。这意味着褪黑素在体内的浓度会在数小时内迅速降低。
在肝细胞中,褪黑素通过细胞色素P4501A2 (CYP1A2) 进行80%的羟基化;然后,在肾脏中,它被磺基结合(占总分解代谢的70%至80%)或与葡萄糖醛酸结合(占总分解代谢的5%)。
CYP1A2确保肝脏分解代谢。即使在肝脏水平,也存在脱乙酰化和脱甲基化途径。脱乙酰后,褪黑素转化为5-甲氧基色胺,氧化后转化为5-甲氧基吲哚乙酸。
褪黑素对人体如此重要,但经常会因一些外部环境、生活作息或疾病状态导致内源性褪黑素分泌不足,这个时候就需要一些外源性褪黑素来补充。
补充外源性褪黑素也有一些注意事项,包括可用的剂量、最佳服用时间、禁忌症。
除了人体自身会分泌褪黑素外,许多食物中也存在一些天然褪黑素,尤其是植物性食品。
✦ 许多植物性食品中含有褪黑素
自从20世纪90年代中期在植物中首次发现褪黑素(“植物褪黑素”)以来,各种食用植物和草药中的褪黑含量不断被提及。
然而,其浓度范围广泛且不一致,取决于许多因素,例如品种、生长条件、发芽、收获和加工(例如烘烤、干燥)等。
尽管褪黑素存在于大多数植物部位,但植物的生殖器官中的含量通常较高,尤其是种子,可能有助于确保植物的生存并抵御环境压力。
值得注意的是,褪黑素在植物中的众多作用之一是刺激促进健康的植物营养素(如芥子油苷和多酚)产生。
褪黑素已被记录在下列植物性食品和饮料中:


Minich DM,et al.Nutrients.2022
✦ 动物食品中的色氨酸有助于转化成褪黑素
虽然有几个变量需要考虑,但一般来说,动物性食品中的褪黑激素含量相对植物性食品中较少。根据已发表的文献,牛奶和乳制品、鸡蛋、鱼和肉类(牛肉、羊肉、猪肉)含有一定水平的褪黑素。
相反,动物食品往往是比植物食品更好的膳食色氨酸来源,因此可能需要考虑将这些食物最终转化为大量的褪黑素。
如前所述,虽然一些天然食物含有褪黑素,但其含量较低,因此很难获得足够的治疗剂量褪黑素。必须强调的是,几乎所有褪黑素产品都涉及工业加工,因此可能导致一些潜在毒性。
褪黑激素补充剂有多种形式,包括片剂、胶囊、舌下片和液体制剂。
• 褪黑素可能产生副作用和依赖性
在临床应用中,据记录,过多的褪黑素或各种缓释剂型会产生副作用,例如第二天健忘症或“褪黑素宿醉”,发现睡了三到四个小时就睡不好,醒来后无法再入睡。长期高剂量服用褪黑素随着时间的推移,个人可能会产生依赖性。
注:具有某些基因型的人,例如褪黑激素受体1B(MTNR1B)基因多态性,如果补充褪黑素,可能需要监测糖化血红蛋白。
• 补充高剂量的褪黑素会导致体温过低
一项关键研究中,比较了多个剂量:生理剂量(0.3mg)、药理剂量(3mg)和0.1mg的低生理剂量。
研究发现补充0.3毫克/天褪黑素的数据最佳客观。生理剂量(0.3 毫克)可恢复睡眠效率,并将血浆褪黑素水平提高至成年早期的正常水平。药理剂量(3毫克)也能改善睡眠;然而,它会导致体温过低,并导致血浆褪黑素在白天一直保持升高状态。
• 一般补充0.5-3毫克/天为宜
临床上补充褪黑素的剂量通常为每日0.5-3毫克;然而,发现剂量取决于产品类型,在某些情况下较低剂量也同样有效。
剂量参数可能会根据健康状况、睡眠问题类型或相关神经病理学等因素而有所不同,因此还需要根据每位患者提供适当的、个性化的剂量。
• 睡前一小时服用效果较好
从时间角度来看,许多与睡眠相关的研究都表明在睡前三十到六十分钟补充褪黑素效果较好;然而,一些研究表明,提前四个小时服用即可有效。
建议在黑暗环境或较弱光刺激下服用褪黑激素,从而模拟基于明暗模式的生理动力学和昼夜节律。
根据已发表的报告,口服褪黑素大多被认为是安全的,然而,在某些特定情况下可能需要进一步的临床监督。
• 一些药物会影响褪黑素的代谢
早期研究已发现,大部分褪黑素通过细胞色素CYP1A2代谢,小部分通过CYP1A1、CYP1B1和CYP2C19进行较少的代谢活动。
因此,影响这些酶途径的药物将影响褪黑素的代谢。褪黑素与一种或多种药物同时服用时应谨慎;否则,可能会导致不良副作用(如极度镇静)。
例如,最著名的相互作用之一是褪黑素与抗抑郁药物氟伏沙明的相互作用。该药物是一种已知的CYP1A2抑制剂,可通过减少褪黑素的降解来增强褪黑激素水平。同样,咖啡因也通过CYP1A2代谢,并可增加褪黑素水平。
总之,虽然还不全面,但褪黑素可以与具有血液稀释、降血糖、降血压、抗惊厥、镇静、抗抑郁或免疫抑制活性的药物、营养素或草药相互作用或受到影响。
褪黑素的代谢和活性可能会受到许多饮食、补充剂和药物的潜在影响,所有这些都说明了这样一个事实:每个人对褪黑素的个性化反应存在差异,具体取决于他们的饮食和医疗背景。
由于缺乏安全性数据,不建议怀孕或哺乳期的女性补充褪黑素。然而,有一些迹象表明褪黑素在这两个阶段可能都有好处。因此,让这些女性咨询了解患者个性化需求的健康专业人士是关键。同样,被诊断患有任何疾病的人应咨询其健康专业人员并接受医疗监督。
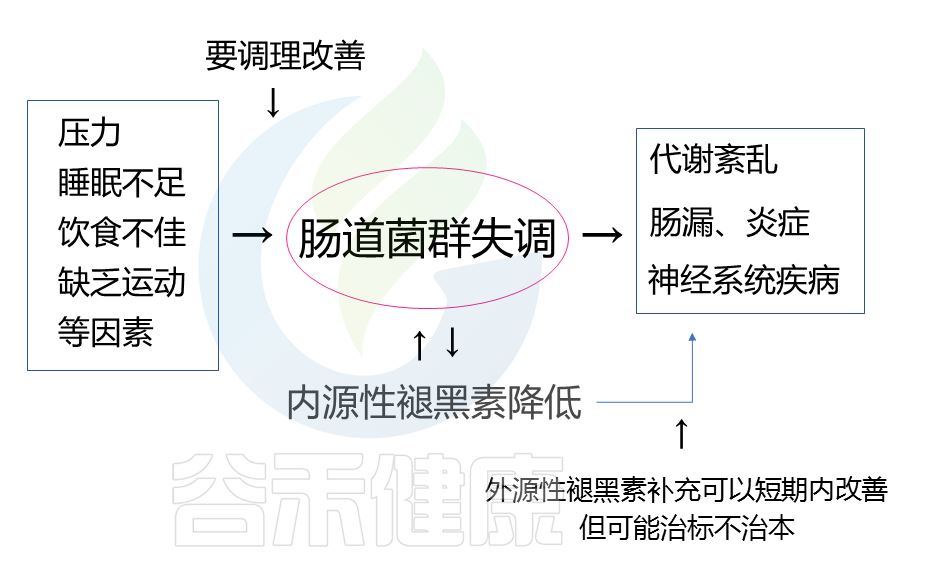
温馨提醒
调查发现,有的褪黑素产品月销已超过3万件,说明需要使用褪黑素来帮助改善睡眠的人已不在少数。需要注意的是,虽然补充外源性褪黑素可以在一定程度上改善睡眠质量、代谢健康或降低焦虑,但服用褪黑素存在的副作用使其不能成为长久的选择。
而且补充褪黑素主要是针对一些因工作昼夜颠倒导致的内源性褪黑素分泌不足造成的睡眠障碍,对于其他原因造成的失眠可能效果一般。我们额外补充的这些褪黑素,并不能促进身体去分泌更多的褪黑素。如果停用褪黑素,可能睡眠情况还会回到原样,并不会解决本质问题。
重点还是要从自身生活习惯出发,改善饮食,调节作息规律,增加体育锻炼并定期体检,及时了解自身健康状况。肠道菌群与很多影响睡眠的因素相关,例如压力、消化等,调节肠道菌群可以更全面地从根本上改善睡眠障碍。
改善内源性褪黑素的措施
除此之外,调节内源褪黑素的措施有以下几种:
•控制光照暴露,睡前半小时不玩手机
光线会影响褪黑素的分泌,晚上避免暴露于强烈的蓝光,尤其是来自电子设备的蓝光。蓝光会抑制褪黑素的分泌,影响睡眠质量。
•维持规律的睡眠时间
建立健康的睡眠习惯,如果不是因为工作导致的昼夜颠倒,尽量每天保持规律的睡眠时间,避免熬夜或睡眠不足。
•营造舒适的睡眠环境
保持安静、黑暗和凉爽的睡眠环境,可以使用遮光窗帘、耳塞或眼罩等辅助工具,有助于提高睡眠质量。
•避免过度应激
减少压力和焦虑,通过放松技巧如深呼吸、冥想和瑜伽等来缓解压力,有助于促进褪黑素的分泌。
•适度运动
进行适度的有氧运动,如散步、跑步或游泳等,可以提高睡眠质量和褪黑素的分泌。
•饮食调整
摄入富含色氨酸的食物,如禽肉、鱼类、坚果和豆类,色氨酸是合成褪黑素的必需物质。此外,可以适量摄入富含维生素B6、钙和镁的食物,这些营养素有助于褪黑素的合成和释放。
褪黑素在临床上有多种应用,以下是一些常见的褪黑素临床应用。
•睡眠障碍
褪黑素补充剂通常用于治疗睡眠障碍,如失眠、睡眠时相延迟综合征和非24小时睡眠觉醒障碍。它可以帮助调节睡眠-觉醒周期并提高睡眠质量。治疗睡眠障碍的剂量通常为0.3毫克至10毫克,睡前30分钟至2小时服用。
•时差反应
褪黑素可用于缓解时差反应症状,时差反应是因跨越多个时区旅行而导致的睡眠-觉醒周期暂时中断的症状。
在睡前适当的时间服用褪黑激素,可以帮助调整人体的生物钟,有利于更快地适应新的时区。
•轮班工作睡眠障碍
夜班或轮班工作的人经常会遇到睡眠困难和昼夜节律紊乱。褪黑素补充剂可用于帮助调节睡眠模式并改善白天的睡眠质量。
•神经退行性疾病
褪黑素已被研究其对阿尔茨海默病、帕金森病和亨廷顿舞蹈病等神经退行性疾病的潜在治疗作用。它具有抗氧化和抗炎的特性,可能有助于保护神经元并减轻神经退行性过程。然而,需要进一步研究以确定其功效和最佳剂量。
•情绪障碍
褪黑素补充剂在治疗重度抑郁症和季节性情感障碍等情绪障碍方面显示出良好的前景。它可能有助于调节昼夜节律、改善睡眠并缓解抑郁症状。
治疗情绪障碍的剂量可能会有所不同,咨询医疗保健专业人士很重要。
•癌症
褪黑素已被研究其潜在的抗癌特性。它具有抗氧化、抗炎和免疫调节作用,可能可以抑制肿瘤生长并增强癌症治疗的有效性。然而,需要更多的研究来确定其在癌症治疗中的功效和最佳用途。
关于褪黑素与肠道微生物群相互作用的新兴研究具有重要的临床意义,并为治疗干预带来了希望。
通过益生菌、益生元或粪菌移植调节肠道微生物群组成和功能可能与补充褪黑素在促进肠道健康和治疗炎症性肠病、肠易激综合征和代谢紊乱等疾病方面具有协同作用。
以下是有关褪黑素-肠道微生物轴未来前景的一些要点。
•时间生物学和个性化医疗
褪黑素和肠道微生物群之间的相互作用为个性化医疗增加了时间生物学的维度。考虑褪黑素产生的昼夜节律以及肠道微生物群组成和功能的昼夜变化,有助于优化针对褪黑激素-肠道微生物群轴的干预措施的时间和剂量。
•微生物代谢物和褪黑激素衍生物
肠道微生物群可以将褪黑素代谢成各种代谢物,其中一些可能具有不同的生物活性。探索这些褪黑激素代谢物的作用及其与肠道微生物群的相互作用可以发现新的治疗途径。
•营养干预
饮食在塑造肠道微生物群组成和功能方面起着至关重要的作用。未来的研究可以调查特定饮食成分,例如色氨酸(褪黑激素的前体)和多酚对褪黑激素-肠道微生物群轴的影响。
了解影响褪黑素产生和肠道微生物群的饮食因素可以为肠道健康的营养干预提供信息。

Iesanu MI,et al.Antioxidants (Basel).2022
•挑战和未来方向
尽管研究数量不断增加,但该领域仍存在一些挑战和未来方向。需要对肠道微生物群和褪黑素测量的研究方法进行标准化,以确保研究之间的一致性和可比性。
需要进行长期临床试验来评估针对褪黑激素-肠道微生物轴的干预措施的安全性、有效性和最佳剂量。
主要参考文献
Iesanu MI, Zahiu CDM, Dogaru IA, Chitimus DM, Pircalabioru GG, Voiculescu SE, Isac S, Galos F, Pavel B, O’Mahony SM, Zagrean AM. Melatonin-Microbiome Two-Sided Interaction in Dysbiosis-Associated Conditions. Antioxidants (Basel). 2022 Nov 14;11(11):2244.
Markowska M, Niemczyk S, Romejko K. Melatonin Treatment in Kidney Diseases. Cells. 2023 Mar 8;12(6):838.
Minich DM, Henning M, Darley C, Fahoum M, Schuler CB, Frame J. Is Melatonin the “Next Vitamin D”?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients. 2022 Sep 22;14(19):3934.
Repova K, Baka T, Krajcirovicova K, Stanko P, Aziriova S, Reiter RJ, Simko F. Melatonin as a Potential Approach to Anxiety Treatment. Int J Mol Sci. 2022 Dec 19;23(24):16187.
Moon E, Kim K, Partonen T, Linnaranta O. Role of Melatonin in the Management of Sleep and Circadian Disorders in the Context of Psychiatric Illness. Curr Psychiatry Rep. 2022 Nov;24(11):623-634.
Zhao ZX, Yuan X, Cui YY, Liu J, Shen J, Jin BY, Feng BC, Zhai YJ, Zheng MQ, Kou GJ, Zhou RC, Li LX, Zuo XL, Li SY, Li YQ. Melatonin Mitigates Oxazolone-Induced Colitis in Microbiota-Dependent Manner. Front Immunol. 2022 Jan 18;12:783806.
Wang X, Wang Z, Cao J, Dong Y, Chen Y. Gut microbiota-derived metabolites mediate the neuroprotective effect of melatonin in cognitive impairment induced by sleep deprivation. Microbiome. 2023 Jan 31;11(1):17.
Miranda-Riestra A, Estrada-Reyes R, Torres-Sanchez ED, Carreño-García S, Ortiz GG, Benítez-King G. Melatonin: A Neurotrophic Factor? Molecules. 2022 Nov 10;27(22):7742.
Zhang B, Chen T, Cao M, Yuan C, Reiter RJ, Zhao Z, Zhao Y, Chen L, Fan W, Wang X, Zhou X, Li C. Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer’s Disease and Obesity. Front Immunol. 2022 May 10;13:900132.

谷禾健康
在过去几十年中,人类的饮食行为发生了巨大的变化。传统的早餐-午餐-晚餐模式已被频繁的小吃、夜间大餐和不吃早餐所取代。这种不规律的饮食模式可能对心血管代谢疾病风险产生不利影响,如肥胖、胰岛素抵抗、高血糖症、2型糖尿病等。
间歇性禁食已被越来越多的人认为是一种有前途的治疗心血管代谢疾病(CMD)的方法。一些神经科学家认为,我们的身体已经进化到能够不吃东西几个小时,甚至几天。
进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
间歇性禁食(IF),包括周期性禁食和限时饮食(TRF)等开始越来越流行。

本文讨论肠道微生物组的组成和功能改变,对代谢、高血压、2型糖尿病、肥胖症及其长期微血管和大血管并发症发展的风险之间潜在联系的新证据,同时也包括间歇性禁食的安全性,将间歇性禁食融入日常生活的建议等。
本文关键词

间歇性禁食在进食和禁食之间循环,通常是只能在特定时间进食,比如通过每周12小时至几天的限制进食。它关注的不是吃什么,而是在什么时间段内可以吃。
在食物缺乏的时间内,人体新陈代谢通过产生和利用脂肪酸衍生的酮,以及通过自噬增加细胞水平的营养循环,将脂肪从储存转换到动员。
注:脂肪动员是指储存在脂肪细胞中的脂肪,被脂肪酶逐步水解为游离脂酸(FFA)及甘油并释放入血液,被其他组织氧化利用的过程。
目前已有许多研究表明,间歇性禁食在减轻体重、改善葡萄糖稳态和血脂以及抗炎作用等方面都带来益处。
间歇性禁食包括以下几种常见的方式:
隔日禁食(ADF)
在某一天规律进食和第二天不进食之间进行交替。
周期性禁食(5:2天)
5:2天的进食也称为周期性禁食,其特征是一周两天极度限制或完全禁食,而一周其他五天可以不受限制地进食。
模拟禁食的饮食(FMD)
定期禁食的一种变体,特点是连续几天低热量摄入周期,然后每一到四个月或每隔一周进行一次正常的饮食循环。
限时饮食(TRF)
不那么极端的饮食,将每天的食物摄入量限制在4-12小时内,例如,分别在12:12小时或16:8小时(禁食:进食),包括斋月期间的禁食。
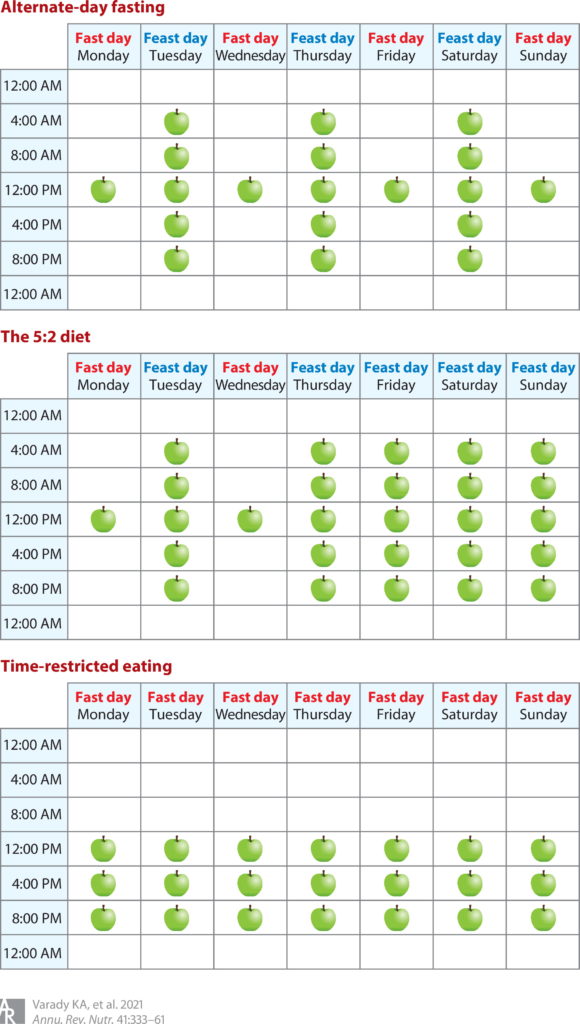
此图概述了一周中每一天的隔日禁食、5:2 饮食和限时进食 (TRE)(此处显示 8 小时 TRE)期间的食物摄入时间。食物摄入时间用苹果图标表示。
临床上对间歇性禁食的研究结果不一致:
几项临床研究表明,间歇性禁食可延长预期寿命并提供广泛的益处,包括减轻肥胖、高血压、2型糖尿病和心血管疾病。
然而,其他研究发现,特定时间的饮食在改善心血管和代谢结果方面并不优于控制能量的饮食。
因此,禁食和进食期间代谢转换的机制值得进一步研究。
最近,间歇性禁食已被证明会影响肠道菌群,几乎涉及宿主生理学的所有方面,这表明间歇性禁食生理影响的全新机制。
人类研究中,关于禁食对肠道菌群的影响

Angoorani P, et al.,Nutr Metab (Lond). 2021
本小节重点介绍一些关于肠道微生物组在间歇性禁食中作用的显著发现,肠道微生物组反过来影响心血管疾病相关的代谢表现,如肥胖、高血糖、高血压等。
我们知道,体重增加是由于过多的能量摄入加上较低的能量消耗,这通常是由体内脂肪的积累造成的。脂肪积累会对心血管系统造成严重的威胁。
关于肥胖与菌群的关系详见我们之前的文章:
体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
对人体随机对照试验的Meta分析表明,每周定期禁食2-3天的间歇性能量限制可改善超重和肥胖使体重减轻,降低体脂。这些改善的重要贡献可归因于肠道微生物群对脂质代谢和能量平衡的影响。
其中一种机制涉及脂肪组织,这是一种对营养刺激敏感并在间歇性禁食期间经历动态重塑的异质器官。
在哺乳动物中发现了两种不同形式的脂肪组织:
▸ 肠道菌群在隔日禁食介导的代谢改善中具有因果作用
喂食高脂肪食物并接受隔日禁食方案的肥胖小鼠在WAT中表现出白色脂肪积累增加,同时伴有体重减轻和肠道微生物组组成改变。
值得注意的是,向接受隔日禁食的肥胖小鼠补充抗生素消除了隔日禁食的有益代谢作用,并且将 隔日禁食小鼠的粪便移植到抗生素治疗的肥胖小鼠的粪便改善了代谢健康,表明肠道微生物组在隔日禁食介导的代谢改善中具有因果作用。
间歇性禁食介导的肠道微生物群调节宿主能量代谢的积极作用
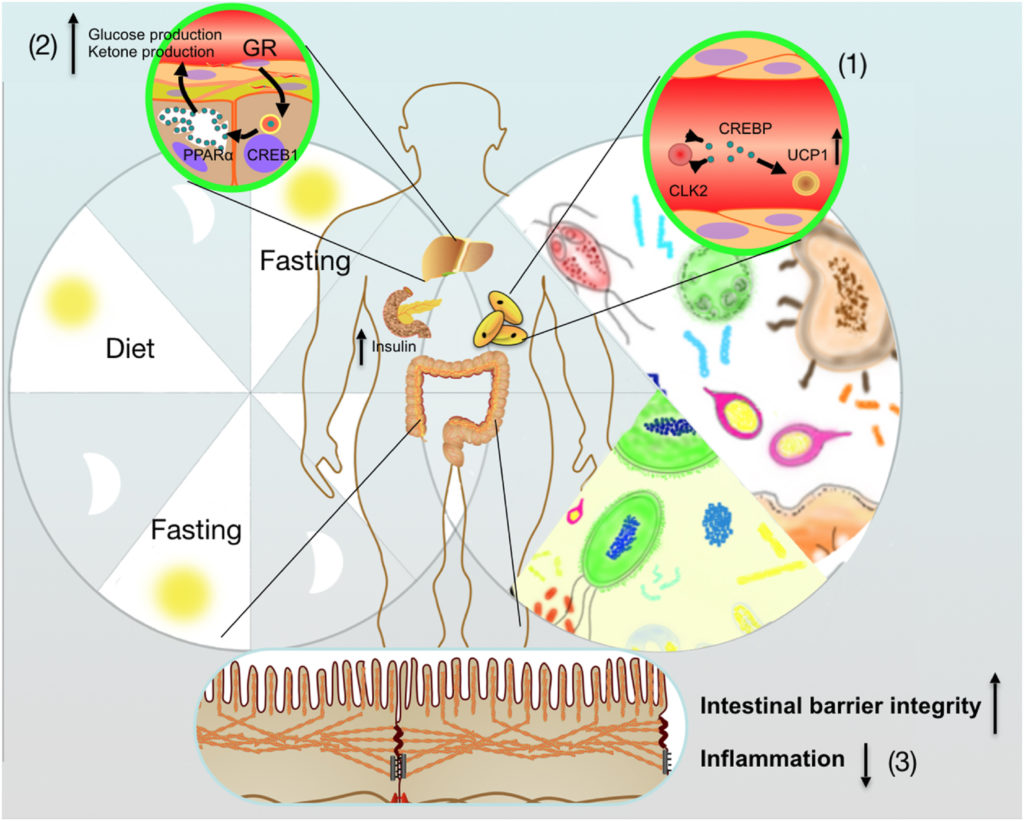
Rong B, et al.,Anim Nutr. 2021
(1) 间歇性禁食通过改善肠道菌群,促进WAT米色脂肪组织
(2) 在不摄入营养期间,肠道微生物群参与增加肝酮的产生
(3) 间歇性禁食优化的微生物群还负责保护宿主肠道屏障
▸ 隔日禁食诱导多种肠道细菌产生乙酸和乳酸
将盲肠代谢组学与Shotgun宏基因组学相结合,发现隔日禁食会导致肠道微生物群的组成发生变化,从而导致产生乳酸和乙酸的细菌(如罗伊氏乳杆菌)发生变化,进而导致血清乳酸和乙酸的积累。
关于罗伊氏乳杆菌详见:认识罗伊氏乳杆菌(Lactobacillus reuteri)
隔日禁食还通过促进米色脂肪生成来增加能量消耗,并改善体重增加和其他代谢紊乱。
在另一项研究中,仅在喂食正常饲料的小鼠中,乳酸杆菌水平在隔日禁食喂养的小鼠身上重复升高,而Allobaculum属则只在隔日禁食和高脂肪饲料的小鼠中富集。Allobaculum属是一种活性的葡萄糖代谢产物,能产生丁酸盐和乳酸盐。
这些结果表明,隔日禁食诱导多种肠道细菌产生乙酸和乳酸。然而,还需要更多的研究来确定乳酸和短链脂肪酸对WAT褐变以及对宿主产热和能量消耗的影响。
肠道微生物群的变化除了影响脂肪细胞产热之外,也可能影响适时进食过程中的脂质摄取。
控制宿主昼夜脂质吸收可能通过以下几种机制发生:
▸核因子白细胞介素-3 (NFIL3)的调节
核因子白细胞介素-3是一种受昼夜节律控制的转录因子,调节参与肠上皮细胞中脂质的摄取、加工和储存的基因的节律性表达。
NFIL3中的节律振荡由肠道微生物组通过激活先天免疫细胞反应驱动。
▸组蛋白脱乙酰酶3(HDAC3)的调节
刺激HDAC3的节律性表达和向染色质招募导致肠上皮组蛋白乙酰化的同步昼夜振荡,这反过来调节营养转运蛋白的基因表达,从而影响营养物质摄取和脂质吸收。
总的来说,肠道微生物群通过调节控制脂质和营养摄入的基因,以及通过产生影响脂肪组织的微生物代谢物来影响能量代谢。
间歇性禁食导致肠道微生物组分和功能的改变,这反过来可能影响心血管代谢健康
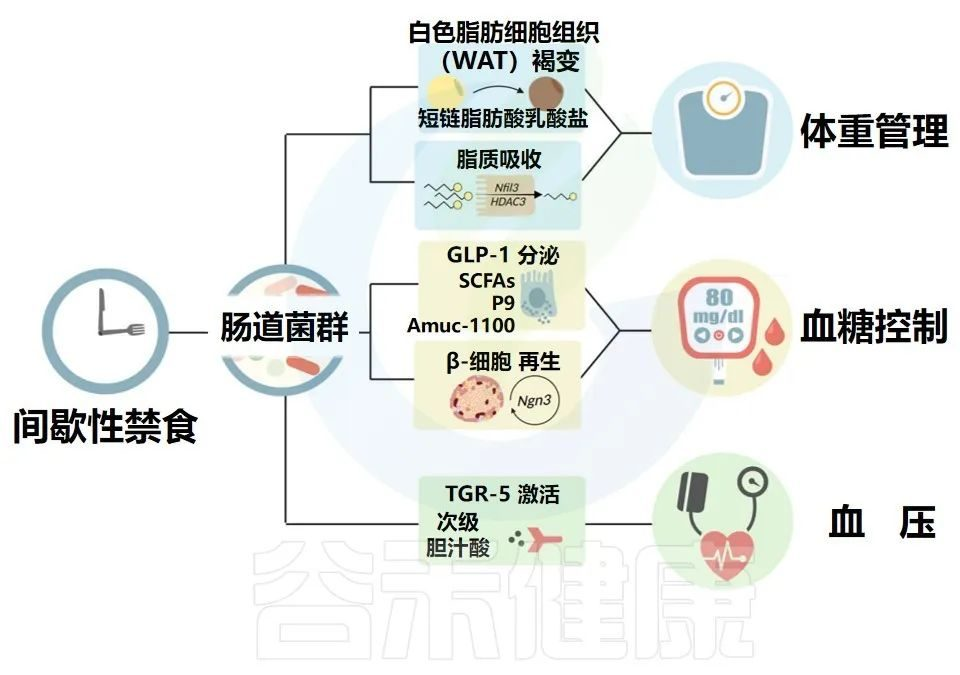
Karina R,et al.Rev Art Jou of Dia.2022
肠道微生物群驱动的WAT褐变和脂质吸收有助于体重管理。微生物通过GLP-1分泌和β细胞再生对血糖控制的影响。
微生物衍生的次级胆汁酸激活TGR-5以控制血压。
对啮齿动物和猴子的研究表明,间歇性禁食对血糖控制具有持续的有益作用。
肠道微生物组分与血糖水平相关,并适应日常生活中的禁食和再喂养期,包括昼夜饮食模式和限时饮食(例如,作为宗教禁食的一部分)。
在小鼠中,乳酸杆菌属在禁食期间高度富集,而Akkermansia muciniphila在喂养期间高度富集。除了昼夜变化外,A. muciniphila在接受限时饮食的人和小鼠体内都显著扩增。
▸A. muciniphila的增加如何在血糖控制中发挥作用?
这些成分的变化很有趣,因为A. muciniphila 与啮齿动物和人类的血糖水平呈负相关。
此外,A. muciniphila的增加与GLP-1的分泌增强有关,GLP-1是一种促胰岛素激素,由肠内分泌L细胞分泌,对膳食作出反应,并在全身血糖控制中发挥关键作用。
▸ 微生物群的昼夜变化 & GLP-1的昼夜分泌
GLP-1的分泌遵循昼夜节律,在活动期葡萄糖负荷后,餐后GLP-1水平较高,而在静息期,GLP-1水平较低,此外还受L细胞时钟机制的调节。
在喂食西方饮食的肥胖小鼠和缺乏微生物组的小鼠中,GLP-1的波动性分泌减弱。这项研究表明,通过将食用正常食物的常规小鼠的粪便微生物群转移到肥胖小鼠中,可以恢复无菌小鼠GLP-1的昼夜节律。
间歇性禁食、肠道微生物群和昼夜节律之间的多向关系
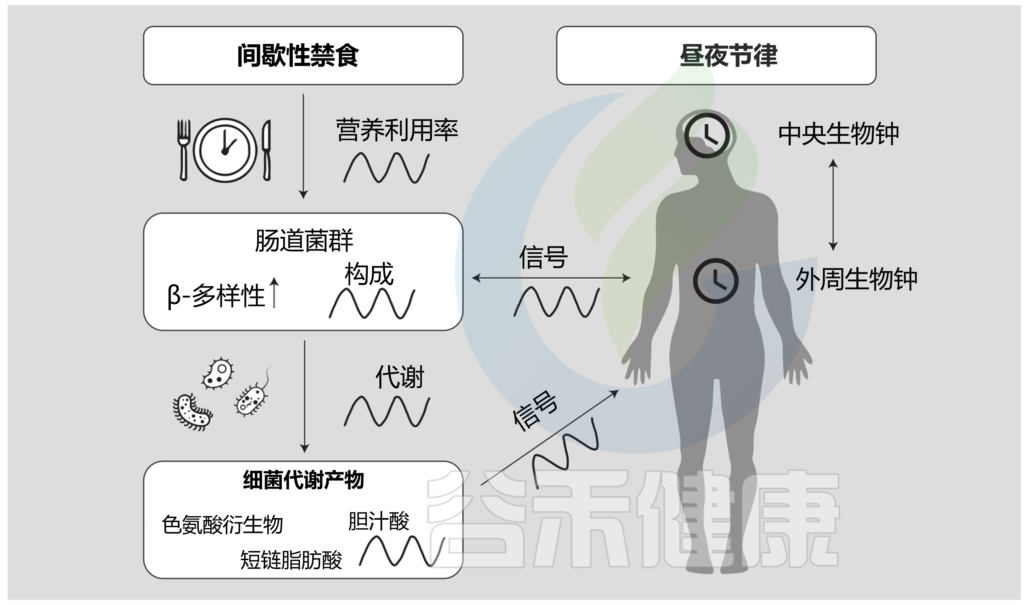
Daas MC, et al.,Benef Microbes. 2021
这些结果表明,微生物群的昼夜变化可能在GLP-1的昼夜分泌及其对葡萄糖稳态的后续影响中起着核心作用。至于机制,最近的研究已经确定了由A. muciniphila产生的几个假定的生物分子,它们可以触发肠L细胞分泌GLP-1。其中,丙酸盐和蛋白P9和Amuc-1100可刺激L细胞分泌GLP-1。
▸ 间歇性禁食改善血糖调节和2型糖尿病
给予肥胖和高血糖小鼠或缺乏瘦素受体的糖尿病db/db小鼠间歇性禁食或模拟禁食的饮食(FMD),可分别改善血糖控制和2型糖尿病。
模拟禁食的饮食有益于葡萄糖稳态的一个主要潜在机制包括神经生长素3(Ngn3)的激活,Ngn3是产生胰岛素的β细胞发育所必需的转录因子。β细胞的再生发生在暴露于间歇性模拟禁食的饮食后,并表明其遵循肠道微生物群的重组,这与db/db小鼠的血糖水平相关。
根据粪便微生物群的16S rRNA测序,
模拟禁食的饮食增加了下列菌的丰度:
模拟禁食的饮食降低了下列菌的丰度:
这与低血糖水平相关。
在此背景下,发现在模拟禁食饮食中具有较高丰度的Blautia,在糖尿病大鼠经2型糖尿病药物治疗后相对增加。
总之,营养时间对肠道微生物群、GLP-1分泌以及β细胞增殖的影响可能有助于改善血糖控制和胰岛素敏感性,从而为基于饮食和微生物群的2型糖尿病治疗潜力提供理论基础。与间歇性禁食对啮齿动物β细胞再生的影响一致,人类随机临床试验表明,与每日热量限制的匹配组相比,定期禁食(5:2饮食)对空腹胰岛素的影响更为显著。
有几个迹象表明,间歇性禁食和进餐时间可能有助于改善小鼠和人类的高血压。
不过间歇性禁食的有效性仍有争议,但DASH饮食(阻止高血压的饮食方法)提供了一种可以降低高血压的低钠饮食。
最近的一项研究表明,在高血压代谢综合征患者中,五天禁食后进行改良DASH饮食可以降低收缩压。
▸ 五天禁食通过改变肠道菌群影响血压
这种禁食还改变了肠道微生物群,包括一些与短链脂肪酸产生相关的菌群和基因。
使用对基线微生物组数据的机器学习分析来预测持续的收缩压反应,确定以下菌群为控制高血压的潜在贡献菌:
在大鼠中,五周的隔日禁食治疗可显著降低易患高血压卒中动物的血压。这种表型变化伴随着微生物组结构的改变,包括下列菌升高:
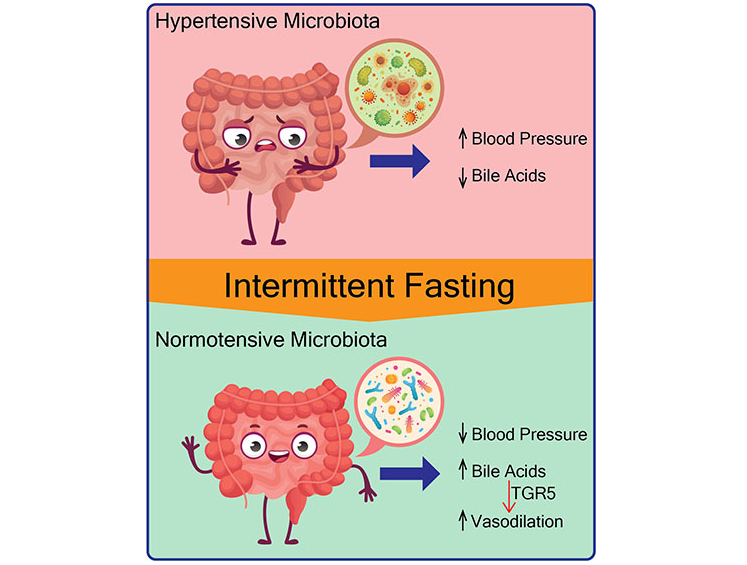
Shi H, et al.,Circ Res. 2021
▸ 隔日禁食饮食的调节血压机制
从机理上讲,隔日禁食饮食与微生物向产生次级胆汁酸的细菌转移有关,包括共轭和非共轭的二级胆汁酸(如牛磺胆酸、牛磺脱氧胆酸、牛磺脱氧胆酸[TUDCA]、LCA、甘鹅脱氧胆酸等),以及胆汁酸受体TGR5的激活。
此外,用胆酸或TGR5激动剂治疗这些高血压大鼠可降低血压,从而超过隔日禁食的需要。
从隔日禁食喂养的大鼠到无菌大鼠的粪菌移植可防止收缩压升高,表明肠道微生物群在降低血压方面的因果作用。
进一步的研究需要确定对次级胆汁酸产生反应的靶组织和细胞类型,以及这些胆汁酸诱导的导致血压下降的细胞途径。此外,还需要更多的试验来确定不同的间歇性禁食在降低各种心血管代谢紊乱患者血压方面的疗效和可持续性。
心血管代谢疾病是一种进行性疾病,具有长期和毁灭性的后果。
2型糖尿病患者的常见表现是微血管并发症,包括视网膜病和肾病以及心血管疾病。作为营养疗法的一部分,间歇性禁食已经成为治疗2型糖尿病几种长期并发症的潜在干预措施,包括视网膜病、认知能力下降、心力衰竭和肾病。
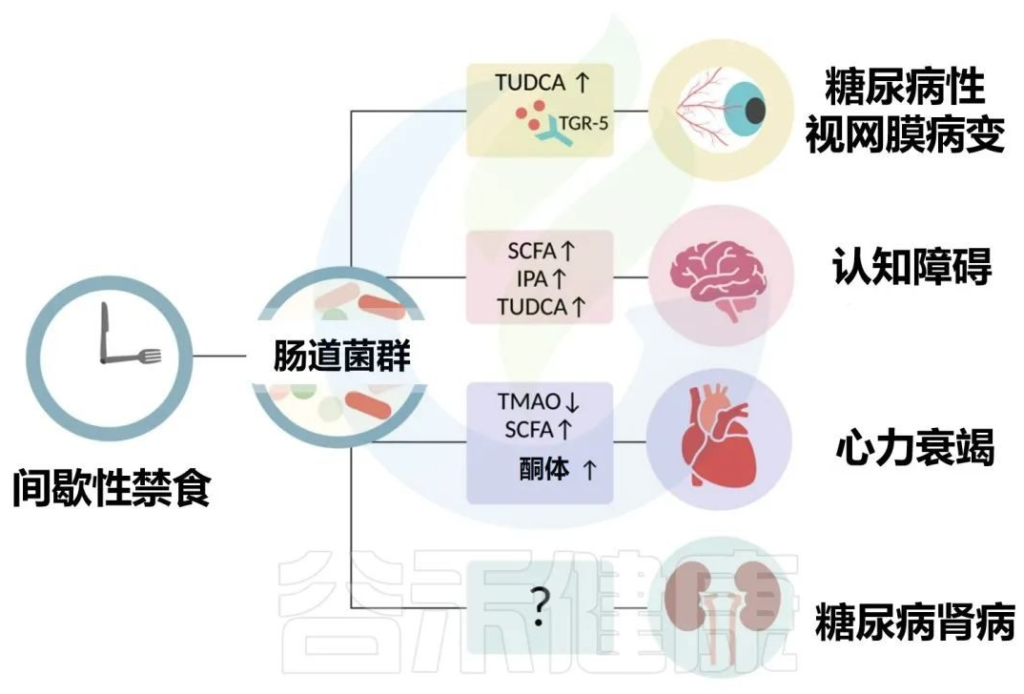
Karina R,et al.Rev Art Jou of Dia.2022
糖尿病性视网膜病变是2型糖尿病的一种并发症,它会影响视网膜的血管,并可能导致未经治疗的个体失明。
幸运的是,通过早期检测和及时治疗可以控制血糖水平和血压,可以降低糖尿病性视网膜病变导致的失明风险。
▸ 糖尿病性视网膜病变的菌群变化
以下三者之间的肠道微生物群存在显著差异:
比如说,研究人员Das等人发现,糖尿病视网膜病变患者中菌群变化:
在这项观察性研究之后,其他研究人员提出了肠道微生物组作为糖尿病视网膜病变鉴别生物标志物的潜在用途,并发现以下细菌是区分2型糖尿病患者和糖尿病视网膜病变患者的主要生物标志物:
这可能有助于视网膜病变的诊断。
其中,巴氏杆菌科在患有视网膜病的2型糖尿病患者中特别减少,这种细菌的减少可以作为该疾病的预测生物标志物。
▸ 隔日禁食干预后,糖尿病小鼠的菌群变化
研究人员使用糖尿病小鼠(db/db)比较了隔日禁食喂养的小鼠与随意喂养的小鼠糖尿病视网膜病变的经典标志物,发现隔日禁食方案阻止了无细胞视网膜毛细血管数量的增加,并减少了炎性细胞对视网膜的浸润。
隔日禁食的糖尿病小鼠具有厚壁菌门显著扩张的特征,更具体地说,在属的水平上,下列菌群丰度增加:
下列菌群减少:
随着肠道微生物组组成的变化, 作者观察到,与非糖尿病小鼠相比,糖尿病小鼠表现出昼夜微生物模式的差异,这种差异也在对隔日禁食的反应中发生了改变。
▸ 隔日禁食引起的代谢变化,有助于改善及诊断视网膜病变
值得注意的是,隔日禁食仅在糖尿病小鼠中增强了初级至次级胆汁酸的代谢,如TUDCA。
TUDCA的受体TGR5在视网膜神经节细胞中表达,这表明TUDCA的微生物生产可能会潜在地影响视网膜。
给糖尿病小鼠补充TGR5的强效激动剂导致糖尿病视网膜病变减少,其特征是视网膜炎症减少和无细胞毛细血管减少。
因此,隔日禁食可能导致次级胆汁酸的肠道细菌生产发生改变,激活视网膜TGR5,防止视网膜变性。
综上所述,这些结果表明,如果隔日禁食等干预措施可能导致肠道微生物群和代谢物的独特改变,这可能有助于视网膜病的诊断,并可能潜在地改善糖尿病视网膜病变。
▸ 2型糖尿病 → 认知障碍
2型糖尿病可引起明显的中枢神经系统并发症,包括结构改变或脑萎缩、脑微血管损伤、神经炎症以及最终导致认知缺陷的脑电生理特性改变。
随着时间的推移,这些认知和大脑结构的改变可能会导致认知能力的加速下降,并增加老年痴呆症等与年龄相关的神经退行性变的风险。
多项因素会导致糖尿病认知障碍,包括大脑胰岛素抵抗和葡萄糖摄取降低以及神经递质代谢紊乱。在动物模型中,各种类型的间歇性禁食有益于大脑健康,延缓神经退行性疾病的发展。
▸ 肠道菌群在调节隔日禁食诱导的认知功能中发挥作用
在隔日禁食治疗糖尿病db/db小鼠期间,肠道微生物组与认知功能之间存在联系。
糖尿病小鼠表现出认知能力下降,但28天的隔日禁食方案改善了焦虑行为、运动活动和突触结构,同时保护了海马中的胰岛素信号和线粒体生物生成。
隔日禁食干预小鼠组脑功能的改善伴随着下列菌群增加:
下列菌群减少:
抗生素治疗后,隔日禁食对糖尿病小鼠认知功能的保护作用被部分消除。学者发现隔日禁食组的初级和次级胆汁酸生物合成途径丰富。
▸ 菌群代谢物在调节隔日禁食诱导的认知功能中发挥作用
此外,db/db隔日禁食小鼠组的粪便和血浆中几种微生物相关代谢物的水平升高,其中包括短链脂肪酸、TUDCA(也可预防视网膜病变的次生胆汁酸)、吲哚-3-丙酸(IPA)和血清素。
补充这些代谢物可改善db/db小鼠的认知功能和胰岛素敏感性。
总的来说,隔日禁食诱导的肠道细菌种类和代谢物可能有助于减轻糖尿病诱导的认知障碍,并表明即使在没有隔日禁食的情况下,细菌代谢物也可能调节大脑功能的特征。
胰岛素抵抗的小鼠模型表明,如TRF和FMD等饮食方式可以改善高血压、血脂异常、高血糖和高胰岛素血症,所有这些都是心血管健康的一般指标。
▸心力衰竭与肠道菌群联系的证据
多项研究表明,心力衰竭患者肠道微生物群的组成发生了改变。对Dahl盐敏感大鼠进行的一项研究表明,补充益生菌植物乳杆菌可降低其对心力衰竭的易感性,并可在心肌梗死后更好地恢复。
已经提出了几种机制来解释肠道微生物组与心力衰竭之间的潜在联系,包括微生物组诱导的炎症调节、肠道通透性以及与细菌过度生长和细菌生物膜形成的关联。
▸肠道菌群影响心血管健康的机制:增加短链脂肪酸产生菌,为心脏提供能量
在几项研究中,在心力衰竭患者中也检测到几种病原菌的扩增。一项研究揭示了间歇性禁食对心脏的益处,提出肠道微生物群可以产生短链脂肪酸,在禁食期间为心脏提供充足的能量。
与常规小鼠相比,无菌小鼠的肝脏酮体生成量减少。根据这项研究,禁食与更高丰度的拟杆菌有关,这些拟杆菌可能负责产生短链脂肪酸,尤其是乙酸盐,可用于肝脏生酮,从而为心脏提供能量来源。
▸肠道菌群影响心血管健康的机制:TMAO降低
一项开创性研究表明,肠道微生物代谢膳食胆碱和左旋肉碱产生TMA,TMA被宿主肝脏转化为 TMAO.
研究发现,TMA-TMAO通路与动脉粥样硬化、血小板过度活跃和血栓形成有关,并用于预测心血管疾病风险的增加。
禁食影响肝脏代谢,与TMAO降低有关。此前有研究表明,维持低水平的TMAO可能对预防2型糖尿病相关的心肌病特别有帮助。
最近,在白天和夜间的db/db小鼠中发现TMAO水平升高,这与各种肠道细菌的昼夜振荡消失有关。作者建议,可以通过限制活跃期的摄食来恢复失去的细菌的昼夜振荡。
根据啮齿类动物的研究结果,间歇性禁食是否能够利用肠道微生物群,调节氧化三甲胺水平,并导致2型糖尿病患者心血管预后的有效改善,仍有待确定。
糖尿病可能导致肾功能障碍或肾病。在糖尿病患者中,血糖控制不良和高血压可导致肾小球滤过、蛋白尿、肾病性蛋白尿,并发展为终末期肾脏疾病。
多项研究表明,糖尿病肾病患者的肠道细菌丰度发生改变,总体上较低的细菌多样性与疾病进展相关。
在啮齿类动物中,糖尿病肾病与菌群及其代谢物(如苯基硫酸盐)的改变有关,并与肾素-血管紧张素系统的激活相关。
已有多项观察性研究测试了斋月禁食对糖尿病肾病严重程度的影响,但没有一项研究显示肾功能有显著变化。这些报告不是随机对照研究,样本量小,并且包含使用不同药物或透析治疗的患者。
目前,间歇性禁食对肾功能和糖尿病肾病的疗效以及肠道菌群在这一过程中的作用尚未阐明。
间歇性禁食除了前面章节提到的,通过脂质代谢来调节能量平衡从而减轻肥胖之外,还可以改善食欲调节,促进减肥。
▸ 三项短期研究评估:间歇性禁食增加饱腹感
在为期8周的ADF试验中,从基线检查到治疗后,主观饥饿感保持不变,饱腹感水平增加。这些饱腹感的增加与肽YY(PYY)的增加平行,肽YY是一种有效的饱腹激素。然而在任何时间点,饱腹感和PYY的变化与体重减轻或静息代谢率无关。
其他研究也有类似的发现。12周ADF后,肥胖受试者的饥饿感未受影响,饱腹感显著增加。饱腹感增加与体重减轻之间没有显著关系。
研究人员比较了ADF和每日卡路里限制对体重减轻后食欲的影响(比基线降低5%)。饥饿感在两组中都有类似的下降,但饱足指数保持不变。
▸ 一项长期研究评估:间歇性禁食对食欲调节没有长期有益影响
Kroeger等人进行的一项为期12个月的试验表明,ADF期间体重下降不理想和饮食依从性差与食欲没有任何有益变化有关。
总之,对ADF的短期研究表明,主观食欲有所改善(最常见的是饱腹感增加),而对ADF的长期研究表明,在食欲调节方面没有长期的益处。这方面还需要更多的研究。
目前似乎还没有任何人体试验检测ADF或5:2饮食对睡眠的影响,但有几项研究测试了限时进食对睡眠的影响。
▸三个限时进食试验:限时进食期间睡眠质量无变化
研究一:经过8周的4小时或6小时限时进食后,睡眠质量没有改变。
研究二:观察到8小时限时进食治疗12周后对睡眠质量没有影响。
研究三:10周10小时限时进食后,睡眠质量没有变化。
虽然这一初步证据表明,限时进食不会影响睡眠质量,但应该注意的是,这些研究的参与者基本上都是良好的睡眠者。因此,通过干预,他们的睡眠质量没有进一步改善,这并不奇怪。
▸限时进食不会影响睡眠时间
限时进食是否会改变睡眠时间也已得到评估。
前面的研究指出,4小时或6小时限时进食的睡眠时间没有变化。同样,8小时和9小时限时进食的睡眠时间保持不变。
然而,大多数参与者的平均睡眠时间为每晚约7小时,这符合国家睡眠基金会规定的最低7小时。这些受试者已经有足够的睡眠时间,这可以解释为什么限时进食不会影响睡眠时间。
▸限时进食可能改善睡眠
研究还评估了限时进食对失眠严重程度的影响。
研究人员推测,睡前禁食2-3小时可能会改善睡眠。更具体地说,睡前不吃脂肪和酸性食物可以减少胃酸反流和夜间胃灼热,这可能有助于降低失眠率。
在6小时限时进食研究中,受试者在基线检查时表现出阈下失眠症,到8周试验结束时,没有出现具有临床意义的失眠症。
相比之下,对于基线检查时无临床意义失眠的受试者,4小时和8小时限时进食对失眠严重程度没有影响。
综上所述,这些发现表明,对于已经显示出健康睡眠习惯的受试者来说,使用限时进食进行轻度减肥不会影响睡眠质量或睡眠时间。相比之下,限时进食可能有助于减轻受这种情况困扰的人的失眠严重程度。需要更多的研究来证实这些初步发现。
间歇性禁食虽然带来以上种种益处,但其安全性一直受到质疑。有些人对胃肠道问题、能量水平紊乱、饮食失调症状和激素紊乱的发生率增加表示担忧。这些饮食是否会对饮食质量产生负面影响也是一个问题。
人体试验的结果表明,禁食通常不会产生任何长期的胃肠道不良反应,例如便秘、腹泻、恶心、口干或口臭。不过早期的 6 小时限时进食导致了一些轻微的呕吐和腹泻病例。
最近的几项试验证明了,间歇性禁食也不会导致易怒、疲劳或头晕的程度增加。因此,迄今为止的研究结果表明,间歇性禁食几乎不会产生胃肠道问题或能量水平紊乱。
禁食因可能增加饮食失调风险而受到质疑。
来自 ADF 和限时进食研究的最新数据表明,这类饮食不会增加抑郁、暴饮暴食、通便行为或对肥胖的恐惧的发生率。
事实上,一项研究表明,ADF 可能对身体形象感知产生很小的有益影响。ADF 的这些发现与每日卡路里限制的发现相当。
在减少能量摄入的长期影响综合评估 (CALERIE) 试验中,将能量限制 25% 不会增加饮食失调症状,也没有其他有害的心理影响。
因此,间歇性禁食,也和卡路里限制一样,不会增加饮食失调症状,并且对身体形象感知具有良性或有益的影响。
然而,应该指出的是,这些研究排除了有饮食失调史的参与者。对于诊断为饮食失调的人来说,间歇性禁食是否安全仍然未知。
▸甲状腺激素
在健康人群和亚临床甲状腺功能减退人群中,研究了禁食期间甲状腺激素水平的变化。
招募年轻男性运动员参加8小时限时进食与阻力训练相结合的试验。8周后,血浆总三碘甲状腺原氨酸(T3)略有下降,但促甲状腺激素(TSH)无明显变化。在这些受试者中未观察到体重变化。游离甲状腺素(fT4)的变化没有报道,因此很难确定限时进食是否破坏这些甲状腺功能正常受试者的T3:fT4比率。
其他研究人员比较了ADF和每日卡路里限制对肥胖和亚临床甲状腺功能减退患者甲状腺水平的影响。24周后,ADF和卡路里限制(8%)同样降低体重,循环fT4、T3和TSH保持不变。这些试点数据表明,在间歇性禁食期间,瘦人的T3水平可能会略有降低,但这些影响不会发生在肥胖和亚临床甲状腺功能减退的人身上。
▸ 生殖激素
在 5:2 禁食 24 周后,绝经前妇女的睾酮、雄烯二酮、脱氢表雄酮硫酸盐、性激素结合球蛋白或催乳素没有变化。
相比之下,在 8 小时限时进食 8 周后,年轻男性的游离和总睾酮浓度降低。合成代谢激素睾酮的减少并没有导致身体成分的任何有害变化或肌肉力量的损害。
由于缺乏这方面的数据,因此很难就禁食对生殖健康的影响得出结论。此外,这些变化如何影响生育能力仍然未知,因为没有研究测试过这些饮食对男性和女性怀孕能力的影响。
据推测,在限时进食期间限制进食时间窗口期会导致高能量食物的消耗增加和补偿性地多喝(即,增加无糖苏打水和咖啡因的摄入)。
研究人员评估了4小时和6小时限时进食期间饮食质量的变化。
▸ 纤维摄入量偏少
8周后,4小时和6小时限时进食组的糖、饱和脂肪、胆固醇和钠摄入量与对照组相比没有显著差异。然而,限时进食受试者纤维摄入量远远低于(∼10-15克/天)在基线检查和治疗后的推荐量[25-38克/天]。ADF和5:2饮食试验中也经常报告纤维摄入不足。
▸ 饮料、酒等摄入量没有变化
至于饮料摄入,8周后,4小时限时进食、6小时限时进食和对照组的饮食苏打水、含咖啡因饮料(即咖啡、茶和能量饮料)和酒精的摄入没有差异。
作为这些发现的补充,一项为期一年的ADF试验报告称,饮料摄入量没有变化。
这些初步发现表明,间歇性禁食不会对饮食质量或饮料摄入产生不利影响。然而,应在间歇禁食期间向受试者提供膳食咨询以增加纤维摄入量,以确保肠道健康。
▸ 间歇性禁食并不代表胡吃海喝
重要的是,个人应注意间歇禁食期间的饮食质量。诚然,这些方案要求个人更多地关注用餐时间,而不是所摄入的营养素类型。虽然如此,临床医生应该向患者明确指出,进食窗口时间并不能让患者完全不考虑健康影响,彻底放纵自己乱吃。
为了使这些方案成为改善健康的可持续解决方案,应鼓励间歇性禁食的人食用水果、蔬菜和全谷物含量高、加工食品含量低的饮食。
本章节总结了一些关于如何开始禁食方案,以及如何将这些方法融入日常生活的实用建议。同时,就哪些人不应该使用间歇性禁食来控制体重提供建议。
对于大多数人来说,大约需要1-2周才能完全适应这种新的饮食模式。
据报道,在初期可能会出现头晕,头痛和便秘,但这些不良反应通常在禁食第二周后消退。
头痛通常是由于水分摄入不足导致脱水,当食物受到限制时可能会发生脱水。增加饮水量(每天增加1.5升)可能有助于个人在禁食期间缓解头痛。
与普遍的看法相反,禁食时锻炼确实是可能的。已经进行了几项将禁食与运动相结合的人体试验。
这些研究中的受试者可以在12-36小时的禁食期内进行中等强度到高强度的耐力或阻力训练。
有趣的是,在研究中,受试者在快节奏的日子里感觉到能量的增强,这对那些希望锻炼的人来说是有利的。
然而ADF期间,建议个人在运动后食用禁食日餐。一些人在运动后会出现能量摄入的代偿性增加。因此,把饭留到运动后吃,可能有助于个人保持在禁食日卡路里目标的范围内。
虽然对于间歇性禁食期间摄入的食物类型没有具体的建议,但始终建议强调多吃水果、蔬菜和全谷类食物。
这些食物可以帮助禁食参与者增加纤维摄入量,从而有助于缓解禁食期间偶尔出现的便秘。
避免超加工食品也很重要。与富含能量相匹配的未加工食品的饮食相比,富含加工食品的饮食会导致自由摄入的能量增加和体重增加。
间歇性禁食期间允许饮酒。然而不建议在ADF和5:2禁食模式中的禁食日饮酒。
禁食日的能量摄入非常有限(∼500千卡),因此建议将这些卡路里花在能提供营养的健康食品上,而不是酒精上,因为酒精会消耗营养。
无论是在禁食期间还是在进食窗口,都允许喝含咖啡因的饮料。越来越多的证据表明,与基线相比,个体在禁食期间的含咖啡因饮料消费模式没有显著改变。
不过,将咖啡因的摄入限制在上午和下午可能是值得的,这样它就不会干扰一个人晚上的入睡能力。
除以上人群之外,一般都可以安全地进行间歇性禁食,这可能是一种生活方式的改变。
如果尝试间歇性禁食后持续发现,异常焦虑、头痛、恶心或其他症状,不要勉强继续,说明暂时还不适合这种方式,可暂停。
间歇性禁食导致肠道菌群结构改变,以及细菌产生特定的代谢物发生变化,如次级胆汁酸和酮体,可能会潜在地影响正常宿主生理,及心血管代谢异常的临床结果。这些发现可以作为治疗干预的潜在基础。
当相同的膳食在不同的时间提供时,餐后对食物的反应因人而异。由于肠道微生物群参与了个人对食物的反应,因此有理由假设个人对间歇性禁食的反应也与肠道微生物群有关。这也是将间歇性禁食方案转化为临床实践的一个挑战。
需要更多控制良好的、前瞻性的、纵向的临床研究,来确定不同饮食带来的微生物变化,以便进一步转化为临床实践。同时包括肠道菌群健康检测在内的对个体肠道微生物组的进一步了解,或将为最终的临床实践带来益处。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Ratiner K, Shapiro H, Goldenberg K, Elinav E. Time-limited diets and the gut microbiota in cardiometabolic disease. J Diabetes. 2022 Jun;14(6):377-393. doi: 10.1111/1753-0407.13288. Epub 2022 Jun 13. PMID: 35698246.
Angoorani P, Ejtahed HS, Hasani-Ranjbar S, Siadat SD, Soroush AR, Larijani B. Gut microbiota modulation as a possible mediating mechanism for fasting-induced alleviation of metabolic complications: a systematic review. Nutr Metab (Lond). 2021 Dec 14;18(1):105. doi: 10.1186/s12986-021-00635-3. PMID: 34906176; PMCID: PMC8670288.
Varady KA, Cienfuegos S, Ezpeleta M, Gabel K. Cardiometabolic Benefits of Intermittent Fasting. Annu Rev Nutr. 2021 Oct 11;41:333-361. doi: 10.1146/annurev-nutr-052020-041327. PMID: 34633860.
Shi H, Zhang B, Abo-Hamzy T, Nelson JW, Ambati CSR, Petrosino JF, Bryan RM Jr, Durgan DJ. Restructuring the Gut Microbiota by Intermittent Fasting Lowers Blood Pressure. Circ Res. 2021 Apr 30;128(9):1240-1254. doi: 10.1161/CIRCRESAHA.120.318155. Epub 2021 Feb 18. Erratum in: Circ Res. 2022 Mar 4;130(5):e18. PMID: 33596669; PMCID: PMC8085162.
Aron-Wisnewsky J,Clément K.The gut microbiome, diet,and links to cardiometabolic and chronic disorders. Nat RevNephrol. 2016;12(3):169-181.
Di Francesco A, Di Germanio C, Bernier M, de Cabo R. A time to fast. Science. 2018;362(6416):770-775.
Daas MC, de Roos NM. Intermittent fasting contributes to aligned circadian rhythms through interactions with the gut microbiome. Benef Microbes. 2021 Apr 12;12(2):147-161. doi: 10.3920/BM2020.0149. Epub 2021 Feb 3. PMID: 33530881.
Rong B, Wu Q, Saeed M, Sun C. Gut microbiota-a positive contributor in the process of intermittent fasting-mediated obesity control. Anim Nutr. 2021 Dec;7(4):1283-1295. doi: 10.1016/j.aninu.2021.09.009. Epub 2021 Oct 9. PMID: 34786501; PMCID: PMC8567329.

谷禾健康

粪球菌属(Coprococcus)
是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,菌种大部分从粪便中分离出来,积极发酵碳水化合物,是和Faecalibacterium prausnitzii 一样,丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。此外,该菌还与抑郁症,幼儿语言发育、便秘、睡眠以及慢性疲劳等相关。
细胞球状,直径0.8~1.5μm,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度37℃,多数物种分离于人的肠道和粪便,很少从人类临床标本中分离出来表明该菌主要定植于健康人的肠道。
需要注意的是,该菌需要与非常耐药且容易引起感染的肠球菌属(Enterococcus )区分开来,他们翻译的中文名虽然只差一个字,但是肠球菌能引发感染,以耐药性出名。
而粪球菌(Coprococcus)是厌氧球菌属,虽然它们都是人类粪便菌群的一部分。但是粪球菌积极发酵碳水化合物,产生丁酸和乙酸以及甲酸或丙酸和/或乳酸等。
在人类粪便中发现的最多产丁酸盐的细菌是属于梭菌簇 IV 和 XIVa 的对氧高度敏感的厌氧菌。其中包括许多以前未描述的与真杆菌属、罗斯氏菌属、普拉梭菌以及本文的粪球菌属。
该菌属主要至少包括以下物种:
Coprococcus catus (species)
Coprococcus comes (species)
Coprococcus eutactus (species)
Coprococcus sp. DJF_CR49 (species)
Coprococcus sp. L2-50
此属的模式种为(Coprococcus eutactus)
不同碳水化合物上的 Coprococcus 物种的生长不太一样,其中:
Coprococcus eutactus的丰度与肠道中更大的细菌基因丰富度有关,β-葡聚糖是与Coprococcus eutactus相关的人类肠道细菌的主要生长底物,其代谢产生丁酸盐和甲酸盐或乳酸。
此外,这两种菌可以利用广泛的碳水化合物底物:
Coprococcus. eutactus
Coprococcus sp. L2-50
但是,Coprococcus comes仅在葡萄糖上表现出良好的生长,而Coprococcus catus 仅在葡萄糖上表现出非常有限的生长,Coprococcus catus代谢产生丁酸盐和丙酸盐。
细菌互相作用或共同在一个生态位生存对整个菌群结构和宿主健康有很重要的影响,例如共现关系(例如,赋予抗生素耐药性)、共生关系(例如,交叉喂养其他成员产生的化合物)和协同作用。
研究报告Coprococcus和Roseburia之间的共现关系的支持,两者都属于Lachnospiraceae家族,表明系统发育密切相关的属也可能具有共现关系,而不是由于它们相似的栖息地偏好而总是相互竞争。然而,由于对人类肠道微生物群落的机理了解不足,因此应谨慎解释肠道细菌之间的生态联系。
此外还发现该菌属在生物化学上与瘤胃球菌密切相关。
值得注意的是,一项来自广东肠道微生物组计划的大规模队列数据,分析得出脱硫弧菌(DSV) 经常在人体肠道中发现,DSV的相对丰度与包括Oscillospira Coprococcus , Ruminococcus , Akkermansia,Roseburia , Faecalibacterium 和 Bacteroides呈正比。
人类肠道微生物群的物种组成对于弯曲杆菌感染的定植抗性很重要。相比于感染弯曲杆菌的人群,健康人群中Coprococcus丰度更好,表明高水平的Coprococcus有利于抵抗弯曲杆菌。
2019年比利时通过一项1070抑郁症病人的验证集小组发现,即使在控制了抗抑郁药的作用后,抑郁症患者的粪球菌属(Coprococcus)和小杆菌属(Dialister)细菌都已耗尽。
还发现Coprococcus具有与多巴胺相关的生物途径,多巴胺是一种会影响心理健康的神经递质。该研究的粪便宏基因组的肠脑模块分析确定,多巴胺代谢物 3,4-二羟基苯乙酸的微生物合成潜力与心理生活质量呈正相关,并表明微生物产生的γ-氨基丁酸在抑郁症中的潜在作用。
研究将重度抑郁症 (MDD) 患者的粪便微生物群移植 (FMT) 移植到大鼠体内,发现:相比较与移植健康粪便的大鼠, FMT-MDD大鼠瘤胃球菌科和毛螺菌属升高,而粪球菌属则被耗尽,从机理上表明粪球菌的缺乏会与抑郁症的关系。
另外一项对82 名抑郁的人随机分配接受多菌株益生菌加生物素治疗或生物素加安慰剂治疗 28 天。发现28天后,与接受安慰剂治疗的个体相比,精神症状的改善明显更高;同时粪便16s测试表明相比于安慰剂组,益生菌组的多样性高,Coprococcus 显著增加。
该研究的益生菌干预组为:包括九种菌株,双歧杆菌W23、乳酸双歧杆菌W51、乳酸双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24 和乳酸乳球菌W19。此外,益生菌产品中还添加了 125 毫克 D-生物素(维生素 B7)、30 毫克马尾草、30 毫克鱼胶原蛋白和 30 毫克角蛋白加基质。
帕金森病是一种神经退行性疾病,其特征是错误折叠的 α-突触核蛋白的细胞内聚集体沿脑轴聚集。一些研究报告了肠道菌群失调与帕金森病之间的关联,尽管因果关系仍有待确定。帕金森病组中最显著的变化突出了细菌类群的减少,特别是在毛螺菌科家庭和关键成员,例如丁酸弧菌属、粪球菌属(Coprococcus)和Blautia。
另外的研究发现帕金森病患者的结肠中有 α-突触核蛋白 (α-Syn) 聚集,并有结肠炎症的证据。PD患者的黏膜和粪便微生物群与对照组相比有显著差异,粪便样本比乙状结肠黏膜有更显著的差异。在属的分类水平上,来自 Blautia、Coprococcus和 Roseburia 属在对照组的粪便中明显多于 PD 患者。
此外,还有研究指出其他神经退行性疾病 (NDs)包括阿尔茨海默病 (AD)、多系统萎缩 (MSA)、多发性硬化症 (MS)、视神经脊髓炎(NMO) 和肌萎缩侧索硬化症 (ALS)中Faecalibacterium 、Coprococcus、Blautia 、 Prevotella减少。
一项针对136名3岁乌干达儿童粪便样本研究表明,产丁酸盐的肠道细菌Coprococcus eutactus可以作为乌干达农村三岁儿童语言发展的预测因子。
该研究模型指出3岁时语言发展高于平均水平的儿童,在其2岁时粪便中有相对较高水平的Coprococcus eutactus,语言发育低的儿童中Coprococcus 属平均丰度低,而且该研究表明早期获得产丁酸盐Coprococcus eutactus对语言发展的重要性,而在在语言发育受损的儿童中,耐氧物种的优势增加。
湿疹的严重程度一般与微生物群多样性和产生丁酸盐的细菌的丰度呈负相关,尤其产生丁酸盐的Coprococcus eutactus相关细菌的降低。我们数据库数据和案例也显示过敏和哮喘的儿童Coprococcus丰度很低或显著低于健康儿童。
自闭症谱系障碍 (ASD) 是世界范围内普遍存在的神经生物学疾病,原因复杂。多项研究表明自闭症儿童Coprococcus、Prevotella、Blautia 、Lachnospiraceae和Ruminococcaceae属的丰度较低。
睡眠在儿童的身心发展中发挥着重要作用。一项针对学龄前儿童(4.37 ±0.48 岁,n=143)的睡眠与肠道微生物群之间的关系研究表明拟杆菌中双歧杆菌的相对丰度较高,在睡眠效率较高和入睡后醒来时间较低(LDA 评分 >2)的儿童中较高。相比之下,包括 Blautia 和 Coprococcus 在内的一些毛螺菌科成员分别与较短的夜间睡眠时间和较低的效率相关。
慢性便秘是全球最常见的胃肠道疾病之一。然而,其发病机制在很大程度上仍不清楚。在便秘患者的肠道微生物组中,产生丁酸盐的 Roseburia、Coprococcus和 Faecalibacterium 属的丰度很低。不存在便秘状态的特定微生物生物标志物,整个肠道微生物群在都可能发挥作用。
此外,功能性便秘(FC)个体的肠道微生物群被证明缺乏属于拟杆菌属、罗斯氏菌属和 Coprococcus 的成员。与对照相比,FC 相对应的微生物组显示出高丰度的参与制氢、产甲烷和甘油降解的基因。
新出现的证据表明,肠道菌群失调与慢性肾脏病 (CKD) 的发病机制有关,其潜在机制涉及粘膜和/或系统免疫或代谢紊乱。
一项纳入1436 名慢性肾病的meta分析显示终末期肾病 (ESRD)患者中普氏菌属、粪球菌属、巨单胞菌属和粪杆菌属的丰度较低。
虚弱是一种常见的老年综合征,与不良健康后果的风险相关。从 176 名韩国老年人的粪便样本中获得的 16S rRNA 基因测序数据研究了虚弱测量与肠道微生物组的关联。发现在较虚弱的个体中,普氏菌和 Coprococcus eutactus的丰度减少。
先兆子痫是一种以高血压和多个器官功能障碍为特征的妊娠特异性疾病,与母体和胎儿并发症有关。
对 213 名孕妇的粪便样本进行 16S rRNA 基因扩增子测序,调查了妊娠 28 周时发生迟发性(>34 孕周)先兆子痫 (DPE) 的女性的肠道微生物群组成发现产丁酸的丰富粪球菌属在 DPE 中显著减少。产生丁酸盐的细菌特别是Coprococcus spp. 丰度的减少可能会增加孕妇患先兆子痫的风险。
此外,研究发现喹那普利在降低肠道菌群负荷较低的高血压大鼠的血压方面更有效。当他们分析肠道微生物群的组成时,Coprococcus 属成为一个重要的参与者。
早期乳腺癌 (BC) 患者和健康对照者的粪便微生物群分析对比表明早期 BC 的患者中微生物多样性的减少、Odoribacter、Butyricimonas和Coprococcus 的相对丰度降低的趋势。
慢性广泛性肌肉骨骼疼痛 (CWP) 是纤维肌痛的特征性症状,已被证明与肠道微生物组的改变有关。在 CWP 病例中,Coprococcus的物种显著减少 。
维生素 D 会增加瘤胃球菌科、阿克曼氏菌、粪杆菌和粪球菌的增加。
在整个人群中,Coprococcus 的变化与体重、总胆固醇和甘油三酯的变化呈正相关,与 HDL 胆固醇呈负相关。
银屑病是一种常见的慢性复发性皮炎。瘤胃球菌科、 Coprococcus_1属和Blautia属的丰度随着银屑病的改善而降低( p< 0.05),这已被证明在银屑病中显著增加。
但是也有研究指出观察到 Coprococcus属减少。这些研究队列都只有几十例,需要更大队列验证。
小檗碱和二甲双胍都是源自草药的成熟药剂,对包括糖尿病在内的多种疾病具有偶然的有益作用。使用二甲双胍或小檗碱干预 db/db 小鼠的肠道微生物群,增加产短链脂肪酸的细菌(例如,丁酸单胞菌属、粪球菌属、瘤胃球菌属)的数量。
补充维生素 D 对 26 种维生素 D 缺乏(25-羟基维生素 D (25(OH)D) ≤50 nmol/L)、超重或肥胖(BMI ≥25 kg/m 2) 其他健康的成年人。
一项研究是 2014 年至 2016 年间进行的基于社区的双盲随机临床试验的辅助研究。参与者在基线和 100,000 国际单位 (IU) 负荷剂量的胆钙化醇之后提供粪便样本,然后每天 4000 IU 或匹配安慰剂 16周。与25(OH)D <50 nmol/L的个体相比,25(OH)D >75 nmol/L 的个体的粪球菌属丰度增高。
关节和肠道炎症之间的密切关系早已为人所知。20 名受肠病性关节炎影响的患者,他们从未接受过生物药物治疗,在基线时和治疗 6 个月后接受了 TNFi 治疗。所有患者都遵循地中海饮食。治疗后6个月毛螺菌科和粪球菌属显著增加。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
紫薯中提取的抗性淀粉 (RS) 有利于增加Coprococcus的丰度。
胞外多糖 (EPS) 是合成并存在于双歧杆菌表面的碳水化合物聚合物。由于其在食品、生物技术、化妆品和医药等多个领域的潜在应用,双歧杆菌 EPS 促进了 Coprococcus 属的生长。与淀粉组相比,EPS 还增加了丙酸的产生。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
主要参考文献:
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S, Raes J. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol. 2019 Apr;4(4):623-632. doi: 10.1038/s41564-018-0337-x. Epub 2019 Feb 4. PMID: 30718848.
Vascellari S, Palmas V, Melis M, Pisanu S, Cusano R, Uva P, Perra D, Madau V, Sarchioto M, Oppo V, Simola N, Morelli M, Santoru ML, Atzori L, Melis M, Cossu G, Manzin A. Gut Microbiota and Metabolome Alterations Associated with Parkinson’s Disease. mSystems. 2020 Sep 15;5(5):e00561-20. doi: 10.1128/mSystems.00561-20. PMID: 32934117; PMCID: PMC7498685.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson’s disease. Mov Disord. 2015 Sep;30(10):1351-60. doi: 10.1002/mds.26307. Epub 2015 Jul 16. PMID: 26179554.
Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, Marmon S, Neimann A, Brusca S, Patel T, Manasson J, Pamer EG, Littman DR, Abramson SB. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015 Jan;67(1):128-39. doi: 10.1002/art.38892. PMID: 25319745; PMCID: PMC4280348.
Sun C, Chen L, Yang H, Sun H, Xie Z, Zhao B, Jiang X, Qin B, Shen Z. Involvement of Gut Microbiota in the Development of Psoriasis Vulgaris. Front Nutr. 2021 Nov 22;8:761978. doi: 10.3389/fnut.2021.761978. PMID: 34881280; PMCID: PMC8646027.
Andreo-Martínez P, García-Martínez N, Sánchez-Samper EP, Martínez-González AE. An approach to gut microbiota profile in children with autism spectrum disorder. Environ Microbiol Rep. 2020 Apr;12(2):115-135. doi: 10.1111/1758-2229.12810. Epub 2019 Nov 27. PMID: 31713352.
Mancabelli L, Milani C, Lugli GA, Turroni F, Mangifesta M, Viappiani A, Ticinesi A, Nouvenne A, Meschi T, van Sinderen D, Ventura M. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses. Sci Rep. 2017 Aug 29;7(1):9879. doi: 10.1038/s41598-017-10663-w. PMID: 28852182; PMCID: PMC5575163.
Yarullina DR, Shafigullin MU, Sakulin KA, Arzamastseva AA, Shaidullov IF, Markelova MI, Grigoryeva TV, Karpukhin OY, Sitdikova GF. Characterization of gut contractility and microbiota in patients with severe chronic constipation. PLoS One. 2020 Jul 17;15(7):e0235985. doi: 10.1371/journal.pone.0235985. PMID: 32678865; PMCID: PMC7367488.
Lim MY, Hong S, Kim JH, Nam YD. Association Between Gut Microbiome and Frailty in the Older Adult Population in Korea. J Gerontol A Biol Sci Med Sci. 2021 Jul 13;76(8):1362-1368. doi: 10.1093/gerona/glaa319. PMID: 33437992.

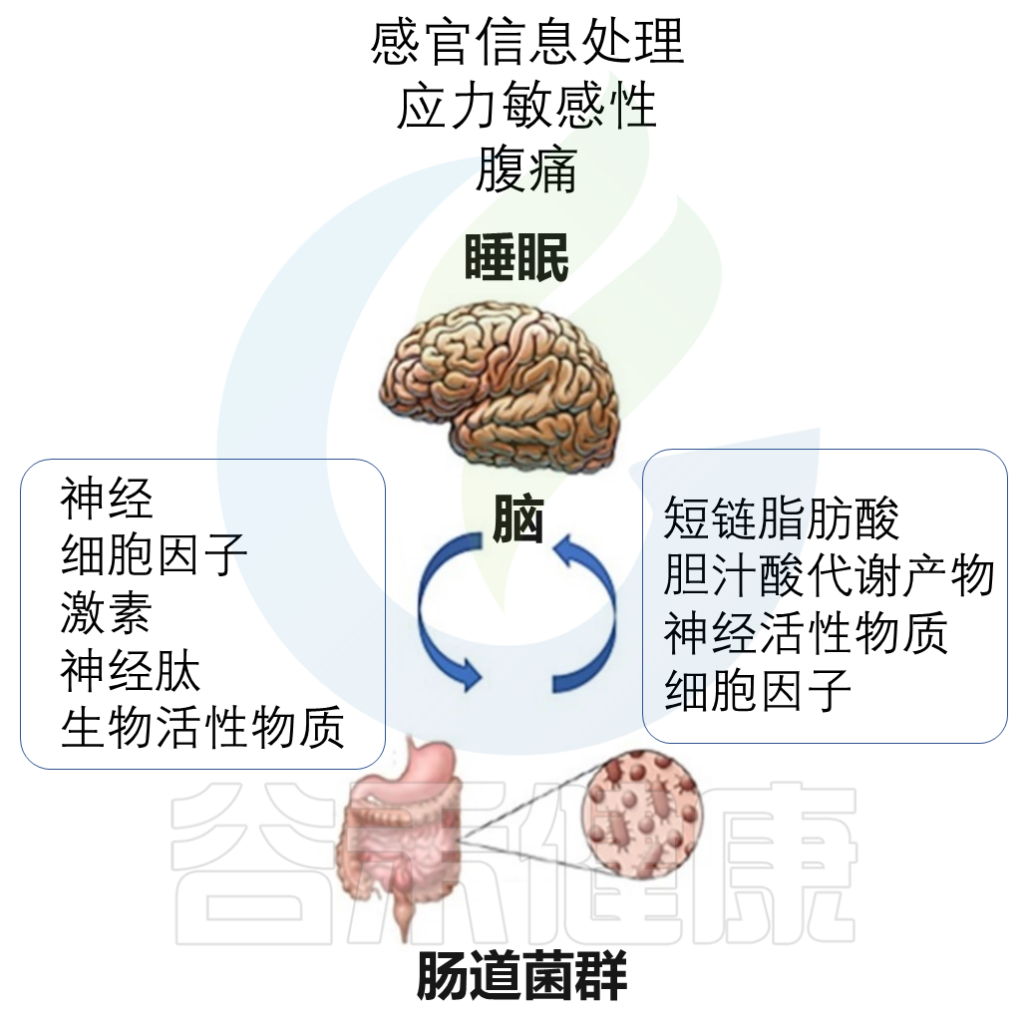
谷禾健康
人一生中平均有三分之一的时间在睡觉。睡眠对于我们是必不可少的存在,它能够促进我们的幸福感。

然而目前,睡眠障碍已经成为了一种流行病。尤其是在新冠肺炎流行之后,进一步加剧了睡眠问题。
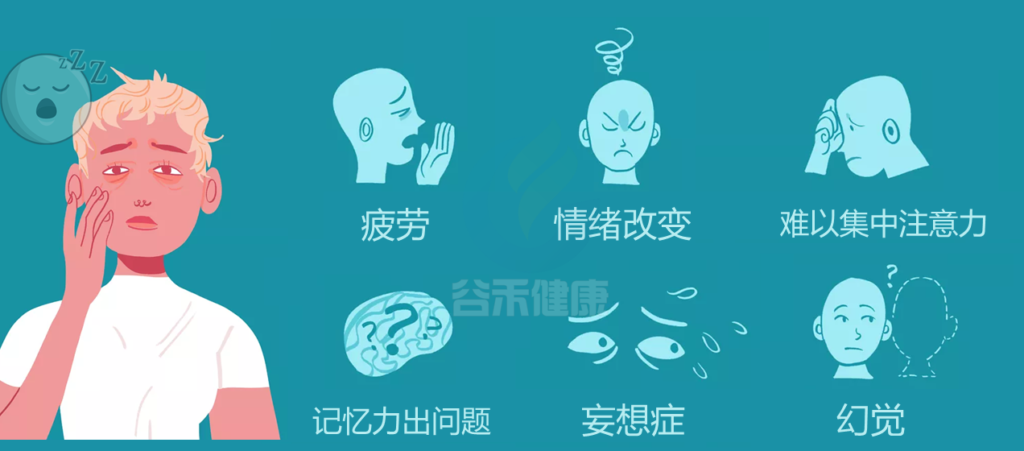
随着睡眠障碍的患病率越来越高,人们开始深入研究——是什么因素决定了睡眠的质量?
众所周知,各种环境因素和其他因素(如心理压力和饮食)的共同作用会影响睡眠质量和睡眠持续时间(下图)。
图1 各种因素的相互作用影响睡眠质量和持续时间
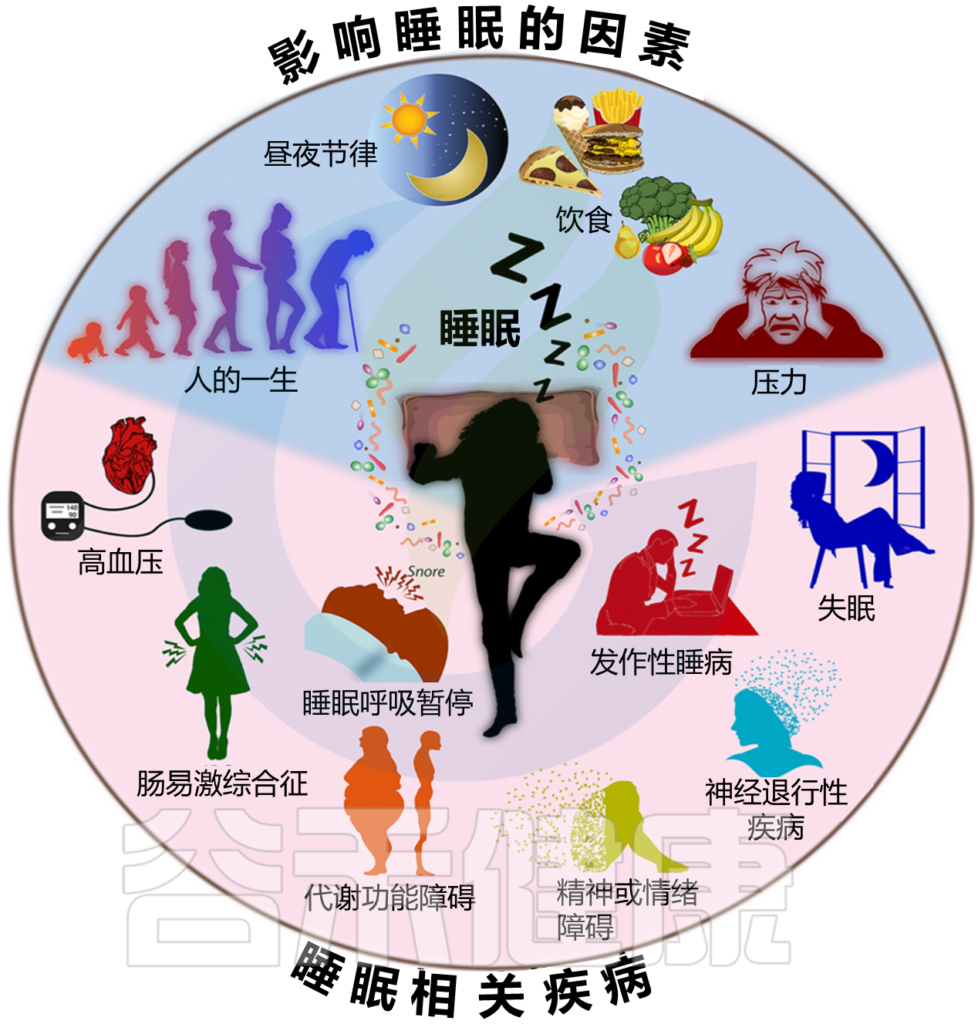
Sen P, et al.,Trends Mol Med. 2021
各种因素对睡眠质量和持续时间的相互作用影响。已知各种不同的因素会影响睡眠。其中包括饮食、压力、昼夜节律调整以及整个生命周期的各个阶段(上图,蓝色背景)。最近的研究表明,这些因素与肠道微生物群相互作用,影响睡眠。
反过来,睡眠质量和持续时间也影响各种因素。睡眠质量差或睡眠不足可导致免疫、代谢功能障碍、血压升高,并可发展为肠易激综合征、各种神经退行性疾病和精神障碍、睡眠呼吸暂停和发作性睡病(下窗格,粉红色背景)。睡眠不足可能通过影响肠道菌群组成而导致这些疾病的发展。
本文从微生物群的角度探讨各种因素如何与肠道微生物群相互作用影响睡眠。包括睡眠与微生物群具有相互作用的可能机制。
此外,还提出了常见的伴随睡眠障碍的疾病以及针对各种睡眠障碍时微生物群对肠道和大脑进行调节改变的现有证据。
睡眠质量与肠道菌群组成之间存在双向关系。使用抗生素干扰肠道微生物群会导致更大的非快速眼动(NREM)睡眠碎片化,从而降低睡眠质量,睡眠中断也会导致肠道微生物群组成的变化。不过,关于睡眠障碍和微生物组成之间关系的结果缺乏一致性。
此外,大多数睡眠研究只关注单一时间点的肠道微生物群。由于肠道菌群每天动态变化,睡眠和肠道菌群之间的关系可能在一天的不同时间有所不同。
尽管如此,越来越多的研究表明,微生物-肠道-大脑轴与睡眠生理和行为有关。
表1 探索肠道微生物如何影响睡眠的各种研究

Sen P, et al.,Trends Mol Med. 2021
睡眠和微生物群组成:交流机制
肠道微生物群通过微生物群-肠道-大脑轴与大脑沟通的各种可能机制。
图2 影响睡眠的微生物群-肠道-大脑轴交流模式

谷禾健康
今日,两条关于睡眠问题登上热搜。
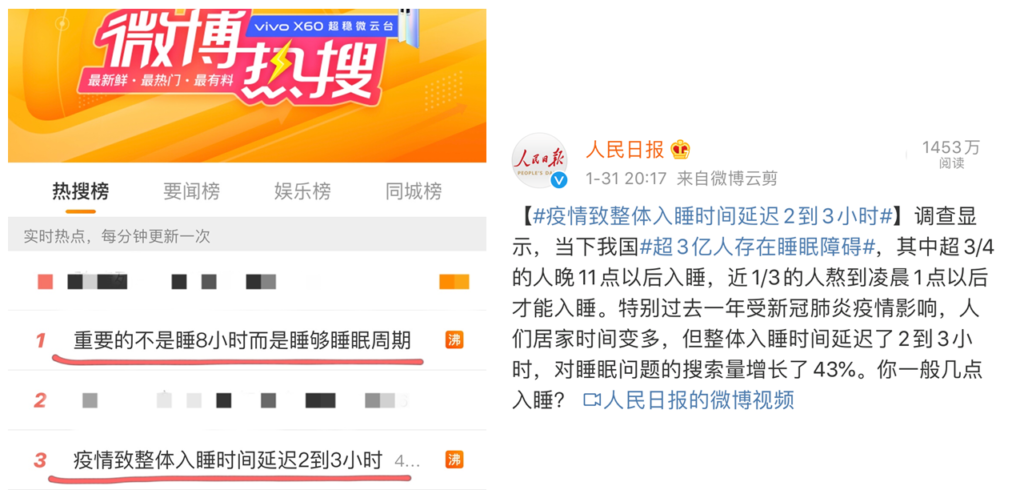
我国有超3亿人存在睡眠障碍,尤其过去这一年,人们整体入睡时间延迟2-3小时,对睡眠搜索量增长43%,看来睡眠问题正在影响越来越多人。
疫情致使整体入睡时间晚2-3小时_腾讯视频
睡眠是由人脑控制的一种复杂的生理行为过程,与免疫功能同为正常生活所必要的生理机能。睡眠是在漫长的一天之后舒缓和恢复的良好方式,睡眠可以让身体和大脑补充能量,良好的睡眠对于巩固记忆、处理信息、生长身体、修复肌肉,增强免疫,抵御疾病至关重要的。
睡眠障碍与各种疾病的发生和发展有关,例如肥胖,II型糖尿病,心血管疾病,抑郁症,癌症等。睡眠不足也会影响判断力和智力。
本文我们来详细了解下,睡眠障碍——这个大多数人都有可能遇到的难题。
首先,关于热搜第一条“睡够睡眠周期”到底什么意思呢?
要了解睡眠障碍之前,我们的先看下,正常生理性睡眠。
正常睡眠结构的特征是轻度睡眠,更深的慢波睡眠和快速眼动(REM)睡眠周期。
第一阶段睡眠(清醒和睡眠的过渡期)
第一阶段睡眠是睡眠周期的开始,被视为清醒和睡眠之间的过渡期。这段睡眠时间仅持续5-10分钟,其特征是混合频率的theta波(非常慢的脑波)。
第二阶段睡眠(体温下降,心率减慢)
第2阶段持续约20分钟,涉及混合频率的脑电波,具有快速的节奏性脑电波活动。在第2阶段,体温开始下降,心率开始减慢。
第三阶段睡眠(从轻度到深度过渡期)
第3阶段睡眠的特征是20%-50%的缓慢脑电波(称为δ波)。这是从轻度睡眠到深度睡眠的过渡时期。
第四阶段睡眠(缓慢脑电波)
阶段4的δ波大于50%,在此期间发生了缓慢的脑电波。阶段4持续约30分钟。
第五阶段睡眠(快速眼动睡眠)
睡眠的第5个阶段,即快速眼动(REM)睡眠,是大多数做梦的时候。第五阶段的特征是呼吸频率增加,大脑活动增加,体内各种代谢功能都显著增加。REM睡眠具有混合频率的EEG和theta波。成年人大约每90分钟出现一次REM睡眠。
睡眠以正常顺序开始,但随后以不规则的顺序循环进行。它开始于阶段1,然后进入阶段2、3和4。在阶段4睡眠之后,在开始REM(阶段5)睡眠之前,重复阶段3和2。REM睡眠结束后,身体通常会返回第2阶段睡眠。REM睡眠的第一个周期是入睡后约90分钟,并且只能持续很短的时间。每个周期,REM睡眠持续时间更长。


失眠是最普遍的睡眠障碍。判断失眠的标准:

标准一: 3个30分钟
入睡时间 [ 入睡时间超过30分钟 ]
睡眠维持困难 [ 醒后再入睡超过30分钟 ]
早醒 [ 比平时提前醒来超过30分钟 ]
标准二:
以上情况 一周超过三天
标准三:
社会功能受损,第二天身体不适
如何判断失眠?权威专家来解答_腾讯视频
影响睡眠质量和持续时间的因素如下,多种内部和外部因素都会对其进行干扰。
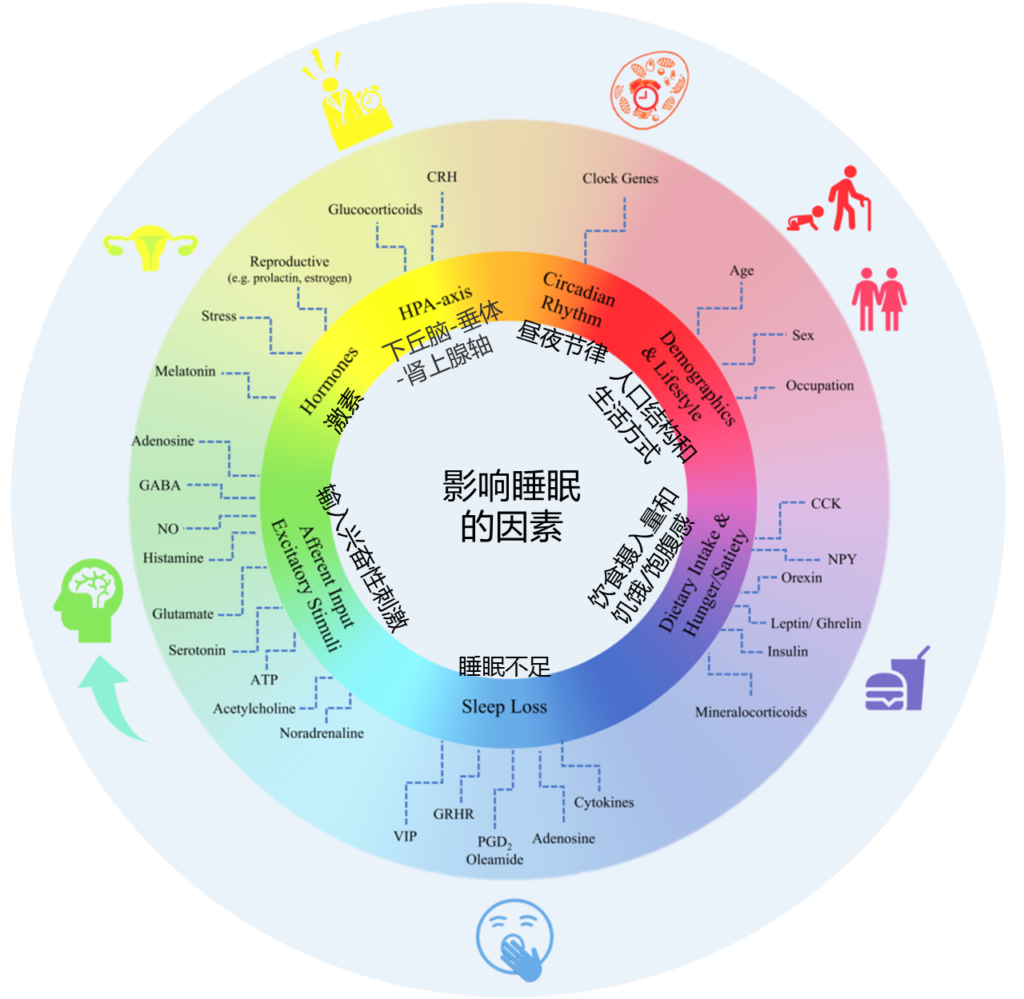
Matenchuk Brittany A,et al., Sleep Med Rev, 2020
睡眠障碍与多种原因有关,通常与不良饮食以及饮食习惯、昼夜节律、压力情绪、生活方式、疼痛炎症、以及慢性疾病等有关。
引起睡眠障碍的原因有很多,但有一个容易被忽略,那就是肠道菌群。
人类微生物群是体内复杂,动态的生态系统。越来越多的研究表明它似乎以许多重要的方式与睡眠相互沟通,相互作用。
菌群改变与睡眠密切相关
研究表明失眠症患者和健康人群肠道微生物的组成、多样性和代谢功能发生了显著变化。随机森林结合交叉验证确定了两种标志性细菌,可用于区分失眠患者和健康人群——拟杆菌属,梭菌属。
对微生物组组成的分析表明,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度与睡眠质量呈正相关,而Lachnospiraceae、棒状杆菌(Corynebacterium)、Blautia等几种菌与睡眠质量测量值呈负相关。
Faecalibacterium是肠道微生物群中产丁酸菌,可能有助于双相患者减轻疾病负担和改善睡眠质量。其潜在机制可能是产生促进睡眠的丁酸盐。
高质量的睡眠与肠道菌群相关,包括Verrucomicrobia菌和Lentisphaerae菌 ,占比偏高,与认知功能改善相关。
乳酸菌数量与睡眠呈负相关。干酪乳杆菌对健康成年人的应激性睡眠障碍有有益作用。短乳杆菌对小鼠的睡眠节律有好处。
微生物组多样性(丰度,香农多样性和辛普森多样性)与睡眠质量和总睡眠时间增加呈正相关。
研究发现,睡眠不足与肠道微生物的多样性降低有关,睡眠越好,微生物组的多样性就越丰富。
一项2019年的研究发现,睡前60分钟(这是衡量睡眠量和睡眠质量的指标)与肠道微生物多样性降低26%有关。这是在控制了可能影响微生物组成的其他因素之后,包括饮食中纤维和脂肪的摄入量,体力活动和身体质量指数。
肠道微生物的多样性高有助于减轻压力和改善睡眠。除了睡眠不足之外,微生物组多样性的降低还与一系列健康问题有关,包括情绪障碍,焦虑,抑郁,免疫系统功能障碍和自身免疫性疾病。
失眠患者肠道菌群的α和β多样性发生了显著改变。睡眠时间减少可能会导致肠道菌群失调。
肠道菌群是如何影响睡眠的呢?
可以通过肠道菌群与大脑之间的持续不断的相互作用来影响。主要有以下途径:
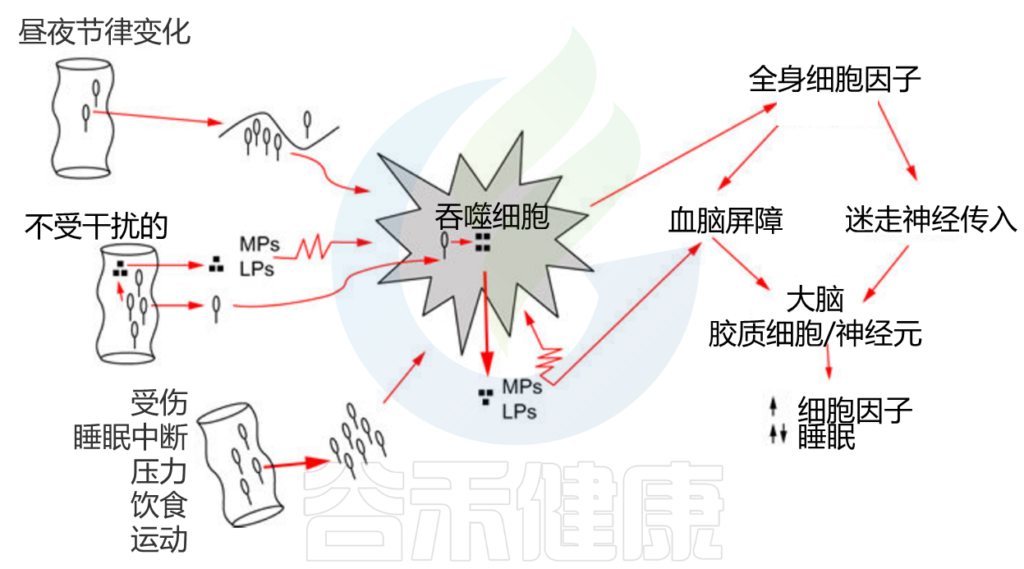
· 免疫系统途径
大脑和肠道微生物组都影响免疫细胞的活性,并依次相互影响。
肠道细菌被吞噬细胞(如巨噬细胞或中性粒细胞)吞噬并被消化;消化产物(如MPs、LPS)被释放到周围的细胞间液中。MPs和LPS反过来激活吞噬细胞(如锯齿状细胞膜所示),然后释放细胞因子。全身性细胞因子通过至少两种途径(迷走神经和血脑屏障)进入大脑。
免疫细胞在保持肠道微生物组健康方面发挥了重要作用,并且帮助免疫系统发挥最佳功能。这些细胞执行许多关键功能,包括:
帮助调控微生物组的组成
调节新陈代谢
限制炎症
保护肠道不受感染
保持肠壁坚固(并避免所谓的“漏肠”)
——细菌细胞壁结构成分影响睡眠
微生物细胞壁的结构成分不断刺激先天免疫系统产生细胞因子,产生一种免疫激活的基本状态,从肠粘膜表面开始,影响全身。
当细菌分裂、生长或死亡时,肽聚糖、脂多糖和其他成分被细菌酶降解或改变。宿主吞噬细胞如巨噬细胞和中性粒细胞也可以消化肽聚糖产生胞壁肽(小糖肽)。从革兰氏阳性或革兰氏阴性细菌中分离出来的肽聚糖,诱导睡眠反应,例如,非快速眼动睡眠的持续时间和强度会增强几个小时。如果给吞噬细胞喂养细菌,它们就会释放出具有生物活性的胞壁酰肽;其中一些胞壁酰肽诱导睡眠反应与完整的肽聚糖和热杀死的整个细菌所诱导的睡眠反应相似。
细菌肽诱导肠巨噬细胞和T细胞产生细胞因子白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNFα);细菌细胞壁脂多糖(LPS)诱导IL-18的合成。
IL-1β,TNFa22,IL-18是非快速眼动睡眠的诱导因子。
其他微生物,如病毒及其组分也通过内源性受体(识别病原体相关分子模式,如Toll样受体)促进细胞因子的产生,从而影响睡眠。
· 神经内分泌途径
肠道内有20多种肠内内分泌细胞,构成最大的内分泌器官。
肠道菌群直接参与多种神经递质,细胞因子和代谢产物的产生,例如5-HT,多巴胺,γ-氨基丁酸(GABA),SCFA和褪黑激素等。
某些乳酸杆菌和双歧杆菌可以产生GABA。在失眠患者中经常观察到GABA mRNA的异常表达。
大肠杆菌产生去甲肾上腺素、5-羟色胺和多巴胺;
链球菌和肠球菌产生5-羟色胺;
芽孢杆菌产生去甲肾上腺素和多巴胺。
Vernia F,et al., Int. J. Med. Sci.2021
这些代谢物直接作用于肠神经系统和迷走神经,并影响中枢神经系统的活性。
此外,肠道菌群还影响下丘脑-垂体-肾上腺(HPA)轴。
HPA轴参与稳态,参与对新刺激的反应。HPA轴是一种自适应系统,目的是在不断变化的环境中保持体内动态平衡。越来越多的研究表明,睡眠与HPA轴活动之间存在相互关系。
HPA轴亢进会对睡眠产生负面影响,导致睡眠碎片化,深度慢波睡眠减少和睡眠时间缩短。反过来,包括失眠和阻塞性睡眠呼吸暂停在内的睡眠障碍会进一步加剧HPA轴功能障碍。
干预以使HPA轴异常正常化,减少夜间CRH亢进和降低皮质醇可能对治疗失眠和其他睡眠障碍有益。详见本文后面改善睡眠章节。
说起HPA轴,就不得不提到皮质醇。它的作用不容小觑。
皮质醇如何产生?
HPA轴被激活,下丘脑促肾上腺皮质激素释放激素(CRH)的分泌,然后刺激垂体前叶释放促肾上腺皮质激素。然后促肾上腺皮质激素刺激肾上腺释放皮质醇,导致交感神经系统的各种生理反应(如肾上腺素的释放、心率加快和血压升高)。
皮质醇升高可能是睡眠障碍的主要原因
HPA轴障碍可能导致皮质醇升高,当皮质醇水平较高时,会激活糖皮质激素受体。在压力时期去甲肾上腺素和糖皮质激素受体可以优先激活,从而增加促肾上腺皮质激素释放激素。这种升高的促肾上腺皮质激素释放激素会增加睡眠脑电波频率,减少短波睡眠,并增加轻度睡眠和频繁醒来。
皮质醇还与昼夜节律相关,这部分我们在下一章节昼夜节律篇讨论。
· 迷走神经途径
肠肌层神经丛的感觉神经元通过调节肠蠕动和肠激素分泌而接触肠道菌群。肠神经系统也与迷走神经形成突触连接,迷走神经将肠道与大脑连接起来。
细胞因子通过迷走神经传入向大脑发出信号,迷走神经的动作电位进一步诱导胶质细胞和神经元在大脑中产生细胞因子。细胞因子浓度高低与睡眠有关。
低浓度的脑细胞因子能促进睡眠,而高浓度的脑细胞因子则不利于睡眠。
睡眠障碍与肠道菌群失调存在循环关系
前面我们知道,肠道菌群会通过多种途径影响睡眠。
Krueger JM,et al .,Int Rev Neurobiol. 2016
反过来睡眠也会影响肠道菌群。
睡眠不足或者其他因素如受伤、食物摄入、压力、昼夜节律和运动等,可致肠屏障损伤和细菌移位,增加感染易感性,激活HPA轴从而影响菌群。
大多数人(和其他哺乳动物)都存在昼夜节律–控制进食和睡眠等过程的代谢时钟。最常见的昼夜节律周期是控制睡眠的周期,科学家们已发现存在着多种控制着不同生物系统的昼夜节律。
过去的研究已表明如果昼夜节律紊乱,人们可能会遇到健康问题。比如,改变工作时间的轮班工人更容易患睡眠障碍、肥胖、糖尿病等。
昼夜节律——皮质醇
前面提到的皮质醇分泌就有昼夜节律。皮质醇的最低点出现在午夜左右。睡眠开始后约2-3小时,皮质醇水平开始上升,并一直持续到清晨。
早晨醒来时,皮质醇开始迅速升高,并持续升高约60分钟。皮质醇的峰值大约是上午9点。随着一天的继续,水平逐渐下降。随着睡眠的开始,皮质醇持续下降直至最低点。
此外,越来越多的研究都表明,机体的昼夜节律能够调节肠道的免疫反应。
昼夜节律——免疫系统
昼夜节律调节免疫系统,并随之调节炎症水平。
第3组先天淋巴细胞(ILC3s)是昼夜脑-肠信号转导的关键介质。ILC3s表达高水平的昼夜节律基因,光-暗周期的反转导致ILC3s主要的昼夜节律振荡。这种作用依赖于中枢神经系统(CNS)和下丘脑SCN中ARNTL的存在,并进一步与肠道菌群组成的变化有关,特别是变形菌门和拟杆菌门丰度的改变。
注:ARNTL——芳香烃受体核转位因子样蛋白
当昼夜节律被破坏时,正常的免疫功能也会被破坏。这样的情况下,人更容易患上各种疾病。
昼夜节律——肠道菌群
研究发现肠道菌群的两个主要组成部分拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度从白天到晚上呈周期性变化。
肠道菌群受昼夜节律信号的影响,同时也对生物钟基因的表达产生交互作用。
来自美国德克萨斯大学西南医学中心的研究人员发现小鼠小肠中的微生物参与肠道昼夜节律。该研究发现改变受试小鼠中组蛋白乙酰化的过程,即在组蛋白末端添加乙酰基的过程,细菌便可开启HDAC3在位于小肠内壁的上皮细胞中的表达。这进而导致了参与基因表达的同步振荡,这些基因表达与脂质代谢和营养物运输有关。相比之下,肠道无菌的小鼠没有表现出这种节律性调节。
肠道微生物的昼夜节律振荡导致血清代谢产物的振荡,并与周围组织的转录和表观遗传波动有关。
昼夜节律——肠道菌群代谢产物
短链脂肪酸影响生物钟基因表达和睡眠模式
肠道微生物代谢产物,短链脂肪酸乙酸、丙酸、丁酸在一天中会发生变化,粪便样本中的最高浓度出现得较早,并且在一天中不断降低。短链脂肪酸可能会影响生物钟基因的表达。
研究发现,肠道微生物群的缺乏,以及微生物代谢物的缺乏,导致中枢和肝脏生物钟基因表达明显受损,这表明肠道微生物群在分子水平上传播生物钟的可能性。
在体外,发现在给予乙酸钠和丁酸钠后,小鼠肝细胞中时钟基因Bmal1和Per2的表达发生了显著变化。
在不同的光照-暗期和摄食周期下,添加乙酸后Per2表达量较高,添加丁酸后Per2表达量较低;短链脂肪酸处理后Bmal1表达持续升高,尤其是丁酸处理。
在无菌小鼠体内,关灯两小时后用丁酸盐治疗5天(小鼠处于活跃期),导致肝细胞中Per2:Bmal1 mRNA比值显著增加。此外,同样的处理也导致了中基底下丘脑细胞中Per2:Bmal1 mRNA比值的非显著增加(p=0.053)。Bmal1和Per2等时钟基因在分子水平上调控昼夜节律;它们的比率是肝脏代谢调节网络的标志。
丁酸盐在肠道菌群与大脑产生睡眠的机制之间提供重要联系。
进一步的研究表明,门静脉注射丁酸盐可导致小鼠非快速眼动睡眠增加70%;全身皮下和腹腔注射丁酸盐对睡眠无影响。这些结果表明,丁酸盐的睡眠诱导作用是由肝脏感觉机制介导的。
昼夜节律——肠上皮屏障
肠道菌群通过肠上皮细胞昼夜节律因子调节。
肠上皮细胞协调消化、免疫和神经内分泌功能,是人体最重要的屏障之一。胞壁肽(MPs)或脂多糖(LPS),通过肠上皮屏障转运。
通过受损的伪反应调节器(PRR)信号,导致过氧化物酶体增殖物激活受体α(PPARα)的永久表达,肠道微生物群的消失会破坏肠上皮细胞中Bmal1和Cry1时钟基因的表达,导致肠上皮细胞活动的完全丧失。
此外,肠道菌群也受饮食周期调控,我们将在下一章节详细了解它们之间的关联。
睡眠与昼夜节律、食物摄入、运动和压力源密切相关;这些变量还相互影响,使它们在睡眠中的行为复杂化。饮食、进餐时间和睡眠之间的联系是相互的,因为昼夜节律驱动着代谢模式的变化,而代谢和营养状况的改变则影响着昼夜节律。
我们常听说健康的饮食,生活方式以及合理的饮食习惯有助于心理和身体健康。
辛辣食物、兴奋剂和不良食物反应(不耐受和食物过敏)影响睡眠可以理解。然而,为什么说不吃饭,吃得太快或吃得过饱,吃饭时间不规律,食物质量差,这些也都是导致睡眠障碍的饮食原因?
从本质上讲,饮食摄入与肠道菌群组成有关,因为我们摄入的食物是微生物生长的主要基质。我们饮食的改变可以在几天内导致我们肠道菌群重塑。
摄食节律和昼夜节律的破坏会导致肠道细菌的时间特异性变化。昼夜节律紊乱也会增加肠上皮屏障的通透性。
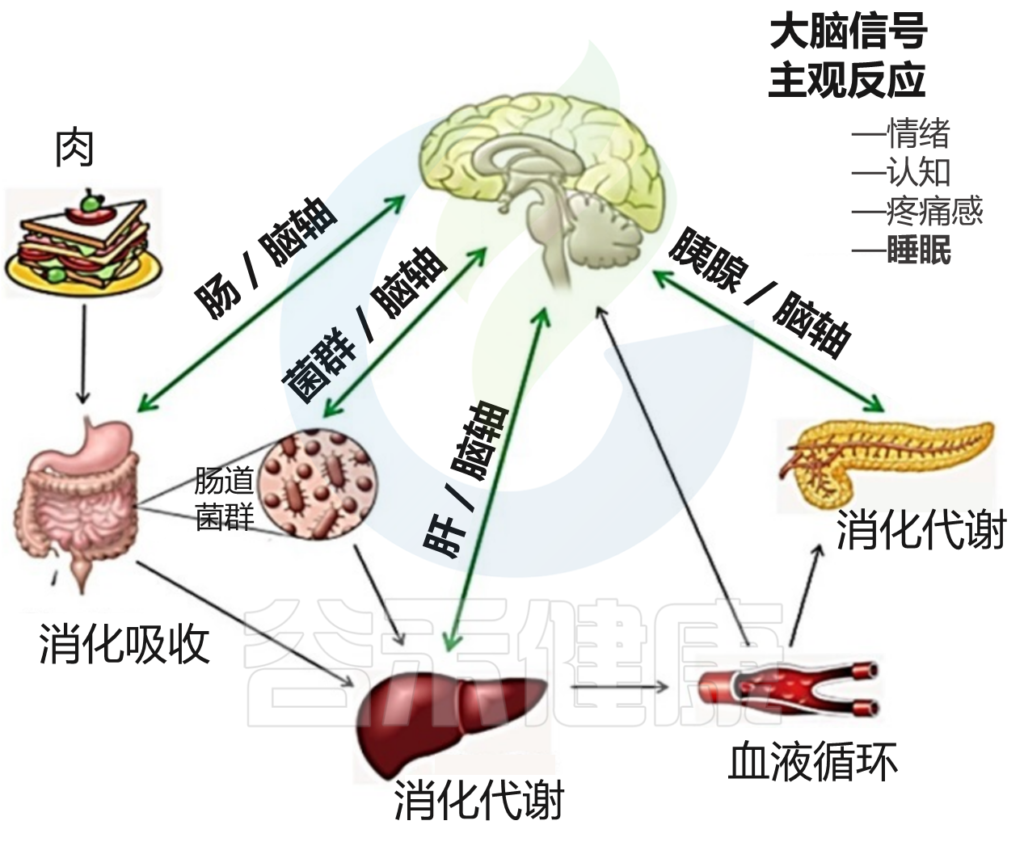
Vernia F,et al., Int. J. Med. Sci.2021
饮食行为影响人类睡眠的时间和质量。睡眠时间短和高能量摄入之间有一致联系。
食物中营养物质影响睡眠
营养物质影响激素的产生,包括生长激素、催乳素、睾酮、褪黑素和血清素,所有这些都在调节生物钟中发挥作用。
食物中存在的氨基酸,如苯丙氨酸、组胺和酪氨酸,促进肾上腺素、去甲肾上腺素和其他刺激性神经递质的产生和释放,可能损害睡眠。
影响色氨酸供应或血清素和褪黑素合成的食物则促进睡眠。一些维生素(B1和B6)也能诱导褪黑素和血清素的产生和释放。
饮食习惯影响睡眠
进餐的时间,特别是零食的频率,使昼夜节律失去同步,影响新陈代谢,并促进肥胖。这与生物钟在调节激素和神经递质释放中的作用是一致的。
不吃饭、或者晚餐十分丰盛的现象越来越普遍。然而将主要热量摄入转移到一天结束时会对消化产生不利影响,并使睡眠困难;如果膳食丰富且脂肪丰富,则更是如此。
相反,碳水化合物对睡眠模式的作用仍有争议,碳水化合物的重量与热量负荷的关系也有争议。
为什么很想吃垃圾食品?
压力在影响饮食模式方面很重要,可能是通过改变下丘脑-垂体-肾上腺轴,让人对垃圾食品(高脂肪和精制糖)产生强烈的渴望。
久坐的生活方式,睡眠时间短同样会让人想吃高能量食物。
为什么睡眠不足与想吃高能量食物有关?
下丘脑外侧神经元通过不同的回路表达神经肽,如黑色素浓缩激素和食欲素/下视黄醇,在调节食物摄取、觉醒、运动行为和自主神经功能方面发挥重要作用。
睡眠限制与饱食因子瘦素浓度降低、促饥饿激素ghrelin浓度增加有关,从而改变了它们发出正确热量需求信号的能力。于是又会促进代谢综合征和肥胖,并再次对生物钟产生不利影响。
注:Ghrelin是一种神经肽,参与睡眠-觉醒调节。
此外,食欲素Orexins在能量稳态和警觉状态之间提供联系,并参与多巴胺能奖赏系统。在动物模型中,产生食欲素的基因突变导致了睡眠表型的改变。有假设说,在清醒时,产生食欲素的细胞的高活性,而在睡眠时几乎没有这种活性,也会影响睡眠。
越来越多的证据也表明睡眠会影响饮食选择。睡眠较少的人更可能喜欢高能量的食物(如脂肪和精制碳水化合物),吃较少的蔬菜,并选择不规律的饮食模式。
糖摄入与睡眠
糖会对肠道健康产生特定作用。有大量证据表明,标准的西方饮食(加工糖和高脂)会导致肠道微生物群的组成发生变化。
上一小节提到的多巴胺奖赏系统与糖摄入也有关系。研究表明,糖是一种有力的触发剂,含糖的食物足以刺激大脑的奖赏系统,从而对食物产生更多的渴望,
糖还有其他间接影响我们肠道健康的方法。高糖饮食会加剧慢性炎症,而炎症则会损害肠道菌群的多样性和功能。经常食用添加糖的饮食可能导致体重增加。
另外添加糖还会升高胆固醇,这与炎症增加有关。关于炎症和睡眠的关系将在下一章节详述。
所有含糖食物(例如水果)都会影响睡眠吗?
不是的。水果之类的天然含糖的食物提升人血糖的速度,远没有含添加糖的食物快。天然食品中纤维含量很高,人体吸收糖的速度变慢,阻止血糖水平飙升。
炎症和睡眠障碍也是双向联系的。
炎症是免疫系统的一种天然的,保护性的生物反应,可以抵抗有害的外来病原体(细菌,病毒,毒素),并帮助身体从受伤中恢复健康。急性炎症的症状包括肿胀和发红,发烧,发冷,疼痛和僵硬以及疲劳,这些迹象表明人体的免疫系统处于“战斗模式”。
睡眠障碍会加剧慢性低度炎症,这是导致疾病的重要因素。不需要几年或者几个月,哪怕只是一晚上的完全睡眠不足就足以提高促炎生物标志物、肿瘤坏死因子α(TNFα)和C反应蛋白(CRP)的循环水平;血清CRP水平随着4天的完全睡眠不足而逐渐升高。
有研究发现,一晚上完全睡眠不足,白细胞介素(IL-6)细胞因子升高,一周失眠不足(每晚4-6小时),IL-6和TNFα的24小时分泌量也会增加。
全身性炎症也会破坏健康的睡眠。通过触发生理和心理变化,让人难以获得良好的睡眠。
细胞因子升高与睡眠困难有关。炎症会在体内造成疼痛和僵硬,使人难以入睡。身体上的疼痛是失眠和其他睡眠问题的常见因素。关于慢性疼痛将在下一章节详细介绍。
炎症涉及较高水平的皮质醇,皮质醇前面了解过,可刺激机敏并导致心理压力。压力是健康睡眠的最重要的常见障碍之一。
7.1 压力,抑郁与睡眠障碍
压力与睡眠
2017年进行的一项研究,压力对大鼠睡眠和肠道健康的影响。通过对小鼠尾部冲击睡眠模式中断。结果发现肠道菌群失去了多样性。少数菌群控制着肠道微生物,失去平衡是不健康的。当他们给小鼠服用益生元时,肠道菌群变得更加多样化,并包含了更多有益菌,如鼠李糖乳杆菌,睡眠变得更好,包括REM和非REM睡眠。
昼夜节律引发情绪波动和睡眠障碍
临床经验表明,扰乱昼夜节律挑起时差综合征或减少睡眠可以触发情绪波动和睡眠障碍。
核心时钟基因突变会引起肠道菌群失调。多种时钟基因变异易患精神疾病,例如重度抑郁症(MDD),双相情感障碍(BD),注意力缺陷多动障碍(ADHD),精神分裂症等。
微生物GABA产生(这是中枢神经系统的主要抑制性神经递质,已证实GABA受体的激活有利于睡眠)对抑郁症和肠道微生物多巴胺代谢物的能力的潜在贡献。
3,4-二羟基苯乙酸(一种主要包含在浆果、水果和蔬菜中的膳食多酚)的合成,与较高的心理生活质量感知相关。
7.2 慢性疼痛与睡眠障碍
慢性疼痛可以对睡眠有不同的影响并取决于疼痛的性质。
疼痛可能在夜间无法缓解,导致睡眠不足。除了缩短总体睡眠时间外,最常见的,慢性疼痛还会导致夜间频繁起床。我们会在轻度睡眠,慢波睡眠和快速眼动(REM)睡眠之间循环。破坏该周期会干扰睡眠阶段的进展,并导致睡眠不足和第二天的疲倦。
疼痛带来的情绪不佳
疼痛也可能伴有焦虑,压力或抑郁。据估计,三分之一的慢性疼痛患者也符合临床抑郁症。这些状况本身会导致睡眠问题。
慢性疼痛间接影响睡眠
患有慢性疼痛的人白天可能会感到疲劳。那么他们不太能做到锻炼或遵循健康饮食,然而这两者对于获得良好的睡眠很重要。
慢性疼痛导致的不稳定睡眠也会打扰夫妻同床,对他们的睡眠质量和健康产生相应的影响。
睡眠对疼痛的影响
新的研究表明,睡眠对疼痛的影响甚至可能比疼痛对睡眠的影响还要强。
睡眠不好导致对疼痛敏感性增强
研究人员发现,睡眠时间短,睡眠分散和睡眠质量差等问题通常会导致第二天对疼痛的敏感性增强,诸如类风湿关节炎。患有睡眠问题的人似乎更有可能最终患上诸如肌痛和偏头痛等疾病。当失眠引起的疼痛加剧时,女性比男性更敏感,年轻人比老年人更有弹性。
慢性疼痛与睡眠障碍的不良循环
患有慢性疼痛的人可能患有自我延续的周期,疼痛,失眠,抑郁或焦虑。例如,遭受痛苦的人在无法入睡时可能会感到焦虑,睡眠不好,醒来时会感到沮丧,这增加了他们对疼痛的敏感性。第二天晚上又开始疼痛,无法入睡,周期一直循环。久而久之,状况可能更加恶化。
前面提到的褪黑素,除了它在调节昼夜节律中的作用,新的研究开始发现褪黑激素在我们对疼痛的感知中产生作用。维生素D、多巴胺也似乎在睡眠和疼痛中都起着作用。
7.3 消化系统疾病与睡眠障碍
胃食管反流性疾病
胃食管反流病以病理性酸或非酸反流为特征,并与多种可能影响上消化道(反流、烧心、疼痛)和/或诱发呼吸道症状(声音嘶哑、发音困难、慢性喉炎、咳嗽、哮喘和慢性支气管炎)的紊乱有关。
有强有力的证据表明胃食管反流病与睡眠障碍之间存在双向关系,因为胃食管反流病的症状会导致入睡困难、睡眠分裂和清晨醒来,而睡眠障碍又会诱发食管痛觉过敏。
因此,有睡眠障碍的胃食管反流病患者比没有睡眠障碍的患者有更严重的症状和更差的生活质量。据报道,在这些患者中,焦虑和抑郁的患病率很高,在某种程度上是由睡眠障碍直接介导的。
IBS
IBS患者的睡眠障碍是有据可查的,入睡困难、睡眠时间短、频繁觉醒等。最近的一项荟萃分析有63620名参与者,结果显示IBS患者睡眠障碍的患病率为37.6%。
IBD
前面章节我们已经知道,炎性细胞因子如肿瘤坏死因子-α(TNF-α)、IL-1和IL-6可引起睡眠障碍,而睡眠障碍可上调细胞因子,尤其是IL-1和TNF-α。(IL-1参与生理性睡眠调节和睡眠对微生物的反应)
临床研究发现睡眠障碍、亚临床炎症和IBD复发风险之间存在关联。最近的一项研究报道,使用匹兹堡睡眠质量指数评估睡眠质量差与粘膜愈合不良有关(P<0.05)。
7.4 肝病与睡眠障碍
睡眠障碍可能发生在急性和慢性肝炎,但更常见于肝硬化患者。相当一部分肝硬化和急慢性肝衰竭患者患有失眠、睡眠延迟和白天过度嗜睡。
肝硬化
最近一项对341名病毒性肝硬化患者的研究证实了这种关联,报告称匹兹堡睡眠质量指数显著升高。多导睡眠图异常也存在。
肝性脑病
睡眠障碍通常是肝性脑病的早期症状,导致日常嗜睡,增加受伤风险,降低生活质量。
肝脏和大脑之间的神经和体液通讯途径尚不完全清楚,但炎症细胞因子如TNF-α、IL-1和IL-6发挥了作用,它们改变了中枢神经递质(血清素和促肾上腺皮质激素释放激素)的浓度。
60%的慢性丙型肝炎患者存在睡眠障碍。
脂肪性肝炎
脂肪性肝炎患者的睡眠障碍可能与肝细胞活性受损和多余脂质处理受损有关。酒精对肝脏和中枢神经系统有直接毒性作用。
最近的分析(2272名参与者)表明,阻塞性睡眠呼吸暂停与脂肪变性、小叶炎症、气球样变性和纤维化显著相关。
瘙痒在慢性肝病患者中很常见,在原发性胆管炎等胆汁淤积性肝病患者中更常见。随之而来的往往是睡眠障碍和生活质量低下。
肝病中瘙痒的患病率从慢性丙型肝炎的5%到原发性胆汁性肝硬化的70%不等。胆汁盐、组胺、5-羟色胺、孕酮代谢物浓度的增加可能与此有关。
7.5 肥胖与睡眠障碍
前面饮食章节我们已经知道,睡眠不足会使身体发出错误信号导致饮食过量,对高热量食物难以抗拒,吃过多自然容易肥胖。
当然,肥胖也会导致睡眠障碍。
超重和肥胖通过胃食管反流病和非酒精性脂肪肝以及阻塞性睡眠呼吸暂停患病率的增加而导致睡眠障碍。
肥胖与阻塞性睡眠呼吸暂停综合征之间存在着相互关系。阻塞性睡眠呼吸暂停会促进行为、代谢和/或激素的变化,促使体重增加和/或减肥困难。阻塞性睡眠呼吸暂停综合征(OSA)与激素水平有关,其特点是瘦素和胃饥饿素水平高,进而促使能量摄入过高。
体重增加10%与患阻塞性睡眠呼吸暂停综合征的概率增加50%有关。当然,体重减轻会减少严重的阻塞性睡眠呼吸暂停,改善睡眠,进一步减轻体重。
因此,阻塞性睡眠呼吸暂停、睡眠时间短和体重增加之间存在关系。一些证据表明,嗜睡与肥胖有关,在没有睡眠呼吸暂停的情况下也是如此。
营养物质改善睡眠
维生素B6
在失眠研究中分析失眠患者中肠道菌群中的维生素B6分解代谢(ko00750)显着增强,导致宿主体内维生素B6缺乏。据报道,维生素B6是失眠症的一种常见治疗方法,维生素B6缺乏会导致疲劳和抑郁。因此,补充维生素B6可以改善失眠症状。
维生素B6食物来源:麦麸、葵花子、大豆、糙米、香蕉、动物肝脏及肾脏、鱼类、瘦肉、坚果等。
叶 酸
叶酸参与髓鞘的形成,在脑脊液和细胞外液中分布较多,可缓解因抑郁导致的失眠,对于人体精神和情绪方面的健康起到重要性的作用。
叶酸食物来源:芦笋,西兰花,胡萝卜,燕麦,奇异果等。
镁
镁补充剂有时用于治疗睡眠障碍,改善睡眠质量并减少睡眠潜伏期(即入睡时间)。一项研究发现,每天服用500mg可以改善老年人的失眠症状。
同时,补充镁也有助于减轻抑郁症症状。
镁食物来源:南瓜子,煮熟的菠菜,黑豆,藜麦,杏仁,腰果,鳄梨,三文鱼等。
锌
除了镁,锌也有促进睡眠的作用,可以改善大脑神经细胞的代谢,平时可以适当多吃一些海鲜、坚果类食物以及全谷类食物,都有助于为身体补充锌元素。
L-茶氨酸
L-茶氨酸:一种氨基酸,L-茶氨酸可以改善放松和睡眠。
益生菌干预
益生菌是一种活的微生物,当其存在的量足够时,可以为宿主带来健康益处,例如发酵食品,如酸奶,开菲尔,豆豉,泡菜,康普茶等。
很少有研究测试通过控制肠道微生物群来改善睡眠的有效性。在一项32名医科学生参加的临床试验中,发现益生菌加氏乳酸杆菌CP2305能显著改善睡眠质量,这可以通过PSQI评分的变化来衡量。在服用了益生菌的男性参与者中,这种改善更为明显,在床上入睡时间的减少。
注:匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)是美国匹兹堡大学精神科医生Buysse博士等人于1989年编制的。该量表适用于睡眠障碍患者、精神障碍患者评价睡眠质量,同时也适用于一般人睡眠质量的评估。
同时,15种肠道微生物的相对丰度在对照组和益生菌组之间有所不同,包括Bact. Vulgatus的减少,在使用益生菌后增加了Dorea Longicatena.
额外的双盲随机对照试验发现,补充益生菌混合物(含Lactobacillus fermentum LF16, L.rhamnosus LR06, L.plantarum LP01,长双歧杆菌 Bifidobacterium longum BL04 ),在年轻健康的参与者中,随着时间的推移,导致PSQI得分下降。
注:PSQI得分越高,表示睡眠质量越差。
高皮质醇诱发的睡眠问题的替代方法
解决慢性皮质醇水平升高的有效方法是确保肾上腺得到适当的营养支持。维生素B6,维生素B5(泛酸)和维生素C通常会由于肾上腺活动时间过长和皮质醇的产生而耗尽。这些营养物质在肾上腺的最佳功能和肾上腺激素的最佳制造中起关键作用。在压力时期,这些营养素的水平可以降低 。
改善睡眠的另一种方法是针对GABA(γ-氨基丁酸)活性。增加GABA活性将降低蓝斑,下丘脑室旁核和HPA轴活性。支持GABA功能的一种方法是减少谷氨酸信号。谷氨酸和GABA活性彼此相反。因此,降低谷氨酸的活性将支持健康的HPA轴活性。
Tips
1 不要在深夜吃东西,破坏微生物生物钟,还会促进胃反流。
2 多吃纤维。纤维有助于有益菌生长。纤维食物包括朝鲜蓟,芦笋,洋葱,豆类,绿叶蔬菜和大多数非淀粉类蔬菜。

3 尝试睡前禁食,禁食会使身体处于“待机”状态,可以自我修复。身体在睡眠过程中会继续燃烧卡路里。睡前禁食,早晨更有可能感到饥饿。可能会促使早起。
4 如果一定要吃,尽量吃易消化食物。消化过程让人清醒睡不着,因此最好在睡前避免食用难消化的食物。包括:脂肪或油炸食品、辛辣食物、酸性食品、碳酸饮料等。
5 多吃各种食物,有益于维持人体健康的微生物群。均衡饮食,食物中的营养素在产生褪黑素以及其他有助于调节睡眠的重要神经递质中起着巨大作用。

6 尝试补充益生元。已显示许多益生元可在人类受试者中发挥作用。如低聚果糖和低聚半乳糖等。
7 创建理想睡眠环境。
关闭电子产品(就寝前30分钟至1小时),保持卧室适宜温度(在16至19°C之间)等

8 调整灯光。晚上关掉灯或调暗灯,黑暗下人体会分泌更多褪黑素,有助于睡眠,当然,早上拉开窗帘享受阳光,可以帮你清醒。
9 舒适的床是最佳睡眠环境。旧的床垫和枕头会引起疼痛和酸痛,难以获得优质的睡眠。通常,专家建议每10年更换一次床垫,每两年更换一次枕头。当然也取决于床垫枕头质量。

10 保持规律作息。最好每天在同一时间上床睡觉,早上同一时间起床,确保人体昼夜节律时钟正常运作。即使在周末或休息日最好也是如此。

11 避免白天睡过多。如果已经出现睡眠障碍,那么白天尽量不要睡觉。如果有午睡习惯,尽量控制在30分钟之内,且在下午3点之前完成。
12 睡前放松,可以进行温水浴,泡脚,深呼吸,做些伸展运动,适量阅读,听听舒缓的音乐等,这些准备工作都有助于良好的睡眠。当有压力或焦虑时,身体会产生更多的皮质醇,皮质醇过高可能导致夜间频繁醒来。

13 如果实在在20分钟或更长时间内无法入睡,请起床并做一些容易累的事情。最重要的是离开床。
14 运动是帮助睡眠的良好方式,如果可以的话,每天至少20-30分钟锻炼,每周五次左右,但不要在睡前剧烈运动。

15 随着年龄的增长,褪黑素水平会下降。可以购买褪黑激素补充剂,该补充剂已被证明可以帮助55岁以上的人们更快入睡和更长的睡眠。睡前一个小时服用。褪黑激素还可以增强肠道微生物的健康多样性。如长期服用需咨询医生。

【附录】
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
相关阅读:
主要参考文献:
Vernia F, Di Ruscio M, Ciccone A, Viscido A, Frieri G, Stefanelli G, Latella G. Sleep disorders related to nutrition and digestive diseases: a neglected clinical condition. Int J Med Sci. 2021 Jan 1;18(3):593-603. doi: 10.7150/ijms.45512.
Krueger JM, Opp MR. Sleep and Microbes. Int Rev Neurobiol. 2016;131:207-225. doi: 10.1016/bs.irn.2016.07.003. Epub 2016 Aug 31.
Matenchuk Brittany A,Mandhane Piush J,Kozyrskyj Anita L,Sleep, circadian rhythm, and gut microbiota.[J] .Sleep Med Rev, 2020, 53: 101340.
Hertenstein E., Feige B., Gmeiner T., Kienzler C., Spiegelhalder K., Johann A., Jansson-Frojmark M., Palagini L., Rucker G., Riemann D., et al. Insomnia as a Predictor of Mental Disorders: A Systematic Review and Meta-Analysis. Sleep Med. Rev. 2019;43:96–105.
Poroyko V.A., Carreras A., Khalyfa A., Khalyfa A.A., Leone V., Peris E., Almendros I., Gileles-Hillel A., Qiao Z., Hubert N., et al. Chronic Sleep Disruption Alters Gut Microbiota, Induces Systemic and Adipose Tissue Inflammation and Insulin Resistance in Mice. Sci. Rep. 2016;6:35405.
Kinnucan J.A., Rubin D.T., Ali T. Sleep and Inflammatory Bowel Disease: Exploring the Relationship between Sleep Disturbances and Inflammation. Gastroenterol. Hepatol. (N.Y.) 2013;9:718–727.
Bowers S.J., Vargas F., Gonzalez A., He S., Jiang P., Dorrestein P.C., Knight R., Wright K.P., Jr., Lowry C.A., Fleshner M., et al. Repeated Sleep Disruption in Mice Leads to Persistent Shifts in the Fecal Microbiome and Metabolome. PLoS ONE. 2020;15
Smith R.P., Easson C., Lyle S.M., Kapoor R., Donnelly C.P., Davidson E.J., Parikh E., Lopez J.V., Tartar J.L. Gut Microbiome Diversity is Associated with Sleep Physiology in Humans. PLoS ONE. 2019;14:e0222394.
Durgan DJ. Obstructive sleep apnea-induced hypertension: role of the gutmicrobiota. Curr Hypertens Rep. 2017; 19: 35
Reynolds AC, Paterson JL, Ferguson SA, Stanley D, Wright KP Jr, Dawson D.The shift work and health research agenda: considering changes in gutmicrobiota as a pathway linking shift work, sleep loss and circadianmisalignment, and metabolic disease. Sleep Med Rev. 2016; 34: 3-9.
Parisi P, Pietropaoli N, Ferretti A, Nenna R, Mastrogiorgio G, Del Pozzo M, etal. Role of the gluten-free diet on neurological-EEG findings and sleepdisordered breathing in children with celiac disease. Seizure. 2015; 25: 181-183
Michalopoulos G, Vrakas S, Makris K, Tzathas C. Association of sleep qualityand mucosal healing in patients with inflammatory bowel disease in clinicalremission. Ann Gastroenterol. 2018; 31: 211-216.
Wang B, Duan R, Duan L. Prevalence of sleep disorder in irritable bowelsyndrome: A systematic review with meta-analysis. Saudi J Gastroenterol.2018; 24: 141-150.