-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
前面的文章中,我们已经了解到,在肝病的发生发展中肠道菌群的变化,详见:
深度解析 | 肠道菌群与慢性肝病,肝癌
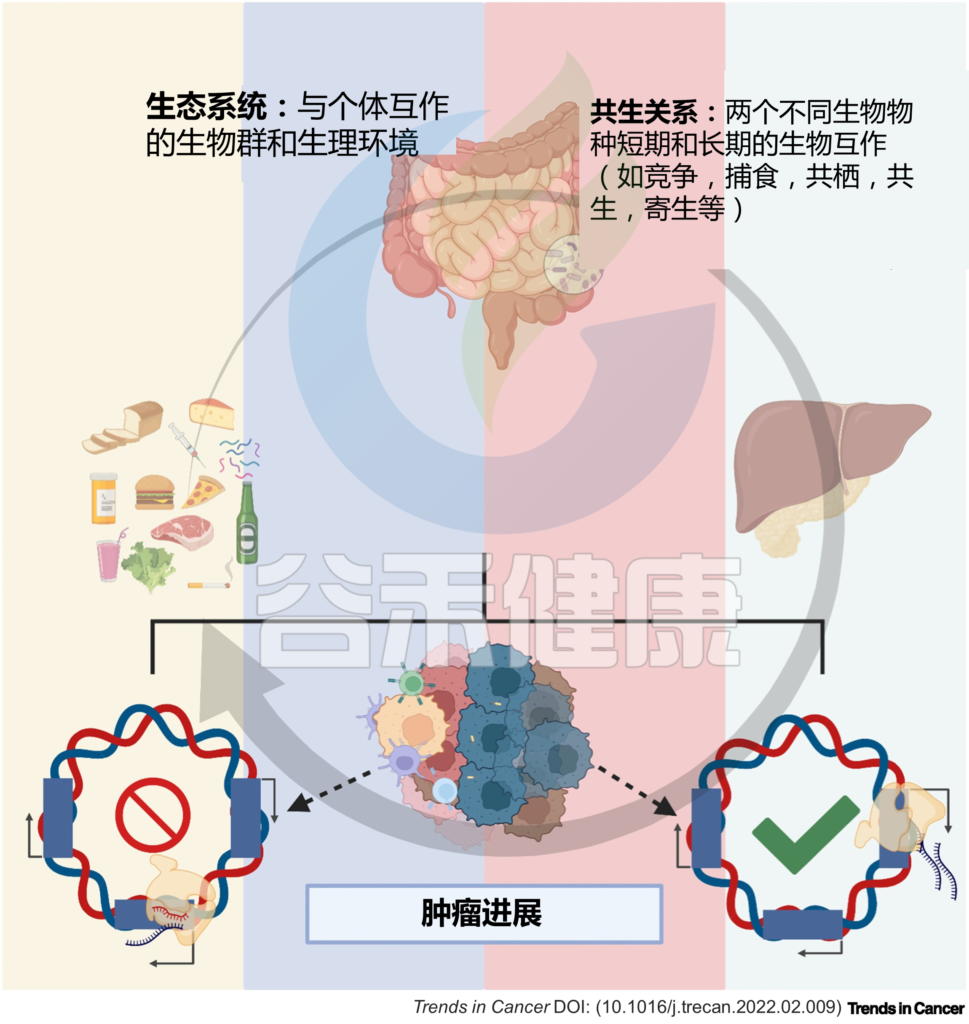
到目前为止,大多数研究都集中在细菌多样性及其代谢物与靶癌细胞表型的关联上,而没有考虑环境的微调。实际上生态系统中,个体在环境中与其他个体相互作用、相互影响和限制。
在肿瘤微环境中,特定的微生物会影响其他细胞(微生物或宿主细胞)并受其影响。
微生物群及其代谢物影响肠-肝轴的组织细胞。肠道微生物群以及肿瘤本身的细菌可以影响肿瘤微环境,包括通过调节癌症、基质和炎症/免疫细胞中的基因转录以及促进或抑制肿瘤进展。
同时,微生物群也受饮食、环境等因素影响,在环境扰动后会适应,从而影响宿主-微生物的相互作用。
本文主要阐述了微生物群在肝脏稳态中的作用,肠道菌群及其代谢物直接和间接地调节肝脏基因表达,导致肠-肝轴失衡,从而促使肝病的发生发展,甚至致癌,并对肿瘤微环境产生影响。
我们的健康和生存能力取决于共生微生物(微生物群)的存在,它们主要存在于上皮细胞界面上,在下消化道中特别丰富。
菌群维持肠道稳态
肠道微生物群中的平衡生态有助于食物加工和吸收,调节宿主新陈代谢,并通过防止病原体和病原菌的扩张或通过调节宿主免疫力和维持肠道上皮的完整性来防止感染。
肠道-肝脏-胰腺轴
在物理上,肝脏和胰腺通过胆管和胰管与肠道相通,而门静脉将肠道菌群产物输送到肝脏。因此,肠道菌群与肝脏和胰腺之间的串扰(肠道-肝脏-胰腺轴)可以将信号整合为一个相互关联的系统。
宿主与微生物群之间复杂而高度协调的相互作用代表了一个自然生态系统。共生相互作用,如互利共生、共栖、捕食、寄生和竞争,是微生物、微生物-宿主和宿主-宿主细胞之间相互作用的基础。
因此,肠-肝轴中的细胞处于稳态平衡,环境扰动会改变这种平衡,从而调节局部和全身的转录反应,并影响健康和疾病,例如癌症。
图1 微生物与宿主的相互作用调节体内平衡和疾病
关于微生物群在致癌中的作用的研究,最初集中在上皮屏障界面的肿瘤上,如胃癌和结肠癌,但胰腺导管腺癌 (PDAC) 为口腔和肠道微生物群以及癌症相关微生物群的作用提供了很多证据。
微生物群对致癌作用的影响,及细菌调节肿瘤微环境的一些机制如下:
胰腺癌研究解决了肠道菌群失调、瘤内细菌和癌症之间的联系
人类胰腺癌前体病变显示被产生 IL-17 的Th17 细胞浸润,加速了癌症的发生和进展。
几项研究表明,胰腺导管腺癌与口腔微生物组的组成、口腔病原体(如牙龈卟啉单胞菌Porphyromonas gingivalis、伴放线聚合杆菌Aggregatibacter actinomycetemcomitans)的丰度增加或口腔微生物抗体的存在有关。胰腺癌中出现了较低的α多样性,产生LPS的细菌增加,产丁酸盐菌减少。
基于与胰腺导管腺癌相关的口腔和肠道微生物群落的概况,已经提出了将胰腺导管腺癌患者与健康个体区分开来的无创诊断模型。
此外,胰腺导管腺癌研究已经确定,胰腺含有与组织相关的细菌和真菌,这些细菌和真菌在胰腺癌中比在正常胰腺组织中的含量更高。胰腺导管腺癌中的细菌主要存在于免疫细胞和癌细胞内。
在分析的每种肿瘤类型中,肿瘤内细菌的组成是不同的,可用于预测肿瘤与正常组织和肿瘤类型。
尽管在大约三分之二的胰腺导管腺癌中观察到细菌,并且数量高于大多数其他肿瘤类型,但与人类细胞相比,它们在肿瘤中的绝对数量仅为约 1/40 – 1/400。
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria较少。
胰腺导管腺癌相关微生物群的组成与十二指肠微生物群相似,这一事实表明细菌可能是通过胆胰管逆行迁移。
肿瘤相关微生物通过各种机制参与胰腺癌的发生或对治疗产生抵抗
例如,表达胞苷脱氨酶长同工型的细菌(如 Gammaproteobacteria)将吉西他滨代谢成无活性形式,导致胰腺导管腺癌出现耐药性。
瘤内细菌可能通过诱导 MDSCs 和抑制 M1 巨噬细胞分化和 CD4 +和 CD8 + T 细胞活化来重新编程肿瘤微环境;通过抗生素治疗进行的细菌消融可重新编程胰腺肿瘤免疫微环境,防止癌变并使免疫检查点抑制治疗产生反应。
然而,肿瘤内细菌也可能是有益的,并且 胰腺导管腺癌的长期幸存者在肿瘤相关微生物群中表现出更高的微生物 α 多样性和独特的特征(假黄单胞菌属Pseudoxanthomonas、链霉菌属Streptomyces、糖多孢菌属Saccharopolyspora),这可能诱导有效的免疫细胞浸润和抗肿瘤免疫。
最近有多项综述回顾了微生物调节在胰腺导管腺癌中的作用。这些研究支持胰腺导管腺癌患者的肿瘤外和肿瘤内微生物群与发育和临床进展的易感性之间的直接联系。
作为一个相互关联的系统,肠-肝轴中的微生物-宿主串扰有望成为肝癌发生的一个重要因素,就像在胰腺导管腺癌中一样。
细菌通过微生物-宿主和宿主-宿主相互作用参与致癌作用
幽门螺杆菌,已被正式确定为胃癌的明确人类致癌物。然而,新出现的证据表明,细菌,无论是存在于上皮屏障界面上还是存在于肿瘤中,都与局部或远处组织的癌变和肿瘤进展有关。
细菌在肿瘤微环境中产生选择性压力以促进肿瘤发生,部分原因是引发 ROS 的产生,影响对 pH 变化的反应,竞争有限的营养物质,增加 DNA 损伤和诱变,调节癌基因途径,影响化学疗法的代谢药物,或调节免疫。
携带产生大肠杆菌素的聚酮化合物-非核糖体肽合酶操纵子 (pks) 的大肠杆菌菌株在结直肠癌中诱导了明显的突变特征,这为细菌在基因组突变中的作用提供了证据。
微生物群对致癌基因诱导的肿瘤进展的影响得到以下观察结果的支持:
突变的p53仅在远端结肠中致癌,因为存在微生物产生的没食子酸,通过破坏 WNT 通路阻止突变的 p53 作为肿瘤抑制因子。相反,肿瘤会对局部组织细胞施加的竞争压力可能会影响肿瘤微环境、周围组织和肠道中的细菌。
宿主-宿主相邻细胞之间的肿瘤微环境竞争动态是生态系统模型的基础,在结肠和肝脏中均发现有致癌作用,并且可以为细菌调节肿瘤微环境提供底物。
恶性干细胞分泌促进邻近干细胞分化为含有促癌突变的克隆的因子。微生物群的改变可能代表另一个触发因素,结合宿主细胞串扰中涉及的其他多个信号,不仅影响癌症前体靶细胞,而且通过调整局部组织环境影响所有细胞。
此外,肿瘤相关细菌大多存在于癌细胞和免疫细胞的细胞内,可能影响癌细胞的信号传导,并在抗原呈递细胞表面以 MHC 限制性肽的形式呈递,从而刺激宿主免疫。
尽管在改进低生物量正常和肿瘤组织样本中稀有细菌的鉴定和分析技术方面取得了很大进展,但这些结果仍需谨慎解读。不过,这支持肿瘤微环境选择居住的微生物群并反过来受微生物群影响的新概念。
此外,肝脏和胰腺之间的生理联系提出了一个问题,即:最近在胰腺导管腺癌中建立的模型是否可以应用于肝细胞癌 (HCC)?
在此阐述了微生物群在维持肠-肝轴稳态中的作用,并关注环境扰动如何直接(通过诱导微生物相对丰度/多样性的变化)或间接(通过微生物代谢物的作用)触发与肝癌发生相关的基因反应。
微生物群的组成是在婴儿早期建立的,并在成年后保持相对稳定。然而,由于生活方式、饮食、疾病、感染和抗生素的使用,细菌种类的相对丰度可能会迅速改变。
微生物群与宿主之间的串扰对健康和疾病产生关键影响
微生物群通过其扩张/收缩、占据不同的解剖生态位以及遗传物质的突变和交换来适应环境变化并调节宿主反应。
微生物群在宿主从出生开始的先天性和适应性免疫系统发育中发挥着重要作用,免疫系统也塑造了宿主-微生物的相互作用。这个过程依赖于肠道黏膜表面的分隔、微生物群感应和信号传递以及免疫细胞启动,以产生特定的反应并维持体内平衡。
结合起来,上皮屏障、其微生物群落和局部免疫系统不仅可以耐受环境中的共生细菌,还可以使免疫系统对条件致病菌或微生物产物做出反应。
当这些防御机制失败时,例如由于肠道通透性增加(肠道渗漏)或生态失调(与疾病相关或与疾病有因果关系的微生物群组成的变化),就会出现细菌代谢物的涌入或先前被分隔,并且有害微生物可能通过肠道血管屏障(GVB)并通过门静脉循环延伸到肝脏。
微生物群在肝脏稳态中的关键作用
在肝脏中,环境扰动会触发肝脏免疫反应,这种反应依赖于常驻免疫细胞以及来自肠道微生物群的循环抗原和内毒素。由与肠道相关淋巴组织 (GALT) 相关的免疫监视形成,证实了微生物群作为一个相互关联的系统在肝脏稳态中的关键作用。
为什么肠道屏障的紊乱会改变肝脏的微环境?
小肠细菌过度生长(SIBO)也与肠漏和细菌流入肝脏有关。
细菌产物或微生物易位的增加会刺激与慢性肝病相关的促炎反应。相反,肝脏通过胆道在肠道中释放胆汁酸和其他生物活性介质,这些介质可能会被肠道微生物群进行生物转化,然后被吸收并释放到体循环中。
生理组织稳态的改变可能导致癌症等疾病。此外,通过将饮食模式与微生物组对免疫和代谢状态的影响和癌症治疗反应联系起来,这种关系揭示了微生物群和肝脏之间的联系,这是由局部环境扰动引发的一系列相互关联的反应。
总的来说,肠-肝轴生态系统可以触发局部和远处的反应,并勾勒出肠道微生物群与肝脏之间的直接和间接相互作用(图 2)。
图2 肠肝轴的双向关系调节体内平衡
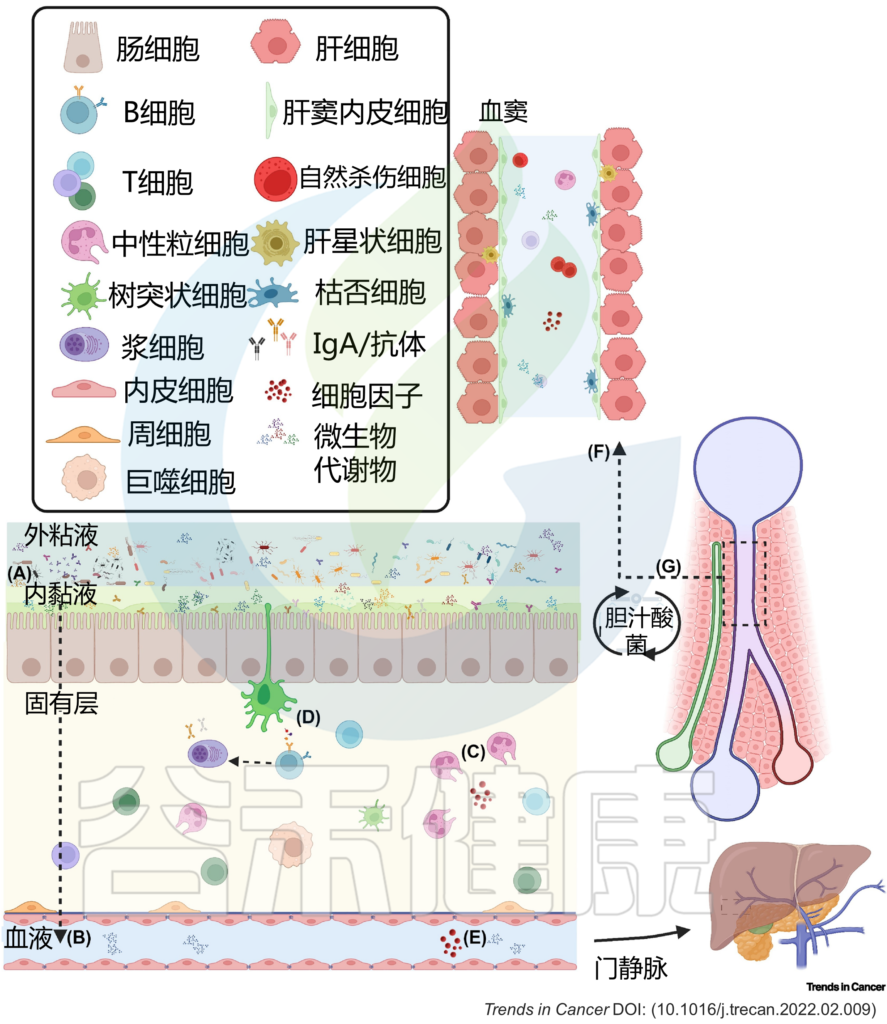
(A) 粘液从物理上将微生物群与上皮衬里分离,而抗菌肽使内部粘液几乎无菌。(B) 因此,微生物群与宿主之间的相互作用主要是间接的,并由代谢产物介导,这些代谢产物可能穿过粘液和上皮屏障,到达固有层中的免疫细胞和基质细胞,或通过淋巴和血管系统到达肝脏和体循环。(C) 免疫细胞通过产生生长因子和细胞因子来巡逻上皮细胞,并加强上皮和粘液屏障。这些产物对微生物产生选择性压力。(D) 树突状细胞感知环境并诱导T细胞和B细胞反应,从而产生IgA抗体,这些抗体转移到管腔,并通过调节微生物组成和多样性来促进粘膜免疫保护。代谢产物通过(E)肠血管屏障通过门静脉流入肝脏。(F) 在肝窦中,免疫细胞扫描异物。(G) 反过来,肝脏通过释放胆汁酸和其他生物活性介质进入胆道与小肠沟通;这些代谢物可被回肠和大肠末端丰富的微生物群生物转化,部分通过门静脉再循环到肝脏,从而可能影响局部和全身功能。
健康的肠道屏障对一些微生物代谢产物是可渗透的,但大多数完整的微生物却不能通过。
然而,饮食和其他环境因素的影响会迅速丰富或消耗特定的营养物质和细菌。这种效应会对微生物代谢物的产生和胆汁酸的转化产生影响,这有可能塑造局部微环境并与包括癌症在内的慢性肝病的发展相关。
例如,酒精会导致肠漏。与 SIBO 一起,它允许内毒素进入循环,导致肝脏疾病。SIBO 是肠道微生物菌群失调的一种表现,其特征是 α 多样性降低,在某些情况下,β 多样性增加,这可能导致全身性炎症。
增加的细菌易位会促进肝硬化进展(肝细胞癌的前体),包括:导致纤维化,通过增加肝细胞与微生物和细菌代谢物的接触,或通过在肝脏中创造转移前的小生境,改变环境以利于转移细胞的募集和增殖,从而促进肝硬化进展。
最后,在某些慢性肝病中,活细菌的易位可能导致 GALT 的免疫麻痹,表明微生物平衡的变化直接影响局部环境的机制。
下文将阐述肠道细菌如何通过扩散到肝脏、影响环境或改变其他细胞中的串扰直接影响肝癌发生。
饮食改变肠道微生物组,对免疫和新陈代谢状况、癌症风险和对癌症治疗的反应产生影响。因此,摄入食物的来源和类型在调节肠道微生物组中起着关键作用,并对宿主-微生物相互作用产生影响。
人类肠道中主要有三种类型(肠型)(拟杆菌属Bacteroides、普氏菌属Prevotella和瘤胃球菌属Ruminococcus)。
在工业化和非工业化人群中观察到的蛋白质和动物脂肪(拟杆菌属Bacteroides)与碳水化合物或植物性食物(普氏菌属Prevotella)的摄入比例不同。工业化与天然富含纤维食品的减少有关。
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
菊粉 是果糖聚合物的异质混合物。果糖摄入转化为乙酸盐,并通过微生物群衍生的乙酸盐经门静脉到达肝脏触发从头脂肪生成。在肠道中,菊粉对成年人微生物组组成的影响:
下列菌增加:
双歧杆菌Bifidobacterium
厌氧菌Anaerostipes
粪杆菌Faecalibacterium
乳杆菌属Lactobacillus
下列菌减少:
拟杆菌属Bacteroides
普氏菌Prevotella、密螺旋体Treponema、琥珀弧菌属Succinivibrio的丰度增加主要与蔬菜的纤维和碳水化合物发酵相关的饮食有关。
高纤维饮食增加了微生物组编码的聚糖降解碳水化合物活性酶,而不影响群落多样性。相比之下,高发酵食品饮食增加了微生物组的多样性并减少炎症。
从机制上讲,缺乏纤维的饮食可以使结肠粘液降解细菌增多,增强柠檬酸杆菌粘液层翻转和相关的结肠炎。这表明饮食模式可能影响肠-肝轴的多种机制。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
丁酸盐是一种短链脂肪酸,通过肠道内膳食纤维的微生物发酵产生。丁酸盐有助于黏膜稳态和肠道内壁的完整性,从而提供肠细胞的大部分能量需求,并通过与几种 G 蛋白偶联受体结合并作为组蛋白脱乙酰酶抑制剂发挥抗炎作用。在小鼠模型中,增加的膳食纤维以微生物群和丁酸盐依赖的方式防止结直肠肿瘤发生。
总的来说,这些研究强调了饮食对微生物群落的深远影响及其对宿主的影响,具体取决于摄入的食物来源。
先前的研究表明,地中海饮食与拟杆菌门Bacteroidetes和某些有益梭菌群Clostridium的富集以及变形杆菌门Proteobacteria和芽孢杆菌门Bacillota的减少有关,可以减少肝脏脂肪,被推荐用于预防非酒精性脂肪性肝病 (NAFLD)。
调节与饮食相关的微生物组是预防肝癌的潜在途径
长期食用可发酵的富含纤维的食物(如可溶性纤维菊粉或富含菊粉的高脂肪饮食)容易导致生态失调的小鼠出现炎症、胆汁淤积和肝细胞癌。总细菌负荷增加,多样性减少,变形杆菌和纤维发酵细菌(如梭菌属)的特定增加。消除这些产生丁酸盐的细菌成功地预防了富含菊粉的肝细胞癌,这表明调节与饮食相关的微生物组是预防肝癌的潜在途径。
由于肠道微生物群失调,高胆固醇/高脂肪饮食依次导致小鼠阶段进展为脂肪变性、脂肪性肝炎、纤维化,最终导致 NAFLD-肝细胞癌。
在每个阶段都富集了不同的微生物群组成,因为在肝细胞癌患者中:
Mucispirillum、Desulfovibrio、Anaerotruncus和 Desulfovibrionaceae依次增加,
而Bifidobacterium、Bacteroides被耗尽。
综合这些发现,饮食模式会通过富集与健康或疾病相关的特定细菌来影响肠道微生物组,从而对肝脏产生潜在影响。
许多微生物群代谢物是肝癌发展的危险因素。考虑到环境塑造和选择特定的微生物群,推测某些物种可能获得哪些竞争优势以及特定微生物群的富集如何影响肝癌的进展。
相似或不同的微生物群组成是否可能参与肝细胞癌和胆管癌 (CCA) 的发展?现在下结论还为时过早,在这部分讨论这两种类型的肝癌。
肝脏中肿瘤和非肿瘤区域之间菌群不同
最近有报道称,病毒和非病毒病因的肝细胞癌中的 16S rRNA 基因测序确定了肝脏中肿瘤和非肿瘤区域之间不同的微生物组成,其中拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形杆菌门Proteobacteria的物种占肿瘤相关菌群的主导地位。相关微生物群Ruminococcus gnavus被确定为感染肝炎病毒的 肝细胞癌患者的特征分类群。
肝硬化、肝细胞癌患者的肿瘤微生物群显示出更高丰度的嗜麦芽窄食单胞菌Stenotrophomonas maltophilia,这与肝星状细胞 (HSC) 中的衰老相关分泌表型 (SASP) 相关,证实了菌群失调与肝细胞调节之间的关联。
NAFLD肝硬化中,伴或不伴肝细胞癌的患者菌群不同
肝细胞癌患者的拟杆菌属Bacteroides和瘤胃球菌科Ruminococcaceae丰度增加,双歧杆菌Bifidobacterium丰度降低,这与粪便钙卫蛋白水平升高和全身炎症相关。同样,与肝硬化患者相比,早期肝细胞癌患者的肠道菌群中产生脂多糖 (LPS) 的菌群增加,而产生丁酸盐的菌群减少。
这些数据表明,在患有 NAFLD 和肝硬化的肝细胞癌患者中,肠道菌群组成与全身炎症相关,并可能促进肝癌的发生。
乙肝病毒感染进展的肝细胞癌的菌群特点
从乙型肝炎病毒 (HBV) 感染进展的肝细胞癌患者显示出丰富的抗炎细菌(例如,普氏菌Prevotella、乳酸杆菌Lactobacillus、双歧杆菌Bifidobacterium、粪杆菌Faecalibacterium)和减少的促炎细菌(例如,大肠杆菌-志贺氏菌Escherichia-Shigella、肠球菌Enterococcus),肠道微生物群可能与调节宿主免疫生物学途径的 HBV 感染有关的成分。
这些研究强调了在肝细胞癌中观察到的微生物多样性,这代表了已知风险因素与肝细胞癌发展之间的相关性。
作为饮食和其他环境因素影响微生物组的相互关联的系统,有必要在多个评估部位(肿瘤和非肿瘤)和组织中表征局部微生物群的组成和多样性,与单细胞分析相关并可能相关与环境因素。此外,突出特定细菌物种富集的潜在因果关系的功能分析是超越相关性的关键步骤。
胆管相关的微生物群
一些细菌科,如Dietziaceae、Pseudomonadaceae、Oxalobacteraceae主导了胆管相关微生物群,表明独特的微生物群落存在于这一解剖学定位中。
肝外胆管癌患者有大量肠球菌Enterococcus、链球菌Streptococcus、拟杆菌属Bacteroides、克雷伯氏菌属Klebsiella、锥体杆菌属Pyramidobacter。
此外,与胆总管结石患者相比,胆管癌患者的胆汁样本富含肠杆菌属Enterobacter、假单胞菌属Pseudomonas、窄食单胞菌属Stenotrophomonas。
最后,与肝细胞癌或肝硬化患者和健康个体相比,肝内胆管癌患者肠道菌群中的4个细菌属增加:
乳酸杆菌Lactobacillus、放线菌Actinomyces、消化链球菌Peptostreptococcus、异体卡多菌Alloscardovia。
肠道微生物群特征可以来区分胆管癌和胆石症
在胆管癌中富集的菌群:拟杆菌属Bacteroides、Muribaculaceae_unclassified、Muribaculum、Alistipes属的物种。
而不同的微生物物种在胆石症组中富集,这表明在从良性肝胆疾病到恶性肝胆疾病的演变过程中微生物关联发生了变化。
总的来说,这些过程可能解释了肠道细菌易位直接导致建立有利于肝癌发展和进展的发炎肝脏环境之间的联系。然而,很难根据与微生物相对丰度的相关性来唯一地假设因果关系,微生物相对丰度由于多种环境因素而迅速改变。
因此,全面的跨界网络分析比较肝细胞癌和胆管癌,并将局部肠道和组织微生物群的组成和多样性以及环境因素对代谢、免疫和转录改变的影响联系起来,对于剖析微生物群在肝癌的发生及其作用机制调节中的因果作用至关重要。
“
强调了微生物群变化对肝脏环境的间接影响(可能通过环境中其他细胞或微生物代谢物的串扰)及其与肝癌发生和进展的关系。
为了了解特定微生物群在肝肿瘤中的潜在影响,有必要将潜在机制以及微生物与其他细胞之间的串扰联系起来。
小鼠中肝细胞癌发展的演变
从这个意义上说,最近的一项研究描述了Mdr2 缺陷小鼠中肝细胞癌发展的时间演变,这些小鼠缺乏从肝脏将磷脂分泌到胆汁中的能力,从而经历胆汁淤积和肝细胞癌发展。
在这些代表炎症诱导肝细胞癌的有用模型的小鼠中,肠道菌群失调诱导肠道屏障功能障碍,先于 LPS 介导的肝脏转录改变,从而导致肝细胞癌发展。
此外,肝内炎症基因谱从肝损伤早期的促炎表型转变为肝细胞癌的免疫抑制表型。这种变化与通过微生物组功能从碳水化合物向氨基酸代谢的转变来重新调整能源利用有关。
菌群改变通过代谢和炎症影响肿瘤发生
微生物群的改变通过影响肝脏碳水化合物和脂质代谢调节炎症,从而导致 NAFLD 及其进展为非酒精性脂肪性肝炎 (NASH)。代谢和炎症的调节可能同样影响肝脏肿瘤发生。
肠道微生物组受饮食和其他环境因素的影响,微生物与营养物质的竞争是调节新陈代谢和免疫反应的关键步骤。例如,通过微生物群介导的膳食纤维发酵产生 SCFA 与胆汁淤积型肝细胞癌相关。
有人认为,细菌产物的易位可能会刺激炎症并释放 GALT 中的活性氧 (ROS),从而影响机械和分泌屏障以及局部微生物群。
这些研究强调需要继续进行系统和全球研究,将肠-肝轴中微生物物种的多样性和丰度作为一个生态系统进行表征,同时也需要开始剖析这些表型背后的机制。
最近有人提出,母亲在怀孕期间摄入丁酸盐和谷氨酰胺会影响新生小鼠的粪便微生物群和代谢物,这与拟杆菌和梭状芽胞杆菌的粪便特征有关。
此外,这些新生小鼠对肝脏免疫激活有抵抗力,导致胆管炎症和损伤。
从机制上讲,细菌代谢物在宿主细胞中触发基因反应的影响可能取决于环境中的转录改变。
对急性肝衰竭动物模型中不同的转录特征进行了检查,表明肠道微生物群和 Toll 样受体 (TLR) 信号激活肝星状细胞、枯否细胞和肝窦内皮细胞 (LSEC) 中的 MYC 依赖性转录程序,导致 Ly6C 阳性炎性单核细胞浸润和肝功能衰竭。
图3 微生物代谢产物和多样性是肝癌进展的触发因素


(A)一些细菌可能会穿透粘液屏障或参与其降解,在某些情况下导致上皮屏障的破坏或破坏,从而允许(B)微生物和微生物代谢物和免疫细胞之间的直接接触,诱导促炎细胞因子的产生和全身传播。粘液/上皮屏障的破坏也可能促进(C)细菌转移到肝脏(D),这为癌细胞的播散创造了一个有利的生态位。因此,先前划分的细菌和微生物产物的涌入影响了局部肝细胞的基因表达。例如:(E)肝细胞可能表达CXCR1并诱导CRCX2+多形核髓系衍生抑制细胞(PMN-MDSCs)的积累,创造免疫抑制环境促进胆管癌(CCA);(F)激活的肝星状细胞在肝细胞癌(HCC)和癌症转移中发挥多种功能,可能通过CXCL12-CXCR4相互作用破坏肝脏中自然杀伤细胞(NK)的功能,改变NK细胞介导的免疫,促进乳腺向肝脏转移;而(G)其他的肝脏免疫细胞可能通过脂多糖(LPS) – toll样受体4 (TLR4)或脱氧胆酸(DCA) -TLR2调节而被激活,并诱导促进肝细胞癌发生的炎症反应。相比之下,(H)被肠道菌群修饰后的肝脏产生的胆汁酸可能会激活肝脏自然杀伤T细胞(NKTs)在肝脏中的趋化因子依赖性积累,从而控制肿瘤的生长。
LPS调节影响肝细胞癌
循环水平的LPS通过TLR4 激活并诱导肝星状细胞分泌生长因子、调节肝脏慢性炎症状态和抑制细胞凋亡,这些过程与肝细胞癌促进有关。门静脉区域 LPS-TLR4 相互作用下游的转录调节因子 YAP1 的激活调节肝细胞的干性。
因为肝细胞周转的位点定位在激活基础稳态和再生的分子途径中很重要。推测 LPS 也可以通过调节局部微环境重编程来调节这些机制以影响肝细胞癌。
肠道微生物群调节肝细胞的基因表达程序,促进肝细胞癌和胆管癌
在胆管癌中,增加的肠道通透性诱导微生物 LPS 易位进入肝脏,通过 TLR4 依赖性机制诱导肝细胞中 CXCL1 的表达。这种表达反过来导致 CCR2 +多形核髓源性抑制细胞 (MDSCs) 的积累。
肝硬化肝细胞癌患者的瘤内S. maltophilia丰度更高。 通过激活 TLR4/NF-κB/NLRP3 通路诱导衰老肝星状细胞中衰老相关分泌表型SASP因子和促炎因子的表达,从而促进肝纤维化,随之而来的肝纤维化加重并发展为肝细胞癌。
肝星状细胞增殖是肝纤维化发展的关键事件。最后,胆汁酸通过激活表皮生长因子受体诱导肝星状细胞增殖。
饮食会迅速改变人体肠道微生物组。饮食衍生的微生物代谢物对甲酚硫酸盐、4-乙基苯基硫酸盐和 4-甲基儿茶酚会影响肝细胞癌亚型。
人类肠道微生物组编码的代谢途径通过众多生物活性分子不断与宿主基因产物相互作用。例如,营养过剩会增加 IL-17A,进而诱导白色脂肪组织中的中性粒细胞浸润和 NASH 诱导的肝细胞癌。
IL-17A 是一种促肿瘤细胞因子,通过调节Kupffer细胞和骨髓源性单核细胞的炎症反应和脂肪变性肝细胞的胆固醇合成,调节酒精诱导的肝脂肪变性、炎症、纤维化和肝细胞癌的进展。
地高辛,一种类视黄醇孤儿受体 γ t (RORγt) 拮抗剂,降低了 IL-17A 水平并稳定了体重。表明其在代谢紊乱中的关键作用。
此外,TNF和IL-17A 与骨髓来源细胞中NLRP3 炎性体激活诱导的肝脏炎症和纤维化的发展有关。
总的来说,这些研究表明饮食代谢物、细胞因子和肝癌疾病之间存在机制联系。
初级胆汁酸在肝细胞中合成,释放到十二指肠,大部分在小肠中重新吸收。一小部分初级胆汁酸逃逸到结肠,肠道共生细菌将其转化为次级胆汁酸,次级胆汁酸对新陈代谢和宿主先天免疫反应具有多种重要功能。
饮食和微生物胆汁酸代谢物均可调节 RORγt 阳性调节性 T 细胞(Treg) ,有助于维持宿主免疫稳态和改善肠道炎症。此外,胆汁酸代谢物可以通过调节 Th17 和 Treg 细胞的平衡来控制宿主免疫反应。
胆汁酸可以在高脂肪饮食中发挥积极作用
膳食胆固醇诱导肠道细菌代谢物改变,包括增加牛磺胆酸和减少 3-吲哚丙酸,从而在小鼠中驱动 NAFLD-肝细胞癌。因此,胆固醇抑制疗法和肠道菌群操作可能是预防 NAFLD-肝细胞癌的有效策略。
石胆酸 (LCA) 衍生物直接影响 CD4+ T 细胞(3-oxoLCA 和 isoalloLCA)
3-oxoLCA 通过直接结合转录因子 RORγt 抑制 Th17 细胞分化,而 isoalloLCA 增强 Treg 细胞分化,证实肠道微生物群可能控制宿主免疫反应。
对于肝内胆管癌,观察到甘熊去氧胆酸和牛磺脱氧胆酸血浆:粪便比率增加,血浆牛磺胆酸和 IL-4 呈正相关,表明肠道微生物群、代谢物、细胞因子和胆汁酸之间存在相互关系。
肥胖诱导的菌群失调促进肝癌发生
最近的一项综合组学研究揭示了一种胆汁酸代谢物升高、胆固醇代谢失调和与 BMI 增加相关的独特炎症反应的胆管癌亚型,这表明肥胖诱导的肠道微生物群失调促进肝癌发生的模型。
从机制上讲,胆汁酸/致癌轴涉及胆汁酸受体,例如法尼醇 X 受体 (FXR) 和 G 蛋白偶联胆汁酸受体 1,它们可能代表癌症的重要治疗靶点。胆汁酸如脱氧胆酸 (DCA) 被证明可阻断 FXR 的功能及其抑制肠癌干细胞增殖的能力,从而影响肠-肝轴稳态。
此外,胆汁酸传感器 FXR 或 G 蛋白偶联受体 TGR5 的激活通过抑制 NF-κB 依赖性信号通路和 NLRP3 依赖性炎症小体活性来抑制炎症信号传导。因此,饮食-肝脏-胆汁酸-微生物群的串扰在胃肠道炎症以及结直肠癌和肝癌的发生中起重要作用,可用于预防癌症的发生或进展。
菌群利用胆汁酸作为信使影响抗肿瘤免疫
肠道微生物组可以利用胆汁酸作为信使,来控制趋化因子依赖性肝脏自然杀伤 T 细胞 (NKT) 的积累,从而影响肝脏中的抗肿瘤免疫。这一过程是由共生肠道细菌的改变、初级和次级胆汁酸的平衡以及 LSEC 中的 CXCL16 表达介导的,LSEC 是最早暴露于肝脏中肠道衍生代谢物的细胞之一。
相反,NKTs 通过与肝细胞的相互作用与 CD8 T 细胞合作,促进 NASH 和 NASH相关的肝细胞癌。
NK 细胞和肝星状细胞之间的相互作用——癌症休眠和转移的主要开关
基质反应阻碍了 NK 细胞和干扰素 γ 介导的肿瘤细胞休眠的维持,并通过组织损伤和活化的肝星状细胞分泌 CXCL12 的过程诱导肝转移,CXCL12 通过 CXCR4 保留和使 NK 细胞静止,抑制免疫监视和促进转移性生长。
某些与肥胖相关的细菌具有增加次级胆汁酸脱氧胆酸的能力
脱氧胆酸的增加会导致肝星状细胞中的 DNA 损伤,从而诱导衰老相关分泌表型,导致炎症和肿瘤促进因子以及 COX2 诱导的免疫抑制性 PGE2 在肝脏中的产生,从而促进肝细胞癌的发展。
肥胖还与微生物群改变有关,导致 TLR2 激动剂脂磷壁酸 (LTA)这一革兰氏阳性菌的主要细胞壁成分的积累增加。脱氧胆酸增加肝星状细胞上 TLR2 的表达,并与 LTA 协同诱导衰老相关分泌表型因子和 COX2,后者通过 PGE2 诱导免疫抑制,并在化学致癌物暴露后促进肥胖相关的肝细胞癌。
总之,这些研究支持了一个模型,即平衡状态的改变会对环境中的连接细胞产生影响,证实微生物组及其代谢物是肠道和肝脏基因反应的关键影响因素,对肝癌发生具有影响。
本文主要介绍了影响肝细胞癌的微生物群的复杂相互作用,强调了微生物群多样性或肠-肝轴中微生物代谢物的改变触发局部细胞中的基因反应。
与肝细胞癌相比,微生物群和PDAC对患者预后的相关性已得到更彻底的研究,并已明确开始确定特定机制,通过这些机制,微生物群可以局部或系统地影响肿瘤微环境,以及肿瘤进展和对治疗的反应。因此,胰腺导管腺癌研究中使用的一些策略可以应用于肝细胞癌研究。
可以看到,目前的研究分析环境中局部细胞内微生物群介导的直接和间接变化,研究视角已逐渐从靶细胞转向微环境/生态系统。肠道微生物群以及肿瘤本身的细菌通过调节癌症、基质和炎症/免疫细胞中的基因转录程序以及促进或抑制肿瘤进展来影响肿瘤微环境。
癌症干细胞和免疫细胞之间的串扰在癌症进展中起着重要作用,那么癌症干细胞是否容易被微生物/代谢物的改变触发?这也是值得关注的问题。由于物理和生理上的联系,评估微生物群对癌症干细胞分化的影响以及作为一个综合系统对肠-肝轴生态系统的影响也非常重要。
主要参考文献:
Silveira MAD, Bilodeau S, Greten TF, Wang XW, Trinchieri G. The gut-liver axis: host microbiota interactions shape hepatocarcinogenesis. Trends Cancer. 2022 Mar 21:S2405-8033(22)00045-0. doi: 10.1016/j.trecan.2022.02.009. Epub ahead of print. PMID: 35331674.
Komiyama S, Yamada T, Takemura N, Kokudo N, Hase K, Kawamura YI. Profiling of tumour-associated microbiota in human hepatocellular carcinoma. Sci Rep. 2021 May 19;11(1):10589. doi: 10.1038/s41598-021-89963-1. PMID: 34012007; PMCID: PMC8134445.
Zhang T, Zhang S, Jin C, Lin Z, Deng T, Xie X, Deng L, Li X, Ma J, Ding X, Liu Y, Shan Y, Yu Z, Wang Y, Chen G, Li J. A Predictive Model Based on the Gut Microbiota Improves the Diagnostic Effect in Patients With Cholangiocarcinoma. Front Cell Infect Microbiol. 2021 Nov 23;11:751795. doi: 10.3389/fcimb.2021.751795. PMID: 34888258; PMCID: PMC8650695.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980. doi: 10.1126/science.aay9189. PMID: 32467386; PMCID: PMC7757858.

谷禾健康

Alistipes是拟杆菌门的一种革兰氏阴性细菌,也是相对新的细菌属,主要从医学临床样本中分离出来。该菌的生态失调,可能是有益的也可能是有害的。
Alistipes可能对某些疾病有保护作用,包括肝纤维化、癌症免疫治疗和心血管疾病。相比之下,其他研究表明Alistipes在结直肠癌中具有致病性,并且与抑郁症有关。
该菌避开富含植物性食物的饮食,可以在高脂肪饮食中茁壮成长,并且在肥胖患者的肠道微生物群中生长得特别好,表明与肥胖相关。
Alistipes 是拟杆菌门中的一个属,革兰氏阴性,专性厌氧,是肠道共生的细菌,G+C 含量为55–58%,直径为 0.2–0.9 µm,长度为 0.5–4 µm 的直或略微弯曲的棒状,末端为圆形。不会形成孢子。细胞通常单独或成对出现,偶尔以较长的细丝出现。
不运动,可产生吲哚。不能还原硝酸盐,不水解精氨酸和尿素,葡萄糖代谢终产物是琥珀酸和少量的乙酸,丙酸。
microbiomology
在分类学上,Alistipes 是在 2003 年在患有阑尾炎的儿童的组织样本中发现后描述的一个属。第一个被发现的Alistipes物种是Alistipes Finegoldii,它是以美国厌氧细菌学和传染病临床研究学家Sydney M. Finegold 的名字命名,极大地促进了我们对厌氧菌的理解。
根据NCBI分类数据库,目前Alistipes由13个物种组成:
2017 年从肠易激综合征患者的结肠中分离出来一种名为Tidjanibacter massiliensis Marseille-P3084 的新物种,与A. putredinis具有 92.1% 的序列同源性,不过该菌株尚未被官方认可或存放在公共菌株生物储存库中。
此外,三个较新的亚种:
从生态学角度来看,Alistipes主要存在于健康人的肠道中。然而,Alistipes也从其他液体中分离出来、如尿液、阑尾、腹部、直肠周围和脑脓肿中分离出来,突出了它们在人类疾病中潜在的机会致病作用。
A. putredinis(ATCC 29800 T型菌株)已从各种标本中分离出来,例如粪便、急性阑尾炎患者的阑尾组织、腹部和直肠脓肿、甚至农场土壤。该菌株对克林霉素、头孢西丁、氯霉素、红霉素和甲硝唑敏感,对四环素和强力霉素有中度耐药。
Alistipes finegoldii 已被认为是肉鸡的生长促进剂,并且已观察到在人类中,A. putredinis随着十字花科蔬菜摄入量的增加而增加,因此可以合理假设不同的Alistipes物种在营养和健康方面可能具有不同的作用。
A. onderdonkii和 A. shahii 分别从腹部脓肿和阑尾组织以及尿液中分离出来。它们具有圆形菌落。这两个种都对 20% 的胆汁具有抗性,并将色氨酸水解为吲哚。它们是过氧化氢酶、氮还原酶和脲酶阴性。琥珀酸是主要的代谢终产物,少量产生乙酸和丙酸。
其他两个种,A. senegalensis 和 A. timonensis 最初是从健康患者的粪便菌群中分离出来的。它们有圆形菌落并产生色素,可以将色氨酸水解为吲哚。A. senegalensis会发酵甘露糖,而A. timonensis 不会。这些细菌菌株对青霉素、阿莫西林加克拉维酸、亚胺培南和克林霉素敏感。此外,A. senegalensis菌株对甲硝唑耐药,A. timonensis 菌株对甲硝唑敏感。
Alistipes inops从人类粪便中分离出物种。它对吲哚产生呈阳性,对过氧化氢酶、硝酸还原酶和脲酶呈阴性。这种细菌是非发酵的,主要代谢终产物是琥珀酸和乙酸。
A. megaguti (Marseille-P5997 T型菌株)是从一名年轻健康女性的新鲜粪便样本中分离出来的。
A. megaguti是过氧化氢酶、脲酶和氧化酶阴性。
A. provencensis (Marseille-P2431 T型菌株) 分离自一名患有高血压和糖尿病的男性患者。该种属氧化酶和脲酶阴性,而过氧化氢酶阳性。
A.ihumii 已从患有神经性厌食症的患者的粪便中分离出来,而A.obesi则从患有病态肥胖症的患者中分离出来。
该菌属大部分耐胆汁,因此,有必要确定对胆汁酸的抗性是否确实决定了Alistipes胃肠道内的区域性富集,或临床上以胆汁改变为特征的疾病,其与Alistipes菌的关系。
肝病和短链脂肪酸中的 Alistipes
肝细胞癌 (HCC) 是全球第二大致命癌症。HCC 通常是由肝硬化、非酒精性脂肪肝病 (NAFLD) 或非酒精性脂肪性肝炎 (NASH) 引起的晚期肝纤维化发展而来的。这些肝脏疾病与“微生物-肝轴”有关,表明生态失调是潜在原因之一。
肝纤维化中Alistipes减少
在对微生物群组成和肝纤维化进行的研究中可以看出,在纤维化的整个进展过程中,Alistipes减少。
例如,在代偿性和失代偿性肝硬化 (LC) 患者中,来自健康志愿者和各种类型 LC 患者的新鲜粪便宏基因组序列表明,与健康对照组相比,A. shahii和A. putredinis菌减少。
针对 LC 患者粪便和活检的研究中,与 LC 患者相比,健康对照患者的Alistipes丰度增加。
代偿发展到失代偿,Alistipes减少
随着疾病从代偿发展到失代偿,观察到Alistipes indistinctus 的减少。一旦个体出现失代偿性肝硬化,患者就会开始产生多种严重并发症,例如肝性脑病。
另一项研究表明,在比较失代偿性肝硬化和急性肝性脑病患者的粪便微生物群时,Alistipes具有保护作用,其丰度的降低与肝性脑病复发的增加相关。因此,Alistipes的减少与肝硬化进展为失代偿状态有关。
NASH 和 NAFLD中 Alistipes 降低
在NASH 和 NAFLD 等其他纤维化疾病中可以看到肝纤维化患者的Alistipes丰度降低。有实质性纤维化的 NAFLD 患者粪便中乙酸盐和丙酸盐浓度降低,丁酸盐浓度无显着差异。当将健康对照与 NASH 患者进行比较时,A. finegoldii 显着减少,标准化计数平均值从 542 减少到 19。在具有显着纤维化的 NAFLD 患者中,观察到 A. onderdonkii 的显着减少从 285 到 31。
Alistipes生产短链脂肪酸
值得注意的是,这些晚期纤维化患者的粪便乙酸盐和丙酸盐水平降低。
Alistipes是一种丙酸生产者,表达甲基丙二酰辅酶A差向异构酶,其中该酶的基因位于具有乙酰辅酶A羧化酶基因的操纵子上。
此外,Alistipes是乙酸盐生产者,由于先前的研究表明短链脂肪酸具有抗炎机制,因此可以表明Alistipes 减少促使短链脂肪酸减少,可能加剧这些 NAFLD 患者中的晚期纤维化。
心血管疾病、高血压和上皮中的 Alistipes
心血管疾病 (CVD) 是发展中国家和发达国家死亡和发病的主要原因。随着全球人口老龄化,预计心血管疾病在未来会上升,因此对与肠道微生物群关系的评估进行了更广泛的研究。
Alistipes与高血压等心血管疾病风险因素以及心房颤动 (AF)、充血性心力衰竭 (CHF) 和动脉粥样硬化性心血管疾病 (ACVD) 等多种心血管疾病相关。
各种研究表明,Alistipes在心血管疾病中起保护作用。
心房颤动患者Alistipes减少
Alistipes与心房颤动 (AF) 等心血管疾病直接相关。心房颤动是最常见的心律失常,在高血压、心力衰竭和肥胖患者中普遍存在。
为了量化肠道微生物组和心房颤动之间的关系,对来自中国参与者的 100 个粪便样本全基因组鸟枪序列进行分析,显示在心房颤动患者肠道中Alistipes急剧减少。
Alistipes和链球菌的拮抗作用
然而,研究中提出在心房颤动期间急剧增加的细菌,如链球菌,可能是导致Alistipes下降的原因,这表明Alistipes和链球菌之间存在潜在的拮抗作用。这种趋势在其他心脏病中很常见,例如 ACVD和 CHF。
但是Alistipes在心血管疾病中证据是矛盾的,尚不清楚关联是保护性的、有益的还是致病的。因为大多数心血管疾病具有共同的病理生理特征,例如内皮功能障碍 ,Alistipes的作用可能取决于多个心血管疾病共享的疾病机制。因此,更多关于肠心轴的研究可能会导致未来对微生物组相关疾病和潜在疗法的理解。
高血压中Alistipes有助于炎症和上皮细胞的改变
宏基因组分析研究了 22 名高血压患者和 18 名对照患者的粪便样本。数据显示A. finegoldii和A. indistinctus的增加与收缩压呈正相关,表明该物种是高血压患者肠道屏障功能障碍和炎症的潜在驱动因素,但是该研究样本量较少,证据力度不大。
肠道炎症和结直肠癌中不一样的 Alistipes
由于胃肠道中微生物群的多样性,菌群失调与炎症性肠病(IBD)之间存在很强的相关性。
人群中最常见的炎症性肠病是克罗恩病 (CD) 和溃疡性结肠炎 (UC)。溃疡性结肠炎是一种主要针对结肠的慢性炎症性疾病。有人提出A. Finegoldii是一种针对结肠炎的保护性物种,因为A. Finegoldii在患有结肠炎的小鼠中减少。
基于这个事实,进行了一项研究,其中微生物群耗竭的小鼠用口服 DSS 治疗以诱发结肠炎。当用 A. finegoldii 灌胃时,结肠炎的严重程度与野生小鼠相似。当给患上结肠炎小鼠添加了A. finegoldii和 Bacteroides Eggerthii (一种结肠炎诱导细菌)时,与单独添加B. Eggerthii 或添加其他细菌(如Parabacteroides distasonis或Prevotella falsenii)的小鼠相比,结肠炎的严重程度显着降低,这进一步表明A. Finegoldii是一种减轻结肠炎的细菌。
具有对比临床意义的是,已从严重克罗恩病的肠壁海绵状瘘管 (CavFT) 微病变中分离出与其他拟杆菌有关的 A. finegoldii. 对自发性克罗恩病回肠炎小鼠模型粪便样本的宏基因组研究显示,与亲代 AKR/J 小鼠群体相比,Alistipes 富集。
8 周龄 NOD2 敲除小鼠富含Alistipes、抗炎细胞因子(TGF-β 和 IL-10)和 CD4 + LAP + FoxP3 –调节性 T 细胞。这些观察结果的一个可能联系来自对姜黄素的研究,姜黄素是一种已被证明可通过 IL-10增加 CD4 + LAP + FoxP3 -细胞来调节肠道炎症的香料。
有趣的是,有炎症的患者服用益生菌后,Alistipes增加了。迄今为止,尚不清楚该属与肠道中的其他微生物(包括食物和益生菌菌株)之间存在哪些相互作用机制。
诱发结直肠癌
已发现Alistipes作为潜在的病原体可能会诱发结直肠癌。A. Finegoldii 通过 IL-6/STAT 3 途径促进右侧结直肠癌。报告指出Alistipes能产生磺脂,已知磺脂类药物可作为血管性血友病因子受体的拮抗剂并抑制肿瘤坏死因子-α (TNF-a),这些物质与微炎症和血管内皮功能障碍有关。
Lipocalin 2 (LCN 2) 是一种与铁载体结合的抗微生物蛋白,最终会降低铁的利用率。
在 IBD 患者中,LCN 2 在黏膜和粪便样本中的浓度很高。从本质上讲,这可以减少Alistipes的繁殖,因为铁是A. finegoldii 生长的调节因子。
小鼠研究表明A. finegoldii在 WT、LCN 2 KO 和 IL-10 KO C57BL/6J 小鼠中口服给药 1 周后引起肠道炎症。因此,该论文得出结论,Alistipes在缺乏 LCN 2 并促进炎症和肿瘤形成的发炎环境中茁壮成长。此外,他们发现在盲肠中发现Alistipes finegoldii的丰度高于大肠内的其他位置。
癌症免疫疗法中的Alistipes
该属已被证明可以通过调节肿瘤微环境在癌症免疫治疗中发挥有益作用。癌症的主要标志之一是逃避免疫系统。因此,一种形式的抗癌治疗是操纵肿瘤微环境。
免疫疗法的一个例子是通过诱导肿瘤相关骨髓细胞产生肿瘤坏死因子 (TNF) 来操纵微环境,最终导致肿瘤根除。
一种方法是使用肿瘤内 CpG-寡脱氧核苷酸 (ODN) 的组合来激活 TLR9 和抑制性 IL-10R 抗体。这种免疫疗法通常会阻止肿瘤生长并通过肿瘤相关的骨髓细胞诱导肿瘤坏死因子依赖性出血性坏死,从而导致肿瘤抑制。
免疫疗法效果依赖微生物群的存在
由于 TNF 产生减少,抗生素导致肿瘤根除效率降低。然后,研究人员怀疑这是否取决于肠道中的细菌负荷。因此,具有 MC38 肿瘤的无菌 (GF) 小鼠接受了抗 IL-10R/CpG-ODN 治疗。与无特定病原体 (SPF) 小鼠相比,经处理的 GF 小鼠产生的 TNF 量显着降低。
这表明肿瘤相关的先天性骨髓细胞由微生物群引发,以响应抗 IL-10R/CpG-ODN 产生炎性细胞因子,并且抗生素治疗或无菌状态导致的细菌负荷减少会降低这种反应,并且TNF依赖的早期肿瘤坏死。
为了更好地了解抗生素的作用和肠道微生物群的作用,用 LPS 灌胃 MC38 荷瘤小鼠并重建 TNF 表达。Alistipes属和 TLR4 引发/TNF 产生的作用,两者之间存在正相关。
TNF 恢复是由于促炎性革兰氏阴性菌A. shahii与 TLR4 结合,启动 TNF 产生表达的作用。
为了进一步证明他们的假设,作者随后显示了抗生素治疗后A. shahii恢复的延迟,这也与抗生素给药后约 4 周的 TNF 恢复阶段平行。
此外,他们表明,当用抗生素预处理并用A. shahii灌胃的小鼠时,与肿瘤相关的骨髓细胞产生 TNF 的功能得到恢复。临床相关,该研究表明,当Alistipes减少,对癌症免疫疗法的最佳反应平行减少 。陆续其他人也确定了Alistipes在癌症免疫治疗中的作用。
精神健康中的 Alistipes
虽然Alistipes常见于肠道,但它已被证明对定位于肠道外的疾病有显着影响,例如抑郁症、焦虑症、慢性疲劳综合征、自闭症、肝硬化和衰老。肠道内的生态失调会影响肠脑轴,并用于解释肠道微生物群、抑郁症和其他情绪障碍(如焦虑)之间的关系。
抑郁患者中Alistipes增加
与健康对照组相比,重度抑郁症患者的粪便中肠杆菌科和Alistipes水平升高,粪杆菌水平降低。Alistipes属吲哚阳性,影响血清素前体色氨酸,而Faecalibacterium具有抗炎特性。
在一项对 BALB/c 小鼠进行的研究中,该小鼠置于压力环境中,Alistipes丰度显着增加。此外,还发现挪威患有慢性疲劳综合症的患者的Alistipes浓度增加了近 4 倍。这些发现与抑郁症患者Alistipes增加的证据相关,因为抑郁症患者通常与疲劳和压力作斗争 。
Aistipes丰度的增加可能与GABA增加有关
研究指出,Alistipes的增加扰乱了肠-脑轴,因为Alistipes是一种吲哚阳性生物体,因此会降低血清素的可用性。色氨酸是血清素的前体,血清素的减少与抑郁症有关。此外,Alistipes已被证明可表达谷氨酸脱羧酶,这是一种在鸡体内将谷氨酸代谢为 γ-氨基丁酸 (GABA) 的酶。因此Alistipes丰度的增加也可能与 GABA 的增加有关。然而,应该进行研究以证明 GABA 是否被分泌到肠腔中。
自闭症患者中Alistipes研究不一致
此外,自闭症谱系障碍患者的大脑和肠道之间存在关联。研究发现自闭症谱系障碍患者的Alistipes减少。然而,另一项针对不同形式的自闭症 PDD-NOS 的研究表明,儿童中存在大量Alistipes。据推测,这可能来自丙酸的产生,丙酸已被证明对大鼠具有神经生物学作用。需要对Alistipes进行更多研究及其对肠脑轴的影响,因为关于其在两个系统中的保护/致病作用存在矛盾的证据。
磺胺类和生化标志物
Alistipes是一种细菌,具有许多与上述疾病相关的免疫和生化途径。一个重要的意义是Alistipes通过 IL-6/STAT 3 途径促进结直肠癌。
因此,未来的研究可以考虑使用Alistipes物种作为结直肠癌的潜在生物标志物,利用我们基于微生物组 DNA 数据的理解以及对疾病发病机制的生化概念的整合。
实现这一目标的一种潜在方法是寻找磺基脂,这是一类独特的鞘脂,在鞘氨醇碱基中具有磺酸基团。
Alistipes产生磺基脂
研究表明,当 C57BL/6N 小鼠喂食含有红花油或猪油脂肪的高脂肪饮食 3 周时,与喂食正常食物的小鼠相比,磺胺脂以及体重都会增加。进行了宏基因组分析并筛选了这些小鼠盲肠中参与磺胺脂生物合成的细菌基因。发现除A. inops外的所有Alistipes物种都产生磺基脂(关于最新物种 A. megaguti、A.provencensis和磺基脂生产的信息仍然未知)。
为了进一步证明磺基脂是细菌的产物和Alistipes的标志物,科学家们对带有Alistipes的无菌 (GF) 小鼠进行了单定殖研究并检测到单定殖小鼠盲肠中明显出现了以前在无菌小鼠中不存在的磺基脂。
因此,由于结直肠癌的常见风险因素是高脂肪饮食、肥胖和年龄,除了这些结肠疾病中Alistipes的丰度增加外,还有一个有趣的提议是使用磺基脂类作为结直肠癌患者风险的标志物。此外,应进行研究以验证Alistipes丰度是否在息肉中增加,癌前与癌性,息肉是结直肠癌的另一个危险因素。
有害代谢产物与结直肠癌相关
此外,Alistipes在共生细菌中具有最多的腐败途径。腐败是肠道微生物群在胃肠道中发酵未消化的蛋白质,通常会导致细菌产生有害代谢物。据报道,这些产物有害并与结直肠癌相关。此类产品包括氨、H2S、甲酚、吲哚和苯酚。
在一项旨在确定肠道细菌使用的主要腐败途径的研究中,发现Alistipes有助于组氨酸降解/四氢呋喃产生、吲哚产生和苯酚产生。已发现组氨酸降解/THF 产生会释放过量的氨,当吸收时会损害结肠细胞。还发现氨会增加肠细胞增殖并有助于结直肠癌中癌细胞的生长。当患者有结直肠癌风险时,发现过量氨和其他Alistipes产生的腐败产物可能对临床医生有用。
Alistipes是一种从临床样本中分离出来的相对较新的细菌属,尽管与拟杆菌门中的其他细菌相比,其分离率较低。全基因组蛋白质系统发育分析表明,与拟杆菌门中的其他成员相比,该属可能具有独特的功能特性。
一般,超过一定量的Alistipes在临床和临床前研究中已被认为是导致疾病的原因。有趣的是,其他研究表明它们的存在与促进健康表型相关,例如Alistipes在结肠炎、自闭症谱系障碍以及各种肝脏和心血管纤维化疾病等疾病中的保护作用。
尽管Alistipes在健康表型中发挥作用,但与之形成鲜明对比的是,Alistipes在焦虑、肌痛性脑脊髓炎/慢性疲劳综合征、抑郁症、PDD-NOS 和 CRC 等疾病中具有致病作用。
根据相关研究的结论,该属可能在疾病的调节中起主导作用,或者可能只是具有辅助作用或共同诱导作用。将进一步需要动物研究来破译其复杂多模式疾病机制,以及亚型表型的有针对性研究。
使用无菌动物和模型将有助于了解该属在疾病和健康中的作用以及与宿主免疫防御耐受性的相互作用,例如应该有研究调查Alistipes及其生产的 SCFAs 的作用对各种肝病的影响和Alistipes对T细胞分化的直接作用。
主要参考文献
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917

谷禾健康

Oscillospira,颤螺菌属,是一种神秘的细菌属,从未培养过,但通过人类微生物组的 16S rRNA 基因调查不断检测到,是人类肠道菌群的谜一样的组件,广泛存在于动物和人类肠道中。大人群水平上, 其与肥胖,消瘦,和胆结石和慢性便秘等相关,并显示出与其病程中的积极或消极变化有一定的相关性。能够产生丁酸盐等短链脂肪酸(SCFAs)的菌属,由于丁酸盐是筛选“下一代益生菌”的重要参考指标,该菌也被列为下一代益生菌的候选者。
颤螺菌属(Oscillospira)是梭菌群中的一个未被充分研究的厌氧细菌属,属于厚壁菌门,瘤胃球菌科。
一个世纪前,Chatton 和 Pérard在豚鼠盲肠内容物中发现了Oscillospira guilliermondii,这是Oscillospira属中唯一已知的物种,这才第一次出现了有关Oscillospira 的记录。然而,由于尚未获得纯培养物,因此对其在肠道中的生态作用和生理特性知之甚少。
由于O. guilliermondii 体型大且形态独特,便于其 DNA 分离和 16S rRNA 基因扩增和测序,因此基于流式细胞术对Oscillospira属进行分类,并通过 16S rRNA 系统发育分析确定为Ruminococcaceae(瘤胃球菌科)的成员。
Oscillospira属的通常是杆状或椭圆形,细胞非常大(大约5-7微米的宽度,70 毫米长),在透射电子显微镜下可以看到细胞内紧密间隔的横向隔膜。一些颤螺菌属有内生孢子(2.5×4 μm),呈棒状纵向排列,具折射性,数量可变,通常含有大量多糖,遇碘呈淡红色或淡紫色。
由于在颤螺菌中观察到孢子样结构,推测这组微生物可能含有孢子相关基因。一些Oscillospira成员基因水平的分析揭示了小酸溶孢子蛋白的存在,孢子成熟蛋白A和B,六种III阶段孢子形成蛋白,以及孢子形成转录调节SpoIIID 和 SpoVT。
然而,一些没有SpoVT 和其他相关的孢子蛋白,表明孢子形成可能是Oscillibacter进化枝中的零星分布特征。有趣的是,产孢基因也存在于一些非产孢菌中,例如Oscillibacter valericigenes,它含有产孢基因但不产生孢子,而这些产孢基因可能起其他作用,如调控基因。
图源:by Takahiro Kanagawa
Oscillospira是一种革兰氏阳性细菌,其 G + C 含量低,序列与从肉鸡盲肠和奶牛瘤胃内容物中获得的梭菌簇 IV(柯林斯命名法)内的未培养细菌克隆的序列接近。有趣的是,来自人类粪便样本的克隆序列也属于这一簇,这表明该簇中的微生物不仅广泛存在于草食动物的消化道中,而且还广泛存在于杂食动物的消化道中。
从宏基因组和代谢特征的发现该生物体具有丁酸激酶介导的通路,从而它被推断Oscillospira是丁酸生产者,并且至少其中的一些物种可以利用葡萄糖酸盐,这是一种常见的动物源性糖,既由人类宿主产生,又由宿主通过富含动物产品的饮食摄入。
另一方面,进一步证明了颤螺菌可以发酵复杂的植物碳水化合物。特定的碳源对其生长也是必不可少的,例如颤螺菌在含有葡萄糖、乙醇和乳酸的培养基中生长良好,尤其是葡萄糖显著促进其生长。
已经表明,颤螺菌难以培养且生长缓慢,这可能与较长的结肠转运时间有关。快速的结肠运输时间选择快速生长的微生物,同样,较慢的运输条件允许较慢的微生物留在管腔中并避免被洗脱,缓慢生长的颤螺菌的特性很合适。
另一方面,基因组中 tRNA 基因的数量可以作为微生物世代的强预测因子。绝大多数快速生长的微生物在其基因组中都有更多的 tRNA 基因拷贝,反之亦然。先前的研究已经表明,有少于40个tRNA基因Oscillospira,和相对于其他快速增长的肠微生物如脆弱拟杆菌(72-73 tRNA基因,产生时间0.63 h)比,Oscillospira是一种生长非常缓慢的生物。
近年来,基于人体肠道菌群的多个16S rRNA扩增子测序数据表明,颤螺菌是人体肠道和粪便菌群的丰富成分,其基因序列量有时占整个肠道菌群的10%以上,同时,Oscillospira可以产生丁酸盐,表明这种生物可能在人体功能和健康的各个方面发挥重要作用。
为了深入了解Oscillospira与人体相关健康状况,广东肠道微生物组计划 (GGMP) 分析了来自中国广东省 14 个区的6000多名参与者,并记录调查了这些参与者的社会人口学和人体测量学参数、饮食、药物、疾病和生活方式的详细信息。发现Oscillospira与人类健康密切相关,因为它的丰度与微生物多样性、高密度脂蛋白和睡眠时间呈正相关。
多种因素影响着颤螺菌的丰度,主要是外源性因素。从一系列文献中得知,饮食、益生菌益生元、重金属、天然活性产品、药理干预、运动和饮食以及其他因素都会影响肠道中Oscillospira的丰度。
益生菌
养殖家禽,益生菌芽孢杆菌通常与饲料混合,以达到保证个人健康和获得高品质的肉的最终目标。
研究发现枯草芽孢杆菌29784显著提高肉鸡增重,提高他们的肠道健康状况,同时增加了肠道中Oscillospira丰度。添加枯草芽孢杆菌对母鸡的饮食,这是能够提高生长性能和肠道功能,诱导Oscillospira逐渐成为在肠道中的优势种。
同样,在新生肉鸡饲养过程中,添加益生菌制剂(解淀粉芽孢杆菌加枯草芽孢杆菌)增加了Oscillospira丰度和显著减少致病的大肠杆菌水平传输,并减轻感染的严重程度。
凝结芽孢杆菌添加可以减轻环磷酰胺诱导的小鼠肠损伤和显着增加有益菌的丰度如Oscillospira。
短双歧杆菌ATCC 15700 (BB) 治疗酒精性肝病 (ALD) 后,症状得到缓解,并显着增加了Oscillospira的丰度。
从Leuconostoc pseudomesenteroides XG5 (XG5-EPS) 中分离出的胞外多糖显着增加了小鼠盲肠微生物群的丰富度,尤其是增加了Oscillospira的相对丰度。
乳酸菌和酵母共同发酵的西藏开菲尔奶 (TKM) 对喂食含有人源菌群相关 (HFA) 的高脂肪饮食的大鼠脂肪沉积的影响,发现TKM减少腹部脂肪沉积和通过调节血清中甘油三酯(TG)水平,同时增加Oscillospira丰度。
然而,并非所有益生菌都可以直接或间接增加颤螺菌的丰度。
研究指出长期补充鼠李糖乳杆菌降低了雌性 Sprague Dawley 大鼠的体重,改善了血清细胞因子,降低了血清脂蛋白谱,而它们的肠道颤螺旋体丰度显着下调。同样,丁酸梭菌能够产生丁酸,丁酸已被证明可以限制肝脏中的脂质沉积,恢复肠道屏障功能,并改善肝脏炎症,并具有益生菌潜力。丁酸梭菌缓解了结肠炎小鼠肠道炎症并伴随Oscillospira丰度降低。
益生元
除了益生菌,益生元对肠道菌群也有重要影响。
低聚果糖(FOS)显著增加的丰度Oscillospira在小鼠肠,特别是当FOS与益生菌组合的进一步能够抑制许多有害肠道微生物。
褐藻糖胶 (FUC) 和低聚半乳糖 (GOS) 改善了高脂饮食大鼠的血清血脂异常、胆盐水解酶 (BSH) 活性和胆汁酸相关代谢水平,并促进了Oscillospira guilliermondii的丰度。
人乳寡糖非常重要,具有独特多样的结构,可以通过不同的机制影响婴幼儿肠道菌群的发育和组成。使用婴儿粪便移植的人类小鼠模型来研究岩藻糖基-α1,3-GlcNAc (3FN)、岩藻糖基-α1,6-GlcNAc、乳-N-二糖 (LNB) 和半乳-N-二糖的作用。关于粪便微生物群和宿主-细菌相互作用,发现所有这些二糖都显着上调了颤螺菌的丰度。
发现豌豆纤维改善了超重个体的健康状况并增加了他们的肠道颤螺菌丰度,同时他们发现增加的Oscillospira与降低的脱氧胆酸(DCA)和粪便中的石胆酸(ISO-LCA)显著关联。
马铃薯纤维是淀粉生产的副产品,富含果胶、纤维素、半纤维素和抗性淀粉等膳食纤维,可被肠道微生物群利用和代谢以产生短链脂肪酸。
其中一个代表产品是 FiberBind 400,是一种市售的马铃薯纤维产品。在胃肠模型(TIM)-2结肠模型测定中,FiberBind 400的摄取增加外源性的肠内存活发酵乳杆菌PCC®,鼠李糖乳杆菌LGG®,罗伊氏乳杆菌RC-14®,副干酪乳杆菌F-19®和也被发现促进肠道的生长Oscillospira。
然而,也有研究发现燕麦 β-葡聚糖 (OG)、燕麦抗性淀粉 (ORS) 和全燕麦食品 (WO) 显着改善了 II 型糖尿病大鼠的症状并降低了它们的肠道颤螺菌丰度。海洋动物来源的Cereus sinensis多糖 (CSP-1) 显着增加了小鼠胸腺、脾脏指数和总 SCFAs 的产生,并降低了Oscillopira丰度,他们假设 CSP-1 可能是一种潜在的益生元。
总之,益生菌和益生元通常在家禽养殖以及特定疾病相关的动物模型中表现出促进健康的作用,其中绝大多数益生菌或益生元摄入可以直接或间接增加宿主肠道中颤螺菌的丰度,而少数人则相反,颤螺菌丰度的上调或下调似乎与特定菌株或特定益生元有关。
重金属
越来越多的流行病学证据表明,重金属可能促成和影响各种代谢疾病的进展,这些疾病的病因和进展部分是由于重金属引起的肠道微生物群紊乱。
通过对不同剂量的铅对肠道菌群和肠屏障在小鼠,发现随着铅剂量的增加,对小鼠结肠组织的损害增加,Coprococcus和Oscillostira的相对丰度呈线性下降。
铅和镉 (Cd) 暴露可以通过改变产生 SCFA 的相关微生物的丰度来影响 SCFA 的浓度,例如瘤胃球菌、拟杆菌、颤螺菌。
一项研究表明,Oscillospira产生丁酸盐和丙酸盐,增加杯状细胞和粘液的产生,保持肠上皮的完整性,减少铅的吸收,从而减少结肠组织的损伤和炎症。

4周龄C57BL / 6雌性小鼠摄取含有100ppb的砷(As)的饮用水13周显示出在一个显著下降Oscillospira丰度,但这是伴随着增加Akkermansia和双歧杆菌丰度。该结果在其他小鼠研究中一致。
此外,Oscillospira似乎对其他重金属同样敏感,例如铜和银,这些重金属可以显着影响大鼠肠道中颤螺菌的比例。然而,也有一些重金属与颤螺菌丰度呈正相关,例如汞暴露会导致小鼠肠道损伤并增加其肠道颤螺菌丰度,这一现象在另一项研究中得到进一步证实。
值得注意的是,研究表明,儿童自闭症谱系障碍 (ASD) 人群中较高浓度的铅、砷、铜、锌、汞、钙和镁,尤其是砷和汞浓度,与肠道中的颤螺菌丰度高度相关。
不同重金属对肠道中颤螺菌丰度的影响各不相同。仅颤螺菌丰度的上调或下调似乎并不能表明特定重金属对宿主健康是否具有积极或消极影响。因此,不同重金属暴露下的颤螺菌丰度模式有待进一步探索,该属也有可能作为评估重金属污染程度的指标之一。
天然产物
天然产物对肠道微生物群的影响已被更频繁地研究。其中,多酚似乎能够对宿主微生物群发挥重要作用。
从谷壳中提取的小米壳多酚(MSP)在体外具有抗动脉粥样硬化作用。以高脂饮食的 ApoE-/- 小鼠为实验对象,研究 MSPs在体内的抗动脉粥样硬化活性发现MSPs有效抑制动脉粥样硬化斑块的发展,降低相关炎症因子的水平,并显着上调紧密连接蛋白(ocludin、zona occludens-1和claudin 1),肠道菌群中Oscillospira和瘤胃球菌进行显著富集。
一种富含多酚的植物提取物,可对高脂饮食 (HFD) 小鼠的体重和胰岛素抵抗产生有益影响。将高强度间歇训练 (HIIT) 和 富含多酚的植物提取物的组合应用于西方饮食诱导的肥胖大鼠模型,发现这种组合方式显着限制了大鼠的体重增加并改善了血糖水平,而它们的颤螺菌丰度也显着增加。
绿茶多酚(GTP),也可以提高雌性SD大鼠的肠道内Oscillospira。然而,多酚也并非都与颤螺菌呈正相关。
研究表明,青砖茶(QZT)具有显着的抗肥胖、清除自由基、抗氧化、抑制脂肪细胞增殖等保健作用。发现QZT提取物改善肠道微生物介导的在高脂肪小鼠代谢紊乱并降低的丰度Oscillospira,其显著正与代谢综合征关联。
除了多酚,其他一些活性产品也有类似的效果。

辣椒素 (CAP) 是辣椒中的一种活性成分,具有多种药理活性和对精神疾病的潜在影响。
发现 CAP 可改善脂多糖 (LPS) 诱导的抑郁样行为小鼠的抑郁和血清 5-羟色胺 (5-HT) 和肿瘤坏死因子-α (TNF-α) 水平,并显着上调小鼠的Oscillospira相对丰度。
蔓越莓渣 (CBP) 富含多酚、复合碳水化合物、纤维和营养矿物质。肉鸡饲养过程中持续增加CBP的最终显著促进了鸡肠道内的Oscillospira丰度。
蓝莓二甲花翠素-3-半乳糖苷(蓝莓M3G)也增加了在小鼠中的肠道微生物的多样性和显著增加的丰度Oscillospira和瘤胃球菌。
多糖是从葛根(PPL)衍生不仅减少了异戊酸浓度在正常小鼠,也显著增加Oscillospira丰度和最终减轻抗生素相关性腹泻(AAD)诱导的结肠病理状况和小鼠肠道菌群的生态失调。
肠道微生物群在改善认知和塑造行为方面也发挥着重要作用。发现 5% 的果胶与 5% 的纤维素混合可改善小鼠的学习和记忆力,并显着增加其肠道颤螺菌的丰度。
同样,肠道微生物群在食物过敏中起着至关重要的作用。在小麦依赖性运动诱发过敏反应(WDEIA)在肠道菌群的变化的患者的研究中,Oscillospira与ω-5醇溶蛋白-特异性免疫球蛋白E(IgE)呈正相关,而双歧杆菌与总 IgE 水平呈显著负相关。
然而,一些天然产物与颤螺菌之间存在负相关关系。
苦豆子(豆科)衍生的生物碱改善抑郁样在慢性应激行为和抑郁有关的指标(CUMS)诱导的抑郁症模型小鼠和降低Oscillospira丰度。

发现用亚麻籽多糖(FSP)处理的高脂肪饮食喂养的小鼠已经显著降低他们的血清空腹血糖,总甘油三酯和总胆固醇水平和显著增加有益的比例Akkermansia和双歧杆菌比,同时降低的比例Oscillospira。
芥末粉显着改善了饮食诱导的肥胖大鼠的健康状况,并下调了它们的肠道Oscillospira丰度。
综上所述,以多酚、纤维为代表的天然产物能够显著改善特定疾病动物模型的健康状况,尤其是高脂饮食引起的肥胖等代谢性疾病,并伴随肠道颤螺菌丰度的显著上调。此外,其他天然活性产品总体上表现出对宿主健康的有益作用,但不同产品作用下的颤螺菌丰度差异很大。
药理干预
药物干预对肠道菌群有重要影响。年龄相关性黄斑变性 (AMD) 是老年人视力障碍的主要原因。AMD小鼠艾替伏辛etifoxine治疗后肠道内的Oscillospira显著降低。
53羟氯喹 (HCQ) 是一种广泛使用的抗疟疾药物,推荐用于治疗 COVID-19。对小鼠进行短期高剂量 HCQ 刺激会改变其肠道微生物群的结构,尤其是Oscillospira的丰度,但不会影响其肠道完整性和免疫反应。
发现杀菌剂福美双使鸡的肠道菌群紊乱,引起脂质代谢的破坏和显著减少Oscillospira。
然而,一些药物的干预可以增加颤螺菌的相对丰度。例如,三氟甲磺酸(TFMS)处理的小鼠显示增加的丰度Oscillospira。
在药物干预过程中,肠道和肠道菌群是药物代谢和药效的中心部位,不同药物的代谢过程可能有不同肠道微生物的参与,而颤螺菌的丰度也可能因药物而异。
运动和饮食
饮食结构和运动模式已被证明会影响宿主健康和肠道微生物组成。
发现高强度间歇训练 (HIIT) 对 Wistar 大鼠的肠道微生物多样性有显著影响,单独的 HIIT 仅对其体脂肪量有显著影响,但当 HIIT 与亚麻籽油 (LO) 结合使用时,α亚麻酸(ALA),以二十二碳六烯酸(DHA)转化率增加,同时结肠菌群的Oscillospira显著增加。
值得注意的是,单独使用 HIIT 和 LO 都不会导致肠粘膜相关菌群发生显着变化,但当联合使用时,它会显着增加Oscillospira丰度。该研究的结果与之前的研究结果相似,因为颤螺菌与体重指数 (BMI) 呈负相关,与瘦度呈正相关。
其他研究也指出显著增加运动后小鼠的Oscillospira上升,伴随短链脂肪酸的水平显著上升。
两项动物实验表明,Oscillospira丰度、乳酸水平和运动强度之间存在很强的相关性。
在一项基于人群的试验中发现,肥胖的人坚持一年的地中海饮食后,普雷沃氏菌减少,而Oscillospira增加。因此,Oscillospira被认为是一种可能的用于减肥和减脂的下一代益生菌候选物。

在一项随机对照试验中,短期食用杏仁也增加了健康成年人的颤螺菌丰度。
高脂肪饮食被认为是不健康的饮食。高脂肪饮食会增加大鼠肠道中的颤螺菌丰度,然而,在 另一项动物试验中看到了相反的结果。发现高脂肪饮食的雌性小鼠肠道中的颤螺菌丰度显着降低,并且尚不清楚这是否是由于物种差异造成的。此外,该研究发现禁食会降低人体肠道中颤螺菌的相对丰度,这表明热量限制可能对颤螺菌具有负面调节作用。
总体而言,适当的运动模式和适度的运动水平似乎增加了颤螺菌的相对丰度在人类和动物中,虽然公认的健康饮食结构也正向调节Oscillopira丰度的增加。
Oscillospira的健康特性
在肠道菌群及其相关疾病的研究中,颤螺菌经常出现在高通量测序数据中,尤其值得注意的是,在某些特定疾病中,颤螺菌的丰度波动较大。在这里,我们总结了与颤螺菌正相关或负相关的疾病。
2 型糖尿病
2 型糖尿病 (T2DM) 大鼠肠道中的颤螺菌丰度与糖尿病和炎症的发展呈正相关。
神经障碍或退化
中枢神经和退行性疾病与颤螺菌之间也存在密切关联。帕金森病 (PD) 患者也有高丰度的颤螺菌,但这一结果在另一项研究中显示出相反的趋势。
测序和分析自闭症儿童的肠道菌群,发现Oscillospira显着增加。
在另一项研究中CUMS诱发抑郁症小鼠,CUMS感应造成的大量增加Oscillospira,治疗后该属下降。
胆病
可以确定的是,Oscillospira与胆结石直接相关,这种生物可用作有症状胆结石形成的生物标志物。胆结石患者有较高的总粪便胆汁酸(BAS)的浓度,微生物多样性降低,伴有的Oscillospira丰度增加, 进一步分析发现与次级 BA 呈正相关,与初级 BA 呈负相关。
便秘
肠道菌群失调被认为是便秘症状的原因之一。发现Oscillospira可能是便秘的生物指标。一个可能的原因是颤螺菌生长缓慢,并参与结肠运输。在广东6000多人队列和 1126 名成年欧洲人的研究中,Oscillospira与胆结石有关,慢运输是已知的危险因素。
此外,埃希氏菌属和克雷伯氏菌属被认为是快速生长的细菌,它们占据空间并消耗营养。从另一个角度来看,Oscillospira被推断能够产生丁酸盐,一种短链脂肪酸。动物研究表明,短链脂肪酸抑制平滑肌收缩性和由此产生的结肠中的液体转运,从而导致便秘的发展。因此,颤螺可能起到加重便秘的作用。然而,这一假设需要通过代谢组学研究进一步验证,因为 SCFA 在结肠转运中的作用存在争议。
因此,颤螺菌与便秘呈正相关,特别是在慢性便秘的女性人群中,这种相关性非常强。
体重
最近的几项研究发现,Oscillospira与儿童和成人的瘦身或较低体重指数(BMI)相关,包括最近的两项双胞胎研究。
最值得注意的是,其中一项研究表明,Oscillospira菌属的成员具有高度遗传性,在瘦人中富集,并且与促进瘦肉型细菌物种Christensenella minuta高度正相关。

肠道微生物群的组成由长期饮食习惯决定,但短期营养干预会迅速影响肠道微生物群。
在一项研究中,志愿者(21-33岁,体重指数19-32)被转换为植物性饮食(平均纤维含量比基线高出近三倍,脂肪和蛋白质含量比基线低约30%)或动物性饮食。随着转向以动物为基础的饮食,Oscillospira相对丰度大大增加,而在以植物为基础的饮食中,Oscillospira的相对丰度减少(更温和)。因此,Oscillospira物种可能具有双抗性。
此外,这项研究表明,Oscillospira不太可能是复杂的纤维降解物,而是依赖于其他物种分泌的发酵产物,例如在转向动物饮食期间也增加的拟杆菌成员,或者依赖于从宿主粘蛋白释放的糖。
在该研究中,Oscillospira是鸟类、鱼类和哺乳动物(小鼠)禁食期间盲肠中唯一增加的属,所以推测Oscillospira也能够降解宿主聚糖(如岩藻糖、唾液酸和葡萄糖醛酸)。这可以部分解释为什么颤螺菌与瘦身有关,因为宿主不得不花费代谢能量来再生降解的糖蛋白,这些糖蛋白包括如肠粘蛋白。
肠炎
炎症性肠病中的颤螺菌大量减少。对炎症性肠病(主要影响肠道、引起疼痛、腹泻和其他表现的免疫失调疾病)患者的五项微生物群研究的荟萃分析表明,克罗恩病患者中的颤螺菌显著减少。
鉴于没有在培养基中培养出颤螺菌分离物(尽管最近可能使用一种新的培养方法获得了一个分离物),并且没有可用的参考基因组,因此很容易理解为什么它仍然是肠道微生物群研究中的一个难题。
如上所述,Oscillospira可能利用哺乳动物衍生的聚糖,来源于宿主或富含动物糖蛋白的饮食。根据Oscillospira分泌的代谢物,基于其与炎症性疾病和BMI的负相关性,我们推测,与其他表现出类似趋势的属(如Roseburia和Faecalibacterium)类似。
目前,多项研究表明炎症与颤螺菌密切相关,且大多呈负相关。
肠炎和肠病
Oscillospira丰度与溃疡性结肠炎(UC)患者的疾病严重程度呈负相关。
在患有炎症性肠病 (IBD) 的儿童的肠道中发现了较低丰度的颤螺菌。显著低丰度Oscillospira也在克罗恩病(CD)患者和儿童非酒精性脂肪性肝病(NALD)患者的肠道中发现。
衰老
衰老是一种以炎症介质循环水平升高为特征的低度慢性炎症。老年人的许多炎症标志物和介质的循环浓度高于青年人。
越来越多的文献表明,与年龄相关的肠道微生物群失调会导致老年人的整体炎症状态。其中,Oscillospira与促炎性单核细胞趋化蛋白 1 (MCP-1) 呈强负相关。
肥胖
发现超重儿童肠道中颤螺菌的丰度显着减少。同样,发现肥胖相关糖尿病患者肠道中的Oscillopira丰度显著降低,而患有局部和全身炎症的肥胖患者的O.guillermondii显着降低。
脆性 X 综合征 (FXS)
是一种神经发育障碍,被认为是遗传性智力障碍的最常见原因,也是自闭症的主要诱发因素之一。发现在 FXS 小鼠模型的肠道中,Oscillospira丰度显着下调。
抑郁症
颤螺菌与几个抑郁症相关指标之间的强相关性先前也在另一项试验中得到证实。这种关系似乎得到了基于人群的实验数据的进一步支持,发现,社交能力(参与者的外向性,社交能力,沟通能力,综合衡量)呈高度正相关Akkermansia,乳酸和Oscillospira,其中,Oscillospira在社会性得分较高的个体中更为丰富。
肝病
临床上,Oscillospira丰度也与肝脏脂肪呈负相关;Oscillospira丰度在非酒精性脂肪肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)的患者中减少。目前,减少的颤螺菌伴随着增加的 2-丁酮已被确定为 NAFLD 发病的肠道微生物群特征。
肺癌
肺癌发病伴随着在Oscillospira丰度显著下降,在两者之间存在负相关。
粪便硬度
一项关于欧洲成年人肠道微生物群和粪便软/硬的研究表明,颤螺菌的丰度与较硬的粪便呈正相关,与稀便呈负相关。
Oscillospira目前纯培养物没有获得,因此,实际的生物学功能和特定的作用与人体健康机理还没有完全确定。
目前对颤螺菌的描述主要体现在其在不同环境中的丰度变化。通过多项研究总结发现颤螺菌与肥胖和肥胖相关的慢性炎症和代谢疾病高度相关,并且在这类疾病中,颤螺菌的丰度显着降低。
此外,一些研究已经证实,Oscillospira与消瘦强相关,并显示出较低的体重指数高度的遗传性。大量证据表明,Oscillospira丰度在与人类肥胖相关的代谢活动中起重要作用。颤螺菌可能是具有减肥、降脂、缓解代谢综合征等作用的下一代益生菌候选物,具有巨大的健康应用潜力。
此外,Oscillospira与中枢神经系统疾病和退行性疾病之间存在关联,但由于证据稀缺且因果关系尚未得到证实,还需要更多的研究来揭示其潜在机制。
外部干预措施,如益生菌,益生元,多酚类物质,饮食和运动,可以显著影响Oscillospira在肠道的丰度,有助于治疗特定肠道菌群介导的如肥胖和肥胖相关的糖尿病。未来,以颤螺菌为核心的微生态制剂可能为食用或药用的食品、保健品和生物制药带来新的选择。
未来,还需要更多的临床前和临床研究来证实颤螺菌在不同疾病中的疗效,那时如果能够攻克这种生物的纯培养技术,将大大加快其开发和应用进程。
主要参考文献:
Konikoff T, Gophna U. Oscillospira: a Central, Enigmatic Component of the Human Gut Microbiota. Trends Microbiol. 2016 Jul;24(7):523-524. doi: 10.1016/j.tim.2016.02.015. Epub 2016 Mar 17. PMID: 26996766.
Feng W, Liu J, Ao H, Yue S, Peng C. Targeting gut microbiota for precision medicine: Focusing on the efficacy and toxicity of drugs. Theranostics. 2020;10(24):11278-11301. Published 2020 Sep 14. doi:10.7150/thno.47289

谷禾健康

Faecalibacterium prausnitzii(F. prausnitzii),普氏栖粪杆菌,又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的 5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
已经证实,患有慢性便秘、乳糜泻、肠易激综合征和炎症性肠病(包括克罗恩病和溃疡性结肠炎)的个体中这种微生物的数量减少。此外,在 2 型糖尿病、结直肠癌和银屑病患者中观察到较低水平的F. prausnitzii。
F. prausnitzii 数量的变化可能是人类肠道菌群失调的迹象,科学家们将其视为下一代益生菌的候选者。
Faecalibacterium prausnitzii,革兰氏阴性,对氧极度敏感,是柔嫩梭菌类群的优势菌,属于梭菌科,厚壁菌门。该物种属于Clostridium cluster IV分组的Clostridium leptum group柔嫩梭菌类群,是该类群的最优势菌种,占64%左右。一般中文翻译柔嫩梭菌指的就是这个类群,其代表物种就是普氏栖粪杆菌,又名普拉梭菌。
普拉梭菌的扫描电子显微镜图像
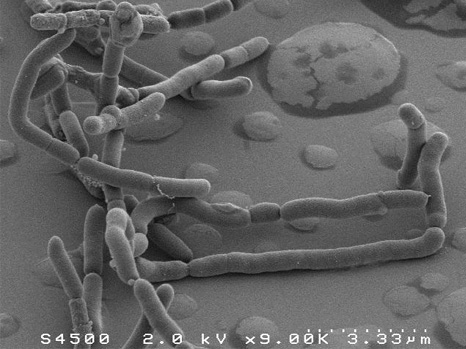
Plateforme MIMA 2, T. Meylheuc
直到 2000 年代中期,16S rRNA 文库的高通量测序和粪便 DNA 的宏基因组分析显示F. prausnitzii是人类肠道中最丰富的细菌之一,人们才完全意识到该物种对人类健康的重要性细菌总数的 5–15%。
在婴儿早期,Faecalibacterium prausnitzii 的数量非常低,并在原定殖细菌建立后增加。同时,在克罗恩病 (CD)和溃疡性结肠炎 (UC) 等各种炎症性肠病 (IBD) 以及结直肠癌 (CRC) 和 2 型糖尿病中观察到 F. prausnitzii 水平降低。
F. prausnitzii 生长繁殖肠道理化调节
F. prausnitzii 生长的最佳 pH 值范围在 5.7 和 6.7 之间,这是在结肠中发现的 pH 值范围。尽管在 5-5.7 的 pH 值范围内菌株之间的耐受性存在差异,但在 3.5 和 4.5 的 pH 值之间没有观察到生长。这表明 pH 值影响F. prausnitzii 沿肠道的分布。
该菌在健康受试者和肠道疾病患者的十二指肠(pH 范围 5.7-6.4)和回肠末端中也被检测到。据报道,溃疡性结肠炎和克罗恩病患者经常出现酸性大便,因此仍有待证明肠道局部 pH 值是否会调节F.prausnitzii 在肠道疾病(如 IBD)患者中的丰度和组成。
F. prausnitzii 对胆汁盐生理浓度的轻微增加也高度敏感,这为克罗恩病患者表现出的F. prausnitzii丰度减少提供了一个合理的解释,因为这些患者的胆红素浓度增加,尤其是那些有回肠疾病受累和接受过肠切除术的患者。
此外,据报道,分离株之间的耐受性存在差异,尤其是胆盐浓度为 0.1% (wt/vol) 时,表明胆汁盐浓度的变化可能决定F. prausnitzii亚型组成的变化。由于克罗恩病患者的胆盐成分也发生改变,需要进一步研究以确定F. prausnitzii是否对某些类型的胆盐成分具有更高的敏感性,并确定不同的胆汁盐谱是否会改变 F. prausnitzii 亚型组成。
F. prausnitzii对氧极为敏感,但它能够通过在黄素和半胱氨酸或谷胱甘肽存在的情况下使用细胞外电子转移来承受肠粘膜中发现的低水平氧气 。最近,已经证明,当与这些抗氧化剂和菊粉作为冷冻保护剂一起配制时,菌株 A2-165 可以在环境空气中保持活力 24 小时。因为氧气梯度在定义结肠中微生物的空间组织方面具有重要作用,确定F. prausnitzii亚型之间的氧耐受性是否存在差异,以及它是否与粘膜的发炎状态相关,将会很有趣。
F. prausnitzii的必需营养素的可用性和有效性可能会影响其在肠道中的分布。
F. prausnitzii的全局营养需求已经通过人工策划的代谢重建进行了调查,该重建确定了几种氨基酸和维生素作为生长因子。体外实验表明,F. prausnitzii可以通过代谢交叉喂养直接或间接地代谢纤维。乙酸盐消耗是F. prausnitzii生产丁酸盐的主要驱动力。当这两个物种在低聚果糖上一起生长时,青春双歧杆菌释放的醋酸盐的消耗已被证明会刺激F. prausnitzii。F. prausnitzii可以代谢来自宿主和饮食来源的底物,菌株之间存在一些差异。
F. prausnitzii分离株可以使用简单碳水化合物生长良好,但菌株之间在发酵更复杂碳水化合物的能力方面存在一些差异,例如那些来自宿主或饮食的碳水化合物,尽管大多数F. prausnitzii菌株都能够发酵菊粉,但研究结果表明,其中只有两种菌株可以在该基质上生长良好。这支持观察到该益生元在营养干预中对该物种的刺激,并表明只有F. prausnitzii种群的一些成员受到菊粉的选择性刺激。
该物种的菌株利用肠腔中发现的其他多糖的能力有限,例如阿拉伯半乳聚糖、木聚糖和可溶性淀粉。大多数分离株可以在苹果果胶上生长,并且能够使用一些果胶衍生物。体外研究表明,在生理条件下,F. prausnitzii可以在某些类型的果胶发酵中发挥关键作用,并且可以与其他肠道细菌成功竞争这种底物。
最近一项基于普拉梭菌 A2-165菌株功能代谢图的研究预测其无法合成氨基酸丙氨酸、半胱氨酸、蛋氨酸、丝氨酸和色氨酸。通过对其他F. prausnitzii菌株基因组的进一步分析,已经观察到维生素和辅助因子(例如:生物素、叶酸、烟酸、泛酸、吡哆醇和硫胺素)的营养缺陷型,并且菌株之间似乎存在与核黄素生产有关的一些差异,这可能是由于菌株间差异。
相比之下,该物种已被预测为钴胺素生产者。有证据表明,一些 IBD 患者易患钴胺素缺乏症,但尚未确定这种情况的原因。由于缺乏一致的临床数据表明 IBD 患者易患这种缺陷,因此确定它是否与肠道中钴胺素生产者的消耗有关会很有价值。
F. prausnitzii与肠道微生物群其他成员的关系
F. prausnitzii在肠道中与C. coccoides组和 Bacteroidetes 的几个成员共同发生。有人提出F. prausnitzii可能依赖其他物种(如拟杆菌)进行交叉饲养。在共培养实验中,观察到F. prausnitzii 的发酵活动过程中,多形拟杆菌(B. thetaiotaomicron)正在发酵果胶。表明后者产生的乙酸盐促进了F. prausnitzii 的生长。此外,B. thetaiotaomicron对果胶的初始发酵可以释放果胶衍生物,然后可以被F. prausnitzii使用。
最近对大鼠模型的研究表明,F.prausnitzii 需要预先存在后,B.thetaiotaomicron才能在肠道定植。已经反复观察到无法维持F. prausnitzii单相关动物模型 并且还描述了一种小鼠模型,其中F. prausnitzii植入胃肠道需要用大肠杆菌预先制备,表明F. prausnitzii和其他菌群存在密切关系。在 IBD 患者中发现了这两种物种之间的相关性,根据疾病位置观察到正相关或负相关。这表明一个种群对另一个种群的影响,尽管还不能排除宿主因素的影响。
F. prausnitzii 的分类学和系统发育
已经确定Faecalibacterium属与厚壁菌门、梭菌类和瘤胃球菌科中的梭菌群 IV的成员有关。目前,F. prausnitzii是唯一成功分离的粪杆菌属物种。
最近对分离株的系统发育表征确定该物种包括两个系统发育群,它们具有 97% 的 16S rRNA 基因序列相似性。其中分类群 I 的减少是肠道炎症的更敏感标志物。迄今为止,大部分可用的基因组和生理数据是使用分类群 II 菌株收集的。
F. prausnitzii基因组之间的平均核苷酸同一性水平非常低,而基因组的可塑性却很高。两个基因组可以根据功能基因互补的差异进行分离,尽管这种划分与基于保守基因系统发育的分离不完全一致,突出了水平基因转移在塑造F. prausnitzii 中的重要性基因组。两个基因组之间的差异主要在于与碳水化合物分解代谢相关的基因(例如分类群 I中预测的唾液酸酶基因)和氨基酸的互补,以及防御机制。
值得注意的是,最近对健康和患病肠道样本中物种多样性和丰度的研究表明,存在其他F. prausnitzii系统发育型,并且不能排除Faecalibacterium属内其他物种的存在。这些已经通过分析粪便样本中总体细菌群落的分子方法估计,代表大约 2% 的粪杆菌序列,并使用物种特异性引物。有趣的是,罕见的系统发育型主要是从患有肠道疾病的受试者身上发现的。
产生丁酸,维持肠道稳态
Faecalibacterium prausnitzii 一直被报道为肠道中发现的主要丁酸盐生产者之一。丁酸盐在肠道生理学和宿主健康中起着至关重要的作用。丁酸盐结肠细胞的主要能量来源之一,能够保持肠道内壁的完整性,防止病原体通过肠道进入人体。它刺激绒毛的生长 (肠道屏障上的微观挤压)并促进粘蛋白的产生,粘蛋白是一种覆盖肠道内壁的保护性凝胶。此外,丁酸盐通过增加紧密连接蛋白的合成和抗菌肽的产生来参与结肠屏障的增强。
肠道屏障依赖于 T 连接蛋白来防止肠道内容物泄漏到血液中。丁酸盐通过激活 AMP 活化蛋白激酶 (AMPK) 来促进紧密结合的 T 连接蛋白。
丁酸盐可以通过调节肠腔 pH 值来调节肠道微生物群,这对产生短链脂肪酸的细菌有益,丁酸盐可以保持上皮缺氧并限制硝酸盐呼吸依赖性细菌的过度生长以维持肠道稳态。
丁酸盐是由某些细菌在乳酸发酵过程中产生的。然而,乳酸也是硫酸盐还原菌的首选能源,硫酸盐还原菌会产生硫化物并抑制结肠细胞对丁酸的氧化。IBD 中产生丁酸盐的菌的消耗可能会削弱已经脆弱的肠上皮细胞,导致共生或低致病性细菌的入侵,随后激活免疫活性细胞。
产生丁酸,抗炎抗肿瘤
丁酸盐可以通过抑制 NF-κB 转录因子激活、上调 PPARγ和抑制干扰素γ来减轻肠黏膜炎症。
此外,F. prausnitzii已被证明可以产生许多具有抗炎特性的物质,包括一种 15 kDa 的蛋白质“微生物抗炎分子”(MAM),它能够抑制肠上皮中的 NF-κB 通路细胞和预防小鼠 IBD 模型中的结肠炎 。而且,丁酸盐可能通过抑制组蛋白脱乙酰酶活性来抑制炎症反应,导致组蛋白过度乙酰化和抑制 NF-κB 活性。
Faecalibacterium prausnitzii 上清液已被证明可以抑制促炎性 IL-8 免疫蛋白的产生。
F. prausnitzii 还通过激活产生 IL-10(一种抗炎蛋白)的 T 细胞来帮助对抗炎症。
F. prausnitzii 的抗炎机制
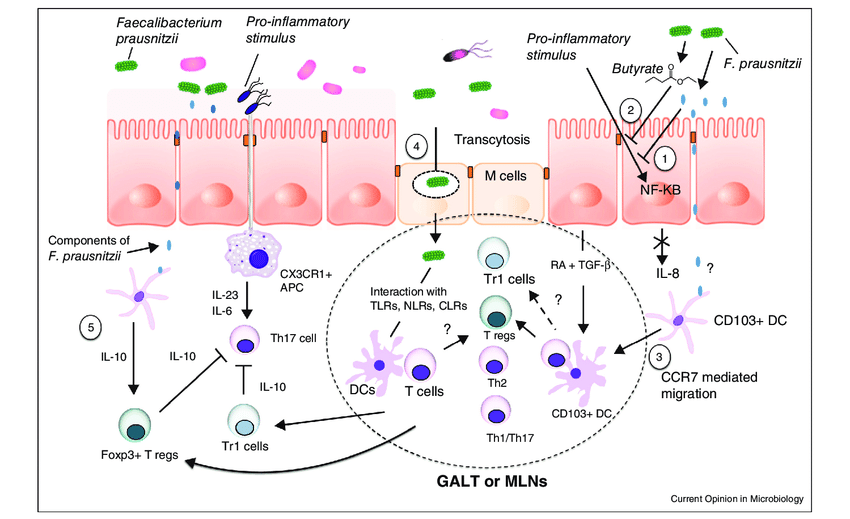
额外的抗炎特性归因于该菌还通过其诱导耐受性细胞因子谱的能力(促炎细胞因子如 IL-12 和 IFN-γ 的分泌非常低,而抗炎细胞因子 IL-10 的分泌增加)。这些抗炎作用部分与能够阻断 NF-κB 激活、IL-8 产生和调节性 T 细胞产生上调的分泌代谢物有关。
这些微生物可以产生莽草酸,一种常见于植物中的酸,能够防止脂多糖 (LPS) 引起的炎症。LPS 是一些细菌外膜上的毒素,可以激活免疫系统并引起炎症。F. prausnitzii 还可以制造水杨酸,这有助于防止细菌形成生物膜,这是一些引起感染的微生物的常见特征。
体外研究表明,丁酸盐还具有抗肿瘤作用,包括减少肠上皮细胞中肿瘤坏死因子 (TNF) 的分泌,并诱导肿瘤细胞的分化和凋亡,从而抑制肿瘤生长。
F. prausnitzii 及其代谢物对小鼠结肠炎发挥保护作用,改善了肠道菌群失调,增加了细菌多样性和产生短链脂肪酸菌的丰度,降低了血清 TNF-α 和Proteinbacteria,酸杆菌门和拟杆菌。这些发现将为F. prausnitzii 的抗炎抗肿瘤作用提供进一步的证据,其具有治疗 IBD 的潜力。

下一代益生菌特性
大多数商业益生菌不包括有益健康的优势肠道微生物菌株,这就是为什么这些益生菌菌株不会在人类肠道中定殖并且它们的作用仅在很短的时间内持续存在的原因。如今,人们对使用共生细菌作为潜在的益生菌剂越来越感兴趣。
使用厌氧细菌和 EOS(氧敏感) 细菌是成功分离可能影响肠道稳态的代表性菌株的先决条件。Faecalibacterium prausnitzii从健康志愿者分离株:F. prausnitzii作为新一代益生菌在使用中向前迈进了一步。
但是下一代共生益生菌必须满足与传统益生菌相同的标准。它们应该:
(i) 被隔离和充分表征
(ii) 达到安全要求,例如可接受的抗生素抗性或缺乏裂解和粘附能力
(iii) 作为益生菌考虑,在被隔离之前对宿主表现出有益的影响
关于F. prausnitzii,虽然对其安全性知之甚少,但该物种作为下一代益生菌具有明显的潜力。到目前为止,所有F. prausnitzii分离株具有一些特征,例如:
(i) 缺乏上皮细胞粘附、质粒、抗微生物和溶血活性
(ii) 存在 DNAse 活性。部分的F. prausnitzii菌株产生的 D-乳酸微弱,不会对宿主产生代谢有害影响,无法降解黏蛋白。
仅使用参考菌株F. prausnitzii A2-165在体外和体内分析了其有益的抗炎作用和生物膜形成菌株 HTF-F。由于益生菌特性通常是菌株特异性的,需要单独研究来评估其他F. prausnitzii分离菌株的抗炎特性。
人体微生物组中 F. prausnitzii 的丰度受其健康状况和结肠环境的影响。这一点尤其重要,因为在患有消化系统疾病的患者中发现了低于平均水平的F. prausnitzii。
克罗恩病和溃疡性结肠炎
肠道微生物群可能通过两种机制驱动致病性,即“促炎”菌群的扩张或微生物群保护性化合物的限制。
健康肠道和IBD患者中 F. prausnitzii
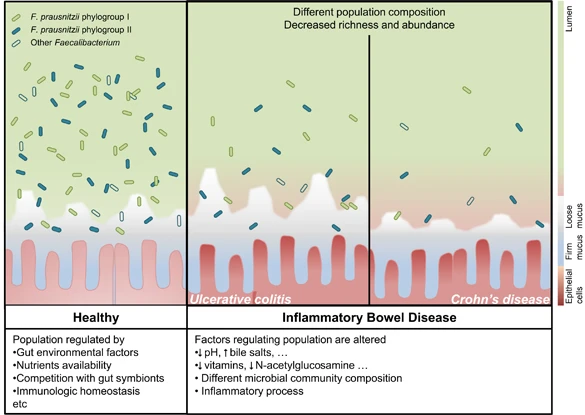
在IBD患者中,肠道环境的改变可能会影响F. prausnitzii 的种群组成和负荷。这些差异可以通过监测来鉴别IBD亚型。
在过去的十年的研究已发现,相当数量的降低的F. prausnitzii水平与某些形式的IBD相关。虽然F. prausnitzii水平与溃疡性结肠炎活动和隐窝炎之间的联系是有争议的,在克罗恩病中F. prausnitzii枯竭,尤其是在疾病发作和克罗恩病的回肠部位。
◥ 治疗后F. prausnitzii恢复
在粪便和活检样本中使用的各种证明方法表明,对克罗恩病患者有效的各种抗炎和抗菌治疗,包括大剂量皮质醇、英夫利昔单抗、干扰素-α2b 和利福昔明,都能够恢复正常水平的F. prausnitzii。
因此,有人提出F. prausnitzii的消耗不是克罗恩病的致病事件,而是产生过量活性氧 (ROS) 的粘膜炎症的结果。这导致粘膜相关和管腔 EOS 培养物显着减少,包括F. prausnitzii。
如何解释Faecalibacterium prausnitzii在溃疡性结肠炎和克罗恩病患者中减少?
◥ pH值
健康的肠道 pH 值 (5.7–6.7) 为 F. prausnitzii 的生长提供了最佳条件,而高酸性环境会抑制 Faecalibacterium prausnitzii 的生长。尤其是,溃疡性结肠炎和克罗恩病患者的大便呈酸性,这可能有助于解释为什么他们的微生物群中缺乏 F. prausnitzii .
◥ 胆汁
胆汁及其成分水平略微升高也会影响 F. prausnitzii 丰度。胆汁是肝脏分泌的一种物质,可在消化过程中分解脂肪。胆汁盐已被证明可以抑制 Faecalibacterium prausnitzii。
研究人员假设这种对胆汁的敏感性可以解释为什么这些微生物在克罗恩病患者中较少。患有这种炎症性疾病的人往往有较高水平的胆红素,胆红素是一种赋予胆汁颜色的色素,特别是如果他们已经切除了部分肠道。
溃疡性结肠炎中, F. prausnitzii有缺陷的肠道定植,这在缓解期短、既往有频繁复发史和结肠炎大范围扩展的患者中更为严重。此外,复发后,F. prausnitzii在维持缓解时逐渐恢复,1年后达到接近参考种群的值。
基于F. prausnitzii菌株特性的治疗探索
科学研究人员提出假设,即F. prausnitzii 的高定植可能会阻止溃疡性结肠炎中粘膜炎症过程的重新激活。这一假设应在未来的研究和增加肠道F. prausnitzii 的策略中得到证实需要在患有广泛疾病的患者中对人群进行验证。
F. prausnitzii菌株还可以利用N-乙酰氨基葡萄糖,一种在肠粘膜中发现的糖蛋白的成分。有趣的是,用这种化合物进行治疗可能会改善克罗恩病,因为它可以作为炎症、受损肠道软组织的愈合因子。因此,鉴于F. prausnitzii能够发酵这种碳水化合物,探索在接受这种治疗的克罗恩病患者中恢复这种有益肠道细菌的效果将是有意义的。
镇痛特性
慢性腹痛是肠易激综合征或炎症性肠病等肠道疾病患者的常见症状之一。研究人员表明,在炎症性肠病的患者中,肠道中的Faecalibacterium prausnitzii细菌的丰度降低。
这些研究人员已经证明,由于压力动物模型(产生绞痛起源的内脏超敏反应),F. prausnitzii丰度的减少与内脏超敏反应的出现有关。对于人类,这种超敏反应会导致肠道不适或腹痛。
科学家已经证明,通过给这些动物服用F. prausnitzii,它们恢复了正常的绞痛敏感性。
结直肠癌
丁酸盐的抗炎功能包括抗癌特性。这种短链脂肪酸是一种组蛋白脱乙酰酶 (HDAC) 抑制剂:它抑制癌细胞的活性和生命周期。这促使研究人员调查 Faecalibacterium prausnitzii 在结直肠癌中的作用。
结直肠癌患者产丁酸盐的细菌较少,包括Faecalibacterium prausnitzii。有人提出,由于丁酸盐产量较低,肠道内壁细胞可能更容易受到损伤,这可能会增加患癌症的风险。
扩展阅读:结直肠癌防治新策略——微生物群
乳腺癌
F.prausnitzii 通过抑制IL-6/STAT3通路抑制乳腺癌细胞的生长。菌群代谢物与菌群结合(如Faecalibacterium与磷胆碱结合)可能是乳腺癌的一种新的检测方法。
糖尿病
糖尿病是一种代谢性疾病,其中由于胰岛素功能受损,身体失去控制血糖的能力。升高的循环葡萄糖会损害血管并增加患心脏病的风险。
许多针对人类的研究已经确定了肠道微生物组的失衡(生态失调),这会削弱肠道内壁,并使不良分子进入体内,从而破坏其他器官。科学家们认为,生态失调先于并促进了糖尿病的发展。
糖尿病患者的厚壁菌门水平较低,包括 Faecalibacterium prausnitzii 和其他可强化肠道内壁的产丁酸盐细菌。
研究表明,脂多糖是在某些革兰氏阴性细菌上发现的促炎分子,当肠道屏障薄弱时,它会进入血液并损害胰腺中的B 细胞功能,产生胰岛素的细胞。
过敏反应
Faecalibacterium prausnitzii通过调节肠道微生物群和短链脂肪酸的产生来缓解屋尘螨引起的过敏性哮喘。
补充F. prausnitzii可阻断嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞的流入,减轻病理变化。此外,活的和死的F. prausnitzii给药都降低了白细胞介素 IL-4、IL-5、IL-13 和免疫球蛋白 G1 的水平,提高了调节性 T 细胞 (Treg) 的比例,改善了微生物生态失调并增强了短链脂肪酸生产。
Faecalibacterium prausnitzii部分通过肠道微生物群调节和短链脂肪酸产生发挥抗哮喘作用,表明其作为预防过敏性哮喘的益生菌剂的潜力。
肝病
研究人员研究了口服F. prausnitzii治疗对高脂肪喂养小鼠的影响。与高脂肪对照小鼠相比,F. prausnitzii处理的小鼠肝脏脂肪含量、天冬氨酸氨基转移酶和丙氨酸氨基转移酶较低,肝脏中脂肪酸氧化和脂联素信号传导增加。肝脏脂质组学分析显示,几种甘油三酯、磷脂和胆固醇酯的含量减少。内脏脂肪组织中的脂联素表达增加,皮下和内脏脂肪组织对胰岛素更敏感。
且F. prausnitzii治疗增加了肌肉质量,这可能与增强线粒体呼吸、改变肠道微生物群组成和改善肠道完整性有关。总的来说,F. prausnitzii治疗可改善肝脏健康,减少小鼠脂肪组织炎症,需要进一步研究以发现其治疗潜力。
其它
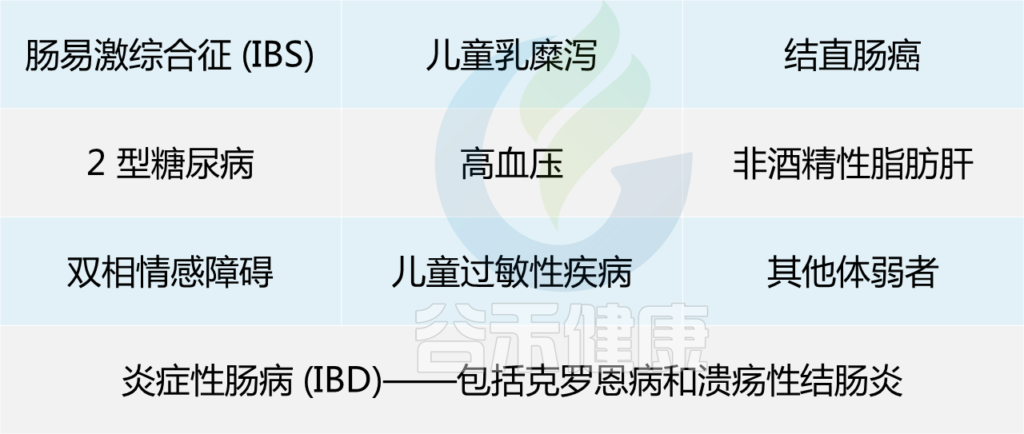
肠道菌群中F. prausnitzii的消耗与微生物失调有关,同时伴随着广泛的代谢和/或免疫介导的慢性疾病,包括银屑病、高血压、心脏和肾脏疾病。
在以下患者中已显示低水平的F. prausnitzii:
综上所述,F. prausnitzii 对人体肠道和健康非常重要,以至于它被称为肠道中的“关键物种”。现在问题来了:如何增加肠道中这种细菌的数量?
能否添加到酸奶中补充?
不能。
添加到酸奶中或作为补充剂的典型细菌在暴露于空气(氧气)时能够存活。然而,F. prausnitzii是“氧敏感的”,它们在暴露于空气后几分钟内就会死亡。研究人员将这种有益细菌视为“未来的益生菌”,目前正在进行研究以找出它可以轻松储存并暴露在空气中几个小时而不会死亡的方法。所以目前没有办法服用益生菌F. prausnitzii补充剂。
除此之外还能做什么呢?
饮食。
高动物肉、高动物脂肪、高糖、高度加工食品和低纤维饮食(典型的西化饮食)会降低F. prausnitzii 的数量,而高纤维、低肉的饮食会增加 F. prausnitzii 的数量。
——高纤维
我们可以做的第一个提高 F. prausnitzii 的数量的办法, 就是增加饮食中的纤维。增加膳食纤维会增加丁酸盐,丁酸盐与结肠健康有关,具有抗炎和抗癌作用。
高纤维是包括:全谷物、蔬菜、水果、坚果、种子和豆类。此外,还要主要吃多样化的植物性饮食,也就是说大量的植物性食物。多样性似乎很重要——不同类型的纤维喂养不同的细菌。
——益生元
菊粉型果聚糖和阿拉伯木聚糖等益生元可增加F. prausnitzii的数量。

一项研究表明,猕猴桃胶囊的摄入增加了功能性便秘患者的Faecalibacterium prausnitzii 丰度。
虽然F. prausnitzii可能是肠道中一种重要的有益细菌,但是它与其他有益细菌的关系,它们是交叉喂养的。研究表明青春双歧杆菌是利用菊粉主要物种并刺激Faecalibacterium prausnitzii的增加。
主要参考文献:
Heinken, A., Khan, M. T., Paglia, G., Rodionov, D. A., Harmsen, H. J. M., & Thiele, I. (2014). Functional Metabolic Map of Faecalibacterium prausnitzii, a Beneficial Human Gut Microbe. Journal of Bacteriology, 196(18), 3289–3302. doi:10.1128/jb.01780-14
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in Microbiology, 7. doi:10.3389/fmicb.2016.00979
Lopez-Siles, M., Duncan, S. H., Garcia-Gil, L. J., & Martinez-Medina, M. (2017). Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. The ISME Journal, 11(4), 841–852. doi:10.1038/ismej.2016.176
Moreno-Indias, I., Sánchez-Alcoholado, L., Pérez-Martínez, P., Andrés-Lacueva, C., Cardona, F., Tinahones, F., & Queipo-Ortuño, M. I. (2016). Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food & Function, 7(4), 1775–1787. doi:10.1039/c5fo00886g
Richardson, D. P., Ansell, J., & Drummond, L. N. (2018). The nutritional and health attributes of kiwifruit: a review. European Journal of Nutrition. doi:10.1007/s00394-018-1627-z
Blatchford, P., Stoklosinski, H., Eady, S., Wallace, A., Butts, C., Gearry, R., … Ansell, J. (2017). Consumption of kiwifruit capsules increases Faecalibacterium prausnitzii abundance in functionally constipated individuals: a randomized controlled human trial. Journal of Nutritional Science, 6. doi:10.1017/jns.2017.52
Lopez-Siles M, Duncan SH, Garcia-Gil LJ, Martinez-Medina M. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. ISME J. 2017 Apr;11(4):841-852. doi: 10.1038/ismej.2016.176. Epub 2017 Jan 3. PMID: 28045459; PMCID: PMC5364359.
Ramirez-Farias C, Slezak K, Fuller Z, Duncan A, Holtrop G, Louis P. Effect of inulin on the human gut microbiota: stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii. Br J Nutr. 2009 Feb;101(4):541-50. doi: 10.1017/S0007114508019880. Epub 2008 Jul 1. PMID: 18590586.
Varela E, Manichanh C, Gallart M, Torrejón A, Borruel N, Casellas F, Guarner F, Antolin M. Colonisation by Faecalibacterium prausnitzii and maintenance of clinical remission in patients with ulcerative colitis. Aliment Pharmacol Ther. 2013 Jul;38(2):151-61. doi: 10.1111/apt.12365. Epub 2013 Jun 3. PMID: 23725320.
Munukka, E., Rintala, A., Toivonen, R. et al. Faecalibacterium prausnitzii treatment improves hepatic health and reduces adipose tissue inflammation in high-fat fed mice. ISME J 11, 1667–1679 (2017). doi.org/10.1038/ismej.2017.24

谷禾健康
罗氏菌属是共生细菌的一部分,在世界各地的人群中都有代表,占健康肠道细菌总数的 2-31%(谷禾数据库)。产生短链脂肪酸,特别是丁酸,影响结肠运动,具抗炎特性。


罗氏菌属(Roseburia),专性革兰氏阳性厌氧菌, 轻微弯曲,杆状,并通过多个亚末端鞭毛运动。
罗氏菌属包括5种:

罗氏菌属代谢膳食成分,刺激其增殖和代谢活动。
罗氏菌属可以分泌各种分子,与宿主和消化道的其他细菌相互作用。
罗氏菌属可以改善肠道生物多样性,提高葡萄糖耐受性,帮助减肥,使结肠细胞恢复活力。
罗氏菌属的失调(过少)可能影响多种代谢途径,并与多种疾病相关(包括肠易激综合征、肥胖、2型糖尿病、神经系统疾病、过敏、肝病等)。
Roseburia也可以作为症状性病理(如胆石形成)的生物标志物,或作为益生菌修复有益菌群。
研究人员利用16S rRNA测序技术研究早产儿肠道菌群的多样性,并对早期肠道定植模式进行了监测。在新生儿中没有发现Roseburia,但在母乳中发现了,可能通过食用母乳获得。
Roseburia在老年人中降低,提示衰老可能导致肠道菌群的改变。 相反,与较年轻的老年人相比,百岁老人的肠道菌群中有更丰富的Roseburia。
罗氏菌产生短链脂肪酸(乙酸,丙酸,丁酸),分解不可消化的碳水化合物。短链脂肪酸在碳水化合物和脂肪等重要营养素的代谢中发挥重要作用。
典型的Roseburia菌株特别喜欢生产高水平的丁酸盐。这些化合物通常参与能量产生,可以保护肠道免受病原体和疾病的侵害。
目前,发现只有Roseburia inulinivorans产生丙酸,但不是从葡萄糖中产生的。在Roseburia中,乙酸辅酶a转移酶是进行丁酸合成最后一步的主要酶。丁酸盐的形成可通过底物水平的磷酸化和质子梯度导致肠上皮能量产生和细胞反应调节。丁酸是罗氏菌属与寄主相互作用的关键因子。
前面小节我们知道,Roseburia从可发酵的膳食碳水化合物中产生了大量的丁酸盐。R. intestinalis主要寄生在粘蛋白层,并确保丁酸盐的生成。Roseburia作为一种高产丁酸菌,可能对控制炎症过程,尤其是肠道炎症过程具有重要作用。

谷禾健康

感到疲惫?乏力?食欲不振?容易流血?皮肤发痒?腿肿?体重减轻?…这些有可能是慢性肝病的信号,慢性肝病是一个主要的健康问题,它可以发展为肝硬化和肝癌。
肝病按照病因划分,常见的有如下几大类:
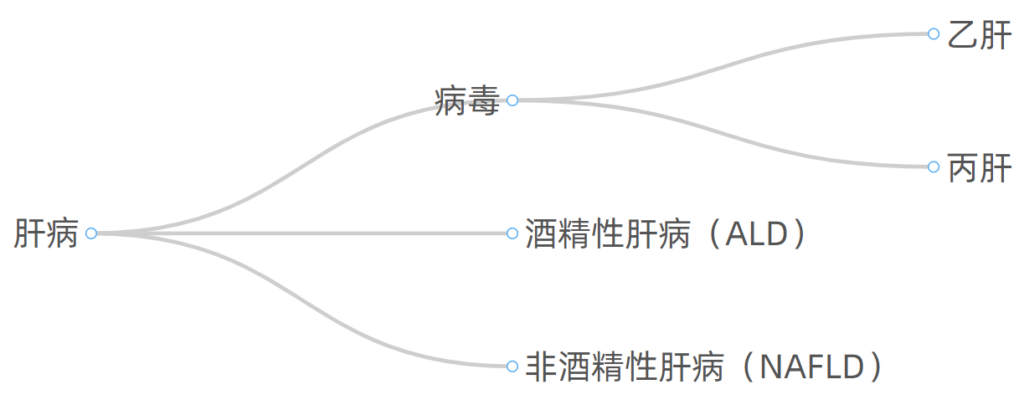
无论病因如何,肝病如果没有得到有效管理控制,进展的常见终末阶段是肝硬化。
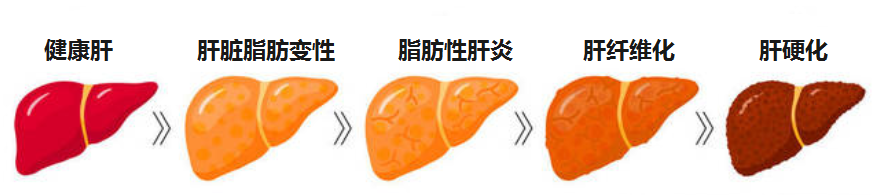

肝硬化可导致失代偿和肝细胞癌的发展。
发病率
目前由于疫苗接种计划和有效抗病毒治疗不断发展,乙肝和丙肝肝硬化的发病率正在下降,但由于以下两个原因导致另两种肝病发病率不断上升:
1、肥胖,导致非酒精性脂肪肝的发病率增加
2、饮酒,导致酒精性肝病的发病率增加。
本文带你详细了解肝病与肠道菌群:


肝脏也是胆汁产生的场所,在肠肝循环中具有重要作用。
肝脏,作为第一个接触微生物产物进入门静脉循环的器官,可能受到肠道微生物群及其变化的多种影响。肠道微生物群的成分或代谢物通过各种机制与肝脏相互作用。
肝脏中产生的胆汁酸(如胆酸和鹅去氧胆酸)与葡萄糖醛酸酶结合。一旦分泌到十二指肠肠腔,肠道菌群代谢和解共轭,产生尿胆原(排泄)和初级胆汁酸被吸收和循环。胆汁酸还通过内在的微生物调节活动来控制和影响菌群。
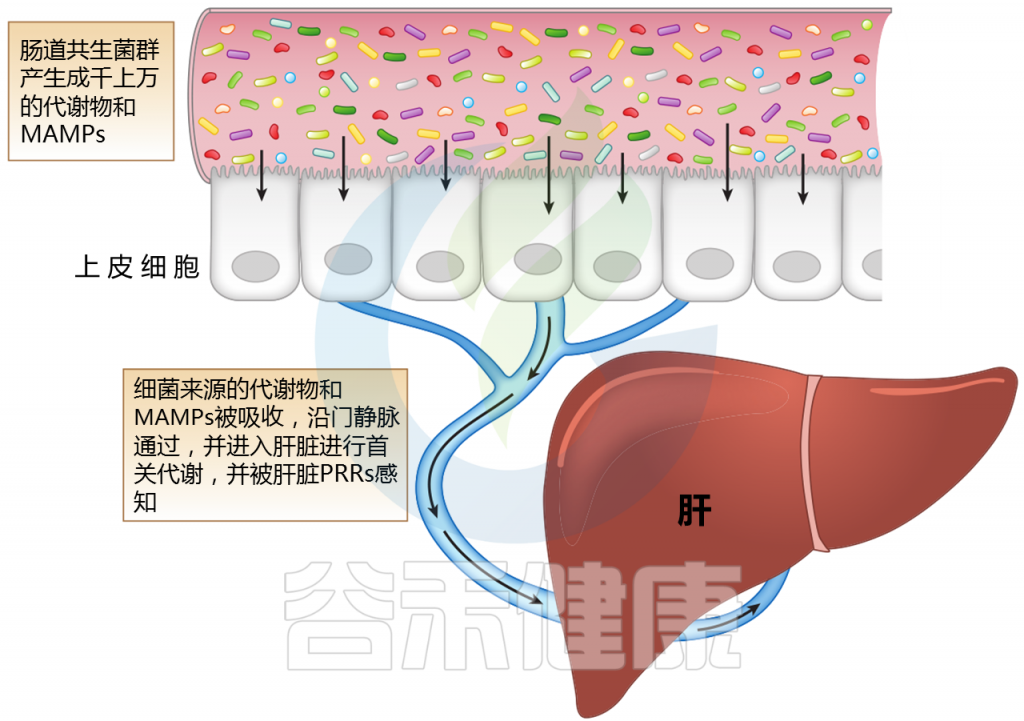

Jones R M,et al.,Annual Review,2020
注:MAMPs——微生物相关分子模式;PRR——模式识别受体
肝脏位于体循环和来自肠道吸收活动的大量外源性分子和微生物相关分子模式(MAMPs)之间的界面。
微生物产生的代谢物会随着微生物群的组成而变化;它们沿着门静脉分流并引发多种信号通路的激活。MAMP暴露过多会导致炎症。
肝硬化前期肠道菌群总体变化:
整体多样性减少,厚壁菌门减少,拟杆菌门和变形菌门增加。
在三种类型的肝炎中,肝硬化前期微生物参与非酒精性脂肪肝病和酒精相关性肝病的证据相对更为有力。
—— 非酒精性脂肪肝病
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)是一种以肝细胞内脂质(主要是甘油三酯)的微泡或大泡状积聚为特征的肝病,并伴有不同程度的炎症浸润。
在非酒精性脂肪性肝病中,研究人员发现粪便、血液和肝活检中的致病菌(如肠杆菌科和大肠杆菌)的相对丰度增加。随着病原菌数量的增加和厚壁菌门数量的减少,菌群失调。
—— 酒精性肝病
长期摄入酒精可导致人类和动物模型中菌群结构的变化,肠道通透性增加,随着持续的酒精滥用,致病菌的多样性进一步减少,相对丰度增加,如肠杆菌科和肠球菌科。
在小鼠中,乙醇可以降低肠道屏障功能,并允许增加局部炎症。从机理上讲,乙醇也能抑制抗微生物凝集素的表达,在慢性乙醇消耗模型中,无Reg3β和Reg3γ的小鼠表现出增加的细菌移位和NASH的发生。这些发现表明乙醇可能介导了肝脏潜在的促炎性刺激,有多个长期后遗症。
尽管肝硬化的病因可能有所不同,但在肝病的末期,微生物群与肝脏的相互作用在很大程度上与病因无关。也就是说无论哪种都可能发展为肝硬化。
前面我们知道,肝炎如果不能得到有效控制,久而久之会对肝造成永久性损伤,也就是肝硬化。肝硬化又分为两种,一种是代偿性肝硬化,一种是失代偿肝硬化。
代偿性肝硬化虽然肝功能减退,但机体仍能正常运行。
失代偿性肝硬化指肝硬化发展到一定程度,出现肝功能衰竭,可能出现严重并发症,如肾功能衰竭、静脉曲张出血和肝性脑病等。
肝硬化患者最初没有症状,等到了肝硬化失代偿(定义为腹水、肝性脑病、黄疸和/或胃肠道出血),就是肝硬化过程中的转折点。
——肝硬化失代偿期会发生什么?
代偿性肝硬化患者可能会保持多年稳定,死亡率非常低,每年< 1%。然而,在第一次住院治疗后,35%的患者将在28天内出现后续的失代偿,需要频繁入院。肝硬化急性失代偿可导致慢加急性肝衰竭(ACLF)。
注:慢加急性肝衰竭是一种综合征,以一个或多个主要器官或系统(肝、肾、脑、凝血、循环或呼吸)衰竭为特征。
慢加急性肝衰竭是失代偿性肝硬化的主要死亡原因。他们的慢加急性肝衰竭(ACLF)的中位时间为2-3年,死亡率每年约为10%。


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
每次失代偿后,慢加急性肝衰竭在28天内的发展约为30%,在此阶段死亡率在28天内攀升至40%。这些器官衰竭患者通常在重症监护室接受治疗,肝移植是唯一的治疗方法。
肠道菌群如何影响肝硬化失代偿?
肝硬化中微生物群-肠道-肝脏相互作用
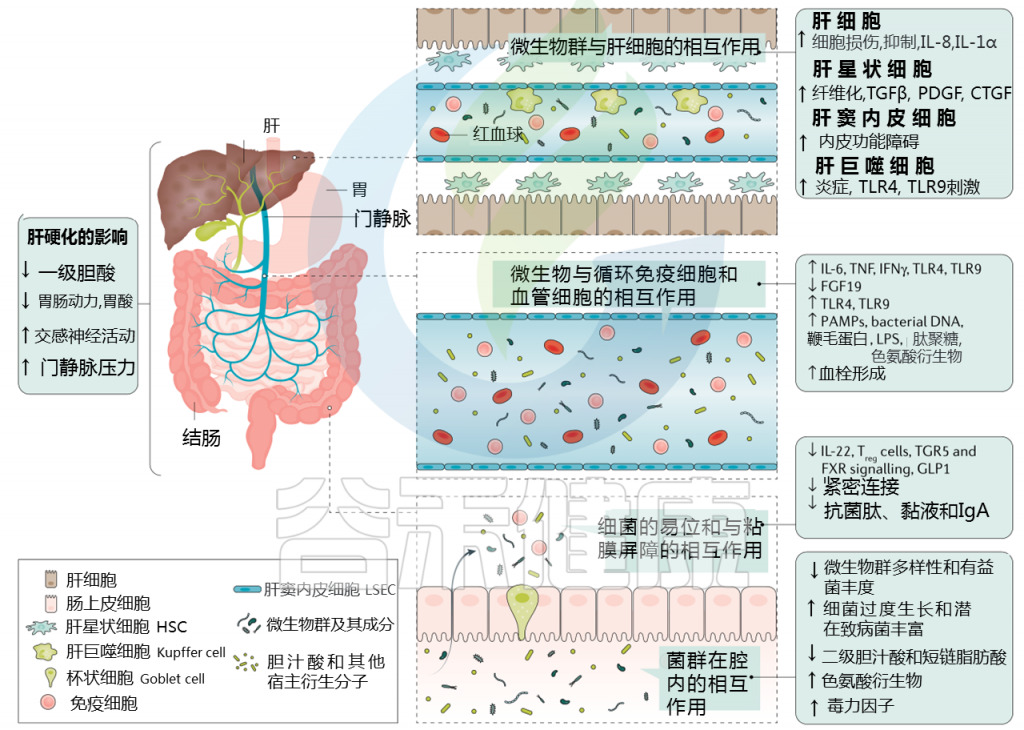

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝硬化发展过程中肠道微生物群的变化在很大程度上归因于肠道微生物群组成及其产物,产物可能具有致病作用。短链脂肪酸(SCFAs)、次级胆汁酸和色氨酸衍生物增加,而粘液蛋白的变化、功能失调的紧密连接和抗菌肽的减少促进了微生物组成分和/或其代谢物(病原体相关分子模式(PAMPs))跨肠屏障的移位。
接下来,就肠道菌群与肠道屏障,病变肝脏的相互作用,菌群代谢产物与转运,门静脉高压和酒精的作用这4个方面展开讨论。
1. 与肠道屏障相互作用
肠漏:
一个不正常的微生物群可以影响肠道上皮屏障,并导致内容物从肠道到肝脏和其他地方难以控制的转移。这种肠上皮屏障的损伤被称为漏肠。
在肝脏疾病期间,由于肝肠循环、肠道炎症和门脉高压的改变,宿主生理和肠道完整性发生重大变化。与此同时,肠道微生物组和肝脏之间的串扰也发生了重大变化:
肠道中的宿主粘膜蛋白和通路(例如FXR信号)被肠道微生物群代谢物(例如短链脂肪酸)改变,并可能导致肝脏损伤;
肝脏疾病进展引起的肠道内化变化可能会影响肠道屏障,促进肠道炎症,降低抑菌肽;
而肠道相关淋巴组织可能通过驱动肠道炎症,从而增加肠屏障的通透性参与肠屏障的功能障碍
由于穿过肠道上皮屏障的细菌成分会引发免疫反应,因此肠道渗漏被认为会增加慢性全身炎症。例如,在肝病患者,尤其是肝硬化患者中,细菌细胞壁脂多糖(LPS)水平升高,也被称为内毒素血症。
2018年的一项研究表明,从失代偿期肝硬化患者的循环血和其他“无菌”隔室中分离出的细菌是可行的,这表明即使是活的细菌也可以在失代偿期肝硬化期间通过肠屏障转位。
2. 与病变肝脏的相互作用
从失代偿到慢加急性肝衰竭的进展与全身炎症的广泛激活有关,影响许多细胞因子和炎症系统。
释放危险相关的分子模式来促进失代偿和炎症
慢加急性肝衰竭的发展,不同衰竭器官的死亡细胞和细胞外基质的重塑,特别是在肝脏,都通过释放危险相关的分子模式来促进失代偿和炎症,最终可能是慢加急性肝衰竭发展的先决条件。
这种联系在乙肝病毒引起的肝硬化和/或慢加急性肝衰竭患者中尤其常见。慢性乙肝病毒的再激活可能导致肝损伤,从而释放危险相关的分子模式,进而导致器官衰竭和慢加急性肝衰竭。
在慢性肝病和肝硬化患者中,甲肝病毒和戊肝病毒重叠感染也可能诱发慢加急性肝衰竭。
对病原体相关分子模式的免疫反应导致器官功能障碍
另一方面,这种炎症的爆发是由微生物或其成分的转移引起的,也称为病原体相关分子模式。对病原体相关分子模式的免疫反应可能在免疫病理学过程中导致器官功能障碍,在这种过程中,免疫反应会导致感染造成损害。
炎症标志物水平升高
血浆中全身性炎症标志物(如IL-8或IL-6)水平升高,无论是否有明显的细菌感染,都与肝硬化和慢加急性肝衰竭的急性失代偿有关。新的数据强化了改变后的肠道微生物群和慢加急性肝衰竭之间的联系。
血浆代谢物特征
除了肠道菌群衍生代谢物与慢加急性肝衰竭发展之间的关联之外,血浆代谢物特征(可能也来自肠道菌群)也与全身炎症和慢加急性肝衰竭密切相关。
这些发现可能解释了为什么肠道微生物群的改变和细菌易位的增加可能为不同器官的免疫病理发展为器官衰竭,加重全身炎症和诱导ACLF的环境。
酒精性肝病
2019年研究表明,乙肝病毒相关ACLF患者的循环细菌DNA显著增加,并与炎症标记物(如CXCL10,一种已知的趋化因子)相关,在非乙肝病毒病因中也与ACLF相关,尤其是酒精性肝硬化。
另外,在急性酒精性肝炎(ACLF的一个亚型)中,研究表明,与没有这种特殊菌株的患者相比,具有一种产生细胞溶血素的肠球菌菌株的患者具有极高的死亡率(180天内的死亡率分别为89%和3.8%)。
我们知道,急性酒精性肝炎与微生物变化密切相关,这可能决定患者的临床特征及其结果。在几乎一半的急性酒精性肝炎患者中,失代偿和慢加急性肝衰竭都会发生,但没有任何可识别的促发事件,这表明这与内源性机制有关(例如,门静脉高压症或细菌易位)。
3. 门静脉高压症和酒精的作用
即使肝硬化的门静脉高压症得到有效治疗,例如通过放置经颈静脉肝内门体分流术(TIPS)支架,许多患者仍出现进一步失代偿和ACLF(2年内约47%),尤其是由于全身炎症和随后的器官衰竭。
此外,与肝静脉、右心房和外周静脉血相比,腹水的存在决定了门静脉循环微生物群的组成(腹水:一种失代偿的指标),以及与炎症标记物和ACLF的发生相关的特定循环微生物群。
然而,应该指出的是,TIPS支架本身可能会加重高动力循环,从而导致内毒素水平的增加。从长远来看,TIPS支架降低了失代偿率,可能主要是由于这些肝硬化患者腹水的发生率降低。
失代偿性肝硬化和ACLF先于酒精性肝硬化发生。这一发现可能很重要,不仅因为酒精是失代偿期肝硬化最常见的病因,而且可能是由于酒精本身对肠道微生物群和肠屏障功能的直接影响。
在健康个体和动物模型中,已经证明急性酗酒会增加循环中的内毒素和细菌DNA水平。
酒精显著改变肠道微生物群的组成,降低拟杆菌的相对丰度,增加变形菌。
它的代谢物,特别是乙醛,可以破坏肠道上皮细胞的紧密连接,导致肠道渗漏,促进细菌和真菌的易位,这两者都可能与肝硬化的进展有关。
在不同病因的肝硬化(例如,非酒精性脂肪性肝炎或乙型肝炎引起的肝硬化)中也观察到微生物群组成的改变以及肠道的渗漏。
4. 微生物代谢产物和转运
肝硬化发展过程中肠道微生物群的变化在很大程度上不仅归因于肠道微生物群的组成,还归因于其产物,这些产物可能具有致病作用。
一项研究表明,在肝硬化向失代偿和ACLF发展的过程中,血液代谢物特征明显改变。
针对903人的大规模研究为某些强预测代谢物模式的微生物起源带来了重要的见解,但很难对这些发现作出有力的陈述。
另一项对602名患者进行的研究表明,微生物群衍生代谢物与ACLF的存在有关。其他微生物成分,如次级胆汁酸、短链脂肪酸和色氨酸代谢物也在肝硬化中发生较大变化,与疾病的进展有关。尤其是,胆汁酸通过下调FXR受体来改变肠道屏障功能,这为临床FXR激动剂已经可用提供了新的治疗机会。
间接证据表明肠道微生物群可能会影响肝硬化的预后。
首先,研究表明,使用非选择性β受体阻滞剂(一种预防肝硬化失代偿的常用方法)治疗可改善肠道屏障,减少肠道转运时间,从而降低肝硬化患者细菌转移的可能性。
第二,在静脉曲张破裂出血期间或作为失代偿期肝硬化的长期预防措施,抗生素治疗是一种推荐的治疗方法,因为它可以改善结果,其机制可能与减少细菌移位有关。
尽管这一观点尚未得到确凿的证实,但我们知道,一种特定的微生物组表型(所谓的肠型)会导致肝功能的病理改变,并且考虑到微生物群中存在着广泛的成员,如真菌或病毒,微生物组标志物可能是非常有用的临床工具,以确定有失代偿和ACLF风险的患者。
肠道微生物群可以作为疾病进展、严重程度和治疗反应的生物标志物。
不同肝病的菌群特征
肝硬化:
瘤胃菌科、毛螺菌科与其他菌(包括肠杆菌科和拟杆菌科)进行比较,菌群比率失调。随着ACLF的发展,肝硬化菌群失调比率恶化。
该研究表明,肝硬化患者的菌群比率失调
对129名患者的研究显示,毛螺菌科减少,巴斯德氏菌科(Pasteurellaceae)的丰度可以预测死亡率。
其他研究也提供了证据,表明特定的微生物组群特征可以区分肝硬化和健康对照组,并且微生物组的变化可能能够监测病情的严重程度和进展情况。
一组45例肝移植受者中,肝移植改变了肠道菌群,使微生物多样性增加,原生细菌增加(如毛螺菌科),潜在致病菌减少(如肠杆菌科)。
该研究强调了患病的肝脏会影响肠道菌群。
肝硬化和慢加急性肝衰竭:
慢加急性肝衰竭和肝硬化的肠道微生物群特征


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
中国肝硬化患者宏基因组全关联研究(MWAS)显示,与健康个体相比,肝硬化肠道菌群组成有大于34个显著差异的菌群。肝硬化患者中韦荣球菌属和链球菌增多,而产丁酸共生菌包括Faecalibacterium prausnitzii 和Coprococcus comes减少。(下表)
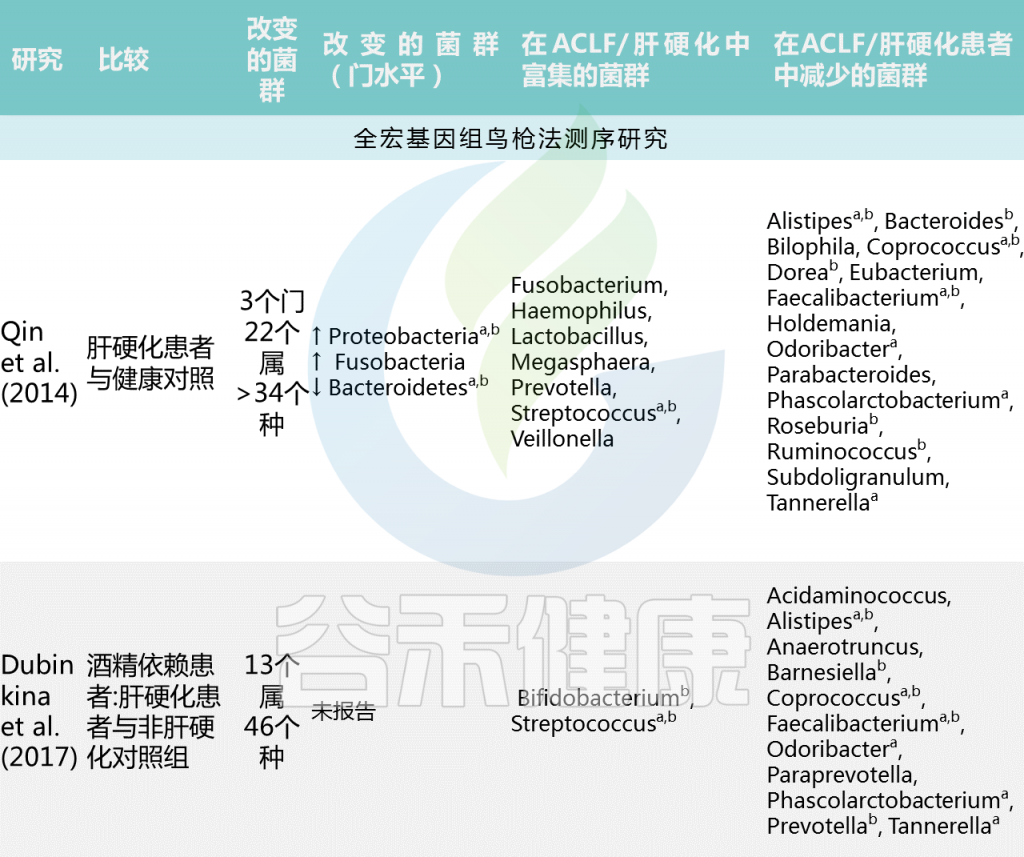

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝细胞癌(HCC)
持续的肝损伤和再生促进了肝细胞癌的发生,它是全球癌症死亡的第三大原因。
肝细胞癌HCC与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
在与非酒精性脂肪性肝病相关的HCC,一项来自意大利的研究注意到拟杆菌和瘤胃球菌科增加,双歧杆菌减少。
不同部位菌群功能
肠道菌群:
从门诊病人的角度来看,肠道菌群可以证明是预测入院,MHE和晚期纤维化患者的有用工具。
一项针对NAFLD肝硬化的研究发现,粪便微生物分析中的27种细菌特征以及年龄,性别和体重指数(BMI)可预测NAFLD肝硬化。
晚期纤维化是NAFLD死亡率的重要预测指标,可以从粪便菌群中推断出纤维化,以帮助识别高危人群。
鉴于失代偿性肝硬化中存在预测的失调模式,因此将CDR(肝硬化失调率-毛螺菌科+瘤胃菌科+韦荣氏菌科/肠杆菌科+拟杆菌科)视为预测失代偿风险的工具(适用于所有常见的CLD病因)较低的分数预示结果较差,并且具有较强的预测价值。
粪便菌群也可以用来预测谁会在90天内再次入院和急性肝性脑病复发,因为急性肝性脑病和其他失代偿的粪便菌群有所不同。
唾液菌群:
唾液菌群失调比率是一种简单实用的临床工具(Lachnospiraceae + Ruminococcaceae + Veillonellaceae/ Streptococcaceae),可以预测有和无肝性脑病的失代谢性肝硬化患者90天的入院情况。
其他部位菌群:
一些研究表明,粪便微生物群和结肠黏膜相关微生物群是不同的。事实上,回肠、空肠和十二指肠粘膜样本或抽吸物的微生物群是不同的,它们可能对肝硬化具有重要的预后能力,主要表现为肝性脑病。然而,这些样本并不容易获得,而且很难将其作为生物标志物进行常规的护理点采集。
微生物工具的潜力
需要进一步的研究才能使人信服结论:患者在不同的条件和疾病下,它们的肠道微生物群既表现出疾病特异性的变化,也表现出非特异性的共同反应。因此,在其作为生物标志物的潜力得以实现之前,确定强有力的疾病特异性肠道菌群特征至关重要。
生物标志物和基于微生物的工具的潜力

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
要更准确地估计疾病对肠道微生物群的影响程度,就需要从世界各地获得强有力的大规模纵向数据,同时考虑各种混杂因素。理解和解释其他相关的混杂因素将使我们更接近以微生物组为基础的肝硬化生物标志物。
微生物组的整体观点,包括微生物基因表达和微生物衍生的代谢物或蛋白质,可能导致更准确和全面的生物标志物,类似于整合宿主遗传学与基因表达和表观遗传学时的强大疾病关联。这种包含宿主-微生物全生物的整体观点也可能支持诊断、分层和治疗的个体化,并可能开创全生物群关联研究的新时代,扩大宏基因组全关联研究领域。
我们知道,即使在没有肝病的情况下,微生物组也在调节情绪和潜在的认知中发挥作用。慢性肝病患者的脑功能改变是肠-肝-脑轴的结果,甚至在肝硬化之前就可以影响病程。
酒精使用障碍(AUD)
一项关于酒精使用障碍(AUD)患者肠-肝-脑轴的重要研究发现,抑郁、焦虑和酒精渴求与肠通透性增加相关,即使在戒酒后,肠通透性高的患者仍然存在抑郁、焦虑和酗酒。
最近发表的一篇关于AUD中这一轴的操纵的文章显示,对于AUD患者,在粪菌移植后,这些渴望、消费和长期的与AUD相关的住院治疗可能会降低。
肝性脑病
肝硬化中普遍存在的认知功能障碍是一种记忆障碍型,称为轻度或隐性肝性脑病。这可以发展为明显的肝性脑病,表现为嗜睡,迷失方向,晕眩和昏迷。
肝性脑病是肠肝轴中与微生物组相关的经典并发症,是全身性内毒素血症和炎症的结果,最终加重了神经炎症,而神经炎症是支撑肝性脑病发病机理的重要因素。
多年来,氨被认为是肝性脑病发病的关键,但后来发现全身炎症对于氨发挥其神经毒性作用是必不可少的。越来越多地描述了特定微生物群在肝性脑病和全身性炎症(包括性别影响)进程中的作用。在小鼠中,发现肠道微生物组是肝性脑病所特有的全身性炎症和神经炎症所必需的。
轻度肝性脑病和PTSD
在临床上,轻度肝性脑病需要专门的认知测试,例如心理计量学肝性脑病评分(PHES),抑制性对照测试,脑卒中诊断等。但这些测试最好在专门的环境中进行,并且需要专业知识。
轻度肝性脑病(MHE)和创伤后应激障碍(PTSD)肠道菌群之间也存在协同作用,与其他人相比,PTSD患者的菌群失调更为严重。PTSD,酒精滥用和肝硬化常常并存。微生物变化可能有助于将MHE与PTSD区别开来,并且可以帮助我们定义较新的疗法。
老年肠道-肝-脑轴改变
利用肠脑轴的主要挑战是老年人群(慢性肝病患者)。老年人患者的致病菌往往更具致病性,随着合并症,住院和抗生素暴露于更大的革兰氏阴性病原体中,病情恶化。
与类似的老年非肝硬化对照组相比,年龄较大(> 65岁)的肝硬化患者往往会改变肠道-肝-脑轴,从而增加炎症并损害记忆的认知能力。在相关网络分析的研究中,更重要的是,在老年肝硬化和非肝硬化组中也发现了类似的模式,这表明老年患者已经具有潜在的肠脑轴改变。
这对肝移植具有重要意义,因为尽管进行了肝移植,但与年龄相关的肠脑轴变化仍可能持续。人口老龄化往往会导致多种其他合并症和精神疾病,需要额外的照顾以确保最佳的移植后效果。
针对肝硬化肠道微生物群的策略
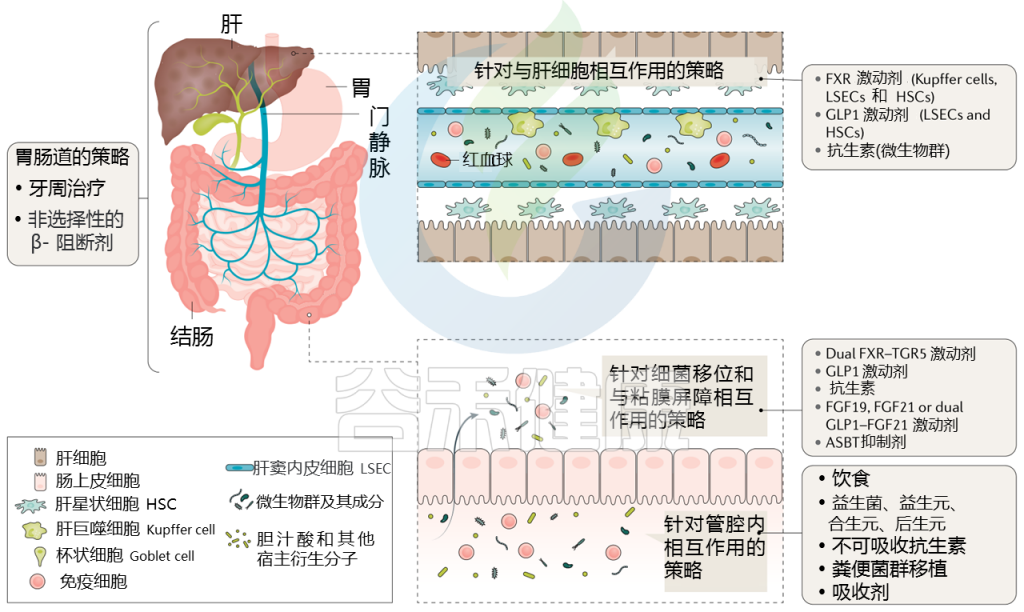

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
通过治疗(部分成立和部分试验)调节肠道微生物群可能改善肝硬化患者的预后,而微生物组生物标志物可能反映对这些治疗的反应。下表显示了不同的策略。
针对肠道微生物群的肝硬化干预措施

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
接下来主要介绍一些具体疗法:饮食、益生菌、抗生素、白蛋白、牙周、粪菌移植等,有些目前正在临床试验中。
饮 食
除其他因素外,饮食对肠道微生物群有重要影响,这一点已在各种疾病和条件下得到研究。一项针对国际肝硬化人群的研究报告称,咖啡、茶、蔬菜和酸奶的摄入都与微生物群落多样性的增加和住院率的降低有关,这为调节肠道微生物群落以促进肝脏健康提供了前景广阔的途径。(具体的饮食方面建议见文末附录部分)
益 生 菌
益生菌已经成为肝硬化临床研究的主题,特别是它们对脑功能的影响和肝性脑病的风险。
益生菌在肝硬化前可以改善NAFLD的组织学,在肝硬化中可以减少失调,对逆转OHE的二级预防有效,减少失代偿事件的住院率,但可能或不能改善认知能力(MHE)。
大多数制剂都含有乳酸菌,可产生短链脂肪酸,有利于结肠健康。一项短期(5天)口服两歧双歧杆菌和植物乳杆菌8PA3的小型试点研究表明,与单独标准治疗相比,口服两歧双歧杆菌和植物乳杆菌8PA3能恢复肠道菌群,并能更好地改善酒精性肝损伤。
以上是关于益生菌的前沿研究,如果想要尝试的话,最好是经过肠道菌群检测或者在医生的指导下服用更可靠。
抗 生 素
抗生素,也被用作失代偿期肝硬化的预防性治疗。
腹水患者发生自发性细菌性腹膜炎(SBP)的风险增加,接受抗生素预防来预防自发性细菌性腹膜炎的发展。这种SBP的一级预防已经被证明可以提高某些患者的生存率。
在一项多中心、随机对照试验中,对严重肝硬化患者使用抗生素,总体生存率没有任何益处,但是,同样,腹水中白蛋白浓度低的患者在接受抗生素治疗时,生存率得到了提高。
预防性抗生素治疗也同样有效建议用于其他临床情况,如静脉曲张破裂出血、既往SBP和复发性显性肝性脑病。然而,尽管对最脆弱的患者的短期效果可能是有益的,但在其他许多患者中,这些治疗不能阻止进一步的失代偿和ACLF。也许这种情况的部分原因是抗生素引起的微生物群落多样性减少。
因此,需要开发一种更具针对性的肠道微生物群来改善肝脏健康。
牙周卫生
也许你不知道,牙周卫生也会与肝硬化有关。已发表的人类MWAS表明,在肝硬化期间,肠道微生物组向口腔微生物组转变。
减少胃部充当天然屏障的酸性环境可能促成口腔微生物群转移到肠道,在肠道上皮屏障适应不同的微生物组分。如前所述,这些变化可能促进肠道微生物群通过肠道屏障的转移,进而导致并发症。因此,防止口腔微生物不必要的转移到肠道,可以成为未来肝硬化治疗的基础。
一项研究表明,与20名非肝硬化对照组相比,30名肝硬化患者的牙周卫生干预措施改变了肠道微生物群,改善了肝性脑病。
白蛋白作为潜在疗法
当肠道屏障被削弱时,它会双向泄漏,这也会导致重要的宿主分子从血液室泄漏到肠腔。例如,在酒精性肝病动物模型中,肠道通透性增加导致粪便白蛋白浓度升高。
随着肝硬化的进展,肝脏中的白蛋白合成受到损害:一方面,肝损伤导致肝细胞功能质量的丧失;
另一方面,肝脏僵硬程度的增加,白蛋白合成减少。不仅白蛋白减少,而且它能结合毒素和其他有害物质。这些观察结果将白蛋白水平定位为肝病严重程度的关键参数。
白蛋白还可通过前列腺素E2改善免疫B细胞功能,减少肝硬化患者的免疫反应,从而阻止与ACLF和死亡密切相关的全身炎症爆发。
长期白蛋白治疗肝损害和非自发性细菌性腹膜炎感染患者分别通过提高生存率和解决ACLF改善了临床结果。因此,白蛋白泄漏到肠腔可能会影响肠道微生物群并被其代谢,从而可能改变微生物组分,间接改变宿主。
粪菌移植(FMT)
失代偿期肝硬化中菌群移植的初步研究正在出现,其安全性也很高,为更大规模的研究铺平了道路。
菌群移植后变形菌减少,放线杆菌增多,肝脏疾病严重程度改善,严重酒精性肝炎患者3个月时的死亡率降低,1年生存率提高。
慢性乙型肝炎FMT组出现微生物改变,HBeAg降低。FMT减少了短期酒精渴求和消费,以及AUD相关的住院治疗。
一项包括20名复发性肝性脑病患者在内的开放性随机试验观察到,使用FMT灌肠剂减少了住院人数,改善了认知和菌群失调。
另一项研究也证明了这一点。使用口服胶囊制剂的FMT的新应用也显示出类似的安全性和对肝硬化和肝性脑病的治疗效果。然而,由于报告了一些由耐yao菌转移导致的FMT相关死亡病例,包括一些肝硬化患者,因此需要谨慎。因此,更好地理解和全面描述这些研究可能带来明确的微生物调节干预治疗失代偿期肝硬化。
加深菌群影响机制的理解
未来的研究应该探索和加深对肠道微生物组变化影响肝硬化进展和失代偿发展的动力学和机制的理解。
诊断、治疗
由于肝硬化表现为肠道微生物群与宿主的大量重要相互作用,微生物组诊断和治疗几乎是治疗疾病进展和失代偿发展的必经之路。需要进一步倡导基于微生物组检测和靶向疗法。
改善预后
针对不同水平微生物群与宿主相互作用的策略改善患者的预后。
产学研合作
使之更容易获得和更具成本效益,微生物检测需要更广泛地适应,因为它相对容易收集且信息量较大。可以帮助诊断,预测和潜在地个性化治疗。
多学科综合
多学科例如微生物学,宿主遗传学,基因组学,表观遗传学,代谢组学,营养学等相结合,更好地利用微生物帮助我们有效的进行慢病管理,预防为主,将指导落实到饮食、生活方式等具体应用上,用全新的视角帮助我们认识健康,保持健康。
饮 食 方 式
尽可能选择对肝脏友好的食物,帮你保护肝脏。以下是一些饮食技巧:
选择全麦谷物,面包和谷物。
多吃各种颜色的水果和蔬菜。
选择低脂乳制品。
选择瘦肉蛋白质。
选择植物油,例如橄榄油,而不是黄油。
零食坚果和种子食物。
减少钠摄入量。
每天喝8-10杯水。
避免含有反式脂肪的加工食品。
避免添加糖。
选择可以长期生活并遵循的饮食计划。
吃八分饱腹感
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
限 制 饮 酒 量
肝脏是负责代谢营养物质和其他摄入物质的主要器官。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
定期减少饮酒量很重要。医生甚至可能建议你完全戒酒。
增 加 运 动 量
运动的好处不仅限于减肥和控制体重,还可以帮助减少肝脏周围的脂肪。定期运动也可以改善你的情绪,助你维持在最佳的健康状态。
开始时要循序渐进,比如可以每周进行150分钟运动开始,尽量选择你喜欢的运动,例如,跑步和步行的组合,多人参与的活动增加趣味性(如各种球类运动),健身房的器械训练等。
睡 觉
充足的睡眠对于保持健康状态非常重要(包括慢性肝病治疗期间睡眠很重要)。如果你觉得入睡困难,开始慢慢尝试练习良好的睡眠习惯,例如:
每天都在同一时间上床睡觉和起床,作息规律。
避免咖啡因,烟草和其他刺激物。
尽量保持卧室环境清爽舒适。
运动尽量安排在清晨或午后,不要在睡前剧烈运动。
相关阅读:
膳食胆固醇通过调节肠道微生物群和代谢产物驱动脂肪肝相关的肝癌
参考文献:
Grat M, Wronka KM, Krasnodebski M, et al. Profile of Gut Microbiota Associated With the Presence of Hepatocellular Cancer in Patients With Liver Cirrhosis. Transplant Proc 2016;48:1687-91.
Jones R M, Neish A S. Gut Microbiota in Intestinal and Liver Disease[J]. Annual Review of Pathology:Mechanisms of Disease, 2020, 16.
Acharya Chathur,Bajaj Jasmohan S,Chronic Liver Diseases and the Microbiome: Translating Our Knowledge of Gut Microbiota to Management of Chronic Liver Disease.[J] .Gastroenterology, 2020
Bajaj JS, Sharma A, Dudeja PK. Targeting Gut Microbiome Interactions in Service-related Gastrointestinal and Liver Diseases of Veterans: Meeting Summary.Gastroenterology 2019.
Liu R, Kang JD, Sartor RB, et al. Neuroinflammation in Murine Cirrhosis Is Dependent on the Gut Microbiome and Is Attenuated by Fecal Transplant. Hepatology 2020;71:611-626
Ren Z, Li A, Jiang J, et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut 2019;68:1014-1023.
Trebicka Jonel,Bork Peer,Krag Aleksander et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure.[J] .Nat Rev Gastroenterol Hepatol, 2020
Lang S, Fairfied B, Gao B, et al. Changes in the fecal bacterial microbiota associated with disease severity in alcoholic hepatitis patients. Gut Microbes 2020;12:1785251.
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease. Hepatology 2019;69:107-120.
Gao B, Duan Y, Lang S, et al. Functional Microbiomics Reveals Alterations of the Gut Microbiome and Host Co-Metabolism in Patients With Alcoholic Hepatitis. Hepatol Commun 2020;4:1168-1182.
Duan, Y . et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505–51 1 (2019)